Актуальность
US Food and Drug Administration (FDA) одобрила абалопаратид для лечения женщин в постменопаузе с остеопорозом, имеющих высокий риск переломов (указание в анамнезе на остеопоретические переломы, множественные факторы риска переломов) или пациентов, которые отмечают непереносимость других препаратов.
Абалопаратид является первым новым анаболическим лекарством, одобренным FDA за последние 15 лет для лечения женщин в постменопаузе.
Рекомендуемая доза составляет 80 мкг подкожно в околопупочную область 1 раз в день. Пациенты должны также получать препараты кальция и витамин D, если их поступление из пищи недостаточно.
Результаты исследования
Одобрение препарата основано на результатах 18 месячного исследования ACTIVE.
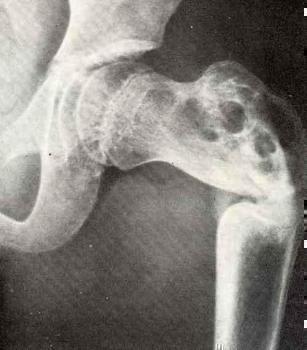
- В исследование ACTIVE были включены более 2000 женщин. Подкожное введение абалопаратида было ассоциировано с достоверным снижением относительного риска перелома позвонков (снижение на 86%) и переломов другой локализации (-43%), по сравнению с плацебо. Абсолютное снижение риска составило 3,6% и 2,0%, соответственно.
- На результата исследования не оказывали влияние возраст, время после начала менопаузы, присутствие или отсутствие ранее переломов (позвоночника и другой локализации) и изначальная минеральная плотность костей.
Исследование ACTIVExtend
- В анализ были включены 1100 пациенток, которые закончили 18-месячное исследование ACTIVE. Пациенты дополнительно получали алендронат в течение 24 месяцев. Результаты первых 6 месяцев наблюдения демонстрируют повышение минеральной плотности костей и снижение риска переломов.
Предупреждения
- В инструкции к препарату содержится информация о дозозависимом повышении риска отсеосаркомы у крыс. Этот эффект наблюдался при применении абалопаратида от 4 до 28 раз в дозе 80 мкг. Может ли прием препарата стать причиной остеосаркомы у людей не известно.
- Препарат не рекомендован у пациентов с повышением риска остеосаркомы, включая лиц с болезнью Педжета, с необъяснимым повышением уровня щелочной фосфатазы, имеющих открытые эпифизы костей, костные метастазы или опухоли костной системы, наследственные заболевания, предрасполагающие к развитию остеосаркомы или при указании в анамнезе на лучевую терапию на область скелета.
- Кумулятивное использование абалопаратида и аналогов паратиреоидного гормона (к примеру, терипаратида) в течение более двух лет не рекомендовано.
Источник: Megan Brooks. medscape. April 28, 2017.
Абалопаратид
Abaloparatide
Фармакологическое действие
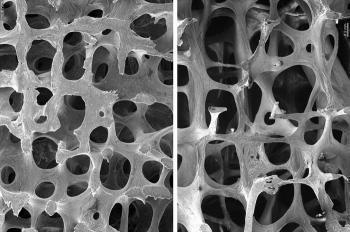
Абалопаратид — синтетический пептид, остеоанаболический препарат, родственный паратиреоидному гормону [PTHrP(1-34)], работает как агонист рецептора последнего (PTH1). Молекула вызывает активацию сигнального пути цАМФ в клетках-мишенях. Она также оказывает анаболический эффект на кости, подтверждённый увеличением минеральной плотности и минерализации костной ткани, что коррелирует с усилением прочности костей в позвоночнике и/или других местах.
Показания
Остеопороз у женщин в постменопаузе с высоким риском переломов, в том числе с остеопорозным переломом в анамнезе, с множественными факторами риска переломов или с непереносимостью, или отсутствием ответа на другие виды лечения остеопороза.
Противопоказания
Повышенная чувствительность к абалопаратиду.
Беременность и грудное вскармливание
Применение при беременности
Категория действия на плод по FDA — N.
Адекватных и строго контролируемых исследований по безопасности применения абалопаратида при беременности не проведено. Экспериментальные исследования на животных не проведены. Неизвестно, оказывает ли абалопаратид немедленное или отсроченное негативное воздействие на плод.
Применение в период грудного вскармливания
Специальных исследований по безопасности применения абалопаратида в период грудного вскармливания не проведено.
Данных об экскреции абалопаратида в грудное молоко нет. Риск для грудного ребёнка не может быть исключён.
Применение при нарушениях функции печени
Недостаточно сведений о степени воздействия абалопаратида у пациентов с печёночной недостаточностью (конкретные рекомендации по дозировке для этой группы пациентов нет).
Применение при нарушениях функции почек
Коррекция дозы не требуется при лёгкой, средней или тяжёлой почечной недостаточности.
Применение в детском возрасте
Безопасность и эффективность не установлены.
Способ применения и дозы
Подкожные инъекции в периумбиликальную область 80 мкг 1 раз в день.
Побочные действия
Гиперкальциурия, головокружение, тошнота, головная боль, сердцебиение, усталость, боль в верхней части живота.
Взаимодействие
На основании исследований in vitro в терапевтических концентрациях не ингибирует и не индуцирует изоферменты CYP.
Меры предосторожности
Остеосаркома
В экспериментальных исследованиях на животных выявлено увеличение количества заболеваемости остеосаркомой у самцов и самок крыс (дозозависимый эффект). Неизвестно, вызывает ли абалопаратид остеосаркому у людей.
Не рекомендуется пациентам с повышенным исходным риском развития остеосаркомы.
Другие рекомендации и предупреждения
Ввиду недостатка клинических данных при длительном лечении абалопаратида, рекомендуемые сроки лечения не должны превышать 24 месяца.
Рекомендуется дополнительное назначение кальция и витамина D, в случае недостаточного поступления с пищей.
Рекомендуется отказаться от курения и употребления алкоголя (может снизить минеральную плотность костей и повысить вероятность переломов).
Классификация
-
АТХ
H05AA04
-
Категория при беременности по FDA
N
(не классифицировано FDA)
Информация о действующем веществе Абалопаратид предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Абалопаратид, содержатся в инструкции производителя, прилагаемой к упаковке.
Остерепар (Osterepar) инструкция по применению
📜 Инструкция по применению Остерепар
💊 Состав препарата Остерепар
✅ Применение препарата Остерепар
📅 Условия хранения Остерепар
⏳ Срок годности Остерепар
Описание лекарственного препарата
Остерепар
(Osterepar)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2021 года.
Дата обновления: 2020.10.08
Владелец регистрационного удостоверения:
Контакты для обращений:
АКРИХИН АО
(Россия)
Код ATX:
M05BA04
(Алендроновая кислота)
Лекарственная форма
| Остерепар |
Таб. 70 мг: 4 шт. рег. №: ЛП-(000969)-(РГ-RU) Предыдущий рег. №: ЛСР-007042/09 |
Форма выпуска, упаковка и состав
препарата Остерепар
Таблетки белого цвета, продолговатые, двояковыпуклые.
Вспомогательные вещества: лактозы моногидрат — 128.64 мг, целлюлоза микрокристаллическая — 65 мг, кроскармеллоза натрия — 15 мг, магния стеарат — 3 мг, кремния диоксид коллоидный безводный — 2 мг.
4 шт. — блистеры (1) — пачки картонные.
Фармакологическое действие
Ингибитор костной резорбции. Относится к группе бисфосфонатов, которые, локализуясь в зонах активной резорбции кости, под остеокластами, ингибируют процесс резорбции костной ткани, обусловленный остеокластами, не оказывая прямого влияния на процесс образования новой костной ткани. Поскольку резорбция кости и появление новой костной ткани взаимосвязаны, образование кости также снижается, но в меньшей степени, чем резорбция, что приводит к прогрессирующему увеличению костной массы. Во время лечения алендронатом формируется нормальная костная ткань, в матрикс которой встраивается алендронат, оставаясь фармакологически неактивным. В терапевтических дозах алендронат не вызывает остеомаляцию.
Фармакокинетика
Всасывание
После приема внутрь в дозах 5-70 мг натощак, не позднее чем за 2 ч до стандартного завтрака, биодоступность алендроната составляет 0.64% у женщин и 0.6% у мужчин.
После приема алендроната натощак за 1-1.5 ч до стандартного завтрака биодоступность снижается приблизительно на 40%.
У пациентов с остеопорозом препарат Остерепар® эффективен при применении натощак не позднее чем за 30 мин до первого приема пищи или жидкости.
Биодоступность алендроната незначительна при его назначении одновременно с приемом пищи или в течение 2 ч после приема пищи. Одновременный прием с кофе или апельсиновым соком снижает биодоступность препарата приблизительно на 60%.
При приеме преднизолона в дозе 20 мг 3 раза/сут в течение 5 дней не происходит клинически значимого изменения биодоступности алендроната.
Распределение
Средний Vd алендроната в равновесном состоянии (за исключением костной ткани) составляет, по меньшей мере, 28 л. При приеме в терапевтических дозах концентрация препарата в плазме крови незначительна (менее 5 нг/мл). Связывание алендроната с белками плазмы составляет приблизительно 78%.
Метаболизм
Нет данных о том, что алендронат подвергается метаболизму в организме человека или животных.
Выведение
После однократного в/в введения алендроната, меченного атомами углерода [14С], приблизительно 50% препарата выводится с мочой в течение 72 ч; выведение меченого препарата с калом было незначительным или не определялось.
После однократного в/в введения алендроната в дозе 10 мг его почечный клиренс составляет 71 мл/мин. Через 6 ч после в/в введения концентрация в плазме крови снижается более чем на 95%. Конечный T1/2 превышает 10 лет, что отражает высвобождение препарата из костной ткани. Алендронат не нарушает выведение препаратов через кислотные и основные транспортные системы почек.
Фармакокинетика у особых групп пациентов
Биодоступность алендроновой кислоты существенно не отличается у мужчин и женщин.
Биодоступность и выведение алендроновой кислоты сходны у пожилых и молодых пациентов.
Фармакокинетические различия по расовому признаку не были изучены.
У пациентов с нарушением функции печени нет необходимости корректировать дозу алендроновой кислоты, поскольку она не метаболизируется и не выводится с желчью.
Показания препарата
Остерепар
- лечение остеопороза у женщин в постменопаузе с целью предупреждения развития переломов, в т.ч. переломов бедра и компрессионных переломов позвоночника;
- лечение остеопороза у мужчин с целью предотвращения возникновения переломов.
Режим дозирования
Препарат принимают внутрь, не разжевывая, запивая питьевой водой, по крайней мере, за 30 мин до первого приема пищи, жидкости или лекарственных препаратов. Другие напитки (включая минеральную воду), пища и некоторые лекарственные средства могут уменьшить всасывание препарата Остерепар®.
Для уменьшения риска возникновения раздражения пищевода препарат Остерепар® следует принимать, выполняя следующие правила:
- принимать утром сразу после подъема с постели;
- запивать полным стаканом воды для облегчения поступления таблетки в желудок;
- не разжевывать таблетки и не рассасывать их во рту из-за возможного образования язв в ротовой полости и глотке;
- пациентам не следует ложиться до первого приема пищи, который следует производить как минимум через 30 мин после приема препарата Остерепар®;
- препарат не следует принимать перед сном или перед подъемом с постели.
Пациентам следует дополнительно принимать препараты кальция и витамина D, если поступление этих веществ с пищей недостаточно.
Лечение остеопороза у женщин в постменопаузе: рекомендуемая доза –1 таб. (70 мг) 1 раз в неделю.
Лечение остеопороза у мужчин: рекомендуемая доза –1 таб. (70 мг) 1 раз в неделю.
Оптимальная длительность применения препарата не установлена. Необходимость продолжения терапии бисфосфонатами должна оцениваться на регулярной основе, особенно после 5 и более лет применения.
Для пациентов пожилого возраста и пациентов с почечной недостаточностью легкой и средней степени тяжести (КК от 35 до 60 мл/мин) коррекции дозы не требуется. Препарат Остерепар® не рекомендуется назначать пациентам с почечной недостаточностью тяжелой степени (КК менее 35 мл/мин) в связи с отсутствием опыта применения у данных пациентов.
Из-за отсутствия клинических данных детям препарат не назначают.
Побочное действие
В однолетнем исследовании у женщин с остеопорозом в период постменопаузы общие профили безопасности алендроната 70 мг 1 раз в неделю (n=519) и алендроната 10 мг/сут (n=370) были в целом схожи.
В двух трехлетних исследованиях с практически идентичным дизайном у женщин в период постменопаузы (алендронат 10 мг: n=196; плацебо: n=397) профили безопасности алендроната 10 мг/сут и плацебо были в целом схожи.
Нежелательные явления, описанные в данных исследованиях как возможно, вероятно или определенно связанные с приемом препарата, представлены в таблице ниже.
Нежелательные явления наблюдались у >1% пациентов в каждой группе приема в однолетнем исследовании. У >1% пациентов, принимавших алендронат 10 мг/сут, нежелательные явления наблюдались с большей частотой, чем в группе плацебо в трехлетнем исследовании.
О следующих нежелательных явлениях сообщалось во время клинических исследований и/или пострегистрационного применения. Частота нежелательных явлений установлена следующим образом: очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (≥1/1000, <1/100), редко (≥1/10000, <1/1000), очень редко (<1/10000, в т.ч. отдельные случаи).
Со стороны иммунной системы: редко – реакции гиперчувствительности, включая крапивницу, отек Квинке.
Со стороны обмена веществ: редко – симптоматическая гипокальциемия, часто на фоне факторов предрасположенности1.
Со стороны нервной системы: часто – головная боль, головокружение2; нечасто – нарушение вкусовых ощущений2.
Со стороны органа зрения: нечасто — воспаление органов зрения (увеит, склерит, эписклерит).
Со стороны органа слуха и лабиринтные нарушения: часто – системное головокружение2; очень редко – остеонекроз наружного слухового канала (нежелательная реакция класса бисфосфонатов).
Со стороны пищеварительной системы: часто – боль в животе, диспепсия, запор, диарея, метеоризм, язва пищевода3, дисфагия3, вздутие живота, кислая отрыжка; нечасто – тошнота, рвота, гастрит, эзофагит3, эрозия пищевода, мелена2; редко – стриктура пищевода3, изъязвление пищевода3, нарушения в верхних отделах пищевода (перфорация, язвы, кровотечение).
Со стороны кожи и подкожных тканей: часто – зуд2, алопеция2; нечасто – кожная сыпь, эритема; редко – кожная сыпь со светочувствительностью, тяжелые кожные реакции, включая синдром Стивенса-Джонсона и токсический эпидермальный некролиз4.
Со стороны костно-мышечной системы: очень часто – скелетно-мышечная боль (в костях, мышцах или суставах), иногда сильная боль1,2; часто – припухлость суставов2; редко – локальный остеонекроз челюсти, ассоциированный главным образом с предшествующей экстракцией зуба и/или локальной инфекцией (включая остеомиелит), часто с медленным выздоровлением1,4, атипичные подвертельные и диафизарные переломы бедренной кости (нежелательная реакция класса бисфосфонатов)5.
Общие расстройства и нарушения в месте введения: часто – астения2, периферический отек2; нечасто – преходящие симптомы как реакция острой фазы (миалгия, недомогание и редко – лихорадка), обычно в связи с началом лечения2.
1 См. раздел «Особые указания».
2 В клинических исследованиях частота была сопоставимой для группы препарата и плацебо.
3 См. разделы «Режим дозирования» и «Особые указания».
4 Данная нежелательная реакция была установлена в ходе пострегистрационного наблюдения.
5 Установлено при пострегистрационном применении.
Противопоказания к применению
- аномалии пищевода и другие факторы, затрудняющие проходимость пищевода (в т.ч. ахалазия, стриктура);
- неспособность пациента оставаться в вертикальном положении, хотя бы сидя, в течение 30 мин;
- гипокальциемия;
- тяжелый гипопаратиреоз;
- хроническая почечная недостаточность (КК менее 35 мл/мин);
- дефицит витамина D;
- тяжелые нарушения минерального обмена;
- беременность;
- период грудного вскармливания;
- детский возраст;
- дефицит лактазы, непереносимость галактозы, глюкозо-галактозная мальабсорбция (препарат содержит лактозу);
- повышенная чувствительность к компонентам препарата.
С осторожностью: заболевания ЖКТ в фазе обострения (дисфагия, заболевания пищевода, эзофагит, гастрит, дуоденит, язвенная болезнь желудка и двенадцатиперстной кишки); серьезные заболевания ЖКТ, перенесенные в предшествующие 12 месяцев (например, пептическая язва, желудочно-кишечное кровотечение), хирургическое вмешательство на верхних отделах ЖКТ, за исключением пилоропластики; предрасположенность к гипокальциемии (гипотиреоз, мальабсорбция кальция); дефицит витамина D.
Применение при беременности и кормлении грудью
Беременность
Нет данных о применении алендроновой кислоты у беременных женщин. Однако существует теоретический риск негативного влияния на плод (в особенности на костную ткань), если беременность наступает после прохождения курса терапии бисфосфонатами. При исследованиях на животных было выявлено нарушение формирования костной ткани плода при применении алендроновой кислоты в высоких дозах, дисфункция родовой деятельности, связанная с гипокалиемией. Применение алендроновой кислоты во время беременности противопоказано.
Период грудного вскармливания
Данных о проникновении в грудное молоко нет; прием алендроновой кислоты в период кормления грудью противопоказан.
Применение при нарушениях функции печени
У пациентов с нарушением функции печени нет необходимости корректировать дозу алендроновой кислоты, поскольку она не метаболизируется и не выводится с желчью.
Применение при нарушениях функции почек
Противопоказано применение препарата при хронической почечной недостаточности (КК менее 35 мл/мин).
Для пациентов с почечной недостаточностью легкой и средней степени тяжести (КК от 35 до 60 мл/мин) коррекции дозы не требуется.
Применение у детей
Из-за отсутствия клинических данных детям препарат не назначают.
Применение у пожилых пациентов
Для пациентов пожилого возраста коррекции дозы не требуется.
Особые указания
Нежелательные реакции со стороны верхних отделов ЖКТ
Алендронат может вызывать местное раздражение слизистой оболочки верхних отделов ЖКТ. В связи с этим во время приема алендроната следует соблюдать осторожность при назначении препарата пациентам с заболеваниями верхних отделов ЖКТ, например, при дисфагии, заболевании пищевода, гастрите, дуодените, язве, серьезном заболевании ЖКТ, перенесенном в предшествующие 12 месяцев, например, при пептической язве, а также при активном желудочно-кишечном кровотечении, хирургической операции на верхних отделах ЖКТ, за исключением пилоропластики (см. раздел «Противопоказания»). Для пациентов с диагностированным пищеводом Барретта вопрос о назначении алендроната должен решаться индивидуально на основании оценки отношения ожидаемой пользы к возможному риску.
При лечении алендронатом известны случаи нежелательных реакций со стороны пищевода (эзофагит, язва или эрозия пищевода), иногда протекавших в тяжелой форме и требовавших стационарного лечения, и в редких случаях, осложнявшихся формированием стриктуры. В связи с этим врачам необходимо уделять особое внимание любым признакам или симптомам, указывающим на возможные нарушения со стороны пищевода, а пациенты должны быть предупреждены о необходимости прекращения приема алендроната и обращения к врачу при появлении симптомов раздражения пищевода, таких как дисфагия, боль при глотании или боль за грудиной, появление или усиление изжоги (см. раздел «Побочное действие»).
Риск возникновения тяжелых нежелательных явлений со стороны пищевода выше у тех пациентов, которые нарушают рекомендации по приему препарата и/или продолжают принимать его при появлении симптомов раздражения пищевода. Особенно важно дать пациенту рекомендации по приему препарата, чтобы он понимал, что риск развития поражения пищевода возрастает в случае невыполнения данных рекомендаций (см. раздел «Режим дозирования»).
Хотя в расширенных клинических исследованиях алендроната повышения риска возникновения нежелательных явлений со стороны ЖКТ не отмечалось, в пострегистрационных отчетах сообщалось о редких случаях развития язвы желудка и двенадцатиперстной кишки, иногда тяжелой и осложненной (см. раздел «Побочное действие»).
Остеонекроз челюсти
У больных раком, при лечении которых проводилось в/в введение бисфосфонатов, отмечались случаи остеонекроза челюсти, обусловленного главным образом предшествующей экстракцией зуба и/или локальной инфекцией (включая остеомиелит). Многие из пациентов также получали химиотерапию и ГКС. Также известны случаи остеонекроза челюсти у пациентов с остеопорозом, принимавших бисфосфонаты перорально.
При оценке индивидуального риска развития некроза челюсти следует учитывать следующие факторы риска:
- активность бисфосфоната (наивысшая у золедроновой кислоты), путь введения (см. выше) и общая доза;
- рак, химиотерапия, радиотерапия, применение ГКС, ингибиторов ангиогенеза, курение;
- болезни зубов в анамнезе, низкий уровень гигиены полости рта, пародонтоз, инвазивные стоматологические процедуры и плохо подобранные протезы.
Перед началом терапии пероральными бисфосфонатами пациентам с неудовлетворительным стоматологическим статусом рекомендуется стоматологический осмотр и превентивные лечебные мероприятия.
Во время курса бисфосфонатов таким пациентам рекомендуется по возможности избегать инвазивных стоматологических процедур. Если у пациента развился остеонекроз челюсти во время терапии бисфосфонатами, хирургическое стоматологическое лечение может ухудшить его состояние. Неизвестно, уменьшает ли прекращение приема бисфосфонатов риск остеонекроза челюсти у пациентов, которым требуются стоматологические процедуры. В каждом случае решение должен принимать лечащий врач на основании оценки отношения ожидаемой пользы к возможному риску для конкретного пациента.
Во время терапии бисфосфонатами следует разъяснить пациентам важность правильной гигиены полости рта, профилактических осмотров, а также предупредить их о необходимости сообщения о любых симптомах со стороны полости рта, например, подвижности зубов, боли или появлении припухлости.
Остеонекроз наружного слухового канала
Сообщалось о случаях остеонекроза наружного слухового канала на фоне приема бисфосфонатов, главным образом при длительной терапии. Возможные факторы риска развития остеонекроза наружного слухового канала включают применение стероидов и химиотерапию и/или местные факторы риска, такие как инфекция или травма. Следует рассмотреть возможность наличия остеонекроза наружного слухового канала у пациентов, принимающих бисфосфонаты, у которых отмечено наличие нарушений со стороны органа слуха, таких как боль, выделения или хроническая инфекция.
Скелетно-мышечная боль
Известно о случаях появления болей в костях, суставах и/или мышцах во время курса бисфосфонатов. Во время пострегистрационного применения в редких случаях данные симптомы были выраженными и/или приводили к инвалидности (см. раздел «Побочное действие»).
Время появления симптомов варьировало от одного дня до нескольких месяцев после начала лечения. У большинства пациентов симптомы разрешались после прекращения лечения. У некоторых из них симптомы появлялись снова при возобновлении приема того же препарата или другого бисфосфоната.
Атипичные переломы бедра
Известно о случаях атипичных подвертельных или диафизарных переломов бедра при лечении бисфосфонатами, главным образом у пациентов, получающих длительную терапию по поводу остеопороза. Эти поперечные или косые переломы могут возникнуть по всей длине бедра от малого вертела бедренной кости до надмыщелкового расширения. Данные переломы происходят после незначительной травмы или без нее, некоторые пациенты испытывают сильную боль в бедре или паховой области, которая часто сочетается с рентгенологическими симптомами стрессовых переломов, за несколько недель или месяцев до появления полной картины перелома бедра. Переломы часто бывают двусторонними, поэтому у пациентов с переломом бедра, принимающих бисфосфонаты, следует обследовать второе (контралатеральное) бедро. Известно, что данные переломы плохо срастаются. При подозрении на атипичный перелом бедра следует рассмотреть возможность прекращения терапии бисфосфонатами до проведения индивидуальной оценки отношения ожидаемой пользы к возможному риску.
Во время терапии бисфосфонатами следует рекомендовать пациентам сообщать о любых болях в бедре или в паховой области. Всех пациентов, поступивших с такими жалобами, необходимо осматривать на предмет неполного перелома бедренной кости.
Кожные реакции
Во время пострегистрационного применения поступали редкие сообщения о тяжелых кожных реакциях, включая синдром Стивенса-Джонсона и токсический эпидермальный некролиз.
Пропуск приема препарата
Пациентов следует предупредить, что при случайном пропуске приема препарата Остерепар® 1 раз в неделю им следует принять 1 таблетку утром ближайшего дня после того, как они вспомнят. Не следует принимать две таблетки в один день, но в последующем необходимо вернуться к приему препарата 1 раз в неделю в тот день недели, который был выбран в начале лечения.
Почечная недостаточность
Препарат Остерепар® противопоказан пациентам с почечной недостаточностью при КК менее 35 мл/мин (см. раздел «Противопоказания»).
Метаболизм костной ткани и минеральный обмен
Следует принимать во внимание и другие причины остеопороза, помимо дефицита эстрогенов и возраста.
При наличии гипокальциемии концентрацию кальция в крови необходимо нормализовать до начала лечения алендронатом (см. раздел «Противопоказания»). Другие нарушения минерального обмена (например, дефицит витамина D и гипопаратиреоз) также должны быть эффективно пролечены до начала терапии алендронатом. У пациентов с данными нарушениями во время терапии препаратом Остерепар® необходимо контролировать концентрацию кальция в сыворотке крови и симптомы гипокальциемии.
Поскольку алендронат увеличивает содержание минеральных веществ в костях, может наблюдаться снижение концентрации кальция и фосфатов в сыворотке крови, особенно у пациентов, принимающих ГКС, у которых всасывание кальция может быть снижено.
Обычно такое снижение небольшое и бессимптомное. Тем не менее, известны редкие случаи симптоматической гипокальциемии, которая иногда достигала тяжелой степени и развивалась у пациентов с соответствующей предрасположенностью (например, гипопаратиреоз, дефицит витамина D и мальабсорбция кальция) (см. раздел «Побочное действие»).
Вспомогательные вещества
Препарат Остерепар® содержит лактозы моногидрат. Пациентам с редкими наследственными заболеваниями, такими как непереносимость галактозы, дефицит лактазы или глюкозо-галактозная мальабсорбция, не следует принимать данный препарат.
Влияние на способность к управлению транспортными средствами и механизмами
Исследований по влиянию алендроновой кислоты на способность управлять транспортными средствами и работу с точными механизмами не проводилось. Однако, учитывая возможность развития побочных реакций (головокружение и других), следует соблюдать осторожность при управлении транспортными средствами, точными механизмами и воздерживаться от выполнения указанных видов деятельности в случае развития побочных эффектов.
Передозировка
Симптомы: боли в животе, диспептические расстройства, дисфагия, изжога, эзофагит, гастрит; могут развиться гипокальциемия и гипофосфатемия.
Лечение: симптоматическое. Показано применение молока и антацидных препаратов для связывания алендроната. В связи с риском поражения пищевода не следует вызывать рвоту, пациент должен находиться в вертикальном положении.
Лекарственное взаимодействие
Кальций, антациды, некоторые пероральные препараты, пища, напитки, в т.ч. минеральные воды, влияют на всасываемость алендроната; лекарственные средства можно принимать внутрь не ранее чем через 1 ч после приема алендроната.
Ранитидин повышает биодоступность (клиническое значение неизвестно).
При совместном применении препарата Остерепар® и заместительной гормональной терапии (эстроген ± прогестин) безопасность и переносимость комбинированной терапии соответствуют таковым при применении каждого из этих препаратов в отдельности. В клинических исследованиях препарата Остерепар® у мужчин, женщин в постменопаузе и пациентов, принимающих ГКС, не было выявлено клинически значимого лекарственного взаимодействия в отношении влияния на связывание с белками, почечной экскреции и метаболизма.
Частота нежелательных явлений со стороны верхнего отдела ЖКТ увеличивается при сочетании препарата Остерепар® в дозе более 10 мг/сут с препаратами, содержащими ацетилсалициловую кислоту. Однако данный эффект не наблюдался при приеме препарата Остерепар® в дозе 70 мг 1 раз в неделю.
Препарат Остерепар® может быть назначен с осторожностью (из-за риска развития желудочно-кишечного кровотечения) пациентам, принимающим НПВП, однако по результатам клинического исследования не было выявлено клинически значимого лекарственного взаимодействия и увеличения частоты побочных эффектов при совместном применении препаратов.
Условия хранения препарата Остерепар
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°С.
Срок годности препарата Остерепар
Срок годности — 3 года. Не применять по истечении срока годности.
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
АКРИХИН АО
(Россия)

|
|
142450 Московская обл., г.о. Богородский, |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
В основном, говоря про остеопороз, врачи в первую очередь думают о женщине в постменопаузе, в то время как примерно у каждого четвертого мужчины в возрасте старше 50 лет в течение жизни может произойти низкотравматический перелом, а смертность, связанная с данными переломами выше, чем у женщин. Остеопороз у мужчин часто остается не диагностированным, и, соответственно, они не получают должного лечения.
Препараты для лечения остеопороза можно условно разделить на антирезорбтивную терапию, преимущественно подавляющую костную резорбцию за счет действия на остеокласт, и анаболические, которые преимущественно усиливают костеобразование. Абалопаратид — синтетический аналог паратиреоидного гормона (ПТГ) из группы анаболических препаратов, вводимый подкожно. В 2017 г. абалопаратид был одобрен FDA для лечения женщин в постменопаузе с высоким риском переломов: с низкотравматическими переломами в анамнезе или с множественными факторами риска переломов; с отсутствием ответа или непереносимостью других лекарственных препаратов для лечения остеопороза (18 недельное исследование ACTIVE, включившее более чем 2000 пациентов).
Результаты двойного слепого рандомизированного плацебо-контролируемого исследования 3 фазы «Абалопаратид для лечения мужчин с остеопорозом» (ATOM), которые были представлены на ежегодном собрании Американской ассоциации клинической эндокринологии (AACE), продемонстрировали, что абалопаратид также эффективен у мужчин, как и у женщин.
В исследовании ATOM приняли участие 228 мужчин в возрасте 40–85 лет с первичным остеопорозом или остеопорозом, вызванным гипогонадизмом, рандомизированных в соотношении 2:1 для получения подкожных инъекций абалопаратида в дозе 80 мкг/сут или плацебо в течение 12 месяцев. Все пациенты имели Т-критерий ≤ -2,5 в поясничном отделе позвоночника или бедре, либо Т-критерий ≤ -1,5 в сочетании с позвоночными или низкотравматическими внепозвоночными переломомами в анамнезе, подтвержденными рентгенологически за последние 5 лет, либо Т-критерий ≤ -2,0 и возраст старше 65 лет.
При применении абалопаратида увеличение минеральной плотности костной ткани было значительно больше в поясничном отделе позвоночника, бедре в целом и шейке бедренной кости через 3, 6 и 12 месяцев по сравнению с исходным уровнем. В среднем через 12 месяцев прирост составил 8,5%, 2,1% и 3,0% соответственно для группы абалопаратида, по сравнению с 1,2%, 0,01% и 0,2% соответственно для группы плацебо (все p ≤0,0001). Что касается маркеров метаболизма костной ткани, медиана N-терминального пропептида проколлагена 1-го типа (PINP) в сыворотке составила 111,2 нг/мл через 1 месяц лечения абалопаратидом и 85,7 нг/мл через 12 месяцев. Уровень С-концевого телопептида коллагена 1 типа (CTx) в крови составил 0,48 нг/мл через 6 месяцев и 0,45 нг/мл через 12 месяцев в группе абалопаратида. В среднем уровни PINP и CTX значительно увеличились через 3, 6 и 12 месяцев по сравнению с исходными значениями (все р <0,001, по сравнению с плацебо).
За период исследования в группе плацебо произошло 3 перелома, в группе абалопаратида — 1 перелом. Наиболее частыми побочными эффектами являлись покраснение в месте инъекции (12,8% против 5,1%), назофарингит (8,7% против 7,6%), головокружение (8,7% против 1,3%) и артралгии (6,7% против 1,3%). Частота серьезных нежелательных явлений, возникших во время лечения, была одинаковой в обеих группах (5,4% против 5,1%). В группе абалопаратида был зарегистрирован 1 смертельный исход, не связанный с применением препарата.
Таким образом, применение абалопаратида в дозе 80 мкг подкожно 1 раз в сутки продемонстрировало эффективность в отношении остеопороза у мужчин. В настоящее время подана заявка в FDA для разрешения использования абалопаратида у мужчин с остеопорозом с высоким риском переломов.
Источники:
∙ Medscape
∙ Clinicaltrials.gov
Примерно у 60% пациентов, принимавших препарат Палексия в таблетках пролонгированного действия, покрытых плёночной оболочкой, наблюдались побочные действия, преимущественно лёгкой или умеренной интенсивности. Наиболее частыми из них были нарушения со стороны желудочно-кишечного тракта и центральной нервной системы (тошнота, головокружение, запор, головная боль и сонливость).
В таблице ниже представлены побочные действия препарата Палексия, выявленные при его применении. Они представлены по классам и частоте: очень частые (1/10); частые (1/100, <1/10); нечастые (1/1 000, <1/100); редкие (1/10 000, <1/1 000); очень редкие (<1/10 000).
| Системноорганные классы | Очень частые (≥ 1/10) |
Частые (от ≥ 1/100 до < 1/10) |
Нечастые (от ≥ 1/1000 до < 1/100) |
Редкие (от ≥ 1/10 000 до < 1/1000) |
|---|---|---|---|---|
| Нарушения со стороны иммунной системы | Гиперчувствительность* | |||
| Нарушения со стороны обмена веществ и питания | Снижение аппетита | Снижение массы тела | ||
| Нарушения психики | Нарушения сна, тревога, подавленное настроение, повышенная возбудимость, беспокойство | Необычные сновидения, нарушения восприятия, дезориентация в месте и во времени, психомоторное возбуждение, спутанность сознания, эйфория | Лекарственная зависимость, патологическое мышление | |
| Нарушения со стороны нервной системы | Головокружение, головная боль, сонливость | Непроизвольные сокращения мышц, тремор, расстройства внимания | Парестезии, гипестезии, нарушение равновесия, седация, обморок, нарушение памяти, когнитивные нарушения, угнетение сознания, дизартрия | Нарушения координации, предобморочное состояние, судороги |
| Нарушения со стороны органа зрения | Нарушение зрения | |||
| Нарушения со стороны сердца и сосудов | «Приливы» | Увеличение частоты сердечных сокращений, снижение частоты сердечных сокращений, ощущение сердцебиения, снижение артериального давления | ||
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | Одышка | Угнетение дыхания | ||
| Нарушения со стороны желудочнокишечного тракта | Зуд, гипергидроз, сыпь | Крапивница | ||
| Нарушения со стороны почек и мочевыводящих путей | Поллакиурия, затруднение мочеиспускания | |||
| Нарушения со стороны репродуктивной системы и молочной железы | Сексуальная дисфункция | |||
| Общие расстройства и нарушения в месте введения | Усталость, сухость слизистой оболочки (рта, глаз и горла), астения, ощущение изменения температуры тела, отёки | Синдром «отмены», раздражительность, необычные ощущения | Ощущение опьянения, чувство расслабленности |
*Примечание: При постмаркетинговом применении препарата сообщалось о редких случаях ангионевротического отёка, анафилаксии и анафилактического шока.
При приёме препарата Палексия внутрь в таблетках пролонгированного действия, покрытых плёночной оболочкой, длительностью до 1 года отмечены случаи слабо выраженного синдрома «отмены» при резком прерывании терапии, по тяжести они классифицировались как лёгкие. Тем не менее, врачи должны принимать во внимание возможность возникновения синдрома «отмены» и обеспечить необходимое лечение в случае его возникновения.
Риск возникновения суицидальных мыслей выше у пациентов, страдающих от хронической боли. Кроме того, лекарственные препараты с выраженным влиянием на моноаминергическую систему увеличивают риск суицидального поведения у пациентов, страдающих от депрессии, особенно в начале лечения. Клинические исследования и постмаркетинговый опыт применения тапентадола не выявили доказательств повышенного риска.
Если возникли указанные в инструкции побочные эффекты, или замечены другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Инструкция по применению
Фармакологические свойства
Пролиа – медикаментозное средство на основе деносумаба, которое является полным аналогом человеческих антител, вырабатываемых иммунными клетками. Медикамент используется для лечения хронически прогрессирующего системного, обменного заболевания скелета, характеризующегося повышенной ломкостью костей, убыли костной ткани, связанной с приемом медикаментов, риска распространения опухолевых клеток из места возникновения в кости и остеобластокластомы.
Препарат эффективно используется для терапии женщин в период климакса, которые страдают от хрупкости и ослабленности костной ткани, защищая их от переломов и травм костей.
Эффективность и полезные действия препарата доказаны многочисленными исследованиями, а также отзывами пациентов, которые начали использование медикамента и продолжали курс терапии продолжительное время.
Состав и форма выпуска
Медикаментозное средство продается в виде раствора, который используется для инъекций. Раствор практически не обладает цветом, может иметь небольшой светло-желтый оттенок. Раствор не должен иметь никаких примесей и осадков. Средство упаковано в шприц-тюбик, что способствует более удобному использованию.
В состав препарата входят следующие компоненты:
• деносумаб;
• глюцит;
• твин 20;
• безводная этановая кислота;
• каустическая сода;
Показания к применению
Медикаментозное средство необходимо начать принимать при возникновении следующих проблем со здоровьем:
• терапия хронически прогрессирующего системного, обменного заболевания скелета, характеризующегося повышенной ломкостью костей, у женщин в период климакса;
• терапия убыли костной ткани у женщин, которые начали лечение злокачественной опухоли железистой ткани молочной железы с использованием блокаторов ароматазы;
• терапия убыли костной ткани у мужчин, которые проходят лечение рака простаты с использованием андрогенных депривационных препаратов;
Международная классификация болезней (МКБ-10)
М.81.0. Постменопаузный остеопороз;
М.81.4. Лекарственный остеопороз.
Побочные эффекты
Применение медикаментозного средства может стать причиной проявления побочных эффектов, таких как:
• понижение содержания кальция в плазме крови;
• «синдром мертвой челюсти»;
• нарушение зрения;
• помутнение хрусталика глаза у мужчин;
• изменения гиподермы и дермы;
• кожная болезнь, сопровождающаяся зудом и появлением пузырьков, гнойничков, чешуек;
• воспалительное поражение кожи;
• боли в конечностях;
• аллергия.
При проявлении побочных признаков пациенту необходимо сообщить об этом лечащему врачу, который примет решение об отмене или корректировке дозировки препарата и окажет соответствующую терапевтическую помощь.
Противопоказания
Медикаментозное средство запрещено принимать при:
• патологическом состоянии, при котором содержание общего кальция в плазме крови ниже нормы;
• повышенной восприимчивости к компонентам препарата.
Применение при беременности
Нет данных и показаний об использовании медикамента Пролиа женщинами, вынашивающими ребенка, а значит, нет научного подтверждения о безопасности средства для развивающегося в утробе женщины плода. Для безопасности мамы и ребенка принимать медикамент беременным женщинам запрещено.
Нет сведений о проникновении компонентов препарата в организм младенца с молоком матери, поэтому рекомендуется прекратить грудное вскармливание в период использования медикамента.
Способ и особенности применения
Медикаментозное средство используется в виде раствора для инъекций под кожу. Рекомендуемая дозировка медикамента составляет 60 мг раз в полгода. Одновременно с использованием препарата Пролиа необходимо употреблять медикаменты, содержащие кальций и кальциферолы.
Курс и дозировка определяются индивидуально лечащим врачом после проведения обследования пациента, сбора анализов и определения точной клинической картины заболевания.
Перед использованием медикаментозного средства необходимо проверить упаковку с раствором на целостность, отсутствие примесей и осадка, наличие помутнений и изменения цвета. При каких-либо нарушениях медикамент становится непригодным для использования, и его необходимо утилизировать в соответствии с санитарными нормами. Нельзя взбалтывать или трясти флакон перед инъекцией.
Медикамент должен быть комнатной температуры, нельзя замораживать раствор. Используется каждый шприц-ампула единоразово, остатки средства в шприце выбрасываются.
В период использования препарата пациентам рекомендуется принимать медикаменты, содержащие кальций и кальциферолы, а также обогащенную минералом пищу. Во время использования медикамента необходимо следить за содержанием кальция в крови пациента, во избежание проявления признаков гипокальциемии.
У ряда пациентов могут наблюдаться дерматологические реакции в виде покраснения кожи, зуда, высыпаний, экземы и других воспалительных проявлений. В случае возникновения подобных проблем, пациенту следует сообщить об этом квалифицированному медицинскому персоналу, который примет нужное решение и назначит симптоматическое лечение.
При продолжительной терапии медикаментом при заболевании раком молочной железы или простаты, ряд пациентов может столкнуться с аваскулярным некрозом, характеризующимся угасанием жизни костной ткани в результате плохого притока крови.
Нет сведений и клинических показаний о действии компонентов препарата на возможность управлять транспортными средствами, а также на проявление признаков снижения скорости реакции, поэтому рекомендуется с осторожностью садиться за руль или выполнять работу, требующую повышенной концентрации внимания или быстроты операций во избежание травмоопасных и угрожающих жизни последствий.
Подробная информация о рекомендуемых дозировках, сроках использования и индивидуальных рекомендациях содержится в инструкции.
Терапия детей, не достигших 18-летнего возраста
Медикаментозное средство не рекомендуется применять на детях, так как действие компонентов препарата на растущий и развивающийся организм не выявлено.
Терапия пожилых пациентов, возраст которых превышает 65-летний рубеж
При назначении медикаментозного средства Пролиа пожилым пациентам, лечащему врачу не нужно корректировать дозировку в большую или меньшую сторону.
Терапия пациентов, страдающих заболеваниями почек
Пациентам с заболеваниями почек не требуется дополнительная корректировка дозировки или продолжительности терапии. При нарушениях работы почек в тяжелой форме, есть риск понижения содержания кальция в плазме крови пациента.
При почечных заболеваниях необходимо принимать параллельно препараты, содержащие кальций и витамин D.
Терапия пациентов, страдающих заболеваниями печени
Нет данных и сведений о функционировании медикамента Пролиа и его компонентов на организм пациентов с заболеваниями печени, поэтому назначать препарат следует с особой осторожностью и только под контролем лечащего врача.
Взаимодействие с другими лекарствами
Нет проведенных исследований о взаимодействии препарата Пролиа с другими лекарственными средствами. Не рекомендуется принимать медикамент в сочетании с другими препаратами.
Решение о совмещенной терапии может принимать только лечащий врач, учитывая все риски и последствия.
Передозировка
Нет данных и сведений о передозировке препаратом Пролиа. При проявлении побочных эффектов, а также любых других неприятных симптомов, пациенту необходимо незамедлительно обратиться к лечащему врачу для получения своевременной терапевтической помощи и принятия решения о коррекции дозировки или отмене терапии препаратом.
Аналоги
Аналогичными по составу и фармакологическому воздействию препарату Пролиа, являются лекарства Denosumab и Xgeva. Действия и эффекты этих средств полностью соответствуют медикаменту Пролиа. Решение о замене препарата на аналог принимает исключительно лечащий врач.
Условия продажи
Медикаментозное средство Пролиа продается в аптечных пунктах только по назначению лечащего врача и при наличии рецептурного листа из медицинского учреждения.
Условия хранения
Медикаментозное средство Пролиа необходимо хранить в недосягаемом детьми и защищенном от проникновения любых источников света месте при температуре от 2 до 8 °С. Нельзя замораживать препарат во избежание риска потери фармакологических свойств и появления осадка. Нельзя встряхивать и взбалтывать флакон с препаратом. Подробную информацию о сроках и нормах хранения, а также данные о сроке годности медикамента в открытом и запечатанном виде, содержит инструкция по применению.
Цены на Пролиа в Москве
Заберите заказ в в аптеке
WER (г. Москва)
Выгодные цены
Сертификаты и лицензии
Прадакса — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер
ЛСР-007065/09
Торговое наименование препарата
Прадакса®
Международное непатентованное наименование
Дабигатрана этексилат
Лекарственная форма
к
Состав
Одна капсула содержит 86,48 мг, 126,83 мг или 172,95 мг дабигатрана этексилата мезилата, что соответствует 75 мг, 110 мг или 150 мг дабигатрана этексилата.
Вспомогательные вещества:
Содержимое капсул: акации камедь 4,43 мг, 6,50 мг или 8.86 мг: винная кислота, крупнозернистая 22,14 мг, 32,48 мг или 44,28 мг; винная кислота, порошок 29,52 мг, 43,30 мг или 59,05 мг: винная кислота, кристаллическая 36,90 мг, 54,12 мг или 73,81 мг; гипромеллоза 2,23 мг, 3,27 мг или 4,46 мг; диметикон 0,04 мг, 0,06 мг или 0,08 мг; тальк 17,16 мг, 25,16 мг или 34,31 мг; гипролоза (гидроксипропилцеллюлоза) 17,30 мг, 25,37 мг или 34,59 мг.
Состав капсульной оболочки: капсула из гипромеллозы (НРМС) с надпечаткой черными чернилами 60* мг, 70* мг или 90* мг.
Состав НРМС капсул: каррагинан (Е407) 0,2 мг. 0.22 мг или 0.285 мг: калия хлорид 0,27 мг, 0,31 мг или 0,4 мг; титана диоксид (Е171) 3,6 мг, 4,2 мг или 5,4 мг; индигокармин (Е132) 0.036 мг. 0,042 мг или 0.054 мг; краситель солнечный закат желтый (Е110) 0,002 мг, 0.003 мг или 0.004 мг: гипромеллоза (гидроксипропилметилцеллюлоза) 52,9 мг, 61.71 мг или 79,35 мг, вода очищенная 3,0 мг, 3,5 мг или 4,5 мг.
Состав чернил черных (%, масс.): шеллак 24 — 27%, бутанол 1 — 3%, изопропанол 1 — 3%, краситель железа оксид черный (Е172) 24 — 28%, вода очищенная 15 — 18%, пропиленгликоль 3 — 7%, этанол 23 — 26%, аммиак водный 1 — 2%, калия гидроксид 0,05 — 0,1%.
*Приблизительная масса капсулы составляет 60, 70 или 90 мг.
Описание
Капсулы 75 мг
Продолговатые капсулы из гипромеллозы (гидроксипропилметилцеллюлозы). Крышка — непрозрачная, светло-синего цвета, корпус — непрозрачный кремового цвета. На крышке напечатан символ компании Берингер Ингельхайм, на корпусе — «R 75». Цвет надпечатки — черный.
Капсулы 110 мг
Продолговатые капсулы из гипромеллозы (гидроксипропилметилцеллюлозы). Крышка — непрозрачная светло-синего цвета, корпус — непрозрачный кремового цвета. На крышке напечатан символ компании Берингер Ингельхайм, на корпусе — «R 110». Цвет надпечатки — черный.
Капсулы 150 мг
Продолговатые капсулы из гипромеллозы (гидроксипропилметилцеллюлозы), размер 0. Крышка — непрозрачная светло-синего цвета, корпус — непрозрачный кремового цвета. На крышке напечатан символ компании Берингер Ингельхайм, на корпусе — «R 150». Цвет надпечатки — черный.
Содержимое капсул — желтоватые пеллеты.
Фармакотерапевтическая группа
Тромбина ингибитор прямой
Код АТХ
B01AE07
Фармакодинамика:
Дабигатрана этексилат является низкомолекулярным, не обладающим фармакологической активностью предшественником активной формы дабигатрана. После приема внутрь дабигатрана этексилат быстро всасывается в желудочно-кишечном тракте (ЖКТ) и, путем гидролиза, катализируемого эстеразами, в печени и плазме крови превращается в дабигатран. Дабигатран является мощным конкурентным обратимым прямым ингибитором тромбина и основным активным веществом в плазме крови.
Так как тромбин (сериновая протеаза) в процессе коагуляции превращает фибриноген в фибрин, угнетение активности тромбина препятствует образованию тромба. Дабигатран оказывает ингибирующее воздействие на свободный тромбин, тромбин, связанный с фибриновым сгустком, и вызванную тромбином агрегацию тромбоцитов.
В экспериментальных исследованиях на различных моделях тромбоза in vivo и ex vivo подтверждено антитромботическое действие и антикоагулянтная активность дабигатрана после внутривенного введения и дабигатрана этексилата — после приема внутрь. Установлена прямая корреляция между концентрацией дабигатрана в плазме крови и выраженностью антикоагулянтного эффекта. Дабигатран удлиняет активированное частичное тромбопластиновое время (АЧТВ), экариновое время свертывания (ЭВС) и тромбиновое время (ТВ).
Профилактика венозных тромбоэмболии (ВТЭ) после эндопротезирования крупных суставов
Результаты клинических исследований у пациентов, перенесших ортопедические операции — эндопротезирование коленного и тазобедренного суставов, — подтвердили сохранение параметров гемостаза и эквивалентность применения 75 мг или 110 мг дабигатрана этексилата через 1-4 часа после операции и последующей поддерживающей дозы 150 или 220 мг один раз в сутки в течение 6-10 дней (при операции на коленном суставе) и 28-35 дней (на тазобедренном суставе), по сравнению с эноксапарином в дозе 40 мг 1 раз в сутки, который применяли накануне и после операции.
Показана эквивалентность антитромботического эффекта дабигатрана этексилата при применении 150 мг или 220 мг по сравнению с эноксапарином в дозе 40 мг в сутки при оценке основной конечной точки, которая включает все случаи венозных тромбоэмболий и смертность от любых причин.
Профилактика инсульта и системных тромбоэмболий у пациентов с фибрилляцией предсердий
При длительном, в среднем около 20 месяцев, применении у пациентов с фибрилляцией предсердий и с умеренным или высоким риском инсульта или системных тромбоэмболий было показано, что дабигатрана этексилат в дозе 110 мг, назначенный 2 раза в день, не уступал варфарину по эффективности предотвращения инсульта и системных тромбоэмболий у пациентов с фибрилляцией предсердий; так же в группе дабигатрана было отмечено снижение риска внутричерепных кровотечений и общей частоты кровотечений.
Применение более высокой дозы препарата (150 мг 2 раза в день) достоверно снижало риск ишемического и геморрагического инсультов, сердечно-сосудистой смертности, внутричерепных кровотечений и общей частоты кровотечений по сравнению с варфарином. Меньшая доза дабигатрана характеризовалась существенно более низким риском больших кровотечений по сравнению с варфарином.
Чистый клинический эффект оценивался путем определения комбинированной конечной точки, включавшей частоту инсульта, системных тромбоэмболий, легочных тромбоэмболий, острого инфаркта миокарда, сердечно-сосудистой смертности и больших кровотечений.
Ежегодная частота перечисленных событий у пациентов, получавших дабигатрана этексилат, была ниже, чем у пациентов, получавших варфарин.
Изменения в лабораторных показателях функции печени у пациентов, получавших дабигатрана этексилат, отмечались со сравнимой или меньшей частотой по сравнению с пациентами, получавшими варфарин.
Профилактика тромбоэмболии у пациентов с протезированными клапанами сердца
В ходе клинических исследований фазы II применения дабигатрана и варфарина у пациентов, перенесших операцию по замене клапана сердца механическим протезом (недавно проведенные операции и операции, проведенные более 3-х месяцев назад), было выявлено повышение частоты тромбоэмболий и общего числа кровотечений (преимущественно за счет малых кровотечений) у пациентов, получавших дабигатрана этексилат. В раннем послеоперационном периоде большие кровотечения в основном характеризовались геморрагическим выпотом в перикард, особенно у пациентов, которым дабигатран этексилат был назначен в раннем периоде (на 3 день) после хирургической замены клапанов сердца.
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями
Результаты клинических исследований у пациентов с наличием острого ТГВ и/или ТЭЛА, которые первоначально получали парентеральную терапию в течение, как минимум, 5 дней, подтвердили, что дабигатрана этексилат в дозе 150 мг, назначенный 2 раза в день, не уступал варфарину по эффективности в отношении снижения частоты рецидивирующего симптоматического ТГВ и/или ТЭЛА и случаев смерти, обусловленных этими заболеваниями, на протяжении 6-месячного периода лечения. У пациентов, получавших дабигатрана этексилат. кровотечения отмечались значительно реже, чем у пациентов, получавших варфарин.
Частота развития инфаркта миокарда во всех проводимых исследованиях при ВТЭ, во всех лечебных группах была низкой.
Показатели функции печени
В исследованиях с применением активных препаратов сравнения возможные изменения показателей функции печени возникали у пациентов, получавших дабигатрана этексилат, со сравнимой или меньшей частотой, чем у пациентов, получавших варфарин. В исследовании с плацебо существенного различия в отношении изменений показателей функции печени, возможно имеющих клиническое значение, между группами с применением дабигатрана и плацебо не отмечалось.
Профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями
Результаты клинического исследования у пациентов с рецидивирующим ТГВ и ТЭЛА, уже получавших в течение от 3 до 12 месяцев антикоагулянтную терапию и нуждавшихся в ее продолжении, подтвердили, что лечение дабигатрана этексилатом в дозе 150 мг два раза в день не уступало лечебному эффекту варфарина (р=0,0135). У пациентов, получавших дабигатрана этексилат, кровотечения отмечались значительно реже, чем у пациентов, получавших варфарин.
В исследовании сравнения дабигатрана этексилата с плацебо у пациентов, уже получавших в течение от 6 до 18 месяцев антагонисты витамина К, было установлено, что дабигатран превосходил плацебо в отношении профилактики рецидивирующего симптоматического ТГВ/ТЭЛА. включая случаи смерти от неустановленной причины; снижение риска за период лечения составило 92% (р<0,0001).
Частота развития инфаркта миокарда во всех проводимых исследованиях при ВТЭ во всех лечебных группах была низкой.
Показатели функции печени
В исследованиях с применением активных препаратов сравнения возможные изменения показателей функции печени возникали у пациентов, получавших дабигатрана этексилат. со сравнимой или меньшей частотой, чем у пациентов, получавших варфарин. В исследовании с плацебо существенного различия в отношении изменений показателей функции печени, возможно имеющих клиническое значение, между группами с применением дабигатрана и плацебо не отмечалось.
Фармакокинетика:
После перорального введения дабигатрана этексилата отмечается быстрое дозозависимое увеличение его концентрации в плазме крови и площади под кривой «концентрация-время» (AUC). Максимальная концентрация дабигатрана этексилата (Сmах) достигается в течение 0,5-2 ч.
После достижения Cmax плазменные концентрации дабигатрана снижаются биэкспоненциально, конечный период полувыведения (Т1/2) в среднем составляет около 11 ч (у людей пожилого возраста). Конечный Т1/2 после многократного применения препарата составлял около 12-14 ч. Т1/2 не зависит от дозы. Однако в случае нарушений функции почек Т1/2 удлиняется.
Абсолютная биодоступность дабигатрана после приема дабигатрана этексилата внутрь в капсулах, покрытых оболочкой из гипромеллозы, составляет около 6,5%.
Прием пищи не влияет на биодоступность дабигатрана этексилата, однако время достижения Сmax возрастает на 2 ч.
При использовании дабигатрана этексилата без специальной капсульной оболочки, изготовленной из гипромеллозы, биодоступность дабигатрана при применении без капсульной оболочки по сравнению с лекарственной формой в капсулах может увеличиваться примерно на 75% (в 1,8 раза) при однократном приеме и примерно на 37% (в 1,4 раза) в равновесном состоянии. Поэтому следует сохранять целостность капсул, изготовленных из гипромеллозы, учитывая риск повышения биодоступности дабигатрана этексилата, и не рекомендуется вскрывать капсулы и применять их содержимое в чистом виде (например, добавляя в пищу или напитки) (см. раздел «Способ применения и дозы»).
При применении дабигатрана этексилата через 1-3 ч у пациентов после оперативного лечения отмечается снижение скорости всасывания препарата по сравнению со здоровыми добровольцами. AUCхарактеризуется постепенным повышением амплитуды без появления высокого пика концентрации в плазме. Сmах в плазме крови отмечается через 6 ч после применения дабигатрана этексилата или через 7-9 ч после операции.
Следует отметить, что такие факторы, как анестезия, парез ЖКТ и хирургическая операция могут иметь значение в замедлении всасывания, независимо от лекарственной формы препарата. Снижение скорости всасывания препарата отмечается обычно только в день операции. В последующие дни всасывание дабигатрана происходит быстро, с достижением Сmах через 2 ч после его приема внутрь.
Метаболизм
После приема внутрь в процессе гидролиза под влиянием эстеразы дабигатрана этексилат быстро и полностью превращается в дабигатран, который является основным активным метаболитом в плазме крови. При конъюгации дабигатрана образуется 4 изомера фармакологически активных ацилглюкуронидов: 1-О, 2-О, 3-О, 4-О, каждый из которых составляет менее 10% от общего содержания дабигатрана в плазме крови. Следы других метаболитов обнаруживаются только при использовании высокочувствительных аналитических методов.
Распределение
Объем распределения дабигатрана составляет 60-70 л и превосходит объем общего содержания воды в организме, что указывает на умеренное распределение дабигатрана в тканях.
Выведение
Дабигатран выводится в неизмененном виде, преимущественно почками (85%), и только 6% — через ЖКТ. Установлено, что через 168 ч после введения меченного радиоактивного препарата 88-94% его дозы выводится из организма.
Дабигатран обладает низкой способностью связывания с белками плазмы крови (34-35%), она не зависит от концентрации препарата.
Особые группы пациентов
Пожилые пациенты
У лиц пожилого возраста значение AUC выше, чем у молодых лиц, в 1,4-1,6 раза (на 40- 60%), а Сmах — более чем в 1,25 раза (на 25%).
Наблюдаемые изменения коррелировали с возрастным снижением клиренса креатинина (КК).
У женщин пожилого возраста (старше 65 лет) величины AUCt,ss иCmax,ss были примерно в 1,9 раза и в 1,6 раза выше, чем у женщин молодого возраста (18-40 лет), а у мужчин пожилого возраста — в 2,2 и 2,0 раза выше, чем у мужчин молодого возраста.
В исследовании у пациентов с фибрилляцией предсердий подтверждено влияние возраста на экспозицию дабигатрана: исходные концентрации дабигатрана у пациентов в возрасте >75 лет были примерно в 1,3 раза (на 31%) выше, а у пациентов в возрасте <65 лет — примерно на 22% ниже, чем у пациентов в возрасте 65-75 лет.
Нарушение функции почек
У добровольцев с умеренным нарушением функции почек (КК — 30-50 мл/мин) значение AUC дабигатрана после приема внутрь было приблизительно в 3 раза больше, чем у лиц с неизмененной функцией почек.
У пациентов с тяжелыми нарушениями функции почек (КК — 10-30 мл/мин) значения AUC дабигатрана этексилата и Т1/2 возрастали соответственно в 6 и 2 раза, по сравнению с аналогичными показателями у лиц без нарушений функции почек.
У пациентов с фибрилляцией предсердий и умеренной почечной недостаточностью (КК 30-50 мл/мин) концентрации дабигатрана до и после применения препарата были в среднем в 2,29 и в 1,81 раза выше, чем у пациентов без нарушений функции почек. При лечении острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактики смертельных исходов, вызываемых этими заболеваниями у пациентов с легкой и умеренной степенью почечной недостаточности (КК 30-50 мл/мин), базальная концентрация дабигатрана в период устойчивого состояния фармакокинетики были в среднем в 1,7 и в 3,4 раза выше, чем у пациентов с КК > 80 мл/мин.
При использовании гемодиализа у пациентов без фибрилляции предсердий было установлено, что количество выводившегося препарата пропорционально скорости тока крови. Длительность диализа, со скоростью тока диализата 700 мл/мин, составляла 4 часа, а скорость тока крови — 200 мл/мин или 350-390 мл/мин. Это приводило к удалению соответственно 50% и 60% концентраций свободного и общего дабигатрана. Антикоагулянтная активность дабигатрана снижалась по мере уменьшения концентраций в плазме, взаимосвязь ФК и ФД не менялась.
Нарушение функции печени
У пациентов с умеренным нарушением функции печени (7-9 баллов по шкале Чайлд-Пью) не было выявлено изменений концентрации дабигатрана в плазме крови по сравнению с пациентами без нарушения функции печени.
Масса тела
В исследованиях базальные концентрации дабигатрана у пациентов с массой тела >100 кг были примерно на 20% ниже, чем у пациентов с массой тела 50-100 кг. Масса тела у большинства (80,8%) пациентов составляла >50 — <100 кг, в пределах этого диапазона явных различий концентраций дабигатрана не установлено. Данные в отношении пациентов с массой тела <50 кг ограничены.
Пол
В основных исследованиях по профилактике развития ВТЭ установлено, что воздействие препарата у женщин было примерно в 1,4-1,5 раза (на 40-50%) выше. У пациенток с фибрилляцией предсердий базальные концентрации и концентрации после применения препарата были в среднем в 1,3 (на 30%) выше. Установленные различия не имели клинического значения.
Этнические группы
В сравнительном исследовании фармакокинетики дабигатрана у европейцев и японцев после однократного и повторного приема препарата в исследуемых этнических группах не было выявлено клинически значимых различий. Фармакокинетические исследования у пациентов негроидной расы ограничены, однако имеющиеся данные указывают на отсутствие значимых различий.
Показания:
— Профилактика венозных тромбоэмболий у пациентов после ортопедических операций;
— профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий;
— лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями;
— профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями.
Противопоказания:
— Известная гиперчувствительность к дабигатрану, дабигатрана этексилату или к любому из вспомогательных веществ;
— тяжелая степень почечной недостаточности (КК менее 30 мл/мин);
— активное клинически значимое кровотечение, геморрагический диатез, спонтанное или фармакологически индуцированное нарушение гемостаза;
— поражение органов в результате клинически значимого кровотечения, включая геморрагический инсульт в течение 6 месяцев до начала терапии;
— существенный риск развития большого кровотечения из имеющегося или недавнего изъязвления ЖКТ, наличие злокачественных образований с высоким риском кровотечения, недавнее повреждение головного или спинного мозга, недавняя операция на головном или спинном мозге или офтальмологическая операция, недавнее внутричерепное кровоизлияние, наличие или подозрение на варикозно-расширенные вены пищевода, врожденные артериовенозные дефекты, сосудистые аневризмы или большие внутрипозвоночные или внутримозговые сосудистые нарушения;
— одновременное назначение любых других антикоагулянтов, в том числе, нефракционированного гепарина, низкомолекулярных гепаринов (НМГ) (эноксапарин, дальтепарин и др.), производные гепарина (фондапаринукс и др.), пероральные антикоагулянты (варфарин, ривароксабан, апиксабан и др.), за исключением случаев перехода лечения с или на препарат ПРАДАКСА® или в случае применения нефракционированного гепарина в дозах, необходимых для поддержания центрального венозного или артериального катетера;
— одновременное назначение кетоконазола для системного применения, циклоспорина, итраконазола, такролимуса и дронедарона;
— нарушения функции печени и заболевания печени, которые могут повлиять на выживаемость;
— наличие протезированного клапана сердца;
— возраст до 18 лет (клинические данные отсутствуют).
С осторожностью:
При состояниях, повышающих риск кровотечения:
— возраст 75 лет и старше;
— умеренное снижение функции почек (КК 30-50 мл/мин);
— одновременное применение ингибиторов Р-гликопротеина (за исключением указанных в разделе «Противопоказания»);
— масса тела меньше 50 кг;
— одновременный прием ацетилсалициловой кислоты, НПВП, клопидогрела, селективных ингибиторов обратного захвата серотонина и селективных ингибиторов обратного захвата норадреналина, а также других препаратов, применение которых может нарушать гемостаз;
— врожденные или приобретенные заболевания свертывающей системы крови;
— тромбоцитопения или функциональные дефекты тромбоцитов;
— недавно проведенная биопсия или перенесенная обширная травма;
— бактериальный эндокардит;
— эзофагит, гастрит или гастроэзофагеальная рефлюксная болезнь.
Беременность и лактация:
Данные о применении дабигатрана этексилата во время беременности отсутствуют. Потенциальный риск у человека неизвестен.
В экспериментальных исследованиях не установлено неблагоприятного воздействия на фертильность или постнатальное развитие новорождённых.
Женщинам репродуктивного возраста следует избегать наступления беременности при лечении препаратом ПРАДАКСА®. При наступлении беременности применение препарата не рекомендуется, за исключением случаев, когда ожидаемая польза превышает возможный риск.
При необходимости применения препарата в период грудного вскармливания, в связи с отсутствием клинических данных, грудное вскармливание рекомендуется прекратить (в качестве меры предосторожности).
Способ применения и дозы:
Капсулы следует принимать внутрь, 1 или 2 раза в день независимо от времени приема пищи, запивая стаканом воды для облегчения прохождения препарата в желудок. Не следует вскрывать капсулу.
Особые указания при изъятии капсул из блистера:
— оторвите один индивидуальный блистер от блистер-упаковки по линии перфорации;
— выньте капсулу из блистера, отслаивая фольгу;
— не выдавливайте капсулы через фольгу.
Применение у взрослых:
Профилактика венозных тромбоэмболий (ВТЭ) у пациентов после ортопедических операций: рекомендованная доза составляет 220 мг 1 раз в сутки (2 капсулы по 110 мг).
У пациентов с умеренным нарушением функции почек в связи с риском кровотечений рекомендованная доза составляет 150 мг 1 раз в сутки (2 капсулы по 75 мг).
Профилактика ВТЭ после эндопротезирования коленного сустава: применение препарата ПРАДАКСА следует начинать через 1-4 ч после завершения операции с приема 1 капсулы (110 мг) с последующим увеличением дозы до 2 капсул (220 мг) однократно в сутки в течение последующих 10 дней. Если гемостаз не достигнут, лечение следует отложить. Если лечение не началось в день операции, терапию следует начинать с приема 2 капсул (220 мг) однократно в сутки.
Профилактика ВТЭ после эндопротезирования тазобедренного сустава: применение препарата ПРАДАКСА следует начинать через 1-4 ч после завершения операции с приема 1 капсулы (110 мг) с последующим увеличением дозы до 2 капсул (220 мг) однократно в сутки в течение последующих 28-35 дней. Если гемостаз не достигнут, лечение следует отложить. Если лечение не началось в день операции, терапию следует начинать с приема 2 капсул (220 мг) однократно в сутки.
Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий: рекомендуется применение препарата ПРАДАКСА в суточной дозе 300 мг (1 капсула по 150 мг 2 раза в день). Терапия должна продолжаться пожизненно.
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями: рекомендуется применение препарата ПРАДАКСА в суточной дозе 300 мг (1 капсула по 150 мг 2 раза в день) после парентерального лечения антикоагулянтом, проводящимся в течение как минимум 5 дней. Терапия должна продолжаться до 6 месяцев.
Профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями: рекомендуется применение препарата ПРАДАКСА в суточной дозе 300 мг (1 капсула по 150 мг 2 раза в день). Терапия может продолжаться пожизненно, в зависимости от индивидуальных факторов риска.
Применение в особых группах пациентов
Применение у детей
У пациентов до 18 лет эффективность и безопасность препарата ПРАДАКСА не изучали, поэтому применение у детей не рекомендуется (см. раздел «Противопоказания»).
Нарушение функции почек
Перед терапией, во избежание назначения препарата пациентам с тяжелыми нарушениями функции почек (КК менее 30 мл/мин), необходимо предварительно оценить клиренс креатинина. В связи с отсутствием данных по применению препарата у пациентов с тяжелыминарушениями функции почек (КК менее 30 мл/мин) применение препарата ПРАДАКСА противопоказано (см. раздел «Противопоказания»).
Функция почек должна оцениваться в процессе лечения, когда возникает подозрение о возможном снижении или ухудшении функции почек (например, при гиповолемии, дегидратации, одновременном применении определенных лекарственных препаратов и т.п.).
В ходе клинической разработки препарата ПРАДАКСА в качестве метода оценки функции почек использовался расчет клиренса креатинина по формуле Кокрофта-Голта (Cocroft-Gault method).
Дабигатран выводится при гемодиализе; однако клинический опыт применения у пациентов, которым проводится гемодиализ, ограничен.
При применении препарата ПРАДАКСА с целью профилактики венозных тромбоэмболий у пациентов после ортопедических операций при умеренных нарушениях функции почек (КК 30-50 мл/мин) суточная доза препарата должна быть снижена до 150 мг (2 капсулы по 75 мг 1 раз в день).
При применении препарата ПРАДАКСА с целью профилактики инсульта, системных тромбоэмболий и снижения сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий при умеренных нарушениях функции почек (КК 30-50 мл/мин) коррекции дозы не требуется. Рекомендуется применение препарата в суточной дозе 300 мг (по 1 капсуле 150 мг 2 раза в день). Функция почек должна оцениваться как минимум один раз в год.
При применении препарата ПРАДАКСА с целью лечения острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактики смертельных исходов, вызываемых этими заболеваниями при КК >30 мл/мин коррекции дозы не требуется. Рекомендуется применение препарата в суточной дозе 300 мг (по 1 капсуле 150 мг 2 раза в день).
При применении препарата ПРАДАКСА с целью профилактики рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями, при умеренных нарушениях функции почек (КК 30-50 мл/мин) коррекции дозы не требуется. Рекомендуется применение препарата в суточной дозе 300 мг (по 1 капсуле 150 мг 2 раза в день). Функция почек должна оцениваться как минимум один раз в год.
Применение у пожилых пациентов
В связи с тем, что повышение экспозиции препарата у пожилых пациентов (старше 75 лет) часто обусловлено снижением функции почек, перед назначением препарата необходимо оценить функцию почек. Почечная функция должна оцениваться как минимум один раз в год или чаще, в зависимости от клинической ситуации. Коррекцию дозы препарата следует проводить в зависимости от тяжести нарушений функции почек (см. «Нарушение функции почек»).
Профилактика венозных тромбоэмболий у пожилых пациентов (старше 75 лет) после ортопедических операции: опыт применения ограничен. Рекомендуемая доза — 150 мг (2 капсулы по 75 мг однократно).
При применении препарата ПРАДАКСА у пожилых пациентов старше 80 лет с целью профилактики инсульта, системных тромбоэмболий и снижения сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий препарат ПРАДАКСА следует принимать в суточной дозе 220 мг (1 капсула по 110 мг 2 раза в сутки).
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями, у пациентов старше 75 лет: коррекции дозы не требуется. Рекомендуется применение препарата в суточной дозе 300 мг (по 1 капсуле 150 мг 2 раза в день).
Профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов,вызываемых этими заболеваниями, у пациентов старше 75 лет: коррекции дозы не требуется. Рекомендуется применение препарата в суточной дозе 300 мг (по 1 капсуле 150 мг 2 раза в день).
Влияние массы тела
Профилактика венозных тромбоэмболий (ВТЭ) у пациентов после ортопедических операций: у пациентов с массой тела менее 50 кг и более 110 кг опыт применения ограничен. В соответствии с фармакокинетическими и клиническими данными коррекции дозы не требуется. Однако за такими пациентами рекомендуется наблюдать.
Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий: в соответствии с фармакокинетическими и клиническими данными коррекции дозы не требуется. Однако за пациентами с массой тела менее 50 кг рекомендуется наблюдать.
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями: не требуется коррекции дозы в зависимости от массы тела.
Профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов,вызываемых этими заболеваниями: не требуется коррекции дозы в зависимости от массы тела.
Одновременное применение препарата ПРАДАКСА с активными ингибиторами Р-гликопротеина (амиодарон, хинидин, верапамил) с целью профилактики венозных тромбоэмболии у пациентов после ортопедических операций:
При одновременном применении с амиодароном, хинидином или верапамилом, дозу препарата ПРАДАКСА следует уменьшить до 150 мг 1 раз в день (2 капсулы по 75 мг) (см. раздел «Взаимодействие с другими лекарственными средствами»).
Пациентам, принимающим препарат ПРАДАКСА после ортопедических операций, не рекомендуется одновременно начинать применение верапамила и подключать его к терапии в дальнейшем.
Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий: коррекции дозы не требуется, пациентам рекомендуется применение препарата в суточной дозе 300 мг (1 капсула по 150 мг 2 раза в день).
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов,вызываемых этими заболеваниями: коррекции дозы не требуется. Рекомендуется применение препарата в суточной дозе 300 мг (по 1 капсуле 150 мг 2 раза в день).
Профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями: коррекции дозы не требуется. Рекомендуется применение препарата в суточной дозе 300 мг (по 1 капсуле 150 мг 2 раза в день).
Применение у пациентов с повышенным риском кровотечений
Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий: присутствие таких факторов как возраст 75 лет или старше, умеренное снижение функции почек (КК 30-50 мл/мин), одновременное применение ингибиторов Р-гликопротеина, антиагрегантов или указание на желудочно-кишечное кровотечение в анамнезе могут повышать риск кровотечения (см. «Особые указания»). У пациентов с одним или более указанных факторов риска, по усмотрению врача, возможно снижение суточной дозы препарата ПРАДАКСА® до 220 мг (прием 1 капсулы 110 мг 2 раза в сутки).
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями: присутствие таких факторов как возраст 75 лет или старше, умеренное снижение функции почек (КК 30-50 мл/мин) или указание на желудочно-кишечное кровотечение в анамнезе могут повышать риск кровотечения (см. «Особые указания»).
У пациентов с одним фактором риска коррекции дозы не требуется. Для пациентов с несколькими факторами риска клинические данные ограничены. У таких пациентов препарат должен применяться только в случаях, когда ожидаемая польза превышает риск кровотечения.
Профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями: присутствие таких факторов как возраст 75 лет или старше, умеренное снижение функции почек (КК 30-50 мл/мин) или указание на желудочно-кишечное кровотечение в анамнезе могут повышать риск кровотечения (см. «Особые указания»).
У пациентов с одним фактором риска коррекции дозы не требуется. Для пациентов с несколькими факторами риска клинические данные ограничены. У таких пациентов препарат должен применяться только в случаях, когда ожидаемая польза превышает риск кровотечения.
Переход от применения препарата ПРАДАКСА к парентеральному применению антикоагулянтов
Профилактика венозных тромбоэмболий у пациентов после ортопедических операций: парентеральное введение антикоагулянтов следует начинать через 24 ч после приема последней дозы препарата ПРАДАКСА.
Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий: парентеральное применение антикоагулянтов следует начинать через 12 ч после приема последней дозы препарата ПРАДАКСА.
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями: парентеральное применение антикоагулянтов следует начинать через 12 ч после приема последней дозы препарата ПРАДАКСА.
Профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями: парентеральное применение антикоагулянтов следует начинать через 12 ч после приема последней дозы препарата ПРАДАКСА.
Переход от парентерального применения антикоагулянтов к применению препарата ПРАДАКСА
Первая доза препарата ПРАДАКСА назначается вместо отменяемого антикоагулянта в интервале 0-2 ч перед сроком очередной инъекции альтернативной терапии или одновременно с прекращением постоянной инфузии (например, внутривенного применения нефракционированного гепарина, НФГ).
Переход от применения антагонистов витамина К к применению препарата ПРАДАКСА
Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий: применение антагонистов витамина К прекращают, применение препарата ПРАДАКСА возможно при МНО <2,0.
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями: применение антагонистов витамина К прекращают, применение препарата ПРАДАКСА возможно при МНО <2,0.
Профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями: применение антагонистов витамина К прекращают, применение препарата ПРАДАКСА возможно при МНО <2,0.
Переход от применения препарата ПРАДАКСА к применению антагонистов витамина К
Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий: при клиренсе креатинина >50 мл/мин применение антагонистов витамина К возможно за 3 дня, а при клиренсе креатинина 30-50 мл/мин — за 2 дня до отмены препарата ПРАДАКСА.
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями: при клиренсе креатинина >50 мл/мин применение антагонистов витамина К возможно за 3 дня, а при клиренсе креатинина 30-50 мл/мин — за 2 дня до отмены препарата ПРАДАКСА.
Профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями: при клиренсе креатинина >50 мл/мин применение антагонистов витамина К возможно за 3 дня, а при клиренсе креатинина 30-50 мл/мин — за 2 дня до отмены препарата ПРАДАКСА.
Кардиоверсия
Профилактика инсульта, системных тромбоэмболии и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий
Проведение плановой или экстренной кардиоверсии не требует отмены терапии препарата ПРАДАКСА.
Пропущенная доза
Профилактика венозных тромбоэмболий у пациентов после ортопедических операций: рекомендуется принять обычную суточную дозу ПРАДАКСА в обычное время на следующий день. В случае пропуска отдельных доз не следует принимать двойную дозу препарата.
Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий: пропущенную дозу препарата ПРАДАКСА можно принять в том случае, если до приема очередной дозы препарата остается 6 ч и более; если срок составил менее 6 ч, пропущенную дозу принимать не следует. В случае пропуска отдельных доз не следует принимать двойную дозу препарата.
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями: пропущенную дозу препарата ПРАДАКСА можно принять в том случае, если до приема очередной дозы препарата остается 6 ч и более; если срок составил менее 6 ч, пропущенную дозу принимать не следует. В случае пропуска отдельных доз не следует принимать двойную дозу препарата.
Профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями: пропущенную дозу препарата ПРАДАКСА можно принять в том случае, если до приема очередной дозы препарата остается 6 ч и более; если срок составил менее 6 ч, пропущенную дозу принимать не следует. В случае пропуска отдельных доз не следует принимать двойную дозу препарата.
Побочные эффекты:
Побочные эффекты, выявленные при применении препарата
— с целью профилактики ВТЭ после ортопедических операций;
— для профилактики инсульта и системных тромбоэмболий у пациентов с фибрилляцией предсердий;
— для лечения острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями;
— для профилактики рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями.
Классификация побочных реакций по частоте развития (количество зарегистрированных случаев/количество пациентов): очень часто — до 1/10 случаев; часто — от 1/100 до 1/10 случаев; редко — от 1/1000 до 1/100 случаев; неизвестно — побочные эффекты из опыта использования не могут быть оценены на основе имеющихся данных; не применимо — побочный эффект не выявлен при применении по данному показанию.
|
Системно-органный класс/ Побочный эффект |
Показание |
|||
|
Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий |
Профилактика венозных тромбоэмболий у пациентов после ортопедических операций |
Лечение острого тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и профилактика смертельных исходов, вызываемых этими заболеваниями |
Профилактика рецидивирующего тромбоза глубоких вен (ТГВ) и/или тромбоэмболии легочной артерии (ТЭЛА) и смертельных исходов, вызываемых этими заболеваниями |
|
|
Частота возникновения |
||||
|
Нарушения со стороны кроветворной и лимфатической системы: |
||||
|
анемия |
часто |
нечасто |
нечасто |
редко |
|
тромбоцитопения |
нечасто |
редко |
редко |
редко |
|
Нарушения со стороны иммунной системы: |
||||
|
реакции гиперчувствительности |
нечасто |
нечасто |
нечасто |
нечасто |
|
— крапивница |
редко |
редко |
редко |
редко |
|
— кожная сыпь |
нечасто |
редко |
нечасто |
нечасто |
|
— кожный зуд |
нечасто |
редко |
редко |
редко |
|
бронхоспазм |
неизвестно |
неизвестно |
неизвестно |
неизвестно |
|
ангионевротический отек |
редко |
редко |
редко |
редко |
|
анафилактические реакции |
неизвестно |
неизвестно |
неизвестно |
неизвестно |
|
Нарушения со стороны нервной системы: |
||||
|
внутричерепное кровотечение |
нечасто |
редко |
редко |
редко |
|
Нарушения со стороны сосудов: |
||||
|
гематома |
нечасто |
нечасто |
нечасто |
нечасто |
|
кровотечение |
нечасто |
редко |
нечасто |
нечасто |
|
Нарушения со стороны органов дыхания, грудной клетки и средостения: |
||||
|
носовое кровотечение |
часто |
нечасто |
часто |
часто |
|
кровохарканье |
нечасто |
редко |
нечасто |
нечасто |
|
Нарушения со стороны ЖКТ: |
||||
|
желудочно-кишечные кровотечения |
часто |
нечасто |
часто |
часто |
|
ректальные кровотечения |
нечасто |
нечасто |
часто |
часто |
|
геморроидальные кровотечения |
нечасто |
нечасто |
редко |
нечасто |
|
боль в животе |
часто |
редко |
нечасто |
нечасто |
|
диарея |
часто |
нечасто |
нечасто |
нечасто |
|
диспепсия |
часто |
редко |
часто |
часто |
|
тошнота |
часто |
нечасто |
нечасто |
нечасто |
|
изъязвление слизистой оболочки ЖКТ, в том числе язва пищевода |
нечасто |
редко |
нечасто |
редко |
|
гастроэзофагит |
нечасто |
редко |
нечасто |
нечасто |
|
гастроэзофагеальная рефлюксная болезнь |
нечасто |
редко |
нечасто |
нечасто |
|
рвота |
нечасто |
нечасто |
нечасто |
нечасто |
|
дисфагия |
нечасто |
редко |
редко |
редко |
|
Нарушения со стороны гепатобилиарной системы: |
||||
|
повышение активности «печеночных» трансаминаз |
редко |
нечасто |
нечасто |
нечасто |
|
нарушение функции печени |
нечасто |
часто |
нечасто |
нечасто |
|
гипербилирубинемия |
редко |
нечасто |
неизвестно |
неизвестно |
|
Изменения со стороны кожи и подкожных тканей: |
||||
|
кожный геморрагический синдром |
часто |
нечасто |
часто |
часто |
|
Скелетно-мышечные нарушения, нарушения со стороны соединительной ткани и костей: |
||||
|
гемартроз |
редко |
нечасто |
нечасто |
редко |
|
Изменения со стороны почек и мочевыводящих путей: |
||||
|
урогенитальные кровотечения |
часто |
нечасто |
часто |
часто |
|
гематурия |
часто |
нечасто |
часто |
часто |
|
Нарушения общего характера и изменения в месте проведения инъекций: |
||||
|
кровотечения из места инъекции |
редко |
редко |
редко |
редко |
|
кровотечения из места введения катетера |
редко |
редко |
редко |
редко |
|
Повреждения, токсичность и осложнения от процедур: |
||||
|
посттравматическое кровотечение |
редко |
нечасто |
нечасто |
редко |
|
кровотечения из места операционного доступа |
редко |
редко |
редко |
редко |
|
Дополнительные специфичные побочные эффекты, выявленные при профилактике венозных тромбоэмболий у пациентов, которым проведены ортопедические операции Нарушения со стороны сосудов: |
||||
|
кровотечение из операционной раны |
не применимо |
нечасто |
не применимо |
не применимо |
|
Общие расстройства и нарушения в месте введения: |
||||
|
Кровянистые выделения |
не применимо |
редко |
не применимо |
не применимо |
|
Повреждения, токсичность и осложнения послеоперационной обработки: |
||||
|
гематома после проведения обработки раны |
не применимо |
нечасто |
не применимо |
не применимо |
|
кровотечение после проведения обработки раны |
не применимо |
нечасто |
не применимо |
не применимо |
|
анемия в послеоперационном периоде |
не применимо |
редко |
не применимо |
не применимо |
|
выделения из раны после проведения процедур |
не применимо |
нечасто |
не применимо |
не применимо |
|
секреция из раны |
не применимо |
нечасто |
не применимо |
не применимо |
|
Хирургические и терапевтические процедуры: |
||||
|
дренаж раны |
не применимо |
редко |
не применимо |
не применимо |
|
дренаж после обработки раны |
не применимо |
редко |
не применимо |
не применимо |
Передозировка:
Передозировка при применении препарата ПРАДАКСАможет сопровождаться геморрагическими осложнениями, что обусловлено фармакодинамическими особенностями препарата. При возникновении кровотечения применение препарата прекращают.
Показано симптоматическое лечение.
Специфического антидота нет.
Учитывая основной путь выведения дабигатрана (почками), рекомендуется обеспечить адекватный диурез.
Проводят хирургический гемостаз и восполнение объема циркулирующей крови (ОЦК).
Возможно использование свежей цельной крови или переливание свежезамороженной плазмы.
Поскольку дабигатран обладает низкой способностью к связыванию с белками плазмы крови, препарат может выводиться при гемодиализе, однако клинический опыт по использованию диализа в этих ситуациях ограничен (см. раздел «Фармакокинетика»).
При передозировке препарата ПРАДАКСА возможно использование концентратов факторов свертывания (активированных или неактивированных) или рекомбинантного фактора VIIa. Существуют экспериментальные данные, подтверждающие эффективность этих средств в противодействие антикоагулянтному эффекту дабигатрана, однако специальных клинических исследований не проводилось.
В случае развития тромбоцитопении, или при применении антиагрегантов длительного действия, может быть рассмотрен вопрос о применении тромбоцитарной массы.
Для ситуаций, когда требуется быстрое устранение активности, существует специфический антидот дабигатрана (МНН: идаруцизумаб), являющийся антагонистом по отношению к фармакодинамическому действию препарата ПРАДАКСА.
Взаимодействие:
Совместное применение препарата ПРАДАКСА с лекарственными средствами, влияющими на гемостаз или систему коагуляции, включая нефракционированый гепарин, низкомолекулярный гепарин, ацетилсалициловую кислоту, нестероидные противовоспалительные препараты, антагонисты витамина К, может существенно повысить риск развития кровотечений.
Фармакокинетические взаимодействия
Дабигатрана этексилат и дабигатран не метаболизируются ферментами микросомального окисления печени, и не являются ни индукторами, ни ингибиторами активности изоферментами цитохрома Р450. Поэтому предполагается, что у дабигатрана отсутствуют клинически значимые фармакокинетические лекарственные взаимодействия с препаратами, метаболизм которых осуществляется изоферментами цитохрома Р450. В клинических исследованиях у здоровых добровольцев не выявлены какие-либо взаимодействия дабигатрана с аторвастатином (субстратCYP3A4) и диклофенаком (субстрат CYP2C9).
Взаимодействия с ингибиторами/индукторами Р-гликопротеина: субстратом для транспортной молекулы Р-гликопротеина является пролекарство дабигатрана этексилат, но не дабигатран. Поэтому проводилось изучение совместного применения с ингибиторами и индукторами транспортера Р-гликопротеина. Одновременное использование ингибиторов Р-гликопротеина (амиодарона, верапамила, хинидина, кетоконазола для системного применения, дронедарона, тикагрелора и кларитромицина) приводит к увеличению концентрации дабигатрана в плазме крови.
Одновременное применение с ингибиторами Р-гликопротеина: одновременное применение с такими ингибиторами Р-гликопротеина, как кетоконазол для системного применения, циклоспорин, итраконазол, такролимус и дронедарон противопоказано. Следует соблюдать осторожность при одновременном назначении с ингибиторами Р-гликопротеина (напр.: амиодарон, хинидин, верапамил и тикагрелор).
Амиодарон. При одновременном применении дабигатрана этексилата с однократной дозой амиодарона (600 мг), принимавшегося внутрь, степень и скорость всасывания амиодарона и активного его метаболита, дезэтиламиодарона, не изменялись. Значения AUC и Сmах дабигатрана увеличивались примерно в 1,6 и 1,5 раз (на 60% и 50%) соответственно.
В исследовании у пациентов с фибрилляцией предсердий концентрация дабигатрана увеличивалась не более чем на 14%, повышение риска кровотечений не было зарегистрировано. Рекомендуется наблюдение за пациентами, применяющими одновременно амиодарон и дабигатрана этексилат в отношении риска кровотечения, в особенности, при наличии почечной недостаточности (от слабой до умеренно выраженной).
Дронедарон. После одновременного применения дабигатрана этексилата и дронедарона в дозе 400 мг однократно, AUC0-∞ и Сmах дабигатрана увеличиваются в 2,1 и 1,9 раз (на 114% и 87%) соответственно, а после многократного применения дронедарона в дозе 400 мг в день — в 2,4 и 2,3 (на 136% и 125%) соответственно. После однократного и многократного применения дронедарона через 2 часа после приема дабигатрана этексилата AUC0-∞ возрастала в 1,3 и 1,6 раз, соответственно. Дронедарон не влиял на конечный Т1/2 и почечный клиренс дабигатрана. Одновременное применение препарата ПРАДАКСА® и дронедарона противопоказано.
Тикагрелор. После одновременного применения однократной дозы (75 мг) дабигатрана этексилата с нагрузочной дозой тикагрелора (180 мг) значения AUC0-∞ и Сmах дабигатрана увеличиваются в 1,73 и 1,95 раз (на 73% и 95%) соответственно. После многократного приема тикагрелора (90 мг два раза в день) это повышение воздействия дабигатрана (в отношении AUC0-∞ и Сmах) уменьшалось, соответственно, до 1,56 раза (до 56%) и до 1,46 раза (до 46%). Концентрация дабигатрана у здоровых добровольцев повышалась в 1,26 раз (до 26%) при совместном применении с тикагрелором в стационарном состоянии или в 1,49 раз (до 49%) при применении нагрузочной дозы тикагрелора с совместным применением дабигатрана этексилата, принимавшегося в дозе 110 мг два раза в сутки. Повышение концентрации было менее выраженным, если нагрузочная доза (180 мг) тикагрелора принималась через два часа после приема дабигатрана (до 27%). Совместное назначение нагрузочной дозы (180 мг) тикагрелора и 110 мг дабигатрана этексилата (в стационарном состоянии) увеличивало показатели AUCt,ss и Cmax,ss дабигатрана в 1,49 раз и 1,65 раз (+49% и 65%), соответственно, по сравнению с приемом только дабигатрана этексилата. Если нагрузочная доза 180 мг тикагрелора давалась через 2 часа после приема 110 мг дабигатрана этексилата (в стационарном состоянии), степень повышения AUCt,ss и Cmax,ss дабигатрана уменьшалась до 1,27-кратной и 1,24-кратной (+27% и 24%) соответственно, по сравнению с приемом только дабигатрана этексилата. Совместное назначение 90 мг тикагрелора х 2 раза в сутки (поддерживающая доза) со 100 мг дабигатрана этексилата повышала корректированные показатели AUCt,ss и Cmax,ss в 1,26 раз и в 1,29 раз соответственно по сравнению с приемом только дабигатрана этексилата.
Верапамил. При одновременном применении дабигатрана этексилата с верапамилом, назначавшимся перорально, значения Сmах и AUCдабигатрана увеличивались в зависимости от времени применения и лекарственной формы верапамила.
Наибольшее повышение эффекта дабигатрана наблюдалось при использовании первой дозы верапамила в лекарственной форме с немедленным высвобождением, которая применялась за 1 ч до приема дабигатрана этексилата (Сmах повысилась на 180%, a AUC — на 150%). При использовании лекарственной формы верапамила с замедленным высвобождением этот эффект прогрессивно снижался (Сmах повысилась на 90%, a AUC — на 70%), также как при использовании многократных доз верапамила (Сmах повысилась на 60%, a AUC — на 50%), что может объясняться индукцией Р-гликопротеина в ЖКТ при длительном применении верапамила.
При использовании верапамила через 2 ч после приема дабигатрана этексилата клинически значимых взаимодействий не наблюдалось (Сmах повышалась на 10%, a AUC — на 20%), поскольку через 2 ч дабигатран полностью всасывается (см. раздел «Способ применения и дозы»).
В исследовании у пациентов с фибрилляцией предсердий концентрация дабигатрана увеличивалась не более чем на 21%, повышение риска кровотечений не было зарегистрировано.
Данные о взаимодействии дабигатрана этексилата с верапамилом, введенным парентерально, отсутствуют; клинически значимого взаимодействия не ожидается.
Кетоконазол. Кетоконазол для системного применения после однократного назначения в дозе 400 мг увеличивает AUC0-∞ и дабигатрана примерно в 2,4 раза (на 138% и 135%) соответственно, а после многократного назначения кетоконазола в дозе 400 мг в день — примерно в 2,5 раза (на 153% и 149%) соответственно. Кетоконазол не влиял на Тmaх и конечный Т1/2. Одновременное применение препарата ПРАДАКСА® и кетоконазола для системного применения противопоказано.
Кларитромицин. При одновременном применении кларитромицина в дозе 500 мг 2 раза в день с дабигатрана этексилатом клинически значимого фармакокинетического взаимодействия не наблюдалось (Сmах повысилась на 15%, a AUC — на 19%).
Хинидин. Значения AUCt,ss и Cmax,ss дабигатрана при применении 2 раза в сутки в случае одновременного назначения с хинидином в дозе 200 мг каждые 2 ч до достижения суммарной дозы 1000 мг повышались в среднем, соответственно, на 53% и на 56%. Взаимодействие с итраконазолом, такролимусом и циклоспорином не изучалось, однако из данных in vitro можно ожидать схожего эффекта, как и от взаимодействия с кетоконазолом. Одновременное применение этих ингибиторов Р-гликопротеина противопоказано.
Одновременное применение с субстратами для Р-гликопротеина
Дигоксин. В исследовании, проведенном с участием 24 здоровых испытуемых, при одновременном назначении препарата ПРАДАКСА® с дигоксином не наблюдалось изменений концентрации дигоксина и клинически значимых изменений концентрации дабигатрана. При одновременном применении дабигатрана этексилата с дигоксином, являющимся субстратом Р-гликопротеина, фармакокинетического взаимодействия не наблюдалось. Ни дабигатран, ни пролекарство дабигатрана этексилат не являются клинически значимыми ингибиторами Р-гликопротеина.
Одновременное применение с индукторами Р-гликопротеина
Следует избегать одновременного назначения препарата ПРАДАКСА и индукторов Р-гликопротеина, поскольку совместное применение приводит к снижению воздействия дабигатрана (см. раздел «Особые указания»).
Рифампицин. Предварительное применение тест-индуктора рифампицина в дозе 600 мг в день в течение 7 дней приводило к снижению воздействия дабигатрана. После отмены рифампицина этот индуктивный эффект снижался, на 7 день эффект дабигатрана был близок к исходному уровню. В течение последующих 7 дней дальнейшего увеличения биодоступности дабигатрана не наблюдалось.
Через 7 дней лечения рифампицином в дозе 600 мг ежедневно ППК0-∞ и Сmах общего дабигатрана были снижены на 67% и 66% по сравнению с референсным лечением, соответственно.
Предполагается, что другие индукторы Р-гликопротеина, такие, как зверобой продырявленный или карбамазепин, могут также снижать концентрацию дабигатрана в плазме крови и должны применяться с осторожностью.
Одновременное применение с антиагрегантами
Совместное применение препарата ПРАДАКСА с лекарственными средствами, влияющими на гемостаз или систему коагуляции, включая нефракционированый гепарин, низкомолекулярный гепарин, ацетилсалициловую кислоту, нестероидные противовоспалительные препараты, антагонисты витамина К, может существенно повысить риск развития кровотечений.
Нефракционированный гепарин: можно применять в дозах, необходимых для поддержания проходимости центрального венозного или артериального катетера.
Ацетилсалициловая кислота (АСК). Эффект одновременного применения дабигатрана этексилата и АСК на риск развития кровотечений был изучен у пациентов с фибрилляцией предсердий в рандомизированном исследовании II фазы совместного применения с АСК.
При изучении одновременного применения дабигатрана этексилата в дозе 150 мг 2 раза в день и АСК у пациентов с фибрилляцией предсердий установлено, что риск кровотечений может повышаться с 12% до 18% (при использовании АСК в дозе 81 мг) и до 24% (при использовании АСК в дозе 325 мг).
НПВП. Применявшиеся НПВП (нестероидные противовоспалительные препараты) для краткосрочной анальгезии после операций не повышали риск кровотечений при одновременном использовании с дабигатрана этексилатом. Длительное применение НПВП увеличивало риск кровотечения примерно на 50%, как при совместном применении дабигатрана этексилата. так и варфарина.
Необходим тщательный контроль за признаками кровотечения, в связи с риском развития при совместном применении с НПВП (Т1/2 более 12 ч).
Низкомолекулярный гепарин: специальных исследований по одновременному применению дабигатрана этексилата и низкомолекулярных гепаринов, таких как эноксапарин, не проводилось.
Через 24 часа после 3-х дневного лечения (40 мг один раз в день) эноксапарином экспозиция дабигатрана была ниже, чем после приема разовой дозы 220 мг дабигатрана этексилата.
Высокая активность анти-FXa/FII наблюдалась после применения дабигатрана этексилата с эноксапарином по сравнению с лечением только дабигатрана этексилатом.
Считается, что это связано с действием эноксапарина и не имеет клинического значения. Другие тесты, связанные с антикоагулянтным действием дабигатрана, значительно не изменялись при предшествующем лечении эноксапарином.
Клопидогрел. Установлено, что одновременное применение дабигатрана этексилата и клопидогрела не приводит к дополнительному увеличению времени капиллярного кровотечения в сравнении с монотерапией клопидогрелом. Кроме того, показано, что значения AUCt,ss и Cmax,ss дабигатрана, а также параметры свертывания крови, которые контролировались для оценки эффекта дабигатрана (АЧТВ, экариновое время свертывания или тромбиновое время (анти FIIa), а также степень ингибирования агрегации тромбоцитов (основной показатель эффекта клопидогрела) во время комбинированной терапии не изменялись по сравнению с соответствующими показателями в монотерапии. При использовании «нагрузочной» дозы клопидогрела (300 или 600 мг) значения AUCt,ss и Cmax,ss дабигатрана повышались на 30-40%.
Одновременное применение с препаратами, повышающими pH содержимого желудка
Выявленные в ходе популяционного анализа изменения фармакокинетических параметров дабигатрана под влиянием ингибиторов протонной помпы и антацидных препаратов оказались клинически незначимыми, поскольку степень выраженности этих изменений была небольшой (снижение биодоступности не было значимым для антацидов, а для ингибиторов протонной помпы составляло 14,6%).
Установлено, что одновременное применение ингибиторов протонной помпы не сопровождается снижением концентрации дабигатрана и в среднем лишь незначительно снижает концентрацию препарата в плазме крови (на 11%). Поэтому одновременное применение ингибиторов протонной помпы, по-видимому, не ведет к повышению частоты инсульта или системных тромбоэмболий, особенно в сравнении с варфарином, и, следовательно, снижение биодоступности дабигатрана. вызываемое одновременным применением пантопразола, вероятно, не имеет клинической значимости.
Пантопразол. При совместном применении дабигатрана этексилата и пантопразола наблюдалось снижение AUC дабигатрана на 30%. Пантопразол и другие ингибиторы протонной помпы применялись совместно с дабигатрана этексилатом в клинических исследованиях, влияние на риск кровотечения или эффективность не наблюдалось.
Ранитидин. Ранитидин при применении одновременно с дабигатрана этексилатом, не оказывал значимого влияния на степень всасывания дабигатрана.
Особые указания:
Риск развития кровотечения
Применение препарата ПРАДАКСА, также как и других антикоагулянтов, рекомендуется с осторожностью при состояниях, характеризующихся повышенным риском кровотечений. Во время терапии препаратом ПРАДАКСА® возможно развитие кровотечений различной локализации. Снижение концентрации гемоглобина и/или гематокрита в крови, сопровождающееся снижением АД, является основанием для поиска источника кровотечения.
Лечение препаратом ПРАДАКСА не требует контроля антикоагулянтной активности. Тест для определения МНО применяться не должен, поскольку есть данные о ложном завышении уровня МНО.
Для выявления чрезмерной антикоагулянтной активности дабигатрана следует использовать тесты для определения тромбинового или экаринового времени свертывания. В случае, когда эти тесты не доступны, следует использовать тест для определения АЧТВ.
В исследовании RE-LY у пациентов с фибрилляцией предсердий превышение уровня АЧТВ в 2-3 раза выше границы нормы перед приемом очередной дозы препарата было ассоциировано с повышенным риском кровотечения.
В фармакокинетических исследованиях ПРАДАКСА показано, что у пациентов со сниженной функцией почек (в том числе у пожилых пациентов) наблюдается повышение экспозиции препарата. Применение препарата ПРАДАКСА противопоказано в случае выраженных нарушений функции почек (КК <30 мл/мин).
В случае развития острой почечной недостаточности препарат ПРАДАКСА следует отменить.
К повышению концентрации дагибатрана в плазме могут приводить следующие факторы: снижение функции почек (КК 30-50 мл/мин), возраст >75 лет, одновременное применение ингибитора Р-гликопротеина. Наличие одного или нескольких таких факторов может повышать риск кровотечения (см. раздел «Способ применения и дозы»).
Совместное применение препарата ПРАДАКСА с лекарственными средствами, влияющими на гемостаз или систему коагуляции, включая нефракционированый гепарин, низкомолекулярный гепарин, ацетилсалициловую кислоту, нестероидные противовоспалительные препараты, антагонисты витамина К, может существенно повысить риск развития кровотечений.
Не изучалось, но может повышать риск кровотечений одновременное применение препарата ПРАДАКСА со следующими препаратами: фондапаринукс натрия, тромболитические препараты, блокаторы гликопротеиновых GP IIb/IIIа рецепторов тромбоцитов, тиклопидин, декстран, ривароксабан и ингибиторы Р-гликопротеина (итраконазол, такролимус, циклоспорин, ритонавир, нелфинавир и саквинавир). Риск кровотечений может повышаться за счет фармакологического взаимодействия у пациентов, одновременно принимающих селективные ингибиторы обратного захвата серотонина или селективные ингибиторы обратного захвата норадреналина. Также риск кровотечений может повышаться при одновременном применении антиагрегантов и других антикоагулянтов.
Совместное применение дронедарона и дабигатрана противопоказано (см. раздел «Противопоказания»).
Одновременное применение тикагрелора может увеличивать воздействие дабигатрана и может приводить к фармакодинамическому взаимодействию, результатом которого может стать повышение риска кровотечений.
Профилактика венозных тромбоэмболий у пациентов после ортопедических операций
Установлено, что применение НПВП для кратковременной анестезии при хирургических вмешательствах одновременно с препаратом ПРАДАКСА не сопровождается повышенным риском кровотечений. Имеются ограниченные данные о регулярном применении НПВП (имеющих Т1/2 менее 12 ч) на фоне лечения препаратом ПРАДАКСА, данных о повышении риска кровотечений не получено.
Профилактика инсульта, системных тромбоэмболий и снижение сердечно-сосудистой смертности у пациентов с фибрилляцией предсердий
Одновременное применение препарата ПРАДАКСА, антиагрегантов (включая АСК и клопидогрел) и НПВП увеличивает риск кровотечения. В особенности одновременное применение антиагрегантов или сильных ингибиторов Р-гликопротеина увеличивает риск больших кровотечений, в том числе желудочно-кишечных кровотечений, у пациентов в возрасте >75 лет. Если возникают клинические подозрения на кровотечение, рекомендуется проведение соответствующих исследований, таких как анализ кала на скрытую кровь или определения уровня гемоглобина (на предмет его снижения).
Применение фибринолитических препаратов может рассматриваться только в случае, если показатели ТВ, ЭВС или АЧТВ у пациента не превышают верхнюю границу нормы местного референсного диапазона.
При повышении риска кровотечений (например, при недавно проведенной биопсии или перенесенной обширной травме, бактериальном эндокардите) требуется контроль состояния пациента с целью своевременного обнаружения признаков кровотечения.
Взаимодействие с индукторами Р-гликопротеина
Применение внутрь совместно с ПРАДАКСА индуктора Р-гликопротеина рифампицина снижало концентрацию дабигатрана в плазме. Предполагается, что другие индукторы Р-гликопротеина, такие, как зверобой продырявленный или карбамазепин, могут также снижать концентрацию дабигатрана в плазме крови и должны применяться с осторожностью (см. раздел «Взаимодействие с другими лекарственными средствами»).
Хирургические операции и вмешательства
У пациентов, применяющих препарат ПРАДАКСА при проведении хирургических операций или инвазивных процедур, повышается риск кровотечений. Поэтому при проведении хирургических вмешательств следует отменить препарат ПРАДАКСА (см. также раздел «Фармакокинетика»).
Предоперационный период
Перед проведением инвазивных процедур или хирургических операций препарат ПРАДАКСА отменяют, по крайней мере, за 24 ч до их проведения. У пациентов с повышенным риском кровотечений или перед проведением обширных операций, требующих полного гемостаза, следует прекратить применение препарата ПРАДАКСА за 2-4 дня до операции. У пациентов с почечной недостаточностью клиренс дабигатрана может удлиняться.
При отмене препарата следует учитывать следующую информацию:
|
КК (мл/мин) |
Т1/2 |
Прекращение приема препарата перед плановой хирургической операцией |
|
|
Высокий риск кровотечения или проведение большой операции |
Стандартный риск |
||
|
≥80 |
~ 13 |
За 2 дня |
За 24 ч |
|
≥50 |
~ 15 |
За 2-3 дня |
За 1 -2 дня |
|
<80 |
|||
|
≥30 |
~ 18 |
За 4 дня |
За 2-3 дня |
|
<50 |
(>48 ч) |
Это следует принимать во внимание перед проведением любых процедур (см. также раздел «Фармакокинетика»).
Препарат ПРАДАКСА противопоказан пациентам с тяжелыми нарушениями функции почек (КК <30 мл/мин), но если препарат все же применяют, отменять его следует не менее чем за 5 дней до операции.
В случае необходимости проведения экстренного хирургического вмешательства прием препарата ПРАДАКСА необходимо временно прекратить. Хирургическое вмешательство, при наличии такой возможности, целесообразно выполнять не ранее, чем через 12 ч после последнего приема ПРАДАКСА. Если операция не может быть отложена, риск кровотечения может повышаться (в случае кардиоверсии см. «Способ применения и дозы»). В таком случае следует оценить соотношение риска кровотечения и необходимости экстренного проведения вмешательства.
Спинальная анестезия/эпидуральная анестезия/люмбальная пункция
Такие процедуры, как спинномозговая анестезия, могут потребовать полного восстановления гемостаза.
В случае травматичной или повторной спинномозговой пункции и длительного использования эпидурального катетера может повышаться риск развития спинномозгового кровотечения или эпидуральной гематомы. Первую дозу препарата ПРАДАКСА следует принимать не ранее, чем через 2 ч после удаления катетера. Необходим контроль состояния пациентов для исключения неврологических симптомов, которые могут быть обусловлены спинномозговым кровотечением или эпидуральной гематомой.
Период после проведения процедуры
Применение препарата ПРАДАКСА можно продолжить по достижении полного гемостаза.
В случае появления желудочно-кишечных симптомов рекомендуется принимать препарат ПРАДАКСА с пищей и/или с ингибитором протонной помпы типа пантопразола.
Влияние на способность управлять транспортными средствами и механизмами:
Влияние препарата ПРАДАКСА на способность управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций не изучалось, но, учитывая, что применение препарата ПРАДАКСА может сопровождаться повышенным риском кровотечений, следует соблюдать осторожность при выполнении таких видов деятельности.
Форма выпуска/дозировка:
Капсулы, 75 мг, 110 мг и 150 мг.
Упаковка:
По 10 капсул в блистер с перфорацией из Аl/Аl фольги. 1, 3, 6 блистеров в пачку картонную с инструкцией по применению.
По 60 капсул во флакон из полипропилена, укупоренный пластиковой завинчивающейся крышкой с контролем вскрытия от детей, с влагопоглотителем.
Один флакон в пачку картонную с инструкцией по применению.
Мультиупаковка (для дозировок 110 мг, 150 мг): по 10 капсул в блистер с перфорацией из Аl/Аl. 6 блистеров в пачку картонную с инструкцией по применению.
По 3 пачки картонные в пленку из полипропилена.
Условия хранения:
Флакон: при температуре не выше 25°С.
Хранить флакон плотно укупоренным, для защиты от влаги.
После вскрытия флакона препарат использовать в течение 4 месяцев.
Блистеры: в сухом месте, при температуре не выше 25°С.
Хранить в недоступном для детей месте.
Срок годности:
3 года.
Не использовать после истечения срока годности.
Условия отпуска
По рецепту
Производитель
Берингер Ингельхайм Фарма ГмбХ и Ко.КГ, Binger Strasse 173, 55216 Ingelheim am Rhein, Germany, Германия
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
Берингер Ингельхайм Интернешнл ГмбХ
Купить Прадакса в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)