Арепливир таблетки — инструкция по применению
Синонимы, аналоги
Статьи
Данный лекарственный препарат зарегистрирован по процедуре регистрации препаратов, предназначенных для применения в условиях угрозы возникновения и ликвидации чрезвычайных ситуаций. Инструкция подготовлена на основании ограниченного объема клинических данных по применению препарата и будет дополняться по мере поступления новых данных. Применение препарата возможно только в условиях стационарной медицинской помощи.
Регистрационный номер:
ЛП-006288
Торговое наименование:
Арепливир
Международное непатентованное или группировочное наименование:
фавипиравир
Лекарственная форма:
таблетки, покрытые пленочной оболочкой
Состав
на 1 таблетку:
Действующее вещество:
Фавипиравир – 200,0 мг
Вспомогательные вещества:
Повидон (К-30), кремния диоксид коллоидный, гипролоза низкозамещенная, целлюлоза микрокристаллическая (тип 101), кросповидон, стеариновая кислота.
Пленочная оболочка:
Готовое пленочное покрытие Опадрай® 03F220114 желтый [Гипромеллоза, титана диоксид, макрогол 4000 (Полиэтиленгликоль 4000), краситель железа оксид желтый Е172].
Описание:
таблетки круглые, двояковыпуклые, покрытые пленочной оболочкой светло-желтого цвета. На поперечном разрезе ядро белого или почти белого цвета.
Фармакотерапевтическая группа:
противовирусное средство
Код ATX:
J05AX27
Фармакологические свойства
Фармакодинамика
Противовирусная активность in vitro
Фавипиравир обладает противовирусной активностью против лабораторных штаммов вирусов гриппа А и В (половинная максимальная эффективная концентрация (ЕС50) 0,014-0,55 мкг/мл).
Для штаммов вирусов гриппа А и В, резистентных к адамантану (амантадину римантадину), осельтамивиру или занамивиру, ЕС50 составляет 0,03-0,94 мкг/мл и 0,09-0,83 мкг/мл, соответственно. Для штаммов вируса гриппа А (включая штаммы, резистентные к адамантану, осельтамивиру и занамивиру), таких как свиной грипп типа А и птичий грипп типа А, включая высокопатогенные штаммы (в том числе, H5N1 и H7N9), ЕС50 составляет 0,06-3,53 мкг/мл.
Для штаммов вирусов гриппа А и В, резистентных к адамантану, осельтамивиру и занамивиру, ЕС50 составляет 0,09-0,47 мкг/мл; перекрестная резистентность не наблюдается.
Фавипиравир ингибирует вирус SARS-CoV-2, вызывающий новую коронавирусную инфекцию (COVID-19). ЕС50 в клетках Vero Е6 составляет 61,88 мкмоль, что соответствует 9,72 мкг/мл.
Механизм действия
Фавипиравир метаболизируется в клетках до рибозилтрифосфата фавипиравира (РТФ фавипиравира) и избирательно ингибирует РНК-зависимую РНК полимеразу, участвующую в репликации вируса гриппа. РТФ фавипиравира (1000 мкмоль/л) не показала ингибирующего действия на α ДНК человека, но показала ингибирующее действие в диапазоне от 9,1 до 13,5 % на β и в диапазоне от 11,7 до 41,2 % на γ ДНК человека. Ингибирующая концентрация (IC50) РТФ фавипиравира для полимеразы II РНК человека составила 905 мкмоль/л.
Резистентность
После 30 пересевов в присутствии фавипиравира не наблюдалось изменений в восприимчивости вирусов гриппа типа А к фавипиравиру, резистентных штаммов также не наблюдалось. В проведенных клинических исследованиях не обнаружено появление вирусов гриппа, резистентных к фавипиравиру.
Фармакокинетика
Всасывание
Фавипиравир легко всасывается в желудочно-кишечном тракте. Время достижения максимальной концентрации (Тmax) 1,5 ч.
Распределение
Связывание с белками плазмы составляет около 54 %.
Метаболизм
Фавипиравир в основном метаболизируется – альдегидоксидазой и частично метаболизируется до гидроксилированной формы ксантиноксидазой. В клетках метаболизируется РТФ фавипиравира. Из других метаболитов, кроме гидроксилата, в плазме крови и моче человека регистрировали также конъюгат глюкуроната.
Выведение
В основном фавипиравир выводится почками в виде активного метаболита гидроксилата, небольшое количество в неизменном виде. Период полувыведения (Т1/2) около 5 ч.
Пациенты с нарушением функции печени
При приеме фавипиравира пациентами с печеночной недостаточностью легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью) увеличения Сmax и AUC составили 1,5 раза и 1,8 раз, соответственно, по сравнению со здоровыми добровольцами. Данные увеличения Сmax AUC пациентов с печеночной недостаточностью тяжелой степени тяжести (класс С по классификации Чайлд-Пью) составляли 2,1 раз и 6,3 раза, соответственно.
Пациенты с нарушением функции почек
У пациентов с почечной недостаточностью средней степени тяжести (СКФ <60 мл/мин и ≥30 мл/мин) остаточная концентрация фавипиравира (Cthrough) увеличивалась в 1,5 раза по сравнению с пациентами без нарушения функции почек. У пациентов с почечной недостаточностью тяжелой и терминальной степени тяжести (СКФ <30 мл/мин) препарат не изучался.
Показания к применению
Лечение новой коронавирусной инфекции (COVID-19).
Противопоказания
Повышенная чувствительность к фавипиравиру или любому компоненту препарата Арепливир.
Печеночная недостаточность тяжелой степени тяжести (класс С по классификации Чайлд-Пью).
Почечная недостаточность тяжелой и терминальной степени тяжести (СКФ <30 мл/мин).
Беременность или планирование беременности.
Период грудного вскармливания.
Детский возраст до 18 лет.
С осторожностью
У пациентов с подагрой и гиперурикемией в анамнезе (возможно повышение уровня мочевой кислоты в крови и обострение симптомов), у пожилых пациентов, пациентов с печеночной недостаточностью легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью), пациентов с почечной недостаточностью средней степени тяжести (СКФ <60 мл/мин и ≥30 мл/мин).
Применение при беременности и в период грудного вскармливания
В доклинических исследованиях фавипиравира в дозировках, схожих с клиническими или меньшими, наблюдалась гибель эмбриона на ранней стадии и тератогенность.
Препарат Арепливир противопоказан беременным, а также мужчинам и женщинам во время планирования беременности. При назначении препарата Арепливир женщинам, способным к деторождению (в том числе в постменопаузе менее 2-х лет), необходимо подтвердить отрицательный результат теста на беременность до начала лечения. Повторный тест на беременность необходимо провести после окончания приема препарата.
Необходимо использовать эффективные методы контрацепции (презерватив со спермицидом) во время приема препарата и после его окончания: в течение 1 месяца женщинам и в течение 3 месяцев мужчинам.
При назначении препарата Арепливир кормящим женщинам необходимо прекратить грудное вскармливание на время приема препарата и в течение 7 дней после его окончания, так как основной метаболит фавипиравира попадает в грудное молоко.
Способ применения и дозы
Внутрь, за 30 мин до еды. Препарат Арепливир назначается в условиях стационара.
Рекомендуемый режим дозирования:
в 1-ый день приема по 1 600 мг (8 таблеток) 2 раза в день, во 2-10 дни по 600 мг (3 таблетки) 2 раза в день.
Общая продолжительность курса лечения составляет 10 дней или до подтверждения элиминации вируса, если наступит ранее (два последовательных отрицательных результата ПЦР-исследования, полученных с интервалом не менее 24 часов).
Побочное действие
В клиническом исследовании препарата Арепливир (данные промежуточного отчета) нежелательные реакции наблюдались у 9 пациентов из 40 (22,5 %), в том числе повышение активности аланинаминотрансферазы (АЛТ) у 5 (12,5%) пациентов, повышение активности аспартатаминотрансферазы (ACT) у 7 (17,5 %) пациентов и повышение активности креатинфосфокиназы у 1 (2,5 %) пациента. Данные нежелательные реакции соответствуют известным нежелательным лекарственным реакциям фавипиравира, представленным в Таблице 1.
Оценка частоты возникновения нежелательных побочных реакций основывается на классификации ВОЗ: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000); частота неизвестна (установить частоту по имеющимся данным не представляется возможным).
Таблица 1. Нежелательные реакции
| Классификация по системам органов | Нежелательные реакции |
| Нарушения со стороны крови и лимфатической системы | часто: нейтропения, лейкопения редко: лейкоцитоз, моноцитоз, ретикулоцитопения |
| Нарушения со стороны обмена веществ и питания | часто: гиперурикемия, гипертриглицеридемия нечасто: глюкозурия редко: гипокалиемия |
| Нарушения со стороны иммунной системы | нечасто: сыпь редко: экзема, зуд |
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | редко: бронхиальная астма, боль в горле, ринит, назофарингит |
| Нарушения со стороны желудочно-кишечного тракта | часто: диарея нечасто: тошнота, рвота, боль в животе редко: дискомфорт в животе, язва двенадцатиперстной кишки, кровянистый стул, гастрит |
| Нарушения со стороны печени и желчевыводящих путей | часто: повышение активности АЛТ, повышение активности ACT, повышение активности гамма-глутамилтрансферазы (ГГТ) редко: повышение активности щелочной фосфатазы (ЩФ), повышение концентрации билирубина в крови |
| Другие | редко: аномальное поведение, повышение активности креатинфосфокиназы (КФК), гематурия, полип гортани, гиперпигментация, нарушение вкусовой чувствительности, гематома, нечеткость зрения, боль в глазу, вертиго, наджелудочковые экстрасистолы, боль в грудной клетке |
Передозировка
Сообщения о передозировке фавипиравиром отсутствуют.
Взаимодействие с другими лекарственными средствами
Препарат Арепливир не метаболизируется цитохромом Р450, главным образом метаболизируется альдегидоксидазой и частично ксантиноксидазой. Препарат Арепливир ингибирует альдегидоксидазу и цитохром CYP2C8, но не индуцирует цитохром Р450.
Таблица 2. Межлекарственные взаимодействия
| Лекарственные средства |
Признаки, симптомы и лечение | Механизм действия и факторы риска |
| Пиразинамид | Гиперурикемия | Дополнительно повышается реабсорбция мочевой кислоты в почечных канальцах. |
| Репаглинид | Может повыситься концентрации репаглинида в крови, возможно развитие нежелательных реакций на репаглинид | Ингибирование CYP2C8 приводит к повышению концентрации репаглинида в крови. |
| Теофиллин | Концентрация фавипиравира в крови может повыситься, возможно развитие нежелательных реакций на фавипиравир | Взаимодействие с ксантиноксидазой может привести к повышению концентрации фавипиравира в крови |
| Фамцикловир, сулиндак | Эффективность данных лекарственных препаратов может быть снижена | Ингибирование фавипиравиром альдегидоксидазы может привести к снижению концентрации активных форм данных препаратов в крови. |
Особые указания
Применение препарата возможно только в условиях стационарной медицинской помощи.
При развитии побочного действия необходимо сообщать об этом в установленном порядке для осуществления мероприятий по фармаконадзору. До начала приема препарата Арепливир необходимо предоставить письменную информацию пациенту об эффективности препарата и рисках, связанных с его применением (в том числе о риске влияния на эмбрион и плод) и получить письменное согласие на применение препарата.
Поскольку в исследованиях фавипиравира на животных наблюдалась смерть эмбрионов и тератогенность, препарат Арепливир нельзя назначать беременным и предположительно беременным женщинам.
- При назначении препарата Арепливир женщинам, способным к деторождению (в том числе в постменопаузе менее 2-х лет), необходимо подтвердить отрицательный результат теста на беременность до начала лечения. Женщинам, способным к деторождению, необходимо в полной мере объяснить риски и тщательно проинструктировать использовать наиболее эффективные методы контрацепции с их партнерами во время приема препарата и в течение 1 месяца после его окончания (презерватив со спермицидом). При предположении о возможном наступлении беременности необходимо незамедлительно отменить прием препарата и проконсультироваться с врачом.
- При распределении в организме человека препарата Арепливир попадает в сперму. При назначении препарата пациентам мужчинам необходимо в полной мере объяснить риски и тщательно проинструктировать использовать наиболее эффективные методы контрацепции при сексуальных контактах во время приема препарата и в течение 3 месяцев после его окончания (презерватив со спермицидом). Дополнительно необходимо проинструктировать пациентов мужчин не вступать в сексуальные контакты с беременными женщинами.
- При распределении в организме человека препарат Арепливир попадает в грудное молоко. При назначении препарата кормящим женщинам необходимо в полной мере объяснить риски и тщательно проинструктировать прекратить грудное вскармливание на время приема препарата и в течение 7 дней после его окончания.
Влияние на способность управлять транспортными средствами, механизмами
Следует соблюдать осторожность при управлении транспортными средствами и работе с механизмами.
Форма выпуска
Таблетки, покрытые пленочной оболочкой, 200 мг.
По 10 таблеток в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой печатной лакированной или из пленки поливинилхлоридной/поливинилиденхлоридной и фольги алюминиевой печатной лакированной.
По 40, 100 таблеток в банку из полиэтилена высокой плотности, укупоренную крышкой из полипропилена с контролем первого вскрытия. Свободное пространство в банке заполняют ватой медицинской гигроскопической. Каждую банку или 4 контурные ячейковые упаковки вместе с инструкцией по медицинскому применению помещают в пачку из картона.
Условия хранения
При температуре не выше 25 °С во вторичной упаковке.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности.
Условия отпуска
Отпускают по рецепту.
Владелец регистрационного удостоверения
ООО «ПРОМОМЕД РУС», Россия
129090, г. Москва, проспект Мира, дом 13, строение 1, офис 13.
Производитель
АО «Биохимик», Россия
Юридический адрес: 430030, Республика Мордовия, г. Саранск, ул. Васенко, д. 15А
Адрес места производства: 430030, Республика Мордовия, г. Саранск, ул. Васенко, д. 15А
Организация, принимающая претензии потребителя
ООО «ПРОМОМЕД РУС», Россия
129090, г. Москва, проспект Мира, дом 13, строение 1, офис 13
Купить Арепливир таблетки в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Арепливир® (Areplivir) инструкция по применению
📜 Инструкция по применению Арепливир®
💊 Состав препарата Арепливир®
✅ Применение препарата Арепливир®
📅 Условия хранения Арепливир®
⏳ Срок годности Арепливир®
Описание лекарственного препарата
Арепливир®
(Areplivir)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для электронного издания справочника Видаль 2023
года, дата обновления: 2023.02.28
Владелец регистрационного удостоверения:
Контакты для обращений:
ПРОМОМЕД РУС ООО
(Россия)
Код ATX:
J05AX27
(Фавипиравир)
Лекарственные формы
| Арепливир® |
Таб., покр. пленочной оболочкой, 200 мг: 35, 40, 45, 70, 90 или 100 шт. рег. №: ЛП-006288 |
|
|
Таб., покр. пленочной оболочкой, 400 мг: 35, 40, 45 или 50 шт. рег. №: ЛП-007609 |
Форма выпуска, упаковка и состав
препарата Арепливир®
Таблетки, покрытые пленочной оболочкой светло-желтого цвета, круглые, двояковыпуклые; на поперечном разрезе ядро белого или почти белого цвета.
Вспомогательные вещества: повидон (К-30), кремния диоксид коллоидный, гипролоза низкозамещенная, целлюлоза микрокристаллическая (тип 101), кросповидон, стеариновая кислота.
Состав пленочной оболочки: готовое пленочное покрытие Опадрай® 03F220114 желтый [гипромеллоза, титана диоксид, макрогол 4000 (полиэтиленгликоль 4000), краситель железа оксид желтый Е172].
5 шт. — упаковки ячейковые контурные (7) — пачки картонные.
10 шт. — упаковки ячейковые контурные (4) — пачки картонные.
10 шт. — упаковки ячейковые контурные (7) — пачки картонные.
10 шт. — упаковки ячейковые контурные (9) — пачки картонные.
10 шт. — упаковки ячейковые контурные (10) — пачки картонные.
15 шт. — упаковки ячейковые контурные (3) — пачки картонные.
15 шт. — упаковки ячейковые контурные (6) — пачки картонные.
40 шт. — банки из полиэтилена высокой плотности (1) — пачки картонные.
100 шт. — банки из полиэтилена высокой плотности (1) — пачки картонные.
Таблетки, покрытые пленочной оболочкой светло-желтого цвета, овальные, двояковыпуклые, с риской с одной стороны; на поперечном разрезе ядро белого или почти белого цвета.
Вспомогательные вещества: повидон (K-30) — 30 мг, кремния диоксид коллоидный — 16 мг, гипролоза низкозамещенная — 120 мг, целлюлоза микрокристаллическая (тип 101) — 270 мг, кросповидон — 28 мг, стеариновая кислота — 6 мг.
Состав пленочной оболочки: готовое пленочное покрытие Опадрай® 03F220114 желтый — 30 мг [гипромеллоза — 62.5%, титана диоксид Е171 — 30.09%, макрогол 4000 (полиэтиленгликоль 4000) — 6.25%, краситель железа оксид желтый Е172 — 1.16%].
5 шт. — упаковки ячейковые контурные (7) — пачки картонные.
10 шт. — упаковки ячейковые контурные (4) — пачки картонные.
10 шт. — упаковки ячейковые контурные (5) — пачки картонные.
15 шт. — упаковки ячейковые контурные (3) — пачки картонные.
40 шт. — банки из полиэтилена высокой плотности (1) — пачки картонные.
50 шт. — банки из полиэтилена высокой плотности (1) — пачки картонные.
40 шт. — банки из полиэтилена низкого давления (1) — пачки картонные.
50 шт. — банки из полиэтилена низкого давления (1) — пачки картонные.
Фармакологическое действие
Противовирусная активность in vitro
Фавипиравир обладает противовирусной активностью против лабораторных штаммов вирусов гриппа А и В (половинная максимальная эффективная концентрация (ЕС50) 0.014-0.55 мкг/мл).
Для штаммов вирусов гриппа А и В, резистентных к адамантану (амантадину, римантадину), осельтамивиру или занамивиру, ЕС50 составляет 0.03-0.94 мкг/мл и 0.09-0.83 мкг/мл, соответственно. Для штаммов вируса гриппа А (включая штаммы, резистентные к адамантану, осельтамивиру и занамивиру), таких как свиной грипп типа А и птичий грипп типа А, включая высокопатогенные штаммы (в т.ч. H5N1 и H7N9), ЕС50 составляет 0.06-3.53 мкг/мл.
Для штаммов вирусов гриппа А и В, резистентных к адамантану, осельтамивиру и занамивиру, ЕС50 составляет 0.09-0.47 мкг/мл; перекрестная резистентность не наблюдается.
Фавипиравир ингибирует вирус SARS-CoV-2, вызывающий новую коронавирусную инфекцию (COVID-19). ЕС50 в клетках Vero Е6 составляет 61.88 мкмоль, что соответствует 9.72 мкг/мл.
Механизм действия
Фавипиравир метаболизируется в клетках до рибозилтрифосфата фавипиравира (РТФ фавипиравира) и избирательно ингибирует РНК-зависимую РНК-полимеразу, участвующую в репликации вируса гриппа. РТФ фавипиравира (1000 мкмоль/л) не показала ингибирующего действия на αДНК человека, но показала ингибирующее действие в диапазоне от 9.1 до 13.5% на β и в диапазоне от 11.7 до 41.2% на γДНК человека. Ингибирующая концентрация (IC50) РТФ фавипиравира для полимеразы II РНК человека составила 905 мкмоль/л.
Резистентность
После 30 пересевов в присутствии фавипиравира не наблюдалось изменений в восприимчивости вирусов гриппа типа А к фавипиравиру, резистентных штаммов также не наблюдалось. В проведенных клинических исследованиях не обнаружено появление вирусов гриппа, резистентных к фавипиравиру.
Фармакокинетика
Всасывание
Фавипиравир легко всасывается из ЖКТ. Tmax — 1.5 ч.
Распределение
Связывание с белками плазмы составляет около 54%.
Метаболизм
Фавипиравир в основном метаболизируется альдегидоксидазой и частично метаболизируется до гидроксилированной формы ксантиноксидазой. В клетках метаболизируется РТФ фавипиравира. Из других метаболитов, кроме гидроксилата, в плазме крови и моче человека регистрировали также конъюгат глюкуроната.
Выведение
В основном фавипиравир выводится почками в виде активного метаболита гидроксилата, небольшое количество в неизменном виде. Т1/2 — около 5 ч.
Фармакокинетика у особых групп пациентов
Пациенты с нарушением функции печени. При приеме фавипиравира пациентами с печеночной недостаточностью легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью) увеличения Cmax и AUC составили 1.5 раза и 1.8 раз, соответственно, по сравнению со здоровыми добровольцами. Данные увеличения Cmax и AUC для пациентов с печеночной недостаточностью тяжелой степени тяжести (класс С по классификации Чайлд-Пью) составляли 2.1 раз и 6.3 раза, соответственно.
Пациенты с нарушением функции почек. У пациентов с почечной недостаточностью средней степени тяжести (СКФ <60 мл/мин и ≥30 мл/мин) остаточная концентрация фавипиравира (Cthrough) увеличивалась в 1.5 раза по сравнению с пациентами без нарушения функции почек. У пациентов с почечной недостаточностью тяжелой и терминальной степени тяжести (СКФ <30 мл/мин) препарат не изучался.
Показания препарата
Арепливир®
- лечение новой коронавирусной инфекции (COVID-19).
Режим дозирования
Внутрь, за 30 мин до еды.
Для лечения новой коронавирусной инфекции (COVID-19), вызванной вирусом SARS-CoV-2, рекомендуется следующий режим дозирования:
- для пациентов с массой тела <75 кг по 1600 мг 2 раза в 1-й день терапии, далее по 600 мг 2 раза/сут, соответственно, со 2-го по 10-й день терапии;
- для пациентов с массой тела ≥75 кг по 1800 мг 2 раза в 1-й день терапии, далее по 800 мг 2 раза/сут, соответственно, со 2-го по 10-й день терапии.
Прием препарата должен осуществляться на основании клинической картины и/или после лабораторного подтверждения диагноза и при наличии характерной клинической симптоматики.
Общая продолжительность курса лечения составляет 10 дней или до подтверждения элиминации вируса, если наступит ранее (два последовательных отрицательных результата ПЦР-исследования, полученных с интервалом не менее 24 ч).
Таблица 1 Схема приема и дозы препарата Арепливир®, таблетки, покрытые пленочной оболочкой, 200 мг
Таблица 2. Схема приема и дозы препарата Арепливир®, таблетки, покрытые пленочной оболочкой , 400 мг
Побочное действие
В клиническом исследовании препарата Арепливир® частота пациентов с зарегистрированными случаями нежелательных явлений составила 24.04% (25/104). Повышение активности АЛТ наблюдалось у 17.3% (18/104) пациентов, повышение активности ACT — у 12.5% (13/104) и повышение активности КФК — у 0.9% (1/104) пациентов. Данные нежелательные реакции соответствуют известным нежелательным лекарственным реакциям фавипиравира, представленным в таблице 3.
Оценка частоты возникновения нежелательных побочных реакций основывается на классификации ВОЗ: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000); частота неизвестна (установить частоту по имеющимся данным не представляется возможным).
Со стороны системы кроветворения: часто — нейтропения, лейкопения; редко — лейкоцитоз, моноцитоз, ретикулоцитопения.
Со стороны обмена веществ: часто — гиперурикемия, гипертриглицеридемия; нечасто — глюкозурия; редко — гипокалиемия.
Со стороны иммунной системы: нечасто — сыпь; редко — экзема, зуд.
Со стороны дыхательной системы: редко — бронхиальная астма, боль в горле, ринит, назофарингит.
Со стороны пищеварительной системы: часто — диарея; нечасто — тошнота, рвота, боль в животе; редко — дискомфорт в животе, язва двенадцатиперстной кишки, кровянистый стул, гастрит.
Со стороны печени и желчевыводящих путей: часто — повышение активности АЛТ, повышение активности ACT, повышение активности ГГТ; редко — повышение активности ЩФ, повышение концентрации билирубина в крови.
Прочие: редко — аномальное поведение, повышение активности КФК, гематурия, полип гортани, гиперпигментация, нарушение вкусовой чувствительности, гематома, нечеткость зрения, боль в глазу, вертиго, наджелудочковые экстрасистолы, боль в грудной клетке.
Таблица 3. Нежелательные реакции
Противопоказания к применению
- повышенная чувствительность к фавипиравиру или любому компоненту препарата;
- печеночная недостаточность тяжелой степени тяжести (класс С по классификации Чайлд-Пью);
- почечная недостаточность тяжелой степени и терминальная стадия почечной недостаточности (СКФ <30 мл/мин);
- беременность или планирование беременности;
- период грудного вскармливания;
- детский и подростковый возраст до 18 лет.
С осторожностью: у пациентов с подагрой и гиперурикемией в анамнезе (возможно повышение концентрации мочевой кислоты в крови и обострение симптомов); у пациентов пожилого возраста; у пациентов с печеночной недостаточностью легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью); у пациентов с почечной недостаточностью средней степени тяжести (СКФ <60 мл/мин и ≥30 мл/мин).
Применение при беременности и кормлении грудью
В доклинических исследованиях фавипиравира в дозах, схожих с клиническими или меньшими, наблюдалась гибель эмбриона на ранней стадии и тератогенность.
Препарат Арепливир® противопоказан беременным, а также мужчинам и женщинам во время планирования беременности. При назначении препарата женщинам, способным к деторождению (в т.ч. в постменопаузе менее 2 лет), необходимо подтвердить отрицательный результат теста на беременность до начала лечения. Повторный тест на беременность необходимо провести после окончания приема препарата. Необходимо использовать эффективные методы контрацепции (презерватив со спермицидом) во время приема препарата и после его окончания: в течение 1 месяца женщинам и в течение 3 месяцев мужчинам.
При назначении препарата Арепливир® кормящим женщинам необходимо прекратить грудное вскармливание на время приема препарата и в течение 7 дней после его окончания, т.к. основной метаболит фавипиравира выделяется с грудным молоком.
Применение при нарушениях функции печени
Противопоказано применение препарата при печеночной недостаточности тяжелой степени тяжести.
С осторожностью следует применять препарат у пациентов с печеночной недостаточностью легкой и средней степени тяжести.
Применение при нарушениях функции почек
Противопоказано применение препарата при почечной недостаточности тяжелой степени, в т.ч. терминальной стадии.
С осторожностью следует применять препарат у пациентов с почечной недостаточностью средней степени тяжести.
Применение у детей
Противопоказано применение препарата в возрасте до 18 лет.
Применение у пожилых пациентов
С осторожностью следует назначать препарат пациентам пожилого возраста.
Особые указания
При развитии побочного действия при применении данного лекарственного препарата необходимо сообщать об этом лечащему врачу или в организацию, принимающую претензии потребителей по телефону горячей линии фармаконадзора.
Поскольку в исследованиях фавипиравира на животных наблюдалась смерть эмбрионов и тератогенность, препарат Арепливир® нельзя назначать беременным и предположительно беременным женщинам.
При назначении препарата Арепливир ® женщинам, способным к деторождению (в т.ч. в постменопаузе менее 2 лет), необходимо подтвердить отрицательный результат теста на беременность до начала лечения. Женщинам, способным к деторождению, необходимо в полной мере объяснить риски и тщательно проинструктировать об использовании наиболее эффективных методов контрацепции с их партнерами во время приема препарата и в течение 1 месяца после его окончания (презерватив со спермицидом). При предположении о возможном наступлении беременности необходимо незамедлительно отменить прием препарата и проконсультироваться с врачом.
При распределении в организме человека фавипиравир попадает в сперму. При назначении препарата пациентам мужчинам необходимо в полной мере объяснить риски и тщательно проинструктировать об использовании наиболее эффективных методов контрацепции при сексуальных контактах во время приема препарата и в течение 3 месяцев после его окончания (презерватив со спермицидом). Дополнительно необходимо проинструктировать пациентов мужчин не вступать в сексуальные контакты с беременными женщинами.
При распределении в организме человека фавипиравир попадает в грудное молоко. При назначении препарата кормящим женщинам необходимо в полной мере объяснить риски и тщательно проинструктировать о прекращении грудного вскармливания на время приема препарата и в течение 7 дней после его окончания.
Влияние на способность к управлению транспортными средствами и механизмами
Следует соблюдать осторожность при управлении транспортными средствами и работе с механизмами.
Передозировка
Сообщения о передозировке фавипиравиром отсутствуют.
Лекарственное взаимодействие
Фавипиравир не метаболизируется изоферментами цитохрома Р450, главным образом метаболизируется альдегидоксидазой и частично ксантиноксидазой.
Фавипиравир ингибирует альдегидоксидазу и изофермент CYP2C8, но не индуцирует изоферменты цитохрома Р450.
Таблица 4 . Межлекарственное взаимодействие
Условия хранения препарата Арепливир®
Препарат следует хранить в недоступном для детей месте, в оригинальной упаковке (пачке) при температуре не выше 25°С.
Срок годности препарата Арепливир®
Срок годности — 2 года. Не применять по истечении срока годности.
Условия реализации
Препарат отпускают по рецепту.
Контакты для обращений
ПРОМОМЕД РУС ООО
(Россия)

|
|
ПРОМОМЕД РУС ООО Организация, принимающая |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код

29.08.2022

29.08.2022

29.08.2022
Описание препарата АРЕПЛИВИР® (концентрат для приготовления раствора для инфузий, 40 мг/мл) основано на официальной инструкции, утверждено компанией-производителем в 2022 году
Дата согласования: 29.08.2022
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
- Отзывы
Действующее вещество
ATX
Фармакологическая группа
Состав
| Концентрат для приготовления раствора для инфузий | 1 мл |
| действующее вещество: | |
| фавипиравир | 40 мг |
| вспомогательные вещества: L-лизина моногидрат — 19,2 мг; натрия гидроксид — до pH 6,5–8,0; вода для инъекций — до 1 мл |
Описание лекарственной формы
Концентрат для приготовления раствора для инфузий: прозрачный или опалесцирующий от желтого или желтого с зеленоватым оттенком до красно-коричневого цвета раствор. Возможно выпадение единичных кристаллов, при обнаружении которых флакон/ампулу необходимо энергично встряхнуть до полного растворения.
Фармакологическое действие
Фармакологическое действие
—
противовирусное.
Фармакодинамика
Противовирусная активность in vitro
Фавипиравир обладает противовирусной активностью против лабораторных штаммов вирусов гриппа А и В (половинная максимальная эффективная концентрация (EC50) 0,014-0,55 мкг/мл).
Фавипиравир ингибирует вирус SARS-CoV-2, вызывающий новую коронавирусную инфекцию (COVID-19). EC50 в клетках Vero Е6 составляет 61,88 мкмоль, что соответствует 9,72 мкг/мл.
Механизм действия
Фавипиравир метаболизируется в клетках до рибозилтрифосфата фавипиравира (РТФ фавипиравира) и избирательно ингибирует РНК-зависимую РНК-полимеразу, участвующую в репликации вируса гриппа. РТФ фавипиравира (1000 мкмоль/л) не показал ингибирующего действия на α-ДНК человека, но показал ингибирующее действие в диапазоне от 9,1 до 13,5% на β- и в диапазоне от 11,7 до 41,2% на γ-ДНК человека. IC50 РТФ фавипиравира для полимеразы II РНК человека составила 905 мкмоль/л.
Фармакокинетика
Всасывание. При пероральном приеме фавипиравир легко всасывается в ЖКТ. Tmax — 1,5 ч.
При в/в введении фавипиравира однократно в диапазоне доз 400–1800 мг Tmax составляет от 1,85 до 2,05 ч. При однократном введении в диапазоне доз 400–1600 мг зависимость Cmax от вводимой дозы фавипиравира носит линейный характер (r2=0,98). Зависимость AUC от вводимой дозы с момента введения до последнего определяемого значения концентрации фавипиравира во временной точке (AUC0-t) носит линейный характер во всем изучаемом диапазоне доз (400–1800 мг) (r2=0,97).
В проведенном клиническом исследовании I фазы препарата АРЕПЛИВИР®, концентрат для приготовления раствора для инфузий, при парентеральном двукратном введении дозы 1600 мг Cmax составило (52,70±14,86) мкг/мл, а Tmax составило 14 ч (через 2 ч после второго введения). Значения AUC0-∞ и AUC0-t составили (554,63±319,12) и (443,82±200,33) мкг·ч/мл соответственно.
Распределение. Связывание с белками плазмы составляет около 54%.
Метаболизм. Фавипиравир в основном метаболизируется альдегидоксидазой и частично метаболизируется до гидроксилированной формы ксантиноксидазой. В клетках метаболизируется до РТФ фавипиравира. Из других метаболитов, кроме гидроксилата, в плазме крови и моче человека регистрировали также глюкуронат.
Выведение. В основном фавипиравир выводится почками в виде активного метаболита гидроксилата, небольшое количество в неизменном виде. T1/2 фавипиравира после перорального применения составляет около 5 ч.
После в/в введения однократно в диапазоне концентраций 400–1800 мг Т1/2 фавипиравира изменяется линейно от 1,62 до 3,37 ч.
Особые группы пациентов
Нарушение функции печени. При приеме пероральной формы фавипиравира пациентами с печеночной недостаточностью легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью) увеличение Сmax и AUC составило 1,5 и 1,8 раза соответственно по сравнению со здоровыми добровольцами. Данные увеличения Сmax и AUC для пациентов с печеночной недостаточностью тяжелой степени (класс С по классификации Чайлд-Пью) составляли 2,1 и 6,3 раза соответственно.
Нарушение функции почек. У пациентов с почечной недостаточностью средней степени тяжести (СКФ <60 и ≥30 мл/мин) остаточная концентрация фавипиравира (Cthrough) увеличивалась в 1,5 раза по сравнению с пациентами без нарушения функции почек. У пациентов с почечной недостаточностью тяжелой и терминальной степени тяжести (СКФ <30 мл/мин) препарат не изучался.
Показания
Лечение новой коронавирусной инфекции (COVID-19).
Противопоказания
повышенная чувствительность к фавипиравиру или любому компоненту препарата АРЕПЛИВИР®;
печеночная недостаточность тяжелой степени (класс С по классификации Чайлд-Пью);
почечная недостаточность тяжелой и терминальной степени тяжести (СКФ <30 мл/мин);
беременность или планирование беременности;
период грудного вскармливания;
возраст до 18 лет.
С осторожностью: подагра и гиперурикемия в анамнезе (возможно повышение уровня мочевой кислоты в крови и обострение симптомов), печеночная недостаточность легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью), почечная недостаточность средней степени тяжести (СКФ <60 и ≥30 мл/мин), пожилой возраст.
Применение при беременности и кормлении грудью
В доклинических исследованиях фавипиравира в дозировках, схожих с клиническими или меньшими, наблюдалась гибель эмбриона на ранней стадии и тератогенность.
Препарат АРЕПЛИВИР® противопоказан беременным, а также мужчинам и женщинам во время планирования беременности. При назначении препарата АРЕПЛИВИР® женщинам, способным к деторождению (в т.ч. в постменопаузе менее 2 лет), необходимо подтвердить отрицательный результат теста на беременность до начала лечения. Повторный тест на беременность необходимо провести после окончания приема препарата.
Необходимо использовать эффективные методы контрацепции (презерватив со спермицидом) во время приема препарата и после его окончания — в течение 1 мес женщинам и в течение 3 мес мужчинам.
При назначении препарата АРЕПЛИВИР® кормящим женщинам необходимо прекратить грудное вскармливание на время приема препарата и в течение 7 дней после его окончания, т.к. основной метаболит фавипиравира попадает в грудное молоко.
Способ применения и дозы
В/в, капельно в течение 2 ч.
Применение препарата АРЕПЛИВИР® должно осуществляться в условиях стационара.
Для лечения новой коронавирусной инфекции (COVID-19), вызванной вирусом SARS-CoV-2
По 1600 мг 2 раза в 1-й день терапии, далее по 800 мг 2 раза в день, соответственно, со 2-го по 10-й день терапии.
Применение препарата должно осуществляться на основании клинической картины и/или после лабораторного подтверждения диагноза и при наличии характерной клинической симптоматики.
Общая продолжительность курса лечения составляет 10 дней или до подтверждения элиминации вируса (отрицательный результат ПЦР-исследования), если наступит ранее.
Инструкция по приготовлению раствора для инфузий
Приготовление раствора для инфузий. Во флаконе/ампуле возможно выпадение единичных кристаллов, при обнаружении которых флакон/ампулу необходимо энергично встряхнуть до полного растворения. Перед приготовлением инфузионного раствора необходимо встряхнуть флакон/ампулу с препаратом. Затем из флакона/ампулы с 200 мл физиологического раствора (0,9% раствор натрия хлорида) удаляют соответственно по 40 или 20 мл раствора и замещают эти количества требуемым количеством препарата АРЕПЛИВИР®, концентрат для приготовления раствора для инфузий, 40 мг/мл. Количество флаконов/ампул препарата и замещаемый объем на инфузию представлены в таблице 1.
Для каждого введения подготавливается препарат в дозе 800 или 1600 мг в 200 мл физиологического раствора (0,9% раствор натрия хлорида).
Таблица 1
Количество лекарственного препарата на 1 инфузию
| Разовая доза, мг | Необходимое количество флаконов препарата АРЕПЛИВИР® (40 мг/мл) на 1 пациента на 1 инфузию | Замещаемый объем физиологического раствора, мл |
| 1600 | 4 флакона/ампулы по 10 мл | 40 |
| 2 флакона/ампулы по 20 мл | ||
| 800 | 2 флакона/ампулы по 10 мл | 20 |
| 1 флакон/ампула по 20 мл |
Хранение раствора для инфузий. Раствор для инфузий следует готовить непосредственно перед применением. Приготовленный раствор для инфузий может храниться при комнатной температуре не выше 25°С не более 4 ч.
Побочные действия
В клиническом исследовании препарата АРЕПЛИВИР®, концентрат для приготовления раствора для инфузий, частота пациентов с зарегистрированными случаями нежелательных явлений составила 18,75% (15/80). В группе пациентов, принимавших АРЕПЛИВИР®, концентрат для приготовления раствора для инфузий, наблюдалось повышение активности АЛТ у 35,71% (5/40) пациентов, повышение активности АСТ у 7,14% (1/40), регистрировалась боль в верхних отделах живота у 7,14% (1/40). Данные нежелательные реакции соответствуют известным нежелательным лекарственным реакциям фавипиравира, представленным в таблице 2.
Оценка частоты возникновения нежелательных побочных реакций основывается на классификации ВОЗ: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000); частота неизвестна (установить частоту по имеющимся данным не представляется возможным).
Таблица 2
Нежелательные реакции
| Классификация по системам органов | Нежелательные реакции |
| Со стороны крови и лимфатической системы | Часто — нейтропения, лейкопения; редко — лейкоцитоз, моноцитоз, ретикулоцитопения |
| Со стороны обмена веществ и питания | Часто — гиперурикемия, гипертриглицеридемия; нечасто — глюкозурия; редко — гипокалиемия |
| Со стороны иммунной системы | Нечасто — сыпь; редко — экзема, зуд |
| Со стороны дыхательной системы, органов грудной клетки и средостения | Редко — бронхиальная астма, боль в горле, ринит, назофарингит |
| Со стороны ЖКТ | Часто — диарея; нечасто — тошнота, рвота, боль в животе; редко — дискомфорт в животе, язва двенадцатиперстной кишки, кровянистый стул, гастрит |
| Со стороны печени и желчевыводящих путей | Часто — повышение активности АЛТ, АСТ, ГГТ; редко — повышение активности ЩФ, повышение концентрации билирубина в крови |
| Другие | Редко — аномальное поведение, повышение активности КФК, гематурия, полип гортани, гиперпигментация, нарушение вкусовой чувствительности, гематома, нечеткость зрения, боль в глазу, вертиго, наджелудочковые экстрасистолы, боль в грудной клетке |
Взаимодействие
Фавипиравир не метабилизируется цитохромом P450, главным образом метаболизируется альдегидоксидазой и частично ксантиноксидазой. Фавипиравир ингибирует альдегидоксидазу и изофермент CYP2C8, но не индуцирует цитохром Р450.
Таблица 3
Межлекарственные взаимодействия
| ЛС | Признаки, симптомы и лечение | Механизм действия и факторы риска |
| Пиразинамид | Гиперурикемия | Дополнительно повышается реабсорбция мочевой кислоты в почечных канальцах |
| Репаглинид | Может повыситься концентрация репаглинида в крови, возможно развитие нежелательных реакций на репаглинид | Ингибирование CYP2C8 приводит к повышению концентрации репаглинида в крови |
| Теофиллин | Концентрация фавипиравира в крови может повыситься, возможно развитие нежелательных реакций на фавипиравир | Взаимодействие с ксантиноксидазой может привести к повышению концентрации фавипиравира в крови |
| Фамцикловир, сулиндак | Эффективность данных лекарственных препаратов может быть снижена | Ингибирование фавипиравиром альдегидоксидазы может привести к снижению концентрации активных форм данных препаратов в крови |
Передозировка
Сообщения о передозировке фавипиравира отсутствуют.
Особые указания
Лечение препаратом АРЕПЛИВИР®, концентрат для приготовления раствора для инфузий, 40 мг/мл предусмотрено только в условиях стационара под наблюдением врача.
При развитии побочного действия необходимо сообщать об этом в установленном порядке для осуществления мероприятий по фармаконадзору.
Поскольку в исследованиях фавипиравира на животных наблюдалась смерть эмбрионов и тератогенность, препарат АРЕПЛИВИР® нельзя назначать беременным и предположительно беременным женщинам.
При назначении препарата АРЕПЛИВИР® женщинам, способным к деторождению (в т.ч. в постменопаузе менее 2 лет), необходимо подтвердить отрицательный результат теста на беременность до начала лечения. Женщинам, способным к деторождению, необходимо в полной мере объяснить риски и тщательно проинструктировать о необходимости использовать наиболее эффективные методы контрацепции во время приема препарата и в течение 1 мес после его окончания (презерватив со спермицидом). При предположении о возможном наступлении беременности необходимо незамедлительно отменить прием препарата и проконсультироваться с врачом.
При распределении в организме человека фавипиравир попадает в сперму. При назначении препарата пациентам-мужчинам необходимо в полной мере объяснить риски и тщательно проинструктировать о необходимости использовать наиболее эффективные методы контрацепции при сексуальных контактах во время приема препарата и в течение 3 мес после его окончания (презерватив со спермицидом). Дополнительно необходимо проинструктировать пациентов-мужчин о необходимости прекратить в сексуальные контакты с беременными женщинами.
При распределении в организме человека фавипиравир попадает в грудное молоко. При назначении препарата кормящим женщинам необходимо в полной мере объяснить риски и тщательно проинструктировать о необходимости прекратить грудное вскармливание на время приема препарата и в течение 7 дней после его окончания.
Влияние на способность управлять транспортными средствами, механизмами. Следует соблюдать осторожность при управлении транспортными средствами и работе с механизмами.
Форма выпуска
Концентрат для приготовления раствора для инфузий, 40 мг/мл. По 10 мл во флаконах бесцветного или темного стекла 1-го гидролитического класса или по 20 мл во флаконах бесцветного или темного стекла 1-го гидролитического класса, герметично укупоренных резиновыми пробками, обжатых колпачками алюминиевыми или комбинированными.
По 1, 5, 6, 10, 12, 15, 20 фл. с препаратом вместе с инструкцией по применению помещают в пачку из картона.
По 48, 50 фл. с приложением равного количества инструкций по применению помещают в коробку из картона (для стационаров).
По 5 ампул помещают в контурную ячейковую упаковку из пленки ПВХ.
По 2, 3 контурные ячейковые упаковки вместе с инструкцией по применению помещают в пачку из картона.
По 9 контурных ячейковых упаковок с приложением инструкций по применению в количестве, равном количеству ампул, помещают в коробку из картона (для стационаров).
Производитель
АО «Биохимик», Россия. 430030, Республика Мордовия, г. Саранск, ул. Васенко, 15А.
Тел.: (8342) 38-03-68.
E-mail: biohimic@biohimic.ru
www.biohimik.ru
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей. ООО «ПРОМОМЕД РУС», Россия. 129090, Москва, пр-т Мира, 13, стр. 1, офис 13.
Тел.: (495) 640-25-28; круглосуточный тел. горячей линии Фармаконадзора: (800) 777-86-04 (бесплатно).
E-mail: reception@promo-med.ru
Условия отпуска из аптек
По рецепту.
Условия хранения
концентрат для приготовления раствора для инфузий 40 мг/мл ампула —
При температуре 2–8 °C в оригинальной упаковке (пачке).
концентрат для приготовления раствора для инфузий 40 мг/мл ампула —
При температуре 2–8 °C в оригинальной упаковке (коробке).
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
таблетки покрытые пленочной оболочкой
Одна таблетка, покрытая пленочной оболочкой, содержит:
Активное вещество: Умифеновира гидрохлорида моногидрат в пересчете на
умифеновира гидрохлорид — 50 мг или 100 мг;
Вспомогательные вещества: повидон (пласдон К-17) — 0,66 мг или 1,32 мг; целлюлоза микрокристаллическая — 34,0 мг или 68,0 мг; крахмал прежелатинизированный (крахмал — 1500) — 4,5 мг или 9,0 мг; магния стеарат — 1,5мг или 3,0 мг; кремния диоксид коллоидный (аэросил) — 1,5 мг или 3,0 мг; сахар молочный (лактозы моногидрат) — до получения таблетки без оболочки массой 150,0 мг или 300,0 мг.
Состав оболочки: опадрай II белый состоящий из: талька (0,89 мг или 1,78 мг), макрогола (1,23 мг или 2,46 мг), титана диоксида (1,5 мг или 3,0 мг), спирта поливинилового (2,38 мг или 4,76 мг) — до получения таблетки с оболочкой массой 156 мг или 312 мг.
Круглые двояковыпуклые таблетки, покрытые пленочной оболочкой белого или почти белого цвета.
Противовирусное и иммуномодулирующее средство
АТХ L03AX Прочие иммуностимуляторы
Фармакодинамика
Противовирусное средство, оказывает иммуномодулирующее и противогриппозное действие, специфически подавляет вирусы гриппа А и В.
Обладает интерферониндуцирующими свойствами, стимулирует гуморальные и клеточные реакции иммунитета, фагоцитарную функцию макрофагов, повышает устойчивость организма к вирусным инфекциям. Предупреждает развитие постгриппозных осложнений, снижает частоту обострений хронических заболеваний, нормализует иммунологические показатели. Противовирусное действие обусловлено подавлением слияния липидной оболочки вируса с клеточными мембранами при контакте вируса с клеткой. Терапевтическая эффективность при гриппе проявляется в снижении интоксикации и выраженности катаральных явлений, укорочении периодов лихорадки и общей продолжительности заболевания.
Относится к малотоксичным лекарственными средствами (ЛС) (LD50>4 г/кг). Не оказывает какого-либо отрицательного воздействия на организм человека при пероральном применении в рекомендуемых дозах.
Фармакокинетика
Абсорбция — быстрая. Быстро распределяется по органам и тканям. Время достижения максимальной концентрации (ТСmах) при приеме в дозе 50 мг — 1,2 ч, 100 мг — 1,5 ч. Метаболизируется в печени. Период полувыведения (Т1/2) — 17-21 ч. Около 40% выводится в неизмененном виде, в основном с желчью (38,9%) и в незначительном количестве почками (0,12%). В течение первых суток выводится 90% от введенной дозы.
Профилактика и лечение у взрослых и детей: грипп, вызванный вирусами А и В, острые респираторные вирусные инфекции (ОРВИ) (в том числе осложненные бронхитом, пневмонией); вторичные иммунодефицитные состояния.
Комплексная терапия хронического бронхита, пневмонии и рецидивирующей герпетической инфекции.
Профилактика послеоперационых инфекционных осложнений и нормализация иммунного статуса у взрослых.
Повышенная чувствительность к компонентам препарата, детский возраст (до 3 лет). Наличие таких заболеваний, как непереносимость галактозы, дефицит лактазы, глюкозо-галактозная мальабсорбция.
Внутрь, до приема пищи. Разовая доза: детям от 3 до 6 лет — 50 мг, от 6 до 12 лет — 100 мг, старше 12 лет и взрослым — 200 мг (2 таблетки по 100 мг или 4 таблетки по 50 мг).
Для неспецифической профилактики
■ При непосредственном контакте с больными гриппом и другими ОРВИ:
— детям от 3 до 6 лет — 50 мг, от 6 до 12 лет — 100 мг, старше 12 лет и взрослым — 200 мг один раз в день в течение 10-14 дней.
■ В период эпидемии гриппа и других ОРВИ, для предупреждения обострений хронического бронхита, рецидива герпетической инфекции:
— детям от 3 до 6 лет — 50 мг, от 6 до 12 лет -100 мг, старше 12 лет и взрослым — 200 мг два раза в неделю в течение 3 недель.
■ Профилактика послеоперационных осложнений:
— детям от 3 до 6 лет — 50 мг, от 6 до 12 лет — 100 мг, старше 12 лет и взрослым — 200 мг за 2 дня до операции, затем на 2 и 5 день после операции.
Для лечения
■ Грипп, другие ОРВИ без осложнений:
— детям от 3 до 6 лет — 50 мг, от 6 до 12 лет — 100 мг, старше 12 лет и взрослым — 200 мг 4 раза в день (каждые 6 часов) в течение 5 дней.
■ Грипп, другие ОРВИ с развитием осложнений (бронхит, пневмония и другие):
— детям от 3 до 6 лет — 50 мг, от 6 до 12 лет — 100 мг, старше 12 лет и взрослым — 200 мг 4 раза в день (каждые 6 часов) в течение 5 дней, затем разовую дозу 1 раз в неделю в течение 4 недель.
При назначении с другими лекарственными средствами отрицательных эффектов не было отмечено.
Не проявляет центральной нейротропной активности и может применяться в медицинской практике в профилактических целях у практически здоровых лиц различных профессий, в том числе требующих повышенного внимания и координации движений (водители транспорта, операторы и так далее).
Таблетки покрытые пленочной оболочкой 50 мг, 100 мг.
По 10 или 20 таблеток в контурной ячейковой упаковке. 1, 2, 3 или 4 контурные ячейковые упаковки по 10 таблеток вместе с инструкцией по применению помещают в пачку картонную. 1 контурную ячейковую упаковку по 20 таблеток с дозировкой 50 мг вместе с инструкцией по применению помещают в пачку картонную.
Список Б. При температуре не выше 25 °С.
В недоступном для детей месте.
2 года.
Не использовать по истечении срока годности, указанного на упаковке.
Без рецепта
Регистрационный номер
ЛСР-005752/09
Дата регистрации
2009-07-16
Дата переоформления
2016-09-16
Владелец регистрационного удостоверения
Производитель
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. ВОЗМОЖНЫ ПОБОЧНЫЕ ЭФФЕКТЫ. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА.В сезон простудПри простудеСредства от простуды
Автор статьи
Подойницына Алёна Андреевна
,
Диплом о фармацевтическом образовании: 105924 3510722 рег. номер 31917
Все авторы
Содержание статьи
- Арпефлю: состав
- Арпефлю: от чего помогает
- Арпефлю: как принимать
- Арпефлю: дозировка
- Арпефлю: аналоги
- Задайте вопрос эксперту по теме статьи
Вирусы управляют миром.Пандемия COVID-19 подтвердила это в 2020 году. Самые частые «встречи» происходят у людей с респираторными вирусами.
Данные ВОЗ говорят о том, что взрослый человек болеет ОРВИ (острой респираторной вирусной инфекцией) в среднем от 2 до 4 раз, а дети — до 6 раз в году.
Во время болезни нужно соблюдать постельный режим, пить много жидкости, «сбивать» температуру выше 38,5 градусов или при невозможности терпеть симптомы. При усугублении состояния в течение трех дней, нужно обратиться к врачу.
С первых дней простуды рекомендуют принимать противовирусные препараты. Например, лекарство Арпефлю. Рассказываем, почему его назначают при ОРВИ, как правильно его принимать и сравним с другими противовирусными средствами.
Арпефлю: состав
Таблетки Арпефлю содержат противовирусное вещество умифеновир.
В состав лекарственной формы входят вспомогательные вещества: повидон, целлюлоза, кукурузный крахмал, магния стеарат, коллоидный диоксид кремния, лактоза и комплексная пищевая добавка Опадрай II (образует пленочную оболочку таблеток).
Арпефлю действует как защитник клеточных оболочек: не дает вирусу проникать сквозь клеточные мембраны и размножаться внутри клетки. Он обладает умеренным иммуномодулирующим действием. Препарат стимулирует реакции иммунитета и выработку интерферона в организме. Особенно эффективен против вирусов гриппа типа А и В.
Арпефлю: от чего помогает
Арпефлю повышает устойчивость организма к ОРВИ. Поэтому врачи рекомендуют его для профилактики заражения при контакте с больными и в период сезонных эпидемий,
назначают для предотвращения инфекционных заражений после операций.
Прием Арпефлю во время болезни:
- снижает общую интоксикацию и выраженность симптомов «простуды»
- сокращает время болезни в среднем на 2 дня
- уменьшает риск развития осложнений от вирусных инфекций и обострений хронических бактериальных заболеваний
От чего таблетки Арпефлю принимают:
- гриппа типа А и В
- ОРВИ
- кишечных ротавирусных инфекций у детей старше 3 лет (в комбинированном лечении)
- хронического бронхита, пневмонии и повторной герпетической инфекции (вместе с другими препаратами)
Вам может быть интересно: Противовирусные препараты недорогие но эффективные
Арпефлю: как принимать
Эффективность лечения будет выше, если пить Арпефлю сразу после появления первых симптомов ОРВИ и не позднее трех суток от начала болезни.
Кратность приема Арпефлю — 4 раза в день. В случае пропуска очередной дозы нужно выпить таблетку как можно скорее и далее продолжить прием по начатой схеме.
Таблетки принимают до приема пищи, запивая водой.
Кстати, при инфекции и лихорадке нужно пить много теплой жидкости. Это может быть просто вода, компоты, морсы, зеленый чай, разбавленные соки. Пить лучше понемногу, но часто. Почему это важно? При температуре потоотделение усиливается, организм обезвоживается, интоксикация растет.
Если в течение трех суток лечения Арпефлю интенсивность симптомов не уменьшается и сохраняется высокая температура, то необходимо обратиться к врачу для корректировки назначений.
Арпефлю: дозировка
Таблетки Арпефлю производятся в дозировках 50 мг и 100 мг.
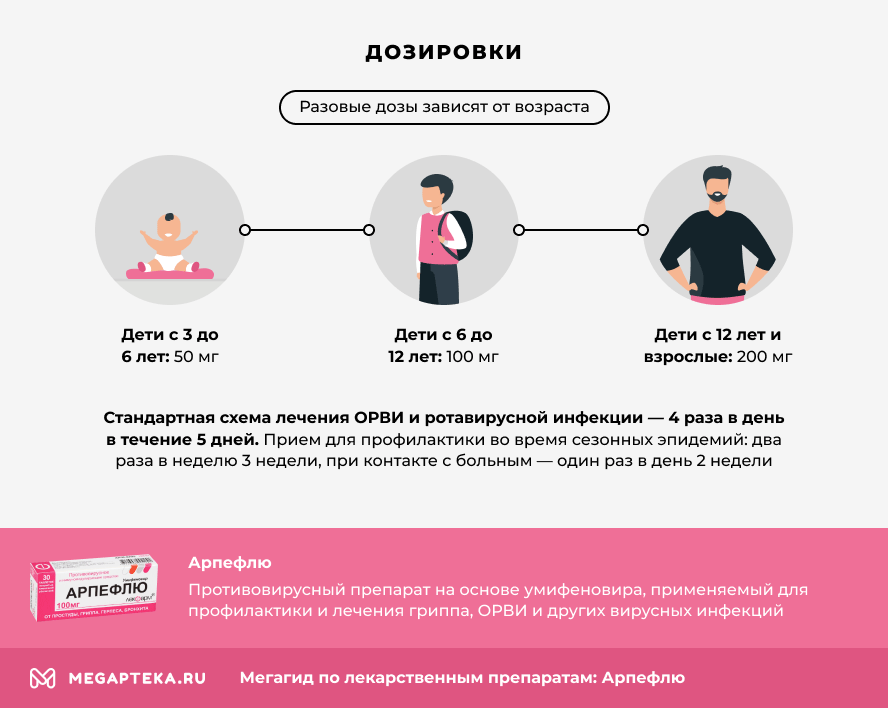
Разовые дозы зависят от возраста:
- дети с 3 до 6 лет — 50 мг
- дети с 6 до 12 лет — 100 мг
- дети с 12 лет и взрослые — 200 мг (принимают по 2 таблетки 100 мг или 4 таблетки по 50 мг)
Стандартная схема лечения ОРВИ и ротавирусной инфекции — 4 раза в день в течение 5 дней.
Прием для профилактики во время сезонных эпидемий: два раза в неделю 3 недели, при контакте с больным — один раз в день 2 недели.
Арпефлю: аналоги
Хотите разбираться в аналогах лекарств, чтобы умело подбирать препараты на свой бюджет? Наша методичка от экспертов-провизоров «Аналоги популярных лекарств» поможет вам в этом! Получить методичку просто: подпишитесь на наши соцсети и напишите в сообщения «аналоги».
Мегаптека в соцсетях: ВКонтакте, Telegram, OK, Viber
К аналогам Арпефлю, содержащим такое же действующее вещество — умифеновир — относятся:
Арбидол, Арбидол Максимум — производитель «Фармстандарт», в линейке препаратов есть капсулы, таблетки и порошок для приготовления детской суспензии с 2 лет. Арбидол Максимум содержит по 200 мг умифеновира в капсулах, это удобно для лечения взрослых пациентов
Афлюдол — производитель «Татхимфармпрепараты», нет различий в формах выпуска, показаниях и дозировках
Умифеновир — производитель «Озон», выпускается в капсулах по 50 и 100 мг, применяется также, как и Арпефлю
Сравнение Арпефлю с противовирусными препаратами с другими действующими веществами представлено в таблице:
| Арпефлю |
Амиксин (Лавомакс, Тилорон) | Ингавирин | Кагоцел | |
| Действующее вещество | умифеновир | тилорон | витаглутам | кагоцел |
| Форма выпуска | таблетки, покрытые оболочкой 50 мг и 100 мг | таблетки 60 мг для детей, 125 мг для взрослых | капсулы для взрослых 90 мг, для детей капсулы 60 мг и сироп | таблетки 12 мг |
| С какого возраста разрешен | с 3 лет | с 7 лет | сироп с 3 лет, капсулы 60 мг с 7 лет | с 3 лет |
| Эффективный прием при ОРВИ | не позднее 3 дней с начала болезни | информации в инструкции нет | не позднее 2 дней | не позднее 4 дня |
| Схема приема | 4 раза в день 5 дней, для взрослых 40 таблеток на курс | курс для взрослых 6 таблеток на 10 дней по схеме, для детей на курс 3/4 таблетки | 1 капсула 1 раз 5-7 дней, на курс 7 капсул | 18 таблеток на 4 дня по схеме |
| Побочные эффекты | аллергические реакции | аллергические реакции, диспепсические явления, кратковременный озноб | аллергические реакции редко | аллергические реакции |
Каждый аналог имеет определенные преимущества:
- Арпефлю — можно применять беременным во II и III триместрах (под наблюдением врачей), он единственный не «пропускает» вирус в клетку
- Амиксин — на курс лечения достаточно 6 таблеток, для детей — всего 3 таблетки.
- Ингавирин — только у него есть противовирусный сироп для детей, он не дает побочных эффектов и имеет удобную схему приема
- Кагоцел — единственное противовирусное, которое можно начать принимать на 4 день после начала заболевания и получить эффект от лечения
Однако все перечисленные препараты не имеют качественных доказательств эффективности. Простуда проходит сама по себе в течение недели.
Противовирусный препарат Арпефлю содержит умифеновир и является аналогом Арбидола. Он не дает вирусам размножаться в клетках организма и увеличивает выработку интерферона для борьбы с инфекцией.
Его назначают для профилактики и лечения гриппа, ОРВИ, ротавирусной и герпесной инфекции. Препарат малотоксичный. Он выводится из организма в неизменном виде и в рекомендуемых дозах не оказывает побочных эффектов. Арпефлю применяют детям с 3 лет. Продается в аптеках без рецепта.
В сравнении с другими противовирусными препаратами Арпефлю имеет как преимущества, так и недостатки. При выборе лекарства при конкретной ОРВИ желательно проконсультироваться с врачом.
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же Вы можете поделиться своим опытом с другими читателями Мегасоветов.
Поделиться мегасоветом
Понравилась статья? Расскажите маме, папе, бабушке и тете Гале из третьего подъезда
Амивирен (150 мг)
МНН: Ламивудин
Производитель: АО Фармасинтез
Анатомо-терапевтическо-химическая классификация: Lamivudine
Номер регистрации в РК:
№ РК-ЛС-5№121752
Информация о регистрации в РК:
23.10.2015 — 23.10.2020
Информация о реестрах и регистрах
Информация по ценам и ограничения
Предельная цена закупа в РК:
65.01 KZT
- Скачать инструкцию медикамента
Торговое название
Амивирен
Международное непатентованное название
Ламивудин
Лекарственная форма
Таблетки, покрытые пленочной оболочкой 150 мг, 300 мг
Состав
Одна таблетка содержит
активное вещество – ламивудин 150 мг, 300 мг
вспомогательные вещества:
Ядро: карбоксиметилкрахмал натрия (примогель), крахмал прежелатинизированный, кремния диоксид коллоидный (аэросил марка А-300), магния стеарат, целлюлоза микрокристаллическая.
Состав оболочки: (готовая водорастворимая пленочная оболочка)
гидроксипропилметилцеллюлоза (гипромеллоза), коповидон (кополивидон), полиэтиленгликоль 6000 (макрогол 6000), глицерил каприлокапрат, титана диоксид (E171), полидекстроза.
Описание
Таблетки, покрытые пленочной оболочкой, белого цвета, круглые, двояковыпуклые (для дозировки 150 мг).
Таблетки, покрытые пленочной оболочкой, белого цвета, овальные, двояковыпуклые, с риской с одной стороны (для дозировки 300 мг).
На поперечном разрезе таблетка белого или белого с желтоватым оттенком цвета.
Фармакотерапевтическая группа
Противовирусные препараты для системного использования. Противовирусные препараты прямого действия. Нуклеозиды – ингибиторы обратной транскриптазы. Ламивудин.
Код АТХ: J05AF05
Фармакологические свойства
Фармакокинетика
Всасывание Ламивудин хорошо всасывается из желудочно-кишечного тракта. Биодоступность ламивудина у взрослых после приема внутрь обычно составляет 80-85%. Среднее время (Тmax) достижения максимальной концентрации (Сmax) ламивудина в сыворотке составляет около 1 часа. При назначении ламивудина в терапевтических дозах (4 мг/кг/сутки в 2 приема с интервалом в 12 часов) Сmax составляет 1-1,9 мкг/мл.
Прием ламивудина вместе с пищей приводит к увеличению Тmax и снижению Сmax (до 47%), однако не влияет на общую степень абсорбции, рассчитанную на основании площади под фармакокинетической кривой «концентрация-время». Поэтому при приеме ламивудина с пищей коррекция дозы не требуется.
Крошение таблеток и прием их с небольшим количеством полутвердой пищи или жидкости не меняет фармакологические свойства препарата и клинический эффект. Эти выводы основаны на физико-химических и фармакокинетических характеристиках действующего вещества.
Распределение и связывание с белками плазмы крови
При внутривенном введении ламивудина объем распределения составляет в среднем 1,3 л/кг, а период полувыведения – 5-7 часов.
В терапевтическом диапазоне доз ламивудин имеет линейную фармакокинетику и в незначительной степени связывается с белками плазмы крови.
Установлено, что ламивудин проникает в центральную нервную систему (ЦНС) и в спинномозговую жидкость. Через 2-4 часа после приема внутрь соотношение концентраций ламивудина в ликворе и сыворотке составляло приблизительно 0,12.
Метаболизм и выведение
В среднем системный клиренс ламивудина составляет приблизительно 0,32 л/кг/ч. Ламивудин выводится преимущественно почками (более 70%) путем активной канальцевой секреции (система транспорта органических катионов), а также посредством метаболизма в печени (менее 10%). Активная форма ламивудина, внутриклеточный ламивудина трифосфат, имеет более длительный период полувыведения из клеток (16-19 часов) по сравнению с периодом полувыведения его из плазмы (5-7 часов). Имеются данные, что фармакокинетические параметры ламивудина при приеме в дозе 300 мг 1 раз в сутки в равновесном состоянии эквивалентны таковым при приеме в дозе 150 мг 2 раза в сутки по показателям площади под фармакокинетической кривой «концентрация-время» на протяжении 24 часов (AUC24) и Сmax для ламивудина трифосфата.
Вероятность неблагоприятного взаимодействия ламивудина с другими препаратами очень мала вследствие ограниченного метаболизма в печени, незначительной степени связывания с белками плазмы и почти полного выведения почками ламивудина в неизмененном виде.
Особые группы пациентов
Дети
В целом, фармакокинетика ламивудина у детей сходна с таковой у взрослых. Однако, абсолютная биодоступность (примерно 55-65%) была ниже и более изменчивой у детей младше 12 лет. В дополнение, показатели системного клиренса выше у детей младшего возраста и снижаются по мере роста, достигая уровня взрослых пациентов к 12-летнему возрасту. Фармакокинетические исследования ламивудина в форме таблеток, покрытых пленочной оболочкой, показали, что прием препарата один раз в день эквивалентен приему препарата два раза в день по показателю AUC24. При приеме ламивудина в рекомендованных дозах средние показатели AUC24 достигали приблизительно 7,1-13,7 мкг* ч/мл, что сопоставимо с показателями AUC24 у взрослых при приеме препарата один раз в день.
Пожилые пациенты
Данные по фармакокинетике ламивудина у пациентов старше 65 лет отсутствуют.
Пациенты с нарушением функции почек
У пациентов с нарушением функции почек концентрация ламивудина в плазме повышена, так как его выведение из организма замедлено. Больным с клиренсом креатинина менее 50 мл/мин дозу ламивудина необходимо снижать.
Пациенты с нарушением функции печени
Данные о применении ламивудина у пациентов с умеренной и тяжелой печеночной недостаточностью свидетельствуют о том, что нарушение функции печени существенно не влияет на фармакокинетику ламивудина.
Беременность
Фармакокинетика ламивудина у беременных не отличается от таковой у небеременных. Исследования показали, что ламивудин проникает через плаценту. Концентрация ламивудина в сыворотке новорожденных в момент рождения такая же, как в сыворотке матери и в крови из пуповины.
Фармакодинамика
Ламивудин является высокоэффективным избирательным ингибитором репликации ВИЧ-1 и ВИЧ-2 in vitro. Также активен в отношении штаммов ВИЧ, устойчивых к зидовудину.
Внутри клеток ламивудин метаболизируется до 5′-трифосфата (активная форма), период полувыведения которого из клеток составляет 16-19 ч. Ламивудина-5′-трифосфат в незначительной степени ингибирует РНК- и ДНК-зависимую обратную транскриптазу ВИЧ. Основной механизм его действия – блокирование синтеза растущей цепи ДНК в процессе обратной транскрипции ВИЧ. Показано, что ламивудин оказывает аддитивное или синергическое действие по отношению к другим антиретровирусным препаратам, прежде всего к зидовудину, угнетая репликацию ВИЧ в культуре клеток.
Ламивудин не нарушает нормальный клеточный метаболизм ДНК и не оказывает существенного влияния на содержание ядерной и митохондриальной ДНК в клетках млекопитающих.
В исследованиях in vitro ламивудин оказывает слабое цитотоксическое действие на лимфоциты периферической крови, а также на лимфоцитарные и моноцитарно-макрофагальные клеточные линии и ряд других стволовых клеток костного мозга. Таким образом, in vitro ламивудин обладает высоким терапевтическим индексом.
Фармакодинамические эффекты
Одна из причин развития резистентности ВИЧ-1 к ламивудину – появление изменений в M184V вирусного генома, который тесно связан с активным центром обратной транскриптазы ВИЧ. Штаммы ВИЧ-1 с мутациями M184V могут появляться как in vitro, так и в организме больных, получающих комбинированную антиретровирусную терапию, включающую ламивудин. Такие штаммы вируса характеризуются сниженной чувствительностью к ламивудину и слабой способностью к репликации in vitro. In vitro штаммы ВИЧ, устойчивые к зидовудину, могут приобрести к нему чувствительность в случае одновременного развития резистентности к ламивудину. Клиническая значимость этого явления не установлена.
Мутации в кодоне M184V приводят к возникновению перекрестной резистентности ВИЧ только к препаратам из группы нуклеозидных ингибиторов обратной транскриптазы. Зидовудин и ставудин сохраняют свою активность, в отношении штаммов ВИЧ-1, резистентных к ламивудину. Абакавир сохраняет антиретровирусную активность в отношении штаммов ВИЧ-1, имеющих M184V мутацию, резистентных к ламивудину. У штаммов ВИЧ с M184V мутациями определяется не более чем 4-кратное снижение чувствительности к диданозину и залцитабину; клиническое значение этого явления не установлено. Тесты на чувствительность ВИЧ к различным антиретровирусным препаратам in vitro не были стандартизованы, и поэтому на их результаты могут влиять различные методологические факторы.
Согласно данным клинических исследований, применение ламивудина в комбинации с зидовудином уменьшает вирусную нагрузку ВИЧ-1 в крови и увеличивает содержание CD4-лимфоцитов. Установлено, что ламивудин в комбинации с зидовудином или с зидовудином и другими препаратами значительно снижает риск прогрессирования ВИЧ-инфекции и летального исхода. У штаммов ВИЧ, выделенных от больных, получавших ламивудин, отмечалось снижение чувствительности к ламивудину in vitro.
Комбинированная терапия ламивудином и зидовудином у пациентов, ранее не получавших антиретровирусную терапию, задерживает появление резистентных к зидовудину штаммов ВИЧ. Ламивудин получил широкое распространение как компонент комбинированной антиретровирусной терапии в сочетании с другими нуклеозидными ингибиторами обратной транскриптазы или препаратами из других групп (ингибиторы протеазы, ненуклеозидные ингибиторы обратной транскриптазы).
Показано, что комбинированная антиретровирусная терапия, включающая ламивудин, эффективна в отношении штамов ВИЧ с мутациями в кодоне M184V.
Чтобы установить взаимосвязь между чувствительностью ВИЧ к ламивудину in vitro и клиническим эффектом терапии, требуются дополнительные исследования.
Показания к применению
— лечение ВИЧ-инфекции в составе комбинированной антиретровирусной терапии у взрослых и детей.
Способ применения и дозы
Назначение терапии должно производиться только врачом, имеющим опыт лечения ВИЧ инфекции.
Амивирен может применяться с едой или без.
Для обеспечения введения полной дозы, таблетка(и) рекомендуется проглатывать полностью без измельчения.
В качестве альтернативы для пациентов, которые не могут проглатывать таблетки, таблетка(и) может быть измельчена и добавлена в небольшое количество полужидкой пищи или жидкости, которые нужно употребить немедленно и полностью.
Взрослые, подростки и дети (весом не менее 25 кг):
Рекомендуемая доза Амивирена составляет 300 мг в день. Вводится либо по 150 мг два раза в день или 300 мг раз вдень.
Дети (весом менее 25 кг):
Для таблеток Амивирен рекомендуется дозировка по категориям веса.
Дети весом ≥ 20 кг до < 25 кг: Рекомендуемая дозировка составляет 225 мг в день. Может вводиться как 75 мг (половина таблетки 150 мг) утром и 150 мг (одна целая таблетка 150 мг) вечером, или 225 мг (полторы таблетки 150 мг) один раз в день.
Дети весом 14 кг до < 20 кг: Рекомендуемая дозировка составляет 150 мг в день. Может вводиться по 75 мг (половина таблетки 150 мг) два раза в день, или 150 мг (одна целая таблетка 150 мг) раз в день.
Дети младше трех месяцев: В связи с недостаточностью имеющихся данных, не представляется возможным предложить рекомендации по дозировке
Пациенты, меняющие режим приема с двух раз в день на один раз в день, должны принимать рекомендуемую разовую дневную дозу (как указано выше) приблизительно через 12 часов после приема последней дозы по двухразовому режиму, и затем продолжать прием рекомендуемой однократной дневной дозы (как указано выше) приблизительно через 24 часа. При переходе обратно на двухразовый режим, пациенты должны принимать рекомендуемую двухразовую дневную дозу приблизительно через 24 часа после приема последней однократной дневной дозы.
Особые группы:
Пожилые люди
Не имеется особых данных; однако, этой группе следует уделять особое внимание в связи с возрастными изменениями, проявляющимися в снижении функции печени и изменении гематологических показателей.
Нарушение функции почек
У пациентов с нарушением функции почек средней и тяжелой степени, концентрация ламивудина в плазме повышена вследствие снижения клиренса. В связи с этим доза должна быть изменена или препарат должен быть отменен для пациентов, у которых клиренс креатинина опускается ниже 30 мл/мин.
Рекомендации по дозировке для взрослых, подростков и детей (весом более 25 кг):
|
Клиренс креатинина (мл/мин) |
Стартовая доза |
Поддерживающая доза |
|
≥50 |
300 мг или 150 мг |
300 мг один раз в день 150 мг два раза в день |
|
30-<50 |
150 мг |
150 мг два раза в день |
Не имеется достаточных данных по использованию ламивудина у детей с нарушением функции почек. На основании предположения, что клиренс креатинина и клиренс ламивудина коррелируют одинаковым образом у детей и у взрослых, рекомендуется снижение дозировки у детей с нарушением функции почек, в зависимости от клиренса креатинина, в той же пропорции, как и для взрослых.
Рекомендации по дозировке для детей в возрасте старше 3 месяцев и весом менее 25 кг:
|
Клиренс креатинина (мл/мин) |
Стартовая доза |
Поддерживающая доза |
|
≥50 |
8 мг/кг или 4 мг/кг |
8 мг/кг один раз в день 4 мг/кг два раза в день |
|
30 до <50 |
4 мг/кг |
4 мг/кг один раз в день |
|
15 до <30 |
4 мг/кг |
2,6 мг/кг один раз в день |
|
5 до <15 |
4 мг/кг |
1,3 мг/кг один раз в день |
|
<5 |
1,3 мг/кг |
0,7 мг/кг один раз в день |
При клиренсе креатинина менее 30 мл/мин рекомендуется применять другую лекарственную форму – раствор для приема внутрь.
Нарушение функций печени
Данные, полученные у пациентов от средней до тяжелой степени печеночной недостаточности, показывают, что нарушение функций печени не оказывает значительного воздействия на фармакокинетику ламивудина. На основании этих данных, изменение дозы для пациентов со средней или тяжелой степенью печеночной недостаточности не требуется, если она не сопровождается почечной недостаточностью.
Противопоказания
— повышенная чувствительность к ламивудину или любому другому компоненту препарата
— детский возраст до 6 лет (дети с массой тела менее 14 кг)
— нарушение функции почек с клиренсом креатинина менее 30 мл/мин
— период грудного вскармливания
— беременность.
С осторожностью:
почечная недостаточность с клиренсом креатинина более 30 мл/мин и менее 50 мл/мин, беременность, пожилой возраст.
Побочные действия
Описанные ниже нежелательные реакции отмечались при лечении ВИЧ-инфекции ламивудином, как в качестве монотерапии, так и при его сочетанном применении с другими антиретровирусными препаратами. Однако, в отношении многих нежелательных реакций неясно, вызваны ли они лекарственными препаратами или являются осложнениями собственно ВИЧ-инфекции.
Частота явлений определяется как: очень часто (>1/10), часто (>1/100, <1/10), нечасто (>1/1000, <1/100), редко (>1/10,000, <1/1000), очень редко (<1/10000).
Со стороны органов кроветворения: нечасто — нейтропения, анемия, тромбоцитопения; очень редко – истинная аплазия эритроидного ростка костного мозга.
Со стороны обмена веществ: часто — повышение концентрации молочной кислоты в сыворотке; нечасто – гипертриглицеридемия, гиперхолистеринемия, резистентность к инсулину. гипергликемия; редко — лактоацидоз; перераспределение/накопление подкожно-жировой клетчатки — частота развития зависит от множества факторов, в т.ч. от конкретной комбинации антиретровирусных препаратов.
Со стороны нервной системы: часто — головная боль, бессонница, очень редко — парестезии; описаны случаи развития периферической нейропатии, однако связь этого осложнения с терапией ламивудином не доказана.
Со стороны желудочно-кишечного тракта: часто — тошнота, рвота, боли в верхних отделах живота, диарея; редко — панкреатит, хотя связь этого осложнения с терапией ламивудином не доказана; повышение активности сывороточной амилазы,
Со стороны гепатобилиарной системы: нечасто — транзиторное повышение активности печеночных ферментов (аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ)); редко – гепатит.
Со стороны кожи и ее производных: часто — сыпь, алопеция.
Со стороны костно-мышечной системы и соединительной ткани: часто- артралгия, мышечные нарушения; редко – рабдомиолиз.
Со стороны дыхательной системы: часто — кашель, назальные симптомы
Аллергические реакции: ангионевротический отек.
Прочие: часто — чувство усталости, недомогание, лихорадка.
Сообщалось о случаях остеонекроза у пациентов с такими факторами риска, как поздние стадии ВИЧ-инфекции или длительная комбинированная антиретровирусная терапия (частота встречаемости неизвестна).
Лекарственные взаимодействия
Вероятность метаболического взаимодействия ламивудина с другими препаратами крайне низка, поскольку ламивудин весьма слабо метаболизируется, в незначительной степени связывается с белками плазмы и выводится преимущественно почками в неизмененном виде.
Ламивудин выводится из организма преимущественно путем активной канальциевой секреции через систему транспорта органических катионов. Следует учитывать возможность взаимодействия ламивудина с препаратами, имеющими такой же механизм выведения, например с триметопримом. Другие препараты (например, ранитидин, циметидин) лишь частично выводятся с помощью указанного механизма и не взаимодействуют с ламивудином.
Препараты, которые выводятся преимущественно путем активной почечной секреции через систему транспорта органических анионов или посредством клубочковой фильтрации, по-видимому, не вступают в клинически значимые взаимодействия с ламивудином.
Зидовудин. При одновременном применении ламивудина и зидовудина наблюдается умеренное (на 28 %) увеличение Сmax зидовудина в плазме, при этом AUC существенно не изменяется. Зидовудин не влияет на фармакокинетику ламивудина.
Триметоприм/сулъфаметоксазол. Одновременное применение триметоприма/сульфаметоксазола (ко-тримоксазола) в дозе 160/800 мг повышает концентрацию ламивудина в плазме крови приблизительно на 40 % (за счет взаимодействия с триметопримом). Однако при отсутствии нарушения функции почек снижения дозы ламивудина не требуется. На фармакокинетику триметоприма и сульфаметоксазола ламивудин не влияет. Не рекомендуется одновременное применение ламивудина с высокими дозами ко-тримоксазола, назначаемого для лечения пневмоцистной пневмонии.
Залцитабин. При одновременном назначении ламивудина и залцитабина ламивудин может ингибировать внутриклеточное фосфорилирование последнего. В связи с этим данная комбинация препаратов не рекомендуется.
Кладрибин. При одновременном назначении ламивудина и кладрибина, ламивудин может ингибировать внутриклеточное фосфорилирование кладрибина. В связи с этим данная комбинация препаратов не рекомендуется.
Особые указания
Лечение ламивудином должен проводить врач, имеющий опыт ведения больных с ВИЧ-инфекцией.
У детей до 6-и лет не рекомендуется применение таблетированных лекарственных форм, поэтому для лечения детей необходимо применять другую лекарственную форму — раствор для приема внутрь (см.раздел «Способ применения и дозы»).
Применение ламивудина в качестве монотерапии не рекомендуется.
Пациентов следует предупредить о том, что лечение антиретровирусными препаратами, в том числе ламивудином, не предотвращает риск передачи ВИЧ другим людям при половых контактах или переливании крови. Поэтому пациенты должны соблюдать соответствующие меры предосторожности.
У пациентов, получающих ламивудин или другие антиретровирусные препараты, могут развиться оппортунистические инфекции или другие осложнения, поэтому они должны находиться под тщательным наблюдением врача, имеющего опыт лечения ВИЧ-инфекции.
Остеонекроз.
Хотя этиология считается многофакторной (включая использование кортикостероидов, употребление алкоголя, тяжелое подавление иммунитета, повышенный индекс массы тела), случаи остеонекроза отмечались чаще у пациентов с прогрессирующей стадией ВИЧ заболевания и/или при длительной комбинированной антиретровирусной терапии. При появлении боли и ломоты в суставах, скованности в суставах или затрудненности движений, пациентам необходимо обратиться за медицинской помощью.
Тройная терапия нуклеозидами.
Сообщалось о случаях отсутствия вирусологического ответа и развития резистентности на ранней стадии при назначении тройной терапии нуклеозидами (комбинация ламивудина с тенофовира дизопроксила фумарата и абакавира, а также ламивудина с тенофовира дизопроксил фумаратом и диданозином) при приеме препаратов один раз в сутки.
Митохондриальная дисфункция.
В условиях in vitro и in vivo выявлена способность нуклеотидных и нуклеозидных аналогов вызывать повреждение митохондрий различной степени. Наблюдались случаи митохондриальной дисфункции у ВИЧ-негативных детей, подвергшихся влиянию нуклеозидных аналогов внутриутробно или сразу после рождения.
Нарушение функции почек.
У пациентов с нарушением функции почек средней и тяжелой степени концентрация ламивудина в плазме повышена вследствие снижения клиренса препарата, поэтому требуется коррекция дозы. У пациентов с нарушением функции почек при клиренсе креатинина <30 мл/мин необходимо применять другую лекарственную форму — раствор для приема внутрь (см.раздел «Способ применения и дозы»).
Пациенты с нарушением функции печени
У пациентов с печеночной недостаточностью средней и тяжелой степени снижения дозы ламивудина не требуется, если только нарушение функции печени не сопровождается почечной недостаточностью.
Панкреатит.
Отмечено несколько случаев развития панкреатита у пациентов, получавших ламивудин. Однако остается неясным, вызвано ли это осложнение ламивудином или самой ВИЧ-инфекцией. При появлении боли в животе, тошноты, рвоты или характерных изменений биохимических показателей у пациента, получающего ламивудин, следует исключить панкреатит. Следует приостановить прием препарата до того момента, пока диагноз панкреатита не будет исключен.
Лактат-ацидоз/выраженная гепатомегалия с жировой дистрофией печени.
У ВИЧ-инфицированных пациентов (преимущественно у женщин), принимавших антиретровирусные препараты из группы аналогов нуклеозидов в качестве монотерапии или в комбинации с ламивудином, описаны случаи лактат-ацидоза, который обычно сопровождался выраженной гепатомегалией и жировой дистрофией печени, в том числе, с летальным исходом. К симптомам, которые могут указывать на развитие лактат-ацидоза, относятся: общая слабость, потеря аппетита, внезапная необъяснимая потеря веса, нарушения со стороны желудочно-кишечного тракта и дыхательной системы (одышка).
Лечение ламивудином всегда требует соблюдения осторожности, и особенно, при наличии у пациента факторов риска развития заболевания печени. В случае появления клинических или лабораторных признаков лактат-ацидоза или нарушения функции печени (включая гепатомегалию и жировую дистофию печени даже в отсутствии выраженного повышения активности печеночных трансаминаз) прием ламивудина следует прекратить.
Следует соблюдать осторожность при назначении нуклеозидных аналогов пациентам с сопутствующим гепатитом С, получающим интерферон альфа и рибавирин в связи с высоким риском развития лактат-ацидоза. За такими пациентами должен проводиться тщательный клинический и лабораторный мониторинг.
Перераспределение подкожно-жировой клетчатки.
У некоторых пациентов комбинированная антиретровирусная терапия может сопровождаться перераспределением/накоплением подкожно-жировой клетчатки, в т.ч. уменьшением количества периферической жировой клетчатки и увеличением висцерального жира, похуданием конечностей и лица, увеличением молочных желез и отложением жира по задней поверхности шеи и спины («горб буйвола»), а также повышением концентрации липидов глюкозы в плазме крови.
Хотя одну или несколько из перечисленных выше нежелательных реакций, связанных с общим синдромом, который часто называют липодистрофией, могут вызывать все препараты из классов ингибиторов протеазы и нуклеозидных ингибиторов обратной транскриптазы, накопленные данные свидетельствуют о существовании различий между отдельными представителями указанных классов препаратов в способности вызывать эти нежелательные реакции.
Следует отметить также, что синдром липодистрофии имеет многофакторную этиологию; например, стадия ВИЧ-инфекции, пожилой возраст и продолжительность антиретровирусной терапии играют важную, возможно синергичную роль, в развитии данного осложнения. Отдаленные последствия указанных нежелательных реакций в настоящее время не установлены. Клиническое обследование пациентов должно включать оценку физических признаков перераспределения жировой ткани. Следует также измерять концентрации липидов глюкозы в плазме крови. Нарушения липидного обмена необходимо корректировать, руководствуясь их клиническими проявлениями.
Синдром восстановления иммунитета.
У ВИЧ-инфицированных пациентов с тяжелым иммунодефицитом во время начала антиретровирусной терапии возможно обострение воспалительного процесса, обусловленного бессимптомной или вялотекущей оппортунистической инфекцией, что может стать причиной серьезного ухудшения состояния или усугубления симптоматики. Как правило, подобные реакции наблюдались в первые недели или месяцы после начала антиретровирусной терапии. Наиболее значимые примеры — цитомегаловирусный ретинит, генерализованная и/или очаговая микобактериальная инфекция и пневмоцистная пневмония. Любые симптомы воспаления необходимо немедленно выявлять и без промедления начинать лечение.
Аутоиммунные заболевания (такие как болезнь Грейвса, синдром Вагнера, полимиозит, синдром Гийена-Барре и др.) наблюдались на фоне восстановления иммунитета, однако время первичных проявлений варьировало, и заболевание могло возникать через много месяцев после начала терапии и иметь атипичное течение.
Пациенты, инфицированные одновременно ВИЧ и вирусом гепатита В.
У пациентов, инфицированных одновременно ВИЧ и вирусом гепатита В, после прекращения терапии ламивудином возможно появление клинических или лабораторных признаков рецидива гепатита, что может иметь тяжелые последствия при декомпенсации функции печени. После окончания терапии ламивудином у пациентов, инфицированных ВИЧ и вирусом гепатита В, необходимо следить за биохимическими показателями функции печени и маркерами репликации вируса гепатита В в течение нескольких месяцев.
Одновременное применение с другими лекарственными препаратами
Вероятность неблагоприятного взаимодействия ламивудина с другими препаратами очень мала вследствие ограниченного метаболизма в печени, незначительной степени связывания с белками плазмы и почти полного выведения почками ламивудина в неизмененном виде.
Ламивудин преимущественно выводится с помощью катионной транспортной системы, соответственно, следует помнить о возможности взаимодействия ламивудина с лекарственными средствами, имеющими тот же путь выведения, например, триметопримом. Клинически значимое взаимодействие ламивудина с лекарственными препаратами, которые выводятся преимущественно с помощью анионной транспортной системы, либо клубочковой фильтрации, маловероятно.
Не следует одновременно назначать ламивудин с залцитабином, кладрибином, а так же с высокими дозами ко-тримоксазола, применяемого для лечения пневмоцистной пневмонии (см. раздел «Взаимодействие с другими лекарственными препаратами»).
У пациентов, одновременно получавших ламивудин и иммунодепрессанты (например, циклоспорин А) в стандартных дозах, клинически значимые неблагоприятные взаимодействия не отмечались. Специальные исследования не проводились.
Не выявлено неблагоприятного фармакокинетического взаимодействия между ламивудином и интерфероном альфа.
Профилактика после вероятного заражения ВИЧ.
Согласно международным рекомендациям (Центр по контролю заболеваемости, июнь 1998), при вероятном заражении через кровь ВИЧ-инфицированного человека (например, через инъекционную иглу), необходимо срочно (в течение 1 -2 часов от момента заражения) назначить комбинированную терапию зидовудином и ламивудином. В случае высокого риска заражения в схему антиретровирусной терапии должен быть включен препарат из группы ингибиторов протеазы. Профилактическое лечение рекомендуется проводить в течение 4 недель. Данных об эффективности профилактического лечения после случайного заражения ВИЧ накоплено недостаточно; контролируемых исследований не проводилось.
Несмотря на быстрое начало лечения антиретровирусными препаратами, нельзя исключить возможность сероконверсии.
Применение при беременности и в период грудного вскармливания
Беременность
Данных о безопасности ламивудина во время беременности в настоящее время недостаточно. Исследования показали, что ламивудин проникает через плаценту. Ламивудин следует применять при беременности только в том случае, если ожидаемая польза для матери превышает потенциальный риск для плода. Хотя результаты экспериментов на животных не всегда можно экстраполировать на человека, данные исследований на кроликах свидетельствуют о возможном риске спонтанного аборта на ранних сроках беременности.
Лактация
По мнению экспертов, всем ВИЧ-инфицированным женщинам следует по возможности отказаться от кормления грудью во избежание передачи вируса ребенку через грудное молоко. После приема внутрь ламивудин выделяется с грудным молоком, при этом концентрация его в грудном молоке практически не отличается от таковой в сыворотке (1-8 мкг/мл). Поскольку ВИЧ и ламивудин проникают в грудное молоко, женщинам, принимающим ламивудин, не рекомендуется кормить ребенка грудью.
Особенности влияния на способность управлять автомобилем и движущимися механизмами
Специальных исследований по изучению влияния препарата на способность управлять автомобилем и движущимися механизмами не проводилось. Однако, исходя из фармакологических свойств ламивудина такое влияние маловероятно. Тем не менее, при оценке способности пациента управлять автомобилем и движущимися механизмами следует принимать во внимание его общее состояние, а также характер нежелательных реакций ламивудина.
Передозировка
Симптомы: имеются немногочисленные данные о последствиях острой передозировки ламивудина у человека, летальных исходов не отмечалось, состояние всех больных нормализовалось. Каких-либо специфических признаков или симптомов передозировки ламивудина выявлено не было.
Лечение: промывание желудка, прием адсорбентов, рекомендуется контролировать состояние пациента и проводить стандартную поддерживающую терапию. Поскольку ламивудин выводится из организма с помощью диализа, возможно применение непрерывного гемодиализа, однако специальных исследований не проводилось.
Форма выпуска и упаковка.
По 10 таблеток в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой печатной лакированной.
По 3, 6 контурных ячейковых упаковок вместе с инструкцией по применению помещают в пачку из картона для потребительской тары. Пачки помещают в групповую упаковку.
Условия хранения
Хранить в оригинальной упаковке производителя при температуре не выше 25 оС.
Хранить в недоступном для детей месте!
Срок годности
3 года
Не использовать по истечении срока, указанного на упаковке.
Условия отпуска из аптек
По рецепту
Производитель
ОАО «Фармасинтез»
664040, Иркутск, Розы Люксембург, 184
Электронный адрес: info@pharmasyntez.com
Владелец регистрационного удостоверения
ОАО «Фармасинтез»
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции:
ТОО «Авицена-ЛТД»
050002, г. Алматы, ул. Джангильдина, 31, офис 416
тел./факс: +7727 3572387 /88/ 89
e-mail: reg@avitsena.kz
| 400339751477976377_ru.doc | 119.5 кб |
| 127341481477977575_kz.doc | 184 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники