В статье освещены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий у детей. Представлены основные принципы дифференциальной диагностики и лечения указанных дефицитных анемий у детей.
В настоящей публикации на основании данных литературы и анализа собственных наблюдений представлены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий, а также принципы их лечения у детей. Установлено, что основной формой дефицитных анемий (ДА) в педиатрической популяции является анемия, обусловленная недостаточным содержанием в организме железа. При этом особо подчеркивается, что железодефицитная анемия (ЖДА) не только наиболее распространенная ДА, но и самое частое гематологическое заболевание у детей [1–3]. С учетом того, что другие типы анемий (в т. ч. развивающиеся при дефиците таких витаминов, как фолиевая кислота и В12) хуже известны врачам-педиатрам, их верификация, как правило, запаздывает, т. к. они ошибочно принимаются за ЖДА. Поздняя диагностика и отсутствие адекватной терапии при этом приводят к прогрессированию патологических процессов. Это негативно сказывается на росте и развитии детского организма и ухудшает качество жизни ребенка. Принимая во внимание актуальность данной проблемы, авторы пришли к выводу о необходимости представить для практикующих врачей-педиатров ключевые положения дифференциальной диагностики и лечения анемий, обусловленных дефицитом железа, фолиевой кислоты и витамина В12 у детей.
Дифференциальная диагностика ДА у детей
Критерием анемии, независимо от этиологии, является снижение уровня гемоглобина (Hb) ниже возрастной нормы. Так, синдром анемии констатируют, если концентрация Hb в капиллярной крови ниже: 110 г/л — у детей в возрасте от 1 мес. до 5 лет, 115 г/л — у детей 6–12 лет, 120 г/л — у детей старше 12 лет и подростков. Кроме этого, зная уровень Hb, можно определить тяжесть анемического синдрома. Так, для детей, достигших месячного возраста и старше, снижение Нb до 90 г/л является признаком анемии легкой степени, уровень Нb в пределах 70–90 г/л характерен для анемии средней тяжести, а падение Нb ниже 70 г/л определяет тяжелую степень анемии [1–4].
Нозологическая верификация характера анемии проводится на основе анализа клинико-анамнестических данных, результатов лабораторного и, если необходимо, инструментального обследования пациента. Общими клиническими проявлениями анемии, независимо от этиологии, являются повышенная утомляемость, снижение работоспособности, склонность к инфекциям. Среди дополнительных симптомов, которые могут отмечаться при ЖДА, — извращение аппетита и пристрастие к необычным запахам, изменение ногтевых пластин, расслоение ногтей, выпадение волос, атрофия сосочков языка, дисфагия. В свою очередь, при витамин В12-дефицитной анемии имеют место неврологические нарушения (атаксия, парестезии, гипорефлексия и другие проявления фуникулярного миелоза), «лакированный» язык и желтуха. Непрямая гипербилирубинемия может также отмечаться и при фолиеводефицитной анемии (табл. 1).
Наличие желтухи и анемии при этом нередко становится причиной ошибочного заключения о гемолитическом характере анемии, если врач не обращает внимания на отсутствие ретикулоцитоза. Следует отметить, что иктеричность при анемиях, обусловленных дефицитом витамина В12 или фолиевой кислоты, связана с неэффективным эритропоэзом и повышенным разрушением предшественников эритроцитов в костном мозге [1–3, 5–7].
Несмотря на описанные выше симптомы, типичные для конкретных ДА, их клинические проявления могут быть слабо выражены при легкой степени анемии, особенно у детей раннего возраста. В связи с этим этиологическая верификация генеза анемического синдрома проводится на основании не только клинических проявлений и анамнестических данных. Обязательным условием установления диагноза является корректная трактовка результатов лабораторного обследования. При этом минимально достаточным уровнем лабораторного обследования является проведение клинического и биохимического анализов крови.
Хорошо известно, что показаниями к исследованию клинического анализа крови для исключения анемии у детей являются анамнестические (недоношенность, задержка внутриутробного развития, исключительно грудное вскармливание ребенка, если мать имеет хронические заболевания кишечника или является вегетарианкой и др.) и/или клинические факторы риска (геморрагический синдром, синдром мальабсорбции, инфекционно-воспалительные заболевания, желтуха, лимфаденопатия, гепато- или спленомегалия и другие патологические состояния). При оценке результатов клинического анализа крови нельзя ограничиваться только поиском лабораторных признаков анемии. Обязательно должны быть проанализированы все параметры гемограммы (эритроциты и их индексы, ретикулоциты, тромбоциты и их индексы, общее количество лейкоцитов, лейкоцитарная формула, а также абсолютное количество нейтрофилов, лимфоцитов, моноцитов и эозинофилов, СОЭ). Это позволяет уже при первичном обращении пациента очертить круг основных причин выявленной анемии и наметить основные диагностические мероприятия для расшифровки генеза заболевания [1–4].
Так, для ЖДА типичными признаками являются: гипохромия и микроцитоз эритроцитов при нормальном уровне ретикулоцитов, если недостаточное содержание железа в организме обусловлено алиментарными факторами или синдромом мальабсорбции. В тех же случаях, когда ЖДА имеет постгеморрагический генез, гипохромия и микроцитоз эритроцитов будут сопровождаться ретикулоцитозом [1–4]. В свою очередь для анемий, обусловленных недостатком в организме как фолиевой кислоты, так и витамина В12, характерны гиперхромия и макроцитоз эритроцитов, а также ретикулоцитопения (табл. 2).
Кроме этого, при фолиево- и витамин В12-дефицитной анемиях могут встречаться лейко- и тромбоцитопения, гиперсегментация нейтрофилов. С учетом того, что в ряде случаев ДА имеет комбинированный генез, при котором дефицит железа сочетается с дефицитом фолиевой кислоты или витамина В12, типичные гематологические признаки могут не выявляться или быть разнонаправленными. Это определяет необходимость обязательного проведения биохимического анализа крови с определением, кроме общепринятых показателей, таких параметров, как железо, железосвязывающая способность, процент насыщения трансферрина, ферритин, фолиевая кислота и витамин В12 [6, 7]. Особо следует подчеркнуть, что ферритин должен определяться вместе с С-реактивным белком (СРБ). При этом оценивать уровень ферритина можно только в тех случаях, когда значения СРБ находятся в пределах нормативных. Это объясняется тем, что ферритин относится к протеинам воспаления и его уровень повышается при воспалительных процессах в организме. В связи с этим нормальный или высокий уровень ферритина при повышенных значениях СРБ может стать причиной ошибочного заключения об отсутствии железодефицитного состояния [2–4]. Особенности биохимического анализа крови при различных вариантах ДА представлены в таблице 2.
Лечение ДА у детей
Корректная трактовка клинико-анамнестических данных и результатов лабораторного обследования позволяет верифицировать причину ДА и своевременно назначить адекватную терапию. Принципиально важным при этом является положение о том, что компенсировать дефицитные состояния невозможно только за счет нормализации рациона питания. Основная роль в купировании дефицита железа, фолиевой кислоты и витамина В12 принадлежит заместительной фармакотерапии [1–7]. При этом для лечения ЖДА используются солевые препараты железа или препараты на основе железа гидроксид полимальтозата. Суточная доза препаратов зависит от массы тела и возраста ребенка, расчет при этом проводится по элементарному железу. Так, для солевых препаратов железа, назначаемых внутрь, используются следующие дозы (расчет по элементарному железу!): для детей до 3 лет — 3 мг/кг/сут, для детей старше 3 лет — 45–60 мг/сут, для подростков —
до 120 мг/сут. При использовании пероральных форм железа гидроксид полимальтозата рекомендованные дозы составляют 5 мг/кг/сут (расчет по элементарному железу!). Продолжительность терапии препаратами железа зависит от степени тяжести ЖДА. При легкой ЖДА курс лечения составляет 3 мес., при среднетяжелой форме — 4,5 мес., при тяжелой — до 6 мес. [3].
В случае диагностики фолиеводефицитной анемии заместительная терапия проводится препаратами фолиевой кислоты. Рекомендовано использовать следующие суточные дозы фолиевой кислоты: для детей до 1 года — 0,25–0,5 мг/сут, для детей старше 1 года — 1,0 мг/сут. При синдроме мальабсорбции доза может быть повышена до 5–15 мг фолиевой кислоты в сутки. Терапия проводится в указанных дозах ежедневно на протяжении 4–6 нед. Через 7 дней от начала лечения необходимо выполнить клинический анализ крови с обязательным подсчетом ретикулоцитов (рис. 1). Повышение уровня ретикулоцитов на фоне приема фолиевой кислоты указывает на правильно установленный диагноз и является обоснованием для продолжения терапии. Купирование анемии достигается через 4–6 нед. от начала лечения [6].
Для лечения витамин В12-дефицитной анемии используют препараты цианокобаламина для парентерального введения. При этом рекомендовано придерживаться следующего режима дозирования: для детей до 1 года — 5 мкг/кг/сут, для детей старше 1 года — 100 мкг/сут, для подростков — 200 мкг/сут. Препарат вводится внутримышечно 1 р./сут ежедневно. На 7–10-й день терапии проводят клинический анализ. Выявление ретикулоцитоза позволяет сделать вывод об эффективности проводимого лечения. Терапию следует продолжить в том же режиме дозирования еще в течение 3–4 нед. В дальнейшем, при достижении нормализации уровня гемоглобина, переходят на поддерживающее лечение: цианокобаламин вводят в терапевтической дозе 1 раз в 7 дней в течение 2 мес., а затем 1 раз в 14 дней в течение 6 мес. (рис. 2). Учитывая, что дефицит витамина В12, как правило, редко обусловлен алиментарными факторами, одновременно проводят поиск причин данного патологического состояния (болезнь Крона, целиакия, инвазия широким лентецом, наследственные нарушения всасывания и/или транспортировки витамина В12 и др.) [7]. В тех случаях, когда имеют место полидефицитные состояния с развитием анемического синдрома, оправданно комбинированное заместительное лечение. Чаще всего у детей встречается сочетанный дефицит железа и фолиевой кислоты, что требует одновременного назначения препаратов железа и фолиевой кислоты.
Заключение
Таким образом, выявление анемии у ребенка определяет необходимость обязательного уточнения причин указанного патологического состояния. Своевременная верификация этиологии анемии позволяет без промедления начать адекватную терапию, что определяет ее эффективность и улучшает качество жизни ребенка. Авторы выражают надежду, что информация, представленная в настоящей публикации, будет полезна практикующим врачам-педиатрам.
Анемию и анемический синдром, вызываемый многими причинами, можно упомянуть среди наиболее часто встречающихся патологических состояний, с которыми ежедневно приходится сталкиваться педиатрам общей практики. В эту группу входят различные заболевания и патологические состояния, характеризующиеся уменьшением содержания гемоглобина и/или эритроцитов в единице объема крови, приводящие к нарушению снабжения тканей кислородом. Применяются следующие лабораторные критерии анемии (Н. П. Шабалов, 2003). В зависимости от возраста детей уровень гемоглобина составляет:
- 0–1 сутки жизни — < 145 г/л;
- 1–14 дней жизни — < 130 г/л;
- 14–28 дней жизни — < 120 г/л;
- 1 мес — 6 лет — < 110 г/л.
Из всех анемий самой распространенной является железодефицитная (ЖДА), которая составляет примерно 80% от всех анемий. По данным Всемирной организации здравоохранения (ВОЗ), в мире более 500 тыс. человек страдает ЖДА. Распространенность ЖДА у детей в России и развитых европейских странах составляет: около 50% — у детей младшего возраста; более 20% — у детей старшего возраста.
ЖДА — это клинико-гематологический синдром, характеризующийся нарушением синтеза гемоглобина в результате дефицита железа, развивающегося на фоне различных патологических (физиологических) процессов, и проявляющийся признаками анемии и сидеропении.
Железо — один из основных микроэлементов в организме человека. В норме в организме взрослого человека содержится 3–5 г железа в связанной форме. 70% общего количества железа входит в состав гемопротеинов. Железо в этих соединениях связано с порфирином. Основной представитель этой группы — гемоглобин (58% железа); также железо содержится в миоглобине (8%), цитохромах, пероксидазах, каталазах — до 4%. Железо входит и в состав негемовых ферментов (ксантиноксидаза, никотинамидадениндинуклеотид (НАДН)-дегидрогеназа, аконитаза, локализующиеся в митохондриях); транспортной формы железа (трансферрин, лактоферрин). Запасы железа в организме существуют в двух формах: в виде ферритина (до 70%) и гемосидерина (до 30%). Особенность распределения железа у детей младшего возраста заключается в том, что у них выше содержание железа в эритроидных клетках и меньше железа приходится на мышечную ткань.
Всасывание железа происходит преимущественно в двенадцатиперстной кишке и проксимальных отделах тощей кишки. В суточном рационе обычно содержится около 5–20 мг железа, а усваивается только около 1–2 мг в сутки. Степень абсорбции железа зависит как от его количества в потребляемой пище и биодоступности, так и от состояния желудочно-кишечного тракта (ЖКТ).
Легче абсорбируется железо в составе гема (мясные продукты) — 9–22%. Всасывание негемового железа определяется диетой и особенностями желудочно-кишечной секреции.
Особенно активно всасывание железа происходит из грудного молока, хотя его содержание в нем невелико — всего 1,5 мг в литре; биодоступность железа грудного молока составляет до 60%. Этому способствует особая форма, в которой оно представлено, — в виде железосодержащего белка лактоферрина. В молекуле лактоферрина определены два активных центра связывания ионов Fe3+. Лактоферрин в грудном молоке содержится в виде насыщенной и ненасыщенной форм. Соотношение форм лактоферрина меняется в зависимости от периода лактации. В течение первых 1–3 мес жизни превалирует насыщенная железотранспортная форма лактоферрина. Наличие специфических рецепторов к лактоферрину на эпителиальных клетках слизистой оболочки кишечника способствует адгезии с ними лактоферрина и более полной его утилизации. Кроме того, лактоферрин, связывая лишнее, не всосавшееся в кишечнике железо, лишает условно-патогенную микрофлору необходимого для ее жизнедеятельности микроэлемента и запускает неспецифические бактерицидные механизмы. Установлено, что бактерицидная функция иммуноглобулина A реализуется только в присутствии лактоферрина.
Физиологические потери железа с мочой, потом, калом, через кожу, волосы и ногти не зависят от пола и составляют 1–2 мг в сутки, у женщин во время менструации — 2–3 мг в сутки. У детей потеря железа составляет 0,1–0,3 мг в сутки, возрастая до 0,5–1,0 мг в сутки у подростков.
Ежедневная потребность детского организма в железе составляет 0,5–1,2 мг в сутки. У детей раннего возраста в связи с быстрыми темпами роста и развития наблюдается повышенная потребность в железе. В этот период жизни запасы железа быстро истощаются из-за усиленного его потребления из депо: у недоношенных детей к 3-му месяцу, у доношенных — к 5–6-му мес жизни. Для обеспечения нормального развития ребенка в суточном рационе новорожденного должно содержаться 1,5 мг железа, а у ребенка 1–3 лет — не менее 10 мг.
Дефицит железа у детей приводит к росту инфекционной заболеваемости органов дыхания и ЖКТ. Железо необходимо для нормального функционирования структур головного мозга, при его недостаточном содержании нарушается нервно-психическое развитие ребенка. Установлено, что у детей, имевших в младенчестве железодефицитную анемию, в возрасте 3–4 лет определяются нарушения передачи нервных импульсов от центров головного мозга к органам слуха и зрения из-за нарушения миелинизации и, как следствие этого, нарушение проводимости нервов.
Причины железодефицитных состояний у детей очень разнообразны. Основной причиной ЖДА у новорожденных считается наличие ЖДА или скрытого дефицита железа у матери во время беременности. К антенатальным причинам относят также и осложненное течение беременности, нарушение маточно-плацентарного кровообращения, фетоматеринские и фетоплацентарные кровотечения, синдром фетальной трансфузии при многоплодной беременности. Интранатальными причинами дефицита железа являются: фетоплацентарная трансфузия, преждевременная или поздняя перевязка пуповины, интранатальные кровотечения из-за травматических акушерских пособий или аномалий развития плаценты или пуповины. Среди постнатальных причин сидеропенических состояний на первое место выступает недостаточное поступление железа с пищей. При этом более всего страдают новорожденные, находящиеся на искусственном вскармливании неадаптированными молочными смесями, коровьим и козьим молоком. Другими постнатальными причинами ЖДА являются: повышенная потребность организма в железе; потери железа, превышающие физиологические; заболевания ЖКТ, синдром нарушенного кишечного всасывания; дефицит запасов железа при рождении; анатомические врожденные аномалии (дивертикул Меккеля, полипозы кишечника); употребление продуктов, тормозящих абсорбцию железа.
В группе риска всегда находятся недоношенные дети и дети, родившиеся с очень большой массой, дети с лимфатико-гипопластическим типом конституции.
У детей первого года жизни к дефициту железа чаще всего приводит несбалансированная диета, в частности вскармливание исключительно молоком, вегетарианство, недостаточное употребление мясных продуктов.
К сидеропении способны приводить кровотечения различной этиологии. Источником этого могут быть: грыжа пищеводного отверстия диафрагмы, варикозное расширение вен пищевода, желудочно-кишечные язвы, опухоли, дивертикулы, язвенный колит, геморроидальные узлы, а также кровотечения из мочеполового тракта и дыхательных путей. Прием некоторых медикаментов, таких как нестероидные противовоспалительные препараты, салицилаты, кумарины, глюкокортикостероиды, также может привести к потере железа. Дефицит железа всегда сопутствует заболеваниям, сопровождающимся нарушениями кишечного всасывания (энтериты, болезнь Крона, паразитарные инвазии и др.). Дисбактериоз кишечника также препятствует нормальному перевариванию пищи и тем самым снижает способность организма усваивать железо. Кроме того, может иметь место нарушение транспорта железа из-за недостаточной активности и снижения содержания трансферрина в организме.
Распознать причину развития ЖДА в каждом конкретном случае чрезвычайно важно. Ориентация на нозологическую диагностику необходима, так как в большинстве случаев при лечении анемии можно воздействовать и на основной патологический процесс.
ЖДА проявляется общими симптомами. Один из главных и видимых признаков — бледность кожных покровов, слизистых оболочек, конъюнктив глаз. Обращают на себя внимание общая вялость, капризность, плаксивость, легкая возбудимость детей, снижение общего тонуса организма, потливость, отсутствие или снижение аппетита, поверхностный сон, срыгивание, рвота после кормления, понижение остроты зрения. Выявляются изменения со стороны мышечной системы: ребенок с трудом преодолевает физические нагрузки, отмечается слабость, утомляемость. У детей первого года жизни может наблюдаться регресс моторных навыков.
Во втором полугодии жизни и у детей старше года наблюдаются признаки поражения эпителиальной ткани — шершавость, сухость кожи, ангулярный стоматит, болезненные трещины в уголках рта, глоссит или атрофия слизистой оболочки ротовой полости, ломкость и тусклость волос, их выпадение, матовость и ломкость ногтей, разрушение зубов (кариес), отставание в физическом и психомоторном развитии.
В зависимости от степени тяжести заболевания выявляются симптомы поражения органов и систем: сердечно-сосудистой — в виде функционального шума в сердце, тахикардии; нервной системы — в виде головных болей, головокружений, обмороков, ортостатических коллапсов. Возможно увеличение размеров печени, селезенки. Со стороны ЖКТ наблюдается затрудненное глотание, вздутие кишечника, диарея, запоры, извращение вкуса — желание есть глину, землю.
Диагноз ЖДА ставится на основании клинической картины, лабораторных признаков анемии и дефицита железа в организме: гипохромная (цветовой показатель < 0,85) анемия различной степени тяжести, гипохромия эритроцитов, снижение средней концентрации гемоглобина в эритроците (менее 24 пг), микроцитоз и пойкилоцитоз эритроцитов (в мазке периферической крови); уменьшение количества сидеробластов в пунктате костного мозга; уменьшение содержания железа в сыворотке крови (< 12,5 мкмоль/л); повышение общей железосвязывающей способности сыворотки (ОЖСС) более 85 мкмоль/л (показатель «голодания»); повышение уровня трансферрина в сыворотке крови, при снижении его насыщения железом (менее 15%); снижение уровня ферритина в сыворотке (< 15 мкг/л).
Лечение ЖДА
Лечение ЖДА у детей раннего возраста должно быть комплексным и базироваться на четырех принципах: нормализация режима и питания ребенка; возможная коррекция причины железодефицита; назначение препаратов железа; сопутствующая терапия.
Важнейшим фактором коррекции железодефицита является сбалансированное питание, и в первую очередь грудное вскармливание. Грудное молоко не только содержит железо в высокобиодоступной форме, но и повышает абсорбцию железа из других продуктов, употребляемых одновременно с ним. Однако интенсивные обменные процессы у грудных детей приводят к тому, что к 5–6-му мес жизни антенатальные запасы железа истощаются даже у детей с благополучным перинатальным анамнезом и малышей, вскармливаемых грудным молоком.
Из других продуктов питания наибольшее количество железа содержится в свиной печени, говяжьем языке, телячьих почках, яичном желтке, устрицах, бобах, кунжуте, морской капусте, пшеничных отрубях, гречке, фисташках, турецком горохе, персиках, овсяных хлопьях, шпинате, лесных орехах и др. (табл.).
Абсорбцию железа тормозят танины, содержащиеся в чае, карбонаты, оксалаты, фосфаты, этилендиаминтетрауксусная кислота, используемая в качестве консерванта, антацидные препараты, тетрациклины. Аскорбиновая, лимонная, янтарная и яблочная кислоты, фруктоза, цистеин, сорбит, никотинамид усиливают всасывание железа.
Необходимы длительные прогулки на свежем воздухе, нормализация сна, благоприятный психологический климат, профилактика острых респираторных вирусных инфекций (ОРВИ), ограничение физической нагрузки. Питание ребенка должно быть сбалансированным и включать продукты, богатые железом, и вещества, усиливающие его всасывание в кишечнике. Детям, страдающим ЖДА, необходимо вводить прикорм на 2–4 нед раньше, чем здоровым. Введение мясного прикорма целесообразно начинать в 6 мес. Следует отказаться от введения в рацион ребенка таких каш, как манная, рисовая, толокняная, отдавая предпочтение гречневой, ячменной, просяной.
Однако эти меры недостаточны и не приводят к излечению ЖДА, поэтому основой терапии являются препараты железа. К основным из них, применяемым перорально, относятся: соединения трехвалентного железа — гидроксид-полимальтозный комплекс (полимальтозат железа), мальтофер, мальтофер фол, феррум лек и железо-протеиновый комплекс (железа протеин сукцинилат) — ферлатум; соединения двухвалентного железа — актиферрин, ферроплекс, тардиферон, гемофер, тотема, фумарат железа, ферронат.
Начинать терапию следует препаратами для приема внутрь и только при плохой их переносимости (тошнота, рвота, диарея), синдроме нарушенного всасывания, резекции тонкого кишечника и т. д. — препараты железа назначают парентерально. При назначении пероральных форм следует отдавать предпочтение неионным соединениям железа — протеиновый (ферлатум) и гидроксид-полимальтозный комплексы Fe3+ (мальтофер, мальтофер фол, феррум лек). Эти соединения имеют большую молекулярную массу, что затрудняет их диффузию через мембрану слизистой кишечника. Они поступают из кишечника в кровь в результате активного всасывания. Это объясняет невозможность передозировки препаратов в отличие от солевых соединений железа, всасывание которых происходит по градиенту концентрации. Взаимодействия их с компонентами пищи и лекарственными препаратами не происходит, что позволяет использовать неионные соединения железа, не нарушая режим питания и терапии сопутствующей патологии. Их применение существенно снижает частоту развития побочных эффектов, обычно наблюдаемых при назначении пероральных препаратов железа (тошнота, рвота, диарея, запоры и др.). Кроме того, у детей раннего возраста большое значение имеет лекарственная форма препарата. В этом возрасте удобно использовать капли и сиропы, что обеспечивает в том числе возможность точного дозирования препаратов и не вызывает негативного отношения ребенка.
При назначении любых препаратов железа необходимо рассчитывать индивидуальную потребность в нем для каждого пациента, исходя из того, что оптимальная суточная доза элементарного железа составляет 4–6 мг/кг. Среднесуточная доза железа при лечении ЖДА составляет 5 мг/кг. Применение более высоких доз не имеет смысла, поскольку объем всасывания железа не увеличивается.
Применение парентеральных препаратов железа показано для быстрого достижения эффекта при анемии тяжелой степени; патологии ЖКТ, сочетающейся с нарушением всасывания; неспецифическом язвенном колите; хроническом энтероколите; при тяжелой непереносимости оральных форм препаратов. На сегодняшний день в Российской Федерации для внутривенного введения разрешен только один препарат — венофер (сахарат железа), для внутримышечного может использоваться феррум лек.
Необходимо помнить, что у детей раннего возраста дефицит железа никогда не бывает изолированным и часто сочетается с недостаточностью витаминов С, В12, В6, РР, А, Е, фолиевой кислоты, цинка, меди и др. Это связано с тем, что алиментарная недостаточность и нарушенное кишечное всасывание, приводящие к дефициту железа, влияют и на насыщаемость данными микронутриентами. Поэтому в комплексную терапию ЖДА необходимо включать поливитаминные препараты.
Об эффективности терапии ЖДА можно судить уже через 7–10 дней по увеличению ретикулоцитов в 2 раза по сравнению с исходным количеством (так называемый ретикулоцитарный криз). Также оценивается прирост гемоглобина, который должен составлять 10 г/л и более в неделю. Соответственно, достижение целевого уровня гемоглобина наблюдается в среднем через 3–5 нед от начала терапии в зависимости от тяжести анемии. Однако лечение препаратами железа должно проводиться в достаточных дозах и длительно (не менее 3 мес) даже после нормализации уровня гемоглобина, с тем чтобы пополнить запасы железа в депо.
Если же в течение 3–4 нед не наблюдается значимого улучшения показателей гемоглобина, то необходимо выяснить, почему лечение оказалось неэффективным. Наиболее часто речь идет: о неадекватной дозе препарата железа; продолжающейся или неустановленной кровопотере; наличии хронических воспалительных заболеваний или новообразований; сопутствующем дефиците витамина В12; неверном диагнозе; глистной инвазии и других паразитарных инфекциях.
Противопоказаниями к назначению препаратов железа являются:
- отсутствие лабораторного подтверждения дефицита железа;
- сидероахрестические анемии;
- гемолитические анемии;
- гемосидероз и гемохроматоз;
- инфекция, вызванная грамотрицательной флорой (энтеробактерии, синегнойная палочка, клебсиелла).
При развитии тяжелых анемий, сопровождаемых угнетением эритропоэза и снижением продукции эритропоэтина, показано назначение препаратов рекомбинантного человеческого эритропоэтина (рчЭПО). Особое значение имеет применение рчЭПО при развитии ранней анемии недоношенных, которая развивается на втором месяце жизни и встречается, по данным различных авторов, в 20–90% случаев. Назначение препаратов рчЭПО (рекормон, эпрекс, эпокрин) приводит к резкой активизации эритропоэза и, как следствие, к значительному возрастанию потребностей в железе.
Поэтому применение рчЭПО является показанием к назначению препаратов железа, как правило, парентеральных. В настоящее время в Российской Федерации разрешены к применению a- и b-эпоэтины, которые вошли в список дополнительного лекарственного обеспечения. Назначeние рчЭПО позволяет в большинстве случаев избежать гемотрансфузий, при которых велика вероятность осложнений (трансфузионные реакции, сенсибилизация и пр.). Предпочтительным способом введения препаратов рчЭПО, особенно в раннем детском возрасте, является подкожный. Подкожный способ введения более безопасный и экономичный, так как для достижения эффекта необходимы меньшие дозы, чем при внутривенном введении. До недавнего времени в странах Евросоюза и в Российской Федерации для лечения гипорегенераторных анемий у детей использовались в основном β-эритропоэтины, которые при подкожном введении не вызывали значимых побочных реакций в отличие от a-эритропоэтинов, при подкожном введении которых был велик риск развития красноклеточной аплазии. Наиболее широкое распространение среди β-эритропоэтинов получил препарат рекормон (Ф. Хоффманн-Ля Рош), который удобен в применении и приводит к быстрому повышению уровня эритроцитов и ретикулоцитов, не влияя на лейкопоэз, повышает уровень гемоглобина, а также скорость включения железа в клетки.
С 2004 г. в европейских странах разрешено подкожное введение a-эритропоэтинов, среди которых в нашей стране наиболее часто используются эпрекс (Янсен-Силаг) и эпокрин (Сотекс-ГосНИИ ОЧБ).
Целью лечения рчЭПО является достижение показателей гематокрита 30–35% и устранение необходимости переливаний крови. Значения целевой концентрации гемоглобина могут варьировать в зависимости от дней и месяцев жизни ребенка, однако не могут быть ниже 100–110 г/л. В зависимости от дозы целевые значения концентрации гемоглобина и гематокрита достигаются примерно через 8–16 нед лечения рчЭПО.
С целью профилактики ЖДА рчЭПО назначается недоношенным новорожденным, родившимся с массой тела 750–1500 г до 34-й недели беременности.
Лечение эритропоэтином должно начинаться как можно раньше и продолжаться 6 нед. Препарат рекормон вводят подкожно в дозе 250 МЕ/кг 3 раза в неделю. Однако необходимо учитывать, что чем меньше возраст ребенка, тем более высокие дозы эритропоэтина ему требуются, поэтому доза может быть увеличена.
Как было сказано выше, терапия рчЭПО приводит к резкому возрастанию потребления железа, поэтому в большинстве случаев, особенно у недоношенных детей, одновременно с повышением гематокрита снижается содержание ферритина в сыворотке. Быстрое расходование запасов железа в организме может привести к ЖДА. Поэтому всем больным, получающим терапию рчЭПО, показано назначение препаратов железа. Терапия препаратами железа должна продолжаться до нормализации уровня сывороточного ферритина (не менее 100 мкг/мл) и насыщения трансферрина (не менее 20%). Если концентрация ферритина в сыворотке сохраняется стойко ниже 100 мкг/мл или есть другие признаки дефицита железа, дозу железа следует увеличить, в том числе с использованием парентеральных препаратов.
Профилактика ЖДА у детей раннего возраста включает в себя: антенатальную (правильный режим и питание беременной, своевременное выявление и лечение анемии беременной, превентивное назначение препаратов железа женщинам из групп риска по развитию ЖДА); постнатальную (соблюдение гигиенических условий жизни ребенка, длительное грудное вскармливание и своевременное введение прикормов, адекватный выбор смеси для детей, находящихся на смешанном и искусственном вскармливании, профилактика развития у ребенка рахита, гипотрофии и ОРВИ). В профилактическом назначении препаратов железа нуждаются:
- женщины репродуктивного возраста, страдающие обильными и длительными менструальными кровотечениями;
- постоянные доноры;
- беременные, особенно повторные беременности, следующие с коротким интервалом;
- женщины с дефицитом железа в период лактации.
Профилактическое назначение препаратов железа показано детям из групп риска по развитию ЖДА:
- недоношенные дети (с 2-месячного возраста);
- дети от многоплодной беременности, осложненных беременностей и родов;
- крупные дети с высокими темпами прибавки массы и роста;
- дети с аномалиями конституции;
- страдающие атопическими заболеваниями;
- находящиеся на искусственном вскармливании неадаптированными смесями;
- с хроническими заболеваниями;
- после кровопотерь и хирургических вмешательств;
- с синдромом мальабсорбции.
Доза железа, назначаемого с профилактической целью, зависит от степени недоношенности ребенка:
- для детей с массой тела при рождении менее 1000 г — 4 мг Fe /кг/день;
- для детей с массой тела при рождении от 1000 до 1500 г — 3 мг Fe/кг/день;
- для детей с массой тела при рождении от 1500 до 3000 г — 2 мг Fe/кг/день.
Значимость проблемы ЖДА у детей раннего возраста обусловлена ее большой распространенностью в популяции и частым развитием при различных заболеваниях, что требует постоянной настороженности врачей любых специальностей. Тем не менее на современном этапе в арсенале врача имеется достаточно диагностических и лечебных возможностей для раннего выявления и своевременной коррекции сидеропенических состояний.
Литература
- Анемии у детей/под ред. В. И. Калиничевой. Л.: Медицина, 1983. 360 с.
- Анемии у детей: диагностика и лечение/под ред. А. Г. Румянцева, Ю. Н. Токарева. М., 2000. 128 с.
- Аркадьева Г. В. Диагностика и лечение железодефицитных анемий. М., 1999. 59 с.
- Белошевский В. А. Железодефицит у взрослых, детей и беременных. Воронеж, 2000. 121 с.
- Борисова И. П., Скобин В. Б., Павлов А. Д. Раннее назначение рекомбинантного эритропоэтина у недоношенных детей/7-й Национальный конгресс «Человек и лекарство». М., 2000. С. 125.
- Вахрамеева С. Н., Денисова С. Н. Латентная форма железодефицитной анемии беременных женщин и состояние здоровья их детей//Российский вестник перинатологии и педиатрии. 1996. № 3. С. 26–29.
- Дворецкий Л. И., Воробьев П. А. Дифференциальный диагноз и лечение при анемическом синдроме. М.: Ньюдиамед, 1994. 24 с.
- Дворецкий Л. И. Железодефицитные анемии//Русский медицинский журнал. 1997. № 19. С. 1234–1242.
- Идельсон Л. И. Гипохромные анемии. М.: Медицина, 1981. 190 с.
- Казакова Л. М., Макрушин И. М. Иммунитет при дефиците железа// Педиатрия. 1992. № 10–12. С. 54–59.
- Казюкова Т. В., Самсыгина Г. А., Левина А. А. Дефицит железа у детей: проблемы и решения//Consilium medicum. 2002. С. 17–19.
- Малаховский Ю. Е., Манеров Ф. К., Сарычева Е. Г. Легкая форма железодефицитной анемии и латентный дефицит железа — пограничные состояния у детей первых двух лет жизни//Педиатрия. 1988. № 3. С. 27–34.
- Папаян А. В., Жукова Л. Ю. Анемии у детей: руководство для врачей. СПб.: Питер, 2001. 382 с.
- Пригожина Т. А. Эффективность рекомбинантного эритропоэтина в комплексной профилактике и лечении ранней анемии недоношенных: автореф. дис. … канд. мед. наук. М., 2001. 19 с.
- Румянцев А. Г., Морщакова Е. Ф. Павлов А. Д. Эритропоэтин. Биологические свойства. Возрастная регуляция эритропоэза. Клиническое применение. М., 2002. С. 137–144; 266–270.
- Румянцев А. Г., Морщакова Е. Ф., Павлов А. Д. Эритропоэтин в диагностике, профилактике и лечении анемий. М., 2003. 568 с.
- Сергеева А. И., Султанова К. Ф., Левина А. А. и др. Показатели метаболизма железа у беременных женщин и детей раннего возраста//Гематология и трансфузиология. 1993. № 9–10. С. 30–33.
- Тетюхина Л. Н., Казакова Л. М. Профилактика дефицита железа как мера по снижению заболеваемости детей//Педиатрия. 1987. № 4. С. 72–73.
- Dallman P. R., Looker A. C., Johnson C. L. et al. Iron Nutrition in Health and Disease. Eds. Hallberg L., Asp N. G. Libbey; London. 1996; 65–74.
- Messer Y., Escande B. Erytropoietin and iron in the anemia of prematurity. TATM 1999; 15–17.
- Ohls R. K. The use of erythropoetin in neonatoles//Clin Perinatol. 2000; 20 (3): 681–696.
- Ulman J. The role of erythropoietin in erythropoiesis regulation in fetuses and newborn infants//Ginekol. Pol. 1996; 67:205–209.
Л. А. Анастасевич, кандидат медицинских наук
А. В. Малкоч, кандидат медицинских наук
РГМУ, Москва
Анемия у детей (Малокровие)
Анемия у детей — это гематологический синдром, характеризующийся снижением концентрации гемоглобина и количества эритроцитов в единице объема крови. При различных формах анемии у детей отмечаются общая слабость, быстрая утомляемость, бледность кожи и слизистых, головокружение, сердцебиение. Анемия у детей диагностируется по клиническим и лабораторным данным (общий анализ крови, определение билирубина, сывороточного железа, общей железосвязывающей способности сыворотки, исследование пунктата костного мозга и т. д.). Общие принципы лечения анемии у детей включают организацию рационального питания, своевременное введение прикормов, витаминотерапию, прием препаратов железа, ФТЛ (гимнастика, массаж, УФО), по показаниям — проведение гемотрансфузий.
Общие сведения
Анемия у детей (малокровие) – патологическое состояние, сопровождающееся снижением уровня гемоглобина и эритроцитов в крови ребенка. Анемия у детей – чрезвычайно распространенное заболевание в современной педиатрии. Около 40% случаев анемии диагностируется у детей в возрасте до 3-х лет; 30% — в пубертатном периоде; остальные – в различные возрастные периоды развития ребенка.
Анемия у детей
Причины
Факторы, способствующие развитию анемии у детей, делятся на антенатальные, интранатальные и постнатальные.
- Антенатальные факторы действуют в течение внутриутробного развития. Для нормального протекания процессов кроветворения у ребенка за период беременности его организм должен получить от матери и накопить достаточное количество железа (около 300 мг). Наиболее интенсивная передача железа от беременной и его депонирование у плода происходит на 28—32 неделях гестации. Нарушение нормального течения беременности в этот период (гестоз, фетоплацентарная недостаточность, угроза выкидыша, преждевременная отслойка плаценты, кровотечение, инфекционные заболевания матери, обострение хронических процессов) приводит к нарушению обмена железом и его недостаточному накоплению в организме ребенка. Анемия у детей возникает в том случае, если женщина также страдала анемией при беременности. Развитию анемии у новорожденных детей способствует многоплодная беременность.
- Интранатальные факторы анемии у детей связаны, главным образом, с кровопотерей во время родов. Кровопотеря возможна в случае преждевременной отслойки плаценты в период родов, ранней или поздней перевязки пуповины, истечения крови из пуповинного остатка при его ненадлежащей обработке, применения травмирующих акушерских пособий. Преждевременные роды приводят к тому, что анемия выявляется у всех недоношенных детей с рождения или приблизительно с 3-го месяца жизни.
- Постнатальные факторы анемии у детей включаются после рождения и могут быть эндогенными или экзогенными. Причинами эндогенной анемии у детей могут служить повреждение эритроцитов вследствие гемолитической болезни новорожденных, аномалии синтеза гемоглобина, первичная конституциональная недостаточность костного мозга.
Анемии у детей наиболее часто обусловлены:
- Алиментарными причинами. В данном случае анемия развивается преимущественно у детей первого года жизни, находящихся на однообразном молочном вскармливании. Анемия у детей раннего возраста может возникать при недостаточном содержании железа в грудном молоке; раннем и необоснованном переводе ребенка на искусственное или смешанное вскармливание; использовании неадаптированных смесей, коровьего или козьего молока для кормления; позднем введении в рацион ребенка прикормов. В более высоком поступлении железа в организм нуждаются недоношенные дети и дети, рожденные с повышенной массой тела. Поэтому несоответствие между поступлением и расходом железа также может послужить причиной анемии у детей первого года жизни.
- Регулярными кровопотерями: при частных носовых кровотечениях, болезнях крови (гемофилии, болезни Виллебранда), меноррагии, желудочно-кишечных кровотечениях, после оперативных вмешательств. У детей с пищевыми аллергиями, экссудативным диатезом, нейродермитом отмечается повышенная потеря железа через эпителий кожных покровов, поэтому такие дети составляют группу риска по развитию железодефицитной анемии.
- Недостаточным всасыванием железа. Кроме потери железа, к развитию анемии у детей может приводить нарушение его всасывания и обмена. Такие расстройства обычно встречаются при синдроме мальабсорбции (гипотрофии, рахите, лактазной недостаточности, целиакии, кишечной форме муковисцидоза и др.). Анемия у детей может являться следствием любого инфекционного или хронического соматического заболевания (туберкулеза, бактериального эндокардита, бронхоэктатической болезни, пиелонефрита и др.), лейкозов, микозов, глистной инвазии, коллагенозов (СКВ, ревматоидного артрита и др.).
- Витаминодефицитом. В развитии анемии у детей определенное значение имеет дефицит витаминов группы B, микроэлементов (магния, меди, кобальта), неблагоприятные гигиенические условия, истощение запасов эндогенного железа, наступающее у грудного ребенка к 5-6 мес.
Патогенез
Частое возникновение анемии у детей обусловлено их интенсивным ростом, активностью процесса эритропоэза, прогрессивным увеличением числа форменных элементов и ОЦК. Вместе с тем, аппарат кроветворения у детей функционально незрел и весьма уязвим перед лицом различных воздействий. Нормальное протекание кроветворения у детей требует большого количества железа, белка, витаминов и микроэлементов, поэтому любые погрешности вскармливания, инфекции, токсические воздействия на костный мозг способны вызвать развитие анемии у ребенка. Особенно чувствительными в этом плане оказываются дети второго полугодия жизни, у которых истощены неонатальные резервы железа.
Длительно существующая анемия у детей сопровождается развитием гипоксии, глубокими тканевыми и органными изменениями. Дети с анемией отстают в физическом и умственном развитии от здоровых сверстников, чаще страдают интеркуррентными заболеваниями, склонны к развитию хронических патологических процессов и различного рода осложнений.
Классификация
В соответствии с этиопатогенезом выделяют следующие группы анемий:
I. Постгеморрагические анемии у детей, обусловленные с острой или хронической кровопотерей.
II. Анемии у детей, обусловленные нарушением гемопоэза:
- железодифицитные (гипохромные)
- наследственные и приобретенные железонасыщенные (сидероахрестические — связаны с дефектами синтеза порфиринов)
- мегалобластные (В12–дефицитные и фолиеводефицитные)
- наследственные и приобретенные дизэритропоэтические
- наследственные и приобретенные гипопластические и апластические (связаны с угнетением кроветворения)
III. Наследственные и приобретенные гемолитические анемии у детей, обусловленные повышенным разрушением эритроцитов и преобладанием процесса кроворазрушения над процессом кровообразования (мембранопатии, ферментопатии, гемоглобинопатии, аутоиммунные анемии, гемолитическая болезнь новорожденных и др.).
Симптомы анемии у детей
Норма гемоглобина крови у детей до 6 лет составляет 125–135 г/л; об анемии у ребенка говорят в том случае, если этот показатель опускается ниже 110 г/л (у детей до 5 лет) и ниже 120 г/л (у детей старше 5 лет).
Видимые изменения при анемии у детей наблюдаются со стороны кожи и ее придатков: кожные покровы становятся бледными, сухими, шелушащимися; ногти деформируются и становятся ломкими; волосы теряют здоровый блеск. Характерным признаком анемии у детей является симптом Филатова – бледность мочек ушей при осмотре в проходящем свете. При тяжелых формах анемии у детей появляются трещины на ладонях и подошвах, в уголках рта; развивается афтозный стоматит, глоссит. Дети с анемией ослаблены, астеничны, часто болеют ОРВИ, бронхитами и пневмониями, острыми кишечными инфекциями.
Со стороны нервной системы, испытывающей гипоксию, отмечается вялость, плаксивость, быстрая истощаемость, головокружения, поверхностный сон, энурез. Выявляется снижение мышечного тонуса, ребенок плохо переносит физические нагрузки, быстро утомляется. У детей первого года жизни отмечается гипотрофия, происходит регресс психомоторного развития.
При анемии у детей выявляются нарушения функции сердечно-сосудистой системы в виде артериальной гипотонии, ортостатических коллапсов, обмороков, тахикардии, систолического шума. Со стороны пищеварительной системы у детей с анемией наблюдаются частые срыгивания и рвота после кормления, метеоризм, диарея или запоры, пониженный аппетит, возможно увеличение селезенки и печени.
Диагностика
Основу диагностики анемии у детей составляют лабораторные исследования. В общем анализе крови при анемии у детей выявляется снижение гемоглобина (Hb менее 120-110 г/л), снижение Er (<3,8х1012/л), снижение ЦП <0,85. Биохимическое исследование крови включает определение сывороточного железа, насыщения трансферрина железом, концентрации ферритина в сыворотке, билирубина, витаминов. В некоторых случаях требуется проведение пункции и исследования костного мозга.
В процессе диагностики определяется форма и степень тяжести анемии у детей. Последняя оценивается по содержанию эритроцитов и гемоглобина:
- анемия легкой степени – Hb 110-90 г/л, Er — до 3,5х1012/л;
- анемия средней степени — Hb 90-70 г/л, Er — до 2,5х1012/л;
- анемия тяжелой степени — Hb менее 70г/л, Er — менее 2,5х1012/л.
По показаниям дети с анемией могут нуждаться в консультациях узких специалистов (детского гастроэнтеролога, детского ревматолога, детского нефролога, детского гинеколога и др.), обследовании ЖКТ (ЭГДС, УЗИ брюшной полости) и почек (УЗИ почек).
Лечение анемии у детей
При анемии у детей требуется организация правильного режима дня и сбалансированного питания ребенка, проведение лекарственной терапии и общеукрепляющих мероприятий. Детям рекомендуется достаточное пребывание на свежем воздухе, дополнительный сон; назначается гимнастика и массаж, УФО.
Детям с анемией, находящимся на грудном вскармливании, следует своевременно вводить прикормы (соки, яичный желток, овощи, мясное пюре). Одновременно необходимо скорректировать рацион кормящей женщины, добавить прием поливитаминов и препаратов железа. Детям, получающим искусственное вскармливание, назначаются адаптированные молочные смеси, обогащенные железом. Диета детей старшего возраста должна содержать печень, говядину, бобовые, зелень, морепродукты, фруктовые и овощные соки.
Медикаментозная терапия анемии у детей включает назначение препаратов железа и поливитаминных препаратов до полной нормализации клинико-лабораторных показателей (в среднем 6-10 недель). В тяжелых случаях может потребоваться проведение гемотрансфузии.
Прогноз и профилактика
Прогноз железодефицитных анемий у детей обычно благоприятный. При своевременной диагностике, правильной организации питания, лечении анемии и сопутствующих заболеваний наступает полное выздоровление. Тяжелая анемия у детей может явиться основанием для переноса сроков вакцинации.
Антенатальный этап профилактики анемии у детей включает полноценное питание беременной, достаточное пребывание на свежем воздухе, прием минерально-витаминных комплексов, содержащих железо. Постнатальное предупреждение анемии у детей сводится к естественному вскармливанию, введению прикормов в рекомендуемые сроки, профилактике заболеваний раннего возраста, организации хорошего ухода и оптимального режима для ребенка, проведению превентивных лечебно-профилактических курсов в группах риска.
|
Литература 1. Анемии новорожденных: диагностика профилактика, лечение. -Клинические рекомендации. — 2015. 2. Классификация и диагностика анемий у детей/ Румянцев А.Г.// Вопросы современной педиатрии. — 2011. — Т.10, №1. 3. Гемолитические анемии у детей/ А.В. Моргун, Т.Е. Таранушенко. — 2018. |
Код МКБ-10 D64.9 |
Анемия у детей — лечение в Москве
Оглавление
Ключевые слова
-
Анемия хронических болезней
-
Воспаление
-
Дефицит железа
-
Ферритин
-
Гепцидин
-
Эритропоэтин
-
Эритропоэзстимулирующие препараты
Список сокращений
CHr — содержание гемоглобина в ретикулоците
Hb – гемоглобин
HYPO — количество гипохромных эритроцитов
MCH — среднее содержание Hb в эритроците
MCHC — средняя концентрация Hb в эритроците
MCV — средний объем эритроцита
RDW — ширина распределения эритроцитов по объему
RET — количество ретикулоцитов
АХБ — анемия хронических болезней
ВИЧ – вирус иммунодефицита человека
д.м.н. – доктор медицинских наук
ДЖ — дефицит железа
ЖДА — железодефицитная анемия
ЖС — железо сыворотки
к.м.н. – кандидат медицинских наук
НТЖ — коэффициента насыщения трансферрина железом
ОЖСС — общая железосвязывающая способность сыворотки
рчЭПО – рекомбинантный человеческий эритропоэтин
Син. – синоним
сТФР-1 — сывороточный трансферриновый рецептор — 1
СФ — сывороточный ферритин
с-ЭПО – сывороточный эритропоэтин
ЦПП — эритроцитарный цинк-протопорфирин
ЭИ — эритроцитарные индексы
ЭПО – эритропоэтин
ЭСП — эритропоэзстимулирующие препараты
Термины и определения
Анемия хронических болезней (син. – анемия воспаления) – вид анемии с мультифакторным патогенезом, развивающейся у пациентов с острой или хронической активацией иммунной системы вследствие различных как инфекционных, так и неинфекционных заболеваний.
Гепцидин – пептид, вырабатываемый гепатоцитами под воздействием провоспалительных цитокинов (преимущественно IL-6). Является важным регулятором системного гомеостаза железа и ключевым фактором развития анемии воспаления. Продукция гепцидина контролируется, главным образом, эритроферроном (вырабатывается эритробластами под воздействием эритропоэтина и отражает степень эритропоэтической активности костного мозга) и воспалением.
Эритропоэтин – гормон гликопротеидной природы, вырабатываемый в печени и почках под воздействием гипоксии. Является основным стимулятором костномозгового кроветворения, воздействуя на коммитированные эритроидные клетки предшественники.
Эритропоэзстимулирующие препараты – группа лекарственных средств, стимулирующих процесс образования эритроцитов в костном мозге, которые применяются для лечения анемий.
1. Краткая информация
1.1 Определение
Анемия хронических болезней (АХБ — D63.8, син. – анемия воспаления) является второй по распространенности после железодефицитной анемии (ЖДА) и наблюдается у пациентов с острой или хронической активацией иммунной системы вследствие различных как инфекционных, так и неинфекционных заболеваний. В отдельную нозологическую единицу АХБ была выделена после публикации Cartwright GE, Wintrobe MM в 1952 году [1].
1.2 Этиология и патогенез
В отличие от ЖДА, развивающейся вследствие абсолютного дефицита железа, патогенез АХБ является мультифакторным [2-4]. По современным представлениям ключевым механизмом развития АХБ является образование гепцидина [5]. Являясь белком, секретируемым гепатоцитами в условиях воспаления, гепцидин блокирует всасывание железа в кишечнике и реутилизацию железа из депо (депонирование железа в клетках моноцитарно-макрофагальной системы), тем самым снижая концентрацию железа в плазме крови, что способствует развитию железодефицитного эритропоэза. Другим важным фактором развития АХБ является неадекватно низкая продукция эритропоэтина (ЭПО) вследствие избыточной продукции провоспалительных цитокинов[4]. Другими патогенетическими факторами развития АХБ являются угнетение костномозгового кроветворения провоспалительными цитокинами и снижение продолжительности жизни эритроцитов [6].
Таким образом, ведущую роль в развитии АХБ играет комплекс факторов, основными из которых являются нарушение гомеостаза железа вследствие повышенной продукции гепцидина и нарушение эритропоэза из-за неадекватно низкой продукции ЭПО степени анемии, что является патогенетическим обоснованием терапевтического применения при АХБ эритропоэзстимулирующих препаратов (ЭСП).
1.3 Эпидемиология
-
Развитие АХБ (син. – анемия воспаления) возможно не только при хронических, но и острых воспалительных заболеваниях. Снижение уровня гемоглобина (Hb) можно обнаружить уже менее, чем через 2 недели от начала болезни. Обычно это умеренная, микроцитарная анемия с уровнем Hb 90-130 г/л и гематокритом 30-40%. Лишь у 20% пациентов гематокрит может снижаться меньше 25%. При хроническом течении анемии, она становится более гипохромной с более выраженным воспалительным компонентом в ее этиологии. При острой инфекции, когда анемия развивается быстро, она часто нормохромная [7].
Наиболее частые состояния, которые могут приводить к развитию АХБ, представлены в таблице 1.
Таблица 1
Основные заболевания, сопровождающиеся развитием анемии хронических болезней [8, 9]
|
Заболевания, ассоциируемые с анемией хронических болезней |
Предположительная распространенность анемии при данном заболевании (%) |
|
Инфекции (острые и хронические):
|
18 – 95 |
|
Рак
|
30 – 77 |
|
Аутоиммунные реакции
|
8 – 71 |
|
Хроническая реакция трансплантат против хозяина после органной трансплантации |
8 – 70 |
|
Хронические заболевания почек |
23 – 50 |
.
1.4 Кодирование по МКБ-10
D63.8 — Анемия при хронических болезнях, классифицированных в других рубриках
1.5 Классификация
В зависимости от выраженности снижения уровня гемоглобина выделяют три степени тяжести анемии:
-
Легкая — уровень гемоглобина выше 90 г/л;
-
Средняя — уровень гемоглобина в пределах 90-70 г/л;
-
Тяжелая — уровень гемоглобина менее 70 г/л.
2. Диагностика
2.1 Жалобы и анамнез
С высокой долей вероятности об АХБ следует думать, если анемия развилась на фоне острых или хронических заболеваний инфекционно-воспалительного характера (Таблица 1). Данный вид анемии необходимо также исключить в случаях, когда рутинная пероральная ферротерапия в течение 4 недель не привела к повышению Нb>10 г/л [10].
При сборе у пациента анамнеза выясняют наличие возможных других причин анемии:
- кровотечения (острые и хронические);
- интеркуррентные заболевания (инфекционно-воспалительные, глистные инвазии, аутоиммунные, болезни почек);
- дефицит железа, фолатов, витамина В12 (алиментарный фактор, нарушенная абсорбция).
При сборе у пациента жалоб выясняют наличие у него следующих симптомов:
- сердцебиение;
- одышка, усиливающаяся при физической нагрузке;
- головокружение, шум в ушах;
- слабость, повышенная утомляемость.
2.2 Физикальное обследование
При физикальном обследовании обращают внимание на выявлении следующих признаков:
-
бледность кожных покровов, видимых слизистых (желтушность кожи и слизистых при гемолизе);
-
тахикардия, тахипноэ;
-
приглушенность сердечных тонов, систолический шум на верхушке сердца и над крупными сосудами;
-
вялость.
Следует отметить, что большинство симптомов являются неспецифическими признаками анемии, которые накладываются на симптомы основного заболевания и побочные эффекты проводимой терапии.
При осмотре врач должен оценивать, как объективные физикальные данные (бледность кожных покровов и видимых слизистых, тахикардия, тахипноэ), так и субъективные симптомы анемии при активном целенаправленном расспросе самого пациента или его родителей (повседневная физическая, эмоциональная и социальная активность, переносимость физических нагрузок).
2.3 Лабораторная диагностика
Учитывая, что ЖДА наиболее распространенный вид анемии у детей, дифференциальный диагноз между ЖДА, АХБ и смешанными случаями (ЖДА в сочетании с АХБ) является наиболее частой задачей для клинициста. Предварительно о характере анемии можно судить уже на основании анализа эритроцитарных индексов (ЭИ) при исследовании крови на автоматическом гематологическом анализаторе. Для АХБ характерны нормальные значения основных ЭИ (MCV может быть понижен), тогда как при ЖДА уровни MCV, MCH, MCHC понижены, а RDW повышен. Наиболее специфичными из ЭИ для ЖДА являются HYPO>5% (количество гипохромных эритроцитов) и Hb-Ret<26 пг (содержание гемоглобина в ретикулоците), определяемые некоторыми моделями автоматических гематологических анализаторов (Таблица 2) [11].
Таблица 2
Значения эритроцитарных индексов, характерные для ЖДА
|
Эритроцитарный индекс |
Значение |
|
Средний объем эритроцита (MCV), fl |
Младше 2 лет < 67 2-5 лет < 73 5-12 лет < 75 Cтарше 12 лет < 80 |
|
Среднее содержание Hb в эритроците (MCH), пг |
< 26 |
|
Средняя концентрация Hb в эритроците (MCHC), г/л |
< 300 |
|
Ширина распределения эритроцитов по объему (RDW), % |
> 14,5 |
|
Количество ретикулоцитов (RET), ‰ |
5-20 (N) |
|
Содержание Hb в ретикулоците (CHr) *, пг |
< 27,5 |
|
Количество гипохромных эритроцитов *, % |
> 5 |
* — параметры доступные наиболее современным моделям гематологических анализаторов. Имеет высокую чувствительность для диагностики дефицита железа (ДЖ), особенно у детей до года, когда использование СФ ограничено.
С целью дифференциальной диагностики с ЖДА проводится определение биохимических показателей обмена железа с расчетом коэффициента насыщения трансферрина железом (НТЖ) и концентрации СФ.
-
В настоящее время СФ рекомендован как наиболее надежный тест для диагностики ДЖ (метод “золотого стандарта”).
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3).
Комментарии: В настоящее время определение СФ считается наиболее надежным тестом для диагностики ДЖ (метод “золотого стандарта”) [12]. Независимо от возраста уровень СФ < 20 мкг/л – самый ранний и специфический признак истощения тканевых запасов железа. При ЖДА уровень СФ обычно меньше 12 мкг/л. Однако использование в качестве критерия ДЖ СФ<30 мкг/л значительно повышает чувствительность и специфичность этого теста. Поэтому использование критерия ДЖ – СФ<30 мкг/л более распространено в клинической практике. Уровень СФ существенно повышается в условиях воспаления (острые и хронические инфекции, болезни печени, аутоиммунные и онкологические заболевания), что может маскировать наличие ДЖ. По этой причине при повышенном уровне С-реактивного белка ДЖ верифицируется при СФ<50 мкг/л. При АХБ уровень СФ нормальный или повышенный.
Для выявления ДЖ в случаях часто встречающегося сочетания ЖДА и АХБ, при котором СФ, как правило, нормальный или повышен, в клинической практике рекомендуется использование коэффициента НТЖ. У пациентов с АХБ в сочетании с ДЖ НТЖ меньше возрастного уровня:
насыщение трансферрина железом (НТЖ), % = (железо сыворотки (ЖС)*/ общую железосвязывающую способность сыворотки* (ОЖСС)) ? 100%
– 1–2 года — < 9%;
– 3–5 лет — < 13%;
– 6–15 лет — < 14%;
– старше 15 лет- <16%.
* — не имеют самостоятельного значения для дифференциальной диагностики АХБ и ЖДА.
- АХБ относится к микро- нормоцитарным, нормохромным, нормо- или гипорегенераторным анемиям. По этой причине дифференциальную диагностику АХБ рекомендовано проводить по схеме: с ЖДА, талассемиями, сидеробластной анемией и анемией, вызванной отравлением свинцом. Трудности диагностики могут возникнуть при смешанных состояниях (ЖДА + АХБ, ЖДА + талассемия), которые достаточно часто встречаются в клинической практике (Таблица 3).
Таблица 3
Дифференциальная диагностика АХБ с другими микроцитарными анемиями
|
Метод диагностики |
ЖДА |
Талассемия |
АХБ |
ЖДА + талассемия |
ЖДА + АХБ |
Анемия при свинцовой интоксикации |
|
Морфология мазка крови |
Микроцитоз, анизоцитоз, пойкилоцитоз, эллиптоцитоз, гипохромия |
Микроцитоз, мишеневидные клетки |
Микроцитоз гипохромия |
Микроцитоз |
Базофильная зернистость эритроцитов |
|
|
НТЖ |
? |
? |
? |
? |
? |
|
|
СФ |
? |
? |
N или ? |
? |
N или ? |
N |
|
Эффект от пероральной ферротерапии |
Есть |
Нет |
Нет |
Частичный (после нормализации ФС сохраняется микроцитоз с MCV <75 fL) |
нет |
нет |
|
Дополнительные методы диагностики |
RDW — ? ОЖСС>72 мкмоль/л Индекс Ментцера* >13 ЦПП ?** CHr < 27,5 пг сТФР ? Гепцидин ? |
RDW – N Индекс Ментцера* <13 Электрофорез Hb, молекулярно-генетические методы (ПЦР, секвенирование ДНК) |
СРБ ? cТФР — N Гепцидин ? |
См. талассемия и ЖДА |
ЦПП ?** CHr< 27,5 пг сТФР ? |
Повышенное содержание свинца в сыворотке крови |
* — индекс Ментцера = MCV (fL) / RBC (первые 2 цифры количества эритроцитов)
** — ЦПП — эритроцитарный цинк-протопорфирин
Нормальный уровень сывороточного трансферринового рецептора — 1 (сТФР-1) и высокая концентрация гепцидина, характерные для АХБ, вероятно, имеют высокую диагностическую ценность. Однако их применение в клинической практике ограничивается отсутствием доступных коммерческих тест-систем и стандартизации в педиатрической практике.
Индикатором неадекватно низкой продукции ЭПО степени тяжести анемии у пациента и предиктором эффективного ответа на рчЭПО-терапию является уровень с-ЭПО <100 МЕ/л при Нb <100 г/л [13].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3).
Костномозговая пункция не показана в связи с достаточной информативностью морфологических и биохимических показателей, за исключением редко возникающего подозрения на сидеробластную анемию (у пациентов с гипохромной анемией при нормальных показателях обмена железа) с целью выявления кольцевидных сидеробластов.
Подозрение на наследственные формы анемии может возникнуть в случае хронической анемии, резистентной к ферротерапии, стойкого снижения (низкий уровень трансферрина, ОЖСС и ?-глобулиновой фракции при атрансферринемии) или повышения (высокий уровень гепцидина при отсутствии других маркеров воспаления при железорефрактерной ЖДА) отдельных лабораторных показателей обмена железа [14].
3. Лечение
3.1 Консервативное лечение
-
Наиболее эффективной схемой лечения АХБ рекомендовано комбинированное использование ЭСП и внутривенных препаратов железа.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3).
Комментарии: Адекватное лечение основного заболевания – наиболее эффективный способ лечения АХБ. Лечение АХБ необходимо при всех хронических заболеваниях трудно поддающихся терапии (системные заболевания соединительной ткани, хронические воспалительные заболевания кишечника, ВИЧ-инфекция и др.), поскольку анемия негативно влияет на качество жизни пациента, ухудшает прогноз и исходы заболеваний и является независимым фактором риска повышенной летальности. Поскольку из-за повышенной концентрации гепцидина при АХБ снижается всасывание железа в кишечнике, лечение данного вида анемии пероральными препаратами железа малоэффективно. Частичный эффект от пероральной ферротерапии может наблюдаться у пациентов с АХБ, развившейся на фоне ДЖ. Внутривенная ферротерапия с патогенетической точки зрения более целесообразна при АХБ, однако если она используется в виде монотерапии (только в случаях доказанного ДЖ при АХБ по низкому уровню НТЖ< 20% или СФ < 100 мкг/л) следует ожидать высокого уровня резистентности (около 50%) к терапии. Это связано с неадекватно низкой продукцией ЭПО степени тяжести анемии, характерной для АХБ [4]. Поэтому наиболее эффективной схемой лечения АХБ является комбинированное использование ЭСП и внутривенных препаратов железа.. Использование пероральных препаратов железа вместо внутривенной ферротерапии допустимо, но может снижать ответ на рчЭПО терапию.
В настоящее время самый большой опыт применения рчЭПО у детей и подростков имеется у пациентов с хронической почечной недостаточностью (см. соответствующие клинические рекомендации). В литературе доступны немногочисленные публикации о эффективности рчЭПО в сочетании с препаратами железа при АХБ у детей [15].
- Репомендовано применения рекомбинантного человеческого эритропоэтина для лечения АХБ у детей и подростков в соответствии с протоколом:
Показания к применению:
Hb < 100 г/л
Противопоказания к применению:
- гематокрит свыше 0,6;
- лейкоцитоз свыше 40?109/л;
- тромбоцитоз свыше 700?109/л;
- индивидуальная непереносимость препарата.
- Сроки лечения:
- продолжительность терапии до 12 недель.
- Режимы дозирования:
- 150-300 МЕ/кг 3 раза в неделю подкожно или 600 МЕ/кг 1 раз в неделю внутривенно.
- Терапевтический режим:
- стартовая доза рчЭПО — 150 МЕ/кг;
- на фоне лечения рчЭПО необходимо дополнительно назначать внутрь или внутривенно препараты железа в суточной дозе не более 5 мг/кг для профилактики функционального дефицита железа.
- Лабораторный контроль:
- общий анализ крови с подсчетом количества эритроцитов, гемоглобина, гематокрита, ретикулоцитов, тромбоцитов перед началом терапии и на фоне лечения каждые 7-10 дней.
- Требования к результатам лечения:
- Целевой уровень Hb – 110 г/л (у детей старше 12 лет – 120 г/л)
- Рекомендовано проведение коррекции дозы рчЭПО.
При отсутствии полного терапевтического ответа через 2 недели применения рчЭПО в дозе 150 МЕ/кг, определяемого как повышение уровня гемоглобина на ? 10 г/л от исходного при отсутствии трансфузий эритроцитарной массы, разовая доза препарата увеличивается на 50 МЕ/кг. Последующее увеличение дозы рчЭПО предусматривается каждые 2 недели на 50 МЕ/кг при условии недостаточной скорости прироста уровня гемоглобина (< 5 г/л в неделю), максимально 300 МЕ/кг. Если доза в 300 МЕ/кг не дает эффекта, дальнейшее повышение дозы нецелесообразно. Если уровень Hb повышается чрезмерно быстро (более чем на 20 г/л в неделю) или если его концентрация превышает 120 г/л, следует прекратить введение препарата.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3).
Комментарии: Протоколы применения рекомбинантного ЭПО при анемии при злокачественных новообразованиях, анемии при хронической почечной недостаточности указаны в соответствующих разделах рекомендаций.
4. Реабилитация
Специфических реабилитационных мероприятий в отношении пациентов с АХБ не разработано.
Подход к мониторированию эффективности лечения в большей мере индивидуален у каждого пациента ввиду различия тяжести АХБ и ответа на лечение.
После нормализации уровня Hb необходимо динамическое наблюдение.
5. Профилактика и диспансерное наблюдение
Специфических профилактических мероприятий в отношении пациентов с АХБ не разработано. Поскольку в основе развития заболевания лежит активация иммунной системы инфекционной или неинфекционной этиологии, адекватная терапия основного заболевания, направленная на купирование синдрома системного воспалительного ответа, будет способствовать меньшему риску развития АХБ.
6. Дополнительная информация, влияющая на течение и исход заболевания
6.1 Причины и признаки декомпенсации хронической анемии
-
АХБ обычно протекает как анемия легкой или средней степени тяжести. Декомпенсация анемии, у пациента с острым или хроническим заболеванием, может произойти в следующих случаях:
-
повышенная потребность в кислороде вследствие инфекции, боли, лихорадки;
-
дальнейшее снижение снабжения тканей кислородом вследствие острой кровопотери, пневмонии;
-
сопутствующий дефицит железа.
-
Ранние признаки декомпенсации:
-
затрудненное, быстрое дыхание с межреберным, подреберным и надгрудинным втяжением (респираторный дистресс);
-
усиленное использование мышц живота для дыхания;
-
раздувание крыльев носа.
-
Признаки острой декомпенсации:
-
форсированный («стонущий») выдох (респираторный дистресс);
-
изменение психического состояния;
-
ослабление периферического пульса;
-
застойная сердечная недостаточность;
-
гепатомегалия;
-
плохая периферическая перфузия (время повторного наполнения капилляров больше 2 сек.).
-
Ребенок с этими клиническими признаками срочно нуждается в терапии, так как имеется высокий риск смерти из-за недостаточной кислородтранспортной способности
6.2 Влияние анемии на качество жизни детей
-
На клиническом уровне связь между анемией и утомляемостью считается обоснованной. У взрослых доказано прямое влияние низкого уровня гемоглобина на утомляемость и другие параметры качества жизни. У детей, особенно младшего возраста, оценка качества жизни связана с техническими сложностями, так как требует заполнения анкетных опросников самими детьми и их родителями.
Критерии оценки качества медицинской помощи
|
№ |
Критерии качества |
Уровень достоверности доказательств |
Уровень убедительности рекомендаций |
| 1 | Выполено определение сывороточного феррритина при диагностике | С | 3 |
| 2 | Проведена комбинированная терапия эритропоэзстимулирующими препараты и внутривенными препаратов железа. | С | 3 |
| 3 | Проведена коррекция дозы рекомбинантного человеческого эритропоэтина | С | 3 |
Список литературы
-
Cartwright GE, Wintrobe MM. The anemia of infection: a review// Adv Intern Med 1952; 5: P. 165-226
-
Nemeth E., Ganz T. Anemia of Inflammation// Hematol Oncol Clin North Am. 2014; 28(4): 671–681
-
Демихов В.Г., Морщакова Е.Ф., Павлов А.Д. Роль гепцидина в патогенезе анемии хронических болезней// Гематол. и трансфузиол. 2006. № 5. С. 31-34.
-
Румянцев А.Г., Морщакова Е.Ф., Павлов А.Д. Эритропоэтин: диагностика, профилактика и лечение анемий. М., 2003. 448 с.
-
Ganz T. Hepcidin, a key regulator of iron metabolism and mediator of anemia of inflammation// Blood 2003; 102: P. 783-788
-
Jelkmann W. Regulation of erythropoietin production// J Physiol 2011; 589 (6): p 1251–1258
-
Jurado R. Iron, Infections, and Anemia of Inflammation // Clin Inf Dis. – 1997. — Vol 25. – P. 888 – 895
-
Weiss G., Goodnough L.T. Anemia of Chronic Disease// N Engl J Med 2005; 352: P. 1011-1023
-
Wilson A, Reyes E, Ofman J. Prevalence and outcomes of anemia in inflammatory bowel disease: a systematic review of the literature// Am J Med 2004; 116: Suppl 7A: 44S-49S
-
Recommendations to prevent and control iron deficiency in the United States// MMW Recomm. Rep. – 1998. – Vol. 47 (RR-3). – P. 1-29
-
Ludwig H., Evstatiev R., Kornek G., Aapro M. et al. Iron metabolism and iron supplementation in cancer patients// Wien Klin Wochenschr 2015; 127: 907–919
-
Beaumont C., Beris F., Beuzard Y., Brugnara C. Disorders of erythropoiesis, erythrocytes and iron metabolism 2009, European School of Hematology and Club du Globule Rouge et du Fer, Handbook, Second Edition, Forum Servis Editore, Genoa, Italy, 653 p.
-
Beguin Y., Clemons G.K., Pootrakul P., Fillet G. Quantitative assessment of erythropoiesis and functional classification of anemia based on measurements of serum transferrin receptor and erythropoietin// Blood 1993; 81: P. 1067-1076
-
Finberg KE. Iron-refractory iron deficiency anemia. Semin Hematol 2009;46:378-386
-
Crary S. E., Hall K., Buchanan G. R. Intravenous Iron Sucrose for Children with Iron Deficiency Failing to Respond to Oral Iron Therapy// Pediatr Blood Cancer. 2011; 56(4): 615–619
Приложение А1. Состав рабочей группы
Румянцев Александр Григорьевич — д-р мед. наук, академик РАН, главный детский гематолог Министерства здравоохранения Российской Федерации, генеральный директор ФГБУ ФНКЦ ДГОИ им. Дмитрия Рогачева, профессор кафедры гематологии, онкологии и лучевой терапии педиатрического факультета РНИМУ им. Н.И.Пирогова
Масчан Алексей Александрович — д-р мед. наук, зам. генерального директора ФГБУ ФНКЦ ДГОИ им. Дмитрия Рогачева, профессор кафедры гематологии, онкологии и лучевой терапии педиатрического факультета РНИМУ им. Н.И.Пирогова, президент Национального общества детских гематологов и онкологов, член Европейского общества гематологов
Демихов Валерий Григорьевич — д.м.н., проф., директор Научно-клинического центра гематологии, онкологии и иммунологии ГБОУ ВПО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, член НОДГО, член Европейской гематологической ассоциации (EHA).
Морщакова Елена Федоровна — д.м.н., профессор, заслуженный врач РФ, член НОДГО.
Лунякова Мария Анатольевна — к.м.н., зав. отделом гематологии и онкологии Научно-клинического центра гематологии, онкологии и иммунологии ГБОУ ВПО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, член НОДГО.
Инякова Наталья Викторовна — к.м.н., врач-гематолог Научно-клинического центра гематологии, онкологии и иммунологии ГБОУ ВПО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, член НОДГО.
Конфликт интересов отсутствует.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
-
Гематологи 14.01.21
-
Детские онкологи 31.08.14
-
Педиатры 31.08.19
-
Терапевты 31.08.49
-
Врачи общей практики 31.08.54
Таблица П1 – Уровни достоверности доказательств
|
Уровень достоверности |
Источник доказательств |
|
I (1) |
Проспективные рандомизированные контролируемые исследования Достаточное количество исследований с достаточной мощностью, с участием большого количества пациентов и получением большого количества данных Крупные мета-анализы Как минимум одно хорошо организованное рандомизированное контролируемое исследование Репрезентативная выборка пациентов |
|
II (2) |
Проспективные с рандомизацией или без исследования с ограниченным количеством данных Несколько исследований с небольшим количеством пациентов Хорошо организованное проспективное исследование когорты Мета-анализы ограничены, но проведены на хорошем уровне Результаты не презентативны в отношении целевой популяции Хорошо организованные исследования «случай-контроль» |
|
III (3) |
Нерандомизированные контролируемые исследования Исследования с недостаточным контролем Рандомизированные клинические исследования с как минимум 1 значительной или как минимум 3 незначительными методологическими ошибками Ретроспективные или наблюдательные исследования Серия клинических наблюдений Противоречивые данные, не позволяющие сформировать окончательную рекомендацию |
|
IV (4) |
Мнение эксперта/данные из отчета экспертной комиссии, экспериментально подтвержденные и теоретически обоснованные |
Таблица П2 – Уровни убедительности рекомендаций
|
Уровень убедительности |
Описание |
Расшифровка |
|
A |
Рекомендация основана на высоком уровне доказательности (как минимум 1 убедительная публикация I уровня доказательности, показывающая значительное превосходство пользы над риском) |
Метод/терапия первой линии; либо в сочетании со стандартной методикой/терапией |
|
B |
Рекомендация основана на среднем уровне доказательности (как минимум 1 убедительная публикация II уровня доказательности, показывающая значительное превосходство пользы над риском) |
Метод/терапия второй линии; либо при отказе, противопоказании, или неэффективности стандартной методики/терапии. Рекомендуется мониторирование побочных явлений |
|
C |
Рекомендация основана на слабом уровне доказательности (но как минимум 1 убедительная публикация III уровня доказательности, показывающая значительное превосходство пользы над риском) или нет убедительных данных ни о пользе, ни о риске) |
Нет возражений против данного метода/терапии или нет возражений против продолжения данного метода/терапии Рекомендовано при отказе, противопоказании, или неэффективности стандартной методики/терапии, при условии отсутствия побочных эффектов |
|
D |
Отсутствие убедительных публикаций I, II или III уровня доказательности, показывающих значительное превосходство пользы над риском, либо убедительные публикации I, II или III уровня доказательности, показывающие значительное превосходство риска над пользой |
Не рекомендовано |
Применение ЭСП при АХБ у детей патогенетически обосновано, однако имеет недостаточную доказательную базу. Необходимы многоцентровые рандомизированные исследования для того, чтобы высказаться за или против применения ЭСП при АХБ в педиатрической практике. До этих пор применение ЭСП возможно в рамках исследовательских протоколов, а также в некоторых исключительных случаях, например, по религиозным убеждениям, как альтернатива гемотрансфузиям (уровень С)
Порядок обновления клинических рекомендаций – пересмотр 1 раз в 5 лет.
Приложение Б. Алгоритмы ведения пациента
Примечания: * — концентрация сывороточного ЭПО < 100 МЕ/л у пациента с Hb<100 г/л дополнительным критерием для выбора комбинированной терапии (рчЭПО + препараты железа)
** — применение внутривенных препаратов железа может быть более эффективным

Приложение В. Информация для пациентов
Анемия хронических болезней (АХБ) наблюдается у значительного числа больных с различными хроническими и воспалительными заболеваниями, однако, часто остается нераспознанной, поскольку маскируется симптомами заболеваний, с которыми она связана. Анемия является независимым фактором риска плохого прогноза при многих заболеваниях, а также значительно снижает качество жизни пациентов. При острой бактериальной инфекции легкая анемия может развиться уже через 24-48 часов от начала заболевания. При хроническом воспалении тяжесть и характер анемии зависит от природы основного заболевания.
Характерной особенностью АХБ является множество причин, способствующих ее развитию:
-
Угнетение продукции красных клеток крови
-
Сокращение продолжительности жизни эритроцитов
-
Нарушение обмена железа
Клиническая картина.
Специфической клинической картины при данной анемии нет. Анемия легкая или умеренная, чаще всего больные адаптированы к анемии, поэтому не вызывает жалоб, но у пожилых людей может приводить к сердечно-сосудистым нарушениям.
Лечение
Коррекция анемии при АХБ нужна не всем пациентам. Часто анемия компенсируется при лечении основного заболевания. Нет оснований рекомендовать назначение витамина В12 или фолиевую кислоту, без прямого определения недостаточности уровня этих витаминов в крови. Терапия проводится больным с гемоглобином менее 100 г/л. Для терапии используются препараты человеческого рекомбинантного эритропоэтина в комбинации с препаратами железа или реже внутривенные препараты железа.
На фоне лечения отмечается улучшение качества жизни больных.
Анемия у детей
Содержание статьи
- Распространенность в мире
- Причины появления анемии у детей
- Виды анемии у детей
- Симптомы анемии у детей
- Методы диагностики анемии у детей
-
Лечение анемии у детей
- Осложнения заболевания
- Профилактика анемии у детей раннего и старшего возраста

Гемоглобин – это важнейший железосодержащий белок, функция которого – доставка кислорода к тканям и органам. Поэтому анемия опасна в первую очередь тем, что у детей в таком состоянии весь организм подвергается кислородному голоданию. То, насколько снижен гемоглобин, определяет выраженность и тяжесть клинической картины.

Второе название связано с тем, что главный симптом патологии – это постоянное ощущение усталости и упадка сил.
Распространенность в мире
Во всем мире анемии подвержено почти 25% населения, наибольшая распространенность – среди детей дошкольного возраста (47,4% или 293 млн). У школьников это состояние выявляется в 25,4% случаев (305 млн). У 9 из 10 детей дошкольного возраста анемия обуславливается дефицитом железа в организме, а у одного (или в 10% случаев) это симптом какой-либо патологии, например лейкемии. Источник:
WHO Global Database on Anaemia Geneva,
World Health Organization, 2008
Нормы содержания гемоглобина в крови для детей до 18 лет
| Возраст ребенка | Норма содержания гемоглобина на единицу крови, г/л |
|---|---|
| 0-2 недели | 125-220 |
| 0,5-1 месяц | 115-180 |
| 1-2 месяца | 90-130 |
| 2 месяца – 0,5 года | 95-140 |
| 0,5-1 год | 105-140 |
| От 1 до 5 лет | 100-140 |
| От 5 до 12 лет | 115-150 |
| Более 12 лет | 115-160 |
Причины появления анемии у детей
Данный диагноз может быть поставлен по различным причинам, среди которых:
- Неправильное питание, дефицит железа. По этим причинам организм ребенка производит малое количество эритроцитов.
- Серповидноклеточная анемия в семейном анамнезе. При таком наследственном расстройстве происходит чрезмерное разрушение красных кровяных телец.
- Большая потеря крови. Это случается по причине травмы, а у девочек может возникать на фоне сильного менструального кровотечения.
- Причиной анемии у новорожденных и грудных детей может быть многоплодная беременность, долгий и сильный недостаток железа в организме будущей матери, неправильное плацентарно-маточное кровообращение, недоношенность, родовое кровотечение, слишком поздняя или преждевременная перевязка пуповины.
- Группа послеродовых факторов, вызывающих анемию в раннем детстве: скудная диета, включающая в основном молочные продукты, ранее начало искусственного кормления, дефицит железа в пище, позднее введение прикорма, отсутствие животного белка в рационе, рахит, частые заболевания.
- Нарушение процесса всасывания железа кишечником. Причинами могут служить: дисбактериоз, синдром нарушенного кишечного всасывания, пищевая аллергия, гастрит и другие заболевания ЖКТ, некоторые болезни поджелудочной железы и печени, толстого и тонкого кишечника.
- Ускоренные темпы роста и повышенная потребность в железе на фоне его потери.
- Нарушенный обмен железа, который появляется вследствие гормональных перемен в организме.
- Кровотечения – не только раневые, но и носовые.
- Гиподинамия, длительное пребывание в неподвижном положении, редкие прогулки на свежем воздухе.
- Гемолиз, то есть разрушение эритроцитов, а также снижение выработки эритроцитов костным мозгом.
- Инфекции, паразитарные заболевания, бактериальные патологии.
- Злокачественные и доброкачественные опухоли в различных частях организма.
- Воздействие радиации.
- Отравление лекарствами и ядовитыми веществами. Сюда же относится долгий и не контролируемый врачебно курс антибиотиков, нестероидных противовоспалительных средств, цитостатиков и др.
-
Дефицит витаминов, в первую очередь В12 и С, необходимых для всасывания достаточного количества железа. Источник:
Н.Л. Прокопцева, Н.А. Ильенкова
Железодефицитная анемия у детей: диагностика, лечение и профилактика
// Сибирское медицинское обозрение, 2011
Виды анемии у детей
Существует несколько классификаций этого заболевания.
По причине возникновения анемия бывает:
- физическая (травмы, операции и др.);
- пищевая (плохой рацион);
- генетическая (наследственная);
- инфекционная (вторичная, появляющаяся на фоне других заболеваний);
- радиационная (из-за воздействия радиации);
- возникающая при отравлении химикатами и медикаментами.
По типу заболевания выделяют следующие его виды:
- связанное с хронической или острой кровопотерей (постгеморрагическое);
- связанное с нарушением гемопоэза: железодефицитные, или гипохромные, анемии у детей, мегалобластные (если у ребенка дефицит витамина В12 и фолиевой кислоты), железонасыщенные, дизэритропоэтические, гипопластические, апластические;
-
обусловленные у детей высоким разрушением эритроцитов и процессом кроворазрушения, преобладающим над процессом кроветворения (гемолитические), – ферментопатии, мембранопатии, аутоиммунные анемии и др. Источник:
А.Г. Румянцев
Классификация и диагностика анемий у детей
// Вопросы современной педиатрии, 2011, т.10, №1
Заболевание может быть связано с недостаточной выработкой эритроцитов костным мозгом. К этому виду патологии относятся следующие подвиды:
- железодефицитная;
- белководефицитная;
- медьдефицитная;
- талассемия;
- витаминодефицитная;
- оротовая ацидурия.

Также у ребенка может быть скрытая анемия, которая напоминает по проявлениям другие формы заболевания, но симптоматика при этом проявляется существенно реже.
Симптомы анемии у детей
Вне зависимости от типа анемии, у ребенка могут быть следующие признаки патологии, особенно при длительном ее течении:
- бледность кожных и слизистых покровов;
- пигментация, сухость, шелушение кожи;
- сниженный аппетит;
- изменение вкуса и обоняния;
- стоматит, кариес;
- разнообразные нарушения в процессе пищеварения и всасывания полезных веществ: тошнота, изжога, неустойчивый стул, гастрит;
- эмоциональная неустойчивость, раздражительность, возбудимость;
- отставание в развитии;
- вялость, заторможенность, апатия, быстрая утомляемость;
- одышка, гипотония, учащенное сердцебиение;
- ослабленность сфинктера мочевого пузыря (проявляется недержанием мочи);
- снижение иммунитета;
- истощение;
- головокружение;
- желание употреблять необычные продукты или вовсе несъедобные вещества;
- опухлость или болезненность языка;
- замедленное заживление ран;
- нарушения сна;
- запоры или диарея;
- шум в ушах.
Методы диагностики анемии у детей

Иногда для установления точной причины симптоматики нужна биопсия костного мозга с последующим гистологическим исследованием.
Диагностика позволяет установить степень тяжести и форму анемии. По ее результатам ребенку могут потребоваться консультации у узкопрофильных врачей (нефролога, гастроэнтеролога, гинеколога и др.), обследования почек (УЗИ) и органов ЖКТ (УЗИ брюшной полости, ЭГДС).
Лечение анемии у детей

Детям старшего возраста рекомендуется употреблять больше говядины, печени, морепродуктов, зелени, бобовых, зеленых овощей и фруктов, овощных и фруктовых соков (свежевыжатых, а не пакетированных).
Если анемией болеет грудной младенец, находящийся на вскармливании материнским молоком, то нужно в первую очередь скорректировать рацион матери – включить в него не только богатые железом продукты, но и препараты железа, поливитаминные комплексы. Не следует затягивать с введением прикорма – мясного пюре, яичного желтка, фруктовых и овощных соков, овощей. Когда ребенок – на искусственном вскармливании, то педиатр должен назначить специальную молочную смесь с повышенным содержанием железа.
Клинические рекомендации для детей при анемии также включают дополнительный сон, достаточные прогулки на свежем воздухе, УФО, массаж, ежедневную гимнастику.
При анемии также проводится медикаментозное лечение, включающее препараты железа, поливитаминные комплексы на срок в среднем 1,5-2,5 месяца или до нормализации у детей клинических показателей крови. Если случай тяжелый, врач может назначить гемотрансфузию (переливание эритроцитарной массы). Источник:
М.В. Эрман
Железодефицитные анемии у детей
// Здоровье – основа человеческого потенциала: проблемы и пути их решения, 2013
Осложнения заболевания
Если анемия у ребенка существует длительное время, то ее последствиями могут быть: выпадение волос, высокая ломкость ногтей. Тяжелая форма патологии может приводить к повышенной кровоточивости (геморрагический синдром), потерям сознания.
Профилактика анемии у детей раннего и старшего возраста

Когда ребенок рождается, необходимо обеспечить ему грудное вскармливание примерно до 1 года, вовремя вводить прикормы, профилактировать болезни раннего возраста. Важен также правильный уход и режим дня. Если новорожденный относится к группе риска по какому-либо заболеванию, нужны специальные лечебно-профилактические курсы.
Для детей школьного возраста наиболее важен рацион. В нем должно быть как можно больше зеленых фруктов и овощей, содержащих фолиевую кислоту, зерновых продуктов (особенно гречневой крупы). Гречка рекомендуется еще и потому, что содержит много железа. Также для профилактики следует принимать поливитаминные комплексы, в которых содержится фолиевая кислота в сочетании со всеми витаминами группы В.
Источники:
- WHO Global Database on Anaemia Geneva, World Health Organization, 2008.
- Н.Л. Прокопцева, Н.А. Ильенкова. Железодефицитная анемия у детей: диагностика, лечение и профилактика // Сибирское медицинское обозрение, 2011.
- А.Г. Румянцев. Классификация и диагностика анемий у детей // Вопросы современной педиатрии, 2011, т.10, №1.
- М.В. Эрман. Железодефицитные анемии у детей // Здоровье – основа человеческого потенциала: проблемы и пути их решения, 2013.
Информация в статье предоставлена в справочных целях и не заменяет консультации квалифицированного специалиста. Не занимайтесь самолечением! При первых признаках заболевания необходимо обратиться к врачу.
Цены
| Наименование услуги (прайс неполный) | Цена |
|---|---|
|
Прием (осмотр, консультация) врача-педиатра первичный, лечебно-диагностический, амбулаторный |
1950 руб. |
|
Прием (осмотр, консультация) врача-педиатра повторный, лечебно-диагностический, амбулаторный |
1800 руб. |
|
Консультация (интерпретация) с анализами из сторонних организаций |
2250 руб. |
|
Назначение схемы лечения (на срок до 1 месяца) |
1800 руб. |
|
Клинический анализ крови (ОАК, ЛФ, СОЭ) с микроскопией мазка при наличии патологических сдвигов, кровь, колич. |
650 руб. |
|
Нейросонография (УЗИ головного мозга) |
2500 руб. |
|
Эхокардиография (УЗИ сердца) |
3650 руб. |
|
Электрокардиография (ЭКГ) |
1400 руб. |
|
Рентгенография органов грудной клетки (обзорная) |
1900 руб. |
Все врачи педиатры
- Все врачи
-
Малая Балканская, 23
-
Дунайский пр-т, 47
-
Ударников, 19к1
-
Маршала Захарова, 20
-
Выборгское шоссе, 17к1
-
-
-
-
-
Хватова Елена Анатольевна
Врач второй квалификационной категории
Основная специальность: педиатр
Дополнительная специальность: гастроэнтеролог
Стаж: 23 года
Приём:
Дунайский пр-т, д. 47 (м. Дунайская)
Цена приёма: 1950 рублей Что входит в стоимость?
-
-
-
-
-
-
-
-
-
Фукс Анна Дмитриевна
Основная специальность: педиатр
Дополнительная специальность: аллерголог-иммунолог
Стаж: 15 лет
Приём:
ул. Маршала Захарова, д. 20 (м. Ленинский проспект)
Цена приёма: 1950 рублей Что входит в стоимость?
-
-
Бочкова Ольга Юрьевна
Врач первой квалификационной категории
Основная специальность: педиатр
Дополнительная специальность: гастроэнтеролог
Стаж: 15 лет
Приём:
Выборгское шоссе, д. 17 корп. 1 (м. Пр-т Просвещения)
Цена приёма: 1950 рублей Что входит в стоимость?
-
-
Чистякова Вера Юрьевна
Кандидат медицинских наук
Основная специальность: педиатр
Дополнительная специальность: гематолог
Стаж: 22 года
Приём:
Дунайский пр-т, д. 47 (м. Дунайская)
Цена приёма: 1950 рублей Что входит в стоимость?
-
Петрова Наталия Витальевна
Кандидат медицинских наук
Основная специальность: педиатр
Дополнительная специальность: аллерголог
Стаж: 34 года
Приём:
Выборгское шоссе, д. 17 корп. 1 (м. Пр-т Просвещения)
Цена приёма: 2500 рублей Что входит в стоимость?
-
-
-
-
-
-
-
-
Пчелина Анастасия Алексеевна
Основная специальность: гематолог
Дополнительная специальность: педиатр
Стаж: 2 года
Приём:
ул. Малая Балканская, д. 23 (м. Купчино)
-
-
-
-
-
Хватова Елена Анатольевна
Врач второй квалификационной категории
Основная специальность: педиатр
Дополнительная специальность: гастроэнтеролог
Стаж: 23 года
Приём:
Дунайский пр-т, д. 47 (м. Дунайская)
Цена приёма: 1950 рублей Что входит в стоимость?
-
-
-
-
Чистякова Вера Юрьевна
Кандидат медицинских наук
Основная специальность: педиатр
Дополнительная специальность: гематолог
Стаж: 22 года
Приём:
Дунайский пр-т, д. 47 (м. Дунайская)
Цена приёма: 1950 рублей Что входит в стоимость?
-
-
-
-
-
-
Фукс Анна Дмитриевна
Основная специальность: педиатр
Дополнительная специальность: аллерголог-иммунолог
Стаж: 15 лет
Приём:
ул. Маршала Захарова, д. 20 (м. Ленинский проспект)
Цена приёма: 1950 рублей Что входит в стоимость?
-
-
-
-
-
-
Бочкова Ольга Юрьевна
Врач первой квалификационной категории
Основная специальность: педиатр
Дополнительная специальность: гастроэнтеролог
Стаж: 15 лет
Приём:
Выборгское шоссе, д. 17 корп. 1 (м. Пр-т Просвещения)
Цена приёма: 1950 рублей Что входит в стоимость?
-
Петрова Наталия Витальевна
Кандидат медицинских наук
Основная специальность: педиатр
Дополнительная специальность: аллерголог
Стаж: 34 года
Приём:
Выборгское шоссе, д. 17 корп. 1 (м. Пр-т Просвещения)
Цена приёма: 2500 рублей Что входит в стоимость?
-
-
-
-
-
-
-
-
-
-
Пчелина Анастасия Алексеевна
Основная специальность: гематолог
Дополнительная специальность: педиатр
Стаж: 2 года
Приём:
ул. Малая Балканская, д. 23 (м. Купчино)
-
Записаться на прием
Наши преимущества
Комплексный подход
В детском медцентре ведётся прием детей с первых дней жизни до совершеннолетия более чем по 25 направлениям.
Собственная лаборатория
На базе медцентров работает собственная лаборатория, поэтому мы делаем анализы и исследования качественно и в срок.
Современное оборудование
Все клиники оснащены передовым оборудованием, в работе используются только проверенные методики
Акции и скидочная система
Регулярные акции и скидки, комплексные программы и обследования в рамках профилактических осмотров.

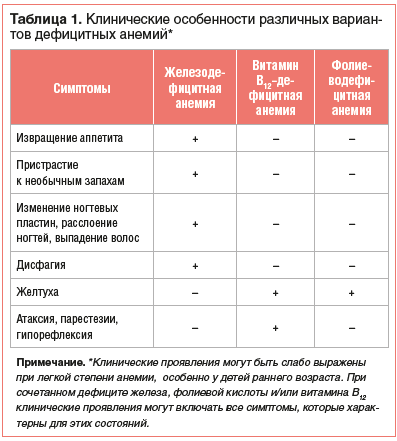
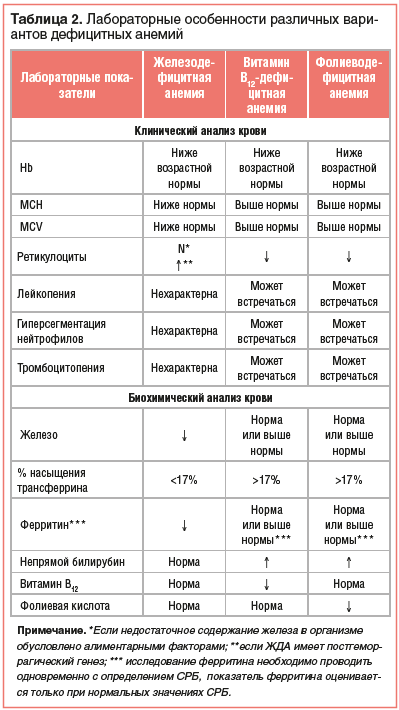



 вирусные (в том числе ВИЧ)
вирусные (в том числе ВИЧ)
























