Описание препарата Оземпик® (раствор для подкожного введения, 1.34 мг/мл) основано на официальной инструкции, утверждено компанией-производителем в 2021 году
Дата согласования: 04.08.2021
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Отзывы
Фотографии упаковок

04.08.2021
04.08.2021
Действующее вещество
ATX
Фармакологическая группа
Состав
| Раствор для подкожного введения | 1 мл |
| действующее вещество: | |
| семаглутид | 1,34 мг |
| вспомогательные вещества: динатрия гидрофосфат дигидрат; пропиленгликоль; фенол; хлористоводородная кислота (для коррекции pH); натрия гидроксид (для коррекции pH); вода для инъекций | |
| для шприц-ручки Оземпик® 0,25 или 0,5 мг/доза: в 1 предварительно заполненной шприц-ручке объемом 1,5 мл содержится 2 мг семаглутида | |
| для шприц-ручки Оземпик® 1 мг/доза: в 1 предварительно заполненной шприц-ручке объемом 3 мл содержится 4 мг семаглутида |
Описание лекарственной формы
Прозрачный бесцветный или почти бесцветный раствор.
Фармакологическое действие
Фармакологическое действие
—
гипогликемическое.
Фармакодинамика
Семаглутид является агонистом рецепторов ГПП-1 (ГПП-1Р), произведенным методом биотехнологии рекомбинантной ДНК с использованием штамма Saccharomyces cerevisiae с последующей очисткой.
Семаглутид представляет собой аналог ГПП-1, имеющий 94% гомологичности с человеческим ГПП-1. Семаглутид действует как агонист ГПП-1Р, который селективно связывается и активирует ГПП-1Р. ГПП-1Р служит мишенью для нативного ГПП-1.
ГПП-1 является физиологическим гормоном, оказывающим сразу несколько эффектов на регуляцию концентрации глюкозы и аппетит, а также на ССС. Влияние на концентрацию глюкозы и аппетит специфически опосредовано ГПП-1Р, расположенными в поджелудочной железе и головном мозге. Фармакологические концентрации семаглутида снижают концентрацию глюкозы крови и массу тела посредством сочетания эффектов, описанных ниже. ГПП-1Р представлены также в специфических областях сердца, сосудов, иммунной системы и почек, где их активация может оказывать сердечно-сосудистые (СС) и микроциркуляторные эффекты.
В отличие от нативного ГПП-1, продленный T1/2 семаглутида (около 1 нед) позволяет применять его п/к 1 раз в неделю. Связывание с альбумином является основным механизмом длительного действия семаглутида, что приводит к снижению выведения его почками и защищает от метаболического распада. Кроме того, семаглутид стабилен в отношении расщепления ферментом ДПП-4. Семаглутид снижает концентрацию глюкозы крови посредством глюкозозависимых стимуляций секреции инсулина и подавления секреции глюкагона. Таким образом, при повышении концентрации глюкозы крови происходит стимуляция секреции инсулина и подавление секреции глюкагона. Механизм снижения уровня гликемии включает также небольшую задержку опорожнения желудка в ранней постпрандиальной фазе. Во время гипогликемии семаглутид уменьшает секрецию инсулина и не снижает секрецию глюкагона.
Семаглутид снижает общую массу тела и массу жировой ткани, уменьшая потребление энергии. Данный механизм затрагивает общее снижение аппетита, включая усиление сигналов насыщения и ослабление сигналов голода, а также улучшение контроля потребления пищи и снижение тяги к пище. Снижается также инсулинорезистентность, возможно, за счет уменьшения массы тела. Помимо этого, семаглутид снижает предпочтение к приему пищи с высоким содержанием жиров. В исследованиях на животных было показано, что семаглутид поглощается специфическими областями головного мозга и усиливает ключевые сигналы насыщения и ослабляет ключевые сигналы голода. Воздействуя на изолированные участки тканей головного мозга семаглутид активирует нейроны, связанные с чувством сытости, и подавляет нейроны, связанные с чувством голода.
В клинических исследованиях (КИ) семаглутид оказывал положительное влияние на липиды плазмы крови, снижал сАД и уменьшал воспаление.
В исследованиях на животных семаглутид подавляет развитие атеросклероза, предупреждая дальнейшее развитие аортальных бляшек и уменьшая воспаление в бляшках.
Фармакодинамические исследования
Все фармакодинамические исследования были проведены после 12 нед терапии (включая период увеличения дозы) при Css семаглутида в дозе 1 мг 1 раз в неделю.
Уровень гликемии натощак и постпрандиальный уровень гликемии
Семаглутид снижает концентрацию глюкозы натощак и концентрацию постпрандиальной глюкозы. По сравнению с плацебо, терапия семаглутидом (1 мг) у пациентов с сахарным диабетом типа 2 (СД2) привела к снижению концентрации глюкозы с точки зрения абсолютного изменения от исходного значения (ммоль/л) и относительного снижения по сравнению с плацебо (%) в отношении концентрации глюкозы натощак (1,6 ммоль/л; 22%), концентрации глюкозы через 2 ч после приема пищи (4,1 ммоль/л; 37%), средней суточной концентрации глюкозы (1,7 ммоль/л; 22%) и постпрандиальных пиков концентрации глюкозы за 3 приема пищи (0,6–1,1 ммоль/л). Семаглутид снижал концентрацию глюкозы натощак после введения первой дозы.
Функция бета-клеток поджелудочной железы и секреция инсулина
Семаглутид улучшает функцию бета-клеток поджелудочной железы. После в/в струйного введения глюкозы пациентам с СД2 семаглутид по сравнению с плацебо улучшал первую и вторую фазу инсулинового ответа с трехкратным и двукратным повышением, соответственно, и увеличивал максимальную секреторную активность бета-клеток поджелудочной железы после теста стимуляции аргинином. Кроме того, по сравнению с плацебо, терапия семаглутидом увеличивает концентрации инсулина натощак.
Секреция глюкагона
Семаглутид снижает концентрацию глюкагона натощак и постпрандиальную концентрацию глюкагона. У пациентов с СД2 семаглутид приводит к относительному снижению концентрации глюкагона по сравнению с плацебо: концентрации глюкагона натощак (8–21%), постпрандиального глюкагонового ответа (14–15%) и средней суточной концентрации глюкагона (12%).
Глюкозозависимая секреция инсулина и глюкозозависимая секреция глюкагона
Семаглутид снижал высокую концентрацию глюкозы в крови, стимулируя секрецию инсулина и снижая секрецию глюкагона глюкозозависимым способом. Скорость секреции инсулина после введения семаглутида пациентам с СД2 была сопоставима с таковой у здоровых добровольцев.
Во время индуцированной гипогликемии семаглутид по сравнению с плацебо не изменял контррегуляторный ответ повышения концентрации глюкагона, а также не усугублял снижение концентрации С-пептида у пациентов с СД2.
Опорожнение желудка
Семаглутид вызывал небольшую задержку раннего постпрандиального опорожнения желудка, тем самым снижая скорость поступления постапрандиальной глюкозы в кровь.
Масса тела и состав тела
Наблюдалось большее снижение массы тела при применении семаглутида по сравнению с изученными препаратами сравнения (плацебо, ситаглиптин, эксенатид замедленного высвобождения (ЗВ), дулаглутид и инсулин гларгин) (см. Клиническая эффективность и безопасность). Потеря массы тела при применении семаглутида происходила преимущественно за счет потери жировой ткани, превышающей потерю мышечной массы в 3 раза.
Аппетит, потребление калорий и выбор продуктов питания
По сравнению с плацебо семаглутид снизил потребление калорий на 18–35% во время трех последовательных приемов пищи ad libitum. Этому способствовали стимулированные семаглутидом подавление аппетита как натощак, так и после приема пищи, улучшенный контроль потребления пищи, ослабление тяги к еде, особенно с высоким содержанием жиров.
Липиды натощак и постпрандиальные липиды
По сравнению с плацебо семаглутид снижал концентрации триглицеридов и Хс-ЛПОНП натощак на 12 и 21%, соответственно. Постпрандиальное увеличение концентрации триглицеридов и Хс-ЛПОНП в ответ на прием пищи с высоким содержанием жиров снизилось более чем на 40%.
Электрофизиология сердца (ЭФс)
Действие семаглутида на процесс реполяризации в сердце было протестировано в исследовании ЭФс. Применение семаглутида в дозах, превышающих терапевтические (при Css до 1,5 мг), не приводило к удлинению скорректированного интервала QT.
Клиническая эффективность и безопасность
Как улучшение гликемического контроля, так и снижение СС-заболеваемости и смертности являются неотъемлемой частью лечения СД2.
Эффективность и безопасность препарата Оземпик® в дозах 0,5 и 1 мг оценивались в 6 рандомизированных контролируемых КИ 3а фазы. Из них 5 КИ в качестве основной цели оценивали эффективность гликемического контроля, в то время как 1 КИ оценивало в качество основной цели СС-исход. В дополнение были проведены 2 КИ препарата Оземпик® 3-й фазы с участием японских пациентов.
Терапия препаратом Оземпик® продемонстрировала устойчивые, статистически превосходящие и клинически значимые улучшения показателя HbA1c и снижение массы тела на срок до 2 лет по сравнению с плацебо и лечением с активным контролем (ситаглиптин, инсулин гларгин, эксенатид ЗВ и дулаглутид).
Возраст, пол, раса, этническая принадлежность, исходные значения ИМТ и массы тела (кг), длительность сахарного диабета (СД) и почечная недостаточность не повлияли на эффективность препарата Оземпик®.
Монотерапия
Монотерапия препаратом Оземпик® в дозах 0,5 и 1 мг 1 раз в неделю в течение 30 нед по сравнению с плацебо привела к статистически более значимому снижению показателей HbA1c (−1,5; −1,6% против 0%, соответственно), глюкозы плазмы натощак (ГПН) (−2,5; −2,3 ммоль/л против −0,6 ммоль/л, соответственно) и массы тела (−3,7; −4,5 кг против −1 кг, соответственно).
Препарат Оземпик® по сравнению с ситаглиптином, оба в комбинации с 1–2 пероральными гипогликемическими препаратами (ПГГП) (метформин и/или препараты группы тиазолидиндиона).
Терапия препаратом Оземпик® в дозах 0,5 и 1 мг 1 раз в неделю в течение 56 нед по сравнению с ситаглиптином привела к устойчивому и статистически более значимому снижению показателей HbA1c (−1,3; −1,6% против −0,5%, соответственно), ГПН (−2,1; −2,6 ммоль/л против −1,1 ммоль/л, соответственно) и массы тела (−4,3; −6,1 кг против −1,9 кг, соответственно). Терапия препаратом Оземпик® в дозах 0,5 и 1 мг по сравнению с ситаглиптином значительно снижала сАД от исходного значения в 132,6 мм рт.ст. (−5,1; −5,6 мм рт.ст. против −2,3 мм рт.ст., соответственно). Изменений дАД не происходило.
Препарат Оземпик® по сравнению с дулаглутидом, оба в комбинации с метформином
Терапия препаратом Оземпик® в дозе 0,5 мг по сравнению с дулаглутидом в дозе 0,75 мг, оба 1 раз в неделю на протяжении 40 нед, привела к устойчивому и статистически превосходящему снижению показателей HbA1c(−1,5 против −1,1%), ГПН (−2,2 против −1,9 ммоль/л) и массы тела (−4,6 против −2,3 кг), соответственно.
Терапия препаратом Оземпик® в дозе 1 мг по сравнению с дулаглутидом в дозе 1,5 мг оба 1 раз в неделю на протяжении 40 нед, привела к устойчивому и статистически превосходящему снижению показателей HbA1c(−1,8 против −1,4%), ГПН (−2,8 против −2,2 ммоль/л) и массы тела (−6,5 против −3,0 кг), соответственно.
Препарат Оземпик® по сравнению с эксенатидом ЗВ, оба в комбинации с метформином или метформином совместно с производным сульфонилмочевины
Терапия препаратом Оземпик® в дозе 1 мг 1 раз в неделю на протяжении 56 нед по сравнению с эксенатидом ЗВ в дозе 2,0 мг привела к устойчивому и статистически более значимому снижению показателей HbA1c(−l,5 против −0,9%), ГПН (−2,8 против −2,0 ммоль/л) и массы тела (−5,6 против −1,9 кг), соответственно.
Препарат Оземпик® по сравнению с инсулином гларгин, оба в комбинации с 1–2 ПГГП (монотерапия метформином или метформин с производным сульфонилмочевины)
Терапия препаратом Оземпик® в дозах 0,5 и 1 мг 1 раз в неделю по сравнению с инсулином гларгин в течение 30 нед привела к статистически более значимому снижению показателей HbA1c(−l,2; −1,6% против −0,8%, соответственно) и массы тела (−3,5; −5,2 кг против 1,2 кг, соответственно).
Снижение показателя ГПН было статистически более значимым для препарата Оземпик® 1 мг по сравнению с инсулином гларгин (−2,7 против −2,1 ммоль/л). Не наблюдалось статистически более значимое снижение показателя ГПН для препарата Оземпик® 0,5 мг (−2,0 против −2,1 ммоль/л).
Доля пациентов, у которых наблюдались тяжелые или подтвержденные (<3,1 ммоль/л) эпизоды гипогликемии, была ниже при применении препарата Оземпик® в дозе 0,5 мг (4,4%) и Оземпик® в дозе 1 мг (5,6%) по сравнению с инсулином гларгин (10,6%).
Больше пациентов достигли показателя HbA1c <7% без тяжелых или подтвержденных эпизодов гипогликемии и без набора веса при применении препарата Оземпик® в дозе 0,5 мг (47%) и Оземпик® в дозе 1 мг (64%) по сравнению с инсулином гларгин (16%).
Препарат Оземпик® по сравнению с плацебо, оба в комбинации с базальным инсулином
Терапия препаратом Оземпик® в дозах 0,5 и 1 мг по сравнению с плацебо в течение 30 нед привела к статистически более значимому снижению показателей HbA1c(−l,4; −1,8% против −0,1%, соответственно), ГПН (−1,6; −2,4 ммоль/л против −0,5 ммоль/л, соответственно) и массы тела (−3,7; −6,4 кг против −1,4 кг, соответственно). Частота тяжелых или подтвержденных эпизодов гипогликемии существенно не различалась при применении препарата Оземпик® и плацебо. Доля пациентов с показателем HbA1c ≤8% на скрининге, сообщивших о тяжелых или подтвержденных (<3,1 ммоль/л) эпизодах гипогликемии, была выше при применении препарата Оземпик® по сравнению с плацебо и сопоставима у пациентов с показателем HbA1c>8% на скрининге.
Комбинация с монотерапией производным сульфонилмочевины
На 30-й нед КИ (см. «Оценка влияния на ССС») была произведена оценка подгруппы из 123 пациентов, находящихся на монотерапии производным сульфонилмочевины. На 30-й нед показатель НЬА1с снизился на 1,6 и 1,5% при применении препарата Оземпик® в дозах 0,5 и 1 мг, соответственно, и увеличился на 0,1% при применении плацебо.
Комбинация с предварительно смешанным инсулином ±1–2 ПГГП
На 30-й нед КИ (см. подраздел «Оценка влияния на ССС») была произведена оценка подгруппы из 867 пациентов, находящихся на терапии предварительно смешанным инсулином (в комбинации или без 2 ПГГП). На 30-й нед показатель HbА1c снизился на 1,3 и 1,8% при применении препарата Оземпик® в дозах 0,5 и 1 мг, соответственно, и снизился на 0,4% при применении плацебо.
Соотношение пациентов, достигших целевого снижения показателя HbА1c
До 79% пациентов достигли целей лечения в отношении снижения показателя HbA1c<7%, и доля таких пациентов была значительно больше при применении препарата Оземпик® по сравнению с пациентами, получавшими ситаглиптин, эксенатид ЗВ, инсулин гларгин, дулаглутид и плацебо.
Доля пациентов, достигших показателя HbA1c менее 7% без тяжелых или подтвержденных эпизодов гипогликемии и без набора веса, была значительно больше при применении препарата Оземпик® в дозах 0,5 и 1 мг (до 66 и 74% соответственно) по сравнению с пациентами, получавшими ситаглиптин (27%), эксенатид ЗВ (29%), инсулин гларгин (16%), дулаглутид 0,75 мг (44%) и дулаглутид 1,5 мг (58%).
Масса тела
Монотерапия препаратом Оземпик® 1 мг или терапия в комбинации с 1–2 лекарственными препаратами приводила к статистически большему снижению массы тела (потеря составляла до 6,5 кг) по сравнению с терапией плацебо, ситаглиптином, эксенатидом ЗВ, инсулином гларгин или дулаглутидом. Снижение массы тела было устойчивым на срок до 2 лет.
После одного года терапии потери массы ≥5 и ≥10% достигло большее количество пациентов, получавших препарат Оземпик® в дозах 0,5 мг (46 и 13%) и 1 мг (до 62 и 24%), по сравнению с пациентами, находившимися на терапии активными препаратами сравнения ситаглиптином и эксенатидом ЗВ (до 18 и до 4%).
В КИ длительностью 40 нед потери массы ≥5 и ≥10% достигло большее количество пациентов, получавших препарат Оземпик® в дозе 0,5 мг (44 и 14%), по сравнению с пациентами, получавшими дулаглутид в дозе 0,75 мг (23 и 3%). Потери массы ≥5 и ≥10% достигло большее количество пациентов, получавших препарат Оземпик® 1 мг (до 63 и 27%), по сравнению с пациентами, получавшими дулаглутид 1,5 мг (30 и 8%).
В СС КИ потери массы тела ≥5 и ≥10% достигло большее количество пациентов, получавших препарат Оземпик® в дозах 0,5 мг (36 и 13%) и 1 мг (47 и 20%) по сравнению с пациентами, подучавшими плацебо 0,5 мг (18 и 6%) и 1 мг (19 и 7%).
ГПН и постпрандиальное увеличение концентрации глюкозы
Во время всех 3 ежедневных приемов пищи препарат Оземпик® 0,5 и 1 мг показал значительное снижение концентрации ГПН до 2,8 ммоль/л и снижение постпрандиального прироста концентрации глюкозы до 1,2 ммоль/л (разница между значениями до и после еды, полученная после 3 приемов пищи) (в дополнение см. «Фармакодинамические исследования»).
Функция бета-клеток поджелудочной железы и инсулинорезистентность
В ходе терапии препаратом Оземпик® 0,5 и 1 мг произошло улучшение функции бета-клеток поджелудочной железы и уменьшение инсулинорезистентности, что подтверждается оценкой гомеостатических моделей функции бета-клеток поджелудочной железы (НОМА-В) и инсулинорезистентности (HOMA-IR) (в дополнение см. «Фармакодинамические исследования»).
Липиды
Во время КИ препарата Оземпик® наблюдалось улучшение профиля липидов крови натощак, преимущественно в группе, получавшей дозу 1 мг (в дополнение см. «Фармакодинамические исследования»).
Оценка влияния на ССС
3297 пациентов с СД2 и высоким СС-риском были рандомизированы в двойное слепое КИ длительностью 104 нед на получение препарата Оземпик® 0,5 или 1 мг 1 раз в неделю либо плацебо 0,5 или 1 мг в дополнение к стандартной терапии СС-заболеваний в течение последующих 2 лет.
Терапия препаратом Оземпик® привела к снижению на 26% риска первичного комбинированного исхода, включающего смерть по причине СС-патологии, инфаркт миокарда (ИМ) без смертельного исхода и инсульт без смертельного исхода. В первую очередь это было обусловлено значительным уменьшением частоты инсульта без смертельного исхода (39%) и незначительным уменьшением частоты ИМ без смертельного исхода (26%), но без изменений в частоте смерти по причине СС-патологии.
Значительно снизился риск реваскуляризации миокарда или периферических артерий, в то время как риск развития нестабильной стенокардии, требующей госпитализации, и риск госпитализации по причине сердечной недостаточности снизились незначительно. Микроциркуляторные исходы включали в себя 158 новых или ухудшившихся случаев нефропатии. ОР в отношении времени до возникновения нефропатии (новые случаи развития персистирующей макроальбуминурии, персистирующее удвоение сывороточной концентрации креатинина, необходимость в постоянной заместительной почечной терапии и смерть по причине болезни почек) составил 0,64.
В дополнение к стандартной терапии СС-заболеваний терапия препаратом Оземпик® в дозах 0,5 и 1 мг по сравнению с плацебо 0,5 и 1 мг в течение 104 нед привела к значительному и устойчивому снижению от исходных значений показателя НЬА1c(−1,1 и −1,4% против −0,4 и −0,4%, соответственно).
АД
Наблюдалось значительное снижение среднего сАД при применении препарата Оземпик® в дозе 0,5 мг (3,5–5,1 мм рт.ст.) и Оземпик® в дозе 1 мг (5,4–7,3 мм рт.ст.) в комбинации с ПГГП или базальным инсулином. Не отмечалось значительной разницы по показателям дАД между препаратом Оземпик® и препаратами сравнения.
Фармакокинетика
Препарат подходит для введения 1 раз в неделю, т.к. T1/2 семаглутида равен приблизительно 1 нед.
Абсорбция. Время достижения Cmax в плазме составило от 1 до 3 дней после введения дозы препарата.
Равновесная концентрация препарата (AUCt/24) достигалась спустя 4–5 нед однократного еженедельного применения препарата. После п/к введения семаглутида в дозах 0,5 и 1 мг средние показатели его Css у пациентов с СД2 составили около 16 и 30 нмоль/л соответственно. Экспозиция для доз семаглутида 0,5 и 1 мг увеличивается пропорционально введенной дозе. При п/к введении семаглутида в переднюю брюшную стенку, бедро или плечо достигается сходная экспозиция. Абсолютная биодоступность семаглутида после п/к введения составила 89%.
Распределение. Средний Vd семаглутида в тканях после п/к введения пациентам с СД2 составил приблизительно 12,5 л. Семаглутид в значительной степени связывался с альбумином плазмы крови (>99%).
Метаболизм. Семаглутид метаболизируется посредством протеолитического расщепления пептидной основы белка и последующего бета-окисления жирной кислоты боковой цепи.
Выведение. ЖКТ и почки являются основными путями выведения семаглутида и его метаболитов. 2/3 введенной дозы семаглутида выводится почками; 1/3 — через кишечник. Приблизительно 3% от введенной дозы выводится почками в виде неизмененного семаглутида. У пациентов с СД2 клиренс семаглутида составил около 0,05 л/ч. С элиминационным T1/2 примерно 1 нед семаглутид будет присутствовать в общем кровотоке в течение приблизительно 5 нед после введения последней дозы препарата.
Особые группы пациентов
Не требуется коррекции дозы семаглутида в зависимости от возраста, пола, расовой и этнической принадлежности, массы тела, наличия почечной или печеночной недостаточности.
Возраст. На основании данных, полученных в ходе КИ 3а фазы, включавших пациентов в возрасте от 20 до 86 лет, показано, что возраст не влиял на фармакокинетику семаглутида.
Пол. Пол не влиял на фармакокинетику семаглутида.
Раса. Расовая группа (белая, черная или афроамериканская, азиатская) не влияла на фармакокинетику семаглутида.
Этническая принадлежность. Этническая принадлежность (латиноамериканская) не влияла на фармакокинетику семаглутида.
Масса тела. Масса тела влияла на экспозицию семаглутида. Более высокая масса тела приводит к более низкой экспозиции. Дозы семаглутида, равные 0,5 и 1 мг, обеспечивают достаточную экспозицию препарата в диапазоне массы тела от 40 до 198 кг.
Почечная недостаточность. Почечная недостаточность не оказала клинически значимого эффекта на фармакокинетику семаглутида. Это было показано у пациентов с различной степенью почечной недостаточности (легкой, средней, тяжелой или у пациентов, находящихся на диализе) по сравнению с пациентами с нормальной функцией почек в исследовании однократной дозы семаглутида равной 0,5 мг. Это также было показано на основании данных КИ 3а фазы для пациентов с СД2 и почечной недостаточностью, хотя опыт применения у пациентов с терминальной стадией заболевания почек был ограничен.
Печеночная недостаточность. Печеночная недостаточность не влияла на экспозицию семаглутида.
Фармакокинетические свойства семаглутида оценивались в ходе исследования однократной дозы семаглутида, равной 0,5 мг, у пациентов с различной степенью печеночной недостаточности (легкой, средней, тяжелой) и пациентов с нормальной функцией печени.
Дети и подростки. Исследований семаглутида у детей и подростков до 18 лет не проводили.
Показания
Препарат Оземпик® показан для применения у взрослых пациентов с сахарным диабетом типа 2 на фоне диеты и физических упражнений для улучшения гликемического контроля в качестве:
— монотерапии;
— комбинированной терапии с другими пероральными гипогликемическими препаратами (ПГГП) — метформином, метформином и производным сульфонилмочевины, метформином и/или тиазолидиндионом, у пациентов, не достигших адекватного гликемического контроля при проведении предшествующей терапии;
— комбинированной терапии с инсулином у пациентов, не достигших адекватного гликемического контроля на терапии препаратом Оземпик® и метформином.
Препарат Оземпик® показан для снижения риска развития больших сердечно-сосудистых событий (включают смерть по причине сердечно-сосудистой патологии, инфаркт миокарда без смертельного исхода, инсульт без смертельного исхода) у пациентов с сахарным диабетом типа 2 и высоким сердечно-сосудистым риском в качестве дополнения к стандартному лечению сердечно-сосудистых заболеваний (на основании анализа времени наступления первого большого сердечно-сосудистого события (см. «Фармакодинамические исследования», подраздел Оценка влияния на ССС).
Противопоказания
гиперчувствительность к семаглутиду или любому из вспомогательных веществ препарата;
медуллярный рак щитовидной железы в анамнезе, в том числе в семейном;
множественная эндокринная неоплазия (МЭН) 2 типа;
сахарный диабет типа 1 (СД1);
диабетический кетоацидоз.
Противопоказано применение препарата Оземпик® у следующих групп пациентов и при следующих состояниях/заболеваниях в связи с отсутствием данных по эффективности и безопасности или ограниченным опытом применения:
— беременность и период грудного вскармливания;
— возраст до 18 лет;
— печеночная недостаточность тяжелой степени;
— терминальная стадия почечной недостаточности (Cl креатинина <15 мл/мин);
— хроническая сердечная недостаточность (ХСН) IV функционального класса (в соответствии с классификацией NYHA (Нью-Йоркская кардиологическая ассоциация).
С осторожностью: препарат Оземпик® рекомендуется применять с осторожностью у пациентов с почечной недостаточностью и пациентов с наличием панкреатита в анамнезе (см. «Особые указания»).
Применение при беременности и кормлении грудью
Беременность. Исследования на животных продемонстрировали репродуктивную токсичность препарата (см. Доклинические данные по безопасности). Данные по применению семаглутида у беременных женщин ограничены.
Противопоказано применять семаглутид во время беременности. Женщинам с сохраненным репродуктивным потенциалом рекомендуется использовать контрацепцию во время терапии семаглутидом.
Если пациентка готовится к беременности либо беременность уже наступила, терапию семаглутидом необходимо прекратить. Из-за длительного T1/2 терапию семаглутидом необходимо прекратить как минимум за 2 мес до планируемого наступления беременности (см. «Фармакокинетика»).
Период грудного вскармливания. У лактирующих крыс семаглутид проникал в молоко. Нельзя исключить риск для ребенка, находящегося на грудном вскармливании. Противопоказано применять семаглутид в период грудного вскармливания.
Способ применения и дозы
П/к, в живот, бедро или плечо, 1 раз в неделю в любое время, независимо от приема пищи. Место инъекции может изменяться без коррекции дозы. Препарат Оземпик® нельзя вводить в/в и в/м.
Дальнейшая информация по способу применения — Руководство по использованию.
При необходимости день еженедельного введения можно менять при условии, что интервал времени между двумя инъекциями составляет не менее 3 дней (>72 ч).
Дозы. Начальная доза препарата Оземпик® составляет 0,25 мг 1 раз в неделю. После 4 нед применения дозу следует увеличить до 0,5 мг 1 раз в неделю. Для дальнейшего улучшения гликемического контроля после как минимум 4 нед применения препарата в дозе 0,5 мг 1 раз в неделю дозу можно увеличить до 1 мг 1 раз в неделю. Доза препарата Оземпик® 0,25 мг не является терапевтической.
Препарат Оземпик® может применяться в виде монотерапии или в комбинации с одним или более гипогликемическими препаратами (см. Клиническая эффективность и безопасность).
При добавлении препарата Оземпик® к предшествующей терапии метформином и/или тиазолидиндионом терапию метформином и/или тиазолидиндионом можно продолжить в прежних дозах. При добавлении препарата Оземпик® к проводимой терапии производным сульфонилмочевины или инсулином следует предусмотреть снижение дозы производного сульфонилмочевины или инсулина с целью снижения риска возникновения гипогликемий (см. «Особые указания»).
Применение препарата Оземпик® не требует проведения самоконтроля концентрации глюкозы крови. Самостоятельный мониторинг концентрации глюкозы в крови необходим для коррекции дозы сульфонилмочевины и инсулина, особенно в начале лечения препаратом Оземпик® и при снижении дозы инсулина. Рекомендуется использовать поэтапный подход к снижению дозы инсулина.
Пропущенная доза. В случае пропуска дозы препарат Оземпик® следует ввести как можно быстрее в течение 5 дней с момента запланированного введения дозы. Если продолжительность пропуска составляет более 5 дней, пропущенную дозу не нужно вводить. Следующую дозу препарата Оземпик® следует ввести в обычный запланированный день. В каждом случае пациенты могут возобновить их обычный однократный еженедельный график введения.
Особые клинические группы пациентов
Пожилой возраст (≥65 лет). Не требуется коррекции дозы в зависимости от возраста. Опыт применения семаглутида у пациентов в возрасте 75 лет и старше ограничен.
Печеночная недостаточность. Не требуется коррекции дозы у пациентов с печеночной недостаточностью (см. «Фармакокинетика»).
Опыт применения семаглутида у пациентов с печеночной недостаточностью тяжелой степени ограничен; применение препарата Оземпик® у таких пациентов противопоказано.
Почечная недостаточность. Не требуется коррекции дозы у пациентов с почечной недостаточностью. Опыт применения препарата у пациентов с терминальной стадией почечной недостаточности отсутствует; применение препарата Оземпик® у таких пациентов противопоказано.
Дети и подростки. Применение препарата Оземпик® у детей и подростков в возрасте до 18 лет противопоказано в связи с отсутствием данных по безопасности и эффективности.
Руководство по использованию
Предварительно заполненная шприц-ручка Оземпик® поставляется в двух видах:
— Оземпик® 0,25 или 0,5 мг/доза раствор для п/к введения в предварительно заполненной шприц-ручке позволяет вводить дозы 0,25 или 0,5 мг. Данная шприц-ручка предназначена для повышения дозы и поддержания терапевтической дозы 0,5 мг. 1 шприц-ручка содержит 1,5 мл раствора.
— Оземпик® 1 мг/доза раствор для п/к введения в предварительно заполненной шприц-ручке позволяет вводить дозу только 1 мг. Данная шприц-ручка предназначена только для поддержания терапевтической дозы 1 мг. 1 шприц-ручка содержит 3 мл раствора.
В упаковку препарата Оземпик® включены иглы НовоФайн® Плюс.
Пациенту следует рекомендовать выбрасывать инъекционную иглу после каждой инъекции в соответствии с местными требованиями.
Шприц-ручка Оземпик® предназначена только для индивидуального использования. Препарат Оземпик® нельзя применять, если он выглядит иначе, чем прозрачный бесцветный или почти бесцветный раствор.
Препарат Оземпик® нельзя применять, если он был заморожен.
Препарат Оземпик® можно вводить при помощи игл длиной до 8 мм. Шприц-ручка предназначена для использования с одноразовыми инъекционными иглами НовоФайн®. Всегда после каждой инъекции удаляйте иглу и храните шприц-ручку Оземпик® с отсоединенной иглой. Это поможет предотвратить закупорку игл, загрязнение, заражение, вытекание раствора и введение неправильной дозы препарата.
Инструкция для пациентов по применению препарата Оземпик® 0,25 или 0,5 мг/доза раствор для п/к введения в предварительно заполненной шприц-ручке
Следует внимательно прочитать данную инструкцию перед применением предварительно заполненной шприц-ручки Оземпик®.
Необходимо использовать шприц-ручку только после того, как пациент научится ею пользоваться под руководством врача или медсестры.
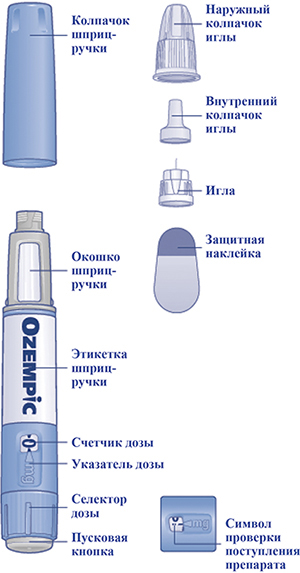
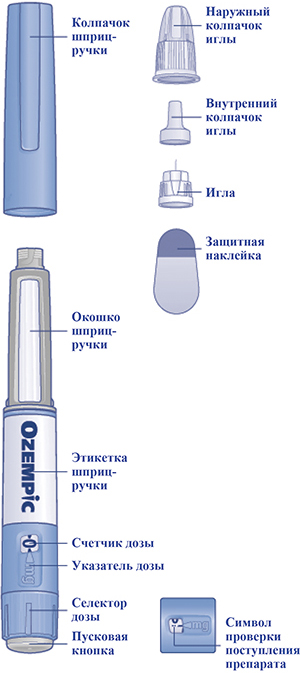
Начать следует с проверки шприц-ручки, чтобы убедиться, что в ней содержится препарат Оземпик® 0,25 или 0,5 мг/доза, затем посмотреть на представленные ниже иллюстрации, чтобы ознакомиться с различными частями шприц-ручки и иглы.
Если пациент слабовидящий или у него имеются серьезные проблемы со зрением и он не может различить цифры на счетчике дозы, не следует использовать шприц-ручку без посторонней помощи. Помочь может человек с хорошим зрением, обученный использованию предварительно заполненной шприц-ручки с препаратом Оземпик®.
Данная шприц-ручка является предварительно заполненной шприц-ручкой. Она содержит 2 мг семаглутида и позволяет выбрать дозы 0,25 или 0,5 мг. Шприц-ручка разработана для использования с одноразовыми иглами НовоФайн® длиной до 8 мм. Иглы НовоФайн® Плюс включены в упаковку.
Важная информация
Следует обратить особое внимание на информацию, размещенную под этим заголовком, это очень важно для безопасного использования шприц-ручки.
Рисунок (внешний вид)
1. Подготовка шприц-ручки с новой иглой к использованию
— Проверить название и цветовой код на этикетке шприц-ручки, чтобы убедиться, что в ней содержится препарат Оземпик® 0,25 или 0,5 мг/доза. Это особенно важно, если пациент применяет более одного инъекционного препарата.
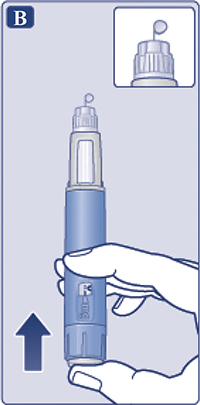
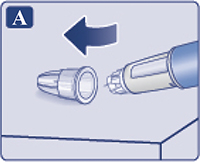
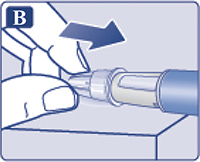
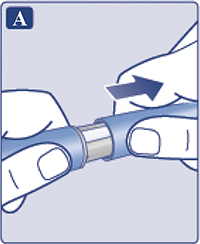
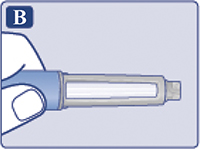
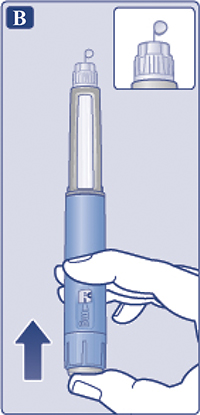
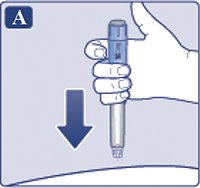
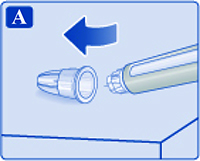
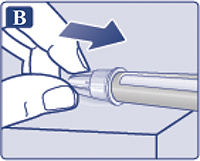
— Снять колпачок со шприц-ручки (рис. 1А).
Убедиться, что раствор в шприц-ручке прозрачный и бесцветный (рис. 1В). Посмотреть в окошко шприц-ручки. Если раствор мутный и не бесцветный, не использовать шприц-ручку.
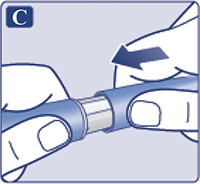
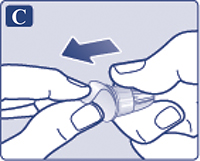
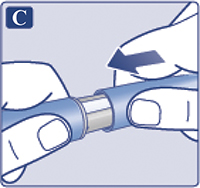
Взять новую иглу и удалить защитную наклейку (рис. 1С). Если защитная наклейка повреждена, не использовать иглу, т.к. в этом случае стерильность не гарантируется.
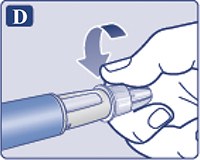
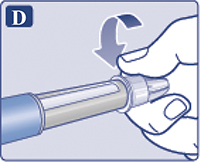
Надеть иглу на шприц-ручку и повернуть ее, чтобы игла плотно держалась на шприц-ручке (рис. 1D).
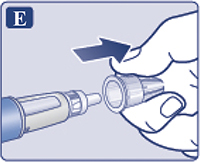
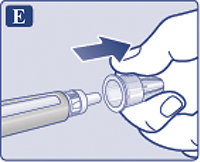
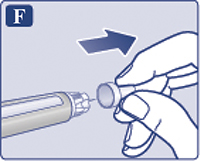
Снять наружный колпачок иглы, но не выбрасывать его (рис. 1Е). Он понадобится после завершения инъекции, чтобы безопасно снять иглу со шприц-ручки.
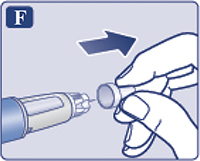
Снять и выбросить внутренний колпачок иглы (рис. 1F). Если пациент попытается надеть внутренний колпачок обратно на иглу, он может случайно уколоться иглой. На конце иглы может появиться капля раствора, это нормальное явление, однако все равно необходимо проверить поступление препарата, если пациент использует новую шприц-ручку в первый раз. Не присоединять новую иглу до тех пор, пока пациент не будет готов сделать инъекцию.
Важная информация
Всегда для каждой инъекции использовать новую иглу. Это может предотвратить закупорку игл, загрязнение, инфицирование и введение неправильной дозы препарата.
Никогда не использовать иглу, если она погнута или повреждена.
2. Проверка поступления препарата
Перед первой инъекцией с помощью каждой новой шприц-ручки проверить поступление препарата. Если шприц-ручка уже находится в использовании, то перейти к операции 3. «Установка дозы».
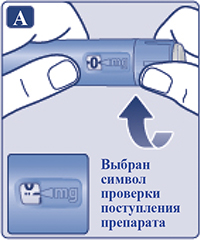
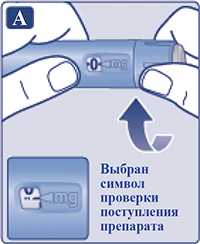
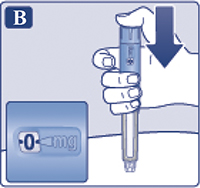
Поворачивать селектор дозы, пока счетчик дозы не поравняется с символом проверки поступления препарата (vvw) (рис. 2А).
Держать шприц-ручку иглой вверх.
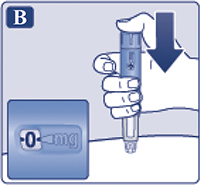
Нажать пусковую кнопку и удерживать ее в этом положении, пока счетчик дозы не возвратится к «0» (рис. 2B). «0» должен стоять напротив указателя дозы. На конце иглы должна появиться капля раствора.
На конце иглы может оставаться маленькая капля, но она не будет введена при инъекции. Если капля раствора на конце иглы не появилась, повторить операцию «2» «Проверка поступления препарата», но не более 6 раз. Если капля раствора так и не появилась, поменять иглу и повторить операцию «2» «Проверка поступления препарата» еще раз. Если капля раствора так и не появилась, утилизировать шприц-ручку и использовать новую.
Важная информация
Всегда перед использованием новой шприц-ручки в первый раз следует убедиться в том, что на конце иглы появилась капля раствора. Это гарантирует поступление препарата. Если капля раствора не появилась, препарат не будет введен, даже если счетчик дозы будет двигаться. Это может указывать на то, что игла закупорена или повреждена. Если не будет проверено поступление препарата перед первой инъекцией с помощью каждой новой шприц-ручки, пациент может не ввести необходимую дозу, и ожидаемый эффект препарата Оземпик® не будет достигнут.
3. Установка дозы
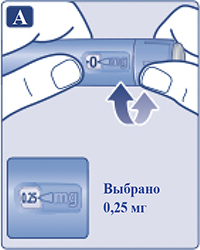
Поворачивать селектор дозы до тех пор, пока он не покажет необходимую дозу (0,25 или 0,5 мг) (рис. 3A).
Если доза была выбрана неправильно, пациент может поворачивать селектор дозы вперед или назад, пока не будет установлена правильная доза. Максимальная доза, которую можно установить, составляет 0,5 мг. Селектор дозы изменяет дозу. Только счетчик дозы и указатель дозы покажут количество мг препарата в выбранной пациентом дозе.
Пациент может выбрать до 0,5 мг препарата на дозу. Если в шприц-ручке содержится менее 0,5 мг, счетчик дозы остановится прежде, чем появится «0,5».
При каждом повороте селектора дозы раздаются щелчки, звук щелчков зависит от того, в какую сторону вращается селектор дозы: вперед, назад или если набранная доза превышает количество мг препарата, оставшегося в шприц-ручке.
Не следует считать щелчки шприц-ручки.
Важная информация
Всегда перед каждой инъекцией проверять какое количество (мг) препарата пациент набрал по счетчику дозы и указателю дозы.
Не следует считать щелчки шприц-ручки.
С помощью селектора дозы нужно выбирать только дозы 0,25 или 0,5 мг. Выбранная доза должна находиться точно напротив указателя дозы — такое положение гарантирует, что пациент получит правильную дозу препарата.
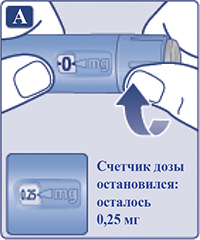
Сколько препарата осталось. Чтобы определить, сколько препарата осталось, следует использовать счетчик дозы (рис. 3B): поворачивать селектор дозы до остановки счетчика дозы. Если он показывает «0,5», в шприц-ручке осталось не менее 0,5 мг препарата. Если счетчик дозы остановился до того, как появилось «0,5», то это означает, что в шприц-ручке осталось недостаточное количество препарата, чтобы ввести полную дозу 0,5 мг.
Важная информация
Если в шприц-ручке осталось недостаточное количество препарата для введения полной дозы, не использовать шприц-ручку. Использовать новую шприц-ручку Оземпик®.
4. Введение препарата
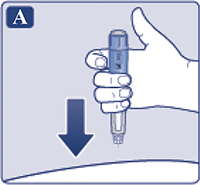
— Ввести иглу под кожу, используя технику инъекций, рекомендованную врачом или медсестрой (рис. 4A).
— Убедиться, что счетчик дозы находится в поле зрения человека, проводящего инъекцию. Не дотрагиваться до счетчика дозы пальцами — это может прервать инъекцию.
— Нажать пусковую кнопку до упора и удерживать ее в этом положении, пока счетчик дозы не покажет «0» (рис. 4B). «0» должен находиться точно напротив указателя дозы. При этом пациент может услышать или ощутить щелчок.
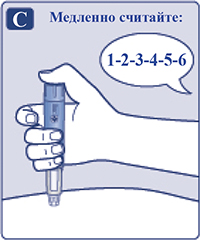
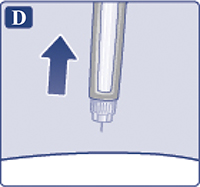
— Удерживать иглу под кожей, после того, как счетчик дозы вернулся к «0» и медленно считать до 6 (рис. 4C). Если извлечь иглу из-под кожи раньше, пациент может увидеть, как препарат вытекает из иглы. В этом случае будет введена неполная доза препарата.
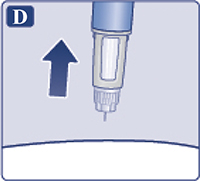
Извлечь иглу из-под кожи (рис. 4D). Если в месте инъекции появилась кровь, необходимо слегка прижать к месту укола ватный тампон. Не массировать место укола. После завершения инъекции пациент может увидеть каплю раствора на конце иглы. Это нормально и не влияет на дозу препарата, которая введена.
Важная информация
Всегда следует сверяться с показаниями счетчика дозы, чтобы знать, какое количество препарата введено. Удерживать пусковую кнопку до тех пор, пока счетчик дозы не покажет «0».
Как выявить закупорку или повреждение иглы. Если после долгого нажатия на пусковую кнопку на счетчике дозы не появляется «0», это может означать закупорку или повреждение иглы. В этом случае пациент не получил препарат, даже если счетчик дозы изменил положение с исходной дозы, которая установлена.
Что делать с закупоренной иглой. Заменить иглу как описано в операции 5 «После завершения инъекции» и повторить все шаги, начиная с операции 1 «Подготовка шприц-ручки с новой иглой к использованию». Убедиться, что установлена полная необходимая пациенту доза.
Никогда не следует дотрагиваться до счетчика дозы во время введения препарата. Это может прервать инъекцию.
5. После завершения инъекции
Положив наружный колпачок иглы на плоскую поверхность, ввести конец иглы внутрь колпачка, не касаясь его или иглы (рис. 5A).
Когда игла войдет в колпачок, осторожно надеть наружный колпачок на иглу (рис. 5B).
Отвинтить иглу и выбросить ее, соблюдая меры предосторожности.
После каждого использования надевать на шприц-ручку колпачок, чтобы защитить содержащийся в ней раствор от воздействия света (рис. 5C).
Всегда после каждой инъекции выбрасывать иглу, чтобы обеспечить комфортную инъекцию и избежать закупорки игл. Если игла закупорена, пациент не введет себе препарат.
Выбрасывать пустую шприц-ручку с отсоединенной иглой необходимо в соответствии с рекомендациями, данными врачом, медсестрой, фармацевтом или местными требованиями.
Важная информация
Никогда не пытаться надеть внутренний колпачок обратно на иглу (можно уколоться).
После каждой инъекции всегда сразу удалять иглу со шприц-ручки. Это может предотвратить закупорку игл, загрязнение, инфицирование, вытекание раствора и введение неправильной дозы препарата.
Дополнительная важная информация
Всегда хранить шприц-ручку и иглы к ней в недоступном для всех, и в особенности для детей, месте.
Никогда не передавать свою шприц-ручку и иглы к ней другим лицам.
Лица, осуществляющие уход за больным, должны обращаться с использованными иглами с особой осторожностью, чтобы предотвратить уколы иглой и перекрестное инфицирование.
Уход за шприц-ручкой
Следует аккуратно обращаться со шприц-ручкой. Небрежное обращение или неправильное использование могут привести к введению неправильной дозы препарата, следствием чего могут стать высокая концентрация глюкозы крови или дискомфорт в области живота (тошнота или рвота). Не оставлять шприц-ручку в автомобиле или любом другом месте, где она может подвергаться воздействию слишком высоких или слишком низких температур. Не применять препарат Оземпик®, если он был заморожен. В этом случае концентрация глюкозы крови может стать слишком высокой или пациент может почувствовать дискомфорт в области живота, такой, как тошнота или рвота. Не применять препарат Оземпик®, если он подвергся воздействию прямых солнечных лучей. В этом случае концентрация глюкозы крови может стать слишком высокой. Предохранять шприц-ручку от попадания на нее пыли, загрязнений и жидкости. Не мыть шприц-ручку, не погружать ее в жидкость и не смазывать ее. При необходимости шприц-ручку можно очищать влажной тканью, смоченной мягким моющим средством. Нельзя ронять или ударять шприц-ручку о твердую поверхность. Если пациент уронил шприц-ручку или сомневается в ее исправности, необходимо присоединить новую иглу и проверить поступление препарата перед тем, как сделать инъекцию. Не пытайтесь повторно заполнить шприц-ручку. Пустую шприц-ручку необходимо выбросить. Не следует пытаться самостоятельно починить шприц-ручку или разобрать ее на части.
Инструкция для пациентов по применению препарата Оземпик® 1 мг/доза раствор для п/к введения в предварительно заполненной шприц-ручке
Следует внимательно прочитать данную инструкцию перед применением предварительно заполненной шприц-ручки Оземпик®.
Необходимо использовать шприц-ручку только после того, как пациент научится ею пользоваться под руководством врача или медсестры.
Начать следует с проверки шприц-ручки, чтобы убедиться, что в ней содержится препарат Оземпик® 1 мг/доза, затем посмотреть на представленные ниже иллюстрации, чтобы ознакомиться с различными частями шприц-ручки и иглы.
Если пациент слабовидящий или у него имеются серьезные проблемы со зрением, и он не может различить цифры на счетчике дозы, не использовать шприц-ручку без посторонней помощи. Помочь может человек с хорошим зрением, обученный использованию предварительно заполненной шприц-ручки с препаратом Оземпик®.
Данная шприц-ручка является предварительно заполненной шприц-ручкой. Она содержит 4 мг семаглутида и позволяет выбрать только дозу 1 мг. Шприц-ручка разработана для использования с одноразовыми иглами НовоФайн® длиной до 8 мм. Иглы НовоФайн® Плюс включены в упаковку.
Важная информация
Следует обратить особое внимание на информацию, размещенную под заголовком «Важная информация», это очень важно для безопасного использования шприц-ручки.
Рисунок (внешний вид)
1. Подготовка шприц-ручки с новой иглой к использованию
Проверить название и цветовой код на этикетке шприц-ручки, чтобы убедиться, что в ней содержится препарат Оземпик® 1 мг/доза. Это особенно важно, если пациент применяет более одного инъекционного препарата.
Снять колпачок со шприц-ручки (рис. 1А).
Убедиться, что раствор в шприц-ручке прозрачный и бесцветный (рис. 1В). Посмотреть в окошко шприц-ручки. Если раствор мутный и не бесцветный, не использовать шприц-ручку.
Взять новую иглу и удалить защитную наклейку (рис.1С). Если защитная наклейка повреждена, не использовать иглу, т.к. в этом случае стерильность не гарантируется.
Надеть иглу на шприц-ручку и повернуть ее, чтобы игла плотно держалась на шприц-ручке (рис. 1D).
Снять наружный колпачок иглы, но не выбрасывать его (рис. 1Е). Он понадобится после завершения инъекции, чтобы безопасно снять иглу со шприц-ручки.
Снять и выбросить внутренний колпачок иглы (рис. 1F). Если пациент попытается надеть внутренний колпачок обратно на иглу, он может случайно уколоться иглой. На конце иглы может появиться капля раствора, это нормальное явление, однако все равно необходимо проверить поступление препарата, если пациент использует новую шприц-ручку в первый раз. Не присоединять новую иглу до тех пор, пока пациент не будет готов сделать инъекцию.
Важная информация.
Всегда для каждой инъекции использовать новую иглу. Это может предотвратить закупорку игл, загрязнение, инфицирование и введение неправильной дозы препарата.
Никогда не использовать иглу, если она погнута или повреждена.
2. Проверка поступления препарата
Перед первой инъекцией с помощью каждой новой шприц-ручки проверить поступление препарата. Если шприц-ручка уже находится в использовании, то перейти к операции 3. «Установка дозы».
Поворачивать селектор дозы, пока счетчик дозы не поравняется с символом проверки поступления препарата (vvw) (рис. 2A).
Держать шприц-ручку иглой вверх.
Нажать пусковую кнопку и удерживать ее в этом положении, пока счетчик дозы не возвратится к «0» (рис. 2B). «0» должен стоять напротив указателя дозы. На конце иглы должна появиться капля раствора.
На конце иглы может оставаться маленькая капля, но она не будет введена при инъекции. Если капля раствора на конце иглы не появилась, повторить операцию «2» «Проверка поступления препарата», но не более 6 раз. Если капля раствора так и не появилась, поменять иглу и повторить операцию «2» «Проверка поступления препарата» еще раз. Если капля раствора так и не появилась, утилизировать шприц-ручку и использовать новую.
Важная информация
Всегда перед использованием новой шприц-ручки в первый раз следует убедиться в том, что на конце иглы появилась капля раствора. Это гарантирует поступление препарата.
Если капля раствора не появилась, препарат не будет введен, даже если счетчик дозы будет двигаться. Это может указывать на то, что игла закупорена или повреждена.
Если не будет проверено поступление препарата перед первой инъекцией с помощью каждой новой шприц-ручки, пациент может не ввести необходимую дозу и ожидаемый эффект препарата Оземпик® не будет достигнут.
3. Установка дозы
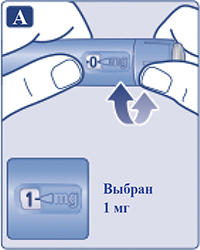
Повернуть селектор дозы, чтобы выбрать дозу 1 мг (рис.3A).
Продолжать поворачивать селектор дозы до тех пор, пока он не покажет необходимую дозу (1 мг).
Только счетчик дозы и указатель дозы покажут, что был выбран 1 мг.
Пациент может выбрать только 1 мг препарата на дозу. Если в шприц-ручке содержится менее 1 мг, счетчик дозы остановится прежде, чем появится «1».
При каждом повороте селектора дозы раздаются щелчки, звук щелчков зависит от того, в какую сторону вращается селектор дозы: вперед, назад или если набранная доза превышает количество мг препарата, оставшихся в шприц-ручке.
Не следует считать щелчки шприц-ручки.
Важная информация
Всегда перед каждой инъекцией проверять по счетчику и указателю дозы, что был набран 1 мг.
Не следует считать щелчки шприц-ручки.
С помощью селектора дозы нужно выбирать только дозу 1 мг. Доза 1 мг должна находиться точно напротив указателя дозы — такое положение гарантирует, что пациент получит правильную дозу препарата.
Сколько препарата осталось. Чтобы определить, сколько препарата осталось, следует использовать счетчик дозы (рис. 3B): поворачивать селектор дозы до остановки счетчика дозы. Если он показывает «1», в шприц-ручке осталось не менее 1 мг препарата. Если счетчик дозы остановился до того, как появилось «1», то это означает, что в шприц-ручке осталось недостаточное количество препарата, чтобы ввести полную дозу 1 мг.
Важная информация
Если в шприц-ручке осталось недостаточное количество препарата для введения полной дозы, не использовать шприц-ручку. Использовать новую шприц-ручку Оземпик®.
4. Введение препарата
Ввести иглу под кожу, используя технику инъекций, рекомендованную врачом или медсестрой (рис. 4A).
Убедиться, что счетчик дозы находится в поле зрения человека, проводящего инъекцию. Не дотрагиваться до счетчика дозы пальцами — это может прервать инъекцию.
Нажать пусковую кнопку до упора и удерживать ее в этом положении, пока счетчик дозы не покажет «0» (рис. 4B). «0» должен находиться точно напротив указателя дозы. При этом пациент может услышать или ощутить щелчок.
Удерживать иглу под кожей, после того как счетчик дозы вернулся к «0», и медленно считать до 6 (рис. 4C). Если извлечь иглу из-под кожи раньше, пациент может увидеть, как препарат вытекает из иглы. В этом случае будет введена неполная доза препарата.
Извлечь иглу из-под кожи (рис. 4D). Если в месте инъекции появилась кровь, необходимо слегка прижать к месту укола ватный тампон. Не массировать место укола. После завершения инъекции пациент может увидеть каплю раствора на конце иглы. Это нормально и не влияет на дозу препарата, которая введена.
Важная информация
Всегда необходимо сверяться с показаниями счетчика дозы, чтобы знать, какое количество препарата введено. Удерживать пусковую кнопку до тех пор, пока счетчик дозы не покажет «0».
Как выявить закупорку или повреждение иглы. Если после долгого нажатия на пусковую кнопку на счетчике дозы не появляется «0», это может означать закупорку или повреждение иглы. В этом случае пациент не получил препарат, даже если счетчик дозы изменил положение с исходной дозы, которая установлена.
Что делать с закупоренной иглой. Заменить иглу, как описано в операции 5 «После завершения инъекции», и повторить все шаги начиная с операции 1 «Подготовка шприц-ручки с новой иглой к использованию». Убедиться, что установлена полная необходимая пациенту доза.
Никогда не следует дотрагиваться до счетчика дозы во время введения препарата. Это может прервать инъекцию.
5. После завершения инъекции
Положив наружный колпачок иглы на плоскую поверхность, ввести конец иглы внутрь колпачка, не касаясь его или иглы (рис. 5A).
Когда игла войдет в колпачок, осторожно надеть наружный колпачок на иглу (рис. 5B).
Отвинтить иглу и выбросить ее, соблюдая меры предосторожности.
После каждого использования надевать на шприц-ручку колпачок, чтобы защитить содержащийся в ней раствор от воздействия света (рис. 5C).
Всегда после каждой инъекции выбрасывать иглу, чтобы обеспечить комфортную инъекцию и избежать закупорки игл. Если игла закупорена, пациент не введет себе препарат.
Выбрасывать пустую шприц-ручку с отсоединенной иглой необходимо в соответствии с рекомендациями, данными врачом, медсестрой, фармацевтом или местными требованиями.
Важная информация
Никогда не пытаться надеть внутренний колпачок обратно на иглу (можно уколоться).
После каждой инъекции всегда сразу удалять иглу со шприц-ручки. Это может предотвратить закупорку игл, загрязнение, инфицирование, вытекание раствора и введение неправильной дозы препарата.
Дополнительная важная информация
Всегда хранить шприц-ручку и иглы к ней в недоступном для всех, и в особенности для детей, месте.
Никогда не передавать свою шприц-ручку и иглы к ней другим лицам.
Лица, осуществляющие уход за больным, должны обращаться с использованными иглами с особой осторожностью, чтобы предотвратить уколы иглой и перекрестное инфицирование.
Уход за шприц-ручкой
Следует аккуратно обращаться со шприц-ручкой. Небрежное обращение или неправильное использование могут привести к введению неправильной дозы препарата, следствием чего могут стать высокая концентрация глюкозы в крови или дискомфорт в области живота (тошнота или рвота). Не оставлять шприц-ручку в автомобиле или любом другом месте, где она может подвергаться воздействию слишком высоких или слишком низких температур. Не применять препарат Оземпик®, если он был заморожен. В этом случае концентрация глюкозы в крови может стать слишком высокой или пациент может почувствовать дискомфорт в области живота (тошнота или рвота). Не применять препарат Оземпик®, если он подвергся воздействию прямых солнечных лучей. В этом случае концентрация глюкозы в крови может стать слишком высокой. Предохранять шприц-ручку от попадания на нее пыли, загрязнений и жидкости. Не мыть шприц-ручку, не погружать ее в жидкость и не смазывать ее. При необходимости шприц-ручку можно очищать влажной тканью, смоченной мягким моющим средством. Нельзя ронять или ударять шприц-ручку о твердую поверхность. Если пациент уронил шприц-ручку или сомневается в ее исправности, необходимо присоединить новую иглу и проверить поступление препарата перед тем, как сделать инъекцию. Не пытаться повторно заполнить шприц-ручку. Пустую шприц-ручку необходимо выбросить. Не следует пытаться самостоятельно починить шприц-ручку или разобрать ее на части.
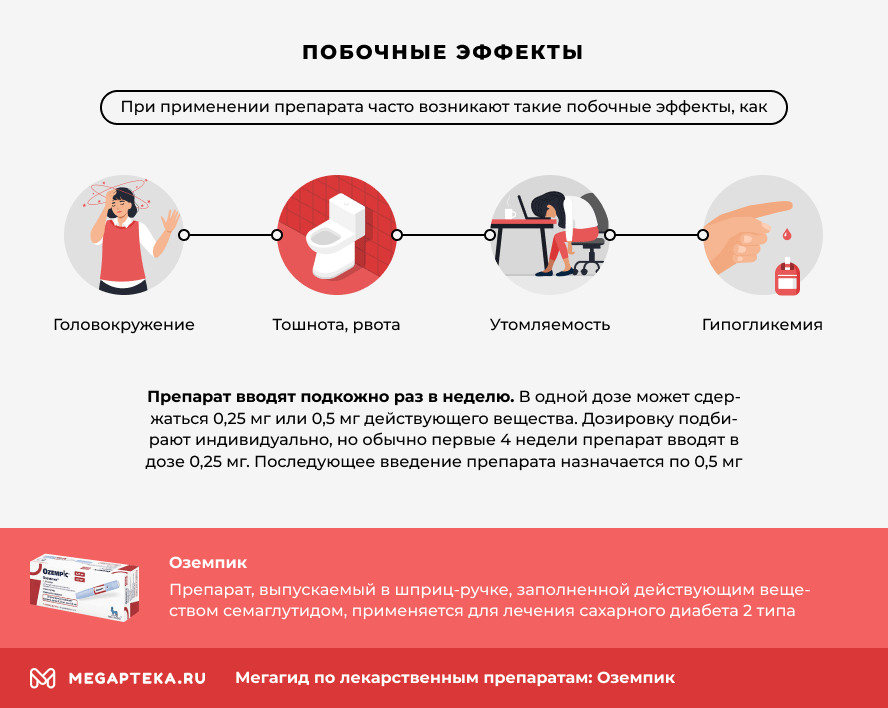
Побочные действия
Наиболее часто регистрируемыми нежелательными реакциями (HP) во время КИ являлись нарушения со стороны ЖКТ, включая тошноту, диарею и рвоту. В целом, данные реакции были легкой или средней степени тяжести и краткосрочными. HP распределены по системно-органным классам в соответствии с MedDRA с указанием частоты их возникновения согласно рекомендациям ВОЗ: очень часто (≥1/10); часто (≥1/100 до <1/10); нечасто (≥1/1000 до <1/100); редко (≥1/10000 до <1/1000); очень редко (<1/10000). В каждой группе частоты развития HP представлены по снижению степени серьезности.
Таблица 1
HP, выявленные при проведении КИ 3-й фазы
| Система органов MedDRA | Очень часто | Часто | Нечасто | Редко |
| Со стороны иммунной системы | Анафилактические реакции | |||
| Со стороны обмена веществ и питания | Гипогликемияа при совместном применении с инсулином и производным сульфонилмочевины | Гипогликемияа при совместном применении с другими ПГГП, снижение аппетита | ||
| Со стороны нервной системы | Головокружение | Дисгевзия | ||
| Со стороны органа зрения | Осложнения диабетической ретинопатииb | |||
| Со стороны сердца | Увеличение ЧСС | |||
| Нарушения со стороны ЖКТ | Тошнота, диарея | Рвота, боль в животе, вздутие живота, запор, диспепсия, гастрит, ГЭРБ, отрыжка, метеоризм | Острый панкреатит | |
| Со стороны печени и желчевыводящих путей | Холелитиаз | |||
| Общие расстройства и нарушения в месте введения | Утомляемость | Реакции в месте введения | ||
| Лабораторные и инструментальные данные | Повышение активности липазы, повышение активности амилазы, снижение массы тела |
aГипогликемия, определенная как тяжелая (требующая помощи другого человека) или симптоматическая, в сочетании с концентрацией глюкозы в плазме крови <3,1 ммоль/л.
bОсложнения диабетической ретинопатии — это сочетание из необходимости в фотокоагуляции сетчатки глаза, необходимости в интравитреальном введении препаратов, кровоизлияния в стекловидное тело, развития слепоты, связанной с СД. Частота основана на исследовании СС-исходов.
2-летнее исследование СС-исходов и безопасности. В популяции пациентов с высоким риском развития СС-заболеваний профиль HP был аналогичным таковому в других КИ 3а фазы (описаны в разделе Клиническая эффективность и безопасность).
Описание отдельных HP
Гипогликемия. Во время монотерапии препаратом Оземпик® не наблюдалось эпизодов тяжелой гипогликемии. Гипогликемия тяжелой степени, в основном, наблюдалась при применении препарата Оземпик® в комбинации с производным сульфонилмочевины или инсулином. Наблюдалось несколько эпизодов тяжелой гипогликемии при применении препарата Оземпик® в комбинации с другими, за исключением производного сульфонилмочевины, ПГГП.
HP со стороны ЖКТ. Во время терапии препаратом Оземпик® в дозах 0,5 и 1 мг у пациентов отмечалась тошнота, диарея и рвота. Большинство реакций были от легкой до средней степени тяжести и краткосрочными. HP стали причиной преждевременного выбывания из КИ 3,9 и 5,9% пациентов, соответственно. Чаще всего о HP сообщалось в первые месяцы терапии.
Острый панкреатит. Частота развития острого панкреатита, подтвержденного по результатам экспертной оценки, в исследованиях 3а фазы составила 0,3% при применении семаглутида и 0,2% при применении препарата сравнения. В 2-летнем исследовании сердечно-сосудистых исходов частота развития острого панкреатита, подтвержденная по результатам экспертной оценки, составила 0,5% при применении семаглутида и 0,6% при применении плацебо (см. «Особые указания».)
Осложнения диабетической ретинопатии. В 2-летнем КИ, в котором участвовали пациенты с СД2 и высоким СС-риском, длительным течением СД и неадекватным контролем гликемии, подтвержденные случаи осложнений диабетической ретинопатии развивались у большего количества пациентов, получавших препарат Оземпик® (3,0%), по сравнению с пациентами, получавшими плацебо (1,8%). У пациентов с анамнезом диабетической ретинопатии в начале КИ возрастание абсолютного риска развития осложнений было выше. У пациентов с отсутствием подтвержденного анамнеза диабетической ретинопатии количество событий было одинаковым при применении препарата Оземпик® и плацебо. В КИ продолжительностью до 1 года частота HP, связанных с диабетической ретинопатией, была одинаковой в группе препарата Оземпик® и препаратов сравнения.
Прекращение лечения по причине HP. Частота прекращения лечения по причине HP составила 8,7% для пациентов, получавших препарат Оземпик® 1 мг. Наиболее частыми HP, приводившими к прекращению лечения, были нарушения со стороны ЖКТ.
Реакции в месте введения. Сообщалось о реакциях в месте введения (таких как сыпь в месте введения, покраснение) у 0,6 и 0,5% пациентов, получавших семаглутид 0,5 и 1 мг, соответственно. Эти реакции носили, как правило, легкий характер.
Иммуногенность. Вследствие потенциальных иммуногенных свойств белковых и пептидных лекарственных препаратов у пациентов могут появиться антитела к семаглутиду после терапии препаратом Оземпик®. В конце КИ доля пациентов, у которых были обнаружены антитела к семаглутиду в любой момент времени, была низкой (1–2%), и ни у одного пациента не было обнаружено нейтрализующих антител к семаглутиду или антител с нейтрализующим эндогенный ГПП-1 эффектом.
Взаимодействие
Исследования семаглутида in vitro показали очень небольшую вероятность ингибирования или индукции ферментов системы цитохрома Р450 (CYP) и ингибирования транспортеров лекарственных препаратов.
Задержка опорожнения желудка при применении семаглутида может оказывать влияние на всасывание сопутствующих пероральных лекарственных препаратов. Семаглутид следует применять с осторожностью у пациентов, получающих пероральные лекарственные препараты, для которых необходима быстрая абсорбция в ЖКТ.
Парацетамол. При оценке фармакокинетики парацетамола во время теста стандартизированного приема пищи было выявлено, что семаглутид задерживает опорожнение желудка. При одновременном применении семаглутида в дозе 1 мг AUC0–60 мин и Cmax парацетамола снизились на 27 и 23%, соответственно. Общая экспозиция парацетамола (AUC0–5 ч) при этом не изменялась. При одновременном приеме семаглутида и парацетамола коррекция дозы последнего не требуется.
Пероральные гормональные контрацептивные средства. Не предполагается, что семаглутид снижает эффективность пероральных гормональных контрацептивных средств. При одновременном применении комбинированного перорального гормонального контрацептивного препарата (0,03 мг этинилэстрадиола/0,15 мг левоноргестрела) и семаглутида последний не оказывал клинически значимого влияния на общую экспозицию этинилэстрадиола и левоноргестрела. Экспозиция этинилэстрадиола не была затронута; наблюдалось увеличение на 20% экспозиции левоноргестрела в равновесном состоянии. Cmax не изменилась ни для одного из компонентов.
Аторвастатин. Семаглутид не изменял системную экспозицию аторвастатина после применения однократной дозы аторвастатина (40 мг). Cmax аторвастатина снизилась на 38%. Это изменение было расценено как клинически незначимое.
Дигоксин. Семаглутид не изменял системную экспозицию или Cmax дигоксина после применения однократной дозы дигоксина (0,5 мг).
Метформин. Семаглутид не изменял системную экспозицию или Cmax метформина после применения метформина в дозе 500 мг 2 раза в день в течение 3,5 дней.
Варфарин. Семаглутид не изменял системную экспозицию или Cmax R- и S-изомеров варфарина после применения однократной дозы варфарина (25 мг). На основании определения МНО клинически значимых изменений фармакодинамических эффектов варфарина также не наблюдалось.
Несовместимость. Вещества, добавленные к препарату Оземпик®, могут вызвать деградацию семаглутида. Препарат Оземпик® нельзя смешивать с другими ЛС, в т.ч. с инфузионными растворами.
Передозировка
В ходе КИ сообщалось о передозировках до 4 мг в однократной дозе и до 4 мг/нед.
Симптомы: наиболее частой HP, о которой сообщалось, была тошнота. Все пациенты выздоровели без осложнений.
Лечение: специфического антидота при передозировке препарата Оземпик® не существует. В случае передозировки рекомендуется проведение соответствующей симптоматической терапии. Учитывая длительный T1/2 препарата (примерно 1 нед), может потребоваться продолжительный период наблюдения и лечения симптомов передозировки.
Особые указания
Применение препарата Оземпик® противопоказано у пациентов с СД1 или для лечения диабетического кетоацидоза.
Препарат Оземпик® не заменяет инсулин. Диабетический кетоацидоз был зарегистрирован у инсулинозависимых пациентов, у которых отмечалось быстрое прекращение лечения или снижение дозы инсулина при начале лечения агонистом ГПП-1P (см. «Способ применения и дозы»).
Реакции со стороны ЖКТ
Применение агонистов ГПП-1Р может быть ассоциировано с HP со стороны ЖКТ. Это следует учитывать при лечении пациентов с почечной недостаточностью, т.к. тошнота, рвота и диарея могут привести к дегидратации и ухудшению функции почек.
Острый панкреатит
При применении агонистов ГПП-1Р наблюдались случаи развития острого панкреатита. Пациенты должны быть проинформированы о характерных симптомах острого панкреатита. При подозрении на панкреатит терапия препаратом Оземпик® должна быть прекращена; в случае подтверждения острого панкреатита терапию препаратом Оземпик® возобновлять не следует. Следует соблюдать осторожность у пациентов с панкреатитом в анамнезе.
При отсутствии других признаков и симптомов острого панкреатита повышение активности ферментов поджелудочной железы не является прогностическим фактором развития острого панкреатита.
Гипогликемия
Пациенты, получающие препарат Оземпик® в комбинации с производным сульфонилмочевины или инсулином, могут иметь повышенный риск развития гипогликемии. В начале лечения препаратом Оземпик® риск развития гипогликемии можно снизить, уменьшив дозу производного сульфонилмочевины или инсулина.
Диабетическая ретинопатия
Наблюдалось повышение риска развития осложнений диабетической ретинопатии у пациентов с наличием диабетической ретинопатии, получающих терапию инсулином и семаглутидом (см. «Побочные действия»). Следует соблюдать осторожность при применении семаглутида у пациентов с диабетической ретинопатией, получающих инсулинотерапию. Такие пациенты должны находиться под постоянным наблюдением и получать лечение в соответствии с клиническими рекомендациями.
Быстрое улучшение гликемического контроля было ассоциировано с временным ухудшением состояния диабетической ретинопатии, однако при этом нельзя исключать и другие причины.
Сердечная недостаточность
Отсутствует опыт применения препарата Оземпик® у пациентов с ХСН IV функционального класса в соответствии с классификацией NYHA. Применение препарата у таких пациентов противопоказано.
Заболевания щитовидной железы
В пострегистрационном периоде применения другого аналога ГПП-1, лираглутида, были отмечены случаи медуллярного рака щитовидной железы (МРЩЖ). Имеющихся данных недостаточно для установления или исключения причинно-следственной связи возникновения МРЩЖ с применением аналогов ГПП-1. Необходимо проинформировать пациента о риске развития МРЩЖ и симптомах опухоли щитовидной железы (появление уплотнения в области шеи, дисфагии, одышки, непроходящей охриплости голоса).
Значительное повышение концентрации кальцитонина в плазме крови может указывать на МРЩЖ (у пациентов с МРЩЖ значения концентрации кальцитонина в плазме крови обычно >50 нг/л). При выявлении повышения концентрации кальцитонина в плазме крови следует провести дальнейшее обследование пациента. Пациенты с узлами в щитовидной железе, выявленными при медицинском осмотре или при проведении УЗИ щитовидной железы, также должны быть дополнительно обследованы.
Применение семаглутида у пациентов с личным или семейным анамнезом МРЩЖ или с синдромом МЭН типа 2 противопоказано.
Доклинические данные по безопасности
Доклинические данные, основанные на исследованиях фармакологической безопасности, токсичности повторных доз и генотоксичности, не выявили какой-либо опасности для человека.
В 2-летних исследованиях канцерогенности у крыс и мышей при клинически значимых концентрациях семаглутид стал причиной развития опухолей С-клеток щитовидной железы без смертельного исхода. Опухоли С-клеток щитовидной железы без смертельного исхода, наблюдаемые у крыс, характерны для группы аналогов ГПП-1. Считается, что в отношении людей данный риск является низким, но не может быть полностью исключен.
Фертильность
Действие семаглутида на фертильность у людей неизвестно. Семаглутид не влиял на фертильность самцов крыс. Среди самок крыс увеличение эстрального цикла и незначительное снижение количества овуляций наблюдалось при дозах, сопровождавшихся снижением массы тела самки.
Влияние на способность управлять транспортными средствами и работать с механизмами. Препарат Оземпик® не влияет или незначительно влияет на способность управлять транспортными средствами или работать с механизмами. Пациенты должны быть предупреждены о том, что им следует соблюдать меры предосторожности во избежание развития у них гипогликемии во время управления транспортными средствами и при работе с механизмами, особенно при применении препарата Оземпик® в комбинации с производным сульфонилмочевины или инсулином.
Форма выпуска
Раствор для подкожного введения, 1,34 мг/мл.
1. Шприц-ручка Оземпик® 0,25 или 0,5 мг/доза. По 1,5 мл препарата в картриджах из стекла, укупоренных поршнями из хлорбутиловой резины с одной стороны и алюминиевыми колпачками с дисками из бромбутиловой резины/полиизопрена с другой стороны. Картридж встроен в мультидозовую одноразовую шприц-ручку для многократных инъекций из полипропилена, полиоксиметилена, поликарбоната и акрилонитрил бутадиен стирола. 1 шприц-ручку и 6 одноразовых игл НовоФайн® Плюс помещают в картонную пачку.
2. Шприц-ручка Оземпик® 1 мг/доза. По 3 мл препарата в картриджах из стекла, укупоренных поршнями из хлорбутиловой резины с одной стороны и алюминиевыми колпачками с дисками из бромбутиловой резины/полиизопрена с другой стороны. Картридж встроен в мультидозовую одноразовую шприц-ручку для многократных инъекций из полипропилена, полиоксиметилена, поликарбоната и акрилонитрил бутадиен стирола. 1 шприц-ручку и 4 одноразовых иглы НовоФайн® Плюс помещают в картонную пачку.
Производитель
Производитель и владелец регистрационного удостоверения:
Ново Нордиск А/С, Ново Алле, DK-2880 Багсваерд, Дания.
www.novonordisk.com
Производство готовой лекарственной формы. Ново Нордиск А/С, Ново Алле, DK-2880 Багсваерд, Дания.
Первичная упаковка. Ново Нордиск А/С, Ново Алле, DK-2880 Багсваерд, Дания.
Вторичная/потребительская упаковка. Ново Нордиск А/С, Бреннум Парк, DK-3400 Хиллерод, Дания.
Производитель (выпускающий контроль качества). Ново Нордиск А/С, Ново Алле, DK-2880 Багсваерд, Дания.
Организация, принимающая претензии от потребителей. ООО «Ново Нордиск», 121614, Москва, ул. Крылатская, 15, оф. 41.
Тел.: (495) 956-11-32; факс: (495) 956-50-13.
www.novonordisk.ru
Оземпик® и НовоФайн® — зарегистрированные торговые марки, принадлежащие компании Ново Нордиск А/С, Дания.
Условия отпуска из аптек
По рецепту.
Условия хранения
В защищенном от света месте, при температуре 2–8 °C (в холодильнике, но не рядом с морозильной камерой, не замораживать).
Используемую или переносимую в качестве запасной шприц-ручку, закрытую колпачком, при t не выше 30 °C или при t 2–8 °C. Использовать в течение 6 нед. Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Оземпик — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-005726
Торговое наименование:
Оземпик®
Международное непатентованное наименование:
семаглутид
Лекарственная форма:
раствор для подкожного введения
Состав
В 1 мл препарата содержится:
действующее вещество: семаглутид 1,34 мг;
вспомогательные вещества: динатрия гидрофосфат дигидрат, пропиленгликоль, фенол, хлористоводородная кислота (для коррекции pH), натрия гидроксид (для коррекции pH), вода для инъекций.
Для шприц-ручки Оземпик® 0,25 мг/доза или 0,5 мг/доза:
В одной предварительно заполненной шприц-ручке объёмом 1,5 мл содержится 2 мг семаглутида.
Для шприц-ручки Оземпик® 1 мг/доза:
В одной предварительно заполненной шприц-ручке объёмом 3 мл содержится 4 мг семаглутида.
Описание
Прозрачный бесцветный или почти бесцветный раствор.
Фармакотерапевтическая группа
Гипогликемическое средство – аналог глюкагоноподобного пептида-1 (ГПП-1).
Код ATX:
A10BJ06.
Фармакологические свойства
Семаглутид является агонистом рецепторов ГПП-1 (ГПП-1Р), произведённым методом биотехнологии рекомбинантной ДНК с использованием штамма Saccharomyces cerevisiae с последующей очисткой.
Семаглутид представляет собой аналог ГПП-1, имеющий 94% гомологичности с человеческим ГПП-1. Семаглутид действует как агонист ГПП-1Р, который селективно связывается и активирует ГПП-1Р. ГПП-1Р служит мишенью для нативного ГПП-1.
ГПП-1 является физиологическим гормоном, оказывающим сразу несколько эффектов на регуляцию концентрации глюкозы и аппетит, а также на сердечно-сосудистую систему (ССС). Влияние на концентрацию глюкозы и аппетит специфически опосредовано ГПП-1Р, расположенными в поджелудочной железе и головном мозге. Фармакологические концентрации семаглутида снижают концентрацию глюкозы крови и массу тела посредством сочетания эффектов, описанных ниже. ГПП-1Р представлены также в специфических областях сердца, сосудов, иммунной системы и почек, где их активация может оказывать сердечно-сосудистые (СС) и микроциркуляторные эффекты.
В отличие от нативного ГПП-1, продлённый период полувыведения семаглутида (около 1 недели) позволяет применять его подкожно (п/к) 1 раз в неделю. Связывание с альбумином является основным механизмом длительного действия семаглутида, что приводит к снижению выведения его почками и защищает от метаболического распада. Кроме того, семаглутид стабилен в отношении расщепления ферментом дипептидилпептидазой-4.
Семаглутид снижает концентрацию глюкозы крови посредством глюкозозависимых стимуляции секреции инсулина и подавления секреции глюкагона. Таким образом, при повышении концентрации глюкозы крови происходит стимуляция секреции инсулина и подавление секреции глюкагона. Механизм снижения уровня гликемии включает также небольшую задержку опорожнения желудка в ранней постпрандиальной фазе. Во время гипогликемии семаглутид уменьшает секрецию инсулина и не снижает секрецию глюкагона.
Семаглутид снижает общую массу тела и массу жировой ткани, уменьшая потребление энергии. Данный механизм затрагивает общее снижение аппетита, включая усиление сигналов насыщения и ослабление сигналов голода, а также улучшение контроля потребления пищи и снижение тяги к пище. Снижается также инсулинорезистентность, возможно, за счёт уменьшения массы тела. Помимо этого, семаглутид снижает предпочтение к приёму пищи с высоким содержанием жиров. В исследованиях на животных было показано, что семаглутид поглощается специфическими областями головного мозга и усиливает ключевые сигналы насыщения и ослабляет ключевые сигналы голода. Воздействуя на изолированные участки тканей головного мозга семаглутид активирует нейроны, связанные с чувством сытости, и подавляет нейроны, связанные с чувством голода.
В клинических исследованиях (КИ) семаглутид оказывал положительное влияние на липиды плазмы крови, снижал систолическое артериальное давление (АД) и уменьшал воспаление.
В исследованиях на животных семаглутид подавляет развитие атеросклероза, предупреждая дальнейшее развитие аортальных бляшек и уменьшая воспаление в бляшках.
Фармакодинамика
Все фармакодинамические исследования были проведены после 12 недель терапии (включая период увеличения дозы) в равновесной концентрации семаглутида 1 мг 1 раз в неделю.
Уровень гликемии натощак и постпрандиальный уровень гликемии
Семаглутид снижает концентрацию глюкозы натощак и концентрацию постпрандиальной глюкозы. По сравнению с плацебо терапия семаглутидом 1 мг у пациентов с сахарным диабетом 2 типа (СД2) привела к снижению концентрации глюкозы с точки зрения абсолютного изменения от исходного значения (ммоль/л) и относительного снижения по сравнению с плацебо (%) в отношении: концентрации глюкозы натощак (1,6 ммоль/л; 22%); концентрации глюкозы через 2 часа после приёма пищи (4,1 ммоль/л; 37%); средней суточной концентрации глюкозы (1,7 ммоль/л; 22%) и постпрандиальных пиков концентрации глюкозы за 3 приёма пищи (0,6-1,1 ммоль/л). Семаглутид снижал концентрацию глюкозы натощак после введения первой дозы.
Функция бета-клеток поджелудочной железы и секреция инсулина
Семаглутид улучшает функцию бета-клеток поджелудочной железы. После внутривенного струйного введения глюкозы пациентам с СД2 семаглутид по сравнению с плацебо улучшал первую и вторую фазу инсулинового ответа с трёхкратным и двукратным повышением, соответственно, и увеличивал максимальную секреторную активность бета-клеток поджелудочной железы после теста стимуляции аргинином. Кроме того, по сравнению с плацебо терапия семаглутидом увеличивает концентрации инсулина натощак.
Секреция глюкагона
Семаглутид снижает концентрацию глюкагона натощак и постпрандиальную концентрацию глюкагона. У пациентов с СД2 семаглутид приводит к относительному снижению концентрации глюкагона по сравнению с плацебо: концентрации глюкагона натощак (8-21%), постпрандиальной) глюкагонового ответа (14-15%) и средней суточной концентрации глюкагона (12%).
Глюкозозависимая секреция инсулина и глюкозозависимая секреция глюкагона
Семаглутид снижал высокую концентрацию глюкозы в крови, стимулируя секрецию инсулина и снижая секрецию глюкагона глюкозозависимым способом. Скорость секреции инсулина после введения семаглутида пациентам с СД2 была сопоставима с таковой у здоровых добровольцев.
Во время индуцированной гипогликемии семаглутид по сравнению с плацебо не изменял контррегуляторный ответ повышения концентрации глюкагона, а также не усугублял снижение концентрации С-пептида у пациентов с СД2.
Опорожнение желудка
Семаглутид вызывал небольшую задержку раннего постпрандиальной) опорожнения желудка, тем самым снижая скорость поступления постпрандиальной глюкозы в кровь.
Масса тела и состав тела
Наблюдалось большее снижение массы тела при применении семаглутида по сравнению с изученными препаратами сравнения (плацебо, ситаглиптином, эксенатидом замедленного высвобождения (ЗВ), дулаглутидом и инсулином гларгин) (см. раздел «Клиническая эффективность и безопасность»). Потеря массы тела при применении семаглутида происходила преимущественно за счёт потери жировой ткани, превышающей потерю мышечной массы в 3 раза.
Аппетит, потребление калорий и выбор продуктов питания
По сравнению с плацебо семаглутид снизил потребление калорий на 18-35 % во время трёх последовательных приёмов пищи ad libitum. Этому способствовали стимулированные семаглутидом подавление аппетита как натощак, так и после приёма пищи, улучшенный контроль потребления пищи, ослабление тяги к еде, особенно с высоким содержанием жиров.
Липиды натощак и постпрандиальные липиды
По сравнению с плацебо семаглутид снижал концентрации триглицеридов и холестерина липопротеинов очень низкой плотности (ЛПОНП) натощак на 12% и 21%, соответственно. Постпрандиальное увеличение концентрации триглицеридов и холестерина ЛПОНП в ответ на приём пищи с высоким содержанием жиров снизилось более чем на 40%.
Электрофизиология сердца (ЭФс)
Действие семаглутида на процесс реполяризации в сердце было протестировано в исследовании ЭФс. Применение семаглутида в дозах, превышающих терапевтические (в равновесной концентрации до 1,5 мг), не приводило к удлинению скорректированного интервала QT.
Клиническая эффективность и безопасность
Как улучшение гликемического контроля, так и снижение СС заболеваемости и смертности являются неотъемлемой частью лечения СД2.
Эффективность и безопасность препарата Оземпик® в дозах 0,5 мг и 1 мг оценивались в шести рандомизированных контролируемых КИ 3а фазы. Из них пять КИ в качестве основной цели оценивали эффективность гликемического контроля, в то время как одно КИ оценивало в качество основной цели СС исход. В дополнение были проведены два КИ препарата Оземпик® 3 фазы с участием японских пациентов.
Терапия препаратом Оземпик® продемонстрировала устойчивые, статистически превосходящие и клинически значимые улучшение показателя HbA1с и снижение массы тела на срок до 2 лет по сравнению с плацебо и лечением с активным контролем (ситаглиптином, инсулином гларгин, эксенатидом ЗВ и дулаглутидом).
Возраст, пол, раса, этническая принадлежность, исходные значения индекса массы тела (ИМТ) и массы тела (кг), длительность сахарного диабета (СД) и почечная недостаточность не повлияли на эффективность препарата Оземпик®.
Монотерапия
Монотерапия препаратом Оземпик® в дозах 0,5 мг и 1 мг 1 раз в неделю в течение 30 недель по сравнению с плацебо привела к статистически более значимому снижению показателей HbA1с (-1,5%, -1,6% против 0%, соответственно), глюкозы плазмы натощак (ГПН) (-2,5 ммоль/л, -2,3 ммоль/л против -0,6 ммоль/л, соответственно) и массы тела (-3,7 кг, -4,5 кг против -1,0 кг, соответственно).
Препарат Оземпик® по сравнению с ситаглиптином, оба в комбинации с 1-2 пероральными гипогликемическими препаратами (ПГГП) (метформином и/или препаратами группы тиазолидиндиона)
Терапия препаратом Оземпик® 0,5 мг и 1 мг 1 раз в неделю в течение 56 недель по сравнению с ситаглиптином привела к устойчивому и статистически более значимому снижению показателей HbA1с (-1,3%, -1,6% против -0,5%, соответственно), ГПН (-2,1 ммоль/л, -2,6 ммоль/л против -1,1 ммоль/л, соответственно) и массы тела (-4,3 кг, -6,1 кг против -1,9 кг, соответственно). Терапия препаратом Оземпик® 0,5 мг и 1 мг по сравнению с ситаглиптином значительно снижала систолическое АД от исходного значения в 132,6 мм рт.ст. (-5,1 мм рт.ст., -5,6 мм рт.ст, против -2,3 мм рт.ст., соответственно). Изменений диастолического АД не происходило.
Препарат Оземпик® по сравнению с дулаглутидом, оба в комбинации с метформином
Терапия препаратом Оземпик® 0,5 мг по сравнению с дулаглутидом 0,75 мг, оба 1 раз в неделю на протяжении 40 недель, привела к устойчивому и статистически превосходящему снижению показателей HbA1с (-1,5% против -1,1%), ГПН (-2,2 ммоль/л против -1,9 ммоль/л) и массы тела (-4,6 кг против -2,3 кг), соответственно.
Терапия препаратом Оземпик® 1 мг по сравнению с дулаглутидом 1,5 мг оба 1 раз в неделю на протяжении 40 недель, привела к устойчивому и статистически превосходящему снижению показателей HbA1с (-l,8% против -1,4%), ГПН (-2,8 ммоль/л против -2,2 ммоль/л) и массы тела (-6,5 кг против -3,0 кг), соответственно.
Препарат Оземпик® по сравнению с эксенатидом ЗВ, оба в комбинации с метформином или метформином совместно с производным сульфонилмочевины
Терапия препаратом Оземпик® 1 мг 1 раз; в неделю на протяжении 56 недель по сравнению с эксенатидом ТВ 2,0 мг привела к устойчивому и статистически более значимому снижению показателей HbA1с (-U5% против -0,9%), ГПН (-2,8 ммоль/л против -2,0 ммоль/л) и массы тела (-5,6 кг против -1,9 кг), соответственно.
Препарат Оземпик® по сравнению с инсулином гларгин, оба в комбинации с 1-2 ПГГП (монотерапия метформином или метформин с производным сульфонилмочевины)
Терапия препаратом Оземпик® в дозах 0,5 мг и 1 мг 1 раз в неделю по сравнению с инсулином гларгин в течение 30 недель привела к статистически более значимому снижению показателей HbA1с (-1,2%, -1,6% против -0,8%, соответственно) и массы тела (-3,5 кг, -5,2 кг против +1,2 кг, соответственно).
Снижение показателя ГПН было статистически более значимым для препарата Оземпик® 1 мг по сравнению с инсулином гларгин (-2,7 ммоль/л против -2,1 ммоль/л). Не наблюдалось статистически более значимое снижение показателя ГПН для препарата Оземпик® 0,5 мг (-2,0 ммоль/л против -2,1 ммоль/л).
Доля пациентов, у которых наблюдались тяжёлые или подтверждённые (<3,1 ммоль/л) эпизоды гипогликемии, была ниже при применении препарата Оземпик® 0,5 мг (4,4%) и Оземпик® 1 мг (5,6%) по сравнению с инсулином гларгин (10,6%).
Больше пациентов достигли показателя HbA1с <7% без тяжёлых или подтверждённых эпизодов гипогликемии и без набора веса при применении препарата Оземпик® 0,5 мг (47%) и Оземпик® 1 мг (64%) по сравнению с инсулином гларгин (16%).
Препарат Оземпик® по сравнению с плацебо, оба в комбинации с базальным инсулином
Терапия препаратом Оземпик® в дозах 0,5 мг и 1 мг по сравнению с плацебо в течение 30 недель привела к статистически более значимому снижению показателей HbA1с (-1,4%, -1,8% против -0,1%, соответственно), ГПН (-1,6 ммоль/л, -2,4 ммоль/л против -0,5 ммоль/л, соответственно) и массы тела (-3,7 кг, -6,4 кг против -1,4 кг, соответственно). Частота тяжёлых или подтверждённых эпизодов гипогликемии существенно не различалась при применении препарата Оземпик® и плацебо. Доля пациентов с показателем HbA1с ≤8% на скрининге, сообщивших о тяжёлых или подтверждённых (<3,1 ммоль/л) эпизодах гипогликемии, была выше при применении препарата Оземпик® по сравнению с плацебо и сопоставима у пациентов с показателем HbA1с >8% на скрининге.
Комбинация с монотерапией производным сульфонилмочевины
На 30-й неделе КИ (см. подраздел «Оценка влияния на ССС») была произведена оценка подгруппы из 123 пациентов, находящихся на монотерапии производным сульфонилмочевины. На 30-й неделе показатель HbA1с снизился на 1,6% и на 1,5% при применении препарата Оземпик® в дозах 0,5 мг и 1 мг, соответственно, и увеличился на 0,1% при применении плацебо.
Комбинация с предварительно смешанным инсулином ± 1-2 ПГГП
На 30-й неделе КИ (см. подраздел «Оценка влияния на ССС») была произведена оценка подгруппы из 867 пациентов, находящихся на терапии предварительно смешанным инсулином (в комбинации или без 2-х ПГГП). На 30-й неделе показатель HbA1с снизился на 1,3% и на 1,8% при применении препарата Оземпик® в дозах 0,5 мг и 1 мг, соответственно, и снизился на 0,4% при применении плацебо.
Соотношение пациентов, достигших целевого снижения показателя HbA1с
До 79% пациентов достигли целей лечения в отношении снижения показателя HbA1с <7%, и доля таких пациентов была значительно больше при применении препарата Оземпик® по сравнению с пациентами, получавшими ситаглиптин, эксенатид ЗВ, инсулин гларгин, дулаглутид и плацебо.
Доля пациентов, достигших показателя HbA1с менее 7% без тяжёлых или подтверждённых эпизодов гипогликемии и без набора веса, была значительно больше при применении препарата Оземпик® в дозах 0,5 мг и 1 мг (до 66% и 74%, соответственно) по сравнению с пациентами, получавшими ситаглиптин (27%), эксенатид ЗВ (29%), инсулин гларгин (16%), дулаглутид 0,75 мг (44%) и дулаглутид 1,5 мг (58%).
Масса тела
Монотерапия препаратом Оземпик® 1 мг или терапия в комбинации с 1-2 лекарственными препаратами приводила к статистически большему снижению массы тела (потеря составляла до 6,5 кг) по сравнению с терапией плацебо, ситаглиптином, эксенатидом ЗВ, инсулином гларгин или дулаглутидом. Снижение массы тела было устойчивым на срок до 2-х лет.
После одного года терапии потери массы ≥5% и ≥10% достигло большее количество пациентов, получавших препарат Оземпик® 0,5 мг (46% и 13%) и 1 мг (до 62% и 24%), по сравнению с пациентами, находившимися на терапии активными препаратами сравнения ситаглиптином и эксенатидом ЗВ (до 18% и до 4%).
В КИ длительностью 40 недель потери массы ≥5% и ≥10% достигло большее количество пациентов, получавших препарат Оземпик® 0,5 мг (44% и 14%), по сравнению с пациентами, получавшими дулаглутид 0,75 мг (23% и 3%). Потери массы ≥5% и ≥10% достигло большее количество пациентов, получавших препарат Оземпик® 1 мг (до 63% и 27%), по сравнению с пациентами, получавшими дулаглутид 1,5 мг (30% и 8%).
В СС КИ потери массы тела ≥5% и ≥10% достигло большее количество пациентов, получавших препарат Оземпик® 0,5 мг (36% и 13%) и 1 мг (47% и 20%), по сравнению с пациентами, получавшими плацебо 0,5 мг (18% и 6%) и 1 мг (19% и 7%).
ГПН и постпрандиальное увеличение концентрации глюкозы
Во время всех трёх ежедневных приёмов пищи препарат Оземпик® 0,5 мг и 1 мг показал значительное снижение концентрации ГПН до 2,8 ммоль/л и снижение постпрандиального прироста концентрации глюкозы до 1,2 ммоль/л (разница между значениями до и после еды, полученная после трёх приёмов пищи) (в дополнение см. раздел «Фармакодинамика»).
Функция бета-клеток поджелудочной железы и инсулинорезистентность
В ходе терапии препаратом Оземпик® 0,5 мг и 1 мг произошло улучшение функции бета-клеток поджелудочной железы и уменьшение инсулинорезистентности, что подтверждается оценкой гомеостатических моделей функции бета-клеток поджелудочной железы (НОМА-IR) и инсулинорезистентности (HOMA-IR) (в дополнение см. раздел «Фармакодинамика»).
Липиды
Во время КИ препарата Оземпик® наблюдалось улучшение профиля липидов крови натощак, преимущественно в группе, получавшей дозу 1 мг (в дополнение см. раздел «Фармакодинамика»).
Оценка влияния на ССС
3297 пациентов с СД2 и высоким СС риском были рандомизированы в двойное слепое КИ длительностью 104 недели на получение препарата Оземпик® 0,5 мг или 1 мг 1 раз в неделю либо плацебо 0,5 мг или 1 мг в дополнение к стандартной терапии СС заболеваний в течение последующих двух лет.
Терапия препаратом Оземпик® привела к снижению на 26% риска первичного комбинированного исхода, включающего смерть по причине СС патологии, инфаркт миокарда (ИМ) без смертельного исхода и инсульт без смертельного исхода. В первую очередь это было обусловлено значительным уменьшением частоты инсульта без смертельного исхода (39%) и незначительным уменьшением частоты ИМ без смертельного исхода (26%), но без изменений в частоте смерти по причине СС патологии.
Значительно снизился риск реваскуляризации миокарда или периферических артерий, в то время как риск нестабильной стенокардии, требующей госпитализации, и риск госпитализации по причине сердечной недостаточности снизились незначительно.
Микроциркуляторные исходы включали в себя 158 новых или ухудшившихся случаев нефропатии. Относительный риск в отношении времени до возникновения нефропатии (новые случаи развития персистирующей макроальбуминурии, персистирующее удвоение сывороточной концентрации креатинина, необходимость в постоянной заместительной почечной терапии и смерть по причине болезни почек) составил 0,64.
В дополнение к стандартной терапии СС заболеваний терапия препаратом Оземпик® в дозах 0,5 мг и 1 мг по сравнению с плацебо 0,5 мг и 1 мг в течение 104 недель привела к значительному и устойчивому снижению от исходных значений показателя HbA1с (-1,1% и -1,4% против -0,4% и -0,4%, соответственно).
Артериальное давление
Наблюдалось значительное снижение среднего систолического АД при применении препарата Оземпик® 0,5 мг (3,5-5,1 мм рт.ст.) и Оземпик® 1 мг (5,4-7,3 мм рт.ст.) в комбинации с ПГГП или базальным инсулином. Не отмечалось значительной разницы по показателям диастолического АД между препаратом Оземпик® и препаратами сравнения.
Фармакокинетика
Препарат подходит для введения 1 раз в неделю, так как период полувыведения семаглутида равен приблизительно 1 неделе.
Абсорбция
Время достижения максимальной концентрации (Сmax) в плазме составило от 1 до 3 дней после введения дозы препарата.
Равновесная концентрация препарата (AUCτ/24) достигалась спустя 4-5 недель однократного еженедельного применения препарата. После п/к введения семаглутида в дозах 0,5 мг и 1 мг средние показатели его равновесной концентрации у пациентов с СД2 составили около 16 нмоль/л и 30 нмоль/л, соответственно.
Экспозиция для доз семаглутида 0,5 мг и 1 мг увеличивается пропорционально введённой дозе.
При п/к введении семаглутида в переднюю брюшную стенку, бедро или плечо достигается сходная экспозиция.
Абсолютная биодоступность семаглутида после п/к введения составила 89%.
Распределение
Средний объём распределения семаглутида в тканях после п/к введения пациентам с СД2 составил приблизительно 12,5 л. Семаглутид в значительной степени связывался с альбумином плазмы крови (>99%).
Метаболизм
Семаглутид метаболизируется посредством протеолитического расщепления пептидной основы белка и последующего бета-окисления жирной кислоты боковой цепи.
Выведение
Желудочно-кишечный тракт (ЖКТ) и почки являются основными путями выведения семаглутида и его метаболитов, 2/3 введённой дозы семаглутида выводится почками, 1/3 – через кишечник.
Приблизительно 3% от введённой дозы выводится почками в виде неизменённого семаглутида.
У пациентов с СД2 клиренс семаглутида составил около 0,05 л/ч. С элиминационным периодом полувыведения примерно 1 неделя семаглутид будет присутствовать в общем кровотоке в течение приблизительно 5 недель после введения последней дозы препарата.
Особые группы пациентов
Не требуется коррекции дозы семаглутида в зависимости от возраста, пола, расовой и этнической принадлежности, массы тела, наличия почечной или печёночной недостаточности.
Возраст
На основании данных, полученных в ходе КИ 3а фазы, включавших пациентов в возрасте от 20 до 86 лет, показано, что возраст не влиял на фармакокинетику семаглутида.
Пол
Пол не влиял на фармакокинетику семаглутида.
Раса
Расовая группа (белая, чёрная или афроамериканская, азиатская) не влияла на фармакокинетику семаглутида.
Этническая принадлежность
Этническая принадлежность (латиноамериканская) не влияла на фармакокинетику семаглутида.
Масса тела
Масса тела влияла на экспозицию семаглутида. Более высокая масса тела приводит к более низкой экспозиции. Дозы семаглутида равные 0,5 мг и 1 мг обеспечивают достаточную экспозицию препарата в диапазоне массы тела от 40 до 198 кг.
Почечная недостаточность
Почечная недостаточность не оказала клинически значимого эффекта на фармакокинетику семаглутида. Это было показано у пациентов с различной степенью почечной недостаточности (лёгкой, средней, тяжёлой или у пациентов, находящихся на диализе) по сравнению с пациентами с нормальной функцией почек в исследовании однократной дозы семаглутида равной 0,5 мг. Это также было показано на основании данных КИ 3а фазы для пациентов с СД2 и почечной недостаточностью, хотя опыт применения у пациентов с терминальной стадией заболевания почек был ограничен.
Печёночная недостаточность
Печёночная недостаточность не влияла на экспозицию семаглутида. Фармакокинетические свойства семаглутида оценивались в ходе исследования однократной дозы семаглутида равной 0,5 мг у пациентов с различной степенью печёночной недостаточности (лёгкой, средней, тяжёлой) по сравнению с пациентами с нормальной функцией печени.
Дети и подростки
Исследований семаглутида у детей и подростков до 18 лет не проводили.
Показания к применению
Препарат Оземпик® показан для применения у взрослых пациентов с сахарным диабетом 2 типа на фоне диеты и физических упражнений для улучшения гликемического контроля в качестве:
• монотерапии;
• комбинированной терапии с другими пероральными гипогликемическими препаратами (ПГГП) – метформином, метформином и производным сульфонилмочевины, метформином и/или тиазолидиндионом, у пациентов, не достигших адекватного гликемического контроля при проведении предшествующей терапии;
• комбинированной терапии с инсулином у пациентов, не достигших адекватного гликемического контроля на терапии препаратом Оземпик® и метформином.
Препарат Оземпик® показан для снижения риска развития больших сердечно-сосудистых событий* у пациентов с сахарным диабетом 2 типа и высоким сердечно-сосудистым риском в качестве дополнения к стандартному лечению сердечно-сосудистых заболеваний (на основании анализа времени наступления первого большого сердечно-сосудистого события – см. раздел «Фармакологические свойства», подраздел «Оценка влияния на ССС»).
* большие сердечно-сосудистые события включают: смерть по причине сердечно-сосудистой патологии, инфаркт миокарда без смертельного исхода, инсульт без смертельного исхода.
Противопоказания
- Гиперчувствительность к семаглутиду или любому из вспомогательных веществ препарата;
- медуллярный рак щитовидной железы в анамнезе, в том числе в семейном;
- множественная эндокринная неоплазия (МЭН) 2 типа;
- сахарный диабет 1 типа (СД 1); диабетический кетоацидоз.
Противопоказано применение препарата Оземпик® у следующих групп пациентов и при следующих состояниях/заболеваниях в связи с отсутствием данных по эффективности и безопасности иди ограниченным опытом применения:
- беременность и период грудного вскармливания:
- возраст до 18 лет;
- печёночная недостаточность тяжёлой степени;
- терминальная стадия почечной недостаточности (клиренс креатинина (КК) <15 мл/мин);
- хроническая сердечная недостаточность (ХСН) IV функционального класса (в соответствии с классификацией NYHA (Нью-Йоркская кардиологическая ассоциация)).
С осторожностью
Препарат Оземпик® рекомендуется применять с осторожностью у пациентов с почечной недостаточностью и у пациентов с наличием панкреатита в анамнезе (см. раздел «Особые указания»).
Применение при беременности и в период грудного вскармливания
Беременность
Исследования на животных продемонстрировали репродуктивную токсичность препарата (см. раздел «Доклинические данные по безопасности»).
Данные по применению семаглутида у беременных женщин ограничены. Противопоказано применять семаглутид во время беременности. Женщинам с сохранённым репродуктивным потенциалом рекомендуется использовать контрацепцию во время терапии семаглутидом. Если пациентка готовится к беременности, либо беременность уже наступила, терапию семаглутидом необходимо прекратить. Из-за длительного периода полувыведения терапию семаглутидом необходимо прекратить как минимум за 2 месяца до планируемого наступления беременности (см. раздел «Фармакокинетика»).
Период грудного вскармливания
У лактирующих крыс семаглутид проникал в молоко. Нельзя исключить риск для ребёнка, находящегося на грудном вскармливании. Противопоказано применять семаглутид в период грудного вскармливания.
Способ применения и дозы
Способ применения
Препарат Оземпик® применяют 1 раз в неделю в любое время, независимо от приёма пищи. Препарат Оземпик® вводят п/к в живот, бедро или плечо. Место инъекции может изменяться без коррекции дозы. Препарат Оземпик® нельзя вводить внутривенно и внутримышечно. Дальнейшая информация по способу применения содержится в разделе «Руководство по использованию».
При необходимости день еженедельного введения можно менять при условии, что интервал времени между двумя инъекциями составляет не менее 3-х дней (>72 часов).
Дозы
Начальная доза препарата Оземпик® составляет 0,25 мг 1 раз в неделю. После 4 недель применения дозу следует увеличить до 0,5 мг 1 раз в неделю. Для дальнейшего улучшения гликемического контроля после как минимум 4 недель применения препарата в дозе 0,5 мг 1 раз в неделю, дозу можно увеличить до 1 мг 1 раз в неделю.
Доза препарата Оземпик® 0,25 мг не является терапевтической.
Препарат Оземпик® может применяться в виде монотерапии или в комбинации с одним или более гипогликемическими препаратами (см. раздел «Клиническая эффективность и безопасность»).
При добавлении препарата Оземпик® к предшествующей терапии метформином и/или тиазолидиндионом терапию метформином и/или тиазолидиндионом можно продолжить в прежних дозах.
При добавлении препарата Оземпик® к проводимой терапии производным сульфонилмочевины или инсулином следует предусмотреть снижение дозы производного сульфонилмочевины или инсулина с целью снижения риска возникновения гипогликемий (см. раздел «Особые указания»).
Применение препарата Оземпик® не требует проведения самоконтроля концентрации глюкозы крови. При применении препарата Оземпик® в комбинации с производным сульфонилмочевины или инсулином, такой самоконтроль концентрации глюкозы крови может потребоваться для коррекции дозы производного сульфонилмочевины или инсулина.
Пропущенная доза
В случае пропуска дозы препарат Оземпик® следует ввести как можно быстрее в течение 5 дней с момента запланированного введения дозы. Если продолжительность пропуска составляет более 5 дней, пропущенную дозу не нужно вводить. Следующую дозу препарата Оземпик® следует ввести в обычный запланированный день. В каждом случае пациенты могут возобновить их обычный однократный еженедельный график введения.
Применение препарата в особых клинических группах пациентов
Пациенты пожилого возраста (≥65 лет)
Не требуется коррекции дозы в зависимости от возраста. Опыт применения семаглутида у пациентов в возрасте 75 лет и старше ограничен.
Пациенты с печёночной недостаточностью
Не требуется коррекции дозы у пациентов с печёночной недостаточностью (см. раздел «Фармакокинетика»). Опыт применения семаглутида у пациентов с печёночной недостаточностью тяжёлой степени ограничен; применение препарата Оземпик® у таких пациентов противопоказано.
Пациенты с почечной недостаточностью
Не требуется коррекции дозы у пациентов с почечной недостаточностью. Опыт применения препарата у пациентов с терминальной стадией почечной недостаточности отсутствует; применение препарата Оземпик® у таких пациентов противопоказано.
Дети и подростки
Применение препарата Оземпик® у детей и подростков в возрасте до 18 лет противопоказано в связи с отсутствием данных по безопасности и эффективности.
Побочное действие
Наиболее часто регистрируемыми нежелательными реакциями (HP) во время КИ являлись нарушения со стороны ЖКТ, включая тошноту, диарею и рвоту. В целом, данные реакции были лёгкой или средней степени тяжести и краткосрочными.
HP распределены по системно-органным классам в соответствии с MedDRA с указанием частоты их возникновения согласно рекомендациям ВОЗ: очень часто (≥1/10); часто (≥1/100 до <1/10); нечасто (≥1/1000 до <1/100); редко (≥1/10000 до <1/1000) и очень редко (<1/10000). В каждой группе частоты развития HP представлены по снижению степени серьёзности.
Таблица 1 HP, выявленные при проведении КИ 3 фазы
| Система органов MedDRA | Очень часто | Часто | Нечасто | Редко |
| Нарушения со стороны иммунной системы | Анафилактические реакции | |||
| Нарушения со стороны обмена веществ и питания | Гипогликемияa при совместном применении с инсулином или производным сульфонилмочевины | Гипогликемияa при совместном применении с другими ПГГП Снижение аппетита |
||
| Нарушения со стороны нервной системы | Головокружение | Дисгевзия | ||
| Нарушения со стороны органа зрения | Осложнения диабетической ретинопатииb | |||
| Нарушения со стороны сердца | Увеличение частоты сердечных сокращений (ЧСС) | |||
| Нарушения со стороны ЖКТ | Тошнота Диарея |
Рвота Боль в животе Вздутие живота Запор Диспепсия Гастрит Гастроэзофагеальная рефлюксная болезнь Отрыжка Метеоризм |
||
| Нарушения со стороны печени и желчевыводящих путей | Холелитиаз | |||
| Общие расстройства и нарушения в месте введения | Утомляемость | Реакции в месте введения | ||
| Лабораторные и инструментальные данные | Повышение активности липазы Повышение активности амилазы Снижение массы тела |
a Гипогликемия, определенная как тяжёлая (требующая помощи другого человека) или симптоматическая в сочетании с концентрацией глюкозы в плазме крови <3,1 ммоль/л
b Осложнения диабетической ретинопатии – это сочетание из: необходимости в фотокоагуляции сетчатки глаза, необходимости в интравитреальном введении препаратов, кровоизлияния в стекловидное тело, развития слепоты, связанной с СД.
Частота основана на исследовании СС исходов.
2-летнее исследование СС исходов и безопасности
В популяции пациентов с высоким риском развития СС заболеваний профиль HP был аналогичным таковому в других КИ 3а фазы (описаны в разделе «Клиническая эффективность и безопасность»).
Описание отдельных HP
Гипогликемия
Во время монотерапии препаратом Оземпик® не наблюдалось эпизодов тяжёлой гипогликемии. Гипогликемия тяжёлой степени, в основном, наблюдалась при применении препарата Оземпик® в комбинации с производным сульфонилмочевины или инсулином. Наблюдалось несколько эпизодов тяжёлой гипогликемии при применении препарата Оземпик® в комбинации с другими, за исключением производного сульфонилмочевины, ПГГП.
HP со стороны ЖКТ
Во время терапии препаратом Оземпик® в дозах 0,5 мг и 1 мг у пациентов отмечалась тошнота, диарея и рвота. Большинство реакций были от лёгкой до средней степени тяжести и краткосрочными. HP стали причиной преждевременного выбывания из КИ 3,9% и 5,9% пациентов, соответственно. Чаще всего о HP сообщалось в первые месяцы терапии.
Осложнения диабетической ретинопатии
В 2-летнем КИ, в котором участвовали пациенты с СД2 и высоким СС риском, длительным течением СД и неадекватным контролем гликемии, подтверждённые случаи осложнений диабетической ретинопатии развивались у большего количества пациентов, получавших препарат Оземпик® (3,0%), по сравнению с пациентами, получавшими плацебо (1,8%). У пациентов с анамнезом диабетической ретинопатии в начале КИ возрастание абсолютного риска развития осложнений было выше. У пациентов с отсутствием подтверждённого анамнеза диабетической ретинопатии количество событий было одинаковым при применении препарата Оземпик® и плацебо.
В КИ продолжительностью до 1 года частота HP, связанных с диабетической ретинопатией, была одинаковой в группе препарата Оземпик® и препаратов сравнения.
Прекращение лечения по причине HP
Частота прекращения лечения по причине HP составила 8,7% для пациентов, получавших препарат Оземпик® 1 мг. Наиболее частыми HP, приводившими к прекращению лечения, были нарушения со стороны ЖКТ.
Реакции в месте введения
Сообщалось о реакциях в месте введения (таких как, сыпь в месте введения, покраснение) у 0,6 % и 0,5 % пациентов, получавших семаглутид 0,5 мг и 1 мг, соответственно. Эти реакции носили, как правило, лёгкий характер.
Иммуногенность
Вследствие потенциальных иммуногенных свойств белковых и пептидных лекарственных препаратов, у пациентов могут появиться антитела к семаглутиду после терапии препаратом Оземпик®. В конце КИ доля пациентов, у которых были обнаружены антитела к семаглутиду в любой момент времени, была низкой (1-2%) и ни у одного пациента не было обнаружено нейтрализующих антител к семаглутиду или антител с нейтрализующим эндогенный ГПП-1 эффектом.
Передозировка
В ходе КИ сообщалось о передозировках до 4 мг в однократной дозе и до 4 мг в неделю. Наиболее частой HP, о которой сообщалось, была тошнота. Все пациенты выздоровели без осложнений.
Специфического антидота при передозировке препарата Оземпик® не существует. В случае передозировки рекомендуется проведение соответствующей симптоматической терапии. Учитывая длительный период выведения препарата (примерно 1 неделя), может потребоваться продолжительный период наблюдения и лечения симптомов передозировки.
Взаимодействие с другими лекарственными средствами
Исследования семаглутида in vitro показали очень небольшую вероятность ингибирования или индукции ферментов системы цитохрома Р450 (CYP) и ингибирования транспортёров лекарственных препаратов.
Задержка опорожнения желудка при применении семаглутида может оказывать влияние на всасывание сопутствующих пероральных лекарственных препаратов. Семаглутид следует применять с осторожностью у пациентов, получающих пероральные лекарственные препараты, для которых необходима быстрая абсорбция в ЖКТ.
Парацетамол
При оценке фармакокинетики парацетамола во время теста стандартизированного приёма пищи было выявлено, что семаглутид задерживает опорожнение желудка. При одновременном применении семаглутида в дозе 1 мг AUC0-60мин и Сmax парацетамола снизились на 27% и 23%, соответственно. Общая экспозиция парацетамола (AUC0-5ч) при этом не изменялась. При одновременном приёме семаглутида и парацетамола коррекция дозы последнего не требуется.
Пероральные гормональные контрацептивные средства
Не предполагается, что семаглутид снижает эффективность пероральных гормональных контрацептивных средств. При одновременном применении комбинированного перорального гормонального контрацептивного препарата (0,03 мг этинилэстрадиола/0,15 мг левоноргестрела) и семаглутида последний не оказывал клинически значимого влияния на общую экспозицию этинилэстрадиола и левоноргестрела. Экспозиция этинилэстрадиола не была затронута; наблюдалось увеличение на 20% экспозиции левоноргестрела в равновесном состоянии. Сmax не изменилась ни для одного из компонентов.
Аторвастатин
Семаглутид не изменял системную экспозицию аторвастатина после применения однократной дозы аторвастатина (40 мг). Сmax аторвастатина снизилась на 38%. Это изменение было расценено как клинически незначимое.
Дигоксин
Семаглутид не изменял системную экспозицию или Сmax дигоксина после применения однократной дозы дигоксина (0,5 мг).
Метформин
Семаглутид не изменял системную экспозицию или Сmax метформина после применения метформина в дозе 500 мг 2 раза в день в течение 3,5 дней.
Варфарин
Семаглутид не изменял системную экспозицию или Сmax R- и S-изомеров варфарина после применения однократной дозы варфарина (25 мг). На основании определения международного нормализованного отношения (МНО) клинически значимых изменений фармакодинамических эффектов варфарина также не наблюдалось.
Несовместимость
Вещества, добавленные к препарату Оземпик®, могут вызвать деградацию семаглутида. Препарат Оземпик® нельзя смешивать с другими лекарственными средствами, в том числе с инфузионными растворами.
Особые указания
Применение препарата Оземпик® противопоказано у пациентов с СД1 или для лечения диабетического кетоацидоза.
Препарат Оземпик® не заменяет инсулин.
Реакции со стороны ЖКТ
Применение агонистов ГПП-1Р может быть ассоциировано с HP со стороны ЖКТ. Это следует учитывать при лечении пациентов с почечной недостаточностью, так как тошнота, рвота и диарея могут привести к дегидратации и ухудшению функции почек.
Острый панкреатит
При применении агонистов ГПП-1Р наблюдались случаи развития острого панкреатита. Пациенты должны быть проинформированы о характерных симптомах острого панкреатита. При подозрении на панкреатит терапия препаратом Оземпик® должна быть прекращена; в случае подтверждения острого панкреатита терапию препаратом Оземпик® возобновлять не следует. Следует соблюдать осторожность у пациентов с панкреатитом в анамнезе.
При отсутствии других признаков и симптомов острого панкреатита повышение активности ферментов поджелудочной железы не является прогностическим фактором развития острого панкреатита.
Гипогликемия
Пациенты, получающие препарат Оземпик® в комбинации с производным сульфонилмочевины или инсулином, могут иметь повышенный риск развития гипогликемии. В начале лечения препаратом Оземпик® риск развития гипогликемии можно снизить, уменьшив дозу производного сульфонилмочевины или инсулина.
Диабетическая ретинопатия
Наблюдалось повышение риска развития осложнений диабетической ретинопатии у пациентов с наличием диабетической ретинопатии, получающих терапию инсулином и семаглутидом (см. раздел «Побочное действие»). Следует соблюдать осторожность при применении семаглутида у пациентов с диабетической ретинопатией, получающих инсулинотерапию. Такие пациенты должны находиться под постоянным наблюдением и получать лечение в соответствии с клиническими рекомендациями. Быстрое улучшение гликемического контроля было ассоциировано с временным ухудшением состояния диабетической ретинопатии, однако при этом нельзя исключать и другие причины.
Сердечная недостаточность
Отсутствует опыт применения препарата Оземпик® у пациентов с ХСН IV функционального класса в соответствии с классификацией NYHA. Применение препарата у таких пациентов противопоказано.
Заболевания щитовидной железы
В пострегистрационном периоде применения другого аналога ГПП-1, лираглутида, были отмечены случаи медуллярного рака щитовидной железы (МРЩЖ). Имеющихся данных недостаточно для установления или исключения причинно-следственной связи возникновения МРЩЖ с применением аналогов ГПП-1. Необходимо проинформировать пациента о риске МРЩЖ и о симптомах опухоли щитовидной железы (появления уплотнения в области шеи, дисфагии, одышки, непроходящей охриплости голоса).
Значительное повышение концентрации кальцитонина в плазме крови может указывать на МРЖЩ (у пациентов с МРЖЩ значения концентрации кальцитонина в плазме крови обычно >50 нг/л). При выявлении повышения концентрации кальцитонина в плазме крови следует провести дальнейшее обследование пациента. Пациенты с узлами в щитовидной железе, выявленными при медицинском осмотре или при проведении УЗИ щитовидной железы, также должны быть дополнительно обследованы.
Применение семаглутида у пациентов с личным или семейным анамнезом МРЩЖ или с синдромом МЭН типа 2 противопоказано.
Доклинические данные по безопасности
Доклинические данные, основанные на исследованиях фармакологической безопасности, токсичности повторных доз и генотоксичности, не выявили какой-либо опасности для человека.
В 2-летних исследованиях канцерогенности у крыс и мышей при клинически значимых концентрациях семаглутид стал причиной развития опухолей С-клеток щитовидной железы без смертельного исхода. Опухоли С-клеток щитовидной железы без смертельного исхода, наблюдаемые у крыс, характерны для группы аналогов ГПП-1. Считается, что в отношении людей данный риск является низким, но не может быть полностью исключён.
Фертильность
Действие семаглутида на фертильность у людей неизвестно. Семаглутид не влиял на фертильность самцов крыс. Среди самок крыс увеличение эстрального цикла и незначительное снижение количества овуляций наблюдалось при дозах, сопровождавшихся снижением массы тела самки.
Влияние на способность управлять транспортными средствами и работу с механизмами
Препарат Оземпик® не влияет или незначительно влияет на способность управлять транспортными средствами или работу с механизмами. Пациенты должны быть предупреждены о том, что им следует соблюдать меры предосторожности во избежание развития у них гипогликемии во время управления транспортными средствами и при работе с механизмами, особенно при применении препарата Оземпик® в комбинации с производным сульфонилмочевины или инсулином.
Руководство по использованию
Предварительно заполненная шприц-ручка Оземпик® поставляется в двух видах:
Оземпик® 0,25 мг/доза или 0,5 мг/доза раствор для подкожного введения в предварительно заполненной шприц-ручке позволяет вводить дозы 0,25 мг или 0,5 мг. Данная шприц-ручка предназначена для повышения дозы и поддержания терапевтической дозы 0,5 мг. Одна шприц-ручка содержит 1,5 мл раствора.
Оземпик® 1 мг/доза раствор для подкожного введения в предварительно заполненной шприц-ручке позволяет вводить дозы только 1 мг. Данная шприц-ручка предназначена только для поддержания терапевтической дозы 1 мг. Одна шприц-ручка содержит 3 мл раствора.
В упаковку препарата Оземпик® включены иглы НовоФайн® Плюс.
Пациенту следует рекомендовать выбрасывать инъекционную иглу после каждой инъекции в соответствии с местными требованиями.
Шприц-ручка Оземпик® предназначена только для индивидуального использования. Препарат Оземпик® нельзя применять, если он выглядит иначе, чем прозрачный бесцветный или почти бесцветный раствор.
Препарат Оземпик® нельзя применять, если он был заморожен.
Препарат Оземпик® можно вводить при помощи игл длиной до 8 мм. Шприц-ручка предназначена для использования с одноразовыми инъекционными иглами НовоФайн®.
Всегда после каждой инъекции удаляйте иглу и храните шприц-ручку Оземпик® с отсоединённой иглой. Это поможет предотвратить закупорку игл, загрязнение, заражение, вытекание раствора и введение неправильной дозы препарата.
Форма выпуска
Раствор для подкожного введения, 1,34 мг/мл.
1) Шприц-ручка Оземпик® 0,25 мг/доза или 0,5 мг/доза.
По 1,5 мл препарата в картриджи из стекла, укупоренные поршнями из хлорбутиловой резины с одной стороны и алюминиевыми колпачками с дисками из бромбутиловой резины/полиизопрена, с другой стороны. Картридж встроен в мультидозовую одноразовую шприц-ручку для многократных инъекций из полипропилена, полиоксиметилена, поликарбоната и акрилонитрил бутадиен стирола. 1 шприц-ручка вместе с инструкцией по применению и 6 одноразовыми иглами НовоФайн® Плюс в картонную пачку.
2) Шприц-ручка Оземпик® 1 мг/доза.
По 3 мл препарата в картриджи из стекла, укупоренные поршнями из хлорбутиловой резины с одной стороны и алюминиевыми колпачками с дисками из бромбутиловой резины/полиизопрена, с другой стороны. Картридж встроен в мультидозовую одноразовую шприц-ручку для многократных инъекций из полипропилена, полиоксиметилена, поликарбоната и акрилонитрил бутадиен стирола. 1 шприц-ручка вместе с инструкцией по применению и 4 одноразовыми иглами НовоФайн® Плюс в картонную пачку.
Срок годности
3 года. Не применять по истечении срока, указанного на этикетке шприц-ручки и упаковке.
Условия хранения
Хранить при температуре от 2 °С до 8 °С (в холодильнике), но не рядом с морозильной камерой. Защищать от света. Не замораживать.
Используемую или переносимую в качестве запасной шприц-ручку с препаратом хранить при температуре не выше 30 °С или при температуре от 2 °С до 8 °С (в холодильнике) в течение 6 недель. Не замораживать. После использования закрывать шприц-ручку колпачком для защиты от света.
Препарат Оземпик® следует предохранять от воздействия избыточного тепла и света. Хранить в недоступном для детей месте.
Условия отпуска
Отпускают по рецепту.
Производитель и владелец регистрационного удостоверения:
Ново Нордиск А/С, Ново Алле, DK-2880 Багсваерд, Дания
Производство готовой лекарственной формы:
Ново Нордиск А/С, Ново Алле, DK-2880 Багсваерд, Дания
Первичная упаковка:
Ново Нордиск А/С, Ново Алле, DK-2880 Багсваерд, Дания
Вторичная/потребительская упаковка:
Ново Нордиск А/С, Бреннум Парк, DK-3400 Хиллерод, Дания
Производитель (Выпускающий контроль качества):
Ново Нордиск А/С, Ново Алле, DK-2880 Багсваерд, Дания
Организация, принимающая претензии от потребителей:
ООО «Ново Нордиск», 121614, Москва, ул. Крылатская, д. 15, офис 41
Оземпик® и НовоФайн® – зарегистрированные торговые марки, принадлежащие компании Ново Нордиск А/С, Дания
Инструкция для пациентов по применению препарата Оземпик® 0,25 мг/доза или 0,5 мг/доза раствор для подкожного введения в предварительно заполненной шприц-ручке.
Внимательно прочитайте данную инструкцию перед применением предварительно заполненной шприц-ручки Оземпик®.
Используйте шприц-ручку только после того, как Вы научитесь ею пользоваться под руководством врача или медсестры.
Начните с проверки шприц-ручки, чтобы убедиться, что в ней содержится препарат Оземпик® 0,25 мг/доза или 0,5 мг/доза, затем посмотрите на представленные ниже иллюстрации, чтобы ознакомиться с различными частями шприц-ручки и иглы.
Если Вы слабовидящий или у Вас имеются серьёзные проблемы со зрением, и Вы не можете различить цифры на счётчике дозы, не используйте шприц-ручку без посторонней помощи. Помочь вам может человек с хорошим зрением, обученный использованию предварительно заполненной шприц-ручки с препаратом Оземпик®.
Данная шприц-ручка является предварительно заполненной шприц-ручкой. Она содержит 2 мг семаглутида и позволяет выбрать дозы 0,25 мг или 0,5 мг. Шприц-ручка разработана для использования с одноразовыми иглами НовоФайн® длиной до 8 мм.
Иглы НовоФайн® Плюс включены в упаковку.
Важная информация


- Подготовка шприц-ручки с новой иглой к использованию
- Проверьте название и цветовой код на этикетке шприц-ручки, чтобы убедиться, что в ней содержится препарат Оземпик® 0,25 мг/доза или 0,5 мг/доза. Это особенно важно, если Вы применяете более одного инъекционного препарата.
- Снимите колпачок со шприц-ручки (рис. А).
- Убедитесь, что раствор в шприц-ручке прозрачный и бесцветный (рис. В).
Посмотрите в окошко шприц-ручки. Если раствор мутный и не бесцветный, не используйте шприц ручку. - Возьмите новую иглу и удалите защитную наклейку (рис. С).
Если защитная наклейка повреждена, не используйте иглу, так как в этом случае стерильность не гарантируется. - Наденьте иглу на шприц-ручку и поверните её, чтобы игла плотно держалась на шприц-ручке (рис. D).
- Снимите наружный колпачок иглы, но не выбрасывайте его (рис. Е). Он понадобится Вам после завершения инъекции, чтобы безопасно снять иглу со шприц-ручки.
- Снимите и выбросьте внутренний колпачок иглы (рис. F). Если Вы попытаетесь надеть внутренний колпачок обратно на иглу, Вы можете случайно уколоться иглой. На конце иглы может появиться капля раствора. Это нормальное явление, однако. Вы всё равно должны проверить поступление препарата, если Вы используете новую шприц-ручку в первый раз.
Не присоединяйте новую иглу до тех пор, пока Вы не будете готовы сделать инъекцию.
Всегда для каждой инъекции используйте новую иглу.
Это может предотвратить закупорку игл, загрязнение, инфицирование и введение неправильной дозы препарата. Никогда не используйте иглу, если она погнута или повреждена. - Проверка поступления препарата
На конце иглы может оставаться маленькая капля, но она не будет введена при инъекции.
Если капля раствора на конце иглы не появилась, повторите операцию «2» «Проверка поступления препарата», но не более 6 раз. Если капля раствора так и не появилась, поменяйте иглу и повторите операцию «2» «Проверка поступления препарата» ещё раз.
Если капля раствора так и не появилась, утилизируйте шприц-ручку и используйте новую.Всегда перед использованием новой шприц-ручки в первый раз убедитесь в том, что на конце иглы появилась капля раствора. Это гарантирует поступление препарата.
Если капля раствора не появилась, препарат не будет введён, даже если счётчик дозы будет двигаться. Это может указывать на то, что игла закупорена или повреждена.
Если Вы не проверите поступление препарата перед первой инъекцией с помощью каждой новой шприц-ручки. Вы можете не ввести необходимую дозу и ожидаемый эффект препарата Оземпик® не будет достигнут. - Установка дозы
- Поворачивайте селектор дозы до тех пор, пока он не покажет необходимую Вам дозу (0,25 мг или 0,5 мг) (рис. А).
Если доза была выбрана неправильно, Вы можете поворачивать селектор дозы вперёд или назад, пока не будет установлена правильная доза.
Максимальная доза, которую можно установить, составляет 0,5 мг.
Селектор дозы изменяет дозу. Только счётчик дозы и указатель дозы покажут количество мг препарата в выбранной Вами дозе.
Вы можете выбрать до 0,5 мг препарата на дозу. Если в шприц-ручке содержится менее 0,5 мг, счётчик дозы остановится прежде, чем появится «0,5».
При каждом повороте селектора дозы раздаются щелчки, звук щелчков зависит от того, в какую сторону вращается селектор дозы: вперёд, назад или, если набранная доза превышает количество мг препарата, оставшихся в шприц-ручке. Не считайте щелчки шприц-ручки.
Всегда перед каждой инъекцией проверяйте какое количество мг препарата Вы набрали по счётчику дозы и указателю дозы.
Не считайте щелчки шприц-ручки.
С помощью селектора дозы нужно выбирать только дозы 0,25 мг или 0,5 мг.
Выбранная доза должна находится точно напротив указателя дозы – такое положение гарантирует, что Вы получите правильную дозу препарата. Сколько препарата осталось- Чтобы определить, сколько препарата осталось, используйте счётчик дозы (рис. А): Поворачивайте селектор дозы до остановки счётчика дозы.
Если он показывает «0,5», в шприц-ручке осталось не менее 0,5 мг препарата.
Если счётчик дозы остановился до того, как появилось «0,5», то это означает, что в шприц-ручке осталось недостаточное количество препарата, чтобы ввести полную дозу 0,5 мг.
Если в шприц-ручке осталось недостаточное количество препарата для введения полной дозы, не используйте шприц-ручку. Используйте новую шприц-ручку Оземпик®.
- Поворачивайте селектор дозы до тех пор, пока он не покажет необходимую Вам дозу (0,25 мг или 0,5 мг) (рис. А).
- Введение препарата
Всегда сверяйтесь с показаниями счётчика дозы, чтобы знать, какое количество мг препарата Вы ввели. Удерживайте пусковую кнопку до тех пор, пока счётчик дозы не покажет «0». Как выявить закупорку или повреждение иглы
- Если после долгого нажатия на пусковую кнопку на счётчике дозы не появляется «0», это может означать закупорку или повреждение иглы.
- В этом случае Вы не получили препарат, даже если счётчик дозы изменил положение с исходной дозы, которую Вы установили.
Что делать с закупоренной иглой
Замените иглу как описано в операции 5 «После завершения инъекции» и повторите все шаги, начиная с операции 1 «Подготовка шприц-ручки с новой иглой к использованию». Убедитесь, что установили полную необходимую Вам дозу.
Никогда не дотрагивайтесь до счётчика дозы во время введения препарата. Это может прервать иъекцию. - После завершения инъекции
Всегда после каждой инъекции выбрасывайте иглу, чтобы обеспечить комфортную инъекцию и избежать закупорки игл. Если игла закупорена, Вы не введёте себе препарат. Выбрасывайте пустую шприц-ручку с отсоединённой иглой в соответствии с рекомендациями данными врачом, медсестрой, фармацевтом или в соответствии с местными требованиями.Никогда не пытайтесь надеть внутренний колпачок обратно на иглу. Вы можете уколоться.
После каждой инъекции всегда сразу удаляйте иглу со шприц-ручки.
Это может предотвратить закупорку игл, загрязнение, инфицирование, вытекание раствора и введение неправильной дозы препарата. Дополнительная важная информация- Всегда храните шприц-ручку и иглы к ней в недоступном для всех, и в особенности для детей, месте.
- Никогда не передавайте свою шприц-ручку и иглы к ней другим лицам.
- Лица, осуществляющие уход за больным, должны обращаться с использованными иглами с особой осторожностью, чтобы предотвратить уколы иглой и перекрёстное инфицирование.
Уход за шприц-ручкой
Аккуратно обращайтесь со шприц-ручкой. Небрежное обращение или неправильное использование могут привести к введению неправильной дозы препарата, следствием чего могут стать высокая концентрация глюкозы крови или дискомфорт в области живота (тошнота или рвота).
- Не оставляйте шприц-ручку в автомобиле или любом другом месте, где она может подвергаться воздействию слишком высоких или слишком низких температур.
- Не применяйте препарат Оземпик®, если он был заморожен. В этом случае концентрация глюкозы крови может стать слишком высокой или Вы можете почувствовать дискомфорт в области живота такой, как тошнота или рвота.
- Не применяйте препарат Оземпик®, если он подвергся воздействию прямых солнечных лучей. В этом случае концентрация глюкозы крови может стать слишком высокой.
- Предохраняйте шприц-ручку от попадания на неё пыли, загрязнений и жидкости.
- Не мойте шприц-ручку, не погружайте её в жидкость и не смазывайте её. При необходимости шприц-ручку можно очищать влажной тканью, смоченной мягким моющим средством.
- Нельзя ронять или ударять шприц-ручку о твёрдую поверхность. Если Вы уронили шприц-ручку или сомневаетесь в её исправности, присоедините новую иглу и проверьте поступление препарата перед тем, как сделать инъекцию.
- Не пытайтесь повторно заполнить шприц-ручку Пустую шприц-ручку необходимо выбросить.
- Не пытайтесь самостоятельно починить шприц-ручку или разобрать её на части.
Инструкция для пациентов по применению препарата Оземпик® 1 мг/доза раствор для подкожного введения в предварительно заполненной шприц-ручке.
Внимательно прочитайте данную инструкцию перед применением предварительно заполненной шприц-ручки Оземпик®.
Используйте шприц-ручку только после того, как Вы научитесь ею пользоваться под руководством врача или медсестры.
Начните с проверки шприц-ручки, чтобы убедиться, что в ней содержится препарат Оземпик® 1 мг/доза, затем посмотрите на представленные ниже иллюстрации, чтобы ознакомиться с различными частями шприц-ручки и иглы.
Если Вы слабовидящий или у Вас имеются серьёзные проблемы со зрением, и Вы не можете различить цифры на счётчике дозы, не используйте шприц-ручку без посторонней помощи. Помочь вам может человек с хорошим зрением, обученный использованию предварительно заполненной шприц-ручки с препаратом Оземпик®.
Данная шприц-ручка является предварительно заполненной шприц-ручкой. Она содержит 4 мг семаглутида и позволяет выбрать только дозу 1 мг. Шприц-ручка разработана для использования с одноразовыми иглами НовоФайн® длиной до 8 мм.
Иглы НовоФайн® Плюс включены в упаковку. 
Обратите особое внимание на информацию, отмеченную такими значками, это очень важно для безопасного использования шприц-ручки.
- Подготовка шприц-ручки с новой иглой к использованию
- Проверьте название и цветовой код на этикетке шприц-ручки, чтобы убедиться, что в ней содержится препарат Оземпик® 1 мг/доза. Это особенно важно, если Вы применяете более одного инъекционного препарата.
Снимите колпачок со шприц-ручки (рис. А). - Убедитесь, что раствор в шприц-ручке прозрачный и бесцветный (рис. В).
Посмотрите в окошко шприц-ручки. Если раствор мутный и не бесцветный, не используйте шприц ручку. - Возьмите новую иглу и удалите защитную наклейку (рис. С).
Если защитная наклейка повреждена, не используйте иглу, так как в этом случае стерильность не гарантируется. - Наденьте иглу на шприц-ручку и поверните её, чтобы игла плотно держалась на шприц-ручке (рис. D).
- Снимите наружный колпачок иглы, но не выбрасывайте его (рис. Е). Он понадобится Вам после завершения инъекции, чтобы безопасно снять иглу со шприц-ручки.
- Снимите и выбросьте внутренний колпачок иглы (рис. F). Если Вы попытаетесь надеть внутренний колпачок обратно на иглу, Вы можете случайно уколоться иглой.
На конце иглы может появиться капля раствора. Это нормальное явление, однако. Вы всё равно должны проверить поступление препарата, если Вы используете новую шприц-ручку в первый раз.
Не присоединяйте новую иглу до тех пор, пока Вы не будете готовы сделать инъекцию.
Всегда для каждой инъекции используйте новую иглу.
Это может предотвратить закупорку игл, загрязнение, инфицирование и введение неправильной дозы препарата.
Никогда не используйте иглу, если она погнута или повреждена. - Проверьте название и цветовой код на этикетке шприц-ручки, чтобы убедиться, что в ней содержится препарат Оземпик® 1 мг/доза. Это особенно важно, если Вы применяете более одного инъекционного препарата.
- Проверка поступления препарата
Всегда перед использованием новой шприц-ручки в первый раз убедитесь в том, что на конце иглы появилась капля раствора. Это гарантирует поступление препарата.
Если капля раствора не появилась, препарат не будет введён, даже если счётчик дозы будет двигаться. Это может указывать на то, что игла закупорена или повреждена.
Если Вы не проверите поступление препарата перед первой инъекцией с помощью каждой новой шприц-ручки, Вы можете не ввести необходимую дозу и ожидаемый эффект препарата Оземпик® не будет достигнут. - Установка дозы
- Поверните селектор дозы, чтобы выбрать дозу 1 мг (рис. А).
Продолжайте поворачивать до тех пор, пока счётчик дозы не остановится и не покажет «1».
Только счётчик дозы и указатель дозы покажут, что был выбран 1 мг.
Вы можете выбрать только 1 мг препарата на дозу. Если в шприц-ручке содержится менее 1 мг, счётчик дозы остановится прежде, чем появится «1».
При каждом повороте селектора дозы раздаются щелчки, звук щелчков зависит от того, в какую сторону вращается селектор дозы: вперёд, назад или, если Вы пытаетесь набрать дозу больше 1 мг. Не считайте щелчки шприц-ручки.
Всегда перед каждой инъекцией но счётчику дозы и указателю дозы проверяйте, что был набран 1 мг.
Не считайте щелчки шприц-ручки.
С помощью селектора дозы нужно выбирать только дозу 1 мг. Доза 1 мг должна находится точно напротив указателя дозы – такое положение гарантирует, что Вы получите правильную дозу препарата.Сколько препарата осталось
- Чтобы определить, сколько препарата осталось, используйте счётчик дозы (рис. А): Поворачивайте селектор дозы до остановки счётчика дозы.
Если он показывает «1», в шприц-ручке осталось не менее 1 мг препарата. Если счётчик дозы остановился до того, как появилась цифра «1», то это означает, что в шприц-ручке осталось недостаточное количество препарата, чтобы ввести полную дозу 1 мг.
Если в шприц-ручке осталось недостаточное количество препарата для введения полной дозы, не используйте шприц-ручку. Используйте новую шприц-ручку Оземпик®.
- Поверните селектор дозы, чтобы выбрать дозу 1 мг (рис. А).
- Введение препарата
- Введите иглу под кожу, используя технику инъекций, рекомендованную врачом или медсестрой (рис. А).
- Убедитесь, что счётчик дозы находится в поле Вашего зрения. Не дотрагивайтесь до счётчика дозы пальцами – это может прервать инъекцию.
- Нажмите пусковую кнопку до упора и удерживайте её в этом положении, пока счётчик дозы не покажет «0» (рис. В). «0» должен находится точно напротив указателя дозы. При этом Вы можете услышать или ощутить щелчок.
- Удерживайте иглу под кожей, после того, как счётчик дозы вернулся к «0» и медленно считайте до 6 (рис. С).
- Если Вы извлечёте иглу из-под кожи раньше, Вы можете увидеть, как препарат вытекает из иглы. В этом случае будет введена неполная доза препарата.
- Извлеките иглу из-под кожи (рис. D). Если в месте инъекции появилась кровь, слегка прижмите к месту укола ватный тампон. Не массируйте место укола.
После завершения инъекции Вы можете увидеть каплю раствора на конце иглы. Это нормально и не влияет на дозу препарата, которую Вы ввели.
Всегда сверяйтесь с показаниями счётчика дозы, чтобы знать, какое количество мг препарата Вы ввели. Удерживайте пусковую кнопку до тех пор, пока счётчик дозы не покажет «0». Как выявить закупорку или повреждение иглы
- Если после долгого нажатия на пусковую кнопку на счётчике дозы не появляется «0», это может означать закупорку или повреждение иглы.
- В этом случае Вы не получили препарат, даже если счётчик дозы изменил положение с исходной дозы, которую Вы установили.
Что делать с закупоренной иглой
Замените иглу как описано в операции 5 «После завершения инъекции» и повторите все шаги, начиная с операции 1 «Подготовка шприц-ручки с новой иглой к использованию». Убедитесь, что установили полную необходимую Вам дозу.
Никогда не дотрагивайтесь до счётчика дозы во время введения препарата. Это может прервать иъекцию. - После завершения инъекции
Никогда не пытайтесь надеть внутренний колпачок обратно на иглу. Вы можете уколоться.
После каждой инъекции всегда сразу удаляйте иглу со шприц-ручки.
Это может предотвратить закупорку игл, загрязнение, инфицирование, вытекание раствора и введение неправильной дозы препарата.
Дополнительная важная информация- Всегда храните шприц-ручку и иглы к ней в недоступном для всех, и в особенности для детей, месте.
- Никогда не передавайте свою шприц-ручку и иглы к ней другим лицам.
- Лица, осуществляющие уход за больным, должны обращаться с использованными иглами с особой осторожностью, чтобы предотвратить уколы иглой и перекрёстное инфицирование.
Уход за шприц-ручкой
Аккуратно обращайтесь со шприц-ручкой. Небрежное обращение или неправильное использование могут привести к введению неправильной дозы препарата, следствием чего могут стать высокая концентрация глюкозы крови или дискомфорт в области живота (тошнота или рвота).
- Не оставляйте шприц-ручку в автомобиле или любом другом месте, где она может подвергаться воздействию слишком высоких или слишком низких температур.
- Не применяйте препарат Оземпик®, если он был заморожен. В этом случае концентрация глюкозы крови может стать слишком высокой или Вы можете почувствовать дискомфорт в области живота такой, как тошнота или рвота.
- Не применяйте препарат Оземпик®, если он подвергся воздействию прямых солнечных лучей. В этом случае концентрация глюкозы крови может стать слишком высокой.
- Предохраняйте шприц-ручку от попадания на неё пыли, загрязнений и жидкости.
- Не мойте шприц-ручку, не погружайте её в жидкость и не смазывайте её. При необходимости шприц-ручку можно очищать влажной тканью, смоченной мягким моющим средством.
- Нельзя ронять или ударять шприц-ручку о твёрдую поверхность. Если Вы уронили шприц-ручку или сомневаетесь в её исправности, присоедините новую иглу и проверьте поступление препарата перед тем, как сделать инъекцию.
- Не пытайтесь повторно заполнить шприц-ручку. Пустую шприц-ручку необходимо выбросить.
- Не пытайтесь самостоятельно починить шприц-ручку или разобрать её на части.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Оземпик® (Ozempic®) инструкция по применению
📜 Инструкция по применению Оземпик®
💊 Состав препарата Оземпик®
✅ Применение препарата Оземпик®
📅 Условия хранения Оземпик®
⏳ Срок годности Оземпик®
Описание лекарственного препарата
Оземпик®
(Ozempic®)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2022 года.
Дата обновления: 2022.06.08
Владелец регистрационного удостоверения:
Контакты для обращений:
НОВО НОРДИСК ООО
(Россия)
Код ATX:
A10BJ06
(Семаглутид)
Лекарственная форма
| Оземпик® |
Р-р д/п/к введения 1.34 мг/1 мл: картридж в шприц-ручке 1.5 мл (0.25 мг/доза или 0.5 мг/доза) и 3 мл (1 мг/доза) рег. №: ЛП-005726 |
Форма выпуска, упаковка и состав
препарата Оземпик®
Раствор для п/к введения бесцветный или почти бесцветный, прозрачный.
Вспомогательные вещества: динатрия гидрофосфата дигидрат, пропиленгликоль, фенол, хлористоводородная кислота (для коррекции pH), натрия гидроксид (для коррекции pH), вода д/и.
1.5 мл (0.25 мг/доза или 0.5 мг/доза) — картриджи стеклянные (1) — шприц-ручки одноразовые пластиковые (1) для многократных инъекций в комплекте с 6 одноразовыми иглами НовоФайн® Плюс — пачки картонные.
3 мл (1 мг/доза) — картриджи стеклянные (1) — шприц-ручки одноразовые пластиковые (1) для многократных инъекций в комплекте с 4 одноразовыми иглами НовоФайн® Плюс — пачки картонные.
Фармакологическое действие
Семаглутид является агонистом рецепторов ГПП-1 (ГПП-1Р), произведенным методом биотехнологии рекомбинантной ДНК с использованием штамма Saccharomyces cerevisiae с последующей очисткой.
Семаглутид представляет собой аналог ГПП-1, имеющий 94% гомологичности с человеческим ГПП-1. Семаглутид действует как агонист ГПП-1Р, который селективно связывается и активирует ГПП-1Р. ГПП-1Р служит мишенью для нативного ГПП-1.
ГПП-1 является физиологическим гормоном, оказывающим сразу несколько эффектов на регуляцию концентрации глюкозы и аппетит, а также на сердечно-сосудистую систему. Влияние на концентрацию глюкозы и аппетит специфически опосредовано ГПП-1Р, расположенными в поджелудочной железе и головном мозге. Фармакологические концентрации семаглутида снижают концентрацию глюкозы крови и массу тела посредством сочетания эффектов, описанных ниже. ГПП-1Р представлены также в специфических областях сердца, сосудов, иммунной системы и почек, где их активация может оказывать сердечно-сосудистые и микроциркуляторные эффекты.
В отличие от нативного ГПП-1, продленный Т1/2 семаглутида (около 1 недели) позволяет применять его п/к 1 раз в неделю. Связывание с альбумином является основным механизмом длительного действия семаглутида, что приводит к снижению выведения его почками и защищает от метаболического распада. Кроме того, семаглутид стабилен в отношении расщепления ферментом дипептидилпептидазой-4.
Семаглутид снижает концентрацию глюкозы крови посредством глюкозозависимых стимуляции секреции инсулина и подавления секреции глюкагона. Таким образом, при повышении концентрации глюкозы крови происходит стимуляция секреции инсулина и подавление секреции глюкагона. Механизм снижения уровня гликемии включает также небольшую задержку опорожнения желудка в ранней постпрандиальной фазе. Во время гипогликемии семаглутид уменьшает секрецию инсулина и не снижает секрецию глюкагона.
Семаглутид снижает общую массу тела и массу жировой ткани, уменьшая потребление энергии. Данный механизм затрагивает общее снижение аппетита, включая усиление сигналов насыщения и ослабление сигналов голода, а также улучшение контроля потребления пищи и снижение тяги к пище. Снижается также инсулинорезистентность, возможно, за счет уменьшения массы тела. Помимо этого, семаглутид снижает предпочтение к приему пищи с высоким содержанием жиров. В исследованиях на животных было показано, что семаглутид поглощается специфическими областями головного мозга и усиливает ключевые сигналы насыщения и ослабляет ключевые сигналы голода. Воздействуя на изолированные участки тканей головного мозга, семаглутид активирует нейроны, связанные с чувством сытости, и подавляет нейроны, связанные с чувством голода.
В клинических исследованиях семаглутид оказывал положительное влияние на липиды плазмы крови, снижал систолическое АД и уменьшал воспаление.
В исследованиях на животных семаглутид подавляет развитие атеросклероза, предупреждая дальнейшее развитие аортальных бляшек и уменьшая воспаление в бляшках.
Фармакодинамика
Все фармакодинамические исследования были проведены после 12 недель терапии (включая период увеличения дозы) в равновесной концентрации семаглутида 1 мг 1 раз в неделю.
Уровень гликемии натощак и постпрандиальный уровень гликемии
Семаглутид снижает концентрацию глюкозы натощак и концентрацию постпрандиальной глюкозы. По сравнению с плацебо терапия семаглутидом 1 мг у пациентов с сахарным диабетом 2 типа (СД2) привела к снижению концентрации глюкозы с точки зрения абсолютного изменения от исходного значения (ммоль/л) и относительного снижения по сравнению с плацебо (%) в отношении: концентрации глюкозы натощак (1.6 ммоль/л; 22%); концентрации глюкозы через 2 ч после приема пищи (4.1 ммоль/л; 37%); средней суточной концентрации глюкозы (1.7 ммоль/л; 22%) и постпрандиальных пиков концентрации глюкозы за 3 приема пищи (0.6-1.1 ммоль/л). Семаглутид снижал концентрацию глюкозы натощак после введения первой дозы.
Функция β-клеток поджелудочной железы и секреция инсулина
Семаглутид улучшает функцию β-клеток поджелудочной железы. После в/в струйного введения глюкозы пациентам с СД2 семаглутид по сравнению с плацебо улучшал первую и вторую фазу инсулинового ответа с трехкратным и двукратным повышением, соответственно, и увеличивал максимальную секреторную активность β-клеток поджелудочной железы после теста стимуляции аргинином. Кроме того, по сравнению с плацебо терапия семаглутидом увеличивает концентрации инсулина натощак.
Секреция глюкагона
Семаглутид снижает концентрацию глюкагона натощак и постпрандиальную концентрацию глюкагона. У пациентов с СД2 семаглутид приводит к относительному снижению концентрации глюкагона по сравнению с плацебо: концентрации глюкагона натощак (8-21%), постпрандиального глюкагонового ответа (14-15%) и средней суточной концентрации глюкагона (12%).
Глюкозозависимая секреция инсулина и глюкозозависимая секреция глюкагона
Семаглутид снижал высокую концентрацию глюкозы в крови, стимулируя секрецию инсулина и снижая секрецию глюкагона глюкозозависимым способом. Скорость секреции инсулина после введения семаглутида пациентам с СД2 была сопоставима с таковой у здоровых добровольцев.
Во время индуцированной гипогликемии семаглутид по сравнению с плацебо не изменял контррегуляторный ответ повышения концентрации глюкагона, а также не усугублял снижение концентрации С-пептида у пациентов с СД2.
Опорожнение желудка
Семаглутид вызывал небольшую задержку раннего постпрандиального опорожнения желудка, тем самым снижая скорость поступления постпрандиальной глюкозы в кровь.
Масса тела и состав тела
Наблюдалось большее снижение массы тела при применении семаглутида по сравнению с изученными препаратами сравнения (плацебо, ситаглиптином, эксенатидом замедленного высвобождения, дулаглутидом и инсулином гларгин) (см. раздел «Клиническая эффективность и безопасность»). Потеря массы тела при применении семаглутида происходила преимущественно за счет потери жировой ткани, превышающей потерю мышечной массы в 3 раза.
Аппетит, потребление калорий и выбор продуктов питания
По сравнению с плацебо семаглутид снизил потребление калорий на 18-35% во время трех последовательных приемов пищи ad libitum. Этому способствовали стимулированные семаглутидом подавление аппетита как натощак, так и после приема пищи, улучшенный контроль потребления пищи, ослабление тяги к еде, особенно с высоким содержанием жиров.
Липиды натощак и постпрандиальные липиды
По сравнению с плацебо семаглутид снижал концентрации триглицеридов и холестерина ЛПОНП натощак на 12% и 21%, соответственно. Постпрандиальное увеличение концентрации триглицеридов и холестерина ЛПОНП в ответ на прием пищи с высоким содержанием жиров снизилось более чем на 40%.
Электрофизиология сердца (ЭФс)
Действие семаглутида на процесс реполяризации в сердце было протестировано в исследовании ЭФс. Применение семаглутида в дозах, превышающих терапевтические (в равновесной концентрации до 1.5 мг), не приводило к удлинению скорректированного интервала QT.
Клиническая эффективность и безопасность
Как улучшение гликемического контроля, так и снижение сердечно-сосудистой заболеваемости и смертности являются неотъемлемой частью лечения СД2.
Эффективность и безопасность препарата Оземпик® в дозах 0.5 мг и 1 мг оценивались в шести рандомизированных контролируемых клинических исследованиях 3а фазы. Из них пять клинических исследований в качестве основной цели оценивали эффективность гликемического контроля, в то время как одно клиническое исследование оценивало в качестве основной цели сердечно-сосудистый исход. В дополнение были проведены два клинических исследования препарата Оземпик® 3 фазы с участием японских пациентов.
В дополнение было проведено исследование 3b фазы для сравнения эффективности и безопасности препарата Оземпик® в дозах 0.5 мг и 1 мг 1 раз в неделю с дулаглутидом 0.75 мг и 1.5 мг 1 раз в неделю соответственно. Также было проведено клиническое исследование 3b фазы с целью изучения эффективности и безопасности семаглутида в качестве дополнения к лечению ингибитором натрийзависимого переносчика глюкозы 2 типа (SGLT2).
Терапия препаратом Оземпик® продемонстрировала устойчивые, статистически превосходящие и клинически значимые улучшение показателя HbA1c и снижение массы тела на срок до 2 лет по сравнению с плацебо и лечение с активным контролем (ситаглиптином, инсулином гларгин, эксенатидом замедленного высвобождения и дулаглутидом).
Возраст, пол, раса, этническая принадлежность, исходные значения ИМТ и массы тела (кг), длительность сахарного диабета (СД) и почечная недостаточность не повлияли на эффективность препарата Оземпик®.
Монотерапия
Монотерапия препаратом Оземпик® в дозах 0.5 мг и 1 мг 1 раз в неделю в течение 30 недель по сравнению с плацебо привела к статистически более значимому снижению показателей HbA1c (-1.5%, -1.6% против 0% соответственно), глюкозы плазмы натощак (ГПН) (-2.5 ммоль/л, -2.3 ммоль/л против -0.6 ммоль/л соответственно) и массы тела (-3.7 кг, -4.5 кг против -1.0 кг соответственно).
Препарат Оземпик® по сравнению с ситаглиптином, оба в комбинации с 1-2 пероральными гипогликемическими препаратами (метформином и/или препаратами группы тиазолидиндиона)
Терапия препаратом Оземпик® 0.5 мг и 1 мг 1 раз в неделю в течение 56 недель по сравнению с ситаглиптином привела к устойчивому и статистически более значимому снижению показателей HbA1c (-1.3%, -1.6% против -0.5% соответственно), ГПН (-2.1 ммоль/л, -2.6 ммоль/л против -1.1 ммоль/л соответственно) и массы тела (-4.3 кг, -6.1 кг против -1.9 кг соответственно). Терапия препаратом Оземпик® 0.5 мг и 1 мг по сравнению с ситаглиптином значительно снижала систолическое АД от исходного значения в 132.6 мм рт.ст. (-5.1 мм рт.ст., -5.6 мм рт.ст. против -2.3 мм рт.ст. соответственно). Изменений диастолического АД не происходило.
Препарат Оземпик® по сравнению с дулаглутидом, оба в комбинации с метформином
Терапия препаратом Оземпик® 0.5 мг по сравнению с дулаглутидом 0.75 мг, оба 1 раз в неделю на протяжении 40 недель, привела к устойчивому и статистически превосходящему снижению показателей HbA1c (-1.5% против -1.1%), ГПН (-2.2 ммоль/л против -1.9 ммоль/л) и массы тела (-4.6 кг против -2.3 кг) соответственно.
Терапия препаратом Оземпик® 1 мг по сравнению с дулаглутидом 1.5 мг оба 1 раз в неделю на протяжении 40 недель, привела к устойчивому и статистически превосходящему снижению показателей HbA1c (-1.8% против -1.4%), ГПН (-2.8 ммоль/л против -2.2 ммоль/л) и массы тела (-6.5 кг против -3.0 кг) соответственно.
Препарат Оземпик® по сравнению с эксенатидом замедленного высвобождения, оба в комбинации с метформином или метформином совместно с производным сульфонилмочевины
Терапия препаратом Оземпик® 1 мг 1 раз в неделю на протяжении 56 недель по сравнению с эксенатидом замедленного высвобождения 2.0 мг привела к устойчивому и статистически более значимому снижению показателей HbA1c (-1.5% против -0.9%), ГПН (-2.8 ммоль/л против -2.0 ммоль/л) и массы тела (-5.6 кг против -1.9 кг) соответственно.
Препарат Оземпик® по сравнению с инсулином гларгин, оба в комбинации с 1-2 пероральными гипогликемическими препаратами (монотерапия метформином или метформин с производным сульфонилмочевины)
Терапия препаратом Оземпик® в дозах 0.5 мг и 1 мг 1 раз в неделю по сравнению с инсулином гларгин в течение 30 недель привела к статистически более значимому снижению показателей HbA1c (-1.2%, -1.6% против -0.8% соответственно) и массы тела (-3.5 кг, -5.2 кг против +1.2 кг соответственно).
Снижение показателя ГПН было статистически более значимым для препарата Оземпик® 1 мг по сравнению с инсулином гларгин (-2.7 ммоль/л против -2.1 ммоль/л). Не наблюдалось статистически более значимое снижение показателя ГПН для препарата Оземпик® 0.5 мг (-2.0 ммоль/л против -2.1 ммоль/л).
Доля пациентов, у которых наблюдались тяжелые или подтвержденные (<3.1 ммоль/л) эпизоды гипогликемии, была ниже при применении препарата Оземпик® 0.5 мг (4.4%) и Оземпик® 1 мг (5.6%) по сравнению с инсулином гларгин (10.6%).
Больше пациентов достигли показателя HbA1c <7% без тяжелых или подтвержденных эпизодов гипогликемии и без набора веса при применении препарата Оземпик® 0.5 мг (47%) и Оземпик® 1 мг (64%) по сравнению с инсулином гларгин (16%).
Препарат Оземпик® по сравнению с плацебо, оба в комбинации с базальным инсулином
Терапия препаратом Оземпик® в дозах 0.5 мг и 1 мг по сравнению с плацебо в течение 30 недель привела к статистически более значимому снижению показателей HbA1c (-1.4%, -1.8% против -0.1% соответственно), ГПН (-1.6 ммоль/л, -2.4 ммоль/л против -0.5 ммоль/л соответственно) и массы тела (-3.7 кг, -6.4 кг против -1.4 кг соответственно). Частота тяжелых или подтвержденных эпизодов гипогликемии существенно не различалась при применении препарата Оземпик® и плацебо. Доля пациентов с показателем HbA1c ≤8% на скрининге, сообщивших о тяжелых или подтвержденных (<3.1 ммоль/л) эпизодах гипогликемии, была выше при применении препарата Оземпик® по сравнению с плацебо и сопоставима у пациентов с показателем HbA1c >8% на скрининге.
Препарат Оземпик® по сравнению с плацебо в качестве дополнения к терапии ингибитором SGLT2 (в качестве монотерапии или в комбинации с производным сульфонилмочевины или метформином).
Терапия препаратом Оземпик® в дозе 1 мг 1 раз в неделю в качестве дополнения к терапии ингибитором SGLT2 (в качестве монотерапии или в комбинации с производным сульфонилмочевины или метформином) по сравнению с плацебо раз в неделю в течение 30 недель привела к статистически значимому снижению показателей HbA1c( -1.5% против -0.1% соответственно), ГПН(-2,2 ммоль/л против 0 ммоль/л, соответственно)и массы тела (-4.7 кг против -0.9 кг соответственно).
Комбинация с монотерапией производным сульфонилмочевины
На 30-й неделе клинических исследований (см. подраздел «Оценка влияния на сердечно-сосудистую систему») была произведена оценка подгруппы из 123 пациентов, находящихся на монотерапии производным сульфонилмочевины. На 30-й неделе показатель HbA1с снизился на 1.6% и на 1.5% при применении препарата Оземпик® в дозах 0.5 мг и 1 мг, соответственно, и увеличился на 0.1% при применении плацебо.
Комбинация с предварительно смешанным инсулином ± 1-2 пероральных гипогликемических препарата
На 30-й неделе клинических исследований (см. подраздел «Оценка влияния на сердечно-сосудистую систему») была произведена оценка подгруппы из 867 пациентов, находящихся на терапии предварительно смешанным инсулином (в комбинации или без двух пероральных гипогликемических препаратов). На 30-й неделе показатель HbA1c снизился на 1.3% и на 1.8% при применении препарата Оземпик® в дозах 0.5 мг и 1 мг, соответственно, и снизился на 0.4% при применении плацебо.
Соотношение пациентов, достигших целевого снижения показателя HbA1c
До 79% пациентов достигли целей лечения в отношении снижения показателя HbA1c <7%, и доля таких пациентов была значительно больше при применении препарата Оземпик® по сравнению с пациентами, получавшими ситаглиптин, эксенатид замедленного высвобождения, инсулин гларгин, дулаглутид и плацебо.
Доля пациентов, достигших показателя HbA1c менее 7% без тяжелых или подтвержденных эпизодов гипогликемии и без набора веса, была значительно больше при применении препарата Оземпик® в дозах 0.5 мг и 1 мг (до 66% и 74%, соответственно) по сравнению с пациентами, получавшими ситаглиптин (27%), эксенатид замедленного высвобождения (29%), инсулин гларгин (16%), дулаглутид 0.75 мг (44%) и дулаглутид 1.5 мг (58%).
Масса тела
Монотерапия препаратом Оземпик® 1 мг или терапия в комбинации с 1-2 лекарственными препаратами приводила к статистически большему снижению массы тела (потеря составляла до 6.5 кг) по сравнению с терапией плацебо, ситаглиптином, эксенатидом замедленного высвобождения, инсулином гларгин или дулаглутидом. Снижение массы тела было устойчивым на срок до 2 лет.
После одного года терапии потери массы ≥5% и ≥10% достигло большее количество пациентов, получавших препарат Оземпик® 0.5 мг (46% и 13%) и 1 мг (до 62% и 24%), по сравнению с пациентами, находившимися на терапии активными препаратами сравнения ситаглиптином и эксенатидом замедленного высвобождения (до 18% и до 4%).
В клиническом исследовании длительностью 40 недель потери массы ≥5% и ≥10% достигло большее количество пациентов, получавших препарат Оземпик® 0.5 мг (44% и 14%), по сравнению с пациентами, получавшими дулаглутид 0.75 мг (23% и 3%). Потери массы ≥5% и ≥10% достигло большее количество пациентов, получавших препарат Оземпик® 1 мг (до 63% и 27%), по сравнению с пациентами, получавшими дулаглутид 1.5 мг (30% и 8%).
В сердечно-сосудистом клиническом исследовании потери массы тела ≥5% и ≥10% достигло большее количество пациентов, получавших препарат Оземпик® 0.5 мг (36% и 13%) и 1 мг (47% и 20%), по сравнению с пациентами, получавшими плацебо 0.5 мг (18% и 6%) и 1 мг (19% и 7%).
ГПН и постпрандиальное увеличение концентрации глюкозы
Во время всех трех ежедневных приемов пищи препарат Оземпик® 0.5 мг и 1 мг показал значительное снижение концентрации ГПН до 2.8 ммоль/л и снижение постпрандиального прироста концентрации глюкозы до 1.2 ммоль/л (разница между значениями до и после еды, полученная после трех приемов пищи) (в дополнение см. выше подраздел «Фармакодинамика»).
Функция β-клеток поджелудочной железы и инсулинорезистентность
В ходе терапии препаратом Оземпик® 0.5 мг и 1 мг произошло улучшение функции β-клеток поджелудочной железы и уменьшение инсулинорезистентности, что подтверждается оценкой гомеостатических моделей функции β-клеток поджелудочной железы (НОМА-В) и инсулинорезистентности (HOMA-IR) (в дополнение см. выше подраздел «Фармакодинамика»).
Липиды
Во время клинических исследований препарата Оземпик® наблюдалось улучшение профиля липидов крови натощак, преимущественно в группе, получавшей дозу 1 мг (в дополнение см. выше подраздел «Фармакодинамика»).
Оценка влияния на сердечно-сосудистую систему
3297 пациентов с СД2 и высоким сердечно-сосудистым риском были рандомизированы в двойное слепое клиническое исследование длительностью 104 недели на получение препарата Оземпик® 0.5 мг или 1 мг 1 раз в неделю либо плацебо 0.5 мг или 1 мг в дополнение к стандартной терапии сердечно-сосудистых заболеваний в течение последующих двух лет.
Терапия препаратом Оземпик® привела к снижению на 26% риска первичного комбинированного исхода, включающего смерть по причине сердечно-сосудистой патологии, инфаркт миокарда без смертельного исхода и инсульт без смертельного исхода. В первую очередь это было обусловлено значительным уменьшением частоты инсульта без смертельного исхода (39%) и незначительным уменьшением частоты инфаркта миокарда без смертельного исхода (26%), но без изменений в частоте смерти по причине сердечно-сосудистой патологии.
Значительно снизился риск реваскуляризации миокарда или периферических артерий, в то время как риск нестабильной стенокардии, требующей госпитализации, и риск госпитализации по причине сердечной недостаточности снизились незначительно. Микроциркуляторные исходы включали в себя 158 новых или ухудшившихся случаев нефропатии. Относительный риск в отношении времени до возникновения нефропатии (новые случаи развития персистирующей макроальбуминурии, персистирующее удвоение сывороточной концентрации креатинина, необходимость в постоянной заместительной почечной терапии и смерть по причине болезни почек) составил 0.64.
В дополнение к стандартной терапии сердечно-сосудистых заболеваний терапия препаратом Оземпик® в дозах 0.5 мг и 1 мг по сравнению с плацебо 0.5 мг и 1 мг в течение 104 недель привела к значительному и устойчивому снижению от исходных значений показателя HbA1с (-1.1% и -1.4% против -0.4% и -0.4% соответственно).
Артериальное давление
Наблюдалось значительное снижение среднего систолического АД при применении препарата Оземпик® 0.5 мг (3.5-5.1 мм рт.ст.) и Оземпик® 1 мг (5.4-7.3 мм рт.ст.) в комбинации с пероральными гипогликемическими препаратами или базальным инсулином. Не отмечалось значительной разницы по показателям диастолического АД между препаратом Оземпик® и препаратами сравнения.
Фармакокинетика
Т1/2 семаглутида равный приблизительно 1 неделе делает возможным режим дозирования препарата Оземпик® 1 раз в неделю.
Всасывание
Время достижения Сmax в плазме составило от 1 до 3 дней после введения дозы препарата.
Равновесная концентрация препарата (AUCt/24) достигалась спустя 4-5 недель однократного еженедельного применения препарата. После п/к введения семаглутида в дозах 0.5 мг и 1 мг средние показатели его равновесной концентрации у пациентов с СД2 составили около 16 нмоль/л и 30 нмоль/л соответственно.
Экспозиция для доз семаглутида 0.5 мг и 1 мг увеличивается пропорционально введенной дозе.
При п/к введении семаглутида в переднюю брюшную стенку, бедро или плечо достигается сходная экспозиция.
Абсолютная биодоступность семаглутида после п/к введения составила 89%.
Распределение
Средний Vd семаглутида в тканях после п/к введения пациентам с СД2 составил приблизительно 12.5 л. Семаглутид в значительной степени связывался с альбумином плазмы крови (>99%).
Метаболизм
Семаглутид метаболизируется посредством протеолитического расщепления пептидной основы белка и последующего бета-окисления жирной кислоты боковой цепи.
Выведение
ЖКТ и почки являются основными путями выведения семаглутида и его метаболитов. 2/3 введенной дозы семаглутида выводится почками, 1/3 — через кишечник.
Приблизительно 3% от введенной дозы выводится почками в виде неизмененного семаглутида.
У пациентов с СД2 клиренс семаглутида составил около 0.05 л/ч. С элиминационным Т1/2 примерно 1 неделя семаглутид будет присутствовать в общем кровотоке в течение приблизительно 5 недель после введения последней дозы препарата.
Фармакокинетика у особых групп пациентов
Не требуется коррекции дозы семаглутида в зависимости от возраста, пола, расовой и этнической принадлежности, массы тела, наличия почечной или печеночной недостаточности.
Возраст. На основании данных, полученных в ходе клинических исследований 3а фазы, включавших пациентов в возрасте от 20 до 86 лет, показано, что возраст не влиял на фармакокинетику семаглутида.
Пол. Пол не влиял на фармакокинетику семаглутида.
Раса. Расовая группа (белая, черная или афроамериканская, азиатская) не влияла на фармакокинетику семаглутида.
Этническая принадлежность. Этническая принадлежность (латиноамериканская) не влияла на фармакокинетику семаглутида.
Масса тела. Масса тела влияла на экспозицию семаглутида. Более высокая масса тела приводит к более низкой экспозиции. Дозы семаглутида равные 0.5 мг и 1 мг обеспечивают достаточную экспозицию препарата в диапазоне массы тела от 40 до 198 кг.
Почечная недостаточность. Почечная недостаточность не оказала клинически значимого эффекта на фармакокинетику семаглутида. Это было показано у пациентов с различной степенью почечной недостаточности (легкой, средней, тяжелой или у пациентов, находящихся на диализе) по сравнению с пациентами с нормальной функцией почек в исследовании однократной дозы семаглутида равной 0.5 мг. Это также было показано на основании данных клинических исследований 3а фазы для пациентов с СД2 и почечной недостаточностью, хотя опыт применения у пациентов с терминальной стадией заболевания почек был ограничен.
Печеночная недостаточность. Печеночная недостаточность не влияла на экспозицию семаглутида. Фармакокинетические свойства семаглутида оценивались в ходе исследования однократной дозы семаглутида равной 0.5 мг у пациентов с различной степенью печеночной недостаточности (легкой, средней, тяжелой) по сравнению с пациентами с нормальной функцией печени.
Дети и подростки. Исследований семаглутида у детей и подростков в возрасте до 18 лет не проводили.
Показания препарата
Оземпик®
Препарат Оземпик® показан для применения у взрослых пациентов с сахарным диабетом 2 типа на фоне диеты и физических упражнений для улучшения гликемического контроля в качестве:
- монотерапии;
- комбинированной терапии с другими пероральными гипогликемическими препаратами — метформином, метформином и производным сульфонилмочевины, метформином и/или тиазолидиндионом, у пациентов, не достигших адекватного гликемического контроля при проведении предшествующей терапии;
- комбинированной терапии с инсулином у пациентов, не достигших адекватного гликемического контроля на терапии препаратом Оземпик® и метформином.
Препарат Оземпик® показан для снижения риска развития больших сердечно-сосудистых событий* у пациентов с сахарным диабетом 2 типа и высоким сердечно-сосудистым риском в качестве дополнения к стандартному лечению сердечно-сосудистых заболеваний (на основании анализа времени наступления первого большого сердечно-сосудистого события — см. раздел «Фармакологическое действие», подраздел «Оценка влияния на сердечно-сосудистую систему»).
* Большие сердечно-сосудистые события включают: смерть по причине сердечно-сосудистой патологии, инфаркт миокарда без смертельного исхода, инсульт без смертельного исхода.
Режим дозирования
Начальная доза препарата Оземпик® составляет 0.25 мг 1 раз в неделю. После 4 недель применения дозу следует увеличить до 0.5 мг 1 раз в неделю. Для дальнейшего улучшения гликемического контроля после как минимум 4 недель применения препарата в дозе 0.5 мг 1 раз в неделю, дозу можно увеличить до 1 мг 1 раз в неделю.
Доза препарата Оземпик® 0.25 мг не является терапевтической. Не рекомендуется введение более 1 мг в неделю.
Препарат Оземпик® может применяться в виде монотерапии или в комбинации с одним или более гипогликемическими препаратами (см. раздел «Клиническая эффективность и безопасность»).
При добавлении препарата Оземпик® к предшествующей терапии метформином и/или тиазолидиндионом, или ингибитором SGLT2 терапию метформином и/или тиазолидиндионом, или ингибитором SGLT2 можно продолжить в прежних дозах.
При добавлении препарата Оземпик® к проводимой терапии производным сульфонилмочевины или инсулином следует предусмотреть снижение дозы производного сульфонилмочевины или инсулина с целью снижения риска возникновения гипогликемий (см. раздел «Особые указания»).
Применение препарата Оземпик® не требует проведения самоконтроля концентрации глюкозы крови. Самостоятельный мониторинг концентрации глюкозы в крови необходим для коррекции дозы сульфонилмочевины и инсулина, особенно в начале лечения препаратом Оземпик® и при снижении дозы инсулина. Рекомендуется использовать поэтапный подход к снижению дозы инсулина.
Пропущенная доза
В случае пропуска дозы препарат Оземпик® следует ввести как можно быстрее в течение 5 дней с момента запланированного введения дозы. Если продолжительность пропуска составляет более 5 дней, пропущенную дозу не нужно вводить. Следующую дозу препарата Оземпик® следует ввести в обычный запланированный день. В каждом случае пациенты могут возобновить их обычный однократный еженедельный график введения.
Особые группы пациентов
Не требуется коррекции дозы у пациентов пожилого возраста (≥65 лет). Опыт применения семаглутида у пациентов в возрасте 75 лет и старше ограничен.
Не требуется коррекции дозы у пациентов с печеночной недостаточностью (см. раздел «Фармакокинетика»). Опыт применения семаглутида у пациентов с печеночной недостаточностью тяжелой степени ограничен; применение препарата Оземпик® у таких пациентов противопоказано.
Не требуется коррекции дозы у пациентов с почечной недостаточностью. Опыт применения препарата у пациентов с терминальной стадией почечной недостаточности отсутствует; применение препарата Оземпик® у таких пациентов противопоказано.
Применение препарата Оземпик® у детей и подростков в возрасте до 18 лет противопоказано в связи с отсутствием данных по безопасности и эффективности.
Способ применения
Препарат Оземпик® применяют 1 раз в неделю в любое время, независимо от приема пищи. Препарат Оземпик® вводят п/к в живот, бедро или плечо. Место инъекции можно изменять без коррекции дозы. Препарат Оземпик® нельзя вводить в/в и в/м.
При необходимости день еженедельного введения можно менять при условии, что интервал времени между двумя инъекциями составляет не менее 3 дней (>72 ч). После выбора нового дня введения следует продолжить введение препарата 1 раз в неделю.
Руководство по использованию
Предварительно заполненная шприц-ручка Оземпик® поставляется в двух видах:
- Оземпик® 0.25 мг/доза или 0.5 мг/доза раствор для п/к введения в предварительно заполненной шприц-ручке позволяет вводить дозы 0.25 мг или 0.5 мг. Данная шприц-ручка предназначена для повышения дозы и поддержания терапевтической дозы 0.5 мг. Одна шприц-ручка содержит 1.5 мл раствора.
- Оземпик® 1 мг/доза раствор для п/к введения в предварительно заполненной шприц-ручке позволяет вводить дозы только 1 мг. Данная шприц-ручка предназначена только для поддержания терапевтической дозы 1 мг. Одна шприц-ручка содержит 3 мл раствора.
В упаковку препарата Оземпик® включены иглы НовоФайн® Плюс.
Пациенту следует рекомендовать выбрасывать инъекционную иглу после каждой инъекции в соответствии с местными требованиями.
Шприц-ручка Оземпик® предназначена только для индивидуального использования.
Препарат Оземпик® нельзя применять, если он выглядит иначе, чем прозрачный бесцветный или почти бесцветный раствор.
Препарат Оземпик® нельзя применять, если он был заморожен.
Препарат Оземпик® можно вводить при помощи игл длиной до 8 мм. Шприц-ручка предназначена для использования с одноразовыми инъекционными иглами НовоФайн®.
Всегда после каждой инъекции следует удалять иглу и хранить шприц-ручку Оземпик® с отсоединенной иглой. Это поможет предотвратить закупорку игл, загрязнение, заражение, вытекание раствора и введение неправильной дозы препарата.
Инструкция для пациентов по применению препарата Оземпик® 0.25 мг/доза или 0.5 мг/доза раствор для п/к введения в предварительно заполненной шприц-ручке
Внимательно прочитайте данную инструкцию перед применением предварительно заполненной шприц-ручки Оземпик®.
Используйте шприц-ручку только после того, как Вы научитесь ею пользоваться под руководством врача или медсестры.
Начните с проверки шприц-ручки, чтобы убедиться, что в ней содержится препарат Оземпик® 0.25 мг/доза или 0.5 мг/доза, затем посмотрите на представленные ниже иллюстрации, чтобы ознакомиться с различными частями шприц-ручки и иглы.
Если Вы слабовидящий или у Вас имеются серьезные проблемы со зрением, и Вы не можете различить цифры на счетчике дозы, не используйте шприц-ручку без посторонней помощи. Помочь вам может человек с хорошим зрением, обученный использованию предварительно заполненной шприц-ручки с препаратом Оземпик®.
Данная шприц-ручка является предварительно заполненной шприц-ручкой. Она содержит 2 мг семаглутида и позволяет выбрать дозы 0.25 мг или 0.5 мг. Шприц-ручка разработана для использования с одноразовыми иглами НовоФайн® длиной до 8 мм.
Иглы НовоФайн® Плюс включены в упаковку.
Δ Важная информация
Обратите особое внимание на информацию, отмеченную такими значками, это очень важно для безопасного использования шприц-ручки.
Предварительно заполненная шприц-ручка с препаратом Оземпик® и игла (пример)
1. Подготовка шприц-ручки с новой иглой к использованию
- Проверьте название и цветовой код на этикетке шприц-ручки, чтобы убедиться, что в ней содержится препарат Оземпик® 0.25 мг/доза или 0.5 мг/доза. Это особенно важно, если Вы применяете более одного инъекционного препарата.
- Снимите колпачок со шприц-ручки (рис. А).
- Убедитесь, что раствор в шприц-ручке прозрачный и бесцветный (рис. В). Посмотрите в окошко шприц-ручки. Если раствор мутный и не бесцветный, не используйте шприц ручку.
- Возьмите новую иглу и удалите защитную наклейку (рис. С). Если защитная наклейка повреждена, не используйте иглу, т.к. в этом случае стерильность не гарантируется.
- Наденьте иглу на шприц-ручку и поверните ее, чтобы игла плотно держалась на шприц-ручке (рис. D).
- Снимите наружный колпачок иглы, но не выбрасывайте его (рис. Е). Он понадобится после завершения инъекции, чтобы безопасно снять иглу со шприц-ручки.
- Снимите и выбросьте внутренний колпачок иглы (рис. F). Если Вы попытаетесь надеть внутренний колпачок обратно на иглу, Вы можете случайно уколоться иглой.
На конце иглы может появиться капля раствора. Это нормальное явление, однако Вы все равно должны проверить поступление препарата, если Вы используете новую шприц-ручку в первый раз.
Не присоединяйте новую иглу до тех пор, пока Вы не будете готовы сделать инъекцию.
Δ Всегда для каждой инъекции используйте новую иглу. Это может предотвратить закупорку игл, загрязнение, инфицирование и введение неправильной дозы препарата.
Δ Никогда не используйте иглу, если она погнута или повреждена.
2. Проверка поступления препарата
- Перед первой инъекцией с помощью каждой новой шприц-ручки проверьте поступление препарата. Если шприц-ручка уже находится в использовании, то перейдите к операции 3 «Установка дозы».
- Поворачивайте селектор дозы, пока счетчик дозы не поравняется с символом проверки поступления препарата (••—) (рис. А).
- Держите шприц-ручку иглой вверх. Нажмите пусковую кнопку и удерживайте ее в этом положении, пока счетчик дозы не возвратится к «0» (рис. В). «0» должен стоять напротив указателя дозы. На конце иглы должна появиться капля раствора.
На конце иглы может оставаться маленькая капля, но она не будет введена при инъекции. Если капля раствора на конце иглы не появилась, повторите операцию «2» «Проверка поступления препарата», но не более 6 раз. Если капля раствора так и не появилась, поменяйте иглу и повторите операцию «2» «Проверка поступления препарата» еще раз. Если капля раствора так и не появилась, утилизируйте шприц-ручку и используйте новую.
Δ Всегда перед использованием новой шприц-ручки в первый раз убедитесь в том, что на конце иглы появилась капля раствора. Это гарантирует поступление препарата.
Если капля раствора не появилась, препарат не будет введен, даже если счетчик дозы будет двигаться. Это может указывать на то, что игла закупорена или повреждена.
Если Вы не проверите поступление препарата перед первой инъекцией с помощью каждой новой шприц-ручки, Вы можете не ввести необходимую дозу и ожидаемый эффект препарата Оземпик® не будет достигнут.
3. Установка дозы
- Поворачивайте селектор дозы до тех пор, пока он не покажет необходимую дозу (0.25 мг или 0.5 мг) (рис. А). Если доза была выбрана неправильно, Вы можете поворачивать селектор дозы вперед или назад, пока не будет установлена правильная доза. Максимальная доза, которую можно установить, составляет 0.5 мг.
Селектор дозы изменяет дозу. Только счетчик дозы и указатель дозы покажут количество мг препарата в выбранной Вами дозе.
Вы можете выбрать до 0.5 мг препарата на дозу. Если в шприц-ручке содержится менее 0.5 мг, счетчик дозы остановится прежде, чем появится «0.5».
При каждом повороте селектора дозы раздаются щелчки, звук щелчков зависит от того, в какую сторону вращается селектор дозы: вперед, назад или, если набранная доза превышает количество мг препарата, оставшихся в шприц-ручке. Не считайте щелчки шприц-ручки.
Δ Всегда перед каждой инъекцией проверяйте, какое количество мг препарата Вы набрали по счетчику дозы и указателю дозы.
Не считайте щелчки шприц-ручки.
С помощью селектора дозы нужно выбирать только дозы 0.25 мг или 0.5 мг. Выбранная доза должна находиться точно напротив указателя дозы — такое положение гарантирует, что Вы получите правильную дозу препарата.
Сколько препарата осталось
Чтобы определить, сколько препарата осталось, используйте счетчик дозы (рис. А): поворачивайте селектор дозы до остановки счетчика дозы.
Если он показывает «0.5», в шприц-ручке осталось не менее 0.5 мг препарата. Если счетчик дозы остановился до того, как появилось «0.5», то это означает, что в шприц-ручке осталось недостаточное количество препарата, чтобы ввести полную дозу 0.5 мг.
Δ Если в шприц-ручке осталось недостаточное количество препарата для введения полной дозы, не используйте шприц-ручку. Используйте новую шприц-ручку Оземпик®.
4. Введение препарата
- Введите иглу под кожу, используя технику инъекций, рекомендованную врачом или медсестрой (рис. А).
- Убедитесь, что счетчик дозы находится в поле Вашего зрения. Не дотрагивайтесь до счетчика дозы пальцами — это может прервать инъекцию.
- Нажмите пусковую кнопку до упора и удерживайте ее в этом положении, пока счетчик дозы не покажет «0» (рис. В). «0» должен находиться точно напротив указателя дозы. При этом Вы можете услышать или ощутить щелчок.
- Удерживайте иглу под кожей, после того, как счетчик дозы вернулся к «0» и медленно считайте до 6 (рис. С).
- Если Вы извлечете иглу из-под кожи раньше, Вы можете увидеть, как препарат вытекает из иглы. В этом случае будет введена неполная доза препарата.
- Извлеките иглу из-под кожи (рис. D). Если в месте инъекции появилась кровь, слегка прижмите к месту укола ватный тампон. Не массируйте место укола.
После завершения инъекции Вы можете увидеть каплю раствора на конце иглы. Это нормально и не влияет на дозу препарата, которую Вы ввели.
Δ Всегда сверяйтесь с показаниями счетчика дозы, чтобы знать, какое количество мг препарата Вы ввели. Удерживайте пусковую кнопку до тех пор, пока счетчик дозы не покажет «0».
Как выявить закупорку или повреждение иглы
- Если после долгого нажатия на пусковую кнопку на счетчике дозы не появляется «0», это может означать закупорку или повреждение иглы.
- В этом случае Вы не получили препарат, даже если счетчик дозы изменил положение с исходной дозы, которую Вы установили.
Что делать с закупоренной иглой
Замените иглу как описано в операции 5 «После завершения инъекции» и повторите все шаги, начиная с операции 1 «Подготовка шприц-ручки с новой иглой к использованию». Убедитесь, что установили полную необходимую Вам дозу.
Никогда не дотрагивайтесь до счетчика дозы во время введения препарата. Это может прервать инъекцию.
5. После завершения инъекции
- Положив наружный колпачок иглы на плоскую поверхность, введите конец иглы внутрь колпачка, не касаясь его или иглы (рис. А).
- Когда игла войдет в колпачок, осторожно наденьте наружный колпачок на иглу (рис. В).
- Отвинтите иглу и выбросьте ее, соблюдая меры предосторожности.
- После каждого использования надевайте на шприц-ручку колпачок, чтобы защитить содержащийся в ней раствор от воздействия света (рис. С).
Всегда после каждой инъекции выбрасывайте иглу, чтобы обеспечить комфортную инъекцию и избежать закупорки игл. Если игла закупорена, Вы не введете себе препарат. Выбрасывайте пустую шприц-ручку с отсоединенной иглой в соответствии с рекомендациями данными врачом, медсестрой, фармацевтом или в соответствии с местными требованиями.
Δ Никогда не пытайтесь надеть внутренний колпачок обратно на иглу. Вы можете уколоться.
Δ После каждой инъекции всегда сразу удаляйте иглу со шприц-ручки. Это может предотвратить закупорку игл, загрязнение, инфицирование, вытекание раствора и введение неправильной дозы препарата.
Δ Дополнительная важная информация:
- Всегда храните шприц-ручку и иглы к ней в недоступном для всех, и в особенности для детей, месте.
- Никогда не передавайте свою шприц-ручку и иглы к ней другим лицам.
- Лица, осуществляющие уход за больным, должны обращаться с использованными иглами с особой осторожностью, чтобы предотвратить уколы иглой и перекрестное инфицирование.
Уход за шприц-ручкой
Аккуратно обращайтесь со шприц-ручкой. Небрежное обращение или неправильное использование могут привести к введению неправильной дозы препарата, следствием чего могут стать высокая концентрация глюкозы крови или дискомфорт в области живота (тошнота или рвота).
- Не оставляйте шприц-ручку в автомобиле или любом другом месте, где она может подвергаться воздействию слишком высоких или слишком низких температур.
- Не применяйте препарат Оземпик®, если он был заморожен. В этом случае концентрация глюкозы крови может стать слишком высокой или Вы можете почувствовать дискомфорт в области живота, такой, как тошнота или рвота.
- Не применяйте препарат Оземпик®, если он подвергся воздействию прямых солнечных лучей. В этом случае концентрация глюкозы крови может стать слишком высокой.
- Предохраняйте шприц-ручку от попадания на нее пыли, загрязнений и жидкости.
- Не мойте шприц-ручку, не погружайте ее в жидкость и не смазывайте ее. При необходимости шприц-ручку можно очищать влажной тканью, смоченной мягким моющим средством.
- Нельзя ронять или ударять шприц-ручку о твердую поверхность. Если Вы уронили шприц-ручку или сомневаетесь в ее исправности, присоедините новую иглу и проверьте поступление препарата перед тем, как сделать инъекцию.
- Не пытайтесь повторно заполнить шприц-ручку. Пустую шприц-ручку необходимо выбросить.
- Не пытайтесь самостоятельно починить шприц-ручку или разобрать ее на части.
Инструкция для пациентов по применению препарата Оземпик® 1 мг/доза раствор для п/к введения в предварительно заполненной шприц-ручке
Внимательно прочитайте данную инструкцию перед применением предварительно заполненной шприц-ручки Оземпик®.
Используйте шприц-ручку только после того, как Вы научитесь ею пользоваться под руководством врача или медсестры.
Начните с проверки шприц-ручки, чтобы убедиться, что в ней содержится препарат Оземпик® 1 мг/доза, затем посмотрите на представленные ниже иллюстрации, чтобы ознакомиться с различными частями шприц-ручки и иглы.
Если Вы слабовидящий или у Вас имеются серьезные проблемы со зрением, и Вы не можете различить цифры на счетчике дозы, не используйте шприц-ручку без посторонней помощи. Помочь вам может человек с хорошим зрением, обученный использованию предварительно заполненной шприц-ручки с препаратом Оземпик®.
Данная шприц-ручка является предварительно заполненной шприц-ручкой. Она содержит 4 мг семаглутида и позволяет выбрать только дозу 1 мг. Шприц-ручка разработана для использования с одноразовыми иглами НовоФайн® длиной до 8 мм.
Иглы НовоФайн® Плюс включены в упаковку.
Δ Важная информация
Обратите особое внимание на информацию, отмеченную такими значками, это очень важно для безопасного использования шприц-ручки.
Предварительно заполненная шприц-ручка с препаратом Оземпик® и игла (пример)
1. Подготовка шприц-ручки с новой иглой к использованию
- Проверьте название и цветовой код на этикетке шприц-ручки, чтобы убедиться, что в ней содержится препарат Оземпик® 1 мг/доза. Это особенно важно, если Вы применяете более одного инъекционного препарата.
- Снимите колпачок со шприц-ручки (рис. А).
- Убедитесь, что раствор в шприц-ручке прозрачный и бесцветный (рис. В). Посмотрите в окошко шприц-ручки. Если раствор мутный и не бесцветный, не используйте шприц-ручку.
- Возьмите новую иглу и удалите защитную наклейку (рис. С). Если защитная наклейка повреждена, не используйте иглу, т.к. в этом случае стерильность не гарантируется.
- Наденьте иглу на шприц-ручку и поверните ее, чтобы игла плотно держалась на шприц-ручке (рис. D).
- Снимите наружный колпачок иглы, но не выбрасывайте его (рис. Е). Он понадобится после завершения инъекции, чтобы безопасно снять иглу со шприц-ручки.
- Снимите и выбросьте внутренний колпачок иглы (рис. F). Если Вы попытаетесь надеть внутренний колпачок обратно на иглу, Вы можете случайно уколоться иглой.
На конце иглы может появиться капля раствора. Это нормальное явление, однако, Вы все равно должны проверить поступление препарата, если Вы используете новую шприц-ручку в первый раз.
Не присоединяйте новую иглу до тех пор, пока Вы не будете готовы сделать инъекцию.
Δ Всегда для каждой инъекции используйте новую иглу. Это может предотвратить закупорку игл, загрязнение, инфицирование и введение неправильной дозы препарата.
Δ Никогда не используйте иглу, если она погнута или повреждена.
2. Проверка поступления препарата
- Перед первой инъекцией с помощью каждой новой шприц-ручки проверьте поступление препарата. Если шприц-ручка уже находится в использовании, то перейдите к операции 3 «Установка дозы».
- Поворачивайте селектор дозы, пока счетчик дозы не поравняется с символом проверки поступления препарата (••—) (рис. А).
- Держите шприц-ручку иглой вверх. Нажмите пусковую кнопку и удерживайте ее в этом положении, пока счетчик дозы не возвратится к «0» (рис. В). «0» должен стоять напротив указателя дозы. На конце иглы должна появиться капля раствора.
На конце иглы может оставаться маленькая капля, но она не будет введена при инъекции.
Если капля раствора на конце иглы не появилась, повторите операцию «2» «Проверка поступления препарата», но не более 6 раз. Если капля раствора так и не появилась, поменяйте иглу и повторите операцию «2» «Проверка поступления препарата» еще раз. Если капля раствора так и не появилась, утилизируйте шприц-ручку и используйте новую.
Δ Всегда перед использованием новой шприц-ручки в первый раз убедитесь в том, что на конце иглы появилась капля раствора. Это гарантирует поступление препарата.
Если капля раствора не появилась, препарат не будет введен, даже если счетчик дозы будет двигаться. Это может указывать на то, что игла закупорена или повреждена.
Если Вы не проверите поступление препарата перед первой инъекцией с помощью каждой новой шприц-ручки, Вы можете не ввести необходимую дозу и ожидаемый эффект препарата Оземпик® не будет достигнут.
3. Установка дозы
- Поверните селектор дозы, чтобы выбрать дозу 1 мг (рис. А). Продолжайте поворачивать до тех пор, пока счетчик дозы не остановится и не покажет «1».
Только счетчик дозы и указатель дозы покажут, что был выбран 1 мг.
Вы можете выбрать только 1 мг препарата на дозу. Если в шприц-ручке содержится менее 1 мг, счетчик дозы остановится прежде, чем появится «1».
При каждом повороте селектора дозы раздаются щелчки, звук щелчков зависит от того, в какую сторону вращается селектор дозы: вперед, назад или, если Вы пытаетесь набрать дозу больше 1 мг. Не считайте щелчки шприц-ручки.
Δ Всегда перед каждой инъекцией по счетчику дозы и указателю дозы проверяйте, что был набран 1 мг.
Не считайте щелчки шприц-ручки.
С помощью селектора дозы нужно выбирать только дозу 1 мг. Доза 1 мг должна находиться точно напротив указателя дозы — такое положение гарантирует, что Вы получите правильную дозу препарата.
Сколько препарата осталось
Чтобы определить, сколько препарата осталось, используйте счетчик дозы (рис. А): поворачивайте селектор дозы до остановки счетчика дозы.
Если он показывает «1», в шприц-ручке осталось не менее 1 мг препарата. Если счетчик дозы остановился до того, как появилась цифра «1», то это означает, что в шприц-ручке осталось недостаточное количество препарата, чтобы ввести полную дозу 1 мг.
Δ Если в шприц-ручке осталось недостаточное количество препарата для введения полной дозы, не используйте шприц-ручку. Используйте новую шприц-ручку Оземпик®.
4. Введение препарата
- Введите иглу под кожу, используя технику инъекций, рекомендованную врачом или медсестрой (рис. А).
- Убедитесь, что счетчик дозы находится в поле Вашего зрения. Не дотрагивайтесь до счетчика дозы пальцами — это может прервать инъекцию.
- Нажмите пусковую кнопку до упора и удерживайте ее в этом положении, пока счетчик дозы не покажет «0» (рис. В). «0» должен находиться точно напротив указателя дозы. При этом Вы можете услышать или ощутить щелчок.
- Удерживайте иглу под кожей, после того, как счетчик дозы вернулся к «0» и медленно считайте до 6 (рис. С). Если Вы извлечете иглу из-под кожи раньше, Вы можете увидеть, как препарат вытекает из иглы. В этом случае будет введена неполная доза препарата.
- Извлеките иглу из-под кожи (рис. D). Если в месте инъекции появилась кровь, слегка прижмите к месту укола ватный тампон. Не массируйте место укола.
После завершения инъекции Вы можете увидеть каплю раствора на конце иглы. Это нормально и не влияет на дозу препарата, которую Вы ввели.
Δ Всегда сверяйтесь с показаниями счетчика дозы, чтобы знать, какое количество мг препарата Вы ввели. Удерживайте пусковую кнопку до тех пор, пока счетчик дозы не покажет «0».
Как выявить закупорку или повреждение иглы
- Если после долгого нажатия на пусковую кнопку на счетчике дозы не появляется «0», это может означать закупорку или повреждение иглы.
- В этом случае Вы не получили препарат, даже если счетчик дозы изменил положение с исходной дозы, которую Вы установили.
Что делать с закупоренной иглой
Замените иглу как описано в операции 5 «После завершения инъекции» и повторите все шаги, начиная с операции 1 «Подготовка шприц-ручки с новой иглой к использованию». Убедитесь, что установили полную необходимую Вам дозу.
Никогда не дотрагивайтесь до счетчика дозы во время введения препарата. Это может прервать инъекцию.
5. После завершения инъекции
- Положив наружный колпачок иглы на плоскую поверхность, введите конец иглы внутрь колпачка, не касаясь его или иглы (рис. А).
- Когда игла войдет в колпачок, осторожно наденьте наружный колпачок на иглу (рис. В).
- Отвинтите иглу и выбросьте ее, соблюдая меры предосторожности.
- После каждого использования надевайте на шприц-ручку колпачок, чтобы защитить содержащийся в ней раствор от воздействия света (рис. С).
Всегда после каждой инъекции выбрасывайте иглу, чтобы обеспечить комфортную инъекцию и избежать закупорки игл. Если игла закупорена, Вы не введете себе препарат. Выбрасывайте пустую шприц-ручку с отсоединенной иглой в соответствии с рекомендациями данными врачом, медсестрой, фармацевтом или в соответствии с местными требованиями.
Δ Никогда не пытайтесь надеть внутренний колпачок обратно на иглу. Вы можете уколоться.
Δ После каждой инъекции всегда сразу удаляйте иглу со шприц-ручки. Это может предотвратить закупорку игл, загрязнение, инфицирование, вытекание раствора и введение неправильной дозы препарата.
Δ Дополнительная важная информация:
- Всегда храните шприц-ручку и иглы к ней в недоступном для всех, и в особенности для детей, месте.
- Никогда не передавайте свою шприц-ручку и иглы к ней другим лицам.
- Лица, осуществляющие уход за больным, должны обращаться с использованными иглами с особой осторожностью, чтобы предотвратить уколы иглой и перекрестное инфицирование.
Уход за шприц-ручкой
Аккуратно обращайтесь со шприц-ручкой. Небрежное обращение или неправильное использование могут привести к введению неправильной дозы препарата, следствием чего могут стать высокая концентрация глюкозы крови или дискомфорт в области живота (тошнота или рвота).
- Не оставляйте шприц-ручку в автомобиле или любом другом месте, где она может подвергаться воздействию слишком высоких или слишком низких температур.
- Не применяйте препарат Оземпик®, если он был заморожен. В этом случае концентрация глюкозы крови может стать слишком высокой или Вы можете почувствовать дискомфорт в области живота такой, как тошнота или рвота.
- Не применяйте препарат Оземпик®, если он подвергся воздействию прямых солнечных лучей. В этом случае концентрация глюкозы крови может стать слишком высокой.
- Предохраняйте шприц-ручку от попадания на нее пыли, загрязнений и жидкости.
- Не мойте шприц-ручку, не погружайте ее в жидкость и не смазывайте ее. При необходимости шприц-ручку можно очищать влажной тканью, смоченной мягким моющим средством.
- Нельзя ронять или ударять шприц-ручку о твердую поверхность. Если Вы уронили шприц-ручку или сомневаетесь в ее исправности, присоедините новую иглу и проверьте поступление препарата перед тем, как сделать инъекцию.
- Не пытайтесь повторно заполнить шприц-ручку. Пустую шприц-ручку необходимо выбросить.
- Не пытайтесь самостоятельно починить шприц-ручку или разобрать ее на части.
Побочное действие
Наиболее часто регистрируемыми нежелательными реакциями (HP) во время клинических исследований являлись нарушения со стороны ЖКТ, включая тошноту, диарею и рвоту. В целом, данные реакции были легкой или средней степени тяжести и краткосрочными.
HP распределены по системно-органным классам в соответствии с MedDRA с указанием частоты их возникновения согласно рекомендациям ВОЗ: очень часто (≥1/10); часто (≥1/100 до <1/10); нечасто (≥1/1000 до <1/100); редко (≥1/10000 до <1/1000) и очень редко (<1/10000). В каждой группе частоты развития HP представлены по снижению степени серьезности.
Таблица 1. HP, выявленные при проведении клинических исследований 3a фазы
a Гипогликемия, определенная как тяжелая (требующая помощи другого человека) или симптоматическая в сочетании с концентрацией глюкозы в плазме крови <3.1 ммоль/л.
b Осложнения диабетической ретинопатии — это сочетание из: необходимости в фотокоагуляции сетчатки глаза, необходимости в интравитреальном введении препаратов, кровоизлияния в стекловидное тело, развития слепоты, связанной с СД.
Частота основана на исследовании сердечно-сосудистых исходов.
c Групповой термин, включающий также нежелательные реакции, связанные с гиперчувствительностью, такие как сыпь и крапивница.
d НР из постмаркетинговых источников
Двухлетнее исследование сердечно-сосудистых исходов и безопасности
В популяции пациентов с высоким риском развития сердечно-сосудистых заболеваний профиль HP был аналогичным таковому в других клинических исследованиях 3а фазы (описаны в подразделе «Клиническая эффективность и безопасность»).
Описание отдельных HP
Гипогликемия
Во время монотерапии препаратом Оземпик® не наблюдалось эпизодов тяжелой гипогликемии. Гипогликемия тяжелой степени, в основном, наблюдалась при применении препарата Оземпик® в комбинации с производным сульфонилмочевины или инсулином. Наблюдалось несколько эпизодов тяжелой гипогликемии при применении препарата Оземпик® в комбинации с другими, за исключением производного сульфонилмочевины, пероральными гипогликемическими препаратами.
Гипогликемия по классификации Американской диабетической ассоциации наблюдалась у 11.3% (0.3 случая/пациенто-год) пациентов при добавлении семаглутида в дозе 1.0 мг к терапии ингибитором SGLT2 по сравнению с 2.0% (0.04 случая/пациенто-год) пациентов, получавших плацебо. О тяжелой гипогликемии сообщалось у 0.7% (0.01 события/пациенто-год) и 0% пациентов соответственно.
HP со стороны ЖКТ
Во время терапии препаратом Оземпик® в дозах 0.5 мг и 1 мг у пациентов отмечалась тошнота, диарея и рвота. Большинство реакций были от легкой до средней степени тяжести и краткосрочными. HP стали причиной преждевременного выбывания из клинических исследований 3.9% и 5.9% пациентов соответственно. Чаще всего о HP сообщалось в первые месяцы терапии.
Пациенты с низкой массой тела при лечении семаглутидом могут испытывать больше НР со стороны ЖКТ.
В клинических исследованиях при одновременном применении ингибитора SGLT2 и семаглутида запор и гастроэзофагеальная рефлюксная болезнь наблюдались у 6.7% и 4% пациентов, получавших семаглутид 1.0 мг, соответственно, по сравнению с отсутствием событий у пациентов, получавших плацебо. Распространенность этих событий со временем не уменьшалась.
Острый панкреатит
Частота развития острого панкреатита, подтвержденного по результатам экспертной оценки, в исследованиях 3а фазы составила 0.3% при применении семаглутида и 0.2% при применении препарата сравнения. В двухлетнем исследовании сердечно-сосудистых исходов частота развития острого панкреатита, подтвержденная по результатам экспертной оценки, составила 0.5% при применении семаглутида и 0.6% при применении плацебо (см. раздел «Особые указания»).
Осложнения диабетической ретинопатии
В двухлетнем клиническом исследовании, в котором участвовали пациенты с СД2 и высоким сердечно-сосудистым риском, длительным течением СД и неадекватным контролем гликемии, подтвержденные случаи осложнений диабетической ретинопатии развивались у большего количества пациентов, получавших препарат Оземпик® (3.0%), по сравнению с пациентами, получавшими плацебо (1.8%). У пациентов с анамнезом диабетической ретинопатии в начале клинического исследования возрастание абсолютного риска развития осложнений было выше. У пациентов с отсутствием подтвержденного анамнеза диабетической ретинопатии количество событий было одинаковым при применении препарата Оземпик® и плацебо.
В клиническом исследовании продолжительностью до 1 года частота HP, связанных с диабетической ретинопатией, была одинаковой в группе препарата Оземпик® и препаратов сравнения.
Прекращение лечения по причине HP
Частота прекращения лечения по причине HP составила 8.7% для пациентов, получавших препарат Оземпик® 1 мг. Наиболее частыми HP, приводившими к прекращению лечения, были нарушения со стороны ЖКТ.
Реакции в месте введения
Сообщалось о реакциях в месте введения (таких как, сыпь в месте введения, покраснение) у 0.6% и 0.5% пациентов, получавших семаглутид 0.5 мг и 1 мг, соответственно. Эти реакции носили, как правило, легкий характер.
Иммуногенность
Вследствие потенциальных иммуногенных свойств белковых и пептидных лекарственных препаратов, у пациентов могут появиться антитела к семаглутиду после терапии препаратом Оземпик®. В конце клинического исследования доля пациентов, у которых были обнаружены антитела к семаглутиду в любой момент времени, была низкой (1-2%) и ни у одного пациента не было обнаружено нейтрализующих антител к семаглутиду или антител с нейтрализующим эндогенный ГПП-1 эффектом.
Противопоказания к применению
- гиперчувствительность к семаглутиду или любому из вспомогательных веществ препарата;
- медуллярный рак щитовидной железы в анамнезе, в т.ч. в семейном;
- множественная эндокринная неоплазия (МЭН) 2 типа;
- сахарный диабет 1 типа (СД1);
- диабетический кетоацидоз.
Противопоказано применение препарата Оземпик® у следующих групп пациентов и при следующих состояниях/заболеваниях в связи с отсутствием данных по эффективности и безопасности иди ограниченным опытом применения:
- беременность;
- период грудного вскармливания;
- возраст до 18 лет;
- печеночная недостаточность тяжелой степени;
- терминальная стадия почечной недостаточности (КК <15 мл/мин);
- хроническая сердечная недостаточность (ХСН) IV функционального класса (в соответствии с классификацией NYHA).
С осторожностью
Препарат Оземпик® рекомендуется применять с осторожностью у пациентов с почечной недостаточностью и у пациентов с наличием панкреатита в анамнезе (см. раздел «Особые указания»).
Применение при беременности и кормлении грудью
Беременность
Исследования на животных продемонстрировали репродуктивную токсичность препарата (см. раздел «Доклинические данные по безопасности»).
Данные по применению семаглутида у беременных женщин ограничены. Противопоказано применять семаглутид во время беременности. Женщинам с сохраненным репродуктивным потенциалом рекомендуется использовать контрацепцию во время терапии семаглутидом. Если пациентка готовится к беременности, либо беременность уже наступила, терапию семаглутидом необходимо прекратить. Из-за длительного Т1/2 терапию семаглутидом необходимо прекратить как минимум за 2 месяца до планируемого наступления беременности (см. раздел «Фармакокинетика»).
Период грудного вскармливания
У лактирующих крыс семаглутид проникал в молоко. Нельзя исключить риск для ребенка, находящегося на грудном вскармливании. Противопоказано применять семаглутид в период грудного вскармливания.
Фертильность
Действие семаглутида на фертильность у людей неизвестно. Семаглутид не влиял на фертильность самцов крыс. Среди самок крыс увеличение эстрального цикла и незначительное снижение количества овуляций наблюдалось при дозах, сопровождавшихся снижением массы тела самки.
Применение при нарушениях функции печени
Не требуется коррекции дозы у пациентов с печеночной недостаточностью.
Противопоказано применение препарата при печеночной недостаточности тяжелой степени.
Применение при нарушениях функции почек
Препарат рекомендуется применять с осторожностью у пациентов с почечной недостаточностью.
Противопоказано применение препарата у пациентов с терминальной стадией почечной недостаточности (КК <15 мл/мин).
Применение у детей
Противопоказано применение препарата в возрасте до 18 лет.
Применение у пожилых пациентов
Не требуется коррекции дозы у пациентов пожилого возраста (≥65 лет).
Опыт применения семаглутида у пациентов в возрасте 75 лет и старше ограничен.
Особые указания
Применение препарата Оземпик® противопоказано у пациентов с СД1 или для лечения диабетического кетоацидоза.
Препарат Оземпик® не заменяет инсулин. Диабетический кетоацидоз был зарегистрирован у инсулинзависимых пациентов, у которых отмечалось быстрое прекращение лечения или снижение дозы инсулина при начале лечения агонистом ГПП-1Р (см. раздел «Режим дозирования»).
Реакции со стороны ЖКТ
Применение агонистов ГПП-1Р может быть ассоциировано с HP со стороны ЖКТ. Это следует учитывать при лечении пациентов с почечной недостаточностью, т.к. тошнота, рвота и диарея могут привести к дегидратации и ухудшению функции почек.
Острый панкреатит
При применении агонистов ГПП-1Р наблюдались случаи развития острого панкреатита. Пациенты должны быть проинформированы о характерных симптомах острого панкреатита. При подозрении на панкреатит терапия препаратом Оземпик® должна быть прекращена; в случае подтверждения острого панкреатита терапию препаратом Оземпик® возобновлять не следует. Следует соблюдать осторожность у пациентов с панкреатитом в анамнезе.
При отсутствии других признаков и симптомов острого панкреатита повышение активности ферментов поджелудочной железы не является прогностическим фактором развития острого панкреатита.
Гипогликемия
Пациенты, получающие препарат Оземпик® в комбинации с производным сульфонилмочевины или инсулином, могут иметь повышенный риск развития гипогликемии. В начале лечения препаратом Оземпик® риск развития гипогликемии можно снизить, уменьшив дозу производного сульфонилмочевины или инсулина.
Диабетическая ретинопатия
Наблюдалось повышение риска развития осложнений диабетической ретинопатии у пациентов с наличием диабетической ретинопатии, получающих терапию инсулином и семаглутидом (см. раздел «Побочное действие»). Следует соблюдать осторожность при применении семаглутида у пациентов с диабетической ретинопатией, получающих инсулинотерапию. Такие пациенты должны находиться под постоянным наблюдением и получать лечение в соответствии с клиническими рекомендациями. Быстрое улучшение гликемического контроля было ассоциировано с временным ухудшением состояния диабетической ретинопатии, однако при этом нельзя исключать и другие причины.
Сердечная недостаточность
Отсутствует опыт применения препарата Оземпик® у пациентов с хронической сердечной недостаточностью IV функционального класса в соответствии с классификацией NYHA. Применение препарата у таких пациентов противопоказано.
Заболевания щитовидной железы
В пострегистрационном периоде применения другого аналога ГПП-1, лираглутида, были отмечены случаи медуллярного рака щитовидной железы (МРЩЖ). Имеющихся данных недостаточно для установления или исключения причинно-следственной связи возникновения МРЩЖ с применением аналогов ГПП-1. Необходимо проинформировать пациента о риске МРЩЖ и о симптомах опухоли щитовидной железы (появления уплотнения в области шеи, дисфагии, одышки, непроходящей охриплости голоса). Значительное повышение концентрации кальцитонина в плазме крови может указывать на МРЩЖ (у пациентов с МРЩЖ значения концентрации кальцитонина в плазме крови обычно >50 нг/л). При выявлении повышения концентрации кальцитонина в плазме крови следует провести дальнейшее обследование пациента. Пациенты с узлами в щитовидной железе, выявленными при медицинском осмотре или при проведении УЗИ щитовидной железы, также должны быть дополнительно обследованы.
Применение семаглутида у пациентов с личным или семейным анамнезом МРЩЖ или с синдромом МЭН типа 2 противопоказано.
Доклинические данные по безопасности
Доклинические данные, основанные на исследованиях фармакологической безопасности, токсичности повторных доз и генотоксичности, не выявили какой-либо опасности для человека.
В двухлетних исследованиях канцерогенности у крыс и мышей при клинически значимых концентрациях семаглутид стал причиной развития опухолей С-клеток щитовидной железы без смертельного исхода. Опухоли С-клеток щитовидной железы без смертельного исхода, наблюдаемые у крыс, характерны для группы аналогов ГПП-1. Считается, что в отношении людей данный риск является низким, но не может быть полностью исключен.
Влияние на способность к управлению транспортными средствами и механизмами
Препарат Оземпик® не влияет или незначительно влияет на способность управлять транспортными средствами или работу с механизмами. Пациенты должны быть предупреждены о том, что им следует соблюдать меры предосторожности во избежание развития у них гипогликемии во время управления транспортными средствами и при работе с механизмами, особенно при применении препарата Оземпик® в комбинации с производным сульфонилмочевины или инсулином.
Передозировка
Симптомы: в ходе клинических исследований сообщалось о передозировках до 4 мг в однократной дозе и до 4 мг в неделю. Наиболее частой HP, о которой сообщалось, была тошнота. Все пациенты выздоровели без осложнений.
Лечение: специфического антидота при передозировке препарата Оземпик® не существует. В случае передозировки рекомендуется проведение соответствующей симптоматической терапии. Учитывая длительный Т1/2 препарата (примерно 1 неделя), может потребоваться продолжительный период наблюдения и лечения симптомов передозировки.
Лекарственное взаимодействие
Исследования семаглутида in vitro показали очень небольшую вероятность ингибирования или индукции ферментов системы цитохрома Р450 (CYP) и ингибирования транспортеров лекарственных препаратов.
Задержка опорожнения желудка при применении семаглутида может оказывать влияние на всасывание сопутствующих пероральных лекарственных препаратов. Семаглутид следует применять с осторожностью у пациентов, получающих пероральные лекарственные препараты, для которых необходима быстрая абсорбция в ЖКТ.
Парацетамол
При оценке фармакокинетики парацетамола во время теста стандартизированного приема пищи было выявлено, что семаглутид задерживает опорожнение желудка. При одновременном применении семаглутида в дозе 1 мг AUC0-60 мин и Cmax парацетамола снизились на 27% и 23%, соответственно. Общая экспозиция парацетамола (AUC0-5 ч) при этом не изменялась. При одновременном приеме семаглутида и парацетамола коррекция дозы последнего не требуется.
Пероральные гормональные контрацептивные средства
Не предполагается, что семаглутид снижает эффективность пероральных гормональных контрацептивных средств. При одновременном применении комбинированного перорального гормонального контрацептивного препарата (0.03 мг этинилэстрадиола/0.15 мг левоноргестрела) и семаглутида последний не оказывал клинически значимого влияния на общую экспозицию этинилэстрадиола и левоноргестрела. Экспозиция этинилэстрадиола не была затронута; наблюдалось увеличение на 20% экспозиции левоноргестрела в равновесном состоянии. Cmax не изменилась ни для одного из компонентов.
Аторвастатин
Семаглутид не изменял системную экспозицию аторвастатина после применения однократной дозы аторвастатина (40 мг). Cmax аторвастатина снизилась на 38%. Это изменение было расценено как клинически незначимое.
Дигоксин
Семаглутид не изменял системную экспозицию или Cmax дигоксина после применения однократной дозы дигоксина (0.5 мг).
Метформин
Семаглутид не изменял системную экспозицию или Cmax метформина после применения метформина в дозе 500 мг 2 раза/сут в течение 3.5 дней.
Варфарин
Семаглутид не изменял системную экспозицию или Cmax R- и S-изомеров варфарина после применения однократной дозы варфарина (25 мг). На основании определения МНО клинически значимых изменений фармакодинамических эффектов варфарина также не наблюдалось.
Несовместимость
Вещества, добавленные к препарату Оземпик®, могут вызвать деградацию семаглутида. Оземпик® нельзя смешивать с другими лекарственными средствами, в т.ч. с инфузионными растворами.
Условия хранения препарата Оземпик®
Препарат следует хранить в недоступном для детей месте при температуре от 2°С до 8°С (в холодильнике), но не рядом с морозильной камерой; защищать от света; не замораживать. Предохранять от воздействия избыточного тепла и света.
Срок годности препарата Оземпик®
Срок годности — 3 года. Не применять по истечении срока, указанного на этикетке шприц-ручки и упаковке.
Используемую или переносимую в качестве запасной шприц-ручку с препаратом хранить при температуре не выше 30°С или при температуре от 2°С до 8°С (в холодильнике) в течение 6 недель. Не замораживать. После использования закрывать шприц-ручку колпачком для защиты от света.
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
НОВО НОРДИСК ООО
(Россия)

|
|
121614 Москва, |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. ВОЗМОЖНЫ ПОБОЧНЫЕ ЭФФЕКТЫ. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА.Жидкие сахарозаменителиЛанцеты для глюкометровПолоски для глюкометровПри диабетеСахарозаменители в таблеткахСтевия
Содержание статьи
- «Оземпик»: для чего
- «Оземпик» действующее вещество
- «Оземпик»: дозировка
- «Оземпик» побочные эффекты
- «Оземпик» ГРЛС
- «Оземпик» аналоги
- «Оземпик» и «Саксенда»
- Задайте вопрос эксперту по теме статьи
По данным ВОЗ за период с 1980 по 2014 г. количество людей, страдающих диабетом, выросло со 108 миллионов до 422 миллионов. С 2000 по 2016 г. преждевременная смертность от диабета увеличилась на 5%.
Здоровое питание, регулярная физическая активность, поддержание здоровой массы тела и воздержание от употребления табака помогут предупредить или отсрочить возникновение диабета 2-го типа. Он является одной из ведущих причин слепоты, почечной недостаточности, сердечных приступов, инсульта и ампутации нижних конечностей. Важно вовремя начать его лечение и регулярно контролировать глюкозу в крови.
В качестве терапии врачи назначают препарат «Оземпик». Расскажем о нем подробнее. Для чего его применяют, какое действующее вещество, какая дозировка препарата содержится и вводится, проявляются ли побочные эффекты и имеются ли у него аналоги.
«Оземпик»: для чего
Препарат «Оземпик» показан к применению у людей с хроническим заболеванием — сахарный диабет 2-го типа. Он применяется совместно с диетотерапией и физическими нагрузками для улучшения контроля глюкозы. Может назначаться в качестве:
- самостоятельного лечения (не в комплексе);
- комбинированной терапии с другими сахароснижающими препаратами (метформином, тиазолидиндионом) у пациентов, не достигших адекватного гликемического контроля при проведении предшествующей терапии;
- комбинированной терапии с инсулином у пациентов, не достигших адекватного гликемического контроля на терапии препаратом «Оземпик» и метформином.
Вам может быть интересно: Диета при повышенном сахаре
«Оземпик» действующее вещество
В составе лекарственного препарата содержится действующее вещество — семаглутид.
«Оземпик»: дозировка
Препарат представляет из себя шприц-ручку, заполненную лекарственным средством. Дозировка действующего вещества составляет 1,34 мг в 1 мл. В шприц-ручке объемом 1,5 мл содержится 2 мг действующего вещества.
Препарат вводят подкожно 1 раз в неделю. В одной дозе может содержаться 0,25 мг или 0,5 мг действующего вещества. Дозировку подбирают индивидуально, но обычно первые 4 недели препарат вводят в дозе 0,25 мг. Последующее введение препарата назначается по 0,5 мг.
«Оземпик» побочные эффекты
При применении препарата часто возникают такие побочные эффекты, как:
- головокружение;
- тошнота, диарея, рвота;
- утомляемость;
- развитие гипогликемии.
«Оземпик» ГРЛС
Препарат зарегистрирован в госреестре лекарственных средств. «Оземпик» полностью производится в Дании. Компания «Ново Нордиск» производит как субстанцию для препарата, так и собирает сам препарат.
Хотите разбираться в аналогах лекарств, чтобы умело подбирать препараты на свой бюджет? Наша методичка от экспертов-провизоров «Аналоги популярных лекарств» поможет вам в этом! Получить методичку просто: подпишитесь на наши соцсети и напишите в сообщения «аналоги».
Мегаптека в соцсетях: ВКонтакте, Telegram, OK, Viber
«Оземпик» аналоги
Аналогами препарата по фармакологической группе, но с разными действующими веществами являются следующие препараты:
- «Саксенда»;
- «Баета»;
- «Виктоза».
Не следует заменять «Оземпик» на эти препараты без консультации врача.
«Оземпик» и «Саксенда»
Оба препарата относятся к фармакологической группе гипогликемическое средство — аналог глюкагоноподобного пептида-1. Но действующие вещества и показания к применению у них разные. «Саксенда» тоже самостоятельно применяется при сахарном диабете 2 типа без дополнительных лекарств.
Показания к применению лекарственного средства «Саксенда» — снижение массы тела у взрослых при ИМТ выше 30. Его действующее вещество — лираглутид. Совместное применение «Саксенда» и «Оземпик» невозможно.
Подведем итоги о лекарственном средстве «Оземпик». Это гипогликемическое средство. Назначается для лечения сахарного диабета 2-го типа в комплексе с физическими упражнениями и диетотерапией. Может применяться в качестве монотерапии, а также совместно с другими препаратами. Например, «Метформином».
«Оземпик» представляет собой шприц-ручк, в которой содержиться лекарственное вещество. С помощью этой шприц-ручки подкожно вводится необходимая доза вещества. Укол ставят 1 раз в неделю.
Из проявления побочных эффектов, часто встречается головокружение, тошнота, диарея, развитие гипогликемии. «Оземпик» имеет 3 аналогичных препарата с похожим действием.
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Также вы можете поделиться своим опытом с другими читателями Мегасоветов.
Выпускающий редактор
Эксперт-провизор
Поделиться мегасоветом
Понравилась статья? Расскажите маме, папе, бабушке и тете Гале из третьего подъезда
Оземпик
Производитель: Ново Нордиск А/С
Номер регистрации в РК:
№ РК-ЛС-5№024719
Информация о регистрации в РК:
04.09.2020 — 04.09.2025
- Скачать инструкцию медикамента
Торговое наименование
Оземпик®
Международное непатентованное название
Семаглутид
Лекарственная
форма, дозировка
Раствор
для подкожного введения, 1,34 мг/мл, (шприц-ручка
1 мг/доза)
Фармакотерапевтическая группа
Пищеварительный
тракт и обмен веществ. Препараты,
применяемые при диабете. Препараты
снижающие уровень глюкозы в крови, исключая инсулины.
Глюкогоноподобного пептида-1 (ГПП-1) аналоги.
Семаглутид
Код
АТХ A10BJ06
Показания к применению
Оземпик®
показан для применения у взрослых пациентов с сахарным диабетом 2
типа с недостаточным контролем в качестве дополнения к диете и
физическим упражнениям
• в
качестве монотерапии при нецелесообразности назначения метформина в
связи с непереносимостью или противопоказаниями
• в
дополнение к другим лекарственным препаратам для лечения диабета.
Перечень
сведений, необходимых до начала применения
Противопоказания
Гиперчувствительность
к действующему веществу или любому из вспомогательных веществ (См.
раздел «Состав лекарственного
препарата»)
Необходимые
меры предосторожности при применении
Семаглутид
не следует применять у пациентов с сахарным диабетом 1 типа или для
лечения диабетического кетоацидоза. Семаглутид не является
заменителем инсулина.
Семаглутид
не рекомендуется применять у пациентов с хронической сердечной
недостаточностью IV функционального класса (по классификации NYHA),
т.к. опыт применения отсутствует.
Воздействие
на желудочно-кишечный тракт (ЖКТ)
Применение
агонистов рецептора ГПП-1 может ассоциироваться с нежелательными
реакциями со стороны ЖКТ. Это следует учитывать при лечении пациентов
с нарушением функции почек, поскольку тошнота, рвота и диарея могут
стать причиной обезвоживания, что может способствовать ухудшению
функции почек (см. раздел «Описание
нежелательных реакций, которые
проявляются при стандартном применении ЛП и меры, которые следует
принять в этом случае»).
Острый
панкреатит
Острый
панкреатит был отмечен при применении агонистов рецептора ГПП-1.
Пациентам следует сообщить о характерных симптомах острого
панкреатита. При подозрении на панкреатит семаглутид необходимо
отменить. При подтверждении панкреатита терапию семаглутидом
возобновлять не следует. У пациентов с панкреатитом в анамнезе
препарат следует применять с осторожностью.
Гипогликемия
Пациенты,
получающие семаглутид в комбинации с препаратами сульфонилмочевины
или инсулином, подвержены более высокому риску развития гипогликемии.
Во время начала лечения семаглутидом риск развития гипогликемии может
быть снижен за счет уменьшения дозы препаратов сульфонилмочевины или
инсулина (см. раздел «Описание
нежелательных реакций, которые
проявляются при стандартном применении ЛП и меры, которые следует
принять в этом случае»).
Диабетическая
ретинопатия
У
пациентов с диабетической ретинопатией, получавших инсулин и
семаглутид, наблюдалось увеличение риска развития диабетической
ретинопатии (см. раздел «Описание
нежелательных реакций, которые
проявляются при стандартном применении ЛП и меры, которые следует
принять в этом случае»).
У пациентов с диабетической ретинопатией, получавших инсулин,
применять семаглутид следует с осторожностью. Данных пациентов
необходимо тщательно наблюдать и проводить лечение в соответствии с
клиническими рекомендациями. Быстрое улучшение контроля концентрации
глюкозы ассоциировалось с временным ухудшением диабетической
ретинопатии, но нельзя исключить и другие механизмы ее развития.
Взаимодействие
с другими лекарственными препаратами
Семаглутид
вызывает задержку опорожнения желудка и потенциально влияет на
скорость всасывания сопутствующих пероральных лекарственных
препаратов. У пациентов, принимающих пероральные лекарственные
препараты, которые требуют быстрого всасывания из желудочно-кишечного
тракта, семаглутид следует применять с осторожностью.
Парацетамол
Оценка
фармакокинетики парацетамола во время теста стандартизованного приема
пищи показала, что семаглутид вызывает задержку опорожнения желудка.
При совместном применении с семаглутидом 1 мг AUC0-60мин
и Сmax
парацетамола снизились на 27% и 23%, соответственно. При этом общая
экспозиция парацетамола (AUC0-5ч)
не изменилась. При совместном применении с семаглутидом коррекция
дозы парацетамола не требуется.
Пероральные
контрацептивы
Семаглутид
не снижает эффективность пероральных контрацептивов, поскольку
семаглутид не оказал клинически значимого влияния на общую экспозицию
этинилэстрадиола и левоноргестрела при совместном применении
комбинированного перорального контрацептивного препарата (0,03 мг
этинилэстрадиола/0,15 мг левоноргестрела) и семаглутида. Препарат не
повлиял на экспозицию этинилэстрадиола, в равновесной концентрации
наблюдалось повышение экспозиции левоноргестрела на 20%. Сmax
не изменилась ни для одного из компонентов.
Аторвастатин
Семаглутид
не изменил общую экспозицию аторвастатина после введения однократной
дозы аторвастатина (40 мг). Сmax
аторвастатина снизилась на 38%. Данное снижение было расценено как
клинически не значимое.
Дигоксин
Семаглутид
не изменил общую экспозицию или Cmax
дигоксина после приема однократной дозы дигоксина (0,5 мг).
Метформин
Семаглутид
не изменил общую экспозицию или Cmax
метформина после приема в дозе 500 мг 2 раза в сутки в течение 3,5
дней.
Варфарин
Семаглутид
не изменил общую экспозицию или Cmax
R- и S-варфарина после приема однократной дозы варфарина (25 мг),
также клинически значимое воздействие на фармакодинамический эффект
варфарина, измеренный с применением международного нормализованного
отношения (МНО), не было отмечено. Однако после начала терапии
семаглутидом у пациентов, получающих варфарин или другие производные
кумарина, рекомендуется более частый контроль MHO.
Специальные
предупреждения
Особые
группы пациентов
Пациенты
пожилого возраста
Не
требуется коррекции дозы в зависимости от возраста. Опыт
применения
препарата у пациентов ≥ 75 лет ограничен.
Пациенты
с почечной недостаточностью
У
пациентов с нарушением функции почек легкой, средней или тяжелой
степени коррекция дозы не требуется.
Опыт
применения семаглутида у пациентов с тяжелым нарушением функции почек
ограничен.
Семаглутид
не рекомендуется применять у пациентов с терминальной стадией
почечной недостаточности.
Пациенты
с печеночной недостаточностью
У
пациентов с нарушением функции печени коррекция дозы не требуется.
Опыт применения семаглутида у пациентов с тяжелым нарушением функции
печени ограничен. У данных пациентов применять семаглутид следует с
осторожностью.
Применение
в педиатрии
Не
рекомендуется применение препарата
у детей и подростков до 18
лет, так как эффективность и безопасность применения у данной
возрастной группы не установлена.
Во
время беременности или лактации
Если
Вы беременны или кормите грудью, а также при подозрении на
беременность или планировании беременности, перед применением
препарата проконсультируйтесь с Вашим лечащим врачом.
Препарат
не следует применять
во время беременности, так как не изучено влияние на плод.
Следовательно, при
применении препарата Оземпик® рекомендуется использовать меры
контрацепции. Лечение
препаратом следует прекратить, по крайней мере, за 2 месяца до
запланированной беременности. Если Вы забеременели в период
применения препарата, немедленно сообщите своему лечащему врачу, так
как может потребоваться изменение лечения.
Во
время грудного вскармливания применять препарат не следует, так как
неизвестно, выделяется ли препарат с грудным молоком.
Особенности
влияния препарата на способность управлять транспортным средством или
потенциально опасными механизмами
При
применении препарата в комбинации с препаратами сульфонилмочевины или
инсулином рекомендуется соблюдать меры предосторожности во избежание
развития низкого уровня сахара в крови (гипогликемии), так как это
может снизить способность к концентрации. Избегайте управления
транспортным средством или работы с механизмами, если у Вас имеются
любые признаки низкого уровня сахара в крови. См. разделы «Перечень
сведений, необходимых до начала применения» и «Описание
нежелательных реакций, которые
проявляются при стандартном применении ЛП и меры, которые следует
принять в этом случае» для
ознакомления с признаками низкого уровня сахара в крови.
Проконсультируйтесь с Вашим
лечащим врачом для дальнейшей информации.
Содержание
натрия
Препарат
содержит менее 1 ммоль натрия (23 мг) на дозу, т.е. препарат «не
содержит натрий».
Рекомендации
по применению
Всегда
применяйте препарат в соответствии с предписаниями Вашего лечащего
врача. Проконсультируйтесь с Вашим лечащим врачом, если Вы не
уверены.
Режим
дозирования
-
Начальная
доза препарата составляет 0,25 мг семаглутида один раз в неделю
в течение 4 недель. -
Через
4 недели Ваш лечащий врач будет увеличивать Вашу дозу до 0,5 мг один
раз в неделю. -
Ваш
лечащий врач может увеличить дозу до 1 мг один раз в неделю в
случае, если Ваш уровень сахара в крови недостаточно контролируется
при применении дозы 0,5 мг один раз в неделю.
Не
меняйте Вашу дозу до тех пор, пока это не порекомендует Ваш лечащий
врач.
Метод
и путь введения
Оземпик®
представлен в виде раствора для подкожного введения. Препарат нельзя
вводить в вену или в мышцу.
-
Рекомендуемые
места для подкожного введения – передняя поверхность бедра,
передняя стенка живота или плечо. Перед использованием шприц-ручки в
первый раз, медицинский работник обучит Вас как использовать
шприц-ручку.
Подробная
информация описана в разделе «Инструкция
по применению препарата Оземпик®»
на обратной стороне этой инструкции.
Частота
применения с указанием времени приема
-
Вам
следует вводит препарат один раз в неделю в один и тот же день
каждой недели, если возможно. -
Вы
можете сами вводить препарат подкожно в любое время суток независимо
от приема пищи.
Рекомендуется
отметить выбранный день недели (например, среда) на картонной пачке и
записывать дату на картонной пачке каждый раз, когда Вы сделали
инъекцию препарата, чтобы помочь Вам запомнить введение инъекции
препарата только один раз в неделю.
При
необходимости, Вы можете изменить день еженедельного введения
препарата так, чтобы интервал времени между двумя инъекциями
составлял не менее 3 суток. После выбора нового дня введения
препарата, следует продолжить введение один раз в неделю.
Меры,
которые необходимо принять в случае передозировки
В
случае, если Вы использовали дозу препарата Оземпик® больше, чем
Вам следует, необходимо немедленно обратиться к Вашему лечащему
врачу. У Вас могут развиться нежелательные реакции, например,
тошнота.
Меры,
необходимые при пропуске одной или нескольких доз лекарственного
препарата
В
случае, если Вы забыли сделать инъекцию Вашей дозы:
-
Если
прошло 5 дней или менее, с тех пор как Вам следовало ввести
пропущенную дозу препарата Оземпик®, сделайте инъекцию сразу,
как только Вы вспомнили. Затем сделайте инъекцию Вашей следующей
дозы как обычно в выбранный день недели по Вашему графику. -
Если
прошло более 5 дней, с тех пор как Вам следовало ввести пропущенную
дозу препарата Оземпик®, то пропущенную дозу следует пропустить.
Затем сделайте инъекцию Вашей следующей дозы как обычно в выбранный
день недели по Вашему графику.
Ни
в коем случае нельзя вводить двойную дозу препарата Оземпик® для
восполнения пропущенной дозы.
Указание
на наличие риска симптомов отмены
Не
прекращайте применение препарата Оземпик®, предварительно не
проконсультировавшись с Вашим лечащим врачом. Если Вы прекратите
применять препарат, Ваш уровень сахара в крови может повыситься.
Рекомендации
по обращению за консультацией к медицинскому работнику для
разъяснения способа применения лекарственного препарата
Если
у Вас есть какие-либо вопросы по применению препарата Оземпик®,
пожалуйста обратитесь за консультацией к медицинскому работнику для
разъяснения способа применения лекарственного препарата.
Описание
нежелательных реакций, которые
проявляются при стандартном применении ЛП и меры, которые следует
принять в этом случае
Показатели
частоты встречаемости нежелательных реакций определены следующим
образом: очень часто (≥ 1/10), часто (≥ 1/100, но < 1/10),
нечасто (≥1/1,000, но < 1/100), редко (≥ 1/10,000, но <
1/1,000) и очень редко (< 1/10,000). В каждой группе частоты
развития нежелательные реакции представлены по снижению степени
серьезности.
Очень
часто
Нарушения
со стороны обмена веществ и питания
-
Гипогликемияа
при применении с инсулином или препаратами сульфонилмочевины
Нарушения
со стороны желудочно-кишечного тракта
-
Тошнота
-
Диарея
Часто
Нарушения
со стороны обмена веществ и питания
—
Гипогликемияа
при применении с другими ПГГП
—
Снижение аппетита
Нарушения
со стороны нервной системы
—
Головокружение
Нарушения
со стороны органов зрения
—
Осложнения диабетической ретинопатииb
Нарушения
со стороны желудочно-кишечного тракта
—
Рвота
—
Боль в животе
—
Вздутие
живота
—
Запор
—
Диспепсия
—
Гастрит
—
Гастроэзофагеальная рефлюксная болезнь
—
Отрыжка
—
Метеоризм
Нарушения
со стороны печени и желчевыводящих путей
—
Холелитиаз
Общие
расстройства и нарушения в месте введения
—
Слабость
Лабораторные
и инструментальные данные
—
Увеличение концентрации липазы
—
Увеличение концентрации амилазы
—
Снижение веса
Нечасто
Нарушения
со стороны нервной системы
—
Дисгевзия
Нарушения
со стороны сердца
—
Увеличение частоты сердечных сокращений
Общие
расстройства и нарушения в месте введения
—
Реакции в месте введения
Редко
Нарушения
со стороны иммунной системы
—
Анафилактическая реакция.
а)
Гипогликемия,
определенная как тяжелая (требующая помощи другого человека) или
симптоматическая в комбинации с концентрацией глюкозы крови < 3,1
ммоль/л
b)
Осложнения диабетической ретинопатии включают в себя: необходимость в
фотокоагуляции сетчатки, лечения интравитреальными препаратами,
кровоизлияние в стекловидное тело, развитие слепоты, связанной с
диабетом (нечасто). Частота основана на исследовании
сердечно-сосудистых исходов.
Описание
отдельных нежелательных реакций
Гипогликемия
При
применении семаглутида в монотерапии эпизоды гипогликемии тяжелой
степени не наблюдались. Гипогликемия тяжелой степени в основном
наблюдалась при применении семаглутида в комбинации с препаратами
сульфонилмочевины (1,2 % пациентов, 0,03 явлений на пациенто-лет) или
инсулином (1,5 % пациентов, 0,02 явлений на пациенто-лет).
Наблюдалось несколько эпизодов (0,1 % пациентов, 0,001 явлений на
пациенто-лет) при применении семаглутида в комбинации с пероральными
гипогликемическими препаратами, за исключением сульфонилмочевины.
Нежелательные
реакции со стороны желудочно-кишечного тракта
Тошнота
отмечалась у 17,0 % и 19,9 % пациентов, получавших семаглутид 0,5 мг
и 1 мг, соответственно, диарея — у 12,2 % и 13,3 % и рвота — у 6,4 %
и 8,4 %. Большинство явлений были легкой и средней степени тяжести и
непродолжительными. Явления стали причиной преждевременного
прекращения лечения у 3,9 % и 5 % пациентов. Чаще всего о явлениях
сообщалось в первые месяцы лечения.
При
лечении семаглутидом нежелательные явления со стороны ЖКТ могут чаще
развиваться у пациентов с низкой массой тела.
Осложнения
диабетической ретинопатии
В
ходе 2-летнего клинического исследования наблюдали 3,297 пациентов с
сахарным диабетом 2 типа, высоким риском развития сердечно-сосудистых
осложнений, длительным течением диабета и неадекватным контролем
глюкозы крови. В данном исследовании подлежащие оценке явления
осложнений диабетической ретинопатии развились у большего числа
пациентов, получавших семаглутид (3,0 %) по сравнению с плацебо (1,8
%). Они наблюдались у пациентов, получавших инсулин, с диабетической
ретинопатией в анамнезе. Разница между видами лечения появилась рано
и сохранялась на протяжении всего исследования. Систематическая
оценка осложнений диабетической ретинопатии выполнялась только в
исследовании сердечно-сосудистых исходов. В клинических исследованиях
продолжительностью до 1 года с участием 4,807 пациентов с сахарным
диабетом 2 типа, связанные с диабетической ретинопатией нежелательные
явления регистрировались с аналогичной частотой, у получавших
семаглутид (1,7 %) и препараты сравнения (2,0 %).
Преждевременное
прекращение по причине нежелательного явления
Частота
преждевременного прекращения лечения в связи с развитием
нежелательных явлений составила 6,1 % и 8,7 % у пациентов, получавших
лечение семаглутидом 0,5 мг и 1 мг, соответственно, по сравнению с
1,5 % у пациентов, получавших плацебо. Наиболее частыми
нежелательными явлениями, ставшими причиной преждевременного
прекращения, были явления со стороны ЖКТ.
Реакции
в месте введения
Реакции
в месте введения (т.е. сыпь, покраснение в месте введения) были
зарегистрированы у 0,6 % и 0,5 % пациентов, получавших семаглутид 0,5
мг и 1 мг, соответственно. Данные реакции обычно были
незначительными.
Иммуногенность
В
соответствии с потенциальными иммуногенными свойствам лекарственных
препаратов, содержащих протеины или пептиды, у пациентов после
лечения семаглутидом могут образоваться антитела. Доля пациентов с
положительными результатами анализа на антитела к семаглутиду в любой
период времени после начального этапа была низкой (1-2 %), ни у
одного пациента не были выявлены антитела, нейтрализующие семаглутид,
или антитела с нейтрализующим действием в отношении эндогенного ГПП-1
в конце исследования.
Увеличение
частоты сердечных сокращений
Увеличение
ЧСС наблюдается при применении аналогов ГПП-1. В исследованиях 3a
фазы, среднее увеличение от 1 до 6 ударов в минуту (увм) от исходного
уровня от 72 до 76 ударов в минуту наблюдались у пациентов,
получавших Оземпик®. В долгосрочных исследованиях у пациентов с
высоким кардио-васкулярным риском, 16 % пациентов, получавших
Оземпик®, имели увеличение в ЧСС >10 увм, в сравнении с 11 % в
группе плацебо после 2 лет лечения.
При
возникновении нежелательных лекарственных реакций обращаться к
медицинскому работнику, фармацевтическому работнику или напрямую в
информационную базу данных по нежелательным реакциям (действиям) на
лекарственные препараты, включая сообщения о неэффективности
лекарственных препаратов РГП
на ПХВ «Национальный центр экспертизы лекарственных средств и
медицинских изделий» Комитета контроля качества и безопасности
товаров и услуг Министерства здравоохранения Республики Казахстан
http://www.ndda.kz
Дополнительные
сведения
Состав
лекарственного препарата
Один мл
препарата содержит
активное
вещество – семаглутид*, 1.34 мг,
*аналог
человеческого глюкагоноподобного пептида-1 (ГПП-1), получено с
использованием клеток Saccharomyces
cerevisiae по технологии
рекомбинантной ДНК.
Одна
предварительно заполненная шприц-ручка содержит 4 мг семаглутида* в 3
мл раствора. Каждая доза содержит 1 мг семаглутида в 0,74 мл
раствора.
вспомогательные
вещества – натрия гидрофосфата
дигидрат, пропиленгликоль, фенол, кислота хлороводородная/натрия
гидроксид (для коррекции рН), вода для инъекций.
Описание
внешнего вида, запаха, вкуса
Прозрачный
бесцветный или почти бесцветный раствор, без помутнения, практически
свободный от механических включений.
Форма выпуска и упаковка
По
3 мл препарата в картриджи из стекла класса I,
укупоренные поршнями из хлорбутиловой резины с одной стороны и
алюминиевыми колпачками с дисками из бромбутиловой
резины/полиизопрена, с другой стороны. Картридж встроен в
многодозовую шприц-ручку для многократных инъекций.
По
1 шприц-ручке вместе с инструкцией по медицинскому применению на
казахском и русском языках и 4 одноразовыми иглами НовоФайн® Плюс
помещают в пачку из картона.
Срок хранения
3
года.
Срок
годности после первого вскрытия: 6 недель.
Не
применять по истечении срока годности!
Дата
окончания срока хранения означает последний день указанного месяца.
Условия хранения
Хранить
при температуре от 2 °С до 8 °С (в холодильнике), вдали от
охлаждающего элемента. Не замораживать.
После
первого вскрытия: хранить при температуре не выше 30°С.
Допускается хранение в холодильнике (2°С-8°С). Не
замораживать. Хранить шприц-ручку с закрытым колпачком для защиты от
света.
Не
хранить шприц-ручку с присоединённой иглой.
Хранить
в недоступном для детей месте!
Условия отпуска из аптек
По
рецепту
Сведения
о производителе / Держатель
регистрационного удостоверения
Ново
Нордиск А/С,
Ново
Алле,
DK-2880
Багсваерд, Дания
Телефон:
+7 (727) 330 77 88
eaeu—safety@novonordisk.com
Наименование,
адрес и контактные данные (телефон, факс, электронная почта)
организации
на
территории Республики Казахстан, принимающей претензии (предложения)
по качеству лекарственных средств от потребителей и
ответственной
за пострегистрационное наблюдение за безопасностью лекарственного
средства
ТОО
«Ново Нордиск Казахстан»
Казахстан,
город Алматы, Медеуский район, Проспект Достык, дом 38, Бизнес центр
«Кен Дала», Блок Б, 8 этаж, почтовый индекс 050010.
телефон:
+7 (727) 330 77 88
eaeu—safety@novonordisk.com
Оземпик®,
НовоФайн®
и НовоТвист®
— зарегистрированные торговые марки, принадлежащие компании Ново
Нордиск A/С, Дания.
©
20XX
Ново
Нордиск А/С
Инструкция
по применению препарата Оземпик® раствор для подкожного введения,
1 мг/доза в
предварительно заполненной шприц-ручке.
Внимательно
прочитайте данную инструкцию перед
применением предварительно заполненной шприц-ручки Оземпик®.
Используйте
шприц-ручку только после того, как Вы научитесь ею пользоваться под
руководством врача или медсестры.
Начните
с проверки маркировки шприц-ручки, чтобы
убедиться, что в ней содержится препарат Оземпик® 1 мг/доза,
затем
посмотрите на представленные ниже иллюстрации, чтобы ознакомиться с
различными частями шприц-ручки и иглы.
Если
Вы слабовидящий или у Вас имеются серьёзные проблемы со зрением, и Вы
не можете различить цифры на счётчике дозы, не используйте
шприц-ручку без посторонней помощи. Помочь
Вам может человек с хорошим зрением, обученный использованию
предварительно заполненной шприц-ручки препарата Оземпик®.
Данная
шприц-ручка является предварительно заполненной шприц-ручкой для
многократного введения. Шприц-ручка содержит 4 мг семаглутида и
позволяет выбрать только дозу 1 мг.
Шприц-ручка
разработана для использования с одноразовыми иглами НовоФайн® или
НовоТвист® длиной до 8 мм.
Иглы
НовоФайн® Плюс включены в упаковку.
1.
Подготовка шприц-ручки с новой иглой к использованию
• Проверьте
название и цветовой код на этикетке шприц-ручки,
чтобы убедиться, что в ней содержится препарат Оземпик®
1 мг/доза.
Это особенно важно, если Вы применяете более одного типа
инъекционного препарата. Использование неправильного препарата может
нанести серьезный вред Вашему здоровью.
• Снимите
колпачок со шприц-ручки.
• Убедитесь,
что раствор в шприц-ручке прозрачный и
бесцветный.
Посмотрите в окошко
шприц-ручки. Если раствор выглядит мутным и не бесцветным, не
используйте шприц-ручку.
• Возьмите
новую иглу
и удалите защитную наклейку.
Если
защитная наклейка повреждена, не используйте иглу, так как в этом
случае стерильность не гарантируется.
• Наденьте
иглу на шприц-ручку и поверните её, чтобы игла плотно держалась на
шприц-ручке.
• Снимите
наружный колпачок иглы, но не выбрасывайте его.
Он понадобится Вам после завершения инъекции, чтобы безопасно снять
иглу со шприц-ручки.
• Снимите и
выбросьте внутренний колпачок иглы.
Если Вы попытаетесь надеть внутренний колпачок обратно на иглу, Вы
можете случайно уколоться иглой.
На
конце иглы может появиться капля раствора. Это нормальное явление,
однако, Вы всё равно должны проверить поступление препарата, если Вы
используете новую шприц-ручку в первый раз. Смотрите операция 2
«Проверка
поступления препарата».
Не
присоединяйте новую иглу к
шприц-ручке
до
тех пор, пока Вы не будете готовы сделать инъекцию.
Всегда
используйте новую иглу для каждой инъекции.
Это уменьшит риск
закупорки игл, загрязнения, инфицирования и введения неправильной
дозы препарата.
Никогда
не используйте иглу, если она погнута или повреждена.
2.
Проверка поступления препарата
• Перед
первой инъекцией с помощью каждой новой шприц-ручки проверьте
поступление препарата.
Если шприц-ручка уже находится в использовании, то перейдите к
операции 3 «Установка дозы».
• Поворачивайте
селектор дозы, пока
счётчик дозы не покажет символ проверки поступления препарата
().
• Держите
шприц-ручку иглой вверх.
Нажмите
пусковую кнопку и удерживайте её в этом положении, пока
счётчик дозы не возвратится к «0». «0» должен
стоять напротив указателя дозы.
На
конце иглы должна появиться капля раствора.
На
конце иглы может оставаться маленькая капля, но она не будет введена
при инъекции.
Если
капля раствора на конце иглы не появилась,
повторите операцию 2 «Проверка поступления препарата», но
не более 6 раз. Если капля раствора так и не появилась, поменяйте
иглу и повторите операцию 2 «Проверка поступления препарата»
ещё раз.
Если
капля раствора так и не появилась, утилизируйте
шприц-ручку и используйте новую.
Всегда
перед
использованием новой шприц-ручки в первый раз убедитесь
в том, что на
конце иглы
появилась капля раствора. Это
гарантирует поступление препарата.
Если капля раствора
не появилась, препарат не
будет введён,
даже если счётчик дозы будет двигаться. Это
может указывать на то, что игла закупорена или повреждена.
Если Вы не проверите
поступление препарата перед первой инъекцией с помощью каждой новой
шприц-ручки, Вы можете не ввести необходимую дозу и ожидаемый эффект
препарата Оземпик® не будет достигнут.
3.
Установка дозы
Поверните
селектор дозы, чтобы выбрать дозу 1 мг.
Продолжайте
поворачивать до тех пор, пока счётчик дозы не остановится и не
покажет «1 мг».
Только
счётчик дозы и указатель дозы покажут, что был выбран 1 мг.
При
каждом повороте селектора дозы раздаются щелчки, звук щелчков зависит
от того, в какую сторону вращается селектор дозы: вперёд, назад или,
если Вы пытаетесь набрать дозу больше 1 мг. Не считайте щелчки
шприц-ручки.
Всегда
перед каждой инъекцией проверяйте, что Вы выбрали дозу 1 мг по
счётчику дозы и указателю дозы.
Не считайте щелчки
шприц-ручки.
Доза 1 мг должна
находиться точно напротив указателя дозы – такое положение
гарантирует, что Вы получите правильную дозу препарата.
Сколько
препарата осталось
Чтобы определить,
сколько препарата осталось, используйте
счётчик дозы:
Поворачивайте селектор дозы до остановки
счётчика дозы.
Если он показывает
«1», в шприц-ручке осталось не
менее 1 мг препарата.
Если счётчик
дозы остановился до того, как появился символ
1,
то это означает, что в шприц-ручке осталось недостаточное количество
препарата, чтобы ввести полную дозу 1 мг.
Если
в шприц-ручке осталось недостаточное количество препарата для
введения полной дозы, не используйте шприц-ручку. Используйте новую
шприц-ручку Оземпик®.
4. Введение
препарата
• Введите
иглу под кожу, используя
технику инъекций, рекомендованную врачом или медсестрой.
• Убедитесь,
что счётчик дозы находится в поле Вашего зрения.
Не дотрагивайтесь до счётчика дозы пальцами – это может
прервать инъекцию.
• Нажмите
пусковую кнопку до упора и удерживайте её в этом положении, пока
счётчик дозы не покажет «0».
«0»
должен находиться точно напротив указателя дозы. При этом Вы можете
услышать или ощутить щелчок.
• Удерживайте
иглу под кожей после того, как
счётчик дозы вернулся к «0» и медленно
считайте до 6.
Это
делается для того, чтобы быть уверенным, что Вы получили полную дозу.
• Если Вы
извлечёте иглу из-под кожи раньше, Вы можете увидеть, как препарат
вытекает из кончика иглы. В этом случае будет введена неполная доза
препарата.
• Извлеките
иглу из-под кожи (рис.
D).
Если в месте инъекции появилась кровь, слегка прижмите к месту укола
ватный тампон. Не
массируйте
место
укола.
После
завершения инъекции Вы можете увидеть каплю раствора на конце иглы.
Это нормально и не влияет на дозу препарата, которую Вы ввели.
-
Всегда
сверяйтесь с показаниями счётчика дозы, чтобы знать, какое
количество мг препарата Вы ввели. Удерживайте
пусковую кнопку до тех пор, пока счётчик дозы не покажет «0».
Как выявить
закупорку или повреждение иглы
– Если после
долгого нажатия на пусковую кнопку на счётчике дозы не появляется
«0», это может означать закупорку или повреждение иглы.
– В этом
случае Вы не
получили
препарат, даже если счётчик дозы изменил положение с исходной дозы,
которую Вы установили.
Что
делать с закупоренной иглой
Замените
иглу как описано в операции 5 «После завершения инъекции»
и повторите все шаги, начиная с операции 1 «Подготовка
шприц-ручки с новой иглой к использованию». Убедитесь, что Вы
выбрали полную необходимую Вам дозу.
Никогда
не дотрагивайтесь до счётчика дозы во время введения препарата. Это
может прервать инъекцию.
5.
После завершения инъекции
• Положив
наружный колпачок иглы на плоскую поверхность, введите
конец иглы внутрь колпачка, не
касаясь его или иглы.
• Когда игла
войдёт в колпачок, осторожно
наденьте наружный колпачок на иглу.
• Отвинтите
иглу и
утилизируйте иглу, в соответствии с местными требованиями.
Проконсультируйтесь с Вашим врачом об утилизации острых предметов.
• После
каждого использования надевайте
на шприц-ручку колпачок шприц-ручки, чтобы
защитить содержащийся в ней раствор от воздействия света.
Всегда
после каждой инъекции выбрасывайте иглу, чтобы
обеспечить комфортную инъекцию и избежать закупорки игл. Если игла
закупорена, Вы не
введёте себе препарат.
Выбрасывайте
пустую шприц-ручку с
отсоединённой иглой
в соответствии с рекомендациями Вашего врача, медсестры, фармацевта
или в соответствии с местными требованиями.
Никогда
не пытайтесь надеть внутренний колпачок иглы обратно на иглу. Вы
можете уколоться иглой.
После
каждой инъекции всегда сразу удаляйте иглу со шприц-ручки.
Это уменьшит риск
закупорки игл, загрязнения, инфицирования, вытекания раствора и
введения неправильной дозы препарата.
Дополнительная
важная информация
• Всегда
храните шприц-ручку и иглы к ней в
недоступном для всех, и
в особенности для детей, месте.
• Никогда
не передавайте свою
шприц-ручку и иглы к ней другим лицам.
• Лица,
осуществляющие уход за больным, должны
обращаться с использованными иглами с особой осторожностью, чтобы
предотвратить уколы иглой и перекрёстное инфицирование.
Уход
за шприц-ручкой
Аккуратно
обращайтесь со шприц-ручкой. Небрежное обращение или неправильное
использование могут привести к введению неправильной дозы препарата.
Если это произойдет, Вы не получите ожидаемый эффект от препарата.
• Не
применяйте препарат Оземпик®, если он был заморожен.
Если
Вы сделаете это, Вы можете не получить ожидаемый эффект от препарата.
• Не
применяйте препарат Оземпик®,
если он подвергся воздействию прямых солнечных лучей.
Если
это произойдет, Вы можете не получить ожидаемый эффект от препарата.
• Предохраняйте
шприц-ручку от попадания на неё пыли, загрязнений и жидкости.
• Не
мойте шприц-ручку, не погружайте её в жидкость и не смазывайте её.
При
необходимости шприц-ручку можно очищать влажной тканью, смоченной
мягким моющим средством.
• Нельзя
ронять или
ударять шприц-ручку
о
твёрдую поверхность.
Если Вы уронили шприц-ручку или сомневаетесь в её исправности,
присоедините новую иглу и проверьте поступление препарата перед тем,
как сделать инъекцию.
• Не
пытайтесь повторно заполнить шприц-ручку.
Пустую шприц-ручку необходимо выбросить.
• Не
пытайтесь самостоятельно починить шприц-ручку или
разобрать её на части.
| Ozempic_1_mg_leaflet_ru_final.docx | 1.61 кб |
| Оземпик_1_мг_каз_оканч_вар.doc | 1.99 кб |








 Всегда для каждой инъекции используйте новую иглу.
Всегда для каждой инъекции используйте новую иглу. Всегда перед использованием новой шприц-ручки в первый раз убедитесь в том, что на конце иглы появилась капля раствора. Это гарантирует поступление препарата.
Всегда перед использованием новой шприц-ручки в первый раз убедитесь в том, что на конце иглы появилась капля раствора. Это гарантирует поступление препарата. 
 Всегда перед каждой инъекцией проверяйте какое количество мг препарата Вы набрали по счётчику дозы и указателю дозы.
Всегда перед каждой инъекцией проверяйте какое количество мг препарата Вы набрали по счётчику дозы и указателю дозы.
 Если в шприц-ручке осталось недостаточное количество препарата для введения полной дозы, не используйте шприц-ручку. Используйте новую шприц-ручку Оземпик®.
Если в шприц-ручке осталось недостаточное количество препарата для введения полной дозы, не используйте шприц-ручку. Используйте новую шприц-ручку Оземпик®. Всегда сверяйтесь с показаниями счётчика дозы, чтобы знать, какое количество мг препарата Вы ввели. Удерживайте пусковую кнопку до тех пор, пока счётчик дозы не покажет «0». Как выявить закупорку или повреждение иглы
Всегда сверяйтесь с показаниями счётчика дозы, чтобы знать, какое количество мг препарата Вы ввели. Удерживайте пусковую кнопку до тех пор, пока счётчик дозы не покажет «0». Как выявить закупорку или повреждение иглы
 Никогда не пытайтесь надеть внутренний колпачок обратно на иглу. Вы можете уколоться.
Никогда не пытайтесь надеть внутренний колпачок обратно на иглу. Вы можете уколоться. 





 Всегда для каждой инъекции используйте новую иглу.
Всегда для каждой инъекции используйте новую иглу. Всегда перед использованием новой шприц-ручки в первый раз убедитесь в том, что на конце иглы появилась капля раствора. Это гарантирует поступление препарата.
Всегда перед использованием новой шприц-ручки в первый раз убедитесь в том, что на конце иглы появилась капля раствора. Это гарантирует поступление препарата. 
 Всегда перед каждой инъекцией но счётчику дозы и указателю дозы проверяйте, что был набран 1 мг.
Всегда перед каждой инъекцией но счётчику дозы и указателю дозы проверяйте, что был набран 1 мг.
 Если в шприц-ручке осталось недостаточное количество препарата для введения полной дозы, не используйте шприц-ручку. Используйте новую шприц-ручку Оземпик®.
Если в шприц-ручке осталось недостаточное количество препарата для введения полной дозы, не используйте шприц-ручку. Используйте новую шприц-ручку Оземпик®. 



 Всегда сверяйтесь с показаниями счётчика дозы, чтобы знать, какое количество мг препарата Вы ввели. Удерживайте пусковую кнопку до тех пор, пока счётчик дозы не покажет «0». Как выявить закупорку или повреждение иглы
Всегда сверяйтесь с показаниями счётчика дозы, чтобы знать, какое количество мг препарата Вы ввели. Удерживайте пусковую кнопку до тех пор, пока счётчик дозы не покажет «0». Как выявить закупорку или повреждение иглы Никогда не пытайтесь надеть внутренний колпачок обратно на иглу. Вы можете уколоться.
Никогда не пытайтесь надеть внутренний колпачок обратно на иглу. Вы можете уколоться.