На чтение 32 мин. Просмотров 7 Опубликовано 24.11.2022
31 декабря 2019 года заканчивается эксперимент по маркировке лекарственных препаратов, и уже с 1 января 2020 года работа в ГИС Маркировка станет обязательным. Предлагаем вашему вниманию подробную инструкцию для аптек и медицинских учреждений для работы по новым правилам.
Главная цель внедрения маркировки – это противодействие производству и обороту недоброкачественной, а также контрафактной и фальсифицированной продукции. Покупатель, отсканировав QR-код, сможет увидеть:
общие сведения о лекарстве: наименование производителя, адрес фирмы, информацию о составе, сроке службы, условиях хранения и многое другое.
проверить легальность продукции.
Для маркировки лекарств используется система автоматизированного учёта и мониторинга движения лекарственных препаратов медицинского назначения (МДЛП). Она дополняет государственную регистрацию и экспертизу лекарств, позволяя отслеживать все этапы их оборота — от производителя до конечного потребителя. Основная цель внедрения системы — борьба с контрафактной продукцией.
МДЛП создавалась и развивалась в несколько этапов:
- 1 февраля 2017 года — начало эксперимента и создание системы под контролем Минздрава, Росздравнадзора, Минпромторга и ФНС.
- 1 ноября 2018 года — переход системы МДЛП к оператору Центр развития перспективных технологий (Оператор-ЦРПТ) и её включение в единую национальную систему маркировки и прослеживаемости товаров Честный ЗНАК.
- 1 июля 2019 года — начало регистрации аптек и медицинских учреждений в системе МДЛП для работы с препаратами из перечня высокозатратных нозологий.
- 1 октября 2019 года — начало обязательной маркировки первой категории лекарств — препаратов из перечня федеральной программы «Семь высокозатратных нозологий» (7ВЗН).
- 1 января 2020 года — плановый срок начала обязательной маркировки всех лекарственных препаратов (перенесён из-за неготовности участников оборота).
- 1 июля 2020 года — начало обязательной маркировки лекарств с массовым запуском системы мониторинга.
Требуемый опыт работы: 3–6 лет
Полная занятость, полный день
Работодатель, вероятно, уже нашел нужного кандидата и больше не принимает отклики на эту вакансию
Проверка технической документации, получаемой в ходе проведения фармацевтической разработки от контрактных организаций. Проведение литературного поиска для обеспечения разработки лекарственных препаратов.
Навыки: Знания: Фармакопейных требований РФ и мировых фармакопей. Высшее профессиональное (фармацевтическое, химическое, биотехнологическое или биологическое). Опыт работы от 2 лет.
Взаимодействие с англоязычными партнерами (разные страны) по организации процесса регистрации лекарственных препаратов. Ведение процесса регистрации и последующего внесения изменений, а.
Высшее фармацевтическое / медицинское / биологическое образование. Подтвержденный опыт работы в регистрации лекарственных препаратов не менее 3-х лет. Интерес к процессам.
Ведение реестра поставщиков. Проверка сертификатов на товары в поставках. Составление передаточных документов для б2б отгрузок. Мониторинг информационного обмена.
Опыт работы с маркировкой приветствуется. Свободное владение компьютером. Опытный пользователь MS Office (excel). Знание процессов ритейла, цепей поставок, электронной коммерции.
Обработка импорта маркируемой продукции: Работа с базой данных маркируемой продукции. Кураторство работы маркирующего склада: Работа в различных ПО, связанных с.
Высшее образование. Знание английского: базовый уровень (читать, писать со словарем). Умение работать в Microsoft Excel (уверенный пользователь), 1С (желательно).
Контроль бизнес-процессов Компании, связанных с соблюдением технологических требований по работе с товарами, в системе «Честный Знак». Контроль за нанесением.
Опыт работы в ЛК системы «Честный Знак». Понимание бизнес-процессов и технологических цепочек, связанных с товарооборотом маркируемой продукции (от эмиссии.
Подбор размера стикера на основании фото отчёта от специалиста по качеству. Подбор действующей ДС на каждое SKU. Подготовка макета на.
Высшее образование, желательно профильное. Знание графических редакторов. Опыт работы в данном направлении от 1 года. Продвинутый пользователь Microsoft Office.
Содержание
- Как начать работать в ГИС Маркировка?
- Что входит в обязанности фармацевта
- Штраф или лишение свободы?
- Работайте с нами
- Видео
- Как работает ФГИС МДЛП
- Каким требованиям должны отвечать участники оборота лекарственных препаратов
- Сроки перемен
- Специалист по регистрации лекарственных препаратов
- Маркировка лекарств при импорте
- Сколько времени дали на маркировку?
- Можно ли обойти маркировку импорта лекарств
- Чем регистрация в ГС 1РУС важна для системы «Честный ЗНАК»
- Что нужно для маркировки товара
- Порядок регистрации в системе маркировки лекарств
- Как наносить Data Matrix на продукцию
- Подведём итоги
- Штрафы за отсутствие маркировки
- Подключитесь к системе маркировки самостоятельно
Как начать работать в ГИС Маркировка?
Предлагаем Вам пошаговую инструкцию по внедрению системы маркировки лекарственных средств:
Обеспечьте УКЭП сотрудников (для работы).
Обратите внимание на то, что Вам необходимо зарегистрировать в ИС МДЛП используемую в Вашей организации информационную систему, с помощью которой предполагается выполнять обмен данными с ИС МДЛП.
Что касается программного обеспечения, то обратите внимание на то, что Центр развития перспективных технологий (ЦРПТ) и фирма «1С» провели совместное тестирование обновленных версий программных продуктов «1С:Розница. Аптека», «1С:Управление аптечной сетью» и продуктов линейки «1С:Медицина» с поддержкой информационной системы мониторинга движения лекарственных препаратов (ИС МДЛП).
Необходимо оборудовать рабочее место сотрудника аптеки: компьютер, сканер двумерных штрих-кодов (DataMatrix) или терминал сбора данных (АТОЛ SMART. DROID 2D), УКЭП. При выборе сканера для считывания маркировки подойдут «2D-типы» сканеров штрих-кодов, например, Motorola DS4308-HD, в характеристиках которых указано, что он способен сканировать штрих-код «DataMatrix». Для удобства использования, рекомендуется приобретать беспроводные сканеры с USB-интерфейсом. Компьютер должен иметь операционную систему Windows 7 или новее / Mas OS X 10. 8 или новее.
Игорь Усманов
специалист компании «Аудэкс»
Департамент автоматизации учета
Что входит в обязанности фармацевта
Обязанности фармацевта включают в себя:
- изготовление лекарств и подготовку сопроводительных документов;
- розничную и оптовую торговлю препаратами.
Кто такой фармацевтВ процессе профориентации и на рынке труда не удается избежать путаницы из-за того, что нет единого понимания, кто такие фармацевты и какие их обязанности, чем занятость отличается от работы провизоров. Фармацевт — это профессия в сфере производства и оборота лекарственных препаратов. Работают фармацевты и провизоры в аптеках, фармацевтических предприятиях, НИИ и оптовых фирмах. В классификации должностей медицинских работников фармацевт — нижний профессионально-квалификационный уровень этой категории штатных позиций фармацевтических организаций. Следующий — провизор, провизор-технолог. В таблице кратко изложены основные данные о должностях и функциональных обязанностях фармацевта и провизора и приведены их сравнительные характеристики. Описание трудовых функций специалиста на должности фармацевта, что входит в обязанности фармацевта в аптеке и на оптовом складе, требования к его квалификационному уровню, знаниям и умениям содержит профессиональный стандарт 02. 075.
Переход с устаревших квалификационных справочников на профессиональные стандарты завершается. В настоящее время действуют следующие основные правила.
Функциональная карта профессиональной деятельности специалиста в сфере обращения лекарственных средств содержит три обобщенные функции со следующими характеристиками:
- уровень квалификации 5 — одинаковый для каждой;
- одинаковое название должности для всех штатных позиций, рекомендованное работодателям;
- цель — удовлетворение потребностей граждан в лекарственных препаратах и товарах аптечного ассортимента надлежащего качества.
Требования к специалистуКак правило, профессиональные стандарты содержат перечень должностей от более низкой к высокой — от описания обобщенной функции исполнителя к функциям руководителя. Обсуждаемый стандарт описывает три равные по профессионально-квалификационным требованиями должностные позиции, различающиеся сферой занятости:
- розничная торговля;
- изготовление препаратов (в том числе ветеринарных);
- оптовая торговля.
Необходимое образование, условия допуска указаны в пунктах 3. 1–3. 3 (ПС 02. 075).
Требуемые знания и умения перечислены в указанных разделах внутри каждой трудовой функции. В примере знания и умения, необходимые для оформления документации по изготовлению лекарственного препарата.
Если работодатель обязан применять профессиональные стандарты (ПС), используется рекомендуемое стандартом название должности. В противном случае сотрудник теряет право на положенные выплаты и компенсации. Что входит в обязанности фармацевтаТрудовые обязанности специалиста фиксируются в должностной инструкции. Документ составляется с использованием ГОСТ Р 7. 97-2016 и методики сборника профстандартов. Особенность заключается в наличии части с перечислением трудовых функций. Требуемые знания и умения традиционно перечисляются в разделе с общими сведениями. Для специалиста, выполняющего должностные обязанности в аптеке и занимающегося изготовлением лекарственных форм (п. 2 ПС 02. 075), начало инструкции имеет вид, представленный ниже — в нем выполняемых функций две.
Перечень делегируемых фармацевту обобщенных функций работодатель определяет самостоятельно, в зависимости от размера предприятия и его структурных особенностей. Должностные обязанности раскрываются через трудовые действия, см. 1 и 3. 2 (ПС 02. 075).
Права и ответственностьСпециалист-фармацевт, как и любой работник, наделяется правами и ответственностью согласно действующему законодательству.
Закончила Тверской государственный университет в 1987 году (тогда он назывался Калининский) по специальности «Экономика труда». Имеет степень кандидата экономических наук (научная специальность – Экономика и управление народным хозяйством).
146
Публикаций
1682
Дней на портале
0
Комментариев
Требования, предъявляемые к сотрудникам правоохранительных органов:
- возрастные — старше 18 лет;
- владение русским языком;
- профессионально-квалификационные, в зависимости от состава службы;
- необходимое состояние здоровья.
Обязанности специалиста по закупкам в зависимости от уровня квалификации и структуры организации включают в себя:
- документационное и информационное обеспечение;
- проведение процедуры;
- прием результатов и экспертизу;
- контроль стадий.
Должностные обязанности директора по строительству содержат ключевую функцию — стратегическое развитие и оперативное управление службой заказчика организации:
- стратегическое планирование и управление;
- оптимизация планов реализации проектов;
- контроль организации и осуществления работ;
- рационализация капиталовложений.
Федеральное агентство по здравоохранению и социальному развитию
Государственное образовательное учреждение высшего профессионального образования
МОСКОВСКАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ имени И. СЕЧЕНОВА
СТАРШЕГО ПРОВИЗОРА Директор Клинического центра
ЦЕНТРАЛИЗОВАННОЙ АПТЕКИ _____________ Г. Кавалерский
«___» _______________ 20__ года
На должность старшего провизора __________________ отдела (далее – отдел) централизованной Аптеки (далее – Аптека) Клинического центра (далее – КЦ) ГОУ ВПО ММА им. Сеченова Росздрава (далее – Академия) принимается лицо, имеющее высшее профессиональное образование по специальности «Фармация», послевузовское и (или) дополнительное профессиональное образование и сертификат специалиста по специальности «Управление и экономика фармации», «Фармацевтическая технология», «Фармацевтическая химия и фармакогнозия», без предъявления требований к стажу работы.
Старший провизор назначается на должность приказом директора Клинического центра по согласованию с заведующим отделом на основании трудового договора. Освобождается от должности приказом директора КЦ в соответствии с действующим законодательством РФ.
Старший провизор непосредственно подчиняется заведующему отделом.
Распоряжения старшего провизора являются обязательными для подчиненных ему провизоров, среднего и младшего фармацевтического персонала отдела.
Старший провизор должен знать законы и иные нормативные правовые акты Российской Федерации по вопросам фармации; фармацевтическое дело; организацию и экономику аптечной службы; нормативные и методические документы по технологии изготовления, контролю качества лекарственных средств, фармацевтическому порядку, санитарному режиму; маркетинг лекарственных средств и изделий медицинского назначения; методы получения и обработки научно-технической информации; основы функционирования бюджетно-страховой медицины и добровольного медицинского страхования; медицинскую этику; психологию профессионального общения; основы трудового законодательства; правила внутреннего распорядка; правила по охране труда и пожарной безопасности.
В своей работе старший провизор руководствуется действующим законодательством Российской Федерации в сфере здравоохранения, в частности, Основами законодательства Российской Федерации об охране здоровья граждан, законодательством о медицинском страховании граждан в Российской Федерации, приказами и инструкциями Минздрава РФ, Минздравсоцразвития России, Уставом Академии, приказами и распоряжениями ректора Академии, директора КЦ, распоряжениями заведующего Аптекой, Положением о КЦ, Положением о централизованной аптеке, Положением об отделе _______________, Правилами внутреннего распорядка, другими локальными актами Академии, принятыми в установленном порядке, и настоящей должностной инструкцией.
На время отсутствия старшего провизора (отпуск, период временной нетрудоспособности, командировка и т. ) его обязанности может исполнять провизор отдела на основании приказа директора КЦ по представлению заведующего отделом.
Старший провизор работает по графику, установленному Положением о _____________________ отделе Централизованной аптеки.
Основными задачами старшего провизора являются:
Изготовление лекарственных средств.
Старший провизор обязан (должностные обязанности указываются с учетом особенностей труда работников в конкретном структурном подразделении в соответствии с приказами Минздравсоцразвития России, а также действующими приказами Минздрава России, Минздрава СССР, Минздрава РСФСР, Минздравмедпрома СССР и т
Осуществлять прием рецептов, требований клиники, поликлиники ММА им. Сеченова, межклинических подразделений, отпуск лекарственных средств и изделий медицинского назначения в соответствии с действующими правилами, хранение лекарственных средств и изделий медицинского назначения в соответствии с их физико-химическими свойствами и установленными правилами хранения.
Изготавливать лекарственные средства.
Проводить контроль качества поступающих и изготовленных в Аптеке лекарственных средств, применяя все виды внутриаптечного контроля и фармацевтического анализа.
Информировать врачей о наличии и применении лекарственных средств и изделий медицинского назначения, проводить санитарно-просветительную работу по вопросам их применения.
Участвовать в оформлении заявок на получение, прием и распределение лекарственных средств и изделий медицинского назначения.
Руководить работой подчиненных ему провизоров.
Вести необходимую учетно-отчетную документацию.
Планировать и анализировать результаты своей работы.
Немедленно информировать заведующего аптекой обо всех происшествиях и чрезвычайных ситуациях в работе аптеки и принятых мерах.
Проходить в установленные сроки периодические медицинские осмотры.
Систематически повышать свою квалификацию.
— трудовую дисциплину;
— правила внутреннего распорядка;
— принципы медицинской этики и деонтологии;
— санитарно-противоэпидемического режима
— охраны труда и техники безопасности
— противопожарной защиты.
Старший провизор имеет право:
Получать информацию, необходимую для выполнения своих должностных обязанностей.
Претендовать на присвоение ему или подтверждение соответствующей квалификационной категории.
Отдавать распоряжения и указания подчиненным ему провизорам, среднему и младшему фармацевтическому персоналу, по вопросам входящим в его компетенцию, и контролировать их исполнение.
Вносить предложения заведующему отделом по вопросам улучшения организации работы отдела и условий своего труда.
Участвовать в работе совещаний, конференций, симпозиумов и т. , на которых рассматриваются вопросы, связанные с работой Аптеки, в установленном в Академии порядке.
Старший провизор несет ответственность за:
ненадлежащее исполнение или неисполнение своих должностных обязанностей, предусмотренных настоящей должностной инструкцией, за нарушение трудовой дисциплины, положений Устава Академии, правил внутреннего распорядка, иных локальных актов, а также несоблюдение санитарно-эпидемического режима, правил и норм охраны труда, техники безопасности и противопожарной защиты в пределах, определенных действующим законодательством Российской Федерации;
правонарушения, совершенные в процессе осуществления своей деятельности, в т. разглашение врачебной тайны, незаконное и нецелевое использование лекарственных средств, изделий медицинского назначения, расходных материалов, материально-технических средств отдела, электроэнергии и других ресурсов в пределах, определенных действующим законодательством Российской Федерации;
3 причинение материального ущерба в пределах, определенных трудовым и гражданским законодательством Российской Федерации.
Заместитель директора КЦ __________________
по лечебной работе
Заведующий аптекой ___________________
Заведующий отделом ___________________
Начальник отдела кадров КЦ О. Нечаева
Начальник планово-финансового отдела Т. Астахова
Начальник юридического отдела О. Тамразова
Председатель профкома Л. Белова
старший провизор ознакомлен:
(ФИО, подпись, число — от руки)
Штраф или лишение свободы?
В случае несоблюдения требований об обязательной маркировке продукции аптеки и медицинские учреждения понесут несут как административную, так и уголовную ответственность:
· административный штраф до 300 тыс. руб. с изъятием непромаркированной продукции
· уголовная ответственность наступает в случаях, когда стоимость непромаркированной продукции превышает крупный или особо крупный размер (от 1,5 млн руб. ) и облагается штрафом в размере до 300 тыс. руб. или лишением свободы до 3 лет со штрафом до 80 тыс. руб.
Работайте с нами
Наши специалисты проведут подключение маркировки «под ключ»: вам нужно будет только начать работать! Настройка, регистрация, запуск, обучение — доверьте все нашим профессионалам.
Выгодно
Гибкая ценовая политика, предложения и скидки для новых и постоянных клиентов. Мы предоставляем возможность приобрести все необходимое для маркировки в одном месте по оптимальной стоимости.
Квалифицированные специалисты, собственный склад — вам не придется ждать.
Быстро
Проводим подключение силами собственных квалифицированных специалистов и с оборудованием, находящимся на собственном складе — вам не придется ждать.
Удобно
Мы предлагаем комплексный подход к обязательной маркировке: оборудование, ПО и сопровождение от А до Я. Все для маркировки в одном месте «под ключ» быстро и качественно!
Видео
Поскольку проект по маркировке лекарственных препаратов реализуется на протяжении уже нескольких лет, нормативная база создавалась постепенно. На сегодняшний день она представлена:
- Федеральным законом «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ в последней редакции.
- Постановлением Правительства РФ от 24 января 2017 г. № 62 «О проведении эксперимента по маркировке контрольными (идентификационными) знаками и мониторингу за оборотом отдельных видов лекарственных препаратов для медицинского применения» с изменениями и дополнениями от 30.12.2017, 28.08.2018 и 07.08.2019.
- Постановлением Правительства РФ от 14 декабря 2018 г. № 1556 «Об утверждении Положения о системе мониторинга движения лекарственных препаратов для медицинского применения» с изменениями и дополнениями от 30.08.2019.
- Постановлением Правительства РФ от 14 декабря 2018 г. № 1557 «Об особенностях внедрения системы мониторинга движения лекарственных препаратов для медицинского применения».
- Постановлением Правительства РФ от 14 декабря 2018 г. № 1558 «Об утверждении Правил размещения общедоступной информации, содержащейся в системе мониторинга движения лекарственных препаратов для медицинского применения, в информационно-телекоммуникационной сети „Интернет“ (в том числе в форме открытых данных)».
- Постановлением Правительства РФ от 8 мая 2019 г. № 577 «Об утверждении размера платы за оказание услуг по предоставлению кодов маркировки, необходимых для формирования средств идентификации и обеспечения мониторинга движения товаров, подлежащих обязательной маркировке средствами идентификации, а также о порядке её взимания».
Как работает ФГИС МДЛП
В системе регистрируются участники оборота лекарственных препаратов медицинского назначения:
- производители;
- дистрибьюторы и логистические компании;
- аптеки;
- медицинские организации.
С 1 июля 2020 года обязанность по маркировке лекарственных препаратов распространится на все лекарства и всех участников оборота.
Оборот немаркированных лекарств с 1 июля 2020 года будет запрещён, за исключением:
- препаратов, произведённых до 1 июля 2020 года;
- препаратов, произведённых до 31 декабря 2019 года и предназначенных для обеспечения больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, злокачественными новообразованиями лимфоидной, кроветворной и родственных им тканей, рассеянным склерозом, а также для обеспечения лиц после трансплантации органов и (или) тканей.
Указанные выше лекарства можно реализовывать, хранить и применять до истечения срока годности.
Для каждого участника в системе МДЛП создаётся свой личный кабинет и предусмотрен свой набор действий по регистрации, направлению сведений в систему и информационному взаимодействию.
Общая схема работы в системе МДЛП:
- Зарегистрированные в системе производители наносят на каждую упаковку лекарственного препарата уникальный идентификационный код — DataMatrix. Код запрашивается у оператора системы через регистратор эмиссии и выдаётся системой. Он наносится на потребительскую (вторичную) упаковку, а если её нет — на первичную упаковку. Сведения о маркировке производители направляют в систему МДЛП.
- Дистрибьюторы, логистические компании и аптеки считывают код с каждого товара и передают в систему сведения о полученных и реализованных лекарственных препаратах.
- Аптеки, осуществляющие бесплатную выдачу лекарств по рецептам, и медицинские организации передают через регистратор выбытия в систему сведения о расходе лекарственных препаратов.
Установить программное обеспечение для работы с квалифицированной подписью. И программное обеспечение, и инструкции по его установке выдаются удостоверяющим центром. В России для работы с сертификатами электронной цифровой подписи используются программы КриптоПро CSP, КриптоПро ЦЭП Browser plug-in и другой вспомогательный софт.
Каким требованиям должны отвечать участники оборота лекарственных препаратов
Маркировка не отменяет обязанностей участников оборота, связанных с экспертизой и государственной регистрацией лекарственных препаратов, как и в целом требований, предъявляемых к участникам рынка в соответствии с №61-ФЗ «Об обращении лекарственных средств». Однако в связи с внедрением обязательной маркировки появился ряд новых требований — они обеспечивают возможность работы в системе МДЛП и предусматривают:
- Наличие специального оборудования и программного обеспечения.
- Регистрацию в системе, для чего нужна квалифицированная электронная подпись.
- Соблюдение установленного порядка передачи сведений в систему для регистрации, маркировки и учёта движения лекарственных препаратов.
Производители (фармацевтические компании) должны быть оснащены регистратором эмиссии — промышленным программно-аппаратным комплексом для генерации ключа и проверочного кода, а также хранения кодов маркировки. Для его получения нужно подать заявку Оператору-ЦРПТ. С производителем заключаются договоры по предоставлению регистратора эмиссии и оказанию услуг по предоставлению кодов маркировки.
Медицинские организации и аптеки, осуществляющие бесплатную реализацию маркированных лекарственных препаратов, должны быть оснащены регистраторами выбытия по количеству мест ведения деятельности. Регистратор — это аналог онлайн-кассы, только для фиксации бесплатного отпуска лекарств. Устройства поставляются Оператором-ЦРПТ, который также обеспечивает их обслуживание.
Не требуется оснащать регистратором выбытия:
- медучреждения Минобороны;
- медицинские (врачебные) кабинеты, действующие в школах, детсадах или в других организациях, при условии, что такие кабинеты входят в структуру медицинской организации;
- структурные подразделения, которые получают препараты из своей головной медицинской организации;
- аптеки (пункты, киоски), которые не реализуют препараты на бесплатной основе по рецепту.
Аптеки, которые занимаются розничной продажей лекарственных препаратов, могут ограничиться имеющимся оборудованием — онлайн-кассой и присоединённым сканером для считывания кода (2D сканер штрихкода). Если розничной продаже сопутствует выдача лекарств по льготным рецептам, нужно дополнительно оснастить аптеку регистратором выбытия.
Зарегистрированные дистрибьюторы используют имеющиеся программно-технические средства, но их обязательно необходимо интегрировать с системой МДЛП (в составе системы Честный ЗНАК).
Сроки перемен
Планируется маркировку вводить в 2020 поквартально:
I квартал – маркировка наносится на те препараты, которые уже маркировались экспериментальном режиме в 2017–2019 гг.
II квартал – маркировка наносится на все жизненно важные препараты, цена которых не превышает 500 руб.
III квартал – маркировка наносится на все жизненно важные препараты, цена которых не превышает 100 руб.
IV квартал – маркируются все остальные препараты.
Специалист по регистрации лекарственных препаратов
Другие названия должности: Специалист по фармакологической безопасности
Подчиняется: Начальник отдела стандартизации и регистрации лекарственных средств/ Руководитель группы регистрации лекарственных средств/ Руководитель отдела регистрации лекарственных средств
Подчинённые:
Цель: Осуществление работ по регистрации/перерегистрации новых продуктов (лекарственных средств). Задачи:Планирование, бюджетирование и выполнение работ по регистрации/перерегистрации новых продуктов (составов, доз, форм выпуска);
Ведение документооборота всех регистрационных процедур;
Отчётность, соблюдение намеченных планов по регистрации лекарственных средств, биологически активных добавок. Функции:Подготовка документов для формирования регистрационных досье и формирование регистрационных досье на лекарственные средства;
Подача регистрационных досье в регуляторные органы и отслеживание статуса прохождения процесса регистрации/перерегистрации/внесения изменений на лекарственные средства;
Учет и выдача в подразделения компании контрольно-разрешительных документов на лекарственные средства, поддержание актуальной электронной базы контрольно-разрешительных документов;
Поддержание в действии объектов интеллектуальной собственности (товарные знаки и патенты) компании– оплата годовых пошлин;
Организация работы по регулированию правоотношений, связанных с использованием объектов интеллектуальной собственности (товарных знаков, патентов), принадлежащих/используемых компанией – организация работ патентных поверенных и контроль исполнения;
Поддержание и регистрация штриховых кодов в системе ЮНИСКАН для лекарственных средств;
Разработка (в части необходимой информации), учет и выдача оригинал-макетов печатной и упаковочной продукции на лекарственные средства на основании макетов, предоставляемых дизайнером;
Подача документов на получение/переоформление лицензий на осуществление деятельности по производству лекарственных средств и фармацевтическую деятельность;
Мониторинг изменений законодательства, относящегося к обращению лекарственных средств;
Участие в разработке внутренней документации компании. Требования к опыту и квалификации: Специалист по регистрации лекарственных препаратов относится к категории специалистов. Высшее фармацевтическое, химико-технологическое, медицинское, биологическое
Знание Федерального Закона №61 «Об обращении лекарственных средств»;
Уверенный пользователь ПК;
Владение английским языком.
Маркировка лекарств при импорте
Первый этап внедрения принудительной маркировки импорта лекарственных препаратов начался ещё в июле 2019 года, когда медицинские организации стали регистрироваться на платформе «Честный ЗНАК». До 1 июля 2020 года маркировку проходили только препараты, относящиеся к списку высокозатратных нозологий. То есть препараты, которыми обеспечивались больные гемофилией, рассеянным склерозом, болезнью Гоше, гипофизарным нанизмом и другими частными недугами. Теперь маркируются все импортные и отечественные лекарства, независимо от назначения.
Важно! Обязательная маркировка не относится к препаратам, зарегистрированным в качестве биологически активной добавки. БАДы не подлежат маркированию.
Маркировку импорта лекарственных препаратов регулируют 13 нормативных документов — законодательные акты, распоряжения правительства и приказы соответствующих ведомств, — общий объём которых переваливает за сотню страниц. Наша выдержка содержит всё, что нужно знать импортёру о маркировке продукта.
Сколько времени дали на маркировку?
Планировалось, что с 1 июля 2020 года реализация препаратов без нанесения маркировочного кода и использования системы «Честный ЗНАК» будет запрещена. Перевозить средства в РФ можно было вплоть до 1 августа 2020 года, но только в том случае, если товар куплен и оплачен ещё до вступления в силу запрета на реализацию лекарств без маркировки. Импортёры должны были зарегистрировать товары до 1 сентября 2020 года.
Тем не менее многие оказались не готовы к изменениям — к началу 2020 года зарегистрировались не все организации. Процесс внедрения системы маркировки также был усложнён и пандемией.
В связи с этим Правительством было принято решение разрешить введение в оборот немаркированные ЛС, произведённые в период с 1 июля по 1 октября 2020 года, при условии согласования с Росздравнадзором. Такая схема оборота лекарств действовала до 1 января 2021 года.
Осенью 2020 года правительством было выпущено постановление № 1779, упростившее работу с системой маркировки.
Так до 1 июля 2021 года у аптек и медицинских учреждений есть возможность выводить ЛС из оборота сразу отправки в систему мониторинга уведомления поступлении препаратов.
Кроме того, до 1 июля 2021 также действует упрощённый механизм обратной приёмки ЛС при их ввозе на территорию России и обороте внутри страны. Согласно новой схеме, участникам оборота не нужно ждать подтверждения о приёмке, а импортёрам — подтверждения о ввозе. Система будет сама подтверждать данные при проверке кода товара и данных участника.
До 1 февраля 2021 года действовал упрощённый порядок оборота лекарственных средств, по которому производитель был обязан маркировать товар, а аптека — сканировать код на кассе.
Что говорит наш эксперт Евгений Мео.
Обратите внимание! Импортёр обязан маркировать продукцию до инициации таможенной процедуры. Маркировка лекарств для импортёров должна соответствовать международным стандартам. Проще говоря, регистрироваться нужно не только на платформе «Честный ЗНАК», но и в ГС 1РУС. Промаркировать препараты проще всего на производстве, однако если этого не произошло, необходимо самостоятельно произвести маркировку. Вы можете использовать специальные принтеры для этикеток со специализированной маркировочной лентой. А можете использовать обычный принтер или онлайн-кассу. Распечатанный код нужно наклеить на упаковку.
Важно! Качество расходных материалов имеет значение — печать должна продержаться не менее 5 лет. Используйте качественную чековую ленту, если применяете для маркировки онлайн-кассу.
Отправьте в Систему мониторинга движения лекарственных препаратов (МДЛП) данные о завершении стадии «выпускающий контроль качества лекарственного препарата (выпуск готовой продукции)». В документе должны быть указаны:
- дата совершения операции;
- индикатор иностранного держателя регистрационных удостоверений лекарственного препарата или ИНН/КПП его (иностранного держателя) представительства;
- наименование производителя лекарственного препарата, осуществляющего стадию «выпускающий контроль качества»;
- адрес производственной площадки, осуществляющей выпускающий контроль качества;
- номер производственной серии;
- дата истечения срока годности;
- перечень уникальных идентификаторов вторичной (потребительской) упаковки лекарственного препарата.
Направить эти сведения в систему МДЛП необходимо в течение пяти рабочих дней после завершения «выпускающий контроль качества», но до осуществления с товаром дальнейших операций.
Передайте в систему МДЛП сведения о результате выполнения операции агрегирования. В них должны содержаться:
- дата совершения операции;
- индикатор иностранного держателя регистрационных удостоверений лекарственного препарата или ИНН/КПП его (иностранного держателя) представительства;
- адрес места осуществления агрегации;
- перечень уникальных идентификаторов заводской (транспортной) упаковки вышестоящего уровня — для каждого из них в случае агрегирования первого уровня дополнительно указывается перечень уникальных идентификаторов потребительской упаковки, а в случае агрегирования второго уровня указывается перечень уникальных идентификаторов заводской (транспортной) упаковки.
Передать указанные сведения в систему МДЛП нужно также в течение пяти рабочих дней с момента выполнения операции агрегирования, но до осуществления с товаром дальнейших операций.
Направьте в систему МДЛП сведения о направлении товара (лекарственных препаратов) в Российскую Федерацию. Сообщение должно содержать:
- дату совершения операции;
- индикатор иностранного держателя регистрационных удостоверений лекарственного препарата или ИНН/КПП его (иностранного держателя) представительства;
- индикатор и название продавца лекарственных препаратов или ИНН (КПП) представителя продавца;
- ИНН (КПП) и название покупателя лекарственных препаратов;
- адрес грузоотправителя;
- цена, по которой товар отпускался производителем;
- перечень уникальных идентификаторов потребительской упаковки товара и/или перечень уникальных идентификаторов заводской (транспортной) упаковки товара.
Срок для подачи сведений установлен такой же: пять рабочих дней, но до осуществления с товаром дальнейших операций.
Отправьте в систему МДЛП информацию о том, что о ввоз лекарственных препаратов на таможенную территорию РФ был зарегистрирован, а товар был размещён в зоне таможенного контроля или перемещён между складами временного хранения. В документы должны быть указаны:
- дата совершения операции;
- ИНН (КПП) импортёра;
- индикатор и название продавца лекарственных препаратов или ИНН (КПП) представителя продавца;
- адрес грузоотправителя;
- адрес склада временного хранения (таможенного склада);
- отпускная цена производителя;
- перечень уникальных идентификаторов потребительской упаковки и (или) уникальных идентификаторов заводской (транспортной) упаковки.
Сведение необходимо подать в течение пяти рабочих дней с момента регистрации, но до осуществления с товаром дальнейших операций.
После выпуска ЛП для внутреннего потребления на территории РФ выберите контрольные образцы товаров, получившие подтверждение соответствия, и направьте в систему мониторинга сведения о них. Информация должна включать в себя:
- дату совершения операции;
- ИНН/КПП импортёра;
- Тип вывода из оборота;
- Вид документа подтверждения соответствия;
- декларацию о соответствии;
- сертификат соответствия;
- регистрационный номер и дату регистрации документа, подтверждающего соответствия;
- номер документа, подтверждающего выпуск лекарственных препаратов для внутреннего потребления;
- перечень уникальных идентификаторов потребительской упаковки.
Можно ли обойти маркировку импорта лекарств
Лекарства — одна из главных позиций импорта в РФ. Более 63% препаратов на рынке имеют иностранное происхождение. Маркировка продукции поможет избавиться от некачественной продукции и снизить число подделок в аптеках. Это предмет усиленного контроля — обойти маркировку не получится. Ошибки и несвоевременная маркировка лекарств для импортёров караются по закону. Обратите внимание! Если в связи с отсутствием маркировки компания нанесла ущерб потребителю лекарственного препарата, размер штрафа увеличивается. Более того, дело может перерасти в уголовное преследование.
Чем регистрация в ГС 1РУС важна для системы «Честный ЗНАК»
Данные из ГС 1РУС перенаправляются в «Честный ЗНАК» автоматически. Подробный порядок описания лекарственного препарата приведён на сайте честныйзнак. Импортёру следует указывать:
- полное название препарата и производителя, а также сертификационный номер;
- страну производителя лекарственного препарата;
- товарный знак, если есть;
- идентификационный код импортёра;
- название товара на этикетке;
- четыре первых знака кода номенклатуры.
Эта и другая информация будет перенаправлена в «Честный ЗНАК» в течение 24 часов с момента заполнения. Потом вы сможете увидеть их в «Личном кабинете» и распечатать коды. Если вы всё ещё не вступили в ГС 1РУС, нужно сделать это как можно скорее. Подробнее об условиях членства можно узнать на официальном сайте GS 1Russia.
Что нужно для маркировки товара
На маркированные лекарства наносится специальный код Data Matrix, который содержит полную информацию о товаре, начиная с названия и заканчивая реквизитами производителя. Фармацевт в аптеке сможет отсканировать этот код и проверить корректность описания, сравнив с данными из системы «Честный ЗНАК». Чтобы сформировать код Data Matrix, нужно:
Порядок регистрации в системе маркировки лекарств
С 1 июля 2020 года регистрацию должны пройти участники оборота лекарств, которые:
- не принимали участия в эксперименте;
- не попали под требования обязательной маркировки лекарств из перечня высокозатратных нозологий;
- только начинают свою деятельность на рынке производства и реализации лекарственных препаратов.
Для каждого из участников оборота (производитель, дистрибьютор, аптека, медучреждение) предусмотрен специфический набор действий по регистрации в системе и внедрению процессов в свою деятельность.
Все участники предварительно должны:
- Оформить усиленную квалифицированную электронную подпись (УКЭП) в одном из удостоверяющих центров, аккредитованных Минкомсвязью России. При наличии УКЭП необходимо проверить её соответствие требованиям. Она должна быть получена на имя руководителя юридического лица или на ИП, быть действующей, а указанные при оформлении сведения — точно совпадать с данными ЕГРЮЛ или ЕГРИП.
- Установить программное обеспечение и настроить его для работы с УКЭП.
- Заполнить профиль в личном кабинете.
- Зарегистрировать в системе места деятельности (производства), используемые на предприятии учётные системы и выпускаемые лекарственные препараты. Для регистрации лекарств обязательно указываются: GTIN товара (ЮНИСКАН ГС1 РУС), номер регистрационного удостоверения препарата и дата его регистрации.
- Установить, внедрить оборудование для взаимодействия с системой и наладить его работу. Это комплексная процедура, часть технологических и бизнес-процессов фармпроизводителя. В результате должны быть обеспечены нанесение кодов Data Matrix, их верификация, интеграция процессов с системой управления заказами (СУЗ) и системой Честный ЗНАК. Основные компоненты промышленного программно-аппаратного комплекса — регистратор эмиссии, СУЗ, интеграционное программное обеспечение.
- Протестировать работу программно-аппаратного комплекса и, если необходимо, обучить персонал.
- Интегрировать используемые программно-аппаратные комплексы (устройства и средства) с системой Честный ЗНАК.
- Протестировать процессы, порядок действий при приёмке лекарственных препаратов, формировании заказов и их отправке в аптечные и медицинские организации. В рамках тестирования необходимо заказать в техподдержке системы МДЛП тестовые коды и выполнить операции в тестовом контуре.
- Обновить программное обеспечение онлайн-кассы для передачи ОФД сведений о продаже маркированных лекарств. Проверить способность имеющегося 2D сканера штрихкода считывать DataMatrix, при необходимости приобрести такой сканер.
- Получить у Оператора-ЦРПТ и установить регистраторы выбытия в количестве, соответствующем числу мест ведения деятельности согласно данным лицензии (только для аптек, осуществляющих бесплатный отпуск лекарств).
- Протестировать процессы и действия в рамках работы с системой МДЛП. Для этого в техподдержке заказываются коды и выполняются операции в тестовом контуре.
- Устранить выявленные в ходе тестирования проблемы.
Медицинские организации должны:
- Получить у Оператора-ЦРПТ и установить регистраторы выбытия в количестве, соответствующем числу мест ведения деятельности согласно данным лицензии.
- Оборудовать рабочие места, установить необходимое для работы в системе программное обеспечение и оборудование, протестировать его. Программно-аппаратный комплекс включает регистратор выбытия, 2D сканер штрихкода, способный считывать DataMatrix, и медицинскую информационную систему (МИС), которая соответствует требованиям системы МДЛП. Работоспособность комплекса проверяется в тестовом контуре с помощью тестовых кодов, полученных в техподдержке системы МДЛП.
- Устранить выявленные в ходе тестирования проблемы и обучить персонал работе в системе.
Эта статья была полезной?
Подключитесь к ЭДО для маркировки
Заполните заявку вручную или загрузите сертификат ЭП
Оформиться в ГС 1РУС. С его помощью вы получите GTIN-код товара, который нужен сервису «Честный ЗНАК» для формирования Data Matrix. Нужно заполнить электронное заявление и подписать его с помощью УКЭП. Сделать это можно, используя любую из систем электронного документооборота. Подробнее о порядке вступления в ГС 1РУС прочитайте по ссылке на официальном сайте российского филиала компании.
Чтобы «Честный ЗНАК» сформировал Data Matrix, нужно представить GRIN-код, код удостоверения и дату регистрации ЛП. Остальные данные подгружаются автоматически из ЮНИСКАН ГС1 РУС. Проверьте их на корректность.
Как наносить Data Matrix на продукцию
Шаблоны для печати этикеток можно найти в профиле «Честного ЗНАКа», а чтобы качественно нанести знак, нужно иметь соответствующее оборудование. Напомним, что качество печати должно быть не ниже C-класса. Более того, должен присутствовать сканер для идентификации кодов и ПО для интеграции с системой управления заказами и платформой «Честный ЗНАК».
С 1 июля продажа препаратов без Data Matrix является незаконной. Это относится как к розничной, так и к оптовой реализации.
При проходе через таможню препарат уже должен содержать нанесённый на упаковку идентификатор Data Matrix. Его корректность будет проверяться сотрудниками таможни. Так как движение лекарств относится к объекту повышенного контроля, обойти маркировку никак не получится. Уклонение ведёт к штрафу вплоть до 300 000 рублей.
Подведём итоги
C 2020 года каждый препарат, зарегистрированный в качестве лекарственного средства, должен отображаться в системе «Честный ЗНАК». Обязанность регистрации лежит не только на производителе, аптеке, больнице или санатории, но и на импортёре ЛП в Россию. В связи с осложнениями, которые возникли из-за пандемии, всё ещё действуют некоторые послабления. Планируется, что с 1 июля 2021 года система обязательной маркировки ЛС начнёт работать согласно запланированной схеме.
Штрафы за отсутствие маркировки
За нарушение правил реализации товаров, подлежащих обязательной маркировке, российским законодательством предусмотрена ответственность
Подключитесь к системе маркировки самостоятельно
Приобретите 2D-сканер для считывания дата-матрикс кодов, терминал для сбора данных и принтер этикеток.
Обновите прошивку вашей кассы самостоятельно или с помощью наших специалистов.
Получите Квалифицированную электронную подпись для маркировки. Вы можете использовать уже имеющуюся.
Зарегистрируйтесь на сайте Честныйзнак. рф и GS1. Заполните самостоятельно данные о вашем предприятии в личном кабинете или обратитесь к нашим специалистам за помощью!
Получите комплексное предложение по маркировке
Получить усиленную квалифицированную подпись (УКЭП). Это аналог вашей обычной подписи для подписания электронных документов. Подтверждает личность и наделяет документ полной юридической силой. Получить УКЭП можно в любом аккредитованном удостоверяющем центре. Помните только, что УКЭП должна содержать сведения о компании, которую вы представляете при импорте лекарственных средств. Так, нельзя использовать подпись ИП, если дистрибуция осуществляется от лица ООО.
Prom-Nadzor.ru
Вы здесь
Должностная инструкция маркировщика
[организационно-правовая форма,
наименование организации, предприятия]
[должность, подпись, Ф. И. О. руководителя или иного
должностного лица, уполномоченного утверждать
должностную инструкцию]
[число, месяц, год]
Должностная инструкция маркировщика [наименование организации, предприятия и т. п.]
Настоящая должностная инструкция разработана и утверждена в соответствии с положениями Трудового кодекса Российской Федерации и иных нормативных актов, регулирующих трудовые правоотношения в Российской Федерации.
1. Общие положения
1.1. Маркировщик относится к категории рабочих.
1.2. Маркировщик назначается на должность и освобождается от нее приказом руководителя предприятия по представлению [вписать нужное] и подчиняется непосредственно [вписать нужное].
1.3. Маркировщик должен знать:
— стандарты и технические условия на маркировку продукции;
— шифр и условные обозначения маркировки;
— правила и способы маркировки продукции;
— номенклатуру, виды, сорта, марки, вес и размеры продукции, подлежащей маркировке;
— шрифты для надписей, способы и правила приготовления красок и клеящих составов;
— устройство и принцип работы маркировочных станков, прессов, электрографов, электроштампов и других аппаратов;
— места для клеймения, навешивания бирок, наклейки этикеток и т. д.;
— применяемые клеймы, их размеры и формы;
— назначение разметочного инструмента и приспособлений, применяемых при маркировке;
— причины бракованного нанесения клейма и способы его устранения;
— порядок оформления документов на маркируемую продукцию;
— правила и нормы охраны труда, техники безопасности и противопожарной защиты;
2. Должностные обязанности
2.1. Осуществляет маркировку различных грузов, изделий, деталей, полуфабрикатов, готовой продукции, упаковочной тары путем клеймения, штемпелевания, пломбирования, наклеивания этикеток, навешивания бирок вручную или с применением специальных маркировочных станков, прессов и автоматов в соответствии со стандартами и техническими условиями.
2.2. Изготавливает трафареты для маркировки продукции.
2.3. Производит четкое и грамотное нанесение на поверхность изделий, тары или бирки надписей, знаков, цифр, букв и других условных обозначений красками определенных цветов от руки, по трафарету, с помощью пистолетов и других распылительных устройств.
2.4. Закрепляет маркировочные надписи путем сушки или покрытия лаком.
2.5. Изготавливает и навешивает металлические знаки.
2.6. Проводит штемпелевание этикеток и бандеролей с занесением в них адресов и других надписей.
2.7. Приготавливает краски и клеящие составы.
2.8. Восстанавливает неясные клейма.
2.9. Осуществляет подбор клейм и определение их пригодности.
2.10. Проверяет качество клеймения и исправления брака.
2.11. Производит гашение или зачистку трафарета на таре, бывшей в употреблении.
2.12. Осуществляет промывку и чистку трафаретов.
2.13. Осуществляет наладку и регулировку маркировочных станков и прессов.
2.14. Оформляет документы на маркируемую продукцию.
2.15. [Вписать нужное].
3. Права
Маркировщик имеет право:
3.1. Получать от работников предприятия информацию, необходимую для осуществления своей деятельности.
3.2. Представлять на рассмотрение своего непосредственного руководителя предложения по вопросам своей деятельности.
3.3. Требовать от руководства предприятия оказания содействия в исполнении своих должностных обязанностей.
3.4. [Вписать нужное].
4. Ответственность
Маркировщик несет ответственность:
4.1. За ненадлежащее исполнение или неисполнение своих должностных обязанностей, предусмотренных настоящей должностной инструкцией, — в пределах, определенных трудовым законодательством Российской Федерации.
4.2. За правонарушения, совершенные в процессе осуществления своей деятельности, — в пределах, определенных административным, уголовным и гражданским законодательством Российской Федерации.
4.3. За причинение материального ущерба — в пределах, определенных действующим законодательством Российской Федерации.
4.4. [Вписать нужное].
Должностная инструкция разработана в соответствии с [наименование, номер и дата документа].
Источник
Разъяснения по «Маркировке»
Специалисты оператора ЦРПТ комментируют вопросы аптек: ФАПы, отпуск лекарственных средств по безналу, работа в личном кабинете ИС «Маркировка», перемещение ЛП внутри аптечной сети и другие практические аспекты
Мы продолжаем серию материалов, в которых представители «Центра развития перспективных технологий» отвечают на вопросы читателей «Катрен-Стиль», посвященные работе с маркированными лекарственными препаратами. Вопросы возникают в ходе специальных бесплатных вебинаров, а также приходят на почту редакции. На этот раз руководитель проекта «Фарма» компании «ЦРПТ» Алексей Косарев и его коллеги решили ответить на самые распространенные вопросы, которые повторяются из раза в раз. Для большей ясности в начале статьи авторы объясняют, где брать информацию самостоятельно — кому из пользователей МДЛП пригодится тот или иной официальный документ.
Вступление: три категории пользователей
Всех пользователей МДЛП можно условно разделить 3 категории. Первая — это участники оборота с объемами более 10 упаковок в день. Они работают с МДЛП через ИТ-интеграторов и ККТ, которые передают данные в МДЛП автоматически. ЦРПТ сотрудничает со всеми крупными ИТ-интеграторами и поставщиками ККТ. Если ваш поставщик ПО есть на сайте «Честный знак» в разделе «Партнеры и Протестированные решения», то интеграция у вас уже есть. Если вы работаете с другим поставщиком, то уточните у него наличие в системе модуля для работы с маркированным товаром. Если у вас «самописная» система, ее надо доработать в соответствии с документами, которые предназначены для ИТ-специалистов (см. ниже). Рекомендуем получить все разъяснения у провайдеров услуг и пройти обучение по работе с новым функционалом в том интерфейсе, в котором вы осуществляете свою ежедневную деятельность.
Вторая категория — это участники оборота с объемами менее 10 упаковок в день. Они могут (но не должны) работать с ИС «Маркировка», внося данные о лекарственных средствах «вручную» через личный кабинет.
Третья категория пользователей — это ИТ-специалисты, которые взаимодействуют с МДЛП на уровне программы.
Для этих трех категорий пользователей подготовлены схемы и инструкции разного уровня погружения в технические детали. Просим обращать внимание на это при изучении ответов на вопросы. Для 1‑й категории основной документ — «Паспорта процессов». Для 3‑й категории (и 2‑й по желанию) основной документ — это «Логическая модель файлов обмена функциональной подсистемы информационной системы маркировки товаров контрольными (идентификационными) знаками лекарственных препаратов для медицинского применения».
Ответы на вопросы
Как будет проходить процесс маркировки товаров в аптечных учреждениях отдаленных населенных пунктов, где работают онлайн-кассы без передачи данных?
Сведения о розничной продаже маркированных лекарств должны передаваться вручную через личный кабинет или через головную организацию при наличии таковой (в таком случае процесс не меняется).
При наличии у учреждения вышестоящей (головной) организации, сведения о выбытии передает указанная организация. Действия происходят по схеме:
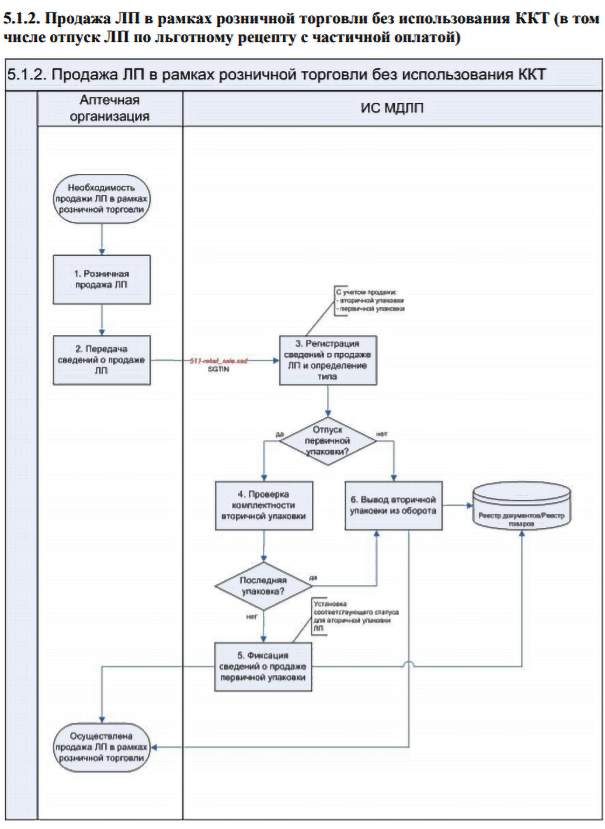
Детальное описание последовательности действий описано в документе «Паспорта процессов» в разделе 5.1.2.
Подскажите, мы планируем осуществлять деятельность в рамках договора комиссии с ФАП, расположенными в сельской местности. Каким образом нам организовать деятельность по маркировке ЛП?
При отпуске лекарственных препаратов через ФАП, сведения о выбытии передаются вышестоящей организацией.
Отпуск препаратов на медпункты, детские сады и детские лагеря при оплате по безналичному расчёту (без ККМ). Как работать с маркированными ЛС?
Если участник оборота, которому осуществляется отпуск ЛП, имеет лицензию на медицинскую деятельность, то он должен быть зарегистрирован в МДЛП. Если не зарегистрирован, тогда выполняется операция отгрузки ЛП под названием «Регистрация в ИС «Маркировка» сведений об отгрузке лекарственных препаратов на незарегистрированное место деятельности».
Как отражать в МДЛП безналичный расчет между организациями, как аптека регистрирует выбытие ЛП, купленных по безналичному расчету другой организацией?
В данном случае осуществляются операции об отгрузке лекарственных препаратов со склада отправителя/приема лекарственных препаратов на склад. Детальное описание последовательности действий описано в документе «Паспорта процессов» в разделах 4.1 и 4.2 соответственно.
Подскажите, какие действия нужно совершать поставщику. Мы небольшая компания, зарегистрированы в «Честном знаке». Дальше непонятно — что нам нужно делать, когда мы получаем товар от производителя и когда мы производим отгрузку в ЛПУ. Где можно найти подробную инструкцию по работе дистрибьютора?
Каждая операция (приемка, перемещение, выбытие лекарственных препаратов) должна фиксироваться в МДЛП. Для каждой из этих операций определен состав передаваемых данных и последовательность действий. Имеется два руководящих документа. Последовательность действий описана в документе «Паспорта процессов».
Первично осуществляется приемка товара от производителя. Для этого необходимо использовать операцию «Регистрация в ИС «Маркировка» подтверждения (акцептования) сведений».
Далее при реализации товара другому участнику оборота (ЛПУ), выполняются следующие операции:
- В случае прямого акцептования — «Регистрация в «ИС «Маркировка» сведений об отгрузке лекарственных препаратов со склада отправителя»
- В случае обратного акцептования — «Регистрация в ИС «Маркировка» подтверждения (акцептования) сведений».
Допустимо ли будет с 01.01.2020 для аптечной сети отражать в ИС МДЛП перемещение отозванной из обращения (забракованной) серии лекарственного препарата между местами осуществления деятельности (из аптеки на аптечный склад) при осуществлении централизованного возврата поставщику с аптечного склада?
Допустимо, если в дальнейшем с отозванной из обращения серией будут выполнены следующие операции:
- Регистрация в ИС «Маркировка» сведений о передаче лекарственных препаратов на уничтожение.
- Регистрация в ИС «Маркировка» сведений о факте уничтожения лекарственных препаратов.
Как будет производиться отпуск лекарственных препаратов в структурные подразделения юридического лица? Как будет осуществляться отпуск в структурных подразделениях, если в них нет программы товарного учета, а только ККТ? Как осуществлять отпуск по договорам, школам и т. д.?
Для выполнения операции перемещения лекарственных средств между местами деятельности в рамках одного ИНН необходимо выполнить операцию — «Регистрация в ИС «Маркировка» сведений о перемещении лекарственных препаратов между различными адресами осуществления деятельности».
При использовании ККТ в аптеке данные о выбытии ЛП будут передаваться в МДЛП в момент осуществления покупки. Данные передаются оператором фискальных данных автоматически, в рамках стандартного пакета.
Учреждения, обладающие лицензией на медицинскую или фармацевтическую деятельность, должны быть зарегистрированы в ИС МДЛП. Реализация ЛП происходит по операциям:
- В случае прямого акцептования — «Регистрация в «ИС «Маркировка» сведений об отгрузке лекарственных препаратов со склада отправителя».
- В случае обратного акцептования — «Регистрация в ИС «Маркировка» подтверждения (акцептования) сведений».
Если препарат в стационаре забракован после списания в отделение регистратором выбытия — как его вернуть поставщику?
Необходимо выполнить операцию повторного ввода ЛП в оборот, а затем осуществить возврат поставщику. Далее выполнить операции:
«Регистрация в ИС «Маркировка» сведений о передаче лекарственных препаратов на уничтожение» и «Регистрация в ИС «Маркировка» сведений о факте уничтожения лекарственных препаратов».
Что будет с остатками в МДЛП, если аптека не смогла принять КиЗы от поставщика при обратном акцептовании (КиЗы, например, на производителе), а продавать уже начала?
В МДЛП рассматривается возможность реализации реестра ожиданий, позволяющего выводить ЛП до момента акцептования. После того как ЛП будет оприходован, он будет выведен из оборота.
Как можно будет осуществлять перемещение товара из одной аптеки в другую в одной сети аптек?
Движение ЛП между местами деятельности в рамках одного ИНН регистрируется операцией — «Регистрация в ИС «Маркировка» сведений о перемещении лекарственных препаратов между различными адресами осуществления деятельности». Данные передаются автоматически через товарно-учетную систему, интегрированную с МДЛП, или вручную посредством функционала личного кабинета МДЛП (последнее целесообразно, если оборот — не более 10 уп./сутки).
Как осуществлять возврат ЛС от структурных подразделений?
Возврат регистрируется операцией — «Регистрация в ИС «Маркировка» сведений о перемещении лекарственных препаратов между различными адресами осуществления деятельности». Данные передаются автоматически.
Если у вас еще остались вопросы по работе с маркированными ЛС, приглашаем вас 11 декабря посетить очередной бесплатный вебинар на тему «АРМ в аптеке: знакомимся с техническими средствами маркировки». Там вы сможете не только услышать официальные рекомендации, но и задать свои вопросы в режиме онлайн. Спешите регистрироваться, количество мест ограниченно.
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
Источник
Маркировка для продавца лекарств
Основные положения и решения для маркировки лекарств:
1. Нормативная документация
Обязательная маркировка товара в аптеке производителем регулируется постановлениями правительства, устанавливающими правила внедрения ИС МДЛП, обращения лекарственных средств (ЛС) и установки размера оплаты услуг за выпуск маркировочных кодов. Основными законодательными документами являются:
- ПП №1556 и ПП №1118 «Положение о системе МДЛП»;
- ПП №1557 «Об особенностях внедрения системы МДЛП»;
- ПП №557 «Об размера платы за услуг по предоставление кодов».
Основным федеральным законом, регулирующим обращение лекарственных средств, является ФЗ №61. Документ определяет полномочия федеральных органов, форму надзора за оборотом и разработкой ЛС, правила регистрации препаратов и другие аспекты.
2. Как работает система маркировки лекарств.
В цепочке логистики участвуют производители, дистрибьюторы, аптеки и медицинские учреждения. Производитель наносит на вторичную упаковку, а если ее нет — на первичную, уникальный цифровой код Data Matrix. Передает сведения о введение продукции в оборот в базу Честного ЗНАКа (ИС МДЛП). Оборудование для маркировки двумерными кодами лекарств изготовитель приобретает самостоятельно. Оператор системы предоставляет за свой счет специальное устройство — регистратор эмиссии. Оно позволяет генерировать ключ и код проверки, хранит и обеспечивает защиту маскировочных кодов.
Обязательна маркировка лекарств для дистрибьюторов. Они должны подтвердить в системе получение партии от изготовителя, указать организации розничную сети, куда переданы препараты. Аптечные сети отправляют в Честный ЗНАК данные о совершенных продажах через ОФД при помощи онлайн-касс. Медицинские учреждения также подтверждают получение препаратов в системе МДЛП. По мере их использования отправляют данные о выбытие через регистратор. Регистратор выбытия — специальное устройство для фиксации выбытия из оборота маркированного лечебного средства. Представляет собой аналог онлайн-кассы, взаимодействующий напрямую с ИС МДЛП. Предоставляется учреждениям за счет оператора системы.
3. Что такое SGTIN в маркировке лекарств?
Для идентификации товаров разработаны коды SGTIN и SSCC. С их помощью можно отличить одну маркировочную единицу от другого продукта.
- SSCC – это номер серии транспортной упаковки.
- GTIN — шифр типа продукции.
- SGTIN – это расширенные кодовые данные GTIN, содержащие в отличие от других кодов информационные данные о фармацевтической продукции.
Получить код SGTIN можно только в ассоциации ГС1 РУС.
При приеме товаров аптекой сканируется проставленный отправителем SSCC. По этому номеру в базу заносятся сразу все вложенные в транспортную тару SGTIN. Если нет номера серийной упаковки, аптечному работнику придется сканировать все коды SGTIN для передачи в ИС МДЛП. Однако давайте сначала разберемся, что нужно для маркировки лекарств аптечным организациям.
Хотите, чтобы наш специалист помог вам зарегистрироваться в системе маркировки?
Обратитесь к нам прямо сейчас и получите специальное предложение!
Свяжитесь с нами
Маркировка лекарственных препаратов 2020 году для аптек
С чего начать маркировку лекарств в аптеке:
- ознакомиться с правовыми документами;
- выбрать способ передачи данных;
- заказать электронную подпись;
- зарегистрироваться на сайте честныйзнак.рф;
- определиться с программой учета;
- подготовить рабочее место сотрудников;
- провести обучение по маркировке лекарств.
Для полноценной работы из оборудования для маркировки лекарств аптечному пункту понадобится персональный компьютер и сканер штрихкода DataMatrix.
Источник
Обзор вебинара с экспертом компании ЦРПТ — описание процессов от приемки лекарств до их отпуска
11 августа на нашем сайте состоялся вебинар, посвященный порядку действий работников аптек при работе с Государственной информационной системой маркировки движения лекарственных препаратов (ГИС МДЛП). О том, что необходимо для соблюдения законодательства и как именно нужно передавать данные в систему маркировки, рассказал представитель оператора системы маркировки компании «ЦРПТ» Дмитрий Кононов. Для тех, кто по каким‑либо причинам не смог принять участие в трансляции, мы публикуем краткое содержание вебинара, а также ответы на вопросы зрителей, заданные в прямом эфире.
Нормативные документы
Основной документ, который содержит все требования по маркировке, — это Постановление Правительства РФ № 1556. Не так давно в него были внесены изменения. Следует перечислить самые важные: теперь в систему нужно вносить данные в течение одного рабочего дня, а не пяти, как это было раньше. Сделано это для того, чтобы было удобнее получать оперативные ответы от поставщика. Т. е. при обратном акцепте аптеке не надо будет 5 дней ждать ответа от поставщика, чтобы начать работать с уже принятым товаром.
Обратите внимание, что дни рабочие. Их отсчет начинается на следующий день после получения лекарственных препаратов. Иными словам, если ЛС в аптеку привезли в пятницу вечером, то следующий рабочий день понедельник — значит, в течение этого дня (до вторника) все сведения должны быть в системе.
Еще одно важное изменение — корректировка формата взаимодействия информационных систем участников с МДЛП производится не чаще 1 раза в 180 дней. Это значит, что на законодательном уровне закреплено, что нельзя вносить в API системы маркировки изменения в течение полугода. Следовательно, если аптека настроила всё свое оборудование, то ей не придется проводить какую‑то переналадку или апгрейд каждую неделю или каждый месяц. 180 дней — довольно большой промежуток.
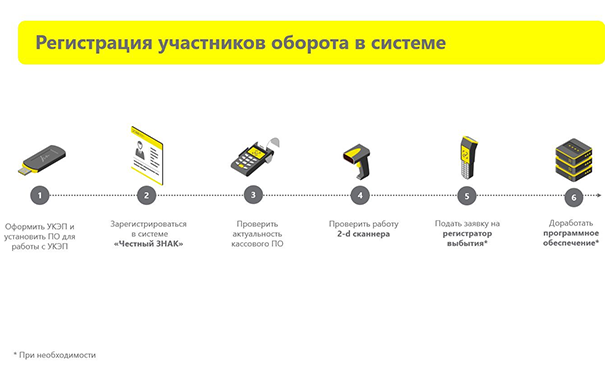
Регистрация в системе
Работа с системой ГИС МДЛП начинается с регистрации. Для этого нужен УКЭП. С его помощью руководитель организации в личном кабинете системы «Честный знак» регистрирует свою организацию. После этого он может там же добавить сотрудников, ответственных за работу с ГИС МДЛП, и дать им права на внесение информации в систему.
Следующий шаг — проверка актуальности программного обеспечения кассового оборудования. Это нужно, чтобы при отпуске через кассу данные направлялись автоматически. После этого необходимо проверить работу 2D-сканера для интеграции со своей товароучетной системой, которая будет передавать данные в ГИС МДЛП.
Если вы осуществляете отпуск бесплатно или со льготой, то необходимо еще подать заявку на получение регистратора выбытия. Подробнее о том, нужен ли вашей аптеке регистратор выбытия, читайте в нашем материале. И последний шаг — это доработка программного обеспечения, если это необходимо.
Прослеживаемость лекарств
Следует пояснить, как именно происходит отслеживание пути лекарственных препаратов. Производитель наносит на упаковку код DataMatrix. Таким образом он гарантирует уникальность упаковки и, соответственно, уникальность ЛС. Далее сведения о коде лекарственного препарата передаются в ГИС Маркировка.
Производитель, наравне с другими участниками системы, передает в нее данные об отгрузке или приемке товара. Он отгружает свои ЛС дистрибьютору, а тот уже вносит в систему свою часть информации о поступивших лекарствах. После этого он отгружает их в аптеку или медицинскую организацию. Далее уже аптека или больница фиксируют выбытие или продажу ЛС.
Что вообще такое код DataMatrix? Он очень похож на QR-код, но значительно отличается от него. Подробные отличия описаны на иллюстрации:
GTIN — это «зашифрованное» наименование лекарственного препарата. В нем указаны название ЛС, лекарственная форма и дозировка. Индивидуальный серийный номер торговой единицы — это дополнение с информацией о серии. Эти два параметра объединяются в один код, называемый SGTIN. Именно он отправляется в систему ГИС МДЛП для отслеживания препаратов в товаропроводящей цепи.
Далее идут ключ проверки и значение кода проверки, которые отвечают за уникальность самого кода DataMatrix и гарантируют, что он не поддельный.
Следующий тип кодов, с которыми можно столкнуться при работе с системой маркировки, это код SSCC — серийный код транспортной упаковки (агрегирующий код). Другими словами, код групповой упаковки, или «код коробки» в которой объединено несколько препаратов при транспортировке. Визуально он представляет собой линейный штриховой код длиной 18 знаков. При этом он всегда начинается с «00». Если вам приходит упаковка с SSCC, то приемку нужно осуществлять по групповой упаковке.
Документы для работы в системе
Оператор системы регулярно старается публиковать более легкие для восприятия инструкции, чем официальные документы. Можно выделить четыре типа таких документов, доступных на сайте «Честный знак»:
- Методические рекомендации по работе с маркированными лекарствами — инструкции по работе с системой.
- Паспорта процессов — описание всех действий при обращении лекарственных препаратов.
- Руководство пользователя ЛК субъекта обращения лекарственных препаратов — инструкция по заполнению информации в личном кабинете.
- Описание схем передачи данных (версия 1.35) — это уже более технические данные, необходимые разработчикам для интеграции программного обеспечения.
Кроме этого, на сайте есть раздел «Обучающий центр», где даны краткие, но подробные видеоинструкции по основным направлениям работы с системой ГИС Маркировка.
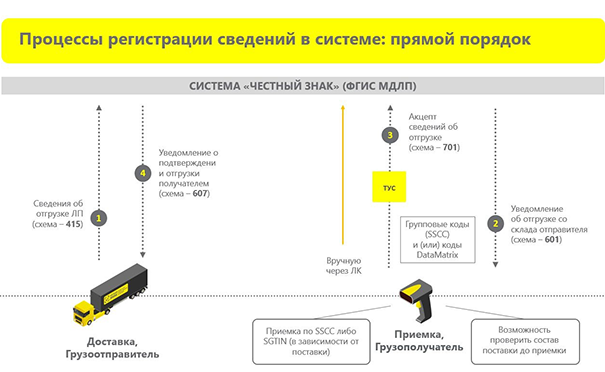
Регистрация сведений в системе МДЛП: прямой порядок (прямой акцепт)
Перейдем к работе в системе и к первому действию — получению товара по прямому акцепту. В этом случае у нас есть грузоотправитель и грузополучатель. Грузоотправитель при прямом порядке формирует условную «коробку» с лекарственными препаратами. Также именно грузоотправитель формирует начальный документ сведений об отгрузке (схема 415). Отправив этот документ, грузоотправитель передает лекарственные препараты в сторону грузополучателя.
Далее система формирует уведомление об отгрузке со склада отправителя. С этого момента грузополучатель знает, что ему должен прийти товар от отправителя по прямому акцепту. Затем по приходе товара у грузополучателя есть один рабочий день для формирования сведений об отгрузке (схема 701). Для этого нужно просканировать групповые коды SSCC, если лекарства пришли в групповой упаковке. Если нет, то необходимо просканировать каждую упаковку.
Затем система формирует уведомление о получении товара. Таким образом, лекарства, образно выражаясь, «встают на баланс аптеки». После этого ими уже можно распоряжаться по своему усмотрению — перемещать между своими организациями, отпускать, продавать и так далее. Таким образом, прямой порядок — от грузоотправителя получателю.
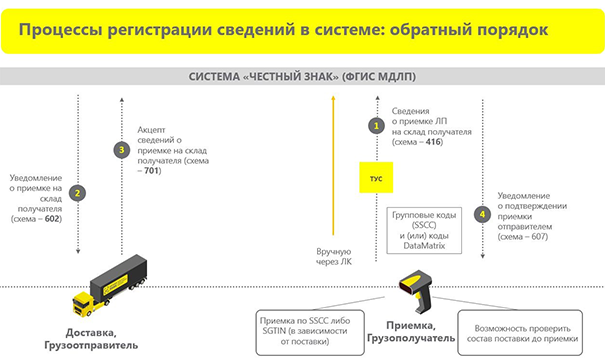
Регистрация сведений в системе МДЛП: обратный порядок (обратный акцепт)
При таком варианте поставок грузоотправитель формирует товар для аптеки и отправляет его, не передавая при этом данные в систему МДЛП. Товар приходит в аптеку, и с этого момента, всё так же в течение одного рабочего дня, нужно сформировать сведения о приемке ЛС (схема 416).
Для этого также необходимо просканировать коды — групповые или у каждой упаковки. Затем грузоотправитель уже получает уведомление, что его товар принят на склад. Он, в свою очередь, смотрит на полученные коды и проверяет по своей накладной. Если всё в порядке, то он отправляет в систему акцепт о приемке, который превращается в уведомление о подтверждении приемки товара. После этого лекарства становятся собственностью аптечной организации.
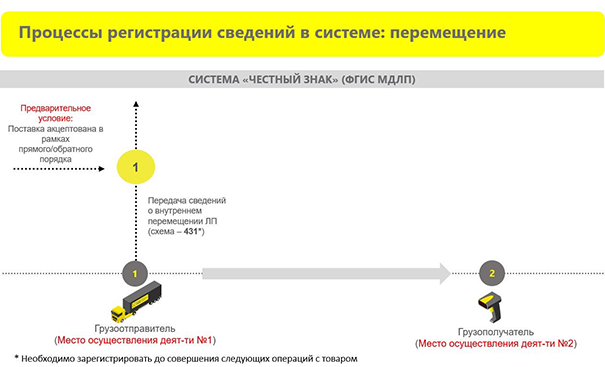
Регистрация сведений в системе: перемещение
Такой вид сведений в первую очередь касается аптечных сетей. Перемещения лекарственных препаратов между собственными местами осуществления деятельности описаны на схеме 431. При этом подтверждения от получателя не требуется, поскольку перемещение происходит между вашими зарегистрированными местами деятельности.
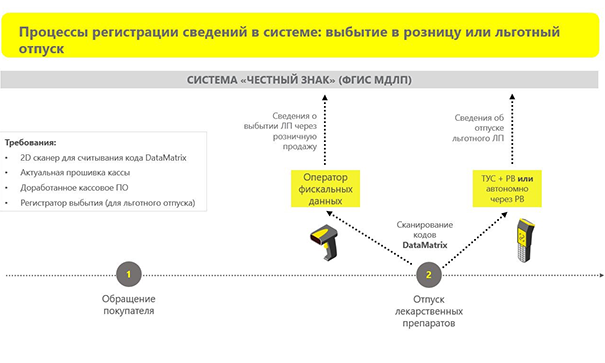
Выбытие в розницу или льготный отпуск
После приемки или перемещения ЛС можно осуществить выбытие лекарств. Если это не льготный отпуск, то понадобится только оператор фискальных данных. Сканирование упаковки автоматически формирует необходимые сведения о выбытии, которые передаются в систему. Поэтому обязательно проверьте актуальную версию программного обеспечения и прошивки кассового аппарата.
Льготный отпуск происходит через регистратор выбытия — именно им надо сканировать код DataMatrix.
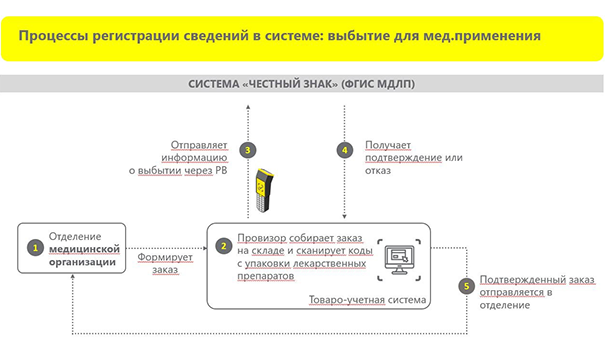
Выбытие для медицинского применения
Процесс отпуска препарата в больничной аптеке можно описать следующей схемой:
Это основные процессы, с которыми может столкнуться аптека в своей повседневной деятельности.
При возникновении каких‑либо трудностей пишите в Службу технической поддержки по адресу [email protected] или звоните по телефону 8 800 222 15 23, описывая во всех подробностях вашу проблему. Каждому обращению присваивается свой уникальный номер, и оно в обязательном порядке будет рассмотрено специалистами.
Ответы на вопросы зрителей вебинара:
В аптечном пункте автономная касса. Как нужно передавать сведения в систему МДЛП о продаже?
Любая автономная касса может передавать накопленные данные при наличии интернета. Если такой возможности нет, то сведения о розничной продаже могут быть переданы через схему 511.
Как быть, если образовался пересорт маркированного товара?
От этого никто не застрахован. Наиболее эффективное средство борьбы с этим — прямой акцепт. Тогда можно не подтверждать прием «лишних препаратов». Также можно написать в Службу технической поддержки.
Нужно ли наносить внутренний штрихкод аптеки на маркированный товар?
Если ваша система обучена работать с DataMatrix, то можно не наносить. Если ваша система так устроена, что наличие внутреннего кода необходимо, то это не запрещается. Единственный момент, что ваш код никаким образом не должен мешать считыванию DataMatrix.
Почему нужно обязательно ходить и ловить спутники ГЛОНАСС?
Синхронизация регистраторов выбытия с системой ГЛОНАСС нужна для того, чтобы регистрировать место совершения действия и, самое главное, время совершения действия. Таким образом, эту информацию нельзя подделать, и она всегда будет корректна. Если качество соединения по каким‑то причинам оставляет желать лучшего, то можно написать в Службу технической поддержки. Возможно, вам следует подобрать более оптимальный вариант регистратора.
Ошибка «КИЗ»: некорректное состояние. Не можем промаркировать товар. Что делать?
С таким вопросом следует обратиться в Службу технической поддержки, с указанием вашей организации и SGTIN, с которым возникает ошибка. Причин может быть несколько. Для этого нужно полное описание процесса, который вы выполняете.
Как проверить актуальность кассового ПО?
В первую очередь — узнать у поставщика ПО. Кроме этого, на сайте «Честный знак» есть список поставщиков, программное обеспечение которых уже прошло проверку на совместимость с ГИС МДЛП.
Проблема с ответом от поставщика по прямому акцепту!
В первую очередь нужно связаться с поставщиком и узнать о причинах задержки. Если же связи нет, то нужно написать в Службу технической поддержки — все проблемы решаемы.
Как передавать данные аптекам, которые работают в автономном режиме?
Если ваша местность отнесена к местам, отдаленным от сетей связи, то в этом случае информацию о выведении ЛС из оборота может осуществлять головная организация. Если же интернет есть, но плохой, то все‑таки придется искать возможности работать онлайн.
Льготный рецепт — при использовании регистратора выбытия документ создается на каждый льготный препарат?
При отпуске по льготе с помощью регистратора выбытия вы получаете рецепт на руки, вводите в регистратор номер рецепта и по этому рецепту выводите все препараты, указанные в рецепте.
Поставщики присылают товар, а мы распределяем его по подведомственной сети. Эти места деятельности надо регистрировать в системе?
Конечно, надо.
Есть ли инструкции по ревизии маркированного товара?
Да, они есть в методических рекомендациях (см. выше).
Кто, кроме получателя, знает день прихода товара?
Логистическая компания, получатель, отправитель и другие участники товаропроводящей цепи.
Если ИП решил стать юридическим лицом, то как быть с товаром, который зарегистрирован на ИП?
Следует начать с того, что все изменения вносятся в лицензию. Вариантов смены типа организации может быть много. Напишите о своем случае в Службу технической поддержки, и вам подскажут алгоритм действий. Что касается ЛС, то они будут «привязаны» к новой лицензии.
Как оформлять в системе отпуск по безналу для организаций?
Для этого у вас должна быть лицензия на оптовую торговлю. Если у вас такая лицензия есть, то нужно оформить как перемещение ЛС в другую организацию — схемы 415 и 416, о которых уже говорилось ранее.
Как быть, если в товаре привезли пересорт или ненадлежащее качество?
Товар ненадлежащего качества можно не принимать — вы не указываете его в документах и осуществляете возврат — схема 252 «Отказ от приемки товара». А сам вопрос по качеству товара нужно урегулировать с поставщиком.
Как быть с недовозом или браком?
Как и в предыдущем случае, нужно формировать отказ от приемки товара.
Если поставщик не подтвердит получение одной позиции — вся накладная «повиснет»?
Если поставщик подтверждает приемку всей групповой упаковки, то, к сожалению, да. Если приемка проводилась по отдельным позициям — то можно будет подтвердить все остальные.
Как оформить списание товара?
Для этого есть специальная схема, указанная в методических рекомендациях.
При прямом акцепте поставщик выбрал неправильное место деятельности. Что делать получателю?
Можно отказаться от приемки и попросить поставщика исправить документ, указав верный идентификатор места. Это нужно сделать на этапе получения уведомления о направлении товара.
Что такое «реестр ожиданий»?
Это специальный инструмент ГИС МДПЛ, который фиксирует документы на выбытие и при отсутствии документов предыдущего порядка (например, приемки этого товара) помещает его в специальный реестр. Там эти данные ожидают получения информации о всей товаропроводящей цепи.
Читайте больше полезного о маркировке лекарственных препаратов в специальной рубрике на нашем сайте.

Специалист по упаковке и маркировке лекарственных средств
Обязанности
Требования
Условия