Содержание
-
Русское название
-
Английское название
-
Латинское название
-
Фармакологическая группа вещества Дурвалумаб
-
Нозологическая классификация
-
Фармакологическое действие
-
Характеристика
-
Фармакология
-
Применение вещества Дурвалумаб
-
Противопоказания
-
Ограничения к применению
-
Применение при беременности и кормлении грудью
-
Побочные действия вещества Дурвалумаб
-
Взаимодействие
-
Передозировка
-
Способ применения и дозы
-
Меры предосторожности
-
Источники информации
-
Торговые названия с действующим веществом Дурвалумаб
Русское название
Дурвалумаб
Английское название
Durvalumab
Латинское название
Durvalumabum (род. Durvalumabi)
Фармакологическая группа вещества Дурвалумаб
Нозологическая классификация
Фармакологическое действие
—
противоопухолевое.
Характеристика
Человеческое моноклональное антитело, IgG1κ.
Фармакология
Фармакодинамика
Механизм действия
Экспрессия белка лиганда рецептора программируемой гибели клетки 1 (PD-L1) является ответом на воздействие адаптивной иммунной системы, который позволяет опухолям избегать обнаружения и элиминации иммунной системой. Экспрессия PD-L1 может индуцироваться воспалительными сигналами (например, интерферон-гамма) и происходить как в опухолевых клетках, так и в опухолеассоциированных иммунных клетках микроокружения опухоли. PD-L1 блокирует функции и активацию Т-клеток посредством взаимодействия с PD-1 и CD80 (B7.1). Связываясь с соответствующими рецепторами, PD-L1 уменьшает цитотоксическую активность Т-клеток, пролиферацию и выработку цитокинов.
Дурвалумаб является полностью человеческим, высокоаффинным моноклональным антителом, которое селективно блокирует взаимодействие PD-L1 с PD-1 или CD80 (В7.1), при этом не затрагивая взаимодействие между PD-1 и PD-L2. Дурвалумаб не индуцирует антителозависимую клеточную цитотоксичность. Селективная блокада взаимодействий между PD-L1 и PD-1 и PD-L1 и CD80 приводит к усилению противоопухолевого иммунного ответа, который может привести к элиминации опухоли. В доклинических исследованиях блокада PD-L1 приводила к увеличению активации Т-лимфоцитов и уменьшению размеров опухолей.
Фармакокинетика
Фармакокинетику дурвалумаба изучали у 1902 пациентов, при этом дозы варьировали от 0,1 до 20 мг/кг, а дурвалумаб вводили один раз в две, три или четыре недели. Фармакокинетическое воздействие увеличивалось более чем пропорционально дозе (нелинейная фармакокинетика) при дозах, составляющих <3 мг/кг, и пропорционально дозе (линейная фармакокинетика) при дозах, составляющих ≥3 мг/кг. Равновесное состояние достигалось примерно через 16 нед.
На основании популяционного фармакокинетического анализа, включавшего данные о 1878 пациентах, получавших дурвалумаб в дозах ≥10 мг/кг каждые 2 нед, средний геометрический Vss составлял 5,64 л. Клиренс дурвалумаба уменьшался с течением времени, и на 365-й день терапии средний геометрический клиренс в равновесном состоянии (Clss) составлял 8,16 мл/ч; уменьшение Clss не считается клинически значимым. Исходя из клиренса исходного уровня, T1/2 составлял приблизительно 18 дней.
Особые группы пациентов
Возраст (19–96 лет), масса тела (34–149 кг), пол, наличие антител к дурвалумабу, концентрация альбумина, активность ЛДГ, концентрация креатинина, концентрация растворимого PD-L1, тип опухоли, расовая принадлежность, нарушение функции почек легкой (Cl креатинина 60–89 мл/мин), средней (Cl 30–59 мл/мин) степени тяжести, нарушение функции печени легкой степени (билирубин <ВГН и активность ACT >ВГН или концентрация билирубина >ВГН до 1,5×ВГН при любой активности ACT) и общее состояние по шкале ВОЗ/ECOG не оказывали клинически значимого воздействия на фармакокинетику дурвалумаба.
Влияние нарушения функции почек тяжелой степени (Cl креатинина 15–29 мл/мин) или функции печени средней (концентрация билирубина >1,5×ВГН до 3×ВГН и любая активность ACT) и тяжелой (концентрация билирубина >3×ВГН и любая активность ACT) степени на фармакокинетику дурвалумаба неизвестно.
Пожилой возраст. В исследовании PACIFIC (первичная популяция для оценки эффективности) коррекции дозы у пожилых пациентов (≥65 лет) не требовалась. Из 476 пациентов с местнораспространенным нерезектабельным немелкоклеточным раком легкого (НМРЛ) , получавших дурвалумаб, 215 пациентов были в возрасте 65 лет и старше. В целом между пациентами в возрасте 65 лет и старше и более молодыми пациентами не отмечалось различий в профилях безопасности.
Применение вещества Дурвалумаб
Нерезектабельный местнораспространенный немелкоклеточный рак легкого у взрослых пациентов, у которых не выявлено прогрессирование заболевания после химиолучевой терапии на основе препаратов платины.
Противопоказания
Повышенная чувствительность к дурвалумабу; нарушение функции печени средней и тяжелой степени тяжести; беременность и период грудного вскармливания; детский возраст до 18 лет.
Ограничения к применению
Тяжелые аутоиммунные заболевания в активной стадии, при которых дальнейшая активация иммунной системы может представлять потенциальную угрозу жизни.
Применение при беременности и кормлении грудью
Женщины с сохраненной детородной функцией должны использовать надежные методы контрацепции во время терапии дурвалумабом и как минимум в течение 3 мес после введения последней дозы.
Данные о применении дурвалумаба у беременных женщин отсутствуют. С учетом механизма действия, дурвалумаб может оказывать влияние на течение беременности и вредное воздействие на плод при его применении во время беременности. На модели аллогенной беременности у мышей было показано, что нарушение передачи сигнала через PD-L1 приводит к увеличению частоты потери плода. В исследованиях у животных не было выявлено репродуктивной токсичности. Человеческий IgG1 проникает через плацентарный барьер. В исследованиях на животных было показано, что дурвалумаб также проникает через плацентарный барьер. Применение дурвалумаба во время беременности может причинить вред плоду. Поэтому дурвалумаб не должен применяться во время беременности и при отсутствии надежной контрацепции во время терапии и как минимум в течение 3 мес после введения последней дозы.
Нет информации, касающейся экскреции дурвалумаба в грудное молоко. По результатам токсикологических исследований, в молоке яванских макак на 28-й день после родов был выявлен дурвалумаб в низких концентрациях. У человека моноклональные антитела могут выделяться в грудное молоко, однако нет данных об их возможной абсорбции и вреде для новорожденного. Тем не менее нельзя исключить риск для младенцев, получающих грудное вскармливание. Поэтому следует либо прекратить грудное вскармливание, либо воздержаться от терапии дурвалумабом, с учетом пользы грудного вскармливания для младенца и пользы терапии дурвалумабом для женщины.
Фертильность
Данные о возможном влиянии дурвалумаба на фертильность у животных и человека отсутствуют.
Побочные действия вещества Дурвалумаб
Краткая характеристика профиля безопасности
Профиль безопасности дурвалумаба был изучен в исследовании PACIFIC (n=475) у пациентов с НМРЛ, которые завершили как минимум 2 цикла одновременной химиолучевой терапии в период от 1 до 42 дней до включения в исследование. В этой популяции пациентов наиболее частыми нежелательными реакциями были кашель (40,2% у пациентов, получавших дурвалумаб, и 30,3% у пациентов, получавших плацебо), инфекции верхних дыхательных путей (26,1 и 11,5%) и сыпь (21,7 и 12%). Наиболее частой нежелательной реакцией 3–4-й степеней тяжести (по общим терминологическим критериям нежелательных явлений Национального института онкологии США, версия 4.03) была пневмония (6,5% у пациентов, получавших дурвалумаб, и 5,6% у пациентов, получавших плацебо). Общая частота нежелательных реакций 3–4-й степеней тяжести у пациентов, получавших дурвалумаб, составила 12,8%, плацебо — 9,8%.
Перечень нежелательных реакций
В таблице приведена частота нежелательных реакций у пациентов с НМРЛ в исследовании PACIFIC, независимо от оценки исследователем причинно-следственной связи с приемом дурвалумаба. Нежелательные реакции сгруппированы по системно-органным классам. Внутри каждого класса нежелательные реакции перечислены в порядке убывания частоты. Частота возникновения нежелательных реакций представлена в следующей градации: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (≤1/10000), частота не установлена (частота не может быть определена на основании имеющихся данных). Внутри одной категории частоты нежелательные лекарственные реакции представлены в порядке убывания серьезности.
Таблица
Нежелательные реакции, отмечавшиеся у пациентов с НМРЛ, получавших дурвалумаб в дозе 10 мг/кг
| Системно-органный класс, нежелательные реакции и их частота | Частота реакций любой степени тяжести, % | Частота реакций 3–4-й степеней тяжести, % | |
| Инфекционные и паразитарные заболевания | |||
| Инфекции верхних дыхательных путей1 | Очень часто | 26,1 | 0,4 |
| Пневмония2, 3 | Очень часто | 17,1 | 6,5 |
| Дентальные инфекции и инфекции мягких тканей полости рта4 | Часто | 3,6 | 0 |
| Кандидоз полости рта | Часто | 3,2 | 0 |
| Грипп | Часто | 2,5 | 0 |
| Со стороны эндокринной системы | |||
| Гипотиреоз5 | Очень часто | 11,6 | 0,2 |
| Гипертиреоз6 | Часто | 8,2 | 0 |
| Недостаточность функции надпочечников | Нечасто | 0,2 | 0 |
| Сахарный диабет типа 1 | Нечасто | 0,2 | 0,2 |
| Гипофизит/гипопитуитаризм | Редко7 | <0,1 | <0,1 |
| Несахарный диабет | Редко7 | <0,1 | <0,1 |
| Со стороны сердца | |||
| Миокардит | Редко7 | <0,1 | <0,1 |
| Со стороны дыхательной системы, органов грудной клетки и средостения | |||
| Кашель/продуктивный кашель8 | Очень часто | 40,2 | 0,6 |
| Пневмонит2 | Очень часто | 12,6 | 1,7 |
| Дисфония | Часто | 3,8 | 0 |
| Интерстициальная болезнь легких | Нечасто | 0,6 | 0 |
| Со стороны ЖКТ | |||
| Диарея | Очень часто | 18,3 | 0,6 |
| Боль в животе9 | Очень часто | 10,1 | 0,4 |
| Колит10 | Часто | 1,1 | 0,2 |
| Со стороны печени и желчевыводящих путей | |||
| Увеличение активности ACT или АЛТ11 | Часто | 6,1 | 1,9 |
| Гепатит3,12 | Нечасто | 0,6 | 0 |
| Со стороны кожи и подкожных тканей | |||
| Сыпь13 | Очень часто | 21,7 | 0,6 |
| Зуд14 | Очень часто | 12,4 | 0 |
| Дерматит | Часто | 1,5 | 0 |
| Потливость в ночное время | Часто | 2,3 | 0 |
| Со стороны скелетно-мышечной системы и соединительной ткани | |||
| Миалгия | Часто | 8 | 0,2 |
| Миозит | Нечасто | 0,4 | 0 |
| Полимиозит3 | Редко7 | <0,1 | <0,1 |
| Со стороны почек и мочевыводящих путей | |||
| Увеличение концентрации креатинина в сыворотке крови | Часто | 4,6 | 0,2 |
| Дизурия | Часто | 2,3 | 0 |
| Нефрит15 | Нечасто | 0,4 | 0 |
| Общие расстройства и реакции в месте введения | |||
| Лихорадка | Очень часто | 14,7 | 0,2 |
| Периферические отеки | Часто | 7,8 | 0 |
| Травмы, интоксикации и осложнения процедур | |||
| Реакции, связанные с введением16 | Часто | 1,9 | 0 |
1 Включает ларингит, назофарингит, паратонзиллярный абсцесс, фарингит, ринит, синусит, тонзиллит, трахеобронхит и инфекцию верхних дыхательных путей.
2 Включает инфекцию легких, пневмоцистную пневмонию Йировеца, пневмонию, аденовирусную пневмонию, бактериальную пневмонию, ЦМВ-пневмонию, пневмонию, вызванную гемофильной палочкой, пневмонию, вызванную клебсиеллой, некротизирующую пневмонию, пневмококковую и стрептококковую пневмонию.
3 В исследовании PACIFIC фатальный пневмонит и фатальная пневмония наблюдались с одинаковой частотой у пациентов, получавших дурвалумаб, и в группе плацебо; фатальный гепатит и фатальный полимиозит были отмечены в других клинических исследованиях.
4 Включает гингивит, инфекцию полости рта, периодонтит, пульпит, абсцесс зуба и дентальную инфекцию.
5 Включает аутоиммунный гипотиреоз и гипотиреоз.
6 Включает гипертиреоз, аутоиммунный тиреоидит, тиреоидит, подострый тиреоидит и Базедову болезнь.
7 Нежелательные реакции не наблюдались в исследовании PACIFIC, но наблюдались в других клинических исследованиях (n=1889).
8 Включает кашель и продуктивный кашель.
9 Включает боль в животе, боль в нижних отделах живота, боль в верхних отделах живота, боль в боковых отделах живота.
10 Включает колит, энтерит, энтероколит и проктит.
11 Включает повышение активности АЛТ, ACT, печеночных ферментов и трансаминаз.
12 Включает гепатит, аутоиммунный гепатит, токсический гепатит, гепатоцеллюлярное повреждение, острый гепатит и гепатотоксичность.
13 Включает эритематозную сыпь, генерализованную сыпь, макулезную сыпь, макулопапулезную сыпь, папулезную сыпь, зудящую сыпь, пустулезную сыпь, эритему, экзему и сыпь.
14 Включает генерализованный зуд и зуд.
15 Включает аутоиммунный нефрит, тубулоинтерстициальный нефрит, нефрит, гломерулонефрит и мембранозный гломерулонефрит.
16 Включает реакции, связанные с инфузией, и крапивницу с датой начала в день инфузии или на следующий день.
Описание отдельных нежелательных реакций
Применение дурвалумаба наиболее часто связано с развитием иммуноопосредованных нежелательных реакций. Эти реакции, включая тяжелые, в большинстве случаев, разрешались после назначения соответствующей терапии или отмены применения дурвалумаба. Данные о приведенных ниже иммуноопосредованных нежелательных реакциях получены из объединенной базы данных 1889 пациентов, принимавших участие в исследовании PACIFIC и двух дополнительных исследованиях (мультикогортное открытое клиническое исследование у пациентов с распространенными сóлидными опухолями и открытое исследование у пациентов с местнораспространенным или метастатическим НМРЛ). В этих исследованиях дурвалумаб применяли в дозе 10 мг/кг 1 раз в 2 недели. Рекомендации по лечению этих нежелательных реакций приведены в разделе «Меры предосторожности».
Иммуноопосредованный пневмонит
В объединенной базе данных по монотерапии дурвалумабом (n=1889 пациентов с опухолями различных типов) иммуноопосредованный пневмонит возник у 79 (4,2%) пациентов, включая реакции 3-й степени тяжести у 12 (0,6%), 4-й степени тяжести у 1 (<0,1%) и 5-й степени тяжести у 5 (0,3%) пациентов. Медиана времени до начала нежелательной реакции составила 53 дня (диапазон 1–341 день). Из этих 79 пациентов 45 получали терапию системными ГКС в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент), 2 пациента также получали инфликсимаб. Терапия дурвалумабом была отменена у 26 пациентов. Реакция разрешилась у 42 пациентов.
Иммуноопосредованный пневмонит чаще отмечался у пациентов в исследовании PACIFIC, завершивших одновременную химиолучевую терапию в период от 1 до 42 дней до начала исследуемой терапии (10,7%), чем у других пациентов в объединенной базе данных по безопасности (2%).
В исследовании PACIFIC в группе пациентов, получавших дурвалумаб (n=475) и плацебо (n=234), иммуноопосредованный пневмонит развился соответственно у 51 (10,7%) и 16 (6,8%) пациентов, включая нежелательные реакции 3-й степени тяжести — у 8 (1,7%) и 6 (2,6%) и реакции 5-й степени тяжести (фатальные) — у 4 (0,8%) и 3 (1,3%) пациентов. Медиана времени до начала нежелательной реакции у пациентов, получавших дурвалумаб, составила 53 дня (диапазон 1–341 день) и 55,5 дня в группе пациентов, получавших плацебо (диапазон 0–231 день). Из 51 пациента, получавших дурвалумаб, 44 получали терапию системными ГКС, включая 28 пациентов, получавших ГКС в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент); 2 пациента также получали инфликсимаб. В группе плацебо 11 из 16 пациентов получали терапию системными ГКС, включая 9 пациентов, получавших ГКС в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент). Реакция разрешилась у 27 пациентов, получавших дурвалумаб, и у 6 пациентов, получавших плацебо.
Иммуноопосредованный гепатит
В объединенной базе данных по монотерапии дурвалумабом иммуноопосредованный гепатит был отмечен у 19 (1%) пациентов, включая реакции 3-й степени тяжести у 11 (0,6%) и 5-й степени тяжести (фатальные) у 1 (<0,1%) пациента. Медиана времени до начала нежелательной реакции составила 70 дней (диапазон 15–312 дней). Из этих 19 пациентов 13 получали терапию системными ГКС в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент). Один пациент также получал микофенолата мофетил. Терапия дурвалумабом была прекращена у 4 пациентов. Реакция разрешилась у 12 пациентов.
Иммуноопосредованный колит
В объединенной базе данных по монотерапии дурвалумабом иммуноопосредованный колит или диарея были отмечены у 31 (1,6%) пациента, включая реакции 3-й степени тяжести у 6 (0,3%) и 4-й степени тяжести у 1 (<0,1%) пациента. Медиана времени до начала нежелательной реакции составила 74 дня (диапазон 1–365 дней). Из этих 31 пациентов 16 получали терапию системными ГКС в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент). Один пациент также получал инфликсимаб. Терапия дурвалумабом была прекращена у 8 пациентов. Реакция разрешилась у 23 пациентов.
Иммуноопосредованные эндокринопатии
Гипотиреоз. В объединенной базе данных по монотерапии дурвалумабом иммуноопосредованный гипотиреоз был отмечен у 137 (7,3%) пациентов, включая реакцию 3-й степени тяжести у 1 (<0,1%) пациента. Медиана времени до начала нежелательной реакции составила 85 дней (диапазон 9–378 дней). 134 из 137 пациентов получали гормонозаместительную терапию, 2 — терапию системными ГКС в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент) по поводу гипотиреоза с последующим назначением гормонозаместительной терапии. Случаев прекращения терапии дурвалумабом по причине гипотиреоза не было.
Гипертиреоз. В объединенной базе данных по монотерапии дурвалумабом иммуноопосредованный гипертиреоз был отмечен у 34 (1,8%) пациентов. Реакций 3-й и 4-й степени тяжести отмечено не было. Медиана времени до начала нежелательной реакции составила 41 день (диапазон 14–195 дней). 26 из 34 пациентов получали специфическую терапию (тиамазол, карбимазол, пропилтиоурацил или бета-адреноблокаторы), 12 пациентам был назначен тироксин при переходе гипертиреоза в гипотиреоз, 12 пациентов получали терапию системными ГКС, и 3 из 12 пациентов — системными ГКС в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент). Случаев прекращения терапии дурвалумабом из-за гипертиреоза не было. У 8 пациентов развился гипотиреоз в исходе гипертиреоза.
Недостаточность функции надпочечников. В объединенной базе данных по монотерапии дурвалумабом иммуноопосредованная недостаточность функции надпочечников была отмечена у 7 (0,4%) пациентов, включая реакцию 3-й степени тяжести у 1 пациента (<0,1%). Медиана времени до начала нежелательной реакции составила 141 день (диапазон 70–265 дней). Все 7 пациентов получали терапию системными ГКС, при этом 2 пациента — системными ГКС в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент). Случаев прекращения терапии дурвалумабом из-за недостаточности функции надпочечников не было. Явление разрешилось у 1 пациента.
Сахарный диабет типа 1. В объединенной базе данных по монотерапии дурвалумабом сахарный диабет типа 1 развился у 1 (<0,1%) пациента (3-я степень тяжести). Терапия дурвалумабом была прекращена из-за развития сахарного диабета типа 1. Время до начала реакции составило 42 дня. Пациент получал инсулинотерапию.
Гипофизит/гипопитуитаризм. В объединенной базе данных по монотерапии дурвалумабом иммуноопосредованный гипопитуитаризм был отмечен у 1 (<0,1%) пациента (3-я степень тяжести). Этот пациент получал терапию системными ГКС в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент) без прекращения терапии дурвалумабом.
Иммуноопосредованный нефрит
В объединенной базе данных по монотерапии дурвалумабом иммуноопосредованный нефрит был отмечен у 3 (0,2%) пациентов, включая реакцию 3-й степени тяжести у 1 пациента (<0,1%). Медиана времени до начала нежелательной реакции составила 95 дней (диапазон 28–239 дней). Из них 2 (0,1%) пациента получали терапию системными ГКС в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент). Терапия дурвалумабом была прекращена у всех 3 пациентов. Явление разрешилось у 2 пациентов.
Иммуноопосредованная сыпь
В объединенной базе данных по монотерапии дурвалумабом иммуноопосредованная сыпь или дерматит были отмечены у 30 (1,6%) пациентов, включая реакции 3-й степени тяжести у 7 (0,4%) пациентов. Медиана времени до начала нежелательной реакции составила 74 дня (диапазон 1–365 дней). 11 из 30 пациентов получали терапию системными ГКС в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент). Терапия дурвалумабом была прекращена у 2 пациентов. Явление разрешилось у 18 пациентов.
Реакции, связанные с введением дурвалумаба
В объединенной базе данных по монотерапии дурвалумабом реакции, связанные с введением, были отмечены у 35 (1,9%) пациентов, включая реакцию 3-й степени тяжести у 5 (0,3%) пациентов.
Изменения лабораторных показателей
В исследовании PACIFIC в группе пациентов, получавших дурвалумаб, отмечены следующие отклонения лабораторных показателей по сравнению с исходными значениями: увеличение активности АЛТ — у 38,5% пациентов (все степени тяжести) и у 2,3% пациентов — 3–4-й степени тяжести, увеличение активности ACT — у 36% пациентов (все степени тяжести) и у 2,8% пациентов — 3–4-й степени тяжести, увеличение концентрации креатинина — у 16,3% (все степени тяжести), увеличение концентрации ТТГ выше ВГН и исходного значения — у 26,5% пациентов (все степени тяжести), снижение концентрации ТТГ ниже НГН и исходного значения — у 31,9% пациентов (все степени тяжести).
Образование антител
Из 1570 пациентов, получавших дурвалумаб в дозе 10 мг/кг 1 раз в 2 недели, антитела к дурвалумабу на фоне терапии были обнаружены у 2,9% (45/1570) пациентов. Нейтрализующие антитела были выявлены у 0,5% пациентов (8/1570). Наличие антител не оказывало клинически значимого влияния на безопасность дурвалумаба. Влияние наличия антител на эффективность не было оценено из-за ограниченного количества пациентов. По данным популяционного фармакокинетического анализа, у пациентов с наличием антител к дурвалумабу ожидается некоторое снижение экспозиции, однако снижение экспозиции менее чем на 30% по сравнению с ее типичным значением не считается клинически значимым.
Пожилой возраст
В целом данные по безопасности не отличались у пациентов пожилого (65 лет и старше) и более молодого возраста. Данные о пациентах с НМРЛ в возрасте 75 лет и старше ограничены.
Взаимодействие
Применение системных ГКС или иммунодепрессантов до начала терапии дурвалумабом, за исключением системных ГКС в физиологической дозе (до 10 мг преднизолона в сутки или эквивалент), не рекомендуется из-за возможного влияния на фармакодинамическую активность и эффективность дурвалумаба. Тем не менее системные ГКС и иммунодепрессанты могут применяться после начала терапии дурвалумабом для лечения иммуноопосредованных нежелательных реакций (см. «Меры предосторожности»). Формальных исследований взаимодействия дурвалумаба не проводилось. Поскольку основными путями метаболизма дурвалумаба являются протеиновый катаболизм с участием ретикулоэндотелиальной системы и мишеньопосредованный клиренс, взаимодействия с другими ЛС на уровне метаболизма не ожидается.
Передозировка
Симптомы. При передозировке дурвалумаба специфическое лечение отсутствует, симптомы передозировки не установлены.
Лечение. В случае передозировки следует проводить симптоматическое лечение и общие поддерживающие мероприятия.
Способ применения и дозы
В/в, в виде инфузии продолжительностью не менее 60 мин, 1 раз в две недели.
Меры предосторожности
При иммуноопосредованных нежелательных реакциях рекомендуется изменение режима применения дурвалумаба и их терапия. В случаях, когда иммуноопосредованные нежелательные реакции не поддаются коррекции высокими дозами системных ГКС, может быть рассмотрена возможность назначения других системных иммунодепрессантов.
Иммуноопосредованный пневмонит
Иммуноопосредованный пневмонит, или интерстициальная болезнь легких, требующий применения системных ГКС и не имеющий альтернативной причины, отмечался у пациентов, получавших дурвалумаб (см. «Побочные действия»).
Необходимо контролировать появление признаков и симптомов развития пневмонита. При подозрении на пневмонит проводят рентгенологическое исследование, рекомендуется корректировка режима терапии.
Лучевой пневмонит часто отмечается у пациентов, получающих лучевую терапию на область легких, клинические проявления пневмонита и лучевого пневмонита очень сходные. В исследовании PACIFIC у пациентов, получавших дуралумаб, завершивших одновременную химиолучевую терапию в период от 1 до 42 дней до начала исследуемой терапии, отмечался как иммуноопосредованный, так и лучевой пневмонит. Пневмонит или лучевой пневмонит развился у 161 (33,9%) пациентов, получавших дурвалумаб, и у 58 (24,8%) пациентов, получавших плацебо, включая реакции 3-й степени тяжести — у 16 (3,4%) и 7 (3%) и реакции 5-й степени тяжести — у 5 (1,1%) и 4 (1,7%) пациентов соответственно. Медиана времени до начала нежелательной реакции составила в обеих группах 55 дней (диапазон 1–406 и 1–255 дней соответственно).
Иммуноопосредованный гепатит
Иммуноопосредованный гепатит, требующий применения системных ГКС и не имеющий альтернативной причины, отмечался у пациентов, получавших дурвалумаб (см. «Побочные действия»). Следует контролировать показатели функции печени у пациентов до начала терапии и периодически во время терапии.
Иммуноопосредованный колит
Иммуноопосредованный колит или диарея, требующий применения системных ГКС и не имеющий альтернативной причины, отмечался у пациентов, получавших дурвалумаб (см. «Побочные действия»). Необходимо контролировать появление признаков и симптомов колита или диареи, рекомендуется корректировка режима терапии.
Иммуноопосредованные эндокринопатии
Гипотиреоз. Иммуноопосредованный гипотиреоз отмечался у пациентов, получавших дурвалумаб (см. «Побочные действия»). Следует контролировать показатели функции щитовидной железы у пациентов до начала и периодически во время терапии. Рекомендуется корректировка режима терапии.
Гипертиреоз. Иммуноопосредованный гипертиреоз отмечался у пациентов, получавших дурвалумаб (см. «Побочные действия»). Следует контролировать показатели функции щитовидной железы у пациентов до начала и периодически во время терапии. Рекомендуется корректировка режима терапии.
Недостаточность функции надпочечников. Иммуноопосредованная недостаточность функции надпочечников отмечалась у пациентов, получавших дурвалумаб (см. «Побочные действия»). Необходимо контролировать появление клинических признаков и симптомов недостаточности функции надпочечников. Рекомендуется корректировка режима терапии у пациентов с недостаточностью функции надпочечников при наличии симптомов.
Сахарный диабет типа 1. Сахарный диабет типа 1 отмечался у пациентов, получавших дурвалумаб (см. «Побочные действия»). Необходимо контролировать появление клинических признаков и симптомов сахарного диабета типа 1. Рекомендуется корректировка режима терапии у пациентов с сахарным диабетом типа 1 при наличии симптомов.
Гипофизит/гипопитуитаризм. Иммуноопосредованный гипофизит/гипопитуитаризм отмечался у пациентов, получавших дурвалумаб (см. «Побочные действия»). Необходимо контролировать появление клинических признаков и симптомов развития гипофизита. Рекомендуется корректировка режима терапии у пациентов с гипофизитом или гипопитуитаризмом при наличии симптомов.
Иммуноопосредованный нефрит
Иммуноопосредованный нефрит, требующий применения системных ГКС и не имеющий альтернативной причины, отмечался у пациентов, получавших дурвалумаб (см. «Побочные действия»). Следует контролировать показатели функции почек у пациентов до начала и периодически во время терапии. Рекомендуется корректировка режима терапии у таких пациентов.
Иммуноопосредованная сыпь
Иммуноопосредованная сыпь или дерматит, требующая применения системных ГКС и не имеющая альтернативной причины, отмечалась у пациентов, получавших дурвалумаб (см. «Побочные действия»). Необходимо контролировать появление клинических признаков и симптомов сыпи и дерматита. Рекомендуется корректировка режима терапии у таких пациентов.
Другие илшуноопосредованные нежелательные реакции
С учетом механизма действия, при применении дурвалумаба могут возникать другие иммуноопосредованные нежелательные реакции. Необходимо контролировать появление их клинических признаков и симптомов. У пациентов, получавших дурвалумаб в монотерапии в клинических исследованиях (n=1889), были отмечены такие иммуноопосредованные нежелательные реакции, как миокардит (<0,1%) и миозит (0,2%). Полимиозит с летальным исходом (<0,1%) был зарегистрирован в продолжающемся клиническом исследовании.
Реакции, связанные с введением дурвалумаба
Необходимо контролировать появление клинических признаков и симптомов реакций, связанных с введением дурвалумаба. У пациентов, получавших дурвалумаб, отмечались тяжелые реакции, связанные с его введением (см. «Побочные действия»).
Влияние на способность к управлению транспортными средствами и механизмами. Маловероятно, что дурвалумаб оказывает влияние на способность к управлению транспортными средствами и механизмами, с учетом его фармакодинамических свойств. Однако при развитии нежелательных реакций, влияющих на концентрацию и скорость реакции, пациенты должны соблюдать осторожность при управлении транспортными средствами и механизмами.
Источники информации
Обобщенные материалы www.grls.rosminzdrav.ru, 2019.
Торговые названия с действующим веществом Дурвалумаб
Фармакологическое действие
Экспрессия белка лиганда рецептора программируемой гибели клетки 1 (PD-L1) является ответом на воздействие адаптивной иммунной системы, который позволяет опухолям избегать обнаружения и элиминации иммунной системой. Экспрессия PD-L1 может индуцироваться воспалительными сигналами (например, IFN-гамма) и происходить как в опухолевых клетках, так и в опухолеассоциированных иммунных клетках микроокружения опухоли. PD-L1 блокирует функции и активацию Т-клеток посредством взаимодействия с PD-1 и CD80 (B7.1). Связываясь с соответствующими рецепторами, PD-L1 уменьшает цитотоксическую активность Т-клеток, пролиферацию и выработку цитокинов. Дурвалумаб является полностью человеческим, высокоаффинным моноклональным антителом, иммуноглобулином G1 каппа (IgGlK), которое селективно блокирует взаимодействие PD-L1 с PD-1 или CD80 (В7.1), при этом не затрагивая взаимодействие между PD-1 и PD-L2.
Дурвалумаб не индуцирует антитело-зависимую клеточную цитотоксичность. Селективная блокада взаимодействий между PD-L1 и PD-1 и PD-L1 и CD80 приводит к усилению противоопухолевого иммунного ответа, который может привести к элиминации опухоли.
Фармакокинетика
Средство вводили в виде в/в инфузий 1 раз в 2, 3 или 4 недели, дозы варьировали от 0,1 мг/кг до 20 мг/кг.
Фармакокинетическое воздействие увеличивалось более чем пропорционально дозе (нелинейная фармакокинетика) при дозах, составляющих <3 мг/кг, и пропорционально дозе (линейная фармакокинетика) при дозах, составляющих >3 мг/кг. Равновесное состояние достигалось примерно через 16 недель.
При применении средства в дозах > 10 мг/кг каждые 2 недели, среднее геометрическое Vd в равновесном состоянии (Vss) составляло 5,64 л. Клиренс дурвалумаба уменьшался с течением времени, что приводило к среднему геометрическому клиренса в равновесном состоянии (CLss), равному 8,16 мл/ч на 365 день терапии; уменьшение CLss не считается клинически значимым. Исходя из клиренса исходного уровня, T1/2 составлял приблизительно 18 дней.
Показания активного вещества
ДУРВАЛУМАБ
Нерезектабельный местно-распространенный немелкоклеточный рак легкого у взрослых пациентов, у которых не выявлено прогрессирование заболевания после химиолучевой терапии на основе препаратов платины.
Режим дозирования
Применяют в виде в/в инфузий, режим дозирования устанавливают индивидуально, с учетом переносимости и безопасности средства.
Рекомендуемая доза составляет 10 мг/кг, продолжительность инфузии — не менее 60 мин.
Побочное действие
Инфекционные и паразитарные заболевания: очень часто — инфекции верхних дыхательных путей (в т.ч. ларингит, назофарингит, паратонзиллярный абсцесс, фарингит, ринит, синусит, тонзиллит, трахеобронхит); пневмония (в т.ч. пневмоцистная пневмония Йировеца, аденовирусная пневмония, бактериальная пневмония, цитомегаловирусная пневмония, пневмония, вызванная гемофильной палочкой, пневмония, вызванная клебсиеллой, некротизирующая пневмония, пневмококковая пневмония, стрептококковая пневмония); часто — дентальные инфекции и инфекции мягких тканей полости рта (в т.ч. гингивит, периодонтит, пульпит, абсцесс зуба); кандидоз полости рта; грипп.
Со стороны эндокринной системы: очень часто — гипотиреоз (в т.ч. аутоиммунный гипотиреоз); часто — гипертиреоз (в т.ч. аутоиммунный тиреоидит, тиреоидит, подострый тиреоидит, Базедова болезнь); нечасто — недостаточность функции надпочечников, сахарный диабет 1 типа; редко — гипофизит/гипопитуитаризм, несахарный диабет.
Со стороны сердечно-сосудистой системы: редко — миокардит.
Со стороны дыхательной системы: очень часто — кашель/продуктивный кашель (в т.ч. продуктивный кашель), пневмонит; часто — дисфония; нечасто — интерстициальная болезнь легких.
Со стороны пищеварительной системы: очень часто — диарея, боль в животе (в т.ч. боль в нижних, верхних и в боковых отделах живота); часто — колит (в т.ч. энтерит, энтероколит, проктит).
Со стороны печени и желчевыводящих путей: часто — увеличение активности АСТ или АЛТ; нечасто — гепатит (в т.ч. аутоиммунный гепатит, токсический гепатит, гепатоцеллюлярное повреждение, острый гепатит и гепатотоксичность).
Со стороны кожи и подкожных тканей: очень часто — сыпь (в т.ч. эритематозная сыпь, генерализованная сыпь, макулезная сыпь, макуло-папулезная сыпь, папулезная сыпь, зудящая сыпь, пустулезная сыпь, эритема, экзема), зуд (в т.ч. генерализованный); часто — дерматит, потливость в ночное время.
Со стороны костно-мышечной системы: часто — миалгия; нечасто — миозит; редко — полимиозит.
Со стороны мочевыводящей системы: часто — увеличение концентрации креатинина в сыворотке крови, дизурия; нечасто — нефрит (в т.ч. аутоиммунный нефрит, тубулоинтерстициальный нефрит, гломерулонефрит, мембранозный гломерулонефрит).
Общие реакции: очень часто — лихорадка; часто — периферические отеки, реакции, связанные с инфузией, крапивница.
Противопоказания к применению
Повышенная чувствительность к средству, возраст до 18 лет, беременность, период грудного вскармливания, нарушение функции печени средней и тяжелой степени тяжести.
С осторожностью: тяжелые аутоиммунные заболевания в активной стадии, при которых дальнейшая активация иммунной системы может представлять потенциальную угрозу жизни.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период грудного вскармливания.
Женщины с сохраненной детородной функцией должны использовать надежные методы контрацепции во время терапии дурвалумабом и, как минимум, в течение 3 мес после введения последней дозы.
Применение при нарушениях функции печени
Следует контролировать показатели функции печени у пациентов до начала терапии дурвалумабом и периодически — во время терапии.
Применение при нарушениях функции почек
Следует контролировать показатели функции почек у пациентов до начала терапии дурвалумабом и периодически — во время терапии.
Применение у детей
Противопоказано применение у детей и подростков в возрасте до 18 лет.
Применение у пожилых пациентов
Коррекции дозы у пожилых пациентов (> 65 лет) не требуется. Между пациентами в возрасте 65 лет и старше и более молодыми пациентами не отмечалось различий в профилях безопасности.
Особые указания
У пациентов, получающих дурвалумаб, необходимо контролировать появление признаков и симптомов пневмонита. При подозрении на пневмонит проводят рентгенологическое исследование и при необходимости проводят соответствующую терапию и/или корректируют режим дозирования.
Иммуноопосредованный гепатит, требующий применения системных ГКС и не имеющий альтернативной причины, отмечался у пациентов, получающих дурвалумаб. Следует контролировать показатели функцию печени у пациентов до начала терапии и периодически — во время терапии; при необходимости проводят соответствующую терапию и/или коррекцию режима дозирования.
Иммуноопосредованный колит или диарея, требующий применения системных ГКС и не имеющий альтернативной причины, отмечался у пациентов, получающих дурвалумаб. Необходимо контролировать появление признаков и симптомов колита или диареи; при необходимости проводят соответствующую терапию и/или коррекцию режима дозирования.
Иммуноопосредованные гипотиреоз и гипертиреоз отмечались у пациентов, получающих дурвалумаб. Следует контролировать показатели функции щитовидной железы у пациентов до начала терапии и периодически — во время терапии. При необходимости проводят соответствующую терапию и/или коррекцию режима дозирования.
Иммуноопосредованная недостаточность функции надпочечников отмечалась у пациентов, получающих дурвалумаб. Необходимо контролировать появление клинических признаков и симптомов недостаточности функции надпочечников; при необходимости проводят соответствующую терапию и/или коррекцию режима дозирования.
Сахарный диабет 1 типа отмечался у пациентов, получающих дурвалумаб. Необходимо контролировать появление клинических признаков и симптомов сахарного диабета 1 типа; при необходимости проводят соответствующую терапию и/или коррекцию режима дозирования.
Иммуноопосредованный гипофизит/гипопитуитаризм отмечался у пациентов, получающих дурвалумаб. Необходимо контролировать появление клинических признаков и симптомов гипофизита; при необходимости проводят соответствующую терапию и/или коррекцию режима дозирования.
Иммуноопосредованный нефрит, требующий применения системных ГКС и не имеющий альтернативной причины, отмечался у пациентов, получающих дурвалумаб. Следует контролировать показатели функции почек у пациентов до начала терапии и периодически — во время терапии. При необходимости проводят соответствующую терапию и/или коррекцию режима дозирования.
Иммуноопосредованная сыпь или дерматит, требующая применения системных ГКС и не имеющая альтернативной причины, отмечалась у пациентов, получающих дурвалумаб. Необходимо контролировать появление клинических признаков и симптомов сыпи и дерматита. При необходимости проводят соответствующую терапию и/или коррекцию режима дозирования.
С учетом механизма действия дурвалумаба, у пациентов могут возникать другие иммуноопосредованные нежелательные реакции (миокардит, миозит). Необходимо контролировать появление клинических признаков и симптомов. При необходимости проводят соответствующую терапию и/или коррекцию режима дозирования.
Влияние на способность к управлению транспортными средствами и механизмами
При развитии нежелательных реакций, влияющих на концентрацию и скорость реакции, на фоне применения дурвалумаба, пациенты должны соблюдать осторожность при управлении транспортными средствами и механизмами.
Лекарственное взаимодействие
Применение системных ГКС или иммуносупрессантов до начала терапии дурвалумабом, за исключением системных ГКС в физиологической дозе (до 10 мг преднизолона в сут или эквивалент), не рекомендуется из-за возможного влияния на фармакодинамическую активность и эффективность дурвалумаба. Тем не менее, системные ГКС и иммуносупрессанты могут применяться после начала терапии дурвалумабом для лечения иммуноопосредованных нежелательных реакций.
Основными путями метаболизма дурвалумаба являются протеиновый катаболизм с участием ретикуло-эндотелиальной системы и мишень-опосредованный клиренс, поэтому взаимодействий с другими лекарственными препаратами на уровне метаболизма не ожидается.
Имфинзи — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-005664
Торговое наименование:
Имфинзи®
Международное непатентованное наименование:
дурвалумаб
Лекарственная форма:
концентрат для приготовления раствора для инфузий
Состав
В 1 мл концентрата содержится:
Действующее вещество: дурвалумаб 50 мг
Вспомогательные вещества: L-гистидин 2 мг, L-гистидина гидрохлорида моногидрат 2,7 мг, α,α-трегалозы дигидрат 104 мг, полисорбат 80 0,2 мг, вода для инъекций приблизительно 900 мг.
Описание
От прозрачной до опалесцирующей, от бесцветной до желтоватого цвета жидкость.
Фармакотерапевтическая группа:
противоопухолевое средство, антитела моноклональные.
Код ATX:
L01XC28
Фармакологические свойства
Фармакодинамика
Механизм действия
Экспрессия белка лиганда рецептора программируемой гибели клетки 1 (PD-L1) является ответом на воздействие адаптивной иммунной системы, который позволяет опухолям избегать обнаружения и элиминации иммунной системой. Экспрессия PD-L1 может индуцироваться воспалительными сигналами (например, IFN-гамма) и происходить как в опухолевых клетках, так и в опухолеассоциированных иммунных клетках микроокружения опухоли. PD-L1 блокирует функции и активацию Т-клеток посредством взаимодействия с PD-1 и CD80 (B7.1). Связываясь с соответствующими рецепторами, PD-L1 уменьшает цитотоксическую активность Т-клеток, пролиферацию и выработку цитокинов.
Дурвалумаб является полностью человеческим, высокоаффинным моноклональным антителом, иммуноглобулином G1 каппа (IgGlK), которое селективно блокирует взаимодействие PD-L1 с PD-1 или CD80 (В7.1), при этом не затрагивая взаимодействие между PD-1 и PD-L2.
Дурвалумаб не индуцирует антителозависимую клеточную цитотоксичность. Селективная блокада взаимодействий между PD-L1 и PD-1 и PD-L1 и CD80 приводит к усилению противоопухолевого иммунного ответа, который может привести к элиминации опухоли. В доклинических исследованиях блокада PD-L1 приводила к увеличению активации Т-лимфоцитов и к уменьшению размеров опухолей.
Фармакокинетика
Фармакокинетику дурвалумаба изучали у 1902 пациентов, при этом дозы варьировали от 0,1 мг/кг до 20 мг/кг, а препарат вводили один раз в две, три или четыре недели. Фармакокинетическое воздействие увеличивалось более чем пропорционально дозе (нелинейная фармакокинетика) при дозах, составляющих <3 мг/кг, и пропорционально дозе (линейная фармакокинетика) при дозах, составляющих ≥3 мг/кг. Равновесное состояние достигалось примерно через 16 недель.
На основании популяционного фармакокинетического анализа, включавшего данные 1878 пациентов, получавших препарат в дозах ≥10 мг/кг каждые 2 недели, среднее геометрическое объема распределения в равновесном состоянии (Vss) составляло 5,64 л. Клиренс дурвалумаба уменьшался с течением времени, что приводило к среднему геометрическому клиренса в равновесном состоянии (CLss), равному 8,16 мл/час на 365 день терапии; уменьшение CLss не считается клинически значимым. Исходя из клиренса исходного уровня, период полувыведения составлял приблизительно 18 дней.
Фармакокинетика у особых групп пациентов
Возраст (19-96 лет), масса тела (34-149 кг), пол, наличие антител к дурвалумабу, концентрация альбумина, активность лактатдегидрогеназы, концентрация креатинина, концентрация растворимого PD-L1, тип опухоли, расовая принадлежность, нарушение функции почек легкой степени тяжести (клиренс креатинина (КК) 60-89 мл/мин), нарушение функции почек средней степени тяжести (КК 30-59 мл/мин), нарушение функции печени легкой степени (билирубин ≤ верхней границы нормы (ВГН) и активность аспартатаминотрансферазы (ACT) > ВГН или концентрация билирубина > ВГН до 1,5×ВГН при любой активности ACT) и общее состояние по шкале ВОЗ/ECOG не оказывали клинически значимого воздействия на фармакокинетику дурвалумаба.
Влияние нарушения функции почек тяжелой степени (КК 15-29 мл/мин) или нарушения функции печени средней степени тяжести (концентрация билирубина >1,5×ВГН до 3×ВГН и любая активность ACT) и нарушения функции печени тяжелой степени (концентрация билирубина >3×ВГН и любая активность ACT) на фармакокинетику дурвалумаба неизвестно.
Пациенты пожилого возраста
Коррекции дозы у пожилых пациентов (≥65 лет) не требуется. Из 476 пациентов с местнораспространенным нерезектабельным немелкоклеточным раком легкого (НМРЛ) в исследовании PACIFIC (первичная популяция для оценки эффективности), получавших препарат Имфинзи®, 215 пациентов были в возрасте 65 лет и старше. В целом, между пациентами в возрасте 65 лет и старше и более молодыми пациентами не отмечалось различий в профилях безопасности.
Показания к применению
- Нерезектабельный местнораспространенный немелкоклеточный рак легкого у взрослых пациентов, у которых не выявлено прогрессирование заболевания после химиолучевой терапии на основе препаратов платины.
- Первая линия терапии распространенного мелкоклеточного рака
легкого (рМРЛ) в комбинации с этопозидом и карбоплатином или цисплатином.
Противопоказания
- Повышенная чувствительность к дурвалумабу или вспомогательным веществам, входящим в состав препарата.
- Детский возраст до 18 лет.
- Беременность и период грудного вскармливания.
- Нарушение функции печени средней и тяжелой степени тяжести.
С осторожностью: тяжелые аутоиммунные заболевания в активной стадии, при которых дальнейшая активация иммунной системы может представлять потенциальную угрозу жизни.
Применение при беременности и в период грудного вскармливания
Женщины с сохраненной детородной функцией
Женщины с сохраненной детородной функцией должны использовать надежные методы контрацепции во время терапии дурвалумабом и, как минимум, в течение 3 месяцев после введения последней дозы препарата.
Беременность
Данные о применении дурвалумаба у беременных женщин отсутствуют. С учетом механизма действия, дурвалумаб может оказывать влияние на течение беременности и вредное воздействие на плод при его применении во время беременности. На модели аллогенной беременности у мышей было показано, что нарушение передачи сигнала через PD-L1 приводит к увеличению частоты потери плода. В исследованиях у животных не было выявлено репродуктивной токсичности. Человеческий иммуноглобулин IgGl проникает через плацентарный барьер. В исследованиях на животных было показано, что дурвалумаб также проникает через плацентарный барьер. Применение дурвалумаба во время беременности может причинить вред плоду. Поэтому дурвалумаб не должен применяться во время беременности и при отсутствии надежной контрацепции во время терапии, и, как минимум, в течение 3 месяцев после введения последней дозы препарата.
Грудное вскармливание
Нет информации, касающейся экскреции дурвалумаба в грудное молоко. По результатам токсикологических исследований в молоке яванских макак на 28 день после родов был выявлен дурвалумаб в низких концентрациях. У человека моноклональные антитела могут выделяться в грудное молоко, однако нет данных об их возможной абсорбции и вреде для новорожденного. Тем не менее, нельзя исключить риск для младенцев, получающих грудное вскармливание. Поэтому следует либо прекратить грудное вскармливание, либо воздержаться от терапии дурвалумабом с учетом пользы грудного вскармливания для младенца и пользы терапии дурвалумабом для женщины.
Фертильность
Данные о возможном влиянии дурвалумаба на фертильность у животных и у человека отсутствуют.
Способ применения и дозы
Дозы
Рекомендуемая доза препарата Имфинзи® составляет 10 мг/кг в виде внутривенной инфузии продолжительностью не менее 60 минут. Препарат необходимо вводить один раз в 2 недели до прогрессирования заболевания или развития неприемлемой токсичности.
Увеличение или уменьшение дозы препарата не рекомендуется. С учетом переносимости и безопасности препарата может потребоваться приостановка терапии или ее отмена.
Рекомендации по купированию иммуноопосредованных нежелательных реакций представлены в Таблице 1. В разделе «Особые указания» приведены дальнейшие рекомендации по мониторингу нежелательных реакций и ведению пациентов.
Таблица 1. Рекомендации по изменению режима терапии препаратом Имфинзи® и купированию нежелательных реакций
| Нежелательная реакция | Степень тяжести1 | Изменение режима терапии препаратом Имфинзи® | Терапия глюкокортикостероидами (если не указано другое) |
| Иммуноопосредованный пневмонит | 2 степень | Приостановка терапии2 | Назначение преднизолона в дозе 1-2 мг/кг/сутки (или эквивалента) с последующим снижением дозы |
| 3 или 4 степень | Прекращение терапии | Назначение преднизолона в дозе 1-4 мг/кг/сутки (или эквивалента) с последующим снижением дозы | |
| Иммуноопосредованный гепатит | 2 степень с активностью аланинаминотр ансферазы (АЛТ) или ACT >3×ВГН до 5×ВГН и/или концентрацией общего билирубина >1,5×ВГН до 3×ВГН | Приостановка терапии2 | Назначение преднизолона в дозе 1-2 мг/кг/сутки (или эквивалента) с последующим снижением дозы |
| 3 степень с активностью АЛТ или ACT >5×ВГН до 8×ВГН или концентрацией общего билирубина >3×ВГН до 5×ВГН | |||
| 3 степень с активностью АЛТ или ACT >8×ВГН или концентрацией общего билирубина >5×ВГН | Прекращение терапии | ||
| Одновременное повышение активности АЛТ или ACT >3×ВГН и концентрации общего билирубина >2×ВГН при отсутствии других причин | |||
| Иммуноопосредованный колит или диарея | 2 степень | Приостановка терапии2 | Назначение преднизолона в дозе 1-2 мг/кг/сутки (или эквивалента) с последующим снижением дозы |
| 3 или 4 степень | Прекращение терапии | ||
| Иммуноопосредованные эндокринопатии: гипертиреоз | 2-4 степень | Приостановка терапии до достижения стабильной клинической ситуации | Симптоматическая терапия |
| Иммуноопосредованные эндокринопатии: гипотиреоз | 2-4 степень | Без изменений | Назначение заместительной терапии гормонами щитовидной железы по клиническим показаниям |
| Иммуноопосредованные эндокринопатии: недостаточность функции надпочечников, гипофизит или гипопитуитаризм | 2-4 степень | Приостановка терапии до достижения стабильной клинической ситуации | Назначение преднизолона в дозе 1-2 мг/кг/сутки (или эквивалента) с последующим снижением дозы и гормонозаместительная терапия по клиническим показаниям |
| Иммуноопосредованные эндокринопатии: сахарный диабет 1 типа | 2-4 степень | Приостановка терапии до достижения стабильной клинической ситуации | Назначение препаратов инсулина по клиническим показаниям |
| Иммуноопосредованный нефрит | 2 степень с повышением концентрации креатинина сыворотки >1,5×ВГН (или исходное значение) до 3×ВГН (или исходное значение) | Приостановка терапии2 | Назначение преднизолона в дозе 1-2 мг/кг/сутки (или эквивалента) с последующим снижением дозы |
| 3 степень с повышением концентрации креатинина сыворотки >3× исходное значение или >3×ВГН до 6×ВГН; 4 степень с повышением концентрации креатинина сыворотки >6×ВГН | Прекращение терапии | ||
| Иммуноопосредованная сыпь или дерматит | 2 степень дольше 1 недели | Приостановка терапии2 | Назначение преднизолона в дозе 1-2 мг/кг/сутки (или эквивалента) с последующим снижением дозы |
| 3 степень | |||
| 4 степень | Прекращение терапии | ||
| Иммуноопосредованный миокардит | 2 степень | Приостановка терапии3 | Назначение преднизолона в дозе 2-4 мг/кг/сутки (или эквивалента) с последующим снижением дозы |
| 3, 4 степень или любая степень при диагнозе, подтвержденном исследованием биоптата | Прекращение терапии | ||
| Иммуноопосредованный миозит/полимиозит | 2 или 3 степень | Приостановка терапии4 | Назначение преднизолона в дозе 2-4 мг/кг/сутки (или эквивалента) с последующим снижением дозы |
| 4 степень | Прекращение терапии | ||
| Инфузионные реакции | 1 или 2 степень | Прервать введение препарата или уменьшить скорость инфузии | Рассмотреть возможность премедикации для профилактики последующих инфузионных реакций |
| 3 или 4 степень | Прекращение терапии |
1 Общие терминологические критерии нежелательных явлений Национального института онкологии США, версия 4,03.
2 В зависимости от тяжести нежелательных реакций следует приостановить терапию препаратом Имфинзи® и назначить терапию глюкокортикостероидами. При отсутствии эффекта или ухудшении состояния возможно повышение дозы глюкокортикостероидов и/или назначение других системных иммуносупрессантов. После улучшения состояния до ≤ 1 степени тяжести следует начать постепенное снижение дозы глюкокортикостероидов продолжительностью не менее 1 месяца.
Терапию препаратом Имфинзи® можно возобновить после приостановки, если тяжесть нежелательной реакции уменьшилась до ≤1 степени тяжести, и доза глюкокортикостероидов была снижена до ≤10 мг преднизолона в сутки или эквивалента.
3 При отсутствии улучшения состояния в течение 3-5 дней, несмотря на применение глюкокортикостероидов, необходимо незамедлительно назначить иммуносупрессивную терапию. После разрешения нежелательной реакции следует начать постепенное снижение дозы глюкокортикостероидов продолжительностью не менее 1 месяца, после чего, в зависимости от клинической ситуации, терапия препаратом Имфинзи® может быть возобновлена.
4 Терапию препаратом Имфинзи® следует прекратить, если нежелательная реакция не разрешится до ≤1 степени тяжести в течение 30 дней, или при наличии дыхательной недостаточности.
При подозрении на возникновение иммуноопосредованных нежелательных реакций необходимо провести обследование для подтверждения этиологии и исключения других причин. При развитии других иммуноопосредованных реакций, не указанных в Таблице 1, необходимо прекратить терапию препаратом Имфинзи®, если тяжесть реакции соответствует 4 степени. Если иммуноопосредованная реакция соответствует 3 степени тяжести, следует приостановить применение препарата Имфинзи®; с учетом клинической ситуации может быть рассмотрен вопрос о прекращении терапии. Необходимо рассмотреть вопрос назначения системных глюкокортикостероидов.
Применение у особых групп пациентов
По данным популяционного фармакокинетического анализа, коррекция дозы препарата Имфинзи® в зависимости от возраста, массы тела, пола и расовой принадлежности не рекомендуется (см. раздел «Фармакокинетика»).
Дети и подростки
Безопасность и эффективность дурвалумаба у пациентов младше 18 лет не были установлены.
Пациенты пожилого возраста (≥65 лет)
Пациентам пожилого возраста (≥65 лет) коррекция дозы не требуется (см. разделы «Фармакодинамика» и «Фармакокинетика»).
Нарушение функции почек
Коррекция дозы препарата Имфинзи® у пациентов с нарушением функции почек легкой и средней степени тяжести не рекомендуется. Ограниченные данные о пациентах с нарушением функции почек тяжелой степени не позволяют сделать выводы о необходимости коррекции дозы в этой популяции пациентов (см. раздел «Фармакокинетика»).
Нарушение функции печени
По данным популяционного фармакокинетического анализа, пациентам с нарушением функции печени легкой степени тяжести коррекция дозы не требуется. Препарат Имфинзи® не изучался у пациентов с нарушением функции печени средней и тяжелой степени тяжести (см. раздел «Фармакокинетика»).
Способ применения
Для внутривенного введения.
Приготовление раствора
Препарат Имфинзи® не содержит консервантов, каждый флакон предназначен для однократного применения. Следует соблюдать правила асептики при приготовлении раствора.
- Перед применением проводят визуальный осмотр лекарственного препарата на предмет наличия механических включений и изменения цвета. Если раствор мутный, его цвет изменен, и отмечаются видимые частицы, флакон утилизируют. Не следует встряхивать флакон.
- Из флакона (флаконов) извлекают нужный объем препарата Имфинзи® и переносят во флакон для внутривенной инфузии, содержащий 0,9% раствор натрия хлорида для инъекций или 5% раствор глюкозы для инъекций. Перемешивают разведенный раствор посредством осторожного переворачивания. Раствор не встряхивать и не замораживать. Окончательная концентрация разведенного раствора должна составлять 1-15 мг/мл.
- Из флакона следует извлекать только одну дозу препарата; не следует повторно прокалывать флакон для извлечения еще одной дозы препарата.
- Частично использованные флаконы препарата Имфинзи® утилизируют.
Хранение раствора для инфузий
Препарат Имфинзи® не содержит консервантов. Раствор для инфузий вводят сразу же после приготовления. Если раствор для инфузий вводят не сразу, и его необходимо хранить, то суммарное время с момента прокола флакона до начала введения не должно превышать:
• 24 часа при хранении в холодильнике при температуре от 2 до 8 °С.
• 4 часа при хранении при комнатной температуре до 25 °С.
Введение
Раствор для инфузий вводят внутривенно, продолжительность введения не менее 60 минут через внутривенный катетер со стерильным встроенным 0,2 или 0,22 микронным фильтром с низким связыванием белков. Через одну и ту же инфузионную систему нельзя одновременно вводить другие лекарственные препараты. Неиспользованный лекарственный препарат и расходные материалы следует утилизировать в соответствии с локальными требованиями.
Побочное действие
Краткая характеристика профиля безопасности
Профиль безопасности препарата Имфинзи® был изучен в исследовании PACIFIC (n=475) у пациентов с местнораспространенным нерезектабельным НМРЛ, которые завершили, как минимум, 2 цикла одновременной химиолучевой терапии в период от 1 до 42 дней до включения в исследование. В этой популяции пациентов наиболее частыми нежелательными реакциями были кашель (40,2% и 30,3% в группе плацебо, соответственно), инфекции верхних дыхательных путей (26,1% и 11,5% в группе плацебо, соответственно) и сыпь (21,7% и 12,0% в группе плацебо, соответственно). Наиболее частой нежелательной реакцией 3-4 степени тяжести (по Общим терминологическим критериям нежелательных явлений Национального института онкологии США, версия 4.03) была пневмония (6,5% и 5,6% в группе плацебо, соответственно). Общая частота нежелательных реакций 3-4 степени тяжести в группе препарата Имфинзи® составила 12,8%, в группе плацебо – 9,8%.
Табличный перечень нежелательных реакции
В Таблице 2 приведена частота нежелательных реакций у пациентов с местнораспространенным нерезектабельным НМРЛ в исследовании PACIFIC независимо от оценки исследователем причинно-следственной связи с приемом препарата. Нежелательные реакции сгруппированы по системно-органным классам. Внутри каждого класса нежелательные реакции перечислены в порядке убывания частоты. Частота возникновения нежелательных реакций представлена в следующей градации: очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (≥1/1000, <1/100), редко (≥1/10000, <1/1000), очень редко (<1/10000), неуточненной частоты (частота не может быть определена на основании имеющихся данных). Внутри одной категории частоты нежелательные лекарственные реакции представлены в порядке убывания серьезности.
Таблица 2. Нежелательные реакции, отмечавшиеся у пациентов с местнораспространенным нерезектабельным НМРЛ, получавших препарат Имфинзи® в дозе 10 мг/кг
| Частота нежелательных реакций любой степени тяжести (%) |
Частота нежелательных реакций 3-4 степени тяжести (%) |
||
| Инфекционные и паразитарные заболевания | |||
| Инфекции верхних дыхательных путей1 | Очень часто | 26,1 | 0,4 |
| Пневмония2,3 | Очень часто | 17,1 | 6,5 |
| Дентальные инфекции и инфекции мягких тканей полости рта4 | Часто | 3,6 | 0 |
| Кандидоз полости рта | Часто | 3,2 | 0 |
| Грипп | Часто | 2,5 | 0 |
| Нарушения со стороны эндокринной системы | |||
| Гипотиреоз5 | Очень часто | 11,6 | 0,2 |
| Гипертиреоз6 | Часто | 8,2 | 0 |
| Недостаточность функции надпочечников | Нечасто | 0,2 | 0 |
| Сахарный диабет 1 типа | Нечасто | 0,2 | 0,2 |
| Гипофизит/гипопитуитаризм | Редко7 | <0,1 | <0,1 |
| Несахарный диабет | Редко7 | <0,1 | <0,1 |
| Нарушения со стороны сердца | |||
| Миокардит | Редко7 | <0,1 | <0,1 |
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | |||
| Кашель/продуктивный кашель8 | Очень часто | 40,2 | 0,6 |
| Пневмонит2 | Очень часто | 12,6 | 1,7 |
| Дисфония | Часто | 3,8 | 0 |
| Интерстициальная болезнь легких | Нечасто | 0,6 | 0 |
| Нарушения со стороны желудочно-кишечного тракта | |||
| Диарея | Очень часто | 18,3 | 0,6 |
| Боль в животе9 | Очень часто | 10,1 | 0,4 |
| Колит10 | Часто | 1,1 | 0,2 |
| Нарушения со стороны печени и желчевыводящих путей | |||
| Увеличение активности ACT или АЛТ11 | Часто | 6,1 | 1,9 |
| Гепатит3,12 | Нечасто | 0,6 | 0 |
| Нарушения со стороны кожи и подкожных тканей | |||
| Сыпь13 | Очень часто | 21,7 | 0,6 |
| зуд14 | Очень часто | 12,4 | 0 |
| Дерматит | Часто | 1,5 | 0 |
| Потливость в ночное время | Часто | 2,3 | 0 |
| Нарушения со стороны скелетно-мышечной и соединительной ткани | |||
| Миалгия | Часто | 8,0 | 0,2 |
| Миозит | Нечасто | 0,4 | 0 |
| Полимиозит3 | Редко7 | <0,1 | <0,1 |
| Нарушения со стороны почек и мочевыводящих путей | |||
| Увеличение концентрации креатинина в сыворотке крови | Часто | 4,6 | 0,2 |
| Дизурия | Часто | 2,3 | 0 |
| Нефрит15 | Нечасто | 0,4 | 0 |
| Общие расстройства и реакции в месте введения | |||
| Лихорадка | Очень часто | 14,7 | 0,2 |
| Периферические отеки | Часто | 7,8 | 0 |
| Травмы, интоксикации и осложнения процедур | |||
| Реакции, связанные с введением препарата16 | Часто | 1,9 | 0 |
1 Включает ларингит, назофарингит, паратонзиллярный абсцесс, фарингит, ринит, синусит, тонзиллит, трахеобронхит и инфекцию верхних дыхательных путей.
2 Включает инфекцию легких; пневмоцистную пневмонию Йировеца; пневмонию; аденовирусную пневмонию; бактериальную пневмонию; цитомегаловирусную пневмонию; пневмонию, вызванную гемофильной палочкой; пневмонию, вызванную клебсиеллой; некротизирующую пневмонию; пневмококковую пневмонию и стрептококковую пневмонию.
3 В исследовании PACIFIC фатальный пневмонит и фатальная пневмония наблюдались с одинаковой частотой в группе препарата Имфинзи® и группе плацебо; фатальный гепатит и фатальный полимиозит были отмечены в других клинических исследованиях.
4 Включает гингивит, инфекцию полости рта, периодонтит, пульпит, абсцесс зуба и дентальную инфекцию.
5 Включает аутоиммунный гипотиреоз и гипотиреоз.
6 Включает гипертиреоз, аутоиммунный тиреоидит, тиреоидит, подострый тиреоидит и Базедову болезнь.
7 Нежелательные реакции не наблюдались в исследовании PACIFIC, но наблюдались в других клинических исследованиях (n=1889).
8 Включает кашель и продуктивный кашель.
9 Включает боль в животе, боль в нижних отделах живота, боль в верхних отделах живота, боль в боковых отделах живота.
10 Включает колит, энтерит, энтероколит и проктит.
11 Включает повышение активности АЛТ, ACT, печеночных ферментов и трансаминаз.
12 Включает гепатит, аутоиммунный гепатит, токсический гепатит, гепатоцеллюлярное повреждение, острый гепатит и гепатотоксичность.
13 Включает эритематозную сыпь, генерализованную сыпь, макулезную сыпь, макулопапулезную сыпь, папулезную сыпь, зудящую сыпь, пустулезную сыпь, эритему, экзему и сыпь.
14 Включает генерализованный зуд и зуд.
15 Включает аутоиммунный нефрит, тубулоинтерстициальный нефрит, нефрит, гломерулонефрит и мембранозный гломерулонефрит.
16 Включает реакции, связанные с инфузией, и крапивницу с датой начала в день инфузии или на следующий день.
Описание отдельных нежелательных реакций
Применение препарата Имфинзи® наиболее часто связано с развитием иммуноопосредованных нежелательных реакций. Эти реакции, включая тяжелые, в большинстве случаев, разрешались после назначения соответствующей терапии или отмены препарата Имфинзи®. Данные о приведенных ниже иммуноопосредованных нежелательных реакциях получены из объединенной базы данных 1889 пациентов, принимавших участие в исследовании PACIFIC и двух дополнительных исследованиях (мультикогортное открытое клиническое исследование у пациентов с распространенными солидными опухолями и открытое исследование у пациентов с местнораспространенным или метастатическим НМРЛ). В этих исследованиях препарат Имфинзи® применялся в дозе 10 мг/кг один раз в 2 недели. Рекомендации по лечению этих нежелательных реакций приведены в разделе «Особые указания».
Иммуноопосредованный пневмонит
В объединенной базе данных по монотерапии препаратом Имфинзи® (n=1889 пациентов с опухолями различных типов) иммуноопосредованный пневмонит возник у 79 (4,2%) пациентов, включая реакции 3 степени тяжести у 12 (0,6%) пациентов, 4 степени тяжести у 1 (<0,1%) пациента и 5 степени тяжести у 5 (0,3%) пациентов. Медиана времени до начала нежелательной реакции составила 53 дня (диапазон 1-341 день). 45 из 79 пациентов получали терапию системными глюкокортикостероидами в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент), 2 пациента также получали инфликсимаб. Терапия препаратом Имфинзи® была отменена у 26 пациентов. Реакция разрешилась у 42 пациентов. Иммуноопосредованный пневмонит чаще отмечался у пациентов в исследовании PACIFIC, завершивших одновременную химиолучевую терапию в период от 1 до 42 дней до начала исследуемой терапии (10,7%), чем у других пациентов в объединенной базе данных по безопасности (2,0%).
В исследовании PACIFIC (n=475 в группе препарата Имфинзи®, n=234 в группе плацебо) иммуноопосредованный пневмонит развился у 51 пациента (10,7%) в группе препарата Имфинзи® и у 16 (6,8%) пациентов в группе плацебо, включая нежелательные реакции 3 степени тяжести у 8 (1,7%) пациентов в группе препарата Имфинзи® по сравнению с 6 (2,6%) пациентами в группе плацебо, и реакции 5 степени тяжести (фатальные) у 4 (0,8%) пациентов в группе препарата Имфинзи® по сравнению с 3 (1,3%) пациентами в группе плацебо. Медиана времени до начала нежелательной реакции в группе препарата Имфинзи® составила 53 дня (диапазон 1-341 день) и 55,5 дней в группе плацебо (диапазон 0-231 день). 44 из 51 пациента в группе препарата Имфинзи® получали терапию системными глюкокортикостероидами, включая 28 пациентов, получавших глюкокортикостероиды в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент), 2 пациента также получали инфликсимаб. В группе плацебо 11 из 16 пациентов получали терапию системными глюкокортикостероидами, включая 9 пациентов, получавших глюкокортикостероиды в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент). Реакция разрешилась у 27 пациентов в группе Имфинзи® и у 6 пациентов в группе плацебо.
Иммуноопосредованный гепатит
В объединенной базе данных по монотерапии препаратом Имфинзи® иммуноопосредованный гепатит был отмечен у 19 (1,0%) пациентов, включая реакции 3 степени тяжести у 11 (0,6%) пациентов и 5 степени тяжести (фатальную) у 1 (<0,1%) пациента. Медиана времени до начала нежелательной реакции составила 70 дней (диапазон 15-312 дней). 13 из 19 пациентов получали терапию системными глюкокортикостероидами в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент). Один пациент также получал микофенолата мофетил. Терапия препаратом Имфинзи® была прекращена у 4 пациентов. Реакция разрешилась у 12 пациентов.
Иммуноопосредованный колит
В объединенной базе данных по монотерапии препаратом Имфинзи® иммуноопосредованный колит или диарея были отмечены у 31 (1,6%) пациента, включая реакции 3 степени тяжести у 6 (0,3%) пациентов и 4 степени тяжести у 1 (<0,1%) пациента. Медиана времени до начала нежелательной реакции составила 74 дня (диапазон 1-365 дней). 16 из 31 пациента получали терапию системными глюкокортикостероидами в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент). Один пациент также получал инфликсимаб. Терапия препаратом Имфинзи® была прекращена у 8 пациентов. Реакция разрешилась у 23 пациентов.
Иммуноопосредованные эндокринопатии
Гипотиреоз
В объединенной базе данных по монотерапии препаратом Имфинзи® иммуноопосредованный гипотиреоз был отмечен у 137 (7,3%) пациентов, включая реакцию 3 степени тяжести у 1 (< 0,1%) пациента. Медиана времени до начала нежелательной реакции составила 85 дней (диапазон 9-378 дней). 134 из 137 пациентов получали гормонозаместительную терапию, 2 пациента – терапию системными глюкокортикостероидами в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент) по поводу гипотиреоза с последующим назначением гормонозаместительной терапии. Случаев прекращения терапии препаратом Имфинзи® из-за гипотиреоза не было.
Гипертиреоз
В объединенной базе данных по монотерапии препаратом Имфинзи® иммуноопосредованный гипертиреоз был отмечен у 34 (1,8%) пациентов. Реакций 3 и 4 степени тяжести отмечено не было. Медиана времени до начала нежелательной реакции составила 41 день (диапазон 14-195 дней). 26 из 34 пациентов получали специфическую терапию (тиамазол, карбимазол, пропилтиоурацил или бета-адреноблокаторы), 12 пациентам был назначен тироксин при переходе гипертиреоза в гипотиреоз, 12 пациентов получали терапию системными глюкокортикостероидами, и 3 из 12 пациентов – терапию системными глюкокортикостероидами в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент). Случаев прекращения терапии препаратом Имфинзи® из-за гипертиреоза не было. У 8 пациентов развился гипотиреоз в исходе гипертиреоза.
Недостаточность функции надпочечников
В объединенной базе данных по монотерапии препаратом Имфинзи® иммуноопосредованная недостаточность функции надпочечников была отмечена у 7 (0,4%) пациентов, включая реакцию 3 степени тяжести у 1 пациента (<0,1%). Медиана времени до начала нежелательной реакции составила 141 день (диапазон 70-265 дней). Все 7 пациентов получали терапию системными глюкокортикостероидами, при этом 2 пациента – терапию системными глюкокортикостероидами в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент). Случаев прекращения терапии препаратом Имфинзи® из-за недостаточности функции надпочечников не было. Явление разрешилось у 1 пациента.
Сахарный диабет 1 типа
В объединенной базе данных по монотерапии препаратом Имфинзи® сахарный диабет 1 типа развился у 1 (<0,1%) пациента (3 степень тяжести). Терапия препаратом Имфинзи® была прекращена из-за развития сахарного диабета 1 типа. Время до начала реакции составило 42 дня. Пациент получал инсулинотерапию.
Гипофизит/гипопитуитаризм
В объединенной базе данных по монотерапии препаратом Имфинзи® иммуноопосредованный гипопитуитаризм был отмечен у 1 (<0,1%) пациента (3 степень тяжести). Этот пациент получал терапию системными глюкокортикостероидами в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент) без прекращения терапии препаратом Имфинзи®.
Иммуноопосредованный нефрит
В объединенной базе данных по монотерапии препаратом Имфинзи® иммуноопосредованный нефрит был отмечен у 3 (0,2%) пациентов, включая реакцию 3 степени тяжести у 1 пациента (<0,1%). Медиана времени до начала нежелательной реакции составила 95 дней (диапазон 28-239 дней). 2 (0,1%) пациента получали терапию системными глюкокортикостероидами в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент). Терапия препаратом Имфинзи® была прекращена у всех 3 пациентов. Явление разрешилось у 2 пациентов.
Иммуноопосредованная сыпь
В объединенной базе данных по монотерапии препаратом Имфинзи® иммуноопосредованная сыпь или дерматит были отмечены у 30 (1,6%) пациентов, включая реакции 3 степени тяжести у 7 (0,4%) пациентов. Медиана времени до начала нежелательной реакции составила 74 дня (диапазон 1-365 дней). 11 из 30 пациентов получали терапию системными глюкокортикостероидами в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент). Терапия препаратом Имфинзи® была прекращена у 2 пациентов. Явление разрешилось у 18 пациентов.
Реакции, связанные с введением препарата
В объединенной базе данных по монотерапии препаратом Имфинзи® реакции, связанные с введением препарата, были отмечены у 35 (1,9%) пациентов, включая реакцию 3 степени тяжести у 5 (0,3%) пациентов.
Изменения лабораторных показателей
В исследовании PACIFIC отклонения лабораторных показателей по сравнению с исходными значениями в группе дурвалумаба были отмечены у следующей пропорции пациентов: увеличение активности АЛТ у 38,5% пациентов (все степени тяжести) и у 2,3% пациентов (3-4 степени тяжести); увеличение активности ACT у 36,0% пациентов (все степени тяжести) и у 2,8% пациентов (3-4 степени тяжести); увеличение концентрации креатинина у 16,3% (все степени тяжести), увеличение концентрации тиреотропного гормона выше ВГН и выше исходного значения у 26,5% пациентов (все степени тяжести); снижение концентрации тиреотропного гормона ниже нижней границы нормы и ниже исходного значения у 31,9% пациентов (все степени тяжести).
Образование антител
Из 1570 пациентов, получавших препарат Имфинзи® в дозе 10 мг/кг один раз в 2 недели, у 2,9% (45/1570) были обнаружены антитела к дурвалумабу на фоне терапии. Нейтрализующие антитела были выявлены у 0,5% пациентов (8/1570). Наличие антител не оказывало клинического значимого влияния на безопасность препарата. Влияние наличия антител на эффективность не было оценено из-за ограниченного количества пациентов. По данным популяционного фармакокинетического анализа, у пациентов с наличием антител к дурвалумабу ожидается некоторое снижение экспозиции, однако снижение экспозиции менее чем на 30% по сравнению с ее типичным значением не считается клиническим значимым.
Пациенты пожилого возраста
В целом, данные по безопасности не отличались у пациентов пожилого возраста (65 лет и старше) и пациентов более молодого возраста. Данные о пациентах с НМРЛ в возрасте 75 лет и старше ограничены.
Передозировка
При передозировке препарата Имфинзи® специфическое лечение отсутствует, симптомы передозировки не установлены. В случае передозировки следует проводить симптоматическое лечение и общие поддерживающие мероприятия.
Взаимодействие с другими лекарственными препаратами
Применение системных глюкокортикостероидов или иммуносупрессантов до начала терапии дурвалумабом, за исключением системных глюкокортикостероидов в физиологической дозе (до 10 мг преднизолона в сутки или эквивалент), не рекомендуется из-за возможного влияния на фармакодинамическую активность и эффективность дурвалумаба. Тем не менее, системные глюкокортикостероиды и иммуносупрессанты могут применяться после начала терапии дурвалумабом для лечения иммуноопосредованных нежелательных реакций (см. раздел «Особые указания»).
Формальных исследований лекарственных взаимодействий дурвалумаба не проводилось. Поскольку основными путями метаболизма дурвалумаба являются протеиновый катаболизм с участием ретикулоэндотелиальной системы и мишень-опосредованный клиренс, взаимодействий с другими лекарственными препаратами на уровне метаболизма не ожидается.
Особые указания
В разделе «Способ применения и дозы» (Таблица 1) приведены рекомендации по изменению режима терапии препаратом Имфинзи® при иммуноопосредованных нежелательных реакциях и их терапии. В случаях, когда иммуноопосредованные нежелательные реакции не поддаются коррекции высокими дозами системных глюкокортикостероидов, может быть рассмотрена возможность назначения других системных иммуносупрессантов.
Иммуноопосредованный пневмонит
Иммуноопосредованный пневмонит, или интерстициальная болезнь легких, требующий применения системных глюкокортикостероидов и не имеющий альтернативной причины, отмечался у пациентов, получающих препарат Имфинзи® (см. раздел «Побочное действие»).
Необходимо контролировать появление признаков и симптомов пневмонита. При подозрении на пневмонит проводят рентгенологическое исследование; рекомендации по ведению пациентов приведены в разделе «Способ применения и дозы».
Лучевой пневмонит часто отмечается у пациентов, получающих лучевую терапию на область легких, а клинические проявления пневмонита и лучевого пневмонита очень сходные. В исследовании PACIFIC у пациентов в группе препарата Имфинзи®, завершивших одновременную химиолучевую терапию в период от 1 до 42 дней до начала исследуемой терапии, отмечался как иммуноопосредованный пневмонит, так и лучевой пневмонит. Пневмонит или лучевой пневмонит развился у 161 (33,9%) пациента в группе препарата Имфинзи® и у 58 (24,8%) пациентов в группе плацебо, включая реакции 3 степени тяжести у 16 (3,4%) пациентов в группе препарата Имфинзи® и у 7 (3,0%) пациентов в группе плацебо, и реакции 5 степени тяжести у 5 (1,1%) пациентов в группе препарата Имфинзи® и у 4 (1,7%) пациентов в группе плацебо. Медиана времени до начала нежелательной реакции составила 55 дней (диапазон 1-406 дней) в группе препарата Имфинзи® и 55 дней (диапазон 1-255 дней) в группе плацебо.
Иммуноопосредованный гепатит
Иммуноопосредованный гепатит, требующий применения системных глюкокортикостероидов и не имеющий альтернативной причины, отмечался у пациентов, получающих препарат Имфинзи® (см. раздел «Побочное действие»). Следует контролировать показатели функции печени у пациентов до начала терапии и периодически – во время терапии. Рекомендации по ведению пациентов приведены в разделе «Способ применения и дозы».
Иммуноопосредованный колит
Иммуноопосредованный колит или диарея, требующий применения системных глюкокортикостероидов и не имеющий альтернативной причины, отмечался у пациентов, получающих препарат Имфинзи® (см. раздел «Побочное действие»). Необходимо контролировать появление признаков и симптомов колита или диареи; рекомендации по ведению пациентов приведены в разделе «Способ применения и дозы».
Иммуноопосредованные эндокринопатии
Гипотиреоз
Иммуноопосредованный гипотиреоз отмечался у пациентов, получающих препарат Имфинзи® (см. раздел «Побочное действие»). Следует контролировать показатели функции щитовидной железы у пациентов до начала терапии и периодически – во время терапии. Рекомендации по ведению пациентов приведены в разделе «Способ применения и дозы».
Гипертиреоз
Иммуноопосредованный гипертиреоз отмечался у пациентов, получающих препарат Имфинзи® (см. раздел «Побочное действие»). Следует контролировать показатели функции щитовидной железы у пациентов до начала терапии и периодически – во время терапии. Рекомендации по ведению пациентов приведены в разделе «Способ применения и дозы».
Недостаточность функции надпочечников
Иммуноопосредованная недостаточность функции надпочечников отмечалась у пациентов, получающих препарат Имфинзи® (см. раздел «Побочное действие»). Необходимо контролировать появление клинических признаков и симптомов недостаточности функции надпочечников. Рекомендации по ведению пациентов с недостаточностью функции надпочечников при наличии симптомов приведены в разделе «Способ применения и дозы».
Сахарный диабет 1 типа
Сахарный диабет 1 типа отмечался у пациентов, получающих препарат Имфинзи® (см. раздел «Побочное действие»). Необходимо контролировать появление клинических признаков и симптомов сахарного диабета 1 типа. Рекомендации по ведению пациентов с сахарным диабетом 1 типа при наличии симптомов приведены в разделе «Способ применения и дозы».
Гипофизит/гипопитуитаризм
Иммуноопосредованный гипофизит/гипопитуитаризм отмечался у пациентов, получающих препарат Имфинзи® (см. раздел «Побочное действие»). Необходимо контролировать появление клинических признаков и симптомов гипофизита. Рекомендации по ведению пациентов с гипофизитом или гипопитуитаризмом при наличии симптомов приведены в разделе «Способ применения и дозы».
Иммуноопосредованный нефрит
Иммуноопосредованный нефрит, требующий применения системных глюкокортикостероидов и не имеющий альтернативной причины, отмечался у пациентов, получающих препарат Имфинзи® (см. раздел «Побочное действие»). Следует контролировать показатели функции почек у пациентов до начала терапии и периодически – во время терапии. Рекомендации по ведению пациентов приведены в разделе «Способ применения и дозы».
Иммуноопосредованная сыпь
Иммуноопосредованная сыпь или дерматит, требующая применения системных глюкокортикостероидов и не имеющая альтернативной причины, отмечалась у пациентов, получающих препарат Имфинзи® (см. раздел «Побочное действие»). Необходимо контролировать появление клинических признаков и симптомов сыпи и дерматита. Рекомендации по ведению пациентов приведены в разделе «Способ применения и дозы».
Другие иммуноопосредованные нежелательные реакции
С учетом механизма действия препарата Имфинзи®, могут возникать другие иммуноопосредованные нежелательные реакции. Необходимо контролировать появление клинических признаков и симптомов. Рекомендации по ведению пациентов приведены в разделе «Способ применения и дозы». У пациентов, получавших препарат Имфинзи® в монотерапии в клинических исследованиях (n=1889), были отмечены следующие иммуноопосредованные нежелательные реакции: миокардит (<0,1%) и миозит (0,2%). Полимиозит с летальным исходом (<0,1%) был зарегистрирован в продолжающемся клиническом исследовании.
Реакции, связанные с введением препарата
Необходимо контролировать появление клинических признаков и симптомов реакций, связанных с введением препарата. У пациентов, получавших препарат Имфинзи®, отмечались тяжелые реакции, связанные с введением препарата (см. раздел «Побочное действие»).
Влияние на способность к управлению транспортными средствами и механизмами
Маловероятно, что препарат Имфинзи® оказывает влияние на способность к управлению транспортными средствами и механизмами, с учетом его фармакодинамических свойств. Однако, при развитии нежелательных реакций, влияющих на концентрацию и скорость реакции, пациенты должны соблюдать осторожность при управлении транспортными средствами и механизмами.
Форма выпуска
Концентрат для приготовления раствора для инфузий, 50 мг/мл
По 2,4 мл (120 мг / 2,4 мл) или 10,0 мл (500 мг / 10,0 мл) в стеклянные флаконы (тип I), закрытые резиновой пробкой из хлорбутила, обжатой сверху алюминиевым колпачком с пластиковой крышкой («флип-офф»). По 1 флакону с инструкцией по применению препарата в картонной пачке с контролем первого вскрытия.
Условия хранения
При температуре от 2 до 8 °С.
Хранить в местах, недоступных для детей.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска
Отпускают по рецепту.
Наименование и юридический адрес держателя (владельца) регистрационного удостоверения
АстраЗенека АБ, SE-151 85 Содерталье, Швеция
AstraZeneca АВ, SE-151 85 Sodertalje, Sweden
Производитель, фасовщик (первичная упаковка), упаковщик (вторичная (потребительская) упаковка)
Кук Фармика ЛЛС, США
1300 Саут Паттерсон Драйв, Блуминггон, Индиана 47403, США
Cook Pharmica LLC, USA
1300 South Patterson Drive, Bloomington, IN 47403, USA
Выпускающий контроль качества
АстраЗенека Фармасьютикалс ЛП
633 Ресерч Корт, Фредерик, Мэриленд (MD) 21703, США
AstraZeneca Pharmaceuticals LP
633 Research Court, Frederick, Maryland (MD) 21703, USA
Наименование, адрес организации, уполномоченной держателем или владельцем регистрационного удостоверения лекарственного препарата для медицинского применения на принятие претензий от потребителя:
Представительство АстраЗенека ЮК Лимитед, Великобритания, в г. Москве и ООО АстраЗенека Фармасьютикалз
123100, г. Москва, 1-й Красногвардейский проезд, д. 21, стр. 1, этаж 30, комнаты 13 и 14
тел. +7495 7995699
факс +7495 7995698
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Imfinzi®
Регистрационный номер
Торговое наименование
Имфинзи®
Международное непатентованное наименование
Лекарственная форма
концентрат для приготовления раствора для инфузий
Состав
В 1 мл концентрата содержится:
Действующее вещество: дурвалумаб 50 мг
Вспомогательные вещества: L-гистидин 2 мг, L-гистидина гидрохлорида моногидрат 2,7 мг, α,α-трегалозы дигидрат 104 мг, полисорбат 80 0,2 мг, вода для инъекций приблизительно 900 мг.
Описание
От прозрачной до опалесцирующей, от бесцветной до желтоватого цвета жидкость.
Фармакотерапевтическая группа
Фармакологические свойства
Фармакодинамика
Механизм действия
Экспрессия белка лиганда рецептора программируемой гибели клетки 1 (PD-L1) является ответом на воздействие адаптивной иммунной системы, который позволяет опухолям избегать обнаружения и элиминации иммунной системой. Экспрессия PD-L1 может индуцироваться воспалительными сигналами (например, IFN-гамма) и происходить как в опухолевых клетках, так и в опухолеассоциированных иммунных клетках микроокружения опухоли. PD-L1 блокирует функции и активацию Т-клеток посредством взаимодействия с PD-1 и CD80 (B7.1). Связываясь с соответствующими рецепторами, PD-L1 уменьшает цитотоксическую активность Т-клеток, пролиферацию и выработку цитокинов. Дурвалумаб является полностью человеческим, высокоаффинным моноклональным антителом, иммуноглобулином G1 каппа (IgGlK), которое селективно блокирует взаимодействие PD-L1 с PD-1 или CD80 (В7.1), при этом не затрагивая взаимодействие между PD-1 и PD-L2.
Дурвалумаб не индуцирует антителозависимую клеточную цитотоксичность. Селективная блокада взаимодействий между PD-L1 и PD-1 и PD-L1 и CD80 приводит к усилению противоопухолевого иммунного ответа, который может привести к элиминации опухоли. В доклинических исследованиях блокада PD-L1 приводила к увеличению активации Т-лимфоцитов и к уменьшению размеров опухолей.
Фармакокинетика
Фармакокинетику дурвалумаба изучали у 1902 пациентов, при этом дозы варьировали от 0,1 мг/кг до 20 мг/кг, а препарат вводили один раз в две, три или четыре недели. Фармакокинетическое воздействие увеличивалось более чем пропорционально дозе (нелинейная фармакокинетика) при дозах, составляющих <3 мг/кг, и пропорционально дозе (линейная фармакокинетика) при дозах, составляющих ≥3 мг/кг. Равновесное состояние достигалось примерно через 16 недель.
На основании популяционного фармакокинетического анализа, включавшего данные 1878 пациентов, получавших препарат в дозах ≥10 мг/кг каждые 2 недели, среднее геометрическое объёма распределения в равновесном состоянии (Vss) составляло 5,64 л. Клиренс дурвалумаба уменьшался с течением времени, что приводило к среднему геометрическому клиренса в равновесном состоянии (CLss), равному 8,16 мл/час на 365 день терапии; уменьшение CLss не считается клинически значимым. Исходя из клиренса исходного уровня, период полувыведения составлял приблизительно 18 дней.
Фармакокинетика у особых групп пациентов
Возраст (19-96 лет), масса тела (34-149 кг), пол, наличие антител к дурвалумабу, концентрация альбумина, активность лактатдегидрогеназы, концентрация креатинина, концентрация растворимого PD-L1, тип опухоли, расовая принадлежность, нарушение функции почек лёгкой степени тяжести (клиренс креатинина (КК) 60-89 мл/мин), нарушение функции почек средней степени тяжести (КК 30-59 мл/мин), нарушение функции печени лёгкой степени (билирубин ≤ верхней границы нормы (ВГН) и активность аспартатаминотрансферазы (ACT) > ВГН или концентрация билирубина > ВГН до 1,5 х ВГН при любой активности ACT) и общее состояние по шкале ВОЗ/ECOG не оказывали клинически значимого воздействия на фармакокинетику дурвалумаба.
Влияние нарушения функции почек тяжёлой степени (КК 15-29 мл/мин) или нарушения функции печени средней степени тяжести (концентрация билирубина > 1,5 х ВГН до 3 х ВГН и любая активность ACT) и нарушения функции печени тяжёлой степени (концентрация билирубина > 3 х ВГН и любая активность ACT) на фармакокинетику дурвалумаба неизвестно.
Пациенты пожилого возраста
Коррекции дозы у пожилых пациентов (≥ 65 лет) не требуется. Из 476 пациентов с местнораспространённым нерезектабельным немелкоклеточным раком лёгкого (НМРЛ) в исследовании PACIFIC (первичная популяция для оценки эффективности), получавших препарат Имфинзи®, 215 пациентов были в возрасте 65 лет и старше. В целом, между пациентами в возрасте 65 лет и старше и более молодыми пациентами не отмечалось различий в профилях безопасности.
Показания
Нерезектабельный местнораспространённый немелкоклеточный рак лёгкого у взрослых пациентов, у которых не выявлено прогрессирование заболевания после химиолучевой терапии на основе препаратов платины.
Противопоказания
- Повышенная чувствительность к дурвалумабу или вспомогательным веществам, входящим в состав препарата.
- Детский возраст до 18 лет.
- Беременность и период грудного вскармливания.
- Нарушение функции печени средней и тяжёлой степени тяжести.
С осторожностью
Тяжёлые аутоиммунные заболевания в активной стадии, при которых дальнейшая активация иммунной системы может представлять потенциальную угрозу жизни.
Применение при беременности и в период грудного вскармливания
Женщины с сохранённой детородной функцией
Женщины с сохранённой детородной функцией должны использовать надёжные методы контрацепции во время терапии дурвалумабом и. как минимум, в течение 3 месяцев после введения последней дозы препарата.
Беременность
Данные о применении дурвалумаба у беременных женщин отсутствуют. С учётом механизма действия, дурвалумаб может оказывать влияние на течение беременности и вредное воздействие на плод при его применении во время беременности. На модели аллогенной беременности у мышей было показано, что нарушение передачи сигнала через PD-L1 приводит к увеличению частоты потери плода. В исследованиях у животных не было выявлено репродуктивной токсичности. Человеческий иммуноглобулин IgG1 проникает через плацентарный барьер. В исследованиях на животных было показано, что дурвалумаб также проникает через плацентарный барьер. Применение дурвалумаба во время беременности может причинить вред плоду. Поэтому дурвалумаб не должен применяться во время беременности и при отсутствии надёжной контрацепции во время терапии, и, как минимум, в течение 3 месяцев после введения последней дозы препарата.
Грудное вскармливание
Нет информации, касающейся экскреции дурвалумаба в грудное молоко. По результатам токсикологических исследований в молоке яванских макак на 28 день после родов был выявлен дурвалумаб в низких концентрациях. У человека моноклональные антитела могут выделяться в грудное молоко, однако нет данных об их возможной абсорбции и вреде для новорождённого. Тем не менее, нельзя исключить риск для младенцев, получающих грудное вскармливание. Поэтому следует либо прекратить грудное вскармливание, либо воздержаться от терапии дурвалумабом с учётом пользы грудного вскармливания для младенца и пользы терапии дурвалумабом для женщины.
Фертильность
Данные о возможном влиянии дурвалумаба на фертильность у животных и у человека отсутствуют.
Способ применения и дозы
Дозы
Рекомендуемая доза препарата Имфинзи® составляет 10 мг/кг в виде внутривенной инфузии продолжительностью не менее 60 минут. Препарат необходимо вводить один раз в 2 недели до прогрессирования заболевания или развития неприемлемой токсичности. Увеличение или уменьшение дозы препарата не рекомендуется. С учётом переносимости и безопасности препарата может потребоваться приостановка терапии или её отмена. Рекомендации по купированию иммуноопосредованных нежелательных реакций представлены в Таблице 1. В разделе «Особые указания» приведены дальнейшие рекомендации по мониторингу нежелательных реакций и ведению пациентов.
Таблица 1. Рекомендации по изменению режима терапии препаратом Имфинзи® и купированию нежелательных реакций
| Нежелательная реакция |
Степень тяжести1 |
Изменение режима терапии препаратом Имфинзи® |
Терапия глюкокортикостероидами (если не указано другое) |
|
Иммуноопосредованный пневмонит |
2 степень |
Приостановка терапии2 |
Назначение преднизолона в дозе 1 — 2 мг/кг/сутки (или эквивалента) с последующим снижением дозы |
|
3 или 4 степень |
Прекращение терапии |
Назначение преднизолона в дозе 1- 4 мг/кг/сутки (или эквивалента) с последующим снижением дозы |
|
|
Иммуноопосредованный гепатит |
2 степень с активностью аланинаминотрансферазы (АЛТ) или ACT > 3 × ВГН до 5 × ВГН и/или концентрацией общего билирубина > 1,5 × ВГН до 3 × ВГН |
Приостановка терапии2 |
Назначение преднизолона в дозе 1 — 2 мг/кг/сутки (или эквивалента) с последующим снижением дозы |
| 3 степень с активностью АЛТ или ACT > 5 × ВГН до 8 × ВГН или концентрацией общего билирубина > 3 × ВГН до 5 × ВГН | |||
| 3 степень с активностью АЛТ или ACT > 8 × ВГН или концентрацией общего билирубина> 5 × ВГН |
Прекращение терапии |
||
| Одновременно е повышение активности АЛТ или ACT > 3 × ВГН и концентрации общего билирубина > 2 × ВГН при отсутствии других причин | |||
|
Иммуноопосредованный колит или диарея |
2 степень |
Приостановка терапии2 |
Назначение преднизолона в дозе 1-2 мг/кг/сутки (или эквивалента) с последующим снижением дозы |
|
3 или 4 степень |
Прекращение терапии |
||
|
Иммуноопосредованные эндокринопатии: гипертиреоз |
2-4 степень |
Приостановка терапии до достижения стабильной клинической ситуации |
Симптоматическая терапия |
|
Иммуноопосредованные эндокринопатии: гипотиреоз |
2-4 степень |
Без изменений |
Назначение заместительной терапии гормонами щитовидной железы по клиническим показаниям |
| Иммуноопосредованные эндокринопатии: недостаточность функции надпочечников, гипофизит или гипопитуитаризм |
2-4 степень |
Приостановка терапии до достижения стабильной клинической ситуации |
Назначение преднизолона в дозе 1-2 мг/кг/сутки (или эквивалента) с последующим снижением дозы и гормонозаместительная терапия по клиническим показаниям |
|
Иммуноопосредованные эндокринопатии: сахарный диабет 1 типа |
2-4 степень |
Приостановка терапии до достижения стабильной клинической ситуации |
Назначение препаратов инсулина по клиническим показаниям |
|
Иммуноопосредованный нефрит |
2 степень с повышением концентрации креатинина сыворотки > 1,5 × ВГН (или исходное значение) до 3 × ВГН (или исходное значение) |
Приостановка терапии2 |
Назначение преднизолона в дозе 1-2 мг/кг/сутки (или эквивалента) с последующим снижением дозы |
|
3 степень с повышением концентрации креатинина сыворотки > 3 × исходное значение или > 3 × ВГН до 6 × ВГН; 4 степень с повышением концентрации креатинина сыворотки > 6 × ВГН |
Прекращение терапии |
||
|
Иммуноопосредованная сыпь или дерматит |
2 степень дольше 1 недели |
Приостановка терапии2 |
Назначение преднизолона в дозе 1- 2 мг/кг/сутки (или эквивалента) с последующим снижением дозы |
|
3 степень |
|||
|
4 степень |
Прекращение терапии |
||
|
Иммуноопосредованный миокардит |
2 степень |
Приостановка терапии3 |
Назначение преднизолона в дозе 2- 4 мг/кг/сутки (или эквивалента) с последующим снижением дозы |
|
3, 4 степень или любая степень при диагнозе, подтвержденном исследованием биоптата |
Прекращение терапии |
||
| Иммуноопосредованный миозит/полимиозит |
2 или 3 степень |
Приостановка терапии4 |
Назначение преднизолона в дозе 2- 4 мг/кг/сутки (или эквивалента) с последующим снижением дозы |
|
4 степень |
Прекращение терапии |
||
|
Инфузионные реакции |
1 или 2 степень |
Прервать введение препарата или уменьшить скорость инфузии |
Рассмотреть возможность премедикации для профилактики последующих инфузионных реакций |
|
3 или 4 степень |
Прекращение терапии |
1 Общие терминологические критерии нежелательных явлений Национального института онкологии США, версия 4.03.
2 В зависимости от тяжести нежелательных реакций следует приостановить терапию препаратом Имфинзи® и назначить терапию глюкокортикостероидами. При отсутствии эффекта или ухудшении состояния возможно повышение дозы глюкокортикостероидов и/или назначение других системных иммуносупрессантов. После улучшения состояния до ≤ 1 степени тяжести следует начать постепенное снижение дозы глюкокортикостероидов продолжительностью не менее 1 месяца.
Терапию препаратом Имфинзи® можно возобновить после приостановки, если тяжесть нежелательной реакции уменьшилась до ≤ 1 степени тяжести, и доза глюкокортикостероидов была снижена до ≤ 10 мг преднизолона в сутки или эквивалента.
3 При отсутствии улучшения состояния в течение 3–5 дней, несмотря на применение глюкокортикостероидов, необходимо незамедлительно назначить иммуносупрессивную терапию. После разрешения нежелательной реакции следует начать постепенное снижение дозы глюкокортикостероидов продолжительностью не менее 1 месяца, после чего, в зависимости от клинической ситуации, терапия препаратом Имфинзи® может быть возобновлена.
4 Терапию препаратом Имфинзи® следует прекратить, если нежелательная реакция не разрешится до ≤ 1 степени тяжести в течение 30 дней, или при наличии дыхательной недостаточности.
При подозрении на возникновение иммуноопосредованных нежелательных реакций необходимо провести обследование для подтверждения этиологии и исключения других причин. При развитии других иммуноопосредованных реакций, не указанных в Таблице 1, необходимо прекратить терапию препаратом Имфинзи®, если тяжесть реакции соответствует 4 степени. Если иммуноопосредованная реакция соответствует 3 степени тяжести, следует приостановить применение препарата Имфинзи® ; с учётом клинической ситуации может быть рассмотрен вопрос о прекращении терапии. Необходимо рассмотреть вопрос назначения системных глюкокортикостероидов.
Применение у особых групп пациентов
По данным популяционного фармакокинетического анализа, коррекция дозы препарата Имфинзи® в зависимости от возраста, массы тела, пола и расовой принадлежности не рекомендуется (см. раздел «Фармакокинетика»).
Дети и подростки
Безопасность и эффективность дурвалумаба у пациентов младше 18 лет не были установлены.
Пациенты пожилого возраста (≥ 65 лет)
Пациентам пожилого возраста (≥ 65 лет) коррекция дозы не требуется (см. разделы «Фармакодинамика» и «Фармакокинетика»).
Нарушение функции почек
Коррекция дозы препарата Имфинзи® у пациентов с нарушением функции почек лёгкой и средней степени тяжести не рекомендуется. Ограниченные данные о пациентах с нарушением функции почек тяжёлой степени не позволяют сделать выводы о необходимости коррекции дозы в этой популяции пациентов (см. раздел «Фармакокинетика»).
Нарушение функции печени
По данным популяционного фармакокинетического анализа, пациентам с нарушением функции печени лёгкой степени тяжести коррекция дозы не требуется. Препарат Имфинзи® не изучался у пациентов с нарушением функции печени средней и тяжёлой степени тяжести (см. раздел «Фармакокинетика»).
Способ применения
Для внутривенного введения.
Приготовление раствора
Препарат Имфинзи® не содержит консервантов, каждый флакон предназначен для однократного применения. Следует соблюдать правила асептики при приготовлении раствора.
— Перед применением проводят визуальный осмотр лекарственного препарата на предмет наличия механических включений и изменения цвета. Если раствор мутный, его цвет изменён, и отмечаются видимые частицы, флакон утилизируют. Не следует встряхивать флакон.
— Из флакона (флаконов) извлекают нужный объём препарата Имфинзи® и переносят во флакон для внутривенной инфузии, содержащий 0,9 % раствор натрия хлорида для инъекций или 5 % раствор глюкозы для инъекций. Перемешивают разведённый раствор посредством осторожного переворачивания. Раствор не встряхивать и не замораживать. Окончательная концентрация разведённого раствора должна составлять 1-15 мг/мл.
— Из флакона следует извлекать только одну дозу препарата; не следует повторно прокалывать флакон для извлечения ещё одной дозы препарата.
— Частично использованные флаконы препарата Имфинзи® утилизируют.
Хранение раствора для инфузии
Препарат Имфинзи® не содержит консервантов. Раствор для инфузий вводят сразу же после приготовления. Если раствор для инфузий вводят не сразу, и его необходимо хранить, то суммарное время с момента прокола флакона до начала введения не должно превышать:
— 24 часа при хранении в холодильнике при температуре от 2 до 8 °C,
— 4 часа при хранении при комнатной температуре до 25 °C.
Введение
Раствор для инфузий вводят внутривенно, продолжительность введения не менее 60 минут через внутривенный катетер со стерильным встроенным 0,2 или 0,22 микронным фильтром с низким связыванием белков. Через одну и ту же инфузионную систему нельзя одновременно вводить другие лекарственные препараты. Неиспользованный лекарственный препарат и расходные материалы следует утилизировать в соответствии с локальными требованиями.
Побочное действие
Краткая характеристика профиля безопасности
Профиль безопасности препарата Имфинзи® был изучен в исследовании PACIFIC (n = 475) у пациентов с местнораспространённым нерезектабельным НМРЛ, которые завершили, как минимум, 2 цикла одновременной химиолучевой терапии в период от 1 до 42 дней до включения в исследование. В этой популяции пациентов наиболее частыми нежелательными реакциями были кашель (40,2 % и 30,3% в группе плацебо, соответственно), инфекции верхних дыхательных путей (26,1 % и 11,5% в группе плацебо, соответственно) и сыпь (21,7 % и 12,0% в группе плацебо, соответственно). Наиболее частой нежелательной реакцией 3-4 степени тяжести (по Общим терминологическим критериям нежелательных явлений Национального института онкологии США, версия 4.03) была пневмония (6,5 % и 5,6% в группе плацебо, соответственно). Общая частота нежелательных реакций 3-4 степени тяжести в группе препарата Имфинзи® составила 12,8 %, в группе плацебо — 9,8 %.
Табличный перечень нежелательных реакций
В Таблице 2 приведена частота нежелательных реакций у пациентов с местнораспространённым нерезектабельным НМРЛ в исследовании PACIFIC независимо от оценки исследователем причинно-следственной связи с приёмом препарата. Нежелательные реакции сгруппированы по системно-органным классам. Внутри каждого класса нежелательные реакции перечислены в порядке убывания частоты. Частота возникновения нежелательных реакций представлена в следующей градации: очень часто (≥ 1/10), часто (≥ 1/100, < 1/10), нечасто (≥ 1/1000, < 1/100), редко (≥ 1/10000, < 1/1000), очень редко (< 1/10000), неуточнённой частоты (частота не может быть определена на основании имеющихся данных). Внутри одной категории частоты нежелательные лекарственные реакции представлены в порядке убывания серьёзности.
Таблица 2. Нежелательные реакции, отмечавшиеся у пациентов с местнораспространённым нерезектабельным НМРЛ, получавших препарат Имфинзи® в дозе 10 мг/кг
|
Частота нежелательных реакций любой степени тяжести (%) |
Частота нежелательных реакций 3-4 степени тяжести (%) |
||
|
Инфекционные и паразитарные заболевания |
|||
|
Инфекции верхних дыхательных путей1 |
Очень часто |
26,1 |
0,4 |
|
Пневмония2 3 |
Очень часто |
17,1 |
6,5 |
|
Дентальные инфекции и инфекции мягких тканей полости рта4 |
Часто |
3,6 |
0 |
|
Кандидоз полости рта |
Часто |
3,2 |
0 |
|
Грипп |
Часто |
2,5 |
0 |
|
Нарушения со стороны эндокринной системы |
|||
|
Гипотиреоз5 |
Очень часто |
11,6 |
0,2 |
|
Гипертиреоз6 |
Часто |
8,2 |
0 |
|
Недостаточность функции надпочечников |
Нечасто |
0,2 |
0 |
|
Сахарный диабет 1 типа |
Нечасто |
0,2 |
0,2 |
|
Гипофизит/гипопитуитаризм |
Редко7 |
<0,1 |
<0,1 |
|
Несахарный диабет |
Редко7 |
<0,1 |
<0,1 |
|
Нарушения со стороны сердца |
|||
|
Миокардит |
Редко7 |
<0,1 |
<0,1 |
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
|||
|
Кашель/продуктивный кашель8 |
Очень часто |
40,2 |
0,6 |
|
Пневмонит2 |
Очень часто |
12,6 |
1,7 |
|
Дисфония |
Часто |
3,8 |
0 |
|
Интерстициальная болезнь легких |
Нечасто |
0,6 |
0 |
|
Нарушения со стороны желудочно-кишечного тракта |
|||
|
Диарея |
Очень часто |
18,3 |
0,6 |
|
Боль в животе9 |
Очень часто |
10,1 |
0,4 |
|
Колит10 |
Часто |
1,1 |
0,2 |
|
Нарушения со стороны печени и желчевыводящих путей |
|||
|
Увеличение активности ACT или АЛТ11 |
Часто |
6,1 |
1,9 |
|
Гепатит3,12 |
Нечасто |
0,6 |
0 |
|
Нарушения со стороны кожи и подкожных тканей |
|||
|
Сыпь13 |
Очень часто |
21,7 |
0,6 |
|
Зуд14 |
Очень часто |
12,4 |
0 |
|
Дерматит |
Часто |
1,5 |
0 |
|
Потливость в ночное время |
Часто |
2,3 |
0 |
|
Нарушения со стороны скелетно-мышечной и соединительной ткани |
|||
|
Миалгия |
Часто |
8,0 |
0,2 |
|
Миозит |
Нечасто |
0,4 |
0 |
|
Полимиозит3 |
Редко7 |
<0,1 |
<0,1 |
|
Нарушения со стороны почек и мочевыводящих путей |
|||
|
Увеличение концентрации креатинина в сыворотке крови |
Часто |
4,6 |
0,2 |
|
Дизурия |
Часто |
2,3 |
0 |
|
Нефрит15 |
Нечасто |
0,4 |
0 |
|
Общие расстройства и реакции в месте введения |
|||
|
Лихорадка |
Очень часто |
14,7 |
0,2 |
|
Периферические отёки |
Часто |
7,8 |
0 |
|
Травмы, интоксикации и осложнения процедур |
|||
|
Реакции, связанные с введением препарата16 |
Часто |
1,9 |
0 |
1 Включает ларингит, назофарингит, паратонзиллярный абсцесс, фарингит, ринит, синусит, тонзиллит, трахеобронхит и инфекцию верхних дыхательных путей.
2 Включает инфекцию лёгких; пневмоцистную пневмонию Йировеца; пневмонию; аденовирусную пневмонию; бактериальную пневмонию; цитомегаловирусную пневмонию; пневмонию, вызванную гемофильной палочкой; пневмонию, вызванную клебсиеллой; некротизирующую пневмонию; пневмококковую пневмонию и стрептококковую пневмонию.
3 В исследовании PACIFIC фатальный пневмонит и фатальная пневмония наблюдались с одинаковой частотой в группе препарата Имфинзи® и группе плацебо; фатальный гепатит и фатальный полимиозит были отмечены в других клинических исследованиях.
4 Включает гингивит, инфекцию полости рта, периодонтит, пульпит, абсцесс зуба и дентальную инфекцию.
5 Включает аутоиммунный гипотиреоз и гипотиреоз.
6 Включает гипертиреоз, аутоиммунный тиреоидит, тиреоидит, подострый тиреоидит и Базедову болезнь.
7 Нежелательные реакции не наблюдались в исследовании PACIFIC, но наблюдались в других клинических исследованиях (n = 1889).
8 Включает кашель и продуктивный кашель.
9 Включает боль в животе, боль в нижних отделах живота, боль в верхних отделах живота, боль в боковых отделах живота.
10 Включает колит, энтерит, энтероколит и проктит.
11 Включает повышение активности АЛТ, ACT, печёночных ферментов и трансаминаз.
12 Включает гепатит, аутоиммунный гепатит, токсический гепатит, гепатоцеллюлярное повреждение, острый гепатит и гепатотоксичность.
13 Включает эритематозную сыпь, генерализованную сыпь, макулезную сыпь, макулопапулезную сыпь, папулезную сыпь, зудящую сыпь, пустулезную сыпь, эритему, экзему и сыпь.
14 Включает генерализованный зуд и зуд.
15 Включает аутоиммунный нефрит, тубулоинтерстициальный нефрит, нефрит, гломерулонефрит и мембранозный гломерулонефрит.
16 Включает реакции, связанные с инфузией, и крапивницу с датой начала в день инфузии или на следующий день.
Описание отдельных нежелательных реакций
Применение препарата Имфинзи® наиболее часто связано с развитием иммуноопосредованных нежелательных реакций. Эти реакции, включая тяжёлые, в большинстве случаев, разрешались после назначения соответствующей терапии или отмены препарата Имфинзи®. Данные о приведённых ниже иммуноопосредованных нежелательных реакциях получены из объединённой базы данных 1889 пациентов, принимавших участие в исследовании PACIFIC и двух дополнительных исследованиях (мультикогортное открытое клиническое исследование у пациентов с распространёнными солидными опухолями и открытое исследование у пациентов с местнораспространённым или метастатическим НМРЛ). В этих исследованиях препарат Имфинзи® применялся в дозе 10 мг/кг один раз в 2 недели. Рекомендации по лечению этих нежелательных реакций приведены в разделе «Особые указания».
Иммуноопосредованный пневмонит
В объединённой базе данных по монотерапии препаратом Имфинзи® (n = 1889 пациентов с опухолями различных типов) иммуноопосредованный пневмонит возник у 79 (4,2 %) пациентов, включая реакции 3 степени тяжести у 12 (0,6 %) пациентов, 4 степени тяжести у 1 (< 0,1 %) пациента и 5 степени тяжести у 5 (0,3 %) пациентов. Медиана времени до начала нежелательной реакции составила 53 дня (диапазон 1-341 день). 45 из 79 пациентов получали терапию системными глюкокортикостероидами в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент), 2 пациента также получали инфликсимаб. Терапия препаратом Имфинзи® была отменена у 26 пациентов. Реакция разрешилась у 42 пациентов. Иммуноопосредованный пневмонит чаще отмечался у пациентов в исследовании PACIFIC, завершивших одновременную химиолучевую терапию в период от 1 до 42 дней до начала исследуемой терапии (10,7 %), чем у других пациентов в объединённой базе данных по безопасности (2,0 %).
В исследовании PACIFIC (n = 475 в группе препарата Имфинзи®, n = 234 в группе плацебо) иммуноопосредованный пневмонит развился у 51 пациента (10,7 %) в группе препарата Имфинзи® и у 16 (6,8 %) пациентов в группе плацебо, включая нежелательные реакции 3 степени тяжести у 8 (1,7 %) пациентов в группе препарата Имфинзи® по сравнению с 6 (2,6 %) пациентами в группе плацебо, и реакции 5 степени тяжести (фатальные) у 4 (0,8 %) пациентов в группе препарата Имфинзи® по сравнению с 3 (1,3 %) пациентами в группе плацебо. Медиана времени до начала нежелательной реакции в группе препарата Имфинзи® составила 53 дня (диапазон 1-341 день) и 55,5 дней в группе плацебо (диапазон 0-231 день). 44 из 51 пациента в группе препарата Имфинзи® получали терапию системными глюкокортикостероидами, включая 28 пациентов, получавших глюкокортикостероиды в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент), 2 пациента также получали инфликсимаб. В группе плацебо 11 из 16 пациентов получали терапию системными глюкокортикостероидами, включая 9 пациентов, получавших глюкокортикостероиды в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент). Реакция разрешилась у 27 пациентов в группе Имфинзи® и у 6 пациентов в группе плацебо.
Иммуноопосредованный гепатит
В объединённой базе данных по монотерапии препаратом Имфинзи® иммуноопосредованный гепатит был отмечен у 19 (1,0 %) пациентов, включая реакции 3 степени тяжести у 11 (0,6 %) пациентов и 5 степени тяжести (фатальную) у 1 (< 0,1 %) пациента. Медиана времени до начала нежелательной реакции составила 70 дней (диапазон 15-312 дней). 13 из 19 пациентов получали терапию системными глюкокортикостероидами в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент). Один пациент также получал микофенолата мофетил. Терапия препаратом Имфинзи® была прекращена у 4 пациентов. Реакция разрешилась у 12 пациентов.
Иммуноопосредованный колит
В объединённой базе данных по монотерапии препаратом Имфинзи® иммуноопосредованный колит или диарея были отмечены у 31 (1,6 %) пациента, включая реакции 3 степени тяжести у 6 (0,3 %) пациентов и 4 степени тяжести у 1 (< 0,1 %) пациента. Медиана времени до начала нежелательной реакции составила 74 дня (диапазон 1-365 дней). 16 из 31 пациента получали терапию системными глюкокортикостероидами в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент). Один пациент также получал инфликсимаб. Терапия препаратом Имфинзи® была прекращена у 8 пациентов. Реакция разрешилась у 23 пациентов.
Иммуноопосредованные эндокринопатии
Гипотиреоз
В объединённой базе данных по монотерапии препаратом Имфинзи® иммуноопосредованный гипотиреоз был отмечен у 137 (7,3 %) пациентов, включая реакцию 3 степени тяжести у 1 (< 0,1 %) пациента. Медиана времени до начала нежелательной реакции составила 85 дней (диапазон 9-378 дней). 134 из 137 пациентов получали гормонозаместительную терапию, 2 пациента — терапию системными глюкокортикостероидами в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент) по поводу гипотиреоза с последующим назначением гормонозаместительной терапии. Случаев прекращения терапии препаратом Имфинзи® из-за гипотиреоза не было.
Гипертиреоз
В объединённой базе данных по монотерапии препаратом Имфинзи® иммуноопосредованный гипертиреоз был отмечен у 34 (1,8 %) пациентов. Реакций 3 и 4 степени тяжести отмечено не было. Медиана времени до начала нежелательной реакции составила 41 день (диапазон 14-195 дней). 26 из 34 пациентов получали специфическую терапию (тиамазол, карбимазол, пропилтиоурацил или бета-адреноблокаторы), 12 пациентам был назначен тироксин при переходе гипертиреоза в гипотиреоз, 12 пациентов получали терапию системными глюкокортикостероидами, и 3 из 12 пациентов — терапию системными глюкокортикостероидами в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент). Случаев прекращения терапии препаратом Имфинзи® из-за гипертиреоза не было. У 8 пациентов развился гипотиреоз в исходе гипертиреоза.
Недостаточность функции надпочечников
В объединённой базе данных по монотерапии препаратом Имфинзи® иммуноопосредованная недостаточность функции надпочечников была отмечена у 7 (0,4 %) пациентов, включая реакцию 3 степени тяжести у 1 пациента (<0,1 %). Медиана времени до начала нежелательной реакции составила 141 день (диапазон 70-265 дней). Все 7 пациентов получали терапию системными глюкокортикостероидами, при этом 2 пациента — терапию системными глюкокортикостероидами в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент). Случаев прекращения терапии препаратом Имфинзи® из-за недостаточности функции надпочечников не было. Явление разрешилось у 1 пациента.
Сахарный диабет 1 типа
В объединённой базе данных по монотерапии препаратом Имфинзи® сахарный диабет 1 типа развился у 1 (< 0,1 %) пациента (3 степень тяжести). Терапия препаратом Имфинзи® была прекращена из-за развития сахарного диабета 1 типа. Время до начала реакции составило 42 дня. Пациент получал инсулинотерапию.
Гипофизит/гипопитуитаризм
В объединённой базе данных по монотерапии препаратом Имфинзи® иммуноопосредованный гипопитуитаризм был отмечен у 1 (< 0,1 %) пациента (3 степень тяжести). Этот пациент получал терапию системными глюкокортикостероидами в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент) без прекращения терапии препаратом Имфинзи®.
Иммуноопосредованный нефрит
В объединённой базе данных по монотерапии препаратом Имфинзи® иммуноопосредованный нефрит был отмечен у 3 (0,2 %) пациентов, включая реакцию 3 степени тяжести у 1 пациента (< 0,1 %). Медиана времени до начала нежелательной реакции составила 95 дней (диапазон 28-239 дней). 2 (0,1 %) пациента получали терапию системными глюкокортикостероидами в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент). Терапия препаратом Имфинзи® была прекращена у всех 3 пациентов. Явление разрешилось у 2 пациентов.
Иммуноопосредованная сыпь
В объединённой базе данных по монотерапии препаратом Имфинзи® иммуноопосредованная сыпь или дерматит были отмечены у 30 (1,6 %) пациентов, включая реакции 3 степени тяжести у 7 (0,4 %) пациентов. Медиана времени до начала нежелательной реакции составила 74 дня (диапазон 1-365 дней). 11 из 30 пациентов получали терапию системными глюкокортикостероидами в высоких дозах (не менее 40 мг преднизона в сутки или эквивалент). Терапия препаратом Имфинзи® была прекращена у 2пациентов. Явление разрешилось у 18 пациентов.
Реакции, связанные с введением препарата
В объединённой базе данных по монотерапии препаратом Имфинзи® реакции, связанные с введением препарата, были отмечены у 35 (1,9 %) пациентов, включая реакцию 3 степени тяжести у 5 (0,3 %) пациентов.
Изменения лабораторных показателей
В исследовании PACIFIC отклонения лабораторных показателей по сравнению с исходными значениями в группе дурвалумаба были отмечены у следующей пропорции пациентов: увеличение активности АЛТ у 38,5 % пациентов (все степени тяжести) и у 2,3 % пациентов (3-4 степени тяжести); увеличение активности ACT у 36,0 % пациентов (все степени тяжести) и у 2,8 % пациентов (3-4 степени тяжести); увеличение концентрации креатинина у 16,3 % (все степени тяжести), увеличение концентрации тиреотропного гормона выше ВГН и выше исходного значения у 26,5 % пациентов (все степени тяжести); снижение концентрации тиреотропного гормона ниже нижней границы нормы и ниже исходного значения у 31,9 % пациентов (все степени тяжести).
Образование антител
Из 1570 пациентов, получавших препарат Имфинзи® в дозе 10 мг/кг один раз в 2 недели, у 2,9 % (45/1570) были обнаружены антитела к дурвалумабу на фоне терапии. Нейтрализующие антитела были выявлены у 0,5 % пациентов (8/1570). Наличие антител не оказывало клинического значимого влияния на безопасность препарата. Влияние наличия антител на эффективность не было оценено из-за ограниченного количества пациентов. По данным популяционного фармакокинетического анализа, у пациентов с наличием антител к дурвалумабу ожидается некоторое снижение экспозиции, однако снижение экспозиции менее чем на 30 % по сравнению с её типичным значением не считается клиническим значимым.
Пациенты пожилого возраста
В целом, данные по безопасности не отличались у пациентов пожилого возраста (65 лет и старше) и пациентов более молодого возраста. Данные о пациентах с НМРЛ в возрасте 75 лет и старше ограничены.
Передозировка
При передозировке препарата Имфинзи® специфическое лечение отсутствует, симптомы передозировки не установлены. В случае передозировки следует проводить симптоматическое лечение и общие поддерживающие мероприятия.
Взаимодействие с другими лекарственными средствами
Применение системных глюкокортикостероидов или иммуносупрессантов до начала терапии дурвалумабом, за исключением системных глюкокортикостероидов в физиологической дозе (до 10 мг преднизолона в сутки или эквивалент), не рекомендуется из-за возможного влияния на фармакодинамическую активность и эффективность дурвалумаба. Тем не менее, системные глюкокортикостероиды и иммуносупрессанты могут применяться после начала терапии дурвалумабом для лечения иммуноопосредованных нежелательных реакций (см. раздел «Особые указания»). Формальных исследований лекарственных взаимодействий дурвалумаба не проводилось. Поскольку основными путями метаболизма дурвалумаба являются протеиновый катаболизм с участием ретикулоэндотелиальной системы и мишень-опосредованный клиренс, взаимодействий с другими лекарственными препаратами на уровне метаболизма не ожидается.
Особые указания
В разделе «Способ применения и дозы» (Таблица 1) приведены рекомендации по изменению режима терапии препаратом Имфинзи® при иммуноопосредованных нежелательных реакциях и их терапии. В случаях, когда иммуноопосредованные нежелательные реакции не поддаются коррекции высокими дозами системных глюкокортикостероидов, может быть рассмотрена возможность назначения других системных иммуносупрессантов.
Иммуноопосредованный пневмонит
Иммуноопосредованный пневмонит, или интерстициальная болезнь лёгких, требующий применения системных глюкокортикостероидов и не имеющий альтернативной причины, отмечался у пациентов, получающих препарат Имфинзи® (см. раздел «Побочное действие»).
Необходимо контролировать появление признаков и симптомов пневмонита. При подозрении на пневмонит проводят рентгенологическое исследование; рекомендации по ведению пациентов приведены в разделе «Способ применения и дозы».
Лучевой пневмонит часто отмечается у пациентов, получающих лучевую терапию на область лёгких, а клинические проявления пневмонита и лучевого пневмонита очень сходные. В исследовании PACIFIC у пациентов в группе препарата Имфинзи®, завершивших одновременную химиолучевую терапию в период от 1 до 42 дней до начала исследуемой терапии, отмечался как иммуноопосредованный пневмонит, так и лучевой пневмонит. Пневмонит или лучевой пневмонит развился у 161 (33,9 %) пациента в группе препарата Имфинзи® и у 58 (24,8 %) пациентов в группе плацебо, включая реакции 3 степени тяжести у 16 (3,4 %) пациентов в группе препарата Имфинзи® и у 7 (3,0 %) пациентов в группе плацебо, и реакции 5 степени тяжести у 5 (1,1 %) пациентов в группе препарата Имфинзи® и у 4 (1,7 %) пациентов в группе плацебо. Медиана времени до начала нежелательной реакции составила 55 дней (диапазон 1-406 дней) в группе препарата Имфинзи® и 55 дней (диапазон 1-255 дней) в группе плацебо.
Иммуноопосредованный гепатит
Иммуноопосредованный гепатит, требующий применения системных глюкокортикостероидов и не имеющий альтернативной причины, отмечался у пациентов, получающих препарат Имфинзи® (см. раздел «Побочное действие»). Следует контролировать показатели функции печени у пациентов до начала терапии и периодически — во время терапии. Рекомендации по ведению пациентов приведены в разделе «Способ применения и дозы».
Иммуноопосредованный колит
Иммуноопосредованный колит или диарея, требующий применения системных глюкокортикостероидов и не имеющий альтернативной причины, отмечался у пациентов, получающих препарат Имфинзи® (см. раздел «Побочное действие»). Необходимо контролировать появление признаков и симптомов колита или диареи; рекомендации по ведению пациентов приведены в разделе «Способ применения и дозы».
Иммуноопосредованные эндокринопатии
Гипотиреоз
Иммуноопосредованный гипотиреоз отмечался у пациентов, получающих препарат Имфинзи® (см. раздел «Побочное действие»). Следует контролировать показатели функции щитовидной железы у пациентов до начала терапии и периодически — во время терапии. Рекомендации по ведению пациентов приведены в разделе «Способ применения и дозы».
Гипертиреоз
Иммуноопосредованный гипертиреоз отмечался у пациентов, получающих препарат Имфинзи® (см. раздел «Побочное действие»). Следует контролировать показатели функции щитовидной железы у пациентов до начала терапии и периодически — во время терапии. Рекомендации по ведению пациентов приведены в разделе «Способ применения и дозы».
Недостаточность функции надпочечников
Иммуноопосредованная недостаточность функции надпочечников отмечалась у пациентов, получающих препарат Имфинзи® (см. раздел «Побочное действие»). Необходимо контролировать появление клинических признаков и симптомов недостаточности функции надпочечников. Рекомендации по ведению пациентов с недостаточностью функции надпочечников при наличии симптомов приведены в разделе «Способ применения и дозы».
Сахарный диабет 1 типа
Сахарный диабет 1 типа отмечался у пациентов, получающих препарат Имфинзи® (см. раздел «Побочное действие»). Необходимо контролировать появление клинических признаков и симптомов сахарного диабета 1 типа. Рекомендации по ведению пациентов с сахарным диабетом 1 типа при наличии симптомов приведены в разделе «Способ применения и дозы».
Гипофизит/гипопитуитаризм
Иммуноопосредованный гипофизит/гипопитуитаризм отмечался у пациентов, получающих препарат Имфинзи® (см. раздел «Побочное действие»). Необходимо контролировать появление клинических признаков и симптомов гипофизита. Рекомендации по ведению пациентов с гипофизитом или гипопитуитаризмом при наличии симптомов приведены в разделе «Способ применения и дозы».
Иммуноопосредованный нефрит
Иммуноопосредованный нефрит, требующий применения системных глюкокортикостероидов и не имеющий альтернативной причины, отмечался у пациентов, получающих препарат Имфинзи® (см. раздел «Побочное действие»). Следует контролировать показатели функции почек у пациентов до начала терапии и периодически — во время терапии. Рекомендации по ведению пациентов приведены в разделе «Способ применения и дозы».
Иммуноопосредованная сыпь
Иммуноопосредованная сыпь или дерматит, требующая применения системных глюкокортикостероидов и не имеющая альтернативной причины, отмечалась у пациентов, получающих препарат Имфинзи® (см. раздел «Побочное действие»). Необходимо контролировать появление клинических признаков и симптомов сыпи и дерматита. Рекомендации по ведению пациентов приведены в разделе «Способ применения и дозы».
Другие иммуноопосредованные нежелательные реакции
С учётом механизма действия препарата Имфинзи®, могут возникать другие иммуноопосредованные нежелательные реакции. Необходимо контролировать появление клинических признаков и симптомов. Рекомендации по ведению пациентов приведены в разделе «Способ применения и дозы». У пациентов, получавших препарат Имфинзи® в монотерапии в клинических исследованиях (n = 1889), были отмечены следующие иммуноопосредованные нежелательные реакции: миокардит (< 0,1 %) и миозит (0,2%). Полимиозит с летальным исходом (< 0,1 %) был зарегистрирован в продолжающемся клиническом исследовании.
Реакции, связанные с введением препарата
Необходимо контролировать появление клинических признаков и симптомов реакций, связанных с введением препарата. У пациентов, получавших препарат Имфинзи®, отмечались тяжёлые реакции, связанные с введением препарата (см. раздел «Побочное действие»).
Влияние на способность управлять транспортными средствами, механизмами
Маловероятно, что препарат Имфинзи® оказывает влияние на способность к управлению транспортными средствами и механизмами, с учетом его фармакодинамических свойств. Однако, при развитии нежелательных реакций, влияющих на концентрацию и скорость реакции, пациенты должны соблюдать осторожность при управлении транспортными средствами и механизмами.
Форма выпуска
Концентрат для приготовления раствора для инфузий, 50 мг/мл.
По 2,4 мл (120 мг / 2,4 мл) или 10,0 мл (500 мг / 10,0 мл) в стеклянные флаконы (тип I), закрытые резиновой пробкой из хлорбутила, обжатой сверху алюминиевым колпачком с пластиковой крышкой («флип-офф»). По 1 флакону с инструкцией по применению препарата в картонной пачке с контролем первого вскрытия.
Хранение
При температуре от 2 до 8 °C.
Хранить в местах, недоступных для детей.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
Отпускают по рецепту.
Производитель
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о препарате Имфинзи:
- Отзывы
- Вопросы (1)
Новости онкологии
09.10.2018
Дурвалумаб увеличивает продолжительность жизни больных раком легкого после химиолучевой терапии
Тюляндин Сергей Алексеевич
Заслуженный деятель науки РФ, главный научный сотрудник ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, председатель Российского общества клинической онкологии (RUSSCO), профессор, доктор медицинских наук, Москва
Примерно у трети больных немелкоклеточным раком легкого (НМРЛ) заболевание диагностируется в III стадии. Это очень разнородная группа больных, которую делят на IIIA стадию с наличием N2 (метастазы в медиастинальные лимфоузлы со стороны поражения) и IIIB стадию с N3 (метастазы в контралатеральные медиастинальные и надключичные лимфоузлы). Результаты лечения больных III стадией остаются неудовлетворительными во всем мире, и по данным ведущих клиник 5-летняя выживаемость для IIIA составляет 36%, а для IIIB – 19%. Основным методом лечения больных с данным распространением является химиолучевая терапия. Ее эффективность аналогична хирургическому лечению, однако учитывая сложность выполнения оперативного пособия, возможные послеоперационные осложнения и последующее худшее качество жизни, предпочтение во всем мире отдается консервативному методу лечения. Редким исключением является Российская Федерация, где у больных III стадией основным методом лечения является хирургический.
С момента внедрения в широкую клиническую практику химиолучевого метода лечения предпринимались многочисленные попытки повышения его эффективности. Изначально в качестве основного режима химиотерапии для комбинации с лучевой терапией была использована комбинация цисплатина и этопозида. Попытка замены ее на комбинацию карбоплатина и паклитаксела или цисплатина и пеметрекседа не привела к ожидаемому результату. Многочисленные исследования с целью дополнить химиолучевое лечение предшествующими индукционными курсами или консолидирующими курсами доцетакселом, поддерживающей терапией пеметрекседом или гефитинибом также потерпели неудачу. Повышение дозы лучевой терапии со стандартных 60 Гр до 74 Гр не повысило эффективность химиолучевой терапии. Таким образом, в течение последних 20 лет стандартом химиолучевой терапии больных III стадий является назначение цисплатина в дозе 50 мг/м2 в 1 и 29 дни лечения и этопозида в дозе 50 мг/м2 в 1-5 и 29-33 дни лечения совместно с лучевой терапией разовой очаговой дозой (РОД) 1,8 Гр 5 дней в неделю 5 недель до суммарной очаговой дозы (СОД) 45 Гр с последующим назначением прицельного облучения РОД 1,8 Гр 8 доз до СОД 14,4 Гр. На этом химиолучевая терапия, которая по продолжительности составляет почти 7 недель, заканчивается.
Появление ингибиторов контрольных точек иммунного ответа стимулировало исследования по их совместному применению с лучевой терапией. Этому есть теоретические предпосылки. Проведение лучевой терапии вызывает гибель опухолевых клеток с выбросом в кровоток огромного количества опухолевых антигенов, что должно облегчать иммунной системе их распознавание и инициацию противоопухолевого иммунитета. Кроме того, в облученной опухоли возникает процесс распада и воспаления, что является фактором, предсказывающим высокую эффективность ингибиторов PD-1/PD-L1.
Дурвалумаб – моноклональное антитело, блокирующее лиганд PD-L1 и предотвращающее инактивацию цитотоксических Т-лимфоцитов, реализующих противоопухолевый иммунный ответ. Дурвалумаб продемонстрировал активность у больных НМРЛ и был зарегистрирован в качестве второй линии системной терапии после ранее проведенной платиносодержащей химиотерапии. В исследовании PACIFIC оценивалась целесообразность консолидации дурвалумабом ранее проведенной химиолучевой терапии у больных НМРЛ III стадией.
В исследование включались больные III стадией НМРЛ, которым была проведена стандартная химиолучевая терапия (2 курса цисплатин-содержащей химиотерапии одновременно с облучением СОД 54-60 ГР) не позднее 42 дней от рандомизации. Больные были рандомизированы в соотношении 2:1 в группу дурвалумаба 10 мг/кг или плацебо каждые 2 недели в течение года [1,2]. Лечение прекращалось досрочно в случае прогрессирования или непереносимой токсичности. Основным критерием эффективности была выживаемость без прогрессирования и общая выживаемость, которые оценивались с момента рандомизации.
В исследование было включено 709 больных с медианой возраста 64 года, 70% мужчин, у 46% диагностирован плоскоклеточный рак, у 53% – IIIA стадия, у 50% был зафиксирован объективный противоопухолевый эффект на фоне химиолучевой терапии. Экспрессия PD-L1 более 25% опухолевых клеток отмечена у 22% больных, менее 25% – у 41% и не была определена у 37% пациентов. Медиана наблюдения за больными составила 25 мес. Медиана числа проведенных инфузий дурвалумаба и плацебо составила 20 и 14 соответственно. В случае прогрессирования заболевания в группе дурвалумаба и плацебо получили последующую химиотерапию 128 (27%) и 71 (30%) больных, иммунотерапию – 8% и 22%, таргетную терапию – 10% и 13% соответственно.
Медиана времени до прогрессирования с момента рандомизации составила 17,2 мес. в группе дурвалумаба и 5,6 мес. в группе плацебо, что соответствует достоверному снижению относительного риска прогрессирования на 49% (HR=0,51; p<0,0001). Выживаемость без прогрессирования при сроке 12 мес. составила 55,7% в группе дурвалумаба и 34,4% – в группе плацебо, при сроке 18 мес. – 49,5% и 26,7% соответственно. Позитивный эффект от добавления дурвалумаба отмечен во всех изученных подгруппах больных. Он был более выражен у больных с экспрессией PD-L1 более 25% (снижение риска прогрессирования на 59%) по сравнению с экспрессией в интервале 1-24% (51%) и экспрессией менее 1% (27%).
Медиана общей продолжительности жизни в группе дурвалумаба не достигнута, в то время как в группе плацебо составила 28,7%, что соответствует снижению относительного риска смерти на 32% (HR=0,68; P=0,0025). Одногодичная выживаемость в группе дурвалумаба и плацебо составила 83,1% и 75,3%, 2-годичная – 66,3% и 55,6% соответственно. При подгрупповом анализе добавление дурвалумаба увеличивало продолжительность во всех изученных подгруппах за исключением больных с экспрессией PD-L1 менее 1% (повышение риска смерти на 38%). В группе дурвалумаба достоверно снизилось развитие новых отдаленных метастазов (22,5%) по сравнению с плацебо (33,8%), в том числе метастазов в головной мозг (6,3% и 11,8% соответственно).
Частота осложнений 3-4 степени составила 30,5% в группе дурвалумаба и 26,1% в группе плацебо. Наиболее частым осложнением 3-4 степени была пневмония (4,4% и 3,8%). Прекращение лечения вследствие токсичности зафиксировано у 15,4% больных в группе дурвалумаба и у 9,8% в группе плацебо. Основными причинами прекращения терапии были пневмониты вследствие проведенной лучевой терапии и/или иммунотерапии и пневмонии.
Исследование PACIFIC убедительно свидетельствует об улучшении отдаленных результатов химиолучевой терапии больных III стадией НМРЛ при консолидации дурвалумабом. Позитивный эффект от добавления дурвалумаба отмечен у всех больных независимо от клинических характеристик пациента и опухолевого процесса. Требуется дополнительная оценка эффективности добавления дурвалумаба у больных с экспрессией PD-L1 менее 1%. Эффект от добавления дурвалумаба на продолжительность жизни частично скрадывается последующим лечением в группе плацебо с включением современных иммуноонкологических препаратов. Следует напомнить, что медиана продолжительности жизни больных III стадий после проведенной химиолучевой терапии составляет 20-25 мес. с момента ее начала по данным многочисленных мета-анализов. В группе плацебо исследования PACIFIC этот показатель составил 28 мес. после ее окончания (следует прибавить как минимум 3 мес. для равноценного сравнения). Добавление дурвалумаба сочеталось с умеренным увеличением токсичности. Снижение риска прогрессирования на 49% и риска смерти на 32% объясняет целесообразность добавления дурвалумаба к проводимой химиолучевой терапии. Одновременно результаты исследования PACIFIC свидетельствуют об эффективности ингибиторов PD-L1/PD-1 у больных с местнораспространенным НМРЛ и делают обоснованным их изучение в качестве адъювантной терапии после выполнения оперативного лечения.
Ключевые слова: немелкоклеточный рак легкого, химиолучевая терапия, дурвалумаб.
Литература:
- Antonia SJ, Villegas A, Daniel D, et al. Durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer. N. Engl. J. Med. 2017, 377: 1919-1929.
- Antonia SJ, Villegas A, Daniel D, et al. Overall survival with durvalumab after chemoradiotherapy in stage III NSCLC. N. Engl. J. Med. This article was published on September 25, 2018, at NEJM.org.
-
По рецепту
Внешний вид товара может отличаться
Имфинзи концентрат для приготовления раствора для инфузий 500 мг флакон 10 мл
Товара нет в наличии.
🏥 Купить Имфинзи концентрат для приготовления раствора для инфузий 500 мг флакон 10 мл в наших аптеках в Москве
💊 Имфинзи концентрат для приготовления раствора для инфузий 500 мг флакон 10 мл в интернет-аптеке «WER.RU»
🚚 Доставка со склада в Москве от 1-го дня
⚠ Отпускается по рецепту в торговом зале аптеки
- Форма выпуска:концентрат
- Дозировка:500 мг
все
товары Имфинзи,
1 шт.
🏥 Купить Имфинзи концентрат для приготовления раствора для инфузий 500 мг флакон 10 мл в наших аптеках в Москве
💊 Имфинзи концентрат для приготовления раствора для инфузий 500 мг флакон 10 мл в интернет-аптеке «WER.RU»
🚚 Доставка со склада в Москве от 1-го дня
⚠ Отпускается по рецепту в торговом зале аптеки
Инструкция по медицинскому
применению Имфинзи
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ, ПЕРЕД ПРИМЕНЕНИЕМ НЕОБХОДИМО
ПРОКОНСУЛЬТИРОВАТЬСЯ СО СПЕЦИАЛИСТОМ
Сертификаты и лицензии
Цель – изучить эффективность и безопасность дурвалумаба у пациентов с нерезектабельным немелкоклеточным раком легкого третьей стадии после химиолучевого лечения.
Материал и методы. В исследовании приняли участие семь больных немелкоклеточным раком легкого, у которых не отмечалось прогрессирования заболевания по окончании химиолучевой терапии. Дурвалумаб назначали в дозе 10 мг/кг внутривенно один раз в две недели. Применение препарата в данном режиме продолжалось до прогрессирования процесса, или до тех пор, пока пациент получал клиническую пользу, или до появления непереносимой токсичности.
Результаты. Двое из семи пациентов получали терапию до прогрессирования заболевания в течение трех месяцев, двое – в течение шести месяцев, один – в течение девяти месяцев, один – в течение 13 месяцев и еще один – в течение 19 месяцев.
Тяжелых иммуноопосредованных нежелательных явлений не зафиксировано. Наблюдавшиеся гематологические и негематологические нежелательные реакции первой и второй степени не привели к отмене препарата.
Заключение. Монотерапия дурвалумабом характеризуется высокой эффективностью, приемлемым профилем токсичности и потенциально ассоциируется с высокой общей выживаемостью больных.
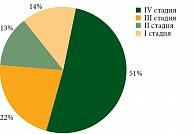
Рис. 1. Структура впервые выявленного НМРЛ в зависимости от стадии
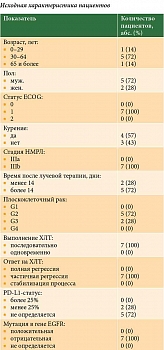
Исходная характеристика пациентов
Рис. 2. Динамика изменения размеров пораженных лимфоузлов средостения на фоне терапии (А – исходно, Б – по окончании четырех курсов химиотерапии, В – по окончании лучевой терапии, Г – через шесть месяцев терапии дурвалумабом)
Введение
Рак легкого является одним из самых распространенных видов рака. Кроме того, он занимает лидирующие позиции в структуре смертности онкологических больных.
В Иркутской области в 2019 г. диагноз «немелкоклеточный рак легкого» (НМРЛ) поставлен 1152 пациентам, из них 893 (77,5%) мужчин и 259 (22,5%) женщин. Всего на диспансерном учете состояло 2807 человек, сняты с учета в связи со смертью – 702 [1]. Данные по стадиям впервые выявленного НМРЛ представлены на рис. 1.
Приблизительно у 30% при постановке диагноза обнаружена местнораспространенная нерезектабельная стадия [1]. Пациентам с местнораспространенным нерезектабельным НМРЛ и хорошим соматическим статусом показана одновременная химиолучевая терапия (ХЛТ) на основе препаратов платины. После проведения таковой медиана выживаемости без прогрессирования не превышает 13 месяцев [2]. До окончания пятилетнего периода наблюдения доживают не более 15% [2]. В отсутствие заметных достижений в области лечения местнораспространенного нерезектабельного НМРЛ [3–7] назрела необходимость в разработке новых терапевтических подходов для повышения выживаемости больных после одновременной ХЛТ.
Необходимо отметить, что современные стандарты по ведению пациентов после ХЛТ предполагают только динамическое наблюдение с целью выявления признаков рецидива или метастазирования [8, 9]. Так, согласно рекомендациям экспертов Европейского общества медицинской онкологии (European Society for Medical Oncology – ESMO), по завершении лечения местнораспространенного НМРЛ последующее наблюдение должно включать [8, 9]:
- изучение анамнеза и физикальное обследование каждые шесть месяцев в течение первых двух лет, затем ежегодно;
- проведение компьютерной томографии органов грудной клетки с контрастированием не реже одного раза в год;
- при возможности назначения противоопухолевой терапии проведение повторной компьютерной томографии каждые полгода в течение трех лет;
- консультирование о модификации образа жизни (отказ от курения) и фармакотерапии.
На сегодняшний день ни в одном исследовании по оценке консолидирующих курсов химиотерапии после ХЛТ положительных результатов не получено [3–7]. Именно поэтому эксперты ESMO не рекомендуют назначать консолидирующую химиотерапию после ХЛТ по радикальной программе. Они также ссылаются на отсутствие убедительных доказательств о какой-либо дополнительной пользе такого лечения для пациентов с местнораспространенным НМРЛ [9].
Первым рандомизированным исследованием фазы III ингибитора иммунных контрольных точек у больных местнораспространенным нерезектабельным НМРЛ III стадии без прогрессирования после одновременной ХЛТ на основе платиносодержащих препаратов стало исследование PACIFIC [10, 11]. В нем сравнивали эффективность и безопасность антитела к PD-L1 дурвалумаба в дозе 10 мг/кг один раз в две недели и плацебо. Пациентов включали в исследование через 1–42 дня по окончании одновременной ХЛТ при условии, что проведено не менее двух циклов химиотерапии на основе препаратов платины.
Дурвалумаб продемонстрировал статистически и клинически значимые преимущества перед плацебо как в отношении выживаемости без прогрессирования, так и в отношении общей выживаемости. Медиана выживаемости без прогрессирования по независимой заслепленной центральной оценке составила 17,2 месяца в группе дурвалумаба и 5,6 месяца в группе плацебо (относительный риск (ОР) 0,51; 95%-ный доверительный интервал (ДИ) 0,41–0,63). Таким образом, разница в медианах выживаемости без прогрессирования составила около года. Увеличение выживаемости без прогрессирования наблюдалось во всех предопределенных подгруппах пациентов, получавших дурвалумаб.
Результаты трехлетней общей выживаемости были представлены на конгрессе Американского общества клинической онкологии в 2019 г. [11]. Так, медиана общей выживаемости в группе дурвалумаба не была достигнута. В группе плацебо она составила 29,1 месяца. Стратифицированный ОР смерти – 0,69 (95% ДИ 0,55–0,86).
Дурвалумаб значительно превосходил плацебо по частоте ответа – 30,0 и 17,8% соответственно. Кроме того, медиана длительности ответа в группе дурвалумаба не была достигнута. В группе плацебо таковая составила 18,4 месяца [10].
Частота выявления новых очагов, включая метастазы в головном мозге, у получавших дурвалумаб оказалась ниже, чем у применявших плацебо [10].
Результаты исследования PACIFIC коренным образом изменили подход к тактике ведения пациентов после ХЛТ, что нашло отражение в клинических рекомендациях Национальной сети многопрофильных онкологических учреждений США [12]. В них предусмотрено, что терапия дурвалумабом показана после радикального курса одновременной ХЛТ у пациентов со всеми подстадиями III стадии нерезектабельного НМРЛ в качестве единственной лечебной опции.
По данному показанию дурвалумаб зарегистрирован в России в июле 2019 г. [13].
Цель исследования
В исследовании предполагалось оценить эффективность и безопасность дурвалумаба у пациентов с нерезектабельным немелкоклеточным раком легкого III стадии после химиолучевого лечения.
Материал и методы
Набор пациентов в рамках персонализированной программы использования незарегистрированного лекарственного препарата дурвалумаб (MEDI 4736) для терапии больных местнораспространенным нерезектабельным НМРЛ по окончании химиолучевой терапии проводился на базе областного онкологического диспансера г. Иркутска с октября 2018 г.
Основные критерии включения в исследование:
- возраст старше 18 лет;
- гистологически или цитологически подтвержденный местнораспространенный нерезектабельный НМРЛ III стадии (в соответствии с версией 7 IASLC Staging Manual in Thoracic Oncology);
- законченная платиносодержащая химиотерапия, проводимая одновременно или последовательно с лучевой терапией, без признаков прогрессирования заболевания;
- проведение режимов химиотерапии в соответствии со стандартами, в рамках химиолучевого лечения суммарная доза лучевой терапии 60 Гр ± 10% (54–66 Гр);
- начало лечения дурвалумабом менее чем через три месяца по окончании лучевой терапии.
В исследование не включали пациентов со смешанной гистологией рака легкого (мелкоклеточный и немелкоклеточный), ранее получавших любые антитела к PD/PD-L1, включая дурвалумаб, с активными или ранее документально подтвержденными аутоиммунными заболеваниями, тяжелой сопутствующей патологией.
Все участники исследования подписали информированное согласие на участие.
План лечения каждого пациента сформирован на общем мультидисциплинарном консилиуме диспансера и одобрен Министерством здравоохранения Российской Федерации.
Все пациенты после ХЛТ получали дурвалумаб в дозе 10 мг/кг один раз в две недели до прогрессирования заболевания, или до тех пор, пока отмечалась клиническая польза от данного вида лечения, или до появления непереносимой токсичности.
Оценка объективного ответа проводилась на основании данных мультиспиральной компьютерной томографии с внутривенным контрастированием согласно критериям RECIST v.1.1.
Анализ токсичности выполнен с помощью критериев СТС AE v.4.
Определяли также выживаемость без прогрессирования (время с момента регистрации до документального подтверждения прогрессирования) и общую выживаемость (время с момента регистрации до даты смерти от любой причины). Функцию выживаемости оценивали методом Каплана – Майера.
Результаты
Всего в исследование было включено семь пациентов. Их исходные характеристики представлены в таблице [14].
Из семи больных двое получали терапию дурвалумабом до прогрессирования заболевания в течение трех месяцев, двое – в течение шести, один – в течение девяти месяцев, один – в течение 13, один пациент – в течение 19 месяцев.
Тяжелых иммуноопосредованных нежелательных явлений не зафиксировано. Наблюдавшиеся гематологические и негематологические нежелательные реакции 1-й и 2-й степени не привели к отмене препарата.
В качестве примера рассмотрим клинический случай.
Пациент М., 1966 года рождения. При прохождении профилактического осмотра на рентгенограмме органов грудной клетки обнаружена опухоль в средостении.
При дообследовании в апреле 2018 г., по результатам мультиспиральной компьютерной томографии (МСКТ) органов грудной клетки, выявлена медиастинальная форма рака правого легкого. Пациент направлен в областной онкологический диспансер.
Согласно данным фибробронхоскопии, рак правого главного бронха с ростом на карину.
Гистологическое заключение: плоскоклеточный рак G3.
При проведении магнитно-резонансной томографии головного мозга и МСКТ органов брюшной полости и малого таза метастазы не выявлены. Состояние по шкале Восточной объединенной группы онкологов (Eastern Cooperative Oncology Group – ECOG) соответствовало нулю.
EGFR отрицательный.
Диагноз: рак правого легкого T4N3M0 IIIb стадии 2-й клинической группы.
В апреле 2018 г. начата химиотерапия доцетакселом 75 мг/м2 и цисплатином 75 мг/м2. Проведено четыре курса полихимиотерапии. Дата окончания – 19 июня 2018 г.
Через четыре месяца в ходе контрольного обследования выявлено умеренное уменьшение метастатических лимфоузлов в средостении (стабилизация по RECIST 1.1).
Проведена лучевая терапия до суммарной очаговой дозы 60 Гр. Завершена 17 августа 2018 г. в Южной Корее.
После контрольной МСКТ в сентябре 2018 г. зафиксирована стабилизация процесса, прогрессирование отсутствовало.
Пациент включен в персонализированную программу использования незарегистрированного препарата дурвалумаб, который был назначен в качестве консолидирующей терапии по жизненным показаниям.
С октября 2018 г. начата иммунотерапия дурвалумабом в дозе 10 мг/кг внутривенно один раз в две недели. Контрольное обследование проводилось каждые три месяца.
В апреле 2019 г., после шести месяцев терапии, рентгенологически подтверждена стабилизация процесса (рис. 2).
На контрольном обследовании в апреле 2020 г., согласно данным компьютерной томографии, при оценке опухоли по критериям RECIST 1.1 стабилизация процесса сохранялась. Масса тела стабильная, состояние по шкале ECOG – 1. Пациент вел активный образ жизни, продолжал работать.
За время терапии дурвалумабом нежелательных явлений не зарегистрировано.
В мае 2020 г. пациент погиб от травм в результате дорожно-транспортного происшествия. Патологоанатомическое заключение свидетельствовало об отсутствии прогрессирования злокачественной опухоли.
Обсуждение результатов
Существенный прогресс в терапии пациентов с местнораспространенным НМРЛ впервые был отмечен в исследовании PACIFIC. Установлено, что применение дурвалумаба по окончании ХЛТ может качественно изменить прогноз у данной категории больных. Речь, в частности, идет об увеличении продолжительности жизни.
В России для эффективного использования дурвалумаба в условиях реальной клинической практики необходимо пересмотреть ряд устоявшихся подходов. Так, в настоящее время в России ХЛТ при НМРЛ проводится не так часто. Некоторые пациенты получают ХЛТ в последовательном режиме (например, пациенты с ECOG 1 и 2). Эффект ХЛТ оценивается через один – три месяца после ее завершения, в то время как наиболее эффективным является максимально раннее начало применения дурвалумаба.
Согласно результатам нашего исследования, большинство пациентов получали последовательную ХЛТ и начинали вводить дурвалумаб более чем через две недели от последней дозы лучевой терапии (в приведенном клиническом случае спустя два месяца), что могло повлиять на результаты лечения.
В дальнейшем представляется важным оценить долгосрочные результаты применения данного препарата в условиях реальной практики.
Заключение
Монотерапия дурвалумабом характеризуется высокой эффективностью, приемлемым профилем токсичности и потенциально ассоциируется с высокой общей выживаемостью пациентов с нерезектабельным немелкоклеточным раком легкого III стадии после химиолучевого лечения [14].
Препарат для иммунной терапии Имфинзи® компании AstraZeneca не достиг основной конечной точки исследования у пациентов с прогрессирующей формой рака легких.
- В исследование III фазы были включены пациенты с IV стадией рака легких. Пациенты были рандомизированы в одну из групп — Имфинзи® (дурвалумаб) сам по себе или в комбинации с тремелимумабом или стандартная химиотерапия.
- Как показал анализ, иммунотерапия не приводит к достоверному улучшению общей выживаемости в сравнении с химиотерапией. Необходимо отметить, что в исследовании участвовали только пациенты, у которых белок PD-L1 продуцировался ≥25% опухолевыми клетками.
Официальные представители компании AstraZenenca не скрывают своего разочарования полученными результатами. Компания продолжит развитие иммунно-онкологического направления. Это и неудивительно, ведь препарат дурвалумаб активно используется в лечении раннего неоперабельного рака легких III стадии и уже одобрен в более, чем 40 странах.
Финансовая заинтересованность фармацевтических компаний, работающих с препаратами для иммунной терапии также понятная. Ведь рак легких, как лидирующая онкологическая причина смерти, представляет для них золотую жилу. Напомним, что стоимость иммунотерапии составляет $100 000 — 150 000 на одного пациента в год.
Источник: Noor Zainab Hussain, Arathy S Nair. AstraZeneca’s Pivotal Lung Cancer Trial Fails Main Goal in Late Stage Trial. medscape. November 20, 2018.

