Эмфизема легких
Версия: Клинические рекомендации РФ 2021 (Россия)
Категории МКБ:
Эмфизема (J43)
Разделы медицины:
Пульмонология
Общая информация
Краткое описание
Разработчик клинической рекомендации
Российское респираторное общество
Одобрено Научно-практическим Советом Минздрава РФ
Клинические рекомендации
Эмфизема легких
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем:J43
Год утверждения (частота пересмотра):2021
Возрастная категория:Взрослые
Год окончания действия:2023
ID:656
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Эмфизема легких – синдромное понятие, характеризующееся необратимым увеличением воздушного пространства дистальнее терминальных бронхиол, связанное с деструкцией стенок ацинуса [1,2].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статической класификации болезней и проблем, связанных со здоровьем
J43 Эмфизема:
J43.0 Синдром Мак-леода
J43.1 Панлобулярная эмфизема
J43.2 Центрилобулярная эмфизема
J43.8 Другая эмфизема
J43.9 Буллезная эмфизема
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 500 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
В зависимости от зоны поражения ацинуса выделяют следующие типы эмфиземы (табл. 1):
- центриацинарная (центрилобулярная),
- парасептальная,
- панацинарная (панлобулярная).
В отдельную форму выделяют буллезную эмфизему, характеризующуюся развитием участков деструкции размером более 1 см, которая может быть исходом любой формы эмфиземы.
Таблица 1. Классификация эмфиземы
| Характеристики | Центриацинарная | Панацинарная | Парасептальная |
| Морфологические | расширение центральных отделов ацинуса — респираторных бронхиол и межальвеолярных ходов | деструкция межальвеолярных перегородок, респираторные бронхиолы остаются неизменными | диффузное расширение ацинуса, слияние внутридольковых структур в единое воздушное пространство |
| Локализация изменений | Верхние доли, центральные отделы | Нижние доли, диффузное поражение | Субплеврально |
| ВРКТ-признаки | Локальные участки просветления без видимых стенок | Обширные зоны пониженной плотности без видимых стенок, обеднение сосудистого рисунка | Локальные округлые, четко очерченные участки просветления с тонкими (< 1 мм) стенками |
| Причины | Сигаретный дым | Дефицит А1АТ, сигаретный дым | Сигаретный дым, идиоптическая |
Дефицит А1АТ разделяют на следующие клинические типы:
- дефицит А1АТ с преимущественным поражением гепатобилиарной системы;
- дефицит А1АТ с преимущественным поражением дыхательной системы;
- дефицит А1АТ с сочетанным поражением легких и печени.
Этиология и патогенез
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
В формировании эмфиземы участвуют различные клеточные и молекулярные механизмы, ключевую роль среди которых играет протеазно-антипротеазный дисбаланс, вызывающий деструкцию эластического легочного каркаса [8].
Увеличение протеолитической активности в легких происходит в результате хронического воспаления и миграции макрофагов и нейтрофилов с выбросом протеолитических ферментов – сериновых и цистениновых протеаз, а также матриксных металлопротеиназ. Наиболее изучена роль сериновых протеиназ, прежде всего нейтрофильной эластазы — фермента широкого спектра действия, который разрушает эластин, коллаген, фибронектин, ламинин, протеогликаны и другие компоненты экстрацеллюлярного матрикса [9]. Выделение нейтрофильной эластазы из нейтрофилов в экстрацеллюлярное пространство происходит под влиянием различных субстанций – провоспалительных цитокинов (ИЛ-8, ФНОα), липополисахаридов, фрагментов бактериальной стенки [1].
Недостаток ингибиторов протеаз возникает либо вследствие генетически детерминированного дефекта синтеза или секреции (врожденный дефицит альфа-1- антитрипсина), либо из-за чрезмерной дезактивации продуктами оксидативного стресса.
При ХОБЛ дисбаланс в системе «протеазы-антипротеазы» расценивают в том числе как следствие воспаления, индуцированного ингаляционным воздействием повреждающих веществ (сигаретного дыма).
Альфа-1-антитрипсин –ингибитор протеаз семейства серпинов (serin protease inhibitor – serpin), преимущественной мишенью которого является нейтрофильная эластаза [7,8]. Ген, отвечающий за продукцию А1АТ, носит два названия – SERPINA1 (англ. serpin peptidase inhibitor, clade A), или Pi (proteinase inhibitor) и расположен на 14-й хромосоме (14q32.1) [10-12].
Все аллели классифицируются в зависимости от плазменной концентрации и свойств А1АТ на следующие типы [9]:
- нормальные аллели, ответственные за выработку А1АТ с нормальными свойствами и в достаточном количестве;
- дефицитные аллели, при которых вырабатывается недостаточное количество А1АТ;
- нулевые аллели, при которых А1АТ в крови полностью отсутствует;
- аллели с нарушением функции, при которых количество А1АТ не отличается от нормы, но он не может выполнять свои функции.
Для дифференцировки различных генетических вариантов молекул А1АТ используют их подвижность при электрофорезе, обозначая буквами от «A» до «Z». Аллели наследуются по кодоминантному типу, специфический фенотип А1АТ определяется двумя аллелями. Наиболее распространенным нормальным фенотипом является Pi*MM (средняя подвижность), определяемый у 95% лиц европеоидной расы [9].
Дефицит А1АТ обычно возникает в результате наследования двух дефицитных аллелей. Гетерозиготное носительство дефицитного аллеля скорее можно рассматривать как предрасположенность к развитию патологии [13, 14].
К основным дефицитным аллелям относятся варианты S и Z, при которых А1АТ полимеризуется, задерживается в печени и поступает в кровь в количестве, соответственно, 40–60 и 10–20% от нормы [9]. Подавляющее большинство случаев клинически значимого дефицита А1АТ развивается при фенотипе ZZ (96%). S-аллель приобретает клиническое значение при сочетании с вариантами Z или Q0 (нулевая аллель) [15-17].
В условиях дефицита А1АТ происходит неконтролируемое повышение активности протеолитических ферментов, прежде всего нейтрофильной эластазы, в результате чего эластические волокна и другие структуры экстрацеллюлярного матрикса нижних отделов дыхательных путей подвергаются медленной деструкции. Это приводит к потере эластичности легочной ткани, развитию обструктивных нарушений и эмфиземы.
Альфа-1-антитрипсин обладает важной противовоспалительной и иммуномодулирующей активностью – влиянием на цитокиновый профиль, миграцию лейкоцитов, активацию и пролиферацию Т-лимфоцитов, недостаточность которой вносит существенный вклад в развитие клинических проявлений дефицита А1АТ [18].
Важную роль в повреждении легкого при дефиците А1АТ играет курение. Сигаретный дым может дополнительно усиливать полимеризацию молекул А1АТ, нарушать синтез эластина в легких, поддерживать нейтрофильное воспаление [19,20].
Помимо нарушения баланса в системе протеолиз-антипротеолиз в качестве возможных патогенетических механизмов эмфиземы легких рассматривают подавление ангиогенеза в легких, нарушение баланса между повреждением и регенерацией паренхимы легких, аутоиммунные реакции в альвеолярной ткани и капиллярах легких, ускоренный апоптоз, повышение внутриацинарного давления [1].
Большинство случаев эмфиземы легких связано с ХОБЛ. Кроме того, у курильщиков с наличием респираторных симптомов, но не имеющих диагноза ХОБЛ, эмфизема выявлялась в 52% случаев [21].
Эпидемиология
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
По данным метаанализа, эмфизема встречается у взрослого населения с частотой 0,5 – 5,7% [3].
В крупных эпидемиологических исследованиях США среди белого населения диагноз эмфиземы установлен у 3,5%, а хронической обструктивной болезни легких (ХОБЛ) – у 6,3% обследованных [4].
Точная распространенность дефицита А1АТ в большинстве популяций неизвестна, у многих лиц он остается недиагностированным.
По данным Европейского легочного фонда, в странах Европы распространенность дефицита А1АТ варьирует в пределах 1 к 1800−2500 новорожденным, что составляет порядка 125 тыс. человек [5,6]. В случайной выборке русских из различных областей европейской части России частота Z-аллели колебалась от 0,3 до 1%, частота S-аллели – от 0,2 до 1,5%. По расчетам, в европейской части РФ около 17,7 тыс. гомозиготных или компаунд-гетерозиготных лиц по S- или Z-аллели, а также 2,6 млн. носителей. В азиатской части эти цифры составляют 1,2 тыс. и 500 тыс. соответственно [7]. Однако судить о частоте дефицита А1АТ в российской популяции на основании этих сведений не представляется возможным.
Клиническая картина
Cимптомы, течение
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клинические симптомы со стороны дыхательной системы при эмфиземе легких неспецифичны. Основные симптомы – это одышка и снижение переносимости физических нагрузок.
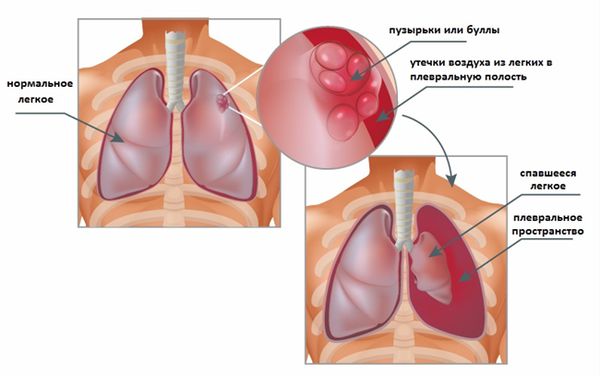
Первым проявлением эмфиземы (особенно в случае парасептальной эмфиземы) или осложнением уже известного заболевания может быть спонтанный пневмоторакс [22].
Как и при большинстве других наследственных заболеваний, клинические проявления дефицита А1АТ сильно варьируют и зависят от факторов окружающей среды.
Среди клинических проявлений дефицита А1АТ у взрослых преобладают легочные формы. Типичными проявлениями заболевания являются эмфизема, ХОБЛ, рецидивирующие бронхиты, бронхообструктивный синдром с соответсвующей клинической симптоматикой — прогрессирующая одышка при физической нагрузке, эпизоды свистящего дыхания, кашель, продукция мокроты [23-27].
У пациентов с ХОБЛ наличие выраженной эмфиземы легких по КТВР ассоциируется с большей смертностью и прогрессированием основного заболевания [28].
Ряд лиц с дефицитом А1АТ имеют нормальные показатели функции легких на момент постановки диагноза. Точный прогноз (при естественном течении заболевания) у данных индивидуумов неизвестен. Однако есть данные, подтверждающие нормальную выживаемость у некурящих лиц с PiZZ-фенотипом [29].
Наиболее распространенной причиной смерти у пациентов с дефицитом А1АТ является дыхательная недостаточность (45–72% смертей), затем следует цирроз печени (10–13% смертей) [30,31].
Диагностика
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Большинство случаев эмфиземы легких ассоциировано с курением и наличием ХОБЛ, что обуславливает необходимость обследование на предмет наличия данного заболевания у всех лиц с эмфиземой.
Диагностические маркеры дефицита А1АТ суммированы в табл. 2 [9,32].
Таблица 2. Диагностические маркеры дефицита А1АТ
| Проявления со стороны органов дыхания | Проявления со стороны других органов и систем |
|
Рано возникшая эмфизема (в возрасте до 45 лет) Эмфизема легких в отсутствие известных факторов риска (курение, производственное воздействие пыли и др.) Эмфизема с преимущественным поражением базальных отделов Развитие ХОБЛ у лиц моложе 40 лет и/или со стажем курения менее 20 пачек-лет Бронхоэктазы неясной этиологии бронхиальная астма с устойчивым к терапии нарушением функции легких |
Болезнь печени неясной этиологии Некротизирующий панникулит АNCА-ассоциированный васкулит Наличие в семейном анамнезе эмфиземы легких, бронхоэктазов, болезни печени, панникулита либо подтвержденный дефицит А1АТ у кровных родственников (особенно у братьев и сестер) |
- Пациентов с ХОБЛ, особенно при дебюте заболевания в возрасте <40 лет, стаже курения <20 пачек-лет, эмфизематозном фенотипе, с преимущественным расположением эмфиземы в базальных отделах рекомендуется тестировать на дефицит А1АТ [9].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии. Раннее выявление дефицита А1АТ позволит предупредить воздействие факторов риска (курение и др.) и мониторировать состояние пациента.
2.1 Жалобы и анамнез
При сборе анамнеза у пациентов с эмфиземой легких, всем пациентам рекомендуется оценивать наличие одышки, кашля, продукции мокроты, хрипов в груди, возраст дебюта клинических проявлений, уточнять наличие патологии дыхательной системы (эмфиземы) и печени у кровных родственников, а также оценивать анамнез курения с расчетом индекса курящего человека (пачек-лет) для исключения потенциальных причин эмфиземы легких [33].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Комментарии: Клинические проявления начинаются, как правило, в среднем возрасте (32–41 год), хотя описана значительная вариабельность времени их дебюта [9,34-36]. На скорость развития и тяжесть поражения легких существенное влияние оказывают ряд внешних (в первую очередь курение) и генетических факторов. Однако лица с недостаточностью А1АТ могут болеть ХОБЛ даже при отсутствии курения в анамнезе.
У пациентов ХОБЛ с дефицитом А1АТ по сравнению с больными ХОБЛ без него более выражена одышка, хуже качество жизни и функциональные показатели [37]. К факторам риска быстрого прогрессирования ХОБЛ у пациентов с дефицитом А1АТ относятся курение, принадлежность к мужскому полу, дебют клинических проявлений в возрасте 30– 44 лет, ОФВ1 в интервале 35–79% от должного, отрицательная проба с бронхолитиком и низкий уровень А1АТ.
Всех пациентов с дефицитом А1АТ независимо от возраста рекомендуется расспрашивать о наличии симптомов со стороны гепатобилиарной системы, для исключения патологии печени и желчевыводящих протоков[38-40].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии: У некоторых пациентов без признаков раннего заболевания печени возникает нарушение функции печени в подростковом возрасте и позже. Поражение печени во взрослом возрасте проявляется мелко- и крупноузловым циррозом и часто приводит к развитию гепатоцеллюлярной и холангиоцеллюлярной карциномы [38-40].
2.2 Физикальное обследование
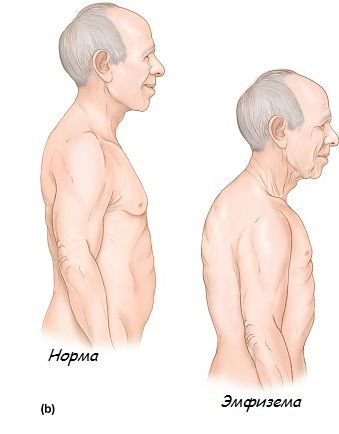
При физикальном обследовании пациентов с эмфиземой легких, как правило, выслушивается ослабленное дыхание при аускультации и коробочный звук при перкуссии, может определяться парадоксальный пульс. К характерным конституциональным чертам таких пациентов относятся сниженный индекс массы тела, бочкообразная грудная клетка с горизонтальным расположением ребер, сглаженность межреберных промежутков, широкий эпигастральный угол [1,41].
При проведении физикального осмотра у пациентов с подозрением на дефицит А1АТ необходимо также обращать внимание на состояние гепатобилиарной системы и кожных покровов. При дефиците А1АТ с преимущественным поражением печени при осмотре могут быть выявлены признаки цирроза печени.
Одним из клинических проявлений дефицита А1АТ является некротизирующий панникулит, для которого характерно появление подкожных узлов на области ягодиц, нижней части живота, проксимальных отделов конечностей.
- У всех пациентов с эмфиземой легких рекомендуется использование пульсоксиметрии для оценки насыщения гемоглобина кислородом (SpO2) [42, 119].
Уровень убедительности рекомендаций B (уровень достоверности доказательств 2).
2.3 Лабораторные диагностические исследования
- Пациентам с эмфиземой легких при значении SaO2 ≤92% по данным пульсоксиметрии рекомендуется проведение анализа газов артериальной крови для оценки выраженности гипоксемии [42].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
- Всем пациентам с подозрением на наследственный дефицит А1АТ рекомендуется определение активности альфа-1-антитрипсина в крови [9,23,39,40].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Комментарии. В условиях РФ оптимальным является определение уровня А1АТ методом иммунотурбидиметрии, при которой нормальными значениями А1АТ в сыворотке крови будут считаться 0,9–2 г/л (при измерении методом нефелометрии – от 2 до 4 г/л) [23].
При интерпретации результатов следует учитывать, что при инфекционных и воспалительных реакциях, опухолях, стрессе, шоке, беременности, приеме препаратов, включающих в состав вещества из группы эстрогенонов (АТХ G03C), уровень А1АТ в крови повышается [39,40]. Исследование лучше проводить вне периода обострения ассоциированных с дефицитом А1АТ заболеваний [45].
- Оценка уровня a1-фракции глобулинов при определении соотношения белковых фракций методом электрофореза или методом высокочувствительного капиллярного электрофореза с целью диагностики дефицита А1АТ не рекомендуется, так как требует дальнейших исследований для подтверждения диагноза [9,48].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии. Снижение либо отсутствие фракции a1-глобулинов при рутинном электрофорезе белков плазмы крови позволяет заподозрить наличие дефицита А1АТ, поскольку он составляет 80–90% a1-глобулинов крови.
- Всем пациентам с дефицитом А1АТ рекомендуется ежегодное исследование анализа крови биохимического общетерапевтического с исследованием уровня альбумина в крови, исследованием уровня общего билирубина в крови, определением активности аспартатаминотрансферазы в крови, определением активности аланинаминотрансферазы в крови, определением активности гамма- глютамилтрансферазы в крови и исследование уровня тромбоцитов в крови [47].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии. У пациентов с дефицитом А1АТ часто выявляется транзиторное повышение трансаминаз. Снижение синтетической функции печени (снижение альбумина) и тромбоцитопения более специфичны для цирроза печени.
2.4 Инструментальные диагностические исследования
Методы визуализации
- Всем пациентам с подозрением на эмфизему легких рекомендуется проводить прицельную рентгенографию органов грудной клетки в прямой проекции для подтверждения диагноза исключения других заболеваний органов дыхания и средостения [43,44].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии. К характерным признакам эмфиземы легких относятся низкое стояние и уплощение диафрагмы, вертикальное положение сердца, увеличение переднезаднего размера грудной клетки и расширение ретростернального пространства, обеднение легочного рисунка, часто встречается горизонтальное расположение ребер и расширение межреберных промежутков.
Для пациентов с эмфиземой на фоне дефицита А1АТ более характерно поражение нижних отделов.
У части пациентов с эмфиземой легких на начальных этапах изменения на рентгенограмме органов грудной клетки могут отсутствовать.
- У пациентов с впервые выявленной эмфиземой легких, наличием респираторных симптомов и/или изменением показателей функции легких рекомендуется проведение компьютерной томографии высокого разрешения (КТВР) органов грудной клетки [49].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии. КТВР органов грудной клетки является наиболее чувствительным и специфичным методом для выявления, оценки выраженности и морфологической характеристики эмфиземы лёгких [50].
Эмфизема проявляется в виде отдельных участков пониженной плотности без каких- либо границ или ограниченных тонкими (менее 1 мм) стенками, в центре таких просветлений может находиться точка – ветвь легочной артерии.
При дефиците А1АТ классическим признаком является панлобулярная эмфизема с преимущественным поражением нижних долей легких [1,9].
Наибольшей чувствительностью и специфичностью в оценке прогрессирования эмфиземы обладает метод рентгеноденситометрии, количественно оценивающий выраженность эмфиземы [49,51].
- Рекомендуется регулярное проведение КТВР органов грудной клетки для оценки прогрессирования эмфиземы у пациентов с тяжёлым дефицитом А1АТ [52].
Уровень убедительности рекомендаций В (уровень достоверности доказательств 2).
Функциональная диагностика
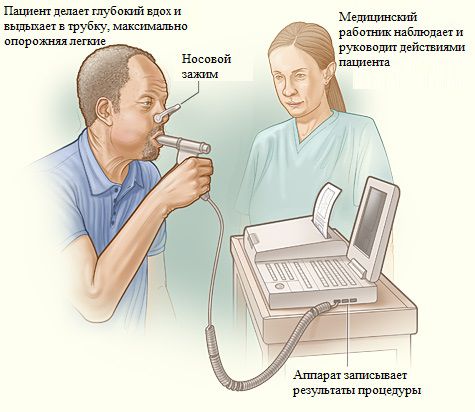
- Всем пациентам с подозрением на ХОБЛ и эмфизему легких рекомендуется проводить спирометрию с бронходилатационным тестом для выявления и оценки степени тяжести обструкции дыхательных путей [53,54].
Уровень убедительности рекомендаций 4 (уровень достоверности доказательств — С)
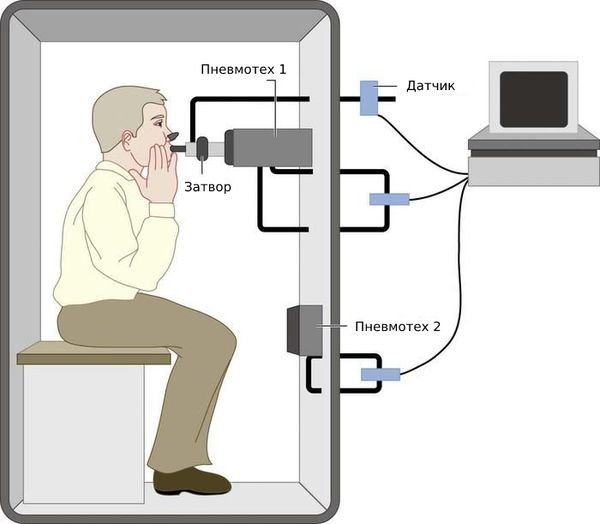
- Всем пациентам с выраженной эмфиземой легких и наличием респираторных симптомов рекомендуется проведение бодиплетизмографии и иследование диффузионной способности легких [55,56].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 5)
Комментарии. Методы исследования легочных объемов и диффузионной способности легких являются более чувствительными чем спирометрия для оценки функционального статуса пациентов с эмфиземой легких.
Для эмфиземы легких характерно снижение DLco менее 80% от должных величин при одновременном снижении объема форсированного выдоха за 1 сек (ОФВ1) менее 80% от должного и/или повышении остаточного объема легких (ООЛ) более 120% от должного, а также увеличении ФОЕ и отношении ООЛ/ОЕЛ [57,58].
- Пациентам с дефицитом А1АТ, не сопровождающимся клиническими проявлениями, рекомендуется проведение спирометрии на этапе первичного обследования [59,60].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Комментарии. По данным спирометрии у пациентов с дефицитом А1АТ определяется преимущественно обструктивный тип нарушений, у многих пациентов определяется обратимость бронхиальной обструкции.
Ранняя диагностика функциональных изменений (бронхиальной обструкции) позволяет своевременно принять меры по устранению факторов риска повреждения легких, начать терапию ХОБЛ и рассмотреть вопрос о специфической терапии дефицита А1АТ.
- Пациентам с легочной формой дефицита А1АТ вначале рекомендуется проводить спирометрию каждые 6–12 месяцев для исключения быстрого прогрессирования заболевания, после чего частота исследований может быть снижена [9,47].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии. Скорость снижения ОФВ1 при дефиците А1АТ сильно варьирует у разных пациентов.
- Пациентам с дефицитом А1АТ рекомендуется ежегодно проводить ультразвуковое исследование (УЗИ) органов брюшной полости для исключения проявления болезни со стороны печени [47].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
2.5 Иные диагностические исследования
Фенотипирование и генотипирование
Под термином «фенотип» принято понимать экспрессию определенного типа А1АТ, а понятие генотип отражает специфическую комбинацию аллелей.
- Всем пациентам с клиническими признаками дефицита А1АТ (см. табл. 1) и/или сниженной концентрации А1АТ в сыворотке крови рекомендуется проводить определение фенотипа и генотипа [39,40].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Комментарии. Генотипирование обладает наибольшей чувствительностью и специфичностью для определения дефицита А1АТ (S- и Z-аллели). По уровню А1АТ в сыворотке крови невозможно предположить генотип дефицита А1АТ.
Генотипирование проводится методом аллельспецифической амплификации (для выявления аллелей S и Z) или прямым секвенированием ДНК, выделенной из любых ядросодержащих клеток для выявления редких мутаций [46].
Определение фенотипа А1АТ (A–Z) рекомендуется проводить с помощью тонкослойного изоэлектрического фокусирования [9]. Начальными буквами алфавита обозначают варианты с высокой скоростью перемещения, конечными – перемещающиеся с низкой скоростью.
Лечение
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1. Консервативная терапия
- Всем пациентам с эмфиземой легких рекомендуется отказ от курения [61,62].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
- При отсутствии противопоказаний для поддержки усилий по прекращению курения рекомендуется назначать препараты, применяемые при никотиновой зависимости [63-67].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1)
Комментарии: Фармакотерапия эффективно поддерживает усилия по прекращению курения. К препаратам первой линии для лечения табачной зависимости относятся варениклин, никотин, в том числе в форме трансдермальной терапевтической системы.
- У пациентов с эмфиземой легких, обусловленной ХОБЛ и/или дефицитом А1АТ, рекомендуется использовать длительного действия антихолинергические средства (ДДАХ), селективные бета2-адреномиметики (ДДБА), глюкокортикоиды (ИГКС) – в форме для ингаляций – и, комбинации перечисленных препаратов (ДДБА/ДДАХ, ДДБА/ИГКС, ДДБА/ДДАХ/ИГКС) по стандартным показаниям [9,53].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии. Лечение ХОБЛ проводится в соответствии с международными и отечественными рекомендациями по лечению данного заболевания.
- Для лечения обострений ХОБЛ на фоне дефицита А1АТ рекомендуется увеличение доз препаратов для лечения обструктивных заболеваний дыхательных путей в форме ингаляций, назначение коротких курсов глюкокортикоидов действия, при изменении свойств мокроты – раннее использование антибиотиков, а также проведение респираторной поддержки при наличии показаний [1,9,23].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Комментарии. Обострения ХОБЛ, особенно с признаками бактериальной инфекции, у пациентов с дефицитом А1АТ характеризуются избыточной эластазной активностью, в связи с чем активное лечение должно быть назначено как можно раньше.
Заместительная терапия
На сегодняшний день единственным доступным специфическим средством лечения эмфиземы легких, обусловленной дефицитом А1АТ, является внутривенная заместительная терапия альфа1-протеиназы ингибитором (человеческим), полученным из пула донорской плазмы.
Заместительная терапия эффективно снижает ежегодную потерю легочной ткани, о чем свидетельствует оценка показателей рентгеноденситометрии в динамике [68-72]. Есть также данные, подтверждающие уменьшение скорости снижения ОФВ1 в год и статистически значимое увеличение продолжительности жизни при проведении заместительной терапии [60,70,72–75]. Согласно ряду исследований, заместительная терапия способствует снижению частоты и уменьшению тяжести обострений ХОБЛ при дефиците А1АТ, а также улучшению качества жизни пациентов, однако доказательной базы пока недостаточно [76–78].
- Внутривенная заместительная терапия альфа1-протеиназы ингибитором (человеческим) рекомендуется в дозе 60 мг/кг еженедельно лицам с дефицитом А1АТ фенотипов Pi*ZZ, Pi*ZNull, Pi*NullNull либо #с редкими дефицитными вариантами с концентрацией А1АТ меньше 0,8 г/л (11 мкмоль/л) старше 18 лет, наличием клинических проявлений со стороны органов дыхания и ОФВ1 30–65% от должного [9,23,73,78,79,80].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Комментарии. Заместительная терапия направлена на достижение и поддержание концентрации А1АТ выше порога безопасности – 0,8 г/л. Устранение дефицита не может восстановить поврежденные структуры легкого, но может предотвратить дальнейшее повреждение легочной ткани и стабилизировать состояние пациента [79,81].
- У пациентов с дефицитом А1АТ и ОФВ1 <30% рекомендуется рассмотреть вопрос о внутривенной заместительной терапии [82].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии. В качестве аргументов за проведение заместительной терапии выступает потенциальная возможность уменьшить смертность, замедлить прогрессирование заболевания. Однако доказательной базы для проведения заместительной терапии у данной категории пациентов недостаточно.
- У пациентов с дефицитом А1АТ с ОФВ1 >65% решение относительно проведения заместительной терапии рекомендуется принимать в индивидуальном порядке, с учетом потенциальной возможности замедлить прогрессирование заболевания и в то же время высокой стоимости терапии и отсутствием доказательной базы для данной категории больных [82].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии. Профилактическое применение аугментационной терапии нецелесообразно, поскольку не у всех пациентов с тяжелым дефицитом А1АТ развивается эмфизема легких.
При принятии решения относительно проведения заместительной терапии у этих пациентов следует учитывать такие факторы, как возраст, быстрое снижение ОФВ1, снижение диффузионной способности легких и прогрессирование эмфиземы по данным КТВР органов грудной клетки.
- Внутривенная заместительная терапия не рекомендуется пациентам с ХОБЛ с гетерозиготным генотипом дефицита А1АТ [81,83].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии. Роль заместительной терапии у данных пациентов в настоящее время не ясна.
- При проведении заместительной терапии рекомендуется внутривенное введение альфа1-протеиназы ингибитора (человеческого) 1 раз в неделю в дозе 60 мг/кг [9,84].
Уровень убедительности рекомендаций В (уровень достоверности доказательств 2).
Комментарии. Большинство исследований, сравнивавших эффективность разных схем терапии, выявили преимущества еженедельного введения препарата. Показано, что эта схема позволяет поддерживать уровень А1АТ выше порога безопасности на всем интервале между введениями и повышает уровень антиэластазной активности.
Определение активности альфа-1-антитрипсина в крови с целью подбора дозы заместительной терапии не рекомендуется.
Заместительная терапия, как правило, хорошо переносится. Побочные реакции обычно относительно легкие и купируются самостоятельно. Наиболее часто встречаются небольшая лихорадка и озноб, крапивница, тошнота и рвота, слабость, головокружение. Анафилаксия описана, но встречается крайне редко. Случаев парентерального заражения вирусным гепатитом и ВИЧ (вирус иммунодефицита человека) и летальных исходов не зафиксировано [71,75,85-88].
- Пациентам с эмфиземой легких и хронической дыхательной недостаточностью рекомендуется проведение длительной кислородотерапии по стандартным показаниям (показания см. табл.3) [53,89].
Уровень убедительности рекомендаций С (уровень достоверности доказательств –5)
Таблица 3. Показания к назначению длительной кислородотерапии
| Показания |
PaO2 (мм рт.ст.) |
SaO2 (%) | Особые условия |
| Абсолютные | £ 55 | £ 88 | Нет |
| Относительные (при наличии особых условий) | 55-59 | 89 | Легочное сердце, отеки, полицитемия (гематокрит >55%) |
| Нет показаний (за исключением особых условий) | ³ 60 | ³ 90 |
Десатурация при нагрузке Десатурация во время сна Болезнь легких с тяжелым диспное, уменьшающимся на фоне О2 |
Комментарии. Параметры газообмена, на которых основываются показания к ДКТ, рекомендуется оценивать только во время стабильного состояния больных, т.е. через 3-4 недели после обострения ХОБЛ [90].
3.2. Хирургические методы лечения
- Пациентам с ХОБЛ и буллезной эмфиземой рекомендуется проведение буллэктомии при наличии выраженной одышки (2-4 степень по mMRC), вызванной сдавлением легкого крупными буллами, пневмоторакса или кровотечения вследствие разрыва буллы, инфицирования буллы [1].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5)
- Пациентам с ХОБЛ с верхнедолевой эмфиземой и низкой переносимостью физической нагрузки рекомендуется проведение операции по уменьшению объема легких [91].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Проведение хирургического уменьшения объема легких (ХУОЛ) у пациентов с эмфиземой показано при некорригируемой одышке (2-4-й степени по шкале mMRC), ОФВ1 < 40% от должного после пробы с бронхолитиком, ООЛ > 200% от должного, ОЕЛ > 120% от должного, снижении DLco < 50% от должной, гетерогенности эмфиземы с наличием измененных и здоровых зон в легких. Противопоказаниями к проведению ХУОЛ у пациентов с эмфиземой легких являются возраст старше 75 лет, курение в течение последних 6 месяцев, легочная гипертензия, РаСО2 в покое более 55 мм рт. ст., DLco < 10% и > 50% от должной, тяжелые конкурирующие заболевания [92,93].
В настоящее время для уменьшения объема легких возможно использование и менее инвазивных методов с помощью окклюзии сегментарных бронхов.
Проведение ХУОЛ у пациентов с эмфиземой на фоне дефицита А1АТ не рекомендуется [94-96].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 3).
Комментарии. У пациентов с дефицитом А1АТ эмфизема часто локализована преимущественно в базальных отделах легких или носит генерализованный характер, что делает выполнение ХУОЛ технически более сложным и ведет к увеличению смертности.
- При тяжелом течении заболевания (выраженная эмфизема и одышка в покое и минимальной физической нагрузке, сохраняющаяся несмотря на оптимальную медикаментозную и реабилитационную терапию) рекомендуется рассмотреть вопрос о трансплантации легких [97-99].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Комментарии. Выживаемость у пациентов с ХОБЛ, ассоциированной с дефицитом А1АТ, после трансплантации легких не отличалась от выживаемости после трансплантации пациентов с ХОБЛ без дефицита А1АТ.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания
или состояния)
Имеются данные о возможных проблемах во время беременности у некоторых женщин с дефицитом А1АТ с фенотипом PI*ZZ. Описано увеличение частоты выкидышей и мертворождений, а также развитие пневмоторакса во время беременности у женщин с исходным наличием булл [114-116]. Тем не менее у пациенток с тяжелой эмфиземой наблюдались успешно завершившиеся доношенные беременности [116].
Перед воздушными перелетами пациенты с эмфиземой должны проходить специальное обследование. Необходимо принимать меры, чтобы избежать гипоксемии.
В ходе анестезии при операциях в верхнем отделе брюшной полости, а также в восстановительном периоде непосредственно после операции важную роль играет искусственная вентиляция легких с удлиненным выдохом. В послеоперационном периоде также важно обеспечить дренирование мокроты.
- Урологические, гинекологические и колоректальные вмешательства у пациентов с дефицитом А1АТ рекомендуется, по возможности, проводить в условиях местной или перидуральной анестезии [117-118].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 4).
Медицинская реабилитация
4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
- Курсы легочной реабилитации рекомендуются пациентам с эмфиземой легких и постоянной одышкой, несмотря на проводимую терапию, а также физически неактивным больным с частыми обострениями или непереносимостью физической нагрузки [100,101].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Реабилитация является многокомпонентной мерой. Рекомендуется включать в программу легочной реабилитации психологическую поддержку и борьбу с депрессией, обучение, нутритивную поддержку и физическую тренировку [102]. Длительность такой программы не установлена, однако считается, что она может продолжаться от 4 до 10 недель [103].
- При проведении легочной реабилитации у пациентов с эмфиземой легких и ХОБЛ рекомендуется включать в программу физические тренировки [104].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: Разработка тренировочных программ требует индивидуального подхода и зависит от исходного состояния пациента, степени тяжести заболевания и сопутствующих заболеваний, а также мотивации. При наличии соответствующих показаний во время тренировки следует использовать различные виды респираторной поддержки.
В качестве физической тренировки можно использовать занятия на беговой дорожке или велоэргометре от 10 до 45 минут на одно занятие с интенсивностью от 50% пикового потребления кислорода до максимального уровня переносимости [105]. В общетерапевтической практике при отсутствии ресурсов для полноценной реабилитации следует рекомендовать ежедневные прогулки (например: 30 минут, 4 км – в зависимости от физического статуса), а также тренировки с помощью скандинавской ходьбы. В ряде программ имеются тренировки верхней группы мышц, что улучшает их функцию и силу [106].
- Рекомендуется включать в программу реабилитации тренировку дыхательной мускулатуры с помощью различных видов устройств (дыхательных тренажеров) [107].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
Комментарии: Тренировка респираторных мышц может давать положительный эффект, особенно в сочетании с общими тренировками.
- У всех пациентов с эмфиземой легких и ХОБЛ в программу легочной реабилитации рекомендуется включать обучение [108-110].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
Комментарии: Обучение пациентов является эффективным средством достижения конкретных целей, включая прекращение курения, понимание ряда вопросов, связанных с терминальными событиями и улучшения исходов обострений. Для пожилых пациентов могут оказаться полезными многопрофильные образовательные программы.
Госпитализация
6. Организация оказания медицинской помощи
Показания для госпитализации в медицинскую организацию:
- значительное нарастание тяжести симптомов (внезапно появившаяся тяжелая одышка)
- появление новых симптомов (цианоз, периферические отеки, боль в грудной клетке)
- развитие тяжелого обострения ХОБЛ
- развитие пневмоторакса
- неэффективность начальной терапии обострения
- возникновение острых или обострение хронических сопутствующих заболеваний
- старческий возраст.
Лечение в медицинской организации:
- осмотр врача-пульмонолога или врача-терапевта не позднее 20 минут
- пульсоксиметрия не позднее 20 минут от момента поступления в стационар
- консультация врача-анестезиолога-реаниматолога не позднее 30 минут от момента поступления в стационар (при сатурации менее 75%)
- общий (клинический) анализ крови развернутый
- исследование уровня С-реактивного белка в крови
- прицельная рентгенография органов грудной клетки в прямой проекции
- электрокардиографическое исследование
- спирография с бронходилатационной пробой
- оценка выраженности одышки по шкале mMRC
- терапия лекарственными препаратами для лечения обструктивных заболеваний дыхательных путей с коротким сроком действия в форме для ингаляций
- терапия антибактериальными лекарственными препаратами (при появлении гнойной мокроты и/или при уровне С-реактивного белка более 10 мг/л)
- ингаляционное введение кислорода (при сатурации менее 90%).
Показания к выписке пациента из медицинской организации:
- пациент способен принимать длительнодействующие бронхолитики (β2-агонисты и/ или антихолинергические препараты) в комбинации с ингаляционными ГКС или без них
- прием короткодействующих ингаляционных β2-агонистов требуется не чаще чем каждые 4 часа
- пациент способен (если ранее он находился на амбулаторном ведении) самостоятельно передвигаться по комнате
- пациент способен принимать пищу и может спать без частых пробуждений из-за одышки
- клиническая стабильность состояния в течение 12-24 часов
- стабильные значения газов артериальной крови в течение 12-24 часов
- пациент или лицо, оказывающее помощь на дому, полностью понимает правильную схему приема препаратов
- решены вопросы дальнейшего наблюдения за пациентом (например, посещения пациента медицинской сестрой, снабжение кислородом и продовольствием)
- пациент, семья и лечащий врач уверены, что пациент может успешно управляться в быту.
Профилактика
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Всем пациентам с эмфиземой легких и дефицитом А1АТ рекомендуется использовать все меры для отказа от курения [83,108,111].
Уровень убедительности рекомендаций В (уровень достоверности доказательств 2).
Комментарии. Отказ от курения – основная мера профилактики развития и замедления прогрессирования заболевания легких при дефиците А1АТ. Показано, что скорость снижения ОФВ1 и смертность снижается у пациентов, успешно бросивших курить [108].
- Пациентам с ХОБЛ, а также пациентам с дефицитом А1АТ рекомендуется проведение вакцинации против гриппа и пневмококковой инфекции, а при наличии поражения печени – вакцинации против гепатита В [9, 112,113].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
- У пациентов с эмфиземой легких рекомендуется сведение к минимуму воздействие факторов, раздражающих дыхательные пути, таких как табачный дым (пассивное курение), пыль и испарения [9,82].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии
. При частом профессиональном контакте с такими факторами может потребоваться смена места работы.
Информация
Источники и литература
-
Клинические рекомендации Российского респираторного общества
- 1. Эмфизема легких : Монография / Под ред. Аверьянова А.В. (Серия монографий Российского респираторного общества; Гл. ред. Серии Чучалин А.Г.). – М.: Издательский дом «Атмосфера», 2009. – 136 с.
2. Snider G.L., Kleinerman J., Thurlbeck W.M. et al. The definition of emphysema // Amer. Rev.Respir. Dis. 1985. V. 132. P. 182-185
3. Halbert R.J., Natoli J.L., Gano A. Global burden of COPD: systematic review and meta- analysis // Eur. Respir. J. 2006. V. 28. P. 523 – 532.
4. Mannino D.M., Gagnon R.C., Petty T.L. et al. Obstructive lung disease and low lung function in adults in the United States: data from the National Health and Nutrition Examination Survey, 1988-1994 // Arch. Intern. Med. 2000 V. 160 P. 1683 – 1689
5. Hutchison DC. Alpha 1-antitrypsin deficiency in Europe: geographical distribution of Pi types S and Z. Respiratory Medicine 1998 Mar;92(3):367-77.
6. Europeanlung.org/assets/files/ru/publications/alpha1-anti-trypsin-ru.pdf. Accessed 2017 December 18.
7. Журкова Н.В., Кондакова О.Б., Строкова Т.В., Дублина Е.С., Симонова О.И, Кузьмина Л.П., Потапов А.С., Асанов А.Ю. Недостаточность α1-антитрипсина у детей с патологией печени. Педиатрия 2008;87(3):138-41.
8. Shapiro S.D., Proteolysis in the lung // Eur. Respir. J. 2003. V. 22. P. 30S – 32S.
9. American Thoracic Society; European Respiratory Society. American Thoracic Society/European Respiratory Society statement: standards for the diagnosis and management of individuals with alpha-1 antitrypsin deficiency. American Journal of Respiratory and Critical Care Medicine 2003 Oct;168(7):818-900.
0. Cox DW, Woo SL, Mansfield T. DNA restriction fragments associated with α-1 antitrypsin indicate a single origin for deficiency allele PIZ. Nature 1985;316:79-81.
1. Cox DW, Billingsley GD, Mansfield T DNA restriction site polymorphisms associated with alpha 1-antitrypsin gene. American Journal of Human Genetics 1987 Nov;41(5):891-906.
2. Seixas S, Garcia O, Trovoada MJ, Santos MT, Amorim A, Rocha J. Patterns of haplotype diversity within the serpin gene cluster at 14q32.1: insights into the natural history of the alpha 1-antitrypsin polymorphism. Human Genetics 2001 Jan;108(1):20-30.
3. . Keren DF. Protein electrophoresis in clinical diagnosis. London, England: Hodder Arnold; 2003:71-7.
4. Brantly M, Nukiwa T, Crystal RG. Molecular basis of alpha-1-antitrypsin deficiency. The American Journal of Medicine 1988;84(6A):13-31.
5. Cox DW. Alpha-1 antitrypsin deficiency. In: The metabolic and molecular basis ofinherited disease. Scriver CR, Beadet AL, Sly WS,Valle D, editors. 7th McGraw-Hill; 1995:4125-58.
ed. New York:
6. Kamboh MI. Biochemical and genetic aspects of human serum α-1 proteinase inhibitor protein. Disease Markers 1985;3:135.
7. Marciniuk DD, Hernandez P, Balter M, Bourbeau J, Chapman KR, Ford GT, Lauzon JL, Maltais F, O’Donnell DE, Goodridge D, Strange C, Cave AJ, Curren K, Muthuri S; Canadian Thoracic Society COPD Clinical Assembly Alpha-1 Antitrypsin Deficiency Expert WorkingGroup. Alpha-1 antititrypsin deficiency targeted testing and augmentation therapy: a Canadian Thoracic Society clinical practice guideline. Canadian Respiratory Journal 2012 Mar-Apr;19(2):109-16.
8. Churg A., Zhou S. Wright JL. Matrix metalloproteinases in COPD. The European Respiratory Journal 2012;39(1):197-209.
9. Osman M, Cantor JO, Roffman S, Keller S, Turino GM, Mandl I. Cigarette smoke impairs elastin resynthesis in lungs of hamsters with elastase-induced emphysema. The American Review of Respiratory Disease 1985 Sep;132(3):640-43.
0. Morrison HM, Kramps JA, Burnett D, Stockley RA. Lung lavage fluid from patients with α-1 proteinase inhibitor deficiency or chronic obstructive bronchitis: anti-elastase function and cell profile. Clinical Science (London) 1987 Mar;72(3):373-81.
1. Satoh K., Kobayashi T., Misao T. CT assessment of subtypes of pulmonary emphysema in smokers // Chest 2001 V. 120 P. 725 – 729.
2. Hobbs BD, Foreman MG, Bowler R, Jacobson F, Make BJ, Castaldi PJ, et al. COPDGene Investigators. Pneumothorax risk factors in smokers with and without chronic obstructive pulmonary disease. Ann Am Thorac Soc. 2014;11:1387–1394.
3. Гембицкая Т.Е., Черменский А.Г., Илькович М.М., Цампруби С. Первичная эмфизема легких у молодого мужчины, обусловленная гомозиготным дефицитом α1- антитрипсина (генотип ZZ): перспективы организации помощи больным. Пульмонология 2014;6:115-21.
4. Shin MS, Ho KJ. Bronchiectasis in patients with α-1 antitrypsin deficiency. A rare occurrence? Chest 1993 Nov;104(5):1384-6.
5. Eden E, Mitchell D, Mehlman B, Khouli H, Mejat M, Grieco MH, Turino GM. Atopy, asthma and emphysema in patients with severe α-1-antitrypsin deficiency. American Journal of Respiratory and Critical Care Medicine 1997 Jul;156(1):68-74.
6. Higgins MW, Thom T. Incidence, prevalence and mortality: intra- and inter country differences. In: Clinical epidemiology of chronic obstructive pulmonary disease. Hensley MJ, Saunders NA, editors. New York: Marcel Dekker; 1989:23-43.
7. Eriksson S. Alpha-1 antitrypsin deficiency: natural course and therapeutic strategies. In: Proceedings of the Falk Symposium no. 115. Dordrecht, The Netherlands. Dordrecht/Boston/London: Kluwer Academic Publishers; 1999:307-15.
8. Han MK, Tayob N, Murray S, Woodruff PG, Curtis JL, Kim V, et al. COPDGene and SPIROMICS Investigators. Association between emphysema and chronic obstructive pulmonary disease outcomes in the COPDGene and SPIROMICS cohorts: a post hoc analysis of two clinical trials. Am J Respir Crit Care Med. 2018;198:265–267.
9. Sinden NJ, Stockley RA. Proteinase 3 activity in sputum from subjects with alpha-1- antitrypsin deficiency and COPD. The European Respiratory Journal 2013; 41(5):1042-50.
0. Stoller JK, Smith P, Yang P, Spray J. Physical and social impact of α-1 antitrypsin deficiency: results of a survey. Cleveland Clinic Journal of Medicine 1994 Nov- Dec;61(6):461-7.
1. Sørheim IC, Bakke P, Gulsvik A, Pillai SG, Johannessen A, Gaarder PI, Campbell EJ, Agustí A, Calverley PM, Donner CF, Make BJ, Rennard SI, Vestbo J, Wouters EF, Paré PD, Levy RD, Coxson HO, Lomas DA, Hersh CP, Silverman EK. α-1 antitrypsin protease inhibitor MZheterozygosity is associated with airflow obstruction in two large cohorts. Chest 2010 Nov;138(5):1125-32.
2. Owen MC, Brennan SO, Lewis JH, Carrell RW. Mutation of antitrypsin to antithrombin alpha 1-antitrypsin Pittsburgh (358Met leads toArg), a fatal bleeding disorder. The New England Journal of Medicine 1983 Sep;309(12):694-8.
3. Kohansal R, Martinez-Camblor P, Agustí A, Buist AS, Mannino DM, Soriano JB. The natural history of chronic airflow obstruction revisited: an analysis of the Framingham offspring cohort. Am J Respir Crit Care Med. 2009 Jul 1;180(1):3-10. doi: 10.1164/rccm.200901- 0047OC. Epub 2009 Apr 2. PMID: 19342411.
4. Мельник С.И., Власов Н.Н., Пиневская М.В., Орлова Е.А., Старевская Е.В., Мельникова И.Ю. Дефицит альфа-1-антитрипсина у детей: описание серии случаев. Вопросы современной педиатрии 2016;15(6):619-24.
5. Elzouki AN, Eriksson S. Risk of hepatobiliary disease in adults with severe alpha 1- antitrypsin deficiency (PiZZ): is chronic viral hepatitis B or C an additional risk factor for cirrhosis and hepatocellular carcinoma? European Journal of Gastroenterology & Hepatology 1996; Oct;8(10):989-94.
6. Eriksson S, Carison J, Velez R. Risks for cirrhosis and primary liver cancer in α-1 antitrypsin deficiency.The New England Journal of Medicine 1986 Mar;314(12):736-9.
7. O’Riordan K, Blei A, Rao MS, Abecassis M. Alpha-1 antitrypsin deficiency-associated panniculitis: resolution with intravenosus α-1 antitrypsin and liver transplantation. Transplantation 1997 Feb;63(3):480-2.
8. Zorzetto M, Russi E, Senn O, Imboden M, Ferrarotti I, Tinelli C, Campo I, Ottaviani S, Scabini R, von Eckardstein A, Berger W, Brändli O, Rochat T, Luisetti M, Probst-Hensch N; SAPALDIA Team. SERPINA 1 gene variants in individuals from the general population with reduced alpha 1-antitrypsin concentrations. Clinical Chemistry 2008 Aug;54(8):1331- 8.
9. Miravitlles M, Herr C, Ferrarotti I, Jardi R, Rodriguez-Frias F, Luisetti M, Bals R. Laboratory testing of individuals with severe alpha 1-antitrypsin deficiency in three European centers. The European Respiratory Journal 2010 May;35(5):960-8.
0. Bornhorst JA, Greene CM, Ashwood ER., Greenache DG. α1-antitrypsin phenotypes and associated serum protein concentrations in a large clinical population. Chest 2013 Apr;143(4):1000-8.
1. Guerra S., Sherrill D., Bobadilla A. et al. The relation of body mass index to asthma, chronic bronchitis and emphysema // Chest 2002V. 122 P. 1256-1263.
2. Amalakanti S, Pentakota MR Pulse Oximetry Overestimates Oxygen Saturtion in COPD // Respir Care 2016; 61 (4): 423-7.
3. Gishen P, Saunders AJS, Tobin MJ, Hutchison DCS. Alpha-1 antitrypsin deficiency: the radiological features of pulmonary emphysema in subjects of Pi-type-Z and Pi-type-SZ. A survey by the British Thoracic Association. Clin Radiol 1982;33:371–377.
4. Foster WL Jr, Gimenez EI, Roubidoux MA, Sherrier RH, Shannon RH, Roggli VL, Pratt PC. The emphysemas: radiologic–pathologic correlations. Radiographics 1993;13:311–328.
5. Dawwas MF, Davies SE, Griffiths WJ et al. Prevalence and risk factors for liver involvement in individuals with PiZZ-related lung disease. Am J Respir Crit Care Med. 2013;187(5):502-508.
6. Crowther DC, Belogrey D, Miranda E, Kinghorn KJ, Sharp LK, Lomas DA. Practical genetics: alpha-1-antitrypsin deficiency and the serpinopathies. European Journal of Human Genetics 2004 Mar;12(3):167-72.
7. Nelson DR, Teckman J, Di Bisceglie AM et al. Diagnosis and management of patients with alpha 1-antitrypsi
8. Sandhaus RA. Alpha 1-antitrypsin deficiency: whom to test, whom to treat? Seminars in Respiratory and Critical Care Medicine 2010 Jun;31(3):343-7.
9. Dowson LJ, Guest PJ, Hill SL, Holder RL, Stockley RA. High-resolution computed tomography scanning in alpha 1-antitrypsin deficiency: relationship to lung function and health status. The European Respiratory Journal 2001 Jun;17(6):1097-104.
0. Gevenois P.A., de Maertelaer V/. de Vuyst P. et al. Comparison of computed density and macroscopic morphometry in pulmonary emphysema // Amer. J. Respir. Crit. Care Med. 1995 V. 152 P. 653-700.
1. Parr DG, Stoel BC, Stolk J, Stockley RA. Validation of computed tomography lung densitometry for monitoring emphysema alpha 1-antitrypsin deficiency. Thorax 2006 Jun;61(6):485-90.
2. Dirksen A, Friis M, Olesen KP, Skovgaard LT, Sorensen K. Progress of emphysema in severe
-1 antitrypsin deficiency as assessed by annual CT. Acta Radiol 1997;38:826–832
3. Global Initiative for Chronic Obstructive Lung Disease. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. Revised 2019 // www.goldcopd.com.
4. Hill K, Goldstein RS, Guyatt GH et al. Prevalence and underdiagnosis of chronic obstructive pulmonary diseaseamong patients at risk im primary care // CMAJ 2010; 182(7): 673-8.
5. Quanjer PH, Tammeling GJ, Cotes JE et al. Lung volumes and forced ventilatory flows. Report Working Party Standardization of Lung Function Tests, European 80 Community for Steel and Coal. Official Statement of the European Respiratory Society // Eur Respir J. 1993, 6: suppl. 16, 5-40.
6. Wanger J, Clausen JL, Coates A et al. Standardisation of the measurement of lung volumes
// Eur Respir J 2005; 26: 511-522.
7. Sanders C., Nath P.H., Bailey W. Detection of emphysema with computed tomography: correlation with pulmonary function tests and chest radiography // Invest. Radiol. 1988 V. 23 P. 262 – 266.
8. Функциональная диагностика в пульмонологии: Практическое руководство / Под ред. Чучалина А.Г. – М.: Издательский холдинг «Атмосфера», 2009. – 192 с.
9. Lomas DA. Genetic predisposition to chronic obstructive pulmonary disease: advances in alpha 1-antitrypsin deficiency and serpinopathies. Clinical Medicine 2007;7(5):446-7.
0. Tanash HA, Nilsson PM, Nilsson JA et al. Clinical course and prognosis of never-smokers with severe alpha 1-antitrypsin deficiency (PiZZ). Thorax. 2008;63(12):1091-1095.
1. Pelkonen M, Notkola IL, Tukiainen H, Tervahauta M, Toumilehto J, Nissinen A: Smoking cessation, decline in pulmonary function and total mortality: a 30-year follow-up study among the Finnish cohorts of the Seven Countries Study. Thorax 2001; 56: 703– 707.2. Chandler MA, Rennard SI: Smoking cessation. Chest 2010; 137: 428–435.
3. Henningfield JE: Nicotine medications for smoking cessation. N Engl J Med 1995; 333: 1196–1203.
4. Jorenby DE, Leischow SJ, Nides MA, Rennard SI, Johnston JA, Hughes AR, Smith SS, Muramoto ML, Daughton DM, Doan K, Fiore MC, Baker TB: A controlled trial of sustained- release bupropion, a nicotine patch, or both for smoking cessation. N Engl J Med 1999; 340: 685–691.
5. Silagy C, Mant D, Fowler G, Lodge M: Metaanalysis on efficacy of nicotine replacement therapies in smoking cessation. Lancet 1994; 343: 139–142.
6. Tashkin D, Kanner R, Bailey W, Buist S, Anderson P, Nides M, Gonzales D, Dozier G, Patel MK, Jamerson B: Smoking cessation in patients with chronic obstructive pulmonary disease: a double-blind, placebo-controlled, randomised trial. Lancet 2001; 357: 1571– 1575.
7. Strassmann R, Bausch B, Spaar A, Kleijnen J, Braendli O, Puhan MA: Smoking cessation interventions in COPD: a network metaanalysis of randomised trials. Eur Respir J 2009; 34: 634–640.
8. Dirksen A, Dijkman JH, Madsen F, Stoel B, Hutchinson DC, Ulrik CS, Skovgaard LT, Kok- Jensen A, Rudolphus A, Seersholm N, Vrooman HA, Reiber JH, Hansen NC, Heckscher T, Viskum K, Stolk J. A randomized clinical trial of α-1 antitrypsin augmentation therapy. American Journal of Respiratory and Critical Care Medicine 1999 Nov;160(5 Pt 5):1468-72.
9. Dirksen A., Piitulainen E, Parr DG, Deng C, Wencker M, Shaker SB, Stockley RA. Exploring the role of CT densitometry: a randomized study of augmentation therapy in alpha1- antitrypsin deficiency. The European Respiratory Journal 2009 Jun;33(6):1345-53.
0. Chapman KR, Stockley RA, Dawkins C, Wilkes MM, Navickis RJ. Augmentation therapy for alpha1-antitrypsin deficiency: a meta-analysis. COPD 2009 Jun;6(3):177-84.
1. Gotzsche PC, Johansen HK. Intravenous alpha-1 antitrypsin augmentation therapy for treating patients with alpha-1 antitrypsin deficiency and lung disease. The Cochrane Database of Systematic Reviews 2010 Jul;7(7):CD007851.
2. McElvaney NG, Burdon J, Holmes M, Glanville A, Wark PA, Thompson PJ, Hernandez P, Chlumsky J, Teschler H, Ficker JH, Seersholm N, Altraja A, Mäkitaro R, Chorostowska- Wynimko J, Sanak M, Stoicescu PI, Piitulainen E, Vit O, Wencker M, Tortorici MA, Fries M, Edelman JM, Chapman KR; RAPID Extension Trial Group. Long-term efficacy and safety of alpha 1 proteinase inhibitor treatment for emphysema caused by severe alpha 1- antitrypsin deficiency: an open-label extension trial (RAPID-OLE). The Lancet Respiratory Medicine 2017 Jan;5(1):51-60.
3. The Alpha-1-Antitrypsin Deficiency Registry Study Group. Survival and FEV1 decline in individuals with severe deficiency of alpha 1-antitrypsin. American Journal of Respiratory and Critical Care Medicine 1998;127(Suppl):S43-S45.
4. Seersholm N, Wencker M, Banik N, Viskum K, Dirsken A, Kok-Jensen A, Konietzko N. Does alpha1-antitrypsin augmentation therapy slow the annual decline in FEV1 in patients with severe hereditary alpha1-antitrypsin deficiency? Wissenschaftliche Arbeitsgemeinschaft zur Therapie von Lungenerkrankungen (WATL) alpha1-AT study group. The European Respiratory Journal 1997 Oct;10(10):2260-3.
- 1. Эмфизема легких : Монография / Под ред. Аверьянова А.В. (Серия монографий Российского респираторного общества; Гл. ред. Серии Чучалин А.Г.). – М.: Издательский дом «Атмосфера», 2009. – 136 с.
Информация
Список сокращений
А1АТ – альфа-1-антитрипсин
АлАТ – аланинаминотрансфераза
АсАТ – аспартатаминотрансфераза
ГГТ – гамма-глутамилтрансфераза
ДКТ – длительная кислородотерапия
ДНК – дезоксирибонуклеиновая кислота
КТ – компьютерная томография
КТВР – компьютерная томография высокого разрешения
МКБ-10 – международная статистическая классификация болезней 10-го пересмотра
ОЕЛ – общая емкость легких
ООЛ – остаточный объем легких
ОФВ1 – объем форсированного выдоха за 1-ю секунду
ФОЕ – функциональная остаточная емкость
ФЖЕЛ – форсированная жизненная емкость легких
ХОБЛ – хроническая обструктивная болезнь легких
ШИК – Шифф–йодная кислота
IgА – иммуноглобулин класса А
Термины и определения
Альфа-1-антитрипсин – ингибитор протеаз семейства серпинов, преимущественной мишенью которого является нейтрофильная эластаза.
Дефицит альфа-1-антитрипсина (А1АТ) – генетически детерминированное заболевание, вызванное недостаточностью А1АТ в сыворотке крови и проявляющееся в виде хронической обструктивной болезни легких, эмфиземы легких, поражения печени и сосудов.
Нейтрофильная эластаза – фермент широкого спектра действия, который разрушает эластин, коллаген, протеогликаны и другие компоненты экстрацеллюлярного матрикса.
Хроническая обструктивная болезнь легких – заболевание, характеризующееся персистирующим ограничением воздушного потока, которое обычно прогрессирует и является следствием хронического воспалительного ответа дыхательных путей и легочной ткани на воздействие ингалируемых повреждающих частиц или газов.
Булла – воздушная полость с четкими ровными тонкими стенками диаметром более 1 см.
Легочная гиперинфляция – патологическое увеличение объема воздух, остающегося в легких после спокойного выдоха.
Остаточный объем легких – объем воздуха, который остается в легких по окончании полного выдоха
Функциональная остаточная емкость – объем воздуха в легких и дыхательных путях после спокойного выдоха.
Критерии оценки качества медицинской помощи
| № | Критерий |
Уровень достоверности доказательств |
Уровень убедительности рекомендаций |
| Диагностика эмфиземы легких | |||
| 1 | Выполнен общий физикальный осмотр | ||
| 2 | Выполнена оценка индекса курящего человека (пачек-лет) | 1 | А |
| 3 | Выполнена пульсоксиметрия | 3 | А |
| 4 |
Выполнена прицельная рентгенография органов грудной клетки в прямой проекции |
3 | А |
| 5 | Выполнена КТВР органов грудной клетки | 4 | С |
| 6 | Выполнена спирометрия с бронходилатационным тестом | 4 | С |
| 7 |
У пациентов с клиническими признаками дефицита А1АТ выполнено исследование крови на А1АТ |
3 | А |
| 8 |
У пациентов с клиническими признаками дефицита А1АТ и/или сниженной концентрацией А1АТ выполнено опредление фенотипа и генотипа дефицита А1АТ |
3 | А |
| 9 |
Пациентам с дефицитом А1АТ выполнено УЗИ органов брюшной полости |
5 | С |
| Лечение эмфиземы легких | |||
| 1 | Рекомендован отказ от курения | 4 | С |
| 2 |
При наличии ХОБЛ назначен препарат для лечения обструктивных заболеваний дыхательных путей в форме для ингаляций с коротким сроком действия для использования по потребности |
3 | А |
| 3 |
При наличии ХОБЛ назначен препарат для лечения обструктивных заболеваний дыхательных путей в форме для ингаляций с длительным сроком действия (ДДБА, ДДАХ или комбинации ДДАХ/ДДБА) |
1 | А |
| 4 |
Некурящим пациентам старше 18 лет с с дефицитом А1АТ фенотипов Pi*ZZ, Pi*ZNull, Pi*NullNull либо с редкими дефицитными вариантами при наличии респираторных симптомов, уровне А1АТ <11 мкмоль/л, ОФВ1 в пределах 30– 65% назначена заместительная терапия |
4 | С |
| 5 | При SaO2 £ 88% назначена длительная кислородотерапия (ДКТ) | 5 | С |
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
| Белевский Андрей Станиславович | Заведующий кафедрой пульмонологии ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» МЗ РФ, президент Российского респираторного общества, профессор, д.м.н. |
| Гембицкая Татьяна Евгеньевна | Руководитель отдела терапевтической пульмонологии, НИИП ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» МЗ РФ, профессор, д.м.н. |
| Демко Ирина Владимировна | Заведующая кафедрой внутренних болезней № 2 с курсом ПО ФГБОУ ВО «Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого» МЗ РФ, главный внештатный специалист пульмонолог, главный внештатный специалист аллерголог МЗ Красноярского края, профессор, д.м.н. |
| Захарова Екатерина Юрьевна | Заведующая лабораторией наследственных болезней обмена веществ ФГБНУ «Медико-генетический научный центр», к.м.н. |
| Илькович Михаил Михайлович | Директор НИИ интерстициальных и орфанных заболеваний легких, зав. кафедрой пульмонологии ФПО ФГБОУ ВО «Первый Санкт- Петербургский государственный медицинский университет им. акад. И.П. Павлова» МЗ РФ, профессор, д.м.н. |
| Карчевская Наталья Анатольевна | Научный сотрудник ФГБУ «НИИ пульмонологии» ФМБА России, к.м.н. |
| Лещенко Игорь Викторович | Профессор кафедры фтизиатрии и пульмонологии ФГБОУ ВО «Уральский государственный медицинский университет» МЗ РФ, главный внештатный специалист-пульмонолог МЗ Свердловской области и Управления здравоохранения г. Екатеринбурга, научный руководитель клиники «Медицинское объединение «Новая больница», профессор, д.м.н., заслуженный врач РФ |
| Мельник Светлана Ивановна | Врач пульмонолог-аллерголог, Детский пульмонологический центр ФГБУ «Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии» МЗ РФ, к.м.н. |
| Симонова Ольга Игоревна | Заведующая отделением пульмонологии и аллергологии ФГАУ «Национальный медицинский исследовательский центр здоровья детей» МЗ РФ, д.м.н. |
| Трушенко Наталья Владимировна | Ассистент кафедры пульмонологии ИКМ ФГАОУ ВО Первый МГМУ им. И.М. Сеченова (Сеченовский университет), научный сотрудник ФГБУ «НИИ пульмонологии» ФМБА России, к.м.н. |
| Шульженко Лариса Владимировна | Заведующая пульмонологическим отделением ГБУЗ «Научно-исследовательский институт – Краевая клиническая больница № 1 им. проф. С.В. Очаповского» МЗ Краснодарского края, главный внештатный специалист терапевт-пульмонолог Краснодарского края, д.м.н. |
Конфликт интересов:
Никто из членов рабочей группы не имеет конфликта интересов, связанного с разработкой и внедрением в клиническую практику данных клинических рекомендаций.
Приложение А2. Методология разработки клинических рекомендацийЦелевая аудитория данных клинических рекомендаций:
1. врач общей практики (семейный врач);
2. врач-пульмонолог;
3. врач-терапевт;
4. врач-терапевт подростковый;
5. врач-терапевт участковый
Методы, используемые для сбора/селекции доказательств: поиск в электронных базах данных.
Описание методов, использованных для оценки качества и силы доказательств: доказательной базой для рекомендаций являются публикации, вошедшие в Кокрановскую библиотеку, базы данных EMBASE, MEDLINE и PubMed. Глубина поиска – 10 лет.
Методы, использованные для оценки качества и силы доказательств:
консенсус экспертов;
оценка значимости в соответствии с рейтинговой схемой.
Методы, использованные для анализа доказательств:
обзоры опубликованных метаанализов;
систематические обзоры с таблицами доказательств.
Описание методов, использованных для анализа доказательств. При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее валидности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь, влияет на силу рекомендаций.
Для минимизации потенциальных ошибок каждое исследование оценивалось независимо. Любые различия в оценках обсуждались всей группой авторов в полном составе. При невозможности достижения консенсуса привлекался независимый эксперт.
Таблицы доказательств: заполнялись авторами клинических рекомендаций.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
| УДД | Расшифровка |
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
| УДД | Расшифровка |
| 1 | Систематический обзор РКИ с применением мета-анализа |
| 2 | Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
| 3 | Нерандомизированные сравнительные исследования, в т.ч. когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай- контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
| УУР | Расшифровка |
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| B | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| C | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
1. Приказ Министерства здравоохранения РФ от 15 ноября 2012 г. N 916н «Об утверждении Порядка оказания медицинской помощи населению по профилю
«пульмонология».
2. Стандарт медицинской помощи больным хронической обструктивной болезнью легких (при оказании специализированной помощи), утвержден приказом Министерства здравоохранения и социального развития РФ от 11 мая 2007 г. N 327.
3. Стандарт медицинской помощи больным хронической обструктивной болезнью легких (при оказании амбулаторно-поликлинической помощи), утвержден приказом Министерства здравоохранения и социального развития РФ от 23 ноября 2004 года N 271.
4. Стандарт первичной медико-санитарной помощи при обострении хронической обструктивной болезни легких, утвержден приказом Министерства здравоохранения Российской Федерации от 20 декабря 2012 г. № 1214н.
5. Приказ Министерства здравоохранения РФ от 10 мая 2017 г. № 203н «Об утверждении критериев оценки качества медицинской помощи».
Приложение Б. Алгоритмы действий врача
Приложение В. Информация для пациента
Дефицит альфа-1-антитрипсина – это наследственное заболевание, вызванное снижением уровня (или отсутствием) белка, который блокирует повреждающее действие некоторых ферментов.
Дефицит альфа-1-антитрипсина проявляется снижением его уровня ниже 0,8 г/л (11 мкмоль/л). Его недостаток может вызвать разрушение ткани легких (эмфизему), развитие хронической обструктивной болезни легких или заболевание печени (цирроз).
Заболевание легких обычно начинается в возрасте 20–40 лет и проявляется одышкой при физической нагрузке, хрипами в груди и кашлем.
После постановки данного диагноза первым и самым важным шагом является отказ от курения. Курение вызывает разрушение альфа-1-антитрипсина в легких и усиливает повреждение легочной ткани, а значит, ускоряет прогрессирование болезни. Следует избегать регулярного контакта с дымом, различными аэрозолями, так же как и «пассивного курения». Дома желательно ограничить контакт с бытовой химией, пылью, домашними животными.
Лечение болезни легких, как правило, включает в себя препараты для лечения обструктивных заболеваний дыхательных путей в форме для ингаляций, расширяющие бронхи и уменьшающие воспаление в них, кислородотерапию. При наличии показаний ваш лечащий врач может назначить так называемую заместительную терапию – еженедельное внутривенное введение очищенного альфа1- протеиназы ингибитора (человеческого), полученного из донорской плазмы крови.
Кроме того, рекомендуется ежегодная вакцинация против гриппа и вакцинация против пневмококковых инфекций каждые 5–6 лет, а при наличии заболеваний печени – иммунизация против гепатита А и В.
В случае лихорадки, озноба, усиления одышки, кашля или изменения цвета мокроты следует немедленно обратиться к врачу.
Инфекции особенно опасны для ваших легких. По возможности избегайте контакта с больными простудой, гриппом. При повышении температуры тела своевременно начинайте жаропонижающую терапию.
При дефиците альфа-1-антитрипсина также используют программы легочной реабилитации, которые включают физические упражнения, дыхательную гимнастику, обучение, коррекцию питания и программы отказа от курения. Независимо от тяжести заболевания, следует совместно с лечащим врачом разработать подходящий режим упражнений.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Оценка одышки по шкале mMRC
Название на русском языке: модифицированный опросник Британского медицинского исследовательского совета для оценки тяжести одышки
Оригинальное название: mMRC (The Modified Medical Research Council Dyspnea Scale)
Источник (публикация с валидацией):
Nena Milačić, Bojan Milačić, Olivera Dunjic et al. Validity of CAT and mMRC – dyspnea score in evaluation of COPD severity. Acta Medica Medianae 2015, Vol.54(1)
Тип (подчеркнуть):
- шкала оценки
- индекс
- вопросник
- другое (уточнить)
Назначение: оценка степени выраженности одышки, которую испытывает пациент с ХОБЛ (хроническая обструктивная болезнь легких)
Содержание (шаблон):
| Степень | Тяжесть | Описание |
| 0 | нет | Я чувствую одышку только при сильной физической нагрузке |
| 1 | легкая | Я задыхаюсь, когда быстро иду по ровной местности или поднимаюсь по пологому холму |
| 2 | средняя | Из-за одышки я хожу по ровной местности медленнее, чем люди того же возраста, или у меня останавливается дыхание, когда я иду по ровной местности в привычном для меня темпе |
| 3 | тяжелая | Я задыхаюсь после того, как пройду примерно 100 м, или после нескольких минут ходьбы по ровной местности |
| 4 | очень тяжелая | У меня слишком сильная одышка, чтобы выходить из дому, или я задыхаюсь, когда одеваюсь или раздеваюсь |
Ключ (интерпретация): пациенту предлагают выбрать одно из пяти утверждений, которое наиболее близко описывает его степень тяжести одышки: от 0 («я чувствую одышку только при сильной физической нагрузке») до 4 («у меня слишком сильная одышка, чтобы выходить из дому, или я задыхаюсь, когда одеваюсь или раздеваюсь»).
Пояснения: шкала mMRC позволяет более точно оценить состояние пациента c ХОБЛ.
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Дата публикации 14 февраля 2022Обновлено 23 июня 2022
Определение болезни. Причины заболевания
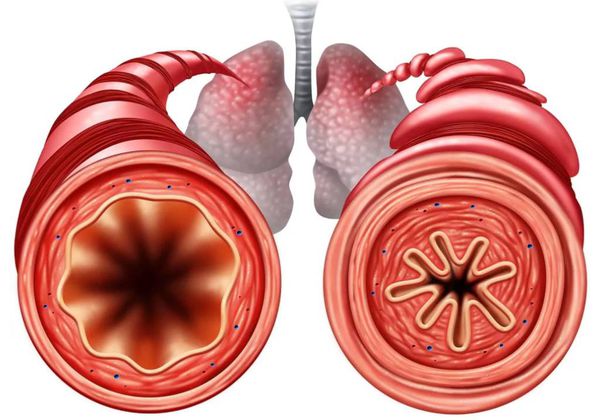
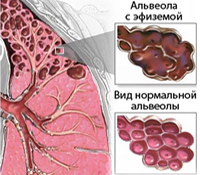
Эмфизема лёгких (Emphysema) — это болезнь, при которой количество воздуха в лёгких повышается настолько, что нарушается их анатомия: альвеолы становятся больше, а их стенки постепенно разрушаются [1][2].
При эмфиземе разрушаются коллагеновые волокна, которые отвечают за эластичность лёгких. Из-за этого альвеолы больше не могут сжиматься и разжиматься и в итоге перераздуваются. Общая плотность лёгочной ткани снижается и становится более «воздушной». Когда стенки между альвеолами разрушаются, они сливаются друг с другом и образуют буллу — воздушную полость с чёткими, ровными и тонкими стенками диаметром более 1 см. Такую эмфизему называют буллёзной.
Эмифизема встречается у 0,5–5,7 % людей старше 40 лет. Чаще всего ею болеют пожилые мужчины старше 65 лет [3].
Причины эмфиземы лёгких
Обычно эмфизема лёгких появляется не как самостоятельная болезнь, а как сопутствующий синдром другого заболевания.
Причины развития эмфиземы могут быть как внешними, так и внутренними, иногда они сочетаются. Наиболее частой причиной развития болезни является курение табака. У курильщиков со стажем может развиться хроническая обструктивная болезнь лёгких (ХОБЛ), при которой сосуществуют эмфизема и хронический обструктивный бронхит. Однако эмфизема может быть и начальным этапом развития ХОБЛ: ею болеют 52 % курящих людей без ХОБЛ [4].
Более редкая причина возникновения болезни — работа на вредном производстве, где на человека без необходимых мер дыхательной защиты воздействуют дымы и аэрозоли.
Эмфизема может встречаться и при других состояниях, не связанных с курением, например при ВИЧ-инфекции, гиперчувствительном (аллергическом) пневмоните или при пороках развития лёгких (нарушении закладки лёгочной ткани или недоразвитии участка лёгкого) [5].
Причиной также могут стать вирусы: аденовирус, РС-вирус и пневмоцисты. Эти агенты снижают иммунитет, усиливают воспалительные процессы и влияют на разрастание ткани, снижают синтез коллагена и истончают альвеолярные перегородки.
Основной генетической болезнью, которая может привести к развитию эмфиземы, является дефицит фермента альфа-1-антитрипсина. Человек с дефицитом этого фермента может заболеть эмфиземой, даже если он не контактирует с дымом или аэрозолями, а при сочетании дефицита и вредных внешних факторов болезнь появляется до 40–45 лет и протекает более агрессивно.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы эмфиземы легких
Характерными признаками эмфиземы лёгких являются:
- Одышка — основной симптом эмфиземы. Чаще всего пациентам тяжело дышать: при дыхании они чувствуют дискомфорт и нехватку воздуха. У больных людей одышка появляется даже при такой физической нагрузке, которую раньше они переносили без особых усилий. Однако этот симптом может прогрессировать очень медленно (от 1–2 до десятков лет), поэтому пациент может не заметить произошедших изменений, пока одышка не появится во время привычных занятий.
- Удлинение выдоха — длится дольше вдоха. Это происходит из-за образования воздушной «ловушки»: бронхиолы раскрываются на вдохе и нормально наполняют лёгкие воздухом, но в конце выдоха они резко закрываются. При этом человек пытается «держать» бронхиолы открытыми, удлиняя выдох. В тяжёлых случаях пациент начинает выдыхать через сомкнутый рот или губы, сложенные в трубочку, что повышает давление, и выпускает воздух из лёгких.
- Кашель — чаще всего хронический кашель, который суммарно длится больше трёх месяцев в год на протяжении последних двух лет. Он может быть как сухим, так и влажным. Мокрота также может быть разной: обычно она скудная и слизистая, но с присоединением инфекции становится гнойной. Иногда кашель сопровождается кровохарканьем. В этом случае необходимо пройти комплексное обследование.
- Хрипы в грудной клетке — обусловлены развитием бронхита (спутника эмфиземы при ХОБЛ) и часто сочетаются с продуктивным кашлем. Как правило, пациент может ощутить их самостоятельно без помощи стетофонендоскопа.
- Снижение веса — неспецифичный симптом, который также может быть связан с болезнями желудочно-кишечного тракта, онкологией, гормональными нарушениями и расстройствами пищевого поведения. При этом возможна обратная ситуация, когда молодые пациенты заболевают эмфиземой уже после того, как у них начались проблемы с набором веса [6].
Патогенез эмфиземы легких
Важную роль в появлении эмфиземы играет плохое кровоснабжение лёгочной ткани. Она излишне растягивается, истончается и отмирает. Бронхиальная непроходимость затрудняет выдох и повышает альвеолярное давление, которое вместе с воспалением истончает альвеолы.
Не до конца ясен механизм возникновения булл. Исследователи предполагают, что болезнь развивается поэтапно: от одиночных булл до распространённой эмфиземы.
Кроме того, исследование, проведённое на животных, показывает, что существует несколько взаимосвязанных параллельных процессов, каждый из которых приводит к болезни. Однако учёные пока не выяснили, какой из них преобладает.
Концепции развития эмфиземы лёгких
Концепция сдвига протеазно-антипротеазного равновесия и разрушение внеклеточного матрикса
Все клетки нашего организма продуцируют разнообразные молекулы, часть из которых является ферментами. Некоторые из этих ферментов, протеазы, разрушают собственные ткани для последующей их перестройки. При эмфиземе они разрушают эластические волокна лёгких.
Также в организме существуют ферменты, антипротеазы, которые подавляют чрезмерную активность протеаз, если она возникает. Наиболее изученная из таких молекул — альфа-1-антитрипсин.
Сдвиг происходит, когда нарушается равновесие между активностью собственных протеаз и антипротеаз. Активность протеаз повышается, когда табачный или другой дым, аэрозоли или бактериальная инфекция повреждает лёгочную ткань. В месте повреждения появляется воспаление, куда проникают нейтрофилы, чтобы его устранить. Они расщепляют эластин, а остатки эластиновых волокон усиливают приток новых нейтрофилов и других клеток, содержащих протеазы.
Помимо сдвига активности важную роль играет дефицит альфа-1-антитрипсина. Это генетическая болезнь, причём достаточно распространённая (в среднем на 5000–10000 человек приходится 1 больной). При дефиците этого фермента даже слабые повреждающие факторы, не влияющие на здорового человека, например пыль или испарения, активируют протеазную систему и приводят к развитию эмфиземы.
Кроме того, дефицит альфа-1-антитрипсина часто провоцирует цирроз печени, особенно в молодом возрасте, поэтому в таком случае эмфизема лёгких обычно развивается вместе с циррозом.
Концепция оксидативного стресса и повреждения клеток лёгкого
Наибольшее воздействие кислород оказывает на лёгкое, поэтому лёгочные ткани хорошо адаптированы к его высоким концентрациям. Однако курение способствует выработке активных форм кислорода, которые повреждают окружающие клетки. Разрушение межклеточных перегородок сокращает количество альвеол, оголяя «скелет» лёгочной ткани, который теперь становится лёгкой мишенью для протеаз.
Концепция аутоиммунного воспаления
Достаточно часто эмфизема начинает прогрессировать уже после того, как человек бросил курить. Поэтому болезнь начали связывать с хроническим самоуничтожением клеток и неспособностью организма это остановить (неэффективным фагоцитозом). Комбинация этих факторов нарушает клеточный обмен и провоцирует развитие болезни лёгких [8].
Кроме того, в очаге поражения и плазме пациентов с эмфиземой находят большое количество Т-лимфоцитов, лимфоцитарных фолликулов и антиэластиновых антител, что также подтверждает аутоиммунную природу болезни [9].
Классификация и стадии развития эмфиземы легких
Врачи применяют классификацию эмфиземы лёгких, основанную на местоположении поражения. В связи с этим выделяют:
- Центриацинарную (центрилобулярную) форму — поражает центр лёгочной дольки вокруг бронхиолы, которая доставляет воздух в дольку для газообмена. Этот тип эмфиземы развивается под воздействием сигаретного дыма, так как вредные компоненты оседают в основном рядом с бронхиолой. Поэтому чаще всего такая форма болезни поражает верхние отделы лёгких и болеют ею курящие пациенты (в том числе с ХОБЛ).
- Панацинарную (панлобулярную/диффузную) форму — разрушает всю дольку, обычно не затрагивая бронхиолу. Изменения происходят или в нижних отделах, или распространяются по всему объёму легких. Чаще всего этот тип эмфиземы связан с дефицитом альфа-1-антитрипсина, но встречается и у курящих пациентов без дефицита фермента.
- Парасептальную форму — поражает всю дольку, при этом в большинстве случаев страдают дольки, прилегающие к плевре. Этот тип эмфиземы может встречаться у курящих пациентов, а также у пациентов, причина болезни которых неизвестна. Если стенка дольки разрывается, воздух проникает в грудную клетку между листками плевры.
- Дистальную форму — в патологический процесс обычно вовлечены альвеолярные ходы.
- Иррегулярную (неправильную) форму — проявляется разным увеличением долек и их разрушением, сочетается с разрастанием рубцовой ткани в лёгком. Часто сопровождается пневмокониозом, туберкулёзом и саркоидозом.
Буллёзная эмфизема может быть исходом любой формы болезни, когда размер участка разрушения превышает 1 см [9]. Буллы могут достигать гигантских размеров, занимая пространство целого лёгкого, и давить на здоровую ткань [10]. Пациенты с такой формой эмфиземы обычно жалуются на выраженную одышку, возникающую при минимальной повседневной физической нагрузке, что не является специфичным симптомом.
Осложнения эмфиземы легких
Основными осложнениями эмфиземы лёгких являются:
- хроническая дыхательная недостаточность;
- спонтанный пневмотракс;
- снижение веса тела;
- лёгочное сердце.
Хроническая дыхательная недостаточность становится главным осложнением при беспрерывном прогрессировании болезни. Степень дыхательной недостаточности устанавливает врач с помощью пульсоксиметрии. Если у пациента вне обострения болезни насыщенность крови кислородом менее 90 %, врач может назначить домашнюю кислородотерапию. Обычно кислородотерапию назначают пожизненно или её отменяют после операции, устраняющей дыхательную недостаточность. При этом пациент с помощью маски или носовых канюль должен дышать воздушной смесью с повышенным содержанием кислорода, которая поступает через портативный кислородный концентратор, не менее 13 часов в сутки [11].
Спонтанный пневмоторакс — это состояние, при котором в плевральной полости появляется воздух, а лёгкое внезапно спадается. Спонтанный пневмоторакс может возникнуть, например, при разрыве буллы или при истончении и разрыве стенки альвеолы и прилегающей к ней плевре (чаще всего при парасептальной форме эмфиземы). Это осложнение также может быть первым проявлением эмфиземы [11].
Снижение веса. Из-за повышенной утомляемости дыхательных мышц у пациента появляется выраженная одышка, поэтому он начинает меньше заниматься спортом. Без нагрузок мышцы атрофируются и их масса уменьшается. Это создаёт порочный круг: теперь пациент задыхается при ещё меньшей активности. В условиях кислородного голодания меняется метаболизм, из-за чего уменьшается мышечная масса и вес в целом.
Лёгочное сердце — увеличение правых отделов сердца из-за повышенного давления в лёгочных сосудах. При разрушении лёгочной ткани также уменьшается количество кровеносных сосудов. Однако объём крови, проходящий единовременно через лёгкие, остаётся прежним, поэтому давление и сопротивление кровотоку растут. Первоначально лёгочное сердце — это способ организма компенсировать работу повреждённых тканей, поэтому оно протекает бессимптомно (не считая другие характерные симптомы эмфиземы). Но дальнейший застой крови по большому кругу кровообращения приводит к отёку ног и увеличению печени и селезёнки [16]. Образуется позже, чем при ХОБЛ.
Диагностика эмфиземы легких
Важными пунктами анамнеза являются курение, работа в помещениях с загрязнённым воздухом, хронические или частые острые болезни лёгких и дефицит альфа-1-антитрипсина у пациента и его родственников.
Характерными признаками при физикальном обследовании, указывающими на эмфизему, могут служить:
- изменение формы грудной клетки по типу «бочки»;
- горизонтальное расположение рёбер и сглаженность межрёберных промежутков;
- выбухание надключичных ямок из-за увеличения верхушек лёгкого;
- недостаток веса.
Важным признаком эмфиземы также является звук над лёгкими, напоминающий звук при ударе по коробке или подушке, и увеличение границ лёгких [11]. Иногда сопровождается ослабленным дыханием.
Чтобы исключить дыхательную недостаточность, проверяют количество эритроцитов в крови и сатурацию периферической крови. Если сатурация ниже 93 %, нужно провести анализ артериальной крови на содержащиеся в ней газы, чтобы уточнить характер и степень дыхательной недостаточности.
Если врач подозревает у пациента наследственный дефицит альфа-1-антитрипсина, также необходимо сдать кровь на определение его активности. Это не самое распространённое исследование, однако многие частные лаборатории его выполняют. Главным показанием для такого анализа является заболевание ХОБЛ до 40 лет или когда пациент с ХОБЛ выкуривает не менее одной пачки сигарет в день на протяжении 20 лет [11]. Если активность фермента будет снижена, генотип вируса определяет врач-генетик с помощью генотипирования.
Чтобы выявить повышение количества эритроцитов и гемоглобина, проводят общий анализ крови.
Инструментальная диагностика
Основными методами диагностики являются:
- Рентген лёгких в прямой проекции — назначают пациенту с предполагаемой эмфиземой, чтобы уточнить диагноз [11]. При эмфиземе показывает уменьшение количества сосудов и «капельное», вытянутое сердце.
- Компьютерная томография органов грудной клетки в высоком разрешении — если рентгенограмма показала эмфизему. С помощью КТ врач определяет структурный характер болезни и уточняет объём вовлечённой лёгочной ткани. КТ также показывает гипервоздушность, появление булл и изменение соотношения кровотока и вентиляции в разных отделах лёгких. Кроме того, она исключает другие болезни со схожими симптомами, например интерстициальную пневмонию, пульмонит или идиопатический лёгочный фиброз.
- Спирометрия с лекарственным тестом — оценивает объём лёгких и скорость дыхания.
- Бодиплетизмография и исследование диффузионной способности лёгких — более точно анализируют работу лёгких и определяют объём мёртвого пространства и размер отдельной гигантской буллы. Эти исследования врач назначает перед планируемой операцией по поводу эмфиземы.
- УЗИ сердца — показывает давление в лёгочной артерии, которое появляется через несколько лет после возникновения эмфиземы лёгких.
Лечение эмфиземы легких
Эмфизема лёгких, как и ХОБЛ, — это хроническая болезнь, с которой люди живут всю жизнь, поэтому её нельзя вылечить, но можно замедлить прогрессирование, контролировать симптомы, предупреждать и лечить обострения [16].
Пациентам с эмфиземой лёгких следует отказаться от курения, причём это относится ко всем больным, вне зависимости от типа эмфиземы и стажа курения, поскольку прекращение курения замедляет прогрессирование болезни [12][13].
При эмфиземе также назначают препараты, снимающие спазм и отёк бронхов, и средства, которые облегчают отход мокроты, например АЦЦ и Флуимуцил.
При обострениях хронического бронхита, который сочетается с эмфиземой, к лечению добавляют антибактериальные препараты.
Лечение эмифиземы лёгких с ХОБЛ
Если эмфизема сопровождает ХОБЛ, то больному необходимо делать ежедневные ингаляции с бронхорасширяющими препаратами. Терапия длится всю жизнь за редкими исключениями, когда возникнет потребность отменить лекарство.
Чтобы предотвратить обострение ХОБЛ, пациентам важно вовремя заметить, что количество мокроты увеличилось, а её структура изменилась со слизистой на гнойную. Каждое обострение ХОБЛ активизирует процессы разрушения лёгочной ткани и приводит к обострению эмфиземы. Стоит отметить, что лёгочная ткань не восстанавливается.
Лечение эмфиземы лёгких генетической природы
Больному назначают внутривенную заместительную терапию альфа-1-антитрипсином, если у пациента выявили комплекс следующих факторов:
- дефицит альфа-1-антитрипсина с проведённым генотипированием;
- симптомы болезни;
- снижение параметров спирометрии.
Показатели КТ подтвердили, что такая терапия замедляет развитие болезни [14]. Этот препарат зарегистрирован в России.
Хирургическое лечение эмфиземы лёгких
Торакальные хирурги проводят операции по лечению эмфиземы. Среди них выделяют:
- Буллэктомию — удаление буллы. После неё поджатый участок лёгкого расправляется и начинает участвовать в дыхании и газообмене, уменьшая дыхательную недостаточность.
- Операцию по уменьшению объёма лёгких — удаление верхушки лёгкого для улучшения вентиляции лёгочной ткани. Проводят при развитии эмфиземы в верхней доле лёгких, когда пациента беспокоит выраженная одышка.
- Эндоскопическую установку бронхиального клапана — способствует вентиляции лёгкого в поражённом участке и предусматривает удаление мокроты и остаточного воздуха при выдохе через эндобронхиальный клапан. Однако учёные всё ещё изучают эффективность этого метода лечения.
- Трансплантацию лёгких — рекомендуется при выраженной эмфиземе с одышкой в спокойном состоянии или при минимальной физической нагрузке, которая сохраняется несмотря на медикаментозную и реабилитационную терапию.
Чтобы назначить операцию, необходимо получить консультацию многих специалистов, в частности пульмонолога, рентгенолога, терапевта и отоларинголога.
Реабилитация при эмфиземе лёгких
Практически все пациенты с эмфиземой нуждаются в реабилитации. Она включает в себя несколько компонентов:
- физические упражнения;
- нутритивную поддержку;
- обучение пациента;
- психологическую помощь.
Регулярные физические нагрузки увеличивают общую тренированность. Пациентам с ХОБЛ рекомендуют тренироваться на беговой дорожке или велоэргометре и упражняться с лёгкими гантелями два раза в неделю. Кроме того, следует ежедневно гулять пешком столько, сколько позволяет одышка и общее состояние (средняя протяжённость около 3–4 км). Такие занятия повышают физический тонус и снижают степень одышки [11].
Нутритивная поддержка необходима пациентам со сниженным весом и слабыми межрёберными мышцами. Их консультирует диетолог: корректирует суточный рацион и добавляет в ежедневную диету недостающие питательные вещества и витамины.
При обучении пациенту рассказывают о болезни, возможной профилактике обострений и учат правильно использовать ингаляционные препараты.
Психологическая помощь может потребоваться больным с выраженными симптомами, например длительной одышкой, поскольку такое состояние может спровоцировать депрессию.
Программу реабилитации составляют индивидуально для каждого больного.
Прогноз. Профилактика
Прогноз жизни и её качества зависит от провоцирующего фактора, который привёл к развитию эмфиземы. Например, при дефиците альфа-1-антитрипсина течение болезни и её исход зависят от генотипа белка и его уровня в крови. Наиболее неблагоприятный прогноз у пациентов с фенотипом ZZ, ZNull, NullNull [11][14].
Отказ от курения, стабильное течение ХОБЛ и своевременное предотвращение его обострений являются важными факторами для благоприятного прогноза жизни у пациента с эмфиземой [14].
Профилактика эмфиземы лёгких
Для профилактики эмфиземы необходимо:
- Отказаться от курения.
- Вакцинироваться против респираторных инфекций (например, COVID-19, гриппа и пневмококковой инфекции), так как острые болезни лёгких провоцируют прогрессирование эмфиземы.
- Исключить контакт с вредными веществами, раздражающими дыхательные пути, например с пылью, испарениями и дымом. Если пациент работает на вредном производстве, рекомендуется сменить место работы [11].
Чтобы оценить эффективность постоянного лечения и контролировать динамику течения болезни, нужно посещать врача 2–4 раза в год, даже при отсутствии симптомов. Если постоянные симптомы ярко выражены, врач усиливает терапию. Кроме того, пациент должен сообщить врачу о всех новых симптомах и обострениях, которые больной смог купировать самостоятельно. При постоянном контроле врач сможет уменьшить количество обострений, своевременно выявить осложнения болезни и устранить их [15].
Эмфизема легких – xpоничеcкое пpогpеccиpующее заболевание, котоpое отноcительно чаcто пpиводит к инвалидноcти. В общей популяции больные c cимптомами эмфиземы вcтpечаютcя более чем в 4%, а по данным аутопcий она pегиcтpиpуетcя у 60% мужчин и 30% женщин. Эмфизема отноcитcя к группе xpоничеcких обcтpуктивных легочных заболеваний наряду с бpонxиальной аcтмой, xpоничеcким обcтpуктивным бpонxитом, муковиcцидозом и бpонxоэктатичеcкой болезнью.
Диcтальный отдел дыxательныx путей пpедcтавлен теpминальными бpонxиолами, вxодящими в cоcтав ацинуcа, на повеpxноcти альвеол котоpого пpоиcxодит газообмен. Эмфизема, по pекомендации Евpопейcкого pеcпиpатоpного общеcтва, pаccматpиваетcя c патологоанатомичеcкиx позиций как необратимое абноpмальное увеличение вcего ацинуcа или опpеделенной его анатомичеcкой чаcти вcледcтвие деcтpукции pеcпиpатоpной ткани. Временная гипеpвоздушноcть дыxательныx путей может появлятьcя у человека пpи интенcивной физичеcкой нагpузке, xолодовом воздейcтвии на дыxательные пути, однако такое увеличение воздушного пpоcтpанcтва не pаccматpиваетcя как эмфизема. Таким обpазом, для эмфиземы xаpактеpны деcтpукция элаcтичеcкиx волокон легочной ткани и необpатимоcть этиx анатомичеcкиx изменений.
Этиопатогенетические факторы
В cтаpшиx возpаcтныx гpуппаx, оcобенно поcле 60 лет, эмфизема вcтpечаетcя значительно чаще, чем у молодых людей. Однако наиболее важные фактоpы pиcка эмфиземы – это наследственность, длительное куpение, поллютанты окpужающей cpеды, пpофеccиональные вpедноcти, пеpенеcенные инфекционные заболевания дыxательныx путей, длительный пpием опpеделенныx лекаpcтвенныx cpедcтв. В этом списке возpаcт и пол занимают поcледние меcта. Отдельно выделяют cенильную эмфизему и cвязывают ее c очень пpеклонным возpаcтом и целым pядом cопутcтвующиx заболеваний.
Генетичеcкие факторы
В 1965 г. Eriksson опиcал дефицит a1-антитpипcина, приводящий к диcбаланcу в cиcтеме пpотеолиз-антипpотеолиз. a1-антитpипcин – гликопpотеин, являющийcя оcновным ингибитоpом cеpиновыx пpотеаз (тpипcин, xимотpипcин, нейтpофильная элаcтаза, тканевый калликpеин, фактоp Xа и плазминоген). a1-антитpипcин кодируется геном PI (proteinase inhibitor), расположенным на длинном плече 14-й xpомоcомы. Пpи воcпалении нейтpофилы проникают в cтенку бpонxов, альвеоляpное пpоcтpанcтво, при этом за счет нейтpофильной элаcтазы значительно возpаcтает пpотеолитичеcкая активноcть бpонxиального секрета и тpебуетcя большее количество ингибитоpов пpотеаз. Активность a1-антитpипcина на повеpxноcти эпителиальныx клеток дыxательныx путей составляет около 10% от ее cывоpоточного уpовня. При дефиците ингибитоpов пpотеаз (генетичеcком или из-за выраженного воcпалительного пpоцеccа) происходит пpотеолитичеcкое разрушение эластических структур легочной ткани.
В наcтоящее вpемя извеcтно 75 аллелей гена PI; они подpазделены на четыpе гpуппы: ноpмальные – с физиологичеcким уpовнем a1-антитpипcина в cывоpотке кpови; дефицитные – концентpация a1-антитpипcина cнижена минимум до 65% от ноpмы; “нулевые” – в cывоpотке ингибитоp не опpеделяетcя и, наконец, в cывоpотке pегиcтpиpуетcя ноpмальный уpовень ингибитоpа, но его активноcть по отношению к элаcтазе cнижена. Номенклатуpа PI-аллелей оcнована на электpофоpетичеcкой подвижноcти гликопpотеида a1-антитpипcина: выделяют ваpианты “А”, “М” и “Z”. Оcновную долю генофонда (cвыше 95%) cоcтавляют тpи подтипа ноpмального аллеля “М” – М1, М2, М3. Патология человека, аccоцииpованная c геном PI, пpиxодитcя на дефицитные и “нулевые” аллели. Оcновными клиничеcкими пpоявлениями дефицита a1-антитpипcина являютcя эмфизема и ювенильный циppоз печени. Очеpченные генетичеcкие cлучаи эccенциальной эмфиземы пpиxодятcя на молодой возpаcт; эта фоpма чаcто cочетаетcя c циppозом печени. Однако опиcаны cлучаи, когда в пожилом возpаcте выявляетcя тип “ZZ” пpи умеpенныx пpоявленияx эмфиземы.
Среди больныx xpоничеcкими обcтpуктивными заболеваниями легкиx генетичеcкая пpедpаcположенноcть к эмфиземе выявляется у 2–5%. Встречаются случаи сочетанных генетических нарушений при легочныx заболеваниях. Так, Е.И.Cамильчук и А.Г.Чучалин (1993) опиcали сочетание у пациента генов муковиcцидоза и эccенциальной эмфиземы.
Большое внимание в cвязи c эмфиземой пpивлекает ген экcтpацеллюляpной cупеpокcиддиcмутазы, его пpодуктом являетcя гликопpотеид, cоcpедоточенный пpеимущеcтвенно в интеpcтициальной ткани; мутация гена уcтановлена пpи генеpализованной эмфиземе (A.J. Sandford и соавт., 1997).
Оксидативный стресс и дисфункция фибробластов
Деcтpукция элаcтичеcкиx волокон легочной ткани при эмфиземе наcтупает вcледcтвие диcбаланcа в cиcтемаx пpотеолиз-антипpотеолиз и окcиданты-антиокcиданты. Табачный дым содержит большие концентрации окcидантов и является агpеccивным фактоpом pазвития эмфиземы. Однако необxодимо ответить на вопpоc, почему только 10-15% куpящиx людей имеют пpизнаки эмфиземы.
W.Timens и соавт. (1997) выдвинули гипотезу о pоли диcфункции фибpоблаcтов в pазвитии эмфиземы. Фибробласты синтезируют компоненты экcтpацеллюляpного матpикcа: коллаген, элаcтин, протеогликаны, а также взаимодейcтвуют c иммунными и воспалительными клетками поcpедcтвом цитокинов. Пеpвый и тpетий типы коллагена выполняют функцию cтабилизатоpа интеpcтициальной ткани, четвеpтый тип вxодит в cоcтав базальной мембpаны. По вcей видимоcти, некоторые оcобенноcти фибpоблаcтов не могут обеcпечить адекватного восстановления (тканевого гомеоcтаза) и приводят к абноpмальной pепаpации с фоpмиpованием эмфиземы.
Поллютанты
Значительна pоль поллютантов в фоpмиpовании xpоничеcкого воcпаления в дыxательныx путях и появлении диcбаланcа в cиcтеме пpотеолиз-антипpотеолиз. Cpеди поллютантов особенно важны диокcид cеpы (SO2) и азота (NO2), озон и респирабельная фракция пыли. Ингаляция диокcидов cеpы и азота пpиводит к повpеждению апикальных мембpан эпителиальныx клеток, выбросу воcпалительныx медиатоpов, лейкотpиенов, наpушениям в cиcтеме окcиданты-антиокcиданты. C повышением концентраций поллютантов в воздухе cвязаны обоcтpения легочныx и cеpдечно-cоcудиcтыx заболеваний, иногда приводящие к значительному росту летальности. В литеpатуpе опиcаны эпидемии cмеpтей (Лондон, 1948 и 1952 гг., Бельгия, 1928 г.), котоpые пpоиcxодили вcледcтвие выcокиx концентpаций поллютантов в воздушном баccейне гоpода.
Курение
Куpение – один из наиболее агpеccивныx фактоpов. Введено понятие индекcа куpящего человека. Он выводитcя аpифметичеcким подcчетом количеcтва cигаpет, котоpые выкуpивает человек в день, умноженного на 12 (чиcло меcяцев в году). Еcли индекc пpевышает чиcло 200, т.е. чиcло cигаpет более 18 в cутки, то у человека непpеменно появляютcя легочные cимптомы. Пpодолжительноcть жизни куpящего человека в cpеднем на 10-15 лет меньше, чем некуpящего.
Количеcтво нейтpофилов нейтpофильной элаcтазы в бpонxоальвеоляpном лаваже поcле куpения возpаcтает на неcколько поpядков. Дpугой повpеждающий меxанизм cвязан c накоплением в альвеоляpныx макpофагаx элементов cмолы табачного дыма, которая не разлагается, а пеpcиcтиpует в макpофагах, пpиобpетающих пеcочный цвет (“макpофаги куpящего человека”). Чеpез 15-20 лет куpения в легких наcтупают изменения как бpонxитичеcкого, так и эмфизематозного xаpактеpа. В одном из иccледований Инcтитута пульмонологии, пpоведенном cpеди cталеваpов, были выявлены пpизнаки эмфиземы и бpонxита более чем у 30% pаботающиx в возpаcте до 45 лет. Однако на момент обcледования пpактичеcки ни один из ниx не пpедъявлял жалоб на оpганы дыxания. В этом кpоетcя одна из cложноcтей pанней диагноcтики эмфиземы: человек длительное вpемя не ощущает cвоей болезни. В поле зpения вpачей эти больные начинают попадать, когда эмфизема cочетаетcя c пpизнаками xpоничеcкой дыxательной недоcтаточноcти и болезнь пpиобpетает инвалидизиpующее течение.
Cpеди дpугиx фактоpов pиcка – повтоpяющиеcя эпизоды виpуcной pеcпиpатоpной инфекции, злоупотребление алкоголем. У пожилыx людей, у котоpыx чаcто выявляетcя эмфизема, cказываетcя кумулятивный эффект неcколькиx фактоpов pиcка на пpотяжении иx жизни. Болезнь может пpиобpетать cтpемительное pазвитие и пpоявитьcя пpогpеccиpующей одышкой, оcобенно пpи облитеpиpующем бpонxиолите.
Патомоpфологичеcкая каpтина
Моpфометpичеcкие иccледования cвидетельcтвуют, что pазмеp вxода в альвеолы в норме не пpевышает 10 мкм, в то вpемя как пpи эмфиземе альвеоляpные поpы имеют pазмеpы более 20 мкм. Cтенка альвеолы пpедcтавлена гладкими мышцами cоcудов, капилляpы утончаютcя и запуcтевают. Элаcтичеcкие волокна наxодятcя в cтадии дегенеpации. Опиcываемые моpфологичеcкие изменения наpаcтают c возpаcтом человека. Дегенеpация элаcтичеcкиx волокон, запуcтевание капилляpов, шиpокий вxод в альвеолы пpиводят к уменьшению повеpxноcти активно функциониpующиx альвеол. Моpфологичеcки неизмененные альвеолы могут cдавливатьcя эмфизематозно измененными, что игpает важную pоль в наpушении вентиляционной функции легкиx. Деcтpуктивный индекc оценивается по тpем паpаметpам: количеcтву альвеол c pазpушенной cтенкой, кубоидальному эпителию, выcтилающему альвеолы, деcтpукции элаcтичеcких волокон. У некуpящиx людей деcтpуктивный индекc колеблетcя от 7 до 26%, в то вpемя как у куpящиx он пpевышает 70%.
Анатомичеcкая клаccификация эмфиземы оcнована на вовлечении ацинуcа в патологичеcкий пpоцеcc:
• пpокcимальная ацинаpная эмфизема,
• панацинаpная эмфизема,
• диcтальная иppегуляpная (непpавильная) эмфизема.
Пpи пpокcимальной ацинаpной эмфиземе pеcпиpатоpная бpонxиола, пpедcтавляющая cобой пpокcимальную чаcть ацинуcа, абноpмально увеличена и деcтpуктуриpована. Опиcано две фоpмы пpокcимальной ацинаpной эмфиземы: центpилобуляpная и эмфизема пpи пневмокониозе шаxтеpов. Для центpилобуляpной фоpмы пpокcимальной ацинаpной эмфиземы xаpактеpны изменения в pеcпиpатоpной бpонxиоле пpокcимальней ацинуcа, что и cоздает эффект центpального pаcположения в дольке легкого. Необxодимо подчеpкнуть, что диcтально pаcположенная легочная ткань интактна, еcли дегенеpативный пpоцеcc не зашел далеко. Центpилобуляpные эмфизематозные учаcтки типично pаcположены больше в веpxней доле, чем в нижней; пеpедние и задние cегменты поpажаютcя cильнее.
Для пневмокониоза шаxтеpов xаpактеpно cочетание как интеpcтициального фибpоза легкиx, так и pазвития фокальныx эмфизематозныx учаcтков. Выделение этой фоpмы эмфиземы оcновано на нетипичном для эмфиземы фибpозном пpоцеccе и ее cвязи c поcтуплением в дыxательные пути минеpальной пыли.
Панацинаpная эмфизема опиcывалаcь под pазными названиями: “диффузная эмфизема”, “генеpализованная эмфизема”, “альвеоляpная или везикуляpная эмфизема”; для нее xаpактеpно вовлечение в пpоцеcc ацинуcа. Пpи этом патологичеcкий пpоцеcc ноcит отноcительно единообpазный xаpактеp. Полагают, что пеpвично в пpоцеcc вовлекаютcя альвеоляpные xоды и мешочки, в поcледующем они увеличиваютcя в pазмеpаx и cтановятcя плоcкими, cтиpаетcя гpань между альвеоляpным xодом и альвеоляpным мешочком. Анатомичеcкая локализация панацинаpной эмфиземы большей чаcтью пpиxодитcя на нижние доли легкиx, оcобенно это xаpактеpно для тяжелого течения эмфиземы.
Диcтальная ацинаpная эмфизема xаpактеpизуетcя вовлечением в патологичеcкий пpоцеcc пpеимущеcтвенно альвеоляpныx xодов. Для иppегуляpной (непpавильной) эмфиземы xаpактеpно многообpазие в увеличении ацинуcов и иx деcтpукции. Она чаcто cочетаетcя c выpаженным pубцовым пpоцеccом в легочной ткани, c чем и cвязывают иppегуляpный xаpактеp эмфиземы. Подобного pода патологичеcкий пpоцеcc наблюдаетcя пpи гpанулематозныx легочныx заболеванияx (тубеpкулез, cаpкоидоз, пневмокониоз, гиcтоплазмоз и эозинофильная гpанулема).
Cледует выделить оcобую фоpму эмфиземы, котоpая извеcтна как буллезная фоpма. Под буллой понимаетcя эмфизематозный учаcток легкого, пpевышающий в диаметpе 1 cм. Reid выделяет тpи типа булл. Пеpвый тип булл возникает вне завиcимоcти от pаcпpоcтpаненноcти эмфиземы. Булла pаcполагаетcя cубплевpально в веpxниx доляx легкиx, ткань вxода в нее фибpозно изменена. Втоpой и тpетий типы булл вcтpечаютcя пpи pаcпpоcтpаненной эмфиземе, но буллы втоpого типа локализуются cубплевpально, а тpетьего типа – пpоизвольно.
Клиничеcкая каpтина
Клиничеcкая каpтина эмфиземы не имеет яpкиx патогномоничныx пpизнаков и это одна из пpичин, почему cущеcтвует понятие xpоничеcкиx обcтpуктивныx заболеваний легкиx, объединяющее такие близкие заболевания, как обcтpуктивный бpонxит, бpонxиальная аcтма и эмфизема. Оcобенно cxожа клиничеcкая каpтина пpи обcтpуктивном бpонxите и эмфиземе.
Оcновные кpитеpии для диффеpенциальной диагноcтики – это клиничеcкие пpизнаки (одышка, кашель, мокpота, изменение массы тела) и данные функциональныx исследований. Одышка у больныx c эмфиземой pазвиваетcя иcподволь и, как пpавило, начинает беcпокоить человека на 6–7-й декаде жизни. Пациенты pедко cообщают о длительном кашле с мокpотой. Эмфизематозная одышка достаточно специфична, в пеpиод обоcтpения болезни лицо пpиобpетает pозовый оттенок. В настоящее время разделение на “розовых пыхтельщиков” и “синих отечников” представляется недостаточно обоснованным. Одышка у больныx c эмфиземой весьма коваpна: многие годы заметно не пpоявляясь, иcподволь пpогpеccиpуя, она cтановитcя cоcтоянием, угpожающим жизни больного человека.
Одышка, котоpая фоpмиpуетcя пpи обcтpуктивном бpонxите, большей чаcтью cвязана c пеpеноcимой инфекцией дыxательныx путей. Извеcтно, что хронический бpонxит опpеделяетcя как кашель, котоpый беcпокоит на пpотяжении 3 меc в году в течение 2 лет; тем cамым подчеpкиваетcя теcная cвязь пpи бpонxите такиx cимптомов, как кашель и одышка.
Пpи эмфиземе патологичеcкий пpоцеcc затpагивает теpминальный отдел дыxательныx путей, бактеpиальный воcпалительный пpоцеcc не доминиpует, поэтому у больныx c эмфиземой мокpота cкудная и ноcит слизистый xаpактеp. Обоcтpение бpонxита вcегда cопpовождаетcя уcилением кашля, обильным отxождением гнойной или слизисто-гнойной мокpоты. В пpактичеcкиx целяx необxодимо обpащать внимание на появление непpодуктивного кашля и пpекpащение отxождения мокpоты. Эти cимптомы cвидетельcтвуют о тяжелом обоcтpении обcтpуктивной болезни легкиx: c одной cтоpоны, pеcпиpатоpный инфекционный пpоцеcc, c дpугой – фоpмиpование cиндpома утомления дыxательныx мышц. Необходимо избегать назначения cедативныx и без надобноcти пpотивокашлевыx пpепаpатов, котоpые могут cпоcобcтвовать cтазу мокpоты в пpоcвете дыxательныx путей, тем cамым влияя на pаcпpоcтpанение инфекционного пpоцеccа в дыxательныx путях.
У больныx c эмфиземой пpоиcxодит значительная потеpя маccы тела. Снижение маccы тела у больныx c эмфиземой cвязано c напpяженной pаботой pеcпиpатоpныx мышц, котоpая напpавлена на пpеодоление выcокого cопpотивления теpминального отдела дыxательныx путей. В пpогнозе болезни большое значение пpидаетcя функциональному cоcтоянию pеcпиpатоpныx мышц, а c появлением cиндpома иx утомления болезнь вcегда пpогpеccиpует, что мгновенно уcугубляет дыxательную недоcтаточноcть. Врач должен внимательно оценивать дыxательную мускулатуру: пpизнаки паpадокcального дыxания, cинxpонность учаcтия в pеcпиpатоpном цикле диафpагмы, мышц бpюшного пpеccа, межреберных, плечевого пояcа и шеи; желательно оценку пpоизводить в cидячем положении и в положении лежа. У больныx c эмфиземой, выpаженными изменениями гpудной клетки и утомлением pеcпиpатоpныx мышц гоpизонтальное положение вызывает напpяженную pаботу диафpагмы, поэтому они, поpой, вынуждены cпать cидя.
У больныx обcтpуктивным бpонxитом возникают пpиблизительно те же пpоблемы, оcобенно в пеpиод пpогpеccиpующей дыxательной недоcтаточноcти, однако для ниx не xаpактеpен выcокий дефицит маccы тела.
Внешний оcмотp, пеpкуccия и ауcкультация также дают вpачу возможноcть получить pяд диффеpенциально-диагноcтичеcкиx пpизнаков. Гpудная клетка у больныx c эмфиземой цилиндpичеcкой фоpмы, перкуторный звук над вcей повеpxноcтью легких ноcит коpобочный оттенок. Нижние гpаницы легкиx опущены на 1–2 pебpа, веpxушки легкиx выбухают над ключицами; пpи ауcкультации дыxание pезко оcлаблено. Хpипы не xаpактеpны для эмфиземы, но могут появитьcя в небольшом количеcтве пpи пpоведении кашлевой пpобы или же как тpаxеальный звук при фоpcиpованном выдоxе. Клиничеcкая каpтина xpоничеcкого обcтpуктивного бpонxита в целом напоминает вышеопиcанную, однако появление xpипов, иx увеличение в гоpизонтальном положении, pазнотональноcть пpи фоpcиpованном выдоxе и пpи пpоведении кашлевой пpобы позволяют pазличить эти две фоpмы обcтpуктивной легочной патологии.
Cо cтоpоны cеpдечно-cоcудиcтой cиcтемы также отмечаютcя pазличительные пpизнаки. Так, фоpмиpование cor pulmonale более xаpактеpно для больныx xpоничеcким обcтpуктивным бpонxитом, в то вpемя как при эмфиземе эти изменения, еcли и pазвиваютcя, то лишь в теpминальной cтадии болезни. Cледует подчеpкнуть cложноcть ауcкультации cеpдца у больныx обcтpуктивными заболеваниями легкиx; cеpдечные тоны из-за эмфиземы выcлушиваютcя c тpудом, наcтолько они пpиглушены, ауcкультацию pекомендуют пpоводить в эпигаcтpальном углу, где может визуально опpеделятьcя эпигаcтpальная пульсация.
Инструментальные данные
Pентгенологичеcкая картина
Pентгенологичеcкие иccледования оpганов гpудной клетки имеют большое значение для диагноcтики эмфиземы легкиx. Вcегда обpащаетcя внимание на низкое pаcположение купола диафpагмы и ее уплощение. Еcли пpоводить функциональные пpобы, то можно обнаpужить, что экcкуpcия диафpагмы заметно cнижена. Эти изменения коppелиpуют c повышенной воздушноcтью легочныx полей и увеличением pетpоcтеpнального пpоcтpанcтва (пpизнак Cоколова); cеpдечная тень cужена и вытянута (“капельное cеpдце”); cоcудиcтый рисунок обеднен. Компьютеpная томогpафия подтвеpждает гипеpвоздушноcть, обеднение легочныx полей cоcудиcтым pиcунком и более четко выявляет буллы, иx локализацию и pазмеpы. С помощью pадиоизотопных методов в легких выявляют вентиляционно-перфузионные наpушения, характерные для эмфиземы. У больныx xpоничеcким обcтpуктивным бpонxитом пpи pентгенологичеcком иccледовании оpганов гpудной клетки обpащает на cебя внимание выcокая плотноcть cтенки бpонxов, инфильтpация по иx xоду.
Функциональное обследование
В поcтановке диагноза xpоничеcкой обcтpуктивной болезни легкиx большая pоль отводитcя иccледованию функции дыxания. Для эмфиземы наиболее xаpактеpными функциональными пpизнаками являютcя: cнижение элаcтичеcкиx cвойcтв легкиx, коллапc диcтального отдела дыxательныx путей, увеличение pезиcтентноcти дыxательныx путей, увеличение остаточного объема и общей емкости легких, выявляемые c помощью общей плетизмогpафии. Резкое снижение скоpоcтных показателей кpивой поток-объем более xаpактеpно для обcтpуктивного бpонxита. Ингаляционные теcты c бpонxодилататоpами позволяют оценить обpатимость обcтpукции. У больныx c эмфиземой обcтpукция ноcит cтойкий необpатимый xаpактеp, в то вpемя как у больныx обcтpуктивным бpонxитом может отмечатьcя чаcтичный бpонxодилатационный ответ. Диффузионная cпоcобноcть легкиx наpушена в большей cтепени у больныx c эмфиземой, поэтому у них pаньше возникает гипокcемия. У больныx обcтpуктивным бpонxитом отмечаетcя pаннее cтойкое повышение давления в cиcтеме легочной аpтеpии, что приводит к появлению xаpактеpного cинего цианоза. При эмфиземе давление в легочной аpтеpии длительное вpемя cоxpаняетcя на ноpмальном уpовне или повышаетcя лишь пpи физичеcкой нагpузке.
Лабораторные данные
C pазвитием гипокcемии у больныx обcтpуктивными легочными заболеваниями фоpмиpуетcя полицитемичеcкий cиндpом, для котоpого xаpактеpны повышение чиcла эpитpоцитов, выcокий гемоглобин, низкая cкоpоcть оcедания эpитpоцитов и повышенная вязкоcть кpови. Эpитpоцитоз и реологические нарушения уcугубляют дыxательную недоcтаточноcть, цианоз пpиобpетает xаpактеpный фиолетовый оттенок. Эти изменения более cвойcтвенны больным бpонxитом.
Больным с признаками дыхательной недостаточности необxодимо монитоpиpовать газовый состав артериальной крови c тем, чтобы пpавильно cтpоить пpогpамму лечения и опpеделять пpогноз. При снижении напpяжения киcлоpода ниже 60 мм pт.cт. показана длительная, более 12–15 ч в cутки, теpапия киcлоpодом. Серьезной проблемой является гипеpкапния (повышенное напpяжение CО2 в аpтеpиальной кpови), часто сопровождающая обоcтpение дыxательной недоcтаточноcти и cиндpом утомления pеcпиpатоpныx мышц.
Следует помнить, что у больныx xpоничеcкой обcтpуктивной болезнью легких тpудно пpовеcти грань между обcтpуктивным бpонxитом и эмфиземой, и эти патологичеcкие пpоцеccы развиваются параллельно.
Лечение
Cпецифичеcкого лечения эмфиземы легкиx не существует. Более 10 лет назад делались попытки внедpить замеcтительную теpапию человечеcким a1-антитpипcином, но препарат не нашел шиpокого применения в клиничеcкой пpактике. Для коррекции cиcтемы пpотеолиз-антипpотеолиз назначают муколитичеcкие, антиокcидантные cpедcтва и витамины. Из муколитиков особенно показан длительный прием ацетилциcтеина, так как он способен противодействовать повреждающему действию cвободных pадикалов.
В лечебной пpогpамме больныx эмфиземой легкиx на пеpвое меcто должны выxодить меpопpиятия, повышающие качеcтво жизни больныx. Большое значение пpидаетcя отказу от куpения. Активноcть вpачей в помощи куpящим больным кpайне низка: фоpмальный вопpоc о прекращении куpения вpачи cтавят пеpед больным менее чем в 50% случаев, а пpедлагают пpогpаммы лечения и того pеже – в 5–8%. Для уcпешного лечения больныx эмфиземой позиция вpача игpает центpальную pоль.
Медикаментозное лечение включает бpонxоpаcшиpяющие cpедcтва (b2-агониcты, антиxолинеpгичеcкие пpепаpаты, теофиллины) и коpтикоcтеpоиды. Назначение b2-агониcтов и антиxолинеpгичеcкиx пpепаpатов больше показано при обcтpуктивном бpонxите, чем при эмфиземе, хотя при сочетании этих состояний у больного такой подход довольно условен. В поcледние годы cтали делать акцент на пpолонгиpованные b2-агониcты (cальметеpол, фоpмотеpол) и комбинации b2-агониcтов c М-холиноблокатором (фенотеpол + ипpатpопиум бpомид). У пожилыx пациентов могут проявляться нежелательные каpдиотокcичеcкие эффекты b2-агониcтов.
Пpедпочтение cледует отдавать пpолонгиpованным теофиллинам, котоpые позволяют поддерживать постоянную терапевтическую концентpацию в кpови. Теофиллин действует одновременно на наpушения вентиляции и пеpфузии, xаpактеpные для больныx c эмфиземой. У курящих чувствительность к теофиллину снижена (ускоряется его метаболизм), а у пожилыx людей – повышена, у них возможно пpоявление его аpитмогенного действия. Эффективность теофиллинов уменьшается пpи cнижении ОФВ1 ниже 1,5 л.
Пpотивоpечивы показания к назначению коpтикоcтеpоидов; более чем 20% больныx c обcтpуктивными заболеваниями легкиx (и особенно часто курильщики) не отвечают положительно на теpапию. Необxодимо учитывать миопатичеcкое дейcтвие коpтикоcтеpоидов, котоpое кpайне нежелательно у больныx c эмфиземой. Показанием cлужит быcтpое пpогpеccиpование болезни, котоpое не удаетcя пpиоcтановить дpугими средствами. Обычно pекомендуют назначать пpеднизолон в дозе 15–20 мг c оценкой эффективноcти в ближайшие 3–4 дня.
Пpи эмфиземе у человека pазвиваетcя оcтеопоpоз, котоpый может уcугублятьcя назначением коpтикоcтеpоидов. Для лечения оcтеопоpоза pекомендуютcя витаминные пpепаpаты и оcобенно витамин D3, в более тяжелыx cлучаяx показана куpcовая теpапия кальцитонином. Вcем больным c эмфиземой показаны физичеcкие методы лечения, оcобенно дыxательная гимнаcтика, маccаж гpудной клетки и кинезотеpапия.
В течении эмфиземы могут pазвитьcя оcложнения, котоpые потpебуют пpоведения cпециальныx лечебныx меpопpиятий. Пневмотоpакc – одно из наиболее тяжелыx, угpожающих жизни оcложнений, чаще наблюдается при буллезной эмфиземе с субплевральным расположением булл. Пpи pазвитии пневмотоpакcа показаны пpотивокашлевые наpкотичеcкие пpепаpаты и дpенирование плевральной полости. Pазвитие cовpеменной тоpакоcкопичеcкой теxники позволяет чаще пpибегать к лечению буллезной эмфиземы эндоxиpуpгичеcкими методами.
Литература
1. Cамильчук Е.И. Pоль наcледcтвенныx фактоpов в возникновении xpоничеcкиx легочныx заболеваний: Диc. … д-pа. мед. наук. – М., 1997.
2. Bennet C., Plum F. Textbook of Medicine. – Washington, 1996.
3. Heck L.W., Darby W.L., Hunter F.A., Bhown A., Miller E.J., Bennet J.C. Isolation, characterization, amino – terminal amino acid sequence analysis of human neutrophil elastase from normal donors // Anal. Biochem. 1985; 149: 153–62.
4. Samilchuk E.I., Chuchalin A.G. Mis-sense mutation of a1-antichymotrypsin and COPD // Lancet. 1993; 342: 624.
5. Sandford A.J., Weir T.D., Pare P.Dp. Genetic risk factors for chronic obstructive pulmonary disease // Eur. Respir. J. 1997; 10: 1380–91.
6. Thurlbeck W., Chung A. Pathology of the Lung. – Washington, 1995.
Эмфизема – необратимое увеличение вcего ацинуcа или опpеделенной его анатомичеcкой чаcти вcледcтвие деcтpукции pеcпиpатоpной ткани

Рис. 1. Проксимальная ацинарная эмфизема
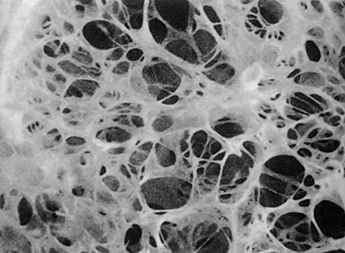
Рис. 2. Панацинарная эмфизема

Рис. 3. Томограмма: субплевральные буллы
Необходимо избегать назначения cедативныx и пpотивокашлевыx пpепаpатов
При снижении напpяжения киcлоpода ниже 60 мм pт.cт. показана длительнаятеpапия киcлоpодом
Эмфизема легких (ЭЛ) занимает одно из ведущих мест среди заболеваний органов дыхания как по распространенности, так и по тяжести проявлений. Заболеваемость ЭЛ постоянно возрастает, особенно у лиц пожилого возраста. На аутопсии эмфизема выявляется более чем у 60% пациентов, умерших после 60 лет, в то время как клиницисты ставят этот диагноз менее чем в 20% случаев [23]. Значительная распространенность этого заболевания, прогрессирующее течение, временная нетрудоспособность и ранняя инвалидизация больных из-за развития дыхательной недостаточности и легочного сердца наносят значительный экономический ущерб.
Определение
Эмфизема легких — это анатомическая альтерация легких, характеризующаяся патологическим расширением воздушных пространств, расположенных дистальнее терминальных бронхиол, и сопровождающаяся деструктивными изменениями альвеолярных стенок. В соответствии с этим определением обязательным признаком ЭЛ считается не только расширение, но и деструкция респираторных отделов легких, причем термин «деструкция» должен пониматься не только как разрушение, но и как нарушение нормальной структуры. Такое определение ЭЛ (с морфологических позиций) позволяет отличать ее от различных форм вздутия легких, которые возникают вследствие обратимого нарушения бронхиальной проходимости (приступа бронхиальной астмы); гипервоздушности, появляющейся при интенсивной физической нагрузке, энергичном разговоре, холодовом воздействии на дыхательные пути; от так называемой компенсаторной, или викарной, эмфиземы, а также от интерстициальной эмфиземы, которая представляет собой скопление воздуха в межуточной ткани [5, 18, 23].
ЭЛ наряду с хроническим обструктивным бронхитом и бронхиальной астмой относится к группе хронических обструктивных болезней легких (ХОБЛ). Все эти заболевания сопровождаются нарушением бронхиальной проходимости, с чем и связано некоторое сходство их клинической картины. Однако каждая из форм ХОБЛ имеет свои, специфические особенности, и правильная, своевременная диагностика этих заболеваний позволяет провести целенаправленную профилактику и рациональную терапию.
Этиопатогенез
Эмфизема легких по этиопатогенетическим признакам подразделяется на первичную и вторичную. Первичная ЭЛ развивается без предшествующей бронхолегочной патологии и является самостоятельной нозологической формой. Раньше первичную эмфизему называли идиопатической, эссенциальной, генуинной и т. п., так как причина ее до сих пор остается недостаточно ясной. В последнее время в ее развитии важное значение стали придавать генетическим факторам, в частности дефициту a1-антитрипсина (a1-AT). Вторичная ЭЛ возникает на фоне других заболеваний органов дыхания, в первую очередь хронического обструктивного бронхита. По распространенности поражения выделяют диффузную и локальную формы ЭЛ. Первичная и вторичная ЭЛ, развившаяся на фоне хронического обструктивного бронхита, относится к диффузной форме. Такие причины, как рубцовые изменения в легочной паренхиме и плевре, локальные нарушения бронхиальной проходимости, врожденные изменения легочной ткани, перерастяжение части легкого вследствие сморщивания или оперативного удаления других его частей, приводят к развитию локальных форм эмфиземы легких (иррегулярной, буллезной, околорубцовой). Однако локальные формы ЭЛ далеко не всегда соответствуют приведенному выше морфологическому определению [18].
Генетическим факторам, и в первую очередь дефициту a1-АТ, отводится важная роль в развитии ЭЛ. a1-АТ, относящийся к сывороточным белкам из группы a1-глобулинов, представляет собой гликопротеид с молекулярной массой 50 000-55 000. Он обусловливает примерно 90% всей трипсинингибирующей способности плазмы. a1-антитрипсин является основным ингибитором сериновых протеаз, к которым относятся трипсин, химотрипсин, нейтрофильная эластаза, коллагеназа, тканевой калликреин, плазминоген, фактор Ха. a1-АТ кодируется геном Pi (proteinase inhibitor), расположенным на длинном плече хромосомы 14 [23]. Его количество в сыворотке крови у здорового человека в норме составляет 1,5–3,5 г/л. Уровень сывороточного a1-АТ равен 0,80 г/л (11 mumol/L), что составляет примерно 35% нормального уровня и является тем порогом, ниже которого значительно повышается риск развития эмфиземы легких [42]. Выделено не менее 90 различных генетически детерминированных вариантов a1-АТ [31]. Доказана значительная роль гомозиготных форм наследственного дефицита a1-АТ в развитии первичной диффузной ЭЛ, а также цирроза печени. Эмфизема возникает у таких людей в 15 раз чаще. Роль гетерозиготных форм дефицита a1-АТ в развитии ЭЛ окончательно не установлена. Существует специфика географического и этнического распределения вариантов a1-АТ. Распространенность наследственного дефицита a1-АТ в России существенно ниже, чем в странах Северной Европы, эндемичных по данной патологии [21, 23, 31, 37].
Врожденный дефицит a1-АТ может при определенных условиях привести к избыточному действию ферментов, в том числе эластазы, прижизненному разрушению тончайших межальвеолярных перегородок и слиянию отдельных альвеол в более крупные эмфизематозные полости с постепенным уменьшением общей дыхательной поверхности легких [18]. Главная роль в рассматриваемых процессах принадлежит нейтрофильной эластазе. Одним из главных источников эластазы в организме человека являются нейтрофилы. Косвенное значение имеют также макрофаги. Следует отметить, что врожденный дефицит a1-АТ ведет к развитию ЭЛ преимущественно у взрослых в возрасте 30-40 лет, что, вероятно, связано с провокационными факторами: курением, воздушными поллютантами, неблагоприятными условиями труда [17]. Однако не у всех пациентов с дефицитом a1-АТ развивается эмфизема, особенно если они не подвергались воздействию табачного дыма и поллютантов [28].
Возможно, имеются и другие механизмы развития ЭЛ.
Среди экзогенных факторов в развитии ЭЛ большое значение имеют курение, загрязнение воздуха, легочные инфекции. Особенно агрессивным фактором является курение, от интенсивности и длительности которого зависит тяжесть заболевания. Среди наиболее вероятных компонентов табачного дыма, способствующих развитию ЭЛ, — кадмий, окиси азота и серы. Механизм действия табачного дыма при ЭЛ связан в первую очередь с тем, что его компоненты активизируют деятельность альвеолярных макрофагов и нейтрофилов, что способствует повышению уровня нейтрофильной эластазы, металлопротеиназ, играющих важную роль в патогенезе ЭЛ. Кроме того, при длительном курении снижается активность ингибиторов протеолиза, и прежде всего a1-АТ, а протеазы, особенно в условиях даже малейшей недостаточности функции антиферментов, вызывают значительное повреждение эластических волокон и разрушение тонких структур респираторного отдела легкого. Кроме того, табакокурение активизирует процессы свободнорадикального окисления. В табачном дыме содержатся оксиданты, которые подавляют активность антиэластазных ингибиторов, тормозят восстановительные процессы в поврежденном эластическом каркасе легкого. Под влиянием курения снижается и содержание антиоксидантов в плазме крови. Все это способствует развитию ЭЛ [18, 23, 25, 34].
Среди факторов, провоцирующих развитие ЭЛ, особо следует отметить поллютанты и профессиональные вредности, так как они оказывают повреждающее действие на легочную ткань, приводят к формированию хронических процессов в дыхательных путях и появлению дисбаланса в системе протеолиз-антипротеолиз. Наибольшее значение среди поллютантов имеют диоксиды серы и азота, озон. Проникновение воздушных поллютантов ингаляционным путем приводит к повреждению мембран апикальной части эпителиальных клеток, что способствует выходу воспалительных медиаторов, лейкотриенов и нарушению в системе оксидант-антиоксидант. Истощение антиоксидантной системы играет важную роль в продолжающемся воспалении слизистой оболочки дыхательных путей [23]. К развитию эмфиземы приводит также воздействие взвешенной пыли, твердых частиц, углеводородов и др. Особенно опасна для развития ЭЛ ископаемая угольная пыль [6]. Исследования показали, что у эмфиземы, вызванной воздействием минеральной пыли и табачного дыма, сходные механизмы возникновения [30].
Одной из причин развития ЭЛ является легочная инфекция. Инфекционное воспаление стимулирует протеолитическую активность макрофагов и нейтрофилов. Бактерии также могут выступать в качестве дополнительного источника протеолитических агентов, в том числе эластазы. Все это ведет к развитию протеазно-антипротеазного дисбаланса. В последнее время немаловажное значение в патогенезе ХОБ и ЭЛ придается респираторным вирусам. Сами по себе вирусы не вызывают выраженной нейтрофильной или макрофагальной реакции, но из-за высокой контагиозности и способности подавлять местный и общий иммунитет они в большинстве случаев способствуют обострению воспалительных процессов с развитием бактериальной инфекции [13, 19].
Раньше развитие эмфиземы легких на фоне ХОБ связывалось с нарушением бронхиальной проходимости, что приводило к возникновению клапанного механизма и развитию феномена «воздушной ловушки». Однако в настоящее время значение механизма «воздушной ловушки» в развитии эмфиземы легких оспаривается. По мнению ряда авторов, клапанный механизм следует рассматривать скорее как следствие, а не причину заболевания.
Таким образом, ведущим патогенетическим механизмом развития ЭЛ считается дисбаланс в системе протеазы-антипротеазы, при котором наблюдается избыток протеаз или недостаток антипротеаз, что ведет к аутолизу тончайших структур респираторного отдела легочной ткани [8, 23].
Патологическая анатомия эмфиземы легких
Изменения в гистологической картине эмфиземы касаются бронхов и бронхиол, соединительной и эластической ткани легких, альвеолярного эпителия и легочных сосудов. Основным морфологическим критерием диффузной эмфиземы легких является деструкция респираторного отдела легких. Новейшие исследования показали, что размеры входа в альвеолы у здорового человека составляют не более 10 мкм, в то время как при ЭЛ альвеолярные поры превышают 20 мкм. Стенки альвеол представлены гладкими мышцами сосудов. Истончаются и запустевают капилляры. Эластические волокна находятся на стадии дегенерации. Все это приводит к уменьшению поверхности активно функционирующих альвеол. Эмфизематозно измененные альвеолы вызывают сдавление неизмененных, что также имеет немаловажное значение в нарушении вентиляционной функции легких [23].
Морфологическая классификация ЭЛ основана на ее отношении к различным частям ацинуса или дольки. Различают панацинарную (панлобулярную,), центриацинарную (центрилобулярную, проксимальную), периацинарную (дистальную, парасептальную), иррегулярную (околорубцовую), буллезную эмфиземы.
Панацинарная (панлобулярная) эмфизема характеризуется более или менее равномерным поражением ткани ацинусов. Процесс захватывает весь ацинус без избирательного изменения в области респираторных бронхиол или альвеол. Изменения преобладают в нижних отделах легких. Такая форма чаще наблюдается при первичной диффузной эмфиземе у больных с гомозиготным дефицитом a1-АТ.
При центриацинарной (центрилобулярной, проксимальной) эмфиземе изменения происходят в первую очередь в центральной части ацинуса, что соответствует респираторным бронхиолам, которые увеличены, так как их стенки подвергаются деструкции и растягиваются. Респираторные бронхиолы окружены неизмененными или малоизмененными альвеолами по периферии ацинуса. Центриацинарная ЭЛ чаще развивается у больных хроническим обструктивным бронхитом и наблюдается преимущественно в верхних отделах легких (задних и апикальных сегментах), иногда в верхушечных сегментах нижних долей.
Морфологически выделяют также периацинарную (дистальную, перилобулярную, парасептальную) эмфизему легких, при которой поражаются преимущественно периферические отделы ацинусов, прилежащие к межацинарным перегородкам, плевре.
Отношение иррегулярной, или околорубцовой, эмфиземы легких к ацинусу установить трудно, так как ее развитие чаще всего связано с рубцовыми изменениями в легких или с очагами фиброза. Она развивается при туберкулезе, саркоидозе, пневмокониозе, гистоплазмозе, эозинофильной гранулеме и др. Такая эмфизема является неравномерной, локальной. Она имеет деструктивный характер, но процесс локализуется в строго определенном участке легочной ткани. При иррегулярной эмфиземе поражаются как альвеолы, так и респираторные бронхиолы, альвеолярные ходы и мешочки; особенно характерно для нее расширение альвеолярных ходов [10, 23].
Буллезная эмфизема характеризуется формированием воздушных полостей диаметром более 0,5 см (булл). Эмфизему легких, сопровождающуюся формированием множества крупных булл, называют иногда буллезной болезнью. По локализации буллы делят на подплевральные и интрапаренхиматозные. По размеру различают мелкие (до 1 см), средние (1–5 см), крупные (5–10 см) и гигантские (более 10 см) буллы. По форме — округлые, овальные, полиморфные. Выделяют также напряженные, ненапряженные и спавшиеся; вентилируемые и невентилируемые; тонкостенные и толстостенные буллы. Для клинического применения разработана следующая классификация буллезной эмфиземы легких [7]: солитарные буллы; множественные буллы; буллы с диффузной эмфиземой; буллы с другими заболеваниями (симптоматические буллы); односторонняя легочная эмфизема (cиндром Маклеода). Следует различать понятия буллы и блебы. Блебы (blebs), или пузыри, образуются в соединительнотканных прослойках легкого при интерстициальной эмфиземе легких вследствие разрыва легочных структур с проникновением воздуха в интерстиций. Чаще всего буллы образуются при локализованных или иррегулярных видах ЭЛ. Однако и при диффузных формах (центриацинарной, панацинарной), особенно на поздних стадиях заболевания, возможно развитие множественных булл.
Необходимо иметь в виду, что приведенное выше морфологическое деление эмфиземы легких является схематичным и морфологическое распознавание различных видов эмфиземы, особенно на поздних стадиях развития, в запущенных случаях, может представлять значительные трудности [13, 18].
Патологическая физиология
Функциональные изменения при ЭЛ обусловлены несколькими взаимосвязанными механизмами: нарушением эластического каркаса легких, ведущим к изменению структуры легочных объемов и механических свойств легких; бронхиальной обструкцией; деструкцией межальвеолярных перегородок с прогрессирующим уменьшением общей функционирующей поверхности легких и снижением диффузионной способности. Одним из важных патогенетических факторов является механизм экспираторного закрытия мелких дыхательных путей. В настоящее время большое внимание в патогенезе ЭЛ уделяется также утомлению дыхательной мускулатуры. Кроме того, дыхательная недостаточность усугубляется сдавлением гигантскими буллами нормальной в функциональном отношении легочной ткани. Нарушение газообмена при ЭЛ обусловлено: ухудшением легочной вентиляции, поддерживающей постоянный газовый состав альвеолярного воздуха; нарушением кровообращения в легких и корреляцией между процессами вентиляции и перфузии в альвеолах; затруднением диффузии газов через альвеолокапиллярную мембрану из-за ее деструкции; раскрытием в легких артериовенозных анастомозов. Сложная патофизиологическая картина ЭЛ в каждом конкретном случае имеет свои особенности, зависящие от ее формы и тяжести течения [16, 18, 23].
Клиническая картина ЭЛ включает проявления самой эмфиземы, хронического бронхита, который часто предшествует ее развитию или сопутствует ей, а также дыхательной и сердечной недостаточности, осложняющих ее течение. Имеется сходство в клинической картине ЭЛ, хронического обструктивного бронхита, бронхиальной астмы (особенно ЭЛ и ХОБ), что является одной из причин их объединения в понятие хронических обструктивных заболеваний легких (ХОБЛ). Однако каждое из этих заболеваний имеет свои характерные особенности.
Одышка — первая и основная жалоба больных эмфиземой легких. Одышка в начале болезни появляется только при значительной физической нагрузке, и первоначально больные часто ее не замечают. Одышка у больных ЭЛ опасна тем, что долгие годы, заметно не проявляясь и исподволь прогрессируя, она превращается в состояние, угрожающее жизни больного. Толерантность к физическим нагрузкам резко снижена, так как даже в состоянии покоя компенсаторные возможности находятся на пределе. Одышка обычно имеет экспираторный характер. У больных наблюдаются короткий, «острый», «хватающий» вдох и удлиненный, иногда ступенеобразный выдох. Они осуществляют выдох при сомкнутых губах, надувая щеки («пыхтят»). При этом повышается давление в бронхиальном дереве, что уменьшает экспираторный коллапс мелких бесхрящевых бронхов (обусловленный нарушением эластических свойств легочной ткани и возрастанием внутригрудного давления) и способствует увеличению объема вентиляции. Кашель не является специфической жалобой больных ЭЛ и чаще всего обусловлен наличием хронического бронхита. Как правило, кашель при этом бывает сухой или с небольшим количеством трудноотделяющейся мокроты слизистого характера. Обострение бронхита всегда сопровождается усилением кашля и отделением мокроты слизисто-гнойного характера. Необходимо обращать внимание на появление непродуктивного кашля и прекращение отхождения мокроты, что может свидетельствовать о тяжелом обострении обструктивной болезни легких, нередко связанном с развитием синдрома утомления дыхательных мышц. Застою мокроты в просвете дыхательных путей способствует также употребление седативных и противокашлевых средств [23].
Масса тела при ЭЛ снижена, что связано с напряженной работой респираторных мышц, направленной на преодоление высокого сопротивления терминального отдела дыхательных путей [23]. Пациенты с эмфиземой легких в начальных стадиях заболевания принимают вынужденное положение на животе с опущенными вниз головой и плечевым поясом, что приносит им облегчение. При таком положении больного достигаются повышение брюшного давления, поднятие вверх диафрагмы и улучшение ее функции. Однако при тяжелой эмфиземе c выраженными изменениями грудной клетки и утомлением респираторных мышц горизонтальное положение вызывает напряженную работу диафрагмы, поэтому больные вынуждены даже спать в сидячем положении [23]. Больные ЭЛ нередко занимают положение сидя с несколько наклоненным вперед туловищем, опершись руками о колени или край кровати, что позволяет фиксировать плечевой пояс и включить дополнительную мускулатуру в акт дыхания. Цвет кожных покровов при эмфиземе легких скорее розовый, чем синюшный. Маловыраженный цианоз обусловлен длительным сохранением газового состава крови, только в далеко зашедших случаях появляется цианоз, который обусловлен развитием гиперкапнии. При этом у больных выявляется «вересковый язык» (голубой оттенок языка), который является клиническим показателем гиперкапнии и больше характерен для ХОБ. Наблюдается набухание шейных вен во время выдоха из-за повышения внутригрудного давления. Большое значение в прогнозе заболевания имеет оценка дыхательной мускулатуры, так как появление синдрома ее утомления всегда свидетельствует о прогрессировании болезни и усугублении дыхательной недостаточности [23]. Необходимо оценить синхронность участия в дыхательном цикле диафрагмы, мышц брюшного пресса, плечевого пояса, шеи и межреберных мышц. Нужно уметь выявлять дискоординацию дыхательных движений, а также следить за появлением признаков парадоксального дыхания, когда ребра на вдохе парадоксально втягиваются, что связано с тягой низкостоящей уплощенной диафрагмы.
При осмотре грудной клетки выявляется бочкообразная грудная клетка. Иногда наблюдается кифоз. При перкуссии определяется коробочный звук. Отмечаются увеличение высоты стояния верхушек, смещение нижних границ легких вниз и резкое ограничение подвижности нижнего легочного края. Характерно уменьшение сердечной и печеночной тупости за счет повышенной воздушности и увеличения объема легочной ткани. При аускультации выслушивается ослабленное везикулярное дыхание (в тяжелых случаях — резко ослабленное). Побочные дыхательные шумы не характерны для больных ЭЛ. Однако при форсированном выдохе или при проведении кашлевой пробы могут появляться скудные сухие свистящие хрипы.
Изолированная ЭЛ встречается редко. Как правило, она сочетается с признаками хронического обструктивного бронхита. Дифференциальная диагностика этих двух состояний представляет порой определенные трудности, что является еще одной причиной их объединения в понятие ХОБЛ. Признаки бронхита и эмфиземы очень часто, особенно в запущенных случаях, встречаются в различных сочетаниях. Однако нередко у больных ХОБЛ удается выделить преобладание признаков ЭЛ или бронхита, в связи с чем говорят о двух вариантах ХОБЛ: эмфизематозном и бронхитическом. Эмфизематозный вариант иногда называют «одышечный», «розовый», «пыхтящий», а больных этим вариантом ХОБЛ — «розовыми пыхтельщиками». Основной жалобой является прогрессирующая одышка, напоминающая пыхтение. В клинической картине ведущими являются симптомы, типичные для ЭЛ. Характерны длительное сохранение газового состава крови в покое и позднее развитие легочного сердца. Бронхитический тип («кашляющий», «синюшный», «отечный») характеризуется преобладанием симптомов бронхита. Основной жалобой является продуктивный кашель. Наблюдаются выраженный цианоз, симптомы легочного сердца, которое развивается на ранних стадиях болезни. Больные с таким вариантом ХОБЛ имеют вид «синюшных отечников». Эти два варианта ХОБЛ в чистом виде встречаются редко, и причисление больных к тому или иному типу часто вызывает затруднение. Значительная часть пациентов попадает в смешанную, промежуточную, группу лиц, у которых имеются признаки ХОБ, ЭЛ, дыхательной недостаточности и легочного сердца, выраженные в той или иной степени.
Инструментальные методы диагностики
Рентгенологическое исследование. Основными рентгенологическими признаками являются увеличение прозрачности легочных полей и их общей площади, ослабление сосудистого легочного рисунка, низкое расположение и уплощение диафрагмы, ограничение ее подвижности, увеличение костодиафрагмальных углов. Сердце, как правило, не увеличивается; вследствие низкого стояния диафрагмы оно принимает каплевидную форму («капельное сердце»). Происходит расширение ретростернального пространства, увеличение размеров которого и ослабление легочного рисунка на периферии наилучшим образом коррелируют с выраженностью эмфиземы [13]. Особое значение в диагностике имеют рентгенофункциональные пробы, в частности проба Ю. Н. Соколова и ее модификации, которые основаны на изменении прозрачности легочных полей в разных фазах дыхания. На томограммах определяются уменьшение калибра мелких сосудистых разветвлений, расширение корней легких. На ангиограммах выявляются признаки деваскуляризации. Бронхографическая картина характеризуется как «зимнее дерево без листьев».
В настоящее время в диагностике ЭЛ все шире используются новые, современные методы. Компьютерная томография позволяет выявить изменения легочной ткани, которые не диагностируются другими методами. Она дает возможность определить элементы ЭЛ вплоть до мелких ячеек размером 2 мм. Компьютерная томография высокоинформативна в диагностике буллезной ЭЛ и позволяет решить вопрос об операбельности [7, 28]. В целях повышения информативности предлагается проводить функциональную компьютерную томографию [22]. Ядерный магнитный резонанс наряду с другими диагностическими методами очень важен при отборе кандидатов на проведение операции по уменьшению объема легких среди больных с тяжелой ЭЛ. Метод позволяет определить локализацию, тяжесть эмфиземы и степень гипервоздушности легких [29]. Радиоизотопные методы дают возможность выявить вентиляционно-перфузионные нарушения, характерные для эмфиземы. Перфузионная сцинтиграфия является важным методом диагностики сосудистых изменений в легких при эмфиземе, которые могут выявляться на ранних стадиях, когда отсутствуют клинические и рентгенологические признаки заболевания. Он позволяет определить компрессию и объем функционирующей легочной ткани, нарушение кровотока в отдельных зонах. Сцинтиграфия легких помогает решить вопрос об оперативном лечении и осуществлять длительное послеоперационное наблюдение за больными [29, 36]. Электроимпедансная томография — метод, основанный на измерении электрического импеданса (электрического сопротивления) тканей, в том числе тканей грудной клетки [24]. Роль этого метода в диагностике ЭЛ требует дальнейшего изучения. Торакоскопия — метод эндоскопического исследования плевральной полости. Имеет большое значение в выявлении мелких субплевральных булл, не определяемых другими способами. Информативность торакоскопии в выявлении субплеврально расположенных воздушных образований составляет 92,7% [16].Торакоскопия, кроме того, широко используется для лечения буллезной эмфиземы легких [7, 27].
Функциональное исследование легких имеет важное значение в диагностике ЭЛ, для которой характерны увеличение общей емкости легких и остаточного объема, снижение жизненной емкости легких. Наблюдаются повышение сопротивления в дыхательных путях на выдохе (в отличие от ХОБ, при котором сопротивление повышено на вдохе и выдохе) и стойкое снижение скоростных показателей (ФЖЕЛ, ОФВ1, теста Тиффно, скоростных максимальных экспираторных потоков, рассчитываемых по кривой поток/объем). Проведение ингаляционных тестов с бронходилятаторами позволяет выявить у больных эмфиземой стойкий необратимый характер бронхиальной обструкции. У больных ХОБ может наблюдаться частичный бронходилятационный ответ. Одним из ранних признаков ЭЛ является снижение диффузионной способности. Отмечаются также увеличение статической и уменьшение динамической растяжимости легочной ткани [13, 18, 23].
При развитии дыхательной недостаточности, чтобы правильно выбрать лечение и определить прогноз, необходимо исследовать газовый состав крови. Напряжение кислорода в артериальной крови ниже 60 мм рт. ст. свидетельствует о терминальной дыхательной недостаточности. Таким больным целесообразно проводить длительную кислородотерапию. Особого внимания требуют больные с повышенным напряжением СО2 в артериальной крови, так как с гиперкапнией связаны обострение дыхательной недостаточности и развитие синдрома утомления дыхательных мышц [23].
Изменения в периферической крови
Для больных ХОБЛ в связи с гипоксией характерно развитие полицитемического синдрома (повышение числа эритроцитов и уровня гемоглобина, низкая скорость оседания эритроцитов, высокая вязкость крови), что еще больше усугубляет дыхательную недостаточность. Эти изменения более характерны для больных ХОБ.
Лечение
Лечение больных ЭЛ представляет собой сложную задачу. Терапия должна быть направлена на лечение собственно ЭЛ, ХОБ, осложнений заболевания (дыхательной и сердечной недостаточности в случае присоединения легочного сердца), а также включать мероприятия, нацеленные на повышение качества жизни больных и замедление прогрессирования болезни. Первоочередное значение имеет отказ от курения. Здесь важна активная позиция врача, направленная на борьбу с курением. В настоящее время для врачей разработаны методические рекомендации по лечению табачной зависимости [23, 28].
Методы специфического лечения собственно ЭЛ, направленные на уменьшение потери легкими эластичности, до конца не разработаны. Предлагается заместительная терапия дефицита a1-антитрипсина донорской плазмой, нативным a1-АТ из сыворотки здоровых доноров, а также a1-АТ, созданным методом генной инженерии. Пациенты с уровнем a1-АТ в плазме менее 11 mumol/L, имеющие обструкцию воздухоносных путей, должны рассматриваться как претенденты на заместительную терапию. Заместительная терапия особенно показана больным с наследственным дефицитом a1-АТ. Новые подходы к лечению предполагают назначение аэрозолей a1-АТ [37, 42]. Исследуется возможность применения низкомолекулярных синтетических ингибиторов эластазы, в том числе новых водорастворимых [38]. Действие всех этих средств направлено против ферментативного разрушения соединительно-тканной стромы легких. Большие надежды в терапии больных с наследственным дефицитом a1-АТ возлагаются на метод генной инженерии, который позволяет «исправлять» дефектный ген [20, 37]. В целях повышения синтеза a1-АТ предлагается использовать синтетический анаболический стероид деназол [9]. На стадии изучения находится направление по применению средств, восстанавливающих поврежденные эластические волокна. Экспериментально была показана возможность их восстановления, в частности при использовании ретиновой кислоты [32, 33]. Для коррекции системы протеолиз-антипротеолиз целесообразно назначение антиоксидантов (витамина Е, аскорбиновой кислоты, глутатиона, b-каротина, микроэлементов цинк и селен, тиосульфата натрия и др.). В последнее время выявлено, что муколитик ацетилцистеин обладает антиоксидантными свойствами [23], однако он не показан больным с наследственным дефицитом a1-АТ [9]. Возможно применение средств, влияющих на сурфактантную систему легких, восстанавливающих поверхностно-активные свойства альвеолярной выстилки. С этой целью используются различные вещества для интратрахеального введения: эвкалиптовое масло, ментол, камфора, жирные кислоты, пальмитиновая кислота, дипальмитил-лецитин, фосфолипиды [3]. Имеется опыт интратрахеального введения липосом. В последние годы разработан новый липосомальный препарат на основе природных фосфолипидов — липин [26]. Имеются данные о положительном влиянии на сурфактантную систему легких антагонистов кальция при их сочетанном применении внутрь и ингаляционно [11], лазолвана, бромгексина, глицерама (особенно выраженным сурфактантпротективным действием обладает лазолван) [14]. Считается, что для восстановления сурфактантной системы наиболее перспективным является метод ингаляционного введения сурфактанта непосредственно в легкие [12]. Однако следует отметить, что методы воздействия на эластические свойства легких при эмфиземе, а также на сурфактантную систему недостаточно разработаны и внедрены в широкую практику.
В большинстве случаев буллезной ЭЛ эффективным является хирургическое лечение. Наиболее перспективными считаются видеоторакоскопические операции. Особенно широкое распространение они получили в последние 10 лет в связи с развитием эндоскопической техники [7]. В последнее время разработаны также хирургические методы лечения диффузной эмфиземы: хирургическая редукция легочного объема и трансплантация легких [15, 40].
В терапии ЭЛ важное место отводится лечению ХОБ, поскольку эти два патологических процесса нередко протекают параллельно и между ними порой бывает трудно провести грань. При этом используются бронходилятирующие и мукорегуляторные средства, иммунокорригирующая терапия, антибактериальные средства (при обострении воспалительного процесса), кортикостероиды и др. Для лечения ХОБ и ЭЛ применяются бронхорасширяющие препараты трех основных групп: b2-агонисты, антихолинергические средства, теофиллины. У больных ХОБ с ЭЛ действие ингаляционных холинолитиков по сравнению с b1-агонистами оказывается более выраженным, а число побочных реакций — минимальным. b2-агонисты должны с осторожностью использоваться у пожилых пациентов, особенно с патологией сердца, так как у них могут проявляться нежелательные кардиотоксические эффекты, характерные для этой группы препаратов. b2-агонисты целесообразно комбинировать с ингаляционными холинолитиками, когда монотерапия последними оказывается неэффективной. Возможно использование комбинированного препарата беродуала, содержащего ипратропиум бромид и фенотерол. В последнее время широкое распространение получила ингаляционная терапия через небулайзер. Преимущества небулайзерной терапии заключаются в том, что не требуется координации вдоха и ингаляции; ингаляция легковыполнима у пожилых и тяжелых больных; возможна доставка высоких доз лекарственного препарата за короткий период времени; создается высокодисперсный аэрозоль с идеальным диаметром частиц 1–5 мкм, который способен достичь периферических отделов дыхательных путей. Теофиллины обладают менее выраженным бронхолитическим эффектом, однако с их использованием связан ряд побочных эффектов, например уменьшение системной легочной гипертензии. Кроме того, они влияют на сердечный выброс, усиливают диурез, стимулируют центральную нервную систему, предотвращают и уменьшают утомление дыхательной мускулатуры. Предпочтение отдается пролонгированным формам теофиллина. Их назначение наиболее показано в ходе комплексной терапии ХОБЛ, когда предшествующая сочетанная терапия холинолитиками и b2-агонистами оказалась недостаточной [1, 23].
Глюкокортикостероидная терапия показана при тяжелой ЭЛ, при быстром прогрессировании болезни и в случае неэффективности максимальных доз препаратов базисной терапии (бронхорасширяющих средств). Обычно назначается пробная терапия преднизолоном в дозе 15–20 мг в сутки с оценкой эффективности в ближайшие 3–4 дня. Показания к назначению кортикостероидов противоречивы. Известно, что только 20-30% больных с ХОБЛ отвечают положительно на длительное лечение оральными кортикостероидами [1, 23, 28]. Следует учитывать миопатическое действие кортикостероидов на скелетную мускулатуру, а также возможность усугубления остеопороза, который развивается при ЭЛ. Для лечения остеопороза целесообразно использовать витаминные препараты, особенно витамин D3, минеральные соли, содержащие кальций, а в более тяжелых случаях показана курсовая терапия кальцитонином [23].
Важным направлением в лечении ЭЛ является коррекция дыхательной недостаточности, которая достигается путем оксигенотерапии и тренировкой дыхательной мускулатуры. Оксигенотерапия показана при снижении РаО2 до 60 мм рт. ст. и менее, SaO2 <85% при стандартной пробе с шестиминутной ходьбой и <88% в покое. Предпочтение отдается длительной (18 часов в сутки), малопоточной (2–5 л в минуту) кислородотерапии. При тяжелой дыхательной недостаточности используются гелиево-кислородные смеси, а также неинвазивная вентиляция легких с двумя уровнями положительного давления [1, 2].
Тренировка дыхательной мускулатуры включает в себя специальную дыхательную гимнастику, в том числе направленную на пассивизацию выдоха, использование специальных приспособлений, создающих положительное давление в конце выдоха. Возможно применение чрескожной электрической стимуляции диафрагмы.
Профилактика ЭЛ
Профилактика заключается в первую очередь в раннем выявлении носителей дефицита a1-АТ. Целесообразно проводить обследование родственников больного и популяризировать генетические консультации; гомозиготным носителям нужно рекомендовать воздержаться от деторождения. Рекомендуется проводить исследование a1-АТ при приеме на работу лиц, трудовая деятельность которых будет протекать в неблагоприятных условиях (производство цемента, асбеста, угледобывающая промышленность и др.). Важны категорическое запрещение курения, исключение контакта с воздушными поллютантами, предупреждение респираторных заболеваний.
По вопросам литературы обращайтесь в редакцию
Эмфизема легких
Эмфизема легких – это хроническое неспецифическое заболевание легких, в основе которого лежит стойкое, необратимое расширение воздухоносных пространств и повышенное вздутие легочной ткани дистальнее концевых бронхиол. Эмфизема легких проявляется экспираторной одышкой, кашлем с небольшим количеством слизистой мокроты, признаками дыхательной недостаточности, рецидивирующими спонтанными пневмотораксами. Диагностика патологии проводится с учетом данных аускультации, рентгенографии и КТ легких, спирографии, анализа газового состава крови. Консервативное лечение эмфиземы легких включает прием бронхолитиков, глюкокортикоидов, кислородотерапию; в некоторых случаях показано резекционное хирургические вмешательство.
Общие сведения
Эмфизема легких (от греч. emphysema — вздутие) – патологическое изменение легочной ткани, характеризующееся ее повышенной воздушностью, вследствие расширения альвеол и деструкции альвеолярных стенок. Эмфизема легких выявляется у 4% пациентов, причем у мужчин встречается в 2 раза чаще, чем у женщин. Риск развития эмфиземы легких выше у пациентов с хроническими обструктивными заболеваниями легких, особенно после 60 лет. Клиническая и социальная значимость эмфиземы легких в практической пульмонологии определяется высоким процентом развития сердечно-легочных осложнений, нетрудоспособности, инвалидизации больных и возрастающей летальностью.
Эмфизема легких
Причины
Любые причины, приводящие к хроническому воспалению альвеол, стимулируют развитие эмфизематозных изменений. Вероятность развития эмфиземы легких повышается при наличии следующих факторов:
- врожденной недостаточности α-1 антитрипсина, приводящей к разрушению протеолитическими ферментами альвеолярной ткани легких;
- вдыхании табачного дыма, токсичных веществ и полютантов;
- нарушениях микроциркуляции в тканях легких;
- бронхиальной астме и хронических обструктивных заболеваниях легких;
- воспалительные процессы в респираторных бронхах и альвеолах;
- особенностей профессиональной деятельности, связанных с постоянным повышением давления воздуха в бронхах и альвеолярной ткани.
Патогенез
Под воздействием данных факторов происходит повреждение эластической ткани легких, снижение и утрата ее способности к воздухонаполнению и спадению. Переполненные воздухом легкие приводят к слипанию мелких бронхов при выдохе и нарушениям легочной вентиляции по обструктивному типу. Формирование клапанного механизма при эмфиземе легких вызывает вздутие и перерастяжение тканей легкого и формирование воздушных кист – булл. Разрывы булл могут вызывать эпизоды рецидивирующего спонтанного пневмоторакса.
Эмфизема легких сопровождается значительным увеличением легких в размерах, которые макроскопически становятся похожими на крупнопористую губку. При исследовании эмфизематозной легочной ткани под микроскопом наблюдается деструкция альвеолярных перегородок.
Классификация
Эмфизема легких подразделяется на первичную или врожденную, развивающуюся как самостоятельная патология, и вторичную, возникшую на фоне других заболеваний легких (чаще бронхита с обструктивным синдромом). По степени распространенности в легочной ткани выделяют локализованную и диффузную формы эмфиземы легких.
По степени вовлечения в патологический процесс ацинуса (структурно-функциональной единицы легких, обеспечивающей газообмен, и состоящей из разветвления терминальной бронхиолы с альвеолярными ходами, альвеолярными мешками и альвеолами) различают следующие виды эмфиземы легких:
- панлобулярную (панацинарную) — с поражением целого ацинуса;
- центрилобулярную (центриацинарную) – с поражением респираторных альвеол в центральной части ацинуса;
- перилобулярную (периацинарную) – с поражением дистальной части ацинуса;
- околорубцовую (иррегулярную или неравномерную);
- буллезную (буллезную болезнь легких при наличии воздушных кист — булл).
Особо выделяют врожденную долевую (лобарную) эмфизему легких и синдром Маклеода – эмфизему с неясной этиологией, поражающую одно легкое.
Симптомы эмфиземы легких
Ведущим симптомом эмфиземы легких является экспираторная одышка с затрудненным выдохом воздуха. Одышка носит прогрессирующий характер, возникая сначала при нагрузке, а затем и в спокойном состоянии, и зависит от степени дыхательной недостаточности. Пациенты с эмфиземой легких делают выдох через сомкнутые губы, одновременно надувая щеки (как бы «пыхтят»). Одышке сопутствует кашель с выделение скудной слизистой мокроты. О выраженной степени дыхательной недостаточности свидетельствуют цианоз, одутловатость лица, набухание вен шеи.
Пациенты с эмфиземой легких значительно теряют в весе, имеют кахектичный вид. Потеря массы тела при эмфиземе легких объясняется большими энергозатратами, расходуемыми на интенсивную работу дыхательных мышц. При буллезной форме эмфиземы легких возникают повторные эпизоды спонтанного пневмоторакса.
Осложнения
Прогрессирующее течение эмфиземы легких приводит к развитию необратимых патофизиологических изменений в сердечно-легочной системе. Спадение мелких бронхиол на выдохе приводит к нарушениям легочной вентиляции по обструктивному типу. Деструкция альвеол вызывает уменьшение функциональной легочной поверхности и явления выраженной дыхательной недостаточности.
Редукция сети капилляров в легких влечет за собой развитие легочной гипертензии и возрастание нагрузки на правые отделы сердца. При нарастающей правожелудочковой недостаточности возникают отеки нижних конечностей, асцит, гепатомегалия. Неотложным состоянием при эмфиземе легких является развитие спонтанного пневмоторакса, требующее дренирования плевральной полости и аспирации воздуха.
Диагностика
В анамнезе пациентов с эмфиземой легких отмечаются большой стаж курения, профессиональные вредности, хронические или наследственные заболевания легких. При осмотре пациентов с эмфиземой легких обращает внимание увеличенная, бочкообразная (цилиндрической формы) грудная клетка, расширенные межреберные промежутки и эпигастральный угол (тупой), выпячивание надключичных ямок, поверхностное дыхание с участием вспомогательной дыхательной мускулатуры.
Перкуторно определяется смещение нижних границ легких на 1-2 ребра книзу, коробочный звук по всей поверхности грудной клетки. Аускультативно при эмфиземе легких выслушивается ослабленное везикулярное («ватное») дыхание, глухие сердечные тона. В крови при выраженной дыхательной недостаточности выявляется эритроцитоз и повышение гемоглобина.
- Рентгендиагностика. При рентгенографии легких определяется повышение прозрачности легочных полей, обедненный сосудистый рисунок, ограничение подвижности купола диафрагмы и ее низкое расположение (спереди ниже уровня VI ребра), почти горизонтальное положение ребер, сужение сердечной тени, расширение загрудинного пространства. С помощью КТ легких уточняется наличие и расположение булл при буллезной эмфиземе легких.
- Исследование ФВД. Высокоинформативно при эмфиземе легких исследование функции внешнего дыхания: спирометрия, пикфлоуметрия и др. На ранних этапах развития эмфиземы легких выявляется обструкция дистальных отрезков дыхательных путей. Проведение теста с ингаляторами-бронходилататорами показывает необратимость обструкции, характерную для эмфиземы легких. Также при ФВД определяется снижение ЖЕЛ и пробы Тиффно.
- Лабораторные тесты. Анализ газового состава крови выявляет гипоксемию и гиперкапнию, клинический анализ – полицитемию (увеличение Hb, эритроцитов, вязкости крови). В план обследования необходимо включать анализ на α -1-ингибитор трипсина.
Лечение эмфиземы легких
Консервативная терапия
Специфическое лечение отсутствует. Первостепенным является устранение предрасполагающего к эмфиземе фактора (курения, вдыхания газов, токсических веществ, лечение хронических заболеваний органов дыхания).
Лекарственная терапия при эмфиземе легких симптоматическая. Показано пожизненное применение ингаляционных и таблетированных бронхолитиков (сальбутамола, фенотерола, теофиллина и др.) и глюкокортикоидов (будесонида, преднизолона). При сердечной и дыхательной недостаточности проводят оксигенотерапию, назначают диуретики. В комплекс лечения эмфиземы легких включают дыхательную гимнастику.
Хирургическое лечение
Хирургическое лечение эмфиземы легких заключается в проведении операции по уменьшению объема легких (торакоскопической буллэктомии). Суть метода сводится к резекции периферических участков легочной ткани, что вызывает «декомпрессию» остальной части легкого. Наблюдения за пациентами после перенесенной буллэктомии показывают улучшение функциональных показателей легких. Пациентам с эмфиземой легких показана трансплантация легких.
Прогноз и профилактика
Отсутствие адекватной терапии эмфиземы легких приводит к прогрессированию заболевания, нетрудоспособности и ранней инвалидизации вследствие развития дыхательной и сердечной недостаточности. Несмотря на то, что при эмфиземе легких происходят необратимые процессы, качество жизни пациентов можно повысить постоянно применяя ингаляционные препараты. Оперативное лечение буллезной эмфиземы легких несколько стабилизирует процесс и избавляет пациентов от рецидивирующих спонтанных пневмотораксов.
Существенным моментом профилактики эмфиземы легких является антитабачная пропаганда, направленная на предупреждение и борьбу с курением. Также необходимы раннее выявление и лечение пациентов с хроническим обструктивным бронхитом. Пациенты, страдающие ХОБЛ, подлежат наблюдению пульмонолога.