Горгиладзе Д. А., Пинаев Р. Н., Александров В. А.
«Центр ревитализации и здоровья» компании Peptides
Москва
2018
Список сокращений, использованных в статье
АМГ — антимюллеровский гормон
ГЗТ — гормонозаместительная терапия
ЛГ — лютеинизирующий гормон
ФСГ — фолликулостимулирующий гормон
Достижения молекулярной биологии и генетики открывают огромные перспективы для развития таких отраслей, как антивозрастная медицина. Одним из ее приоритетных направлений в России является применение комплекса низкомолекулярных пептидов, исправляющих ошибки в работе генома. Исследования последних пяти десятилетий и колоссальный клинический опыт (более 15 млн наблюдений) позволяют с уверенностью говорить о чрезвычайной эффективности пептидных препаратов в профилактике преждевременного старения и продлении активного долголетия. Антивозрастная медицина сегодня — это, прежде всего, комплекс мероприятий, направленных на синхронную отладку работы всех органов и систем, что позволяет достигать выраженного и стойкого эффекта ревитализации. Это также неинвазивные эстетические программы, основанные на различных методах введения пептидов и последующей коррекции биологического возраста. Нельзя не упомянуть и о том, что в последнее время, антивозрастная медицина все больше и больше опирается на данные гормонального профиля и генетического паспорта пациентов. Это позволяет своевременно вносить поправки в индивидуальные программы ревитализации с целью профилактики заболеваний, развивающихся преимущественно во второй половине жизни.
Одной из особенностей работы с пациентами является их возраст (30–60 лет). Зачастую уже к 35 годам жизни в организме имеется целый комплекс нарушений, который ранее был типичен для лиц на 15–20 лет старше. Похожая ситуация наблюдается с женщинами в возрасте 34–38 лет. С каждым годом растет число пациенток, имеющих проблемы с зачатием, при этом, во время обследования мы зачастую наблюдаем у них картину предклимактерического периода, то есть данные их гормонального профиля и показатели функционального резерва яичников соответствуют возрасту на 6–8 лет старше. Эта абсолютно нетипичная ранее картина становится все более привычной для нас сегодня. В качестве возможных причин ее возникновения можно считать: длительное применение оральных контрацептивов, частые стрессы, неправильный образ жизни и питание с применением огромного количества консервантов, трансжиров и генетически модифицированных продуктов.
Сегодня нами, в рамках Российского общества антивозрастной медицины, ведется активная совместная работа по пересмотру, коррекции и разработке новых усовершенствованных схем и методик применения антивозрастных препаратов. Пришло время поделиться опытом работы и в гинекологии, в частности, программами подготовки к беременности у женщин начала второй половины репродуктивного возраста.
Традиционно ведение и лечение репродуктологами и гинекологами этой категории пациенток включает в себя курсовое применение гормонозаместительной терапии (ГЗТ) с последующей отменой последней. Делается это в надежде на то, что в период отмены гормональных препаратов будет получен ответ со стороны яичников, то есть всплеск их функции. На практике в большинстве случаев функция яичников продолжает оставаться сниженной. В этом случае лечащий врач рекомендует снова перейти на ГЗТ либо провести курс гомеопатических препаратов с элементами экстрактов яичников для подготовки к гормональной стимуляции и экстракорпоральному оплодотворению. При этом мало кто из специалистов обращает внимание на то, что уже давно в арсенале медиков имеются физиологичные препараты, корректирующие функции яичников и эндокринной системы в целом. И применяются они довольно успешно.
Материалы и методы
Нами было проведено изучение эффективности терапии пептидами яичников (препарат «Женолутен») и шишковидной железы (препарат «Эндолутен») у 276 пациенток в возрасте от 34 до 38 лет с умеренным снижением репродуктивной функции. В исследование не включались больные с нестабильными менструациями, хроническим аднекситом, поликистозом яичников, эндометриозом, непроходимостью маточных труб, миомой матки, аутоиммунным тиреоидитом, микроаденомой гипофиза, а также с незначительным или умеренным повышением уровня пролактина, говорящим о возможном наличии так называемого гипоталамического синдрома. В случае последнего применение препаратов шишковидной железы может вызывать укорочение или удлинение менструального цикла и повышение уровня стимуляции со стороны гипофиза, выражающееся наиболее часто в увеличении уровня фолликулостимулирующего гормона (ФСГ) и реже в колебаниях уровня лютеинизирующего гормона (ЛГ).
Изучение эффективности комплекса пептидных препаратов проводилось с сентября 2013 г. по июнь 2018 г. в московском отделении «Центра ревитализации и здоровья» компании Peptides. Все пациентки были разделены на две группы и обследованы до начала терапии:
— контрольная группа (62 пациентки), получавшая плацебо;
— вторая группа (214 пациенток), получавшая пептиды яичников и шишковидной железы.
Оценка эффективности препаратов проводилась спустя 4 месяца от начала применения терапии.
Все пептидные препараты, участвовавшие в исследовании, разработаны Санкт-Петербургским институтом биорегуляции и геронтологии и являются по своей сути парафармацевтическими комплексами низкомолекулярных пептидов с молекулярной массой до 5000 Да, выделенными из органов и тканей молодых животных — телят до 12-месячного возраста. В качестве обоснования для настоящего исследования послужили данные изучения эффективности представленных препаратов, полученные ранее.
«Женолутен» обладает тканеспецифическим регулирующим действием на клетки тканей яичников, обменные процессы в них; способствует уменьшению выраженности патологических изменений в них, нормализации гормонального статуса и менструальной функции.
«Эндолутен» обладает тканеспецифическим регулирующим действием на клетки шишковидной железы, нормализует синтез и экскрецию эндогенного серотонина и мелатонина, что проявляется в восстановлении пульсового ритма секреции ФСГ и ЛГ; нормализации работы нервной, эндокринной, репродуктивной, иммунной систем; коррекции менструальной функции, липидного и углеводного обмена; антиатерогенном, антидиабетическом и антиаутоиммунном эффектах.
Комплекс пептидных препаратов назначался по следующей схеме:
— «Женолутен» — 2 капсулы (20 мг) в сутки в утренние часы в течение 4 месяцев;
— «Эндолутен» — 1 капсула (10 мг) утром 1 раз в 72 ч в течение 4 месяцев.
Применение препарата шишковидной железы в сниженной дозе и с интервалом в 72 ч основано на огромном количестве наблюдений, которые показали зависимость эффектов препарата от его дозы и периодичности приема. При применении препарата эпифиза в «стандартной дозе» (20 мг утром ежедневно) примерно в 40% случаев наблюдаются колебания уровня артериального давления, нарушения сна, резкие колебания уровня сахара крови. Репродуктивная система женского организма также достаточно резко реагирует на подобную схему приема. Изменяется менструальный цикл. Могут наблюдаться дисфункциональные маточные кровотечения или наоборот — полное временное прекращение менструаций. Были нередки случаи образования множественных фолликулярных кист яичников, разрастания эндометрия и стимуляции роста миоматозных узлов.
Совершенно обратная ситуация наблюдается при применении препарата шишковидной железы в сниженной дозе (10 мг) с периодичностью 72 ч (48 ч для синтезированных аналогов пептида эпифиза). При такой адаптированной схеме наблюдается эффект самоадаптации и калибровки функции надпочечников, гипоталамуса и гипофиза, поскольку все они функционально связаны с работой шишковидной железы. Поэтому данная схема применения является наиболее физиологически правильной.
Критериями оценки эффективности комплекса пептидов являлись:
— показатели уровня стимуляции яичников (ФСГ крови);
— показатели уровня эстрогенпродуцирующей функции яичников (эстрадиол крови);
— показатели функционального резерва яичников (определение уровня антимюллеровского гормона (АМГ) и количества антральных фолликулов в яичниках при проведении ультразвуковой диагностики).
Результаты исследования
Установлено, что применение комплекса пептидных препаратов у пациенток со снижением репродуктивной функции способствовало улучшению общего самочувствия и лабораторных показателей. Данные динамики отображены в таблице 1.
Таблица 1
Показатели гормонального статуса и репродуктивной функции у 276 человек на фоне применения пептидных препаратов яичников и шишковидной железы
|
Показатель |
Норма (фолликулярная фаза) |
До начала терапии (контрольная группа, 62 чел) |
Через 4 месяца от начала терапии (контрольная группа, 62 чел) |
До начала терапии (вторая группа, 214 чел) |
Через 4 месяца от начала терапии (вторая группа, 214 чел) |
|
Фолликулостимулирующий гормон, мМЕ/л |
1,37–9,90 |
6,38±0,42 |
5,71±0,29 |
6,24±0,31 |
4,96±0,29* |
|
Эстрадиол, пмоль/л |
68–1269 |
183,14±16,92 |
209,26±12,64 |
194,16±11,57 |
616,24±69,42* |
|
Антимюллеровский гормон, нг/мл |
1,0–12,6 |
0,74±0,12 |
0,82±0,24 |
0,76±0,13 |
1,16±0,18* (68% общего количества случаев) |
|
Антральные фолликулы по данным УЗИ (правый яичник) |
10-25 |
7–8 |
7–8 |
7–8 |
10–11* |
|
Антральные фолликулы по данным УЗИ (левый яичник) |
10–25 |
7–8 |
8–9 |
7–8 |
11–12* (98% общего количества случаев) |
* Достоверно в сравнении с данными контрольной группы.
Как видно из приведенной таблицы, комплекс пептидов яичников и шишковидной железы оказывает выраженное положительное действие на гормональный статус репродуктивной системы. Причем на начальных этапах терапии отмечается умеренная стимуляция функции яичников (повышение уровня ФСГ) с последующей стабилизацией показателей их центральной регуляции. В процессе терапии уровень эстрадиола повышается и остается в диапазоне оптимальных значений в течение нескольких месяцев после окончания курса пептидов. Показатели функционального резерва яичников также изменяются, причем это больше актуально в отношении антральных фолликулов яичников. Если в первые 2 месяца терапии наблюдается лишь тенденция к увеличению их количества, то спустя 4 месяца эти изменения актуальны и достоверны. Динамика уровня АМГ менее резкая, но тоже имеет место в 68% случаев. В группе, получавшей плацебо, динамика со стороны уровня ФСГ и эстрадиола минимальная. Наблюдалась лишь тенденция к увеличению уровня эстрадиола и снижению ФСГ. Показатели функционального резерва в контрольной группе не менялись. Результаты представлены в таблицах 1 и 2.
Таблица 2
Динамика показателей функционального резерва яичников у второй группы на фоне применения пептидных препаратов яичников и шишковидной железы (214 человек)
|
Показатель |
Пациентки, у которых наблюдались улучшения, чел |
|
|
через 2 месяца от начала терапии |
через 4 месяца от начала терапии |
|
|
Увеличение числа антральных фолликулов |
119 (56%) |
209 (98%)* |
|
Повышение уровня антимюллеровского гормона |
97 (45%) |
146 (68%)* |
* Достоверно в сравнении с данными группы до начала терапии.
Еще один немаловажный аспект — это не просто нормализация гормонального статуса женщины и приведение его в возрастную норму, а наступление беременности. Анализируя данные, можно говорить, что курсовое применение пептидных препаратов яичников и шишковидной железы существенно повышает шансы на зачатие. Результаты представлены в таблице 3.
Таблица 3
Частота случаев наступления беременности естественным способом после курса биорегулирующей терапии пептидами яичников и шишковидной железы у второй группы (214 человек)
|
Показатель |
Количество пациенток |
||
|
через 4–6 месяцев от начала терапии |
через 6–8 месяцев от начала терапии |
всего |
|
|
Наступление беременности без применения гормональной стимуляции |
152 (71%) |
28 (13%) |
180 (84%) |
Эффективность терапии составила 84%. В группе, получавшей плацебо, беременность наступила в 8 случаях из 62 (13%). Для улучшения результатов терапии пептидами имеет смысл проводить либо более длительный курс (6 месяцев), либо после перерыва в 1–2 месяца провести повторный 4-месячный курс препаратов.
На основании полученных данных можно сделать вывод о том, что комплекс пептидов яичников и шишковидной железы оказывает регулирующее действие на работу репродуктивной системы, ее биологический возраст, функциональный резерв, а также способствует улучшению фертильности. Особую актуальность подобная терапия может иметь для профилактики старения сосудов, кожи, костей и суставов, поскольку реологические свойства крови, ее липидный спектр, а также состояние коллагена и эластина являются частично сопряженными с гормональной функцией яичников. Таким образом, результаты исследования свидетельствуют об эффективности и целесообразности применения комплекса пептидов яичников и шишковидной железы в составе схем подготовки к зачатию. Препараты при правильном приеме не вызывают побочных действий, осложнений и лекарственной зависимости. Абсолютных противопоказаний к их применению нет.
Рекомендуемые дозировки препаратов:
— «Женолутен» — 2 капсулы в сутки в течение 4 месяцев;
— «Эндолутен» — 1 капсула утром 1 раз в 72 ч в течение 4 месяцев.
Целесообразно проводить повторные курсы каждые 4–6 месяцев.
Заключение
На основании данных, полученных в ходе исследования, можно сделать вывод о том, что существующие традиционные схемы коррекции гормонального баланса и менструальной функции требуют пересмотра и нового подхода. Последний связан с включением в эти схемы высокоэффективных физиологичных пептидных препаратов центрального и адресного действия, направленных на расширение резервных возможностей органов и тканей нейроэндокринной и репродуктивной систем.
Вся правда о гормонозаместительной терапии
Беру на себя смелость описать преимущества и страхи перед назначением гормонозаместительной терапии (ГЗТ). Уверяю вас – будет интересно!
Менопауза, как утверждает современная наука, это не здоровье, это болезнь. Характерными специфическими проявлениями для неё являются вазомоторная нестабильность (приливы), психологические и психосоматические расстройства (депрессия, тревожность и др.), урогенитальные симптомы -сухость слизистых, болезненное мочеиспускание и ноктурия — «ночные хождения в туалет». Долговременные последствия: ССЗ (сердечно-сосудистые заболевания), остеопороз (снижение плотности костной ткани и переломы), остеоартроз и болезнь Альцгеймера (слабоумие). А так же сахарный диабет и ожирение.
ГЗТ у женщин сложнее и многограннее, чем у мужчин. Если мужчине нужен для замещения только тестостерон, то женщине и эстрогены, и прогестерон, и тестостерон, а иногда и тироксин.
При ГЗТ используются меньшие дозы гормонов, чем в препаратах гормональной контрацепции. Препараты ГЗТ не обладают контрацептивными свойствами.
Все приведённые ниже материалы основаны на результатах крупномасштабного клинического исследования ГЗТ у женщин: Womens Health Initiative (WHI) и опубликованы в 2012 году в консенсусе по гормонозаместительноной терапии НИИ Акушерства и гинекологии им. В.И. Кулакова (Москва).
Итак, основные постулаты ГЗТ.
- ГЗТ можно начинать принимать ещё в течение 10 лет после прекращения менструального цикла (учитывая противопоказания!). Этот период называется «окном терапевтических возможностей». Старше 60 лет ГЗТ обычно не назначают.
Как долго назначают ГЗТ? – «Столько, сколько нужно» Для этого в каждом конкретном случае надо определиться с целью применения ГЗТ, чтобы определить сроки ГЗТ. Максимальный срок использования ГЗТ: «последний день жизни – последняя таблетка». - Основным показанием к ГЗТ являются вазомоторные симптомы менопаузы (это климактерические проявления: приливы), и урогенитальные расстройства (диспариуния -дискомфорт при половом акте, сухость слизистых, дискомфорт при мочеиспускании и др.)
- При правильном выборе ГЗТ нет данных об увеличении частоты рака молочной железы и органов малого таза, риск может повышаться при длительности терапии более 15 лет! А так же ГЗТ может использоваться после лечения рака эндометрия 1 стадии, меланоме, цистаденомах яичников.
- При удалённой матке (хирургическая менопауза) — ГЗТ получают в виде монотерапии эстрогенами.
- При вовремя начатой ГЗТ снижается риск сердечно- сосудистых заболевний и нарушения обмена веществ. То есть, при проведении гормонозаместительной терапии поддерживается нормальный обмен жиров (и углеводов), и это является профилактикой развития атеросклероза и сахарного диабета, так как дефицит половых гормонов в постменопаузе усугубляет имеющиеся, а иногда провоцирует начало метаболических нарушений.
- Риск тромбозов повышается при использовании ГЗТ при ИМТ (индексе массы тела) = более 25, то есть при избытке веса!!! Вывод: избыток веса — это всегда вред.
- Риск тромбозов выше у курящих женщин. (особенно при выкуривании более 12 пачки в день).
- Желательно использование в ГЗТ метаболически нейтральных гестагенов (эта информация больше для врачей)
- Трансдермальные формы (наружные, то есть гели) предпочтительнее при ГЗТ, они в России существуют!
- Психо-эмоциональные расстройства часто превалируют в климактерии (что не позволяет за их «маской» разглядеть психогенное заболевание). Поэтому ГЗТ можно давать в течение 1 месяца для проведения пробной терапии с целью дифференциальной диагностики с психогенными заболеваниями (эндогенной депрессией и т.д.).
- При наличии не леченной артериальной гипертензии, ГЗТ возможна только после стабилизации артериального давления.
- Назначение ГЗТ возможно только после нормализации гипертриглицеридемии** (триглицериды — вторые, после холестерина, «вредные» жиры, которые запускают процесс атеросклероза. А вот, трансдермальная (в виде гелей) ГЗТ возможна на фоне повышенного уровня триглицеридов).
- У 5 % женщин климактерические проявления сохраняются в течение 25 лет после прекращения менструального цикла. Для них особенно важна ГЗТ для поддержания нормального самочувствия.
- ГЗТ – это не способ лечения остеопороза, это способ профилактики (надо заметить – более дешевый способ профилактики, чем потом стоимость лечения самого остеопороза).
- Повышение веса часто сопровождает менопаузу, иногда это дополнительно + 25 кг и более, это вызвано дефицитом половых гормонов и связанных с ними нарушений (инсулинорезистентностью, нарушением толерантности к углеводам, снижением выработки инсулина поджелудочной железой, повышение выработки холестерина и триглицеридов печенью). Это называется общим словом – менопаузальный метаболический синдром. Вовремя назначенная ГЗТ – способ профилактики менопаузального метаболического синдрома (при условии, что его не было раньше, до периода менопаузы!)
- По типу климактерических проявлений можно определить каких гормонов в организме женщине не хватает, ещё до забора крови на гормональный анализ. По этим признакам климактерические расстройства у женщин делят на 3 типа:
а) 1 тип — только эстроген-дефицитный: вес стабилен, нет абдоминального ожирения (на уровне живота), нет снижения либидо, нет депрессии и нарушений мочеиспускания и снижения мышечной массы, но есть климактерические приливы, сухость слизистых ( +диспариуния), и бессимптомный остеопороз;
б) 2 тип (только андроген-дефицитный, депрессивный) если у женщины есть прибавка веса резко в области живота — абдоминальное ожирение, нарастание слабости и снижения мышечной массы, ноктурия — «ночные позывы в туалет», сексуальные расстройства, депрессия, но нет приливов и остеопороза по денситометрии (это изолированная нехватка «мужских» гормонов);
в) 3 тип, смешанный, эстроген-андроген-дефицитный: если выражены все перечисленные ранее нарушения — выражены приливы и урогенитальные расстройства (диспариуния, сухость слизистых и др.), резкое повышение веса, снижение мышечной массы, депрессия, слабость – то не хватает как эстрогенов, так и тестостерона, они оба требуются для ГЗТ.
Нельзя сказать что какой либо из этих типов благоприятнее, чем другой.
**Классификация по материалам Апетова С.С. - Вопрос о возможном применении ЗГТ в комплексной терапии стрессового недержания мочи в менопаузе должен решаться индивидуально.
- ГЗТ используется для профилактики деградации хряща, в некоторых случаях и для лечения остеоартроза. Увеличение частоты остеоартрита с множественным поражением суставов у женщин после наступления менопаузы указывает на вовлечение женских половых гормонов в поддержание гомеостаза суставных хрящей и межпозвоночных дисков.
- Доказана польза терапии эстрогенами в отношении когнитивной функции (память и внимание).
- Лечение с помощью ГЗТ предотвращает развитие депрессивно-тревожного состояния, которое часто реализуется с менопаузой у предрасположенных к нему женщин (но эффект этой терапии возникает при условии, если терапия ГЗТ начата первые годы менопаузы, а лучше пременопаузы).
- Я уже не пишу о пользе ГЗТ для сексуальной функции женщины, эстетических (косметологических) моментах –профилактика «провисания» кожи лица и шеи, профилактика усугубления морщин, седины, потери зубов (от пародонтоза) и др.
Противопоказания к ГЗТ:
Основные 3:
- Рак молочных желез в анамнезе, в настоящее время или при подозрении на него; при наличии наследственности по раку молочной железы, женщине необходимо сделать генетический анализ на ген данного рака! И при высоком риске рака — ГЗТ уже не обсуждается.
- Венозная тромбоэмболия в анамнезе или в настоящее время (тромбоз глубоких вен, легочная эмболия) и артериальная тромбоэмболическая болезнь в настоящее время или в анамнезе (например: стенокардия, инфаркт миокарда, инсульт).
- Заболевания печени в стадии обострения.
Дополнительные:
- эстроген-зависимые злокачественные опухоли, например, рак эндометрия или при подозрении на эту патологию;
- кровотечения из половых путей неясной этиологии;
- нелеченная гиперплазия эндометрия;
- некомпенсированная артериальная гипертензия;
- аллергия к активным веществам или к любому из составляющих препарата;
- кожная порфирия;
- разрегулированный сахарный диабет 2 типа
Обследования перед назначением ЗГТ:
- Сбор анамнеза (для выявления факторов риска ГЗТ): осмотр, рост, вес, ИМТ, окружность живота, АД.
- Гинекологический осмотр, забор мазков на онкоцитологию, УЗИ органов малого таза.
- Маммография
- Липидограмма, сахар крови, или сахарная кривая с 75 гр глюкозы, инсулин с подсчётом индекса НОМА
- Дополнительно (не обязательны):
- анализ на ФСГ, эстрадиол, ТТГ, пролактин, тестостерон общий, 25-ОН-витамин Д, АЛТ, АСТ, креатинин, коагулограмма, СА-125
- Денситометрия (на остеопороз), ЭКГ.
- Индивидуально – УЗДГ вен и артерий
О препаратах, используемых в ГЗТ.
У женщин 42-52 лет при сочетании регулярных циклов с задержками цикла (как явление пременопаузы), нуждающихся в контрацепции, не курящих!!!, можно использовать не ГЗТ а контрацепцию — Джес, Логест, Линдинет, Мерсилон или Регулон/ или использование внутриматочной системы — Мирены (при отсутствии противопоказаний).
Далее переходят на ГЗТ в циклическом режиме (с менструальноподрбными кровотечениями), при прекращении цикла — переходят на непрерывный режим терапии.
Этрогены накожные (гели):
Дивигель 0.5 и 1 гр 0.1%, Эстрожель
Комбинированные препараты Э/Г для циклической терапии: Фемостон 2/10, 1/10, Климинорм, Дивина, Трисеквенс
Комбинированные препараты Э/Г для непрерывного приёма: Фемостон 1/2.5 конти, Фемостон 1/5, Анжелик, Клмодиен, Индивина, Паузогест, Климара, Прогинова, Паузогест, Овестин
Тиболон
Гестагены: Дюфастон, Утрожестан
Андрогены: Андрогель, Омнадрен-250
К альтернативным методам лечения относятся
растительные препараты: фитоэстрогены и фитогормоны. Данные о долговременной безопасности и эффективности этой терапии не достаточны.
В некоторых случаях возможно единовременное сочетание гормональной ГЗТ и фитоэстрогенов. (например, при недостаточном купировании приливов одним видом ГЗТ).
Женщины, получающие ЗГT, должны не реже одного раза в год посещать врача. Первое посещение намечается через 3 месяца от начала ГЗТ. Необходимые обследования для мониторирования ГЗТ врач вам назначит, учитывая особенности вашего здоровья!

Важно! Обращение администрации сайта о вопросах в блоге:
Уважаемые читатели! Создавая этот блог, мы ставили себе цель дать людям информацию по эндокринным проблемам, методам диагностики и лечения. А также по сопутствующим вопросам: питанию, физической активности, образу жизни. Его основная функция – просветительская.
В рамках блога в ответах на вопросы мы не можем оказывать полноценные врачебные консультации, это связано и недостатком информации о пациенте и с затратами времени врача, для того чтобы изучить каждый случай. В блоге возможны только ответы общего плана. Но мы понимаем, что не везде есть возможность проконсультироваться с эндокринологом по месту жительства, иногда важно получить еще одно врачебное мнение. Для таких ситуаций, когда нужно более глубокое погружение, изучение медицинских документов, у нас в центре есть формат платных заочных консультаций по медицинской документации.
Как это сделать? В прейскуранте нашего центра есть заочная консультация по медицинской документации, стоимостью 3900 руб. Если эта сумма вас устраивает, вы можете прислать на адрес patient@mc21.ru сканы медицинских документов, видеозапись, подробное описание, все то, что сочтете нужным по своей проблеме и вопросы, на которые хотите получить ответы. Врач посмотрит, можно ли по представленной информации дать полноценное заключение и рекомендации. Если да, вышлем реквизиты, вы оплатите, врач пришлет заключение. Если по предоставленным документам нельзя дать ответ, который можно было бы рассматривать как консультацию врача, мы пришлем письмо о том, что в данном случае заочные рекомендации или выводы невозможны, и оплату брать, естественно, не будем.
С уважением, администрация Медицинского центра «XXI век»
Мы используем cookies
Во время посещения сайта вы соглашаетесь с тем, что мы обрабатываем ваши персональные данные.
Подробнее
Таблетки массой 0,215 г и 0,08 г; капсулы по 0,215 г.
Номер свидетельства
Форма выпуска
Таблетки массой 0,215 г и 0,08 г; капсулы по 0,215 г.
Состав
Состав (капсулы): носитель МКЦ; оболочка капсулы (желатин) или оболочка капсулы (носитель гидроксипропилметилцеллюлоза, вода очищенная, загуститель каррагинан, консервант ацетат калия); пептидный комплекс А-8 (экстракт из эпифиза телят не старше 12-месячного возраста или свиней); антислёживающий агент кальциевая соль стеариновой кислоты.
Состав (таблетки): подсластитель сорбит; носитель МКЦ; пептидный комплекс А-8 (экстракт из эпифиза телят не старше 12-месячного возраста или свиней); какао порошок; антислёживающий агент кальциевая соль стеариновой кислоты; ароматизатор «Ваниль» (мальтодекстрин, антислёживающий агент диоксид кремния аморфный E551, вкусоароматические вещества).
Область применения
Для реализации населению в качестве биологически активной добавки к пище — источника пептидов.
Рекомендации по применению
Взрослым по 1–2 таблетки (капсулы) 1–2 раза в день во время еды. Продолжительность приёма — 1 месяц. При необходимости приём БАД можно повторить через 3–6 месяцев.
Противопоказания
Индивидуальная непереносимость компонентов, беременность, кормление грудью, склонность к расстройствам функции кишечника* (*для БАД в форме таблеток).
Особые указания
Перед применением рекомендуется проконсультироваться с врачом.
Условия хранения
Хранить в сухом, защищённом от попадания прямых солнечных лучей, недоступном для детей месте при температуре от 2 °C до 25 °C.
Условия реализации
Места реализации определяются национальным законодательством государств-членов Евразийского экономического союза.
Производитель
ООО «ФАРМАКОР ПРОДАКШН», 197375, г. Санкт-Петербург, ул. Репищева, д. 14, корпус 5, офис 247 (адрес места осуществления деятельности по изготовлению продукции: 197375, г. Санкт-Петербург, ул. Репищева, д. 14) (Российская Федерация); ООО «Химико-биологическое объединение «Фирма ВИТА» (ООО «ХБО «ВИТА»), 192148, г. Санкт-Петербург, Старопутиловский вал, д. 7, корп. 2, литер А
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о биологически активной добавке ЭНДОЛУТЕН®:
- Отзывы
- Вопросы
Информация о биологически активной добавке ЭНДОЛУТЕН® предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения содержатся в инструкции производителя, прилагаемой к упаковке БАД.
Отзывы и статьи
Эндолутен пептиды эпифиза — клиническое исследование
30 декабря 2022, 17:30
Эндолутен — это пептиды эпифиза или шишковидной железы. Не смотря на крохотные размеры, шишковидная железа имеет большое значение для здоровой работы организма. Она влияет на общую заболеваемость, гормональный фон, а так же стабильная эпифиза — сможет продлить молодость как можно дольше. Несмоненно Эндолутен это самый популярный из всех пептидов Хавинсона и самый дорогой. В 2011 года ученые решили провести клиническое испытания Эндолутена, чтобы разобраться в том, насколько пептид эффективен на самом деле.
Для клинического исследования было отобрано 163 больных (48 мужчин и 115 женщин) с дисгормональной миокардиодистрофией, физиогенной астенией, климактерическим синдромом легкой и средней степени тяжести у женщин, а так же онкологических больных после курсов лучевой и химиотерапии. Пациенты были разделены на 2 группы. Контрольная группа — 64 человека, которые получали общепринятое лечение. Основная группа дополнительно к общеприянытому лечению использовала Эндолутен по 1-3 капсулы до еды, 2-3 раза в день в течение 15-30 дней.
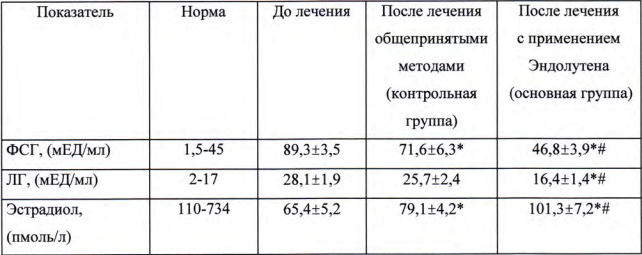
Влияние Эндолутена на содержание гормонов гипофиза в сыворотке крови больных дисгормональной миокардиодистрофией
В процессе применения Эндолутена у больных дисгормональной миокардиодистрофией отмечалось улучшение субъективных показателей заболевания, что проявляллось в уменьшении приступов болей в области сердца, повышении работоспоосбности и нормализации психоэмоционального состояния.
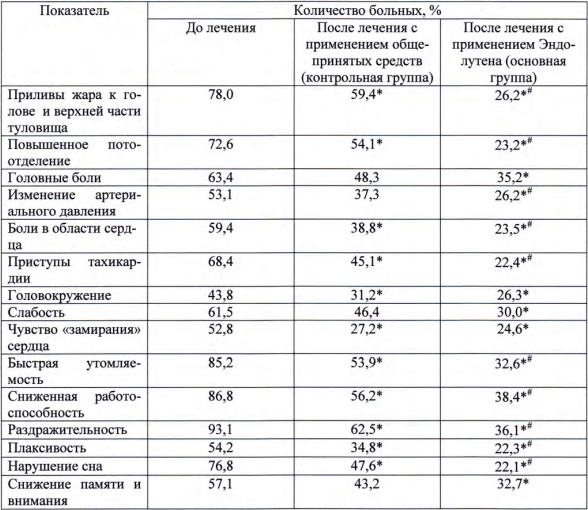
Динамика субъективных показателей у больных с климактерическим синдромом
У пациенток с климактерическим синдромом отмечалось улучшение субъективных показателей, что проявлялось в уменьшении приступов болей в области сердца, головокружения, улучшении сна. Уменьшилось количество жалоб на потоотделения, приливы жара в голове, колебания артериального давления. Таким образом, полученные результаты свидетельствуют о лечебной и профилактической эффективности Эндолутена и целесообразности его применения для профилактики и в комплексном лечении различных патологических состояний и заболеваний, связанных с нарушением нейроэндокринной регуляции основных функций организма.
Полный текст исследования : https://disk.yandex.ru/i/7OlsEm7uVg6_-g
Пептидный препарат Кортексин, представляющий собой комплекс натуральных низкомолекулярных соединений мозга животных (высокоочищенная вытяжка ядерных белков), продолжает оставаться одним из самых широко обсуждаемых в периодической медицинской печати фармакологических средств. При этом внимание привлекают два аспекта: во-первых, применение Кортексина представителями различных врачебных специальностей (мультидисциплинарность в целевом назначении препарата), а во-вторых, отсутствие возрастных ограничений к его использованию. В современной фармакопее существует не слишком много подобных лекарственных препаратов, не имеющих возрастных противопоказаний и ограничений к применению. Поэтому Кортексин, обосновано называемый «препаратом XXI века», заслуживает более подробного рассмотрения [1].
Категоризация и состав Кортексина
Как известно, Кортексин принадлежит к фармакологической группе 9.7 («Ноотропы (нейрометаболические стимуляторы)»). По АТХ-системе (анатомо-терапевтически-химической) классификации препарат относится к рубрике N06BX («Другие психостимуляторы и ноотропные препараты»). Среди пептидных препаратов х-классов (цитогены, цитамины, цитомедины) Кортексин относится к цитомединам, которые представляют собой высокоочищенную вытяжку ядерных белков (фракции 1–10 кДа) и характеризуются подтвержденным свойством к регуляции иммунологической реактивности [2]. Кортексин — инновационный пептидный препарат; его субстанция и лекарственные формы защищены патентами РФ (РФ № 2104702, 2275924, 2195297) и других стран.
Кортексин — многокомпонентный препарат, состав которого не ограчивается нейропептидными субстанциями. Помимо нейропептидов, ингредиенты Кортексина представлены не менее чем тремя группами веществ: аминокислотами, витаминами и минеральными веществами. Есть основания полагать, что положительные эффекты препарата объясняются не только действием аминокислот и полипептидов, но и нейрохимической активностью макро- и микроэлементов, витаминов [3, 4].
В частности, в составе пептидов Кортексина имеется не менее двух стимулирующих аминокислот — аспарагиновой кислоты (446 нмоль/мг) и глицина (298 нмоль/мг). Помимо вышеназванных аспарагиновой кислоты и глицина, в Кортексине представлены следующие аминокислоты:
-
треонин (212 нмоль/мг);
-
серин (268 нмоль/мг);
-
глутаминовая кислота (581 нмоль/мг);
-
пролин (187 нмоль/мг);
-
аланин (346 нмоль/мг);
-
валин (240 нмоль/мг);
-
изолейцин (356 нмоль/мг);
-
тирозин (109 нмоль/мг);
-
фенилаланин (162 нмоль/мг);
-
гистидин (116 нмоль/мг);
-
лизин (253 нмоль/мг);
-
аргинин и другие аминокислоты (202 нмоль/мг).
Из представленной информации следует, что на долю аспарагиновой кислоты приходится до 12%, а глутаминовой кислоты — около 15% от общего содержания аминокислот в составе пептидов Кортексина. Метионина в препарате не содержится. Кроме того, стабилизатором препарата является свободная аминокислота глицин (12 мг), роль которой в нормализации функций коры головного мозга многократно доказана.
В Кортексине представлен ряд витаминов, в частности, водорастворимые: тиамин (витамин В1) — 0,08 мкг/10 мг, рибофлавин (витамин В2) — 0,03 мкг/10 мг, ниацин (витамин В3, витамин РР, никотиновая кислота) — 0,05 мкг/10 мг; а также жирорастворимые: ретинол (витамин А) — 0,011 мкг/10 мг, альфа-токоферол (витамин Е) — 0,007 мкг/10 мг. Надо признать откровенно, что такой витаминный состав является оптимальным для нейронов головного мозга, так как идеально сбалансирован природой!
Кроме пяти эссенциальных витаминов, в препарате Кортексин содержится немало минеральных веществ (макро- и микроэлементов):
-
медь (Cu): 0,2129 мкг/10 мг;
-
железо (Fe): 2,26 мкг/10 мг;
-
кальций (Ca): 22,93 мкг/10 мг;
-
магний (Mg): 8,5 мкг/10 мг;
-
калий (K): 19,83 мкг/10 мг;
-
натрий (Na): 643,2 мкг/10 мг;
-
сера (S): 152,65 мкг/10 мг;
-
фосфор (P): 91,95 мкг/10 мг;
-
цинк (Zn): 4,73 мкг/10 мг;
-
молибден (Mb): 0,0203 мкг/10 мг;
-
кобальт (Co): 0,0044 мкг/10 мг;
-
марганец (Mn): 0,0061 мкг/10 мг;
-
селен (Se): 0,0745 мкг/10 мг;
-
алюминий (Al): 0,3104 мкг/10 мг;
-
литий (Li): 0,0340 мкг/10 мг [4].
Практически все из перечисленных минеральных веществ, входящих в состав препарата Кортексин, обладают нейромодулирующими и иными функциями.
Традиционные и новые области применения Кортексина
Кортексин применяется не только в Российской Федерации. Он зарегистрирован и используется в таких странах, как Украина, Беларусь, Армения, Узбекистан, Казахстан, Азербайджан, Киргизия, Таджикистан и Молдова (применению Кортексина во всех случаях предшествовала доклиническая и клиническая экспертиза).
Важнейшим свойством Кортексина, определяющим области его использования, считается коррекция когнитивных функций, но когнитивно-модулирующий эффект препарата является далеко не единственным. Описаны ноотропный, нейротрофический, антиконвульсантный, иммуномодулирующий (иммунорегуляторный) и нейропротекторный эффекты препарата, а также его антистрессорное, антиоксидантное и метаболическое действие. В связи с последним хотелось бы особенно отметить способность Кортексина к нормализации обмена нейромедиаторов и регуляции баланса активирующих/тормозных аминокислот.
Поэтому на протяжении последних 10 лет Кортексин активно использовался российскими врачами в различных областях клинической медицины (в неврологии, педиатрии, офтальмологии, геронтологии и т. д.): при черепно-мозговых травмах, нейроинфекциях, детском церебральном параличе (ДЦП), перинатальном поражении нервной системы, нарушениях (задержка) психомоторного и речевого развития, нарушениях мышления, сниженной способности к обучению, невротических расстройствах, синдроме дефицита внимания и гиперактивности (СДВГ), синдроме эмоционального выгорания, вегетативной дисфункции, гипертензивной ангиоретинопатии, глаукоме, диабетической нейропатии, амблиопии и т. д. [1–6].
Следует отметить, что для препарата Кортексин обнаруживаются все новые области применения. Так, Бочкова Л. Г. и Носова О. М. (2008) сообщают об опыте использования Кортексина при лечении натальной цервикальной травмы у новорожденных, Каменских Т. Г. и соавт. (2006) — в терапии частичной атрофии зрительного нерва (ЧАЗН), Утаганова Г. Х. (2010) — в коррекции шейно-спондилогенных поражений у детей раннего возраста [7–9].
Кортексин активно используется в геронтологии (нарушения мозгового кровообращения, астенические состояния, энцефалопатии различного генеза и т. д.) [10]. Достаточно вспомнить, что препарат был впервые внедрен в клиническую практику сотрудниками Военно-Медицинской Академии (на полях сражений в Афганистане [16, 17]), а затем сотрудниками Санкт-Петербургского института биорегуляции и геронтологии СЗО РАМН. По утверждению член-корреспондента РАМН, проф. Хавинсона В. Х., являющегося вице-президентом Геронтологического общества РАН, «использование пептидных препаратов позволяет эффективно проводить профилактику преждевременного старения, а также лечить заболевания, ассоциированные с возрастом…».
Использование Кортексина при мигрени, рекомендуемое Пак Л. А. и соавт. (2005, 2006, 2008), Иззати-Заде К. Ф. и соавт. (2006) и др., уже прочно вошло в практику российских неврологов, занимающихся этой группой первичных цефалгий [11–14]. Указывается, что во время приступа мигрени Кортексин стабилизирует мембраны тромбоцитов, тормозит развитие «серотонинового каскада», подавляет нейрональную корковую депрессию Лео, снижает нейрогенное воспаление сосудов твердой оболочки мозга, подавляет высвобождение нейропептидов боли и воспаления из периваскулярных афферентных волокон тройничного нерва [14].
Предварительные исследования сотрудников НЦЗД РАМН позволяют предположить, что в ближайшем будущем Кортексин будет применяться в качестве средства для коррекции различных форм неврологического дефицита, сопутствующего некоторым разновидностям пищевой непереносимости (целиакия, лактазная недостаточность и др.) в детском возрасте, а впоследствии — у совершеннолетних пациентов. Но, по-видимому, наиболее впечатляющей является возможность применения препарата в лечении эпилепсии.
Кортексин и эпилепсия
Терапия эпилепсии — сравнительно недавнее показание к применению Кортексина. Об использовании Кортексина в комплексном лечении различных форм эпилепсии сообщается в работах Гузевой В. И. и Трубачевой А. Н. (2003), Головкина В. И. (2005, 2006) и Звонковой Н. Г. (2006) [15–18]. Хоршев С. К. и соавт. (2002, 2008) рассматривают Кортексин в качестве корректора нейроиммунной составляющей эпилептогенеза и, основываясь на данных собственных биохимических и нейроиммунофизиологических исследований, рекомендуют этот нейропептидный препарат для профилактического лечения эпилепсии [19, 20]. Эффективности Кортексина в терапии эпилепсии у детей и взрослых посвящены публикации Цыгана В. Н. и соавт. (2008) и Федуновой Г. В. и соавт. (2008) [21, 22]. На необходимость коррекции когнитивных нарушений ноотропными препаратами при эпилепсии указывают Балканская С. В. и соавт. (2007, 2008) и Калинин В. В. и соавт. (2009) [23–25]. Именно Кортексину в этом плане принадлежит немаловажная роль.
Наконец, в апреле 2010 г. на XVII Российском национальном конгрессе «Человек и лекарство» при поддержке компании «Герофарм» был проведен симпозиум «Нейропротекция в терапии эпилепсии» (под председательством проф. Гехт А. Б.). В ходе работы указанного симпозиума докладчики (Калинин В. В., Калачева И. О., Одинцова Г. В.) отразили как теоретические аспекты, так и собственный опыт применения препарата Кортексин в лечении эпилепсии у детей и совершеннолетних пациентов.
В частности, в Институте мозга РАН (Н. Ю. Королева и Г. В. Одинцова) имеется положительный опыт применения Кортексина у 8 000 пациентов, и, как отметила А. Б. Гехт, в это учреждение поступают «далеко не самые легкие больные».
Не исключено, что в дальнейшем Кортексин найдет широкое применение в превентивном лечении фебрильных судорог (ФС), являющихся наиболее частым хроническим нарушением церебральных функций у детей.
Кортексин для детей — новая форма нейропептидного препарата
Новая форма препарата под названием «Кортексин для детей» была зарегистрирована в Российской Федерации 27 апреля 2009 г. [26].
Кортексин для детей — это лиофилизат для приготовления раствора для внутримышечного введения. В 1 флаконе (емкость 3 мл) содержатся 5 мг Кортексина (комплекс водорастворимых полипептидных фракций с молекулярной массой не более 10000 Да) вместо 10 мг, присутствующих в стандартной форме препарата Кортексин, а также глицин 6 мг как стабилизатор.
Фактически, Кортексин для детей — это чуть ли не единственный пример, когда препарат ноотропного действия адресно предназначается для пациентов педиатрического возраста. Предполагается, что новая форма пептидного препарата (Кортексин для детей) окажется востребованной и найдет самое широкое применение как в России, так и за ее пределами.
О чем умалчивает «Формулярная система»
Ранее нами уже неоднократно указывалось, что в «Формулярной системе» России отсутствует даже упоминание о Кортексине [2, 4, 6]. Приходится констатировать, что в XI выпуске (2010 г.) этого ежегодно обновляемого издания информация о Кортексине вновь отсутствует [27]. Это тем более странно, когда даже в интернет-энциклопедии «Википедия» представлены данные об этом «фармакопейном полипептидном биорегуляторе с биологической активностью».
Состав Кортексина в «Регистре лекарственных средств» (2010) представлен следующим образом: «в 1 флаконе Кортексина — 10 мг, глицина — 12 мг» (глицин, присутствующий в препарате, одновременно выполняет роль стабилизатора) [28]. В «Справочнике Видаль» (2010) состав Кортексина описан еще лаконичнее: «комплекс полипептидных фракций, выделенных из коры головного мозга крупного рогатого скота и свиней — 10 мг» [29]. На самом деле, как указывается выше, ингредиенты гораздо более многочисленны.
Мы постараемся представить информацию о препарате Кортексин, использовав форму, подобную обычно применяемой в «Федеральном руководстве по использованию лекарственных средств».
Кортексин (cortexin). Пептидный препарат, представляющий комплекс низкомолекулярных пептидов, выделенных из коры головного мозга крупного рогатого скота (телят) и свиней, не достигших 12-месячного возраста. Для выделения препарата используется метод уксусно-кислой экстракции. С целью получения фракции полипептидов с молекулярной массой, не превышающей 10000 Да (10 кДа), полученный экстракт подвергается многоступенчатой очистке и многократной фильтрации на специальных фильтрах. Очистка активной субстанции Кортексина обеспечивает инфекционную и антигенную безопасность препарата (отсутствие инфекционных агентов, нуклеиновых кислот, амилоидов, функционально активных проонкогенов и других нежелательных примесей).
Кортексин обладает выраженной метаболической активностью: нормализация обмена нейромедиаторов; регуляция баланса тормозных/активирующих аминокислот и уровней серотонина и дофамина; ГАМКергическое действие; антиоксидантный эффект; нормализация биоэлектрической активности (БЭА) мозга. Обладая выраженным тканеспецифическим действием на клетки коры головного мозга, этот нейропептидный препарат оказывает церебропротекторное, ноотропное, нейротрофическое), нейрометаболическое, стимулирующее, антистрессорное, антиоксидантное, противосудорожное и иммунорегуляторное действие.
Показания. Черепно-мозговая травма (ЧМТ), нарушения мозгового кровообращения (НМК — острые и хронические), нейроинфекции (вирусные и бактериальные), астенические состояния, энцефалопатии различного генеза, энцефалит (острый и хронический) и энцефаломиелит, эпилепсия, различные формы ДЦП, критические состояния новорожденных с перинатальным поражением нервной системы (ППНС), нарушения психомоторного и речевого развития, нарушения (снижение) памяти, мышления; нарушения других когнитивных функций (КФ), головные боли различного генеза и т. д.
Противопоказания. Индивидуальная непереносимость препарата, беременность, лактация.
Побочные эффекты. При применении по показаниям побочных эффектов Кортексина не выявлено.
Взаимодействие. Лекарственное взаимодействие препарата Кортексин с другими лекарственными средствами (ЛС) не описано.
Дозы и применение. Препарат назначают во внутримышечных введениях детям с массой тела до 20 кг — в дозе 0,5 мг/кг, а с массой тела более 20 кг — в дозе 10 мг. Продолжительность курса лечения Кортексином обычно составляет 10 дней. При необходимости предусмотрен повторный курс через 1–6 (чаще 3–6) месяцев.
Содержимое 1 флакона растворяют в 1–2 мл 0,5%-го раствора новокаина, воды для инъекций или 0,9%-го изотонического раствора NaCl.
Кортексин. Лиофилизированный порошок (лиофилизат) или пористая масса белого/белого с желтоватым оттенком цвета — для приготовления раствора для внутримышечного введения (флак.), 1 мл (1 мл = 10 мг).
Кортексин для детей. Лиофилизат для приготовления раствора для внутримышечного введения (флак.), 3 мл (5 мг).
* * *
В новом англоязычном научном журнале The Open Neuropsychopharmacology Journal, издаваемом с 2008 г. в Нидерландах, в конце 2009 г. появилась совместная публикация российских и итальянских ученых (Московский государственный университет им. М. В. Ломоносова, компания «Герофарм», L’Istituto Superiore di Sanita, Рим), посвященная применению препарата Кортексин и его влиянию на когнитивные функции и поведенческие реакции (в условиях эксперимента).
В частности, Adriani W. и cоавт. (2009) сообщают о подтвержденном анксиолитическом эффекте Кортексина, одновременно подчеркивая активность препарата при использовании в малых дозах и отсутствие побочных реакций при его применении в лечебных целях [30]. Такие публикации указывают не только на эффективность нейропептидного биорегулятора Кортексин с позиций доказательной медицины, но и на международное признание этого российского препарата.
Тканеспецифичность и высокая биодоступность Кортексина определяют все больший спектр возможностей для применения этого препарата в лечении пациентов, начиная с периода новорожденности и до старческого возраста.
Реальность дел в сегодняшней фармакологии такова, что фактически имеется очень скудный перечень препаратов, разрешенных для применения у детей, и в этом плане высокие терапевтические свойства Кортексина делают его препаратом выбора.
Литература
-
Дьяконов М. М. Кортексин — препарат XXI века. Лечение и профилактика заболеваний головного мозга // Aqua Vitae. 2001. № 3. С. 22–23.
-
Студеникин В. М. Применение препарата кортексин в нейропедиатрии // Мед. вестник. 2006. № 37 (380). С. 14.
-
Шабалов Н. П., Платонова Т. Н., Скоромец А. П. Кортексин в нейропедиатрии. Метод. реком. СПб. 2006. 64 с.
-
Студеникин В. М., Пак Л. А., Шелковский В. И. и др. Применение кортексина в детской неврологии: опыт и перспективы // Фарматека. 2008. № 14. С. 23–29.
-
Гранстрем О. К., Сорокина Е. Г., Сторожевых Т. П. и др. Последние новости о кортексине (нейропротекция на молекулярном уровне) // Terra Medica Nova. 2008. № 5. С. 1–4.
-
Студеникин В. М., Пак Л. А., Шелковский В. И. и др. Об опыте и перспективах применения отечественного нейропептидного препарата в детской неврологии // Леч. Врач. 2009. № 5. С. 42–45.
-
Бочкова Л. Г., Носова О. М. Ноотропная и нейропротекторная терапия новорожденных с натальной цервикальной травмой // Перинатология и педиатрия. 2008. № 1. С. 32–34.
-
Каменских Т. Г., Башкатов А. Н., Тучин В. В. и др. Клинико-экспериментальное обоснование применения препарата «Кортексин» в лечении частичной атрофии зрительного нерва // Русский мед. ж. 2006. № 4. С. 147–150.
-
Утаганова Г. Х. Натальные шейно-спондилогенные поражения у детей раннего возраста (клиника, диагностика, лечение). Автореф. дис. … канд. мед. наук. М., 2010. 28 с.
-
Морозов В. Г., Хавинсон В. Х. Перспективы применения цитомединов в клинической медицине и геронтологии // Клин. геронтология. 2000. Т. 78. № 2. С. 42–45.
-
Пак Л. А., Горюнова А. В., Студеникин В. М. и др. Оценка эффективности терапии первичных головных болей у детей пептидным биорегулятором кортексин // Педиатр. фармакология. 2005. Прилож. С. 121.
-
Пак Л. А., Горюнова А. В., Студеникин В. М. и др. Oпыт клинического применения препаратов топирамат и кортексин в превентивной терапии мигрени у детей // Вопр. совр. педиатрии. 2006. Т. 5. № 1. С. 441.
-
Пак Л. А., Горюнова А. В., Студеникин В. М. и др. Опыт терапии первичной головной боли у детей // Доктор.ру. 2008. № 4. С. 28–30.
-
Иззати-заде К. Ф., Лодочникова Л. Н., Шутов А. А. Мигрень — еще одна мишень для лечения кортексином // Нейроиммунология. 2006. Т. 4. № 3–4. С. 63–70.
-
Гузева В. И., Трубачева А. Н. Применение кортексина в комплексном лечении эпилепсии у детей // Terra Medica. 2003. № 2. C. 19–21.
-
Головкин В. И. Кортексин в лечении эпилепсии. В кн.: Кортексин — пятилетний опыт в отечественной неврологии / Под ред. Скоромца А. А., Дьяконова М. М. СПб.: Наука. 2005. С. 107–113.
-
Головкин В. И. Кортексин в лечении эпилепсии // Медико-фармацевт. вестн. Татарстана. 2006. № 6 (234). С. 15.
-
Звонкова Н. Г. Иммунологические показатели у детей с эпилепсией при использовании традиционных и альтернативных методов терапии. Автореф. дис. … к.м.н. М., 2006. 26 с.
-
Хоршев С. К., Поляков Ю. И., Бессмельцев С. С. Кортексин как корректор нейроиммунной составляющей эпилептогенеза. Мат. XI Всеросс. конф. «Нейроиммунология». СПб. 2002. С. 301–302.
-
Хоршев С. Л., Корсакова Е. А., Столяров И. Д. и др. Профилактическое лечение эпилепсии: возможности кортексина (нейроиммунофизиологическое и биохимическое исследование) // Нейроиммунология. 2008. Т. VI. № 1. С. 22–26.
-
Цыган В. Н., Миролюбов А. В., Богословский М. М. и др. Эффективность Кортексина при лечении эпилепсии // Terra Medica Nova. 2008. № 4. С. 20–24.
-
Федунова Г. В., Сысоева Е. Н. Опыт применения кортексина при симптоматической эпилепсии у детей // Глав. врач. 2008. № 4 (16). С. 32.
-
Балканская С. В., Студеникин В. М., Кузенкова Л. М. и др. Ноотропные препараты в коррекции когнитивных функций у детей с эпилепсией // Вопр. совр. педиатрии. 2007. Т. 6. № 2. С. 92–96.
-
Балканская С. В., Студеникин В. М., Кузенкова Л. М. и др. Когнитивные нарушения и их коррекция у детей с эпилепсией // Практика педиатра. 2008. № 3. С. 24–27.
-
Студеникин В. М. Кортексин для детей — новая форма популярного нейропептидного препарата // Мед. вестник. 2009. № 24. С. 13.
-
Калинин В. В., Железнова Е. В., Соколова Л. В. и др. Когнитивные и психотропные эффекты препарата Кортексин при лечении больных эпилепсией // Психиатрия и психофармакотерапия. 2009. Т. 11. № 3. С. 50–54.
-
Федеральное руководство по использованию лекарственных средств (формулярная система). Вып. XI. М.: Эхо. 2010.
-
Регистр лекарственных средств России «Энциклопедия лекарств». Изд-е 18-е, перераб. и доп. М.: РЛС-2010.
-
Справочник Видаль. Лекарственные препараты в России: Справочник. Изд. 16-е, перераб., исправл. и доп. М.: АстраФармСервис. 2010.
-
Adriani W., Granstrem O., Romano E. et al. Modulatory effects of cortexin and cortagen on locomotor activity and anxiety-related behavior in mice // Open Neuropsychopharmacology Journal. 2009. Vol. 2. P. 22–29.
В. М. Студеникин, доктор медицинских наук, профессор
Л. А. Пак, кандидат медицинских наук
С. Ш. Турсунхужаева
В. И. Шелковский, кандидат медицинских наук
С. В. Балканская, кандидат медицинских наук
НЦЗД РАМН, Москва
Контактная информация об авторах для переписки: studenikin@nczd.ru