Фармакологическое действие
Противоопухолевое средство галихондриновой группы, ингибитор динамики микротрубочек нетаксанового ряда. По своей структуре препарат представляет собой упрощенный синтетический аналог галихондрина В, натурального вещества, выделенного из морской губки Halichondria okadai.
Эрибулин тормозит фазу роста микротрубочек, не влияя на фазу укорачивания, что приводит к формированию тубулиновых агрегатов, не обладающих функциональной активностью. Противоопухолевое действие эрибулина реализуется через тубулин-опосредованный антимитотический механизм, ведущий к блокаде клеточного цикла в фазах G2/M и нарушению формирования митотических веретен, что, в итоге, приводит к апоптотической гибели клетки в результате длительной блокировки митоза.
Эрибулин также влияет на микроокружение опухоли и ее фенотип с помощью механизмов, которые не связаны с его антимитотическим эффектом. Эти дополнительные эффекты эрибулина включают: (I) ремоделирование сосудистого русла опухоли, при котором улучшается перфузия центральной части опухоли и снижается ее гипоксия, и (II) фенотипический переход более агрессивных мезенхимальных фенотипов в менее агрессивные эпителиальные посредством инверсии эпителиально-мезенхимального перехода.
Фармакокинетика
Фармакокинетические параметры эрибулина не зависят от дозы или времени в интервале от 0.22 до 3.53 мг/м2.
Фармакокинетика эрибулина характеризуется быстрой фазой распределения, сменяемой продолжительной фазой выведения с конечным T1/2, в среднем, около 40 ч. Препарат имеет большой Vd (в среднем от 43 до 114 л/м2).
При концентрациях в плазме человека от 100 до 1000 нг/мл связывание эрибулина с белками плазмы составляет от 49% до 65%.
После введения пациентам 14С-меченого эрибулина фракция неизмененного препарата в плазме была подавляющей. Концентрации метаболитов соответствовали менее 0.6% исходного эрибулина, подтверждая тот факт, что значимых метаболитов эрибулина в организме человека не образуется.
Клиренс эрибулина составляет в среднем от 1.16 до 2.42 л/ч/м2. При еженедельном введении эрибулина значимой кумуляции не наблюдается.
Выводится эрибулин, главным образом, с желчью. Транспортный белок, отвечающий за экскрецию препарата с желчью, в настоящее время неизвестен. Доклинические исследования указывают на участие в этом процессе Р-гликопротеина. Однако показано, что в клинически значимых концентрациях эрибулин не является ингибитором P-гликопротеина in vitro.
In vivo сопутствующее введение кетоконазола, являющего ингибитором P-гликопротеина, не оказывает влияния на фармакокинетические параметры эрибулина (AUC и Cmax).
Исследования in vitro показали, что эрибулин не является субстратом транспортера органических катионов (ОСТ1).
После введения пациентам 14C-меченного эрибулина примерно 82% дозы выводилось с калом и 9% — с мочой. Большую часть радиоактивной метки в кале и моче составляет неизмененный эрибулин.
У пациентов с печеночной недостаточностью легкой (класс А по шкале Чайлд-Пью) или средней (класс В по шкале Чайлд-Пью) степени тяжести, связанной с образованием метастазов в печени, экспозиция эрибулина была выше, соответственно, в 1.8 и 3 раза по сравнению с пациентами с нормальной функцией печени.
Применение эрибулина в дозе 1.1 мг/м2 у пациентов с легкой печеночной недостаточностью и в дозе 0.7 мг/м2 — у пациентов с умеренной печеночной недостаточностью обеспечивало примерно ту же экспозицию, что и при применении 1.4 мг/м2 у пациентов с нормальной функцией печени.
У пациентов с почечной недостаточностью средней и тяжелой степени наблюдалось увеличение AUC с поправкой на дозу в 1.5 раза.
Показания активного вещества
ЭРИБУЛИН
Местно-распространенный или метастатический рак молочной железы у пациентов, получавших ранее не менее одного режима химиотерапии по поводу распространенного заболевания. Предшествующая терапия должна включать антрациклины и таксаны в адъювантном режиме или в условиях метастатической формы заболевания (за исключением тех пациентов, которым не могли назначаться данные препараты).
Неоперабельная липосаркома у пациентов, получавших ранее химиотерапию антрациклинами по поводу распространенного или метастатического заболевания (за исключением тех пациентов, которым не могли назначаться данные препараты).
Режим дозирования
Вводят в/в.
Рекомендуемая доза препарата составляет 1.4 мг/м2 в 1-й и 8-й дни каждого 21-дневного цикла.
При развитии проявлений токсичности требуется коррекция дозы эрибулина.
После снижения дозы эрибулина ее обратное повышение в последующих циклах не рекомендуется.
Побочное действие
Определение категорий частоты нежелательных явлений: очень часто (≥1/10 случаев); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100) и редко (≥1/10 000, <1/1000).
Инфекционные и паразитарные заболевания: часто — инфекция мочевыводящих путей, пневмония, кандидоз полости рта, герпес слизистой оболочки полости рта, инфекция верхних дыхательных путей, назофарингит, ринит, опоясывающий лишай; нечасто — сепсис, нейтропенический сепсис, септический шок.
Со стороны крови и лимфатической системы: очень часто — нейтропения, лейкопения, анемия; часто — лимфопения, фебрильная нейтропения, тромбоцитопения; редко — диссеминированное внутрисосудистое свертывание крови.
Со стороны обмена веществ: очень часто — снижение массы тела; часто — гипокалиемия, гипомагниемия, обезвоживание, гипергликемия, гипофосфатемия.
Со стороны нервной системы: очень часто — периферическая невропатия, головная боль; часто — бессонница, депрессия, головокружение, гипестезия, летаргия, нейротоксичность.
Со стороны органов чувств: часто — повышение слезоотделения, конъюнктивит, вертиго, звон в ушах.
Со стороны сердечно-сосудистой системы: часто — тахикардия, «приливы», тромбоэмболия легочной артерии; нечасто — тромбоз глубоких вен.
Со стороны дыхательной системы: очень часто — диспноэ, кашель; часто — орофарингеальная боль, носовое кровотечение, ринорея; нечасто — интерстициальные заболевания легких.
Со стороны пищеварительной системы: очень часто — снижение аппетита, тошнота, запор, диарея, рвота; часто — боль в животе, стоматит, сухость ротовой полости, диспепсия, гастроэзофагеальная рефлюксная болезнь, вздутие живота, дисгевзия; нечасто — язвенное поражение слизистой оболочки ротовой полости, панкреатит.
Со стороны печени и желчевыводящих путей: часто — повышение активности АСТ, АЛТ, ГГТ, гипербилирубинемия; нечасто — гепатотоксичность.
Со стороны кожи и подкожных тканей: очень часто — алопеция; часто — сыпь, зуд, поражение ногтей, ночная потливость, сухость кожи, эритема, гипергидроз, ладонно-подошвенная эритродизестезия; частота неизвестна — синдром Стивенса-Джонсона/токсический эпидермальный некролиз.
Аллергические реакции: нечасто — ангионевротический отек.
Со стороны костно-мышечной системы: очень часто — артралгия и миалгия, боль в спине, боль в конечностях; часто — боль в костях, мышечный спазм, мышечно-скелетная боль и боль в груди, мышечная слабость.
Со стороны мочевыделительной системы: часто — дизурия; нечасто — гематурия, протеинурия, почечная недостаточность.
Общие реакции: очень часто — утомляемость/астения, лихорадка; часто — мукозиты, периферические отеки, боль, озноб, боль в груди, гриппоподобный синдром.
Противопоказания к применению
Беременность, период лактации (грудного вскармливания); возраст до 18 лет; повышенная чувствительность к эрибулину.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период лактации (грудного вскармливания).
Женщины фертильного возраста должны быть проинформированы о необходимости применения контрацептивных средств в период лечения эрибулином, или в период лечения их партнеров, а также в течение 3 месяцев после его завершения.
В доклинических исследованиях наблюдалась тестикулярная токсичность препарата. До начала лечения пациентам мужского пола следует обратиться за консультацией по поводу консервации спермы, поскольку при лечении эрибулином существует вероятность развития необратимого бесплодия.
Применение у пожилых пациентов
Препарат противопоказан для применения у пожилых пациентов
Особые указания
С осторожностью следует применять при синдроме врожденного удлинения интервала QT; заболеваниях сердца (сердечная недостаточность, брадиаритмия); электролитном дисбалансе (например, гипокалиемия, гипомагниемия); одновременном приеме лекарственных средств, удлиняющих интервал QT (в т.ч. антиаритмических IA и III классов); одновременном приеме лекарственных средств, обладающих узким терапевтическим диапазоном и метаболизирующихся преимущественно изоферментом CYP3A4; при тяжелой печеночной недостаточности и нарушении функции печени, связанном с циррозом (применение препарата у данной группы пациентов не изучалось); почечной недостаточности средней и тяжелой степени.
У каждого пациента перед введением любой дозы эрибулина следует проводить клинический анализ крови. Лечение эрибулином можно начинать только при значении АЧН выше 1.5×109/л и числе тромбоцитов выше 100×109/л.
При развитии фебрильной нейтропении, а также при тяжелой нейтропении или тромбоцитопении, следует скорректировать лечение.
При активности АЛТ или АСТ, превышающей ВГН более чем в 3 раза, повышается риск развития нейтропении 4 степени и фебрильной нейтропении. При значениях билирубина, превышающих ВГН более чем в 1.5 раза, также повышается риск развития нейтропении 4 степени и фебрильной нейтропении, хотя данные, подтверждающие эту зависимость, ограничены.
При тяжелой нейтропении по решению лечащего врача и в соответствии с действующими рекомендациями может быть назначен гранулоцитарный колониестимулирующий фактор (Г-КСФ) или его аналог.
Следует вести постоянное наблюдение за возможными признаками периферической моторной или сенсорной невропатии у пациентов. Развитие тяжелой периферической невропатии требует задержки введения или уменьшения дозы.
В период лечения мониторинг ЭКГ рекомендуется проводить у пациентов с сердечной недостаточностью и брадиаритмиями, а также при одновременном приеме лекарственных средств, удлиняющих интервал QT (в т.ч. антиаритмических IA и III классов). До начала лечения следует скорректировать электролитный дисбаланс (например, гипокалиемию, гипомагниемию), а на фоне лечения мониторировать содержание этих электролитов в крови.
Лекарственное взаимодействие
Согласно исследованиям in vitro, эрибулин может быть слабым ингибитором изофермента CYP3A4. Данные in vivo не доступны. При одновременном применении с лекарственными средствами, обладающими узким терапевтическим диапазоном и метаболизирующимися преимущественно изоферментом CYP3A4 (например, алфентанил, циклоспорин, эрготамин, фентанил, пимозид, хинидин, сиролимус, такролимус) следует проявлять осторожность и вести наблюдение за нежелательными явлениями.
Описание препарата Халавен® (раствор для внутривенного введения, 0.5 мг/мл) основано на официальной инструкции, утверждено компанией-производителем в 2020 году
Дата согласования: 16.09.2020
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
- Отзывы
Фотографии упаковок

16.09.2020
Действующее вещество
ATX
Фармакологическая группа
Состав
| Раствор для внутривенного введения | 1 мл |
| активное вещество: | |
| эрибулина мезилат | 0,5 мг |
| вспомогательные вещества: этанол — 0,05 мл; хлористоводородная кислота и натрия гидроксид — до рН 6–9; вода для инъекций — до 1 мл |
Описание лекарственной формы
Прозрачный бесцветный раствор.
Фармакологическое действие
Фармакологическое действие
—
противоопухолевое.
Фармакодинамика
Эрибулин относится к ингибиторам динамики микротрубочек, принадлежащим к галихондриновой группе противоопухолевых средств. По своей структуре препарат представляет собой упрощенный синтетический аналог галихондрина B, натурального вещества, выделенного из морской губки Halichondria okadai.
Эрибулин тормозит фазу роста микротрубочек, не влияя на фазу укорачивания, что приводит к формированию тубулиновых агрегатов, не обладающих функциональной активностью. Противоопухолевое действие эрибулина реализуется через тубулинопосредованный антимитотический механизм, ведущий к блокаде клеточного цикла в фазах G2/M и нарушению формирования митотических веретен, что в итоге приводит к апоптотической гибели клетки в результате длительной необратимой блокировки митоза.
Эрибулин также влияет на микроокружение опухоли и ее фенотип с помощью механизмов, которые не связаны с его антимитотическим эффектом. Эти дополнительные эффекты эрибулина включают: (I) ремоделирование сосудистого русла опухоли, при котором улучшается перфузия центральной части опухоли и снижается ее гипоксия, и (II) фенотипический переход более агрессивных мезенхимальных фенотипов в менее агрессивные эпителиальные посредством инверсии эпителиально-мезенхимального перехода.
Клиническая эффективность
Рак молочной железы. Эффективность препарата Халавен® при лечении местнораспространенного или метастатического рака молочной железы была подтверждена в двух рандомизированных сравнительных исследованиях III фазы с участием более 1800 пациентов, в которых конечными точками оценки эффективности были общая выживаемость и выживаемость без прогрессирования.
Саркомы мягких тканей. Эффективность препарата Халавен® при лечении сарком мягких тканей была подтверждена в ходе 2 исследований II фазы и одного рандомизированного исследования III фазы в сравнении с дакарбазином с участием 452 пациентов с местно-распространенными неоперабельными и/или метастатическими саркомами мягких тканей одного из следующих подтипов — лейомиосаркома или липосаркома. Конечной точкой оценки эффективности была общая выживаемость.
Применение в комбинации
Применение эрибулина в комбинации с трастузумабом и капецитабином изучено в ходе двух исследований II фазы.
Фармакокинетика
Распределение
Фармакокинетика эрибулина характеризуется быстрой фазой распределения, сменяемой продолжительной фазой выведения с конечным T1/2, в среднем около 40 ч. Препарат имеет большой Vd (в среднем от 43 до 114 л/м2).
Эрибулин слабо связывается с белками плазмы. При концентрациях в плазме человека от 100 до 1000 нг/мл доля связанного с белками плазмы эрибулина составляет от 49 до 65%.
Метаболизм
После введения пациентам 14С-меченного эрибулина фракция неизмененного препарата в плазме была наибольшей. Концентрации метаболитов соответствовали менее 0,6% исходного эрибулина, подтверждая тот факт, что значимых метаболитов эрибулина в организме человека не образуется.
Выведение
Эрибулин обладает низким значением клиренса (в среднем варьирующим от 1,16 до 2,42 л/ч/м2). При еженедельном введении эрибулина значимой кумуляции не наблюдается. Фармакокинетические параметры эрибулина не зависят от дозы или времени в интервале от 0,22 до 3,53 мг/м2.
Выводится эрибулин главным образом с желчью. Транспортный белок, отвечающий за экскрецию препарата с желчью, в настоящее время неизвестен. Доклинические исследования указывают на участие в этом процессе P-gp. Однако показано, что в клинически значимых концентрациях эрибулин не является ингибитором P-gp in vitro.
In vivo сопутствующее введение кетоконазола, являющегося ингибитором P-gp, не оказывает влияние на фармакокинетические параметры эрибулина (AUC и Cmax).
Исследования in vitro показали, что эрибулин не является субстратом транспортера органических катионов (ОСТ1).
После введения пациентам 14С-меченного эрибулина примерно 82% дозы выводилось с калом и 9% — с мочой, что говорит о том, что почечный клиренс не является значимым путем выведения препарата. Бóльшую часть радиоактивной метки в кале и моче представлял неизмененный эрибулин.
Печеночная недостаточность
Оценка фармакокинетики эрибулина у пациентов с легкой или умеренной печеночной недостаточностью (класс А или В по Чайлд-Пью соответственно), связанной с образованием метастазов в печени, по сравнению с пациентами с нормальной функцией печени (n=6) показала, что экспозиция эрибулина в первых двух группах пациентов была выше соответственно в 1,8 и 3 раза.
Применение препарата Халавен® в дозе 1,1 мг/м2 у пациентов с легкой печеночной недостаточностью и в дозе 0,7 мг/м2 у пациентов с печеночной недостаточностью средней степени тяжести обеспечивало примерно ту же экспозицию, что и при применении в дозе 1,4 мг/м2 у пациентов с нормальной функцией печени.
Применение препарата Халавен® у пациентов с тяжелой печеночной недостаточностью (класс С по Чайлд-Пью), а также с печеночной недостаточностью, связанной с циррозом, не изучалось.
Почечная недостаточность
У некоторых пациентов с почечной недостаточностью средней и тяжелой степени наблюдалось увеличение экспозиции эрибулина с высокой степенью вариабельности. Фармакокинетика эрибулина у пациентов с нормальной функцией почек (Cl креатинина >80 мл/мин), почечной недостаточностью средней и тяжелой степени (Cl креатинина 30–50 или 15–<30 мл/мин соответственно) изучалась в исследовании I фазы. Величина Cl креатинина оценивалась по формуле Кокрофта-Голта. У пациентов с почечной недостаточностью средней и тяжелой степени тяжести наблюдалось увеличение AUC с поправкой на дозу в 1,5 раза.
Показания
пациенты с местнораспространенным или метастатическим раком молочной железы, получившие ранее не менее одного режима химиотерапии по поводу распространенного заболевания. Предшествующая терапия должна включать антрациклины и таксаны в адъювантном режиме или в условиях метастатической формы заболевания за исключением тех пациентов, которым не могли назначаться данные препараты;
пациенты с неоперабельной липосаркомой, получившие ранее химиотерапию антрациклинами по поводу распространенного или метастатического заболевания (за исключением тех пациентов, которым не могли назначаться данные препараты).
Противопоказания
гиперчувствительность к эрибулину или какому-либо из вспомогательных веществ;
беременность;
период грудного вскармливания;
возраст до 18 лет.
С осторожностью: синдром врожденного удлинения интервала QT; заболевания сердца (сердечная недостаточность, брадиаритмия); электролитный дисбаланс (например гипокалиемия, гипомагниемия); одновременный прием ЛС, удлиняющих интервал QT (в т.ч. антиаритмические средства IA и III классов); одновременный прием ЛС, обладающих узким терапевтическим диапазоном и метаболизирующихся преимущественно изоферментом СYP3А4 (см. «Взаимодействие»); тяжелая печеночная недостаточность и нарушение функции печени, связанное с циррозом (применение препарата у данной группы пациентов не изучалось); почечная недостаточность средней и тяжелой степени (см. «Способ применения и дозы»).
Применение при беременности и кормлении грудью
Беременность
Данных о применении препарата Халавен® у беременных нет. В доклинических исследованиях эрибулин оказывал эмбриотоксическое, фетотоксическое и тератогенное действие. Халавен® не следует применять при беременности.
Женщины фертильного возраста должны быть проинформированы о необходимости предохранения от беременности при использовании ими или их партнерами препарата Халавен®, а также об обязательном применении эффективных методов контрацепции в период лечения препаратом Халавен® и в течение 3 мес после его завершения.
Лактация
Данных о проникновении эрибулина или его метаболитов в грудное молоко человека или животных нет. Поскольку риск для новорожденных и грудных детей не может быть исключен, Халавен® не следует применять в период грудного вскармливания.
Фертильность
В доклинических исследованиях наблюдалась тестикулярная токсичность препарата. До начала лечения пациентам мужского пола следует обратиться за консультацией по поводу консервации спермы, поскольку при лечении препаратом Халавен® существует вероятность развития необратимого бесплодия.
Способ применения и дозы
В/в. Лечение препаратом Халавен® следует проводить только под контролем врача, имеющего соответствующий опыт применения цитотоксических ЛС.
Противорвотные средства, включая ГКС рекомендуются в случае возникновения у пациента тошноты и рвоты.
Рекомендуемая доза препарата Халавен® составляет 1,4 мг/м2. Данная доза вводится в/в в течение 2–5 мин в 1-й и 8-й дни каждого 21-дневного цикла.
Отсрочка введения очередной дозы в ходе терапии
Введение препарата Халавен® в 1-й или 8-й день необходимо отложить при наличии какого-либо из следующих состояний:
— абсолютное число нейтрофилов (АЧН) <1·109/л;
— количество тромбоцитов <75·109/л;
— негематологическая токсичность 3-й или 4-й степени.
Введение препарата Халавен® на 8-й день цикла может быть отложено максимум на 1 нед.
Если к 15-му дню токсические проявления не разрешились или их выраженность не уменьшилась до 2-й степени и менее, введение очередной дозы препарата следует пропустить.
В случае разрешения или снижения выраженности токсических проявлений до 2-й степени или ниже к 15-му дню препарат Халавен® должен вводиться в сниженной дозе, при этом проведение следующего цикла лечения должно быть начато не ранее чем через 2 нед.
Снижение дозы в ходе лечения
Рекомендации по расчету дозы при возобновлении терапии приведены в таблице.
Таблица
| Нежелательные реакции после предыдущего введения препарата Халавен® | Рекомендуемая доза, мг/м2 |
| Гематологические | |
| Нейтропения (<0,5·109/л) продолжительностью более 7 дней | 1,1 |
| Нейтропения (<1·109/л), осложненная лихорадкой или инфекцией | |
| Тромбоцитопения (<25·109/л) | |
| Тромбоцитопения (<50·109/л), осложненная кровотечением или требующая переливания крови/тромбоцитарной массы | |
| Негематологические | |
| Любые нежелательные реакции 3-й или 4-й степени в предыдущем цикле | |
| Рецидив любой из вышеуказанных гематологических или негематологических нежелательных реакций | |
| Несмотря на снижение дозы до 1,1 мг/м2 | 0,7 |
| Несмотря на снижение дозы до 0,7 мг/м2 | Прекращение терапии препаратом Халавен® |
После снижения дозы эрибулина ее обратное повышение в последующих циклах не рекомендуется.
Применение у пациентов с печеночной недостаточностью
Нарушение функции печени, связанное с образованием метастазов. Рекомендуемая доза препарата Халавен® для пациентов с легкой печеночной недостаточностью (класс А по Чайлд-Пью) составляет 1,1 мг/м2 в/в в течение 2–5 мин в 1-й и 8-й дни 21-дневного лечебного цикла.
Рекомендуемая доза препарата Халавен® для пациентов с печеночной недостаточностью средней степени тяжести (класс В по Чайлд-Пью) составляет 0,7 мг/м2 в/в в течение 2–5 мин в 1-й и 8-й дни 21-дневного цикла терапии.
Применение препарата Халавен® у пациентов с тяжелой печеночной недостаточностью (класс С по Чайлд-Пью) не изучалось, но ожидается, что может потребоваться более значительное снижение дозы препарата Халавен®.
Нарушение функции печени, связанное с циррозом. Применение препарата у данной группы пациентов не изучалось. Вышеприведенные дозы могут применяться для пациентов с печеночной недостаточностью легкой и средней степени тяжести, при условии тщательного мониторинга, т.к. может потребоваться дальнейшее снижение дозы.
Применение у пациентов с почечной недостаточностью
У некоторых пациентов с почечной недостаточностью средней или тяжелой степени тяжести (Cl креатинина <50 мл/мин) может наблюдаться увеличение экспозиции эрибулина и, как следствие, может потребоваться снижение начальной дозы. Для всех пациентов с почечной недостаточностью рекомендуются дополнительные меры предосторожности и мониторинг побочных явлений.
Применение у детей
Применение препарата у детей и подростков по показанию рак молочной железы не предусмотрено.
Безопасность и эффективность препарата Халавен® у пациентов моложе 18 лет с саркомами мягких тканей к настоящему моменту не оценивалась.
Применение у лиц пожилого возраста
Специальных рекомендаций для лиц пожилого возраста по изменению дозы не предусмотрено.
Инструкции по разведению препарата перед введением
Препарат Халавен® разводят в асептических условиях не более чем в 100 мл 0,9% раствора натрия хлорида для инъекций. Препарат нельзя смешивать с другими ЛС, а также разводить в 5% растворе декстрозы.
Перед введением следует обеспечить хороший доступ к периферическим венам или центральной вене. Халавен® не оказывает раздражающее или некротизирующее действие в месте введения. В случае экстравазации лечение должно быть симптоматическим.
Побочные действия
К наиболее часто встречающимся побочным реакциям при терапии препаратом Халавен® относят подавление функции костного мозга, выражающееся в нейтропении, лейкопении, анемии и тромбоцитопении с сопутствующими инфекциями. Также сообщалось о новых проявлениях или ухудшении ранее имевшейся периферической нейропатии. Гастроинтестинальная токсичность, проявляющаяся в виде анорексии, тошноты, рвоты, диареи, запоров и стоматита также относится к побочным эффектам при терапии препаратом Халавен®. Прочие побочные эффекты включают утомляемость, алопецию, повышение активности печеночных ферментов, сепсис и мышечно-скелетную боль.
Профиль безопасности комбинации препарата Халавен® с трастузумабом или капецитабином соответствует известному профилю безопасности каждого из данных препаратов в отдельности.
Ниже представлена частота возникновения побочных эффектов, наблюдаемых у пациентов с раком молочной железы и саркомами мягких тканей, которые получали рекомендованную дозу препарата Халавен® в монотерапии в клинических исследованиях II и III фазы.
Для обозначения частоты нежелательных явлений используется следующая классификация: очень часто (≥1/10 случаев); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000). В пределах каждой группы побочные эффекты представлены в порядке убывания частоты. Если применимо, приведена общая и суммарная по побочным эффектам 3-й и 4-й степени частота встречаемости
Инфекционные и паразитарные заболевания: часто — инфекция мочевыводящих путей (8,5%) (G3/4: 0,7%); пневмония (1,6%) (G3/4: 1%), кандидоз полости рта, герпес слизистой оболочки полости рта, инфекция верхних дыхательных путей, назофарингит, ринит, опоясывающий лишай; нечасто — сепсис (0,5%) (G3/4: 0,5%)1; нейтропенический сепсис (0,2%) (G3/4: 0,2%), септический шок (0,2%) (G3/4: 0,2%)1.
Со стороны крови и лимфатической системы: очень часто — нейтропения (53,6%) (G3/4: 46%), лейкопения (27,9%) (G3/4: 17%), анемия (21,8%) (G3/4: 3%); часто — лимфопения (5,7%) (G3/4: 2,1%), фебрильная нейтропения (4,4%) (G3/4: 4,3%)1, тромбоцитопения (4,2%) (G3/4: 0,7%); редко — диссеминированное внутрисосудистое свертывание крови2.
Со стороны обмена веществ и питания: очень часто — снижение аппетита (22,5%) (G3/4: 0,7%)3; часто — гипокалиемияя (6,8%) (G3/4: 2%), гипомагниемия (2,8%) (G3/4: 0,3%), обезвоживание (2,8%) (G3/4: 0,5%)3, гипергликемия, гипофосфатемия, гипокальциемия.
Нарушения психики: часто — бессонница, депрессия.
Со стороны нервной системы: очень часто — периферическая нейропатия4 (35,9%) (G3/4: 7,3%), головная боль (17,5%) (G3/4: 0,7%); часто — дисгевзия, головокружение (9%) (G3/4: 0,4%)3, гипестезия, летаргия, нейротоксичность.
Со стороны органа зрения: часто — повышение слезоотделения (5,8%) (G3/4: 0,1%)3, конъюнктивит.
Со стороны органа слуха и лабиринтные нарушения: часто — вертиго, звон в ушах.
Со стороны сердца: часто — тахикардия.
Со стороны сосудов: часто — приливы, ТЭЛА (1,3%) (G3/4: 1,1%)1; нечасто — тромбоз глубоких вен.
Со стороны дыхательной системы, органов грудной клетки и средостения: очень часто — диспноэ (15,2%) (G3/4: 3,5%)1, кашель (15%) (G3/4: 0,5%)3; часто — орофарингеальная боль носовое кровотечение, ринорея; нечасто — интерстициальные заболевания легких (0,2%) (G3/4: 0,1%).
Со стороны ЖКТ: очень часто — тошнота (35,7%) (G3/4: 1,1%)3, запор (22,3%) (G3/4: 0,7%)3, диарея (18,7%) (G3/4: 0,8%), рвота (18,1%) (G3/4: 1%); часто — боль в животе, стоматит (11,1%) (G3/4: 1%)3, сухость ротовой полости, диспепсия (6,5%) (G3/4: 0,3%)3, ГЭРБ, вздутие живота; нечасто — изъязвление слизистой оболочки ротовой полости, панкреатит.
Со стороны печени и желчевыводящих путей: часто — повышение активности АСТ (7,7%) (G3/4: 1,4%)3, АЛТ (7,6%) (G3/4: 1,9%)3, ГГТ (1,7%) (G3/4: 0,9%)3, гипербилирубинемия (1,4%) (G3/4: 0,4%); нечасто — гепатотоксичность (0,8%) (G3/4: 0,6%).
Со стороны кожи и подкожных тканей: очень часто — алопеция; часто — сыпь (4,9%) (G3/4: 0,1%), зуд (3,9%) (G3/4: 0,1%)3, поражение ногтей, ночная потливость, сухость кожи, эритема, гипергидроз, ладонно-подошвенная эритродизестезия (1%) (G3/4: 0,1%)3; нечасто — ангионевротический отек (0,1%); частота неизвестна — синдром Стивенса-Джонсона/токсический эпидермальный некролиз2.
Со стороны скелетно-мышечной и соединительной ткани: очень часто — артралгия и миалгия (20,4%) (G3/4: 1%), боль в спине (12,8%) (G3/4: 1,5%), боль в конечностях (10%) (G3/4: 0,7%)3; часто — боль в костях (6,7%) (G3/4: 1,2%), мышечный спазм (5,3%) (G3/4: 0,1%)3, мышечно-скелетная боль и боль в груди, мышечная слабость.
Со стороны почек и мочевыводящих путей: часто — дизурия; нечасто — гематурия, протеинурия, почечная недостаточность.
Общие расстройства и нарушения в месте введения: очень часто — утомляемость/астения (53,2%) (G3/4: 7,7%), лихорадка (21,8%) (G3/4: 0,7%); часто — воспаление слизистых оболочек (6,4%) (G3/4: 0,9%)3, периферический отек, боль, озноб, боль в груди, гриппоподобный синдром.
Лабораторные и инструментальные данные: очень часто — снижение массы тела (11,4%) (G3/4: 0,4%)3.
1 Включая случаи 5-й степени.
2 Спонтанные сообщения.
3 Только 3-й степени.
4 Включая термины: периферическая нейропатия, периферическая моторная нейропатия, полинейропатия, парестезия, периферическая сенсорная нейропатия, периферическая сенсомоторная нейропатия и демиелинизирующая полинейропатия.
В целом препарат Халавен® имеет схожий профиль безопасности при применении при раке молочной железы и саркомах мягких тканей.
Дополнительная информация по некоторым побочным эффектам
Нейтропения. Наблюдавшаяся нейтропения была обратимой и некумулятивной. Среднее время до ожидаемого минимума числа нейтрофилов (надир) составляло 13 дней, а среднее время до восстановления после тяжелой нейтропении (АЧН <0,5·109/л) составило 8 дней.
В исследовании EMBRACE снижение числа нейтрофилов до значений <0,5·109/л, длящееся более 7 дней, встречалось в 13% случаев.
При саркомах мягких тканей сообщения о нейтропении, возникшей в ходе лечения, встречались реже (37,4% случаев), чем при раке молочной железы (57,9% случаев). Всего нейтропения вместе с патологически измененными нейтрофилами встречалась с частотой 76 и 84,3% соответственно. Медиана длительности терапии составила 12 нед для пациентов с саркомами мягких тканей и 15,9 нед для пациентов с раком молочной железы.
Сообщалось о случаях фебрильной нейтропении, нейтропенического сепсиса, сепсиса и септического шока с летальным исходом. Среди 1963 пациентов с саркомами мягких тканей и раком молочной железы, получавших эрибулин в рекомендованных дозах в ходе клинических исследований, наблюдалось по одному летальному случаю нейтропенического сепсиса (0,1%) и фебрильной нейтропении (0,1%), а также 3 летальных случая сепсиса (0,2%) и один случай септического шока (0,1%).
При тяжелой нейтропении по решению лечащего врача и в соответствии с действующими рекомендациями может быть назначен гранулоцитарный колониестимулирующий фактор (Г-КСФ) или его аналог.
В 2 клинических исследованиях III фазы (исследование 305 и 301) Г-КФС получали 18 и 13% пациентов соответственно. В исследовании III фазы у пациентов с саркомами мягких тканей Г-КФС получали 26% пациентов.
Нейтропения приводила к прекращению участия в исследовании менее 1% пациентов, получающих эрибулин.
ДВС. Сообщалось о случаях развития ДВС, обычно ассоциированного с нейтропенией и/или сепсисом.
Периферическая нейропатия. Среди 1559 пациентов с раком молочной железы наиболее частым побочным явлением, приводящим к отмене терапии эрибулином, была периферическая нейропатия (3,4%). Медиана до появления периферической нейропатии 2-й степени составила 12,6 нед (после 4 циклов). У 2 из 404 пациентов с саркомами мягких тканей периферическая нейропатия привела к отмене терапии эрибулином. Медиана до появления периферической нейропатии 2-й степени составила 18,4 нед.
Развитие периферической нейропатии 3-й и 4-й степени возникало у 7,4% пациентов с раком молочной железы и у 3,5% пациентов с саркомами мягких тканей. В клинических исследованиях было показано, что у пациентов с нейропатией, имевшейся до начала терапии препаратом Халавен®, не было большего риска развития новых или ухудшения уже имеющихся ее симптомов, в отличие от пациентов, не имевших периферической нейропатии до начала терапии препаратом Халавен®.
У пациентов с раком молочной железы с предшествующей периферической нейропатией 1-й или 2-й степени частота возникновения периферической нейропатии 3-й степени при лечении препаратом Халавен® составляла 14%.
Гепатотоксичность. У некоторых пациентов наблюдалось увеличение активности печеночных ферментов в начале лечения эрибулином (чаще всего в 1–2-м циклах). Хотя это происходило, скорее всего, вследствие адаптации печени к лечению эрибулином, о гепатотоксичности также сообщалось.
Дополнительная информация по безопасности в особых группах пациентов
Пожилой возраст. Среди 1559 пациентов с раком молочной железы, получавших эрибулин в рекомендованных дозах, 283 (18,2%) были старше 65 лет. В исследовании на 404 пациентах с саркомами, 90 пациентов (22,3%), получавших, эрибулин, были старше 65 лет. Профиль безопасности эрибулина у пожилых пациентов (старше 65 лет) аналогичен профилю безопасности препарата у более молодой популяции за исключением утомляемости и астении, которые усиливались с возрастом. Специальных рекомендаций по снижению дозы у пожилых пациентов нет.
Печеночная недостаточность. При активности АЛТ или АСТ, превышающей ВГН более чем втрое, у пациента повышается риск развития нейтропении 4-й степени и фебрильной нейтропении. При значениях билирубина, превышающих ВГН более чем в 1,5 раза, также повышается риск развития нейтропении 4-й степени и фебрильной нейтропении, хотя данные, подтверждающие эту зависимость, ограничены.
Извещение о нежелательных реакциях
Крайне важно извещать о нежелательных реакциях, возникших во время пострегистрационного применения ЛС. Это позволит контролировать соотношение пользы и риска лекарственного средства. Просьба медицинским работникам извещать о возникновении любых нежелательных реакций по адресу, указанному в данном описании.
Взаимодействие
Лекарственная несовместимость
Данный препарат нельзя смешивать с другими лекарственными препаратами.
Раствор для инъекций Халавен® не следует разводить в 5% растворе декстрозы для инфузий.
Эрибулин преимущественно (до 70%) экскретируется с желчью. Транспортный белок, отвечающий за этот процесс, не выявлен. Эрибулин не является субстратом BCRP, белков-переносчиков органических анионов (OAT1, OAT3, OATP1B1, OATP1B3), белков множественной лекарственной резистентности (MRP2, MRP4) и транспортного белка желчных кислот (BSEP).
Лекарственное взаимодействие с ингибиторами и индукторами изофермента CYP3A4 не ожидается. Клинически значимых различий в экспозиции эрибулина (AUC и Cmax) при его применении совместно с кетоконазолом (ингибитор изофермента СYP3А4 и P-gp) и рифампицином (индуктор изофермента CYP3A4) не наблюдалось.
Влияние эрибулина на фармакокинетику других ЛС
Согласно исследованиям in vitro, эрибулин может быть слабым ингибитором изофермента CYP3A4. Данные in vivo не доступны. При одновременном применении с ЛС, обладающими узким терапевтическим диапазоном и метаболизирующимися преимущественно изоферментом СYP3А4 (например алфентанил, циклоспорин, эрготамин, фентанил, пимозид, хинидин, сиролимус, такролимус) следует проявлять осторожность и вести наблюдение за нежелательными явлениями.
Эрибулин не оказывает ингибирующее действие на изоферменты CYP1A2, CYP2В6, CYP2С8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 в терапевтическом диапазоне концентраций. В клинически значимых концентрациях эрибулин не оказывает ингибирующее действие на транспортную активноть BCRP, OCT1, OCT2, OAT1, OAT3, OATP1B1 и OATP1B3.
Передозировка
В одном из случаев передозировки пациенту ошибочно было введено 8,6 мг препарата Халавен® (примерно в 4 раза выше запланированной дозы), в результате чего развилась реакция гиперчувствительности 3-й степени на 3-й день и нейтропения 3-й степени — на 7-й. Обе нежелательные реакции разрешились при помощи поддерживающей терапии.
Антидот при передозировке препарата Халавен® неизвестен. В случае передозировки рекомендуется постоянное наблюдение за пациентом и использование симптоматической терапии.
Особые указания
Гематологические
Миелосупрессия является дозозависимой и в первую очередь выражается в виде нейтропении (см. «Побочные действия»). У каждого пациента перед введением любой дозы препарата Халавен® следует провести клинический анализ крови. Лечение препаратом Халавен® можно начинать только при АЧН выше 1,5·109/л и числе тромбоцитов выше 100·109/л.
Менее чем у 5% пациентов, получавших Халавен®, наблюдалась фебрильная нейтропения. При развитии у пациента фебрильной нейтропении, а также при тяжелой нейтропении или тромбоцитопении следует скорректировать лечение в соответствии с рекомендациями, приведенными в разделе «Способ применения и дозы».
При активности АЛТ или АСТ, превышающей ВГН более чем втрое, у пациента повышается риск развития нейтропении 4-й степени и фебрильной нейтропении. При значениях билирубина, превышающих ВГН более чем в полтора раза, также повышается риск развития нейтропении 4-й степени и фебрильной нейтропении, хотя данные, подтверждающие эту зависимость, ограничены.
Сообщалось о случаях фебрильной нейтропении, нейтропенического сепсиса, сепсиса и септического шока с летальным исходом.
При тяжелой нейтропении по решению лечащего врача и в соответствии с действующими рекомендациями может быть назначен Г-КСФ или его аналог.
Периферическая нейропатия
Следует вести постоянное наблюдение за возможными признаками периферической моторной или сенсорной нейропатии у пациентов. Развитие тяжелой периферической нейропатии требует задержки введения или уменьшения дозы.
Пациенты с предшествующей периферической нейропатией более чем 2-й степени тяжести не включались в клинические исследования. Тем не менее у пациентов с предшествующей нейропатией 1-й или 2-й степени тяжести не наблюдался больший риск развития новых или ухудшения уже имеющихся ее симптомов в сравнении с пациентами, включенными в исследование без данного состояния.
Удлинение интервала QT
В неконтролируемом открытом исследовании ЭКГ у 26 пациентов удлинение интервала QT отмечалось на 8-й день, независимо от концентрации эрибулина и при нормальных значениях интервала в 1-й день.
На фоне лечения препаратом Халавен® мониторинг ЭКГ рекомендуется проводить у пациентов с сердечной недостаточностью и брадиаритмиями, а также при одновременном приеме ЛС, удлиняющих интервал QT (в т.ч. антиаритмические средства IA и III классов). До начала лечения препаратом Халавен® рекомендуется устранить электролитный дисбаланс (например гипокалиемия, гипомагниемия), а на фоне лечения мониторировать содержание этих электролитов в крови.
Не рекомендуется назначать препарат Халавен® пациентам, имеющим синдром врожденного удлинения интервала QT.
Использование в комбинациях
Установлено, что применение эрибулина в комбинации с анти-HER2-терапией и капецитабином является безопасным.
Вспомогательные вещества
Халавен® содержит небольшое количество этанола (менее 100 мг/доза).
Специальные меры предосторожности при утилизации и использовании
Подготовка и введение препарата может осуществляться исключительно лицами, имеющими соответствующий опыт работы с цитостатиками.
Халавен® представляет собой цитотоксический противоопухолевый препарат, и при работе с ним, как и с другими токсичными веществами, следует проявлять осторожность. Рекомендуется использовать перчатки, защитные очки и защитную одежду. В случае попадания раствора препарата на кожу, необходимо сразу же тщательно промыть этот участок кожи водой с мылом. При контакте препарата со слизистыми оболочками место контакта необходимо тщательно промыть водой. При беременности не следует работать с препаратом Халавен®.
Хранение вскрытой упаковки
С микробиологической точки зрения, Халавен® следует использовать немедленно после вскрытия. Если препарат не применяется сразу же после вскрытия упаковки, за сроки и условия его хранения отвечает лицо, работающее с препаратом.
Если Халавен® не применяется сразу же после вскрытия упаковки в виде неразведенного раствора, максимальный срок хранения при 25 °C на рассеянном свету составляет 4 ч, а в условиях холодильника (2–8°C) — 24 ч.
Разведенный раствор препарата Халавен® (в концентрациях от 0,02 до 0,2 мг/мл в 0,9% растворе натрия хлорида для инъекций) может храниться не более 24 ч при температуре 2–8°C, за исключением тех ситуаций, когда разведение исходного раствора осуществлялось в стандартизованных контролируемых асептических условиях.
Неиспользованные остатки препарата и использованные материалы следует утилизировать согласно действующим в РФ требованиям.
Влияние на способность управлять транспортными средствами и работать с механизмами. При приеме препарата Халавен® могут наблюдаться такие побочные эффекты, как усталость или головокружение, которые могут оказывать слабое или умеренное воздействие на возможность управлять автомобилем или работать с механизмами. Пациентов следует информировать о том, что при появлении чувства усталости или головокружения им нельзя управлять автомобилем или работать с механизмами.
Форма выпуска
Раствор для внутривенного введения, 0,5 мг/мл. По 2 мл препарата во флаконе из прозрачного бесцветного гидролитического стекла I типа (Ф. США) номинальной вместимостью 5 мл, укупоренном серой бутилкаучуковой пробкой с тефлоновым покрытием (Teflon® 2) и закатанном алюминиевым колпачком, снабженным отрывным пластиковым диском синего цвета.
По 1 или 6 фл. вместе с инструкцией по применению в картонной пачке.
Места вскрытия картонной пачки заклеены двумя прозрачными защитными стикерами.
Производитель
Производство готовой лекарственной формы и первичная упаковка:
БСП Фармасьютикалс С.п.А., Италия. BSP Pharmaceuticals S.p.A., Via Appia Km 65,561 (loc. Latina Scalo) — 04013 Latina (LT), Italy.
Вторичная упаковка и выпускающий контроль качества:
Эйсай Мануфэкчуринг Лимитед, Соединенное Королевство. Eisai Manufacturing Limited, European Knowledge Centre, Mosquito Way, Hatfield, Hertfordshire AL10 9SN, United Kingdom
или
ОАО «Фармстандарт-УфаВИТА», 450077, Россия, Республика Башкортостан, г. Уфа, ул. Худайбердина, д. 28.
Юридическое лицо, на имя которого выдано регистрационное удостоверение: Эйсай Юроп Лимитед, Соединенное Королевство. Eisai Europe Limited, European Knowledge Centre, Mosquito Way, Hatfield, Hertfordshire AL10 9SN, United Kingdom.
Организация, уполномоченная принимать претензии на территории Российской Федерации: ООО «Эйсай», 117342, Москва, ул. Профсоюзная, 65, к. 1, этаж 21, комн. 5.02.
Тел.: (495) 580 70 26, (495) 580 70 27.
e-mail: info_russia@eisai.net.
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
4 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
(HALAVEN®)
Регистрационный номер:
ЛП-001782
Торговое название: Халавен
Международное непатентованное название:
эрибулин
Лекарственная форма:
раствор для внутривенного введения
Состав
1 мл препарата содержит:
активное вещество: эрибулина мезилат 0,5 мг;
вспомогательные вещества: этанол 0,05 мл, хлористоводородная кислота и натрия гидроксид до рН 6,0-9,0, вода для инъекций до 1,0 мл.
Описание: прозрачный бесцветный раствор
Фармакотерапевтическая группа
Противоопухолевое средство
Код ATX: L01XX41
Фармакологические свойства
Фармакодинамика
Эрибулин относится к ингибиторам динамики микротрубочек нетаксанового ряда, принадлежащим к галихондриновой группе противоопухолевых средств. По своей структуре препарат представляет собой упрощенный синтетический аналог галихондрина В, натурального вещества, выделенного из морской губки Halichondriaokadai. Эрибулин тормозит фазу роста микротрубочек, не влияя на фазу укорачивания, что приводит к формированию тубулиновых агрегатов, не обладающих функциональной активностью. Противоопухолевое действие эрибулина реализуется через тубулин-опосредованный антимитотический механизм, ведущий к блокаде клеточного цикла вфазах G2/M (стадии клеточного цикла GAP 2/митоза) и нарушению формирования митотических веретен, что, в итоге, приводит к апоптотической гибели клетки в результате длительной блокировки митоза.
Фармакокинетика
Распределение
Фармакокинетика эрибулина характеризуется быстрой фазой распределения, сменяемой продолжительной фазой выведения с конечным периодом полувыведения (Тш), в среднем, около 40 ч. Препарат имеет большой объем распределения (в среднем, варьирующим от 43 до 114 л/м2).
Эрибулин слабо связывается с белками плазмы. При концентрациях в плазме человека от 100 до 1000 нг/мл, доля связанного с белками плазмы эрибулина составляет от 49% до 65%.
Метаболизм
В первичной культуре гепатоцитов человека не было обнаружено индуцирующего потенциала эрибулина в отношении изоферментов 1А или ЗА (в концентрациях до 5 дМ), а также 2С9 или 2С19 (до 10 дМ) цитохрома Р450.
После введения пациентам 14С-меченного эрибулина, фракция неизмененного препарата в плазме была подавляющей. Концентрации метаболитов соответствовали менее 0.6% исходного эрибулина, подтверждая тот факт, что значимых метаболитов эрибулина в организме человека не образуется.
Выведение
Эрибулин обладает низким значением клиренса (в среднем, варьирующим от 1,16 до 2,42 л/ч/м2). При еженедельном введении эрибулина значимой кумуляции не наблюдается. Фармакокинетические параметры эрибулина не зависят от дозы или времени в интервале от 0,22 до 4,0 мг/м2.
Выводится эрибулин, главным образом, с желчью. Транспортный белок, отвечающий за экскрецию препарата с желчью, в настоящее время неизвестен. Доклинические исследования указывают на участие в этом процессе Р-гликопротеина. После введения пациентам 14С-меченного эрибулина примерно 82% дозы выводилось с калом и 9% — с мочой, что говорит о том, что почечный клиренс не является значимым путем выведения препарата. Большую часть радиоактивной метки в кале и моче представлял неизмененный эрибулин.
Фармакокинетика при печеночной недостаточности
Оценка фармакокинетики эрибулина у пациентов с легкой (класс А по Чайлд-Пью) или умеренной (класс В по Чайлд-Пью) печеночной недостаточностью, по сравнению с пациентами с нормальной функцией печени (п=6), показала, что экспозиция эрибулина в первых двух группах пациентов была выше, соответственно, в 1,8 и 2,5 раза. Применение препарата Халавен в дозе 1,1 мг/м2 пациентам с легкой печеночной недостаточностью и в дозе 0,7 мг/м2 — пациентам с умеренной печеночной недостаточностью обеспечивало примерно ту же экспозицию, что и при применении 1,4 мг/м2 пациентам с нормальной функцией печени.
Халавен не изучался у пациентов с тяжелой печеночной недостаточностью (класс С по Чайлд-Пью).
Фармакокинетика при почечной недостаточности
Специальных исследований фармакокинетики эрибулина у больных с почечной недостаточностью не проводилось. Согласно доступным данным предполагается, что среднегеометрические значения показателей системной экспозиции, нормализованных по дозе, у больных с легкими нарушениями функции почек (клиренс креатинина — КК, 50-80 мл/мин) будут соответствовать значениям у пациентов с нормальной функцией почек. Тем не менее, у больных с умеренными нарушениями функции почек (КК 30-50 мл/мин) среднегеометрические значения показателей системной экспозиции, нормализованных по дозе, увеличивались вдвое в сравнении с данными пациентов с нормальной функцией почек.
Влияние возраста, пола или расы на фармакокинетику
Данные популяционного анализа продемонстрировали отсутствие клинически значимого влияния возраста, пола или расы на фармакокинетические параметры эрибулина.
Показания к применению
Монотерапия у пациентов с местно-распространенным или метастатическим раком молочной железы, получивших ранее не менее двух различных режимов химиотерапии по поводу распространенного заболевания. Предшествующая терапия должна включать антрациклины и таксаны, за исключением тех пациентов, которым не могли назначаться данные препараты.
Противопоказания
Гиперчувствительность кэрибулину или какому-либо из вспомогательных веществ. Тяжелая печеночная недостаточность (отсутствие данных по применению).
Тяжелая почечная недостаточность (отсутствие данных по применению). Беременность и период грудного вскармливания. Возраст до 18 лет.
С осторожностью: при синдроме врожденного удлинения интервала Q-T, заболеваниях сердца (сердечная недостаточность, инфаркт миокарда, брадикардия), электролитном дисбалансе (например, гипокалиемия, гипомагниемия), при одновременном приеме лекарственных средств, удлиняющих интервал Q-T (в том числе антиаритмических IA и III классов).
Применение при беременности и в период грудного вскармливания
Беременность
Данных о применении препарата Халавен у беременных нет. В доклинических исследованиях эрибулин оказывал эмбриотоксическое, фетотоксическое и тератогенное действие. Халавен не следует применять при беременности. Лактация
Данных о проникновении эрибулина или его метаболитов в грудное молоко человека или животных нет. Поскольку риск для новорожденных и грудных детей не может быть исключен, Халавен не следует применять в период грудного вскармливания.
Способ применения и дозы
Внутривенно.
Лечение препаратом Халавен следует проводить только под контролем врача, имеющего соответствующий опыт применения цитотоксических лекарственных препаратов. Противорвотные средства рекомендуются в случае возникновения у пациента тошноты и рвоты.
Рекомендуемая доза препарата Халавен составляет 1,4 мг/м2. Данная доза вводится внутривенно в течение 2-5 минут в 1-й и 8-й дни каждого 21-дневного цикла. Отсрочка введения очередной дозы в ходе терапии
- Введение препарата Халавен в 1-й или 8-й день цикла терапии необходимо отложить при наличии какого-либо из следующих состояний:
- Абсолютное число нейтрофилов (АЧН) < 1 х 109/л
- Количество тромбоцитов <75 х 109/л
- Негематологическая токсичность 3 или 4 степени.
- Введение препарата Халавен на 8-й день цикла может быть отложено максимум на 1 неделю.
- Если к 15 дню токсические проявления не разрешились или их
- Выраженность не уменьшилась до 2 степени и менее, введение очередной дозы препарата следует пропустить.
- В случае разрешения или снижения выраженности токсических проявлений до 2 степени или ниже к 15 дню, препарат Халавен должен вводиться в сниженной дозе, при этом проведение следующего цикла лечения должно быть начато не ранее чем через 2 недели.
Снижение дозы в ходе лечения
Рекомендации по расчету дозы при возобновлении терапии приведены в Таблице 1.
Таблица 1. Рекомендации по снижению дозы препарата Халавен.
|
Нежелательные реакции после введения препарата Халавен |
Рекомендуемая доза |
|
Нейтропения < 0.5 х 109/л, продолжительностью более 7 дней |
1,1 мг2/м |
|
Нейтропения < 1 х 109/л, осложненная лихорадкой или инфекцией |
|
|
Тромбоцитопения < 25 х 109/л |
|
|
Тромбоцитопения < 50 х 109/л, требующая переливания крови/тромбоцитарной массы |
|
|
Негематологические нежелательные реакции 3 или 4 степени |
|
|
Пропуск или отсрочка введения препарата на 8-й день в предыдущем цикле |
|
|
Рецидив любой из вышеуказанных гематологических или негематологических нежелательных реакций |
|
|
Несмотря на снижение дозы до 1,1 мг/м |
0,7 мг/м2 |
|
Несмотря на снижение дозы до 0,7 мг/м |
Прекращение терапии |
После снижения дозы из-за токсичности ее обратное повышение в последующих циклах не рекомендуется.
Не требуется специальных действий в случае отмены лечения препаратом Халавен.
Применение у пациентов с печеночной недостаточностью Рекомендуемая доза препарата Халавен для пациентов с легкой печеночной недостаточностью (класс А по Чайлд-Пью) составляет 1,1 мг/м2 внутривенно в течение 25 минут в 1-й и 8-й дни 21-дневного лечебного цикла. Рекомендуемая доза препарата Халавен для пациентов с умеренной печеночной недостаточностью (класс В по Чайлд-Пью) составляет 0,7 мг/м2 внутривенно в течение 2-5 минут в 1-й и 8-й дни 21-дневного цикла терапии.
Опыт применения препарата Халавен у пациентов с тяжелой печеночной недостаточностью (класс С по Чайлд-Пью) отсутствует.
Применение у пациентов с почечной недостаточностью
Специальных рекомендаций по изменению дозы у пациентов с легкой почечной недостаточностью нет. Рекомендуемая доза препарата Халавен для пациентов с умеренной почечной недостаточностью (КК 30-50 мл/мин) составляет 1,1 мг/м2 внутривенно в течение 2-5 минут в 1-й и 8-й дни 21-дневного лечебного цикла. Безопасность применения препарата Халавен у пациентов с тяжелой почечной недостаточностью (КК < 30 мл/мин) не изучалась.
Применение у детей
Данные по безопасности и эффективности препарата Халавен у пациентов моложе 18 лет отсутствуют.
Применение у лиц пожилого возраста
Специальных рекомендаций для лиц пожилого возраста по изменению дозы не предусмотрено.
Инструкции по разведению препарата перед введением
Препарат Халавен разводят в асептических условиях не более чем в 100 мл 0,9% раствора натрия хлорида для инъекций. Препарат нельзя смешивать с другими лекарственными средствами, а также разводить в 5% растворе декстрозы.
Перед введением следует обеспечить хороший доступ к периферическим венам или к центральной вене. Халавен не оказывает раздражающего или некротизирующего действия в месте введения. В случае экстравазации лечение должно быть симптоматическим.
Побочное действие
Для обозначения частоты нежелательных явлений используется следующая классификация: очень часто (> 1/10 случаев); часто (> 1/100, < 1/10); нечасто (> 1/1000, <1/100); редко (> 1/10000, < 1/1000); очень редко (< 1/10000) и неизвестно (частота не может быть определена из имеющихся данных).
Нарушения со стороны крови и лимфатической системы
Очень часто: нейтропения, лейкопения, анемия.
Часто: фебрильная нейтропения, тромбоцитопения, лимфопения.
Нарушения со стороны метаболизма Очень часто: снижение аппетита.
Часто: гипокалиемия, гипомагниемия, обезвоживание, гипергликемия, гипофосфатемия.
Психические нарушения Часто: бессонница, депрессия.
Нарушения со стороны нервной системы
Очень часто: периферическая нейропатия (сенсорная, моторная и сенсомоторная нейропатия), парестезии, полинейропатия (включая демиелинизирующую полинейропатию), головная боль.
Часто: дисгевзия, головокружение, гипестезия, летаргия, нейротоксичность.
Нарушения со стороны органа зрения
Часто: повышение слезоотделения, конъюнктивит.
Нарушения со стороны органа слуха и лабиринтные нарушения
Часто: головокружение, связанное с нарушением вестибулярного аппарата.
Нечасто: звон в ушах.
Нарушения со стороны сердечно-сосудистой системы
Часто: «приливы», тахикардия.
Нечасто: тромбоз (включая тромбоз глубоких вен и тромбоэмболию легочной артерии).
Нарушения со стороны органов дыхания, органов грудной клетки и средостения
Часто: одышка, кашель, орофарингеальная боль, носовое кровотечение, ринорея, назофарингит, ринит, инфекция верхних дыхательных путей.
Нечасто: интерстициальные заболевания легких.
Нарушения со стороны желудочно-кишечного тракта (ЖКТ)
Очень часто: тошнота, запор, диарея, рвота.
Часто: стоматит, сухость ротовой полости, диспепсия, боль в животе, гастроэзофагеальная рефлюксная болезнь, изъязвление слизистой оболочки ротовой полости, кандидиаз полости рта, вздутие живота.
Нарушения со стороны печени и желчевыводящих путей Часто: повышение активности аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (ACT) в крови. Нечасто: нарушение функции печени, гипербилирубинемия.
Нарушения со стороны почек и мочевыводящих путей
Нечасто: дизурия, гематурия, протеинурия, почечная недостаточность, инфекция мочевыводящих путей.
Нарушения со стороны кожи и подкожных тканей Очень часто: алопеция.
Часто: сыпь, зуд, поражение ногтей, ночная потливость, ладонно-подошвенная эритродизестезия, сухость кожи, эритема, гипергидроз. Нечасто: ангионевротический отек.
Нарушения со стороны костно-мышечной и соединительной ткани Очень часто: артралгия, миалгия.
Часто: боль в конечностях, мышечный спазм, мышечная слабость, мышечная боль, боль в спине, боль в груди, боль в костях.
Прочие
Очень часто: утомляемость и астения, лихорадка.
Часто: воспаление слизистых оболочек, периферические отеки, озноб, гриппоподобный синдром, снижение массы тела, присоединение вторичных инфекций. Нечасто: пневмония, нейтропенический сепсис, герпес слизистой оболочки полости рта, опоясывающий лишай.
Передозировка
В одном из случаев передозировки пациенту ошибочно было введено 8,6 мг препарата Халавен (примерно в 4 раза выше запланированной дозы), в результате чего развилась реакция гиперчувствительности 3 степени на 3-й день и нейтропения 3 степени — на 7-й. Обе нежелательные реакции разрешились при помощи поддерживающей терапии. Антидот при передозировке препаратом Халавен неизвестен. В случае передозировки рекомендуется постоянное наблюдение за пациентом и использование симптоматической терапии.
Взаимодействие с другими лекарственными препаратами
Лекарственная несовместимость
Данный препарат нельзя смешивать с другими лекарственными препаратами. Раствор для инъекций Халавен не следует разводить в 5% растворе декстрозы для инфузий.
Эрибулин преимущественно экскретируется с желчью. Транспортный белок, отвечающий за этот процесс, не выявлен. В связи с этим, не рекомендуется одновременное с эрибулином применение препаратов (например, таких как, циклоспорин, ритонавир, саквинавир, лопинавир, эфавиренц, эмтрицитабин, верапамил, кларитромицин, хинин, хинидин, дизопирамид и др), являющихся ингибиторами печеночных транспортных белков (органического анион-транспортного белка (OATPs), Р-гликопротеина, белков множественной лекарственной устойчивости (МСП) и др).
Не рекомендуется одновременный прием с рифампицином, карбамазепином, фенитоином, зверобоем продырявленным, поскольку эти препараты могут привести к заметному снижению концентрации эрибулина в плазме.
Лекарственное взаимодействие с ингибиторами изофермента CYP3А4 цитохрома Р-450 не ожидается. Клинически значимых различий в экспозиции эрибулина (AUC и Сшах) при его применении совместно с кетоконазолом (ингибитор изофермента CYP3 А4) не наблюдалось.
Эрибулин не оказывает ингибирующего действия на изоферменты CYP1A2, CYP2C9, CYP2C19, CYP2D6, СУР2Е1или CYP3A4 в терапевтическом диапазоне концентраций.
Особые указания
Гематологические
Миелосупрессия является дозозависимой и, в первую очередь, выражается в виде нейтропении. Среднее время до ожидаемого минимума числа нейтрофилов (надир) составляло 13 дней, а среднее время до восстановления после тяжелой нейтропении (<0,5 х 109/л) составило 8 дней. У каждого пациента перед введением любой дозы препарата Халавен следует провести клинический анализ крови. Лечение препаратом Халавенможно начинать только при АЧН выше 1,5 х 10 9 /л и числе тромбоцитов выше 100 х109 /л.
Менее чем у 5% пациентов, получающих Халавен, наблюдалась фебрильная нейтропения. При развитии у пациента фебрильной нейтропении, а также при тяжелой нейтропении или тромбоцитопении, следует скорректировать лечение в соответствии с приведенными выше рекомендациями.
При активности АЛТ или ACT, превышающей верхнюю границу нормы более чем втрое, у пациента повышается риск развития нейтропении 4 степени и фебрильной нейтропении. При значениях билирубина, превышающих верхнюю границу нормы более чем в полтора раза, также повышается риск развития нейтропении 4 степени и фебрильной нейтропении, хотя данные, подтверждающие эту зависимость, ограничены. При тяжелой нейтропении по решению лечащего врача и в соответствии с действующими рекомендациями может быть назначен гранулоцитарный колониестимулирующий фактор (Г-КСФ) или его аналог.
Периферическая нейропатия
Следует вести постоянное наблюдение за возможными признаками периферической моторной или сенсорной нейропатии у пациентов.
В клинической практике было показано, что у пациентов с нейропатией, имевшейся до начала терапии препаратом Халавен, не наблюдался больший риск развития новых или ухудшения уже имеющихся ее симптомов, в отличие от пациентов, не имевших периферической нейропатии до начала терапии препаратом Халавен.
Влияние на репродуктивную функцию
Женщины детородного возраста должны быть проинформированы о необходимости предохранения от беременности при использовании ими или их партнерами препаратаХалавен, а также об обязательном применении эффективных методов контрацепции в период лечения препаратом Халавен и в течение 3 месяцев после его завершения.
В доклинических исследованиях наблюдалась тестикулярная токсичность препарата. До начала лечения пациентам мужского пола следует обратиться за консультацией по поводу консервации спермы, поскольку при лечении препаратом Халавен существует вероятность развития необратимого бесплодия.
Удлинение интервала Q-T
Удлинение интервала Q-T отмечалось на 8-ой день, независимо от концентрации эрибулина и при нормальных значениях интервала в 1-ый день. На фоне лечения препаратом Халавен мониторинг ЭКГ рекомендуется проводить у пациентов с сердечной недостаточностью и брадиаритмиями, а также при одновременном приеме лекарственных средств, удлиняющих интервал Q-T (в том числе антиаритмических IA и III классов). До начала лечения препаратом Халавен рекомендуется устранить электролитный дисбаланс (например, гипокалиемию, гипомагниемию), а на фоне лечения мониторировать содержание этих электролитов в крови.
Не рекомендуется назначать препарат Халавен больным, имеющим синдром врожденного удлинения интервала Q-T.
Специальные меры предосторожности при утилизации и использовании Подготовка и введение препарата может осуществляться исключительно лицами, имеющими соответствующий опыт работы с цитостатиками.
Халавен представляет собой цитотоксический противоопухолевый препарат, и при работе с ним, как и с другими токсичными веществами, следует проявлять осторожность. Рекомендуется использовать перчатки, защитные очки и защитную одежду. В случае попадания раствора препарата на кожу, необходимо сразу же тщательно промыть этот участок кожи водой с мылом. При контакте препарата со слизистыми оболочками, место контакта необходимо тщательно промыть водой. При беременности не следует работать с препаратом Халавен.
Хранение вскрытой упаковки
С микробиологической точки зрения Халавен следует использовать немедленно. Хранение препарата после вскрытия упаковки или после его разведения не предусмотрено, за исключением тех ситуаций, когда хранение такого препарата осуществляется в контролируемых и стандартизованных асептических условиях. Если препарат не применяется сразу же после вскрытия упаковки, за сроки и условия его хранения отвечает лицо, работающее с препаратом.
Если Халавен не применяется в виде неразведенного раствора сразу же после вскрытия упаковки, максимальный срок хранения при 25°С на рассеянном свету составляет 4 ч, а в условиях холодильника (2-8°С) — 24 ч.
Разведенный раствор препарата Халавен (в концентрациях от 0,02 мг/мл до 0,2 мг/мл в 0,9% растворе натрия хлорида для инъекций) может храниться не более 24 ч при температуре 2-8°С, за исключением тех ситуаций, когда разведение исходного раствора осуществлялось в стандартизованных контролируемых асептических условиях. Неиспользованные остатки препарата и использованные материалы следует утилизовать согласно действующим в РФ требованиям.
Влияние на способность управления автомобилем и работы с механизмами
При приеме препарата Халавен могут наблюдаться такие побочные эффекты как усталость или головокружение, которые могут оказывать слабое или умеренное воздействие на возможность управлять автомобилем или использовать механизмы. Пациентов следует информировать о том, что при появлении чувства усталости или головокружения им нельзя управлять автомобилем или использовать механизмы.
Форма выпуска
Раствор для внутривенного введения, 0,5 мг/мл.
По 2 мл препарата во флаконах из прозрачного бесцветного гидролитического стекла типа I (Ф. США) номинальной вместимостью 5 мл, укупоренных серыми бутилкаучуковыми пробками с тефлоновым покрытием (Teflon® 2) и закатанных алюминиевыми колпачками, снабженными отрывными пластиковыми дисками (FLIP OFF) синего цвета. По 1 флакону вместе с инструкцией по применению в картонной пачке.
Условия хранения
Хранить при температуре от 8 до 25 °С.
Не замораживать и не хранить в холодильнике.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
По рецепту.
Юридическое лицо, на имя которого выдано регистрационное удостоверение (владелец РУ)
Эйсай Юроп Лимитед, Юропиан Ноуледж Центр, Москито Вэй, Хэтфилд, Хертфордшир,
ALIO 9SN, Соединенное Королевство.
Производитель
НерФарМа С.р.Л., Нервиано, Италия
Выпускающий контроль качества
Эйсай Мануфэкчуринг Лимитед, Соединенное Королевство
Получить дополнительную информацию о препарате, а также направить свои претензии и информацию о нежелательных явлениях можно по следующему адресу в России:
ООО «Райфарм»,
127006 Москва, ул. Малая Дмитровка, д.4, офис 8.
В настоящее время единого стандарта лечения пациенток с метастатическим раком молочной железы (РМЖ), ранее получавших терапию, не существует. Эрибулина мезилат одобрен в России для лечения больных местнораспространенным или метастатическим РМЖ, у которых отмечалось прогрессирование заболевания после применения не менее одного режима химиотерапии, назначенного по поводу распространенного заболевания и включавшего антрациклины и таксаны. В статье представлен обобщенный опыт применения эрибулина в реальной клинической практике при метастатическом РМЖ, а также рассмотрен клинический случай. Проанализированы эффективность и безопасность эрибулина, в частности при длительном применении, нежелательные явления.

Таблица 1. Характеристики больных (n = 26) и особенности опухолевого процесса

Таблица 1. Характеристики больных (n = 26) и особенности опухолевого процесса

Таблица 3. Нежелательные явления на фоне терапии эрибулином
Рис. 1. Рентгеновская компьютерная томография органов брюшной полости
Рис. 2. Рентгеновская компьютерная томография органов малого таза
Введение
Рак молочной железы (РМЖ) занимает второе место в структуре общей онкологической заболеваемости, уступая по частоте раку кожи, и остается основной онкологической патологией в женской популяции (20,9%): за период с 2005 по 2015 г. зафиксирован прирост стандартизированного показателя заболеваемости на 21% [1].
Благодаря инновационным противоопухолевым препаратам метастатический РМЖ перешел в разряд заболеваний с «хроническим» течением. То есть появилась возможность сдерживать прогрессирование болезни на протяжении длительного периода. Пациентки при этом сохраняют социальную активность и работоспособность. Основной целью лечения является увеличение продолжительности жизни при максимальном сохранении ее качества [2].
Благодаря внедрению в клиническую практику таргетных препаратов существенно улучшился прогноз заболевания при HER2-положительном РМЖ. Однако серьезную проблему по-прежнему представляет лечение пациенток с HER2-негативным РМЖ. Речь, в частности, идет об опухолях с трижды негативным (ТН) фенотипом, при которых отсутствуют специфические мишени для таргетной и гормональной терапии, чем обусловлено крайне агрессивное течение и быстрое прогрессирование заболевания [3]. При этом единственным надежным критерием, определяющим влияние терапии на увеличение продолжительности жизни, является показатель общей выживаемости (ОВ).
Антрациклины и таксаны остаются наиболее эффективными препаратами для лечения РМЖ, но резерв их использования при распространенном процессе ограничен в силу частого применения в неоадъювантных, адъювантных режимах и первой линии метастатического РМЖ. Выбор режимов для последующих линий представляет сложную задачу в ежедневной практике врачей-онкологов из-за отсутствия доказанного преимущества какого-либо из зарегистрированных препаратов по показателю ОВ. В соответствии с регистрационным показанием эрибулин рекомендован при местнораспространенном или метастатическом РМЖ у пациенток, получивших ранее не менее одного режима химиотерапии по поводу распространенного заболевания [4]. При этом более раннее назначение эрибулина ассоциируется с более значимым увеличением продолжительности жизни [5].
Эффективность и безопасность эрибулина
По механизму действия эрибулин отличается от других препаратов, у которых мишенью служит тубулин. Эрибулин блокирует митоз посредством образования функционально неактивных тубулиновых агрегатов, необратимо подавляя фазу роста микротрубочек и не влияя на фазу укорачивания [4, 6]. Эрибулин также воздействует на микроокружение опухоли и ее фенотип с помощью механизмов, не связанных с его антимитотическим эффектом. Эти дополнительные эффекты включают ремоделирование сосудистого русла опухоли, при котором улучшается перфузия центральной части опухоли и снижается ее гипоксия, и фенотипический переход более агрессивных мезенхимальных фенотипов в менее агрессивные эпителиальные посредством инверсии эпителиально-мезенхимальной трансформации [4, 7, 8].
Эрибулин в режиме монотерапии достоверно и клинически значимо увеличивает продолжительность жизни больных метастатическим РМЖ, получивших в анамнезе несколько режимов химиотерапии, когда резервы антрациклинов и таксанов исчерпаны (в сравнении с терапией по выбору врача) (исследование EMBRACE) [9].
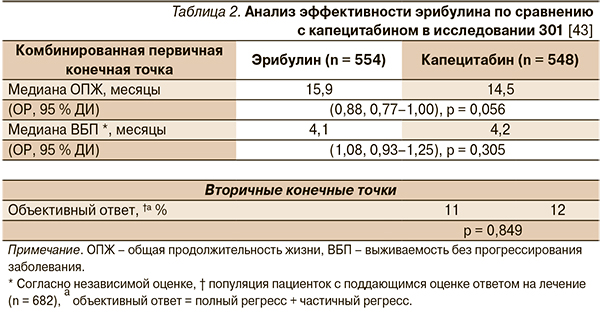
В исследовании III фазы сравнивали эффективность эрибулина и капецитабина. Основными конечными точками служили ОВ и выживаемость без прогрессирования (ВБП). При анализе всей популяции медиана ОВ была выше в группе эрибулина (15,9 против 14,5 месяца). Различия оказались близки к достоверным, но не достигли статистической значимости (р = 0,056) [10].
Изначально запланированный подгрупповой анализ в рамках данного исследования продемонстрировал, что в отдельных подгруппах эрибулина разница в ОВ была достоверно выше, чем в группе капецитабина. В группе эрибулина достоверная разница в увеличении ОВ на 2,4 месяца наблюдалась у пациенток с HER2-негативным РМЖ (15,9 и 13,5 месяца соответственно; p = 0,030) и на 3,9 месяца – с ЕR-негативным РМЖ (14,4 и 10,5 месяца соответственно; p = 0,0162). Максимальное различие в ОВ на пять месяцев зафиксировано у пациенток с ТН РМЖ (14,4 месяца в группе эрибулина и 9,4 месяца в группе капецитабина; p = 0,0062) [11]. Оценка качества жизни продемонстрировала улучшение показателей в обеих химиотерапевтических группах, причем выигрыш в группе эрибулина был более существенным, чем в группе капецитабина [12].
Помимо результатов исследований, упомянутых выше, в настоящее время доступны данные объединенного анализа. Из 1864 больных, участвовавших в двух исследованиях, 1644 пациентки получили химиотерапию эрибулином после первой линии по поводу распространенного заболевания. Достоверная разница в увеличении ОВ при использовании эрибулина отмечалась во всей популяции больных, а также в подгруппе ТН РМЖ (различия составили 4,3 месяца) и HER2-негативного РМЖ (3,1 месяца) [13]. Таким образом, объединенный анализ подтвердил существенные преимущества эрибулина перед другими видами терапии у больных распространенным РМЖ после применения антрациклинов и таксанов.
Кроме данных международных рандомизированных исследований для клиницистов особую ценность представляют результаты применения эрибулина в рутинной клинической практике.
Нами был проведен ретроспективный анализ эффективности и безопасности применения эрибулина в клинической практике у 26 пациенток с морфологически верифицированным распространенным РМЖ, получивших в условиях реальной клинической практики не менее двух курсов эрибулина после лечения антрациклинами и таксанами. Сбор данных проводился с января 2015 г. по январь 2017 г. Характеристики больных и особенности опухолевого процесса представлены в табл. 1.
Как видно из табл. 1, медиана возраста больных составила 50 лет. Статус – 0–2 балла по шкале ECOG. По результатам иммуногистохимического анализа у 14 пациенток диагностировали HER2-негативный, у девяти – ТН РМЖ. Две пациентки имели HER2-положительный статус и получали лечение эрибулином в комбинации с трастузумабом. У половины больных отмечались метастазы в двух и более органах, у 88,5% – висцеральные метастазы. Чаще метастазы были диагностированы в костях (34,6%), печени (46,2%) и легких (65,4%). Пациентки с метастатическим поражением костей получали стандартную терапию остеомодифицирующими агентами (бисфосфонаты, деносумаб).
Варианты предшествующего лечения приведены в табл. 2. Большинство больных (76,9%) получили терапию антрациклинами и таксанами, а 1/3 – дополнительно капецитабин. 5 (19,2%) пациенткам эрибулин назначали в первой линии терапии, 8 (30,8%) – во второй линии, 6 (23,1%) – в третьей, 4 (15,4%) – в четвертой, 2 (7,7%) – в пятой, 1 (3,8%) – в седьмой.
Лечение эрибулином проводилось в стандартном режиме. Препарат назначали в дозе 1,4 мг/м2 в виде 2–5-минутной инфузии в 1-й и 8-й дни 21-дневного цикла. 3 (11,5%) больным из-за нежелательных явлений потребовалась редукция дозы препарата до 1,1 мг/м2. Повторных редукций дозы не потребовалось. Терапия продолжалась до прогрессирования заболевания, развития неприемлемой токсичности или невозможности введения препарата по любой другой причине, включая отказ от продолжения терапии. Эффективность в рамках клинической практики оценивали после каждых двух курсов лечения по критериям RECIST [14].
Всего проведено 133 цикла терапии эрибулином. Медиана числа циклов эрибулина, полученных больными, достигла пяти, диапазон составил от двух до десяти циклов. Ни у одной пациентки не зафиксировано полной или частичной регрессии. Между тем более чем у половины (65,4%) удалось достичь стабилизации заболевания. Медиана времени без прогрессирования составила 4,01 месяца (95%-ный доверительный интервал 1,91–5,54).
Полученные результаты свидетельствуют о высокой противоопухолевой активности препарата (большинство больных имели висцеральные метастазы, половина из них получала препарат в качестве третьей и последующих линий терапии). Несмотря на то что медиана времени до прогрессирования составила четыре месяца, у 5 (19,2%) больных зафиксирована длительная стабилизация заболевания, в частности свыше шести месяцев.
Оценивая токсичные реакции, можно отметить, что у 8 (30,8%) пациенток каких-либо нежелательных явлений не зарегистрировано. Среди побочных реакций чаще наблюдались тошнота 1–2-й степени, нейтропения и нейропатия (табл. 3).
В обновленную инструкцию по применению эрибулина была добавлена информация об эффективности и безопасности эрибулина с трастузумабом и капецитабином по результатам исследований фазы II. Данные комбинации эффективны, при этом профиль безопасности соответствует известному профилю безопасности каждого препарата в отдельности [2, 15, 16].
Терапия эрибулином была отменена у 20 (76,9%) пациенток из-за прогрессирования заболевания, у 1 (3,9%) – из-за плохой переносимости.
На основании вышеизложенных данных применения эрибулина в реальной клинической практике у пациенток с метастатическим РМЖ можно сделать вывод, что препарат характеризуется клинической эффективностью, хорошей переносимостью, приемлемым и контролируемым профилем побочных эффектов.
Клинический случай
Больная З. 62 лет.
В 2008 г. проведено комплексное лечение по поводу рака левой молочной железы стадии IIB с включением радикальной мастэктомии слева, дистанционной гамма-терапии, адъювантной полихимиотерапии (шесть циклов без антрациклинов).
В 2009 г. при контрольном обследовании обнаружен рак правой молочной железы. Выполнена радикальная мастэктомия. Послеоперационная стадия – IIIС. Определен рецепторный статус опухоли – ЭР+; ПР-; Her2/neu++; дополнительное FISH-тестирование – амплификация отсутствует.
Проведены послеоперационная дистанционная гамма-терапия, восемь циклов дополнительнй полихимиотерапии – комбинация «циклофосфамид + доксорубицин + фторурацил». Дополнительная эндокринотерапия включала прием тамоксифена в стандартной дозе 20 мг/сут.
В июне 2010 г. на фоне эндокринотерапии обнаружена единичная опухоль мягких тканей правой половины передней грудной стенки. При дополнительном обследовании других очагов поражения не обнаружено. Проведено комбинированное лечение в виде удаления опухоли и локальной лучевой терапии на ложе метастаза. Определен рецепторный статус удаленной метастатической опухоли – ЭР+; ПР-; Her2/neu++; дополнительное FISH-тестирование – амплификация отсутствует.
По завершении комбинированного лечения выполнены сцинтиграфия скелета, рентгеновская компьютерная томография (РКТ) органов грудной полости, брюшной полости, малого таза. Выявлены единичные метастазы в поясничных позвонках. С учетом характера процесса, биологического профиля метастатической и основной опухоли принято решение о проведении эндокринотерапии второй линии в виде приема анастрозола в стандартном режиме 1 мг/сут внутрь ежедневно на фоне приема бисфосфонатов – золедроновой кислоты в стандартном режиме 4 мг внутривенно капельно один раз в 28 дней.
При контрольном обследовании в апреле 2011 г. обнаружена положительная динамика в виде значительного уменьшения размеров очагов в поясничных позвонках. Лечение продолжено в прежнем режиме.
При обследовании в июле 2011 г. (сцинтиграфия скелета, РКТ органов грудной полости, брюшной полости, малого таза) – полная ремиссия поражений костей скелета. Продолжено лечение в виде эндокринотерапии второй линии.
При контрольном обследовании в декабре 2011 г. и марте 2012 г. ремиссия сохранялась. В июне 2012 г. обнаружена небольшая опухоль в мягких тканях правой подмышечной области. Других патологических очагов не выявлено. 20 июня 2012 г. в хирургическом отделении Пятигорского онкологического диспансера опухоль мягких тканей правой подмышечной области была удалена. Гистологически – метастаз протокового рака. Определен рецепторный статус удаленной метастатической опухоли – ЭР++; ПР-; Her2/neu++. Выполнено дополнительное FISH-тестирование – амплификация отсутствует, Ki-67 – 30%.
Проведено шесть циклов дополнительной химиотерапии – паклитаксел в монорежиме.
При контрольных обследованиях в сентябре и декабре 2012 г. ремиссия сохранялась, метастатических очагов не обнаружено. От предложенной эндокринотерапии больная отказалась.
До июня 2013 г. пациентка за медицинской помощью не обращалась. В июне 2013 г. резко ухудшилось общее состояние, развился болевой синдром второй степени.
При контрольном обследовании выявлены множественные метастазы в кости таза и крестец. С учетом тяжести общего состояния принято решение о проведении эндокринотерапии третьей линии на фоне применения бисфосфонатов. Назначена терапия фулвестрантом в стандартной дозе на фоне регулярного приема золедроновой кислоты. До мая 2016 г. – стабилизация процесса без появления новых очагов поражения на фоне терапии фулвестрантом.
В мае 2016 г. пациентка обратилась с жалобами на наличие множества плотных образований в мягких тканях правой половины грудной стенки. Выполнена аспирационная биопсия одного из образований. Цитологически – метастаз протокового рака. В июне 2016 г. выполнены сцинтиграфия скелета, РКТ органов грудной полости, брюшной полости, малого таза, костей черепа. Картина обнаруженных ранее поражений костей скелета – без существенной динамики. Дополнительно – опухолевая деструкция грудины, в мягких тканях правой половины грудной стенки множественные опухолевые очаги от 3 до 14 мм в диаметре, в правой плевральной полости выпот толщиной до 5 мм.
Принято решение о прекращении эндокринотерапии и переходе на химиотерапию препаратом эрибулин в монорежиме. На момент начала лечения – 1 балл по ECOG, индекс Карновского – 80%. Первый цикл (июнь 2016 г.) проведен в стандартной дозе 1,4 мг/м² внутривенно болюсно в 1-й и 8-й дни лечения.
При контрольном обследовании в сентябре 2016 г. – выраженная положительная динамика: отсутствие плеврита, полная редукция мягкотканных очагов передней грудной стенки с сохранением деструкции грудины.
До февраля 2017 г. проведено восемь циклов химиотерапии эрибулином в стандартной дозе. В процессе лечения отмечались эпизоды гематологической токсичности, разрешившиеся самостоятельно и не потребовавшие отмены препарата или модификации его дозы. При контрольном обследовании в феврале 2017 г. сохранялись деструктивные изменения грудины. Мягкие ткани передней грудной стенки не изменены, данных о плеврите нет. РКТ органов брюшной полости (рис. 1А, 1Б) – без выраженной патологии, РКТ органов малого таза (рис. 2) – признаки немногочисленных мелких остеосклеротических и остеобластических очагов в костях таза и головках бедренных костей 5–10 мм – без динамики. Канцеро-эмбриональный антиген (СЕА) – в норме, углеводный антиген (СА 15-3) – в норме, тканевый полипептидный антиген (ТРА-М) – в норме. На момент консультации – ECOG – 0, индекс Карновского – 100%.
Согласно современным рекомендациям, не существует какого-либо единого стандарта лечения пациенток с метастатическим раком молочной железы (РМЖ), ранее получавших терапию. Эрибулина мезилат недавно был одобрен в России для лечения больных местно-распространенным или метастатическим РМЖ, у которых прогрессирование наступало после применения минимум двух режимов химиотерапии, которую назначали по поводу распространенного заболевания и включавшей антрациклины и таксаны. Благодаря уникальному механизму действия эрибулин, возможно, обладает более высокой, чем другие ингибиторы микротрубочек, противоопухолевой активностью, а также потенциалом преодоления химиорезистентности, являющейся существенной клинической проблемой. Одобрение эрибулина Европейским агентством по лекарственным средствам в 2011 г. было основано на результатах исследования III фазы EMBRACE – первого исследования, в котором было продемонстрировано значительное увеличение выживаемости больных распространенным РМЖ, ранее получавших антрациклины и таксаны. Кроме того, данные, полученные в исследовании 301, подтверждают целесообразность применения эрибулина у женщин с меньшим стажем лечения, чем у участников исследования EMBRACE. Результаты субанализов данных, полученных в этих исследованиях, также указывают на то, что в отдельных группах пациенток, в т. ч. для лиц, имеющих тройной отрицательный фенотип опухоли, влияние эрибулина на общую выживаемость может быть более выраженным, чем в общей популяции пациенток. Наряду с преимуществами в эффективности эрибулин обладает хорошей переносимостью, клинически приемлемым и контролируемым профилем побочных эффектов. В данном обзоре приводится описание эрибулина, включая его механизм действия и ключевые данные об эффективности и безопасности, полученные в исследованиях III фазы.
Введение
Рак молочной железы (РМЖ) является наиболее частым онкологическим заболеванием и ведущей причиной смертности от рака среди женщин в Европе [1]. Распространенность и заболеваемость в России в 2012 г. составили соответственно 381,2 и 39,2 случая на 100 тыс. населения [2].
В результате повышения качества лечения на ранних стадиях заболевания в большинстве развитых стран численность пациенток с метастатическим РМЖ (мРМЖ) сократилась, однако приблизительно у трети женщин, получавших когда-либо лечение по поводу ранних стадий болезни, в конечном итоге развивается метастатический рак [3]. Кроме того, примерно у 6 % пациенток мРМЖ диагностируется при первом обращении к врачу [1].
Появление в последние годы большого количества новых препаратов способствует увеличению выживаемости больных мРМЖ [4], однако по-прежнему остаются пациентки, у которых либо отсутствует ответ на терапию, либо со временем развивается резистентность к ней, и в этой ситуации мРМЖ становится фатальным заболеванием [5–7]. Кроме того, следует отметить, что достижения в лекарственной терапии последних лет касались главным образом лечения HER2-положительного РМЖ (лапатиниб, пертузумаб, трастузумаба эмтанзин) [1, 8–10], а также совершенствования лекарственных форм уже имеющихся препаратов, например разработка наб-паклитаксела, что позволяет применять паклитаксел в более высоких дозах [11]. В то же время возможности терапии мРМЖ на более поздних этапах (после нескольких линий химиотерапии), а также РМЖ с тройным негативным фенотипом, который составляет 15–20 % всех случаев и отличается агрессивным течением, по-прежнему ограничены [12–14].
Поскольку мРМЖ все еще остается неизлечимым заболеванием, одной из главных целей лечения наряду с поддержанием хорошего качества жизни, в т. ч. путем уменьшения токсичности препаратов, является продление ее сроков. Вместе с тем среди исследований, проведенных с участием женщин с мРМЖ, редко встречаются такие, в которых в качестве первичной конечной точки была выбрана общая выживаемость, хотя для многих пациенток даже при наличии риска токсичности терапии большое значение имеют ее преимущества в отношении выживаемости [15, 16]. Поиск публикаций, проведенный в сентябре 2010 г., выявил данные только о пяти исследованиях III фазы с участием пациенток с мРМЖ, ранее получавших антрациклины и таксаны, и только в одном из них общая выживаемость была выбрана в качестве конечной точки (которая не была достигнута) [15].
В связи с недостаточным объемом исследовательских данных, которые показывали бы увеличение выживаемости среди пациенток с мРМЖ, отсутствует какой-либо стандарт лечения больных мРМЖ, ранее получавших терапию, особенно женщин с тройным отрицательным подтипом заболевания [1, 15, 17, 18]. Вместо этого при выборе схемы терапии рассматриваются такие аспекты, как предыдущее лечение, время до рецидива, предпочтения пациенток и врачей, доступность лекарственных препаратов, токсичность и качество жизни [1, 5, 6].
В данном обзоре рассматривается новый химиотерапевтический препарат эрибулин, недавно одобренный в России для лечения больных местно-распространенным или мРМЖ с прогрессированием после применения не менее двух схем химиотерапии распространенного заболевания (в т. ч. антрациклины и таксаны). Одобрение эрибулина Европейским агентством по лекарственным средствам (European Medicines Agency) в 2011 г. [19] было основано на результатах исследования III фазы EMBRACE – первого исследования, в котором было продемонстрировано значительное увеличение выживаемости пациенток, ранее получавших антрациклины и таксаны по поводу метастатической болезни [15].
Эрибулин – нетаксановый ингибитор микротрубочек с уникальным механизмом действия
Эрибулина мезилат представляет собой синтетический аналог галихондрина B, первоначально выделенного из морской губки Halichondria okadai [20]. Это нетаксановый ингибитор микротрубочек, механизм действия которого отличается от механизма действия других препаратов, воздействующих на тубулин, включая таксаны, алкалоиды барвинка и эпотилоны. Он угнетает образование митотического веретена, связываясь с участками, расположенными на плюс-конце микротрубочки, тем самым селективно подавляет ее рост, не влияя на фазу укорачивания, и вызывает преобразование тубулина в изолированные нефункциональные агрегаты. Это препятствует митозу и в конечном итоге ведет к снижению пролиферации клеток и увеличению апоптоза [21–25]. Эрибулин также обладает способностью необратимо блокировать митоз, которая редко встречается среди ингибиторов микротрубочек [26].
Способность эрибулина индуцировать необратимую блокаду митоза наряду со стойким удержанием препарата в опухолевых клетках может способствовать более высокой противоопухолевой активности по сравнению с другими ингибиторами микротрубочек [4]. Кроме того, вследствие мутаций β-тубулина в опухолевых клетках может развиваться резистентность к ингибиторам микротрубочек. Однако в доклинических исследованиях клетки рака яичников, резистентные к паклитакселу, проявляли почти идентичную чувствительность к эрибулину по сравнению с нерезистентными к паклитакселу материнскими клетками [27]. Это является еще одним подтверждением уникальности механизма действия эрибулина и указывает на его потенциал с точки зрения преодоления химиорезистентности. Механизм действия эрибулина, включая его воздействие на гены в клетках кровеносных сосудов, имеющие отношение к ангиогенезу (например, на фактор роста эндотелия сосудов), ремоделирование сосудистой системы, а также на морфологию, миграцию и инвазию клеток, продолжают изучать [28–30].
На основании данных об активности эрибулина и его контролируемом профиле токсичности, зарегистрированных в исследованиях I [31–34] и II фаз [35, 36], было проведено исследование III фазы EMBRACE.
Эффективность эрибулина по сравнению с терапией по выбору врача
В исследованиях III фазы, как правило, проводится сравнение нового препарата с имеющейся стандартной терапией. Поскольку четкий стандарт лечения пациенток с местно-распространенным и мРМЖ после применения антрациклинов и таксанов отсутствует [1, 12, 17], в качестве препарата сравнения, отражающего терапевтические решения, принимаемые в реальных клинических условиях, в исследовании EMBRACE была использована терапия по выбору врача [15].
Дизайн исследования EMBRACE приведен на рисунке (a). В группе терапии по выбору врача 96 % пациенток получали химиотерапию (наиболее часто применялись винорелбин, гемцитабин и капецитабин), 4 % – гормональную и никто из пациенток не получал биологическую или оптимальную поддерживающую терапию в качестве единственного вида лечения. Исходные демографические характеристики и биологические особенности опухоли были хорошо сбалансированы между сравниваемыми группами, а выборка исследования была репрезентативной относительно общей популяции женщин с местнорецидивирующим или мРМЖ, ранее получавших лечение. Из пациенток, рандомизированных для участия в исследовании EMBRACE, 25 % представляли Восточную Европу, у 19 % присутствовал тройной негативный фенотип опухоли [15].
Применение эрибулина позволило увеличить медиану общей продолжительности жизни по сравнению с терапией по выбору врача на 2,5 месяца (13,1 и 10,6 месяца соответственно, p = 0,014), что соответствует увеличению данного показателя на 23 % (табл. 1). Это различие является не только статистически значимым, но и клинически важным для этой популяции больных [15].
Существенное и клинически значимое преимущество в выживаемости среди пациенток, получавших эрибулин, было подтверждено результатами незапланированного обновленного анализа общей выживаемости, проведенного по требованию органов нормативного регулирования как США, так и Европы (соответственно 13,2 и 10,5 месяца, p = 0,014; табл. 1) [15, 37]. Одно- и двухлетняя выживаемость составила 54,5 и 21,9 % в группе терапии эрибулином и 42,8 и 19,2 % в группе терапии по выбору врача соответственно [37].
Увеличение общей выживаемости среди пациенток, получавших эрибулин, не зависело от возраста, рецепторного статуса, предыдущей терапии капецитабином, количества пораженных органов, локализации метастазов (все эти критерии были определены заранее) и от времени до появления первого метастатического очага (незапланированный критерий) [38–40]. Поисковый анализ данных, полученных в исследовании EMBRACE, показал, что преимущество эрибулина по общей выживаемости перед терапией по выбору врача было более выраженным среди пациенток, получивших не более трех предыдущих схем терапии (13,3 и 10,7 месяца; отношение рисков [ОР] = 0,77, 95 % доверительный интервал [ДИ] – 0,61–0,90; p = 0,039), чем среди пациенток, получивших более трех предыдущих схем терапии (11,7 и 10,0 месяцев; ОР = 0,90, 95 % ДИ – 0,60–1,35; p = 0,607), хотя исследование не обладало достаточной статистической мощностью для демонстрации статистической значимости результатов данного анализа [41].
Вторичными конечными точками исследования EMBRACE были выживаемость без прогрессирования заболевания и частота объективного ответа [15]. Как и в случае общей продолжительности жизни, медиана времени до прогрессирования заболевания (согласно исследовательской оценке) была значительно выше в группе терапии эрибулином, чем в группе терапии по выбору врача (3,6 и 2,2 месяца соответственно; p = 0,002) (табл. 1). Согласно независимой оценке, медиана времени до прогрессирования была также выше среди пациенток, получавших эрибулин, однако данный результат не был статистически значимым (табл. 1).
Таким образом, фактически эрибулин стал первым препаратом, при использовании которого в монотерапии продемонстрировано статистически и клинически значимое увеличение выживаемости больных местно-распространенным и мРМЖ, получавших ранее антрациклины и таксаны. Результаты исследования EMBRACE и последующее одобрение эрибулина в США (2010) [42] и Европе (2011) [19] показывают, что увеличение продолжительности жизни пациенток, страдающих мРМЖ, является реальной и достижимой целью.
Эффективность эрибулина на ранних этапах лечения мРМЖ
Приблизительно в одно время с исследованием EMBRACE началось второе исследование III фазы, в котором проводилось сравнение терапии эрибулином и капецитабином женщин с местно-распространенным и мРМЖ. Капецитабин является одобренным и широко применяемым в этой группе больных препаратом монохимиотерапии в Европе [12, 43, 44], хотя его преимущества в отношении выживаемости не изучались в рамках исследования с достаточной статистической мощностью.
Дизайн исследования 301 приведен на рисунке (б). Критерии включения были аналогичны таковым в исследовании EMBRACE, пациентки получали исследуемый препарат в первой, второй или третьей линиях терапии местно-распространенного или метастатического заболевания, в то время как в исследовании EMBRACE исследуемый препарат применялся только в терапии третьей и последующих линий [15, 43]. Исходные демографические характеристики пациенток и биологические особенности опухолей были в целом хорошо сбалансированы [43]. Медиана числа предыдущих схем химиотерапии была равна 2, при этом большинство больных получали исследуемый препарат в первой (20,0 %) или второй (52,0 %) линиях терапии метастатического заболевания [45]. Примерно у четверти пациенток из числа рандомизированных в данное исследование опухоли имели тройной отрицательный фенотип [43].
В качестве комбинированной первичной конечной точки исследования 301 были выбраны общая выживаемость и выживаемость без прогрессирования заболевания. Терапия эрибулином обеспечила более длительную общую продолжительность жизни по сравнению с капецитабином, однако это отличие не было статистически значимым (15,9 и 14,5 месяца, p = 0,056; табл. 2). Тенденция к большей продолжительности жизни в группе терапии эрибулином наметилась уже на раннем этапе и сохранилась на протяжении всего исследования. Одно-, двух- и трехлетняя выживаемость среди пациенток, получавших эрибулин и капецитабин, составила соответственно 64,4 и 58,0 % (p = 0,035), 32,8 и 29,8 % (p = 0,324) и 17,8 и 14,5 % (p = 0,175) [43].
Согласно независимой оценке, в группах терапии эрибулином и капецитабином получены сходные показатели времени до прогрессирования заболевания (4,1 и 4,2 месяца, p = 0,305) (табл. 2). Отмеченная тенденция к увеличению общей выживаемости без увеличения выживаемости без прогрессирования заболевания среди пациенток, получавших эрибулин, могла быть обусловлена несбалансированностью терапии, полученной после окончания исследования: эрибулин был одобрен ближе к завершению исследования, что ограничило число пациенток, которые смогли перейти с капецитабина на эрибулин. В сравниваемых группах была также зарегистрирована сходная частота объективного ответа (11,0 и 11,5 %; p = 0,849) (табл. 2) [43].
Токсичность и безопасность эрибулина
В исследовании EMBRACE отсутствовала возможность оценить влияние исследуемого препарата на качество жизни, т. к. использование различных препаратов терапии по выбору врача осложнило бы интерпретацию данных [15]. Однако, поскольку поддержание качества жизни пациентки является одной из основных целей терапии мРМЖ, оно оценивалось в качестве вторичной конечной точки в исследовании 301. У пациенток, получавших эрибулин, улучшение как общего состояния здоровья (общего качества жизни), так и когнитивной функции было значительно более выраженным, чем у пациенток, получавших капецитабин (6,5; p = 0,048 и 15,3; p < 0,001 соответственно). При этом эмоциональное состояние улучшилось в большей степени у пациенток, получавших капецитабин, чем у пациенток, получавших эрибулин (3,3; p = 0,033). Что касается побочных эффектов, то осложнения со стороны желудочно-кишечного тракта (включая тошноту, рвоту и диарею) чаще встречались в группе капецитабина, а нарушение вкусовых ощущений, приливы и алопеция – в группе эрибулина [46].
Нежелательные явления, отмеченные в исследованиях EMBRACE и 301, соответствовали выявленному ранее профилю побочных эффектов эрибулина. Общая частота и доля серьезных нежелательных явлений у пациенток, получавших эрибулин, в обоих исследованиях были сопоставимыми. Доля пациенток, у которых были отмечены нежелательные явления, приведшие к прекращению лечения, была сопоставимой в обоих исследованиях. Наиболее распространенные нежелательные явления, отмеченные не менее чем у 25 % пациенток, представлены в табл. 3 [15, 43].
Наиболее распространенными проявлениями гематологической токсичности 3/4-й степеней тяжести (отмеченными не менее чем у 10 % пациенток) после терапии эрибулином в исследованиях EMBRACE и 301 были нейтропения (45 и 46 % соответственно) и лейкопения (14 и 15 % соответственно) [15, 43]. Нейтропения была причиной редукции доз и увеличения интервалов между введениями, а также назначения гранулоцитарного колониестимулирующего фактора [15]. Частота фебрильной нейтропении, связанной с применением эрибулина, была низкой (5 и 2 % больных, получавших эрибулин в исследованиях EMBRACE и 301 соответственно) [15, 43].
В исследовании EMBRACE наиболее распространенным нежелательным явлениям, приведшим к прекращению терапии эрибулином, стала периферическая нейропатия (всех степеней тяжести), отмеченная у 35 % пациенток и приведшая к прекращению лечения 5 % пациенток. В исследовании 301 периферическая сенсорная нейропатия была отмечена у 13 % пациенток, получавших эрибулин, и у 7 % пациенток, получавших капецитабин [43].
В недавнем исследовании II фазы (n = 104) сообщается о более низкой частоте периферической нейропатии после терапии эрибулином по сравнению с иксабепилоном: все степени тяжести – 31 и 44 % соответственно, и 3/4-й степеней тяжести – 10 и 20 % соответственно. В группе терапии эрибулином было меньше пациенток, прекративших лечение вследствие нежелательных явлений, чем в группе терапии иксабепилоном (12 и 32 % соответственно) [47, 48].
Таким образом, результаты анализа безопасности, проведенного в исследованиях EMBRACE и 301, показывают, что эрибулин хорошо переносится и имеет клинически приемлемый и контролируемый профиль побочных эффектов. Эрибулин является водорастворимым и для приготовления не требует липофильных растворителей, в связи с чем исчезает необходимость в премедикации для профилактики реакций гиперчувствительности [49].
Эффективность эрибулина в различных подгруппах больных
В исследованиях EMBRACE и 301 было продемонстрировано, что эрибулин эффективен в различных подгруппах пациенток. Результаты субанализов показали, что в отдельных популяциях пациенток его эффект может быть еще более выраженным.
Запланированные заранее поисковые анализы данных, полученных в исследованиях EMBRACE и 301, свидетельствуют о возможном более выраженном эффекте эрибулина в подгруппе пациенток с тройным отрицательным фенотипом заболевания по сравнению с терапией по выбору врача (9,5 и 7,0 месяца; ОР = 0,71, 95 % ДИ – 0,46–1,10) [50] и капецитабином (14,4 и 9,4 месяца; ОР = 0,78, 95 % ДИ – 0,55–0,90; p = 0,0062) [45].
Кроме того, результаты заранее запланированного поискового анализа данных, полученных в исследовании 301, указывают на то, что преимущество эрибулина перед капецитабином по общей выживаемости является более выраженным среди пациенток с HER2-отрицательным (15,9 и 13,5 месяца; ОР = 0,84; 95 % ДИ – 0,73–0,98; p = 0,0299) и ER-отрицательным заболеваниями (14,4 и 10,5 месяца; ОР = 0,78, 95 % ДИ – 0,64–0,96; p = 0,0162). Более выраженный эффект в отношении общей выживаемости наблюдался при терапии эрибулином пациенток с невисцеральными проявлениями болезни, поражением нескольких органов, прогрессированием более чем через 6 месяцев после последней химиотерапии, наличием терапии антрациклинами и (или) таксанами в анамнезе.
Таким образом, данные, полученные в исследованиях III фазы, свидетельствуют, что эрибулин обеспечивает существенное и клинически значимое увеличение выживаемости ранее леченных пациенток с мРМЖ по сравнению с терапией по выбору врача и сравнимую эффективность лечения по сравнению с широко применяемым препаратом капецитабин. Помимо высокой эффективности эрибулин обладает хорошей переносимостью, клинически приемлемым и контролируемым профилем побочных эффектов.
Особый интерес представляют результаты субанализов данных, полученных в этих исследованиях, указывающие на то, что в отдельных подгруппах больных эффект эрибулина может быть более выраженным, что заслуживает дальнейшего изучения. В настоящее время продолжаются исследования по изучению действия эрибулина при тройном отрицательном и HER2-положительном подтипах заболевания, а также на более ранних стадиях РМЖ, в т. ч. в комбинации с другими препаратами.
Стенина Марина Борисовна, доктор медицинских наук, ведущий научный сотрудник отделения клинической фармакологии и химиотерапии, ФГБУ «РОНЦ им. Н.Н.Блохина» РАМН, Москва