Средняя цена за 1л(кг) дезсредства Фенокси-стерил:

Купить дезсредство Фенокси-стерил в регионах
Белгород, склад дезсредств ООО Торговый Дом ВладМиВа, тел.: (4722) 200-555, www.vladmiva.ru
Владивосток, склад дезсредств ООО ТД Асепт, тел.: (4232) 310-444 320-671 319-701, www.aseptvl.ru
Скачать полный прайс ООО ТД Асепт
Москва, склад дезсредств ГУП Московский городской центр дезинфекции, тел.: (499)188-62-65, 188-26-01, www.mgcd.ru
Москва, склад дезсредств ООО ГермесМедТорг, тел.: (495) 920-39-11,
Скачать полный прайс ООО ГермесМедТорг
Москва, склад дезсредств ООО Дезнэт, тел.: (495) 980-08-99, 778-72-74, www.deznet.ru
Скачать полный прайс ООО Дезнэт
Москва, склад дезсредств ООО ДЕЗСНАБ-ТРЕЙД, тел.: (495) 558-63-56 (985) 773-51-00, www.dezsnab-trade.ru
Москва, склад дезсредств ООО Медез, тел.: (499) 714-91-50, www.medez.ru
Скачать полный прайс ООО Медез
Москва, склад дезсредств ООО НаНоДез, тел.: (499) 508-53-19 (499) 508-55-92, www.nano-dez.ru
Скачать полный прайс ООО НаНоДез
Москва, склад дезсредств ТК Бинго Гранд, тел.: (495) 411-99-51, www.infodez.ru
Скачать полный прайс ТК Бинго Гранд
Нижний Новгород, склад дезсредств ООО Ромислав, тел.: (831) 413-75-57, 413-75-27, www.romislav.ru
Ростов-на-Дону, склад дезсредств ООО Айтэм Сервисез, тел.: (863) 296-96-53 296-90-60, ecolabhealthcare.ru
Скачать полный прайс ООО Айтем Сервисез
Санкт-Петербург, склад дезсредств ООО Медикал Системз Сервайс, тел.: (812) 995-84-26, www.medicalss.ru
Скачать полный прайс ООО Медикал Системз Сервайс
Производитель дезсредства Фенокси-стерил:ТОО «Производственный комплекс «Аврора» (Казахстан)
Фенокси-стерил ИНСТРУКЦИЯ по применению скачать
Функциональные и технические характеристики дезинфицирующего средства Фенокси-стерил: средство дезинфицирующее Фенокси-стерил представляет собой жидкий концентрат и содержит в качестве активной основы смесь ЧАС, альдегидов и производных фенола.
Дезсредство Фенокси-стерил предназначено для дезинфекции ИМН; стерилизации ИМН; дезинфекции высокого уровня . Срок годности средства-2года, рабочих растворов-14сут.
ДВУ (дез. высокого уровня): 5%-60мин; 6%-40мин
— для стерилизации ИМН из различных материалов: хирургических, стоматологических ( в т.ч. вращающихся) инструментов, гибких и жестких эндоскопов и инструментов к ним; для дезинфекции высокого уровня эндоскопов.
Средство обладает активностью в отношении грамположительных и грамотрицатепьных бактерий (включая микобактерии туберкулеза и споровые формы бактерий), вирусов (в том числе вирусы энтерапьных и парентеральных гепатитов, ВИЧ, полиомиелита, аденовируса, вирусов «атипичной пневмонии» (SARS), гриппа человека и «птичьего гриппа» H5N1, герпеса и др.), грибов рода Кандида, Дерматофитон, спороцидным действием.
дезинфекция высокого уровня эндоскопов 6,0% — 20 мин. стерилизация ИМН 6,0% — 30 мин.
дидецилдиметиламмония хлорид (ЧАС) — 7,5%, алкилдиметилбензиламмония хлорид (ЧАС) — 7,5%, 2-феноксиэтанол — 10%, глутаровый альдегид — 5%, а также функциональные компоненты.
Пластиковые флаконы — 0,5л,1 л, 5л.
| Описание | Средство для дезинфекции и холодной химической стерилизации, дезинфекция высокого уровня. ДВУ эндоскопов | ||||||||||||||||
| Бренд | Фенокси-Стерил | ||||||||||||||||
| Состав | Глутаровый альдегид – 5 %; смесь ЧАС – 17 %, 2-феноксиэтанол – 10 % | ||||||||||||||||
| Объем, мл | 5000 | ||||||||||||||||
| Срок годности | 3 года | ||||||||||||||||
| Условия хранения | Хранить средство в герметично закрытых емкостях при температуре от +5 °С до + 35 °С | ||||||||||||||||
| Форма выпуска | жидкость | ||||||||||||||||
| Дополнительная информация | |||||||||||||||||
| Страна производства | Казахстан | ||||||||||||||||
| Единица измерения | Штука | ||||||||||||||||
|
Подходящие ЕНСТРУ |
|
| Состав | Глутаровый альдегид – 5 %; смесь ЧАС – 17 %, 2-феноксиэтанол – 10 % |
| Объем, мл | 5000.0000 |
| Описание | Средство для дезинфекции и холодной химической стерилизации, дезинфекция высокого уровня. ДВУ эндоскопов |
| Форма выпуска | жидкость |
| Срок годности | 3 года |
| Условия хранения | Хранить средство в герметично закрытых емкостях при температуре от +5 °С до + 35 °С |
| Дополнительная информация |
Дезинфекции всегда должна предшествовать стадия очистки поверхности. Пищевые загрязнения, оставшиеся на плохо очищенной поверхности, являются источниками питания и очагами роста микроорганизмов. Хорошее санитарно-гигиеническое состояние на пищевом предприятии достигается комбинированной программой тщательной очистки всех поверхностей и оборудования с последующей дезинфекцией. Известно, что при тщательной очистке с поверхности удаляется до 90% микроорганизмов. На недомытой поверхности остатки загрязнений не только защищают микроорганизмы от санитарной обработки, но и снижают эффективность дезинфицирующего средства за счет эффекта разбавления или химической реакции органического вещества с дезинфектантом.
Химические соединения, предназначенные для использования в пищевой промышленности в качестве дезинфектантов, отличаются химической структурой, активностью против различного вида микроорганизмов и условиями, при которых они проявляют максимальную активность. В общем, случае справедлива закономерность – чем выше концентрация дезинфицирующего средства, тем быстрее и эффективнее его действие. Чтобы выбрать эффективное дезинфицирующее средство, нужно экспериментальным или теоретическим путем определить потенциальные патогенные микроорганизмы и убедиться в том, что, выбранный дезинфектант активен в отношении этих микроорганизмов. Поскольку химические дезинфектанты не обладают высокой проникающей способностью, микроорганизмы в трещинах, царапинах и других неровностях поверхности, внутри минеральных загрязнений могут быть не полностью уничтожены после обработки. Чтобы действие химических дезинфектантов было эффективно, поверхность перед обработкой должна быть тщательно очищена.
Эффективность обработки зависит от ряда физико-химических факторов:
- время экспозиции. Исследования показали, что гибель популяции микроорганизмов носит логарифмический характер: 90% микроорганизмов гибнет в определенный интервал времени, 90% оставшихся организмов гибнет в следующий интервал времени, при этом остается лишь 1% от первоначального количества микроорганизмов. Время экспозиции зависит от эффективности воздействия дезинфицирующего средства на данный вид микроорганизмов, способности к образованию спор и других физико-химических факторов.
- температура. С увеличением температуры возрастают скорости роста микроорганизмов и их гибели вследствие действия химических дезинфицирующих средств. Увеличение температуры приводит к снижению поверхностного натяжения, вязкости и изменению ряда других параметров, которые способствуют гибели микроорганизмов.
- концентрация. С увеличением концентрации дезинфицирующего средства возрастает скорость гибели микроорганизмов.
- показатель pH . Активность антимикробных соединений, как правило, зависит от показателя pH среды. Например, хлор и йод содержащие дезинфицирующие средства теряют свою активность с увеличением показателя pH среды.
- жесткость воды. С увеличением концентрации солей жесткости воды снижается биологическая активность дезинфицирующих средств, в результате их взаимодействия с солями жесткости воды. Например, четвертичные аммониевые соединения не совместимы с солями кальция и магния. При жесткости воды выше 200 ppm дезинфицировать поверхность четвертичными аммониевыми соединениями без добавления комплексообразователей, смягчающих воду, бесполезно.
- чистота поверхности и оборудования. Многие дезинфицирующие вещества – гипохлорит, йодофоры и многие другие химические дезинфектанты взаимодействуют с органическими соединениями, оставшимися на плохо очищенной поверхности, и теряют свою биологическую активность. Характеристики идеального дезинфектанта.
Идеальный дезинфектант должен обладать следующими свойствами
- высокой биологической активностью против вегетативных бактерий, грибов, дрожжей, обеспечивающей быструю гибель микроорганизмов;
- устойчивостью к окружающей среде (быть эффективным в жесткой воде, в присутствии остатков органических соединений, остатков моющих средств);
- отсутствием токсичности и кожно-раздражающего действия;
- отсутствием запаха;
- стабильностью в концентрированном виде и виде рабочего раствора;
- легкостью в использовании;
- доступностью;
- доступной ценой;
- легкостью идентификации во время использования.
К сожалению, идеальное дезинфицирующее средство, удовлетворяющее одновременно всем выше перечисленным параметрам пока не создано. На практике следует выбирать дезинфектант с высокой биологической активностью против микроорганизмов, которые есть или теоретически могут появиться на предприятии. От правильного выбора дезинфицирующего средства и соблюдения санитарно-гигиенических правил обработки поверхностей и оборудования будет зависеть безопасность произведенных продуктов питания.
Классификация химических дезинфицирующих веществ.
Дезинфицирующие средства классифицируют по их действию на различные формы микроорганизмов: бактерициды уничтожают вегетативные микроорганизмы, спороциды уничтожают споры, фунгициды уничтожают грибы, вируциды уничтожают вирусы. Химические антисептики используются для дезинфекции кожи. Бактериостатические вещества препятствуют размножению бактерий, фактически их не уничтожая.
Химические соединения воздействуют на клетку несколькими способами. Один из них — коагуляция протеина. В обычном состоянии протеин диспергирован внутри клетки. Дезинфицирующее соединение взаимодействует с протеином, вызывая его коагуляцию и выпадение в осадок. Клетка перестает функционировать в нормальном режиме и погибает. Еще один способ воздействия дезинфицирующего вещества на микроорганизмы – разрушение мембраны клетки. Мембрана клетки работает как избирательный барьер, одни растворы она пропускает внутрь клетки, другие растворы не могут преодолеть этот барьер. Вещества, которые сорбируются на клеточной мембране, могут заметно изменить ее физико-химические характеристики, препятствуя нормальному функционированию. Это может привести к ингибированию активности или к гибели клетки.
Химический антагонизм. Ферменты выполняют свою каталитическую функцию благодаря их сродству с некоторыми химическими соединениями, которые называют природными субстратами. Природные субстраты в стандартном режиме находятся внутри клетки. Если природные субстраты в заметном количестве заменяются дезинфектантом, фермент будет связан с химическим веществом, а не субстратом. В случае образования достаточно устойчивой связи фермент — химический дезинфектант клетка теряет способность к размножению.
Обычно химические дезинфицирующие вещества классифицируют по типу биологически-активного вещества, входящего в его состав.
Хлор-содержащие дезинфицирующие средства.
Жидкий хлор, гипохлорит, хлорамин, диоксид хлора являются дезинфицирующими агентами. Они различаются по своей антимикробной активности. Хлор в газообразном состоянии (Cl2) вводят в воду и получают антимикробный агент — хлорноватистую кислоту (НОСl). НОСl диссоциирует в воде с образованием иона водорода Н+ и иона гипохлорита (OCl— ).
Жидким хлором называют раствор гипохлорита натрия в воде (NaOCl), это наиболее распространенная форма дезинфицирующего средства на основе хлора. Следует отметить, что хлорноватистая кислота в 80 раз активнее в качестве дезинфицирующего агента, чем гипохлорит ион. Считается, что механизм антимикробного действия хлорсодержащих соединений заключается в окислении аминокислот мембраны клетки, разрушении мембраны, прерывании синтеза протеина, ингибировании поглощения кислорода клетки и т.д. Некоторые соединения хлорамина более активны против ряда микроорганизмов, чем гипохлориты. Например, дихлороизоцианурат натрия более активен, чем гипохлорит натрия против таких бактерий, как E.coli, S.aureus и некоторых других.
В последние годы возрос интерес к дезинфицирующим средствам на основе диоксида хлора (ClO2). Диоксид хлора в 2.5 раза активнее, чем гипохлорит натрия в качестве окислителя. Диоксид хлора наиболее активен при рН=8.5.
Один из способов получения диоксида хлора можно представить следующим образом:
5NaClO2 + 4HCl → 4ClO2 + 5NaCl + 2H2O
NaOCl + HCl → NaCl + HOCl
HOCl + 2NaClO2 → ClO2 + 2NaCl + H2O
Используя эти химические реакции, можно непосредственно в пенной пушке или пеногенераторе получать пену, содержащую 5 ppm диоксида хлора. Диоксид хлора активен против широкого спектра микроорганизмов, в том числе спорообразующие бактерии и вирусы. Его действие на микроорганизмы заключается в ингибировании воспроизведения микроорганизмов, поскольку диоксид хлора является сильным окислителем.
Когда хлорсодержащие соединения используют для обработки поверхностей, уничтожаются клетки вегетативных и спорообразующих бактерий. Вегетативные клетки уничтожить легче, чем споры Clostridium, которые в свою очередь легче уничтожить, чем споры Bacillius. Хлорсодержащие соединения в концентрации 50 ppm обладают слабой активностью в отношении Listeria monocytogenes, концентрации выше 50 ppm хлорсодержащие соединения эффективны в отношении этого патогенного микроорганизма. В целом эффективность хлорсодержащих соединений возрастает с увеличением концентрации и температуры раствора и понижением значения pH. Следует отметить, что с увеличением температуры увеличивается и скорость коррозии металлов, если обрабатывается металлическая поверхность.
К достоинствам хлорсодержащих соединений следует отнести:
- эффективность в отношении различных бактерий, грибков и вирусов;
- доступность в жидкой и гранулированной форме;
- соли жесткости воды оказывают слабое влияние на активность;
- при использовании хлорсодержащих соединений не происходит образования токсичных побочных продуктов;
Хлорсодержащие соединения обладают меньшей коррозионной способностью, чем жидкий хлор.
К недостаткам хлорсодержащих соединений следует отнести:
- нестабильность и потеря активности с увеличением температуры и при взаимодействии с органическими веществами;
- снижение биологической активности с увеличением показателя pH среды.
- коррозия нержавеющей стали и других металлов, что допускает лишь кратковременный контакт с поверхностями и оборудованием из металлов;
- теряют активность при хранении на свету и использовании при температурах выше 60ºС
- в области низких значений pH (pH <4.0) может происходить образование токсичного газа Cl2, обладающего сильным коррозионным действием;
- при высоких концентрациях в жидких формах могут быть взрывоопасными.
Йод содержащие соединения.
Соединения йода используются для дезинфекции поверхностей и оборудования, а также в качестве кожных антисептиков. Йодофоры используют также как соединения хлора в водоподготовке. Оказалось, что двухатомный йод J2 является самым активным антимикробным агентом из йодсодержащих соединений. Его активность проявляется в том, что он разрушает связи, удерживающие протеины в клетке вместе и ингибирует синтез протеинов. Свободный элементарный йод и йодноватистая кислота проявляют высокую активность в уничтожении микроорганизмов. В качестве дезинфицирующих агентов используют спиртосодержащие соединения йода и соединения на водной основе, эти растворы также используют в качестве кожных антисептиков. Активными в отношении микроорганизмов формами являются J2 и иодноватистая кислота НОJ.
Йодофорами называют комплексы элементарного йода J с неионогенными ПАВ, например нонилфенолэтиленоксидом, или комплекс йода с полимером – поливинилпирролидоном в водном растворе. Йодофоры чаще других йод содержащих соединений используются в качестве дезинфицирующих агентов. Поскольку активность в отношении микроорганизмов увеличивается с понижением значения pH, йодофоры комбинируют с фосфорной кислотой. Сочетание йодофоров с поверхностно-активными веществами и кислотами придает им моющие свойства. Такие средства обладают одновременно моющими и дезинфицирующими свойствами, они обладают лучшей растворимостью в водных растворах, чем суспензии или водные растворы йода. Они не обладают запахом и кожно-раздражающим действием.
Поведение комплекса ПАВ-йод можно объяснить химическим равновесием:
R + J2 ↔ RJ + HJ, R — неионогенное ПАВ
Количество доступного свободного йода определяет биологическую активность йодофора. Спорообразующие бактерии более устойчивы к действию йодофоров, чем вегетативные, и времена экспозиции, приведенные в таблице 4.1, в 10 -1000 раз больше, чем времена экспозиции, необходимые для аналогичного воздействия на вегетативные клетки. Активность йод содержащих веществ по своему действию на вегетативные клетки сравнима с хлор содержащими дезинфектантами, однако действие йодофоров на спорообазующие бактерии слабее. Йод содержащие дезинфицирующие агенты более устойчивы к воздействию органических веществ, чем хлор содержащие. Йодофоры обычно используют в концентрациях 12.5 – 25 ppm. Йодофоры более активны против Tubercule bacillus и других вирусов, чем остальные дезинфицирующие агенты. Йод содержащие соединения проявляют максимальную активность в области значений pH 2.5 – 3.5. Йодофоры в виде концентрированных и стабилизированных растворов имеют длительные сроки хранения. В разбавленных растворах йод имеет тенденцию к испарению, особенно активно этот процесс протекает при температуре выше 50ºС.
Таблица 1 Инактивация спорообразующих бактерий. Тесты проведены в дистиллированной воде при Т=15-20ºС.
|
Микроорганизм |
Показатель рН |
Концентрация, ppm |
Время снижения числа микроорганизмов на 90%, мин. |
|
Bacillus cereus |
6.5 |
50 |
10 |
|
6.5 |
25 |
30 |
|
|
2.3 |
25 |
30 |
|
|
Bacillus subtilis |
— |
25 |
5 |
|
Clostridium botulinum A |
2.8 |
100 |
6 |
Материалы из пластмасс и резины способны адсорбировать соединения йода, что может привести к появлению пятен. В желтый цвет соединения йода окрашивают и органические загрязнения, этот эффект можно использовать для контроля остатков пищевых загрязнений на поверхностях.
Растворы йодофоров имеют кислый характер, поэтому они эффективны в жесткой воде, не способствуя при этом удалению минеральных отложений. Многие органические вещества, особенно молоко и молочные продукты инактивируют дезинфектанты на основе соединений йода.
К недостаткам дезинфицирующих агентов на основе соединений йода следует отнести невысокую активность против спорообразующих бактерий и бактериофагов, а также слабую биологическую активность при низких температурах. При температурах выше 50ºС.
Четвертичные аммониевые соединения.
Четвертичные аммониевые соединения часто используют для обработки полов, стен, мебели и оборудования. Эти соединения являются поверхностно-активными веществами и обладают хорошей смачивающей способностью. Невысокая моющая способность четвертичных аммониевых соединений при великолепной антимикробной активности предопределило их использование в качестве дезинфицирующих средств. Например, четвертичные аммониевые соединения обладают высокой активностью против L.monocytogenes и плесневых грибов.
В четвертичных аммониевых соединениях азот, соединенный с четырьмя органическими радикалами имеет положительный заряд:
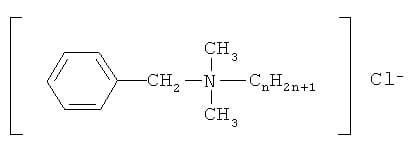
Механизм воздействия четвертичных аммониевых соединений на микроорганизмы отличается от соединений хлора и йода. Дезинфицирующие агенты на основе четвертичных аммониевых соединений образуют бактериостатическую пленку на поверхности. Эти соединения селективно убивают патогенные микроорганизмы. Они не убивают спорообразующие бактерии, однако ингибируют их рост. Четвертичные аммониевые соединения обладают большей стабильностью в присутствии органических соединений по сравнению с хлор и йод содержащими дезинфектантами, однако присутствие органических веществ может привести к снижению их активности. Как правило, в состав дезинфицирующих веществ на основе четвертичных аммониевых солей входят диметилбезиламмонийхлорид, диметилэтилбензиламмонийхлорид, оба соединения не теряют активности в воде с содержанием солей жесткости от 500 до 1000 ppm, даже без добавления комплексообразующих агентов. В концентрациях, в которых четвертичные аммониевые соли используются для дезинфекции оборудования и поверхностей они не являются токсичными, не обладают кожно-раздражающим действием, не вызывают коррозию металлов, что является большим преимуществом по сравнению с хлор — содержащими соединениями. Следует иметь в виду, что четвертичные аммониевые соединения инактивируются анионными ПАВ, поэтому их можно комбинировать или использовать совместно только с определенными классами ПАВ – катионными и амфотерными.
К преимуществам дезинфектантов на основе четвертичных аммониевых солей следует отнести – бесцветность и отсутствие запаха, стабильность в присутствии органических веществ, отсутствие коррозии металлов, стабильность в широком интервале температур, отсутствие кожно-раздражающего действия, эффективность при высоких значениях pH, высокая активность в отношении плесневых грибов, отсутствие токсичности.
К недостаткам четвертичных аммониевых оснований следует отнести потерю активности в присутствии анионных ПАВ, пленкообразование на пищевом оборудовании и поверхностях, а также слабую активность в отношении грам-отрицательных бактерий за исключением Salmonella и E.coli. Активность в отношении грам-отрицательных бактерий усиливают, комбинируя четвертичные аммониевые соли с другими дезинфицирующими агентами.
Учитывая выше приведенные сведения, компания НПФ Химитек разработала и выпускает дезинфицирующее средство ХИМИТЕК УНИВЕРСАЛ-ДЕЗ. В качестве действующего вещества продукт содержит в составе четвертичное аммонийное соединение (ЧАС) нового поколения – дидецилдиметиламмоний хлорида, который внесён в Реестр Биоцидной продукции по Регламенту №(EU) 528/2012.
Рабочие растворы средства обладают стабильностью в жёсткой воде, а также не теряет активности при наличии на поверхности органических загрязнений и остаточных количеств ПАВ. На практике это означает: если предварительная очистка поверхности проведена не очень тщательно, эффективность дезинфектанта не снижается. Рабочие растворы средство обладают активностью против грамположительных и грамотрицательных бактерий, дрожжеподобных грибов и дрожжей — специфической микрофлоры предприятий пищевой промышленности и общественного питания. Средство не проявляет коррозионную активность, т.е. не повреждает объекты и поверхности из любых материалов. Обладают широкой областью применения: можно обеззараживать всё — от яичной скорлупы до мусоровозов. Обладает моющей способностью и высокой стабильность растворов при хранении.
Дезинфектанты на основе кислот
Дезинфицирующие вещества на основе кислот считаются токсикологически безопасными и биологически активными. Их используют в ополаскивающих и дезинфицирующих составах. Чаще всего используют органические кислоты, такие как уксусная, надуксусная, молочная, пропионовая и муравьиная. Присутствие кислот в ополаскивающих составах позволяет нейтрализовать и удалить остатки щелочных моющих и дезинфицирующих веществ. Действие кислотосодержащих дезинфицирующих веществ основано на взаимодействии и разрушении мембраны клетки. Появление технологий автоматической мойки, в которых последнюю стадию ополаскивания желательно комбинировать с дезинфекцией, вызвало появление большого количества дезинфицирующих продуктов на основе кислот. Эти продукты, как правило, используют в заключительной стадии обработки оборудования – ополаскивания и дезинфекции, после чего оборудование оставляют на ночь с минимальным риском микробного обсеменения. Требования к таким продуктам – отсутствие коррозионной способности по отношению к металлам.
На активность дезинфицирующих веществ на основе кислот может повлиять изменение pH среды, pH <3 — наиболее благоприятная среда для таких продуктов. В отличие от йодофоров соли жесткости воды не оказывают заметного влияния активность кислотосодержащих дезинфицирующих веществ. Кислотосодержащие вещества относятся к быстро действующим, они проявляют активность не только в отношении бактерий, но и дрожжей и вирусов. Дезинфектанты на основе кислот обладают хорошими смачивающими свойствами, не оставляют пятен, не вызывают коррозию оборудования. Жесткая вода и присутствие органических веществ практически не оказывают влияния на эффективность продуктов. Дезинфицирующие вещества наносят на поверхность различными способами – распылением, с помощью пеногенератора, с помощью уборочного инвентаря – салфеток и губок, а также используют в CIP- мойках. Поскольку кислотосодержащие дезинфицирующие вещества теряют активность в щелочной области pH, следует тщательно смывать щелочные моющие и дезинфицирующие средства перед обработкой кислотосодержащими дезинфицирующими веществами. В состав кислотосодержащих средств входят анионные ПАВ, кислоты – фосфорная кислота или органические кислоты, перекись водорода. Дезинфицирующий продукт выбирают в зависимости от способа применения (ручная уборка, уборка с использованием пеногенератора, CIP- мойка и т.д.), вида поверхности и устойчивости поверхности к действию продукта.
В последние годы очень сильно вырос интерес к дезинфицирующим веществам на основе надуксусной кислоты. Дезинфицирующие средства на надуксусной (перуксусной) кислоте, обладают высокой эффективностью, широким спектром действия. В зависимости от задачи надуксусную кислоту используют в интервале концентрации от 30 до 250 ppm. Надуксусная кислота практически безопасна для человека: в концентрациях до 80 ppm может присутствовать на овощах и фруктах, а в концентрациях до 250 ppm – на обработанных поверхностях. Дезинфицирующие средства на основе надуксусной кислоты не требуют смывания (если не содержат моющих компонентов или других веществ, которые сами по себе должны смываться с поверхностей или пищевого оборудования). Использование таких средств позволяет сэкономить время, снизить расход воды, и таким образом, сократить финансовые затраты на дезинфекцию.
Надуксусная кислота нашла широкое применение в различных областях. Ее используют для дезинфекции оборудования и предварительно очищенных твёрдых поверхностей в производстве молочных продуктов, вина, напитков, оборудования птицеферм и животноводческих хозяйств. Поскольку надуксусная кислота активна против дрожжей Candida, Saccharomyces, Hansenula и плесневых грибов – Penicillium, Aspergillus, Mucor Geotrichum, она нашла широкое применение в производстве пива и безалкогольных напитков. Именно надуксусная кислота используется для дезинфекции алюминиевой тары – банок для пива и безалкогольных напитков и для консервированных продуктов.. Увеличившийся интерес к использованию надуксусной кислоты в пищевой промышленности связан с ее высокой активностью в отношении таких патогенных микроорганизмов, как Listeria, Salmonella,
а также способностью уничтожать биопленки. Надуксуная кислота нашла широкое применение для ограничения роста бактерий, грибов и слизи в системах охлаждения воды, парообразования, системах обратного осмоса и фильтрации. Кроме того, ее используют для удаления минеральных отложений, запахов, биопленок с оборудования и поверхностей. К положительным свойствам надуксусной кислоты следует также отнести свойства отбеливателя.
Действие надуксусной кислоты основано на окислении внешней клеточной мембраны вегетативных бактериальных клеток, эндоспор, дрожжей и плесневых грибов. Чем сильнее окислитель, тем быстрее погибает патогенный микроорганизм. Надуксусная кислота является очень эффективным окислителем. По своей окислительной способности надуксусная кислота уступает только озону и намного превосходит хлорсодержащие соединения (Таблица 2).
Таблица 2. Окислительная способность некоторых дезинфектантов.
|
Дезинфицирующее вещество |
Окислительная .способность, эВ |
|
Озон |
2.07 |
|
Надуксуная кислота |
1.81 |
|
Диоксид хлора |
1.51 |
|
Гипохлорит натрия |
1.36 |
Дезинфицирующие средства на основе надуксусной кислоты не оказывают значительного воздействия на окружающую среду. Средства имеют короткий период полураспада на уксусную кислоту и кислород и обычно не требуют нейтрализации перед выбросом в сточные воды. Результаты токсикологических исследований показали, что надуксусная кислота обладает гораздо меньшей токсичностью для живых организмов морской и пресной воды, чем другие средства дезинфекции. При попадании на почву надуксусная кислота разлагается в течение нескольких минут, не оказывая влияния на качество почвы.
Хранение продуктов на основе надуксусной кислоты осуществляют с соблюдением несложных правил – в отсутствии прямого попадания солнечных лучей и при температуре, не превышающей 20°С.
Одним из немногих ограничений для использования этого дезинфектанта является характерный запах уксуса. Но поскольку надуксусная кислота эффективно воздействует на патогенные микроорганизмы даже в очень низких концентрациях, рабочие растворы обладают очень слабым запахом.
Надуксусную кислоту (НУК) в качестве действующего вещества содержат дезинфицирующие средства ХИМИТЕКПОЛИДЕЗ®-СУПЕР и ХИМИТЕК ПОЛИДЕЗ®-DRY. Оба высокоэффективны при низких концентрациях, работают в воде любой степени жёсткости, обладают отбеливающими свойствами, применяются в различных областях. ХИМИТЕК ПОЛИДЕЗ®-СУПЕР жидкий концентрированный продукт, широко используется на предприятиях пищевой и перерабатывающей промышленности после мойки для дезинфекции всех кислотостойких поверхностей. Средство эффективно в малых концентрациях – от 0,2%, не требует ротации. Средство разрешено для дезинфекции не только поверхностей, но и продуктов питания: овощного сырьё, зелени, скорлупы яиц и тушек птиц.
ХИМИТЕК ПОЛИДЕЗ®-DRY отличается от средства ХИМИТЕК ПОЛИДЕЗ®-СУПЕР тем, что выпускается в форме порошка, при растворении которого в воде происходит реакция образования НУК, при этом раствор обладает нейтральным рН (7,0-8,5) и не имеет резкого химического запаха. Он не оказывает коррозионного воздействия на металлические поверхности. Средство не имеет побочных эффектов в форме фиксации белковых загрязнений и развития резистентности у микроорганизмов. Безопасно и экологично. Дополнительным свойством этого дезинфектанта является хорошая моющая способность за счет содержащихся в составе ПАВ, что позволяет добиться высокой степени чистоты обрабатываемых поверхностей.
Перекись водорода.
Перекись водорода используется в пищевой промышленности в различных концентрациях от 3% и до 90% применяется в пищевой промышленности. Перекисью водорода обрабатывают поверхность упаковки для фруктов. В концентрации 6% перекись водорода проявляет бактерицидные свойства. В общем можно сказать, что перекись водорода более активна в отношении грам — положительных бактерий, чем грам — отрицательных. Уничтожение спор спорообразующих бактерий происходит при обработке поверхности перекись водорода в концентрации от 10 до 30%. Этот антимикробный агент может использоваться на любом оборудовании и поверхностях. В случае использования концентрированных растворов пероксида и опасения возможности коррозии оборудования следует использовать антикоррозионные добавки. Было показано, что перекись водорода убивает Listeria monocytogenes на латексных перчатках. Перекись водорода используют для обработки различных поверхностей из полимерных материалов, смол и каучуков.
Перекись водорода часто используют в комбинации с другими дезинфицирующими веществами, например, надуксусной кислотой или четвертичными аммониевыми соединениями.
Средство ПОЛИДЕЗ® производства НПФ Химитек в качестве действующего вещества содержит перекись водорода и четвертичные аммонийные соединения. Средство активно в отношении грамотрицательных и грамположительных бактерий (включая бактерии туберкулёза), вирусов, грибов рода Кандида и Трихофитон. Продукт имеет нейтральный pH (5,8–7,0), не вызывает коррозию металлов, не имеет резкого запаха. Рабочие растворы стабильны в широком температурном диапазоне, режим разведения и применения – от 20 до 50°C, работает в воде любой степени жёсткости.
Дезинфектанты на основе спиртов.
В целя дезинфекции наиболее часто используют три спирта- этиловый, изопропиловый и n-пропиловый, последний, в основном, используется в Европе. Дезинфицирующие агенты на основе спиртов проявляют максимальную эффективность в интервале концентраций 60-70%. Концентрации дезинфицирующего агента, необходимые для инактивации патогенных микроорганизмов выше, чем концентрации хлор- содержащих, четвертичных аммониевых солей и кислотосодержащих дезинфицирующих агентов. Спорообразующие микроорганизмы в достаточной степени устойчивы к действию спиртов, однако обработка спиртосодержащими растворами при концентрации спирта 70% и 65ºС инактивирует споры, например споры Bacillus subtilis. Обработка спиртосодержащими дезинфектантами дороже, чем продуктами других химических классов, поэтому их не используют для полной обработки поверхностей или оборудования. В основном, такими составами обрабатывают небольшие малодоступные участки оборудования и поверхностей. Кроме того, составы на основе спиртов используют для дезинфекции рук персонала.
Для проведения экспресс-дезинфекции небольших по площади, а также труднодоступных поверхностей компания НПФ Химитек разработала и выпускает дезинфицирующее средство ХИМИТЕК ПОЛИДЕЗ-ЭКСПРЕСС. В качестве действующего вещества продукт содержит изопропиловый и пропиловый спирты, обладает антимикробной активностью в отношении грамотрицательных и грамположительных бактерий, дрожжеподобных грибов и дрожжей. Помимо всего продукт готов к использованию, имеет удобную упаковку и не требует смывания. Обладает стабильностью микробиологической активности при хранении, низкой токсичностью.
Дезинфектанты на основе альдегидов.
Наиболее известными дезинфицирующими агентами этого класса являются глютаровый альдегид и формальдегид. Альдегиды активны в отношении бактерий, вирусов, плесневых грибов и спор. Однако этот класс соединений очень быстро инактивируется протеинами, поэтому для достижения необходимого эффекта дезинфекции поверхность должна быть предварительно тщательно очищена. Известно, что глютаровый альдегид вызывает сильную денатурацию белка и потому, в случае некачественной очистки, фиксирует загрязнения на обрабатываемой поверхности.
Действие альдегидов основано на их взаимодействии с внешними слоями клетки, в результате чего клетка метаболизирует, и происходит ингибирование ее активности. Щелочная среда наиболее благоприятна для взаимодействия альдегидов с внешними слоями клетки. Для обработки используют растворы различных концентраций — 0.8-1.6% для ингибирования E.coli. Для ингибирования спорообразующих бактерий концентрацию альдегидов в растворе увеличивают до 2%.
При работе с дезинфицирующими агентами на основе альдегидов персонал должен быть хорошо обучен, нарушение правил работы с такими продуктами может нанести ущерб здоровью работников, поскольку обладает альдегиды обладают ярко выраженным раздражающим, наркологическим, сенсибилизирующим и токсическим эффектом.
Бисфенолы.
Бисфенолы – это соединения дифенил метана, дифенил эфира, дифенил сульфида, содержащие галогены и гидроксильные группы. Они проявляют активность в отношении бактерий, грибов и водорослей. Триклозан и гексахлоропрен – представители этого класса соединений, которые наиболее часто используются в качестве дезинфектантов и антисептиков. Триклозан — 5-хлоро-2-(2,4-дихлорфеноси)фенол входит в состав антибактериального мыла, очищающих гелей для рук и зубных паст, поскольку проявляет высокую активность в отношении стафилокков. Триклозан может содержать высоко токсичные для человека соединения диоксин и дибензофуран, поэтому перед использованием этого дезинфицирующего агента на пищевом средстве следует внимательно ознакомиться со способом производства этого соединения и содержанием примесей, которые должны присутствовать в паспорте безопасности.
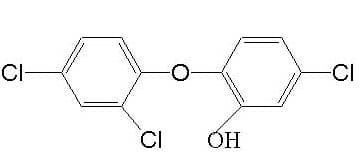
Механизм действия триклозана на бактериальную клетку считается до конца не установленным. Предполагается, что триклозан блокирует биосинтез липидов путем специфического ингибирования фермента еноил-ацил-преносящий белок-редуктазы.
Действие триклозана, как и диоксинов и фенолов — подавление развития микроорганизмов. Но в свою очередь они могут вызывать у них мутации. Помимо этого, у них у всех сильно выражено раздражающее действие на кожу.
Бигуанидины.
Группа бигуанидинов представлена хлоргексидином, алексидином и полимерными бигуанидинами. Хлоргексидин один из наиболее используемых антисептиков для обработки рук, в концентрации 0.0001 мг/л он является бактериостатиком. В концентрации 0.002 мг/л – бактерицидом с широким спектром действия. Активность хлоргексидина зависит от pH среды, в щелочной среде она выше, чем в кислой среде. Его активность заметно снижается в присутствии органических веществ. При концентрации выше 0.005 мг/л и температуре 70º С хлоргексидин проявляет активность в отношении спорообразующих бактерий, хотя действует, в основном, как бактериостатик. Полимерные бигуанидины нашли применение в пищевой промышленности, в медицине, в санитарной обработке бассейнов.
Таблица 3.Основные дезинфицирующие вещества.
|
Дезинфицирующие агенства |
Применение |
Активность в отношении бактерий |
Активность в отношении спор |
Комментарии |
|
Галоген-содержащие |
50-250 мг/л |
> 10 мг/л |
> 50 мг/л |
Хлор содержащие соединение дешевле, чем йодофоры, но обладают коррозионным действием |
|
Четвертичные аммониевые соединения |
150-250 мг/л |
>100 мг/л |
— |
Обладают пролонгированным действием (~ 1 день), нейтральны, не агрессивны |
|
Перекись водорода |
3-90% |
>6% |
10-30% |
Более эффективна в сочетании с надуксусной кислотой |
|
Надуксусная кислота |
30-250 ppm |
30 ppm |
> 100 ppm |
Широкий спектр активности, присутствие органических веществ практически не снижает активности |
|
Спирты (этанол) |
20-70% |
>22% |
60-70% |
Имеют промышленное применение |
|
Альдегиды |
0.8-16 мг/л |
< 10 мг/л |
20 мг/л |
Имеют ограниченное промышленное применение в пищевой промышленности |
|
Бисфенолы |
2-20 мг/л |
> 10 мг/л |
— |
|
|
Бигуанидины |
> 150 мг/л |
1-60 мг/л |
— |
Используют в рецептурах кожного антисептика |
Стратегия оптимизации процессов очистки и дезинфекции.
Устойчивость патогенных микроорганизмов к действию моющих и дезинфицирующих веществ пока еще не стала глобальной проблемой пищевой промышленности. Однако работники пищевой промышленности должны осознавать возможность появления устойчивых штаммов патогенных микроорганизмов в случае неправомерного использования моющих и дезинфицирующих средств. Исследования показали, что даже кратковременное воздействие дезинфицирующими веществами на Listeria Monocytogenes в концентрациях, недостаточных для гибели патогенных микроорганизмов вызывают их мутацию, при этом могут сформироваться патогенные микроорганизмы, устойчивые к действию дезинфицирующих веществ. При использовании моющих и дезинфицирующих веществ следует принимать во внимание следующие факторы:
- выбор дезинфектанта, активного против данного вида патогенных микроорганизмов,
- соблюдение условий применения, рекомендованных производителем (температура, pH среды),
- присутствие веществ, способных к инактивации моющих или дезинфицирующих веществ,
- мониторинг чистоты поверхности и микробного фона до и после применения моющих и дезинфицирующих средств.
Как уже отмечалось, важным обстоятельством является правильный выбор дезинфицирующего агента, обладающего необходимым спектром активности против конкретного вида микроорганизмов. Например, не имеет смысла использовать дезинфицирующий агент на основе спиртов против спорообразующих бактерий вследствие низкой эффективности и возможности мутации некоторых микроорганизмов. Использование дезинфицирующих агентов, выделяющих активный хлор, будет ограничено их способностью к коррозии металлов и их способностью разрушать материалы на полимерной основе.
Соблюдение условий применения, обеспечивающих максимальный эффект снижения числа микроорганизмов, является важным обстоятельством как с точки зрения безопасности пищевого производства, так и с точки зрения сохранения сокращения финансовых затрат на уборку и дезинфекцию. К основным факторам, влияющим на процессы мойки и дезинфекции, относят концентрацию моющих или дезинфицирующих веществ, механическую работу, время и температуру. При применении дезинфицирующих средств следует руководствоваться рекомендациями производителя. Использование более концентрированных растворов, чем это необходимо, может привести к образованию нерастворимых соединений и активизации коррозионных процессов. Обработка поверхностей и оборудования при температурах более высоких, чем рекомендовано в инструкции производителя может привести к химическому разложению активного вещества, выпадению солей жесткости воды, полимеризации протеинов и жиров, что негативно скажется на качестве дезинфекции. Еще одним важным фактором в процессе дезинфекции является время контакта дезинфицирующего вещества, чем выше время контакта, тем выше число инактивированных микроорганизмов.
Существует много математических моделей, описывающих процесс инактивации микроорганизмов. При использовании этих моделей возникают трудности, поскольку они включают в себя параметры, которые сложно определить экспериментальным путем. Одна из моделей, которая используется чаще других, является линейно-логарифмическая модель Чика-Ватсона:
Log(N1/N0) = — ĸCnt ,
N1 — выжившее число микроорганизмов,
N0 –первоначальное число микроорганизмов,
ĸ — константа скорости дезинфекции,
C –концентрация дезинфектанта,
n – коэффициент разбавления,
t – время контакта.
Коэффициент разбавления n зависит от вида дезинфицирующего агента. Например, для четвертичных аммониевых солей n=1. Это означает, что при снижении концентрации n в два раза следует в два раза увеличить время экспозиции. Для этанола n=10, это означает, что при снижении концентрации этанола в два раза эффективность обработки снижается в 2¹º, т.е. в 1024 раза.
Очевидно, что механическая работа вносит важный вклад в качество дезинфекционной обработки. Чем больше затрачено механических усилий, тем меньше количество микроорганизмов остается на поверхности после очистки. Конечный результат зависит от правильности выбора дезинфектанта и технологий мойки и дезинфекции. При выборе моющих и дезинфицирующих средств и определении порядка выполнения технологических операций следует выбирать такое сочетание моющих и дезинфицирующих средств, чтобы не происходило инактивации дезинфицирующего вещества.
Таблица 5. Характеристики стандартных дезинфицирующих веществ
|
Характеристики |
Йодофоры |
Хлорсодержа- щие соединения |
Кислотосодер- жащие соединения |
Четвертичные аммониевые соли |
|
Антимикробная активность |
Вегетативные клетки |
Хорошая |
Хорошая |
Хорошая, имеется некоторая селективность |
|
Воздействие на дрожжи |
Хорошая |
Хорошая |
Хорошая |
Хорошая |
|
Воздействие на плесневые грибы |
Хорошая |
Хорошая |
Хорошая |
Хорошая |
|
Стабильность |
||||
|
при хранении |
Зависит от температуры |
Низкая |
Великолепная |
Великолепная |
|
при использовании |
Зависит от температуры |
Зависит от температуры |
Великолепная |
Великолепная |
|
Быстрота воздействия |
Быстрое |
Быстрое |
Быстрое |
Быстрое |
|
Проницаемость |
Хорошая |
Слабая |
Хорошая |
Великолепная |
|
Пленкообразование |
Нет или слабое |
— |
— |
+ |
|
Влияние органических веществ |
Среднее |
Сильное |
Незначительное |
Незначительное |
|
Легкость измерения |
Великолепная |
Великолепная |
Великолепная |
Великолепная |
Если после прочтения статьи у вас позникли вопросы — звоните по телефону вверху страницы! Или пишите на service@chemitech.ru Ответим на ваши вопросы по применению!
Самый частый вопрос, который покупатели задают в чат поддержки нашего интернет-магазина — как правильно приготовить рабочий раствор дезинфицирующего средства. С этим вопросом обычно обращаются рядовые потребители, поэтому будет уместным собрать всю информацию по данному вопросу в один обзор.
Для начала хотелось бы обратить Ваше внимание на следующее: Всегда строго следуйте инструкции к дезинфицирующему средству!
В инструкции указываются те требования к приготовлению рабочих растворов дезинфицирующих средств, которые производитель посчитал важными для конкретного дезсредства.
Производители дезсредств придерживаются некоторых общих правил, которые справедливы для приготовления рабочих растворов практических всех дезинфицирующих средств. Например:
- Посуда для должна быть химически нейтральна, чистой, без следов ржавчины. Обычно это эмалированная посуда (без повреждения эмали), стеклянные или пластмассовые ёмкости
- Для приготовления обычно используют чистую холодную питьевую воду. Если производитель требует дистиллированную воду, то это будет обязательно указано в инструкции к раствору для дезинфекций.
- Некоторые препараты, могут быть использованы не только в виде водного раствора, но в виде водно-спиртового. Для приготовления таких дезсредств используют не 2 компонента, а 3.
- К работе не допускаются лица моложе 18 лет и не страдающие аллергическими заболеваниями и повышенной чувствительностью к химическим веществам.
- При работе со средством кожу рук необходимо защищать резиновыми перчатками.
- Мерная посуда должна быть чистой, сухой и химически нейтральной. Весьма желательно пользоваться раздельной посудой для каждого компонента рабочего раствора.
- При всех работах следует избегать попадания средства в глаза и на кожу.
Ключевое понятие для приготовления рабочего раствора дезинфицирующего средства — концентрация, которая подразумевает долю дезсредства в общем объеме рабочего раствора. Обратите внимание, что обычно концентрация дезсредства для разных режимов обработки и разных обрабатываемых поверхностей отличаются, порой — существенно. Концентрация — понятие относительное и поэтому справедливо для любого дезинфицирующего средства, то есть 1%-ный рабочий раствор препарата Альфадез, Миродез или любого иного означает, что в составе присутствует 1/100 часть дезинфицирующего средства и 99/100 частей воды.
Ниже приведена универсальная таблица для приготовления рабочих растворов для дезинфекции в диапазоне 0,1% — 4%. Иные концентрации можно высчитать из данных таблица по правилам обычной пропорции.
Концентрация рабочих растворов дезинфицирующих средств
|
Концентрация рабочего раствора (%) по препарату |
Количество концентрата средства и воды (мл), необходимые для приготовления: |
|||
|
1 л раствора |
10 л раствора |
|||
|
средство |
вода |
средство |
вода |
|
|
0,1 |
1,0 |
999,0 |
10 |
9990 |
|
0,2 |
2,0 |
998,0 |
20 |
9980 |
|
0,3 |
3,0 |
997,0 |
30 |
9970 |
|
0,4 |
4,0 |
996,0 |
40 |
9960 |
|
0,5 |
5,0 |
995,0 |
50 |
9950 |
|
0,8 |
8,0 |
992,0 |
80 |
9920 |
|
1,0 |
10,0 |
990,0 |
100 |
9900 |
|
1,2 |
12,0 |
988,0 |
120 |
9880 |
|
1,5 |
15,0 |
985,0 |
150 |
9850 |
|
2,0 |
20,0 |
980,0 |
200 |
9800 |
|
2,5 |
25,0 |
975,0 |
250 |
9750 |
|
3,0 |
30,0 |
970,0 |
300 |
9700 |
|
3,5 |
35,0 |
965,0 |
350 |
9650 |
|
4,0 |
40,0 |
960,0 |
400 |
9600 |
После приготовления рабочего раствора дезинфицирующего средства рекомендуется проверить концентрацию дезсредства с помощью соответствующих индикаторных полосок. Сами индикаторные полоски не входят в комплект поставки дезинфицирующего средства, их можно купить отдельно в нашем интернет-магазине.
Внимательно читайте и следуйте инструкции при приготовлении рабочего раствора дезинфицирующего средства!
Задать интересующие Вас вопросы, а также купить дезинфицирующие средства в Москве с доставкой, Вы можете в нашем интернет-магазине по телефону или через онлайн-чат.
Если вы уже знаете, как приготовить рабочий раствор дезсредства, то вам будет интересно узнать, как провести дезинфекцию парикмахерских или маникюрных инструментов.
В одном литре содержатся:
Г идроксиэтилкрахмал 200/0,5 -60,0 г
— степень замещения 0,43-0,55
— средняя молекулярная масса 200000 дальтон
натрия хлорид -9,0 г
Вспомогательные вещества: натрия гидроксид, кислота хлористоводородная 25%, вода для инъекций.
Электролиты:
Na+ 154 ммоль/л
СГ 154 ммоль/л
Теоретическая осмолярность 308 мосмоль/л
Титруемая кислотность менее 1 ммоль NaOH/л
pH 3,5-6,0
Прозрачный или слегка опалесцирующий, бесцветный или слабо желтого цвета раствор.
ХАЕС-стерил 6% является синтетическим коллоидом для восполнения объема, действие которого на внутрисосудистое увеличение объема и гемодилюцию зависит от молярного замещения по гидроксиэтиловым группам (0,5), характера замещения (отношение Сг/Сб) 5:1, средней молекулярной массы (200 000 Да), концентрации (6%), а также дозирования и скорости инфузии.
Быстрая инфузия (приблизительно 500 мл в течение 20 мин) ХАЕС-стерил 6% приводит к платообразному нерасширяющемуся увеличению объема плазмы приблизительно на 100% перелитого объема в течение 3-4 ч. Затем объем плазмы последовательно уменьшается. Соответственно, эффект ХАЕС-стерил 6% представляет собой среднесрочное увеличение объема плазмы, гемодинамики и транспорта кислорода по меньшей мере на 3 — 4 ч. В то же время нарушенная микроциркуляция улучшается путем улучшения гемореологических свойств крови вследствие снижения гематокрита, вязкости плазмы и агрегации эритроцитов. Фармакокинетика
ХАЕС-стерил 6% содержит 6% гидроксиэтилкрахмала (ГЭК) в качестве коллоидного осмотически активного ингредиента. ГЭК подвергается ферментативному расщеплению амилазой крови. Вследствие молекулярной массы 200 000 Да и молярного замещения 0,5, достигается сохранение в системе кровообращения в течение среднего времени.
Концентрация ГЭК после инфузии возрастает до 94% введенной дозы и снижается до 68%, 42%, 27% и 16% через 1, 3, 6 и 12 ч после инфузии соответственно.
ХАЕС-стерил 6% последовательно гидролизируется амилазой сыворотки и выводится почками. Через примерно 24 ч приблизительно 47% перелитого ХАЕС-стерил 6% восстанавливается в моче, и приблизительно 10% все еще обнаруживается в сыворотке.
Лечение и профилактика дефицита объема (гиповолемия) и шока (терапия восполнения объема), связанных с операциями (геморрагический шок), травмами (травматический шок).
Для уменьшения потребности донорской крови при хирургических вмешательствах (острая нормоволемическая гемодилюция ОНГ).
Терапевтическое разбавление крови (гемодилюция).
Раствор не использовать в качестве кровозаменителя.
— Сепсис
— Тяжелые заболевания печени
— Повышенная чувствительность к гидроксиэтилкрахмалу или любым другим компонентам препарата
— Гиперволемия
— Гипергидратация
— Тяжелая сердечная недостаточность или стадия сердечной декомпенсации
— Отек легких
— Почечная недостаточность с олигурией, анурией или сывороточным креатинином> 2 мг / дл
— Тромбоцитопения или другие серьезные расстройства свертывания крови (например, афибриногенемия, тяжелый геморрагический диатез) (за исключением чрезвычайных ситуаций угрожающих жизни)
— Внутричерепное кровотечение
— Диализ пациентов, потому что ХАЕС-стерил выводится только путем клубочковой фильтрации
В первом триместре беременности
Беременность
До сих пор нет данных об эмбриотоксических эффектах ГЭК, но нет достаточного опыта терапевтического применения гидроксиэтилкрахмала во время беременности. Должны быть тщательно продуманы все преимущества по сравнению с возможным риском для ребенка. Во время беременности применение возможно только после первого триместра и только по жизненным показаниям. При использовании этого продукта во время беременности, следует серьезно рассмотреть риск анафилактической реакции и, как следствие, повреждения мозга плода.
Лактация
Не известно выделяется ли ГЭК в грудное молоко.
Так как нет достаточного опыта применения препарата по время кормления грудью, должны быть тщательно взвешены терапевтические преимущества по сравнению с возможным риском для ребенка.
Фертильность Нет данных.
Первые 10 — 20 мл следует вводить медленно, при тщательном наблюдении за пациентом для исключения возможных анафилактоидных реакций.
Суточная доза и скорость инфузии определяются клиническим состоянием больного, количеством потери крови и сгущением крови. Эти условия должны быть приняты для обеспечения точности дозировки и для сохранения минимальной эффективной скорости инфузии. Терапевтический предел определяется эффектом на введение раствора.
У пациентов без сердечно-сосудистых и легочных рисков, гематокритное число 30% считается предельным для тех случаев, когда необходимо введение коллоидного плазмозаменителя. Длительность и схема терапии зависят от продолжительности и выраженности гиповолемии. Нужно учитывать риск циркуляторной перегрузки вследствие превышения скорости введения или дозы.
Применение у пациентов в критическом состоянии см. в разделе «Меры предосторожности». Многодневное введение показано только в исключительных случаях. Считается, что риск неблагоприятных последствий связан с увеличением дозы. Повторное использование вливаний гидроксиэтилкрахмала требует мониторинга параметров свертывания.
Терапия и профилактика гиповолемии и шока (терапия восполнения объема)
Суточная доза:
Средняя суточная доза составляет обычно 500 — 1000 мл.
Максимальная суточная доза:
2 г ГЭК на кг массы тела (= 33 мл на кг массы тела или 2500 мл/75 кг массы тела).
Скорость инфузии:
Если это не острая чрезвычайная ситуация, объем инфузии 500 мл в 30 минут не должен быть превышен.
Максимальная скорость инфузии:
1,2 г ГЭК на кг массы тела в час (= 20 мл на кг массы тела в час или 1500 мл/75кг в час).
Аллогенное сохранение крови во время операции (острая нормоволемическая гемодилюция)
Для непосредственного предоперационного замещения: отбор собственной крови,
одновременно с осуществлением введения ХАЕС-стерила в соотношении 1:1 (до показателя гематокрита не ниже 30%).
Отбор крови: 2-3 х 500 мл (аутологичной крови)
Суточная доза: 2-3 х 500мл (ХАЕС-стерил)
Скорость инфузии: 1000 мл/15-30 мин
Скорость взятия крови: 1000 мл/15-30 мин
2
Терапевтическая гемодилюция _
Целью является снижение гематокрита до 35 — 40%.
Гемодилюция может быть изоволемическая или гиперволемическая.
Суточная доза:
250 мл, 500 мл или 2 х 500 мл, в зависимости от индивидуальных потребностей.
Скорость инфузии:
250 мл в 0,5 — 2 часа, 500 мл в 4 — 6 часов, 2 х 500 мл в 8 — 24 часов.
Например, при отоневрологических заболеваниях, таких как потеря слуха, шум в ушах, акустическая травма максимальная суточная доза до 500 мл.
Дети и молодежь
Нет никаких исследований по безопасности и эффективности у детей и подростков.
Пожилые пациенты
Для использования у пациентов пожилого возраста доза должна адаптироваться к текущему клиническому состоянию.
У пациентов с нарушением функции почек
При почечной недостаточности доза должна быть уменьшена соответственно.
Способ применения
Для внутривенного использования.
Продолжительность лечения
Терапия и профилактика гиповолемии и шока (терапия замены объема)
Продолжительность и объем лечения зависит от продолжительности и масштабов гиповолемии, гемодинамики и гемодилюции.
Аллогенное сохранение крови во время операции (острая нормоволемическая гемодилюция—) Как правило, острая нормоволемическая гемодилюция выполняется один раз до операции. Если гематокрит в пределах нормы, возможно повторное использование.
Терапевтическая гемодилюция
Гемодилюция ХАЕС-стерил рекомендуется в течение до 10 дней.
Редко — аллергические реакции разной степени тяжести: кожная сыпь, тахикардия, резкое снижение артериального давления, головокружение, тошнота, рвота, бронхоспазм, анафилактический шок вплоть до остановки дыхания и сердечной деятельности. При возникновении аллергических реакций введение раствора должно быть немедленно прекращено, и сразу же начато проведение экстренных мероприятий в зависимости от клинических симптомов и степени тяжести. Необходимо назначить антигистаминные препараты, глюкокортикостероиды (преднизолон 120 мг внутривенно), эпинефрин 0,05-0,1 мг внутривенно, введение альбумина 5%.
Длительное ежедневное применение ХАЕС-стерила в средних и высоких дозах часто вызывает трудно поддающийся лечению зуд. В этих случаях рекомендуется снижение максимальной суточной дозы до 250 мл в сутки.
Изредка — боли в поясничной области. В этом случае вливание препарата следует прекратить, обеспечить обильное введение жидкости и частый контроль креатинина сыворотки.
Высокие дозы ХАЕС-стерила в результате эффекта разведения могут вызвать увеличение времени кровотечения, однако вливание ХАЕС-стерила не вызывает клинически значимых кровотечений. Следует обращать внимание на возможное снижение гематокрита и развитие гипопротеинемии. При применении ХАЕС-стерила может повышаться активность сывороточной амилазы, что может мешать в диагностике панкреатита.
Введение в дозах превышающих терапевтические или при чрезмерной скорости инфузии и повышение объема циркулирующей плазмы может тем самым привести к увеличению сердечной недостаточности, утяжелению отека легких, снижению свертываемости крови.
Более высокие дозы ГЭК влияют на снижение гематокрита и гемоглобина и концентрации белков плазмы. Значения ниже 10 г/дл гемоглобина или падение гематокрита ниже 27% считаются критическими. При общем белке < 5,0 г/дл необходимо введение альбумина. Чрезмерная гемодилюция может привести к нарушению транспорта кислорода.
Меры в случае случайной передозировки: прекращение инфузии.
У пациента должен быть контроль признаков и симптомов декомпенсации сердечно-сосудистой системы и контроль функции печени и почек. Необходим тщательный контроль водно-солевого баланса и наблюдение за любыми признаками геморрагического диатеза. В зависимости от требований, следует также рассмотреть другие поддерживающие мероприятия или симптоматическую терапию.
Гиперволемию можно лечить путем введения диуретика.
Если клиническое состояние стабилизировалось, ГЭК терапия может быть выполнена с использованием более низкой скорости инфузии, а также более тщательного наблюдения за пациентом.
Одновременное применение гидроксиэтилкрахмала с гепарином или пероральными антикоагулянтами может увеличить время кровотечения.
Особое внимание необходимо уделять пациентам, принимающим другие лекарственные средства, особенно при приеме бета-блокаторов и вазодилататоров, поскольку изменения системного артериального давления и частоты сердечных сокращений могут быть не обнаружены, несмотря на объем замещающую терапию.
Следует иметь в виду, что ГЭК может оказывать, влияние на клинико-химические показатели (глюкозу, белок, СОЭ, жирные кислоты, холестерин, сорбитдегидрогеназу, удельный вес мочи). Какие-либо данные по взаимодействию гидроксиэтилкрахмала с пищевыми продуктами отсутствуют.
Влияние на способность управлять автомобилем и на способность управлять механизмами или работать с техникой
Этот вопрос в целом не имеет значения, так как средство используется в условиях стационара.
Внимание у пациентов с
— Аллергическим анамнезом
— Компенсированной сердечной недостаточностью
— Нарушением функции почек
— Хроническими заболеваниями печени
— Гипернатриемией
— Гиперхлоремией
— Геморрагическим диатезом легкой степени
— Обезвоживанием с эксикозом межклеточного пространства (в данном случае возможна только замена жидкости растворами кристаллоидов).
Следует отдавать преимущество использованию растворов кристаллоидов у пациентов в критическом состоянии, а ХАЕС-стерил 6% использовать только в тех ситуациях, когда растворов кристаллоидов недостаточно для стабилизации состояния пациента, а также в случае, если ожидаемая польза оправдывает риск.
Для пациентов в критическом состоянии следует предусмотреть снижение дозы в зависимости от фактических потребностей пациента и степени тяжести его состояния. Следует применять наиболее низкую эффективную дозу.
В отсутствие фибриногена препарат должен вводиться только в угрожающих жи-ши крайних случаях, до тех пор, пока кровь не готова к замещению.
С вливанием коллоидных растворов всегда возможна реакция несовместимости, первые 10-20 мл вводят медленно под тщательным наблюдением пациента.
Требуется регуляция водного баланса и протеинграмма.
При несоблюдении принципов дозирования возможен риск острой перегрузки объемом (в частности, при кардиальной и легочной предрасположенности пациентов).
При недостатке жидкости в интерстиции невозможно восстановить потерю с помощью растворов электролитов. При шоковых состояниях, которые обусловлены преимущественно водными потерями и потерями электролитов (тяжелая рвота, понос, ожоги), после начального лечения ХАЕС-стерилом дальнейшее лечение следует проводить с помощью сбалансированного раствора электролитов. Следует обеспечить обильное введение жидкости.
В начале терапии, требуется контроль креатинина сыворотки.
Если уровень креатинина> 2 мг/дл введение ХАЕС-стерила противопоказано.
При пограничных уровнях креатинина от 1,2 до 2,0 мг/дл (компенсируется сохранением), особенно у пожилых пациентов должна быть тщательно продумана гемодилюция.
Если препарат вводится таким пациентам необходимо тщательное наблюдение за балансом жидкости и за сохранением почечной функции и необходим ежедневный мониторинг уровня креатинина.
Несмотря на нормальный уровень креатинина патологические изменения анализа мочи могут указывать на компенсаторные повреждения почек. В этих случаях, уровень креатинина должен быть проверен в день введения.
При нормальном сывороточном креатинине и анализе мочи и небольшом сроке применения ХАЕС-стерила (1-2 дня), мониторинга почечной функции не требуется.
Если при применении ХАЕС-стерила уровень сывороточного креатинина 2 мг/дл превышен, то лечение должно быть немедленно прекращено.
Адекватное потребление жидкости (2-3 литра в день) является необходимым для всех пациентов. Необходимо быть особенно осторожными у пациентов с тяжелыми нарушениями кровотечения (например, при тяжелой болезни Виллебранда).
РЕАКЦИЯ НЕПЕРЕНОСИМОСТИ
Клинические проявления. После воздействия аллергена у большинства больных аллергические реакции (АР) развиваются в течение 5-60 мин. Менее типичным является развитие АР через несколько часов после экспозиции аллергена. Кроме того, у 5-20% пациентов развивается двухфазная реакция, при которой отмечается повторное развитие симптомов спустя 1-8 ч в результате позднего ответа, когда, несмотря на терапию, симптомы сохраняются до 48 ч. Двухфазные АР чаше отмечаются у лиц, у которых реакция развивалась спустя более чем 30 мин после контакта с аллергеном. Клинические проявления широко варьируют. Самые распространенные симптомы — крапивница и сосудистый отек, их регистрируют у 88% больных. Эти симптомы часто возникают после ощущения генерализованного зуда, чувства жжения, гиперемии кожных покровов, а также ощущения страха смерти. Со стороны желудочно-кишечного тракта в 30% случаев отмечаются тошнота и кишечная колика. Развивается затрудненное дыхание, удушье (особенно у лиц, страдающих бронхиальной астмой), отек гортани встречается приблизительно у 50% пациентов.
Анафилактический ток может быть у 1/3 пострадавших. Смерть чаще всего развивается в результате не купирующегося бронхоспазма, асфиксии, обусловленной отеком верхних дыхательных путей, и коллапса. Коллапс является следствием уменьшения объёма циркулирующей крови вплоть до 50% объема в результате увеличения сосудистой проницаемости, повышения общего периферического сопротивления сосудов и сердечной недостаточности. При этом наблюдаются различные нарушения сердечного ритма (брадикардия, тахикардия и экстрасистолия).
Тактика лечения анафилактоидной реакции
При симптомах средней степени тяжести, когда отсутствует рефрактерный отек гортани, бронхоспазм или тяжелая артериальная гипотензия, следует вводить 0,3-0,5 мл 1:1000 раствора адреналина подкожно или внутримышечно. Инъекции можно повторять каждые 10-15 мин максимально до 3 доз. Безотлагательным лечебным мероприятием при анафилактическом шоке является быстрое и эффективное купирование отека гортани (стридор), бронхоспазма (одышка и цианоз) и артериальной гипотензии.
1-й этап лечения: восстановление ПРОХОДИМОСТИ дыхательных путей, нормализация АД (необходимо положить пациента на спину с приподнятыми ногами) и произвести инъекцию адреналина. Риск летального исхода самый высокий у пациентов, которым промедлили с введением адреналина. Наилучший путь введения адреналина — внутримышечный (действие начинается быстрее, чем при подкожном введении). Адреналин вводят внутримышечно в дозе 0,5-1 мг (0,5-1 мл 0,1% раствора). При крайне тяжелом состоянии пациента и при выраженных нарушениях гемодинамики адреналин в дозе 500 мкг (5 мл раствора в разведении 1:10 000, т.е. 0,01%) вводят внутривенно медленно (100 мкг/мин), при достижении эффекта введение прекращают; детям 10 мкг/кг (0,1 мл/кг 0,01% раствора) медленно в течение нескольких минут. При инъекциях необходимо быть особенно внимательным и применять правильную концентрацию раствора адреналина (0,01%, а не 0,1%). Следует еще раз подчеркнуть, что при отсутствии особых показаний адреналин следует ввести немедленно внутримышечно, а не терять время на внутривенные инъекции. Если быстро добиться внутривенного введения препарата невозможно, адреналин нужно ввести эндотрахеально через интубационную трубку. Интубация должна быть выполнена немедленно, если, развился стридор, значительный отек лица или верхних дыхательных путей. Если в связи с отеком нарушена анатомия верхних дыхательных путей и выполнение интубации затруднено, по жизненным показаниям необходимо выполнить трахеостомию.
Дальнейшая фармакотерапия. Зависит от степени тяжести клинических симптомов, может потребоваться неоднократное назначение катехоламинов, антигистаминных средств, глюкокортикостероидов. Адреналин — препарат выбора в лечении анафилаксии, в т.ч. анафилактического шока, т.к. он эффективно корригирует артериальную гипотензию и бронхоспазм. Пациентам с тяжелым отеком верхних дыхательных путей, выраженным бронхоспазмом или тяжелой артериальной гипотензией продолжают инфузию адреналина (1,0-
10,0 мкг/мин), ее регулируют по клинической эффективности под постоянным контролем за функционированием дыхательной системы и сердечно-сосудистой системы. Пациенты, получающие бета-адреноблокаторы, могут быть резистентны к введению эпинефрина, в связи, с чем у них могут развиться рефрактерная артериальная гипотензия и брадикардия. Поэтому им показано дополнительное внутривенное введение сальбутамола и/или глюкагона. Глюкагон оказывает положительное инотропное и хронотропное действие, которое реализуется не через Р-адренорецепторы, поэтому его следует использовать (внутривенно 1 мл) у этих пациентов. Вазопрессорные средства следует применять у пациентов с рефрактерной артериальной гипотензией, несмотря на внутривенное введение жидкости. В дополнение к адреналину эффективно введение допамина (5-20 мкг/кг/мин), норэпинефрина (0,5-30 мкг/мин) или фенилэфрина (30-180 мкг/мин).
Антигистаминные средства нужно назначать всем пациентам с анафилаксией. Комбинация Hj- и Нг-блокаторов превосходит по эффективности монотерапию любого Hi-блокатора. Дифенгидрамин (25-50 мг внутривенно каждые 4-6 ч) следует вводить в сочетании с ранитидином (внутривенно медленно 50 мг каждые 6-8 ч). Введение этих лекарственных средств нужно продолжать до полного купирования симптомов.
Глюкокортикоиды эффективны для предупреждения поздней фазы анафилактоидаойреакции, но не являются препаратами I линии. Рекомендуют гидрокортизон 100 мг внутривенно каждые 6 ч или другой глюкокортикоид в эквивалентной дозе.
Ангионевротический отек. Для оказания неотложной помощи применяют инъекции адреналина и ингаляцию кислорода, а также антигистаминные средства и глюкокортикоиды, при необходимости интубацию трахеи и другие реанимационные мероприятия.
При кровопотере более 20-25% объема циркулирующей крови покачано введение эритроцитарной массы.
При введение ХАЕС-стерила может иногда возникать, особенно при введении в течение нескольких дней, увеличение уровня а-амилазы в сыворотки крови, но это не связано с клиническими проявлениями панкреатита.
Наблюдаемые возникновения анафилактических реакций см. раздел «Побочное действие».
В литературе описывается взаимосвязь между дозой и частотой возникновение зуда при отоневрологических заболеваниях, таких, например как резкое падение слуха, шум в ушах. При этих заболеваниях, чтобы уменьшить частоту возникновения зуда, рекомендуют ограничение дозы до максимально допустимой — 250 мл в сутки (соответственно 15 г ГЭК/сутки) и обеспечение обильного введения жидкости.
Появление болей в поясничной области требует прекращения введения лекарственного средства, обильного введения жидкости и контроля уровня креатинина сыворотки.
При смешивании с другими лекарственными средствами и другими манипуляциями повышается риск микробного загрязнения, чему должно быть уделено внимание.
Дети и молодежь
Клинические исследования у детей не проводились. Результаты ретроспективного анализа данных от 150 детей разных возрастных групп (от новорожденных до подростков), получающих ГЭК периоперационно или при консервативной интенсивной терапии, показывают, что отношение пользы и риска положительное.
250 мл раствора в полиолефиновом мешке «фрифлекс» во внешнем пакете из полимерной пленки. 30 пакетов с инструкцией по применению в картонной коробке.
500 мл раствора в пластиковом флаконе, снабженном петлей-держателем для капельницы, укупоренном комбинированной пластиковой крышкой «шип-шейк». 10 флаконов с инструкцией по применению в картонной коробке.
При температуре не выше 25°С в защищенном от света месте. Замораживание не допускается. Хранить в недоступном для детей месте.
3 года в мешке «фрифлекс»; 5 лет в пластиковом флаконе.
Не применять по истечении срока годности, указанного на упаковке
Хаес-Стерил (Haes-Steril)
💊 Состав препарата Хаес-Стерил
✅ Применение препарата Хаес-Стерил
⚠️ Государственная регистрация данного препарата отменена
Описание активных компонентов препарата
Хаес-Стерил
(Haes-Steril)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2020.07.24
Владелец регистрационного удостоверения:
Код ATX:
B05AA07
(Гидроксиэтилкрахмал)
Лекарственная форма
| Хаес-Стерил |
Р-р д/инф. 10% (ГЭК 200/0.5): фл. стеклян. 250 мл или 500 мл 10 шт. с держателями д/капельн. или без них, фл. пласт. 250 мл или 500 мл 10 или 20 шт. с петлей-держателем д/капельн., контейнеры полиолеф. «фрифлекс» 250 мл или 500 мл 10, 15, 20 или 30 шт. рег. №: П N013101/01 |
Форма выпуска, упаковка и состав
препарата Хаес-Стерил
Раствор для инфузий 10% бесцветный или слегка желтоватого цвета, прозрачный или слегка опалесцирующий.
Вспомогательные вещества: натрия хлорид — 9 г, вода д/и — до 1 л, натрия гидроксид — q.s. для коррекции pH.
250 мл — флаконы стеклянные (10) — коробки картонные.
250 мл — флаконы стеклянные с держателями для капельницы (10) — коробки картонные.
250 мл — флаконы пластиковые с петлей-держателем для капельницы (10) — коробки картонные.
250 мл — флаконы пластиковые с петлей-держателем для капельницы (20) — коробки картонные.
250 мл — контейнеры полиолефиновые «фрифлекс» (1) — пакеты пластиковые (10) — коробки картонные.
250 мл — контейнеры полиолефиновые «фрифлекс» (1) — пакеты пластиковые (15) — коробки картонные.
250 мл — контейнеры полиолефиновые «фрифлекс» (1) — пакеты пластиковые (20) — коробки картонные.
250 мл — контейнеры полиолефиновые «фрифлекс» (1) — пакеты пластиковые (30) — коробки картонные.
500 мл — флаконы стеклянные (10) — коробки картонные.
500 мл — флаконы стеклянные с держателями для капельницы (10) — коробки картонные.
500 мл — флаконы пластиковые с петлей-держателем для капельницы (10) — коробки картонные.
500 мл — флаконы пластиковые с петлей-держателем для капельницы (20) — коробки картонные.
500 мл — контейнеры полиолефиновые «фрифлекс» (1) — пакеты пластиковые (10) — коробки картонные.
500 мл — контейнеры полиолефиновые «фрифлекс» (1) — пакеты пластиковые (15) — коробки картонные.
500 мл — контейнеры полиолефиновые «фрифлекс» (1) — пакеты пластиковые (20) — коробки картонные.
500 мл — контейнеры полиолефиновые «фрифлекс» (1) — пакеты пластиковые (30) — коробки картонные.
Фармакологическое действие
Плазмозамещающее средство, гидроксиэтилированный крахмал (ГЭК). ГЭК — это высокомолекулярное соединение, состоящее из полимеризованных остатков глюкозы, которое получают путем гидроксиэтилирования амилопектина — природного полисахарида, содержащегося в крахмале картофеля и кукурузы восковой спелости. Амилопектин быстро гидролизуется в крови, время его присутствия в кровеносном русле составляет около 20 мин. Для повышения стабильности и увеличения длительности действия амилопектин подвергают гидроксиэтилированию. Глубина этого процесса характеризуется степенью замещения.
Интенсивность и длительность объемзамещающего действия препаратов ГЭК определяются молекулярной массой и степенью замещения субстанции ГЭК. Чем выше степень замещения, тем дольше сохраняется ГЭК в циркулирующей крови. При соотношении C2/C6 более 8 ГЭК метаболизируется в организме значительно медленнее, чем при соотношении менее 8.
Пентакрахмал имеет молекулярную массу около 200 000 дальтон и степень замещения около 0.5; соотношение C2/C6, определяющее особенности замещения, равно 6.
Улучшает реологические свойства крови за счет снижения показателей гематокрита, уменьшает вязкость плазмы, снижает агрегацию эритроцитов, способствует восстановлению нарушенной микроциркуляции.
Депонируется в клетках РЭС, что не имеет клинического значения.
Фармакокинетика
После в/в инфузии пентакрахмал подвергается интенсивному метаболизму, расщепляясь (под действием амилазы сыворотки) до низкомолекулярных фрагментов. Продукты метаболизма с молекулярной массой менее 50 000 дальтон быстро выводятся почками. Около 70% дозы выводится с мочой в течение 24 ч и около 80% — в течение недели.
Показания активных веществ препарата
Хаес-Стерил
В качестве плазмозамещающего средства при гиповолемии и шоке, связанных с оперативными вмешательствами, ранениями, инфекционными заболеваниями и ожогами; нарушения микроциркуляции; терапевтическая гемодилюция.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Устанавливают индивидуально, в зависимости от выраженности нарушений гемодинамики, клинической ситуации. Суточную дозу и скорость введения рассчитывают в зависимости от величины кровопотери, показателей гемоглобина и гематокрита. Вводят в/в, капельно.
Необходимо применять минимальную эффективную дозу. Лечение следует проводить при постоянном гемодинамическом мониторинге; по достижении целевых гемодинамических показателей инфузию следует прекратить.
Побочное действие
Со стороны свертывающей системы крови: очень часто — снижение гематокрита и развитие дилюционной гипопротеинемии; часто (частота зависит от введенной дозы) — увеличение времени кровотечения и АЧТВ, снижение содержания комплекса факторов свертывания крови VIII и Виллебранда.
Со стороны иммунной системы: очень редко — анафилактические реакции различной степени тяжести.
Со стороны кожи и подкожных тканей: редко — упорный, но обратимый кожный зуд.
Со стороны печени и желчевыводящих путей: частота не установлена — поражение печени.
Со стороны мочевыделительной системы: редко — боли в области почек; частота не установлена — нарушение функции почек.
Со стороны лабораторных показателей: часто — повышение активности альфа-амилазы плазмы крови, не связанное с нарушением функции поджелудочной железы; возможно — изменение концентрации глюкозы, белка, жирных кислот, холестерина, сорбитдегидрогеназы в плазме крови, показателей СОЭ, биуретовой пробы, удельного веса мочи.
Противопоказания к применению
Повышенная чувствительность к ГЭК; ожоги, сепсис, внутричерепная гипертензия, артериальная гипертензия, продолжающееся внутричерепное или внутримозговое кровотечение, хроническая сердечная недостаточность, почечная недостаточность или проведение заместительной почечной терапии, тяжелая печеночная недостаточность, отек легких, состояние после трансплантации органов, гипергидратация, гиперволемия, дегидратация, тяжелая коагулопатия, тяжелая гиперхлоремия или тяжелая гипернатриемия, гипокалиемия, гемодиализ; детский и подростковый возраст до 18 лет; I триместр беременности.
Не применять при открытых операциях на сердце в условиях искусственного кровообращения.
Противопоказано применение у пациентов реанимационного профиля (обычно находящихся в отделении реанимации и интенсивной терапии).
С осторожностью: компенсированная хроническая сердечная недостаточность, хронические заболевания печени, нарушения свертываемости крови, болезнь Виллебранда, геморрагический диатез, гипофибриногенемия, пациенты, подвергшиеся хирургическому вмешательству и/или с наличием травмы, пожилой возраст, II-III триместры беременности; период грудного вскармливания.
Применение при беременности и кормлении грудью
Противопоказано применение в I триместре беременности. Во II-III триместрах беременности применение возможно только по жизненным показаниям, в тех случаях, когда потенциальная польза для матери превышает потенциальный риск для плода. При применении пентакрахмала при беременности необходимо учитывать риск возникновения анафилактических реакций и возможный риск поражения головного мозга плода. При необходимости применения в период лактации следует решить вопрос о прекращении грудного вскармливания.
Применение при нарушениях функции печени
Противопоказан к применению при тяжелой печеночной недостаточности. С осторожностью следует применять при хронических заболеваниях печени.
Применение при нарушениях функции почек
Противопоказан к применению при почечной недостаточности или при проведении заместительной почечной терапии.
Применение у детей
Противопоказано применение у детей и подростков в возрасте до 18 лет.
Применение у пожилых пациентов
С осторожностью следует применять у пожилых пациентов (старше 65 лет). Для предотвращения осложнений со стороны сердечно-сосудистой системы и почек, вызванных гиперволемией, пожилым пациентам необходим тщательный подбор дозы и контроль во время лечения.
Особые указания
Для предотвращения осложнений со стороны сердечно-сосудистой системы и почек, вызванных гиперволемией, пожилым пациентам, у которых более вероятно наличие сердечной и/или почечной недостаточности, необходим тщательный подбор дозы и контроль во время лечения.
Особую осторожность следует соблюдать при применении растворов ГЭК у пациентов с нарушениями свертывания крови, с нарушением функции печени. Следует тщательно оценить целесообразность применения ГЭК для лечения гиповолемии и осуществлять мониторинг гемодинамических параметров для контроля достижения необходимого эффекта и определения дозы ГЭК. Необходимо избегать перегрузки объемом, связанной с передозировкой средства или с высокой скоростью инфузии. Дозу необходимо подбирать с осторожностью, особенно у пациентов с заболеваниями легких и сердечно-сосудистой системы.
Следует избегать назначения высоких доз пентакрахмала пациентам с гиповолемией из-за возможной выраженной гемодилюции. В случае повторного применения пентакрахмала необходимо тщательно контролировать параметры свертывания крови.
При развитии реакций повышенной чувствительности следует немедленно прекратить введение пентакрахмала и провести необходимые неотложные мероприятия. Пациенты должны находиться под непрерывным медицинским наблюдением, дополнительные терапевтические меры следует принимать в зависимости от состояния пациентов.
При применении пентакрахмала следует контролировать ОЦК, концентрацию электролитов, лейкоцитов, тромбоцитов, гемоглобина, показателей свертывания крови. При первых признаках коагулопатии применение средства следует прекратить.
При операциях на открытом сердце, связанных с проведением искусственного кровообращения, повышен риск кровотечения, поэтому применение ГЭК противопоказано.
До начала и во время применения ГЭК необходимо проверять функцию почек, осуществлять постоянный контроль содержания креатинина в сыворотке крови, водно-электролитного баланса, а также показателей задержки мочи. При первых признаках поражения почек на фоне лечения применение пентакрахмала следует прекратить. Мониторинг функции почек необходимо проводить на протяжении 90 дней после применения пентакрахмала (риск поражения почек в отдаленном периоде).
Нарушение функции почек на фоне терапии раствором ГЭК может усугубить исходную печеночную недостаточность (с портальной гипертензией), и может привести к механической обструкции желчных протоков.
Во время лечения необходимо обеспечить достаточное поступление жидкости в организм (не менее 2-3 л жидкости в сутки).
При лечении пациентов, группа крови которых не установлена, необходимо иметь в виду, что введение больших объемов ГЭК может затруднять трактовку результатов реакции агглютинации.
Пентакрахмал может дать положительный результат при проведении допинг-контроля.
Лекарственное взаимодействие
При одновременном применении с аминогликозидами увеличивается риск нефротоксичности, поэтому рекомендуется избегать одновременного длительного применения пентакрахмала и аминогликозидов.
При одновременном применении с антикоагулянтами возможно увеличение времени кровотечения.
Пентакрахмал несовместим с растворами других лекарственных средств.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Аналоги препарата
Венофундин
(B.BRAUN MELSUNGEN, Германия)
Волекам
(МЕДСИНТЕЗ ЗАВОД, Россия)
Волекам® ГЭК-200
(МИРАКЛ ФАРМ, Россия)
Волемкор
(Фирма МЕДПОЛИМЕР, Россия)
Гидроксиэтилкрахмал …
(КУРСКАЯ БИОФАБРИКА — ФИРМА «БИОК», Россия)
Гидроксиэтилкрахмал …
(КРАСФАРМА, Россия)
Гидроксиэтилкрахмал …
(ПФК АЛИУМ, Россия)
Гидроксиэтилкрахмал …
(ИСТ-ФАРМ, Россия)
Гидроксиэтилкрахмал …
(АВЕКСИМА СИБИРЬ, Россия)
Гидроксиэтилкрахмал-…
(ЭСКОМ НПК, Россия)
Все аналоги
Национальная ассоциация специалистов по контролю инфекций, связанных с оказанием медицинской помощи
ФЕДЕРАЛЬНЫЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПО ВЫБОРУ ХИМИЧЕСКИХ СРЕДСТВ
ДЕЗИНФЕКЦИИ И СТЕРИЛИЗАЦИИ ДЛЯ
ИСПОЛЬЗОВАНИЯ В МЕДИЦИНСКИХ ОРГАНИЗАЦИЯХ
Москва 2015
Шестопалов Н.В., Пантелеева Л.Г., Соколова Н.Ф., Абрамова И.М., Лукичев С.П. Федеральные клинические рекомендации по выбору химических средств дезинфекции и стерилизации для использования в медицинских организациях – М., 2015. – 67 с.
Клинические рекомендации направлены на обоснование применения и выбор химических средств дезинфекции и стерилизации для использования в медицинских организациях. В рекомендациях приводится классификация и характеристика действующих веществ дезинфицирующих средств, что позволяет выбирать приемлемые и наиболее эффективные из них для применения в различных подразделениях медицинских организаций. Представлены рекомендации по выбору средств дезинфекции и стерилизации для отделений хирургического, акушерского и стоматологического профилей, а также обеззараживания воздуха, систем вентиляции и кондиционирования.
Клинические рекомендации предназначены для эпидемиологов, врачей и медицинских сестер медицинских организаций, организаторов здравоохранения и могут быть полезными для научных работников и преподавателей медицинских ВУЗов.
Федеральные клинические рекомендации по выбору химических средств дезинфекции и стерилизации для использования в медицинских организациях были рассмотрены на Всероссийской научно-практической конференции специалистов по контролю инфекций, связанных с оказанием медицинской помощи 19-21 ноября 2014 г. и утверждены на заседаниях Общего собрания членов НП «НАСКИ» (Протокол № 6 от 19.11.2014 г.) и Профильной комиссии Минздрава России по эпидемиологии (Протокол № 4 от 20.11.2014 г.).
Содержание
2. Термины и определения
8
4. Дезинфицирующие средства, их основные группы, классификации и характеристика
14
5. Устойчивость микроорганизмов к химическим дезинфицирующим средствам
24
6. Общие рекомендации по выбору химических средств дезинфекции и стерилизации
30
7. Рекомендации по выбору химических средств дезинфекции и стерилизации для медицинских организаций (отделений) хирургического профиля
42
8. Рекомендации по выбору химических средств дезинфекции и стерилизации для медицинских организаций (отделений) акушерского профиля
43
9. Рекомендации по выбору химических средств дезинфекции и стерилизации для медицинских организаций (отделений) стоматологического профиля
44
10. Рекомендации по выбору химических средств для обеззараживания воздуха
45
11. Рекомендации по выбору химических средств для обеззараживания систем вентиляции и кондиционирования
46
Приложение 1 (справочное). Перечень ДВ, входящих в состав ДС, зарегистрированных в Российской Федерации
47
Приложение 2 (справочное). Патогенные вирусы, эпидемиологически значимые для медицинских организаций
51
Использованные нормативные и методические документы
54
Авторский коллектив
|
Общая редакция: |
|
|
Шестопалов Н.В., Пантелеева Л.Г., Соколова Н.Ф. |
ФБУН НИИДезинфектологии Роспотребнадзора |
|
Абрамова И.М. |
кафедра дезинфектологии ГБОУ ВПО Первого МГМУ им. И.М. Сеченова Минздрава России |
|
Лукичев С.П. |
ФГБУЗ «Головной центр гигиены и эпидемиологии ФМБА России» |
|
В создании рекомендаций участвовали: |
|
|
Благонравова А.С., Ковалишена О.В. |
кафедра эпидемиологии ГБОУ ВПО НижГМА Минздрава России |
|
Канищев В.В. |
НИЦ ФГКУ ЦНИИИ МО РФ |
|
Моспанов С.А. |
ЗАО Эколаб |
Сокращения
|
ДВ – |
действующее вещество |
|
ДХЦК – |
дихлоризоциануровая кислота |
|
ТХЦК – |
трихлоризоциануровая кислота |
|
ДС – |
дезинфицирующее средство |
|
ПАВ – |
поверхностно-активные вещества |
|
КПАВ – |
катионные поверхностно-активные вещества |
|
ЧАС – |
четвертичные аммониевые соединения |
|
ГА – |
глутаровый альдегид |
|
ПСО – |
предстерилизационная очистка |
|
ДВУ – |
дезинфекция высокого уровня |
|
ИСМП – |
инфекции, связанные с оказанием медицинской помощи |
1. Методология
Методы, используемые для сбора/селекции доказательств:
Поиск в электронных базах данных и библиотечных фондах.
Описание методов, использованных для сбора/селекции доказательств:
Доказательной базой для рекомендаций являются тематические монографии, публикации в периодических специализированных изданиях, материалы конференций, съездов. Глубина составляет не менее 5 лет.
Методы, использованные для оценки качества и силы доказательства:
Консенcус экспертов.
Методы, использованные для анализа доказательств:
Обзоры опубликованных анализов.
Методы, использованные для формирования рекомендаций:
Консенcус экспертов.
Индикаторы доброкачественной практики:
Рекомендуемая доброкачественная практика базируется на клиническом, научно-исследовательском, экспертном и организационно-методическом опыте членов рабочей группы по разработке рекомендаций.
Экономический анализ:
Анализ стоимости не проводился и публикации по данному вопросу не рассматривались.
Методы валидизации:
Внешняя экспертная оценка.
Внутренняя экспертная оценка.
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых просили оценить настоящие рекомендации с позиции доступности для понимания. Получены комментарии со стороны клинических эпидемиологов в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций, как рабочего инструмента повседневной практики. Комментарии, полученные от экспертов систематизировались и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался и вносимые, в результате этого, изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультация и экспертная оценка:
Последние изменения в настоящих рекомендация были представлены для дискуссии в предварительной версии на Всероссийской научно-практической конференции специалистов по контролю инфекций, связанных с оказанием медицинской помощи 19-21 ноября 2014 г.
Предварительная версия была выставлена для широкого обсуждения на сайте www/nasci.ru для того, чтобы специалисты, не принимавшие участия в конференции, имели возможность принять участие в обсуждении и совершенствовании рекомендаций.
Проект рекомендаций был рецензирован также независимыми экспертами прежде всего с точки зрения доходчивости и точности интерпретации положений, лежащих в основе рекомендаций.
Рабочая группа:
Для окончательной редакции членами рабочей группы были повторно проанализированы все замечания и комментарии экспертов, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
2. Термины и определения
Антимикробный спектр – область, диапазон микробоцидного действия химических средств дезинфекции и стерилизации.
Аэрозольная дезинфекция – дезинфекция воздуха и поверхностей объектов окружающей среды с использованием химических ДС в виде аэрозолей жидкостей (туман) или твердых тел (дым).
Бактерицидная активность (бактерицидное действие, бактерицидность) – способность химического ДС вызывать гибель вегетативных форм бактерий.
Безоболочечные вирусы – мелкие по размеру, не имеющие внешней оболочки вирусы (гепатита А, полиомиелита, Коксаки, ЕСНО и др.). Они состоят из нуклеокапсида, включающего нуклеиновую кислоту (в основном РНК, реже ДНК) и один или нескольких видов белковых молекул. Безоболочечные вирусы, в большинстве случаев, являются гидрофильными (они не чувствительны к растворителям липидов).
Вирулицидная активность (вирулицидное действие, вирулицидность) – способность химических ДС инактивировать вирусы.
Вирулицидное средство (вирулицид) – химическое ДС, обладающее вирулицидной активностью.
Гигиеническая обработка рук – обеззараживание кистей рук кожным антисептиком. Гигиеническая обработка рук обеспечивает гибель транзиторной микрофлоры.
Гигиеническое мытье рук – удаление загрязнений путем мытья мылом и водой, при этом происходит некоторое снижение (в среднем в 100 раз) количество транзиторной микрофлоры.
Дезинфекция – обеспечение гибели микроорганизмов – возбудителей инфекционных и паразитарных болезней на (в) объектах окружающей среды, с использованием специальных средств и способов, в целях прерывания путей передачи возбудителя инфекции.
Дезинфекция высокого уровня эндоскопов (ДВУ) – обеспечение гибели всех патогенных и условно-патогенных микроорганизмов (бактерий, в том числе микобактерий туберкулеза, любых вирусов и грибов рода Сandida) стерилизующим (спороцидным) средством на эндоскопах, используемых при нестерильных эндоскопических манипуляциях.
Дезинфицирующие химические средства (дезинфектанты, химические средства дезинфекции) − химические средства, обладающие антимикробной активностью и предназначенные для дезинфекции объектов окружающей среды.
Действующее вещество – химическое вещество, входящее в состав химического ДС, которое способно вызывать гибель микроорганизмов. Количество ДВ в составе одного ДС может быть несколько.
Деконтаминация – уничтожение микроорганизмов на поверхности тела человека, животного и абиотических объектов внешней среды или внутри объектов (например, медицинских изделий).
Инфекции, связанные с оказанием медицинской помощи (ИСМП) – инфекционные заболевания, присоединяющиеся к основному заболеванию у госпитализированных пациентов, а также связанных с оказанием любых видов медицинской помощи (в амбулаторно-поликлинических, образовательных, санаторно-оздоровительных учреждениях, учреждениях социальной защиты населения, при оказании скорой медицинской помощи, помощи на дому и др.), и случаи инфицирования медицинских работников в результате их профессиональной деятельности.
Кожные антисептики – ДС, предназначенные для обеззараживания кожных покровов. По назначению кожные антисептики подразделяются на 5 групп: для гигиенической обработки рук; для обработки рук хирургов; для обработки операционного поля и локтевых сгибов доноров; для обработки инъекционного поля; для полной или частичной санитарной обработки кожных покровов.
Композиционное (комбинированное) химическое ДС – средство, в состав которого входят несколько (два и более) ДВ.
Концентрированный раствор ДС – заблаговременно приготовленный раствор ДВ и функциональных добавок с более высоким их содержанием, чем та концентрация, в которой эти вещества применяются для целей дезинфекции (рабочие растворы). Концентраты предназначены для приготовления рабочих растворов способом разведения водой (или спиртом) до необходимого объема.
Микробная контаминация – попадание микроорганизмов (в том числе потенциально опасных для здоровья человека) на поверхности тела человека, животного и абиотические объекты внешней среды или внутрь объектов (например, медицинских изделий), которые могут послужить фактором передачи инфекции.
Минимальная концентрация раствора ДС – концентрация раствора ДС, вызывающая гибель микроорганизма определенного вида при самом малом содержании ДВ в одной из исследованных концентраций растворов.
Обеззараживание объекта – умерщвление на (в) объектах окружающей среды или удаление с (или из) таких объектов микроорганизмов – возбудителей инфекционных и паразитарных болезней с использованием специальных средств и способов, в целях обеспечения инфекционной безопасности этих объектов.
Оболочечные вирусы – крупные или средние по размеру вирусы (вирусы гриппа, ВИЧ, парентеральных гепатитов В, С, Д, герпеса и др.), имеющие внешнюю суперкапсидную липидсодержащую оболочку. Оболочка состоит из фрагментов двухслойных клеточных мембран клеток хозяина и вирусных белков. Она придает вирусам липофильные свойства (чувствительность к растворителям липидов).
Обработка инъекционного поля – обеззараживание кожи в месте инъекции (или взятия крови на анализ у пациентов) путем обработки кожным антисептиком. Обработка инъекционного поля должна обеспечивать уничтожение транзиторной микрофлоры.
Обработка кожи операционного поля и локтевых сгибов – обеззараживание кожных покровов в области оперативного вмешательства и места взятия крови у доноров (локтевой сгиб) кожным антисептиком, обеспечивающее уничтожение транзиторной флоры.
Обработка рук хирургов – обеззараживание кистей рук и предплечий кожным антисептиком. Обработка рук хирургов обеспечивает уничтожение транзиторной и снижение количества резидентной микрофлоры.
Предстерилизационная очистка – удаление с медицинских изделий любых неорганических и органических загрязнений перед стерилизацией.
Рабочий раствор – определенное количество действующего вещества (веществ) в воде (или спирте, смеси спиртов), рекомендованное Инструкцией по применению конкретного средства. В Инструкции по применению концентрации рабочего раствора приведены по препарату (количество средства в растворе в граммах, рассчитанное в %) и/или по ДВ (т.е. по содержанию ДВ в %).
Растворимость ДС – способность ДС образовывать с другими веществами однородные системы – растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц.
Режим дезинфекции (стерилизации) – сочетание характеристик химического средства дезинфекции (стерилизации) и условий его применения, при котором достигается заданная эффективность.
Режим применения дезинфицирующего средства – совокупность факторов, условий, технологии применения ДС, позволяющая обеспечить достижение целевой эффективности и безопасности применения средства.
Режим ДВУ – использование стерилизующего (спороцидного) средства в концентрации, рекомендованной для стерилизации (в концентрации, обеспечивающей гибель спор), при времени дезинфекционной выдержки, обеспечивающей уничтожение (умерщвление) всех патогенных и условно-патогенных микроорганизмов (бактерий, в том числе микобактерий туберкулеза, любых вирусов и грибов рода Сandida) на эндоскопах, используемых при нестерильных эндоскопических манипуляциях.
Резидентная (естественная, постоянная) микрофлора – совокупность микробиоценозов (сообществ микроорганизмов), характеризующихся определенным видовым составом, постоянным присутствием и занимающих тот или иной биотоп (место обитания).
Резистентность – устойчивость, сопротивляемость. Применительно к дезинфекции – устойчивость популяций микроорганизмов к ДС.
Резистентность микроорганизмов (применительно к дезинфекции) – полная или частичная невосприимчивость к воздействию химических средств дезинфекции и стерилизации. Резистентность может быть естественной (генетически закрепленной, характерной для всех микроорганизмов данного семейства, рода, вида) и приобретенной (как результат адаптации микроорганизмов к воздействию отдельных ДС).
Ротация ДС – замена средств на основе ДВ из одной химической группы на средства с аналогичными свойствами из другой группы химических соединений.
Санитарная обработка кожных покровов – обеззараживание кожных покровов тела (всего или отдельных участков) человека путем обработки антисептиками с моющими свойствами для обеспечения снижения количества транзиторной микрофлоры.
Спороцидная активность ДС – способность химического ДС вызывать гибель спор микроорганизмов.
Стабилизаторы (применительно к дезинфекции) – это вещества, повышающие стабильность химических средств дезинфекции и стерилизации путем создания определенного значения pH среды, предупреждения окислительно-восстановительных процессов и проч.
Стабильность химических средств дезинфекции и стерилизации – способность средств сохранять физико-химические свойства и антимикробную активность в течение определенного срока хранения, предусмотренного требованиями нормативно-технической документации по применению средств.
Стабильность рабочего раствора ДС при хранении – сохранение всех свойств раствора ДС, заявленных в инструкции по применению.
Стерилизация – обеспечение гибели микроорганизмов всех видов на всех стадиях развития, включая споры.
Транзиторная (временная, непостоянная) микрофлора — это микроорганизмы, которые приобретаются человеком, в том числе медицинским персоналом и пациентами, в медицинских организациях, при контакте с предметами, контаминированными этими микроорганизмами.
Туберкулоцидная активность – способность ДС вызывать гибель микобактерий туберкулеза.
Условно-патогенные микроорганизмы (оппортунистические, потенциально-патогенные) – группа разнородных по систематическому положению микробов, которые вступают с организмом человека в одних случаях в отношения симбиоза и (или) нейтрализма, в других – в конкурентные отношения, нередко приводящие к развитию заболевания. Условно-патогенные микроорганизмы встречаются среди бактерий, грибов, простейших и, возможно, вирусов.
Фунгицидная активность – способность ДС вызывать гибель возбудителей грибковых болезней (кандидозов, дерматофитий), а также плесневых грибов.
Экологическая безопасность ДС – допустимый уровень негативного воздействия ДС на окружающую среду и человека.
Экспозиция (время дезинфекционной или стерилизационной выдержки) – интервал времени, необходимый для осуществления процесса дезинфекции (стерилизации).
3. Общие положения
3.1. Одним из главных направлений в деятельности медицинских организаций является обеспечение безопасности пациентов и персонала. Наиболее существенной составляющей всего комплекса безопасности считается профилактика инфекций, связанных с оказанием медицинской помощи.
3.2. Деятельность медицинских организаций на современном уровне характеризуется широким внедрением в практику новых методов лечения и диагностики, что ведет к использованию новых технологий и медицинских изделий, в том числе инструментов, медицинской техники, новых материалов. Важнейшим аспектом неспецифической профилактики ИСМП является использование химических средств дезинфекции и стерилизации. В настоящее время имеются сотни зарегистрированных в установленном порядке дезинфицирующих и стерилизующих средств на основе ДВ из разных групп химических соединений и различающихся по составу рецептур.
3.3. В условиях интенсивного внедрения и использования современных медицинских технологий, с одной стороны, и большого разнообразия дезинфекционных средств, с другой стороны, перед медицинскими организациями стоит сложная задача оптимального выбора эффективных и безопасных химических средств дезинфекции и стерилизации.
3.4. Изложенные в настоящем документе рекомендации по выбору и использованию химических средств дезинфекции и стерилизации разработаны с участием ведущих специалистов в области дезинфектологии и клинической эпидемиологии на основе обобщения накопленного опыта и существующих научных данных по физико-химическим свойствам, токсикологическим характеристикам, антимикробным и целевым возможностям различных ДС.
4. Дезинфицирующие средства, их основные группы, классификации и характеристика
4.1. Современные ДС представляют собой индивидуальные химические соединения или композиционные составы, включающие несколько ДВ. Кроме того, в состав ДС часто входят различные функциональные компоненты: ингибиторы коррозии, красители, отдушки, стабилизаторы, загустители и др. Главные требования, предъявляемые к современным ДС, применяемым в медицинских организациях, является их эффективность и безопасность.
4.2. Эффективность ДС оценивается по их антимикробному действию, которое включает:
— бактерицидную активность;
— туберкулоцидную активность;
— фунгицидную активность;
— вирулицидную активность;
— спороцидную активность.
4.3. Безопасность ДС оценивается по их токсикологическим характеристикам в соответствии с общепринятыми классификациями опасности и токсичности:
— классификация опасности по степени воздействия на организм ГОСТ 12.1.007-76;
— классификация токсичности при введении под кожу и в брюшную полость животного (по К. К. Сидорову);
— классификация химических веществ по степени летучести (С20);
— классификация опасности по выраженности местно-раздражающих свойств дезинфицирующих средств на коже;
— классификация степени ингаляционной опасности дезинфицирующих средств по зоне острого биоцидного действия;
— классификация степени ингаляционной опасности дезинфицирующих средств по зоне подострого биоцидного действия.
Для использования в медицинских организациях выбирают готовые к применению средства или рабочие растворы средств, относящиеся при поступлении в желудок и нанесении на кожу к 4 классу (малоопасных) или 3 классу (умеренно опасных) соединений по ГОСТ 12.1.007-76. «Вредные вещества. Классификация и общие требования безопасности».
Для текущей дезинфекции (в присутствии пациентов) используют рабочие растворы ДС, относящиеся к 4 классу опасности при ингаляционном пути поступления (классификация степени ингаляционной опасности ДС в зоне острого биоцидного действия [МУ 1.2.1105–02. «Оценка токсичности и опасности дезинфицирующих средств»].
4.4. Эффективность и безопасность ДС обусловлены ДВ, входящими в состав химических средств дезинфекции и стерилизации. Перечень ДВ, входящих в состав средств, зарегистрированных в Российской Федерации приведен в Приложении 1.
4.5. Основные характеристики некоторых групп ДВ и ДС на их основе.
4.5.1. Катионные поверхностно-активные вещества (КПАВ)
Наиболее распространенными в рецептурах ДС являются КПАВ. Важнейшими представителями КПАВ являются соединения ЧАС, производные гуанидинов, третичные алкиламины (далее — алкиламины).
КПАВ характеризуются следующими физико-химическими свойствами: не летучи, не имеют резкого запаха, хорошо растворяются в воде, некоторые из них имеют моющие свойства, стабильны, не повреждают объекты обеззараживания. КПАВ обладают бактерицидной активностью, фунгицидной и избирательной вирулицидной активностью. Они не проявляют спороцидного, а также туберкулоцидного (за исключением алкиламинов) действия.
Четвертичные аммониевые соединения (ЧАС)
По своим характеристикам ЧАС являются типичными представителями КПАВ. Наиболее эффективными ЧАС являются соединения, молекулы которых имеют длину цепи, состоящую из 10-16 атомов углерода. Отрицательное влияние на антимикробную активность ЧАС оказывают катионы металлов, кислая среда (pH<3), органические вещества, повышенная минерализация воды. ЧАС не проявляют туберкулоцидной и спороцидной активности, инактивируют липофильные вирусы, но избирательно и в высоких концентрациях − гидрофильные вирусы. Для повышения активности ЧАС в композиционных средствах их используют в сочетании с другими ДВ.
Средства на основе ЧАС применяют для обработки поверхностей в помещениях при текущей и профилактической дезинфекции, приборов, оборудования. ЧАС входят в состав кожных антисептиков, а также разных по назначению ДС, в том числе многих композиционных препаратов для дезинфекции медицинских изделий и других объектов.
Производные гуанидинов
Производные гуанидинов также являются типичными представителями КПАВ по физико-химическим свойствам; проявляют хорошую бактерицидную и вирулицидную активность в отношении оболочечных (липофильных) и безоболочечных (гидрофильных) вирусов. Особенностью полимерных производных гуанидина (полигуанидинов) является способность к образованию пленки на обработанной поверхности, чем обусловлено длительное остаточное (пролонгированное) антимикробное действие таких средств. После обработки медицинских изделий (при подсыхании раствора на поверхности или в каналах), могут нарушаться их функциональные свойства (например, помутнение оптики эндоскопов, нарушение проходимости изделий с каналами и др.). Кроме того, способность к образованию на поверхности пленки является причиной того, что рабочие растворы ДС на основе полимерных производных гуанидина могут фиксировать загрязнения органической природы (кровь, слюна и др.).
Наиболее распространенными в рецептурах ДС являются следующие производные гуанидинов: хлоргексидины (мономерные производные гуанидина) и полимерные производные − полигексаметиленбигуанидин, полигексаметиленгуанидин гидрохлорид, полигексаметиленгуанидин фосфат и др. Мономерные производные гуанидина нередко включают в состав кожных антисептиков.
Алкиламины
Алкиламины являются производными жирных кислот. Амины делятся на первичные, вторичные и третичные, в зависимости от количества атомов водорода, замененных алкильными радикалами. Вещества, содержащие две или три аминные группы, именуются диаминами и триаминами, соответственно.
Дезинфицирующие средства, содержащие третичный амин или диамин, проявляют высокую бактерицидную, туберкулоцидную, фунгицидную и вирулицидную активность, но спороцидным действием не обладают. Из перечисленных выше КПАВ третичный амин обладает наиболее высокой активностью и широким спектром антимикробного действия.
4.5.2. Кислородактивные соединения
Кислородактивные соединения относятся к группе окислителей. Применительно к ДС кислородактивные соединения – это соединения, высвобождающие активный кислород, обеспечивающий гибель микроорганизмов. Основными представителями этой группы соединений являются: перекись водорода, перборат натрия, перкарбонат натрия, пероксогидрат фторида калия, надуксусная, надмуравьиная и другие надкислоты. Средства на основе кислородактивных соединений производятся в виде жидких концентратов (перекись водорода, надкислоты, диоксид хлора), в виде порошков (пербораты, перкарбонаты и др.) и таблеток.
Повышение температуры рабочих растворов ДС, выделяющих кислород, приводит к усилению антимикробного действия. Кислая среда (pH 3,07 – 4,3 является оптимальной для воздействия кислородактивных соединений на микроорганизмы. Присутствие органических веществ снижает антимикробную активность кислородактивных соединений. Кислородактивные соединения имеют различную антимикробную активность. Наиболее эффективными из них являются надкислоты. При нейтральном или слабощелочном значениях pH рабочих растворов надуксусная кислота совместима с материалами медицинских изделий (в т. ч. эндоскопы). Пербораты и перкабонаты натрия в сочетании с тетраацетилэтилендиамином (ТАЭД) проявляют высокую активность в отношении всех видов бактерий, в том числе споровых форм, а также грибов и вирусов.
Эффективные концентрации перекиси водорода в виде монопрепарата составляют 3-6%. Перекись водорода в композиционных средствах с катионными и анионными ПАВ может повышать свою антимикробную активность.
4.5.3. Хлорактивные соединения
Хлорактивные соединения относятся к группе окислителей, как и кислородактивные соединения. Хлорактивные соединения характеризуются высвобождением активного хлора, что и обусловливает их антимикробное действие.
Хлорактивные соединения подразделяются на две группы: неорганические и органические хлорактивные соединения.
К неорганическим хлорактивным соединениям относятся:
— гипохлорит кальция нейтральный;
— гипохлорит кальция технический;
— двуосновная соль гипохлорита кальция;
— гипохлорит натрия;
— гипохлорит лития;
— хлорная известь, известь белильная термостойкая и др.
К органическим хлорактивным соединениям относятся:
— дихлордиметилгидантоин;
— натриевая соль дихлоризоциануровой кислоты (ДХЦК);
— натриевая соль трихлоризоциануровой кислоты (ТХЦК);
— хлорамины (Б, Т, ХБ) и др.
Хлорактивные ДС проявляют высокую эффективность и демонстрируют широкий спектр антимикробной активности в отношении всех видов бактерий (в том числе образующих споры), а также вирусов и грибов. С повышением температуры растворов антимикробная активность хлорактивных соединений возрастает. В присутствии органических веществ антимикробное действие хлорактивных ДС снижается за счет взаимодействия хлора с органическим субстратом.
Среди неорганических хлорактивных соединений наибольшее распространение в качестве ДВ получил гипохлорит натрия. ДС на основе гипохлорита натрия обладают высокой антимикробной активностью. При изменении pH рабочих растворов в кислую сторону антимикробная активность гипохлорита натрия возрастает, однако стабильность данного соединения падает.
На основе органических хлорактивных соединений широкое применение получили средства на основе ДХЦК, ТХЦК в виде таблеток и гранул, как наиболее удобных в применении форм выпуска. Не теряют актуальности ДС на основе дихлордиметилгидантоина, хлорамина.
4.5.4. Альдегиды
Альдегиды являются одними из важнейших ДВ, которые обладают бактерицидной, в том числе туберкулоцидной, спороцидной, фунгицидной и вирулицидной активностью. Альдегиды характеризуются наличием в молекуле одной или нескольких альдегидных групп. Химическая характеристика альдегидов выражается формулой R-СОН. Если группа -СОН повторяется один раз, то такие альдегиды являются одноатомными. Если группа -СОН повторяется дважды, то такие альдегиды называют многоатомными или диальдегидами. Представителями одноатомных альдегидов являются уксусный, валерьяновый, пропиловый альдегиды.
Применительно к ДС наибольший интерес представляют диальдегиды. Основными соединениями этой группы являются глутаровый альдегид (ГА), альдегид янтарной кислоты, ортофталевый альдегид, глиоксаль. Различные альдегиды отличаются друг от друга антимикробной активностью. Самым распространенным в рецептурах ДС является ГА. Антимикробная активность ГА в значительной степени зависит от pH рабочих растворов. Наиболее активен ГА в пределах значений pH от 7,5 до 8,5. Глиоксаль и альдегид янтарной кислоты имеют широкий спектр антимикробного действия, но их активность значительно ниже, чем ГА.
Большим преимуществом альдегидов является щадящее действие на изделия из металлов, полимерных материалов, стекла. ДС на основе альдегидов используют для стерилизации и ДВУ эндоскопов, дезинфекции и стерилизации стоматологических и других медицинских изделий. Существенным недостатком альдегидов является их способность фиксировать органические загрязнения на поверхности и в каналах медицинских изделий, поэтому необходима их тщательная очистка перед использованием альдегидсодержащих средств.
4.5.5. Спирты
Наиболее широко в составе ДС применяются в качестве ДВ такие спирты, как этанол (этиловый спирт), 1-пропанол (пропиловый спирт), 2-пропанол (изопропиловый спирт). Спирты обладают бактерицидным, вирулицидным и. фунгицидным действием. Изопропиловый спирт в концентрациях не ниже 60% вызывает гибель микобактерий туберкулеза. Вирулицидная. активность спиртов неоднозначна Липофильные вирусы чувствительны ко всем перечисленным выше трем спиртам. Гидрофильные вирусы (например, вирус гепатита А, полиовирус, энтеровирусы Коксаки и ЕСНО) инактивируются только этанолом. Спирты могут использоваться в рецептурах ДС как в качестве самостоятельных ДВ, так и в сочетании с другими ДВ. В отдельных случаях в рецептурах ДС используются многоатомные спирты: 1,3-бутандиол или этиленгликоль.
Спирты могут комбинироваться практически со всеми ДВ (ЧАС, производные гуанидина, йод, органические кислоты, перекись водорода, производные фенола). ДС на основе спиртов, как правило, выпускаются в виде готовых к применению растворов, которые используются в качестве кожных антисептиков. Спиртосодержащие ДС применяют также для обеззараживания небольших по площади поверхностей способами орошения или протирания (не более 10% от общей площади помещения).
Эффективные концентрации спиртов в кожных антисептиках следующие (по массе): изопропилового спирта – не менее 60%; этилового спирта – не менее 70%. Наличие в рецептурах ДС разных спиртов составляет их концентрации в итоговой сумме в таком же диапазоне – 60-70%. Это положение в равной степени относится как кожным антисептикам, так и к ДС, предназначенным для обработки небольших по площади поверхностей.
4.5.6. Фенол и его производные
Основные фенольные соединения, используемые в качестве ДВ в рецептурах ДС, хорошо растворяются в воде. К таким соединениям относятся: о-фенилфенол, 2-феноксиэтанол, 2-фенокси-1-пропанол, триклозан. Наиболее высокую антимикробную активность производные фенола проявляют в кислой среде. Они обладают бактерицидным, в том числе туберкулоцидным, фунгицидным и избирательным вирулицидным действием. Однако не все производные фенола обладают широким спектром антимикробного действия. Например, триклозан эффективен только против бактерий (за исключением микобактерий туберкулеза). Органические загрязнения снижают активность производных фенола в меньшей степени, чем других ДВ. ДС на основе фенола недостаточно эффективны против гидрофильных вирусов и инактивируют их в высоких концентрациях. Однако, в сочетании с другими ДВ, в частности со спиртами, активность производных фенола может усиливаться.
Из перечисленных выше соединений фенола в состав кожных антисептиков включают феноксиэтанол, триклозан.
4.5.7. Неорганические и органические кислоты
Кислоты могут использоваться в качестве самостоятельных ДС, а также в качестве вспомогательных веществ в сложных составах, выполняющих, помимо антимикробного действия, другие функции. Органические кислоты (лимонная, молочная, гликолевая) избирательно действуют на вирусы и в водных растворах эффективны против оболочечных вирусов. Надкислоты характеризуются широким спектром антимикробной (бактерии, в том числе микобактерии туберкулеза, споры бактерий, вирусы, грибы) активности, они входят в состав дезинфицирующих и стерилизующих средств.
4.5.8. Средства, содержащие ферменты − протеазу, липазу, амилазу применяют для предстерилизационной очистки медицинских изделий. Эти ферменты могут входить в состав композиционных дезинфицирующих средств, предназначенных для дезинфекции и предстерилизационной очистки.
4.6. Классификации ДС
4.6.1. Классификация ДС по ДВ:
1. Средства, содержащие ЧАС.
2. Средства, содержащие производные гуанидинов.
3. Средства, содержащие алкиламины.
4. Средства, содержащие альдегиды (альдегидосодержащие средства).
5. Средства, высвобождающие хлор (хлорактивные средства).
6. Средства, высвобождающие кислород (кислородактивные средства).
7. Средства, содержащие спирты (спиртосодержащие).
8. Средства, содержащие производные фенола (фенолсодержащие).
9. Средства, содержащие йод (йодсодержащие).
10. Средства, содержащие кислоты.
11. Средства, содержащие щелочи.
12. Композиционные средства.
При использовании данной классификации ДС следует учитывать, что в одну и ту же группу ДС могут входить средства на основе ДВ из различных химических групп. Так, в группу хлорактивных средств входят, например, ДС на основе натриевой соли ДХЦК и гипохлориты, а в группу кислородактивных средств включены надуксусная кислота и перекись водорода. К спиртосодержащим следует относить те средства, в которых спирты, как ДВ, имеют ведущее значение в формировании антимикробной активности (в концентрациях, указанных в п. 4.5.5.). В ряде рецептур ДС спирты используются в качестве функциональной добавки в незначительных количествах (ниже указанных в п. 4.5.5.) для стабилизации растворов, улучшения растворимости и др., в таких ДС они не определяют их антимикробную активность.
Наиболее сложно в практических условиях классифицировать композиционные ДС, в рецептурах которых содержится два и более ДВ. Для этих целей может быть использована классификация по степени выраженности антимикробной активности ДВ. Так, если в рецептуре представлены два и более ДВ, то ДС следует отнести к группе наиболее активного ДВ. Например, ДС содержит три ДВ: ЧАС + производное гуанидина + ГА. В отношении любых видов микроорганизмов наибольшую активность проявляет ГА. Такое средство следует классифицировать, как альдегидосодержащее ДС.
4.6.2. Средства дезинфекции и стерилизации выпускают в виде концентратов и готовых к применению форм. Ниже приведена классификация средств по формам выпуска:
1. Жидкости – концентраты;
2. Жидкости, готовые к применению;
3. Гели (готовые к применению);
4. Мыла (лосьоны) жидкие (готовые к применению);
5. Пенки (готовые к применению);
6. Муссы (готовые к применению);
7. Порошки – концентраты;
8. Гранулы (готовые к применению или концентраты в зависимости от объекта обеззараживания);
9. Таблетки (концентраты);
10. Салфетки (готовые к применению), пропитанные раствором ДС (в том числе, кожным антисептиком).
5. Устойчивость микроорганизмов к химическим дезинфицирующим средствам
5.1. Микроорганизмы разных видов существенно различаются между собой по чувствительности/устойчивости к различным химическим соединениям (табл. 1), что следует учитывать при выборе дезинфицирующих и стерилизующих средств.
5.2. Самыми устойчивыми к действию химических средств дезинфекции являются прионы и споры бактерий (ранги А и Б, класс 1), наименее устойчивыми — вегетативные формы бактерий и слабоустойчивые вирусы парентеральных гепатитов В, С, Д, ВИЧ-инфекции, герпеса, гриппа и др. (ранги З и И, класс 3).
5.3. Внутри каждого класса ранги, обозначенные буквами алфавита от А до И, показывают последовательное снижение устойчивости микроорганизмов к ДС. Однако, в зависимости от вида ДВ в составе композиционных средств, возможно изменение порядка взаиморасположения микроорганизмов внутри того или иного класса, например, грибов рода Candida и вирусов (ранги Б и Г, класс 2) и др.
5.4. При выборе режимов дезинфекции (концентрация, время дезинфекционной выдержки) различных объектов, контаминированных перечисленными микроорганизмами, необходимо учитывать, что, если средство эффективно в отношении более устойчивых микроорганизмов, то оно будет эффективно и в отношении менее устойчивых микроорганизмов. Из этого следует, что, например, химические средства и режимы дезинфекции, эффективные в отношении споровых форм бактерий, будут эффективны в отношении всех ниже расположенных (табл.1) групп менее устойчивых микроорганизмов.
5.5. Спектр антимикробной активности (табл. 2) средств различается. Он зависит от химического состава средства, его концентрации, режима применения и естественной (или сформировавшейся) устойчивости к действию средства микроорганизмов, циркулирующих в медицинских организациях.
Таблица 1
Сравнительная устойчивость микроорганизмов к химическим дезинфицирующим средствам
|
Классы и ранги устойчивости микроорганизмов к ДС |
Разновидности микроорганизмов и примеры инфекционных болезней, вызываемых ими |
||
|
Группы и виды микроорганизмов |
Примеры вызываемых инфекций |
||
|
1 класс Высокая устойчивость |
Ранг А |
Прионы |
Болезнь Крейтцфельдта-Якоба Газовая анаэробная инфекция Псевдомембранозный колит Столбняк, ботулизм Сибирская язва |
|
Ранг Б |
Споры бактерий |
||
|
2 класс Средняя устойчивость |
Ранг В |
Микобактерии туберкулеза Грибы-дерматофиты Грибы рода Aspergillus |
Туберкулез Дерматофитии Аспергиллёз |
|
Ранг Г |
Полиовирусы Вирусы Коксаки, ЕСНО, энтеровирусы 68-71 типов Риновирусы Норовирусы Вирус гепатита А Грибы рода Candida |
Полиомиелит Энтеровирусные инфекции Респираторные инфекции Норовирусная инфекция Гепатит А Кандидозы |
|
|
Ранг Д |
Ротавирусы Реовирусы |
Ротавирусный гастроэнтерит Лихорадочные заболевания, энтериты |
|
|
Ранг Е |
Аденовирусы |
Фарингиты,кератиты, конъюн-ктивиты, гастроэнтериты |
|
|
3 класс Низкая устойчивость |
Ранг З |
Вегетативные формы бактерий, в том числе возбудители холеры, чумы, туляремии |
Кишечные инфекции Инфекции верхних дыхательных путей, пневмонии, бакте- риемии и др. Холера, чума, туляремия |
|
Ранг И |
Вирусы парентеральных гепатитов В, С, D; ВИЧ Вирусы герпеса Цитомегаловирус Вирусы гриппа Вирусы парагриппа Коронанавирусы Вирусы геморрагических лихорадок, в том числе вирусы Эбола, Марбург и др. |
Парентеральные гепатиты В, С, D; ВИЧ-инфекция Герпетическая инфекция Цитомегалия Грипп (в т.ч. «птичий», «свиной») ОРВИ Атипичная пневмония (ТОРС) Вирусные геморрагические лихорадки, в том числе Эбола, Марбург и др. |
5.4. Бактерицидной активностью (кроме микобактерий туберкулеза) обладают все ДВ, перечисленные в табл. 2, в эффективных концентрациях.
5.5. Туберкулоцидная активность присуща не всем веществам, перечисленным в табл. 2.
В целом, ЧАС не рассматриваются как вещества, обладающие высокой туберкулоцидной активностью.
Не обладают туберкулоцидной активностью, вне зависимости от концентрации, полимерные и мономерные производные гуанидина. Также не следует выбирать композиции ЧАС с производными гуанидина.
Таблица 2
Антимикробная активность химических веществ
по результатам отечественных и зарубежных исследований
(+ активные; ± не все активные; – не активные)
|
Микроорганизмы, ранги, классы |
Химические вещества |
|||||||
|
Хлорактивные |
Кислородактивные |
Альдегиды |
Третичные алкиламины |
Четвертичные аммониевые соединения |
Полимерные и мономерные производные гуанидина гидрохлорид |
Спирты |
Производные фенола |
|
|
Споры бактерий (ранг Б, класс 1) |
± |
+ |
+ |
– |
– |
– |
– |
– |
|
Микобактерии (ранг В, класс 2) |
+ |
+ |
+ |
+ |
– |
– |
+ |
± |
|
Бактерии (ранг З, класс 3) |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Грибы (ранг В, класс 3) |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
± |
|
Вирусы ранга Г (класс 2) |
+ |
+ |
+ |
+ |
± |
± |
± |
– |
|
Вирусы рангов Д и Е (класс 2) Вирусы ранга И (класс 3) |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
± |
5.6. Фунгицидной активностью в отношении грибов рода Candida характеризуются перечисленные в табл. 2 соединения и средства на их основе. В отношении грибов рода Trichophyton и плесневых грибов рода Aspergillus концентрации рабочих растворов эффективных средств значительно выше, поэтому в инструкциях по применению средств режимы дезинфекции разных объектов, контаминированных этими грибами, существенно различаются и представлены раздельно.
5.7. Спороцидной активностью (см. табл. 2) обладают ДС на основе альдегидов, кислородактивных соединений (в том числе диоксида хлора), некоторых хлорактивных соединений, анолиты.
Не обладают спороцидной активностью средства на основе ЧАС, полимерных и мономерных производных гуанидина, алкиламинов, спиртов, производных фенолов и композиционные составы на основе этих соединений, независимо от концентрации последних в средстве или его рабочих растворах. Перечисленные средства нельзя применять ни для дезинфекции объектов, контаминированных бактериями в споровой форме, ни для ДВУ эндоскопов, используемых при нестерильных эндоскопических манипуляциях, ни для стерилизации медицинских изделий.
5.8. Вирулицидная активность также присуща перечисленным в табл. 2 веществам в отношении вирусов (липофильных) с низкой устойчивостью к ДС — возбудителей парентеральных гепатитов В, С, Д, ВИЧ-инфекции, герпеса, цитомегалии, гриппа (в том числе «птичьего», «свиного»), коронавируса – возбудителя тяжелого респираторного синдрома (ТОРС − «атипичной пневмонии»), возбудителей ОРВИ (ранг И, класс 3) и др.
При инфекциях, вызываемых ротавирусами, реовирусами, риновирусами, аденовирусами – микроорганизмами со средней устойчивостью (ранги Д и Е, класс 2) к химическим средствам, эффективны также те соединения и средства на их основе, которые активны в отношении более устойчивых вирусов (ранг Г, класс 2).
5.9. Классификация вирулицидной активности химических ДС представлена в таблице 3. Согласно этой классификации, в отношении вирусов Коксаки, ЕСНО, энтеровирусов 68-71 типов, полиомиелита, гепатита А (ранг Г, класс 2) не эффективны водные растворы хлоргексидина биглюконата, клатрата дидецилдиметиламмония бромида с мочевиной, фенола и его производных, изопропилового спирта.
Таблица 3
Классификация дезинфицирующих средств по вирулицидной активности
|
1 группа Высокая вирулицидная активность |
2 группа Умеренная вирулицидная активность |
3 группа Избирательная вирулицидная активность |
|
альдегиды (кроме глиоксаля); надуксусная кислота; натриевая и калиевая соли дихлоризоциануровой кислоты; натриевая соль трихлоризоциануровой кислоты; анолиты; дихлордиметилгидантоин; диоксид хлора |
хлорамин; гипохлорит натрия; гипохлорит кальция; некоторые ЧАС*; полимерные производные гуанидина; глиоксаль; перекись водорода; спирт этиловый |
хлоргексидина биглюконат; клатрат дидецилдиметилам-мония бромида с мочевиной; производные фенола; изопропиловый спирт |
|
Концентрации рабочих растворов по действующему веществу – сотые доли процента и выше |
Концентрации рабочих растворов по действующему веществу – десятые доли процента и выше |
Вне зависимости от концентрации рабочего раствора не инактивируют вирусы ранга Г (класса 2) |
|
инактивируют: вирусы классов 2 и 3 (всех рангов). |
инактивируют: вирусы рангов Д и Е (класса 2); вирусы ранга И (класса 3) |
6. Общие рекомендации по выбору химических средств дезинфекции и стерилизации
6.1. К применению в медицинских организациях допускаются только средства, зарегистрированные в установленном порядке и соответствующие требованиям Федерального Закона ФЗ-52 «О санитарно-эпидемиологическом благополучии населения». Средства для дезинфекции (включая кожные антисептики), предстерилизационной очистки и стерилизации должны иметь следующие документы:
— свидетельство о государственной регистрации единой формы для стран Таможенного союза, утвержденной Решением Комиссии таможенного союза от 28 мая 2010 г. № 299;
— декларацию о соответствии средства обязательным требованиям;
— инструкцию по применению, утвержденную производителем (или другой организацией по его поручению);
— этикетку (тарную), утвержденную производителем (или другой организацией по его поручению.
6.2. Основными критериями выбора ДС для обработки различных объектов в медицинской организации, в том числе медицинских изделий, являются:
— спектр антимикробной активности;
— время дезинфекционной выдержки;
— безопасность применения средства в рекомендованных режимах для медицинского персонала и пациентов;
— отсутствие (или низкая способность) у средства фиксировать органические загрязнения (кровь, мокрота, слюна и др.) на поверхности и в каналах изделий;
— способность средства сохранять антимикробную активность в присутствии органических загрязнений, о чем свидетельствует информация в инструкции на средство по режимам обеззараживания посуды с остатками пищи, лабораторной посуды, белья, загрязненного выделениями;
— наличие у средства моющих свойств, позволяющих совмещать дезинфекцию с предстерилизационной очисткой (при необходимости) или сочетать в одном этапе обработки дезинфекцию и мойку, например, поверхностей в помещениях, оборудования;
— стабильность средства и его рабочих растворов при хранении;
— растворимость в воде;
— экологическая безопасность.
Кроме того, следует учитывать:
— чувствительность к средству микрофлоры в медицинской организации по результатам мониторинга устойчивости;
— эпидемиологическую ситуацию в ЛПО;
— тип (профиль) медицинской организации;
— для композиционных средств – соотношение (по процентному содержанию) различных ДВ в составе средства;
— характеристику объектов (материал, конструктивные особенности и пр.) обрабатываемых средством.
— способ обработки объекта (ручной, механизированный с использованием специального оборудования и т.п.).
6.3. При выборе ДС значение имеет уровень их антимикробной активности, который характеризуется минимальными концентрациями рабочих растворов индивидуальных соединений или композиционных средств на их основе. Рекомендуемые при выборе средств для медицинских организаций минимальные концентрации рабочих растворов (по ДВ), обеспечивающие гибель бактерий (кроме микобактерий туберкулеза), представлены в табл. 4.
Учитывая возможность формирования устойчивых к дезинфектантам штаммов микроорганизмов, не рекомендуется применять ДС, если концентрации растворов по ДВ меньше приведенных в табл. 4.
Композиции на основе нескольких ДВ из группы КПАВ (ЧАС, полимерные производные гуанидина, третичные алкиламины) содержат, как правило, не менее 0,01 % по сумме ДВ. При появлении новых ДВ минимальные концентрации могут измениться.
Таблица 4
Минимальные концентрации некоторых химических соединений (действующих веществ) в рабочих растворах при бактериальных
(кроме туберкулеза) инфекциях
|
Химические соединения |
Концентрация рабочего раствора по действующему веществу, % |
|
Катионные поверхностно-активные вещества: |
|
|
четвертичные аммониевые соединения |
Не менее 0,02 |
|
полимерные производные гуанидина |
Не менее 0,05 |
|
третичные алкиламины |
Не менее 0,01 |
|
Хлорактивные: натриевая соль дихлоризоциануровой кислоты |
Не менее 0,015 (по активному хлору ) |
|
Кислородактивные: перекись водорода |
Не менее 3,0 |
6.4. Концентрацию ДВ в растворе средства при известной концентрации раствора по препарату рассчитывают по следующей формуле:
(С × М)
Х = ————-, где
100
Х – искомая концентрация ДВ в рабочем растворе, %;
С – концентрация рабочего раствора по препарату, приведенная в инструкции по применению, %;
М – количество ДВ в средстве (%), указанное в инструкции по применению.
Примечание: в инструкциях по применению средств концентрации рабочих растворов приведены по препарату (количество средства в растворе в граммах, рассчитанное в %) и/или по ДВ (т.е .по количеству или нескольких ДВ, если они из одной химической группы, %).
Примеры расчета концентрации ДВ в рабочих растворах средств
Пример 1. Концентрация ДВ в средстве (М) – 25 %, концентрация рабочего раствора по препарату (С) – 0,5 %. Для получения искомой концентрации (Х) необходимо выполнить следующие вычисления: (25×0,5):100=0,125%. Таким образом, концентрация ДВ в рабочем растворе равна 0,125%.
Если средство содержит несколько ДВ (например, полимерное производное гуанидина и ЧАС), то сначала рассчитывается концентрация по каждому ДВ, а потом эти концентрации суммируются.
Пример 2. Концентрация одного ДВ (М1) в средстве – 25%, концентрация рабочего раствора по препарату (С1) – 0,5 %, другого ДВ (М2) –– 4%, при концентрации рабочего раствора по препарату (С2) – 0,5%. Тогда: Х1=(25×0,5):100=0,125%, Х2=(4×0,5):100=0,02%. Итоговая суммарная концентрация двух ДВ в рабочем растворе равна 0,125 + 0,02=0,145%.
6.5. Для использования в отделениях разного профиля, в разных структурных подразделениях, помещениях различного назначения необходимо предусмотреть применение ДС, относящихся к различным группам химических соединений и выбирать те из них, которые обеспечат максимальную эффективность дезинфекции.
6.6. В специализированных медицинских организациях (отделениях) инфекционного профиля (туберкулезных, микологических, инфекционных и др.) используют средства, эффективные в отношении соответствующих видов микроорганизмов:
— в туберкулезных – обладающие туберкулоцидным действием с указанием в инструкции по применению средства, что оно тестировано на Mycobacterium terrae;
— в микологических – обладающие фунгицидным действием в отношении грибов рода Trichophyton;
— в инфекционных – обладающие бактерицидным, вирулицидным, фунгицидным действием (в соответствии со спецификой работы подразделения).
6.7. В случае госпитализации в инфекционное отделение больного с неясным диагнозом, для текущей дезинфекции до установления диагноза выбирают средства с широким спектром антимикробной активности – бактерицидной (при подозрении на туберкулез – туберкулоцидной), вирулицидной, фунгицидной; после установления диагноза – в соответствии с видовой принадлежностью возбудителя.
6.8. При выявлении в стационаре (отделении) ИСМП используют ДС, эффективные в отношении возбудителя соответствующей инфекции. В целях предупреждения формирования устойчивых к ДС штаммов микроорганизмов следует по результатам мониторинга устойчивости проводить ротацию ДС.
С этой целью осуществляют замену средств на основе соединений из одной химической группы, например, КПАВ, если к ним сформировалась устойчивость микроорганизмов, на средства из другой химической группы, например, хлорактивных или кислородактивных соединений, а также композиционных средств на их основе.
6.9. К кожным антисептикам и средствам другого назначения на основе спиртов (если спирты являются основным ДВ в обозначенных ранее в п. 4.5.5. концентрациях), не установлено формирования резистентности микроорганизмов.
6.10. Для дезинфекции поверхностей в помещениях, медицинского оборудования, приборов, мебели, стен, пола, которые загрязнены биологическими жидкостями пациента, выбирают ДС, обладающие бактерицидной (включая туберкулоцидную), вирулицидной и фунгицидной активностью в отношении грибов рода Candida.
В помещениях (операционные, процедурные, перевязочные, манипуляционные и др.), где поверхности в помещениях могут быть загрязнены кровью, для проведения различных видов уборок и дезинфекции применяют средства по режимам, эффективным в отношении вирусов.
6.11. Для обеззараживания поверхностей в помещениях в присутствии пациентов, игрушек, столовой посуды, изделий из тканей не допускается применять средства на основе альдегидов.
6.12. В целях профилактики грибковых инфекций резиновые коврики, поверхности ванн, пол душевых кабин обеззараживают средствами по режиму, эффективному в отношении грибов рода Trichophyton.
6.13. Для обработки поверхностей, пораженных плесневыми грибами, выбирают средства на основе полимерных производных гуанидина, ЧАС, хлорактивных и кислородактивных соединений и их композиций.
6.14. Для профилактики и борьбы с поражением поверхностей плесневыми грибами следует исключить возможность систематического увлажнения поверхностей в виде протечек и др. Кроме того, следует использовать специальные средства для пропитки поверхностей фунгицидными средствами.
6.15. Для дезинфекции небольших по площади, а также труднодоступных поверхностей, выбирают композиционные средства на основе спиртов с другим ДВ (например, ЧАС), выпускаемые в аэрозольных и беспропеллентных упаковках или в виде дезинфицирующих салфеток. В соответствии с инструкциями по применению ДС обработке подлежит не более 10% от общей площади поверхности помещения.
6.16. В присутствии пациентов не проводят обработку даже небольших по площади поверхностей аэрозолями ДС.
6.17. Для обеззараживания текстильных изделий следует выбирать средства на основе кислородактивных соединений. Перекись водорода в концентрациях выше 3% влияет на прочность тканей. Наиболее предпочтительными являются средства для дезинфекции, совмещенной со стиркой текстильных изделий.
6.18. Для дезинфекции выделений человека (фекалии, моча, мокрота, рвотные массы, кровь), остатков пищи, смывных вод, посуды из-под выделений, контейнеров для сбора медицинских отходов целесообразно использовать ДС, содержащие в качестве ДВ неорганические соединения хлора. Неорганические соединения хлора обладают способностью гомогенизировать органические вещества с экзотермической реакцией, что способствует более эффективному проникновению хлора в глубь субстрата и контакту с микроорганизмами.
Для обеззараживания больших объемов крови не следует использовать ДС на основе перекиси водорода ввиду интенсивного пенообразования при взаимодействии средства с кровью.
6.19. Для дезинфекции, очистки и стерилизации медицинских изделий, а также для дезинфекции любых других объектов используют только те средства, в инструкциях по применению которых имеются установленные режимы дезинфекции и стерилизации, т.е. указаны конкретные концентрации рабочих растворов и время обеззараживания, которые не вступают в противоречие с рекомендациями и данными, изложенными в настоящем документе.
6.20. Для дезинфекции медицинских изделий применяют ДС, обладающие широким спектром антимикробной активности (вирулицидной, бактерицидной, фунгицидной — в отношении грибов рода Candida). Выбор режимов дезинфекции в медицинских организациях фтизиатрического профиля проводят из тех ДС, которые эффективны в отношении микобактерий туберкулеза, о чем имеется информация в инструкции по применению такого средства о том, что оно тестировано на Mycobacterium terrae; в микологических стационарах (кабинетах) – по режимам, эффективным в отношении грибов рода Trichophyton (табл. 2).
6.21. Средства для обработки медицинских изделий можно условно разделить по назначению на несколько групп:
1. Средства, предназначенные для дезинфекции (Д).
2. Средства, предназначенные для дезинфекции, совмещенной с предстерилизационной очистки (Д+ПО).
3. Средства, предназначенные для дезинфекции, предстерилизационной очистки и ДВУ эндоскопов (Д+ПО+ДВУ).
4. Средства, предназначенные для стерилизации.
5. Средства, предназначенные для дезинфекции, предстерилизационнной очистки, ДВУ эндоскопов и стерилизации (Д+ПСО+ ДВУ+С).
6. Средства, предназначенные для ДВУ эндоскопов и стерилизации (ДВУ+С).
Это деление на группы условно потому, что единичные средства имеют только одно назначение, например, ферментные средства для предстерилизационной очистки. Большинство средств имеют назначение многоцелевое, т.е. для разных видов обработки медицинских изделий и других объектов.
6.22. Для дезинфекции медицинских изделий применяют ДС, обладающие широким спектром антимикробной активности (вирулицидной, бактерицидной, фунгицидной — в отношении грибов рода Candida). Выбор режимов дезинфекции в медицинских организациях фтизиатрического профиля проводят из тех ДС, которые эффективны в отношении микобактерий туберкулеза. Информация в инструкции по применению такого средства указывает на то, что оно тестировано на Mycobacterium terrae. В микологических стационарах (кабинетах) – применяют средства по режимам, эффективным в отношении грибов рода Trichophyton (табл. 2).
6.23. При выборе ДС следует, в целях исключения их вредного воздействия на медицинские изделия, руководствоваться рекомендациями производителей этих изделий, касающихся совместимости конкретных ДС с материалами, используемыми при изготовлении медицинских изделий.
6.24. При выборе ДС, используемых для механизированной мойки и дезинфекции, предпочтение следует отдавать малопенящимся средствам. Пена может значительно снизить эффективность механизированной обработки.
6.25. Для дезинфекции медицинских изделий после применения их у пациентов, например, с газовой анаэробной инфекцией или псевдомембранозным колитом, вызываемым Clostridium difficile, выбирают спороцидные средства.
6.26. Для ДВУ эндоскопов выбирают средства с подтвержденной спороцидной активностью на основе альдегидов, кислородактивных и хлорактивных соединений. При этом концентрация раствора (или ДВ в готовых к применению средствах) одинаковы для режимов стерилизации и ДВУ. В инструкциях/методических указаниях по применению этих средств режимы ДВУ и стерилизации различаются только по времени дезинфекционной и стерилизационной выдержки.
6.27. Для дезинфекции контура циркуляции диализирующей жидкости гемодиализных установок выбирают средства на основе надуксусной и других органических кислот, гипохлорита натрия, в инструкциях/методических указаниях по применению которых имеются соответствующие рекомендации.
Эти рекомендации не относятся к гемодиализаторам, которые после применения подлежат утилизации в соответствии с требованиями действующих СанПиН по обращению с медицинскими отходами.
6.28. Для дезинфекции поверхности гемодиализных установок применяют рекомендованные производителями установок средства, обладающие, в том числе, активностью в отношении вирусов парентеральных гепатитов В,С, Д и ВИЧ-инфекции.
6.29. Выбор средства для предстерилизационной очистки медицинских изделий (окончательной очистки эндоскопов) основывается на критериях его эффективности и безопасности и зависит от:
— особенностей медицинских изделия (материал, назначение);
— намечаемого процесса обработки (очистка в виде самостоятельного процесса или при совмещении с дезинфекцией);
— способа очистки (ручной, механизированный);
— типа оборудования для осуществления очистки механизированным способом.
6.30. Критериями выбора средств для предстерилизационной очистки медицинских изделий (окончательной очистки эндоскопов) являются:
— наличие моющих свойств, позволяющих удалять загрязнения различной природы (органические и неорганические, включая остатки лекарственных препаратов);
— безопасность для персонала и пациентов в применяемых режимах обработки;
— отсутствие повреждающего действия на обрабатываемые изделия в применяемых режимах обработки; низкое пенообразование (для средств, применяемых механизированным способом).
— низкое пенообразование (для средств, применяемых механизированным способом).
Высокую моющую активность обеспечивают средства на основе ферментов, поверхностно-активных веществ (неионогенных и катионных), некоторые кислородактивные (в том числе на основе перекиси водорода, надкислот) средства, электрохимически активированные растворы (католиты, нейтральные анолиты).
6.31. Средства, одновременно обладающие антимикробными и моющими свойствами, при наличии в составе различных сочетаний альдегидов, спиртов, КПАВ (ЧАС, полимерные и мономерные производные гуанидина, третичные алкиламины) могут в определенных концентрациях и в зависимости от количественных соотношений ДВ проявлять фиксирующее действие.
Исключение фиксирующего действия при применении таких средств для предстерилизационной очистки медицинских изделий или окончательной очистки эндоскопов (при совмещении и без совмещения с дезинфекцией) обеспечивается точным соблюдением режимов и технологии обработки, предписанных инструкцией по применению конкретного средства.
6.32. Стерилизации подлежат медицинские изделия многократного применения (в том числе хирургические и стоматологические инструменты, эндоскопы для стерильных эндоскопических манипуляций, инструменты к эндоскопам), которые при применении будут иметь контакт с кровью, раневой поверхностью, инъекционными препаратами, а также изделия, контактирующие со слизистыми и способные вызвать их повреждения.
6.33. Выбор средства для стерилизации медицинских изделий основывается на критериях его эффективности и безопасности и зависит от:
— особенностей медицинских изделий (материал, назначение);
— способа стерилизации (ручной, с применением специального оборудования);
— типа оборудования.
6.34. Критериями выбора средств для стерилизации медицинских изделий являются:
— широкий спектр антимикробной активности – спороцидное, вирулицидное, фунгицидное, бактерицидное действие;
— безопасность для персонала и пациентов в применяемых режимах обработки;
— отсутствие повреждающего действия на обрабатываемые изделия в применяемых режимах обработки.
6.35. При выборе средств для химической стерилизации медицинских изделий допускается использовать только те средства, которые обладают спороцидным действием. К таким средствам относятся:
— альдегидсодержащие средства;
— кислородактивные средства;
— некоторые хлорактивные (хлорсодержащие) средства.
При этом необходимо помнить, что ДС на основе производных гуанидина, ЧАС, алкиламинов, спиртов и фенолов, а также ДС на основе различных комбинаций этих ДВ, не обладают спороцидным действием и не могут использоваться для химической стерилизации медицинских изделий.
6.36. Для ДВУ эндоскопов выбирают те средства, в инструкциях по применению которых режимы ДВУ и стерилизации различаются только по времени дезинфекционной и стерилизационной выдержки! При этом концентрация раствора (или ДВ в готовых к применению средствах) и температура раствора одинаковы для режимов ДВУ и стерилизации.
6.37. При выборе кожных антисептиков, моющих средств, а также средств для ухода за кожей рук необходимо учитывать индивидуальную переносимость медицинского персонала. Для этих целей рекомендуется проводить предварительный отбор средств с различным химическим составом и от разных производителей. Целью отбора является определение наиболее безопасных и комфортных в применении средств.
6.38. При выборе средств для ухода за кожей рук медицинского персонала следует отдавать предпочтение средствам (кремы, бальзамы, лосьоны), предназначенным специально для медицинских работников и обеспечивающим увлажнение кожи, заживление мелких повреждений, питание, эластичность кожи и др., без парфюмерных отдушек и красителей.
6.39. Отбор средств следует проводить таким образом, чтобы медицинский персонал не имел предварительной информации о химическом составе, их торговых наименованиях и производителях средств. Это позволит наиболее объективно оценить выбираемые средства. В процессе отбора средств медицинский персонал заполняет соответствующую анкету. Данные анкетирования обобщаются и анализируются. На основании результатов анкетирования определяется перечень выбираемых средств.
6.40. Для обработки рук хирургов и других медицинских работников, участвующих в выполнении оперативных вмешательств, следует выбирать кожные антисептики на основе спиртов.
6.41. Для гигиенической обработки рук медицинских работников выбирают кожные антисептики на основе спирта (смеси спиртов) или кожные антисептики композиционного состава на водной основе.
6.42. Наряду с кожными антисептиками в виде готовых к применению средств, применяют антисептики в виде геля, дезинфицирующих салфеток.
6.43. Для гигиенической обработки рук медицинских работников выбирают кожные антисептики на основе спирта (смеси спиртов) или кожные антисептики композиционного состава на водной основе.
6.44. Наряду с кожными антисептиками в виде готовых к применению средств, применяют антисептики в виде геля, дезинфицирующих салфеток. Для индивидуального применения целесообразно выбирать кожные антисептики во флаконах небольшого объема (до 200 мл), которые удобно носить в кармане медицинской одежды.
6.45. Для нанесения на руки медицинских работников (или пациентов) кожного антисептика или жидкого мыла применяют дозаторы (диспенсеры). Для индивидуального применения целесообразно выбирать кожные антисептики во флаконах небольшого объема (до 200 мл), которые удобно носить в кармане медицинской одежды.). Для ухода за кожей рук предпочтение следует отдавать специальным средствам), предназначенные для медицинских работников.
6.46. Перед хирургическим вмешательством и другими манипуляциями, связанными с нарушением целостности кожных покровов (пункции, биопсии), операционное поле пациента обрабатывают антисептиком на основе спирта. Только при определенных видах вмешательств с использованием оборудования, для работы которого не желательно присутствие молекул спирта в воздухе, выбирают антисептики, не содержащие спирта.
6.47. Обработку локтевых сгибов доноров проводят теми же антисептиками, что и обработку операционного поля.
6.48. Для обработки мест инъекций (подкожных, внутримышечных, внутривенных) и взятия проб крови следует использовать спиртосодержащие кожные антисептики, в том числе в виде дезинфицирующих салфеток.
6.49. Для обработки операционного поля и инъекционного поля у детей младшего возраста выбирают антисептики на основе этилового спирта.
6.50. Для санитарной обработки кожных покровов пациентов используют антисептики, обладающие дезинфицирующими и моющими свойствами, но не содержащие спирты.
7. Рекомендации по выбору химических средств дезинфекции и стерилизации для медицинских организаций хирургического профиля
7.1. В целях профилактики и борьбы с ИСМП систематически осуществляется профилактическая дезинфекция (текущие и генеральные уборки), а при появлении случая ИСМП – текущая (дезинфекция всех предметов, имеющих контакт с заболевшим пациентом) и/или заключительная (обеззараживание всех предметов в палате после перевода пациента в другое отделение, выздоровления и др.) дезинфекция.
7.2. Для профилактической дезинфекции в помещениях медицинских организаций хирургического профиля необходимо использовать ДС, обладающие бактерицидной активностью.
7.3. Для проведения генеральных уборок в палатных отделениях, врачебных кабинетах, кабинетах и отделениях физиотерапии, функциональной диагностики, административно-хозяйственных помещениях и др. используют ДС, обладающие бактерицидной активностью.
7.4. Для генеральных уборок в операционных блоках, перевязочных, манипуляционных, стерилизационных, палатах интенсивной терапии должны использоваться ДС, обладающие бактерицидной, вирулицидной и фунгицидной активностью.
7.5. Текущие уборки в помещениях проводят по режимам, обеспечивающим гибель бактериальной микрофлоры; при появлении в стационаре ИСМП — по режиму, эффективному в отношении возбудителя соответствующей инфекции.
7.6. При проведении заключительной дезинфекции следует применять средства с широким спектром антимикробного действия, обладающие бактерицидным, вирулицидным (при необходимости спороцидным действием).
7.7. При выборе средств для дезинфекции, предстерилизационной очистки и стерилизации медицинских изделий следует руководствоваться положениями разделов 3 – 6 и пунктов 6.19 − 6.36 настоящих клинических рекомендаций.
8. Рекомендации по выбору химических средств дезинфекции и стерилизации для медицинских организаций акушерского профиля
8.1. Для текущих уборок (профилактическая дезинфекция при отсутствии ИСМП) используют ДС средства по режимам, обеспечивающим гибель бактерий. Для текущих уборок при наличии ИСМП используют ДС по режимам, обеспечивающим гибель возбудителя соответствующей инфекции.
8.2. При дезинфекции объектов, загрязненных кровью и другими биологическими субстратами, представляющими опасность в распространении парентеральных вирусных гепатитов и ВИЧ-инфекции, следует применять ДС по противовирусному режиму.
8.3. Для генеральных уборок в операционных блоках, родильных залах, перевязочных, процедурных, манипуляционных, стерилизационных выбирают ДС с широким спектром антимикробного действия и проводят по режимам, обеспечивающим гибель бактерий, вирусов и грибов рода Candida.
8.4. Для генеральных уборок в палатных отделениях, врачебных кабинетах, административно-хозяйственных помещениях, отделениях и кабинетах физиотерапии, функциональной диагностики и др. выбирают ДС и режимы дезинфекции, эффективные в отношении бактерий.
8.5. Для текущей дезинфекции пеленальных столов, весов и всего оборудования, используемого при оказании первичной помощи новорожденным, должны применяться ДС, обладающие бактерицидной, вирулицидной и фунгицидной активностью.
8.6. Для дезинфекции кувезов выбирают средства, обладающие бактерицидным, вирулицидным (в отношении устойчивых к дезинфектантам вирусов) и фунгицидным (в отношении грибов рода Candida) действием, в инструкциях по применению которых есть соответствующие рекомендации. Они не должны оказывать повреждающего действия на материалы кувеза.
Не выбирают средства, содержащие альдегиды, хлорактивные соединения, производные фенола.
8.7. При выборе средств для дезинфекции, предстерилизационной очистки и стерилизации медицинских изделий следует руководствоваться положениями разделов 3 – 6 и пунктов 6.19 − 6.36 настоящих клинических рекомендаций.
9. Рекомендации по выбору химических средств дезинфекции и стерилизации для медицинских организаций стоматологического профиля
9.1. Для генеральной уборки в операционном блоке, хирургическом кабинете, стерилизационной выбирают ДС, обладающие широким спектром антимикробного (вирулицидное, бактерицидное, фунгицидное — с активностью в отношении грибов рода Сandida) действия и применяют по режимам, эффективным в отношении вирусов и грибов рода Сandida). . В медицинских организациях фтизиатрического профиля для генеральных уборок вышеуказанных помещений должны использоваться ДС, обладающие туберкулоцидной активностью.
9.2. В остальных помещениях медицинской организации стоматологического профиля используют ДС по режимам, эффективным в отношении бактерий.
9.3. Для дезинфекции поверхностей предметов, находящихся в зоне лечения (столик для инструментов, кнопки управления, клавиатура, воздушный пистолет, светильник, подголовник и подлокотники стоматологического кресла) должны использоваться ДС, обладающие бактерицидной, вирулицидной и фунгицидной активностью. В медицинских организациях фтизиатрического профиля для дезинфекции в стоматологических кабинетах выбирают ДС, обладающими туберкулоцидной активностью.
9.4. Для обработки вращающихся стоматологических инструментов выбирают только специальные дезинфицирующие и чистящие средства с учетом рекомендаций производителей этих инструментов.
9.5. Для дезинфекции стоматологических оттисков, зубопротезных заготовок, зубных протезов и др., стоматологических отсасывающих систем, слюноотсосов и плевательниц выбирают средства, обладающие широким спектром антимикробного (вирулицидное, бактерицидное и фунгицидное − с активностью в отношении грибов рода Candida) действия.
Выбор режимов дезинфекции проводят по наиболее устойчивым микроорганизмам − между вирусами и грибами рода Candida (во фтизиатрических медицинских организациях − по микобактериям туберкулеза). При этом следует учитывать вид материала, из которого изготовлено конкретное изделие. Во избежание нарушения работы стоматологических отсасывающих систем выбирают средства с низким пенообразованием.
9.6. При выборе средств для дезинфекции, предстерилизационной очистки и стерилизации медицинских изделий следует руководствоваться также положениями разделов 3 – 6 и пунктов 6.9 − 6.36 настоящих клинических рекомендаций.
10. Рекомендации по выбору химических средств для обеззараживания воздуха
Для обеззараживания воздуха выбирают химические ДС, зарегистрированные в установленном порядке, и имеющие утвержденные режимы и технологию применения в виде аэрозолей, получаемых с помощью специальной распыливающей аппаратуры. Обработку проводят только в отсутствие пациентов.
11. Рекомендации по выбору химических средств для обеззараживания систем вентиляции и кондиционирования воздуха
11.1. Для обеззараживания систем вентиляции и кондиционирования воздуха следует использовать только те ДС, которые зарегистрированы в установленном порядке и в инструкциях по применению которых имеются утвержденные режимы и технология проведения работ. Кроме того, необходимо учитывать соответствующие рекомендации производителей систем вентиляции и кондиционирования воздуха.
11.2. Для дезинфекции систем кондиционирования должны использоваться средства, обладающие бактерицидной (в т.ч. в отношении легионелл), вирулицидной и фунгицидной активностью.
Приложение 1 (справочное)
Перечень ДВ, входящих в состав средств дезинфекции, предстерилизационной очистки и стерилизации, зарегистрированных в Российской Федерации
1. 1,1-бифенил-2-ол
2. 1,3-Бутандиол (альфа-метилтриметиленгликоль, бетта-бутиленгликоль)
3. 1,3-дихлор 5,5-диметилгидантион
4. 2-Бифенилол (о-Фенилфенол, 2-Фенифенол)
5. 2-н-октил-4-изотиазолин-3-он
6. 2-фенилфенол
7. 2-феноксиэтанол
8. 4-хлор-3-метилфенол
9. 5-хлор-2-гидроксидифенилметан
10. N,N-бис(3-аминопропил)додециламин (триамин, додецилпропилен триамин)
11. N-децил-N-изононил-N—N-диметиламмония хлорид
12. N-оксидN,N-ди/2-гидроксиэтиленалкилоамин
13. Алкидиметилэтиламмоний метилсульфат
14. Алкилдиметилбензиламмоний хлорид (синонимы: бензалкония хлорид, дельтамин, катамин АБ)
15. Алкилдиметилэтилбензиламмоний хлорид
16. Альфа-амилаза
17. Ацетатная соль алкилдиамина
18. Бензосульфохлорамид натрия (тригидрат М-хлорбензолсульфонамида натрия, хлорамин Б)
19. Бензалконий хлорид
20. Бутилдигликоль
21. Гидроксид натрия
22. Гидроксид калия
23. Гипохлорит кальция
24. Гипохлорит лития
25. Гипохлорит натрия
26. Глиоксаль
27. Глюкопротамин
28. Глутаровый альдегид
29. Диальдегид янтарной кислоты
30. Дидецилдиметиламмоний хлорид
31. Дидецилдиметиламмоний бромид с мочевиной (клатрат ЧАС с карбамидом)
32. Дидецилметилполи(оксиэтил)аммоний пропионат
33. Дизобутилфеноксиэтилдиметилбензилхлорид аммония
34. Диметил-2-гидроксипропиламмоний хлорид
35. Диметокситетрагидрофуран
36. Диоксид хлора
37. Диоксилдиметиламмоний хлорид
38. Диоктилдиметиламмоний хлорид
39. Изононилдецилдиметиламмоний хлорид
40. Ионы серебра
41. Йод кристалический
42. Калия йодид
43. Калия перманганат
44. Карбонат натрия
45. Кокобензилдиметиламмоний хлорид
46. Кокоалкилдиметилбензиламмоний хлорид
47. Метилизотиазолон
48. Метилхлоризотиазолон
49. Мецетроний этилсульфат
50. Молочная кислота
51. Монобромуксусная кислота
52. Муравьиная кислота
53. Надмуравьиновая кислота
54. Надуксусная кислота
55. Натриевая соль дихлоризоциануровой кислоты (Na-соль ДХЦК, натрий дихлоризоцианурат)
56. Натриевая соль о-фенилфенола
57. Натриевая соль трихлоризоциануровой кислоты (Na-соль ТХЦК)
58. Оксилдецилдиметиламмоний хлорид
59. Октенидин гидрохлорид
60. Октенидин дигидрохлорид
61. Октилдецилдиметиламмоний хлорид
62. Ортофталевый альдегид
63. Перборат натрия
64. Перекись водорода
65. Перкарбонат натрия
66. Пероксигидрат мочевины
67. Пероксогидрат фторида калия
68. Пероксимоносульфат калия
69. Повидон йода
70. Полигексаметиленбигуанидин гидрохлорид
71. Полигексаметиленгуанидин гидрохлорид
72. Полигексаметиленгуанидин фосфат
73. Протеаза
74. Профлавин ацетат
75. Салициловая кислота
76. Сорбиновая кислота
77. Спирт изопропиловый (2-пропанол, изопропанол)
78. Спирт пропиловый (1-пропанол, N-пропанол)
79. Спирт этиловый (этанол)
80. Спирт этиловый денатурированный
81. Субтилизин
82. Сульфат натрия
83. Тетраацетилэтилендиамин
84. Тетранатриевая соль этилендиаминтетрауксусной кислоты
85. Тетранил У (ундециленамидопропилтримониум метосульфат)
86. Триклозан (2,4,4-трихлоро-2-гидрооксидифениловый эфир)
87. Триэтаноламин
88. Уксусная кислота
89. Ундециловая кислота
90. Феноксипропанол
91. Формальдегид
92. Фосфорная кислота
93. Хлоргексидин биглюконат
94. Хлоргексидин
95. Хлорит натрия
96. Цетрилтриметиламмоний хлорид
97. Цетримоний хлорид (гексадецилтриметиламмоний хлорид)
98. Цетилпиридиния хлорид
99. Этилендиамин тетрауксусная кислота
100. Этоксилат высшего спирта
101. Янтарная кислота
102. Янтарный альдегид
Приложение 2 (справочное)
Патогенные вирусы, эпидемиологически значимые для медицинских организаций
|
Семейство |
Представители |
Нуклеиновая кислота |
Внешняя оболочка |
|
РНК-содержащие вирусы |
|||
|
Пикорнавирусы |
Вирус полиомиелита. |
РНК |
Нет |
|
Вирусы Коксаки. |
|||
|
ЕСНО-вирусы. |
|||
|
Риновирусы. |
|||
|
Вирус гепатита А |
|||
|
Калицивирусы |
Вирус Норфолк. |
РНК |
Нет |
|
Вирус гепатита Е |
|||
|
Тогавирусы |
Вирус краснухи. |
РНК |
Есть |
|
Флавивирусы |
Вирус желтой лихорадки. |
РНК |
Есть |
|
Вирусы Денге. |
|||
|
Вирус энцефалита Сент-Луис |
|||
|
Вирус гепатита С |
|||
|
Вирус гепатита G |
|||
|
Коронавирусы |
Коронавирусы |
РНК |
Есть |
|
Рабдовирусы |
Вирус бешенства. |
РНК |
Есть |
|
Вирус везикулярного стоматита |
|||
|
Филовирусы |
Вирус Марбург. |
РНК |
Есть |
|
Вирусы Эбола |
|||
|
Парамиксовирусы |
Вирусы парагриппа. |
РНК |
Есть |
|
Респираторно — синцитиальный вирус |
|||
|
Вирус ньюкаслской болезни. |
|||
|
Вирус эпидемического паротита |
|||
|
Вирус кори |
|||
|
Ортомиксовирусы |
Вирусы гриппа А, В и С |
РНК |
Есть |
|
Буньявирусы |
Хантавирусы |
РНК |
Есть |
|
Вирус калифорнийского энцефалита |
|||
|
Вирус сицилийской лихорадки |
|||
|
Вирус неаполитанской лихорадки |
|||
|
Аренавирусы |
Вирус лимфоцитарного хориоменингита |
РНК |
Есть |
|
Вирус Ласса |
|||
|
Вирусы южноамериканских геморрагических лихорадок |
|||
|
Реовирусы |
Ротавирусы. |
РНК |
Нет |
|
Реовирусы |
|||
|
Вирус колорадской клещевой лихорадки |
|||
|
Ретровирусы |
ВИЧ-1 и ВИЧ-2 |
РНК |
Есть |
|
Т-лимфотропные вирусы человека типов 1 и 2 |
|||
|
ДНК-содержащие вирусы |
|||
|
Гепаднавирусы |
Вирус гепатита В |
ДНК |
Есть |
|
Парвовирусы |
Парвовирус В19 |
ДНК |
Нет |
|
Паповавирусы |
Вирус папилломы человека. |
ДНК |
Нет |
|
Вирус JC. |
|||
|
Вирус ВК |
|||
|
Аденовирусы |
Аденовирусы человека |
ДНК |
|
|
Герпесвирусы |
Вирусы простого герпеса типов 1 и 2а |
ДНК |
Есть |
|
Вирус varicella-zosterб |
|||
|
Вирус Эпштейна—Баррв |
|||
|
Цитомегаловирусг |
|||
|
Герпесвирусы человека типов 6, 7, 8 |
|||
|
Поксвирусы |
Вирус натуральной оспы |
ДНК |
Есть |
|
Вирус контагиозного пустулезного дерматита |
|||
|
Вирус контагиозного моллюска |
а Другое название — герпесвирусы человека типов 1 и 2.
б Другое название — герпесвирус человека типа 3.
в.Другое название – герпесвирус человека типа 4.
г Другое название – герпесвирус человека типа 5.
Использованные нормативные и методические документы
1. Использование ультрафиолетового бактерицидного излучения для обеззараживания воздуха в помещениях. Руководство Р 3.5.1904-04 М., 2004, 46 с.
2. Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности: руководство Р 4.2.2643-10. – М., 2011,615 с.
3. Санитарно-эпидемиологические правила и нормативы. СанПиН 2.1.7.2790−10 «Санитарно-эпидемиологические требования к обращению с медицинскими отходами». М., 2010, 31 с.
4. Санитарно-эпидемиологические правила и нормативы. СанПиН 2.1.3.2630−10 «Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность». М., 2010, 255 с.
5. СП 3.1.1275-03 «Профилактика инфекционных заболеваний при эндоскопических манипуляциях». М., 2003,15 с.
6. СП 3.1.2659-10 «Изменения и дополнения №1 к СП 3.1.1275-03 «Профилактика инфекционных заболеваний при эндоскопических манипуляциях». М., 2010, 4 с.
7. ГОСТ 12.1.007-76 «Вредные вещества. Классификация и общие требования безопасности». М., 6 с.
8. «Методические указания по дезинфекции, предстерилизационной очистке и стерилизации изделий медицинского назначения» № МУ-287-113 от 30.12.1998 г., 67 с.
13. Очистка, дезинфекция и стерилизация эндоскопов и инструментов к ним. Методические указания МУ 3.5.1937-04. М., 2005, 22 с.
14. МУ 3.5. 2431-08 «Методические указания по изучению и оценке вирулицидной активности дезинфекционных средств». М., 2010, 39 с.
15. МУ 3.5.2435-09 «Методические указания по изучению и оценке спороцидной активности дезинфицирующих и стерилизующих средств». М..2009, 75 с.
16. МУ 3.5.2596-10 «Методы изучения и оценки туберкулоцидной активности дезинфицирующих средств». М. 2010, 54 с.
17. Методические указания. МУ 1.2.1105-02 «Оценка токсичности и опасности дезинфицирующих средств». М., 2002, 36 с.
18. Гигиенические нормативы. Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны. ГН 2.2.5.1313-03. М., 2003, 390 с.
19. Н.Ф. Измеров, И.В Саноцкий, К.К. Сидоров. Параметры токсикометрии промышленных ядов при однократном воздействии. М., 1977, 197 с.
Литература
1. Абрамова И.М. Изучение спороцидной активности глутарового альдегида и композиций на его основе // Сб. науч. трудов: Основные направления развития науки и практики дезинфекционного дела. М., 1981. − С. 46-48.
2. Абрамова И.М. Актуальные вопросы осуществления предстерилизационной очистки и стерилизации изделий медицинского назначения // Профилактическая медицина – практическому здравоохранению: Сб. науч. статей МПФ ППО ММА им. И.М. Сеченова. Вып. 3 / Под ред. Е.Н. Беляева, А.М. Большакова и Б.Л. Черкасского. – М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2007. – С. 243-246.
3. Абрамова И.М. Современные методы стерилизации медицинских изделий в аспекте профилактики внутрибольничных инфекций // Актуальные вопросы эпидемиологии инфекционных болезней: Сб. науч. трудов (вып. 
4. Абрамова И.М. Современные подходы к обработке эндоскопического оборудования в России // Клин. эндоскопия. – 2008. – № 3(16). – С. 2-5.
5. Абрамова И.М. Совершенствование средств и правил обработки эндоскопического оборудования в России // Поликлиника. – 2008. – № 4. – С. 92-94.
6. Абрамова И.М., Готье Т.М. Изучение устойчивости спорообразующих культур к растворам перекиси водорода и Дезоксона-I // Актуальные вопросы дезинфекции и стерилизации: Сб. науч. трудов. – М., 1984. – С. 40-42.
7. Абрамова И. М., Сукиасян А.Н., Копылова А.И. Спороцидная активность глутарового альдегида в зависимости от рН и температуры растворов // Вопросы дезинфекции и стерилизации: Сб. науч. трудов. – М., 1986. – С. 58-61.
8. Анисимова Л.И. Современные антисептические средства для гигиенической обработки рук медицинского персонала лечебно-профилактических учреждений // Актуальные вопросы теории и практики дезинфектологии: Материалы Всерос. науч.-практич. конф., посвящ. 75-летию НИИ дезинфектологии Роспотребнадзора; Москва, 22-23 мая 2008 г.: В 2 тт. / Под ред. М.Г. Шандалы. – М.: ИПК ИТАР-ТАСС, 2008.– Т. 1.– С. 83-84.
9. Арефьева Л.И., Дехтярева Л.Г. Евдокимова М.П. и др. ДП-2 — новая дезинфицирующая композиция //Актуальные вопросы дезинфекции и стерилизации: Сб. науч. трудов. – М., 1986. – С. 9-12.
10. Бахир В.М. Электрохимическая активация. В 2 ч. – М.: ВНИИМТ, 1992. –Ч.1. – 401с.
11. Бахир В.М., Леонов Б.И., Паничева С.А. и др. Пути создания эффективных и безопасных антимикробных средств жидких средств и эволюция общественного восприятия дезинфекционных мероприятий // Дез. дело. – 2004. – № 3. – С.44-49.
12. Брико Н.И., Вартапетова Н.В., Карпушкина А.В., Брусина Е.Б., Дементьева Л.А. Профилактика инфекций, связанных с оказанием медицинской помощи в акушерских отделениях и стационарах: Клинико-организационное руководство. 1-е изд. – М.: Институт Здоровья Семьи, 2013. – 192 с.
13. Вашков В.И. Антимикробные средства и методы дезинфекции при инфекционных заболеваниях. – М.: Медицина, 1977. –296 с.
14. Вашков В.И. Средства и методы стерилизации, применяемые в медицине. – М.: Медицина, 1973. − 176 с.
15. Вашков В.И., Комков И.П., Одинец Е.Е., Панкратов В.А. Бактерицидные свойства некоторых свободных четвертичных аммониевых оснований // Проблемы дезинфекции и стерилизации: Сб. науч. трудов – М., 1970. Вып.19. – С. 116-118.
16. Веткина И.Ф., Комаринская Л.В., Ильин И.Ю., Соловьева М.В. Современный подход к выбору дезинфицирующих средств в системе профилактики внутрибольничных инфекций (ВБИ). – «ФАРМиндекс Практик», 2005. Вып. 7. – С. 13-20
17. Внутрибольничные инфекции: Пер. с англ./ Под ред. Р.П. Венцела. – М., Медицина. –1990. –656 с.
18. Гаврилова И.А., Титов Л.П. Ультрамикроскопические различия в строении Pseudomonas aeruginosa чувствительных и резистентных к дезинфицирующим средствам на основе полигексаметиленгуанидина и четвертичных аммониевых соединений. // Весцi Нацыянальнай акадэмii навук Беларусi. Серыя медыцынскiх навук. – 2013. – № 4. – С. 13-20.
19. Герасимов В.Н., Лущиков С.Б., Бабич И.В. и др. Антимикробные и де-зинфицирующие свойства двух хлорактивных дезинфектантов: усовер-шенствованного гипохлорита натрия и двуосновной соли гипохлорита кальция. // Дез дело. – 1999. – № 4. – С. 10-18.
20. Гембицкий П.А., Воинцева И.И. Полимерный биоцидный препарат полигексаметиленгуанидин. – Запорожье: Полиграф, 1998. – 43 с.
21. Гигиена рук в здравоохранении: Под ред. Г. Кампфа. Пер с нем. К. Здоровья.−2005. – 304 с
22. Гренкова Т.А., Селькова Е.П., Алёшкин В.А. и др. Риск передачи ВИЧ и вируса гепатита С во время эндоскопических манипуляций /Эпидемиология и вакцинопрофилактика. – 2009.- № 1.- С.26-30.
23. Гренкова Т.А., Селькова Е.П., Алёшкин В.А. и др. Эпидемиологическая безопасность бронхоскопических манипуляций для пациентов и персонала в диагностических центрах противотуберкулёзных учреждений //Клиническая эндоскопия. – 2009 – №1. – С. 28 — 34.
24. Гудзь О В. Адаптационные возможности возбудителей гнойной инфекции к поверхностно-активным веществам и антисептическим средствам // Врач. дело. 1989. − № 2. − С. 105-107.
25. Гудзь О.В. Итоги и перспективы клинического применения дезинфекционных средств из группы четвертичных аммониевых соединений // Провизор. 1998. − № 12. − С. 46-48.
26. Дьяков В.В. Влияние некоторых действующих веществ на фиксирующие свойства дезинфицирующих средств, применяемых для
предстерилизационной очистки медицинских изделий // Состояние и перспективы совершенствования научного и практического обеспечения дезинфекционной деятельности в Российской Федерации: Сб. тезисов Всерос. науч.-практич. конф., 22-23 сентября 2010 г., Звенигород. – М.: Роспотребнадзор; ФГУН «НИИ дезинфектологии»; Национальная ор-ганизация дезинфекционистов, 2010. – С. 28-29.
27. Дьяков В.В, Абрамова И.М. Предстерилизационная очистка изделий медицинского назначения новыми средствами, содержащими ферменты // Актуальные вопросы теории и практики дезинфектологии: Мате-риалы Всерос. науч.-практич. конф., посвящ. 75-летию НИИ дезинфектологии Роспотребнадзора; Москва, 22-23 мая 2008 г.: В 2-х т. / Под ред. М.Г. Шандалы. – М.: ИПК ИТАР-ТАСС, 2008.– Т. 1.– С. 106-108.
28. Единые санитарно-эпидемиологические требования к товарам, подлежащим санитарно-эпидемиологическому надзору (контролю). – 4-е изд., стереотип. – М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2011. – 707 с.
29. Еремеева Н.И., Кравченко М.А., Канищев В.В. и др. Вопросы преодоления устойчивости микобактерий разных видов к дезинфицирующим средствам //Дез. дело. – 2007. – №3. – С.35-39
30. Ефимов К.М., Гембицкий П.А., Снежко А.Г. Полигуанидины − класс малотоксичных дезсредств пролонгированного действия // Дез. дело.− 2000. − № 4. − С. 32-36.
31. Канищев В.В. Отвечает ли задачам профилактики ВБИ использование в ЛПО дезсредств в режиме, рекомендуемом в отношении бактерий (кроме туберкулеза). // Дез. дело. – 2011. – №2. – С. 36-44.
32. Колосовская Е.Н., Техова И.Г. Современное состояние выбора дезинфекционных средств в лечебно-профилактических учреждениях // Клин. эпидемиология. – 2010. – № 1. – С. 13-18.
33. Красильников А.П. Справочник по антисептике. – Мн.: Выш. шк., 1995. – 367с.
34. Ланге К.Р. Поверхностно-активные вещества. Синтез, свойства, анализ, применение / К.Р. Ланге. – СПб.: Профессия, 2005. – 240 с. – [Пер. с англ. под науч. ред. Л.П. Зайченко.]
35. Лаптева Е.С., Цуцунава М.Р., Алешева Н.В. Инфекционный контроль в ЛПО: Учебно-методическое пособие. – СПб. Издательство СЗГМУ им. И.И. Мечникова, 2013. 56 с.
36. Лебедева Н.С. Бактерицидные и спороцидные свойства калиевой соли дихлоризоциануровой кислоты // Проблемы дезинфекции и стерилизации. Труды ЦНИДИ: М., 1970. – Вып. 19. – С. 135-139.
37. Левчук Н.Н., Фёдорова Л.С., Цвирова И.М., Белова А.С. Дезинфектологические подходы к выбору средств, применяемых для обеззараживания крови / Материалы IV Ежегодного Всерос. Конгресса по инфекц. болезням (Москва, 26-28 марта 2012 г.) // Инфекц. болезни. – 2012. – Т. 10, Прилож. № 1. – С. 220.
38. Лиманов В.Е., Дивинская Л.П., Путятина Т.И. и др. Синтез и антибактериальная активность ряда четвертичных аммониевых соединений на основе синтетических спиртов // Проблемы дезинфекции и стерилизации. Тр. ЦНИДИ: М., 1970. – Вып.19. – С. 119-123.
39. Лурик Б.Б., Цвирова И.М. Активация твердых перекисных соединений с целью создания бактерицидных препаратов // Основные направления дезинфекционного дела. Сб. науч. трудов − М., 1987. − С.151-154.
40. Лярский П.П., Цетлин В.М. Дезинфекция аэрозолями. М.: Медицина, 1981. – 176 с.
41. Мельникова Г.Н. Современные антисептические средства для обработки рук медицинского персонала // Дез. дело. – 2008. – № 3. – С. 60-64.
42. Мельникова Г.Н. Устойчивость к дезинфицирующим средствам микро-организмов, выделенных в гематологическом стационаре // Проблемы дезинфекции и стерилизации: Сб. науч. трудов. – М., 1984. – С.47-50.
43. Мельникова Г.Н., Абрамова И.М. Современные стерилизационные упаковки как одна из мер защиты пациентов от внутрибольничных инфекций // Внутрибольничные инфекции в стационарах различного профиля, профилактика, лечение осложнений: Тезисы докл. VII науч.-практич. конф., Москва, 2-3 апреля 2009 г. – М., 2009. – С. 48-49.
44. Мельникова Г.Н., Панин О.Г. Сравнительная устойчивость музейных штаммов спор бацилл к действию некоторых стерилизующих и дезин-фицирующих агентов // Проблемы дезинфекции и стерилизации: Сб. науч. трудов. – М., 1980. – С.46-50.
45. Мельникова Г.Н., Шестопалова Т.Н., Пантелеева Л.Г. Сравнительная оценка антимикробной активности антисептических средств для гигиенической обработки рук / Материалы VI Ежегодного Всерос. Конгресса по инфекц. болезням (Москва, 24-26 марта 2014 г.) // Инфекц. болезни. – 2014. – Т. 12, прилож. № 1. – С. 198.
46. Мерка В., Зикан В., Щита Ф. Дезинфекционные свойства некоторых перекисных соединений //Воен.-мед. журн. − 1967. − № 2. − С.46-47.
47. Морозова Н.С., Никишаев В.И., Грицай И.М. Очистка, дезинфекция, стерилизация эндоскопов и инструментов к ним. – К.: ТОВ «Бii Граф», 2006. – 72 с.
48. Опарин П.С. Гигиена больничных отходов. Иркутск: Восточно-Сибирский научный центр СО РАМН, 2001. − 176 с.
49. Осипян В.Т., Шапилов О.Д., Граменицкая В.В., Савинский Я.П. Бактерицидные и дезинфицирующие свойства некоторых ацильных гидроперекисей. // ЖМЭИ. – 1969. – № 12. – С. 126-130.
50. Основы проведения дезинфекции и стерилизации при инфекционных заболеваниях: Методические рекомендации / Сурикова Л.Е., Никонович Т.Н., Раевская И.А., Чистенко Г.Н. – Мн.: БГМУ, 2004. – 58 с.
51. Павлова И.Б., Куликовский А.В. Субмикроскопическое изучение бактерий и спор при воздействии надуксусной кислоты и некоторые аспекты механизма действия препарата // ЖМЭИ − 1978. − № 2. − С.37-41.
52. Панкратова Г.П. Токсичность и безопасность применения дезинфицирующих средств // Глав. мед. сестра. – 2007. – № 3. – С. 83-87.
53. Панкратова Г.П., Мальцева М.М., Новикова Э.А. К вопросу о безопасности применения дезинфицирующих средств в лечебно-профилактических учреждениях // Санитарно-эпидемиологическая безопасность России: актуальность проблемы, методы и средства для её решения: Тезисы докл. науч.-практич. конф. (18 октября 2006 г.) // 11-я Международная специализированная выставка «Волгаздравэкспо» (Казань, 18-20 октября 2006 г.). – Казань, 2006. – С. 50-54.
54. Пантелеева Л.Г. Дезинфектанты с вирулицидной активностью для применения в лечебно-профилактических учреждениях // Глав. мед. сестра. – 2007. – № 1. – С. 81-87.
55. Пантелеева Л.Г. Классификация дезинфицирующих средств по вирулицидной активности / Материалы II Ежегодного Всерос. Конгресса по инфекц. болезням (Москва, 29-31 марта 2010 г.) // Инфекц. болезни. – 2010. – Т. 8, прилож. № 1. – С. 236-237.
57. Пантелеева Л.Г. Обоснования выбора дезинфицирующих средств для применения в медицинских организациях // Внутрибольничные инфекции в стационарах различного профиля, профилактика, лечение осложнений: Маиериалы X науч.-практич. конф. [Тематическая выставочная экспозиция. Программа, материалы конференции, каталог участников выставки], Москва, 5-6 апреля 2012 г. – М., 2012. – С. 45-46.
58. Пантелеева Л.Г. Современные средства и методы защиты рук медицинских работников от возбудителей внутрибольничных инфекций // Мед. сестра. – 2010. – № 7. – С. 41-42.
59. Пантелеева Л.Г., Ершова О.Н., Гренкова Т.А., Селькова Е.П. Внедрение системы мер по совершенствованию гигиены рук в лечебном учреждении: Практические рекомендации. – М., 2011. – 44 с
60. Пантелеева Л.Г., Федорова Л.С., Цвирова И.М, Белова A.C. Вирулицидная, туберкулоцидная, фунгицидная активность новых средств из группы поверхностно-активных веществ // Дез. дело.−1998.− №3.− С. 16-17.
61. Профилактика внутрибольничных инфекций: Руководство для врачей / Под ред. Е.П.Ковалевой, Н.А.Семиной. − М.:ТОО “Рарогъ”. −1993. − 228 с.
62. Покровский В.И., Монисов A.A., Шандала М.Г. и др. Концепция профилактики внутрибольничных инфекций // Эпидемиология и инфекционные болезни.− 2000. − № 5. − С. 4-9.
63. Профилактическое руководство Всемирной организации гастроэнтерологов (ВОГ – OMGE). Дезинфекция в эндоскопии. – 25 с.
64. Райнбабен Ф. Основы противовирусной дезинфекции. Пер. с нем. – М.: ООО «Самарово», «Летний сад», 2014. – 525 с.
65. Рамкова Н.В., Абрамова И.М., Кареев Н.В. Стерилизация медицинских инструментов к гибким эндоскопам // Основные направления дезинфек-ционного дела. Сб. научн. трудов. − М., 1987. − С.54-57.
66. Рамкова Н.В., Абрамова М.И., Рысина Э.М. и др. Антимикробные и моющие свойства электрохимически активированных растворов, полу¬чаемых в установке » Редокс» // Проблемы дезинфекции и стерилизации. Сб. научн. трудов. − М., 1991. − С. 42-46.
67. Рекомендации АСПРЭ по выбору и применению дезинфицирующих средств – АРIС// Am. J. Infect. – 1996. − Vol. 24.− P. 313- 342.
68. Руководство ВОЗ по гигиене рук в медико-санитарной помощи (пересмотренный проект). Резюме. Чистые руки – это более безопасные руки. Всемирный альянс за безопасность пациентов.− 2006.− 31 с.
69. Руководство по инфекционному контролю в стационаре. Пер.с англ. / Под ред. Р.Венцеля, Т.Бревера, Ж-П.Бутцлера. — Смоленск: МАКМАХ, 2003. — 272 с.
70. Руководство по дезинфекции и стерилизации в медицинских учреждениях /Под ред. A. Rutala, D. J. Weber.− 2008. −170 с.
71. Руководство по медицинской вирусологии / Под ред. Д.К. Львова. — М.: Мединформагентство, 2008.− С. 312 — 317.
72. Селькова Е.П., Гренкова Т.А., Чижов А.И., Храпунова И.А. Эпидемиологические проблемы предупреждения инфекционных
заболеваний в гибкой эндоскопии // Эпидемиология и вакцинопрофилактика. – 2006. – №5. – С.36-43.
73. Соколова Н.Ф. Профилактическая дезинфекция в ЛПУ – главное направление в борьбе с внутрибольничными инфекциями // Стратегия и тактика борьбы с внутрибольничными инфекциями на современном этапе развития медицины: Материалы международного конгресса, Москва, 10-12 октября 2006 г.
74. Соколова Н.Ф. Современные проблемы организации и проведения дезинфекционных мероприятий в ЛПУ // Ремедиум Приволжье. – 2006. – № 5. – С. 40-42.
75. Соколова Н.Ф., Канищев В.В., Левчук Н.Н. и др. К вопросу об устойчивости споровых культур к дезинфицирующим средствам // Международные медико-санитарные правила и реализация глобальной стратегии борьбы с инфекционными болезнями в государствах-участниках СНГ: Материалы VIII Межгосударственной науч.-практич. конф. государств-участников СНГ, Саратов, 25-26 сентября 2007 г. / Под ред. В.В. Кутырева. – Саратов: ООО «Приволжское издательство», 2007. – С. 292-293.
76. Соколова Н.Ф., Федорова Л.С., Цвирова И.М. Бактерицидная и дезинфицирующая активность некоторых поверхностно-активных веществ и перспективы их применения для профилактики гнойно-септических заболеваний // Актуальные проблемы клинической микробиологии. − М., 1989. − С.18-20.
77. Сукиасян А.Н., Абрамова М.И. Синтез и изучение спороцидной актив¬ности препарата на основе надмалеиновой кислоты // Современные методы и средства дезинфекции и стерилизации: Сб. науч. трудов. − М., 1989.− С. 27-29.
78. Украинцев А.Д., Власов И.Г., Крашенинникова Т.К., Краснопевцева И.В., Светницкий Е.Н. Сравнительный анализ средств, применяемых для дезинфекции опасных микроорганизмов. – Химическая и биологическая безопасность. – 2005. – №6. – С. 3-25
79. Федорова Л.С. Теория и практика совершенствования дезинфицирующих средств. – М.: Медицина, 2006. – 216 с.
80. Фёдорова Л.С. Дезинфектологическая профилактика туберкулёза // Стратегия и тактика борьбы с внутрибольничными инфекциями на современном этапе развития медицины: Материалы международного конгресса, Москва, 10-12 октября 2006 г. – М., 2006. – С. 183-184.
81. Федорова Л.С., Арефьева Л.И., Панкратова Г.П. и др. Антимикробная активность, дезинфицирующие свойства и токсичность алкил (С12-С14) диметилбензиламмоний хлорида // Современные методы и средства дезинфекции и стерилизации: Сб. науч. трудов. − М., 1989. − С.17-20.
82. Фёдорова Л.С., Кожичкина Н.В. Дезинфекционные мероприятия при дерматомикозах // Материалы XI Всерос. съезда дерматовенерологов и косметологов, Екатеринбург, 9-12 ноября 2010 г. – Екатеринбург, 2010. – С. 99.
83. Фёдорова Л.С., Чернявский И.Н., Кудряшова Е.В., Никитина О.Н. Обоснование необходимости проведения дезинфекции систем вентиляции и кондиционирования воздуха / Материалы II Ежегодного Всерос. Конгресса по инфекц. болезням (Москва, 29-31 марта 2010 г.) // Инфекц. болезни. – 2010. – Т. 8, прилож. № 1. – С. 337.
84. Фёдорова Л.С., Чернявский И.Н., Мальцева М.М., Панкратова Г.П., Рысина Т.З. Эффективность и безопасность полимерных производных гуанидина при применении для дезинфекции систем вентиляции и кондиционирования воздуха // Актуальные вопросы эпидемиологии инфекционных болезней: Сб. науч. трудов / Под ред. А.А. Шапошникова и Г.В. Ющенко. – М.: ЗАО «МП “Гигиена”», 2011. – Вып. 10. – С. 771-775.
85. Цвирова И.М., Крученок Т.Е., Эпштейн А.Е. и др. Сравнительная бактерицидная активность четвертичных аммониевых солей // Химико-фармацевт. журн. – 1984. – № 10. – С. 1218-1224.
86. Чернявская М.А. Антибактериальные, мембранотропные и денатурирующие свойства препаратов на основе хлоргидрата децилового эфира глицина // Научные основы дезинфекции и стерилизации. Сб. науч. трудов. − М., 1991. − С. 38-42.
87. Чернявская М.А., Белова А.С., Стефанович В.В. Сравнительная оценка действия ЧАС на клетки кишечной палочки в зависимости от их структуры. — Проблемы дезинфекции и стерилизации. Сб. науч. трудов. − М.,1983.− С. 31-34.
88. Чубенко Г.И. Избранные вопросы дезинфекции: Учебное пособие. – Благовещенск: ГОУ ВПО АГМА, 2010. – 69 с.
89. Шалимов А.А., Грубник В.В., Ткаченко А.И и др. Инфекционный контроль в хирургии. 3-е изд., доп. и перераб. – Киев, 2001. – 121 с.
90. Шандала М. Г. Актуальные вопросы общей дезинфектологии. Избранные лекции – М.: Медицина, 2009 – 111с.
91. Шандала М.Г., Пантелеева Я.Г., Абрамова И.М. и др. Дезинфекция и стерилизация в лечебно-профилактических учреждениях // Справочник госпитального эпидемиолога. М.: Хризостом, 1999. − С. 221-272.
92. Шандала М.Г., Юзбашев В.Г., Вассерман A.JI. Использование ультрафиолетового бактерицидного излучения в борьбе с инфекционными заболеваниями // Гиг. и сан. −1999. – №-5. – С. 23-25
93. Шандала М.Г., Фёдорова Л.С., Белова А.С. Современные проблемы обеззараживания медицинских отходов // Проблемы обращения с отходами лечебно-профилактических учреждений: Сб. материалов V Междунар. конф.
(Москва, 2-5 марта 2009 г.) / Под ред. Н.В. Русакова. – М., 2009. – С. 159-160.
94. Шапилов О.Д., Костюковский Я.Л., Осипян В.Т. Получение и свойства системы окислительного действия на основе перекиси водорода и уксусного ангидрида. // ЖМЭИ. – 1971. – №2. – С. 285-290.
95. Шеина И.В., Скворцова Е.К., Тибаева В.Н. Эффективность водных растворов катионных веществ при обеззараживании поверхностей / Проблемы дезинфекции и стерилизации. Сб. науч. трудов. − М., 1980. − С.16-19.
96. Юзбашев В.Г., Абрамова И.М. Современные средства и технологии обеззараживания воздуха в лечебно-профилактических учреждениях // Актуальные вопросы теории и практики дезинфектологии: Материалы Всерос. науч.-практич. конф., посвящ. 75-летию НИИ дезинфектологии Роспотребнадзора; Москва, 22-23 мая 2008 г.: В 2 т. / Под ред. М.Г. Шандалы. – М.: ИПК ИТАР-ТАСС, 2008.– Т. 1.– С. 198-200.
97. Эпидемиологические и дезинфектологические обоснования рационального выбора методов, средств и режимов дезинфекции и стерилизации в лечебно-профилактических учреждениях. Рекомендации для медицинских работников / Сост. М.Г. Шандала, В.А. Алёшкин, Е.П. Селькова, Л.Г. Пантелеева, Н.Ф. Соколова, И.М. Абрамова, А.И. Чижов, Т.А. Гренкова. – М.: ООО «Типография Момент», 2006. – 39 с.
98. Armstrong J. A., Erochlich E.J. Inactivation of virus by benzalconium chloride // J. Appl. Microbiol.− 1964. − Vol. 12. − P. 132
99. Benzi-Cipelli R. Antimicrobial (bactericidal, sporocidal, antiviral, fungicidal and protozoacidal) activity of combination of glutaraldehyde and cotrimide // J. Med. 1984. − Vol. 82. − 5. − P. 692-707.
100. Best M, Sattar S.A., Springthorpe V.S., Kennedy M.E. Efficacies of selected disinfectants against Mycobacterium tuberculosis // J. Clin. Microbiol. − 1990.− 10.− P. 2234-2239.
101. Block S. Disinfection, sterilization, and preservation. 5th ed. / Block S. // Philadelphia, Lippincott, Williams & Wilkins, PA 19106 USA. − 2001. − 1481p.
102. Bockelmann J. and Bockelmann B. The sporocidal action of hydrogen peroxide — a literature review. Lebensneittel — Wessenschaft und Techogic. − 1972. − Bd. 5. − S.221.
103. Flemming H., Die Peresigsaure als Dеsinfektionsmittel. Ein Ubebliek. — Zbl. Bakt. Hyg., I Abt. Orig, B.,− 1984. − Bd. 179. − №2. − S. 97-111.
104. Hussaini S.N., Ruby K.P. Sporocidal activity of peracetic acid against B. anthracis spores.− Vet. Rec. −1976. − Vol. 98. − № 13. − Р. 257-259.
105. Jto K.A., Denny C.B. Brawn Ch.,K., Voo M., Seeger M. Resistance of bacterial spores to hydrogen peroxide // Food Technol.− 1973. − Bd. 27. − Р.58-66.
106. Russell A.D. Mechanisms of bacterial insusceptibility to biocides // Am. J. Infect. Control.− 2001. − Vol.29. − P. 259-61.
107. Rutala W.A., Cole E C. Antiseptics and disinfectants-safe and effective // Am. J. Infect. Control.− 1984. − Vol. 5. − P. 215-218.
108. Rutala W.A. Guidelines for selection and use of disinfectants // Am. J. Infect. Control. − 1990.− Vol.18 (2). − P. 100-116.
109. Rutala W.A. Дезинфекция, стерилизация и удаление отходов // Внутрибольничные инфекции / Пер. с англ. Ред. Р.П. Венцела. М.: Медицина, −1990.− С. 159-211.
110. Rutala W.A., Gergen M.F., Jones J.F., Weber D.J. Levels of microbial contamination on surgical instruments // Am. J. Infect. Control.− 1998. − 26. − P. 143-145.
111. Rutala W.A., Weber D.J. Infection control: the role of disinfection and sterilization // J. Hosp. Infect.− 1999. − № 43, Suppl. − P. 43-55.
112. Simpson G.D., Miller R.F., Laxton G.D., Clements W.R. Chlorine dioxide: the «ideal» biocide? // Spec. Chem.− 2000. − Vol. 20.− № 9. − P. 358-359.
113. Schaberg D.R., Rubens C.E., Alford R.N. Evolution of antimicrobial resistance and nosocomial infection // Am. J. Med.− 1981. − 70. − P. 445.
114. Sautter R.L., Maltman L.H., Zegspi R.S. Serratia marcesceus meningits associated with a contaminated benzalсonium chloride Solution // Am. J. Infect. Control. − 1984. − Vol. 5. − P.223-225.
115. Sprobig M. Peressigsaure-25 Jahre Entwieckliend und Erfarung. Mixrobielle Umwielt und antimicrobielle Mabhahmen // Schritenreiche fur Teorie und Praxis in Medizin, Pharmazie und Wirtckhaft. − Leipzig. − 1988. − Bd. II. − S.136-139.
116. Sprobig M., Mucke H. Antimicrobielle Wirkungvon Perissigsaure in gegemwart von blut. Microbielle Umwelt und antimicrobielle Mabhahmen // Schritenreiche fur Teorie und Praxis in Medizin, Pharmazie und Wirtshhaft. − Leipzig. −1988. − Bd II. − S.119-121.
117. Tshernjawskaja M.A., Belowa A.S. Untersuchungen zum antibakteriellen. Wirgungmechanismus von Wassersloffperoxid − Praparaten / Z. ges. Hyg. − 1990. − Bd.36 . − 2.− S.86-88.
118. Wille B. Moglichkeiten einer Resistenzentwiklung von Microorganismen gegen Desinfektionsmittel. − Zbl. Bact. Hyg., −I Abt. Orig. B. − 1976 − 162, 1-2. − S. 217-220.



