
В. А. Исаков, Е. И. Архипова, Д. В. Исаков
ГЕРПЕСВИРУСНЫЕ
ИНФЕКЦИИ
ЧЕЛОВЕКА
Руководство для врачей
2-е издание, переработанное и дополненное
Санкт-Петербург СпецЛит
2013
УДК 616 018.1 095:578.245 078 И85
Ре ц е н з е н т ы:
Ю.В. Лобзин — заслуженный деятель науки РФ, академик РАМН, профессор, директор ФГУ НИИ детских инфекций федерального медико биологического агентства;
Г. С. Архипов — доктор медицинских наук, профессор, заведующий кафедрой микробиологии, иммунологии и инфекционных болезней ИМО Новгородского государственного университета им. Ярослава Мудрого, заслуженный работник высшей школы
Исаков В. А., Архипова Е. И., Исаков Д. В.
И85 Герпеcвирусные инфекции человека : руководство для врачей / под ред. В. А. Исакова. — СПб. : СпецЛит, 2013. — 2 е изд., перераб. и доп. — 670 с. : ил. — ISBN 978 5 299 00454 0
Isakov V. A., Arhipova E. I., Isakov D. V.
Herpesviral infections in human (2nd edition, revised and enlarged): Guidelines for physicians. — Saint Petersburg : SpecLit, 2013. — 670 pp.
В книге освещены вопросы эпидемиологии, иммунопатогенеза и патомор фологии, клинической картины и лабораторной диагностики, основные прин ципы комплексной терапии и профилактики больных герпесвирусными ин фекциями (в том числе генитальным герпесом, офтальмогерпесом) с пораже нием различных органов и систем. Подробно изложены вопросы влияния герпетической инфекции на беременность, плод и новорожденного, тактика ве дения беременных с герпесом. Изложены особенности клиники и лечения, классификация простого герпеса у лиц с иммунодефицитными состояниями. Дана информация о новых противовирусных, иммунотропных средствах и вак цинах, применяемых для лечении больных герпесвирусными инфекциями. По казана эффективность системной энзимотерапии в комплексном лечении ви русно бактериальных инфекций урогенитального тракта.
Руководство предназначено для акушеров гинекологов, дерматовенероло гов, инфекционистов, офтальмологов, педиатров, терапевтов, клинических им мунологов и вирусологов, научных сотрудников, врачей общей практики, аспи рантов, клинических ординаторов, интернов и студентов медицинских вузов.
Current guidelines highlights aspects of epidemiology, immunopathogenesis and pathomorphology, clinical picture, laboratory diagnostics, basics of combined therapy and prophylaxis in patients with herpesviral diseases (including genital her pes, ophthalmic herpes) developed in different organs and systems of the body. Issu es connected to effects of herpesviral infection on gestation course, fetus and ne wborn children as well as maintenance of pregnant women are described in detail. Specifics of clinical picture, treatment, classification of HSV infection in patients with immunocompromised conditions were paid special attention in the text of the guidelines. In addition, novel antivirals, immunotropic medicines and vaccines appli ed for treatment of patients with herpesviral infections are addressed. Finally, effica cy of systemic enzyme therapy applied for combined treatment of mixed viral bacte rial infections of urogenital tract was discussed.
For Ob/Gyn, dermatovenerologits, infectiologists, oculists, general practitio ners, clinical immunologists and virologists, scientific researchers, PhD students, re sidents, interns and medical students.
УДК 616 018.1 095:578.245 078
|
ISBN 978 5 299 00454 0 |
♥ ООО «Издательство „СпецЛит“», 2011 |
|
ОГЛАВЛЕНИЕ |
|
|
Условные сокращения . . . . . |
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6 |
|
Предисловие (Ершов Ф. И.) . |
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 12 |
|
Введение . . . . . . . . . . . . . . . |
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 15 |
Глава 1. Этиология. Характеристика герпеcвирусов (Исаков В. А., Архи
пова Е. И., Исаков Д. В.) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 17 1.1. Классификация вирусов герпеса. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 17 1.2. Структура вирусов герпеса . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 21 1.3. Характеристика представителей семейства герпесвирусов . . . . . . . . . 23 Литература . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 34
Глава 2. Эпидемиология герпеcвирусных инфекций (Архипова Е. И.,
Исаков В. А., Калугина М. Ю., Исаков Д. В.) . . . . . . . . . . . . . . . . . . . 35 2.1. Источник герпетической инфекции и механизмы ее передачи. . . . . . 35 2.2. Восприимчивость человека к герпетической инфекции и показатели
заболеваемости . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 37 Литература . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 49
Глава 3. Патогенез и иммунология герпеcвирусных инфекций
(Исаков Д. В., Исаков В. А., Архипова Е. И.) . . . . . . . . . . . . . . . . . . . 50 3.1. Механизмы репродукции вирусов герпеса. . . . . . . . . . . . . . . . . . . . . . 50 3.2. Цитомегаловирусная инфекция . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 55 3.3. Вирус ветряной оспы — опоясывающего герпеса . . . . . . . . . . . . . . . . 57 3.4. Новые сведения об иммунопатогенезе герпеcвирусных инфекций. . . 59 3.5. Молекулярные механизмы уклонения вирусов от иммунной атаки. . 71 3.6. Молекулярные механизмы модуляции активности естественных кил
леров вирусами. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 81 Литература . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 86
Глава 4. Лабораторная диагностика герпесвирусных инфекций (Исаков В. А., Смирнова Т. С., Исаков Д. В., Волчек И. В.) . . . . . . . . 87
4.1. Современные методы диагностики герпесвирусных инфекций . . . . . 87 4.2. Новые технологии лабораторной диагностики вирусных и бактери
альных инфекций . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 105 4.2.1. Диагностика TORCH инфекций (Дробченко С. Н., Савичева А. М.,
Шипицына Е. В., Шалепо К. В, Ткаченко С. Б.) . . . . . . . . . . . . . . . . 105
4.2.2.Тест системы ЗАО «ЭКОлаб» для диагностики простого герпеса и цитомегаловирусной инфекции (Марданлы С. Г., Николаева Е. Г.) 108
4.3.Персонализированная терапия урогенитальных инфекций (Вол
чек И. В., Петров А. С., Исаков В. А.) . . . . . . . . . . . . . . . . . . . . . . . . . . 118 4.4. Применение проточной цитофлуорометрии для оценки фагоцитарной
активности нейтрофилов (Акинфиева О. В., Бубнова Л. Н.) . . . . . . . . . . . 126
4.5.Лабораторная диагностика ЦМВ инфекции у реципиентов почечного транс плантата (Гаранжа Т. А., Суворова П. А., Мосешвили Э. Г., Тихо
миров Д. С., Туполева Т. А., Пурло Н. В., Бирюкова Л. С., Филатов Ф. П.). . . 127
4.6.Клинико этиологические особенности моно и смешанных микоплаз менных инфекций урогенитального тракта (Егоров А. А., Стуколки
на Н. Е., Федюра И. Ф., Волков А. В., Чеботкевич В. Н.) . . . . . . . . . . . . . 129 4.7. Рекомендации по забору и транспортировке образцов клинического
материала . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 135 4.8. Основные коммерческие тест системы для диагностики герпесвирус
ных инфекций. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 137 Литература . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 139
3
Глава 5. Клинические проявления герпеcвирусных инфекций (Исаков В. А., Архипова Е. И., Исаков Д. В., Корягин В. Н., Калугина М. Ю., Сизова Н. В., Яковлев А. А., Анищик В. А.) . . . . . . . . . . . . . . . . . . . . 140
5.1. Инфекции, обусловленные вирусами простого герпеса . . . . . . . . . . . 142 5.2. Клиника герпеcвирусных инфекций . . . . . . . . . . . . . . . . . . . . . . . . . . 165 5.3. Опоясывающий герпес . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 174 5.4. ВЭБ инфекция . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 179 5.5. Инфекция ВГЧ 6 и ВГЧ 7 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 189 5.6. Инфекция, ассоциированная с ВГЧ 8 . . . . . . . . . . . . . . . . . . . . . . . . . 202
5.7.Мезенхимальная дисплазия, остеохондроз позвоночника и герпети ческая инфекция. Новый взгляд на этиопатогенез клапанных поро
ков сердца (Митрофанова Л. Б., Митрофанов Н. А.) . . . . . . . . . . . . . 205 5.8. Урогенитальный герпес . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 209
5.8.1. Клинико иммунологическая характеристика рецидивирующего генитального герпеса . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 209 5.8.2. Инаппарантные (бессимптомные) формы генитального гер песа . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 214 5.8.3. Клинико иммунологические особенности атипично протекаю щей герпетической инфекции при невынашивании в первом триме
стре беременности . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 220 Литература . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 226
Глава 6. Герпетическая инфекция глаз (офтальмогерпес) (Мошетова Л. К., Чернакова Г. М.) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 229
6.1. Патогенез офтальмогерпеса . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 229 6.2. Клинические формы офтальмогерпеса . . . . . . . . . . . . . . . . . . . . . . . . 231 6.3. Лечение офтальмогерпеса. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 233 Литература . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 239
Глава 7. Герпесвирусы и репродуктивное здоровье человека (Исаков В. А., Кущ А. А., Науменко В. А., Ярославский В. К.) . . . . . . . . . . . . . . . . . 239
7.1. Значение герпесвирусов в этиологии бесплодия (Кущ А. А., Наумен ко В. А.). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 239
7.1.1. Герпесвирусы и мужское бесплодие. . . . . . . . . . . . . . . . . . . . . . 240 7.1.2. Роль мужского фактора в вертикальной передаче герпесви русов . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 252
7.1.3. Герпесвирусы и женское бесплодие . . . . . . . . . . . . . . . . . . . . . 259 7.2. Герпеcвирусы и беременность . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 268 Литература . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 288
Глава 8. Герпес у лиц со сниженным иммунным статусом (Исаков В. А., Исаков Д. В., Аспель Ю. В.) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 292
8.1. Герпес у ВИЧ инфицированных и больных СПИДом . . . . . . . . . . . . 292 8.2. Герпес у онкогематологических больных . . . . . . . . . . . . . . . . . . . . . . . 314 8.3. Особенности герпетической инфекции у больных гриппом и ОРЗ . . 327 Литература . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 333
Глава 9. Лечение герпесвирусных инфекций (Исаков В. А., Ермоленко Д. К., Исаков Д. В.) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 335
9.1. Общие принципы терапии вирусных инфекций . . . . . . . . . . . . . . . . . 335 9.2. Этапное лечение и диспансеризация больных рецидивирующим
герпесом . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 339
4
9.3. Эффективность комплексной терапии тяжелых форм ГГ с монотон ным типом рецидивирования. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 352
9.4. Терапия генитального герпеса у беременных . . . . . . . . . . . . . . . . . . . 358 9.5. Лечение герпеса у лиц со сниженным иммунным статусом . . . . . . . . 367 9.6. Терапия опоясывающего герпеса и синдрома постгерпетической
невралгии . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 375 9.7. Лечение бактериальных инфекций, сопутствующих генитальному
герпесу . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 385 9.7.1. Клинико иммунологическая характеристика больных с вирус но бактериальными инфекциями УГТ . . . . . . . . . . . . . . . . . . . . . . . . 389 9.7.2. Общие рекомендации при лечении больных урогенитальным хламидиозом. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 395 9.7.3. Общие рекомендации при лечении гарднереллеза, микоплаз моза (уреаплазмоза) и трихомониаза . . . . . . . . . . . . . . . . . . . . . . . . . 407
9.8. Этиотропная терапия хронического урогенитального хламидиоза . . 410 Литература . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 418
Глава 10. Системная энзимотерапия в комплексном лечении урогениталь ных инфекций (Стернин Ю. И., Исаков В. А.) . . . . . . . . . . . . . . . . 421
10.1. Препараты системной энзимотерапии . . . . . . . . . . . . . . . . . . . . . . . . 421 10.2. Фармакологические свойства препаратов системной энзимотерапии . . 424 10.3. Показания и противопоказания к применению системной энзимо
терапии. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 430 10.4. Системная энзимотерапия в комплексном лечении урогенитальных
инфекций . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 437 10.5. Эффективность системной энзимотерапии в лечении опоясываю
щего герпеса. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 446 10.6. Использование системной энзимотерапии у детей и подростков для
лечения заболеваний урогенитального тракта . . . . . . . . . . . . . . . . . . 457 Литература . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 463
Глава 11. Лекарственные препараты для терапии герпесвирусных инфекций у взрослых и детей (Исаков В. А., Исаков Д. В., Лобзин С. В.,
Шишкин М. К.). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 466 11.1. Перспективы терапии герпесвирусных инфекций . . . . . . . . . . . . . . 466 11.2. Противогерпетические химиопрепараты . . . . . . . . . . . . . . . . . . . . . 472 11.3. Средства патогенетической терапии. . . . . . . . . . . . . . . . . . . . . . . . . . 509 11.4. Иммунотропные средства . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 516 11.5. Про и пребиотики . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 554
Литература . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 586
Глава 12. Индукторы интерферонов — эффективные препараты для тера пии вирусных инфекций (Исаков В. А., Коваленко А. Л.,
Исаков Д. В., Аспель Ю. В., Ермоленко Д. К.). . . . . . . . . . . . . . . . . . 588
Литература . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 638
Глава 13. Вакцинопрофилактика герпеса (Исаков В. А., Баринский И. Ф., Ермоленко Д. К., Исаков Д. В., Мордвинцева Э. Ю.) . . . . . . . . . . . . 640
Литература . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 660 Заключение . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 662
|
УСЛОВНЫЕ СОКРАЩЕНИЯ |
|
|
АГ (Ag) |
— антиген |
|
АЗЦТЛ |
— антителозависимая цитотоксичность лимфоцитов |
|
АЛ |
— алпизарин |
|
АлАТ |
— аланинаминотрансфераза |
|
АНБ |
— антитела к неструктурным белкам |
|
АО |
— антиоксидант |
|
АОА |
— антиоксидантная активность |
|
АОЗ |
— антиоксидантная защита |
|
АОТ |
— антиоксидантная терапия |
|
АПК |
— антиген презентирующие клетки |
|
АРВТ |
— антиретровирусная терапия |
|
АсАТ |
— аспартатаминотрансфераза |
|
АТ (Ab) |
— антитело |
|
АТП |
— аллогенная трансплантация почки |
|
АТФ |
— аденинтрифосфорная кислота |
|
АУФОК |
— аутотрансфузии ультрафиолетом облученной крови |
|
АФК |
— активные формы кислорода |
|
АЦ |
— ацикловир |
|
АЦ ТФ |
— ацикловиртрифосфат |
|
БАД |
— биологически активная добавка |
|
БГМ |
— бактериальный гнойный менингит |
|
БКД |
— белково клеточная диссоциация |
|
БКМ |
— быстрый культуральный метод |
|
БТ |
— базисная терапия |
|
БТШ |
— белки теплового шока |
|
ВААРТ |
— высокоактивная антиретровирусная терапия |
|
ВАЦ |
— валацикловир |
|
ВВО ОГ (ВВЗ, VZV) — вирус ветряной оспы — опоясывающего герпеса |
|
|
(вирус варицелла зостер) |
|
|
ВГ |
— вирусный гепатит |
|
ВГВ |
— вирус гепатита B |
|
ВГС |
— вирус гепатита С |
|
ВГЧ 6 (HHV 6) |
— вирус герпеса человека 6 го типа |
|
ВГЧ 7 (HHV 7) |
— вирус герпеса человека 7 го типа |
|
ВГЧ 8 (HHV |
— вирус герпеса человека 8 го типа |
|
вДНК |
— вирусная ДНК |
|
ВДП |
— верхние дыхательные пути |
|
ВЗОМТ |
— воспалительные заболевания органов малого таза |
|
ВИ |
— вирусная ( ые) инфекция ( и) |
|
ВИН |
— вторичная иммунологическая недостаточность |
|
ВИЧ (HIV) |
— вирус иммунодефицита человека |
|
ВИЭФ |
— встречный иммуноэлектрофорез |
|
ВКО |
— вирус коровьей оспы |
|
ВЛОК |
— внутрисосудистое лазерное облучение крови |
|
ВМ |
— внутрипросветная микрофлора |
|
ВО |
— ветряная оспа |
|
ВОГ |
— вирус опоясывающего герпеса |
|
ВПГ 1 (HSV 1) |
— вирус простого герпеса 1 го типа |
|
ВПГ 2 (HSV 2) |
— вирус простого герпеса 2 го типа |
|
ВПЧ (HPV) |
— вирус папилломы человека |
|
ВР |
— виролекс |
|
ВРТ |
— вспомогательные репродуктивные технологии |
|
ВСВИС |
— воспалительный синдром восстановления иммунной системы |
6
|
ВУИ |
— внутриутробная инфекция |
|
ВЭ |
— внезапная экзантема |
|
ВЭБ (EBV) |
— вирус Эпстайна — Барр (Эпштейна — Барр) |
|
ГАМК |
— гамма аминомасляная кислота |
|
ГБО |
— гипербарическая оксигенация |
|
ГВ |
— герпесвирусы |
|
ГВИ |
— герпесвирусные инфекции |
|
ГВЦ |
— герпетическая вакцина |
ГГ— генитальный герпес
|
ГИ |
— герпетическая инфекция |
|
ГК |
— герпетический кератит |
|
ГКЗ |
— генитальный кандидоз |
|
ГКС |
— глюкокортикостероиды |
|
Г КСФ |
— гранулоцитарный колониестимулирующий фактор |
|
ГМ |
— гепатомегалия |
|
ГМ КСФ |
— гранулоцитарно макрофагальный колониестимулирующий фак |
|
тор |
|
|
ГМФ |
— гуанозинмонофосфат |
|
ГОМК |
— гамма оксимасляная кислота |
|
ГП |
— генерализованный пародонтит |
|
ГС |
— герпетический стоматит |
|
ГСМ |
— гепатоспленомегалия |
|
ГТФ |
— гуанозинтрифосфат |
|
ГЦВ |
— ганцикловир |
|
ГЭ |
— герпетический энцефалит |
|
ДВС синдром |
— синдром диссеминированного внутрисосудистого свертывания |
|
ДК |
— дендритная клетка |
|
ДН |
— дыхательная недостаточность |
|
ДНК |
— дезоксирибонуклеиновая кислота |
|
ДФ |
— дифосфат |
|
дц РНК |
— двухцепочечная РНК |
|
ЕК |
— естественные киллеры |
|
ЖКТ |
— желудочно кишечный тракт |
|
ЗВ |
— зовиракс |
|
ЗШМ |
— заболевания шейки матки |
|
ИА |
— индекс авидности |
|
ИБ |
— иммуноблот |
|
ИБС |
— ишемическая болезнь сердца |
|
ИВЛ |
— искусственная вентиляция легких |
|
ИВС |
— Институт вакцин и сывороток |
|
ИГВ |
— инактивированная герпетическая вакцина |
|
ИГХИ |
— иммуногистохимическое исследование |
|
ИД |
— имунодефицит |
|
ИДС |
— иммунодефицитные состояния |
|
ИДУ |
— 5 йод 2 дезоксиуридин |
ИИ— индукторы интерферона
|
ИК |
— иммунные комплексы |
|
ИКК |
— иммунокомпетентные клетки |
|
ИКСИ |
— инъекция сперматозоида в цитоплазму яйцеклетки |
|
ИЛ (IL) |
— интерлейкин |
|
ИМ |
— инфекционный мононуклеоз |
|
ИМД |
— иммуномодуляторы |
|
ИППП |
— инфекции, передающиеся половым путем |
|
ИПХТ |
— интенсивная противоопухолевая химиотерапия |
|
ИРИ |
— иммунорегуляторный индекс |
|
ИС |
— индекс сперматогенеза |
7
|
ИССК |
— иммуносупрессивный тип саркомы Капоши |
|
ИФ |
— иммунофлюоресценция |
|
ИФА |
— иммуноферментный анализ |
|
ИФН (IFN) |
— интерферон |
|
ИФТС |
— иммуноферментные тест системы |
|
ИХП |
— ингибиторы хеликаз праймаз |
|
ИЦ |
— индекс цитотоксичности |
КК— клинический контроль
|
КОЕ |
— колониеобразующие единицы |
|
КонА |
— конканавалин А |
|
КТ |
— компьютерная томография |
|
КФС |
— креатинфосфокиназа |
|
ЛАП |
— лимфаденопатия |
|
ЛАЭЦКТ |
— локальная ауто экспресс цитокинотерапия |
|
ЛБ |
— лимфома Беркитта |
|
ЛДГ |
— лактатдегидрогеназа |
|
ЛМТ |
— лазеромагнитотерапия |
|
ЛПУ |
— лечебно профилактическое учреждение |
|
ЛТСК |
— лимфоидная ткань, связанная с кишечником |
|
ЛУ |
— лимфатический узел |
|
ЛФ |
— лактоферрин |
|
ЛХМ |
— лимфоцитарный хориоменингит |
|
ЛЦР |
— лигазная цепная реакция |
|
лЦФ |
— линимент циклоферона |
|
мАТ |
— моноклональные антитела |
|
МБК |
— многоочаговая болезнь Кастлемана |
|
МБТ |
— микобактерии туберкулеза |
|
МГ |
— молекулярная гибридизация |
|
МД |
— мезенхимальная дисплазия |
|
МИК |
— минимальное количество лактобацилл, ингибирующее рост |
|
тест культуры |
|
|
МКА |
— моноклональные антитела |
|
МКПК |
— мононуклеарные клетки периферической крови |
|
ММС |
— моноцитарно макрофагальная система |
|
МН |
— моноциты |
|
МПБ |
— мясо пептонный бульон |
|
МПД |
— межпозвоночный диск |
|
мРНК |
— матричная РНК |
|
МРТ |
— магнитно резонансная томография (томограмма) |
|
МФ |
— макрофаги |
|
МФА |
— метод флюоресцирующих антител |
|
НБ |
— нейропатическая боль |
|
НВЗ |
— неспецифические воспалительные заболевания |
|
НК (NK) |
— натуральные киллеры |
|
НП |
— нуклеотидные последовательности |
|
НПВП |
— нестероидные противовоспалительные препараты |
|
НПК |
— незрелые половые клетки |
|
НРИФ |
— непрямая реакция иммунофлюоресценции |
|
НСТ |
— нитросиний тетразолий |
|
ОАГА |
— отягощенный акушерско гинекологический анамнез |
|
ОАК |
— общий анализ крови |
|
ОАМ |
— общий анализ мочи |
|
ОГ |
— опоясывающий герпес |
|
ОЛ |
— острый лейкоз |
|
ОЛЛ |
— острый лимфобластный лейкоз |
|
ОЛС |
— опухоль лимфатической системы |
8
|
ОМЛ |
— острый миелобластный лейкоз |
|
ОНГМ |
— отек набухание головного мозга |
|
ОНМК |
— острое нарушение мозгового кровообращения |
|
ОП |
— оптическая плотность |
|
ОРВИ |
— острая респираторная вирусная инфекция |
|
ОРГ |
— орофациальный герпес |
|
ОРЗ |
— острое респираторное заболевание |
|
ОРИТ |
— отделение реанимации и интенсивной терапии |
|
ОФГ |
— офтальмогерпес |
|
ОрГ |
— орофациальный герпес |
|
ПВИ |
— папилломавирусная инфекция |
|
ПВИГ |
— папилломавирусная инфекция гениталий |
|
ПВЛ |
— первичная выпотная лимфома |
|
ПВП |
— противовирусные препараты |
|
ПГ |
— простой герпес |
|
ПГВ |
— противогерпетическая вакцина |
|
ПГЛ |
— персистирующая генерализованная лимфаденопатия |
|
ПГН |
— постгерпетическая невралгия |
|
пДК |
— плазмацитоидные дендритные клетки |
|
ПЗН |
— постзостерная невралгия |
|
ПИФ |
— прямая иммунофлюоресценция |
|
ПИЭФ |
— прямой иммуноэлектрофорез |
|
ПК |
— периферическая кровь |
|
ПМ |
— пристеночная микрофлора |
|
ПМНК |
— периферические мононуклеарные клетки |
|
ПОЛ |
— перекисное окисление липидов |
|
ПРГ |
— простой рецидивирующий герпес |
|
ПС |
— псевдотуберкулез |
|
ПЦВ |
— пенцикловир |
|
ПЦВ ТФ |
— пенцикловиртрифосфат |
|
ПЦР |
— полимеразная цепная реакция |
|
ПЦР РВ |
— полимеразная цепная реакция в реальном времени |
|
РБТЛ |
— реакция бласттрансформации лейкоцитов |
|
РГ |
— рецидивирующий герпес |
|
РГА |
— реакция гемагглютинации |
|
РГГ |
— рецидивирующий генитальный герпес |
|
РГГБИ |
— РГГ с сопутствующей бактериальной инфекцией |
|
РЗМЛ |
— реакция задержки миграции лимфоцитов |
|
РИА |
— реакция иммунной агглютинации |
|
РИФ |
— реакция иммунной флюоресценции |
|
РН |
— реакция нейтрализации |
|
РНГА |
— реакция непрямой гемагглютинации |
|
РНИФ |
— реакция непрямой иммунофлюоресценции |
|
РНК |
— рибонуклеиновая кислота |
|
РПГА |
— реакция пассивной гемагглютинации |
|
РС |
— респираторно синцитиальный |
|
РСК |
— реакция связывания комплемента |
|
РТГА |
— реакция торможения гемагглютинации |
|
РТМЛ |
— реакция торможения миграции лейкоцитов |
|
РТПХ |
— реакция «трансплантат против хозяина» |
|
РЦР |
— ранние цитокиновые реакции |
|
САБТ |
— системная антибактериальная терапия |
|
СГB |
— стрептококки группы B |
|
СИОЗС |
— селективные ингибиторы обратного захвата серотонина |
СИОЗСН — селективные ингибиторы обратного захвата серотонина и норадреналина СК — саркома Капоши
9
Книга «Герпесвирусные инфекции человека: руководство для врачей»
Автор: Исаков В. А., Архипова Е. И.
ISBN 978-5-299-00454-0
В книге освещены вопросы эпидемиологии, иммунопатогенеза и патоморфологии, клинической картины и лабораторной диагностики, основные принципы комплексной терапии и профилактики больных герпесвирусными инфекциями (в том числе генитальным герпесом, офтальмогерпесом) с поражением различных органов и систем.
Подробно изложены вопросы влияния герпетической инфекции на беременность, плод и новорожденного, тактика ведения беременных с герпесом. Изложены особенности клиники и лечения, классификация простого герпеса у лиц с иммунодефицитными состояниями.
Дана информация о новых противовирусных, иммунотропных средствах и вакцинах, применяемых для лечении больных герпесвирусными инфекциями. Показана эффективность системной энзимотерапии в комплексном лечении вирусно-бактериальных инфекций урогенитального тракта.
Руководство предназначено для акушеров-гинекологов, дерматовенерологов, инфекционистов, офтальмологов, педиатров, терапевтов, клинических иммунологов и вирусологов, научных сотрудников, врачей общей практики, аспирантов, клинических ординаторов, интернов и студентов медицинских вузов.
Содержание книги «Герпесвирусные инфекции человека: руководство для врачей» — Исаков В. А.
Глава 1. Этиология. Характеристика герпесвирусов
1.1. Классификация вирусов герпеса
1.2. Структура вирусов герпеса
1.3. Характеристика представителей семейства герпесвирусов
Глава 2. Эпидемиология герпесвирусных инфекций
2.1. Источник герпетической инфекции и механизмы ее передачи
2.2. Восприимчивость человека к герпетической инфекции и показатели заболеваемости
Глава 3. Патогенез и иммунология герпесвирусных инфекций
3.1. Механизмы репродукции вирусов герпеса
3.2. Цитомегаловирусная инфекция
3.3. Вирус ветряной оспы — опоясывающего герпеса
3.4. Новые сведения об иммунопатогенеэе герпесвирусных инфекций
3.5. Молекулярные механизмы уклонения вирусов от иммунной атаки
3.6. Молекулярные механизмы модуляции активности естественных киллеров вирусами
Глава 4. Лабораторная диагностика герпесвирусных инфекций
4.1. Современные методы диагностики герпесвирусных инфекций
4.2. Новые технологии лабораторной диагностики вирусных и бактериальных инфекций
4.2.1. Диагностика TORCH-инфекций
4.2.2. Тест-системы ЗАО «ЭКОлаб» для диагностики простого герпеса и цитомегаловирусной инфекции
4.3. Персонализированная терапия урогенитальных инфекций
4.4. Применение проточной цитофлуорометрии для оценки фагоцитарной активности нейтрофилов
4.5. Лабораторная диагностика ЦМВ-инфекции у реципиентов почечного трансплантата
4.6. Клинико-этиологические особенности моно- и смешанных микоплазменных инфекций урогенитального тракта
4.7. Рекомендации по забору и транспортировке образцов клинического материала
4.8. Основные коммерческие тест-системы для диагностики герпесвирусных инфекций
Глава 5. Клинические проявления герпесвирусных инфекций
5.1. Инфекции, обусловленные вирусами простого герпеса
5.2. Клиника герпесвирусных инфекций
5.3. Опоясывающий герпес
5.4. ВЭБ-инфекция
5.5. Инфекция ВГЧ-6 и ВГЧ-7
5.6. Инфекция, ассоциированная с ВГЧ-8
5.7. Мезенхимальная дисплазия, остеохондроз позвоночника и герпетическая инфекция. Новый взгляд на этиопатогенез клапанных пороков сердца
5.8. Урогенитальный герпес
5.8.1. Клинико-иммунологическая характеристика рецидивирующего генитального герпеса
5.8.2. Инаппарантные (бессимптомные) формы генитального герпеса
5.8.3. Клинико-иммунологические особенности атипично протекающей герпетической инфекции при невынашивании в первом триместре беременности
Глава 6. Герпетическая инфекция глаз (офтальмогерпес)
6.1. Патогенез офтальмогерпеса
6.2. Клинические формы офтальмогерпеса
6.3. Лечение офтальмогерпеса
Глава 7. Герпесвирусы и репродуктивное здоровье человека
7.1. Значение герпесвирусов в этиологии бесплодия
7.1.1. Герпесвирусы и мужское бесплодие
7.1.2. Роль мужского фактора в вертикальной передаче герпесвирусов
7.1.3. Герпесвирусы и женское бесплодие
7.2. Герпесвирусы и беременность
Глава 8. Герпес у лиц со сниженным иммунным статусом
8.1. Герпес у ВИЧ-инфицированных и больных СПИДом
8.2. Герпес у онкогематологических больных
8.3. Особенности герпетической инфекции у больных гриппом и ОРЗ
Глава 9. Лечение герпесвирусных инфекций
9.1. Общие принципы терапии вирусных инфекций
9.2. Этапное лечение и диспансеризация больных рецидивирующим герпесом
9.3. Эффективность комплексной терапии тяжелых форм ГГ с монотонным типом рецидивирования
9.4. Терапия генитального герпеса у беременных
9.5. Лечение герпеса у лиц со сниженным иммунным статусом
9.6. Терапия опоясывающего герпеса и синдрома постгерпетической невралгии
9.7. Лечение бактериальных инфекций, сопутствующих генитальному герпесу
9.7.1. Клинико-иммунологическая характеристика больных с вирусно-бактериальными инфекциями УГТ
9.7.2. Общие рекомендации при лечении больных урогенитальным хламидиозом
9.7.3. Общие рекомендации при лечении гарднереллеза, микоплазмоза (уреаплазмоза) и трихомониаза
9.8. Этиотропная терапия хронического урогенитального хламидиоза
Глава 10. Системная энзимотерапия в комплексном лечении урогенитальных инфекций
10.1. Препараты системной энзимотерапии
10.2. Фармакологические свойства препаратов системной энзимотерапии
10.3. Показания и противопоказания к применению системной энзимотерапии
10.4. Системная энзимотерапия в комплексном лечении урогенитальных инфекций
10.5. Эффективность системной энзимотерапии в лечении опоясывающего герпеса
10.6. Использование системной энзимотерапии у детей и подростков для лечения заболеваний урогенитального тракта
Глава 11. Лекарственные препараты для терапии герпесвирусных инфекций у взрослых и детей
11.1. Перспективы терапии герпесвирусных инфекций
11.2. Противогерпетические химиопрепараты
11.3. Средства патогенетической терапии
11.4. Иммунотропные средства
11.5. Про- и пребиотики
Глава 12. Индукторы интерферонов — эффективные препараты для терапии вирусных инфекций
Глава 13. Вакцинопрофилактика герпеса
Примеры страниц из книги «Герпесвирусные инфекции человека: руководство для врачей» — Исаков В. А.
Основная цель данного обзора — это освещение для врачей различных специальностей эпидемиологических и клинических особенностей, ключевых современных принципов диагностики и противовирусной терапии герпесвирусных инфекций (ГВИ).
Инфекции на протяжении всей истории человечества остаются ведущей (35%) причиной смерти, при этом ГВИ занимают после ОРВИ и гриппа второе место (15,8%), не считая ВИЧ/СПИДа[1, 3, 4, 6, 7, 11]. ГВИ рассматриваются как системные заболевания — герпетические болезни, инфекции иммунной системы. Они значительно превосходят по частоте встречаемости такие «популярные» возбудители ИППП, как ВПЧ, вирус гепатита В и ВИЧ. Около 0,03% новорожденных инфицированы вирусами простого герпеса (ПГ) и 1,5% — цитомегаловирусами, при этом в 90% случаев инфицирование происходит интранатально[10].
Множество герпес-ассоциированных заболеваний и состояний, включая невынашивание беременности, тератогенное, канцерогенное действие герпесвируса (ГВ); ассоциация с развитием иммунодефицитов и атеросклероза, а также недостаточное внимание врачей к медицинской и социальной значимости, позволяют считать ГВИ серьезной междисциплинарной проблемой здравоохранения современного человечества.
Основными факторами глобального распространения ГВИ на Земле являются многообразие путей передачи, инфицирование людей в любом возрасте, передача ГВ при отсутствии везикулезных высыпаний (в 20% случаев имеет место бессимптомное выделение ГВ, в 60% — нетипичные, нераспознанные и субклинические формы), неадекватная диагностика ГВИ вследствие их недооценки врачами, значительный клинический полиморфизм, торпидность к существующим методам лечения и отсутствие радикальной терапии и эффективной профилактики, а также несоблюдение правил контроля за излеченностью.
До настоящего времени многие врачи считают, что необязательно лечить герпес. Во внимание принимаются только ветряная оспа, инфекционный мононуклеоз, герпес зостер и тяжелые формы рецидивирующих ГВИ кожи и/или слизистых оболочек.
Описаны первичные и повторные (хронические) формы ГВИ, вызванные ГВ 1 и 2 типа (ГВ1 и ГВ2).
КЛИНИЧЕСКИЕ ФОРМЫ ПРОСТОГО ГЕРПЕСА ЧЕЛОВЕКА[1–4, 6–8, 11]
В соответствии с международной классификацией[2, 10, 12], выделяют первичный и рецидивирующий ПГ. Он может протекать типично, атипично и в форме бессимптомного выделения вируса. На долю первичного (острого) ПГ приходится до 20% всех случаев этого заболевания. Частота рецидивов зависит от типа вируса, локализации инфекции и особенностей организма (иммунитета слизистых оболочек, кожи, клеточного иммунитета). Генитальный герпес (ГГ), вызванный ГВ2, реактивируется в 2 раза чаще, рецидивирует в 8–10 раз чаще, чем обусловленный ГВ1. Герпес лица и полости рта, вызванный ГВ1, рецидивирует чаще, чем при инфицировании ГВ2.
Первичный простой герпес
Кожно-слизистый герпес
Классические формы:
- у детей — герпетический гингивостоматит (в возрасте от 6 месяцев до 3 лет), лабиальный, назальный и кожный герпес (или первичный герпес кожи), редко — кератоконъюнктивит, ГГ, энцефалит;
- у взрослых — ОРВИ, ГВ-фарингит, ГВ-тонзиллит; герпес носогубного треугольника, ГГ и анальный герпес (герпетический проктит).
Особые формы: герпес борцов, герпес кистей, герпес новорожденных, герпетическая экзема Капоши (вариолиформный пустулез, чаще наблюдается у маленьких детей, но рецидивирующие формы возможны и у взрослых), офтальмогерпес (у детей чаще связан с ГВ1, у лиц старше 16 лет — ГВ2) — конъюнктивит, блефароконъюнктивит, кератит, кератоиридоциклит, хориоретинит, увеит, периваскулит сетчатки, неврит зрительного нерва.
Другие клинические формы
- Нейрогерпес (энцефалит, асептический менингит, автономная радикулопатия).
- Висцеральный герпес (эзофагит, пневмония, гепатит и другие поражения).
- Генерализованный герпес.
- Врожденный герпес.
- Герпес у ВИЧ-инфицированных и у пациентов с другими иммунодефицитными состояниями (ИДС).
Повторный (рецидивирующий) простой герпес (1)
Типичные формы: герпес лица, гингивостоматит, ГГ, кожный герпес, герпес ягодиц, герпес кистей (герпетический панариций; при нем ГВ1 чаще выявляют у людей в возрасте до 20 лет, а ГВ2 — 20 и более лет), кератоконъюнктивит. Разновидности: геморрагический, геморрагическо-некротический, язвенный, эрозивно-язвенный, отечный, элефантиазоподобный, герпес слизистых оболочек, мигрирующий, диссеминированный, рупоидный, импетигоподобный, склеродермоподобный. Абортивные формы: зудящая, эритематозная, папулезная.
Атипичные формы (при выраженных ИДС): зостериформный ПГ, рецидивирующая герпетическая (герпетиформная) экзема Капоши — Юлиусберга, язвенно-некротическая форма ПГ на фоне тяжелых сопутствующих заболеваний.
Генерализованные формы: висцеральная (эзофагит, пневмония, менингит, энцефалит, гепатит; диссеминированная форма — поражение многих органов и систем), церебральная.
Латентная форма (синонимы — инапарантное (транзиторное), персистирующее течение). При данной форме ПГ частота носительства ГВ1 + ГВ2 составляет в различных популяциях от 0,5% до 8,0%[6, 7, 10].
Локализованная форма: энцефалит, везикулез кожи, слизистых полости рта, глаз.
Висцеральная форма (поражение легких, печени, селезенки, надпочечников): интерстициальная герпетическая пневмония, герпетический гепатит, герпетический эзофагит, герпетический очаговый нефрит и др. — при выраженных ИДС, часто с присоединением бактериальной инфекции.
Преимущественное поражение нервной системы: транзиторные неврологические изменения, кистозные полости в белом веществе лобных и теменных долей, субэпендимальные кисты, ограниченный внутриутробный энцефалит, генерализация с менингоэнцефалитом.
Медленная форма простого герпеса — подострый герпетический энцефалит.
Герпетическая острая респираторная инфекция (2)
Доля герпетической ОРВИ составляет от 5–7% до 20% всех случаев ОРВИ в любом возрасте. Клинически она малоотличима от других простуд.
При изучении динамики выделения ГВ из слюны при отсутствии герпетических высыпаний на лице было выявлено, что 7,4% образцов слюны содержали ГВ. Частота его выделения со слюной увеличивалась до 21%, если обследуемые страдали ОРВИ, и достигала 17% после стоматологических процедур. В период рецидивов герпеса губ ГВ можно обнаружить в слюне в 3 раза чаще, чем вне рецидивов.
Некоторые характеристики отдельных видов герпеса
При лабиальном (красной каймы губ или вокруг рта) и/или назальном герпесе
(преддверия и крыльев носа) (герпетическая лихорадка) в 80–90% случаев выявляют ГВ1. У детей и взрослых он проявляется появлением группирующихся везикулезных высыпаний на лице (редко — в области ушных раковин) вследствие экссудативного воспаления, сменяющихся эрозиями, корочками, временной пигментацией.
Герпес слизистых оболочек полости рта
(гингивостоматит/тонзиллит, фарингит и др.) может сопровождаться лимфаденопатией, лихорадкой, интоксикацией, болезненными эрозиями. ГВ1 при этой форме обнаруживают в 80–90%, ГВ2 — в 10–20% случаев, чаще у детей младше 3 лет и у лиц с ИДС.
ГГ и/или анальный герпес
(ГВ1 в 10–30% случаев) — это поражение полового члена, вульвы, влагалища, цервикального канала, уретры, эндометрия; перианальный герпес — промежности, крестца, ягодиц (ГВ2 в 70–90% случаев). Представляет собой везикулезные и эрозивно-язвенные высыпания, возникающие на эритематозно-отечной коже и слизистой оболочке гениталий; возможны асимптомные варианты. Клинические проявления: уретрит, простатит, аднексит, вульвовагинит, невралгия тазово-нервного сплетения, цистит.
Области поражения:
- у женщин — большие и малые половые губы (60–80%), стенки слизистой оболочки влагалища (27–38%) и шейки матки (12–88%), преддверие влагалища (27–38%), промежность (8–17%), а также ягодицы, клитор и перианальное поражение;
- у мужчин — головка полового члена (26–36%), венечная борозда (47–70%), препуциальный мешок (10–17%), области наружного и внутреннего листка крайней плоти, реже — кожа полового члена и мошонки, бедра, область губок уретры.
Женщины предъявляют жалобы на периодические тянущие боли внизу живота, в области проекции яичников, иррадиирующие в поясничную область и прямую кишку, боли в промежности. Мужчины указывают на периодически появляющиеся боли в промежности, тянущие ощущения в мошонке, в теле полового члена. В ряде случаев болевой приступ имитирует клинику «острого живота».
Герпес новорожденных в 30% случаев вызывается ГВ1, в 70% случаев — ГВ2, нередко с инфекционно-токсическим шоком. ГВ выявляется у 1,6–6,9% женщин, посещающих венерологические клиники и не страдающих ГГ. Бессимптомная форма герпеса внутренних гениталий обнаруживается у 20–40% женщин с ГГ ягодиц и бедра. Особенно важное значение имеют бессимптомные формы герпеса у женщин во время беременности. При изучении 184 случаев неонатального герпеса американские ученые установили, что лишь 22% матерей таких детей имели в анамнезе ГГ[13].
Врожденная ГВИ — инфицирование плода во время беременности при повреждении плаценты, если мать страдает ГВИ и у нее диагностирована вирусемия; возможна восходящая инфекция из гениталий матери. При врожденной ГВИ существует риск внутриутробной смерти и гибели младенца после рождения.
При инфицировании плода на ранних сроках беременности ГВИ может оказывать тератогенное влияние и приводить к умственному недоразвитию. При выздоровлении возможны остаточные явления: микроцефалия, микроофтальмия и хориоретинит. Инфицирование в I триместре беременности приводит к развитию у плода микро-, гидроцефалии, пороков сердца, ЖКТ, мочеполовой системы, скелета, к катаракте, глухоте. Инфицирование во II и III триместрах вызывает у плода гепатомегалию, спленомегалию, анемию, желтуху, гипотрофию, пневмонию, менингоэнцефалит, сепсис. Необходимо подчеркнуть, что сепсис у плода часто является причиной его антенатальной гибели.
Инфицирование восходящим путем (из шейки матки) сопровождается накоплением возбудителя в околоплодных водах и имеет следующие клинические проявления: многоводие, невынашивание беременности, задержка внутриутробного развития, отечный синдром. Поражение плода в таких случаях менее тяжелое, чем при трансплацентарной передаче ГВИ.
Герпес беременных: по результатам серологических обследований, распространенность ГВ2-инфекции среди беременных женщин составляет в Азии 8%, в Австралии — 14%, в странах Европы — 14–19%, в США — 22–36%, в России — 35%. Смертность от неонатального герпеса — 50–70%, здоровыми остаются только 15% детей. Заражение плода может произойти либо трансплацентарно в случае вирусемии у матери, либо при прохождении через инфицированные родовые пути. При трансплацентарном инфицировании в сроках до 20 недель в 34% случаев наступает самопроизвольный выкидыш, в 20–34 недели в 30% случаев наблюдаются преждевременные роды[5].
Нейрогерпес: энцефалиты, асептические менингиты, миелит, менингоэнцефалиты (в более чем 50% случаев вызываются ГВ2); невриты и полирадикулоневриты; пояснично-крестцовый радикулит (в более чем 50% случаев обусловлен ГВ1). Вовлечение в инфекционный процесс нервной системы встречается приблизительно у 30% пациентов, часто страдающих рецидивирующей формой ГГ, и нередко является единственным клиническим симптомом при ГВИ внутренних гениталий [8].
Герпетический сепсис
(диссеминированная форма ПГ) протекает с поражением кожи, слизистых оболочек, глаз, печени, головного мозга, легких, коры надпочечников; сопровождается лихорадкой, интоксикацией, синдромом диссеминированного внутрисосудистого свертывания. Летальность при нем — 80%. Встречается у лиц с тяжелой иммуносупрессией и у детей до 1 месяца, относится к ВИЧ/СПИД-индикаторным болезням.
Даже легкие и среднетяжелые формы ГВИ могут быть маркерами как иммунной дисфункции, системных заболеваний, так и одним из признаков злокачественных заболеваний, ВИЧ-инфекции, других социально-значимых болезней, определяющих качество и продолжительность жизни большого числа людей.
Клинические проявления первичной ГВИ более выражены у серонегативных, нежели у серопозитивных лиц, что свидетельствует о влиянии иммунного ответа на ГВ1, сформировавшегося в детском возрасте, на тяжесть клинических проявлений герпеса при инфицировании гениталий ГВ2. При наличии антител к ГВ1 у человека в 2 раза выше риск развития бессимптомной формы ГВ2-инфекции.
Клинические симптомы первичного ГГ развиваются лишь в 9–25% случаев[2, 7, 10]. Латентная стадия характеризуется присутствием специфических IgG против вируса (серопозитивность), хотя обычно у людей с нормальным иммунным статусом сам вирус в этот период в периферической крови при ПЦР не определяется. Активация латентного генома с возобновлением полного цикла репликации вируса может закончиться развитием продуктивной инфекции, а в определенных случаях и генерализованным процессом.
В клиническом течении ГВИ выделяют четыре этапа: пощипывания, воспаления изъязвления, струпообразования. Наиболее яркие клинические проявления характерны для первого клинического эпизода первичного ГГ. Он развивается у лиц, ранее не имевших контакта с ГВ (серонегативных), и характеризуется генитальными и экстрагенитальными поражениями. Примерно через 1–7 дней (инкубационный период) после полового контакта с инфицированным лицом у пациента в области наружных и внутренних половых органов обнаруживаются сгруппированные болезненные пузырьки. Новые высыпания могут появляться до 10-го дня от начала заболевания. Пузырьки превращаются в пустулы, которые вскрываются с образованием язв. Вокруг язв остаются сероватые корочки, покрывающие стенки пузырьков. У некоторых больных наблюдаются лихорадочное состояние, головная боль, общее недомогание. Герпетические поражения экстрагенитальных зон как результат самозаражения чаще имеют место у женщин, преимущественно на пальцах рук.
Первый клинический эпизод ГВИ развивается на фоне серопозитивности к ней. При этом симптоматика, как правило, менее интенсивна, чем при первом клиническом эпизоде первичного ГГ, но более выражена, чем при рецидивирующей форме заболевания.
Рецидивирующий ГГ наблюдается у 30–50% инфицированных. Реактивация вирусов происходит обычно в первые несколько месяцев после первичного эпизода заболевания. Рецидивирующий характер типичен для инфекции, вызванной ГВ2. В этом случае рецидивы наблюдаются чаще и в более ранние сроки, чем при инфекции, обусловленной ГВ1. В течение года рецидивы отмечают у 89% пациентов с ГВ2.
Обострения ПГ могут быть спровоцированы снижением иммунной реактивности, переохлаждением или перегревом, физической или психической травмой, интеркуррентными заболеваниями, световым или хирургическим воздействием, приемом алкоголя, гормональными циклами, медицинскими инвазивными вмешательствами. Выделение вируса при хроническом ПГ продолжается не менее 4 дней.
Клинические симптомы рецидивов в большинстве случаев менее тяжелы и продолжительны по сравнению с первым эпизодом ГГ. Вторичное ИДС при рецидивирующих формах герпеса клинически проявляется частыми ОРВИ, субфебрилитетом, лимфоаденопатией, снижением работоспособности и психоастенией. При наличии ИДС и инфицировании ГВ1 + ГВ2 увеличивается риск рака шейки матки у женщин и карциномы простаты у мужчин. Большое значение приобретает ранний атерогенез с ускоренным течением, ассоциированным с патогенным воздействием ГВ, радиационного фактора. Он ускоряет иммунное старение[6].
ДИАГНОСТИКА
Прежде всего, проблемы возникают при диагностике ПГ. Его клинические проявления многообрзны и зависят от генетической устойчивости человека к ГВ, от состояния иммунного и интерферонового статуса, нейрогуморальных факторов, локализации очага, механизма инфицирования и поражения, вирусной нагрузки, давности заболевания, возраста пациента, стадии инфекционного процесса, т. е. факторов, определяющих тяжесть, распространенность заболевания, риск развития рецидивирующих и осложненных форм.
Диагностика ПГ (первичного и рецидивирующего) включает десять этапов.
- Определение клинической картины и общеклиническое обследование.
- Сбор анамнеза (иммунологического, инфекционного, дерматологического, эпидемиологического, аллергологического).
- Осмотр врача-специалиста (дерматолога-венеролога, инфекциониста, иммунолога-аллерголога, гинеколога, уролога, педиатра, невролога, офтальмолога).
- Серологическая диагностика: анализ крови на антитела к ГВ (IgM, IgG) + госпитальный комплекс.
- Молекулярно-биологическая диагностика (ПЦР) в режиме реального времени: анализ крови, слюны, мочи, бронхосмывов, проб с элементов сыпи, с шейки матки и др. на определение ДНК ГВ. При детекции ГВ нередко проводят генотипирование c разделением на ГВ1 и ГВ2. Для диагностики необходимы, как правило, не менее двух биотопов.
- Иммуноблоттинг: обнаружение высокоспецифичных белков ГВ1, ГВ2 (gG1, gG2) для референс-диагностики ПГ (подтверждающий тест).
- Определение авидности IgG к ГВ для дифференцировки стадии инфекционного процесса.
- Определение иммунного статуса методом лазерной проточной цитофлюориметрии (фенотипирование лимфоцитов цельной венозной крови) c оценкой противовирусного врожденного и приобритенного иммунитета.
- Определение интерферонового и цитокинового статуса.
- Иммуногистохимическое исследование и иммунофлуоресцентный анализ (чаще используется при онкогематологических состояниях, в научных исследованиях).
Минимальный объем диагностики, обычный для клинической практики, — это этапы 1–5, для полной картины и при соответствующих возможностях учреждения рекомендуются этапы 1–5, 7–9, в спорных и сложных случаях и для подтверждений необходимы этапы 6 и 10.
ТЕРАПИЯ
Поиск вещества, активно подавляющего репликацию вирусной ДНК и не представляющего опасность для человека, был начат еще в 1950-е гг. До 1970-х гг. эффективных средств лечения ГВИ практически не существовало. Именно в тот период ученые начали осуществлять синтез ациклических нуклеозидов, которые нарушали процесс построения нуклеиновых кислот ГВ. Первым препаратом этой группы стал идоксуридин, затем появился видарабин.
Был разработан способ инактивации вирусной ДНК — подавление активности вирусных ферментов, обеспечивающих амплификацию ДНК. Наиболее безопасным вариантом оказались синтетические аналоги нуклеозидов герпесвирусной ДНК, которые избирательно фосфорилируются не клеткой, а вирус-специфическим ферментом тимидинкиназой. В процессе копирования вирусной ДНК эти псевдонуклеазиды встраиваются в дочерние вирусные ДНК, что приводит к генетическому дефекту или супрессии вирусной ДНК. В 1974 г. специалисты фирмы Glaxo Wellcome (Wellcome Foundation Ltd., Великобритания) совместно с соавторами разработали в США первый лечебный синтетический нуклеозид ацикловир, впоследствии успешно внедренный в клиническую практику.
В зависимости от тяжести течения и частоты рецидивов, а также с учетом этиопатогенетического принципа терапии основными видами лечения являются:
- этиотропная противовирусная терапия (ациклические нуклеозиды) — при количестве рецидивов 6 и более в год — 5–30 дней, менее 6 рецидивов в год — 1–12 месяцев;
- патогенетическая терапия (иммуномодуляторы, ИФН, вакцинация);
- заместительная терапия (Ig, ИФН);
- симптоматическая терапия (НПВП, адаптогены, антиоксиданты).
Препараты второго поколения, признанные во всем мире, — валацикловир и фамцикловир, отличающиеся большей биодоступностью и противовирусным спектром, чем ацикловир.
Механизм действия аномальных нуклеозидов (валтрекса, вектавира, фамвира, цимевена) связан с угнетением синтеза вирусной ДНК и репликации вирусов путем конкурентного ингибирования вирусной ДНК-полимеразы.
РЕКОМЕНДОВАННЫЕ СХЕМЫ ТЕРАПИИ ПРОСТОГО ГЕРПЕСА[2, 8–10]
При первичном эпизоде ПГ:
- ацикловир 200 мг 5 раз в сутки № 7–10 или 400 мг 3 раза в сутки № 7–10;
- валацикловир 500 мг или 1000 мг 2 раза в сутки № 7–10;
- фамцикловир 250 мг 3 раза в сутки № 5–10.
При рецидивирующем ПГ:
- ацикловир 200 мг 5 раз в сутки № 5–10, или 400 мг 3 раза в сутки № 5–10, или 800 мг 2–3 раза в сутки № 2–5;
- валацикловир 500 мг 2 раза в сутки № 3–5 (уровень доказательности II bA) или 500–1000 мг 1 раз в сутки № 3–5;
- фамцикловир 125 мг 2 раза в сутки № 5, или 1000 мг 2 раза в сутки № 1, или 500 мг 1 раз в сутки и 250 мг 2 раза в сутки № 2.
Пролонгированная (супрессивная) терапия ПГ:
- ацикловир 400 мг 2 раза в сутки (уровень доказательности II B);
- валацикловир 500 мг 1 раз в сутки (при частоте рецидивов < 6–10 обострений в год), 1000 мг 1 раз в сутки (при частоте рецидивов ≥ 6–10 обострений в год);
- фамцикловир 250 мг 2 раза в сутки.
Однако уместно обратить внимание на серьезный недостаток, которым обладают все без исключения ациклические нуклеозиды: по своему предназначению и механизму действия они подавляют только активно реплицирующиеся ГВ. А это значит, что даже самое эффективное разовое использование курса какого-либо химиотерапевтического препарата ни в коей мере не предотвращает возможный рецидив той же самой ГВИ или тем более новую ГВИ родственным штаммом или новым типом ГВ. Это самое серьезное ограничение существующей химиотерапии ГВИ.
Назначение иммуномодуляторов целесообразно у тех пациентов, которые находятся в пролиферативной фазе противогерпетического иммунного ответа, т. е. не раньше 21-го дня при остром герпесе и 14-го дня при рецидивах. В других фазах инфекционного процесса влияние иммуномодуляторов на специфический иммунный ответ несопоставимо мало по сравнению с прямым иммуномодулирующим эффектом самих ГВ и сопутствующим любой вирусной инфекции выбросом в гемоциркуляцию естественных цитокинов. Поэтому надежду на успех лечения следует связывать с применением специфических противогерпетических противовирусных препаратов, среди которых особое место занимает валацикловир ввиду сочетания его невысокой стоимости, клинической эффективности и удобных схем применения, а соответственно, приверженности к лечению пациентов. Эффективность ациклических нуклеозидов при ПГ за последние 20 лет подтверждена десятками миллионов случаев успешного лечения острых и хронических форм.
При микст-ГВИ целесообразно использование нуклеозидов нового поколения, среди которых также стоит особо выделить валацикловир благодаря его более высокой биодоступности, удобству применения, включая меньшую кратность, и более высокой активности в отношении сочетанной инфекции ПГ с цитомегаловирусом, вирусом Эпштейна — Барр, вирусной инфекцией и ГВИ, вызванной ГВ человека 6 типа.
ЗАКЛЮЧЕНИЕ
Препаратами первой линии при лечении острых и рецидивирующих герпесвирусных инфекций на сегодняшний день являются ациклические нуклеозиды второго поколения.
Применение иммуномодуляторов следует ограничить межрецидивными и репаративными фазами этих персистирующих заболеваний. Их, как правило, рекомендуют при среднетяжелых и тяжелых формах после клинического и лабораторно-иммунологического обследования у дерматолога-венеролога, инфекциониста, гинеколога, уролога и клинического иммунолога для подбора персонифицированной индивидуальной терапии простого герпеса с обязательным учетом частоты рецидивов и особенностей иммунного статуса.
(1) Второй тип встречается чаще, чем первый.
(2) В данном случае имеются в виду рецидивирующие ОРВИ герпесвирусной природы.
В статье рассмотрены клинические особенности и возможности терапии герпесвирусных инфекции человека. Определена эффективность валацикловира в отношении репликации вируса Эпштейна – Барр, вируса герпеса человека 6 типа, цитомегаловируса.
Введение
Герпесвирусы широко распространены в человеческой популяции и обладают большим разнообразием клинических проявлений, поражая различные органы и ткани. В настоящее время известно 8 видов герпесвирусов человека, разделенных на 3 группы: α-герпесвирусы — вирусы простого герпеса 1 и 2 типа (ВПГ-1, -2), вирус ветряной оспы (ВВО), β-герпесвирусы: цитомегаловирус (ЦМВ), вирус герпеса человека 6 типа (ВГЧ-6), ВГЧ-7 и γ-герпесвирусы: вирус Эпштейна – Барр (ВЭБ) и ВГЧ-8 [1, 2].
По данным ВОЗ, около 90% населения земного шара инфицированы одним или несколькими видами герпесвирусов. Первичное инфицирование, как правило, происходит в детском возрасте, после чего вирусы герпесгруппы переходят в латентное состояние, которое характеризуется отсутствием вирусной репликации и экспрессией вирусных белков. Реактивация герпесвирусов из латентной формы происходит на фоне транзиторных (инфекция, неблагоприятные факторы внешней среды, психоэмоциональные перегрузки, эндокринные нарушения и др.) или стойких (первичные или вторичные иммунодефициты, иммуносупрессивная терапия) иммунодефицитных состояний.
Распространенность герпесвирусов в мире и широкий клинический полиморфизм потенцируют проведение большого количества исследований в области изучения патофизиологии и иммунобиологии этой инфекции, а также поиск эффективной противовирусной терапии [1–3].
В своей практической деятельности врачи многих специальностей, в т. ч. и иммунологи, встречаются с заболеваниями, вызванными ВПГ 1 и 2 типа (лабиальный и генитальный герпес), ВВО (ветряная оспа, опоясывающий лишай), для которых разработаны и стандартизированы методы диагностики и терапии. Однако патофизиология и патоморфология хронических герпесвирусных инфекций, обусловленных β- и γ-герпесвирусами, недостаточно изучены, не разработаны четкие методы и стандарты их лечения, что создает определенные трудности в ведении таких пациентов.
Вирус Эпштейна – Барр
ВЭБ относится к семейству γ-герпесвирусов и обладает тропностью к эпителиальным клеткам верхних дыхательных путей (ВДП) и В-лимфоцитам. Входными воротами инфекции являются эпителиальные клетки и восприимчивые В-лимфоциты лимфоидной ткани ротоглотки, несущие поверхностные рецепторы для ВЭБ — молекулы CD21. Таким образом, первичная репликация вируса происходит в эпителии слизистых оболочек и лимфоидных образованиях ротоглотки (острый тонзиллофарингит). Дальнейшая генерализация инфекционного процесса обеспечивает клиническую картину инфекционного мононуклеоза (лихорадка, лимфаденопатия, гепато- и спленомегалия). После перенесенной первичной инфекции ВЭБ пожизненно персистирует в миндалинах, лимфатических узлах и В-лимфоцитах.
В литературе описаны разнообразные ассоциации ВЭБ как с опухолевыми (злокачественные лимфомы, назофарингеальная карцинома, лимфома Беркитта, болезнь Ходжкина, волосатоклеточная лейкоплакия, лимфопролиферативная болезнь — плазматическая гиперплазия, В-клеточная гиперплазия, В-клеточная лимфома, иммунобластная лимфома), так и с неопухолевыми (хроническая активная ВЭБ-инфекция (хронический мононуклеоз), летальный инфекционный мононуклеоз, вирусный гепатит, артриты, энцефалиты, миелиты, рассеянный склероз, синдром Гийена – Барре, синдром Дункана) процессами [1–4]. Однако чаще всего иммунолог в своей практике встречается с локальной реактивацией ВЭБ в области ротоглотки, что способствует снижению местного иммунитета слизистых оболочек и хронизации воспалительных процессов ВДП.
Цитомегаловирус
ЦМВ относится к семейству β-герпесвирусов. Для постнатальной цитомегаловирусной инфекции (ЦМВИ) входными воротами служат чаще всего слизистые оболочки ротоглотки и слюнные железы, где и происходит первичная репродукция вируса. Первичное инфицирование ЦМВ иммунокомпетентных лиц обычно протекает бессимптомно, лишь в 5% случаев — в виде мононуклеозоподобного синдрома (цитомегаловирусный мононуклеоз). Отличительными признаками острого процесса являются высокая лихорадка, интоксикационный синдром, сиалоаденит (чаще околоушных слюнных желез), фарингит, гепатомегалия, спленомегалия, выраженный и длительный астенический синдром. При этом для острого процесса поражение миндалин нехарактерно, увеличение регионарных лимфатических узлов отмечается редко. После разрешения первичной ЦМВИ вирус персистирует в латентном состоянии в моноцитах, эпителиальных клетках и клетках слюнных желез, которые являются резервуаром вирусных частиц.
ЦМВИ у взрослых протекает в латентной (локализованной) и генерализованной формах. Латентная форма обычно не проявляется четкими клиническими симптомами. Иногда наблюдаются легкие гриппоподобные состояния, субфебрилитет. У женщин латентно протекающая ЦМВИ может проявляться в виде повторного невынашивания беременности и мертворождения, а также в виде вульвовагинита, кольпита, цервицита, эндометрита, сальпингоофорита.
Генерализованная форма приобретенной ЦМВИ у взрослых наблюдается редко, чаще на фоне иммуносупрессии, и, безусловно, является прерогативой наблюдения инфекционистов. При этом могут поражаться желудочно-кишечный тракт (гепатит, сиалоаденит, эзофагит, гастрит, энтероколит), надпочечники (адреналит), бронхолегочная система (интерстициальная пневмония, бронхит, фиброзирующий бронхиолит, альвеолит), нервная система (энцефаловентрикулит, миелит, полирадикулопатия, полинейропатия), почки, глаза, миокард [1–3].
У иммунокомпетентных взрослых ЦМВ не поражает лимфоидную ткань, а его локальная реактивация проявляется репликацией в клетках эпителия слюнных желез, поэтому, вероятнее всего, он не играет какой-либо роли в развитии хронических воспалительных заболеваний ВДП у взрослых, характеризующихся в первую очередь поражением лимфоидных структур ротоглотки.
Вирус герпеса человека 6 типа
Еще один представитель семейства β-герпесвирусов — ВГЧ-6. Ведущий путь передачи герпесвирусной инфекции, вызванной ВГЧ-6, — воздушно-капельный. В таких случаях первичная репликация происходит в слюнных железах, лимфоидной ткани ротоглотки и шейных лимфатических узлах. Генерализация инфекции может происходить гематогенным или лимфогенным путем. Около 90% инфицированных клеток представлено Т-лимфоцитами (преимущественно CD4+), оставшаяся часть включает В-лимфоциты, моноцитарно-макрофагальные, глиальные клетки и мегакариоциты. Первичная ВГЧ-6-инфекция может протекать бессимптомно, в виде внезапной экзантемы, фебрильных или нефебрильных судорог.
На сегодняшний день считается доказанной роль ВГЧ-6 в формировании инфекционного мононуклеоза (или мононуклеозоподобного синдрома), который характеризуется непродолжительной фебрильной лихорадкой, умеренно выраженными симптомами интоксикации, умеренной лимфоаденопатией, поражением лимфоидной ткани ротоглотки (острый тонзиллит), умеренной гепатомегалией и, в половине случаев, спленомегалией, розеолоподобными высыпаниями (внезапная экзантема). В дальнейшем ВГЧ-6 переходит в латентную или персистирующую форму. Системная реактивация ВГЧ-6 чаще наблюдается у иммунокомпрометированных лиц и может приводить к развитию тяжелых органных поражений (энцефалит, пневмонит, миокардит и др.) и потенциально летальных системных поражений (вирусный сепсис) [1–3, 5].
К числу основных зон персистенции ВГЧ-6 относятся моноциты слюнных желез и лимфоидная ткань ротоглотки [2, 3, 5], поэтому реактивация хронической инфекции у иммунокомпетентных взрослых может происходить по типу мононуклеозоподобного синдрома, с воспалением слизистых оболочек и лимфоидных структур ротоглотки (тонзиллит, фарингиты). Не исключено также, что ВГЧ-6 играет определенную роль в снижении мукозального иммунитета ротоглотки и поддержании хронического воспалительного процесса на местном уровне.
Лечение герпесвирусных инфекций
В настоящее время наиболее изученными и эффективными средствами лечения инфекций, вызванных вирусами герпесгруппы, являются ациклические нуклеозиды.
Ацикловир — ациклический аналог гуанозина, впервые синтезированный в 1974 г. Ацикловир обладает in vitro специфической ингибирующей активностью против ВПГ-1, -2, ВВО, ЦМВ, ВЭБ и ВГЧ-6. Ацикловир ингибирует синтез вирусной ДНК сразу после фосфорилирования и превращения в активную форму — ацикловиртрифосфат. Первая стадия фосфорилирования требует активности вирус-специфических ферментов. Для ВПГ, ВВО и ВЭБ таким ферментом является вирусная тимидинкиназа, которая присутствует в инфицированных клетках. Частичная селективность фосфорилирования сохраняется у ЦМВ и опосредуется через продукт гена фосфотрансферазы UL97. Активация ацикловира специфическим вирусным ферментом в значительной степени объясняет его селективность. Процесс фосфорилирования ацикловира (превращение из моно- в трифосфат) завершается клеточными киназами. Ацикловиртрифосфат конкурентно ингибирует вирусную ДНК-полимеразу и, будучи аналогом нуклеозида, встраивается в вирусную ДНК, что приводит к облигатному разрыву цепи, прекращению синтеза ДНК и, следовательно, к блокированию репликации вируса. Однако биодоступность ацикловира составляет 30%.
В дальнейшем были синтезированы другие молекулы ациклических нуклеозидов — валацикловир и фамцикловир, обладающие гораздо большей биодоступностью — 54% и 77% соответственно.
Валацикловир синтезирован в 1987 г. и представляет собой L-валиновый эфир ацикловира. Эфирная «надстройка» обеспечивает более высокий уровень всасываемости перорально введенного препарата, повышая его биодоступность в 4–5 раз в сравнении с таковой ацикловира, при полном сохранении уникально высокого уровня безопасности и переносимости. Механизм действия валацикловира отличается от такового у ацикловира только на первом этапе, когда в кишечнике и печени валацикловир при помощи фермента валацикловир-гидролазы освобождается от своей эфирной «надстройки», превращаясь в ацикловир, который в дальнейшем фосфорилируется и включается в синтез дефектных герпесвирусных ДНК новых поколений [3].
В официальной инструкции к ацикловиру, валацикловиру и фамцикловиру показана их избирательная активность in vitro в отношении ВПГ, ВВО, ВЭБ, ЦМВ, а для валацикловира — и в отношении ВГЧ-6.
Как уже упоминалось, лечение инфекций, вызванных α-герпесвирусами (ВПГ-1, -2, ВВО), достаточно хорошо изучено и стандартизировано. В случае ЦМВИ лечение также хорошо изучено и в некоторой степени стандартизировано благодаря высокоспецифичному и высокоэффективному средству — ганцикловиру, еще одному аналогу ациклических нуклеозидов. Однако до настоящего времени не разработаны эффективные противовирусные стандарты для лечения других герпесвирусных инфекций.
Наибольший практический интерес представляет лечение ВЭБ-инфекции. Учитывая современные знания о структуре вириона, жизненном цикле и патогенезе ВЭБ, а также понимая механизмы фармакодинамики ациклических нуклеозидов, ученые уже много лет проводят исследования по их применению для лечения ВЭБ-инфекции. Уже в 1980-х гг. описаны попытки применять ацикловир для лечения острого инфекционного мононуклеоза, обусловленного ВЭБ. Так, ацикловир был исследован для лечения инфекционного мононуклеоза в 5 рандомизированных плацебо-контролируемых двойных слепых исследованиях (Andersson et al., 1986; Andersson et al., 1987; Pagano et al., 1983; Tynell et al., 1996; Van der Horst et al.,
1991), где применялся как в парентеральной, так и в пероральной форме, а также в комбинации с системными глюкокортикостероидами, в дозах, определенных для ВВО. Результаты исследований неоднозначны, однако в некоторых из них отмечается положительная клиническая эффективность ацикловира. Все пять исследований сообщили о вирус-супрессивном эффекте в отношении репликации ВЭБ в орофарингеальной области [6–10].
В последние годы для лечения ВЭБ-инфекции начали применять валацикловир, учитывая его большую биодоступность [11]. Так, J. H. Balfour et al. пролечили 20 студентов с симптомами инфекционного мононуклеоза и идентификацией ДНК ВЭБ в крови и ротоглоточных смывах методом полимеразной цепной реакции в реальном времени (TaqMan). Валацикловир применялся в дозе 3 г/сут в течение 14 дней. Через 2 нед. у всех пациентов выявлялось снижение репликации ВЭБ как в ротоглоточных смывах, так и в крови, а также отмечалось снижение тяжести заболевания [12].
Еще одно небольшое исследование проводилось на 19 пациентах с волосатоклеточной лейкоплакией и ВИЧ-инфекцией, у которых была обнаружена ДНК ВЭБ в ротоглотке. Пациенты получали валацикловир 1000 мг перорально каждые 8 ч в течение 28 дней. Клиническая эффективность составила 84%, также отмечалось снижение репликации ДНК ВЭБ [13].
В другом исследовании 20 мужчин-спортсменов получали валацикловир в дозе 500 мг 2 р./сут, что привело к снижению вирусной нагрузки в слюне на 82% по сравнению с плацебо [14].
В исследовании Н. Е. Vezina et al. приняли участие 8 па-
циентов с ВЭБ-обусловленным мононуклеозом, подтвержденным репликацией ВЭБ в периферической крови и смывах с ротоглотки. Они получали валацикловир в дозе 1500 мг 2 р./сут в течение 7 дней. Вирусологические и клинические ответы оценивали в течение 12 дней. Отмечено, что количество ДНК ВЭБ в пероральных смывах и в крови, а также тяжесть заболевания уменьшались во время лечения. После лечения вирусная нагрузка в ротоглотке и тяжесть болезни продолжали снижаться [15].
В исследовании Y. Hoshino et al. 45 пациентов с рецидивирующим генитальным герпесом получали вирус-
супрессивную терапию — валацикловир в дозе 500 мг 1 р./сут в течение 12 мес., также у этих пациентов измеряли уровень ДНК ВЭБ в крови каждые 3 мес. Количество ВЭБ-инфицированных В-клеток периферической крови со временем уменьшилось в группе лечения валацикловиром [16].
Эти и некоторые другие исследования эффективности ацикловира и валацикловира были проанализированы в обзорном исследовании в Кокрановском центральном регистре контролируемых испытаний, который содержит специализированный регистр группы Cochrane Acute Respiratory Infections (ARI), MEDLINE (с 1946 г. по 15 апреля 2016 г.), Embase (с 1974 г. по 15 апреля 2016 г.), CINAHL (с 1981 г. по 15 апреля 2016 г.), LILACS (с 1982 г. по 15 апреля 2016 г.) и Web of Science (с 1955 г. по 15 апреля 2016 г.). Авторами собрана и проанализирована информация во Всемирной платформе регистрации клинических испытаний Всемирной организации здравоохранения (ВОЗ) и ClinicalTrials.gov для завершенных и текущих испытаний, отмечены целесообразность и необходимость дальнейших исследований в этой
области [17].
Таким образом, попытки применения ациклических нуклеозидов в лечении β- и γ-герпесвирусных инфекций осуществляются уже давно.
Целью настоящего исследования являлось определение эффективности валацикловира в отношении репликации ВЭБ, ВГЧ-6, ЦМВ в ротоглотке у часто болеющих взрослых с хроническими воспалительными заболеваниями ВДП.
Материал и методы
В ФГБУ «ГНЦ Институт иммунологии» ФМБА России амбулаторно обследовано 80 пациентов (30 мужчин и 50 женщин в возрасте от 18 до 60 лет) с частыми рецидивами хронических воспалительных заболеваний ВДП (хронический фарингит, тонзиллит, тонзиллофарингит) вне периода обострения. Средний возраст мужчин составил 33,83±5,7 года, женщин — 34,37±6,4 года. В среднем частота обострений хронического фарингита/тонзиллита составляла не менее 5 раз в год, средний показатель по группе — 7,1±2,1 раза в год.
Критериями исключения были хронический тонзиллит токсико-аллергической формы I и II стадии, атрофическая и катаральная форма хронического фарингита, хронические риносинуситы, в т. ч. аллергической этиологии. Кроме того, в исследование не включались пациенты с множественным поверхностным или глубоким кариесом, курящие, а также женщины в период беременности или лактации.
Основными жалобами пациентов являлись дискомфорт в горле в виде першения, саднения, неловкости и/или жжения, боли при глотании («пустой глоток»), «простреливание» в ухо, ощущение крупинок на языке (пробок из миндалин), покалывание при глотании и разговоре, нерезкие болевые ощущения в области региональных лимфатических узлов и общая симптоматика (слабость, недомогание, субфебрилитет). Все указанные жалобы беспокоили пациентов преимущественно в период обострения, однако могли сохраняться и в период ремиссии, но с меньшей интенсивностью.
Для уточнения этиологической характеристики хронических воспалительных заболеваний ВДП всем пациентам вне периода обострения проводили анализ бактериальной и вирусной микрофлоры ротоглотки. Забор биоматериала для микробиологического исследования проводили стерильным тупфером для взятия мазков, собирали между дужками миндалин, по язычку и задней стенке глотки, не касаясь губ, щек и языка. Материал доставляли в лабораторию в термоконтейнерах в течение 2 ч с момента забора. Посев осуществляли на нескольких питательных средах (кровяной агар с добавлением 5% крови крупного рогатого скота (на основе колумбийского агара); уриселект; желточно-солевой агар (на основе солевого агара) и агар Сабуро). Все посевы культивировали по стандартной методике при температуре 37,0 °С в течение 24–48 ч.
Тинкториальные свойства изучали путем окраски по Граму по общепринятой методике, в соответствии с инструкцией производителя. Биохимическую идентификацию выделенных микроорганизмов осуществляли с помощью полуавтоматического бактериологического фотометра BBL Crystal AutoReader; для дрожжевых грибов использовали среду Сабуро с последующей идентификацией на хромогенном агаре, с ручной постановкой чувствительности к антимикотикам, труднокультивируемые грибы идентифицировали с помощью автоматического бактериологического анализатора Vitek 2 Compact и автоматического микробиологического анализатора BD Phoenix 100, определяли чувствительность к антимикотикам; Slidex pneumokit — сенсибилизированный латекс использовали для определения пневмококков; проводили оптохиновый тест, тест с желчью, определение каталазной активности. Гемолитическую активность культур изучали на агаре с добавлением 5% эритроцитов барана.
Вирусную нагрузку определяли в биоматериале смешанной слюны и в образцах цельной крови. Материал слюны собирался утром, натощак, в стерильные контейнеры и доставлялся в лабораторию для исследования в течение 2 ч с момента забора. Забор крови также проводился в утренние часы в день сдачи биоматериала смешанной слюны, натощак. Выявление и количественное определение ДНК ВЭБ, ВГЧ-6, ЦМВ в биоматериале проводились методом ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени с помощью прибора Applied Biosystems 7300 Real Time PCR System.
После выявления ДНК герпесвирусов и определения их вирусной нагрузки в биоматериале (образцы смешанной слюны и цельная кровь) пациенты получали препарат валацикловир по схеме 500 мг 3 р./сут в течение 14 дней. Контроль вирусной нагрузки в биоматериале оценивался после окончания лечения через 14±2 дня.
Побочные реакции при приеме исследуемого препарата оценивали согласно объективным данным и субъективным ощущениям пациента. Выраженность побочных реакций оценивали по следующей шкале: 5 баллов — не отмечается побочных эффектов; 4 балла — наблюдаются незначительные побочные эффекты, не причиняющие серьезных проблем пациенту и не требующие отмены препарата; 3 балла — отмечаются побочные эффекты, оказывающие влияние на состояние пациента, но не требующие отмены препарата; 2 балла — имеет место нежелательный побочный эффект, оказывающий значительное отрицательное влияние на состояние пациента, требующий отмены препарата; 1 балл — побочный эффект, требующий отмены препарата и применения дополнительных медицинских мероприятий.
Переносимость препарата оценивалась как лечащим врачом, так и пациентами согласно следующей шкале: 5 — очень хорошая, 4 — хорошая, 3 — удовлетворительная, 2 — плохая, 1 — очень плохая.
Статистическую обработку данных проводили с помощью пакета прикладных программ Statistica 12.0. В процессе анализа полученных данных и проверки их на нормальность распределения установлено, что данные имеют характер распределения, отличный от нормального, поэтому для статистической обработки использовали непараметрические методы. Для сравнения двух независимых групп применяли непараметрический критерий Манна — Уитни. Критическое значение уровня статистической значимости при проверке нулевых гипотез принимали равным 0,05.
Результаты
Микробный пейзаж ротоглотки обследованных пациентов представлен нормальной и условно-патогенной микрофлорой. Наибольшую долю составили грамположительные α-гемолитические стрептококки (Str. anginosus group, Str. sanguinis group, Str. viridans) — около 65% случаев, на втором месте оказался Staphylococcus aureus — в 24% случаев, в 12,2% случаев обнаружены представители β-гемолитических стрептококков группы В — Str. milleri group, грамотрицательные энтеробактерии (Pseudomonas aeruginosa, Klebsiella pneumoniae, Proteus mirabili, Serratia marcesceus) — в 6,5% случаев, Staphylococcus epidermidis — в 2,5%, Str. pneumoniae — в 1%, грамположительные палочки — в 1%. Грибковая флора (Candida albicans) встречалась в 6% случаев.
Исследование репликации герпесвирусов в смешанной слюне у пациентов показало преобладание микст-инфекции в отношении двух исследуемых вирусов — ВЭБ и ВГЧ-6 (65% случаев, 52 человека). На втором месте по частоте — моноинфекция, обусловленная ВГЧ-6 (20%, 16 человек). Только в 15% случаев (12 человек) выявлена моноинфекция, обусловленная ВЭБ. ДНК ЦМВ в слюне обследуемых пациентов не выявлялась. Также все образцы цельной крови были протестированы на наличие ДНК вирусов герпесгруппы. Ни у одного пациента репликации ДНК ВЭБ, ЦМВ и ВГЧ-6 в крови зарегистрировано не было.
Изучение вирусной нагрузки выявленных инфекций в смешанной слюне показало клинически значимые результаты — более 1000 копий ДНК (3 Lg) на 105 клеток образца. Для пациентов, имевших микст-инфекцию, средняя концентрация ВЭБ составила 4,47±0,17 Lg, копий/105 клеток, концентрация ВГЧ-6 у этих же пациентов несколько меньше и составила 3,12±0,13 Lg, копий/105 клеток. Наличие моноинфекции, обусловленной только ВЭБ, характеризовалось несколько меньшей концентрацией — в среднем 3,99±0,33 Lg, копий/105 клеток. Возможно, взаимовлияние этих двух инфекций выражается в усилении репликации ВЭБ в присутствии активной ВГЧ-6-инфекции. Вирусная нагрузка моноинфекции, обусловленной ВГЧ-6, в среднем составила 4,03±0,22 Lg, копий/105 клеток.
После лечения отмечено снижение вирусной репликации в смешанной слюне у исследуемых. Так, из 64 пациентов, у которых до лечения обнаруживалась ВЭБ-инфекция, после лечения полное подавление репликации вируса в ротоглотке отмечено у 44 пациентов (68,75%). В отношении ВГЧ-6 эти данные менее результативны — отсутствие репликации отмечено после лечения у 13 пациентов из 68 (19,2%).
Оценка вирусной нагрузки после лечения показала достоверное снижение активности ВЭБ-инфекции (подавление репликации вируса до нулевых или клинических незначимых значений). Средняя концентрация вирусной нагрузки ВЭБ по всей группе до лечения составила 3,51±0,23 Lg, копий/105 клеток. После лечения отмечено достоверное снижение концентрации ВЭБ — 0,88±0,18 Lg, копий/105 клеток (р<0,05).
Достоверные отличия по снижению концентрации ВЭБ после лечения (р<0,05) представлены на рисунке 1.
Исследование динамики вирусной нагрузки в отношении ВГЧ-6 показало другой результат. Средняя концентрация ВГЧ-6 по всей группе до лечения составила 2,84±0,17 Lg, копий/105 клеток. После курса лечения средняя концентрация ВГЧ-6 составила 2,15±0,18 Lg, копий/105 клеток и не имела достоверных отличий от показателей до лечения (рис. 2).
Анализ изменений концентрации ДНК герпесвирусов в зависимости от моно- или микст-инфекции показал высокую эффективность влияния противовирусной терапии на концентрацию ВЭБ. Так, у пациентов с ВЭБ-инфекцией в сочетании с ВГЧ-6 отмечено снижение средней вирусной нагрузки на 75% (p<0,05). В случае моноинфекции, вызванной ВЭБ, снижение активности вирусной репликации еще более значимое — на 86% (p<0,05). В отношении инфекции, вызванной ВГЧ-6, эти изменения недостоверны: при моноинфекции и микст-инфекции — на 27% и 23% соответственно (рис. 3).
За время проведения исследования не было отмечено нежелательных явлений, связанных с назначением валацикловира, требующих прерывания или прекращения терапии. Большинство пациентов оценили переносимость препарата как «хорошую» и «очень хорошую».
Таким образом, валацикловир показал хорошую переносимость у пациентов с реактивацией герпесвирусной инфекции в ротоглотке. Также продемонстрирована клиническая эффективность терапии валацикловиром в виде выраженного снижения вирусной нагрузки ДНК ВЭБ в ротоглотке у пациентов с частыми обострениями воспалительных заболеваний ВДП (часто болеющих взрослых).
Обсуждение
Первичная герпесвирусная инфекция, обусловленная ВЭБ, ЦМВ, ВГЧ-6, протекает в большинстве случаев в виде инфекционного мононуклеоза. В дальнейшем герпесвирусы пожизненно персистируют в макроорганизме, в т. ч. и в области входных ворот инфекции (лимфоидная ткань ротоглотки). При неблагоприятных условиях и снижении местного или системного иммунитета может происходить локальная реактивация герпесвирусов, провоцируя развитие воспаления на местном уровне.
Микробный пейзаж ротоглотки у часто болеющих взрослых вне периода обострения представлен преимущественно нормальной или условно-патогенной микрофлорой.
В смешанной слюне часто болеющих взрослых вне периода обострения с высокой частотой достоверности обнаруживается ДНК ВЭБ, ВГЧ-6, и не обнаруживается ДНК ЦМВ. При этом в образцах крови указанных пациентов ДНК вирусов герпесгруппы не выявлена, что свидетельствует не о системной, а о преимущественно местной реактивации герпесвирусной инфекции. Учитывая, что титры вирусной нагрузки ВЭБ при микст-инфекции выше (4,47 Lg, копий/105 клеток), чем при моноинфекции
(3,99 Lg, копий/105 клеток), можно предположить стимулирующее влияние ВГЧ-6 на активность ВЭБ.
Стандартная антибактериальная терапия без учета вирусной репликации зачастую неэффективна или недостаточно эффективна. Применение противовирусной терапии ациклическими нуклеозидами в комплексном лечении пациентов с частыми рецидивами хронических воспалительных заболеваний ВДП позволяет повысить целенаправленность этиотропной терапии текущего воспалительного процесса.
Из ациклических нуклеозидов наиболее оптимальным и исследованным в лечении герпесвирусов является валацикловир, обладающий высокой биодоступностью и хорошим профилем безопасности. В нашей работе мы применяли дозу валацикловира в 2 раза меньшую, чем та, которая ранее апробировалась разными исследователями, главным образом потому, что мы воздействовали не на острый системный процесс, а на локальную реактивацию герпесвирусной инфекции. Выяснилось, что применение валацикловира в дозе 500 мг 3 р./сут достоверно снижает репликацию ВЭБ в ротоглотке у пациентов с микст-инфекцией (ВЭБ + ВГЧ-6) — на 75%, в большей степени у пациентов с моноинфекцией (ДНК ВЭБ) — на 86%. В отношении инфекции, вызванной ВГЧ-6, не получено достоверных данных о снижении вирусной нагрузки.
Выводы
У часто болеющих взрослых микробный пейзаж вне периода обострения представлен сочетанной бактериально-вирусной микрофлорой: нормальной и/или условно-патогенной бактериальной флорой и представителями герпесгруппы (ВЭБ, ВГЧ-6), что может играть роль в хронизации воспаления в ротоглотке, способствовать снижению местного иммунитета и приводить к частым обострениям патологии ВДП.
Применение валацикловира в дозе 500 мг 3 р./сут в течение 14 дней оказалось эффективным в отношении ВЭБ — на фоне терапии вирусная нагрузка снижалась до нулевых или клинически незначимых титров.
Валацикловир обладает хорошей переносимостью и безопасностью как у молодых пациентов, так и у пациентов старшего возраста.
Дальнейшие исследования должны быть направлены на оценку клинической эффективности валацикловира в лечении реактивации ВЭБ-инфекции у часто болеющих взрослых.
Дата публикации 17 июля 2019Обновлено 16 января 2023
Определение болезни. Причины заболевания
Простой герпес — это высококонтагиозное острое и хроническое инфекционное заболевание, при котором поражается кожа и слизистые оболочки. Его провоцируют вирусы простого герпеса I и II типов, вызывая типичную пузырьковую сыпь и изъязвления, как правило, локализованного характера. У людей с выраженным иммунодефицитом эти вирусы могут вызывать тяжёлые генерализованные формы болезни.
Заболевание входит в TORCH-комплекс, так как влияет на развитие плода: при первичном заражении или реактивации (реже) у беременных оно вызывает врождённую инфекцию.
Краткое содержание стетьи — в видео:
Этиология
Семейство — Herpesviridae (от греч. herpes — ползучий)
Подсемейство — α-герпесвирусы (Alphaherpesvirinae)
Виды — вирус простого герпеса I, II (Herpes simplex virus I, II)
ДНК-содержащие вирусы. В их составе есть нуклеоид — вирусный геном-ДНК, который окружён капсидом сложного строения, покрытым оболочкой белково-липидного характера. Также вирусы содержат гликопротеиды gG1 и gG2, что позволяет провести серотипическое деление вируса герпеса на I и II тип.
Обладают специфической способностью прикрепляться к покровным тканям человека. Это сопровождается постоянной или периодической персистенцией — способностью к размножению в инфицированных клетках без проявлений патологического действия, т. е. простым неактивным носительством.
Достаточно неустойчивы во внешней среде. В условиях комнатной температуры сохраняются до суток, на металле — до 2 часов. За 30 минут разрушается под действием тепла от 50°C. В течении минут исчезает при высушивании и под действием органических растворителей — спирта и хлорсодержащих веществ. При -70°C сохраняется до пяти суток. Культивация происходит на куриных эмбрионах и культурах клеток[1][2][3][6][10][11].
Эпидемиология
Данным вирусом инфицировано более 90 % населения планеты. После 30-40 лет им заражается почти 100 % людей, причём преимущественно I типом вируса.
Единожды инфицированный человек становится пожизненным носителем вируса одного или обоих типов. Данных об эпизодах самоизлечения нет.
В последнее время появились случаи носительства вируса простого герпеса с отсутствием специфических антител IgG к обоим типам вируса. Клиническое и эпидемиологическое значение этого феномена неизвестно. Возможно, такое явление перекрёстно связано с лицами, которые не поддаются заражению.
Источник инфекции — инфицированный человек. Он заразен в любую фазу болезни или носительства, но преимущественно при обострении.
Вирус может находиться в любой биологической жидкости организма — слюне, сперме, вагинальном секрете, отделяемом пузырьков и других.
Восприимчивость всеобщая. Риск заражения возрастает при травмировании кожи и слизистых оболочек здорового человека и попадании на них инфицированных биологических субстратов. Причём вирус может передаваться даже при отсутствии видимых поражений у инфицированного человека.
Большая часть случаев протекает в виде неактивного носительства. Как правило, первично человек приобретает I тип вируса простого герпеса (с детства), а II тип появляется в период половой зрелости. Однако всё относительно.
Основные способы передачи вируса:
- герпеса I типа — посредством обмена слюной, т. е. при разговоре, поцелуях, облизывании общих игрушек и т. п.;
- герпеса 2 типа — при половых контактах.
В 20% случаев возможна обратная связь типов вирусов и способов их передачи.
Механизм передачи:
- воздушно-капельный — аэрозольный и контактно-бытовой пути;
- контактный — контактно-бытовой, половой, парентеральный и трансплантационный пути;
- вертикальный — от матери-плоду через кровь, восходящим путём или во время родов — при прохождении ребёнка через инфицированные родовые пути, причём при первичном заражении женщины во время беременности риск передачи достигает 60 %, а при обострении имеющейся герпетической инфекции — не более 7 %;
- горизонтальный — от жены к мужу и наоборот.
Доказано, что заражение герпесом II типа повышает риск заражения и передачи ВИЧ-инфекции[1][2][4][7][9][11].
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы простого герпеса
Инкубационный период при приобретённой форме длится 2-14 дней. Чаще всего установить его не удаётся из-за отсутствия манифестации.
Простой герпес у детей обычно протекать по типу стоматита и гингивита — повышается температура, появляется лихорадка, общая интоксикация, очаговая гиперемия (покраснение) всех слизистых образований ротовой полости, болезненность при жевании, повышенное слюноотделение. Маленькие дети из-за болевых явлений отказываются от еды. В короткий промежуток времени на месте гиперемии появляются мелкие везикулярные высыпания, которые быстро вскрываются, оставляя после себя болезненные эрозии — афты. Увеличиваются и становятся болезненными регионарные лимфоузлы. С течением времени иммунитет укрепляется и симптомы постепенно регрессируют без каких-либо следов поражения. Рецидивы наблюдаются редко.
При поражении кожи (преимущественно у взрослых) везикулярные высыпания чаще появляются вокруг рта, крыльев носа, иногда на туловище и ягодицах. Сыпь представляет собой небольшие везикулы с серозным содержимым на слегка гиперемированном фоне кожи. Впоследствии они вскрываются и подсыхают, после чего образуются бесследно отпадающие корки.
Иногда пузырьки сливаются в достаточно большие пузыри. Нередко их содержимое нагнаивается, образуется мокнутий, и присоединяется вторичная стрептококковая или стафилококковая инфекция (стафило- и стрептодермии).
Общее самочувствие, как правило, не изменяется. Иногда может быть несколько увеличен и болезнен регионарный лимфоузел. В основном процесс редко продолжается более недели.
При серьёзных иммунодефицитах инфекция может принять более распространённое (генерализованное) течение. В таком случае возникает синдромом общей инфекционной интоксикации и затрагиваются внутренние органы: увеличивается печень и селезёнка, поражается нервная система (менингоэнцефалиты, энцефалиты и менингиты), а также лёгкие, почки и другие органы. При рецидивах хронической инфекции больные иногда ощущают слабый дискомфорт и пощипывание в области будущих высыпаний.
При генитальном герпесе высыпания появляются на коже и слизистых в области половых органов и промежности. Обычно они сопровождаются болезненностью, гиперемией окружающей ткани, увеличением и болезненностью паховых лимфоузлов. Частота рецидивирования зависит от индивидуальных особенностей иммунной системы.
При офтальмогерпесе — герпесе глаз — чаще наблюдаются односторонние поражения из-за перехода первичного процесса на орган зрения, т. е. происходит вторичное поражение. Могут наблюдаться кератиты, блефароконъюнктивиты, иридоциклиты, увеиты, хориоретиниты, невриты зрительного нерва и другие проявления.
Весьма необычной является форма проявления простого герпеса, известная под названием герпетиформная экзема Капоши — герпетическая экзема. Как правило, она возникает у лиц, имеющих какое-либо кожное заболевание или предрасположенность к нему (дерматоз или «проблемная кожа»). При этом наблюдается интоксикация и высокая температура тела, повсеместно появляются герпетические пузырьки, достаточно обильные и близко расположенные, периодически сливающиеся, иногда с геморрагической пропиткой. В некоторых случаях происходит их нагноение, далее они вскрываются, подсыхают и образуют сплошную корку. При тотальной обработке высыпаний зелёнкой кожа больного приобретает вид кожи крокодила. Заболевание нередко протекает достаточно тяжело, может привести к летальному исходу.
При беременности инфицирование ребёнка происходит:
- до родов — в 5 % случаев (первичное заражение и восходящая инфекция в этот период редки);
- во время родов, т. е. при прохождении через естественные родовые пути — в 95 % случаев.
При первичном инфицировании беременной в первый триместр или при восходящем инфицировании плода зачастую развиваются пороки развития, несовместимые с жизнью, или происходит выкидыш, особенно при заражении II типом вируса герпеса, который является инфицирующим агентом чаще всего — до 80 % случаев.
При инфицировании беременной во II и III триместрах риск поражения ребёнка составляет около 50 %. При этом увеличивается печень и селезёнка, возникает специфическое воспаление лёгких, желтуха, нарушение обмена веществ, гипотрофия, менингоэнцефалит, анемия и другое. После рождения может протекать как в малосимптомной субклинической форме, так и иметь тяжёлые инвалидизирующие последствия — слепота, тяжёлые поражения ЦНС, глухота[1][2][6][8][11].
Патогенез простого герпеса
Ворота инфекции — повреждённая кожа и слизистые оболочки.
Вирус прикрепляется к поверхности клетки эпителия, проникает в неё и начинает размножаться. Это может привести к гибели самой клетки, а при массивном процессе — к явным воспалительным процессам, появлению характерной гиперемии, везикулёзных высыпаний и попаданию вируса в кровь и лимфу. В крови вирус обнаруживается на поверхности эритроцитов, лимфоцитов, тромбоцитов. В этот период вирус может попасть в различные органы и ткани, в т. ч. передаться плоду при первичном заражении матери во время беременности.
Вирус простого герпеса инфицирует чувствительные нервные окончания, паравертебральные нервные ганглии. Оттуда может произойти нейрогенное распространение вируса до кожи, в связи с чем появляются новые высыпания. Они далёки от места первичного внедрения:
- при распространении вируса по зрительному нерву поражается орган зрения;
- иногда возникает поражение мочеполовой сферы, причём даже у людей, не ведущих половую жизнь и т. д.
Если иммунная система адекватна, то вирус исчезает из органов и тканей, но при этом пожизненно сохраняется в чувствительных нервных волокнах. Там он может передаваться из клетки в клетку, минуя межклеточное пространство, и в итоге оказывается недоступным для противодействия иммунной системы – т. н. «иммунное ускользание». После этого вирус может более никогда не иметь манифестных проявлений, но при иммунных нарушениях — Т-клеточном иммунодефиците, нарушении продукции интерферона и работы макрофагов — возможна его реактивация, гиперразмножение, выход из нейросенсорных депо и вновь поражение кожи и слизистых оболочек.
Предрасполагающими факторами реактивации вируса могут являться:
- стресс;
- острые или хронические заболевания;
- гормональные нарушения.
Одну из ключевых ролей в появлении симптомов простого герпеса играют макрофаги. Они «позволяют» или «не позволяют» осуществлять размножение вируса внутри себя (т. н. пермиссивность). В первом варианте развивается инфекция с выраженными симптомами, во втором — субклиническая картина заболевания.
Особую роль играет повышение чувствительности организма антигенами вируса. Оно проявляется в развитии местных аллергических реакций замедленного типа в местах высыпаний. При СПИДе данная реактивация приобретает генерализованный вторичный характер с поражением большинства внутренних органов — головного мозга, печени, лёгких, почек и других.
Иммунитет при инфекции вируса простого герпеса является типоспецифическим (против I или II типа вируса), лишь частично перекрёстным. Он не предотвращает обострения заболевания, но препятствует вторичной генерализации (за исключением СПИД-ассоциированных состояний) и инфицированию плода[1][2][6][9][11].
Классификация и стадии развития простого герпеса
В МКБ-10 (Международной классификации болезней) выделяют на две группы, связанных с вирусом простого герпеса:
- Инфекционные герпетические заболевания:
- герпетическая экзема (экзема Капоши);
- герпетический везикулярный дерматит;
- герпетический гингивостоматит и фаринготонзиллит;
- герпетический менингит;
- герпетический энцефалит;
- офтальмогерпес;
- диссеминированная герпетическая болезнь (герпетический сепсис);
- другие формы герпетических инфекций;
- неуточнённая герпетическая инфекция.
- Генитальные герпетические инфекции:
- герпетические инфекции перианальных кожных покровов и прямой кишки;
- неуточнённая аногенитальная герпетическая инфекция.
По степени тяжести простой герпес бывает:
- лёгким;
- среднетяжёлым;
- тяжёлым (с осложнениями).
По форме возникновения заболевания различают:
- приобретённый герпес:
- первичный герпес;
- рецидивирующий герпес;
- врождённый герпес.
По форме и распространённости инфекции выделяют четыре стадии простого герпеса:
- латентная стадия — носительство с отсутствием симптомов;
- локализованная стадия — единственный очаг поражения;
- распространённая стадия — не менее двух очагов поражения;
- генерализованная стадия — висцеральная, диссеминированная.
По клинической картине и локализации высыпаний различают две формы простого герпеса:
- Типичные формы:
- герпес слизистых оболочек желудочно-кишечного тракта — стоматит, гингивит, фарингит, эзофагит;
- герпес глаз — иридоциклит, кератит, конъюнктивит, неврит зрительного нерва, оптикомиелит;
- герпес кожи — поражение губ, крыльев носа, лица, рук, ягодиц и других частей тела;
- герпес половых органов — поражение слизистой оболочки полового члена, влагалища, вульвы, цервикального канала;
- герпес нервной системы — неврит, менингит, менингоэнцефалит, менингоэнцефалорадикулит, поражения бульбарных нервов, энцефалит;
- герпес внутренних органов — гепатит, пневмония, панкреатит, трахеобронхит;
- генерализованный простой герпес — висцеральная форма (пневмония, гепатит, эзофагит) и диссеминированная форма (сепсис).
- Атипичные формы:
- абортивный герпес — мало заметные папулы на огрубевшей коже, иногда просто дискомфорт без высыпаний;
- отёчный герпес — отёк тканей и боль в области губ и век (рыхлой подкожной клетчатки);
- зостериформный простой герпес — локализация по ходу нервного ствола, группировка и боли напоминают опоясывающий герпес;
- герпетиформная экзема Капоши — обильные обширные сливающиеся высыпания по всему телу;
- язвенно-некротический герпес — с развитием некроза тканей;
- геморрагический герпес — с кровянистым пропитыванием высыпаний и тканей;
- эрозивно-язвенный герпес — с образованием язв и эрозий;
- диссеминированный герпес — отдельные высыпания на различных участках тела, часто переходит в генерализованную форму при СПИДе;
- рупиоидный герпес — чаще возникает на лице с присоединением вторичной бактериальной флоры;
- мигрирующий герпес — изменение локализации высыпаний[1][2][10][11].
Осложнения простого герпеса
- герпетический энцефалит и менингоэнцефалит — резкое повышение температуры тела, мучительные головные боли, сопровождающиеся выраженной менингеальной симптоматикой, рвотой без облегчения, иногда нарушениями сознания; прогноз в половине случаев неблагоприятный;
- врождённая герпетическая инфекция — полисистемное поражение организма, сопровождается нарушением зрения и слуха, гепатитом, пневмонией, поражением почек, менингитами и менинноэнцефалитами, задержкой развития;
- присоединение вторичной бактериальной флоры — нагноение при обширных высыпаниях, а при иммунодефиците — повышение температуры тела, интоксикация, гнойное содержимое высыпаний; требует назначения системной антибактериальной терапии;
- офтальмогерпес с органическими поражениями ткани глаза — кератиты с формированием рубцов, которые приводят к нарушению зрения[1][4][9][10].
Диагностика простого герпеса
Лабораторная диагностика:
- клинический анализ крови — нормальные размеры эритроцитов или лейкопения (сниженный уровень лейкоцитов); при присоединении вторичной флоры возможен нейтрофильный лейкоцитоз — повышенный уровень нейтрофилов в крови; СОЭ в норме или повышена;
- общий анализ мочи — не информативен, возможны воспалительные изменения при локализации процесса в соответствующей зоне;
- биохимический анализ крови — зависит от распространённости процесса и наличия сопутствующих заболеваний; как правило, без существенных отклонений; при генерализованных формах повышается АЛТ и АСТ;
- ИФА-диагностика крови — выявляется повышенный в четыре раза титр IgG антител как маркера инфицирования вирусом; иногда появляется IgM к вирусу простого герпеса;
- ПЦР биологического материала — в отделяемом высыпаний, ликворе или крови выявления ДНК вируса[1][5][8][9][10][11].
Дифференциальная диагностика:
- везикулёзный осповидный риккетсиоз — пребывание на очаговой территории, факт укусу клеща, первичный аффект, панваскулит, генерализованная лимфаденопатия;
- ветряная оспа — контакт с больным ветряной оспой или опоясывающим герпесом, отсутствие ветряной оспы в прошлом, единичные несливающиеся везикулы по всему телу, отсутствие болей в местах высыпаний;
- энтеровирусная инфекция — тёплое время года, преимущественное поражение кистей и стоп, преобладание папулёзных элементов сыпи, часто в совокупности с синдромом поражение ЖКТ;
- рожистое воспаление — яркая гиперемия, чётко отграниченный отёк от здоровой кожи, неровные валикообразные края;
- стрептококковые и стафилококковые поражения кожи — явные гнойничковые высыпания, иногда эрозии, при посеве выявляется обильный рост бактерий[1][2][7][10].
Лечение простого герпеса
Больные с осложнёнными формами простого герпеса подлежат госпитализации в инфекционный стационар. Остальные пациенты при отсутствии серьёзных сопутствующих состояний могут лечиться на дому амбулаторно.
Существует две стратегии этиотропного лечения:
- По требованию — при отсутствии частых рецидивов нужно как можно раньше принимать ударную дозировку ацикловирсодержащих препаратов в течении суток. Это позволяет оборвать процесс и не допустить развития высыпаний.
- Длительное противорецидивное лечение — при обострении простого герпеса раз в 1-2 месяца и чаще показан ежедневный приём прямых противовирусных препаратов сроком не менее одного года, в течение которого происходит восстановление и «отдых» иммунного звена, ответственного за противогерпетический иммунный ответ.
Применение средств местного действия в виде мазей и кремов имеет ограниченный малоэффективный результат.
Высокоэффективное этиотропное лечение вполне может быть дополнено средствами повышения иммунной защиты организма (при наличии резервов организма) и витаминотерапией.
В исходе продолжительной терапии проводиться специфическая вакцинация для стимуляции клеточных механизмов противогерпетического иммунитета[1][2][3][8][11].
Прогноз. Профилактика
При неосложнённых формах болезни прогноз благоприятный, при генерализованных или формах с поражением ЦНС — серьёзный, возможен летальный исход или инвалидизация.
Важное значение в профилактике развития манифестной инфекции имеет ведение здорового образа жизни, правильное питание, предупреждение и лечение сопутствующих заболеваний, избегание переохлаждений и стрессов.
Специальных ограничительных мероприятий при заболевании не проводят. Больного следует обеспечить индивидуальной посудой, не допускать поцелуев с неинфицированными людьми.
При генитальном герпесе высокоэффективным мероприятием является использование презерватива. Определённое снижение риска распространения инфекции даёт регулярный приём противогерпетических средств уже инфицированным людям.
Если у беременной выявлен генитальный герпес при наличии частых рецидивов, высокой вирусной нагрузке области гениталий и родовых путей, то пациентке показан профилактический приём противогерпетических средств, начиная с 36 недели беременности и до родов (если планируются естественные роды). Или же выполняется плановое кесарево сечение.
Вакцинация для предотвращения инфицирования простым герпесом не разработана. Вакцина используется лишь для снижения количества рецидивов[1][2][11].





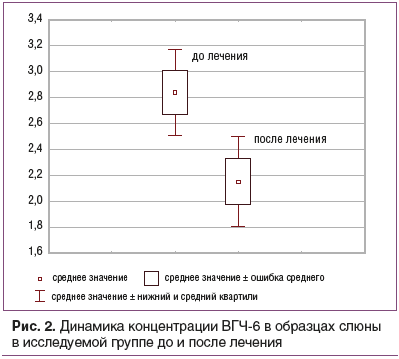


![Герпес у детей: везикулярные высыпания и афты [12] Герпес у детей: везикулярные высыпания и афты [12]](https://probolezny.ru/media/bolezny/gerpes-prostoy/gerpes-u-detyay-vezikulyarnye-vysypaniya-i-afty-12_s_V3e4hKy.jpeg)

![Генитальный герпес [13][14] Генитальный герпес [13][14]](https://probolezny.ru/media/bolezny/gerpes-prostoy/genitalnyy-gerpes-13-14_s.jpeg)
![Офтальмогерпес [15] Офтальмогерпес [15]](https://probolezny.ru/media/bolezny/gerpes-prostoy/oftalmogerpes-15_s.jpeg)
![Герпетиформная экзема Капоши [16] Герпетиформная экзема Капоши [16]](https://probolezny.ru/media/bolezny/gerpes-prostoy/gerpetiformnaya-ekzema-kaposhi-16_s.jpeg)

