Дата публикации 17 июня 2021Обновлено 13 апреля 2023
Определение болезни. Причины заболевания
Гиперплазия эндометрия (гиперпластические процессы эндометрия) — это патологическое разрастание желёз слизистой оболочки матки. Эндометрий состоит из желёз и стромы (основы). В норме строма занимает более половины площади эндометрия, при гиперплазии соотношение желёз к строме становится более 50 % [24].
Диагноз «гиперплазия эндометрия» ставится только по заключению гистологического исследования. Без своевременной диагностики и целенаправленного лечения повышается риск развития рака эндометрия.
Гиперплазию нужно отличать от пролифелирующего эндометрия, при котором эндометрий растёт, но не имеет структурных особенностей, характерных для ранней, средней или поздней стадии пролиферации в нормальном менструальном цикле. Также он отличается наличием участков кровоизлияний, дистрофических изменений и распадом [22].
Пролиферирующий эндометрий не является формой гиперплазии, так как соотношение желёз эндометрия к строме не изменяется. Однако если состояние не лечить, повышается риск развития гиперплазии [23].
Распространённость заболевания составляет 15–50 % от всех гинекологических патологий [7]. Гиперплазия эндометрия может возникнуть у женщин всех возрастов, но чаще развивается в 40-44 года, когда происходит гормональная перестройка из-за приближения менопаузы [1][6].
В составе маточного эндометрия есть специфические рецепторы, которые делают его органом-мишенью для половых гормонов. При гормональном сбое нарушается рост и дифференцировка эндометриальных клеток, что приводит к разрастанию эндометрия.
Факторы риска развития гиперплазии эндометрия [1][8][11]:
- ожирение и связанное с ним избыточное образование эстрогенов из андрогенов в жировой ткани [3];
- возраст старше 35 лет;
- наследственность и генетические мутации;
- злостное курение табака;
- раннее менархе (начало менструации) — до 12 лет;
- поздняя менопауза — позже 55 лет;
- затянувшийся период менопаузального перехода;
- хроническая ановуляция (отсутствие овуляции у женщины репродуктивного возраста более шести циклов подряд);
- сопутствующие заболевания: сахарный диабет 2-го типа, ожирение, синдром Линча (наследственный неполипозный колоректальный рак), синдром поликистозных яичников (СПКЯ), гормональные опухоли яичников, бесплодие, а также заболевания пищеварительного тракта, иммунной системы и щитовидной железы;
- приём некоторых лекарственных препаратов: менопаузальная заместительная гормональная терапия (ЗГТ), содержащая только эстрогены; длительная терапия Тамоксифеном. Этот препарат применяется в составе комплексного лечения рака молочной железы. Его побочным эффектом является влияние на слизистую оболочку матки с развитием гиперплазии [14].
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы гиперплазии эндометрия
В редких случаях гиперплазия эндометрия может протекать без симптомов [16][17]. Но обычно для гиперпластических процессов эндометрия характерны нарушения менструального цикла:
- интервал между менструациями более 35 дней или менее 21 дня;
- затяжные, обильные менструации;
- кровянистые выделения из половых путей между менструациями;
- отсутствие менструаций более шести месяцев вне беременности и лактации.
Пациентки репродуктивного возраста иногда жалуются на отсутствие беременности при регулярной половой жизни [15][18].
В период перехода к менопаузе основным симптомом заболевания являются нерегулярные обильные менструации, сменяющиеся длительными мажущими кровянистыми выделениями.
Женщины менопаузального возраста жалуются на скудные кровянистые выделения из половых путей. Они могут проявляться эпизодически либо быть продолжительными.
Иногда пациенток беспокоят симптомы, характерные для обменных и эндокринных нарушений: головные боли, избыточная прибавка веса, нарушение сна, периодически возникающая жажда, утомляемость, пониженная работоспособность и раздражительность, чрезмерный рост волос (в том числе на участках кожи, для которых это несвойственно) [2][11].
Патогенез гиперплазии эндометрия
Состояние эндометрия зависит от фазы менструального цикла:
- I фаза (фаза пролиферации) — продолжается до 14-го дня (при 28-дневном цикле). Под воздействием эстрогенов происходит пролиферация (рост) эндометрия. Его железы увеличиваются, слегка извиваются, их просвет расширяется, но секрета они ещё не содержат [3]. Максимальный рост наблюдается к концу фазы, когда в яичнике созревает один из фолликулов и происходит овуляция. Толщина функционального слоя эндометрия в этот период составляет 4–5 мм.
- II фаза (фаза секреции, или лютеиновая фаза) — продолжается с 14-го по 28-й день, совпадает с развитием жёлтого тела в яичнике на месте лопнувшего фолликула. Под влиянием гормонов жёлтого тела, в том числе прогестерона, железы эндометрия ещё больше извиваются и заполняются секретом. В них откладывается гликоген, фосфор и кальций, необходимые для питания и последующей имплантации эмбриона в слизистую оболочку матки. Толщина функционального слоя эндометрия в позднюю стадию фазы секреции (при отсутствии беременности) составляет 15 мм. Когда происходит обратное развитие жёлтого тела, уровень прогестерона и эстрогенов снижается, функциональный слой эндометрия отторгается и начинается менструация.
В патогенезе гиперплазии эндометрия выделяют два варианта развития событий:
- Гормонозависимый — избыточное влияние эстрогенов на слизистую оболочку матки при недостаточном воздействии прогестерона, который должен подавлять действие эстрогенов. Наблюдается при недостатке прогестерона или при избытке эстрогенов. В этом случае эстрогены провоцируют патологический рост эндометриальных желёз, при котором изменяется их форма и размер. Из-за недостатка прогестерона не наступает фаза секреции, поэтому эндометрий продолжает активно расти. Гиперплазия эндометрия почти всегда является гормонозависимой.
- Гормононезависимый — патологический ответ желёз и стромы эндометрия на нормальный уровень эстрогена. Может возникнуть из-за хронического воспаления эндометрия. В этом случае аномальное разрастание эндометрия связано с тем, что у рецепторов меняется структура и функции.
При гиперплазии эндометрия без клеточной атипии из-за гормонального дисбаланса увеличивается количество желёз. Их соотношение к строме эндометрия начинает превышать 50 % [3][7].
В случае гиперплазии эндометрия с атипией избыток желёз эндометрия сочетается с клеточными мутациями (атипическим перерождением). Атипическая гиперплазия эндометрия является предраковым состоянием.
Классификация и стадии развития гиперплазии эндометрия
Рассмотрим две основные международные классификации гиперплазии эндометрия, которые основаны на оценке строения ткани [4][9][12].
Международная классификация болезней 10-го пересмотра (МКБ-10):
- N85.0 Железистая гиперплазия эндометрия (кистозная, железисто-кистозная, полипоидная).
- N85.1 Аденоматозная (атипическая) гиперплазия эндометрия.
Пересмотренная классификация ВОЗ 2014 года:
- Гиперплазия эндометрия без атипии. Синонимы: доброкачественная, простая неатипическая, сложная неатипическая.
- Атипическая гиперплазия эндометрия. Синонимы: простая атипическая, сложная атипическая, эндометриальная интраэпителиальная неоплазия [25].
| Новый термин | Синонимы | Генетические изменения | Наличие рака эндометрия | Риск рака эндометрия |
|---|---|---|---|---|
| Гиперплазия эндометрия без атипии | 1. Простая неатипическая гиперпазия 2. Сложная гиперплазия без атипии |
Редко | Менее 1 % | 1,01–1,03 |
| Гиперплазия эндометрия с атипией | 1. Сложная атипическая гиперплазия эндометрия 2. Простая атипическая гиперплазия эндометрия 3. Эндометриальная интраэпителиальная неоплазия (EIN) |
Множество генетических изменений | от 25–33 до 59 % |
14–45 |
Основная цель этих классификаций — разграничить доброкачественную гиперплазию и гиперплазию с наличием атипических клеток. Это важно, чтобы определить дальнейшую тактику ведения пациенток, так как атипичная гиперплазия часто перерождается в рак [9].
Осложнения гиперплазии эндометрия
Анемия. Для гиперплазии эндометрия характерны аномальные маточные кровотечения. В связи с этим женщины часто страдают от хронического малокровия разной степени выраженности.
Бесплодие. Гормональные изменения отражаются на качестве эндометрия, что создаёт риск неудачной имплантации эмбриона. Помимо этого, гиперплазия эндометрия часто выявляется на фоне хронической ановуляции, при которой зачатие невозможно.
Перерождение в рак эндометрия. Самое грозное осложнение гиперплазии эндометрия. Согласно исследованию 2006 года, атипическая гиперплазия эндометрия перерождается в аденокарциному эндометрия в 29 % случаев. Гиперплазия без атипии становится злокачественной менее чем в 5 % случаев [4][10].
Риск озлокачествления зависит в первую очередь от выраженности клеточного атипизма, т. е. от степени изменения клеток. Возраст, состояние яичников, сопутствующие эндокринные заболевания, ожирение и приём гормональных препаратов не так сильно влияют на риск перерождения [10]. Поэтому так важна своевременная диагностика гиперплазии эндометрия и последующее выделение пациенток с этой патологией в группу онкологического риска [13].
Диагностика гиперплазии эндометрия
Диагностика основана на анализе данных анамнеза пациентки (истории болезни), клинической картины заболевания (жалоб и физикального осмотра), а также на результатах ультразвукового и гистероскопического исследования с обязательным патоморфологическим анализом соскоба из полости матки.
Диагноз «гиперплазия эндометрия» ставится только на основании гистологического исследования материала, полученного при диагностическом выскабливании слизистой оболочки матки или удалении матки.
Анамнез и клиническая картина
При сборе анамнеза врач-гинеколог задаёт пациентке вопросы:
- Были ли гинекологические проблемы у мамы, бабушки или других родственников по женской линии.
- Какой образ жизни ведёт пациентка.
- Есть ли вредные привычки.
- Какой характер питания.
- Как проходят менструации: длина цикла, характер и продолжительность менструаций.
- Бывают ли аномальные маточные кровотечения. Если да, каков их характер и продолжительность.
- Была ли беременность и роды, планируется ли беременность в будущем. Невозможность зачать ребёнка и невынашивание могут быть симптомом гиперплазии эндометрия [18].
- Есть ли сопутствующие заболевания из группы риска по развитию гиперплазии эндометрия.
- Принимает ли пациентка какие-либо гормональные препараты.
Физикальный осмотр включает в себя местный осмотр наружных половых органов, исследование влагалища и шейки матки в зеркалах, а также бимануальное (двумя руками) исследование матки и придатков. Осмотр проводится на первичном приёме, чтобы исключить воспалительные заболевания и/или объёмные опухолевые образования.
Инструментальная диагностика
Трансвагинальное ультразвуковое исследование (ТВУЗИ) органов малого таза. Толщина эндометрия по данным УЗИ не является надёжным критерием выявления гиперплазии эндометрия у женщин репродуктивного возраста [26]. Исследование проводят, чтобы исключить другие причины аномальных маточных кровотечений или оценить толщину эндометрия у женщин в постменопаузе [23][27].
У женщин репродуктивного и пременопаузального возрастов при подозрении на гиперплазию эндометрия ТВУЗИ органов малого таза проводится на 5–7-й день менструального цикла. В норме в это время толщина эндометрия не превышает 6 мм. Патологию эндометрия подозревают, когда его толщина не соответствует определённой фазе менструального цикла:
- на 5–7-й день цикла толщина эндометрия более 6 мм (в среднем 8–15 мм);
- в середине цикла (на 14–15-й день при 28-дневном цикле) толщина эндометрия более 15 мм [13][14].
В постменопаузе толщина эндометрия в норме должна быть не более 4–5 мм. Патологическое утолщение диагностируют, когда этот показатель превышает 5 мм [12]. Допустимая толщина эндометрия на фоне приёма Тамоксифена не больше 9 мм.
Помимо измерения толщины врач ультразвуковой диагностики оценивает кровоснабжение эндометрия, а также его контуры, однородность и соответствие фазе цикла у женщин репродуктивного возраста. Для атипической гиперплазии характерно более выраженное утолщение слизистого слоя матки, его неоднородность, неровные извилистые контуры и более интенсивная васкуляризация (кровоснабжение) [2][7].
В некоторых случаях, например при обильном кровотечении, которое угрожает здоровью пациентки, ТВУЗИ не проводится. Сразу принимается решение об обоснованном диагностическом выскабливании по жизненным показаниям [19].
Гистероскопия с раздельным диагностическим выскабливанием (РДВ) матки и цервикального канала — информативный метод в диагностике гиперпластических процессов эндометрия. При помощи гистероскопа (эндоскопического прибора для осмотра полости матки) врач оценивает состояние слизистой оболочки матки и цервикального канала. При необходимости удаляет локальные поражения и обязательно берёт материал для последующего гистологического исследования.
Если выскабливание проводят как лечебную процедуру при обильном маточном кровотечении, врач полностью удаляет слизистую оболочку матки под контролем гистероскопии.
Цитологическое исследование аспирата из полости матки. Пайпель-биопсия. Специальный зонд, введённый в полость матки, «всасывает» фрагменты эндометрия. В последующем специалист оценивает выраженность его пролиферативных изменений (т. е. новообразований клеток и клеточных структур). Пайпель-биопсия эндометрия — высокочувствительный метод диагностики гиперплазии и рака эндометрия [28].
У женщин репродуктивного возраста (15–49 лет) аспират берут на 2–26-й день менструального цикла. У женщин в пременопаузе (с 40–45 лет и до наступления менопаузы) и в менопаузальном возрасте (своевременная менопауза наступает в 46–54 года) пайпель-биопсию можно делать в любой день [20][21].
Дифференциальная диагностика гиперплазии эндометрия проводится с полипом эндометрия, субмукозной (подслизистой) миомой матки, эндометритом, прервавшейся беременностью и раком эндометрия.
Лечение гиперплазии эндометрия
Лечение патологии эндометрия основывается на трёх принципах:
- Предупредить развитие/прогрессирование злокачественного процесса эндометрия.
- Исключить сопутствующие злокачественные процессы в эндометрии.
- Выбрать наиболее подходящий пациентке план лечения [3].
Тактика лечения будет зависеть от результата гистологического исследования эндометрия, полученного в ходе выскабливания, от возраста женщины, сопутствующих заболеваний и репродуктивных планов.
Лечебная тактика в зависимости от наличия или отсутствия атипии [27][29].
Гиперплазия эндометрия без атипии:
- Консервативное лечение:
- нормализация менструального цикла;
- снижение веса;
- пероральные контрацептивы;
- циклические гестагены;
- внутриматочная система «Мирена».
- Хирургическое (только в исключительных случаях).
Гиперплазия эндометрия с атипией:
- Консервативное лечение проводится только у женщин, желающих сохранить способность к деторождению. Назначаются высокие дозы гестагенов и гистологический мониторинг.
- Хирургическое лечение. Выполняется пангистерэктомия — радикальная операция, при которой тело, шейка матки, маточные трубы и яичники удаляются через разрез в брюшной полости.
Наблюдение. У 70–80 % пациенток наблюдается самостоятельное исчезновение признаков гиперплазии. Поэтому если у женщины нет никаких симптомов и факторов риска, то врач наблюдает за состоянием эндометрия с помощью контрольных биопсий один раз в 6 месяцев. При получении двух последовательных негативных биопсий пациентку снимают с учёта [12].
Медикаментозное лечение гормональными препаратами проводится пациенткам репродуктивного возраста с неатипической гиперплазией эндометрия при наличии симптомов, факторов риска, отсутствии регресса за 6 месяцев наблюдения и при атипической гиперплазии эндометрия у женщин, планирующих беременность.
В периоды пери- и постменопаузы гормонотерапию проводят только при неатипических формах гиперплазии эндометрия [30].
Гормональную терапию назначают не менее чем на 6 месяцев:
- Внутриматочная гормональная контрацепция (ЛНГ-ВМС): спираль «Мирена», LNG-20.
- Прогестагены в циклическом (у менструирующих женщин) или непрерывном режиме (при сложной гиперплазии и при наличии сопутствующей патологии матки): Норколут (Норэтистерон), Дюфастон (Дидрогестерон), Утрожестан.
- Агонисты гонадотропин рилизинг-гормона (аГнРГ) применяются у пациенток с рецидивирующей гиперплазией эндометрия и у женщин репродуктивного возраста с атипической гиперплазией: Бусерелин-депо (Бусерелин).
После курса медикаментозной терапии необходимо сделать не менее двух контрольных биопсии эндометрия с интервалом один раз в 6 месяцев [3][11]. Критерием излеченности гиперплазии эндометрия будет отсутствие патологических изменений в биоптате.
В качестве негормональной терапии возможно применение препаратов:
- Циклодинон — негормональный лекарственный растительный препарат из плодов Витекса священного. Компоненты препарата нормализуют концентрацию половых гормонов.
- Мастодинон — комбинированный препарат на растительной основе [32].
Лечение нужно сочетать с низкокалорийной диетой и достаточной физической нагрузкой согласно общему физическому развитию женщины. При необходимости врач назначает препараты, которые нормализуют метаболизм углеводов в организме: подавляют образование глюкозы клетками печени, повышают чувствительность тканей к инсулину, расщепляют сложные сахара.
Хирургическое лечение. Атипическая гиперплазия эндометрия на начальном этапе требует обязательной консультации онкогинеколога, который должен установить, нужна ли операция и в каком объёме.
Чаще всего выполняется надвлагалищная ампутация матки — суправагинальная гистерэктомия (удаление тела и шейки матки). Вопрос о сохранении яичников решается строго индивидуально, зависит от возраста пациентки и факторов риска.
Показания к гистерэктомии:
- Атипический гиперпластический процесс эндометрия у пациенток старше 50 лет.
- Атипическая гиперплазия эндометрия, развившаяся в ходе лечения неатипической гиперплазии.
- Рецидивирующая гиперплазия эндометрия, особенно в сочетании с миомой матки и аденомиозом (эндометриоз тела матки) [3][11].
Прогноз. Профилактика
После успешного лечения пациентки должны находиться на диспансерном учёте: посещать гинеколога и делать ТВУЗИ органов малого таза один раз в пол года на протяжении пяти лет [11][12].
Применение прогестагенов в лечении гиперплазии эндометрия без атипии дают хорошие результаты: в 89–96 % случаев патологические изменения достаточно быстро регрессируют [3][5]. Рецидив заболевания при неатипическом процессе выявляют в 6 % случаев.
В случае атипической гиперплазии эффективность лечения составляет 50 %. Рецидив регистрируется в 25 % случаев, ещё в 25 % выявляется рак эндометрия [10].
Обследование для исключения гиперплазии или рака эндометрия показано в следующих случаях:
1. Если есть аномальные маточные кровотечения [29][31]:
- В постменопаузальном периоде показанием является любое маточное кровотечение, независимо от объёма и длительности. Первый шаг в этом случае — измерение толщины эндометрия с помощью ТВУЗИ:
- если этот показатель менее 5 мм — риск атипии минимальный;
- если толщина эндометрия более 5 мм — показана биопсия эндометрия.
- В период перименопаузы (от 45 лет и до менопаузы) обследование необходимо при частых, длительных или обильных аномальных маточных кровотечениях.
- До 45 лет:
- Показания у женщин с ожирением: частые, длительные или обильные аномальные маточные кровотечения.
- У женщин без ожирения: длительные аномальные маточные кровотечения в сочетании с хронической ановуляцией, монотерапией эстрогенами, эстрогенпродуцирующей опухолью, отсутствием эффекта от лечения аномальных маточных кровотечений, высоким риском развития рака эндометрия (синдром Линча), отсутствием менструации в течение шести и более месяцев с хронической ановуляцией.
2. Если по результатам цитологического исследования соскоба шейки матки отмечается:
- наличие атипических клеток эндометрия;
- наличие атипических клеток любой локализации у женщин старше 35 лет с факторами риска развития рака эндометрия;
- наличие клеток эндометрия с признаками доброкачественной гиперплазии у женщин старше 40 лет с нарушениями менструального цикла или факторами риска развития рака эндометрия.
Профилактика:
- Своевременно выявлять и лечить заболевания женских половых органов.
- Избегать искусственного прерывания беременности.
- Вести здоровый образ жизни с регуляцией диеты, снижением веса при ожирении, контролем уровня глюкозы в крови при сахарном диабете, отказом от курения.
- Полноценно питаться, отдыхать и заниматься спортом.
Акушерство и гинекология
Российские и международные подходы к ведению пациентов с гиперплазией эндометрия
Несмотря на то что тема гиперплазии эндометрия (ГЭ) весьма актуальна как среди врачей, так и среди пациенток, вопросы классификации заболевания и тактики ведения пациентов до сих пор остаются дискуссионными. Отчасти это обусловлено особенностями установления диагноза ГЭ, единственным основанием для которого является морфологическая верификация. Однако результаты гистологического исследования значительно зависят от человеческого фактора, как на преаналитическом, так и на лабораторном этапах диагностики.
Проблема лабораторной диагностики связана с субъективной оценкой гистологических срезов, требующей высокого уровня квалификации специалистов. Но даже у специалистов экспертного уровня процент несовпадения развернутой интерпретации гистологических находок слишком велик, а проведение уточняющей молекулярно-генетической диагностики малодоступно и в большей степени предназначено для подтверждения неопластических изменений, чем для дифференциальной диагностики и прогноза ГЭ (идет процесс накопления данных). Это послужило поводом для упрощения основанной на гистологических признаках клинической классификации ГЭ. В 2014 г. Всемирная организация здравоохранения (ВОЗ) поддержала классификацию, согласно которой выделяются две формы ГЭ: гиперплазия эндометрия без атипии, или доброкачественная гиперплазия эндометрия (ДГЭ), и атипическая гиперплазия эндометрия (АГЭ); (табл. 1.) По сути, две формы ГЭ в данной классификации отражают два возможных пути развития заболевания – путь гиперплазии с низкой, практически сходной с популяционной, вероятностью исхода в рак эндометрия (РЭ), и путь неоплазии с высоким риском малигнизации.
| Таблица 1. Новая классификация ГЭ (ВОЗ, 2014) | ||||
|---|---|---|---|---|
|
Новый термин |
Синонимы |
Генетические изменения |
Сосуществующая инвазивная эндометриальная карцинома |
Прогрессия до инвазивной карциномы, относительный риск |
|
Гиперплазия эндометрия (ГЭ) без атипии |
ДГЭ; простая |
Низкое число соматических мутаций в отдельных железах; отсутствие морфологических изменений при окрашивании гематоксилин-эозином |
Менее 1 % |
1,01–1,03 |
|
Атипическая гиперплазия эндометрия (АГЭ). Эндометриоидная интраэпителиальная неоплазия |
Сложная АГЭ; простая АГЭ; эндометриальная интраэпителиальная неоплазия (EIN) |
Множество генетических изменений, типичных для эндометриоидного РЭ, в том числе: микросателлитная нестабильность, инактивация PAX2, мутации PTEN, KRAS и CTNNB1 (b-катехин) |
25–33%; 59 % |
14–45 |
| Emons G, Beckmann MW, Schmidt D et al. New WHO classification of endometrial hyperplasias. Geburtsh Frauenheilk 2015; 75: 135–136. |
Главной проблемой преаналитического этапа является его инвазивность, которая ставит клинициста перед выбором метода получения биоматериала из полости матки. Сегодня популярна позиция бережного отношения к эндометрию, предполагающая использование в рамках диагностики его патологии аспирационную биопсию (вслепую) или прицельную биопсию (под контролем гистероскопии). Ограничением данного метода является высокая вероятность непопадания микроскопических атипических очагов в образцы биоматериала, направляемого на исследование. Поэтому для получения релевантных результатов гистологического исследования биопсия эндометрия может применяться при низком риске АГЭ или, наоборот, при высоком риске РЭ, когда число атипических клеток в эндометрии будет преобладать, определяя их высокую вероятность попадания в биоптат. В остальных случаях следует выполнять тотальное выскабливание эндометрия (кюретаж) под контролем гистероскопии.
Таким образом, решение вопроса о выборе метода получения биоматериала (биопсия или кюретаж) требует учета риска той или иной степени ГЭ и РЭ. С целью определения группы риска в каждом конкретном случае необходимо оценивать возраст, анамнестические факторы, клинические симптомы заболевания и результаты ультразвукового исследования у пациентки.
Принципы терапии гиперпластических процессов эндометрия
Удаление патологически измененной ткани эндометрия является одновременно и адекватным преаналитическим этапом диагностики, и способом лечения. Дальнейшая консервативная (гормональная) терапия либо оперативное лечение направлены на предотвращение повторного эпизода роста патологически измененной ткани.
К гормональным методам лечения/профилактики ГЭ относят:
– Прогестины.
– Комбинированные оральные контрацептивы (КОК).
– Антигонадотропные препараты (в настоящее время практически не применяются).
– Аналоги гонадолиберина.
Критерии выбора гормональной терапии:
– морфологическая характеристика ГЭ;
– возраст пациентки;
– дополнительные цели терапии;
– наличие сопутствующей патологии и противопоказаний к назначению препаратов;
– предпочтения и жизненные планы пациентки.
АГЭ требует назначения прогестинов пролонгированного действия или аналогов гонадолиберина, возможно сочетание этих двух методов терапии. При отсутствии эффекта от 6-месячного курса лечения ставится вопрос о гистерэктомии. Пациенткам старше 45 лет и более молодым женщинам, осуществившим репродуктивные планы, гистерэктомию следует предлагать как основной метод лечения.
Способ ведения пациенток с ДГЭ определяется степенью риска ее рецидивов. При наличии сложной ГЭ без атипии или клинических факторов риска РЭ, или хронической ановуляторной дисфункции яичников, или повторного эпизода ГЭ рекомендуется лечение с помощью прогестинов и аналогов гонадолиберина (последние обычно назначаются при сочетанной доброкачественной патологии матки, в первую очередь – миомы).
Согласно существующим клиническим рекомендациям, спорадический эпизод ДГЭ у женщин, не отягощенных факторами риска РЭ, лечения не требует. Но при наличии дополнительных обстоятельств, например нарушений менструального цикла или необходимости предохранения от нежеланной беременности, выбор терапии должен планироваться с учетом эпизода ДГЭ. Более того, актуальным является вопрос профилактики гиперплазии/неоплазии у пациенток, не имеющих в текущий момент пролиферативной патологии эндометрия, но относящихся к группе риска по ее возникновению.
В связи с указанными профилактическими целями наиболее перспективным является назначение КОК сексуально активным женщинам, не планирующим беременность. Обоснованием такой стратегии служат данные метаанализов, продемонстрировавшие достоверное и значительное снижение риска РЭ у женщин, принимавших КОК. Однако при выборе конкретного средства следует учитывать, что антипролиферативный потенциал КОК повышается в прямой зависимости от силы гестагенного воздействия входящего в состав препарата прогестина.
Характеристики прогестагенного эффекта на эндометрий определяются длительностью воздействия в течение условного цикла (14 дней, 21 день, 28 дней) и дозой, необходимой для контроля избыточного роста железистого компонента ткани. Суточная доза прогестина в составе КОК рассчитывается, исходя из способности молекулы выполнять противозачаточную функцию, т.е. подавлять овуляцию. Оценка дозы, необходимой для контроля пролиферации (табл. 2), является предметом вторичного интереса.
| Таблица 2. Суточная доза прогестагена, необходимая для контроля пролиферации эндометрия | |
|---|---|
|
Прогестаген |
Доза, мг |
|
Прогестерон |
200–300 |
|
Медроксипрогестерона ацетат |
2,5–10,0 |
|
Хлормадинона ацетат |
10,0 |
|
Ципротерона ацетат |
1,0 |
|
Дидрогестерон |
5,0–10,0 |
|
Номегестрола ацетат |
5,0–10,0 |
|
Норэтиндрона ацетат |
0,5–1,0 |
|
Левоноргестрел |
0,075 |
|
Дезогестрел |
0,075 |
|
Норгестимат |
0,09 |
|
Гестоден |
0,05 |
|
Диеногест |
3,0–4,0 |
|
Дроспиренон |
2,0 |
Впечатление о неадекватной антипролиферативной активности некоторых прогестинов (хлормадинона ацетат, номегестрола ацетат, диеногест), составленное по сравнению суточной дозы, содержащейся в таблетке КОК, и дозы, необходимой для подавления эстрогензависимой пролиферации эндометрия, обманчиво. Во-первых, при использовании любого КОК достигается снижение преовуляторного подъема эстрадиола, что снижает эстрогенную нагрузку на эндометрий. Во-вторых, дополнительный антипролиферативный потенциал достигается увеличением экспозиции прогестина на более длительный, по сравнению с 10–12-дневным физиологическим действием прогестерона, срок. В-третьих, этинилэстрадиол в составе КОК обеспечивает экспрессию рецепторов прогестерона и, следовательно, повышение чувствительности эндометрия к действию прогестинов. Тем не менее с позиций получения дополнительного, лечебно-профилактического антипролиферативного эффекта желательно использовать КОК, в состав которых входит прогестин, имеющий «запас дозы» по прогестагенному действию на эндометрий.
Фармакологические отличия прогестинов также важны. Полноту эффекта определяет фармакокинетика молекулы, и такие прогестины, как ципротерона ацетат, дезогестрел и дроспиренон теряют в активности из-за своей неполной или вариабельной биодоступности. Два прогестина, входящие в состав КОК, имеют стабильно высокую биодоступность при запасе дозы для подавления эстрогензависимой пролиферации эндометрия – левоноргестрел (100%) и гестоден (99%).
Преимущество гестодена перед левоноргестрелом для большинства женщин состоит в отсутствии агонистического влияния на андрогеновые рецепторы и, следовательно, минимальной способностью вызывать андрогензависимые побочные эффекты. Эта реакция на прием большинства прогестинов – производных нортестостерона обусловлена не действием на рецепторы андрогенов, а вытеснением тестостерона из связи с глобулином, связывающим половые гормоны (ГСПГ). Поскольку синтез ГСПГ стимулируется эстрогенами в составе КОК, андрогензависимые побочные эффекты препаратов, содержащих производные нортестостерона, встречаются редко, и их вероятность снижается в линейке левоноргестрел – гестоден, дезогестрел, норгестимат – диеногест. Дополнительным преимуществом гестодена перед другими производными нортестостерона является его слабая антиминералокортикоидная активность, улучшающая переносимость КОК. Таким образом, препараты, содержащие гестоден, в том числе Линдинет-20R
и Линдинет-30R, можно считать средствами первого выбора для контрацепции у женщин, перенесших спорадический эпизод ДГЭ или входящих в группу риска по развитию РЭ.
Выбор дозы эстрогенного компонента в составе КОК зависит от возраста пациентки. В целом для профилактики ГЭ больше подходят низкодозированные КОК, содержащие 30 мкг этинилэстрадиола (Линдинет-30R). Данная позиция обосновывается двумя аргументами. Во-первых, наиболее частым симптомом ДГЭ являются аномальные маточные кровотечения (АМК). Во-вторых, АМК могут предшествовать развитию ГЭ, отражая один из наиболее значимых факторов риска патологической пролиферации эндометрия – ановуляцию. Поскольку значительная часть женщин, нуждающихся в применении КОК с целью контрацепции и профилактики ГЭ/РЭ, страдает нарушениями менструального цикла по типу АМК или имеет высокую вероятность их развития, выбор падает на низкодозированные КОК, лучше контролирующие менструальный цикл по сравнению с микродозированными комбинациями. Однако, рекомендуя КОК женщинам старше 35 лет, врач должен проявлять осторожность, ввиду повышения тромботических рисков. В соответствии с рекомендациями ВОЗ, для первичного назначения КОК женщинам старшего фертильного возраста следует предпочесть микродозированный КОК. Таким образом, средством выбора для женщин старшего фертильного возраста становится Линдинет-20R.
Кузнецова Ирина Всеволодовна, д.м.н., профессор, руководитель направления «Гинекологическая эндокринология» НОЧУ ДПО «Высшая медицинская школа»
Список исп. литературыСкрыть список
29 сентября 2020
Количество просмотров: 5468
«Клинические рекомендации «Гиперплазия эндометрия»
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ГИПЕРПЛАЗИЯ ЭНДОМЕТРИЯ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: N85.0, N85.1
Год утверждения (частота пересмотра): 2021
Возрастная категория: Взрослые
Год окончания действия: 2023
ID: 646
Разработчик клинической рекомендации
— Российское общество акушеров-гинекологов
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
ГЭ — гиперплазия эндометрия
РЭ — рак эндометрия
ЭА — эндометриоидная аденокарцинома
АГЭ — атипическая гиперплазия эндометрия
АМК — аномальное маточное кровотечение
УЗИ — ультразвуковое исследование
МРТ — магнитно-резонансная томография
ЛНГ-ВМС — левоноргестрел-высвобождающая внутриматочная система
ГС — гистероскопия
ВОЗ — Всемирная организация здравоохранения
СПЯ — синдром поликистозных яичников
аГн-РГ — агонисты гонадотропин-рилизинг-гормона
КОК — комбинированные оральные контрацептивы
Термины и определения
Гиперплазия эндометрия — это патологический процесс слизистой оболочки матки, характеризующийся пролиферацией желез и увеличением железисто-стромального соотношения.
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Гиперплазия эндометрия (ГЭ) — это патологический процесс слизистой оболочки матки, характеризующийся пролиферацией желез и увеличением железисто-стромального соотношения [1].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Одной из ведущих причин развития ГЭ является абсолютная или относительная гиперэстрогения. К патогенетическим механизмам формирования ГЭ относят также подавление процессов апоптоза, о чем свидетельствует нарушение баланса активности подавляющей апоптоз системы генов Bcl-2 и проапоптотической системы генов Fas/FasL [2], [3]. ГЭ может возникать на фоне мутаций гена супрессора опухолей PTEN (phosphatase/tensin homolog) [4].
Факторы риска ГЭ можно разделить на три группы (1) раннее менархе или поздняя менопауза, бесплодие, ановуляция, обусловленная фазой менопаузального перехода и/или синдромом поликистозных яичников (СПЯ), (2) ятрогенные факторы (монотерапия эстрогенами или тамоксифеном); и (3) сопутствующие заболевания (ожирение, сахарный диабет (СД) 2-го типа, артериальная гипертензия и синдром Линча, а также эстроген-секретирующие опухоли яичников, например, гранулезно-клеточные опухоли) [5], [6].
ГЭ без атипии характеризуется поликлональными и диффузными изменениями, атипическая ГЭ (АГЭ) — моноклональными поражениями, которые могут прогрессировать до эндометриоидной аденокарциномы (ЭА), являющейся основным гистологическим подтипом рака эндометрия (РЭ) [7]. Риск прогрессирования ГЭ без атипии в РЭ в течение 20 лет достигает 5%, при АГЭ риск возрастает до 27,5% [8].
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
По результатам популяционного исследования повозрастной частоты различных типов ГЭ (тестировано 63688 образцов эндометрия), обобщенная частота ГЭ составляет — 133 случая на 100 000 женщин-лет, при этом максимум (386 на 100 000 женщин-лет) приходится на возраст 50 — 54 года, минимум (6 на 100 000 женщин-лет) — на возраст до 30 лет. Частота простой ГЭ составляет 58 случаев на 100 000 женщин-лет, сложной ГЭ — 63 на 100 000 и АГЭ — 17 на 100 000 [9].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
N85.0 Железистая гиперплазия эндометрия
N85.1 Аденоматозная гиперплазия эндометрия
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
В настоящее время в клинической практике используется бинарная классификация Всемирной организации здравоохранения (ВОЗ) 2014 года (оставленная без изменений в редакции 2020 года). Согласно этой классификации выделяют две формы [1], [10].
— гиперплазия эндометрия без атипии
— гиперплазия эндометрия с атипией.
Ранее в международной клинической практике использовалась классификация ВОЗ 2003 года, включающая 4 категории ГЭ: простая и сложная ГЭ без атипии, простая и сложная АГЭ, но в связи с низкой воспроизводимостью диагнозов она была упрощена до бинарной классификации [11], [12], [13].
Существует также альтернативная система — классификация ЭИН (эндометриальная интраэпителиальная неоплазия), где вместо термина «атипическая гиперплазия эндометрия» используется термин «эндометриальная интраэпителиальная неоплазия» [14]. ЭИН предполагает наличие латентных генетически трансформированных клеток (недоступных световой микроскопии), которые могут привести к возникновению мутантных клонов, проявляющихся фенотипически структурными и цитологическими перестройками. В классификации ЭИН также есть категория доброкачественной ГЭ. Американская коллегия акушеров и гинекологов (2015), рекомендует клиническое применение классификации ЭИН, как более объективной, основанной на морфометрических параметрах [15]. С 2014 г. термин «ЭИН» инкорпорирован в классификационную систему ВОЗ, которая рекомендует его использование наравне с термином «АГЭ», с единым гистологическим кодом (8380/2) [1], [10].
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
ГЭ проявляется аномальными маточными кровотечениями (АМК) в виде обильных или межменструальных маточных кровотечений при регулярном менструальном цикле или олигоменореи [16]. Характер АМК не позволяет предположить тип ГЭ. ГЭ формируется, как правило, на фоне прогестерон-дефицитного состояния и может быть причиной ановуляторного бесплодия [5], [6], [17], [18]. Для женщин с избыточной массой тела, ожирением, имеющих длительные ановуляторные менструальные циклы и увеличение конверсии андрогенов в эстрогены в жировой ткани, характерно повышение риска развития ГЭ и РЭ [19], [20].
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Диагноз ГЭ устанавливается на основании жалоб на АМК, анамнестических данных, физикального обследования, заключения УЗИ органов малого таза [21], [22], [23]. Окончательный диагноз ГЭ подтверждается патолого-анатомическим исследованием эндометрия [1], [7], [10], [24], [25], [26], [27].
2.1 Жалобы и анамнез
См. пункт 1.6 «Клиническая картина».
2.2 Физикальное обследование
— Рекомендуется всем пациенткам с ГЭ проведение физикального обследования по стандартным принципам пропедевтики, а также проведение осмотра шейки матки в зеркалах и бимануального влагалищного исследования [21], [22], [28].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии: Всем пациенткам с ГЭ необходимо вычислять ИМТ для диагностики избыточной массы тела или ожирения. ИМТ вычисляется по формуле: ИМТ (кг/м2) = масса тела (кг)/рост2 (м2). Ожирение является доказанным фактором риска ГЭ и РЭ, влияет на восстановление репродуктивной функции и исходы беременностей, увеличивает риск сердечно-сосудистых заболеваний. При ожирении снижается эффективность терапии и вероятность последующей ремиссии ГЭ.
2.3 Лабораторные диагностические исследования
— Рекомендуется проведение контроля лабораторных данных с целью выявления сопутствующих заболеваний, предоперационного обследования и определения тактики ведения всем пациенткам с подозрением на ГЭ [21], [22].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5).
Комментарии: В комплекс лабораторных обследований целесообразно включить общий (клинический) анализ крови, анализ крови биохимический общетерапевтический с оценкой печеночных ферментов (аланинаминотрансфераза, аспартатаминотрансфераза, щелочная фосфатаза) и с определением уровня ферритина, коагулограмму (ориентировочное исследование системы гемостаза), оценку гормонов сыворотки крови для диагностики и выявления причин ановуляции и олигоменореи (исследование уровня фолликулостимулирующего гормона в сыворотке крови, исследование уровня лютеинизирующего гормона в сыворотке крови, исследование уровня прогестерона в крови, исследование уровня свободного тестостерона, андростендиона, дегидроэпиандростерона сульфата в крови, исследование уровня пролактина в крови, тиреоидные гормоны — исследование уровня тиреотропного гормона в крови, свободного тироксина сыворотки крови), проведение скрининга на ИППП (Chlamydia trachomatis, Neisseria gonorrhoeae, Trichomonas vaginalis, Mycoplasma genitalium) методом ПЦР (при подозрении на инфекции), исследование уровня хорионического гонадотропина в крови [21], [22].
— Рекомендуется проводить микроскопическое исследование влагалищных мазков у пациенток с подозрением на ГЭ для исключения воспалительных заболеваний органов малого таза [21], [22].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
— Рекомендуется проведение цитологического исследования микропрепарата шейки матки у пациенток с подозрением на ГЭ с целью выявления цервикальной интраэпителиальной неоплазии [21], [22], [29].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
2.4 Инструментальные диагностические исследования
— Рекомендуется всем пациенткам с ГЭ проведение УЗИ органов малого таза (по возможности трансвагинального) для оценки состояния эндо- и миометрия [23], [25], [26], [27], [30], [31].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 2)
Комментарии: УЗИ органов малого таза, проводимое при возможности в 1ую фазу цикла или на фоне АМК, рассматривается как скрининговая процедура для оценки эндо- и миометрия. В репродуктивном возрасте увеличение м-эхо более 7 — 8 мм на 5 — 7-й дни цикла при неоднородной структуре с эхогенными включениями позволяет заподозрить ГЭ. Четких эхографических признаков ГЭ в репродуктивном возрасте нет, в связи с чем диагностическая значимость УЗИ для выявления ГЭ у женщин данной возрастной группы ограничена. В постменопаузе при толщине эндометрия 3 — 4 мм вероятность РЭ составляет менее 1% [23]. В постменопаузе у женщин с АМК при толщине эндометрия менее 5 мм, риск развития РЭ составляет примерно 0,07% и 7,3% при эндометрии более 5 мм [30], [32]. Не рекомендуется рутинно использовать магнитно-резонансную томографию (МРТ) органов малого таза в качестве метода диагностики ГЭ. Однако этот метод рассматривается как перспективный в дифференциальной диагностике АГЭ и РЭ. Поскольку МРТ с использованием диффузно взвешенных последовательностей позволяет выявить начальные признаки инвазии ткани эндометрия в миометрий, характерные для ранней стадии РЭ [33].
— Рекомендуется при подозрении на ГЭ по данным УЗИ органов малого таза проведение патологото-анатомического исследования биопсийного (операционного) материала эндометрия, полученного путем биопсии эндометрия или диагностического выскабливания полости матки по возможности под контролем гистероскопии [34], [35], [36], [37], [31].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 2)
Комментарии: Гистероскопия (ГС) обеспечивает проведение биопсии или диагностического выскабливания полости матки с удалением очаговых поражений, включая полипы эндометрия или субмукозные миоматозные узлы под визуальным контролем [34], [35], [36], [37], [31].
— Рекомендовано при подозрении на ГЭ по данным УЗИ органов малого таза проведение биопсии эндометрия у пациенток репродуктивного возраста с регулярным менструальным циклом [34], [35], [36], [37], [31].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 2)
— Рекомендуется окончательный диагноз ГЭ у пациенток с рецидивирующей ГЭ, наличием факторов риска развития РЭ в перименопаузе и постменопаузе ставить на основании результатов патолого-анатомического исследования эндометрия, полученного при диагностическом выскабливании полости матки (при отсутствии условий выполнения гистероскопии) [1], [7], [25], [26], [27], [31].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 2)
2.5 Иные диагностические исследования
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Терапия ГЭ включает консервативное (гормональное) и оперативное лечение. Выбор тактики ведения ГЭ зависит от морфологического патолого-анатомического заключения, возраста пациентки, ее репродуктивных планов, наличия факторов риска ГЭ и сопутствующей гинекологической и экстрагенитальной патологии [25], [26], [27]. Цель терапии ГЭ состоит в купировании АМК, профилактике рецидивов ГЭ и развитии РЭ.
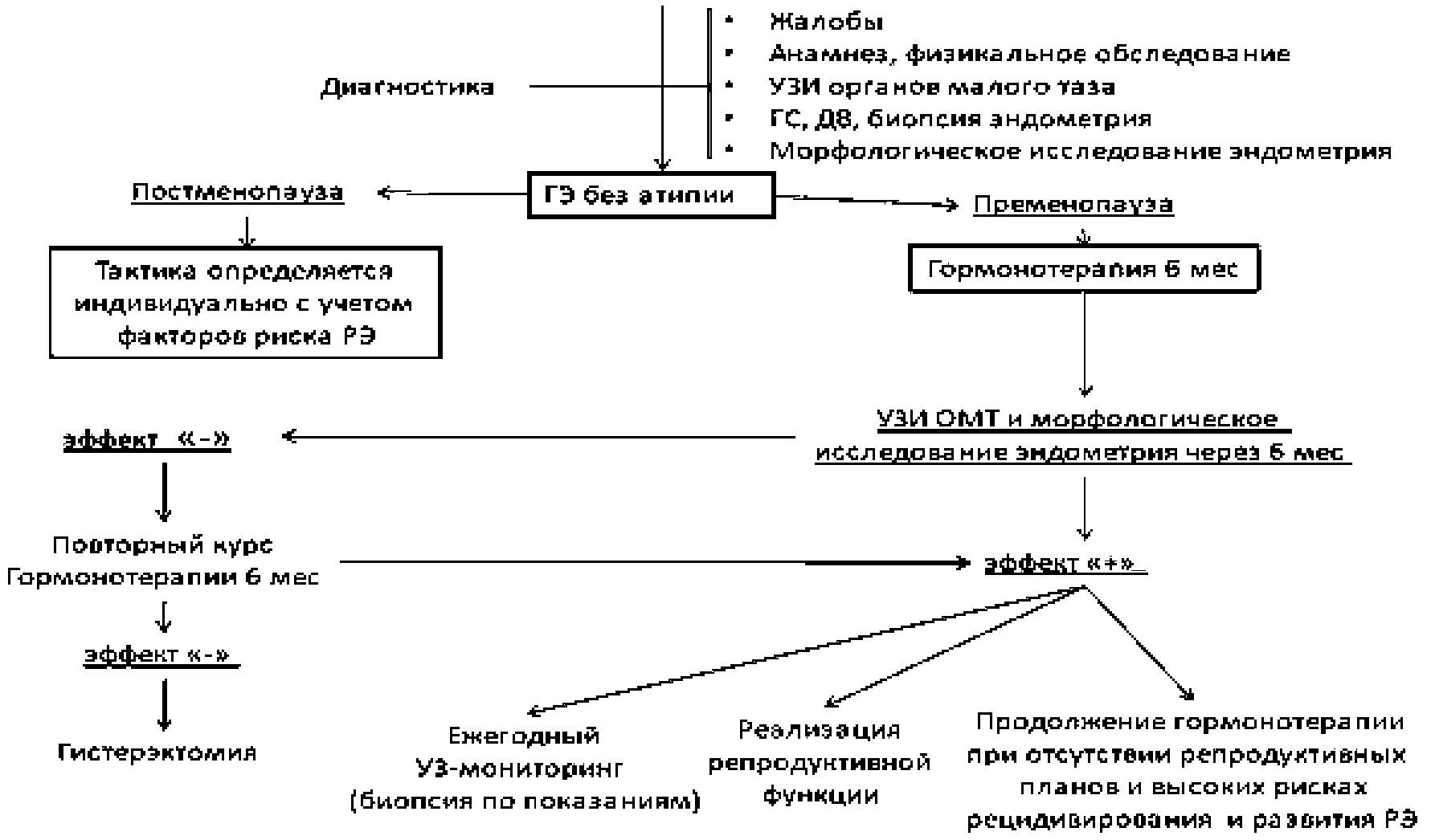
3.1 Тактика ведения пациенток с ГЭ без атипии
— Рекомендуется после морфологической верификации диагноза ГЭ в качестве медикаментозной терапии локальное воздействие #левоноргестрела в форме внутриматочной терапевтической системы (по АТХ — Пластиковые спирали с гестагенами) [38], [39], [40], [41].
Уровень убедительности рекомендаций A (уровень достоверности доказательств — 1)
Комментарии: Эффективность левоноргестрел-высвобождающей внутриматочной системы (ЛНГ-ВМС) при ГЭ без атипии достигает 100% при минимальном системном воздействии и побочных эффектов [6], [7], [38], [39], [40], [41]. По результатам обзора 2020 года, включающего 11 рандомизированных клинических исследований, частота регресса ГЭ на фоне ЛНГ-ВМС в 3 раза выше в сравнении с пероральными формами прогестагенов [41].
— Рекомендуется после морфологической верификации диагноза ГЭ в случае противопоказаний к ЛНГ-ВМС или отказа от ее введения терапия прогестагенами (по анатомо-терапевтическо-химической классификации лекарственных средств (АТХ) — Прогестагены) в непрерывном или пролонгированном циклическом режимах [38], [39], [40], [42], [43].
Уровень убедительности рекомендаций — B (уровень достоверности доказательств — 2)
Комментарии: В случае противопоказаний к ЛНГ-ВМС или отказа от ее введения при ГЭ без атипии возможно назначение в непрерывном или пролонгированном циклическом режимах прогестагенов. Прогестагены в циклическом режиме менее эффективны для регрессии ГЭ без атипии в сравнении с непрерывным режимом приема и ЛНГ-ВМС [6], [7], [38], [39], [40], [42], [43].
— Рекомендуется применение агонистов гонадотропин-рилизинг-гормона (аГн-РГ) (по АТХ — Аналоги гонадотропин-рилизинг гормона) при сочетании ГЭ с миомой матки и эндометриозом [44], [45], [46], [47].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 4)
Комментарии: Применение аГн-РГ целесообразно при сочетании ГЭ с миомой матки или эндометриозом [44], [45], [46], [47]. При выраженных симптомах эстроген-дефицита и необходимости проведении терапии более 6 месяцев целесообразно назначение возвратной терапии препаратами для непрерывного режима менопаузальной гормонотерапии [47].
— Рекомендуется при морфологически верифицированной ГЭ проводить терапию #левоноргестрелом в форме внутриматочной терапевтической системы (по АТХ — Пластиковые спирали с гестагенами) или прогестагенами в течение 6 месяцев с последующим патолого-анатомическим исследованием биопсийного (операционного) материала эндометрия (при наличии внутриматочной терапевтической системы — без ее удаления) для определения дальнейшей тактики ведения [39], [41], [42], [43], [48], [49], [50].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 3)
Комментарии: Для контроля эффективности лечения ГЭ без атипии забор ткани эндометрия для патолого-анатомического исследования как при биопсии, так и при ГС и ДВ слизистой полости матки. Проведение 6 месячного курса терапии ЛНГ-ВМС (в сравнении с 3-х месячным) увеличивает эффективность регресса ГЭ с 84% до 100%, пероральных прогестагенов с 50% до 64% [48]. Если нет побочных эффектов и пациентка не заинтересована в беременности, целесообразно продлить терапию ЛНГ-ВМС на срок до 5 лет, для снижения риска рецидивов ГЭ, проводя ежегодный УЗИ-мониторинг за состоянием эндометрия и биопсию эндометрия [49], [50].
— Рекомендуется информировать пациентку о возможности рецидива ГЭ после завершения курса терапии [42], [49], [50].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 3)
Комментарии: Несмотря на значительно более высокую эффективность ЛНГ-ВМС в сравнении с непрерывным или циклическим режимами прогестагенов, после отмены 6-месячного курса терапии частота рецидивов через 2 года может достигать примерно 40% [50]. Рецидивы значительно чаще возникают у пациенток с ИМТ >= 35 кг/м2.
— Рекомендуется при отсутствии эффекта от консервативного лечения и прогрессировании ГЭ рассмотреть вопрос о хирургическом лечении (гистерэктомия, по возможности, лапароскопическим доступом или резекция эндометрия под гистероскопическим контролем (гистерорезектоскопия)) [27], [54], [55], [56].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии: Вопрос о гистерэктомии решается при незаинтересованности пациентки в реализации репродуктивной функции, при прогрессировании ГЭ в АГЭ, при рецидиве ГЭ после 12 месячного курса лечения, при отказе пациентки от консервативного лечения [27].
— Не рекомендуется проводить аблацию эндометрия для лечения ГЭ [27].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
— Рекомендуется у пациенток с ГЭ и бесплодием лечение проводить в соответствии с клиническими рекомендациями «Женское бесплодие» [18], [57], [58].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
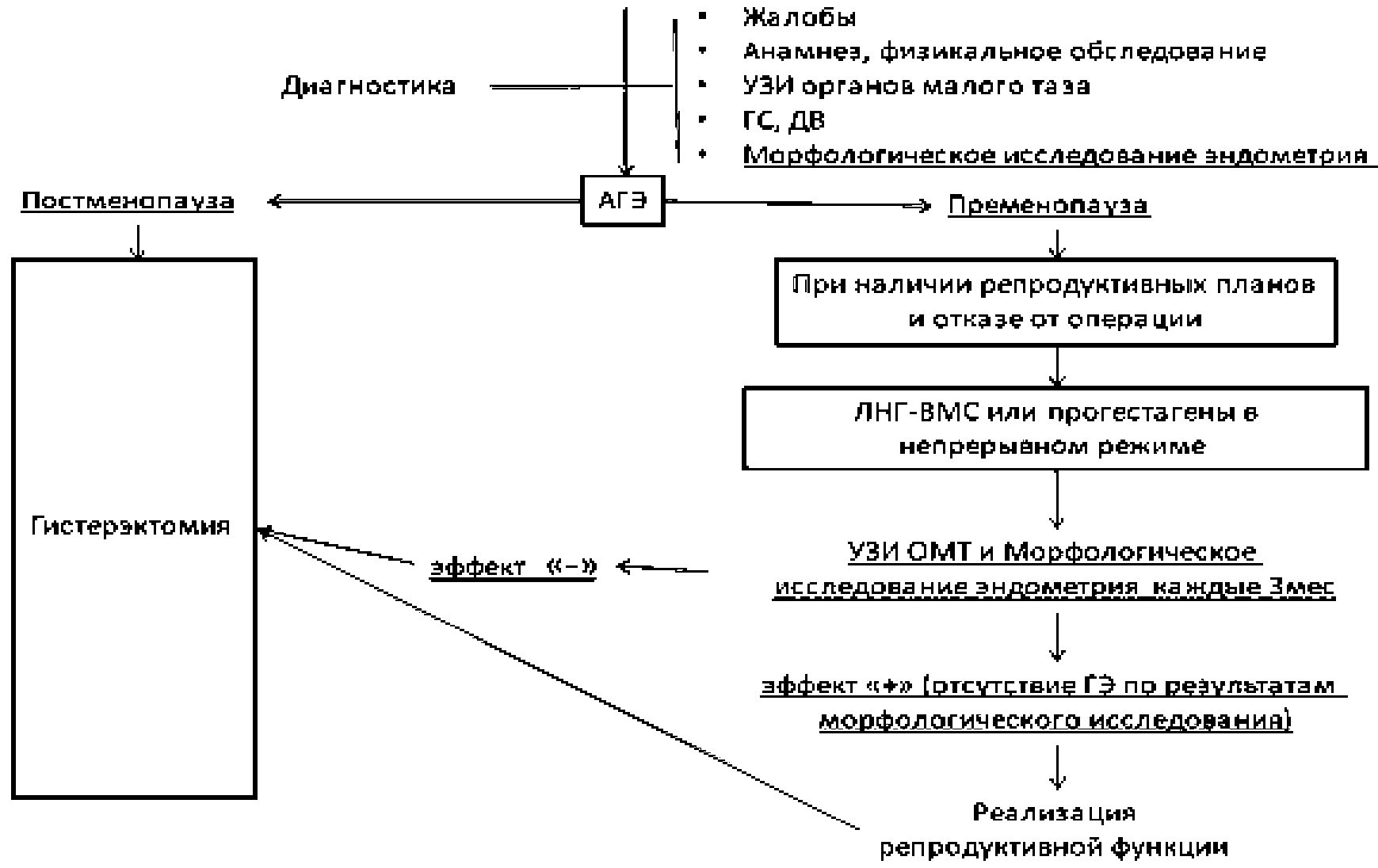
3.2 Тактика ведения женщин с АГЭ
— Рекомендуется при АГЭ проведение гистерэктомии, по возможности, лапароскопическим доступом [55], [56], [59], [60], [61].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 4)
Комментарии: Необходимо проведение гистерэктомии ввиду высокой вероятности сопутствующего РЭ (по некоторым данным диагностируется в 40 — 60% случаев) [59], [60], [61].
Окончательный объем — гистерэктомия с маточными трубами, а в ряде случаев — гистерэктомия с придатками, решается в зависимости от сопутствующей патологии и факторов риска [61].
— Рекомендуется при выявлении АГЭ у пациенток репродуктивного возраста с настойчивым желанием сохранить детородную функцию и отказе от гистерэктомии, проведение врачебной комиссии для определения возможности консервативного лечения путем локального введения #левоноргестрела в форме внутриматочной терапевтической системы (по АТХ — Пластиковые спирали с гестагенами) или прогестагенами (по анатомо-терапевтическо-химической классификации лекарственных средств (АТХ) — Прогестагены) в непрерывном режиме с обязательным патолого-анатомическим исследованием биопсийного (операционного) материала эндометрия каждые 3 месяца [51], [53], [57], [58], [59], [60], [61], [62], [63], [64], [65], [66], [67], [68], [69], [70].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 2)
Комментарии: О возможности проведения консервативной терапии свидетельствуют литературные данные о частоте регрессии заболевания в 85,6% случаев, в то время как рецидив возможен в 26% случаев [65]. При оценке результатов применения ЛНГ-ВМС и оральных прогестагенов выявлено, что регрессия ГЭ, индуцированная ЛНГ-ВМС, происходит достоверно чаще (90% по сравнению с 69%) [39]. При АГЭ вероятность сопутствующего РЭ диагностируется в 40 — 60% случаев, что свидетельствует о целесообразности гистерэктомии при АГЭ [59], [60].
4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
Специфической реабилитации нет.
Консультация врача-физиотерапевта для определения программы реабилитации.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
— Рекомендуется динамическое наблюдение с проведением ультразвукового исследования органов малого таза и ежегодным проведением биопсии эндометрия пациенткам из группы высокого риска рецидива ГЭ и развития РЭ [51], [52], [53].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 3)
Комментарии: График наблюдения может меняться в зависимости от клинической ситуации. Оптимальная частота и кратность обследований четко не определена из-за малого количества опубликованных данных. В течение первого года рекомендована биопсия эндометрия каждые 6 месяцев, со снятием с учета при отсутствии ГЭ по данным 2 последовательных патолого-анатомических исследований биопсийного (операционного) материала эндометрия [25], [26], [27].
Факторами риска рецидива ГЭ и развития РЭ являются: избыточная масса тела и ожирение, СПЯ и др. [17], [19], [20], [51], [52], [53].
При ожирении снижается эффективность терапии и вероятность последующей ремиссии ГЭ. Необходима модификация факторов риска, лечение ожирения, СД, артериальной гипертензии, СПЯ и нормализации массы тела. Комплекс мер должен включать физические нагрузки и рациональное сбалансированное питание, снижение каллоража на 30% для достижения и поддержания нормальной массы тела. Физическая активность должна составлять минимум 150 минут в неделю, включая упражнения на укрепление мышц в течение 2 дней в неделю. График и интенсивность тренировок подбирается индивидуально [19], [20], [53].
Показано, что длительный прием прогестагенов снижает риск ГЭ, прием комбинированных оральных контрацептивов (КОК) приводит к снижению риска развития РЭ [71], хотя нет доказательной базы об эффективности КОК для профилактики рецидивов ГЭ.
6. Организация оказания медицинской помощи
Показания для госпитализации в медицинскую организацию:
— Проведение оперативного лечения
— Аномальные маточные кровотечения
Показания к выписке из медицинской организации:
— купирование АМК
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Не требуется.
Критерии оценки качества медицинской помощи
N
Критерии качества
Оценка выполнения (да/нет)
1
Выполнена патолого-анатомическое исследование биопсийного (операционного) материала (при установлении диагноза)
Да/нет
2
Выполнено УЗИ органов малого таза
Да/нет
3
Назначено гормональное лечение при ГЭ без атипии
Да/нет
4
Выполнено патолого-анатомическое исследование биопсийного (операционного) материала эндометрия для оценки излеченности гиперплазии эндометрия
Да/нет
5
Пациентка информирована о необходимости устранения модифицируемых факторов риска
Да/нет
Список литературы
1. Cree IA, White VA, Indave BI, Lokuhetty D. Revising the WHO classification: female genital tract tumours. Histopathology. 2020 Jan; 76(1): 151 — 156. doi: 10.1111/his.13977.
2. Hutt S, Tailor A, Ellis P, Michael A, Butler-Manuel S, Chatterjee J. The role of biomarkers in endometrial cancer and hyperplasia: a literature review. Acta Oncol. 2019 Mar; 58(3): 342 — 352. doi: 10.1080/0284186X.2018.1540886.
3. Allison KH, Tenpenny E, Reed SD, Swisher EM, Garica RL. Immunohistochemical markers in endometrial hyperplasia: is there a panel with promise? A review. Appl Immunohistochem Mol Morphol 2008; 16: 329-43.
4. Russo M, Newell JM, Budurlean L, Houser KR, Sheldon K, Kesterson J, et al. Mutational profile of endometrial hyperplasia and risk of progression to endometrioid adenocarcinoma. Cancer. 2020 Jun 15; 126(12): 2775 — 2783. doi: 10.1002/cncr.32822.
5. Габидуллина Р.И., Смирнова Г.А., Нухбала Ф.Р. и др. Гиперпластические процессы эндометрия: современная тактика ведения пациенток. Гинекология. 2019; 21 (6): 53 — 58. DOI: 10.26442/20795696.2019.6.190472.
6. Chandra V, Kim JJ, Benbrook DM, et al. Therapeutic options for management of endometrial hyperplasia. J Gynecol Oncol 2016; 27: e8.
7. Sanderson PA, Critchley HO, Williams AR, Arends MJ, Saunders PT. New concepts for an old problem: the diagnosis of endometrial hyperplasia. Hum Reprod Update. 2017 Mar 1; 23(2): 232 — 254. doi: 10.1093/humupd/dmw042.
8. Lacey JV Jr, Sherman ME, Rush BB, Ronnett BM, Ioffe OB, Duggan MA, et al. Absolute risk of endometrial carcinoma during 20-year follow-up among women with endometrial hyperplasia. J Clin Oncol. 2010 Feb 10; 28(5): 788-92. doi: 10.1200/JCO.2009.24.1315.
9. Reed SD, Newton KM, Clinton WL, et al. Incidence of endometrial hyperplasia. Am J Obstet Gynecol 2009; 200. 678.e1-6.
10. Kurman R, Carcangiu M, Herrington C, Young R. World Health Organisation Classification of Tumors of Female Reproductive Organs, 4th edn Lyon France: International Agency for Research on Cancer (IARC) Press, 2014.
11. Tavassoli F, Devilee P (eds.). World Health Organization Classification of Tumours. Pathology and Genetics. Tumours of the Breast and Female Genital Organs. IARC Press, Lyon 2003; 217 — 228.
12. Pennant ME, Mehta R, Moody P, et al. Premenopausal abnormal uterine bleeding and risk of endometrial cancer. BJOG 2017; 124: 404-11.
13. Raffone A, Travaglino A, Saccone G, Insabato L, Mollo A, De Placido G, et al. Endometrial hyperplasia and progression to cancer: which classification system stratifies the risk better? A systematic review and meta-analysis. Arch Gynecol Obstet. 2019.
14. Mutter GL. Endometrial intraepithelial neoplasia (EIN): will it bring order to chaos? The Endometrial Collaborative Group. Gynecol Oncol. 2000 Mar; 76(3): 287-90. doi: 10.1006/gyno.1999.5580.
15. Committee on Gynecologic Practice, Society of Gynecologic Oncology. The American College of Obstetricians and Gynecologists Committee Opinion no. 631. Endometrial intraepithelial neoplasia. Obstet Gynecol. 2015 May; 125(5): 1272-8. doi: 10.1097/01.AOG.00004.
16. Fraser IS, Critchley HO, Broder M, et al. The FIGO recommendations on terminologies and definitions for normal and abnormal uterine bleeding. Semin Reprod Med 2011; 29: 383-90.
17. Walker K, Decherney AH, Saunders R. Menstrual Dysfunction in PCOS. Clin Obstet Gynecol. 2021 Mar 1; 64(1): 119 — 125. doi: 10.1097/GRF.0000000000000596. PMID: 33481414.
18. Tian Y, Liu Y, Wang G, Lv Y, Zhang J, Bai X, et al. Endometrial hyperplasia in infertile women undergoing IVF/ICSI: A retrospective cross-sectional study. J Gynecol Obstet Hum Reprod. 2020 Apr 29: 101780. doi: 10.1016/j.jogoh.2020.101780.
19. Wise MR, Jordan V, Lagas A, Showell M, Wong N, Lensen S, et al. Obesity and endometrial hyperplasia and cancer in premenopausal women: A systematic review. Am J Obstet Gynecol 2016; 214: 689.e1 — 689.e17.
20. Beavis AL, Cheema S, Holschneider CH, et al. Almost half of women with endometrial cancer or hyperplasia do not know that obesity affects their cancer risk. Gynecol Oncol Rep 2015; 13: 71-5.
21. Singh S, Best C, Dunn S, Leyland N, Wolfman WL; CLINICAL PRACTICE — GYNAECOLOGY COMMITTEE. Abnormal uterine bleeding in pre-menopausal women. J Obstet Gynaecol Can. 2013 May; 35(5): 473 — 475. English, French. doi: 10.1016/S1701-2163(15) 30939-7. PMID: 237.
22. Heavy menstrual bleeding: assessment and management NICE guideline [NG88] Published date: 14 March 2018 Last updated: 31 March 2020.
23. ACOG Committee Opinion No. 426: The Role of Transvaginal ultrasonography in the Evaluation of Postmenopausal Bleeding Obstetrics & Gynecology: February 2009 — Volume 113 — Issue 2 Part 1 — p 462 — 464.
24. World Health Organization Classification of Tumors. WHO, 2003-14, P. 53 — 58.
25. HKCOG GUIDELINES NUMBER 16 (September 2015). Guidelines on Clinical Management of Endometrial Hyperplasia, published by The Hong Kong College of Obstetricians and Gynaecologists, A Foundation College of Hong Kong Academy of Medicine.
26. Auclair MH, Yong PJ, Salvador S, Thurston J, Colgan TTJ, Sebastianelli A. Guideline No. 392-Classification and Management of Endometrial Hyperplasia. J Obstet Gynaecol Can. 2019 Dec; 41(12): 1789 — 1800. doi: 10.1016/j.jogc.2019.03.025.
27. Gallos ID, Alazzam M, Clark T, Faraj R, Rosenthal A, Smith P GJ. RCOG Green-top Guideline: Management of Endometrial Hyperplasia. Royal College of Obstetricians & Gynaecologists. 2016.
28. Савельева Г.М. и др. Национальное руководство // Акушерство-М.: Гэотар-Медиа. — 2015.
29. Unim B. et al. Role of pap-test in cervical cancer prevention: a systematic review and meta-analysisBrigid Unim // European Journal of Public Health. — 2014. — Т. 24.
30. Schmidt, T., Breidenbach, M., Nawroth, F., Mallmann, P., Beyer, I. M., Fleisch, M. C., et al. Hysteroscopy for asymptomatic postmenopausal women with sonographically thickened endometrium. Maturitas, 2009, 62, 176 — 178.
31. Wanderley MD, lvares MM, Vogt MF, Sazaki LM. Accuracy of Transvaginal Ultrasonography, Hysteroscopy and Uterine Curettage in Evaluating Endometrial Pathologies. Rev Bras Ginecol Obstet. 2016 Oct; 38(10): 506 — 511. doi: 10.1055/s-0036-1593774. Epub 2016.
32. Smith-Bindman R, Weiss E, Feldstein V. How thick is too thick? When endometrial thickness should prompt biopsy in postmenopausal women without vaginal bleeding. Ultrasound in Obstetrics and Gynecology, 2004, 24, 558-65.
33. Natarajan P, Vinturache A, Hutson R, Nugent D, Broadhead T. The value of MRI in management of endometrial hyperplasia with atypia. World J Surg Oncol. 2020 Feb 10; 18(1): 34. doi: 10.1186/s12957-020-1811-5.
34. Hwang WY, Suh DH, Kim K, No JH, Kim YB. Aspiration biopsy versus dilatation and curettage for endometrial hyperplasia prior to hysterectomy. Diagn Pathol. 2021 Jan 14; 16(1): 7. doi: 10.1186/s13000-020-01065-0. PMID: 33441173; PMCID: PMC7807457.
35. Lee N, Lee KB, Kim K, Hong JH, Yim GW, Seong SJ, Lee B, Lee JM, Cho J, Lim S, Ouh YT, Kim YB. Risk of occult atypical hyperplasia or cancer in women with nonatypical endometrial hyperplasia. J Obstet Gynaecol Res. 2020 Sep 17. doi: 10.1111/jog.14474.
36. Management of acute abnormal uterine bleeding in nonpregnant reproductive-aged women. Committee Opinion No. 557. American College of Obstetricians and Gynecologists. Obstet Gynecol 2013.
37. Bedner R, Rzepka-Gorska I. Hysteroscopy with directed biopsy versus dilatation and curettage for the diagnosis of endometrial hyperplasia and cancer in perimenopausal women. Eur J Gynaecol Oncol. 2007; 28(5): 400-2. PMID: 17966221.
38. Abu Hashim H, Ghayaty E, El Rakhawy M. Levonorgestrel-releasing intrauterine system vs oral progestins for non-atypical endometrial hyperplasia: a systematic review and meta-analysis of randomized trials. Am J Obstet Gynecol 2015; 213: 469-78.
39. Gallos ID, Shehmar M, Thangaratinam S, Papapostolou TK, Coomarasamy A, Gupta JK. Oral progestogens vs levonorgestrel-releasing intrauterine system for endometrial hyperplasia: a systematic review and metaanalysis. Am J Obstet Gynecol. 2010.
40. El Behery MM, Saleh HS, Ibrahiem MA, Kamal EM, Kassem GA, Mohamed Mel S. Levonorgestrel-releasing intrauterine device versus dydrogesterone for management of endometrial hyperplasia without atypia. Reprod Sci. 2015 Mar; 22(3): 329-34. doi: 10.1177/19337.
41. Mittermeier T, Farrant C, Wise MR. Levonorgestrel-releasing intrauterine system for endometrial hyperplasia. Cochrane Database Syst Rev. 2020 Sep 6; 9: CD012658. doi: 10.1002/14651858.CD012658.
42. Sletten ET, Arnes M, Lys LM, Larsen M, Orbo A. Significance of progesterone receptors (PR-A and PR-B) expression as predictors for relapse after successful therapy of endometrial hyperplasia: a retrospective cohort study. BJOG. 2019 Jun; 126(7): 936-94.
43. Marra C, Penati C, Ferrari L, Cant MG, Bargossi L, Fruscio R. Treatment of simple and complex endometrial non-atypical hyperplasia with natural progesterone: response rate to different doses. Gynecol Endocrinol. 2014; 30(12): 899 — 901. doi: 10.3109/0951.
44. Адамян Л.В., ред. Сочетанные доброкачественные опухоли и гиперпластические процессы матки (миома, аденомиоз, гиперплазия эндометрия). Клинические рекомендации по ведению больных. М.; 2015.
45. Andreeva E, Absatarova Y. Triptorelin for the treatment of adenomyosis: A multicenter observational study of 465 women in Russia. Int J Gynaecol Obstet. 2020 Dec; 151(3): 347 — 354. doi: 10.1002/ijgo.13341. Epub 2020 Sep 19. PMID: 32815156; PMCID: PMC7756.
46. Zhang Y, Sun L, Guo Y, Cheng J, Wang Y, Fan S, Duan H. The impact of preoperative gonadotropin-releasing hormone agonist treatment on women with uterine fibroids: a meta-analysis. Obstet Gynecol Surv. 2014 Feb; 69(2): 100-8. doi: 0.1097/OGX.000000000000.
47. Agorastos T, Vaitsi V, Paschopoulos M, Vakiani A, Zournatzi-Koiou V, Saravelos H, et al. Prolonged use of gonadotropin-releasing hormone agonist and tibolone as add-back therapy for the treatment of endometrial hyperplasia. Maturitas. 2004 Jun 15; 48(2).
48. Dolapcioglu K, Boz A, Baloglu A. The efficacy of intrauterine versus oral progestin for the treatment of endometrial hyperplasia. A prospective randomized comparative study. Clin Exp Obstet Gynecol 2013; 40: 122-6.
49. Gallos ID, Krishan P, Shehmar M, et al. Relapse of endometrial hyperplasia after conservative treatment: a cohort study with long-term follow-up. Hum Reprod 2013; 28: 1231-6.
50. Orbo A, Arnes M, Vereide AB, Straume B. Relapse risk of endometrial hyperplasia after treatment with the levonorgestrel-impregnated intrauterine system or oral progestogens. BJOG. 2016 Aug; 123(9): 1512-9. doi: 10.1111/1471-0528.13763.
51. Renaud MC, Le T. SOGC-GOC-SCC Policy and Practice Guidelines Committee. Epidemiology and investigations for suspected endometrial cancer. J Obstet Gynaecol Can 2013; 35: 380-1.
52. Wise MR, Gill P, Lensen S, et al. Body mass index trumps age in decision for endometrial biopsy: cohort study of symptomatic premenopausal women. Am J Obstet Gynecol 2016; 215. 598.e1-8.
53. Rosen MW, Tasset J, Kobernik EK, Smith YR, Johnston C, Quint EH. Risk Factors for Endometrial Cancer or Hyperplasia in Adolescents and Women 25 Years Old or Younger. J Pediatr Adolesc Gynecol. 2019 Oct; 32(5): 546 — 549. doi: 10.1016/j.jpag.2019.06.004.
54. Evans EC, Matteson KA, Orejuela FJ, Alperin M, Balk EM, El-Nashar S, et al. Society of Gynecologic Surgeons Systematic Review Group. Salpingo-oophorectomy at the Time of Benign Hysterectomy: A Systematic Review. Obstet Gynecol. 2016 Sep; 128(3): 476-85.
55. Mourits MJ, Bijen CB, Arts HJ, ter Brugge HG, van der Sijde R, Paulsen L, et al. Safety of laparoscopy versus laparotomy in early-stage endometrial cancer: a randomised trial. Lancet Oncol 2010; 11: 763-71.
56. Galaal K, Bryant A, Fisher AD, et al. Laparoscopy versus laparotomy for the management of early stage endometrial cancer. Cochrane Database Syst Rev 2012; 9: CD006655.
57. Zapardiel I, Cruz M, Diestro MD, Requena A, Garcia-Velasco JA. Assisted reproductive techniques after fertility-sparing treatments in gynaecological cancers. Hum Reprod Update. 2016 Apr; 22(3): 281 — 305. doi: 10.1093/humupd/dmv066. Epub 2016 Jan 12. PMID.
58. Cao DY, Yu M. Pregnant rate and pregnancy-relating factors of patients with early endometrial carcinoma and severe atypical hyperplasia of endometrium after fertility-preserving treatment by progestin. Zhonghua Fu Chan Ke Za Zhi. 2013 Jul; 48(7).
59. Vetter MH, Smith B, Benedict J, Hade EM, Bixel K, Copeland LJ, et al. Preoperative predictors of endometrial cancer at time of hysterectomy for endometrial intraepithelial neoplasia or complex atypical hyperplasia. Am J Obstet Gynecol. 2020 Jan; 222(1):
60. Doherty MT, Sanni OB, Coleman HG, Cardwell CR, McCluggage WG, Quinn D, et al. Concurrent and future risk of endometrial cancer in women with endometrial hyperplasia: A systematic review and meta-analysis. PLoS One. 2020 Apr 28; 15(4): e0232231. doi: 10.1371/.
61. Salvador S, Scott S, Francis JA, et al. No. 344-Opportunistic salpingectomy and other methods of risk reduction for ovarian/fallopian tube/peritoneal cancer in the general population. J Obstet Gynaecol Can 2017; 39: 480-93.
62. Antonsen SL, Ulrich L, Hogdall C. Patients with atypical hyperplasia of the endometrium should be treated in oncological centers. Gynecol Oncol 2012; 125: 124-8.
63. Signorelli M, Caspani G, Bonazzi C, Chiappa V, Perego P, Mangioni C. Fertility-sparing treatment in young women with endometrial cancer or atypical complex hyperplasia: a prospective single-institution experience of 21 cases. BJOG. 2009 Jan; 116(1): 114.
64. Gallos ID, Yap J, Rajkhowa M, et al. Regression, relapse, and live birth rates with fertility-sparing therapy for endometrial cancer and atypical complex endometrial hyperplasia: A systematic review and metaanalysis. Am J Obstet Gynecol 2012; 207: 266.e.
65. Garzon S, Uccella S, Zorzato PC, Bosco M, Franchi MP, Student V, Mariani A. Fertility-sparing management for endometrial cancer: review of the literature. Minerva Med. 2021 Feb; 112(1): 55 — 69. doi: 10.23736/S0026-4806.20.07072-X. Epub 2020 Nov 18.
66. Trimble CL, Method M, Leitao M, et al. Management of endometrial precancers. Obstet Gynecol 2012; 120: 1160-75.
67. Fernandez-Montoli ME, Sabadell J, Contreras-Perez NA. Fertility-Sparing Treatment for Atypical Endometrial Hyperplasia and Endometrial Cancer: A Cochrane Systematic Review Protocol. Adv Ther. 2021 Apr 8. doi: 10.1007/s12325-021-01693-y.
68. Simpson AN, Feigenberg T, Clarke BA, et al. Fertility sparing treatment of complex atypical hyperplasia and low grade endometrial cancer using oral progestin. Gynecol Oncol 2014; 133: 229-33.
69. Kudesia R, Singer T, Caputo TA, et al. Reproductive and oncologic outcomes after progestin therapy for endometrial complex atypical hyperplasia or carcinoma. Am J Obstet Gynecol 2014; 210: 255.e14.
70. Koskas, M., Uzan, J. (2014). Prognostic factors of oncologic and reproductive outcomes in fertility-sparing management of endometrial atypical hyperplasia and adenocarcinoma: systematic review and meta-analysis. Fertility and Sterility, 101(3), 785 — 794.
71. Karlsson T, Johansson T, Hoglund J, Ek WE, Johansson. Time-Dependent Effects of Oral Contraceptive Use on Breast, Ovarian, and Endometrial Cancers. Cancer Res. 2021 Feb 15; 81(4): 1153 — 1162. doi: 10.1158/0008-5472.CAN-20-2476. Epub 2020 Dec 17.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Адамян Лейла Владимировна — Академик РАН, доктор медицинских наук, профессор, заместитель директора ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства Здравоохранения РФ, Заслуженный деятель науки России, заведующая кафедрой репродуктивной медицины и хирургии ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России, главный специалист Минздрава России по акушерству и гинекологии, является Президентом общества по репродуктивной медицине и хирургии, Российской ассоциации гинекологов-эндоскопистов, Российской ассоциации по эндометриозу, членом Российского общества акушеров-гинекологов.
Андреева Елена Николаевна — доктор медицинских наук, профессор, директор Института репродуктивной медицины, зав. отделением эндокринной гинекологии, профессор кафедры эндокринологии ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России, профессор кафедры репродуктивной медицины и хирургии ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России, является членом общества по репродуктивной медицине и хирургии, Российской ассоциации гинекологов-эндоскопистов, Российской ассоциации по эндометриозу, Российского общества акушеров-гинекологов, международной ассоциации акушеров-гинекологов и эндокринологов.
Артымук Наталья Владимировна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии имени профессора Г.А. Ушаковой ФГБОУ ВО «Кемеровский государственный медицинский университет» Минздрава России, главный внештатный специалист Минздрава России по акушерству и гинекологии в Сибирском федеральном округе (г. Кемерово), является членом президиума правления Российского общества акушеров-гинекологов, президент Кемеровской региональной общественной организации «Ассоциация акушеров-гинекологов».
Башмакова Надежда Васильевна — д.м.н., профессор, главный акушер-гинеколог УФО.
Беженарь Виталий Федорович — доктор медицинских наук, профессор, заведующий кафедрой акушерства, гинекологии и неонатологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России, является членом общества по репродуктивной медицине и хирургии, Российской ассоциации гинекологов-эндоскопистов, Российского общества акушеров-гинекологов.
Белокриницкая Татьяна Евгеньевна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии ФПК и ППС ФГБОУ ВО «Читинская государственная медицинская академия» Минздрава России, заслуженный врач Российской Федерации, главный внештатный специалист Минздрава России по акушерству и гинекологии в Дальневосточном федеральном округе (г. Чита), является членом Российского общества акушеров-гинекологов, президент Забайкальского общества акушеров-гинекологов.
Думановская Мадина Равилевна — кандидат медицинских наук, научный сотрудник отделения гинекологической эндокринологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства Здравоохранения РФ, является членом Ассоциации гинекологов-эндокринологов, Российского общества акушеров-гинекологов.
Сутурина Лариса Викторовна — д.м.н., профессор, руководитель отдела охраны репродуктивного здоровья ФГБНУ «Научный центр проблем здоровья семьи и репродукции человека» (г. Иркутск), является членом Ассоциации гинекологов-эндокринологов России, членом Российского общества акушеров-гинекологов.
Сметник Антонина Александровна — зав. отделением гинекологической эндокринологии, к.м.н., является членом Российского общества акушеров-гинекологов, вице-президент Российской ассоциации по менопаузе.
Тоноян Нарине Марзпетуновна — кандидат медицинских наук, врач-акушер-гинеколог отделения оперативной гинекологии ФГБУ «Научный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства Здравоохранения РФ.
Филиппов Олег Семенович — д.м.н., профессор, заместитель директора Департамента медицинской помощи детям и службы родовспоможения Министерства здравоохранения Российской Федерации, профессор кафедры акушерства и гинекологии ФГБОУ ВО МГМСУ им. А.И. Евдокимова Минздрава России (г. Москва).
Хохлова Светлана Викторовна — доктор медицинских наук, заведующая онкологическим отделением противоопухолевой лекарственной терапии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства Здравоохранения РФ.
Чернуха Галина Евгеньевна — доктор медицинских наук, профессор, заведующая отделением гинекологической эндокринологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства Здравоохранения РФ, является президентом Ассоциации гинекологов-эндокринологов, членом Российского общества акушеров-гинекологов.
Ярмолинская Мария Игоревна — доктор медицинских наук, профессор кафедры акушерства и гинекологии ФГБОУ ВО СЗГМУ имени И.И. Мечникова Минздрава России, руководитель отдела эндокринологии репродукции ФГБУ «НИИ акушерства и гинекологии имени Д.О. Отта», является членом Российского общества акушеров-гинекологов.
Конфликт интересов: Все члены рабочей группы заявляют об отсутствии конфликта интересов.
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций:
1. Врачи-акушеры-гинекологи, врачи-терапевты, врачи общей практики;
2. Студенты, ординаторы, аспиранты;
3. Преподаватели, научные сотрудники.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
УДД
Расшифровка
1
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
2
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
3
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
4
Несравнительные исследования, описание клинического случая
5
Имеется лишь обоснование механизма действия или мнение экспертов
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
УДД
Расшифровка
1
Систематический обзор РКИ с применением мета-анализа
2
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
3
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
4
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль»
5
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
УУР
Расшифровка
A
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
B
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
C
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию — не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
1) Приказ Министерства здравоохранения РФ от 20 октября 20 г. N 1130н «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)» (с изменениями и дополнениями);
2) Приказ Министерства здравоохранения РФ от 31 июля 2020 г. N 803н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению».
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
Гиперплазия эндометрия без атипии
Гиперплазия эндометрия с атипией
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Гиперплазия эндометрия — это патологический процесс, при котором происходит избыточное разрастание слизистой оболочки матки, чаще возникающее на фоне задержек менструаций. В большинстве случаев этот процесс не является злокачественным, но при определенных обстоятельствах может привести к раку эндометрия.
Эндометрий циклически изменяется на протяжении каждого менструального цикла в ответ на воздействие гормонов, вырабатываемых в яичниках. Во время первой фазы менструального цикла (фолликулярной фазы) яичники активно вырабатывают женские половые гормоны (эстрогены), это способствует росту эндометрия (пролиферации). Примерно в середине менструального цикла в одном из яичников происходит овуляция, после которой формируется желтое тело (временная эндокринная железа, необходимая для наступления и поддержания беременности), секретирующее гормон-прогестерон. Он необходим для подготовки эндометрия к имплантации эмбриона и его дальнейшего развития. Если беременность не наступает, уровни эстрогена и прогестерона уменьшаются, происходит отторжение слизистой оболочки матки (менструация). Этот процесс имеет циклический характер и повторяется каждый менструальный цикл.
Почему развивается гиперплазия эндометрия?
В большинстве случаев гиперплазия эндометрия возникает при отсутствии овуляции, на фоне избыточной продукции эстрогена и снижения прогестерона. В этих случаях происходит задержка менструации, эндометрий продолжает расти в ответ на действие эстрогенов. Весь этот процесс может приводить к нарушению клеточной дифференцировки, и является фактором риска развития онкологического процесса.
Гиперплазия эндометрия может проявиться в любом возрастном периоде, но чаще возникает на фоне ожирения, СПЯ или бесплодии, в период менопаузального перехода, когда овуляция становится редкой, а также в период менопаузы.
Помимо указанных состояний возможно развитие гиперплазии эндометрия:
— при приеме эстрогенных препаратов и тамоксифена, применяемого при РМЖ
Факторы риска возникновения гиперплазии эндометрия:
— возраст старше 35 лет
— отсутствие беременностей и родов в течение жизни
— позднее наступление менопаузы
— раннее начало менструаций
— отягощенный соматический анамнез: сахарный диабет, артериальная гипертензия
— ожирение
— курение
— семейный анамнез рака яичников, толстой кишки или матки
Диагноз гиперплазия эндометрия окончательно ставится на основании результатов патолого-анатомического исследования ткани эндометрия.
Выделяют два типа гиперплазии эндометрия:
— доброкачественная гиперплазия эндометрия (гиперплазия эндометрия без атипии)
— предраковые изменения эндометрия (гиперплазия эндометрия с атипией).
Наиболее частый симптом гиперплазии эндометрия — аномальное маточное кровотечение.
При возникновении хотя бы одного из нижеперечисленных симптомов, вам следует обратиться к акушеру-гинекологу:
— обильное кровотечение со сгустками во время менструации,
— менструация более 8 дней (обычно после задержки менструации)
— менструальные циклы короче 21 дня (считая с первого дня менструального цикла до первого дня следующего)
— межменструальные кровотечения
— любое кровотечение на фоне постменопаузы.
При наличии кровотечения необходимо проведение ультразвукового исследования органов малого таза с измерением толщины эндометрия (при утолщении эндометрия можно заподозрить гиперплазию эндометрия).
Для окончательного установления диагноза и остановки кровотечения проводится биопсия эндометрия или диагностическое выскабливание под контролем гистероскопии с последующей оценкой эндометрия под микроскопом. Гиперплазию эндометрия можно лечить препаратами прогестерона, как путем введения гормональной спирали, так и путем перорального или вагинального. Длительность терапии определяется индивидуально и зависит от возраста и типа гиперплазии.
При выявлении предраковой формы гиперплазии эндометрия возможно удаление матки (гистерэктомия).
Приложение Г1 — ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Не требуется
Сайт издательства «Медиа Сфера»
содержит материалы, предназначенные исключительно для работников здравоохранения. Закрывая это сообщение, Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
ГБУЗ МО «Московский областной научно-исследовательский институт акушерства и гинекологии» Минздрава Московской области, Москва, Россия
Чечнева М.А.
Московский областной НИИ акушерства и гинекологии
Гиперплазия эндометрия в пери- и постменопаузе
Авторы:
Капитанова О.В., Чечнева М.А.
Как цитировать:
Капитанова О.В., Чечнева М.А. Гиперплазия эндометрия в пери- и постменопаузе. Российский вестник акушера-гинеколога.
2020;20(3):35‑40.
Kapitanova OV, Chechneva MA. Endometrial hyperplasia in peri- and postmenopausal women. Russian Bulletin of Obstetrician-Gynecologist. 2020;20(3):35‑40. (In Russ.)
https://doi.org/10.17116/rosakush20202003135

Читать метаданные
Большая клиническая значимость гиперпластических процессов в эндометрии заключается в том, что они являются одной из самых распространенных причин маточных кровотечений у женщин в возрасте 45—55 лет и их госпитализации в стационар. Гиперплазия эндометрия, особенно с атипией, является значительной клинической проблемой, поскольку может предшествовать раку эндометрия. За последние несколько лет оценка состояния эндометрия изменилась в признании того, что патология эндометрия не всегда носит глобальный характер. Толщина эндометрия не может быть единственным признаком гиперплазии эндометрия.
Авторы:
Капитанова О.В.
ГБУЗ МО «Московский областной научно-исследовательский институт акушерства и гинекологии» Минздрава Московской области, Москва, Россия
Чечнева М.А.
Московский областной НИИ акушерства и гинекологии
Список литературы:
- Макаров, И.О. Онкологические аспекты гиперпластических процессов в эндометрии. Российский вестник акушера-гинеколога. 2011;1:13-16.
- Максимов С.Я., Гусейнов К.Д., Косников А.Г. Факторы риска возникновения злокачественных новообразований органов репродуктивной системы женщин. Вопросы онкологии. 2013;53:4:496-501.
- Руководство по гинекологии. Под ред. акад. РАМН, проф. Айламазяна Э.К. М.: МЕДпресс-информ; 2012.
- Савельева Г.М., Бреусенко В.Г., Каппушева Л.М. Постменопауза. Физиология и патология. Вестник Российской ассоциации акушеров-гинекологов. 2008;2:56-59.
- Ашрафян Л.А., Новикова Е.Г. Гинекологические аспекты в тенденциях заболеваемости и смертности от рака органов репродуктивной системы. Журнал акушерских и женских болезней. 2011;1:XLX:27-33.
- Доброхотова Ю.Э., Сапрыкина Л.В. Гиперплазия эндометрия. М.: ГЭОТАР-Медиа; 2018.
- Вихляева Е.М. Руководство по эндокринной гинекологии. М.: МИА; 2006.
- Стрижаков А.Н., Давыдов А.И., Пашков В.М. Доброкачественные заболевания матки. М. 2011.
- Сидорова И.С., Унанян А.Д., Власов Р.С., Евкина И., Карпов Д. Гиперпластические процессы эндометрия: особенности клиники и терапии. Врач. 2011;3:40-42.
- Серов В.Н. Клинико-физиологические основы гинекологической эндокринологии. М. 2008.
- Ragupathy, K, Cawley, N, Ridout, A, Iqbal, P, Alloub, M. Nonassessable endometrium in women with post-menopausal bleeding: to investigate or ignore. Arch Gynecol Obstet. 2013;288:375-378.
- Манухин И.Б., Тактаров В.Г., Шмелева С.В. Здоровье женщины в климактерии. Руководство. (Серия «Практические руководства»). 2010.
- Серов В.Н., Сухих Г.Т., Прилепская В.Н., Радзинский В.Е. Руководство по амбулаторно-поликлинической помощи в акушерстве и гинекологии. М.: ГЕОТАР-Медиа; 2016.
- Аксель Е.М. Заболеваемость и смертность от злокачественных новообразований органов женской репродуктивной системы в России. Онкогинекология. 2015;1:4-13.
- Endometrial cancer. Practice Bulletin N 149. American College of Obstetricians and Gynecologists. Obstet Gynecol. 2015;125:1006-1026.
- Бохман Я.В. Лекции по онкогинекологии. М.: Медицинское информационное агентство; 2007.
- Бочкарева Н.В., Фомина С.В., Коломиец Л.А. Развитие рака эндометрия у больных разных возрастных групп с гиперпластическими процессами эндометрия. Медицинская радиология и радиационная безопасность. 2009;3:333-338.
- Кузнецов Р.Э., Чернеховская Н.Е., Андреев В.Г., Поваляев А.В. Заболевания матки и придатков. Диагностическая лапароскопия. М.: МЕДпресс-информ; 2009.
- Бабурин Д.В., Унанян А.Л. Тактика ведения пациенток с атипической гиперплазией эндометрия. Архив акушерства и гинекологии им. В.Ф. Снегирева. 2016;4:188-192.
- Epidemiology and investigations for suspected endometrial cancer. Joint SOGC-GOC-SCC Clinical Practice Guideline. J Obstet Gynaecol Canada. 2013;291:1-9.
- Timmermans A, Opmeer BC, Khan KS, Bachmann LM, Epstein E, Clark TJ, Gupta JK, Bakour SH, van den Bosch T, van Doorn HC, Cameron ST, Giusa MG, Dessole S, Dijkhuizen FP, Ter Riet G, Mol BW. Endometrial thickness measurement for detecting endometrial cancer in women with postmenopausal bleeding: a systematic review and metaanalysis. Obstet Gynecol. 2010;116:160-167. https://doi.org/10.1097/AOG.0b013e3181e3e7e8
- Colombo N, Preti E, Landoni F, Carinelli S, Colombo A, Marini C, Sessa C; ESMO Guidelines Working Group. Endometrial cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2013;24:6:33-38. https://doi.org/10.1093/annonc/mdt353
- Giannella L, Cerami LB, Setti T, Bergamini E, Boselli F. Prediction of Endometrial Hyperplasia and Cancer among Premenopausal Women with Abnormal Uterine Bleeding. Biomed Res Int. 2019;2019:8598152. https://doi.org/10.1155/2019/8598152
- Trimble CL, Method M, Leitao M, Lu K, Ioffe O, Hampton M, Higgins R, Zaino R, Mutter GL. Society of Gynecologic Oncology Clinical Practice Committee. Management of endometrial precancers. Obstet Gynecol. 2012;120:1160-1175. https://doi.org/10.1097/aog.0b013e31826bb121
- Лучевая диагностика в гинекологии. Руководство для врачей. Под ред. Труфанова Г.Е., Панова В.О. СПб.: ЭЛБИ-СПб; 2008.
- Бенасэрраф Б., Голдстейн С., Гроцман И. Ультразвуковые исследования в гинекологии. М.: МЕДпресс-информ; 2016.
- Боровкова Л.В., Ершова В.О., Игнатьев А.А. Современные методы диагностики доброкачественных и злокачественных процессов эндометрия. Медицинский альманах. 2009;3:105-108.
- Буланов М.Н. Ультразвуковая гинекология: курс лекций в трех томах. М.: Видар-М; 2010.
- Сухих Г.Т., Сметник В.П., Андреева Е.Н., Балан В.Е., Гависова А.А., Григорян О.Р., Ермакова Е.И., Зайдиева Я.З., Ильина Л.М., Касян В.Н., Марченко Л.А., Подзолкова Н.М., Роговская С.И., Сметник А.А., Чернуха Г.Е., Юренева С.В. КР117 30 Менопаузальная гормонотерапия и сохранение здоровья женщин в зрелом возрасте. Клинические рекомендации. Проблемы репродукции. 2016;8-9.
- Baber RJ, Panay N, Fenton A, and the IMS Writing Group. 2016 IMS Recommendations on women’s midlife health and menopause hormone therapy. Climacteric. 2016;19:2:109-150. https://doi.org/10.3109/13697137.2015.1129166
- Демичева Т.В., Гришин Г.Н., Крикунова Л.И. Роль ультразвукового исследования в диагностике рака эндометрия и оценке стадии заболевания. Российский онкологический журнал. 2012;4:28-31.
- Jokubkiene L, Sladkevicius P, Valentin L. Transvaginal ultrasound examination of the endometrium in postmenopausal women without vaginal bleeding. Ultrasound Obstet Gynecol. 2016;48:3:390-396. PMID:26678251. https://doi.org/10.1002/uog.15841
- Сабанцев М.А., Баженова Л.Г., Шрамко С.В., Левченко В.Г., Маркина Л.А., Хвостова Е.П. Информативность стандартных методов диагностики пролиферативных заболеваний эндометрия. Российский вестник акушера-гинеколога. 2017;17:1:62-66.
- Breijer MC, Peeters JA, Opmeer BC, Clark TJ, Verheijen RH, Mol BW, Timmermans A. Capacity of endometrial thickness measurement to diagnose endometrial carcinoma in asymptomatic postmenopausal women: a systematic review and metaanalysis. Ultrasound Obstet Gynecol. 2012;40:621-629. https://doi.org/10.1002/uog.12306
- Озерская И.А. Эхография в гинекологии. М.: Видар-М; 2013.
- Lev-Sagie A, Hamani Y, Imbar T, Hurwitz A, Lavy Y. The significance of intrauterine lesions detected by ultrasound in asymptomatical postmenopausal women. Br J Obstet Gynaecol. 2005;112:379-382. https://doi.org/10.1111/j.1471-0528.2004.00444.x
- Ozelci R, Dilbaz B, Akpınar F, Kınay T, Baser E, Aldemir O, Altınbas SK. The significance of sonographically thickened endometrium in asymptomatic postmenopausal women. Obstet Gynecol Sci. 2019;62:4:273-279. https://doi.org/10.5468/ogs.2019.62.4.273
- Li Z, Li L. Risk of malignancies among asymptomatic postmenopausal women with thickened endometrium: A cohort study. Medicine (Baltimore). 2019;98:6:e14464. https://doi.org/10.1097/MD.0000000000014464
- Alcázar JL, Bonilla L, Marucco J, Padilla AI, Chacón E, Manzour N, Salas A. Risk of endometrial cancer and endometrial hyperplasia with atypia in asymptomatic postmenopausal women with endometrial thickness ≥11 mm: A systematic review and meta-analysis. J Clin Ultrasound. 2018;46:9:565-570. https://doi.org/10.1002/jcu.22631
- Ghoubara A, Emovon E, Sundar S, Ewies A. Thickened endometrium in asymptomatic postmenopausal women — determining an optimum threshold for prediction of atypical hyperplasia and cancer. J Obstet Gynaecol. 2018;38:8:1146-1149. https://doi.org/10.1080/01443615.2018.1458081
- Louie M, Canavan TP, Mansuria S. Threshold for endometrial sampling among postmenopausal patients without vaginal bleeding. Int J Gynaecol Obstet. 2016;132:3:314-317. https://doi.org/10.1016/j.ijgo.2015.07.023
- Wolfman W, Leyland N, Heywood M, Singh SS, Rittenberg DA, Soucy R, Allaire C, Awadalla A, Best C, Dunn S, Leroux N, Potestio F, Senikas V, Wallace S, Menzies R; Society of Obstetricians and Gynaecologists of Canada. Asymptomatic endometrial thickening. J Obstet Gynaecol Canada. 2009;32:10:990-999.
- Genc M, Genc B, Sahin N, Celik E, Turan GA, Gur EB, Guclu S. Endometrial pathology in postmenopausal women with no bleeding. Climacteric. 2015;18:2:241-245. https://doi.org/10.3109/13697137.2014.944152
- Адамян Л.В., Мельникова Н.С., Касян В.Н. Патология эндометрия в постменопаузе: нужен ли ультразвуковой скрининг? Проблемы репродукции. 2019;25:2:113-119. https://doi.org/10.17116/repro201925021113
- Litta P, Di Giuseppe J, Moriconi L, Delli Carpini G, Piermartiri MG, Ciavattini, A. Predictors of malignancy in endometrial polyps: a multi-institutional cohort study. Eur J Gynaecol Oncol. 2014;35:4:382-386.
- Ricciardi E, Vecchione A, Marci R, Schimberni M, Frega A, Maniglio P, Caserta D, Moscarini M. Clinical factors and malignancy in endometrial polyps. Analysis of 1027 cases. European J Obstet, Gynecol Reprod Biol. 2014;183:121-124. https://doi.org/10.1016/j.ejogrb.2014.10.021
- Gambadauro P, Martinez-Maestre MA, Schneider J, Torrejon R. Endometrial polyp or neoplasia? A case-control study in women with polyps at ultrasound. Climacteric. 2015;18:3:399-404. https://doi.org/10.3109/13697137.2014.967673
- Ferrazzi E, Zupi E, Leone FP, Savelli L, Omodei U, Moscarini M, Barbieri M, Cammareri G, Capobianco G, Cicinelli E, Coccia ME, Donarini G, Fiore S, Litta P, Sideri M, Solima E, Spazzini D, Testa AC, Vignali M. How often endometrial polyps malignant in asymptomatic postmenopausal women? A multicenter study. Am J Obstet Gynecol. 2009;200:3:235. https://doi.org/10.1016/j.ajog.2008.09.876
Введение
Гиперпластические процессы в эндометрии представляют большую медико-биологическую и социально-экономическую проблему и занимают значительное место в структуре гинекологической заболеваемости [1—6]. Высокая распространенность гиперпластических процессов в эндометрии, отсутствие должной эффективности от гормональной терапии, а также вероятность озлокачествления ставят гиперплазию эндометрия (ГЭ) в ряд наиболее актуальных проблем современной медицины. По данным Е.М. Вихляевой, гиперплазией эндометрия страдают почти 50% женщин позднего репродуктивного возраста и в период перименопаузы [7].
Большая клиническая значимость гиперпластических процессов в эндометрии заключается в том, что они являются одной из наиболее частых причин маточных кровотечений у женщин в возрасте 45—55 лет и их госпитализации в стационар [8—12]. Другая причина пристального внимания к ГЭ — это возможность их злокачественной трансформации. По данным статистики РФ, рак эндометрия (РЭ) занимает 3-е место в структуре онкологической заболеваемости женского населения [13, 14]. Малигнизация железистой гиперплазии и полипа эндометрия встречается в 2—5% и достигает 10% в постменопаузе [15—17]. Атипическая гиперплазия прогрессирует в инвазивный рак с частотой до 50% наблюдений [18, 19]. Однако, по данным разных авторов, РЭ по результатам гистологического исследования подтверждается у 1—10% женщин, имеющих кровотечение в постменопаузе. Практически в 60% наблюдений выявляется атрофия эндометрия и примерно с одинаковой частотой — полипы эндометрия, ГЭ и другие доброкачественные изменения эндометрия [20, 21]. Таким образом, в большинстве случаев причиной кровотечений в постменопаузе служат изменения эндометрия доброкачественного характера.
Факторами риска развития РЭ являются пожилой возраст пациенток (старше 50 лет), ожирение, поздняя менопауза, сахарный диабет, длительная эстрогеновая стимуляция, прием тамоксифена [22, 23].
При ожирении и индексе массы тела (ИМТ) более 25 кг/м2 повышается риск развития РЭ на 200—400% [24]. Так как более 50% женщин в постменопаузе имеют избыточную массу тела, необходима онконастороженность в данной возрастной группе.
Диагностика патологии эндометрия
В скрининговой диагностике патологии эндометрия наиболее информативным неинвазивным методом обследования является лучевой — ультразвуковое исследование (УЗИ) — неинвазивный, легко выполнимый и высокоинформативный метод обследования больных для выявления количественных и качественных характеристик всех слоев эндометрия с оценкой их кровоснабжения, что позволяет современная аппаратура [25, 26]. Методами лучевой диагностики, в отсутствие клинических проявлений заболевания, могут выявляться различные признаки диффузных (гиперплазия) или очаговых (полипы) изменений эндометрия [27, 28].
В настоящее время согласно клиническим рекомендациям Министерства здравоохранения РФ [29] и международным протоколам [30] за верхнюю границу нормы толщины М-эха принимают 4 мм. Если она ниже этой границы, то вероятность РЭ составляет менее 1% [31—34], в таких случаях биопсия эндометрия не требуется. В ряде случаев увеличение толщины эндометрия по данным УЗИ выявляется у женщин в постменопаузе в отсутствие симптомов заболевания. Однако тактика ведения в таких случаях окончательно не определена. Последнее обстоятельство особенно важно, поскольку в настоящее время среди исследователей прочно укоренилось мнение, что толщина эндометрия является ведущим признаком гиперплазии [35]. Однако в литературе появляются данные о необходимости изменения ультразвуковых критериев толщины эндометрия для определения дальнейшей тактики ведения женщин в отсутствие клинических проявлений в постменопаузе, так как выбор метода лечения и его применение порой ограничены из-за сопутствующей соматической патологии больных. Особые трудности возникают при лечении больных с ГЭ старше 60 лет ввиду высокого риска развития осложнений при оперативном вмешательстве и применении анестезиологического пособия. Поэтому необходимо разграничить группы пациенток с утолщенным эндометрием (по УЗИ в отсутствие клинических проявлений), которым обязательно должны проводиться дальнейшая диагностика и лечение, и группы пациенток, которые могут находиться под динамическим наблюдением (без риска развития РЭ) в связи с возрастом, наличием соматической патологии или нежеланием (отказом) пациентки от дальнейшего лечения (диагностического обследования).
Современные данные литературы о дифференциальной диагностике и тактике ведения женщин в пери- и постменопаузе с патологией эндометрия
В исследовании A. Lev-Sagie и соавт. [36] под наблюдением находились 82 женщины в постменопаузе со случайно выявленным при УЗИ утолщением эндометрия, всем выполнена гистероскопия с выскабливанием стенок полости матки. По результатам гистологического исследования, у 67 (82%) пациенток выявлены неактивные полипы, у 7 — субмукозные узлы, у 6 — атрофия эндометрия, у 1 — простая гиперплазия, еще у 1 — полип с простой гиперплазией. Ни одного случая сложной гиперплазии или РЭ не было. При этом частота развития осложнений оперативного вмешательства составила 3,6%: 2 перфорации матки, 1 осложнение интубации.
R. Ozelci и соавт. [37] проанализировали истории болезни 266 женщин в постменопаузе, которым были выполнены гистероскопия и биопсия эндометрия. В исследование были включены пациентки с отсутствим симптомов, у которых, по данным трансвагинального ультразвукового исследования (ТВУИ), толщина эндометрия равна или превышает 6 мм. По результатам гистологического исследования, наиболее часто выявляемыми очаговыми поражениями у пациенток в отсутствие симптоматики были полипы эндометрия, диагностированные в 168 (63,1%) наблюдениях. У 24 (9%) пациенток была диагностирована простая гиперплазия, у 4 (1%) — атипичная гиперплазия и у 8 (3%) — аденокарцинома эндометрия. По мнению авторов обзора, при толщине эндометрия ≥10,5 мм рекомендованы гистероскопия и кюретаж стенок полости матки.
Другие исследователи [38] провели ретроспективный анализ (с января 2006 г. по январь 2017 г.) медицинских карт 488 женщин в постменопаузе, не имевших клинических проявлений, у которых при ТВУИ выявили эндометрий толщиной ≥5 мм и провели гистероскопию с последующей биопсией эндометрия. Наиболее частыми патологическими находками были полипы (51,0%) и нормальный эндометрий (34,2%). У 15 (3,1%) и 10 (2,0%) больных имелась интраэпителиальная неоплазия и карцинома соответственно. Однако пациентки с карциномой обладали более толстым эндометрием, в котором чаще определялся кровоток при цветовом допплеровском картировании (ЦДК). В исследовании отмечено, что при злокачественных новообразованиях толщина эндометрия была ≥12 мм, и при ЦДК определялись локусы кровотока в эндометрии.
J. Alcázar и соавт. [39] изучили результаты исследований, опубликованных в период с января 1990 г. по декабрь 2016 г., и оценили корреляцию между толщиной эндометрия, измеренной с помощью ТВУИ, и гистологическими находками у женщин, не имевших клинических проявлений в постменопаузе. Научные работы, включавшие исследования у пациенток, которые принимали заместительную гормональную терапию, тамоксифен или ингибиторы ароматазы, были исключены. Было выявлено 289 исследований, и оценены данные по 4751 женщине. Распространенность РЭ или ГЭ с атипией составила 2,4%. В результате исследователи пришли к выводу, что риск развития РЭ или ГЭ с атипией был в 2,6 раза выше у женщин с толщиной эндометрия ≥11 мм в отличие от такового у женщин с толщиной эндометрия 5—10 мм, хотя имелись значительные расхождения в разных исследованиях.
A. Ghoubara и соавт. в своем исследовании [40] также пришли к выводу, что использование порога толщины эндометрия ≥10 мм у женщин без клинических симптомов позволяет не упустить ни одного случая атипичной ГЭ или РЭ.
Целью исследования M. Louie и соавт. [41] было уточнение частоты внутриматочной патологии у 462 женщин с бессимтомно протекающей постменопаузой, не имевших клинических ее проявлений, и обеспечение оптимального порога для взятия у них биоптата эндометрия. В исследование включали женщин без симптомов заболевания эндометрия, если при ТВУИ у них была выявлена толщина эндометрия выше 4 мм.
Среди 462 женщин карцинома была выявлена у 9 (1,9%), атипичная гиперплазия — у 7 (1,5%). Толщина эндометрия, равная или превышающая 14 мм, достоверно ассоциировалась с типичной гиперплазией (отношение шансов — ОШ 4,29; 95% доверительный интервал — ДИ 1,30—14,20; p=0,02), с отрицательным прогностическим значением 98,3%. Толщина более 15 мм была ассоциирована с карциномой (ОШ — 4,53; 95% ДИ — 1,20—17,20; p=0,03), с прогностической значимостью отрицательного результата теста 98,5% и риском развития рака 0,06%. Таким образом, исследователи пришли к выводу, что случайно обнаруженное утолщение эндометрия менее 15 мм не может служить основанием для взятия биопсии эндометрия у женщин в постменопаузе, не имеющих вагинального кровотечения.
W. Wolfman и соавт. [42] изучили материалы публикаций, вышедших с 1970 по 2009 г., о результатах обследования женщин в постменопаузе без аномальных маточных кровотечений, у которых при УЗИ обнаружено утолщение эндометрия. При детальной оценке информативности, рисков и стоимости диагностического выскабливания авторы пришли к выводу, что применение инвазивных методов исследования только на основании увеличения показателя М-эхо является излишней (неоправданной) процедурой.
Однако некоторые исследователи придерживаются другой точки зрения. Целью исследования M. Genc и соавт. [43] было уточнение частоты внутриматочной патологии у 283 женщин в постменопаузе, госпитализированных в гинекологическое отделение для проведения гистерэктомии по причинам, не связанным с патологией эндометрия. По результатам гистологического исследования, у 75,6% из 209 пациенток, не имевших кровотечения в постменопаузе, обнаружена патология полости матки, о которой не подозревали на этапе предоперационной подготовки: ГЭ, полипы, миома матки, аденомиоз — в 1 (0,5%) наблюдение, аденокарциномы. У 87,8% из 74 женщин с кровотечением в постменопаузе обнаружена внутриматочная патология, в том числе 13 (17,6%; p=0,0001) наблюдений РЭ. Таким образом, патология полости матки может иметься и у женщин в постменопаузе, не имеющих симптомов заболевания, поэтому авторы настаивают на ежегодном скрининге и консультировании пациенток пожилого и старческого возраста, не дожидаясь у них эпизода кровотечения.
Л.В. Адамян и соавт. [44] в своем исследовании пациенток без клинических проявлений внутриматочных заболеваний в постменопаузе с подозрением на патологию эндометрия по данным ТВУЗ (толщина эндометрия более 4 мм), чаще всего выявляли полипы эндометрия (63,9%), атрофию эндометрия (30,5%), а частота аденокарциномы составила 2,1%. Авторы исследования акцентируют внимание на том, что риск возникновения злокачественных новообразований достаточно высок, что свидетельствует о важности адекватного обследования и своевременного лечения женщин этой возрастной группы, а также о необходимости скринингового обследования с применением УЗИ.
По данным литературы, у пациенток без клинических проявлений заболевания матки в постменопаузе с утолщеным эндометрием (по данным УЗИ) наиболее часто при гистероскопии и гистологическом исследовании выявляются полипы эндометрия. Однако частота РЭ у женщин с полипами эндометрия составляет 0,3—4,8% [45]. Большинство исследователей настаивают на обращении особого внимания на пациенток в постменопаузе с полипами, проявляющимися маточным кровотечением. Так, E. Ricciardi и соавт. [46] изучали распространенность полипов с атипией у пациенток в постменопаузе. В ретроспективном исследовании проанализированы данные 1027 женщин с полипами эндометрия в пери- и постменопаузе. Доброкачественные полипы выявлены в 95,8% случаев, предраковые — в 2,67% и с атипией — в 1,54% случаев. У женщин в постменопаузе (старше 60 лет) и старческом возрасте риск развития РЭ был выше (ОШ 3,05; 95% ДИ 1,54—6,19; p<0,001 и ОШ 2,8; 95% ДИ 1,38—5,56; p≤0,003 соответственно). У пациенток с кровотечением в постменопаузе риск развития РЭ повышался более чем в 30 раз (ОШ 31,1; 95% ДИ 10,3—111; p<0,001). По мнению авторов, на пациенток с кровотечением в постменопаузе следует обращать особое внимание, а женщины без симптомов заболевания в постменопаузе относятся к группе промежуточного риска, поэтому к ним необходим индивидуальный подход.
P. Gambadauro и соавт. [47] при анализе данных 1390 пациенток в постменопаузе с подозрением на полип эндометрия (по данным УЗИ) после гистероскопии установили, что все случаи неоплазии отмечены лишь у пациенток с кровотечением. У 40,6% женщин без кровотечения гистологически подтверждена доброкачественная структура полипа эндометрия. Пациентки, у которых диагностирован РЭ, были значительно старше пациенток с доброкачественной патологией, а также имели более высокий индекс массы тела. По мнению авторов, большое число женщин в постменопаузе без симптомов заболевания с подозрением на полип по данным УЗИ направляют на гистероскопию, хотя риск неоплазии в таких случаях крайне невысок.
E. Ferrazzi и соавт. [48] наблюдали 1152 женщины без симптомов заболевания в постменопаузе, у которых по данным УЗИ и соногистерографии выявлены полипы эндометрия, всем женщинам выполнены гистероскопия и кюретаж стенок полости матки. По данным гистологического исследования, выявлен 1 (менее 0,1%) случай РЭ в полипе диаметром более 4 мм, при этом частота неоплазии была в 10 раз ниже, чем у пациенток с кровотечением. Частота атипических гиперпластических полипов составила 1,2% у пациенток без симптомов заболевания и 2,2% — при наличии кровотечения. Выявлены 3 (0,3%) случая РЭ (не в полипе), которые в ходе гистероскопии визуализировались в виде полипоидных изменений. Риск выявления неоплазии у пациенток без клинических проявлений зависел от диаметра полипа (более 18 мм, ОШ 6,9; 95% ДИ 2,2—21,4 мм). При этом среди осложнений было 3 перфорации, 7 разрывов шейки матки, 3 ложных хода.
Заключение
У пациенток в пери- и постменопаузе патологические процессы в эндометрии протекают чаще всего бессимптомно, однако риск возникновения злокачественных новообразований выше общепопуляционных показателей, особенно при наличии кровотечений и рецидивов патологических процессов в эндометрии. Следует отметить, что диагноз может быть установлен на основании ультразвукового скрининга. При отсутствии единого мнения о рацио- нальных диагностике и наблюдении данного контингента женщин эта проблема требует дальнейшего изучения.
Участие авторов:
Концепция и дизайн исследования — М.А. Чечнева;
Сбор и обработка материала — О.В. Капитанова;
Статистическая обработка данных — О.В. Капитанова;
Написание текста — О.В. Капитанова;
Редактирование — М.А. Чечнева.
Авторы заявляют об отсутствии конфликта интересов.
Клинические рекомендации, утвержденные МЗ РФ
-
ДОБРОКАЧЕСТВЕННАЯ ДИСПЛАЗИЯ МОЛОЧНОЙ ЖЕЛЕЗЫ
-
ЦЕРВИКАЛЬНАЯ ИНТРАЭПИТЕЛИАЛЬНАЯ НЕОПЛАЗИЯ, ЭРОЗИЯ И ЭКТРОПИОН ШЕЙКИ МАТКИ
-
ВНЕМАТОЧНАЯ (ЭКТОПИЧЕСКАЯ) БЕРЕМЕННОСТЬ
-
АНОМАЛЬНЫЕ МАТОЧНЫЕ КРОВОТЕЧЕНИЯ
-
ВОСПАЛИТЕЛЬНЫЕ БОЛЕЗНИ ЖЕНСКИХ ТАЗОВЫХ ОРГАНОВ
-
ВРОЖДЕННАЯ ДИСФУНКЦИЯ КОРЫ НАДПОЧЕЧНИКОВ (АДРЕНОГЕНИТАЛЬНЫЙ СИНДРОМ)
-
ВЫПАДЕНИЕ ЖЕНСКИХ ПОЛОВЫХ ОРГАНОВ
-
МЕНОПАУЗА И КЛИМАКТЕРИЧЕСКОЕ СОСТОЯНИЕ У ЖЕНЩИНЫ
-
СИНДРОМ ПОЛИКИСТОЗНЫХ ЯИЧНИКОВ
-
СИНДРОМ ГИПЕРСТИМУЛЯЦИИ ЯИЧНИКОВ
-
УРОГЕНИТАЛЬНЫЕ ЗАБОЛЕВАНИЯ, ВЫЗВАННЫЕ MYCOPLASMA GENITALIUM
-
УРОГЕНИТАЛЬНЫЙ ТРИХОМОНИАЗ
-
АНОГЕНИТАЛЬНАЯ ГЕРПЕТИЧЕСКАЯ ВИРУСНАЯ ИНФЕКЦИЯ
-
АНОГЕНИТАЛЬНЫЕ (ВЕНЕРИЧЕСКИЕ) БОРОДАВКИ
На Школах РОАГ новые клинические рекомендации представляют их разработчики – ведущие эксперты НМИЦ АГП им. В.И. Кулакова.
Предложения по внесению изменений в действующие клинические рекомендации