
1. Состав:
Основные компоненты: мед; молекулярный комплекс смол, полисахаридов и флавоноидов из Гринделии, Подорожника и Цмина.
Дополнительные компоненты: тростниковый сахар; вода; эфирные масла: сладкий апельсин, лимон, мирт, ароматизатор натуральный лимонный, гуммиарабик, ксантановая камедь.
2. Описание:
Состав препарата Grintuss Pediatric был специально разработан для детей от 1 года и старше. Регулирующее действие в сочетании с защитой слизистой оболочки горла особенно важно при детском кашле.
Благодаря этим характеристикам, Grintuss быстро успокаивает как дневной, так и ночной кашель. Grintuss Pediatric — это сироп с органическими ингредиентами, который также подходит для детей с непереносимостью глютена.
Подходит для детей от 1 года.
Необходима консультация педиатра, если кашель сохраняется более нескольких дней.
3. Условия применения и дозировка
Перед употреблением взболтать. Прилагается мерная ложка. После применения плотно закройте флакон и хорошо промойте мерную ложку.
Дозировка сиропа для детей Grintuss Pediatric Syrup:
Детям от 1 года до 6 лет: 5 мл два-четыре раза в день, последняя доза принимается перед сном.
Дозировка сиропа для взрослых Grintuss Adult Syrup:
Детям старше 12 лет и взрослым: 2 мерных ложки (10 мл) два-четыре раза в день, последняя доза принимается перед сном.
4. Особые указания:
Не применять при индивидуальной гиперчувствительности или аллергии на любой компонент в составе сиропа.
Если симптомы не улучшаются, обратитесь к врачу.
5. Условия хранения:
Хранить при комнатной температуре, в недоступном для детей месте, вдали от источников тепла и света.
Не использовать после истечения срока годности, указанного на упаковке.
После вскрытия срок хранения препарата составляет 3 месяца.
6. Производитель:
Aboca, Италия
Инструкции по применению медицинских препаратов, размещены на этом сайте с целью ознакомления. Помните, что прием медицинских препаратов должен осуществляться только по рекомендации врача.
Если вы пользовались этим медицинским средством, оставьте пожалуйста свой отзыв ниже.
The formulation of Grintuss Pediatric was specifically developed for use in children 1 year of age and older. A modulating action coupled with protection of the mucous membrane is especially important in children’s cough. Thanks to these characteristics, Grintuss Pediatric rapidly soothes both daytime and night-time cough, a particularly frequent problem in children. Grintuss Paediatric is a syrup with ingredients from Organic Farming and is also suitable for children with coeliac disease. Remember that it is always best to consult your paediatrician, especially if the cough persists for more than a few days.
Indicated for children from 1 year old.
Composition
FUNCTIONAL SUBSTANCES:
- Honey*;
- Molecular complex of Resins, Polysaccharides and Flavonoids from Grindelia*, RibwortPlantain* and Helichrysum* (Poliresin®); Titrated in polysaccharides (molecular weight > 20,000 Daltons) ≥ 20%
Also contains: Cane Sugar*; Water; Essential Oils of: Lemon, Sweet Orange, Myrtle, Natural Lemon Flavouring, Gum Arabic, Xanthan Gum.
* Ingredient from Organic Farming
Instructions for use
Take 5 ml (one dosage spoon) for children aged 1 to 6 years old, or 10ml (two dosage spoons) for those over 6 years old, two to four times a day, taking the last dose before going to bed.
Shake before use. Contains dosage spoon. After use, close the bottle properly and wash the dosage spoon thoroughly.
Once open, use the product within three months.
Warnings
Do not use in case of individual hypersensitivity or allergy to one or more components.
If symptoms do not improve, consult a doctor.
Store at room temperature, away from heat sources and light.
Keep out of the reach of children. The “use by” date refers to the intact product, stored correctly.
Packaging
180 g glass bottle – approx. 132 mL
CONTAINS DOSAGE SPOON
Возраст
От 1 года, Для детей, Для подростков
Форма выпуска
Сироп
Свойства
Защищающий, Смягчение, Увлажнение
Проблема
Сухой кашель, Мокрый кашель, Кашель, Раздражение, Сухость
Основные ингредиенты
Мед , Подорожник , Полисахарид , Тмин , Флавоноиды
Часть тела
Гортань, Бронх
Органные системы
Дыхательная система
Метод приминения
Перорально
Страна производитель
Италия
- Research
- Open Access
- Published: 10 June 2014
- Vitalia Murgia2,
- Davide Caimmi3,
- Sreedhar Anapurapu4,
- Amelia Licari3 &
- …
- Gian Luigi Marseglia3
Italian Journal of Pediatrics
volume 40, Article number: 56 (2014)
Cite this article
-
7281 Accesses
-
14 Citations
-
3 Altmetric
-
Metrics details
Abstract
Background
Cough is an extremely common problem in pediatrics, mostly triggered and perpetuated by inflammatory processes or mechanical irritation leading to viscous mucous production and increased sensitivity of the cough receptors. Protecting the mucosa might be very useful in limiting the contact with micro-organisms and irritants thus decreasing the inflammation and mucus production. Natural molecular complexes can act as a mechanical barrier limiting cough stimuli with a non pharmacological approach but with an indirect anti-inflammatory action.
Objective
Aim of the study was to assess the efficacy of a medical device containing natural functional components in the treatment of cough persisting more than 7 days.
Methods
In this randomized, parallel groups, double-blind vs. placebo study, children with cough persisting more than 7 days were enrolled. The clinical efficacy of the study product was assessed evaluating changes in day- and night-time cough scores after 4 and 8 days (t4 and t8) of product administration.
Results
In the inter-group analysis, in the study product group compared with the placebo group, a significant difference (t4 study treatment vs. t4 placebo, p = 0.03) was observed at t4 in night-time cough score.
Considering the intra-group analysis, only the study product group registered a significant improvement from t0 to t4 in both day-time (t0 vs. t4, p = 0.04) and night-time (t0 vs. t4, p = 0.003) cough scores.
A significant difference, considering the study product, was also found in the following intra-group analyses: day-time scores at t4 vs. t8 (p =0.01) and at t0 vs. t8 (p = 0.001); night-time scores at t4 vs. t8 (p = 0.05), and at t0 vs. t8 (p = 0.005). Considering a subgroup of patients with higher cough (≥3) scores, 92.9% of them in the study product group improved at t0 vs. t4 day-time.
Conclusions
Grintuss® pediatric syrup showed to possess an interesting profile of efficacy and safety in the treatment of cough persisting more than 7 days.
Background
Cough is an extremely common problem in pediatrics[1], it is related to a poor quality of life and absence from school for children and from work for parents; moreover night-time cough is the most difficult to solve and to be tolerated. Anatomically the upper airway comprehend nasal cavities, pharynx and larynx. Upper respiratory tract infections represent the most common acute illness in the community. They can range from the self-limiting common cold, to viral and bacterial infections of pharynx and larynx and to inflammation from irritating agents. Lower respiratory infections represent a less frequent problem in children, even if a more serious one, and they involve trachea, bronchi and lungs. A persisting cough is often accompanied by upper respiratory tract infection (URTIs)[2, 3], whereas other causes may be exposure to passive tobacco smoke, pollutants, aerosols and dust. A persistent cough is defined as a protracted cough lasting between 2 and 4 weeks. According to literature two out of three children aged between 0 and 4 years visit their GP at least once a year with an acute respiratory infection and up to three-quarters of these will have a cough[4]. Prospective studies of acute cough in young children in general practice have suggested that about 50% recover by 10 days and 90% by 3 weeks, so 10% of children still have problems in the third to fourth weeks[5].
In recent researches, many of the most common medications used to treat cough are nowadays studied to evaluate not only their efficacy, but also safety, in order to underline how benefits/risks ratio tent toward their beneficial effects[6–8]. In most cases, the pharmacological treatment aims to suppress the symptom (cough suppressant therapy), with synthetic agents that play an inhibitory effect on the cough reflex or act as mucolytic drugs, with the simple intent to reduce both intensity and frequency of cough in the short term, increasing the possibility to experience side effects[9–12].
Respiratory viruses, bacteria and irritants would cause a widespread inflammation of the mucosa of several anatomical areas, especially the upper respiratory tract mucosa, desquamation of the epithelial cells and damage of the nerve endings, which may then lead to a certain degree of hyper-reactivity of the cough reflex. Such a local environment may increase the sensitivity of the mucosa towards certain stimuli and local irritants, inducing a vicious circle that leads to an increased mucosal damage[13], that may facilitate irritating agents access towards the nerve endings of the sub mucosa by activating constriction and bronchial reflexes[14–16].
Starting from the above assumptions, it seems reasonable that the protective effect exerted by a mechanical barrier may represent a reliable therapeutic approach, different from the past, and able to more effectively limit the damage caused by micro-organisms and irritants on the mucosa due to an indirect anti-inflammatory action.
The barrier effect could be achieved by a particular combination of functional components (obtained from natural molecular complexes) such as resins, polysaccharides, saponins and flavonoids that are able to exert an indirect anti-inflammatory effect on the upper respiratory tract area[17–19].
In the light of these considerations, it might be interesting and innovative to investigate the efficacy of a mechanical and non-pharmacological therapeutic intervention in the treatment of persisting cough.
Aim of the present randomized, double-blind, placebo-controlled trial was therefore to assess the effectiveness of the medical device Grintuss® (the study product, classified according to the Directive 93/42/EC, containing a combination of specific fractions of substances such as resins, polysaccharides, saponins, flavonoids and sugars) in comparison with a placebo, in the treatment of cough persisting for more than 7 days.
Methods
In the present randomized, parallel groups, double-blind vs. placebo study, 102 children aged 3 to 6 years (51 for each group) were consecutively enrolled. They were referred for persisting cough (at least 7 days up to 3 weeks, not treated with any other antitussive product) to the Pediatric Allergology and Pulmonology Unit of the Azienda Ospedaliero-Universitaria of Udine (Italy), or to the Immuno-Pneumo-Allergy Unit of the Department of Pediatrics of the University of Pavia (Italy).
Informed parental consent was obtained to be eligible for enrollment into the study. The study was performed according to the rules of Pavia and Udine Universities Ethics Committees and conducted by the CRO SPRIM ALS GCP Srl Italy.
The primary endpoint of the study was to evaluate the clinical efficacy of Grintuss® assessing the changes in the day- and night-time cough score[20] (evaluated by the specialist during the visits at t4 and t8 and recorded by parents in a daily diary) after 4 and 8 days of product administration (Table 1)[21–25]. All adverse events and severe adverse events were recorded and evaluated.
Cough clinical scores (Modified from Chung 2002)
Full size table
The study product (a syrup containing specific fractions of substances such as resins, polysaccharides, saponins, flavonoids and sugars derived from Grindelia robusta, Plantago lanceolata, Helichrysum italicum, honey) was administered as it was, 4 doses a day, 5 ml each, for 8 days. The placebo was a syrup having the same organoleptic properties, viscosity and texture of the study product; it contained xanthan gum, citric acid, sugarcane, sorbate potassium (E202), acesulfame K, lemon and orange flavours, plant charcoal and beta-carotene and it was administered according to the same modalities of the study product. Both of them were supplied by Aboca S.p.A. Società Agricola, Italy. During the whole study period the following treatments were not allowed: immunostimulants or immunoregulators of biological origin, corticosteroids, antibiotics, antihistaminics and bronchodilators.
The sample size was obtained assuming a mean cough score of 3 points in both groups at baseline, and a mean change in cough score of 2 and 1 points respectively for placebo and treatment group at the end of the study, with 1.3 standard deviation.
Data from both centers participating in this study were combined. Data were summarized for demographic characteristics, efficacy observations and measurements, safety observations and evaluations using standard descriptive statistics. Safety was assessed on the frequency of adverse reactions attributable to the study product, summarized and described for each treatment group. Changes between groups in cough score were assessed with Student’s T-test and pooled T-test. Differences in efficacy between treatment and placebo groups for children with intense cough (scores ≥3) were tested by means of Fisher exact test.
Results
All the patients (102 screened and 102 randomized to study product (n = 51) or placebo (n = 51)) were analyzed according to the intention- to-treat (ITT) population, that includes all randomized patients who took at least one dose of study product or placebo. Forty-four patients randomized to placebo and 47 patients randomized to study treatment completed the study; two patients discontinued the study (both randomized to placebo). No patients discontinued for adverse events, severe adverse events or other safety reasons.
Demographic data and other baseline characteristics
Subjects demographics and anamnestic data are summarized in Table 2, and include age (years), gender, height (m), weight (kg), body mass index (kg/m2), numbers, if any, of siblings, and presence of fever. The study product group and the placebo group presented comparable demographic characteristics, without any meaningful differences as regards to all the evaluated parameters. As for the results of the cough scores, there was no significant difference in the two groups at t0.
Demographic and anamnestic data from participants at the inclusion visit (t0)
Full size table
Analysis of safety variables
A total of 34 subjects experienced an adverse event (17 in the treatment group and 17 in the placebo group) and the total number of adverse events was 55 (24 in the treatment group and 31 in the placebo group). Adverse events included mainly the appearance of fever, cold and episodes of vomiting. No severe adverse event was recorded. All adverse events were assessed as “unrelated” to the study products and the subjects recovered in all cases.
Cough score and efficacy of the product
As regard to the primary endpoint of the study (change of cough score between t0-enrolment in the study, t4-first control visit and t8-end of the treatment), when symptoms score was compared between study product and placebo, significant differences were detected favouring the study product.
In the inter-group analysis, in the study product group compared with the placebo group, a significant difference (t4 study treatment vs. t4 placebo, p = 0.03, T-test) was observed at t4 in night-time cough score (Figure 1).
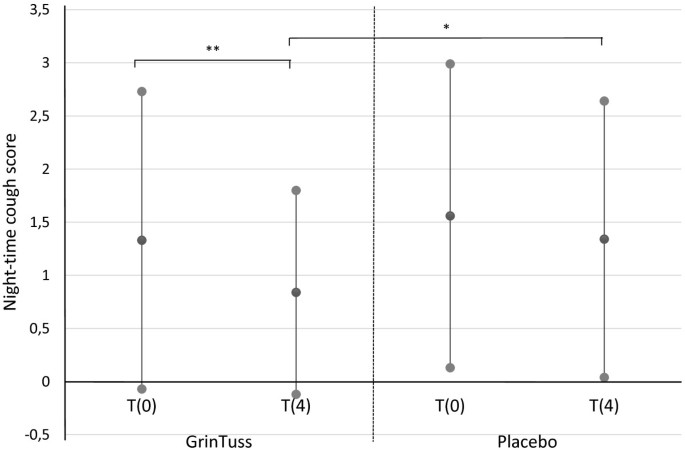
Night-time cough score. Night-time cough score measured at different times (day 0 and day 4) in patients enrolled for both study product and placebo groups. Means (black dots) and corresponding standard deviations show a significant decrease in mean night-time cough score for the study product group among time (T-test, ** p = 0.003), and a significant difference of mean night-time cough score between study product and placebo groups at t4 (T-test, * p = 0.03).
Full size image
Considering the intra-group analysis, only the study product group registered a significant improvement from t0 to t4 in both day-time (t0 vs. t4, p = 0.04, T-test) and night-time (t0 vs. t4, p = 0.003, T-test) cough scores (Figures 1 and2).
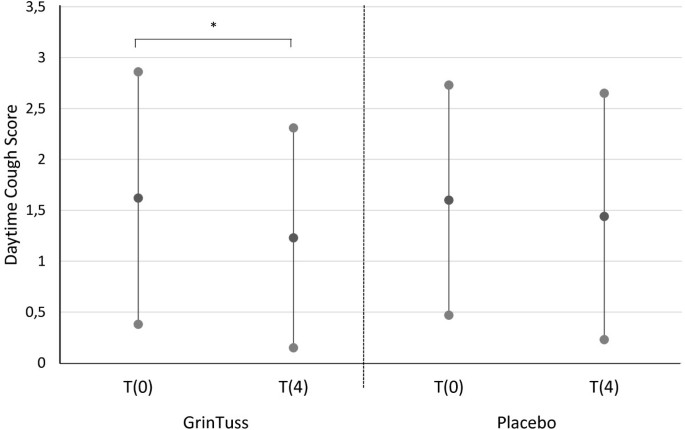
Day-time cough score. Day-time cough score measured at different times (day 0 and day 4) in patients enrolled for both study product and placebo groups. Means (black dots) and corresponding standard deviations show a significant decrease in mean day-time cough score for the study product group among time (T-test, * p = 0.04).
Full size image
For the study product group, there was also a significant difference in day-time cough scores, comparing t4 vs. t8 (intra-group analysis, p =0.01, T-test) and t0 vs. t8 (intra-group analysis, p = 0.001, T-test) (data not shown). Moreover, a significant difference has been found in night-time scores comparing t4 vs. t8 (intra-group analysis, p = 0.05, T-test) and t0 vs. t8 (intra-group analysis, p = 0.005, T-test) (data not shown).In order to assess the treatment effects in children with more intense cough, evidenced by a cough score ≥ 3, a subgroup analysis was performed splitting all the participant data into two subgroups (≥3 and <3). Considering day-time cough, 13 (92.9%) out of 14 children in the study group with a t0 score ≥ 3 improved at t4, reporting a score < 3 (p = 0.03 Fisher-test) (Figure 3).
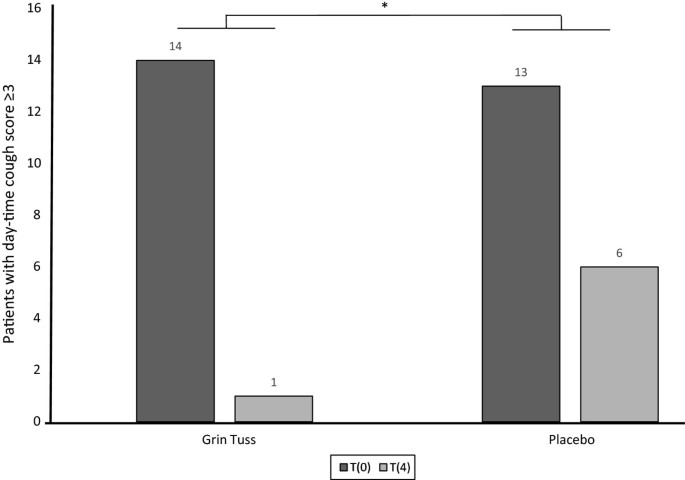
Day-time cough score improvement in subgroups of patients with cough score ≥ 3 at t0. It is shown the cough score in subgroups of children with score ≥ 3 in both treatment groups, between t0 and t4. As regards day-time cough in 14 children in the treatment group reporting a score ≥ 3 at t0, 13 (92.9%) improved, reporting a score < 3 at t4. As regards day-time cough in 13 children in the placebo group reporting a score ≥ 3 at t0, 7 (53.8%) improved reporting a score < 3 at t4. Fisher test shows a significant decrease of patients with day-time acute cough score between study product group and placebo group, at different times (day 0 and day 4) (* p = 0.03).
Full size image
Discussion
In children, in order to treat an episode of cough, therapies need to show a satisfactory safety profile and efficacy. Cough has a high frequency in pediatrics; it tends to persist, to generate intense discomfort in both the child and parents, and it is accompanied by the risk of unnecessary prescriptions of antibiotics and other treatments that may be associated to significant side effects[26]. Despite a certain number of studies, to date, a specific effective and safe treatment for cough has not yet been developed; such a treatment should improve both acute cough and cough persisting more than 7 days.
We then evaluated the efficacy of the study product, a medical device (Class IIa according to the definition of art. 1 of Directive 93/42/EC), whose effects can be exerted by acting as a mechanical barrier, in patients with a cough persisting for more than 7 days. It contains functional components selected for their ability to exert a barrier effect on the mucosa, and for their indirect anti-inflammatory activity. The study product is the result of a combination of specific fractions of substances such as resins, polysaccharides, saponins, flavonoids and sugars derived from Grindelia robusta, Plantago lanceolata, Helichrysum italicum, honey. Preclinical data by in vitro experimental assays strongly support that the study product possesses adhesive properties on human oral mucosa (under publication) and exerts a barrier effect against irritant agents even showing an indirect anti-inflammatory action.
Resins have adhesive properties, while polysaccharides have shown to have both adhesive and emollient properties[27–29]. Together, they create the mechanical barrier that limits the contact between irritants or micro-organisms and the upper respiratory tract mucosa, therefore reducing both the stimulation of nerve endings and the inflammation. Saponins are known for their ability to lower the surface tension[30]; thanks to this property, they reduce the viscosity of the mucus allowing an easier elimination. The polysaccharides attract water and moisturize the mucosa making the mucus less viscous and easier to be expelled[29]. The results of this study allow us to hypothesize that the study product can be helpful in acute cough and in cough that tends to persist even more than seven days (Figure 1). Moreover, reducing the night-time cough score at t4 (Figure 1), it is possible to achieve an improvement in quality of life, since night-time cough is less easy to control, and it creates great discomfort and causes loss of sleep both in children and parents.
The fact that the study product is effective since the first days of treatment is definitely an interesting feature, especially considering that parents, after one week of symptoms, may start to worry about it, and may seek other therapeutic intervention exposing the child to the risk of inappropriate treatment.
At last, the present study confirms the safety of the study product, since there has not been any relevant adverse event related to use of the product.
Grintuss® syrup is on the market since more than 10 years, during which the post-marketing surveillance system, in compliance with Directive 93/42/EC, has not registered incident or side effects related to the Medical Device. Grintuss® should not be used in case of known hypersensitivity to the components of medical device. No other contraindication have been registered. The present study confirms the safety of the study product.
Conclusion
The results of this study support the evidence that Grintuss® pediatric syrup possesses an interesting profile of efficacy and safety in the treatment of cough persisting for more than 7 days. The treatment with Grintuss® is safe and effective in the relief of cough, starting on onset of application. The mechanical barrier, limiting the contact with external irritant agents or micro-organisms, helps the physiological recovery of the mucosa. The decrease of cough supports the protective role of Grintuss® thus showing an improvement in health. This effect moreover is especially evident at night.
References
-
Hay AD, Wilson A, Fahey T, Peters TJ: The duration of acute cough in pre-school children presenting to primary care: a prospective cohort study. Fam Pract. 2003, 20: 696-705. 10.1093/fampra/cmg613.
Article
PubMedGoogle Scholar
-
Dicpinigaitis PV, Colice GL, Goolsby MJ, Rogg GI, Spector SL, Winther B: Acute cough: a diagnostic and therapeutic challenge. Cough. 2009, 5: 11-10.1186/1745-9974-5-11.
Article
PubMed Central
PubMedGoogle Scholar
-
Weinberger M, Fischer A: Differential diagnosis of chronic cough in children. Allergy Asthma Proc. 2014, 35 (2): 95-103. 10.2500/aap.2014.35.3711.
Article
PubMedGoogle Scholar
-
Hay AD, Wilson AD: The natural history of acute cough in children aged 0 to 4 years in primary care: a systematic review. Br J Gen Pract. 2002, 52 (478): 401-409.
PubMed Central
PubMedGoogle Scholar
-
Shields MD, Thavagnanam S: The difficult coughing child: prolonged acute cough in children. Cough. 2013, 9 (1): 11-10.1186/1745-9974-9-11.
Article
PubMed Central
PubMedGoogle Scholar
-
Lee PCL, Jawad MSM, Eccles R: Antitussive efficacy of dextromethorphan in cough associated with acute respiratory tract infection. J Pharm Pharmacol. 2000, 52: 1137-1142. 10.1211/0022357001774903.
Article
CAS
PubMedGoogle Scholar
-
Yoder KE, Shaffer ML, La Tournous SJ, Paul IM: Child assessment of dextromethorphan, diphenhydramine, and placebo for nocturnal cough due to upper respiratory infection. Clin Pediatr (Phila). 2006, 45 (7): 633-640. 10.1177/0009922806291014.
Article
Google Scholar
-
Anderson-James S, Marchant JM, Acworth JP, Turner C, Chang AB: Inhaled corticosteroids for subacute cough in children. Cochrane Database Syst Rev. 2013, 2: CT008888-
Google Scholar
-
Rimsza ME, Newberry S: Unexpected infant deaths associated with use of cough and cold medications. Pediatrics. 2008, 122 (2): e318-e322. 10.1542/peds.2007-3813.
Article
PubMedGoogle Scholar
-
Agence française de sécurité sanitaire des produits de santé: Retrait des spécialités mucolytiques chez le nourrisson: dernière étape de l’opération de rappel. 2010,http://ansm.sante.fr/S-informer/Informations-de-securite-Retraits-de-lots-et-de-produits/Retrait-des-specialites-mucolytiques-chez-le-nourrisson-derniere-etape-de-l-operation-de-rappel/(language)/fre-FR,
Google Scholar
-
AIFA: Nota Informativa Dell’agenzia Italiana Del Farmaco. Ufficio di Farmacovigilanza. Agenzia Italiana del Farmaco. Mucolitici per uso orale e rettale: controindicazione nei bambini al di sotto dei 2 anni. Novembre 2010. [http://www.agenziafarmaco.gov.it/it/content/nota-informativa-importante-sui-mucolitici-uso-orale-e-rettale-30112010]
-
Eccles R: Acute and Chronic Cough. Edited by: Francis Group, Redington AE, Taylor MH. 2005, 215-236. Acute Cough: Epidemiology, Mechanisms, and Treatment, Lenfant C (Series Editor): Lung Biology in Health and Disease, vol 205]
Chapter
Google Scholar
-
Raeessi MA, Aslani J, Raeessi N, Gharaie H, Karimi Zarchi AA, Raeessi F: Honey plus coffee versus systemic steroid in the treatment of persistent post-infectious cough: a randomised controlled trial. Prim Care Respir J. 2013, 22 (3): 325-330. 10.4104/pcrj.2013.00072.
Article
PubMedGoogle Scholar
-
Rolla G, Colagrande P, Scappaticci E, Bottomicca F, Magnano M, Brussino L, Dutto L, Bucca C: Damage of the pharyngeal mucosa and hyper-responsiveness of airway in sinusitis. J Allergy Clin Immunol. 1997, 100 (1): 52-57. 10.1016/S0091-6749(97)70194-5.
Article
CAS
PubMedGoogle Scholar
-
Mu L, Sanders I: Sensory nerve supply of the human oro- and laryngopharynx: a preliminary study. Anat Rec. 2000, 258 (4): 406-420. 10.1002/(SICI)1097-0185(20000401)258:4<406::AID-AR9>3.0.CO;2-5.
Article
CAS
PubMedGoogle Scholar
-
Wheeler-Hegland K, Pitts T, Davenport PW: Cortical gating of oropharyngeal sensory stimuli. Front Physiol. 2010, 1: 167-
PubMed Central
PubMedGoogle Scholar
-
Paul IM, Beiler J, McMonagle A, Shaffer ML, Duda L, Berlin CM: Effect of honey, dextromethorphan, and no treatment on nocturnal cough and sleep quality for coughing children and their parents. Arch Pediatr Adolesc Med. 2007, 161 (12): 1140-1146. 10.1001/archpedi.161.12.1140.
Article
PubMedGoogle Scholar
-
Cohen HA, Rozen J, Kristal H, Laks Y, Berkovitch M, Uziel Y, Kozer E, Pomeranz A, Efrat H: Effect of honey on nocturnal cough and sleep quality: a double-blind, randomized, placebo-controlled study. Pediatrics. 2012, 130 (3): 465-471. 10.1542/peds.2011-3075.
Article
PubMedGoogle Scholar
-
Shadkam MN, Mozaffari-Khosravi H, Mozayan MR: A comparison of the effect of honey, dextromethorphan, and diphenhydramine on nightly cough and sleep quality in children and their parents. J Altern Complement Med. 2010, 16 (7): 787-793. 10.1089/acm.2009.0311.
Article
PubMedGoogle Scholar
-
Chung KF: Assessment and measurement of cough: the value of new tools. Pulm Pharmacol Ther. 2002, 15 (3): 267-272. 10.1006/pupt.2002.0360. Review
Article
CAS
PubMedGoogle Scholar
-
Mattoli L, Cangi F, Maidecchi A, Ghiara C, Ragazzi E, Tubaro M, Stella L, Tisato F, Traldi P: Metabolomic fingerprinting of plant extracts. J Mass Spectrom. 2006, 41: 1534-1545. 10.1002/jms.1099.
Article
CAS
PubMedGoogle Scholar
-
Mattoli L, Cangi F, Ghiara C, Burico M, Maidecchi M, Bianchi E, Ragazzi E, Bellotto L, Seraglia R, Traldi P: A metabolite fingerprinting for the characterization of commercial botanical dietary supplements. Metabolomics. 2011, 7: 437-445. 10.1007/s11306-010-0268-x.
Article
CASGoogle Scholar
-
Mattoli L, Burico M, Maidecchi M, Bianchi E, Ragazzi E, Bellotto L, Seraglia R, Traldi P: The fingerprinting of sedivitax, a commercial botanical dietary supplement: the classical LC-MS approach Vs direct metabolite mapping, natural products. Indian J. 2012, 8 (4): 129-151.
CAS
Google Scholar
-
Van der Kooy F, Maltese F, Choi YH, Kim HK, Verpoorte R: Quality control of herbal material and phytopharmaceuticals with MS and NMR based metabolic fingerprinting. Planta Med. 2009, 75: 763-775. 10.1055/s-0029-1185450.
Article
CAS
PubMedGoogle Scholar
-
Eccles R: Mechanisms of the placebo effect of sweet cough syrups. Respir Physiol Neurobiol. 2006, 152 (3): 340-348. 10.1016/j.resp.2005.10.004.
Article
PubMedGoogle Scholar
-
Goldman RD: Codeine for acute cough in children. Can Fam Physician. 2010, 56 (12): 1293-1294.
PubMed Central
PubMedGoogle Scholar
-
Wegener T, Kraft K: Plantain (Plantago lanceolata L.): anti-inflammatory action in upper respiratory tract infections. Wien Med Wochenschr. 1999, 149 (8–10): 211-216.
CAS
PubMedGoogle Scholar
-
Fraternale D1, Giamperi L, Bucchini A, Ricci D: Essential oil composition and antioxidant activity of aerial parts of Grindelia robusta from central Italy. Fitoterapia. 2007, 78 (6): 443-445. 10.1016/j.fitote.2007.04.011.
Article
CAS
PubMedGoogle Scholar
-
Franz G: Polysaccharides in pharmacy: current applications and future concepts. Planta Med. 1989, 55 (6): 493-497. 10.1055/s-2006-962078.
Article
CAS
PubMedGoogle Scholar
-
Böttger S, Hofmann K, Melzig MF: Saponins can perturb biologic membranes and reduce the surface tension of aqueous solutions: a correlation?. Bioorg Med Chem. 2012, 20 (9): 2822-2828. 10.1016/j.bmc.2012.03.032.
Article
PubMedGoogle Scholar
Download references
Author information
Authors and Affiliations
-
Pediatric Department, Allergology and Pulmonology Unit, School of Medicine, DPMSC, University of Udine, Udine, Italy
Mario Canciani
-
Primary care pediatrician, scientific advisor on Phytotherapy, Italian National Health System, Mogliano Veneto, Treviso, Italy
Vitalia Murgia
-
Department of Pediatrics, Immuno-Pneumo-Allergy Unit, University of Pavia, Fondazione IRCCS Policlinico San Matteo, Pavia, Italy
Davide Caimmi, Amelia Licari & Gian Luigi Marseglia
-
Biometrics Department (CRO), SPRIM Advanced Life sciences (G.C.P), Milan, Italy
Sreedhar Anapurapu
Authors
- Mario Canciani
You can also search for this author in
PubMed Google Scholar - Vitalia Murgia
You can also search for this author in
PubMed Google Scholar - Davide Caimmi
You can also search for this author in
PubMed Google Scholar - Sreedhar Anapurapu
You can also search for this author in
PubMed Google Scholar - Amelia Licari
You can also search for this author in
PubMed Google Scholar - Gian Luigi Marseglia
You can also search for this author in
PubMed Google Scholar
Corresponding author
Correspondence to
Gian Luigi Marseglia.
Additional information
Competing interests
VM has been a scientific advisor and/or a speaker on educational meetings on Phytotherapy for several companies: Aboca, Dicofarm, Cristalfarma, Labomar, Lemuria, Milte. The other authors declare that they have no competing interests.
Authors’ contributions
MC and GLM designed the study; MC, VM and GLM drafted the manuscript; DC and AL were responsible for data acquisition; SA was responsible for data management and statistical analysis. All authors read and approved the final manuscript.
Authors’ original submitted files for images
Rights and permissions
Open Access This article is licensed under a Creative Commons Attribution 4.0 International License, which permits use, sharing, adaptation, distribution and reproduction in any medium or format, as long as you give appropriate credit to the original author(s) and the source, provide a link to the Creative Commons licence, and indicate if changes were made.
The images or other third party material in this article are included in the article’s Creative Commons licence, unless indicated otherwise in a credit line to the material. If material is not included in the article’s Creative Commons licence and your intended use is not permitted by statutory regulation or exceeds the permitted use, you will need to obtain permission directly from the copyright holder.
To view a copy of this licence, visit https://creativecommons.org/licenses/by/4.0/.
The Creative Commons Public Domain Dedication waiver (https://creativecommons.org/publicdomain/zero/1.0/) applies to the data made available in this article, unless otherwise stated in a credit line to the data.
Reprints and Permissions
About this article
Cite this article
Canciani, M., Murgia, V., Caimmi, D. et al. Efficacy of Grintuss® pediatric syrup in treating cough in children: a randomized, multicenter, double blind, placebo-controlled clinical trial.
Ital J Pediatr 40, 56 (2014). https://doi.org/10.1186/1824-7288-40-56
Download citation
-
Received: 25 March 2014
-
Accepted: 29 May 2014
-
Published: 10 June 2014
-
DOI: https://doi.org/10.1186/1824-7288-40-56
Keywords
- Antitussive
- Children
- Cough
- Efficacy
- Grintuss®
- Barrier effect
- Safety
Grintuss детский сироп является медицинским продуктом на основе меда и молекулярных комплексов, который оказывает защитное И смягчающее действие на дыхательные пути.
Состав
Активные вещества: мед*; молекулярный комплекс смол, полисахаридов, флавоноидов с grindelli*, подорожника* и бессмертника итальянского* (Poliresin®); Назначают на содержание полисахаридов (молекулярный вес >20 000 Дальтон) £ 2096
Также включает в себя: тростниковый сахар*; вода; эфирные масла: лимона, сладкого апельсина, мирта; натуральный ароматизатор лимона; смолу акации; резину ksantanową.
*Ингредиент из Органического земледелия
Действие
Grintuss детский сироп является медицинским продуктом на 100% естественным, созданным на основе инновационных процессов добычи и производства, которые обеспечивают уплотнение смол, полисахаридов и флавоноидов, отвечающих за работу mukoadhezyjne и защитные на слизистую оболочку. Мед присутствует в составе влияет на это действие и придает мозоли приятный вкус.
Работает на сухой кашель сдерживая раздражение слизистой и кашель мокрый, способствуя увлажнению и удалению слизи.
Основные механизмы действия Grintuss:
Grintuss модулируя кашель без его подавления, Уважая таким образом важную защитную роль кашля для дыхательных путей.
Показания
Grintuss детский сироп показан для лечения кашля, как сухого, так и мокрого, у детей старше 1. года жизни.
Инструкция по применению изделия медицинского
Рекомендуется прием 5 мл (одной чайной ложки), детям старше 1. 6. году жизни и 10 мл (две чайные ложки), детям старше 6. лет, от двух до четырех раз в день, давая последнюю порцию перед сном.
Встряхнуть перед использованием. Содержит чайной ложкой дозирующей.
После использования плотно закрыть бутылку и тщательно вымойте чайную ложку шприцем.
Противопоказания и меры предосторожности
Не применять в случае повышенной чувствительности или аллергии на один или несколько компонентов.
Примечания
Доставка / прием продукта:
Прием заказанных товаров возможна по территории всей Польши. Добро пожаловать в , для того, чтобы узнать расположении ближайшей аптеки, которая реализует ваш заказ. Доставка в аптеки по всей стране осуществляется бесплатно в течение 24-72h
Элин Морис1, Питер Кардос2
Название: Морис Э., Кардос П. Комплексный обзор противокашлевых препаратов, применяемых в Европе. BMJ Open Resp Res 2016;3:e000137. doi:10.1136/bmjresp-2016- 000137
Получено 21 марта 2016 года
Принято 28 июня 2016 года
1 Начальник центра сердечно-сосудистых и метаболических исследований, Медицинская школа Халл-Йорк, Университет Халла, больница Касл-Хилл, Коттингем, Великобритания
2 Врачебный центр и центр противоаллергических, респираторных препаратов и препаратов для регуляции сна при больнице Красного креста Майнгау, Франкфурт, Германия
_________
Корреспонденция на имя:
Д-р Элин Морис;
A.H.Morice@hull.ac.uk
_________
РЕЗЮМЕ
Острый кашель, вызванный острыми респираторно-вирусными инфекциями, вероятно, является самым распространенным заболеванием среди людей. Широко распространенное назначение антибиотиков в таких случаях малоэффективно, а специфической терапии не существует. Домашние средства и непатентованные препараты являются основным компонентом лечения данного кратковременного, но изнурительного состояния, при котором кашель является наиболее неприятным симптомом. В Европе существуют различные вариации в отношений рекомендаций врачебного персонала для лечения острого кашля. Это подтверждается данными предшествующих исследований, проведенных по стандартам, которые на сегодняшний день нельзя считать узаконенными. Острый кашель особенно тяжело поддается изучению в контролируемых условиях ввиду высокой частоты спонтанной ремиссии и выраженного эффекта плацебо. В данной статье представлена валидированная современная методика оценки эффективности противокашлевых препаратов и обзор препаратов, применяемых в странах Европы в нарушение данных стандартов.
ВВЕДЕНИЕ
Острый кашель — самый распространенный симптом, требующий обращения за медицинской помощью. Он обусловливает 50% новых обращений за медицинской помощью и является основным источником консультаций в фармацевтической практике. Поскольку симптоматическая терапия является основным методом лечения данного доброкачественного самоизлечивающегося заболевания, фармацевты играют ключевую роль в лечении данного состояния.
К сожалению, многие непатентованные препараты, рекомендованные в настоящее время в странах Европы, основаны на практическом опыте и не прошли клинические исследования достаточного качества, дабы соответствовать стандартам современной научно-обоснованной медицины. Здесь приведен обзор диагностических и терапевтических вариантов для лечения самого распространенного недуга человечества.
Острый кашель при простуде и остром бронхите
Во всем мире существует несколько схожих терминов, описывающих клинический синдром острой респираторно-вирусной инфекции (ОРВИ). С нашей точки зрения, представленная ниже терминология в полной мере отражает различные аспекты одного и того же синдрома.
Простуда — это ОРВИ, симптомы которой включают боль в горле, чихание, озноб, насморк, заложенность носа, кашель и недомогание.1
Острый кашель, то есть кашель, имеющий условную продолжительность < 2 недель, — одна из самых распространенных причин обращения пациента к врачу в амбулаторных условиях.2
Острый бронхит — клинический термин, подразумевающий самоограничивающееся воспаление крупных дыхательных путей легких, характеризуемое кашлем без пневмонии, которая диагностируется за счет очагового уплотнения при рентгенографии грудной клетки.3
В настоящее время бытует мнение, что дифференцированная диагностика острого кашля, обусловленного острым бронхитом и/или обычной простудой, не целесообразна.4 5 Существуют лишь незначительные патологические различия, если таковые вообще имеются, в связи с основной локализацией вирусов, поражающих дыхательные пути. Эпидемиологические исследования показали, что острый кашель у в целом здоровых людей проходит самостоятельно в среднем за 14 дней.6 Однако, у детей острый кашель может сохраняться в среднем до 25 дней.7
Острый бронхит вызывают вирусы (в ~50% случаях риновирусная инфекция) как минимум в 90% случаев.8 Для данных инфекций не существует радикального (противовирусного) лечения, а антибактериальная терапия неоднократно показывала свою неэффективность у пациентов при отсутствии предшествующего заболевания легких.9 Несмотря на самоограничивающийся характер заболевания, острый бронхит представляет собой серьезную проблему для пациента и требует немалых финансовых затрат со стороны общества, в основном в связи с отсутствием пациентов на работе и в школе. Свыше 50% новых обращений к врачу обусловлены в основном острым кашлем и 85% случаев по ошибке лечат антибиотиками — которые не оказывают влияния на выздоровление.10 Видимый успех связан c быстрым спонтанным выздоровлением и выраженным эффектом плацебо.11 Необоснованное и неконтролируемое применение антибиотиков при остром бронхите приводит к растущей резистентности к данному типу препаратов.12
Острый кашель на фоне острых респираторно-вирусных инфекций
При острых респираторно-вирусных инфекциях боль в горле, головная боль, чихание, насморк и заложенность носа возникают на ранних стадиях заболевания; кашель развивается лишь на 2-4 день, однако позднее на 4 день становится наиболее изнуряющим и самым длительным симптомом, сохраняющимся на 14 дня.13-15
Вирусные инфекции респираторного эпителия вызывают ранний выброс многих медиаторов воспаления, разрушающих респираторный эпителий, сенсибилизируя хемочувствительные кашлевые рецепторы и нейронный путь кашлевого рефлекса.16 17 Таким образом, гиперчувствительность афферентных нервов, а не гиперпродукция слизи, считается основным механизмом, вызывающим кашель при остром бронхите. При гиперсекреции слизи слабовыраженной или умеренной степени она является обусловленной поверхностными бокаловидными клетками и подслизистыми железами.18 Выработка слизи, как правило, происходит при простуде только в первые 48-72 часа. Оценка групп плацебо (n=774) в нескольких исследованиях пациентов с простудой после 1 дня не выявила увеличения отхождения мокроты.19 Следовательно, при респираторно-вирусных инфекциях отхождение мокроты сохраняется непродолжительный период времени, а ее количество незначительно.20 С терапевтической точки зрения, лечение влажного и сухого кашля остается одинаковым, и недавно были предприняты попытки отказаться от такой классификации.21 Таким образом, противокашлевые препараты с доказанной эффективностью могут служить подходящим методом лечения для облегчения изнурительного кашля любой природы при острой респираторно-вирусной инфекции. Усугубление бронхиальной обструкции представляет риск лишь для пациентов с предшествующей хронической обструкцией дыхательных путей.2
Большинство сведений в поддержку лекарственной терапии при остром кашле устарели и имеют ненадлежащее качество. Имеется мало данных, полученных из рандомизированных контролируемых исследований, соответствующих современным стандартам. При назначении терапии также имеют место географические различия. Например, в Германии непатентованные секретолитики и муколитики, например, амброксол и N-ацетилцистеин (NAS) — самые часто применяемые препараты, процент продаж которых составляет 47,4% от всего сегмента непатентованных препаратов для лечения простуды (источник: Отчет Межконтинентальной маркетинговой службы по непатентованным препаратам). Напротив, в Северной Америке чаще всего применяются непатентованные пероральные деконгестанты/Н-1 антигистамины первого поколения (седативные). Оба варианта имеют мало подтверждающих данных. Разрушение полимеров слизи и снижение ее вязкости с помощью муколитиков не доказало свою эффективность при лечении острого бронхита.22 Хотя антигистамины первого поколения, например, дифенгидрамин, могут обладать эффективностью при лечении кашля,23 о препаратах второго поколения этого сказать нельзя.
Как оценить эффективность противокашлевых препаратов
Поскольку острый бронхит и острый кашель по определению являются самоизлечивающимися заболеваниями продолжительностью несколько дней, очень сложно различить спонтанные ремиссии ввиду натурального улучшения состояния пациента на фоне приема любых препаратов. На протяжении многих лет применяются три способа оценки противокашлевой активность современных препаратов. Субъективные меры, например, визуальная аналоговая шкала (ВАШ) или простой опрос пациента об облегчении кашля первоначально были предпочтительным способом оценки эффективности, и многие давно применяемые препараты были одобрены на этом основании. К сожалению, многие исследования имели неудачный дизайн и недостаточное количество пациентов, зачастую с сочетанием таких заболеваний, как хронический бронхит, туберкулез и даже рак легких! Очевидно, что такие исследования были бы недопустимы сегодня. Следовательно, научные обоснования многих традиционных противокашлевых препаратов слишком слабы и, на наш взгляд, недостаточны для того, чтобы утверждать о противокашлевой активности с точки зрения современной «доказательной медицины».
Было разработано два объективных метода оценки кашля. Во-первых, в 1950-е гг. была применена кашлевая проба, которая впоследствии была усовершенствована, став очень точным средством оценки кашлевого рефлекса. Участник вдыхает возрастающую концентрацию провоцирующего кашель вещества, например, лимонной кислоты или капсаицина — жгучего экстракта красного перца. Влияние препарата на чувствительность кашлевого рефлекса сравнивали с таковым плацебо. Данный метод оптимально подходит для оценки характеристик исследуемого препарата, например, временного периода, и часто применяется при разработке новых препаратов; он также был рекомендован Управлением по контролю за продуктами и лекарствами (FDA) в рамках подачи документации на регистрацию. Однако, полученные данные не всегда коррелируют с субъективными мерами. Например, морфин обладает высокой эффективностью в подавлении кашля у некоторых пациентов, но при этом не меняет чувствительность кашлевого рефлекса.
Третий метод был разработан недавно и направлен на оценку кашля путем подсчета его эпизодов.24 Для его разработки потребовалось несколько технических этапов, в частности вычислительной способности, дабы сформировать надежный способ подсчета кашлевых эпизодов. Подсчет кашлевых эпизодов считается «золотым стандартом» для оценки противокашлевой эффективности FDA. К сожалению, поскольку этот метод был разработан лишь недавно, лишь немногие непатентованные противокашлевые препараты были изучены с его использованием. В действительности лишь один препарат, декстрометорфан, доказал эффективность в данной области.25
Оптимальнее всего рассматривать различные методы оценки кашля, как показано на трех частично совпадающих кругах диаграммы Венна (рисунок 1). Из трех имеющихся методов субъективная оценка обладает наименьшей надежностью, и оценку прошли лишь несколько заметных исключений. Таким образом, мы считаем, что заявления о противокашлевой активности, используя исключительно субъективные критерии, дают недостаточно доказательств об эффективности; данную точку зрения поддерживает FDA.
Так, в попытке усовершенствовать рациональное назначение терапии мы провели обзор данных о часто применяемых препаратах при остром кашле, особенно в странах Европы. Мы провели оценку трех аспектов эффективности препарата при остром кашле: влияния на кашлевой рефлекс с помощью кашлевой пробы, а также объективного (регистрация кашля) и субъективного критериев (т.е. показателей симптома, специфического качества инструментов оценки) влияния на клинический исход.
Рисунок 1. Три метода изучения кашля и их взаимосвязь. LCQ, опросник интенсивности кашля Лестера
ЭФФЕКТИВНОСТЬ ПРОТИВОКАШЛЕВЫХ ПРЕПАРАТОВ Кодеин
Кодеин зачастую считают прототипичным противокашлевым препаратом, хотя имеется немного информации о том, что он обладает собственной присущей ему активностью. У людей кодеин действует в качестве пролекарства, превращаясь в морфин в печени под действием ферментов цитохрома P450 2D6.26 Морфин на протяжении столетий применялся для лечения кашля и доказал свою эффективность в рандомизированных контролируемых исследованиях (РКИ). Опыт применения препарата при хроническом кашле свидетельствует о том,что морфин эффективен лишь у одной трети-половины пациентов, тогда как у остальных он не облегчает тяжесть данного симптома. Неизвестно, насколько эти данные применимы также к острому бронхиту и кашлю при простуде.
Несмотря на щирокое применение, имеется совсем мало клинических данных в пользу выраженной противокашлевой активности при пероральном применении кодеина. В некоторых исследованиях сообщалось об отсутствии эффекта при кашлевой пробе или на ощущение необходимости откашляться, тогда как в других испытаниях сообщалось о слабовыраженном, но заметном эффекте.27 В двух исследованиях с качественным дизайном по изучению кашля на фоне ОРВИ кодеин 30 мг в течение 4 дней 4 раза в сутки оказывал влияние, не превышавшее эффект плацебо в форме сиропа, как по объективным данным о первоначальном кашле, так и при последующей оценке кашля самими пациентами.28 Во втором исследовании в параллельных группах кодеин (50 мг) п/о сравнивали с плацебо в форме сиропа у 82 участников с использованием трех методов оценки кашля; опять же установленный эффект не превышал эффект плацебо.29
Система цитохрома, превращающая пролекарство кодеин в морфин обладает высоким полиморфизмом.28 Некоторые пациенты являются быстрыми метаболизаторами, превращая большую часть кодеина в морфин при первом прохождении через печень.26 У других, медленных метаболизаторов, трансформации подвергается лишь незначительная часть кодеина. Таким образом, при назначении кодеина пациентам, ранее не применявшим препарат, невозможно предсказать степень опиатного воздействия или побочные эффекты. Передозировка или недостаточная дозировка не поддаются прогнозированию. Европейское медицинское агентство ограничило применение кодеина у детей именно по этой причине, а FDA в настоящее время занимается оценкой применение препаратов на основе кодеина для лечения кашля и простуды у детей.30 31 У детей-быстрых метаболизаторов отмечались опасные уровни седации и угнетения дыхания.26 На наш взгляд, это не просто проблема для детей, а риск, связанный с применением кодеина, намного перевешивает ограниченные данные о его эффективности в клинических исследованиях.
Декстрометорфан
В рамках подсчета кашлевых эпизодов, который считается золотым стандартом оценки кашля регуляторными органами, включая FDA, лишь декстрометорфан доказал способность эффективно подавлять кашель, исходя из данного объективного метода. В ходе трех исследований, проведенных Парвесом и др.,27 проводилось наблюдение 451 пациента с использованием акустических мониторов для контроля кашля. По сравнению с плацебо отмечалось выраженное сокращение кашлевых эпизодов при приеме декстрометорфана 30 мг. Для того, чтобы подтвердить терапевтический эффект, декстрометорфан применяли в форме капсул, тем самым устраняя успокоительный эффект сиропа. Это может объяснять относительно медленное начало действия, наблюдаемое в исследовании. Последующие исследования дестрометорфана были проведены с использованием формы сиропа, что обусловило быстрое развитие успокоительного действия и эффективности препарата. Такие положительные результаты были подтверждены данными последующего мета-анализа.32
По второму аспекту оценки эффективности противокашлевых препаратов декстрометорфан также удовлетворяет требованиям. Были проведены многочисленные исследования фармакодинамики и фармакокинетики декстрометорфана в различных условиях кашлевой пробы.27 Проба с лимонной кислотой — наиболее распространенный вариант, однако недавно было доказано, что для декстрометорфана проба с капсаицином является более надежной.33 Было установлено, что декстрометорфан обладает медленным началом действия, достигая максимум приблизительно через 2 часа. В связи с относительно медленным проникновением через гематоэнцефалический барьер и последующим удержанием в центральной нервной системе декстрометорфан обладает более длительной противокашлевой эффективностью, значительно превышая плацебо уже через 24 часа.34 Некоторые пробы также показали, что повышение рекомендованной дозы 30 мг может обладать большей эффективностью в отношении кашля.
При остром кашле на фоне простуды получить субъективные данные об эффекте декстрометорфана сложнее. Как и во многих литературных источниках, содержащих субъективную оценку противокашлевой эффективности различных препаратов, многие исследования не соответствуют современным критериям, включая небольшое количество участников, зачастую с различными заболеваниями и измерением тяжести симптомов без валидированных методик. Вероятно, наибольшей проблемой для любой субъективной оценки кашля при простуде является быстрая скорость спонтанной ремиссии при данном остром заболевании, выраженный эффект плацебо и успокаивающее влияние сиропов. В современных препаратах, содержащих декстрометорфан, все эти дополнительные опции применяются для увеличения эффективности. Сочетая три направления в доказательной базе, была отмечена чрезмерная противокашлевая активность, обусловленная декстрометорфаном в дозе 30 мг примерно на 17%.32
Пентоксиверин
Пентоксиверина цитрат применяется в качестве неопиоидного противокашлевого средства центрального действия. О его клинической эффективности имеется очень мало сведений, полученных из давно проведенных клинических исследований с неподходящим дизайном более чем 50-летней давности. Однако, исследования на животных демонстрируют эффективность при индуцированном кашле путем электрической стимуляции или пробы с лимонной кислотой.35 36 По нашему опыту, исследования на животных с очень низкой долей вероятности способны предсказать клиническую эффективность противокашлевых препаратов.
Бутамират
Препараты на основе бутамирата широко применяются в странах Европы в качестве непатентованных противокашлевых средств. Предположительно бутамират обладает центральным механизмом действия, который не имеет ни химического, ни фармакологического отношения к действию опиоидных алкалоидов. Бутамират также обладает неспефическим антихолинергическим действием и, следовательно, бронхорасширяющими свойствами. Бутамират, согласно заявлению производителя, обладал эффективностью в нескольких двойных слепых, рандомизированных исследования в параллельных группах с использованием кодеина и других препаратов сравнения, однако во всех исследованиях отсутствовал плацебо-контроль.37-39 Единственное плацебо-контролируемое исследование осталось неопубликованным и прилагается к досье. Влияние бутамирата на чувствительность кашлевого рефлекса, согласно результатам ингаляционной кашлевой пробе с капсаицином у здоровых участников, было недавно изучено в ходе плацебо-контролируемого рандомизированного перекрестного исследования с шестью периодами, в котором декстрометорфан служил в качестве положительного контроля. Все четыре дозы бутамирата не вызывали более выраженного подавления кашлевого рефлекса по сравнению с плацебо, тогда как декстрометорфан был намного эффективнее.33
Леводропропизин
Считается, что леводропропизин обладает периферическим действием, и данный противокашлевой препарат широко применяется в странах южной Европы, особенно в Италии. Клинические исследования в поддержку его применения у детей и взрослых, приведены в недавно проведенноммета-анализе с открытым доступом.40 Было проведено четыре исследования с участием детей и три — с участием взрослых. Лишь в двух исследованиях было сравнение с плацебо. Исследование на детях включало 12 детей41 с астмой; об исследовании на взрослых (n=40) отсутствуют полные данные, однако оно было включено в другой мета-анализ и, по-видимому, было проведено с участием госпитализированных пациентов, большинство из которых страдали хроническим бронхитом.42 таким образом, отсутствуют плацебо-контролируемые исследования, демонстрирующие эффективность леводропропизина при остром кашле. Среди других сравнительных исследований лишь два были проведены на пациентах с острым кашлем.43 44 Самым крупномасштабным и, следовательно, давшим большую часть результатов мета-анализа, было нерандомизированное открытое обсервационное испытание с участием детей.43 Все виды лечения обладали одинаковой эффективностью в ослаблении субъективных мер, однако, поскольку препараты сравнения также не показали эффективность в сравнении с плацебо, данное заявление несет в себе мало пользы.
Амброксол
Амброксол — активный метаболит бромгексина и наиболее часто применяется непатентованный препарат в Германии (в 2015 году его доля на рынке отхаркивающих средств составляла 24% + дополнительно 1,7% для бромгексина, источник: Отчет Межконтинентальной маркетинговой службы по непатентованным препаратам). Наибольшее число упоминаний датируются 1970-80-ми гг. и связаны с долгосрочным применением препарата при обструктивной болезни легких для профилактики обострений и при хроническом бронхите45 для увеличения отхаркивания. Недавно проведенный обзор по клиническим данным о применении амброксола46 показал, что, исходя из применимости дизайна исследования (т.е. рандомизированное, двойное слепое, контролируемое) при кратковременном применении у взрослых, лишь 3 исследования из 24 соответствовали задаче.15 47 48 Лишь испытание, проведенное Маттисом и др.,15 было направлено на изучение острых респираторно-вирусных инфекций в ходе крупномасштабного исследования с 4 параллельными группами (приблизительно по 170 пациентов в каждой группе), имевшего двойной слепой, рандомизированный дизайн под контролем четырех плацебо. Проводилось сравнение влияния 3×30 мг амброксола в 1-3 дни, 2×30 мг в 4-14 дни, 4×300 мг миртола (стандартизованного фитотерапевтического дистиллята, содержащего 1,18 цинеол), 1-14 дни и 2×250 мг цефуроксима в 1-6 дни в сравнении с плацебо свыше 2 недель. Среди вторичных исходов имелись данные из дневников пациентов о ночном кашле и кашлевых эпизодах в день оценки. Все три варианта лечения обладали схожей эффективностью и значительно превосходили плацебо. В ходе других двух исследований было изучено кратковременное лечение хронических состояний.47 48 Исследования на детях были проведены только без контрольной группы или в сравнении с активным препаратом сравнения при открытом дизайне.
Исходя из имеющихся данных, симптоматическая эффективность амброксола в сравнении с плацебо при кашле была доказано в единственном РКИ.
N-ацетилцистеин
NAC — второй по популярности препарат для лечения острого кашля в Германии, его доля на рынке непатентованных отхаркивающих препаратов составляла 23,5% в 2015 году (источник: Отчет Межконтинентальной маркетинговой службы по непатентованным препаратам). Данный факт резко контрастирует с имеющимися данными для данного показания. Мета-анализ трех РКИ Кокрановской библиотеки у пациентов с кашлем на 7 день в качестве основного исхода был проведен в отношении инфекций верхних и нижних дыхательных путей у детей.49 Была отмечена статистически значимая польза, однако авторы посчитали эти данные не имеющими особой клинической значимости. Еще один Кокрановский обзор непатентованных препаратов при остром кашле, проведенный в 2014 году, не выявил каких-либо ссылок на NAS50, равно как и поиск MEDLINE авторами данной статьи (условия поиска «N-ацетилцистеин И Кашель; N-ацетилцистеин И Бронхит; Ацетилцистеин И Кашель; Ацетилцистеин И Бронхит).
Оксомемазин
Отсутствуют опубликованные, плацебо-контролируемые, двойные слепые исследования с применением оксомемазина при кашле. В исследовании, проведенном Пужетом и др.,51 оксомемазин и гуайфенезин сравнивали в ходе простого слепого исследования с клобутинолом с участием 130 пациентов с «кашлем инфекционной природы». Интенсивность кашля по оценке с помощью ВАШ быстро снижалась в группе оксомемазина, хотя различия в общей частоте разрешения кашля отсутствовали. В неконтролируемом исследовании на 46 детях младше 2 лет52 прогресс был описан как «удовлетворительный» у половины участников. Шапуи и др.53 сообщали о неконтролируемых наблюдениях влияния «нового антигистамина» на кашель с другими аллергическими реакциями без указания данных о пациентах.
Гелицидин
Гелицидин — мукогликопротеин, экстрагируемый из улитки Helix pomatia. Гелицидин более 50 лет применяется во Франции для лечения кашля. Исследования на животных in vivo показали противокашлевую эффективность на кошках; однако данное исследование не было опубликовано.54 Плацебо-контролируемое исследование на взрослых госпитализированных пациентах с различными диагнозами, а также обсервационное исследование с участием детей также не попали в печать.54 Исследования 1950-х гг. утверждают об антибактериальном эффекте при коклюше, вызванном Haemophilus (ныне Bordetella).55 Также было проведено исследование под контролем сиропа плацебо54 с объективным подсчетом кашля в лаборатории исследования сна у 30 пациентов с хронической обструктивной болезнью легких и объективно подтвержденным ночным кашлем. В отношении первичных исходов частоты кашля и длительности кашля было о отмечено почти 50% превосходство в их снижении, тогда как в отношении вторичных субъективных исходов статистически значимые различия не наблюдались. Таким образом, отсутствуют опубликованные клинические сведения в поддержку воздействия гелицидина при остром кашле или остром бронхите.
Ментол
Ментол — монотерпен, получаемый из мяты перечной Mentha arvensis, из которого экстрагируют натуральное мятное масло. Охлаждающий эффект ментола обусловлен специфическим «холодовым» рецептором TRPM8, входящим в семейство ноцицепторов транзиторного рецепторного потенциала.56 Он расположен главным образом в афферентных сенсорных нейронах и оказывает противораздражающее действие за счет блокады потенциалзависимых натриевых каналов.
Ментол обладает древней историей и является основным ингредиентом многих непатентованных препаратов. Противокашлевая эффективность была коммерциализирована после разработки ментоловой мази Лансфордом Ричардсоном в 1890 году,57 а недавно полученные данные показали, что противокашлевой эффект ментола может заключаться в активации афферентных чувствительных нейронов носа, а не легких.58
Клинические данные об активности ментола ограничиваются несколькими клиническими исследованиями, проведенными в соответствии с современными стандартами. Провокационные испытания у здоровых добровольцев демонстрируют кратковременное ослабление индуцированного кашля. В ходе простого и слабо контролируемого исследования пары ментола вызывали ослабление кашля, индуцированного капсаицином. 59 Кашель, вызванный ингаляцией лимонной кислоты, сокращался у взрослых при ингаляции паров ментола по сравнению с контролем, в котором осуществлялась ингаляция воздуха и соснового масла60, и у детей в сравнении с исходной пробой. Однако полученные результаты не достигали значимости по сравнению с плацебо.61 Как это ни удивительно, отсутствуют опубликованные клинические исследования влияния ментола и препаратов на его основе при остром кашле или бронхите.
Дифенгидрамин
Дифенгидрамин — H1 антигистамин первого поколения, одобренный к применению в некоторых странах в качестве непатентованного противокашлевого средства, в том числе в США и Великобритании. В Германии дифенгидрамин 50 мг был одобрен в качестве снотворного и противорвотного средства. Противокашлевые препараты первого поколения в сочетании с пероральными деконгестантами рекомендованы руководством Американской коллегии врачей-специалистов по заболеваниям грудной клетки по лечению кашля при простуде и при так называемом синдроме кашля верхних дыхательных путей.62 Однако, несмотря на название данного руководства, данная рекомендация основана на экспертной оценке.63 Провокационные исследования на здоровых добровольцах64 и пациентах с острой респираторно-вирусной инфекцией (комбинация сиропа дифенгидрамина с деконгестантом) у взрослых позволили установить эффективность.65 Тем не менее, для острого кашля отсутствуют исследования симптомов или объективного контроля кашля. Имеет место четкое несоответствие между данными об эффективности и широком применении дифенгидрамина/комбинаций с деконгестантом при остром кашле — несмотря на выраженный седативный эффект (головокружение) — особенно в США. В Таблице 1 приведена оценка соответствия европейских противокашлевых препаратов современным показателям в исследованиях кашля.
Противокашлевые препараты в комбинированной терапии простуды
Сочетание активных ингредиентов часто применяется для борьбы с многочисленными симптомами ОРВИ. Такой подход основан исключительно на логике, когда симптомы требуют различных терапевтических мер. Таким образом, добавление парацетамола к противокашлевому средству для борьбы с кашлем и головной болью или болью в мышцах имеет смысл. Аналогичным образом, добавление седативного антигистамина в препарат, принимаемый на ночь, который содержит противокашлевой ингредиент, также может обладать дополнительной пользой и облегчать симптом. Однако, некоторые комбинации, представленные на рынке, необоснованны и составлены со слабым пониманием патофизиологических аспектов. Эксперты все в большей степени осознают, что имеется мало сведений в поддержку отхаркивающей активности, а некоторые препараты, расцениваемые как отхаркивающие средства, в провокационных исследованиях обладали противовоспалительным,66 антиоксидантным67 и противокашлевым свойствами.68 Аналогичным образом, отхаркивающие средства, несмотря на их широкое назначение в составе комбинированной терапии, могут оказывать воздействие путем ослабления чувствительности кашлевого рефлекса и, следовательно, облегчения ощущения гиперсекреции слизи. Вероятно, наиболее интересные иссоедования, позволяющие понять механизм действия амброксола, — это недавние исследования его способности подавлять потенциалзависимые натриевые каналы, расположенные на чувствительных нервах.69 Подобная активность, вероятно, лежит в основе клинически значимых местных анестезирующих свойств, что говорит в пользу применения амброксола для лечения боли в горле. Блокада натриевых каналов также может объяснять некоторые другие свойства данного класса препаратов за счет блокады нейрогенного воспаления.
Таблица 1. Доказанная в РКИ эффективность противокашлевых препаратов с помощью трех различных систем оценки интенсивности кашля при остром бронхите
| Данные РКИ по эффективности препаратов | Субъективные клинические симптомы | Объективная регистрация кашля | Кашлевая проба | Примечания |
| Кодеин | — | — | — | Отсутствие убедительных данных об эффективности |
| Декстрометорфан | + | + | ++ | Хорошо охарактеризовано в объективных исследованиях |
| Пентоксиверин | — | — | — | Лишь исследования на животных и 3 клинических исследования давностью более 50 лет |
| Бутамират | — | — | — | Отсутствие опубликованных плацебо-контролируемых исследований |
| Леводропропизин | + | — | + | 6 краткосрочных исследований под контролем плацебо и исследований с активным контролем n=174 |
| Амброксол | + | — | — | Многие дополнительные неинтервенционные исследования |
| N-ацетилцистеин | Дети + Взрослые — | — | — | Многочисленные исследования ХОБЛ, хронического кашля, антиоксидантных свойств |
| Оксомемазин | — | — | — | Лишь обсервационные исследования |
| Ментол | — | — | + | Широкое применение. Пары противокашлевого средства за счет TRPM8 |
| Гелицидин | — | — | — | Отсутствие клинических данных об эффективности при остром кашле |
| Дифенгидрамин | — | — | — | Широкое клиническое применение |
| ХОБЛ, хроническая обструктивная болезнь легких; РКИ, рандомизированное контролируемое исследование. |
Возможно, наиболее важным аспектом при применении комбинированных препаратов является возможность лекарственного взаимодействия, поэтому требуется проведение надлежащих исследований безопасности и эффективности. Следует рассматривать лишь исследования с достаточной мощью. В качестве примера Мидзогути и др.70 обследовали 432 участников в ходе плацебо-контролируемого исследования сиропа, содержащего 15 мг декстрометорфана бромида, 7,5 мг доксиламина сукцината, 600 мг парацетамола и 8 мг эфедрина сульфата. Первичная конечная точка (совокупность облегчения заложенности носа/насморка/кашля/боли через 3 часа после применения препарата) показала высокий выраженный благоприятный эффект в группе, получавшей активное лечение (p=0,0002). Показатель каждого отдельного симптома также продемонстрировал статистически значимое улучшение через 3 часа после приема препарата (p<0,017). В группе активного лечения на следующее утро было отмечено продолжающееся клиническое и статистическое улучшение (p<0,003). Данные о пользе исследуемого сиропа также подтверждались увеличением показателя общего облегчения состояния в ночное время (p<0,0001) и более высокой удовлетворенности от сна (p=0,002). Нежелательные эффекты отмечалось вдвое реже в группе активного контроля по сравнению с плацебо, и частота явлений в данной популяции не превышала 1%. По нашему мнению, лишь использование крупномасштабных контролируемых исследований с надлежащим дизайном подобно этому позволяет с уверенностью рекомендовать комбинированные препараты.
Рекомендованные терапевтические методы
- ОРВИ являются доброкачественными и самоизлечивающимися состояниями, поэтому пациентам со слабовыраженными симптомами ничего не угрожает.
- Успокаивающее действие простой микстуры от кашля/сиропа, например, на основе меда и лимона, могут в значительной степени облегчить кашель, хотя и на непродолжительный срок. Данный подход является предпочтительным, особенно у детей.
- При сухом или малопродуктивном кашле наиболее показан декстрометорфан 30-60 мг/сутки.
- При наличии дополнительных симптомов следует рассмотреть назначение комбинированного препарата, содержащего достаточное количество декстраметорфана.
- Кашель, сохраняющийся более 2 недель, требует дополнительной диагностической оценки.
ЗАКЛЮЧЕНИЯ
Острый кашель — самый распространенный симптом, встречающийся у людей. Хотя, как правило, это доброкачественное и самоизлечивающееся состояние, частота последствий острых респираторно-вирусных инфекций играет важнейшую роль. При использовании научно-обоснованного лечения можно достичь значительного улучшения исхода для пациентов. Хотя существует немало пробелов в знаниях касательно лечения острого кашля, улучшение понимания механизма кашлевой гиперчувствительности позволяет с большей эффективностью подбирать рациональное лечение. Лучшее понимание механизма нормализации данного аномального рефлекса, позволяющего облегчить состояние и сократить длительность заболевания, может сыграть ключевую роль для общества в целом.
Финансирование Procter & Gamble.
Конфликт интересов В момент составления данной статьи AM и PK являлись оплачиваемыми консультантами PGT Healthcare, однако отвечали за полное составление текста статьи. Компания PGT Healthcare также оплатила публикацию данной статьи.
Источник и экспертное рецензирование Не заказано; экспертное рецензирование проводится независимым специалистом.
Заявление о коллективном использовании данных Дополнительные данные отсутствуют.
Открытый доступ Данная статья находится в открытом доступе и подлежит распространению согласно условиям лицензии Сообщества творческих людей (CC BY 4.0), позволяющей другим лицам распространять, компоновать, адаптировать и использовать данную статью для комерческой цели при условии указания оригинальной работы. См: http:// creativecommons.org/licenses/by/4.0/
ССЫЛКИ
- Eccles R. Understanding the symptoms of the common cold and influenza. Lancet Infect Dis 2005;5:718-25.
- Burt CW, Schappert SM. Ambulatory care visits to physician offices, hospital outpatient departments, and emergency departments: United States, 1999-2000. Vital Health Stat 2004;157:1-70.
- Wenzel RP, Fowler AA III. Clinical practice. Acute bronchitis. N Engl JMea 2006;355:2125-30.
- Braman SS. Chronic cough due to acute bronchitis: ACCP evidence-based clinical practice guidelines. Chest 2006; 129:95S-103S.
- Hueston WJ, Mainous AG III, Dacus EN, etal. Does acute bronchitis really exist? A reconceptualization of acute viral respiratory infections. J Fam Pract 2000;49:401-6.
- Albert RH. Diagnosis and treatment of acute bronchitis. Am Fam Physician 2010;82:1345-50.
- Thompson M, Vodicka TA, Blair PS, etal., TARGET Programme Team. Duration of symptoms of respiratory tract infections in children: systematic review. BMJ 2013;347:f7027.
- Acute Cough Illness (Acute Bronchitis) http://www.cdc.gov/getsmart/ community/materials-references/print-materials/hcp/ adult-acute-cough-illness.pdf (accessed Jan 2016).
- Fahey T, Stocks N, Thomas T. Quantitative systematic review of randomised controlled trials comparing antibiotic with placebo for acute cough in adults. BMJ 1998;316:906-10.
- Butler CC, Hood K, Verheij T, etal. Variation in antibiotic prescribing and its impact on recovery in patients with acute cough in primary care: prospective study in 13 countries. BMJ 2009;338:b2242.
- Lee PC, Jawad MS, Hull JD, etal. The antitussive effect of placebo treatment on cough associated with acute upper respiratory infection. Psychosom Med 2005;67:314-17.
- Antibiotic resistance: a final warning. Lancet 2013;382:1072.
- Witek TJ, Ramsey DL, Carr AN, et al. The natural history of community-acquired common colds symptoms assessed over 4-years. Rhinology 2015;53:81-8.
- Gwaltney JM Jr, Hendley JO, Simon G, etal. Rhinovirus infections in an industrial population. II. Characteristics of illness and antibody response. JAMA 1967;202:494-500.
- Matthys H, de MC, Carls C, etal. Efficacy and tolerability of myrtol standardized in acute bronchitis. A multi-centre, randomised, double-blind, placebo-controlled parallel group clinical trial vs. cefuroxime and ambroxol. Arzneimittelforschung 2000;50: 700-11.
- Abdullah H, Heaney LG, Cosby SL, etal. Rhinovirus upregulates transient receptor potential channels in a human neuronal cell line: implications for respiratory virus-induced cough reflex sensitivity. Thorax 2014;69:46-54.
- Atkinson SK, Sadofsky LR, Morice AH. How does rhinovirus cause the common cold cough? BMJ Open Resp Res 2016;3:e000118.
- Rubin BK. Mucolytics, expectorants, and mucokinetic medications. RespirCare 2007;52:859-65.
- Lehrl S, Matthys H, Kamin W, etal. The BSS—a valid clinical instrument to measure the severity of acute bronchitis. Pulm Respir Res 2014;1:00016.
- Morice AH, Widdicombe J, Dicpinigaitis P, etal. Understanding cough. EurRespirJ 2002;19:6-7.
- Morice AH, Kantar A, Dicpinigaitis PV, et al. Treating acute cough: wet versus dry—have we got the paradigm wrong? ERJ Open Res 2015;1:00055-2015.
- Nadel JA. Mucous hypersecretion and relationship to cough. Pulm Pharmacol Ther2013;26:510-13.
- Gwaltney JM, Druce HM. Efficacy of brompheniramine maleate for the treatment of rhinovirus colds. Clin Infect Dis 1997;25: 1188-94.
- Morice AH, Fontana GA, Belvisi MG, et al. ERS guidelines on the assessment of cough. EurRespirJ 2007;29:1256-76.
- Parvez L, Vaidya M, Sakhardande A, etal. Evaluation of antitussive agents in man. Pulm Pharmacol 1996;9:299-308.
- Gasche Y, Daali Y, Fathi M, et al. Codeine intoxication associated with ultrarapid CYP2D6 metabolism. N Engl J Med 2004;351:2827-31.
- Dicpinigaitis PV, Morice AH, Birring SS, et al. Antitussive drugs— past, present, and future. Pharmacol Rev 2014;66:468-512.
- Eccles R, Morris S, Jawad M. Lack of effect of codeine in the treatment of cough associated with acute upper respiratory tract infection. J Clin Pharm Thei 1992;17:175-80.
- Freestone C, Eccles R, Morris S, et al. Assessment of the antitussive efficacy of codeine using cough sound pressure levels as a means of measuring cough. Pulm Pharmacol 1996;9:365.
- European Medicines Agency. Codeine not to be used in children below 12 years for cough and cold. 24 April 2015, EMA/249413/ 2015.
- U.S. Food and Drug Administration Drug Safety Communications. FDA evaluating the potential risks of using codeine cough-and-cold medicines in children. 1 July 2015.
- Pavesi L, Subburaj S, Porter-Shaw K. Application and validation of a computerized cough acquisition system for objective monitoring of acute cough: a meta-analysis. Chest 2001;120:1121-8.
- Faruqi S, Wright C, Thompson R, et al. A randomized placebo controlled trial to evaluate the effects of butamirate and dextromethorphan on capsaicin induced cough in healthy volunteers. BrJ Clin Pharmacol 2014;78:1272-80.
- Abdul-Manap R, Wright CE, Rostami-Hodjegan A, etal. Cytochrome P450 2D6 (CYP2D6) activity in relation to the antitussive effect of dextromethorphan. BrJ Clin Pharmacol 1999;47:586-7.
- Brown C, Fezoui M, Selig WM, et al. Antitussive activity of sigma-1 receptor agonists in the guinea-pig. Br J Pharmacol 2004;141:233-40.
- Talbott MW, Barch GK, Gabel LP. A new method for evaluating antitussives in cats using an electrode-cannula. Eur J Pharmacol 1975;34:59-63.
- Lejeune J, Weibel MA. Comparison of 2 antitussive agents in pediatrics (butamirate citrate in drinkable solution and zipeprol syrup). Rev Med Suisse Romande 1990;110:181-5.
- Germouty J, Weibel MA. Clinical comparison of butamirate citrate with a codeine-based antitussive agent. Rev Med Suisse Romande 1990;110:983-6.
- Charpin J, Weibel MA. Comparative evaluation of the antitussive activity of butamirate citrate linctus versus clobutinol syrup. Respiration 1990;57:275-9.
- Zanasi A, Lanata L, Fontana G, et al. Levodropropizine for treating cough in adult and children: a meta-analysis of published studies. Multidiscip RespirMed 2015;10:19.
- Fiocchi A, Arancio R, Murgo P, etal. Levodropropizine effectiveness on nocturnal cough in asthmatic children. Eur Res J 1991;4:594.
- Allegra L, Bossi R. Clinical trials with the new antitussive levodropropizine in adult bronchitic patients. Arzneimittelforschung 1988;38:1163-6.
- Banderali G, Riva E, Fiocchi A, et al. Efficacy and tolerability of levodropropizine and dropropizine in children with non-productive cough. J Int Med Res 1995;23:175-83.
- Catena E, Daffonchio L. Efficacy and tolerability of levodropropizine in adult patients with non-productive cough, comparison with dextromethorphan. Pulm Pharmacol Ther 1997;10:89-96.
- Terminology, definitions, and classification of chronic pulmonary emphysema and related conditions: a report of the conclusions of a CIBA guest symposium. Thorax 1959;14:286-99.
- Malerba M, Ragnoli B. Ambroxol in the 21st century: pharmacological and clinical update. Expert Opin Drug Metab Toxicol 2008;4:1119-29.
- Germouty J, Jirou-Najou JL. Clinical efficacy of ambroxol in the treatment of bronchial stasis. Respiration 1987;51(Suppl 1):37-41.
- Ericsson CH, Juhasz J, Jonsson E, et al. Ambroxol therapy in simple chronic bronchitis: effects on subjective symptoms and ventilatory function. EurJ Respir Dis 1986;69:248-55.
- Chalumeau M, Duijvestijn YC. Acetylcysteine and carbocysteine for acute upper and lower respiratory tract infections in paediatric patients without chronic broncho-pulmonary disease. Cochrane Database Syst Rev 2013;5:CD003124.
- Smith SM, Schroeder K, Fahey T. Over-the-counter (OTC) medications for acute cough in children and adults in community settings. Cochrane Database Syst Rev 2014;(11):CD001831.
- Pujet JC, Keddad K, Sevenier F, et al. Comparative study of two antitussive drugs in the treatment of acute dry cough of infectious origin (prospective, randomized, single blind study). Therapie 2002;57:457-63.
- Alison M. Therapeutic trials in children and particularly in infants of a new expectorant cough syrup with oxomemazine base. J Med Lyon 1965;46:1683-6.
- Chapuis, Dalmais, Belpois, etal. [Oxomemazine (new antihistaminic). Its value in general medicine]. Lyon Med 1965;214:413-16.
- Sergysels R, Art G. A double-masked, placebo-controlled polysomnographic study of the antitussive effects of helicidine. Curr Ther Res Clin Exp 2001;62:35-47.
- Mainil J. Inhibition of Hemophilus pertussis in vitro and lysis of mucoid substances which it secretes, with an extract of secretions of Gastropoda. Ann Pharm Fr 1950;8:734-6.
- Bautista DM, Siemens J, Glazer JM, etal. The menthol receptor TRPM8 is the principal detector of environmental cold. Nature 2007;448:204-8.
- Al Aboud K. The founder of Vicks: Lunsford Richardson (1854¬1919). Skinmed 2010;8:100-1.
- Plevkova J, Biringerova Z, Gavliakova S, etal. The role of nasal trigeminal nerves expressing TRP channels in modulation of cough threshold and urge to cough—possible clinical application. Clin TranslAllergy 2013;3(Suppl 2):O17.
- Wise PM, Breslin PA, Dalton P. Sweet taste and menthol increase cough reflex thresholds. Pulm Pharmacol The/ 2012;25:236-41.
- Morice AH, Marshall AE, Higgins KS, et al. Effect of inhaled menthol on citric acid induced cough in normal subjects. Thorax 1994;49:1024-6.
- Kenia P, Houghton T, Beardsmore C. Does inhaling menthol affect nasal patency or cough? Pediatr Pulmonol 2008;43:532-7.
- Irwin RS, Baumann MH, Bolser DC, etal. (ACCP) ACoCP. Diagnosis and management of cough executive summary: ACCP evidence-based clinical practice guidelines. Chest 2006;129:1S-23S.
- Chronic cough. Lancet 1981;2:907-8.
- Packman EW, Ciccone PE, Wilson J, et al. Antitussive effects of diphenhydramine on the citric acid aerosol-induced cough response in humans. IntJ Clin Pharmacol Ther Toxicol 1991;29:218-22.
- Dicpinigaitis PV, Dhar S, Johnson A, etal. Inhibition of cough reflex sensitivity by diphenhydramine during acute viral respiratory tract infection. IntJ Clin Pharm 2015;37:471-4.
- Beeh KM, Beier J, Esperester A, etal. Antiinflammatory properties of ambroxol. EurJ Med Res 2008;13:557-62.
- Rahman I, Skwarska E, MacNee W. Attenuation of oxidant/ antioxidant imbalance during treatment of exacerbations of chronic obstructive pulmonary disease. Thorax 1997;52:565-8.
- Dicpinigaitis PV, Gayle YE. Effect of guaifenesin on cough reflex sensitivity. Chest 2003;124:2178-81.
- Kamei J, Nakanishi Y, Ishikawa Y, etal. Possible involvement of tetrodotoxin-resistant sodium channels in cough reflex. Eur J Pharmacol 2011;652:117-20.
- Mizoguchi H, Wilson A, Jerdack GR, etal. Efficacy of a single evening dose of syrup containing paracetamol, dextromethorphan hydrobromide, doxylamine succinate and ephedrine sulfate in subjects with multiple common cold symptoms. Int J Clin Pharmacol Thei 2007;45:230-6.
COMPOSITION PRODUIT
SUBSTANCES FONCTIONNELLES :
• Miel*
• Complexe moléculaire de Résines, Polysaccharides et Flavonoïdes de Grindelia*, Plantain* et Hélichryse* (Poliresin®),
Titré en polysaccharides (masse moléculaire >20 000 Dalton) ≥ 20%
Contient aussi : Sucre de Canne*, Eau, Huiles essentielles de : Citron, Orange douce, Myrte, Arôme naturel de Citron, Gomme arabique, Gomme de xanthane.
*Ingrédient issu de l’Agriculture Biologique
POSOLOGIE
Il est conseillé de prendre 5 ml (une cuillère mesure) pour les enfants de 1 à 6 ans, et 10 ml (deux cuillères mesures) pour les enfants de plus de 6 ans, deux à quatre fois par jour, en effectuant la dernière prise avant le coucher. Agiter avant l’emploi. Contient une cuillère mesure. Bien refermer le flacon après chaque utilisation et laver soigneusement la cuillère mesure. Une fois ouvert, utiliser le produit dans les trois mois qui suivent.
MISES EN GARDE
Ne pas utiliser le produit en cas d’hypersensibilité ou d’allergie individuelle envers un ou plusieurs des composants. Si les symptômes persistent, il est conseillé de consulter un médecin. Conserver à température ambiante, loin de toute source de chaleur et à l’abri de la lumière. Tenir hors de portée des enfants.
INDICATIONS
Grintuss Pediatric sirop est indiqué pour le traitement de la toux sèche et grasse, chez les enfants à partir d’1 an.
PROPRIÉTÉS
Grintuss est un produit à base de miel et de complexes moléculaires qui exerce une action protectrice et par conséquent lénitive des voies aériennes supérieures. Il agit sur la toux sèche en luttant contre l’irritation de la muqueuse et sur la toux grasse en favorisant l’hydratation et l’élimination du mucus. Grintuss est un produit avec des ingrédients issus de l’Agriculture Biologique, sans gluten et au goût agréable.
Grintuss protège la muqueuse en calmant l’irritation, hydrate et favorise l’élimination du mucus à travers les mécanismes d’action suivants :
• Effet barrière : il forme un film protecteur qui adhère à la muqueuse et la protège du contact avec les agents irritants
• Action Muco-régulatrice : il stimule l’hydratation du mucus et en favorise l’élimination
• Action Lubrifiante : il réduit le frottement au niveau du pharynx qui cause la toux
Grintuss module la toux sans la supprimer, en respectant ainsi son rôle important de défense des voies aériennes supérieures. Grintuss Pediatric Sirop est formulé avec des complexes moléculaires végétaux tels que les résines, les polysaccharides et les flavonoïdes. Ces substances, unies au miel, apportent au produit une propriété mucoadhésive, protectrice et émolliente et un goût très agréable.
Нервная система. Анальгетики. Другие анальгетики и антипиретики. Анилиды. Парацетамол, комбинации исключая психолептики.
Код АТХ N02BE51
Тайлолфен Хот показан для облегчения симптомов гриппа, ОРВИ и простуд, включающих в себя:
— повышенная температура тела
— лихорадка, озноб
— головная боль
— боль в горле
— заложенность носа
— синусит и связанные с ним боли
— острый ринит (носовой катар)
— гиперчувствительность к компонентам препарата
— тяжелые нарушения функции печени и почек
— острый инфаркт миокарда, артериальная гипертензия, в том числе осложненная ангиопатия сетчатки, выраженный атеросклероз аорты и сосудов головного мозга
— сахарный диабет
— бронхиальная астма
— закрытоугольная глаукома
— гипертиреоз
— одновременный прием ингибиторов моноаминооксидазы
— дефицит фермента глюкозо-6-фосфатдегидрогеназы (признаки такого заболевания крови, как анемия)
— задержка мочи, связанная с нарушением функции предстательной железы
— синдром Жильбера (вторичная колеблющаяся доброкачественная желтуха в результате дефицита глюкуронил-трансферазы)
При назначении парацетамола пациентам с почечной или печеночной недостаточностью рекомендуется соблюдать осторожность. Риск передозировки выше у лиц с нецирротической алкогольной болезнью печени.
Необходимо проконсультироваться с врачом, прежде чем принимать этот препарат у пациентов с этими симптомами:
— Увеличение предстательной железы
— Заболевание сосудистой системы (например, феномен Рейно).
Этот препарат не должен использоваться пациентами, принимающими другие симпатомиметики (такие как противоотечные средства, средства для подавления аппетита и амфетаминоподобные психостимуляторы).
Пациентам не следует принимать другие парацетамол содержащие, противопростудные или противоотечные препараты одновременно.
Если симптомы не проходят, обратитесь к врачу.
В случае передозировки следует немедленно обратиться к врачу, даже если вы чувствуете себя хорошо из-за риска позднего серьезного повреждения печени.
Хлорфенамин, как и другие препараты, обладающие антихолинергическим эффектом, следует применять с осторожностью при эпилепсии, повышенном внутриглазном давлении, включая глаукому, гипертрофию предстательной железы, тяжелой гипертонии или сердечно-сосудистых заболеваниях, бронхите, бронхоэктазии или астме, печеночной, почечной недостаточности. Дети и пожилые люди чаще испытывают неврологические антихолинергические эффекты и парадоксальное возбуждение (например, прилив энергии, беспокойство, нервозность).
Воздействие алкоголя может быть усилено, и поэтому следует избегать одновременного использования.
Не следует использовать с другими антигистаминсодержащими препаратами, включая антигистаминсодержащие препараты от кашля и простуды.
Натрий
Этот лекарственный препарат содержит 450 мг бикарбоната натрия, 45 мг безводного карбоната натрия и 10 мг бензоата натрия на дозу (общее количество натрия: 144,336 мг). Для учета пациентами на контролируемой натриевой диете.
Сахароза
Пациенты с редкими наследственными проблемами непереносимости фруктозы, мальабсорбции глюкозы-галактозы или недостаточности сахарозы-изомальтазы не должны принимать это лекарство.
Скорость абсорбции парацетамола может быть увеличена метоклопрамидом или домперидоном, а абсорбция колестирамином снижена. Антикоагулянтный эффект варфарина и других кумаринов может быть усилен при длительном регулярном ежедневном применении парацетамола с повышенным риском кровотечений, случайные дозы не оказывают существенного эффекта.
Фенилэфрин следует использовать с осторожностью в сочетании со следующими препаратами, поскольку было сообщено о взаимодействиях
| Ингибиторы моноаминоксидазы (включая моклобемид) | Гипертонические взаимодействия возникают между симпатомиметическими аминами, такими как ингибиторы фенилэфрина и моноаминоксидазы (см. Противопоказания). |
| Симпатомиметические амины | Одновременный прием фенилэфрина с другими симпатомиметическими аминами может увеличить риск сердечно-сосудистых побочных эффектов. |
| Бета-блокаторы и другие гипотензивные средства (в том числе дебрисохин, гуанетидин, резерпин, метилдопа) | Фенилэфрин может снизить эффективность бета-блокирующих и гипотензивных препаратов. Риск гипертонии и других сердечно-сосудистых побочных эффектов может быть увеличен. |
| Трициклические антидепрессанты (например, амитриптилин) | Может увеличить риск сердечно-сосудистых побочных эффектов с фенилэфрином. |
| Алкалоиды спорыньи | (эрготамин и метилсергид) повышенный риск эрготизма |
| Дигоксин и сердечные гликозиды | Увеличьте риск нерегулярного сердцебиения или сердечного приступа |
Одновременное использование хлорфенамина со снотворными или анксиолитиками может вызвать усиление седативного эффекта, поэтому следует проконсультироваться с врачом, прежде чем принимать хлорфенамин одновременно с этими препаратами.
Хлорфенамин ингибирует метаболизм фенитоина и может привести к токсичности фенитоина.
Антихолинергические эффекты хлорфенамина усиливаются с помощью ингибиторов МАО. Перед применением Тайлолфен Хот пациенты должны быть проинформированы о том, что после применения ингибиторов МАО должно пройти не менее 2-х недель.
Беременность
Большой объем данных о беременных женщинах свидетельствует, об отсутствии у парацетамола фето и/или неонатальной токсичности, а также способности вызывать пороки развития. Эпидемиологические исследования развития нервной системы у детей, подвергшихся внутриутробному воздействию парацетамола, показали неубедительные результаты. Допускается прием парацетамола во время беременности, исходя из клинической необходимости, однако его следует принимать в минимальной эффективной дозе, на минимально возможные короткие сроки и с наименьшей возможной частотой.
Адекватных данных по применению малеата хлорфенамина у беременных женщин нет. Потенциальный риск для человека неизвестен. Использование в третьем триместре может привести к реакциям у новорожденных или недоношенных новорожденных. Не следует использовать во время беременности, если это не рассматривается врачом.
Кормление грудью
Фенилэфрин может выводиться с грудным молоком.
Малеат хлорфенамина и другие антигистаминные препараты могут подавлять лактацию и могут выделяться с грудным молоком.
Не использовать во время кормления грудью, если врач не считает это необходимым.
Так как антихолинергические свойства хлорфенамина могут вызывать сонливость, головокружение, помутнение зрения и психомоторные нарушения у некоторых пациентов, необходимо соблюдать осторожность при вождении автомобиля и при управлении другими потенциально опасными механизмами.
Режим дозирования
Взрослым и детям старше 12 лет назначают по 1 пакетику (500 мг) каждые 6 ч, но не более 4 пакетиков (2 г) в сутки. Максимальная рекомендуемая суточная доза 4 пакетика (2 г) в сутки. Перед приемом содержимое 1 пакетика растворяют в стакане горячей воды.
При отсутствии выраженного терапевтического эффекта, высокой температуре, которая держится более 3 дней, а также при появлении новых симптомов следует срочно обратиться к врачу.
У пациентов, употребляющих алкоголь, из-за риска гепатотоксичности, общая суточная доза парацетамола не должна превышать 2 грамма.
Не принимайте непрерывно более 7 дней без консультации врача.
Метод и путь введения
Следует принимать внутрь, по нижеуказанной схеме.
Ингредиент каждого пакета следует растворить в 160 мл горячей воды (примерно одна чашка стандартного размера) и немедленно выпить. Необходимо придерживаться периода 6 часов между приемами препарата. Рекомендуемая максимальная суточная доза — 4 пакетика.

Парацетамол
Поражение печени у взрослых возможно при приеме 10 г и более парацетамола. Прием 5 г и более парацетамола может привести к поражению печени у пациентов, имеющих следующие факторы риска:
Если пациент:
а) находится на длительном лечении карбамазепином, фенобарбитоном, фенитоином, примидоном, рифампицином, препаратами зверобоя продырявленного или другими препаратами, которые вызывают индукцию ферментов печени;
б) регулярно злоупотребляет алкоголем;
c) имеет заболевания, при которых вероятно имеется истощение глутатиона, например, при расстройстве пищевого поведения, муковисцидозе, ВИЧ-инфекции, голодании, кахексии.
Симптомами острого отравления парацетамолом в течение первых 24-х часов после передозировки могут быть: тошнота, рвота, боли в животе, нарушение метаболизма глюкозы (потливость, головокружение, потеря сознания), бледность кожных покровов, снижение аппетита, нарушение углеводного обмена.
Передозировка парацетамола при однократном введении у взрослых или у детей может вызвать некроз клеток печени, который может вызвать полный и необратимый некроз, приводящий к гепатоцеллюлярной недостаточности, нарушениям метаболизма глюкозы, метаболическому ацидозу и энцефалопатии (нарушение функции мозга), кровотечениям, гипогликемии, отеку мозга, что может привести к коме и летальному исходу.
Поражение печени определяется через 12-48 часов после передозировки. Одновременно наблюдаются повышенные уровни печеночных трансаминаз (АСТ, АЛТ), лактатдегидрогеназы и билирубина, а также повышенные уровни протромбина.
При длительном применении с превышением рекомендованной дозы может наблюдаться гепатотоксическое и нефротоксическое действие (почечная колика, неспецифическая бактериурия, интерстициальный нефрит, папиллярный некроз).
Лечение:
при превышении необходимой дозы нужна незамедлительная медицинская помощь. Симптомы могут ограничиваться тошнотой или рвотой и не отражать тяжести передозировки или риска повреждения органов. В течение первого часа после передозировки рекомендуется промывание желудка и прием энтеросорбентов (активированный уголь, полифепан). Следует определить уровень парацетамола в плазме крови, но не ранее чем через 4 ч после передозировки (более ранние результаты недостоверны). Нужно как можно скорее ввести антидот N-ацетилцистеин в течение 24 ч после передозировки, в соответствии с общепринятыми руководствами по его применению. При необходимости пациенту вводят N-ацетилцистеин внутривенно согласно рекомендуемым дозам. При отсутствии рвоты до поступления пациента в стационар возможно применение метионина в качестве альтернативы.
Фенилэфрина гидрохлорид
Симптомы и признаки:
Передозировка фенилэфрина может привести к эффектам, аналогичным тем, которые перечислены в разделе «Побочные реакции». Дополнительные симптомы могут включать гипертонию и, возможно, рефлюкс-брадикардию. В тяжелых случаях могут возникнуть спутанность сознания, галлюцинации, судороги и аритмии. Однако количество, необходимое для получения серьезной токсичности фенилэфрина, будет больше, чем требуется, чтобы вызвать токсичность, связанную с парацетамолом.
Лечение:
Лечение должно быть клинически целесообразным. При тяжелой гипертензии может потребоваться лечение альфа-блокирующими препаратами, такими как фентоламин.
Обращайтесь за консультацией к медицинскому работнику для разъяснения способа применения лекарственного препарата.
В целом, Тайлолфен Хот хорошо переносится.
Побочные реакции на лекарства ранжируются по частоте, наиболее часто сначала, с использованием следующего соглашения: очень часто (≥1/10); часто (≥1/100 до <1/10); редко (≥1/1000 до <1/100); редко (≥1/10000 до <1/1000); очень редко (<1/10000), неизвестно (не может быть оценено по имеющимся данным).
Парацетамол
— тромбоцитопения, агранулоцитоз не обязательно могут появиться по причине приема парацетамола
— анафилаксия, кожные реакции гиперчувствительности, включая кожную сыпь, ангиодему и синдром Стивенса-Джонсона/токсический эпидермальный некролиз
— бронхоспазм
— дисфункция печени
Хлорфенирамин малеат
Очень часто:
— седативный эффект, сонливость
Часто:
— нарушение внимания, нарушение координации, головокружение, головная боль
— нечеткое зрение
— тошнота, сухость во рту
— усталость
Неизвестно
— гемолитическая анемия, дискразии крови
— аллергическая реакция, ангионевротический отек, анафилактические реакции
— анорексия
— спутанность сознания, возбуждение, раздражительность, кошмары, депрессия
— тиннитус
— сердцебиение, тахикардия, аритмии
— гипотония
— сгущение бронхиального секрета
— рвота, боли в животе, диарея, диспепсия
— гепатит, желтуха
— эксфолиативный дерматит, сыпь, крапивница, светочувствительность
— подергивание мышц, мышечная слабость
— стеснение в груди
— задержка мочи
Фенилэфрин
— нервозность, раздражительность, возбужденное состояние и возбудимость.
— головная боль, головокружение, бессонница
— повышенное кровяное давление
— тошнота, рвота
Неизвестно:
— мидриаз, закрытоугольная глаукома, чаще всего встречается у пациентов с закрытоугольной глаукомой
— тахикардия, сердцебиение, кожные и подкожные нарушения
— аллергические реакции (например, сыпь, крапивница, аллергический дерматит)
— реакции гиперчувствительности, в том числе возможна перекрестная чувствительность с другими симпатомиметиками
— дизурия, задержка мочи. Это наиболее вероятно у людей с обструкцией выходного отверстия мочевого пузыря, такой как наблюдается гипертрофия простаты
При возникновении нежелательных лекарственных реакций обращаться к медицинскому работнику, фармацевтическому работнику или напрямую в информационную базу данных по нежелательным реакциям (действиям) на лекарственные препараты, включая сообщения о неэффективности лекарственных препаратов
РГП на ПХВ «Национальный Центр экспертизы лекарственных средств и медицинских изделий» Комитет медицинского и фармацевтического контроля Министерства здравоохранения Республики Казахстан http://www.ndda.kz
Один пакет содержит
активные вещества: парацетамол 500 мг, хлорфенирамина малеат 4 мг, фенилэфрина гидрохлорид 10 мг,
вспомогательные вещества: кислота лимонная безводная, кислота винная, натрия гидрокарбонат, натрия карбонат безводный, натрия бензоат (Е211), ароматизатор лимонный, сахар рафинированный, поливинилпирролидон К 30, железа оксид желтый (Е172).
Гранулированный сыпучий порошок беловато-желтого цвета с лимонным запахом.
Порошок для приготовления раствора для приема внутрь.
По 20 г препарата в трехслойные прессованные пакеты из полиэстера, фольги алюминиевой и пленки полиэтиленовой.
По 6 или 12 пакетов вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в пачку картонную.
3 года
Не применять по истечении срока годности.
Условия хранения
Хранить при температуре не выше 25°С в сухом, защищенном от света месте.
Хранить в недоступном для детей месте!
Без рецепта
Сведения о производителе
Нобел Илач Санаи ве Тиджарет А.Ш.
Санджаклар Махаллеси Эски Акчакоджа Джадесси №299, 81100 г.Стамбул, Турция
Номер телефона: +90 216 633 60 01
Адрес электронной почты: nobel@nobel.com.tr
Держатель регистрационного удостоверения
АО «Нобел Алматинская Фармацевтическая Фабрика»
Республика Казахстан, г. Алматы, ул. Шевченко 162 Е.
Номер телефона: (+7 727) 399-50-50
Номер факса: (+7 727) 399-60-60
Адрес электронной почты nobel@nobel.kz
Наименование, адрес и контактные данные (телефон, факс, электронная почта) организации на территории Республики Казахстан, принимающей претензии (предложения) по качеству лекарственных средств от потребителей и ответственной за пострегистрационное наблюдение за безопасностью лекарственного средства:
АО «Нобел Алматинская Фармацевтическая Фабрика»
Республика Казахстан, г. Алматы, ул. Шевченко 162 Е.
Номер телефона: (+7 727) 399-50-50
Номер факса: (+7 727) 399-60-60
Адрес электронной почты nobel@nobel.kz

