Содержание
Введение……………………………………………………………………………………………….3
1. Химическая связь: основные понятия…………………………………………………4
2. Ковалентная химическая связь…………………………………………………………..7
3. Ионная химическая связь и ее свойства………………………………………………9
4. Металлическая связь………………………………………………………………………..11
5. Водородная связь……………………………………………………………………………..13
Заключение………………………………………………………………………………………….15
Список использованной литературы…………………………………………………….16
Введение
Молекулы химических веществ представляют собой сложную систему атомных ядер и электронов. Атомы в молекуле удерживаются преимущественно силами электростатического характера. В этом случае говорят, что они связаны химической связью. Химическая связь осуществляется s- и p-электронами внешнего и d-электронами предвнешнего слоя.
Возникновение химических связей – это самопроизвольный процесс, а причиной тому является уменьшение энергии системы.
Образование любой химической связи обязательно сопровождается выделением энергии, в то время как разрыв – требует ее поглощения.
Выделяют внутримолекулярные и межмолекулярные связи, которые отличаются друг от друга по энергии в десятки раз. Образование внутримолекулярных химических связей связано со сближением атомов за счет неспаренных электронов с антипараллельными спинами. Результатом такого сильного обменного взаимодействия приводи является образование общей электронной пары. В то же время, возрастает электронная плотность в межъядерном пространстве, что способствует стягиванию ядер двух атомов. При этом энергия системы уменьшается, а между атомами возникает химическая связь и образуется молекула.
Учение о химической связи является одной из центральных проблем современной химии. Число химических соединений непрерывно возрастает. Ежегодно описывается около двадцати тысяч новых соединений. Число возможных реакций между этими соединениями невероятно велико. Не зная природу воздействия атомов в веществе, невозможно понять причины многообразия соединений, представить их строение, состав, механизм образования и т.д.
Актуальность выбранной темы связана с колоссальным количеством новых химических соединений, нуждающихся в изучении, в молекулах которых сосредоточены различного рода химические связи.
Целью работы является рассмотрение основных понятий и типов химической связи.1
Возникновение химических связей – процесс самопроизвольный и причина этого процесса –
1. Химическая связь: основные понятия
Как правило, взаимодействие атомов обусловливает возникновение химических связей, приводящих к образованию устойчивых многоатомных систем: молекулы, молекулярного иона, кристалла.
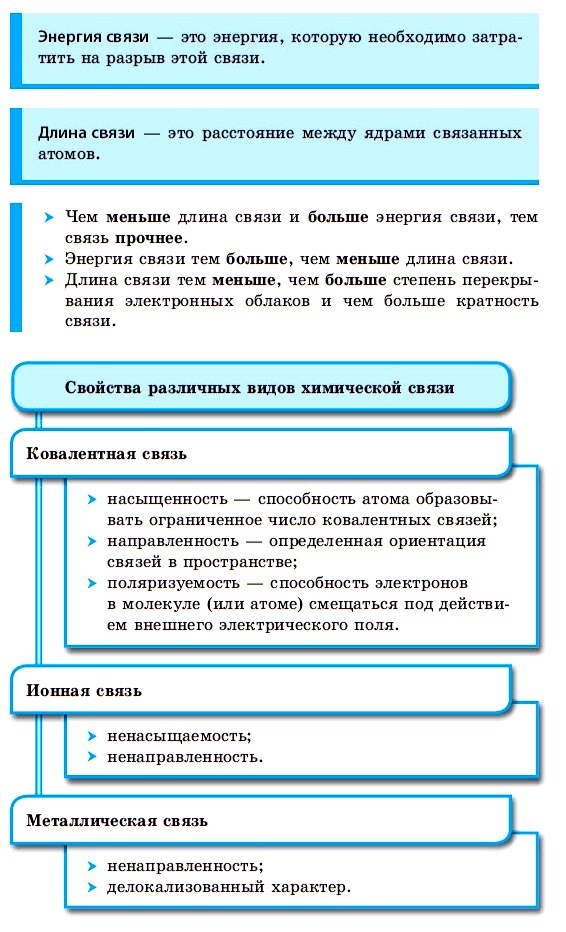
Условием образования химической связи является уменьшение потенциальной энергии системы взаимодействующих атомов.
Химическая связь возникает благодаря взаимодействию электрических полей, создаваемых электронами и ядрами атомов, участвующих в образовании молекулы или кристалла.
Химическая связь характеризуется несколькими основными параметрами, представленных в таблице 1.
Таблица 1 – Параметры химической связи
Таким образом, химической связью называют совокупность сил, под действием которых атомы, ионы или молекулы связываются друг с другом в новые устойчивые образования: молекулы, сложные ионы, ассоциаты.2
В зависимости от характера взаимодействия общей электронной пары с ядрами атомов, можно выделить несколько типов химической связи (рисунок 1).
Рисунок 1 – Типы химической связи
В зависимости от симметрии электронных облаков, в результате перекрывания которых образуется химическая связь, суммарное электронное облако будет иметь различную симметрию, в соответствии с которой они распадаются на три вида: σ-, π- и δ- связи.
σ-связь осуществляется при перекрывании облаков вдоль линии, соединяющей центры атомов, при этом максимальная электронная плотность достигается в межъядерном пространстве и имеет цилиндрическую симметрию относительно линии, соединяющей центры атомов. Как видно из рисунка 2, в образовании σ-связи в силу своей шаровой симметрии всегда принимают участие s-электроны.
Рисунок 2 – Образование σ-связи
π-связи возникают при перекрывании электронных облаков над и под линией, соединяющей центры атомов. Суммарные электронные облака также симметрично расположены относительно этой оси, но они не имеют цилиндрической симметрии, как в случае σ-связи (рисунок 3).
Рисунок 3 – Образование π-связи
δ-связь образуют только d-электроны. Это происходит за счет перекрывания всех четырех своих лепестков электронных облаков, которые расположены в параллельных плоскостях.
Выше была рассмотрена классификация химических связей, исходившая из симметрии электронных облаков. Существует и другой подход к классификации химической связи, основанный на характере распределения электронной плотности между атомами в молекуле, т. е. химическая связь рассматривается с точки зрения принадлежности электронной пары тому или иному атому. При этом, возможны три случая.
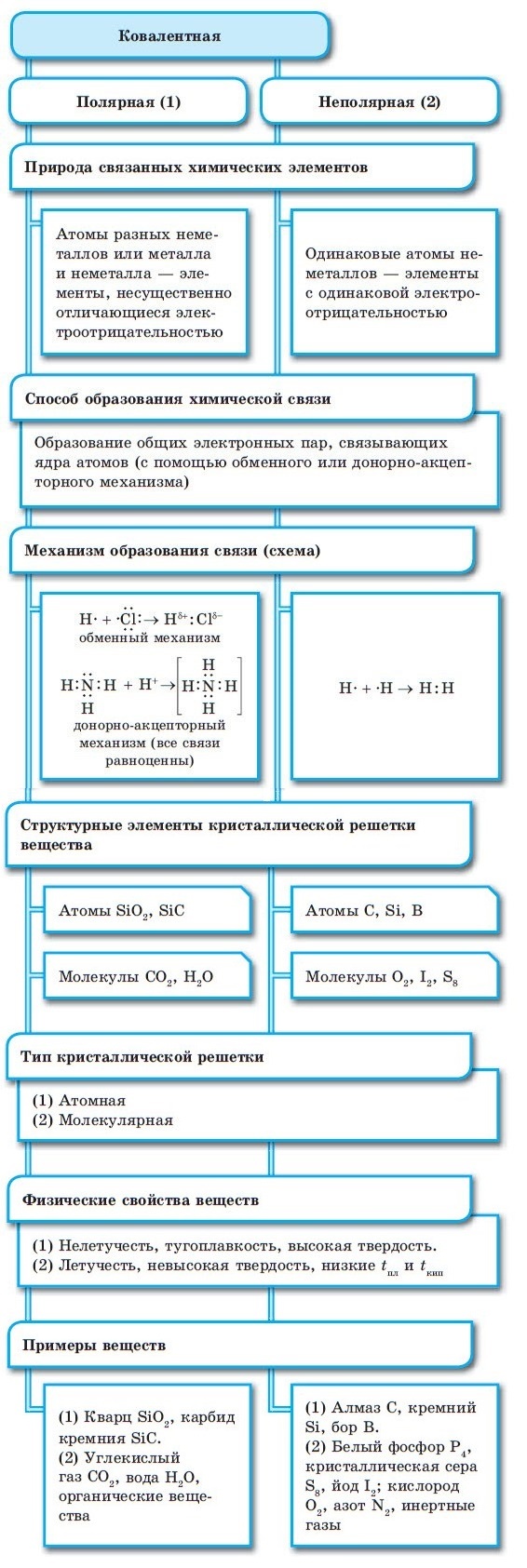
В первом случае, электронная пара связывает в молекуле два одинаковых атома и в равной мере принадлежит им обоим. В молекуле нет разделения центров тяжести положительного и отрицательного зарядов, так как они совпадаю. Такая связь называется ковалентной неполярной.
Если электронная пара связывает два различных атома, то она смещается в сторону более электроотрицательного атома. Центры тяжести положительного и отрицательного зарядов разделяются, связь становится полярной и носит название ковалентной полярной связи.
Третий случай связан с полной передачей электронной пары во владение одного из атомов. Это происходит при взаимодействии двух атомов, резко отличающихся по электроотрицательности, т. е. способности удерживать электронную пару в своем электрическом поле. При этом атом, отдавший электроны, становится положительно заряженным ионом, а атом, принявший их, – отрицательным. В этом случае связь носит название ионной.3
2. Ковалентная химическая связь
Ковалентной связью называют связь атомов в молекуле с помощью общих электронных пар. Общая электронная пара образуется в результате перекрывания электронных облаков.
Существует два механизма образования общих электронных пар: из неспаренных электронов и по донорно-акцепторному механизму.
По первому механизму неспаренные электроны каждого из атомов образуют общую пару электронов. По этому механизму образование молекул H2, Cl2 и HCl изображено на рисунке 4.
Рисунок 4 – Образование ковалентной связи
По второму механизму свободная пара электронов одного атома переходит на свободную орбиталь другого атома.
Например, при взаимодействии аммиака NH3 и иона водорода Н+ неподеленная пара электронов атома азота переходит на свободную орбиталь иона водорода Н+ и образуется ион аммония NH4+ (рисунок 5).
Рисунок 5 – Донорно-акцепторный механизм образования ковалентной связи
Ковалентная связь может быть полярной или неполярной.
Неполярная ковалентная связь образуется между атомами элементов с одинаковым значением электроотрицательности. В этом случае общая электронная пара располагается на одинаковом расстоянии от ядер обоих атомов. Например, неполярная ковалентная связь имеется у молекул H2, Cl2, O2.
Поляpная ковалентная связь образуется между атомами элементов с разной электроотрицательностью. В данном случае общая электронная пара смещается в сторону атома с большим значением электроотрицательности. Такая связь есть в молекулах хлористого водорода (HCl), воды (Н2О).
Основные характеристики ковалентной связи представлены в таблице 2.
Таблица 2 – Характеристики ковалентной связи4
3. Ионная химическая связь и ее свойства
Ионная связь – химическая связь между ионами, осуществляемая электростатическим притяжением.
Ионных соединений сравнительно немного. В случае если разница электроотрицательностей элементов будет велика, произойдет не просто смещение электронной плотности, а полная передача электрона от одного атома к другому. Рассмотрим это на примере фторида натрия NaF (рисунок 6).
Рисунок 6 – Образование ионной связи
Атом натрия стремится отдать один электрон, а атом фтора готов его принять. Это легко осуществляется при их взаимодействии, которое сопровождается переходом электрона. При этом атом натрия полностью передает свой электрон атому фтору: натрий лишается электрона и становится заряженным положительно, а хлор приобретает электрон и становится заряженным отрицательно. Например: NaF – фторид натрия; КCl – хлорид калия и др.
Свойства ионной химической связи представлены на рисунке 7.
Рисунок 7 – Свойства ионной химической связи
Свойства, описанные выше, вытекают из электростатической природы ионной связи. Силовые линии из точечного заряда имеют сферическое строение (рисунок 8).
Рисунок 8 – Электростатическая природа ионной связи
Вследствие ненаправленности и ненасыщаемости ионной связи энергетически наиболее выгодно, когда каждый ион окружен максимальным числом ионов противоположного знака. Однако из- за отталкивания одноименных ионов друг от друга устойчивость системы достигается лишь при определенной взаимной координации ионов. В отличие от ковалентных соединений координационное число в «чисто» ионных соединениях не зависит от специфики электронной структуры элементов, а определяется соотношением размеров ионов.
Таким образом, в обычных условиях ионные соединения представляют собой кристаллические вещества. Поэтому для них понятие «простые двухионные молекулы» типа NaCl теряет смысл, а весь кристалл можно рассматривать как единую гигантскую молекулу.5
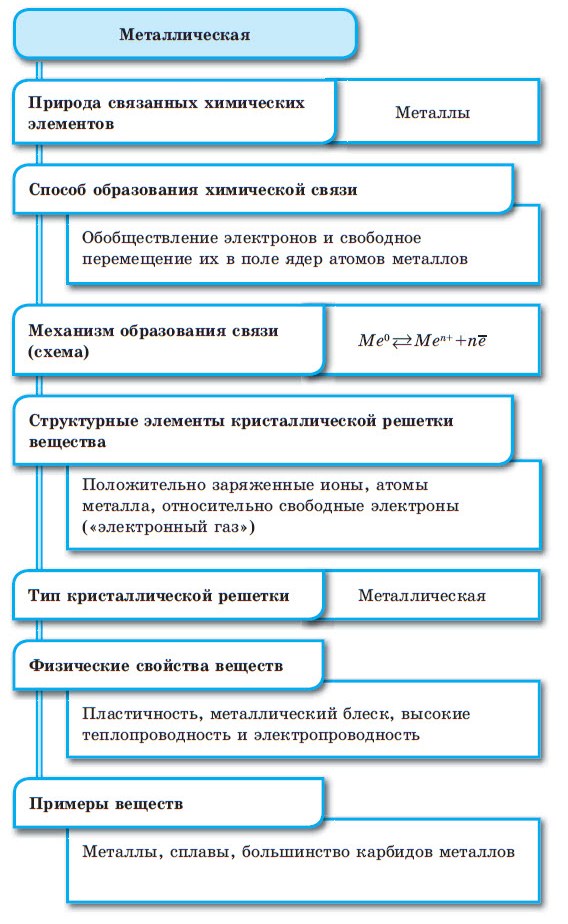
4. Металлическая связь
Металлы обладают высокой тепло- и электропроводностью. Данный аспект заставляет предположить, что валентные электроны их атомов металлов способны свободно перемещаться внутри его кристаллической решетки.
На рисунке 9 изображена одна из моделей строения металлов, согласно которой электроны образуют газ из отрицательных зарядов, который прочно скрепляет положительные ионы металла в одно целое. На рисунке 9 изображены положительно заряженные ионы, которые остаются после отрыва от атомов валентных электронов. Эти ионы содержат атомное ядро и внутреннюю замкнутую электронную оболочку атома. Каждый обрамленный кружком положительный заряд соответствует атомному ядру с заполненными электронными оболочками.
Рисунок 9 – Сечение металлического кристалла в атомной плоскости со схематическим изображением электронного газа
Данная модель металлической связи, основанная на представлении об «электронном газе», обусловливает и два других характерных свойств металлов – пластичность и ковкость.
Ковкое вещество легко поддается расплющиванию в тонкие листы; пластичное вещество можно вытягивать в тонкую проволоку. Для того чтобы такая обработка металлов с изменением формы происходила без разрушения, атомные плоскости кристалла должны легко скользить одна по другой. Такое смещение атомов не вызывает появления больших сил отталкивания в металлах, потому что подвижный электронный газ постоянно смягчает перемещение положительных ионов, экранируя их друг от друга.
Иначе обстоит дело в ионных кристаллах, где химическая связь практически полностью обусловлена электростатическим притяжением между противоположно заряженными ионами. В ионном кристалле валентные электроны прочно связаны с ядром атома. Сдвиг ионных слоев в таком кристалле приводит к сближению ионов одинакового заряда и вызывает сильное отталкивание между ними, в результате чего происходит разрушение кристалла (рисунок 10).
Рисунок 10 – Силы, возникающие при сдвиговой деформации кристаллов: а — сдвиг слоев металлического кристалла вдоль атомной плоскости;
б — сдвиг слоев ионного кристалла вдоль атомной плоскости
За более совершенную модель связи в металлах отвечает теория молекулярных орбиталей. Согласно этой модели, весь кристалл металла следует рассматривать как одну гигантскую молекулу. Все атомные орбитали определенного типа взаимодействуют в кристалле, образуя совокупность делокализованных орбиталей, простирающихся по всему кристаллу.6
5. Водородная связь
Водородная связь является специфической разновидностью межмолекулярного и внутримолекулярного взаимодействия.
Водородная связь – это дополнительная химическая связь между положительно поляризованным атомом водорода и отрицательно поляризованным атомом элемента с высокой электроотрицательностью (чаще всего фтора, кислорода или азота) в составе одной или разных молекул.
Схематично водородную связь обозначают тремя точками (рисунок 11).
Рисунок 11 – Образование водородной связи
Водородную связь, которая осуществляется между атомами одной молекулы, называют внутримолекулярной, а если связь возникает между разным молекулами, то межмолекулярной (рисунок 12).
Рисунок 12 – Типы водородной связи
Образование водородной связи напрямую связано с уникальными свойствами положительно поляризованного атома водорода. Его единственный электрон смещен в направлении атома, с которым атом водорода образует ковалентную связь. Поэтому другой стороной, на которой «оголяется» положительно заряженное ядро, атом водорода способен сближаться с электроотрицательными атомами до расстояний, близких к длине химической связи.
Длина водородной связи в 1.5-2 раза больше длины ковалентной связи, она в 5-6 раз слабее её, но в несколько раз прочнее вандерваальсовых сил.
Водородная связь между молекулами H2O является причиной проявления водой некоторых аномальных свойств. Плотность воды при переходе из твердого состояния в жидкое не уменьшается, как у большинства веществ, а возрастает. Это обусловлено тем, что в твердом состоянии молекулы воды соединены водородными связями, образуя ажурную структуру с множеством пустот. При плавлении льда примерно 15% водородных связей разрываются, что способствует сокращению объема, занимаемого водой. При дальнейшем нагревании противодействуют две тенденции: дальнейший разрыв водородных связей, способствующий увеличению плотности, и рост кинетической энергии молекул воды, приводящий к снижению плотности. При 4°С действия этих двух эффектов уравниваются, а при дальнейшем нагревании уже преобладает эффект увеличения кинетической энергии, что приводит к снижению плотности воды. Таким образом, при 4°С плотность воды максимальна.
Если бы максимум плотности воды приходился на 0°С, то поверхностные слои воды при охлаждении сверху опускались бы на дно, уступая место менее холодным слоям, и водоемы быстро замерзали бы на всю глубину. При этом многие формы жизни в воде были бы невозможны. В действительности замерзший слой воды является более легким и остается на поверхности, значительно замедляя дальнейшую кристаллизацию. Поэтому большинство водоемов зимой не промерзает до дна. Вода кипит при аномально высокой температуре. На разрыв водородных связей при переходе из жидкого в газообразное состояние необходимо затратить значительную энергию. При отсутствии водородных связей точка кипения воды лежала бы не при 100°С, а при –80°С. Тогда бы на Земле не было водоемов, а значит, и многих форм жизни.7
Заключение
На всех этапах развития химии вопросам химической связи уделялось много внимания и создавались теории в соответствии с общими представлениями в науке своего времени.
В начале XIX века была известна только одна количественная характеристика атома – масса, возникла гравитационная теория Бертолле (образование химической связи объяснялось взаимодействием масс атомов).
Главным вкладом в развитие представлений о строении молекул явилась теория химического строения органических соединений.
Вопрос о природе химической связи был решен после открытия электронного строения атомов, так как это позволило установить фундаментальную роль электронов в образовании химической связи.
Сегодня, не представляется возможным изучения свойств, строения химических соединений и их превращений без знания теории химической связи.
Не имея представлений о теории строения молекул и теории химической связи, практически невозможно понять элементарный химический процесс, построить его схему и на основании этого предвидеть кинетические характеристики. Помимо прочего, без использования данных теорий сегодня не обходится создание новейших веществ и материалов с заданными свойствами, например таких как полупроводниковые материалы, специальные керамические материалы, стали, стекла и прочее.8
Список использованной литературы
1. Сечкарев, Б.А. Химическая связь: учебное пособие / Б.А. Сечкарев, Ф.В. Титов; ГОУ ВПО «Кемеровский университет». – Кемерово: Кузбасвузиздат, 2006. – 169 с.
2. Громаков, Н.С. Химическая связь: Учебное пособие по химии для студентов дневной, заочной и дистанционной форм обучения, Казань: КГАСУ, 2011. – 132 с.
3. Коренев, Ю.М. Общая и неорганическая химия / Ю.М. Корнев, В.П. Овчаренко. – М.: Школа имени А. Н. Колмогорова, Издательство Московского университета, 2000. – 384 с.
4. Загурская, И.Н. Неорганическая химия: учебное пособие / И.Н.
Загурская, Д.В. Цымай, И.Н. Загурский. – Орел: ОрелГТУ, 2008 – 180 с.
5. Ткачев, С.В. Основы общей и неорганической химии: учеб.-метод. пособие / С. В. Ткачев. – 11-е изд. – Минск: БГМУ, 2013. – 211 с.
6. Павлов, Н.Н. Общая и неорганическая химия: Учебник / Н.Н. Павлов. – СПб.: Лань, 2011. – 422 с.
7. Минкин, В.И. Теория строения молекул / В.И. Минкин, Б. Я. Симкин, Р.М. Миняев. – Ростов на/Д: Феникс, 1997. – 236 с.
8. Хрущева, И.В. Общая и неорганическая химия: Учебник / И.В. Хрущева, В.И. Щербаков, Д.С. Леванова. — СПб.: Лань П, 2016. – 496 с.
1 Сечкарев, Б.А. Химическая связь: учебное пособие / Б.А. Сечкарев, Ф.В. Титов; ГОУ ВПО «Кемеровский университет». – Кемерово: Кузбасвузиздат, 2006. С. 8.
2 Громаков, Н.С. Химическая связь: Учебное пособие по химии для студентов дневной, заочной и дистанционной форм обучения, Казань: КГАСУ, 2011. С. 13-15.
3 Коренев, Ю.М. Общая и неорганическая химия / Ю.М. Корнев, В.П. Овчаренко. – М.: Школа имени А. Н. Колмогорова, Издательство Московского университета, 2000. – С. 27-28.
4 Загурская, И.Н. Неорганическая химия: учебное пособие / И.Н. Загурская, Д.В. Цымай, И.Н. Загурский. – Орел: ОрелГТУ, 2008 – С. 51.
5 Ткачев, С.В. Основы общей и неорганической химии: учеб.-метод. пособие / С. В. Ткачев. – 11-е изд. – Минск: БГМУ, 2013. С. 47.
6 Павлов, Н.Н. Общая и неорганическая химия: Учебник / Н.Н. Павлов. – СПб.: Лань, 2011. С. 265.
7 Минкин, В.И. Теория строения молекул / В.И. Минкин, Б. Я. Симкин, Р.М. Миняев. – Ростов на/Д: Феникс, 1997. С. 49.
8 Хрущева, И.В. Общая и неорганическая химия: Учебник / И.В. Хрущева, В.И. Щербаков, Д.С. Леванова. — СПб.: Лань П, 2016. С. 147.
Химическая связь: ковалентная, ионная, металлическая
Ключевые слова конспекта. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
Силы, которые удерживают атомы в молекулах, называются химическими связями.
Образование химической связи происходит в том случае, если этот процесс сопровождается выигрышем энергии. Эта энергия возникает, если каждый атом, образующий химическую связь, получает устойчивую электронную конфигурацию.
По способу образования и существования химическая связь может быть ковалентной (полярной, неполярной), ионной, металлической.
Ковалентная химическая связь
■ Ковалентная химическая связь — это связь, возникающая между атомами путем образования общих электронных пар за счет неспаренных электронов.
Внешние уровни большинства элементов периодической системы (кроме благородных газов) содержат неспаренные электроны, то есть являются незавершенными. В процессе химического взаимодействия атомы стремятся завершить свой внешний электронный уровень.
Например, электронная формула атома водорода: 1s1. Ее графический вариант:
Таким образом, атом водорода в химических реакциях стремится завершить свой внешний 1 s-уровень одним s-электроном. При сближении двух атомов водорода происходит усиление притяжения электронов одного атома к ядру другого атома. Под действием этой силы расстояния между ядрами атомов сокращаются и в результате их электронные орбитали перекрывают друг друга, создавая общую электронную орбиталь — молекулярную. Электроны каждого из атомов водорода через область перекрывания орбиталей мигрируют от одного атома к другому, то есть образуют общую электронную пару. Ядра будут сближаться до тех пор, пока нарастающие силы отталкивания одноименных зарядов не уравновесят силы притяжения.
Переход электронов с атомной орбитали на молекулярную сопровождается снижением энергии системы (более выгодное энергетическое состояние) и образованием химической связи:
Подобным образом образуются общие электронные пары при взаимодействии атомов р-элементов. Так образуются все двухатомные молекулы простых веществ. При образовании F2 и Cl2 перекрываются по одной р-орбитали от каждого из атомов (образуется одинарная связь), а при взаимодействии атомов азота перекрываются по три р-орбитали от каждого и в молекуле азота N2 образуется тройная связь.
Электронная формула атома хлора: 1s22s22p63s23p5. Графическая формула:
Таким образом, на внешней орбитали атом хлора содержит один неспаренный р-электрон. Взаимодействие двух атомов хлора будет происходить по следующей схеме:
Электронная формула атома азота: 1s22s22p3. Графическая формула:
На внешней орбитали атома азота находятся 3 неспаренных р-электрона. Взаимодействие двух атомов азота будет происходить по следующей схеме:
Прочность связей в молекуле определяется количеством общих электронных пар у ее атомов. Двойная связь прочнее одинарной, тройная — прочнее двойной.
С увеличением количества связей между атомами сокращается расстояние между ядрами атомов, которое называют длиной связи, и увеличивается количество энергии, необходимое для разрыва связи, которое называется энергией связи. Например, в молекуле фтора связь одинарная, ее длина составляет 1,42 нм (1 нм = 10–9 м), а в молекуле азота связь тройная, ее длина — 0,11 нм. Энергия связи в молекуле азота в 7 раз превышает энергию связи в молекуле фтора.
При взаимодействии атома водорода с атомом хлора оба атома будут стремиться завершить свои внешние энергетические уровни: водород — 1 s-уровень и хлор — 3р-уровень. В результате их сближения происходит перекрывание 1 s-орбитали атома водорода и 3р-орбитали атома хлора, а из соответствующих неспаренных электронов формируется общая электронная пара:
В молекулах Н2 и HCl область перекрывания орбиталей атомов водорода расположена в одной плоскости — на прямой, соединяющей центры атомных ядер. Такая связь называется σ-связью (сигма-связью):
Однако если в молекуле формируется двойная связь (с участием двух электронных орбиталей), то одна связь будет σ-связью, а вторая будет образована между орбиталями, расположенными параллельно друг другу. Параллельные орбитали перекроются с образованием двух общих участков, расположенных сверху и снизу от линии, соединяющей центры атомов.
Химическая связь, образующаяся в результате бокового перекрывания орбиталей — в двух местах, называется π-связью (пи-связью):
При образовании ковалентной связи меду атомами с одинаковой электроотрицательностью (Н2, F2, O2, N2) общая электронная пара будет располагаться на одинаковом расстоянии от атомных ядер. При этом общие электронные пары принадлежат в равной степени обоим атомам одновременно, и ни на одном из атомов не будет избыточного отрицательного заряда, который несут на себе электроны. Такой вид ковалентной связи называется неполярной.
■ Ковалентная неполярная связь — вид химической связи, образующийся между атомами с одинаковой электроотрицательностью.
В случае, когда электроотрицательности элементов, вступающих во взаимодействие, не равны, но близки по значению, общая электронная пара смещается в сторону элемента с большей электроотрицательностью. При этом на нем образуется частичный отрицательный заряд (за счет отрицательно заряженных электронов):
В результате на атомах соединения образуются частичные заряды Н+0,18 и Cl–0,18; а в молекуле возникают два полюса — положительный и отрицательный. Такую ковалентную связь называют полярной.
■ Ковалентная полярная связь — вид ковалентной связи, образующейся при взаимодействии атомов, электроотрицательность которых отличается незначительно.
Образовавшийся частичный заряд на атомах в молекуле обозначают греческой буквой 8 (дельта), а направление смещения электронной пары — стрелкой:
Ионная химическая связь
В случае химического взаимодействия между атомами, электроотрицательность которых резко отличается (например, между металлами и неметаллами), происходит почти полное смещение электронных облаков к атому с большей электроотрицательностью. При этом, поскольку заряд ядра атома имеет положительное значение, атом, который почти полностью отдал свои валентные электроны, превращается в положительно заряженную частицу — положительный ион, или катион. Атом, получивший электроны, превращается в отрицательно заряженную частицу — отрицательный ион, или анион:
Ион — это одноатомная или многоатомная отрицательно либо положительно заряженная частица, в которую превращается атом в результате потери или присоединения электронов.
Между разноименно заряженными ионами при их сближении возникают силы электростатического притяжения — положительно и отрицательно заряженные ионы сближаются, образуя молекулу вещества.
■ Ионная химическая связь — это связь, образующаяся между ионами за счет сил электростатического притяжения.
Процесс присоединения электронов в ходе химических взаимодействий атомами с большей электроотрицательностью называется восстановлением, а процесс отдачи электронов атомами с меньшей электроотрицательностью — окислением.
Схему образования ионной связи между атомами натрия и хлора можно представить следующим образом:
Ионная химическая связь присутствует в оксидах, гидроксидах и гидридах щелочных и щелочноземельных металлов, в солях, а также в соединениях металлов с галогенами.
Ионы могут быть как простыми (одноатомными): Cl– , Н+, Na+, так и сложными (многоатомными): NH4–. Заряд иона принято записывать вверху после знака химического элемента. Вначале записывается величина заряда, а затем его знак.
Металлическая связь
Между атомами металлов возникает особый вид химической связи, которая называется металлической. Образование этой связи обусловлено тремя особенностями строения атомов металлов:
- на внешнем энергетическом уровне присутствуют 1—3 электрона (исключения: атомы олова и свинца (4 электрона), атомы сурьмы и висмута (5 электронов), атом полония (6 электронов));
- атом имеет сравнительно большой радиус;
- атом имеет большое количество свободных орбиталей (например, у Na один валентный электрон располагается на 3-м энергетическом уровне, который имеет десять орбиталей (одну s-, три р- и пять d-орбиталей).
При сближении атомов металлов происходит перекрытие их свободных орбиталей, и валентные электроны получают возможность перемещаться на близкие по значениям энергии орбитали соседних атомов. Атом, теряющий электрон, превращается в ион. Таким образом, в металле формируется совокупность электронов, свободно перемещающихся между ионами. Притягиваясь к положительным ионам металла, электроны восстанавливают их, а затем снова отрываются, переходя к другим ионам. Такой процесс превращения атомов в ионы и обратно происходит в металлах непрерывно. Частицы, из которых состоят металлы, называют атом-ионами.
■ Металлическая связь — это связь, образующаяся между атом-ионами в металлах и сплавах посредством постоянного перемещения между ними валентных электронов:
Конспект урока «Химическая связь: ковалентная, ионная, металлическая».
Следующая тема: «Валентность химических элементов».
Содержание:
- Химическая связь
- Ковалентная связь
- Свойства ковалентной связи
- Ионная связь
- Полярные и неполярные молекулы
- Металлическая связь
- Водородная связь
- Типы кристаллических решеток
- Структурные формулы
- Степень окисления
- Химическая связь и валентность
- Виды химичеcких связей
- Электроотрицательность
- Ковалентная связь
- Ионная связь
- Взаимосвязь между типами связей, видами кристаллических решеток и свойствами веществ
- Химическая связь и строение вещества
- Ковалентная связь
- Типы ковалентной связи
- Характеристики ковалентной связи
- Направленность ковалентной связи
- Гибридизация атомных орбиталей II геометрия молекул
- Электроотрицательность и полярность связи
- Относительная электроотрицательность
- Ионная связь
- Металлическая связь
- Водородная связь
- Химическая связь и строение молекул
- Теория химического строения
- Ковалентная связь. Метод валентных связей
- Неполярная и полярная ковалентная связь
- Способы образования ковалентной связи
- Направленность ковалентной связи
- Гибридизация атомных электронных орбиталей
- Многоцентровые связи
- Метод молекулярных орбиталей
- Ионная связь
- Водородная связь
Химическая связь — связь между атомами в молекуле или молекулярном соединении, возникающая в результате переноса электронов с одного атома на другой, либо обобществления электронов для обоих атомов.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Химическая связь
Химическая связь — это взаимодействие атомов, обуславливающее устойчивость молекулы или кристалла как целого. … Химическая связь определяется взаимодействием между заряженными частицами (ядрами и электронами).
Ковалентная связь
Учение о химической связи — центральный вопрос современной химии. Без него нельзя понять причин многообразия химических соединений, механизма их образования, строения и реакционной способности.
Образование молекул из атомов приводит к выигрышу энергии, так как в обычных условиях молекулярное состояние устойчивее, чем атомное. Учение о строении атомов объясняет механизм образования молекул, а также природу химической связи.
У атома на внешнем энергетическом уровне может содержаться от одного до восьми электронов. Если число электронов на внешнем уровне атома максимальное, которое он может вместить, то такой уровень называется завершенным. Завершенные уровни характеризуются большой прочностью. Таковы внешние уровни атомов благородных газов: у гелия на внешнем уровне два электрона (

Химическая связь образуется за счет валентных электронов, но осуществляется она по-разному. Различают три основных типа химических связей: ковалентную, ионную и металлическую.
Механизм возникновения ковалентнойсвязи рассмотрим на примере образования молекулы водорода:
Ядро свободного атома водорода окружено сферически симметричным электронным облаком, образованным 1s-электроном (см. рис. 2.2). При сближении атомов до определенного расстояния происходит частичное перекрывание их электронных облаков (орбиталей) (рис. 3.1). В результате между центрами обоих ядер возникает молекулярное двухэлектронное облако, обладающее максимальной электронной плотностью в пространстве между ядрами; увеличение же плотности отрицательного заряда благоприятствует сильному возрастанию сил притяжения между ядрами и молекулярным облаком.
Итак, ковалентная связь образуется в результате перекрывания электронных облаков атомов, сопровождающегося выделением энергии. Если у сблизившихся до касания атомов водорода расстояние между ядрами составляет 0,106 нм, то после перекрывания электронных облаков (образования молекулы 
Изображать химические связи принято по-разному:
1) с помощью электронов в виде точек, поставленных у химического знака элемента. Тогда образование молекулы водорода можно показать схемой
2) с помощью квантовых ячеек (орбиталей), как размещение двух электронов с противоположными спинами в одной молекулярной квантовой ячейке:
Схема, расположенная слева, показывает, что молекулярный энергетический уровень ниже исходных атомных уровней, а значит, молекулярное состояние вещества более устойчиво, чем атомное;
3) часто, особенно в органической химии, ковалентную связь изображают черточкой (штрихом) (например, Н—Н), которая символизирует пару электронов.
Ковалентная связь в молекуле хлора также осуществляется с помощью двух общих электронов, или электронной пары:
Как видно, каждый атом хлора имеет три неподеленные пары и один неспаренный электрон. Образование химической связи происходит за счет несиаренных электронов каждого атома. Неспаренные электроны связываются в общую пару электронов, называемую также поделенной парой.
Если между атомами возникла одна ковалентная связь (одна общая электронная пара), то она называется одинарной; если больше, то кратной: двойной (две общие электронные пары), тройной (три общие электронные пары).
Одинарная связь изображается одной черточкой (штрихом), двойная — двумя, тройная — тремя. Черточка между двумя атомами показывает, что у них пара электронов обобщена, в результате чего и образовалась химическая связь.
С помощью таких черточек изображают структурные формулы молекул (см. §3.8).
Итак, в молекуле хлора каждый его атом имеет завершенный внешний уровень из восьми электронов (
Несколько по-иному изображают связь в молекуле кислорода 

Однозначное решение об изображении электронной структуры молекулы кислорода еще не найдено. Однако ее нельзя изображать так:

В молекуле азота 
Очевидно, молекула азота прочнее молекулы кислорода или хлора, чем и обусловлена значительная инертность азота в химических реакциях.
Химическая связь, осуществляемая электронными парами, называется ковалентной. Это двухэлектронная и двухцентровая (удерживает два ядра) связь. Соединения с ковалентной связью называются гомеополярными или атомными.
Различают две разновидности ковалентной связи: неполярную и полярную.
В случае неполярной ковалентной связи электронное облако, образованное общей парой электронов, или электронное облако связи, распределяется в пространстве симметрично относительно ядер обоих атомов. Примером являются двухатомные молекулы, состоящие из атомов одного элемента: 




В случае полярной ковалентной связи электронное облако связи смещено к атому с большей относительной электроотрицательностью. Примером могут служить молекулы летучих неорганических соединений: 



Образование молекулы НСl можно представить схемой
Электронная пара смеш,ена к атому хлора, так как относительная элек-троотрнцательность атома хлора (2,83) больше, чем атома водорода (2,1).
Ковалентная связь образуется не только за счет перекрывания одноэлектронных облаков, — это обменный механизм образования ковалентной связи.
Возможен и другой механизм ее образования — донорно-акцепторный. В этом случае химическая связь возникает за счет двух-электронного облака одного атома и свободной орбитали другого атома. Рассмотрим в качестве примера механизм образования иона аммония 


Заряд иона водорода становится общим (он делокализован, т. е. рассредоточен между всеми атомами), а двухэлектронное облако (неподеленная электронная пара), принадлежащее азоту, становится общим с водородом. В схемах изображение ячейки 
Атом, предоставляющий неподеленную электронную пару, называется донором, а атом, принимающий ее (т. е. предоставляющий свободную орбиталь), называется акцептором.
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома (донора) и свободной орбитали другого атома (акцептора) называется донорно-акцспторным. Образованная таким путем ковалентная связь называется донорно-акцепторной или координационной связью.
Однако это не особый вид связи, а лишь иной механизм (способ) образования ковалентной связи. По свойствам четвертая N—Н-связь в ионе аммония ничем не отличается от остальных трех.
Свойства ковалентной связи
Характерные свойства ковалентной связи — ее длина, энергия, насыщаемость и направленность.
Длина связи — это межъядерное расстояние. Химическая связь тем прочнее, чем меньше ее длина. Однако мерой прочности связи является энергия связи.
Энергия связи определяется количеством энергии, которое необходимо для разрыва связи. Обычно она измеряется в килоджоулях, отнесенных к 1 моль вещества. Так, согласно опытным данным, длины связи молекул 


Под насыщаемостью понимают способность атомов образовывать ограниченное число ковалентных связей. Например, атом водорода (один неспаренный электрон) образует одну связь, атом углерода (четыре неспаренных электрона в возбужденном состоянии) — не более четырех связей. Вследствие насыщаемости связей молекулы имеют определенный состав: 


Направленность ковалентной связи обусловливает пространственную структуру молекул, т. е. их геометрию (форму). Рассмотрим это на примере образования молекул 


Известно, что ковалентная связь возникает в направлении максимального перекрывания электронных орбиталей взаимодействующих атомов. При образовании молекул 
На внешнем уровне атома кислорода имеются два неспаренных электрона. Орбитали их взаимно перпендикулярны, т. е. располагаются относительно друг друга под углом 90°. При образовании молекулы воды орбиталь каждого р-электрона перекрывается орбпталыо 1s-электрона атома водорода вдоль линии осей координат в месте, обозначенном более густыми точками (рис. 3.3). Химические связи в этом случае должны быть направлены под углом 90°. Экспериментально найдено, что угол между связями в молекуле воды 
Таким образом, атом кислорода с двумя неспаренными (валентными) р-электронами образует с водородом молекулу воды, которая имеет угловую форму. Очевидно, молекулы такой же формы должны образовать с водородом аналоги кислорода — сера, селен, теллур.
В образовании молекулы 

Ковалентные связи, образуемые многовалентными атомами, всегда имеют пространственную направленность. Углы между связями называются валентными.
Очень часто электроны, участвующие в образовании ковалентной связи, находятся в различных состояниях, например один в s-, другой в р-орбиталях. Казалось бы, и связи в молекуле по прочности должны быть неравноценными. Однако опыт показывает, что они равнозначны. Это явление объясняется представлением о гибридизации атомных орбиталей, введенным Л. Полингом.
Гибридизацию валентных орбиталей рассмотрим на примере образования молекул хлорида бериллия 


Переход атома бериллия в возбужденное состояние сопровождается разъединением спаренных электронов, т. е. распадом двухэлектронного облака (
Перевод 2s-электрона на 2p-орбиталь, т. е. переход атома в возбужденное состояние, требует затраты энергии, которая с избытком компенсируется в реакции за счет образования двух связей. В возбужденном состоянии бериллий присоединяет два атома хлора:
Обе связи Be—Сl одинаково прочны и расположены под углом 180°.
Одинаковая прочность связей объясняется гибридизацией валентных (внешних) орбиталей, т. е. смешением их и выравниванием по форме и энергии. В этом случае первоначальная форма и энергия электронных орбиталей атома взаимоизменяются и образуются электронные орбитали одинаковой формы и энергии. Гибридная орбиталь асимметрична и сильно вытянута по одну сторону от ядра (рис. 3.5).
Химическая связь, образуемая с участием электронов гибридных орбиталей, прочнее связи с участием электронов негибридных (чистых) s— и р-орбиталей, так как при гибридизации происходит большее перекрывание. Гибридизация осуществляется тогда, когда в образовании связей данного атома участвуют электроны разного типа (в нашем примере s— и р-электроны). При этом число гибридных орбиталей равно числу исходных.
Таким образом, в образовании химической связи в молекуле 

В молекуле хлорида бора 

У атома бора (электронная структура 


При образовании молекулы метана атом углерода переходит в возбужденное состояние, сопровождающееся разъединением спаренных 2s-электронов, т. е. распадом двухэлектронного облака на одно-электронные:
Как видно из схемы, атом углерода в основном состоянии имеет два неспаренных электрона (двухвалентен), в возбужденном состоянии (обозначено звездочкой) — четыре (четырехвалентен) и может присоединить четыре атома водорода:
При образовании молекулы метана у атома углерода подверглись гибридизации орбитали одного s— и трех p-электронов и получились четыре одинаковые гибридные орбитали (рис. 3.10). Такая гибридизация называется 
Валентный угол между осями гибридных орбиталей составляет 109°28′. В результате перекрывания четырех гибридных 
Гибридизацией орбиталей объясняется и тот факт, что валентные углы связей у молекул воды и аммиака меньше тетраэдрического (см. рис. 3.3 и 3.4). Как и в случае образования метана, при образовании молекул воды и аммиака происходит 




Представление о гибридизации валентных орбиталей широко используется в органической химии (см. ч. III).
Ионная связь
Возникновение ионной связи рассмотрим на примере образования хлорида натрия NaCl. Атомы натрия и хлора, из которых образовалось это соединение, резко отличаются по электроотрицательности: для атома натрия она равна 1,01, для атома хлора 2,83. Как видно из электронных формул Na 

т.е. электронная оболочка атома Na превратилась в устойчивую оболочку атома благородного газа Ne — 





Химическая связь между ионами, осуществляемая электростатическим прнтяжением, называется элекгровалентной или ионной связью. Соединения, которые образовались путем притяжения ионов, называются гетерополярными или ионными.
Ионные соединения образуют атомы элементов, резко отличных по электроотрицательности, например атомы элементов главных подгрупп I и II групп с элементами главных подгрупп VI и VII групп. Ионных соединений сравнительно немного.
Молекулы хлорида натрия NaCl существуют только в парообразном состоянии. В твердом (кристаллическом) состоянии ионные соединения состоят из закономерно расположенных положительных и отрицательных ионов. Молекулы в этом случае отсутствуют (см. §3.7).
Ковалентная связь является более общим типом химической связи. Теория связи объясняет возникновение ионной связи из ковалентной предельной односторонней поляризацией (смещением) общей электронной пары, когда последняя переходит во владение одного из соединяющихся атомов. Например:
В приведенном примере предельная односторонняя поляризация производится атомом хлора, проявляющим неметаллические свойства (электроотрицательность 
Очевидно, полярную ковалентную связь можно определить как разновидность ковалентной связи, которая претерпела лишь незначительную одностороннюю поляризацию (связующее электронное облако сместилось к атому с большей относительной электроотрицатель-нос гыо). Она является промежуточной между ионной и неполярной ковалентной связями.
Таким образом, в механизме возникновения неполярной ковалентной, полярной ковалентной и ионной связей нет принципиального различия. Они различаются лишь степенью поляризации (смещения) общих электронных пар. Природа химической связи едина.
Предсказать полярность связи можно на основании значений относительной элсктроотрицательности атомов элементов (табл. 2.2). Чем больше разность относительных электроотрицательностей связанных атомов (обозначим ее через 

Итак, химическая связь между атомами ионная вплоть до 

В действительности связи не бывают ионными на 100%. Поэтому говорят о степени или доле ионности связи. Ее определяют опытным путем. Оказывается, даже в таком соединении, как CsF, ионная связь выражена только на 89%.
Ионная связь в отличие от ковалентной связи характеризуется ненаправленностью в пространстве и ненасыщаемсстью. Ненаправленность связи определяется тем, что каждый ион, представляющий как бы заряженный шар, может притягивать ион противоположного знака по любому направлению. Взаимодействие ионов противоположного знака не приводит к компенсации силовых полей: способность притягивать ионы противоположного знака у них остается по другим направлениям (ненасыщгемость). Например, в кристалле NaCl каждый нон 

Полярные и неполярные молекулы
Односторонняя поляризация приводит к неравномерному распределению электронной плотности в молекуле. Например, в молекуле НС1 электронная плотность около ядра хлора выше, чем около ядра водорода. Электрические центры положительных и отрицательных зарядов в молекуле не совпадают в одной точке, а находятся на некотором расстоянии l (рис. 3.12).
Молекула при общей нейтральности представляет собой электрический диполь с зарядом —q у атома хлора и +q у атома водорода. Такие связи и молекулы называются полярными. Заряды атомов в молекуле q называются эффективными зарядами (в молекуле НСl 

Мера полярности связи и молекулы — электрический момент диполя 
где q — эффективный заряд; l — длина диполя.
В системе СИ единица электрического момента диполя выражается значением 


Электрический момент диполя — векторная величина. Направление его условно принимают от положительного заряда к отрицательному — в сторону смещения связующего электронного облака.
Электрические моменты диполей экспериментально определены для различных связей и большого числа веществ (они имеют значении от 0 до 

Следует отличать полярность молекулы от полярности связи. Для двухатомных молекул типа АВ эти понятия совпадают, как это уже показано на примере молекулы НСl. В таких молекулах чем больше разность электроотрицательностей элементов, тем больше электрический момент диполя.
В многоатомных молекулах связь между атомами может быть полярной, а сами молекулы в зависимости от пространственного строения могут быть как полярными, так и неполярными. Электрический момент диполя в таких молекулах определяется числом полярных связей и их направленностью. Он равен векторной сумме моментов диполя отдельных связей. Например, электрический момент диполя связи С=0 равен 




В угловой молекуле 


В свою очередь по значению и направлению 




Молекулы, содержащие неполярную ковалентную связь, называются неполярными или гомеополярными. У таких молекул связующее электронное облако распределяется симметрично между ядрами обоих атомов и ядра в равной мере действуют на него. Примером могут служить молекулы простых веществ, состоящие из атомов одного элемента, 



Способность молекул (и отдельных связей) поляризоваться под влиянием внешнего электрического поля называется поляризуемостью.
Это может происходить и под влиянием поля, создаваемого приблизившейся полярной молекулой. Поэтому поляризуемость имеет большое значение в химических реакциях.
Всегда важно учитывать полярность молекулы и ее электрический момент диполя. С последним связана реакционная способность веществ. Как правило, чем больше электрический момент диполя молекулы, тем выше реакционная способность вещества. С электрическим моментом диполя связана также и растворимость веществ.
Полярные молекулы жидкостей благоприятствуют электролитической диссоциации растворенные в них электролитов.
Металлическая связь
Атомы большинства металлов на внешнем энергетическом уровне содержат небольшое число электронов. Так, по одному электрону содержат 16 элементов, по два — 58, по три — 4 элемента и ни одного — только Pd. Атомы элементов Ge, Sn и Pb имеют на внешнем уровне по 4 электрона, Sb и Bi — по 5 и Ро — 6, но эти элементы не являются характерными металлами.
Элементы металлы образуют простые вещества — металлы. В сбычных условиях — это кристаллические вещества (кроме ртути). На рис. 3.14 представлена схема кристаллической решетки натрия. Как видно, каждый атом натрия окружен восемью соседними. На примере натрия рассмотрим природу химической связи в металлах.
У атома натрия, как и у других металлов, имеется избыток валентных орбиталей и недостаток электронов. Так, валентный электрон 
Металлическую связь образуют элементы, атомы которых па внешнем уровне имеют мало валентных электронов по сравнению с общим числом внешних энергетически близких орбиталей, а валентные электроны из-за небольшой энергии ионизации слабо удерживаются в атоме. Химическая связь в металлических кристаллах сильно делокализована, т. е. электроны, осуществляющие связь, обобществлены («электронный газ») и перемещаются по всему куску металла, в целом электронейтрального.
Металлическая связь характерна для металлов в твердом и жидком состоянии. Это свойство агрегатов атомов, расположенных в непосредственной близости друг к другу. Однако в парообразном состоянии атомы металлов, как и всех веществ, связаны между собой ковалентной связью. Пары металлов состоят из отдельных молекул (одноатомных и двухатомных). Прочность связи в кристалле больше, чем в молекуле металла, а потому процесс образования металлического кристалла протекает с выделением энергии.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку и в ее основе лежит обобщение валентных электронов. Однако электроны, которые осуществляют ковалентную связь, находятся вблизи соединенных атомов и прочно с ними связаны. Электроны же, осуществляющие металлическую связь, свободно перемещаются по всему кристаллу и принадлежат всем его атомам. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической — пластичны, т. е. они изменяют форму при ударе, прокатываются в тонкие листы и вытягиваются в проволоку.
Металлической связью объясняются физические свойства металлов (см. § 12.2).
Водородная связь
Водородная связь—это своеобразная химическая связь. Она может быть межмолекулярной и внутримолекулярной.
Межмолекулярная водородная связь возникает между молекулами, в состав которых входят водород и сильно электроотрицательный элемент — фтор, кислород, азот, реже хлор, сера. Поскольку в такой молекуле общая электронная пара сильно смещена от водорода к атому электроотрицательного элемента, а положительный заряд водорода сконцентрирован в малом объеме, то протон взаимодействует с неподеленной электронной парой другого атома или иона, обобществляя ее. В результате образуется вторая, более слабая связь, получившая название водородной.
Ранее водородную связь сводили к электростатическому притяжению между протоном и другой полярной группой. Но более правильным следует считать, что в ее образование вносит вклад и донорно-акцепторпое взаимодействие. Для этой связи характерны направленность в пространстве и насыщаемость.
Обычно водородную связь обозначают точками и этим указывают, что она намного слабее ковалентной связи (примерно в 15—20 раз). Тем не менее она ответственна за ассоциацию молекул. Например, образование димсров (в жидком состоянии они наиболее устойчивы) воды и уксусной кислоты можно представить схемами:
Как видно из этих примеров, посредством водородной связи объединены две молекулы воды, а в случае уксусной кислоты — две молекулы кислоты с образованием циклической структуры.
Водородная связь весьма распространена и играет важную роль при ассоциации молекул, в процессах кристаллизации, растворения, образования кристаллогидратов, электролитической диссоциации и других важных физико-химических процессах.
Водородная связь оказывает влияние на свойства многих веществ. Так, благодаря водородной связи фтороводород в обычных условиях существует в жидком состоянии (ниже 19,5°С) и содержит молекулы состава от 


который входит в состав солей — гидрофторидов (

Наличием водородных связей объясняется более высокая температура кипения воды (100°С) по сравнению с водородными соединениями элементов подгруппы кислорода (


Особенно распространены водородные связи в молекулах белков, нуклеиновых кислот и других биологически важных соединений, а потому эти связи играют важную роль в химии процессов жизнедеятельности.
Типы кристаллических решеток
Твердые вещества, как правило, имеют кристаллическое строение. Оно характеризуется правильным расположением частиц в строго определенных точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас, который называют кристаллической решеткой. Точки,
в которых размещены частицы, называются узлами кристаллической решетки. В узлах воображаемой решетки могут находиться ионы, атомы или молекулы. Они совершают колебательные движения. С повышением температуры амплитуда колебании возрастает, что проявляется в тепловом расширении тел.
В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Кристаллические решетки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером может служить кристалл хлорида натрия, в котором, как уже отмечалось, каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион — шестью ионами натрия. Такому расположению соответствует наиболее плотная упаковка, если ионы представить в виде шаров, размещенных в кристалле (рис. 3.15). Очень часто кристаллические решетки изображают, как показано на рис. 3.16, где указывается только взаимное расположение частиц, но не их размеры.
Число ближайших соседних частиц, вплотную примыкающих к данной частице в кристалле или в отдельной молекуле, называется координационным числом.
В решетке хлорида натрия координационные числа обоих ионов равны 6. Итак, в кристалле хлорида натрия нельзя выделить отдельные молекулы соли. Их нет. Весь кристалл следует рассматривать как гигантскую макромолекулу, состоящую из равного числа ионов 


Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и уменьшению прочности связи между ними. Поэтому расплавы их проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде.
Кристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными. Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером может служить алмаз — одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами. Координационное число углерода в алмазе 4. Структура алмаза показана на рис. 11.1. В решетке алмаза, как и в решетке хлорида натрия, молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. В неорганической химии известно большое число веществ с атомной кристаллической решеткой. Они имеют высокие температуры плавления (у алмаза свыше 3500°С), прочны и тверды, практически нерастворимы в жидкостях. Атомная кристаллическая решетка характерна для твердого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием.
Кристаллические решетки, состоящие из молекул (полярных и неполярных), называются молекулярными. Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решеткой невелико. Примерами их являются лед, твердый оксид углерода (IV) («сухой лед»), твердые галогеноводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (









В твердом состоянии металлы образуют металлические кристаллические решетки. Последние обычно описывают как сочетание катионов металла, связанных воедино валентными электронами, т. е. отрицательно заряженным «электронным газом». Электроны электростатически притягивают катионы, обеспечивая стабильность решетки. На рис. 3.18 представлено схематическое изображение металлической решетки (свободные электроны показаны точками). Сравните ее с другими типами кристаллических решеток.
Структурные формулы
Состав соединения изображается в виде химических формул: эмпирических, электронных и структурных. В качестве примера напишем соответствующие формулы молекул водорода, воды, аммиака и метана.
Эмпирические или молекулярные формулы отражают только качественный и количественный состав молекул, т. е. вид и число атомов в соединении.
Электронные формулы состоят из символов элементов, вокруг которых точками обозначены электроны внешнего уровня, а между атомами — связующие электронные пары. Они показывают порядок соединения атомов в молекуле, а также природу химической связи и механизм образования молекулы из атомов, а потому часто применяются для объяснения поведения соединений в различных реакциях. Две точки между атомами в электронных формулах обозначают места перекрывания электронных облаков, а значит, и наибольшую плотность связующего двухэлектронного облака.
Структурные электронные формулы, или формулы строения, — это формулы, в которых каждая связующая электронная пара изображается черточкой (штрихом). Они, как и электронные формулы, показывают порядок соединения атомов в молекуле, их взаимосвязь друг с другом. Для упрощения структурные формулы принято изображать в сокращенном виде, отмечая только связи между атомами, образующими цепь. Например, этан 



У первых шарики-атомы соединяются с помощью стержней, символизирующих валентные связи, у вторых пластилиновые шарики вдавлены друг в друга, демонстрируя заполнение пространства молекулы. Обе модели наглядно передают форму молекулы. Модель молекулы метана, где углерод соединен с четырьмя одинаковыми атомами водорода, можно представить в виде тетраэдра (правильного четырехгранника): в центре его находится атом углерода, в вершинах — атомы водорода (см. рис. 3.11). Таким образом, четыре валентности углерода направлены в пространстве к четырем вершинам тетраэдра. Эти направления сохраняются и при образовании углеродных цепей. Молекулу этана можно представить фигурой, состоящей из двух тетраэдров, соединенных вершинами (рис. 3.20), и т. д.
В химии обычно пользуются структурными формулами, памятуя, что атомы имеют пространственное расположение. Эти формулы применяют только для соединений с ковалентной связью, имеющих молекулярные кристаллические решетки. К последним относятся подавляющее большинство органических соединений, многие кислоты и некоторые оксиды неметаллов.
Степень окисления
Степень окисления атома (элемента) относится к основным понятиям химии. Оно введено для характеристики состояния атома в соединении.
При определении этого понятия условно предполагают, что в соединении связующие (валентные) электроны переходят к более электроотрицательным атомам, а потому соединения состоят только из положительно и отрицательно заряженных ионов. В действительности же в большинстве случаев происходит не полная отдача электронов, а только смещение электронной пары или, точнее, связующего электронного облака от одного атома к другому.
Степень окисления — это условный заряд атома в соединении, вычисленный исходя из предположения, что оно состоит только из ионов.
Это понятие можно определить и иначе: степень окисления — это тот электрический заряд, который возник бы на атоме, если бы электронные пары, которыми он связан с другими атомами в соединении, перешли к более электроотрицательным атомам, а электронные пары, принадлежащие одинаковым атомам, были бы между ними поделены.
Из приведенных определений следует, что степень окисления выражает значение электрического заряда (в единицах заряда электрона) и основывается на предположении о принадлежности электронов каждой связи в молекуле или ионе более электроотрицательным атомам.
Степень окисления может иметь отрицательное, положительное и нулевое значение, которое обычно выражают арабскими цифрами со знаком 


Отрицательное значение степени окисления имеют атомы, которые приняли электроны от других атомов, т. е. в их сторону смещено связующее электронное облако. Отрицательную степень окисления (—1) имеет атом фтора во всех его соединениях.
Положительное значение степени окисления имеют атомы, отдающие свои электроны другим атомам, т. е. связующее электронное облако оттянуто от них. К таковым относятся металлы в соединениях. Степень окисления щелочных металлов равна +1, а щелочноземельных +2.
Нулевое значение степени окисления имеют атомы в молекулах простых веществ, например водорода, хлора, азота, так как в этом случае электронное облако в равной мере принадлежит обоим атомам. Если вещество находится в атомном состоянии, то степень окисления его атомов также равна нулю.
Степень окисления может представлять собой и дробное число. Например, степень окисления железа в магнитном железняке 
У одноатомных ионов степень окисления равна заряду иона: для иона 


В большинстве соединений атомы водорода имеют степень окисления + 1, только в гидридах металлов, например 


Пользуясь этими сведениями, можно вычислять степень окисления атомов в сложных соединениях, учитывая, что
алгебраическая сумма степеней окисления атомов в соединении всегда равна нулю, а в сложном ионе — заряду иона.
В качестве примера рассмотрим вычисление степени окисления фосфора в фосфорной кислоте 


Допустим, требуется найти степень окислення хрома в ионе 

Многие атомы (а значит, и элементы) имеют несколько значений степени окисления. В качестве примера можно привести элементы VII группы периодической системы — хлор и марганец. В соляной кислоте степень окисления хлора равна —1, в свободном состоянии в молекуле 










У атомов элементов VI группы, например у серы, в соединениях наиболее характерные степени окисления —2, +4, +6. Высшая степень окисления элемента равна +6.
В V группе азот в соединениях 





В соединениях элементов IV группы высшая степень окисления равна +4, у элементов III группы +3, у элементов II группы +2, а у щелочных металлов +1.
Зная степень окисления, составляют формулы бинарных соединений. Так, чтобы написать формулу нитрида кремния, по табл. 2.2 определяем, что у азота большая относительная электроотрицательность, чем у кремния. Число электронов, смещаемых к азоту, равно 4 и степень окисления кремния +4. К атому азота может сместиться 3 электрона (на его р-орбиталях 3 неспаренных электрона). Тогда степень окисления азота будет равна —3, а формула соединения 


Высшая положительная степень окисления проявляется, когда в образовании связи принимают участие все валентные электроны атома. Численно она равна номеру группы периодической системы и является важной количественной характеристикой элемента в его соединениях. Наименьшее значение степени окисления элемента, которое встречается в его соединениях, принято называть низимй степенью окисления. Все остальные степени окисления элемента называют средними или промежуточными. Например, у атома (элемента) серы высшая степень окисления равна +6, низшая —2, промежуточная +4.
Изменение степеней окисления элементов по группам периодической системы отражает периодичность изменения химических свойств элементов с ростом порядкового номера.
Степень окисления весьма удобно применять при классификации различных веществ, описании их свойств и при рассмотрении окислительно-восстановительных реакций. Покажем это на нескольких примерах. Определив степень окисления фосфора в кислотах 




Второй пример — окисление 



Зная степень окисления элемента в соединении, можно предсказать, окислительные или восстановительные свойства проявит это соединение. Так, сера в серной кислоте 


Особенно широко применяется понятие степени окисления при изучении оксислительно-восстановительных реакций (см. гл. 7).
Химическая связь и валентность
Валентность атома (элемента) также относится к основным понятиям химии. Она характеризует способность атомов элементов к образованию химических связей. Ранее ее определяли как число атомов одновалентного элемента, с которым соединяется один атом данного элемента. Так, в соляной кислоте НСl хлор одновалентен, в воде 






Понять физический смысл валентности и структурных формул помогло учение о строении атомов и химической связи. Атомы элементов способны отдавать, присоединять электроны или образовывать общие электронные пары. Электроны, которые участвуют в образовании химических связей между атомами, называются валентными. Это наиболее слабо связанные электроны.
У химических элементов общее число валентных электронов в атоме, как правило, равно номеру группы периодической системы элементов Д. И. Менделеева. Так, атом серы (элемент VI группы) содержит всего 16 электронов, из них валентных 6.
К валентным относятся прежде всего электроны внешних незавершенных уровней. Однако валентными могут быть и электроны второго снаружи уровня (например, у d-элементов), а также электроны третьего снаружи уровня (например, у f-элементов).
С развитием учения о химической связи изменялось и само понятие валентности. В настоящее время
валентность определяется, как число химических связей, которыми данный атом соединен с другими.
Число же связей, которые может образовывать атом, равно числу его неспаренных электронов. И валентность атома элемента в простейших случаях определяется числом неспаренных электронов в нем, идущих на образование общих электронных пар. При этом не учитывается полярность образовавшихся связей, а потому валентность не имеет знака. Следует подчеркнуть, что валентность, определяемая, как число связей, не может быть ни отрицательной, ни нулевой.
Рассмотрим это положение на примерах азота 




Во всех этих соединениях азот трехвалентен. Однако степень окисления азота различна и соответственно равна 0, —2, —3 (цифры над символами). В ионе аммония 

Валентность азота в молекуле азотной кислоты также равна четырем. В настоящее время структурную формулу азотной кислоты изображают так:
При этом имеется в виду, что оба атома кислорода, связанные только с азотом, равноценны; они находятся на одинаковом расстоянии от атома азота и несут каждый по половинному заряду электрона, т. е. четвертая связь азота разделена поровну между двумя атомами кислорода. При этом атомы в молекуле имеют устойчивые электронные конфигурации внешних уровней: у кислорода и азота — восьмиэлектронные, а у водорода — двухэлектронные.
Электронную структуру азотной кислоты последовательно можно вывести так.
1. Атом водорода связывается с атомом кислорода ковалентной связью:
2. За счет неспаренного электрона атом кислорода образует ковалентную связь с атомом азота:
3. Два неспаренных электрона атома азота образуют ковалентную связь со вторым атомом кислорода:
4. Третий атом кислорода, возбуждаясь, образует свободную 2р-орбиталь путем спаривания неспаренных электронов (при возбуждении такое спаривание возможно). Взаимодействие нсподеленной пары азота со свободной орбиталыо третьего атома кислорода приводит к образованию молекулы азотной кислоты:
В азотной кислоте атом азота может отдать один электрон с подуровня 2s одному из атомов кислорода и тогда будет иметь четыре неспаренных электрона, т. е. станет четырехвалентным в виде 
Азот не может быть пятивалентным. Высшим пределом является такое значение валентности, которое равно числу возможных орбиталей (квантовых ячеек) на внешнем уровне атома. У атомов элементов II периода, куда входит и азот, на внешнем уровне имеется четыре орбиталн: одна s— и три р-орбитали. А значит, максимальное число ковалентных связей (в том числе и образованных по донорно-акцепторному механизму) 4. С увеличением же номера периода возрастает число образуемых связей, т. е. возрастает валентность элементов. Однако степень окислення азота в азотной кислоте равна +5.
Рассмотрим еще один пример определения валентности атомов. Химическая связь в молекуле СО очень прочна (1071 кДж/моль), а физические свойства оксида углерода (II) близки к свойствам азота. Это объясняется образованием тройной связи в молекуле СО:
Из этой схемы видно, что за счет двух неспаренных электронов атомов углерода и кислорода возникают две ковалентные связи. Третья связь возникает по донорно-акцепторному механизму за счет неподеленной электронной пары атома кислорода (донора) и свободной орбитали атома углерода (акцептора) (на схеме электроны углерода изображены крестиками). Таким образом, валентность углерода и кислорода в оксиде углерода (II) равна 3, а степень окисления: углерода +2, кислорода —2.
Сопоставим оба понятия. Степень окисления — условное, формальное понятие. Например, эффективный заряд хлора в хлороводороде равен — 0,18, а в хлориде натрия — 0,87, однако степень окнсления хлора равна —1 (учитывается только число принятых или отданных электронов). К тому же далеко не все вещества состоят из ионов (см. определение степени окисления).
Во многих случаях степень окисления атома элемента не совпадает с числом образуемых им связей, т. е. не равна валентности данного элемента. Особенно наглядно это видно на примере органических соединений. Известно, что в органических соединениях валентность углерода равна 4 (образует четыре связи), однако степень окисления углерода, как легко подсчитать, в метане 




Валентность измеряется только числом ковалентных химических связей, в том числе возникших и по донорно-акцепторному механизму. Нельзя говорить о валентности атомов в соединениях, в которых отсутствуют ковалентные связи, надо говорить о степени окисления. В неорганической химии во многих случаях валентность атома теряет определенность: ее числовая величина зависит от знания химического строения соединения.
По формулам большинства неорганических соединений можно судить лишь о степени окисления элементов, а не о их валентности.
Поэтому в неорганической химии предпочтительнее применять понятие степени окисления, а в органической — валентности (валентность — основное понятие теории строения органических соединений А. М. Бутлерова). Это оправдано тем, что большинство неорганических соединений имеет немолекулярное строение, а большинство органических — молекулярное. И нельзя эти два понятия отождествлять, даже если они численно совпадают.
Виды химичеcких связей — это 1. Ионная; 2. Ковалентная; 3. Металлическая; 4. Водородная
Виды химичеcких связей
Существует всего 6 видов химичеcких связей:
- Металлическая связь
- Ковалентная связь
- Ионная связь
- Ван-дер-ваальсова связь
- Водородная связь
- Двухэлектронная трёхцентровая химическая связь
Химическая связь — это то взаимодействие атомов, обуславливающее устойчивость молекулы или кристалла как целого. Химическая связь определяется взаимодействием между заряженными частицами. Современное описание химической связи проводится на основе квантовой механики . Основные характеристики химической связи — прочность, длина, полярность, устойчивость.
Основные свойства ковалентных связей:
- направленность,
- насыщаемость,
- полярность,
- поляризуемость.
Эти свойства связи влияют на химические и физические свойства веществ.
Электроотрицательность
Как образуются соединения? Что такое ионы? Как они образуются?
После ознакомления и подробного изучения Периодической системы Д. И. Менделеева можно приступить к изучению способности элементов образовывать химические соединения.
Химическая активность элементов определяется незавершенностью внешнего энергетического уровня. Элементы могут завершить внешние уровни путем присоединения или отдачи электронов при образовании химических соединений. Эта способность определяется двумя факторами:
1) электронным строением элементов;
2) значением атомного радиуса.
В периодах слева направо увеличивается число электронов на внешнем энергетическом уровне (валентные электроны) элементов. В этом же направлении растут и значения заряда ядер атомов. Усиливается сила притяжения электрона к ядру. Поэтому постепенно уменьшаются значения атомных радиусов (табл. 18). Усиливается способность завершить
энергетический уровень путем присоединения электронов. Для того чтобы убедиться в этом, рассмотрим строение внешних энергетических уровней элементов 3-го периода и определим число электронов, недостающих для их завершения (табл. 19).
У элементов, расположенных в начале периода (IA, IIA), на внешнем энергетическом уровне имеется мало электронов. Поэтому они их легко отдают, принимая при этом электронное строение инертного газа, которым завершается предыдущий период. А у элементов, расположенных в конце периода (VIA, VIIA), на внешнем энергетическом уровне не хватает одного или двух электронов. Они с легкостью присоединяют, принимая
электронное строение инертного газа, которым завершается данный период.
Величина, по которой определяется легкость отдачи или присоединения электрона элементом, называется электроотрицательностью.
Электроотрицательность — величина, характеризующая свойство атомов элемента притягивать к себе электроны, которые участвуют в образовании химических связей от других атомов в соединениях.
У элементов одной группы число валентных электронов одинаково. А число энергетических уровней, т. е. радиусы атомов, увеличивается сверху вниз, значит, усиливается способность отдавать электрон с внешнего уровня.
Электроотрицательность является универсальной характеристикой металлических и неметаллических свойств элементов.
Чем меньше электроотрицательность, тем ярче выражены металлические свойства. Чем больше электроотрицательность, тем ярче выражены неметаллические свойства.
Электроотрицательность элементов в периодах увеличивается слева направо, в группах – снизу вверх (табл. 20).
На практике используется понятие относительной электро-отрицательности, которое ввел в науку американский ученый Л. Полинг. Ее значение меняется от 0,7 до 4,0. Цезий – элемент с наименьшим (0,7), а фтор – с наибольшим (4,0) значением электроотрицательности.
Физический смысл этого понятия сводится к объяснению способности элемента завершить свой незавершенный энергетический уровень при взаимодействии с другими элементами.
Вам уже известно, что при образовании ионов типичные металлы отдавая, а типичные неметаллы принимая электрон завершают свои энергетические уровни. Первые из них заряжаются положительно, а вторые – отрицательно.
Ковалентная связь
Молекулы, как известно, состоят из атомов. А как атомы соединены между собой?
При образовании химических связей происходят изменения во внешних энергетических уровнях элементов. Существуют четыре типа химических связей, из которых мы подробно рассмотрим пока два.
Ковалентная связь образуется между атохмами неметаллов. Ковалентная связь осуществляется путем образования общей электронной пары между элементами.
Образование химических связей можно объяснить, используя понятие электроотрицательности элементов.
Рассмотрим образование молекулы водорода, когда химическая связь образуется между элементами с одинаковыми значениями электроотрицательности. Электронная формула атома водорода 
Теперь рассмотрим, как образуется связь между атомами в молекуле водорода
При перекрывании электронных облаков двух s-электронов образуется электронная пара, общая для обоих атомов, которая находится на одинаковом расстоянии от обоих ядер. Такая связь называется ковалентной неполярной (рис. 44).
Неполярная ковалентная связь образуется между атомами с одинаковой электроотрицательностью (ЭО).
Для того чтобы легче воспринимать образование связи, электроны обозначают точками.
Из этой записи видно, что при образовании молекулы водорода каждый атом приобретает завершенный электронный слой. В графических формулах молекул одной электронной паре соответствует одна черточка (

На примере молекулы кислорода можно также проследить механизм образования ковалентной неполярной связи. Электронная формула атома кислорода 

Число валентных электронов в атоме кислорода равно шести, но только два из шести являются неспаренными и участвуют в образовании химических связей.
Вокруг каждого ядра вращаются восемь электронов, т. е. каждый из атомов кислорода приобретает завершенный электронный слой.
Ковалентная полярная связь образуется между неметаллами, незначительно различающимися значениями электроотрицательности (ЭО).
Если два взаимодействующие элемента являются неметаллами, считается, что электрон смещается от элемента с меньшей электроотрицательностью к элементу с большим значением этого показателя. Поэтому первый из них заряжается положительно, а второй – отрицательно.
Рассмотрим образование связи в молекуле фтороводорода HF. Электроотрицательность фтора равна 4, а водорода – 2,1. Разница 
Существует также другой прием записи ковалентной связи: с помощью диаграммы «точек и крестов».
В молекуле данного соединения в образовании связи участвуют два разных атома. Поэтому электрон водорода, который участвует, обозначен «крестом», а фтора – «точками».
В данном случае каждый атом приобретает завершенный электронный слой (рис. 46).
Но образующаяся общая электронная пара смещается в сторону более электроотрицательного элемента фтора. Это показано стрелкой.
В молекулах 
Ковалентной полярной связью называется связь, образующаяся между атомами с небольшой разницей электроотрицательности.
Электроотрицательность, ковалентная полярная, неполярная связь.
Ионная связь
Как образуются ионы? В каком случае атом теряет электрон и когда приобретает?
В рассмотренной нами молекуле фтороводорода общая электронная пара смещена в сторону фтора. Несмотря на это, электронное облако является общим для обоих атомов.
В молекулах, состоящих из атомов элементов, резко отличающихся значениями электроотрицательности, образуется ионная связь. Например, KF. Электроотрицательность калия 0,8; а фтора 4.
Электронная формула атома калия 
В этом случае валентный электрон атома калия 
Атомы, отдавая или принимая электроны, превращаются в заряженные частицы – ионы. Разноименные ионы по законам электростатики притягиваются друг к другу, в результате чего образуется молекула с ионной связью. На рисунке 47 показана схема образования
поваренной соли (NaCl). Какая связь образуется? Образуется ионная связь.
Положительно заряженные ионы называются катионами, отрицательно заряженные — анионами.
Ионная связь образуется между ионами за счет сил электростатического притяжения.
Ионная связь возникает между типичными металлами (IA, IIA) и типичными неметаллами (VIA и VIIA).
Взаимосвязь между типами связей, видами кристаллических решеток и свойствами веществ
Любое вещество можно перевести в твердое состояние, создав определенные условия. Большинство твердых веществ при дроблении образуют мелкие кристаллики определенной формы, поэтому и называются кристаллическими. В кристаллических веществах ионы, атомы или молекулы расположены в строгом порядке, на определенных расстояниях, образуя кристаллические решетки.
Кристаллическая решетка – это пространственная структура, в которой структурные единицы (атомы, молекулы, ионы) закономерно повторяются в узлах решеток. Кристаллической структурой определяются некоторые физические свойства веществ. По характеру частиц в узлах решетки кристаллические решетки делятся на три типа (рис. 48):
1) атомная;
2) молекулярная;
3) ионная.
С помощью данных, приведенных в таблице 21, можно охарактеризовать каждый тип кристаллических решеток.
1. В веществах с атомной кристаллической решеткой (рис. 48, а) связи ковалентные. В нормальных условиях это твердые, плохо растворимые вещества с высокими температурами плавления.
2. Вещества с молекулярной кристаллической решеткой (рис. 48, б) характеризуются летучестью, при нагревании легко плавятся или разлагаются.
3. Вещества с ионной кристаллической решеткой (рис. 48, в) растворяются в воде, их водные растворы и расплавы проводят электрический ток.
ДЕЛАЕМ ВЫВОДЫ
- 1. Электроотрицательность — это способность атомов элемента притягивать к себе электроны, которые участвуют в образовании химических связей от других атомов в соединениях.
- 2. Электроотрицательность зависит от числа электронов на внешнем энергетическом уровне и радиуса атома. Поэтому в периоде слева направо значения электроотрицательностей увеличиваются, а в группах сверху вниз — уменьшаются.
- 3. Тип химической связи определяется с помощью понятия электроотрицательности элементов.
- 4. Ковалентная связь осуществляется путем образования общей электронной пары между неметаллами.
- 5. Ковалентная связь делится на полярную и неполярную: ковалентная неполярная связь образуется между элементами с одинаковой электроотрицательностью, а ковалентная полярная — между элементами с малой разницей в электроотрицательностях.
- 6. Ионная связь образуется между ионами за счет сил электростатического притяжения.
- 7. Заряженные частицы называются ионами, они образуются путем отдачи или присоединения элементом электронов.
- 8. Типы кристаллических решеток веществ определяются видом химической связи в соединениях: ионная, атомная, молекулярная.
- 9. Свойства веществ зависят от типа их кристаллических решеток и вида химической связи.
Химическая связь и строение вещества
Химическая связь — это взаимодействие двух атомов, осуществляемое путем обмена электронами. При образовании химической связи атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную) внешнюю оболочку, соответствующую строению атома ближайшего инертного газа.
Ковалентная связь
Химическая связь — это электростатическое взаимодействие, которое объединяет отдельные атомы в более сложные системы (малекулы кристаллы и т. д.). Образование химическои связи — процесс самопротпволь-ный н всегда сопровождается выделением энергии, так как полная энергия молекуты {или другой многоатомной системы) всегда меньше суммарной энергии изолированных атомов. В этом состоит основная причина образования химической связи. Различают четыре типа химических связей: ионную ,ковалентную . металлическую и водородную .
Химическая связь, образованная посредством общих электронных пар. называется ковалентной связью . Слово “ковалентная” означает «совместно валентная”.
Теорию ковалентной связи предложил в 1916 г. американский ученый Гильберт Льюис. За счет ковалентной связи образуется большинство молекул, молекулярных ионов, свободных радикалов и атомных кристаллических решеток. Существует два механизма образования ковалентной связи: обменный и донорно-акцепторный
Обменный механизм действует, когда атомы образуют общие электронные пары за счет объединения неспаренных электронов:
При образовании связи по донорно-акценторному механизму один из атомов выступает в роли донора электронов, другой — в роли акцептора. Акцептор предоставляет свободную орбиталь, а донор — неподеленную электронную пару. Ковалентная связь образуется за счет перехода уже существующей электронной пары в общее пользование донора и акцептора;
Катион аммония образуется по донорно-акцепторному механизму. Азот в молекуле аммиака имеет неподеленную пару электронов, поэтому он выступает в роли донора. Катион водорода имеет свободную орбиталь и выступает в роли акцептора:
В результате в ионе аммония четыре ковалентные связи Н — N. три из них образованы по обменному механизму, а одна — по донорно-акцепторному, но несмотря на это, все связи равноценны.
Типы ковалентной связи
По степени смещенности общих электронных пар к одному m связанных ими атомов ковалентная связь может быть полярной и неполярной .
Образование неполярной ковалентной связи рассмотрим на примере образования молекулы брома:
При образовании молекулы хлора общие электронные пары не смещены ни к одному из атомов, так как эта атомы имеют одинаковую электроотрицательность (ЭО). Электронная плотность связи находится на одинаковом расстоянии от ядер химически связанных атомов хлора. Ковалентную химическую сеязь, образующуюся между птомаин с одинаковой электроотрицательностью, называют неполярной . Посредством ковалентной неполярном связи образованы молекулы простых веществ-неметаллов, таких как 
Рассмотрим .механизм образования полярной ковалентной связи на примере бромистого водорода НВг. За счет обобществления неспаренных электронов брома и водорода образуется молекула бромистого водорода. Возникающая при этом обобществленная электронная пара будет смещена к более электроотрицательному брому.
В той части молекулы, где находится более электроотрицательный элемент 



Химическая связь, образованная атомами, электроотрицательньность которых отличается незначительно. называется ковалентной
полярной связью . Надо отметить, что в обоих случаях ковалентная связь образована по обменному механизму
Следует различать полярность молекулы п полярность связи. Поляр* ность связи зависит от значений электроотрицательности связанных атомов, а полярность молекулы зависит и от полярности связи, и от геометрии молекулы. Например, связи в молекуле углекислого газа 
Молекула воды 




Диполь — электроне и тральная система, в которой центры положительного и отрицательного зарядов на.хоояшея но определенном расстоянии друг от друга , Гемолитический п гетеролитический разрыв ковалентной связи.
Разрыв ковалентной связи может происходить двумя способами* обратными механизмами ее образования. Разрыв связи* при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим :
В результате гомолитического разрыва образуются сходные по электронному строению частниы. кажлая из которых имеет неспаренный электрон. Такие частицы называются свободными радикалами . Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролшпнческим , В результате гетеролити-ческого разрыва образуются разноименно заряженные ноны— катион и анион:
Гомолитический разрыв более характерен для неполярных и слабополярных связен» а гетеролитический — для полярных.
Существуют два механизма образования ковалентной связи: обменный и донорно-акцепторный . Химическая связь, образованная посредством общих электронных пар, называется ковалентной связью , При образовании связи по донорно-акцепторному механизму один из атомов выступает в роли донора электронов, другой — в роли акцептора. Акцептор предоставляет свободную орбиталь, а донор — неподеленную электронную пару. По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть неполярной и полярной . Полярность связи зависит от значении электроотрицательное™ связанных атомов, а полярность молекулы зависит и от полярности связи, и от геометрии молекулы. В результате гемолитического разрыва образуются свободные радикалы. В результате гетеролитического разрыва образуются разноименно заряженные ионы — катион и анион .
Характеристики ковалентной связи
Важнейшими характеристиками ковалентной связи являются: 1) энергия; 2) длина: 3) направленность: 4) насыщаемость; 5) полярность. Рассмотрим первые четыре характеристики ковалентной связи (полярность была рассмотрена выше).
Энергия химической связи — это энергия, которая выделяется при ее образовании . Данная энергия равна энергии, требующейся для разделения молекулы на отдельные атомы. Энергия связи измеряется в кДж моль и является мерой прочности связи: чем больше энергия связи, тем она прочнее. Энергия химической связи зависит от кратности, длины и способа перекрывания атомных орбиталей.
Длина связи — межъядерное расстояние (рис. 14). Чем это расстояние короче, тем прочнее химическая связь. Например, в ряду молекул 

Кратность связи между данными атомами равна числу их обобществленных электронных пар. По числу’ общих электронных пар различают одинарные, двойные и тройные кова-
Если между двумя атомами в молекуле возникают кратные связи (двойные или тройные), одна из связей будет о-связью, т, е. образованной перекрыванием электронных облаков вдоль оси («осевой линии), соединяющей ядро атомов, а все остальные — 














Под насыщаемостью ковалентной связи понимают способность атомов образовывать ограниченное число ковалентных связей. Вы уже знаете, что число ковалентных связен зависит от числа имеющихся на внешнем энергетическом уровне неспаренных электронов, наличия неподеленных электронных пар и вакантных электронных орбиталей. От насыщаемости ковалентной связи зависит стехиометрия молекулярных соединении, их формульный состав, массовые соотношения элементов.
Направленность ковалентной связи
Каждая молекула характеризуется определенным пространственным строением (или геометрией) потому, что все атомные орбитали, кроме s-типа, обладают определенной ориентацией. Геометрию элементов некоторых атомов будем рассматривать в будущем. Все вещества с ковалентной связью, как правило, при обычных условиях могут быть жидкостями. газами, твердыми по агрегатному состоянию; низкоплавные. летучие. Они могут образовывать два типа кристаллических решеток: атомные и молекулярные
(рис. 15). Атомными кристалическими решетками называются те решетки, в узлах которых находятся атомы, между которыми образованы ковалентные связи. Пример: алмаз, графит, бор. кремнии. SiC — карборунд, 

Молекулярными кристаллическими решетками называются те кристаллические решетки, в узлах которых находятся молекулы, между которыми слабые силы межмолекулярного взаимодействия. Большинство веществ с такой решеткой являются газами



Энергия химической связи зависит от кратности, межьядерного расстояния и способа перекрывания атомных орбиталей. Чем короче межъядерное расстояние, тем прочнее химическая связь. По числу общих электронных пар (т, е. по кратности) различают одинарные . двойные и тройные ковалентные связи . Между энергией связи, ее длиной и кратностью существует определенная связь: чем выше кратность связи, тем больше ее энергия и меньше длина. По способу перекрывания электронных орбиталей ковалентная связь делится на
Гибридизация атомных орбиталей II геометрия молекул
Гибридизация атомных орбиталей — это взаимодействие (смешение) разных по пипу, но близких по энергии атомных орбиталей данного атома с образованием гибридных орбиталей одинаковой формы и энергии .
При гибридизации атомные орбитали становятся одинаковыми, вследствие чего образуются равноценные связи с другими атомами и достигается их максимальное удаление друг от друга в пространстве. Существуют следующие основные типы гибридизации: 



sp-гибридные орбитали атома бериллия перекрываются р-орбиталями двух атомов хлора с образованием двух 
Гибридные sp-облака всегда располагаются под утлом 180°. поэтому для молекул, которые содержат sp -гибридизованные атомы, характерно линейное строение. Примеры химических соединении, для которых характерна sp-гибридизация, —





У каждого атома хлора имеется по одному валентному неспаренному p-электрону. орбитали которых перекрываются, образуя плоскостную треугольную молекулу (см, рис. 191.)
Примерами других соединений, в которых имеет место 






Такую валентность углерод имеет в возбужденном состоянии:

Каждый атом водорода имеет по одному валентному s -электрону, орбигтали которого имеют сферическую форму. При перекрывании четырех гибридных орбиталей атома углерода и s-орбнтале четырех атомов водорода возникают четыре
Примеры соединений и частиц, для которых характерна










Под гибридизацией понимают процесс выравнивания электронных орбиталей по форме и энергии. Существуют следующие основные типы гибридизации: 

Соединения, в которых имеет место 

Электроотрицательность и полярность связи
Все известные химические элементы можно разделить на металлы и неметаллы .
Металлы — элементы, атомы которых способны отозвать электроны .
Неметаллы — элементы, отамы которых могут принимать электроны .
При взаимодействии металла с неметаллом атом первого теряет электроны, а атом второго их присоединяет.
А что происходит, если взаимодействуют атомы двух неметаллов?
Сравним атомы серы и кислорода:
Чем слабее связаны валентные электроны с ядром, тем больше радиус атома серы. При образовании связи произойдет сдвиг электронов от серы к кислороду.
Значит, атомы разных неметаллов притягивают к себе электроны неодинаково.
Способность атомов элементов оттягивать к себе общие электронные пары в химических соединениях называется мекшроотр1щательио-апью (ЭО).
Общие электронные пары образуются валентными электронами, поэтому можно сказать, что электроотрицательность — это способность атома притягивать к себе валентные электроны других атомов электроотрицательность (X) — фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары, электроотрицательность — химическое свойство атома, количественная характеристика способности атома в молекуле притягивать к себе злектроны атомов других элементов „
Относительная электроотрицательность
Первой и наиболее известной шкалой относительной электроотрицательное является шкала Л. Полинга, полученная из термохимических данных и предложенная в 1932 г За единицу в ней принята электроотрицательность лития. Наиболее электроотрицательным среди элементов, способных образовывать соединения, является фтор, и его электроотрицательность равна —4.
электроотрицательность остальных элементов изменяется в пределах от 0,7 до 4.
Как правило, неметаллы имеют ЭО больше двух. У металлов значение ЭО меньше двух. Некоторые элементы (В. Si, Ge, As. Те)со значениями электроотрицательное™. близкими к двум, способны проявлять промежуточные свойства. Элементы VTO группы периодической системы (благородные газы) имеют нулевую электроотрицательность (табл. 9).
Электроотрицательность элементов периодической системы, как правило, последовательно возрастает слева направо в каждом периоде н наибольшее значение — у галогенов. Чем выше электроотрицательность , тем сильнее у элементов выражены неметаллические свойства. В пределах каждой группы, за несколькими исключениями, электро-отрицательность последовательно убывает сверху вниз, следовательно, металлические свойства элементов возрастают. Наименьшее значение наблюдается у щелочных металлов.
Элементы с высокой и низкой электроотрицательностью являются активными.
Пользуясь понятием электроотрицательность элементов, .можно предсказать вид химической связи. Как вы знаете, химическая связь возникает за счет перераспределения электронов валентных орбиталей, в результате чего возникает устойчивая электронная конфигурация благородного газа за счет образования ионов или образования общих электронных пар. При взаимодействии атомов с одинаковой электро-отрицательностью образуется неполярная ковалентная связь. В этом случае связывающие электронные пары располагаются симметрично между ядрами связывающихся атомов. В результате образуются нело лярные молекулы, в которых электроны расположены симметрично относительно ядер.
Чаще всего встречается полярная ковалентная связь — она образуется между любыми атомами, электроотрцательности которых отличаются, но незначительно. Следовательно, в результате смещения обшей электронной пары к одному из атомов проявляется полярность связи. Полярность химической связи иногда указывают символами зарядов у атомов (например. 
Чем выше значение электроотрицательного двух атомов, тем более полярной является химическая связь между ними. Предельный случай поляризации химической связи — полный переход электронов от одного атома к другому» при этом образуются два иона, между которыми возникает ионная связь. ‘Этот вид связи происходит между атомами элементов, Электроотрицательность которых резко отличаются (между атомами металлов и неметаллов).
Давайте установим, как происходи сдвиг электронов при взаимодействии атомов хлора и серы, серы и кислорода и какая связь будет более полярна.
.Хлор и сера расположены в третьем периоде. Электроотрицательность по периоду возрастает слева направо. ЭО хлора больше ЭО серы.
значит, электроны будут сдвинуты от серы к хлору. Заряд атома серы будет положительным, а хлора — отрицательным:
Проверим вывод по шкале Полинга. Электроотрицательность хлора равна 3. а электроотрицательность серы — 2,5. Хлор более электроотрицательный. Разница между электроотрицательность элементов составляет 0,5.
Кислород н сера расположены в шестой А группе. электроотрицательность по группе сверху’ вниз уменьшается. ЭО кислорода больше ЭО серы, значит электроны будут сдвинуты от серы к кислороду. Атом серы имеет положительный заряд, а кислорода — отрицательный:
Разница между электроотрицательностями элементов составляет 0,5. Следовательно, связь между серой и кислородом будет более полярна. чем связь между серой и хлором.
Полярность молекул в значительной мере определяет свойства веществ. Полярные молекулы поворачиваются друг к другу разноимённо заряженными полюсами, и между ними возникает взаимное притяжение. поэтому вещества, образованные полярными молекулами, имеют более высокие температуры плавлення и кипения, чем вещества, молекулы которых неполярны.
Жидкости, молекулы которых полярны, имеют более высокую растворимость. При этом чем больше полярность молекул растворителя, тем выше растворимость в ней полярных или ионных соединении. Например, раствор хлороводорода в воде, молекулы которой полярны, хорошо проводит электрический ток. Раствор хлороводорода в бензоле не обладает заметной электропроводностью. Это указывает на отсутствие ионизации хлороводорода в бензольном растворе, так как молекулы бензола неполярны.
электроотрицательность — химическое свойство атома, количественная характеристика способности атома в молекуле притяпшать к себе электроны атомов других элементов. Электроотрицательность элементов периодической системы, как правило, последовательно возрастает слева направо в каждом периоде, и наибольшее значение — у галогенов, а наименьшее — у щелочных металлов. В пределах каждой группы, за несколькими исключениями, электроотрицательность последовательно убывает сверху вниз, следовательно. металлические свойства элементов возрастают. Чем выше значение электроотрицательности двух атомов, тем более полярной является химическая связь между ними. Предельный случаи поляризации химической связи — полный переход электронов от одного атома к другому между которыми возникает ионная связь.
Ионная связь
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей 

Ионную связь можно рассматривать как крайний случаи ковалентной полярной связи. В ее основе лежит электростатическое взаимодействие ионов, согласно которому атомы элементов с числом электронов в наружном слое меньше восьми присоединяют или теряют такое число электронов, которое делает наружный электронный слои таким, как у атома ближайшего инертного газа. Например, рассмотрим схему образования ионной связи во фториде натрия (рис, 22):
Электрон переходит от атома натрия к атому фтора. Оба нона — натрия и фтора — имеют устойчивые электронные конфигурации. По своим свойствам ионная связь отличается от ковалентной связи. Силы электростатического взаимодействия направлены от данного иона во все стороны, поэтому данный ион может притягивать ионы противоположного знака в любом направлении. Этим обусловлены не-
направленность и ненасыщаемость ионной связи. Б кристаллической решетке ионных соединении вокруг каждого иона располагается определенное число ионов с противоположным зарядом. Например. в кристаллической решетке фторида натрия NaF каждый ион натрия 

Таким образом, весь кристалл фторида натрия представляет собой как бы одну гигантскую молекулу, состоящую из огромного числа ионов 





Нонная связь образуется между атомами, которые имеют очень большую разность электроотрицательностей. В ее основе лежит электростатическое взаимодействие ионов. По своим свойствам лонная связь отличается от ковалентной связи. Силы электростатического взаимодействия направлены от данного иона во все стороны, вследствие чего данный нон может притягивать ионы противоположного знака в любом направлении. Этим обусловлены не-направленность п ненасыщаемость ионной связи. В кристаллической решетке ионных соединении вокруг каждого иона располагается определенное число ионов с противоположным зарядом. По прочности ионные кристаллические решетки уступают атомным, но превосходят молекулярные Им свойственны сравнительно высокие температуры плавления, малая летучесть, большая твердость, проводят электрический ток в растворах и расплавах.
Металлическая связь
Металлическая связь имеет место в металлах и сплавах. Металлы и их сплавы были известны человечеству с давних пор. Большинство химических элементов (более 90) относятся к металлам.
Металлам называют вещества, обладающие высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеснам .
В периодической системе химических элементов металлы расположены левее и ниже условной разделительной линии, поправленной от бора к астату, или достаточно вспомнить, как в ней расположены неметаллы.
У атомов металлов на внешнем энергетическом уровне обычно находится от одного до трех электронов. Например, один у натрия, два у магния и три у алюминия.
У некоторых металлов на внешнем энергетическом уровне атома располагаются четыре или пять электронов. Например
Вступая в химические реакции, атомы металлов отдают свои валентные электроны. Легкость отдачи электронов возрастает с уменьшением числа электронов на внешнем энергетическом уровне и с удалением внешнего энергетического уровня от атомного ядра.
Следовательно, с ростом порядкового номера элемента способность отдавать электроны и металличность в периодах уменьшается, а в подгруппах увелчивается.
Наиболее типичные металлы расположены в начале периодов (элементы IA. ИА групп),
В химических соединениях металлы проявляют только положительные степени окисления и обладают восстановительными свойствами.
В отличие от атомов неметаллов атомы металлов обладают большим радиусом и легко отдают валентные электроны. При этом атомы металлов превращаются в положительно заряженные ноны. Оторвавшиеся от атомов электроны относительно свободно перемещаются между положительно заряженными нонами металлов. Между этими заряженным! частицами образуется особый тип химической связи — металлическая — Эта связь обусловливает образование металлической кристаллической решетки простых веществ металлов. В узлах этих кристалл!песKiк решеток находятся положительно заряженные
ионы металлов, а между ними передвигаются свободные электроны. Поскольку электроны находятся в непрерывном движении, то при их столкновении с нонами металлов последние превращаются в нейтральные атомы, а затем вновь в ноны. Вследствие этого ионы металлов в кристалитической решетке, окруженные подвижными электронами, получили название ион-атамов в отличие от обычных ионов.
Кристаллические решетки, в узлах которых находятся положительно заряженные ноны и некоторое число нейтральных атомов, между которыми передвигаются относительно свободные электроны, называют металлическими
Знаешь ли ты?
В организме ионы металлов в виде соединений с белками переносятся кровью в определенные органы. Интересно, что каждый металл имеет ‘ любимые» органы. Так. в костной ткани накааливаются свинец, бериллий, барий. Ртуть собирается в почках, мышьяк оседает в пи повидло ft железе, хром содержится в поджелудочной железе.
Связь, которую осуществляют эти относительно свободные электроны между нонами п а томами металлов, образующих кристаллическую решетку, называют металлической связью (рис. 24).
Особое строение кристаллических решеток металлов обусловливает их общие физические свойства. Металлы являются хорошими проводниками электричества и теплоты. Это обусловлено наличием электро-
нов. свободно перемещающихся по всему объему кристаллической решетки металла. Помимо того что электроны могут быть участниками направленного движения (электрического тока), они также могут переносить и тепловую энергию. Благодаря особенности металлической связи многие металлы пластичны, обладают хорошей ковкостью. При механическом воздействии на металл происходит смешение слоев атомов, однако благодаря перемещению электронов по всему кристаллу связь не разрывается. Прекрасный пример пластических свойств металлов демонстрирует золото: из 1 грамма этого металла можно получить проволоку длиной три километра! А из железа можно прокатать пластинку настолько тонкую, что через нее можно читать текст учебника. Металлическая связь — это особый вид химической связи, но наряду с отличиями она имеет и сходство с ковалентным и ионным типами связи.
Кристаллические решетка в узлах которых находятся положительно заряженные ионы и некоторое число нейтральных атомов, между которыми передвигаются относительно свободные электроны, называют металлическими С вязь, которую осуществляют эти относительно свободные электроны между ионами металлов, образующих кристаллическую решетку, называют металлическом связью . Особое строение кристаллических решеток металлов обусловливает их общие физические свойства. Металлическая связь — это особый вид химической связи, но наряду с отличиями. она имеет и сходство с ковалентным и ионным типами связи.
Водородная связь
Химические связи образуются не только между атомами но и между молекулами. Одним из таких видов является водородная связь, возникающая между молекулами* в состав которых входит водород и элемент с высокой отрицательностью (F, О, N), связанный с атомом водорода ковалентной полярной связью. Водородные связи характерны для таких веществ* как вода аммиак фтороаодороа спирты, уксусная кислота. Водородные связи широко распространены в природе, например в белках, нуклеиновых кислотах.
Водородная связь — это связь между положительно заряженным атомом водорода одной молекулы {части молекулы) и отрицательно заряженным атомом другой молекулы {другой части молекулы ). Водородная связь имеет частично электростатический, частично донорно-акцепторный механизм.
Например, в молекуле фтороводорода HF атом с большой электро-отрицательностью — фтор — смешает на себя электронное облако, приобретая знач1ггелънын эффективный отрицательный заряд, а ядро атома водорода <протон) практически лишается электронного облака и приобретает эффективный положительный заряд. Между протоном атома водорода и отрицательно заряженным атомом фтора соседней молекулы возникает электростатическое притяжение, что и приводит к образованию водородной связи (рис. 25).
Водородная связь проявляется тем сильнее, чем больше электроотрицательность атома-партнера и чем меньше его размеры. Энергия водородной связи невелика (10—40 кДж моль, что в 10 раз меньше ковалентной связи). Однако она влияет на физические и химические свойства веществ. Вещества, способные образовывать водородные свя-
зн с молекулами растворителя, обладают хорошей растворимостью. В водных растворах молекулы 
Водородная связь, возникшая между молекулами, называется .«вясмо-лекуляриой (рис. 26). Соединения с межмолекулярнымн водородными связями имеют значительно более высокие температуры кипения, чем соединения с тон же молекулярной массой, но не ассоциированные за счет водородных связей. Например, температура кипения этанола (78,3°С) значительно выше, чем температура кипения ли метилового эфира (24°С), Образованием водородных связен объясняется растворимость многих органических соединений Например, в водном растворе происходит гидратация низших спиртов .
Водородная связь может возникать внутри молекулы. Внутримолекулярные связи встречаются в органических веществах. Такая связь называется внутримолекулярной еооорсдиои связью . Например, внутримолекулярная водородная связь в молекуле салициловой кислоты возникла за счет натичия в гидроксильной группе -ОН с частично положительным зарядом водорода 
внутримолекулярными водородными связями не могут вступать в межмолекулярные водородные связи, поэтому вещества с такими связями не образуют ассоциатов. более летучи, имеют более низкие вязкости температуры кипения и плавления, чем их изомеры, способные образовать межмолекулярную связь. Водородные связи играют огромную роль в формировании пространственной структуры белков, углеводов, нуклеиновых кислот. Вещества с водородной связью имеют молекулярные кристаллические решетки, например вода (рис. 27).
Единая природа химической связи. Деление химических связен на типы носит условный характер, так как все они характеризуются определенным единством. Ионную связь, как мы уже говорили, можно рассматривать как предельный случай ковалентной полярной связи. В веществах часто отсутствуют предельные случаи химической связи (или ”чистые” химические связи). Например, фторид лития LiF относят к конным соединениям. Фактически же в нем связь на 80% ионная и на 20% о ковалентная. Различные типы связей могут переходить одна в другую, например, при электролитической диссоциации в воде ковалентных соединений ковалентная полярная связь переходит в ионную: при испарении металлов металлическая связь превращается в ковалентную неполярную и т. д.
Знаешь ли ты?
В отсутствие водородных связей воза кипела бы при -80°С в. разумеется, наша форма жизни была бы невозможна.
Водородная связь — это связь между положительно заряженным атомом водорода одной молекулы (части молекулы) и отрицательно заряженным атомом другой молекулы (другой части молекулы). Водородная связь имеет частично электростатический, частично донорно-акиепторный механизм. Водородная связь может возникать не только между разными молекуламиI. но и внутри самой молекулы. Молекулы с внутримолекулярными водородными связями не могут вступать в межмолекулярные водородные связи. Вещества с водородной связью имеют молекулярные кристаллические решетки. Деление химических связен на типы носит условный характер, так как все они характеризуются определенным единством. Различные типы связей могут переходить одна в другую.
Химическая связь и строение молекул
При взаимодействии атомов между ними может возникать химическая связь, приводящая к образованию устойчивой многоатомной системы — молекулы, молекулярного иона, кристалла. Чем прочнее химическая связь, тем больше энергии нужно затратить для ее разрыва; поэтому энергия разрыва связи служит мерой ее прочности. Энергия разрыва связи всегда положительна: в противном случае химическая связь самопроизвольно разрывалась бы с выделением энергии. Из этого следует, что при образовании химической связи энергия всегда выделяется за счет уменьшения потенциальной энергии системы взаимодействующих электронов и ядер *. Поэтому потенциальная энергия образующейся частицы (молекулы, кристалла) всегда меньше, чем суммарная потенциальная энергия исходных свободных атомов. Таким образом, условием образования химической связи является уменьшение потенциальной энергии системы взаимодействующих атомов.
* Здесь и ниже системой будем называть совокупность взаимодействующих частиц (атомов, атомных ядер, электронов).
Химическая связь возникает благодаря взаимодействию электрических полей, создаваемых электронами и ядрами атомов, участвующих в образовании молекулы или кристалла. Познание характера этого взаимодействия оказалось возможным на основе представлений о строении атома и о корпускулярно-волновых свойствах электрона.
Идея об электрической природе химической связи была высказана в 1807 г, выдающимся английским физиком Г. Дэви, который предположил, что молекулы образуются благодаря электростатическому притяжению разноименно заряженных атомов. Эта идея была развита известным шведским химиком И. Я. Берцелиусом, разработавшим в 1812—1818 гг. электрохимическую теорию химической связи. Согласно этой теории, все атомы обладают положительным и отрицательным полюсами, причем у одних атомов преобладает положительный полюс («электроположительные» атомы), а у других — отрицательный («электроотрицательные» атомы). Атомы, у которых преобладают противоположные полюса, притягиваются друг к другу: например, электроположительные атомы кальция притягиваются к электроотрицательным атомам кислорода, образуя молекулу оксида кальция СаО. В молекуле СаО электрические заряды атомов скомпенсированы неполностью; молекула обладает избыточным положительным зарядом и при взаимодействии с другой молекулой, имеющей нескомпенсированный отрицательный заряд (например, с молекулой СО2), будет притягиваться к ней. В результате образуется более сложная молекула СаО*СО2 (т. е. СаСОз).
Удачно объясняя некоторые химические явления, электрохимическая теория противоречила, однако, ряду фактов. Так, с точки зрения этой теория было необъяснимым существование молекул, образованных одинаковыми атомами (Н2, О2, С12 и т. п.), обладающими, согласно Берцелиусу, одноименными зарядами. С развитием химии обнаруживалось все большее число подобных противоречий; поэтому теория Берцелиуса вскоре перестала пользоваться признанием.
При всей своей незрелости теория Дэви — Берцелиуса содержала рациональную мысль об электрическом происхождении сил, обусловливающих образование химической связи.
Крупным шагом в развитии представлений о строении молекул явилась теория химического строения, выдвинутая в 1861 г. выдающимся русским химиком А. М. Бутлеровым.
Теория химического строения
Основу теории, разработанной А. М. Бутлеровым, составляют следующие положения:
1. Атомы в молекулах соединены друг с другом в определенной последовательности. Изменение этой последовательности приводят к образованию нового вещества с новыми свойствами.
2. Соединение атомов происходит в соответствии с их валентностью.
3. Свойства веществ зависят не только от их состава, но и от их «химического строения», т. е. от порядка соединения атомов в молекулах и характера их взаимного влияния. Наиболее сильно влияют друг на друга атомы, непосредственно связанные между собой.
Александр Михайлович Бутлеров родился 25 августа 1828 г. в г. Чистополе Казанской губернии. В 1849 г. он окончил Казанский университет, где его учителями были выдающиеся русские химики К. К. Клаус и Н. Н. Зинин.
После окончания университета Бутлеров был оставлен при нем для подготовки к профессорскому званию. В 1851 г. Бутлеров защитил диссертацию на тему «Об окисления
органических соединений» и получил степень магистра, а в 1854 г., после защиты диссертации «Об эфирных маслах», он был утвержден в степени доктора и избран профессором Казанского университета.
В 1868 г. совет Петербургского университета ио предложению Менделеева избрал Бутлерова ординарным профессором по кафедре органической химии, после чего вся его научная и педагогическая деятельность протекала в Петербурге.
С первых же шагов своей научной деятельности Бутлеров проявил себя блестящим
экспериментатором и осуществил ряд замечательных синтезов. Экспериментаторский талант Бутлерова сочетается с широкими теоретическими обобщениями и научным предвидением. Бутлеров был убежден в возможности выразить формулами строение молекул химических соединений и притом сделать это путем изучения их химических превращений.
В 1861 г. Бутлеров выступает на съезде немецких естествоиспытателей и врачей с докладом «О химическом строении веществ». Этот доклад открыл целую эпоху в химии. Вернувшись в Казань, Бутлеров детально развивает новое учение.
В 1862—1863 гг. Бутлеров пишет «Введение к полному изучению органической химии», в котором располагает весь фактический материал органической химии па основе строго научной классификации, вытекающей из теории химического строения. Принятая в этой книге классификация органических соединений сохранилась в своих главных чертах до наших дней.
Бутлеров воспитал блестящую плеяду учеников, продолжавших развивать его идеи. Из его школы вышли такие выдающиеся ученые, как В. В. Марковннков, А. Е. Фаворский и многие другие.
Таким образом, согласно теории Бутлерова свойства веществ определяются не только их качественным и количественным составом, как считали раньше, но и внутренней структурой молекул, определенным порядком соединения между собой атомов, образующих молекулу. Эту внутреннюю структуру Бутлеров называл «химическим строением».
Особенно важной была идея Бутлерова о том, что атомы, соединяясь в определенной последовательности в соответствии с их валентностью, взаимно влияют друг на друга таким образом, что частично изменяется их собственная природа, их «химическое содержание». Так, свойства атома водорода существенно меняются в зависимости от того, соединен ли он с атомом хлора (в молекуле HCl), кислорода (в молекуле Н2О) или азота (в молекуле NH3). В первом случае в водных растворах атом водорода сравнительно легко отщепляется от молекулы НСl в виде иона Н+, что и обусловливает кислотные свойства хлороводорода; от молекулы воды ион водорода отщепляется с гораздо большим трудом, так что кислотные свойства выражены у воды весьма слабо; наконец, для молекулы аммиака отщепление иона водорода еще менее характерно— аммиак ведет себя как основание. Особенно многообразно проявляется взаимное влияние атомов в молекулах органических соединений (стр. 448, 449).
Учение Бутлерова позволило ориентироваться в огромном разнообразии веществ, дало возможность определять строение молекул на основании изучения их химических свойств, предугадывать свойства веществ по строению их молекул, намечать пути синтеза различных соединений.
Из теории Бутлерова вытекает возможность изображать строение молекул в виде структурных формул, в которых указана последовательность соединения атомов друг с другом, а каждая черточка, соединяющая атомы, обозначает единицу валентности. Так, строение молекул хлороводорода (НCl), хлорноватистой ((НСlО) и хлорноватой (НСO3) кислот выражается следующими структурными формулами:
Эти формулы прежде всего показывают, что только в молекуле НСl атом водорода непосредственно связан с атомом хлора, тогда как в молекулах НСlО и НСlОз он соединен не с хлором, а с атомом кислорода. Кроме того, структурная формула хлорноватой кислоты указывает на неравноценность атомов кислорода; в ее молекуле каждый из двух атомов кислорода соединен с атомом хлора двумя валентными связями, а третий связан одновременно с атомами хлора и водорода.
Структурные формулы позволяют, например, понять причину различий в некоторых свойствах ортофосфориой (Н3РО4), фосфористой (Н3РО3) и фосфорноватистой (Н3РО2) кислот. Молекулы каждой из этих кислот содержат по три атома водорода. Приведем их структурные формулы:
Как видно, в молекуле ортофосфорной кислоты каждый атом водорода соединен с атомом кислорода. Все эти атомы водорода способны замещаться атомами металлов: поэтому Н3РО4 трехосновна. В молекуле фосфористой кислоты только два атома водорода непосредственно связаны с атомами кислорода и способны замещаться атомами металлов: эта кислота двухосновна. В молекуле же фосфорноватистой кислоты с атомом кислорода связан лишь один атом водорода, что и обусловливает ее одноосновность.
Изображение химического строения молекул с помощью структурных формул особенно важно при изучении органических веществ (см. § І63).
Структурные формулы отражают лишь последовательность соединения атомов друг с другом, а не взаимное расположение атомов в пространстве. Изображение химического строения с помощью структурных формул допустимо только для веществ, состоящих из молекул. Между тем многие вещества состоят не из молекул, а из атомов (например, карбид кремния SiC) или имеют ионное строение (например, хлорид натрия NaCl). Структура подобных веществ определяется типом их кристаллической решетки и будет подробнее рассмотрена в гл. V.
Теория химического строения объяснила явление изомерии, которое заключается в существовании соединений, обладающих одним и тем же качественным и количественным составом, но разными свойствами. Такие соединения были названы изомерами.
Явление изомерии будет подробно рассмотрено при изучении органических соединений (см. § 162), среди которых оно очень распространено. Следует, однако, иметь в виду, что изомерия присуща и неорганическим веществам. Так, еще в 1824 г. Либих установил, что серебряные соли гремучей кислоты AgONC и циановой кислоты AgNCO имеют одинаковый состав, тогда как свойства этих веществ сильно различаются. С примерами изомерии мы встретимся и при изучении комплексных соединений (см. § 205).
Разрабатывая теорию химического строения, Бутлеров не ставил перед собой задачу выяснения природы химической связи, справедливо считая, что химия в то время еще не была готова к решению этой задачи. Действительно, необходимой предпосылкой создания теории химической связи было выяснение строения атома. Лишь после того, как стали известны основные черты электронной структуры атомов, появилась возможность для разработки такой теории. В 1916 г. американский физико-химик Дж. Льюис высказал предположение, что химическая связь возникает путем образования электронной пары, одновременно принадлежащей двум атомам; эта идея послужила исходным пунктом для разработки современной теории ковалентной связи. В том же 1916 г. немецкий ученый В. Коссель предположил, что при взаимодействии двух атомов один из них отдает, а другой принимает электроны; при этом первый атом превращается в положительно заряженный, а второй — в отрицательно заряженный ион; взаимное электростатическое притяжение образовавшихся ионов и приводит к образованию устойчивого соединения. Дальнейшее развитие идей Косселя привело к созданию современных представлений о ионной связи.
Ковалентная связь. Метод валентных связей
Мы уже знаем, что устойчивая молекула может образоваться только при условии уменьшения потенциальной энергии системы взаимодействующих атомов. Для описания состояния электронов в молекуле следовало бы составить уравнение Шредингера для соответствующей системы электронов и атомных ядер и найти его решение, отвечающее минимальной энергии системы. Но, как указывалось в § 31, для многоэлектронных систем точное решение уравнения Шредингера получить не удалось. Поэтому квантово-механическое описание строения молекул получают, как и в случае многоэлектронных атомов, — лишь на основе приближенных решений уравнения Шредингера.
Впервые подобный приближенный расчет был произведен в 1927 г. В. Гейтлером и Ф. Лондоном для молекулы водорода. Эти авторы сначала рассмотрели систему из двух атомов водорода, находящихся на большом расстоянии друг от друга. При этом условии можно учитывать только взаимодействие каждого электрона со «своим» ядром, а всеми остальными взаимодействиями (взаимное отталкивание ядер, притяжение каждого электрона к «чужому» ядру, взаимодействие между электронами) можно пренебречь. Тогда оказывается возможным выразить зависимость волновой функции рассматриваемой системы от координат и тем самым определить плотность общего электронного облака в любой точке пространства. (Напомним, что плотность электронного облака пропорциональна квадрату волновой функции — см. § 26).
Далее Гейтлер и Лондон предположили, что найденная ими зависимость волновой функции от координат сохраняется и при сближении атомов водорода. При этом, однако, необходимо уже учитывать и те взаимодействия (между ядрами, между электронами и т. д.), которыми при значительном удалении атомов друг от друга можно было пренебрегать. Эти дополнительные взаимодействия рассматриваются как некоторые поправки («возмущения») к исходному состоянию электронов в свободных атомах водорода.
В результате Гейтлер и Лондон получили уравнения, позволяющие найти зависимость потенциальной энергии Е системы, состоящей из двух атомов водорода, от расстояния r между ядрами этих атомов. При этом оказалось, что результаты расчета зависят от того, одинаковы или противоположны по знаку спины взаимодействующих электронов. При совпадающем направлении спинов (рис. 26, кривая а) сближение атомов приводит к непрерывному возрастанию энергии системы. В этом случае для сближения атомов требуется затрата энергии, так что такой процесс оказывается энергетически невыгодным и химическая связь между атомами не возникает. При противоположно направленных спинах (рис. 26, кривая б) сближение атомов до некоторого расстояния r0 сопровождается уменьшением энергии системы. При r = r0 система обладает наименьшей потенциальной энергией, т. е. находится в наиболее устойчивом состоянии; дальнейшее сближение атомов вновь приводит к возрастанию энергии. Но это и означает, что в случае противоположно направленных спинов атомных электронов образуется молекула Н2 — устойчивая система из двух атомов водорода, находящихся на определенном расстоянии друг от друга.
Рис. 26. Энергия системы, состоящей из двух атомов водорода:
а — при одинаково направленных спинах электронов; б — при противоположно направленных спинах; Ео — энергия системы из двух невзаимодействующих атомов водорода; r0 — межъядерное расстояние в молекуле водорода.
Образование химической связи между атомами водорода является результатом взаимопроникновения («перекрывания») электронных облаков, происходящего при сближении взаимодействующих атомов (рис. 27). Вследствие такого взаимопроникновения плотность отрицательного электрического заряда в межъядерном пространстве возрастает. Положительно заряженные ядра атомов притягиваются к области перекрывания электронных облаков. Это притяжение преобладает над взаимным отталкиванием одноименно заряженных электронов, так что в результате образуется устойчивая молекула.
Рис. 27. Схема перекрывания атомных электронных облаков в молекуле водорода.
Полученные Гейтлером и Лондоном (и впоследствии уточненные другими исследователями) расчетные значения межъядерного расстояния и энергии связи в молекуле водорода оказались близки к экспериментально найденным значениям. Это означало, что приближения, использованные Гейтлером и Лондоном при решении уравнения Шредингера, не вносят существенных ошибок и могут считаться оправданными. Таким образом, исследование Гейтлера и Лондона позволяло сделать вывод, что химическая связь в молекуле водорода осуществляется путем образования пары электронов с противоположно направленными спинами, принадлежащей обоим атомам. Процесс «спаривания» электронов при образовании молекулы водорода может быть изображен следующей схемой:
Волнистые линии на схеме показывают, что в молекуле водорода каждый электрон занимает место в квантовых ячейках обоих атомов, т. е. движется в силовом поле, образованном двумя силовыми центрами — ядрами атомов водорода.
Такая двухэлектронная двухцентровая связь называется ковалентной связью.
Представления о механизме образования химической связи, развитые Гейтлером и Лондоном на примере молекулы водорода, были распространены и на более сложные молекулы. Разработанная на этой основе теория химической связи получила название метода валентных связей (метод ВС). Метод ВС дал теоретическое объяснение важнейших свойств ковалентной связи, позволил понять строение большого числа молекул. Хотя, как мы увидим ниже, этот метод не оказался универсальным и в ряде случаев не в состоянии правильно описать структуру и свойства молекул (см. § 45), все же он сыграл большую роль в разработке квантово-механической теории химической связи и не потерял своего значения до настоящего времени.
В основе метода ВС лежат следующие положения:
1. Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
Комбинации таких двухэлектронных двухцентровых связей, отражающие электронную структуру молекулы, получили название валентных схем.
2. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
При оценке степени перекрывания электронных облаков следует учитывать знаки волновых функций электронов. Поскольку электронам присущи волновые свойства, то прп взаимодействии двух электронов образуется общая «электронная волна». Там, где амплитуды исходных волн имеют одинаковые знаки, при их сложении возникает суммарная волна с амплитудой, имеющей большее абсолютное значение, чем исходные амплитуды. Напротив, там, где амплитуды исходных волн имеют различные знаки, при их сложении возникает суммарная волна с амплитудой имеющей меньшее абсолютное значение,— волны будут «гасить» друг друга. Но, как уже указывалось, роль амплитуды электронной волны играет волновая функция j (см. § 26). Поэтому в тех областях пространства, где волновые функции взаимодействующих электронов имеют одинаковые знаки, абсолютное значение волновой функции образующегося общего электронного облака будет больше, чем значения функции ф у изолированных атомов. При этом будет возрастать и величина j2, т. е. плотность электронного облака. Здесь происходит положительное перекрывание электронных облаков, которое приводит к взаимному притяжению ядер. В тех же областях пространства, где знаки волновых функций взаимодействующих электронов противоположны, абсолютное значение суммарной волновой функции будет меньше, чем у изолированных атомов. Здесь величина j2, а значит и плотность электронного облака, будет уменьшаться. В этом случае имеет место отрицательное перекрывание, приводящее к взаимному отталкиванию ядер.
Некоторые возможные варианты перекрывания электронных облаков с указанием знаков соответствующих волновых функций изображены на рис. 28.
Рис. 28. Схема различных случаев перекрывания электронных облаков:
а и б — положительное перекрывание; в — отрицательное перекрывание; г — суммарное перекрывание, равное нулю.
Для наглядного изображения валентных схем обычно пользуются следующим способом. Электроны, находящиеся во внешнем электронном слое, обозначают точками, располагаемыми вокруг химического символа атома. Общие для двух атомов электроны показывают точками, помещаемыми между их химическими символами; двойная или тройная связь обозначается соответственно двумя или тремя парами общих точек. Применяя эти обозначения, образование молекулы водорода можно представить следующим образом:
Эта схема показывает, что при соединении двух атомов водорода в молекулу каждый из атомов приобретает устойчивую двухэлектронную оболочку, подобную электронной оболочке атома гелия.
Аналогичными схемами можно представить образование молекулы азота:
При соединении двух атомов азота в молекулу общими становятся три пары электронов (тройная связь); благодаря этому наружная оболочка каждого атома дополняется до устойчивой восьмиэлектронной конфигурации атома неона.
Строение молекул некоторых сложных веществ — аммиака, воды, диоксида углерода и метана — можно изобразить схемами:
В молекуле аммиака каждый из трех атомов водорода связан с атомом азота парой общих электронов (один электрон от атома водорода, другой — от атома азота). Таким образом, азот имеет восьмиэлектронную внешнюю оболочку, а ядро каждого атома водорода окружено двумя электронами, образующими устойчивую «гелиевую» оболочку. Такие же оболочки имеют атомы водорода в молекулах воды и метана. В молекуле диоксида углерода, где атом углерода связан с каждым из атомов кислорода двумя парами электронов (двойная связь), все три атома имеют восьмиэлектронные внешние оболочки.
Из приведенных схем видно, что каждая пара электронов, связывающих два атома, соответствует одной черточке, изображающей ковалентную связь в структурных формулах:
Число таких общих электронных пар, связывающих атом данного элемента с другими атомами, или, иначе говоря, число образуемых атомом ковалентных связей, называется ковалентностью элемента в соответствующем соединении. Так, ковалентность азота в молекулах N2 и NH3 равна трем, ковалентность кислорода в молекулах Н2О и СО2— двум, ковалентность углерода в молекулах СН4 и СО2— четырем.
Неполярная и полярная ковалентная связь
Если двухатомная молекула состоит из атомов одного элемента, как, например, молекулы Н2, N2, CI2 и т. п., то каждое электронное облако, образованное общей парой электронов и осуществляющее ковалентную связь, распределяется в пространстве симметрично относительно ядер обоих атомов. В подобном случае ковалентная связь называется неполярной или гомеополярной. Если же двухатомная молекула состоит из атомов различных элементов, то общее электронное облако смещено в сторону одного из атомов, так что возникает асимметрия в распределении заряда. В таких случаях ковалентная связь называется полярной или гетерополярной.
Для оценки способности атома данного элемента оттягивать к себе общую электронную пару пользуются величиной относительной электроотрицательности. Чем больше электроотрицательность атома, тем сильнее притягивает он общую электронную пару. Иначе говоря, при образовании ковалентной связи между двумя атомами разных элементов общее электронное облако смещается к более электроотрицательному атому, и в тем большей степени, чем больше различаются электроотрицательности взаимодействующих атомов. Значения электроотрицательности атомов некоторых элементов по отношению к электроотрицательности фтора, которая принята равной 4, приведены в табл. 6 *.
Таблица 6. Относительная электроотрицательность атомов
* Относительная электроотрицательность атома не является строго постоянной величиной: она зависит как от валентности, проявляемой атомом в соответствующем соединении, так и от того, с атомами каких других элементов соединен данный атом. Поэтому числа, приведенные в табл. 6, могут служить лишь для оценки направления смещения электронов при образовании молекул.
Как показывает табл. 6, электроотрицателыюсть закономерно изменяется в зависимости от положения элемента в пернодической системе. В начале каждого периода находятся элементы с наиболее низкой электроотрицательностью — типичные металлы, в конце периода (перед благородными газами)—элементы с наивысшей электроотрицательностью, т. е. типичные неметаллы. У элементов одной и той же подгруппы электроотрицательность с ростом заряда ядра проявляет тенденцию к уменьшению. Таким образом, чем более типичным металлом является элемент, тем ниже его электроотрицательность; чем более типичным неметаллом является элемент, тем выше его электроотрицательность.
Смещение общего электронного облака при образовании полярной ковалентной связи приводит к тому, что средняя плотность отрицательного электрического заряда оказывается выше вблизи более электроотрицательного атома и ниже — вблизи менее электроотрицательного. В результате первый атом приобретает избыточный отрицательный, а второй — избыточный положительный заряд; эти заряды принято называть эффективными зарядами атомов в молекуле.
Так, в молекуле хлороводорода общая электронная пара смещена в сторону более электроотрицательного атома хлора, что приводит к появлению у атома хлора эффективного отрицательного заряда, равного 0,17 заряда электрона, а у атома водорода такого же по абсолютной величине эффективного положительного заряда. Следовательно, молекула НСl является полярной молекулой. Ее можно рассматривать как систему из двух равных по абсолютной величине, но противоположных по знаку зарядов, расположенных на определенном расстоянии друг от друга. Такие системы называются электрическими диполями. Хотя суммарный заряд диполя равен пулю, в окружающем его пространстве образуется электрическое поле, изображенное на рис. 29. Напряженность этого поля пропорциональна дипольному моменту молекулы m, представляющему собой произведение абсолютного значения заряда электрона q на расстояние l между центрами положительного и отрицательного зарядов в молекуле:
Дипольный момент молекулы служит количественной мерой ее полярности. Дипольные моменты молекул обычно измеряют в дебаях (D) *: 1D = 3,33*10-80 Кл*м.
* Эта единица названа в честь голландского физика П. Дебая, известного своими работами в области физики твердого тела, рентгеноструктурного анализа и теории полярных жидкостей.
Рис. 29. Электрическое поле диполя.
Стрелками показаны направления силовых линий.
Молекула тем более полярна, чем больше смещена общая электронная пара к одному из атомов, т. е. чем выше эффективные заряды атомов и чем больше длина диполя l. Поэтому в ряду сходно построенных молекул дипольный момент возрастает по мере увеличения разности электроотрицательностей атомов, образующих молекулу. Например, дипольные моменты НСl, НВr и HI равны соответственно 1,04; 0,79 и 0,38 D, что связано с уменьшением разности электроотрицательностей атомов при переходе от НСl к НВг и HI (см. табл. 6).
Многоатомные молекулы также могут быть неполярными— при симметричном распределении зарядов или полярными — при ассиметричном распределении зарядов. В последнем случае дипольный момент молекулы будет отличаться от нуля. Каждой связи в многоатомной молекуле можно приписать определенный дипольный момент, характеризующий ее полярность; при этом следует принимать во внимание не только величину дипольного момента, но и его направление, т. е. рассматривать дипольный момент каждой связи как вектор. Тогда суммарный дипольный момент молекулы в целом можно считать равным векторной сумме дипольных моментов отдельных связей. Дипольный момент обычно принято считать направленным от положительного конца диполя к отрицательному.
Дипольные моменты молекул можно экспериментально определять путем измерения некоторых макроскопических свойств соответствующего вещества, например, его диэлектрической проницаемости *. Найденные таким образом значения дипольных моментов содержат важную информацию о геометрической структуре молекул.
*Диэлектрической проницаемостью (или диэлектрической постоянной) вещества называется число, показывающее, во сколько раз взаимодействие между зарядами в среде данного вещества слабее, чем в вакууме.
Так, на рис. 30 изображены схемы возможного строения молекулы типа АВ2; векторы дипольных моментов отдельных связей Л—В показаны стрелками, направленными от А к В. При линейном строении (рис. 30, а) равные по величине дипольные моменты двух связей А—В противоположны по направлению. Следовательно, дипольный момент такой молекулы будет равен нулю. В случае углового строения (рис. 30, б) векторная сумма дипольных моментов двух связей А—В отличается от нуля; такая молекула обладает дипольным моментом и является полярной. Поэтому наличие или отсутствие дипольного момента у молекулы типа АВ2 позволяет сделать вывод о ее геометрическом строении. Например, то, что молекула СО2 неполярна, а молекула SO2 обладает дипольным моментом (m=1,61 D), свидетельствует о линейном строении первой молекулы и об угловом строении второй.
Рис. 30. Дипольные моменты отдельных связей в молекулах типа АВ2 различного строения:
а — линейное строение; б — угловое строение; жирной средней стрелкой показан вектор суммарного дипольного момента молекулы.
На рис. 31 изображены схемы возможного строения молекулы типа АВз. Если молекула построена в форме плоского треугольника (рис. 31, а), то векторная сумма дипольных моментов отдельных связен равна нулю — молекула неполярна. Если молекула имеет пирамидальное строение (рис. 31, б), то ее суммарный дипольный момент отличается от нуля — молекула полярна. Таким образом, можно сделать вывод, что молекула ВF3, дипольный момент которой равен нулю, имеет плоское строение, а полярная молекула NH3 (m= 1,46 D) построена в форме пирамиды *.
Рис. 31. Дипольные моменты отдельных связей в молекулах типа АВ3:
а — плоский треугольник; б — пирамида; жирной стрелкой показан вектор суммарного дипольного момента молекулы.
* Следует иметь в виду, что на величину дипольного момента молекулы влияет не только полярность отдельных связей н геометрическая структура молекулы, но и наличие неподеленных электронных пар на гибридных орбиталях.
Полярность молекул оказывает заметное влияние на свойства образуемых ими веществ. Полярные молекулы стремятся ориентироваться по отношению друг к другу разноименно заряженными концами. Следствием такого диполь-дипольного взаимодействия является взаимное притяжение полярных молекул и упрочнение связи между ними. Поэтому вещества, образованные полярными молекулами, обладают, как правило, более высокими температурами плавления и кипения, чем вещества, молекулы которых неполярны.
При растворении вещества, состоящего из полярных молекул или имеющего ионное строение, в жидкости, также составленной из полярных молекул, между молекулярными диполями растворителя и молекулами или кристаллами растворяемого вещества возникают электростатические силы диполь-дипольного или ион-дипольного взаимодействия, способствующие распаду растворяемого вещества на ионы (см. § 83). Поэтому жидкости, состоящие из полярных молекул, проявляют свойства ионизирующих растворителей, т. е. способствуют электролитической диссоциации растворенных в них веществ. Так, хлороводород растворяется и в воде, и в бензоле, но его растворы в воде хорошо проводят электрический ток, что свидетельствует о практически полной диссоциации молекул НСl на ионы, тогда как растворы НСl в бензоле не обладают заметной электрической проводимостью.
Способы образования ковалентной связи
Как уже говорилось, общая электронная пара, осуществляющая ковалентную связь, может образоваться за счет неспаренных электронов, имеющихся в невозбужденных взаимодействующих атомах. Это происходит, например, при образовании таких молекул, как Н2, НСl, Сl2. Здесь каждый из атомов обладает одним неспаренным электроном; при взаимодействии двух таких атомов создается общая электронная пара — возникает ковалентная связь.
В невозбужденном атоме азота имеются три неспаренных электрона:
Следовательно, за счет неспаренных электронов атом азота может участвовать в образовании трех ковалентных связей. Это и происходит, например, в молекулах N2 или NH3, в которых ковалентность азота равна 3.
Однако число ковалентных связей может быть и больше числа имеющихся у невозбужденного атома неспаренных электронов. Так, в нормальном состоянии внешний электронный слой атома углерода имеет структуру, которая изображается схемой:
За счет имеющихся неспаренных электронов атом углерода может образовать две ковалентные связи. Между тем для углерода характерны соединения, в которых каждый его атом связан с соседними атомами четырьмя ковалентными связями (например, СО2, СН4 и т. д.). Это оказывается возможным благодаря тому, что при затрате некоторой энергии можно одни из имеющихся в атоме 2s-электронов перевести на подуровень 2р; в результате атом переходит в возбужденное состояние, а число неспаренных электронов возрастает. Такой процесс возбуждения, сопровождающийся «распариванием» электронов, может быть представлен следующей схемой, в которой возбужденное состояние отмечено звездочкой у символа элемента:
Теперь во внешнем электронном слое атома углерода находятся четыре неспаренных электрона; следовательно, возбужденный атом углерода может участвовать в образовании четырех ковалентных связей. При этом увеличение числа создаваемых ковалентных связей сопровождается выделением большего количества энергии, чем затрачивается на перевод атома в возбужденное состояние.
Если возбуждение атома, приводящее к увеличению числа неспаренных электронов, связано с очень большими затратами энергии, то эти затраты не компенсируются энергией образования новый связей; тогда такой процесс в целом оказывается энергетически невыгодным. Так, атомы кислорода и фтора не имеют свободных орбиталей во внешнем электронном слое:
Здесь возрастание числа неспаренных электронов возможно только путем перевода одного из электронов на следующий энергетический уровень, т. е. в состояние 3s. Однако такой переход сопряжен с очень большой затратой энергии, которая не покрывается энергией, выделяющейся при возникновении новых связей. Поэтому за счет неспаренных электронов атом кислорода может образовать не больше двух ковалентных связей, а атом фтора — только одну. Действительно, для этих элементов характерна постоянная ковалентность, равная двум для кислорода и единице — для фтора.
Атомы элементов третьего и последующих периодов имеют во внешнем электронном слое d-подуровень, на который при возбуждении могут переходить s- и p-электроны внешнего слоя. Поэтому здесь появляются дополнительные возможности увеличения числа неспаренных электронов. Так, атом хлора, обладающий в невозбужденном состоянии одним неспаренным электроном,
может быть переведен, при затрате некоторой энергии, в возбужденные состояния (Сl *), характеризующиеся тремя, пятью или семью неспаренными электронами;
Поэтому, в отличие от атома фтора, атом хлора может участвовать в образовании не только одной, но также трех, пяти пли семи ковалентных связей. Так, в хлористой кислоте HClO2 ковалентность хлора равна трем, в хлорноватой кислоте HClO3 — пяти, а в хлорной кислоте HClO4 — семи. Аналогично атом серы, также обладающий незанятым 3d-подуровнем, может переходить в возбужденные состояния с четырьмя или шестью неспаренными электронами и участвовать, следовательно, в образовании не только двух, как у кислорода, но также четырех или шести ковалентных связей. Этим можно объяснить существование соединений, в которых сера проявляет ковалентность, равную четырем (SO2, SCI4) или шести (SF6).
Во многих случаях ковалентные связи возникают и за счет спаренных электронов, имеющихся во внешнем электронном поле атома. Рассмотрим, например, электронную структуру молекулы аммиака:
Здесь точками обозначены электроны, первоначально принадлежавшие атому азота, а крестиками — принадлежавшие атомам водорода. Из восьми внешних электронов атома азота шесть образуют три ковалентные связи и являются общими для атома азота и атомов водорода. Но два электрона принадлежат только азоту к образуют неподеленную электронную пару. Такая пара электронов тоже может участвовать в образовании ковалентной связи с другим атомом, если во внешнем электронном слое этого атома есть свободная орбиталь. Незаполненная 1s-орбиталь имеется, например, у иона водорода Н+, вообще лишенного электронов:
Поэтому при взаимодействии молекулы NH3 с ионом водорода между ними возникает ковалентная связь; неподеленная пара электронов атома азота становится общей для двух атомов, в результате чего образуется ион аммония NH+4:
Здесь ковалентная связь возникла за счет пары электронов, тронной пары, и свободной орбитали другого атома (акцепт — первоначально принадлежавшей одному атому (донору электора электронной пары). Такой способ образования ковалентной связи называется донорно-акцепторным. В рассмотренном примере донором электронной пары служит атом азота, а акцептором — атом водорода.
Опытом установлено, что четыре связи N—Н в ионе аммония во всех отношениях равноценны. Из этого следует, что связь, образованная донорно-акцепторным способом, не отличается по своим свойствам от ковалентной связи, создаваемой за счет неспаренных электронов взаимодействующих атомов *.
* Ковалентную связь, образованную донорно-акцепторным способом, иногда кратко называют донорно-акцепторной связью. Под этим термином следует, однако, понимать не особый вид связи, а лишь определенный способ образования ковалентной связи.
Другим примером молекулы, в которой имеются связи, образованные донорно-акцепторным способом, может служить молекула оксида азота(1) N2O.
Раньше структурную формулу этого соединения изображали следующим образом:
Согласно этой формуле центральный атом азота соединен с соседними атомами пятью ковалентными связями, так что в его внешнем электронном слое находятся десять электронов (пять электронных пар). Но такой вывод противоречит электронной структуре атома азота, поскольку его наружный L-слой содержит всего четыре орбитали (одну s- и три р-орбитали) и не может вместить более восьми электронов. Поэтому приведенную структурную формулу нельзя признать правильной.
Рассмотрим электронную структуру оксида азота(1), причем электроны отдельных атомов будем попеременно обозначать точками или крестиками. Атом кислорода, имеющий два неспаренных электрона, образует две ковалентных связи с центральным атомом азота:
За счет неспаренного электрона, оставшегося у центрального атома азота, последний образует ковалентную связь со вторым атомом азота:
Таким образом, внешние электронные слои атома кислорода и центрального атома азота оказываются заполненными: здесь образуются устойчивые восьмиэлектронные конфигурации. Но во внешнем электронном слое крайнего атома азота размещено только шесть электронов; этот атом может, следовательно, быть акцептором еще одной электронной пары. Соседний же с ним центральный атом азота обладает неподеленной электронной парой и может выступать в качестве донора. Это приводит к образованию по донорно-акцепторному способу еще одной ковалентной связи между атомами азота:
Теперь каждый из трех атомов, составляющих молекулу N2O, обладает устойчивой восьмиэлектронной структурой внешнего слоя. Если ковалентную связь, образованную донорно-акцепторным способом, обозначить, как это принято, стрелкой, направленной or атома-донора к атому-акцептору, то структурную формулу оксида азота (1) можно представить следующим образом:
Таким образом, в оксиде азота(1) ковалентность центрального атома азота равна четырем, а крайнего — двум.
Рассмотренные примеры показывают, что атомы обладают разнообразными возможностями для образования ковалентных связей. Последние могут создаваться и за счет неспаренных электронов невозбужденного атома, и за счет неспаренных электронов, появляющихся в результате возбуждения атома («распаривания» электронных пар), и, наконец, по донорно-акцепторному способу. Тем не менее, общее число ковалентных связей, которые способен образовать данный атом, ограничено. Оно определяется общим числом валентных орбиталей, т. е. тех орбиталей, использование которых для образования ковалентных связей оказывается энергетически выгодным. Квантово-механический расчет показывает, что к подобным орбиталям принадлежат s- и р-орбитали внешнего электронного слоя и d-орбитали предшествующего слоя; в некоторых случаях, как мы видели на примерах атомов хлора и серы, в качестве валентных орбиталей могут использоваться и d-орбитали внешнего слоя.
Атомы всех элементов второго периода имеют во внешнем электронном слое четыре орбитали при отсутствии d-орбиталей в предыдущем слое. Следовательно, на валентных орбиталях этих атомов может разместиться не более восьми электронов. Это означает, что максимальная ковалентность элементов второго периода равна четырем.
Атомы элементов третьего и последующих периодов могут использовать для образования ковалентных связей не только s- и р-, но также и d-орбитали. Известны соединения d-элементов, в которых в образовании ковалентных связей участвуют s- и р-орбитали внешнего электронного слоя и все пять d-орбиталей предшествующего слоя; в подобных случаях ковалентность соответствующего элемента достигает девяти.
Способность атомов участвовать в образовании ограниченного числа ковалентных связей получила название насыщаемости ковалентной связи.
Направленность ковалентной связи
Свойства молекулы, се способность вступать в химическое взаимодействие с другими молекулами (реакционная способность) зависят не только от прочности химических связей в молекуле, но в значительной мере и ст ее пространственного строения. Раздел химии, изучающий геометрическую структуру молекул, их пространственное строение, называется стереохимией.
Выше (§ 39) уже говорилось, что образование ковалентной связи является результатом перекрывания валентных электронных облаков взаимодействующих атомов. Но такое перекрывание возможно только при определенной взаимной ориентации электронных облаков; при этом область перекрывания располагается в определенном направлении по отношению к взаимодействующим атомам. Иначе говоря, ковалентная связь обладает направленностью.
Так, в молекуле водорода (рис. 27) перекрывание атомных s-электронных облаков происходит вблизи прямой, соединяющей ядра взаимодействующих атомов (т. е. вблизи оси связи). Образованная подобным образом ковалентная связь называется s-связью (сигма-связь).
В образовании s-связи могут принимать участие и р-электронные облака, ориентированные вдоль оси связи. Так, в молекуле HF (рис. 32) ковалентная s-связь возникает вследствие перекрывания 1s-электронного облака атома водорода и 2р-электронного облака атома фтора. Химическая связь в молекуле F2 (рис. 33) — тоже s-связь; она образована 2р-электронными облаками двух атомов фтора.
При взаимодействии р-электронных облаков, ориентированных перпендикулярно оси связи (рис. 34), образуется не одна, а две области перекрывания, расположенные по обе стороны от этой оси. Такая ковалентная связь называется π-связью (пи- связь).
Рис. 32. Схема перекрывания 2р-электронного облака атома фтора и 1s-электронного облака атома водорода при образовании s-связи в молекуле HF:
+ Н — знаки волновой функции.
Рис. 33. Схема перекрывания 2р-электронных облаков атомов фтора при образовании s-связи в молекуле F2
Рис. 34. Схема перекрывания р-электронных облаков при образовании π-связи.
Рассмотрим образование молекулы азота N2. Каждый атом азота обладает тремя неспаренными 2р-электронами, электронные облака которых ориентированы в трех взаимно перпендикулярных направлениях.
На рис. 35 изображено перекрывание р-электронных облаков в молекуле N2 (для удобства изображения перекрывание рх—, ру – рz -облаков показано раздельно). Как показывает рис. 35, атомы азота связаны в молекуле N2 тремя ковалентными связями. Но эти связи неравноценны: одна из них s-связь, а две другие π-связи. Вывод о неравноценности связей в молекуле азота подтверждается тем, что энергия их разрыва различна.
Рис. 35. Схема перекрывания 2р-электронных облаков в молекуле N2:
а — s-связь; б и в — π-связи.
Представление о направленности ковалентных связей позволяет объяснить взаимное расположение атомов в многоатомных молекулах. Так, при образовании молекулы воды электронные облака двух неспаренных 2р-электронов атома кислорода перекрываются с 1s-электронными облаками двух атомов водорода; схема этого перекрывания изображена на рис. 36. Поскольку р-электронные облака атома кислорода ориентированы во взаимно перпендикулярных направлениях, то молекула Н2О имеет, как показано на рис. 36, угловое строение, причем можно ожидать, что угол между связями О—Н будет составлять 90°.
Молекула NH3, образующаяся при взаимодействии трех р-электронов атома азота с s-электронами трех атомов водорода (рис. 37), имеет структуру пирамиды, в вершине которой находится атом азота, а в вершинах основания атомы водорода. И в этом случае можно ожидать, что углы между связями N—Н будут равны 90′. Эти выводы о взаимном расположении атомов в молекулах NH3 и Н2О соответствуют действительности. Значительная полярность молекул воды (m =1,84 D) и аммиака (m = 1,48 D), а также данные структурных исследований свидетельствуют о том, что молекула Н2О имеет угловое строение, а молекула NH3 построена в форме пирамиды. Однако углы между связями (валентные углы) отличаются от 90°: в молекуле воды угол НОН составляет 104,5°, а в молекуле аммиака угол HNH равен 107,3°.
Рис. 36. Схема образования химических связей в молекуле воды.
Рис. 37. Схема образования химических связей в молекуле аммиака.
Для объяснения отличия валентных углов в молекулах Н2О и NH3 от 90° следует принять во внимание, что устойчивому состоянию молекулы отвечает такая ее геометрическая структура и такое пространственное расположение электронных облаков внешних оболочек атомов, которым отвечает наименьшая потенциальная энергия молекулы. Это приводит к тому, что при образовании молекулы формы и взаимное расположение атомных электронных облаков изменяются по сравнению с их формами и взаимным расположением в свободных атомах. В результате достигается более полное перекрывание валентных электронных облаков и, следовательно, образование более прочных ковалентных связей. В рамках метода валентных связей такая перестройка электронной структуры атома рассматривается па основе представления о гибридизации атомных орбиталей.
Гибридизация атомных электронных орбиталей
Метод гибридизации атомных орбиталей исходит из предположения, что при образовании молекулы вместо исходных атомных s-, р- и d-электронных облаков образуются такие равноценные «смешанные» или гибридные электронные облака, которые вытянуты по направлению к соседним атомам, благодаря чему достигается их более полное перекрывание с электронными облаками этих атомов. Такая деформация электронных облаков требует затраты энергии. Но более полное перекрывание валентных электронных облаков приводит к образованию более прочной химической связи и, следовательно, к дополнительному выигрышу энергии. Если этот выигрыш энергии достаточен, чтобы с избытком скомпенсировать затраты энергии на деформацию исходных атомных электронных облаков, такая гибридизация приводит, в конечном счёте, к уменьшению потенциальной энергии образующейся молекулы и, следовательно, к повышению ее устойчивости.
Рассмотрим в качестве примера гибридизации образование молекулы фторида бериллия ВеР2. Каждый атом фтора, входящий в состав этой молекулы, обладает одним неспаренным электроном,
который и участвует в образовании ковалентной связи. Атом бериллия в невозбужденном состоянии (1s22s2) неспаренных электронов не имеет:
Поэтому для участия в образовании химических связей атом бериллия должен перейти в возбужденное состояние (ls22s12p1):
Образовавшийся возбужденный атом Be* обладает двумя неспаренными электронами: электронное облако одного из них соответствует состоянию 2s, другого — 2р. При перекрывании этих электронных облаков с р-электронными облаками двух атомов фтора могут образоваться ковалентные связи (рис. 38).
Однако, как уже было сказано, при затрате некоторой энергии вместо исходных s- и р-орбиталей атома бериллия могут образоваться две равноценные гибридные орбитали (sp-орбиталп). Форма и расположение этих орбиталей показаны на рис. 39, из которого видно, что гибридные sp-орбитали вытянуты в противоположных направлениях.
Рис. 38. Схема перекрывания 2p-электронных облаков атомов фтора с 2s— и 2р-электронными облакамн атома бериллия (для каждой связи отдельно).
Области перекрывания электронных облаков заштрихованы.
Рис. 39. Форма (схематическое изображение) и взаимное расположение гибридных sp-электронных облаков атома бериллия (для каждой гибридной орбитали отдельно).
Перекрывание гибридных sp-электронных облаков атома бериллия с р-электронными облаками атомов фтора изображено на рис. 40. Благодаря вытянутой форме гибридных орбиталей достигается более полное перекрывание взаимодействующих электронных облаков, а значит, образуются более прочные химические связи. Энергия, выделяющаяся при образовании этих связей, больше, чем суммарные затраты энергии на возбуждение атома бериллия и гибридизацию его атомных орбиталей. Поэтому процесс образования молекулы BeF2 энергетически выгоден.
Рис. 40. Схема образования химических связей в молекуле BeF2.
В целях упрощения рисунка гибридные sp-электронные облака атома бериллия изображены неполностью.
Рассмотренный случай гибридизации одной s- и одной р-орбитали, приводящий к образованию двух sp-орбиталей, называется sp—гибридизацией. Как показывает рис. 39, sp-орбитали ориентированы в противоположных направлениях, что приводит к линейному строению молекулы. Действительно, молекула BeF2 линейна, а обе связи Be-F в этой молекуле во всех отношениях равноценны.
Возможны и другие случаи гибридизации атомных орбиталей, однако число образующихся гибридных орбиталей всегда равно общему числу исходных атомных орбиталей, участвующих в гибридизации. Так, при гибридизации одной s- и двух р-орбиталей (sp2— гибридизация —читается «эс-пэ-два») образуются три равноценные sр2-орбитали. В этом случае гибридные электронные облака располагаются в направлениях, лежащих в одной плоскости и ориентированных под углами 120° друг к другу (рис. 41). Очевидно, что этому типу гибридизации соответствует образование плоской треугольной молекулы.
Примером молекулы, в которой осуществляется sр2-гибридизация, может служить молекула фторида бора BF3. Здесь вместо исходных одной s- и двух р-орбиталей возбужденного атома бора
образуются три равноценные sр2-орбитали. Поэтому молекула BF3 построена в форме правильного треугольника, в центре которого расположен атом бора, а в вершинах — атомы фтора. Все три связи В—F в молекуле BF3 равноценны.
Если в гибридизации участвуют одна s- и три р-орбитали (sp3— гибридизация), то в результате образуются четыре гибридные sр3-орбитали, вытянутые в направлениях к вершинам тетраэдра, т. е. ориентированные под углами 109°28′ друг к другу (рис. 42). Такая гибридизация осуществляется, например, в возбужденном атоме углерода при образовании молекулы метана
СН4. Поэтому молекула метана имеет форму тетраэдра, причем все четыре связи С—Н в этой молекуле равноценны.
Рис. 41. Взаимное расположение гибридных sр2-электроиных облаков.
Рис. 42. Взаимное расположение гибридных sр3-электронных облаков.
Вернемся к рассмотрению структуры молекулы воды. При ее образовании происходит sр3-гибрпдизация атомных орбиталей кислорода. Именно поэтому валентный угол НОН в молекуле Н2О (104,5°) близок не к 90°, а к тетраэдрическому углу (109,5°). Небольшое отличие этого угла от 109,5° можно понять, если принять во внимание неравноценность состояния электронных облаков, окружающих атом кислорода в молекуле воды. В самом деле, в молекуле метана (1)

все восемь электронов, занимающие в атоме углерода гибридные sр3-орбитали, участвуют в образовании ковалентных связей С—Н. Это обусловливает симметричное распределение электронных облаков по отношению к ядру атома углерода. Между тем, в молекуле воды(II) только четыре из восьми электронов, занимающих гибридные sр3-орбитали атома кислорода, образуют связи О—Н, а две электронные пары остаются неподеленными, т. е. принадлежат только атому кислорода. Это приводит к некоторой асимметрии в распределении электронных облаков, окружающих атом кислорода, и, как следствие, к отклонению угла между связями О—Н от 109,5°.
При образовании молекулы аммиака также происходит sр3-гибридизация атомных орбиталей центрального атома (азота). Именно поэтому валентный угол HNH (107,3°) близок к тетраэдрическому. Небольшое отличие этого угла от 109,5° объясняется, как и в молекуле воды, асимметрией в распределении электронных облаков вокруг ядра атома азота: из четырех электронных пар три участвуют в образовании связей N — Н, а одна остается неподеленной.
Как показывают рис. 39, 41 и 42, гибридные электронные облака смещены относительно ядра атома. Поэтому центр электрического заряда неподеленной электронной пары, находящейся на гибридной орбитали, не совпадает с положением атомного ядра, т. е. с центром имеющегося в атоме положительного заряда. Такое смещение заряда неподеленной электронной пары приводит к появлению дипольного момента, вносящего существенный вклад в суммарный дипольный момент молекулы. Из этого следует, что полярность молекулы зависит не только от полярности отдельных связей и их взаимного расположения (см. § 40), но и от наличия неподеленных электронных пар па гибридных орбиталях и от пространственного расположения этих орбиталей.
У элементов третьего и последующих периодов в образовании гибридных электронных облаков могут участвовать и d-орбитали. Особенно важен случай sр3d2-гибридизации, когда в образовании гибридных орбиталей участвуют одна s-,три р- и две d-орбитали. В этом случае образуются шесть равноценных гибридных орбиталей, вытянутых в направлениях к вершинам октаэдра. Октаэдрическая структура молекулы SF6, ионов [SiF6]2—, [Fe(CN6)]3— и многих других объясняется sр3d2-гибридизацией атомных орбиталей центрального атома.
Многоцентровые связи
По мере развития метода валентных связей выяснилось, что в некоторых случаях любая из возможных для данной молекулы валентных схем плохо согласуется с установленными на опыте свойствами этой молекулы: истинные свойства молекулы оказываются промежуточными между теми, которые приписываются ей каждой отдельной схемой. В подобных случаях структуру молекулы можно выразить набором из нескольких валентных схем. Такой способ описания молекул получил название метода наложения валентных схем.
Рассмотрим, например, электронную структуру молекулы азотной кислоты HNO3. В этой молекуле атом водорода связан с атомом кислорода ковалентной связью:
Атом кислорода за счет оставшегося у него неспаренного электрона образует ковалентную связь с атомом азота:
В свою очередь, два неспаренных электрона атома азота участвуют в образовании двух ковалентных связей со вторым атомом кислорода:
Мы видим, что у атома азота сохранилась неподеленная пара электронов, так что здесь азот, выступая в качестве донора электронной пары, способен образовать еще одну ковалентную связь по донорно-акцепторному способу. В молекуле HNO3 акцептором электронной пары атома азота является третий атом кислорода, переходящий в возбужденное состояние, в котором он обладает одной свободной 2р-орбиталью *;
* В данном случае возбуждение атома выражается не в распаривании электронов, как это имело место в рассмотренных раньше случаях (см. § 41), а в переходе неспаренного электрона на орбиталь, занятую другим неспаренным.
Таким образом, получаем следующую валентную схему молекулы азотной кислоты:
или
Согласно последней схеме (в которой цифрами занумерованы связи азот— кислород), связи 1 и 2 в молекуле HNO3 неодинаковы: связь 1—двойная, а связь 2 — простая. В действительности же эти связи во всех отношениях (энергия связи, межъядерные расстояния N — О и т. д.) равноценны. Это означает, что структуру молекулы HNO3 можно с равным основанием описать аналогичной валентной схемой:
Каждая из валентных схем (I) и (II) неточно описывает строение и свойства молекулы азотной кислоты: истинная структура этой молекулы является промежуточной между схемами (I) и (II) и может рассматриваться как результат сочетания (или наложения) этих валентных схем.
Из сказанного не следует, что азотная кислота может реально существовать в двух различных формах (I) и (II): описание молекулы HNO3 с помощью набора валентных схем означает только, что каждая из этих схем в отдельности не соответствует истинной электронной структуре молекулы.
Распределение электронов в молекуле азотной кислоты можно более точно передать следующей схемой:
Здесь пунктирные линии означают, что одна из общих электронных пар не принадлежит целиком ни связи 1 (схема I), ни связи 2 (схема II), но в равной степени распределена между этими связями. Иначе говоря, эта электронная пара принадлежит не двум, а трем атомам — атому азота и двум атомам кислорода; образованная ею связь является, следовательно, не двухцентровой, а трехцентровой.
Электронная структура иона 
каждая из которых указывает на неравноценность связей углерод — кислород. Такой вывод не соответствует действительности: все три связи С—О в ионе 
Здесь, как и раньше, пунктирные линии означают, что одна из общих электронных пар в равной степени распределена между всеми тремя связями С—О.
Эта электронная пара принадлежит всем четырем атомам, входящим в состав
иона 
Примерами молекул с многоцентровыми связями могут служить также молекулы бензола и диборана.
Как указывалось в § 39, одно из положений метода ВС заключается в том,
что все химические связи являются двухцентровыми. Однако на самом деле,
как показывают рассмотренные выше примеры, в ряде случаев правильнее считать двухэлектронные связи многоцентровыми.
Метод молекулярных орбиталей
Как было показано в предыдущих параграфах, метод ВС позволяет понять способность атомов к образованию определенного числа ковалентных связей, объясняет направленность ковалентной связи, дает удовлетворительное описание структуры и свойств большого числа молекул. Однако в ряде случаев метод ВС не может объяснить природу образующихся химических связей или приводит к неверным заключениям о свойствах молекул.
Так, согласно методу ВС, все ковалентные связи осуществляются общей парой электронов. Между тем, еще в конце прошлого века было установлено существование довольно прочного молекулярного иона водорода 


Далее, образование молекулы кислорода О2 описывается методом ВС как результат создания двух общих электронных пар:
Согласно такому описанию, молекула О2 не содержит неспаренных электронов. Однако магнитные свойства кислорода указывают на то, что в молекуле О2 имеются два неспаренных электрона.
Каждый электрон, благодаря наличию у него спина, создает собственное магнитное поле. Направление этого поля определяется направлением спина, так что магнитные поля, образованные двумя спаренными электронами, взаимно компенсируют друг друга. Поэтому молекулы, в состав которых входят только спаренные электроны, не создают собственного магнитного поля. Вещества, состоящие из таких молекул, являются диамагнитными — они выталкиваются из магнитного поля. Напротив, вещества, молекулы которых содержат неспаренные электроны, обладают собственным магнитным полем и являются парамагнитными; такие вещества втягиваются в магнитное поле.
Кислород — вещество парамагнитное, что свидетельствует о наличии в его молекуле неспаренных электронов.
На основе метода ВС трудно объяснить и то, что отрыв электронов от некоторых молекул приводит к упрочнению химической связи. Так, энергия разрыва связи в молекуле F2 составляет 155 кДж/моль, а в молекулярном ионе 

Приведенные здесь и многие другие факты получают более удовлетворительное объяснение на основе метода молекулярных орбиталей (метод МО).
Мы уже знаем, что состояние электронов в атоме описывается квантовой механикой как совокупность атомных электронных орбиталей (атомных электронных облаков); каждая такая орбиталь характеризуется определенным набором атомных квантовых чисел. Метод МО исходит из предположения, что состояние электронов в молекуле также может быть описано как совокупность молекулярных электронных орбиталей (молекулярных электронных облаков), причем каждой молекулярной орбитали (МО) соответствует определенный набор молекулярных квантовых чисел. Как и в любой другой многоэлектронной системе, в молекуле сохраняет свою справедливость принцип Паули (см. § 32), так что на каждой МО может находиться не более двух электронов, которые должны обладать противоположно направленными спинами.
Молекулярное электронное облако может быть сосредоточено вблизи одного из атомных ядер, входящих в состав молекулы: такой электрон практически принадлежит одному атому и не принимает участия в образовании химических связей. В других случаях преобладающая часть электронного облака расположена в области пространства, близкой к двум атомным ядрам; это соответствует образованию двухцентровой химической связи. Однако в наиболее общем случае электронное облако принадлежит нескольким атомным ядрам и участвует в образовании многоцентровой химической связи. Таким образом, с точки зрения метода МО двухцентровая связь представляет собой лишь частный случай многоцентровой химической связи.
Основная проблема метода МО — нахождение волновых функций, описывающих состояние электронов на молекулярных орбиталях. В наиболее распространенном варианте этого метода, получившем сокращенное обозначение «метод МО ЛКАО» (молекулярные орбитали, линейная комбинация атомных орбиталей), эта задача решается следующим образом.
Пусть электронные орбитали взаимодействующих атомов характеризуются волновыми функциями j1, j2, j3 … и т.д. Тогда предполагается, что волновая функция j, отвечающая молекулярной орбитали, может быть представлена в виде суммы
где С1, С2, С3 …— некоторые численные коэффициенты.
Для уяснения физического смысла такого подхода вспомним, что волновая функция j соответствует амплитуде волнового процесса, характеризующего состояние электрона (см. § 26). Как известно, при взаимодействии, например, звуковых или электромагнитных волн их амплитуды складываются. Как видно, приведенное уравнение равносильно предположению, что амплитуды молекулярной «электронной волны» (т. е. молекулярная волновая функция) тоже образуются сложением амплитуд взаимодействующих атомных «электронных волн» (т. е. сложением атомных волновых функций). При этом, однако, под влиянием силовых полей ядер и электронов соседних атомов волновая функция каждого атомного электрона изменяется по сравнению с исходной волновой функцией этого электрона в изолированном атоме. В методе МО ЛКАО эти изменения учитываются путем введения коэффициентов С1, С2 и т. д., так что при нахождении молекулярной волновой функции складываются не исходные, а измененные амплитуды — С1j1, С2j2 и т. д.
Выясним, какой вид будет иметь молекулярная волновая функция j, образованная в результате взаимодействия волновых функций (j1 и j2) 1s-орбиталей двух одинаковых атомов. Для этого найдем сумму С1j1+ С2j2. В данном случае оба рассматриваемых атома одинаковы, так что коэффициенты С1 и С2 равны по величине (С1=С2 = С), и задача сводится к определению суммы С (j1+ j2). Поскольку постоянный коэффициент С не влияет на вид искомой молекулярной волновой функции, а только изменяет ее абсолютные значения, мы ограничимся нахождением суммы (j1+ j2).
Для этого расположим ядра взаимодействующих атомов на том расстоянии друг от друга (r), на котором они находятся в молекуле, и изобразим волновые функции 1s-орбиталей этих атомов (рис. 43,а); каждая из этих функций имеет вид, показанный на рис. 9, а. Чтобы найти молекулярную волновую функцию j, сложим величины j1 и j2: в результате получится кривая, изображенная на рис. 43, б. Как видно, в пространстве между ядрами значения молекулярной волновой функции j больше, чем значения исходных атомных волновых функций. Но квадрат волновой функции характеризует вероятность нахождения электрона в соответствующей области пространства, т. е. плотность электронного облака (см. § 26). Значит, возрастание j в сравнении с j1 и j2 означает, что при образовании МО плотность электронного облака в межъядерном пространстве увеличивается. В результате возникают силы притяжения положительно заряженных атомных ядер к этой области — образуется химическая связь. Поэтому МО рассматриваемого типа называется связывающей.
Рис. 43. Схема образования связывающей МО из атомных 1s-орбиталей.
В данном случае область повышенной электронной плотности находится вблизи оси связи, так что образовавшаяся МО относится к s-типу. В соответствии с этим, связывающая МО, полученная в результате взаимодействия двух атомных 1s-орбиталей, обозначается sсв1s.
Электроны, находящиеся на связывающей МО, называются связывающими электронами.
Как указывалось, волновая функция 1s-орбитали обладает постоянным знаком. Для отдельного атома выбор этого знака произволен: до сих пор мы считали его положительным. Но при взаимодействии двух атомов знаки волновых функций их 1s-орбиталей могут оказаться различными. Значит, кроме случая, изображенного на рис. 43, а, где знаки обеих волновых функций одинаковы, возможен и случай, когда знаки волновых функций взаимодействующих 1s-орбиталей различны. Такой случай представлен на рис. 44, а: здесь волновая функция 1s-орбитали одного атома положительна, а другого — отрицательна. При сложении этих волновых функций получится кривая, показанная на рис. 44, б. Молекулярная орбиталь, образующаяся при подобном взаимодействии, характеризуется уменьшением абсолютной величины волновой функции в межъядерном пространстве по сравнению с ее значением в исходных атомах: на оси связи появляется даже точка, в которой значение волновой функции, а, следовательно, и ее квадрата, обращается в нуль. Это означает, что в рассматриваемом случае уменьшится и плотность электронного облака в пространстве между атомами. В результате притяжение каждого атомного ядра в направлении к межъядерной области пространства окажется более слабым, чем в противоположном направлении, т. е. возникнут силы, приводящие к взаимному отталкиванию ядер. Здесь, следовательно, химическая связь не возникает; образовавшаяся в этом случае МО называется разрыхляющей (sразр 1s), а находящиеся на ней электроны—разрыхляющими электронами.
Рис. 44. Схема образования разрыхляющей МО из атомных 1s-орбиталей.
Переход электронов с атомных 1s-орбиталей на связывающую МО, приводящий к возникновению химической связи, сопровождается выделением энергии. Напротив, переход электронов с атомных 1s-орбиталей на разрыхляющую МО требует затраты энергии. Следовательно, энергия электронов на орбитали sсв1s ниже, а на орбитали sразр1s выше, чем на атомных ls-орбиталях. Это соотношение энергий показано на рис. 45, на котором представлены как исходные ls-орбитали двух атомов водорода, так и молекулярные орбитали sсв1s и sразр1s. Приближенно можно считать, что при переходе 1s-электрона на связывающую МО выделяется столько же энергии, сколько необходимо затратить для его перевода на разрыхляющую МО.
Мы знаем, что в наиболее устойчивом (невозбужденном) состоянии атома электроны занимают атомные орбитали, характеризующиеся наименьшей возможной энергией. Точно так же наиболее устойчивое состояние молекулы достигается в том случае, когда электроны занимают МО, отвечающие минимальной энергии. Поэтому при образовании молекулы водорода оба электрона перейдут с атомных 1s-орбиталей на связывающую молекулярную орбиталь sсв1s (рис. 46); в соответствии с принципом Паули, электроны, находящиеся на одной МО, должны обладать противоположно направленными спинами. Используя символы, выражающие размещение электронов на атомных и молекулярных орбиталях, образование молекулы водорода можно представить схемой:
Рис. 45. Энергетическая схема образования МО при взаимодействии 1s-орбиталей двух одинаковых атомов.
Рис. 46. Энергетическая схема образования молекулы водорода.
В методе ВС кратность связи определяется числом общих электронных пар: простой считается связь, образованная одной общей электронной парой, двойной — связь, образованная двумя общими электронными парами, и т. д. Аналогично этому, в методе МО кратность связи принято определять по числу связывающих электронов, участвующих в ее образовании: два связывающих электрона соответствуют простой связи, четыре связывающих электрона — двойной связи и т. д. При этом разрыхляющие электроны компенсируют действие соответствующего числа связывающих электронов. Так, если в молекуле имеются 6 связывающих и 2 разрыхляющих электрона, то избыток числа связывающих электронов над числом разрыхляющих равен четырем, что соответствует образованию двойной связи. Следовательно, с позиции метода МО химическую связь в молекуле водорода, образованную двумя связывающими электронами, следует рассматривать как простую связь.
Теперь становится понятной возможность существования устойчивого молекулярного иона 
В молекулярном ионе 


Рис. 47. Энергетическая схема образования молекулярного иона водорода 
Рис. 48. Энергетическая схема образования молекулярного иона гелия
Напротив, гипотетическая молекула Не2 должна быть энергетически неустойчивой, поскольку здесь из четырех электронов, которые должны разместиться на МО, два займут связывающую, а два — разрыхляющую МО. Следовательно, образование молекулы Не2 не будет сопровождаться выделением энергии. Действительно, молекулы Не2 экспериментально не обнаружены.
В молекулах элементов второго периода МО образуются в результате взаимодействия атомных 2s- и 2р-орбиталей; участие внутренних 1s-электронов в образовании химической связи здесь пренебрежимо мало. Так, на рис. 49 приведена энергетическая схема образования молекулы Li2: здесь имеются два связывающих электрона, что соответствует образованию простой связи. В молекуле же Ве2 число связывающих и разрыхляющих электронов одинаково, так что эта молекула, подобно молекуле Не2, энергетически неустойчива. Действительно, молекул Ве2 обнаружить не удалось.
Схема образования МО при взаимодействии атомных 2р-орбиталей показана на рис. 50. Как видно, из шести исходных 2р-орбиталей образуются шесть МО: три связывающих и три разрыхляющих. При этом одна связывающая (sсв 2р) и одна разрыхляющая (sразр2р) орбитали принадлежат к s-типу: они образованы взаимодействием атомных 2р-орбиталей, ориентированных вдоль оси связи. Две связывающие (πсв2р) и две разрыхляющие (πразр2р) орбитали образованы взаимодействием 2р-орбиталей, ориентированных перпендикулярно оси связи; эти орбитали принадлежат к π-типу.
Рис. 49. Энергетическая схема образования молекулы лития Li2
Рис. 50. Энергетическая схема образования МО при взаимодействии 2р-орбиталей двух одинаковых атомов.
На рис. 51 представлена схема заполнения МО в молекуле азота N2. Здесь на МО должны разместиться шесть 2р-электронов обоих атомов азота. Они заполняют три связывающие МО, а все разрыхляющие МО остаются незанятыми. Общее число связывающих электронов в молекуле N2 равно шести, что соответствует образованию тройной связи.
В молекуле кислорода О2 (рис. 52) в образовании химических связей принимают участие по четыре 2р-электрона каждого атома; всего, следовательно, на МО должны перейти восемь электронов. Шесть из них занимают три связывающие МО, а два размещаются на разрыхляющих молекулярных орбиталях πраз2р; здесь избыток числа связывающих электронов над числом разрыхляющих равен четырем, а кратность связи — двум. Обе орбитали πразр2р энергетически равноценны, и электроны должны размещаться здесь в соответствии с правилом Хуида (см. § 32), которое сохраняет свою справедливость и в приложении к молекулам. Поэтому каждая из орбиталей πразр2р занимается одним электроном и притом так, что спины этих электронов имеют одинаковое направление. Из схемы на рис. 52 вытекает, что в молекуле О2 имеются два неспаренных электрона, вследствие чего эта молекула должна быть парамагнитной. Как указывалось выше, это подтверждается на опыте. Таким образом, метод МО объясняет магнитные свойства молекулярного кислорода.
Рис. 51. Энергетическая схема образования молекулы азота N2.
Рис. 52. Энергетическая схема образования молекулы кислорода 02.
При образовании иона 

Подобным же образом рассматривается с точки зрения метода МО образование молекул, состоящих из различных атомов. Так, на рис. 53 представлена энергетическая схема образования молекулы оксида углерода СО. Здесь на МО переходят четыре 2р-электрона атома кислорода и
два 2р-электрона атома углерода. Энергия 2р-электронов соединяющихся атомов неодинакова; заряд ядра атома кислорода выше, чем заряд ядра атома углерода, так что 2р-электроны в атоме кислорода сильнее притягиваются ядром. Поэтому на рис. 53 расположение 2р-орбиталей атома кислорода соответствует более низкой энергии в сравнении с 2р-орбиталями атома углерода. Как показывает схема, все шесть электронов, участвующих в образовании связи, размещаются на трех связывающих МО.
Рис. 53. Энергетическая схема образования молекулы оксида углерода СО.
Наличие в молекуле СО шести связывающих электронов при отсутствии разрыхляющих электронов отвечает, как и в молекуле азота (рис. 51), образованию тройной связи. Это объясняет значительное сходство в свойствах свободного азота и оксида углерода, например, близость энергии диссоциации молекул (N2— 945, СО — 1076 кДж/моль), межъядерных расстояний в молекулах (соответственно 0,110 и 0,113 нм), температур плавления (63 и 68 К) и кипения (77 и 82 К).
Рассмотренные примеры показывают, что метод МО успешно объясняет строение и свойства таких молекул, описание которых
с помощью метода ВС встречает существенные затруднения.
Ионная связь
Связь такого типа осуществляется в результате взаимного электростатического притяжения противоположно заряженных ионов. Ионы могут быть простыми, т. е. состоящими из одного атома (например, катионы Na+, К+, анионы F—, Сl—), или сложными, т. е. состоящими из двух или более атомов, (например, катион 


В отличие от ковалентной связи, ионная связь не обладает направленностью. Это объясняется тем, что электрическое поле иона обладает сферической симметрией, т. е. убывает с расстоянием по одному и тому же закону в любом направлении. Поэтому взаимодействие между ионами осуществляется одинаково независимо от направления. Как уже отмечалось выше (см. рис. 29), система из двух зарядов, одинаковых по абсолютной величине, но противоположных по знаку, создает в окружающем пространстве электрическое поле. Это означает, что два разноименных иона, притянувшиеся друг к другу, сохраняют способность электростатически взаимодействовать с другими ионами. В этом состоит еще одно различие между ионным и ковалентным типами связи: ионная связь не обладает насыщаемостью. Поэтому к данному иону может присоединиться различное число ионов противоположного знака. Это число определяется относительными размерами взаимодействующих ионов, а также тем, что силы притяжения разноименно заряженных ионов должны преобладать над силами взаимного отталкивания, действующими между ионами одного знака.
Отсутствие у ионной связи направленности и насыщаемости обусловливает склонность ионных молекул к ассоциации, т. е. к соединению их друг с другом. При высоких температурах кинетическая энергия движения молекул преобладает над энергией их взаимного притяжения: поэтому в газообразном состоянии ионные соединения существуют в основном в виде неассоциированных молекул. Но при понижении температуры, при переходе в жидкое и, особенно, в твердое состояние ассоциация ионных соединений проявляется сильно. Все ионные соединения в твердом состоянии имеют не молекулярную, а ионную кристаллическую решетку (см. гл. V), в которой каждый ион окружен несколькими ионами противоположного знака. При этом все связи данного иона с соседними ионами равноценны, так что весь кристалл можно рассматривать как единую гигантскую «молекулу».
Как указывалось в § 34, атомы неметаллов характеризуются положительными значениями сродства к электрону: при присоединении электрона к такому атому выделяется энергия. Однако присоединение второго электрона к атому любого неметалла требует затраты энергии, так что образование простых многозаряднык анионов (например, О2—, N3-) оказывается энергетически невыгодным. Поэтому в таких соединениях, как оксиды (ВаО, Аl2О3 и др.) или сульфиды (например, ZnS, CuS), не образуется «чисто» ионная связь: здесь химическая связь всегда носит частично ковалентный характер. Вместе с тем, многозарядные сложные анионы (


Но даже в типичных ионных соединениях, например, в галогенидах щелочных металлов, не происходит полного разделения отрицательного и положительного зарядов, т. е. полного перехода электрона от одного атома к другому. Например, в кристалле NaCl эффективный отрицательный заряд атома хлора составляет лишь 0,94 заряда электрона; таким же по абсолютной величине положительным зарядом обладает и атом натрия.
Неполное разделение зарядов в ионных соединениях можно объяснить взаимной поляризацией ионов, т. е. влиянием их друг на друга, которое приводит к деформации электронных обо лочек ионов. Причиной поляризации всегда служит действие электрического поля (см., например, рис. 54, пунктиром показана деформация электронной оболочки иона в электрическом поле), смещающего электроны и ядра атомов в противоположных направлениях. Каждый ион, будучи носителем электрического заряда, является источником электрического поля. Поэтому, взаимодействуя, противоположно заряженные ионы поляризуют друг друга.
Рис. 54. Поляризация иона в электрическом поле.
Наибольшее смещение испытывают при поляризации электроны внешнего слоя; в первом приближении можно считать, что деформации подвергается только внешняя электронная оболочка. Однако под действием одного и того же электрического поля различные ионы деформируются в разной степени. Иначе говоря, поляризуемость различных ионов неодинакова: чем слабее связаны внешние электроны с ядром, тем легче поляризуется ион, тем сильнее он деформируется в электрическом поле. У ионов одинакового заряда, обладающих аналогичным строением внешнего электронного слоя, поляризуемость возрастает с увеличением размеров иона, так как внешние электроны удаляются все дальше от ядра, экранируются все большим числом электронных слоев и в результате слабее удерживаются ядром. Так, у ионов щелочных металлов поляризуемость возрастает в ряду
Ll+<Na+<K+<Rb+<Cs+
Точно так же поляризуемость ионов галогенов изменяется в следующей последовательности:
F—< Сl—< Вr—<I—
Превращение атома в положительно заряженный ион всегда приводит к уменьшению его размеров. Кроме того, избыточный положительный заряд катиона затрудняет деформацию его внешних электронных облаков. Напротив, отрицательно заряженные ионы всегда имеют большие размеры, чем нейтральные атомы, а избыточный отрицательный заряд приводит здесь к отталкиванию электронов и, следовательно, к ослаблению их связи с ядром. По этим причинам поляризуемость анионов, как правило, значительно выше поляризуемости катионов.
Поляризующая способность ионов, т. е. их способность оказывать деформирующее воздействие на другие ионы, также зависит от заряда и размера нона. Чем больше заряд иона, тем сильнее создаваемое им электрическое поле; следовательно, наибольшей поляризующей способностью обладают многозарядные ноны. При одном и том же заряде напряженность электрического поля вблизи иона тем выше, чем меньше его размеры. Поэтому поляризующая способность ионов одинакового заряда и аналогичного электронного строения падает с увеличением ионного радиуса. Так, в ряду катионов щелочных металлов поляризующая способность изменяется в порядке, обратном порядку изменения поляризуемости:
Li+>Na+>K+>Rb+>Cs+
Как упоминалось выше, размеры анионов, вообще говоря, больше размеров катионов. Вследствие этого анионы, как правило, обладают меньшей поляризующей способностью, чем катионы.
Таким образом, анионы в сравнении с катионами характеризуются сильной поляризуемостью и слабой поляризующей способностью. Поэтому при взаимодействии разноименных ионов поляризации подвергается главным образом отрицательный ион; поляризацией положительного иона в большинстве случаев можно пренебречь.
Влияние на поляризацию аниона его размеров, а также размеров и заряда катиона иллюстрируется схемой, изображенной на рис. 55.
Рис. 55. Схема влияния на поляризацию отрицательных ионов:
а—заряда положительного иона; б — размера положительного иона, в — размера отрицательного иона.
В результате поляризующего действия катиона внешнее электронное облако аниона смещается (рис. 56). Происходит как бы обратный перенос части электронного заряда от аниона к катиону. Это и приводит к тому, что эффективные заряды атомов в ионном соединении оказываются меньше целого заряда электрона. Рис. 56 показывает также, что в результате поляризации электронные облака катиона и аниона оказываются неполностью разделенными и частично перекрываются, так что связь между атомами из чисто ионной превращается в сильно полярную ковалентную связь. Из этого следует, что ионную связь можно рассматривать не как особый вид связи, а как предельный случай полярной ковалентной связи.
Рис. 56. Смещение электронного облака аниона в результате поляризации.
Положение деформированною электронного облака показано пунктиром.
Поляризация ионов оказывает заметное влияние на свойства образуемых ими соединений. Поскольку с усилением поляризации возрастает степень ковалентности связи, то это сказывается на диссоциации солей в водных растворах. Так, хлорид бария ВаС12 принадлежит к сильным электролитам (см. § 84) и в водных растворах практически полностью распадается на ионы, тогда как хлорид ртути HgCI2 почти не диссоциирует на ионы. Это объясняется сильным поляризующим действием иона Hg2+, радиус которого (0,112 нм) заметно меньше радиуса иона Ва2+ (0,138 нм).
Особенно высоким поляризующим действием обладает ион водорода Н+, который отличается от всех других ионов гораздо меньшими размерами и полным отсутствием электронов. Поэтому ион водорода не испытывает отталкивания от аниона и может сблизиться с ним до очень малого расстояния, внедряясь в его электронную оболочку и вызывая сильную ее деформацию. Так, радиус иона Сl— равен 0,181 нм, а расстояние между ядрами атомов хлора и водорода в молекуле НСl составляет всего 0,127 нм. В дальнейшем мы увидим, что многие кислоты по ряду своих свойств (устойчивость, способность диссоциировать в водных растворах на ионы, окислительная способность) сильно отличаются от свойств образуемых ими солей. Одной из причин таких различий как раз и является сильное поляризующее действие иона водорода.
Водородная связь
Еще в XIX веке было замечено, что соединения, в которых атом водорода непосредственно связан с атомами фтора, кислорода и азота, обладают рядом аномальных свойств. Это проявляется, например, в значениях температур плавления и кипения подобных соединений. Обычно в ряду однотипных соединений элементов данной подгруппы температуры плавления и кипения с увеличением атомной массы элемента возрастают. Это объясняется усилением взаимного притяжения молекул, что связано с увеличением размеров атомов и с ростом дисперсионного взаимодействия между ними (см.§ 48). Так, в ряду HCl—НВr—HI температуры плавления равны соответственно—114,2, —86,9 и —50,8 °С. Аналогичная зависимость наблюдается и в ряду H2S—H2Se—Н2Те. Однако, как показывают рис. 57 и 58, фтороводород и вода плавятся и кипят при аномально высоких температурах.
Рис. 57. Зависимость температуры плавления 

Рис. 58. Зависимость температуры плавления 

В настоящее время установлено, что эти и некоторые другие особенности указанных соединений объясняются способностью атома водорода, соединенного с атомом сильно электроотрицательного элемента, к образованию еще одной химической связи с другим подобным атомом. Эта связь называется водородной.
Возникновение водородной связи можно в первом приближении объяснить действием электростатических сил. Так, при образовании полярной ковалентной связи между атомом водорода и атомом фтора, который характеризуется высокой электроотрицательностью, электронное облако, первоначально принадлежавшее атому водорода, сильно смещается к атому фтора. В результате атом фтора приобретает значительный эффективный отрицательный заряд, а ядро атома водорода (протон) с «внешней» по отношению к атому фтора стороны почти лишается электронного облака. Между протоном атома водорода и отрицательно заряженным атомом фтора соседней молекулы HF возникает электростатическое притяжение, что и приводит к образованию водородной связи. Это обусловлено тем, что, обладая ничтожно малыми размерами и, в отличие от других катионов, не имея внутренних электронных слоев, которые отталкиваются отрицательно заряженными атомами, ион водорода (протон) способен проникать в электронные оболочки других атомов.
Процесс образования водородной связи при взаимодействии двух молекул HF может быть представлен следующей схемой:
Здесь пунктиром обозначена водородная связь, а знаки «+» и «—» относятся к эффективным зарядам атомов.
Из сказанного ясно, что условием образования водородной связи является высокая электроотрицательность атома, непосредственно связанного в молекуле с атомом водорода. Только при этом условии электронное облако атома водорода достаточно сильно смещается в сторону атома-партнера, а последний приобретает высокий эффективный отрицательный заряд. Именно поэтому водородная связь характерна для соединения самых электроотрицательных элементов: сильнее всего она проявляется у соединений фтора и кислорода, слабее — у соединений азота и еще слабее — у соединений хлора и серы.
Энергия водородной связи значительно меньше энергии обычной ковалентной связи (150—400 кДж/моль). Она равна примерно 8 кДж/моль у соединений азота и достигает около 40 кДж/моль у соединений фтора. Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, т. е. их объединение в димеры (удвоенные молекулы) или полимеры, которые в ряде случаев существуют не только в жидком состоянии вещества, но сохраняются и при переходе его в пар. Именно ассоциация молекул, затрудняющая отрыв их друг от друга, и служит причиной аномально высоких температур плавления и кипения таких веществ, как фтороводород, вода, аммиак. Другие особенности этих веществ, обусловленные образованием водородных связей и ассоциацией молекул, будут рассмотрены ниже, при изучении отдельных соединений.
Водородная связь служит причиной некоторых важных особенностей воды — вещества, играющего огромную роль в процессах, протекающих в живой и неживой природе. Она в значительной мере определяет свойства и таких биологически важных веществ, как белки и нуклеиновые кислоты.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Воздух
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа кислорода
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований
Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Химические связи
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными.
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Ключевое понятие здесь – ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ. Именно она определяет тип химической связи между атомами и свойства этой связи.
Электроотрицательность χ – это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Электроотрицательность сложно определить однозначно. Л.Полинг составил таблицу относительных электроотрицательностей (на основе энергий связей двухатомных молекул). Наиболее электроотрицательный элемент – фтор со значением 4.
Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль разность электроотрицательностей атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Если значения электроотрицательностей взаимодействующих атомов равны или примерно равны: ЭО(А)≈ЭО(В), то общая электронная пара не смещается ни к одному из атомов: А : В. Такая связь называется ковалентной неполярной.
Если электроотрицательности взаимодействующих атомов отличаются, но не сильно (разница электроотрицательностей примерно от 0,4 до 2: 0,4<ΔЭО<2), то электронная пара смещается к одному из атомов. Такая связь называется ковалентная полярная.
Если электроотрицательности взаимодействующих атомов отличаются существенно (разница электроотрицательностей больше 2: ΔЭО>2), то один из электронов практически полностью переходит к другому атому, с образованием ионов. Такая связь называется ионная.
Основные типы химических связей — ковалентная, ионная и металлическая связи. Рассмотрим их подробнее.
Ковалентная химическая связь
Ковалентная связь – это химическая связь, образованная за счет образования общей электронной пары А:В. При этом у двух атомов перекрываются атомные орбитали. Ковалентная связь образуется при взаимодействии атомов с небольшой разницей электроотрицательностей (как правило, между двумя неметаллами) или атомов одного элемента.
Основные свойства ковалентных связей
- направленность,
- насыщаемость,
- полярность,
- поляризуемость.
Эти свойства связи влияют на химические и физические свойства веществ.
Направленность связи характеризует химическое строение и форму веществ. Углы между двумя связями называются валентными. Например, в молекуле воды валентный угол H-O-H равен 104,45о, поэтому молекула воды — полярная, а в молекуле метана валентный угол Н-С-Н 109о28′.
Насыщаемость — это способность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется валентностью.
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.
Ковалентная неполярная химическая связь
Существует 2 вида ковалентного связывания – ПОЛЯРНЫЙ и НЕПОЛЯРНЫЙ.
Пример. Рассмотрим строение молекулы водорода H2. Каждый атом водорода на внешнем энергетическом уровне несет 1 неспаренный электрон. Для отображения атома используем структуру Льюиса – это схема строения внешнего энергетического уровня атома, когда электроны обозначаются точками. Модели точечных структур Льюиса неплохо помогают при работе с элементами второго периода.
H. + .H = H:H
Таким образом, в молекуле водорода одна общая электронная пара и одна химическая связь H–H. Эта электронная пара не смещается ни к одному из атомов водорода, т.к. электроотрицательность у атомов водорода одинаковая. Такая связь называется ковалентной неполярной.
Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.
Дипольный момент неполярных связей равен 0.
Примеры: H2 (H-H), O2 (O=O), S8.
Ковалентная полярная химическая связь
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).
Чем больше различие в электроотрицательностях атомов, тем выше полярность связи и тем больше дипольный момент. Между соседними молекулами и противоположными по знаку зарядами действуют дополнительные силы притяжения, что увеличивает прочность связи.
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Примеры: HCl, CO2, NH3.
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
А. + .В= А:В
2. Донорно-акцепторный механизм образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В
При этом один из атомов предоставляет неподеленную электронную пару (донор), а другой атом предоставляет вакантную орбиталь для этой пары (акцептор). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей статье.
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в ионе аммония NH4+, в ионах органических аминов, например, в ионе метиламмония CH3-NH3+;
– в комплексных соединениях, химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na[Al(OH)4] связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO3, NaNO3, в некоторых других соединениях азота;
– в молекуле озона O3.
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении. Кратность связи достаточно легко можно определить из значения валентности атомов, образующих молекулу.
Например, в молекуле водорода H2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.
В молекуле азота N2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.
Длина ковалентной связи
Длина химической связи – это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А2 и В2:
Длину химической связи можно примерно оценить по радиусам атомов, образующих связь, или по кратности связи, если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
Например. В ряду: C–C, C=C, C≡C длина связи уменьшается.
| Связь |
Длина связи, нм |
| H-F | 0,092 |
| H-Cl | 0,128 |
| H-Br | 0,142 |
| H-I | 0,162 |
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Например. В ряду: C–C, C=C, C≡C длина связи уменьшается.
| Связь |
Длина связи, нм |
| С–С | 0,154 |
| С=С | 0,133 |
| С≡С | 0,120 |
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Например, в ряду соединений HF, HCl, HBr слева направо прочность химической связи уменьшается, т.к. увеличивается длина связи.
Ионная химическая связь
Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов.
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.
Пример. Атом натрия содержит на 3 энергетическом уровне 1 электрон. Легко отдавая его, атом натрия образует гораздо более устойчивый ион Na+, с электронной конфигурацией благородного газа неона Ne. В ионе натрия содержится 11 протонов и только 10 электронов, поэтому суммарный заряд иона -10+11 = +1:
+11Na )2)8)1 — 1e = +11Na+ )2)8
Пример. Атом хлора на внешнем энергетическом уровне содержит 7 электронов. Чтобы приобрести конфигурацию стабильного инертного атома аргона Ar, хлору необходимо присоединить 1 электрон. После присоединения электрона образуется стабильный ион хлора, состоящий из электронов. Суммарный заряд иона равен -1:
+17Cl )2 )8 )7 + 1e = +17Cl— )2 )8 )8
Обратите внимание:
- Свойства ионов отличаются от свойств атомов!
- Устойчивые ионы могут образовывать не только атомы, но и группы атомов. Например: ион аммония NH4+, сульфат-ион SO42- и др. Химические связи, образованные такими ионами, также считаются ионными;
- Ионную связь, как правило, образуют между собой металлы и неметаллы (группы неметаллов);
Образовавшиеся ионы притягиваются за счет электрического притяжения: Na+Cl—, Na2+ SO42-.
Наглядно обобщим различие между ковалентными и ионным типами связи:
Металлическая химическая связь
Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов. Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями.
Отдавая электроны, атомы металлов превращаются в положительно заряженные ионы. Оторвавшиеся электроны относительно свободно перемещаются между положительно заряженными ионами металлов. Между этими частицами возникает связь, т.к. общие электроны удерживают катионы металлов, расположенные слоями, вместе, создавая таким образом достаточно прочную металлическую кристаллическую решетку. При этом электроны непрерывно хаотично двигаются, т.е. постоянно возникают новые нейтральные атомы и новые катионы.
Межмолекулярные взаимодействия
Отдельно стоит рассмотреть взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия. Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не появляются новые ковалентные связи. Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами. Силы Ван-дер-Ваальса делятся на ориентационные, индукционные и дисперсионные. Энергия межмолекулярных взаимодействий намного меньше энергии химической связи.
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи. Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородную связь можно обозначать точками: Н ··· O. Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь. Она характерна прежде всего для соединений фтора с водородом, а также кислорода с водородом, в меньшей степени азота с водородом.
Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H2O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение температуры кипения.
Например, как правило, при повышении молекулярной массы наблюдается повышение температуры кипения веществ. Однако в ряду веществ H2O-H2S-H2Se-H2Te мы не наблюдаем линейное изменение температур кипения.
А именно, у воды температура кипения аномально высокая — не меньше -61оС, как показывает нам прямая линия, а намного больше, +100 оС. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20оС) вода является жидкостью по фазовому состоянию.
Тренировочный тест по теме «Химические связи» — 10 вопросов, при каждом прохождении новые.
365
Создан на
07 января, 2022 От Admin
Тренировочный тест «Химические связи»
1 / 10
Из предложенного перечня веществ выберите два вещества, которые имеют молекулярную кристаллическую решётку.
1) CO2
2) SiO2
3) NH3
4) NaH
5) PbO2
2 / 10
Из предложенного перечня выберите два вещества с ковалентной неполярной химической связью, которые имеют молекулярную кристаллическую решётку.
1) пероксид водорода
2) хлороводород
3) кремний
4) азот
5) графит
3 / 10
Из предложенного перечня выберите два вещества, которые имеют ионную кристаллическую решётку.
1) Na2CO3
2) HBr
3) SO2
4) PCl3
5) (NH4)2SО4
4 / 10
Из предложенного перечня выберите два вещества немолекулярного строения, в которых представлена ковалентная полярная связь.
1) диметиламин
2) бензойная кислота
3) сульфид калия
4) нитрат аммония
5) формиат кальция
5 / 10
Из предложенного перечня выберите два вещества, в которых присутствует ковалентная полярная химическая связь.
1) азот
2) белый фосфор
3) бромоводород
4) оксид серы (IV)
5) оксид калия
6 / 10
Из предложенного перечня выберите два вещества, в которых присутствует ковалентная полярная и ковалентная неполярная химическая связь.
1) этан
2) гидроксид кальция
3) пероксид водорода
4) сульфат натрия
5) оксид натрия
7 / 10
Из предложенного перечня выберите два свойства, которые характеризуют вещества с металлической кристаллической решёткой.
1) высокая электропроводность в кристаллическом состоянии
2) низкая теплопроводность
3) пластичность
4) хрупкость
5) летучесть
Запишите в поле ответа номера выбранных свойств.
8 / 10
Из предложенного перечня выберите два соединения, в которых присутствует ковалентная неполярная химическая связь.
1) PCl3
2) HBr
3) F2
4) H2O2
5) Ba(OH)2
9 / 10
Из предложенного перечня выберите два соединения, между молекулами которых образуется водородная связь.
1) C2H4
2) NH3
3) SiH4
4) CH3OH
5) CH3COOCH3
10 / 10
Из предложенного перечня выберите два вещества, в которых есть водородные связи.
1) ацетат натрия
2) водород
3) сульфат меди (II)
4) глицерин
5) фтороводород
Ваша оценка
The average score is 39%