Описание препарата Иларис® (лиофилизат для приготовления раствора для подкожного введения, 150 мг) основано на официальной инструкции, утверждено компанией-производителем в 2015 году
Дата согласования: 14.08.2015
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Отзывы
Фотографии упаковок

14.08.2015
Действующее вещество
ATX
Фармакологическая группа
Состав
| Лиофилизат для приготовления раствора для подкожного введения | 1 фл. |
| активное вещество: | |
| канакинумаб | 150 мг |
| вспомогательные вещества: L-гистидин — 2,801 мг; L-гистидина гидрохлорида моногидрат — 1,673 мг; полисорбат 80 — 0,6 мг; сахароза — 92,35 мг; кислота хлористоводородная 1 М — до рН 6,5 | |
| если комплектность предполагает включение растворителя: 1 фл. растворителя содержит воды для инъекций — 5 мл |
Описание лекарственной формы
Лиофилизат: лиофилизированный порошок белого цвета.
Фармакологическое действие
Фармакологическое действие
—
иммунодепрессивное.
Фармакодинамика
Канакинумаб — полностью человеческое моноклональное антитело IgG1/каппа изотипа к ИЛ-1β. Канакинумаб с высоким аффинитетом связывается с человеческим ИЛ-lβ, нейтрализуя таким образом его биологическое действие, блокируя взаимодействие ИЛ-1β с его рецепторами, ИЛ-1β-индуцированную активацию генов и продукцию медиаторов воспаления, таких как ИЛ-6 и ЦОГ-2.
При лечении пациентов с системным ювенильным идиопатическим артритом (сЮИА) отмечалось быстрое и продолжительное улучшение суставных и системных проявлений заболевания: значительное уменьшение числа воспаленных суставов, быстрое исчезновение лихорадки и снижение реактантов острой фазы у большинства пациентов.
У 33% пациентов на 29-й день терапии отмечалось улучшение течения заболевания на 100% по педиатрическим критериям Американской коллегии ревматологов в сравнении с отсутствием эффекта в группе плацебо. Применение канакинумаба позволяет существенно снизить или отменить применение ГКС при терапии сЮИА. Канакинумаб позволяет удлинить временной промежуток до обострения заболевания, улучшить качество жизни пациентов и выполнение ими ежедневных задач.
У пациентов с подагрическим артритом и различными фенотипами криопиринассоциированного периодического синдрома (cryopyrin-associated periodic syndrome, CAPS) включая семейный холодовой аутовоспалительный синдром/семейную холодовую крапивницу (Familial Cold Autoinflammatory Syndrome/Familial Cold Urticaria, FCAS/FCU), синдром Макла-Уэльса (Muckle-Wells Syndrome, MWS) и мультисистемное младенческое воспалительное заболевание/хронический младенческий неврологический кожно-артикулярный синдром (Neonatal onset multisystemic inflammatory disease/Chronic infantile neurological cutaneous and articular, NOMID/CINCA), канакинумаб снижает выраженность местных и системных воспалительных реакций, вызванных избыточной продукцией ИЛ-1β. При применении препарата у больных с острым приступом подагрического артрита снижается концентрация лабораторных маркеров воспаления: (С-реактивный белок (СРБ), сывороточный амилоид А (САА), в течение короткого времени уходят признаки воспаления пораженного сустава (боль, отек, покраснение).
На фоне применения препарата Иларис® 150 мг п/к у пациентов с частыми обострениями приступов подагры (как минимум 3 приступа в течение года) было отмечено статистически значимое снижение интенсивности боли (по шкале ВАШ) по сравнению с группой контроля (триамцинолон 40 мг). На фоне применения препарата Иларис® снижение интенсивности боли наблюдается начиная с 24 ч после введения препарата и продолжается в течение 7 дней после введения.
При применении препарата Иларис® было продемонстрировано статистически значимое снижение риска возникновения нового приступа подагры на 62% в течение 12 нед терапии и на 56% в течение 24 нед терапии по сравнению с данными показателями в группе контроля.
Эффективность препарата Иларис® при подагрическом артрите была сопоставима у пациентов в возрасте ≥65 и ≤65 лет.
При применении канакинумаба у больных с различными фенотипами CAPS отмечается уменьшение уже в течение первых суток следующих проявлений заболевания: лихорадки, повышенной утомляемости, кожной сыпи, артралгии, миалгии, головной боли/мигрени, конъюнктивита, слабости, а также снижение (в течение нескольких дней) продукции маркеров воспаления, включая СРБ и САА, и приводит к нормализации числа лейкоцитов и тромбоцитов (в случае их повышения).
При длительном применении канакинумаба (в течение 48 нед) у пациентов с CAPS полный ответ на терапию, определяемый как сочетание уменьшения (до минимальной степени или полного исчезновения) симптомов аутовоспалительного заболевания и поражений кожи (сыпь по типу крапивницы), и снижения показателей СРБ и САА <10 мг/л, наблюдался в 97% случаев в течение 7 дней после начала терапии. При применении канакинумаба у больных не отмечалось развитие рецидивов заболевания (в группе больных, получавших лечение плацебо, рецидивы наблюдались в 81% случаев).
Фармакокинетика
Абсорбция. У взрослых пациентов с различными фенотипами CAPS после однократного п/к введения 150 мг препарата Tmax канакинумаба составляет около 7 дней. Средний конечный T1/2 составляет 26 дней. При п/к введении канакинумаба абсолютная биодоступность — 66% (популяционный фармакокинетический анализ у пациентов с CAPS, включая детей в возрасте от 2 лет). Параметры фармакокинетики (AUC и Cmax) повышаются пропорционально дозе в диапазоне от 0,3 до 10 мг/кг при в/в инфузии или п/к введении (в дозе от 150 до 600 мг).
Распределение. Канакинумаб связывается с сывороточным ИЛ-1β. Vss изменяется в зависимости от массы тела. У пациентов с CAPS Vss составляет 6,2 л при массе тела 70 кг, у пациентов с сЮИА — 3,2 л при массе тела 33 кг и у пациентов с подагрическим артритом — 7,9 л при массе тела 93 кг. При п/к введении препарата в течение 6 мес в дозе 150 мг каждые 8 нед, в дозе 4 мг/кг каждые 4 нед, 150 мг каждые 12 нед коэффициент кумуляции канакинумаба составляет 1,3; 1,6 и 1,1 соответственно.
Выведение. Клиренс изменяется в зависимости от массы тела. Для пациентов с CAPS этот показатель составляет 0,17 л/сут при массе тела 70 кг, у пациента с сЮИА — 0,11 л/сут при массе тела 33 кг, у пациента с подагрическим артритом — 0,23 л/сут при массе тела 93 кг. После учета весовых различий существенная разница в фармакокинетических свойствах канакинумаба у пациентов с подагрическим артритом, различными фенотипами CAPS и сЮИА не была выявлена.
При повторном применении препарата не наблюдается увеличение клиренса или изменение каких-либо других, зависимых от времени, фармакокинетических параметров канакинумаба. При назначении препарата с учетом массы тела, пол и возраст пациентов не оказывают влияние на фармакокинетику препарата.
Особые группы пациентов
Пациенты в возрасте ≤18 лет. У пациентов в возрасте 4 лет и старше после п/к однократного введения препарата в дозе 150 мг или 2 мг/кг Tmax канакинумаба составляет 2–7 дней. Конечный T1/2 канакинумаба у данной категории больных сходен с таковым у взрослых и составляет от 22,9 до 25,7 дня. Результаты популяционного анализа фармакокинетики канакинумаба у детей в возрасте от 2 до 4 лет сходны с таковыми у пациентов 4 лет и старше. Фармакокинетические характеристики у пациентов с CAPS и сЮИА схожи. При п/к введении канакинумаба в дозе 4 мг/кг каждые 4 нед у пациентов с сЮИА значения AUC и Cmax были аналогичны в возрастной группе от 2 до младше 20 лет.
Пациенты в возрасте ≥65 лет. Не была выявлена разница в фармакокинетических параметрах, основанных на клиренсе и Vss, у пациентов старшей возрастной группы и в возрасте менее 65 лет.
Показания
острый подагрический артрит:
— лечение частых острых приступов подагрического артрита и предупреждение развития новых приступов при неэффективности, непереносимости или наличии противопоказаний к применению НПВС и/или колхицина и невозможности проведения терапии повторными курсами ГКС;
криопиринассоциированный периодический синдром у взрослых и детей в возрасте ≥2 лет, включая:
— семейный холодовой аутовоспалительный синдром/семейная холодовая крапивница;
— синдром Макла-Уэльса;
— младенческое мультисистемное воспалительное заболевание/хронический младенческий неврологический кожно-артикулярный синдром;
активная фаза системного ювенильного идиопатического артрита у детей в возрасте ≥2 лет.
Противопоказания
повышенная чувствительность к активному веществу или другим компонентам препарата в анамнезе;
острые инфекционные заболевания;
беременность;
период грудного вскармливания;
дети младше 2 лет (безопасность и эффективность для указанной категории пациентов изучены недостаточно).
С осторожностью: пожилые пациенты; наличие в анамнезе рецидивирующих инфекций или любых состояний, предрасполагающих к развитию инфекции.
Применение при беременности и кормлении грудью
Имеются ограниченные данные по применению препарата Иларис® у пациенток репродуктивного возраста и беременных пациенток. В исследованиях на животных у препарата не была выявлена какая-либо репродуктивная токсичность. Женщинам следует применять надежные методы контрацепции во время терапии препаратом Иларис® и в течение 3 мес после применения последней дозы препарата.
Неизвестно, проникает ли канакинумаб в грудное молоко. При необходимости применения препарата грудное вскармливание следует прекратить.
Способ применения и дозы
П/к в те участки тела, где есть подкожно-жировая клетчатка: в живот, переднюю поверхность бедер, заднебоковую поверхность плеч (см. Указания по применению).
Препарат (лиофилизат) растворяют в 1 мл воды для инъекций (см. Указания по применению).
Подагрический артрит
Рекомендованная доза препарата у взрослых — 150 мг, препарат вводят во время приступа подагрического артрита, одномоментно. Для достижения максимальной эффективности препарат необходимо вводить как можно раньше после начала приступа подагрического артрита.
Пациентам, которые не ответили на первую инъекцию препарата Иларис®, повторно вводить препарат не следует. Пациентам, ответившим на лечение, повторное введение препарата Иларис® возможно как минимум через 12 нед после предыдущей инъекции.
Применять препарат Иларис® для терапии приступов подагрического артрита следует по мере необходимости. Оптимизирование контроля гиперурикемии следует проводить с помощью соответствующих противоподагрических препаратов.
Терапия препаратом может быть инициирована и проводиться только врачом, имеющим опыт диагностики и лечения пациентов с подагрическим артритом.
CAPS
Рекомендованные стартовые дозы препарата Иларис® для пациентов с CAPS:
взрослым и детям ≥4 лет, в зависимости от массы, тела назначают:
— масса тела >40 кг — 150 мг;
— масса тела ≥15 кг и ≤40 кг — 2 мг/кг;
— масса тела ≥7,5 кг и <15 кг — 4 мг/кг.
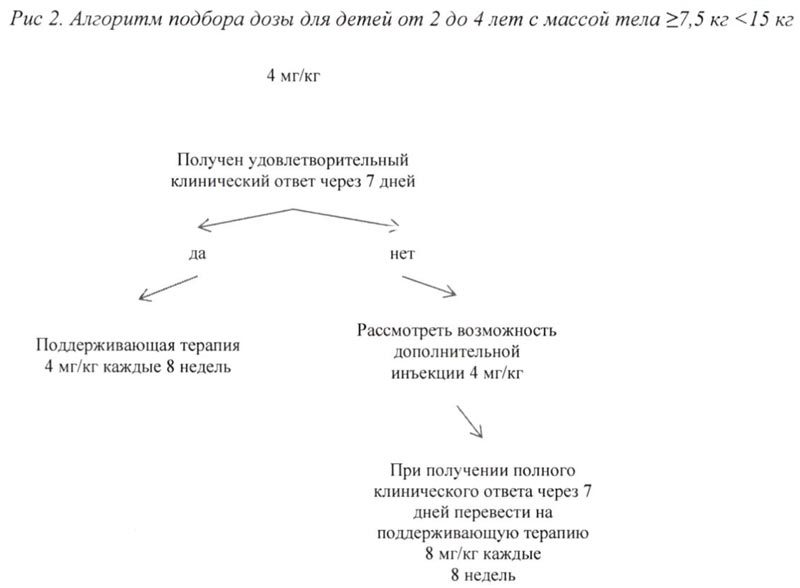
У детей от 2 и <4 лет с массой тела ≥7,5 кг препарат применяют из расчета 4 мг/кг.
Препарат вводят п/к — 1 инъекция с интервалом 8 нед.
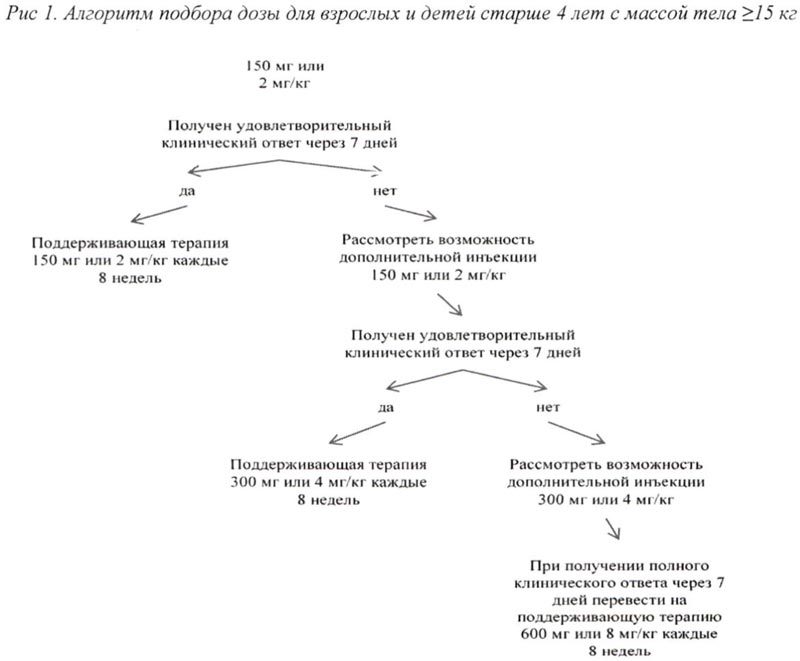
Если у пациентов при стартовой дозе 150 мг или 2 мг/кг не получен удовлетворительный клинический ответ, а именно процесс разрешения сыпи и других симптомов воспаления не наблюдается в течение 7 дней после первой инъекции препарата Иларис®, возможно проведение второй инъекции препарата в дозе 150 мг (при массе тела >40 кг) или 2 мг/кг (при массе тела ≥15 кг и ≤40 кг). При достижении в последующем полного клинического ответа данным пациентам рекомендуется поддерживающая терапия препаратом Иларис® в дозе 300 мг, 1 инъекция с интервалом 8 нед (при массе тела >40 кг) или 4 мг/кг, 1 инъекция с интервалом 8 нед (при массе тела ≥15 кг и ≤40 кг).
Если удовлетворительный клинический эффект не наблюдается в течение 7 дней после повышения дозы, возможно проведение третьей инъекции препарата Иларис® в дозе 300 мг, 1 инъекция с интервалом 8 нед (при массе тела >40 кг) или 4 мг/кг (при массе тела ≥15 кг и ≤40 кг). При достижении в последующем полного клинического ответа данным пациентам рекомендуется поддерживающая терапия препаратом Иларис® в дозе 600 мг, 1 инъекция с интервалом 8 нед (при массе тела >40 кг) или 8 мг/кг (при массе тела ≥15 кг и ≤40 кг), 1 инъекция с интервалом 8 нед.
Если у пациентов при стартовой дозе 4 мг/кг удовлетворительный клинический эффект не наблюдается в течение 7 дней после первой инъекции, возможно проведение второй инъекции препарата Иларис® в дозе 4 мг/кг. При достижении в последующем полного клинического ответа данным пациентам рекомендуется поддерживающая терапия препаратом в дозе 8 мг/кг, 1 инъекция с интервалом 8 нед.
Клинический опыт применения препарата с интервалом дозирования <4 нед или в дозе >600 мг или 8 мг/кг ограничен.
Повышение дозы препарата Иларис® требовалось наиболее часто для пациентов с NOMID/CINCA по сравнению с FCAS или MWS.
Терапия препаратом может быть инициирована и проводиться только врачом, имеющим опыт диагностики и лечения пациентов с CAPS.
При сЮИА рекомендованная доза у пациентов с массой тела ≥7,5 кг составляет 4 мг/кг (с увеличением до 300 мг) каждые 4 нед в виде п/к инъекции.
После обучения технике п/к инъекций пациенты или лица, за ними ухаживающие, могут самостоятельно вводить препарат под надлежащим контролем (если врач сочтет это необходимым). Пациенты или лица, ухаживающие за ними, должны быть проинструктированы по технике приготовления раствора и правилам пользования шприцами и иглами, пригодными для проведения инъекции.
Особые группы пациентов
Пациенты ≥65 лет. Не требуется коррекция дозы препарата у пациентов в возрасте ≥65 лет.
Пациенты ≤18 лет. Подагрический артрит — нет данных по применению препарата Иларис® для лечения подагрического артрита у детей и подростков ≤18 лет. CAPS и сЮИА — опыт применения канакинумаба у детей младше 2 лет ограничен.
Нарушение функции почек. Не требуется коррекция дозы препарата у пациентов с нарушениями функции почек (опыт клинического применения у таких пациентов ограничен).
Нарушение функции печени. У пациентов с нарушениями функции печени эффективность и безопасность применения препарата не изучались. Так как препарат Иларис® — человеческий IgG, предполагается, что печеночная недостаточность не влияет на фармакокинетику данного препарата.
Указания по применению
I. Препарат Иларис®, в комплектации флакон с лиофилизатом без растворителя
Следует учесть, что подготовка к инъекции составляет около 30 мин.
Перед началом необходимо: найти чистое, удобное место для проведения инъекции; вымыть руки с мылом; проверить даты срока годности на флаконах и шприцах; не использовать препарат при истекшем сроке годности (последний день месяца, указанного на флаконе); всегда использовать новые неоткрытые иглы и шприцы; избегать касания игл и верхних частей флаконов.
Следует подготовить необходимые материалы: 1 фл. с лиофилизатом препарата Иларис® (хранить охлажденным при температуре от 2 до 8°C), входит в состав упаковки.
Для проведения инъекции помимо флакона с препаратом Иларис® необходимо: 1 фл. с водой для инъекции; 1 шприц (объемом 1 мл); 1 большая игла (50 мм) для приготовления раствора (игла для разведения); 1 маленькая игла для п/к инъекции (13 мм), спиртовые тампоны; чистые, сухие ватные тампоны; лейкопластырь; контейнер для использованных флаконов, игл и шприца.
Приготовление раствора препарата Иларис®
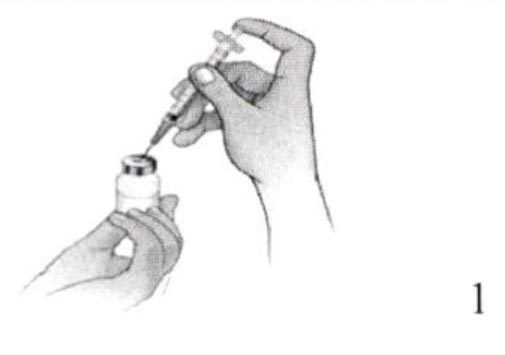
1. Снять защитную крышку с флакона с препаратом Иларис® и растворителем, не трогая руками пробки флаконов. Протереть их спиртовым тампоном.
2. Открыть упаковку с шприцем и иглой для разведения. Надеть иглу на шприц.
3. Аккуратно снять с иглы защитный колпачок и отложить его в сторону. Оттянуть поршень шприца назад до отметки 1 мл, заполняя шприц воздухом. Ввести иглу во флакон с водой для инъекции через центр резиновой пробки.
4. Осторожно надавливать на поршень шприца сверху вниз, чтобы воздух вошел во флакон с водой.
5. Перевернуть флакон с вставленными в него иглой и шприцем и поднести к глазам.
6. Убедиться в том, что конец иглы покрыт водой, и медленно передвигать поршень шприца вниз, немного ниже отметки 1 мл. Если возникли пузырьки воздуха в шприце, удалить их, согласно инструкциям, полученным от медицинского работника.
7. Убедиться, что 1 мл воды для инъекций находится в шприце, а затем вытащить иглу из флакона (во флаконе останется вода — это нормально).
8. Вставить иглу с шприцем в центр пробки флакона с препаратом Иларис®, стараясь не трогать иглу и пробку флакона, и медленно выпустить всю воду (1 мл) из шприца во флакон.
9. Осторожно извлечь шприц с иглой из флакона, надеть на иглу защитный колпачок.
10. Не дотрагиваясь до резиновой пробки флакона, наклонить его под углом 45° и вращать в течение 1 мин. Не встряхивать. Затем отставить флакон на 5 мин.
11. Затем аккуратно повращать флакон во фронтальной плоскости 10 раз, не дотрагиваясь до резиновой пробки.
12. Снова отставить флакон на 15 мин, при комнатной температуре, для получения прозрачного раствора. Не встряхивать. Не использовать раствор, если в нем присутствуют посторонние частицы.
13. Убедиться, что весь раствор находится внизу флакона. Если капли раствора остались на пробке, слегка постучать по стенке флакона. Раствор должен быть прозрачным и свободным от посторонних видимых частиц. Если приготовленный раствор не используется сразу, необходимо поставить его в холодильник (при температуре 2–8 °С) и использовать в течение 24 ч.
Подготовка к инъекции
14. Протереть резиновую пробку флакона с приготовленным раствором препарата Иларис® новым спиртовым тампоном.
15. Снять защитный колпачок с иглы (игла для приготовления раствора), оттянуть поршень шприца до отметки 1 мл, набрав тем самым в него воздух. Вставить иглу в центр резиновой пробки флакона с препаратом Иларис® и выпустить в него весь воздух из шприца (не выпускать воздух непосредственно в раствор).
16. Не переворачивать флакон с шприцем. Опустить иглу до дна флакона.
17. Наклонить флакон, чтобы было возможно набрать необходимое количество раствора. Примечание: требуемое количество соответствует назначенной дозе (от 0,2 до 1 мл).
18. Медленно оттягивая поршень до необходимой метки (от 0,2 до 1 мл), набрать требуемое количество приготовленного раствора препарата Иларис®. Необходимо соблюдать осторожность, чтобы воздух не попал в шприц с раствором. Убедиться, что в шприце находится необходимое для инъекции количество раствора.
19. Извлечь шприц с иглой из флакона (неиспользованный раствор препарата Иларис® может остаться во флаконе). Надеть защитный колпачок на иглу, с помощью которой набирали препарат, и снять ее со шприца. Убрать иглу в специальный контейнер. Открыть упаковку с инъекционной иглой и надеть ее на шприц. Отложить шприц в сторону.
Проведение инъекции
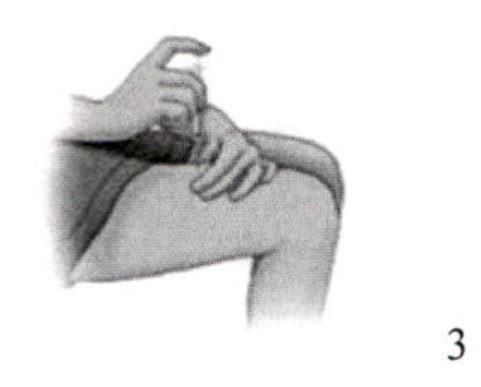
20. Выбрать место для инъекции: верхняя часть плеча, верхняя часть бедра, живот или ягодица. Не делать инъекцию в то место, где наблюдаются покраснение, сыпь, гематома, нарушение целостности кожных покровов или поверхность кожи неровная. Избегать инъекции в рубцовую ткань, т.к. это может послужить причиной недостаточной экспозиции канакинумаба. Избегать попадания в кровеносный сосуд.
21. Протереть предполагаемое место инъекции новой спиртовой салфеткой и подождать, чтобы поверхность кожи стала сухой. Снять защитный колпачок с инъекционной иглы.
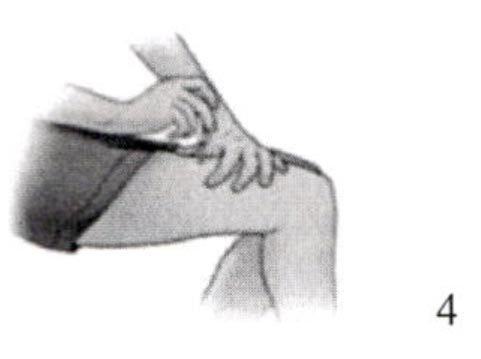
22. Осторожно сжать кожу над местом инъекции. Взять шприц под углом 90° и аккуратным плавным движением ввести иглу полностью в кожу.
23. Не вынимать иглу до тех пор, пока полностью не введен препарат. Отпустить кожную складку и извлечь иглу. Не использовать шприц и иглу повторно. Использованные иглы и шприц убрать в специальный контейнер.
После инъекции
24. Не протирать место инъекции. Если в месте инъекции отмечается кровоточивость, с помощью сухого тампона слегка надавить на место инъекции и подержать его в таком положении в течение 1–2 мин или до тех пор, пока кровоточивость не прекратится. Затем заклеить место инъекции пластырем.
25. Убрать использованные иглы и шприц в специальный контейнер для последующей утилизации. Никогда не использовать повторно шприц и иглу. Ни остатки раствора, ни остатки воды для инъекции не могут быть использованы еще раз. Каждый раз необходимо убедиться, что емкости с остатками воды для инъекции и препаратом Иларис® (если он остается) выброшены. Убедиться, что дети не смогут достать контейнер с использованными иглами и шприцем.
II. Препарат Иларис®, в комплектации флакон с лиофилизатом в комплекте с растворителем
Содержимое готового набора: флакон с порошком; флакон с растворителем; шприц для инъекции на 1 мл; безопасная игла; адаптер флакона (2 шт.); очищающие (спиртовые) салфетки (4 шт.).
Смешивание препарата Иларис® с растворителем
1. Снять с флакона с порошком отщелкивающуюся крышку, после чего протереть резиновую пробку свежей очищающей салфеткой. Примечание: не дотрагиваться до протертой резиновой пробки.
2. Взять один из блистер-лотков с адаптерами флаконов и, крепко удерживая блистер-лоток, полностью удалить с него пленочную крышку. Необходимо соблюдать осторожность и не дотрагиваться до адаптера флакона. Не вынимать адаптер флакона из блистер-лотка.
3. Поставить флакон с порошком на ровную поверхность. Держась за блистер-лоток, поместить адаптер флакона на верхушку флакона с порошком и протолкнуть его до конца вниз, пока он не защелкнется на флаконе.
4. Удерживая блистер-лоток за его верхнюю часть, приподнять его вертикально вверх и удалить блистер-лоток с адаптера флакона. Примечание: если адаптер флакона поставлен неправильно, не следует дотрагиваться до него. Перед тем как исправить положение адаптера снова поместить на него блистер-лоток.
5. Чтобы присоединить второй адаптер на флакон с растворителем, содержащий воду для инъекций, повторить п. 1–4. Примечание: теперь на обоих флаконах надеты адаптеры, и они готовы к использованию.
6. После того, как адаптеры надеты на оба флакона, раскрыть упаковку шприца, стянув с нее пленку, и вынуть шприц. Стараясь не дотрагиваться до кончика шприца, оттянуть поршень вниз, впустив в шприц 1 мл воздуха. Примечание: заполнение шприца воздухом (1 мл) облегчает последующий забор в шприц воды для инъекций и уменьшает образование пузырьков воздуха.
7. Взять флакон с растворителем и аккуратно навинтить шприц на адаптер флакона. Не прикладывать усилий. Примечание: необходимо соблюдать осторожность и не дотрагиваться до кончика шприца или адаптера флакона. На этом этапе игла не требуется.
8. Медленно протолкнуть поршень вниз до самого конца, чтобы ввести во флакон с растворителем 1 мл воздуха. Удерживать поршень в этом положении.
9. Перевернуть шприц так, чтобы флакон с растворителем оказался дном вверх, и поднять его на уровень глаз. Медленно потянуть за поршень вниз с тем, чтобы отобрать в шприц 1 мл воды. Продолжая удерживать флакон в направлении дном вверх, проверить, нет ли в шприце крупных пузырьков воздуха.
10. Удалить из шприца крупные пузырьки воздуха, для чего выполнить следующую процедуру: слегка постучать по шприцу с тем, чтобы крупные пузырьки воздуха поднялись наверх. Аккуратно протолкнуть поршень вверх с тем, чтобы крупные пузырьки воздуха вошли во флакон. Снова медленно оттянуть поршень назад до отметки 1 мл. Повторять эти действия до тех пор, пока не будут удалены все крупные пузырьки. Убедиться в том, что в шприце содержится 1 мл воды. Держась за поршень, свинтить шприц с флакона, предварительно поставленного на чистую и ровную поверхность во избежание разбрызгивания. Примечание: часть воды останется во флаконе с растворителем.
11. Поставить флакон с порошком на чистую и ровную поверхность. Навинтить на адаптер флакона шприц, содержащий 1 мл воды. Не прикладывать усилий. Примечание: следует соблюдать осторожность и не касаться пальцами кончика шприца или верхней части флакона. На этом этапе игла не требуется.
12. Медленно протолкнуть поршень вниз до самого конца, чтобы перенести 1 мл воды из шприца во флакон с порошком. Шприц пока не отсоединять.
13. Совершая круговые движения, медленно повращать шприц вместе с флаконом под углом 45° в течение по крайней мере 1 мин, не следует встряхивать шприц и флакон.
14. Поставить флакон вместе со шприцем на ровную поверхность и оставить их на 5 мин. Примечание: поршень может немного подняться. Это может случиться, поскольку давление во флаконе слегка повышено.
15. По прошествии 5 мин снова протолкнуть поршень шприца до конца вниз. Аккуратно перевернуть флакон вместе со шприцем 10 раз в вертикальной плоскости. Ни в коем случае не встряхивать шприц и флакон.
16. Дать флакону вместе со шприцем постоять еще 15 мин. По прошествии 15 мин, не встряхивая флакон, убедиться в том, что раствор не мутный и не содержит частиц. Наверху раствора может присутствовать пена; это не должно вызывать беспокойства и не является помехой для выполнения следующего этапа. Если в растворе все еще присутствуют частицы, повторить п. 15, описанный выше, после чего оставить флакон со шприцем еще на 5 мин, а затем снова проверить, нет ли в растворе частиц. Если раствор не мутный и не содержит частиц, отобрать назначенную дозу, как описано в следующем разделе. Примечание: если раствор не используется сразу после приготовления, его следует поставить в холодильник (при температуре 2–8 °C) и использовать в течение 24 ч.
Подготовка к инъекции
17. Перевернуть флакон вместе со шприцем дном вверх и аккуратно оттянуть поршень вниз с тем, чтобы отобрать в шприц 1 мл раствора. Шприц пока не отсоединять.
Медленно протолкнуть поршень до самого конца, чтобы перенести весь раствор обратно во флакон. Примечание: цель данного этапа — обеспечить полное перемешивание раствора и уменьшить образование пузырьков воздуха.
18. Поднять шприц на уровень глаз и снова медленно оттянуть поршень назад, чтобы отобрать требуемый объем раствора. Примечание: требуемое количество зависит от дозы, которую необходимо ввести (от 0,2 до 1 мл). Какой именно объем раствора нужно вводить, скажет врач. Продолжая удерживать флакон дном вверх, проверить, нет ли в растворе, набранном в шприц, крупных пузырьков воздуха (при этом часть раствора может остаться во флаконе).
19. Удалить из раствора крупные пузырьки воздуха, для чего выполнить следующую процедуру: слегка постучать по шприцу с тем, чтобы крупные пузырьки воздуха поднялись наверх; аккуратно протолкнуть поршень вверх с тем, чтобы крупные пузырьки воздуха вошли во флакон; снова медленно оттянуть поршень назад до отметки, соответствующей назначенной дозе. Повторять эти действия до тех пор, пока не будут удалены все крупные пузырьки. Удостовериться, что объем раствора в шприце соответствует назначенной дозе. Держась за поршень, свинтить шприц с флакона, предварительно поставленного на чистую и ровную поверхность во избежание разбрызгивания. Положить приготовленный шприц на чистую и ровную поверхность. Примечание: не следует дотрагиваться до кончика шприца.
20. Вынуть безопасную иглу из блистерной упаковки и навинтить ее на приготовленный шприц. Примечание: не следует дотрагиваться до кончика шприца или иглы. Переместить откидной предохранитель в направлении корпуса шприца.
Техника проведения инъекции, выбор места инъекции, поведение после инъекции — см. выше, в разделе I.
Побочные действия
При применении препарата Иларис® в ходе клинических исследований отмечалось повышение частоты инфекционных заболеваний, преимущественно инфекций верхних дыхательных путей. Течение инфекционных заболеваний чаще всего было легким или средней степени тяжести, однако отмечались и случаи тяжелого течения инфекционных заболеваний. Наблюдались изолированные случаи развития редких или оппортунистических инфекций на фоне приема препарата Иларис®, однако связь данных заболеваний с приемом препарата неизвестна.
Для оценки частоты нежелательных явлений (НЯ), выявленных в плацебо-контролируемых клинических исследованиях (при применении препарата для лечения CAPS в дозе 150 мг при массе тела >40 кг и 2 мг/кг при массе тела ≥15 кг и ≤40 кг и при лечении сЮИА у пациентов в возрасте от 2 до 20 лет) и для лечения острых приступов подагрического артрита в дозах от 10 до 300 мг в активно-контролируемых исследованиях, использованы следующие критерии (согласно классификации ВОЗ): очень часто (≥1/10 назначений); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000); частота неизвестна (недостаточно данных для оценки частоты развития).
Подагрический артрит
Инфекционные и паразитарные заболевания: очень часто — инфекции (в частности назофарингит, синусит, вирусные инфекции верхних дыхательных путей, бронхит, пневмония, фарингит, грипп, инфекции мочевыводящих путей, инфекции уха, гастроэнтерит, панникулит).
Со стороны нервной системы: часто — головокружение/вертиго.
Со стороны костно-мышечной системы: часто — боль в спине.
Со стороны пищеварительной системы: нечасто — гастроэзофагеальная рефлюксная болезнь.
Общие нарушения и реакции в месте введения: часто — общая слабость/повышенная утомляемость.
Реакции в месте введения наблюдались у 1,2% пациентов, получавших лечение препаратом Иларис® в клинических исследованиях.
Изменения лабораторных показателей
Общий анализ крови. Снижение количества лейкоцитов равное или менее 0,8 × нижняя граница нормы отмечалось у 6,7% пациентов, получавших лечение препаратом Иларис®, по сравнению с 1,4% пациентов, получавших триамцинолон. Снижение абсолютного количества нейтрофилов ниже 1 × 109/л отмечалось у 2% пациентов в сравнительных исследованиях по подагрическому артриту. Наблюдались также изолированные случаи снижения количества нейтрофилов ниже 0,5 × 109/л. В 12,7% случаев на фоне терапии канакинумабом наблюдалось легкое и преходящее снижение количества тромбоцитов (в пределах от 75 × 109/л) до нижней границы нормы (у препарата сравнения данное снижение наблюдалось в 7,7% случаев).
Мочевая кислота. На фоне терапии канакинумабом наблюдается преходящее повышение концентрации мочевой кислоты (примерно на 0,6 мг/дл). Препарат Иларис® не уменьшает способность противоподагрических средств снижать концентрацию мочевой кислоты при совместном применении.
АСТ/АЛТ. На фоне терапии канакинумабом возможно развитие слабо и умеренно выраженного повышения активности АСТ/АЛТ.
Триглицериды. На фоне терапии канакинумабом в среднем наблюдается повышение концентрации триглицеридов в плазме крови на 33,5 мг/дл, а в группе применения триамцинолона незначительное снижение на 3,1 мг/дл. Повышение концентрации триглицеридов более чем в 5 раз (по сравнению с ВГН) отмечалось в 2,4% случаев в группе применения канакинумаба и в 0,7% случаев в группе применения триамцинолона. Клиническая значимость данного наблюдения неизвестна.
CAPS
Инфекционные и паразитарные заболевания: очень часто — назофарингит; часто — инфекции мочевыводящих путей; инфекции верхних дыхательных путей, вирусная инфекция.
Со стороны нервной системы: очень часто — головокружение/вертиго1.
Со стороны кожи и подкожных тканей: очень часто — реакция в месте введения препарата2.
1 Симптомы вертиго в некоторых случаях рассматривались как серьезные НЯ, все эпизоды вертиго разрешались, несмотря на продолжение терапии препаратом.
2 НЯ было выявлено с помощью опросника для врача.
В ходе длительных открытых исследований с эскалацией дозы отмечалось повышение частоты инфекционных заболеваний (гастроэнтерит, инфекции дыхательных путей, в т.ч. верхних дыхательных путей), тошноты и головокружения в группе пациентов, получающих дозы препарата 600 мг или 8 мг/кг, по сравнению с группами, получающими другие дозы препарата.
Изменения лабораторных показателей
Общий анализ крови. При применении препарата в клинических исследованиях у пациентов с CAPS отмечалось повышение гемоглобина и снижение числа лейкоцитов, нейтрофилов и тромбоцитов. Однако данные изменения были, вероятно, связаны со снижением выраженности воспалительного процесса на фоне терапии препаратом и не имели клинической значимости.
Ферменты печени. В редких случаях у больных с CAPS, получавших лечение препаратом, наблюдалось повышение активности печеночных трансаминаз.
Билирубин. В ряде случаев на фоне терапии препаратом у пациентов с CAPS отмечалось бессимптомное незначительное увеличение содержания билирубина в сыворотке крови, не сопровождающееся повышением активности печеночных трансаминаз.
сЮИА
Инфекционные и паразитарные заболевания: очень часто — инфекции (в частности назофарингит, вирусные инфекции верхних дыхательных путей, пневмония, ринит, фарингит, тонзиллит, синусит, инфекции мочевыводящих путей, гастроэнтерит, вирусная инфекция).
Со стороны пищеварительной системы: очень часто — боль в верхней части живота.
Со стороны кожи и подкожных тканей: очень часто — реакция в месте введения препарата легкой степени тяжести1; часто — реакция в месте введения препарата средней степени тяжести1.
1 Не приводило к прекращению исследования.
Изменения лабораторных показателей
Общий анализ крови. Снижение числа лейкоцитов ≤0,8 × нижняя граница нормы отмечалось у 10,4% пациентов, получавших лечение препаратом Иларис®, по сравнению с 4% в группе плацебо.
Транзиторное снижение абсолютного количества нейтрофилов <1 × 109/л отмечалось у 6% пациентов, получавших лечение препаратом Иларис®, по сравнению с 2% в группе плацебо. Отмечался один случай снижения абсолютного количества нейтрофилов <0,5 × 109/л при лечении препаратом Иларис®.
Умеренное и транзиторное снижение в пределах от 75 × 109/л до нижней границы нормы тромбоцитов отмечалось у 6,3% пациентов, получавших препарат Иларис®, по сравнению с 2% в группе плацебо.
Ферменты печени. Трехкратное повышение АЛТ и/или ACT по сравнению с ВГН отмечалось у 4,1% пациентов, получавших лечение препаратом Иларис®, по сравнению с 2% в группе плацебо. При последующем обследовании отмечалась нормализация показателей.
Реакции гиперчувствительности
При применении препарата Иларис® в клинических исследованиях сообщалось о нежелательных явлениях, расцененных врачами как реакции гиперчувствительности. В большинстве случаев данные реакции были выражены в легкой степени. При применении препарата не наблюдалось развитие анафилактоидных или анафилактических реакций. Однако при назначении препарата Иларис® нельзя исключить риск развития тяжелых реакций гиперчувствительности, которые могут отмечаться при инъекционном введении препаратов белкового происхождения. У пациентов, получавших лечение препаратом Иларис® по поводу CAPS, сЮИА и подагрического артрита, выявлялись антитела к препарату в 1,5; 3 и 2% случаев соответственно. Взаимосвязь между образованием антител, клиническим ответом и развитием нежелательных явлений не выявлена.
Особые группы пациентов
Применение у больных в возрасте ≤18 лет (пациенты с CAPS). У детей от 2 до 17 лет не наблюдались клинически значимые отличия в безопасности и переносимости препарата Иларис®, включая общую частоту и тяжесть инфекций, в сравнении с общей популяцией больных. Наиболее часто у детей наблюдались инфекции верхних дыхательных путей.
Применение у больных ≥65 лет. Не были выявлены различия в профиле безопасности препарата у данной группы больных.
Пациент должен быть информирован о необходимости обращения к врачу в случае развития сильных побочных реакций, в т.ч. не указанных в инструкции.
Взаимодействие
Специальные исследования по взаимодействию препарата Иларис® с другими лекарственными препаратами не проводились. Поскольку экспрессия в печени изоферментов системы цитохрома Р450 может быть подавлена цитокинами, стимулирующими хроническое воспаление, такими как ИЛ-1β, то при назначении мощных ингибиторов цитокинов экспрессия в печени изоферментов системы цитохрома Р450 может быть нормализована. Это является клинически значимым для препаратов, метаболизирующихся с помощью изоферментов системы цитохрома Р450 и имеющих узкий терапевтический индекс, когда доза препарата подбирается индивидуально. При назначении препарата Иларис® пациентам, принимающим такие препараты, их дозу следует при необходимости корректировать (в зависимости от их клинического эффекта и концентрации действующего вещества в плазме крови).
В клинических исследованиях отмечено безопасное применение Иларис® с противоподагрическими средствами.
Препарат не рекомендуется назначать одновременно с ингибиторами ФНО и другими блокаторами ИЛ-1, поскольку их использование на фоне применения препарата Иларис® повышает риск развития тяжелых инфекций.
Данные о влиянии вакцинации живыми вакцинами, а также о возможной вторичной передаче инфекции пациентам, получающим лечение препаратом, отсутствуют. Вакцинировать больных, получающих лечение препаратом Иларис®, живыми вакцинами следует только в случае, когда польза от вакцинации превышает возможный риск. Рекомендуется, чтобы иммунизация была проведена (согласно календарю прививок) до начала терапии препаратом Иларис® (включая пневмококковую вакцину и инактивированную вакцину против гриппа). В случае необходимости вакцинацию живыми вакцинами проводят после начала терапии препаратом (по крайней мере через 3 мес после последней инъекции препарата и за 3 мес до следующей).
Данные проведенных клинических исследований у взрослых здоровых добровольцев показывают, что однократное введение препарата Иларис® в дозе 300 мг не влияет на начало выработки антител и персистенцию поствакцинального ответа при вакцинации против гриппа и менингококковой инфекции (гликозилированной белковой вакциной).
Передозировка
О подтвержденных случаях передозировки препарата не сообщалось.
Лечение: следует обеспечить наблюдение за больным с целью выявления возможных НЯ, а также при необходимости назначить соответствующую симптоматическую терапию.
Особые указания
Опыт применения препарата Иларис® у пациентов с CAPS без установленной мутации в NLRP3-гене ограничен.
Нейтропения
На фоне терапии ингибиторами ИЛ-1, включая препарат Иларис®, нейтропения (абсолютное число нейтрофилов (АЧН) ниже 1,5 × 109/л) в основном отмечалась у пациентов с другими заболеваниями, а не различными фенотипами CAPS. До начала лечения препаратом, через 1–2 мес после начала и периодически во время терапии препаратом необходимо проводить стандартный общеклинический анализ крови с целью выявления нейтропении. У пациентов с нейтропенией лечение препаратом Иларис® следует начинать только после нормализации числа нейтрофилов. При выявлении снижения АЧН на фоне терапии препаратом следует обеспечить надлежащий контроль состояния пациентов и при необходимости рассмотреть вопрос о прекращении лечения препаратом.
Злокачественные новообразования
Имеются сообщения о случаях развития злокачественных новообразований у пациентов, получающих терапию препаратом Иларис®, однако риск развития злокачественных новообразований на фоне терапии антителами, связывающими ИЛ-1, неизвестен.
Инфекционные заболевания
Применение препарата Иларис® может сопровождаться увеличением частоты серьезных инфекций, поэтому пациенты должны находиться под наблюдением врача с целью выявления симптомов инфекции во время и после терапии препаратом. Лечение препаратом Иларис® не следует начинать или продолжать у пациентов с активной инфекцией. При применении препарата Иларис® отмечались единичные случаи оппортунистических инфекций (в т.ч. аспергиллез, атипичные инфекционные заболевания микобактериальной этиологии, опоясывающий лишай). Невозможно исключить причинно-следственную связь между данными явлениями и применением препарата. При применении препарата приблизительно у 12% пациентов с различными фенотипами CAPS наблюдались положительные результаты туберкулиновой пробы без каких-либо признаков туберкулезной инфекции (латентной или активной). Нет данных об увеличении риска реактивации туберкулезной инфекции при лечении моноклональными антителами к ИЛ-1 (например препаратом Иларис®). Перед применением препарата Иларис® необходимо провести обследование всех пациентов с целью выявления активной или латентной туберкулезной инфекции, включая сбор анамнеза и проведение соответствующих скрининговых тестов, например туберкулиновой пробы, тестов IGRA (Interferon-Gamma-Release-Assay) или рентгенологического исследования грудной клетки. Во время лечения препаратом следует тщательно контролировать состояние пациентов с целью выявления туберкулезной инфекции. Рекомендовано информировать пациентов о необходимости обращаться к врачу при появлении следующих симптомов на фоне и после терапии препаратом Иларис®: длительно сохраняющийся кашель, потеря веса, субфебрильная температура. В случае конверсии туберкулинового теста из негативного в позитивный, особенно у пациентов высокого риска, необходимо провести альтернативные скрининговые тесты. При выявлении туберкулезной инфекции лечение препаратом Иларис® не следует начинать или продолжать.
Синдром активации макрофагов у пациентов с сЮИА
Синдром активации макрофагов — известное жизнеугрожающее состояние, которое может развиваться у пациентов с ревматическими заболеваниями, в частности у пациентов с сЮИА и требовать интенсивной терапии. Врачам следует внимательно относиться к симптомам инфекции или ухудшению течения сЮИА, известными как пусковой механизм для синдрома активации макрофагов. Данные клинических исследований указывают на то, что препарат Иларис®, по всей вероятности, не увеличивает риск развития синдрома активации макрофагов у пациентов с сЮИА, однако не позволяют сделать окончательные выводы.
Влияние на способность управлять транспортными средствами и работать с механизмами. Пациентам, у которых на фоне применения препарата Иларис® возникает вертиго, следует воздержаться от управления транспортными средствами или механизмами до полного исчезновения данного нежелательного явления.
Форма выпуска
Лиофилизат для приготовления раствора для подкожного введения, 150 мг. Во флаконе бесцветного стекла вместимостью 6 мл, укупоренном резиновой пробкой, обкатанной алюминиевым колпачком с пластиковой крышкой. По 1 фл. в пачке.
Лиофилизат для приготовления раствора для подкожного введения, 150 мг с растворителем — вода для инъекций.
1-й пластиковый поддон содержит: флакон с лиофилизатом — флакон бесцветного стекла (тип 1, Ph. Eur./USP), вместимостью 6 мл, укупоренный резиновой пробкой, обкатанный алюминиевым колпачком с пластиковой отщелкивающейся крышкой (flip-off устройство). Флакон с растворителем — во флаконе бесцветного стекла (тип 1, Ph. Eur./USP) вместимостью 6 мл, укупоренном резиновой пробкой, обкатанном алюминиевым колпачком с пластиковой отщелкивающейся крышкой (flip-off устройство), 5 мл воды для инъекций.
2-й пластиковый поддон содержит комплект устройств для инъекций: 1 стерильный шприц с системой Луер-Лок, 1 безопасную стерильную иглу для инъекций, 2 адаптера Луер-Лок к флакону, 4 спиртовые салфетки.
2 пластиковых поддона в пачке.
Производитель
Новартис Фарма Штейн АГ. Лихтштрассе 35, 4056, Базель, Швейцария.
Владелец регистрационного удостоверения: Новартис Фарма АГ. Швейцария.
Дополнительную информацию о препарате можно получить по адресу: 125315, Москва, Ленинградский пр-т, 72, корп. 3.
Тел.: (495) 967-12-70; факс: (495) 967-12-68.
Условия отпуска из аптек
По рецепту.
Условия хранения
В защищенном от света месте, при температуре 2–8 °C (не замораживать).
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Иларис — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-005320
Торговое наименование:
Иларис®
Международное непатентованное наименование (МНН):
канакинумаб
Лекарственная форма:
раствор для подкожного введения.
Состав:
1 мл препарата содержит:
действующее вещество: канакинумаб 150,00 мг;
вспомогательные вещества: маннитол, гистидин/гистидина гидрохлорида моногидрат, полисорбат-80, вода для инъекций.
Описание:
От бесцветного до светло-коричневато-желтого цвета прозрачный или опалесцирующий раствор.
Фармакотерапевтическая группа
Иммунодепрессивное средство – антитела моноклональные к интерлейкину-1β.
Код ATX:
L04AC08.
Фармакологические свойства
Механизм действия
Канакинумаб – человеческое моноклональное антитело IgGl/каппа изотипа к интерлейкину-1β (ИЛ-1β). Канакинумаб с высоким аффинитетом связывается с человеческим ИЛ-1β, нейтрализуя, таким образом, его биологическое действие, блокируя взаимодействие ИЛ-1β с его рецепторами, ИЛ-1β-индуцированную активацию генов и продукцию медиаторов воспаления, таких как ИЛ-6 и циклооксигеназа-2. Таким образом, канакинумаб подходит для коррекции заболеваний и состояний, характеризующихся гиперпродукцией ИЛ-1β на местном или системном уровне.
Фармакодинамика
Избыточная продукция ИЛ-1β при воспалительных заболеваниях может приводить к развитию местного или системного воспалительного процесса, избыточной продукции С-реактивного белка (СРБ) или сывороточного амилоида А (САА) и лихорадки.
Криопирин-ассоциированный периодический синдром (cryopyrin-associated periodic syndrome, CAPS)
У пациентов с различными фенотипами CAPS, включая семейный холодовой аутовоспалительный синдром/семейную холодовую крапивницу (Familial Cold Autoinflammatory Syndrome/ Familial Cold Urticaria, FCAS/FCU), Синдром Макла-Уэлъса (Muckle-Wells Syndrome, MWS) и мультисистемное младенческое воспалительное заболевание/хронический младенческий неврологический кожно-артикулярный синдром (Neonatal onset multisystemic inflammatory disease/Chronic infantile neurological cutaneous and articular syndrome, NOMID/C1NCA), с избыточной неконтролируемой продукцией ИЛ-1β (что проявляется лихорадкой, повышенной утомляемостью, кожной сыпью, артритом, выраженным лейкоцитозом, большим количеством тромбоцитов, а также увеличением концентрации СРБ) отмечен быстрый ответ на терапию канакинумабом. На фоне терапии препаратом такие явления как повышенная концентрация СРБ, САА, лейкоцитоз и повышенное количество тромбоцитов быстро возвращались к нормальному уровню.
Болезнь Стилла у взрослых и юношеский артрит с системным началом (системный ювенильный идиопатический артрит, сЮИА, классификация ILAR, международной лиги ревматологических ассоциаций)
Болезнь Стилла у взрослых и сЮИА – тяжелые аутовоспалительные заболевания, которые обусловлены врожденным иммунитетом посредством провоспалительных цитокинов, ключевым среди которых является ИЛ-1β.
Общие проявления болезни Стилла взрослых и сЮИА включают лихорадку, кожную сыпь, гепатоспленомегалию, лимфаденопатию, полисерозит и артрит. Лечение препаратом у большинства данных пациентов приводило к быстрому и устойчивому улучшению со стороны суставных и системных проявлений сЮИА со значительным уменьшением количества воспаленных суставов, быстрому разрешению лихорадки и уменьшению концентрации реактантов острой фазы.
Подагрический артрит
Обострение подагрического артрита обусловлено активацией тканевых макрофагов и одновременной гиперпродукцией ИЛ-1β, что приводит к острому воспалительному ответу с выраженным болевым синдромом. Продукция ИЛ-1β провоцируется отложением кристаллов солей мочевой кислоты (мононатрия урат моногидрата) в суставах и окружающих тканях, что приводит к активации комплексов «NALP3-инфламосома». Такие активаторы врожденного иммунитета, как эндогенные агонисты толл-подобных рецепторов, также могут вносить свой вклад в активацию транскрипции гена ИЛ-1β, инициируя обострение подагрического артрита. После терапии канакинумабом в течение короткого времени отмечается снижение концентрации лабораторных маркеров воспаления (СРБ, САА), и исчезают признаки воспаления пораженного сустава (боль, отек, покраснение).
Фармакокинетика
Всасывание
У взрослых пациентов с различными фенотипами CAPS после однократного подкожного (п/к) введения 150 мг канакинумаба время достижения максимальной концентрации (Сmax) составляет около 7 дней. Средний конечный период полувыведения составляет 26 дней. При п/к введении канакинумаба абсолютная биодоступность составляет 66% (популяционный фармакокинетический анализ у пациентов с CAPS, включая детей в возрасте от 2 лет). Параметры фармакокинетики (площадь под кривой «концентрация – время» (AUC) и Сmax) повышаются пропорционально дозе в диапазоне доз от 0,30 до 10,0 мг/кг при внутривенной (в/в) инфузии или при п/к введении (в дозе от 150 до 600 мг).
Распределение
Канакинумаб связывается с сывороточным ИЛ-1β. Объем распределения (Vss) изменяется в зависимости от массы тела.
У пациентов с CAPS Vss составляет 6,2 л при массе тела 70 кг, 5,0 л – у пациентов с синдромом периодической лихорадки (TRAPS, H1DS/MKD, FMF) с массой тела 55 кг, у пациентов с сЮИА – 3,2 л при массе тела 33 кг и у пациентов с подагрическим артритом – 7,9 л при массе тела 93 кг. При п/к введении препарата в течение 6 месяцев в дозе 150 мг каждые 8 недель, в дозе 4 мг/кг каждые 4 недели, 150 мг каждые 12 недель коэффициент кумуляции канакинумаба составляет 1,3, 1,6 и 1,1 соответственно.
Выведение
Клиренс (С1) изменяется в зависимости от массы тела. Для пациентов с CAPS этот показатель составляет 0,17 л/сут при массе тела 70 кг, 0,14 л/сут – у пациентов с синдромом периодической лихорадки (TRAPS, HIDS/MKD, FMF) при массе тела 55 кг, у пациентов с сЮИА – 0,11 л/сут при массе тела 33 кг, у пациентов с подагрическим артритом – 0,23 л/сут при массе тела 93 кг. После учета весовых различий существенной разницы в фармакокинетических свойствах канакинумаба у пациентов с подагрическим артритом, различными фенотипами CAPS, TRAPS, HIDS/MKD, FMF и сЮИА выявлено не было. При повторном применении препарата не наблюдается увеличения С1 или изменений каких-либо других, зависимых от времени фармакокинетических параметров канакинумаба. После коррекции дозы по массе тела не отмечено изменения фармакокинетических показателей в зависимости от возраста и пола.
Фармакокинетика в особых клинических случаях
Пациенты в возрасте младше 18 лет
У пациентов в возрасте от 4 лет и старше после однократного п/к введения препарата в дозе 150 мг или 2 мг/кг 1 раз время достижения Сmax канакинумаба составляет 2-7 дней.
Конечный период полувыведения канакинумаба у пациентов данной категории сходен с таковым у взрослых и составляет от 22,9 до 25,7 дней.
По данным анализа популяционного фармакокинетического моделирования фармакокинетические параметы канакинумаба у детей с CAPS в возрасте от 2 до 4 лет сходны с таковыми у пациентов 4 лет и старше. Дополнительный фармакокинетический анализ показал, что параметры фармакокинетики канакинумаба у 6 детей с CAPS в возрасте младше 2 лет были сходными с таковыми у детей в возрасте старше 2 лет. Фармакокинетические характеристики у пациентов с CAPS, TRAPS, HIDS/MKD, FMF и сЮИА схожи. При п/к введении канакинумаба в дозе 4 мг/кг каждые 4 педели у пациентов с сЮИА значения AUC и Сmax были аналогичны в возрастной группе от 2 до 20 лет.
По данным анализа популяционного фармакокинетического моделирования фармакокинетические параметры канакинумаба у пациентов с сЮИА в возрасте 16-20 лет и возрасте младше 16 лет были схожими. У пациентов с сЮИА в возрасте старше и младше 20 лет расчетная экспозиция канакинумаба в равновесном состоянии при величине дозы 4 мг/кг (максимум 300 мг) были сопоставимы.
У пациентов с синдромом периодической лихорадки (TRAPS, HIDS/MKD, FMF) экспозиция при минимальной концентрации канакинумаба в плазме крови при п/к введении препарата в дозе 2 мг/кг каждые 4 недели сопоставима в возрастных группах у пациентов в возрасте от 2 до 20 лет.
Пациенты в возрасте старше 65 лет
Не было выявлено разницы в фармакокинетических параметрах, основанных на С1 и Vss, у пациентов старшей возрастной группы и пациентов в возрасте менее 65 лет.
Показания к применению
Аутовоспалителъные синдромы периодической лихорадки:
- криопирин-ассоциированный периодический синдром (CAPS) у взрослых и детей в возрасте 2 лет и старше, включая:
- семейный холодовой аутовоспалительный синдром (РСА8)/семейная холодовая крапивница (FCU),
- синдром Макла-Уэльса (MWS),
- младенческое мультисистемное воспалительное заболевание (NOMID)/хронический младенческий неврологический кожно-артикулярный синдром (CINCA);
- периодический синдром, ассоциированный с рецепторами к фактору некроза опухоли (TRAPS) у взрослых и детей в возрасте 2 лет и старше;
- гипер-IgD-синдром/синдром дефицита мевалонат-киназы (HIDS/MKD) у взрослых и детей в возрасте 2 лет и старше;
- семейная средиземноморская лихорадка (FMF) у взрослых и детей в возрасте 2 лет и старше в монотерапии при наличии противопоказаний к /непереносимости терапии колхицином или в комбинации с колхицином при отсутствии адекватного терапевтического ответа на монотерапию максимально переносимой дозой колхицина.
Активная фаза болезни Стилла, в том числе болезни Стилла взрослых (БСВ) и системного ювенильного идиопатического артрита (сЮИА) у пациентов от 2 лет и старше при неадекватном ответе на терапию нестероидными противовоспалительными препаратами (НПВП) и системными глюкокортикостероидными препаратами. Препарат Иларис® можно применять в монотерапии и в комбинации с метотрексатом.
Острый подагрический артрит с целью лечения частых острых приступов подагрического артрита и предупреждения развития новых приступов при неэффективности, непереносимости или при наличии противопоказаний к применению нестероидных противовоспалительных препаратов и/или колхицина и при невозможности проведения терапии повторными курсами глюкокортикостероидов.
Противопоказания
- Подтвержденная повышенная чувствительность к действующему веществу или другим компонентам препарата.
- Острые тяжелые инфекционные заболевания.
- Возраст менее 2 лет (безопасность и эффективность для пациентов указанной категории изучены недостаточно).
С осторожностью
Препарат следует с осторожностью применять у пожилых пациентов; у пациентов с рецидивирующими инфекциями или любыми состояниями в анамнезе, предрасполагающими к развитию инфекций.
Применение при беременности и в период грудного вскармливания
Пациенты и пациентки с сохраненным репродуктивным потенциалом /контрацепция
Женщинам следует применять надежные методы контрацепции во время терапии препаратом Иларис® и в течение 3 месяцев после применения последней дозы препарата.
Беременность
Данные по применению канакинумаба у беременных пациенток ограничены. В исследованиях у животных не выявлено какой-либо репродуктивной токсичности. Риск для плода/матери неизвестен. В связи с вышесказанным применение препарата у беременных пациенток или у пациенток, планирующих беременность, возможно только после тщательной оценки отношения польза-риск.
В исследованиях у животных показано, что канакинумаб проникает через плаценту и обнаруживается у плода. Данные у человека отсутствуют, однако поскольку канакинумаб является иммуноглобулином класса G (IgGl) ожидается трансплацентарная передача у человека. Клиническое влияние данного явления неизвестно. Тем не менее, не рекомендовано применение живых вакцин у новорожденного, подверженного действию канакинумаба in utero, в течение 16 недель после применения последней дозы препарата у матери до родоразрешения.
Пациенток, получавших препарат во время беременности, следует проинформировать о необходимости сообщить о данном факте медицинскому работнику до проведения какой-либо вакцинации новорожденного.
Грудное вскармливание
Неизвестно, проникает ли канакинумаб в грудное молоко. Таким образом, решение о грудном вскармливании на фоне терапии препаратом следует принимать только после тщательной оценки отношения польза-риск.
В исследованиях у животных антимышиные ИЛ-1β-антитела передавались с молоком потомству и не оказывали какого-либо неблагоприятного воздействия на его развитие.
Фертильность
Официальные исследования для оценки возможного влияния препарата Иларис® на фертильность у человека не проводились. По данным исследований у самцов обезьян (Callithrix jacchus) канакинумаб не оказывает влияния на мужскую фертильность. Антимышиные ИЛ-1β-антитела не оказывают нежелательного влияния фертильность самок и самцов мышей.
Способ применения и дозы
У пациентов с аутовоспалительными синдромами периодических лихорадок (CAPS, TRAPS, HIDS/MKD, FMF), а также болезнью Стилла, в том числе с сЮИА терапия препаратом Иларис® может быть инициирована и проводиться только под контролем врача, имеющего опыт диагностики и лечения соответствующих заболеваний. После обучения технике приготовления раствора, выбору шприцов и игл, пригодных для инъекции, а также технике проведения п/к инъекции, пациенты с вышеуказанными заболеваниями или лица, за ними ухаживающие, могут самостоятельно вводить препарат под надлежащим контролем (если врач сочтет это необходимым).
У пациентов с подагрическим артритом терапия препаратом Иларис® может быть инициирована и проводиться только под контролем врача, имеющего опыт применения биологических лекарственных препаратов; введение препарата должно осуществляться только медицинским работником.
Препарат вводят п/к, выбирая участки тела с выраженной подкожной клетчаткой, например, передняя поверхность живота, передняя поверхность верхней части бедра, наружная поверхность верхней части плеча или ягодицы (см. раздел «Указания по применению»). Во избежание болезненных ощущений следует менять место введения при каждой последующей инъекции. Следует избегать введения препарата в участки с нарушением целостности кожных покровов, области ушибов или с наличием сыпи. Следует избегать введения препарата в рубцовую ткань в связи с возможным снижением экспозиции канакинумаба.
Каждый флакон препарата Иларис® предназначен для однократного использования у одного пациента для введения однократной дозы.
Криопирин-ассоциированный периодический синдром (CAPS)
Рекомендованные начальные дозы препарата Иларис® для пациентов с криопирин-ассоциированным периодическим синдромом указаны в таб. 1
Таб.1 Рекомендованные начальные дозы препарата Иларис® для пациентов с криопирин-ассоциированным периодическим синдромом
| Категория пациентов | Масса тела | Рекомендованная начальная доза |
| Дети в возрасте от 2 лет до 4 лет | ≥7,5 кг | 4 мг/кг |
| Взрослые и дети старше 4 лет | >40 кг | 150 мг |
| ≥15 — ≤40 кг | 2 мг/кг | |
| ≥7,5 — <15 кг | 4 мг/кг |
Препарат вводят п/к, 1 инъекция с интервалом 8 недель.
Если при стартовой дозе 150 мг или 2 мг/кг не получен удовлетворительный клинический ответ, а именно процесс разрешения сыпи и других симптомов воспаления не наблюдается в течение 7 дней после первой инъекции препарата Иларис®, возможно проведение второй инъекции препарата в дозе 150 мг (при массе тела >40 кг) или 2 мг/кг (при массе тела ≥15 кг и ≤40 кг). При достижении в последующем полного клинического ответа данным пациентам рекомендовано проводить поддерживающую терапию препаратом Иларис® в дозе 300 мг 1 инъекция с интервалом 8 недель (при массе тела >40 кг) или 4 мг/кг 1 инъекция с интервалом 8 недель (при массе тела ≥15 кг и ≤40 кг).
Если удовлетворительный клинический эффект не наблюдается в течение 7 дней после повышения дозы, возможно проведение третьей инъекции препарата Иларис® в дозе 300 мг (при массе тела >40 кг) или 4 мг/кг (при массе тела ≥15 кг и ≤40 кг).
При достижении в последующем полного клинического ответа данным пациентам рекомендовано проводить поддерживающую терапию препаратом Иларис®в дозе 600 мг 1 инъекция с интервалом 8 недель (при массе тела >40 кг) или 8 мг/кг (при массе тела ≥15 кг и ≤40 кг) 1 инъекция с интервалом 8 недель на основании индивидуальной клинической оценки.
Если при стартовой дозе 4 мг/кг удовлетворительный клинический эффект не наблюдается в течение 7 дней после первой инъекции, возможно проведение второй инъекции препарата Иларис® в дозе 4 мг/кг. При достижении в последующем полного клинического ответа данным пациентам следует рассмотреть возможность поддерживающей терапии в дозе 8 мг/кг 1 инъекция с интервалом 8 недель на основании индивидуальной клинической оценки.
Алгоритм подбора дозы для взрослых и детей старше 4 лет с массой тела ≥ 15 кг представлен на рис. 1, для детей от 2 до 4 лет с массой тела ≥7,5 кг <15 кг представлен на рис. 2.
Клинический опыт применения препарата с интервалом дозирования менее 4 недель или в дозе более 600 мг или 8 мг/кг ограничен.
Периодический синдром, ассоциированный с рецепторами к фактору некроза опухоли (TRAPS), гипер-IgD-синдром/синдром дефицита мевалонат-киназы (HIDS/MKD), семейная средиземноморская лихорадка (FMF)
Рекомендованная начальная доза препарата у взрослых и детей в возрасте 2 лет и старше составляет:
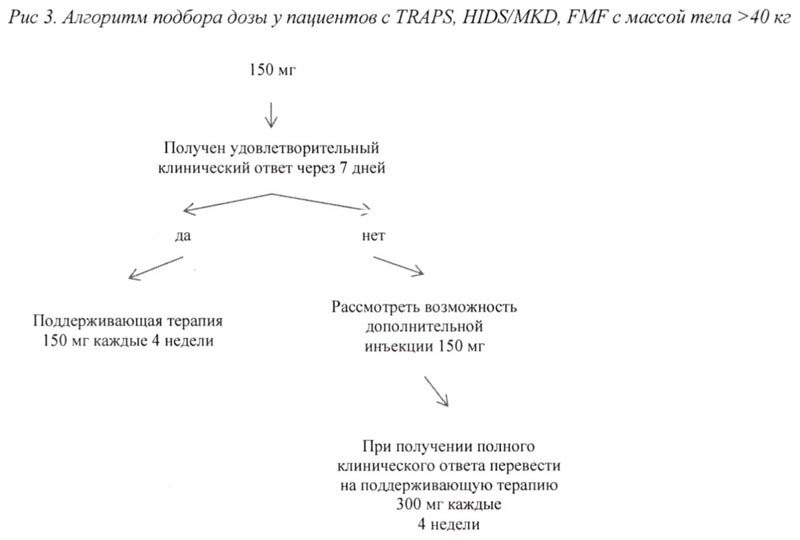
— 150 мг у пациентов с массой тела >40 кг;
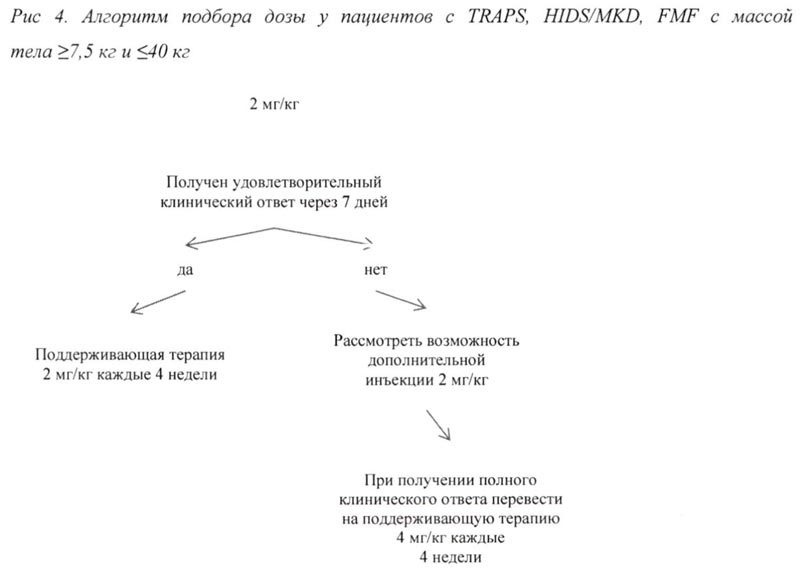
— 2 мг/кг у пациентов с массой тела ≥7,5 кг и ≤40 кг.
Препарат применяют в виде п/к инъекции каждые 4 недели.
При отсутствии удовлетворительного клинического ответа в течение 7 дней после первой инъекции препарата Иларис® возможно проведение второй инъекции препарата в дозе 150 мг (при массе тела >40 кг) или 2 мг/кг (при массе тела ≥7,5 кг и ≤40 кг). При достижении в последующем полного клинического ответа данным пациентам рекомендовано проводить поддерживающую терапию препаратом Иларис® в дозе 300 мг или 4 мг/кг каждые 4 недели в виде п/к инъекции.
Продолжение терапии препаратом у пациентов без клинического улучшения должно быть повторно рассмотрено лечащим врачом.
Болезнь Стилла (болезнь Стилла у взрослых и сЮИА у пациентов в возрасте старше 2 лет)
Рекомендованная доза у пациентов с массой тела ≥7,5 кг составляет 4 мг/кг (максимально до 300 мг) каждые 4 недели в виде п/к инъекции. Продолжение терапии препаратом у пациентов без клинического улучшения должно быть повторно рассмотрено лечащим врачом.
Подагрический артрит
Контроль гиперурекимии и его оптимизацию следует проводить с помощью соответствующих противоподагрических препаратов.
Применять препарат Иларис® для терапии приступов обострения подагрического артрита следует по мере необходимости.
Рекомендованная доза препарата у взрослых составляет 150 мг, препарат вводят однократно п/к во время приступа подагрического артрита. Для достижения максимальной эффективности препарат необходимо вводить как можно раньше после начала приступа подагрического артрита.
Пациентам с отсутствием терапевтического ответа на первую инъекцию не следует вводить препарат повторно. У пациентов с положительным ответом на терапию препаратом при необходимости продолжения лечения повторное введение препарата возможно не ранее чем через 12 недель после предыдущей инъекции.
Применение у особых групп пациентов
Пациенты в возрасте старше 65 лет
Не требуется коррекции дозы препарата у пациентов в возрасте старше 65 лет.
Пациенты в возрасте младше 18 лет
Нет данных по применению препарата Иларис® для лечения подагрического артрита у детей и подростков младше 18 лет.
Опыт применения канакинумаба у детей младше 2 лет ограничен по показаниям криопирин-ассоциированный периодический синдром (CAPS), периодический синдром, ассоциированный с рецепторами к фактору некроза опухоли (TRAPS), гипер-IgD-синдром/синдромом дефицита мевалонат-киназы (HIDS/MKD), семейная средиземноморская лихорадка (FMF), доступные данные указаны в разделах «Фармакологические свойства» и «Побочное действие», однако рекомендации по режиму дозирования отсутствуют. Нет данных по эффективности и безопасности канакинумаба у пациентов с сЮИА младше 2 лет.
Пациенты с нарушением функции почек
Не требуется коррекции дозы препарата у пациентов с нарушениями функции почек (опыт клинического применения у таких пациентов ограничен).
Пациенты с нарушением функции печени
У пациентов с нарушениями функции печени эффективность и безопасность применения препарата не изучались. Так как канакинумаб является человеческим IgG, предполагается, что нарушение функции печени не влияет на его фармакокинетику.
Побочное действие
При применении препарата Иларис® в ходе клинических исследований отмечалось повышение частоты инфекционных заболеваний, преимущественно инфекций верхних дыхательных путей. Течение инфекционных заболеваний чаще всего было легкой или средней степени тяжести, однако отмечались и случаи тяжелого течения. На фоне терапии препаратом отмечены случаи развития реакций гиперчувствительности. Отмечены случаи развития оппортунистических инфекций на фоне лечения препаратом Иларис®.
Влияния продолжительной терапии на тип или частоту развития нежелательных лекарственных реакций (НЛР) не наблюдалось.
Нежелательные реакции (HP) сгруппированы в соответствии с классификацией органов и систем органов MedDRA, перечислены в порядке уменьшения важности. Частота встречаемости оценивалась следующим образом: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1 /10000), частота неизвестна – недостаточно данных для оценки частоты развития.
CAPS, TRAPS, HIDS/MKD, FMF, сЮИА и подагрический артрит
Инфекционные и паразитарные заболевания: очень часто – инфекции дыхательных путей (в том числе пневмония, бронхит, грипп, вирусные инфекции, синусит, ринит, фарингит, тонзиллит, назофарингит, инфекции верхних дыхательных путей), инфекции уха, целлюлит, гастроэнтерит, инфекции мочевыводящих путей; часто – вульвовагинальный кандидоз.
Нарушения со стороны нервной системы, часто – головокружение/вертиго.
Нарушения со стороны желудочно-кишечного тракта: очень часто – боль в верхней части живота1; нечасто – гастроэзофагеальная рефлюксная болезнь2.
Нарушения со стороны кожи и подкожных тканей: очень часто – реакция в месте введения.
Нарушения со стороны скелетно-мышечной и соединительной ткани: очень часто – артралгия1; часто – скелетно-мышечная боль, боль в спине2.
Общие расстройства и нарушения в месте введения: часто – общая слабость/повышенная утомляемость2.
Лабораторные и инструментальные данные: очень часто – снижение почечного клиренса креатинина1,3, протеинурия1,4, лейкопения1,5; часто – нейтропения5; нечасто – уменьшение количества тромбоцитов5.
Ссылки:
1 – при СЮИА;
2 – при подагрическом артрите;
3 – исходя из расчетного клиренса креатинина, большинство случаев носили преходящий характер;
4 – в большинстве случаев при помощи тест-полоски определялись «следы белка» или «1+»;
5 – см. информацию ниже.
Описание отдельных нежелательных реакции
Долгосрочные данные и изменения лабораторных показателей у пациентов с CAPS
При применении препарата в клинических исследованиях у пациентов с CAPS отмечалось увеличение средних показателей концентрации гемоглобина и снижение количества лейкоцитов, нейтрофилов и тромбоцитов.
В редких случаях у пациентов с CAPS, получавших лечение препаратом, наблюдалось повышение активности «печеночных» трансаминаз.
В ряде случаев на фоне терапии препаратом у пациентов с CAPS отмечалось бессимптомное незначительное увеличение концентрации билирубина в сыворотке крови, не сопровождающееся повышением активности «печеночных» трансаминаз.
В долгосрочных открытых клинических исследованиях с эскалацией дозы случаи инфекций (гастроэнтерит, инфекция дыхательных путей, инфекция верхних дыхательных путей), рвота и головокружение более часто отмечались в группе 600 мг или 8 мг/кг по сравнению с группами, получавшими другую дозу.
Лабораторные показатели у пациентов с TRAPS, HIDS/MKD и FMF
Нейтрофилы
Несмотря на то, что уменьшение количества нейтрофилов ≥2 степени тяжести отмечено у 6,5% пациентов (часто) и уменьшение 1 степени тяжести отмечено у 9,5% пациентов, данные явления в целом носили преходящий характер; инфекция, ассоциированная со снижением количества нейтрофилов, не была определена как HP.
Тромбоциты
Несмотря на то, что уменьшение количества тромбоцитов (≥2 степени тяжести) отмечено у 0,6% пациентов, кровотечение не было определено как HP. Незначительное и транзиторное уменьшение количества тромбоцитов 1 степени тяжести отмечено у 15,9% пациентов без ассоциации с кровотечением.
Лабораторные показатели у пациентов с сЮИА
Гематологические показатели
Снижение количества лейкоцитов ≤0,8×нижней границы нормы (НГН) отмечалось у 33 пациентов (16,5%).
В программе клинической разработки при сЮИА транзиторное уменьшение абсолютного количества нейтрофилов до <1×109/л отмечено у 12 пациентов (6,0%).
В программе клинической разработки при сЮИА транзиторное уменьшение тромбоцитов <НГН отмечено у 19 пациентов (9,5%).
Аланинаминотрансфераза (АЛТ) и/или аспартатаминотрансфераза (ACT)
В программе клинической разработки при сЮИА увеличение АЛТ и/или АСТ>3×ВГН (высшей границы нормы) отмечено у 19 пациентов (9,5%).
Лабораторные показатели у пациентов с подагрическим артритом
Гематологические показатели
Снижение количества лейкоцитов ≤0,8×НГН отмечалось у 6,7% пациентов, получавших лечение препаратом Иларис® по сравнению с 1,4% пациентов, получавших триамцинолон. В сравнительных исследованиях снижение абсолютного количества нейтрофилов ниже 1×109/л отмечалось у 2% пациентов с подагрическим артритом. Наблюдались также изолированные случаи снижения количества нейтрофилов ниже 0,5×109/л.
В 12,7% случаев на фоне терапии канакинумабом наблюдалось легкое (<НГН и >75×109/л) и преходящее снижение количества тромбоцитов (у препарата сравнения данное снижение наблюдалось в 7,7% случаев).
Мочевая кислота
В сравнительных исследованиях у пациентов с подагрическим артритом после лечения препаратом Иларис® наблюдалось повышение концентрации мочевой кислоты (0,7 мг/дл на 12 неделе и 0,5 мг/дл на 24 неделе). В другом исследовании у пациентов, начавших лечение противоподагрическими препаратами, повышения концентрации мочевой кислоты не наблюдалось. Повышение концентраций мочевой кислоты в ходе клинических исследований у пациентов с неподагрическим артритом не наблюдалось.
АЛТ/АСТ
К концу клинического исследования у пациентов, получавших препарат Иларис®, по сравнению с пациентами, получавшими триамцинолон, отмечалось увеличение средней активности АЛТ на 3,0 Ед/л и срединного значения активности АЛТ на 2,0 Ед/л, а также увеличение средней активности ACT на 2,7 Ед/л и срединного значения активности ACT на 2,0 Ед/л от исходного значения. Однако частота клинически значимого увеличения активности (>3 ВГН) ACT и АЛТ была более выражена у пациентов, получавших триамцинолон (на 2,5% для ACT и АЛТ), по сравнению с пациентами, получавшими терапию препаратом Иларис® (1,6% для АЛТ и 0,8% для ACT).
Триглицериды
На фоне терапии канакинумабом наблюдалось повышение концентрации триглицеридов в плазме крови в среднем на 33,5 мг/дл, а в группе применения триамцинолона – незначительное снижение на 3,1 мг/дл. Повышение концентрации триглицеридов более чем в 5 раз (по сравнению с ВГН) отмечалось в 2,4% случаев в группе применения канакинумаба и в 0,7% случаев в группе применения триамцинолона. Клиническая значимость данного наблюдения неизвестна.
Долгосрочные данные наблюдательного исследования
В рамках долгосрочного исследования по данным регистра выявлено 243 пациента с CAPS (85 педиатрических пациентов в возрасте от 2 до 17 лет и 158 взрослых пациентов старше 18 лет), которые получили лечение препаратом в рутинной клинической практике (в среднем в течение 3,8 лет). Профиль долгосрочной безопасности в данном исследовании соответствовал определенному в ходе интервенционных клинических исследований.
Педиатрические пациенты
В интервенционных клинических исследованиях препарат Иларис® получили 80 педиатрических пациентов с CAPS (в возрасте от 2 до 17 лет). В целом не отмечено клинически значимых различий безопасности и профиля переносимости препарата по сравнению с общей популяцией пациентов с CAPS (в целом 211 взрослых и педиатрических пациентов), включая общую частоту развития и тяжести эпизодов инфекций. Инфекции верхних дыхательных путей являлись наиболее часто отмечавшимися инфекционными заболеваниями.
В небольшом открытом клиническом исследовании дополнительно участвовали 6 пациентов в возрасте младше 2 лет. Профиль безопасности в данном исследовании соответствовал таковому для популяции в возрасте 2 лет и старше.
В 16-недельном исследовании препарат получили 102 пациента с TRAPS, H1DS/MKD и FMF в возрасте от 2 до 17 лет. В целом не отмечено клинически значимых различий безопасности и профиля переносимости препарата по сравнению с общей популяцией.
Применение у пациентов старше 65 лет
Не было выявлено различий профиля безопасности препарата у пациентов данной группы.
Если отмечено ухудшение клинического течения любого из указанных в инструкции побочных эффектов, или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Передозировка
Полученные данные о передозировке препаратом ограничены. В клинических исследованиях на ранних этапах пациенты и здоровые добровольцы получали препарат внутривенно или п/к в дозе до 10 мг/кг, что не сопровождалось явлениями острой токсичности. При передозировке препаратом Иларис® следует обеспечить наблюдение пациента с целью выявления возможных нежелательных явлений, а также при необходимости немедленно начать соответствующую симптоматическую терапию.
Взаимодействие с другими лекарственными средствами
Специальных исследований по взаимодействию препарата Иларис® с другими лекарственными препаратами не проводилось.
При применении одного из ингибиторов ИЛ-1 с ингибиторами фактора некроза опухоли (ФНО) отмечалось увеличение частоты развития серьезных инфекций. Применение препарата Иларис® с ингибиторами ФНО не рекомендовано в связи с увеличением риска развития серьезных инфекций.
Поскольку экспрессия изоферментов системы цитохрома Р450 в печени может быть подавлена цитокинами, стимулирующими хроническое воспаление, такими как ИЛ-1β, при применении мощных ингибиторов цитокинов, экспрессия изоферментов системы цитохрома Р450 в печени может быть нормализована. Это является клинически значимым для препаратов, метаболизирующихся с помощью изоферментов системы цитохрома Р450 и имеющих узкий терапевтический индекс, когда доза препарата подбирается индивидуально. При применении препарата Иларис® у пациентов, принимающих такие препараты, их дозу следует при необходимости корректировать (в зависимости от их клинического эффекта и концентрации действующего вещества в плазме крови).
В клинических исследованиях отмечено безопасное применение препарата Иларис® с противоподагрическими средствами.
Данные о влиянии живых вакцин, а также о возможном инфицировании у пациентов, получающим лечение препаратом, отсутствуют. Проводить вакцинацию живыми вакцинами у пациентов, получающих лечение препаратом Иларис®, следует только в случае, когда польза от вакцинации превышает возможный риск. Следует провести все рекомендованные местным календарем прививок вакцинации (включая пневмококковую вакцину и инактивированную вакцину против гриппа) до начала терапии препаратом Иларис®.
В случае необходимости вакцинацию живыми вакцинами проводят после начала терапии препаратом (по крайней мере через 3 месяца после последней инъекции препарата и за 3 месяца до следующей). Данные проведенных клинических исследований у взрослых здоровых добровольцев показывают, что однократное введение препарата Иларис® в дозе 300 мг не влияет на начало выработки антител и персистенцию поствакцинального ответа при вакцинации против гриппа и менингококковой инфекции (гликозилированной белковой вакциной).
В 56-недельном открытом клиническом исследовании у пациентов с CAPS в возрасте 4 лет и младше отмечено развитие достаточного количества антител у всех пациентов, получивших иммунизацию стандартными неживыми вакцинами.
Особые указания
Опыт применения препарата Иларис® у пациентов с CAPS без установленной мутации в NLRP3 гене ограничен.
Нейтропения и лейкопения
На фоне терапии ингибиторами ИЛ-1, включая препарат Иларис®, отмечено развитие нейтропении (абсолютное количество нейтрофилов ниже 1,5×109/л) и лейкопении. Не следует начинать лечение препаратом у пациентов с нейтропенией или лейкопенией. Перед началом терапии препаратом следует определить количество лейкоцитов, в том числе нейтрофилов и повторно оценить данные показатели через 1-2 месяца. В случае длительной или повторной терапии следует периодически контролировать данные показатели во время лечения. При выявлении снижения абсолютного количества нейтрофилов и лейкоцитов на фоне терапии препаратом следует обеспечить надлежащий контроль состояния пациента и при необходимости рассмотреть вопрос о прекращении лечения препаратом.
Злокачественные новообразования
Имеются сообщения о случаях развития злокачественных новообразований у пациентов, получающих препарат Иларис®, однако риск развития злокачественных новообразований на фоне терапии антителами, связывающими ИЛ-1, неизвестен.
Инфекционные заболевания
Применение препарата Иларис® может сопровождаться увеличением частоты развития серьезных инфекций, поэтому следует тщательно наблюдать пациента с целью выявления симптомов инфекции во время и после терапии препаратом. Следует соблюдать осторожность при применении препарата у пациентов с инфекциями, рецидивирующими инфекционными заболеваниями в анамнезе или сопутствующими заболеваниями, предрасполагающими к развитию инфекций. При CAPS, TRAPS, HIDS/MKB, FMF и болезни Стилла лечение препаратом Иларис® не следует начинать или продолжать у пациентов с активной инфекцией, требующей медицинского вмешательства. У пациентов с подагрическим артритом не следует начинать терапию препаратом в активный период инфекции. Не следует применять препарат одновременно с ингибиторами ФНО, так как это может приводить к увеличению риска развития серьезных инфекций.
При применении препарата Иларис® отмечались единичные случаи оппортунистических инфекций (в т.ч. аспергиллез, атипичные инфекционные заболевания микобактериальной этиологии, опоясывающий лишай). Невозможно исключить причинно-следственную связь между данными явлениями и применением препарата.
При применении препарата приблизительно у 12% пациентов с различными фенотипами CAPS наблюдались положительные результаты туберкулиновой пробы без каких-либо признаков туберкулезной инфекции (латентной или активной). Нет данных об увеличении риска реактивации туберкулезной инфекции при лечении моноклональными антителами к ИЛ-1 (например, препарат Иларис®). Перед применением препарата Иларис® необходимо обследовать всех пациентов с целью выявления активной или латентной туберкулезной инфекции (включая сбор анамнеза и проведение соответствующих скрининговых тестов, например, туберкулиновой пробы, тестов IGRA (Interferon-Gamma-Release-Assay) или рентгенологического обследования органов грудной клетки. Во время и после лечения препаратом следует тщательно контролировать состояние пациента с целью выявления туберкулезной инфекции. Следует информировать пациента о необходимости обращаться к врачу при появлении следующих симптомов на фоне и после терапии препаратом Иларис®: длительно сохраняющийся кашель, снижение массы тела, субфебрильная температура. В случае конверсии туберкулинового теста из негативного в позитивный, особенно у пациентов высокого риска, необходимо провести альтернативные скрининговые тесты. При выявлении туберкулезной инфекции лечение препаратом Иларис® не следует начинать или продолжать.
Синдром активации макрофагов у пациентов с болезнью Стилла у взрослых и сЮИА
Синдром активации макрофагов – известное жизнеугрожающее состояние, которое может развиваться у пациентов с ревматическими заболеваниями, в частности у пациентов с болезнью Стилла, и требовать интенсивной терапии. Врачу следует внимательно относиться к симптомам инфекции или ухудшению течения заболевания, известными как пусковой механизм для синдрома активации макрофагов. Данные клинических исследований указывают, что препарат Иларис®, по всей вероятности, не увеличивает риск развития синдрома активации макрофагов у пациентов с сЮИА, однако, не позволяют сделать окончательных выводов.
Реакции гиперчувствительности
При применении препарата Иларис® сообщалось о реакциях гиперчувствительности. В большинстве случаев данные реакции были выражены в легкой степени. При применении препарата не наблюдалось развития анафилактоидных или анафилактических реакций. Однако при применении препарата Иларис® нельзя исключить риск развития тяжелых реакций гиперчувствительности, которые могут отмечаться при инъекционном введении препаратов белкового происхождения.
Нарушение функции печени
В клинических исследованиях отмечены транзиторное повышение активности печеночных трансаминаз или концентрации билирубина.
Влияние на способность управлять транспортными средствами, механизмами
Пациентам, у которых на фоне применения препарата Иларис® возникает вертиго, следует воздержаться от управления транспортными средствами или механизмами до полного исчезновения данного нежелательного явления.
Форма выпуска
По 1 мл раствора для подкожного введения 150 мг/мл во флакон из бесцветного стекла гидролитического класса I вместимостью 2 мл, укупоренный пробкой из хлорбутилового каучука, ламинированного фторполимером, обкатанной алюминиевым колпачком с пластиковой отщелкивающейся крышкой.
По 1 флакону вместе с инструкцией по медицинскому применению в пачку картонную. Условия ХРАНЕНИЯ
Хранить в защищенном от света месте при температуре от 2 до 8 °С. Не замораживать.
Хранить в оригинальной картонной пачке.
Препарат следует хранить в недоступном для детей месте.
Срок годности
3 года.
Препарат не применять по истечении срока годности.
Условия отпуска
По рецепту.
Наименование и адрес юридического лица, на имя которого выдано регистрационное удостоверение
Новартис Фарма АГ, Лихтштрассе 35, 4056 Базель, Швейцария / Novartis Pharma AG, Lichtstrasse 35, 4056 Basel, Switzerland.
Производитель
Все стадии производства
Новартис Фарма Штейн АГ, Шаффхаузерштрассе, 4332 Штейн, Швейцария/ Novartis Pharma Stein AG, Schaffhauserstrasse, 4332 Stein, Switzerland.
Получить дополнительную информацию о препарате, а также направить претензии и информацию о нежелательных явлениях можно по следующему адресу в России:
ООО «Новартис Фарма»
125315, г. Москва, Ленинградский проспект, дом 72, корпус 3
Указания по применению
Перед началом
Найдите чистое, удобное место.
Вымойте руки с мылом.
После того, как достали флакон из холодильника, проверьте дату срока годности на нем. Не используйте препарат при истекшем сроке годности (последний день месяца, указанного на флаконе).
Оставьте закрытый флакон на 10 минут, чтобы раствор стал комнатной температуры. Не нагревайте флакон.
Всегда используйте новые неоткрытые иглы и шприцы. Избегайте касания игл и верхних частей флакона.
Перед началом процедуры полностью прочитайте данную инструкцию.
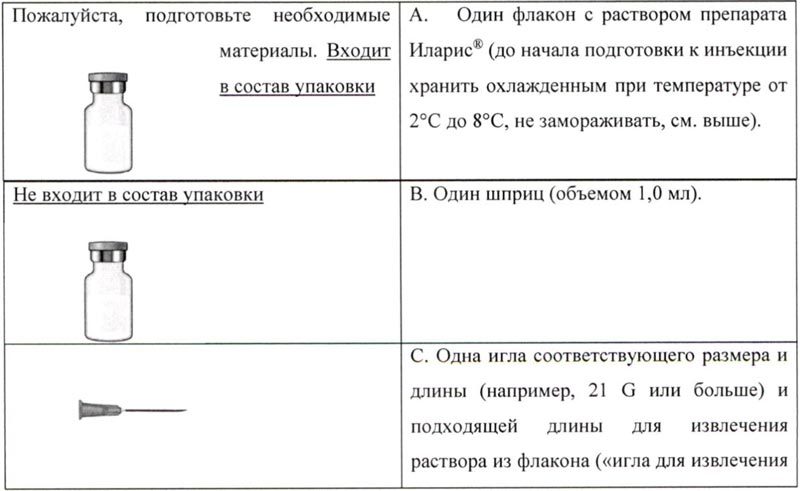
Подготовка к инъекции препарата Иларис®:
- Удалите защитную крышку с флакона (А), не дотрагиваясь до пробки флакона. Протрите пробку флакона спиртовой салфеткой (Е).
- Откройте упаковку со шприцем (В) и иглой большего размера для извлечения раствора (С), зафиксируйте иглу на шприце.
- Аккуратно снимите с иглы для извлечения раствора защитный колпачок и отложите его в сторону. Введите иглу во флакон с раствором препарата Иларис® через центр резиновой пробки (Рис. 1).
- Наклоните флакон, чтобы обеспечить извлечение требуемого объема раствора в шприц (Рис. 2). Медленно потяните вверх поршень до соответствующей отметки, наполняя шприц раствором препарата Иларис®. Если вы заметили пузырьки воздуха в шприце, удалите их, согласно инструкциям, полученным от медицинского работника. Убедитесь, что в шприц набрано требуемое количество раствора препарата Иларис®. Примечание: требуемое количество раствора зависит от назначенной дозы, инструкции предоставляются медицинским работником.
- Удалите шприц с иглой из флакона и наденьте колпачок на иглу. Снимите иглу со шприца и поместите в контейнер для игл. Откройте упаковку с инъекционной иглой и зафиксируйте ее на шприце. Немедленно приступайте к инъекции.
- Выберите место для инъекции: верхняя часть плеча, верхняя часть бедра, передняя поверхность живота или ягодицы. Не делайте инъекцию в участок кожи с сыпью, покраснением, гематомой, нарушением целостности кожных покровов или при наличии неровной поверхности кожи. Избегайте инъекций в рубцовую ткань, поскольку ли может приводить к недостаточному воздействию (экспозиции) канакинумаба. Избегайте попадания в кровеносный сосуд.
- Протрите предполагаемое место инъекции новой спиртовой салфеткой и подождите, пока поверхность кожи станет сухой. Снимите защитный колпачок с инъекционной иглы.
- Возьмите кожу над местом инъекции в небольшую складку. Возьмите шприц под углом 90 градусов и аккуратным, плавным движением введите иглу полностью в кожу (Рис. 3).
- Не вынимайте иглу до тех пор, пока полностью не введете препарат. Отпустите кожную складку и извлеките иглу (Рис. 4). Утилизируйте иглу и шприц в контейнер для использованных игл, при этом не следует надевать защитный колпачок на иглу или отделять иглу от шприца.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Иларис® (Ilaris)
💊 Состав препарата Иларис®
✅ Применение препарата Иларис®
Описание активных компонентов препарата
Иларис®
(Ilaris)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2020.04.16
Владелец регистрационного удостоверения:
Код ATX:
L04AC08
(Канакинумаб)
Лекарственная форма
| Иларис® |
Лиофилизат д/пригот. р-ра д/п/к введения 150 мг: фл. 1 шт. рег. №: ЛП-001414 |
Форма выпуска, упаковка и состав
препарата Иларис®
Лиофилизат для приготовления раствора для п/к введения в виде порошка белого цвета; восстановленный раствор: слабо опалесцирующий, от слабо желтого до слабо коричневого или коричневато-желтого цвета.
Вспомогательные вещества: сахароза, L-гистидин, L-гистидина гидрохлорида моногидрат, полисорбат 80.
Флаконы бесцветного стекла вместимостью 6 мл (1) — пачки картонные×.
× допускается запечатывание пачки прозрачным стикером.
Фармакологическое действие
Иммунодепрессант, моноклональные антитела к интерлейкину-1β.
Канакинумаб — полностью человеческое моноклональное антитело IgG1/каппа изотипа к интерлейкину-1β (ИЛ-1β). Канакинумаб с высоким аффинитетом связывается с человеческим ИЛ-1β, таким образом предотвращает взаимодействие ИЛ-1β с его рецепторами, ИЛ-1β-индуцированную активацию генов и продукцию медиаторов воспаления, таких как ИЛ-6 и ЦОГ-2.
У пациентов с подагрическим артритом и различными фенотипами криопирин-ассоциированного периодического синдрома (cryopyrin-associated periodic syndrome, CAPS), включая семейный холодовой аутовоспалительный синдром/семейную холодовую крапивницу (Familial Cold Autoinflammatory Syndrome/Familial Cold Urticaria, FCAS/FCU), Синдром Макла-Уэллса (Muckle-Wells Syndrome, MWS) и мультисистемное младенческое воспалительное заболевание/хронический младенческий неврологический кожно-артикулярный синдром (Neonatal onset multisystemic inflammatory disease/Chronic infantile neurological cutaneous and articular, NOMID/CINCA), канакинумаб снижает выраженность местных и системных воспалительных реакций, вызванных избыточной продукцией ИЛ-1β. При применении у больных с острым приступом подагрического артрита снижается концентрация лабораторных маркеров воспаления (C-реактивный белок (СРБ), сывороточного амилоида А (САА)), в течение короткого времени уходят признаки воспаления пораженного сустава (боль, отек, покраснение).
При применении канакинумаба у больных с различными фенотипами CAPS отмечается уменьшение уже в течение первых суток следующих проявлений заболевания: лихорадки, повышенной утомляемости, кожной сыпи, артралгии, миалгии, головной боли/мигрени, конъюнктивита, слабости, а также снижение (в течение нескольких дней) продукции маркеров воспаления, включая как СРБ и САА, и приводит к нормализации числа лейкоцитов и тромбоцитов (в случае их повышения).
Фармакокинетика
У взрослых пациентов с различными фенотипами CAPS после однократного п/к введения канакинумаба в дозе 150 мг Tmax канакинумаба составляет около 7 дней. При п/к введении канакинумаба абсолютная биодоступность — 63% (популяционный фармакокинетический анализ).
Сmax в плазме крови и AUC повышаются пропорционально дозе в диапазоне доз от 0.30 до 10.0 мг/кг при в/в инфузии или при п/к введении в дозе от 150 мг до 300 мг.
Не было выявлено существенной разницы в фармакокинетических свойствах канакинумаба у пациентов с подагрическим артритом и различными фенотипами CAPS.
Vss канакинумаба изменяется в зависимости от массы тела. Для типичных пациентов, страдающих подагрическим артритом, с массой тела 93 кг Vss равен 7.92 л. Для пациентов с различными фенотипами CAPS Vss составляет 6.01 л у типичного пациента с массой тела 70 кг.
При п/к введении препарата в течение 6 месяцев (дозе 150 мг) каждые 8 недель коэффициент кумуляции канакинумаба составляет 1.3, каждые 12 недель — 1.1.
Средний конечный T1/2 составляет 26 дней. Клиренс канакинумаба изменяется в зависимости от массы тела. Для типичных пациентов, страдающих подагрическим артритом, с массой тела 93 кг клиренс равен 0.23 л/сут. Для пациентов с различными фенотипами CAPS клиренс составляет 0.17 л/сут у типичного пациента с массой тела 70 кг.
Показания активных веществ препарата
Иларис®
Острый подагрический артрит: лечение острых приступов подагрического артрита и предупреждение развития новых приступов при неэффективности, непереносимости или при наличии противопоказаний к применению НПВС и/или колхицина и при невозможности проведения терапии повторными курсами ГКС.
Криопирин-ассоциированный периодический синдром (CAPS) у взрослых и детей в возрасте 4 лет и старше с массой тела >15 кг, включая: семейный холодовой аутовоспалительный синдром (FCAS)/ семейная холодовая крапивница (FCU); синдром Макла-Уэллса (MWS); младенческое мультисистемное воспалительное заболевание (NOMID)/хронический младенческий неврологический кожно-артикулярный синдром (CINCA).
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Вводят п/к.
Дозу устанавливают индивидуально, в зависимости от показаний, возраста, массы тела. Интервал между введениями в зависимости от показаний составляет 8-12 недель.
Побочное действие
Инфекционные и паразитарные заболевания: очень часто — инфекции, в частности, назофарингиты, синуситы (вирусные), инфекции верхних дыхательных путей, бронхиты, грипп, инфекции мочевыводящих путей, гастроэнтериты, панникулиты, пневмонии, фарингиты, инфекции уха.
Со стороны нервной системы: часто — головокружение/вертиго.
Со стороны костно-мышечной системы: часто — боль в спине.
Со стороны системы кроветворения: часто — тромбоцитопения, лейкопения; нечасто — нейтропения.
Со стороны обмена веществ: часто — дислипидемия; возможно преходящее повышение концентрации мочевой кислоты.
Со стороны органа слуха и лабиринтные нарушения: часто — головокружение.
Со стороны пищеварительной системы: часто — рвота; нечасто — гастроэзофагеальная рефлюксная болезнь; В ряде случаев на фоне терапии препаратом у пациентов с CAPS отмечалось бессимптомное незначительное увеличение содержания билирубина в сыворотке крови, не сопровождающееся повышением активности печеночных трансаминаз.
Со стороны печени и желчевыводящих путей: часто — повышение уровня билирубина, повышение активности ACT.
Аллергические реакции: не наблюдалось развития анафилактоидных или анафилактических реакций, однако нельзя исключить риск развития тяжелых реакций гиперчувствительности, которые могут отмечаться при инъекционном введении препаратов белкового происхождения.
Иммунологические реакции: 1% — у пациентов, получавших канакинумаб по поводу подагрического артрита, выявлялись антитела к канакинумабу; у пациентов с CAPS данные антитела не определялись.
Общие реакции: нечасто — общая слабость.
Местные реакции: часто — реакция в месте введения.
Противопоказания к применению
Острые инфекционные заболевания; беременность; период лактации (грудного вскармливания); дети младше 4 лет и массой тела менее 15 кг (безопасность и эффективность для указанной категории пациентов изучены не достаточно); повышенная чувствительность к канакинумабу.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период лактации (грудного вскармливания).
Особые указания
Опыт применения канакинумаба у пациентов без установленной мутации в NLRP3 гене ограничен.
С осторожностью следует применять канакинумаб у пациентов пожилого возраста; при указаниях в анамнезе на рецидивирующие инфекции или любые состояния, предрасполагающие к развитию инфекции.
Применение канакинумаба может сопровождаться увеличением частоты серьезных инфекций, поэтому пациенты должны находиться под наблюдением врача, с целью выявления симптомов инфекции во время и после терапии препаратом. При развитии тяжелых инфекций лечение канакинумабом не следует начинать или продолжать.
Развитие тяжелых и системных инфекционных заболеваний на фоне терапии препаратом сопровождалось клиническими симптомами (лихорадка) и повышением продукции маркеров воспаления (содержания СРБ в сыворотке крови). Однако, поскольку нельзя исключить возможность развития инфекционных процессов без данных проявлений, при применении препарата следует обеспечить надлежащий контроль за состоянием пациентов.
До начала лечения, через 1-2 месяца после начала и периодически во время терапии необходимо проводить стандартные клинический анализ крови с целью выявления нейтропении. У пациентов с нейтропенией лечение канакинумабом следует начинать только после нормализации числа нейтрофилов. При выявлении снижения АЧН на фоне терапии следует обеспечить надлежащий контроль за состоянием пациентов и при необходимости рассмотреть вопрос о прекращении лечения препаратом.
В ходе клинических исследований сообщалось о случаях развития злокачественных новообразований у пациентов, получающих канакинумаб, однако риск развития злокачественных новообразований на фоне терапии антителами, связывающими ИЛ-1 неизвестен.
При применении канакинумаба приблизительно у 12% больных с различными фенотипами CAPS наблюдались положительные результаты туберкулиновой пробы без каких-либо признаков туберкулезной инфекции (латентной или активной). Нет данных об увеличении риска реактивации туберкулезной или оппортунистических инфекций при лечении моноклональными антителами к ИЛ-1 (в т.ч. канакинумаба).
Перед началом лечения канакинумабом проводят обследование всех пациентов с целью выявления активной или латентной туберкулезной инфекции (включая сбор анамнеза и проведение соответствующих скрининговых тестов, например туберкулиновой пробы, тестов IGRA (Interferon-Gamma-Release-Assay) или рентгенологического исследования грудной клетки. Во время лечения следует тщательно контролировать состояние больных с целью выявления туберкулезной инфекции. В случае конверсии туберкулинового теста из негативного в позитивный, особенно у пациентов группы высокого риска, необходимо провести альтернативные скрининговые тесты. При выявлении туберкулезной инфекции лечение канакинумабом не следует начинать или продолжать.
Вакцинировать больных, получающих лечение канакинумабом, живыми вакцинами следует только в случае, когда польза от вакцинации превышает возможный риск. В случае необходимости вакцинацию живыми вакцинами проводят после начала терапии (по крайней мере, через 3 месяца после последней инъекции препарата и за 3 месяца до следующей).
Влияние на способность к управлению транспортными средствами и механизмами
Пациентам, у которых на фоне применения канакинумаба возникает вертиго, не следует управлять автотранспортом или работать с механизмами до полного исчезновения данной побочной реакции.
Лекарственное взаимодействие
Поскольку экспрессия в печени изоферментов системы цитохрома Р450 может быть подавлена цитокинами, стимулирующими хроническое воспаление, такими как ИЛ-1β, то при назначении мощных ингибиторов цитокинов экспрессия в печени изоферментов системы цитохрома Р450 может быть нормализована. Это является клинически значимым для препаратов, метаболизирующихся с помощью изоферментов системы цитохрома Р450 и имеющих узкий терапевтический индекс, когда доза препарата подбирается индивидуально. При применении канакинумаба у пациентов, получающих такие препараты, их дозу следует при необходимости корректировать (в зависимости от их клинического эффекта и концентрации действующего вещества в плазме крови).
В клинических исследованиях отмечено безопасное применение канакинумаба с противоподагрическими средствами.
Канакинумаб не рекомендуется применять одновременно с ингибиторами ФНО и другими блокаторами ИЛ-1β, поскольку при данной комбинации повышается риск развития тяжелых инфекций.
Данные о влиянии вакцинации живыми вакцинами, а также о возможной вторичной передаче инфекции, пациентам, получающим лечение препаратом, отсутствуют.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
П/к в те участки тела, где есть подкожно-жировая клетчатка: в живот, переднюю поверхность бедер, заднебоковую поверхность плеч (см. Указания по применению).
Препарат (лиофилизат) растворяют в 1 мл воды для инъекций (см. Указания по применению).
Подагрический артрит
Рекомендованная доза препарата у взрослых — 150 мг, препарат вводят во время приступа подагрического артрита, одномоментно. Для достижения максимальной эффективности препарат необходимо вводить как можно раньше после начала приступа подагрического артрита.
Пациентам, которые не ответили на первую инъекцию препарата Иларис®, повторно вводить препарат не следует. Пациентам, ответившим на лечение, повторное введение препарата Иларис® возможно как минимум через 12 нед после предыдущей инъекции.
Применять препарат Иларис® для терапии приступов подагрического артрита следует по мере необходимости. Оптимизирование контроля гиперурикемии следует проводить с помощью соответствующих противоподагрических препаратов.
Терапия препаратом может быть инициирована и проводиться только врачом, имеющим опыт диагностики и лечения пациентов с подагрическим артритом.
CAPS
Рекомендованные стартовые дозы препарата Иларис® для пациентов с CAPS:
взрослым и детям ≥4 лет, в зависимости от массы, тела назначают:
— масса тела >40 кг — 150 мг;
— масса тела ≥15 кг и ≤40 кг — 2 мг/кг;
— масса тела ≥7,5 кг и <15 кг — 4 мг/кг.
У детей от 2 и <4 лет с массой тела ≥7,5 кг препарат применяют из расчета 4 мг/кг.
Препарат вводят п/к — 1 инъекция с интервалом 8 нед.
Если у пациентов при стартовой дозе 150 мг или 2 мг/кг не получен удовлетворительный клинический ответ, а именно процесс разрешения сыпи и других симптомов воспаления не наблюдается в течение 7 дней после первой инъекции препарата Иларис®, возможно проведение второй инъекции препарата в дозе 150 мг (при массе тела >40 кг) или 2 мг/кг (при массе тела ≥15 кг и ≤40 кг). При достижении в последующем полного клинического ответа данным пациентам рекомендуется поддерживающая терапия препаратом Иларис® в дозе 300 мг, 1 инъекция с интервалом 8 нед (при массе тела >40 кг) или 4 мг/кг, 1 инъекция с интервалом 8 нед (при массе тела ≥15 кг и ≤40 кг).
Если удовлетворительный клинический эффект не наблюдается в течение 7 дней после повышения дозы, возможно проведение третьей инъекции препарата Иларис® в дозе 300 мг, 1 инъекция с интервалом 8 нед (при массе тела >40 кг) или 4 мг/кг (при массе тела ≥15 кг и ≤40 кг). При достижении в последующем полного клинического ответа данным пациентам рекомендуется поддерживающая терапия препаратом Иларис® в дозе 600 мг, 1 инъекция с интервалом 8 нед (при массе тела >40 кг) или 8 мг/кг (при массе тела ≥15 кг и ≤40 кг), 1 инъекция с интервалом 8 нед.
Если у пациентов при стартовой дозе 4 мг/кг удовлетворительный клинический эффект не наблюдается в течение 7 дней после первой инъекции, возможно проведение второй инъекции препарата Иларис® в дозе 4 мг/кг. При достижении в последующем полного клинического ответа данным пациентам рекомендуется поддерживающая терапия препаратом в дозе 8 мг/кг, 1 инъекция с интервалом 8 нед.
Клинический опыт применения препарата с интервалом дозирования <4 нед или в дозе >600 мг или 8 мг/кг ограничен.
Повышение дозы препарата Иларис® требовалось наиболее часто для пациентов с NOMID/CINCA по сравнению с FCAS или MWS.
Терапия препаратом может быть инициирована и проводиться только врачом, имеющим опыт диагностики и лечения пациентов с CAPS.
При сЮИА рекомендованная доза у пациентов с массой тела ≥7,5 кг составляет 4 мг/кг (с увеличением до 300 мг) каждые 4 нед в виде п/к инъекции.
После обучения технике п/к инъекций пациенты или лица, за ними ухаживающие, могут самостоятельно вводить препарат под надлежащим контролем (если врач сочтет это необходимым). Пациенты или лица, ухаживающие за ними, должны быть проинструктированы по технике приготовления раствора и правилам пользования шприцами и иглами, пригодными для проведения инъекции.
Особые группы пациентов
Пациенты ≥65 лет. Не требуется коррекция дозы препарата у пациентов в возрасте ≥65 лет.
Пациенты ≤18 лет. Подагрический артрит — нет данных по применению препарата Иларис® для лечения подагрического артрита у детей и подростков ≤18 лет. CAPS и сЮИА — опыт применения канакинумаба у детей младше 2 лет ограничен.
Нарушение функции почек. Не требуется коррекция дозы препарата у пациентов с нарушениями функции почек (опыт клинического применения у таких пациентов ограничен).
Нарушение функции печени. У пациентов с нарушениями функции печени эффективность и безопасность применения препарата не изучались. Так как препарат Иларис® — человеческий IgG, предполагается, что печеночная недостаточность не влияет на фармакокинетику данного препарата.
Указания по применению
I. Препарат Иларис®, в комплектации флакон с лиофилизатом без растворителя
Следует учесть, что подготовка к инъекции составляет около 30 мин.
Перед началом необходимо: найти чистое, удобное место для проведения инъекции; вымыть руки с мылом; проверить даты срока годности на флаконах и шприцах; не использовать препарат при истекшем сроке годности (последний день месяца, указанного на флаконе); всегда использовать новые неоткрытые иглы и шприцы; избегать касания игл и верхних частей флаконов.
Следует подготовить необходимые материалы: 1 фл. с лиофилизатом препарата Иларис® (хранить охлажденным при температуре от 2 до 8°C), входит в состав упаковки.
Для проведения инъекции помимо флакона с препаратом Иларис® необходимо: 1 фл. с водой для инъекции; 1 шприц (объемом 1 мл); 1 большая игла (50 мм) для приготовления раствора (игла для разведения); 1 маленькая игла для п/к инъекции (13 мм), спиртовые тампоны; чистые, сухие ватные тампоны; лейкопластырь; контейнер для использованных флаконов, игл и шприца.
Приготовление раствора препарата Иларис®
1. Снять защитную крышку с флакона с препаратом Иларис® и растворителем, не трогая руками пробки флаконов. Протереть их спиртовым тампоном.
2. Открыть упаковку с шприцем и иглой для разведения. Надеть иглу на шприц.
3. Аккуратно снять с иглы защитный колпачок и отложить его в сторону. Оттянуть поршень шприца назад до отметки 1 мл, заполняя шприц воздухом. Ввести иглу во флакон с водой для инъекции через центр резиновой пробки.
4. Осторожно надавливать на поршень шприца сверху вниз, чтобы воздух вошел во флакон с водой.
5. Перевернуть флакон с вставленными в него иглой и шприцем и поднести к глазам.
6. Убедиться в том, что конец иглы покрыт водой, и медленно передвигать поршень шприца вниз, немного ниже отметки 1 мл. Если возникли пузырьки воздуха в шприце, удалить их, согласно инструкциям, полученным от медицинского работника.
7. Убедиться, что 1 мл воды для инъекций находится в шприце, а затем вытащить иглу из флакона (во флаконе останется вода — это нормально).
8. Вставить иглу с шприцем в центр пробки флакона с препаратом Иларис®, стараясь не трогать иглу и пробку флакона, и медленно выпустить всю воду (1 мл) из шприца во флакон.
9. Осторожно извлечь шприц с иглой из флакона, надеть на иглу защитный колпачок.
10. Не дотрагиваясь до резиновой пробки флакона, наклонить его под углом 45° и вращать в течение 1 мин. Не встряхивать. Затем отставить флакон на 5 мин.
11. Затем аккуратно повращать флакон во фронтальной плоскости 10 раз, не дотрагиваясь до резиновой пробки.
12. Снова отставить флакон на 15 мин, при комнатной температуре, для получения прозрачного раствора. Не встряхивать. Не использовать раствор, если в нем присутствуют посторонние частицы.
13. Убедиться, что весь раствор находится внизу флакона. Если капли раствора остались на пробке, слегка постучать по стенке флакона. Раствор должен быть прозрачным и свободным от посторонних видимых частиц. Если приготовленный раствор не используется сразу, необходимо поставить его в холодильник (при температуре 2–8 °С) и использовать в течение 24 ч.
Подготовка к инъекции
14. Протереть резиновую пробку флакона с приготовленным раствором препарата Иларис® новым спиртовым тампоном.
15. Снять защитный колпачок с иглы (игла для приготовления раствора), оттянуть поршень шприца до отметки 1 мл, набрав тем самым в него воздух. Вставить иглу в центр резиновой пробки флакона с препаратом Иларис® и выпустить в него весь воздух из шприца (не выпускать воздух непосредственно в раствор).
16. Не переворачивать флакон с шприцем. Опустить иглу до дна флакона.
17. Наклонить флакон, чтобы было возможно набрать необходимое количество раствора. Примечание: требуемое количество соответствует назначенной дозе (от 0,2 до 1 мл).
18. Медленно оттягивая поршень до необходимой метки (от 0,2 до 1 мл), набрать требуемое количество приготовленного раствора препарата Иларис®. Необходимо соблюдать осторожность, чтобы воздух не попал в шприц с раствором. Убедиться, что в шприце находится необходимое для инъекции количество раствора.
19. Извлечь шприц с иглой из флакона (неиспользованный раствор препарата Иларис® может остаться во флаконе). Надеть защитный колпачок на иглу, с помощью которой набирали препарат, и снять ее со шприца. Убрать иглу в специальный контейнер. Открыть упаковку с инъекционной иглой и надеть ее на шприц. Отложить шприц в сторону.
Проведение инъекции
20. Выбрать место для инъекции: верхняя часть плеча, верхняя часть бедра, живот или ягодица. Не делать инъекцию в то место, где наблюдаются покраснение, сыпь, гематома, нарушение целостности кожных покровов или поверхность кожи неровная. Избегать инъекции в рубцовую ткань, т.к. это может послужить причиной недостаточной экспозиции канакинумаба. Избегать попадания в кровеносный сосуд.
21. Протереть предполагаемое место инъекции новой спиртовой салфеткой и подождать, чтобы поверхность кожи стала сухой. Снять защитный колпачок с инъекционной иглы.
22. Осторожно сжать кожу над местом инъекции. Взять шприц под углом 90° и аккуратным плавным движением ввести иглу полностью в кожу.
23. Не вынимать иглу до тех пор, пока полностью не введен препарат. Отпустить кожную складку и извлечь иглу. Не использовать шприц и иглу повторно. Использованные иглы и шприц убрать в специальный контейнер.
После инъекции
24. Не протирать место инъекции. Если в месте инъекции отмечается кровоточивость, с помощью сухого тампона слегка надавить на место инъекции и подержать его в таком положении в течение 1–2 мин или до тех пор, пока кровоточивость не прекратится. Затем заклеить место инъекции пластырем.
25. Убрать использованные иглы и шприц в специальный контейнер для последующей утилизации. Никогда не использовать повторно шприц и иглу. Ни остатки раствора, ни остатки воды для инъекции не могут быть использованы еще раз. Каждый раз необходимо убедиться, что емкости с остатками воды для инъекции и препаратом Иларис® (если он остается) выброшены. Убедиться, что дети не смогут достать контейнер с использованными иглами и шприцем.
II. Препарат Иларис®, в комплектации флакон с лиофилизатом в комплекте с растворителем
Содержимое готового набора: флакон с порошком; флакон с растворителем; шприц для инъекции на 1 мл; безопасная игла; адаптер флакона (2 шт.); очищающие (спиртовые) салфетки (4 шт.).
Смешивание препарата Иларис® с растворителем
1. Снять с флакона с порошком отщелкивающуюся крышку, после чего протереть резиновую пробку свежей очищающей салфеткой. Примечание: не дотрагиваться до протертой резиновой пробки.
2. Взять один из блистер-лотков с адаптерами флаконов и, крепко удерживая блистер-лоток, полностью удалить с него пленочную крышку. Необходимо соблюдать осторожность и не дотрагиваться до адаптера флакона. Не вынимать адаптер флакона из блистер-лотка.
3. Поставить флакон с порошком на ровную поверхность. Держась за блистер-лоток, поместить адаптер флакона на верхушку флакона с порошком и протолкнуть его до конца вниз, пока он не защелкнется на флаконе.
4. Удерживая блистер-лоток за его верхнюю часть, приподнять его вертикально вверх и удалить блистер-лоток с адаптера флакона. Примечание: если адаптер флакона поставлен неправильно, не следует дотрагиваться до него. Перед тем как исправить положение адаптера снова поместить на него блистер-лоток.
5. Чтобы присоединить второй адаптер на флакон с растворителем, содержащий воду для инъекций, повторить п. 1–4. Примечание: теперь на обоих флаконах надеты адаптеры, и они готовы к использованию.
6. После того, как адаптеры надеты на оба флакона, раскрыть упаковку шприца, стянув с нее пленку, и вынуть шприц. Стараясь не дотрагиваться до кончика шприца, оттянуть поршень вниз, впустив в шприц 1 мл воздуха. Примечание: заполнение шприца воздухом (1 мл) облегчает последующий забор в шприц воды для инъекций и уменьшает образование пузырьков воздуха.
7. Взять флакон с растворителем и аккуратно навинтить шприц на адаптер флакона. Не прикладывать усилий. Примечание: необходимо соблюдать осторожность и не дотрагиваться до кончика шприца или адаптера флакона. На этом этапе игла не требуется.
8. Медленно протолкнуть поршень вниз до самого конца, чтобы ввести во флакон с растворителем 1 мл воздуха. Удерживать поршень в этом положении.
9. Перевернуть шприц так, чтобы флакон с растворителем оказался дном вверх, и поднять его на уровень глаз. Медленно потянуть за поршень вниз с тем, чтобы отобрать в шприц 1 мл воды. Продолжая удерживать флакон в направлении дном вверх, проверить, нет ли в шприце крупных пузырьков воздуха.
10. Удалить из шприца крупные пузырьки воздуха, для чего выполнить следующую процедуру: слегка постучать по шприцу с тем, чтобы крупные пузырьки воздуха поднялись наверх. Аккуратно протолкнуть поршень вверх с тем, чтобы крупные пузырьки воздуха вошли во флакон. Снова медленно оттянуть поршень назад до отметки 1 мл. Повторять эти действия до тех пор, пока не будут удалены все крупные пузырьки. Убедиться в том, что в шприце содержится 1 мл воды. Держась за поршень, свинтить шприц с флакона, предварительно поставленного на чистую и ровную поверхность во избежание разбрызгивания. Примечание: часть воды останется во флаконе с растворителем.
11. Поставить флакон с порошком на чистую и ровную поверхность. Навинтить на адаптер флакона шприц, содержащий 1 мл воды. Не прикладывать усилий. Примечание: следует соблюдать осторожность и не касаться пальцами кончика шприца или верхней части флакона. На этом этапе игла не требуется.
12. Медленно протолкнуть поршень вниз до самого конца, чтобы перенести 1 мл воды из шприца во флакон с порошком. Шприц пока не отсоединять.
13. Совершая круговые движения, медленно повращать шприц вместе с флаконом под углом 45° в течение по крайней мере 1 мин, не следует встряхивать шприц и флакон.
14. Поставить флакон вместе со шприцем на ровную поверхность и оставить их на 5 мин. Примечание: поршень может немного подняться. Это может случиться, поскольку давление во флаконе слегка повышено.
15. По прошествии 5 мин снова протолкнуть поршень шприца до конца вниз. Аккуратно перевернуть флакон вместе со шприцем 10 раз в вертикальной плоскости. Ни в коем случае не встряхивать шприц и флакон.
16. Дать флакону вместе со шприцем постоять еще 15 мин. По прошествии 15 мин, не встряхивая флакон, убедиться в том, что раствор не мутный и не содержит частиц. Наверху раствора может присутствовать пена; это не должно вызывать беспокойства и не является помехой для выполнения следующего этапа. Если в растворе все еще присутствуют частицы, повторить п. 15, описанный выше, после чего оставить флакон со шприцем еще на 5 мин, а затем снова проверить, нет ли в растворе частиц. Если раствор не мутный и не содержит частиц, отобрать назначенную дозу, как описано в следующем разделе. Примечание: если раствор не используется сразу после приготовления, его следует поставить в холодильник (при температуре 2–8 °C) и использовать в течение 24 ч.
Подготовка к инъекции
17. Перевернуть флакон вместе со шприцем дном вверх и аккуратно оттянуть поршень вниз с тем, чтобы отобрать в шприц 1 мл раствора. Шприц пока не отсоединять.
Медленно протолкнуть поршень до самого конца, чтобы перенести весь раствор обратно во флакон. Примечание: цель данного этапа — обеспечить полное перемешивание раствора и уменьшить образование пузырьков воздуха.
18. Поднять шприц на уровень глаз и снова медленно оттянуть поршень назад, чтобы отобрать требуемый объем раствора. Примечание: требуемое количество зависит от дозы, которую необходимо ввести (от 0,2 до 1 мл). Какой именно объем раствора нужно вводить, скажет врач. Продолжая удерживать флакон дном вверх, проверить, нет ли в растворе, набранном в шприц, крупных пузырьков воздуха (при этом часть раствора может остаться во флаконе).
19. Удалить из раствора крупные пузырьки воздуха, для чего выполнить следующую процедуру: слегка постучать по шприцу с тем, чтобы крупные пузырьки воздуха поднялись наверх; аккуратно протолкнуть поршень вверх с тем, чтобы крупные пузырьки воздуха вошли во флакон; снова медленно оттянуть поршень назад до отметки, соответствующей назначенной дозе. Повторять эти действия до тех пор, пока не будут удалены все крупные пузырьки. Удостовериться, что объем раствора в шприце соответствует назначенной дозе. Держась за поршень, свинтить шприц с флакона, предварительно поставленного на чистую и ровную поверхность во избежание разбрызгивания. Положить приготовленный шприц на чистую и ровную поверхность. Примечание: не следует дотрагиваться до кончика шприца.
20. Вынуть безопасную иглу из блистерной упаковки и навинтить ее на приготовленный шприц. Примечание: не следует дотрагиваться до кончика шприца или иглы. Переместить откидной предохранитель в направлении корпуса шприца.
Техника проведения инъекции, выбор места инъекции, поведение после инъекции — см. выше, в разделе I.
Состав
Главный функциональный элемент — канакинумаб.
Другие ингредиенты: маннит, гистидин, моногидрат гистидина гидрохлорида, полисорбат 80, вода для инъекций.
Форма выпуска
Медикамент выпускается в виде инъекционного раствора. Продается в упаковках с одним флаконом в каждой.
Фармакодинамика препарата
Канакинумаб представляет собой полностью человеческое моноклональное антитело IgG1/κ, обозначаемое суффиксом «умаб». Канакинумаб специфически связывается с провоспалительным цитокином интерлейкином-1-бета (ИЛ-1β) и нейтрализует его. В результате подавляется взаимодействие между ИЛ-1β и рецептором ИЛ-1 и, следовательно, экспрессия других медиаторов воспаления.
Синдромы периодической лихорадки связаны с неконтролируемой гиперпродукцией IL-1β, что объясняет клинический ответ канакинумаба при этих заболеваниях.
Фармакокинетика
Абсолютная биодоступность оценивается в 66%. Канакинумаб связывается с IL-1β плазмы, но связывание с белками плазмы количественно не определялось. Путь выведения еще не определен.
Показания к применению
Используется у пациентов в возрасте 4 лет и старше для лечения семейного простудного аутовоспалительного синдрома (FCAS) и синдрома Макла-Уэллса (MWS), которые являются частью криопирин-ассоциированного периодического синдрома (CAPS), а также у пациентов в возрасте 2 лет и старше для лечения системного ювенильного идиопатического артрита (ЮИА).
Противопоказания
Основные ограничения:
- аллергия на один из составляющих элементов;
- активные, тяжелые инфекции.
Побочные действия
Наиболее частыми негативными эффектами являются инфекции (преимущественно верхних) дыхательных путей.
Другие распространенные побочные действия включают: ушные инфекции, целлюлит, гастроэнтерит, инфекцию мочеиспускательного канала, вульвовагинальный кандидоз, головокружение, жалобы на верхние отделы живота, реакции в месте инъекции, боль в суставах и спине, скелетно-мышечную боль, усталость/астению, снижение почечного клиренса креатинина, протеинурию, лейкопения, нейтропения.
Медикаментозные взаимодействия
При использовании медикамента необходимо учитывать следующие взаимодействия:
- ингибиторы TNF;
- субстраты CYP450;
- живые вакцины.
Применение и дозы
Препарат вводится подкожно, обычно в дозе 150 мг для пациентов с массой тела более 40 кг и 2 мг/кг м.т. для больных с массой тела от 15 кг до 40 кг каждые 8 недель. Доза и схема введения могут быть скорректированы врачом.
Передозировка
Данные отсутствуют.
Особые указания
Перед началом терапии взрослым, детям и подросткам рекомендуется пройти все прививки, включая пневмококковую вакцинацию и вакцинацию инактивированной противогриппозной вакциной.
Применение у беременных и лактирующих женщин
По усмотрению врача.
Вождение транспортных средств и работа с механизмами
Не влияет.
Условия продажи
По наличию рецепта от врача.
Рекомендации по хранению
Лекарственное средство необходимо хранить в холодильнике. Необходимо избегать воздействия солнечных лучей и ограничивать доступ к лекарствам для детей раннего возраста. Температурные значения находятся в пределах 2-8°С.
Москва
Москва: ближние регионы
Москва: дальние регионы
Санкт-Петербург
Анапа
Белгород
Воронеж
Екатеринбург
Иркутск
Казань
Краснодар
Красноярск
Курск
Липецк
Нижний Новгород
Новосибирск
Пенза
Пермь
Ростов на Дону
Самара
Саратов
Тула
Тюмень
Уфа
Хабаровск
Челябинск
Энгельс
Другие регионы РФ
Доставка по Москве осуществляется курьером.
Стоимость доставки:
—
БЕСПЛАТНО!
(для заявок на сумму более 3000 руб);
—
200 р.
(для заявок на сумму менее 3000 руб).
Сделать заказ и получить консультацию можно по телефону: 8 (495) 120-28-79
Адрес: 119530, Москва, Очаковское ш., 34