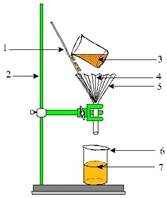
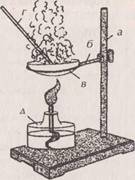
Инструкции
к практическим работам для 8 класса
Практическая работа 3
Признаки
протекания химических реакций
Цель:
научиться определять по характерным признакам химические явления.
Оборудование:
пробирки, пробиркодержатель, шпатели, пипетка, горелка.
Реактивы:
мел, уксус, крахмал, йодная настойка, сахар.
Ход
работы.
I.
Повторите правила ТБ при работе в химическом кабинете.
Правила
техники безопасности.
1) Внимательно
читайте этикетку на сосуде с тем веществом, которое берете для опыта. Открывая
сосуд с реактивом, не кладите пробку на лабораторный стол боком, а поставьте
вниз дном.
2) Реактивы
берите только в тех количествах, которые указаны в инструкции.
3) Излишек
реактива не сливайте (не высыпайте) назад в посуду, где они находились.
4) Сосуд, из
которого взяли реактив, сразу же закройте пробкой (крышкой) и поставьте на
место.
5) Не
пробуйте вещества на вкус!
6) Будьте
особенно осторожны при работе с нагревательными приборами. Чтобы потушить
горелку, нужно закрыть её колпачком, задувать нельзя.
7) После
окончания работы уберите рабочее место, выключите электронагревательные приборы
и вымойте руки.
Если произошел
несчастный случай, немедленно обращайтесь к учителю.
II.
Ознакомьтесь с инструкцией к практической работе.
Результаты
опытов записывайте в тетрадь сразу же после выполнения опыта.
Опыт 1.
Горение сухого горючего.
Соберите горелку и
зажгите сухое горючее. Что наблюдаете? Потушите горелку с помощью колпачка.
Сделайте вывод о признаке реакции.
Опыт 2.
Взаимодействие крахмала с йодом.
В пробирку
поместите немного порошка крахмала и добавьте каплю йодной настойки. Опишите
наблюдаемые явления. Сделайте вывод о признаке реакции.
Опыт 3.
Нагревание сахара.
В пробирку
поместите немного сахарного песка. Укрепите пробирку в пробиркодержателе.
Зажгите горелку и нагрейте сахар в пробирке. Что наблюдаете? Поставьте пробирку
вместе с держателем в штатив для пробирок. (Ни в коем случае не трогайте
пробирку – она горячая!). Сделайте вывод о признаках реакции.
Опыт 4.
Взаимодействие мела с уксусом.
В пробирку
поместите небольшой кусочек мела и прилейте 1 мл уксуса. Что наблюдаете?
Сделайте вывод о признаке реакции.
III.
Заполните таблицу
|
Описание |
Наблюдения |
Признак |
|
Опыт 1. Зажгли горелку. |
IV. Сделайте
общий вывод к работе.
8 класс
Практическая
работа 6
Решение
экспериментальных задач по теме
«Важнейшие
классы неорганических соединений».
Цель: научиться
решать экспериментальные задачи.
Оборудование:
пробирки.
Реактивы:
в пробирках под номерами растворы кислоты и щелочи; индикаторы (фенолфталеин,
метилоранж), сульфат меди(II), гидроксид натрия, соляная кислота, (для
дополнительной задачи магний, гидроксид магния).
Ход работы
Задача 1. В двух пробирках
находятся растворы кислоты и щелочи. Определите вещества.
Задача 2. Получите гидроксид меди(II) из
имеющихся реактивов.
Задача 3. Химическим способом
отмойте пробирку, загрязненную на практическом занятии гидроксидом меди(II).
Задача 4. В склянке без этикетки
находится бесцветный раствор. Предполагают, что это раствор фенолфталеина.
Проведите опыт, подтверждающий или опровергающий данное предположение.
К задачам 2, 3 и 4 напишите
уравнения реакций.
Напишите вывод к работе.
Дополнительное задание
Задача 5. В вашем распоряжении
магний, гидроксид магния и соляная кислота. Сколькими способами вы сможете
получить хлорид магния?
Практическая работа № 1 и № 2
^ Правила техники безопасности (Т.Б.) при работе в хим. кабинете. Ознакомление с лабораторным оборудованием. Изучение строения пламени. Очисгка поваренной соли.
Цель: ГЬзнакомитъся с Т.Б. при работе в кабинете химии, познакомиться с лабораторным оборудованием изучить строение пламени и очистить загрязненную поваренную соль. Прочти Т.Б. (не переписывая в тетрадь)
Т. Б.: Шзнакомься с инструкцией находящейся в кабинете химии. Изучи ее и запомни, как пользоваться лабораторным оборудованием. Правильно туши и пользуйся спиртовкой. Экономно расходуй хим. в-ва. № твоем столе должно быть чисто.
Выдели сбоку у себя в тетради /с Т.Б. ознакомлен
Число, подпись твоя.
/ Оборудование: Лабораторный штатив, хим. посуда, спиртовка, воронка, пробирки в штативе, фильтр, склянки с растворами №С1 — поваренная соль, НО, стеклянная палочка, мерная посуда и др.
Ход работы.
- Ознакомление с лабораторным штативом
- Сделай рисунок лаб. Штатива карандашом и подпиши название
- Сделай рисунок и надписи к тому лабораторному оборудованию, которое стоит у вас на столе.
- Сделай выводы, для чего вы с этим знакомшшсь.
- Зажги спиртовку, пламя, зарисуй его, подпиши, сделав вывод, какая часть пламени самая яркая и горячая.
- Зарисуй спиртовку и сделай вывод как ее правильно тушить и почему?
- Очисгка поваренной соли.
Цель: Ознакомиться со способами разделения смесей, основанными на различии в физич. Свойствах компонентов; научиться правильно проводить фильтрование и выпаривание р-ров. Рассмотрим выданную смесь соли с песком. Опишите ее внешний вид. ГЬдумайте, как разделить эту смесь. Результаты оформить в таблицу.
Документ содержит инструкции по выполнению практических работ по химии.
Просмотр содержимого документа
«5Практическая работа»
Практическая работа №5
Признаки химической реакции.
Цель: наблюдение признаков химических реакций при проведении опытов.
|
Оборудование и реактивы |
Ход работы. Рисунки. |
Наблюдения. Уравнения реакций, названия продуктов |
Выводы |
|
Штатив с пробирками, спиртовка со спичками, Cu – медная проволока, О2 – из воздуха СиО и H2S04 |
I. Взаимодействие оксида меди(П) с серной кислотой Прокалить проволоку в пламени спиртовки CuO на кончике шпателя + 1мл H2SO4; нагрели. |
Наблюдайте цвет, осадок, газ, запах, свет или выделение тепла. Cu+ О2 = СиО+ H2S04 = |
Признаки данной реакции ______________ Тип реакции _________ . Признаки данной реакции ______________ Тип реакции _________ . |
|
СаСОз — известняк и НС1 |
II. Взаимодействие карбоната кальция (мела) с соляной кислотой 1 кус. CaCO3 + 1мл НСl |
Наблюдали_______________ CaCO3 + НСl = |
Признаки данной реакции ______________ Тип реакции _________ . |
|
FeCl3 и KSCN |
III. Взаимодействие хлорида железа (III) с роданидом калия 1мл FeCl3 + 2-3 капли KSCN |
Наблюдали_______________ FeCl3 + KSCN = |
Признаки данной реакции ______________ Тип реакции _________ . |
|
Na 2C03 и СаСl2 |
IV. Взаимодействие карбоната натрия с хлоридом кальция 1мл Na2SO4 + 1мл BaCl2 |
Наблюдали_______________ Na2SO4 + BaCl2 = |
Признаки данной реакции ______________ Тип реакции _________ . Вывод: Признаки химической реакции ___________________ |
Просмотр содержимого документа
«6 Практическая работа»
Практическая работа №6. «Получение водорода»
Цель: научиться собирать газ с относительной плотностью меньше плотности воздуха; убедиться опытным путем, что водород является восстановителем.
|
Оборудо—вание и реактивы |
Ход работы |
Наблюдения. Рисунки с обозначениями к ним. |
Выводы. Уравнения реакций. |
|
Прибор для получе-ния газов, спиртов-ка, спички, лабора-торный штатив, штатив с пробирками, гранулы цинка (Zn), соляная кислота (HCI), оксид меди(II) (CuO), |
1. В пробирку с газоотводной трубкой опустили 2-3 гранулы цинка и налили соляной кислоты (чтобы кислота покрывала цинк) 2. Собрали водород методом вытеснения воды. 3. Проверка водорода на чистоту. Для опыта использовали водород, собранный вытеснением воздуха. Поднесли пробирку с водородом к пламени спиртовки. |
Если раздавшийся звук напоминает сухой треск, то значит водород чистый. А если звук резкий, «тявкающий», то водород смешан с воздухом. |
Zn + 2HCl = =… + ..+ ..+Q H2+O2=.. |
|
4. В сухую пробирку поместили 0,5 см3 оксида меди (II). Пропустили водород через нагретый оксид меди (II). |
CuO+H2=.. + +.. |
Просмотр содержимого документа
«61 Практическая работа»
Практическая работа №6. «Получение водорода»
Цель: получить водород взаимодействием соляной кислоты с цинком; изучить некоторые свойства газа водорода..
|
Оборудо—вание и реактивы |
Ход работы |
Наблюдения. Рисунки с обозначениями к ним. |
Выводы. Уравнения реакций, тип реакций. |
|
Прибор для получе-ния газов, спиртов-ка, спички, лабора-торный штатив, штатив с пробирками, гранулы цинка (Zn), соляная кислота (HCI), оксид меди(II) (CuO), |
1.Получение водорода. В пробирку с газоотводной трубкой опустили 3 гранулы цинка и налили соляной кислоты (чтобы кислота покрывала цинк) 2. Собрали водород методом вытеснения воздуха. 3. Проверка водорода на чистоту Поднесли пробирку с водородом к пламени спиртовки. |
Если раздавшийся звук напоминает сухой треск, то значит водород чистый. А если звук резкий, «тявкающий», то водород смешан с воздухом. С водородом безопасно работать, если услышали звук «п-пах». Наблюдали на стенках пробирки _____. |
Zn + 2HCl = =..?.. + ..?.↑ + +Q Эта реакция ……… Водород – это газ ………………. H2+O2=..?. Эта реакция …………………. |
|
4.Восстановление водородом оксида меди(II). В сухую пробирку поместили 0,5 см3 оксида меди (II). Пропустили водород через нагретый оксид меди (II). |
На поверхности кристаллов оксида меди (II) наблюдали ………… |
CuO+H2=.?.+.?. Эта реакция ………………….. |
Вывод: …… в лаборатории получают реакцией ……. между…. и ….. Его собирают способом …. …., в пробирку дном ….,так как он ……. воздуха. Проверяют на чистоту звуком сгорания. Водород …., ….., ….., …… Водород ….. на воздухе, образуя ……Водород обладает …… свойствами, так как ……. медь из оксида меди.
Просмотр содержимого документа
«7 Практическая работа»
Практическая работа №7. «Получение кислорода»
Цель:получить кислород разложением перманганата калия; изучить некоторые свойства кислорода.
|
Оборудо—вание и реактивы |
Ход работы |
Наблюдения. Рисункис обозначениями к ним. |
Выводы. Уравнения реакций, тип реакций. |
|
Металлический штатив с лапкой, спиртовка, спички, пробирка с газоотвод-ной трубкой, пробирка, комочек ваты, пипетка, химичес-кий стакан, лучинка, коничес-кая колба с пробками. Реактивы. KMnO4крис, известко-вая вода Сa(OH)2, древесный уголь. |
Опыт I Получение кислорода нагреванием перманганата калия. Собрали кислород методом вытеснения воздуха. Опыт 2. Обнаружение кислорода тлеющей лучиной Опыт 3. Сжигание древесного угля в кислороде. Запишите уравнения соответствующих реакций. |
Что наблюдаете? |
t KMnO4 = K2MnO4+.?.+.?. (назовите продукты) Тип реакции: ___ Почему кислород можно собирать методом вытеснения воздуха? С+О2 =..?. Тип реакции ___ |
Вывод: Кислород в лаборатории получают реакцией ………….……….……….
Его собирают способом……………….., так как он …………. воздуха.
Кислород….., ….., …., …, …. .
Кислород взаимодействует с ………., образуя ……. .
Эта реакция называется реакцией …….
Просмотр содержимого документа
«8 Практическая работа»
Практическая работа № 8
Тема: «Условия протекания химических реакций между растворами электролитов до конца».
Цель: Осуществить практически реакции ионного обмена, выяснить условия протекания химических реакций между растворами электролитов до конца.
Оборудование и реактивы: пробирки, растворы сульфата меди (II) (СuSO4 ) , сульфата алюминия (Al2(SO4)3) , гидроксида натрия( NаOH), хлорида бария (BaCL2), карбоната натрия(Na2CO3), азотной кислоты (НNО3), фенолфталеин, серной (Н2SO4) и соляной кислот( НСl).
|
Ход работы |
Наблюдения. Рисунки с обозначениями к ним. |
Уравнения реакций. Выводы. |
|
Опыт 1. р-р CuSO4 р-р NaOH
|
Образовался голубой |
CuSO4 + NaOH = Полное ионное уравнение Сокращенное ионное ур-е Вывод: реакция идёт до конца, т.к. ионы … и … связываются c образованием … |
|
|
|
BaCL2+ Al2(SO4)3 = Полное ионное уравнение Сокращенное ионное ур-е Вывод: реакция идёт до конца, т.к. __________ |
|
Опыт 2. р-р Na2CO3 р-р НNО3
|
Выделяется _________
|
Na2CO3 + НNО3 = Полное ионное уравнение Сокращенное ионное ур-е Вывод: реакция идёт до конца, т.к.___________ |
|
Опыт 3.
|
Наблюдали ___________ Наблюдали ________ |
NаOH+ НСl= Полное ионное уравнение Сокращенное ионное ур-е Вывод: реакция идёт до конца, т.к. __________ Cu(OH)2 + Н2SO4 = Полное ионное уравнение Сокращенное ионное ур-е Вывод: реакция идёт до конца, т.к. __________ |
Вывод: Реакция ионного обмена протекает до конца при условии, что в растворе присутствуют ионы ………. электролита, которые ………………. друг с другом с образованием ….…, ..……, …….
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Преподавание основ химии в школе
не может совершенствоваться без соответствующей организации школьного
химического эксперимента.
Химический эксперимент –
источник знаний о веществе и химической реакции – важное условие активизации
познавательной деятельности учащихся, воспитания устойчивого интереса к
предмету, а также представлений о практическом применении химических знаний.
Данные методические указания к
выполнению практических работ по ХИМИИ составлены в соответствии с действующей
рабочей программой и разработаны на основе обязательного минимума содержания
химии для основной общеобразовательной школы и требований Федерального
государственного образовательного стандарта основного общего образования к
уровню подготовки учащихся, что явилось главным принципом его
структурирования.
Инструктивные карточки
составлены в соответствии с образовательной линией Габриеляна О.С. Многие
практические работы составлены с учётом замены химического оборудования и
реактивов на более простые и доступные.
Представленные инструктивные
карточки для фронтального и звеньевого проведения работ. Карточки содержат
краткое описание выполняемых опытов, иллюстрации, показывающие как должен быть
собран прибор для проведения опыта, что даёт возможность учащимся ясно видеть
цель работы, не отвлекаться на чтение опытов, которые не будут выполняться в
данной работе, а также даёт представление о том, какие записи необходимо
сделать в тетради для составления отчёта о работе. В ходе выполнения
практических работ инструктивные карточки должны находиться на столах у
учащихся и способствовать чёткой и слаженной работе во время проведения опытов.
Изложены правила техники
безопасности при работе в химической лаборатории, сведения о посуде,
оборудовании и приборах, используемых при проведении лабораторных работ.
На лабораторных и
практических занятиях устанавливается связь между теоретическими и
практическими знаниями и умениями, облегчается понимание фактического
материала.
ИНСТРУКЦИЯ ПО ОХРАНЕ ТРУДА ДЛЯ
УЧАЩИХСЯ ПРИ РАБОТЕ В КАБИНЕТЕ
ХИМИИ
ОБЩИЕ
ТРЕБОВАНИЯ БЕЗОПАСНОСТИ
1.
Соблюдение требований настоящей инструкции обязательно для
учащихся, работающих в кабинете.
2.
Запишите на обложке тетради номер своего рабочего места.
3.
Пребывание учащихся в помещении кабинета разрешается только в
присутствии учителя химии; пребывание учащихся в лаборантской запрещается.
4.
Портфели, сумки и другие вещи следует убирать в ящики стола. Во
время работы на столе должны находиться только: необходимое оборудование,
тетрадь и письменные принадлежности.
5.
В ходе выполнения работы по одному варианту координируйте свои
действия с действиями соседа по парте, разговаривая при этом шепотом.
6.
Перед началом практической работы (ПР) учащиеся должны изучить
правила техники безопасности.
7.
Прежде чем приступить к выполнению ПР, следует подготовиться к
ней, уяснить цели и задачи, прочитав инструкцию по ее выполнению и внимательно
выслушав объяснение учителя.
8.
Уборку рабочих мест по окончании работы следует проводить в
соответствии с инструкцией к работе и указаниями учителя.
9.
После окончания работы сдать рабочее место дежурному по классу.
По окончании ПР учащиеся должны тщательно вымыть руки с мылом.
10.
При получении травмы, а также при плохом самочувствии учащиеся
должны немедленно сообщить об этом учителю.
11.
При необходимости ученик должен уметь пользоваться содержимым
аптечки и согласно инструкции уметь оказать первую помощь при порезах и ожогах.
12.
При возникновении в кабинете во время занятий аварийных ситуаций
(пожар, появление сильных посторонних запахов) не допускать паники и
подчиняться только указаниям учителя.
ТРЕБОВАНИЯ БЕЗОПАСНОСТИ ВО ВРЕМЯ РАБОТЫ В
КАБИНЕТЕ ХИМИИ
ЗАПРЕЩАЕТСЯ!?
1.
Есть, пить в химическом кабинете, пробовать вещества на вкус.
2.
Брать вещества руками.
3.
Оставлять неубранными рассыпанные или разлитые реактивы.
4.
Выливать или высыпать отработанные реактивы в раковину.
5.
Выливать или высыпать остатки реактивов в склянки и банки, из
которых они были взяты.
6.
Использовать вещества, если они находятся не в подписанных
склянках.
7.
Набирать одной и той же ложечкой или пипеткой различные вещества.
8.
Менять пробки и пипетки от различных банок или склянок.
9.
Оставлять открытыми склянки с жидкостями и банки с сухими веществами.
10.
Работать с легковоспламеняющимися веществами вблизи огня.
11.
Переходить на другие рабочие места без разрешения учителя.
12.
Перебрасывать друг другу какие-либо предметы.
13.
Бесцельно смешивать растворы или испытывать вещества по
собственному усмотрению, проводить самостоятельно любые опыты, не
предусмотренные данной работой.
14.
Уносить с собой что бы то ни было из предметов и веществ,
предназначенных для проведения опытов.
15.
Зажигать спиртовку без надобности.
16.
Оставлять пробирки и другую химическую посуду грязной.
ТРЕБОВАНИЯ ОХРАНЫ ТРУДА В АВАРИЙНЫХ СИТУАЦИЯХ
1.
При разливе водного раствора кислоты или щелочи, а также при
рассыпании твердых реактивов немедленно сообщить об этом учителю
(преподавателю) или лаборанту. Не убирать самостоятельно любые вещества.
2.
При разливе легковоспламеняющихся жидкостей или органических
веществ немедленно погасить открытый огонь спиртовки и сообщить об этом учителю
(преподавателю) или лаборанту.
3.
При разливе легковоспламеняющейся жидкости и ее воспламенении
немедленно сообщить об этом учителю (преподавателю) и по его указанию покинуть
помещение.
4.
В случае, если разбилась лабораторная посуда, не собирать ее
осколки незащищенными руками, а использовать для этой цели щетку и совок.
5.
При получении травмы учащийся немедленно сообщает об этом
преподавателю.
6.
Учитель немедленно оказывает первую помощь пострадавшему и
сообщает администрации учреждения.
ТРЕБОВАНИЯ ОХРАНЫ ТРУДА ПО ОКОНЧАНИИ РАБОТЫ
1.
Погасить спиртовку специальным колпачком, не задувать пламя
спиртовки, а также не гасить его пальцами.
2.
Привести в порядок рабочее место, сдать все оборудование,
приборы, реактивы учителю (преподавателю) или лаборанту, отработанные водные
растворы слить в стеклянный сосуд вместимостью не менее 3л.
3.
Проветрить помещение и тщательно вымыть руки с мылом.
КРАТКАЯ ИНСТРУКЦИИ ПО ОКАЗАНИЮ
МЕР ПЕРВОЙ ПОМОЩИ ПРИ
РАЗЛИЧНОГО РОДА ОТРАВЛЕНИЯХ ИЛИ ПОРАЖЕНИЯХ ОРГАНИЗМА
|
ПОРАЖЕНИЯ |
ПЕРВАЯ ПОМОЩЬ |
|
При порезах стеклом |
Обработать |
|
при ожогах: |
|
|
1. термическом (огнем, паром, горячим предметом) |
|
|
А) первой степени(краснота) |
Для снятия болевых |
|
Б) второй степени (пузыри) |
Обработать |
|
Б) второй степени (пузыри) |
Покрыть рану стерильной повязкой и направить пострадавшего |
|
2. кислотном (серной, азотной, |
Промыть |
|
(соды). |
|
|
3. щелочном |
Участок |
|
при отравлениях: |
|
|
А) кислотами |
Вызвать |
|
Б) щелочами |
Первая помощь как при отравлении кислотами. Затем пить 1%ный |
|
В) газами |
Обеспечить доступ чистого |
|
При поражениях электрическим током |
Обеспечить |
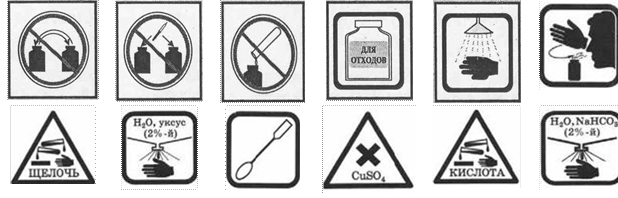
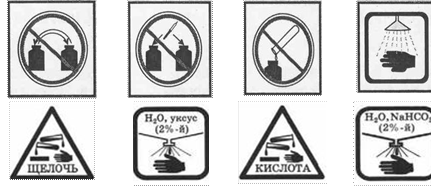
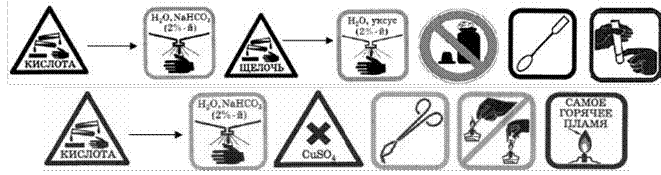
ЗНАКИ, ОБОЗНАЧАЮЩИЕ ПРАВИЛА ТЕХНИКИ
БЕЗОПАСНОСТИ ПРИ ВЫПОЛНЕНИИ ХИМИЧЕСКИХ ОПЫТОВ, И ИХ РАСШИФРОВКА
|
Запрещается брать вещества руками |
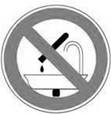
Запрещается оставлять |
|
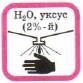
Едкое вещество — кислота! |
Едкое вещество — щёлочь! Разрушает и раздражает кожу, слизистые оболочки |
|
Токсичное и |
Токсичное и |
|
Токсичное и |
Определяя вещество по |
|
себе газ рукой, не делайте |
|||
|
Попавшие на кожу капли холодной воды, а затем обработайте |
Попавшие на кожу капли раствора щелочи немедленно смойте холодной воды, а затем обработайте поврежденную поверхность |
||
|
Пробирку закрепляйте в пробиркодержателе у отверстия |
Зажигайте спиртовку |
||
|
Нагревайте сначала всю пробирку или стеклянную пластину, вещество |
Перемешивание растворов в пробирке |
||
|
Используйте для металлической, стеклянной |
Для перемешивания веществ резиновой трубки, |
||
|
Используйте шпатель для твердых веществ |
Нагревайте вещества в |
||
|
Запрещается пробовать вещества на вкус |
Оставлять неубранными |
||
|
Менять пробки |
|
и пипетки от различных |
Набирать одной и той же |
|
банок и склянок запрещается |
|||
|
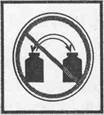
Выливать или высыпать остатки реактивов в банки из которых запрещается |
Собирайте остатки веществ |
||
|
Смойте реактив водой, а |
Выливать или высыпать |
ЛАБОРАТОРНОЕ ОБОРУДОВАНИЕ
|
а |
|
Химическая пробирка — используется для проведения опытов и |
|
б |
|
Колба коническая — |
|
в |
|
Химический стакан — служит |
|
г |
|
Колба круглодонная — используется для проведения |
|
д |
|
Колба плоскодонная — служит |
|
е |
|
Чашка выпаривания |
|
ж |
|
Тигель — предназначается |
|
з |
|
Щипцы тигельные — |
|
и |
|
Треугольник фарфоровый — используют для размещения в нем |
|
к |
|
Ложечка — предназначена для |
|
л |
|
Ступка с пестиком — служит для размельчения и растирания |
|
м |
|
Керамическая прокладка |
|
н |
|
Пробиркодержатель — используется |
ПЕРЕЧЕНЬ
ПРАКТИЧЕСКИХ РАБОТ ДЛЯ 8 КЛАССА
Практическая работа №1
Тема: «Лабораторное
оборудование и приемы обращения с ним. Правила безопасной работы в химической
лаборатории»
Цель работы: ознакомиться
с правилами техники безопасности при работе в кабинете химии, лабораторным
оборудованием и приемами обращения с ним.
Оборудование:
Лабораторный штатив с кольцом и лапкой, спиртовка, пробиркодержатель, колбы,
стаканы, воронка, фарфоровая посуда, спички.
Примечание: Внимательно слушай
указания учителя?! Алгоритм проведения работы: 1 этап:
Изучение техники безопасности при работе в кабинете химии — учебник стр.198
[1].
2 этап: Строение и обращение с лабораторным
штативом
— Изучи строение
лабораторного штатива, используя учебник стр.200 [1];
— Собери штатив
для работы и разбери его;
—
Зарисуй строение штатива (см. рис.1), отметь его назначение в
тетради.

Рисунок 1 — Лабораторный штатив
3 этап: Строение спиртовки, приемы работы с
ней
—
Изучите строение спиртовки и приемы обращения с ней, используя
инструкцию и учебник стр. 200-201[1];
—
В тетради зарисуйте спиртовку и укажите ее части (см. рис.2).
Инструкция по технике безопасности
работы со спиртовкой:
1.
Снять колпачок. Проверить плотно ли прилегает диск к отверстию сосуда. Если
зажечь спиртовку сразу же после снятия колпачка, загорается плёнка спирта на
горлышке спиртовки как раз на том месте, где колпачок прилегает к горлышку.
Пламя проникает под диск с трубкой, и пары спирта внутри резервуара загораются.
Может произойти взрыв и выброс диска вместе с фитилём. Чтобы избежать этого,
приподнимите на несколько секунд диск с фитилём для
удаления паров. Если
случится воспламенение паров, быстро отставьте в сторону предметы (тетрадь
для практических работ) и позовите учителя.
2.
Зажжённую спиртовку нельзя переносить с места на место, нельзя
также зажигать одну спиртовку непосредственно от другой. Для зажигания
спиртовки пользуйтесь спичками.
3.
Гасить спиртовку можно только одним способом — накрыть
пламя фитиля колпачком.
Колпачок должен находиться всегда под
рукой.
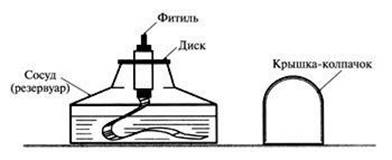
Рисунок 2 — Спиртовка
4 этап: Строение пламени
—
Изучи строение пламени спиртовки (см. рис.3), выясни, в какой
зоне пламени следует производить нагревание и почему;
—
Рассмотрите пламя спиртовки, выделите три зоны: нижняя часть
— тёмная и самая холодная, средняя часть — яркая, верхняя часть —
менее яркая но с наиболее высокой температурой;
—
Внесите на короткое время лучину в разные зоны пламени и по
характеру обугливания определите какая часть пламя самая горячая.
Рекомендуется
нагревать вещества в верхней части пламени!
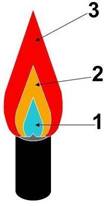
Рисунок 3 — Строение пламени
1 — темная
зона (холодное пламя); 2 — яркая часть; 3 — верхняя часть (горячее пламя).
5 этап:
Знакомство и обращение с лабораторным оборудованием и посудой
Внимательно
следи за рассказом учителя, в тетради сделай рисунки (а, б, в, г, е, к)
(см.
выше лабораторное оборудование) и вывод о том, как
следует обращаться с оборудованием и посудой.
6 этап: Оформите
отчёт о проделанной работе
Обратите внимание на оформление в тетради отчёта,
записи и рисунки делай аккуратно
Ход
работы:
|
№ |
Название прибора, его |
Назначение прибора и его частей |
|
|
1 |
Лабораторный штатив |
Лабораторный штатив служит для … 1 2 4 – 5 – |
|
|
2 |
Спиртовка |
Спиртовка служит для … 1 2 3 |
|
|
3 |
Строение пламени |
1 – 2 – 3 – |
|
|
4 |
Лабораторное оборудование а) б) в) |
и посуда г) е) к) |
а — ……. служит для … б — …… служит для |
7 этап:
Сделайте общий вывод о выполненной практической работе Вывод: ……
8 этап: Приведите
в порядок своё рабочее место
Практическая работа №2
Тема: «Приготовление
растворов с определенной массовой долей растворенного вещества»
Цель: научиться
взвешивать на лабораторных весах, определять объем жидкости с помощью мерного
цилиндра, приготовлять раствор с определенной массовой долей вещества.
Оборудование: химический
стакан, палочка для перемешивания, мерный цилиндр, лабораторные весы, разновесы.
Реактивы: сахар, соль, вода.
Инструктаж по технике безопасности?! Правила
техники безопасности:
Осторожно обращайтесь с химическим оборудованием!
Пользуйтесь чистой и пригодной для работы посудой. Знаки безопасности:




Алгоритм
проведения работы:
1 этап:
В тетради записать название темы, цели, оборудование, реактивы.
2 этап:
Расчёт задачи
Рассчитайте массу сахара и массу
воды, необходимые для приготовления необходимого вам раствора используя
формулы: m(вещества) = m(раствора) · ω(вещества) m(H2O)
= m(раствора) — m(вещества)
Определите
объем воды, соответствующий вычисленной массе, используя формулу: V = m ·
ρ
Помните, что для воды ρ = 1
г/мл.
Определите количества вещества,
используя формулу:
Определите число молекул, используя формулу:
Задачи
для выполнения:
Вариант №1
Задача 1
Вычислите сколько г сахара (С12Н22О11) необходимо и какой объём воды потребуется для
приготовления 60г 4% раствора. Чему равно количество сахара в растворе?
Задача 2
Приготовьте 50мл 6% раствора NaCl и рассчитайте количество и число молекул
данного вещества в растворе.
Вариант №2
Задача 1
Вычислите сколько г сахара (С12Н22О11) необходимо и какой объём воды потребуется для
приготовления 50г 3% раствора. Чему равно количество сахара в растворе?
Задача 2
Приготовьте 30мл 9% раствора NaCl и рассчитайте количество и число молекул
данного вещества в растворе.
*
Задача дополнительно:
Для подкормки
комнатных растений применяют раствор сульфата калия с массовой долей 2%.
Приготовьте 75г такого раствора.
3 этап: Оформление работы
в тетради (см. прил.№1). После произведенных расчетов по одному из вариантов
оформите их в тетради. 4 этап: Практическая часть
Ø
На лабораторных весах взвесьте вычисленную массу сахара (см.
прил.№2);
Ø
Всыпьте сахар в стакан;
Помните!
К соли приливают воду!
Ø
С помощью мерного цилиндра отмерьте вычисленный объем воды.
Перелейте воду в химический стакан с сахаром (см.
прил.№3);
Ø
Перемешайте содержимое химического стакана до полного растворения
сахара.
5
этап: Оформление работы в тетради (см. прил.№1) 6 этап: Сделайте
общий вывод о проделанной работе Вывод: ……
7 этап: Приведите в порядок своё рабочее
место.
Сдайте
тетради на проверку
|
Ход работы: |
Приложение №1 |
||||||
|
Теоретическая часть (расчет) |
Вывод |
||||||
|
Задача №1 |
1) … |
||||||
|
Дано: m (раствора) = ω (вещества) = |
Ре
|
шение: шение: |
2) … |
||||
|
m (С12Н22О11) — ? Задача №2 Дано: V (раствора) = ω (вещества) = n (NaCl) — ? N (NaCl) — ? |
|||||||
|
Практическая часть |
|||||||
|
Что делали (рисунок) |
Что наблюдали? |
Вывод |
|||||
|
1) 2) 3) … |
1) 2) 3) … |
1) 2) 3) … |
|||||
Приложение №2 Правила взвешивания на лабораторных весах
Перед началом работы проверьте,
в порядке ли набор разновесов, находятся ли весы в равновесии, и, если нет,
уравновесьте их с помощью чистого речного песка или бумаги. Не кладите вещество
на чашу весов! Взвешивайте его обязательно на листе бумаги. Располагая на весах
взвешиваемый предмет или разновесы, придерживайте чашу весов (но не стрелку),
чтобы избежать резких колебаний чаши в ту или иную сторону. Разновесы кладите
только пинцетом. Снимая разновесы с весов, помещайте их только на отведенное
место в футляре. При взвешивании разновесы всегда размещайте на правой чаше
весов, а взвешиваемое вещество (предмет) — на левой. Разновесы ставьте на чашу
весов всегда в определенном порядке: начните с более тяжелого разновеса, чем
взвешиваемый предмет. Если он слишком тяжел, то снимите его и положите
следующий, более легкий. И наоборот. Если масса разновесов мала, то, не
снимая положенные разновесы, дополните более тяжелыми. Приведите весы в
равновесие. По окончании взвешивания чаши весов необходимо протереть.
Приложение №3 Правила пользования мерным цилиндром
Чтобы правильно отмерить
измерительным цилиндром необходимый объем неокрашенной прозрачной жидкости —
воды, её наливают так, чтобы нижний край мениска находился на уровне
необходимого деления цилиндра. Соблюдайте правильное положение цилиндра
относительно глаз при наполнении его жидкостью! Последние порции воды
приливайте по каплям с помощью пипетки, чтобы не перелить.
Практическая работа №3
Тема: «Очистка загрязнённой поваренной соли»
Цель работы: научиться
проводить простейшие способы разделения смесей:
отстаивание, фильтрование, выпаривание. Формировать
важнейшие методы познания – наблюдения и умения описывать его.
Оборудование: 2 стаканчика,
стеклянная палочка, фильтр, воронка, спички, спиртовка, зажим, чашка для
выпаривания
Реактивы: смесь песка с солью,
дистиллированная вода.
Инструктаж
по технике безопасности?!
Примечание: Внимательно слушай
указания учителя?!
Осторожно
обращайтесь с химическим оборудованием!
Пользуйтесь чистой и пригодной для
работы посудой. Знаки безопасности:
Алгоритм
проведения работы:
1 этап: Растворение загрязненной поваренной
соли в воде
Ø
Возьмите загрязненную поваренную соль из стакана сухой ложкой;
Ø
Насыпьте 3 ложки данной соли в чистый стакан;
Ø
Налейте в стакан воды на 1/3 его объема;
Ø
Перемешайте содержимое стеклянной палочкой с резиновым
наконечником. 2 этап: Очистка загрязненной поваренной соли
фильтрованием
Ø
Возьмите кружок фильтровальной бумаги, сложите его пополам и еще
раз пополам. Сектор, стоящий из четырех слоев бумаги, разверните так, чтобы
образовался бумажный конус — фильтр.
Ø
Вложите фильтр в стеклянную воронку так, чтобы он плотно прилегал
к его стенкам и не доходил до края воронки примерно на 0,5см. Смочите фильтр
водой, держа воронку наклонно и вращая ее над банкой или стаканом.
Ø
Воронку с фильтром вставьте в кольцо штатива. Под воронку
поставьте пустой стакан так, чтобы конец воронки касался внутренней стенки
стакана (предупреждения разбрызгивания жидкости).
Ø
Фильтруемую жидкость наливайте на фильтр по стеклянной палочке.
Нижний конец палочки направьте к стенке воронки, а не в середину фильтра, чтобы
его не порвать.
Ø
В воронку следует наливать столько фильтруемый жидкости, чтобы
она не доходила до края фильтра на 0,5см.
3 этап:
Получение кристаллической поваренной соли выпариванием раствора
Ø
Фильтрат из стакана вылейте в выпарительную чашу;
Ø
Поставьте чашу в кольцо штатива;
Ø
Зажгите спиртовку;
Ø
Нагревайте фильтрат до начала образования кристаллов;
Ø
Во время нагревания помешивайте жидкость палочкой, не доводя ее
до кипения во избежание ее разбрызгивания.
4
этап: Составьте отчет о проделанной работе, используя
таблицу (см. ниже) Ход работы:
|
Название |
Что наблюдал? (Запишите |
Ответы на контрольные вопросы |
|||||||||
|
1.
|
1. 2. |
||||||||||
|
2. Фильтрование
|
Какие вещества находятся в фильтрате? |
||||||||||
|
3. Выпаривание
|
1. 2. операций, как: — растворение; — Для чего они применяются? а) растворение: б) фильтрование: … в) выпаривание: … |
||||||||||
|
а — … |
в — … |
д — … |
|||||||||
|
б — … |
г — … |
5 этап:
Сделайте общий вывод о проделанной работе Вывод: ……
6 этап:
Приведите в порядок свое рабочее место
Сдайте
тетради на проверку
Практическая работа №4
Тема: «Получение кислорода и изучение его
свойств»
Цель работы: рассмотреть
один из способов получения кислорода в лаборатории (разложением перманганата
калия или пероксида водорода), изучить химические свойства кислорода,
полученного в результате опыта.
Оборудование: штатив
лабораторный, пробирки, спиртовка, пробка с газоотводной трубкой, лучинка,
спички, ложка для сжигания веществ, пробка.
Реактивы: пероксид
водорода — H2O2, оксид марганца (IV) — MnO2 (или перманганат калия
— KMnO4), кусочек древесного угля.
Инструктаж
по технике безопасности?!
Примечание: Внимательно слушай
указания учителя?!
Осторожно
обращайтесь с химическим оборудованием!
Пользуйтесь чистой и пригодной для
работы посудой. Знаки безопасности:
Алгоритм
проведения работы:
1
этап: (в лаборатории можно получать одним из предложенных способам)
А. Получение кислорода путем разложения
перманганата калия — KMnO4
методом вытеснения воздуха
Ø
Соберите прибор, как показано на рисунке 1 или 2
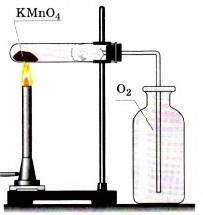
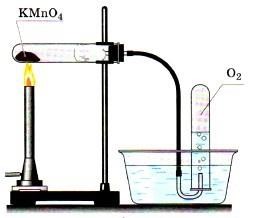
Рисунок
1 — Вытеснение воздуха Рисунок 2 — Вытеснение
воды
Ø
Поместите в пробирку на 1/5 ее объема перманганата калия.
Ø
В отверстие пробирки вставьте неплотный кусочек ваты и закройте
пробирку
пробкой с газоотводной трубкой. Проверьте прибор на
герметичность: опустите конец газоотводной трубки в стакан с водой,
выделившийся из трубки пузырек свидетельствует о герметичности прибора.
Ø
Пробирку с перманганатом калия закрепите горизонтально в лапке
штатива. Газоотводную трубку, погрузите почти до дна склянки – приемника.
Ø Нагревайте пробирку по
всем правилам. Полноту наполнения склянки
кислородом контролируйте тлеющей лучинкой.
Ø
После заполнения склянки кислородом, закройте ее стеклянной
пластиной и сохраните кислород для следующих опытов.
Б. Получение кислорода путем разложения пероксида
водорода — H2O2 методом вытеснения
воды
Ø
Соберите прибор, как показано на рисунке.

2 этап:
Сжигание угля в кислороде
Ø
В железной ложечке нагревайте кусочек древесного угля в пламени
спиртовки до красного каления;
Ø
Внесите тлеющий уголек в склянку с собранным кислородом; Ø
Сделайте вывод.
3 этап:
Сжигание серы в кислороде
Ø
В железную ложечку положите кусочек серы и подожгите его в
пламени; Ø Внесите горящую серу в сосуд с
кислородом; Ø Сделайте вывод.
4 этап:
Сжигание красного фосфора в кислороде
Ø
В железную ложечку положите красного фосфора и подожгите его в
пламени; Ø Внесите горящий фосфор в сосуд с
кислородом; Ø Сделайте вывод.
5
этап: Составьте отчет о проделанной работе, используя
таблицу Ход работы:
|
Название опыта, рисунки с |
Уравнения реакций Допишите уравнения и укажите условия их |
Выводы, ответы на |
|
1. Получение кислорода |
KMnO4 = H2O2 = Опишите, как вы |
Что происходит при нагревании перманганата калия? Охарактеризуйте |
|
2. Сжигание угля в |
C + O2 = |
Как изменилось пламя? Почему? |
|
3. Сжигание серы в |
S + O2 = |
Как изменилось пламя? Почему? |
|
4. Сжигание красного |
P + O2 = |
Как изменилось пламя? Почему? |
6 этап:
Сделайте общий вывод о проделанной работе Вывод: ……
7 этап:
Приведите в порядок свое рабочее место
Сдайте
тетради на проверку
Практическая работа №5
Тема: «Признаки протекания химических реакций»
Цель работы: осуществлять
реакции, относящиеся к разным типам; научиться определять признаки химических
реакций, соблюдать правила техники безопасности, закрепить правила оказания
первой помощи при попадании кислоты на кожу человека. Продолжить отработку
навыков составления уравнений химических реакций.
Оборудование: пробирки,
штатив для пробирок, нагревательный прибор, спички, пробиркодержатель, стакан
на 50мл, тигельный щипцы, медная проволока, лучинка, лист бумаги, шпатель.
Реактивы: кусочки
мрамора, медная проволока, разбавленная серная кислота, соляная кислота;
растворы — хлорида железа (III), роданида калия, карбоната натрия, хлорида
кальция.
Инструктаж
по технике безопасности?!
Примечание: Внимательно слушай
указания учителя?!
Вспомните оказание первой помощи при
попадании кислоты или щелочи на кожу или
глаза
Если на кожу попала
кислота — промыть пораженный участок кожи большим количеством воды
(УПГ), затем 5%-ным водным раствором NaHCO3 (соды). Наложить повязку с ватой, смоченной
риванолом или фурацилином. Для обработки глаз после промывания струей воды
(УПГ) использовать 3%-ный водный раствор NaHCO3 (соды).
Если на кожу попала
щёлочь — участок кожи обильно промыть водой (УПГ). Глаза промыть
струей воды (УПГ). Затем глаза и кожу обработать 2%-ным водным раствором борной
кислоты Н3ВО3.
Осторожно обращайтесь с химическим оборудованием!
Пользуйтесь чистой и пригодной для работы посудой.
Знаки
безопасности:
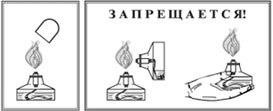

Алгоритм
проведения работы:
1 этап:
Прокаливание медной проволоки и взаимодействие оксида меди (II) с раствором
серной кислоты
Ø
Зажгите спиртовку;
Ø
Возьмите тигельными щипцами медную проволочку и внесите в пламя
спиртовки; Ø Поместите черный налёт в
пробирку и прилейте в неё раствор серной кислоты; Ø Сделайте
вывод.
2 этап:
Взаимодействие мрамора с кислотой
Ø
В пробирку положите кусочки мрамора и прилейте раствор соляной
кислоты; Ø Зажгите лучину и внесите её в
пробирку; Ø Сделайте вывод.
3 этап:
Взаимодействие хлорида железа (III) с роданидом калия
Ø
В пробирку налейте 2мл раствора хлорида железа (III), затем
добавьте несколько капель роданида калия;
Ø
Сделайте вывод.
4 этап:
Взаимодействие карбоната натрия с хлоридом кальция
Ø
В пробирку налейте 2мл раствора карбоната натрия, затем добавьте
несколько капель хлорида кальция;
Ø
Сделайте вывод.
5 этап:
Составьте отчет о проделанной работе
Ход работы:
|
Название опыта, рисунки с |
Уравнения реакций |
Вывод |
|
1. |
Cu + O2 = CuO + H2SO4 = |
Реакция №1 Тип реакции: … Признак Реакция №2 Тип реакции: … Признак реакции: … Условия протекания реакции: |
|
2. Взаимодействие мрамора с |
Тип реакции: |
|
|
кислотой. |
CaCO3 + HCl = |
Признак реакции: Условия протекания реакции: |
|
3. |
FeCl3 + KSCN = |
Тип реакции: … Признак реакции: … Условия протекания реакции: |
|
4. Взаимодействие карбоната натрия с хлоридом кальция |
Na2CO3 + CaCl2 |
Тип реакции: … Признак реакции: … Условия протекания реакции: |
6 этап:
Сделайте общий вывод о проделанной работе Вывод: ……
7 этап:
Приведите в порядок свое рабочее место
Сдайте
тетради на проверку
Практическая работа №6
Тема: «Реакции ионного обмена»
Цель работы: научиться на
практике осуществлять реакции ионного обмена, проведение которых необходимы для
доказательства наличия сульфат — и хлорид — ионов в растворах.
Совершенствовать умение объяснять наблюдения и результаты проводимых
опытов.
Оборудование: штатив с пробирками.
Реактивы: растворы
сульфата натрия и сульфата калия, хлорид бария, хлорид натрия, нитрат серебра,
сульфат магния, карбонат аммония, гидроксид натрия.
Инструктаж
по технике безопасности?!
Примечание: Внимательно слушай
указания учителя?!
Вспомните оказание первой помощи при попадании
щелочи на кожу или глаза.
Если на кожу попала
щёлочь — участок кожи обильно промыть водой (УПГ). Глаза
промыть струей воды (УПГ). Затем глаза и кожу обработать 2%-ным водным
раствором борной кислоты Н3ВО3.
Осторожно обращайтесь с химическим оборудованием!
Пользуйтесь чистой и пригодной для работы посудой.
Знаки
безопасности:
Не забывайте о требовании безопасности во время работы!
Требования охраны труда в аварийных ситуациях!




Алгоритм
оформления работы:
Тема:
Цель:
Оборудование и вещества:
1 этап:
Опыт №1. Обнаружение сульфат — ионов SО42-
Ø
В одну пробирку налейте 1-2мл раствора сульфата натрия; Ø
В другую пробирку налейте 1-2мл раствора сульфата калия; Ø
В обе пробирки добавьте раствор хлорида бария.
2
этап: Опыт №2. Обнаружение хлорид — ионов Сl—
Ø В пробирку налейте 1-2мл раствора хлорида натрия; Ø
Добавьте раствор нитрата серебра.
3 этап:
Составьте отчет о проделанной работе, используя таблицу 1
Таблица 1
|
Название опыта, рисунки с обозначениями |
Уравнения реакций |
Выводы, ответы на |
|
1. Обнаружение сульфат — |
В чём сущность обнаружения |
|
|
2. Обнаружение хлорид — |
Какие соединения могут служить реагентом на ионы хлора? |
4 этап:
Опыт №3. Распознавание веществ
Ø
В первую пробирку налейте 1-2мл раствора сульфата магния;
Ø
Во вторую пробирку налейте 1-2мл раствора карбоната аммония;
Ø
В третью пробирку налейте 1-2мл раствора хлорида бария;
Ø
Во все три пробирки добавьте по каплям раствор гидроксида натрия.
5 этап:
Составьте отчет о проделанной работе, используя таблицу 2
Таблица 2
|
Реактив |
Наблюдаемый эффект |
Уравнения реакций Запишите в молекулярном и ионном виде |
Вывод |
|
Реагент — NaOH |
|||
|
MgSO4 |
|||
|
(NH3)2CO3 |
|||
|
BaCl2 |
6 этап:
Сделайте общий вывод о проделанной работе Вывод: ……
7 этап:
Приведите в порядок свое рабочее место
Сдайте
тетради на проверку
Практическая работа №7
Тема:
«Решение экспериментальных задач по теме «Основные
классы
неорганических соединений»
Цель работы: на практике
применить знания, полученные при изучении химических свойств и способов получения
классов неорганических веществ. Совершенствовать умение объяснять наблюдения и
результаты проводимых опытов.
Оборудование: штатив с пробирками, химическая
ложечка.
Реактивы: хлорида магния,
гидроксид натрия, сульфат калия, карбонат натрия, нитрат цинка, фосфат калия,
хлорид кальция, 15-% раствор соляная кислота, хлорид железа (III), раствор
серной кислоты, оксид меди (II), гидроксид меди (II).
Инструктаж
по технике безопасности?!
Примечание: Внимательно слушай
указания учителя?!
Вспомните оказание первой помощи при попадании
кислоты или щелочи на кожу или
глаза
Если на кожу попала
кислота — промыть пораженный участок кожи большим количеством воды
(УПГ), затем 5%-ным водным раствором NaHCO3 (соды). Наложить повязку с ватой, смоченной
риванолом или фурацилином. Для обработки глаз после промывания струей воды
(УПГ) использовать 3%-ный водный раствор NaHCO3 (соды).
Если на кожу попала щёлочь — участок кожи
обильно промыть водой (УПГ). Глаза промыть струей воды (УПГ). Затем глаза и
кожу обработать 2%-ным водным раствором борной кислоты Н3ВО3.
Осторожно обращайтесь с химическим оборудованием!
Пользуйтесь чистой и пригодной для работы посудой.
Знаки
безопасности:
Не
забывайте о требовании безопасности во время работы! Требования охраны
труда в аварийных ситуациях!

Алгоритм
оформления работы:
Тема:
Цель:
Оборудование и вещества: 1 этап:
Опыт №1
Ø
В пять пробирок добавить хлорид магния;
Ø
В каждую из пяти пробирок налить растворы веществ:
|
№ пробирки |
1 |
2 |
3 |
4 |
5 |
|
реактивы |
гидроксид натрия |
сульфат калия |
карбонат натрия |
нитрат цинка |
фосфат калия |
Ø
Составьте отчет о проделанной работе, используя таблицу (вещества
(реактивы) записывать формулами):
|
№ пробирки с реактивом |
Наблюдаемый эффект |
Уравнения реакций Запишите в молекулярном и ионном |
Вывод |
|
|
Реагент — хлорид |
||||
|
1 |
гидроксид натрия |
— — — Объясните |
||
|
2 |
сульфат калия |
— — — Объясните |
||
|
3 |
карбонат натрия |
— — — Объясните |
||
|
4 |
нитрат цинка |
— — — Объясните |
||
|
5 |
фосфат калия |
— — — Объясните |
2 этап:
Опыт №2
Ø
Получите сульфат меди (II) двумя способами;
Ø
Составьте план решения задачи;
Ø
Оформите отчет о работе используя таблицу:
|
План решения (последовательность действий) |
Уравнения реакций. Запишите уравнения в молекулярном и |
Выводы. Наблюдения. |
|
1. …. |
||
|
2. …. |
3 этап:
Опыт №3 FeCl3 → Fe(OH)3
→ Fe2(SO4)3
Ø
Предложи план осуществления данной цепочки превращений; Ø
Оформите отчет о работе используя таблицу:
|
План решения (последовательность действий) |
Уравнения реакций. Запишите уравнения в молекулярном и |
Выводы. Наблюдения. |
|
1. …. |
||
|
2. …. |
4 этап: Сделайте
общий вывод о проделанной работе Вывод: ……
5 этап: Приведите
в порядок свое рабочее место
Сдайте
тетради на проверку
ПЕРЕЧЕНЬ
ПРАКТИЧЕСКИХ РАБОТ ДЛЯ 9 КЛАССА
Практические работы №1
Тема: «Решение экспериментальных задач по
теме «Металлы и их соединения»
Цель работы: повторите
правила техники безопасности; на практике провести реакции подтверждающие
наличие в растворе данных ионов; получить заданные вещества.
Совершенствовать умение объяснять наблюдения и
результаты.
Оборудование: штатив с пробирками,
химическая ложечка.
Реактивы: хлорид
алюминия, гидроксид натрия, железная стружка,
оксид железа (II), гидроксид железа (II), раствор серной кислоты, хлорид железа
(III), роданид калия, нитрат серебра.
Инструктаж
по технике безопасности?!
Примечание: Внимательно слушай
указания учителя?!
Осторожно
обращайтесь с химическим оборудованием!
Пользуйтесь чистой и пригодной для работы посудой. Знаки
безопасности:

Инструкция
о мерах первой помощи:
ИНСТ-6 «Инструкция по уничтожению отработанных
веществ»
ИНСТ-1 «Инструкция по безопасной работе со
стеклянной посудой»
ИНСТ-8 «Техника безопасности при работе с
кислотами»
ИНСТ-9 «Техника безопасности при работе со
щелочами»
ИНСТ-16 «Техника безопасности при работе с
роданидами»
ИНСТ-28 «Техника безопасности при работе с хлоридами» Алгоритм
оформления работы:
1
этап: В тетради записать: Тема:
Цель:
Оборудование
и реактивы:
2
этап: Проверим, справедливо ли для химии
математическое выражение «от перемены мест слагаемых сумма не изменяется»
Ø
Получим гидроксид алюминия по реакции обмена согласно уравнению: AlCl3
+ 3NaОН = Al(OH)3 + 3NaCl
Для этого проведём данную реакцию двумя способами:
в пробирку №1 прилейте 1-2мл раствора хлорида
алюминия; к раствору хлорида
алюминия добавляйте по каплям раствор гидроксида
натрия. Что наблюдаете?
в пробирку №2 прилейте 1-2мл раствора гидроксида
натрия; к раствору гидроксида
натрия прилейте 1-2мл раствора хлорида алюминия.
Ø
Составьте отчет о проделанной работе, используя таблицу:
|
Что делили? (рисунки с |
Уравнения реакций. Запишите уравнения в |
Вывод |
|
Пробирка №1 |
— — — Название |
|
|
Пробирка №2 |
— — — Название |
3
этап: Получите сульфат железа (II) тремя
способами, исходя из предложенных реактивов
Ø
В пробирке №1 проведите реакцию замещения;
Ø
В пробирках №2 и №3 получите сульфат железа (II) по реакциям обмена;
Ø Составьте отчет о проделанной работе, используя
таблицу:
|
Что делили? (рисунки с |
Уравнения реакций |
Вывод |
|
Пробирка №1 |
— — Укажите |
|
|
Пробирка №2 |
— — Укажите |
|
|
Пробирка №3 |
— — — Название |
Примечание: для реакций замещения составьте
электронный баланс; для реакций обмена –
ионные уравнения.
4
этап: Проведите реакции, подтверждающие качественный
состав хлорида железа (III)
Ø
В две пробирки прилейте по 1-2мл раствора хлорида железа (III);
в первую пробирку добавьте несколько капель раствора реактива на катион железа
(III); во вторую добавьте несколько капель раствора реактива на хлорид-ион.
Ø
Составьте отчет о проделанной работе, используя таблицу
(уравнения реакций запишите в молекулярном и ионном виде):
|
Что делили? (рисунки с |
Уравнения реакций. Запишите уравнения в |
Вывод |
|
Пробирка №1 |
а) б) |
— — Укажите |
|
Пробирка №2 |
— — Укажите |
5
этап: Сделайте общий вывод о проделанной работе
Вывод: ……
6
этап: Приведите в порядок свое рабочее место
Сдайте
тетради на проверку
Практическая работа №2
Тема: «Качественные реакции на ионы в
растворе»
Цель работы: провести
реакции, подтверждающие наличие в растворе данных ионов; решить задачи, на
распознавание веществ, используя минимальное число реактивов.
Совершенствовать умение объяснять наблюдения и
результаты.
Оборудование: штатив с пробирками,
химическая ложечка, спиртовка, спички.
Инструктаж
по технике безопасности?!
Примечание: Внимательно слушай
указания учителя?!
Осторожно
обращайтесь с химическим оборудованием!
Пользуйтесь
чистой и пригодной для работы посудой.
Знаки
безопасности:
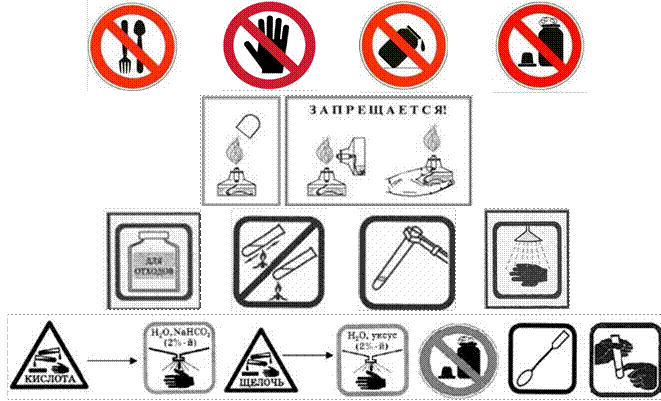
Инструкция
о мерах первой помощи:
ИНСТ-6 «Инструкция по уничтожению отработанных
веществ»
ИНСТ-1 «Инструкция по безопасной работе со
стеклянной посудой»
ИНСТ-7 «Техника безопасности при работе со
спиртовкой и сухим горючим»
ИНСТ-8 «Техника безопасности при работе с
кислотами»
ИНСТ-9 «Техника безопасности при работе со
щелочами»
ИНСТ-16 «Техника безопасности при работе с
роданидами»
ИНСТ-28 «Техника безопасности при работе с
хлоридами»
Алгоритм
оформления работы:
1
этап (для всех вариантов) : Тема:
Цель:
Оборудование и реактивы:
Вариант — 1
Реактивы: хлорида
алюминия, гидроксид аммония, сульфат железа (II), гидроксид натрия, гексациано
(III) феррат калия (красную кровяную соль).
2
этап: В пробирку налейте 1-2мл хлорида алюминия
прилейте гидроксид аммония составьте отчет о проделанной работе, используя
таблицу:
|
Что делили? (рисунок с |
Уравнения реакций Запишите в |
Вывод |
|
— — Признак |
3
этап: В две пробирки налейте сульфат железа (ll)
Ø
Прилейте в каждую пробирку выбранный реактив
пробирка №1 — гидроксид
натрия пробирка №2 — красную кровяную соль
Ø
составьте отчет о проделанной работе, используя таблицу:
|
Реактив |
Наблюдаемый эффект |
Уравнения реакций Запишите в молекулярном и ионном виде |
Вывод |
|
|
Реагент |
Реагент K3[Fe(CN)6] |
|||
|
FeSO4 |
FeSO4 + NaOH = FeSO4 + K3[Fe(CN)6] |
— |
Вариант — 2
Реактивы: гидроксид
натрия, карбонат калия, хлорид бария, вода, раствор серной кислоты, хлорид
алюминия.
2
этап: Определите в какой пробирке находится каждое из
веществ с помощью одного реактива
Пробирки:
№1 — гидроксид натрия
№2
— карбонат калия
№3
— хлорид бария
Примечание: растворите каждое из исследуемых
веществ в 3-4мл воды.
Ø
прилейте в каждую пробирку выбранный реактив;
Ø
составьте отчет о проделанной работе, используя таблицу:
|
Реактив |
Наблюдаемый эффект |
Уравнения реакций Запишите в |
Вывод |
|
Реагент ( ? ) |
|||
|
NaOH |
— — Признак |
||
|
K2CO3 |
— — Признак |
||
|
BaCl2 |
— — Признак |
3
этап: Получите раствор алюмината натрия исходя из
хлорида алюминия
Ø
В пробирку налейте 1-2мл раствора хлорида алюминия;
Ø
Добавьте 2-3 капли выбранного вами реактива для проведения
реакции обмена; Ø К полученному осадку добавляйте
реактив до получения алюмината натрия; Ø Заполните таблицу:
|
Что делили? (рисунок с |
Уравнения реакций Запишите в |
Вывод |
|
№1 №2 |
— Объясните наблюдаемое (опишите внешний |
Вариант — 3
Реактивы: гидроксид
натрия, хлорид натрия, хлорид алюминия и хлорид железа (lll), вода, железный
купорос, хлорид бария, роданид калия.
2
этап: Определите в какой пробирке находится каждое из
веществ с помощью одного реактива
Пробирки:
№1 — хлорид натрия
№2
— хлорид алюминия
№3
— хлорид железа (III)
Примечание: растворите каждое из исследуемых
веществ в 3-4мл воды.
Ø
Прилейте в каждую пробирку выбранный реактив
Ø
Составьте отчет о проделанной работе, используя таблицу:
|
Реактив |
Наблюдаемый эффект |
Уравнения реакций Запишите в |
Вывод |
|
Реагент ( ? ) |
|||
|
NaCl |
— — Признак |
||
|
AlCl3 |
— — Признак |
||
|
FeCl3 |
— — Признак |
3
этап: Определите содержит ли образец железного
купороса примесь сульфата железа
(III)
Ø
Растворите образец в 3-4мл дистиллированной воды;
Ø
Добавьте 1-2 капли выбранного вами реактива для проведения
реакции обмена; Ø Заполните таблицу:
|
Что делили? (рисунки с обозначениями) |
Наблюдаемый эффект |
Уравнения реакций Запишите в молекулярном и ионном |
Вывод |
|
|
Реагент KCNS |
Реагент BaCl2 |
|||
|
Обнаружение ионов — Fe 2+ |
— — Признак |
|||
|
Обнаружение ионов — SO42- |
— — Признак |
Вариант — 4
Реактивы: сульфат железа
(III), гидроксид натрия, гексациано (II) феррат калия (желтая кровяная соль),
роданид калия, сульфат железа (II), сульфат алюминия, сульфат никеля (II),
сульфат меди (II), хлорид бария.
2 этап:
Качественный состав сульфат железа (III)
Ø
Проделайте реакции подтверждающие качественный состав сульфат
железа
(III), используя имеющиеся реактивы;
Ø
Составьте отчет о проделанной работе, используя таблицу:
|
Реактив |
Наблюдаемый эффект |
Уравнения реакций Запишите в |
Вывод |
|||
|
Реагент ? |
Реагент ? |
Реагент ? |
Реагент ? |
|||
|
Fe2(SO4)3 |
Fe2(SO4)3 + Fe2(SO4)3 + Fe2(SO4)3 + Fe2(SO4)3 + |
— Объясните наблюдаемое — Признак |
3 этап:
В 4 пробирках находятся вещества: FeSO4, CuSO4, Al2(SO4)3,
NiSO4
Определите в
какой пробирке находится каждое из веществ с помощью одного реактива.
|
Реактив |
Наблюдаемый эффект |
Уравнения реакций Запишите в |
Вывод |
|
Реагент ( ? ) |
|||
|
FeSO4 |
— — Признак |
||
|
CuSO4 |
— — Признак |
||
|
Al2(SO4)3 |
— — Признак |
||
|
NiSO4 |
— — Признак |
4 этап:
Сделайте общий вывод о проделанной работе Вывод: ……
5 этап:
Приведите в порядок свое рабочее место
Сдайте
тетради на проверку
Практическая работа №3
Тема: «Получение водорода и изучение его
свойств»
Цель работы: изучить
лабораторный способ получения, собирания и распознавания водорода.
Совершенствовать умение объяснять наблюдения и результаты.
Оборудование: штатив с пробирками,
химическая ложечка, спиртовка, спички.
Реактивы: цинк, раствор соляной кислоты.
Инструктаж
по технике безопасности?!
Примечание: Внимательно слушай
указания учителя?!
Осторожно
обращайтесь с химическим оборудованием!
Пользуйтесь чистой и пригодной для
работы посудой. Знаки безопасности:


Инструкция
о мерах первой помощи:
ИНСТ-6 «Инструкция по уничтожению отработанных
веществ»
ИНСТ-1 «Инструкция по безопасной работе со
стеклянной посудой»
ИНСТ-8 «Техника безопасности при работе с кислотами» Алгоритм
оформления работы:
1
этап: В тетради записать: Тема: Цель:
Оборудование
и реактивы:
2
этап: Соберите прибор Кирюшкина как показано на
рисунке 2, проверьте прибор на герметичность.
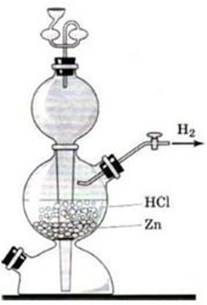

Рисунок
1 — Аппарат Киппа Рисунок 2 — Прибор Кирюшкина
3
этап: В пробирку положите 1-2 гранулы цинка, прилейте
1-2мл соляной кислоты. Закройте пробирку пробкой с газоотводной трубкой и
наденьте на кончик трубки ещё одну пробирку. Подождите пока пробирка не
заполнится газом.
4
этап: Снимите пробирку с газоотводной трубки, и не
переворачивая её, немного наклонив поднесите отверстием к пламени спиртовки.
Вы должны услышать либо глухой хлопок п-пах,
либо «лающий» звук. 5 этап: Составьте отчет о проделанной работе,
используя таблицу:
|
Что делили? (рисунок с обозначениями) |
Уравнения реакций Запишите в молекулярном и ионном |
Вывод |
|
— — — |
6 этап:
Сделайте общий вывод о проделанной работе Вывод: ……
7 этап:
Приведите в порядок свое рабочее место
Сдайте
тетради на проверку
Практическая работа №4
Тема: «Получение аммиака и изучение его
свойств»
Цель работы: получить
лабораторным способ аммиак, собирать и распознать его. Совершенствовать умение
объяснять наблюдения и результаты.
Оборудование: штатив с
пробирками, химическая ложечка, спиртовка, спички, фарфоровая чашечка, стеклянная
палочка.
Реактивы: хлорид аммония, гидроксид кальция,
хлорида алюминия, фенолфталеин.
Инструктаж
по технике безопасности?!
Примечание: Внимательно слушай
указания учителя?!
Осторожно
обращайтесь с химическим оборудованием!
Пользуйтесь чистой и пригодной для работы посудой. Знаки
безопасности:



Инструкция
о мерах первой помощи:
ИНСТ-6 «Инструкция по уничтожению отработанных
веществ»
ИНСТ-1 «Инструкция по безопасной работе со
стеклянной посудой»
ИНСТ-2 «Основные правила для снижения загрязнения
воздуха при демонстрационных опытах»
ИНСТ-9 «Техника безопасности при работе со щелочами»
Алгоритм оформления работы:
1
этап: В тетради записать: Тема: Цель:
Оборудование
и реактивы:
2
этап: Соберите прибор для получения аммиака и
проверьте его на герметичность
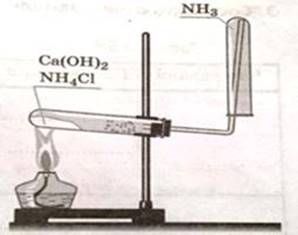
Ø
В фарфоровой чашечке смешайте по 1-ой чайной ложечке (ложечки
возьмите разные) хлорида аммония и гидроксида кальция, поместите смесь в сухую
пробирку, закройте пробкой с газоотводной трубкой согнутой под прямым углом и
повёрнутой вверх ( как на рисунке); дно пробирки со смесью немного приподнимите,
на стеклянную трубку наденьте сухую пробирку.
Ø
Прогрейте сначала всю пробирку, а затем то место, где находится
смесь. Не прекращая нагревания, определите наличие аммиака по изменению цвета
влажной фенолфталеиновой бумажки, поднесённой к отверстию пробирки-приёмника.
Ø
Прекратите нагревание:
— снимите
пробирку с аммиаком с трубочки;
— сразу же
отверстие трубочки закройте кусочком влажной ваты; — пробирку с аммиаком
закройте большим пальцем.
Ø
Опустите пробирку с аммиаком в кристаллизатор с водой, впустите
капельку воды, закройте снова пробирку под водой, палец будет втягиваться в
пробирку, так как в ней образовался вакуум . Снова под водой отнимите палец.
Ø
Закройте пробирку пальцем под водой и выньте её из сосуда.
Ø
Разделите содержимое пробирки на две части — в одну добавьте 2-3
капли фенолфталеина; — в другую 2-3 капли хлорида алюминия.
3
этап: Составьте отчет о проделанной работе, используя
таблицу:
|
Что делили? (рисунок с обозначениями) |
Уравнения реакций Запишите в молекулярном и ионном виде |
Вывод |
|
1. 2. 3. |
4 этап:
Сделайте общий вывод о проделанной работе
Вывод: ……
5 этап:
Приведите в порядок свое рабочее место
Сдайте
тетради на проверку
Практическая работа №5
Тема: «Получение углекислого газа и изучение
его свойств»
Цель работы: закрепить
теоретические знания о свойствах оксида углерода (IV) и карбонатов. Отработать
экспериментальные умения в процессе проведения эксперимента. Развивать
практические навыки проведения химических опытов. Воспитывать культуру
проведения эксперимента. Закрепить навыки безопасного обращения с реактивами.
Оборудование: лабораторный
штатив, прибор для получения газов, химические стаканы на 50мл, зажим Мора,
пробирки, химическая ложечка.
Реактивы: кусочки мрамора, соляная кислота
(1:2), известковая вода.
Инструктаж
по технике безопасности?!
Примечание: Внимательно слушай
указания учителя?!
Осторожно
обращайтесь с химическим оборудованием!
Пользуйтесь чистой и пригодной для работы посудой. Знаки
безопасности:


Инструкция
о мерах первой помощи:
ИНСТ-6 «Инструкция по уничтожению отработанных
веществ»
ИНСТ-1 «Инструкция по безопасной работе со
стеклянной посудой»
ИНСТ-8
«Техника безопасности при работе с кислотами» ИНСТ-9 «Техника безопасности при
работе со щелочами» Алгоритм оформления работы:
1 этап:
В тетради записать: Тема: Цель:
Оборудование
и реактивы:
2 этап:
Соберите прибор для получения углекислого газа. В пробирку, закрепленную в
штативе, поместите 1-2 кусочка мела или мрамора, прилейте 2мл соляной кислоты и
быстро закройте пробкой с газоотводной трубкой.
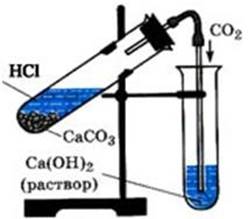
3 этап:
Перенесите конец газоотводной трубки в пробирку с 1мл известковой воды и
пропускайте через неё углекислый газ.
4
этап: Составьте отчет о проделанной работе, используя
таблицу:
|
Что делили? (рисунок с |
Уравнения реакций Запишите в |
Вывод |
|
дайте характеристику реакции по всем изученным признакам классификации |
1. 2. 3. |
|
|
дайте характеристику реакции по всем изученным признакам классификации |
5
этап: Любознательным!!!
В земной коре в разных частях
света, есть бездонные пещеры — своеобразные черные дыры, происхождение которых
овеяно легендами и преданиями. Решающую роль в появлении этих пещер играет
углекислый газ, который извлекается из воздуха дождевой водой. Потоки дождевой
воды попадают на пласты известняка и превращают его в растворимый гидрокарбонат
кальция, который уносится подземными водами.
Внутри подземных известковых
пластов образуются огромные полости — карстовые пещеры. В недрах Земли
грунтовые воды (раствор NaHCO3)
могут подвергаться нагреванию. Стекая со стен пещеры, раствор Ca(HCO3)2 начинает испаряться, а сама соль разлагается с
образованием кристаллов нерастворимого карбоната кальция CaCO3. Так природа создает
сталактиты и сталагмиты, похожие на колонны сказочных дворцов.
Напишите уравнения реакций о
которых говорится в рассказе
|
Уравнения реакций |
Вывод |
|
1. 2. |
6 этап:
Сделайте общий вывод о проделанной работе Вывод: ……
7 этап:
Приведите в порядок свое рабочее место
Сдайте
тетради на проверку
Практическая работа №6
Тема: «Решение
экспериментальных задач по теме «Неметаллы IV – VII групп и их соединений»
Цель: провести реакции,
подтверждающие наличие в растворе данных ионов; решить задачи, на распознавание
веществ, используя минимальное число реактивов. Совершенствовать умение
объяснять наблюдения и результаты.
Оборудование: штатив с пробирками,
химическая ложечка, спиртовка, спички.
Инструктаж
по технике безопасности?!
Примечание: Внимательно слушай
указания учителя?!
Осторожно
обращайтесь с химическим оборудованием!
Пользуйтесь
чистой и пригодной для работы посудой. Знаки безопасности:

Инструкция
о мерах первой помощи:
ИНСТ-1 «Инструкция по безопасной работе со
стеклянной посудой»
ИНСТ-2«Основные правила снижения
загрязнения воздуха при демонстрационных опытах»
ИНСТ-6 «Инструкция по уничтожению отработанных
веществ»
ИНСТ-7 «Техника безопасности при работе со
спиртовкой и сухим горючим»
ИНСТ-8 «Техника безопасности при работе с
кислотами»
ИНСТ-9 «Техника безопасности при работе со
щелочами»
ИНСТ-11 «Техника безопасности при работе с
нитратами»
ИНСТ-12 «Техника безопасности при работе с
соединениями меди»
ИНСТ-16 «Техника безопасности при работе с
роданидами»
ИНСТ-28
«Техника безопасности при работе с хлоридами» Алгоритм оформления работы:
1
этап (для всех вариантов): В тетради записать: Тема:
Цель:
Оборудование
и реактивы:
Вариант — 1
Реактивы: сульфид калия,
хлорид калия, карбонат натрия, нитрат серебра, соляная кислота, нитрат меди
(II), роданид калия, гидроксид натрия, бромид калия, хлорид бария. 2 этап: В
4 пробирках находятся вещества: K2S, KCl, Na2CO3,
KBr.
Ø
С помощью имеющихся реактивов составьте план распознавания
веществ, докажите их наличие в пробирках;
Ø
Составьте отчет о проделанной работе, используя таблицу:
|
Реактив |
Наблюдаемый |
Уравнения реакций Запишите в |
Вывод |
|
|
Реагент HCl |
Реагент AgNO3 |
|||
|
K2S |
? |
— — Признак |
||
|
KCl |
? |
— — Признак |
||
|
Na2CO3 |
? |
— — Признак |
||
|
KBr |
? |
— — Признак |
3
этап: Докажите опытным путём, качественный состав
сульфата железа (III)
|
Реактив |
Наблюдаемый |
Уравнения реакций Запишите в |
Вывод |
|
|
Реагент BaCl2 |
Реагент KCNS |
|||
|
Fe2(SO4)3 |
— — Признак |
4
этап:
Ø
Исходя из схемы: Cu(NO3)2 → Cu(OH)2
→ CuO получите оксид меди (II);
Ø
Составьте отчет о проделанной работе, используя таблицу:
|
Что делили? (рисунок с обозначениями) |
Уравнения реакций Запишите в молекулярном и ионном виде |
Вывод |
|
— — Признак |
Вариант — 2
Реактивы: карбонат
натрия, хлорид натрия, фосфат натрия, силикат натрия, серная кислота (р-р),
нитрат серебра, гидроксид натрия, медь, азотная кислота (к), хлорид аммония. 2
этап: В 4 пробирках находятся вещества: Na2СO3, NaCl,
Na3PO4, Na2SiO3.
Ø
С помощью имеющихся реактивов составьте план распознавания
веществ, докажите их наличие в пробирках;
Ø
Составьте отчет о проделанной работе, используя таблицу:
|
Реактив |
Наблюдаемый |
Уравнения реакций Запишите в |
Вывод |
|
|
Реагент ? |
Реагент ? |
|||
|
Na2СO3 |
— — Признак |
|||
|
NaCl |
— — Признак |
|||
|
Na3PO4 |
— — Признак |
|||
|
Na2SiO3 |
— — Признак |
3
этап: Докажите опытным путём, качественный состав
хлорида аммония
|
Реактив |
Наблюдаемый |
Уравнения реакций Запишите в |
Вывод |
|
|
Реагент ? |
Реагент ? |
|||
|
NH4Cl |
— — Признак |
4
этап: Исходя из имеющихся реактивов получите оксид
азота (IV) Ø Составьте отчет о проделанной
работе, используя таблицу:
|
Что делили? (рисунок с |
Уравнения реакций |
Вывод |
|
— — Признак |
5 этап:
Сделайте общий вывод о проделанной работе Вывод: ……
6 этап:
Приведите в порядок свое рабочее место
Сдайте
тетради на проверку
ТЕХНИКЕ БЕЗОПАСТНОСТИ ДЛЯ УЧАЩИХСЯ В КАБИНЕТЕ ХИМИИ
I.
ОБЩИЕ ПОЛОЖЕНИЯ
1.
Соблюдение требований настоящей инструкции обязательно для всех
учащихся, работающих в кабинете химии.
2.
Учащиеся могут находиться в кабинете только в присутствии
учителя; пребывание учащихся в помещении лаборантской не допускается.
3.
Присутствие посторонних лиц в кабинете химии во время
эксперимента допускается только с разрешения учителя.
4.
В кабинете химии запрещается принимать пищу и напитки.
5.
Учащимся запрещается выносить из кабинета и вносить в него любые
вещества без разрешения учителя.
6.
Не допускается загромождение проходов портфелями и сумками.
7.
Во время работы в кабинете химии учащиеся должны соблюдать
чистоту, порядок на рабочем месте, а также четко следовать правилам техники
безопасности.
8.
Учащимся запрещается бегать по кабинету, шуметь и устраивать
игры.
9.
Не допускается нахождение учащихся в кабинете во время его
проветривания проветривания
10.
Учащиеся, присутствующие на лабораторной или практической работе
без халата, непосредственно к проведению эксперимента не допускаются.
II.
ТРЕБОВАНИЯ БЕЗОПАСНОСТИ ПЕРЕД НАЧАЛОМ РАБОТЫ
1.
Перед проведением экспериментальной работы каждый учащийся должен
надеть халат. Халат должен быть из хлопчатобумажной ткани, застёгиваться только
спереди, манжеты рукавов должны быть на пуговицах. Длина халата — ниже колен.
Стирать халат, испачканный химическими реактивами, необходимо отдельно от
остального нательного белья.
2.
При проведении эксперимента, связанного с нагреванием жидкостей
до температуры кипения, использованием разъедающих растворов, учащиеся должны
пользоваться средствами индивидуальной защиты (по указанию учителя).
3.
Учащиеся, имеющие длинные волосы, не должны оставлять их в
распущенном виде, чтобы исключить возможность их соприкосновения с лабораторным
оборудованием, реактивами и тем более — с открытым огнем.
4.
Прежде, чем приступить к выполнению эксперимента, учащиеся должны
по учебнику или инструктивной карточке изучить и уяснить порядок выполнения
предстоящей работы.
5.
Учащиеся обязаны внимательно выслушать инструктаж учителя по
технике безопасности в соответствии с особенностями предстоящей работы. Текущий
инструктаж по технике безопасности перед практической работой регистрируется,
собственноручно учащимися в тетрадях для практических работ. Текущий инструктаж
перед лабораторной работой не регистрируется. 6. Приступать к проведению эксперимента
учащиеся могут только с разрешения учителя.
III.
ТРЕБОВАНИЯ БЕЗОПАСНОСТИ ВО ВРЕМЯ РАБОТЫ
1.
Во время работы в кабинете химии учащиеся должны быть максимально
внимательными, дисциплинированными, строго следовать указаниям учителя,
соблюдать тишину, поддерживать чистоту и порядок на рабочем месте.
2.
Во время демонстрационных опытов учащиеся должны находиться на
своих рабочих местах или пересесть по указанию учителя на другое, более
безопасное место.
3.
При выполнении лабораторных и практических работ учащиеся должны
неукоснительно соблюдать правила техники, безопасности, следить, чтобы вещества
не попадали на кожу лица и рук, так как многие из них вызывают раздражение
кожи и слизистых оболочек.
4.
Никакие вещества в лаборатории нельзя пробовать на вкус!
Нюхать вещества можно, лишь осторожно направляя на себя их пары или газы
лёгким движением руки, а не наклоняясь к сосуду и не вдыхая полной грудью.
5.
При выполнении лабораторных работ учащиеся должны точно повторять
действия учителя, показывающего, как нужно правильно проводить эксперимент.
6.
Подготовленный к работе прибор учащиеся должны показать учителю
или лаборанту.
7.
По первому требованию учителя учащиеся обязаны прекратить
выполнение работы. Возобновление работы возможно только с разрешения учителя.
8.
Учащимся запрещается самостоятельно проводить любые опыты, не
предусмотренные в данной работе.
9.
Учащимся запрещается выливать в канализацию растворы и
органические жидкости.
10.
Обо всех разлитых и рассыпанных реактивах учащиеся должны
немедленно сообщить учителю или лаборанту. Учащимся запрещается самостоятельно
убирать любые вещества.
11.
Обо всех неполадках в работе оборудования, водопровода,
электросети и т.п.
учащиеся обязаны сообщить учителю или лаборанту.
Учащимся запрещается самостоятельно устранять неисправности.
12.
При получении травм (порезы, ожоги и т.п.), а также при плохом
самочувствии учащиеся должны немедленно сообщить об этом учителю или
лаборанту.
13.
Во время работы учащимся запрещается переходить на другое рабочее
место без разрешения учителя.
14.
Учащимся запрещается брать вещества и какое-либо оборудование с
незадействованных на данный момент рабочих мест.
15.
Недопустимо во время работы перебрасывать друг другу какие-либо
вещи.
16.
Запрещается оставлять без присмотра включенные нагревательные
приборы, а также зажигать горелки и спиртовки без надобности.
IV.
ТРЕБОВАНИЯ БЕЗОПАСНОСТИ ПО ОКОНЧАНИИ РАБОТЫ
1. Уборка
рабочих мест производится в соответствии с указаниями учителя.
2. Учащиеся
должны привести в порядок свое рабочее место, сдать учителю или лаборанту
дополнительные реактивы и оборудование.
3. По
окончании работ учащиеся обязаны вымыть руки с мылом.
4. Стирать
халат, испачканный химическими реактивами, необходимо отдельно от остального
нательного белья.
V.
АВАРИЙНЫЕ СИТУАЦИИ
При возникновении аварийных
ситуаций во время занятий в кабинете химии (пожар, появление посторонних
запахов), не допускать паники и подчиняться только указаниям учителя.
ИНСТ — 1 «ИНСТРУКЦИЯ ПО БЕЗОПАСНОЙ
РАБОТЕ СО СТЕКЛЯННОЙ ПОСУДОЙ
И АМПУЛАМИ»
1.
Стекло — хрупкий материал, имеющий малое сопротивление при ударе
и незначительную прочность при изгибе. Применение физической силы при работе со
стеклянными деталями связано с опасностью их поломки. Особенно велико бывает
искушение применить усилие при разъединении заклинивших шлифов, вынимании
пробок, насаживании резиновых шлангов на отверстия большего диаметра. Однако во
всех этих случаях лучше недооценить прочность стеклянной детали, чем
переоценить ее. Вероятность ранения рук пропорциональна усилию, приложенному к
стеклянной детали.
2.
Ни при каких обстоятельствах нельзя допускать нагревания
жидкостей в закрытых колбах или приборах, не имеющих сообщения с атмосферой,
даже в тех случаях, когда температура нагрева не превышает температуру кипения
жидкости.
3.
Категорически запрещается использовать посуду, имеющую трещины
или отбитые края. Острые края стеклянных трубок следует немедленно оплавить
в пламени горелки. Не оплавленные края стеклянных трубок опасны не только как
источник травм — со временем они перерезают надетые на них резиновые шланги,
особенно тонкостенные, что может послужить причиной аварии.
4.
Работы, при проведении которых возможно бурное течение процесса,
перегрев стеклянного прибора или его поломка с разбрызгиванием горячих или
едких продуктов, должны выполняться в вытяжных шкафах на противнях; по месту
работ следует устанавливать прозрачные предохранительные щитки. Работающий
должен надеть защитные очки или маску, перчатки и резиновый фартук.
5.
При смешивании или разбавлении веществ, сопровождающемся
выделением тепла, следует пользоваться термостойкой или фарфоровой посудой.
6.
Стеклянную посуду (тонкостенные химические стаканы и колбы из
обычного стекла) запрещается нагревать на открытом огне без асбестированной
сетки.
7.
При переносе сосудов с горячей жидкостью следует пользоваться
полотенцем или другими материалами, сосуд при этом необходимо держать обеими
руками: одной — за горловину, а другой — за дно. Большие химические стаканы с
жидкостью нужно поднимать только двумя руками так, чтобы отогнутые края стакана
опирались на указательные пальцы.
8.
Нагревая жидкость в пробирке, необходимо держать последнюю так,
чтобы отверстие было направлено в сторону от себя и соседей по работе.
9.
Посуда, хранящаяся в рабочем столе или шкафу, должна содержаться
в порядке, мелкие детали — в неглубоких коробках в один слой на вате. При
выдвижении ящиков стола посуда не должна ударяться друг о друга. Если посуда не
имеет своего постоянного места, хранится неаккуратно, в тесноте, она неизбежно
бьется, что повышает вероятность травм.
10.
Недопустимо убирать осколки разбитой посуды незащищенными
руками! Осколки необходимо убирать с помощью щетки и совка.
11.
Стеклянные приборы и посуду больших размеров можно переносить
только двумя руками. Крупные (более 5л) бутыли с жидкостями переносят вдвоем в
специальных корзинах или ящиках с ручками. Поднимать крупные бутыли за горло
запрещается.
12.
Запаянную ампулу вскрывают только после охлаждения ниже
температуры кипения запаянного вещества: после охлаждения ампулу заворачивают в
какую-либо ткань (не использовать полотенце!), затем делают надрез ножом или
напильником на капилляре и отламывают его.
13.
Все операции с ампулами до их вскрытия следует проводить не
вынимая их из защитной оболочки в вытяжном шкафу, надев защитные очки или
маску.
14.
Чтобы избежать травмирования при резании стеклянных трубок,
сборке и разборке приборов и узлов, изготовленных из стекла, необходимо
соблюдать следующие меры безопасности:
—
ломать стеклянные трубки небольшого диаметра после надрезки их
напильником или специальным ножом для резки стекла, предварительно защитив руки
какой-либо тканью
(не использовать полотенце!);
—
просверленная пробка, в которую вставляют стеклянную трубку, не
должна упираться в ладонь, ее следует держать за боковую поверхность;
стеклянная трубка при этом должна быть предварительно смазана глицерином или
смочена водой;
—
нельзя сильно сжимать трубку, ее необходимо держать как можно
ближе к вставляемому в пробку концу.
15.
Колбу или другой тонкостенный сосуд, в который вставляют пробку,
следует держать за горлышко по возможности ближе к устанавливаемой пробке,
защищая при этом руку какойлибо тканью.
16.
Тонкостенную посуду (колбы, пробирки) следует укреплять в лапках
лабораторного штатива осторожно, слегка поворачивая вокруг вертикальной оси или
перемещая вверх-вниз.
17.
Для нагревания жидкости пробирку запрещается наполнять более чем
на треть. Недопустимо нагревать сосуды выше уровня жидкости, а также пустые
сосуды с каплями влаги внутри!
18.
При нагревании стеклянных пластинок необходимо сначала равномерно
прогреть весь предмет, а затем проводить местный нагрев.
19.
Обезвреживание и удаление остатков веществ из химической посуды
необходимо производить по возможности сразу же после освобождения посуды. При
обезвреживании и мытье посуды необходимо надевать защитные очки, перчатки,
фартук. Посуду следует обезвреживать в вытяжном шкафу.
20.
При мытье посуды надо обязательно надевать резиновые перчатки, а
в случае использования агрессивных жидкостей — защитные очки или маску, фартук
из химически стойкого материала.
21.
При мытье посуды щетками (ершами) следует направлять дно сосуда
только от себя или вниз.
22.
С точки зрения техники безопасности, шлифы, безусловно,
предпочтительнее резиновых пробок. В то же время заклинивание конусных шлифов —
сравнительно частое явление. Разъединение же заклинивших шлифов с применением
физической силы — опасная процедура, нередко приводящая к поломке деталей и,
как следствие, к травмам. Чтобы разъединить шлифованное соединение или вынуть
плотно притертую пробку рекомендуется осторожно нагреть внешний шлиф над
пламенем спиртовки так, чтобы внутренний шлиф не успел прогреться. Внутренний
шлиф осторожно покачивают в разные стороны, прилагая основное усилие вдоль оси
шлифа. Руки при этой операции обязательно защищают полотенцем, пальцы держат по
возможности ближе к шлифу. Нельзя прилагать усилие к изогнутым частям
разъединяемых деталей. Если результат не достигнут с первого раза, после
охлаждения шлифов операцию следует повторить. Нельзя прибегать к нагреванию,
если сосуд содержит горючую или легковоспламеняющуюся жидкость! Если шлиф
заклинило в результате кристаллизации попавшего на его поверхность вещества,
рекомендуется замочить шлиф на несколько часов в жидкости, хорошо растворяющей
данное вещество. После того как жидкость проникнет в зазор между шлифами, соединение
тщательно обтирают снаружи и, если оно не разъединяется обычным способом,
прибегают к нагреванию.
Практика показывает, что гораздо
проще и безопаснее заранее предотвратить заклинивание шлифов, чем заниматься
разъединением деталей. Залог безотказной работы шлифованных соединений —
использование только хорошо притертых шлифов и правильное применение смазки.
ИНСТ — 2 «ОСНОВНЫЕ ПРАВИЛА ДЛЯ СНИЖЕНИЯ
ЗАГРЯЗНЕНИЯ ВОЗДУХА ПРИ ДЕМОНСТРАЦИОННЫХ ОПЫТАХ»
Источники загрязнения воздуха
помещений химического кабинета многочисленны и разнообразны. Загрязнение
воздуха класса-лаборатории происходит главным образом при неправильном
проведении многих демонстрационных опытов и некоторых лабораторных и
практических работ, предусмотренных программой. Значительно снижается чистота
воздуха лаборантской при подготовке демонстрационных опытов и практических
работ. Наконец, чистота воздуха может зависеть от исправности газовой сети,
канализации и от своевременного выноса ведра с отходами после работы.
При проведении демонстраций учитель должен помнить
следующие правила:
1.
Опыты с относительно большим количеством вредных газов следует
проводить только в вытяжном шкафу специальной конструкции, имеющем витринное
стекло в стенке, обращенной к учащимся.
2.
При отсутствии специального вытяжного шкафа такие вредные газы,
как сероводород, хлороводород, оксиды азота, лучше получать в малых количествах
— в пробирках.
3.
Для опытов следует брать минимальное количество вредных
реагирующих веществ.
4.
Трубчатые соединения приборов должны быть абсолютно плотными.
Важно обеспечить хорошее прилегание пробок, что лучше достигается при пробках
из резины.
5.
Подливание соляной кислоты при получении хлора и подачу воды при
получении ацетилена следует производить каплями с помощью пипетки или воронки с
краном.
6.
Нагревание спиртовками и газовыми горелками нужно вести осторожно
во избежание растрескивания прибора.
7.
В приборе должна быть предусмотрена возможность поглощения
избытка получаемого газа с помощью соответствующего раствора, налитого в
стеклянную банку с пробкой и газоприёмной трубкой. Для поглощения хлора,
хлороводорода, брома, бромоводорода, сероводорода, сернистого газа
используют раствор гидроксида натрия; оксиды азота N0 и N02
поглощаются насыщенным раствором сульфата железа (II). Сернистый газ
можно растворить также водой со льдом, а сероводород — раствором
аммиака. В некоторых случаях возможно использование несложных устройств
с активированным углем, поглощающим вредные вещества.
8.
Сжигать вещества, образующие вредные газы, следует в небольших
стеклянных банках с пробками, через которые пропущена стальная проволока с
ложечкой.
ИНСТ — 6 «ИНСТРУКЦИЯ ПО
УНИЧТОЖЕНИЮ ОТРАБОТАННЫХ ЛВЖ,
ОБЕЗВРЕЖИВАНИЮ ВОДНЫХ РАСТВОРОВ, ПО УБОРКЕ РАЗЛИТЫХ ЛВЖ И ОРГАНИЧЕСКИХ
РЕАКТИВОВ»
Отходы ЛВЖ и ГЖ
(горючая жидкость) объемом не более 0,5л сжигают на воздухе один раз в месяц
или чаще в месте, согласованном с органами пожарной охраны и СЭС. Жидкость
наливают в металлический или фарфоровый сосуд вместимостью не менее 1л,
помещенный в ямку, глубиной не менее 3/4 высоты сосуда или зафиксированный от
падения иным способом. Располагаются относительно сосуда таким образом, чтобы
ветер дул в спину, и затем металлическим прутом, длиной не менее 1,5м, с
факелом на конце поджигают содержимое сосуда. Работать необходимо в
перчатках и защитных очках!
Уничтожение отходов производит
учитель или лаборант.
Отработанные водные
растворы собирают, независимо от их происхождения, в закрывающийся
стеклянный сосуд вместимостью не менее 3л. После того, как он наполнится на
4/5, проверяют рН и при необходимости нейтрализуют жидкость до рН 7-7,5
твердыми карбонатами или гидроксидами натрия или калия. Жидкость выливают в
канализацию с одновременной подачей свежей воды. Ликвидацию растворов
производит учитель или лаборант.
При разливе ЛВЖ или
органических реактивов объемом до 0,05л необходимо немедленно
погасить открытый огонь (спиртовки, газовые горелки) во всем помещении и
проветрить его. Если разлито более 0,1л, следует сначала незамедлительно
удалить учащихся из помещения, погасить открытый огонь и отключить систему
электроснабжения через устройство, находящееся вне лаборатории. Место пролитой
жидкости следует засыпать сухим песком, затем загрязненный песок собрать
деревянным совком или лопатой (недопустимо использовать стальную лопату или
совок!) в закрывающуюся тару и обезвредить в тот же день.
Все указанные действия выполняет
учитель или лаборант.
Внимание !!!
Работу в лаборатории можно
возобновить только после полного исчезновения запаха разлитой жидкости.
ИНСТ — 7 «ТЕХНИКА БЕЗОПАСНОСТИ ПРИ РАБОТЕ СО
СПИРТОВКАМИ И СУХИМ ГОРЮЧИМ»
Спиртовки широко
распространены в химических кабинетах. Они просты по устройству, но требуют
осторожности при эксплуатации.
Перед зажиганием спиртовки
следует произвести внешний осмотр и удостовериться, что корпус ее исправен,
фитиль вытащен на требуемую высоту и достаточно распушен, а горловина и
держатель фитиля совершенно сухие. Если спиртом смочены держатель фитиля и
горловина спиртовки, почти неизбежно произойдет взрыв паров внутри, следствием
чего может быть нарушение целостности корпуса, выброс держателя, растекание
спирта и пожар. Поэтому ни в коем случае нельзя зажигать спиртовку с остатками
жидкости, а следует выждать некоторое время и дать ей обсохнуть.
Фитиль должен плотно входить в направляющую
трубу держателя, иначе не исключена возможность вспышки паров внутри спиртовки
Зажженную спиртовку нельзя
переносить с места на место, нельзя также зажигать одну спиртовку
непосредственно от другой. Для зажигания спиртовки пользуйтесь спичками.
Гасить спиртовку можно только
одним способом — накрывать пламя фитиля колпачком. Колпачок должен находиться
всегда под рукой.
Заполняются спиртовки только этиловым
спиртом. В самом крайнем случае можно заливать в спиртовки керосин
(но не бензин, не метанол!).
В нерабочем состоянии спиртовки
хранят в металлических ящиках для ЛВЖ или под тягой (в изолированном от других
реактивов отсеке).
Сухое горючее. При
выполнении учениками опытов, связанных с нагреванием, из-за отсутствия спирта
приходится пользоваться так называемым сухим горючим.
Прежде чем раздавать таблетки
сухого горючего, учащимся нужно рассказать о правилах пользования ими, особенно
о способе тушения.
Зажигать таблетки сухого горючего
надо спичками, а тушить — с помощью колпачка от спиртовок, керамическими
тигельками, накрыв таблетку сверху. Недогоревшие таблетки издают довольно
неприятный запах, поэтому их лучше сжигать до конца или сразу же убирать в
вытяжной шкаф.
ИНСТ — 8 «ТЕХНИКА БЕЗОПАСНОСТИ ПРИ РАБОТЕ С КИСЛОТАМИ»
Концентрированные кислоты вызывают
обезвоживание кожи и других тканей.
По быстроте действия и по
скорости разрушения тканей тела кислоты располагаются в следующем порядке,
начиная с наиболее сильных: царская водка (смесь азотной и соляной кислот),
азотная кислота, серная кислота, плавиковая кислота, соляная кислота, уксусная
кислота (90—100%), молочная кислота, щавелевая кислота и т.д. Очень опасны
ожоги хромовой смесью. Сильное раздражающее действие на слизистые оболочки
дыхательных путей и глаз оказывают дымящие кислоты (концентрированные соляная и
азотная кислоты).
Кислоты вызывают
локальный химический ожог. Исключение составляет циановодород HCN и некоторые
другие, обладающие общеядовитым действием.
Степень тяжести химического
ожога зависит от силы и концентрации кислоты. Даже уксусная и щавелевая кислоты
способны вызвать некроз кожи при концентрации 60-70% и выше. Наиболее
сильные, долго не заживающие ожоги происходят от: царской водки, соляной и
азотной кислот в отдельности, хромовой, серной, плавиковой, хлорной кислот.
Концентрированные кислоты опасны
еще и тем, что могут выделять едкие пары. Например, азотная кислота с
концентрацией выше 63% выделяет физиологически активные оксиды азота. От
концентрированной серной кислоты воздух загрязняется оксидами серы. Ледяная
уксусная и муравьиная кислоты сильно раздражают дыхательные пути и слизистые
оболочки глаз, являются легковоспламеняющимися жидкостями.
Концентрированные кислоты хранят
под тягой. Переливают их также под тягой, пользуясь индивидуальными средствами
защиты (очки или защитная маска, резиновые перчатки, халат, резиновый фартук).
При пользовании склянкой с
кислотой необходимо следить, чтобы на каждой склянке было четкое название
кислоты. Наливать кислоту надо так, чтобы при наклоне склянки этикетка, во
избежание ее порчи оказывалась сверху.
Опыты с концентрированными кислотами
должны демонстрироваться учителем
или лаборантом (без допуска
учащихся к реактивам) в защитной спецодежде и очках (маске).
При разбавлении или укреплении
растворов кислот льют кислоту большей концентрации в сосуд с кислотой меньшей
концентрации; при изготовлении смеси кислот необходимо вливать жидкость большей
плотности в жидкость с меньшей плотностью.
Приливают кислоту по стеклянной
палочке с предохранительным резиновым кольцом внизу. Налив определенную порцию
кислоты, размешивают содержимое сосуда, в котором готовят раствор. Первые
порции обычно делают небольшими. Во время растворения следят за температурой
жидкости и не допускают перегрева, иначе сосуд может лопнуть.
В случае пролива кислоты ее
необходимо убрать. Лучший способ уборки — засыпать лужу сухим кварцевым песком.
Его перемешивают на месте разлива, а затем, собрав в совок, выбрасывают или
зарывают в землю. После уборки песка место разлива обрабатывают 10-15%ным
раствором соды, а затем моют водой.
Только в крайних случаях можно
воспользоваться тряпками для уборки, т.к. некоторые кислоты (хлорная, азотная)
активно взаимодействуют с органическими веществами, и в процессе реакции
выделяется такое количество теплоты, что возможно воспламенение.
Необходимо быть предельно
внимательными при транспортировке сосудов с кислотами. Склянку с кислотой
нельзя прижимать руками к груди, т.к. возможно расплескивание и ожоги.
Наливать кислоту нужно в сосуды объемом не более 1л.
Первая помощь. Пораженный
участок кожи промывают сильно скользящей струёй холодной воды в течение
10-15мин. После промывки на обожженное место накладывают пропитанную водным
2%-м раствором питьевой соды марлевую повязку или ватный тампон. Через 10мин.
повязку снимают, кожу обмывают, осторожно удаляют влагу фильтровальной бумагой
или мягкой тканью и смазывают глицерином для уменьшения болевых ощущений.
При
попадании капель кислоты в глаза их промывают проточной водой в течение 15мин.
и после этого — 2%-ным водным раствором питьевой
соды. После этого пострадавшего отправляют в лечебное учреждение.
Отработанные кислоты собирают в
отдельные сосуды и сливают в канализацию только после их нейтрализации (эту
операцию проводит лаборант). В крайнем случае можно, предварительно открыв
кран, медленно вылить реактив по стенке раковины. После этого вода должна
литься еще 1-2минуты.
Учащимся запрещается готовить
растворы кислот для опытов. Пробы для опытов должны выдаваться учителем или
лаборантом в готовом виде.
ИНСТ — 9 «ТЕХНИКА БЕЗОПАСНОСТИ ПРИ РАБОТЕ СО ЩЕЛОЧАМИ»
Щелочи оказывают на
организм в основном локальное действие, вызывая омертвение (некроз) только тех
участков кожного покрова, на которые они попали. Однако в дальнейшем организм
испытывает общее отравление в результате всасывания в кровь продуктов
взаимодействия мышечных тканей и щелочей. Действие щелочей, особенно
концентрированных, характеризуется значительной глубиной проникновения,
поскольку они растворяют белок. В связи с этим очень опасно попадание щелочи
в глаза: при запоздалой первой помощи оно сопровождается полной потерей
зрения.
Твердые щелочи очень
гигроскопичны, поглощают из воздуха углекислый газ с образованием
соответствующих карбонатов.
Хранить твердые щелочи следует в
емкостях из полиэтилена или в толстостенных широкогорлых стеклянных банках,
плотно закрывающихся пропарафиненными корковыми пробками.
Из концентрированных аммиачных
растворов, обладающих основными свойствами, выделяется большое количество газообразного
аммиака. Он раздражающе действует на верхние дыхательные пути, а в
высоких концентрациях — и на нервную систему. Хорошо растворяясь в воде, аммиак
концентрируется во влаге слизистых оболочек, особенно в глазах, и это наиболее
опасно, потому что если не принять мер первой помощи он проникает глубоко в
ткани и вызывает необратимые изменения глазного яблока спустя длительное время
с момента поражения, поэтому переливать концентрированные растворы аммиака
нужно только под тягой. Опыты с аммиаком также должны проводиться в вытяжном
шкафу.
Во время приготовления растворов
щелочей твердые вещества из содержащих их емкостей берут только специальной
ложечкой и ни в коем случае не насыпают, потому что пыль может попасть в глаза
и на кожу. После использования ложечку тщательно моют, т. к. щелочь прочно
пристает ко многим поверхностям.
При взятии навески используют
тонкостенные фарфоровые чашечки. Бумагой, тем более фильтровальной,
пользоваться нельзя, т. к. щелочь ее разъедает.
Растворы приготавливают в
толстостенных фарфоровых сосудах в два этапа. Сначала делают концентрированный
раствор, охлаждают его до комнатной температуры, а потом разбавляют до нужной
концентрации. Такая последовательность вызвана значительным экзотермическим
эффектом растворения.
При оказании первой помощи
необходимо немедленно каким-либо предметом удалить приставшие к коже кусочки
щелочи и промыть пораженное место обильной струёй воды. Щелочь смывается плохо,
промывание должно быть продолжительным (10-15мин.) и тщательным. Для
нейтрализации проникшей в поры кожи щелочи на пораженное место после промывания
накладывают повязку из марли или ватный тампон, пропитанные 5%-м раствором
уксусной кислоты. Через 10мин. повязку снимают, кожу обмывают, осторожно
удаляют воду фильтровальной бумагой или мягкой тканью и смазывают глицерином
для уменьшения болевых ощущений.
Если щелочь попала в глаза,
немедленно следует промыть их проточной водой из фонтанчика в течение 15-20мин.
После этого глаза ополаскивают 2%-м раствором борной кислоты и закапывают под
веки альбуцид.
После оказания первой помощи нужно незамедлительно
обратиться к врачу-окулисту.
Запрещается
учащимся готовить растворы щелочей для опытов. Пробы для опытов должны
выдаваться учителем или лаборантом в готовом виде. 25%-ый раствор аммиака
учащимся не выдается!
Группа хранения № 7 — вещества повышенной
физиологической активности.
ИНСТ — 11 «ТЕХНИКА БЕЗОПАСНОСТИ ПРИ РАБОТЕ С НИТРАТАМИ»
Все нитраты — канцерогены,
оказывают сжигающее действие на кожу и слизистые оболочки. При нагревании
нитраты алюминия, аммония, свинца (II), серебра, меди (II) разлагаются с
выделением оксидов азота.
Нитрат
серебра AgNO3 следует хранить в плотно закрытых баночках (до 50г) из темного
стекла в светонепроницаемом футляре. Для демонстрационных опытов используется
2%-й раствор, хранить его нужно также в склянках из темного стекла с притертыми
или резиновыми пробками. Учащимся выдают 1%-й раствор в небольших количествах в
склянках из темного стекла.
При попадании нитрата бария
Ba(NO3)2 внутрь возможны отравления,
сопровождающиеся повышением кровяного давления, воспалительными заболеваниями
пищевода, желудка, головного мозга, поражением гладкой и сердечной мускулатуры.
Опыты с нитратами (в твердом,
кристаллическом состоянии) проводятся только учителем в вытяжном шкафу. При
работе с этими веществами необходимо применять индивидуальные средства защиты,
также следует соблюдать правила личной гигиены, не допускать образования пыли
от препаратов и попадания ее внутрь организма, на кожу и в глаза. После
завершения работы необходимо тщательно помыть руки с мылом под проточной водой.
Запрещается учащимся готовить
набор реактивов для опытов. Пробы веществ для опытов должны выдаваться
учителем или лаборантом в готовом вид. Группы хранения: №6 — нитраты калия,
натрия, аммония, алюминия;
№7
— нитраты бария и серебра.
ИНСТ — 12 «ТЕХНИКА
БЕЗОПАСНОСТИ ПРИ РАБОТЕ С СОЕДИНЕНИЯМИ МЕДИ»
В школьной практике используются: медь металлическая, оксид и гидроксид
меди (II), соли меди: малахит (в порошке), медный купорос (CuSO4×5H2О)
и безводный сульфат меди (II), хлорид меди (II).
Соединения меди в виде пыли
вызывают раздражение слизистых оболочек дыхательных путей, кашель. При
попадании на кожу, особенно в местах микротравм, эти вещества вызывают сильное
раздражение, могут привести к аллергии в легкой форме.
Соли меди токсичны,
при попадании внутрь организма вызывают отравление, пыль раздражает глаза и
вызывает изъязвление роговицы. При хронической интоксикации возможны:
функциональное расстройство нервной системы, нарушение функции печени и почек,
изъязвление носовой перегородки. Не допускать попадания препаратов внутрь
организма.
При работе с препаратами следует
применять индивидуальные средства защиты, соблюдать правила личной гигиены. Не
допускать при работе с соединениями меди образования пыли от препаратов.
Учащимся соединения меди выдаются в небольших
количествах. Группа хранения № 8.
ИНСТ — 16 «ТЕХНИКА БЕЗОПАСНОСТИ ПРИ РАБОТЕ
С КРАСНОЙ И ЖЕЛТОЙ
КРОВЯНЫМИ СОЛЯМИ, РОДАНИДАМИ,
СУЛЬФИДАМИ, ФТОРИДАМИ»
Все перечисленные препараты
являются соединениями повышенной физиологической активности. При работе с ними
следует применять индивидуальные средства защиты, соблюдать правила личной
гигиены.
Не допускать попадания
препаратов внутрь организма!
Желтая кровяная соль K4[Fe(CN)6]×3H2O
и красная кровяная соль K3[Fe(CN)6] в
присутствии кислот или кислых солей разлагаются с образованием циановодорода
HCN. Под действием желудочного сока может также образовываться синильная
кислота, поэтому прием внутрь 2-3г солей вызывает отравление со смертельным
исходом.
Учащимся для проведения опытов
выдавать препараты в виде разбавленных растворов, а в твердом виде — не более
1г на учащегося.
Роданид калия KCNS —
наркотик. Попадание внутрь 30г и более вызывает острый психоз. Выдавать
препарат учащимся только в виде разбавленных растворов.
Сульфид натрия Na2S×9H2O особенно
опасен при попадании внутрь: возможен летальный исход от 3-5г и выше. Выдавать
препарат учащимся только в виде разбавленных растворов.
Фториды в организме
действуют в основном на различные ферменты, а также на центральную нервную
систему. При случайном попадании внутрь возможен летальный исход после приема
0,2г NaF и более.
С фторидами должен работать
только учитель!
Необходимо вести строгий учет при хранении
препаратов.
Первая помощь — промывание
желудка 2%-м раствором соды, затем следует выпить стакан молока с двумя яичными
белками. Можно также давать взвесь чистого мела (детский зубной порошок или
порошок «Особый» в воде.
Группа хранения №7 — вещества повышенной
физиологической активности.
ИНСТ — 28 «ТЕХНИКА БЕЗОПАСНОСТИ ПРИ РАБОТЕ С ХЛОРИДАМИ»
Хлорид лития моногидрат LiCl × H2O в виде пыли
вызывает раздражение слизистых оболочек дыхательных путей.
Хлорид калия КС1 в виде
пыли, попадая на кожные раны, ухудшает их заживление, способствует развитию
гнойной инфекции.
Хлорид железа(III) FeCl3
пылит. Его пыль вызывает раздражение слизистых оболочек органов дыхания и
зрения. При попадании в пищеварительный тракт может вызвать рвоту. Работы с
препаратом следует производить, не допуская его распыления. При раздражении
слизистых оболочек дыхательных путей необходимо проводить содовые и масляные
ингаляции, пить теплое молоко с питьевой содой, при раздражении глаз —
промывать их 2%-м раствором борной кислоты.
Хлорид цинка ZnCl2
резко раздражает и прижигает кожу и слизистые оболочки. При контакте может
всасываться в кожу рук. Кратковременное вдыхание дыма хлорида цинка вызывает
кашель и тошноту, через 1-24 часа появится одышка, повышение температуры,
воспалительные явления в легких. Работы с хлоридом цинка следует производить,
не допуская его распыления, исключая соприкосновение кожи с препаратом. После
работы необходимо тщательно вымыть руки теплой водой, смазать жиром. При попадании
кристаллов или раствора на кожные покровы или слизистые оболочки необходимо
немедленно промыть эти места обильной струей воды. При попадании препарата
внутрь следует вызвать рвоту, направить пострадавшего в медпункт.
Хлорид кальция CaCl2
при систематическом воздействии на кожу раздражает и высушивает ее, особенно
раздражающе действует на слизистые оболочки верхних дыхательных путей и глаз.
Хлорид магния MgCl2
нетоксичен. При попадании внутрь действует как «осмотическое»
слабительное, причем токсического эффекта обычно не наблюдается вследствие
медленного его всасывания и быстрого выделения. Однако попадание внутрь больших
доз опасно.
Хлорид алюминия AlCl3 может вызывать раздражение
слизистых оболочек органов дыхания, желудочно-кишечного тракта, кровоточивость
десен, а также может вызвать лейкемию.
Хлорид натрия NaCl и его
растворы, особенно горячие, попадая на кожные раны, ухудшают их заживление. При
систематическом действии препарата на кожу наблюдаются глубокие болезненные и
долго незаживающие раны. В условиях периодического воздействия пыли хлорида
натрия в концентрациях 95-150 мг/м3 может возникнуть
отравление — «синдром соляной пыли» с головными болями, болями в
груди, с поражением носовых пазух, явлениями пневмосклероза.
Хлорид аммония NH4Cl нетоксичен, но может вызвать
раздражение слизистых оболочек и кожных покровов.
Группа хранения № 7 — хлорид цинка, остальные
препараты — группа № 8.
СПИСОК ЛИТЕРАТУРЫ
1.
Габриелян О.С. Химия. 8 класс: учебник / О.С. Габриелян — 5-е
издание, стереотип — М.: Дрофа, 2016 — 287с.
2.
Габриелян О.С. Химия. 9 класс: учебник / О.С. Габриелян — М.:
Дрофа, 2017 — 320с.
3.
Основная образовательная программа основного общего образования МБОУ
СОШ №23 г.Новочеркасска, реализующая ФГОС в 5-8 классах на 2015-2020 учебный
год.
4.
Приказ Министерства Образования и науки Российской Федерации от
30.08.2013 года №1015 «Об утверждении Порядка организации и осуществления
образовательной деятельности по основным общеобразовательным программам —
образовательным программам начального общего, основного общего и среднего
общего образования». Режим доступа: https://минобрнауки.рф/
5.
Программы основного общего образования по химии для 8-9 классов
к учебнику О.С. Габриелян. Авторы О.С. Габриелян, А.В. Купцова — М., 2016 —
139с.
6.
Федеральный государственный образовательный стандарт основного
общего образования. Режим доступа: https://минобрнауки.рф/
7.
Федеральный закон «Об образовании в Российской Федерации» от
29.12.2012 года
№273-Ф3. Режим доступа: https://минобрнауки.рф/
В данном комплекте инстукции представлены все инструктивные карточки для проведения химического практикума на уроках химии в 9 классе к учебно-методическому комплексу О.С.Габриеляна. Использование инструктивных карточек позволяет учащимся правильно оформить практические работы, сократить время на оформление, определение плана практической работы. Может быть использован не только при проведении практических работ по химии 9 класса к УМК О.С. Габриеляна, но и при проведении работ к УМК других авторов.
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.











 р
р Образовался ____осадок.
Образовался ____осадок. 

 CO2
CO2  р-р
р-р