План
– конспекта урока
Предмет: Химия
Класс: 8
Учебник: Химия:
Неорганическая химия. 8 класс. Рудзитис Г. Е., Фельдман Ф. Г.
Тема
урока: «Получение кислорода и изучение его свойств»
Цель
– закрепить и усовершенствовать знания учащихся об основных способах получения
кислорода в лабораторных условиях и изучить его свойства.
Задачи:
Образовательные:
·
изучить способы получения кислорода
(способом вытеснения воздуха и способом вытеснения воды), его физические и
химические свойства;
Воспитывающие:
·
развить кругозор учащихся;
·
самостоятельность, аккуратность,
трудолюбие, сотрудничество, наблюдательность, воспитать бережное
отношение к растительному миру, так как растения являются
производителями кислорода;
Развивающие:
·
умения составлять уравнения химических
реакций;
·
соблюдение правила техники безопасности во
время проведения химических экспериментов;
·
умение делать выводы.
Тип
урока: Урок совершенствования и применения
знаний (практическая работа).
Необходимое
оборудование и реактивы: лабораторный штатив с
пробирками, пробка с газоотводной трубкой, колба плоскодонная, ложечки для
сжигания веществ (с пробкой), горелка и спички, лучины, кристаллизатор с
водой, стеклянная пластинка; перманганат калия KMnO4,
уголь С (порошок), известковая вода Ca(OH)2.
Основные
этапы урока:
1.
Организационная часть (2 мин)
2.
Вводная часть (10 мин)
3.
Основная часть (20 мин)
4.
Заключительная часть (13 мин).
|
Основные этапы урока, время |
Методы |
Содержание учебного материала, деятельность учителя |
Содержание учебного материала, деятельность учащихся |
Примечание |
|
Организационная |
Приветствую |
Приветствуют |
||
|
Вводная |
Беседа |
— Целью — До — Затем Прибор Во время 1. Почему 2. 3. Как |
Ученики внимательно Ученики Ответы 1. Кислород 2. 3. |
|
|
Основная |
Ученический |
После Учитель |
Ученики После После |
Учитель |
|
Заключительная |
Самостоятельная |
Учитель |
Выполняют |
В |
Приложение
к конспекту урока
Приложение 1. Правила техники
безопасности.
Осторожно обращайтесь с химическим оборудованием!
Помните! Пробирку прогревают, держа ее в наклонном положении, по всей длине
двумя-тремя движениями в пламени спиртовки. При нагревании направляйте
отверстие пробирки в сторону от себя и соседей.
|
|
|
Тушите |
Приложение
2. Карта – инструкция к практической работе «Получение кислорода и изучение его
свойств»
Цель
— научить использовать лабораторное оборудование и посуду для получения,
собирания и доказательства наличия кислорода, соблюдать правила техники
безопасности.
В
этой работе вам предстоит изучить один из лабораторных способов получение
кислорода и его свойства. Выяснить роль катализатора. Совершенствовать умение
работать с приборами. Научиться собирать кислород различными способами,
формировать навыки нагревания и пользования нагревательными приборами, соблюдая
правила техники безопасности при работе с нагревательными приборами, при
нагревании, при собирании приборов.
|
Оборудование |
Реактивы |
|
Лабораторный Пробка с Колба Ложечки Горелка Кристаллизатор Стеклянная |
Перманганат Пероксид Оксид Уголь Сера Фосфор Железная |
Задание
1. Проверка прибора на герметичность.
·

состоящий из пробирки и газоотводной трубки.
·
Проверьте прибор на герметичность!
Зажмите пробирку в ладони, опустите конец трубки в воду: появление пузырьков
воздуха указывает на герметичность прибора.
·
Если пузырьки не побулькивают через воду,
это означает, что прибор не герметичен. Об этом надо поставить в известность
учителя или лаборанта.
Задача
2. Получение кислорода нагреванием перманганата калия
1. Вытеснением
воздуха
·

пробирку до 1/ 5 ее объема насыпьте перманганат калия, введите в пробирку
небольшой рыхлый тампон из ваты и плотно закройте ее пробкой с газоотводной
трубкой, держа пробирку пальцами у отверстия.
·
Снова испытайте прибор на герметичность (см.
задача 1).
·
Закрепите пробирку прибора в лапке штатива
в горизонтальном положении, при этом, постукивая пальцем по пробирке,
добейтесь, чтобы содержимое было не только на дне пробирки, а распределилось до
ее середины. Отрегулируйте высоту пробирки так, чтобы конец газоотводной трубки
почти доходил до дна сосуда для собирания кислорода способом вытеснения
воздуха.
·
Прогрейте пробирку пламенем спиртовки (равномерно
перемещая пламя спиртовки вдоль пробирки); поставьте спиртовку под ту часть,
где находится перманганат калия.
·
Соберите кислород вытеснением воздуха из
стакана.
·
Проверьте, наполнен ли стакан кислородом:
поднесите тлеющую лучинку к отверстию в стакан.
2.
Собирание кислорода «над водой»
·
Наденьте на конец газоотводной трубки
стеклянный наконечник.
·

трубку с наконечником в стакан с водой (не более 1/ 2 высоты стакан).
·
Наполните пустую пробирку с водой, и
закройте ее пробкой с держателем.
·
Опустите пробирку в стакан с водой; выньте
пробку с держателем. Наденьте пробирку на наконечник газоотводной трубки, не
вынимая пробирку из воды.
·
Закройте конец газоотводной трубки
кусочком ваты.
·
Нагрейте вновь пробирку с перманганатом
калия и соберите кислород вытеснением воды из пробирки.
·
Закройте пробирку с кислородом пробкой с
держателем, выньте из стакана и поставьте в штатив. Докажите, что в пробирке
находится кислород.
Выньте
газоотводную трубку из стакана с водой, не прекращая нагревания пробирки с
перманганатом калия, в противном случае воду из стакана может перебросить в
раскаленную пробирку!

Горение угля в кислороде. Доказательства присутствия CO2
·

перманганата калия, вытеснением воздуха (см. предыдущий пункт «Вытеснение
воздухом»).
·
Затем кусочек угля укрепите на конце
проволоки, которую держите тигельными щипцами при внесении угля в пламя;
раскаленный уголек внесите в сосуд с кислородом. Обратите внимание на
беспламенное горение угля.
·
Прилейте в сосуд немного известковой воды,
взболтайте ее.
Оформите
отчет о работе:
|
Выполняемые операции |
Рисунки с обозначениями исходных и |
Наблюдения. Условия |
Объяснения наблюдений. Выводы |
|
Сборка прибора для получения кислорода. Проверка прибора на |
|||
|
Получение кислорода |
|||
|
Доказательство получения кислорода c помощью |
|||
|
Характеристика физических свойств О2. Собирание О2 двумя |
|||
|
Характеристика |
ВЫВОД:
_________________________________________________________
Образец
отчета о проделанной практической работе
|
Выполняемые операции |
Рисунки с обозначениями исходных и |
Наблюдения. |
Объяснения наблюдений. |
|
Сборка прибора для получения кислорода. |
|
Выделяются пузырьки воздуха |
Прибор собран герметично |
|
Получение кислорода из KMnO4 |
|
При нагревании KMnO4происходит реакция: |
О2 получают в лаборатории разложением KMnO4 при |
|
Доказательство получения кислорода при помощи |
|
Тлеющая лучинка |
Полученный газ О2поддерживает горение |
|
Характеристика |
|
Кислород вытесняет воздух и воду из сосудов |
Кислород – газ без цвета и запаха, |
|
Характеристика химических свойств О2. Взаимодействие |
|
Раскаленный уголек ярко горит в О2: Известковая вода |
О2взаимодействует |
ВЫВОД:
Один из способов получения кислорода в лаборатории –
разложение КMnO4. Кислород – газ без цвета и запаха, тяжелее воздуха
в 1,103 раза (Mr(O2) = 32, Mr(возд.)
= 29, из чего следует 32/29 1,103),
малорастворим в воде. Вступает в реакции с простыми веществами, образуя оксиды.
Приложение
3. Карточка для самостоятельной работы
(Демонстрационная карточка).
1)
Заполните пропуски в таблице:
|
Название |
Уравнение |
Наблюдение |
|
1. |
…KMnO4 |
При |
|
2. |
|
При |
|
3. |
|
При (легче/ |
|
4. |
С + O2 à… |
Уголь |
|
5. |
… + Ca(OH)2 |
Известковая |
2) Какие из
физических свойств можно отнести к кислороду (н. у.): легче воздуха, тяжелее
воздуха, твердый, жидкий, газ, бесцветный, зеленый, голубой,
хорошо растворим в воде, мало растворим в воде, электропроводен, с
резким запахом, сладкий, кислый.
3) Допишите схемы
реакций, лежащих в основе лабораторных способов получения кислорода. Расставьте
коэффициенты:
а) H2O2
à H2O
+
б) KMnO4
K2MnO4+MnO2¯+
в) H2O H2
+
г) HgO à Hg
+
4) Задача 1: Определите, какое из
соединений железа – Fe2О3 или Fe3О4 –
богаче железом?
Задача 2: Какое число молекул
содержится в 2, 5 моль кислорода?
Задача 3: Определите количество вещества
и число молекул, составляющие 12 г. кислорода?
Список
литературы:
1. Карты —
инструкции для практических занятий по химии 8 -11 класс. Т. С. Назарова, В. Н.
Лаврова.
2. Рабочая тетрадь
по химии 8 класс. Гузей Л. С.
3. Ерыгин
Д.П., Шишкин Е.А. Методика решения задач по химии: Учеб. пособие для студентов
пед. ин-тов по биол. и хим. спец. – М.: Просвещение, 1989.
4. Катаева Л.Г.,
Толкачева Т.К. Карточки-задания по неорганической химии: 8 класс —
96 с.
5. Задачи по химии
и способы их решения 8 -9 класс. Габриелян О. С.
ВЫПОЛНЕНИЕ РАБОТЫ
Загрузите по очереди два следующих видео — опыта и внимательно наблюдайте за экспериментом:
1. Получение кислорода (нажмите «Посмотреть опыт»)
Кислород( O 2 ) в лаборатории получают разложением перманганата калия KMnO 4 (марганцовки). Для опыта понадобится пробирка с газоотводной трубкой. В пробирку насыпаем кристаллический перманганат калия. Для сбора кислорода приготовим колбу. При нагревании перманганат калия начинает разлагаться, выделяющийся кислород поступает по газоотводной трубке в колбу. Кислород тяжелее воздуха, поэтому не покидает колбу и постепенно заполняет ее. Тлеющая лучинка вспыхивает в колбе: значит нам удалось собрать кислород.
2KMnO4 = K2 MnO4 + MnO2 + O2 ↑
Чистый кислород впервые получили независимо друг от друга шведский химик Шееле (при прокаливании селитры) и английский ученый Пристли (при разложении оксидов ртути и свинца). До их открытия ученые считали, что воздух ‑ однородная субстанция. После открытия Шееле и Пристли Лавуазье создал теорию горения и назвал новый элемент Oxygenium (лат.) – рождающий кислоту, кислород. Кислород — необходим для поддержания жизни. Человек может выдержать без кислорода всего несколько минут.
2. Обнаружение кислорода
Кислород поддерживает горение — это свойство кислорода используется для его обнаружения
3. Горение угля в кислороде
Кислород активно взаимодействует со многими веществами. Посмотрим, как реагирует кислород с углем. Для этого раскалим кусочек угля на пламени спиртовки. На воздухе уголь едва тлеет, потому что кислорода в атмосфере около двадцати процентов по объему. В колбе с кислородом уголь раскаляется. Горение углерода становится интенсивным. При сгорании углерода образуется углекислый газ:
С+О2= СО2
Добавим в колбу с газом известковую воду – она мутнеет. Известковая вода обнаруживает углекислый газ. Вспомните, как разжигают гаснущий костер. Дуют на угли или интенсивно обмахивают их для того, чтобы увеличить подачу кислорода в зону горения.
Урок №
Тема: Практическая работа №3 «Получение и свойства кислорода »
Тип урока: комбинированный
Цель урока:
- научить использовать лабораторное оборудование и посуду для получения, собирания и доказательства наличия кислорода;
- Продолжить формирование умений по составлению уравнений химических реакций, расстановке коэффициентов в уравнениях химических реакций. Развивать практические умения и навыки в ходе выполнения лабораторных опытов;
- способствовать формированию культуры учебного труда, аккуратности, внимания при проведении эксперимента, совершенствовать технику безопасного труда;
- способствовать развитию у школьников интереса к химической науке, к исследовательской деятельности
Оборудование и реактивы:
- штатив лабораторный с лапкой;
- спиртовка;
- пробирки 2 шт;
- пробка с газоотводной трубкой;
- спички;
- лучинка;
- вата.
- перманганат калия (твердый) KMnO4;
Ход урока:
1. Организационный момент. Приветствие учащихся, настрой на урок.
2. Актуализация знаний:
Сегодня на уроке мы с вами продолжим изучать кислород, вещество, вокруг которого, как говорил шведский химик Якоб Берцелиус, вращается вся земная химия. (Слайд 1) Мы уже достаточно много узнали о кислороде и, что бы вы проверили и оценили свои знания, предлагаю вам химический диктант. (Слайд 2) Если утверждение соответствует простому веществу – кислороду, и вы с утверждением согласны, то ставим “да”, если нет — “нет”.
- В промышленности получают из воздуха.
- Хорошо растворим в воде.
- При обычных условиях – бесцветный газ.
- Сложное вещество.
- Газ, имеющий запах.
- В природе встречается только в связанном виде.
- Простое вещество.
- Легче воздуха.
- Собирают в сосуд, поставленный обычно на дно.
- Малорастворим в воде.
- В природе встречается в свободном и связанном виде.
- Собирают в перевёрнутый вверх дном сосуд.
- Тяжелее воздуха.
- Необходим для дыхания.
- Применяют для сварки и резки металлов.
Проводится проверка. Учащиеся оценивают друг друга
«5»- 15 правильных ответов «4»- 14-11 правильных ответов «3»- 10-6 правильных ответов
Перед вами на доске записи, распределите их на две группы:
(газ, простое вещество, жидкость голубого цвета, кристаллы синего цвета, окисление, без запаха, без вкуса, горение)
1 – физические свойства (газ, простое вещество, жидкость голубого цвета, кристаллы синего цвета, без запаха, без вкуса);
2 – химические свойства (окисление, горение)
Записываем тему урока в тетрадь.
Прежде чем начнем получать кислород и рассматривать его свойства, я предлагаю вам поиграть в «Лото». Вам нужно закрыть красными фишками формулы оксидов. Как вы их определили? (слайд 5).
Mg, P2O5, S, SO2, H2, CO2, Fе2O3, C, H2O, CuO
А теперь подумайте и скажите, как их можно получить?
3. Практическая работа «Получение и свойства кислорода »
Но, чтобы убедиться, что такие реакции действительно идут, я предлагаю вам посмотреть их протекание. Демонстрация горения серы и фосфора в кислороде с последующей записью соответствующих химических реакций на доске (слайд-видео)
А вот оксид СО2 я предлагаю вам получить самостоятельно в ходе лабораторной работы. Что с чем должно прореагировать? (Слайд 6)
Каждый на парту получает карточку с изображением прибора для получения кислорода и описанием опыта «Получение кислород, разложением перманганата калия, собирая методом вытеснения воздуха».
Перед тем, как учащиеся приступят к выполнению опыта повторить ТБ с нагревательными приборами.
Перед учащимися поставить задачу не просто проделать опыт, но и описать его.
Лабораторная работа 10-15 минут.
Обсуждение опыта: Что получали? Из какого вещества? Каким методом? Что произошло с тлеющей лучинкой?
Записать уравнение реакции С + О2 = СО2 в тетрадь.
Сегодня мы на уроке наблюдали получение кислорода путем нагревания
2KMnO4 —t—→ K2MnO4 + MnO2 + O2↑ ,
еще кислород можно получать методом нагревания KClO3(хлорат калия)
2KClO3 —t—→ 2KCl +3O2↑,
и из 2H2O2 —-cat—→ 2 H2O + O2↑
4. Домашнее задание
§22-24, на «3», на «4» и «5» дополнительно зад 5 и творческое задание: нарисовать плакат или листовку о вреде пожара, составить инструкцию поведения в лесу, чтобы избежать пожар, поведение во время пожара
5. Закрепление: решение задачи
Задача. Определите, какое из соединений железа – Fe2О3 или Fe3О4 – богаче железом?
Дано:
Найти:
Fe2O3,
Fe3O4.
(Fe) в Fe2O3,
‘(Fe) в Fe3O4
Решение
(Х) = n•Ar(X)/Mr, где n – число атомов элемента Х в формуле вещества.
Mr(Fe2O3) = 56•2 + 16•3 = 160,
(Fe) = 56•2/160 = 0,7,
(Fe) = 70%,
Mr (Fe3O4) = 56•3 + 16•4 = 232,‘(Fe) = 56•3/232 = 0,724,
‘(Fe) = 72,4%.
Ответ. Fe3O4 богаче железом, чем Fe2O3.
7. Сказать, что оценивание будет проведено индивидуальной карте учебных достижений с учетом работы на уроке. Перечислить наиболее активных учащихся.
8. Рефлексия (Слайд 20)
Приложение №1
Карта-инструкция
Практическая работа № 3 «Получение и свойства кислорода».
Цель работы: научиться использовать лабораторное оборудование и посуду для получения, собирания и доказательства наличия кислорода, соблюдать правила техники безопасности.
Оборудование и реактивы: штатив лабораторный с лапкой, спиртовка, пробирки 2 шт., пробка с газоотводной трубкой, спички, лучинка, вата, перманганат калия (твердый) KMnO4.
Правила техники безопасности.
Осторожно обращайтесь с химическим оборудованием!
Помните! Пробирку прогревают, держа ее в наклонном положении, по всей длине двумя-тремя движениями в пламени спиртовки. При нагревании направляйте отверстие пробирки в сторону от себя и соседей.
Ход работы:
1. Собрать прибор для получения кислорода.
2. Насыпать в пробирку перманганат калия (KMnO4). Твердого вещества должно быть 1-1,5 см по высоте пробирки.
3. Прогрейте пробирку, а потом нагревайте перманганат калия.
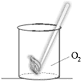
4. Подожгите лучинку, дождитесь появления на конце красного уголька и тут же погасите. Поднесите тлеющую лучинку к краю стакана. Если лучинка вспыхнет, прекратите нагревание перманганата калия. Погасите спиртовку
5. Оформите отчет о работе.
Что делали
Наблюдения
Результаты
1.Сборка прибора для получения кислорода (указать название оборудования и посуды)
2. Получение кислорода из KMnO4
при нагревании
KMnO4 —t—→ K2MnO4 + MnO2 +….
3. Доказательство получения кислорода при помощи
тлеющей лучинки
Вывод:________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Получение кислорода и изучение его свойств.
Цель работы: освоить один из лабораторных способов получения кислорода и собирание его методом вытеснения воздуха; закрепить знания о физических и химических свойствах кислорода.
1. Получение и собирание кислорода.
1) Соберите прибор для получения газов. Проверьте его на герметичность.
2) В пробирку примерно на четверть её объема насыпьте порошок KMnO4. Закройте пробирку пробкой с газоотводной трубкой. Закрепите прибор в штативе в наклонном положении, как показано на риснуке. Подготовьте стакан (или пробирку) для собирания кислорода. Нагрейте сначала всю пробирку, а потом только ту её часть, где находится KMnO4.

3) Убедившись, что стакан или пробирка заполнились кислородом, прекратите нагревание и закройте сосуд с кислородом.
2. Исследование свойств кислорода.
1) Какие физические свойства кислорода можно установить, рассматривая полученный газ?
2) Внесите в сосуд с кислородом тлеющую лучинку. Что вы наблюдаете? О чём это свидетельствует?
3. Сделайте отчет о проделанной работе по плану:
1) Название работы.
2) Цель работы.
3) Использованное оборудование.
4) Название каждой части работы с краткой записью результатов, рисунком прибора, пояснительными надписями и и ответами на поставленные в работе вопросы.
5) Составление уравнения соответствующих химических реакций.
6) Общий вывод.
ОТВЕТЫ
Исследование свойств кислорода
1) Рассматривая полученный кислород, мы видим, что газ прозрачный и не имеет цвета. Если открыть сосуд, то можно убедиться в том, что кислород не имеет запаха.
2) При внесении тлеющий лучинки в сосуд мы видим, что её тление усиливается (угольки становятся ярче). Это свидетельствует о том, что кислород поддерживает горение.
ОТЧЕТ
Название: Получение кислорода и изучение его свойств.
Цель: освоить один из лабораторных способов получения кислорода и собирание его методом вытеснения воздуха. Подтвердить на практике физические и химические свойства кислорода.
Использованное оборудование: пробирка с газоотводной трубкой, спиртовка, штатив с лапкой, химический стакан, вата, лучинка, спички, перманганат калия.

Вывод: мы освоили лабораторный способ получения кислорода путём разложения перманганата калия и собирания кислорода методом вытеснения воздуха. На практике изучили физические и химические свойства кислорода.

Карта-инструкция
Практическая работа № 3 «Получение и свойства кислорода».
Цель работы: научиться использовать лабораторное оборудование и посуду для получения, собирания и доказательства наличия кислорода, соблюдать правила техники безопасности.
Оборудование и реактивы: штатив лабораторный с лапкой, спиртовка, пробирки 2 шт., пробка с газоотводной трубкой, спички, лучинка, вата, перманганат калия (твердый) KMnO4.
Правила техники безопасности.
Осторожно обращайтесь с химическим оборудованием!
Помните! Пробирку прогревают, держа ее в наклонном положении, по всей длине двумя-тремя движениями в пламени спиртовки. При нагревании направляйте отверстие пробирки в сторону от себя и соседей.
Ход работы:
1. Собрать прибор для получения кислорода.
2. Насыпать в пробирку перманганат калия (KMnO4). Твердого вещества должно быть 1-1,5 см по высоте пробирки.
3. Прогрейте пробирку, а потом нагревайте перманганат калия.
4. Подожгите лучинку, дождитесь появления на конце красного уголька и тут же погасите. Поднесите тлеющую лучинку к краю стакана. Если лучинка вспыхнет, прекратите нагревание перманганата калия. Погасите спиртовку
5. Оформите отчет о работе.
Что делали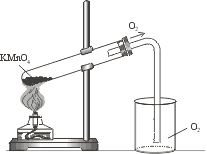
Наблюдения
Результаты
1.Сборка прибора для получения кислорода (указать название оборудования и посуды)
2. Получение кислорода из KMnO4
при нагревании
KMnO4 —t—→ K2MnO4 + MnO2 +….
3. Доказательство получения кислорода при помощи
тлеющей лучинки