Твердые желатиновые капсулы № 1 с прозрачным корпусом и синей крышечкой, с надписью «EPHACT» на корпусе и крышечке, которые содержат смесь красных, голубых и белых гранул;
1 капсула содержит фенилпропаноламин гидрохлорида 50 мг, хлорфенирамина малеата 8 мг
Вспомогательные вещества : сахар, глицерола моностеарат, этилцеллюлоза, поливинилпирролидон К-30; красители : бриллиантовый голубой и понсо 4R.
Капсулы пролонгированного действия.
Противоотечные средства для системного применения при патологии полости носа.
Фармакологические. Действие препарата обусловлено свойствами компонентов, входящих в его состав.
Фенилпропаноламин — симпатомиметический средство, которое применяется для устранения застойных явлений в слизистой оболочке верхних дыхательных путей. Благодаря сосудосуживающим эффектом уменьшается гиперемия, отек и улучшается проходимость дыхательных путей.
Хлорфенирамин — сильнодействующий блокатор Н 1 рецепторов, ингибитор биологических эффектов гистамина: подавляет симптоматику аллергического ринита, ринорею, неприятные ощущения в носоглотке и гортани.
Препарат обеспечивает терапевтическое действие в течение 12 часов после приема.
Фармакокинетика. Капсулы Эффекта содержат многослойные гранулы, которые обеспечивают постепенное контролируемое выделение активных компонентов и их стабильную концентрацию в сыворотке крови.
Фенилпропаноламин — быстро и полностью всасывается в желудочно-кишечном тракте, максимальная концентрация в плазме крови достигается через 1 — 2 ч и выводится в основном в неизмененном виде с мочой.
Хлорфенерамину малеат хорошо абсорбируется из желудочно-кишечного тракта. Метаболизируется при «первом прохождении» через печень и внутрипеченочной рециркуляции. Прием хлорфенирамина с пищей значительно уменьшает его биодоступность. Максимальная концентрация в сыворотке крови достигается через 2,5 — 6 ч, выводится с мочой в виде метаболитов.
Эффект применяется для симптоматического лечения заболеваний верхних дыхательных путей, сопровождающихся отеком слизистой оболочки верхних дыхательных путей, першением в горле, насморком, заложенностью носа, слезотечением. Препарат также применяется для лечения ринопатий аллергического происхождения (аллергический ринит, поллиноз) и вазомоторных ринитов.
Взрослым и детям старше 12 лет препарат Эффект назначают по 1 капсуле каждые 12 часов. Продолжительность лечения зависит от характера заболевания и составляет, как правило, 1 — 6 дней.
Капсулу глотают целиком, запивая большим количеством жидкости. Содержимое капсулы можно высыпать в ложку и проглотить, не разжевывая (с медом, джемом и т.д.), запивая жидкостью, но продолжительность действия в таком в случае будет короче.
Со стороны сердечно-сосудистой системы: повышение артериального давления, аритмии, боли в области сердца.
Со стороны нервной системы: нарушения сна, нарушения зрения (мидриаз, парез аккомодации), повышение внутриглазного давления, тремор мышц, головокружение, головная боль, повышенная возбудимость.
Со стороны пищеварительной системы: сухость во рту, снижение аппетита, тошнота, рвота, боль в эпигастрии.
Другие: аллергические реакции, очень редко — нарушение кроветворения, ухудшение оттока мочи.
Повышенная чувствительность к компонентам препарата глаукома, феохромоцитома, тиреотоксикоз, доброкачественная гиперплазия (аденома) предстательной железы, сахарный диабет в стадии декомпенсации, бронхиальная астма в стадии декомпенсации, хроническая сердечная недостаточность, артериальная гипертензия, ишемическая болезнь сердца, нарушения кроветворения, одновременное применение парацетамола и других лекарственных средств, содержат активные вещества, входящие в состав препарата, одновременное применение ингибиторов МАО, трициклических антидепрессантов, бета-адреноблокаторов; беременность и кормление грудью; возраст до 12 лет.
Передозировка проявляется усилением побочных действий. При появлении первых признаков передозировки следует прекратить прием препарата и промыть желудок с помощью толстого зонда. ОСОБЫЕ.
С осторожностью следует назначать Эффект пациентам с бронхиальной астмой, заболеваниями сердечно-сосудистой системы, повышенным глазным давлением, дефицитом глюкозо-6-фосфатдегидрогеназы, больным сахарным диабетом, лицам пожилого возраста и ослабленным пациентам.
Пациентам, принимающим Эффект, следует воздерживаться от употребления алкоголя
Назначение эффекта возможно не ранее чем через 14 дней после отмены ингибиторов МАО.
При применении лекарственных средств, содержащих фенилпропаноламин, есть риск развития острого нарушения мозгового кровообращения по геморрагическим типу.
Эффект может вызвать слабость, поэтому во время лечения необходимо воздерживаться от управления транспортными средствами или работы с механизмами.
Эффект нежелательно назначать вместе с тиоридазином, индометацином, ингибиторами МАО (МАО).
При одновременном применении
- препарат усиливает действие ингибиторов МАО и этанола;
- повышается риск побочного действия препаратов, содержащих псевдоэфедрин, фенилэфрин, эфедрин;
- с антидепрессантами, противопаркинсоническими и протипсихотропнимы средствами повышается риск развития задержки мочи, сухости во рту, запора;
- ингибиторов МАО, фуразолидон возможно резкое повышение артериального давления, психомоторное возбуждение, гипертермия;
- с трициклическими антидепрессантами возможно усиление симпатомиметической действия;
- гуанетидин усиливает альфа-симпатомиметическую действие эффекта, одновременно ослабляется действие гуанетидина.
Хранить в недоступном для детей, сухом, темном месте при температуре не выше 25 ° С. Срок годности — 3 года.
Что это такое
Омега-3 — это одна из жирных кислот — основного компонента животных и растительных жиров. Представить ее можно как длинную гусеницу, где каждый членик — атом углерода. Если этот атом углерода полностью облеплен атомами водорода его называют насыщенным, а если частично — ненасыщенным. По этому принципу жирные кислоты делят на насыщенные, полиненасыщенные и мононенасыщенные.
Соответственно, у насыщенных кислот все атомы углерода максимально заполнены водородом. В основном это животные жиры, им свойственно твердеть при остывании.
«Лучше ограничить количество этих жиров в рационе — считает кардиолог одной московской клиники. Они повышают уровень липопротеидов низкой плотности — „плохого“ холестерина, что может увеличить риск сердечно-сосудистых заболеваний».
У мононенасыщенных не заполнены только два атома углерода и в результате между ними образуются двойные связи в тех местах, где мог быть водород. А у полиненасыщенных жирных кислот таких участков много. Жиры с этими кислотами обычно жидкие.
«Они выполняют в организме человека множество функций: регулируют липидный обмен, оказывают противовоспалительное действие, благоприятно влияют на течение беременности и т. д.», — говорит кандидат медицинских наук, кардиолог и диетолог GMS Clinic Наталья Поленова.
Омега-3 (иногда обозначают ω-3) — это группа полиненасыщенных жирных кислот. Эти кислоты не синтезируются в организме человека и должны поступать с пищей. Их много в лососе, скумбрии, сельди, семенах и масле льна.
Раньше считалось, что омега-3 снижают риск сердечно-сосудистых заболеваний и улучшают работу мозга. Но после проведенных исследований выяснилось, что дополнительный прием БАД с омега-3 не влияет на риск развития болезней сердца из-за низкого содержания в них этих кислот. Для появления клинически значимого эффекта их концентрация должна быть не меньше 1 грамма, а это может привести к неприятным побочным эффектам, начиная от отрыжки, заканчивая носовыми кровотечениями. Существуют лекарства содержащие до 4 грамм омега-3 жирных кислот, но они применяются только под присмотром врачей, так как могут вызвать побочные эффекты. Например, внутреннее кровотечение при совместном применении с аспирином или варфарином.
Кому действительно нужно
Люди в группе риска сердечно-сосудистых заболеваний, например с ожирением, могут получить рецепт на лекарства с омега-3 жирными кислотами, содержащимися в гораздо большей концентрации, чем в БАД. Это позволит снизить уровень триглицеридов в крови до оптимального уровня.
«Согласно Меморандуму Международного общества по изучению атеросклероза, применение препаратов ω-3 ПНЖК в кардиологии может быть полезно даже в случае, если пациент уже принимает препараты, снижающие холестерин — статины», — приводит официальную позицию Поленова.
Также эти препараты могут помочь людям с плохой памятью, но при этом болезнь Альцгеймера и старческую деменцию ими предупредить не получится.
Как правильно принимать
Помимо омега-3 кислот, человеку необходимы и омега-6, но обычно в рационе их гораздо больше. Такой дисбаланс провоцирует развитие воспалений, сердечно-сосудистых и аутоиммунных заболеваний. Ученые до сих пор спорят какое же соотношение этих двух кислот будет оптимальным для человека, поэтому специалисты делают акцент на том, что нужно не снижать количество омега-6 в рационе, а скорее увеличивать поступление двух главных омега-3: эйкозапентаеновой (EPA) и докозагексаеновой (DHA).
«Лучший источник омега-3 — жирная рыба, — считает кардиолог московской клиники. — Ее надо есть не реже 2х раз в неделю, но при покупке обращать внимание на качество и происхождением. Например лосось, который вырастили на ферме будет не так полезен, как дикий».
В случае, если на рыбу есть аллергия помогут пищевые добавки или растительные источники омега-3, например, из морских водорослей.
Наталья Поленова подчеркивает, что наибольшую пользу омега-полиненасыщенные кислоты принесут, если поступят в организм в составе пищи.
Если и выбирать БАДы, то только после консультации с врачом. Покупать самые дешевые может быть опасно для здоровья, так как концентрация активного вещества в добавках может отличаться от заявленной и быть гораздо выше терапевтической дозы, как это бывает с витамином D.
- Омега-3 — жизненно важные жирные кислоты, которые не синтезируются у нас в организме, а должны поступать с пищей.
- Современные исследования не показали существенной пользы приема БАД с омега-3 в концентрации менее 1 грамма.
- Доказательство пользы лекарств на основе омега-3 были получены при дозировке больше 1 грамма в сутки, но они могут вызвать побочные реакции и должны назначаться врачом.
- Вместо БАД лучше есть больше морской жирной рыбы, например, лосося или сельди.
- Омега-3 в одиночку не спасает от болезни Альцгеймера, старческой деменции.
- Омега-3 можно принимать людям в группе риска сердечно-сосудистых болезней, но только по назначению врача и в дополнение к более эффективным препаратам.
Источник Форма Е-Аптека
Статьи по теме

01 февраля 2023
5 способов продлить молодость кожи без косметолога
Соблюдая эти несложные правила, можно помочь своей коже как можно дольше оставаться свежей и молодой. Сразу оговоримся — чудес не бывает, и красивая, сияющая кожа возможна только у здорового человека. Специально для Super ведущий терапевт GMS Clinic, кандидат медицинских наук, руководитель направления Longevity Светлана Артемова объясняет, что может помочь вашей коже кроме регулярных чек-апов и следования здоровому образу жизни.
Читать статью
11 ноября 2022
Дженерик или оригинал: как быстро сориентироваться в аптеке
Часто в аптеке слышишь: «Берите дженерик, дешевле, а работает так же». Так ли это? И в чем разница?
Читать статью

13 октября 2022
Зачем нужна функциональная диагностика?
Для постановки полного диагноза бывает недостаточно знаний врача и его умений прощупать или выслушать фонендоскопом пациента. Нужны дополнительные исследования.
Читать статью

18 августа 2022
Главные факты о раздельном питании: за и против
Текст представлен не полностью. Всю статью вы можете прочитать на РБК Стиль. Раздельное питание подразумевает, что пища должна быть простой, а для лучшего пищеварения продукты нужно правильно комбинировать между собой. Разбираемся, так ли это и что думают врачи о раздельном питании.
Читать статью
23 июля 2022
Как понять результаты липидного профиля
Текст предоставлен не полностью. Всю статью вы можете прочитать на РБК Стиль. Чтобы понять, почему из-за повышенного холестерина, который никак человека не беспокоит и «не виден на тарелке», вдруг придётся пересмотреть свои привычки, нужно разобраться, что же этот профиль обозначает.
Читать статью

18 июля 2022
Сахарный диабет и хронические заболевания печени (Часть 2)
Текст предоставлен не полностью. Всю статью вы можете прочитать на КиберЛенинка. Особенности лечения сахарного диабета и других заболеваний печени.
Читать статью
Другие статьи этого автора
18 июля 2022
Сердечный приступ или нет? Как инфаркт маскируется под паническую атаку и другие недомогания
Простой и понятный чек-лист от экспертов о том, как распознать различные недомогания, связанные с работой сердца.
Читать
статью
18 июля 2022
По следу пандемии
Разбираемся в том, есть ли связь между инфекцией COVID-19 и синдромом Гийена-Барре вместе с Натальей Поленовой, семейным врачом GMS Clinic.
Читать
статью

18 июля 2022
Что делать, если человеку плохо: тактика, которая спасет жизнь
Прохожему стало плохо. Или он упал и сильно ударился. Или задыхается. Мало кто знает, как действовать в подобной ситуации. Для того чтобы супергеройствовать было проще, мы поговорили с большим количеством экспертов и составили гид по первой помощи людям в любой непонятной ситуации.
Читать
статью

18 июля 2022
Для чего организму нужен калий и в каких продуктах он содержится
Калий — микроэлемент, который помогает нормальной работе нервной системы, поддерживает здоровье сердца и тонус мышц.
Читать
статью

18 июля 2022
Зачем проверяют сердечно-сосудистые маркеры
Текст предоставлен не полностью. Всю статью вы можете прочитать на ФОРМА — блог СБЕР ЕАПТЕКИ. Это специфические биохимические показатели крови. Анализы назначаются кардиологами и часто в срочном порядке из-за неотложного состояния пациента, например при инфаркте сердечной мышцы. Рассказываем, что они показывают, какие бывают и на что обращать внимание.
Читать
статью

18 июля 2022
Чем опасно высокое давление
Текст предоставлен не полностью. Всю статью вы можете прочитать на ФОРМА — блог СБЕР ЕАПТЕКИ. Болезни сердечно-сосудистой системы на первом месте в причинах смертности, а высокое давление — главный локомотив разрушения сердца и сосудов. Среди взрослого населения им страдает 30-45%, а старше 60 лет — 60% и больше.
Читать
статью
Эзиклен — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-004957
Торговое наименование:
Эзиклен®
Международное непатентованное или группировочное наименование:
калия сульфат + магния сульфат + натрия сульфат
Лекарственная форма:
концентрат для приготовления раствора для приема внутрь
Состав:
Состав (г/один флакон):
| Действующие вещества: | |
| Натрия сульфат безводный | 17,510 |
| Магния сульфата гептагидрат | 3,276 |
| Калия сульфат | 3,130 |
| Вспомогательные вещества: | |
| Натрия бензоат | 0,098 |
| Лимонная кислота безводная | 0,315 |
| Яблочная кислота | 0,315 |
| Сукралоза | 0,3025 |
| Ароматизатор плодово-ягодный коктейль1 | 0,7875 |
| Вода очищенная | 169,641 |
Состав (г/два флакона):
| Действующие вещества: | |
| Натрия сульфат безводный | 35,020 |
| Магния сульфата гептагидрат | 6,552 |
| Калия сульфат | 6,260 |
| Вспомогательные вещества: | |
| Натрия бензоат | 0,196 |
| Лимонная кислота безводная | 0,630 |
| Яблочная кислота | 0,630 |
| Сукралоза | 0,605 |
| Ароматизатор плодово-ягодный коктейль1 | 1,575 |
| Вода | 339,282 |
1 Ароматизатор плодово-ягодный коктейль состоит из смеси натуральных и синтетических ароматизаторов, пропиленгликоля (Е1520), этилового спирта, уксусной кислоты и бензойной кислоты (Е210).
Описание:
Прозрачная или слегка опалесцирующая жидкость с фруктовым запахом.
Фармакотерапевтическая группа
Осмотическое слабительное средство
Код ATX:
A06AD10.
Фармакологические свойства
Фармакодинамика:
Эзиклен® является осмотическим слабительным средством. Механизм действия препарата в первую очередь обусловлен ограниченным по насыщаемости процессом активного транспорта сульфатов. При достижении порога насыщения всасывания сульфаты остаются в просвете кишечника.
Осмотический эффект неабсорбированных сульфатов и прием внутрь значительного объема воды вызывает задержку воды в кишечнике, что обеспечивает слабительное действие, вызывая обильную водянистую диарею, и приводит к очищению кишечника.
Фармакокинетика:
Абсорбция сульфата представляет собой ограниченный по насыщаемости процесс активного транспорта; абсорбированные сульфаты выводятся преимущественно почками. В клинических исследованиях после приема препарата, сходного по содержанию сульфатов с препаратом Эзиклен®, у шести здоровых добровольцев (в режиме дробного применения, т.е. прием двух доз с перерывом в 12 ч) максимальная концентрация (Сmax) сульфатов в сыворотке наблюдалась приблизительно через 16 ч после приема первой дозы и через 5 ч после приема второй дозы и составила 499,50 мкМоль/л, по сравнению с исходным значением 141-467 мкМоль/л, в среднем — 335 мкМоль/л. Затем сывороточная концентрация сульфатов снижалась с периодом полувыведения 8,5 ч.
Основным путем выведения сульфатов является выведение кишечником (около 70% от принятого количества).
Системная экспозиция сульфатов: AUC (площадь под фармакокинетической кривой «концентрация-время») и Сmax после приема препарата Эзиклен® было изучено в ходе сравнительного исследования у здоровых добровольцев, у 6 пациентов с нарушением функции почек средней степени тяжести (клиренс креатинина от 30 до 49 мл/мин) и у 6 пациентов с нарушением функции печени легкой или средней степени тяжести (по шкале Чайлд-Пью: А (N=5) и В (N=1), соответственно). Нарушение функции почек приводило к снижению количества сульфатов, выводимых почками. Средние значения AUC и Сmax сульфатов были приблизительно на 50% выше у пациентов с нарушением функции почек по сравнению со здоровыми добровольцами. Системное воздействие препарата на концентрацию сульфатов не зависело от нарушения функции печени. Во всех трех исследуемых группах концентрация сульфатов в сыворотке вернулась к исходному значению на 6-й день после приема препарата Эзиклен®. В данном исследовании прием препарата Эзиклен® не привел к клинически значимому повышению концентрации сульфатов в крови у пациентов с нарушением функции печени или почек.
Показания к применению
Препарат Эзиклен® предназначен для очищения толстой кишки у взрослых пациентов при подготовке к эндоскопическому и радиологическому исследованию толстой кишки или к хирургическим вмешательствам, требующим отсутствия содержимого в толстой кишке.
Противопоказания
- Гиперчувствительность к действующим веществам или к любому из компонентов препарата
- Желудочно-кишечная обструкция или подозрение на желудочно-кишечную обструкцию
- Перфорация кишечника
- Нарушения опорожнения желудка (в том числе, гастропарез)
- Кишечная непроходимость
- Токсический колит или токсический мегаколон
- Профузная рвота
- Дегидратация тяжелой степени
- Застойная сердечная недостаточность
- Асцит
- Тяжелая почечная недостаточность (скорость клубочковой фильтрации <30 мл/мин/1,73м²)
- Активная фаза воспалительных заболеваний кишечника (таких, как болезнь Крона, язвенный колит)
- Беременность и период грудного вскармливания
- Детский возраст до 18 лет
С осторожностью
Пожилой возраст; нарушение функции почек легкой или средней степени тяжести; нарушение функции печени; одновременное применение препаратов, влияющих на концентрацию электролитов: блокаторы кальциевых каналов, диуретики, препараты лития или другие препараты подобного действия; одновременное применение препаратов, удлиняющих интервал QT; снижение моторики ЖКТ (в т. ч. в анамнезе), наличие хирургических вмешательств на ЖКТ, которые привели к нарушению моторики; у пациентов с нарушенным рвотным рефлексом, со склонностью к регургитации и аспирации; у истощенных, ослабленных пациентов; у пациентов с клинически значимыми нарушениями функции сердца; у пациентов, имеющих высокий риск развития водно-электролитных нарушений (включая гипонатриемию и гипокалиемию).
Применение при беременности и в период грудного вскармливания
Беременность
Исследования репродуктивной функции у животных с применением сульфатов натрия, магния и калия не проводились.
Данные по применению данного препарата у беременных женщин отсутствуют.
Препарат Эзиклен® не рекомендуется принимать во время беременности.
Грудное вскармливание
Неизвестно, происходит ли проникновение препарата Эзиклен® с грудным молоком.
Нельзя исключать риск для новорожденного/младенца.
Следует прекратить грудное вскармливание на период приема препарата Эзиклен® и вплоть до 48 часов после приема второй дозы.
Фертильность
Данные о влиянии на фертильность отсутствуют.
Способ применения и дозы
Внутрь.
Взрослые
Для надлежащего очищения кишечника требуется прием двух флаконов препарата Эзиклен®.
Перед приемом содержимое каждого флакона необходимо развести водой. Пациент должен выпить полученный разведенный раствор и еще две чашки, наполненные до метки водой или разрешенной прозрачной жидкостью (т.е. приблизительно 1 л), в течение следующих двух часов, как описано ниже в разделах Режим применения и Схема разведения и применения.
Разрешенными прозрачными жидкостями являются: вода, чай или кофе (без молока или немолочных сливок), газированные (обогащенные углекислым газом) или негазированные легкие напитки, осветленные фруктовые соки (без мякоти, не красные и не фиолетовые), бульоны или процеженные от твердых ингредиентов супы.
В общей сложности, для очистки кишечника перед проведением процедуры необходимо выпить не менее 3 л жидкости.
Раствор после разведения должен быть использован незамедлительно.
Режим применения
Препарат принимают либо в режиме дробного применения (первый флакон принимается вечером накануне процедуры, а второй — на следующее утро), либо в режиме единовременного применения (прием накануне процедуры). Подходящий режим приема препарата Эзиклен® может быть определен врачом.
Если позволяет время назначенной процедуры, то режим дробного применения предпочтительнее, чем режим единовременного приема накануне процедуры. Режим единовременного применения накануне процедуры потенциально подходит в качестве альтернативного режима.
- Режим дробного применения
День перед процедурой:
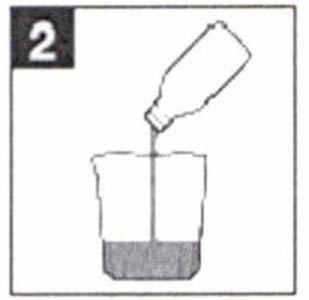
Вечером накануне процедуры (например, в 18.00) необходимо следовать следующим инструкциям:- Содержимое одного флакона препарата Эзиклен® следует вылить в прилагаемый мерный стакан и развести водой до метки (т.е. до объема 0,5 л).
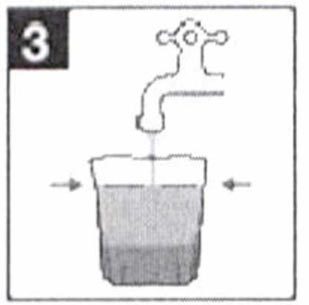
- В течение последующих двух часов пациент должен выпить полученный раствор и дополнительно два мерных стакана воды или прозрачной жидкости (т.е. около 1 л).
День процедуры:
Утром в день процедуры (через 10-12 ч после вечернего приема препарата) необходимо повторить действия, согласно инструкциям для вечера накануне:- Содержимое второго флакона препарата Эзиклен® следует вылить в прилагаемый мерный стакан и развести водой до метки (т.е. до объема 0,5 л).
- В течение последующих двух часов пациент должен выпить полученный раствор и дополнительно два мерных стакана воды или прозрачной жидкости (т.е. около 1 л).
Прием полного объема разведенного раствора препарата Эзиклен® и дополнительного количества воды или прозрачной жидкости должен быть закончен как минимум за 2 часа и не позднее 4 часов до начала процедуры.
- Режим единовременного применения
(режим применения для использования в зависимости от индивидуальных потребностей пациента)
День перед процедурой:
Вечером накануне процедуры (например, в 18:00):- Содержимое одного флакона препарата Эзиклен® следует вылить в прилагаемый мерный стакан и развести водой до метки (т.е. до объема 0,5 л).
- В течение последующих двух часов пациент должен выпить полученный раствор и дополнительно два мерных стакана воды или прозрачной жидкости (т.е. около 1 л).
Приблизительно через 2 ч после начала приема первой дозы:
- Содержимое второго флакона препарата Эзиклен® следует вылить в прилагаемый мерный стакан и развести водой до метки (т.е. до объема 0,5 л).
- В течение последующих двух часов пациент должен выпить полученный раствор и дополнительно два мерных стакана воды или прозрачной жидкости (т.е. около 1 л).
Прием полного объема разведенного раствора препарата Эзиклен® и дополнительного количества воды или прозрачной жидкости должен быть закончен как минимум за 2 часа и не позднее 4 часов до начала процедуры.
Схема разведения и приема препарата
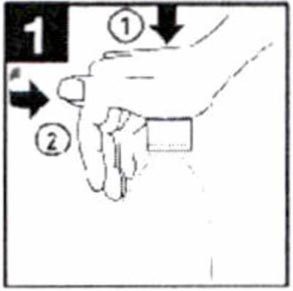
- Откройте флакон, нажав на крышку и поворачивая ее против часовой стрелки.
- Вылейте содержимое одного флакона в прилагаемый мерный стакан.
- Разведите препарат водой до метки (т.е. до объема 0,5 л).
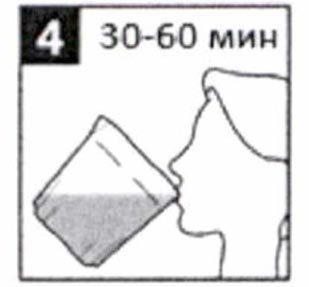
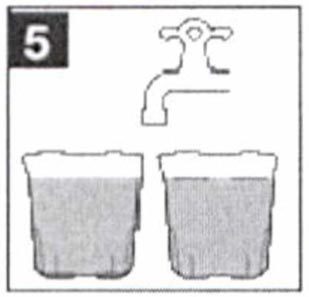
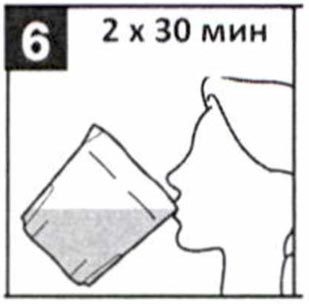
- Медленно выпейте всю жидкость из стакана, в течение 30-60 мин.
- ВАЖНО: Выпейте еще два (2) мерных стакана воды или прозрачной жидкости.
Каждый раз наполняйте стакан до метки. - Медленно выпейте жидкость из каждого стакана в течение 30 мин (2 х 30 мин).
Выполнение этапов с 1 по 6 занимает около 2 часов.
Следует повторить все этапы со вторым флаконом препарата Эзиклен®.
После процедуры
Для того чтобы восполнить потерянную в процессе подготовки к процедуре жидкость, пациенты должны выпить достаточное ее количество, чтобы поддержать соответствующий уровень гидратации.
Ограничения в питании
В день накануне процедуры допускается легкий завтрак. Далее пациент может употреблять только прозрачные жидкости в качестве приема пищи вплоть до процедуры. Следует избегать приема жидкостей красного и фиолетового цвета, молока и алкогольных напитков.
Особые группы пациентов
Пожилые пациенты
В ходе клинических исследований препарата не было выявлено разницы в эффективности и безопасности препарата Эзиклен® у пожилых пациентов и пациентов других возрастных групп. Для пожилых пациентов не требуется коррекция дозы, однако, следует соблюдать осторожность при применении препарата у таких пациентов, как и в любой другой популяции высокого риска.
Пациенты с нарушением функции почек
Существуют ограниченные данные по этой группе пациентов. Не требуется коррекции дозы для пациентов с нарушением функции почек легкой или средней степени тяжести, однако, следует соблюдать осторожность при применении препарата у таких пациентов, как и в любой другой популяции высокого риска. Препарат Эзиклен® противопоказан пациентам с нарушением функции почек тяжелой степени тяжести.
Пациенты с нарушением функции печени
Существуют ограниченные данные по этой группе пациентов. Не требуется коррекция дозы для пациентов с нарушением функции печени, однако, следует соблюдать осторожность при применении препарата у таких пациентов, как и в любой другой популяции высокого риска.
Детская популяция
Безопасность и эффективность препарата Эзиклен® у детей (т.е. у пациентов младше 18 лет) пока не установлена. Данные отсутствуют.
Побочное действие
Диарея, возникающая после приема препарата Эзиклен®, является ожидаемым эффектом при очищении кишечника в ходе подготовки перед процедурами и возникает у большинства пациентов. Наиболее частыми сообщаемыми побочными реакциями в клинических исследованиях и пострегистрационном наблюдении были: дискомфорт, вздутие живота, боль в животе, тошнота и рвота.
Во время клинических исследований сообщения о рвоте поступали с большей частотой при использовании режима единовременного применения, чем при использовании режима дробного применения.
Частота побочных реакций при применении препарата Эзиклен® классифицирована следующим образом:
Очень часто (≥1/10); часто (от ≥1/100 до <1/10); нечасто (от ≥1/1 000 до <1/100), редко (от ≥1/10 000 до <1/1 000), очень редко (<1/10 000), неизвестно (невозможно оценить на основании имеющихся данных).
| Системно-органный класс | Частота | Побочное действие |
| Нарушения со стороны иммунной системы | Неизвестно (пострегистрационные данные) | Гиперчувствительность (включая крапивницу, зуд, сыпь, эритему, диспноэ, чувство сдавления в горле) |
| Нарушения со стороны нервной системы | Нечасто | Головная боль, головокружение |
| Нарушения со стороны желудочно-кишечного тракта (ЖКТ) | Очень часто | Вздутие живота, боль в животе, тошнота, рвота |
| Нечасто | Дискомфорт в аноректальной области, сухость во рту | |
| Нарушения со стороны почек и мочевыводящих путей | Нечасто | Дизурия |
| Общие расстройства и нарушения в месте введения | Очень часто | Дискомфорт |
| Нечасто | Лихорадка | |
| Лабораторные и инструментальные данные | Нечасто | Повышение активности аспартатаминотрансферазы, креатинфосфокиназы, лактатдегидрогеназы в крови; повышение концентрации фосфора в крови; гипербилирубинемия; отклонения в результатах биохимического анализа крови, включая гипонатриемию, гипокалиемию, гипокальциемию и гиперурикемию |
Дополнительная информация для особых групп пациентов
Во время клинических исследований было обнаружено временное повышение концентрации мочевой кислоты. Для пациентов у которых в анамнезе имеются клинические проявления подагры или гиперурикемии см. информацию в разделе «Особые указания».
В ходе клинических исследований не было обнаружено разницы в безопасности приема препарата Эзиклен® у пожилых пациентов и пациентов других возрастных групп. Следует соблюдать осторожность при применении препарата у таких пациентов, как и в любой другой популяции высокого риска (см. раздел «Особые указания»).
Передозировка
В случае передозировки или неправильного применения (например, применение неразведенного препарата и/или прием недостаточного объема воды) возможно возникновение тошноты, рвоты, диареи и электролитных нарушений. Обычно в этом случае применяется симптоматическая терапия, в том числе прием жидкости внутрь. В редких случаях передозировки, сопровождающихся тяжелыми метаболическими нарушениями, рекомендуется проведение внутривенной регидратация.
Взаимодействие с другими лекарственными средствами
Как и для любых других препаратов для очищения кишечника:
- С осторожностью применять у пациентов, получающих терапию препаратами, влияющими на концентрацию электролитов: блокаторы «медленных» кальциевых каналов, диуретики, препараты лития или другие препараты подобного действия.
- Следует соблюдать осторожность при приеме препаратов, удлиняющих интервал QT.
- Диарея является ожидаемым эффектом, и прием внутрь других лекарственных препаратов в течение 1-3 ч после начала приема препарата Эзиклен® и до окончания процесса очищения кишечника может привести к вымыванию их из ЖКТ и нарушению абсорбции. Может быть изменен терапевтический эффект препаратов, применяемых регулярно внутрь, имеющих узкий терапевтический диапазоном или короткий период полувыведения (например, пероральные контрацептивы, противоэпилептические препараты, гипогликемические препараты, антибиотики, левотироксин натрия, дигоксин и т. д.).
Особые указания
Препарат Эзиклен® не применяется для лечения запоров.
Электролитные расстройства и дегидратация:
- Учитывая потенциальный риск развития серьезных электролитных нарушений, необходимо тщательно оценить соотношение польза/риск прежде, чем применять препарат Эзиклен® в группах высокого риска. Перед применением препарата Эзиклен® должны быть исключены противопоказания для его назначения. Особое внимание необходимо уделить применению специальных мер предосторожности, включая необходимость поддержания соответствующей гидратации.
- Все пациенты должны быть предупреждены о необходимости поддержания адекватного уровня гидратации до, во время и после приема препарата Эзиклен®. Если у пациента развивается обильная рвота или признаки дегидратации после приема препарата, должны быть приняты меры по регидратации во избежание потенциального риска серьезных осложнений, связанных с нарушением водно-электролитного баланса (такими как, судороги и аритмия сердца). Кроме того, рекомендуется проведение предварительных лабораторных анализов (определение концентрации электролитов, креатинина и азота мочевины крови). Пациентам необходимо рекомендовать пить как можно больше воды или прозрачных жидкостей для поддержания соответствующего уровня гидратации.
Пациенты группы высокого риска:
- У истощенных, ослабленных пациентов, пожилых пациентов, пациентов с клинически значимыми нарушениями функции почек, печени или сердца, а также у пациентов, имеющих высокий риск развития электролитных нарушений, необходимо провести биохимические анализы с определением сывороточной концентрации электролитов и оценить функцию почек перед началом и после применения препарата.
- Пациентам с дегидратацией или нарушениями водно-электролитного баланса необходимо провести соответствующую терапию для их устранения до приема препарата для очищения кишечника. Кроме того, следует соблюдать осторожность при использовании препарата у пациентов с патологическими состояниями или у пациентов, принимающих препараты, которые увеличивают риск появления нарушений водно-электролитного баланса (включая гипонатриемию и гипокалиемию) или повышают риск потенциальных осложнений. Необходимо наблюдение за такими пациентами.
- Существует теоретический риск удлинения интервала QT, которое может произойти в результате электролитных нарушений.
Необходимо соблюдать осторожность при использовании препарата у следующих групп пациентов:
- Препарат должен применяться с осторожностью и только под наблюдением медицинского персонала у пациентов с нарушенным рвотным рефлексом и у пациентов со склонностью к регургитации и аспирации.
- Снижение моторики ЖКТ, в том числе наличие в анамнезе хирургических вмешательств на желудочно-кишечном тракте, которые привели к снижению моторики.
Гиперурикемия:
- Прием препарата Эзиклен® может вызвать временное легкое или умеренное повышение концентрации мочевой кислоты. Возможность повышения концентрации мочевой кислоты должна учитываться до назначения препарата пациентам с проявлениями подагры или гиперурикемией.
Дополнительная информация:
- Перед приемом препарат необходимо развести водой. Прием неразбавленного раствора может увеличить риск тошноты, рвоты, дегидрации и электролитных нарушений. Каждый флакон препарата необходимо разводить водой, а также употреблять рекомендуемое дополнительное количество воды для обеспечения хорошей переносимости препарата у пациента.
- Лекарственный препарат содержит 247,1 ммоль (или 5,684 г) натрия на флакон. Это необходимо принимать во внимание у пациентов, которые находятся на диете с контролем потребления натрия.
- Лекарственный препарат содержит 35,9 ммоль (или 1,405 г) калия на флакон. Это необходимо принимать во внимание у пациентов со сниженной функцией почек или у пациентов, которые находятся на диете с контролем потребления калия.
Влияние на способность управлять транспортными средствами, механизмами
Прием препарата Эзиклен® не оказывает влияния на способность управлять автомобилем и работать с механизмами.
Форма выпуска
Концентрат для приготовления раствора для приема внутрь.
176 мл концентрата в прозрачном флаконе из полиэтилентерефталата темно-коричневого цвета вместимостью 180 мл с запечатанной завинчивающейся крышкой из полиэтилена высокой плотности, защищенной от случайного открывания детьми.
Два флакона с концентратом и один полипропиленовый мерный стакан для разведения и приема помещены вместе с инструкцией по медицинскому применению в пачку картонную.
Условия хранения
Хранить в недоступном для детей месте. При температуре не выше 30 °С.
Срок годности
3 года.
После вскрытия флакона и/или разведения водой раствор должен быть использован незамедлительно.
Не применять по истечении срока годности.
Условия отпуска
Отпускают по рецепту.
Производитель
Бофур Ипсен Индастри
Рю Эт Виртон — 28100 Дрё, Франция
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей.
Владелец регистрационного удостоверения: Ипсен Фарма, Франция.
В случае необходимости, претензии потребителей направлять по адресу представительства в РФ:109147, Москва, ул. Таганская, 17-23
Купить Эзиклен в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Одна таблетка содержит: действующего вещества – албендазола – 400 мг; вспомогательные вещества – целлюлоза микрокристаллическая, крахмал кукурузный, кроскармеллоза натрия, кросповидон, повидон К 30, натрия лаурилсульфат, магния стеарат, Опадрай II (в т.ч. макрогол 4000, лактозы моногидрат, гипромеллоза, титана диоксид Е 171).
Таблетки покрытые пленочной оболочкой белого цвета, с двояковыпуклой поверхностью, круглые.
Антигельминтное средство.
Код АТХ: Р02СA03.
Фармакодинамика
Албендазол является производным бензимидазола с противогельинтной и антипротозойной активностью в отношении кишечных и тканевых паразитов. Албендазол оказывает ларвицидное, овоцидное и противогельминтное действие, предположительно, за счет ингибирования полимеризации тубулина. Это вызывает нарушение метаболизма гельминтов, в том числе, энергетическое истощение (подавление поглощения глюкозы), что приводит к обездвиживанию, а затем уничтожению восприимчивых гельминтов.
Фармакокинетика
После приема внутрь албендазол плохо абсорбируется из желудочно-кишечного тракта (ЖКТ) – менее 5 %, в неизмененном виде не определяется в плазме, биодоступность – низкая. Системное фармакологическое действие усиливается при приеме лекарственного средства с жирной пищей, при этом повышается абсорбция и увеличивается Сmax в плазме крови в 5 раз. Время достижения Сmax албендазола сульфоксида составляет 2‒5 ч. Связывание с белками плазмы – 70 %. Албендазол обнаруживается в желчи, печени, стенке кисты и кистозной жидкости, цереброспинальной жидкости.
Албендазол быстро претерпевает эффект первого прохождения печени, и, как правило, не обнаруживается в крови. Основным метаболитом, обладающим антигельминтной активностью и обеспечивающим эффективность при системных тканевых инфекциях, является албендазола сульфоксид.
После приема лекарственного средства в разовой дозе 400 мг фармакологически активный метаболит, албендазола сульфоксид, достигает плазменных концентраций от 1,6 до 6,0 мкмоль/л. T1/2 албендазола сульфоксида составляет 8,5 ч. Выводится с желчью через кишечник в виде албендазола сульфоксида и лишь незначительная часть его количества выводится с мочой. Выведение из кист наблюдалось в течение нескольких недель после длительного приема высоких доз. При внепеченочном холестазе печеночный клиренс значительно снижается, что приводит к увеличению AUC и повышению содержания в плазме албендазола сульфоксида.
Особые категории пациентов
Дети: фармакокинетика албендазола сульфоксида при приеме одно-кратных доз 200–300 мг (приблизительно 10 мг/кг) албендазола сопоставима с фармакокинетикой, наблюдавшейся у взрослых после приема пищи. Клинический опыт применения у детей младше 6 лет ограничен.
Пациенты пожилого возраста: фармакокинетика албендазола сульфоксида сопоставима с фармакокинетикой у здоровых молодых пациентов.
Пациенты с нарушением функции почек: фармакокинетика албендазола при применении у пациентов с нарушением функции почек не была исследована.
Пациенты с нарушением функции печени: фармакокинетика албендазола при применении у пациентов с нарушением функции печени не была исследована.
Кишечные инфекции и ларвальный (личиночный) гельминтоз (в том числе, смешанные глистные инвазии)
– Нематодозы: аскаридоз, энтеробиоз, трихоцефалез, анкилостомоз, некатороз, стронгилоидоз.
– Трематодозы: описторхоз и клонорхоз.
– Лямблиоз у детей 2–12 лет.
– Цестодозы: тениоз (Taenia solium, Taenia saginata), гименолепидоз.
Системные гельминтозы
– Эхинококкоз. Албендазол демонстрирует наибольшую эффективность при лечении кист печени, легких и брюшины. Опыт применения при кистах костей, сердца и центральной нервной системы ограничен.
– Кистозный эхинококкоз (вызванный Echinococcus granulosus). Албендазол применяется для лечения пациентов с кистозным эхинококкозом:
1. если хирургическое вмешательство неприемлемо.
2. перед хирургическим вмешательством.
3. после хирургического вмешательства в случае, если предоперационное лечение было слишком кратковременным, или произошла утечка содержимого кисты, или во время хирургического вмешательства был выявлен жизнеспособный материал.
4. после чрескожного дренирования кист в диагностических или терапевтических целях.
– Альвеолярный эхинококкоз (вызванный Echinococcus multilocularis). Албендазол применяется для лечения пациентов:
1. при неоперабельном заболевании, особенно в случаях локальных или отдаленных метастазов.
2. после паллиативного хирургического вмешательства.
3. после радикального хирургического вмешательства или трансплантации печени.
– Нейроцистицеркоз. Албендазол применяется для лечения пациентов со следующими состояниями:
1. одиночные или множественные кисты или гранулематозные поражения паренхимы головного мозга.
2. арахноидальные или внутрижелудочковые кисты.
3. гроздевидные кисты.
Лекарственное средство принимают внутрь во время приема пищи. Предпочтителен прием в одно и то же время суток. Если через 3 недели не наступает выздоровление, то следует назначить второй курс лечения.
Для пациентов, которые не в состоянии проглотить таблетку целиком, рекомендуется ее размельчить и запить небольшим количеством воды.
|
Инфекция |
Возраст |
Продолжительность приема |
|
Энтеробиоз, анкилостомидоз,
некатороз, |
Взрослые и дети старше 2 лет (›10 кг) |
400 мг 1 раз в сутки однократно |
|
Дети от 1 до 2 лет (›10 кг) |
200 мг 1 раз в сутки однократно |
|
|
Стронгилоидоз, тениоз, гименолепидоз |
Взрослые и дети старше 2 лет (›10 кг) |
400 мг 1 раз в сутки в течение 3 дней. |
|
Клонорхоз, описторхоз |
Взрослые и дети старше 2 лет (›10 кг) |
400 мг 2 раза в сутки в течение 3 дней |
|
Кожный синдром Larva Migrans |
Взрослые и дети старше 2 лет (›10 кг) |
400 мг 1 раз в сутки. Продолжительность приема от 1 дня до 3 дней |
|
Лямблиоз |
Только дети от 2 (›10 кг) до 12 лет |
400 мг 1 раз в сутки в течение 5 дней |
Особые категории пациентов
Дети. У детей младше 4 лет, или испытывающих трудности с глотанием рекомендуется применять лекарственное средство в форме суспензии.
Пациенты пожилого возраста. Опыт применения у пациентов в возрасте 65 лет или старше ограничен. Согласно данным отчетов, коррекция дозы не требуется, однако албендазол следует с осторожностью применять у пациентов с признаками нарушения функции печени (см. раздел «Пациенты с нарушением функции печени»).
Пациенты с нарушением функции почек. Поскольку выведение почками албендазола и его основного метаболита албендазола сульфоксида незначительно, вероятность изменения клиренса этих соединений у таких пациентов является низкой. Пациентам с нарушением функции почек коррекция дозы не требуется, однако за такими пациентами следует проводить тщательное наблюдение.
Пациенты с нарушением функции печени. Поскольку албендазол быстро метаболизируется в печени с образованием основного фармакологически активного метаболита албендазола сульфоксида, при нарушении функции печени можно ожидать существенного влияния на фармакокинетику албендазола сульфоксида. За пациентами с отклонением функциональных проб печени (трансаминаз) следует проводить тщательное наблюдение перед началом терапии албендазолом.
Системные гельминтные инфекции (продолжительное лечение более высокими дозами).
Имеется ограниченный опыт использования албендазола у детей в возрасте до шести лет, поэтому не рекомендуется применять албендазол в данном возрастном периоде. Рекомендуемая доза для детей старше 6 лет – 12 мг/кг/сут в разделенных дозах.
Для пациентов с массой тела более 60 кг доза лекарственного средства составляет 400 мг 2 раза в сутки. Для пациентов с массой тела менее 60 кг лекарственное средство назначают из расчета 15 мг/кг/сут в 2 приема. Максимальная суточная доза составляет 800 мг. Рекомендуется проводить одновременное лечение всех членов семьи.
|
Инфекция |
Продолжительность приема |
|
Кистозный эхинококкоз |
28 дней. При неоперабельной форме рекомендуется три 28-дневных цикла лечения, разделенных 14-дневным перерывом в приеме лекарственного средства. Перед операцией рекомендовано два 28-дневных цикла, разделенных 14-дневным перерывом в приеме лекарственного средства. Если предоперационный курс меньше 14 дней или найдены жизнеспособные кисты, то после операции проводят два цикла по 28 дней, разделенных 14-дневным перерывом в приеме лекарственного средства. |
|
Альвеолярный эхинококкоз |
28 дней. Второй 28-дневный курс повторяют после двухнедельного перерыва в приеме лекарственного средства. Лечение может быть продолжено в течение нескольких месяцев или лет. |
|
Нейроцистицеркоз |
Продолжительность приема 7–31 день. Второй курс можно повторить после двухнедельного перерыва в приеме лекарственного средства. |
Особые категории пациентов
Особенности дозирования у пожилых пациентов и пациентов с нарушением функции почек – см. кишечные инфекции и кожный синдром Larva migrans.
Побочное действие
Нежелательные реакции, представленные ниже, перечислены в соответствии с поражением органов и систем органов и частотой встречаемости. Частота встречаемости определяется следующим образом: очень часто (≥ 1/10), часто (≥ 1/100 и ˂ 1/10), нечасто (≥ 1/1000 и ˂ 1/100), редко (≥ 1/10000 и ˂ 1/1000), очень редко (˂ 1/10000, включая отдельные случаи). Категории частоты были сформированы на основании пострегистра-ционного наблюдения.
Частота встречаемости нежелательных реакций
Применение при кишечных инфекциях и ларвальном (личиночном) гельминтозе (кожная форма) (меньшая длительность с применением меньшей дозы)
Нарушения со стороны иммунной системы: редко: реакции повышенной чувствительности, включая сыпь, зуд и крапивницу.
Нарушения со стороны нервной системы: нечасто: головная боль и головокружение.
Нарушения со стороны желудочно-кишечного тракта: нечасто: симптомы со стороны верхних отделов желудочно-кишечного тракта (например, боль в эпигастрии или животе, тошнота, рвота) и диарея.
Нарушения со стороны печени и желчевыводящих путей: редко: повышение уровня ферментов печени.
Нарушения со стороны кожи и подкожных тканей: очень редко: многоформная эритема, синдром Стивенса-Джонсона.
Применение при системных гельминтозах (более длительное лечение с применением высоких доз)
Нарушение со стороны крови и лимфатической системы: нечасто: лейкопения; очень редко: панцитопения, апластическая анемия, агранулоцитоз.
У пациентов с заболеваниями печени, такими как, эхинококкоз печени, чаще наблюдается угнетение костного мозга (см. разделы «Способ применения и дозы», «Меры предосторожности»).
Нарушения со стороны иммунной системы: нечасто: реакции повышенной чувствительности, включая сыпь, зуд и крапивницу.
Нарушения со стороны нервной системы: очень часто: головная боль; часто: головокружение.
Нарушения со стороны желудочно-кишечного тракта: часто: желудочно-кишечные расстройства (боль в животе, тошнота, рвота).
При лечении пациентов с эхинококкозом наблюдались нарушения со стороны желудочно-кишечного тракта, связанные с албендазолом.
Нарушения со стороны печени и желчевыводящих путей: очень часто: небольшое или умеренное увеличение уровня ферментов печени, гепатит.
Нарушения со стороны кожи и подкожных тканей: часто: обратимая алопеция (истончение волос и умеренное выпадение волос); очень редко: многоформная эритема, синдром Стивенса-Джонсона.
Общие расстройства и нарушения в месте введения: часто: лихорадка.
— повышенная чувствительность к албендазолу или любому другому компоненту, входящему в состав лекарственного средства;
— албендазол не следует применять во время беременности или у женщин с предполагаемой беременностью.
Для женщин детородного возраста сначала необходимо исключить беременность (см. также «Применение в период беременности и кормления грудью»).
Сообщение о предполагаемых побочных реакциях
Медицинским работникам рекомендуется направлять информацию о любых подозреваемых нежелательных реакциях и неэффективности лекарственного средства по адресу: Республиканское унитарное предприятие «Центр экспертиз испытаний в здравоохранении», www.rceth.by.
Возможно слабое или умеренное повышение активности печеночных ферментов при продолжительном приеме лекарственного средства, которое нормализируется после прекращения приема. Определение показателей функции печени следует проводить перед началом каждого цикла лечения и каждые 2 нед в течение лечения. Если активность печеночных трансаминаз увеличивается в 2 раза и более, албендазол следует отменить. Лечение повторяют, когда показатели функции печени возвратятся к норме.
Албендазол может вызывать угнетение костного мозга, поэтому следует проводить анализы крови пациента как в начале лечения, так и каждые 2 нед в течение 28-дневного цикла лечения. Пациенты с заболеванием печени, включая печеночный эхинококкоз, более склонны к угнетению костного мозга, в результате чего возникает панцитопения, апластическая анемия, агранулоцитоз и лейкопения, что обусловливает необходимость тщательного контроля показателей крови. В случае возникновения значительного снижения показателей крови лечение следует прекратить.
Лечение албендазолом может обнаружить наличие уже существующего нейроцистицеркоза, особенно на территориях с высоким уровнем инфицирования штаммами Taenia solium. У пациентов могут возникать неврологические симптомы, например, судороги, повышение внутричерепного давления и фокальные симптомы вследствие воспалительной реакции, вы-званной гибелью паразитов в мозгу. Симптомы могут возникнуть сразу после лечения, поэтому следует немедленно начать соответствующую терапию кортикостероидами и противосудорожными лекарственными средствами.
Цистицеркоз может, в редких случаях, затрагивать сетчатку глаза. Если такие повреждения визуализируются, необходимость в проведении терапии цистицеркоза следует сопоставлять с возможностью повреждения сетчатки, вызванного албендазол-индуцированными изменениями в сетчатке.
Для предотвращения возникновения случаев повышения церебрального давления в течение первой недели лечения рекомендуется применять пероральные или внутривенные кортикостероиды.
Лечение лекарственным средством не требует применения клизм, слабительных средств или специальной диеты.
Албендазол содержит лактозу. Пациенты с редкими наследственными нарушениями, такими как, непереносимость галактозы, лактазная недостаточность Лаппа и нарушение всасывания глюкозы-галактозы, не должны принимать это лекарственное средство.
Лекарственное средство противопоказано во время беременности. Во избежание приема албендазола в течение ранней беременности, женщины детородного возраста должны проводить лечение после получения отрицательного теста на беременность; этот тест следует повторить, по крайней мере, один раз перед началом следующего цикла. Следует принимать меры контрацепции во время и в течение одного месяца после окончания лечения при системной инфекции. Неизвестно, секретируется ли у человека албендазол или его метаболиты в грудное молоко. Поэтому не следует использовать албендазол в период грудного вскармливания, за исключением случаев, когда предполагается, что потенциальная польза превышает возможные риски, связанные с лечением.
C осторожностью применяется у детей.
Учитывая возможность развития головокружений, необходимо при вождении транспортных средств и обслуживании механического оборудования в движении соблюдать осторожность.
Установлено, что албендазол индуцирует печеночные ферменты системы цитохрома Р450, ответственной за его метаболизм.
Лекарственные средства, которые могут уменьшить эффективность албендазола, и при использовании которых требуется мониторинг эффектов, поскольку может возникнуть необходимость применения других режимов дозирования или терапии:
– противосудорожные (например, фенитоин: фосфенитон, карбамазепин, фенобарбитал, примидон);
– левамизол;
– ритонавир.
Лекарственные средства, которые могут увеличивать уровни активных метаболитов албендазола, и при использовании которых необходимо проводить мониторинг за возможным увеличением побочных эффектов албендазола:
– циметидин;
– дексаметазон (непрерывное использование повышает уровни метаболитов албендазола на 50 %);
– празиквантел.
Грейпфрутовый сок также увеличивает уровень албендазола сульфоксида в плазме.
Другие возможные взаимодействия
В связи с возможным изменением активности цитохрома Р450 существует теоретический риск взаимодействия со следующими лекарственными средствами:
– пероральными противозачаточными средствами;
– антикоагулянтами;
– гипогликемическими средствами для приема внутрь;
– теофиллином.
Необходимо соблюдать осторожность при применении Албендазола пациентами, принимающими вышеуказанные лекарственные средства.
Симптомы передозировки не описаны.
Лечение: промывание желудка, симптоматическое лечение и общие поддерживающие меры.
По 2 или 10 таблеток в контурной ячейковой упаковке из пленки поливинилхлоридной и фольги алюминиевой.
1 контурную ячейковую упаковку по 10 таблеток вместе с листком-вкладышем помещают в пачку из картона (№10х1).
1, 2 или 3 контурные ячейковые упаковки по 2 таблетки вместе с листком-вкладышем помещают в пачку из картона (№2х1, №2х2, №2х3).
В защищенном от света и влаги месте, при температуре не выше 25 °С. Хранить в недоступном для детей месте.
2 года. Лекарственное средство не использовать после окончания срока годности.
Информация о производителе
Открытое акционерное общество «Борисовский завод медицинских препаратов», Республика Беларусь, Минская обл., г. Борисов, ул. Чапаева, 64, тел/факс. +375(177) 735612, 731156.
Илсира® (Ilsira) инструкция по применению
📜 Инструкция по применению Илсира®
💊 Состав препарата Илсира®
✅ Применение препарата Илсира®
📅 Условия хранения Илсира®
⏳ Срок годности Илсира®
Описание лекарственного препарата
Илсира®
(Ilsira)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2023 года.
Дата обновления: 2022.11.11
Владелец регистрационного удостоверения:
Контакты для обращений:
БИОКАД АО
(Россия)
Код ATX:
L04AC
(Ингибиторы интерлейкина)
Лекарственная форма
| Илсира® |
Р-р д/п/к введения 180 мг/1 мл: шприцы 0.9 мл 2 или 4 шт. в компл. с салфетками рег. №: ЛП-006244 |
Форма выпуска, упаковка и состав
препарата Илсира®
Раствор для п/к введения прозрачный, желто-коричневого цвета; возможно наличие легкой опалесценции.
* предварительно наполненный шприц.
Вспомогательные вещества: натрия ацетата тригидрат — 0.392 мг, глицин — 6.8 мг, маннитол — 20.7 мг, кислота уксусная ледяная — до pH 5.0, вода д/и — до 0.9 мл.
0.9 мл — шприцы трехкомпонентные из бесцветного стекла (1) — упаковки ячейковые контурные (2) в комплекте с салфетками спиртовыми (2 шт.) — пачки картонные.
0.9 мл — шприцы трехкомпонентные из бесцветного стекла (1) — упаковки ячейковые контурные (4) в комплекте с салфетками спиртовыми (4 шт.) — пачки картонные.
На каждый шприц наклеивают самоклеящуюся этикетку.
Фармакологическое действие
Левилимаб — рекомбинантное моноклональное антитело подкласса IgG1, высокогомологичное нативным человеческим антителам, связывающееся с α-субъединицей рецептора к интерлейкину-6 (ИЛ-6). Молекула левилимаба содержит вариабельные фрагменты легких и тяжелых цепей глубокой оптимизации и константные домены с полностью человеческой последовательностью. Левилимаб связывается и блокирует как растворимые (рИЛ6Р), так и мембранные рецепторы ИЛ-6 (мИЛ6Р). Блокада обеих форм рецептора позволяет предотвратить реализацию ИЛ-6-ассоциированного провоспалительного каскада, препятствует активации антиген-представляющих клеток, В- и Т-лимфоцитов, моноцитов и макрофагов, эндотелиальных клеток и фибробластов, и избыточной продукции других провоспалительных цитокинов. ИЛ-6 является ключевым элементом синдрома массивного высвобождения цитокинов (синдрома «цитокинового шторма», гемофагоцитарного лимфогистиоцитоза или синдрома активации макрофагов), который может привести к острому респираторному дистресс-синдрому, полиорганной недостаточности и являться причиной летального исхода. Массивное высвобождение цитокинов («цитокиновый шторм») наблюдается у пациентов, получающих иммуносупрессивную терапию, включая деплецирующие агенты (в частности моноклональные антитела к рецепторам Т- и В-лимфоцитов), а также при тяжелых инфекционных заболеваниях, в т.ч. у пациентов с COVID-19. Высокий уровень ИЛ-6 в крови ассоциирован с более тяжелым течением новой коронавирусной инфекции и выраженными изменениями легких, что обусловливает потребность в интенсивной терапии и увеличивает риск летального исхода при COVID-19. ИЛ-6 – единственный цитокин, непосредственно индуцирующий синтез острофазовых белков в гепатоцитах: С-реактивного белка (СРБ), фибриногена, сывороточного амилоидного белка А-SAA, гепсидина, лептина. Кроме того, ИЛ-6 участвует в активации и поддержании местных воспалительных реакций (образование паннуса в синовии, стимуляция остеокластогенеза — эрозии хрящевой ткани, остеопороз), что наблюдается в патогенезе ревматоидного артрита.
Специфическая противовоспалительная активность левилимаба продемонстрирована в тестах in vitro и in vivo. Левилимаб оказывает антипролиферативное действие на культуру клеток DS-1, вызывая дозозависимое ингибирование роста клеток. На модели коллаген-индуцированного артрита у яванских макак (Macaca fascicularis) многократное (1 раз в неделю в течение 7 недель) п/к введение левилимаба сопровождается снижением выраженности воспалительной реакции в суставах, что подтверждено при гистологическом исследовании (значимое снижение выраженности воспалительных и дегенеративных изменений хрящевой ткани).
Изменение параметров фармакодинамических маркеров (нарастание концентрации рИЛ6Р, насыщение мИЛ6Р, нарастание концентрации ИЛ-6) свидетельствует о высокоэффективной дозозависимой нейтрализации препаратом левилимаб обеих форм рецептора ИЛ-6, что в свою очередь сопровождается быстрым и выраженным снижением сывороточной концентрации СРБ, отражающим эффективное подавление воспалительного процесса. В клинических исследованиях левилимаба продемонстрировано блокирование до 90% мембранных рецепторов к ИЛ-6 в течение первых 2 часов от момента однократного п/к введения препарата в дозе 1.6 мг/кг и более.
Фармакокинетика
Всасывание и распределение
При однократном п/к введении левилимаба наблюдается дозозависимый рост его концентрации в сыворотке крови. После введения препарат начинает обнаруживаться в сыворотке крови пациентов через 2-12 ч, и его концентрация нарастает, достигая максимальных значений через 96 [72-168] ч. Дозы препарата, превышающие 2.0 мг/кг, продемонстрировали двухфазный характер увеличения концентрации: первый пик наблюдался в период 48-72 ч, второй – к 168 ч с последующим снижением до неопределяемых значений к 70 дню.
После однократного п/к введения препарата в дозе 162 мг Cmax левилимаба в сыворотке крови составляла 17543 [10975; 28323] нг/мл, а значения показателя AUC, рассчитанного в период 0-168 ч (AUC0-168) – 1866231 [1297632-3719014] нг/мл×ч.
При многократном введении левилимаба пациентам с ревматоидным артритом значения суммарной AUC, рассчитанной в период 0-2016 ч после введения (AUC0-2016), составили 189580779 [134794695; 230680771] нг/мл×ч при введении 1 раз в неделю и 50763951 [34465213.5; 65810194.5] нг/мл×ч при введении 1 раз в 2 недели. Показатель Сmax-mult при повторных введениях нарастал и достигал значений 201024 [151563-246408] нг/мл при еженедельном введении препарата и 51570 [37201-71740] нг/мл при введении 1 раз в 2 недели. При этом Tmax составляло 1848 [1512; 2016] ч при еженедельном введении препарата и 1848 [1512; 1848] ч при введении 1 раз в 2 недели соответственно. Стационарный Vd составил 7871.029 [4226.795; 13363.547] мл при введении препарата 1 раз в неделю и 7130.453 [5532.978; 11387.959] мл при введении 1 раз в 2 недели.
При повторных введениях отмечается накопление препарата, с ростом Cmax в 6.5-14.2 раза при еженедельном введении и в 1.9-4.2 раза при введении препарата 1 раз в 2 недели. Коэффициент кумуляции (AR) составил 10.932 [6.446; 14.178] для еженедельного введения препарата и 2.593 [1.902; 4.164] для введения 1 раз в 2 недели.
Таким образом, у пациентов с ревматоидным артритом многократное п/к введение левилимаба 1 раз в неделю обеспечивает более высокую сывороточную концентрацию и экспозицию по сравнению с введением 1 раз в 2 недели.
Выведение
Общий клиренс (Cl) левилимаба после однократного введения в дозе 2.2 мг/кг составил 35.288±11.7 мл/ч, а в дозе 2.9 мг/кг показатель Cl – 25.974±1.1 мл/ч. T1/2 однократной п/к дозы 2.9 мг/кг составил 133.683 [92.754; 197.197] ч. Значения показателей, характеризующих период элиминации, обладают дозозависимостью (показатели среднего времени пребывания препарата в организме (MRT) и T1/2 нарастают с увеличением введенной дозы, а Cl – снижается), что говорит о нелинейной фармакокинетике препарата, обусловленной мишень-опосредованными распределением и элиминацией.
Фармакокинетика у особых групп пациентов
Пациенты с почечной и печеночной недостаточностью: специальных исследований у данной категории пациентов не проводилось; фармакокинетические данные у больных с почечной и печеночной недостаточностью отсутствуют.
Пациенты в возрасте старше 65 лет: фармакокинетические данные у лиц в возрасте старше 65 лет отсутствуют.
Показания препарата
Илсира®
Новая коронавирусная инфекция (COVID-19)
- патогенетическая терапия синдрома высвобождения цитокинов при тяжелом течении новой коронавирусной инфекции (CОVID-19).
Ревматоидный артрит
- ревматоидный артрит умеренной или высокой степени активности у взрослых с отсутствием адекватного ответа на терапию одним или несколькими болезнь-модифицирующими противоревматическими препаратами, в т.ч. для торможения рентгенологической прогрессии. Левилимаб применяется в комбинированной терапии с метотрексатом и/или другими синтетическими базисными противовоспалительными препаратами.
Режим дозирования
Для п/к введения.
Препарат Илсира® предназначен для введения как в амбулаторно-поликлинических, так и в стационарных условиях.
Применение левилимаба должно осуществляться под контролем врача. В случае длительного применения препарата, в частности для терапии ревматоидного артрита, если врач считает это возможным, после соответствующего обучения технике п/к инъекций пациенты могут самостоятельно вводить себе препарат.
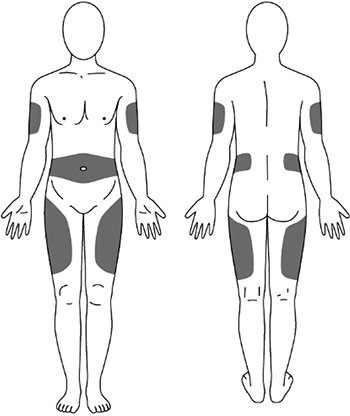
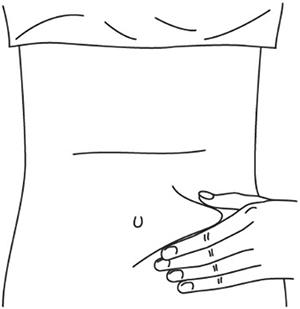
Препарат Илсира® вводят п/к с помощью преднаполненного шприца в область передней брюшной стенки (отступая не менее 5 см от пупка), передней и боковой поверхности бедра или средней трети наружной части плеча.
Не следует вводить препарат в места с поврежденной или измененной кожей (с наличием уплотнений, покраснений, новообразований, гиперпигментаций или повышенной чувствительности).
С целью патогенетической терапии синдрома высвобождения цитокинов при тяжелом течении новой коронавирусной инфекции (CОVID-19) рекомендуемая доза препарата Илсира® составляет 324 мг однократно в виде двух п/к инъекций по 162 мг каждая. В случае недостаточного эффекта первой дозы левилимаба возможно повторное введение препарата через 48–96 ч в дозе 324 мг в виде двух п/к инъекций по 162 мг каждая. Решение о необходимости повторного введения принимается исключительно врачом.
Для терапии ревматоидного артрита рекомендуемая доза препарата Илсира® составляет 162 мг 1 раз в неделю.
При достижении ремиссии заболевания возможно применение в режиме 162 мг п/к 1 раз в 2 недели. Пациентам, не достигшим ремиссии, рекомендовано продолжить применение препарата в дозе 162 мг п/к 1 раз в неделю. Пациентам, имеющим нарастание активности заболевания после снижения кратности введений, рекомендовано возобновить применение препарата в дозе 162 мг п/к 1 раз в неделю.
При развитии нежелательных явлений в ходе терапии ревматоидного артрита, связанных с изменением лабораторных показателей, следует провести коррекцию дозы и режима введения в соответствии с рекомендациями в таблицах 1, 2 и 3.
Таблица 1. Рекомендации по коррекции дозы при повышении активности печеночных ферментов АЛТ или АСТ
Таблица 2. Рекомендации по коррекции дозы при снижении абсолютного числа нейтрофилов (АЧН)
Таблица 3. Рекомендации по коррекции дозы при снижении количества тромбоцитов
Пропуск дозы при терапии ревматоидного артрита
При пропуске очередного введения по любой причине инъекция препарата Илсира® должна быть произведена как можно быстрее. Новый отсчет для даты следующего введения начинают с момента фактически проведенной инъекции препарата Илсира®.
Указания по применению
Подготовка к проведению п/к инъекции
- Тщательно вымойте руки.
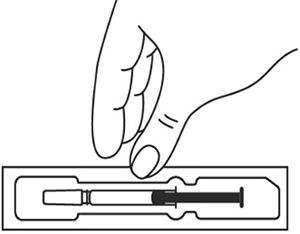
img_ilsira_0.tif|jpg
- Извлеките упаковку со шприцем из холодильника. Затем извлеките шприц с лекарственным препаратом из картонной пачки. Осмотрите шприц, а также лекарственный препарат, находящийся в нем. Нельзя использовать шприц в случае:
- помутнения раствора, наличия в препарате посторонних видимых частиц;
- изменения цвета;
- повреждения любых частей шприца;
- истечения срока годности (годен до …), указанного на картонной пачке, а также на этикетке шприца.
- Оставьте шприц при комнатной температуре приблизительно на 25-30 мин. Не следует согревать шприц с препаратом каким-либо другим способом.
img_ilsira_2-1.tif|jpg
- Подготовьте спиртовую салфетку/ватный тампон.
На данном этапе не следует снимать колпачок шприца.
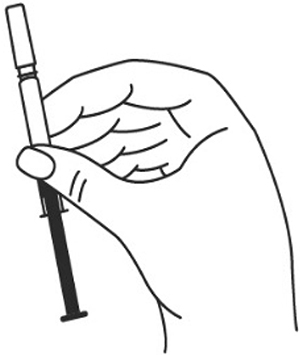
Техника выполнения п/к инъекции препарата Илсира® в преднаполненном шприце
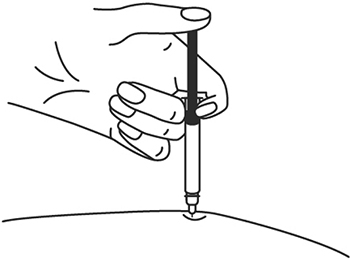
1. Выберите место инъекции (передняя брюшная стенка (отступая не менее 5 см от пупка), передняя и боковая поверхность бедра или средняя треть наружной части плеча (возможные места для инъекций закрашены на рисунке ниже)).
2. Нельзя вводить препарат в место на коже, где имеется болезненность, покраснение, уплотнение или кровоподтек. Эти признаки могут указывать на наличие инфекции. Также не следует вводить препарат в места родинок, гиперпигментаций и шрамов.
3. Место укола необходимо обработать спиртовой салфеткой круговыми движениями.
4. Шприц не встряхивать.
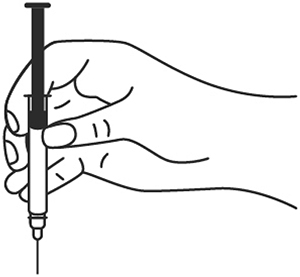
5. Снимите колпачок с иглы, не дотрагиваясь до иглы и избегая прикосновения к другим поверхностям.
6. Одной рукой возьмите в складку обработанную кожу.
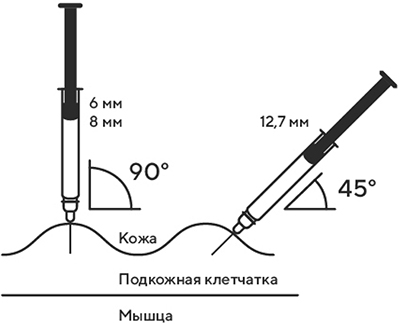
7. В другую руку возьмите шприц, держа его градуированной поверхностью вверх. Введение препарата необходимо осуществлять под углом 45 или 90 градусов к поверхности кожи в зависимости от толщины кожи и выраженности подкожно-жирового слоя (у худощавых пациентов введение препарата осуществляется под углом 45 градусов, у пациентов с толщиной кожной складки более 1.5 см допустимо введение под углом 90 градусов).
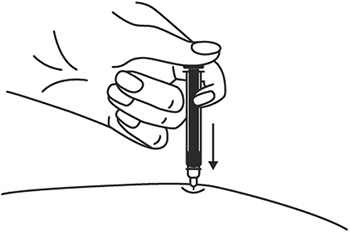
8. Одним быстрым движением полностью введите иглу в кожную складку.
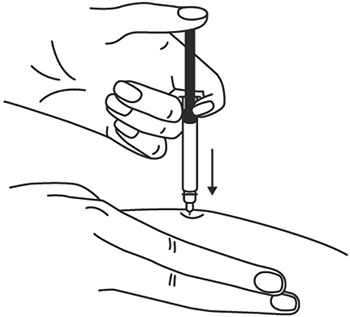
9. После введения иглы отпустите складку кожи.
10. Введите весь раствор медленным постоянным надавливанием на поршень шприца в течение 2-5 сек.
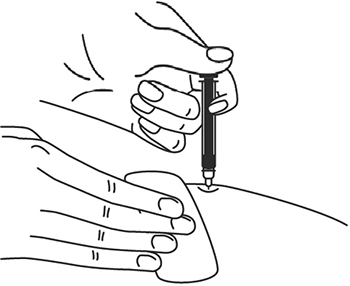
11. Когда шприц будет пустым, выньте иглу из кожи под тем же углом.
12. Кусочком марли слегка прижмите область инъекции в течение 10 сек, но ни в коем случае не трите поверхность. Из места инъекции может выделиться небольшое количество крови. При желании можно воспользоваться пластырем.
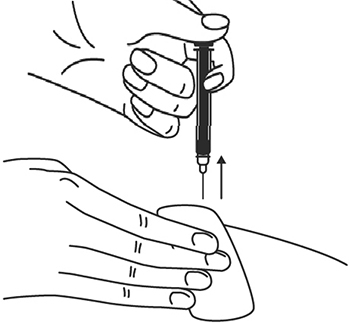
13. После инъекции шприц повторно не использовать.
14. Вторую инъекцию препарата Илсира® для достижения общей дозы 324 мг выполнить аналогичным образом.
15. При последующих инъекциях следует менять место введения.
Утилизация расходного материала
Неиспользованный раствор препарата, использованные шприцы, салфетки/ватные тампоны и другие расходные материалы подлежат утилизации с применением закрывающегося контейнера, устойчивого к проколам для острых предметов из пластика или стекла.
Не допускать хранения использованных шприцев в местах, доступных для детей.
Побочное действие
В рамках проведенных клинических исследований у здоровых добровольцев, пациентов с ревматоидным артритом и тяжелым течением новой коронавирусной инфекции (COVID-19) препарат Илсира® показал благоприятный профиль безопасности. Наиболее частыми нежелательными реакциями в проведенных клинических исследованиях были повышение активности АЛТ и АСТ, нейтропения и повышение уровня липидов в крови. Спектр зарегистрированных нежелательных явлений, связанных с применением препарата Илсира®, был ожидаемым для класса ингибиторов рецепторов ИЛ-6. Летальных исходов, связанных с терапией препаратом Илсира®, в ходе клинических исследований не было.
В данной инструкции нежелательные реакции представлены в соответствии с международным словарем нежелательных реакций MedDRA. Ниже приведен перечень нежелательных реакций, зарегистрированных у пациентов, получавших левилимаб в рамках клинических исследований, и имеющих определенную, вероятную или возможную степень связи с приемом препарата. Частота указана с учетом следующих критериев: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000), очень редко (≤10000).
* В клинических исследованиях регистрировались местные реакции в виде эритемы и кожного зуда.
** Данное НР проявлялось повышением АСТ и АЛТ и не сопровождалось другими симптомами токсического гепатита на фоне множественной лекарственной терапии.
Также в ходе клинической разработки регистрировались единичные нежелательные явления, для которых в настоящее время связь с применением левилимаба не установлена достоверно: воспаление очага кожного поражения, астения, анемия, лимфаденит, лимфоцитоз, отклонение от нормы процедуры визуализации легких, снижение активности АСТ.
В качестве нарушений со стороны иммунной системы в пострегистрационном периоде наблюдались единичные реакции гиперчувствительности (анафилактический шок, ангиоотек), что согласуется с известным профилем безопасности препаратов класса ингибиторов рецепторов ИЛ-6.
Противопоказания к применению
- гиперчувствительность к левилимабу, а также к любому из вспомогательных веществ препарата;
- клинически значимые активные инфекции, включая туберкулез;
- сепсис, обусловленный патогенами, отличными от COVID-19;
- вирусный гепатит В;
- нейтропения менее 0.5×109/л;
- тромбоцитопения менее 50×109/л;
- повышение активности АСТ или АЛТ более чем в 5 раз;
- печеночная недостаточность тяжелой степени (класс С по классификации Чайлд-Пью);
- почечная недостаточность тяжелой степени и в терминальной стадии (СКФ менее 30 мл/мин);
- детский и подростковый возраст до 18 лет;
- беременность;
- период грудного вскармливания;
- комбинированное применение с ингибиторами ФНОα или применение в течение 1 месяца после терапии моноклональными антителами к ФНОα.
С осторожностью
Следует соблюдать осторожность при назначении левилимаба следующим категориям пациентов:
- с хроническими и рецидивирующими инфекциями или с указаниями в анамнезе на них;
- с сопутствующими заболеваниями, предрасполагающими к развитию инфекций;
- в периоде ранней реконвалесценции после тяжелых и среднетяжелых инфекционных заболеваний;
- после недавно проведенной вакцинации живыми аттенуированными вакцинами;
- с печеночной недостаточностью легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью);
- с почечной недостаточностью средней степени тяжести (СКФ <60 мл/мин и ≥30 мл/мин);
- с дивертикулитом, дивертикулезом и язвенным поражением органов ЖКТ, в т.ч. в анамнезе, в связи с риском перфорации ЖКТ;
- с демиелинизирующими заболеваниями;
- у получающих иммуносупрессивную терапию после трансплантации органов.
В связи со способностью левилимаба подавлять реакции острой фазы воспаления следует проявлять особую осторожность в отношении раннего выявления инфекционных заболеваний на фоне терапии.
В связи с ограниченными данными клинических исследований о применении левилимаба у пациентов пожилого возраста следует соблюдать осторожность при назначении препарата пациентам этой возрастной группы.
Применение при беременности и кормлении грудью
Беременность
Исследований влияния на плод у беременных женщин не проводилось. Известно, что моноклональные антитела могут проникать через плацентарный барьер. Препарат Илсира® противопоказан к применению во время беременности. Женщины детородного возраста и их половые партнеры должны использовать эффективные средства контрацепции в период проведения терапии левилимабом.
Период грудного вскармливания
Неизвестно, проникает ли левилимаб в грудное молоко. Учитывая то, что иммуноглобулины класса G, к которым относится левилимаб, могут выделяться с грудным молоком, препарат Илсира® противопоказан к применению в период грудного вскармливания.
Фертильность
Данные о влиянии препарата на фертильность у людей отсутствуют.
Применение при нарушениях функции печени
Противопоказано применение препарата при печеночной недостаточности тяжелой степени (класс С по классификации Чайлд-Пью).
С осторожностью следует назначать препарат пациентам с печеночной недостаточностью легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью).
Применение при нарушениях функции почек
Противопоказано применение препарата при почечной недостаточности тяжелой степени и в терминальной стадии (СКФ менее 30 мл/мин).
С осторожностью следует назначать препарат пациентам с почечной недостаточностью средней степени тяжести (СКФ <60 мл/мин и ≥30 мл/мин).
Применение у детей
Противопоказано применение препарата в детском и подростковом возрасте до 18 лет.
Применение у пожилых пациентов
Следует соблюдать осторожность при назначении препарата пациентам пожилого возраста.
Особые указания
Прослеживаемость
В целях улучшения прослеживаемости биотехнологических лекарственных препаратов наименование и номер серии назначаемого лекарственного препарата левилимаб должны указываться в медицинской документации пациента.
Инфекции
Наличие таких потенциально тяжелых инфекций как ВИЧ, активный гепатит В, сифилис, туберкулез, относится к противопоказаниям для назначения левилимаба. Левилимаб не следует применять у пациентов с активным течением инфекционных заболеваний, включая локализованные инфекции. Учитывая иммуносупрессивное действие левилимаба, терапия этим препаратом потенциально может приводить к обострению хронических инфекций и повышению риска первичного инфицирования.
При реактивации гепатита В или развитии серьезных инфекций терапию левилимабом следует прекратить и назначить соответствующую этиотропную терапию.
Соблюдение осторожности требуется в отношении пациентов с рецидивирующими инфекционными заболеваниями в анамнезе, а также лиц, имеющих факторы риска развития инфекций в виде сопутствующих заболеваний или сопутствующей терапии.
С учетом подавления левилимабом реакций острой фазы воспаления симптомы инфекционного заболевания могут быть стерты, что следует учитывать при раннем выявлении серьезных инфекций у пациентов, получающих препарат Илсира®. При появлении любых симптомов, свидетельствующих о развитии инфекционного заболевания на фоне применения левилимаба, пациенту следует немедленно обратиться к врачу для своевременной диагностики и назначения терапии.
Туберкулез
Пациентам с активным туберкулезом терапия препаратом Илсира® противопоказана. Перед назначением препарата Илсира® и в ходе терапии необходимо проводить стандартный скрининг на туберкулез. Пациентам с латентным туберкулезом рекомендуется пройти стандартный курс противотуберкулезной терапии перед началом терапии препаратом Илсира®.
Лабораторные показатели
Нейтропения. В клинических исследованиях препарата Илсира® отмечалось снижение числа нейтрофилов. При длительной терапии пациентов с ревматоидным артритом снижение АЧН не сопровождалось более высокой частотой развития инфекций, в т.ч. серьезных. Следует соблюдать осторожность при лечении препаратом Илсира® пациентов с АЧН <2×109/л. При снижении АЧН <0.5×109/л терапию препаратом Илсира® следует отменить. Следует оценивать число нейтрофилов через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Тромбоцитопения. В клинических исследованиях препарата Илсира® отмечалось снижение числа тромбоцитов. При длительной терапии пациентов с ревматоидным артритом снижение числа тромбоцитов не сопровождалось развитием кровотечений. Следует соблюдать осторожность при назначении терапии препаратом Илсира® при числе тромбоцитов ниже 100×103/мкл. Лечение не рекомендуется при числе тромбоцитов <50×103/мкл. Следует оценивать число тромбоцитов через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Ферменты печени. В клинических исследованиях препарата Илсира® отмечалось повышение активности печеночных трансаминаз без признаков печеночной недостаточности. Частота возникновения подобных изменений может возрастать при совместном использовании с препаратами, обладающими потенциальным гепатотоксическим действием (например, метотрексатом, антибактериальными препаратами и другими). Следует соблюдать осторожность при назначении терапии препаратом Илсира® у пациентов с показателями АЛТ или АСТ, превышающими ВГН более чем в 1.5 раза. Следует оценивать показатели активности печеночных трансаминаз (АЛТ и АСТ) через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Изменение показателей липидного обмена. В клинических исследованиях препарата Илсира® отмечалось повышение концентрации липидов (холестерин общий и/или ТГ). Следует оценивать показатели липидного обмена через 4-8 недель после начала терапии левилимабом, а в дальнейшем в соответствии с клинической практикой. При ведении пациентов с гиперлипидемией следует учитывать национальные рекомендации.
Реакции гиперчувствительности
При использовании левилимаба потенциально возможно развитие реакции гиперчувствительности. В рамках проведенных клинических исследований левилимаба реакций гиперчувствительности не зарегистрировано. В ходе пострегистрационного периода оценки препарата Илсира® описаны единичные случаи анафилактических реакций и реакций гиперчувствительности. При возникновении анафилактических или других серьезных аллергических реакций применение препарата Илсира® следует немедленно прекратить и начать соответствующую симптоматическую терапию.
Злокачественные новообразования
У пациентов с РА наблюдается повышенный риск злокачественных новообразований, который может усугубляться при длительном применении иммуносупрессивных лекарственных средств. Объем клинических данных по препаратам класса ингибиторов рецептора ИЛ-6 в целом и левилимабу в частности недостаточен для установления частоты развития злокачественных образований и подтверждение наличия причинно-следственной связи с терапией. Продолжается изучение безопасности левилимаба в ходе долгосрочного применения.
Наличие алкогольной или наркотической зависимости
Наличие алкогольной или наркотической зависимости, а также психических расстройств может стать причиной несоблюдения пациентом графика лечения левилимабом, что, в свою очередь может привести к снижению эффективности терапии. Необходимо более тщательное наблюдение за пациентами с указанными состояниями в связи с отсутствием результатов клинических исследований у данной категории пациентов и возможностью повышенного риска развития гепатотоксичности и других неблагоприятных последствий.
Иммуногенность
В ходе клинических исследований препарата Илсира®, в т.ч. при долгосрочном (в течение года) лечении ревматоидного артрита, выработки связывающих антител к левилимабу выявлено не было.
Пациенты в возрасте старше 65 лет
Данные об эффективности и безопасности препарата у пациентов в возрасте старше 65 лет ограничены. Не предполагается наличия существенных возрастных различий в распределении и выведении препарата.
Пациенты с нарушениями функции почек и печени
Эффективность и безопасность препарата у данной категории пациентов не изучались.
Использование в педиатрии
Исследование эффективности и безопасности препарата у детей и подростков в возрасте до 18 лет не проводилось.
Вакцинация
Не следует проводить иммунизацию живыми аттенуированными вакцинами в ходе лечения препаратом Илсира®, т.к. клиническая оценка безопасности данного взаимодействия в рамках клинических исследований не проводилась. Вакцинация живыми аттенуированными вакцинами до начала терапии препаратом Илсира®, а также интервал между вакцинацией и началом терапии должны соответствовать действующим клиническим рекомендациям.
Демиелинизирующие заболевания
С учетом данных по профилю безопасности препаратов класса ингибиторов рецепторов ИЛ-6 следует соблюдать осторожность при применении левилимаба у пациентов с демиелинизирующими заболеваниями. Необходимо тщательно контролировать появление симптомов, указывающих на развитие демиелинизирующего заболевания ЦНС, несмотря на то, что способность левилимаба вызывать демиелинизирующие заболевания ЦНС в настоящее время не установлена.
Влияние на способность к управлению транспортными средствами и механизмами
Отсутствуют данные о влиянии препарата Илсира® на способность управлять транспортными средствами и работать с машинами и/или механизмами. Учитывая то, что при терапии другими ингибиторами рецептора ИЛ-6 отмечались эпизоды головокружения, пациентам, испытывающим головокружение при применении препарата Илсира®, не рекомендуется управлять транспортными средствами и механизмами до тех пор, пока головокружение не прекратится.
Передозировка
Клинические данные о передозировке препарата Илсира® отсутствуют. Максимальная переносимая доза левилимаба для человека не установлена. В клинических исследованиях при п/к введении левилимаба в максимальной суточной дозе 324 мг двукратно с интервалом 48-96 ч новых нежелательных реакций, изменяющих представление о профиле безопасности препарата, не зарегистрировано.
Лечение: специфический антидот отсутствует; проводят симптоматическую терапию.
Лекарственное взаимодействие
Сведений о наличии неблагоприятного лекарственного взаимодействия левилимаба с другими лекарственными препаратами до настоящего времени не получено.
Смешивание препарата с другими лекарственными средствами строго запрещено.
Условия хранения препарата Илсира®
Препарат следует хранить в защищенном от света, недоступном для детей месте при температуре от 2° до 8°С; не замораживать.
Срок годности препарата Илсира®
Срок годности — 2 года. Не применять по истечении срока годности.
Условия реализации
Препарат отпускают по рецепту.
Контакты для обращений
БИОКАД АО
(Россия)

|
|
198515 Санкт-Петербург, |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Описание препарата АЦЦ® (гранулы для приготовления раствора для приема внутрь, 100 мг) основано на официальной инструкции, утверждено компанией-производителем в 2017 году
Дата согласования: 11.09.2017
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Комментарий
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
- Отзывы
Действующее вещество
ATX
Фармакологическая группа
Нозологическая классификация (МКБ-10)
Список кодов МКБ-10
- E84.0 Кистозный фиброз с легочными проявлениями
(гранулы для приготовления раствора для приема внутрь) - H66.9 Средний отит неуточненный
(гранулы для приготовления раствора для приема внутрь) - J01 Острый синусит
(гранулы для приготовления раствора для приема внутрь) - J04 Острый ларингит и трахеит
(гранулы для приготовления раствора для приема внутрь) - J18 Пневмония без уточнения возбудителя
(гранулы для приготовления раствора для приема внутрь) - J20 Острый бронхит
(гранулы для приготовления раствора для приема внутрь) - J21 Острый бронхиолит
(гранулы для приготовления раствора для приема внутрь) - J32 Хронический синусит
(гранулы для приготовления раствора для приема внутрь) - J37 Хронический ларингит и ларинготрахеит
(гранулы для приготовления раствора для приема внутрь) - J42 Хронический бронхит неуточненный
(гранулы для приготовления раствора для приема внутрь) - J44 Другая хроническая обструктивная легочная болезнь
(гранулы для приготовления раствора для приема внутрь) - J44.9 Хроническая обструктивная легочная болезнь неуточненная
(сироп) - J45 Астма
(гранулы для приготовления раствора для приема внутрь) - J47 Бронхоэктатическая болезнь [бронхоэктаз]
(гранулы для приготовления раствора для приема внутрь) - J85 Абсцесс легкого и средостения
(сироп) - R09.3 Мокрота
(гранулы для приготовления раствора для приема внутрь)
Состав
АЦЦ® 100
| Таблетки шипучие | 1 табл. |
| активное вещество: | |
| ацетилцистеин | 100 мг |
| вспомогательные вещества: лимонная кислота безводная — 679,85 мг; натрия гидрокарбонат — 194 мг; натрия карбонат безводный — 97 мг; маннитол — 65 мг; аскорбиновая кислота — 12,5 мг; лактоза безводная — 75 мг; натрия сахаринат — 6 мг; натрия цитрат — 0,65 мг; ароматизатор ежевичный «В» — 20 мг |
АЦЦ®
| Гранулы для приготовления раствора для приема внутрь (апельсиновые) | 1 пак. |
| активное вещество: | |
| ацетилцистеин | 100 мг |
| вспомогательные вещества: сахароза — 2829,5 мг; аскорбиновая кислота — 12,5 мг; сахарин — 8 мг; ароматизатор апельсиновый — 50 мг |
| Сироп | 1 мл |
| активное вещество: | |
| ацетилцистеин | 20 мг |
| вспомогательные вещества: метилпарагидроксибензоат — 1,3 мг; натрия бензоат — 1,95 мг; динатрия эдетат — 1 мг; натрия сахаринат — 1 мг; кармеллоза натрия — 2 мг; натрия гидроксид, 10% водный раствор — 30–70 мг; ароматизатор «Вишня» — 1,5 мг; вода очищенная — 910,25–950,25 мг |
Описание лекарственной формы
Таблетки шипучие, 100 мг: круглые плоскоцилиндрические белого цвета, с запахом ежевики. Возможно наличие слабого серного запаха. Восстановленный раствор: бесцветный прозрачный с запахом ежевики. Возможно наличие слабого серного запаха.
Гранулы для приготовления раствора для приема внутрь (апельсиновые): однородные, белого цвета, без агломератов, с запахом апельсина.
Сироп: прозрачный, бесцветный, слегка вязкий раствор с вишневым запахом.
Фармакологическое действие
Фармакологическое действие
—
муколитическое.
Фармакодинамика
Ацетилцистеин является производным аминокислоты цистеина. Оказывает муколитическое действие, облегчает отхождение мокроты за счет прямого воздействия на реологические свойства мокроты. Действие обусловлено способностью разрывать дисульфидные связи мукополисахаридных цепей и вызывать деполимеризацию мукопротеидов мокроты, что приводит к уменьшению ее вязкости. Препарат сохраняет активность при наличии гнойной мокроты.
Оказывает антиоксидантное действие, основанное на способности его реактивных сульфгидрильных групп (SH-группы) связываться с окислительными радикалами и таким образом нейтрализовать их.
Кроме того, ацетилцистеин способствует синтезу глутатиона, важного компонента антиокислительной системы и химической детоксикации организма. Антиоксидантное действие ацетилцистеина повышает защиту клеток от повреждающего действия свободнорадикального окисления, свойственного интенсивной воспалительной реакции.
При профилактическом применении ацетилцистеина отмечается уменьшение частоты и тяжести обострений бактериальной этиологии у пациентов с хроническим бронхитом и муковисцидозом.
Фармакокинетика
Абсорбция высокая. Быстро метаболизируется в печени с образованием фармакологически активного метаболита — цистеина, а также диацетилцистеина, цистина и смешанных дисульфидов. Биодоступность при приеме внутрь составляет 10% (из-за наличия выраженного эффекта первого прохождения через печень). Tmax в плазме крови составляет 1–3 ч. Связь с белками плазмы крови — 50%. Выводится почками в виде неактивных метаболитов (неорганические сульфаты, диацетилцистеин). T1/2 составляет около 1 ч, нарушение функции печени приводит к удлинению T1/2 до 8 ч. Проникает через плацентарный барьер. Данные о способности ацетилцистеина проникать через ГЭБ и выделяться с грудным молоком отсутствуют.
Показания
Для всех лекарственных форм
заболевания органов дыхания, сопровождающиеся образованием вязкой трудноотделяемой мокроты:
— острый и хронический бронхит;
— обструктивный бронхит;
— трахеит;
— ларинготрахеит;
— пневмония;
— абсцесс легкого;
— бронхоэктатическая болезнь;
— бронхиальная астма;
— хроническая обструктивная болезнь легких;
— бронхиолиты;
— муковисцидоз;
острый и хронический синусит;
воспаление среднего уха (средний отит).
Противопоказания
Для всех лекарственных форм
повышенная чувствительность к ацетилцистеину или другим компонентам препарата;
язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения;
кровохаркание, легочное кровотечение;
беременность;
период грудного вскармливания;
детский возраст до 2 лет.
Для таблеток шипучих, 100 мг, дополнительно
дефицит лактазы, непереносимость лактозы, глюкозо-галактозная мальабсорбция.
С осторожностью: язвенная болезнь желудка и двенадцатиперстной кишки в анамнезе; бронхиальная астма; обструктивный бронхит; печеночная и/или почечная недостаточность; непереносимость гистамина (следует избегать длительного приема препарата, т.к. ацетилцистеин влияет на метаболизм гистамина и может привести к возникновению признаков непереносимости, таких как головная боль, вазомоторный ринит, зуд); варикозное расширение вен пищевода; заболевания надпочечников; артериальная гипертензия.
Для гранул для приготовления раствора дополнительно
дефицит сахаразы/изомальтазы, непереносимость фруктозы, глюкозо-галактозная недостаточность.
С осторожностью: язвенная болезнь желудка и двенадцатиперстной кишки в анамнезе; артериальная гипертензия; варикозное расширение вен пищевода; бронхиальная астма; обструктивный бронхит; заболевания надпочечников; печеночная и/или почечная недостаточность; непереносимость гистамина (следует избегать длительного приема препарата, т.к. ацетилцистеин влияет на метаболизм гистамина и может привести к возникновению признаков непереносимости, таких как головная боль, вазомоторный ринит, зуд).
Для сиропа дополнительно
С осторожностью: язвенная болезнь желудка и двенадцатиперстной кишки в анамнезе; бронхиальная астма; печеночная и/или почечная недостаточность; непереносимость гистамина (следует избегать длительного приема препарата, т.к. ацетилцистеин влияет на метаболизм гистамина и может привести к возникновению признаков непереносимости, таких как головная боль, вазомоторный ринит, зуд); варикозное расширение вен пищевода; заболевания надпочечников; артериальная гипертензия.
Применение при беременности и кормлении грудью
Данные по применению ацетилцистеина в период беременности и грудного вскармливания ограничены. Применение препарата при беременности возможно только в том случае, если предполагаемая польза для матери превышает потенциальный риск для плода.
В случае необходимости применения препарата в период лактации следует решить вопрос о прекращении грудного вскармливания.
Способ применения и дозы
АЦЦ® 100
АЦЦ®
Внутрь, после еды.
При отсутствии других назначений рекомендуется придерживаться следующих дозировок.
Муколитическая терапия
Взрослые и дети старше 14 лет: по 2 табл. шипучие 100 мг 2–3 раза в день или 2 пак. АЦЦ® гранул для приготовления раствора 100 мг 2–3 раза в день, или 10 мл сиропа 2–3 раза в день (400–600 мг ацетилцистеина в день).
Дети от 6 до 14 лет: по 1 табл. шипучей 100 мг 3 раза в день или по 2 табл. шипучие 2 раза в день, или 1 пак. АЦЦ® гранул для приготовления раствора 3 раза в день или 2 пак. 2 раза в день, или по 5 мл сиропа 3–4 раза в день или по 10 мл сиропа 2 раза в день (300–400 мг ацетилцистеина в день).
Дети от 2 до 6 лет: по 1 табл. шипучей 100 мг или 1 пак. АЦЦ® гранул для приготовления раствора 100 мг 2–3 раза в день, или 5 мл сиропа 2–3 раза в день (200–300 мг ацетилцистеина в день).
Муковисцидоз
Для пациентов с муковисцидозом (врожденное нарушение обмена веществ с частыми инфекциями бронхиальных путей) и массой тела более 30 кг в случае необходимости возможно увеличение дозы до 800 мг ацетилцистеина в день.
Дети старше 6 лет: по 2 табл. шипучих 100 мг или 2 пак. АЦЦ® гранул 100 мг для приготовления раствора 3 раза в день, или 10 мл сиропа 3 раза в день (600 мг ацетилцистеина в день).
Дети от 2 до 6 лет: по 1 табл. шипучей 100 мг или 1 пак. АЦЦ® гранул 100 мг для приготовления раствора, или 5 мл сиропа 4 раза в день (400 мг ацетилцистеина в день).
Таблетки шипучие следует растворять в 1 стакане воды и принимать сразу после растворения, в исключительных случаях можно оставить готовый к применению раствор на 2 ч.
Гранулы для приготовления раствора для приема внутрь (апельсиновые) следует растворять в воде, соке или холодном чае и принимать после еды.
Дополнительный прием жидкости усиливает муколитический эффект препарата. При кратковременных простудных заболеваниях длительность приема составляет 5–7 дней.
При хроническом бронхите и муковисцидозе препарат следует принимать более длительное время для достижения профилактического эффекта от инфекций.
Сироп АЦЦ® принимают при помощи мерного шприца или мерного стаканчика, находящегося в упаковке. 10 мл сиропа соответствует 1/2 мерного стаканчика или 2 наполненным шприцам.
Использование мерного шприца
1. Открыть крышку флакона, надавив на нее и повернув против часовой стрелки.
2. Снять со шприца пробку с отверстием, вставить ее в горлышко флакона и вдавить до упора. Пробка предназначена для соединения шприца с флаконом и остается в горлышке флакона.
3. Плотно вставить шприц в пробку. Осторожно перевернуть флакон вверх дном, потянуть поршень шприца вниз и набрать необходимое количество сиропа. Если в сиропе видны пузырьки воздуха, нажать на поршень до упора, после чего наполнить шприц заново. Вернуть флакон в исходное положение и вынуть шприц.
4. Сироп из шприца следует вылить на ложку или прямо в рот ребенку (в защечную область, медленно, так, чтобы ребенок смог проглотить сироп надлежащим образом), во время приема сиропа ребенок должен находиться в вертикальном положении.
5. После использования промыть шприц чистой водой.
Указание для больных сахарным диабетом: 1 шипучая таблетка соответствует 0,006 ХЕ; 1 пак. АЦЦ® гранул для приготовления раствора 100 мг соответствует 0,24 ХЕ; 10 мл (2 мерные ложки) готового к употреблению сиропа содержат 3,7 г D-глюцитола (сорбитол), что соответствует 0,31 ХЕ.
Побочные действия
По данным ВОЗ нежелательные реакции классифицированы в соответствии с их частотой развития следующим образом: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000); частота неизвестна — по имеющимся данным установить частоту возникновения не представлялось возможным.
Аллергические реакции: нечасто — кожный зуд, сыпь, экзантема, крапивница, ангионевротический отек, снижение АД, тахикардия; очень редко — анафилактические реакции вплоть до шока, синдром Стивенса-Джонсона, токсический эпидермальный некролиз (синдром Лайелла).
Со стороны дыхательной системы: редко — одышка, бронхоспазм (преимущественно у пациентов с гиперреактивностью бронхов при бронхиальной астме).
Со стороны ЖКТ: нечасто — стоматит, боль в животе, тошнота, рвота, диарея; изжога, диспепсия (кроме сиропа).
Со стороны органов чувств: нечасто — шум в ушах.
Прочие: очень редко — головная боль, лихорадка, единичные сообщения о развитии кровотечений в связи с наличием реакции повышенной чувствительности, снижение агрегации тромбоцитов.
Взаимодействие
Для всех лекарственных форм
При одновременном применении ацетилцистеина и противокашлевых средств из-за подавления кашлевого рефлекса может возникнуть застой мокроты. Поэтому подобные комбинации следует подбирать с осторожностью.
Одновременный прием ацетилцистеина с вазодилатирующими средствами и нитроглицерином может привести к усилению сосудорасширяющего действия.
При одновременном применении с антибиотиками для приема внутрь (в т.ч. пенициллины, тетрациклины, цефалоспорины) возможно их взаимодействие с тиоловой группой ацетилцистеина, что может привести к снижению их антибактериальной активности. Поэтому интервал между приемом антибиотиков и ацетилцистеина должен составлять не менее 2 ч (кроме цефиксима и лоракарбена).
При контакте с металлами, резиной образуются сульфиды с характерным запахом..
Передозировка
Симптомы: ацетилцистеин при приеме в дозе до 500 мг/кг не вызывал какие-либо симптомы интоксикации. При ошибочной или преднамеренной передозировке могут наблюдаться такие явления как диарея, рвота, боли в желудке, изжога и тошнота. У детей может наблюдаться гиперсекреция мокроты.
Лечение: симптоматическое.
Особые указания
При работе с препаратом необходимо пользоваться стеклянной посудой, избегать контакта с металлами, резиной, кислородом, легко окисляющимися веществами.
При применении ацетилцистеина очень редко сообщалось о случаях развития тяжелых аллергических реакций, таких как синдром Стивенса-Джонсона и синдром Лайелла. При возникновении изменений кожи и слизистых оболочек следует немедленно обратиться к врачу, прием препарата необходимо прекратить.
Пациентам с бронхиальной астмой и обструктивным бронхитом ацетилцистеин следует назначать с осторожностью под системным контролем бронхиальной проходимости.
Не следует принимать препарат непосредственно перед сном (рекомендуется принимать препарат до 18:00).
Влияние на способность управлять транспортными средствами и работать с механизмами. Данных об отрицательном влиянии препарата в рекомендуемых дозах на способность управлять транспортными средствами, механизмами нет.
Специальные меры предосторожности при уничтожении неиспользованного лекарственного препарата. Нет необходимости в специальных мерах предосторожности при уничтожении неиспользованного препарата.
Для сиропа дополнительно
Следует избегать применения препарата у пациентов с почечной и/или печеночной недостаточностью во избежание дополнительного образования азотистых соединений.
1 мл сиропа содержит 41,02 мг натрия. Это необходимо учитывать при применении препарата пациентами, соблюдающими диету, направленную на ограничение потребления натрия (со сниженным содержанием натрия/соли).
Форма выпуска
АЦЦ® 100
Таблетки шипучие, 100 мг.
При упаковке Гермес Фарма Гес.м.б.Х., Австрия: 20 табл. шипучих в пластмассовой или алюминиевой тубе. 1 туба по 20 табл. шипучих в картонной пачке.
АЦЦ®
Гранулы для приготовления раствора для приема внутрь (апельсиновые), 100 мг. 3 г гранул в пакетиках из комбинированного материала (алюминиевая фольга/бумага/ПЭ). 20 пак. в картонной пачке.
Сироп, 20 мг/мл. Во флаконах из темного стекла, укупоренных белыми крышками с уплотнительной мембраной, с функцией защиты от вскрытия детьми, с защитным кольцом, 100 мл.
Дозирующие устройства:
— прозрачный мерный стаканчик (колпачок), градуированный на 2,5; 5 и 10 мл;
— прозрачный шприц для дозирования, градуированный на 2,5 и 5 мл с белым поршнем и с кольцом-адаптером для закрепления на флаконе.
1 фл. вместе с дозирующими устройствами в картонной пачке.
Производитель
АЦЦ® 100
Таблетки шипучие
1. Гермес Фарма Гес.м.б.Х., Австрия.
2. Гермес Арцнаймиттель ГмбХ, Германия.
Держатель регистрационного удостоверения: Сандоз д.д. Веровшкова 57, Любляна, Словения.
АЦЦ®
Гранулы для приготовления раствора
Держатель регистрационного удостоверения: Сандоз д.д., Веровшкова 57, 1000 г. Любляна, Словения.
Произведено: Линдофарм ГмбХ, Нойштрассе 82, 40721 Хильден, Германия.
Сироп
Фарма Вернигероде ГмбХ, Германия.
Держатель регистрационного удостоверения: Сандоз д.д. Веровшкова 57, Любляна, Словения.
Претензии потребителей направлять в ЗАО «Сандоз»: 125315, Москва, Ленинградский пр-т, 72, корп. 3.
Тел.: (495) 660-75-09; факс: (495) 660-75-10.
Комментарий
RU1708679180
Условия отпуска из аптек
Без рецепта.
Условия хранения
При температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
гранулы для приготовления раствора для приема внутрь 100 мг пакет (пакетик) из комбинированного материала —
4 года.
сироп 20 мг/мл флакон темного стекла —
2 года.
Флакон после вскрытия хранить не более 10 сут при температуре не выше 25 °C
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Джакави® (15 мг)
МНН: Руксолитиниб
Производитель: Новартис Фарма Штейн АГ
Анатомо-терапевтическо-химическая классификация: Руксолитиниб
Номер регистрации в РК:
№ РК-ЛС-5№021459
Информация о регистрации в РК:
24.01.2020 — бессрочно
Информация о реестрах и регистрах
Информация по ценам и ограничения
Предельная цена закупа в РК:
24 980 KZT
- Скачать инструкцию медикамента
Торговое название
Джакави®
Международное непатентованное название
Руксолитиниб
Лекарственная форма
Таблетки 5 мг, 15 мг и 20 мг
Состав
Одна таблетка содержит
активное вещество — руксолитиниба фосфат 6,60 мг, 19,80 мг или 26,40 мг (эквивалентно руксолитиниба 5 мг, 15 мг или 20 мг)
вспомогательные вещества: лактозы моногидрат, целлюлоза микрокристаллическая, натрия крахмала гликолят (тип А), гидроксипропилцеллюлоза, повидон, кремния диоксид коллоидный безводный, магния стеарат.
Описание
Таблетки круглой формы, от белого до почти белого цвета, с гравировкой «NVR» на одной стороне и «L5» на другой стороне, диаметром около 7.5 мм (для дозировки 5 мг).
Таблетки овальной формы, от белого до почти белого цвета, с гравировкой «NVR» на одной стороне и «L15» на другой стороне, длиной около 15.0 мм и шириной около 7.0 мм (для дозировки 15 мг).
Таблетки продолговатой формы, от белого до почти белого цвета, с гравировкой «NVR» на одной стороне и «L20» на другой стороне, длиной около 16.5 мм и шириной около 7.4 мм (для дозировки 20 мг).
Фармакотерапевтическая группа
Противоопухолевые препараты. Ингибиторы протеинкиназы. Руксолитиниб.
Код АТХ L01XE18
Фармакологические свойства
Фармакокинетика
Абсорбция
Руксолитиниб относится к I классу молекул согласно биофармацевтической классификационной системе и характеризуется высокой проницаемостью, высокой способностью к растворению и быстрым растворением. В клинических исследованиях руксолитиниб показал быстрое всасывание после перорального применения, достигнув максимальную плазменную концентрацию (Cmax) примерно через 1 час после принятия дозы. По результатам исследования баланса масс у человека пероральная абсорбция руксолитиниба составила 95% и более. Среднее значение Cmax и общей экспозиции (AUC) руксолитиниба имело пропорциональное повышение в диапазоне однократных доз от 5 до 200 мг. Клинически релевантных изменений фармакокинетики руксолитиниба при приеме одновременно с пищей с высоким содержанием жиров не наблюдалось. Среднее значение Cmax имело умеренное снижение (24%), тогда как среднее значение AUC практически не имело изменений (4% повышение) при приеме одновременно с пищей с высоким содержанием жиров.
Распределение
Средний объем распределения в равновесном состоянии составляет примерно 75 л у пациентов с миелофиброзом (МФ) и истинной полицитемией (ИП). При клинически значимых концентрациях руксолитиниба связь с плазменными белками in vitro составила примерно 97%, при этом в основном с альбумином. Исследование общей ауторадиографии у крыс показало отсутствие проникновения руксолитиниба через гематоэнцефалический барьер.
Биотрансформация/метаболизм
In vitro исследования указывают на то, что CYP3A4 является основным ферментом, ответственным за метаболизм руксолитиниба. Исходное вещество является преобладающей составляющей у человека, представляя примерно 60% связанного с препаратом материала в кровотоке. Два основных и активных метаболита были определены в плазме здоровых добровольцев, представляя 25% и 11% значений AUC исходного вещества. Данные метаболиты обладают 1/2 – 1/5 JAK-связанной фармакологической активностью исходного вещества. Совокупность всех активных метаболитов способствует 18% общей фармакодинамики руксолитиниба. При клинически релевантных концентрациях руксолитиниб не ингибирует CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 и CYP3A4, а также не является мощным индуктором CYP1A2, CYP2B6 и CYP3A4 по результатам исследований in vitro.
Выведение
После перорального приема однократной дозы [14C]-меченного руксолитиниба здоровыми взрослыми добровольцами выведение преимущественно происходило посредством метаболизма с выведением 74% радиоактивности с мочой и 22% с калом. Неизмененное вещество составило менее 1% общей выведенной радиоактивности. Средний период полувыведения руксолитиниба составил примерно 3 часа.
Линейность/нелинейность
Пропорциональность дозам продемонстрирована в исследованиях по изучению однократной дозы и многократных доз.
Особые популяции
Влияние возраста, пола или расы
У здоровых людей разного пола и расы никаких релевантных различий в фармакокинетике руксолитиниба не наблюдалось. При популяционной фармакокинетической оценке у пациентов с миелофиброзом никакой очевидной закономерности между пероральным клиренсом и возрастом и расой пациентов не выявлено. Прогнозируемый пероральный клиренс составлял 17,7 л/ч у женщин и 22,1 л/ч — у мужчин с вариабельностью между пациентами с миелофиброзом 39%.
Нарушение функции почек
После приема однократной дозы руксолитиниба 25 мг экспозиция руксолитиниба у пациентов с разной степенью нарушения функции почек и у пациентов с нормальной функцией почек была схожей. Однако значение AUC метаболитов руксолитиниба в плазме крови, как правило, повышалось с увеличением тяжести нарушения функции почек, и было наиболее заметно увеличенным у пациентов с тяжелым нарушением функции почек. Проведение диализа не приводит к ускоренному выведению руксолитиниба из организма. Изменение доз препарата рекомендуется для пациентов с тяжелым нарушением функции почек (клиренс креатина – менее, чем 30 мл/мин). Изменение доз препарата рекомендуется для пациентов с терминальной стадией почечной недостаточности (см. раздел «Способ применения и дозы»).
Нарушение функции печени
После приема однократной дозы руксолитиниба 25 мг среднее значение AUC руксолитиниба увеличивалось у пациентов с легким, умеренным и тяжелым нарушением функции печени на 87; 28 и 65%, соответственно по сравнению с пациентами с нормальной функцией печени. Четкой взаимосвязи между AUC препарата и степенью нарушения функции печени с учетом баллов по классификации Чайлд-Пью не выявлено. Терминальный Т½ был удлинен у пациентов с нарушением функции печени по сравнению с контрольной группой здоровых участников исследования (4,1–5 ч против 2,8 ч). Для пациентов с нарушением функции печени рекомендуется снижение дозы препарата (см. раздел «Способ применения и дозы»).
Фармакодинамика
Руксолитиниб является селективным ингибитором янус-киназ (JAK) JAK1 и JAK2 (значение IC50 для ферментов JAK1 и JAK2 составляет 3,3 и 2,8 нмоль соответственно). Данные киназы способствуют передаче сигналов от многочисленных цитокинов и факторов роста, играющих важную роль в гемопоэзе и функции иммунной системы.
Активированные JAK-киназы, воздействуя на цитокиновые рецепторы, активируют STAT-белки (STATs) (переносчики сигнала и активаторы транскрипции), которые в результате активации транспортируются внутрь ядра и модулируют экспрессию генов. Дисрегуляция пути JAK-STAT ассоциирована с некоторыми видами злокачественных новообразований и повышением пролиферации и выживаемости злокачественных клеток.
Миелофиброз и истинная полицитемия — миелопролиферативные новообразования, которые, как известно, сопровождаются нарушением регуляции в передаче сигналов с участием JAK1 и JAK2. В основе нарушения регуляции лежат высокие уровни циркулирующих цитокинов, активирующих путь JAK-STAT-мутации, при которых белковый продукт экспрессии мутантного гена приобретает новые и патологические функции, такие как мутация JAK2V617F, а также приводят к исключению негативных регуляторных механизмов. У пациентов с миелофиброзом отмечается нарушение регуляции в передаче сигналов при участии JAK независимо от статуса относительно мутации JAK2V617F. Активация мутации в JAK2 (V617F или экзон 12) обнаруживается у >95% пациентов с истинной полицитемией. Руксолитиниб ингибирует передачу сигналов по JAK-STAT-пути и пролиферацию клеток в цитокинзависимых клеточных моделях гематологических злокачественных новообразований, а также цитокинзависимых пролиферирующих клетках Ba/F3 путем экспрессии видоизмененного белка JAK2V617F с IC50, что находится в диапазоне 80–320 нмоль.
Руксолитиниб ингибирует цитокин-индуцированное фосфорилирование STAT3 в цельной крови у здоровых людей и пациентов с миелофиброзом. Применение руксолитиниба приводит к максимальному угнетению фосфорилирования STAT3 через 2 ч после приема дозы препарата с возвратом значений показателей фосфорилирования до значений, близких к исходному уровню, через 8 ч как у здоровых людей, так и пациентов с миелофиброзом, что указывает на отсутствие накопления исходного препарата или активных метаболитов. Повышенные на исходном уровне значения маркеров воспаления, связанные с появлением системных симптомов, такие как фактор некроза опухоли-α, интерлейкин-6 и С-реактивный белок (СРБ) у пациентов с миелофиброзом, снижались после лечения руксолитинибом. С течением времени у пациентов с миелофиброзом признаки резистентности к фармакодинамическим эффектам при лечении руксолитинибом не развивались. Аналогично, у пациентов с истинной полицитемией также отмечались базовые повышения уровня воспалительных маркеров, которые снизились после лечения руксолитинибом.
В клиническом исследовании не отмечалось удлинения QT/QTc интервала при применении руксолитиниба в однократных дозах или в дозах, превышающих терапевтические (до 200 мг), что указывает на отсутствие влияния на реполяризацию сердца.
Показания к применению
— лечение при заболеваниях, связанных со спленомегалией или симптомах первичного миелофиброза (также известного как хронический идиопатический миелофиброз), при миелофиброзе, развившемся вследствие истинной полицитемии или в результате эссенциальной тромбоцитемии у взрослых пациентов
— лечение пациентов с истинной полицитемией, сопровождающейся резистентностью или непереносимостью к гидроксикарбамиду
Способ применения и дозы
Инструкция по мониторингу:
До начала лечения препаратом Джакави® следует провести анализ крови с подсчетом форменных элементов крови.
Абсолютное число форменных элементов крови необходимо контролировать каждые 2-4 недели во время подбора дозы руксолитиниба и далее по клиническим показаниям.
Препарат Джакави® принимают внутрь, независимо от приема пищи. Рекомендуемая начальная доза препарата Джакави® для лечения миелофиброза составляет 15 мг 2 раза в сутки для пациентов с количеством тромбоцитов 100.000-200.000/мм3, и 20 мг 2 раза в сутки для пациентов с количеством тромбоцитов >200.000/мм3. Рекомендуемая начальная доза у пациентов с истинной полицитемией составляет 10 мг, перорально 2 раза/сутки.
Максимальная рекомендуемая начальная доза у пациентов с количеством тромбоцитов 50.000-100.000мм3 составляет 5 мг 2 раза в сутки и данным пациентам необходимо соблюдать осторожность при титровании дозы.
Дозу препарата Джакави® подбирают с учетом безопасности и эффективности проводимого лечения. Лечение должно быть приостановлено при выявлении количества тромбоцитов менее 50.000/мм3 или при снижении абсолютного числа нейтрофилов менее 500/мм3. При лечении истинной полицитемии применение препарата должно быть приостановлено, если уровень гемоглобина достигает значений ниже 8 г/дл. После восстановления числа тромбоцитов и нейтрофилов выше указанных показателей, применение препарата Джакави® может быть возобновлено в дозе 5 мг 2 раза в сутки, далее доза может постепенно повышаться, при этом необходим тщательный мониторинг числа форменных элементов крови. Рекомендовано снижение дозы, при уменьшении числа тромбоцитов менее 100.000/мм3 во избежание прерывания применения препарата вследствие развившейся тромбоцитопении. При лечении истинной полицитемии решение о снижении дозы может быть согласовано, если уровень гемоглобина снижается ниже 12 г/дл, и рекомендуется, если уровень гемоглобина снижается ниже 10 г/дл.
В случае терапевтической необходимости, и если количество тромбоцитов и нейтрофилов является адекватными, принимаемая доза препарата Джакави® может быть увеличена максимально на 5 мг 2 раза в сутки, до максимальной дозы 25 мг 2 раза в сутки. Начальную дозу не следует повышать в течение первых 4 недель лечения, и затем не чаще чем 1 раз в 2 недели.
Максимальная доза препарата Джакави® составляет 25 мг 2 раза в сутки. В случае пропуска приема очередной дозы препарата, пациент не должен принимать дополнительную дозу, и следующую дозу должен принять в обычное предписанное время.
Лечение препаратом продолжают до тех пор, пока сохраняется положительный терапевтический эффект.
Коррекция дозы при одновременном применении мощных ингибиторов CYP3A4 или флуконазола:
В случае если препарат Джакави® применяется одновременно с мощными ингибиторам CYP3A4 или двухкомпонентными умеренными ингибиторами ферментов CYP2C9 и CYP3A4 (например, флуконазол), общая суточная доза препарата Джакави® должна быть снижена приблизительно на 50%, либо путем соответственного снижения дозы при приеме 2 раза в сутки, либо путем снижения частоты введения соответственно до 1 раза в день (в случае, когда такой режим приема возможен). Следует избегать одновременного использования препарата Джакави® с дозировками флуконазола, превышающими 200 мг в день (см. раздел Лекарственные взаимодействия). Также рекомендован более частый мониторинг гематологических показателей и клинических признаков и симптомов, связанных с нежелательными реакциями на препарат Джакави® при начале приема мощных ингибиторов CYP3A4 или двухкомпонентных умеренных ингибиторов ферментов CYP2C9 и CYP3A4.
Особые группы пациентов
Почечная недостаточность
У пациентов с тяжелой почечной недостаточностью (клиренс креатинина <30мл/мин) рекомендуемую начальную дозу, основанную на количестве тромбоцитов у пациентов с миелофиброзом, необходимо снизить примерно на 50%. Рекомендуемая начальная доза для пациентов с истинной полицитемией с тяжелой почечной недостаточностью составляет 5 мг 2 раза в день. Пациентам с тяжелой почечной недостаточностью, принимающим препарат Джакави®, необходим тщательный контроль и возможно снижение дозы для предотвращения побочных действий.
Данные по определению оптимального режима дозирования для пациентов на диализе с терминальной стадией почечной недостаточности ограничены. Имеющиеся данные для этой популяции указывают на то, что пациенты с миелофиброзом на диализе должны начинать терапию с первоначальной разовой дозы 15 мг или 20 мг в зависимости от количества тромбоцитов, с последующими разовыми дозами только после каждой процедуры диализа, при этом необходимо тщательно контролировать безопасность и эффективность терапии.
Рекомендуемая начальная доза для пациентов с истинной полицитемией с ХПН на гемодиализе представляет собой однократную дозу в объеме 10 мг или две дозы по 5 мг с интервалом 12 часов, которую следует вводить после диализа и только в день гемодиализа, на основании тщательного мониторинга безопасности и эффективности.
Печеночная недостаточность
У пациентов с печеночной недостаточностью любой степени рекомендуемую начальную дозу с учетом количества тромбоцитов необходимо снизить примерно на 50%. Пациентам с печеночной недостаточностью, принимающим препарат Джакави®, необходим тщательный контроль и возможно снижение дозы для предотвращения побочных действий.
Педиатрия
Безопасность и эффективность препарата Джакави® у детей младше 18 лет не установлена.
Пожилые пациенты
Дополнительной коррекция дозы у пожилых пациентов не требуется.
Побочные действия
В период проведения двух рандомизированных базовых исследований COMFORT-I и COMFORT-II, пациенты подвергались действию препарата Джакави® в среднем в течение 10,8 месяцев (диапазон от 0,3 до 23,5 месяцев). Большинство пациентов (68,4%) принимали препарат в течение, как минимум, 9 месяцев. Из 301 пациентов, у 111 (36,9%) количество тромбоцитов находилось в интервале 100.000/мм3 -200.000/мм3, а у 190 (63,1%) количество тромбоцитов было >200.000/мм3.
В данных клинических исследованиях, отмена препарата из-за нежелательных явлений, независимо от причины наблюдалась у 11,3% пациентов.
Наиболее частыми побочными эффектами, о которых сообщалось, были тромбоцитопения и анемия.
Гематологические нежелательные реакции (любая степень по Общим критериям терминологии для обозначения нежелательных явлений [СТСАЕ]) включали случаи анемии (82,4%), тромбоцитопении (69,8%) и нейтропении (16,6%).
Анемия, тромбоцитопения и нейтропения — дозозависимые эффекты.
Три наиболее частые негематологические нежелательные реакции: синяки (21,6%), головокружение (15,3%) и головная боль (14,0%).
Три наиболее частые негематологические отклонения лабораторных показателей от нормы включали: повышение уровней АлАТ (27,2%), АсАТ (18,6%), а также гиперхолестеринемию (16,9%). Безопасность при применении препарата в течение долгого времени: как и ожидалось, общая частота некоторых нежелательных явлений увеличилась при оценки данных по безопасности за 3 года (средняя продолжительность воздействия — 33,4 месяца в отношении пациентов, принимавших участие в исследованиях COMFORT-I и COMFORT-II, рандомизированных на начальном этапе в группу для приема препарата русолитиниб) у 457 пациентов с миелофиброзом, принимавших руксолитиниб в течение долгого времени в рандомизированных основных исследованиях фазы III. Данная оценка включает данные пациентов, которые изначально были рандомизированы в группу для приема руксолитиниб (n=301) и пациентов, которые начали принимать руксолитиниб после других видов лечения (n=156). В результате этих обновленных данных 21,4% пациентов досрочно прекратили лечения из-за нежелательных явлений, связанных с приемом препарата руксолитиниб.
Истинная полицитемия (ИП)
Безопасность препарата Джакави® оценивалась у 110 пациентов с истинной полицитемией в рамках открытого, рандомизированного, контролируемого исследования RESPONSE III фазы . Нежелательные лекарственные реакции, перечисленные ниже, отображают начальный период исследования (до 32 недели) с эквивалентным воздействием руксолитиниба и наилучшей доступной терапией, что соответствует средней продолжительности воздействия Джакави® 7,8 месяцев. Средний возраст пациентов, получающих препарат Джакави®, составил около 60 лет.
Прекращение лечения из-за нежелательных явлений, независимо от причины, наблюдалось у 3,6% пациентов, получавших препарат Джакави®, и 1,8% пациентов, получавших наилучшую доступную терапию.
Гематологические нежелательные реакции (любой степени по общей терминологии критериев побочных эффектов) включали анемию (43,6%) и тромбоцитопению (24,5%). Анемия или тромбоцитопения 3 и 4 степени были отмечены у 1,8% или 5,4% пациентов, соответственно.
К трем наиболее частым негематологическим нежелательным реакциям относятся головокружение (15,5%), запор (8,2%), и опоясывающий лишай (6,4%).
К трем наиболее частым негематологическим лабораторным отклонениям (любой степени по общей терминологии критериев побочных эффектов) относятся гиперхолестеринемия (30,0%), повышение уровня аланинаминотрансферазы (22,7%) и повышение уровня аспартатаминотрансферазы (20,9%). Все нежелательные реакции (по общей терминологии критериев побочных эффектов) относились к 1-2 степени, за исключением одного случая роста уровня аланинаминотрансферазы 3 степени.
Профиль долгосрочной безопасности: средняя продолжительность воздействия препарата Джакави® составила 18,6 месяцев (диапазон от 0,3 до 35,9 месяцев). При более длительном воздействии, совокупная частота нежелательных реакций увеличивалась, при отсутствии новых выводов о профиле безопасности. При корректировке с учетом воздействия, уровни нежелательных реакций, как правило, сопоставимы с теми, которые были отмечены в начальный период исследования.
Нижеприведенные побочные реакции классифицированы по органам, системам и частоте возникновения, причем наиболее распространенные указаны первыми. Для каждой частоты в группе побочные реакции расположены в порядке возрастания серьезности.
В программе проведения клинических исследований тяжесть побочных реакций на применение препарата оценивалась на основе СТСАЕ, определяющих степень 1 — легкая степень, степень 2 — умеренная степень, степень 3 — тяжелая степень и степень 4 — опасная для жизни.
Побочные действия у пациентов с миелофиброзом
Очень часто (> 1/10)
-
головокружение
-
головная боль
-
инфекции мочевых путей
-
кровоподтеки
-
анемия, в т.ч. анемия 3 степени (˂8,0-6,5 г/дл), 4 степени (˂6,5 г/дл) и анемия любой степени
-
тромбоцитопения любой степени
-
нейтропения любой степени
-
гиперхолестеринемия 1 и 2 степени
-
повышение АЛТ, АСТ любой степени
-
увеличение веса
-
кровотечения (любые кровотечения включая внутричерепные, желудочно-кишечные кровотечения, кроподтеки и другие)
-
другие кровотечения (включая носовые, пост-абортные кровотечения и гематурия)
Часто (> 1/100, < 1/10)
-
нейтропения 3 степени (˂1000-500/мм3) и 4 степени (˂500 /мм3)
-
тромбоцитопения 3 степени (˂50.000-25.000/мм3) и 4 степени (˂25.000 /мм3)
-
метеоризм
-
повышение АЛТ 3 степени (˃5-20 х ВГН*)
-
опоясывающий герпес
-
внутричерепные кровотечения
-
желудочно-кишечные кровотечения
-
другие кровотечения (включая носовые, пост-абортные кровотечения и гематурия)
Нечасто (≥1/1,000, <1/100)
-
туберкулез
* = верхняя граница нормы
Побочные действия у пациентов с истинной полицитемией
Очень часто (> 1/10)
-
головокружение
-
артериальная гипертензия
-
кровоподтеки
-
тромбоцитопения любой степени
-
нейтропения любой степени
-
гиперхолестеринемия 1 и 2 степени
-
гипертриглицеридемия 1 степени
-
повышение АЛТ, АСТ любой степени
-
кровотечения (любые кровотечения включая внутричерепные, желудочно-кишечные кровотечения, кроподтеки и другие)
-
другие кровотечения (включая носовые, пост-абортные кровотечения и гематурия)
Часто (> 1/100, < 1/10)
-
увеличение веса
-
запор
-
инфекции мочевых путей
-
тромбоцитопения 3 степени (˂50.000-25.000/мм3) и 4 степени (˂25.000 /мм3)
-
опоясывающий герпес
Нечасто (≥1/1,000, <1/100)
-
туберкулез
-
анемия, в т.ч. анемия 3 степени (˂8,0-6,5 г/дл), 4 степени (˂6,5 г/дл) и анемия любой степени
-
тромбоцитопения 4 степени (˂25.000 /мм3)
-
повышение АЛТ 3 степени (˃5-20 х ВГН*)
* = верхняя граница нормы
При прекращении терапии пациенты могут отмечать возвращение симптомов миелофиброза, включая: утомляемость, боль в костях, лихорадочное состояние, зуд, ночные приливы, симптоматическая спленомегалия и потеря веса. В клинических исследованиях общий счет симптомов для симптомов миелофиброза постепенно вернулся к исходному уровню в течение 7 дней после прекращения приема доз.
Описание отдельных нежелательных лекарственных реакций
Анемия
В клиническом исследовании III фазы, среднее время первого появления 2 степени CTCAE или более высокого уровня анемии составил 1,5 месяца. Один пациент в ходе клинических исследований (0,3%) прекратил лечение вследствие развития анемии.
У пациентов, получавших препарат Джакави®, в среднем, снижение гемоглобина достигало максимально низкого уровня (на 15-20 г/л ниже исходного показателя) на 8-12 неделе терапии. В дальнейшем уровень гемоглобина постепенно повышался и сохранялся на уровне на 10 г/л ниже исходного (до начала лечения). Данная тенденция наблюдалась у пациентов, независимо от того, получали ли они гемотрансфузии во время терапии.
В рандомизированном плацебо-контролируемом исследовании (COMFORT-I), у 60,6% пациентов, принимавших препарат Джакави® и 37,7% пациентов, принимавших плацебо проводилось переливание эритроцитов в течение рандомизированного лечения. В исследовании COMFORT-II, частота переливания эритроцитов составляла 53,4% в группе, принимавшей препарат Джакави® и 41,1% в группе пациентов, которые получали лучшую доступную терапию (ЛДТ). В течение рандомизированного периода в базовых исследованиях, анемия возникала реже у пациентов с истинной полицитемией (43,6%) против 82,4% пациентов с миелофиброзом. В группе пациентов с истинной полицитемией, нежелательные явления 3 и 4 степени CTCAE были зарегистрированы у 1,8%, в то время как у пациентов с миелофиброзом, частота неблагоприятных явлений составляла 42,5%.
Тромбоцитопения
В клинических исследованиях тромбоцитопения 3 или 4 степени тяжести развивалась приблизительно к 8 неделе терапии. Тромбоцитопения была в целом обратима при снижении дозы или прерывании лечения. Уровень тромбоцитов восстанавливался до значений более 50.000/мм3 в течение 14 дней. Трансфузии концентратов тромбоцитов применялись у 4,5% пациентов, получавших препарат Джакави®, и у 5,8% пациентов, в контрольной группе. В клинических исследованиях прекращение лечения вследствие развития тромбоцитопении наблюдалось у 0,7% пациентов, получавших препарат Джакави®, и у 0,9% пациентов, получавших контрольный режим терапии. Пациенты с количеством тромбоцитов от 100.000/мм3 до 200.000/мм3 перед началом принятия препарата Джакави® имели более высокую частоту тромбоцитопении 3 или 4 степени по сравнению с пациентами, количество тромбоцитов которых составляет >200.000/мм3 (64,2% против 35,4%).
В течение рандомизированного периода в базовых исследованиях, количество случаев тромбоцитопении было меньше у пациентов с истинной полицитемией (24,5%), по сравнению с пациентами с миелофиброзом (69,8%). Частота появления тромбоцитопении тяжелой степени (например, 3 и 4 степени CTCAE) была ниже у пациентов с истинной полицитемией (5,5%), чем у пациентов с миелофиброзом.
Нейтропения
В клинических исследованиях фазы III, нейтропения 3 или 4 степени тяжести развивалась приблизительно к 12 неделе терапии. Задержка введения очередной дозы или снижение дозы вследствие развития нейтропении наблюдались у 1% пациентов, и у 0,3% пациентов было прекращено лечение вследствие развития нейтропении.
В период рандомизации основных исследований у пациентов с истинной полицитемией нейтропения наблюдалась в 2 случаях (1,8%), из которых у одного пациента отмечалась нейтропения 4 степени по CTCAE.
Кровотечения
На 3 этапе базовых исследований случаи кровотечения при миелофиброзе (включая внутричерепные и желудочно-кишечные кровоподтеки и прочие случаи кровотечения) наблюдались среди 32,6% пациентов, принимавших препарат Джакави®, и 23,2% пациентов, проходивших стандартное лечение (плацебо или лучшая доступная терапия). Частота случаев 3-4 степени была аналогична той, которая наблюдалась среди пациентов, принимавших препарат Джакави® или проходивших стандартное лечение (4,7 % против 3,1 %). Сообщается, что у большинства пациентов со случаями кровотечения во время лечения имелись кровоподтеки (65.3 %).
Сообщается, что чаще всего случаи наличия кровоподтеков наблюдались у пациентов, принимавших препарат Джакави®, по сравнению с пациентами, проходивших стандартное лечение (21,3 % против 11,6 %). Случаи внутричерепного кровотечения наблюдались у 1 % пациентов, принимавших препарат Джакави®, и у 0,9 % пациентов, проходивших стандартное лечение. Случаи желудочно-кишечного кровотечения наблюдались у 5,0 % пациентов, принимавших препарат Джакави®, и у 3,1% пациентов, проходивших стандартное лечение. Другие случаи кровотечения (включая такие случаи, как носовое кровотечение, геморрагия после прохождения процедур и гематурия) были обнаружены у 13,3 % пациентов, принимавших препарат Джакави®, и 10,3 % пациентов, проходивших стандартное лечение.
В период рандомизации базового исследования пациентов с истинной полицитемией случаи кровотечения (включая внутричерепные и желудочно-кишечные кровоподтеки и прочие случаи кровотечения) наблюдались среди 20 % пациентов, принимавших препарат Джакави®, и 15,3 % пациентов, проходивших лучшую доступную терапию. В группах пациентов, принимавших препарат Джакави® и проходивших наиболее доступную терапию наблюдалась схожая частотность случаев наличия кровоподтеков (10,9 % против 8,1 %). Среди пациентов, принимавших препарат Джакави® не было обнаружено случаев внутричерепного или желудочно-кишечного кровотечения. У одного пациента, принимавшего препарат Джакави® случилось кровотечение 3 степени (кровотечение после прохождения процедуры); данные о случаях кровотечения 4 степени отсутствуют.
Другие случаи кровотечения (включая такие случаи, как носовое кровотечение, геморрагия после прохождения процедур и кровоточивость десен) были отмечены среди 11,8 % пациентов, принимавших препарат Джакави®, и 6,3 % пациентов, проходивших наиболее доступную терапию.
Инфекции мочевыводящих путей
В клинических исследованиях инфекции мочевыводящих путей 3 и 4 степени тяжести наблюдались у 1% пациентов. Уросепсис — у 1% пациентов, инфекции почек — у 1 пациента. В период рандомизации основных исследований один случай (0,9%) инфекции мочеполовых путей 3-4 степени был отмечен среди пациентов с истинной полицитемией. Опоясывающий герпес
Уровень частоты случаев опоясывающего герпеса у пациентов с миелофиброзом 4,0%.
Повышение систолического артериального давления
На 3 этапе базовых клинических исследований среди пациентов с миелофиброзом увеличение систолического артериального давления на 20 мм рт. ст. или выше исходной отметки было отмечено у 31,5 % пациентов, посетивших врача минимум один раз, по сравнению с 19,5 % пациентов в контрольной группе. В группе COMFORT-I (пациенты с миелофиброзом) среднее увеличение систолического артериального давления от исходной отметки составило 0-2 мм рт. ст. среди пациентов, принимавших препарат Джакави®, в то время как в группе пациентов, принимавших плацебо, наблюдается снижение давления на 2-5 мм рт. ст. В группе COMFORT-II средние значения показали небольшую разницу между пациентами с миелофиброзом, принимавшими руксолитиниб, и пациентами в контрольной группе.
За произвольно взятый период базового исследования пациентов с истинной полицитемией, среднее значение систолического артериального давления увеличилось на 0,65 мм рт. ст. среди пациентов, принимавших препарат Джакави®, в то время как в группе пациентов, проходивших лучшую доступную терапию, отмечено снижение давления на 2 мм рт. ст.
Противопоказания
-
повышенная чувствительность к активной субстанции или к любому из вспомогательных веществ
-
беременность и период лактации
Лекарственные взаимодействия
Взаимодействия, обуславливающие снижение дозы
Сильные ингибиторы CYP3A4: у здоровых добровольцев, принимавших сильный ингибитор CYP3A4 кетоконазол в дозе 200 мг 2 раза в сутки в течение 4 дней, значение AUC препарата Джакави® увеличилось на 91%, а период полувыведения удлинился с 3,7 до 6 часов.
При применении препарата Джакави® с сильными ингибиторами CYP3A4 суммарную суточную дозу препарата Джакави® следует снизить примерно на 50%.
Пациентов следует тщательно контролировать на предмет цитопении, а титрование доз следует осуществлять с учетом безопасности и эффективности.
Прочие взаимодействия, подлежащие рассмотрению
Легкие и умеренные ингибиторы CYP3A4: у здоровых добровольцев, принимавших умеренный ингибитор CYP3A4 эритромицин в дозе 500 мг 2 раза в сутки в течение 4 дней, отмечалось 27% повышение AUC препарата Джакави®.
Коррекция дозы не требуется при комбинированном применении препарата Джакави® с легкими и умеренными ингибиторами CYP3A4 (например, эритромицином). Пациентов следует тщательно контролировать на предмет цитопении при назначении терапии умеренными ингибиторами CYP3A4.
Двухкомпонентные умеренные ингибиторы CYP2C9 и CYP3A4 (напр. флуконазол): На основании компьютерного моделирования прогнозировалось увеличение AUC руксолитиниба в 2,9 раза и 4,3 раза при совместном введении 200 мг или 400 мг флуконазола, соответственно. Снижение дозы на 50% должно быть предусмотрено при использовании лекарственных препаратов, которые являются двухкомпонентными ингибиторами ферментов CYP2C9 и CYP3A4. Рекомендуется избегать сопутствующего применения Джакави® с флуконазолом в дозировке свыше 200 мг в день.
Индукторы CYP3A4: при назначении индукторов CYP3A4 коррекция дозы не требуется. Возможно рассмотрение постепенного повышения дозы препарата Джакави® при снижении эффективности терапии во время применения индукторов CYP3A.
У здоровых добровольцев, получавших сильный индуктор CYP3A4 рифампицин в дозе 600 мг 1 раз в сутки в течение 10 дней, отмечалось снижение значения AUC препарата Джакави® на 71% после принятия однократной дозы и сокращение периода полувыведения с 3,3 до 1,7 часа. Относительное количество активных метаболитов по отношению к исходному веществу повысилось.
Р-гликопротеин и другие транспортеры: коррекция дозы при комбинированном применении препарата Джакави® с веществами, взаимодействующими с Р-гликопротеином и другими транспортерами, не требуется.
Субстраты CYP3A4: исследование здоровых пациентов показало, что препарат Джакави® не имел клинически значимого фармакокинетического взаимодействия с мидазоламом (субстратом СYP3A4).
Пероральные контрацептивы: исследование здоровых пациентов показало, что препарат Джакави® не воздействует на фармакокинетику пероральных контрацептивов, содержащих этинилэстрадиол и левоноргестрел. Поэтому не ожидается, что контрацептивная эффективность данного сочетания будет поставлена под угрозу совместным принятием руксолитиниба.
Особые указания
Лечение препаратом Джакави® может приводить к развитию гематологических нежелательных реакций, включающих тромбоцитопению, анемию и нейтропению. До начала лечения препаратом Джакави® необходимо провести общий анализ крови.
Пациенты с низким количеством тромбоцитов (<200.000/мм3) в начале терапии имеют более высокую вероятность развития тромбоцитопении во время терапии препаратом Джакави®. Тромбоцитопения, в целом, обратима и обычно корректируется снижением дозы или временным прекращением приема препарата Джакави®. Тем не менее, в некоторых случаях, могут потребоваться трансфузии концентратов тромбоцитов.
При развитии анемии у пациентов может потребоваться также переливание эритроцитной массы. Кроме того, необходимо рассмотреть коррекцию дозы либо о прекращении применения препарата Джакави®.
Нейтропения (абсолютное число нейтрофилов (АЧН) <500/мм3), в целом, обратима и корректируется временным прекращением приема препарата Джакави®.
Общий анализ крови необходимо контролировать по клиническим показаниям, а корректировку дозы проводить по мере необходимости.
Инфекции
Перед назначением препарата Джакави® следует оценить наличие и риск развития тяжелых бактериальных, микобактериальных, грибковых и вирусных инфекций. У пациентов, принимавших препарат Джакави® при миелофиброзе, отмечался туберкулез. Необходимо уделять внимание вероятности латентного или активного туберкулеза. Терапия препаратом Джакави® не должна начинаться до разрешения тяжелого активного инфекционного процесса. Врач должен вести тщательное наблюдение за пациентами, получающими препарат Джакави® на предмет развития симптомов инфекции, и в случае необходимости, незамедлительно начинать соответствующее лечение.
Сообщалось о случаях увеличения вирусной нагрузки гепатита B (титр HBV-ДНК) с и без сопутствующего увеличения показателей аланинаминотрансферазы и аспартатаминотрансферазы у пациентов с хроническими вирусными гепатитами B, принимающих Джакави®. Воздействие Джакави® на вирусную репликацию у пациентов с хронической формой вирусного гепатита B не известно. Пациенты с хроническим вирусным гепатитом B должны наблюдаться и контролироваться в соответствии с клиническими рекомендациями.
Опоясывающий герпес
Перед назначением препарата Джакави® врач должен обучить пациентов своевременному выявлению ранних симптомов опоясывающего герпеса, сообщив о необходимости раннего начала лечения.
Прогрессирующая мультифокальная лейкоэнцефалопатия
Прогрессирующая мультифокальная лейкоэнцефалопатия (ПМЛ) отмечалась при терапии миелофиброза с применением руксолитиниба. Врачи должны быть особо бдительны к появлению психоневрологических симптомов, указывающих на ПМЛ.
Немеланомный рак кожи (НМРК)
Случаи немеланомного рака кожи включая базалиому, плоскоклеточный рак и клеточную карциному Меркеля были зарегистрированы у пациентов, принимавших препарат Джакави®. Большинство из этих пациентов имели историю длительного лечения гидроксимочевиной и предшествовавших НМРК или предраковых поражений кожи. Не было установлено причинно-следственной связи с руксолитинибом. Для пациентов, которые находятся в группе повышенного риска развития рака кожи, рекомендуется периодическое исследование кожи.
Пациенты с нарушением функции почек
Начальную дозу препарата Джакави® необходимо снизить для пациентов с тяжелым нарушением функции почек. Для лиц с терминальной стадией почечной недостаточности, находящихся на гемодиализе, начальная доза должна базироваться на основании количества тромбоцитов тогда как для рекомендуемая начальная доза для пациентов с истинной полицитемией составляет 10 мг, однократно. Последующие дозы препарата, для пациентов с миелофиброзом и истинной полицитемией следует принимать в дни проведения диализа после завершения каждой процедуры гемодиализа. Дополнительные изменения в режиме дозирования препарата следует проводить на фоне тщательного контроля безопасности и эффективности применения препарата.
Пациенты с нарушением функции печени
Начальную дозу препарата Джакави® следует снизить для пациентов с нарушением функции печени. Дальнейшие изменения доз препарата необходимо проводить с учетом безопасности и эффективности его применения.
Взаимодействия
При применении препарата Джакави® с мощными ингибиторами CYP ЗА4 или двухкомпонентными ингибиторами ферментов CYP2С9 и CYPЗА4 (например, флуконазолом) стандартную дозу препарата Джакави® следует снизить на 50%.
Синдром отмены
После отмены терапии ожидается возвращение симптомов, связанных с миелофиброзом.
Дети
Безопасность и эффективность препарата Джакави® у детей младше 18 лет не установлена.
Беременность и период лактации
Женщинам детородного возраста необходимо принимать меры предосторожности для предотвращения беременности во время терапии. В случае беременности необходимо провести индивидуальную оценку риск/пользы с тщательной консультацией относительно потенциального риска для плода.
Адекватных и контролируемых исследований препарата Джакави® у беременных женщин не проводилось.
Руксолитиниб не проявил тератогенного действия у крыс и кроликов в исследованиях внутриутробного развития плода. Эмбриотоксичность и фетотоксичность руксолитиниба отмечена у крыс (повышение постимплантационной гибели плода и снижение фетального веса).
Потенциальный риск для человека не известен. Не рекомендуется применять препарат Джакави® во время беременности.
Женщины, принимающие препарат, не должны кормить грудью.
У лактирующих крыс руксолитиниб и/или его метаболиты выделялись в грудное молоко с концентрацией, превышающей в 13 раз материнскую плазменную концентрацию. Неизвестно, выделяется ли препарат Джакави® в грудное молоко человека.
Фертильность
Данные о влиянии руксолитиниба на фертильность у человека отсутствует. В исследованиях на животных влияние на фертильность или репродуктивный потенциал особей мужского и женского полов не обнаружено. В пре- и постнатальном исследовании у крыс фертильность у первого поколения потомства также не была подвержена влиянию.
Особенности влияния лекарственного средства на способность управлять автотранспортом или другими потенциально опасными механизмами
Исследования влияния препарата на способность к вождению и работе с механизмами не проводились. Учитывая возможность развития некоторых побочных эффектов на фоне приема препарата Джакави® (головокружение) пациентам следует соблюдать осторожность при управлении транспортными средствами и занятиях другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания.
Передозировка
Симптомы: применение руксолитиниба однократно в дозе до 200 мг переносилось удовлетворительно. Превышение рекомендуемых доз ассоциировалось с усилением миелосупрессии, что проявлялось лейкопенией, анемией и тромбоцитопенией.
Лечение: симптоматическая терапия. Гемодиализ не способствует ускорению выведения руксолитиниба из организма. Антидот к руксолитинибу неизвестен.
Форма выпуска и упаковка
По 14 таблеток помещают в контурную ячейковую упаковку из прозрачной бесцветной ламинированной пластиковой пленки поливинилхлоридной/полихлортрифторэтиленовой и фольги алюминиевой печатной лакированной.
По 4 контурные упаковки вместе с инструкцией по медицинскому применению на государственном и русском языках вкладывают в картонную пачку.
Условия хранения
Хранить при температуре не выше 30 С.
Хранить в недоступном для детей месте!
Срок хранения
2 года
Препарат не следует использовать после окончания срока годности, указанного на упаковке.
Условия отпуска из аптек
По рецепту
Производитель
Новартис Фарма Штейн АГ, Швейцария
Владелец регистрационного удостоверения
Новартис Фарма АГ, Швейцария
Адрес организации, принимающей претензии от потребителя по качеству продукта (товара) и ответственной за пострегистрационное наблюдение за безопасностью лекарственного средства на территории Республики Казахстан
Филиал Новартис Фарма Сервисэз АГ в Казахстане
050051 г. Алматы, ул. Луганского, 96
тел.: (727) 258-24-47
факс: (727) 244-26-51
e-mail: drugsafety.cis@novartis.com
EU SPC от 02.06.2015 (2015-PSB/GLC-0744-s от 06.05.2015)
| 580676491477976421_ru.doc | 156 кб |
| 084040211477977674_kz.doc | 172 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники