22.09.2022
Описание препарата Клайра® (набор таблеток, покрытых пленочной оболочкой) основано на официальной инструкции, утверждено компанией-производителем в 2022 году
Дата согласования: 22.09.2022
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
- Отзывы
Действующее вещество
ATX
Фармакологическая группа
Состав
| Таблетки, покрытые пленочной оболочкой разного цвета | 1 бл. |
| Таблетки, покрытые пленочной оболочкой темно-желтого цвета | 1 табл. |
| ядро | |
| действующее вещество: | |
| эстрадиола валерат, микро 20 | 3,000 мг |
| вспомогательные вещества: лактозы моногидрат — 48,360 мг; крахмал кукурузный — 14,400 мг; крахмал кукурузный прежелатинизированный — 9,600 мг; повидон 25 — 4,000 мг; магния стеарат — 0,640 мг | |
| оболочка пленочная: гипромеллоза — 1,5168 мг; макрогол 6000 — 0,3036 мг; тальк — 0,3036 мг; титана диоксид — 0,5840 мг; краситель железа оксид желтый — 0,2920 мг | |
| Таблетки, покрытые пленочной оболочкой розового цвета | 1 табл. |
| ядро | |
| действующие вещества: | |
| эстрадиола валерат, микро 20 | 2,000 мг |
| диеногест, микро | 2,000 мг |
| вспомогательные вещества: лактозы моногидрат — 47,360 мг; крахмал кукурузный — 14,400 мг; крахмал кукурузный прежелатинизированный — 9,600 мг; повидон 25 — 4,000 мг; магния стеарат — 0,640 мг | |
| оболочка пленочная: гипромеллоза — 1,51680 мг; макрогол 6000 — 0,30360 мг; тальк — 0,30360 мг; титана диоксид — 0,83694 мг; краситель железа оксид красный — 0,03906 мг | |
| Таблетки, покрытые пленочной оболочкой бледно-желтого цвета | 1 табл. |
| ядро | |
| действующие вещества: | |
| эстрадиола валерат, микро 20 | 2,000 мг |
| диеногест, микро | 3,000 мг |
| вспомогательные вещества: лактозы моногидрат — 46,360 мг; крахмал кукурузный — 14,400 мг; крахмал кукурузный прежелатинизированный — 9,600 мг; повидон 25 — 4,000 мг; магния стеарат — 0,640 мг | |
| оболочка пленочная: гипромеллоза — 1,51680 мг; макрогол 6000 — 0,30360 мг; тальк — 0,30360 мг; титана диоксид — 0,83694 мг; краситель железа оксид желтый — 0,03906 мг | |
| Таблетки, покрытые пленочной оболочкой красного цвета | 1 табл. |
| ядро | |
| действующее вещество: | |
| эстрадиола валерат, микро 20 | 1,000 мг |
| вспомогательные вещества: лактозы моногидрат — 50,360 мг; крахмал кукурузный — 14,400 мг; крахмал кукурузный прежелатинизированный — 9,600 мг; повидон 25 — 4,000 мг; магния стеарат — 0,640 мг | |
| оболочка пленочная: гипромеллоза — 1,5168 мг; макрогол 6000 — 0,3036 мг; тальк — 0,3036 мг; титана диоксид — 0,5109 мг; краситель железа оксид красный — 0,3651 мг | |
| Таблетки, покрытые пленочной оболочкой белого цвета (плацебо) | 1 табл. |
| ядро | |
| вспомогательные вещества: лактозы моногидрат — 52,1455 мг; крахмал кукурузный — 24,0000 мг; повидон 25 — 3,0545 мг; магния стеарат — 0,8000 мг | |
| оболочка пленочная: гипромеллоза — 1,0112 мг; тальк — 0,2024 мг; титана диоксид — 0,7864 мг |
Описание лекарственной формы
Темно-желтые таблетки: круглые, двояковыпуклые, покрытые пленочной оболочкой темно-желтого цвета, с гравировкой «DD» в правильном шестиугольнике на одной стороне.
Розовые таблетки: круглые, двояковыпуклые, покрытые пленочной оболочкой розового цвета, с гравировкой «DJ» в правильном шестиугольнике на одной стороне.
Бледно-желтые таблетки: круглые, двояковыпуклые, покрытые пленочной оболочкой бледно-желтого цвета, с гравировкой «DH» в правильном шестиугольнике на одной стороне.
Красные таблетки: круглые, двояковыпуклые, покрытые пленочной оболочкой красного цвета, с гравировкой «DN» в правильном шестиугольнике на одной стороне.
Белые таблетки (плацебо): круглые, двояковыпуклые, покрытые пленочной оболочкой белого цвета, с гравировкой «DT» в правильном шестиугольнике на одной стороне.
Фармакологическое действие
Фармакологическое действие
—
контрацептивное.
Фармакодинамика
Препарат Клайра® представляет собой комбинированный (эстроген + гестаген) пероральный контрацептивный препарат (КОК).
Контрацептивный эффект КОК осуществляется посредством взаимодополняющих механизмов, наиболее важными из которых являются подавление овуляции; повышение вязкости секрета шейки матки, препятствующее проникновению сперматозоидов в полость матки, и изменения в эндометрии, препятствующие имплантации оплодотворенной яйцеклетки. У женщин, принимающих КОК, уменьшаются болезненность и интенсивность менструальноподобных кровотечений, в результате чего снижается риск железодефицитной анемии.
Ограниченные эпидемиологические данные свидетельствуют о том, что риск венозной тромбоэмболии (ВТЭ) при применении препарата Клайра® может находиться в том же диапазоне, что и риск при применении других КОК, включая КОК, содержащие левоноргестрел.
Комбинация диеногеста и эстрадиола валерата обладает благоприятным эффектом в отношении эндометрия, что может быть применимо для лечения обильных и/или длительных менструальных кровотечений без органической патологии. Эффективность и безопасность комбинации диеногеста и эстрадиола валерата в лечении симптомов дисфункционального маточного кровотечения изучены в двух двойных слепых, контролируемых плацебо клинических исследованиях. Оба исследования продемонстрировали клинически и статистически значимое уменьшение менструальной кровопотери. Это сопровождалось статистически значимым улучшением показателей метаболизма железа (гемоглобина (Hb), гематокрита и ферритина).
В качестве эстрогена в препарате Клайра® используется эстрадиола валерат, предшественник естественного 17β-эстрадиола человека (1 мг эстрадиола валерата соответствует 0,76 мг 17β-эстрадиола). Таким образом, эстрадиола валерат отличается от обычно используемых в КОК синтетических эстрогенов — этинилэстрадиола или его предшественника местранола, содержащих этинильную группу в положении 17α. Эта группа обусловливает более высокую метаболическую стабильность, однако также и более выраженное действие на печень.
Применение комбинации диеногеста и эстрадиола валерата оказывает менее выраженное действие на печень в сравнении с трехфазными КОК, содержащими этинилэстрадиол и левоноргестрел. Было показано, что влияние на концентрацию глобулина, связывающего половые гормоны (ГСПГ) и параметры гемостаза менее выражено. В комбинации с диеногестом эстрадиола валерат демонстрирует повышение липопротеидов высокой плотности (ЛПВП), тогда как концентрация холестерина (Хс) и липопротеидов низкой плотности (Хс-ЛПНП) несколько снижается.
Диеногест — это производное нортестостерона, не обладающее андрогенной, но проявляющее антиандрогенную активность, которая составляет примерно 1/3 от активности ципротерона ацетата. Несмотря на низкое сродство к рецепторам прогестерона (диеногест связывается с рецепторами прогестерона в матке с относительной аффинностью, составляющей только 10%), диеногест обладает сильным прогестагенным действием in vivo. Диеногест не обладает значимой андрогенной, минералокортикоидной или глюкокортикоидной активностью in vivo.
При правильном применении индекс Перля (показатель, отражающий частоту наступления беременности у 100 женщин в течение года применения контрацептива) составляет менее 1. При пропуске таблеток или неправильном применении индекс Перля может возрастать.
Фармакокинетика
Диеногест
Абсорбция. После перорального приема диеногест быстро и практически полностью всасывается. Максимальная концентрация (Cmax) в плазме крови, составляющая 90,5 нг/мл, достигается примерно через 1 час после перорального приема таблетки препарата Клайра®, содержащей 2 мг эстрадиола валерата + 3 мг диеногеста. Биодоступность составляет около 91%. Фармакокинетика диеногеста в дозовом диапазоне от 1 до 8 мг характеризуется зависимостью от дозы.
Одновременный прием пищи не оказывает клинически значимого влияния на скорость и степень всасывания диеногеста.
Распределение. Относительно большая (10%) часть циркулирующего диеногеста находится в несвязанном виде, тогда как около 90% неспецифически связано с альбумином. Диеногест не связывается с ГСПГ, и кортикостероидсвязывающим глобулином (КСГ). По этой причине отсутствует возможность вытеснения тестостерона из его связи с ГСПГ или кортизола из его связи с КСГ. Какое-либо влияние на физиологические процессы транспорта эндогенных стероидов, следовательно, является маловероятным. Объем распределения (Vd) диеногеста при равновесной концентрации (Css) составляет 46 л после внутривенного введения 85 мкг меченного тритием диеногеста.
Метаболизм. Диеногест почти полностью метаболизируется, проходя известными путями метаболизма половых гормонов (гидроксилирование, конъюгирование), с образованием преимущественно фармакологически неактивных метаболитов. Метаболиты выводятся очень быстро, так что преобладающей фракцией в плазме крови является неизмененный диеногест.
Общий клиренс после внутривенного (в/в) введения меченного тритием диеногеста — 5,1 л/ч.
Элиминация. Период полувыведения (T1/2) диеногеста из плазмы крови составляет примерно 11 часов. После приема внутрь в дозе 0,1 мг/кг диеногест выводится в виде метаболитов почками и через кишечник в соотношении примерно 3:1. После перорального приема 42% дозы выводится в пределах первых 24 часов, а 63% — в пределах 6 дней путем почечной экскреции. Через 6 дней почками и через кишечник выводится в совокупности 86% дозы.
Равновесная концентрация. Фармакокинетика диеногеста не зависит от концентрации ГСПГ. Css достигается через 3 дня приема одной и той же дозы, составляющей 3 мг диеногеста в сочетании с 2 мг эстрадиола валерата. Минимальная концентрация (Cmin), Cmax и средняя концентрация диеногеста в плазме крови при равновесном состоянии составляют соответственно 11,8; 82,9 и 33,7 нг/мл. Средний коэффициент кумуляции по площади под кривой «концентрация-время» (AUC0–24) — 1,24.
Эстрадиола валерат
Абсорбция. После приема внутрь эстрадиола валерат быстро и полностью абсорбируется. Расщепление на эстрадиол и валериановую кислоту происходит в ходе всасывания в слизистой оболочке желудочно-кишечного тракта (ЖКТ) или во время первого пассажа через печень, в результате чего образуются эстрадиол и его метаболиты — эстрон и эстриол. Cmax эстрадиола в плазме крови, равная 70,6 пг/мл, достигается между 1,5 и 12 часами после разового приема внутрь таблетки, содержащей 3 мг эстрадиола валерата в 1-й день курса. Одновременный прием пищи не оказывает клинически значимого влияния на скорость и степень всасывания эстрадиола валерата.
Метаболизм. Валериановая кислота очень быстро метаболизируется. После приема внутрь примерно 3% дозы становятся непосредственно биодоступными в виде эстрадиола. Эстрадиол подвергается интенсивному эффекту первичного прохождения через печень, и значительная часть введенной дозы метаболизируется уже в слизистой ЖКТ. В совокупности с пресистемным метаболизмом в печени около 95% принятой внутрь дозы метаболизируется до поступления в системную циркуляцию. Основными метаболитами являются эстрон, эстрона сульфат и эстрона глюкуронид.
Распределение. В плазме крови 38% эстрадиола связано с ГСПГ, 60% — с альбумином и 2–3% циркулирует в несвязанном виде. Эстрадиол может незначительно повышать концентрацию ГСПГ в плазме крови; этот эффект зависит от дозы. На 21-й день цикла приема концентрация ГСПГ составляла примерно 148% от исходной, а к 28-му дню (завершение приема таблеток, не содержащих гормоны) снизилась приблизительно до 141% от исходной. Кажущийся объем распределения (Vd) после в/в введения — 1,2 л/кг.
Элиминация. Вследствие большого циркулирующего пула сульфатов и глюкуронидов эстрогена, а также кишечно-печеночной рециркуляции T1/2 эстрадиола в терминальной фазе после перорального приема представляет собой комплексный параметр, который зависит от всех этих процессов и находится в диапазоне около 13–20 часов.
Эстрадиол и его метаболиты выводятся главным образом почками, при этом около 10% выводится через кишечник.
Равновесная концентрация. На фармакокинетику эстрадиола влияет концентрация ГСПГ. У женщин измеряемая концентрация эстрадиола в плазме крови представляет собой совокупность эндогенного эстрадиола и эстрадиола, поступившего при приеме препарата Клайра®. Во время фазы приема таблеток, содержащих 2 мг эстрадиола валерата + 3 мг диеногеста, Cmax и средняя концентрация эстрадиола в плазме крови при равновесном состоянии составляют соответственно 66,0 и 51,6 пг/мл. В течение всего 28-дневного цикла поддерживались стабильные Cmin эстрадиола в диапазоне от 28,7 до 64,7 пг/мл.
Показания
пероральная контрацепция;
терапия обильных и/или длительных менструальных кровотечений без органических причин у женщин, желающих применять пероральные контрацептивы.
Противопоказания
Применение препарата Клайра® противопоказано при наличии любого из заболеваний/состояний или факторов риска, перечисленных ниже.
венозный тромбоз или тромбоэмболия (ВТЭ), в т.ч. тромбоз глубоких вен (ТГВ), тромбоэмболия легочной артерии (ТЭЛА), в настоящее время или в анамнезе;
артериальный тромбоз или тромбоэмболия (АТЭ), в т.ч. инфаркт миокарда, инсульт; или продромальные состояния, в т.ч. транзиторная ишемическая атака, стенокардия;
выявленная наследственная или приобретенная предрасположенность к венозному или артериальному тромбозу, включая резистентность к активированному протеину С, дефицит антитромбина III, дефицит протеина С, дефицит протеина S, гипергомоцистеинемию, антифосфолипидные антитела (антитела к кардиолипину, волчаночный антикоагулянт);
наличие высокого риска развития венозной или артериальной тромбоэмболии ввиду наличия множественных факторов риска (см. раздел «Особые указания») или наличие одного серьезного фактора риска (сахарный диабет с диабетической ангиопатией, неконтролируемая артериальная гипертензия, тяжелая дислипопротеинемия);
объемные оперативные вмешательства с длительной иммобилизацией или обширная травма;
мигрень с очаговой неврологической симптоматикой в настоящее время или в анамнезе;
заболевания печени тяжелой степени (до нормализации показателей функции печени) в настоящее время или в анамнезе;
опухоли печени (доброкачественные и злокачественные) в настоящее время или в анамнезе;
гормонозависимые злокачественные новообразования половых органов или молочных желез (в т.ч. подозрение на них);
кровотечение из влагалища неясной этиологии;
беременность (в т.ч. предполагаемая);
период грудного вскармливания;
гиперчувствительность к диеногесту и/или эстрадиола валерату, и/или к любому из вспомогательных веществ в составе препарата;
непереносимость лактозы, дефицит лактазы, синдром глюкозо-галактозной мальабсорбции.
При возникновении любого из данных заболеваний/состояний или факторов риска на фоне применения препарата, прием препарата следует немедленно прекратить.
С осторожностью
Если какие-либо из состояний/заболеваний или факторов риска, указанных ниже, имеются в настоящее время, следует провести тщательную оценку ожидаемой пользы к возможному риску применения препарата Клайра® для каждой женщины индивидуально и обсудить это до начала приема препарата:
факторы риска развития тромбоза и тромбоэмболий — курение; ожирение; дислипопротеинемия; контролируемая артериальная гипертензия; мигрень без очаговой симптоматики; неосложненные заболевания клапанов сердца; нарушение сердечного ритма; обширные хирургические вмешательства без длительной иммобилизации;
другие заболевания, при которых могут отмечаться нарушения периферического кровообращения: сахарный диабет; системная красная волчанка; гемолитико-уремический синдром; болезнь Крона и язвенный колит; серповидноклеточная анемия;
наследственный ангионевротический отек;
гипертриглицеридемия;
заболевания, впервые возникшие или усугубившиеся во время беременности или на фоне предыдущего приема половых гормонов (например, холестатическая желтуха, холестатический зуд, холелитиаз, отосклероз с ухудшением слуха, порфирия, герпес беременных, хорея Сиденгама);
послеродовый период.
Применение при беременности и кормлении грудью
Беременность. Прием препарата Клайра® в период беременности противопоказан. В случае диагностирования беременности на фоне применения контрацептива следует немедленно прекратить его прием. Многочисленные эпидемиологические исследования не выявили ни увеличения риска возникновения дефектов развития у детей, рожденных женщинами, получавшими половые гормоны до беременности, ни наличия тератогенного действия, когда половые гормоны принимались по неосторожности в ранние сроки беременности.
Период грудного вскармливания. Применение препарата Клайра®, как и других КОК, может уменьшать количество грудного молока и изменять его состав, поэтому прием препарата противопоказан до прекращения грудного вскармливания. Небольшое количество входящих в состав контрацептива гормонов и/или их метаболитов может проникать в грудное молоко. Это может оказывать влияние на ребенка.
Способ применения и дозы
Как и когда принимать препарат Клайра®
Внутрь. Таблетки следует принимать ежедневно в указанном на упаковке порядке, независимо от приема пищи, приблизительно в одно и то же время, и запивать водой. Прием таблеток осуществляется непрерывно. Следует принимать по одной таблетке в сутки последовательно в течение 28 дней. Прием таблеток из каждой новой упаковки начинают после приема последней таблетки из предшествующей календарной упаковки. Менструальноподобное кровотечение обычно начинается во время приема последних таблеток календарной упаковки (второй красной таблетки или белых таблеток) и может еще не завершиться до начала приема таблеток из следующей календарной упаковки. У некоторых женщин кровотечение продолжается после приема первых таблеток из новой календарной упаковки.
Подготовка книжки-раскладушки
Для того чтобы следить за приемом таблеток, к упаковке прилагаются 7 наклеек с проставленными на них названиями 7 дней недели.
Необходимо выбрать наклейку, которая начинается с того дня недели, в который женщина приступает к приему таблеток. Например, если прием начинается в среду, следует использовать наклейку, которая начинается со слова «CP».
Наклейка наносится на верхнюю часть раскладывающейся упаковки препарата Клайра®, где расположена надпись «Сюда наклеить календарь», так, чтобы название первого дня находилось над таблеткой с номером 1.
Теперь над каждой таблеткой находится название соответствующего дня недели, и видно, была ли уже принята таблетка в тот или иной день или нет. Необходимо следовать направлению стрелки на книжке-раскладушке, пока не будут приняты все 28 таблеток.
Следующую упаковку начинают без перерыва, т.е. на следующий день после того, как закончена текущая упаковка, даже если кровотечение не прекратилось. Это означает, что следующую упаковку следует начинать в тот же самый день недели, что и текущую, и что менструальноподобное кровотечение должно выпадать каждый месяц на одни и те же дни недели.
Если препарат Клайра® используется, как указано в инструкции, женщина защищена от нежелательной беременности даже в течение тех двух дней, когда она принимает неактивные таблетки.
Начало приема таблеток из первой упаковки
Если в прошлом месяце гормональные контрацептивы не применялись. Начинают прием препарата Клайра® в первый день цикла, т.е. в первый день менструального кровотечения.
Если женщина переходит на прием препарата Клайра® с других КОК, комбинированного контрацептивного вагинального кольца или трансдермального пластыря. Начинают прием препарата Клайра® на следующий день после того, как была принята последняя таблетка, содержащая гормоны (таблетка с действующими веществами) из текущей упаковки КОК. Если в упаковке предыдущего КОК есть таблетки, не содержащие гормоны, их надо выбросить и начинать прием из первой упаковки препарата Клайра®, не делая перерыва. Если ранее женщина пользовалась комбинированным контрацептивным вагинальным кольцом или трансдермальным пластырем, принимать препарат Клайра® следует начинать в день удаления кольца/пластыря.
При переходе с контрацептивных препаратов, содержащих только гестаген (мини-пили, инъекционные формы, имплантат) или с внутриматочной терапевтической системы с высвобождением гестагена. Перейти с «мини-пили» на прием препарата Клайра® можно в любой день (без перерыва), с имплантата или внутриматочного контрацептива с высвобождением гестагена — в день его удаления, с инъекционной формы — со дня, когда должна была быть сделана следующая инъекция. Во всех случаях в течение первых 9 дней приема таблеток препарата Клайра® необходимо использовать дополнительный барьерный метод контрацепции (например, презерватив).
После аборта в I триместре беременности. Женщина может начать прием таблеток немедленно. В этом случае в дополнительных мерах контрацепции нет необходимости.
После родов или прерывания беременности (в т.ч. самопроизвольного) во II триместре. Начинать прием препарата следует на 21–28-й день после родов (при отсутствии грудного вскармливания) или сразу после прерывания беременности (в т.ч. самопроизвольного) во II триместре. Если прием препарата начат позднее, необходимо использовать дополнительно барьерный метод контрацепции в течение первых 9 дней приема таблеток. Если половой контакт имел место до начала приема препарата Клайра®, должна быть исключена беременность или следует дождаться первой менструации.
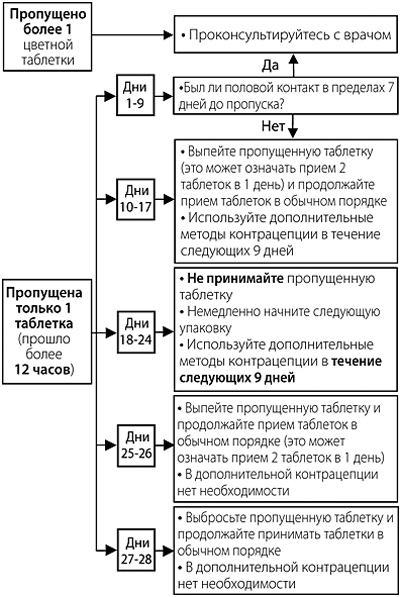
Рекомендации в случае пропуска таблеток
Пропущенными (белыми) таблетками, не содержащими гормоны, можно пренебречь. Однако их следует выбросить во избежание непреднамеренного продления интервала между приемом таблеток с гормонами.
Следующие рекомендации относятся исключительно к пропуску таблеток с гормонами:
— если задержка в приеме таблетки с гормонами составляет менее 12 часов, контрацептивная защита не снижается. Женщина должна выпить пропущенную таблетку сразу, как только вспомнит об этом, а остальные таблетки принимать в обычное время.
— если задержка в приеме таблетки с гормонами составляет более 12 часов, контрацептивная защита может снизиться. Женщина должна принять последнюю пропущенную таблетку сразу, как только вспомнит об этом, даже если это будет означать, что ей придется выпить 2 таблетки одновременно. Затем она продолжит прием таблеток в обычное время.
В зависимости от дня менструальноподобного цикла, в который была пропущена таблетка (подробнее см. таблицу 1), требуется применять дополнительные меры контрацепции (например, барьерный метод предохранения, в частности презервативы) в соответствии со следующими рекомендациями:
Таблица 1
Рекомендации в случае пропуска таблеток
| День | Цвет, содержание эстрадиола валерата (ЭВ) и диеногеста (ДНГ) | Рекомендации, которым требуется следовать, если была пропущена одна таблетка и прошло более 12 часов |
| 1–2-й | Темно-желтые таблетки (3,0 мг ЭВ) | Принять пропущенную таблетку немедленно, а следующую таблетку — в обычное время (даже если это означает, что придется принять 2 таблетки в один день). Продолжить принимать таблетки в обычном порядке, использовать дополнительные меры контрацепции в течение 9 последующих дней. |
| 3–7-й | Розовые таблетки (2,0 мг ЭВ + 2,0 мг ДНГ) | |
| 8–17-й | Бледно-желтые таблетки (2,0 мг ЭВ + 3,0 мг ДНГ) | |
| 18–24-й | Бледно-желтые таблетки (2,0 мг ЭВ + 3,0 мг ДНГ) | Выбросить текущую календарную упаковку и немедленно начать прием с первой таблетки из новой календарной упаковки. Продолжить принимать таблетки в обычном порядке. Использовать дополнительные меры контрацепции в течение последующих 9 дней |
| 25–26-й | Красные таблетки (1,0 мг ЭВ) | Немедленно принять пропущенную таблетку, а следующую таблетку — в обычное время (даже если это означает, что придется принять 2 таблетки в один день). В дополнительных мерах контрацепции нет необходимости |
| 27–28-й | Белые таблетки (плацебо) | Выбросить пропущенную таблетку и продолжить прием таблеток в обычном порядке. В дополнительных мерах контрацепции нет необходимости |
Допускается принимать не более 2 таблеток в один день.
Если женщина забыла начать новую календарную упаковку или пропустила одну или более таблеток с 3-го по 9-й день календарной упаковки, она уже может быть беременна (в том случае, если у нее был половой контакт в течение 7 дней перед пропуском таблетки). Чем больше таблеток (особенно с комбинацией диеногеста и эстрадиола валерата в дни с 3-го по 24-й) пропущено и чем ближе они к фазе приема неактивных таблеток (белых), тем выше вероятность беременности.
Если женщина пропускала прием таблеток и затем в конце календарной упаковки/в начале новой календарной упаковки менструальноподобное кровотечение у нее отсутствовало, следует рассмотреть вероятность беременности.
Для удобства данная информация представлена на упаковке в виде следующей схемы.
Рекомендации при желудочно-кишечных расстройствах
Если после приема любой из 26 активных таблеток препарата Клайра® у женщины начинается рвота или сильная диарея, всасывание действующих веществ может быть неполным. Если рвота произошла через 3–4 часа после приема активной таблетки, это равнозначно пропуску таблетки. Поэтому в этом случае следует учитывать информацию, указанную в разделе Рекомендации в случае пропуска таблеток. Если женщина не хочет менять свою обычную схему приема, дополнительную таблетку того же цвета следует принять из другой упаковки. Рвота или диарея в дни приема последних 2 неактивных таблеток не оказывают никакого влияния на эффективность контрацепции.
Как прекратить принимать препарат Клайра®
Можно прекратить прием препарата Клайра® в любое время. Если женщина не планирует беременность, следует позаботиться о других методах контрацепции. Если планируется беременность, следует просто прекратить прием препарата Клайра®.
Дополнительная информация для особых категорий пациенток
Дети и подростки. Данные по эффективности и безопасности по применению препарата у девочек-подростков до 18 лет отсутствуют.
Пациентки пожилого возраста. Не применимо. Препарат Клайра® не показан после наступления менопаузы.
Нарушения функции печени. Препарат Клайра® противопоказан у женщин с тяжелыми заболеваниями печени до тех пор, пока показатели функции печени не придут в норму (см. раздел «Противопоказания»).
Нарушения функции почек. Препарат Клайра® специально не изучался у пациенток с нарушениями функции почек. Имеющиеся данные не предполагают коррекции режима дозирования у таких пациенток.
Побочные действия
Возможные нежелательные реакции при применении препарата Клайра® приведены в таблице ниже в соответствии с системно-органным классам MedDRA. Частоты определяются как часто (≥1/100 и <1/10); нечасто (≥1/1000 и <1/100) и редко (≥1/10000 и <1/1000) (см. таблицу 2).
Таблица 2
Нежелательные эффекты при применении препарата Клайра®
| Системно-органный класс | Часто | Нечасто | Редко |
| Инфекционные и паразитарные заболевания | − | Грибковая инфекция, инфекция влагалища неуточненная, кандидозный вульвагинит | Кандидоз, оральный герпес, синдром гистоплазмоза глаз, опоясывающий лишай, инфекция мочевыводящих путей, бактериальный вагинит, воспалительные заболевания органов малого таза |
| Нарушения со стороны обмена веществ и питания | − | Повышение аппетита | Задержка жидкости, гипертриглицеридемия |
| Нарушения со стороны нервной системы | Головная боль (в т.ч. головная боль напряжения), боль в области пазух носа | Головокружение, мигрень (в т.ч. с аурой и без ауры) | Нарушение внимания, парестезии, вертиго |
| Нарушения со стороны психики | − | Депрессия/снижение настроения, снижение либидо, психические нарушения, перепады настроения, аффективная лабильность, бессонница | Агрессивность, тревожность, дисфория, повышение либидо, нервозность, беспокойство, нарушение сна, стресс |
| Нарушения со стороны зрения | − | − | Непереносимость контактных линз, сухость слизистой оболочки глаз, отек век |
| Нарушения со стороны сосудов | − | Повышение артериального давления (АД), «приливы» | Кровотечение из варикознорасширенных вен, снижение АД, боли по ходу вен, ВТЭ, АТЭ, флебит поверхностных вен, тромбофлебит |
| Нарушения со стороны сердца | − | − | Инфаркт миокарда, ощущение сердцебиения |
| Нарушения со стороны ЖКТ | Боли в животе, вздутие живота, тошнота | Диарея, рвота | Запор, диспепсия, гастроэзофагеальный рефлюкс, сухость во рту |
| Нарушения со стороны печени и желчевыводящих путей | − | Повышение активности печеночных ферментов (аланинаминотрансферазы, аспартатаминотрансферазы, гамма-глутамилтрансферазы) | Фокальная нодулярная гиперплазия печени, хронический холецистит |
| Нарушения со стороны кожи и подкожных тканей | Акне | Алопеция, зуд (в т.ч. генерализованный и зудящая сыпь), сыпь (в т.ч. пятнистая сыпь), гипергидроз | Аллергическая кожная реакция, включая аллергический дерматит и крапивницу, хлоазма, дерматит, гирсутизм, гипертрихоз, нейродерматит, нарушение пигментации, себорея, поражение кожи, в т.ч. нарушение тургора кожи |
| Нарушения со стороны скелетно-мышечной и соединительной ткани | − | Мышечные спазмы | Боли в спине, ощущение тяжести, боль в челюсти |
| Нарушения со стороны почек и мочевыводящих путей | − | − | Боль в области мочевыводящих путей |
| Нарушения со стороны половых органов и молочной железы | Отсутствие менструальноподобных кровотечений, дискомфорт в молочных железах, боли в молочных железах, болезненность сосков, боли в сосках, болезненное менструальноподобное кровотечение, нерегулярные менструальноподобные кровотечения (метроррагия) | Увеличение молочных желез, диффузное уплотнение молочных желез, дисплазия эпителия шейки матки, дисфункциональное маточное кровотечение, диспареуния, фиброзно-кистозная мастопатия, обильное менструальноподобное кровотечение, киста яичника, боли в тазовой области, предменструальный синдром, лейомиома матки, спазм мышц матки, выделения из влагалища, сухость слизистой оболочки вульвы и влагалища, кровянистые выделения/кровотечения из влагалища, в т.ч. «мажущие» выделения | Доброкачественное новообразование в молочной железе, в т.ч. киста молочной железы, рак молочной железы in situ, полип шейки матки, кровотечение во время полового сношения, галакторея, скудные кровянистые менструальноподобные выделения, задержка менструальноподобного кровотечения, разрыв кисты яичника, ощущение жжения во влагалище, запах из влагалища, вульвовагинальный дискомфорт |
| Нарушения со стороны крови и лимфатической системы | − | − | Лимфаденопатия |
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | − | − | Бронхиальная астма, одышка, носовое кровотечение |
| Общие расстройства | Повышение массы тела | Раздражительность, периферические отеки, снижение массы тела, утомляемость | Боль в груди, недомогание, лихорадка |
| Лабораторные инструментальные данные | − | Повышение или снижение АД | Патологические результаты цитологического исследования по Папаниколау |
Нежелательные реакции с очень низкой частотой возникновения или с отсроченным развитием, связанные с применением КОК:
Опухоли
— у женщин, применяющих КОК, незначительно повышена частота выявления рака молочной железы (РМЖ). Поскольку РМЖ редко встречается у женщин моложе 40 лет, превышение частоты незначительно по отношению к общему риску возникновения РМЖ. Причинная связь возникновения РМЖ с применением КОК не установлена;
— опухоли печени (доброкачественные и злокачественные).
Прочие состояния:
— артериальные и венозные тромбозы и тромбоэмболические осложнения;
— узловатая эритема, многоформная эритема;
— выделения из молочных желез;
— гипертриглицеридемия (повышенный риск развития панкреатита при применении КОК);
— повышение АД;
— наступление или ухудшение состояний, при которых связь с применением КОК не является неоспоримой: желтуха и/или зуд, связанные с холестазом; образование камней желчного пузыря; порфирия; системная красная волчанка; гемолитико-уремический синдром; хорея Сиденгама; герпес во время беременности; потеря слуха, связанная с отосклерозом; эпилепсия;
— у женщин с наследственным ангионевротическим отеком экзогенные эстрогены могут вызвать или усилить симптомы ангионевротического отека;
— нарушения функции печени;
— нарушения толерантности к глюкозе или влияние на периферическую инсулинорезистентность;
— болезнь Крона, язвенный колит;
— хлоазма;
— гиперчувствительность (включая такие симптомы как сыпь, крапивница).
Взаимодействие
Взаимодействия других препаратов (индукторов ферментов) с пероральными контрацептивами могут приводить к «прорывным» кровотечениям и/или снижению контрацептивного эффекта (см. раздел «Взаимодействие»).
Взаимодействие
Влияние других лекарственных средств на комбинацию диеногеста и эстрадиола валерата
Возможно взаимодействие с лекарственными средствами, индуцирующими микросомальные ферменты печени, в результате чего может увеличиваться клиренс половых гормонов, что, в свою очередь, может приводить к «прорывным» маточным кровотечениям и/или снижению контрацептивного эффекта.
Тактика ведения. Индукция микросомальных ферментов печени может наблюдаться уже через несколько дней совместного применения препаратов-индукторов и препарата Клайра® и сохраняться до 4 недель после его окончания.
Краткосрочное лечение. Женщинам, которые получают лечение препаратами, индуцирующими микросомальные ферменты печени, следует временно использовать барьерный метод контрацепции или выбрать другой негормональный метод контрацепции в дополнение к приему препарата Клайра®. Барьерный метод контрацепции следует использовать в течение всего периода приема сопутствующих препаратов и в течение 28 дней после их отмены. Если прием сопутствующих препаратов продолжается после того, как закончились таблетки с гормонами в упаковке препарата Клайра®, необходимо выбросить таблетки без гормонов (плацебо) и сразу же начинать прием таблеток, содержащих гормоны, из новой упаковки контрацептива.
Длительное лечение. Женщинам, которые получают длительное лечение препаратами, индуцирующими микросомальные ферменты печени, рекомендуется рассмотреть другой эффективный негормональный метод контрацепции.
Вещества, увеличивающие клиренс КОК (снижающие эффективность путем индукции ферментов): фенитоин, барбитураты, бозентан, примидон, карбамазепин, рифампицин и, возможно, также окскарбазепин, топирамат, фелбамат, гризеофульвин, а также препараты, содержащие зверобой продырявленный.
Одновременный прием рифампицина вместе с таблетками, содержащими эстрадиола валерат и диеногест, приводил к существенному снижению равновесной концентрации и системной экспозиции диеногеста и эстрадиола.
Системная экспозиция диеногеста и эстрадиола при равновесной концентрации, измеряемая на основе AUC0–24, снизилась, соответственно, на 83 и 44%.
Вещества с различным влиянием на клиренс КОК. При совместном применении с КОК многие ингибиторы протеаз ВИЧ или вируса гепатита С и ненуклиозидные ингибиторы обратной транскриптазы могут как увеличивать, так и уменьшать концентрацию эстрогена или прогестина в плазме крови. В некоторых случаях такое влияние может быть клинически значимо.
Вещества, снижающие клиренс КОК (ингибиторы ферментов). Диеногест является субстратом CYP3A4. Сильные и средней мощности ингибиторы CYP3A4, такие как азольные антимикотики (например, итраконазол, вориконазол, флуконазол), верапамил, макролиды (например, кларитромицин, эритромицин), дилтиазем и грейпфрутовый сок могут повышать плазменные концентрации эстрогена или прогестина, или их обоих. При одновременном приеме с сильным ингибитором кетоконазолом величина AUC0–24 в равновесном состоянии у диеногеста возросла в 2,86 раза, а у эстрадиола — в 1,57 раза. При одновременном применении с умеренным ингибитором эритромицином величина AUC0–24 у диеногеста и эстрадиола в равновесном состоянии увеличилась, соответственно, в 1,62 и 1,33 раза.
Влияние КОК на другие лекарственные препараты. КОК могут влиять на метаболизм других препаратов, что приводит к повышению (например, циклоспорин) или снижению (например, ламотриджин) их концентрации в плазме крови и тканях. Однако, исходя из данных исследований in vitro, ингибирование ферментов CYP при применении препарата Клайра® в терапевтической дозе маловероятно.
Несовместимость. Отсутствует.
Передозировка
О серьезных нарушениях при передозировке препарата Клайра® не сообщалось.
На основании суммарного опыта применения КОК симптомы, которые могут отмечаться при передозировке КОК: тошнота, рвота, «мажущие» кровянистые выделения или метроррагия.
Лечение: симптоматическое.
Особые указания
Если какие-либо из состояний/заболеваний или факторов риска, указанных ниже, имеются в настоящее время, следует провести тщательную оценку ожидаемой пользы к возможному риску применения препарата Клайра® для каждой женщины индивидуально и обсудить это до начала приема препарата.
В случае утяжеления, усиления или первого проявления любого из этих состояний, заболеваний или факторов риска, женщина должна проконсультироваться со своим врачом, который может принять решение о необходимости прекращения приема препарата.
Следующая информация о необходимости соблюдения мер предосторожности основана, главным образом, на данных клинических и эпидемиологических исследований с КОК, содержащими этинилэстрадиол.
Риск развития ВТЭ и АТЭ. Результаты эпидемиологических исследований указывают на наличие взаимосвязи между применением КОК и повышением частоты развития венозных и артериальных тромбозов и тромбоэмболий (таких как ТГВ и ТЭЛА, инфаркт миокарда, цереброваскулярные нарушения). Данные заболевания отмечаются редко. Повышенный риск присутствует после первоначального применения КОК или возобновления применения после перерыва в 4 недели и более. Наибольший риск развития ВТЭ наблюдается в первый год применения КОК, преимущественно в течение первых 3 месяцев. Применение любого КОК увеличивает риск ВТЭ по сравнению с отсутствием применения. Препараты, содержащие левоноргестрел, норгестимат или норэтистерон, связаны с самым низким риском развития ВТЭ. Ограниченные данные свидетельствуют о том, что препарат Клайра® может иметь риск ВТЭ в том же диапазоне. Выбор в пользу приема препарата Клайра®, а не одного из препаратов, имеющих самый низкий риск развития ВТЭ, должен быть сделан только после обсуждения с женщиной, позволяющего убедиться, что она полностью понимает риск ВТЭ, связанный с применением КОК; влияние существующих у нее факторов риска на риск ВТЭ и то, что риск развития ВТЭ максимален в первый год применения КОК.
ВТЭ может оказаться жизнеугрожающей или привести к летальному исходу (в 1–2% случаев). Крайне редко при применении КОК возникает тромбоз других кровеносных сосудов, например, печеночных, брыжеечных, почечных, мозговых вен и артерий или сосудов сетчатки глаза.
Симптомы тромбоза глубоких вен: односторонний отек или отек вдоль вены, боль или дискомфорт в нижней конечности только в вертикальном положении или при ходьбе, локальное повышение температуры, покраснение или изменение окраски кожных покровов нижней конечности.
Симптомы тромбоэмболии легочной артерии: затрудненное или учащенное дыхание; внезапный кашель, в т.ч. с кровохарканием; острая боль в грудной клетке, которая может усиливаться при глубоком вдохе; чувство тревоги; сильное головокружение; учащенное или нерегулярное сердцебиение. Некоторые из этих симптомов (например, одышка, кашель) являются неспецифическими и могут быть истолкованы неверно, как признаки других более часто встречающихся и менее тяжелых состояний/заболеваний (например, инфекции дыхательных путей). Артериальная тромбоэмболия может привести к инсульту, окклюзии сосудов или инфаркту миокарда.
Симптомы инсульта: внезапная слабость или потеря чувствительности лица, конечностей, особенно с одной стороны тела, внезапная спутанность сознания, проблемы с речью и пониманием; внезапная одно- или двухсторонняя потеря зрения; внезапное нарушение походки, головокружение, потеря равновесия или координации движений; внезапная, тяжелая или продолжительная головная боль без видимой причины; потеря сознания или обморок с судорожным приступом или без него.
Другие признаки окклюзии сосудов: внезапная боль, отечность и незначительная синюшность конечностей, «острый» живот.
Симптомы инфаркта миокарда: боль, дискомфорт, давление, тяжесть, чувство сжатия или распирания в груди или за грудиной, с иррадиацией в спину, челюсть, левую верхнюю конечность, область эпигастрия; холодный пот, тошнота, рвота или головокружение, сильная слабость, тревога или одышка; учащенное или нерегулярное сердцебиение.
Артериальная тромбоэмболия может оказаться жизнеугрожающей или привести к летальному исходу. У женщин с сочетанием нескольких факторов риска или высокой выраженностью одного из них следует рассматривать возможность их взаимоусиления. В подобных случаях степень повышения риска тромбообразования может оказаться более высокой. В таком случае прием комбинации диеногеста и эстрадиола валерата противопоказан.
Риск развития тромбоза (венозного и/или артериального), тромбоэмболии или цереброваскулярных нарушений повышается:
— с возрастом;
— у курящих (с увеличением количества сигарет или повышением возраста риск нарастает, особенно у женщин старше 35 лет);
при наличии:
— ожирения (индекс массы тела 30 кг/м2 и более);
— семейного анамнеза (например, венозной или артериальной тромбоэмболии когда-либо у близких родственников или родителей в возрасте менее 50 лет). В случае наследственной или приобретенной предрасположенности женщина должна быть осмотрена соответствующим специалистом для решения вопроса о возможности приема контрацептива;
— дислипопротеинемии;
— артериальной гипертензии;
— мигрени;
— заболеваний клапанов сердца;
— фибрилляции предсердий;
— длительной иммобилизации, обширного хирургического вмешательства, любой операции на нижних конечностях или обширной травмы.
В этих случаях прием препарата необходимо прекратить (в случае планируемой операции, по крайней мере, за 4 недели до нее) и не возобновлять прием в течение 2 недель после окончания иммобилизации.
Временная иммобилизация (например, авиаперелет длительностью более 4 часов) может также являться фактором риска развития ВТЭ, особенно при наличии других факторов риска. Вопрос о возможной роли варикозного расширения вен и поверхностного тромбофлебита в развитии ВТЭ остается спорным.
Следует учитывать повышенный риск развития тромбоэмболий в послеродовом периоде.
Нарушения периферического кровообращения также могут отмечаться при сахарном диабете, системной красной волчанке, гемолитико-уремическом синдроме, хронических воспалительных заболеваниях кишечника (болезнь Крона или язвенный колит) и серповидно-клеточной анемии.
Увеличение частоты и тяжести мигрени во время применения препарата (что может предшествовать цереброваскулярным нарушениям) является основанием для немедленного прекращения приема контрацептива.
К биохимическим показателям, указывающим на наследственную или приобретенную предрасположенность к венозному или артериальному тромбозу относится следующее: резистентность к активированному протеину С, гипергомоцистеинемия, дефицит антитромбина III, дефицит протеина С, дефицит протеина S, антифосфолипидные антитела (антитела к кардиолипину, волчаночный антикоагулянт). При оценке соотношения «польза-риск», следует учитывать, что адекватное лечение соответствующего состояния может уменьшить связанный с ним риск тромбоза. Также следует учитывать, что риск тромбозов и тромбоэмболий при беременности выше, чем при приеме низкодозированных КОК (<0,05 мг этинилэстрадиола).
Опухоли
Доклинические данные. Доклинические данные, полученные в ходе стандартных исследований токсичности при многократном введении доз, генотоксичности, канцерогенного потенциала и токсичности для репродуктивной системы, не указывают на существование специфического риска для человека. Однако следует учитывать, что половые гормоны способны стимулировать рост ряда гормонозависимых тканей и опухолей. Наиболее существенным фактором риска развития рака шейки матки (РШМ) является персистирующая папилломавирусная инфекция (ПВИ). Имеются сообщения о некотором повышении риска развития РШМ при длительном применении КОК, однако связь с приемом КОК не доказана.
До настоящего времени существуют противоречия относительно степени влияния на эти данные различных факторов, в частности, скрининговых обследований шейки матки или особенностей полового поведения женщины (количества сексуальных партнеров или более редкое применение барьерных методов контрацепции), а также причинно-следственной взаимосвязи этих факторов. По данным мета-анализа результатов 54 эпидемиологических исследований было выявлено небольшое повышение (в 1,24) риска развития РМЖ у женщин, принимающих КОК. Повышенный риск постепенно исчезает в течение 10 лет после прекращения приема КОК. В связи с тем, что РМЖ отмечается редко у женщин до 40 лет, увеличение числа диагнозов РМЖ у женщин, принимающих КОК в настоящее время или принимавших их недавно, является незначительным по отношению к общему риску развития этого заболевания. Его связь с приемом КОК не доказана. Наблюдаемое повышение риска развития РМЖ может быть обусловлено не только более ранней диагностикой РМЖ, но и биологическим действием половых гормонов или сочетанием этих двух факторов. У женщин, когда-либо применявших КОК, выявляются более ранние клинические стадии РМЖ, чем у женщин, никогда их не применявших. В редких случаях на фоне применения КОК наблюдалось развитие доброкачественных, а в крайне редких — злокачественных опухолей печени, которые в отдельных случаях приводили к угрожающему жизни внутрибрюшному кровотечению. В случае появления сильных болей в области живота, увеличения печени или признаков внутрибрюшного кровотечения, это следует учитывать при проведении дифференциального диагноза.
Другие состояния. У женщин с гипертриглицеридемией (или наличием этого состояния в семейном анамнезе) возможно повышение риска развития панкреатита во время приема КОК. Несмотря на то, что небольшое повышение артериального давления (АД) наблюдалось у многих женщин, принимающих КОК, клинически значимое повышение отмечалось редко. Тем не менее, если во время приема КОК развивается стойкое клинически значимое повышение АД, следует прекратить прием КОК и начать лечение артериальной гипертензии. Прием препарата может быть возобновлен, если с помощью гипотензивной терапии достигнуты нормальные значения АД.
Следующие состояния, как сообщалось, развиваются или ухудшаются как во время беременности, так и при приеме КОК, но их связь с приемом КОК не доказана: желтуха и/или зуд, связанный с холестазом; формирование камней в желчном пузыре; порфирия; системная красная волчанка; гемолитико-уремический синдром; хорея Сиденгама, гестационный герпес; потеря слуха, связанная с отосклерозом. Также описаны случаи ухудшения течения эндогенной депрессии, эпилепсии, болезни Крона и язвенного колита на фоне применения КОК.
У женщин с наследственными формами ангионевротического отека экзогенные эстрогены могут вызывать или ухудшать симптомы ангионевротического отека. Острые или хронические нарушения функции печени могут потребовать прекращения приема контрацептива до нормализации показателей функции печени. Рецидив холестатической желтухи, развившейся впервые во время предшествующей беременности или предыдущего приема половых гормонов, требует прекращения приема КОК. Хотя КОК могут оказывать влияние на инсулинорезистентность и толерантность к глюкозе, необходимости в коррекции дозы гипогликемических препаратов у пациенток с сахарным диабетом, применяющих низкодозированные КОК (<0,05 мг этинилэстрадиола), как правило, не возникает. Тем не менее, женщины с сахарным диабетом должны находиться под тщательным наблюдением во время приема КОК. Поскольку эстрогены могут вызывать задержку жидкости, женщины с хронической сердечной или почечной недостаточностью также должны находиться под тщательным медицинским наблюдением. Иногда может развиваться хлоазма, особенно у женщин с наличием в анамнезе хлоазмы беременных. Женщины со склонностью к хлоазме во время приема препарата должны избегать длительного пребывания на солнце и воздействия ультрафиолетового излучения.
Влияние на лабораторные тесты. Прием препарата Клайра® может влиять на результаты некоторых лабораторных исследований, включая биохимические параметры функции печени, щитовидной железы, надпочечников и почек, концентрацию транспортных белков в плазме, например, КСГ и фракции липидов/липопротеидов, параметры углеводного обмена и гемостаза. Эти изменения обычно остаются в пределах лабораторных норм.
Медицинские осмотры. Перед началом (или возобновлением) приема контрацептива необходимо ознакомиться с анамнезом жизни, семейным анамнезом женщины, провести тщательное общемедицинское (включая измерение АД, частоты сердечных сокращений, определение ИМТ) и гинекологическое обследование, включая обследование молочных желез и цитологическое исследование шейки матки (например, тест по Папаниколау), следует исключить беременность. Важно обратить внимание женщины на информацию о венозном и артериальном тромбозе, включая информацию о риске при приеме препарата Клайра® по сравнению с другими КОК, о симптомах ВТЭ и АТЭ, известных факторах риска и действиях в случае подозрения на тромбоз. Объем дополнительных исследований и частота контрольных осмотров определяется индивидуально, но не реже 1 раза в 6 месяцев.
Необходимо иметь в виду, что препарат не предохраняет от ВИЧ-инфекции (СПИД) и других заболеваний, передающихся половым путем.
Снижение эффективности. Эффективность контрацептивного препарата может быть снижена в следующих случаях: при пропуске приема таблеток с гормонами, желудочно-кишечных расстройствах во время приема таблеток с гормонами или в результате лекарственного взаимодействия.
Недостаточный контроль менструальноподобного цикла. На фоне применения препарата Клайра®, особенно в первые месяцы приема, могут возникать нерегулярные менструальноподобные кровотечения («мажущие» выделения или «прорывные» маточные кровотечения). Поэтому оценка любых нерегулярных менструальноподобных кровотечений должна проводиться только после периода адаптации, который составляет приблизительно 3 менструальноподобных цикла. Если нерегулярные менструальноподобные кровотечения повторяются или впервые возникают после предшествующих регулярных циклов, следует рассмотреть вероятность причин негормонального характера и провести тщательное обследование для исключения злокачественных новообразований или беременности. Подобные мероприятия могут включать диагностическое выскабливание. У некоторых женщин во время приема таблеток без гормонов (белого цвета) менструальноподобное кровотечение может не начаться. Если прием препарата Клайра® осуществлялся в соответствии с рекомендациями, указанными в разделе «Способ применения и дозы», беременность маловероятна. Однако если перед первым отсутствовавшим менструальноподобным кровотечением таблетки принимались нерегулярно, или отсутствуют подряд 2 менструальноподобных кровотечения, не следует продолжать применение препарата Клайра® до тех пор, пока не будет исключена беременность.
Влияние на способность к управлению транспортными средствами и механизмами. Не отмечено отрицательного влияния приема препарата на способность к управлению транспортными средствами, механизмами и занятия потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Форма выпуска
Таблетки, покрытые пленочной оболочкой, 2 мг + 2 мг, 3 мг + 2 мг и 1 мг, 3 мг. 2 темно-желтых таблетки, 5 розовых таблеток, 17 бледно-желтых таблеток, 2 красных таблетки и 2 белых таблетки (всего 28 таблеток) в одном блистере из пленки ПВХ и алюминиевой фольги. 1 блистер вклеен в книжку-раскладушку картонную. 1 или 3 книжки-раскладушки вместе с самоклеящимся календарем приема и инструкцией по применению запечатаны в прозрачную пленку. На прозрачную пленку наносится упаковочный стикер.
Производитель
Байер Веймар ГмбХ и Ко. КГ, Германия. Доберайнерштрассе, 20, D-99427 Веймар, Германия/Bayer Weimar GmbH & Co. KG, Germany. Dobereinerstrasse 20, D-99427 Weimar, Germany.
Юридическое лицо, на имя которого выдано регистрационное удостоверение: Байер АГ, Кайзер-Вильгельм-Аллее, 1, 51373 г. Леверкузен, Германия/Bayer AG, Kaiser-Wilhelm-Allee, 1, 51373 Leverkusen, Germany.
Организация, принимающая претензии от потребителей: АО «БАЙЕР», 107113, Москва, 3-я Рыбинская ул., 18, стр. 2.
Тел.: +7 (495) 231-12-00.
www.bayer.ru
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре не выше 30 °C.
Хранить в недоступном для детей месте.
Срок годности
5 лет.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Клайра® (Qlaira®) инструкция по применению
📜 Инструкция по применению Клайра®
💊 Состав препарата Клайра®
✅ Применение препарата Клайра®
📅 Условия хранения Клайра®
⏳ Срок годности Клайра®
Описание лекарственного препарата
Клайра®
(Qlaira®)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2023 года.
Дата обновления: 2023.01.09
Владелец регистрационного удостоверения:
Контакты для обращений:
БАЙЕР АГ
(Германия)
Код ATX:
G03AB08
(Диеногест и эстрадиол)
Лекарственная форма
| Клайра® |
Набор таб., покр. пленочн. оболочкой: 28 или 84 шт., в т.ч.: таб. темно-желтого цвета 3 мг: 2 шт., таб. розового цвета 2 мг+2 мг: 5 шт., таб. бледно-желтого цвета 2 мг+3 мг: 17 шт., таб. красного цвета 1 мг: 2 шт., таб. (плацебо) белого цвета: 2 шт. рег. №: ЛП-000010 |
Форма выпуска, упаковка и состав
препарата Клайра®
Набор таблеток, покрытых пленочной оболочкой, пяти видов.
Таблетки, покрытые пленочной оболочкой темно-желтого цвета, круглые, двояковыпуклые, с гравировкой «DD» в правильном шестиугольнике на одной стороне; (2 шт. в блистере).
Вспомогательные вещества: лактозы моногидрат — 48.36 мг, крахмал кукурузный — 14.4 мг, крахмал кукурузный прежелатинизированный — 9.6 мг, повидон 25 — 4 мг, магния стеарат — 0.64 мг.
Состав оболочки: гипромеллоза — 1.5168 мг, макрогол 6000 — 0.3036 мг, тальк — 0.3036 мг, титана диоксид — 0.584 мг, краситель железа оксид желтый — 0.292 мг.
Таблетки, покрытые пленочной оболочкой розового цвета, круглые, двояковыпуклые, с гравировкой «DJ» в правильном шестиугольнике на одной стороне; (5 шт. в блистере).
Вспомогательные вещества: лактозы моногидрат — 47.36 мг, крахмал кукурузный — 14.4 мг, крахмал кукурузный прежелатинизированный — 9.6 мг, повидон 25 — 4 мг, магния стеарат — 0.64 мг.
Состав оболочки: гипромеллоза — 1.5168 мг, макрогол 6000 — 0.3036 мг, тальк — 0.3036 мг, титана диоксид — 0.83694 мг, краситель железа оксид красный — 0.03906 мг.
Таблетки, покрытые пленочной оболочкой бледно-желтого цвета, круглые, двояковыпуклые, с гравировкой «DH» в правильном шестиугольнике на одной стороне; (17 шт. в блистере).
Вспомогательные вещества: лактозы моногидрат — 46.36 мг, крахмал кукурузный — 14.4 мг, крахмал кукурузный прежелатинизированный — 9.6 мг, повидон 25 — 4 мг, магния стеарат — 0.64 мг.
Состав оболочки: гипромеллоза — 1.5168 мг, макрогол 6000 — 0.3036 мг, тальк — 0.3036 мг, титана диоксид — 0.83694 мг, краситель железа оксид желтый — 0.03906 мг.
Таблетки, покрытые пленочной оболочкой красного цвета, круглые, двояковыпуклые, с гравировкой «DN» в правильном шестиугольнике на одной стороне; (2 шт. в блистере).
Вспомогательные вещества: лактозы моногидрат — 50.36 мг, крахмал кукурузный — 14.4 мг, крахмал кукурузный прежелатинизированный — 9.6 мг, повидон 25 — 4 мг, магния стеарат — 0.64 мг.
Состав оболочки: гипромеллоза — 1.5168 мг, макрогол 6000 — 0.3036 мг, тальк — 0.3036 мг, титана диоксид — 0.5109 мг, краситель железа оксид красный — 0.3651 мг.
Таблетки (плацебо), покрытые пленочной оболочкой белого цвета, круглые, двояковыпуклые, с гравировкой «DT» в правильном шестиугольнике на одной стороне; (2 шт. в блистере).
Вспомогательные вещества (на 1 таб. (плацебо)): лактозы моногидрат — 52.1455 мг, крахмал кукурузный — 24 мг, повидон 25 — 3.0545 мг, магния стеарат — 0.8 мг.
Состав оболочки (на 1 таб. (плацебо)): гипромеллоза — 1.0112 мг, тальк — 0.2024 мг, титана диоксид — 0.7864 мг.
28 шт. — блистеры (1) — книжки-раскладушки (1) с самоклеящимся календарем приема — пленка×.
28 шт. — блистеры (1) — книжки-раскладушки (3) с самоклеящимся календарем приема — пленка×.
× На прозрачную пленку наносится упаковочный стикер.
Фармакологическое действие
Фармакодинамика
Клайра® — комбинированный (эстроген+гестаген) пероральный контрацептивный препарат (КОК). Контрацептивный эффект КОК осуществляется посредством взаимодополняющих механизмов, наиболее важными из которых являются подавление овуляции; повышение вязкости секрета шейки матки, препятствующее проникновению сперматозоидов в полость матки, и изменения в эндометрии, препятствующие имплантации оплодотворенной яйцеклетки. У женщин, принимающих КОК, уменьшаются болезненность и интенсивность менструальноподобных кровотечений, в результате чего снижается риск железодефицитной анемии.
Ограниченные эпидемиологические данные свидетельствуют о том, что риск венозной тромбоэмболии (ВТЭ) при применении препарата Клайра® может находиться в том же диапазоне, что и риск при применении других КОК, включая КОК, содержащие левоноргестрел.
Комбинация диеногеста и эстрадиола валерата обладает благоприятным эффектом в отношении эндометрия, что может быть применимо для лечения обильных и/или длительных менструальных кровотечений без органической патологии. Эффективность и безопасность комбинации диеногеста и эстрадиола валерата в лечении симптомов дисфункционального маточного кровотечения изучены в двух двойных слепых, плацебо-контролируемых клинических исследованиях. Оба исследования продемонстрировали клинически и статистически значимое уменьшение менструальной кровопотери. Это сопровождалось статистически значимым улучшением показателей метаболизма железа (гемоглобина, гематокрита и ферритина).
В качестве эстрогена в препарате Клайра® используется эстрадиола валерат, предшественник естественного 17β-эстрадиола человека (1 мг эстрадиола валерата соответствует 0.76 мг 17β-эстрадиола). Таким образом, эстрадиола валерат отличается от обычно используемых в КОК синтетических эстрогенов — этинилэстрадиола или его предшественника местранола, содержащих этинильную группу в положении 17α. Эта группа обусловливает более высокую метаболическую стабильность, однако также и более выраженное действие на печень.
Применение комбинации диеногеста и эстрадиола валерата оказывает менее выраженное действие на печень в сравнении с трехфазными КОК, содержащими этинилэстрадиол и левоноргестрел. Было показано, что влияние на концентрацию глобулина, связывающего половые гормоны (ГСПГ) и параметры гемостаза менее выражено. В комбинации с диеногестом эстрадиола валерат демонстрирует повышение ЛПВП, тогда как концентрация холестерина ЛПНП несколько снижается.
Диеногест — производное нортестостерона, не обладающее андрогенной, но проявляющее антиандрогенную активность, которая составляет примерно 1/3 от активности ципротерона ацетата. Несмотря на низкое сродство к рецепторам прогестерона (диеногест связывается с рецепторами прогестерона в матке с относительной аффинностью, составляющей только 10%), диеногест обладает сильным прогестагенным действием in vivo. Диеногест не обладает значимой андрогенной, минералокортикоидной или глюкокортикоидной активностью in vivo.
При правильном применении индекс Перля (показатель, отражающий частоту наступления беременности у 100 женщин в течение года применения контрацептива) составляет менее 1. При пропуске таблеток или неправильном применении индекс Перля может возрастать.
Фармакокинетика
Диеногест
Всасывание
После перорального приема диеногест быстро и практически полностью всасывается. Cmax в плазме крови, составляющая 90.5 нг/мл, достигается примерно через 1 ч после перорального приема таблетки препарата Клайра®, содержащей 2 мг эстрадиола валерата + 3 мг диеногеста. Биодоступность составляет около 91%. Фармакокинетика диеногеста в дозовом диапазоне от 1 до 8 мг характеризуется зависимостью от дозы. Одновременный прием пищи не оказывает клинически значимого влияния на скорость и степень всасывания диеногеста.
Распределение
Относительно большая (10%) часть циркулирующего диеногеста находится в несвязанном виде, тогда как около 90% неспецифически связано с альбумином. Диеногест не связывается с ГСПГ и кортикостероид-связывающим глобулином (КСГ). По этой причине отсутствует возможность вытеснения тестостерона из его связи с ГСПГ или кортизола из его связи с КСГ. Какое-либо влияние на физиологические процессы транспорта эндогенных стероидов, следовательно, является маловероятным. Vd диеногеста при равновесной концентрации составляет 46 л после в/в введения 85 мкг меченного тритием диеногеста.
Равновесная концентрация. Фармакокинетика диеногеста не зависит от концентрации ГСПГ. Css достигается через 3 дня приема одной и той же дозы, составляющей 3 мг диеногеста в сочетании с 2 мг эстрадиола валерата. Cmin, Cmax и средняя концентрации диеногеста в плазме крови при равновесном состоянии составляют соответственно 11.8, 82.9 и 33.7 нг/мл. Средний коэффициент кумуляции по AUC0–24 ч — 1.24.
Метаболизм
Диеногест почти полностью метаболизируется, проходя известными путями метаболизма половых гормонов (гидроксилирование, конъюгирование), с образованием преимущественно фармакологически неактивных метаболитов. Метаболиты выводятся очень быстро, так что преобладающей фракцией в плазме крови является неизмененный диеногест.
Общий клиренс после в/в введения меченного тритием диеногеста — 5.1 л/ч.
Выведение
T1/2 диеногеста из плазмы крови составляет примерно 11 ч. После приема внутрь в дозе 0.1 мг/кг диеногест выводится в виде метаболитов, которые выводятся почками и через кишечник в соотношении примерно 3:1. После перорального приема 42% дозы выводится в пределах первых 24 ч, а 63% — в пределах 6 дней путем почечной экскреции. Через 6 дней почками и через кишечник выводится в совокупности 86% дозы.
Эстрадиола валерат
Всасывание
После приема внутрь эстрадиола валерат быстро и полностью абсорбируется. Расщепление на эстрадиол и валериановую кислоту происходит в ходе всасывания в слизистой оболочке ЖКТ или во время «первого прохождения» через печень, в результате чего образуются эстрадиол и его метаболиты — эстрон и эстриол. Cmax эстрадиола в плазме крови, равная 70.6 пг/мл, достигается между 1.5 и 12 ч после разового приема внутрь таблетки, содержащей 3 мг эстрадиола валерата, в 1-й день курса. Одновременный прием пищи не оказывает клинически значимого влияния на скорость и степень всасывания эстрадиола валерата.
Распределение
В плазме крови 38% эстрадиола связано с ГСПГ, 60% — с альбумином, и 2-3% циркулирует в несвязанном виде. Эстрадиол может незначительно повышать концентрацию ГСПГ в плазме крови; этот эффект зависит от дозы. На 21-й день цикла приема концентрация ГСПГ составляла примерно 148% от исходной, а к 28-му дню (завершение приема таблеток, не содержащих гормоны) снизилась приблизительно до 141% от исходной. Кажущийся Vd после в/в введения — 1.2 л/кг.
Равновесная концентрация. На фармакокинетику эстрадиола влияет концентрация ГСПГ. У женщин измеряемая концентрация эстрадиола в плазме крови представляет собой совокупность эндогенного эстрадиола и эстрадиола, поступившего при приеме препарата Клайра®. Во время фазы приема таблеток, содержащих 2 мг эстрадиола валерата+3 мг диеногеста, Cmax и средняя концентрация эстрадиола в плазме крови при равновесном состоянии составляют соответственно 66.0 и 51.6 пг/мл. В течение всего 28-дневного цикла поддерживались стабильные Cmin эстрадиола в диапазоне от 28.7 до 64.7 пг/мл.
Метаболизм
Валериановая кислота очень быстро метаболизируется. После приема внутрь примерно 3% дозы становятся непосредственно биодоступными в виде эстрадиола. Эстрадиол подвергается интенсивному эффекту «первого прохождения» через печень, и значительная часть введенной дозы метаболизируется уже в слизистой ЖКТ. В совокупности с пресистемным метаболизмом в печени около 95% принятой внутрь дозы метаболизируется до поступления в системную циркуляцию. Основными метаболитами являются эстрон, эстрона сульфат и эстрона глюкуронид.
Выведение
Вследствие большого циркулирующего пула сульфатов и глюкуронидов эстрогена, а также кишечно-печеночной рециркуляции, T1/2 эстрадиола в терминальной фазе после перорального приема представляет собой комплексный параметр, который зависит от всех этих процессов и находится в диапазоне около 13-20 ч.
Эстрадиол и его метаболиты выводятся, главным образом, почками, при этом около 10% выводится через кишечник.
Показания препарата
Клайра®
- пероральная контрацепция;
- терапия обильных и/или длительных менструальных кровотечений без органических причин у женщин, желающих применять пероральные контрацептивы.
Режим дозирования
Как и когда принимать препарат Клайра®
Таблетки следует принимать ежедневно в указанном на упаковке порядке, независимо от приема пищи, приблизительно в одно и то же время, и запивать водой. Прием таблеток осуществляется непрерывно. Следует принимать по 1 таб./сут последовательно в течение 28 дней. Прием таблеток из каждой новой упаковки начинают после приема последней таблетки из предшествующей календарной упаковки. Менструальноподобное кровотечение обычно начинается во время приема последних таблеток календарной упаковки (второй красной таблетки или белых таблеток) и может еще не завершиться до начала приема таблеток из следующей календарной упаковки. У некоторых женщин кровотечение продолжается после приема первых таблеток из новой календарной упаковки.
Подготовка книжки-раскладушки
Для того чтобы следить за приемом таблеток, к упаковке прилагаются 7 наклеек с проставленными на них названиями 7 дней недели.
Необходимо выбрать наклейку, которая начинается с того дня недели, в который женщина приступает к приему таблеток. Например, если прием начинается в среду, следует использовать наклейку, которая начинается со слова «СР». Наклейка наносится на верхнюю часть раскладывающейся упаковки препарата Клайра®, где расположена надпись «Сюда наклеить календарь», так, чтобы название первого дня находилось над таблеткой с номером «1».
Теперь над каждой таблеткой находится название соответствующего дня недели, и видно, была ли уже принята таблетка в тот или иной день или нет. Необходимо следовать направлению стрелки на книжке-раскладушке, пока не будут приняты все 28 таблеток.
Следующую упаковку начинают без перерыва, т.е. на следующий день после того, как закончена текущая упаковка, даже если кровотечение не прекратилось. Это означает, что следующую упаковку следует начинать в тот же самый день недели, что и текущую, и что менструальноподобное кровотечение должно выпадать каждый месяц на одни и те же дни недели.
Если препарат Клайра® используется как указано в инструкции, женщина защищена от нежелательной беременности даже в течение тех 2 дней, когда она принимает неактивные таблетки.
Как начинать прием таблеток из первой упаковки
Если в прошлом месяце гормональные контрацептивы не применялись
Начинают прием препарата Клайра® в 1-й день цикла, т.е. в 1-й день менструального кровотечения.
Если женщина переходит на прием препарата Клайра® с других КОК, комбинированного контрацептивного вагинального кольца или трансдермального пластыря
Начинают прием препарата Клайра® на следующий день после того, как была принята последняя активная таблетка (последняя таблетка с активными компонентами) из текущей упаковки КОК. Если в упаковке предыдущего КОК есть таблетки, не содержащие гормоны, их следует выбросить и начать прием из первой упаковки препарата Клайра®, не делая перерыва. Если ранее женщина пользовалась комбинированным контрацептивным вагинальным кольцом или трансдермальным пластырем, принимать препарат Клайра® следует начать в день удаления кольца/пластыря.
При переходе с контрацептивных препаратов, содержащих только гестаген («мини-пили», инъекционные формы, имплантат), или с внутриматочной терапевтической системы с высвобождением гестагена
Перейти с «мини-пили» на препарат Клайра® можно в любой день (без перерыва), с имплантата или внутриматочного контрацептива с высвобождением гестагена — в день его удаления, с инъекционной формы — со дня, когда должна была быть сделана следующая инъекция. Во всех случаях в течение первых 9 дней приема таблеток препарата Клайра® необходимо использовать дополнительный барьерный метод контрацепции (например, презерватив).
После аборта в I триместре беременности
Женщина может начать прием таблеток немедленно. В этом случае в дополнительных мерах контрацепции нет необходимости.
После родов или прерывания беременности (в т.ч. самопроизвольного) во II триместре
Начинать прием препарата следует на 21-28 день после родов (при отсутствии грудного вскармливания) или сразу после прерывания беременности (в т.ч. самопроизвольного) во II триместре. Если прием препарата начат позднее, необходимо использовать дополнительно барьерный метод контрацепции в течение первых 9 дней приема таблеток.
Если половой контакт имел место до начала приема препарата Клайра®, должна быть исключена беременность или следует дождаться первой менструации.
Рекомендации в случае пропуска таблеток
Пропущенными (белыми) неактивными таблетками можно пренебречь. Однако их следует выбросить во избежание непреднамеренного продления интервала между приемом активных таблеток.
Следующие рекомендации относятся исключительно к пропуску активных таблеток
Если задержка в приеме любой из таблеток составляет менее 12 ч, контрацептивная защита не снижается. Женщина должна выпить пропущенную таблетку сразу, как только вспомнит об этом, а остальные таблетки принимать в обычное время.
Если задержка в приеме любой активной таблетки составляет более 12 ч, контрацептивная защита может снизиться. Женщина должна принять последнюю пропущенную таблетку сразу, как только вспомнит об этом, даже если это будет означать, что ей придется выпить 2 таблетки одновременно. Затем необходимо продолжить принимать таблетки в обычное время.
В зависимости от дня менструальноподобного цикла, в который была пропущена таблетка (подробнее см. таблицу 1), требуется применять дополнительные меры контрацепции (например, барьерный метод, в частности, презервативы) в соответствии со следующими рекомендациями.
Таблица 1. Рекомендации в случае пропуска таблеток
Допускается принимать не более 2 таб. в один день.
Если женщина забыла начать новую календарную упаковку или пропустила одну или более таблеток с 3-го по 9-й день календарной упаковки, она уже может быть беременна (в том случае, если у нее был половой контакт в течение 7 дней перед пропуском таблетки). Чем больше таблеток (особенно с комбинацией диеногеста и эстрадиола валерата в дни с 3-го по 24-й) пропущено и чем ближе они к фазе приема неактивных (белых) таблеток, тем выше вероятность беременности.
Если женщина пропускала прием таблеток, и затем в конце календарной упаковки/в начале новой календарной упаковки менструальноподобное кровотечение у нее отсутствовало, следует рассмотреть вероятность беременности.
Для удобства данная информация представлена на упаковке в виде следующей схемы:
Рекомендации при желудочно-кишечных расстройствах
Если после приема любой из 26 активных (содержащих гормоны) таблеток препарата Клайра® у женщины начинается рвота или сильная диарея, всасывание активных веществ может быть неполным. Если рвота произошла через 3-4 ч после приема активной таблетки, это равнозначно пропуску таблетки. Поэтому в этом случае следует учитывать информацию, указанную в разделе «Рекомендации в случае пропуска таблеток». Если женщина не хочет менять свою обычную схему приема, дополнительную таблетку того же цвета следует принять из другой упаковки. Рвота или диарея в дни приема последних 2 неактивных таблеток не оказывают никакого влияния на эффективность контрацепции.
Как прекратить прием препарата Клайра®
Можно прекратить прием препарата Клайра® в любое время. Если женщина не планирует беременность, следует позаботиться о других методах контрацепции. Если планируется беременность, следует просто прекратить прием препарата Клайра®.
Дополнительная информация для особых категорий пациенток
Дети и подростки: данные по эффективности и безопасности по применению препарата у девочек в возрасте до 18 лет отсутствуют.
Пациентки пожилого возраста: не применимо. Препарат Клайра® не показан после наступления менопаузы.
Пациентки с нарушениями функции печени: препарат Клайра® противопоказан у женщин с заболеваниями печени тяжелой степени до тех пор, пока показатели функции печени не придут в норму (см. также раздел «Противопоказания»).
Пациентки с нарушениями функции почек: препарат Клайра® специально не изучался у пациенток с нарушениями функции почек. Имеющиеся данные не предполагают коррекции режима дозирования у таких пациенток.
Побочное действие
Возможные нежелательные реакции (НР) при применении препарата Клайра® приведены в таблице ниже в соответствии с системно-органным классам MedDRA. Частота встречаемости определяется следующим образом: часто (≥1/100 и <1/10), нечасто (≥1/1000 и <1/100), редко (≥1/10000 и <1/1000).
Ниже перечислены НР с очень низкой частотой или отсроченным развитием симптомов, связанные с приемом КОК.
Опухоли
- у женщин, применяющих КОК, незначительно повышена частота выявления рака молочной железы (РМЖ). Поскольку РМЖ редко встречается у женщин моложе 40 лет, превышение частоты незначительно по отношению к общему риску возникновения РМЖ. Причинная связь возникновения РМЖ с применением КОК не установлена;
- опухоли печени (доброкачественные и злокачественные).
Прочие состояния
- артериальные и венозные тромбозы и тромбоэмболические осложнения;
- узловатая эритема, многоформная эритема;
- выделения из молочных желез;
- гипертриглицеридемия (повышенный риск развития панкреатита при применении КОК);
- повышение АД;
- наступление или ухудшение состояний, при которых связь с применением КОК не является неоспоримой: желтуха и/или зуд, связанные с холестазом; образование камней желчного пузыря; порфирия; системная красная волчанка; гемолитико-уремический синдром; хорея Сиденхема; герпес во время беременности; потеря слуха, связанная с отосклерозом; эпилепсия;
- у женщин с наследственным ангионевротическим отеком экзогенные эстрогены могут вызвать или усилить симптомы ангионевротического отека;
- нарушения функции печени;
- нарушения толерантности к глюкозе или влияние на периферическую инсулинорезистентность;
- болезнь Крона, язвенный колит;
- хлоазма;
- гиперчувствительность (включая такие симптомы как сыпь, крапивница).
Взаимодействие
Взаимодействие других препаратов (индукторов ферментов) с пероральными контрацептивами может приводить к «прорывным» кровотечениям и/или снижению контрацептивного эффекта (см. раздел «Лекарственное взаимодействие»).
Противопоказания к применению
Применение препарата Клайра® противопоказано при наличии любого из заболеваний/состояний или факторов риска, перечисленных ниже.
- венозный тромбоз или тромбоэмболия (ВТЭ), в т.ч. тромбоз глубоких вен (ТГВ), тромбоэмболия легочной артерии (ТЭЛА), в настоящее время или в анамнезе;
- артериальный тромбоз или тромбоэмболия (АТЭ), в т.ч. инфаркт миокарда, инсульт; продромальные состояния, в т.ч. транзиторная ишемическая атака, стенокардия;
- выявленная наследственная или приобретенная предрасположенность к ВТЭ или АТЭ, включая резистентность к активированному протеину С, гипергомоцистеинемию, дефицит антитромбина III, дефицит протеина С, дефицит протеина S, антифосфолипидные антитела (антитела к кардиолипину, волчаночный антикоагулянт);
- наличие высокого риска развития ВТЭ и АТЭ ввиду наличия множественных факторов риска (см. раздел «Особые указания») или наличие одного серьезного фактора риска, как:
- сахарный диабет с диабетической ангиопатией;
- неконтролируемая артериальная гипертензия;
- тяжелая дислипопротеинемия.
- объемные оперативные вмешательства с длительной иммобилизацией или обширная травма;
- мигрень с очаговой неврологической симптоматикой в настоящее время или в анамнезе;
- заболевания печени тяжелой степени (до нормализации показателей функции печени) в настоящее время или в анамнезе;
- опухоли печени (доброкачественные и злокачественные) в настоящее время или в анамнезе;
- гормонозависимые злокачественные новообразования половых органов или молочных желез (в т.ч. подозрение на них);
- кровотечение из влагалища неясной этиологии;
- беременность (в т.ч. предполагаемая);
- период грудного вскармливания;
- непереносимость лактозы, дефицит лактазы, синдром глюкозо-галактозной мальабсорбции;
- гиперчувствительность к диеногесту и/или эстрадиола валерату, и/или к любому из вспомогательных веществ в составе препарата.
При возникновении любого из данных заболеваний/состояний или факторов риска на фоне применения препарата следует немедленно прекратить прием препарата.
С осторожностью
Если какие-либо из заболеваний/состояний или факторов риска, указанных ниже, имеются в настоящее время, следует провести тщательную оценку ожидаемой пользы и возможного риска применения препарата Клайра® для каждой женщины индивидуально и обсудить это до начала приема препарата:
- факторы риска развития тромбоза и тромбоэмболии (курение, ожирение, дислипопротеинемия, контролируемая артериальная гипертензия, мигрень без очаговой симптоматики, неосложненные заболевания клапанов сердца, нарушение сердечного ритма, обширные хирургические вмешательства без длительной иммобилизации);
- другие заболевания, при которых могут отмечаться нарушения периферического кровообращения (сахарный диабет, системная красная волчанка, гемолитико-уремический синдром, болезнь Крона и язвенный колит, серповидно-клеточная анемия);
- наследственный ангионевротический отек;
- гипертриглицеридемия;
- заболевания, впервые возникшие или усугубившиеся во время беременности или на фоне предыдущего приема половых гормонов (например, холестатическая желтуха, холестатический зуд, холелитиаз, отосклероз с ухудшением слуха, порфирия, герпес беременных, хорея Сиденхема);
- послеродовый период.
Применение при беременности и кормлении грудью
Беременность
Прием препарата Клайра® противопоказан при беременности. В случае диагностирования беременности на фоне применения контрацептива следует немедленно прекратить прием препарата. Многочисленные эпидемиологические исследования не выявили ни увеличения риска возникновения дефектов развития у детей, рожденных женщинами, получавшими половые гормоны до беременности, ни наличия тератогенного действия, когда половые гормоны принимались по неосторожности в ранние сроки беременности.
Период грудного вскармливания
Применение препарата Клайра®, как и других КОК, может уменьшать количество грудного молока и изменять его состав, поэтому прием препарата противопоказан до прекращения грудного вскармливания. Небольшое количество входящих в состав контрацептива гормонов и/или их метаболитов может проникать в грудное молоко. Это может оказывать влияние на ребенка.
Применение при нарушениях функции печени
Препарат противопоказан при заболеваниях печени тяжелой степени (до нормализации показателей функции печени) в настоящее время или в анамнезе; опухолях печени (доброкачественные и злокачественные) в настоящее время или в анамнезе.
Применение при нарушениях функции почек
Препарат специально не изучался у пациенток с нарушениями функции почек. Имеющиеся данные не предполагают коррекции режима дозирования у таких пациенток.
Применение у детей
Препарат Клайра показан только после наступления менархе.
Данные по эффективности и безопасности по применению препарата у девочек в возрасте до 18 лет отсутствуют.
Применение у пожилых пациентов
Не применимо. Препарат не показан после наступления менопаузы.
Особые указания
Если какие-либо из заболеваний/состояний или факторов риска, указанных ниже, имеются в настоящее время, следует тщательно соотнести потенциальный риск и ожидаемую пользу применения препарата Клайра® для каждой женщины индивидуально и обсудить это до начала приема препарата. В случае утяжеления, усиления или первого проявления любого из этих состояний, заболеваний или факторов риска женщина должна проконсультироваться со своим врачом, который может принять решение о необходимости отмены препарата.
Следующая информация о необходимости соблюдения мер предосторожности основана, главным образом, на данных клинических и эпидемиологических исследований с КОК, содержащими этинилэстрадиол.
Риск развития ВТЭ и АТЭ
Результаты эпидемиологических исследований указывают на наличие взаимосвязи между применением КОК и повышением частоты развития венозных и артериальных тромбозов и тромбоэмболий (таких как ТГВ, ТЭЛА, инфаркт миокарда и цереброваскулярные нарушения). Данные заболевания отмечаются редко.
Повышенный риск присутствует после первоначального применения КОК или возобновления применения после перерыва в 4 недели и более. Наибольший риск развития ВТЭ наблюдается в первый год применения КОК, преимущественно в течение первых 3 месяцев.
Применение любого КОК увеличивает риск ВТЭ по сравнению с отсутствием применения. Препараты, содержащие левоноргестрел, норгестимат или норэтистерон, связаны с самым низким риском развития ВТЭ. Ограниченные данные свидетельствуют о том, что препарат Клайра® может иметь риск ВТЭ в том же диапазоне. Выбор в пользу приема препарата Клайра®, а не одного из препаратов, имеющих самый низкий риск развития ВТЭ, должен быть сделан только после обсуждения с женщиной, позволяющего убедиться, что она полностью понимает риск ВТЭ, связанный с применением КОК; влияние существующих у нее факторов риска на риск ВТЭ и то, что риск развития ВТЭ максимален в первый год применения КОК.
ВТЭ может оказаться жизнеугрожающей или привести к летальному исходу (в 1-2% случаев).
Крайне редко при применении КОК возникает тромбоз других кровеносных сосудов, например, печеночных, брыжеечных, почечных, мозговых вен и артерий или сосудов сетчатки глаза.
Симптомы тромбоза глубоких вен: односторонний отек или отек вдоль вены, боль или дискомфорт в нижней конечности только в вертикальном положении или при ходьбе, локальное повышение температуры, покраснение или изменение окраски кожных покровов нижней конечности.
Симптомы тромбоэмболии легочной артерии: затрудненное или учащенное дыхание; внезапный кашель, в т.ч. с кровохарканьем; острая боль в грудной клетке, которая может усиливаться при глубоком вдохе; чувство тревоги; сильное головокружение; учащенное или нерегулярное сердцебиение. Некоторые из этих симптомов (например, одышка, кашель) являются неспецифическими и могут быть истолкованы неверно, как признаки других более часто встречающихся и менее тяжелых состояний/заболеваний (например, инфекции дыхательных путей).
Артериальная тромбоэмболия может привести к инсульту, окклюзии сосудов или инфаркту миокарда.
Симптомы инсульта: внезапная слабость или потеря чувствительности лица, конечностей, особенно с одной стороны тела, внезапная спутанность сознания, проблемы с речью и пониманием; внезапная одно- или двухсторонняя потеря зрения; внезапное нарушение походки, головокружение, потеря равновесия или координации движений; внезапная, тяжелая или продолжительная головная боль без видимой причины; потеря сознания или обморок с судорожным приступом или без него.
Другие признаки окклюзии сосудов: внезапная боль, отечность и незначительная синюшность конечностей, симптомокомплекс «острый живот».
Симптомы инфаркта миокарда: боль, дискомфорт, давление, тяжесть, чувство сжатия или распирания в груди или за грудиной, с иррадиацией в спину, челюсть, левую верхнюю конечность, область эпигастрия; холодный пот, тошнота, рвота или головокружение, выраженная слабость, тревога или одышка; учащенное или нерегулярное сердцебиение.
Артериальная тромбоэмболия может оказаться жизнеугрожающей или привести к летальному исходу.
У женщин с сочетанием нескольких факторов риска или высокой выраженностью одного из них следует рассматривать возможность их взаимоусиления. В подобных случаях степень повышения риска тромбообразования может оказаться более высокой. В таком случае прием комбинации диеногеста и эстрадиола валерата противопоказан.
Риск развития тромбоза (венозного и/или артериального), тромбоэмболии или цереброваскулярных нарушений повышается:
- с возрастом;
- у курящих (с увеличением количества сигарет или повышением возраста риск нарастает, особенно у женщин старше 35 лет);
при наличии:
- ожирения (ИМТ 30 кг/м2 и более);
- указаний в семейном анамнезе (например, венозной или артериальной тромбоэмболии когда-либо у близких родственников или родителей в возрасте менее 50 лет). В случае наследственной или приобретенной предрасположенности женщина должна быть осмотрена соответствующим специалистом для решения вопроса о возможности приема контрацептива;
- дислипопротеинемии;
- артериальной гипертензии;
- мигрени;
- заболеваний клапанов сердца;
- фибрилляции предсердий;
- длительной иммобилизации, обширного хирургического вмешательства, любой операции на нижних конечностях или обширной травмы. В этих случаях прием препарата необходимо прекратить (в случае планируемой операции, по крайней мере, за 4 недели до нее) и не возобновлять прием в течение 2 недель после окончания иммобилизации. Временная иммобилизация (например, авиаперелет длительностью более 4 ч) может также являться фактором риска развития ВТЭ, особенно при наличии других факторов риска.
Вопрос о возможной роли варикозного расширения вен и поверхностного тромбофлебита в развитии ВТЭ остается спорным.
Следует учитывать повышенный риск развития тромбоэмболий в послеродовом периоде.
Нарушения периферического кровообращения также могут отмечаться при сахарном диабете, системной красной волчанке, гемолитико-уремическом синдроме, хронических воспалительных заболеваниях кишечника (болезнь Крона или язвенный колит) и серповидно-клеточной анемии.
Увеличение частоты и тяжести мигрени во время применения препарата (что может предшествовать цереброваскулярным нарушениям) является основанием для немедленного прекращения приема контрацептива.
К биохимическим показателям, указывающим на наследственную или приобретенную предрасположенность к венозному или артериальному тромбозу, относится следующее: резистентность к активированному протеину С, гипергомоцистеинемия, дефицит антитромбина III, дефицит протеина С, дефицит протеина S, антифосфолипидные антитела (антитела к кардиолипину, волчаночный антикоагулянт).
При оценке соотношения польза-риск, следует учитывать, что адекватное лечение соответствующего состояния может уменьшить связанный с ним риск тромбоза. Также следует учитывать, что риск тромбозов и тромбоэмболий при беременности выше, чем при приеме низкодозированных КОК (<0.05 мг этинилэстрадиола).
Опухоли
Доклинические данные, полученные в ходе стандартных исследований токсичности при многократном введении доз, генотоксичности, канцерогенного потенциала и токсичности для репродуктивной системы, не указывают на существование специфического риска для человека. Однако следует учитывать, что половые гормоны способны стимулировать рост ряда гормонозависимых тканей и опухолей.
Наиболее существенным фактором риска развития рака шейки матки (РШМ) является персистирующая папилломавирусная инфекция (ПВИ). Имеются сообщения о некотором повышении риска развития РШМ при длительном применении КОК, однако связь с приемом КОК не доказана. До настоящего времени существуют противоречия относительно степени влияния на эти данные различных факторов, в частности, скрининговых обследований шейки матки или особенностей полового поведения женщины (количества сексуальных партнеров или более редкое применение барьерных методов контрацепции), а также причинно-следственной взаимосвязи этих факторов.
По данным мета-анализа результатов 54 эпидемиологических исследований было выявлено небольшое повышение (в 1.24) риска развития РМЖ у женщин, принимающих КОК. Повышенный риск постепенно исчезает в течение 10 лет после прекращения приема КОК. В связи с тем, что РМЖ отмечается редко у женщин до 40 лет, увеличение числа диагнозов РМЖ у женщин, принимающих КОК в настоящее время или принимавших их недавно, является незначительным по отношению к общему риску развития этого заболевания. Его связь с приемом КОК не доказана. Наблюдаемое повышение риска развития РМЖ может быть обусловлено не только более ранней диагностикой РМЖ, но и биологическим действием половых гормонов или сочетанием этих двух факторов. У женщин, когда-либо применявших КОК, выявляются более ранние клинические стадии РМЖ, чем у женщин, никогда их не применявших.
В редких случаях на фоне применения КОК наблюдалось развитие доброкачественных, а в крайне редких — злокачественных опухолей печени, которые в отдельных случаях приводили к угрожающему жизни внутрибрюшному кровотечению. В случае появления сильных болей в области живота, увеличения печени или признаков внутрибрюшного кровотечения, это следует учитывать при проведении дифференциального диагноза.
Другие состояния
У женщин с гипертриглицеридемией (или наличием этого состояния в семейном анамнезе) возможно повышение риска развития панкреатита во время приема КОК.
Несмотря на то, что небольшое повышение АД наблюдалось у многих женщин, принимающих КОК, клинически значимое повышение отмечалось редко. Тем не менее, если во время приема КОК развивается стойкое клинически значимое повышение АД, следует прекратить прием КОК и начать лечение артериальной гипертензии. Прием препарата может быть возобновлен, если с помощью гипотензивной терапии достигнуты нормальные значения АД.
Следующие состояния, как сообщалось, развиваются или ухудшаются как во время беременности, так и при приеме КОК, но их связь с приемом КОК не доказана: желтуха и/или зуд, связанный с холестазом; формирование камней в желчном пузыре; порфирия; системная красная волчанка; гемолитико-уремический синдром; хорея Сиденхема, гестационный герпес; потеря слуха, связанная с отосклерозом.
Также описаны случаи ухудшения течения эндогенной депрессии, эпилепсии, болезни Крона и язвенного колита на фоне применения КОК.
У женщин с наследственными формами ангионевротического отека экзогенные эстрогены могут вызывать или ухудшать симптомы ангионевротического отека.
Острые или хронические нарушения функции печени могут потребовать прекращения приема контрацептива до нормализации показателей функции печени. Рецидив холестатической желтухи, развившейся впервые во время предшествующей беременности или предыдущего приема половых гормонов, требует прекращения приема КОК.
Хотя КОК могут оказывать влияние на инсулинорезистентность и толерантность к глюкозе, необходимости в коррекции дозы гипогликемических препаратов у пациенток с сахарным диабетом, применяющих низкодозированные КОК (<0.05 мг этинилэстрадиола), как правило, не возникает. Тем не менее, женщины с сахарным диабетом должны находиться под тщательным наблюдением во время приема КОК.
Поскольку эстрогены могут вызывать задержку жидкости, женщины с хронической сердечной или почечной недостаточностью также должны находиться под тщательным медицинским наблюдением.
Иногда может развиваться хлоазма, особенно у женщин с наличием в анамнезе хлоазмы беременных. Женщинам со склонностью к хлоазме во время приема препарата должны избегать длительного пребывания на солнце и воздействия ультрафиолетового излучения.
Влияние на лабораторные тесты
Прием препарата Клайра® может влиять на результаты некоторых лабораторных исследований, включая биохимические параметры функции печени, щитовидной железы, надпочечников и почек, концентрацию транспортных белков в плазме, например, КСГ и фракции липидов/липопротеидов, параметры углеводного обмена и гемостаза. Эти изменения обычно остаются в пределах лабораторных норм.
Медицинские осмотры
Перед началом (или возобновлением) приема контрацептива необходимо ознакомиться с анамнезом жизни, семейным анамнезом женщины, провести тщательное общемедицинское (включая измерение АД, ЧСС, определение ИМТ) и гинекологическое обследование, включая обследование молочных желез и цитологическое исследование шейки матки (например, тест по Папаниколау), следует исключить беременность.
Важно обратить внимание женщины на информацию о венозном и артериальном тромбозе, включая информацию о риске при приеме препарата Клайра® по сравнению с другими КОК, о симптомах ВТЭ и АТЭ, известных факторах риска и действиях в случае подозрения на тромбоз.
Объем дополнительных исследований и частота контрольных осмотров определяется индивидуально, но не реже 1 раза в 6 месяцев.
Необходимо иметь в виду, что препарат не предохраняет от ВИЧ-инфекции (СПИД) и других заболеваний, передающихся половым путем.
Снижение эффективности
Эффективность контрацептивного препарата может быть снижена в следующих случаях: при пропуске приема таблеток, содержащих гормоны, желудочно-кишечных расстройствах во время приема таблеток, содержащих гормоны, или в результате лекарственного взаимодействия.
Недостаточный контроль менструальноподобного цикла
На фоне применения препарата Клайра®, особенно в первые месяцы приема, могут возникать нерегулярные менструальноподобные кровотечения («мажущие» выделения или «прорывные» маточные кровотечения). Поэтому оценка любых нерегулярных менструальноподобных кровотечений должна проводиться только после периода адаптации, который составляет приблизительно 3 менструальноподобных цикла.
Если нерегулярные менструальноподобные кровотечения повторяются или впервые возникают после предшествующих регулярных циклов, следует рассмотреть вероятность причин негормонального характера и провести тщательное обследование для исключения злокачественных новообразований или беременности. Подобные мероприятия могут включать диагностическое выскабливание.
У некоторых женщин во время приема неактивных таблеток (белого цвета) менструальноподобное кровотечение может не начаться. Если прием препарата Клайра® осуществлялся в соответствии с рекомендациями, указанными в разделе «Режим дозирования», беременность маловероятна. Однако, если перед первым отсутствовавшим менструальноподобным кровотечением таблетки принимались нерегулярно, или отсутствуют подряд 2 менструальноподобных кровотечения, не следует продолжать применение препарата Клайра® до тех пор, пока не будет исключена беременность.
Влияние на способность к управлению транспортными средствами и механизмами
Не отмечено отрицательного влияния приема препарата на способность к управлению транспортными средствами, механизмами и занятия потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Передозировка
О серьезных нарушениях при передозировке препаратом Клайра® не сообщалось.
На основании суммарного опыта применения КОК симптомы, которые могут отмечаться при передозировке активных таблеток: тошнота, рвота, «мажущие» кровянистые выделения или метроррагия.
Лечение: симптоматическое.
Лекарственное взаимодействие
Влияние других лекарственных средств на комбинацию диеногеста и эстрадиола валерата
Возможно взаимодействие с лекарственными средствами, индуцирующими микросомальные ферменты печени, в результате чего может увеличиваться клиренс половых гормонов, что, в свою очередь, может приводить к «прорывным» маточным кровотечениям и/или снижению контрацептивного эффекта.
Индукция микросомальных ферментов печени может наблюдаться уже через несколько дней совместного применения препаратов-индукторов и препарата Клайра® и сохраняться до 4 недель после его окончания.
Краткосрочное лечение
Женщинам, которые получают лечение препаратами, индуцирующими микросомальные ферменты печени, следует временно использовать барьерный метод контрацепции или выбрать другой негормональный метод контрацепции в дополнение к приему препарата Клайра®. Барьерный метод контрацепции следует использовать в течение всего периода приема сопутствующих препаратов и в течение 28 дней после их отмены. Если прием сопутствующих препаратов продолжается после того, как закончились активные таблетки в упаковке препарата Клайра®, необходимо выбросить неактивные таблетки (плацебо) и сразу же начать прием активных таблеток из новой упаковки.
Длительное лечение
Женщинам, которые получают длительное лечение препаратами, индуцирующими микросомальные ферменты печени, рекомендуется рассмотреть другой эффективный негормональный метод контрацепции.
Вещества, увеличивающие клиренс КОК (снижающие эффективность путем индукции ферментов): фенитоин, барбитураты, бозентан, примидон, карбамазепин, рифампицин и, возможно, также окскарбазепин, топирамат, фелбамат, гризеофульвин, а также препараты, содержащие зверобой продырявленный.
Одновременный прием рифампицина вместе с таблетками, содержащими эстрадиола валерат и диеногест, приводил к существенному снижению равновесной концентрации и системной экспозиции диеногеста и эстрадиола. Системная экспозиция диеногеста и эстрадиола при равновесной концентрации, измеряемая на основе AUC0-24 ч, снизилась, соответственно, на 83% и на 44%.
Вещества с различным влиянием на клиренс КОК: при совместном применении с КОК многие ингибиторы протеаз ВИЧ или вируса гепатита С и ненуклеозидные ингибиторы обратной транскриптазы могут как увеличивать, так и уменьшать концентрацию эстрогенов или прогестинов в плазме крови. В некоторых случаях такое влияние может быть клинически значимым.
Вещества, снижающие клиренс КОК (ингибиторы ферментов). Диеногест является субстратом цитохрома CYP3A4. Сильные и умеренные ингибиторы CYP3A4, такие как противогрибковые препараты группы азолов (например, итраконазол, вориконазол, флуконазол), верапамил, антибиотики группы макролидов (например, кларитромицин, эритромицин), дилтиазем и грейпфрутовый сок могут повышать плазменные концентрации эстрогена или прогестина, или их обоих.
При одновременном приеме с сильным ингибитором кетоконазолом величина AUC0-24 ч в равновесном состоянии у диеногеста возросла в 2.86 раза, а у эстрадиола – в 1.57 раза. При одновременном применении с умеренным ингибитором эритромицином величина AUC0-24 ч у диеногеста и эстрадиола в равновесном состоянии увеличилась соответственно в 1.62 раза и в 1.33 раза.
Влияние КОК на другие лекарственные препараты
КОК могут влиять на метаболизм других препаратов, что приводит к повышению (например, циклоспорин) или снижению (например, ламотриджин) их концентрации в плазме крови и тканях.
Однако, исходя из данных исследований in vitro, ингибирование ферментов CYP при применении препарата Клайра® в терапевтической дозе маловероятно.
Несовместимость
Отсутствует.
Условия хранения препарата Клайра®
Препарат следует хранить в недоступном для детей месте при температуре не выше 30°С.
Срок годности препарата Клайра®
Срок годности — 5 лет. Не применять по истечении срока годности.
Условия реализации
Препарат отпускают по рецепту.
Контакты для обращений
БАЙЕР АГ
(Германия)

|
|
Организация, принимающая |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код

Клайра®
МНН: Диеногест, Эстрадиола валерат
Производитель: Байер Веймар ГмбХ и Ко.КГ
Анатомо-терапевтическо-химическая классификация: Прогестагены и эстрогены (комбинации для последовательного приема)
Номер регистрации в РК:
№ РК-ЛС-5№019670
Информация о регистрации в РК:
27.11.2017 — бессрочно
- Скачать инструкцию медикамента
Торговое название
Клайра
Международное непатентованное наименование
Нет
Лекарственная форма
Состав
Одна темно-желтая таблетка, покрытая пленочной оболочкой содержитактивное вещество- эстрадиола валерат, микро 20, в пересчете на 100 % вещество 3,000 мг,
вспомогательные вещества:
ядро: лактозы моногидрат, крахмал кукурузный, крахмал кукурузный прежелатинизированный, повидон 25, магния стеарат,
оболочка: гипромеллоза тип 2910, макрогол 6000, тальк, титана диоксид (Е171), железа оксид желтый (Е 172).
Одна средне-красная таблетка, покрытая пленочной оболочкой содержитактивные вещества:
эстрадиола валерат, микро 20, в пересчете на 100 % вещество 2,000 мг, диеногест, микро, в пересчете на 100 % вещество 2,000 мг,
вспомогательные вещества:
ядро: лактозы моногидрат, крахмал кукурузный, крахмал кукурузный прежелатинизированный, повидон 25, магния стеарат,
оболочка: гипромеллоза тип 2910, макрогол 6000, тальк, титана диоксид (Е171), железа оксид желтый (Е 172).
Одна светло-желтая таблетка, покрытая пленочной оболочкой содержитактивные вещества:
эстрадиола валерат, микро 20, в пересчете на 100 % вещество 2,000 мг, диеногест, микро, в пересчете на 100 % вещество 3,000 мг,
вспомогательные вещества:
ядро: лактозы моногидрат, крахмал кукурузный , крахмал кукурузный прежелатинизированный, повидон 25, магния стеарат,
оболочка: гипромеллоза тип 2910, макрогол 6000, тальк, титана диоксид (Е171), железа оксид желтый (Е 172).
Одна темно-красная таблетка, покрытая пленочной оболочкой содержитактивное вещество:
эстрадиола валерат, микро 20, в пересчете на 100 % вещество 1,000 мг,
вспомогательные вещества:
ядро: лактозы моногидрат, крахмал кукурузный, крахмал кукурузный прежелатинизированный, повидон 25, магния стеарат,
оболочка: гипромеллоза тип 2910, макрогол 6000, тальк, титана диоксид (Е171), железа оксид желтый (Е 172).
Одна белая таблетка покрытая пленочной оболочкой (плацебо) содержитвспомогательные вещества:
ядро: лактозы моногидрат, крахмал кукурузный, повидон 25, магния стеарат
оболочка: гипромеллоза тип 2910, тальк, титана диоксид (Е171).
Описание
Таблетки, покрытые пленочной оболочкой темно-желтого цвета, круглой формы, двояковыпуклые, с гравировкой «DD» в правильном шестиугольнике на одной стороне.
Средне-красные таблетки «Эстрадиола валерат 2 мг + Диеногест 2 мг»
Таблетки, покрытые пленочной оболочкой средне-красного цвета, круглой формы, двояковыпуклые, с гравировкой «DJ» в правильном шестиугольнике на одной стороне.
Светло-желтые таблетки «Эстрадиола валерат 2 мг + Диеногест 3 мг»
Таблетки, покрытые пленочной оболочкой светло-желтого цвета, круглой формы, двояковыпуклые, с гравировкой «DН» в правильном шестиугольнике на одной стороне.
Темно-красные таблетки «Эстрадиола валерат 1 мг»
Таблетки, покрытые пленочной оболочкой темно-красного цвета, круглой формы, двояковыпуклые, с гравировкой «DN» в правильном шестиугольнике на одной стороне.
Белые таблетки «Плацебо»
Таблетки, покрытые пленочной оболочкой белого цвета, круглой формы, двояковыпуклые, с гравировкой «DТ» в правильном шестиугольнике на одной стороне.
Фармакотерапевтическая группа
Код АТХ G03AB
Фармакологические свойства
Фармакокинетика
Диеногест
Абсорбция
После перорального приема диеногест быстро и практически полностью всасывается. Максимальная концентрация в сыворотке крови, составляющая 90,5 нг/мл, достигается примерно через 1 час после перорального приема таблетки Клайры, содержащей 2 мг эстрадиола валерата + 3 мг диеногеста. Биодоступность составляет около 91%. Фармакокинетика диеногеста в дозовом диапазоне от 1 до 8 мг характеризуется зависимостью от дозы.
Одновременный прием пищи не оказывает клинически значимого влияния на скорость и степень всасывания диеногеста.
Распределение
Относительно большая (10%) часть циркулирующего диеногеста находится в несвязанном виде, тогда как около 90% неспецифически связано с альбумином. Диеногест не связывается с ГСПГ и с кортикостероид-связывающим глобулином (КСГ). По этой причине отсутствует возможность вытеснения тестостерона из его связи с ГСПГ или кортизола из его связи с КСГ. Какое-либо влияние на физиологические процессы транспорта эндогенных стероидов, следовательно, является маловероятным. Объем распределения диеногеста при равновесной концентрации составляет 46 л после внутривенного введения 85 мкг меченного тритием диеногеста.
Метаболизм
Диеногест почти полностью метаболизируется, проходя известными путями метаболизма стероидных гормонов (гидроксилирование, конъюгирование), с образованием преимущественно эндокринологически неактивных метаболитов. Метаболиты выводятся очень быстро, так что преобладающей фракцией в плазме крови является неизмененный диеногест.
Общий клиренс после внутривенного введения меченного тритием диеногеста — 5,1 л/ч.
Элиминация
Период полувыведения диеногеста из плазмы крови составляет примерно 11 ч. После приема внутрь в дозе 0,1 мг/кг диеногест выводится в виде метаболитов, которые выводятся почками и через кишечник в соотношении примерно 3:1. После перорального приема 42% дозы выводится в пределах первых 24 часов, а 63% — в пределах 6 дней путем почечной экскреции. Через 6 дней почками и через кишечник выводится в совокупности 86% дозы.
Равновесная концентрация
Фармакокинетика диеногеста не зависит от концентрации ГСПГ. Равновесная концентрация достигается через 3 дня приема одной и той же дозы, составляющей 3 мг диеногеста в сочетании с 2 мг эстрадиола валерата. Минимальная, максимальная и средняя концентрации диеногеста в сыворотке крови при равновесном состоянии составляют, соответственно, 11,8 нг/мл, 82,9 нг/мл и 33,7 нг/м. Средний коэффициент кумуляции по площади под кривой «концентрация-время» (AUC0-24 ч )- 1,24.
Эстрадиола валерат
Абсорбция
После приема внутрь эстрадиола валерат быстро и полностью абсорбируется. Расщепление на эстрадиол и валериановую кислоту происходит в ходе всасывания в слизистой оболочке желудочно-кишечного тракта (ЖКТ) или во время первого пассажа через печень, в результате чего образуются эстрадиол и его метаболиты — эстрон и эстриол. Максимальная концентрация эстрадиола в сыворотке крови, равная 70,6 пг/мл, достигается между 1,5 и 12 часами после разового приема внутрь таблетки, содержащей 3 мг эстрадиола валерата в 1-ый день цикла.
Одновременный прием пищи не оказывает клинически значимого влияния на скорость и степень всасывания эстрадиола валерата.
Метаболизм
Валериановая кислота очень быстро метаболизируется. После приема внутрь примерно 3% дозы становятся непосредственно биодоступными в виде эстрадиола. Эстрадиол подвергается интенсивному эффекту «первичного прохождения» через печень, и значительная часть введенной дозы метаболизируется уже в слизистой ЖКТ. В совокупности с пресистемным метаболизмом в печени около 95% принятой внутрь дозы метаболизируется до поступления в системную циркуляцию. Основными метаболитами являются эстрон, эстрона сульфат и эстрона глюкуронид.
Распределение
В сыворотке крови 38% эстрадиола связано с ГСПГ, 60% с альбумином, и 2-3% циркулирует в несвязанном виде. Эстрадиол может незначительно повышать концентрацию ГСПГ в сыворотке крови; этот эффект зависит от дозы. На 21-ый день цикла приема концентрация ГСПГ составляла примерно 148% от исходной, а к 28-му дню (завершение фазы приема неактивных таблеток) снизилась приблизительно до 141% от исходной. Кажущийся объем распределения после внутривенного введения — 1,2 л/кг.
Элиминация
Период полувыведения эстрадиола из плазмы крови составляет примерно 90 ч. Однако ситуация отличается при приеме внутрь. Вследствие большого циркулирующего пула сульфатов и глюкуронидов эстрогена, а также кишечно-печеночной рециркуляции, период полувыведения эстрадиола в терминальной фазе после перорального приема представляет собой комплексный параметр, который зависит от всех этих процессов и находится в диапазоне около 13-20 ч.
Эстрадиол и его метаболиты выводятся, главным образом, почками, при этом около 10% выводится через кишечник.
Равновесная концентрация
На фармакокинетику эстрадиола влияет концентрация ГСПГ. У женщин измеряемая концентрация эстрадиола в плазме крови представляет собой совокупность эндогенного эстрадиола и эстрадиола, поступившего при приеме препарата Клайра. Во время фазы приема таблеток, содержащих 2 мг эстрадиола валерата + 3 мг диеногеста максимальная и средняя концентрации эстрадиола в сыворотке крови при равновесном состоянии составляют, соответственно, 66,0 пг/мл и 51,6 пг/мл. В течение всего 28-дневного цикла поддерживались стабильные минимальные концентрации эстрадиола в диапазоне от 28,7 пг/мл до 64,7 пг/мл.
Фармакодинамика
Контрацептивный эффект Клайра основывается на взаимодействии различных факторов, наиболее важными из которых являются: торможение овуляции, изменение вязкости шеечной слизи и изменения в эндометрии. Помимо контрацептивного действия, комбинированные оральные контрацептивы (КОК) оказывают позитивное воздействие, которое следует учитывать при выборе метода контроля за рождаемостью. Цикл становится более регулярным, реже наблюдаются болезненные менструации, уменьшается интенсивность кровотечения, в результате чего снижается риск железодефицитной анемии.
Существуют также данные о снижении риска развития рака эндометрия и яичников. Высокодозированные оральные контрацептивы (0,05 мг этинилэстрадиола) снижают частоту развития кист яичников, воспалительных заболеваний малого таза, доброкачественных заболеваний молочной железы и внематочной беременности. Насколько эти данные относятся к низкодозированным контрацептивам, требует дальнейшего изучения.
Преимуществом препарата Клайра является то, что он содержит в своем составе эстрадиол, обладающий ограниченным пролиферативным влиянием на эндометрий и прогестаген с выраженным эффектом на эндометрий, а также представляет режим дозирования в виде снижения дозы эстрогена и повышения дозы прогестагена, что может быть использовано с целью лечения тяжелых и/или длительных менструальных кровотечений у женщин без наличия органической патологии, нуждающихся в использовании оральной контрацепции.
Эстрогеном в препарате Клайра является эстрадиола валерат, предшественник естественного 17-эстрадиола человека (1 мг эстрадиола валерата соответствует 0,76 мг 17-эстрадиола). Эстрогенный компонент, используемый в этом КОК, таким образом, отличается от обычно используемых в КОК эстрогенов, которые являются синтетическими эстрогенами — этинилэстрадиол или его предшественник местранол, оба содержащие этинильную группу в положении 17. Эта группа обуславливает более высокую метаболическую стабильность, однако, также и более выраженное действие на печень.
Прием препарата Клайра ведет к менее выраженному действию на печень по сравнению с трехфазными КОК, содержащими этинилэстрадиол и левоноргестрел. Было показано, что влияние на концентрацию глобулина, связывающего половые гормоны (ГСПГ) и параметры гемостаза менее выражено. В комбинации с диеногестом эстрадиола валерат демонстрирует повышение липопротеидов высокой плотности (ЛПВП), тогда как концентрация холестерина липопротеидов низкой плотности (ЛПНП) несколько снижается.
Диеногест представляет собой прогестаген, действующий при оральном применении, который характеризуется дополнительными частичными антиандрогенными эффектами. Благодаря особой химической структуре обеспечивается спектр фармакологического действия, сочетающий наиболее важные преимущества 19-нор-прогестагенов и производных прогестерона.
Показания к применению
— оральная контрацепция
— лечение обильных менструальных кровотечений у женщин без наличия органической патологии, нуждающихся в использовании оральной контрацепции.
Решение о назначении Клайра следует принимать в индивидуальном порядке с учетом имеющихся у женщины факторов риска, в частности развития венозной тромбоэмболии, и оценки риска развития венозной тромбоэмболии на фоне приема Клайра в сравнении с другими оральными контрацептивами.
Способ применения и дозы
При правильном приеме комбинированных оральных контрацептивов показатель «неудачи метода» составляет не более 1% в год. Контрацептивная надежность может снижаться при пропуске таблеток или неправильном их приеме.
Способ применения
Для приема внутрь
Таблетки следует принимать внутрь по порядку, указанному на упаковке, каждый день примерно в одно и то же время с небольшим количеством воды.
Следует принимать по одной таблетке в сутки последовательно в течение 28 дней. Каждую новую упаковку начинают после приема последней таблетки из предшествующей календарной упаковки. Менструальноподобное кровотечение обычно начинается во время приема последних таблеток календарной упаковки и может еще не завершиться до начала следующей календарной упаковки. У некоторых женщин менструальноподобное кровотечение начинается после приема первых таблеток из новой календарной упаковки.
Как начать прием Клайра
— При отсутствии приема каких-либо гормональных контрацептивов в предыдущем месяце
Прием Клайра начинается в первый день менструального цикла (т.е. в первый день менструального кровотечения).
— При переходе с комбинированных гормональных контрацептивов (комбинированного орального контрацептива, вагинального кольца, трансдермального пластыря)
Женщине следует начать прием препарата Клайра на следующий день после приема последней гормонсодержащей таблетки из предыдущей упаковки комбинированного орального контрацептива.
При переходе с вагинального кольца или трансдермального пластыря предпочтительно начать прием Клайра в день удаления кольца или пластыря.
Если ранее использовался только прогестагенный метод контрацепции (мини-пили, инъекция, имплант) или внутриматочная система с высвобождением прогестагена (ВМС)
Женщина может перейти на прием препарата Клайра с мини-пили в любой день (с импланта или ВМС — в день их удаления; с инъекционного метода – в день, на который назначена очередная инъекция), но во всех случаях в течение первых 9 дней приема таблеток рекомендуется дополнительно использовать барьерный метод контрацепции.
После аборта в первом триместре беременности
Женщина может начать прием таблеток немедленно. В этом случае в дополнительных мерах контрацепции нет необходимости.
После родов или аборта во втором триместре беременности
Следует рекомендовать женщине приступать к приему таблеток на 21-28 день после родов или аборта во втором триместре беременности. Если женщина начала принимать таблетки позднее, то ей рекомендуется дополнительно использовать барьерный метод контрацепции в течение первых 9 дней приема таблеток. Однако если половой контакт уже имел место, перед фактическим началом приема препарата Клайра необходимо исключить беременность, или женщине следует подождать наступления первой менструации.
О кормящих женщинах см. раздел Беременность и лактация.
Прием пропущенных таблеток
Пропущенными (белыми) неактивными таблетками можно пренебречь. Однако их следует выбросить во избежание непреднамеренного продления интервала между приемом активных таблеток.
Следующие советы относятся исключительно к пропуску активных таблеток.
Если задержка в приеме любой из активных таблеток составляет менее 12 часов, контрацептивная защита не снижается. Женщина должна выпить пропущенную таблетку сразу, как только вспомнит об этом, а остальные таблетки принимать в обычное время.
Если задержка в приеме любой из активных таблеток составляет более 12 часов, контрацептивная защита может снизиться. Женщина должна принять последнюю пропущенную таблетку сразу, как только вспомнит об этом, даже если это будет означать, что ей придется выпить 2 таблетки одновременно. Затем она продолжит принимать таблетки в обычное время.
В зависимости от дня цикла, в который была пропущена таблетка (подробнее см. Таблицу 1), требуется применять дополнительные меры контрацепции (например, барьерный метод предохранения, в частности презервативы) в соответствии со следующими принципами:
Таблица 1. Принципы обращения с пропущенными таблетками
|
ДЕНЬ |
Цвет Содержание эстрадиола валерата (ЭВ) и диегногеста (ДНГ) |
Принципы, которым требуется следовать, если была пропущена одна таблетка, и прошло более 12 часов: |
|
1 — 2 |
Темно-желтые таблетки (3,0 мг ЭВ) |
— Принять пропущенную таблетку немедленно, а следующую таблетку — в обычное время (даже если это означает, что придется принять 2 таблетки в один день) — Продолжить принимать таблетки в обычном порядке — Дополнительные меры контрацепции в течение последующих 9 дней |
|
3-7 |
Cредне-красные таблетки (2,0 мг ЭВ + 2,0 мг ДНГ) |
|
|
8-17 |
Светло-желтые таблетки (2,0 мг ЭВ + 3,0 мг ДНГ) |
|
|
18-24 |
Светло-желтые таблетки (2,0 мг ЭВ + 3,0 мг ДНГ) |
Выбросить текущую календарную упаковку и немедленно начать прием с первой таблетки из новой календарной упаковки Продолжить принимать таблетки в обычном порядке Дополнительные меры контрацепции в течение последующих 9 дней |
|
25-26 |
Темно-красные таблетки (1,0 мг ЭВ) |
Немедленно принять пропущенную таблетку, а следующую таблетку — в обычное время (даже если это означает, что придется принять 2 таблетки в один день) В дополнительных мерах контрацепции нет необходимости |
|
27-28 |
Белые таблетки (Плацебо) |
Выбросить пропущенную таблетку и продолжить прием таблеток в обычном порядке В дополнительных мерах контрацепции нет необходимости |
Допускается принимать не более 2 таблеток в один день.
Если женщина забыла начать новую календарную упаковку или пропустила одну или более таблеток с 3-го по 9-ый день календарной упаковки, она уже может быть беременна (в том случае, если у нее был половой контакт в течение 7 дней перед пропуском таблетки). Чем больше таблеток (особенно с комбинацией двух активных компонентов в дни с 3-го по 24-ый) пропущено, и чем ближе они к фазе приема неактивных таблеток, тем выше вероятность беременности.
Если женщина пропускала прием таблеток, и затем в конце календарной упаковки/в начале новой календарной упаковки менструальноподобное кровотечение у нее отсутствовало, следует рассмотреть вероятность беременности.
Рекомендации при желудочно-кишечных расстройствах
При тяжелых желудочно-кишечных расстройствах всасывание может быть неполным, поэтому следует принять дополнительные контрацептивные меры.
Если рвота происходит в течение 3-4 часов после приема гормонсодержащей таблетки , то сразу следует принять следующую таблетку, желательно не позднее 12 часов с момента последнего приема. Если период после рвоты составляет более 12 часов, то в данном случае действуют рекомендации, касающиеся пропущенных таблеток, которые приведены в разделе «Прием пропущенных таблеток». Если женщина не хочет менять свою обычную схему приема таблеток, ей необходимо выпить дополнительную таблетку (или таблетки) из новой упаковки.
Дополнительная информация для отдельных категорий пациенток
Пациенты пожилого возраста
Не применимо. Препарат Клайра не показан после наступления менопаузы.
Пациенты с нарушениями функции печени
Препарат Клайра противопоказан женщинам с тяжелыми заболеваниями печени до тех пор, пока показатели функции печени не придут в норму. См. также раздел «Противопоказания».
Пациенты с нарушениями функции почек
Препарат Клайра специально не изучался у пациенток с нарушениями функции почек. Имеющиеся данные не предполагают коррекции режима дозирования у таких пациенток.
Применение в педиатрии
Доступные данные по применению препарат Клайра у пациенток младше 18 лет отсутствуют.
Побочные действия
Данные о побочных реакциях, представленных ниже, классифицированы в соответствии с медицинским словарем для регуляторной деятельности MedDRA, SOSc. Частота основана на данных клинических исследований. Наиболее подходящий термин MedDRA использовался для описания определенной реакции, ее синонимов и связанных заболеваний.
Часто (1/100, 1/10)
— головная боль (включая синусовую головную боль и головную боль напряжения)
— боли в животе, тошнота
— акне (включая пустулезные)
— аменорея, дискомфорт в молочных железах (включая боль, напряженность в молочных железах, нарушения и боль в соске), дисменорея, межцикловые кровотечения, метроррагия (включая нерегулярные менструации)
— прибавка массы тела
Нечасто (1/1 000, 1/100)
— грибковые инфекции, вульво-вагинальные грибковые инфекции (включая вульво-вагинальный кандидоз и выявление специфической цервикальной грибковой инфекции), вагинальные инфекции
— повышенный аппетит
— депрессия, снижение настроения, эмоциональная лабильность (включая плаксивость и аффективную лабильность), бессонница, снижение либидо (включая потерю либидо), нарушения психики, изменения в настроении
— головокружение, мигрень (включая мигрень с аурой и без ауры)
— приливы жара, артериальная гипертензия
— диарея, рвота
— повышение активности ферментов печени (включая АЛТ, АСТ и гамма-глютамилтрансферразу)
— алопеция, повышенное потоотделение, зуд (включая генерализованный), сыпь (включая макулярную)
— мышечные спазмы
— увеличение молочных желез (включая набухание), уплотнение в молочной железе, дисплазия шейки матки, дисфункциональные маточные кровотечения, диспареуния, фиброзно-кистозная болезнь молочных желез, меноррагия, нарушение менструального цикла, киста яичника, предменструальный синдром, лейомиома матки, боль в тазовой области
— спастические сокращения матки, маточное/вагинальное кровотечение, в том числе мажущие выделения, вагинальные выделения, сухость влагалища
— утомляемость, раздражительность, отеки (включая генерализованные отеки)
— снижение массы тела, изменения артериального давления (включая повышение и снижение)
Редко (1/10 000, 1/1000)
— кандидоз, герпес ротовой полости, воспалительные заболевания органов таза, синдром предполагаемого гистоплазмоза глаз, опоясывающий лишай, инфекции мочевыделительной системы, бактериальный вагинит
— задержка жидкости, гипертриглицеридемия
— агрессия, беспокойство, дисфория, повышение либидо, нервозность, кошмары во сне, беспокойство, нарушения сна, стресс
— нарушение внимания, парестезия, вертиго
— непереносимость контактных линз, сухость глаз, отек глаз
— инфаркт миокарда, сердцебиение
— варикозное расширение вен, венозная тромбоэмболия, артериальная тромбоэмболия, артериальная гипотензия, поверхностный флебит
— боль в венах
— сухость во рту, запоры, диспепсия, гастроэзофагеальный рефлюкс
— фокальная нодулярная гиперплазия печени, хронический холецистит
— аллергические кожные реакции (включая аллергический дерматит и крапивницу), хлоазма, дерматит, гирсутизм, гипертрихоз, нейродермит, нарушения пигментации, себорея, кожные нарушения, в том числе уплотнение
— боли в спине, боли в челюсти, ощущение тяжести
— боли в области мочевыделительной системы
— патологическое кровотечение отмены, доброкачественная неоплазия молочной железы, новообразование молочной железы in situ, киста молочной железы, выделения из молочной железы, полип шейки матки, эритема шейки матки, посткоитальное кровотечение, галакторея, вагинальные выделения, гипоменорея, задержка менструации, разрыв кисты яичника, запах из вагинальной области
— ощущение жжения и дискомфорта в вульво-вагинальной области
— лимфоаденопатия
— астма, одышка, носовое кровотечение
— боли в груди, недомогание, гипертермия
— нарушения в мазке из цервикального канала
Описание отдельных побочных реакций
Сообщалось о повышенном риске развития артериальных и венозных тромботических и тромбоэмболических нарушений, включая инфаркт миокарда, инсульт, транзиторные ишемические атаки, венозный тромбоз и тромбоэмболию легочной артерии у женщин, использующих комбинированные гормональные контрацептивы, о которых более детально написано в разделе «Особые указания».
Следующие побочные реакции отмечались у женщин, использующих оральные комбинированные контрацептивы, которые также описаны в разделе «Особые указания»:
— венозные тромбоэмболические нарушения
— артериальные тромбоэмболические нарушения
— артериальная гипертензия
— опухоли печени
— появление или ухудшение состояний, для которых взаимосвязь с приемом комбинированных пероральных контрацептивов не доказана: Болезнь Крона, язвенный колит, эпилепсия, фиброиды матки, порфирия, системная красная волчанка, гестационный герпес, хорея Сиденгама, гемолитико-уремический синдром, холестатическая желтуха
— хлоазма
— острое или хроническое нарушение функции печени может потребовать прекращения приема комбинированного перорального контрацептива, пока функциональные печеночные пробы не вернутся к норме
— у женщин с наследственным ангионевротическим отеком экзогенные эстрогены могут провоцировать или обострять симптомы данного заболевания
— частота диагноза рака молочной железы слегка повышена среди женщин, принимающих оральные контрацептивы. Поскольку рак молочной железы отмечается редко у женщин младше 40 лет, увеличение числа диагнозов является незначительным по отношению к общему риску развития этого заболевания. Его связь с приемом комбинированных пероральных контрацептивов не доказана. Дополнительную информацию см. в разделах «Противопоказания» и «Особые указания»
С неизвестной частотой (несмотря на то, что эти побочные реакции не выявлялись в процессе клинических исследований Клайра®, нельзя исключить возможность их возникновения):
— мультиформная эритема, узловатая эритема, выделения из молочных желез и реакции гипречувствительности
Противопоказания
Комбинированные пероральные контрацептивы не должны применяться при наличии какого-либо из состояний, перечисленных ниже. Если какие-либо из этих состояний развиваются впервые на фоне приема, препарат должен быть немедленно отменен.
— наличие или риск венозной тромбоэмболии
-
венозная тромбоэмболия в настоящее время (на антикоагулянтной терапии) или в анамнезе (например, тромбоз глубоких вен, или тромбоэмболия легочной артерии)
-
наследственно обусловленная или приобретенная предрасположенность к венозной тромбоэмболии (например, резистентность к активированному протеину С (включая фактор V Лейдена), дефицит антитромбина III, протеина С или протеина S
-
большие хирургические вмешательства с продолжительной иммобилизацией
-
высокий риск венозной тромбоэмболии вследствие наличия множественных факторов риска
— наличие или риск артериальной тромбоэмболии
-
артериальная тромбоэмболия в настоящее время или в анамнезе (например, инфаркт миокарда) или состояния, предшествующие артериальной тромбоэмболии (например, стенокардия)
-
цереброваскулярные нарушения — инсульт в настоящее время или в анамнезе или состояния, предшествующие цереброваскулярным нарушениям (например, транзиторные ишемические атаки)
-
наследственно обусловленная или приобретенная предрасположенность к артериальной тромбоэмболии (например, гипергомоцистеинемия и антифосфолипидные антитела (антитела к кардиолипину и волчаночный антикоагулянт)
-
мигрень с очаговыми неврологическими симптомами в анамнезе
-
высокий риск развития артериальной тромбоэмболии вследствие наличия множественных факторов риска, таких как:
— сахарный диабет с сосудистыми осложнениями
— выраженная артериальная гипертензия
— выраженная дислипопротеинемия
— панкреатит с выраженной гипертриглицеридемией в настоящее время или в анамнезе
— тяжелые заболевания печени в настоящее время или в анамнезе (до нормализации печеночных тестов)
— опухоли печени (доброкачественные или злокачественные) в настоящее время или в анамнезе
— выявленные гормонозависимые злокачественные заболевания (например,
половых органов или молочных желез) или подозрение на них
— вагинальное кровотечение неясного генеза
— гиперчувствительность к любому из компонентов препарата
Лекарственные взаимодействия
Эффекты других препаратов на Клайра
Возможно взаимодействие с лекарственными средствами, индуцирующими микросомальные ферменты печени, что может способствовать к возрастанию клиренса половых гормонов и вести к прорывным кровотечениям и/или снижению контрацептивной эффективности препарата.
Во время приема таких препаратов, женщине следует дополнительно использовать барьерный или другой метод контрацепции в дополнение к Клайра. При этом барьерный метод контрацепции следует использовать в течение периода сопутствующего приема препаратов и в течение 28 дней после их отмены.
Вещества, повышающие клиренс половых гормонов (снижающие эффективность комбинированных гормональных контрацептивов вследствие индукции ферментов печени), например:
фенитоин, барбитураты, примидон, карбамазепин и рифампицин; также есть предположения в отношении окскарбазепина, топирамата, фелбамата, гризеофульвина и препаратов, содержащих зверобой.
Вещества с различными эффектами на клиренс комбинированных оральных контрацептивов
При сочетанном применении с комбинированными оральными контрацептивами многие ингибиторы ВИЧ/HCV-протеазы и ненуклеозидные ингибиторы обратной транскриптазы могут повышать или снижать концентрацию эстрогенов или прогестинов в плазме крови. Указанные изменения в некоторых случаях могут иметь релевантное значение.
Вещества, снижающие клиренс комбинированных оральных контрацептивов (ингибиторы ферментов)
Диеногест является субстратом системы цитохрома Р450 (СYР) 3A4.
Известные ингибиторы CYP3A4, такие как противогрибковые препараты (например, итраконазол, вориконазол, флуконазол), верапамил, макролиды (например, кларитромицин, эритромицин), дилтиазем и грейпфрутовый сок могут повышать уровень диеногеста в плазме крови.
Эффекты препарата Клайра в отношении других лекарственных средств
КОК могут влиять на метаболизм ряда других лекарственных средств (например, ламотриджина), что может приводить либо к повышению (например, циклоспорина), либо к снижению концентрации (например, ламотриджина) этих веществ в плазме крови и тканях.
Исходя из данных исследований in vitro, ингибирование ферментов CYP при применении препарата Клайра в терапевтической дозе маловероятно.
Помимо вышесказанного, при назначении сопутствующей терапии необходимо ознакомиться с разделом лекарственных взаимодействий каждого из назначаемых препаратов.
Особые указания
Меры предосторожности и предупреждения
Предупреждения
Если какие-либо из состояний/факторов риска, указанных ниже, имеются в настоящее время, необходимо обсудить с женщиной целесообразность применения Клайра.
В случае усиления или первого проявления любого из этих состояний или факторов риска женщина должна проконсультироваться со своим врачом, который может принять решение о необходимости отмены препарата.
При подозрении или подтверждении венозной тромбоэмболии (ВТЭ) или артериальной тромбоэмболии (АТЭ) следует прекратить прием комбинированных оральных контрацептивов (КОК). Если женщине назначена антикоагулянтная терапия, следует обеспечить адекватную контрацепцию альтернативный методом, учитывая тератогенный эффект антикоагулянтной терапии (кумаринами).
Не проводилось эпидемиологических исследований по влиянию эстрадиола или эстрадиол-валерат-содержащих КОК. Все следующие предупреждения основаны на клинических и эпидемиологических данных по изучению этинилэстрадиол содержащих препаратов.
-
Циркуляторные нарушения
Риск венозной тромбоэмболии
Использование любых комбинированных оральных контрацептивов повышает риск развития ВТЭ у пациенток, по сравнению с женщинами, не использующих их.
Препараты, содержащие левоноргестрел, норгестимат и норэтистерон имеют наименьший риск развития ВТЭ. Степень риска при применении Клайра в сравнении с указанными препаратами неизвестна. Решение об использовании препарата иного, чем известным с низким риском ВТЭ, должно быть принято после совместного обсуждения с женщиной. Это необходимо для обеспечения гарантии того, что женщина осведомлена о рисках развития ВТЭ на фоне препарата Клайра, и каким образом имеющиеся у нее факторы риска повлияют на указанный риск, а также о том, что риск ВТЭ максимален в первый год применения КОК. Кроме того, имеются некоторые доказательства того, что повышение риска может отмечаться при возобновлении использования КОК после перерыва в приеме в течение 4 недель или более.
У женщин, не применяющих комбинированные гормональные контрацептивы и при отсутствии беременности, ВТЭ развивается с частотой 2 на 10 000 случаев на протяжении 1 года. Однако этот риск может значительно увеличиваться в зависимости от индивидуальных факторов риска каждой женщины (см. ниже).
Данные эпидемиологических исследований свидетельствуют о том, что из 10 000 женщин, принимающих низкодозированные комбинированные гормональные контрацептивы (менее 50 мкг этинилэстрадиола), в 6-12 случаях может развиться ВТЭ в течение 1 года.
Предполагается, что из 10 000 женщин, которые используют комбинированные гормональные контрацептивы, содержащие левоноргестрел, в 6 случаях может развиться ВТЭ в течение 1 года.
Степень риска при применении КОК, содержащих диеногест в комбинации с эстрадиолом, в сравнении с КОК, содержащих левоноргестрел, неизвестна.
Частота развития ВТЭ на фоне приема низкодозированных КОК ниже, чем ожидаемая при беременности и в послеродовом периоде.
Венозная тромбоэмболия может привести к летальному исходу в 1-2% случаев.
У женщин, принимающих комбинированные пероральные контрацептивы, крайне редки случаи тромбоза других кровеносных сосудов, например печеночных, мезентериальных, почечных, церебральных артерий и вен, а также сосудов сетчатки.
Факторы риска развития венозной тромбоэмболии
Риск развития венозных тромбоэмболических осложнений на фоне приема комбинированных оральных контрацептивов может существенно повышаться, если у женщины имеются дополнительные факторы риска, особенно при наличии множественных факторов риска. Назначение Клайра противопоказано, если у женщины имеются множественные факторы риска, которые обуславливают высокий риск развития венозного тромбоза.
Следует учитывать вероятность повышенного синергического риска тромбоза у женщин с комбинацией нескольких факторов риска или более высокой выраженностью одного из факторов риска. В таких случаях повышенный риск может быть выше, чем просто совокупный риск с учетом всех факторов. Комбинированные пероральные контрацептивы не следует назначать в случае отрицательной оценки соотношения риск/преимущество (см. раздел «Противопоказания»).
Риск артериальной тромбоэмболии
Данные эпидемиологических исследований свидетельствуют о повышенном риске развития АТЭ (инфаркт миокарда) или цереброваскулярных нарушений (например, транзиторные ишемические атаки, инсульт).
Артериальные тромбоэмболические процессы могут быть жизнеугрожающими или привести к летальному исходу.
Факторы риска развития артериальной тромбоэмболии
Риск развития артериальных тромбоэмболических осложнений или цереброваскулярных нарушений на фоне приема комбинированных оральных контрацептивов повышается при наличии у женщины факторов риска.
Назначение препарата Клайра противопоказано, если у женщины имеются один значительный фактор или множественные факторы риска, которые обуславливают высокий риск развития артериального тромбоза.
Следует учитывать вероятность повышенного синергического риска тромбоза у женщин с комбинацией нескольких факторов риска или более высокой выраженностью одного из факторов риска.
В таких случаях повышенный риск может быть выше, чем просто совокупный риск с учетом всех факторов. Комбинированные пероральные контрацептивы не следует назначать в случае отрицательной оценки соотношения риск/преимущество (см. раздел «Противопоказания»).
Факторы риска развития венозной и артериальной тромбоэмболии
Риск развития тромбоза (венозного и/или артериального), тромбоэмболических или цереброваскулярных нарушений повышается:
— с возрастом (старше 35 лет);
— у курящих (женщинам следует отказаться от курения, если они намерены принимать КОК. Женщинам старше 35 лет, продолжающим курение строго рекомендованы другие методы контрацепции);
— при наличии семейного анамнеза (т.е. венозной или артериальной тромбоэмболии когда-либо у родных братьев или сестер или родителей в относительно молодом возрасте до 50 лет). Если наследственная предрасположенность известна или предполагается, женщине необходимо проконсультироваться с врачом для решения вопроса о возможности приема комбинированных оральных контрацептивов;
-
при ожирении (индекс массы тела (ИМТ) более чем 30 кг/м2). Риск повышается при увеличении ИМТ. Особенно важно учитывать наличие других факторов риска;
-
при дислипопротеинемии;
-
при артериальной гипертензии;
-
при мигрени;
-
при заболеваниях клапанов сердца;
-
при фибрилляции предсердий;
-
при длительной иммобилизации, серьезном хирургическом вмешательстве, любой операции на ногах или обширной травме. В этих ситуациях желательно прекратить использование комбинированных пероральных контрацептивов (в случае планируемой операции, по крайней мере, за четыре недели до нее) и не возобновлять прием в течение двух недель после окончания иммобилизации. Временная иммобилизация, включая перелеты на самолете длительностью более 4 часов, может повышать риск развития ВТЭ, в частности у женщин, имеющих другие факторы риска. Для предотвращения незапланированной беременности необходимо использовать другой метод контрацепции. Если отмена препарата Клайра не была проведена заранее, следует рассмотреть необходимость назначения антитромботической терапии.
Вопрос о возможной роли варикозного расширения вен и поверхностного тромбофлебита в развитии венозных тромбоэмболий остается спорным. Следует учитывать повышенный риск развития тромбоэмболии во время беременности и, особенно в течение 6 недель послеродового периода.
Циркуляторные нарушения также могут отмечаться при сахарном диабете, системной красной волчанке, гемолитико-уремическом синдроме, хронических воспалительных заболеваниях кишечника (болезнь Крона или неспецифический язвенный колит) и серповидно-клеточной анемии.
Увеличение частоты и тяжести мигрени во время применения комбинированных оральных контрацептивов (что может предшествовать цереброваскулярным нарушениям) может быть основанием для немедленного прекращения приема этих препаратов.
Биохимические параметры, которые могут быть показателями наследственной или приобретенной предрасположенности к венозному или артериальному тромбозу, включают резистентность к активированному протеину С, гипергомоцистеинемию, дефицит антитромбина-III, дефицит протеина С, дефицит протеина S, антифосфолипидные антитела (антитела к кардиолипину, волчаночный антикоагулянт).
При оценке соотношения риск/преимущество, врачу следует принять во внимание, что адекватное лечение соответствующего состояния может уменьшить связанный с ним риск развития тромбоза. Также следует учитывать, что риск тромбозов и тромбоэмболий при беременности выше, чем при приеме низкодозированных комбинированных оральных контрацептивов (меньше 0,05 мг этинилэстрадиола).
Симптомы венозной тромбоэмболии
Симптомы тромбоза глубоких вен включают следующее:
односторонний отек в ноге или вдоль вены на ноге, боль или дискомфорт в ноге только в вертикальном положении или при ходьбе, локальное повышение температуры в пораженной конечности, покраснение или изменение окраски кожных покровов на ноге.
Симптомы тромбоэмболии легочной артерии заключаются в следующем: внезапное начало необъяснимой одышки или учащенного дыхания, внезапный приступ кашля, который может сопровождаться кровохарканьем, острая боль в грудной клетке, которая может усиливаться при глубоком дыхании, чувство тревоги, сильное головокружение; учащенное или нерегулярное сердцебиение. Некоторые из этих симптомов (например, «одышка» и «кашель») являются неспецифическими и в этой связи могут быть ошибочно интерпретированы как признаки более частых и менее тяжелых нарушений (например, инфекции дыхательных путей).
Другие признаки окклюзии сосудов могут включать следующее:
внезапная боль, отек и посинение конечности.
При окклюзии сосудов глаз может отмечаться расплывчатое зрение, которое может прогрессировать до потери зрения. В некоторых случаях может происходить почти внезапная потеря зрения.
Симптомы артериальной тромбоэмболии
Симптомами цереброваскулярных нарушений могут быть внезапная слабость или онемение лица, верхних и нижних конечностей, особенно с одной стороны тела, внезапная спутанность сознания, нарушение речи или трудности с восприятием; внезапное ухудшение зрения одного или обоих глаз, внезапное нарушение походки, головокружение, потеря равновесия или координации движений, внезапная тяжелая или продолжительная головная боль без видимой причины, потеря сознания или обморок с припадком или без него. Другими признаками окклюзии сосудов могут быть также внезапная боль, отек или слабая синюшность конечностей, симптомы «острого живота».
Симптомы инфаркта миокарда включают: боль, дискомфорт, давление, тяжесть, чувство сжатия или распирания в груди, в руке или за грудиной, чувство дискомфорта с иррадиацией в спину, скулы, гортань, руку, желудок, чувство полноты или распирания в желудке, чувство удушья, холодный пот, тошнота, рвота или головокружение, сильная слабость, чувство тревоги, одышка, учащенное или нерегулярное сердцебиение.
Опухоли
Наиболее существенным фактором риска развития рака шейки матки является вирусная инфекция — персистирующая папиллома человека (HPV). Имеются сообщения о некотором повышении риска развития рака шейки матки при длительном применении комбинированных пероральных контрацептивов, однако остаются противоречивыми данные о том, в какой степени это может быть связано с другими факторами, в том числе со скринингом на предмет патологии шейки матки и особенностями полового поведения (более редкое применение барьерных методов контрацепции).
Мета-анализ 54 фармако-эпидемиологических исследований продемонстрировал, что имеется несколько повышенный относительный риск (RR=1.24) развития рака молочной железы, диагностированного у женщин, которые на момент исследования использовали комбинированные оральные контрацептивы. Повышенный риск постепенно исчезает в течение 10 лет после прекращения приема этих препаратов. В связи с тем, что рак молочной железы отмечается редко у женщин младше 40 лет, увеличение числа случаев рака молочной железы у женщин, принимающих комбинированные оральные контрацептивы в настоящее время или принимавших недавно, является незначительным по отношению к общему риску развития этого заболевания. Его связь с приемом комбинированных оральных контрацептивов не доказана. Наблюдаемое повышение риска может быть следствием более ранней диагностики рака молочной железы у женщин, применяющих комбинированные оральные контрацептивы, биологических эффектов комбинированных оральных контрацептивов или сочетанием обоих факторов. У женщин, использовавших комбинированные оральные контрацептивы, выявляется клинически менее выраженный рак молочной железы, чем у женщин, никогда их не применявших.
В редких случаях на фоне применения комбинированных оральных контрацептивов наблюдалось развитие доброкачественных опухолей печени и еще в более редких случаях развитие злокачественных опухолей печени. В отдельных случаях, опухоли печени могут приводить к жизнеугрожающим интраабдоминальным кровотечениям. В случае появления сильных болей в верхней области живота, увеличения печени или признаков интраабдоминального кровотечения следует учитывать опухоль печени при проведении дифференциального диагноза.
Злокачественные опухоли могут быть жизнеугрожающими или привести к летальному исходу.
Другие состояния
У женщин с гипертриглицеридемией (или наличия этого состояния в семейном анамнезе) возможно повышение риска развития панкреатита во время приема комбинированных оральных контрацептивов.
Хотя небольшое повышение артериального давления было описано у многих женщин, принимающих комбинированные оральные контрацептивы, клинически значимые повышения отмечались редко. Тем не менее, если во время приема комбинированных оральных контрацептивов развивается стойкое, клинически значимое повышение артериального давления, следует отменить эти препараты и начать лечение артериальной гипертензии. Прием комбинированных оральных контрацептивов может быть продолжен, если с помощью гипотензивной терапии достигнуты нормальные значения артериального давления.
Следующие состояния, наблюдаемые при беременности, могут также появляться или ухудшаться при приеме комбинированных оральных контрацептивов: желтуха и/или зуд, связанный с холестазом; формирование камней в желчном пузыре; порфирия; системная красная волчанка; гемолитико- уремический синдром; хорея Сиденгама; герпес беременных; потеря слуха, связанная с отосклерозом. Однако взаимосвязь между развитием указанных состояний и приемом комбинированных оральных контрацептивов не доказана.
У женщин с наследственным ангионевротическим отеком экзогенные эстрогены могут провоцировать или обострять симптомы данного заболевания.
При наличии острых или хронических нарушений функции печени необходимо решить вопрос о прекращении использования комбинированных оральных контрацептивов, до тех пор, пока показатели функции печени не нормализуются. При развитии рецидивирующей холестатической желтухи, которая развивается впервые во время беременности или предыдущего приема половых гормонов следует прекратить прием комбинированных оральных контрацептивов.
Хотя комбинированные оральные контрацептивы могут оказывать влияние на резистентность к инсулину и толерантность к глюкозе, нет необходимости изменения терапевтического режима у больных сахарным диабетом, использующих низкодозированные комбинированные оральные контрацептивы (<0,05 мг этинилэстрадиола). Тем не менее, женщины с сахарным диабетом должны тщательно наблюдаться во время приема комбинированных оральных контрацептивов.
На фоне применения комбинированных оральных контрацептивов наблюдались проявления болезни Крона и неспецифического язвенного колита.
Женщины со склонностью к хлоазме во время приема комбинированных оральных контрацептивов должны избегать длительного пребывания на солнце и воздействия ультрафиолетового излучения.
Медицинские осмотры
Перед началом применения препарата Клайра, а также периодически в процессе применения препарата женщине рекомендуется провести тщательный сбор анамнеза, включая семейный, пройти тщательное общемедицинское и гинекологическое обследование (включая измерение артериального давления, исследование молочных желез, органов брюшной полости и малого таза, в том числе цитологическое исследование цервикальной слизи), исключить беременность. Важно проводить периодические медицинские обследования, поскольку противопоказания (например, транзиторные ишемические атаки и другие) или факторы риска (например, наследственная предрасположенность к венозным или артериальным тромбозам) могут проявиться в процессе применения препарата.
Следует предупредить женщину, что препараты типа Клайра не предохраняют от ВИЧ-инфекции (СПИД) и других заболеваний, передающихся половым путем!
Снижение эффективности
Эффективность комбинированных оральных контрацептивных препаратов может быть снижена при пропуске приема гормонсодержащих таблеток, при развитии рвоты и диареи во время приема таблеток или в результате лекарственного взаимодействия.
Влияние на менструальный цикл
На фоне приема комбинированных оральных контрацептивов могут отмечаться нерегулярные кровотечения (мажущие кровянистые выделения или прорывные кровотечения), особенно в течение первых месяцев применения. Поэтому, оценка любых нерегулярных кровотечений должна проводиться только после периода адаптации, составляющего приблизительно три цикла.
Если нерегулярные кровотечения повторяются или развиваются после предшествующих регулярных циклов, следует провести тщательное обследование для исключения злокачественных новообразований или беременности.
У некоторых женщин во время приема таблеток плацебо может не развиться кровотечение отмены. Если комбинированные оральные контрацептивы принимались согласно указаниям, маловероятно, что женщина беременна. Тем не менее, если до этого комбинированные оральные контрацептивы принимались нерегулярно или, если отсутствуют подряд два кровотечения отмены, до продолжения приема препарата должна быть исключена беременность
Лактоза
В каждой темно-желтой, средне-красной, светло-желтой и темно-красной гормонсодержащей таблетке препарата Клайра содержится 46, 45, 48 или 44 мг лактозы, соответственно, а в одной несодержащей гормона таблетке белого цвета содержится 50 мг лактозы.
У пациенток с редкими наследственными нарушениями, такими как непереносимость галактозы, дефицит лактазы Lapp или глюкозо-галактозная мальабсорбция, находящихся на безлактозной диете, следует учитывать количество лактозы, содержащейся в препарате.
Лабораторные тесты
Прием комбинированных оральных контрацептивов может влиять на результаты некоторых лабораторных тестов, включая биохимические показатели функции печени, почек, щитовидной железы, надпочечников, уровень транспортных белков в плазме, показатели углеводного обмена, параметры коагуляции и фибринолиза. Изменения обычно не выходят за границы нормальных значений.
Применение в педиатрии
Доступные данные по применению препарат Клайра у пациенток младше 18 лет отсутствуют.
Беременность и период лактации
Беременность
Клайра не назначается во время беременности. Если во время приема препарата выявляется беременность, необходимо сразу же отменить его прием. Однако обширные фармако-эпидемиологические исследования не выявили никакого повышенного риска дефектов развития у детей, рожденных женщинами, получавшими половые стероиды (в том числе комбинированные оральные контрацептивы) до беременности или тератогенного действия, когда половые стероиды принимались по неосторожности в ранние сроки беременности.
Следует учитывать повышенный риск развития ВТЭ при возобновлении приема Клайра в послеродовом периоде.
Лактация
Прием комбинированных оральных контрацептивов может уменьшать количество грудного молока и изменять его состав, поэтому, их использование в целом не рекомендуется до прекращения грудного вскармливания. Небольшое количество половых стероидов и/или их метаболитов может выводиться с молоком.
Особенности влияния лекарственного средства на способность управлять транспортным средством и потенциально опасными механизмами
Не выявлены.
Передозировка
О серьезных побочных эффектах при передозировке не сообщалось. Симптомы, которые могут отмечаться при приеме гормонсодержащих таблеток: тошнота, рвота и, у молодых девушек, незначительное влагалищное кровотечение.
Лечение: симптоматическое, специфического антидота нет.
Форма выпуска и упаковка
По 28 таблеток (26 активных: 2 темно-желтых, 5 средне-красных, 17 светло-желтых, 2 темно-красных и 2 белых таблеток плацебо) помещают в контурную ячейковую упаковку из пленки ПВХ и фольги алюминиевой.
1 контурная упаковка вклеена в книжку-раскладушку картонную. По 1 книжке-раскладушке вместе с самоклеющимся календарем и инструкцией по медицинскому применению на государственном и русском языках запечатаны в прозрачную пленку.
Условия хранения
Хранить при температуре не выше 30о С.
Хранить в недоступном для детей месте!
Срок хранения
5 лет
Не применять по истечении срока годности.
Условия отпуска из аптек
По рецепту
Производитель
Байер Веймар ГмбХ и Ко. КГ, 99427 Веймар, Германия
Владелец регистрационного удостоверения
Байер Фарма АГ, Берлин, Германия
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукта (товара):
ТОО «Байер КАЗ»
ул. Тимирязева, 42, бизнес-центр «Экспо-Сити», пав. 15
050057 Алматы, Республика Казахстан
тел. +7 727 258 80 40, факс: +7 727 258 80 39
e-mail: kz.claims@bayer.com
| 429393521477976970_ru.doc | 168.5 кб |
| 857530941477978145_kz.doc | 204 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
Ядро:
• Активный компонент
Эстрадиола валерат, микро 20 – 3,00 мг
• Вспомогательные компоненты
Лактозы моногидрат, крахмал кукурузный, крахмал кукурузный прежелатинизированный, повидон-25, магния стеарат
Оболочка: гипромеллоза, макрогол-6000, тальк, титана диоксид, краситель железа оксид желтый.
На одну розовую таблетку покрытую пленочной оболочкой:
Ядро:
• Активные компоненты
Эстрадиола валерат, микро 20 – 2,00 мг
Диеногест, микро — 2,00 мг
• Вспомогательные компоненты
Лактозы моногидрат, крахмал кукурузный, крахмал кукурузный прежелатинизированный, повидон-25, магния стеарат
Оболочка: гипромеллоза, макрогол-6000, тальк, титана диоксид, краситель железа оксид красный.
На одну светло-желтую таблетку покрытую пленочной оболочкой:
Ядро:
• Активные компоненты
Эстрадиола валерат, микро 20 – 2,00 мг
Диеногест, микро — 3,00 мг
• Вспомогательные компоненты
Лактозы моногидрат, крахмал кукурузный, крахмал кукурузный прежелатинизированный, повидон-25, магния стеарат
Оболочка: гипромеллоза, макрогол-6000, тальк, титана диоксид, краситель железа оксид желтый.
На одну красную таблетку покрытую пленочной оболочкой:
Ядро:
• Активный компонент
Эстрадиола валерат, микро 20 – 1,00 мг
• Вспомогательные компоненты
Лактозы моногидрат, крахмал кукурузный, крахмал кукурузный прежелатинизированный, повидон-25, магния стеарат
Оболочка: гипромеллоза, макрогол-6000, тальк, титана диоксид, краситель железа оксид красный.
На одну белую таблетку покрытую пленочной оболочкой (плацебо):
Ядро:
• Вспомогательные компоненты
Лактозы моногидрат, крахмал кукурузный, повидон-25, магния стеарат.
Оболочка: гипромеллоза, тальк, титана диоксид.
Темно-желтые таблетки: круглые двояковыпуклые таблетки, покрытые пленочной оболочкой темно-желтого цвета, с гравировкой “DD” в правильном шестиугольнике на одной стороне. Вид таблеток на поперечном разрезе: ядро от белого до почти белого цвета, оболочка темно-желтая.
Розовые таблетки: круглые двояковыпуклые таблетки, покрытые пленочной оболочкой розового цвета, с гравировкой “DJ” в правильном шестиугольнике на одной стороне. Вид таблеток на поперечном разрезе: ядро от белого до почти белого цвета, оболочка – розовая.
Светло-желтые таблетки: круглые двояковыпуклые таблетки, покрытые пленочной оболочкой бледно-желтого цвета, с гравировкой “DH” в правильном шестиугольнике на одной стороне. Вид таблеток на поперечном разрезе: ядро от белого до почти белого цвета, оболочка – бледно-желтая.
Красные таблетки: круглые двояковыпуклые таблетки, покрытые пленочной оболочкой красного цвета, с гравировкой “DN” в правильном шестиугольнике на одной стороне. Вид таблеток на поперечном разрезе: ядро от белого до почти белого цвета, оболочка – красная.
Белые таблетки (плацебо): круглые двояковыпуклые таблетки, покрытые пленочной оболочкой белого цвета, с гравировкой “DT” в правильном шестиугольнике на одной стороне. Вид таблеток на поперечном разрезе: ядро от белого до почти белого цвета, оболочка – белая.
Половые гормоны и модуляторы половой системы. Гормональные контрацептивы для системного применения. Прогестагены и эстрогены (фиксированные комбинации).
Код АТС G03AB08.
• оральная контрацепция
• лечение тяжелых и/или длительных менструальных кровотечений у женщин без наличия органической патологии, нуждающихся в использовании оральной контрацепции. Решение о назначении препарата Клайра должно приниматься с учетом имеющихся индивидуальных факторов риска женщины, в том числе тех, которые связаны с риском развития ВТЭ (венозная тромбоэмболия). Также следует учитывать, насколько риск развития ВТЭ при приеме препарата Клайра сопоставим с риском развития ВТЭ при приеме других комбинированных оральных контрацептивов (КОК).
Внутрь, независимо от приема пищи.
Как применять препарат Клайра
Таблетки следует принимать в указанном на упаковке порядке каждый день приблизительно в одно и то же время, при необходимости запивая водой или другой жидкостью. Прием таблеток осуществляется непрерывно. Следует принимать по одной таблетке в сутки последовательно в течение 28 дней. Каждую новую упаковку начинают после приема последней таблетки из предшествующей календарной упаковки. Менструальноподобное кровотечение обычно начинается во время приема последних таблеток календарной упаковки и может еще не завершиться до начала следующей календарной упаковки. У некоторых женщин менструальноподобное кровотечение начинается после приема первых таблеток из новой календарной упаковки.
Как начинать прием препарата Клайра
• Если гормональная контрацепция не использовалась ранее (в предыдущем месяце) Таблетки начинают принимать в 1-ый день естественного менструального цикла женщины (т.е. в 1-ый день менструального кровотечения).
• Переход с другого комбинированного орального контрацептива (КОК) (другого КОК, вагинального кольца или трансдермального пластыря)
Женщине следует начать прием препарата Клайра на следующий день после того, как была выпита последняя активная таблетка (таблетка, содержащая активные вещества) из упаковки предыдущих КОК. При использовании вагинального кольца или трансдермального пластыря женщине следует начать прием препарата Клайра в день их удаления.
• Если ранее использовался только прогестагенный метод контрацепции (мини-пили, инъекция, имплант) или внутриматочная система с высвобождением прогестагена (ВМС)
Женщина может перейти на прием препарата Клайра с мини-пили в любой день (с импланта или ВМС – в день их удаления; с инъекционного метода – в день, на который назначена очередная инъекция), но во всех случаях в течение первых 9 дней приема таблеток рекомендуется дополнительно использовать барьерный метод контрацепции.
• После аборта в первом триместре беременности
Женщина может начать прием таблеток немедленно. В этом случае в дополнительных мерах контрацепции нет необходимости.
• После родов или аборта во втором триместре беременности:
О кормящих женщинах см. раздел «Беременность и лактация».
Следует рекомендовать женщине приступать к приему таблеток на 21-28 день после родов или аборта во втором триместре беременности. Если женщина начала принимать таблетки позднее, то ей рекомендуется дополнительно использовать барьерный метод контрацепции в течение первых 9 дней приема таблеток. Однако если половой контакт уже имел место, перед фактическим началом приема препарата Клайра необходимо исключить беременность, или женщине следует подождать наступления первой менструации.
Прием пропущенных таблеток
Пропущенными (белыми) неактивными таблетками можно пренебречь. Однако их следует выбросить во избежание непреднамеренного продления интервала между приемом активных таблеток.
Следующие советы относятся исключительно к пропуску активных таблеток:
Если задержка в приеме любой из таблеток составляет менее 12 часов, контрацептивная защита не снижается. Женщина должна выпить пропущенную таблетку сразу, как только вспомнит об этом, а остальные таблетки принимать в обычное время.
Если задержка в приеме любой из таблеток составляет более 12 часов, контрацептивная защита может снизиться. Женщина должна принять последнюю пропущенную таблетку сразу, как только вспомнит об этом, даже если это будет означать, что ей придется выпить 2 таблетки одновременно. Затем она продолжит принимать таблетки в обычное время.
В зависимости от дня менструальноподобного цикла, в который была пропущена таблетка (подробнее см. Таблицу 1), требуется применять дополнительные меры контрацепции (например, барьерный метод предохранения, в частности презервативы) в соответствии со следующими принципами:
Таблица 1. Принципы обращения с пропущенными таблетками
|
ДЕНЬ |
Цвет Содержание эстрадиола валерата (ЭВ) и диеногеста (ДНГ) |
Принципы, которым требуется следовать, если была пропущена одна таблетка, и прошло более 12 часов: |
| 1-2 |
Темно-желтые таблетки (3,0 мг ЭВ) |
— Принять пропущенную таблетку немедленно, а следующую таблетку – в обычное время (даже если это означает, что придется принять 2 таблетки в один день) — Продолжить принимать таблетки в обычном порядке — Дополнительные меры контрацепции в течение последующих 9 дней |
| 3-7 |
Розовые таблетки (2,0 мг ЭВ + 2,0 мг ДНГ) |
|
| 8-17 |
Светло-желтые таблетки (2,0 мг ЭВ + 3,0 мг ДНГ) |
|
| 18-24 |
Светло-желтые таблетки (2,0 мг ЭВ + 3,0 мг ДНГ) |
— Выбросить текущую календарную упаковку и немедленно начать прием с первой таблетки из новой календарной упаковки — Продолжить принимать таблетки в обычном порядке — Дополнительные меры контрацепции в течение последующих 9 дней |
| 25-26 |
Красные таблетки (1,0 мг ЭВ) |
— Немедленно принять пропущенную таблетку, а следующую таблетку – в обычное время (даже если это означает, что придется принять 2 таблетки в один день) — В дополнительных мерах контрацепции нет необходимости |
| 27-28 |
Белые таблетки (Плацебо) |
— Выбросить пропущенную таблетку и продолжить прием таблеток в обычном порядке — В дополнительных мерах контрацепции нет необходимости |
Допускается принимать не более 2 таблеток в один день.
Если женщина забыла начать новую календарную упаковку или пропустила одну или более таблеток с 3-го по 9-ый день календарной упаковки, она уже может быть беременна (в том случае, если у нее был половой контакт в течение 7 дней перед пропуском таблетки). Чем больше таблеток (особенно, с комбинацией двух активных компонентов в дни с 3-го по 24-ый) пропущено, и чем ближе они к фазе приема неактивных таблеток, тем выше вероятность беременности.
Если женщина пропускала прием таблеток, и затем в конце календарной упаковки/в начале новой календарной упаковки менструальноподобное кровотечение у нее отсутствовало, следует рассмотреть вероятность беременности.
Рекомендации при желудочно-кишечных расстройствах
При тяжелых желудочно-кишечных расстройствах (таких, как рвота или диарея) всасывание может быть неполным, поэтому следует принять дополнительные контрацептивные меры (например, барьерный метод предохранения, в частности презервативы).
Если через 3-4 часа после приема активной таблетки произойдет рвота, то в данном случае действуют рекомендации, касающиеся пропущенных таблеток, которые приведены в разделе «Прием пропущенных таблеток». Если женщина не хочет менять свою обычную схему приема таблеток, ей необходимо выпить дополнительную таблетку (или таблетки) из новой упаковки.
Дополнительная информация для отдельных групп пациенток
Дети и подростки
Информация о применении препарата у подростков младше 18 лет отсутствует.
Гериатрические пациенты
Препарат Клайра не показан после наступления менопаузы.
Пациенты с нарушениями функции печени
Препарат Клайра противопоказан у женщин с тяжелыми заболеваниями печени. См. также раздел «Противопоказания».
Пациенты с нарушениями функции почек
Препарат Клайра специально не изучался у пациенток с нарушениями функции почек.
Препарат Клайра не должен применяться при наличии какого-либо из состояний, перечисленных ниже. Если какие-либо из этих состояний развиваются впервые на фоне приема, препарат должен быть немедленно отменен.
• Наличие или риск развития венозной тромбоэмболии (ВТЭ)
— Венозная тромбоэмболия – ВТЭ в настоящее время (прием антикоагулянтов) или в анамнезе (в том числе, тромбоз глубоких вен (ТГВ), тромбоэмболия легочной артерии (ТЭЛА).
— Выявленная наследственная или приобретенная предрасположенность к венозному тромбозу, такая как резистентность к активированному протеину С, (в том числе фактор V Лейдена), дефицит антитромбина III, дефицит протеина С, дефицит протеина S.
— Обширное хирургическое вмешательство с продолжительной иммобилизацией (см. раздел «Меры предосторожности»)
— Высокий риск венозного тромбоза вследствие наличия множественных факторов риска (см. раздел «Меры предосторожности»)
• Наличие или риск развития артериальной тромбоэмболии (АТЭ)
— Артериальная тромбоэмболия – АТЭ в настоящее время или в анамнезе (например, инфаркт миокарда), или продромальное состояние (например, стенокардия)
— Цереброваскулярное расстройство – апоплексия головного мозга в настоящее время или в анамнезе, или продромальное состояние (например, преходящее нарушение мозгового кровообращения)
— Выявленная наследственная или приобретенная предрасположенность к артериальному тромбозу, такая как гипергомоцистеинемия и антифосфолипидные антитела (антифосфолипидные антитела, волчаночный антикоагулянт)
— Мигрень с очаговыми неврологическими симптомами в анамнезе.
— Высокий риск артериального тромбоза вследствие наличия множественных факторов риска (см. раздел «Меры предосторожности»)
• Сахарный диабет с сосудистыми осложнениями
• Гипертоническая болезнь в тяжелой форме
• Дислипопротеинемия в тяжелой форме
• Печеночная недостаточность и тяжелые заболевания печени (до тех пор, пока печеночные тесты не придут в норму) в настоящее время или в анамнезе.
• Опухоли печени (доброкачественные или злокачественные) в настоящее время или в анамнезе.
• Выявленные гормонозависимые злокачественные новообразования (в том числе половых органов или молочных желез) или подозрение на них.
• Вагинальное кровотечение неясного генеза.
• Повышенная чувствительность к любому из компонентов препарата Клайра.
Меры предосторожности
Если какие-либо из заболеваний/состояний/факторов риска, указанных ниже, имеются в настоящее время, то следует тщательно соотнести потенциальный риск и ожидаемую пользу применения препарата Клайра в каждом индивидуальном случае и обсудить его с женщиной до того, как она решит начать прием препарата.
В случае обострения или первого проявления любого из этих состояний или факторов риска, женщина должна проконсультироваться со своим врачом, который может принять решение о необходимости отмены препарата.
В случае подозрения или подтверждения ВТЭ или АТЭ, применение КОК должно быть прекращено. При необходимости начала антикоагулянтной терапии, необходимо назначить адекватную альтернативную контрацепцию по причине тератогенности антикоагулянтной терапии (кумарины).
Все следующие предупреждения и меры предосторожности главным образом основаны на клинических и эпидемиологических данных по изучению этинилэстрадиол-содержащих препаратов.
• Заболевания сердечно-сосудистой системы
Риск развития венозной тромбоэмболии (ВТЭ)
Применение любого комбинированного гормонального контрацептива (КОК) увеличивает риск развития венозной тромбоэмболии (ВТЭ) по сравнению с отсутствием применения. Препараты, которые содержат левоноргестрел, норгестимат или норэтистерон, связаны с наименьшим риском ВТЭ. Ограниченные данные демонстрируют, что риск ВТЭ при приеме Клайра может быть в таком же диапазоне, что и риск ВТЭ при приеме указанных выше препаратов. Решение о применении любого другого препарата (такого как Клайра), не являющегося препаратом с наименьшим риском ВТЭ, следует принимать только после обсуждения с женщиной, чтобы удостовериться в том, что она понимает:
— риск развития ВТЭ при приеме КОК
— как ее текущие факторы риска влияют на риск развития ВТЭ
— что риск развития ВТЭ является наибольшим в первый год применения.
Также имеются указания на то, что риск развития ВТЭ повышается при возобновлении применения КОК после перерыва между приемами в 4 недели и более.
Примерно у 2 из 10 000 женщин, которые не применяют КОК и не являются беременными, развивается ВТЭ в течение одного года. Однако у некоторых женщин этот риск может быть намного выше, в зависимости от фоновых факторов риска (см. ниже). Эпидемиологические исследования у женщин, которые применяли низкую дозу (< 50 мкг этинилэстрадиола) комбинированных гормональных контрацептивов, показали, что у приблизительно 6-12 из 1000 пациенток будет развиваться ВТЭ в течение одного года.
По оценкам, из 10 000 женщин, которые применяют левоноргестрел-содержащие КОК, у приблизительно 6 пациенток разовьется ВТЭ в течение одного года.
Ограниченные эпидемиологические данные свидетельствуют о том, что риск развития ВТЭ при приеме Клайра может находиться в том же диапазоне, что и риск развития ВТЭ при приеме других КОК, включая левоноргестрел-содержащих КОК.
Количество эпизодов ВТЭ в год при приеме низкодозированных КОК ниже ожидаемого количества во время беременности или в послеродовой период.
ВТЭ может привести к летальному исходу в 1-2% случаев.
Крайне редко при использовании комбинированных пероральных контрацептивов возникает тромбоз других кровеносных сосудов, например, печеночных, брыжеечных, почечных, мозговых вен и артерий или сосудов сетчатки.
Факторы риска развития ВТЭ
Риск венозной тромбоэмболии может существенно увеличиваться у женщин, принимающих КОК, с дополнительными факторами риска, особенно при наличии множественных факторов риска (см. Таблицу 2 ниже).
Препарат Клайра противопоказан женщине с множественными факторами риска, подвергающими ее высокому риску венозного тромбоза (см. раздел «Противопоказания»), При наличии у женщины более одного фактора риска, возможно, что увеличение риска больше суммы отдельных факторов – в таком случае следует оценивать общий риск ВТЭ женщины. Если соотношение пользы и рисков считается отрицательным, КОК не должен назначаться (см. раздел «Противопоказания»),
Таблица 2: Факторы риска развития ВТЭ
|
Фактор риска |
Комментарий |
| Ожирение (индекс массы тела более 30 кг/м2) |
Риск существенно увеличивается при увеличении ИМТ. Особенно важно учитывать наличие других факторов риска. |
|
Длительная иммобилизация, серьезное хирургическое вмешательство, любая операция на ногах или тазу, нейрохирургическая операция или обширная травма Примечание: временная иммобилизация, включая авиаперелет > 4 часов, также может являться фактором риска для ВТЭ, особенно у женщин с другими факторами риска |
В этих ситуациях желательно прекратить прием таблеток (в случае планируемой операции, по крайней мере, за четыре недели до нее) и не возобновлять прием в течение двух недель после окончания иммобилизации. Следует использовать другой способ контрацепции во избежание нежелательной беременности. Следует рассмотреть назначение антитромботической терапии, если препарат Клайра не был предварительно отменен. |
|
Отягощенный семейный анамнез (венозная тромбоэмболия когда-либо у сестры или брата или у одного из родителей, особенно, в сравнительно молодом возрасте, например, до 50 лет). |
В случае предполагаемой наследственной предрасположенности женщина должна быть осмотрена специалистом для решения вопроса о возможности приема любых КОК |
| Другие клинические состояния, связанные с ВТЭ |
Рак, системная красная волчанка, гемолитико-уремический синдром, хроническая воспалительная болезнь кишечника (болезнь Крона или язвенный колит) и серповидно-клеточная анемия |
| Возраст | Особенно старше 35 лет |
Вопрос о возможной роли варикозного расширения вен и поверхностного тромбофлебита в возникновении или развитии тромбоза вен остается спорным.
Следует учитывать повышенный риск тромбоэмболии при беременности и, особенно в течение 6 недель после родов (см. раздел «Беременность и лактация»).
Симптомы ВТЭ (тромбоз глубоких вен и тромбоэмболия легочной артерии)
В случае появления указанных симптомов следует рекомендовать пациентке немедленно обратиться за неотложной медицинской помощью и проинформировать врача о том, что она принимает КОК.
Симптомы тромбоза глубоких вен (ТГВ) могут включать в себя:
— односторонний отек ноги или вдоль вены ноги;
— боль или болезненность в ноге, которая может ощущаться только в положении стоя или при ходьбе
— повышение температуры в пострадавшей ноге; красная или обесцвеченная кожа на ноге.
Симптомы тромбоэмболии легочной артерии (ТЭЛА) могут включать в себя:
— внезапное развитие необъяснимой одышки или учащенное дыхание;
— внезапный кашель, который может быть связан с кровохарканьем;
— острая боль в груди;
— тяжелое головокружение;
— высокая или нерегулярная частота сердечных сокращений.
Некоторые из этих симптомов (например, одышка, кашель) являются неспецифическими и могут быть неверно интерпретированы как более распространенные или менее тяжелые явления (например, инфекции дыхательных путей).
Другими признаками окклюзии сосуда могут являться: внезапная боль, отек и легкое посинение конечности.
В случае окклюзии сосуда глаза симптомы могут различаться: от безболезненного нарушения четкости зрения до прогрессирующей потери зрения. В некоторых случаях потеря зрения происходит практически внезапно.
Риск развития артериальной тромбоэмболии (АТЭ)
Эпидемиологические исследования связывают применение КОК с повышенным риском артериальной тромбоэмболии (инфаркта миокарда) или острого нарушения мозгового кровообращения (например, транзиторная ишемическая атака, инсульт). Явления артериальной тромбоэмболии могут быть смертельными.
Факторы риска развития АТЭ
Риск артериальной тромбоэмболии или инсульта у пользователей КОК увеличивается у женщин с факторами риска (см. Таблицу 3). Препарат Клайра противопоказан женщинам с одним серьезным или множественными факторами риска АТЭ, подвергающими ее высокому риску артериального тромбоза (см. раздел «Противопоказания»). При наличии у женщины более одного фактора риска, возможно, что увеличение риска больше суммы отдельных факторов – в таком случае следует оценивать общий риск женщины. Если соотношение пользы и риска сочтено отрицательным, не следует назначать КОК (см. раздел «Противопоказания»).
Таблица 3: Факторы риска развития АТЭ
|
Фактор риска |
Комментарий |
| Возраст | Особенно старше 35 лет |
| Курение |
Женщинам следует рекомендовать воздержаться от курения, если они хотят использовать КОК. Женщинам старше 35 лет, которые продолжают курение, следует настоятельно рекомендовать использовать другой способ контрацепции. |
| Гипертензия | |
| Ожирение (индекс массы тела более 30 кг/м2) |
Риск существенно увеличивается при увеличении ИМТ. Особенно большое значение имеет у женщин с дополнительными факторами риска. |
|
Отягощенный семейный анамнез (артериальная тромбоэмболия когда-либо у сестры или брата или у одного из родителей, особенно в сравнительно раннем возрасте, например, до 50 лет). |
В случае предполагаемой наследственной предрасположенности женщина должна быть осмотрена специалистом для решения вопроса о возможности приема любых КОК. |
| Мигрень |
Увеличение частоты и тяжести мигрени во время применения КОК (что может предшествовать цереброваскулярным нарушениям) может быть основанием для немедленного прекращения приема этих препаратов. |
|
Другие клинические состояния, связанные с нежелательными явлениями со стороны сосудов |
Сахарный диабет, гипергомоцистеинемия, порок клапанов сердца и фибрилляция предсердий, дислипопротеинемия и системная красная волчанка. |
Симптомы АТЭ
В случае появления симптомов женщине следует рекомендовать немедленно обратиться за медицинской помощью и проинформировать врача о том, что она принимает КОК.
Симптомы острого нарушения мозгового кровообращения могут включать в себя:
— внезапное онемение или слабость мышц лица, руки или ноги, особенно с одной стороны тела;
— внезапные затруднения с передвижением, головокружение, потеря чувства равновесия или координации движений;
— внезапную спутанность сознания, проблемы с речью и пониманием речи;
— внезапное нарушение зрения на одном или обоих глазах;
— внезапная, тяжелая или продолжительная головная боль без известной причины;
— потеря сознания или обморок с судорогами или без них.
Временные симптомы предполагают, что эпизод является транзиторной ишемической атакой (ТИА).
Симптомы инфаркта миокарда (ИМ) могут включать в себя:
— боль, ощущение дискомфорта, ощущение давления, тяжести, ощущение сдавления или переполнения в груди, руке или под грудиной;
— ощущение дискомфорта, иррадиирущее в спину, челюсть, горло, руку, живот;
— ощущение переполнения желудка, расстройства желудка или удушья;
— потливость, тошноту, рвоту или головокружение;
— слабость в конечностях, тревогу или одышку;
— высокую или нерегулярную частоту сердечных сокращений.
Опухоли
Некоторые эпидемиологические исследования показали, что длительное применение КОК (> 5 лет) может повысить риск рака шейки матки, однако это утверждение все еще имеет противоречивый характер, поскольку окончательно не установлено, насколько результаты исследований учитывали сопутствующие факторы, например, половое поведение и другие факторы, например, папилломавирусную инфекцию человека.
Мета-анализ 54 эпидемиологических исследований выявил небольшое увеличение относительного риска (ОР = 1,24) развития рака молочной железы у женщин, принимающих КОК в настоящее время. Повышенный риск постепенно исчезает в течение 10 лет после прекращения приема этих препаратов. В связи с тем, что рак молочной железы отмечается редко у женщин моложе 40 лет, некоторое увеличение числа диагностированного рака молочной железы у женщин, принимающих КОК в настоящее время или принимавших недавно, является незначительным по отношению к общему риску этого заболевания. Его связь с приемом КОК не доказана. Наблюдаемое повышение риска может быть также следствием более ранней диагностики рака молочной железы у женщин, применяющих КОК. У женщин, когда-либо использовавших КОК, выявляются более ранние стадии рака молочной железы, чем у женщин, никогда не применявших.
В редких случаях на фоне применения КОК наблюдалось развитие доброкачественных, а в крайне редких случаях – злокачественных опухолей печени, которые в отдельных случаях приводили к угрожающему жизни внутрибрюшному кровотечению. При появлении сильных болей в верхних отделах живота, увеличения размеров печени или признаков внутрибрюшного кровотечения у женщин, принимающих КОК, при дифференциальной диагностике необходимо исключить опухоли печени.
Другие состояния
У женщин с гипертриглицеридемией (или наличия этого состояния в семейном анамнезе) возможно повышение риска развития панкреатита во время приема КОК.
Хотя небольшое повышение артериального давления было описано у многих женщин, принимающих КОК, клинически значимые повышения отмечались редко. Однако если на фоне приема препарата Клайра развивается стойкое, клинически значимое повышение артериального давления, следует отменить препарат и начать лечение артериальной гипертензии. Прием препарата Клайра при необходимости можно возобновить, если посредством гипотензивной терапии удается достичь нормальных показателей артериального давления (АД).
Следующие состояния развиваются или ухудшаются как во время беременности, так и при приеме КОК, но их связь с приемом КОК не доказана: желтуха и/или холестатический зуд, холелитиаз, порфирия, системная красная волчанка, гемолитико-уремический синдром, хорея Сиденгама, герпес беременных, обусловленная отосклерозом потеря слуха.
У женщин с наследственными формами ангионевротического отека экзогенные эстрогены могут индуцировать или ухудшать симптомы ангионевротического отека.
Острые или хронические нарушения функции печени могут потребовать отмены препарата Клайра до тех пор, пока показатели функции печени не придут в норму. Рецидивирующая холестатическая желтуха, которая развивается впервые во время беременности или предыдущего приема половых гормонов, требует прекращения приема препарата Клайра.
Хотя КОК могут оказывать влияние на резистентность к инсулину и толерантность к глюкозе, нет необходимости изменения терапевтического режима у больных сахарным диабетом, которые используют низкодозированные КОК с содержанием этинилэстрадиола < 0,05 мг. Тем не менее, женщины, страдающие сахарным диабетом, во время приема препарата Клайра нуждаются в тщательном наблюдении.
Также описаны случаи ухудшения эндогенной депрессии, эпилепсии, болезни Крона и неспецифического язвенного колита на фоне применения комбинированных пероральных контрацептивов.
Психические расстройства
Депрессивное настроение и депрессия являются общеизвестными нежелательными реакциями при применении гормональных контрацептивов (см. раздел «Нежелательные реакции»). Депрессия может быть серьезным расстройством и является известным фактором риска суицидального поведения и суицида. Женщинам следует рекомендовать обратиться к лечащему врачу в случае появления изменений настроения и симптомов депрессии, в том числе вскоре после начала лечения.
Иногда может развиваться хлоазма, особенно у женщин с хлоазмой беременных в анамнезе. Женщинам, склонным к развитию хлоазмы, в период приема препарата Клайра следует избегать воздействия солнца или ультрафиолетового излучения.
Эстрогены могут вызывать задержку жидкости, и поэтому пациентки с сердечной или почечной дисфункцией должны находиться под тщательным наблюдением. Также тщательному наблюдению подлежат пациентки с терминальной почечной недостаточностью, так как уровень циркулирующих эстрогенов может увеличиваться после приема препарата Клайра.
Данное лекарственное средство содержит не более 50 мг лактозы на одну таблетку. Пациентки с редкой наследственной непереносимостью лактозы, лактазной недостаточностью или глюкозо-галактозной мальабсорбцией, которые находятся на безлактозной диете, должны принимать во внимание эти данные.
Влияние на лабораторные тесты
Прием препарата Клайра может влиять на результаты некоторых лабораторных исследований, включая биохимические параметры функции печени, щитовидной железы, надпочечников и почек, концентрацию транспортных белков в плазме, например, КСГ и фракции липидов/липопротеидов, параметры углеводного обмена и параметры свертывания и фибринолиза. Эти изменения обычно остаются в пределах лабораторных норм.
Медицинские осмотры
Перед началом применения препарата Клайра необходимо тщательно оценить противопоказания к назначению препарата на основании анамнеза жизни, семейного анамнеза женщины, а также общемедицинского и гинекологического обследования, беременность должна быть исключена. Частота и характер этих обследований должны основываться на существующих нормах медицинской практики при необходимом учете индивидуальных особенностей каждой пациентки. Как правило, измеряется АД, проверяется состояние молочных желез, брюшной полости и органов малого таза, включая цитологию шейки матки.
Необходимо разъяснять женщинам, что препарат Клайра не защищает от ВИЧ-инфекций (СПИДа) и других заболеваний, передающихся половым путем.
Снижение эффективности
Эффективность препарата Клайра может быть снижена при пропуске таблеток с активными компонентами (см. рекомендации по приему пропущенных таблеток в разделе «Способ применения и дозы»), желудочно-кишечных расстройствах во время приема таблеток с активными компонентами (см. рекомендации при желудочно-кишечных расстройствах в разделе «Способ применения и дозы») или на фоне сопутствующей терапии лекарственными средствами (см. раздел «Взаимодействия с другими лекарственными средствами»).
Контроль цикла
На фоне приема препарата Клайра, особенно в первые месяцы, могут возникать нерегулярные менструальноподобные кровотечения (мажущие выделения или прорывные маточные кровотечения). Поэтому, оценка любых нерегулярных менструальноподобных кровотечений должна проводиться только после периода адаптации, который составляет приблизительно 3 менструальноподобных цикла.
На основе дневников пациентов из сравнительного клинического исследования, процент женщин, принимавших препарат Клайра, у которых возникали межменструальные кровотечения, составлял от 10 до 18%.
При использовании препарата Клайра может наблюдаться аменорея, что не указывает на наличие беременности. На основе дневников пациенток, аменорея наблюдается приблизительно в 15% циклах.
Если нерегулярные менструальноподобные кровотечения повторяются или впервые возникают после предшествующих регулярных циклов, следует рассмотреть вероятность причин также негормонального характера и провести тщательное обследование для исключения злокачественных новообразований или беременности. Подобные мероприятия могут включать диагностическое выскабливание.
У некоторых женщин во время приема неактивных таблеток белого цвета менструальноподобное кровотечение может не развиться. Если прием препарата Клайра осуществлялся в соответствии с правилами, указанными в разделе «Способ применения и дозы», беременность маловероятна. Однако если перед первым отсутствовавшим менструальноподобным кровотечением таблетки принимались нерегулярно, или отсутствуют подряд 2 менструальноподобных кровотечения, не следует продолжать использование препарат Клайра до тех пор, пока не будет исключена беременность.
Примечание: для выявления возможных взаимодействий следует ознакомиться с инструкциями по применению соответствующих лекарственных препаратов.
Исследования взаимодействия с другими лекарственными средствами проводились только у взрослых пациентов.
Следующие взаимодействия с другими лекарственными средствами были описаны в литературе для КОК в целом, или были изучены в ходе клинических исследований препарата Клайра.
• Влияние других лекарственных средств на препарат Клайра
Возможны взаимодействия с препаратами, являющимися индукторами микросомальных ферментов, которые могут привести к повышению клиренса половых гормонов и к прорывным кровотечениям и/или снижению контрацептивной эффективности.
Индукция ферментов может обнаружиться уже через несколько дней терапии. Максимальная индукция ферментов, как правило, наблюдается в течение нескольких недель. После прекращения терапии индукция ферментов может продолжаться в течение приблизительно 4 недель.
Краткосрочная терапия
Женщины, принимающие эти препараты, должны временно использовать барьерные методы контрацепции дополнительно к используемому КОК или выбрать другой метод контрацепции. Во время одновременного приема препаратов и в течение 28 дней после их отмены следует дополнительно использовать барьерный метод контрацепции. Если в течение этого периода заканчиваются содержащие гормоны светло-розовые таблетки, покрытые пленочной оболочкой, то следует пропустить прием не содержащих гормоны белых таблеток, покрытых пленочной оболочкой, из текущей упаковки и начать прием таблеток из следующей упаковки КОК.
Долгосрочная терапия
Для женщин, длительно применяющих препараты с активными веществами, индуцирующими печеночные ферменты, рекомендуется другой надежный, негормональный метод контрацепции.
Вещества, увеличивающие клиренс КОК (снижающие эффективность КОК через индукцию ферментов), например:
Барбитураты, карбамазепин, фенитоин, примидон, рифампицин и препараты для лечения ВИЧ: ритонавир, невирапин и эфавиренц, а также возможно фелбамат, гризеофульвин, окскарбазепин, топирамат и продукты, содержащие растительное лекарственное средство зверобой (зверобой пронзённолистный).
Данные клинических исследований продемонстрировали существенное снижение равновесной концентрации и системной экспозиции диеногеста и эстрадиола при одновременном приеме сильного индуктора микросомальных ферментов цитохрома Р450 (CYP3A4), такого как рифампицин. AUC (0-24 часа) диеногеста и эстрадиола в устойчивом состоянии, были снижены на 83% и 44%, соответственно.
Вещества с различным действием на клиренс КОК, например:
При одновременном приеме с КОК многие ингибиторы протеазы ВИЧ/вируса гепатита С и ненуклеозидные ингибиторы обратной транскриптазы могут увеличивать или снижать плазменные концентрации эстрогена или прогестина. В некоторых случаях эти изменения могут иметь клиническое значение.
Таким образом, для определения потенциальных взаимодействий и для любых соответствующих рекомендаций должна быть изучена информация о назначении сопутствующих лекарственных препаратов против ВИЧ/вируса гепатита С. В случае каких-либо сомнений, женщины, получающие терапию с использованием ингибиторов протеазы или ненуклеозидных ингибиторов обратной транскриптазы должны использовать дополнительный барьерный метод контрацепции.
Вещества, снижающие клиренс КОК (ингибиторы ферментов):
Диеногест является субстратом CYP3А4.
Клиническая значимость потенциальных взаимодействий с ингибиторами ферментов, остается неизвестной.
Совместный прием КОК и сильных ингибиторов CYP3А4 может привести к увеличению плазменных концентраций эстрогена или прогестина, или обоих гормонов.
Совместный прием с сильным ингибитором фермента CYP3A4 кетоконазолом приводил к 2,9-кратному и 1,6-кратному увеличению AUC (0-24 часа) при стационарной концентрации диеногеста и эстрадиола, соответственно. Совместный прием с умеренным ингибитором эритромицином приводил к 1,6-кратному и 1,3-кратному увеличению AUC (0-24 часа) при стационарной концентрации диеногеста и эстрадиола, соответственно.
• Влияние препарата Клайра на другие лекарственные средства
Пероральные контрацептивы могут влиять на метаболизм других препаратов, что приводит к повышению (например, циклоспорин) или снижению (например, ламотриджин) их концентрации в плазме и тканях.
Сопутствующий прием 2 мг диеногеста + 0,03 мг этинилэстрадиола и нифедипина не влияет на фармакокинетику нифедипина, и таким образом, подтверждает результаты исследований in vivo, указывающих, на то, что ингибирование CYP ферментов препаратом Клайра в его терапевтической дозе маловероятно.
• Другие формы взаимодействия
Лабораторные анализы
Прием контрацептивных стероидов может влиять на результаты некоторых лабораторных тестов, включая биохимические параметры функции печени, щитовидной железы, надпочечников и почек, а также плазменные уровни транспортных белков, например, кортикостероид-связывающего глобулина и фракций липид/липопротеин, показатели углеводного обмена, а также параметры свертывания и фибринолиза. Однако эти изменения, как правило, остаются в диапазоне нормы.
Лекарственное средство Клайра не следует использовать во время беременности.
Если беременность наступила на фоне применения препарата Клайра, дальнейший прием требуется прекратить. Однако крупномасштабные эпидемиологические исследования не выявили увеличения риска развития врожденных дефектов у детей, родившихся у женщин, которые использовали КОК до беременности, равно как и тератогенного воздействия КОК при их случайном приеме в начале беременности. Исследования у животных не выявили риска репродуктивной токсичности (см. раздел «Доклинические данные по безопасности»).
При повторном назначении приема препарата Клайра в послеродовой период следует учитывать повышенный риск развития ВТЭ (см. раздел «Способ применения и дозы» и раздел «Меры предосторожности»).
Грудное вскармливание
КОК могут влиять на лактацию, поскольку они способны уменьшать объем вырабатываемого грудного молока, а также изменять его состав. Следовательно, КОК обычно не рекомендуется использовать до окончания периода лактации. Небольшое количество контрацептивных гормонов и/или их метаболитов может выделяться с грудным молоком. Это количество может оказать влияние на ребенка.
Наиболее частыми встречающимися нежелательными реакциями при применении препарата Клайра в качестве орального контрацептива, или при лечении тяжелых менструальных кровотечений у женщин без наличия органической патологии, нуждающихся в использовании оральной контрацепции, являются: акне, дискомфорт в молочных железах, головная боль, межменструальное кровотечение, тошнота и увеличение массы тела. К серьезным нежелательными реакциям относятся: артериальная и венозная тромбоэмболия, которые подробно описаны в разделе «Меры предосторожности».
В приведенной ниже таблице представлены нежелательные реакции (HP) с учетом системно-органных классов словаря MedDRA. Для описания конкретной нежелательной реакции используется наиболее подходящий термин MedDRA (версия 12.0). Синонимичные понятия или связанные нарушения не указываются, однако их также следует принимать во внимание. Показатели частоты основаны на данных клинических исследований. Нежелательные реакции регистрировались в пяти клинических исследованиях фазы III (N = 2 266 женщин, для которых существует риск наступления беременности, N = 264 женщины, страдающие от дисфункционального маточного кровотечения без органической патологии, которые желают использовать пероральные контрацептивы), при этом считалось, что данные явления имеют, по крайней мере, возможную причинную связь с приемом препарата Клайра. Все нежелательные лекарственные реакции, перечисленные в категории «редко», наблюдались у 1-2 добровольцев, в связи с чем показатель составляет <0,1%.
N = 2 530 женщин (100,0%)
|
Системно-органный класс |
Часто (≥ 1/100 — < 1/10) |
Нечасто (≥ 1/1 000 — < 1/100) |
Редко (≥ 1/10 000-< 1/1 000) |
| Инфекционные и паразитарные заболевания |
Грибковая инфекция Вульвовагинальная грибковая инфекция1 Вагинальная инфекция |
Кандидоз Оральный герпес Воспалительное заболевание органов малого таза Синдром предполагаемого гистоплазмоза глаз Разноцветный лишай Инфекция мочевыводящих путей Бактериальный вагинит |
|
| Нарушения со стороны обмена веществ и питания | Повышенный аппетит |
Задержка жидкости Гипертриглицеридемия |
|
| Нарушения психики |
Депрессия / подавленное настроение Эмоциональное расстройство2 Бессонница Снижение либидо3 Психическое расстройство Изменение настроения4 |
Агрессивность Тревожность Дисфория Повышение либидо Повышенная возбудимость Ночной страх Беспокойное состояние Нарушение сна Стресс |
|
| Нарушения со стороны нервной системы | Головная боль5 |
Головокружение Мигрень6 |
Нарушение внимания Парестезия Вертиго |
| Нарушения со стороны органа зрения |
Непереносимость контактных линз Сухость глаз Отек глаз |
||
| Нарушения со стороны сердца |
Инфаркт миокарда Сердцебиение |
||
| Нарушения со стороны сосудов |
Приливы Гипертензия |
Кровотечение из варикозно-расширенных вен Венозная тромбоэмболия (ВТЭ) Артериальная тромбоэмболия (АТЭ) Гипотензия Поверхностный флебит Боли по ходу вен |
|
| Нарушения со стороны желудочно-кишечного тракта |
Боль в животе7 Тошнота |
Диарея Рвота |
Запор Сухость во рту Диспепсия Гастроэзофагеальная рефлюксная болезнь |
| Нарушения со стороны печени и желчевыводящих путей | Повышенный уровень печеночных ферментов8 |
Очаговая узловая гиперплазия печени Хронический холецистит |
|
| Нарушения со стороны кожи и подкожных тканей | Акне9 |
Алопеция Гипергидроз Зуд10 Сыпь11 |
Аллергическая кожная реакция12 Хлоазма Дерматит Гирсутизм Гипертрихоз Нейродермит Нарушение пигментации Себорея Поражение кожи13 |
|
Нарушения со стороны скелетно-мышечной и соединительной ткани |
Мышечные спазмы |
Боль в спине Боль в челюсти Чувство тяжести |
|
| Нарушения со стороны почек и мочевыводящих путей | Боль в области мочевыводящих путей | ||
|
Нарушения со стороны половых органов и молочной железы |
Аменорея Дискомфорт в молочных железах14 Дисменорея Ациклическое кровотечение (метроррагия)15 |
Увеличение молочных желез16 Объемное образование в молочной железе Дисплазия шейки матки Дисфункциональное маточное кровотечение Диспареуния Фиброзно-кистозная болезнь молочных желез Меноррагия Нарушение менструального цикла Киста яичника Боль в тазовой области Предменструальный синдром Лейомиома матки Спазмы матки Маточное/ влагалищное кровотечение, в том числе мажущие выделения17 Выделения из влагалища Сухость в вульвовагинальной области |
Аномальное кровотечение отмены Доброкачественное новообразование молочной железы Рак молочной железы in situ Киста молочной железы |
| Нарушения со стороны крови и лимфатической системы | Лимфаденопатия | ||
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
Астма Одышка Носовое кровотечение |
||
| Общие расстройства и нарушения в месте введения |
Утомляемость Раздражимость Отек18 |
Боль в грудной клетке Недомогание Повышенная температура |
|
| Лабораторные и инструментальные данные | Увеличение массы тела |
Снижение массы тела Изменения кровяного давления19 |
Аномальный мазок из шейки матки |
1 в том числе вульвовагинальный кандидоз и выявленный грибок в образце из шейки матки
2 в том числе плаксивость и аффективная лабильность
3 в том числе потеря либидо
4 в том числе изменения настроения и перепады настроения
5 в том числе головная боль напряжения и синусовая головная боль
6 в том числе мигрень с аурой и мигрень без ауры
7 в том числе вздутие живота, боль в верхней части живота и боль в нижней части живота
8 в том числе повышенный уровень аланинаминотрансферазы, повышенный уровень аспартатаминотрансферазы и повышенный уровень гамма-глутамилтрансферазы
9 в том числе пустулезные угри
10 в том числе генерализованный зуд и зудящая сыпь
11 в том числе макулезная сыпь
12 в том числе аллергический дерматит и крапивница
13 в том числе чувство натянутости кожи
14 в том числе боль в молочной железе, нагрубание молочных желез, нарушения в области сосков и боль в сосках
15 в том числе нерегулярная менструация
16 в том числе отек молочной железы
17 в том числе влагалищное кровотечение, генитальное кровотечение и маточное кровотечение
18 в том числе периферический отек
19 в том числе повышенное кровяное давление и пониженное кровяное давление
Описание отдельных нежелательных реакций
У женщин, принимающих КОК, наблюдается повышенный риск развития артериальных и венозных тромботических и тромбоэмболических явлений, включая инфаркт миокарда, инсульт, транзиторные ишемические атаки, венозный тромбоз и тромбоэмболию легочной артерии; данные явления описаны более подробно в разделе «Меры предосторожности».
Информация о частоте возникновения аменореи и ациклического кровотечения, полученная из дневников пациенток, обобщается в разделе «Меры предосторожности» под заголовком «Контроль цикла».
Ниже приведены серьезные нежелательные явления, о которых сообщалось у женщин, принимающих КОК; данные явления обсуждаются в разделе «Меры предосторожности»:
Опухоли
— Частота диагностирования рака молочной железы у женщин, принимающих КОК, повышена весьма незначительно. Поскольку рак молочной железы среди женщин в возрасте младше 40 лет встречается редко, избыточное количество случаев является незначительным по отношению к общему риску развития рака молочной железы. Причинная связь с приемом КОК не установлена. Дополнительная информация представлена в разделах «Противопоказания» и «Меры предосторожности»;
— Опухоли печени;
Другие нарушения
— Узловая эритема, многоформная эритема;
— Выделения из молочных желез;
— Гипертензия;
— Развитие или усугубление заболеваний, в случае которых связь с приемом КОК является неоднозначной: болезнь Крона, язвенный колит, эпилепсия, мигрень, миома матки, порфирия, системная красная волчанка, гестационный герпес, хорея Сиденгама, гемолитико-уремический синдром, холестатическая желтуха;
— У женщин, страдающих наследственным ангионевротическим отеком, экзогенные эстрогены могут спровоцировать появление или обострение симптомов ангионевротического отека;
— Острые или хронические нарушения функции печени могут обусловить необходимость прекращения приема КОК до тех пор, пока маркеры функции печени не вернутся к нормальным уровням;
— Хлоазма;
— Гиперчувствительность (в том числе такие симптомы, как сыпь, крапивница);
Взаимодействие
Прорывное кровотечение и (или) неэффективность контрацептивного средства могут иметь место в результате взаимодействия других препаратов (индукторов ферментов) с оральными контрацептивами (см. раздел «Взаимодействия с другими лекарственными средствами»).
Предоставление сообщений о подозреваемых нежелательных реакциях
Важным является предоставление сообщений о подозреваемых нежелательных реакциях после регистрации лекарственного средства. Это позволяет осуществлять непрерывный мониторинг соотношения пользы и риска для лекарственного средства. Специалистов системы здравоохранения просят сообщать о любых подозреваемых нежелательных реакциях посредством национальной системы предоставления сообщений.
О серьезных нарушениях при передозировке препаратом Клайра не сообщалось. На основании суммарного опыта применения КОК симптомы, которые могут отмечаться при передозировке активными таблетками, включают: тошноту, рвоту, мажущие кровянистые выделения или метроррагию.
Лечение: симптоматическое.
Не отмечено отрицательного влияния препарата Клайра на способность к управлению автомобилем и работу с механизмами, однако пациентки, у которых в течение периода адаптации (первые 3 месяца приема препарата) отмечаются эпизоды головокружений и нарушение концентрации внимания должны соблюдать осторожность.
Фармакодинамические свойства
В рамках клинических исследований препарата Клайра, проводимых в Европейском союзе и в США/ Канаде, были рассчитаны следующие индексы Перля:
Индекс Перля (возраст 18-50 лет)
Ненадежность метода: 0,42 (верхний предел 95%-го доверительного интервала (ДИ) 0,77)
Ошибки при приеме + ненадежность метода: 0,79 (верхний предел 95%-го ДИ 1,23).
Индекс Перля (возраст 18-35 лет)
Ненадежность метода: 0,51 (предел 95%-го ДИ 0,97)
Ошибки при приеме + ненадежность метода: 1,01 (предел 95%-го ДИ 1,59)
Контрацептивный эффект КОК основан на взаимодействии различных факторов, наиболее важными из которых считаются ингибирование овуляции, изменения цервикального секрета и изменения в эндометрии.
В рамках трехциклового исследования ингибирования овуляции терапия препаратом Клайра привела к подавлению развития фолликула у большинства женщин. Активность яичников вернулась к уровням, наблюдавшимся до терапии, в течение цикла после лечения.
Дозирование препарата Клайра осуществляется по убывающей для эстрогена и по возрастающей для прогестина схеме, которая может использоваться для лечения тяжелого менструального кровотечения при отсутствии органической патологии; такие симптомы иногда называют дисфункциональным маточным кровотечением (ДМК).
Два многоцентровых двойных слепых рандомизированных исследования со схожим дизайном были проведены с целью оценки эффективности и безопасности применения препарата Клайра у женщин с симптомами ДМК, которые желали использовать оральные контрацептивы. 269 женщин были рандомизированы на получение препарата Клайра, а 152 пациентки – на получение плацебо.
Спустя 6 месяцев терапии медиана потери менструальной крови (ПМК) снизилась на 88% (с 142 мл до 17 мл) в группе, получавшей препарат Клайра, по сравнению с 24% (снижение с 154 мл до 117 мл) в группе плацебо.
Спустя 6 месяцев лечения доля женщин, которые полностью излечились от любых симптомов ДМК, составила 29% в группе, принимавшей препарат Клайра, по сравнению с 2% в группе, принимавшей плацебо.
Эстрогеном, входящим в состав препарата Клайра, является эстрадиола валерат, сложный эфир естественного 17β-эстрадиола человека (1 мг эстрадиола валерата соответствует 0,76 мг 17β-эстрадиола). Данный эстроген отличается от эстрогенов этинилэстрадиола или его предшественника местранола, которые используются в составе других КОК, отсутствием этинильной группы в позиции 17-альфа.
Диеногест является производным нортестостерона, не обладающим какой-либо андрогенной активностью, однако он обладает антиандрогенной активностью, уровень которой приблизительно в три раза меньше уровня, характерного для ципротерона ацетата. Диеногест связывается с прогестероновым рецептором матки человека, при этом относительная аффинность прогестерона составляет лишь 10%. Несмотря на слабую аффинность по отношению к прогестероновому рецептору, диеногест обладает сильным прогестагенным эффектом in vivo. Диеногест не обладает какой-либо значительной андрогенной, минералокортикоидной или глюкокортикоидной активностью in vivo.
В рамках одного клинического исследования проводился анализ гистологии эндометрия в подгруппе женщин (n = 218) спустя 20 циклов лечения. Какие-либо аномальные результаты получены не были.
Фармакокинетические свойства
• Диеногест
Абсорбция
После перорального приема диеногест быстро и практически полностью всасывается. Максимальная концентрация в сыворотке крови, составляющая 90,5 нг/мл, достигается примерно через 1 час после перорального приема таблетки Клайры, содержащей 2 мг эстрадиола валерата + 3 мг диеногеста. Биодоступность составляет около 91%. Фармакокинетика диеногеста в дозовом диапазоне от 1 до 8 мг характеризуется зависимостью от дозы.
Одновременный прием пищи не оказывает клинически значимого влияния на скорость и степень всасывания диеногеста.
Распределение
Относительно большая (10%) часть циркулирующего диеногеста находится в несвязанном виде, тогда как около 90% неспецифически связано с альбумином. Диеногест не связывается с глобулином, связывающим половые гормоны (ГСПГ) и с кортикостероид-связывающим глобулином (КСГ). По этой причине отсутствует возможность вытеснения тестостерона из его связи с ГСПГ или кортизола из его связи с КСГ. Какое-либо влияние на физиологические процессы транспорта эндогенных стероидов, следовательно, является маловероятным. Объем распределения диеногеста при равновесной концентрации составляет 46 л после внутривенного введения 85 мкг меченного тритием диеногеста.
Метаболизм
Диеногест почти полностью метаболизируется, проходя известными путями метаболизма стероидных гормонов (гидроксилирование, конъюгирование), с образованием преимущественно эндокринологически неактивных метаболитов. Метаболиты выводятся очень быстро, так что преобладающей фракцией в плазме крови является неизмененный диеногест.
Общий клиренс после внутривенного введения меченного тритием диеногеста – 5,1 л/ч.
Элиминация
Период полувыведения диеногеста из плазмы крови составляет примерно 11 ч. Диеногест интенсивно метаболизируется и только 1% препарата выводится в неизменном виде. После приема внутрь в дозе 0,1 мг/кг диеногест выводится почками и через кишечник в соотношении примерно 3:1. После перорального приема 42% дозы выводится в пределах первых 24 часов, а 63% – в пределах 6 дней путем почечной экскреции. Через 6 дней почками и через кишечник выводится в совокупности 86% дозы.
Равновесная концентрация
Фармакокинетика диеногеста не зависит от концентрации ГСПГ. Равновесная концентрация достигается через 3 дня приема одной и той же дозы, составляющей 3 мг диеногеста в сочетании с 2 мг эстрадиола валерата. Минимальная, максимальная и средняя концентрации диеногеста в сыворотке крови при равновесном состоянии составляют, соответственно, 11,8 нг/мл, 82,9 нг/мл и 33,7 нг/м. Средний коэффициент кумуляции по площади под кривой «концентрация-время» (AUC0-24 ч) – 1,24.
• Эстрадиола валерат
Абсорбция
После приема внутрь эстрадиола валерат быстро и полностью абсорбируется. Расщепление на эстрадиол и валериановую кислоту происходит в ходе всасывания в слизистой оболочке желудочно-кишечного тракта (ЖКТ) или во время первого пассажа через печень, в результате чего образуются эстрадиол и его метаболиты – эстрон и эстриол. Максимальная концентрация эстрадиола в сыворотке крови, равная 70,6 пг/мл, достигается между 1,5 и 12 часами после разового приема внутрь таблетки, содержащей 3 мг эстрадиола валерата в 1-ый день курса.
Одновременный прием пищи не оказывает клинически значимого влияния на скорость и степень всасывания эстрадиола валерата.
Метаболизм
Валериановая кислота очень быстро метаболизируется. После приема внутрь примерно 3% дозы становятся непосредственно биодоступными в виде эстрадиола. Эстрадиол подвергается интенсивному эффекту «первичного прохождения» через печень, и значительная часть введенной дозы метаболизируется уже в слизистой ЖКТ. В совокупности с пресистемным метаболизмом в печени около 95% принятой внутрь дозы метаболизируется до поступления в системную циркуляцию. Основными метаболитами являются эстрон, эстрона сульфат и эстрона глюкуронид.
Распределение
В сыворотке крови 38% эстрадиола связано с ГСПГ, 60% с альбумином, и 2-3% циркулирует в несвязанном виде. Эстрадиол может незначительно повышать концентрацию ГСПГ в сыворотке крови; этот эффект зависит от дозы. На 21-ый день цикла приема концентрация ГСПГ составляла примерно 148% от исходной, а к 28-му дню (завершение фазы приема неактивных таблеток) снизилась приблизительно до 141% от исходной. Кажущийся объем распределения после внутривенного введения – 1,2 л/кг.
Элиминация
Вследствие большого циркулирующего пула сульфатов и глюкуронидов эстрогена, а также кишечно-печеночной рециркуляции, период полувыведения эстрадиола в терминальной фазе после перорального приема представляет собой комплексный параметр, который зависит от всех этих процессов и находится в диапазоне около 13-20 ч. Эстрадиол и его метаболиты выводятся, главным образом, почками, при этом около 10% выводится через кишечник.
Равновесная концентрация
На фармакокинетику эстрадиола влияет концентрация ГСПГ. У женщин измеряемая концентрация эстрадиола в плазме крови представляет собой совокупность эндогенного эстрадиола и эстрадиола, поступившего при приеме препарата Клайра. Во время фазы приема таблеток, содержащих 2 мг эстрадиола валерата + 3 мг диеногеста максимальная и средняя концентрации эстрадиола в сыворотке крови при равновесном состоянии составляют, соответственно, 66,0 пг/мл и 51,6 пг/мл. В течение всего 28-дневного цикла поддерживались стабильные минимальные концентрации эстрадиола в диапазоне от 28,7 пг/мл до 64,7 пг/мл.
Таблетки покрытые пленочной оболочкой.
2 темно-желтых таблетки, 5 розовых таблеток, 17 светло-желтых таблеток, 2 красных таблетки и 2 белых таблетки (всего 28 таблеток) в одном блистере из пленки ПВХ/алюминиевой фольги.
1 блистер вклеен в книжку-раскладушку картонную. Книжка-раскладушка вместе с самоклеющимся календарем приема и инструкцией по применению запечатана в прозрачную пленку.
Хранить при температуре не выше 30°С. Хранить в недоступном для детей месте.
5 лет. Не использовать по истечении срока годности!
По рецепту.
Производитель
Байер Веймар ГмбХ и Ко.КГ,
Деберайнер штрассе, 20, D-99427, Веймар, Германия.
Bayer Weimar GmbH & Co.KG,
Dobereiner Str. 20, D-99427, Weimar, Germany.
За дополнительной информацией обращаться по адресу:
220089, Минск, пр-т Дзержинского, 57, пом. 54, 14 этаж.
Тел.: + 375 (17) 2395420 (30), факс: + 375 (17) 2395439
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. ВОЗМОЖНЫ ПОБОЧНЫЕ ЭФФЕКТЫ. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА.Прокладки ежедневныеПрокладки супертонкие
Автор статьи
Диплом о фармацевтическом образовании: 105924 1197876, рег. номер 30353
Все авторы
Содержание статьи
- Клайра: состав
- Клайра: как принимать первую упаковку
- Клайра при эндометриозе
- Клайра: побочные эффекты
- Клайра и алкоголь: совместимость
- Клайра: аналоги
- Клайра или Ярина: что лучше
- Клайра или Джес: что лучше
- Краткое содержание
- Задайте вопрос эксперту по теме статьи
Противозачаточным таблеткам чуть более пятидесяти лет. Первые оральные контрацептивы содержали «убойные» дозы гормонов и имели тяжелые побочные действия вплоть до инсультов. Ученые-фармакологи на протяжении полусотни лет продолжают исследования и создают новые безопасные и эффективные КОКи (комбинированные оральные контрацептивы). По мнению врачей-гинекологов это самый надежный способ предупредить нежелательную беременность.
Сегодня в российских аптеках можно купить больше 50 торговых наименований КОКов. Провизор Наталья Зотина рассказывает о препарате Клайра: что входит в состав, когда и как применяется, какие побочные эффекты, можно ли совмещать с алкоголем. Описывает отличия Клайры и препаратов Джес и Ярина.
Клайра: состав
Как и все КОКи, Клайра содержит комбинацию гормонов эстрогена и гестагена. Они отвечают соответственно за первую и вторую половину менструального цикла. Уникальность препарата заключается в том, что он многофазный. Содержание гормонов повторяет по дням их колебания во время нормального цикла.
В упаковке Клайры 28 таблеток пяти видов:
- темно-желтые (эстрадиола валерат 3 мг) 2 шт
- розовые (эстрадиола валерат 2 мг+диеногест 2 мг) 5 шт
- бледно-желтые (эстрадиола валерат 2 мг+диеногест 3 мг) 17 шт
- красные (эстрадиола валерат 1 мг) 2 шт
- белые (плацебо) 2 шт
Порядок приема таблеток указан на упаковке. Их принимают каждый день в одно и то же время независимо от приема пищи. Прием таблеток из новой упаковки начинают на следующей день после последней таблетки из предыдущей упаковки.
Когда начинаются месячные во время приема Клайры?
Во время приема последних таблеток — второй красной и белых с плацебо — происходит псевдоменструация. У некоторых женщин менструальноподобное кровотечение может продолжаться и в период приема первых таблеток из новой упаковки.
Клайра: как принимать первую упаковку
Правила приема первой упаковки зависят от ситуации:
- В предыдущем месяце и ранее не было приема КОКов: первую таблетку из упаковки Клайры принимают в первый день цикла — первый день менструального кровотечения.
- Ранее была контрацепция с использованием КОК, пластыря, вагинального кольца: на следующий день после принятия последней таблетки с гормонами, в день удаления пластыря или кольца.
- При переходе с контрацептивов, содержащих только гестагены (мини-пили, инъекции, имплантат, внутриматочная терапевтическая система): в этом случае необходимо в течение 9 дней с момента приема Клайры использовать дополнительные методы контрацепции (презерватив). Перейти с мини-пили можно в любой день, с инъекций — в день, когда должна быть сделана инъекция, с имплантата и внутриматочной системы — в день их удаления.
- После аборта в первом триместре: принимают первую таблетку Клайры в этот же день.
- После родов и в случае прерванной беременности во втором триместре: в случае родов женщине можно принимать Клайру, если она не кормит грудью. Первый прием — на 21-28 день после родов. При прерывании беременности — немедленно.
- Если прием будет начат позднее, то в первые 9 дней необходимо использовать дополнительный барьерный метод контрацепции. Если до приема Клайры был сексуальный контакт, то необходимо убедиться в отсутствии беременности или дождаться первой менструации.
Клайра: когда можно не предохраняться?
В случаях, описанных под номерами 1, 2 и 4.
Клайра при эндометриозе
В инструкции к противозачаточным таблеткам Клайра нет показания лечения эндометриоза. Эндометриоз — хроническое гормональнозависимое заболевание. Мажущие выделения, болезненные менструации, выделения в сгустках — его симптомы. Для терапии симптомов эндометриоза назначают гестагены. Они останавливают прогрессирование заболевания. КОКами его не лечат.
Клайра содержит гестаген диеногест и меньшее количество эстрогена эстрадиола валерата, чем другие КОКи. Поэтому гинекологи часто назначают Клайру пациенткам с эндометриозом как контрацептив первого выбора. Препарат предохраняет от беременности и благоприятно влияет на эндометрий.
Клайра: побочные эффекты
Клайра часто оказывает следующие побочные эффекты:
- головная боль, боль в пазухах носа, мигрень, головокружение
- боли в животе, вздутие, тошнота
- акне
- боли и дискомфорт в молочных железах и сосках
- болезненные, нерегулярные менструальноподобные кровотечения, их отсутствие
- увеличение массы тела
Клайра и алкоголь: совместимость
В инструкции к препарату нет указаний на несовместимость с алкоголем. Врачи рекомендуют ограничивать прием спиртных напитков при приеме Клайры, чтобы не усугублять ее побочные эффекты.
Клайра: аналоги
Противозачаточных таблеток с идентичным Клайре составом нет. Аналогами по действию являются почти все противозачаточные таблетки. В зависимости от содержания гормона эстрогена их делят на три группы. Назовем те, которые врачи назначают часто:
- среднедозированные: Диане-35, Хлое
- низкодозированные: Жанин, Линдинет 30, Регулон, Силует, Ярина
- микродозированные: Дима, Джес, Логест, Линдинет 20, Мерсилон, Новинет
Нельзя однозначно сказать, что лучше, например, Клайра или Силует. Все КОКи имеют много противопоказаний и побочных действий, несовместимы с некоторыми медикаментами, а разница количественного и качественного состава определяет специфику дополнительного действия. Поэтому самостоятельно их выбирать нельзя. Прием КОКа назначает специалист, он же делает выбор определенного препарата.
Клайра или Ярина: что лучше
Одним женщинам лучше подойдет Клайра, другим — Ярина. Определить это может врач-гинеколог.
Рассмотрим отличия аналогов: Ярина содержит эстроген этинилэстрадиол, а Клайра — эстрадиола валерат, который ближе по химическому строению к натуральному.
Ярина — монофазный КОК, содержит одинаковое количество эстрогена и гестагена во всех таблетках. Клайра — многофазный, содержит 5 видов таблеток с разной комбинацией гормонов. Их состав повторяет изменение гормонального уровня при естественном менструальном цикле.
Гестаген в Ярине — дроспиренон, который обладает антиандрогенным действием. Поэтому Ярину назначают как средство контрацепции при болезненных месячных, а также для улучшения состояния кожи при акне, уменьшения отечности и нагрубания груди. Клайру — при обильных, длительных менструациях.
Клайра или Джес: что лучше
Джес повторяет состав Ярины, только содержит меньше этинилэстрадиола — 20 мг против 30 мг у Ярины. Поэтому Джес врачи выбирают при назначении женщинам, которые имеют факторы риска для приема КОКов. Это курение, лишний вес, компенсированный сахарный диабет. Показания к приему Джес: контрацепция и лечение угревой сыпи средней степени тяжести и тяжелой формы предменструального синдрома.
Джес отличается от Клайры режимом приема: препарат содержит 24 активные таблетки и 4 плацебо. Эта схема 24+4 позволяет сохранить противозачаточный эффект при пропуске таблетки в течение 24 часов. У Клайры задержка в приеме более 12 часов снижает контрацептивную защиту.
Краткое содержание
- Клайра — многофазный контрацептив. Таблетки содержат эстроген и гестаген в разных количествах, которые повторяют колебания гормонов при нормальном цикле. Поэтому в упаковке Клайры 5 видов цветных таблеток.
- Правила приема первой упаковки зависит от ситуации: принимала или нет женщина другие контрацептивы, роды или прерванная беременность.
- Лечение эндометриоза не указано в инструкции к таблеткам Клайра как показание к применению. Комбинация диеногеста и эстрадиола валерата обладает благоприятным эффектом в отношении эндометрия, что применяется для лечения обильных и длительных менструаций без органической патологии.
- Клайра часто вызывает побочные эффекты: головная боль, боль в животе, тошнота, газообразование, акне, увеличение массы тела.
- В инструкции к препарату нет указаний на несовместимость с алкоголем.
- Противозачаточных таблеток с таким же составом, как в Клайре, нет.
- Ярина отличается от Клайры действующими веществами — эстрогеном и гестагеном. Их количество постоянно во всех таблетках в упаковке.
- Джес повторяет состав Ярины, за исключением количества эстрогена и схемы приема.
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же Вы можете поделиться своим опытом с другими читателями Мегасоветов.
Поделиться мегасоветом
Понравилась статья? Расскажите маме, папе, бабушке и тете Гале из третьего подъезда