Описание препарата Иларис® (лиофилизат для приготовления раствора для подкожного введения, 150 мг) основано на официальной инструкции, утверждено компанией-производителем в 2015 году
Дата согласования: 14.08.2015
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Отзывы
Фотографии упаковок

14.08.2015
Действующее вещество
ATX
Фармакологическая группа
Состав
| Лиофилизат для приготовления раствора для подкожного введения | 1 фл. |
| активное вещество: | |
| канакинумаб | 150 мг |
| вспомогательные вещества: L-гистидин — 2,801 мг; L-гистидина гидрохлорида моногидрат — 1,673 мг; полисорбат 80 — 0,6 мг; сахароза — 92,35 мг; кислота хлористоводородная 1 М — до рН 6,5 | |
| если комплектность предполагает включение растворителя: 1 фл. растворителя содержит воды для инъекций — 5 мл |
Описание лекарственной формы
Лиофилизат: лиофилизированный порошок белого цвета.
Фармакологическое действие
Фармакологическое действие
—
иммунодепрессивное.
Фармакодинамика
Канакинумаб — полностью человеческое моноклональное антитело IgG1/каппа изотипа к ИЛ-1β. Канакинумаб с высоким аффинитетом связывается с человеческим ИЛ-lβ, нейтрализуя таким образом его биологическое действие, блокируя взаимодействие ИЛ-1β с его рецепторами, ИЛ-1β-индуцированную активацию генов и продукцию медиаторов воспаления, таких как ИЛ-6 и ЦОГ-2.
При лечении пациентов с системным ювенильным идиопатическим артритом (сЮИА) отмечалось быстрое и продолжительное улучшение суставных и системных проявлений заболевания: значительное уменьшение числа воспаленных суставов, быстрое исчезновение лихорадки и снижение реактантов острой фазы у большинства пациентов.
У 33% пациентов на 29-й день терапии отмечалось улучшение течения заболевания на 100% по педиатрическим критериям Американской коллегии ревматологов в сравнении с отсутствием эффекта в группе плацебо. Применение канакинумаба позволяет существенно снизить или отменить применение ГКС при терапии сЮИА. Канакинумаб позволяет удлинить временной промежуток до обострения заболевания, улучшить качество жизни пациентов и выполнение ими ежедневных задач.
У пациентов с подагрическим артритом и различными фенотипами криопиринассоциированного периодического синдрома (cryopyrin-associated periodic syndrome, CAPS) включая семейный холодовой аутовоспалительный синдром/семейную холодовую крапивницу (Familial Cold Autoinflammatory Syndrome/Familial Cold Urticaria, FCAS/FCU), синдром Макла-Уэльса (Muckle-Wells Syndrome, MWS) и мультисистемное младенческое воспалительное заболевание/хронический младенческий неврологический кожно-артикулярный синдром (Neonatal onset multisystemic inflammatory disease/Chronic infantile neurological cutaneous and articular, NOMID/CINCA), канакинумаб снижает выраженность местных и системных воспалительных реакций, вызванных избыточной продукцией ИЛ-1β. При применении препарата у больных с острым приступом подагрического артрита снижается концентрация лабораторных маркеров воспаления: (С-реактивный белок (СРБ), сывороточный амилоид А (САА), в течение короткого времени уходят признаки воспаления пораженного сустава (боль, отек, покраснение).
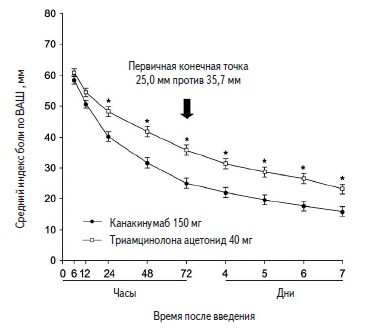
На фоне применения препарата Иларис® 150 мг п/к у пациентов с частыми обострениями приступов подагры (как минимум 3 приступа в течение года) было отмечено статистически значимое снижение интенсивности боли (по шкале ВАШ) по сравнению с группой контроля (триамцинолон 40 мг). На фоне применения препарата Иларис® снижение интенсивности боли наблюдается начиная с 24 ч после введения препарата и продолжается в течение 7 дней после введения.
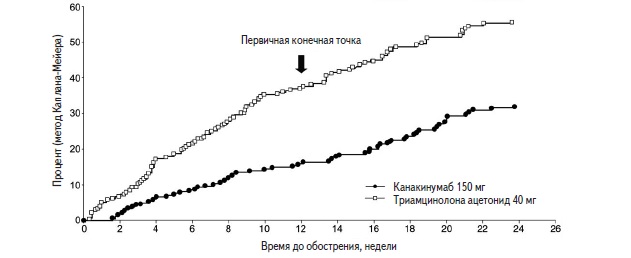
При применении препарата Иларис® было продемонстрировано статистически значимое снижение риска возникновения нового приступа подагры на 62% в течение 12 нед терапии и на 56% в течение 24 нед терапии по сравнению с данными показателями в группе контроля.
Эффективность препарата Иларис® при подагрическом артрите была сопоставима у пациентов в возрасте ≥65 и ≤65 лет.
При применении канакинумаба у больных с различными фенотипами CAPS отмечается уменьшение уже в течение первых суток следующих проявлений заболевания: лихорадки, повышенной утомляемости, кожной сыпи, артралгии, миалгии, головной боли/мигрени, конъюнктивита, слабости, а также снижение (в течение нескольких дней) продукции маркеров воспаления, включая СРБ и САА, и приводит к нормализации числа лейкоцитов и тромбоцитов (в случае их повышения).
При длительном применении канакинумаба (в течение 48 нед) у пациентов с CAPS полный ответ на терапию, определяемый как сочетание уменьшения (до минимальной степени или полного исчезновения) симптомов аутовоспалительного заболевания и поражений кожи (сыпь по типу крапивницы), и снижения показателей СРБ и САА <10 мг/л, наблюдался в 97% случаев в течение 7 дней после начала терапии. При применении канакинумаба у больных не отмечалось развитие рецидивов заболевания (в группе больных, получавших лечение плацебо, рецидивы наблюдались в 81% случаев).
Фармакокинетика
Абсорбция. У взрослых пациентов с различными фенотипами CAPS после однократного п/к введения 150 мг препарата Tmax канакинумаба составляет около 7 дней. Средний конечный T1/2 составляет 26 дней. При п/к введении канакинумаба абсолютная биодоступность — 66% (популяционный фармакокинетический анализ у пациентов с CAPS, включая детей в возрасте от 2 лет). Параметры фармакокинетики (AUC и Cmax) повышаются пропорционально дозе в диапазоне от 0,3 до 10 мг/кг при в/в инфузии или п/к введении (в дозе от 150 до 600 мг).
Распределение. Канакинумаб связывается с сывороточным ИЛ-1β. Vss изменяется в зависимости от массы тела. У пациентов с CAPS Vss составляет 6,2 л при массе тела 70 кг, у пациентов с сЮИА — 3,2 л при массе тела 33 кг и у пациентов с подагрическим артритом — 7,9 л при массе тела 93 кг. При п/к введении препарата в течение 6 мес в дозе 150 мг каждые 8 нед, в дозе 4 мг/кг каждые 4 нед, 150 мг каждые 12 нед коэффициент кумуляции канакинумаба составляет 1,3; 1,6 и 1,1 соответственно.
Выведение. Клиренс изменяется в зависимости от массы тела. Для пациентов с CAPS этот показатель составляет 0,17 л/сут при массе тела 70 кг, у пациента с сЮИА — 0,11 л/сут при массе тела 33 кг, у пациента с подагрическим артритом — 0,23 л/сут при массе тела 93 кг. После учета весовых различий существенная разница в фармакокинетических свойствах канакинумаба у пациентов с подагрическим артритом, различными фенотипами CAPS и сЮИА не была выявлена.
При повторном применении препарата не наблюдается увеличение клиренса или изменение каких-либо других, зависимых от времени, фармакокинетических параметров канакинумаба. При назначении препарата с учетом массы тела, пол и возраст пациентов не оказывают влияние на фармакокинетику препарата.
Особые группы пациентов
Пациенты в возрасте ≤18 лет. У пациентов в возрасте 4 лет и старше после п/к однократного введения препарата в дозе 150 мг или 2 мг/кг Tmax канакинумаба составляет 2–7 дней. Конечный T1/2 канакинумаба у данной категории больных сходен с таковым у взрослых и составляет от 22,9 до 25,7 дня. Результаты популяционного анализа фармакокинетики канакинумаба у детей в возрасте от 2 до 4 лет сходны с таковыми у пациентов 4 лет и старше. Фармакокинетические характеристики у пациентов с CAPS и сЮИА схожи. При п/к введении канакинумаба в дозе 4 мг/кг каждые 4 нед у пациентов с сЮИА значения AUC и Cmax были аналогичны в возрастной группе от 2 до младше 20 лет.
Пациенты в возрасте ≥65 лет. Не была выявлена разница в фармакокинетических параметрах, основанных на клиренсе и Vss, у пациентов старшей возрастной группы и в возрасте менее 65 лет.
Показания
острый подагрический артрит:
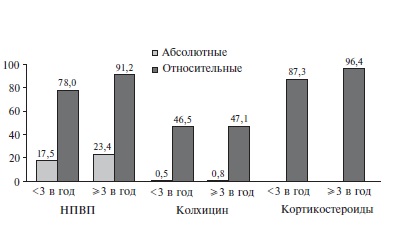
— лечение частых острых приступов подагрического артрита и предупреждение развития новых приступов при неэффективности, непереносимости или наличии противопоказаний к применению НПВС и/или колхицина и невозможности проведения терапии повторными курсами ГКС;
криопиринассоциированный периодический синдром у взрослых и детей в возрасте ≥2 лет, включая:
— семейный холодовой аутовоспалительный синдром/семейная холодовая крапивница;
— синдром Макла-Уэльса;
— младенческое мультисистемное воспалительное заболевание/хронический младенческий неврологический кожно-артикулярный синдром;
активная фаза системного ювенильного идиопатического артрита у детей в возрасте ≥2 лет.
Противопоказания
повышенная чувствительность к активному веществу или другим компонентам препарата в анамнезе;
острые инфекционные заболевания;
беременность;
период грудного вскармливания;
дети младше 2 лет (безопасность и эффективность для указанной категории пациентов изучены недостаточно).
С осторожностью: пожилые пациенты; наличие в анамнезе рецидивирующих инфекций или любых состояний, предрасполагающих к развитию инфекции.
Применение при беременности и кормлении грудью
Имеются ограниченные данные по применению препарата Иларис® у пациенток репродуктивного возраста и беременных пациенток. В исследованиях на животных у препарата не была выявлена какая-либо репродуктивная токсичность. Женщинам следует применять надежные методы контрацепции во время терапии препаратом Иларис® и в течение 3 мес после применения последней дозы препарата.
Неизвестно, проникает ли канакинумаб в грудное молоко. При необходимости применения препарата грудное вскармливание следует прекратить.
Способ применения и дозы
П/к в те участки тела, где есть подкожно-жировая клетчатка: в живот, переднюю поверхность бедер, заднебоковую поверхность плеч (см. Указания по применению).
Препарат (лиофилизат) растворяют в 1 мл воды для инъекций (см. Указания по применению).
Подагрический артрит
Рекомендованная доза препарата у взрослых — 150 мг, препарат вводят во время приступа подагрического артрита, одномоментно. Для достижения максимальной эффективности препарат необходимо вводить как можно раньше после начала приступа подагрического артрита.
Пациентам, которые не ответили на первую инъекцию препарата Иларис®, повторно вводить препарат не следует. Пациентам, ответившим на лечение, повторное введение препарата Иларис® возможно как минимум через 12 нед после предыдущей инъекции.
Применять препарат Иларис® для терапии приступов подагрического артрита следует по мере необходимости. Оптимизирование контроля гиперурикемии следует проводить с помощью соответствующих противоподагрических препаратов.
Терапия препаратом может быть инициирована и проводиться только врачом, имеющим опыт диагностики и лечения пациентов с подагрическим артритом.
CAPS
Рекомендованные стартовые дозы препарата Иларис® для пациентов с CAPS:
взрослым и детям ≥4 лет, в зависимости от массы, тела назначают:
— масса тела >40 кг — 150 мг;
— масса тела ≥15 кг и ≤40 кг — 2 мг/кг;
— масса тела ≥7,5 кг и <15 кг — 4 мг/кг.
У детей от 2 и <4 лет с массой тела ≥7,5 кг препарат применяют из расчета 4 мг/кг.
Препарат вводят п/к — 1 инъекция с интервалом 8 нед.
Если у пациентов при стартовой дозе 150 мг или 2 мг/кг не получен удовлетворительный клинический ответ, а именно процесс разрешения сыпи и других симптомов воспаления не наблюдается в течение 7 дней после первой инъекции препарата Иларис®, возможно проведение второй инъекции препарата в дозе 150 мг (при массе тела >40 кг) или 2 мг/кг (при массе тела ≥15 кг и ≤40 кг). При достижении в последующем полного клинического ответа данным пациентам рекомендуется поддерживающая терапия препаратом Иларис® в дозе 300 мг, 1 инъекция с интервалом 8 нед (при массе тела >40 кг) или 4 мг/кг, 1 инъекция с интервалом 8 нед (при массе тела ≥15 кг и ≤40 кг).
Если удовлетворительный клинический эффект не наблюдается в течение 7 дней после повышения дозы, возможно проведение третьей инъекции препарата Иларис® в дозе 300 мг, 1 инъекция с интервалом 8 нед (при массе тела >40 кг) или 4 мг/кг (при массе тела ≥15 кг и ≤40 кг). При достижении в последующем полного клинического ответа данным пациентам рекомендуется поддерживающая терапия препаратом Иларис® в дозе 600 мг, 1 инъекция с интервалом 8 нед (при массе тела >40 кг) или 8 мг/кг (при массе тела ≥15 кг и ≤40 кг), 1 инъекция с интервалом 8 нед.
Если у пациентов при стартовой дозе 4 мг/кг удовлетворительный клинический эффект не наблюдается в течение 7 дней после первой инъекции, возможно проведение второй инъекции препарата Иларис® в дозе 4 мг/кг. При достижении в последующем полного клинического ответа данным пациентам рекомендуется поддерживающая терапия препаратом в дозе 8 мг/кг, 1 инъекция с интервалом 8 нед.
Клинический опыт применения препарата с интервалом дозирования <4 нед или в дозе >600 мг или 8 мг/кг ограничен.
Повышение дозы препарата Иларис® требовалось наиболее часто для пациентов с NOMID/CINCA по сравнению с FCAS или MWS.
Терапия препаратом может быть инициирована и проводиться только врачом, имеющим опыт диагностики и лечения пациентов с CAPS.
При сЮИА рекомендованная доза у пациентов с массой тела ≥7,5 кг составляет 4 мг/кг (с увеличением до 300 мг) каждые 4 нед в виде п/к инъекции.
После обучения технике п/к инъекций пациенты или лица, за ними ухаживающие, могут самостоятельно вводить препарат под надлежащим контролем (если врач сочтет это необходимым). Пациенты или лица, ухаживающие за ними, должны быть проинструктированы по технике приготовления раствора и правилам пользования шприцами и иглами, пригодными для проведения инъекции.
Особые группы пациентов
Пациенты ≥65 лет. Не требуется коррекция дозы препарата у пациентов в возрасте ≥65 лет.
Пациенты ≤18 лет. Подагрический артрит — нет данных по применению препарата Иларис® для лечения подагрического артрита у детей и подростков ≤18 лет. CAPS и сЮИА — опыт применения канакинумаба у детей младше 2 лет ограничен.
Нарушение функции почек. Не требуется коррекция дозы препарата у пациентов с нарушениями функции почек (опыт клинического применения у таких пациентов ограничен).
Нарушение функции печени. У пациентов с нарушениями функции печени эффективность и безопасность применения препарата не изучались. Так как препарат Иларис® — человеческий IgG, предполагается, что печеночная недостаточность не влияет на фармакокинетику данного препарата.
Указания по применению
I. Препарат Иларис®, в комплектации флакон с лиофилизатом без растворителя
Следует учесть, что подготовка к инъекции составляет около 30 мин.
Перед началом необходимо: найти чистое, удобное место для проведения инъекции; вымыть руки с мылом; проверить даты срока годности на флаконах и шприцах; не использовать препарат при истекшем сроке годности (последний день месяца, указанного на флаконе); всегда использовать новые неоткрытые иглы и шприцы; избегать касания игл и верхних частей флаконов.
Следует подготовить необходимые материалы: 1 фл. с лиофилизатом препарата Иларис® (хранить охлажденным при температуре от 2 до 8°C), входит в состав упаковки.
Для проведения инъекции помимо флакона с препаратом Иларис® необходимо: 1 фл. с водой для инъекции; 1 шприц (объемом 1 мл); 1 большая игла (50 мм) для приготовления раствора (игла для разведения); 1 маленькая игла для п/к инъекции (13 мм), спиртовые тампоны; чистые, сухие ватные тампоны; лейкопластырь; контейнер для использованных флаконов, игл и шприца.
Приготовление раствора препарата Иларис®
1. Снять защитную крышку с флакона с препаратом Иларис® и растворителем, не трогая руками пробки флаконов. Протереть их спиртовым тампоном.
2. Открыть упаковку с шприцем и иглой для разведения. Надеть иглу на шприц.
3. Аккуратно снять с иглы защитный колпачок и отложить его в сторону. Оттянуть поршень шприца назад до отметки 1 мл, заполняя шприц воздухом. Ввести иглу во флакон с водой для инъекции через центр резиновой пробки.
4. Осторожно надавливать на поршень шприца сверху вниз, чтобы воздух вошел во флакон с водой.
5. Перевернуть флакон с вставленными в него иглой и шприцем и поднести к глазам.
6. Убедиться в том, что конец иглы покрыт водой, и медленно передвигать поршень шприца вниз, немного ниже отметки 1 мл. Если возникли пузырьки воздуха в шприце, удалить их, согласно инструкциям, полученным от медицинского работника.
7. Убедиться, что 1 мл воды для инъекций находится в шприце, а затем вытащить иглу из флакона (во флаконе останется вода — это нормально).
8. Вставить иглу с шприцем в центр пробки флакона с препаратом Иларис®, стараясь не трогать иглу и пробку флакона, и медленно выпустить всю воду (1 мл) из шприца во флакон.
9. Осторожно извлечь шприц с иглой из флакона, надеть на иглу защитный колпачок.
10. Не дотрагиваясь до резиновой пробки флакона, наклонить его под углом 45° и вращать в течение 1 мин. Не встряхивать. Затем отставить флакон на 5 мин.
11. Затем аккуратно повращать флакон во фронтальной плоскости 10 раз, не дотрагиваясь до резиновой пробки.
12. Снова отставить флакон на 15 мин, при комнатной температуре, для получения прозрачного раствора. Не встряхивать. Не использовать раствор, если в нем присутствуют посторонние частицы.
13. Убедиться, что весь раствор находится внизу флакона. Если капли раствора остались на пробке, слегка постучать по стенке флакона. Раствор должен быть прозрачным и свободным от посторонних видимых частиц. Если приготовленный раствор не используется сразу, необходимо поставить его в холодильник (при температуре 2–8 °С) и использовать в течение 24 ч.
Подготовка к инъекции
14. Протереть резиновую пробку флакона с приготовленным раствором препарата Иларис® новым спиртовым тампоном.
15. Снять защитный колпачок с иглы (игла для приготовления раствора), оттянуть поршень шприца до отметки 1 мл, набрав тем самым в него воздух. Вставить иглу в центр резиновой пробки флакона с препаратом Иларис® и выпустить в него весь воздух из шприца (не выпускать воздух непосредственно в раствор).
16. Не переворачивать флакон с шприцем. Опустить иглу до дна флакона.
17. Наклонить флакон, чтобы было возможно набрать необходимое количество раствора. Примечание: требуемое количество соответствует назначенной дозе (от 0,2 до 1 мл).
18. Медленно оттягивая поршень до необходимой метки (от 0,2 до 1 мл), набрать требуемое количество приготовленного раствора препарата Иларис®. Необходимо соблюдать осторожность, чтобы воздух не попал в шприц с раствором. Убедиться, что в шприце находится необходимое для инъекции количество раствора.
19. Извлечь шприц с иглой из флакона (неиспользованный раствор препарата Иларис® может остаться во флаконе). Надеть защитный колпачок на иглу, с помощью которой набирали препарат, и снять ее со шприца. Убрать иглу в специальный контейнер. Открыть упаковку с инъекционной иглой и надеть ее на шприц. Отложить шприц в сторону.
Проведение инъекции
20. Выбрать место для инъекции: верхняя часть плеча, верхняя часть бедра, живот или ягодица. Не делать инъекцию в то место, где наблюдаются покраснение, сыпь, гематома, нарушение целостности кожных покровов или поверхность кожи неровная. Избегать инъекции в рубцовую ткань, т.к. это может послужить причиной недостаточной экспозиции канакинумаба. Избегать попадания в кровеносный сосуд.
21. Протереть предполагаемое место инъекции новой спиртовой салфеткой и подождать, чтобы поверхность кожи стала сухой. Снять защитный колпачок с инъекционной иглы.
22. Осторожно сжать кожу над местом инъекции. Взять шприц под углом 90° и аккуратным плавным движением ввести иглу полностью в кожу.
23. Не вынимать иглу до тех пор, пока полностью не введен препарат. Отпустить кожную складку и извлечь иглу. Не использовать шприц и иглу повторно. Использованные иглы и шприц убрать в специальный контейнер.
После инъекции
24. Не протирать место инъекции. Если в месте инъекции отмечается кровоточивость, с помощью сухого тампона слегка надавить на место инъекции и подержать его в таком положении в течение 1–2 мин или до тех пор, пока кровоточивость не прекратится. Затем заклеить место инъекции пластырем.
25. Убрать использованные иглы и шприц в специальный контейнер для последующей утилизации. Никогда не использовать повторно шприц и иглу. Ни остатки раствора, ни остатки воды для инъекции не могут быть использованы еще раз. Каждый раз необходимо убедиться, что емкости с остатками воды для инъекции и препаратом Иларис® (если он остается) выброшены. Убедиться, что дети не смогут достать контейнер с использованными иглами и шприцем.
II. Препарат Иларис®, в комплектации флакон с лиофилизатом в комплекте с растворителем
Содержимое готового набора: флакон с порошком; флакон с растворителем; шприц для инъекции на 1 мл; безопасная игла; адаптер флакона (2 шт.); очищающие (спиртовые) салфетки (4 шт.).
Смешивание препарата Иларис® с растворителем
1. Снять с флакона с порошком отщелкивающуюся крышку, после чего протереть резиновую пробку свежей очищающей салфеткой. Примечание: не дотрагиваться до протертой резиновой пробки.
2. Взять один из блистер-лотков с адаптерами флаконов и, крепко удерживая блистер-лоток, полностью удалить с него пленочную крышку. Необходимо соблюдать осторожность и не дотрагиваться до адаптера флакона. Не вынимать адаптер флакона из блистер-лотка.
3. Поставить флакон с порошком на ровную поверхность. Держась за блистер-лоток, поместить адаптер флакона на верхушку флакона с порошком и протолкнуть его до конца вниз, пока он не защелкнется на флаконе.
4. Удерживая блистер-лоток за его верхнюю часть, приподнять его вертикально вверх и удалить блистер-лоток с адаптера флакона. Примечание: если адаптер флакона поставлен неправильно, не следует дотрагиваться до него. Перед тем как исправить положение адаптера снова поместить на него блистер-лоток.
5. Чтобы присоединить второй адаптер на флакон с растворителем, содержащий воду для инъекций, повторить п. 1–4. Примечание: теперь на обоих флаконах надеты адаптеры, и они готовы к использованию.
6. После того, как адаптеры надеты на оба флакона, раскрыть упаковку шприца, стянув с нее пленку, и вынуть шприц. Стараясь не дотрагиваться до кончика шприца, оттянуть поршень вниз, впустив в шприц 1 мл воздуха. Примечание: заполнение шприца воздухом (1 мл) облегчает последующий забор в шприц воды для инъекций и уменьшает образование пузырьков воздуха.
7. Взять флакон с растворителем и аккуратно навинтить шприц на адаптер флакона. Не прикладывать усилий. Примечание: необходимо соблюдать осторожность и не дотрагиваться до кончика шприца или адаптера флакона. На этом этапе игла не требуется.
8. Медленно протолкнуть поршень вниз до самого конца, чтобы ввести во флакон с растворителем 1 мл воздуха. Удерживать поршень в этом положении.
9. Перевернуть шприц так, чтобы флакон с растворителем оказался дном вверх, и поднять его на уровень глаз. Медленно потянуть за поршень вниз с тем, чтобы отобрать в шприц 1 мл воды. Продолжая удерживать флакон в направлении дном вверх, проверить, нет ли в шприце крупных пузырьков воздуха.
10. Удалить из шприца крупные пузырьки воздуха, для чего выполнить следующую процедуру: слегка постучать по шприцу с тем, чтобы крупные пузырьки воздуха поднялись наверх. Аккуратно протолкнуть поршень вверх с тем, чтобы крупные пузырьки воздуха вошли во флакон. Снова медленно оттянуть поршень назад до отметки 1 мл. Повторять эти действия до тех пор, пока не будут удалены все крупные пузырьки. Убедиться в том, что в шприце содержится 1 мл воды. Держась за поршень, свинтить шприц с флакона, предварительно поставленного на чистую и ровную поверхность во избежание разбрызгивания. Примечание: часть воды останется во флаконе с растворителем.
11. Поставить флакон с порошком на чистую и ровную поверхность. Навинтить на адаптер флакона шприц, содержащий 1 мл воды. Не прикладывать усилий. Примечание: следует соблюдать осторожность и не касаться пальцами кончика шприца или верхней части флакона. На этом этапе игла не требуется.
12. Медленно протолкнуть поршень вниз до самого конца, чтобы перенести 1 мл воды из шприца во флакон с порошком. Шприц пока не отсоединять.
13. Совершая круговые движения, медленно повращать шприц вместе с флаконом под углом 45° в течение по крайней мере 1 мин, не следует встряхивать шприц и флакон.
14. Поставить флакон вместе со шприцем на ровную поверхность и оставить их на 5 мин. Примечание: поршень может немного подняться. Это может случиться, поскольку давление во флаконе слегка повышено.
15. По прошествии 5 мин снова протолкнуть поршень шприца до конца вниз. Аккуратно перевернуть флакон вместе со шприцем 10 раз в вертикальной плоскости. Ни в коем случае не встряхивать шприц и флакон.
16. Дать флакону вместе со шприцем постоять еще 15 мин. По прошествии 15 мин, не встряхивая флакон, убедиться в том, что раствор не мутный и не содержит частиц. Наверху раствора может присутствовать пена; это не должно вызывать беспокойства и не является помехой для выполнения следующего этапа. Если в растворе все еще присутствуют частицы, повторить п. 15, описанный выше, после чего оставить флакон со шприцем еще на 5 мин, а затем снова проверить, нет ли в растворе частиц. Если раствор не мутный и не содержит частиц, отобрать назначенную дозу, как описано в следующем разделе. Примечание: если раствор не используется сразу после приготовления, его следует поставить в холодильник (при температуре 2–8 °C) и использовать в течение 24 ч.
Подготовка к инъекции
17. Перевернуть флакон вместе со шприцем дном вверх и аккуратно оттянуть поршень вниз с тем, чтобы отобрать в шприц 1 мл раствора. Шприц пока не отсоединять.
Медленно протолкнуть поршень до самого конца, чтобы перенести весь раствор обратно во флакон. Примечание: цель данного этапа — обеспечить полное перемешивание раствора и уменьшить образование пузырьков воздуха.
18. Поднять шприц на уровень глаз и снова медленно оттянуть поршень назад, чтобы отобрать требуемый объем раствора. Примечание: требуемое количество зависит от дозы, которую необходимо ввести (от 0,2 до 1 мл). Какой именно объем раствора нужно вводить, скажет врач. Продолжая удерживать флакон дном вверх, проверить, нет ли в растворе, набранном в шприц, крупных пузырьков воздуха (при этом часть раствора может остаться во флаконе).
19. Удалить из раствора крупные пузырьки воздуха, для чего выполнить следующую процедуру: слегка постучать по шприцу с тем, чтобы крупные пузырьки воздуха поднялись наверх; аккуратно протолкнуть поршень вверх с тем, чтобы крупные пузырьки воздуха вошли во флакон; снова медленно оттянуть поршень назад до отметки, соответствующей назначенной дозе. Повторять эти действия до тех пор, пока не будут удалены все крупные пузырьки. Удостовериться, что объем раствора в шприце соответствует назначенной дозе. Держась за поршень, свинтить шприц с флакона, предварительно поставленного на чистую и ровную поверхность во избежание разбрызгивания. Положить приготовленный шприц на чистую и ровную поверхность. Примечание: не следует дотрагиваться до кончика шприца.
20. Вынуть безопасную иглу из блистерной упаковки и навинтить ее на приготовленный шприц. Примечание: не следует дотрагиваться до кончика шприца или иглы. Переместить откидной предохранитель в направлении корпуса шприца.
Техника проведения инъекции, выбор места инъекции, поведение после инъекции — см. выше, в разделе I.
Побочные действия
При применении препарата Иларис® в ходе клинических исследований отмечалось повышение частоты инфекционных заболеваний, преимущественно инфекций верхних дыхательных путей. Течение инфекционных заболеваний чаще всего было легким или средней степени тяжести, однако отмечались и случаи тяжелого течения инфекционных заболеваний. Наблюдались изолированные случаи развития редких или оппортунистических инфекций на фоне приема препарата Иларис®, однако связь данных заболеваний с приемом препарата неизвестна.
Для оценки частоты нежелательных явлений (НЯ), выявленных в плацебо-контролируемых клинических исследованиях (при применении препарата для лечения CAPS в дозе 150 мг при массе тела >40 кг и 2 мг/кг при массе тела ≥15 кг и ≤40 кг и при лечении сЮИА у пациентов в возрасте от 2 до 20 лет) и для лечения острых приступов подагрического артрита в дозах от 10 до 300 мг в активно-контролируемых исследованиях, использованы следующие критерии (согласно классификации ВОЗ): очень часто (≥1/10 назначений); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000); частота неизвестна (недостаточно данных для оценки частоты развития).
Подагрический артрит
Инфекционные и паразитарные заболевания: очень часто — инфекции (в частности назофарингит, синусит, вирусные инфекции верхних дыхательных путей, бронхит, пневмония, фарингит, грипп, инфекции мочевыводящих путей, инфекции уха, гастроэнтерит, панникулит).
Со стороны нервной системы: часто — головокружение/вертиго.
Со стороны костно-мышечной системы: часто — боль в спине.
Со стороны пищеварительной системы: нечасто — гастроэзофагеальная рефлюксная болезнь.
Общие нарушения и реакции в месте введения: часто — общая слабость/повышенная утомляемость.
Реакции в месте введения наблюдались у 1,2% пациентов, получавших лечение препаратом Иларис® в клинических исследованиях.
Изменения лабораторных показателей
Общий анализ крови. Снижение количества лейкоцитов равное или менее 0,8 × нижняя граница нормы отмечалось у 6,7% пациентов, получавших лечение препаратом Иларис®, по сравнению с 1,4% пациентов, получавших триамцинолон. Снижение абсолютного количества нейтрофилов ниже 1 × 109/л отмечалось у 2% пациентов в сравнительных исследованиях по подагрическому артриту. Наблюдались также изолированные случаи снижения количества нейтрофилов ниже 0,5 × 109/л. В 12,7% случаев на фоне терапии канакинумабом наблюдалось легкое и преходящее снижение количества тромбоцитов (в пределах от 75 × 109/л) до нижней границы нормы (у препарата сравнения данное снижение наблюдалось в 7,7% случаев).
Мочевая кислота. На фоне терапии канакинумабом наблюдается преходящее повышение концентрации мочевой кислоты (примерно на 0,6 мг/дл). Препарат Иларис® не уменьшает способность противоподагрических средств снижать концентрацию мочевой кислоты при совместном применении.
АСТ/АЛТ. На фоне терапии канакинумабом возможно развитие слабо и умеренно выраженного повышения активности АСТ/АЛТ.
Триглицериды. На фоне терапии канакинумабом в среднем наблюдается повышение концентрации триглицеридов в плазме крови на 33,5 мг/дл, а в группе применения триамцинолона незначительное снижение на 3,1 мг/дл. Повышение концентрации триглицеридов более чем в 5 раз (по сравнению с ВГН) отмечалось в 2,4% случаев в группе применения канакинумаба и в 0,7% случаев в группе применения триамцинолона. Клиническая значимость данного наблюдения неизвестна.
CAPS
Инфекционные и паразитарные заболевания: очень часто — назофарингит; часто — инфекции мочевыводящих путей; инфекции верхних дыхательных путей, вирусная инфекция.
Со стороны нервной системы: очень часто — головокружение/вертиго1.
Со стороны кожи и подкожных тканей: очень часто — реакция в месте введения препарата2.
1 Симптомы вертиго в некоторых случаях рассматривались как серьезные НЯ, все эпизоды вертиго разрешались, несмотря на продолжение терапии препаратом.
2 НЯ было выявлено с помощью опросника для врача.
В ходе длительных открытых исследований с эскалацией дозы отмечалось повышение частоты инфекционных заболеваний (гастроэнтерит, инфекции дыхательных путей, в т.ч. верхних дыхательных путей), тошноты и головокружения в группе пациентов, получающих дозы препарата 600 мг или 8 мг/кг, по сравнению с группами, получающими другие дозы препарата.
Изменения лабораторных показателей
Общий анализ крови. При применении препарата в клинических исследованиях у пациентов с CAPS отмечалось повышение гемоглобина и снижение числа лейкоцитов, нейтрофилов и тромбоцитов. Однако данные изменения были, вероятно, связаны со снижением выраженности воспалительного процесса на фоне терапии препаратом и не имели клинической значимости.
Ферменты печени. В редких случаях у больных с CAPS, получавших лечение препаратом, наблюдалось повышение активности печеночных трансаминаз.
Билирубин. В ряде случаев на фоне терапии препаратом у пациентов с CAPS отмечалось бессимптомное незначительное увеличение содержания билирубина в сыворотке крови, не сопровождающееся повышением активности печеночных трансаминаз.
сЮИА
Инфекционные и паразитарные заболевания: очень часто — инфекции (в частности назофарингит, вирусные инфекции верхних дыхательных путей, пневмония, ринит, фарингит, тонзиллит, синусит, инфекции мочевыводящих путей, гастроэнтерит, вирусная инфекция).
Со стороны пищеварительной системы: очень часто — боль в верхней части живота.
Со стороны кожи и подкожных тканей: очень часто — реакция в месте введения препарата легкой степени тяжести1; часто — реакция в месте введения препарата средней степени тяжести1.
1 Не приводило к прекращению исследования.
Изменения лабораторных показателей
Общий анализ крови. Снижение числа лейкоцитов ≤0,8 × нижняя граница нормы отмечалось у 10,4% пациентов, получавших лечение препаратом Иларис®, по сравнению с 4% в группе плацебо.
Транзиторное снижение абсолютного количества нейтрофилов <1 × 109/л отмечалось у 6% пациентов, получавших лечение препаратом Иларис®, по сравнению с 2% в группе плацебо. Отмечался один случай снижения абсолютного количества нейтрофилов <0,5 × 109/л при лечении препаратом Иларис®.
Умеренное и транзиторное снижение в пределах от 75 × 109/л до нижней границы нормы тромбоцитов отмечалось у 6,3% пациентов, получавших препарат Иларис®, по сравнению с 2% в группе плацебо.
Ферменты печени. Трехкратное повышение АЛТ и/или ACT по сравнению с ВГН отмечалось у 4,1% пациентов, получавших лечение препаратом Иларис®, по сравнению с 2% в группе плацебо. При последующем обследовании отмечалась нормализация показателей.
Реакции гиперчувствительности
При применении препарата Иларис® в клинических исследованиях сообщалось о нежелательных явлениях, расцененных врачами как реакции гиперчувствительности. В большинстве случаев данные реакции были выражены в легкой степени. При применении препарата не наблюдалось развитие анафилактоидных или анафилактических реакций. Однако при назначении препарата Иларис® нельзя исключить риск развития тяжелых реакций гиперчувствительности, которые могут отмечаться при инъекционном введении препаратов белкового происхождения. У пациентов, получавших лечение препаратом Иларис® по поводу CAPS, сЮИА и подагрического артрита, выявлялись антитела к препарату в 1,5; 3 и 2% случаев соответственно. Взаимосвязь между образованием антител, клиническим ответом и развитием нежелательных явлений не выявлена.
Особые группы пациентов
Применение у больных в возрасте ≤18 лет (пациенты с CAPS). У детей от 2 до 17 лет не наблюдались клинически значимые отличия в безопасности и переносимости препарата Иларис®, включая общую частоту и тяжесть инфекций, в сравнении с общей популяцией больных. Наиболее часто у детей наблюдались инфекции верхних дыхательных путей.
Применение у больных ≥65 лет. Не были выявлены различия в профиле безопасности препарата у данной группы больных.
Пациент должен быть информирован о необходимости обращения к врачу в случае развития сильных побочных реакций, в т.ч. не указанных в инструкции.
Взаимодействие
Специальные исследования по взаимодействию препарата Иларис® с другими лекарственными препаратами не проводились. Поскольку экспрессия в печени изоферментов системы цитохрома Р450 может быть подавлена цитокинами, стимулирующими хроническое воспаление, такими как ИЛ-1β, то при назначении мощных ингибиторов цитокинов экспрессия в печени изоферментов системы цитохрома Р450 может быть нормализована. Это является клинически значимым для препаратов, метаболизирующихся с помощью изоферментов системы цитохрома Р450 и имеющих узкий терапевтический индекс, когда доза препарата подбирается индивидуально. При назначении препарата Иларис® пациентам, принимающим такие препараты, их дозу следует при необходимости корректировать (в зависимости от их клинического эффекта и концентрации действующего вещества в плазме крови).
В клинических исследованиях отмечено безопасное применение Иларис® с противоподагрическими средствами.
Препарат не рекомендуется назначать одновременно с ингибиторами ФНО и другими блокаторами ИЛ-1, поскольку их использование на фоне применения препарата Иларис® повышает риск развития тяжелых инфекций.
Данные о влиянии вакцинации живыми вакцинами, а также о возможной вторичной передаче инфекции пациентам, получающим лечение препаратом, отсутствуют. Вакцинировать больных, получающих лечение препаратом Иларис®, живыми вакцинами следует только в случае, когда польза от вакцинации превышает возможный риск. Рекомендуется, чтобы иммунизация была проведена (согласно календарю прививок) до начала терапии препаратом Иларис® (включая пневмококковую вакцину и инактивированную вакцину против гриппа). В случае необходимости вакцинацию живыми вакцинами проводят после начала терапии препаратом (по крайней мере через 3 мес после последней инъекции препарата и за 3 мес до следующей).
Данные проведенных клинических исследований у взрослых здоровых добровольцев показывают, что однократное введение препарата Иларис® в дозе 300 мг не влияет на начало выработки антител и персистенцию поствакцинального ответа при вакцинации против гриппа и менингококковой инфекции (гликозилированной белковой вакциной).
Передозировка
О подтвержденных случаях передозировки препарата не сообщалось.
Лечение: следует обеспечить наблюдение за больным с целью выявления возможных НЯ, а также при необходимости назначить соответствующую симптоматическую терапию.
Особые указания
Опыт применения препарата Иларис® у пациентов с CAPS без установленной мутации в NLRP3-гене ограничен.
Нейтропения
На фоне терапии ингибиторами ИЛ-1, включая препарат Иларис®, нейтропения (абсолютное число нейтрофилов (АЧН) ниже 1,5 × 109/л) в основном отмечалась у пациентов с другими заболеваниями, а не различными фенотипами CAPS. До начала лечения препаратом, через 1–2 мес после начала и периодически во время терапии препаратом необходимо проводить стандартный общеклинический анализ крови с целью выявления нейтропении. У пациентов с нейтропенией лечение препаратом Иларис® следует начинать только после нормализации числа нейтрофилов. При выявлении снижения АЧН на фоне терапии препаратом следует обеспечить надлежащий контроль состояния пациентов и при необходимости рассмотреть вопрос о прекращении лечения препаратом.
Злокачественные новообразования
Имеются сообщения о случаях развития злокачественных новообразований у пациентов, получающих терапию препаратом Иларис®, однако риск развития злокачественных новообразований на фоне терапии антителами, связывающими ИЛ-1, неизвестен.
Инфекционные заболевания
Применение препарата Иларис® может сопровождаться увеличением частоты серьезных инфекций, поэтому пациенты должны находиться под наблюдением врача с целью выявления симптомов инфекции во время и после терапии препаратом. Лечение препаратом Иларис® не следует начинать или продолжать у пациентов с активной инфекцией. При применении препарата Иларис® отмечались единичные случаи оппортунистических инфекций (в т.ч. аспергиллез, атипичные инфекционные заболевания микобактериальной этиологии, опоясывающий лишай). Невозможно исключить причинно-следственную связь между данными явлениями и применением препарата. При применении препарата приблизительно у 12% пациентов с различными фенотипами CAPS наблюдались положительные результаты туберкулиновой пробы без каких-либо признаков туберкулезной инфекции (латентной или активной). Нет данных об увеличении риска реактивации туберкулезной инфекции при лечении моноклональными антителами к ИЛ-1 (например препаратом Иларис®). Перед применением препарата Иларис® необходимо провести обследование всех пациентов с целью выявления активной или латентной туберкулезной инфекции, включая сбор анамнеза и проведение соответствующих скрининговых тестов, например туберкулиновой пробы, тестов IGRA (Interferon-Gamma-Release-Assay) или рентгенологического исследования грудной клетки. Во время лечения препаратом следует тщательно контролировать состояние пациентов с целью выявления туберкулезной инфекции. Рекомендовано информировать пациентов о необходимости обращаться к врачу при появлении следующих симптомов на фоне и после терапии препаратом Иларис®: длительно сохраняющийся кашель, потеря веса, субфебрильная температура. В случае конверсии туберкулинового теста из негативного в позитивный, особенно у пациентов высокого риска, необходимо провести альтернативные скрининговые тесты. При выявлении туберкулезной инфекции лечение препаратом Иларис® не следует начинать или продолжать.
Синдром активации макрофагов у пациентов с сЮИА
Синдром активации макрофагов — известное жизнеугрожающее состояние, которое может развиваться у пациентов с ревматическими заболеваниями, в частности у пациентов с сЮИА и требовать интенсивной терапии. Врачам следует внимательно относиться к симптомам инфекции или ухудшению течения сЮИА, известными как пусковой механизм для синдрома активации макрофагов. Данные клинических исследований указывают на то, что препарат Иларис®, по всей вероятности, не увеличивает риск развития синдрома активации макрофагов у пациентов с сЮИА, однако не позволяют сделать окончательные выводы.
Влияние на способность управлять транспортными средствами и работать с механизмами. Пациентам, у которых на фоне применения препарата Иларис® возникает вертиго, следует воздержаться от управления транспортными средствами или механизмами до полного исчезновения данного нежелательного явления.
Форма выпуска
Лиофилизат для приготовления раствора для подкожного введения, 150 мг. Во флаконе бесцветного стекла вместимостью 6 мл, укупоренном резиновой пробкой, обкатанной алюминиевым колпачком с пластиковой крышкой. По 1 фл. в пачке.
Лиофилизат для приготовления раствора для подкожного введения, 150 мг с растворителем — вода для инъекций.
1-й пластиковый поддон содержит: флакон с лиофилизатом — флакон бесцветного стекла (тип 1, Ph. Eur./USP), вместимостью 6 мл, укупоренный резиновой пробкой, обкатанный алюминиевым колпачком с пластиковой отщелкивающейся крышкой (flip-off устройство). Флакон с растворителем — во флаконе бесцветного стекла (тип 1, Ph. Eur./USP) вместимостью 6 мл, укупоренном резиновой пробкой, обкатанном алюминиевым колпачком с пластиковой отщелкивающейся крышкой (flip-off устройство), 5 мл воды для инъекций.
2-й пластиковый поддон содержит комплект устройств для инъекций: 1 стерильный шприц с системой Луер-Лок, 1 безопасную стерильную иглу для инъекций, 2 адаптера Луер-Лок к флакону, 4 спиртовые салфетки.
2 пластиковых поддона в пачке.
Производитель
Новартис Фарма Штейн АГ. Лихтштрассе 35, 4056, Базель, Швейцария.
Владелец регистрационного удостоверения: Новартис Фарма АГ. Швейцария.
Дополнительную информацию о препарате можно получить по адресу: 125315, Москва, Ленинградский пр-т, 72, корп. 3.
Тел.: (495) 967-12-70; факс: (495) 967-12-68.
Условия отпуска из аптек
По рецепту.
Условия хранения
В защищенном от света месте, при температуре 2–8 °C (не замораживать).
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Иларис — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер
ЛП-001414
Торговое наименование препарата
Иларис®
Международное непатентованное наименование
Канакинумаб
Лекарственная форма
лиофилизат для приготовления раствора для подкожного введения
Состав
1 флакон лиофилизата для приготовления раствора для подкожного введения содержит:
действующее вещество: канакинумаб 150 мг;
вспомогательные вещества: L-гистидин 2,801 мг, L-гистидина гидрохлорид моногидрат 1,673 мг, полисорбат-80 0,60 мг, сахароза 92,35 мг, кислота хлористоводородная 1 М до pH 6,5.
Если комплектность предполагает включение растворителя: 1 флакон растворителя содержит: вода для инъекций — 5 мл.
Описание
Лиофилизат: лиофилизированный порошок белого цвета.
Растворитель: прозрачная бесцветная жидкость.
Фармакотерапевтическая группа
Иммунодепрессивное средство, антитела моноклональные к интерлейкину-1β
Код АТХ
L04AC08
Фармакодинамика:
Канакинумаб — полностью человеческое моноклональное антитело IgGl/каппа изотипа к интерлейкину-1β(ИЛ-1β). Канакинумаб с высоким аффинитетом связывается с человеческим ИЛ-1β, нейтрализуя, таким образом, его биологическое действие, блокируя взаимодействие ИЛ-1β с его рецепторами, ИЛ-1β-индуцированную активацию генов и продукцию медиаторов воспаления, таких как ИЛ-6 и циклооксигеназа-2.
При лечении пациентов с системным ювенильным идиопатическим артритом (сЮИА) отмечалось быстрое и продолжительное улучшение суставных и системных проявлений заболевания: значительное уменьшение числа воспаленных суставов, быстрое исчезновение лихорадки и снижение реактантов острой фазы у большинства пациентов.
У 33% пациентов на 29 день терапии отмечалось улучшение течения заболевания на 100% по педиатрическим критериям Американской коллегии ревматологов в сравнении с отсутствием эффекта в группе плацебо. Применение канакинумаба позволяет существенно снизить или отменить применение глюкокортикостероидов при терапии сЮИА. Канакинумаб позволяет удлинить временной промежуток до обострения заболевания, улучшить качество жизни пациентов и выполнение ими ежедневных задач.
У пациентов с подагрическим артритом и различными фенотипами криопирин- ассоциированного периодического синдрома (cryopyrin-associated periodic syndrome, CAPS) включая семейный холодовой аутовоспалительный синдром/семейную холодовую крапивницу (Familial Cold Autoinflammatory Syndrome/ Familial Cold Urticaria, FCAS/FCU), Синдром Макл-Уэльса (Muckle-Wells Syndrome, MWS) и мультисистемное младенческое воспалительное заболевание/хронический младенческий неврологический кожно- артикулярный синдром (Neonatal onset multisystemic inflammatory disease/Chronic infantile neurological cutaneous and articular, NOMID/CINCA), канакинумаб снижает выраженность местных и системных воспалительных реакций, вызванных избыточной продукцией ИЛ-1β. При применении препарата у больных с острым приступом подагрического артрита снижается концентрация лабораторных маркеров воспаления (С реактивный белок (СРВ), сывороточного амилоида А (САА)), в течение короткого времени уходят признаки воспаления пораженного сустава (боль, отек, покраснение).
На фоне применения препарата Иларис® 150 мг подкожно у пациентов с частыми обострениями приступов подагры (как минимум, 3 приступа в течение года) было отмечено статистически значимое снижение интенсивности боли (по шкале ВАШ) по сравнению с группой контроля (триамциналон 40 мг). На фоне применения препарата Иларис® снижение интенсивности боли наблюдается начиная с 24 часов после введения препаратов и в течение 7 дней после введения.
При применении препарата Иларис® было продемонстрировано статистически значимое снижение риска возникновения нового приступа подагры на 62% в течение 12 недель терапии и на 56% в течение 24 недель терапии по сравнению с группой контроля.
Эффективность препарата Иларис® при подагрическом артрите была сопоставима у пациентов в возрасте >65 и <65 лет.
При применении канакинумаба у больных с различными фенотипами CAPS отмечается уменьшение уже в течение первых суток следующих проявлений заболевания: лихорадки, повышенной утомляемости, кожной сыпи, артралгии, миалгии, головной боли/мигрени, конъюнктивита, слабости, а также снижение (в течение нескольких дней) продукции маркеров воспаления, включая как СРВ и САА, и приводит к нормализации числа лейкоцитов и тромбоцитов (в случае их повышения).
При длительном применении канакинумаба (в течение 48 недель) у пациентов с CAPS полный ответ на терапию, определяемый как сочетание уменьшения (до минимальной степени или полного исчезновения) симптомов аутовоспалительного заболевания и поражений кожи (сыпь по типу крапивницы), и снижения показателей СРВ и САА <10 мг/л, наблюдался в 97% случаев в течение 7-ми дней после начала терапии. При применении канакинумаба у больных не отмечалось развития рецидивов заболевания (в группе больных, получавших лечение плацебо, рецидивы наблюдались в 81% случаев).
Фармакокинетика:
Абсорбция
У взрослых пациентов с различными фенотипами CAPS после однократного подкожного введения 150 мг препарата время достижения максимальной концентрации (Сmах) канакинумаба составляет около 7-ми дней. Средний конечный период полувыведения составляет 26 дней. При подкожном введении канакинумаба абсолютная биодоступность — 66% (популяционный фармакокинетический анализ у пациентов с CAPS, включая детей в возрасте от 2 лет).
Параметры фармакокинетики (площадь под кривой «концентрация — время» (AUC) и максимальная концентрация (Сmах) повышаются пропорционально дозе в диапазоне доз от 0,30 до 10,0 мг/кг при внутривенной инфузии или при подкожном введении (в дозе от 150 до 600 мг).
Распределение
Канакинумаб связывается с сывороточным ИЛ-1β. Объем распределения (Vss) изменяется в зависимости от массы тела.
У пациентов с CAPS Vss составляет 6,2 л при массе тела 70 кг, у пациентов с сЮИА — 3,2 л при массе тела 33 кг и у пациентов с подагрическим артритом — 7,9 л при массе тела 93 кг. При подкожном введении препарата в течение 6 месяцев в дозе 150 мг каждые 8 недель, в дозе 4 мг/кг каждые 4 недели, 150 мг каждые 12 недель коэффициент кумуляции канакинумаба составляет 1,3,1,6 и 1,1, соответственно.
Выведение
Клиренс (С1) изменяется в зависимости от массы тела. Для пациентов с CAPS этот показатель составляет 0,17 л/сут при массе тела 70 кг, у пациента с сЮИА 0,11 л/сут при массе тела 33 кг, у пациента с подагрическим артритом 0,23 л/сут при массе тела 93 кг. После учета весовых различий существенной разницы в фармакокинетических свойствах канакинумаба у пациентов с подагрическим артритом, различными фенотипами CAPS и сЮИА не было выявлено.
При повторном применении препарата не наблюдается увеличения О или изменений каких-либо других, зависимых от времени фармакокинетических параметров канакинумаба. При назначении препарата с учетом массы тела пол и возраст пациентов не оказывают влияния на фармакокинетику препарата.
Фармакокинетика в особых клинических случаях
Пациенты в возрасте < 18 лет
У пациентов в возрасте от 4 лет и старше после подкожного однократного введения препарата в дозе 150 мг или 2 мг/кг время достижения Сmах канакинумаба составляет 2-7 дней. Конечный период полувыведения канакинумаба у данной категории больных сходен с таковым у взрослых и составляет от 22,9 до 25,7 дней. Результаты популяционного анализа фармакокинетики канакинумаба у детей в возрасте от 2 до 4 лет сходны с таковыми у пациентов 4 лет и старше. Фармакокинетические характеристики у пациентов с CAPS и сЮИА схожи. При подкожном введении канакинумаба в дозе 4мг/кг каждые 4 недели у пациентов с сЮИА значения AUC и Сmах были аналогичны в возрастной группе от 2 до младше 20 лет.
Пациенты в возрасте > 65 лет
Не было выявлено разницы в фармакокинетических параметрах, основанных на С1 и Vss, у пациентов старшей возрастной группы и пациентов в возрасте менее 65 лет.
Показания:
Острый подагрический артрит
Лечение частых острых приступов подагрического артрита и предупреждение развития новых приступов при неэффективности, непереносимости или при наличии противопоказаний к применению нестероидных противовоспалительных препаратов и/или колхицина и при невозможности проведения терапии повторными курсами глюкокортикостероидов.
Криопирин-ассоциированный периодический синдром (CAPS) у взрослых и детей в возрасте >2 лег и старше, включая:
— семейный холодовой аутовоспалительный синдром (FCAS)/ Семейная холодовая крапивница (FCU);
— синдром Макл-Уэльса (MWS);
— младенческое мультисистемное воспалительное заболевание (NOMID) / хронический младенческий неврологический кожно-артикулярный синдром (CINCA).
Активная фаза системного ювенильного идиопатического артрита (сЮИА) у детей в возрасте >2 лет и старше.
Противопоказания:
— Повышенная чувствительность к активному веществу или другим компонентам препарата в анамнезе;
— острые инфекционные заболевания;
— беременность и период грудного вскармливания;
— дети младше 2 лет (безопасность и эффективность для указанной категории пациентов изучены не достаточно).
С осторожностью:
Препарат следует с осторожностью применять у пожилых пациентов; при наличии у больных в анамнезе рецидивирующих инфекций или любых состояний, предрасполагающих к развитию инфекции.
Беременность и лактация:
Имеются ограниченные данные по применению препарата Иларис® у пациенток репродуктивного возраста и у беременных пациенток. В исследованиях на животных у препарата не было выявлено какой-либо репродуктивной токсичности. Женщинам следует применять надежные методы контрацепции во время терапии препаратом Иларис® и в течение 3 месяцев после применения последней дозы препарата.
Неизвестно, проникает ли канакинумаб в грудное молоко. При необходимости применения препарата грудное вскармливание следует прекратить.
Способ применения и дозы:
Препарат (лиофилизат) растворяют в 1 мл воды для инъекций (см. раздел «Указания по применению»).
Инъекции проводят подкожно в те участки тела, где есть подкожно-жировая клетчатка: в живот, переднюю поверхность бедер, заднебоковую поверхность плеч.
Подагрический артрит
Рекомендованная доза препарата у взрослых 150 мг, препарат вводят во время приступа подагрического артрита, одномоментно подкожно. Для достижения максимальной эффективности препарат необходимо вводить как можно раньше после начала приступа подагрического артрита.
Пациентам, которые не ответили на первую инъекцию препарата Иларис®, повторно вводить препарат не следует. Пациентам, ответившим на лечение, повторное введение препарата Иларис® возможно, как минимум, через 12 недель после предыдущей инъекции.
Применять препарат Иларис® для терапии приступов подагрического артрита следует по мере необходимости. Оптимизирование контроля гиперурекимии следует проводить с помощью соответствующих противоподагрических препаратов.
Терапия препаратом может быть инициирована и проводится только врачом, имеющим опыт диагностики и лечения пациентов с подагрическим артритом.
Криопирин-ассоциированный периодический синдром
Рекомендованные стартовые дозы препарата Иларис® для пациентов с криопирин-ассоциированным периодическим синдромом:
Взрослым и детям > 4 лет в зависимости от массы тела назначают:
— пациентам с массой тела >40 кг — 150 мг;
— пациентам с массой тела >15 кг и <40кг — 2мг/кг;
-пациентам с массой тела >7,5 кг и <15кг — 4мг/кг.
Детям в возрасте от 2 лет и <4 лет с массой тела >7,5 кг препарат применяют из расчета 4 мг/кг.
Препарат вводят подкожно (п/к) 1 инъекция с интервалом 8 недель.
Если у пациентов при стартовой дозе 150 мг или 2 мг/кг не получен удовлетворительный клинический ответ, а именно процесс разрешения сыпи и других симптомов воспаления не наблюдается в течение 7-ми дней после первой инъекции препарата Иларис®, возможно проведение второй инъекции препарата в дозе 150 мг (при массе тела >40 кг) и 2 мг/кг (при массе тела >15 кг и <40 кг).
При достижении в последующем полного клинического ответа данным пациентам рекомендуется поддерживающая терапия препаратом Иларис® в дозе 300 мг 1 инъекция с интервалом 8 недель (при массе тела >40 кг) и 4 мг/кг 1 инъекция с интервалом 8 недель (при массе тела >15 кг и <40 кг).
Если удовлетворительный клинический эффект не наблюдается в течение 7 дней после повышения дозы, возможно проведение третьей инъекции препарата Иларис® в дозе 300 мг 1 инъекция с интервалом 8 недель (при массе тела > 40 кг) или 4 мг/кг (при массе тела >15 кг и <40 кг). При достижении в последующем полного клинического ответа данным пациентам рекомендуется поддерживающая терапия препаратом Иларис® в дозе 600 мг 1 инъекция с интервалом 8 недель (при массе тела > 40 кг) или 8 мг/кг (при массе тела >15 кг и <40 кг) 1 инъекция с интервалом 8 недель.
Если у пациентов при стартовой дозе 4 мг/кг удовлетворительный клинический эффект не наблюдается в течение 7 дней после первой инъекции, возможно проведение второй инъекции препарата Иларис® в дозе 4 мг/кг. При достижении в последующем полного клинического ответа данным больным рекомендуется поддерживающая терапия препаратом в дозе 8 мг/кг 1 инъекция с интервалом 8 недель.
Клинический опыт применения препарата с интервалом дозирования менее 4-х недель или в дозе более 600 мг или 8 мг/кг ограничен.
Повышение дозы препарата Иларис® требовалась наиболее часто для пациентов сNOMID/CINCA по сравнению с FCAS или MWS.
Терапия препаратом может быть инициирована и проводится только врачом, имеющим опыт диагностики и лечения пациентов с CAPS.
сЮИА
При сЮИА рекомендованная доза у пациентов с массой тела >7,5 кг составляет 4 мг/кг (с увеличением до 300 мг) каяцые 4 недели в виде подкожной инъекции.
После обучения технике подкожных инъекций, пациенты или лица, за ними ухаживающие, могут самостоятельно вводить препарат под надлежащим контролем (если врач сочтет это необходимым). Пациенты или лица, ухаживающие за ними, должны быть проинструктированы по технике приготовления раствора, шприцам и иглам, пригодным для проведения инъекции.
Применение у разных групп пациентов
Пациенты в возрасте > 65 лет
Не требуется коррекции дозы препарата у пациентов в возрасте > 65 лет.
Пациенты в возрасте < 18 лет
Подагрический артрит
Нет данных по применению препарата Иларис® для лечения подагрического артрита у детей и подростков < 18 лет.
Криопирин-ассоциированный периодический синдром с ЮИА
Опыт применения канакинумаба у детей младше 2 лет ограничен.
Пациенты с нарушением функции почек
Не требуется коррекции дозы препарата у пациентов с нарушениями функции почек (опыт клинического применения у таких пациентов ограничен).
Пациенты с нарушением функции печени
У пациентов с нарушениями функции печени эффективность и безопасность применения препарата не изучались. Так как препарат Иларис® — человеческий IgG, предполагается, что печеночная недостаточность не влияет на фармакокинетику данного препарата.
Побочные эффекты:
При применении препарата Иларис® в ходе клинических исследований отмечалось повышение частоты инфекционных заболеваний, преимущественно инфекций верхних дыхательных путей. Течение инфекционных заболеваний чаще всего было легким или средней степени тяжести, однако отмечались и случаи тяжелого течения инфекционных заболеваний. Наблюдались изолированные случаи развития редких или оппортунистических инфекций на фоне приема препарата Иларис®, однако, связь данных заболеваний с приемом препарата не известна.
Для оценки частоты нежелательных явлений (НЯ), выявленных в плацебо-контролируемых клинических исследованиях (при применении препарата для лечения криопирин-ассоциированного периодического синдрома в дозе 150 мг при массе тела >40 кг и 2 мг/кг при массе тела >15 кг и <40 кг и при лечении сЮИА у пациентов в возрасте от 2 до 20 лет) и для лечения острых приступов подагрического артрита в дозах от 10 мг до 300 мг в активно контролируемых иссследованиях, использованы следующие критерии (согласно классификации ВОЗ): очень частые (>1/10 назначений); частые (>1/100, <1/10); нечастые (>1/1000, <1/100); редкие (>1/10000, <1/1000); очень редкие (< 1/10000), частота неизвестна (недостаточно данных для оценки частоты развития). **
Подагрический артрит
Инфекционные и паразитарные заболевания: очень часто — инфекции (в частности, назофарингит, синусит, вирусные инфекции верхних дыхательных путей, бронхит, пневмония, фарингит, грипп, инфекции мочевыводящих путей, инфекции уха, гастроэнтерит, панникулит).
Нарушения со стороны нервной системы: часто — головокружение/вертиго.
Нарушения со стороны костно-мышечной системы: часто — боль в спине.
Нарушения со стороны пищеварительной системы: нечасто — гастроэзофагеальная рефлюксная болезнь.
Общие нарушения и реакции в месте введения: часто — общая слабость/повышенная утомляемость.
Реакции в месте введения препарата наблюдались у 1,2% пациентов, получавших лечение препаратом Иларис® в клинических исследованиях.
Изменения лабораторных показателей
Общий анализ крови
Снижение количества лейкоцитов <0,8х109/л нижней границы нормы отмечалось у 6,7% пациентов получавших лечение препаратом Иларис® по сравнению с 1,4% пациентов, получавших триамцинолон. Снижение абсолютного количества нейтрофилов ниже 1 х 109 /л отмечалось у 2% пациентов в сравнительных исследованиях по подагрическому артриту. Наблюдались также изолированные случаи снижения количества нейтрофилов ниже 0,5 х 109 /л.
В 12,7% случаев на фоне терапии канакинумабом наблюдалось легкое и преходящее снижение количества тромбоцитов (в пределах от 75 х109/л) до нижней границы нормы (у препарата сравнения данное снижение наблюдалось в 7,7% случаев).
Мочевая кислота
На фоне терапии канакинумабом наблюдается преходящее повышение концентрации мочевой кислоты (примерно на 0,6 мг/дл). Препарат Иларис® не уменьшает способность противоподагрических средств снижать концентрацию мочевой кислоты при совместном применении.
Аспартатаминотрасфераза/аланинаминотрансфераза (АСТ/АЛТ)
На фоне терапии канакинумабом возможно развитие слабо и умеренно выраженного повышения активности АСТ/АЛТ.
Триглицериды
На фоне терапии канакинумабом, в среднем, наблюдается повышение концентрации триглицеридов в плазме крови на 33,5 мг/дл, а в группе применения триамцинолона — незначительное снижение на 3,1 мг/дл. Повышение концентрации триглицеридов более чем в 5 раз (по сравнению с верхней границей нормы) отмечалось в 2,4% случаев в группе применения канакинумаба и в 0,7% случаев в группе применения триамцинолона. Клиническая значимость данного наблюдения неизвестна.
Криопирин-ассоциированный периодический синдром
Инфекционные и паразитарные заболевания: очень часто — назофарингит; часто — инфекции мочевыводящих путей; инфекции верхних дыхательных путей, вирусная инфекция.
Нарушения со стороны нервной системы: очень часто — головокружение/вертиго*.
Нарушения со стороны кожи и подкожных тканей: очень часто — реакция в месте введения препарата**.
*Симптомы вертиго, в некоторых случаях, рассматривались как серьезные НЯ, все эпизоды вертиго разрешались, несмотря на продолжение терапии препаратом.
** Нежелательное явление (НЯ) было выявлено с помощью опросника для врача.
В ходе длительных, открытых исследований с эскалацией дозы отмечалось повышение частоты инфекционных заболеваний (гастроэнтерит, инфекции дыхательных путей и инфекции верхних дыхательных путей), тошноты и головокружения в группе пациентов, получающих дозы препарата 600 мг или 8 мг/кг, по сравнению с группами, получающими другие дозы препарата.
Изменения лабораторных показателей
Общий анализ крови
При применении препарата в клинических исследованиях у пациентов с CAPS отмечалось повышение гемоглобина и снижение числа лейкоцитов, нейтрофилов и тромбоцитов. Однако данные изменения были, вероятно, связаны со снижением выраженности воспалительного процесса на фоне терапии препаратом и не имели клинической значимости.
Ферменты печени
В редких случаях у больных с CAPS, получавших лечение препаратом, наблюдалось повышение активности «печеночных» трансаминаз.
Билирубин
В ряде случаев на фоне терапии препаратом у пациентов с CAPS отмечалось бессимптомное незначительное увеличение содержания билирубина в сыворотке крови, не сопровождающееся повышением активности «печеночных» трансаминаз.
сЮИА
Инфекционные и паразитарные заболевания: очень часто — инфекции (в частности, назофарингит, вирусные инфекции верхних дыхательных путей, пневмония, ринит, фарингит, тонзиллит, синусит, инфекции мочевыводящих путей, гастроэнтерит, вирусная инфекция).
Нарушения со стороны пищеварительной системы: очень часто — боль в верхней части живота.
Нарушения со стороны кожи и подкожных тканей: очень часто — реакция в месте введения препарата легкой степени тяжести*, часто — реакция в месте введения препарата средней степени тяжести*.
* — не приводило к прекращению исследования.
Изменения лабораторных показателей
Общий анализ крови
Снижение числа лейкоцитов <0,8х109/л нижней границы нормы отмечалось у 10,4% пациентов, получавших лечение препаратом Иларис®, по сравнеиию с 4,0% в группе плацебо.
Транзиторное снижение абсолютного количества нейтрофилов <1×109/л отмечалось у 6,0% пациентов, получавших лечение препаратом Иларис®, по сравнению с 2,0% в группе плацебо. Отмечался одни случай снижения абсолютного количества нейтрофилов <0,5х109/л при лечении препаратом Иларис®.
Умеренное и транзиторное снижение в пределах от 75 х109/л до нижней границы нормы тромбоцитов отмечалось у 6,3% пациентов, получавших препарат Иларис®, по сравнению с 2,0% в группе плацебо.
Ферменты печени
Трехкратное повышение АЛТ и /или ACT по сравнению с верхней границей нормы отмечалось у 4,1 % пациентов, получавших лечение препаратом Иларис®, по сравнению с 2,0% в группе плацебо. При последующем обследовании отмечалась нормализация показателей.
Реакции гиперчувствительности
При применении препарата Иларис® в клинических исследованиях сообщалось о нежелательных явлениях, расцененных врачами как реакции гиперчувствительности. В большинстве случаев данные реакции были выражены в легкой степени. При применении препарата не наблюдалось развития анафилактоидных или анафилактических реакций. Однако, при назначении препарата Иларис® нельзя исключить риск развития тяжелых реакций гиперчувствительности, которые могут отмечаться при инъекционном введении препаратов белкового происхождения. У пациентов, получавших лечение препаратам Иларис® по поводу подагрического артрита, CAPS и сЮИА выявлялись антитела к препарату в 1,5%, 3% и 2% случаев, соответственно. Взаимосвязи между образованием антител, клиническим ответом и развитием нежелательных явлений не выявлено.
Применение у больных в возрасте < 18 лет (пациенты с CAPS)
У детей в возрасте от 2 до 17 лет не наблюдалось клинически значимых отличий в безопасности и переносимости препарата Иларис®, включая общую частоту и тяжесть инфекций, в сравнении с общей популяцией больных. Наиболее часто у детей наблюдались инфекции верхних дыхательных путей.
Применение у больных > 65 лет
Не было выявлено различий в профиле безопасности препарата у данной группы больных.
Пациент должен быть информирован необходимости обращения к врачу в случае развития сильных побочных реакций, в том числе неуказанных в инструкции.
Передозировка:
О подтвержденных случаях передозировки препаратом не сообщалось. При передозировке препаратом Иларис® следует обеспечить наблюдение за больным с целью выявления возможных нежелательных явлений, а также при необходимости назначить соответствующую симптоматическую терапию.
Взаимодействие:
Специальных исследований по взаимодействию препарата Иларис® с другими лекарственными препаратами не проводилось. Поскольку экспрессия в печени изоферментов системы цитохрома Р450 может быть подавлена цитокинами, стимулирующими хроническое воспаление, такими как ИЛ-1β, то при назначении мощных ингибиторов цитокинов, экспрессия в печени изоферментов системы цитохрома Р450 может быть нормализована. Это является клинически значимым для препаратов, метаболизирующихся с помощью изоферментов системы цитохрома Р450 и имеющих узкий терапевтический индекс, когда доза препарата подбирается индивидуально. При назначении препарата Иларис® пациентам, принимающим такие препараты, их дозу следует при необходимости корректировать (в зависимости от их клинического эффекта и концентрации действующего вещества в плазме крови).
В клинических исследованиях отмечено безопасное применение Иларис с противоподагрическими средствами. Препарат не рекомендуется назначать одновременно с ингибиторами ФНО и другими блокаторами ИЛ-1, поскольку их использование на фоне применения препарата Иларис® повышает риск развития тяжелых инфекций.
Данные о влиянии вакцинации живыми вакцинами, а также о возможной вторичной передаче инфекции, пациентам, получающим лечение препаратом, отсутствуют. Вакцинировать больных, получающих лечение препаратом Иларис®, живыми вакцинами следует только в случае, когда польза от вакцинации превышает возможный риск. Рекомендуется, чтобы иммунизация была проведена (согласно календарю прививок) до начала терапии препаратом Иларис® (включая пневмококковую вакцину и инактивированную вакцину против гриппа).
В случае необходимости вакцинацию живыми вакцинами проводят после начала терапии препаратом (по крайней мере, через 3 месяца после последней инъекции препарата и за 3 месяца до следующей). Данные проведенных клинических исследований на взрослых здоровых добровольцах показывают, что однократное введение Илариса в дозе 300 мг не влияет на начало выработки антител и персистенцию поствакцинального ответа при вакцинации против гриппа и менингококковой инфекции (гликозилированной белковой вакциной).
Особые указания:
Опыт применения препарата Иларис® у пациентов с CAPS без установленной мутации в NLRP3 гене ограничен.
Нейтропения
На фоне терапии ингибиторами ИЛ-1, включая препарат Иларис®, нейтропения (абсолютное число нейтрофилов (АЧН) ниже 1.5х109) в основном отмечалась у пациентов с другими заболеваниями, а не у пациентов с различными фенотипами CAPS. До начала лечения препаратом, через 1-2 месяца после начала и периодически во время терапии препаратом необходимо проводить стандартные общеклинический анализ крови с целью выявления нейтропении. У пациентов с нейтропенией лечение препаратом Иларис® следует начинать только после нормализации числа нейтрофилов. При выявлении снижения АЧН на фоне терапии препаратом следует обеспечить надлежащий контроль состояния пациентов и при необходимости рассмотреть вопрос о прекращении лечения препаратом.
Злокачественные новообразования
Имеются сообщения о случаях развития злокачественных новообразований у пациентов, получающих терапию препаратом Иларис®, однако риск развития злокачественных новообразований на фоне терапии антителами, связывающими ИЛ-1 неизвестен.
Инфекционные заболевания
Применение препарата Иларис® может сопровождаться увеличением частоты серьезных инфекций, поэтому пациенты должны находиться под наблюдением врача, с целью выявления симптомов инфекции во время и после терапии препаратом.
Лечение препаратом Иларис® не следует начинать или продолжать у пациентов с активной инфекцией. При применении препарата Иларис® отмечались единичные случаи оппортунистических инфекций (в т.ч. аспергиллез, атипичные инфекционные заболевания микобактериальной этиологии, опоясывающий лишай). Невозможно исключить причинно-следственную связь между данными явлениями и применением препарата.
При применении препарата приблизительно у 12% пациентов с различными фенотипами CAPS наблюдались положительные результаты туберкулиновой пробы без каких- либо признаков туберкулезной инфекции (латентной или активной). Нет данных об увеличении риска реактивации туберкулезной инфекции при лечении моноклональными антителами к ИЛ-1 (например, препарата Иларис®). Перед применением препаратом Иларис® необходимо провести обследование всех пациентов с целью выявления активной или латентной туберкулезной инфекции (включая сбор анамнеза и проведение соответствующих скрининговых тестов, например туберкулиновой пробы, тестов IGRA (Interferon-Gamma-Release-Assay) или рентгенологического исследования грудной клетки. Во время лечения препаратом следует тщательно контролировать состояние пациентов с целью выявления туберкулезной инфекции. Рекомендовано информировать пациентов о необходимости обращаться к врачу при появлении следующих симптомов на фоне и после терапии препаратом Иларис® (длительно сохраняющийся кашель, потеря веса, субфебрильная температура). В случае конверсии туберкулинового теста из негативного в позитивный, особенно у пациентов высокого риска, необходимо провести альтернативные скрининговые тесты. При выявлении туберкулезной инфекции лечение препаратом Иларис® не следует начинать или продолжать.
Синдром активации макрофагов у пациентов с сЮИА
Синдром активации макрофагов — известное жизнеугрожающее состояние, которое может развиваться у пациентов с ревматическими заболеваниями, в частности у пациентов с сЮИА и требовать интенсивной терапии. Врачам следует внимательно относиться к симптомам инфекции или ухудшению течения сЮИА, известными как пусковой механизм для синдрома активации макрофагов. Данные клинических исследований указывают на то, что препарат Иларис® по всей вероятности не увеличивает риск развития синдрома активации макрофагов у пациентов с сЮИА, однако, не позволяет сделать окончательных выводов.
Влияние на способность управлять транспортными средствами и механизмами:
Пациентам, у которых на фоне применения препарата Иларис® возникает вертиго, следует воздержаться от управления транспортными средствами или механизмами до полного исчезновения данного нежелательного явления.
Форма выпуска/дозировка:
Лиофилизат для приготовления раствора для подкожного введения, 150 мг.
Упаковка:
I. Лиофилизат для приготовления раствора для подкожного введения
Лиофилизат для приготовления раствора для подкожного введения 150 мг во флакон бесцветного стекла вместимостью 6 мл, укупоренный резиновой пробкой, обкатанный алюминиевым колпачком с пластиковой крышкой. По одному флакону вместе с инструкцией по применению помещают в пачку.
ИЛИ
II. Лиофилизат для приготовления раствора для подкожного введения с растворителем — вода для инъекций
1. Первый пластиковый поддон содержит:
Флакон с лиофилизатом. По 150 мг действующего вещества во флакон бесцветного стекла (тип 1, Евр. Ф./Ф. США) вместимостью 6 мл, укупоренный резиновой пробкой, обкатанный алюминиевым колпачком с пластиковой отщелкивающейся крышкой (“flip-off’ устройство).
Флакон с растворителем. По 5 мл воды для инъекций во флакон бесцветного стекла (тип 1, Евр. Ф./Ф. США) вместимостью 6 мл, укупоренный резиновой пробкой, обкатанный алюминиевым колпачком с пластиковой отщелкивающейся крышкой (“flip-off’ устройство).
2. Второй пластиковый поддон содержит комплект устройств для инъекций: один стерильный шприц с системой «Луер-Лок», одну безопасную стерильную иглу для инъекций, два адаптера «Луер-Лок» к флакону, четыре спиртовые салфетки.
Два пластиковых поддона вместе с инструкцией по применению помещают в пачку.
Условия хранения:
Хранить при температуре от 2 до 8 °С в защищенном от света месте.
Не замораживать.
Препарат следует хранить в недоступном для детей месте.
Срок годности:
Лиофилизат-3 года.
Растворитель — 5 лет.
Дата истечения срока годности комплекта определяется по более ранней дате истечения срока годности компонента, входящего в комплект.
Препарат не применять по истечении срока годности.
Условия отпуска
По рецепту
Производитель
Новартис Фарма Штейн АГ, Schaffhauserstrasse, 4332 Stein, Switzerland, Швейцария
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
Новартис Фарма АГ
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Rec.INN
зарегистрированное ВОЗ
Входит в состав препаратов:
список
Фармакологическое действие
Иммунодепрессант, моноклональные антитела к интерлейкину-1β.
Канакинумаб — полностью человеческое моноклональное антитело IgG1/каппа изотипа к интерлейкину-1β (ИЛ-1β). Канакинумаб с высоким аффинитетом связывается с человеческим ИЛ-1β, таким образом предотвращает взаимодействие ИЛ-1β с его рецепторами, ИЛ-1β-индуцированную активацию генов и продукцию медиаторов воспаления, таких как ИЛ-6 и ЦОГ-2.
У пациентов с подагрическим артритом и различными фенотипами криопирин-ассоциированного периодического синдрома (cryopyrin-associated periodic syndrome, CAPS), включая семейный холодовой аутовоспалительный синдром/семейную холодовую крапивницу (Familial Cold Autoinflammatory Syndrome/Familial Cold Urticaria, FCAS/FCU), Синдром Макла-Уэллса (Muckle-Wells Syndrome, MWS) и мультисистемное младенческое воспалительное заболевание/хронический младенческий неврологический кожно-артикулярный синдром (Neonatal onset multisystemic inflammatory disease/Chronic infantile neurological cutaneous and articular, NOMID/CINCA), канакинумаб снижает выраженность местных и системных воспалительных реакций, вызванных избыточной продукцией ИЛ-1β. При применении у больных с острым приступом подагрического артрита снижается концентрация лабораторных маркеров воспаления (C-реактивный белок (СРБ), сывороточного амилоида А (САА)), в течение короткого времени уходят признаки воспаления пораженного сустава (боль, отек, покраснение).
При применении канакинумаба у больных с различными фенотипами CAPS отмечается уменьшение уже в течение первых суток следующих проявлений заболевания: лихорадки, повышенной утомляемости, кожной сыпи, артралгии, миалгии, головной боли/мигрени, конъюнктивита, слабости, а также снижение (в течение нескольких дней) продукции маркеров воспаления, включая как СРБ и САА, и приводит к нормализации числа лейкоцитов и тромбоцитов (в случае их повышения).
Фармакокинетика
У взрослых пациентов с различными фенотипами CAPS после однократного п/к введения канакинумаба в дозе 150 мг Tmax канакинумаба составляет около 7 дней. При п/к введении канакинумаба абсолютная биодоступность — 63% (популяционный фармакокинетический анализ).
Сmax в плазме крови и AUC повышаются пропорционально дозе в диапазоне доз от 0.30 до 10.0 мг/кг при в/в инфузии или при п/к введении в дозе от 150 мг до 300 мг.
Не было выявлено существенной разницы в фармакокинетических свойствах канакинумаба у пациентов с подагрическим артритом и различными фенотипами CAPS.
Vss канакинумаба изменяется в зависимости от массы тела. Для типичных пациентов, страдающих подагрическим артритом, с массой тела 93 кг Vss равен 7.92 л. Для пациентов с различными фенотипами CAPS Vss составляет 6.01 л у типичного пациента с массой тела 70 кг.
При п/к введении препарата в течение 6 месяцев (дозе 150 мг) каждые 8 недель коэффициент кумуляции канакинумаба составляет 1.3, каждые 12 недель — 1.1.
Средний конечный T1/2 составляет 26 дней. Клиренс канакинумаба изменяется в зависимости от массы тела. Для типичных пациентов, страдающих подагрическим артритом, с массой тела 93 кг клиренс равен 0.23 л/сут. Для пациентов с различными фенотипами CAPS клиренс составляет 0.17 л/сут у типичного пациента с массой тела 70 кг.
Показания активного вещества
КАНАКИНУМАБ
Острый подагрический артрит: лечение острых приступов подагрического артрита и предупреждение развития новых приступов при неэффективности, непереносимости или при наличии противопоказаний к применению НПВС и/или колхицина и при невозможности проведения терапии повторными курсами ГКС.
Криопирин-ассоциированный периодический синдром (CAPS) у взрослых и детей в возрасте 4 лет и старше с массой тела >15 кг, включая: семейный холодовой аутовоспалительный синдром (FCAS)/ семейная холодовая крапивница (FCU); синдром Макла-Уэллса (MWS); младенческое мультисистемное воспалительное заболевание (NOMID)/хронический младенческий неврологический кожно-артикулярный синдром (CINCA).
Режим дозирования
Вводят п/к.
Дозу устанавливают индивидуально, в зависимости от показаний, возраста, массы тела. Интервал между введениями в зависимости от показаний составляет 8-12 недель.
Побочное действие
Инфекционные и паразитарные заболевания: очень часто — инфекции, в частности, назофарингиты, синуситы (вирусные), инфекции верхних дыхательных путей, бронхиты, грипп, инфекции мочевыводящих путей, гастроэнтериты, панникулиты, пневмонии, фарингиты, инфекции уха.
Со стороны нервной системы: часто — головокружение/вертиго.
Со стороны костно-мышечной системы: часто — боль в спине.
Со стороны системы кроветворения: часто — тромбоцитопения, лейкопения; нечасто — нейтропения.
Со стороны обмена веществ: часто — дислипидемия; возможно преходящее повышение концентрации мочевой кислоты.
Со стороны органа слуха и лабиринтные нарушения: часто — головокружение.
Со стороны пищеварительной системы: часто — рвота; нечасто — гастроэзофагеальная рефлюксная болезнь; В ряде случаев на фоне терапии препаратом у пациентов с CAPS отмечалось бессимптомное незначительное увеличение содержания билирубина в сыворотке крови, не сопровождающееся повышением активности печеночных трансаминаз.
Со стороны печени и желчевыводящих путей: часто — повышение уровня билирубина, повышение активности ACT.
Аллергические реакции: не наблюдалось развития анафилактоидных или анафилактических реакций, однако нельзя исключить риск развития тяжелых реакций гиперчувствительности, которые могут отмечаться при инъекционном введении препаратов белкового происхождения.
Иммунологические реакции: 1% — у пациентов, получавших канакинумаб по поводу подагрического артрита, выявлялись антитела к канакинумабу; у пациентов с CAPS данные антитела не определялись.
Общие реакции: нечасто — общая слабость.
Местные реакции: часто — реакция в месте введения.
Противопоказания к применению
Острые инфекционные заболевания; беременность; период лактации (грудного вскармливания); дети младше 4 лет и массой тела менее 15 кг (безопасность и эффективность для указанной категории пациентов изучены не достаточно); повышенная чувствительность к канакинумабу.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период лактации (грудного вскармливания).
Особые указания
Опыт применения канакинумаба у пациентов без установленной мутации в NLRP3 гене ограничен.
С осторожностью следует применять канакинумаб у пациентов пожилого возраста; при указаниях в анамнезе на рецидивирующие инфекции или любые состояния, предрасполагающие к развитию инфекции.
Применение канакинумаба может сопровождаться увеличением частоты серьезных инфекций, поэтому пациенты должны находиться под наблюдением врача, с целью выявления симптомов инфекции во время и после терапии препаратом. При развитии тяжелых инфекций лечение канакинумабом не следует начинать или продолжать.
Развитие тяжелых и системных инфекционных заболеваний на фоне терапии препаратом сопровождалось клиническими симптомами (лихорадка) и повышением продукции маркеров воспаления (содержания СРБ в сыворотке крови). Однако, поскольку нельзя исключить возможность развития инфекционных процессов без данных проявлений, при применении препарата следует обеспечить надлежащий контроль за состоянием пациентов.
До начала лечения, через 1-2 месяца после начала и периодически во время терапии необходимо проводить стандартные клинический анализ крови с целью выявления нейтропении. У пациентов с нейтропенией лечение канакинумабом следует начинать только после нормализации числа нейтрофилов. При выявлении снижения АЧН на фоне терапии следует обеспечить надлежащий контроль за состоянием пациентов и при необходимости рассмотреть вопрос о прекращении лечения препаратом.
В ходе клинических исследований сообщалось о случаях развития злокачественных новообразований у пациентов, получающих канакинумаб, однако риск развития злокачественных новообразований на фоне терапии антителами, связывающими ИЛ-1 неизвестен.
При применении канакинумаба приблизительно у 12% больных с различными фенотипами CAPS наблюдались положительные результаты туберкулиновой пробы без каких-либо признаков туберкулезной инфекции (латентной или активной). Нет данных об увеличении риска реактивации туберкулезной или оппортунистических инфекций при лечении моноклональными антителами к ИЛ-1 (в т.ч. канакинумаба).
Перед началом лечения канакинумабом проводят обследование всех пациентов с целью выявления активной или латентной туберкулезной инфекции (включая сбор анамнеза и проведение соответствующих скрининговых тестов, например туберкулиновой пробы, тестов IGRA (Interferon-Gamma-Release-Assay) или рентгенологического исследования грудной клетки. Во время лечения следует тщательно контролировать состояние больных с целью выявления туберкулезной инфекции. В случае конверсии туберкулинового теста из негативного в позитивный, особенно у пациентов группы высокого риска, необходимо провести альтернативные скрининговые тесты. При выявлении туберкулезной инфекции лечение канакинумабом не следует начинать или продолжать.
Вакцинировать больных, получающих лечение канакинумабом, живыми вакцинами следует только в случае, когда польза от вакцинации превышает возможный риск. В случае необходимости вакцинацию живыми вакцинами проводят после начала терапии (по крайней мере, через 3 месяца после последней инъекции препарата и за 3 месяца до следующей).
Влияние на способность к управлению транспортными средствами и механизмами
Пациентам, у которых на фоне применения канакинумаба возникает вертиго, не следует управлять автотранспортом или работать с механизмами до полного исчезновения данной побочной реакции.
Лекарственное взаимодействие
Поскольку экспрессия в печени изоферментов системы цитохрома Р450 может быть подавлена цитокинами, стимулирующими хроническое воспаление, такими как ИЛ-1β, то при назначении мощных ингибиторов цитокинов экспрессия в печени изоферментов системы цитохрома Р450 может быть нормализована. Это является клинически значимым для препаратов, метаболизирующихся с помощью изоферментов системы цитохрома Р450 и имеющих узкий терапевтический индекс, когда доза препарата подбирается индивидуально. При применении канакинумаба у пациентов, получающих такие препараты, их дозу следует при необходимости корректировать (в зависимости от их клинического эффекта и концентрации действующего вещества в плазме крови).
В клинических исследованиях отмечено безопасное применение канакинумаба с противоподагрическими средствами.
Канакинумаб не рекомендуется применять одновременно с ингибиторами ФНО и другими блокаторами ИЛ-1β, поскольку при данной комбинации повышается риск развития тяжелых инфекций.
Данные о влиянии вакцинации живыми вакцинами, а также о возможной вторичной передаче инфекции, пациентам, получающим лечение препаратом, отсутствуют.
|
Необходим предварительный заказ по телефону или на сайте. Дождитесь подтверждения оператора, прежде чем приезжать в аптеку. |
||||||
|
Канакинумаб в лечении подагрического артрита
Ключевую роль в развитии острого подагрического артрита играет активация NLRP3 инфламмасомы под действием кристаллов моноурата натрия. В состав инфламмасомы входит прокаспаза-1, которая превращается в активную каспазу-1, вызыващую секрецию интерлейкина (ИЛ-1β) – основного провоспалительного цитокина, индуцирующего острый воспалительный ответ. Канакинумаб – это человеческие моноклональные IgG1 антитела к интерлейкину (ИЛ)-1β, которые связываются с цитокином и блокируют его взаимодействие с рецепторами. В двух рандомизированных клинических исследованиях 3 фазы канакинумаб (одна инъекция 150 мг подкожно) превосходил триамцинолона ацетонид по эффективности в лечении острого подагрического артрита у пациентов с частыми приступами подагры. Лечение канакинумабом по сравнению с глюкокортикостероидом привело к значительному увеличению времени до первого обострения и снижению риска обострений на 62% за 12 недель. Применение канакинумаба у пациентов с острым подагрическим артритом обосновано при наличии противопоказаний к назначению нестероидных противовоспалительных препаратов и/или колхицина, недостаточной их эффективности или плохой переносимости.
Подагра – это хроническое системное заболевание, которое характеризуется стойкой гиперурикемией и образованием
кристаллов моноурата натрия, откладывающихся в суставах и других тканях [1]. В странах Европы и США
распространенность подагры составляет 3-6% у мужчин и 1-2% у женщин [2]. Заболеваемость увеличивается с возрастом и
достигает пика в возрасте 40-50 лет у мужчин и после 60 лет у женщин. Подагра проявляется рецидивирующими приступами
острого моноартрита, которые продолжаются от нескольких часов до 7-10 дней. Если гиперурикемия не контролируется, то
со временем продолжающееся отложение кристаллов моноурата натрия и воспаление приводят к развитию хронической
тофусной подагры (тофусы в cуставах и мягких тканях, хронический эрозивный артрит с функциональными нарушениями,
подагрическая нефропатия). Ключевую роль в патогенезе острого подагрического артрита играют активация NLRP3
инфламмасомы под действием кристаллов моноурата натрия и выделение интерлейкина 1β [1], поэтому основные стратегии
лечения подагры включают в себя профилактику приступов артрита путем уратснижающей терапии, вызывающей рассасывание
кристаллов, и купирование атак артрита с помощью противовоспалительных препаратов, включая ингибиторы интерлейкина
1β, такие как канакинумаб.
Диагностика подагры
Подагра известна с глубокой древности. Первые описания этого заболевания содержатся в египетских папирусах,
датируемых 2600 годом до нашей эры, и в трудах Гиппократа [3]. Очень точное описание подагрического приступа в
конце XVII века дал английский врач Thomas Sydenham, который на протяжении многих лет сам страдал этим
заболеванием: “После приятно проведенного вечера и обильного ужина человек
ложится спать, но примерно в два часа ночи просыпается от сильнейшей боли. Возникает она обычно с большого
пальца ноги и нарастает настолько быстро, что через час-два человек практически не может пошевелиться.
Раздирающая боль распространяется на все кости и связки ног. Больному кажется, что в палец впилась клыками
огромная собака и что кто-то раздирает сухожилия. Больного сильно знобит. Палец становится красным, горячим,
иногда опухает.» [4].
У 85-90% больных подагра начинается с моноартрита с поражением сустава нижних конечностей (чаще всего страдают
первый плюснефаланговый сустав, другие суставы стопы или голеностопный сустав), который развивается под
действием различных провоцирующих факторов, таких как острые заболевания, хирургические вмешательства,
дегидратация, употребление алкоголя или большого количества мяса, прием некоторых лекарственных средств, в том
числе диуретиков. Острая нестерпимая боль часто возникает ночью, быстро нарастает, достигая максимума в течение
нескольких часов, сопровождается покраснением и опуханием пораженного сустава, ограничением подвижности и резкой
болезненностью при дотрагивании. Приступ полностью проходит в течение 14 дней (обычно быстрее). Подобные
приступы обычно повторяются в течение ближайших нескольких месяцев или лет, а у трети нелеченных больных в
течение 5 лет развивается хроническая подагра, характеризующаяся хроническим деструктивным полиартритом,
деформацией суставов и образованием тофусов – отложений кристаллов моноурата натрия, окруженных мононуклеарными
и гигантскими клетками [3]. Тофусы представляют собой безболезненные узелки размером от нескольких миллиметров
до 2-3 см. Внесуставные тофусы обычно локализуются на ушных раковинах, в области локтевой поверхности
предплечий, ахиллова сухожилия и др.
Картина острого моноартрита с поражением сустава нижних конечностей типична, но не специфична для подагры.
Сходные клинические проявления могут наблюдаться при септическом артрите, а также болезни отложения кристаллов
пирофосфата кальция, псориатическом артрите, реактивном артрите [5]. В связи с этим диагноз подагры должен
основываться на совокупности клинических и анамнестических данных, результатов лабораторных и других методов
исследования. В крупном исследовании SUGAR были проанализированы различные признаки, которые повышали
вероятность диагноза подагры, подтвержденного при анализе пунктата синовиальной жидкости или содержимого тофуса,
у 983 пациентов с артритом, поступавших в ревматологическое отделение [6]. Наиболее важное диагностическое
значение имели особенности приступа, в частности быстрое нарастание боли и ее полное купирование в течение 2
недель, локализация поражения, наличие тофусов, гиперурикемия, результаты ультразвукового исследования и др.
(табл. 1).
| Признаки | Отн. шансов (95% доверительный интервал |
|---|---|
| Покраснение сустава | 2,13 (1,06-4,29) |
| Боль, достигающая максимума в течение <24ч | 7,34 (1,17-46,06) |
| Прекращение приступа в течение 2 недель | 3,58 (1,85-6,95) |
| Тофусы | 7,29 (2,42-21,99) |
| Поражение первого плюснефалангового сустава, в том числе в анамнезе | 2,30 (1,18-4,49) |
| Локализация поражения при текущем артрите | |
| Первый плюснефаланговый сустав | 2,82 (1,37-5,81) |
| Другой сустав стопы или голеностопный суста | 2,28 (1,00-5,19) |
| Сывороточный уровень мочевой кислоты >360 мкмоль/л (6 мг/дл) | 3,35 (1,57-7,15) |
| “Двойной контур» при УЗИ | 7,23 (3,47-15,04) |
| Эрозии или кисты при рентгенографии суставов | 2,49 (1,26-4,90) |
В 2018 г. эксперты Европейской антиревматической лиги (EULAR) опубликовали новые рекомендации по диагностике
подагры, в которых выделены основные клинические признаки, с большой долей вероятности указывающие на наличие
подагры, в том числе моноартрит с поражением сустава стопы или голеностопного сустава, похожие приступы острого
артрита в анамнезе, быстрое нарастание боли и опухания (в течение <24 ч), покраснение кожи в области
пораженного сустава, мужской пол, гиперурикемия и сопутствующие сердечно-сосудистые заболевания [7]. Однако в
рекомендациях отмечена неспецифичность указанных признаков и не предлагается балльная их оценка, содержавшаяся в
предыдущих рекомендациях ACR/EULAR 2015 года [8].
Важное значение в диагностике подагры имеет гиперурикемия, которая является одним из основных факторов риска
развития этого заболевания. По данным систематизированного обзора популяционных проспективных исследований,
частота развития подагры варьировалась от 3 случаев на 1000 пациенто-лет при сывороточном уровне мочевой кислоты
<6 мг/дл до 70 случаев на 1000 пациенто-лет при повышении уровня мочевой кислоты>10 мг/дл. Сходные результаты
были получены при анализе частоты рецидивирования подагры, которая достигала 60-90% при гиперурикемии более
9 мг/дл [9]. Даже при отсутствии симптомов у 1525% пациентов с гиперурикемией можно выявить отложение
кристаллов моноурата натрия [7]. Однако высокая гиперурикемия не всегда приводит к развитию подагры.
Например, в исследовании Normative Aging Study развитие подагрического артрита в течение 5 лет было отмечено
только у 22% мужчин с бессимптомной гиперурикемией >9 мг/дл [10]. Гиперурикемию саму по себе не следует
считать надежным диагностическим признаком подагры. В двух исследованиях ее специфичность составила всего
53-61% [11,12]. Отсутствие гиперурикемии делает диагноз подагры маловероятным, но полностью его не
исключает. Например, в одном исследовании у 14% из 339 пациентов с острым подагрическим артритом
сывороточный уровень мочевой кислоты был ниже 6 мг/дл [13].
“Золотым стандартом» диагностики подагры является поляризационная микроскопия синовиальной жидкости или
содержимого тофуса, позволяющая выявить кристаллы моноурата натрия. В рекомендациях EULAR это исследование
предлагается проводить всем больным с предполагаемым диагнозом подагры, в том числе всем взрослым пациентам с
недифференцированным или впервым возникшим артритом независимо от его локализации (табл. 2) [7]. Синовиальная
жидкость может быть взята не только из воспаленного, но и интактного, но ранее поражавшегося сустава. Если
проведение инвазивного исследования по каким-то причинам невозможно, что в обычной клинической практике – не
редкость, то для подтверждения диагноза целесообразно использовать дополнительные методы, в частности
ультразвуковое исследование. Высокоспецифичными признаками считают феномен “двойного контура» и наличие тофусов
– гиперэхогенных узелков, хорошо дифференцируемых от окружающих тканей [14]. Следует учитывать, что
чувствительность метода ниже у пациентов с длительностью заболевания менее 2 лет. Перспективным методом
диагностики подагры считают также биэнергетическую компьютерную томографию.
| Рекомендации | Класс рекомендации | Степень доказанности |
|---|---|---|
| 1. У всех больных с предполагаемой подагрой рекомендуется исследование синовиальной жидкости или аспирата содержимого тофуса, так как наличие кристаллов моноурата натрия позволяет установить определенный диагноз подагры |
2b | B |
| 2. Подагру следует подозревать у всех взрослых пациентов с острым артритом. Если анализ синовиальной жидкости не возможен, то в пользу этого диагноза свидетельствуют следующие клинические признаки: моноартрит с поражением суставов стопы, особенно первого плюснефалангового сустава, или голеностопного сустава, сходные эпизоды острого артрита в анамнезе, резкая боль и припухание сустава, которые быстро нарастают и достигают максимума в течение первых суток, эритема, мужской пол, сопутствующие сердечнососудистые заболевания и гиперурикемия. Перечисленные проявления характерны, но не специфичны для подагры. |
2b | B |
| 3. Поиск кристаллов в синовиальной жидкости настоятельно рекомендуется всем пациентам с артритом неясной природы. |
3 | C |
| 4. Диагноз подагры не может основываться только на наличии гиперурикемии | 2a | B |
| 5. Если диагноз подагры вызывает сомнение, а пункция сустава невозможна, то рекомендуется использование визуализирующих методов с целью выявления отложений кристаллов моноурата натрия или изменений, характерных для других заболеваний. |
1b | A |
| 6. Обычная рентгенография может быть использована для выявления отложений кристаллов моноурата натрия, но обладает ограниченной ценностью в диагностике обострения подагры. Более информативным у пациентов с предполагаемым обострением подагры или хроническим подагрическим артритом может оказаться ультразвуковое исследование, которое позволяет выявить “скрытые» тофусы или феномен “двойного контура», типичный для отложения уратов в суставах |
1b | A |
| 7. У всех пациентов с подагрой необходимо выявлять факторы риска хронической гиперурикемии, в том числе хроническую болезнь почек, избыточную массу тела, прием лекарственных средств, таких как диуретики, аспирин в низкой дозе, циклоспорин, такролимус, употребление большого количества алкоголя (особенно пива и крепких спиртных напитков), недиетических содовых напитков, мяса, ракообразных/моллюсков. |
1a | A |
| 8. У пациентов с подагрой необходимо оценивать наличие сопутствующих заболеваний, включая ожирение, нарушение функции почек, артериальную гипертонию, ишемическую болезнь сердца, сердечную недостаточность, сахарный диабет и дислипидемию. |
1a | A |
Методы лечения подагры
Лечение подагры предполагает коррекцию факторов риска гиперурикемии, прежде всего с помощью диеты, уратснижающую
терапию и применение противовоспалительных препаратов с целью купирования приступов подагрического артрита и их
профилактики в первые 6 мес после назначения уратснижающих средств [15]. Неотъемлемым компонентом ведения
пациентов является лечение сопутствующих заболеваний, прежде всего сердечно-сосудистых. Хотя важность
диетотерапии не вызывает сомнения, переоценивать ее эффективность также не следует, поэтому во всех случаях
необходимо определить целесообразность назначения уратснижающих препаратов, которые снижают частоту приступов
подагры и обеспечивают возможность растворения кристаллов моноурата натрия. В последних рекомендациях EULAR,
опубликованных в 2017 году, указано, что уратснижающая терапия необходима всем пациентам с рецидивирующим
подагрическим артритом (≥2 приступов в год), тофусами, уратной артропатией и/или камнями в почках, однако ее
можно начать и после первого приступа артрита у пациентов молодого возраста (<40 лет), а также при очень
высокой гиперурикемии (>8,0 мг/дл, или 480 мкмоль/л) или при наличии сопутствующих заболеваний, таких как хрони
ческая почечная недостаточность, артериальная гипертония, ишемическая болезнь сердца, сердечная недостаточность.
Лечение обычно начинают с аллопуринола в низкой дозе (100 мг/сут), которую постепенно увеличивают на 100 мг
каждые 2-4 недели (максимальная доза – 900 мг/сут) до достижения целевого сывороточного уровня мочевой кислоты
(360 мкмоль/л). При недостаточной эффективности или непереносимости аллопуринола его можно заменить на другой
ингибитор ксантиноксидазы – фебуксостат (80-120 мг/сут), который метаболизируется в печени и практически не
выводится почками. За рубежом используются также урикозурические средства (бензбромарон и др.), однако в
Российской Федерации они не зарегистрированы.
Для купирования приступов подагрического артрита и их профилактики применяют колхицин (в первый день в дозе 1 мг
в течение 12 ч от начала приступа, а затем 0,5 мг через 1 ч) и/или нестероидные противовоспалительные препараты
(НПВП). Реже назначают глюкокортикостероиды в дозе 30-35 мг/сут в пересчете на преднизолон на 3-5 дней [15].
Колхицин в дозе 0,5-1 мг/сут рекомендуется также применять в течение первых 6 мес после назначения уратснижающей
терапии для профилактики приступов подагрического артрита. Применения колхицина и НПВП необходимо избегать у
пациентов с тяжелым нарушением функции почек.
Альтернативой перечисленным противовоспалительным препаратам в случае их неэффективности служат ингибиторы
интерлейкина-1b, в частности зарегистрированный в Российской Федерации канакинумаб. Основанием для назначения
этого пре парата пациентам с частыми рецидивами подагрического артрита могут быть и противопоказания к
применению стандартных противовоспалительных средств [16,17].
J. Saseen в крупном исследовании изучил частоту абсолютных и относительных противопоказаний к назначению
колхицина, НПВП и глюкокортикостероидов у 15669 пациентов с подагрой, которые были разделены на две когорты в
зависимости от частоты приступов в год (<3 или ≥3) (рис. 1) [18]. Про ти вопоказания оценивали на основании
инструкций по применению или базы данных Thomson Reuters Micromedex 2.0 (табл. 3) [19]. Среди больных с частотой
приступов <3 в год абсолютные или относительные противопоказания к назначению НПВП имелись в 78,7% случаев,
колхицина – в 46,5%, глюкокортикостероидов – в 87,3%. Еще выше частота противопоказаний оказалась у
пациентов с более частыми приступами подагрического артрита – 91,5%, 47,1% и 96,4%, соответственно.
Необходимо отметить, что хотя противопоказания к лечению колхицином были выявлены фактически у каждого
второго пациента как с частыми, так и более редкими приступами подагры, тем не менее, частота абсолютных
противопоказаний была очень низкой (0,5-0,8%).
противопоказаний к назначению противовоспалительных препаратов у 15569 пациентов с подагрой.
По оси абсцисс указана частота приступов подагрического артрита в год.
| Препараты | Абсолютные противопоказания | Относительные противопоказания |
|---|---|---|
| Примечание: мощные ингибиторы CYP3A4 – атазанавир, кларитромицин, дарунавир с ритонавиром, индинавир, итраконазол, кетоконазол, лопинавир с ритонавиром, нефазодон, нелфинавир, ритонавир, саквинавир с ритонавиром, телитромицин, типранавир с ритонавиром. Ингибиторы Р-гликопротеина – циклоспорин, ранолазин. Умеренные ингибиторы CYP3A4 – дилтиазем, верапамил, ампренавир с ритонавиром, фосампренавир с ритонавиром. ХБП – хроническая болезнь почек |
||
| НПВП | ХБП 3-5 стадии Сердечная недостаточность Гастродуоденальная язва или кровотечение Лечение варфарином |
Сердечно-сосудистые заболевания ХБП 1-2 стадии Артериальная гипертония Лечение ингибиторами АПФ или блокаторами ангиотензиновых рецепторов, аспирином, b-адреноблокаторами, глюкокортикостероидами, диуретиками |
| Колхицин | ХБП или заболевание печени И лечение мощным ингибитором CYP3A4 или ингибитором Р-гликопротеина Применение ингибитора Р-гликопротеина или мощного ингибитора CYP3A4 |
Хроническая болезнь почек или заболевание печени И лечение умеренным ингибитором CYP3A4 Прием дигоксина, фибратов, умеренных ингибиторов CYP3A4 или статинов |
| Глюкокортикостероиды | Нет | Сахарный диабет, дислипидемия, сердечная недостаточность, артериальная гипертония, гастродуоденальная язва или кровотечение Лечение аспирином, дигоксином, НПВП, варфарином |
Сходные данные приводят R.Keenan и соавт., которые проанализировали влияние сопутствующих заболеваний на
лечение подагры у 575 больных [20]. У многих пациентов имелись различные противопоказания к назначению
по крайней мере одного противоподагрического препарата. Например, колхицин в трети случаев применяли
несмотря на наличие противопоказаний.
Эффективность и безопасность канакинумаба в лечении и профилактике подагрического
артрита
Центральную роль в развитии приступов подагрического артрита играет образование NLRP3 инфламмасомы при
взаимодействии кристаллов моноурата натрия с фагоцитами [21]. Этот процесс лежит в основе патогенеза многих
аутовоспалительных заболеваний, в том числе криопирин-ассоциированного периодического синдрома [22]. NLRP3
(криопирин) относится к семейству внутриклеточных NOD-подобных рецепторов, которые распознают молекулярные
фрагменты, ассоциированные с повреждением (DAMP). К последним относятся кристаллы моноурата натрия. При
активации NLRP3 связывается с другими белками с образованием в макрофагах и нейтрофилах инфламмасомы, в состав
которой входят также белок ASC и прокаспаза-1. Последняя превращается в активную каспазу-1, которая вызывает
активацию и секрецию ИЛ-1β, являющегося основным провоспалительным цитокином и индуцирующего острый
воспалительный ответ [23].
Для подавления ИЛ-1β могут быть использованы генно-инженерные биологические препараты, в частности канакинумаб
(зарегистрирован в Российской Федерации под торговым наименованием Иларис®) – человеческие моноклональные IgG1
антитела к ИЛ-1β, которые связываются с цитокином и блокируют его взаимодействие с рецепторами. Эффективность
канакинумаба установлена в лечении системного ювенильного идиопатического артрита, болезни Стилла взрослых,
семейной средиземноморской лихорадки (периодической болезни), а также криопирин-ассоциированного периодического
синдрома и других редких генетических аутовоспалительных заболеваний [24].
Эффективность канакинумаба в профилактике приступов подагрического артрита была впервые показана в 24-недельном
рандомизированном контролируемом исследовании 2 фазы у 432 больных подагрой, начавших уратснижающую терапию
аллопуринолом в дозе 100-300 мг/сут [25]. В этом исследовании тестировали различные дозы канакинумаба (одна
подкожная инъекция в дозах 25, 50, 100, 200 или 300 мг; четыре инъекции с 4-недельным интервалом – 50 мг, 50 мг,
25 мг и 25 мг), который сравнивали с колхицином (0,5 мг/сут ежедневно в течение 16 недель). Применение
канакинумаба в дозах 50 мг и более привело к снижению среднего числа обострений на пациента на 62-72% по
сравнению с колхицином и риска развития по крайней мере одного обострения на 64-72% (рис. 2). Во всех группах
канакинумаба процент больных, перенесших по крайней мере один подагрический приступ (15-27%), был достоверно
ниже, чем в группе колхицина (44%, p<0,05).
артрита(методКаплана-Мейера)
Таким образом, это исследование показало, что канакинумаб (однократная инъекция в дозе ≥50 мг или 4 инъекции с
4-недельным интервалом) может быть использован для профилактики приступов подагрического артрита в первые месяцы
после назначения урат снижающей терапии и по эффективности превосходит колхицин, который считается стандартом
профилактики обострений подагры.
Эффективность и безопасность канакимуба при остром подагрическом артрите подтверждены в двух рандомизированных,
многоцентровых, контролируемых, 12-недельных исследованиях 3 фазы (β-RELIEVED and β-RELIEVED-II), которые
проводились по одинаковому протоколу в Европе, США и других странах [26]. В целом в них были включены 456
больных с острым подагрическим артритом (около 90% – мужчины), у которых отмечались противопоказания к
назначению НПВП и/или колхицина, плохая их переносимость или неэффективность. В течение первых 5 дней после
развития приступа пациентам вводили одну дозу канакинумаба 150 мг подкожно или триамцинолона ацетонида 40 мг
внутримышечно.
У большинства пациентов (82,6%) имелись сопутствующие заболевания, в том числе артериальная гипертония (59,5%)
или хроническая болезнь почек 2-5 стадии (83,7%), а средняя частота приступов артрита за предыдущий год
составила 6,5. Только 42% больных получали уратснижающую терапию. После завершения 12-недельных исследований 335
больных продолжили участие в продленной фазе двух исследований. Во время этого периода исследуемые препараты
вводили при необходимости.
Целями обоих исследований были следующие: (1) подтвердить, что канакинумаб в дозе <150 мг подкожно
превосходит триамцинолона ацетонид в дозе 40 мг внутримышечно по эффективности в купировании боли в пораженном
суставе через 72 ч после введения (интенсивность боли оценивали с помощью визуальной аналоговой шкалы длиной 100
мм); (2) доказать, что канакинумаб увеличивает время до первого рецидива подагрического артрита по сравнению с
триамцинолона ацетонидом. Необходимым условием было достижение обеих первичных конечных точек.
Средний исходный индекс боли в двух группах исходно составил 74,1 мм. Уже через 6 ч после введения препарата в
группе канакинумаба он снизился в большей степени, чем в группе триамцинолона, а разница между группами достигла
статистической значимости через 24 ч и сохранялась через 7 дней. Через 72 ч средний индекс боли в группах
канакинумаба и триамцинолона составил 25,0 и 35,7 мм, соответственно (разница между группами 10,7 мм,
p<0,0001) (рис. 3). Доля пациентов, которым потребовался прием дополнительных препаратов, в том числе
глюкокортикостероидов внутрь, в группе канакинумаба также была достоверно ниже, чем в группе триамцинолона
(37,3% и 54,6%, соответственно; p=0,0001; пероральные глюкокортикостероиды – 11,1% и 23,6%). Преимущество
канакинумаба перед глюкокортикостероидом было подтверждено и при анализе мнения врачей и пациентов об
эффективности лечения, а также динамики болезненности (p≤0,0001), припухлости (p≤0,01) и эритемы (p≤0,05).
(мм) в течение 7 дней после введения канакинумаба или глюкокортикостероида в исследованиях
β-RELIEVED.
* достоверныеразличиямеждудвумягруппами
Лечение канакинумабом привело к быстрому снижению медиан уровней С-реактивного белка и сывороточного амилоидного
А-белка (SAA), которые оставались низкими на протяжении всего 24-недельного исследования и во всех точках были
ниже, чем в группе глюкокортикостероида (p≤0,0001 через 72 ч и 7 дней). Следует отметить, что сохранение
субклинической воспалительной активности даже вне приступов подагры в редких случаях может привести к развитию
АА-амилоидоза. Остановить прогрессирование амилоидоза у таких пациентов можно только путем длительного
многолетнего лечения ингибитором интерлейкина-1β.
Мы наблюдали 66-летнего мужчину с хронической тофусной подагрой, которая осложнилась развитием АА-амилоидоза,
проявлявшегося нефротическим синдром и нарушением функции почек и подтвержденного при гистологическом
исследовании биоптата почки. Применение канакинумаба позволило не только купировать нефротический синдром, но и
задержать прогрессирующее ухудшение функции почек, которое потребовало бы назначения почечной заместительной
терапии [27].
Лечение канакинумабом сопровождалось значительным увеличением времени до первого обострения и снижением риска
обострений на 62% за 12 недель по сравнению с триамцинолона ацетонидом (p≤0,0001) (рис. 4). В группе
канакинумаба по сравнению с группой триамцинолона ацетонида были значительно ниже доля пациентов, перенесших
одно обострение во время исследования (16,0% и 35,8%, соответственно), среднее число обострений на пациента
(0,19 и 0,51) и процент больных, у которых зарегистрировали по крайней мере два обострения (2,7% и 11,4%).
Эффекты канакинумаба сохранялись на протяжении всего 24-недельного исследования: увеличение медианы времени до
обострения со 131 в группе сравнения до >168 дней в основной группе, снижение риска развития обострения на 56%
по сравнению с триамцинолона ацетонидом (p≤0,0001) и среднего числа обострений на пациента с 0,87 в группе
триамцинолона ацетонида до 0,40 в группе канакинумаба (p<0,0001).
артрита в группах канакинумаба и триамцинолона ацетонида
Лечение канакинумабом было в целом безопасным, а большинство нежелательных явлений оказались легкими или
средне-тяжелыми. Частота инфекций в группе канакинумаба была выше, чем в группе триамцинолона (20,4% и 12,2%,
соответственно). Серьезные инфекции были зарегистрированы только в группе канакинумаба, однако частота их была
низкой (1,8%). У всех 4 пациентов антибиотикотерапия привела к выздоровлению. Оппортунистических инфекций
отмечено не было.
D. Solomon и соавт. изучали эффективность кана кинумаба в профилактике приступов подагры на основании
ретроспективного анализа результатов рандомизированного исследования CANTOS, в котором этот препарат сравнивали
с плацебо у 10059 пациентов с перенесенным инфарктом миокарда и уровнем высокочувствительного СРБ по крайней
мере 19,1 нмоль/л [28]. 762 их них страдали подагрой. Канакинумаб в разных дозах (50, 150 или 300 мг каждые 3
мес) применяли в течение в среднем 3,7 лет. Во время исследования по крайней мере один приступ подагрического
артрита развился у 195 пациентов. У 87 из них имелась подагра в анамнезе, а у 34 – наблюдались повторные
приступы подагры. В группе плацебо частота приступов подагрического артрита составила 0,38 на 100 пациенто-лет и
зависела от сывороточных уровней мочевой кислоты: 0,28, 1,36 и 5,94 на 100 пациенто-лет при уровне мочевой
кислоты ≤404,5 мкмоль/л, 404,6-535,3 мкмоль/л и ≥535,4 мкмоль/л, соответственно. Лечение канакинумабом не влияло
на сывороточные уровни мочевой кислоты, но привело к значительному снижению уровня высокочувствительного СРБ. В
группах канакинумаба риск развития подагрического артрита достоверно снизился по сравнению c плацебо на 55-60%,
причем этот эффект не зависел от дозы ингибитора интерлейкина1β или сывороточного уровня мочевой кислоты (табл.
4). Хотя исследование CANTOS не предполагало изучение эффективности длительной терапии канакимубом в
профилактике приступов подагрического артрита, тем не менее, ретроспективный анализ полученных данных показал,
что применение этого препарата снижает риск их развития по сравнению с плацебо.
| Исходные сывороточные уровни мочевой кислоты |
Плацебо | Канакинумаб (все дозы) | Отн. шансов (95% ДИ | ||||
|---|---|---|---|---|---|---|---|
| Число пациентов |
Число приступов |
Частота на 100 пациенто-лет (95% ДИ) |
Число пациентов |
Число приступов |
Частота на 100 пациенто-лет (95% ДИ) |
||
| ≤404,5 мкмоль/л | 2326 | 24 | 0,28 (0,18–0,41) | 4614 | 19 | 0,,11 (0,07–0,17) | 0,40 (0,22–0,73) |
| 404,6–535,3 мкмоль/л | 831 | 41 | 1,36 (1,00–1,85) | 1684 | 41 | 0,65 (0,48–0,89) | 0,48 (0,31–0,74) |
| ≥535,4 мкмоль/л | 186 | 34 | 5,94 (4,25–8,32) | 418 | 36 | 2,55 (1,84–3,54) | 0,45 (0,28–0,72) |
Заключение
У многих пациентов с подагрическим артритом имеются сопутствующие заболевания, которые часто ограничивают
применение стандартных противовоспалительных препаратов. Кроме того, последние могут взаимодействовать с
различными лекарственными средствами, не всегда эффективны или плохо переносятся. Основания для назначения
канакинумаба пациентам с острым подагрическим артритом включают в себя противопоказания к применению НПВП и
колхицина, недостаточную их эффективность или плохую переносимость. Соответственно, чаще всего необходимость в
применении канакинумаба возникает у пациентов с тяжелым и часто рецидивирующим подагрическим артритом, которые
плохо отвечают на колхицин и/или НПВП, и больных с различными сопутствующими заболеваниями, которым стандартные
противовоспалительные препараты нельзя назначить из-за абсолютных противопоказаний. Канакинумаб в дозе 150 мг
подкожно может быть использован для купирования острого подагрического артрита у взрослых пациентов с частыми
обострениями заболевания (≥3 за предыдущий год). Препарат следует вводить как можно раньше после развития
приступа. При необходимости повторного введения канакинумаба интервал между инъекциями должен составлять не
менее 12 недель. При неэффективности первой инъекции вводить препарат повторно нецелесообразно. По эффективности
в лечении острого подагрического приступа канакинумаб достоверно превосходил глюкокортикостероиды. Если пациент
не получает уратснижающую терапию, то после купирования острого подагрического артрита необходимо начать лечение
аллопуринолом. В этом случае введение канакинумаба позволяет свести к минимуму риск развития обострений
подагрического артрита, который увеличивается в первые месяцы после начала любой уратснижающей терапии.
Используемые источники
- Dalbeth N, Merriman TR, Stamp LK. Gout. Lancet 2016;388(10055):2039-52.
- Kuo C-F, Grainge MJ, Zhang W, Doherty M. Global epidemiology of gout: prevalence, incidence and risk factors. Nat Rev Rheumatol 2015;11:649–62.
- Richette P, Bardin T. Gout. Lancet 2010;375:318–28.
- Насонова В., Барскова В. Болезнь изобилия. Наука и жизнь 2004;7. https://www.nkj.ru/archive/articles/2216/.
- Zhang W, Doherty M, Bardin T, et al. EULAR evidence based recommendations for gout. Part II: Management. Report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 2006;65:1312–24.
- Taylor WJ, Fransen J, Jansen TL, et al. Study for Updated Gout Classification Criteria (SUGAR): identification of features to classify gout. Arthritis Care Res (Hoboken) 2015;67:1304–15.
- Richette P, Doherty M, Pascual E, et al. 2018 updated European League Against Rheumatism evidence-based recommendations for the diagnosis of gout. Ann Rheum Dis 2019 Jun 5. pii: annrheumdis-2019-215315.
- Neogi T, Jansen T, Dalbeth N, et al. 2015 Gout classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Ann Rheum Dis 2015;74(10):1789–98.
- Shiozawa A, Szabo SM, Bolzani A, et al. Serum uric acid and the risk of incident and recurrent gout: a systematic review. J Rheumatol 2017;44:388–96.
- Campion EW, Glynn RJ, DeLabry LO. Asymptomatic hyperuricemia. Risks and consequences in the normative aging study. Am J Med 1987;82:421–6.
- Malik A, Schumacher HR, Dinnella JE, et al. Clinical diagnostic criteria for gout: comparison with the gold standard of synovial fluid crystal analysis. J Clin Rheumatol 2009;15:22–4.
- Janssens HJEM, Fransen J, van de Lisdonk EH, et al. A diagnostic rule for acute gouty arthritis in primary care without joint fluid analysis. Arch Intern Med2010;170:1120–6.
- Schlesinger N, Norquist JM, Watson DJ. Serum urate during acute gout. J Rheumatol 2009;36:1287–9.
- Ogdie A, Taylor WJ, Neogi T, et al. Performance of ultrasound in the diagnosis of gout in a multicenter study: comparison with monosodium urate monohydrate crystal analysis as the gold standard. Arthritis Rheumatol 2017;69:429–38.
- Richette P, Doherty M, Pascual E, et al. 2016 updated EULAR evidence-based recommendations for the management of gout. Ann Rheum Dis 2017;76(1):29-42.
- Елисеев М.С., Насонов Е.Л. Применение канакинумаба при подагре. Научно-практическая ревматология 2018;56:41-8. [Eliseev MS, Nasonov EL. Therapy with canakinumab for gout. Rheumatology Science and Practice 2018;56:41-8 (In Russ.)].
- Елисеев М.С., Желябина О.В., Мукагова М.В., Насонов Е.Л. Клинический опыт применения блокатора интерлейкина 1β канакинумаба у больных хронической тофусной подагрой: купирование артрита и профилактика обострений при назначении аллопуринола. Современная ревматология 2015;9(2):16-22 [Eliseev MS, Zhelyabina OV, Mukagova MV, Nasonov EL. Clinical experience with the interleukin 1β blocker canakinumab in patients with chronic tophaceous gout: abolishment of arthritis and prevention of exacerbations when allopuninol is used. Sovremennaya Revmatologiya = Modern Rheumatology Journal. 2015;9(2):16-22 (In Russ.)].
- Saseen JJ. Comparison of patient characteristics and gout-related health-care resource utilization and costs in patients with frequent versus infrequent gouty arthritis attacks. Rheumatology (Oxford) 2012;51(11):2004-12.
- Reuters T. Micromedex Healthcare Series [intranet database] Version 5.1. Greenwood Village, CO: Thomson Reuters (Healthcare) Inc, 2011.
- Keenan RT, O’Brien WR, Lee KH, et al. Prevalence of contraindications and prescription of pharmacologic therapies for gout. Am J Med 2011;124;155−63.
- Martinon F, Petrilli V, Mayor A, Tardivel A, Tschopp J. Gout-associated uric acid crystals activate the NALP3 inflammasome. Nature 2006;440:237–41.
- Козловская Л.В., Рамеев В.В., Новиков П.И. и др. Криопирин-ассоциированный периодический синдром. Клин фармакол тер 2016;25(2):82-9. [Kozlovskaya LV, Rameev VV, Novikov PI, et al. Сryopyrin-associated periodic syndrome. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2016; 25(2):82-9 (In Russ.)].
- Насонов Е.Л., Елисеев М.С. Роль интерлейкина 1 в развитии заболеваний человека. Научно-практическая ревматология 2016;54(1):60-77. [Nasonov EL, Eliseev MS. Role of interleukin 1 in the development of human diseases. Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice 2016;54(1):60-77 (In Russ.)].
- Моисеев С.В., Рамеев В.В. Канакинумаб в лечении периодической болезни и других аутовоспалительных заболеваний – исследование CLUSTER. Клин фармакол тер 2018;24(4):59-64. [Moiseev SV, Rameev VV. The interleukin-1b inhibitors for the treatment of familial Mediterranean fever and other autoinflammatory diseases: CLUSTER trial. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2018;24(4):59-64 (In Russ.)].
- Schlesinger N, Mysler E, Lin HY, et al. Canakinumab reduces the risk of acute gouty arthritis flares during initiation of allopurinol treatment: results of a doubleblind, randomised study. Ann Rheum Dis 2011;70:1264-71.
- Schlesinger N, Alten RE, Bardin T, et al. Canakinumab for acute gouty arthritis in patients with limited treatment options: results from two randomised, multicentre, active-controlled, double-blind trials and their initial extensions. Ann Rheum Dis 2012;71(11):1839-48.
- Рамеев В.В., Елисеев М.С., Моисеев С.В. Концепция аутовоспаления в генезе подагры и гиперурикемии. Клин фармакол тер 2019;28(2):28-33 [Rameev VV, Eliseev MS, Moiseev SV. Autoinflammation in the pathogenesis of gout and hyperuricemia. Clin Pharmacol Ther 2019;28(2). Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2019;28(2):28-33 (In Russ.)].
- Solomon DH, Glynn RJ, MacFadyen JG, et al. Relationship of interleukin-1β blockade with incident gout and serum uric acid levels: exploratory analysis of a randomized controlled trial. Ann Intern Med 2018;169(8):535-42.
Версия на английском языке