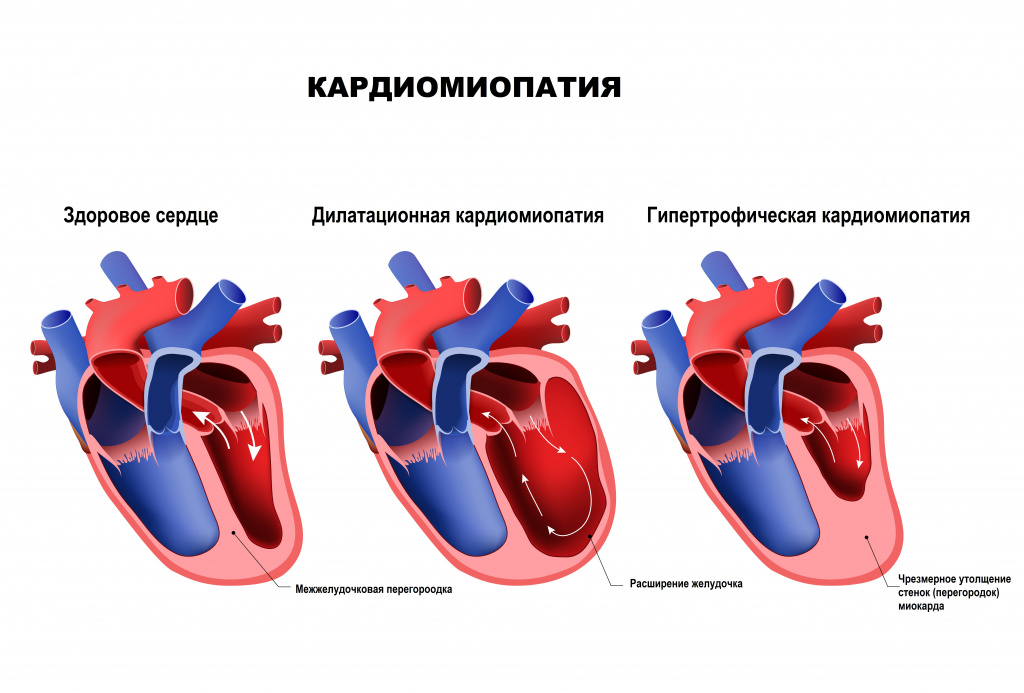
Гипертрофическая кардиомиопатия
Версия: Клинические рекомендации РФ 2018-2020 (Россия)
Категории МКБ:
Другая гипертрофическая кардиомиопатия (I42.2), Обструктивная гипертрофическая кардиомиопатия (I42.1)
Разделы медицины:
Кардиология
Общая информация
Краткое описание
Разработчик клинической рекомендации
Российское кардиологическое общество
Ассоциации сердечно-сосудистых хирургов России
Одобрено Научно-практическим Советом Минздрава РФ
Клинические рекомендации
Гипертрофическая кардиомиопатия
Год утверждения (частота пересмотра): 2020
Возрастная категория: Взрослые
Год окончания действия: 2022
ID: 283
Определение заболевания или состояния (группы заболеваний или состояний)
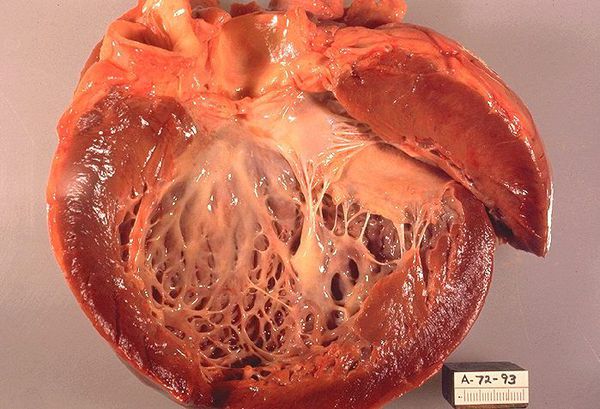
Гипертрофическая кардиомиопатия (ГКМП) — генетически обусловленное заболевание миокарда, характеризующееся гипертрофией миокарда левого (более 1,5 см) и/или правого желудочка, чаще асимметрического характера за счет утолщения межжелудочковой перегородки, что не может объясняться исключительно повышением нагрузки давлением, и возникающее при отсутствии другого сердечного или системного заболевания, метаболического или полиорганного синдрома, связанного с ГЛЖ.
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
I42.1 — Обструктивная гипертрофическая кардиомиопатия.
I42.2 — Другая гипертрофическая кардиомиопатия.
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 500 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
В повседневной клинической практике применяют несколько классификационных подходов — клинический, гемодинамический, морфологический, генетический.
Клинические варианты течения ГКМП – см. раздел Клиническая картина.
Гемодинамический принцип классификации
В зависимости от наличия или отсутствия обструкции ВТЛЖ в покое и при нагрузке выделяют следующие варианты ГКМП:
— необструктивная ГКМП: ГД в ВТЛЖ <30 мм рт.ст. в покое и при нагрузке
— обструктивная ГКМП: ГД в ВТЛЖ >30 (50) мм рт. ст. в покое и при нагрузке.
— латентная обструкция: ГД в ВТЛЖ <30 в покое и >30 (50) мм рт. ст. при нагрузке.
(подробнее критерии обструкции ВТЛЖ см. в разделе «Диагностика»)
Морфологический принцип классификации ГКМП
1. Асимметричная форма ГКМП
a. Гипертрофия МЖП (+/- вовлечение ПЖ):
i. Базальной части МЖП (субаортальная)
ii. Сигмовидная МЖП
iii. Гипертрофия всей МЖП
iv. Двояковыпуклая МЖП (англ. «reverse curve») — преимущественно среднежелудочковая гипертрофия МЖП без вовлечения свободной стенки ЛЖ [136, 137]
v. Комбинированная (МЖП + другой отдел ЛЖ или ПЖ)
b. Апикальная гипертрофия (+/- срединные сегменты ЛЖ)
c. Среднежелудочковая ГКМП (с вовлечением срединных отделов не только МЖП, но и
свободной стенки ЛЖ, ЛЖ типа «песочные часы»)
d. Гипертрофия другой стенки ЛЖ (боковая, задняя)
2. Симметричная форма ГКМП
В отечественной и зарубежной литературе иногда используется термин «диффузная гипертрофия ЛЖ», под которым можно понимать комбинированную (пункт 1.a.v.) или симметричную гипертрофию ЛЖ [138].
По степени выраженности гипертрофии
1. «Умеренная» (в англоязычной литературе используется термин «mild») — (максимальная толщина стенки ЛЖ ˂18 мм).
2. Промежуточная.
3. Экстремальная (максимальная толщина стенки ЛЖ ≥30 мм).
Предложена классификация кардиомиопатий MOGE(s) (2013), которая выделяет не только «классические» морфофункциональные фенотипы (гипертрофический, дилатационный, рестриктивный, аритмогенная дисплазия, некомпактный миокард), но и смешанные фенотипы (при ГКМП – см. таблицу П 2, Приложение Г3) [15, 43, 139].
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
ГКМП является генетически обусловленной патологией; идентифицированы более 20 причинных генов, связанных с развитием ГКМП. Генетический скрининг 8 наиболее частых причинных генов, кодирующих различные белки кардиомиоцитов, дает возможность определить причину заболевания примерно в 60% случаев [1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13].
В основе развития ГКМП наиболее часто лежат патогенные варианты в генах, кодирующих сократительные белки саркомера — миозин (MYH7), миозинсвязывающий белок С (MYBPC3), актин (ACTC), тропонин (TNNI3, TNNT2, TNNC) [2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17].
На долю патогенных вариантов в генах MYH7 и MYBPC3 приходится около половины всех случаев развития ГКМП. Манифестация клинических проявлений при двух самых распространенных мутациях MYH и MYBP-C возможна в любом возрасте. Дебют заболевания в детском и подростковом возрасте, а также у молодых взрослых часто ассоциирован с семейной формой заболевания и более тяжелым течением [2, 3, 4, 6, 7, 8, 12, 16, 17, 18, 19].
Развитие ГКМП на фоне мутаций в гене TNNT2 ассоциировано с большим риском развития синдрома ВСС на фоне умеренного увеличения толщины МЖП и более низкими показателями массы миокарда ЛЖ [2, 3, 4, 5, 6, 7, 9, 10, 11, 13, 15, 16, 20, 21, 22, 23, 24].
В большинстве случаев патогенные варианты, ассоциированные с ГКМП, представляют собой уникальные замены, описанные однократно или всего для нескольких случаев; частота каждой такой замены среди всех генетических причин ГКМП не превышает 1% [5, 25, 26].
В ряде случаев (5–7%) заболевание может развиваться на фоне 2, 3 и более патогенных вариантов. Часто встречаются комбинации мутаций в генах, кодирующих саркомерные белки. В этом случае заболевание характеризуется более ранним дебютом (часто в детском возрасте), большей степенью гипертрофии МЖП и более высоким риском развития синдрома ВСС [3, 4, 7, 16, 23, 27, 28].
Развитие ГКМП на фоне патогенных вариантов в генах цитоскелета часто ассоциировано с сочетанными пороками сердца (ДМПП, ДМЖП), а также признаками некомпактного миокарда [3, 4, 29, 30].
Патогенные варианты в генах, кодирующих белки цитоскелета, ионных каналов, структуру Z-дисков и другие внутриклеточные структуры, определяют развитие ГКМП в 15–20% [3, 4, 19, 27, 29, 30].
Молекулярный патогенез ГКМП
В основе молекулярного патогенеза ГКМП, ассоциированной с патогенными вариантами в генах, кодирующих белки саркомера, часто лежит нарушение кальциевого гомеостаза, повышение чувствительности миофиламентов к ионам кальция. Это проявляется в усилении силы сокращения саркомера в систолу, снижении степени его расслабления в диастолу на фоне повышенных потребностей кардиомиоцита в АТФ, что влечет нарушение внутриклеточных сигнальных процессов и реактивацию компенсаторных эмбриональных программ гипертрофического роста [16, 31].
На уровне кардиомиоцитов данные процессы приводят к повышению синтеза эмбриональных форм саркомерных белков и активации киназных сигнальных каскадов, обеспечивающих процессы собственно гипертрофии КМЦ, пролиферации фибробластов, трансформации фибробластов в миофибробласты и дисбаланс в системе коллагенолиза [16, 31, 32, 33, 34, 35, 36].
На гистологическом уровне отражением прямого действия «причинного» генетического варианта и молекулярного патогенеза является дискомплексация кардиомицитов и мышечных волокон — феномен «disarray», фиброз разной степени выраженности [3, 4, 16, 31, 32, 33, 34, 35, 37, 38, 39, 40, 41, 42].
Этиология и молекулярный патогенез фенокопий ГКМП
Заболевания генетической и негенетической природы, по морфофункциональному фенотипу схожих с ГКМП, но имеющие отличный от нее этиопатогенез и, следовательно, подходы к терапии, называют фенокопиями ГКМП.
Наиболее часто встречающиеся фенокопии ГКМП и их молекулярный патогенез представлены в таблице П1, Приложение Г3 [37, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60].
Патогенез симптомов и синдромов ГКМП
Патогенез ГКМП на органном уровне заключается в совокупности нескольких синдромов: обструкции ВТЛЖ, ишемии миокарда, систолической и диастолической дисфункции ЛЖ, аритмическом и ХСН.
Синдром обструкции ВТЛЖ
В создании обструкции ВТЛЖ участвуют структурные, кинетические и геометрические факторы [61]:
1. Структурные аномалии:
a. сужение ВТЛЖ гипертрофированной МЖП (уменьшение степени обструкции ВТЛЖ после миоэктомии/САА обусловлено воздействием на этот фактор);
b. ПСД (передне-систолическое движение) створок МК;
c. уменьшенная полость ЛЖ;
d. аномалии папиллярных мышц (и другие малые аномалии сердца) (гипертрофия и дислокация, добавочная ПМ);
e. апикально-базальный мышечный пучок.
2. Кинетические факторы — гиперсократимость ЛЖ и ускорение кровотока в ВТЛЖ;
3. Геометрические факторы:
a. переднее смещение МК, точка коаптации створок МК смещена ближе к МЖП [62];
b. малый аорто-митральный угол (˂120°).
Чем больше факторов имеется у конкретного пациента, тем более выражен синдром обструкции ВТЛЖ.
Передне-систолическое движение створок МК обусловлено следующими факторами:
a. аномалии створок МК (удлинение, избыточность);
b. нарушение координации кровотока в полости ЛЖ в раннюю систолу, в результате чего на створки МК действует сила, сдвигающая их в сторону ВТЛЖ [63, 64];
c. аномалии хорд МК;
d. меньшее соотношение длины передней и задней створок МК (<1,3), при этом точка коаптации створок МК смещается кпереди ближе к ВТЛЖ [65, 66, 67].
У пациентов с латентной обструкцией провоцирующими ее факторами являются: увеличение сократимости ЛЖ при нагрузке, приводящее к уменьшению конечно-систолического размера ЛЖ и переднему смещению МК; ускорение кровотока в ВТЛЖ в период систолы, усугубляющее ПСД МК [68].
У пациентов с ГКМП может быть лабильная обструкция, характеризующаяся значительными спонтанными колебаниями внутрижелудочкового ГД без видимой причины [69].
Кроме обструкции ВТЛЖ, у пациентов с ГКМП может наблюдаться среднежелудочковая обструкция. Среднежелудочковая обструкция развивается у пациентов с гипертрофией срединных сегментов МЖП и, как правило, в сочетании с гипертрофией папиллярных мышц [70, 71, 72]
При комбинированной гипертрофии (МЖП + апикальные сегменты) может быть 2-уровневая обструкция (срединно-желудочковая + на уровне ВТЛЖ) [73].
Синдром ишемии миокарда ЛЖ
У пациентов с ГКМП при интактных коронарных артериях может развиваться ишемия миокарда. В англоязычной литературе используют термин INOCA (ischemia and no obstructive coronary artery) [74].
Факторы, приводящие к ишемии миокарда:
a. относительная коронарная недостаточность (уменьшение резерва коронарного кровотока при выраженной гипертрофии);
b. ишемия субэндокардиальных слоев миокарда за счет компрессии интрамуральных коронарных артерий;
c. периваскулярный фиброз, при этом интрамуральные коронарные артерии не могут расшириться во время физической нагрузки, когда возрастает потребность миокарда в кислороде и требуется увеличение коронарного кровотока;
d. врожденная патология коронарных артерий — «миокардиальные мышечные мостики» и интрамуральное расположение ветвей крупных коронарных артерий;
e. помимо перечисленных причин, у 15–25% пациентов наблюдают сопутствующий атеросклероз в эпикардиальных коронарных артериях (в старшей возрастной группе пациентов).
У пациентов с ГКМП может развиваться инфаркт миокарда (ИМ) как 2 типа, (без атеротромбоза), так и 1 типа. Факторы риска равития инфаркта миокарда 2 типа у пациентов с ГКМП представлены в таблице П9, Приложение Г1. [75-90].
Синдром дисфункции ЛЖ
Диастолическая функция ЛЖ может быть нарушена уже у носителей мутации, в догипертрофической стадии ГКМП — генотип (+)/фенотип (-) [91].
При ГКМП нарушения касаются двух основных детерминант диастолического наполнения ЛЖ — активной релаксации и растяжимости миокарда. Гипертрофия миокарда per se вызывает нарушение активного расслабления. Хаотическое расположение сократительных элементов (disarray) и интерстициальный фиброз приводят к снижению податливости ЛЖ, и, как следствие, к возрастанию сопротивления наполнению ЛЖ и повышению давления наполнения. В начальных стадиях ГКМП нарушено только активное расслабление миокарда, при этом давление в ЛП не увеличено. По мере прогрессирования гипертрофии, развития фиброза, нарастания степени митральной регургитации, присоединения ишемии миокарда диастолические нарушения нарастают, приводя к увеличению давления в ЛП (соответственно, и к увеличению КДД ЛЖ). Также выраженная диастолическая дисфункция может приводить к развитию легочной гипертензии у некоторых пациентов (ЛГ у 50% симптомных пациентов) [91-96].
Систолическая функция ЛЖ может оцениваться как по параметрам сократимости, так и по объемным показателям.
— Глобальная систолическая функция ЛЖ, оцениваемая по параметрам сократимости, у пациентов с ГКМП сверхнормальная, что выражается высокой ФВЛЖ. Следует учесть, что показатель ФВ при ГЛЖ и маленьком ЛЖ может некорректно характеризовать сократимость. Региональная систолическая функция ЛЖ гетерогенна: гипертрофированные сегменты ЛЖ гипокинетичны (снижена степень систолического утолщения и деформация), а негипертрофированые сегменты имеют нормальную/сверхнормальную сократимость.
— Объемным показателем систолической функции ЛЖ является величина ударного объема (УО). При ГКМП и уменьшенном ЛЖ (малый КДО) УО снижен, несмотря на высокую ФВЛЖ. Также снижена возможность прироста УО при физической нагрузке.
— Систолическая функция ЛЖ, анализируемая по систолической деформации, может быть нарушена уже у носителей ГКМП-мутации, на догипертрофической стадии.
— При прогрессировании заболевания (негативное ремоделирование, adverse remodeling) в дилатационной стадии наблюдается уменьшение степени гипертрофии («выгорание»), сопровождаемое снижением общей сократимости ЛЖ (ФВ ˂ 50%) [21, 24, 92-94, 97-101].
ПЖ при ГКМП
У 30–44% пациентов с ГКМП наблюдаются структурные и функциональные нарушения в ПЖ. Критерием гипертрофии миокарда ПЖ считается увеличение толщины стенки ПЖ ˃ 5 мм. Толщина миокарда ПЖ ˃ 10 мм считается экстремальной ГПЖ [102].
Гипертрофия ПЖ в единичных случаях бывает изолированной, без ГЛЖ.
Структурное ремоделирование ПЖ в 15–90% приводит к внутрижелудочковой обструкции, которая может быть на уровне срединных сегментов ПЖ или на уровне выходного тракта ПЖ [103]. Критерием наличия обструкции ВТПЖ считается увеличение градиента давления в ВТПЖ ˃16 мм рт. ст. в покое [104].
Систолическая дисфункция ПЖ проявляется уменьшением продольной деформации ПЖ; при этом другие показатели систолической функции ПЖ (TAPSE и s’латеральной части трикуспидального кольца), как правило, в пределах нормальных значений.
Диастолическая дисфункция ПЖ в начальных стадиях характеризуется Е/А˂1, увеличением RV DecT (время замедления кровотока в фазу раннего наполнения ПЖ), E/e’ ˃6,0. Показано, что наличие диастолической дисфункции ПЖ является предиктором ВСС и ХСН [96, 102-109].
Внезапная сердечная смерть
В основе патогенеза ВСС лежат фатальные нарушения ритма, вызванные ишемией миокарда и электрической нестабильностью. ВСС чаще обусловлена ФЖ (62,4%), брадиаритмиями (16,5%), ЖТ типа «Torsades de pointes» (12,7%), ЖТ (8,3%) и асистолией [79, 110 -121].
Синкопальные состояния могут быть обусловлены как аритмическими, так и гемодинамическими причинами. К гемодинамическим причинам относят ситуативное увеличение обструкции ВТЛЖ (физическая нагрузка), вызывающее значимое уменьшение ударного объема и падение АД, а также снижение периферического сопротивления в результате неадекватной вазодилатации, в том числе вазовагальные обмороки [122-125].
Фибрилляция предсердий
Факторы:
a. «предсердная миопатия» — показано, что функция ЛП нарушена у носителей мутации в доклинической стадии до развития гипертрофии [126].
b. структурное (дилатация) и функциональное ремоделирование ЛП, приводящее к электрической нестабильности
c. интерстициальный фиброз ЛП [127, 128].
Хроническая сердечная недостаточность
Факторы:
a. уменьшенный ЛЖ (малый КДО) и, несмотря на высокую ФВЛЖ, малый УО ЛЖ;
b. неспособность увеличить в должной степени УО при физической нагрузке;
c. обструкция ВТЛЖ, вносящая вклад в уменьшение УО;
d. систолическая дисфункция ЛЖ при прогрессировании ГКМП, особенно в дилатационной стадии (ишемия миокарда, диссинхрония ЛЖ);
e. диастолическая дисфункция ЛЖ (фиброз миокарда, повышение давления в ЛП и КДД)
f. митральная регургитация (вносит вклад в повышение давления в ЛП);
g. нарушения ритма (ФП);
h. легочная гипертензия.
[21, 92, 101, 127, 129-133].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
При ГКМП нет четкой географической, этнической или половой структуры распределения.
ГКМП — практически единственное кардиоваскулярное заболевание, которое может манифестировать в любом возрасте человека от младенчества до глубокой старости (с первых дней до 90 и более лет); при этом средний возраст пациентов при установке диагноза составляет 30–40 лет.
Согласно данным эпидемиологических исследований, проводимых в разных частях света, распространенность ГКМП составляет 1:500 в общей популяции. В разных возрастных когортах она варьируется от 1:500 до 1:200.
При применении более чувствительных методов визуализации (МРТ, КТ) и более широком использовании генетического тестирования и каскадного скрининга для родственников первой линии родства распространенность ГКМП соответствует 0,6% (1:167).
Частота в общей популяции превышает встречаемость ГКМП в кардиологической практике, так как большая часть пациентов остается неидентифицированной ввиду бессимптомности. При выявлении гипертрофии сердца в старших возрастных группах и толщине стенки ЛЖ 12 мм и более необходимо учитывать возможность фенокопий ГКМП и вторичной ГЛЖ [3, 4, 28, 31, 134, 135].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
ГКМП — заболевание, характеризующееся выраженной гетерогенностью клинических проявлений.
Клинические варианты течения ГКМП:
1. ВСС — может отмечаться при любом варианте течения ГКМП, в том числе без предшествующей симптоматики (наиболее часто встречается у молодых пациентов < 35 лет, включая спортсменов).
2. Бессимптомное течение — встречается у пациентов с исходно необструктивной формой ГКМП (небольшая степень гипертрофии миокарда, без сопутствующих аномалий МК). Продолжительность жизни у этих пациентов как в общей популяции — 75 лет и более. Также бессимптомными могут быть пациенты с небольшой степенью обструкции ВТЛЖ (в покое и/или при нагрузке).
3. Симптомное стабильное (на фоне медикаментозной терапии) доброкачественное течение
a. у пациентов с исходно необструктивной формой ГКМП
b. при ОГКМП с небольшой степенью обструкции ВТЛЖ.
4. Симптомное осложненное течение ГКМП проявляется:
a. фибрилляцией предсердий — пароксизмальная, персистирующая или постоянная (от 25 до 30%), ассоциированная с сердечной недостаточностью различной степени выраженности и повышенным риском тромбоэмболических осложнений, включая инсульт
b. ХСН — появление одышки, слабости, утомляемости, в сочетании, пресинкопы и синкопы, аритмии. Нарастание тяжести ХСН до III–IV ФК (NYHA) при сохраненной систолической функции ЛЖ
c. Синдром стенокардии (в том числе атипичный болевой синдром) или безболевая ишемия. Ишемия миокарда при ГКМП может осложняться ИМ 2 типа.
5. Симптомное течение с негативным ремоделированием
а) «Конечная стадия»: дальнейшее прогрессирование явлений застойной сердечной недостаточности, связанной с негативным ремоделированием и выраженной систолической и/или диастолической дисфункцией ЛЖ (фенотипы ГКМП+ДКМП или ГКМП+РКМП).
б) Развитие верхушечной аневризмы ЛЖ — при обструкции средней части полости ЛЖ (редкий вариант течения ГКМП).
Формализованный подход, предложенный Rowin E.J., Maron M.S. и соавт. [140], к оценке вариантов клинического течения предлагает учитывать у пациента одного и более одного синдрома (ХСН+ФП), (ХСН+ВСС), (ФП+ВСС), (ХСН+ФП+ВСС) и использование термина «прогрессирующее течение симптомной ГКМП».
Основные клинико-морфологические варианты течения и исходы заболевания при ГКМП представлены в таблице П13, Приложение Г1 [3, 4, 24, 29, 34, 97, 98, 116, 138, 140-151].
Диагностика
Диагностика
Критерии диагноза ГКМП
Критерием диагноза ГКМП у взрослых является увеличение толщины стенки ЛЖ в одном или более сегментах ≥ 15 мм (определяемое любым визуализирующим методом — ЭХОКГ/МРТ/КТ), которая не объясняется исключительно увеличением нагрузки давлением. У родственников пробанда критерием диагноза ГКМП является толщина стенки ЛЖ, равная 13–14 мм [4].
Диагностика может быть затруднена в ситуациях сочетания ГКМП и АГ, у спортсменов и др. Также диагноз ГКМП требует исключения фенокопий ГКМП (см. раздел «ГКМП и АГ»).
Критерием вовлечения ПЖ при ГКМП является увеличение толщины стенки ПЖ ˃5 мм, а толщина миокарда ПЖ ˃10 мм считается экстремальной ГПЖ [134,152].
Критерием диагноза обструктивной ГКМП большинство европейских исследователей считает ГД в ВТЛЖ ≥30 мм рт. ст., в покое или провоцируемый. ГД ≥ 50 мм рт. ст. считается критерием гемодинамически значимой обструкции [4, 153].
Американские исследователи критерием диагноза обструктивной ГКМП считают ГД в ВТЛЖ ≥50 мм рт. ст., в покое или провоцируемый. Для провокации предлагается нагрузочная проба, а не проба Вальсальвы, т.к. было показано, что проба Вальсальвы не обладает достаточной чувствительностью [3, 4, 154].
При ГКМП, кроме субаортальной обструкции, может наблюдаться среднежелудочковая обструкция (изолированная или в сочетании с субаортальной). Критерия ГД для среднежелудочковой обструкции не выработано.
Критерием обструкции ВТПЖ считается увеличение ГД в ВТПЖ ˃ 16 мм рт.ст. в покое [104].
Жалобы и анамнез
- У всех пациентов рекомендован детальный анализ жалоб и анамнеза [1, 3, 4, 79, 155, 156].
ЕОК нет (УДД 5 УУР С)
Комментарий: многие пациенты не имеют жалоб или они малозначительны. В таких случаях диагноз ставится случайно или по результатам скрининга.
Должен быть решен вопрос об отличии истинного отсутствия симптомов от адаптации за счет образа жизни, путем проведения теста с максимальной переносимой физической нагрузкой и оценки биомаркеров ХСН в динамике.
В развернутой стадии заболевания при ГКМП наиболее частыми жалобами являются одышка, снижение толерантности к ФН, разнообразные болевые ощущения в грудной клетке кардиалгического и/или стенокардитического характера, нарушения ритма сердечной деятельности (перебои, учащенное сердцебиение), головокружение, пресинкопы и синкопы.
Важно помнить, что манифестация клинических проявлений ГКМП в молодом и пожилом возрасте имеет существенные различия.
Молодой возраст ассоциирован с семейной формой заболевания и является важной детерминантой тяжести течения, риска нежелательных кардиоваскулярных событий, доказанным фактором риска ВСС.
Необходимо учитывать все, в том числе дополнительные «новые», факторы риска ВСС, особенно у носителей патогенных вариантов, в том числе у родственников пробанда — генотип (+)/фенотип(-) (см. соотв. разделы)
При сборе семейного анамнеза обращают внимание на то, были ли у родственников указания на ВСС, ХСН, синкопальные состояния, имплантированные ЭКС, инсульт в молодом возрасте и другие системные заболевания.
Пожилой возраст ассоциирован с несемейной формой заболевания и коморбидностью (АГ, ИМТ/ ожирение, дислипидемия, ИБС).
Физикальное обследование
- У всех пациентов рекомендуется стандартное физикальное обсдедование сердечно-сосудистой системы, включающее аускультацию сердца, измерение АД (при необходимости — повторное, а также лежа, сидя, стоя), пальпацию пульса, измерение ЧСС (при ФП — дефицит пульса) [3, 4, 157-161].
УДД 5 УУР С
Комментарий: основной диагностический признак обструктивной ГКМП — грубый систолический шум выброса, который выявляют над всей поверхность сердца, с максимумом на верхушке и в четвертом межреберье слева от грудины. Систолический шум — низкочастотный, носит характер крещендо-декре щендо, выслушивается вдоль левого края грудины и усиливается под воз действием факторов, увеличивающих внутрижелудочковый градиент давле ния: переход в вертикальное положе ние, динамическая физическая нагруз ка, тахикардия, прием пищи, проба Вальсальвы, прием периферических вазодилататоров.
Большинство пациентов с обструкцией ВТЛЖ также имеют аускультативные признаки митральной регургитации. Со стороны других систем и органов при ГКМП обычно клинически значимых отклонений нет [3, 4, 157, 162].
У пациентов с обструкцией ВТЛЖ часто выявляется неустойчивость артериального пульса (значительные колебания ЧСС в ортостазе и клиностазе, во время бодрствования и сна).
- Рекомендуется обратить внимание на внесердечные проявления заболевания, указывающие на фенокопии ГКМП [37, 43, 44, 46, 47, 49-51, 58-60, 163-166].
ЕОК IB (УДД 4 УУР С)
Лабораторные диагностические исследования
- У всех пациентов с ГКМП для выявления сопутствующих заболеваний рекомендуется рутинное лабораторное обследование, включающее клинический анализ крови и общий анализ мочи, биохимический анализ крови (холестерин, триглицериды, калий, натрий, АСТ, АЛТ, мочевина, креатинин, билирубин, глюкоза) [3, 4, 167].
УДД 5 УУР С
Комментарий: рутинное лабораторное обследование помогает выявить сопутствующие заболевания, которые могут вызвать или усугубить миокардиальную дисфункцию и состояние пациента.
Определение концентрации N-терминального про-мозгового натрийуретического пептида (NtproBNP) и высокоспецифичного сердечного тропонина в плазме не входит в рутинное лабораторное обследование, однако, их высокие уровни ассоциированы с выраженностью ДД, ГЛЖ, тяжестью функциональных нарушений (ишемии миокарда, прогрессирование ХСН) и неблагоприятным прогнозом [4, 32, 34, 92, 96, 141, 168].
- При подозрении на конкретную фенокопию ГКМП с целью проведения дифференциального диагноза рекомендуется специальное лабораторное обследование. [3, 4, 44, 46, 47, 59, 60, 64, 92, 163, 169].
ЕОК IC (УДД 1 УУР C)
Комментарий: некоторые показатели, позволяющие предположить конкретный диагноз фенокопии ГКМП, приведены в таблице П1, Приложение Г1.
ГКМП — это диагноз исключения. Фенокопии, вторичные и специфические причины ГЛЖ и ГПЖ должны быть исключены.
Стратегия генетического тестирования и семейного скрининга
- Медико-генетическое консультирование рекомендовано проводить профессионалами, обученными в этой специальной области и работающими в мультидисциплинарной команде [3, 4, 30].
ЕОК IIаС (УДД 5 УУР C)
- Медико-генетическое консультирование рекомендовано проводить всем пациентам с ГКМП с целью выявления причинной мутации [3, 4, 18, 17, 27, 30, 31, 116, 170-173].
ЕОК IB (УДД 5 УУР С)
Комментарий: все пациенты должны быть полноценно осведомлены о смысле и значимости скрининга, возможных его результатах, их клиническом значении, а также в целом о вопросах наследственности сердечно-сосудистых заболеваний.
Рекомендации по генетическому тестированию пробандов
- Рекомендуется, чтобы генетическое тестирование выполнялось в сертифицированных диагностических лабораториях с экспертными навыками в интерпретации мутаций, связанных с кардиомиопатиями [17, 19, 27, 30, 31, 116, 171, 172].
ЕОК IC (УДД 5 УУР С)
- При подозрении на конкретную фенокопию ГКМП с целью проведения дифференциального диагноза рекомендуется генетическое тестирование [3, 4, 18, 27, 30, 31, 46, 51, 59, 60, 171].
ЕОК IB (УДД 5, УУР С)
Комментарий: генетическое тестирование у пациентов с ГЛЖ неясного генеза и толщиной стенки 13–14 мм рекомендовано проводить только после детального обследования (включая МРТ с контрастированием) и консилиума мультидисциплинарной командой специалистов.
- Посмертное генетическое исследование образцов законсервированных тканей или ДНК рекомендовано проводить для умерших пациентов с патоморфологически подтвержденной ГКМП, чтобы иметь возможность выполнить каскадный генетический скрининг родственников [3, 4, 27, 30, 163].
ЕОК IIаС (УДД 5 УУР С)
Комментарий: проведение генетического скрининга при ГКМП может носить диагностический и предиктивный характер.
В первом случае генетическая диагностика является частью инструментов диагностического поиска и призвана помочь в подтверждении диагноза ГКМП при наличии стертой или неполной клинической картины, а также при наличии системных проявлений заболевания или для исключения фенокопий ГКМП [1-4, 14, 15].
Оценка вклада конкретного генетического варианта должна проводиться в соответствии с рекомендациями Американской коллегии медицинской генетики (American College of Medical Genetics and Genomics — ACMG) от 2015 года, отечественными рекомендациями, разработанными на их основе, а также рядом их модификаций и дополнений, разработанных для отдельно взятых генов [30].
При ГКМП, в дополнение к вышеперечисленным источникам, обязательным документом для интерпретации результатов генетического исследования является руководство по оценке вариантов в гене MYH7 [8].
Оценка патогенной значимости выявленных вариантов должна происходить с обязательным использованием международных баз данных о частоте и патогенной роли генетических вариантов, таких как Clinvar, ClinGen, Varsome, Exac, and Gnomad [22, 23].
Рекомендации по генетическому и клиническому тестированию взрослых родственников
- Каскадный генетический скрининг после предварительного медико-генетического консультирования рекомендуется взрослым родственникам первой степени родства пациентов, имеющих явную патогенную мутацию [3, 4, 8, 18, 27, 31, 174].
ЕОК IB (УДД 5 УУР С)
- Клиническое обследование, включающее ЭКГ, ЭХОКГ и длительное динамическое наблюдение рекомендовано родственникам первой степени родства, у которых выявлена та же явная патогенная мутация, что и у пробанда [3, 4, 18, 27, 149, 150, 172, 174].
ЕОК IС (УДД 5 УУР C)
- Родственников первой степени родства, у которых не выявлена та же явная патогенная мутация, что и у пробанда, рекомендуется вывести из дальнейшего динамического наблюдения, но с рекомендацией обратиться за повторным обследованием, если у них разовьются симптомы или появятся новые релевантные данные [3, 4, 27, 28, 170, 174].
ЕОК IIаB (УДД 5 УУР С)
- Если явной патогенной мутации у пробанда не выявлено или генетический скрининг не проводился, клиническое обследование с ЭКГ и ЭХОКГ рекомендовано предложить родственникам первой степени родства каждые 2–5 лет (или 6–12 месяцев, если имеются диагностически незначимые аномалии) [3, 4, 27, 174].
ЕОК IIаС (УДД 5 УУР С)
Комментарий: предиктивный генетический скрининг основан на использовании информации о конкретной генетической причине заболевания, идентифицированной у пробанда, для определения носительства данного варианта у его родственников. Целью данного скрининга является определение необходимости регулярной диспансеризации и прицельного клинического наблюдения в случае носительства патогенного варианта, а также исключение необходимости такого скрининга при отсутствии носительства патогенного варианта.
При проведении каскадного скрининга членов семьи пробанда рекомендуется сочетать его с клиническом обследованием сердечно-сосудистой системы (анамнестические данные, объективный осмотр, ЭКГ и ЭХОКГ — см. таблицу П8, Приложение Г1) для определения сегрегации выявленного варианта с фенотипом заболевания или для исключения данной сегрегации. Данная информация может быть важна при оценке степени патогенности выявленных вариантов и их классификации в соответствие с критериями Американской коллегии медицинской генетики (American College of Medical Genetics and Genomics — ACMG) [22].
Существует «балльная модель» прогнозирования вероятности обнаружения генетических вариантов в генах, наиболее распространенных при ГКМП, которая включает возраст пациента, женский пол, наличие артериальной гипертензии, морфологию МЖП по типу «reverse curve» и соотношение толщины МЖП/ЗСЛЖ. Сумма баллов ≤2 предсказывает низкую вероятность обнаружения генетических вариантов в причинных генах, наиболее распространенных при ГКМП (таблица П1, Приложение Г2) [8, 29, 93, 144, 170, 175].
Инструментальные диагностические исследования
Электрокардиография и мониторирование ЭКГ
- Проведение ЭКГ (в 12 отведениях) рекомендуется при первичном обследовании всех пациентов с подозрением на ГКМП и в процессе динамического наблюдения [3, 4, 160, 176-180].
ЕОК IB (УДД 5 УУР С)
- Всем пациентам с ГКМП при ухудшении симптоматики рекомендуется повторная регистрация ЭКГ с целью выявления нарушений сердечного ритма и проводимости, ишемии миокарда [3, 4, 160, 176-179].
ЕОК IB (УДД 5 УУР С)
- Регистрация ЭКГ рекомендуется как компонент скрининг-алгоритма у родственников первой степени родства пациентов с ГКМП [3, 4, 27, 135, 160, 170, 174, 177].
ЕОК IC (УДД 5 УУР С)
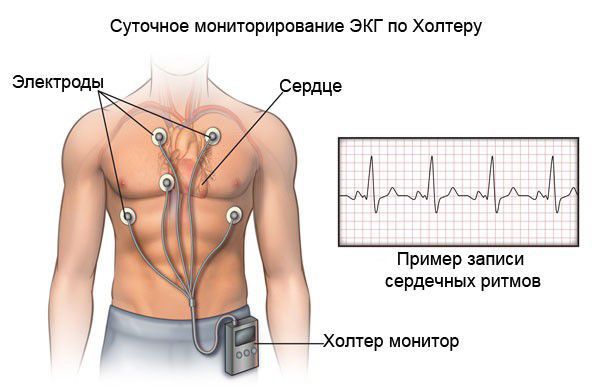
- ХМЭКГ рекомендуется всем пациентам с ГКМП, в том числе асимптомным, с целью выявления нарушений ритма сердца (ФП и ЖТ) и проводимости для стратификации риска ВСС и отбора кандидатов для имплантации ИКД*** [3, 4, 112, 114, 161, 181-183].
УДД 5 УУР C
- Проведение ХМЭКГ (оптимально продолжительностью 48–72 часа) рекомендуется при первичном клиническом обследовании и каждые 12–24 месяцев [4, 161, 176, 181, 184].
ЕОК IIаС (УДД 5 УУР С)
- Рекомендовано использование петлевого регистратора с целью выявления нарушений сердечного ритма у пациентов с жалобами на частые сердцебиения, у которых при длительном мониторировании ЭКГ причина осталась неуточненной [3, 4, 20, 185-187].
ЕОК IIаС (УДД 5 УУР С)
Комментарий: адекватная оценка нарушений ритма и проводимости критически необходима для стратификации риска ВСС, поэтому в некоторых случаях необходим длительный ЭКГ- мониторинг. Кроме рутинного суточного мониторирования ЭКГ, возможны варианты: 48/72-часовой мониторинг, наружный петлевой регистратор, регистратор событий, имплантируемый петлевой регистратор. ЭКГ-диагностика должна повторяться каждые 12–24 месяца, оптимально продолжительностью 48 часов.
Показанием к ХМЭКГ является появление у пациента жалоб на сердцебиение и/или головокружение.
Необходимо учитывать, что нарушения ритма и проводимости могут быть обусловлены проводимой терапией.
ЭКГ-признаки, помогающие в дифференциальной диагностике ГКМП и фенокопий ГКМП, представлены в таблице П2, Приложение Г1 [3, 4, 20, 49, 125, 141, 147, 163, 185, 188-190].
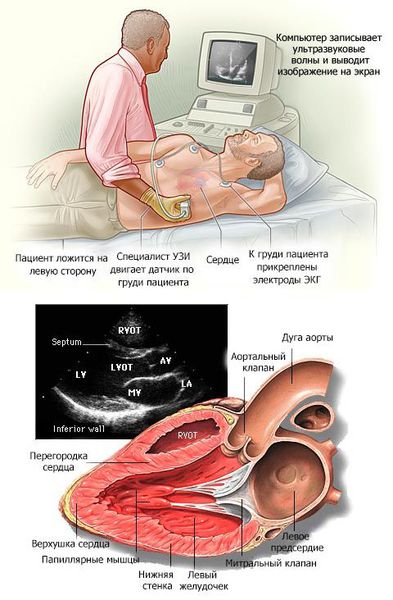
Эхокардиография
ЭХОКГ-исследование пациентам необходимо выполнять в соответствии с рекомендациями по эхокардиографии AHA, ASE (American Society of Echocardiography) и EACVI (European Association of Cardiovascular Imaging) до выхода отечественных рекомендаций [152, 191-196].
- Всем пациентам с подозрением на ГКМП для выявления ГЛЖ и внутрижелудочковой обструкции при первичном обследовании рекомендована ТТ-ЭХОКГ с провокационной пробой Вальсальвы [3, 4, 98, 137, 149, 181, 197-201].
ЕОК IB (УДД 4 УУР С)
- Всем пациентам с ГКМП измерение максимальной диастолической толщины миокарда ЛЖ рекомендуется проводить во всех сегментах, от базальных до верхушки в 2D-режиме по короткой оси ЛЖ [94, 149, 191, 193, 202-204].
ЕОК IB (УДД 4 УУР С)
- Всем пациентам с ГКМП рекомендуется тщательная оценка диастолической функции ЛЖ, включая трансмитральный кровоток, в легочных венах, тканевую допплерографию, измерение размера и объема ЛП для стратификации риска ВСС [91, 94, 95, 98, 108, 137, 195, 205].
ЕОК IB (УДД 4 УУР С)
- Симптомным пациентам с максимальным ГД в ВТЛЖ (в покое или спровоцированным) <50 мм рт. ст. рекомендуется проведение стресс-ТТ-ЭХОКГ для выявления провоцируемой обструкции ВТЛЖ и стресс-индуцируемой МР [68, 109, 116, 137, 152, 199, 206-212]
ЕОК IB (УДД 4 УУР С)
- Асимптомным пациентам с максимальным градиентом давления в ВТЛЖ (покоя или индуцированным) < 50 мм рт.ст. рекомендовано проведение стресс-ТТ-ЭХОКГ, если наличие обструкции имеет значение для рекомендаций по образу жизни и назначения лекарственной терапии [68, 199, 206, 208].
ЕОК IIbС (УДД 4 УУР С)
- У пациентов с субоптимальным качеством изображения или с предполагаемой апикальной гипертрофией ЛЖ или аневризмой, рекомендуется ЭХОКГ с контрастированием полости ЛЖ, как альтернатива МРТ сердца [115, 148, 213-216].
ЕОК IIаС (УДД 5 УУР С)
- Интракоронарное контрастирование миокарда при ТТ-ЭХОКГ во время диагностической КАГ рекомендуется пациентам, у которых планируется САА, для идентификации подходящей для аблации септальной ветви коронарной артерии [196, 216-219].
ЕОК IB (УДД 4 УУР С)
- Повторные ЭХОКГ-исследования рекомендуются пациентам с ГКМП с изменениями в клиническом статусе или появлением новой сердечно-сосудистой симптоматики для своевременного выявления осложнений и динамики ремоделирования сердца [68, 149, 178, 184, 199].
ЕОК IB (УДД 4 УУР С)
- ЭХОКГ рекомендуется как компонент скрининг-алгоритма членов семьи пациента с ГКМП, у которого выявлена ассоциированная с заболеванием генная мутация [3, 4, 27, 135, 170, 174].
ЕОК IС (УДД 5 УУР С)
Комментарий: требуется использовать расширенный протокол ЭХОКГ, адаптированный к диагностике ГКМП. Перечень показателей, входящих в протокол ТТ-ЭХОКГ, представлены в таблице П3, Приложение Г1.
Для дифференциальной диагностики с фенокопиями и при выборе хирургической тактики при ГКМП могут использоваться дополнительные опции при ЭХОКГ, представлены в таблице П4, Приложение Г1.
ЭХОКГ-находки, позволяющие дифференцировать ГКМП и фенокопии ГКМП, представлены в таблице П5, Приложение Г1 [1, 4, 29, 144, 163].
Рекомендации по чреспищеводной эхокардиографиии при ГКМП
- ЧП-ЭХОКГ рекомендована для пациентов, у которых неясен механизм обструкции ВТЛЖ или для оценки состояния МК до процедуры СAА, или если регистрируется выраженная МР, предположительно не связанная с ПСД створок, а обусловленная собственными аномалиями МК [192, 220-223].
ЕОК IIaС (УДД 4 УУР С)
- Пациентам с ГКМП при выполнении САА для корректного определения целевой зоны воздействия рекомендовано интраоперационное ЧП-ЭХОКГ с интракоронарным контрастированием миокарда [196, 216-219].
ЕОК IIaC (УДД 4 УУР С)
Консенсус экспертов EACVI 2015
- Интра/периоперационная ЧП-ЭХОКГ при СМЭ рекомендована пациентам для уточнения механизма обструкции ВТЛЖ, контроля хирургической стратегии, оценки постхирургических осложнений и выявления остаточной обструкции ВТЛЖ [192, 216, 217, 220-224].
ЕОК IС (УДД 4 УУР С)
Проведение провокационной пробы Вальсальвы для диагностики латентной обструкции ВТЛЖ
Пробу Вальсальвы при ТТ-ЭХОКГ следует проводить в положении пациента лежа на левом боку. Пациенту следует напрячь мышцы передней брюшной стенки, что повышает внутрибрюшное и внутригрудное давление. Контроль уровня напряжения целесообразно осуществлять с помощью устройства, представляющего манометр, соединенный с мундштуком; при этом пациента просят удерживать напряжение, чтобы давление на манометре составляло 20–40 мм рт.ст. Во время пробы Вальсальвы регистрируется максимальная скорость кровотока в ВТЛЖ с использованием постоянно-волнового допплера. Если в положении пациента лежа проба отрицательная, то рекомендуется провести пробу в положении сидя и стоя.
Магнитно-резонансная томография
- МРТ сердца с контрастированием (при отсутствии противопоказаний) рекомендуется выполнить как минимум один раз после постановки диагноза ГКМП для уточнения данных ЭХОКГ (анатомии сердца, функции желудочков), а также выявления и оценки распространенности фиброза миокарда и исключения других заболеваний [57, 189, 216, 225-231].
ЕОК IB (УДД 4 УУР С)
Консенсус экспертов EACVI 2015
- Проведение МРТ родственникам пробанда первой линии родства рекомендуется, если постановка диагноза значимо влияет на образ жизни (напр. запрещение соревновательного спорта), а при ЭХОКГ имеется низкое качество изображения, или данные пограничные/сомнительные, или есть изменения на ЭКГ, а ЭХОКГ — без отклонений от нормы [3, 216, 226, 229, 233].
УДД 5 УУР C
Консенсус экспертов EACVI 2015
- Пациентам c предполагаемым амилоидозом сердца рекомендовано МРТ сердца с контрастированием с целью выявления зон ПНГ [49, 53, 56, 57, 164, 234-236].
ЕОК IIаС (УДД 2 УУР A)
- МРТ сердца с контрастированием рекомендуется до операции хирургической и нехирургической редукции МЖП для оценки характера и распространенности гипертрофии и фиброза миокарда [41, 189, 228, 230, 237].
ЕОК IIаС (УДД 4 УУР С)
- МРТ сердца и сосудов должна интерпретироваться специалистами, имеющими опыт в визуализации сердца и оценке заболеваний миокарда [4, 54, 226, 231, 238].
ЕОК IС (УДД 5 УУР С)
Комментарий: МРТ не имеет присущих ЭХОКГ ограничений и является «золотым стандартом» оценки толщины миокарда и объемов ЛЖ и ПЖ (больше точность измерений и воспроизводимость, меньше операторозависимость), поэтому при отсутствии противопоказаний, если позволяют ресурсы и опыт, МРТ должна рассматриваться для пациентов с ГКМП в качестве базового метода исследования [216, 227, 231, 238, 239].
МРТ также позволяет исследовать текстуру миокарда, т.е. наличие и распространенность миокардиального фиброза. Методика основана на том, что в сегментах миокарда с ˃15% фиброза выявляется феномен позднего накопления гадолиния (ПНГ) — задержка вымывания Gd-контраста. Наличие распространенного фиброза является предиктором негативного ремоделирования, развития систолической дисфункции и ХСН, а также относится к дополнительным факторам риска ВСС.
При МРТ выявляются 2 основных паттерна фиброза:
1. Интрамуральный фиброз в пределах гипертрофированных сегментов, который на гистологическом уровне является отражением прямого действия «причинного» генетического варианта и молекулярного патогенеза, проявляющего дискомплексацией кардиомицитов и мышечных волокон — феномен «disarray», фиброзом разной степени выраженности.
2. Зоны фиброза могут быть выявлены в МЖП в передней и/или задней областях, граничащих со свободной стенкой ПЖ (т. наз. «right ventricular insertion points»). Считается, что это интерстициальный фиброз или промежуточный фенотип ПНГ, начальная стадия [99, 216, 230].
Параметры, которые необходимо оценить при МРТ сердца у пациента с ГКМП, представлены в таблице П6, Приложение Г1.
У носителей мутаций в догипертрофической стадии ГКМП при МРТ можно выявить «малые аномалии сердца» — крипты миокарда, аномалии МК, апикальное смещение папиллярных мышц. На доклинической стадии у некоторых пациентов с генотипом(+)/фенотипом(-) могут быть выявлены зоны ПНГ. (см. алгоритм диагностики на доклинической стадии) [239-241].
При МРТ сердца также выявляются аномалии аппарата МК (см. таблицу П6, Приложение Г1).
Кроме значимости в диагностике ГКМП, МРТ сердца играет роль в диагностике фенокопий ГКМП. При амилоидозе зоны ПНГ определяются в эндокардиальных и субэндокардиальных отделах и не зависит от зон кровоснабжения миокарда [57, 236]. При болезни Андерсона-Фабри — наличие интрамиокардиального ПНГ чаще всего по заднебоковому сегменту на базальном и среднем уровнях [171]. У спортсменов с ГЛЖ, отсутствуют зоны ПНГ.
Компьютерная томография / Мультиспиральная компьютерная томография
- Пациентам с ГКМП, у которых низкое качество ЭХОКГ изображения, а проведение МРТ противопоказано для оценки толщины миокарда и размеров полостей сердца рекомендуется выполнять КТ/МСКТ сердца с контрастированием [216, 242].
ЕОК IIаС (УДД 5 УУР С)
Комментарий: КТ сердца, кроме анатомических данных сердца, позволяет также визуализировать коронарные артерии, оценивать их проходимость и анатомические особенности, наличие миокардиальных «мышечных мостиков», что играет важную роль в диагностике ИБС, в том числе при ГКМП у пациентов старшей возрастной группы.
МСКТ сердца, имеющая высокое пространственное разрешение, позволяет обеспечить точное измерение толщины, массы миокарда, объема желудочков и фракцию выброса. Сравнительное исследование показало высокую точность метода МСКТ, сопоставимую с результатами метода МРТ сердца [243, 244].
По сравнению с МРТ, минусом МСКТ является более низкое временное разрешение, более низкое контрастирование мягких тканей и наличие ионизирующего излучения [244].
Сцинтиграфия
- Сцинтиграфию костей (с 99mTc-DPD или 99mTc-пирофосфатом) рекомендуется выполнять пациентам, у которых подозревается ATTR-амилоидоз [163, 164, 235, 245, 246].
ЕОК IIаВ (УДД 2 УУР B)
Комментарий: по данным сцинтиграфии с 99mTc-пирофосфатом возможна точная дифференциальная диагностика AL- и ATTR-амилоидоза сердца (при условии исключения моноклональной гаммапатии неопределенного значения) [45, 235].
Позитронная эмиссионная томография
ПЭТ может использоваться для исследования метаболизма миокарда (радиофармпрепараты — F18 -дезоксиглюкоза и С11 -ацетат) и диагностики автономной дисфункции сердца.
При ГКМП может выявляться нарушение обратного захвата нейромедиаторов и уменьшение плотности бета-адренорецепторов.
Коронарная ангиография
КАГ является методом выбора диагностики наличия и выраженности обструктивного поражения эпикардиальных коронарных артерий.
- Взрослым пациентам с ГКМП с предотвращенной ВСС (после успешных реанимационных мероприятий), пациентам с устойчивой ЖТ и пациентам со стабильной стенокардией ≥3 класса (по классификации Канадского сердечно-сосудистого общества — CCS) рекомендуется инвазивная КАГ с целью диагностики обструктивного поражения эпикардиальных коронарных артерий [3, 4, 74, 113, 242, 247, 248].
ЕОК IС (УДД 5 УУР С)
- Пациентам с ГКМП с типичными болями в грудной клетке (˂3 класс стенокардии по классификации Канадского сердечно-сосудистого общества — CCS), у которых есть промежуточная предтестовая вероятность атеросклеротической ишемической болезни сердца с учетом возраста, пола и факторов риска атеросклероза рекомендуется КАГ или КТ-ангиография с целью диагностики обструктивного поражения эпикардиальных коронарных артерий [4, 74, 242, 249].
ЕОК IIаС (УДД 5 УУР С).
- Для всех пациентов с ГКМП старше 40 лет рекомендуется КАГ или КТ-ангиография до редукции МЖП, независимо от наличия типичного стенокардитического болевого синдрома с целью диагностики обструктивного поражения эпикардиальных коронарных артерий [4, 242, 248, 250].
ЕОК IIаС (УДД 4 УУР С)
Комментарий: необходимость КАГ диктуется особенностью врачебной тактики. При INOCA у пациентов с ГКМП появляется необходимость в постановке стентов при меньшей, чем принято у пациентов с ИБС, степенью стеноза, т.е. при стенозах ˂50%. (см. раздел «Диагностика ГКМП у отдельных категорий пациентов» и раздел «Патогенез») [74, 76, 82, 85, 251].
Инвазивное измерение давления в полостях сердца
- Катетеризация сердца для оценки функции желудочков и давления заклинивания легочной артерии рекомендуется у пациентов, которым планируется трансплантация сердца или механическая поддержка кровообращения [252-257].
ЕОК IB (УДД 5 УУР С)
- У симптомных пациентов с неопределенными результатами неинвазивной визуализации сердца рекомендовано рассмотреть возможность катетеризации левого и правого желудочков для оценки тяжести обструкции ВТЛЖ/ВТПЖ и измерения давления наполнения ЛЖ/ПЖ [69].
ЕОК IIbC (УДД 4 УУР С)
Электрофизиологическое тестирование
- Внутрисердечное электрофизиологическое исследование рекомендуется пациентам с документированными персистирующими или периодическими наджелудочковыми тахикардиями (трепетание предсердий, предсердная тахикардия, атриовентрикулярная узловая риентри тахикардия, тахикардия, опосредованная добавочными проводящими путями) и пациентам с синдромом раннего возбуждения желудочков, для идентификации субстрата аблации и лечения [20, 113, 176, 185, 258-261].
ЕОК IС (УДД 4 УУР С)
- Для отдельных пациентов с документированными, симтомными, мономорфными устойчивыми (>30 с) ЖТ рекомендовано рассмотреть возможность внутрисердечного электрофизиологического исследования для идентификации субстрата аблации и лечения [176, 259, 260, 262, 263].
ЕОК IIbC (УДД 4 УУР С)
Комментарий: пациентам с ГКМП не рекомендовано внутрисердечное электрофизиологическое исследование с программируемой желудочковой стимуляцией в качестве рутинной процедуры для стратификации риска ВСС [4, 111, 176, 262].
Нагрузочные тесты
- Тредмил-тест с мониторированием ЭКГ и АД рекомендуется для стратификации риска ВСС пациентов с ГКМП, при недоступности эргоспирометрии [4, 264, 265].
ЕОК IIаВ (УДД 5 УУР С)
- Пациентам с ГКМП, у которых в покое максимальный ГД в ВТЛЖ ˂30 мм рт.ст., при пробе Вальсальвы ГД ˂50 мм рт.ст. рекомендуется проведение ТТ-ЭХОКГ в условиях нагрузки (стресс-ЭХОКГ) для определения и количественной оценки динамической обструкции ВТЛЖ [152, 208, 211, 266, 267].
ЕОК IIаВ (УДД 5 УУР С)
Комментарий: варианты нагрузочных тестов представлены в таблице П7, Приложение Г1.
Вопросы, на которые должна ответить стресс-ЭХОКГ (должны быть отражены в заключении):
1. Величина нарастания ГД в ВТЛЖ на пике нагрузки и в восстановительном периоде.
2. Реакция АД на нагрузку.
3. Индуцируется ли нагрузкой ишемия миокарда ЛЖ.
4. Усугубляется ли диастолическая дисфункция (E/A, E/e’).
5. Степень изменения митральной регургитации на фоне стресс-ЭХОКГ (динамическая МР).
Наиболее подходит для стресс-ЭХОКГ у пациентов с ГКМП «лежачий велоэргометр», который позволяет получать ЭХОКГ-изображения на разных ступенях нагрузочной пробы (рекомендуется регистрация показателей на ступени нагрузки 50 вт., на пике нагрузки и в восстановительном периоде). Использование тредмила и сидячего велоэргометра не позволяет регистрировать ЭХОКГ-показатели в процессе проведения нагрузки, поэтому регистрация проводится немедленно после ее прекращения и в восстановительном периоде. Показано, что максимальный ГД в ВТЛЖ на пике нагрузки и сразу после ее прекращения почти совпадают [208].
При тредмил-тесте применяют протокол Брюса или модифицированный протокол Брюса. При велоэргометрии ступени теста — 50–100–150 вт.
У пациентов с ГКМП не рекомендуется проводить стресс-ЭХОКГ с добутамином из-за высокого риска индукции ЖНР. Кроме того, добутамин может спровоцировать увеличение ГД в ВТЛЖ у пациентов без ГКМП.
Во время проведения нагрузочного теста регистрируется ЭКГ (постоянно), АД (каждые 2 мин) и изменения клинической симптоматики.
Реакция АД на нагрузку является важнейшей частью нагрузочного тестирования. Неадекватная реакция АД входит в шкалу стратификации риска ВСС у пациентов с ГКМП.
Неадекватной реакцией АД считается:
— гипотензивная (АД на пике нагрузки ниже исходного или если на первых ступенях нагрузки АД несколько повышается, а на пике нагрузки — более чем на 20 мм рт.ст. ниже этого уровня);
— недостаточный прирост АД на пике нагрузки (менее 20 мм рт.ст.).
Критерии прекращения нагрузочного теста:
1. Достижение субмаксимальной ЧСС
2. Выраженная усталость и одышка
3. Боли в области сердца
4. Гипотензия (снижение АД ˃20 мм рт.ст. от исходного)
5. Жизнеопасные ЖНР [68, 87, 109, 116, 152, 199, 206, 207-212].
Эргоспирометрия
- Пациентам с ГКМП с выраженной симптоматикой с систолической и/или диастолической дисфункцией ЛЖ, для определения показаний к трансплантации сердца или механической поддержке кровообращения рекомендуется эргоспирометрия (кардиопульмональное нагрузочное тестирование с одновременным измерением респираторных газов) [4, 252-254, 256,257, 268-271].
ЕОК IB (УДД 3 УУР В)
- Пациентам с ГКМП, независимо от симптоматики, рекомендована эргоспирометрия (или стандартный тредмил-тест, или велоэргометрия при его отсутствии) с целью оценки тяжести и механизма непереносимости физической нагрузки и изменений систолического АД [4, 269, 272, 273].
ЕОК IIаВ (УДД 4 УУР С)
- Эргоспирометрия (или стандартный тредмил-тест, или велоэргометрия при его отсутствии) рекомендовано симптомным пациентам, которым планируется СМЭ/РМЭ для определения ограничений по нагрузке [4, 269, 272, 273, 274].
ЕОК IIаС (УДД 4 УУР С)Иные диагностические исследования
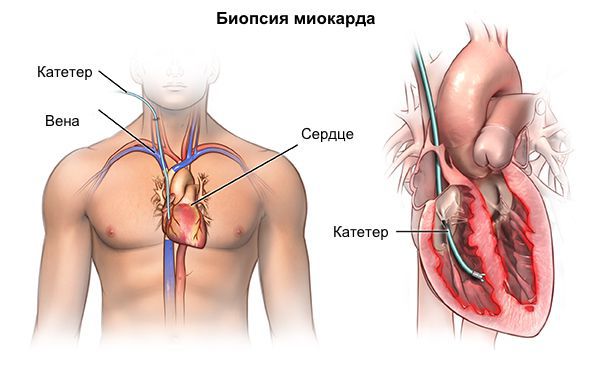
Биопсия миокарда и абдоминального жира
- Биопсия миокарда рекомендована при подозрении на инфильтративные, воспалительные заболевания сердца или болезни накопления которые не могут быть подтверждены другими методами [4, 50, 275, 276].
ЕОК IIаС (УДД 4 УУР С)
- Биопсия абдоминального жира рекомендована при подозрении на амилоидоз [4, 25, 37, 53, 276, 277].
ЕОК IIаВ (УДД 2 УУР С)
Диагностика заболевания у отдельных категорий пациентов
Дифференциальный диагноз ГКМП и ГЛЖ вследствие артериальной гипертензии
На естественное течение ГКМП оказывает влияние наличие факторов кардиометаболического риска (АГ, ожирение/избыточная масса тела), встречаемость которых увеличивается с возрастом [278-282].
В старшей возрастной группе пациентов с доказанной ГКМП встречаемость АГ составляет 70–90%. По определению при ГКМП гипертрофия миокарда ЛЖ не обусловлена нагрузкой давлением, но АГ — это нагрузка давлением, поэтому в случае сочетания ГКМП с АГ требуется модификация критериев ГКМП.
Вероятность ГКМП у пациентов с АГ повышается при наличии одного и более из следующих критериев:
1. указание на семейный анамнез ГКМП или внезапную сердечную смерть (ВСС) в молодом возрасте у родственников первой линии родства;
2. несоответствие между выраженной гипертрофией ЛЖ (максимальная толщина стенок ≥15 мм) и недавно возникшей легкой и умеренной АГ при адекватной приверженности пациента терапии, а также других причин, способных вызвать подобную степень ГЛЖ.
Возможным вариантом критерия ГКМП при сопутствующей АГ является толщина миокарда ЛЖ ≥20 мм; толщина миокарда 15–20 мм представляет «серую зону».
Выбор критерия ГКМП «толщина стенки ЛЖ ≥20 мм» при сопутствующей АГ обусловлен тем, что показано: при перегрузке давлением (АГ, аортальный стеноз или их сочетание) толщина миокарда ЛЖ, как правило, не превышает 20 мм (в некоторых исследованиях превышает 20 мм лишь у единичных пациентов) [82, 212, 247, 278, 279, 283-288].
Если выявленная толщина миокарда у пациента в «серой зоне» (15–20 мм), то вывод о диагнозе ГКМП можно сделать только на основании тщательного анализа большого числа факторов: семейный анамнез, длительность АГ, уровень «нагрузки давлением» (эпизодические повышения АД или стабильно повышенное АД), приверженность пациента терапии АГ, наличие изменений ЭКГ/ЭХОКГ до развития АГ, динамика размеров полостей сердца и увеличения толщины стенок ЛЖ при ЭХОКГ/МРТ и др.).
Следует также учитывать, что при АГ может наблюдаться асимметричная ГЛЖ — по некоторым данным, до 20% (т.е. соотношение тМЖП/тЗС >1,5) [247, 287].
ГКМП и базальная септальная гипертрофия (S-образная МЖП с «выпуклостью» в базальном сегменте)
У пожилых пациентов с S-образной МЖП может выявляться «выпуклость» (англ. bulge) в базальной части перегородки, которая не обусловлена ГКМП. Как правило, у этих пациентов присутствует сопутствующая АГ и/или патология аортального клапана (небольшая аортальная регургитация и/или невыраженный аортальный стеноз) [202, 203, 247, 286, 289].
Базальная септальная гипертрофия может приводить к увеличению ГД в ВТЛЖ, как правило, не выше 15–20 мм рт.ст. в покое и возрастать до 35 мм рт.ст. при нагрузочных пробах [212].
Схема дифференциального диагноза ГКМП и базальной септальной гипертрофии представлена в таблице П 10, Приложение Г1.
ГКМП и инфаркт миокарда 1 и 2 типов
Клинически у пациентов с ГКМП и ишемией миокарда (INOCA) может развиваться острый коронарный синдром и инфаркт миокарда (ИМ) [74, 76, 88, 249].
ИМ при необструктивном поражении эпикардиальных коронарных артерий, ИМБОКА (MINOCA) — это «рабочий диагноз», требующий уточнения причины, лежащей в основе у конкретного пациента.
В генезе ИМ при ГКМП могут обсуждаться следующие патогенетические механизмы (см. также таблицу П9, Приложение Г1.
1. Ишемия при необструктивном поражении эпикардиальных коронарных артерий (INOCA — Ischemia with Non-Obstructive Coronary Arteries) (см. раздел «Патогенез»).
2. Ишемия при обструктивном поражении эпикардиальных коронарных артерий — ИБС в старшей возрастной группе пациентов с ГКМП.
При ГКМП может развиться ИМ 1 типа,диагностика и лечение которого изложены в соответствующих клинических рекомендациях.
Для исключения/подтверждения обструктивного поражения эпикардиальных коронарных артерий пациентам с ГКМП показана инвазивная КАГ или КТ ангиография
Одновременно с КАГ пациентам с ГКМП рекомендуется выполнять ЛЖ-вентрикулорафию, которая выявляет у пациента либо «эпикардиальный паттерн» (зоны нарушения сократимости в пределах стенозированных коронарных артерий), либо «микроваскулярный паттерн» (зоны нарушения сократимости в бассейнах разных коронарных артерий, в том числе и без стенозов) [74, 76, 77, 85, 86, 88, 251, 290-295].
Данный феномен в отечественной литературе называется «ИМБОКА» — инфаркт миокарда без обструкции коронарных артерий (англоязычный термин — MINOCA) или ИМ 2 типа. ИМ 2 типа (ИМБОКА, MINOCA) — это ИМ, развивающийся без атеротромбоза, из-за несоответствия между потребностью миокарда в кислороде и его доставкой.
Ишемия при необструктивном поражении эпикардиальных коронарных артерий (INOCA — Ischemia with Non-Obstructive Coronary Arteries) имеет общий патогенетический механизм как при кардиомиопатиях, так и при фенокопиях ГКМП, например, при амилоидной кардиомиопатии. [56].
Гипертрофическая кардиомиопатия и ГЛЖ у спортсменов
Рекомендации по занятию спортом, физкультурой, участию в спортивных соревнованиях
- Пациентам с ГКМП независимо от возраста, пола, расовой принадлежности, наличия обструкции ВТЛЖ, проведенных ранее операции СМЭ/РМЭ или САА, или имплантации ИКД***, не рекомендовано (противопоказано) участие в спортивных соревнованиях и упражнениях высокой интенсивности [3, 4, 113, 158, 182, 258, 296-299].
ЕОК IC (УДД 5 УУР С)
Комментарий: из-за высокого риска ВСС занятия соревновательными видами спорта пациентам с ГКМП противопоказаны.
Для носителей явных патогенных мутаций без проявлений заболевания по ЭКГ и ЭХОКГ рекомендации по оптимальному уровню физической активности и характеру физических нагрузок должны быть сформулированы после консилиума с участием мультидисциплинарной команды специалистов (врач-генетик, врач-кардиолог, врач по спортивной медицине, медицинский психолог и др) на основе рассмотрения выявленной мутации, результатов регулярных и повторных клинических исследований (МРТ с контрастированием, проведение стресс-ТТ-ЭХОКГ), с учетом стратификации риска ВСС на основе европейской и американской моделей.
Спортсмены высокого класса с ГЛЖ и толщиной стенки ЛЖ ˃13 мм (13–15 мм) составляют лишь небольшую часть (1,5–1,7%). Как правило, это спортсмены с большой массой тела. Именно у этой группы требуется дифференциальный диагноз с ГКМП [182, 297, 299].
Наиболее часто используемые показатели для дифференциальной диагностики ГКМП и адаптивной ГЛЖ у спортсменов представлены в таблице П 11, Приложение Б.
Важным дифференциально-диагностическим признаком является выявление ПНГ при МРТ с контрастированием. Это свидетельствует в пользу ГКМП, однако отсутствие ПНГ не исключает заболевания.
Анализируя спортивную ГЛЖ, необходимо также принимать в расчет следующие факторы: вид спорта и интенсивность тренировок, возраст, пол (у мужчин ГЛЖ больше), рост и вес спортсмена. Окончательный вывод о диагнозе ГКМП у спортсмена делается на основе комплексной оценки как можно большего числа показателей.
Стратификация риска и стратегии первичной и вторичной профилактики ВСС
Показатели ежегодной смертности от сердечно-сосудистых причин у взрослых пациентов с ГКМП составляют 1–2%. ВСС, ХСН и тромбоэмболические осложнения являются основными причинами.
Внезапная сердечная смерть (ВСС) — это смерть, наступающая неожиданно и мгновенно из-за кардиальных причин (у пациента без заболевания сердца или с таковым) в течение 1 ч после появления первых симптомов ухудшения общего состояния.
К понятию ВСС не относят случаи насильственной смерти или смерти, возникающей в результате отравления, асфиксии, травмы или другого какого-либо несчастного случая.
Риск ВСС у пациентов с ГКМП без традиционных факторов риска составляет 5,9% за 10 лет [4, 118].
- 5-летний риск ВСС рекомендуется оценивать при первичном обследовании пациента с ГКМП и в дальнейшем переоценивать каждые 1–2 года или при изменении клинического статуса [4, 114,115, 117, 179, 180, 198, 199, 261, 262].
ЕОК IB (УДД 4 УУР С)
- Шкала HCM Risk-SCD рекомендуется в качестве метода оценки риска внезапной смерти в течение 5 лет для пациентов ≥16 лет без случаев реанимации после эпизодов ЖТ/ФЖ или спонтанной устойчивой ЖТ с потерей сознания или гемодинамическими нарушениями [4, 114,115, 117, 179, 180, 198, 199, 261, 262, 271].
ЕОК IB (УДД 3 УУР B)
Комментарий: регистрация жизнеугрожающих ЖНР и брадиаритмий осуществляется с помощью поверхностной ЭКГ в покое, при ХМЭКГ, с помощью наружного или имплантируемого записывающего устройства, также — при нагрузочной пробе [179].
Независимо от нозологии, подавляющее большинство опасных для жизни желудочковых нарушений сердечного ритма (83,4%) обусловлено электрической нестабильностью миокарда. ВСС чаще обусловлена ФЖ (62,4%), брадиаритмиями (16,5%), ЖТ типа «Torsades de pointes» (12,7%) и ЖТ (8,3%).
ЖТ неустойчивая (ЖТ, состоящая как минимум из 3 желудочковых комплексов, с частотой ≥120 и продолжительностью не более 30 сек, которая прекращается самостоятельно). ЖТ может быть мономорфной (неизмененная морфология комплекса QRS в 12 отведениях) и полиморфной (во время ЖТ в 12 отведениях ЭКГ изменяется конфигурация комплекса QRS;
ЖТ устойчивая (мономорфная, полиморфная) — ЖТ продолжительностью более 30 сек, зачастую не купирующаяся самостоятельно;
Фибрилляция желудочков — нерегулярный желудочковый ритм (обычно с частотой более 300 ударов в минуту) с выраженной вариабельностью длины цикла, морфологии и амплитуды комплексов QRS.
Существует две модели стратификации риска ВСС:
1. На основе традиционных факторов риска (американская модель).
2. На основе расчета индивидуальных оценок риска, персонифицированный подход (европейская модель) – шкала HCM Risk-SCD.
Шкала оценки риска ВСС у пациентов с ГКМП (европейская модель) представлена в таблице П2, приложение Г3.
«Калькулятор» риска ВСС при ГКМП по европейской модели представлен на сайте http://doc2do.com/hcm/webHCM.html).
Шкала оценки риска ВСС у пациентов с ГКМП (американская модель) представлена в таблице П3, приложение Г2.
Европейская модель прогнозирования риска ВСС HCM Risk-SCD имеет ограничения:
1. не применяется у пациентов старше 80 лет и моложе 16 лет;
2. не применяется у пациентов с фенокопиями ГКМП, ГЛЖ у спортсменов
Проведена модификация формулы расчета с использованием такого фактора как максимальная толщина стенки ЛЖ (в HCM Risk-SCD Calculator — рекомендовано указывать не более 35 мм) (продолжается апробация новой модели) [181].
Алгоритм первичной и вторичной профилактики ВСС у пациентов с ГКМП представлен в Приложении Б7).
Лечение
Лечение
Лечение ГКМП включает медикаментозную терапию, эндоваскулярные вмешательства, хирургические и нехирургические методы редукции гипертрофированной МЖП, механическую поддержку кровообращения, трансплантацию сердца.
Рекомендации по лечению ГКМП основаны на данных об эффективности и безопасности применяемых фармакологических средств, полученных в основном в наблюдательных исследованиях. Рандомизированные клинические исследования малочисленны и включают малое количество пациентов [89, 154, 137, 301-310].
Фармакотерапия при ГКМП в основном улучшает симптоматику и предупреждает осложнения (антикоагулянтная терапия при ФП, кордарон-фармакологическая кардиоверсия и профилактика рецидивов ФП, лечение желудочковых нарушений сердечного ритма и др.) [129, 311-314]. Единственные вмешательства при ГКМП, которые, как полагают, влияют на долгосрочный прогноз, представляют собой хирургическую миоэктомию и имплантацию кардиовертера-дефибриллятора*** (ИКД***) [154, 181 300, 315–323].
Сопутствующие заболевания (артериальная гипертензия, сахарный диабет, дислипидемия и др.) рекомендовано лечить в соответствии с существующими национальными клиническими рекомендациями [3, 4, 175, 155, 324-327].
Подходы к медикаментозной терапии на догипертрофической стадии гипертрофической кардиомиопатии
Разрабатываются подходы к фармакотерапии носителей мутации, ассоциированной с ГКМП, на догипертрофической стадии. Клинические исследования и используемые препараты на догипертрофической стадии ГКМП представлены в таблице 5, приложение А3 [328].
1. Медикаментозная терапия
Подходы к медикаментозной терапии на гипертрофической стадии гипертрофической кардиомиопатии у бессимптомных пациентов
- Не рекомендуется назначение бета-адреноблокаторов и блокаторов «медленных» кальциевых каналов (верапамил**) пациентам с бессимптомным течением ГКМП, так как их полезное действие не доказано. [3, 4, 329].
ЕОК IIIC (УДД 5 УУР С)
- Рекомендовано рассмотреть возможность назначения бета-адреноблокаторов или верапамила** асимптомным взрослым с обструкцией ВТЛЖ (покоя или индуцируемой) для снижения ГД в ЛЖ [3, 4, 329, 330].
ЕОК IIbC (УДД 5 УУР С)
Комментарий:
1. Симптомный или бессимптомный пациент, решает врач после детального обследования.
2. Должен быть решен вопрос об отличии истинного отсутствия симптомов от адаптации за счет образа жизни, путем проведения теста с физической нагрузкой и оценки биомаркеров ХСН в динамике.
3. В рамках ведения здорового образа жизни целесообразно проведение аэробных упражнений низкой интенсивности.
4. Необходима ежегодная переоценка риска ВСС, включающая ЭКГ, ХМЭКГ, ЭХОКГ.
5. Алгоритм тактики ведения асимптомных пациентов с ГКМП представлен в Приложении Б1.
Медикаментозная терапия симптомных пациентов с гипертрофической кардиомиопатией
Общие принципы медикаментозной терапии
1. Лечение пациентов с обструктивной и необструктивной формами заболевания имеет существенные различия.
2. Лечение должно быть адаптировано к уникальным характеристикам каждого отдельного пациента.
3. Лекарственные препараты, традиционно применяемые в терапии ГКМП, являются средствами с отрицательным инотропным действием и направлены на купирование или облегчение симптомов заболевания.
4. Правожелудочковая ОГКМП и 2-желудочковая ОГКМП лечатся по тем же принципам, как и при обструкции ВТЛЖ.
Медикаментозная терапия обструкции выходного тракта левого желудочка
- Лечение любыми лекарственными средствами рекомендуется начинать с минимальных доз и с осторожным их титрованием в течение достаточно долгого времени [3, 4, 11, 31, 39, 150, 175, 208, 266, 301, 329,331–335].
ЕОК IB (УДД 5 УУР С)
Комментарий:
Упрощенный алгоритм диагностики и подходов к лечению обструктивных форм ГКМП представлен в Приложении Б2.
Алгоритм фармакотерапии обструктивной ГКМП представлен в Приложении Б3.
- Бета-адреноблокаторы с подбором максимальной переносимой дозы рекомендуются в качестве первой линии терапии для уменьшения симптомов у пациентов с обструкцией ВТЛЖ (покоя и индуцируемой) [3, 4, 11, 31, 39, 40, 150, 175, 266, 301, 329, 331, 333, 335, 336].
ЕОК IB (УДД 2 УУР A)
Комментарий: правила и особенности назначения бета-адреноблокаторов представлены в таблице 1, Приложение А3.
- Верапамил** с подбором максимальной переносимой дозы рекомендуется тем пациентам с обструкцией ВТЛЖ (покоя или индуцируемой), которые не переносят бета-адреноблокаторы или имеют противопоказания к их назначению [3, 4, 11, 31, 39, 175, 301, 329, 332, 335, 337–341].
ЕОК IB (УДД 2 УУР A)
Комментарий: правила и особенности назначения верапамила** представлены в Таблице 2, Приложение А3.
- Дилтиазем с подбором максимальной переносимой дозы рекомендован симптомным пациентам с обструкцией ВТЛЖ (покоя или индуцируемой), которые не переносят бета-адреноблокаторы и верапамил** или имеют противопоказания к их назначению [3, 4, 31, 39, 150, 175, 301, 302, 329, 332, 335, 342].
ЕОК IIС (УДД 2 УУР C)
Комментарий: рекомендуемые начальные и целевые дозы при медикаментозной терапии ГКМП представлены в Таблице 3, Приложение А3.
Пациенты с ГКМП и среднежелудочковой обструкцией ЛЖ должны получать высокие дозы бета-адреноблокаторов (бисопролол**), верапамила** или дилтиазема*, но ответ на лечение часто неоптимальный. Эта когорта пациентов, как правило, имеет симптомный вариант, характеризующийся повышенным риском прогрессирующей ХСН и ВСС. У 25% из них развивается аневризма верхушки ЛЖ [71–73, 215, 294, 343, 344].
Лечение ХСН с ФВ ЛЖ ≥ 50% у пациентов с ГКМП
- Бета-адреноблокаторы, верапамил** рекомендованы для улучшения симптомов сердечной недостаточности у пациентов с обструктивной ГКМП и ХСН II–IV ФК (NYHA) с ФВ ≥50% [3, 4, 11, 31, 39, 101, 132, 150, 175, 198, 302, 325, 326, 329, 340, 341, 345, 346].
ЕОК IIаС (УДД 3 УУР С)
- Малые дозы петлевых и тиазидных диуретиков рекомендованы для пациентов с необструктивной ГКМП и II–IV ФК (NYHA) с ФВ ЛЖ ≥50% для улучшения симптомов ХСН [31, 132, 175, 198, 325, 326, 329, 345–347].
ЕОК IIаС (УДД 5 УУР С)
- Рекомендовано рассмотреть возможность назначения (с осторожностью) низких доз петлевых или тиазидных диуретиков симптомным пациентам с обструкцией ВТЛЖ для уменьшения одышки при нагрузке [3, 4, 31, 51, 132, 175, 198, 329].
ЕОК IIb (УДД 5 УУР С)
Комментарий: алгоритм врачебной тактики лечения ХСН при ГКМП представлен в Приложении Б4.
Подключение низких доз петлевых или тиазидных диуретиков следует осуществлять под контролем ЧСС и ГД, так как уменьшение объема циркулирующей крови у пациентов с ОГКМП может приводить к увеличению Г Д в ВТЛЖ.
- При гипотензии и отеке легких, которые обусловлены тяжелой индуцируемой обструкцией ВТЛЖ, рекомендованы бета-адреноблокаторы (per os или внутривенно) и добутамин** [3, 4, 348].
ЕОК IIаC (УДД 5 УУР С)
Комментарий: в случае развития отека легких при низком АД у пациента ОГКМП с высоким ГД в ВТЛЖ необходимо исключить ОКС, так как использование в этой ситуации органических нитратов и препаратов с положительным инотропным эффектом является опасным для жизни.
- Пациентам с ГКМП и обструкцией ВТЛЖ (покоя или индуцируемой) не рекомендуется применение органических нитратов и ингибиторов фосфодиэстеразы [3, 4, 348, 349].
ЕОК IIIС (УДД 5 УУР С)
- Пациентам с ГКМП и обструкцией ВТЛЖ (покоя или индуцируемой) не рекомендуется применение блокаторов «медленных» кальциевых каналов производных дигидропиридинов (нифедипин**). [3, 4].
ЕОК ШС (УДД 5 УУР С)
Комментарий: основной нежелательный механизм действия органических нитратов и ингибиторов фосфодиэстеразы, обусловлен увеличением обструкции ВТЛЖ.
- Пациентам с ГКМП и обструкцией ВТЛЖ (покоя и индуцируемой) не рекомендуется дигоксин** [3, 4].
ЕОК IIIC (УДД 5 УУР С)
- Пациентам с ГКМП и устойчивым синусовым ритмом не рекомендуется применение сердечных гликозидов [3, 4, 329].
ЕОК IIIС (УДД 5 УУР С)
Комментарий: положительные инотропные препараты, такие как наперстянка, противопоказаны вследствие положительного инотропного и проаритмогенного эффектов.
- Верапамил** не рекомендуется пациентам с обструктивной ГКМП в случаях наличия системной гипотензии и выраженной одышки в покое [3, 4, 329, 350].
ЕОК IIIС (УДД 5 УУР С)
Лечение ХСН с ФВ ЛЖ ˂50% у пациентов с ГКМП
- Пациентам с необструктивной ГКМП и ФВ ЛЖ<50% рекомендуются бета-адреноблокатор в дополнение к АКФ ингибитору (или антагонисту ангиотензина II, если пациент не переносит АКФ ингибиторы) для уменьшения симптомов, снижения риска госпитализаций по поводу ХСН и ВСС (в отсутствие рандомизированных исследований по ГКМП, эффективность по госпитализациям, симптомам и смертности предполагается, но не доказана) [3, 4, 132, 133, 155, 198, 325, 326, 345, 346, 351].
ЕОК IIаС (УДД 5 УУР С)
Комментарий: Бета-адреноблокаторы являются препаратами первой линии, применяемыми для снижения ГД в ВТЛЖ и облегчения симптомов. Отрицательные инотропные эффекты бета-адреноблокаторов являются относительно умеренными, поэтому они могут использоваться даже у пациентов с ГКМП и ХСН с ФВ ЛЖ <50%.
Бета-адреноблокаторы не вызывают резкого изменения ФВ ЛЖ в покое.
Бисопролол** предпочтительней при ГКМП и ХСН с ФВ ЛЖ <50% [329]
- Пациентам с необструктивной ГКМП и II–IV ФК (NYHA) с ФВ ЛЖ <50% рекомендуются малые дозы петлевых или тиазидных диуретиков для уменьшения симптомов, снижения риска госпитализаций по поводу ХСН (в отсутствие рандомизированных исследований по ГКМП эффективность по госпитализациям, симптомам и смертности предполагается, но не доказана) [3, 4, 132, 133, 155, 175, 198, 325 ,326, 345, 346].
ЕОК IIаС (УДД 5 УУР С)
- Пациентам с необструктивной ГКМП с ФВ ЛЖ <50% и постоянными симптомами ХСН II–IV ФК (NYHA), несмотря на лечение АКФ ингибиторами (или антагонистами ангиотензина II, если пациент не переносит АКФ ингибиторы) и бета-адреноблокаторами, рекомендуются альдостерона антагонисты для снижения риска госпитализаций по поводу ХСН и ВСС (в отсутствие рандомизированных исследований по ГКМП эффективность по госпитализациям, симптомам и смертности предполагается, но не доказана) [4, 132, 133, 155, 175, 198, 325, 326, 345, 346].
ЕОК IIаС (УДД 5 УУР С)
Комментарий: алгоритм врачебной тактики лечения ХСН при ГКМП представлен в Приложении Б4.
Тактика лечения пациентов с необструктивной ГКМП с систолической дисфункцией базируется на принципах доказательной фармакотерапии, разработанных для взрослых пациентов с ХСН со сниженной ФВЛЖ, и включает рекомендации по применению бета-адреноблокаторов, АКФ ингибиторов, антагонистов ангиотензина II, диуретиков и др. [155, 175, 325, 326].
Данные, полученные Maron M.S. и соавт. (2018) в проспективном рандомизированном двойном слепом исследовании, не подтверждают использование спиронолактона при ГКМП для улучшения ремоделирования ЛЖ путем уменьшения фиброза миокарда или изменения клинического течения [307].
Лечение синдрома стенокардии у пациентов с ГКМП
- Бета-адреноблокаторы, верапамил**, дилтиазем рекомендованы пациентам с необструктивной ГКМП и стенокардитическими болями при отсутствии обструктивной коронарной болезни сердца [3, 4, 74, 77, 251, 292, 329, 352, 353].
ЕОК IIаС (УДД 5 УУР С)
Комментарий: правила и особенности назначения верапамила** представлены в таблице 2, Приложение А3 и таблице 3, Приложение А3.
Пациенты с ГКМП часто предъявляют жалобы на боль в грудной клетке, которая может иметь или не иметь типичные признаки стенокардии. Этот симптом возникает из-за дисбаланса между поставкой и потребностью кислорода, приводит к гипоперфузии и ишемии миокарда, которая вторична по отношению к уменьшению кровотока через малые интрамуральные коронарные артерии (см. раздел «Патогенез»).
На этапе появления у пациента приступов стенокардии необходимо уточнить, не появилась ли у него индуцируемая нагрузкой латентная коронарогенная обструкция и/или ишемия миокарда.
Рекомендована стресс-ЭХО-КГ для определения показаний к КАГ и реваскуляризации, в том числе при стенозах КА <50%.
Верапамил** способен уменьшать ишемию миокарда, в т.ч. безболевую, и улучшать его диастолическую функцию ЛЖ.
Ранолазин применяют для лечения стенокардии у пациентов, перенесших острый коронарный синдром (РКИ MERLIN TIMI). Он ингибирует поздний натриевый ток в сердечных миоцитах, что уменьшает перегрузку кальцием в этих клетках, тем самым снижая диастолическое напряжение стенки ЛЖ и потребность миокарда в кислороде.
По данным Gentry J.L. и соавт. (2016), регулярное применение ранолазина в течение 2 месяцев в дозировке 500–1000 мг 2 раза в день привело к значительному облегчению стенокардии и симптомов сердечной недостаточности (СН), а также улучшению качества жизни симптомных пациентов с ГКМП [304].
В мультицентровом плацебо-контролируемом исследовании RESTYLE-HCM (Olivotto I., Camici P.G. и соавт., 2018 г.) применение ранолазина в течение 5 месяцев не привело к значимому улучшению переносимости физической нагрузки, показателей диастолической функции, уменьшению уровней МНУП или улучшению качества жизни у пациентов необструктивной ГКМП по сравнению с группой, получавших плацебо. Прием ранолазина достоверно ассоциирован со снижением количества желудочковых экстрасистол по результатам суточного мониторирования ЭКГ. Ранолазин продемонстрировал отличные показатели безопасности [309].
- Рекомендовано рассмотреть возможность использования органических нитратов per os у пациентов с необструктивной ГКМП со стенокардитическими болями и отсутствием обструктивной болезни коронарных артерий [3, 4].
ЕОК IIbС (УДД 5 УУР С)
Лечение артериальной гипертензии у пациентов с ГКМП
Лечение АГ у пациентов с необструктивной ГКМП проводится в полном соответствии с Клиническими Рекомендациями по лечению АГ у взрослых.
Особенности медикаментозной терапии АГ при обструктивной ГКМП:
Шаг 1. Прекратить прием периферических вазодилататоров (если пациент ранее разово или курсами принимал вазодилататоры).
Шаг 2. Назначить максимально переносимые дозы бета-адреноблокатора, верапамила или комбинации обоих препаратов под контролем ЧСС и проводить ЭКГ-мониторинг QT/QTс и АВ-проведения). Предпочтительно использовать пролонгированные и селективные бета-адреноблокаторы (бисопролол**, атенолол**).
Шаг 3. На фоне проводимой терапии бета-адреноблокатором (бисопролол** или атенолол**) при условии эффективного контроля ГД в ВТЛЖ с помощью ЭХО-КГ, нарушений ритма и проводимости, продолжительности интервала QT/QTc по ЭКГ и ХМЭКГ и отсутствии появления дополнительной клинической симптоматики рассмотреть возможность осторожно добавить низкую дозу гидрохлортиазида** с триамтереном** под контролем ГД в ВТЛЖ [327, 329, 332, 354].
Опыт лечения по Sherrid M.V. [332]: при тяжелой обструкции в ВТЛЖ у пациентов с ОГКМП+АГ, не контролируемой фармакотерапией, проводимой в полном объеме, приблизительно четверти пациентов (22%) потребовалась редукция МЖП с целью снижения ГД в ВТЛЖ, и 16% потребовался ДЭКС*** с короткой задержкой АВ для уменьшения ГД в ВТЛЖ у пациентов с исходными (или ятрогенными на фоне комбинированной терапии) нарушениями АВ проведения и внутрижелудочковыми блокадами.
Лечение фибрилляции предсердий у пациентов с ГКМП
ФП является наиболее частой аритмией при ГКМП, распространенность которой зависит от тяжести заболевания: 22% в общей когорте и до 32% в когорте пациентов с показаниями для имплантации ИКД*** и ЭКС***/ДЭКС*** [11, 31, 129, 134, 150, 184, 197, 314, 355–358]. Частота встречаемости ФП de novo в общей когорте ГКМП составляет около 2% в год [129, 314, 357].
Задачами фармакотерапии при ГКМП, осложненной ФП, являются купирование приступа, профилактика рецидивов аритмии и тромбоэмболических осложнений.
Восстановление синусового ритма и профилактика рецидивов фибрилляции предсердий
- Рекомендовано каждые 6–12 месяцев проводить 48-часовое ХМЭКГ для выявления бес-или малосимптомных пароксизмов ФП и определения риска ВСС в когорте пациентов с ГКМП и размером ЛП ≥45 мм, находящихся на синусовом ритме [3, 4, 112, 128, 131, 179, 183, 314, 359–364]
ЕОК IIаС (УДД 4 УУР С)
Комментарий: обнаружение ФП с помощью имплантируемого петлевого регистратора представляет собой уникальную возможность для быстрого выявления бес- или малосимптомных пароксизмов ФП с целью профилактики тромбоэмболических осложнений до того, как случился инсульт. Предикторами и факторами риска возникновения ФП при ГКМП являются: предсердная миопатия, увеличение размера и объема ЛП, повышение уровней NTproBNP в крови, ХСН III–IV ФК (NYHA), пожилой возраст, обструкция ВТЛЖ, вовлечение правых отделов сердца, генетические факторы.
- Восстановление синусового ритма путем прямой электрической или фармакологической кардиоверсии с внутривенным введением амиодарона** рекомендовано у пациентов с недавно возникшей (<48 часов) ФП [113, 131, 183, 314, 359, 364].
ЕОК IIаС (УДД 5, УУР C)
Комментарий: без предшествующей антикоагулянтной подготовки кардиоверсия может быть проведена только в случае, если длительность текущего пароксизма не превышает 48 часов. У пациентов с бессимптомными пароксизмами ФП, а также в ситуациях, когда пациент затрудняется назвать длительность текущего пароксизма и не получает антикоагулянтную терапию постоянно, рекомендуется воздержаться от незамедлительного восстановления синусового ритма.
В этой ситуации возможно применение 2 стратегий ведения.
Первая стратегия: проведение ранней кардиоверсии после ЧП-ЭХОКГ, не выявившей тромбы в полостях предсердий. Антикоагулянтная поддержка во время процедуры восстановления синусового ритма обязательна.
Вторая стратегия: при невозможности проведения ЧП-ЭХОКГ или выявлении тромбов в полостях предсердий при ЧП-ЭХОКГ следует проводить позднюю кардиоверсию после 3 недель антикоагулянтной терапии (после контрольной ЧП-ЭХОКГ, обязательной в случае наличия тромбов в полостях предсердий при первом обследовании).
- Амиодарон** рекомендован для профилактики рецидивов ФП после прямой электрической кардиоверсии [301, 314, 356, 359, 364, 365].
ЕОК IIаB (УДД 4 УУР С)
- Бета-адреноблокатор, верапамил** или дилтиазем** рекомендуются для контроля частоты сокращений желудочков у пациентов с ГКМП с постоянной или персистирующей ФП [3, 4, 111, 131, 301, 314, 359, 364, 365].
ЕОК IС (УДД 5 УУР С)
- Рекомендовано рассмотреть возможность назначения низких доз дигоксина** пациентам с необструктивной ГКМП, страдающим постоянной формой ФП и ХСН II–IV ФК NYHA, с ФВ <50%, для контроля частоты сокращения желудочков [3, 4, 131, 132, 155, 175, 198, 314, 325, 326, 329, 345, 346, 366].
ЕОК IIbС (УДД 5 УУР С)
Комментарий: амиодарон** считается лучшим препаратом для контроля ритма, он безопасен и эффективен у пациентов с ГКМП, осложненной ФП.
Соталол** может использоваться в качестве альтернативного антиаритмического агента в лечении пациентов ГКМП, особенно в случае имплантации ИКД***, хотя клинический опыт его применения ограничен.
Начальные и целевые дозы при лекарственной терапии ГКМП представлены в Таблице 3, Приложение А3
Профилактика тромбоэмболических осложнений у пациентов с ГКМП
- Если нет противопоказаний, антагонисты витамина К (варфарин**, целевое МНО 2,0–3,0) или дабигатрана этексилат** или ривароксабан** или апиксабан** рекомендуются всем пациентам, у которых развилась персистирующая, постоянная или пароксизмальная форма ФП, для профилактики тромбоэмболических осложнений [3, 4, 131, 150, 184, 311–314, 357, 359, 360, 364, 367–373].
ЕОК IС (УДД 2 УУР B)
Комментарий: Необходимо помнить об эмбриотоксичности варфарина (см. раздел «ГКМП у беременных»).
Меньше данных по антикоагулянтной терапии при трепетании предсердий и других предсердных аритмиях, но риск тромбоэмболий при них считается таким же, как при ФП.
- Оценка риска кровотечений при помощи шкалы HAS-BLED рекомендуется при назначении варфарина** без или в сочетании с ингибиторами агрегации тромбоцитов. [3, 4, 131, 314, 359, 360, 364, 368, 311, 313, 369–374]
ЕОК IIаD (УДД 4 УУР С)
Комментарий:
Шкала HAS-BLED (не валидирована для пациентов с ГКМП): баллы ≥ 3 указывают на высокий риск кровотечений и должны быть приняты меры предосторожности с лабораторным и клинико-инструментальным контролем. Шкала HAS-BLED – см.таблицу П5, Приложение Г2.
- Если пациент с ГКМП, осложненной ФП, не может принимать подобранную дозу варфарина** из-за побочных действий или невозможности поддерживать терапевтический уровень антикоагуляции (МНО 2,0–3,0), или невозможности осуществлять мониторинг МНО, рекомендуется использовать дабигатрана этексилат** или ривароксабан**, или апиксабан**. [3, 4, 131, 314, 359, 360, 364, 368, 375, 376, 311, 313, 369–374, 377].
ЕОК IB (УДД 1 УУР B)
Комментарий:
Варфарин** или дабигатрана этексилат** или ривароксабан** или апиксабан** следует назначать независимо от шкалы CHA2DS2-VASс даже после одного эпизода ФП.Шкала CHA2DS2-VASс – см.таблицу П4, Приложение Г2.
- Во всех случаях ГКМП, осложненной ФП, рекомендуется пожизненная терапия варфарином** (МНО 2,0–3,0) или дабигатрана этексилатом** или ривароксабаном** или апиксабаном** даже если синусовый ритм был восстановлен [3, 4, 111, 113, 131, 150, 175, 314, 329, 357, 359, 360, 364, 368, 311, 313, 369–374, 377].
ЕОК IС (УДД 4 УУР С)
- Терапия ацетилсалициловой кислотой в дозировке 75–100 мг плюс клопидогрел** 75 мг в день (при низком риске кровотечений) рекомендуется, если пациент с ГКМП, осложненной ФП, отказывается принимать варфарин** или дабигатрана этексилат** или ривароксабан**, или апиксабан**. [4, 378]
ЕОК IIаB (УДД 5 УУР С)
- Пациентам с ГКМП, осложненной ФП без выраженного увеличения ЛП в случаях рефрактерной к фармакотерапии симптоматики и невозможности использования антиаритмических препаратов рекомендовано проведение катетерных процедур [4, 111, 131, 359, 360, 364, 379].
ЕОК IIаB (УДД 5 УУР С)
Комментарий: Инвазивные методы лечения ФП – см. Лечение, раздел 2. Хирургическое лечение
2. Хирургическое и интервенционное лечение ГКМП
Редукция МЖП
При обструктивной ГКМП хирургический метод лечения является «золотым стандартом» (средние показатели смертности <2%, эффективность более чем у 90% пациентов, частота осложнений <5%).
В некоторых медицинских Центрах редукцию МЖП рекомендуют выполнять пациентам с более мягкой симптоматикой в случаях значительной латентной обструкции, у которых максимальный и индуцируемый ГД ≥ 50 мм рт.ст.
Определяющим фактором для достижения хороших результатов СМЭ/РМЭ и САА является опыт Центров, который должен измеряться более чем 50 процедурами, выполняемыми в год, и более чем 20 процедурами, выполняемыми хирургом или интервенционным кардиологом. Редукция МЖП должна выполняться опытным специалистом, работающим в мультидисциплинарной команде экспертов в лечении ГКМП [3, 4, 106, 213, 321, 320, 380-388].
- Редукция МЖП рекомендуется пациентам ГКМП с ГД в ВТЛЖ (в покое или максимальным провоцируемым) ≥ 50 мм рт. ст., с ХСН III–IV ФК (NYHA), несмотря на максимальную переносимую терапию [3, 4, 73,105, 106, 316-321, 380-384, 388-394].
ЕОК IВ (УДД 2 УУР A)
Комментарий:
Редукция МЖП осуществляется с помощью септальной миоэктомии (СМЭ), расширенной СМЭ (РМЭ) и септальной спиртовой аблации (САА).
Показания к редукции МЖП (СМЭ/РМЭ/САА) представлены в Приложении Б 10.
- Редукция МЖП рекомендована для пациентов с ГКМП и повторными обмороками при нагрузке, вызываемыми ГД в ВТЛЖ (в покое или максимальным провоцируемым) ≥ 50 мм рт.ст., несмотря на оптимальную терапию [3, 4, 123-125].
ЕОК IIаС (УДД 4 УУР С)
Комментарий:
Алгоритм дигностики и врачебной тактики при синкопальных состояниях представлен в Приложении Б8.
Показания к редукции МЖП (СМЭ/РМЭ/САА) представлены в Приложении Б 10.
Алгоритм предоперационной диагностики для выбора дополнительных вмешательств на МК при СМЭ/РМЭ представлен в Приложение Б5. ) (см. также рекомендации к МРТ).
Алгоритм выбора метода редукции МЖП при ГКМП представлен в Приложении Б6.
Сравнение СМЭ/РМЭ и САА представлено Приложении Б 11.
- СМЭ/РМЭ предпочтительнее, чем САА, и рекомендуется пациентам с показаниями к редукции МЖП, имеющим показания для других хирургических вмешательств (на папиллярных мышцах, протезирование митрального клапана, АКШ) [3, 4, 217, 224, 317, 318, 381, 382, 385-387, 391, 398-402].
ЕОК IС (УДД 2 УУР B)
Комментарий:
СМЭ — «миоэктомия по Morrow» трансаортальным доступом (первая операция была проведена в 1958 г.) в большинстве случаев устраняет обструкцию ВТЛЖ, вызванную гипертрофированной МЖП, однако не устраняет аномалии МК, вносящие вклад в обструкцию ВТЛЖ.
Messmer B.J. с соавт. (1994) усовершенствовали миэктомию по Morrow, расширив область резекции гипертрофированной МЖП в апикальном направлении к основанию ПМ (РМЭ). Иногда в англоязычной литературе РМЭ называют процедурой RPR (сокр. от resection — резекция гипертрофированного участка МЖП, plication — укорочение передней створки МК путем создания горизонтальной складки в ее основании, release – освобождение/иссечение аномальных прикреплений гипертрофированных папиллярных мышц).
При выявлении 2-уровневой обструкции (увеличенный ГД в ВТЛЖ и на уровне средней части полости ЛЖ) миоэктомия может быть расширена до середины полости ЛЖ и вокруг основания ПМ, однако данные о долгосрочном эффекте такого подхода ограничены.
В специализированных центрах, имеющих наибольший опыт по лечению пациентов с ГКМП, используется трансапикальный доступ, направленный на снижение ГД и уменьшение симтомов у пациентов среднежелудочковой ОГКМП. В редких случаях при 2- уровневой обструкции ЛЖ используют комбинированный трансапикальный+трансаортальный доступ или правожелудочковый и трансаортальный доступы [71, 343, 403].
При среднежелудочковой ОГКМП, при отсутствии выраженных аномалий митрального клапана может быть выполнена миоэктомия из правого желудочка трансвентрикулярным или транспредсердным доступом. Этот хирургический доступ имеет преимущество перед трансаортальным доступом у пациентов молодого возраста с выраженной гипертрофией МЖП вследствие более низкого риска развития АВБ [404, 405].
При выявлении двухжелудочковой обструкции (увеличенный ГД в ВТЛЖ > 50мм рт. ст. и увеличенный ГД в ВТПЖ > 16мм рт. ст.) может применяться комбинированный доступ: СМЭ трансаортальным доступом и РМЭ доступом со стороны ПЖ.
В специализированных центрах, имеющих наибольший опыт по лечению пациентов с ГКМП, при выявлении двухжелудочковой обструкции, при отсутствии аномалий подклапанных структур митрального клапана миоэктомия может быть выполнена доступом из ПЖ трансвентрикулярным или транспредсердным доступом [106, 321, 406-408].
Аномалии структур аппарата МК, ассоциированные с ГКМП, могут и должны быть устранены во время операции с целью снизить ГД в ВТЛЖ, не прибегая к замене митрального клапана.
Показателями эффективности процедуры РМЭ при ЭХОКГ являются:
1. контакт передней створки МК и МЖП (SAM-syndrome) отсутствует,
2. остаточный ГД в ВТЛЖ при провокации должен быть не более 20 мм рт. ст.
Уровень успеха и частота осложнений главным образом зависят от опыта хирурга или интервенционного кардиолога.
Пожелания пациента (после подробного обсуждения вариантов лечения) имеют значение для принятия окончательного решения.
Выбор метода редукции МЖП (СМЭ/РМЭ или САА) должен основываться на тщательном обследовании пациента и обсуждении мультидисциплинарной командой специалистов.
- Протезирование МК рекомендовано у симптомных пациентов с ГД в ВТЛЖ (в покое или максимальным провоцируемым) ≥ 50 мм рт.ст. и митральной регургитацией от средней до тяжелой степени, не вызванных изолированной ПСД створки МК [3, 4, 321].
ЕОК IIаС (УДД 5 УУР С)
Комментарий: дополнительные врожденные или приобретенные аномалии МК могут вызывать выраженную митральную регургитацию, которая не обусловлена исключительно ПСД МК. В этой ситуации пластика МК (пликация), как правило, не снижает степень регургитации, и устранение ее возможно лишь протезированием МК.
- Рекомендуется рассмотреть возможность протезирования МК у пациентов с ГД в ВТЛЖ (в покое или максимальным провоцируемым) ≥ 50 мм рт.ст. и максимальной толщиной межжелудочковой перегородки ≤16 мм в месте митрально-септального контакта, если имеется митральная регургитация от средней до тяжелой степени после изолированной миоэктомии [4, 409, 410].
ЕОК IIbС (УДД 4 УУР С)
Комментарий: подобные случаи описаны у пациентов, оперированных в первые 2 десятилетия после применения процедуры «миэктомии по Morrow» (изолированной миоэктомии, 1958) [411].
Описаны также методики успешной коррекции обструкции ВТЛЖ и митральной недостаточности путем выполнения трансмитральной СМЭ с отсечением передней створки МК и выполнения СМЭ из ВТЛЖ с последующей пластикой или протезированием МК [405 412].
Для выполнения адекватной редукции МЖП при РМЭ рядом авторов рекомендовано применять различные технические приемы: мобилизация сердца, применение торакоскопии [388].
Специфического обезболивания при хирургических и инвазивных вмешательствах пациентам с ГКМП не требуется.
Рекомендации по ЭКС у пациентов с обструктивной ГКМП
- Рекомендуется рассмотреть возможность постоянной ЭКС*** с оптимальным АВ-интервалом для снижения ГД в ВТЛЖ или для расширения возможности лекарственной терапии бета-адреноблокатором и/или верапамилом** у отдельных пациентов с ГД в ВТЛЖ (в покое или максимальным провоцируемым) ≥ 50 мм рт.ст., синусовым ритмом, имптомами, рефрактерными к лекарственной терапии, имеющими противопоказания к САА или СМЭ/РМЭ, или высокий риск развития АВ-блокады в результате САА или СМЭ/РМЭ [4, 214, 232, 305, 306, 308, 310, 413-415].
ЕОК IIbС (УДД 2 УУР B)
Комментарий: суть метода состоит в изменении последовательности распространения волны возбуждения — сокращение охватывает вначале верхушку желудочков, а затем МЖП, что приводит к уменьшению субаортального ГД благодаря запаздыванию и снижению регионарной сократимости МЖП и, как следствие, расширению ВТЛЖ. Этому способствует также запаздывание систолического движения кпереди передней створки МК и уменьшение его амплитуды. Важное значение имеет подбор наименьшей величины времени задержки нанесения желудочкового импульса после предсердного, которая обеспечивает преждевременную деполяризацию верхушки сердца, не приводя при этом к ухудшению внутрисердечной и центральной гемодинамики (сердечного выброса и АД).
В ряде случаев приходится прибегать к удлинению времени спонтанной АВ-проводимости с помощью терапии бета-адреноблокатором или верапамилом** и даже аблации АВ-узла.
Инвазивные методы лечения ФП пациентов с ГКМП
- Рекомендовано рассмотреть возможность проведения радиочастотной аблации очага ФП пациентам с ГКМП, если ФП не может быть предотвращена антиаритмической терапией, или частота желудочковых сокращений не контролируется лекарственными препаратами, или ассоциирована с непереносимыми побочными действиями лекарственных препаратов [4, 111, 131, 314, 329, 359, 360, 364].
ЕОК IIbС (УДД 5 УУР С)
- Имплантация двухкамерного (DDD) электрокардиостимулятора*** с функцией переключения режима (после аблации АВ-узла у пациентов ГКМП с ФВ ≥50%), рекомендуется при наличии пароксизмальной ФП, и однокамерного (VVIR) — при наличии персистирующей или постоянной формы [4, 232, 305, 314, 359, 360, 364, 41].
ЕОК IС (УДД 5 УУР С)
- Пациентам с ГКМП, осложненной любой формой ФП, и ФВ ˂50% после аблации АВ-узла и при наличии показаний к сердечной ресинхронизирующей терапии рекомендовано рассмотреть возможность имплантации трехкамерного (бивентрикулярного) ЭКС*** [4, 20, 130, 359, 364].
ЕОК IIbС (УДД 5 УУР С)
- Рекомендовано рассмотреть возможность аблации очага ФП во время СМЭ/РМЭ у пациентов с ГКМП, осложненной симптомной ФП при наличии показаний и отсутствии противопоказаний [3, 4, 359, 364, 417-420].
ЕОК IIbС (УДД 5 УУР С)
Комментарий:
Радиочастотная аблация ФП у пациентов с ГКМП менее успешна, чем без ГКМП.
— Предикторами неэффективности лечения ФП при ГКМП являются: дилатация ЛП, обструкция ВТЛЖ, длительность и тип ФП.
— Пациентам с ГКМП и ФП чаще требуются проведение повторных процедур. Ремоделирование предсердий, зависимое от ГКМП, может повлиять на исход, даже если процедура изначально успешна.
Операция Cох-Maze («Лабиринт») либо ее модификации с применением радиочастотной и крио-аблации представляется целесообразной как сопутствующая при СМЭ/РМЭ или протезировании митрального клапана у пациентов с ГКМП, осложненной ФП, рефрактерной к фармакотерапии.
ACCF/AHA (2011) рекомендуют операцию «Лабиринт» у отдельных пациентов с ФП как сопутствующую при СМЭ/РМЭ или протезировании МК (уровень IIаС). В рекомендациях ESC такой рекомендации нет.
Если операция «Лабиринт» показана, то выполняться она должна как сопутствующая, после консилиума мультидисциплинарной командой, хирургом, имеющим опыт выполнения подобного вмешательства.
В центрах, использующих операцию «лабиринт» (модификация III и IV), отмечают, что у пациентов с ГКМП это дополнительное при СМЭ/РМЭ вмешательство является безопасным и эффективным.
Рекомендации по сердечной ресинхронизирующей терапии у пациентов с ГКМП
- Пациентам с ГКМП, максимальным ГД в ВТЛЖ <30 мм рт. ст., ХСН II–IV ФК по NYHA, ФВЛЖ <50% и БЛНПГ с длительностью QRS >120 мс рекомендовано рассмотреть возможность сердечной ресинхронизирующей терапия для улучшения симптоматики [3, 4, 20, 130].
ЕОК IIbС (УДД 4 УУР С)
Рекомендации по практическим аспектам имплантации кардиовертера-дефибриллятора***
Алгоритм первичной и вторичной профилактики ВСС у пациентов с ГКМП представлен в таблице Приложение Б7.
Шкала оценки риска ВСС у пациентов с ГКМП (европейская модель) представлена в таблице П2, приложение Г2.
Шкала оценки риска ВСС у пациентов с ГКМП (американская модель) представлена в таблице П3, приложение Г2.
- Рекомендуется имплантация ИКД*** у пациентов с ГКМП, перенесших остановку сердца по причине ЖТ или ФЖ, или у пациентов со спонтанной устойчивой ЖТ, приводящей к потере сознания или нарушения гемодинамики, при ожидаемой продолжительности жизни >1 года [3, 4, 112, 113, 115-121, 125, 189, 207, 210, 259, 260, 265, 300, 323, 421-423].
ЕОК I B (УДД 5 УУР С)
Комментарий: Для верификации аритмии в отдельных случаях может выполняться инвазивное электрофизиологическое исследование.
- Пятилетний риск внезапной смерти необходимо оценивать при первоначальном обследовании пациента, а также каждые 1–2 года или при изменении клинического статуса [3, 4, 115, 171, 181, 300, 323, 424].
ЕОК I B (УДД 4 УУР С)
- Имплантация ИКД*** рекомендуется пациентам с предполагаемым 5-летним риском внезапной смерти ≥6% и ожидаемой продолжительностью жизни >1 года после подробного клинического обследования с оценкой риска последующих осложнений и влияния ИКД*** на образ жизни, социально-экономический статус и психологическое здоровье [115, 181, 189, 200, 201, 300, 323, 421, 424].
ЕОК IIa B (УДД 3 УУР A)
- Рекомендовано рассмотреть возможность имплантации ИКД*** в отдельных группах пациентов с 5-летним риском ВСС от ≥4 до <6% и ожидаемой продолжительностью жизни >1 года после подробного клинического обследования с оценкой риска последующих осложнений и влияния ИКД*** на образ жизни, социально-экономический статус и психологическое здоровье [115, 171, 189, 181, 323, 424].
ЕОК IIb B (УДД 4 УУР С)
- Рекомендуется рассмотреть возможность имплантации ИКД*** у отдельных пациентов с 5-летним риском ВСС <4% при наличии клинических характеристик с доказанным прогностическим значением, и в случаях, когда в результате оценки риска последующих осложнений и влияния ИКД*** на образ жизни, социально-экономический статус и психологическое здоровье предполагается общее положительное влияние имплантации ИКД*** [3, 4, 84, 115, 181, 189, 200, 201, 228, 323, 424].
ЕОК IIb B (УДД 4 УУР С)
Комментарий: американская модель позволяет оценивать риск ВСС у пациентов с низким/средним риском.
Последние литературные данные показывают, что наличие распространенного фиброза, оцениваемого по ПНГ при МРТ (˃15% ) является предиктором риска ВСС при ГКМП. Этот показатель не входит в европейскую модель стратификации риска, однако если у пациента низкий или средний риск ВСС ( <6%), а при МРТ площадь фиброза ˃15% — это является дополнительным аргументом в пользу имплантации ИКД*** [115, 228, 231].
Рекомендации по имплантации вспомогательных левожелудочковых устройств
- Рекомендуется рассмотреть возможность терапии путем имплантации устройств механической поддержки кровообращения на период нахождения в листе ожидания для некоторых пациентов с терминальной стадией ХСН, которые могут рассматриваться как кандидаты для трансплантации сердца [211, 253, 425, 426].
ЕОК IIbС (УДД 4 УУР С)
Комментарий: в мировой практике 50% операций по пересадке сердца выполняются на фоне предшествующей имплантации устройств механической поддержки кровообращения [253].
Трансплантация сердца у пациентов с ГКМП
- Ортотопическая трансплантация сердца рекомендована для пациентов с ГКМП, имеющих ФВЛЖ <50% и симптомы III–IV ФК по NYHA, или неустранимые желудочковые аритмии, несмотря на оптимальную терапию при наличии показаний и отсутствие противопоказаний для трансплантации [97, 98, 168, 253, 255, 257, 425, 427].
ЕОК IIaB (УДД 4 УУР С)
Комментарий: описана трансформация ГКМП в смешанный фенотип (ГКМП + ДКМП), согласно классстфикации MOGE(s), так называемая дилатационная стадия ГКМП [43].
Трансплантация сердца может быть жизненно важной стратегией лечения при ГКМП в конечной стадии заболевания.
Плохой краткосрочный прогноз у пациентов с дилатационной стадией ГКМП предполагает целесообразность более раннего рассмотрения агрессивных методов лечения, поскольку «окно возможностей» может быть небольшим, особенно у пациентов с семейным анамнезом развития дилатационной стадии ГКМП.
Заключение, что у пациента развивается дилатация ЛЖ, следует основывать на динамике размеров ЛЖ. Даже «нормальные» размеры ЛЖ могут означать «дилатационную стадию», например, в динамике КДРлж 35 мм → 55 мм (при условии корректного измерения).
Посттрансплантационная выживаемость у пациентов с ГКМП сходна с таковой при трансплантации сердца по другим поводам [255, 257, 425, 427].
- Рекомендовано рассмотреть возможность ортотопической трансплантации сердца для пациентов с ФВ ЛЖ ≥ 50% и симптомами ХСН III–IV ФК (NYHA), вызванной диастолической дисфункцией, резистентной к лекарственной терапии при наличии показаний и отсутствии противопоказаний для трансплантации [97, 98, 168, 253, 425, 427].
ЕОК IIIB (УДД 4 УУР С)
Комментарий: кроме дилатационной стадии, при ГКМП тяжелая степень ХСН может наблюдаться при другом варианте негативного ремоделирования — смешанном фенотипе (ГКМП+РКМП).
Итоговый алгоритм врачебной тактики в зависимости от стадии ГКМП и варианта клинического течения представлен в Приложении Б9.
3. Беременность и роды у пациенток с ГКМП
Изменения гемодинамики при беременности
Беременность, как правило, существенно не усугубляет гемодинамические расстройства при ГКМП, поэтому исходно бессимптомные и малосимптомные пациентки с ГКМП переносят беременность хорошо. Однако у некоторых пациенток гемодинамические и нейрогуморальные факторы гестационного периода могут провоцировать развитие нарушений ритма и ХСН.
У беременных с обструктивной формой ГКМП степень обструкции ВТЛЖ может как увеличиться (из-за обычного для беременности увеличения УО, ЧСС, небольшого снижения АД вследствие снижения общего периферического сопротивления), так и снизиться (из-за небольшого увеличения диастолического размера ЛЖ и увеличения диаметра ВТЛЖ) [3, 4, 428-430].
Рекомендации при планировании беременности
- При планировании беременности и наличии ГКМП в семье одного из родителей рекомендована консультация врача-генетика для оценки риска передачи заболевания потомству [29, 30, 174, 428-431].
ЕОК IС (УДД 5 УУР С)
- При планировании беременности пациенткам с ГКМП и обструкцией выносящего тракта ЛЖ с наличием синкопальных состояний и/или жизнеугрожающих нарушений ритма рекомендовано решить вопрос о предварительной хирургической коррекции ГКМП [3, 4, 366, 428, 432].
ЕОК IС (УДД 5 УУР С)
- Экстракорпоральное оплодотворение не рекомендовано (противопоказано) женщинам, у которых ГКМП осложнилась ХСН, ФП, рестриктивным типом наполнения ЛЖ, а также с выраженной гипертрофией ЛЖ [4, 428, 430-433].
ЕОК IС (УДД 5 УУР С)
Тактика ведения беременности при ГКМП
- Если ГКМП диагностирована до беременности или в сроки до 12 недель, а также при подозрении на ГКМП, рекомендована госпитализация женщины в кардиологическое отделение с целью уточнения диагноза, решения вопроса о пролонгировании беременности и, в случае необходимости, лечения [3, 4, 30, 429, 432].
ЕОК IС (УДД 5 УУР С)
- При беременности пациенткам с ГКМП стратификацию материнского риска рекомендовано проводить, используя модифицированную классификацию ВОЗ материнского риска [3, 4, 429, 430-433].
ЕОК IС (УДД 5 УУР С)
Комментарий: в идеале оценка риска должна проводиться до зачатия.
- У пациенток с ГКМП терапию бета-адреноблокатором рекомендовано продолжить, если они принимали их до беременности [3, 4, 366, 428, 432, 433].
ЕОК IIС (УДД 3 УУР B)
- Терапию бета-адреноблокатором рекомендовано начать беременной женщине с ГКМП и симптомами обструкции ВТЛЖ или нарушениями ритма сердца [3, 4, 366, 428, 432, 433].
ЕОК IС (УДД 5 УУР С)
- При терапии бета-адреноблокатором рекомендовано контролировать состояние и темп роста плода [3, 4, 366, 428-433].
ЕОК IС (УДД 5 УУР С)
- Беременным с ГКМП при развитии ФП рекомендовано проведение кардиоверсии [3, 4, 428, 434].
ЕОК IIС (УДД 4 УУР С)
- Беременным с ГКМП и ФП рекомендована антикоагулянтная терапия (выбор препарата — гепарин натрия (нефракционированный или низкомолекулярный) или варфарин** — зависит от срока беременности). Использование дабигатрана этексилата** или ривароксабана**, или апиксабана** не рекомендуется [3, 4, 366, 428, 430, 432].
ЕОК IС (УДД 5 УУР С)
- Терапию варфарином** при ФП у беременных рекомендовано начинать со 2 триместра (в первом триместре возможен тератогенный эффект) и закончить за 1 месяц до родов [3, 4, 428, 430, 432].
ЕОК IB (УДД 5 УУР С)
Комментарий: рекомендуемые режимы антикоагулянтной терапии при ГКМП у беременных с ФП и опасности, связанные с терапией варфарином**, представлены в таблице 4, Приложение А3.
- Большинству беременных с ГКМП рекомендовано программируемое родоразрешение через естественные родовые пути [3, 4, 428, 429, 430, 432].
ЕОК IС (УДД 5 УУР С)
Комментарий:
— Врачебная тактика ведения беременности и родоразрешения представлена в Приложении Б 12
— Выбор медицинского учреждения для ведения беременных и родоразрешения представлен в Приложении Б 13.
— Ограничения в выборе методов диагностики у беременных представлены в таблице П 12, Приложение Г1.
— При ведении беременности и родов интересы матери должны доминировать.
— Большинство женщин с неосложненной ГКМП относятся по модифицированной классификации ВОЗ материнского риска к классу II (ВОЗ II). Часть симптомных пациенток относится к ВОЗ III; они должны наблюдаться в специализированных учреждениях (см. Приложение Б 13).
— Женщины с ГКМП, осложненной ХСН и дисфункцией ЛЖ (дилатационная стадия или присоединение рестриктивного фенотипа), относятся к классу IV материнского риска, и им беременность противопоказана.
— При выраженной симптомной обструкции ВТЛЖ (также относятся к классу IV ВОЗ) беременность может стать возможной после предварительной коррекции обструкции ВТЛЖ.
— Терапию бета-адреноблокатором (метопролол**, резервный — бисопролол**) беременным с ГКМП необходимо осуществлять под контролем ЧСС и АД, т.к. чрезмерное снижение АД может привести к уменьшению маточно-плацентарного кровотока и задержке внутриутробного развития плода [3, 4, 428].
— Контрацепция у женщин с бессимптомной или малосимптомной ГКМП не имеет каких-либо особенностей по сравнению со здоровыми.
— Если ГКМП осложнилась ХСН и ФП, то следует с осторожностью использовать пероральные контрацептивы из-за риска тромбоэмболий. Их использование возможно при адекватной антикоагулянтной терапии [3, 4, 428-430].
Дополнительная информация, влияющая на течение и исход заболевания
Другими важными целями при лечении ГКМП являются:
— коррекция всех потенциально модифицируемых факторов риска (курение, дислипидемия, гипергликемия, ожирение);
— лечение сопутствующих заболеваний в соответствие с национальными клиническими рекомендациями (ИБС, АГ, СД, ХБП).
Медицинская реабилитация
Реабилитация
Специальных рекомендаций по реабилитации пациентов с ГКМП не существует. После хирургического или эндоваскулярного вмешательства пациентам с ГКМП проводятся такие же реабилитационные мероприятия, как и пациентам с другой сердечно-сосудистой патологией, перенесшим хирургические или эндоваскулярные вмешательства.
Госпитализация
Организация оказания медицинской помощи
- Пациентам с неочевидным диагнозом, тяжелыми симптомами или повышенным риском связанных с заболеванием осложнений рекомендуется обследование и лечение у специалистов мультидисциплинарной команды, экспертов в ведении ГКМП [3, 4, 436].
ЕОК IIbС (УУР C, УДД 5)
- Независимо от выраженности симптомов рекомендуется регулярное обследование пациентов и, при возможности, родственников первой степени родства [3, 4, 11, 27, 116, 145, 146, 178, 184, 200, 332, 356, 43].
ЕОК IС (УДД 4 УУР С)
- Рекомендовано во всех случаях ГКМП клиницистам планировать обследование и лечение пациентов в центрах с мультидисциплинарной командой специалистов, с опытом диагностики и лечения заболеваний миокарда [3, 4, 436].
ЕОК IIaС (УДД 5 УУР С)
Показания к плановой госпитализации в медицинскую организацию
1. Уточнение причины ГЛЖ неясного генеза и необходимость в специальных методах исследования (исключение фенокопий ГКМП).
2. Использование диагностических процедур, проведение которых невозможно или нецелесообразно в условиях поликлиники.
3. Трудности в подборе медикаментозной терапии для коррекции синдромов (из-за сочетания патологий ГКМП/ОГКМП + АГ, ГКМП + СД 2 типа, синдром стенокардии).
4. Назначение бета-адреноблокаторов, верапамила**: их комбинации рекомендуется начинать в условиях стационара с малых доз, проводить титрование до максимально переносимых доз под контролем самочувствия и ЭКГ.
5. Рефрактерность к проводимой в полном объеме фармакотерапии и наличие показаний к СМЭ/РМЭ, САА, ЭКС.
Показания к экстренной госпитализации в медицинскую организацию
1. Прогрессия ХСН, требующая интенсивной терапии.
2. Отек легких.
3. Инсульт.
4. Опасные для жизни нарушения сердечного ритма и проводимости, требующие интенсивной терапии.
5. Синкопальные состояния.
6. ОКС.
7. Предотвращенная ВСС.
Показания к выписке пациента из медицинской организации
1. При плановой госпитализации показанием к выписке пациента с ГКМП является улучшение клинической симптоматики на фоне проводимой фармакотерапии, имплантации ИКД***, ЭКС***/ДЭКС***, эндоваскулярного/хирургического лечения (СМЭ/РМЭ, САА)
2. При экстренной госпитализации показанием к выписке пациента с ГКМП является коррекция нарушений ритма и проводимости, в том числе фатальных, отсутствие осложнений требующих, интенсивной терапии и стабилизация ХСН.
3. Нормализация показателей (целевые уровни АД, гликемии, липидограммы) при, соответственно АГ, СД тип 1 или тип 2, дислипидемии, если ухудшение в течение этих заболеваний явилось основанием для плановой или экстренной госпитализации пациентов с ГКМП в сочетании с коморбидной патологией
4. При синдроме стенокардии показанием для выписки пациента с ГКМП является достижение стабилизации состояния пациента с ГКМП на фоне фармакотерапии, эндоваскулярного / хирургического лечения (АКШ)
5. Установление диагноза фенокопий ГКМП, выписка/перевод пациента в специализированные отделения для этиопатогенетического лечения (например, в гематологическое отделение при AL-амилоидозе с изолированным/ преимущественным поражением сердца)
Иные организационные технологии
Целесообразно создание территориальных регистров пациентов с ГКМП.
При анализе работы ЛПУ с пациентами с ГКМП целесообразно оценивать следующие показатели:
— соотношение ГКМП и фенокопий ГКМП, этиологический спектр фенокопий ГКМП;
— соотношение обструктивных и необструктивных форм ГКМП;
— соотношение семейных и спорадических случаев заболевания;
— частоту госпитализаций в связи с прогрессированием ХСН, ФП, ОКС, случаи ВСС;
— потребность в ЭКГ, ЭХОКГ, МРТ, КТ, коронарографии для выполнения рекомендаций по динамическому наблюдению и обследованию пробанда и родственников пациентов первой линии родства;
— cмертность (%), осложнения (%) за год, 3 года, 5 лет;
— частоту выявления факторов кардиометаболического риска (АГ, дислипидемия, ожирение/избыточный вес, СД 1 и 2 типа) в разных возрастных группах ГКМП;
— результаты мониторирования потенциально модифицируемых факторов: антропометрических данных (ИМТ, ОТ), показателей липидного профиля, уровня гликемии) в разных возрастных группах пациентов.
Профилактика
Профилактика
Профилактики ГКМП как заболевания не существует.
Профилактические мероприятия у пациентов с ГКМП заключаются в профилактике основных осложнений заболевания, которые представлены в таблице П3, Приложение Г3.
Общие рекомендации по образу жизни пациенту с ГКМП представлены в Приложении В.
Диспансерное наблюдение пациентов с ГКМП
Пациенты с ГКМП нуждаются в пожизненном наблюдении для выявления изменений в симптоматике и предупреждения осложнений.
На начальном этапе медикаментозного лечения плановые повторные визиты к врачу желательно проводить через 6, 9, 12 месяцев (при необходимости чаще) для оценки переносимости, эффективности и безопасности лечения, а также контроля выполнения врачебных рекомендаций. При недостаточной эффективности и плохой переносимости проводимого медикаментозного лечения рекомендована замена используемого лекарственного препарата с последующим контролем проводимого лечения.
- Всем пациентам с ГКМП, включая носителей патологических мутаций без фенотипических проявлений болезни и пациентов с бессимптомным течением заболевания, рекомендовано динамическое наблюдение, в ходе которого оценивается характер и выраженность клинических, морфологических и гемодинамических нарушений и определяется лечебная стратегия [3, 4, 116, 145, 146, 332, 356, 358].
ЕОК IB (УДД 5 УУР С)
- У клинически стабильных пациентов рекомендуются повторные ТТ-ЭХОКГ каждые 1–2 года [3, 4, 116, 145, 146, 178, 184, 200, 216, 356, 332, 358, 435].
ЕОК IС (УДД 5 УУР С)
Консенсус экспертов EACVI 2015
- Повторные ЭХОКГ-исследования рекомендуются пациентам с ГКМП с изменениями в клиническом статусе или появлением новых сердечно-сосудистых проявлений [3, 4, 116, 145, 146, 178, 184, 200, 356, 332, 358, 435].
ЕОК IB (УДД 5 УУР С)
- 48-часовое ХМЭКГ рекомендуется каждые 12–24 месяца клинически стабильным пациентам, каждые 6–12 — месяцев пациентам с синусовым ритмом и размером ЛП ≥45 мм или при появлении новых жалоб на сердцебиения [3, 4, 112, 181, 184, 314, 421].
ЕОК IС (УДД 5 УУР С)
- Рекомендовано рассмотреть возможность проведения нагрузочного тестирования каждые 2–3 года для клинически стабильных пациентов и каждый год — при прогрессировании симптомов [3, 4, 209, 216, 269].
ЕОК IIbС (УДД 5, УУР C)
- Рекомендовано рассмотреть возможность проведения МРТ сердца каждые 5 лет для клинически стабильных пациентов и каждые 2–3 года — пациентам с прогрессированием заболевания [4, 216, 237].
ЕОК IIbС (УДД 5 УУР С)
Консенсус экспертов EACVI 2015
- Полное обследование, включающее ЭКГ и ТТ-ЭХОКГ и ХМЭКГ, рекомендуется в течение 1– 3 месяцев и 6–12 месяцев после проведения редукции МЖП [4].
ЕОК (УДД 5 УУР С)
Комментарий: неотъемлемой частью мероприятий при лечении и динамическом наблюдении за пациентами с ГКМП должно быть повышение их образовательного уровня. Если даже врач разработает оптимальную программу лечения для каждого конкретного пациента, провести ее в жизнь будет весьма сложно при наличии низкой мотивации к лечению. Все применяемые методы лечения и профилактики должны быть обсуждены и согласованы с пациентом. При выборе режима назначения препарата необходимо учитывать образ жизни пациента. Все рекомендации, даваемые пациенту, должны быть ясными, четкими и соответствовать его интеллектуальному уровню.
Для некоторых пациентов, которым устных рекомендаций недостаточно, следует рассмотреть возможность продублировать их в письменном виде для обеспечения осознанного участия пациента в лечебно-профилактическом процессе и повышения эффективности лечения [3, 4].
Информация
Источники и литература
-
Клинические рекомендации Ассоциации сердечно-сосудистых хирургов России
- 36. Shlyakhto E. V. et al. Cellular aspects of pathogenesis of hypertrophic cardiomyopathy: Role
of cardiomyocyte polyploidy and activation of nuclear antigen of the proliferating cell in
myocardium // Cell tissue biol. 2007. Vol. 1, № 6. P. 582–588.
37. Frustaci A., Russo M.A., Chimenti C. Diagnostic contribution of left ventricular
endomyocardial biopsy in patients with clinical phenotype of hypertrophic cardiomyopathy //
Hum. Pathol. 2013. Vol. 44, № 1. P. 133–141.
38. Leone O. et al. 2011 Consensus statement on endomyocardial biopsy from the Association
for European Cardiovascular Pathology and the Society for Cardiovascular Pathology // Cardiovasc.
Pathol. 2012. Vol. 21, № 4. P. 245–274.
39. Philipson D.J. et al. Emerging pharmacologic and structural therapies for hypertrophic
cardiomyopathy // Heart Fail. Rev. 2017. Vol. 22, № 6. P. 879–888.
40. Roberts R., Sigwart U. Current concepts of the pathogenesis and treatment of hypertrophic
cardiomyopathy // Circulation. 2005. Vol. 112, № 2. P. 293–296.
41. Varnava A.M. et al. Hypertrophic cardiomyopathy: The interrelation of disarray, fibrosis and
small vessel disease // Heart. 2000. Vol. 84, № 5. P. 476–482.
42. Зайцев В.В. и др. Клиническое значение различных методов оценки миокардиального
фиброза при гипертрофической кардиомиопатии // Кардиология. 2020. Т. 60. № 3. С. 44–50.
43. Arbustini E. et al. The MOGE(S) classification for a phenotype-genotype nomenclature of
cardiomyopathy: Endorsed by the world heart federation // J. Am. Coll. Cardiol. 2013. Vol. 62, № 22.
P. 2046–2072.
44. Barcia G. et al. Pitfalls in molecular diagnosis of Friedreich ataxia // Eur. J. Med. Genet. 2018.
Vol. 61, № 8. P. 455–458.
45. Bokhari S. et al. 99mTc-pyrophosphate scintigraphy for differentiating light-chain cardiac
amyloidosis from the transthyretin-related familial and senile cardiac amyloidoses // Circ.
Cardiovasc. Imaging. 2013. Vol. 6, № 2. P. 195–201.
46. Charron P. et al. Danon’s disease as a cause of hypertrophic cardiomyopathy: A systematic
survey // Heart. 2004. Vol. 90, № 8. P. 842–846.
47. Cook A., Giunti P. Friedreich’s ataxia: Clinical features, pathogenesis and management // Br.
Med. Bull. 2017. Vol. 124, № 1. P. 19–30.
48. D’souza A. et al. Localized insulin-derived amyloidosis: A potential pitfall in the diagnosis
of systemic amyloidosis by fat aspirate // Am. J. Hematol. 2012. Vol. 87, № 11. P. E131-132.
49. Dubrey S.W., Hawkins P.N., Falk R.H. Amyloid diseases of the heart: Assessment, diagnosis,
and referral // Heart. 2011. Vol. 97, № 1. P. 75–84.
50. Frustaci A. et al. Evolution of cardiac pathology in classic Fabry disease: Progressive
cardiomyocyte enlargement leads to increased cell death and fibrosis, and correlates with severity
of ventricular hypertrophy // Int. J. Cardiol. 2017. Vol. 248. P. 257–262.
51. Monserrat L. et al. Prevalence of Fabry Disease in a Cohort of 508 Unrelated Patients With
Hypertrophic Cardiomyopathy // J. Am. Coll. Cardiol. 2007. Vol. 50, № 25. P. 2399–2403.
52. Planté-Bordeneuve V., Said G. Familial amyloid polyneuropathy // Lancet Neurol. 2011. Vol.
10, № 12. P. 1086–1097.
53. Quarta C.C. et al. Defining the diagnosis in echocardiographically suspected senile systemic
amyloidosis // JACC Cardiovasc. Imaging. 2012. Vol. 5, № 7. P. 755–758.
54. European Reference Networks in the Field of Rare Diseases: State of the Art and Future
Directions. Third Report [Electronic resource]. 2008. URL: http://www.eucerd.eu/?
post_type=document&p=1204.
55. Sado D.M. et al. Identification and assessment of anderson-fabry disease by cardiovascular
magnetic resonance noncontrast myocardial T1 mapping // Circ. Cardiovasc. Imaging. 2013. Vol. 6,
№ 3. P. 392–398.
- 36. Shlyakhto E. V. et al. Cellular aspects of pathogenesis of hypertrophic cardiomyopathy: Role
-
Клинические рекомендации Российского кардиологического общества
- 1. Габрусенко С.А., Селезнёв Д.М., Наумов В.Г. Генетические аспекты гипертрофической
кардиомиопатии (обзор литературы) // Практикующий врач. 2000. Т. 18. № 2. С. 2–5.
2. Шляхто Е.В. и др. Первичные кардиомиопатии, современное представление //
Терапевтический архив. 2005. Т. 77. № 12. С. 77–83.
3. Gersh B.J. et al. 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic
cardiomyopathy: Executive summary: A report of the American College of cardiology
foundation/American heart association task force on practice guidelines // Circulation. 2011. Vol.
124, № 24. P. 2761–2796.
4. Elliott P. et al. 2014 ESC guidelines on diagnosis and management of hypertrophic
cardiomyopathy: The task force for the diagnosis and management of hypertrophic
cardiomyopathy of the European Society of Cardiology (ESC) // Eur. Heart J. 2014. Vol. 35, № 39. P.
2733–2779.
5. Alfares A.A. et al. Results of clinical genetic testing of 2,912 probands with hypertrophic
cardiomyopathy: Expanded panels offer limited additional sensitivity // Genet. Med. 2015. Vol. 17,
№ 11. P. 880–888.
6. Coats C.J., Elliott P.M. Genetic biomarkers in hypertrophic cardiomyopathy // Biomark. Med.
2013. Vol. 7, № 4. P. 505–516.
7. Elliott P., McKenna W.J. Hypertrophic cardiomyopathy // Lancet. 2004. Vol. 363, № 9424. P.
1881–1891.
8. Kelly M.A. et al. Adaptation and validation of the ACMG/AMP variant classification
framework for MYH7-associated inherited cardiomyopathies: Recommendations by ClinGen’s
Inherited Cardiomyopathy Expert Panel // Genet. Med. 2018. Vol. 20, № 3. P. 351–359.
9. Kokado H. et al. Clinical features of hypertrophic cardiomyopathy caused by a Lys183
deletion mutation in the cardiac troponin I gene // Circulation. 2000. Vol. 102, № 6. P. 663–669.
10. Kostareva A. et al. Deletion in TNNI3 gene is associated with restrictive cardiomyopathy //
Int. J. Cardiol. 2009. Vol. 131, № 3. P. 410–412.
11. Maron B.J. Hypertrophic Cardiomyopathy: A Systematic Review // JAMA. 2002. Vol. 287, №
10. P. 1308–1320.
12. Maron B.J. et al. Moving Beyond the Sarcomere to Explain Heterogeneity in Hypertrophic
Cardiomyopathy: JACC Review Topic of the Week // J. Am. Coll. Cardiol. 2019. Vol. 73, № 15. P.
1978–1986.
13. Mogensen J. et al. Frequency and Clinical Expression of Cardiac Troponin I Mutations in 748
Consecutive Families With Hypertrophic Cardiomyopathy // J. Am. Coll. Cardiol. 2004. Vol. 44. P.
2315–2325.
14. Селезнёв Д.М. и др. Роль мутаций в гене тяжелой цепи сердечного бета-миозина в
российской популяции больных с гипертрофической кардиомиопатией // Кардиология. 2005.
Т. 45. № 4. С. 15–20.
15. Туральчук М.В., Новик Г.А., Гудкова А.Я. Особенности течения кардиомиопатий с
рестриктивным фенотипом, обусловленных мутациями генов сердечного тропонина I и
десмина, и алгоритмы их диагностики // Педиатрическая фармакология. 2011. Т. 8. № 4. С.
112–116.
16. Burton D. et al. Two mutations in troponin I that cause hypertrophic cardiomyopathy have
contrasting effects on cardiac muscle contractility // Biochem. J. 2002. Vol. 362, № 2. P. 443–451.
17. Zhou N. et al. Whole-exome sequencing identifies rare compound heterozygous mutations
in the MYBPC3 gene associated with severe familial hypertrophic cardiomyopathy // Eur. J. Med.
Genet. 2018. Vol. 61, № 8. P. 434–441.
18. Charron P. et al. Accuracy of European diagnostic criteria for familial hypertrophic
cardiomyopathy in a genotyped population // Int. J. Cardiol. 2003. Vol. 90, № 1. P. 33–38.
19. Lopes L.R. et al. Use of high-throughput targeted exome-sequencing to screen for copy
number variation in hypertrophic cardiomyopathy // Eur. J. Med. Genet. 2015. Vol. 58, № 11. P.
611–616.
20. Brignole M. et al. 2013 ESC Guidelines on cardiac pacing and cardiac resynchronization
therapy: The Task Force on cardiac pacing and resynchronization therapy of the European Society
of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association //
Europace. 2013. Vol. 15, № 8. P. 1070–1118.
21. Hiemstra Y.L. et al. Development of and Progression of Overt Heart Failure in
Nonobstructive Hypertrophic Cardiomyopathy // Am. J. Cardiol. 2018. Vol. 122, № 4. P. 656–662.
22. Ho C.Y. et al. The burden of early phenotypes and the influence of wall thickness in
hypertrophic cardiomyopathy mutation carriers: Findings from the HCMNet study // JAMA
Cardiol. 2017. Vol. 2, № 4. P. 419–428.
23. Hodatsu A. et al. Compound heterozygosity deteriorates phenotypes of hypertrophic
cardiomyopathy with founder MYBPC3 mutation: Evidence from patients and zebrafish models //
Am. J. Physiol. — Hear. Circ. Physiol. 2014. Vol. 307, № 11. P. H1594–H1604.
24. Horimoto M. et al. Development of obstructive hypertrophic cardiomyopathy from
nonobstructive hypertrophic cardiomyopathy // Am. J. Cardiol. 1998. Vol. 82, № 3. P. 403–405.
25. Ansari-Lari M.A., Ali S.Z. Fine-Needle Aspiration of Abdominal Fat Pad for Amyloid
Detection: A Clinically Useful Test? // Diagn. Cytopathol. 2004. Vol. 30, № 3. P. 178–181.
26. Canepa M. et al. Comparison of clinical presentation, left ventricular morphology,
hemodynamics, and exercise tolerance in obese versus nonobese patients with hypertrophic
cardiomyopathy // Am. J. Cardiol. 2013. Vol. 112, № 8. P. 1182–1189.
27. Charron P. et al. Genetic counselling and testing in cardiomyopathies: A position statement
of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases //
Eur. Heart J. 2010. Vol. 31, № 22. P. 2715–2728.
28. Finocchiaro G. et al. Impact of demographic features, lifestyle, and comorbidities on the
clinical expression of hypertrophic cardiomyopathy // J. Am. Heart Assoc. 2017. Vol. 6, № 12. P.
e007161.
29. Bos J.M., Ommen S.R., Ackerman M.J. Genetics of hypertrophic cardiomyopathy: one, two,
or more diseases? // Curr. Opin. Cardiol. 2007. Vol. 22, № 3. P. 193–199.
30. Richards S. et al. Standards and guidelines for the interpretation of sequence variants: A
joint consensus recommendation of the American College of Medical Genetics and Genomics and
the Association for Molecular Pathology // Genet. Med. 2015. Vol. 17, № 5. P. 405–424.
31. Marian A.J., Braunwald E. Hypertrophic cardiomyopathy: Genetics, pathogenesis, clinical
manifestations, diagnosis, and therapy // Circ. Res. 2017. Vol. 121, № 7. P. 749–770.
32. Бокерия Л.А. и др. Экспрессия генов матриксной металлопротеиназы-1 (ММР-1),
тканевого ингибитора матриксных металлопротеиназ-1 (TIMP-1), коллагена I и III типов в
миокарде больных идиопатической гипертрофической кардиомиопатией // Бюллетень
НЦССХ им. А.Н. Бакулева РАМН. 2005. Т. 6. № 4. С. 35–42.
33. Гудкова А.Я. и др. Гипертрофическая кардиомиопатия. Клинико-морфологические
сопоставления // Архив патологии. 2012. Т. 74. № 4. С. 8–11.
34. Гудкова А.Я. Характеристика течения обструктивной гипертрофической
кардиомиопатии у взрослых (обзор литературы и результаты собственных исследований) //
Артериальная гипертензия. 2008. Т. 14. № 2, Приложение 2. С. 39–49.
35. Гудкова А.Я., Шляхто Е.В. Клеточные механизмы гипертрофии миокарда при
гипертрофической кардиомиопатии и эссенциальной артериальной гипертензии //
Артериальная гипертензия. 2008. Т. 14. № 4. С. 364–380.
- 1. Габрусенко С.А., Селезнёв Д.М., Наумов В.Г. Генетические аспекты гипертрофической
Информация
Список сокращений
АВ — атриовентрикулярный
АВБ — атриовентрикулярная блокада
АГ артериальная гипертензия
АД — артериальное давление
АТФ — аденозинтрифосфорная кислота
АКФ — ангиотензин-конвертирующий фермент
БЛНПГ — блокада левой ножки пучка Гиса
БПНПГ — блокада правой ножки пучка Гиса
ВСС — внезапная сердечная смерть
ВТЛЖ — выходной тракт левого желудочка
ГКМП — гипертрофическая кардиомиопатия
ГЛЖ — гипертрофия левого желудочка
ГД — градиент давления
ДНК — дезоксирибонуклеиновая кислота
ДЭКС — двухкамерный имплантируемый электрокардиостимулятор
ЖНР — желудочковые нарушения ритма
ЖТ — желудочковая тахикардия
ЗСЛЖ — задняя стенка левого желудочка
ИКД — имплантируемый кардиовертер-дефибриллятор
ИМБОКА — инфаркт миокарда без обструкции коронарных артерий
КАГ — коронароангиография
КДД — конечно-диастолическое давление
КДО — конечно-диастолический объем
КТ/МСКТ — компьютерная томография/мультиспиральная компьютерная томография
ЛЖ — левый желудочек
ЛП — левое предсердие
МЖП — межжелудочковая перегородка
МК — митральный клапан
МНУП — мозговой натрийуретический пептид
МР — митральная регургитация
МРТ — магнитно-резонансная томография
НУЖТ — неустойчивая желудочковая тахикардия
ОГКМП — обструктивная ГКМП
ПНГ — позднее накопление гадолиния
ПСД — переднее систолическое движение
РМЭ — расширенная миоэктомия
САА — септальная алкогольная аблация
СМЭ — септальная миоэктомия
ТТ-ЭХОКГ — трансторакальная эхокардиография
УО — ударный объем
ФВЛЖ — фракция выброса левого желудочка
ФК — функциональный класс
ФЖ — фибрилляция желудочков
ФП — фибрилляция предсердий
ХМЭКГ — холтеровское мониторирование ЭКГ
ХСН — хроническая сердечная недостаточность
ЧП-ЭХОКГ — чреспищеводная эхокардиография
ЧСС — частота сердечных сокращений
ЭКГ — электрокардиография
ЭКС — электрокардиостимулятор, электрокардиостимуляция
ЭХОКГ — эхокардиография
INOCA — ischemia with non-obstructive coronary arteries (ишемия без обструкции коронарных артерий)
LAMP2 — ген лизосом-2-ассоциированного мембранного белка 2
MINOCA — myocardial infarction with non-obstructive coronary arteries (инфаркт миокарда без обструкции коронарных артерий)
Nt-proBNP — N-концевой фрагмент предшественника МНУП
AHA — American Heart Association (Американская ассоциация сердца)
ACC — American College of Cardiology (Американская коллегия кардиологов)
ATTR — транстиретиновый амилоидоз
EACVI — European Association of Cardiovascular Imaging (Европейская ассоциация по сердечно-сосудистой визуализации)
ESC — European Society of Cardiology (Европейское общество кардиологов)
HCM Risk-SCD — шкала риска ВСС при ГКМП
MOGE’S — классификация кардиомиопатий
NYHA — Нью-Йоркская ассоциация кардиологов
Термины и определения
Гипертрофическая кардиомиопатия (ГКМП) — генетически обусловленное заболевание миокарда, характеризующееся гипертрофией миокарда левого (более 1,5 см) и/или правого желудочка, чаще асимметрического характера за счет утолщения межжелудочковой перегородки, что не может объясняться исключительно повышением нагрузки давлением, и возникающее при отсутствии другого сердечного или системного заболевания, метаболического или полиорганного синдрома, связанного с ГЛЖ.
Обструктивная гипертрофическая кардиомиопатия (ОГКМП) — форма ГКМП, сопровождающаяся нарушением внутрисердечной гемодинамики в виде препятствия систолическому изгнанию из ЛЖ и/или правого желудочка (ПЖ), что приводит к увеличению градиента давления (ГД) в выходном тракте левого и/или ПЖ желудочка (ВТЛЖ; ВТПЖ).
ГЛЖ вторичного генеза — универсальная компенсаторно-приспособительная реакция в ответ на известный гемодинамический или другой фактор.
Догипертрофическая стадия ГКМП — этап в развитии заболевания, при котором отсутствуют признаки гипертрофии миокарда, определяемые с помощью визуализирующих методик.
Субклиническая стадия ГКМП — этап в развитии заболевания, при котором нет клинической симптоматики, характерной для ГКМП.
Генотип (+)/фенотип (-) — носители патологической мутации, ассоциированной с ГКМП, догипертрофической и субклинической стадиями ГКМП.
Возрастзависимая пенетрантность — увеличение частоты выявления фенотипических признаков ГКМП, определяемых с помощью рутинных методов (ЭКГ, ЭХОКГ), среди носителей патогенных генетических вариантов по мере повышения возраста.
Внезапная сердечная смерть (ВСС) — ненасильственная, обусловленная заболеваниями сердца смерть, манифестирующая внезапной потерей сознания в течение первого часа с момента появления острых симптомов.
Стратификация риска ВСС — определение независимых предикторов, определяющих вероятность риска ВСС у пациентов с определенной сердечно-сосудистой патологией. Шкала риска ВСС при ГКМП (HCM Risk—SCD) рекомендуется в качестве метода оценки риска ВСС.
Передне-систолическое движение створок митрального клапана — движение створок МК в систолу к МЖП вплоть до касания (митрально-септальный контакт), участвующее в создании обструкции ВТЛЖ. Англоязычный термин — systolic anterior motion syndrome (SAM-syndrome).
Базальная обструкция (обструкция в ВТЛЖ) — препятствие на уровне ВТЛЖ систолическому изгнанию из ЛЖ.
Среднежелудочковая обструкция — препятствие систолическому кровотоку в средней части полости ЛЖ, на уровне срединных сегментов ЛЖ.
«Классический фенотип» ГКМП — морфофункциональный фенотип ГКМП, при котором сочетаются асимметричная ГЛЖ (гипертрофия МЖП), уменьшенный размер полости ЛЖ и обструкция ВТЛЖ.
Латентная обструкция — гемодинамическая форма обструктивной ГКМП, при которой препятствие систолическому изгнанию из ЛЖ возникает только при нагрузке или провокационных пробах.
Негативное ремоделирование (англ. adverse remodeling) — финальная стадия адаптивных и дезадаптивных изменений в пораженном органе. При этом наблюдаются «смешанные» морфофункциональные фенотипы — гипертрофический + дилатационный, гипертрофический + рестриктивный, и, как правило, уменьшение степени гипертрофии.
Расширенная миоэктомия — операция, включающая резекцию МЖП в большем объеме, чем при септальной миоэктомии по A.Morrow, мобилизацию и резекцию гипертрофированных папиллярных мышц и гипертрофированных мышечных трабекул (апикально-базального мышечного пучка).
Редукция МЖП — хирургическое (СМЭ, РМЭ) или эндоваскулярное (САА) воздействие по уменьшению толщины МЖП.
Секвенирование нового поколения расшифровка структуры десятков и сотен генов определяемая одномоментно.
Септальная миоэктомия — операция резекции миокарда в базальных сегментах МЖП.
Уровень достоверности доказательств (УДД) — степень уверенности в том, что найденный эффект от применения медицинского вмешательства является истинным.
Уровень убедительности рекомендаций (УУР) — степень уверенности в достоверности эффекта вмешательства и в том, что следование рекомендациям принесет больше пользы, чем вреда в конкретной ситуации.
Фенокопия ГКМП — заболевание с известным этиопатогенезом, фенотипически похожее на ГКМП.
Феномен «disarray» — беспорядочное расположение кардиомиоцитов и мышечных волокон.
Критерии оценки качества медицинской помощи
Приложение А1. Состав рабочей группы
1. Габрусенко С.А.
2. Гудкова А.Я.
3. Козиолова Н.А.
Другие члены рабочей группы
1. Александрова С.А.
2. Берсенева М.И.
3. Гордеев М.Л.
4. Дземeшкевич С.Л.
5. Заклязьминская Е.В.
6. Каплунова В.Ю.
7. Костарева А.А.
8. Крутиков А.Н.
9. Маленков Д.А.
10. Новикова Т.Н.
11. Саидова М.А.
12. Санакоев М.К.
13. Стукалова О.В.
Члены Рабочей группы подтвердили отсутствие финансовой поддержки / конфликта интересов. В случае сообщения о наличии конфликта интересов член(ы) рабочей группы был(и) исключен(ы) из обсуждения разделов, связанных с областью конфликта интересов.
Приложение А2. Методология разработки клинических рекомендаций
Вследствие того, что члены Российского кардиологического общества входят в состав Европейского общества кардиологов и также являются его членами, все рекомендации Европейского общества кардиологов (ЕОК) формируются с участием российских экспертов, которые являются соавторами европейских рекомендаций. Таким образом, существующие рекомендации ЕОК отражают общее мнение ведущих российских и европейских кардиологов. В связи с этим формирование Национальных рекомендаций проводилось на основе рекомендаций ЕОК, с учетом национальной специфики, особенностей обследования, лечения, учитывающие доступность медицинской помощи. По этой причине в тексте настоящих клинических рекомендаций, одновременно использованы две шкалы оценки достоверности доказательств тезисов рекомендаций: уровни достоверности доказательств ЕОК с УУР и УДД. Добавлены классы рекомендаций ЕОК, позволяющие оценить необходимость выполнения тезиса рекомендаций (Таблицы 1, 2, 3, 4).
Представленные Рекомендации разработаны на основе Российских рекомендаций по диагностике и лечению гипертрофической кардиомиопатии 2016 года, рекомендаций по диагностике и лечению гипертрофической кардиомиопатии Европейского общества кардиологов 2014 года, созданных на основе многолетнего опыта и большого количества исследований по различным аспектам диагностики и лечения ГКМП. В Рекомендациях изложены основные аспекты патогенеза, клинического течения, методы диагностики и принципы лечения пациентов с ГКМП с учетом индивидуальных особенностей пациента.
Целевая аудитория данных клинических рекомендаций:
1. Врач-кардиолог
2. Врач-терапевт
3. Врач общей практики
4. Врач сердечно-сосудистый хирург
5. Врач функциональной диагностики
6. Врач лучевой диагностики
Таблица 1.Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
Таблица 2.Шкала оценки уровней достоверности доказательств (УДД)для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Связанные документы
1. Приказ Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. № 918н «Об утверждении Порядка оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями»
2. Стандарт медицинской помощи больным с обструктивной гипертрофической, другой гипертрофической кардиомиопатией. МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ от 24 мая 2006 года № 380. Об утверждении стандарта медицинской помощи больным с обструктивной гипертрофической, другой гипертрофической кардиомиопатией. URL: http://docs.cntd.ru/document/901984540
3. Приказ Министерства здравоохранения Российской Федерации от 15 июля 2016 г. № 520н «Об утверждении критериев оценки качества медицинской помощи»
4. Приказ Министерства здравоохранения Российской Федерации от 15 июля 2016 г. № 520н «Об утверждении критериев оценки качества медицинской помощи»
5. 4. Приказ Министерства здравоохранения Российской Федерации от 28.02.2019 № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации» (Зарегистрирован 08.05.2019 № 54588)
Таблица 1/А3. Правила и особенности назначения бета-адреноблокаторов при ГКМП
Таблица 2/А3. Правила и особенности назначения верапамила** при ГКМП
Таблица 3/А3. Начальные и целевые дозы при медикаментозной терапии ГКМП
Таблица 4/А3. Рекомендуемые режимы антикоагулянтной терапии при ГКМП у беременных с ФП и опасности, связанные с терапией варфарином**
Таблица 5/А3. Клинические исследования и используемые препараты на догипертрофической стадии ГКМП (адаптировано из: Philipson DJ et al. [39])
Приложение Б. Алгоритмы ведения пациента
Приложение Б1. Алгоритм тактики ведения асимптомных пациентов с ГКМП
Приложение Б2. Упрощенный алгоритм диагностики и подходов к лечению пациентов с обструкцией на уровне ВТЛЖ
Приложение Б3. Алгоритм фармакотерапии обструктивной ГКМП
Приложение Б4. Алгоритм врачебной тактики лечения ХСН при ГКМП
Приложение Б5. Алгоритм предоперационной диагностики для выбора дополнительных вмешательств на МК при СМЭ/РМЭ (адаптировано из [398])
Приложение Б6. Алгоритм выбора метода редукции МЖП
Приложение Б7. Алгоритм первичной и вторичной профилактики ВСС у пациентов с ГКМП
Приложение Б8. Алгоритм диагностики и врачебной тактики при синкопальных состояниях
Приложение Б9. Алгоритм врачебной тактики в зависимости от стадии ГКМП и варианта клинического течения
Приложение Б10. Показания к редукции МЖП (СМЭ/РМЭ/САА)
Приложение Б11. Сравнение СМЭ/РМЭ и САА
(адаптировано из: Batzner A, Schäfers HJ, Borisov KV, Seggewiß H. Hypertrophic Obstructive Cardiomyopathy. Dtsch Arztebl Int. 2019 [393])
Приложение Б12. Врачебная тактика ведения беременности и родоразрешения в зависимости от степени обструкции ВТЛЖ (по [428])
Приложение Б13. Учреждение для ведения беременных с ГКМП
Алгоритм ведения пациента с ГКМП
Приложение В. Информация для пациентов
Общие рекомендации по образу жизни (адаптировано из [4])
Приложение Г.
Приложение Г1. Принципы и особенности диагностики и оценки сердечно-сосудистого риска при ГКМП
Таблица П1/Г1. Изменения лабораторных тестов, позволяющие заподозрить некоторые фенокопии ГКМП (адаптировано из [4])
Таблица П2/Г1. Электрокардиографические аномалии, позволяющие предположить конкретный диагноз фенокопии ГКМП или морфологический вариант ГКМП (по Rapezzi C et al., 2013 [164])
Таблица П3/Г1. Параметры протокола ТТ-ЭХОКГ-исследования у пациента с ГКМП (адаптировано из [216])
Таблица П4/Г1. Дополнительные опции при ЭХОКГ
Таблица П5/Г1. Эхокардиографические особенности, позволяющие предположить диагноз фенокопии ГКМП (адаптировано из [4])
Таблица П6/Г1. Параметры, которые необходимо оценить при МРТ сердца у пациента с ГКМП
Таблица П7/Г1. Варианты нагрузочных тестов
Таблица П8/Г1. Диагностика у родственников пробанда, носителей мутаций генотип(+)/фенотип(-) в догипертрофической стадии (адаптировано из [173])
Таблица П9/Г1. Факторы риска развития инфаркта миокарда 2 типа у пациентов с ГКМП
Таблица П10/Г1. Схема дифференциального диагноза ГКМП и базальной септальной гипертрофии (адаптировано из [437])
Таблица П11/Г1. Дифференциальная диагностика ГКМП и спортивной ГЛЖ
Таблица П12/Г1. Ограничения в методах диагностики при беременности
Таблица П13/Г1. Упрощенная модель клинических вариантов течения ГКМП
Приложение Г2. Шкалы оценки риска
Таблица П1/Г2. Шкала прогнозирования вероятности обнаружения генетических вариантов при ГКМП (адаптировано из [170])
Название на русском языке: Шкала прогнозирования вероятности обнаружения генетических вариантов при ГКМП
Оригинальное название (если есть): нет
Источник (официальный сайт разработчиков, публикация с валидацией): Ingles J. Non-familial hypertrophic cardiomyopathy prevalence, natural history, and clinical implications. Circ Cardiovasc. / Ingles J, Burns C, Bagnall RD et al. // Genet. 2017:10 [170].
Тип (подчеркнуть):
— индекс
— вопросник
— другое (уточнить):
Назначение: клинический инструмент для прогнозирования вероятности обнаружения генетических вариантов при ГКМП
Содержание (шаблон):

Таблица П2/Г2. HCM Risk-SCD. Шкала оценки риска ВСС у пациентов с ГКМП (европейская модель)
Название на русском языке: HCM Risk-SCD. Шкала оценки риска ВСС у пациентов с ГКМП (европейская модель).
Оригинальное название (если есть): HCM Risk-SCD
Источник (официальный сайт разработчиков, публикация с валидацией): O’Mahony C. A novel clinical risk prediction model for sudden cardiac death in hypertrophic cardiomyopathy (HCM Risk-SCD). / O’Mahony C, Jichi F, Pavlou M et al. // Eur Heart J. 2014;35:2010–2020 [181].
Liebregts M. Validation of the HCM Risk-SCD model in patients with hypertrophic cardiomyopathy following alcohol septal ablation / Liebregts M, Faber L, Jensen MK et al. // Europace. 2018;20(FI2):198–203 [300].
«Калькулятор» на сайте http://doc2do.com/hcm/webHCM.html
Тип (подчеркнуть):
— индекс
— вопросник
— другое (уточнить):
Назначение: клинический инструмент для прогнозирования риска ВСС у пациентов с ГКМП.
Содержание (шаблон):
Таблица П3/Г2. Шкала оценки риска ВСС у пациентов с ГКМП (американская модель)
Название на русском языке: Шкала оценки риска ВСС у пациентов с ГКМП (американская модель).
Оригинальное название (если есть): нет
Источник (официальный сайт разработчиков, публикация с валидацией): 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: executive summary: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines // Circulation. 2011; 124(2):2761–2796 [3].
Goff ZD. Sudden death related cardiomyopathies — hypertrophic cardiomyopathy. / Goff Z.D., Calkins H. // Prog Cardiovasc Dis. 2019;62(3):212–216 [121].
Тип (подчеркнуть):
— индекс
— вопросник
— другое (уточнить):
Назначение: клинический инструмент для прогнозирования риска ВСС у пациентов с ГКМП.
Содержание (шаблон):
Ключ (интерпретация) к имплантации ИКД***:
Таблица П4/Г2. CHA2DS2-VASс. Шкала оценки риска тромбоэмболических осложнений у пациентов с фибрилляцией/трепетанием предсердий
Название на русском языке: CHA2DS2-VASс. Шкала оценки риска тромбоэмболических осложнений у пациентов с фибрилляцией/трепетанием предсердий
Оригинальное название (если есть): CHA2DS2-VASс
Источник (официальный сайт разработчиков, публикация с валидацией): Olesen, Jonas Bjerring, et al. Validation of risk stratification schemes for predicting stroke and thromboembolism in patients with atrial fibrillation: nationwide cohort study. Bmj 342 (2011): d124 [438].
Тип (подчеркнуть):
— индекс
— вопросник
— другое (уточнить):
Назначение: клинический инструмент для прогнозирования риска ишемического инсульта и системного тромбоэмболизма при фибрилляции предсердий
Ключ (интерпретация):
Таблица П5/Г2. HAS-BLED. Шкала оценки риска кровотечения
Название на русском языке: HAS-BLED. Шкала оценки риска большого кровотечения в течение 1 года у пациентов с фибрилляцией/трепетанием предсердий, получающих антикоагулянтную терапию в сочетании с ингибиторами агрегации тромбоцитов или без.
Оригинальное название (если есть): HAS-BLED
Источник (официальный сайт разработчиков, публикация с валидацией): Pisters R, Lane DA, Nieuwlaat R, de Vos CB, Crijns HJ, Lip GY. A novel user-friendly score (HASBLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro Heart Survey. Chest. 2010 Nov;138(5):1093-100 [368].
Lip GY, Frison L, Halperin JL, Lane DA. Comparative validation of a novel risk score for predicting bleeding risk in anticoagulated patients with atrial fibrillation: the HAS-BLED (Hypertension, Abnormal Renal/Liver Function, Stroke, Bleeding History or Predisposition, Labile INR, Elderly, Drugs/Alcohol Concomitantly) score. J Am Coll Cardiol. 2011 Jan 11;57(2):173-80 [439].
Тип (подчеркнуть):
— индекс
— вопросник
— другое (уточнить):
Назначение: клинический инструмент для прогнозирования риска большого кровотечения в течение 1 года
Ключ (интерпретация):
Приложение Г3. Иные
Таблица П1/Г3. Молекулярный патогенез фенокопий ГКМП
Таблица П2/Г3. Морфофункциональные фенотипы при ГКМП
Таблица П3/Г3. Основные мероприятия по профилактике осложнений у пациентов с ГКМП
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Дата публикации 29 декабря 2019Обновлено 29 апреля 2021
Определение болезни. Причины заболевания
Кардиомиопатия — это заболевание миокарда неизвестной этиологии, основными признаками которой являются кардиомегалия (увеличение размеров сердца) и/или сердечная недостаточность. При этом поражения клапанов, коронарных артерий, системных и лёгочных сосудов исключаются [4].
Дословно с греческого cardiomyopathia можно перевести как «болезнь мышцы сердца». Термин был предложен в 1957 году [3]. Интерес к этой группе заболеваний возник в 50-х годах прошлого века, когда начали описываться различные случаи заболеваний у пациентов с сердечной недостаточностью. При развитии типичных симптомов у пациентов не было выявлено чёткой причины поражения сердца.
Пусковым механизмом возникновения кардиомиопатии поначалу считали процесс воспаления в сердце, который мог быть спровоцирован вирусными, бактериальными и аутоиммунными повреждениями клеток. Исходя из этой теории, назначение антибиотиков, противовирусных и противовоспалительных препаратов должно было привести к регрессии повреждения и восстановлению функции сердца. Однако практика это не подтвердила.
Риск развития кардиомиопатий повышен у лиц с отягощённой наследственностью, а также после перенесённых острых инфекционных заболеваний. Для появления вторичных кардиомиопатий важно наличие системных аутоиммунных заболеваний, эндокринной патологии (сахарный диабет, тиреотоксикоз) и токсических факторов.
В настоящее время причиной заболевания считают мутацию генов, ответственных за работу комплекса внутриклеточных белков рабочих клеток миокарда — кардиомиоцитов. Уже выявлено свыше 1400 генов, и исследования продолжаются [4].
Первичные кардиомиопатии чаще выявляют в детском и молодом возрасте, вторичные же возможны в любом возрасте.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы кардиомиопатии
Специфических, характерных только для кардиомиопатии симптомов не существует. Именно эта особенность и затрудняет раннюю диагностику заболевания. Кардиомиопатия длительно протекает бессимптомно или малосимптомно, в развёрнутой стадии похожа по клинике на проявления ишемической болезни сердца, различных пороков сердца.
Первыми жалобами, с которыми пациенты обращаются к врачу, являются:
- одышка при привычных нагрузках и иногда в покое;
- болевые ощущения в грудной клетке, возникающие как при нагрузке, так и в покое;
- перебои в работе сердца;
- приступы внезапного сердцебиения;
- потемнения в глазах;
- обмороки.
Нередко заболевание выявляется во время рутинной записи ЭКГ при прохождении профилактических осмотров, однако надо помнить, что первым проявлением заболевания может стать неожиданная (внезапная) смерть, наступившая без видимых причин [9].
Патогенез кардиомиопатии
За последние годы благодаря возможностям генетики было установлено, что причиной многих кардиомиопатий являются генетические мутации, которые приводят к выработке дефектных белков кардиомиоцита. От того, какой белок рабочей клетки миокарда (кардиомиоцита) изменился, зависит развитие определённого вида кардиомиопатии.
Раньше считалось, что кардиомиопатии возникают из-за воспаления в сердце, которое связано с повреждением клеток различными вирусами [5]. Однако исследования показали, что только у части больных развитию кардиомиопатии предшествует вирусное заболевание [6]. В этом случае после острого миокардита (воспаления сердечной мышцы) наступает множественное поражение кардиомиоцитов. Часть из них теряет свои функции, и вместо мышечной сократительной ткани появляется фиброзная малоэластичная ткань. Сохранившийся миокард вынужденно берёт на себя работу умерших клеток и поэтому также изменяется. В итоге возникает деформация как повреждённых участков миокарда, так и оставшихся рабочими, что приводит к изменению анатомии сердца. Стенки и полости сердца деформируются, клапанные кольца зачастую растягиваются.
Подобные изменения бывают также при наследственных нарушениях обмена веществ и лизосомальных болезнях накопления (редких заболеваниях, при которых нарушается функция внутриклеточных органелл лизосом). Из-за врождённой нехватки ферментов, перерабатывающих углеводсодержащие продукты, в организме накапливаются крупные молекулы гликогена, гликопротеина и др., которые повреждают организм. Таких заболеваний известно более сотни, но их распространённость невелика. Как правило, проявляются они в детском и молодом возрасте и помимо поражения сердца затрагивают практически весь организм: кости, мышцы, нервную систему, зрение и слух. Самыми изученными болезнями накопления являются гемохроматоз, болезнь Пике и болезнь Фабри.
Имеются особые семейные формы кардиомиопатий, поэтому важно изучение наследственности пациентов и сбор семейного анамнеза [6].
Нередко возникают проблемы при обследовании спортсменов, так как из-за регулярных нагрузок их сердечная мышца компенсаторно увеличивается, и развивается так называемое «спортивное сердце» [9]. Поэтому в таких случаях для достоверной дифференциальной диагностики необходимы точные генетическое тесты, которые сейчас только разрабатываются. Вероятно, что при этих факторах имеется генетический дефект, который при регулярных физических нагрузках приводит к развитию кардиомиопатии.
Классификация и стадии развития кардиомиопатии
По мере накопления информации были выявлены самые распространённые типы кардиомиопатии и их семейные формы:
- гипертрофическая;
- дилатационная;
- рестриктивная.
К редким формам кардиомиопатии относят также системные заболевания и патологические состояния, при которых возникают так называемые вторичные кардиомиопатии: диабетическая, тиреотоксическая, алкогольная, аутоиммунная и другие.
Исходя из причины развития болезни, становится ясным, что кардиомиопатии могут быть как изолированными – первичными, так и являться частью системного заболевания, т. е. быть вторичными.
В России традиционно применяется клинико-морфологическая классификация первичных кардиомиопатий, где кардиомиопатии разделяются на:
- гипертрофическую;
- дилатационную;
- рестриктивную;
- аритмогенную дисплазию правого желудочка;
- редкие формы неклассифицируемых кардиомиопатий.
При гипертрофической кардиомиопатии имеется выраженное, чаще неравномерное увеличение миокарда левого и/или реже правого желудочка. При этом чаще разрастается межжелудочковая перегородка. Она препятствует току крови из сердца в аорту. Это увеличение миокарда при гипертрофической кардиомиопатии появляется без видимых причин. Известно, что сердце может увеличиваться из-за длительной гипертонии, ишемической болезни сердца врождённых и приобретённых пороках сердца [1].
Анатомическая классификация гипертрофической кардиомиопатии в зависимости от локализации:
I. Гипертрофия левого желудочка:
- Асимметрическая:
- гипертрофия межжелудочковой перегородки — 90 % случаев;
- среднежелудочковая гипертрофия — ≈ 1 %;
- верхушечная гипертрофия — ≈ 3%;
- гипертрофия боковой или задней части межжелудочковой перегородки ≈ 1 %.
- Симметрическая, или концентрическая — ≈ 5 %.
II. Гипертрофия правого желудочка — менее 1 % [1].
В зависимости от наличия обструкции выносного тракта левого желудочка (область между межжелудочковой перегородкой и передней створкой митрального клапана) в покое и при нагрузке выделяют два типа гипертрофической кардиомиопатии:
- обструктивный тип — градиент давления (разница в показателях давления крови) в выносном тракте левого желудочка > 30 мм рт. ст.;
- скрытый — градиент давления усиливается при нагрузке > 30 мм рт. ст.;
- необструктивный — градиент давления < 30 мм рт. ст. в покое и при нагрузке.
Такие варианты и типы гипертрофической кардиомиопатии важны для выбора метода лечения пациента, в том числе и хирургического.
При дилатационной кардиомиопатии выявляется растяжение всех камер сердца и снижение его систолической функции. При этом падает сила, с которой сердце выталкивает кровь в большой круг кровообращения. Рестриктивная кардиомиопатия — редкий вид кардиомиопатии. При ней нарушается эластичность миокарда при сохранной систолической функции сердца. Чаще всего это случается в результате фиброзных изменений эндокарда, субэндокарда и миокарда, то есть при разрастании соединительной ткани. При это размеры сердца остаются нормальными или даже уменьшаются.
Рестриктивная кардиомиопатия может быть идиопатической или вторичной по отношению к другим заболеваниям, в частности к эндомиокардиальному фиброзу, саркоидозу и амилоидозу, а также развивается в рамках карциноидного синдрома, при котором повышена выработка вазоактивных веществ (серотонина, гистамина, простагландинов, брадикинина).
К тяжело выявляемым видам относится аритмогенная дисплазия правого желудочка, при которой происходят структурные изменения в строении стенки правого желудочка — замещение кардиомиоцитов фиброзно-жировой тканью и развитие аритмии.
Неклассифицируемые кардиомиопатии: некомпактный миокард, стресс-индуцированная кардиомиопатия.
Вторичные (специфические) кардиомиопатии: при имеющемся известном заболевании тяжесть поражения сердца более выражена и не соответствует причине:
- ишемическая кардиомиопатия (вследствие ишемической болезни сердца);
- гипертоническая кардиомиопатия;
- воспалительная кардиомиопатия как исход миокардита;
- метаболические кардиомиопатии (эндокринные, семейные болезни накопления, дефицит витаминов);
- генерализованные системные заболевания (патология соединительной ткани, инфильтрации и гранулёмы);
- мышечные дистрофии при генерализованных миотонических дистрофиях;
- нейромышечные нарушения при атаксии (нарушении согласованности движений различных мышц);
- как следствие токсического воздействия алкоголя, медикаментов и облучения. Если доказана чёткая связь между повреждающим фактором и развитием кардиомиопатии, то её могут назвать токсической, лекарственной или лучевой кардиомиопатией;
- перипартальная кардиомиопатия во время беременности и после родов.
Осложнения кардиомиопатии
Особенности течения кардиомиопатии представляют угрозу для жизни. Болезнь может дебютировать сразу внезапной смертью или жизнеугрожающими аритмиями: фибрилляцей желудочков, желудочковой тахикардией. Высокий риск внезапной сердечной смерти связан с такими факторами риска, как:
- семейный анамнез (случаи внезапной сердечной смерти из-за гипертрофической кардиомиопатии);
- обмороки;
- зафиксированная частая желудочковая тахикардия;
- падение артериального давления при нагрузках;
- толщина мышечной тени левого желудочка более 3 см;
- обширное и диффузное позднее усиление контрастности гадолиния на МРТ [15].
При более стабильном течении развивается сердечная недостаточность, которая тяжело поддаётся традиционной медикаментозной терапии. Хроническую сердечную недостаточность можно заподозрить по следующим признакам:
- одышка, возникающая при нагрузке различной интенсивности;
- повышенная утомляемость при выполнении привычной деятельности;
- учащённое сердцебиение;
- появление отёков на ногах к концу дня.
С утяжелением недостаточности все симптомы становятся более выраженными. Выделяют пять стадий сердечной недостаточности:
- I стадия (HI) — начальная — проявляется в виде одышки и сердцебиения только при значительной физической нагрузке.
- II стадия — нарушение гемодинамики при незначительной физической нагрузке, иногда в покое.
- Н IIА стадия — одышка и сердцебиение при умеренной физической нагрузке. Нерезкий цианоз. Появление сухого кашля, иногда кровохарканье, сердцебиение, перебои в области сердца. Заметно снижается трудоспособность.
- Н IIБ стадия — одышка в покое. Вся объективная симптоматика сердечной недостаточности резко усиливается: выраженный цианоз, застойные изменения в лёгких, длительные ноющие боли, перебои в области сердца. Присоединяются признаки недостаточности кровообращения по большому кругу, постоянные отёки. Больные нетрудоспособны.
- III стадия (Н III) — конечная, дистрофическая стадия недостаточности — развиваются необратимые изменения в органах, нарушается обмен веществ, развивается истощение больных. Лечение неэффективно.
Диагностика кардиомиопатии
Особых признаков, характерных для этого заболевания, при сборе жалоб и осмотре пациента выявить не удаётся.
При клиническом осмотре обращают на себя внимание признаки сердечной недостаточности различной степени выраженности, аритмии, возможны тромбоэмболические осложнения.
В основном кардиомиопатии выявляются при проведении эхокардиографии (ЭХОКГ) и электрокардиографии (ЭКГ). Дополнительно применяются рентгеноконтрастная вентрикулография и магнитно-резонансная томография (МРТ) с контрастированием гадолинием.
Наиболее точную информацию о заболевании предоставляет эхокардиография[8]. Это исследование безопасно, доступно и является рутинным методом в кардиологии. Благодаря ЭХОКГ можно установить тип кардиомиопатии, степень утолщения сердечной мышцы, наличие постоянного или преходящего препятствия току крови из выходного отдела сердца или растяжения его полостей. Метод незаменим при динамическом наблюдении за пациентами, позволяет оценить прогноз и тяжесть заболевания.
В современной кардиологии всё больше распространяются новые методы визуализации сердца и сосудов — например, магнитно-резонансная томография (МРТ). Но её недостатком является дороговизна оборудования и малая доступность методики из-за отсутствия качественного оборудовании и специалистов.
На стандартной ЭКГ также могут быть зарегистрированы изменения в виде признаков гипертрофии миокарда левого желудочка, а также признаки его перегрузки и различные нарушения ритма сердца.
При холтеровском мониторировании ЭКГ также фиксируются нарушения ритма и проводимости практически в 100 % случаях. Выявление таких нарушении ритма сказывается на подборе базисной терапии кардиомиопатии.
В особых случаях для уточнения диагноза редких форм кардиомиопатии (например, при амилоидозе) возможна прижизненная биопсия миокарда. Методика инвазивная, потенциально опасная для пациента, требует использования уникального комплекса аппаратуры и высочайшей квалификации специалистов, что возможно только в нескольких научных кардиологических центрах РФ.
Из лабораторных методов диагностики помимо стандартных анализов крови (клинического и биохимического), необходимо отметить ДНК-диагностику. Она является «золотым стандартом» при подозрении на кардиомиопатию согласно мировым (европейским и американским) руководствам. Этот подход на данный момент является практически единственным, который применим для раннего выявления и прогнозирования риска развития семейных форм кардиомиопатии. В России такой уровень диагностики возможен в единичных лабораториях и является дорогостоящей процедурой из-за своей уникальности.
Лечение кардиомиопатии
По современным представлениям стратегия лечения пациента определяется в процессе разделения больных на категории в зависимости от типа кардиомиопатии.
Все больные с выявленной кардиомиопатией, независимо от течения заболевания (в том числе и бессимптомные), нуждаются в динамическом наблюдении. Кратность наблюдения и объём обследований определяются индивидуально. В обязательный перечень входят стандартные анализы (клинический и биохимический анализ крови), ЭКГ, ЭХОКГ и холтеровское мониторирование ЭКГ.
Лечебная тактика зависит от множества факторов и подбирается индивидуально. При этом учитываются анатомические особенности — обструкция выносного тракта левого желудочка, растяжение полостей сердца, наличие клапанной патологи, стадия сердечной недостаточности и также сопутствующие заболевания. Необходимо выявлять факторы, повышающие риск внезапной смерти и жизнеугрожающих аритмий [15]
К общим мероприятиям относятся ограничение значительных физических нагрузок и исключение занятий спортом, которые могут вызывать дальнейшую нагрузку на миокард [9]. Но больным кардиомиопатией не требуется полное исключение физических нагрузок и соблюдение постельного режима [10]. Уровень нагрузок, их частота, интенсивность и длительность подбираются индивидуально. Показано исключить употребление алкоголя и табакокурение.
При дилатационной кардиомиопатии необходимо лечить причину развития растяжения полостей сердца, если это возможно. В медикаментозной терапии сердечной недостаточности применяют все стандартные группы лекарств:
- ингибиторы АПФ;
- блокаторы рецепторов ангиотензина II;
- бета-блокаторы;
- блокаторы рецепторов альдостерона;
- диуретики;
- дигоксин.
Для терапии тяжёлой сердечной недостаточности рекомендованы комбинированные препараты, содержащие сакубитрил и валсартан, а также имплантируемый кардиовертер-дефибриллятор и/или сердечная ресинхронизирующая терапия. Используют пероральные антикоагулянты у пациентов с нарушения ритма сердца [12].
В лечении обструктивной кардиомиопатии некоторые группы лекарств имеют ограничения (ингибиторы АПФ, блокаторы рецепторов ангиотензина II), но применяются бета-адреноблокаторы и блокаторы кальциевых каналов. При необходимости применяют антиаритмические препараты [13].
В лечении рестриктивной кардиомиопатии упор делается на лечение основного заболевания, вызвавшего изменения в сердце. Возможно применение диуретиков [14].
Помимо лекарств в ряде случаев прибегают к хирургическим методам лечения кардиомиопатии.
При гипертрофической кардиомиопатии применяется септальная миэктомия — иссечение миокарда, расположенного в основании межжелудочковой перегородки. Она может быть дополнена и вмешательством на изменённом митральном клапане: вальвулопластикой, протезированием митрального клапана и коррекцией кольца митрального клапана.
При тяжёлой обструктивной гипертрофической кардиомиопатии рассматривается проведение операции — иссечения части сердечной мышцы или более щадящая методика — чрескожная транслюминальная алкогольная абляция. При ней через катетер вводится до 3 мл 96 % спирта в зону максимальной гипертрофии миокарда и вызывается его инфаркт. Из-за этого мышца уменьшается в размере, исчезает препятствие (обструкция) току крови через митральное кольцо. Далее проводится установка кардиостимулятора для синхронизации работы всех отделов сердца. Эта процедура проводится кардиохирургами в специализированных отделениях.
Некоторым пациентам для профилактики аритмии устанавливается особый вид стимулятора работы сердца — дефибриллятор-кардиовертер, что в итоге продлевает им жизнь [2].
И безусловно в особо тяжёлых ситуациях для спасения жизни рассматривается возможность трансплантации сердца. Это уникальные операции, проводящиеся в специализированных центрах как в Российской Федерации, так и за рубежом. Ежегодно в РФ проводится менее 100 таких операции. Пациенту с пересаженным сердцем требуется пожизненное наблюдение в центре трансплантации и приём ряда мощных препаратов, влияющих на иммунную систему [11].
Прогноз. Профилактика
Прогноз зависит от подтипа кардиомиопатии и течения заболевания. В связи со сложностью выявления, крупных исследований по этим видам заболеваний нет, данные по продолжительности жизни только примерные.
Прогноз по дилатационной кардиомиопатии неблагоприятный, но может улучшаться на фоне терапии. Примерно пятая часть всех больных умирают в течение первого года. От 40 до 50 % всех случаев смерти — внезапные, в результате злокачественной аритмии или эмболии [13]. Прогноз лучше, если вследствие компенсаторной гипертрофии толщина стенки желудочков сохранена, и хуже, если стенки истончены.
Прогноз при гипертрофической кардиомиопатии также неблагоприятный, но смертность не такая высокая — в первый год умирают 1 % заболевших, чаще от внезапной смерти, обусловленной факторами риска (наследственностью, тахикардией, предшествующим обмороками, понижением давления).
При рестриктивной кардиомиопатии прогноз неблагоприятный, так как заболевание часто находят уже на поздней стадии развития. Лечение только симптоматическое и поддерживающее.
Существует определённый процент пациентов с кардиомиопатией, которые длительно живут без клинических проявлений этого заболевания и почти также долго, как и здоровые люди [9]. Так как причины кардиомиопатии не до конца изучены, специальной профилактики на данный момент не разработано. Профилактикой можно считать раннюю диагностику и регулярные врачебные осмотры — ежегодно у терапевта с проведением ЭКГ и стандартных анализов. Консультация кардиолога и ЭХОКГ смогут подтвердить подозрения или исключит заболевание.
Для человека с выявленной кардиомиопатии частота посещений и обследований устанавливается индивидуально.
Кардиомиопатия: причины появления, симптомы, диагностика и способы лечения.
Определение
Кардиомиопатии (КМП) – группа гетерогенных (разнородных) заболеваний, характеризующихся патологией сердечной мышцы с ее структурными и/или функциональными нарушениями, не обусловленными ишемической болезнью сердца, гипертензией, клапанными пороками и врожденными заболеваниями.
Причины появления кардиомиопатий
Считается, что кардиомиопатия возникает как результат совокупности различных факторов: генетических (мутации генов), аутоиммунного воспаления (при некоторых бактериальных и вирусных заболеваниях), поражениях органов при генерализованном (полиорганном) заболевании.
Классификация кардиомиопатий
Согласно классификации Всемирной организации здравоохранения, кардиомиопатии делятся на идиопатические, специфические и неклассифицируемые болезни миокарда.
Идиопатические кардиомиопатии:
- дилатационная;
- гипертрофическая (обструктивная или необструктивная);
- рестриктивная;
- аритмогенная дисплазия правого желудочка;
- перипортальная (послеродовая).
Специфические кардиомиопатии (ассоциированные со специфическим системным или несистемным заболеванием):
- инфекционные;
- метаболические:
- эндокринные (при гипо- и гипертиреозе, микседеме, акромегалии, феохромоцитоме, сахарном диабете, ожирении),
- при болезнях накопления (амилоидозе, гемохроматозе, саркоидозе, лейкозе, мукополисахаридозе, гликогенозе, липидозе),
- при дефиците микроэлементов, питательных веществ и электролитном дисбалансе;
- при системных заболеваниях соединительной ткани;
- при системных нейромышечных расстройствах и миодистрофиях (атаксии Фридрейха, синдроме Нунана, лентигинозе, миотонии).
К неклассифицируемым болезням миокарда относятся фиброэластоз эндомиокарда, или детская форма КМП, идиопатический миокардит Фидлера.
Симптомы кардиомиопатии
Гипертрофическая кардиомиопатия
Клинические проявления варьируют от бессимптомных форм до тяжелых нарушений в работе сердца – вплоть до внезапной смерти, которая чаще всего регистрируется в детском или юношеском возрасте во время физической нагрузки или сразу после нее.
Пациентов беспокоят следующие симптомы:
- одышка при физической нагрузке (у некоторых больных в покое и в ночные часы), обусловленная венозным застоем крови в легких из-за диастолической дисфункции увеличенного левого желудочка сердца;
- кардиалгии, связанные с несоответствием коронарного кровотока весу миокарда;
- головокружения и синкопальные (обморочные) состояния; у детей они отмечаются при физической нагрузке и эмоциональном стрессе;
- учащенное сердцебиение из-за нарушений ритма сердца;
- быстрая утомляемость.
Дилатационная кардиомиопатия
Заболевание характеризуется дилатацией (растяжением) левого желудочка с нарушением насосной функции сердца при отсутствии других заболеваний (артериальной гипертензии, клапанной патологии, ишемической болезни сердца), которые могли бы вызвать такие нарушения.
Основные клинические симптомы обычно появляются постепенно, а у некоторых пациентов отсутствуют вовсе, несмотря на наличие дилатации желудочков в течение месяцев и даже лет.
К моменту постановки диагноза 73% больных имеют симптомы застойной сердечной недостаточности.
Жалобы пациентов обычно связаны с проявлениями застойной сердечной недостаточности: боль в сердце, одышка, общая слабость и быстрая утомляемость, периферические отеки, учащенное сердцебиение, тяжесть в правом подреберье и эпигастрии, симптоматическая стенокардия.
Рестриктивная кардиомиопатия
При заболевании стенки желудочков становятся жесткими, нерастяжимыми (не обязательно утолщенными), что препятствует нормальному заполнению сердца кровью между ударами.
Симптоматика определяется тяжестью сердечной недостаточности, и длительное время заболевание может протекать бессимптомно. Пациентов беспокоят слабость, повышенная утомляемость, одышка даже при незначительной физической нагрузке, кашель, который может усиливаться в положении лежа, отеки, увеличение живота, у детей отставание в физическом развитии.
Аритмогенная кардиомиопатия правого желудочка
Заболевание характеризуется прогрессирующим замещением клеток сердца правого желудочка жировой или фиброзно-жировой тканью, приводящим к атрофии и истончению стенки желудочка, его дилатации.
Длительное время аритмогенная кардиомиопатия протекает бессимптомно, хотя органическое повреждение, лежащее в основе заболевания, медленно прогрессирует. Клинические признаки заболевания (сердцебиение, пароксизмальная тахикардия, головокружение и/или обмороки) обычно появляются в подростковом возрасте. Ведущими клиническими проявлениями являются жизнеугрожающие аритмии и внезапная остановка кровообращения, которая наступает во время физических нагрузок или напряженной спортивной активности.
Ишемическая кардиомиопатия
Заболевание обусловлено диффузными морфофункциональными нарушениями, развивающимися в результате хронической и эпизодов острой ишемии миокарда.
К развитию ишемической кардиомиопатии может привести обширный инфаркт миокарда или многочисленные мелкоочаговые инфаркты.
В типичных случаях клиническая картина включает стенокардию напряжения, кардиомегалию (увеличение сердца), хроническую сердечную недостаточность (причем у части больных отсутствуют клинические и ЭКГ-признаки стенокардии).
Симптомы идентичны проявлениям сердечной недостаточности у больных с дилатационной кардиомиопатией.
Гипертензивная кардиомиопатия
Заболевание развивается на фоне неконтролируемого повышенного артериального давления в течение долгого времени.
Интенсивность симптомов зависит от степени тяжести заболевания и характера его течения. К самым частым жалобам пациентов можно отнести боль и ощущение сдавленности в груди, одышку, кашель, отсутствие аппетита, периферические отеки.
Метаболическая кардиомиопатия
Метаболическая кардиомиопатия — невоспалительное поражение миокарда, в основе которого лежит нарушение обмена веществ, приводящее к дистрофии миокарда и недостаточной сократительной функций сердца.
Клинические проявления многообразны и не являются специфичными, причем начальная стадия заболевания может протекать вовсе без симптомов, но со временем при отсутствии должного лечения развивается тяжелая сердечная недостаточность.
Воспалительная кардиомиопатия
Заболевание представляет собой сочетание миокардита и дисфункции миокарда. Пациенты жалуются на боль в груди, нередко иррадиирующую в левую руку, приступы учащенного сердцебиения, одышку при физической нагрузке, а затем и в покое, периферические отеки, быструю утомляемость.
Диагностика кардиомиопатии
Диагностика кардиомиопатии строится на сборе анамнеза и лабораторных и инструментальных обследованиях больного. Основной диагностический критерий кардиомиопатии — наличие дисфункции миокарда, выявляемой при ультразвуковом обследовании сердца.
Кроме того, назначают следующие исследования:
- Общий анализ крови.
К каким врачам обращаться
Для постановки диагноза необходимо обратиться к
терапевту
, врачу общей практики или
кардиологу
.
Лечение кардиомиопатии
С целью снижения нагрузки на миокард рекомендовано ограничение избыточных физических нагрузок, исключение занятий профессиональным спортом.
Уровень нагрузок, их частота, интенсивность и длительность подбираются врачом.
Кроме того, для уменьшения выраженности отеков (то есть предотвращения застоя жидкости) больному следует отказаться от жирной, жареной, соленой и копченой пищи, употребления алкоголя.
Традиционными лекарственными средствами при кардиомиопатии являются бета-адреноблокаторы, блокаторы кальциевых каналов, ингибиторы АПФ, мочегонные, антиаритмические, антикоагулянты.
Хирургические методы лечения кардиомиопатии (резекция участка межжелудочковой перегородки, замена митрального клапана, пересадка сердца) применяют в тех случаях, когда консервативная терапия не дает желаемых результатов, а состояние пациента стремительно ухудшается.
Осложнения
Основными и наиболее частыми осложнениями считаются сердечная недостаточность, аритмии и нарушение функции сердечных клапанов.
К наиболее опасным осложнениям врачи относят эмболию (образование кровяных сгустков и тромбов), которая может привести к инфаркту и инсульту.
Внезапная остановка сердца при отсутствии своевременных реанимационных действий опасна летальным исходом.
Профилактика кардиомиопатии
Хотя кардиомиопатия является серьезной патологией, а ее специальной профилактики на данный момент не разработано, это заболевание все же не приговор. Пациентам из группы риска (то есть имеющим сопутствующие заболевания, повышающие риск развития кардиомиопатии) следует регулярно проходить скрининговые обследования, посещать врача и четко следовать его рекомендациям.
Источники:
- Кардиомиопатии и миокардиты / В.С. Моисеев, Г.К. Киякбаев, П.В. Лазарев // – Москва : ГЭОТАР-Медиа. – 2020. – 512 с.
- Кардиология. Национальное руководство. 2-е изд., перераб и доп. / под ред. Е.В. Шляхто // Изд. «Гэотар-Медиа», М. – 2015. – 800 с.
- Клинические рекомендации «Гипертрофическая кардиомиопатия». Разраб.: Российское кардиологическое общество, Ассоциация сердечно-сосудистых хирургов России. – 2020.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
1. Габрусенко С. А., Селезнёв Д. М., Наумов В. Г. Генетические аспекты гипертрофической кардиомиопатии (обзор литературы). Практикующий врач. 2000;18(2):2-5.
2. Шляхто Е. В., Гудкова А. Я., Костарева А. А. Первичные кардиомиопатии, современное представление. Терапевтический архив. 2005;77(12):77-83.
3. Gersh BJ, Maron BJ, Bonow RO, et al.; American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines; American Association for Thoracic Surgery; American Society of Echocardiography; American Society of Nuclear Cardiology; Heart Failure Society of America; Heart Rhythm Society; Society for Cardiovascular Angiography and Interventions; Society of Thoracic Surgeons. 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: executive summary: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. Circulation. 2011;124(24):2761-96. doi:10.1161/CIR.0b013e318223e230.
4. Authors/Task Force members, Elliott PM, Anastasakis A, Borger MA, et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J. 2014;35(39):2733-79. doi:10.1093/eurheartj/ehu284.
5. Alfares AA, Kelly MA, McDermott G, et al. Results of clinical genetic testing of 2,912 probands with hypertrophic cardiomyopathy: expanded panels offer limited additional sensitivity. Genet Med. 2015;17(11):880-8. doi:10.1038/gim.2014.205. Erratum in: Genet Med. 2015;17(4):319.
6. Coats CJ, Elliott PM. Genetic biomarkers in hypertrophic cardiomyopathy. Biomark Med. 2013;7(4):505-16. doi:10.2217/bmm.13.79.
7. Elliott P, McKenna WJ. Hypertrophic cardiomyopathy. Lancet. 2004;363(9424):1881-91. doi:10.1016/S0140-6736(04)16358-7.
8. Kelly MA, Caleshu C, Morales A, et al. Adaptation and validation of the ACMG/AMP variant classification framework for MYH7-associated inherited cardiomyopathies: recommendations by ClinGen’s Inherited Cardiomyopathy Expert Panel. Genet Med. 2018;20(3):351-9. doi:10.1038/gim.2017.218.
9. Kokado H, Shimizu M, Yoshio H, et al. Clinical features of hypertrophic cardiomyopathy caused by a Lys183 deletion mutation in the cardiac troponin I gene. Circulation. 2000;102(6):663-9. doi:10.1161/01.cir.102.6.663.
10. Kostareva A, Gudkova A, Sjöberg G, et al. Deletion in TNNI3 gene is associated with restrictive cardiomyopathy. Int J Cardiol. 2009;131(3):410-2. doi:10.1016/j.ijcard.2007.07.108.
11. Maron BJ. Hypertrophic cardiomyopathy: a systematic review. JAMA. 2002;287(10):1308-20. doi:10.1001/jama.287.10.1308.
12. Maron BJ, Maron MS, Maron BA, Loscalzo J. Moving Beyond the Sarcomere to Explain Heterogeneity in Hypertrophic Cardiomyopathy: JACC Review Topic of the Week. J Am Coll Cardiol. 2019;73(15):1978-86. doi:10.1016/j.jacc.2019.01.061.
13. Mogensen J, Murphy RT, Kubo T, et al. Frequency and clinical expression of cardiac troponin I mutations in 748 consecutive families with hypertrophic cardiomyopathy. J Am Coll Cardiol. 2004;44(12):2315-25. doi:10.1016/j.jacc.2004.05.088.
14. Селезнёв Д. М., Габрусенко С. А., Парфенова Е. В. и др. Роль мутаций в гене тяжелой цепи сердечного бета-миозина в российской популяции больных с гипертрофической кардиомиопатией. Кардиология. 2005;45(4):15-20.
15. Туральчук М. В., Новик Г. А., Гудкова А. Я. Особенности течения кардиомиопатий с рестриктивным фенотипом, обусловленных мутациями генов сердечного тропонина I и десмина, и алгоритмы их диагностики. Педиатрическая фармакология. 2011;8(4):112-6.
16. Burton D, Abdulrazzak H, Knott A, et al. Two mutations in troponin I that cause hypertrophic cardiomyopathy have contrasting effects on cardiac muscle contractility. Biochem J. 2002;362(Pt 2):443-51. doi:10.1042/0264-6021:3620443.
17. Zhou N, Qin S, Liu Y, et al. Whole-exome sequencing identifies rare compound heterozygous mutations in the MYBPC3 gene associated with severe familial hypertrophic cardiomyopathy. Eur J Med Genet. 2018;61(8):434-41. doi:10.1016/j.ejmg.2018.03.001.
18. Charron P, Forissier JF, Amara ME, et al. Accuracy of European diagnostic criteria for familial hypertrophic cardiomyopathy in a genotyped population. Int J Cardiol. 2003;90(1):33-8; discussion 38-40. doi:10.1016/s0167-5273(02)00534-x.
19. Lopes LR, Murphy C, Syrris P, et al. Use of high-throughput targeted exome-sequencing to screen for copy number variation in hypertrophic cardiomyopathy. Eur J Med Genet. 2015;58(11):611-6. doi:10.1016/j.ejmg.2015.10.001.
20. European Society of Cardiology (ESC); European Heart Rhythm Association (EHRA), Brignole M, Auricchio A, Baron-Esquivias G, et al. 2013 ESC guidelines on cardiac pacing and cardiac resynchronization therapy: the task force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA). Europace. 2013;15(8):1070-118. doi:10.1093/europace/eut206.
21. Hiemstra YL, Debonnaire P, van Zwet EW, et al. Development of and Progression of Overt Heart Failure in Nonobstructive Hypertrophic Cardiomyopathy. Am J Cardiol. 2018;122(4):656-62. doi:10.1016/j.amjcard.2018.04.038.
22. Ho CY, Day SM, Colan SD, et al.; HCMNet Investigators. The Burden of Early Phenotypes and the Influence of Wall Thickness in Hypertrophic Cardiomyopathy Mutation Carriers: Findings From the HCMNet Study. JAMA Cardiol. 2017;2(4):419-28. doi:10.1001/jamacardio.2016.5670.
23. Hodatsu A, Konno T, Hayashi K, et al. Compound heterozygosity deteriorates phenotypes of hypertrophic cardiomyopathy with founder MYBPC3 mutation: evidence from patients and zebrafish models. Am J Physiol Heart Circ Physiol. 2014;307(11):H1594-604. doi:10.1152/ajpheart.00637.2013.
24. Horimoto M, Yokota K, Inoue H, et al. Development of obstructive hypertrophic cardiomyopathy from nonobstructive hypertrophic cardiomyopathy. Am J Cardiol. 1998;82(3):403-5. doi:10.1016/s0002-9149(98)00337-3.
25. Ansari-Lari MA, Ali SZ. Fine-needle aspiration of abdominal fat pad for amyloid detection: a clinically useful test? Diagn Cytopathol. 2004;30(3):178-81. doi:10.1002/dc.10370.
26. Canepa M, Sorensen LL, Pozios I, et al. Comparison of clinical presentation, left ventricular morphology, hemodynamics, and exercise tolerance in obese versus nonobese patients with hypertrophic cardiomyopathy. Am J Cardiol. 2013;112(8):1182-9. doi:10.1016/j.amjcard.2013.05.070.
27. Charron P, Arad M, Arbustini E, et al.; European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Genetic counselling and testing in cardiomyopathies: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2010;31(22):2715-26. doi:10.1093/eurheartj/ehq271.
28. Finocchiaro G, Magavern E, Sinagra G, et al. Impact of Demographic Features, Lifestyle, and Comorbidities on the Clinical Expression of Hypertrophic Cardiomyopathy. J Am Heart Assoc. 2017;6(12):e007161. doi:10.1161/JAHA.117.007161.
29. Bos JM, Ommen SR, Ackerman MJ. Genetics of hypertrophic cardiomyopathy: one, two, or more diseases? Curr Opin Cardiol. 2007;22(3):193-9. doi:10.1097/HCO.0b013e3280e1cc7f.
30. Richards S, Aziz N, Bale S, et al.; ACMG Laboratory Quality Assurance Committee. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med. 2015;17(5):405-24. doi:10.1038/gim.2015.30.
31. Marian AJ, Braunwald E. Hypertrophic Cardiomyopathy: Genetics, Pathogenesis, Clinical Manifestations, Diagnosis, and Therapy. Circ Res. 2017;121(7):749-70. doi:10.1161/CIRCRESAHA.117.311059.
32. Бокерия Л. А., Гудкова А. Я., Созин С. Е. и др. Экспрессия генов матриксной металлопротеиназы-1 (ММР-1), тканевого ингибитора матриксных металлопротеиназ-1 (TIMP-1), коллагена I и III типов в миокарде больных идиопатической гипертрофической кардиомиопатией. Бюллетень НЦССХ им. А. Н. Бакулева РАМН. 2005;6(4):35-42.
33. Гудкова А. Я., Рыбакова М. Г., Шляхто Е. В., Бокерия Л. А. Гипертрофическая кардиомиопатия. Клинико-морфологические сопоставления. Архив патологии. 2012;74(4):8-11.
34. Гудкова А. Я. Характеристика течения обструктивной гипертрофической кардиомиопатии у взрослых (обзор литературы и результаты собственных исследований). Артериальная гипертензия. 2008;14(2), Приложение 2:39-49.
35. Гудкова А. Я., Шляхто Е. В. Клеточные механизмы гипертрофии миокарда при гипертрофической кардиомиопатии и эссенциальной артериальной гипертензии. Артериальная гипертензия. 2008;14(4):373-80.
36. Shliakhto EV, Bokeriia LA, Rybakova MG, et al. Cellular aspects of hypertrophic cardiomyopathy pathogenesis: the role of cardiomyocyte polyploidy and activation of the proliferating cell nuclear antigen in the myocardium. Tsitologiia. 2007;49(10):817-23.
37. Frustaci A, Russo MA, Chimenti C. Diagnostic contribution of left ventricular endomyocardial biopsy in patients with clinical phenotype of hypertrophic cardiomyopathy. Hum Pathol. 2013;44(1):133-41. doi:10.1016/j.humpath.2012.04.023.
38. Leone O, Veinot JP, Angelini A, et al. 2011 consensus statement on endomyocardial biopsy from the Association for European Cardiovascular Pathology and the Society for Cardiovascular Pathology. Cardiovasc Pathol. 2012;21(4):245-74. doi:10.1016/j.carpath.2011.10.001.
39. Philipson DJ, DePasquale EC, Yang EH, Baas AS. Emerging pharmacologic and structural therapies for hypertrophic cardiomyopathy. Heart Fail Rev. 2017;22(6):879-88. doi:10.1007/s10741-017-9648-x.
40. Roberts R, Sigwart U. Current concepts of the pathogenesis and treatment of hypertrophic cardiomyopathy. Circulation. 2005;112(2):293-6. doi:10.1161/01.CIR.0000146788.30724.0A.
41. Varnava AM, Elliott PM, Sharma S, et al. Hypertrophic cardiomyopathy: the interrelation of disarray, fibrosis, and small vessel disease. Heart. 2000;84(5):476-82. doi:10.1136/heart.84.5.476.
42. Зайцев В. В., Гурщенков А. В., Митрофанова Л. Б. и др. Клиническое значение различных методов оценки миокардиального фиброза при гипертрофической кардиомиопатии. Кардиология. 2020;60(3):44-50. doi:10.18087/cardio.2020.3.n561.
43. Arbustini E, Narula N, Dec GW, et al. The MOGE(S) classification for a phenotype-genotype nomenclature of cardiomyopathy: endorsed by the World Heart Federation. J Am Coll Cardiol. 2013;62(22):2046-72. doi:10.1016/j.jacc.2013.08.1644. Erratum in: J Am Coll Cardiol. 2014;63(2):191-4.
44. Barcia G, Rachid M, Magen M, et al. Pitfalls in molecular diagnosis of Friedreich ataxia. Eur J Med Genet. 2018;61(8):455-8. doi:10.1016/j.ejmg.2018.03.004.
45. Bokhari S, Castaño A, Pozniakoff T, et al. (99m)Tc-pyrophosphate scintigraphy for differentiating light-chain cardiac amyloidosis from the transthyretin-related familial and senile cardiac amyloidoses. Circ Cardiovasc Imaging. 2013;6(2):195-201. doi:10.1161/CIRCIMAGING.112.000132.
46. Charron P, Villard E, Sébillon P, et al. Danon’s disease as a cause of hypertrophic cardiomyopathy: a systematic survey. Heart. 2004;90(8):842-6. doi:10.1136/hrt.2003.029504.
47. Cook A, Giunti P. Friedreich’s ataxia: clinical features, pathogenesis and management. Br Med Bull. 2017;124(1):19-30. doi:10.1093/bmb/ldx034.
48. D’Souza A, Theis JD, Vrana JA, et al. Localized insulin-derived amyloidosis: a potential pitfall in the diagnosis of systemic amyloidosis by fat aspirate. Am J Hematol. 2012;87(11):E131-2. doi:10.1002/ajh.23334.
49. Dubrey SW, Hawkins PN, Falk RH. Amyloid diseases of the heart: assessment, diagnosis, and referral. Heart. 2011;97(1):75-84. doi:10.1136/hrt.2009.190405.
50. Frustaci A, Chimenti C, Doheny D, Desnick RJ. Evolution of cardiac pathology in classic Fabry disease: Progressive cardiomyocyte enlargement leads to increased cell death and fibrosis, and correlates with severity of ventricular hypertrophy. Int J Cardiol. 2017;248:257-62. doi:10.1016/j.ijcard.2017.06.079.
51. Monserrat L, Gimeno-Blanes JR, Marín F, et al. Prevalence of fabry disease in a cohort of 508 unrelated patients with hypertrophic cardiomyopathy. J Am Coll Cardiol. 2007;50(25):2399-403. doi:10.1016/j.jacc.2007.06.062.
52. Planté-Bordeneuve V, Said G. Familial amyloid polyneuropathy. Lancet Neurol. 2011;10(12):1086-97. doi:10.1016/S1474-4422(11)70246-0.
53. Quarta CC, Guidalotti PL, Longhi S, et al. Defining the diagnosis in echocardiographically suspected senile systemic amyloidosis. JACC Cardiovasc Imaging. 2012;5(7):755-8. doi:10.1016/j.jcmg.2012.02.015.
54. RDTF Report: European reference networks in the field of Rare Diseases: State of the art and Future Directions. Jul, 2008. http://www.eucerd.eu/upload/file/Publication/RDTFERN2008.pdf.
55. Sado DM, White SK, Piechnik SK, et al. Identification and assessment of Anderson-Fabry disease by cardiovascular magnetic resonance noncontrast myocardial T1 mapping. Circ Cardiovasc Imaging. 2013;6(3):392-8. doi:10.1161/CIRCIMAGING.112.000070.
56. Tsai SB, Seldin DC, Wu H, et al. Myocardial infarction with «clean coronaries» caused by amyloid light-chain AL amyloidosis: a case report and literature review. Amyloid. 2011;18(3):160-4. doi:10.3109/13506129.2011.571319.
57. Vogelsberg H, Mahrholdt H, Deluigi CC, et al. Cardiovascular magnetic resonance in clinically suspected cardiac amyloidosis: noninvasive imaging compared to endomyocardial biopsy. J Am Coll Cardiol. 2008;51(10):1022-30. doi:10.1016/j.jacc.2007.10.049.
58. Wilkinson JD, Lowe AM, Salbert BA, et al. Outcomes in children with Noonan syndrome and hypertrophic cardiomyopathy: a study from the Pediatric Cardiomyopathy Registry. Am Heart J. 2012;164(3):442-8. doi:10.1016/j.ahj.2012.04.018.
59. Yang Z, Vatta M. Danon disease as a cause of autophagic vacuolar myopathy. Congenit Heart Dis. 2007;2(6):404-9. doi:10.1111/j.1747-0803.2007.00132.x.
60. Yang Z, McMahon CJ, Smith LR, et al. Danon disease as an underrecognized cause of hypertrophic cardiomyopathy in children. Circulation. 2005;112(11):1612-7. doi:10.1161/CIRCULATIONAHA.105.546481.
61. Ibrahim M, Rao C, Ashrafian H, et al. Modern management of systolic anterior motion of the mitral valve. Eur J Cardiothorac Surg. 2012;41(6):1260-70. doi:10.1093/ejcts/ezr232.
62. Deng L, Huang X, Yang C, et al. Numerical simulation study on systolic anterior motion of the mitral valve in hypertrophic obstructive cardiomyopathy. Int J Cardiol. 2018;266:167-73. doi:10.1016/j.ijcard.2018.01.062.
63. Manabe S, Kasegawa H, Arai H, Takanashi S. Management of systolic anterior motion of the mitral valve: a mechanism-based approach. Gen Thorac Cardiovasc Surg. 2018;66(7):379-89. doi:10.1007/s11748-018-0915-0.
64. Ro R, Halpern D, Sahn DJ, et al. Vector flow mapping in obstructive hypertrophic cardiomyopathy to assess the relationship of early systolic left ventricular flow and the mitral valve. J Am Coll Cardiol. 2014;64(19):1984-95. doi:10.1016/j.jacc.2014.04.090.
65. Hymel BJ, Townsley MM. Echocardiographic assessment of systolic anterior motion of the mitral valve. Anesth Analg. 2014;118(6):1197-201. doi:10.1213/ANE.0000000000000196.
66. Sherrid MV, Gunsburg DZ, Moldenhauer S, Pearle G. Systolic anterior motion begins at low left ventricular outflow tract velocity in obstructive hypertrophic cardiomyopathy. J Am Coll Cardiol. 2000;36(4):1344-54. doi:10.1016/s0735-1097(00)00830-5.
67. Silbiger JJ. Abnormalities of the Mitral Apparatus in Hypertrophic Cardiomyopathy: Echocardiographic, Pathophysiologic, and Surgical Insights. J Am Soc Echocardiogr. 2016;29(7):622-39. doi:10.1016/j.echo.2016.03.003.
68. Shah JS, Esteban MT, Thaman R, et al. Prevalence of exercise-induced left ventricular outflow tract obstruction in symptomatic patients with non-obstructive hypertrophic cardiomyopathy. Heart. 2008;94(10):1288-94. doi:10.1136/hrt.2007.126003.
69. Geske JB, Sorajja P, Ommen SR, Nishimura RA. Variability of left ventricular outflow tract gradient during cardiac catheterization in patients with hypertrophic cardiomyopathy. JACC Cardiovasc Interv. 2011;4(6):704-9. doi:10.1016/j.jcin.2011.02.014.
70. Efthimiadis GK, Pagourelias ED, Parcharidou D, et al. Clinical characteristics and natural history of hypertrophic cardiomyopathy with midventricular obstruction. Circ J. 2013;77(9):2366-74. doi:10.1253/circj.cj-12-1561.
71. Minami Y, Kajimoto K, Terajima Y, et al. Clinical implications of midventricular obstruction in patients with hypertrophic cardiomyopathy. J Am Coll Cardiol. 2011;57(23):2346-55. doi:10.1016/j.jacc.2011.02.033.
72. Yan LR, Zhao SH, Wang HY, et al. Clinical characteristics and prognosis of 60 patients with midventricular obstructive hypertrophic cardiomyopathy. J Cardiovasc Med (Hagerstown). 2015;16(11):751-60. doi:10.2459/JCM.0000000000000163.
73. Hang D, Schaff HV, Ommen SR, et al. Combined transaortic and transapical approach to septal myectomy in patients with complex hypertrophic cardiomyopathy. J Thorac Cardiovasc Surg. 2018;155(5):2096-102. doi:10.1016/j.jtcvs.2017.10.054.
74. Pacheco Claudio C, Quesada O, Pepine CJ, Noel Bairey Merz C. Why names matter for women: MINOCA/INOCA (myocardial infarction/ischemia and no obstructive coronary artery disease). Clin Cardiol. 2018;41(2):185-93. doi:10.1002/clc.22894.
75. Аверкина Н. В., Габрусенко С. А., Овчинников А. Г. и др. Оценка перфузии миокарда у больных с гипертрофической кардиомиопатией в сопоставлении с клиническими и эхокардиографическими данными. Терапевтический архив. 2003;78(4):20-5.
76. Аверков О. В., Барбараш О. Л., Бойцов С. А. и др. Дифференцированный подход в диагностике, формулировке диагноза, ведении больных и статистическом учете инфаркта миокарда 2 типа (согласованная позиция). Российский кардиологический журнал. 2019;(6):7-21. doi:10.15829/1560-4071-2019-6-7-21.
77. Каплунова В. Ю., Шакарьянц В. А., Кожевникова М. В. и др. Гипертрофическая кардиомиопатия и ишемическая болезнь сердца. Варианты сочетанной патологии. Кардиология. 2017;57(12):16-24. doi:10.18087/cardio.2017.12.10062.
78. Костин С. И. Морфологические и морфометрические особенности гипертрофической кардиомиопатии. Архив патологии. 1989;51(1):47-52.
79. Мухарлямов Н. Кардиомиопатии. Москва, 1990. с.283. ISBN 5-225-02119-0.
80. Aletras AH, Tilak GS, Hsu LY, Arai AE. Heterogeneity of intramural function in hypertrophic cardiomyopathy: mechanistic insights from MRI late gadolinium enhancement and high-resolution displacement encoding with stimulated echoes strain maps. Circ Cardiovasc Imaging. 2011;4(4):425-34. doi:10.1161/CIRCIMAGING.110.958751.
81. Camici PG, Olivotto I, Rimoldi OE. The coronary circulation and blood flow in left ventricular hypertrophy. J Mol Cell Cardiol. 2012;52(4):857-64. doi:10.1016/j.yjmcc.2011.08.028.
82. Einarsen E, Cramariuc D, Lønnebakken MT, et al. Comparison of Frequency of Ischemic Cardiovascular Events in Patients With Aortic Stenosis With Versus Without Asymmetric Septal Hypertrophy (from the SEAS Trial). Am J Cardiol. 2017;119(7):1082-7. doi:10.1016/j.amjcard.2016.11.064.
83. Foà A, Agostini V, Rapezzi C, et al. Histopathological comparison of intramural coronary artery remodeling and myocardial fibrosis in obstructive versus end-stage hypertrophic cardiomyopathy. Int J Cardiol. 2019;291:77-82. doi:10.1016/j.ijcard.2019.03.060.
84. Kwon DH, Smedira NG, Rodriguez ER, et al. Cardiac magnetic resonance detection of myocardial scarring in hypertrophic cardiomyopathy: correlation with histopathology and prevalence of ventricular tachycardia. J Am Coll Cardiol. 2009;54(3):242-9. doi:10.1016/j.jacc.2009.04.026.
85. Maron MS, Olivotto I, Maron BJ, et al. The case for myocardial ischemia in hypertrophic cardiomyopathy. J Am Coll Cardiol. 2009;54(9):866-75. doi:10.1016/j.jacc.2009.04.072.
86. Mundhenke M, Schwartzkopff B, Strauer BE. Structural analysis of arteriolar and myocardial remodelling in the subendocardial region of patients with hypertensive heart disease and hypertrophic cardiomyopathy. Virchows Arch. 1997;431(4):265-73. doi:10.1007/s004280050098.
87. Nakamura T, Sakamoto K, Yamano T, et al. Increased plasma brain natriuretic peptide level as a guide for silent myocardial ischemia in patients with non-obstructive hypertrophic cardiomyopathy. J Am Coll Cardiol. 2002;39(10):1657-63. doi:10.1016/s0735-1097(02)01813-2.
88. Raphael CE, Cooper R, Parker KH, et al. Mechanisms of Myocardial Ischemia in Hypertrophic Cardiomyopathy: Insights From Wave Intensity Analysis and Magnetic Resonance. J Am Coll Cardiol. 2016;68(15):1651-60. doi:10.1016/j.jacc.2016.07.751.
89. Sciagrà R, Calabretta R, Cipollini F, et al. Myocardial blood flow and left ventricular functional reserve in hypertrophic cardiomyopathy: a 13NH3 gated PET study. Eur J Nucl Med Mol Imaging. 2017;44(5):866-75. doi:10.1007/s00259-016-3603-2.
90. Shin YJ, Lee JH, Yoo JY, et al. Clinical significance of evaluating coronary atherosclerosis in adult patients with hypertrophic cardiomyopathy who have chest pain. Eur Radiol. 2019;29(9):4593-602. doi:10.1007/s00330-018-5951-8.
91. Liu W, Sun D, Yang J. Diastolic Dysfunction of Hypertrophic Cardiomyopathy Genotype-Positive Subjects Without Hypertrophy Is Detected by Tissue Doppler Imaging: A Systematic Review and Meta-analysis. J Ultrasound Med. 2017;36(10):2093-103. doi:10.1002/jum.14250.
92. Covella M, Rowin EJ, Hill NS, et al. Mechanism of Progressive Heart Failure and Significance of Pulmonary Hypertension in Obstructive Hypertrophic Cardiomyopathy. Circ Heart Fail. 2017;10(4):e003689. doi:10.1161/CIRCHEARTFAILURE.116.003689.
93. Germans T, Rüssel IK, Götte MJ, et al. How do hypertrophic cardiomyopathy mutations affect myocardial function in carriers with normal wall thickness? Assessment with cardiovascular magnetic resonance. J Cardiovasc Magn Reson. 2010;12(1):13. doi:10.1186/1532-429X-12-13.
94. Huang X, Yue Y, Wang Y, et al. Assessment of left ventricular systolic and diastolic abnormalities in patients with hypertrophic cardiomyopathy using real-time three-dimensional echocardiography and two-dimensional speckle tracking imaging. Cardiovasc Ultrasound. 2018;16(1):23. doi:10.1186/s12947-018-0142-y.
95. Matsumura Y, Elliott PM, Virdee MS, et al. Left ventricular diastolic function assessed using Doppler tissue imaging in patients with hypertrophic cardiomyopathy: relation to symptoms and exercise capacity. Heart. 2002;87(3):247-51. doi:10.1136/heart.87.3.247.
96. Бокерия Л. А., Борисов К. В., Синев А. Ф. Улучшение диастолической функции левого и правого желудочков сердца после хирургической коррекции гипертрофической обструктивной кардиомиопатии при помощи оригинального способа. Грудная и сердечно-сосудистая хирургия. 1999;(4):4-10.
97. Harris KM, Spirito P, Maron MS, et al. Prevalence, clinical profile, and significance of left ventricular remodeling in the end-stage phase of hypertrophic cardiomyopathy. Circulation. 2006;114(3):216-25. doi:10.1161/CIRCULATIONAHA.105.583500.
98. Biagini E, Spirito P, Rocchi G, et al. Prognostic implications of the Doppler restrictive filling pattern in hypertrophic cardiomyopathy. Am J Cardiol. 2009;104(12):1727-31. doi:10.1016/j.amjcard.2009.07.057.
99. Bravo PE, Luo HC, Pozios I, et al. Late gadolinium enhancement confined to the right ventricular insertion points in hypertrophic cardiomyopathy: an intermediate stage phenotype? Eur Heart J Cardiovasc Imaging. 2016;17(3):293-300. doi:10.1093/ehjci/jev154.
100. Fernández A, Vigliano CA, Casabé JH, et al. Comparison of prevalence, clinical course, and pathological findings of left ventricular systolic impairment versus normal systolic function in patients with hypertrophic cardiomyopathy. Am J Cardiol. 2011;108(4):548-55. doi:10.1016/j.amjcard.2011.03.083.
101. Melacini P, Basso C, Angelini A, et al. Clinicopathological profiles of progressive heart failure in hypertrophic cardiomyopathy. Eur Heart J. 2010;31(17):2111-23. doi:10.1093/eurheartj/ehq136.
102. Maron MS, Hauser TH, Dubrow E, et al. Right ventricular involvement in hypertrophic cardiomyopathy. Am J Cardiol. 2007;100(8):1293-8. doi:10.1016/j.amjcard.2007.05.061.
103. Falcone DM, Moore D, Lambert EC. Idiopathic hypertrophic cardiomyopathy involving the right ventricle. Am J Cardiol. 1967;19(5):735-40. doi:10.1016/0002-9149(67)90480-8.
104. Shimizu M, Kawai H, Yokota Y, Yokoyama M. Echocardiographic assessment of right ventricular obstruction in hypertrophic cardiomyopathy. Circ J. 2003;67(10):855-60. doi:10.1253/circj.67.855.
105. Бокерия Л. А., Борисов К. В. Обструктивная гипертрофическая кардиомиопатия: методы хирургической коррекции. Грудная и сердечно-сосудистая хирургия. 1997;(1):61-5.
106. Бокерия Л. А., Борисов К. В., Синев А. Ф. и др. Результаты медикаментозного и хирургического лечения гипертрофической кардиомиопатии с обструкцией выводных отделов левого и правого желудочков сердца. Грудная и сердечно-сосудистая хирургия. 2004;2:4-9.
107. Бокерия Л. А., Борисов К. В., Синев А. Ф., Шевердина В. В. Хирургическая коррекция ранее неоперабельных форм гипертрофической обструктивной кардиомиопатии. Грудная и сердечно-сосудистая хирургия. 1999;(6):130-6.
108. Pagourelias ED, Efthimiadis GK, Parcharidou DG, et al. Prognostic value of right ventricular diastolic function indices in hypertrophic cardiomyopathy. Eur J Echocardiogr. 2011;12(11):809-17. doi:10.1093/ejechocard/jer126.
109. Shah JP, Yang Y, Chen S, et al. Prevalence and Prognostic Significance of Right Ventricular Dysfunction in Patients With Hypertrophic Cardiomyopathy. Am J Cardiol. 2018;122(11):1932-8. doi:10.1016/j.amjcard.2018.08.043.
110. Кактурский Л. Внезапная смерть (клиническая морфология). Москва, 2000. с.126. ISBN 5-93649-001-7.
111. Ревишвили А. Ш., Бойцов С. А., Давтян К. В. и др. Клинические рекомендации по проведению электрофизиологических исследований, катетерной абляции и применению имплантируемых антиаритмических устройств. Москва, 2017. с. 701. https://vnoa.ru/upload/Recomendation_2017_30_10_2017_HR.pdf. ISBN 978-5-9500922-0-6.
112. Adabag AS, Casey SA, Kuskowski MA, et al. Spectrum and prognostic significance of arrhythmias on ambulatory Holter electrocardiogram in hypertrophic cardiomyopathy. J Am Coll Cardiol. 2005;45(5):697-704. doi:10.1016/j.jacc.2004.11.043.
113. Zipes DP, Camm AJ, Borggrefe M, et al.; American College of Cardiology; American Heart Association Task Force; European Society of Cardiology Committee for Practice Guidelines; European Heart Rhythm Association; Heart Rhythm Society. ACC/AHA/ESC 2006 guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: a report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop guidelines for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death) developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society. Europace. 2006;8(9):746-837. doi:10.1093/europace/eul108.
114. Czosek RJ, Jefferies JL, Khoury PR, et al. Arrhythmic Burden and Ambulatory Monitoring of Pediatric Patients with Cardiomyopathy. Pacing Clin Electrophysiol. 2016;39(5):443-51. doi:10.1111/pace.12835.
115. Desai M, Mentias A. Risk stratification in hypertrophic cardiomyopathy. Aging (Albany NY). 2019;11(6):1617-8. doi:10.18632/aging.101895.
116. Elliott PM, Poloniecki J, Dickie S, et al. Sudden death in hypertrophic cardiomyopathy: identification of high risk patients. J Am Coll Cardiol. 2000;36(7):2212-8. doi:10.1016/s0735-1097(00)01003-2.
117. Goyal V, Jassal DS, Dhalla NS. Pathophysiology and prevention of sudden cardiac death. Can J Physiol Pharmacol. 2016;94(3):237-44. doi:10.1139/cjpp-2015-0366.
118. Marrakchi S, Kammoun I, Bennour E, et al. Risk stratification in hypertrophic cardiomyopathy. Herz. 2020;45(1):50-64. [In English]. doi:10.1007/s00059-018-4700-8.
119. Weissler-Snir A, Adler A, Williams L, et al. Prevention of sudden death in hypertrophic cardiomyopathy: bridging the gaps in knowledge. Eur Heart J. 2017;38(22):1728-37. doi:10.1093/eurheartj/ehw268.
120. Weissler-Snir A, Chan RH, Adler A, et al. Usefulness of 14-Day Holter for Detection of Nonsustained Ventricular Tachycardia in Patients With Hypertrophic Cardiomyopathy. Am J Cardiol. 2016;118(8):1258-63. doi:10.1016/j.amjcard.2016.07.043.
121. Goff ZD, Calkins H. Sudden death related cardiomyopathies – Hypertrophic cardiomyopathy. Prog Cardiovasc Dis. 2019;62(3):212-6. doi:10.1016/j.pcad.2019.04.001.
122. Bois JP, Adams JC, Kumar G, et al. Relation Between Temperature Extremes and Symptom Exacerbation in Patients With Hypertrophic Cardiomyopathy. Am J Cardiol. 2016;117(6):961-5. doi:10.1016/j.amjcard.2015.12.046.
123. Haghjoo M, Faghfurian B, Taherpour M, et al. Predictors of syncope in patients with hypertrophic cardiomyopathy. Pacing Clin Electrophysiol. 2009;32(5):642-7. doi:10.1111/j.1540-8159.2009.02338.x.
124. Seggewiß H, Koljaja-Batzner A, Seggewiß K, Meesmann M. Synkope bei hypertropher (obstruktiver) Kardiomyopathie [Syncope in hypertrophic (obstructive) cardiomyopathy]. Herzschrittmacherther Elektrophysiol. 2018;29(2):178-82. [In German]. doi:10.1007/s00399-018-0567-x.
125. Williams L, Frenneaux M. Syncope in hypertrophic cardiomyopathy: mechanisms and consequences for treatment. Europace. 2007;9(9):817-22. doi:10.1093/europace/eum093.
126. Farhad H, Seidelmann SB, Vigneault D, et al. Left Atrial structure and function in hypertrophic cardiomyopathy sarcomere mutation carriers with and without left ventricular hypertrophy. J Cardiovasc Magn Reson. 2017;19(1):107. doi:10.1186/s12968-017-0420-0.
127. Burstein B, Nattel S. Atrial fibrosis: mechanisms and clinical relevance in atrial fibrillation. J Am Coll Cardiol. 2008;51(8):802-9. doi:10.1016/j.jacc.2007.09.064.
128. Philipson DJ, Rader F, Siegel RJ. Risk factors for atrial fibrillation in hypertrophic cardiomyopathy. Eur J Prev Cardiol. 2019:2047487319828474. doi:10.1177/2047487319828474.
129. Garg L, Gupta M, Sabzwari SRA, et al. Atrial fibrillation in hypertrophic cardiomyopathy: prevalence, clinical impact, and management. Heart Fail Rev. 2019;24(2):189-97. doi:10.1007/s10741-018-9752-6.
130. Killu AM, Park JY, Sara JD, et al. Cardiac resynchronization therapy in patients with end-stage hypertrophic cardiomyopathy. Europace. 2018;20(1):82-8. doi:10.1093/europace/euw327.
131. Kirchhof P, Benussi S, Kotecha D, et al.; ESC Scientific Document Group. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J. 2016;37(38):2893-962. doi:10.1093/eurheartj/ehw210.
132. Maron BJ, Rowin EJ, Udelson JE, Maron MS. Clinical Spectrum and Management of Heart Failure in Hypertrophic Cardiomyopathy. JACC Heart Fail. 2018;6(5):353-63. doi:10.1016/j.jchf.2017.09.011.
133. Seferović PM, Polovina M, Bauersachs J, et al. Heart failure in cardiomyopathies: a position paper from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2019;21(5):553-76. doi:10.1002/ejhf.1461.
134. Maron BJ, Olivotto I, Spirito P, et al. Epidemiology of hypertrophic cardiomyopathy-related death: revisited in a large non-referral-based patient population. Circulation. 2000;102(8):858-64. doi:10.1161/01.cir.102.8.858.
135. Semsarian C, Ingles J, Maron MS, Maron BJ. New perspectives on the prevalence of hypertrophic cardiomyopathy. J Am Coll Cardiol. 2015;65(12):1249-54. doi:10.1016/j.jacc.2015.01.019.
136. Amano Y, Kitamura M, Takayama M, et al. MRI classification of asymmetric septal hypertrophic cardiomyopathy and its relation to the presence of risk factors. Int J Cardiovasc Imaging. 2012;28(8):2019-25. doi:10.1007/s10554-012-0034-4.
137. Geske JB, Ommen SR, Gersh BJ. Hypertrophic Cardiomyopathy: Clinical Update. JACC Heart Fail. 2018;6(5):364-75. doi:10.1016/j.jchf.2018.02.010.
138. Дземешкевич С. Л., Фролова Ю. В., Ким С. Ю. и др. Анатомические и морфологические признаки диффузно-генерализованной формы гипертрофической кардиомиопатии. Российский кардиологический журнал. 2015;(5):58-63. doi:10.15829/1560-4071-2015-5-58-63.
139. Gudkova A, Kostareva A, Sjoberg G, et al. Diagnostic challenge in desmin cardiomyopathy with transformation of clinical phenotypes. Pediatr Cardiol. 2013;34(2):467-70. doi:10.1007/s00246-012-0312-x.
140. Rowin EJ, Maron MS, Chan RH, et al. Interaction of Adverse Disease Related Pathways in Hypertrophic Cardiomyopathy. Am J Cardiol. 2017;120(12):2256-64. doi:10.1016/j.amjcard.2017.08.048.
141. Габрусенко С. А., Сафрыгина Ю. В., Овчинников А. Г. и др. Клинико-гемодинамический статус и сердечные натрийуретические пептиды в плазме больных гипертрофической кардиомиопатией. Кардиологический вестник (Бюллетень РКНПК). 2006;1(2):25-31.
142. Стрельцова А. А., Гудкова А. Я., Костарева А. А. Фибрилляция предсердий при гипертрофической кардиомиопатии: современные аспекты эпидемиологии, факторов риска, патогенеза и фармакотерапии. Consilium Medicum. 2018;20(5):34-9. doi:10.26442/2075-1753_2018.5.34-39.
143. Стрельцова А. А., Гудкова А. Я., Полякова А. А. и др. Полиморфный вариант rs1739843 гена белка теплового шока 7 (HSPB7) и его связь с вариантами клинического течения и исходами у пациентов с гипертрофической кардиомиопатией (результаты 10-летнего наблюдения). Российский кардиологический журнал. 2019;(10):7-15. doi:10.15829/1560-4071-2019-10-7-15.
144. Binder J, Ommen SR, Gersh BJ, et al. Echocardiography-guided genetic testing in hypertrophic cardiomyopathy: septal morphological features predict the presence of myofilament mutations. Mayo Clin Proc. 2006;81(4):459-67. doi:10.4065/81.4.459.
145. Elliott P, Spirito P. Prevention of hypertrophic cardiomyopathy-related deaths: theory and practice. Heart. 2008;94(10):1269-75. doi:10.1136/hrt.2008.154385.
146. Elliott PM, Gimeno JR, Thaman R, et al. Historical trends in reported survival rates in patients with hypertrophic cardiomyopathy. Heart. 2006;92(6):785-91. doi:10.1136/hrt.2005.068577.
147. Kawai C, Sakurai T, Fujiwara H, et al. Hypertrophic obstructive and non-obstructive cardiomyopathy in Japan. Diagnosis of the disease with special reference to endomyocardial catheter biopsy. Eur Heart J. 1983;4, Suppl F:121-5. doi:10.1093/eurheartj/4.suppl_f.121.
148. Kitaoka H, Kuwahara T, Nishida K, et al. Hypertrophic cardiomyopathy with progression from apical hypertrophy to asymmetrical septal hypertrophy: a case report. J Cardiol. 2005;45(4):155-9.
149. Klues HG, Schiffers A, Maron BJ. Phenotypic spectrum and patterns of left ventricular hypertrophy in hypertrophic cardiomyopathy: morphologic observations and significance as assessed by two-dimensional echocardiography in 600 patients. J Am Coll Cardiol. 1995;26(7):1699-708. doi:10.1016/0735-1097(95)00390-8.
150. Maron BJ, Olivotto I, Bellone P, et al. Clinical profile of stroke in 900 patients with hypertrophic cardiomyopathy. J Am Coll Cardiol. 2002;39(2):301-7. doi:10.1016/s0735-1097(01)01727-2.
151. Thaman R, Gimeno JR, Reith S, et al. Progressive left ventricular remodeling in patients with hypertrophic cardiomyopathy and severe left ventricular hypertrophy. J Am Coll Cardiol. 2004;44(2):398-405. doi:10.1016/j.jacc.2004.01.054.
152. Lancellotti P, Pellikka PA, Budts W, et al. The Clinical Use of Stress Echocardiography in Non-Ischaemic Heart Disease: Recommendations from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. J Am Soc Echocardiogr. 2017;30(2):101-38. doi:10.1016/j.echo.2016.10.016.
153. Parato VM, Antoncecchi V, Sozzi F, et al.; Italian Chapter of ISCU. Echocardiographic diagnosis of the different phenotypes of hypertrophic cardiomyopathy. Cardiovasc Ultrasound. 2016;14(1):30. doi:10.1186/s12947-016-0072-5.
154. Lambiase PD, Barr C, Theuns DA, et al.; EFFORTLESS Investigators. Worldwide experience with a totally subcutaneous implantable defibrillator: early results from the EFFORTLESS S-ICD Registry. Eur Heart J. 2014;35(25):1657-65. doi:10.1093/eurheartj/ehu112.
155. Ponikowski P, Voors AA, Anker SD, et al.; Authors/Task Force Members; Document Reviewers. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2016;18(8):891-975. doi:10.1002/ejhf.592.
156. Maron BJ, McKenna WJ, Danielson GK, et al.; Task Force on Clinical Expert Consensus Documents. American College of Cardiology; Committee for Practice Guidelines. European Society of Cardiology. American College of Cardiology/European Society of Cardiology clinical expert consensus document on hypertrophic cardiomyopathy. A report of the American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents and the European Society of Cardiology Committee for Practice Guidelines. J Am Coll Cardiol. 2003;42(9):1687-713. doi:10.1016/s0735-1097(03)00941-0.
157. Barrett MJ, Ayub B, Martinez MW. Cardiac auscultation in sports medicine: strategies to improve clinical care. Curr Sports Med Rep. 2012;11(2):78-84. doi:10.1249/JSR.0b013e318249c0ff.
158. Cantwell JD. Preparticipation physical evaluation: getting to the heart of the matter. Med Sci Sports Exerc. 1998;30(10 Suppl):S341-4. doi:10.1097/00005768-199810001-00001.
159. Efthimiadis GK, Parcharidou D, Pagourelias ED, et al. Prevalence and clinical outcomes of incidentally diagnosed hypertrophic cardiomyopathy. Am J Cardiol. 2010;105(10):1445-50. doi:10.1016/j.amjcard.2009.12.066.
160. Harmon KG, Zigman M, Drezner JA. The effectiveness of screening history, physical exam, and ECG to detect potentially lethal cardiac disorders in athletes: a systematic review/meta-analysis. J Electrocardiol. 2015;48(3):329-38. doi:10.1016/j.jelectrocard.2015.02.001.
161. Raviele A, Giada F, Bergfeldt L, et al.; European Heart Rhythm Association. Management of patients with palpitations: a position paper from the European Heart Rhythm Association. Europace. 2011;13(7):920-34. doi:10.1093/europace/eur130.
162. Attenhofer Jost CH, Turina J, Mayer K, et al. Echocardiography in the evaluation of systolic murmurs of unknown cause. Am J Med. 2000;108(8):614-20. doi:10.1016/s0002-9343(00)00361-2.
163. Rapezzi C, Arbustini E, Caforio AL, et al. Diagnostic work-up in cardiomyopathies: bridging the gap between clinical phenotypes and final diagnosis. A position statement from the ESC Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2013;34(19):1448-58. doi:10.1093/eurheartj/ehs397.
164. Rapezzi C, Quarta CC, Obici L, et al. Disease profile and differential diagnosis of hereditary transthyretin-related amyloidosis with exclusively cardiac phenotype: an Italian perspective. Eur Heart J. 2013;34(7):520-8. doi:10.1093/eurheartj/ehs123.
165. Sarkozy A, Digilio MC, Dallapiccola B. Leopard syndrome. Orphanet J Rare Dis. 2008;3:13. doi:10.1186/1750-1172-3-13.
166. Scaglia F, Towbin JA, Craigen WJ, et al. Clinical spectrum, morbidity, and mortality in 113 pediatric patients with mitochondrial disease. Pediatrics. 2004;114(4):925-31. doi:10.1542/peds.2004-0718.
167. Pagourelias ED, Efthimiadis GK, Kouidi E, et al. Efficacy of various «classic» echocardiographic and laboratory indices in distinguishing the «gray zone» between athlete’s heart and hypertrophic cardiomyopathy: a pilot study. Echocardiography. 2013;30(2):131-9. doi:10.1111/echo.12014.
168. Coutu M, Perrault LP, White M, et al. Cardiac transplantation for hypertrophic cardiomyopathy: a valid therapeutic option. J Heart Lung Transplant. 2004;23(4):413-7. doi:10.1016/S1053-2498(03)00225-0.
169. Zhang C, Huang X, Li J. Light chain amyloidosis: Where are the light chains from and how they play their pathogenic role? Blood Rev. 2017;31(4):261-70. doi:10.1016/j.blre.2017.03.002.
170. Ingles J, Burns C, Bagnall RD, et al. Nonfamilial Hypertrophic Cardiomyopathy: Prevalence, Natural History, and Clinical Implications. Circ Cardiovasc Genet. 2017;10(2):e001620. doi:10.1161/CIRCGENETICS.116.001620.
171. Maron BJ, Pelliccia A, Spirito P. Cardiac disease in young trained athletes. Insights into methods for distinguishing athlete’s heart from structural heart disease, with particular emphasis on hypertrophic cardiomyopathy. Circulation. 1995;91(5):1596-601. doi:10.1161/01.cir.91.5.1596.
172. Young L, Smedira NG, Tower-Rader A, et al. Hypertrophic cardiomyopathy: A complex disease. Cleve Clin J Med. 2018;85(5):399-411. doi:10.3949/ccjm.85a.17076.
173. Efthimiadis GK, Pagourelias ED, Gossios T, Zegkos T. Hypertrophic cardiomyopathy in 2013: Current speculations and future perspectives. World J Cardiol. 2014;6(2):26-37. doi:10.4330/wjc.v6.i2.26.
174. Hershberger RE, Givertz MM, Ho CY, et al. Genetic Evaluation of Cardiomyopathy – A Heart Failure Society of America Practice Guideline. J Card Fail. 2018;24(5):281-302. doi:10.1016/j.cardfail.2018.03.004.
175. Efthimiadis GK, Pagourelias E, Zegkos T, et al. An Overview of Pharmacotherapy in Hypertrophic Cardiomyopathy: Current Speculations and Clinical Perspectives. Rev Cardiovasc Med. 2016;17(3-4):115-23.
176. Fananapazir L, Tracy CM, Leon MB, et al. Electrophysiologic abnormalities in patients with hypertrophic cardiomyopathy. A consecutive analysis in 155 patients. Circulation. 1989;80(5):1259-68. doi:10.1161/01.cir.80.5.1259.
177. Kelly BS, Mattu A, Brady WJ. Hypertrophic cardiomyopathy: electrocardiographic manifestations and other important considerations for the emergency physician. Am J Emerg Med. 2007;25(1):72-9. doi:10.1016/j.ajem.2006.04.017.
178. McLeod CJ, Ackerman MJ, Nishimura RA, et al. Outcome of patients with hypertrophic cardiomyopathy and a normal electrocardiogram. J Am Coll Cardiol. 2009;54(3):229-33. doi:10.1016/j.jacc.2009.02.071.
179. Wilke I, Witzel K, Münch J, et al. High Incidence of De Novo and Subclinical Atrial Fibrillation in Patients With Hypertrophic Cardiomyopathy and Cardiac Rhythm Management Device. J Cardiovasc Electrophysiol. 2016;27(7):779-84. doi:10.1111/jce.12982.
180. Хирманов В. Н., Трешкур Е. В., Тюрина Т. В. и др. Электрокардиографические методы в диагностике, выборе метода и тактики лечения гипертрофической кардиомиопатии. Progress in Biomedical Research: Сборник статей. СПб, 1997. Т. 2 (1), сс. 7-21.
181. O’Mahony C, Jichi F, Pavlou M, et al.; Hypertrophic Cardiomyopathy Outcomes Investigators. A novel clinical risk prediction model for sudden cardiac death in hypertrophic cardiomyopathy (HCM risk-SCD). Eur Heart J. 2014;35(30):2010-20. doi:10.1093/eurheartj/eht439.
182. Wasfy MM, Weiner RB. Differentiating the athlete’s heart from hypertrophic cardiomyopathy. Curr Opin Cardiol. 2015;30(5):500-5. doi:10.1097/HCO.0000000000000203.
183. Weigner MJ, Caulfield TA, Danias PG, et al. Risk for clinical thromboembolism associated with conversion to sinus rhythm in patients with atrial fibrillation lasting less than 48 hours. Ann Intern Med. 1997;126(8):615-20. doi:10.7326/0003-4819-126-8-199704150-00005.
184. Guttmann OP, Rahman MS, O’Mahony C, et al. Atrial fibrillation and thromboembolism in patients with hypertrophic cardiomyopathy: systematic review. Heart. 2014;100(6):465-72. doi:10.1136/heartjnl-2013-304276.
185. Task Force members, Brignole M, Vardas P, Hoffman E, et al.; EHRA Scientific Documents Committee. Indications for the use of diagnostic implantable and external ECG loop recorders. Europace. 2009;11(5):671-87. doi:10.1093/europace/eup097. Erratum in: Europace. 2009;11(6):836.
186. Frangini PA, Cecchin F, Jordao L, et al. How revealing are insertable loop recorders in pediatrics? Pacing Clin Electrophysiol. 2008;31(3):338-43. doi:10.1111/j.1540-8159.2008.00995.x.
187. Solano A, Menozzi C, Maggi R, et al. Incidence, diagnostic yield and safety of the implantable loop-recorder to detect the mechanism of syncope in patients with and without structural heart disease. Eur Heart J. 2004;25(13):1116-9. doi:10.1016/j.ehj.2004.05.013.
188. Moon JC, Reed E, Sheppard MN, et al. The histologic basis of late gadolinium enhancement cardiovascular magnetic resonance in hypertrophic cardiomyopathy. J Am Coll Cardiol. 2004;43(12):2260-4. doi:10.1016/j.jacc.2004.03.035.
189. O’Hanlon R, Grasso A, Roughton M, et al. Prognostic significance of myocardial fibrosis in hypertrophic cardiomyopathy. J Am Coll Cardiol. 2010;56(11):867-74. doi:10.1016/j.jacc.2010.05.010.
190. Pernat A, Pohar B, Horvat M. Heart conduction disturbances and cardiovascular collapse after disopyramide and low-dose metoprolol in a patient with hypertrophic obstructive cardiomyopathy. J Electrocardiol. 1997;30(4):341-4. doi:10.1016/s0022-0736(97)80048-9.
191. Cerqueira MD, Weissman NJ, Dilsizian V, et al.; American Heart Association Writing Group on Myocardial Segmentation and Registration for Cardiac Imaging. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart. A statement for healthcare professionals from the Cardiac Imaging Committee of the Council on Clinical Cardiology of the American Heart Association. Circulation. 2002;105(4):539-42. doi:10.1161/hc0402.102975.
192. Flachskampf FA, Badano L, Daniel WG, et al. Recommendations for transoesophageal echocardiography: update 2010. Eur J Echocardiogr. 2010;11(7):557-76. doi:10.1093/ejechocard/jeq057. Erratum in: Eur J Echocardiogr. 2011;12(3):255.
193. Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2015;16(3):233-70. doi:10.1093/ehjci/jev014. Erratum in: Eur Heart J Cardiovasc Imaging. 2016;17(4):412. Erratum in: Eur Heart J Cardiovasc Imaging. 2016;17(9):969.
194. Mitchell C, Rahko PS, Blauwet LA, et al. Guidelines for Performing a Comprehensive Transthoracic Echocardiographic Examination in Adults: Recommendations from the American Society of Echocardiography. J Am Soc Echocardiogr. 2019;32(1):1-64. doi:10.1016/j.echo.2018.06.004.
195. Nagueh SF, Appleton CP, Gillebert TC, et al. Recommendations for the evaluation of left ventricular diastolic function by echocardiography. Eur J Echocardiogr. 2009;10(2):165-93. doi:10.1093/ejechocard/jep007.
196. Senior R, Becher H, Monaghan M, et al. Contrast echocardiography: evidence-based recommendations by European Association of Echocardiography. Eur J Echocardiogr. 2009;10(2):194-212. doi:10.1093/ejechocard/jep005.
197. Maron BJ, Casey SA, Hauser RG, Aeppli DM. Clinical course of hypertrophic cardiomyopathy with survival to advanced age. J Am Coll Cardiol. 2003;42(5):882-8. doi:10.1016/s0735-1097(03)00855-6.
198. Maron BJ, Rowin EJ, Maron MS, Braunwald E. Nonobstructive Hypertrophic Cardiomyopathy Out of the Shadows: Known from the Beginning but Largely Ignored … Until Now. Am J Med. 2017;130(2):119-23. doi:10.1016/j.amjmed.2016.09.015.
199. Maron MS, Olivotto I, Zenovich AG, et al. Hypertrophic cardiomyopathy is predominantly a disease of left ventricular outflow tract obstruction. Circulation. 2006;114(21):2232-9. doi:10.1161/CIRCULATIONAHA.106.644682.
200. Spirito P, Autore C, Formisano F, et al. Risk of sudden death and outcome in patients with hypertrophic cardiomyopathy with benign presentation and without risk factors. Am J Cardiol. 2014;113(9):1550-5. doi:10.1016/j.amjcard.2014.01.435.
201. Spirito P, Bellone P, Harris KM, et al. Magnitude of left ventricular hypertrophy and risk of sudden death in hypertrophic cardiomyopathy. N Engl J Med. 2000;342(24):1778-85. doi:10.1056/NEJM200006153422403.
202. Belenkie I, MacDonald RP, Smith ER. Localized septal hypertrophy: part of the spectrum of hypertrophic cardiomyopathy or an incidental echocardiographic finding? Am Heart J. 1988;115(2):385-90. doi:10.1016/0002-8703(88)90486-3.
203. Gardin J, Palabrica T, Dubria S, et al. Localized basal ventricular septal hypertrophy — prevalence, functional and clinical correlates in a population referred for echocardiography. Am J Noninvas Card. 1992;6(1):5-8. doi:10.1159/000470319.
204. Losi MA, Nistri S, Galderisi M, et al.; Working Group of Echocardiography of the Italian Society of Cardiology. Echocardiography in patients with hypertrophic cardiomyopathy: usefulness of old and new techniques in the diagnosis and pathophysiological assessment. Cardiovasc Ultrasound. 2010;8:7. doi:10.1186/1476-7120-8-7.
205. Alvares RF, Goodwin JF. Non-invasive assessment of diastolic function in hypertrophic cardiomyopathy on and off beta adrenergic blocking drugs. Br Heart J. 1982;48(3):204-12. doi:10.1136/hrt.48.3.204.
206. Dimitrow PP, Bober M, Michałowska J, Sorysz D. Left ventricular outflow tract gradient provoked by upright position or exercise in treated patients with hypertrophic cardiomyopathy without obstruction at rest. Echocardiography. 2009;26(5):513-20. doi:10.1111/j.1540-8175.2008.00851.x.
207. Elliott P, Gimeno J, Tomé M, McKenna W. Left ventricular outflow tract obstruction and sudden death in hypertrophic cardiomyopathy. Eur Heart J. 2006;27(24):3073; author reply 3073-4. doi:10.1093/eurheartj/ehl383.
208. Nistri S, Olivotto I, Maron MS, et al. Timing and significance of exercise-induced left ventricular outflow tract pressure gradients in hypertrophic cardiomyopathy. Am J Cardiol. 2010;106(9):1301-6. doi:10.1016/j.amjcard.2010.06.057.
209. Olivotto I, Montereggi A, Mazzuoli F, Cecchi F. Clinical utility and safety of exercise testing in patients with hypertrophic cardiomyopathy. G Ital Cardiol. 1999;29(1):11-9.
210. Sadoul N, Prasad K, Elliott PM, et al. Prospective prognostic assessment of blood pressure response during exercise in patients with hypertrophic cardiomyopathy. Circulation. 1997;96(9):2987-91. doi:10.1161/01.cir.96.9.2987.
211. Tower-Rader A, Betancor J, Lever HM, Desai MY. A Comprehensive Review of Stress Testing in Hypertrophic Cardiomyopathy: Assessment of Functional Capacity, Identification of Prognostic Indicators, and Detection of Coronary Artery Disease. J Am Soc Echocardiogr. 2017;30(9):829-44. doi:10.1016/j.echo.2017.05.017.
212. Yalçin F, Muderrisoglu H, Korkmaz ME, et al. The effect of dobutamine stress on left ventricular outflow tract gradients in hypertensive patients with basal septal hypertrophy. Angiology. 2004;55(3):295-301. doi:10.1177/000331970405500309.
213. Mestres CA, Bartel T, Sorgente A, et al. Hypertrophic obstructive cardiomyopathy: what, when, why, for whom? Eur J Cardiothorac Surg. 2018;53(4):700-7. doi:10.1093/ejcts/ezy020.
214. Mickelsen S, Bathina M, Hsu P, et al. Doppler evaluation of the descending aorta in patients with hypertrophic cardiomyopathy: potential for assessing the functional significance of outflow tract gradients and for optimizing pacemaker function. J Interv Card Electrophysiol. 2004;11(1):47-53. doi:10.1023/B:JICE.0000035929.84238.2f.
215. Tezuka A, Higo K, Nakamukae Y, et al. Bisoprolol Successfully Improved the Intraventricular Pressure Gradient in a Patient with Midventricular Obstructive Hypertrophic Cardiomyopathy with an Apex Aneurysm due to Apical Myocardial Damage. Intern Med. 2019;58(4):535-9. doi:10.2169/internalmedicine.0997-18.
216. Cardim N, Galderisi M, Edvardsen T, et al. Role of multimodality cardiac imaging in the management of patients with hypertrophic cardiomyopathy: an expert consensus of the European Association of Cardiovascular Imaging Endorsed by the Saudi Heart Association. Eur Heart J Cardiovasc Imaging. 2015;16(3):280. doi:10.1093/ehjci/jeu291.
217. Kim MS, Klein AJ, Groves BM, et al. Left ventricular outflow tract obstruction in the presence of asymmetric septal hypertrophy and accessory mitral valve tissue treated with alcohol septal ablation. Eur J Echocardiogr. 2008;9(5):720-4. doi:10.1093/ejechocard/jen152.
218. Monakier D, Woo A, Puri T, et al. Usefulness of myocardial contrast echocardiographic quantification of risk area for predicting postprocedural complications in patients undergoing septal ethanol ablation for obstructive hypertrophic cardiomyopathy. Am J Cardiol. 2004;94(12):1515-22. doi:10.1016/j.amjcard.2004.08.030.
219. Wallace EL, Thompson JJ, Faulkner MW, et al. Septal perforator anatomy and variability of perfusion bed by myocardial contrast echocardiography: a study of hypertrophic cardiomyopathy patients undergoing alcohol septal ablation. J Interv Cardiol. 2013;26(6):604-12. doi:10.1111/joic.12068.
220. Grigg LE, Wigle ED, Williams WG, et al. Transesophageal Doppler echocardiography in obstructive hypertrophic cardiomyopathy: clarification of pathophysiology and importance in intraoperative decision making. J Am Coll Cardiol. 1992;20(1):42-52. doi:10.1016/0735-1097(92)90135-a.
221. Marwick TH, Stewart WJ, Lever HM, et al. Benefits of intraoperative echocardiography in the surgical management of hypertrophic cardiomyopathy. J Am Coll Cardiol. 1992;20(5):1066-72. doi:10.1016/0735-1097(92)90359-u.
222. Oki T, Fukuda N, Iuchi A, et al. Transesophageal echocardiographic evaluation of mitral regurgitation in hypertrophic cardiomyopathy: contributions of eccentric left ventricular hypertrophy and related abnormalities of the mitral complex. J Am Soc Echocardiogr. 1995;8(4):503-10. doi:10.1016/s0894-7317(05)80338-4.
223. Yu EH, Omran AS, Wigle ED, et al. Mitral regurgitation in hypertrophic obstructive cardiomyopathy: relationship to obstruction and relief with myectomy. J Am Coll Cardiol. 2000;36(7):2219-25. doi:10.1016/s0735-1097(00)01019-6.
224. McIntosh CL, Maron BJ, Cannon RO 3rd, Klues HG. Initial results of combined anterior mitral leaflet plication and ventricular septal myotomy-myectomy for relief of left ventricular outflow tract obstruction in patients with hypertrophic cardiomyopathy. Circulation. 1992;86(5 Suppl):II60-7.
225. Green JJ, Berger JS, Kramer CM, Salerno M. Prognostic value of late gadolinium enhancement in clinical outcomes for hypertrophic cardiomyopathy. JACC Cardiovasc Imaging. 2012;5(4):370-7. doi:10.1016/j.jcmg.2011.11.021.
226. Moon JC, Fisher NG, McKenna WJ, Pennell DJ. Detection of apical hypertrophic cardiomyopathy by cardiovascular magnetic resonance in patients with non-diagnostic echocardiography. Heart. 2004;90(6):645-9. doi:10.1136/hrt.2003.014969.
227. Olivotto I, Maron MS, Autore C, et al. Assessment and significance of left ventricular mass by cardiovascular magnetic resonance in hypertrophic cardiomyopathy. J Am Coll Cardiol. 2008;52(7):559-66. doi:10.1016/j.jacc.2008.04.047.
228. Prinz C, Schwarz M, Ilic I, et al. Myocardial fibrosis severity on cardiac magnetic resonance imaging predicts sustained arrhythmic events in hypertrophic cardiomyopathy. Can J Cardiol. 2013;29(3):358-63. doi:10.1016/j.cjca.2012.05.004.
229. Rickers C, Wilke NM, Jerosch-Herold M, et al. Utility of cardiac magnetic resonance imaging in the diagnosis of hypertrophic cardiomyopathy. Circulation. 2005;112(6):855-61. doi:10.1161/CIRCULATIONAHA.104.507723.
230. Rudolph A, Abdel-Aty H, Bohl S, et al. Noninvasive detection of fibrosis applying contrast-enhanced cardiac magnetic resonance in different forms of left ventricular hypertrophy relation to remodeling. J Am Coll Cardiol. 2009;53(3):284-91. doi:10.1016/j.jacc.2008.08.064.
231. Webb J, Fovargue L, Tøndel K, et al. The Emerging Role of Cardiac Magnetic Resonance Imaging in the Evaluation of Patients with HFpEF. Curr Heart Fail Rep. 2018;15(1):1-9. doi:10.1007/s11897-018-0372-1.
232. Albano BB, Fadreguilan EC, Chua JM, et al. Treating a Structural Heart Disease Using a Non-structural Approach: Role of Cardiac Pacing in Hypertrophic Cardiomyopathy. Cardiol Res. 2017;8(1):20-5. doi:10.14740/cr512w.
233. Puntmann VO, Gebker R, Duckett S, et al. Left ventricular chamber dimensions and wall thickness by cardiovascular magnetic resonance: comparison with transthoracic echocardiography. Eur Heart J Cardiovasc Imaging. 2013;14(3):240-6. doi:10.1093/ehjci/jes145.
234. Falk RH. Diagnosis and management of the cardiac amyloidoses. Circulation. 2005;112(13):2047-60. doi:10.1161/CIRCULATIONAHA.104.489187.
235. Gillmore JD, Maurer MS, Falk RH, et al. Nonbiopsy Diagnosis of Cardiac Transthyretin Amyloidosis. Circulation. 2016;133(24):2404-12. doi:10.1161/CIRCULATIONAHA.116.021612.
236. Syed IS, Glockner JF, Feng D, et al. Role of cardiac magnetic resonance imaging in the detection of cardiac amyloidosis. JACC Cardiovasc Imaging. 2010;3(2):155-64. doi:10.1016/j.jcmg.2009.09.023.
237. Todiere G, Aquaro GD, Piaggi P, et al. Progression of myocardial fibrosis assessed with cardiac magnetic resonance in hypertrophic cardiomyopathy. J Am Coll Cardiol. 2012;60(10):922-9. doi:10.1016/j.jacc.2012.03.076.
238. O’Hanlon R, Assomull RG, Prasad SK. Use of cardiovascular magnetic resonance for diagnosis and management in hypertrophic cardiomyopathy. Curr Cardiol Rep. 2007;9(1):51-6. doi:10.1007/s11886-007-0010-0.
239. Patel P, Dhillon A, Popovic ZB, et al. Left Ventricular Outflow Tract Obstruction in Hypertrophic Cardiomyopathy Patients Without Severe Septal Hypertrophy: Implications of Mitral Valve and Papillary Muscle Abnormalities Assessed Using Cardiac Magnetic Resonance and Echocardiography. Circ Cardiovasc Imaging. 2015;8(7):e003132. doi:10.1161/CIRCIMAGING.115.003132.
240. Gruner C, Chan RH, Crean A, et al. Significance of left ventricular apical-basal muscle bundle identified by cardiovascular magnetic resonance imaging in patients with hypertrophic cardiomyopathy. Eur Heart J. 2014;35(39):2706-13. doi:10.1093/eurheartj/ehu154.
241. Brouwer WP, Germans T, Head MC, et al. Multiple myocardial crypts on modified long-axis view are a specific finding in pre-hypertrophic HCM mutation carriers. Eur Heart J Cardiovasc Imaging. 2012;13(4):292-7. doi:10.1093/ehjci/jes005.
242. Schroeder S, Achenbach S, Bengel F, et al.; Working Group Nuclear Cardiology and Cardiac CT; European Society of Cardiology; European Council of Nuclear Cardiology. Cardiac computed tomography: indications, applications, limitations, and training requirements: report of a Writing Group deployed by the Working Group Nuclear Cardiology and Cardiac CT of the European Society of Cardiology and the European Council of Nuclear Cardiology. Eur Heart J. 2008;29(4):531-56. doi:10.1093/eurheartj/ehm544.
243. Esposito A, Colantoni C, De Cobelli F, et al. Multidetector computed tomography for coronary stents imaging: high-voltage (140-kVp) prospective ECG-triggered versus standard-voltage (120-kVp) retrospective ECG-gated helical scanning. J Comput Assist Tomogr. 2013;37(3):395-401. doi:10.1097/RCT.0b013e3182873559.
244. Shiozaki AA, Senra T, Arteaga E, et al. Myocardial fibrosis detected by cardiac CT predicts ventricular fibrillation/ventricular tachycardia events in patients with hypertrophic cardiomyopathy. J Cardiovasc Comput Tomogr. 2013;7(3):173-81. doi:10.1016/j.jcct.2013.04.002.
245. Rapezzi C, Quarta CC, Guidalotti PL, et al. Usefulness and limitations of 99mTc-3,3-diphosphono-1,2-propanodicarboxylic acid scintigraphy in the aetiological diagnosis of amyloidotic cardiomyopathy. Eur J Nucl Med Mol Imaging. 2011;38(3):470-8. doi:10.1007/s00259-010-1642-7.
246. Rapezzi C, Quarta CC, Guidalotti PL, et al. Role of (99m)Tc-DPD scintigraphy in diagnosis and prognosis of hereditary transthyretin-related cardiac amyloidosis. JACC Cardiovasc Imaging. 2011;4(6):659-70. doi:10.1016/j.jcmg.2011.03.016.
247. Katayama M, Panse PM, Kendall CB, et al. Left Ventricular Septal Hypertrophy in Elderly Patients With Aortic Stenosis. J Ultrasound Med. 2018;37(1):217-24. doi:10.1002/jum.14320.
248. Mitsutake R, Miura S, Sako H, et al. Usefulness of multi-detector row computed tomography for the management of percutaneous transluminal septal myocardial ablation in patient with hypertrophic obstructive cardiomyopathy. Int J Cardiol. 2008;129(2):e61-3. doi:10.1016/j.ijcard.2007.06.132.
249. Scalone G, Niccoli G, Crea F. Editor’s Choice – Pathophysiology, diagnosis and management of MINOCA: an update. Eur Heart J Acute Cardiovasc Care. 2019;8(1):54-62. doi:10.1177/2048872618782414.
250. Okayama S, Uemura S, Soeda T, et al. Role of cardiac computed tomography in planning and evaluating percutaneous transluminal septal myocardial ablation for hypertrophic obstructive cardiomyopathy. J Cardiovasc Comput Tomogr. 2010;4(1):62-5. doi:10.1016/j.jcct.2009.10.004.
251. Villa AD, Sammut E, Zarinabad N, et al. Microvascular ischemia in hypertrophic cardiomyopathy: new insights from high-resolution combined quantification of perfusion and late gadolinium enhancement. J Cardiovasc Magn Reson. 2016;18:4. doi:10.1186/s12968-016-0223-8.
252. Chen JM, Levin HR, Michler RE, et al. Reevaluating the significance of pulmonary hypertension before cardiac transplantation: determination of optimal thresholds and quantification of the effect of reversibility on perioperative mortality. J Thorac Cardiovasc Surg. 1997;114(4):627-34. doi:10.1016/S0022-5223(97)70053-9.
253. Kato TS, Takayama H, Yoshizawa S, et al. Cardiac transplantation in patients with hypertrophic cardiomyopathy. Am J Cardiol. 2012;110(4):568-74. doi:10.1016/j.amjcard.2012.04.030.
254. Lindelöw B, Andersson B, Waagstein F, Bergh CH. High and low pulmonary vascular resistance in heart transplant candidates. A 5-year follow-up after heart transplantation shows continuous reduction in resistance and no difference in complication rate. Eur Heart J. 1999;20(2):148-56. doi:10.1053/euhj.1998.1155.
255. Maron MS, Kalsmith BM, Udelson JE, et al. Survival after cardiac transplantation in patients with hypertrophic cardiomyopathy. Circ Heart Fail. 2010;3(5):574-9. doi:10.1161/CIRCHEARTFAILURE.109.922872.
256. Mehra MR, Kobashigawa J, Starling R, et al. Listing criteria for heart transplantation: International Society for Heart and Lung Transplantation guidelines for the care of cardiac transplant candidates – 2006. J Heart Lung Transplant. 2006;25(9):1024-42. doi:10.1016/j.healun.2006.06.008.
257. Torres MF, Perez-Villa F. Heart transplantation in patients with hypertrophic cardiomyopathy. Glob Cardiol Sci Pract. 2018;2018(3):32. doi:10.21542/gcsp.2018.32.
258. Blomström-Lundqvist C, Scheinman MM, Aliot EM, et al.; European Society of Cardiology Committee, NASPE-Heart Rhythm Society. ACC/AHA/ESC guidelines for the management of patients with supraventricular arrhythmias – executive summary: a report of the American college of cardiology/American heart association task force on practice guidelines and the European society of cardiology committee for practice guidelines (writing committee to develop guidelines for the management of patients with supraventricular arrhythmias) developed in collaboration with NASPE-Heart Rhythm Society. J Am Coll Cardiol. 2003;42(8):1493-531. doi:10.1016/j.jacc.2003.08.013.
259. Бокерия Л. А., Берсенёва М. И., Маленков Д. А. Аритмогенные осложнения гипертрофической кардиомиопатии. Анналы аритмологии. 2010;7(3):62-9.
260. Muresan L, Cismaru G, Martins RP, et al. Recommendations for the use of electrophysiological study: Update 2018. Hellenic J Cardiol. 2019;60(2):82-100. doi:10.1016/j.hjc.2018.09.002.
261. Wang W, Lian Z, Rowin EJ, et al. Prognostic Implications of Nonsustained Ventricular Tachycardia in High-Risk Patients With Hypertrophic Cardiomyopathy. Circ Arrhythm Electrophysiol. 2017;10(3):e004604. doi:10.1161/CIRCEP.116.004604.
262. Inada K, Seiler J, Roberts-Thomson KC, et al. Substrate characterization and catheter ablation for monomorphic ventricular tachycardia in patients with apical hypertrophic cardiomyopathy. J Cardiovasc Electrophysiol. 2011;22(1):41-8. doi:10.1111/j.1540-8167.2010.01875.x.
263. Lim KK, Maron BJ, Knight BP. Successful catheter ablation of hemodynamically unstable monomorphic ventricular tachycardia in a patient with hypertrophic cardiomyopathy and apical aneurysm. J Cardiovasc Electrophysiol. 2009;20(4):445-7. doi:10.1111/j.1540-8167.2008.01366.x.
264. Refaat MM, Hotait M, Tseng ZH. Utility of the exercise electrocardiogram testing in sudden cardiac death risk stratification. Ann Noninvasive Electrocardiol. 2014;19(4):311-8. doi:10.1111/anec.12191.
265. Yi G, Poloniecki J, Dickie S, et al. Can the assessment of dynamic QT dispersion on exercise electrocardiogram predict sudden cardiac death in hypertrophic cardiomyopathy? Pacing Clin Electrophysiol. 2000;23(11 Pt 2):1953-6. doi:10.1111/j.1540-8159.2000.tb07060.x.
266. Nistri S, Olivotto I, Maron MS, et al. β Blockers for prevention of exercise-induced left ventricular outflow tract obstruction in patients with hypertrophic cardiomyopathy. Am J Cardiol. 2012;110(5):715-9. doi:10.1016/j.amjcard.2012.04.051.
267. Rowin EJ, Maron BJ, Olivotto I, Maron MS. Role of Exercise Testing in Hypertrophic Cardiomyopathy. JACC Cardiovasc Imaging. 2017;10(11):1374-86. doi:10.1016/j.jcmg.2017.07.016.
268. Mancini DM, Eisen H, Kussmaul W, et al. Value of peak exercise oxygen consumption for optimal timing of cardiac transplantation in ambulatory patients with heart failure. Circulation. 1991;83(3):778-86. doi:10.1161/01.cir.83.3.778.
269. Sharma S, Elliott P, Whyte G, et al. Utility of cardiopulmonary exercise in the assessment of clinical determinants of functional capacity in hypertrophic cardiomyopathy. Am J Cardiol. 2000;86(2):162-8. doi:10.1016/s0002-9149(00)00854-7.
270. Колоскова Н. Н., Шаталов К. В., Бокерия Л. А. Определение пикового потребления кислорода: клиническое использование и перспективы. Креативная кардиология. 2014;(2):20-8.
271. Coats CJ, Rantell K, Bartnik A, et al. Cardiopulmonary Exercise Testing and Prognosis in Hypertrophic Cardiomyopathy. Circ Heart Fail. 2015;8(6):1022-31. doi:10.1161/CIRCHEARTFAILURE.114.002248.
272. Arena R, Owens DS, Arevalo J, et al. Ventilatory efficiency and resting hemodynamics in hypertrophic cardiomyopathy. Med Sci Sports Exerc. 2008;40(5):799-805. doi:10.1249/MSS.0b013e31816459a1.
273. Olivotto I, Maron BJ, Montereggi A, et al. Prognostic value of systemic blood pressure response during exercise in a community-based patient population with hypertrophic cardiomyopathy. J Am Coll Cardiol. 1999;33(7):2044-51. doi:10.1016/s0735-1097(99)00094-7.
274. Diodati JG, Schenke WH, Waclawiw MA, et al. Predictors of exercise benefit after operative relief of left ventricular outflow obstruction by the myotomy-myectomy procedure in hypertrophic cardiomyopathy. Am J Cardiol. 1992;69(19):1617-22. doi:10.1016/0002-9149(92)90713-9.
275. Bennett MK, Gilotra NA, Harrington C, et al. Evaluation of the role of endomyocardial biopsy in 851 patients with unexplained heart failure from 2000-2009. Circ Heart Fail. 2013;6(4):676-84. doi:10.1161/CIRCHEARTFAILURE.112.000087.
276. Schönland SO, Hegenbart U, Bochtler T, et al. Immunohistochemistry in the classification of systemic forms of amyloidosis: a systematic investigation of 117 patients. Blood. 2012;119(2):488-93. doi:10.1182/blood-2011-06-358507.
277. Quarta CC, Gonzalez-Lopez E, Gilbertson JA, et al. Diagnostic sensitivity of abdominal fat aspiration in cardiac amyloidosis. Eur Heart J. 2017;38(24):1905-8. doi:10.1093/eurheartj/ehx047.
278. Крылова Н. С., Хашиева Ф. М., Демкина А. Е. и др. Гипертрофическая кардиомиопатия и артериальная гипертензия: возможно ли сочетание? Сердце: журнал для практикующих врачей. 2015;14(3):164-9.
279. Полякова А. А., Гудкова А. Я., Крутиков А. Н. и др. Гипертрофическая кардиомиопатия в старшей возрастной группе: влияние факторов кардиометаболического риска и полиморфизма гена MADD. Артериальная гипертензия. 2018;24(1):29-40. doi:10.18705/1607-419X-2018-24-1-29-40.
280. Abel ED, Litwin SE, Sweeney G. Cardiac remodeling in obesity. Physiol Rev. 2008;88(2):389-419. doi:10.1152/physrev.00017.2007.
281. Ommen SR, Lopez-Jimenez F. Obesity and hypertrophic cardiomyopathy: chickens, eggs, and causality: clinical skills remain the key to caring for patients. J Am Coll Cardiol. 2013;62(5):458-9. doi:10.1016/j.jacc.2013.03.063.
282. Olivotto I, Maron BJ, Tomberli B, et al. Obesity and its association to phenotype and clinical course in hypertrophic cardiomyopathy. J Am Coll Cardiol. 2013;62(5):449-57. doi:10.1016/j.jacc.2013.03.062.
283. van Straten AH, Soliman Hamad MA, Peels KC, et al. Increased septum wall thickness in patients undergoing aortic valve replacement predicts worse late survival. Ann Thorac Surg. 2012;94(1):66-71. doi:10.1016/j.athoracsur.2012.03.027.
284. Di Tommaso L, Stassano P, Mannacio V, et al. Asymmetric septal hypertrophy in patients with severe aortic stenosis: the usefulness of associated septal myectomy. J Thorac Cardiovasc Surg. 2013;145(1):171-5. doi:10.1016/j.jtcvs.2011.10.096.
285. Dweck MR, Joshi S, Murigu T, et al. Left ventricular remodeling and hypertrophy in patients with aortic stenosis: insights from cardiovascular magnetic resonance. J Cardiovasc Magn Reson. 2012;14(1):50. doi:10.1186/1532-429X-14-50.
286. Maron BJ, Edwards JE, Epstein SE. Disproportionate ventricular thickening in patients with systemic hypertension. Chest. 1978;73(4):466-70. doi:10.1378/chest.73.4.466.
287. Rodrigues JC, Amadu AM, Dastidar AG, et al. Prevalence and predictors of asymmetric hypertensive heart disease: insights from cardiac and aortic function with cardiovascular magnetic resonance. Eur Heart J Cardiovasc Imaging. 2016;17(12):1405-13. doi:10.1093/ehjci/jev329.
288. Tuseth N, Cramariuc D, Rieck AE, et al. Asymmetric septal hypertrophy – marker of hypertension in aortic stenosis (a SEAS substudy). Blood Press. 2010;19(3):140-4. doi:10.3109/08037051.2010.481816.
289. Shapiro LM, Howat AP, Crean PA, Westgate CJ. An echocardiographic study of localized subaortic hypertrophy. Eur Heart J. 1986;7(2):127-32. doi:10.1093/oxfordjournals.eurheartj.a062034.
290. Raissuni Z, Doghmi N, Mousseaux E, et al. Hypertrophic cardiomyopathy mimicking STEMI: The role of cardiac magnetic resonance imaging in the detection of microvascular coronary dysfunction. Diagn Interv Imaging. 2014;95(11):1111-2. doi:10.1016/j.diii.2013.12.020.
291. Timmer SA, Knaapen P. Coronary microvascular function, myocardial metabolism, and energetics in hypertrophic cardiomyopathy: insights from positron emission tomography. Eur Heart J Cardiovasc Imaging. 2013;14(2):95-101. doi:10.1093/ehjci/jes242.
292. Zhang YD, Li M, Qi L, et al. Hypertrophic cardiomyopathy: Cardiac structural and microvascular abnormalities as evaluated with multi-parametric MRI. Eur J Radiol. 2015;84(8):1480-6. doi:10.1016/j.ejrad.2015.04.028.
293. Gutiérrez-Barrios A, Camacho-Jurado F, Díaz-Retamino E, et al. Invasive assessment of coronary microvascular dysfunction in hypertrophic cardiomyopathy: the index of microvascular resistance. Cardiovasc Revasc Med. 2015;16(7):426-8. doi:10.1016/j.carrev.2015.06.008.
294. Ismail TF, Hsu LY, Greve AM, et al. Coronary microvascular ischemia in hypertrophic cardiomyopathy — a pixel-wise quantitative cardiovascular magnetic resonance perfusion study. J Cardiovasc Magn Reson. 2014;16(1):49. doi:10.1186/s12968-014-0049-1.
295. Olivotto I, Girolami F, Sciagrà R, et al. Microvascular function is selectively impaired in patients with hypertrophic cardiomyopathy and sarcomere myofilament gene mutations. J Am Coll Cardiol. 2011;58(8):839-48. doi:10.1016/j.jacc.2011.05.018.
296. Zipes DP, Camm AJ, Borggrefe M, et al.; American College of Cardiology/American Heart Association Task Force; European Society of Cardiology Committee for Practice Guidelines; European Heart Rhythm Association; Heart Rhythm Society. ACC/AHA/ESC 2006 Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death: a report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines (writing committee to develop Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death): developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society. Circulation. 2006;114(10):e385-484. doi:10.1161/CIRCULATIONAHA.106.178233.
297. Basavarajaiah S, Wilson M, Whyte G, et al. Prevalence of hypertrophic cardiomyopathy in highly trained athletes: relevance to pre-participation screening. J Am Coll Cardiol. 2008;51(10):1033-9. doi:10.1016/j.jacc.2007.10.055.
298. Malhotra A, Sharma S. Hypertrophic Cardiomyopathy in Athletes. Eur Cardiol. 2017;12(2):80-2. doi:10.15420/ecr.2017:12:1.
299. Pelliccia A, Solberg EE, Papadakis M, et al. Recommendations for participation in competitive and leisure time sport in athletes with cardiomyopathies, myocarditis, and pericarditis: position statement of the Sport Cardiology Section of the European Association of Preventive Cardiology (EAPC). Eur Heart J. 2019;40(1):19-33. doi:10.1093/eurheartj/ehy730.
300. Liebregts M, Faber L, Jensen MK, et al. Validation of the HCM Risk-SCD model in patients with hypertrophic cardiomyopathy following alcohol septal ablation. Europace. 2018;20(FI2):f198-f203. doi:10.1093/europace/eux251.
301. Spoladore R, Maron MS, D’Amato R, et al. Pharmacological treatment options for hypertrophic cardiomyopathy: high time for evidence. Eur Heart J. 2012;33(14):1724-33. doi:10.1093/eurheartj/ehs150.
302. Toshima H, Koga Y, Nagata H, et al. Comparable effects of oral diltiazem and verapamil in the treatment of hypertrophic cardiomyopathy. Double-blind crossover study. Jpn Heart J. 1986;27(5):701-15. doi:10.1536/ihj.27.701.
303. Galve E, Sambola A, Saldaña G, et al. Late benefits of dual-chamber pacing in obstructive hypertrophic cardiomyopathy: a 10-year follow-up study. Heart. 2010;96(5):352-6. doi:10.1136/hrt.2008.158915.
304. Gentry JL 3rd, Mentz RJ, Hurdle M, Wang A. Ranolazine for Treatment of Angina or Dyspnea in Hypertrophic Cardiomyopathy Patients (RHYME). J Am Coll Cardiol. 2016;68(16):1815-7. doi:10.1016/j.jacc.2016.07.758.
305. Kappenberger L, Linde C, Daubert C, et al. Pacing in hypertrophic obstructive cardiomyopathy. A randomized crossover study. PIC Study Group. Eur Heart J. 1997(8):1249-56. doi:10.1093/oxfordjournals.eurheartj.a015435.
306. Maron BJ, Nishimura RA, McKenna WJ, et al. Assessment of permanent dual-chamber pacing as a treatment for drug-refractory symptomatic patients with obstructive hypertrophic cardiomyopathy. A randomized, double-blind, crossover study (M-PATHY). Circulation. 1999;99(22):2927-33. doi:10.1161/01.cir.99.22.2927.
307. Maron MS, Chan RH, Kapur NK, et al. Effect of Spironolactone on Myocardial Fibrosis and Other Clinical Variables in Patients with Hypertrophic Cardiomyopathy. Am J Med. 2018;131(7):837-41. doi:10.1016/j.amjmed.2018.02.025.
308. Nishimura RA, Trusty JM, Hayes DL, et al. Dual-chamber pacing for hypertrophic cardiomyopathy: a randomized, double-blind, crossover trial. J Am Coll Cardiol. 1997;29(2):435-41. doi:10.1016/s0735-1097(96)00473-1.
309. Olivotto I, Camici PG, Merlini PA, et al. Efficacy of Ranolazine in Patients With Symptomatic Hypertrophic Cardiomyopathy: The RESTYLE-HCM Randomized, Double-Blind, Placebo-Controlled Study. Circ Heart Fail. 2018;11(1):e004124. doi:10.1161/CIRCHEARTFAILURE.117.004124.
310. Slade AK, Sadoul N, Shapiro L, et al. DDD pacing in hypertrophic cardiomyopathy: a multicentre clinical experience. Heart. 1996;75(1):44-9. doi:10.1136/hrt.75.1.44.
311. Jung H, Yang PS, Jang E, et al. Effectiveness and Safety of Non-Vitamin K Antagonist Oral Anticoagulants in Patients With Atrial Fibrillation With Hypertrophic Cardiomyopathy: A Nationwide Cohort Study. Chest. 2019;155(2):354-63. doi:10.1016/j.chest.2018.11.009.
312. Zhou Y, He W, Zhou Y, Zhu W. Non-vitamin K antagonist oral anticoagulants in patients with hypertrophic cardiomyopathy and atrial fibrillation: a systematic review and meta-analysis. J Thromb Thrombolysis. 2020;50(2):311-7. doi:10.1007/s11239-019-02008-3.
313. Rujirachun P, Charoenngam N, Wattanachayakul P, et al. Efficacy and safety of direct oral anticoagulants (DOACs) versus vitamin K antagonist (VKA) among patients with atrial fibrillation and hypertrophic cardiomyopathy: a systematic review and meta-analysis. Acta Cardiol. 2020;75(8):724-31. doi:10.1080/00015385.2019.1668113.
314. Patten M, Pecha S, Aydin A. Atrial Fibrillation in Hypertrophic Cardiomyopathy: Diagnosis and Considerations for Management. J Atr Fibrillation. 2018;10(5):1556. doi:10.4022/jafib.1556.
315. Dearani JA, Ommen SR, Gersh BJ, et al. Surgery insight: Septal myectomy for obstructive hypertrophic cardiomyopathy–the Mayo Clinic experience. Nat Clin Pract Cardiovasc Med. 2007;4(9):503-12. doi:10.1038/ncpcardio0965.
316. Leonardi RA, Kransdorf EP, Simel DL, Wang A. Meta-analyses of septal reduction therapies for obstructive hypertrophic cardiomyopathy: comparative rates of overall mortality and sudden cardiac death after treatment. Circ Cardiovasc Interv. 2010;3(2):97-104. doi:10.1161/CIRCINTERVENTIONS.109.916676.
317. Zeng Z, Wang F, Dou X, et al. Comparison of percutaneous transluminal septal myocardial ablation versus septal myectomy for the treatment of patients with hypertrophic obstructive cardiomyopathy – a meta analysis. Int J Cardiol. 2006;112(1):80-4. doi:10.1016/j.ijcard.2005.10.009.
318. Afanasyev AV, Bogachev-Prokophiev AV, Ovcharov MA, et al. Single-Centre Experience of Surgical Myectomy for Hypertrophic Obstructive Cardiomyopathy. Heart Lung Circ. 2020;29(6):949-55. doi:10.1016/j.hlc.2019.07.009.
319. Veselka J, Faber L, Liebregts M, et al. Short- and long-term outcomes of alcohol septal ablation for hypertrophic obstructive cardiomyopathy in patients with mild left ventricular hypertrophy: a propensity score matching analysis. Eur Heart J. 2019;40(21):1681-7. doi:10.1093/eurheartj/ehz110.
320. Майстренко А. Д., Гурщенков А. В., Паскарь Н. С. и др. Современное состояние проблемы хирургического лечения гипертрофической обструктивной кардиомиопатии. Вестник хирургии имени И.И. Грекова. 2013;172(2):082-7. doi:10.24884/0042-4625-2013-172-2-082-087.
321. Хитрова М. Э., Бокерия Л. А., Берсенева М. И. и др. Метаанализ результатов хирургического лечения гипертрофической обструктивной кардиомиопатии. Креативная кардиология. 2017;11(4):337-47. doi:10.24022/1997-3187-2017-11-4-337-347.
322. Богданов Д. В., Шапошник И. И. Варианты клинического течения, исходы и прогноз гипертрофической необструктивной кардиомиопатии – результаты длительного наблюдения. Российский кардиологический журнал. 2019;(11):48-54. doi:10.15829/1560-4071-2019-11-48-54.
323. Vriesendorp PA, Schinkel AF, Liebregts M, et al. Validation of the 2014 European Society of Cardiology guidelines risk prediction model for the primary prevention of sudden cardiac death in hypertrophic cardiomyopathy. Circ Arrhythm Electrophysiol. 2015;8(4):829-35. doi:10.1161/CIRCEP.114.002553.
324. Falk V, Baumgartner H, Bax JJ, et al.; ESC Scientific Document Group. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur J Cardiothorac Surg. 2017;52(4):616-64. doi:10.1093/ejcts/ezx324. Erratum in: Eur J Cardiothorac Surg. 2017;52(4):832.
325. Lourenço AP, Leite-Moreira AF, Balligand JL, et al. An integrative translational approach to study heart failure with preserved ejection fraction: a position paper from the Working Group on Myocardial Function of the European Society of Cardiology. Eur J Heart Fail. 2018;20(2):216-27. doi:10.1002/ejhf.1059.
326. Мареев В. Ю., Фомин И. В., Агеев Ф. Т. и др. Клинические рекомендации ОССН — РКО — РНМОТ. Сердечная недостаточность: хроническая (ХСН) и острая декомпенсированная (ОДСН). диагностика, профилактика и лечение. Кардиология. 2018;58(6S):8-158. doi:10.18087/cardio.2475.
327. Кобалава Ж. Д., Конради А. О., Недогода С. В. и др. Артериальная гипертензия у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(3):3786. doi:10.15829/1560-4071-2020-3-3786.
328. Гудкова А. Я., Стрельцова А. А., Костарева А. А. Гипертрофическая кардиомиопатия: современные возможности фармакологических подходов к лечению. Терапевтический архив. 2019;91(9):129-36. doi:10.26442/00403660.2019.09.000137.
329. Ammirati E, Contri R, Coppini R, et al. Pharmacological treatment of hypertrophic cardiomyopathy: current practice and novel perspectives. Eur J Heart Fail. 2016;18(9):1106-18. doi:10.1002/ejhf.541.
330. Spicer RL, Rocchini AP, Crowley DC, et al. Hemodynamic effects of verapamil in children and adolescents with hypertrophic cardiomyopathy. Circulation. 1983;67(2):413-20. doi:10.1161/01.cir.67.2.413.
331. Flamm MD, Harrison DC, Hancock EW. Muscular subaortic stenosis. Prevention of outflow obstruction with propranolol. Circulation. 1968;38(5):846-58. doi:10.1161/01.cir.38.5.846.
332. Sherrid MV. Drug Therapy for Hypertrophic Cardiomypathy: Physiology and Practice. Curr Cardiol Rev. 2016;12(1):52-65. doi:10.2174/1573403×1201160126125403.
333. Sherrid MV, Gunsburg D, Sharma A. Medical treatment of hypertrophic cardiomyopathy. Curr Cardiol Rep. 2000;2(2):148-53. doi:10.1007/s11886-000-0012-7.
334. Sherrid MV, Barac I, McKenna WJ, et al. Multicenter study of the efficacy and safety of disopyramide in obstructive hypertrophic cardiomyopathy. J Am Coll Cardiol. 2005;45(8):1251-8. doi:10.1016/j.jacc.2005.01.012.
335. Sherrid MV, Shetty A, Winson G, et al. Treatment of obstructive hypertrophic cardiomyopathy symptoms and gradient resistant to first-line therapy with β-blockade or verapamil. Circ Heart Fail. 2013;6(4):694-702. doi:10.1161/CIRCHEARTFAILURE.112.000122.
336. Adelman AG, Shah PM, Gramiak R, Wigle ED. Long-term propranolol therapy in muscular subaortic stenosis. Br Heart J. 1970;32(6):804-11. doi:10.1136/hrt.32.6.804.
337. Bonow RO, Dilsizian V, Rosing DR, et al. Verapamil-induced improvement in left ventricular diastolic filling and increased exercise tolerance in patients with hypertrophic cardiomyopathy: short- and long-term effects. Circulation. 1985;72(4):853-64. doi:10.1161/01.cir.72.4.853.
338. Bonow RO, Rosing DR, Epstein SE. The acute and chronic effects of verapamil on left ventricular function in patients with hypertrophic cardiomyopathy. Eur Heart J. 1983;4, Suppl F:57-65. doi:10.1093/eurheartj/4.suppl_f.57.
339. Gistri R, Cecchi F, Choudhury L, et al. Effect of verapamil on absolute myocardial blood flow in hypertrophic cardiomyopathy. Am J Cardiol. 1994;74(4):363-8. doi:10.1016/0002-9149(94)90404-9.
340. Rosing DR, Condit JR, Maron BJ, et al. Verapamil therapy: a new approach to the pharmacologic treatment of hypertrophic cardiomyopathy: III. Effects of long-term administration. Am J Cardiol. 1981;48(3):545-53. doi:10.1016/0002-9149(81)90086-2.
341. Rosing DR, Kent KM, Maron BJ, Epstein SE. Verapamil therapy: a new approach to the pharmacologic treatment of hypertrophic cardiomyopathy. II. Effects on exercise capacity and symptomatic status. Circulation. 1979;60(6):1208-13. doi:10.1161/01.cir.60.6.1208.
342. Said SM, Schaff HV, Abel MD, Dearani JA. Transapical approach for apical myectomy and relief of midventricular obstruction in hypertrophic cardiomyopathy. J Card Surg. 2012;27(4):443-8. doi:10.1111/j.1540-8191.2012.01475.x.
343. Shah A, Duncan K, Winson G, et al. Severe symptoms in mid and apical hypertrophic cardiomyopathy. Echocardiography. 2009;26(8):922-33. doi:10.1111/j.1540-8175.2009.00905.x.
344. Maron MS, Rowin EJ, Olivotto I, et al. Contemporary Natural History and Management of Nonobstructive Hypertrophic Cardiomyopathy. J Am Coll Cardiol. 2016;67(12):1399-409. doi:10.1016/j.jacc.2016.01.023.
345. McMurray JJ, Adamopoulos S, Anker SD, et al.; ESC Committee for Practice Guidelines. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2012;33(14):1787-847. doi:10.1093/eurheartj/ehs104. Erratum in: Eur Heart J. 2013;34(2):158.
346. Сафрыгина Ю. В., Габрусенко С. А., Овчинников А. Г. и др. Сердечные натрийуретические пептиды в плазме больных гипертрофической кардиомиопатией. Кардиология. 2007;47(5):50-7.
347. Braunwald E, Lambrew CT, Rockoff SD, et al. Idiopathic hypertrophic subaortic stenosis. I. A description of the disease based upon an analysis of 64 patients. Circulation. 1964;30:Suppl 4:3-119. doi:10.1161/01.cir.29.5s4.iv-3.
348. Okeie K, Shimizu M, Yoshio H, et al. Left ventricular systolic dysfunction during exercise and dobutamine stress in patients with hypertrophic cardiomyopathy. J Am Coll Cardiol. 2000;36(3):856-63. doi:10.1016/s0735-1097(00)00818-4.
349. Epstein SE, Rosing DR. Verapamil: its potential for causing serious complications in patients with hypertrophic cardiomyopathy. Circulation. 1981;64(3):437-41. doi:10.1161/01.cir.64.3.437.
350. Shimada YJ, Passeri JJ, Baggish AL, et al. Effects of losartan on left ventricular hypertrophy and fibrosis in patients with nonobstructive hypertrophic cardiomyopathy. JACC Heart Fail. 2013;1(6):480-7. doi:10.1016/j.jchf.2013.09.001.
351. Udelson JE, Bonow RO, O’Gara PT, et al. Verapamil prevents silent myocardial perfusion abnormalities during exercise in asymptomatic patients with hypertrophic cardiomyopathy. Circulation. 1989;79(5):1052-60. doi:10.1161/01.cir.79.5.1052.
352. Wilmshurst PT, Thompson DS, Juul SM, et al. Effects of verapamil on haemodynamic function and myocardial metabolism in patients with hypertrophic cardiomyopathy. Br Heart J. 1986;56(6):544-53. doi:10.1136/hrt.56.6.544.
353. Argulian E, Messerli FH, Aziz EF, et al. Antihypertensive therapy in hypertrophic cardiomyopathy. Am J Cardiol. 2013;111(7):1040-5. doi:10.1016/j.amjcard.2012.12.026.
354. Olivotto I, Cecchi F, Poggesi C, Yacoub MH. Patterns of disease progression in hypertrophic cardiomyopathy: an individualized approach to clinical staging. Circ Heart Fail. 2012;5(4):535-46. doi:10.1161/CIRCHEARTFAILURE.112.967026.
355. Robinson K, Frenneaux MP, Stockins B, et al. Atrial fibrillation in hypertrophic cardiomyopathy: a longitudinal study. J Am Coll Cardiol. 1990;15(6):1279-85. doi:10.1016/s0735-1097(10)80014-2.
356. Olivotto I, Cecchi F, Casey SA, et al. Impact of atrial fibrillation on the clinical course of hypertrophic cardiomyopathy. Circulation. 2001;104(21):2517-24. doi:10.1161/hc4601.097997.
357. Maron BJ, Gardin JM, Flack JM, et al. Prevalence of hypertrophic cardiomyopathy in a general population of young adults. Echocardiographic analysis of 4111 subjects in the CARDIA Study. Coronary Artery Risk Development in (Young) Adults. Circulation. 1995;92(4):785-9. doi:10.1161/01.cir.92.4.785.
358. Camm AJ, Lip GY, De Caterina R, et al.; ESC Committee for Practice Guidelines-CPG; Document Reviewers. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: an update of the 2010 ESC Guidelines for the management of atrial fibrillation–developed with the special contribution of the European Heart Rhythm Association. Europace. 2012;14(10):1385-413. doi:10.1093/europace/eus305.
359. Camm CF, Camm AJ. Atrial Fibrillation and Anticoagulation in Hypertrophic Cardiomyopathy. Arrhythm Electrophysiol Rev. 2017;6(2):63-8. doi:10.15420/aer.2017.4.2.
360. Di Cori A, Lilli A, Zucchelli G, Zaca V. Role of cardiac electronic implantable device in the stratification and management of embolic risk of silent atrial fibrillation: are all atrial fibrillations created equal? Expert Rev Cardiovasc Ther. 2018;16(3):175-81. doi:10.1080/14779072.2018.1438267.
361. van Velzen HG, Theuns DA, Yap SC, et al. Incidence of Device-Detected Atrial Fibrillation and Long-Term Outcomes in Patients With Hypertrophic Cardiomyopathy. Am J Cardiol. 2017;119(1):100-5. doi:10.1016/j.amjcard.2016.08.092.
362. Brambatti M, Connolly SJ, Gold MR, et al.; ASSERT Investigators. Temporal relationship between subclinical atrial fibrillation and embolic events. Circulation. 2014;129(21):2094-9. doi:10.1161/CIRCULATIONAHA.113.007825.
363. European Heart Rhythm Association; European Association for Cardio-Thoracic Surgery, Camm AJ, Kirchhof P, Lip GY, et al. Guidelines for the management of atrial fibrillation: the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Eur Heart J. 2010;31(19):2369-429. doi:10.1093/eurheartj/ehq278. Erratum in: Eur Heart J. 2011;32(9):1172.
364. Miller CAS, Maron MS, Estes NAM III, et al. Safety, Side Effects and Relative Efficacy of Medications for Rhythm Control of Atrial Fibrillation in Hypertrophic Cardiomyopathy. Am J Cardiol. 2019;123(11):1859-62. doi:10.1016/j.amjcard.2019.02.051.
365. Schaufelberger M. Cardiomyopathy and pregnancy. Heart. 2019;105(20):1543-51. doi:10.1136/heartjnl-2018-313476.
366. Azarbal F, Singh M, Finocchiaro G, et al. Exercise capacity and paroxysmal atrial fibrillation in patients with hypertrophic cardiomyopathy. Heart. 2014;100(8):624-30. doi:10.1136/heartjnl-2013-304908.
367. Pisters R, Lane DA, Nieuwlaat R, et al. A novel user-friendly score (HAS-BLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro Heart Survey. Chest. 2010;138(5):1093-100. doi:10.1378/chest.10-0134.
368. Lee HJ, Kim HK, Jung JH, et al. Novel Oral Anticoagulants for Primary Stroke Prevention in Hypertrophic Cardiomyopathy Patients With Atrial Fibrillation. Stroke. 2019;50(9):2582-6. doi:10.1161/STROKEAHA.119.026048.
369. Dominguez F, Climent V, Zorio E, et al. Direct oral anticoagulants in patients with hypertrophic cardiomyopathy and atrial fibrillation. Int J Cardiol. 2017;248:232-8. doi:10.1016/j.ijcard.2017.08.010.
370. Li B, Sun C, Qin F, et al. Could direct oral anticoagulants be an alternative to vitamin K antagonists in patients with hypertrophic cardiomyopathy and atrial fibrillation? Int J Cardiol. 2018;256:39. doi:10.1016/j.ijcard.2017.10.113.
371. Lozier MR, Sanchez AM, Lee JJ, et al. Thromboembolic Outcomes of Different Anticoagulation Strategies for Patients with Atrial Fibrillation in the Setting of Hypertrophic Cardiomyopathy: A Systematic Review. J Atr Fibrillation. 2019;12(4):2207. doi:10.4022/jafib.2207.
372. Ruff CT, Giugliano RP, Braunwald E, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials. Lancet. 2014;383(9921):955-62. doi:10.1016/S0140-6736(13)62343-0.
373. Connolly SJ, Ezekowitz MD, Yusuf S, et al.; RE-LY Steering Committee and Investigators. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009;361(12):1139-51. doi:10.1056/NEJMoa0905561. Erratum in: N Engl J Med. 2010;363(19):1877.
374. Gómez-Outes A, Terleira-Fernández AI, Calvo-Rojas G, et al. Dabigatran, Rivaroxaban, or Apixaban versus Warfarin in Patients with Nonvalvular Atrial Fibrillation: A Systematic Review and Meta-Analysis of Subgroups. Thrombosis. 2013;2013:640723. doi:10.1155/2013/640723.
375. Клинические рекомендации. Фибрилляция предсердий. Москва, 2017. 65 с. https://racvs.ru/clinic/files/2017/Atrial-Fibrillation.pdf.
376. ACTIVE Investigators, Connolly SJ, Pogue J, Hart RG, et al. Effect of clopidogrel added to aspirin in patients with atrial fibrillation. N Engl J Med. 2009;360(20):2066-78. doi:10.1056/NEJMoa0901301.
377. Бокерия Л. А., Бокерия О.Л., Меликулов А. Х. и др. Хирургическое лечение фибрилляции предсердий: современное состояние проблемы. Анналы аритмологии. 2009;6(2):5-11.
378. Nishimura RA, Schaff HV. Septal myectomy for patients with hypertrophic cardiomyopathy: A new paradigm. J Thorac Cardiovasc Surg. 2016;151(2):303-4. doi:10.1016/j.jtcvs.2015.09.068.
379. Swistel DG, Balaram SK. Surgical myectomy for hypertrophic cardiomyopathy in the 21st century, the evolution of the «RPR» repair: resection, plication, and release. Prog Cardiovasc Dis. 2012;54(6):498-502. doi:10.1016/j.pcad.2012.03.001.
380. Swistel DG, Sherrid MV. The surgical management of obstructive hypertrophic cardiomyopathy: the RPR procedure-resection, plication, release. Ann Cardiothorac Surg. 2017;6(4):423-5. doi:10.21037/acs.2017.06.03.
381. Veselka J, Jensen MK, Liebregts M, et al. Long-term clinical outcome after alcohol septal ablation for obstructive hypertrophic cardiomyopathy: results from the Euro-ASA registry. Eur Heart J. 2016;37(19):1517-23. doi:10.1093/eurheartj/ehv693.
382. Afanasyev AV, Bogachev-Prokophiev AV, Kashtanov MG, et al. Myectomy versus alcohol septal ablation in patients with hypertrophic obstructive cardiomyopathy. Interact Cardiovasc Thorac Surg. 2020;31(2):158-65. doi:10.1093/icvts/ivaa075.
383. Bogachev-Prokophiev A, Afanasyev A, Zheleznev S, et al. Mitral valve repair or replacement in hypertrophic obstructive cardiomyopathy: a prospective randomized study. Interact Cardiovasc Thorac Surg. 2017;25(3):356-62. doi:10.1093/icvts/ivx152.
384. Bogachev-Prokophiev A, Afanasyev AV, Zheleznev S, et al. Septal Myectomy With Vs Without Subvalvular Apparatus Intervention in Patients With Hypertrophic Obstructive Cardiomyopathy: A Prospective Randomized Study. Semin Thorac Cardiovasc Surg. 2019;31(3):424-31. doi:10.1053/j.semtcvs.2019.01.011.
385. Afanasyev A, Bogachev-Prokophiev A, Lenko E, et al. Myectomy with mitral valve repair versus replacement in adult patients with hypertrophic obstructive cardiomyopathy: a systematic review and meta-analysis. Interact Cardiovasc Thorac Surg. 2019;28(3):465-72. doi:10.1093/icvts/ivy269.
386. Гурщенков А. В., Сухова И. В., Зайцев В. В. и др. Пятилетний опыт использования мобилизации сердца при септальной миоэктомии. Кардиология и сердечно-сосудистая хирургия. 2018;11(4):54-8. doi:10.17116/kardio201811454.
387. Agarwal S, Tuzcu EM, Desai MY, et al. Updated meta-analysis of septal alcohol ablation versus myectomy for hypertrophic cardiomyopathy. J Am Coll Cardiol. 2010;55(8):823-34. doi:10.1016/j.jacc.2009.09.047.
388. Alam M, Dokainish H, Lakkis NM. Hypertrophic obstructive cardiomyopathy-alcohol septal ablation vs. myectomy: a meta-analysis. Eur Heart J. 2009;30(9):1080-7. doi:10.1093/eurheartj/ehp016.
389. Swistel DG, Balaram SK. Resection, Plication, Release – the RPR procedure for obstructive hypertrophic cardiomyopathy. Anadolu Kardiyol Derg. 2006;6 Suppl 2:31-6.
390. Каштанов М. Г., Чернышев С. Д., Кардапольцев Л. В. и др. Этаноловая септальная аблация в лечении обструктивной гипертрофической кардиомиопатии: отбор пациентов и рациональность ее применения. Патология кровообращения и кардиохирургия. 2017;21(1):104-16.
391. Batzner A, Schäfers HJ, Borisov KV, Seggewiß H. Hypertrophic obstructive cardiomyopathy – the role of myectomy and percutaneous septal ablation in drug-refractory disease. Dtsch Arztebl Int. 2019;116:47-53. doi:10.3238/arztebl.2019.0047.
392. Сухов В. К., Шлойдо Е. А., Шубенок Д. А. и др. Спиртовая септальная абляция при обструктивной гипертрофической кардиомиопатии. Международный журнал интервенционной кардиоангиологии. 2013;(35):75.
393. Schaff HV, Dearani JA, Ommen SR, et al. Expanding the indications for septal myectomy in patients with hypertrophic cardiomyopathy: results of operation in patients with latent obstruction. J Thorac Cardiovasc Surg. 2012;143(2):303-9. doi:10.1016/j.jtcvs.2011.10.059.
394. McCully RB, Nishimura RA, Tajik AJ, et al. Extent of clinical improvement after surgical treatment of hypertrophic obstructive cardiomyopathy. Circulation. 1996;94(3):467-71. doi:10.1161/01.cir.94.3.467.
395. Orme NM, Sorajja P, Dearani JA, et al. Comparison of surgical septal myectomy to medical therapy alone in patients with hypertrophic cardiomyopathy and syncope. Am J Cardiol. 2013;111(3):388-92. doi:10.1016/j.amjcard.2012.10.014.
396. Halpern DG, Swistel DG, Po JR, et al. Echocardiography before and after resect-plicate-release surgical myectomy for obstructive hypertrophic cardiomyopathy. J Am Soc Echocardiogr. 2015;28(11):1318-28. doi:10.1016/j.echo.2015.07.002.
397. Kaple RK, Murphy RT, DiPaola LM, et al. Mitral valve abnormalities in hypertrophic cardiomyopathy: echocardiographic features and surgical outcomes. Ann Thorac Surg. 2008;85(5):1527-35, 1535.e1-2. doi:10.1016/j.athoracsur.2008.01.061.
398. Kofflard MJ, van Herwerden LA, Waldstein DJ, et al. Initial results of combined anterior mitral leaflet extension and myectomy in patients with obstructive hypertrophic cardiomyopathy. J Am Coll Cardiol. 1996;28(1):197-202. doi:10.1016/0735-1097(96)00103-9.
399. Schoendube FA, Klues HG, Reith S, et al. Long-term clinical and echocardiographic follow-up after surgical correction of hypertrophic obstructive cardiomyopathy with extended myectomy and reconstruction of the subvalvular mitral apparatus. Circulation. 1995;92(9 Suppl):II122-7. doi:10.1161/01.cir.92.9.122.
400. Steggerda RC, Damman K, Balt JC, et al. Periprocedural complications and long-term outcome after alcohol septal ablation versus surgical myectomy in hypertrophic obstructive cardiomyopathy: a single-center experience. JACC Cardiovasc Interv. 2014;7(11):1227-34. doi:10.1016/j.jcin.2014.05.023.
401. Богачев-Прокофьев А. В., Железнев С. И., Фоменко М. С. и др. Эффективность расширенной миоэктомии у пациентов с желудочковой обструкцией при гипертрофической кардиомиопатии. Кардиология. 2017;57(5):38-43. doi:10.18565/cardio.2017.5.38-43.
402. Borisov KV. Right ventricle myectomy. Ann Cardiothorac Surg. 2017;6(4):402-9. doi:10.21037/acs.2017.07.10.
403. Wehman B, Ghoreishi M, Foster N, et al. Transmitral Septal Myectomy for Hypertrophic Obstructive Cardiomyopathy. Ann Thorac Surg. 2018;105(4):1102-8. doi:10.1016/j.athoracsur.2017.10.045.
404. Бокерия Л. А. Гипертрофическая обструктивная кардиомиопатия. Анналы хирургии. 2013;(5):5-14.
405. Takahashi J, Wakamatsu Y, Okude J, et al. Septal myectomy, papillary muscle resection, and mitral valve replacement for hypertrophic obstructive cardiomyopathy: a case report. Ann Thorac Cardiovasc Surg. 2008;14(4):258-62.
406. Cooley DA, Wukasch DC, Leachman RD. Mitral valve replacement for idiopathic hypertrophic subaortic stenosis. Results in 27 patients. J Cardiovasc Surg (Torino). 1976t;17(5):380-7.
407. Stassano P, Di Tommaso L, Triggiani D, et al. Mitral valve replacement and limited myectomy for hypertrophic obstructive cardiomyopathy: a 25-year follow-up. Tex Heart Inst J. 2004;31(2):137-42.
408. Reis RL, Bolton MR, King JF, et al. Anterion-superior displacement of papillary muscles producing obstruction and mitral regurgitation in idiopathic hypertrophic subaortic stenosis. Operative relief by posterior-superior realignment of papillary muscles following ventricular septal myectomy. Circulation. 1974;50(2 Suppl):II181-8.
409. Shimahara Y, Fujita T, Kobayashi J, et al. Combined mechanical mitral valve replacement and transmitral myectomy for hypertrophic obstructive cardiomyopathy treatment: An experience of over 20 years. J Cardiol. 2019;73(4):318-25. doi:10.1016/j.jjcc.2018.12.012.
410. Topilski I, Sherez J, Keren G, Copperman I. Long-term effects of dual-chamber pacing with periodic echocardiographic evaluation of optimal atrioventricular delay in patients with hypertrophic cardiomyopathy >50 years of age. Am J Cardiol. 2006;97(12):1769-75. doi:10.1016/j.amjcard.2006.01.040.
411. Хирманов В. Н., Юзвинкевич С. А., Домашенко А. А. и др. Отдаленные результаты лечения гипертрофической кардиомиопатии с помощью постоянной двукамерной электрокардиостимуляции. Кардиология. 2002;(8):46-7.
412. Трешкур Т. В., Крутиков А. Н., Хирманов В. Н. и др. Внутрисердечная гемодинамика у больных с гипертрофической кардиомиопатией при лечении постоянной двухкамерной электрокардиостимуляцией. Вестник аритмологии. 1995;(4):248-9.
413. Daubert C, Gadler F, Mabo P, Linde C. Pacing for hypertrophic obstructive cardiomyopathy: an update and future directions. Europace. 2018;20(6):908-20. doi:10.1093/europace/eux131.
414. Quintana E, Cox JL. Surgical management of atrial fibrillation at the time of septal myectomy. Ann Cardiothorac Surg. 2017;6(4):386-93. doi:10.21037/acs.2017.05.08.
415. Бокерия Л. А., Бокерия О. Л., Климчук И. Я., Санакоев М. К. Хирургическая коррекция обструктивной гипертрофической кардиомиопатии с SAM-синдромом и фибрилляцией предсердий. Анналы аритмологии. 2016;13(4):216-21. doi:10.15275/annaritmol.2016.4.4.
416. Бокерия Л. А., Тетвадзе И. В., Маленков Д. А., Санакоев М. К. Сочетанная операция миоэктомии межжелудочковой перегородки из правого желудочка и эпикардиальная криомодификация операции «лабиринт». Анналы аритмологии. 2013;10(2):64-8. doi:10.15275/annaritmol.2013.2.1.
417. Bogachev-Prokophiev AV, Afanasyev AV, Zheleznev SI, et al. Concomitant ablation for atrial fibrillation during septal myectomy in patients with hypertrophic obstructive cardiomyopathy. J Thorac Cardiovasc Surg. 2018;155(4):1536-42.e2. doi:10.1016/j.jtcvs.2017.08.063.
418. Monserrat L, Elliott PM, Gimeno JR, et al. Non-sustained ventricular tachycardia in hypertrophic cardiomyopathy: an independent marker of sudden death risk in young patients. J Am Coll Cardiol. 2003;42(5):873-9. doi:10.1016/s0735-1097(03)00827-1.
419. Task Force for the Diagnosis and Management of Syncope; European Society of Cardiology (ESC); European Heart Rhythm Association (EHRA); Heart Failure Association (HFA); Heart Rhythm Society (HRS), Moya A, Sutton R, Ammirati F, et al. Guidelines for the diagnosis and management of syncope (version 2009). Eur Heart J. 2009;30(21):2631-71. doi:10.1093/eurheartj/ehp298.
420. Sherrid MV, Massera D. Risk Stratification and Hypertrophic Cardiomyopathy Subtypes. J Am Coll Cardiol. 2019;74(19):2346-9. doi:10.1016/j.jacc.2019.09.020.
421. Mentias A, Raeisi-Giglou P, Smedira NG, et al. Late Gadolinium Enhancement in Patients With Hypertrophic Cardiomyopathy and Preserved Systolic Function. J Am Coll Cardiol. 2018;72(8):857-70. doi:10.1016/j.jacc.2018.05.060. Erratum in: J Am Coll Cardiol. 2018;72(14):1761.
422. Трансплантация сердца и механическая поддержка кровообращения. Национальные клинические рекомендации. 2016. 115 с. https://sudact.ru/law/natsionalnye-klinicheskie-rekomendatsii-transplantatsiia-serdtsa-i-mekhanicheskaia/natsionalnye-klinicheskie-rekomendatsii/.
423. Topilsky Y, Pereira NL, Shah DK, et al. Left ventricular assist device therapy in patients with restrictive and hypertrophic cardiomyopathy. Circ Heart Fail. 2011;4(3):266-75. doi:10.1161/CIRCHEARTFAILURE.110.959288.
424. Biagini E, Spirito P, Leone O, et al. Heart transplantation in hypertrophic cardiomyopathy. Am J Cardiol. 2008;101(3):387-92. doi:10.1016/j.amjcard.2007.09.085.
425. Диагностика и лечение сердечно-сосудистых заболеваний при беременности 2018. Национальные рекомендации. Российский кардиологический журнал. 2018;(3):91-134. doi:10.15829/1560-4071-2018-3-91-134.
426. Goland S, van Hagen IM, Elbaz-Greener G, et al. Pregnancy in women with hypertrophic cardiomyopathy: data from the European Society of Cardiology initiated Registry of Pregnancy and Cardiac disease (ROPAC). Eur Heart J. 2017;38(35):2683-90. doi:10.1093/eurheartj/ehx189.
427. Regitz-Zagrosek V, Roos-Hesselink JW, Bauersachs J, et al.; ESC Scientific Document Group. 2018 ESC Guidelines for the management of cardiovascular diseases during pregnancy. Eur Heart J. 2018;39(34):3165-241. doi:10.1093/eurheartj/ehy340.
428. Bowyer L. The Confidential Enquiry into Maternal and Child Health (CEMACH). Saving Mothers’ Lives: reviewing maternal deaths to make motherhood safer 2003-2005. The Seventh Report of the Confidential Enquiries into Maternal Deaths in the UK. Obstet. Med. 2008;1(1):54-54. doi:10.1258/om.2008.080017.
429. Billebeau G, Etienne M, Cheikh-Khelifa R, et al. Pregnancy in women with a cardiomyopathy: Outcomes and predictors from a retrospective cohort. Arch Cardiovasc Dis. 2018;111(3):199-209. doi:10.1016/j.acvd.2017.05.010.
430. Krul SP, van der Smagt JJ, van den Berg MP, et al. Systematic review of pregnancy in women with inherited cardiomyopathies. Eur J Heart Fail. 2011;13(6):584-94. doi:10.1093/eurjhf/hfr040.
431. Tromp CH, Nanne AC, Pernet PJ, et al. Electrical cardioversion during pregnancy: safe or not? Neth Heart J. 2011;19(3):134-6. doi:10.1007/s12471-011-0077-5.
432. Maron MS, Finley JJ, Bos JM, et al. Prevalence, clinical significance, and natural history of left ventricular apical aneurysms in hypertrophic cardiomyopathy. Circulation. 2008;118(15):1541-9. doi:10.1161/CIRCULATIONAHA.108.781401.
433. Burton H, Alberg C, Stewart A. Heart to Heart: Inherited Cardiovascular Conditions Services – A Needs Assessment and Service Review. 2009. 163 p. ISBN: 978-1-907198-01-4.
434. Canepa M, Pozios I, Vianello PF, et al. Distinguishing ventricular septal bulge versus hypertrophic cardiomyopathy in the elderly. Heart. 2016;102(14):1087-94. doi:10.1136/heartjnl-2015-308764.
435. Olesen JB, Lip GY, Hansen ML, et al. Validation of risk stratification schemes for predicting stroke and thromboembolism in patients with atrial fibrillation: nationwide cohort study. BMJ. 2011;342:d124. doi:10.1136/bmj.d124.
436. Lip GY, Frison L, Halperin JL, Lane DA. Comparative validation of a novel risk score for predicting bleeding risk in anticoagulated patients with atrial fibrillation: the HAS-BLED (Hypertension, Abnormal Renal/Liver Function, Stroke, Bleeding History or Predisposition, Labile INR, Elderly, Drugs/Alcohol Concomitantly) score. J Am Coll Cardiol. 2011;57(2):173-80. doi:10.1016/j.jacc.2010.09.024.