Кипролис — инструкция по применению
Синонимы, аналоги
Статьи
КИПРОЛИС
Регистрационный номер:
ЛП-003538
Торговое наименование:
Кипролис
Международное непатентованное или группировочное наименование:
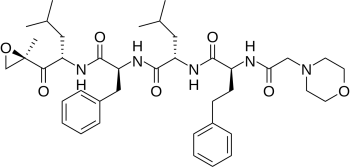
карфилзомиб
Лекарственная форма:
лиофилизат для приготовления раствора для инфузий
Состав
Каждый флакон содержит:
Действующее вещество: 60 мг карфилзомиба.
Вспомогательные вещества: сульфобутиловый эфир бетадекс натрия (сульфобутиловый эфир бета-циклодекстрина) — 3090 мг, лимонная кислота — 59,4 мг, натрия гидроксид (для регулирования pH).
Описание
Лиофилизат или порошок от белого до желтоватого цвета, свободный от видимых включений.
Восстановленный раствор: прозрачный раствор от бесцветного до светло-желтого цвета, свободный от видимых включений.
Фармакотерапевтическая группа
Противоопухолевое средство, другие противоопухолевые средства
Код АТХ:
L01XG02
Фармакологические свойства
Фармакодинамика
Механизм действия
Карфилзомиб представляет собой тетрапептидэпоксикетонный ингибитор протеасомы, селективно и необратимо связывающийся с N-терминальным треонином активных центров основной протеолитической субъединицы 20S, входящей в состав протеасомы 26S и не оказывает, либо оказывает незначительное влияние на протеазы других классов. Карфилзомиб показал антипролиферативный и проапоптотический эффекты в доклинических моделях гемобластозов. У животных карфилзомиб ингибировал активность протеасомы в крови и тканях и замедлял опухолевый рост в моделях множественной миеломы. В экспериментах in vitro было показано, что карфилзомиб характеризуется минимальной нейротоксичностью и минимальной реактивностью в отношении непротеасомных протеаз.
Фармакодинамические эффекты
Внутривенное введение карфилзомиба приводило к подавлению химотрипсиноподобной (CT-L) активности протеасомы, измеряемой в крови через 1 час после введения первой дозы препарата. Введение препарата в дозах ≥ 15 мг/м2 вызывало устойчивое (≥ 80%) ингибирование CT-L активности протеасомы. Дополнительно, введение карфилзомиба в дозе 20 мг/м2 приводило к ингибированию латентного мембранного белка 2 типа (LMP2) и субъединиц мультикаталитического эндопептидазподобного комплекса 1 (MECL1) иммунопротеасом в диапазоне от 26% до 32% и от 41% до 49%, соответственно. Ингибирование протеасомы сохранялось 48 часов и более после введения первой дозы карфилзомиба при его введении каждую неделю. Комбинированное назначение препарата с леналидомидом и дексаметазоном не оказывало влияния на выраженность ингибирования протеасомы.
При применении более высокой дозы, — 56 мг/м2, отмечалось не только более выраженное ингибирование субъединиц CT-L (≥ 90%), по сравнению с дозами 15 — 20 мг/м2, но также и более выраженное ингибирование других субъединиц протеасом (LMP7, MECL1 и LMP2). Ингибирование субъединиц LMP7, MECL1 и LMP2 при применении препарата в дозе 56 мг/м2 увеличилось примерно на 8%, 23% и 34% соответственно по сравнению с дозами 15-20 мг/м2. Уровень ингибирования протеасом был эквивалентным при режиме введения в виде 2-10 минутной инфузии и 30-минутной инфузии для обоих исследованных уровней дозы (20 и 36 мг/м2).
Фармакокинетика
Всасывание
После 2-10 минутного внутривенного введения карфилзомиба в дозе 27 мг/м2, максимальная концентрация (Cmax) и площадь под кривой «концентрация-время» (AUC) составляли 4232 нг/мл и 379 нг∙ч/мл, соответственно. При многократном введении препарата Кипролис в дозах 15 и 20 мг/м2, значения системной экспозиции (AUC) и периода полувыведения в 1 и 15 или 16 дни первого цикла терапии были аналогичны, что свидетельствует об отсутствии системной кумуляции карфилзомиба. При применении препарата в дозах от 20 до 56 мг/м2 отмечалось дозозависимое повышение экспозиции.
При 30-минутной инфузии достигались сходные параметры периода полувыведения и AUC, однако отмечено 2-3 кратное снижение Cmax по сравнению с Cmax достигнутой при 2-10-минутной инфузии той же дозы. После 30-минутной инфузии дозы 56 мг/м2, отмечено повышение в 2,5 раза AUC (948 нг∙ч/мл) по сравнению с дозой 27 мг/м2, а Cmax (2079 нг/мл) была ниже, по сравнению с дозой 27 мг/м2 вводимой в виде инфузии в течение от 2 до 10 минут.
Распределение
Средний объем распределения карфилзомиба в равновесном состоянии при дозировании 20 мг/м2 составлял 28 л. В экспериментах in vitro связывание карфилзомиба с белками плазмы крови человека составляло в среднем 97% в диапазоне концентраций от 0,4 до 4 мкмоль.
Метаболизм
Карфилзомиб быстро и интенсивно метаболизируется. Основными метаболитами, присутствовавшими в плазме крови и моче человека в определяемых количествах и образуемыми человеческими гепатоцитами в условиях in vitro, были фрагменты пептида и диол карфилзомиба, что указывает на то, что главными путями метаболизма карфилзомиба являются расщепление под действием пептидазы и гидролиз эпоксидных групп. Механизмы, опосредованные системой цитохрома Р450, играют незначительную роль в общем метаболизме карфилзомиба. Метаболиты препарата не обладают известной биологической активностью.
Выведение
После внутривенного введения в дозах ≥ 15 мг/м2 карфилзомиб быстро выводится из системной циркуляции со значениями периода полувыведения ≤ 1 часа в первый день первого цикла терапии. Системный клиренс препарата варьировал от 151 до 263 л/ч и превышал печеночный кровоток, что свидетельствовало о том, что карфилзомиб преимущественно элиминировался непеченочными путями. Карфилзомиб подвергается интенсивному метаболизму с последующим выведением почками.
Особые группы пациентов
Результаты популяционных фармакокинетических анализов свидетельствуют об отсутствии влияния возраста, пола или расы на фармакокинетику карфилзомиба.
Печеночная недостаточность
В исследование фармакокинетики препарата было включено 33 пациента с рецидивными или прогрессирующими злокачественными новообразованиями (солидные опухоли: n = 31; гемобластозы: n = 2) с нормальной функцией печени (концентрация билирубина ≤ верхней границы нормального диапазона; аспартатаминотрансфераза [АСТ] ≤ верхней границы нормального диапазона, n = 10), с нарушением функции печени легкой степени тяжести (билирубин > 1-1,5 × верхняя граница нормального диапазона или АСТ > верхней границы нормального диапазона, при этом билирубин ≤ верхней границы нормального диапазона, n = 14) или нарушением функции печени средней степени тяжести (билирубин > 1,5-3 × верхняя граница нормального диапазона; любая активность АСТ, n = 9). Параметры фармакокинетики карфилзомиба не оценивались у пациентов с тяжелым нарушением функции печени (билирубин > 3 × верхняя граница нормального диапазона при любой активности АСТ). Препарат Кипролис в виде монотерапии вводился внутривенно в течение 30 минут в дозе 20 мг/м2 в 1 и 2 дни, и в дозе 27 мг/м2 — в 8, 9, 15 и 16 дни первого цикла. Если пациенты хорошо переносили препарат, начиная со второго цикла он использовался в дозе 56 мг/м2. Исходная функция печени не оказывала значимого влияния на общее значение системной экспозиции (AUClast) карфилзомиба после его однократного или многократного введения (отношение среднегеометрических значений AUClast при использовании препарата в дозе 27 мг/м2 в 16 день первого цикла терапии у пациентов с нарушением функции печени легкой или средней степени тяжести по сравнению с пациентами, имевшими нормальные функциональные показатели, составило 144,4% и 126,1%, соответственно; при введении в дозе 56 мг/м2 в первый день второго цикла — 144,7% и 121,1%, соответственно). Однако у пациентов с наличием нарушения функции печени легкой или средней степени тяжести на момент исходной оценки, у всех из которых были солидные опухоли, отмечалось повышение частоты патологических изменений функции печени, нежелательных явлений ≥ 3 степени и серьезных нежелательных явлений по сравнению с пациентами с нормальной функцией печени (см. раздел «Способ применения и дозы»).
Почечная недостаточность
Фармакокинетика карфилзомиба изучалась в двух специализированных исследованиях у пациентов с нарушением функции почек.
В первое исследование было включено 50 пациентов с множественной миеломой с нормальной функцией почек (клиренс креатинина (ККр) > 80 мл/мин; n = 12), с нарушением функции почек легкой степени (ККр 50-80 мл/мин; n = 12), средней степени (ККр 30-49 мл/мин; n = 10) и тяжелой степени (ККр < 30 мл/мин; n = 
Результаты обоих исследований показали, что функция почек не оказывала значимого влияния на значения экспозиции карфилзомиба после его однократного и многократного введения. Соотношения среднегеометрических значений AUClast при введении препарата в дозе 15 мг/м2 в первый день первого цикла терапии у пациентов с легкой, средней и тяжелой степенью выраженности почечной недостаточности, а также находящихся на хроническом диализе, по сравнению с пациентами с нормальной функцией почек, составили 124,36%; 111,07%; 84,73% и 121,72%, соответственно. Соотношения среднегеометрических значений AUClast при использовании препарата в дозе 27 мг/м2 в 16 день первого цикла терапии, а также в дозе 56 мг/м2 в первый день второго цикла терапии у пациентов с ТСПН по сравнению с пациентами с нормальной функцией почек, составили 139,72% и 132,75%, соответственно. В первом исследовании значения экспозиции (AUClast) метаболита M14 (пептидного фрагмента и наиболее распространенного циркулирующего метаболита) возрастали в 2-3 раза у пациентов с нарушением функции почек средней и тяжелой степени выраженности, соответственно, и в 7 раз — у пациентов, требовавших проведения диализа. Во втором исследовании значения экспозиции метаболита M14 были выше (приблизительно в 4 раза) у пациентов с ТСПН по сравнению с пациентами с нормальной функцией почек. Данный метаболит не имеет известной биологической активности.
Серьезные нежелательные явления, связанные с ухудшением функции почек, чаще отмечались у пациентов, имевших нарушение данной функции на момент исходной оценки (см. раздел «Способ применения и дозы»).
Показания к применению
Препарат Кипролис в комбинации с даратумумабом и дексаметазоном, с леналидомидом и дексаметазоном либо только с дексаметазоном показан для лечения множественной миеломы у взрослых пациентов, получавших минимум одну линию предшествующей противоопухолевой терапии.
Монотерапия препаратом Кипролис рецидивирующей и рефрактерной множественной миеломы у пациентов, получивших минимум 2 предыдущие линии терапии, включая бортезомиб и иммуномодулирующее средство.
Противопоказания
Гиперчувствительность к действующему веществу или любому вспомогательному веществу препарата.
Беременность и период грудного вскармливания.
С осторожностью
При комбинированном применении с препаратами, увеличивающими риск тромбозов (в частности с гормональными контрацептивами), с препаратами, являющимися субстратами изоферментов CYP1A2, 2C8, 2C9, 2C19 и 2B6, с субстратами P-gp (в частности с дигоксином, колцихином), при нарушениях функции печени средней и тяжелой степени тяжести.
Применение при беременности и в период грудного вскармливания
Женщины, обладающие репродуктивным потенциалом/требования к контрацепции мужчин и женщин
Пациентки, обладающие репродуктивным потенциалом и получающие препарат Кипролис (и/или их половые партнеры), должны использовать эффективные контрацептивы в процессе терапии и в течение 1 месяца после ее завершения.
Невозможно исключить снижение эффективности пероральных контрацептивов на фоне терапии карфилзомибом (см. раздел «Взаимодействие с другими лекарственными средствами»). Кроме того, учитывая повышение риска венозных тромбоэмболий на фоне терапии карфилзомибом, во время терапии карфилзомибом женщины должны избегать использования гормональных контрацептивов, которые сами по себе ассоциируются с повышением риска тромбозов (см. разделы «Побочное действие» и «Особые указания»). Если пациентка в настоящее время получает пероральные или другие гормональные контрацептивы, ассоциированные с повышением риска тромбоза, данная пациентка должна быть переведена на альтернативный эффективный метод контрацепции.
Пациенты мужского пола должны использовать эффективные контрацептивы в течение всей длительности терапии и в течение 3 месяцев после ее завершения, если их половые партнеры женского пола беременны либо обладают репродуктивным потенциалом и не используют эффективные контрацептивы.
Беременность
Данные об использовании карфилзомиба у беременных отсутствуют.
Исследования на животных показали репродуктивную токсичность.
Учитывая механизм действия и результаты исследований на животных, препарат Кипролис может вызывать повреждение плода при использовании в период беременности. Препарат Кипролис не должен использоваться в период беременности. Если препарат Кипролис используется в период беременности или при наступлении беременности у пациентки на фоне терапии данным препаратом, данная пациентка должна быть проинформирована о потенциальном риске для плода.
Леналидомид структурно подобен талидомиду, который является известным тератогеном для человека и способен вызываться тяжелые, угрожающие жизни дефекты развития у плода. При использовании леналидомида в период беременности следует ожидать тератогенного эффекта данного препарата. Необходимо соблюдать требования Программы по профилактике беременности у пациенток, получающих леналидомид, во всех случаях, за исключением ситуаций, когда имеется надежная информация о том, что данная пациентка не обладает репродуктивным потенциалом (см. инструкцию по применению леналидомида).
Грудное вскармливание
Сведения о возможности карфилзомиба или его метаболитов экскретироваться в грудное молоко у человека отсутствуют. Учитывая фармакологические характеристики препарата, невозможно исключить риск для ребенка, находящегося на грудном вскармливании. Следовательно, в качестве превентивной меры, грудное вскармливание противопоказано в течение курса терапии препаратом Кипролис и минимум 2 дней после ее завершения.
Фертильность
Исследований влияния на фертильность у животных не проводилось.
Способ применения и дозы
Терапия препаратом Кипролис должна проводиться под контролем врача, имеющего опыт использования противоопухолевых препаратов.
Режим дозирования
Доза препарата рассчитывается на основе площади поверхности тела пациента (ППТ). Пациенты, у которых ППТ составляет более 2,2 м2, должны получать препарат в дозе, рассчитанной для ППТ равной 2,2 м2 При изменении массы тела на ≤ 20% модификации дозы не требуется.
Препарат Кипролис в комбинации с леналидомидом и дексаметазоном
При применении в комбинации с леналидомидом и дексаметазоном препарат Кипролис вводится в виде внутривенной (в/в) инфузии в течение 10 минут на протяжении двух последовательных дней, каждую неделю в течение 3 недель (1, 2, 8, 9, 15 и 16 день) с последующим перерывом в 12 дней (с дня 17 до дня 28), как указано в таблице 1. Каждый период продолжительностью 28 дней расценивается как один цикл терапии.
Препарат Кипролис вводится в начальной дозе 20 мг/м2 (максимальная доза — 44 мг) во время первого цикла (в первый и второй дни). При хорошей переносимости необходимо повышение дозы на восьмой день первого цикла до 27 мг/м2 (максимальная доза — 60 мг). Начиная с 13 цикла, инфузии препарата Кипролис в восьмой и девятый дни пропускаются. Лечение может продолжаться до прогрессирования заболевания или развития неприемлемой токсичности.
Проведение терапии препаратом Кипролис в комбинации с леналидомидом и дексаметазоном в течение более чем 18 циклов должно быть основано на индивидуальной оценке соотношения пользы и рисков, поскольку данные о переносимости и токсичности карфилзомиба после 18 циклов терапии ограничены.
При применении в комбинации с препаратом Кипролис леналидомид вводится в дозе 25 мг, перорально, в 1-21 дни, дексаметазон — в дозе 40 мг, перорально или внутривенно, в 1, 8, 15 и 22 дни цикла длительностью 28 дней. Снижение начальной дозы леналидомида должно осуществляться в соответствии с рекомендациями, приведенными в инструкции по применению, например, у пациентов при наличии исходной почечной недостаточности. Дексаметазон должен быть принят за 30 минут — 4 часа до введения препарата Кипролис.
Таблица 1. Препарат Кипролис в комбинации с леналидомидом и дексаметазоном
| Цикл 1 | |||||||||||
| Неделя 1 | Неделя 2 | Неделя 3 | Неделя 4 | ||||||||
| День 1 | День 2 | Дни 3-7 | День 8 | День 9 | Дни 10-14 | День 15 | День 16 | Дни 17-21 | День 22 | Дни 23-28 | |
| Препарат Кипролис (мг/м2)a | 20 | 20 | — | 27 | 27 | — | 27 | 27 | — | — | — |
| Дексаметазон (мг) | 40 | — | — | 40 | — | — | 40 | — | — | 40 | — |
| Леналидомид | 25 мг в сутки | — | — | ||||||||
| Циклы со 2 по 12 | |||||||||||
| Неделя 1 | Неделя 2 | Неделя 3 | Неделя 4 | ||||||||
| День 1 | День 2 | Дни 3-7 | День 8 | День 9 | Дни 10-14 | День 15 | День 16 | Дни 17-21 | День 22 | Дни 23-28 | |
| Препарат Кипролис (мг/м2)a | 27 | 27 | — | 27 | 27 | — | 27 | 27 | — | — | — |
| Дексаметазон (мг) | 40 | — | — | 40 | — | — | 40 | — | — | 40 | — |
| Леналидомид | 25 мг в сутки | — | — | ||||||||
| Начиная с Цикла 13 | |||||||||||
| Неделя 1 | Неделя 2 | Неделя 3 | Неделя 4 | ||||||||
| День 1 | День 2 | Дни 3-7 | День 8 | День 9 | Дни 10-14 | День 15 | День 16 | Дни 17-21 | День 22 | Дни 23-28 | |
| Препарат Кипролис (мг/м2)a | 27 | 27 | — | — | — | — | 27 | 27 | — | — | — |
| Дексаметазон (мг) | 40 | — | — | 40 | — | — | 40 | — | — | 40 | — |
| Леналидомид | 25 мг в сутки | — | — |
a Длительность инфузии составляет 10 минут и не изменяется в течение всего курса терапии.
Препарат Кипролис в комбинации с дексаметазоном
При применении в комбинации с дексаметазоном препарат Кипролис вводится внутривенно в виде 30-минутной инфузии на протяжении двух последовательных дней, каждую неделю в течение 3 недель (дни 1, 2, 8, 9, 15 и 16), с последующим перерывом в 12 дней (с дня 17 до дня 28), как указано в таблице 2. Каждый период продолжительностью 28 дней расценивается как один цикл терапии.
Препарат Кипролис вводится, начиная с дозы 20 мг/м2 (максимальная доза 44 мг) в цикле 1 в дни 1 и 2. При хорошей переносимости, доза должна быть повышена со дня 8 цикла 1 до 56 мг/м2 (максимально 123 мг).
Лечение может продолжаться до прогрессирования заболевания или развития неприемлемой токсичности.
Если препарат Кипролис применяют в комбинации только с дексаметазоном, то последний принимают перорально в дозе 20 мг или внутривенно в дни 1, 2, 8, 9, 15, 16, 22 и 23 каждого 28-дневного цикла. Дексаметазон должен вводиться за 30 минут — 4 часа до введения препарата Кипролис.
Таблица 2. Препарат Кипролис в комбинации с только дексаметазоном
| Цикл 1 | ||||||||||||
| Неделя 1 | Неделя 2 | Неделя 3 | Неделя 4 | |||||||||
| День 1 | День 2 | Дни 3-7 | День 8 | День 9 | Дни 10-14 | День 15 | День 16 | Дни 17-21 | День 22 | День 23 | Дни 24-28 | |
| Препарат Кипролис (мг/м2)a | 20 | 20 | — | 56 | 56 | — | 56 | 56 | — | — | — | — |
| Дексаметазон (мг) | 20 | 20 | — | 20 | 20 | — | 20 | 20 | — | 20 | 20 | — |
| Начиная с цикла 2 и последующие циклы | ||||||||||||
| Неделя 1 | Неделя 2 | Неделя 3 | Неделя 4 | |||||||||
| День 1 | День 2 | Дни 3-7 | День 8 | День 9 | Дни 10-14 | День 15 | День 16 | Дни 17-21 | День 22 | День 23 | Дни 24-28 | |
| Препарат Кипролис (мг/м2)a | 56 | 56 | — | 56 | 56 | — | 56 | 56 | — | — | — | — |
| Дексаметазон (мг) | 20 | 20 | — | 20 | 20 | — | 20 | 20 | — | 20 | 20 | — |
a Инфузия вводится в течение 30 минут на протяжении всего режима.
Препарат Кипролис в комбинации с даратумумабом и дексаметазоном
При применении в комбинации с даратумумабом и дексаметазоном препарат Кипролис вводят внутривенно в виде 30-минутной инфузии на протяжении двух последовательных дней, каждую неделю в течение 3 недель (дни 1, 2, 8, 9, 15 и 16) с последующим 12-дневным перерывом (с дня 17 до дня 28), как указано в таблице 3. Каждый 28-дневный период расценивается как один цикл терапии. Препарат Кипролис вводится, начиная с дозы 20 мг/м2 (максимальная доза 44 мг) в цикле 1 в дни 1 и 2. При хорошей переносимости, доза должна быть повышена со дня 8 цикла 1 до 56 мг/м2 (максимальная доза 123 мг).
Лечение может продолжаться до прогрессирования заболевания или развития неприемлемой токсичности.
Дексаметазон применяется перорально или внутривенно в дозе 20 мг в дни 1, 2, 8, 9, 15 и 16 и в дозе 40 мг в день 22 каждого 28-дневного цикла. Пациентам старше 75 лет дексаметазон необходимо применять перорально или внутривенно в дозе 20 мг один раз в неделю, начиная со второй недели. Дексаметазон следует применять за 30 минут – 4 часа до применения препарата Кипролис.
Даратумумаб может применяться внутривенно или подкожно.
При внутривенном применении даратумумаб вводят в дозе 16 мг/кг фактической массы тела дробно, по 8 мг/кг в дни 1 и 2 цикла 1. Далее даратумумаб вводят в дозе 16 мг/кг один раз в неделю в дни 8, 15 и 22 цикла 1 и дни 1, 8, 15 и 22 цикла 2, затем каждые 2 недели в течение 4 циклов (циклы 3–6) и потом каждые 4 недели в течение оставшихся циклов или до прогрессирования заболевания.
Альтернативно даратумумаб может вводиться подкожно в дозе 1800 мг в дни 1, 8, 15 и 22 цикла 1 и дни 1, 8, 15 и 22 цикла 2, затем каждые 2 недели в течение 4 циклов (циклы 3-6) и потом каждые 4 недели в течение оставшихся циклов или до прогрессирования заболевания. Дополнительную информацию по применению лекарственной формы для подкожного введения смотрите в инструкции по медицинскому применению даратумумаба.
В дни, когда применяется более одного из этих лекарственных средств, рекомендуется придерживаться следующей последовательности: дексаметазон, лекарственные средства, применяемые перед инфузией даратумумаба (см. подраздел «Одновременно используемые препараты»), карфилзомиб, даратумумаб и лекарственные средства, применяемые после инфузии даратумумаба (см. подраздел «Одновременно используемые препараты»).
Дополнительную информацию по применению смотрите в инструкциях по медицинскому применению даратумумаба и дексаметазона.
Таблица 3. Препарат Кипролис в комбинации с дексаметазоном и даратумумабом
| Цикл 1 | ||||||||||||
| Неделя 1 | Неделя 2 | Неделя 3 | Неделя 4 | |||||||||
| День 1 | День 2 | Дни 3-7 | День 8 | День 9 | Дни 10-14 | День 15 | День 16 | Дни 17-21 | День 22 | День 23 | Дни 24-28 | |
| Препарат Кипролис (мг/м2)a | 20 | 20 | — | 56 | 56 | — | 56 | 56 | — | — | — | — |
| Дексаметазон (мг)b | 20 | 20 | — | 20 | 20 | — | 20 | 20 | — | 40 | — | — |
| Даратумумаб (внутривенно ИЛИ подкожно) | ||||||||||||
| Внутривенное введение (мг/кг) | 16 | — | — | 16 | — | — | 16 | — | — | 16 | — | — |
| Подкожное введение (мг) | 1800 | — | — | 1800 | — | — | 1800 | — | — | 1800 | — | — |
| Цикл 2 | ||||||||||||
| Неделя 1 | Неделя 2 | Неделя 3 | Неделя 4 | |||||||||
| День 1 | День 2 | Дни 3-7 | День 8 | День 9 | Дни 10-14 | День 15 | День 16 | Дни 17-21 | День 22 | День 23 | Дни 24-28 | |
| Препарат Кипролис (мг/м2)a | 56 | 56 | — | 56 | 56 | — | 56 | 56 | — | — | — | — |
| Дексаметазон (мг)b | 20 | 20 | — | 20 | 20 | — | 20 | 20 | — | 40 | — | — |
| Даратумумаб (внутривенно ИЛИ подкожно) | ||||||||||||
| Внутривенное введение (мг/кг) | 16 | — | — | 16 | — | — | 16 | — | — | 16 | — | — |
| Подкожное введение (мг) | 1800 | — | — | 1800 | — | — | 1800 | — | — | 1800 | — | — |
| Циклы 3-6 | ||||||||||||
| Неделя 1 | Неделя 2 | Неделя 3 | Неделя 4 | |||||||||
| День 1 | День 2 | Дни 3-7 | День 8 | День 9 | Дни 10-14 | День 15 | День 16 | Дни 17-21 | День 22 | День 23 | Дни 24-28 | |
| Препарат Кипролис (мг/м2)a | 56 | 56 | — | 56 | 56 | — | 56 | 56 | — | — | — | — |
| Дексаметазон (мг)b | 20 | 20 | — | 20 | 20 | — | 20 | 20 | — | 40 | — | — |
| Даратумумаб (внутривенно ИЛИ подкожно) | ||||||||||||
| Внутривенное введение (мг/кг) | 16 | — | — | — | — | — | 16 | — | — | — | — | — |
| Подкожное введение (мг) | 1800 | — | — | — | — | — | 1800 | — | — | — | — | — |
| Цикл 7 и все последующие циклы | ||||||||||||
| Неделя 1 | Неделя 2 | Неделя 3 | Неделя 4 | |||||||||
| День 1 | День 2 | Дни 3-7 | День 8 | День 9 | Дни 10-14 | День 15 | День 16 | Дни 17-21 | День 22 | День 23 | Дни 24-28 | |
| Препарат Кипролис (мг/м2)a | 56 | 56 | — | 56 | 56 | — | 56 | 56 | — | — | — | — |
| Дексаметазон (мг)b | 20 | 20 | — | 20 | 20 | — | 20 | 20 | — | 40 | — | — |
| Даратумумаб (внутривенно ИЛИ подкожно) | ||||||||||||
| Внутривенное введение (мг/кг) | 16 | — | — | — | — | — | — | — | — | — | — | — |
| Подкожное введение (мг) | 1800 | — | — | — | — | — | — | — | — | — | — | — |
a Длительность инфузии составляет 30 минут и не изменяется в течение всего курса терапии.
b Пациентам старше 75 лет дексаметазон необходимо применять перорально или внутривенно в дозе 20 мг один раз в неделю начиная со второй недели.
Монотерапия препаратом Кипролис
В качестве монотерапии препарат Кипролис вводится внутривенно (в/в) путем десятиминутной инфузии на протяжении двух последовательных дней каждую неделю в течение 3 недель с последующим перерывом в 12 дней, как указано в таблице 4. Каждый период продолжительностью 28 дней расценивается как один цикл терапии. Рекомендуемая начальная доза препарата Кипролис составляет 20 мг/м2 (максимальная доза 44 мг) в 1 и 2 дни цикла 1. При переносимости данной дозы, доза должна быть повышена до целевой — 27 мг/м2 (максимальная доза 60 мг) на 8 день цикла 1. Начиная с цикла 13, дозы препарата Кипролис в день 8 и день 9 пропускаются. Лечение может продолжаться до прогрессирования заболевания или развития неприемлемой токсичности.
Таблица 4. Монотерапия препаратом Кипролис
| Препарат Кипролис (мг/м2) | |||||||||
| Цикл 1 | |||||||||
| Неделя 1 | Неделя 2 | Неделя 3 | Неделя 4 | ||||||
| День 1 | День 2 | Дни 3-7 | День 8 | День 9 | Дни 10-14 | День 15 | День 15 | Дни 17-21 | Дни 22-18 |
| 20 | 20 | — | 27 | 27 | — | 27 | 27 | — | — |
| Препарат Кипролис (мг/м2) | |||||||||
| Циклы со 2 по 12 | |||||||||
| Неделя 1 | Неделя 2 | Неделя 3 | Неделя 4 | ||||||
| День 1 | День 2 | Дни 3-7 | День 8 | День 9 | Дни 10-14 | День 15 | День 15 | Дни 17-21 | Дни 22-18 |
| 27 | 27 | — | 27 | 27 | — | 27 | 27 | — | — |
| Препарат Кипролис (мг/м2) | |||||||||
| Начиная с цикла 13 | |||||||||
| Неделя 1 | Неделя 2 | Неделя 3 | Неделя 4 | ||||||
| День 1 | День 2 | Дни 3-7 | День 8 | День 9 | Дни 10-14 | День 15 | День 15 | Дни 17-21 | Дни 22-18 |
| 27 | 27 | — | — | — | — | 27 | 27 | — | — |
Одновременно используемые препараты
У пациентов, получающих препарат Кипролис, должен рассматриваться вопрос о профилактической противовирусной терапии с целью снижения риска реактивации опоясывающего герпеса (см. раздел «Побочное действие»).
Проведение тромбопрофилактики рекомендуется у пациентов, получающих препарат Кипролис в комбинации с даратумумабом и дексаметазоном, с леналидомидом и дексаметазоном или только с дексаметазоном, что должно основываться на оценке риска и клинического статуса пациента. При необходимости одновременного использования других лекарственных средств, в частности профилактической терапии антацидами, необходимо руководствоваться инструкциями по применению леналидомида и дексаметазона.
Пациентам, получающим препарат Кипролис в комбинации с даратумумабом и дексаметазоном, также показан прием определенных лекарственных средств перед инфузией, чтобы снизить риск возникновения связанных с даратумумабом инфузионных реакций.
Дополнительную информацию о сопутствующих препаратах, включая лекарственные средства, применяемые до и после инфузии, смотрите в инструкции по медицинскому применению даратумумаба.
Гидратация, мониторинг водного и электролитного баланса
Перед введением препарата в рамках первого цикла терапии рекомендуется проведение адекватной гидратации пациента, особенно при высоком риске синдрома лизиса опухоли или нефротоксичности. Всем пациентам показан мониторинг с целью выявления признаков гиперволемии, и количество необходимой жидкости должно корректироваться с учетом индивидуальных потребностей пациентов. Общий объем жидкости может корректироваться по клиническим показаниям у пациентов с наличием сердечной недостаточности на момент исходной оценки или составляющих группу риска данной патологии (см. раздел «Особые указания»).
Рекомендуемый режим гидратации предусматривает как пероральную гидратацию (30 мл/кг в сутки в течение 48 часов, предшествующих первому дню первого цикла), так и внутривенную гидратацию (в объеме от 250 мл до 500 мл соответствующего раствора для внутривенного введения перед введением каждой дозы в рамках первого цикла терапии). По мере необходимости, дополнительно вводят внутривенно 250 мл — 500 мл инфузионного раствора после введения препарата Кипролис в рамках первого цикла терапии. Пероральная и/или внутривенная гидратация должны продолжаться, по мере необходимости, в течение последующих циклов.
Если предусмотрена комбинированная терапия с внутривенным введением даратумумаба, в дни его применения не требуется ни пероральная, ни внутривенная гидратация.
Концентрация калия в сыворотке крови должна контролироваться ежемесячно или более часто в процессе терапии препаратом Кипролис, по клиническим показаниям, в зависимости от значения показателя до начала терапии, используемой сопутствующей терапии (например, препаратами, которые, как известно, повышают риск гипокалиемии) и связанных сопутствующих заболеваний.
Рекомендуемые принципы модификации дозы
Необходима модификация дозы препарата Кипролис в соответствии с проявлениями токсичности. Рекомендуемые действия и режимы модификации дозы приведены в таблице 5. Значения сниженных доз приведены в таблице 6.
Таблица 5. Модификация дозы в процессе терапии препаратом Кипролис
| Гематологическая токсичность | Рекомендуемое действие |
|
|
|
|
| Негематологическая (почечная) токсичность | Рекомендуемое действие |
|
|
| Прочие виды негематологической токсичности | Рекомендуемое действие |
|
|
a Ступени снижения дозы приведены в таблице 6.
Таблица 6. Снижение дозы препарата Кипролис
| Режим | Доза | Первое снижение дозы | Второе снижение дозы | Третье снижение дозы |
| Монотерапия | 27 мг/м2 | 20 мг/м2 | 15 мг/м2a | — |
| Препарат Кипролис, леналидомид и дексаметазон | 27 мг/м2 | 20 мг/м2 | 15 мг/м2a | — |
| Препарат Кипролис и дексаметазон | 56 мг/м2 | 45 мг/м2 | 36 мг/м2a | 27 мг/м2 |
| Препарат Кипролис, даратумумаб и дексаметазон | 56 мг/м2 | 45 мг/м2 | 36 мг/м2a | 27 мг/м2 |
Примечание: Время инфузии остается неизменным при снижении дозы.
a Если симптомы не разрешаются, следует отменить препарат Кипролис.
Премедикация дексаметазоном при монотерапии препаратом Кипролис
При применении препарата Кипролис в качестве монотерапии, производится премедикация дексаметазоном — 4 мг перорально или внутривенно, минимум за 30 минут, но не более чем за 4 часа перед введением любой дозы препарата Кипролис в течение цикла 1, с целью снижения частоты и степени тяжести инфузионных реакций (см. раздел «Особые указания»). При развитии этих симптомов или их повторном появлении во время последующих циклов, производится возобновление премедикации дексаметазоном.
Особые группы пациентов
Пациенты с почечной недостаточностью
Пациенты с умеренной или тяжелой почечной недостаточностью допускались к участию в исследованиях комбинации препарат Кипролис/дексаметазон, но исключались из исследований комбинации препарат Кипролис/леналидомид. Поэтому было получено ограниченное количество данных по применению препарата Кипролис в комбинации с леналидомидом и дексаметазоном у пациентов с клиренсом креатинина (ККр < 50 мл/мин). Для соответствующего снижения стартовой дозы леналидомида у пациентов с нарушениями функции почек, выявленными до начала лечения, необходимо следовать рекомендациям, приведенным в инструкции по применению препарата леналидомид.
Согласно имеющимся фармакокинетическим данным, пациентам с легкой, умеренной или тяжелой почечной недостаточностью или постоянно находящимся на длительном диализе, коррекция стартовой дозы препарата Кипролис не требуется (см. раздел «Фармакокинетика»). Однако в клинических исследованиях 3 фазы частота нежелательных явлений, связанных с острой почечной недостаточностью, была выше у пациентов с более низким исходным клиренсом креатинина, по сравнению с пациентами с более высоким исходным клиренсом креатинина.
Перед началом лечения необходимо выполнить оценку функции почек пациента и в дальнейшем показатели функции почек необходимо оценивать хотя бы раз месяц или так часто, как это предусмотрено в клинических рекомендациях, особенно важное значение такой мониторинг имеет для пациентов с более низким исходным клиренсом креатинина (ККр < 30 мл/мин). В случае выявления токсичности терапии необходимо соответствующим образом скорректировать дозу (см. таблицу 5). Было получено ограниченное количество данных об эффективности и безопасности препарата у пациентов с исходным клиренсом креатинина < 30 мл/мин.
Поскольку клиренс препарата Кипролис во время диализа не изучался, лекарственный препарат следует вводить после проведения диализа.
Пациенты с печеночной недостаточностью
Пациенты с умеренной или тяжелой печеночной недостаточностью не допускались к участию в исследованиях применения препарата Кипролис в комбинации с леналидомидом и дексаметазоном или только с дексаметазоном.
Фармакокинетика препарата Кипролис не изучалась у пациентов с тяжелыми нарушениями функции печени. Согласно имеющимся фармакокинетическим данным, пациентам с легкой или умеренной печеночной недостаточностью коррекции стартовой дозы препарата Кипролис не требуется. Однако у пациентов, у которых до начала лечения была выявлена легкая или умеренная печеночная недостаточность, была зафиксирована более высокая частота патологических изменений функции печени, нежелательных явлений степени ≥ 3 и серьезных нежелательных явлений, чем у пациентов с нормальной функцией печени (см. разделы «Фармакокинетика» и «Особые указания»). Перед началом лечения пациентам должен быть назначен анализ на определение активности ферментов печени и содержания билирубина и в дальнейшем такой анализ следует выполнять один раз в месяц в течение всего курса лечения карфилзомибом, вне зависимости от исходных показателей, и в случае выявления токсичности терапии необходимо соответствующим образом скорректировать дозу (см. таблицу 5). Особое внимание следует уделять пациентам с умеренными и тяжелыми нарушениями функции печени, поскольку в этой популяции пациентов было получено очень ограниченное количество данных об эффективности и безопасности препарата.
Пациенты пожилого возраста
В целом частота определенных нежелательных явлений (включая сердечную недостаточность) в клинических исследованиях была выше в подгруппе пациентов в возрасте от 75 лет и старше по сравнению с пациентами младше 75 лет (см. раздел «Особые указания»).
Дети
Безопасность и эффективность использования препарата Кипролис у детей не установлены. Соответствующие данные отсутствуют.
Способ введения
Препарат Кипролис вводится внутривенно путем инфузии. Доза 20/27 мг/м2 вводится в течение 10 минут. Доза 20/56 мг/м2 должна быть введена в течение 30 минут.
Не допускается струйное или болюсное введение препарата Кипролис.
Система для внутривенных инфузий должна быть промыта физиологическим раствором натрия хлорида или 5% раствором глюкозы для инъекций непосредственно перед и после введения препарата Кипролис.
Не допускается смешивание препарата Кипролис или одновременная инфузия с другими лекарственными средствами.
Общие меры предосторожности
Карфилзомиб является цитотоксическим агентом. В связи с этим следует соблюдать осторожность при приготовлении препарата Кипролис и обращении с ним. Рекомендуется использовать перчатки и другие защитные средства.
Несовместимость
Исследования совместимости не проводились, в этой связи данный лекарственный препарат не следует смешивать с другими лекарственными препаратами.
Кипролис, лиофилизат для приготовления раствора для инфузий, не следует смешивать с раствором натрия хлорида для инъекций 9 мг/мл (0,9%).
Восстановление и подготовка к внутривенному введению
Препарат Кипролис не содержит консервантов, и флаконы предназначены только для однократного использования. При работе необходимо соблюдать требования асептики.
Восстановленный раствор содержит карфилзомиб в концентрации 2 мг/мл. Прочитайте полностью инструкцию по приготовлению раствора перед восстановлением:
- Рассчитайте дозу (в мг/м2) и количество флаконов препарата Кипролис, необходимые пациенту, в зависимости от исходной площади поверхности тела (ПИТ). Пациенты с ППТ более 2,2 м2 должны получить дозу на основании ППТ 2,2 м2. Коррекция дозы не требуется при изменении массы тела на ≤ 20%.
- Извлеките флакон из холодильника непосредственно перед применением.
- Используйте иглу 21 или большего калибра (0,8 мм или меньшего внешнего диаметра иглы) для асептического восстановления каждого флакона путем медленного введения 29 мл стерильной воды для инъекций через пробку, и, направляя струю воды для инъекций ПО ВНУТРЕННЕЙ СТЕНКЕ ФЛАКОНА для минимизации пенообразования.
- Содержимое флакона аккуратно медленно перемешайте вращением и/или переворачиванием в течение примерно 1 минуты или до полного растворения. НЕ ВСТРЯХИВАТЬ. В случае пенообразования необходимо дать раствору отстояться до тех пор, пока пена не исчезнет (примерно 5 минут), и раствор не станет прозрачным.
- Визуально осмотрите раствор на наличие посторонних частиц и изменение цвета перед введением. Восстановленный раствор должен быть прозрачным, от бесцветного до светло-желтого цвета и не должен вводиться при любых изменениях цвета или наличии посторонних частиц.
- Весь неиспользованный остаток препарата во флаконе необходимо утилизировать.
- Раствор препарата Кипролис можно вводить непосредственно внутривенно либо посредством введения препарата в пакет с раствором для внутривенных инфузий. Не допускается внутривенное струйное или болюсное введение препарата.
- При введении в в/в пакет, отбирают рассчитанную дозу препарата из флакона, используя иглу 21 или большего калибра (0,8 мм или меньшего внешнего диаметра иглы), и растворяют в в/в пакете объемом 50 или 100 мл, содержащем 5% раствора глюкозы для инъекций.
Восстановленный раствор
Химическая и физическая стабильность восстановленного раствора во флаконе, шприце или пакете для внутривенных инфузий была продемонстрирована при хранении препарата в течение 24 часов при температуре 2°C — 8°C или в течение 4 часов при температуре 25°C. При этом период времени с момента восстановления препарата до его введения не должен превышать 24 часов.
С микробиологической точки зрения восстановленный раствор должен быть использован непосредственно после восстановления. В противном случае ответственность за соблюдение сроков и условий хранения несет пользователь. Время хранения раствора перед использованием не должно превышать 24 часов при температуре 2°C — 8°C.
Утилизация
Весь неиспользованный остаток препарата и отходы подлежат утилизации в соответствии с местными требованиями.
Побочное действие
Обзор профиля безопасности
В число наиболее серьезных нежелательных реакций, которые могут развиться во время лечения препаратом Кипролис входят: сердечная недостаточность, инфаркт миокарда, остановка сердца, ишемия миокарда, интерстициальная болезнь легких, пневмонит, острый респираторный дистресс-синдром, острая дыхательная недостаточность, легочная гипертензия, одышка, артериальная гипертензия, в том числе гипертонический криз, острая почечная недостаточность, синдром лизиса опухоли, инфузионные реакции, желудочно-кишечное кровотечение, внутричерепное кровоизлияние, легочное кровотечение, тромбоцитопения, печеночная недостаточность, реактивация вируса гепатита B, синдром задней обратимой энцефалопатии (СЗОЭ), тромботическая микроангиопатия и тромботическая тромбоцитопеническая пурпура/гемолитико-уремический синдром (ТТП/ГУС). В клинических исследованиях препарата Кипролис кардиотоксичность и одышка обычно развивались на ранних этапах терапии (см. раздел «Особые указания»). Наиболее частыми нежелательными реакциями (возникавшими у более 20% пациентов) были: анемия, утомляемость, тромбоцитопения, тошнота, диарея, повышенная температура, одышка, инфекции дыхательных путей, кашель и нейтропения.
Начальная доза карфилзомиба, равная 20 мг/м2, затем повышалась до 27 мг/м2 в исследовании PX-171-009 и до 56 мг/м2 в исследовании 2011-003 (см. раздел «Фармакодинамика»). Результаты сравнения нежелательных реакций, развившихся в группе препарата Кипролис и дексаметазона (Kd) исследования 2011-003, с таковыми в группе препарата Кипролис, леналидомида и дексаметазона (KRd) исследования РХ-171- 009 указывают на то, что потенциальная дозозависимая связь может иметь место в случае со следующими нежелательными реакциями: сердечная недостаточность (Kd 8,2%, KRd 6,4%), одышка (Kd 30,9%, KRd 22,7%), артериальная гипертензия (Kd 25,9%, KRd 15,8%) и легочная гипертензия (Kd 1,3%, KRd 0,8%).
В исследовании 20160275, в рамках которого проводилось сравнение терапии препаратом Кипролис в комбинации с даратумумабом и дексаметазоном (KdD) и терапии препаратом Кипролис в комбинации только с дексаметазоном (Kd), летальные исходы вследствие нежелательных явлений в течение 30 дней с момента применения последней дозы какого- либо из этих препаратов наблюдались у 10 % пациентов в группе KdD и у 5 % пациентов в группе Kd. Наиболее распространенной причиной летального исхода у пациентов обеих групп являлось развитие инфекции (5 % в группе KdD и 3 % в группе Kd). Риск возникновения нежелательных явлений с летальным исходом, потенциально связанных с терапией, был выше среди пациентов в возрасте ≥ 65 лет. Серьезные нежелательные явления отмечались у 56 % пациентов в группе KdD и 46 % пациентов в группе Kd. Наиболее распространенными серьезными нежелательными явлениями в группе KdD по сравнению с группой Kd были: анемия (2 % по сравнению с 1 %), диарея (2 % по сравнению с 0 %), пирексия (4 % по сравнению с 2 %), пневмония (12 % по сравнению с 9 %), грипп (4 % по сравнению с 1 %), сепсис (4 % по сравнению с 1 %) и бронхит (2 % по сравнению с 0 %).
Список нежелательных реакций
Перечисленные ниже нежелательные реакции упорядочены по классам систем органов и категориям частоты встречаемости (см. таблицу 7). Категории частоты определялись на основании общей частоты, указанной для каждой нежелательной реакции в объединенном наборе данных из клинических исследований (n = 3878). В рамках каждого класса систем органов и категории частоты встречаемости нежелательные реакции перечислены в порядке снижения степени серьезности.
Таблица 7. Список нежелательных реакций
| Класс систем органов MedDRA | Очень часто(> 1/10) | Часто (> 1/100 — < 1/10) | Нечасто (> 1/1000 — < 1/100 | Редко (> 1/10 000 — < 1/1000) |
| Инфекции и инвазии | Пневмония, инфекция дыхательных путей | Сепсис, инфекция легких, вирусная инфекция, опоясывающий герпес*, инфекция мочевыводящих путей, бронхит, гастроэнтерит, вирусная инфекция, назофарингит, ринит | Колит, ассоциированный с Clostridium difficile, цитомегаловирусная инфекция, реактивация вируса гепатита B | |
| Нарушения со стороны иммунной системы | Гиперчувствительность к лекарственному средству | |||
| Нарушения со стороны кроветворной и лимфатической систем | Тромбоцитопения, нейтропения, анемия, лимфопения, лейкопения | Фебрильная нейтропения | Гемолитико-уремический синдром, тромботическая тромбоцитопеническая пурпура | Тромботическая микроангиопатия |
| Нарушения со стороны обмена веществ и питания | Гипокалиемия, снижение аппетита | Дегидратация, гиперкалиемия, гипомагниемия, гипонатриемия, гиперкальциемия, гипокальциемия, гипофосфатемия, гиперурикемия, гипоальбуминемия, гипергликемия | Синдром лизиса опухоли | |
| Психические нарушения | Бессонница | Тревожность, спутанность сознания | ||
| Нарушения со стороны нервной системы | Головокружение, периферическая нейропатия, головная боль | Парестезия, гипестезия | Внутричерепное кровоизлияние, нарушение мозгового кровообращения, синдром задней обратимой энцефалопатии | |
| Нарушения со стороны органа зрения | Катаракта, снижение четкости зрения | |||
| Нарушения со стороны органов слуха и равновесия | Звон в ушах | |||
| Кардиологические нарушения | Сердечная недостаточность, инфаркт миокарда, фибрилляция предсердий, тахикардия, снижение фракции выброса, сердцебиение | Остановка сердца, кардиомиопатия, ишемия миокарда, перикардит, выпот в полость перикарда, желудочковая тахикардия | ||
| Нарушения со стороны сосудистой системы | Артериальная гипертензия | Тромбоз глубоких вен, гипотензия, гиперемия | Гипертонический криз, кровотечение | Осложненный гипертонический криз |
| Нарушения со стороны органов дыхательной системы, грудной клетки и средостения | Диспноэ, кашель | Тромбоэмболия легочной артерии, отек легких, носовое кровотечение, боль в ротоглотке, дисфония, свистящее дыхание, легочная гипертензия | Острый респираторный дистресс-синдром, острая дыхательная недостаточность, легочное кровотечение, интерстициальная болезнь легких, пневмонит | |
| Нарушения со стороны пищеварительной системы | Рвота, диарея, запор, боли в животе, тошнота | Желудочно-кишечное кровотечение, диспепсия, зубная боль | Перфорация желудочно-кишечного тракта, острый панкреатит | |
| Нарушения со стороны гепатобилиарной системы | Повышение активности аланинаминотрансферазы, повышение активности аспартатаминотрансферазы, повышение активности гамма-глутамилтранспептидазы, гипербилирубинемия | Печеночная недостаточность, холестаз | ||
| Нарушения со стороны кожи и подкожных тканей | Кожные высыпания, кожный зуд, эритема, гипергидроз | Ангионевротический отёк | ||
| Нарушения со стороны костно-мышечной системы и соединительной ткани | Боль в спине, артралгия, боли в конечности, мышечные спазмы | Скелетно-мышечная боль, скелетно-мышечная боль в грудной клетке, боль в костях, миалгия, мышечная слабость | ||
| Нарушения со стороны почек и мочевыводящих путей | Повышение концентрации креатинина в крови | Острое повреждение почек, почечная недостаточность, нарушение функции почек, снижение почечного клиренса креатинина | ||
| Системные нарушения и осложнения в месте введения | Пирексия, периферические отеки, астения, утомляемость, озноб | Боли в грудной клетке, боль, реакции в месте инфузии, гриппоподобный синдром, недомогание | Полиорганная недостаточность | |
| Изменения результатов лабораторных и инструмен-тальных исследований | Повышение концентрации С-реактивного белка, повышение концентрации мочевой кислоты в крови | |||
| Травмы, отравления и осложнения процедур | Реакция, связанная с инфузией |
* Частота рассчитана по данным клинических исследований, большинство пациентов в которых получали профилактическую терапию.
Описание выделенных нежелательных реакций
Сердечная недостаточность, инфаркт миокарда и ишемия миокарда
В клинических исследованиях применения препарата Кипролис сердечная недостаточность была выявлена примерно у 5% пациентов (степень тяжести > 3 отмечалась примерно у 3%), инфаркт миокарда был диагностирован примерно у 1% пациентов (степень тяжести ≥ 3 отмечалась примерно у 1%), а ишемия миокарда развилась у < 1% пациентов (степень тяжести ≥ 3 отмечалась у < 1 %). Эти нежелательные явления обычно регистрировались на ранних этапах терапии препаратом Кипролис (< 5 циклов).
В исследовании 20160275 общая частота возникновения нарушений со стороны сердца (любой и всех степеней тяжести) в подгруппе пациентов, у которых изначально имелись нарушения со стороны сосудов или гипертензия, составила 29,9 % по сравнению с 19,8 % (KdD по сравнению Kd) и 30,6 % по сравнению с 18,1 % соответственно. Частота возникновения нарушений со стороны сердца с летальным исходом составила 1,9 % по сравнению с 0,0 % (KdD по сравнению Kd) и 1,5 % по сравнению с 0,0 %, соответственно. Ни один тип явлений со стороны сердца не обусловливал разницу между группами KdD и Kd в подгруппе пациентов, у которых изначально имелись нарушения со стороны сосудов или гипертензия.
Принципы клинического ведения пациентов с кардиологическими нарушениями, возникшими на фоне лечения препаратом Кипролис приведены в разделе «Особые указания».
Диспноэ
Одышка была выявлена примерно у 24% участников клинических исследований препарата Кипролис. Большинство нежелательных реакций, связанных с одышкой, были несерьезными (степень тяжести ≥ 3 отмечалась у < 5% пациентов), купировались и лишь в редких случаях приводили к прекращению лечения. Такие нежелательные реакции чаще всего развивались на ранних этапах исследования (< 3 циклов). Принципы клинического ведения пациентов с одышкой, возникшей на фоне лечения препаратом Кипролис, приведены в разделе «Особые указания».
Артериальная гипертензия, включая гипертонические кризы
Были зарегистрированы случаи развития гипертонических кризов (неосложненных и осложненных) после применения препарата Кипролис. Некоторые из этих нарушений имели смертельный исход. В клинических исследованиях нежелательные явления, связанные с артериальной гипертензией, были выявлены примерно у 21% пациентов и примерно у 8% пациентов развились нежелательные явления степени тяжести ≥ 3, хотя гипертонический криз был диагностирован у < 0,5% пациентов. Частота нежелательных явлений, связанных с артериальной гипертензией, не различалась у пациентов с артериальной гипертензией в анамнезе и пациентов, ранее не страдавших этим заболеванием. Принципы клинического ведения пациентов с артериальной гипертензией, развившейся на фоне лечения препаратом Кипролис, приведены в разделе «Особые указания».
Тромбоцитопения
Тромбоцитопения была зарегистрирована примерно у 33% участников клинических исследований препарата Кипролис и примерно у 20% развилась тромбоцитопения степени тяжести ≥ 3. В исследовании 20160275 частота возникновения тромбоцитопении степени тяжести ≥ 3 составила 24,4 % в группе KdD и 16,3 % в группе Kd. Препарат Кипролис вызывает тромбоцитопению путем подавления высвобождения тромбоцитов из мегакариоцитов, что приводит к классической циклической тромбоцитопении, при которой количество тромбоцитов опускается до минимального уровня на 8 или 15 день каждого 28-дневного цикла и которая обычно ассоциирована с восстановлением исходного количества тромбоцитов к началу следующего цикла. Принципы клинического ведения пациентов с тромбоцитопенией, развившейся на фоне лечения препаратом Кипролис, приведены в разделе «Особые указания».
Венозные тромбоэмболии
У пациентов, получавших препарат Кипролис, регистрировались случаи венозных тромбоэмболий, в том числе тромбоза глубоких вен и тромбоэмболии легочной артерии с летальным исходом (см. раздел «Особые указания»). В трех исследованиях фазы 3 общая частота венозных тромбоэмболических осложнений была выше в группах препарата Кипролис. В исследовании РХ-171-009 частота таких осложнений составила 15,6% — в группе KRd, и 9,0% — в группе Rd. Венозные тромбоэмболии ≥ 3 степени тяжести отмечались у 5,6% пациентов — в группе KRd, и у 3,9% пациентов — в группе Rd. В исследовании 2011-003 частота венозных тромбоэмболий составляла 12,5% — в группе Kd, и 3,3% — в группе комбинации бортезомиба и дексаметазона (Vd). Венозные тромбоэмболии ≥ 3 степени тяжести отмечались у 3,5% пациентов — в группе Kd, и у 1,8% пациентов — в группе Vd. В исследовании 20160275 частота возникновения венозных тромбоэмболий составила 6,2 % в группе KdD и 11,1 % в группе Kd. Венозные тромбоэмболии степени тяжести ≥ 3 отмечались у 1,9 % пациентов в группе KdD и у 6,5 % пациентов в группе Kd.
Печеночная недостаточность
Случаи печеночной недостаточности, включая случаи с летальным исходом, сообщались у < 1% пациентов в клинических исследованиях препарата Кипролис. Принципы клинического ведения гепатотоксичности, возникающей на фоне лечения препаратом Кипролис, приведены в разделе «Особые указания».
Периферическая нейропатия
В рандомизированном открытом многоцентровом исследовании, в рамках которого комбинация препарата Кипролис, вводимого в виде инфузии продолжительностью 30 минут в дозе 20/56 мг/м2, и дексаметазона (Kd, n = 464) сравнивалась с комбинацией бортезомиба и дексаметазона (Vd, n = 465), периферическая нейропатия степени тяжести 2 и выше была выявлена у 7% пациентов с рецидивирующей множественной миеломой, получавших режим терапии Kd, и у 35% пациентов, получавших режим терапии Vd, что было зафиксировано на момент изначально запланированного анализа OS. В исследовании 20160275 случаи возникновения периферической нейропатии степени тяжести 2 и выше были зарегистрированы у 10,1 % пациентов с рецидивирующей множественной миеломой в группе KdD по сравнению с 3,9 % пациентов в группе Kd.
Инфузионные реакции
В исследовании 20160275 наблюдался повышенный риск возникновения инфузионных реакций в случае применения карфилзомиба совместно с даратумумабом.
Инфекции дыхательных путей
В исследовании 20160275 сообщалось о серьезных случаях инфекций дыхательных путей, возникавших в каждой группе лечения (27,6 % в группе KdD и 15,0 % в группе Kd). В исследовании 20160275 сообщалось о серьезных случаях пневмонии, возникавших в каждой группе лечения (15,3 % в группе KdD и 9,8 % в группе Kd). К летальному исходу привели 1,3 % и 0 % явлений в группах KdD и Kd, соответственно.
Вторичные первичные злокачественные новообразования
В исследовании 20160275 в каждой группе лечения были зарегистрированы случаи возникновения вторичных первичных злокачественных новообразований (1,9 % в группе KdD и 1,3 % в группе Kd).
Оппортунистические инфекции
В исследовании 20160275 в каждой группе лечения были зарегистрированы случаи возникновения оппортунистических инфекций (9,4 % в группе KdD и 3,9 % в группе Kd). В группе KdD в ≥ 1 % случаев оппортунистические инфекции включали опоясывающий герпес, кандидоз полости рта, оральный герпес и простой герпес.
Реактивация гепатита B
В исследовании 20160275 частота реактивации гепатита B составила 0,6 % в группе KdD в сравнении с 0 % в группе Kd.
Другие особые группы пациентов
Пациенты пожилого возраста
В целом частота отдельных нежелательных явлений (включая сердечную аритмию, сердечную недостаточность (см. раздел «Особые указания»), диспноэ, лейкопению и тромбоцитопению) в клинических исследованиях препарата Кипролис была выше у пациентов в возрасте ≥ 75 лет по сравнению с пациентами в возрасте < 75 лет.
Передозировка
В настоящее время отсутствует достаточная информация для того, чтобы сделать заключение о безопасности использования препарата в дозах, превышающих дозы, используемые в рамках клинических исследований. При ошибочном введении препарата Кипролис в дозе 200 мг, сообщалось об остром развитии озноба, понижении артериального давления, почечной недостаточности, тромбоцитопении и лимфопении.
Специфический антидот для карфилзомиба в случае передозировки неизвестен. В случае передозировки пациент должен находиться под наблюдением, особенно на предмет развития нежелательных лекарственных реакций на препарат Кипролис, перечисленных в разделе «Побочное действие».
Взаимодействие с другими лекарственными средствами
Карфилзомиб преимущественно метаболизируется пептидазой и эпоксидгидролазой, и как следствие, не ожидается влияния при одновременном введении ингибиторов и индукторов цитохрома P450 на фармакокинетический профиль карфилзомиба.
Исследования in vitro показали, что карфилзомиб не индуцирует CYP3A4 человека в культуре гепатоцитов. В клиническом исследовании, предусматривавшем пероральный прием мидазолама (метаболизирующегося с участием CYP3A) и введение карфилзомиба в дозе 27 мг/м2 (посредством инфузии длительностью 2-10 минут), было показано, что одновременное введение карфилзомиба не оказывало влияния на параметры фармакокинетики мидазолама. Эти данные свидетельствуют о том, что карфилзомиб, как ожидается, не будет ингибировать метаболизм субстратов CYP3A4/5 и не является индуктором CYP3A4 у человека. Исследования карфилзомиба в дозе 56 мг/м2 не проводилось. Однако неизвестно, является ли карфилзомиб индуктором CYP1A2, 2C8, 2C9, 2C19 и 2B6 в терапевтических концентрациях. Следует соблюдать осторожность при комбинировании карфилзомиба с препаратами, являющимися субстратами этих изоферментов, в частности пероральными контрацептивами. Необходимо принять эффективные меры для предотвращения беременности (см. раздел «Применение при беременности и в период грудного вскармливания»; а также инструкцию по применению препарата леналидомид); пациентам, использующим пероральные контрацептивы, необходимо перейти на альтернативный эффективный метод контрацепции.
Карфилзомиб не ингибирует CYP1A2, 2B6, 2C8, 2C9, 2C19 и 2D6 in vitro и поэтому, как ожидается, не будет оказывать влияния на значения экспозиции лекарственных препаратов, являющихся субстратами этих изоферментов.
Карфилзомиб является субстратом P-гликопротеина (P-gp), но не является субстратом BCRP. Однако, учитывая тот факт, что препарат Кипролис вводится внутривенно и интенсивно метаболизируется, одновременное применение ингибиторов или индукторов P-gp или BCRP вероятно не скажется на параметрах фармакокинетики карфилзомиба. В исследованиях in vitro в концентрациях, меньших, нежели ожидаемые при использовании препарата в терапевтических дозах (3 мкмоль/л), карфилзомиб ингибировал эффлюкс дигоксина (являющегося субстратом P-gp) на 25%. Следует соблюдать осторожность при комбинировании карфилзомиба с субстратами P-gp (например, дигоксином, колхицином).
В исследованиях in vitro карфилзомиб ингибировал OATP1B1 при значениях IC50 = 2,01 мкмоль/л, при этом неизвестно, может ли карфилзомиб в системных концентрациях ингибировать другие транспортеры (OATP1B3, OAT1, OAT3, OCT2 и BSEP). Карфилзомиб не ингибирует UGT2B7 человека, однако ингибирует UGT1A1 человека при значениях IC50 = 5,5 мкмоль/л. Тем не менее, учитывая быструю элиминацию карфилзомиба, а также быстрое снижение его системной концентрации через 5 минут после завершения инфузии, риск клинически значимых взаимодействий с субстратами OATP1B1 и UGT1A1, вероятно, является низким.
Особые указания
Поскольку препарат Кипролис применяется в комбинации с другими лекарственными средствами, перед началом лечения необходимо изучить также инструкции по применению этих лекарственных средств. Учитывая, что в комбинации с препаратом Кипролис может назначаться леналидомид, особое внимание следует уделить требованиям в отношении предотвращения наступления беременности во время терапии леналидомидом и выполнения тестов на беременность (см. раздел «Применение при беременности и в период грудного вскармливания»).
Нарушения со стороны сердца
После применения препарата Кипролис отмечали развитие или прогрессирование сердечной недостаточности (например, застойная сердечная недостаточность, отек легких, снижение фракции выброса), ишемию миокарда и инфаркт миокарда. Летальные исходы вследствие остановки сердца возникали в течение суток после введения препарата Кипролис, и сообщалось о летальных случаях сердечной недостаточности и инфаркта миокарда. Потенциальные дозозависимые эффекты см. в разделе «Побочное действие».
Хотя перед началом введения в цикле 1 необходима адекватная гидратация, также необходим мониторинг всех пациентов на предмет гиперволемии, особенно пациентов с риском развития сердечной недостаточности. При необходимости, у пациентов с сердечной недостаточностью или составляющих группу высокого риска данной патологии, может потребоваться коррекция общего объема инфузионной терапии (см. раздел «Способ применения и дозы»).
При развитии нежелательных явлений со стороны сердца 3 или 4 степени тяжести, необходимо отменить препарат до разрешения явлений и рассмотреть вопрос о возобновлении применения препарата Кипролис в дозе, сниженной на 1 уровень на основании оценки соотношения польза/риск (см. раздел «Способ применения и дозы»).
Риск сердечной недостаточности возрастает у пациентов пожилого возраста (≥ 75 лет). Кроме того, риск сердечной недостаточности возрастает у пациентов азиатского происхождения
Перед началом лечения рекомендуется провести тщательную оценку факторов сердечно-сосудистого риска.
Пациенты с сердечной недостаточностью III и IV функционального класса по классификации Нью-Йоркской кардиологической ассоциации (NYHA), недавно перенесшие инфаркт миокарда и имевшие неконтролируемые лекарственной терапией нарушения проводимости, не включались в клинические исследования. Эти пациенты могут быть подвержены более высокому риску развития осложнений со стороны сердца. Пациенты с признаками или симптомами сердечной недостаточности III или IV функционального класса по классификации NYHA, недавно перенесшие инфаркт миокарда (в течение последних 4 месяцев), а также пациенты с неконтролируемой стенокардией или аритмией должны проходить полное кардиологическое обследование перед началом терапии препаратом Кипролис. Состояние пациента следует оптимизировать по результатам такого обследования, уделяя особое внимание контролю артериального давления и содержанию жидкости в организме. Впоследствии пациентам следует проводить терапию с осторожностью, пациенты должны находиться под пристальным наблюдением.
Изменения на электрокардиограмме
В клинических исследованиях и пострегистрационном периоде были зарегистрированы случаи удлинения интервала QT. Были получены сообщения о случаях желудочковой тахикардии у пациентов, которые проходили лечение препаратом Кипролис.
Легочная токсичность
У пациентов, получавших препарат Кипролис, были зарегистрированы случаи острого респираторного дистресс-синдрома (ОРДС), острой дыхательной недостаточности и острой диффузной инфильтративной болезни легких, таких как пневмонит и интерстициальное заболевание легких. Некоторые из этих нарушений имели смертельный исход. Необходимо выполнить оценку состояния пациента и прекратить применение препарата Кипролис до разрешения легочной токсичности, после чего решение о возобновлении терапии принимают на основании результатов оценки соотношения польза/риск (см. раздел «Способ применения и дозы»).
Легочная гипертензия
Были получены сообщения о выявлении во время лечения препаратом Кипролис легочной гипертензии, в некоторых случаях с летальным исходом. При подозрении на это заболевание пациенту показано соответствующее обследование. В случае подтверждения легочной гипертензии следует прекратить применение препарата Кипролис до тех пор, пока симптоматика не разрешится или функция легких не восстановится до исходного уровня, а затем рассмотреть вопрос о возобновлении терапии на основании результатов оценки соотношения польза/риск (см. раздел «Способ применения и дозы»).
Диспноэ
У пациентов, получавших лечение препаратом Кипролис, часто появлялись жалобы на одышку. Пациенту с одышкой показано обследование с целью исключения кардиопульмональных осложнений, включая сердечную недостаточность и легочные синдромы. В случае развития одышки 3 или 4 степени тяжести применение препарата Кипролис прекращают до тех пор, пока одышка не купируется или параметры дыхания не восстановятся до исходного уровня, после чего рассматривают вопрос и возобновлении терапии на основании результатов оценки соотношения польза/риск (см. разделы «Способ применения и дозы» и «Побочное действие»).
Артериальная гипертензия
На фоне применения препарата Кипролис были зарегистрированы случаи артериальной гипертензии, включая гипертонический криз и осложненный гипертонический криз. Некоторые из этих случаев имели смертельный исход. Случаи гипертензии чаще регистрировались у пациентов, получавших препарат Кипролис в комбинации с даратумумабом в рамках исследования 20160275. Рекомендуется достигнуть контроля артериальной гипертензии до начала лечения препаратом Кипролис и контролировать ее во время лечения. Всем пациентам показан регулярный осмотр с целью выявления артериальной гипертензии и назначения лечения, если в этом возникнет необходимость. Если артериальную гипертензию невозможно контролировать, дозу препарата Кипролис необходимо снизить. В случае диагностирования гипертонического криза применение препарата Кипролис прекращают до тех пор, пока гипертонический криз не будет купирован или показатели артериального давления не восстановятся до исходного уровня, после чего рассматривают вопрос и возобновлении терапии на основании результатов оценки соотношения польза/риск (см. раздел «Способ применения и дозы»).
Острая почечная недостаточность
Были получены сообщения о случаях острой почечной недостаточности у пациентов, которые проходили лечение препаратом Кипролис. Некоторые из этих случаев имели смертельный исход. Острая почечная недостаточность чаще диагностировалась у пациентов с рецидивирующей или рефрактерной множественной миеломой на поздней стадии, получавших монотерапию препаратом Кипролис. В клинических исследованиях фазы 3 частота нежелательных явлений, связанных с острой почечной недостаточностью, была выше у пациентов с более низким исходным клиренсом креатинина, по сравнению с пациентами с более высоким исходным клиренсом креатинина. У большинства пациентов клиренс креатинина не изменялся с течением времени. Показатели функции почек необходимо контролировать хотя бы раз месяц или так часто, как это предусмотрено клиническими рекомендациями, особенно у пациентов с более низким исходным клиренсом креатинина. В случае необходимости препарат начинают вводить в сниженной дозе или отменяют (см. раздел «Способ применения и дозы»).
Синдром лизиса опухоли
Синдром лизиса опухоли (СЛО), в том числе с летальным исходом, отмечался у пациентов, получавших препарат Кипролис. Пациенты с высокой опухолевой нагрузкой должны рассматриваться как имеющие более высокий риск СЛО. Необходимо обеспечить адекватную гидратацию перед введением препарата Кипролис в цикле 1 терапии, а также, при необходимости, при последующих циклах (см. раздел «Способ применения и дозы»). У пациентов, имеющих высокий риск развития СЛО, следует рассмотреть вопрос об использовании средств, снижающих концентрацию мочевой кислоты. В процессе лечения необходим мониторинг признаков СЛО, в том числе регулярная оценка концентрации электролитов в сыворотке крови и адекватная коррекция выявленных изменений. Необходимо прекращение лечения препаратом Кипролис до разрешения симптомов СЛО (см. раздел «Способ применения и дозы»).
Инфузионные реакции
Инфузионные реакции, в том числе жизнеугрожающие, отмечались у пациентов, получавших препарат Кипролис. Симптомы могут включать повышение температуры тела, озноб, артралгию, миалгию, покраснение лица, отек лица, рвоту, слабость, затруднение дыхания, понижение артериального давления, обморок, брадикардию, чувство стеснения в грудной клетке или стенокардию. Эти реакции могут развиваться немедленно после или в течение 24 часов после введения препарата. С целью снижения частоты и степени тяжести реакций, перед введением препарата Кипролис производится введение дексаметазона в качестве премедикации (см. раздел «Способ применения и дозы»).
Кровотечения и тромбоцитопения
Сообщалось о развитии кровотечений (например, кровотечение в ЖКТ, легочное, внутричерепное), часто связанных с тромбоцитопенией, у пациентов, получавших препарат Кипролис. Некоторые случаи завершились летальным исходом (см. раздел «Побочное действие»).
Препарат Кипролис вызывает развитие тромбоцитопении с надиром, наблюдавшимся в день 8 и день 15 каждого цикла длительностью 28 дней с последующим восстановлением до исходных значений к началу следующего цикла (см. раздел «Побочное действие»). Необходим частый мониторинг количества тромбоцитов при лечении препаратом Кипролис. При необходимости требуется снизить или отменить дозу препарата (см раздел «Способ применения и дозы»).
Венозные тромбоэмболические осложнения
У пациентов, получавших препарат Кипролис, были зарегистрированы случаи венозных тромбоэмболических осложнений, включая тромбоз глубоких вен и тромбоэмболию легочной артерии с летальным исходом.
Пациентам с известными факторами риска тромбоэмболии, в том числе с тромбозом в анамнезе, показан тщательный мониторинг. Необходимо минимизировать все модифицируемые факторы риска (например, курение, артериальная гипертензия и гиперлипидемия). Также следует с осторожностью подходить к сочетанному применению других препаратов, которые могут повысить риск тромбоза (например, средства для стимуляции эритропоэза или препараты гормонозаместительной терапии). Пациентам и лечащим врачам рекомендуется быть настороженными в отношении признаков и симптомов тромбоэмболии. Пациентов необходимо проинструктировать о том, что в случае развития таких симптомов, как затрудненное дыхание, боль в груди, кровохарканье, отеки на руках или ногах, или боль в конечностях, они должны обратиться за медицинской помощью.
Следует рассмотреть вопрос о назначении профилактики тромбоза, в каждом конкретном случае выполнив оценку соотношения польза/риск.
Гепатотоксичность
Сообщались случаи развития печеночной недостаточности, в том числе с летальным исходом. Препарат Кипролис может вызывать повышение активности печеночных трансаминаз в сыворотке крови (см. раздел «Побочное действие»). При необходимости требуется снизить или отменить дозу препарата (см. раздел «Способ применения и дозы»). Мониторинг активности печеночных ферментов и билирубина следует контролировать в начале лечения и ежемесячно во время лечения карфилзомибом, вне зависимости от исходных значений.
Тромботическая микроангиопатия
У пациентов, получавших препарат Кипролис, регистрировались случаи тромботической микроангиопатии, включая случаи тромботической тромбоцитопенической пурпуры/гемолитико-уремического синдрома (ТТП/ГУС). Некоторые из этих случаев имели смертельный исход. Необходимо выполнять мониторинг на предмет появления признаков и симптомов ТТП/ГУС. При подозрении на этот диагноз следует прекратить применение препарата Кипролис и обследовать пациента на возможную ТТП/ГУС. Если диагноз ТТП/ГУС не подтвердился, терапию препаратом Кипролис можно возобновить. Безопасность повторного назначения терапии препаратом Кипролис пациентам, перенесшим ТТП/ГУС, не установлена.
Синдром задней обратимой энцефалопатии (СЗОЭ)
У пациентов, получавших препарат Кипролис, регистрировались случаи развития синдрома задней обратимой энцефалопатии (СЗОЭ). СЗОЭ, ранее носивший название синдрома обратимой задней лейкоэнцефалопатии, представляет собой редкое неврологическое нарушение, которое может проявляться судорожными припадками, головной болью, заторможенностью, спутанностью сознания, слепотой, изменением уровня сознания, а также другими зрительными и неврологическими нарушениями, наряду с повышением артериального давления, для подтверждения диагноза выполняется нейровизуализация. При подозрении на СЗОЭ применение препарата Кипролис следует прекратить. Безопасность повторного назначения терапии препаратом Кипролис пациентам, перенесшим СЗОЭ, не установлена.
Реактивация вируса гепатита В (HBV)
Сообщалось о случаях реактивации вируса гепатита В (HBV) у пациентов, получавших карфилзомиб.
Все пациенты должны быть обследованы на HBV до начала терапии карфилзомибом. Для пациентов с положительным результатом серологического исследования на HBV следует рассмотреть возможность профилактики с использованием противовирусных препаратов. Таких пациентов следует контролировать на предмет клинических и лабораторных признаков реактивации HBV во время и после окончания терапии. При необходимости следует проконсультироваться со специалистами по лечению HBV-инфекции. Безопасность возобновления применения карфилзомиба после достижения адекватного контроля реактивации HBV неизвестна. Поэтому возобновление терапии следует обсудить со специалистами по лечению HBV.
Прогрессирующая мультифокальная лейкоэнцефалопатия
Сообщалось о случаях прогрессирующей мультифокальной лейкоэнцефалопатии (ПМЛ) у пациентов, получавших карфилзомиб, которым была назначена предшествующая или сопутствующая иммуносупрессивная терапия.
Пациентов, получающих карфилзомиб, необходимо контролировать на наличие любых новых или ухудшающихся неврологических, когнитивных или поведенческих признаков и симптомов, которые могут указывать на ПМЛ, в рамках дифференциальной диагностики нарушений ЦНС.
При подозрении на ПМЛ дальнейшая терапия должна быть приостановлена до тех пор, пока специалист не исключит ПМЛ. Если ПМЛ подтверждается, терапию карфилзомибом следует прекратить.
Контрацепция
Женщины репродуктивного возраста (и/или их партнеры) должны использовать эффективные методы контрацепции во время всего курса лечения и в течение одного месяца после его завершения. Мужчины должны использовать эффективные методы контрацепции во время лечения и еще в течение 3 месяцев после его завершения в том случае, если их партнерша беременна или способна к зачатию, и не пользуется эффективными средствами контрацепции (см. раздел «Применение при беременности и в период грудного вскармливания»). Карфилзомиб может снижать эффективность пероральных контрацептивов (см. раздел «Взаимодействие с другими лекарственными средствами»).
Содержание натрия
Кипролис, 60 мг, лиофилизат для приготовления раствора для инфузий
Данный лекарственный препарат во флаконе, содержащем 60 мг карфилзомиба, содержит 216 мг натрия, что эквивалентно 11 % рекомендуемой ВОЗ максимальной суточной дозы натрия 2 г для взрослых.
Содержание циклодекстрина
Кипролис, 60 мг, лиофилизат для приготовления раствора для инфузий
Данный лекарственный препарат во флаконе, содержащем 60 мг карфилзомиба, содержит 3000 мг циклодекстрина (сульфобутиловый эфир бетадекс натрия), что эквивалентно дозе 88 мг/кг для взрослых с массой тела 70 кг.
Влияние на способность управлять транспортными средствами, механизмами
Препарат Кипролис оказывает незначительное влияние на способность к управлению автомобилем и работе с механизмами.
В клинических исследованиях отмечались случаи утомляемости, головокружения, обмороков, помутнения зрения, сонливости и/или снижения артериального давления. Пациентам, получающим терапию препаратом Кипролис, необходимо рекомендовать воздерживаться от управления автомобилем и работы с механизмами, если у них отмечаются данные симптомы.
Форма выпуска
Лиофилизат для приготовления раствора для инфузий, 60 мг.
Количество препарата, содержащее 60 мг карфилзомиба, во флакон из прозрачного стекла I гидролитического класса вместимостью 50 мл, укупоренный 20 мм эластомерной пробкой (из хлоробутилового каучука), ламинированной фторполимером, обжатый колпачком комбинированным (алюминиевым с отламывающимся полипропиленовым колпачком). По 1 флакону с наклеенной этикеткой помещают в жесткий пластиковый контейнер и вместе с инструкцией по применению помещают в картонную пачку. На каждую пачку наклеивают две прозрачные защитные этикетки — контроль первого вскрытия, имеющие продольную цветную полосу.
Условия хранения
Хранить при температуре не выше 8 °C. Не замораживать.
Хранить в оригинальной упаковке для защиты от света.
Хранить в недоступном для детей месте!
Срок годности
3 года.
Не использовать по истечении срока годности, указанного на упаковке.
Условия отпуска
Отпускают по рецепту.
Держатель регистрационного удостоверения
Амджен Европа Б.В., Нидерланды
Минервум 7061
4817 ZK Бреда
Нидерланды
Производитель
Производитель готовой лекарственной формы/фасовщик (первичная упаковка)
Патеон Мэньюфэкчуринг Сервисез ЛЛС, США
5900 Мартин Лютер Кинг Дж. Хайвей, Гринвилл, Северная Каролина 27834, США
или
Амджен Технолоджи (Айрлэнд) Анлимитед Компани, Ирландия
Поттери Роуд, Дан Лэйри, гр. Дублин, Ирландия
Упаковщик (вторичная (потребительская) упаковка)/ выпускающий контроль качества
Амджен Европа Б.В., Нидерланды
Минервум 7061, 4817 ZK Бреда, Нидерланды
или
Амджен Технолоджи (Айрлэнд) Анлимитед Компани, Ирландия
Поттери Роуд, Дан Лэйри, гр. Дублин, Ирландия
или
Общество с ограниченной ответственностью «Добролек» (ООО «Добролек»), Россия
115446, Москва, Коломенский проезд, 13А
или
Открытое акционерное общество «Фармстандарт-Уфимский витаминный завод» (ОАО «Фармстандарт-УфаВИТА»), Россия
450077, Республика Башкортостан, г. Уфа, ул. Худайбердина, д. 28
Организация, принимающая претензии от потребителей
ООО «Амджен»
123112, Москва, Пресненская набережная, д.8, строение 1, 7 этаж
Тел: +7 (495) 745 04 78
Факс: +7 (499) 995 19 65
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Лиофилизированная масса
или порошок белого или почти белого цвета.
Восстановленный раствор
прозрачный, бесцветный, без посторонних видимых включений.
На 1 флакон:
Действующее вещество: карфилзомиб — 60,00 мг
Вспомогательные вещества: натриевая соль
сульфобутилового эфира бета-циклодекстрина, лимонная кислота безводная (Е330),
натрия гидроксид
L01XX45. Прочие
противоопухолевые средства. Карфилзомиб.
Фармакодинамика
Механизм действия
Карфилзомиб представляет
собой тетрапептидный эпоксикетонный ингибитор протеасомы, который селективно и
необратимо связывается с N-терминальным треонин-содержащим активным центром 20S-протеасомы, являющейся
протеолитической центральной частицей протеасомы 26S, и оказывает
незначительное влияние на протеазы других классов. Карфилзомиб проявлял
антипролиферативную и проапоптотическую активность в доклинических моделях
гематологических опухолей. У животных карфилзомиб ингибировал активность
протеасомы в крови и тканях и замедлял опухолевый рост в моделях множественной
миеломы. In vitro было обнаружено, что карфилзомиб обладает минимальной
нейротоксичностью и минимальной реактивностью в отношении непротеасомных
протеаз.
Фармакодинамические
эффекты
Внутривенное введение
карфилзомиба приводило к подавлению протеасомной химотрипсиноподобной (CT-L)
активности при измерении в крови через 1 час после введения первой дозы. Дозы ≥15 мг/м2
последовательно индуцировали ингибирование (≥80%)
CT-L активности протеасомы. Кроме того, введение карфилзомиба в дозе 20 мг/м2
приводило к ингибированию латентного мембранного белка типа 2 (LMP2) и
субъединиц иммунопротеасомы, подобных мультикаталитическому эндопептидазному комплексу
1 (MECL1), в диапазоне от 26% до 32% и от 41% до 49%,
соответственно. Ингибирование протеасомы сохранялось в течение ≥48 часов после введения первой дозы карфилзомиба при его
еженедельном дозировании. Комбинированное применение
препарата с леналидомидом и дексаметазоном не влияла
на ингибирование протеасомы.
При дозе более 56 мг/м2
наблюдалось не только увеличение ингибирования субъединиц CT-L (≥90%) по
сравнению с дозами от 15 до 20 мг/м2, но и увеличение ингибирования
других субъединиц протеасомы (LMP7, MECL1 и LMP2).
Наблюдалось увеличение ингибирования субъединиц LMP7, MECL1 и LMP2
примерно на 8,23 и 34%, соответственно, при введении дозы 56 мг/м2
по сравнению с дозами от 15 до 20 мг/м2. Схожее ингибирование
протеасомы карфилзомибом достигалось при длительности инфузий от 2 до 10 минут
и 30 минут для 2 протестированных доз (20 и 36 мг/м2).
Клиническая эффективность
Карфилзомиб в комбинации
с леналидомидом и дексаметазоном для лечения пациентов с рецидивирующей
множественной миеломой — исследование РХ-171-009 (ASPIRE)
Безопасность и
эффективность карфилзомиба изучали в рандомизированном открытом многоцентровом
исследовании, включавшем 792 пациента с рецидивирующей множественной миеломой,
которые были рандомизированы 1:1 для оценки комбинации карфилзомиба,
леналидомида и дексаметазона в сравнении с леналидомидом и дексаметазоном.
В этом исследовании
оценивали карфилзомиб в начальной дозе 20 мг/м2, которая затем была
увеличена до 27 мг/м2 на 8-й день 1-го цикла; препарат вводили два
раза в неделю в течение 3 из 4 недель в виде инфузии в течение 10 минут.
Лечение карфилзомибом проводили в течение не более 18 циклов, если его не
прекращали раньше в связи с прогрессированием заболевания или неприемлемой
токсичностью. Применение леналидомида и дексаметазона могло продолжаться до
прогрессирования заболевания или неприемлемой токсичности.
Пациенты со следующими
состояниями были исключены из исследования: скорость клиренса креатинина <50
мл/мин, застойная сердечная недостаточность III-IV класса по NYHA или инфаркт
миокарда в течение последних 4 месяцев, прогрессирование заболевания во время лечения
с применением схемы, содержащей бортезомиб, или прогрессирование в течение
первых 3 месяцев лечения леналидомидом и дексаметазоном, или прогрессирование в
любое время во время лечения леналидомидом и дексаметазоном, если это была
последняя линия терапии пациента. В соответствии с критериями включения в
исследование была зарегистрирована небольшая подгруппа пациентов с миеломой,
рефрактерной к бортезомибу (n=118) или леналидомиду (n=57). Включенные пациенты
были определены как рефрактерные к терапии, если они соответствовали любому из
следующих 3 критериев: отсутствие ответа (<минимального ответа) на любой
режим терапии; прогрессирование заболевания во время применения любого режима
терапии; или прогрессирование заболевания в течение 60 дней после завершения
любого режима. В данном исследовании не оценивали соотношение польза/риск в
более широкой рефрактерной популяции.
Статус заболевания и
другие исходные характеристики были хорошо сбалансированы между двумя группами,
включая возраст (64 года, диапазон 31-91 год), пол (56% мужчин), общее
состояние по шкале ECOG (48% с показателем 1), генетические мутации с высоким
риском, состоящие из генетических подтипов t (4; 14), t (14; 16) или делеции 17р
в ≥60% плазматических клеток (13%), генетические мутации с неизвестным
риском, включавшие пациентов с результатами, которые не были получены или не
были проанализированы (47%), и исходной III стадией заболевания по ISS (20%).
Пациенты получали от 1 до 3 предыдущих линий терапии (медиана 2), включая
предшествующее лечение бортезомибом (66%), талидомидом (44%) и леналидомидом
(20%).
Пациенты в группе
карфилзомиба, леналидомида и дексаметазона (KRd) продемонстрировали лучшую
выживаемость без прогрессирования (ВБП) по сравнению с пациентами в группе леналидомида и дексаметазона (Rd), (отношение рисков (ОР)=0,69,
одностороннее значение р<0,0001), что представляет
собой 45% улучшение ВБП или 31% снижение риска случая,
определяемого стандартными критериями объективного ответа Международной рабочей
группы по изучению множественной миеломы (1МWG)/Европейского общества
по трансплантации костного мозга (ЕВМТ), согласно оценке Независимого
наблюдательного комитета (IRC).
Преимущество влияния на
ВБП применения KRd отмечалось во всех подгруппах, включая пациентов в возрасте ≥75 лет (n=96), пациентов с
генетическими мутациями высокого риска (n=100) или
неизвестного уровня риска (n=375) и пациентов с
исходным клиренсом креатинина в диапазоне от 30 до <50 мл/мин (n=56).
Предварительно
запланированный анализ общей выживаемости (ОВ) был выполнен после наступления
246 случаев смерти в группе KRd и 267 — в группе Rd. Медиана наблюдения
составила приблизительно 67 месяцев. У пациентов в группе KRd по сравнению с
пациентами в группе Rd наблюдали статистически значимое преимущество в
отношении ОВ. У пациентов в группе KRd отмечено снижение риска смерти на 21% по
сравнению с пациентами в группе Rd (ОР=0,79; 95% ДИ: 0,67, 0,95; р=0,0045).
Наблюдалось увеличение медианы ОВ на 7,9 месяцев у пациентов в группе KRd по
сравнению с пациентами в группе Rd.
Пациенты в группе KRd
сообщали об улучшении общего состояния здоровья с более высокими показателями
общего состояния здоровья/качества жизни (КЖ) по сравнению с группой Rd в
течение 18 циклов лечения (односторонне значение без учета множественности
сравнений р=0,0001) с оценкой по шкале КЖ EORTC QLQ-C30,
валидированной для множественной миеломы.
Карфилзомиб в комбинации
с дексаметазоном для лечения пациентов с рецидивирующей множественной миеломой
— исследование 2011-003 (ENDEAVOR)
Безопасность и
эффективность карфилзомиба изучали в рандомизированном открытом многоцентровом
исследовании фазы III, в котором оценивалась комбинация карфилзомиба и
дексаметазона (Kd) в сравнении с комбинацией бортезомиба и дексаметазона (Vd).
Всего было включено и рандомизировано 929 пациентов с рецидивирующей или
рефрактерной множественной миеломой, которые получали от 1 до 3 предшествующих
линий терапии (464 в группе Kd; 465 в группе Vd).
В этом исследовании
карфилзомиб оценивали в начальной дозе 20 мг/м2, которая затем была
увеличена до 56 мг/м2 на 8-й день 1-го цикла; препарат вводили два
раза в неделю в течение 3 из 4 недель в виде инфузии в течение 30 минут до
прогрессирования заболевания или до развития неприемлемой токсичности.
Пациенты,
рандомизированные в группу Vd, могли получать бортезомиб либо внутривенно (n=108), либо
подкожно (n=357). Пациенты, у которых отмечались следующие состояния,
были исключены из исследования: клиренс креатинина <15 мл/мин, застойная
сердечная недостаточность III-IV класса по NYHA, инфаркт миокарда в течение
последних 4 месяцев или фракция выброса левого желудочка (ФВЛЖ) <40%.
Критерии включения в исследование позволяли включать пациентов, ранее
получавших лечение карфилзомибом (n=3) или бортезомибом (n=502), при условии, что
пациенты имели хотя бы частичный ответ (ЧО) на предшествующую терапию
ингибиторами протеасомы, терапия ингибиторами протеасомы не отменялась из-за
проявлений токсичности, и пациенты не получали лечения ингибиторами протеасомы
по меньшей мере 6 месяцев со времени введения последней дозы.
Демографические данные и
базовые характеристики пациентов в исследовании 2011-003 были хорошо
сбалансированы между двумя группами, включая предшествующее лечение
бортезомибом (54%), предшествующее лечение леналидомидом (38%), рефрактерность
к леналидомиду (25%), возраст (65 лет, диапазон 30-89 лет), пол (51% мужчин),
общее состояние; по шкале ECOG (45% с показателем 1), генетические мутации с высоким риском, состоящие из генетических подтипов t (4; 14) или t (14; 16) в 10% или
более плазматических клеток или делеции 17р в ≥20% плазматических клеток (23%), генетические мутации с
неизвестным риском, которые включали пациентов с результатами, которые не были
получены или не были проанализированы (9%), а также исходную III стадию
заболевания по ISS (24%).
Исследование показало
значительное улучшение ВБП у пациентов в группе Kd по сравнению с пациентами в
группе Vd (OP: 0,53, 95%
ДИ: 0,44, 0,65 [р <0,0001]). Аналогичные
результаты ВБП наблюдались у пациентов, которые получали предшествующее лечение
бортезомибом (ОР 0,56, 95%ДИ: 0,44, 0,73), и у пациентов, которые ранее не
получали лечения бортезомибом (ОР 0,48, 95% ДИ:
0,36, 0,66).
Преимущество лечения Kd в
отношении ВБП наблюдалось во всех подгруппах, включая пациентов в
возрасте ≥75 лет (n=143), пациентов с
генетическими мутациями высокого риска (n=210) и пациентов с
исходным клиренсом креатинина в диапазоне от 30 до 50 мл/мин (n=128).
У пациентов, которые
ранее получали бортезомиб (54%), медиана ВБП составила 15,6 месяца в группе
Kd по сравнению с 8,1 месяца в группе Vd (ОР=0,56, 95% ДИ: 0,44, 0,73), общая частота ответа (ОЧО) составила 71,2%
по сравнению с 60,3%.
У пациентов, которые
ранее получали леналидомид (38%), медиана ВБП составила 12,9 месяцев в группе
Kd по сравнению с 7,3 месяца в группе Vd (ОР=0,69,95%ДИ: 0,52,0,92), ОЧО
составила 70,1% по сравнению с 59,3%. У пациентов, рефрактерных к леналидомиду
(25%), медиана ВБП составила 8,6 месяца в
группе Kd по сравнению с 6,6 месяца в группе Vd (ОР=0,80, 95% ДИ: 0,57, 1,11),
ОЧО составила 61,9% по сравнению с 54,9%.
Предварительно
запланированный второй промежуточный анализ ОВ был выполнен после наступления
189 случаев смерти в группе Kd и 209 — в группе Vd. На момент проведения
анализа было зарегистрировано 80% от общего количества случаев, необходимых для
окончательного анализа. Медиана наблюдения составила приблизительно 37 месяцев.
У пациентов в группе Kd по сравнению с пациентами в группе Vd наблюдали
статистически значимое преимущество в отношении ОВ (ОР=0,791; 95% ДИ: 0,65,
0,96; р=0,010).
Фармакокинетика
Всасывание
Сmах и AUC после 2-10 минут
внутривенной инфузии дозы 27 мг/м2 составили 4232 нг/мл и 379 нгꞏч/мл,
соответственно. При многократном введении карфилзомиба в дозах 15 и 20 мг/м2
значения системной экспозиции (AUC) и периода полувыведения на день 1 и
15 или 16 первого цикла терапии были схожими, что свидетельствует об отсутствии
системной кумуляции карфилзомиба. При применении препарата в дозах от 20 до 56
мг/м2 отмечалось дозозависимое увеличение экспозиции.
При 30-минутной инфузии
достигались сходные показатели периода полувыведения и AUC, но Сmах была в 2-3 раза ниже по
сравнению с концентрацией, наблюдаемой при 2-10-минутной инфузии той же дозы.
После 30-минутной инфузии дозы 56 мг/м2 AUC (948 нг-ч/мл) была
примерно в 2,5 раза больше наблюдаемой при инфузии дозы 27 мг/м2, а
Сmах (2079 нг/мл) была ниже по сравнению с инфузией
дозы 27 мг/м2 в течение 2-10 минут.
Распределение
Средний объем
распределения дозы карфилзомиба 20 мг/м2 в равновесном состоянии
составлял 28 л. В экспериментах in vitro связывание карфилзомиба с
белками плазмы крови человека составляло в среднем 97% в диапазоне концентраций
от 0,4 до 4 микромоль.
Биотрансформация
Карфилзомиб быстро и
интенсивно метаболизируется. Основными метаболитами, определяемыми в плазме крови и моче человека и
образующимися in vitro в гепатоцитах человека, были пептидные фрагменты и диол карфилзомиба, что
свидетельствует о том, что расщепление пептидазой и эпоксидный гидролиз
являются основными путями метаболизма. Механизмы, опосредованные цитохромом
Р450, играют незначительную роль в общем метаболизме карфилзомиба. Метаболиты
препарата не обладают известной биологической активностью.
Выведение
После внутривенного
введения в дозах ≥15 мг/м2 карфилзомиб быстро выводился из
системного кровотока с периодом полувыведения ≤1
час в 1-й день 1-го цикла терапии. Системный клиренс варьировал от 151 до 263
л/час и превышал печеночный кровоток, что свидетельствует о том, что
карфилзомиб преимущественно выводится минуя печень. Карфилзомиб подвергается
метаболизму с последующим выведением метаболитов с мочой.
Особые категории
пациентов
Данные популяционного
фармакокинетического анализа указывают на отсутствие влияния возраста, пола или
расы на фармакокинетику карфилзомиба.
Нарушение функции почек
Фармакокинетику
карфилзомиба изучали в двух специальных исследованиях, посвященных нарушению
функции почек.
Первое исследование было
проведено с участием 50 пациентов с множественной миеломой с нормальной
функцией почек (CrCL >80 мл/мин, n=12), нарушением функции
почек легкой степени (CrCL 50-80 мл/мин, n=12), средней степени
(CrCL 30-49 мл/мин, n=10) и тяжелой степени (CrCL <30 мл)/мин, n=8), а также пациентов на
постоянном диализе (n=8). Карфилзомиб в качестве монотерапии вводили внутривенно в
течение от 2 до 10 минут в дозах до 20 мг/м2. Фармакокинетические
данные получали у пациентов после введения дозы 15 мг/м2 в 1-м цикле
и после введения дозы 20 мг/м2 во 2-м цикле. Второе исследование
было проведено с участием 23 пациентов с рецидивирующей множественной миеломой
с клиренсом креатинина ≥75 мл/мин (n=13) и пациентов с
терминальной стадией почечной недостаточности (ТПН), нуждающихся в диализе (n=10). Фармакокинетические
данные получали у пациентов после введения дозы 27 мг/м2в виде
30-минутной инфузии в течение 1-го цикла, день 16, и после введения дозы 56
мг/м2 во 2-ом цикле, день 1.
Результаты обоих
исследований показывают, что состояние функции почек не оказывало заметного
влияния на экспозицию карфилзомиба после однократного или повторного введения.
Среднее геометрическое соотношение AUClast при дозе 15 мг/м2
надень 1 цикла 1 при нарушении функции почек легкой, средней, тяжелой степени и
при постоянном диализе в сравнении с нормальной функцией почек составило
124,36%, 111,07%, 84,73% и 121,72% соответственно. Среднее геометрическое
соотношение AUClast при дозе 27 мг/м2 на день 16 цикла 1
и при дозе 56 мг/м2 на день 1 цикла 2 для ТПН по сравнению с
нормальной функцией почек составило 139,72% и 132,75% соответственно. В первом
исследовании метаболит М14, пептидный фрагмент и наиболее распространенный
циркулирующий метаболит, увеличивался в 2 и 3 раза у пациентов с нарушением
функции почек средней и тяжелой степени, соответственно, и в 7 раз у пациентов,
нуждающихся в диализе (на основании AUClast). Во втором исследовании
экспозиция М14 была выше (приблизительно в 4 раза) у пациентов с ТПН, чем у
пациентов с нормальной функцией почек. Этот метаболит не имеет известной
биологической активности. Серьезные нежелательные явления, связанные с
ухудшением функции почек, чаще встречались у пациентов с исходным нарушением функции
почек (см. раздел «Способ применения и дозировка»).
Нарушение функции печени
В фармакокинетическом
исследовании, включавшем 33 пациента с рецидивирующим или прогрессирующими
злокачественными новообразованиями на поздней стадии (солидные опухоли; n=31 или гематологические
злокачественные новообразования; n=2), имевших нормальную функцию печени (билирубин
≤ верхней границы нормы [ВГН], аспартатаминотрансфераза [ACT] ≤ВГН, n=10), нарушение функции печени легкой степени
(билирубин >1-1,5 х ВГН или ACT >ВГН, но билирубин ≤ВГН, n=14) или нарушение
функции печени средней степени тяжести (билирубин >1,5-3хВГН;
любой уровень ACT, n=9). Фармакокинетика карфилзомиба не изучалась у
пациентов с нарушением функции печени тяжелой степени (билирубин >3хВГН и
любой уровень ACT). Карфилзомиб в качестве монотерапии вводили внутривенно в
течение 30 минут в дозе 20 мг/м2 в дни 1 и 2 и в дозе 27 мг/м2 в
дни 8, 9, 15 и 16 цикла 1. При хорошей переносимости дозу увеличивали до 56
мг/м2, начиная с цикла 2. Исходное состояние функции печени не
оказывало заметного влияния на общую системную экспозицию (AUClast) карфилзомиба после
однократного или повторного введения дозы (среднее геометрическое соотношение
AUClast при дозе 27 мг/м2 в день 16 цикла 1
при нарушении функции печени легкой и средней степени по сравнению с нормальной
функция печени составляло 144,4% и 126,1% соответственно, а при дозе 56 мг/м2
в день 1 цикла 2 составляло 144,7% и 121,1%). Тем не менее, у пациентов с
солидными опухолями с исходным нарушением функции печени легкой или средней
степени была отмечена более высокая частота возникновения нарушений функции
печени, нежелательных явлений ≥3 степени и серьезных нежелательных явлений по
сравнению с пациентами с нормальной функцией печени (см. раздел «Способ
применения и дозировка»).
Карфилзомиб показан для
лечения взрослых пациентов с множественной миеломой в комбинации с
леналидомидом и дексаметазоном, либо только с дексаметазоном, получивших, по
крайней мере, один курс предшествующей терапии (см. раздел «Фармакодинамика»),
Лечение карфилзомибом
должно проводиться под контролем врача, имеющего опыт проведения противоопухолевой
терапии.
Способ применения
Карфилзомиб необходимо
вводить путем внутривенной инфузии. Дозу 20/27 мг/м2 вводят в
течение 10 минут. Дозу 20/56 мг/м2 вводят в течение 30 минут.
Карфилзомиб нельзя
вводить внутривенным струйным или болюсным введением.
Систему для внутривенного
введения следует промывать обычным раствором хлорида натрия или 5% раствором
глюкозы для инъекций непосредственно перед и после введения карфилзомиба.
Не смешивайте карфилзомиб
и не вводите в виде инфузии с другими лекарственными средствами.
Разведение и подготовка к
внутривенному введению
Карфилзомиб является
цитотоксическим агентом. Поэтому следует соблюдать осторожность при обращении и
приготовлении раствора карфилзомиба. Рекомендуется использовать перчатки и
другие защитные средства.
Флаконы карфилзомиба не
содержат антимикробных консервантов и предназначены только для однократного
применения. Следует соблюдать надлежащие требования асептики.
Химическая и физическая
стабильность восстановленных растворов во флаконе, шприце или пакете для
внутривенного вливания была продемонстрирована в течение 24 часов при 2-8°С или в течение 4 часов при 25°С. Время, прошедшее от разведения до введения, не
должно превышать 24 часов.
С микробиологической
точки зрения раствор следует использовать немедленно после приготовления. Если
препарат не используется немедленно, время и условия хранения при использовании
являются ответственностью пользователя и не должны превышать 24 часов при
температуре от 2 до 8°С.
Восстановленный раствор
содержит карфилзомиб в концентрации 2 мг/мл. Полностью прочитайте инструкцию по
приготовлению раствора до разведения.
1. Извлеките флакон из холодильника непосредственно перед применением.
2. Рассчитайте дозу (мг/м2) и необходимое количество
флаконов карфилзомиба с использованием исходной площади поверхности тела (ППТ)
пациента. Пациенты с ППТ более 2,2 м2 должны получать дозу,
основанную на ППТ 2,2 м2. Корректировки дозы не должны проводиться
при изменениях массы тела ≤20%.
3. Используйте только иглу калибра 21 или более (игла с наружным
диаметром 0,8 мм или меньше) для асептического восстановления содержимого
каждого флакона путем медленного введения 29 мл стерильной воды для инъекций
через пробку, направляя раствор на ВНУТРЕННЮЮ СТЕНКУ ФЛАКОНА для минимизации
пенообразования.
4. Аккуратно медленно вращайте и/или переворачивайте флакон в течение
примерно 1 минуты или до полного растворения. НЕ ВСТРЯХИВАТЬ. В случае
пенообразования дайте раствору отстояться во флаконе до тех пор, пока
пенообразование не прекратится (примерно 5 минут) и раствор не станет
прозрачным.
5. Визуально проверьте раствор на наличие посторонних частиц и
изменение цвета перед введением. Восстановленный раствор должен быть прозрачным,
бесцветным и не должен вводиться, если наблюдаются какие-либо изменения цвета
или наличие посторонних частиц.
6. Утилизируйте любой неиспользованный остаток во флаконе.
7. Карфилзомиб можно вводить непосредственно путем внутривенной
инфузии или, как вариант, через пакет для внутривенных вливаний. Запрещено
введение внутривенно струйно или в виде болюса.
8. При введении через пакет для внутривенного вливания используйте
только иглу калибра 21 или более (игла с наружным диаметром не более 0,8 мм)
для извлечения рассчитанной дозы из флакона и разведения в пакете для
внутривенного вливания объемом 50 или 100 мл, содержащем 5% раствор глюкозы для
инъекций.
Режим дозирования
Доза рассчитывается с
использованием исходной ППТ пациента. Пациенты с ППТ более 2,2 м2должны
получать дозу, рассчитанную для ППТ 2,2 м2. Корректировки дозы не
требуется при изменениях массы тела, меньших или равных 20%.
Карфилзомиб в комбинации
с леналидомидом и дексаметазоном
При совместном применении
с леналидомидом и дексаметазоном карфилзомиб вводят в виде 10-минутной
внутривенной инфузии, на протяжении двух последовательных дней, каждую неделю в
течение трех недель (дни 1, 2, 8, 9, 15 и 16), с последующим
перерывом в течение 12 дней (день 17-28), как показано в таблице 1. Каждый
28-дневный период расценивается как один цикл терапии.
Начальная доза
карфилзомиба в дни 1 и 2 цикла 1 составляет 20 мг/м2 (максимальная
доза — 44 мг). При хорошей переносимости доза должна быть увеличена до 27 мг/м2
на день 8 цикла 1 (максимальная доза — 60 мг). Начиная с цикла 13, введение
Карфилзомиба на 8 и 9 день исключается.
Лечение может
продолжаться до прогрессирования заболевания или развития неприемлемой
токсичности.
Лечение карфилзомибом в
сочетании с леналидомидом и дексаметазоном в течение более 18
циклов должно основываться на индивидуальной оценке пользы/риска, так как
данные о переносимости и токсичности карфилзомиба при применении свыше 18
циклов ограничены (см. раздел «Фармакодинамика»).
Леналидомид в сочетании с
карфилзомибом применяется перорально в дозе 25 мг в дни 1-21, а дексаметазон —
перорально или внутривенно в дозе 40 мг в дни 1,8, 15 и 22 каждого 28-дневного
цикла. Следует рассматривать снижение начальной дозы леналидомида в
соответствии с рекомендациями, указанными в действующей инструкции по
медицинскому применению леналидомида, например, для пациентов с исходным
нарушением функции почек. Дексаметазон следует назначать за 30 минут — 4 часа
до введения карфилзомиба.
Таблица 1. Карфилзомиб в
сочетании с леналидомидом и дексаметазоном*
|
Цикл 1
|
|||||||||||
| Неделя 1 | Неделя 2 | Неделя 3 | Неделя 4 |
||||||||
|
День 1 |
День 2 |
Дни 3-7 |
День 8 |
День 9 |
Дни 10-14 |
День 15 |
День 16 |
Дни 17-21 |
День 22 |
Дни 23-28 |
|
| Карфилзомиб (мг/м2) | 20 | 20 | — | 27 | 27 | — | 27 | 27 | — | — | — |
| Дексаметазон (мг) | 40 | — | — | 40 | — | — | 40 | — | — | 40 | — |
| Леналидомид |
25 мг в сутки |
— | — | ||||||||
|
Циклы 2-12
|
|||||||||||
| Неделя 1 | Неделя 2 | Неделя 3 | Неделя 4 | ||||||||
|
День 1 |
День 2 |
Дни 3-7 |
День 8 |
День 9 |
Дни 10-14 |
День 15 |
День 16 |
Дни 17-21 |
День 22 |
Дни 23-28 |
|
| Карфилзомиб (мг/м2) | 27 | 27 | — | 27 | 27 | — | 27 | 27 | — | — | — |
| Дексаметазон (мг) | 40 | — | — | 40 | — | — | 40 | — | — | 40 | — |
| Леналидомид |
25 мг в |
— | — | ||||||||
|
Цикл 13 и все последующие циклы
|
|||||||||||
| Неделя 1 | Неделя 2 |
Неделя 3 |
Неделя 4 |
||||||||
|
День 1 |
День 2 |
Дни 3-7 |
День 8 |
День 9 |
Дни 10-14 |
День 15 |
День 16 |
Дни 17-21 |
День 22 |
Дни 23-28 |
|
| Карфилзомиб (мг/м2) | 27 | 27 | — | — | — | — | 27 | 27 | — | — | — |
| Дексаметазон (мг) | 40 | — | — | 40 | — | — | 40 | — | — | 40 | — |
| Леналидомид |
25 мг в |
— | — |
а Время инфузии составляет
10 минут и остается неизменным на протяжении всего лечения
Карфилзомиб в сочетании с
дексаметазоном
При совместном применении
с дексаметазоном карфилзомиб вводят внутривенно в виде 30-минутной инфузии, в
течение двух последовательных дней, каждую неделю в течение трех недель
(дни 1, 2, 8, 9, 15 и 16), с последующим 12-дневным перерывом (день 17-28),
как показано в таблице 2. Каждый 28-дневный период расценивается как один цикл
терапии.
Начальная доза
Карфилзомиба в дни 1 и 2 цикла 1 составляет 20 мг/м2 (максимальная
доза — 44 мг). При хорошей переносимости доза должна быть увеличена до 56 мг/м2
на день 8 цикла 1 (максимальная доза 123 мг).
Лечение может
продолжаться до прогрессирования заболевания или развития неприемлемой токсичности.
При совместном применении
карфилзомиба только с дексаметазоном, дексаметазон вводят перорально или внутривенно в дозе 20 мг в дни 1, 2, 8, 9,
15, 16, 22 и 23 каждого 28-дневного цикла.
Дексаметазон следует назначать за 30 минут – 4
часа до введения карфилзомиба.
Таблица 2. Карфилзомиб в
сочетании с дексаметазонома
|
Цикл 1 |
||||||||||||
|
Неделя 1 |
Неделя 2 |
Неделя 3 |
Неделя 4 |
|||||||||
|
День 1 |
День 2 |
Дни 3-7 |
День 8 |
День 9 |
Дни 10-14 |
День 15 |
День 16 |
Дни 17-21 |
День 22 |
День 23 |
Дни 24-28 |
|
| Карфилзомиб (мг/м2) | 20 | 20 | — | 56 | 56 | — | 56 | 56 | — | — | — | — |
| Дексаметазон (мг) | 20 | 20 | — | 20 | 20 | — | 20 | 20 | — | 20 | 20 | — |
|
Цикл 2 и все последующие циклы
|
||||||||||||
|
Неделя 1 |
Неделя 2 |
Неделя 3 |
Неделя 4 |
|||||||||
|
День 1 |
День 2 |
Дни 3-7 |
День 8 |
День 9 |
Дни 10-14 |
День 15 |
День 16 |
Дни 17-21 |
День 22 |
День 23 |
Дни 24-28 |
|
| Карфилзомиб (мг/м2) | 56 | 56 | — | 56 | 56 | — | 56 | 56 | — | — | — | — |
| Дексаметазон (мг) | 20 | 20 | — | 20 | 20 | — | 20 | 20 | — | 20 | 20 | — |
а Время инфузии составляет
30 минут и остается неизменным на протяжении всей схемы лечения
Сопутствующие
лекарственные средства
Для снижения риска
реактивации опоясывающего герпеса следует рассмотреть вопрос о проведении
профилактической противовирусной терапии у пациентов, получающих карфилзомиб.
Рекомендуется
профилактика тромбоза у пациентов, получающих карфилзомиб в сочетании с
дексаметазоном или леналидомидом и дексаметазоном; она должна основываться на
оценке основных рисков и клинического состояния пациента. Другие сопутствующие
лекарственные средства, которые могут потребоваться, например, для антацидной
профилактики, описаны в действующей версии инструкций по медицинскому
применению леналидомида и дексаметазона.
Профилактика
обезвоживания, контроль уровня жидкости и электролитов
Перед введением дозы в
цикле 1 необходима адекватная гидратация, особенно у пациентов с высоким риском
развития синдрома лизиса опухоли или нефротоксичности. Все пациенты должны
наблюдаться на предмет наличия признаков гиперволемии, а потребность в
гидратации должна быть адаптирована к индивидуальным потребностям пациента.
Общий объем жидкости может быть скорректирован по клиническим показаниям у
пациентов с исходной сердечной недостаточностью или ее риском (см. раздел «Меры
предосторожности»).
Рекомендуемый режим
гидратации включает как пероральный прием жидкости (30 мл/кг/день в течение 48
часов до дня 1 цикла 1), так и внутривенное введение жидкости (от 250 мл до 500
мл соответствующего раствора для внутривенного введения перед введением каждой
дозы цикла 1). При необходимости, добавляют 250-500 мл жидкости для
внутривенного введения после введения карфилзомиба в цикле 1. При
необходимости, пероральную и/или внутривенную гидратацию следует продолжать в
последующих циклах.
Уровни калия в сыворотке
крови во время лечения карфилзомибом следует контролировать ежемесячно или чаще
при наличии клинических показаний, в зависимости от уровня калия до начала
лечения, применяемой сопутствующей терапии (например, лекарственных средств,
повышающих риск возникновения гипокалиемии) и сопутствующих заболеваний.
Рекомендуемая коррекция
дозы
При развитии токсичности
требуется коррекция режима дозирования карфилзомиба.
Рекомендуемые действия и
модификация дозы представлены в таблице 3. Снижение уровня дозы
представлено в таблице 4.
Таблица 3. Корректировка
дозы во время лечения карфилзомибом
|
Гематологическая токсичность |
Рекомендуемое действие |
|
• Абсолютное количество нейтрофилов <0,5 х 109/л (см. раздел «Меры предосторожности») |
• Отмена назначения — При восстановлении до ≥0,5 х 109/л продолжить лечение в той же дозе • При последующих снижениях до <0,5 х 109/л следовать рекомендациям, описанным выше, и рассмотреть вопрос о снижении дозы на 1 уровень при возобновлении лечения карфилзомибома |
|
• Фебрильная нейтропения • Абсолютное количество нейтрофилов <0,5 х 109/л и температура в полости рта >38,5°С или два последовательных измерения >38,0°С в течение 2 часов |
• Отмена назначения • Если абсолютное количество нейтрофилов возвращается к исходному уровню и лихорадка прекращается, лечение возобновить терапию в той же дозе |
|
• Количество тромбоцитов <10 х 109/л или признаки кровотечения на фоне тромбоцитопении (см. раздел «Меры предосторожности») |
• Отмена назначения — При восстановлении до ≥10 х 109/л и/или достижении контроля кровотечения, возобновить лечение в той же дозе • При последующих снижениях до <10 х 109/л следовать рекомендациям, описанным выше, и рассмотреть вопрос о снижении дозы на 1 уровень при возобновлении лечения карфилзомибома |
| Негематологическая токсичность (почечная) | Рекомендуемое действие |
|
• Креатинин сыворотки крови, в два и более раза превышающий исходный уровень; или • Клиренс креатинина <15 мл/мин (или уменьшение клиренса креатинина до ≤50% от исходного уровня) или потребность в диализе (см. раздел «Меры предосторожности») |
• Отмена назначения и продолжение контроля функции почек (креатинин сыворотки крови или клиренс креатинина) — Следует возобновить лечение карфилзомибом, когда функция почек восстановится в пределах 25% от исходного уровня; следует рассмотреть возможность снижения дозы на 1 уровеньа • Для пациентов на диализе, получающих карфилзомиб, дозу следует вводить после процедуры диализа |
| Другая негематологическая токсичность | Рекомендуемое действие |
|
• Все другие виды негематологической токсичности 3 или 4 степени (см. раздел «Меры предосторожности») |
• Отмена назначения до разрешения или возвращения к исходному уровню • Следует рассмотреть вопрос о возобновлении следующего запланированного лечения со снижением дозы на 1 уровень3 |
а Снижение уровня дозы
представлено в таблице 4.
Таблица 4. Снижение
уровня дозы карфилзомиба
|
Схема |
Доза карфилзомиба |
Первый уровень снижения дозы карфилзомиба |
Второй уровень снижения дозы карфилзомиба |
Третий уровень снижения дозы карфилзомиба |
|
Карфилзомиб, леналидомид и дексаметазон |
27 мг/м2 |
20 мг/м2 |
15 мг/м2 | — |
|
Карфилзомиб и дексаметазон |
56 мг/м2 |
45 мг/м2 |
36 мг/м2 | 27 мг/м2 |
Примечание: время инфузии
карфилзомиба остается неизменным при снижении уровня дозы
а Если симптомы
сохраняются, прекратить лечение карфилзомибом
Особые категории
пациентов
Нарушение функции почек Пациенты с нарушением
функции почек средней или тяжелой степени были включены в исследования
комбинации карфилзомиб-дексаметазон, но были исключены из исследований
комбинаций карфилзомиб-леналидомид. Таким образом, данные для карфилзомиба в
сочетании с леналидомидом и дексаметазоном у пациентов с клиренсом креатинина
(CrCL <50 мл/мин) ограничены. Соответствующее снижение начальной дозы
леналидомида у пациентов с исходным нарушением функции почек следует
рассматривать в соответствии с рекомендациями, содержащимися в инструкции по
медицинскому применению леналидомида.
На основании имеющихся
фармакокинетических данных (см. раздел «Фармакокинетика») не рекомендуется
коррекция начальной дозы карфилзомиба для пациентов с исходным нарушением
функции почек легкой, средней или тяжелой степени или для пациентов на
постоянном диализе. Однако в клинических исследованиях фазы III частота
возникновения нежелательных явлений острой почечной недостаточности была выше у
пациентов с более низким исходным клиренсом креатинина, чем у пациентов с более
высоким исходным клиренсом креатинина.
Функция почек должна
оцениваться в начале лечения и контролироваться не реже одного раза в месяц или
в соответствии с принятыми клиническими рекомендациями, особенно у пациентов со
сниженным исходным клиренсом креатинина (CrCL <30 мл/мин). Следует проводить
соответствующую коррекцию дозы с учетом токсичности (см. таблицу 3). Имеются
ограниченные данные об эффективности и безопасности для пациентов с исходным
клиренсом креатинина <30 мл/мин.
Так как диализный клиренс
концентраций карфилзомиба не изучен, лекарственное средство следует вводить
после процедуры диализа.
Нарушение функции печени
Пациенты с нарушением
функции печени средней или тяжелой степени были исключены из исследований
карфилзомиба в сочетании с леналидомидом и дексаметазоном или только дексаметазоном.
Фармакокинетика
карфилзомиба не оценивалась у пациентов с нарушением функции печени тяжелой
степени. На основании имеющихся фармакокинетических данных не рекомендуется
корректировать начальную дозу пациентам с нарушением функции печени легкой или
средней степени. Однако у пациентов с исходным нарушением функции печени легкой
или средней степени наблюдали более высокую частоту возникновения нарушений
функции печени, нежелательных явлений степени 3 и выше и серьезных
нежелательных явлений, по сравнению с пациентами с нормальной функцией печени
(см. разделы «Фармакокинетика» и «Меры предосторожности»). Необходимо
определить показатели ферментов печени и билирубина в начале лечения и
проверять их ежемесячно во время лечения карфилзомибом, независимо от исходных
значений; следует проводить соответствующую коррекцию дозы с учетом токсичности
(см. таблицу 3). Особое внимание необходимо уделять пациентам с нарушением
функции печени средней и тяжелой степени ввиду весьма ограниченных данных об
эффективности и безопасности для этой популяции.
Пациенты пожилого
возраста
В целом, частота
возникновения определенных нежелательных явлений (включая сердечную
недостаточность) в клинических исследованиях у пациентов старше 75 лет была
выше, чем у пациентов моложе 75 лет (см. раздел «Меры предосторожности»).
Дети
Безопасность и
эффективность карфилзомиба у детей не установлены. Данные отсутствуют.
Серьезные нежелательные реакции, которые могут возникнуть во
время лечения карфилзомибом, включают: сердечную
недостаточность, инфаркт миокарда, остановку
сердца, ишемию миокарда, интерстициальную легочную болезнь, пневмонит, острый
респираторный дистресс-синдром (ОРДС), острую дыхательную недостаточность,
легочную гипертензию, одышку, артериальную гипертензию, включая гипертонический
криз, острую почечную недостаточность, синдром лизиса опухоли (СЛО), реакцию на
инфузию, желудочно-кишечное кровотечение, внутричерепное кровоизлияние,
легочное кровотечение, тромбоцитопению, печеночную недостаточность, реактивацию
вируса гепатита В, синдром обратимой задней энцефалопатии (СОЗЭ),
тромботическую микроангиопатию и тромботическую тромбоцитопеническую
пурпуру/гемолитический уремический синдром (ТТП/ГУС). В клинических исследованиях
карфилзомиба кардиотоксичность и одышка обычно возникали в начале курса лечения
(см. раздел «Меры предосторожности»). Наиболее распространенными нежелательными
реакциями (встречающимися у >20% пациентов) были: анемия, усталость,
тромбоцитопения, тошнота, диарея, гипертермия, одышка, инфекции дыхательных
путей, кашель и нейтропения.
После начала введения
карфилзомиба в дозе 20 мг/м2 доза была увеличена до 27 мг/м2
в исследовании РХ-171-009 и до 56 мг/м2 в исследовании 2011-003 (см.
раздел «Фармакодинамика»). Сравнение нежелательных реакций, происходящих в
группе карфилзомиба и дексаметазона (Kd) исследования 2011-003 по сравнению с
группой карфилзомиба, леналидомида и дексаметазона (KRd) исследования РХ-171-009,
позволяет предположить, что возможна потенциальная дозозависимость для
следующих нежелательных реакций: сердечная недостаточность (Kd 8,2%, KRd 6,4%),
одышка (Kd 30,9%, KRd 22,7%), артериальная гипертензия (Kd 25,9%, KRd 15,8%) и
легочная гипертензия (Kd 1,3%, KRd 0,8%). Наблюдаемые нежелательные явления
классифицированы по системно-органным классам и частоте, указанной как: очень
часто (≥1/10); часто (от ≥1/100 до
<1/10); нечасто (от ≥1/1000 до <1/100); редко (от ≥1/10000 до <1/1000), очень редко (<1/10000);
неизвестно (не может быть оценена на основе имеющихся данных).
Инфекционные и
паразитарные заболевания: очень часто — пневмония, инфекция дыхательных путей; часто —
сепсис, инфекция легких, грипп, опоясывающий лишай (частота рассчитана на
основании данных клинических исследований, в которых большинство пациентов
использовали профилактические меры), инфекция мочевыводящих путей, бронхит,
гастроэнтерит, вирусная инфекция, назофарингит, ринит; нечасто —
псевдомембранозный колит, вызванный Clostridium difficile, цитомегаловирусная
инфекция, реактивация вируса гепатита В.
Нарушения со стороны
иммунной системы: нечасто — гиперчувствительность к лекарственному средству.
Нарушения со стороны
крови и лимфатической системы: очень часто — тромбоцитопения, нейтропения,
анемия, лимфопения, лейкопения; часто — фебрильная нейтропения; нечасто — ГУС;
редко — ТТП, тромботическая микроангиопатия.
Нарушения со стороны
обмена веществ и питания: очень часто — гипокалиемия, гипергликемия, снижение
аппетита; часто — обезвоживание, гиперкалиемия, гипомагниемия, гипонатриемия,
гиперкальциемия, гипокальциемия, гипофосфатемия, гиперурикемия,
гипоальбуминемия; нечасто — синдром лизиса опухоли.
Нарушения психики: очень часто —
бессонница; часто — тревожность, спутанность сознания.
Нарушения со стороны
нервной системы: очень часто — головокружение, периферическая невропатия, головная
боль; часто — парестезия, гипестезия; нечасто — внутричерепное кровоизлияние,
острое нарушение мозгового кровообращения; редко — СОЗЭ.
Нарушения со стороны
органов зрения: часто — катаракта, помутнение зрения.
Нарушения со стороны
органов слуха и лабиринтные нарушения: часто тиннитус.
Нарушения со стороны
сердца:
часто — сердечная недостаточность, инфаркт миокарда, фибрилляция предсердий, тахикардия, снижение
фракции выброса, пальпитация; нечасто — остановка сердечной деятельности,
кардиомиопатия, миокардиальная ишемия, перикардит, перикардиальный выпот.
Нарушения со стороны
сосудов:
очень часто — гипертензия; часто — тромбоз глубоких вен, гипотония, приливы;
нечасто — гипертонический криз, кровотечение; редко — гипертоническая болезнь.
Нарушения со стороны
дыхательной системы, органов грудной клетки и средостения: очень часто — одышка, кашель; часто —
тромбоэмболия легочной артерии, отек легких, носовое кровотечение, боль в
ротоглотке, дисфония, свистящее дыхание, легочная гипертензия; нечасто — ОРДС,
острая дыхательная недостаточность, легочное кровотечение, интерстициальное
заболевание легких, пневмонит.
Нарушения со стороны
желудочно-кишечного тракта: очень часто — рвота, диарея, запор, боль в животе, тошнота;
часто — кровотечение из желудочно-кишечного тракта, диспепсия, зубная боль;
нечасто — перфорация желудочно-кишечного тракта.
Нарушения со стороны
печени и желчевыводящих путей: часто — увеличение уровня
аланинаминотрансферазы, увеличение уровня аспартатаминотрансферазы, повышенный
уровень гамма-глутамилтрансферазы, гипербилирубинемия; нечасто — печеночная недостаточность,
холестаз.
Нарушения со стороны кожи
и подкожных тканей: часто — сыпь, зуд, эритема, гипергидроз; редко —
ангионевротический отек.
Нарушения со стороны
скелетно-мышечной и соединительной ткани: очень часто — боль в спине, артралгия, боль в конечностях,
мышечные спазмы; часто — костно-мышечная боль, боль в области грудной клетки
при заболеваниях опорно-двигательного аппарата, боль в костях, миалгия,
мышечная слабость.
Нарушения со стороны
почек и мочевыводящих путей: очень часто — повышенный уровень креатинина в
крови; часто — острая почечная недостаточность, почечная недостаточность,
нарушение функции почек, снижение клиренса креатинина в почках.
Общие расстройства и
нарушения в месте введения: очень часто — пирексия, периферический отек, астения,
усталость, озноб; часто — боль в грудной клетке, боль, реакции в месте
проведения инфузии, гриппоподобное заболевание, чувство общего недомогания;
нечасто — синдром полиорганной дисфункции.
Влияние на результаты
лабораторных и инструментальных исследований: часто — повышенное содержание
С-реактивного белка, повышенное содержание мочевой кислоты в крови.
Травмы, интоксикации и
осложнения манипуляций: часто — реакция, связанная с инфузией.
Описание отдельных
нежелательных реакций
Сердечная
недостаточность, инфаркт миокарда и ишемия миокарда
В клинических
исследованиях карфилзомиба сердечная недостаточность была отмечена примерно у
7% пациентов (у 5% пациентов отмечалась степень ≥3), инфаркт миокарда был
отмечен примерно у 2% пациентов (у 1,5% пациентов отмечалась степень ≥3), а ишемия миокарда — примерно у 1% пациентов (у <1%
пациентов отмечалась степень ≥3). Эти явления
обычно возникали на ранних стадиях курса терапии карфилзомибом (<5 циклов).
Клиническое ведение сердечных заболеваний во время лечения карфилзомибом
описано в разделе «Меры предосторожности».
Одышка
Одышка была
зарегистрирована примерно у 30% пациентов в клинических исследованиях
карфилзомиба. Большинство нежелательных реакций, связанных с одышкой,
были несерьезными (у <5% пациентов отмечалась
степень ≥3), они купировались, редко приводили
к прекращению лечения и возникали в начале курса
(<3 циклов). Клиническое ведение одышки во время лечения карфилзомибом
описано в разделе «Меры предосторожности».
Гипертензия, включая
гипертонический криз
Гипертонические кризы
(экстренное состояние или гипертоническая болезнь) произошли после введения
карфилзомиба. Некоторые из данных явлений имели смертельный исход. В
клинических исследованиях нежелательные явления гипертензии наблюдали приблизительно
у 20% пациентов, у 7,5% пациентов регистрировали гипертензию ≥3 степени,
но гипертонические кризы наблюдали у <0,5% пациентов. Частота возникновения
нежелательных явлений гипертензии была одинаковой среди пациентов с
гипертензией в анамнезе или без нее. Клиническое ведение гипертензии во время
лечения карфилзомибом описано в разделе «Меры предосторожности».
Тромбоцитопения
Тромбоцитопению
регистрировали примерно у 34% пациентов в клинических исследованиях
карфилзомиба, и примерно у 20% пациентов были явления ≥3 степени.
Карфилзомиб вызывает тромбоцитопению путем ингибирования образования
тромбоцитов в мегакариоцитах, что приводит к классической циклической
тромбоцитопении с самыми низкими уровнями тромбоцитов на 8 или 15 день каждого
28-дневного цикла, восстановление до исходного уровня обычно происходит к
началу следующего цикла. Клиническое ведение тромбоцитопении во время лечения
карфилзомибом описано в разделе «Меры предосторожности».
Венозные
тромбоэмболические явления
Сообщалось о случаях
венозных тромбоэмболических явлений, в том числе тромбоза глубоких вен и
тромбоэмболии легочной артерии со смертельными исходами, у пациентов,
получавших карфилзомиб (см. раздел «Меры предосторожности»). Общая частота
возникновения венозных тромбоэмболических явлений была выше в группах
карфилзомиба в двух исследованиях фазы 3. В исследовании РХ-171-009 частота
возникновения венозных тромбоэмболических явлений составила 15,6% в группе KRd
и 9,0% в группе Rd. Венозные тромбоэмболические явления >3 степени отмечали
у 5,6% пациентов в группе KRd и у 3,9% пациентов в группе Rd. В исследовании
2011 003 частота возникновения венозных тромбоэмболических явлений составила
12,5% в группе Kd и 3,3% в группе бортезомиба с дексаметазоном (Vd). Венозные
тромбоэмболические явления ≥3 степени отмечали у 3,5% пациентов в группе
Kd и у 1,8% пациентов в группе Vd.
Печеночная
недостаточность
Сообщалось о случаях
печеночной недостаточности, в том числе со смертельным исходом, у <1%
пациентов в клинических исследованиях карфилзомиба. Клиническое ведение
печёночной недостаточности во время лечения карфилзомибом описано в разделе
«Меры предосторожности».
Периферическая невропатия
В рандомизированном
открытом многоцентровом исследовании пациентов, получавших карфилзомиб с дозировкой
20/56 мг/м2 в течение 30-минутной инфузии в сочетании с
дексаметазоном (Kd, n=464) по сравнению с комбинацией бортезомиба и дексаметазона
(Vd, n=465), явления периферической невропатии 2 степени и выше
были зарегистрированы у 7% пациентов с рецидивирующей множественной миеломой в
группе Kd, по сравнению с 35% в группе Vd во время запланированного анализа ОВ.
Пожилые пациенты (в возрасте ≥ 75 лет)
В целом, частота
возникновения определенных нежелательных явлений (включая нарушения сердечного
ритма, сердечную недостаточность (см. раздел «Меры предосторожности»), одышку,
лейкопению и тромбоцитопению) в клинических исследованиях карфилзомиба была
выше среди пациентов в возрасте >75 лет по сравнению с пациентами моложе 75
лет.
Сообщение о нежелательных
реакциях
Важно сообщать о
подозреваемых нежелательных реакциях после регистрации лекарственного средства
с целью обеспечения непрерывного мониторинга соотношения «польза-риск» при его применении.
В случае возникновения
нежелательных реакций, в том числе, не указанных в инструкции по
медицинскому применению, пациентам следует обратиться к врачу.
Медицинским работникам
рекомендуется сообщать о любых подозреваемых нежелательных реакциях в Республиканское
унитарное предприятие «Центр экспертиз и испытаний в здравоохранении» www.rceth.by.
Повышенная
чувствительность к карфилзомибу или к любому из вспомогательных веществ,
указанных в разделе «Состав».
Женщины в период грудного
вскармливания (см. раздел «Фертильность, беременность и лактация».
В настоящее время нет
достаточных данных для того, чтобы сделать выводы о безопасности доз,
превышающих те, которые были оценены в клинических исследованиях. После
ошибочного введения 200 мг карфилзомиба сообщалось об остром развитии озноба,
артериальной гипотензии, почечной недостаточности, тромбоцитопении и
лимфопении.
Не существует известных
специфических антидотов при передозировке карфилзомибом. В случае передозировки
пациент должен находиться под наблюдением, особенно в отношении нежелательных
реакций на карфилзомиб, перечисленных в разделе «Побочное действие».
Поскольку карфилзомиб
назначают в комбинации с другими лекарственными средствами, следует
ознакомиться с их инструкциями по медицинскому применению до начала лечения
карфилзомибом. Поскольку в сочетании с карфилзомибом можно использовать
леналидомид, необходимо уделить особое внимание связанным с этим лекарственным
средством требованиям к диагностике и предупреждению беременности (см. раздел
«Фертильность, беременность и лактация»).
Нарушения со стороны
сердца
После введения
карфилзомиба имели место случаи возникновения или усугубления сердечной недостаточности
(например, застойная сердечная недостаточность, отек легких, сниженная фракция
выброса левого желудочка), ишемии и инфаркта миокарда. Сообщалось об остановке
сердца с летальным исходом в течение суток после введения карфилзомиба, а также
о летальных исходах, связанных с сердечной недостаточностью и инфарктом
миокарда (см. раздел «Побочное действие»).
Хотя перед началом цикла
1 требуется адекватная гидратация, следует проводить контроль всех пациентов на
наличие признаков гиперволемии, особенно пациентов с риском возникновения
сердечной недостаточности. Общий объем жидкости может быть скорректирован в
соответствии с клиническими показаниями у пациентов с исходной сердечной
недостаточностью или с риском ее возникновения (см. раздел «Способ применения и
дозировка»).
При развитии
нежелательных явлений со стороны сердца 3 или 4 степени необходимо отменить
карфилзомиб до разрешения явлений и рассмотреть вопрос о возобновлении
применения карфилзомиба в дозе, сниженной на 1 дозовый уровень на основании
оценки пользы/риска (см. раздел «Способ применения и дозировка»).
Риск возникновения
сердечной недостаточности увеличивается у пожилых пациентов (≥75 лет).
Риск возникновения
сердечной недостаточности также увеличивается у пациентов азиатского происходжения.
Рекомендуется провести
тщательную оценку факторов риска сердечно-сосудистых заболеваний до начала
лечения.
Пациенты с сердечной
недостаточностью III и IV функциональных классов по классификации Нью-Йоркской
кардиологической ассоциации (NYHA), недавним инфарктом миокарда в анамнезе и
нарушениями проводимости, не контролируемыми лекарственными средствами, не включались
в клинические исследования. Эти пациенты могут подвергаться большему риску
возникновения осложнений со стороны сердца. Пациенты с признаками или
симптомами сердечной недостаточности III или IV функциональных классов по
классификации NYHA, инфарктом миокарда в анамнезе (в последние 4 месяца), а
также пациенты с неконтролируемой стенокардией или аритмией должны пройти
комплексное кардиологическое обследование до начала лечения карфилзомибом. Это
обследование должно оптимизировать состояние пациента, причем особое внимание
следует уделять контролю артериального давления и контролю гидратации.
Впоследствии пациенты
должны проходить лечение с осторожностью и оставаться под пристальным
наблюдением.
Электрокардиографические
изменения
В клинических исследованиях
сообщали о случаях удлинения интервала QT. Нельзя исключить влияние
карфилзомиба на интервал QT.
Легочная токсичность
ОРДС, острая дыхательная
недостаточность и острое диффузное инфильтративное заболевание легких, такое
как пневмонит и интерстициальная болезнь легких, развивались у пациентов,
получавших карфилзомиб. Некоторые из этих состояний имели смертельный исход.
Оцените явление и приостановите применение карфилзомиба до его разрешения, а
также определите, нужно ли возобновлять лечение карфилзомибом на основе оценки
пользы/риска (см. раздел «Способ применения и дозировка»).
Легочная гипертензия
У пациентов, получавших
карфилзомиб, регистрировали случаи легочной гипертензии. Некоторые из данных
явлений имели смертельный исход. Проводите соответствующую оценку. При легочной
гипертензии приостановите прием карфилзомиба до выздоровления или возвращения к
исходному уровню и определите, следует ли возобновлять применение карфилзомиба
на основе оценки пользы/риска (см. раздел «Способ применения и дозировка»).
Одышка
Имелись частые сообщения
об одышке у пациентов, леченных карфилзомибом. Оцените одышку на предмет
исключения сердечно-легочных заболеваний, включая сердечную недостаточность и
легочные синдромы. При одышке 3 или 4 степени приостановите прием карфилзомиба
до разрешения симптомов или возврата к исходному состоянию и определите,
следует ли возобновлять прием карфилзомиба на основе оценки пользы/риска (см.
разделы «Способ применения и дозировка» и «Побочное действие»).
Артериальная гипертензия
При применении
карфилзомиба отмечали явления артериальной гипертензии, в том числе
гипертонические кризы. Некоторые из данных явлений имели смертельный исход.
Рекомендуется контроль артериальной гипертензии до начала и во время лечения.
Всем пациентам следует проводить регулярный контроль артериального давления во
время лечения карфилзомибом и получать необходимое лечение. Если артериальную
гипертензию невозможно контролировать, то следует уменьшить дозу карфилзомиба.
При гипертоническом
кризе следует приостановить применение карфилзомиба
до разрешения симптомов или возврата к исходному состоянию и определить, следует ли возобновлять применение карфилзомиба
на основе оценки пользы/риска (см. раздел «Способ применения и дозировка»).
Острая почечная
недостаточность
Сообщалось о случаях
острой почечной недостаточности у пациентов, получавших карфилзомиб. Некоторые
из данных явлений имели смертельный исход. Острая почечная недостаточность чаще
отмечалась у пациентов с прогрессирующей рецидивирующей и рефрактерной
множественной миеломой, получавших монотерапию карфилзомибом. В клинических
исследованиях фазы III частота возникновения нежелательных явлений острой
почечной недостаточности была выше у пациентов с более низким исходным
клиренсом креатинина, чем у пациентов с более высоким исходным клиренсом
креатинина.
У большинства пациентов
клиренс креатинина был стабильным с течением времени. Функция почек должна
контролироваться не реже одного раза в месяц или в соответствии с принятыми
клиническими рекомендациями, особенно у пациентов со сниженным исходным
клиренсом креатинина. При необходимости следует уменьшить дозу или
приостановить применение препарата (см. раздел «Способ применения и
дозировка»).
Синдром лизиса опухоли
Сообщалось о случаях СЛО,
в том числе со смертельным исходом, у пациентов, получавших карфилзомиб.
Пациенты с высокой опухолевой нагрузкой должны рассматриваться как подверженные
большему риску возникновения СЛО. Убедитесь, что пациенты получили достаточную
гидратацию перед введением карфилзомиба во время цикла 1 и в последующих циклах
по мере необходимости. Для пациентов с высоким риском развития СЛО следует
рассмотреть прием лекарственных средств, снижающих уровень мочевой кислоты.
Признаки СЛО во время лечения необходимо контролировать, включая регулярное
измерение электролитов в сыворотке крови, и незамедлительно реагировать на них.
Приостановите применение карфилзомиба до разрешения СЛО (см. раздел «Способ
применения и дозировка»).
Инфузионные реакции
Инфузионные реакции, в
том числе жизнеугрожающие, были зарегистрированы у пациентов, которые получали
карфилзомиб. Симптомы могут включать лихорадку, озноб, артралгию, миалгию,
покраснение лица, отек лица, рвоту, слабость, одышку, гипотонию, обморок,
стеснение в груди или стенокардию. Эти реакции могут развиваться немедленно или
в течение 24 часов после введения карфилзомиба.
Дексаметазон следует
вводить до карфилзомиба, чтобы уменьшить частоту возникновения и тяжесть
реакций (см. раздел «Способ применения и дозировка»).
Кровотечения и
тромбоцитопения
Случаи кровотечений
(например, желудочно-кишечное, легочное и внутричерепное), часто связанные с
тромбоцитопенией, были зарегистрированы у пациентов, которых лечили
карфилзомибом. Некоторые из данных явлений имели смертельный исход (см. раздел
«Побочное действие»).
Карфилзомиб вызывает
тромбоцитопению с минимальными уровнями тромбоцитов, наблюдаемыми на 8-й или
15-й день каждого 28-дневного цикла, с восстановлением до исходного уровня к
началу следующего цикла. Количество тромбоцитов следует часто контролировать во
время лечения карфилзомибом. При необходимости следует снизить дозу или
прекратить применение (см. раздел «Способ применения и дозировка»).
Венозные
тромбоэмболические явления
Сообщалось о случаях
венозных тромбоэмболических явлении, в том числе тромбоза глубоких вен и тромбоэмболии легочной артерии со смертельными
исходами, у пациентов, получавших карфилзомиб.
Пациенты с известными
факторами риска тромбоэмболии, включая тромбоз в анамнезе, должны находиться
под пристальным наблюдением. Необходимо предпринять меры, чтобы попытаться
минимизировать все модифицируемые факторы риска (например, курение,
артериальная гипертензия и гиперлипидемия). Следует соблюдать осторожность при
одновременном назначении других средств, которые могут увеличить риск тромбоза
(например, эритропоэтических средств или заместительной гормональной терапии).
Пациентам и врачам следует проявлять настороженность в отношении признаков и
симптомов тромбоэмболии. Пациентам следует рекомендовать обратиться за
медицинской помощью, если у них появляются такие симптомы, как одышка, боль в
груди, кровохарканье, отек или боль в руках или ногах.
Следует рассмотреть
проведение тромбопрофилактики на основе индивидуальной оценки пользы/риска.
Гепатотоксичность
Сообщалось о случаях
печеночной недостаточности, в том числе со смертельным исходом. Карфилзомиб
может вызвать повышение уровня трансаминаз в сыворотке крови. При необходимости
уменьшите или отмените дозирование согласно рекомендациям (см. раздел «Способ
применения и дозировка»). Следует контролировать уровень ферментов печени и
билирубина в начале лечения, а затем ежемесячно во время лечения карфилзомибом,
независимо от исходных значений.
Тромботическая
микроангиопатия
Явления тромботической
микроангиопатии, включая ТТП/ГУС, были зарегистрированы у пациентов, получавших
карфилзомиб. Некоторые из них имели смертельный исход. Необходимо
контролировать признаки и симптомы ТТП/ГУС. При подозрении на развитие этих
состояний прекратите назначение карфилзомиба и оцените наличие ТТП/ГУС у
пациентов. Если диагноз ТТП/ГУС исключен, то лечение карфилзомибом можно
возобновить. Безопасность возобновления лечения карфилзомибом у пациентов,
ранее перенесших ТТП/ГУС, не известна.
Синдром обратимой задней
энцефалопатии
У пациентов, получавших
карфилзомиб, были зарегистрированы явления СОЗЭ. СОЗЭ, ранее называемый
синдромом обратимой задней лейкоэнцефалопатии, представляет собой редкое
неврологическое нарушение, которое может проявляться судорогами, головной
болью, заторможенностью, спутанностью сознания, слепотой, изменением уровня
сознания, а также другими зрительными и неврологическими расстройствами, наряду
с артериальной гипертензией. Этот диагноз подтверждается данными
нейрорентгеновской визуализации. Если подозревается СОЗЭ, то лечение
карфилзомибом необходимо прекратить. Безопасность возобновления лечения
карфилзомибом у пациентов, ранее перенесших СОЗЭ, не известна.
Реактивация вируса
гепатита В (ВГВ)
У пациентов, получавших
карфилзомиб, были зарегистрированы явления реактивации вируса гепатита В (ВГВ).
До начала лечения
карфилзомибом все пациенты должны быть обследованы на ВГВ. Для пациентов с
положительной серологией ВГВ следует рассмотреть вопрос о проведении
профилактики с применением противовирусных препаратов. Следует проводить
контроль на предмет клинических и лабораторных признаков реактивации ВГВ во
время и после окончания лечения. При необходимости следует проконсультироваться
со специалистами по лечению инфекции ВГВ. Безопасность возобновления применения
карфилзомиба после адекватного контроля реактивации ВГВ не известна. Поэтому
возобновление терапии следует обсудить со
специалистами по лечению ВГВ.
Прогрессирующая
мультифокальная лейкоэнцефалопатия
Сообщалось о явлениях
прогрессирующей мультифокальной лейкоэнцефалопатии (ПМЛ) у пациентов,
получавших карфилзомиб, которые ранее проходили иммуносупрессивную терапию или
одновременно с ней.
Необходимо контролировать
пациентов, получающих карфилзомиб, на наличие любых новых или усугубляющихся
неврологических, когнитивных или поведенческих признаков и симптомов, которые
позволяют подозревать ПМЛ при проведении дифференциальной диагностики нарушений
ЦНС.
Если подозревается
наличие ПМЛ, дальнейшее назначение должно быть приостановлено до тех пор, пока
специалист не исключит наличие ПМЛ с помощью подходящего диагностического
исследования. Если наличие ПМЛ подтверждается, то необходимо прекратить лечение
карфилзомибом.
Контрацепция
Пациенты женского пола,
способные к деторождению (и/или их партнеры), должны применять эффективные
средства контрацепции в течение лечения и в течение одного месяца после него.
Пациенты мужского пола должны применять эффективные средства контрацепции во
время лечения и в течение 3 месяцев после лечения, если их партнерша беременна
или детородного возраста и не применяет эффективные средства контрацепции (см.
раздел «Фертильность, беременность и лактация»). Карфилзомиб может снизить
эффективность оральных контрацептивов (см. раздел «Взаимодействие с другими
лекарственными средствами и иные формы взаимодействия»).
Вспомогательные вещества
Данное лекарственное
средство содержит до 0,3 ммоль (7 мг) натрия на миллилитр восстановленного
раствора. Это следует принимать во внимание при применении у пациентов,
находящихся на диете с контролируемым потреблением натрия.
Контрацепция
Пациенты женского пола
детородного возрастаю, проходящие лечение карфилзомибом (и/или их партнеры),
должны применять эффективные средства контрацепции в течение лечения и в
течение одного месяца после него.
Не исключено, что
эффективность оральных контрацептивов может быть снижена во время лечения
карфилзомибом (см. раздел «Взаимодействие с другими лекарственными средствами и
иные формы взаимодействия»). Кроме того, из-за повышенного риска венозных
тромбоэмболических осложнений, связанных с карфилзомибом, женщинам следует
избегать использования гормональных контрацептивов, которые ассоциированы с
риском развития тромбоза во время лечения карфилзомибом (см. разделы «Меры
предосторожности» и «Побочное действие»). Если пациентка в настоящее время
использует оральные контрацептивы или гормональный метод контрацепции,
связанные с риском тромбоза, необходимо перевести ее на альтернативный метод
эффективной контрацепции.
Пациенты мужского пола
должны применять эффективные средства контрацепции во время и в течение 3
месяцев после лечения, если их партнерша беременна или обладает детородным
потенциалом и не применяет эффективные средства контрацепции.
Беременность
Данные о применении
карфилзомиба у беременных женщин отсутствуют.
Исследования на животных
показали токсическое воздействие на репродуктивную функцию.
На основании механизма
действия и результатов исследования на животных можно сделать
вывод, что карфилзомиб может причинить вред плоду при применении
беременной женщиной. Карфилзомиб может применяться во
время беременности только в том случае, если потенциальная польза превышает
потенциальный риск для плода. Если карфилзомиб применяется при беременности или
если в период лечения данным лекарственным средством у пациентки наступает
беременность, ее необходимо поставить в известность о потенциальной опасности
для плода.
Леналидомид структурно
родственен талидомиду. Талидомид является известным активным тератогенным
веществом для человека, вызывающим тяжелые опасные для жизни врожденные пороки
развития. При приеме леналидомида во время беременности ожидается тератогенное
воздействие леналидомида на человека. Условия Программы по предупреждению
беременности для леналидомида должны выполняться для всех пациентов, если нет
надежных доказательств того, что пациентка не имеет детородного потенциала.
Пожалуйста, обратитесь к действующей версии инструкции по медицинскому
применению леналидомида.
Лактация
Неизвестно, выделяется ли
карфилзомиб или его метаболиты в грудное молоко. Исходя из его
фармакологических свойств, нельзя исключать риск для грудного ребенка.
Следовательно, в качестве меры предосторожности, грудное вскармливание
противопоказано во время и в течение не менее 2 дней после лечения
карфилзомибом.
Фертильность
Исследования фертильности
на животных не проводились.
Карфилзомиб оказывает
незначительное влияние на способность управлять транспортными средствами и
работу с механизмами.
В клинических
исследованиях наблюдали усталость, головокружение, обморок, помутнение зрения,
сонливость и/или падение артериального давления. Пациентам, проходящим лечение
карфилзомибом, следует рекомендовать отказаться от управления транспортными
средствами или работы с механизмами в случае возникновения каких-либо из этих
симптомов.
Карфилзомиб в основном
метаболизируется через пептидазную и эпоксидгидролазную активность, и в
результате фармакокинетический профиль карфилзомиба вряд ли будет затронут
совместным применением ингибиторов и индукторов цитохрома Р450.
Исследования in vitro
показали, что карфилзомиб не индуцирует человеческий CYP3A4 в культивируемых
гепатоцитах человека. Клиническое исследование с пероральным приемом мидазолама
в качестве пробы CYP3A, проведенного с применением 27 мг/м2
карфилзомиба (инфузия в течение 2-10 минут), продемонстрировало, что
фармакокинетика мидазолама не зависела от сопутствующего введения карфилзомиба,
что указывает на то, что ингибирование метаболизма субстратов CYP3A4/5
карфилзомибом не ожидается, и что он не является индуктором CYP3A4 у человека.
Не было проведено клинических исследований с применением дозы 56 мг/м2.
Однако неизвестно, является ли карфилзомиб индуктором CYP1A2, 2С8, 2С9, 2С19 и
2В6 в терапевтических концентрациях. Следует соблюдать осторожность при
сочетании карфилзомиба с лекарственными средствами, которые являются субстратами
этих ферментов, такими как оральные контрацептивы. Должны быть приняты
эффективные меры по предотвращению беременности (см. раздел «Фертильность,
беременность и лактация», а также актуальную инструкцию по
медицинскому применению леналидомида); если пациентка использует оральные контрацептивы, следует использовать
альтернативный эффективный метод контрацепции.
Карфилзомиб не ингибирует
CYP1А2, 2В6, 2С8, 2С9, 2С19 и 2D6 in
vitro и поэтому не ожидается, что он влияет на системное воздействие лекарственных
средств, которые являются субстратами этих ферментов, в результате их
ингибирования.
Карфилзомиб является
субстратом Р-гликопротеина (P-gp), но не BCRP. Однако, учитывая, что
карфилзомиб вводится внутривенно и интенсивно метаболизируется, фармакокинетический
профиль карфилзомиба вряд ли будет подвержен влиянию ингибиторов или индукторов
P-gp или BCRP. In vitro, при концентрациях (3 мкМ) ниже, чем ожидаемые
при терапевтических дозах, карфилзомиб ингибирует эффлюксный транспорт
дигоксина, субстрата P-gp, на 25%. Следует соблюдать осторожность при сочетании
карфилзомиба с субстратами P-gp (например, дигоксином, колхицином).
In vitro карфилзомиб ингибирует
ОАТР1В1 с IC50=2,01 мкМ, тогда как неизвестно, может ли карфилзомиб
ингибировать другие переносчики ОАТР1ВЗ, ОАТ1, ОАТЗ, ОСТ2 и BSEP на
системном уровне. Карфилзомиб не ингибирует UGT2B7 человека, но ингибирует
UGT1A1 человека с IC50=5,5 мкМ. Тем не менее, учитывая быстрое выведение
карфилзомиба, особенно быстрое снижение системной концентрации через 5 минут
после окончания инфузии, риск клинически значимых взаимодействий с субстратами
ОАТР1В1 и UGT1A1, вероятно, низок.
Несовместимость
Учитывая отсутствие
исследований совместимости, смешивание данного лекарственного средства с
другими средствами не допускается.
Порошок Карфилзомиб для
приготовления раствора для инфузий нельзя смешивать с раствором натрия хлорида
9 мг/мл (0,9%) для инъекций.
3 года.
Не применять по истечении
срока годности, указанного на упаковке.
Хранить при температуре
от 2 до 8 °C. Хранить в недоступном для детей месте.
По 60 мг лекарственного
средства во флаконах вместимостью 50 мл, укупоренных пробкой резиновой с двумя
прорезями и обкатанных алюмопластиковым колпачком с отщелкивающейся крышечкой
из пластмассы цвета слоновой кости.
По 1 флакону в пачке из
картона вместе с инструкцией по медицинскому применению.
Информация о производителе (заявителе):
СООО «НАТИВИТА»
Республика Беларусь,
211361, Витебская область, г.п. Бешенковичи, ул. Строителей, 3.
Тел./факс: +375213163164
E-mail: info@nativita.com
Информацию о
нежелательных реакциях направлять на электронный адрес: pv@nativita.com
Кипролис (Kyprolis)
💊 Состав препарата Кипролис
✅ Применение препарата Кипролис
Описание активных компонентов препарата
Кипролис
(Kyprolis)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2022.07.13
Владелец регистрационного удостоверения:
Код ATX:
L01XG02
(Карфилзомиб)
Лекарственная форма
| Кипролис |
Лиофилизат д/пригот. р-ра д/инф. 60 мг: фл. 1 шт. рег. №: ЛП-003538 |
Форма выпуска, упаковка и состав
препарата Кипролис
Лиофилизат для приготовления раствора для инфузий в виде лиофилизата или порошка от белого до желтоватого цвета, свободного от видимых включений; восстановленный раствор: прозрачный раствор от бесцветного до светло-желтого цвета, свободный от видимых включений.
Вспомогательные вещества: сульфобутиловый эфир бетадекс натрия (сульфобутиловый эфир бета-циклодекстрина) — 3090 мг, лимонная кислота — 59.4 мг, натрия гидроксид (для регулирования pH).
Флаконы стеклянные вместимостью 50 мл (1) — контейнеры пластиковые жесткие (1) — пачки картонные×.
× на каждую пачку наклеивают две прозрачные защитные этикетки — контроль первого вскрытия, имеющие продольную цветную полосу.
Фармакологическое действие
Противоопухолевое средство. Представляет собой тетрапептидэпоксикетонный ингибитор протеасомы, селективно и необратимо связывающийся с N-терминальным треонином активных центров основной протеолитической субъединицы 20S, входящей в состав протеасомы 26S и не оказывает, либо оказывает незначительное влияние на протеазы других классов.
Карфилзомиб показал антипролиферативный и проапоптотический эффекты в доклинических моделях гемобластозов. У животных карфилзомиб ингибировал активность протеасомы в крови и тканях и замедлял опухолевый рост в моделях множественной миеломы. В экспериментах in vitro было показано, что карфилзомиб характеризуется минимальной нейротоксичностью и минимальной реактивностью в отношении непротеасомных протеаз.
В/в введение карфилзомиба приводило к подавлению химотрипсиноподобной активности (CT-L) протеасомы, измеряемой в крови через 1 час после введения первой дозы препарата. Введение в дозах ≥15мг/м2 вызывало устойчивое (≥80%) ингибирование CT-L активности протеасомы.
Дополнительно, введение карфилзомиба в дозе 20 мг/м: приводило к ингибированию латентного мембранного белка 2 типа (LMP2) и субъединиц мультикаталитического эндопептидазоподобного комплекса 1 (МЕСL1) иммунопротеасом в диапазоне от 26% до 32% и от 41% до 49% соответственно. Ингибирование протеасомы сохранялось 48 ч и более после введения первой дозы карфилзомиба при его введении каждую неделю. Комбинированное применение с леналидомидом и дексаметазоном не оказывало влияния на выраженность ингибирования протеасомы.
При применении более высокой дозы — 56 мг/м2, отмечалось не только более выраженное ингибирование субъединиц CT-L(≥90%), по сравнению с дозами 15-20 мг/м2, но также и более выраженное ингибирование других субъединиц протеасом (LMP7, МЕСL1 и LMP2). Ингибирование субъединиц LMP7, МЕСL1 и LMP2 при применении карфилзомиба в дозе 56 мг/м2 увеличилось примерно на 8%, 23% и 34%, соответственно, по сравнению с дозами 15-20 мг/м2. Уровень ингибирования протеасом был эквивалентным при режиме введения в виде 2-10-минутной и 30-минутной инфузии для обеих исследованных доз 20 и 36 мг/м2.
Фармакокинетика
После в/в введения карфилзомиба в дозе 27 мг/м2 в течение 2-10 мин Cmax и AUC составляли 4232 мг/мл и 379 нг×ч/мл, соответственно. При многократном введении в дозах 15 и 20 мг/м2, значения системной экспозиции (AUC) и T1/2 в 1 и 15 или 16 дни первого цикла терапии были аналогичны, что свидетельствует об отсутствии системной кумуляции карфилзомиба. При применении в дозах от 20 до 56 мг/м2 отмечалось дозозависимое повышение экспозиции. При 30-минутной инфузии достигались сходные параметры T1/2 и AUC, однако отмечено 2-3 кратное снижение Cmax по сравнению с Cmax достигнутой при 2-10-минутной инфузии той же дозы. После 30-минутной инфузии дозы 56 мг/м2, отмечено повышение в 2.5 раза AUC (948 нг×ч/мл) по сравнению с дозой 27 мг/м2, а Cmax (2079 нг/мл) была ниже, по сравнению с дозой 27 мг/м2 вводимой в виде инфузии в течение от 2 до 10 мин.
Связывание карфилзомиба с белками плазмы крови человека составляло в среднем 97% в диапазоне концентраций от 0.4 до 4 мкмоль. Средний Vd карфилзомиба в равновесном состоянии при дозе 20 мг/м2 составлял 28 л.
Карфилзомиб подвергается интенсивному метаболизму с последующим выведением почками.
Карфилзомиб быстро и интенсивно метаболизируется. Основными метаболитами, присутствовавшими в плазме крови и моче человека в определяемых количествах и образуемыми человеческими гепатоцитами в условиях in vitro, были фрагменты пептида и диол карфилзомиба, это указывает на то, что главными путями метаболизма карфилзомиба являются расщепление под действием пептидазы и гидролиз эпоксидных групп. Механизмы, опосредованные системой цитохрома Р450, играют незначительную роль в общем метаболизме карфилзомиба. Метаболиты препарата не обладают известной биологической активностью.
После в/в введения в дозах >15 мг/м2 карфилзомиб быстро выводится из системного кровотока со значениями T1/2 <1 ч в первый день первого цикла терапии. Системный клиренс препарата варьировал от 151 до 263 л/ч и превышал печеночный кровоток, что свидетельствовало о том, что карфилзомиб преимущественно элиминировался внепеченочными путями.
Показания активных веществ препарата
Кипролис
В комбинации с даратумумабом и дексаметазоном, с леналидомидом и дексаметазоном либо только с дексаметазоном: лечение множественной миеломы у взрослых пациентов, получавших минимум одну линию предшествующей противоопухолевой терапии.
В качестве монотерапии рецидивирующей и рефрактерной множественной миеломы у пациентов, получивших минимум 2 предыдущие линии терапии, включая бортезомиб и иммуномодулирующее средство.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Терапия должна проводиться под контролем врача, имеющего опыт использования противоопухолевых препаратов.
Вводят в/в в виде инфузии.
Начальная доза — 20 мг/м2 (максимальная доза — 44 мг). Увеличение дозы проводится в соответствии со схемой лечения и переносимостью.
Лечение может продолжаться до прогрессирования заболевания или развития неприемлемой токсичности.
Побочное действие
Инфекции и инвазии: очень часто — пневмония, инфекция дыхательных путей; часто — сепсис, инфекция легких, вирусная инфекция, опоясывающий герпес, инфекция мочевыводящих путей, бронхит, гастроэнтерит, вирусная инфекция, назофарингит, ринит; нечасто — колит, ассоциированный с Clostridium difficile.
Со стороны иммунной системы: нечасто — реакции повышенной чувствительности.
Со стороны системы кроветворения: очень часто — тромбоцитопения, нейтропения, анемия, лимфопения, лейкопения; часто — фебрильная нейтропения; нечасто — гемолитико-уремический синдром; редко — тромботическая тромбоцитопеническая пурпура, тромботическая микроангиопатия.
Со стороны обмена веществ: очень часто — гипокалиемия, гипергликемия, снижение аппетита; часто — дегидратация, гиперкалиемия, гипомагниемия, гипонатриемия, гиперкальциемия, гипокальциемия, гипофосфатемия, гиперурикемия, гипоальбуминемия; нечасто — синдром лизиса опухоли.
Психические нарушения: очень часто — бессонница; часто — тревожность, спутанность сознания.
Со стороны нервной системы: очень часто — головокружение, периферическая нейропатия, головная боль; часто — парестезия, гипестезия; нечасто — внутричерепное кровоизлияние, нарушение мозгового кровообращения; редко — синдром задней обратимой энцефалопатии.
Со стороны органов чувств: часто — катаракта, снижение четкости зрения, звон в ушах.
Со стороны сердечно-сосудистой системы: очень часто — артериальная гипертензия; часто — сердечная недостаточность, инфаркт миокарда, фибрилляция предсердий, тахикардия, снижение фракции выброса, сердцебиение, тромбоз глубоких вен, артериальная гипотензия, гиперемия; нечасто — остановка сердца, ишемия миокарда, перикардит, выпот в полость перикарда, гипертонический криз, кровотечение; редко — осложненный гипертонический криз.
Со стороны дыхательной системы: очень часто — диспноэ, кашель; часто — тромбоэмболия легочной артерии, отек легких, носовое кровотечение, боль в ротоглотке, дисфония, свистящее дыхание, легочная гипертензия; нечасто — острый респираторный дистресс-синдром, острая дыхательная недостаточность, легочное кровотечение, интерстициальная болезнь легких, пневмонит.
Со стороны пищеварительной системы: очень часто — рвота, диарея, запор, боли в животе, тошнота; часто — желудочно- кишечное кровотечение, диспепсия, зубная боль; нечасто — перфорация ЖКТ.
Со стороны печени и желчевыводящих путей: часто — повышение активности АЛТ и АСТ, повышение активности гамма-глутамилтранспептидазы, гипербилирубинемия; нечасто — печеночная недостаточность, холестаз.
Со стороны кожи и подкожных тканей: часто — кожные высыпания, кожный зуд, эритема, гипергидроз.
Со стороны костно-мышечной системы: очень часто — боль в спине, артралгия, боли в конечности, мышечные спазмы; часто — скелетно-мышечная боль, скелетно-мышечная боль в грудной клетке, боль в костях, миалгия, мышечная слабость.
Со стороны мочевыводящей системы: очень часто — повышение концентрации креатинина в плазме; часто — острое повреждение почек, почечная недостаточность, нарушение функции почек, снижение почечного клиренса креатинина.
Общие реакции: очень часто — пирексия, периферические отеки, астения, утомляемость, озноб; часто — боли в грудной клетке, боль, реакции в месте инфузии, гриппоподобный синдром, недомогание ; нечасто — полиорганная недостаточность.
Лабораторные показатели: часто — повышение концентрации С-реактивного белка, повышение концентрации мочевой кислоты в плазме.
Прочие: часто — реакция, связанная с инфузией
Противопоказания к применению
Повышенная чувствительность к карфилзомибу, беременность, период грудного вскармливания.
С осторожностью
При комбинированном применении с препаратами, увеличивающими риск тромбозов (в частности с гормональными контрацептивами), с препаратами, являющимися субстратами изоферментов CYP1A2, 2C8, 2C9, 2C19 и 2B6, субстратами P-гликопротеина (в частности с дигоксином, колхицином), при нарушениях функции печени средней и тяжелой степени.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период грудного вскармливания.
Женщины репродуктивного возраста (и/или их партнеры) должны использовать эффективные методы контрацепции во время всего курса лечения и в течение одного месяца после его завершения. Мужчины должны использовать эффективные методы контрацепции во время лечения и еще в течение 3 месяцев после его завершения в том случае, если их партнерша беременна или способна к зачатию, и не пользуется эффективными средствами контрацепции.
Применение при нарушениях функции печени
С осторожностью применять при нарушениях функции печени средней и тяжелой степени.
Применение у детей
Препарат противопоказан для применения у детей и подростков в возрасте до 18 лет
Особые указания
Поскольку карфилзомиб применяется в комбинации с другими лекарственными средствами, перед началом лечения необходимо изучить также инструкции по применению этих лекарственных средств.
При введении карфилзомиб отмечались случаи первичного развития или усугубления сердечной недостаточности (в частности, хронической сердечной недостаточности, отека легких, снижения фракции выброса левого желудочка), ишемии миокарда и инфаркта миокарда. Летальные исходы вследствие остановки сердца возникали в течение суток после введения, сообщалось о летальных случаях сердечной недостаточности и инфаркта миокарда.
Хотя перед началом введения в цикле 1 необходима адекватная гидратация, также необходим мониторинг всех пациентов на предмет гиперволемии, особенно пациентов с риском развития сердечной недостаточности. При необходимости, у пациентов с сердечной недостаточностью или составляющих группу высокого риска данной патологии, может потребоваться коррекция общего объема инфузионной терапии.
При развитии нежелательных явлений со стороны сердца 3 или 4 степени тяжести, необходимо отменить карфилзомиб до разрешения явлений и рассмотреть вопрос о возобновлении применения карфилзомиба в дозе, сниженной на 1 уровень на основании оценки соотношения польза/риск. Риск сердечной недостаточности возрастает у пациентов пожилого возраста (> 75 лет). Пациенты с симптомами сердечной недостаточности III-IV ФК по классификации NYHA, недавно перенесшие инфаркт миокарда (в течение последних 4 месяцев), а также пациенты с неконтролируемой стенокардией или аритмией должны проходить полное медицинское обследование перед началом терапии карфилзомибом. Эта оценка должна оптимизировать состояние пациента при особом внимании к контролю АД и инфузионной терапии. Впоследствии пациентам следует проводить терапию с осторожностью, пациенты должны находиться под тщательным наблюдением.
Нельзя исключать вероятность влияния карфилзомиба на интервал QT.
При развитии легочной токсичности следует провести клиническое обследование пациента и прекратить применение карфилзомиба до разрешения этого состояния. Решение о возобновлении терапии принимают на основании результатов оценки соотношения польза/риск.
При развитии легочной гипертензии следует провести клиническое обследование пациента и прекратить применение карфилзомиба до разрешения этого состояния. Решение о возобновлении терапии принимают на основании результатов оценки соотношения польза/риск.
При появлении одышки показано обследование с целью исключения кардиопульмональных осложнений, включая сердечную недостаточность и легочные синдромы. В случае развития одышки 3 или 4 степени тяжести применение карфилзомиба прекращают до тех пор, пока одышка не купируется или параметры дыхания не восстановятся до исходного уровня. Решение о возобновлении терапии принимают на основании результатов оценки соотношения польза/риск.
Рекомендуется контролировать артериальную гипертензию до начала лечения. Всем пациентам показан регулярный осмотр с целью выявления артериальной гипертензии и назначения лечения, если в этом возникнет необходимость. Если артериальную гипертензию невозможно контролировать, требуется коррекция дозы карфилзомиба. В случае диагностирования гипертонического криза применение карфилзомиба прекращают до тех пор, пока гипертонический криз не будет купирован или показатели АД не восстановятся до исходного уровня. Решение о возобновлении терапии принимают на основании результатов оценки соотношения польза/риск.
Острая почечная недостаточность чаще диагностировалась у пациентов с рецидивирующей или рефрактерной множественной миеломой на поздней стадии, получавших монотерапию карфилзомибом. Показатели функции почек необходимо контролировать хотя бы раз месяц или так часто, как это предусмотрено клиническими рекомендациями, особенно у пациентов с более низким исходным КК. В случае необходимости дозу карфилзомиба уменьшают или отменяют его.
Пациенты, имеющие высокую опухолевую массу, по-видимому, имеют более высокий риск синдрома лизиса опухоли (СЛО). Необходимо обеспечить адекватную гидратацию перед введением карфилзомиба в цикле I терапии, а также, при необходимости, при последующих циклах. У пациентов, имеющих высокий риск развития СЛО, следует рассмотреть вопрос об использовании средств, снижающих концентрацию мочевой кислоты. В процессе лечения необходим мониторинг признаков СЛО, в т.ч. регулярная оценка концентрации электролитов в сыворотке крови и адекватная коррекция выявленных изменений. Необходимо отменить карфилзомиб до разрешения симптомов СЛО.
Инфузионные реакции могут развиваться немедленно после или в течение 24 ч после введения карфилзомиба. С целью снижения частоты и степени тяжести реакций, перед введением карфилзомиба производится введение дексаметазона в качестве премедикации.
Карфилзомиб вызывает развитие тромбоцитопении с надиром, наблюдавшимся в день 8 и день 15 каждого цикла длительностью 28 дней с последующим восстановлением до исходных значений к началу следующего цикла. Необходим частый мониторинг количества тромбоцитов при лечении карфилзомибом. При необходимости требуется уменьшение дозы или отмена карфилзомиба.
Пациентам с известными факторами риска тромбоэмболии, в том числе с тромбозом в анамнезе, показан тщательный мониторинг. Необходимо минимизировать все модифицируемые факторы риска (например, курение, артериальная гипертензия и гиперлипидемия). Также следует с осторожностью подходить к сочетанному применению других препаратов, которые могут повысить риск тромбоза (например, средства для стимуляции эритропоэза или препараты гормонозаместительной терапии). Пациентам и лечащим врачам рекомендуется проявлять особое внимание к признакам и симптомам тромбоэмболии. Пациентов необходимо проинструктировать о том, что в случае развития таких симптомов, как затрудненное дыхание, боль в груди, кровохарканье, отеки на руках или ногах, или боль в конечностях, следует немедленно обратиться за медицинской помощью. Следует рассмотреть вопрос о назначении профилактики тромбоза, в каждом конкретном случае после оценки соотношения польза/риск.
При повышении активности печеночных трансаминаз в сыворотке крови в случае необходимости требуется уменьшение дозы или отмена карфилзомиба. Мониторинг активности печеночных ферментов и билирубина следует контролировать в начале лечения и ежемесячно во время лечения карфилзомибом, вне зависимости от исходных значений.
У пациентов, получавших карфилзомиб, регистрировались случаи тромботической микроангиопатии, включая случаи тромботической тромбоцитопенической пурпуры/гемолитико-уремического синдрома (ТТП/ГУС). Некоторые из этих случаев имели смертельный исход.
Необходимо тщательное наблюдение на предмет появления симптомов тромботической тромбоцитопенической пурпуры/гемолитико-уремического синдрома (ТТП/ГУС). При подозрении на этот диагноз следует отменить карфилзомиб и провести соответствующее обследование. Если диагноз ТТП/ГУС не подтвердился, то карфилзомиб можно возобновить. Безопасность повторного применения карфилзомиба у пациентов, перенесших ТТП/ГУС, не установлена.
У пациентов, получавших препарат Кипролис, регистрировались случаи развития синдрома задней обратимой энцефалопатии (СЗОЭ). СЗОЭ, ранее носивший название синдрома обратимой задней лейкоэнцефалопатии, представляет собой редкое неврологическое нарушение, которое может проявляться судорожными припадками, головной болью, заторможенностью, спутанностью сознания, слепотой, изменением уровня сознания, а также другими зрительными и неврологическими нарушениями, наряду с повышением артериального давления, для подтверждения диагноза выполняется нейровизуализация.
При подозрении на синдром задней обратимой энцефалопатии (СЗОЭ) применение карфилзомиба следует прекратить. Безопасность повторного применения карфилзомиба у пациентов, перенесших СЗОЭ, не установлена.
Влияние на способность к управлению транспортными средствами и механизмами
Карфилзомиб оказывает незначительное влияние на способность к управлению автомобилем и работе с механизмами.
Учитывая возможные побочные реакции, в период лечения пациентам рекомендуется воздерживаться от управления автомобилем и работы с механизмами.
Лекарственное взаимодействие
Неизвестно, является ли карфилзомиб индуктором изоферментов CYP1A2, 2С8, 2С9, 2С19 и 2В6 в терапевтических концентрациях. Следует соблюдать осторожность при сопутствующем применении карфилзомиба с препаратами, являющимися субстратами этих изоферментов, в частности с пероральными контрацептивами.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Амджен Европа Б.В.
При температуре не выше 8 °C, не замораживать, в оригинальной упаковке для защиты от света.
Хранить в недоступном для детей месте.
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Обобщенные материалы www.grls.rosminzdrav.ru, 2016 и www.rxlist.com, 2015.
Гиперчувствительность к карфилзомибу; беременность и период грудного вскармливания; возраст до 18 лет.
Наиболее серьезными нежелательными реакциями, которые могут возникнуть в процессе лечения карфилзомибом, являются кардиотоксичность, одышка, острая почечная недостаточность, синдром лизиса опухоли, инфузионные реакции, тромбоцитопения, гепатотоксичность, синдром обратимой задней энцефалопатии и тромботическая тромбоцитопеническая пурпура/гемолитико-уремический синдром. Наиболее частыми нежелательными реакциями, возникавшими у более 20% пациентов в объединенной популяции клинических исследований (N=1581), были анемия, повышенная утомляемость, тромбоцитопения, диарея, тошнота, пирексия, одышка, кашель, нейтропения, инфекции верхних дыхательных путей, периферические отеки и головная боль.
Ниже перечислены нежелательные реакции, приведенные по классам систем органов (в терминологии MedDRA) и частоте встречаемости. Частота встречаемости определялась на основе приблизительной частоты каждой нежелательной реакции в клинических исследованиях (N=1581) для объединенных популяций монотерапии и комбинированной терапии. В рамках каждого класса систем органов и категории частоты встречаемости нежелательные реакции перечислены в порядке снижения степени серьезности. Для оценки частоты встречаемости использовалась шкала: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100) и редко (≥1/10000, <1/1000).
Инфекции и инвазии: очень часто — пневмония, инфекция дыхательных путей, назофарингит; часто — сепсис, грипп, инфекция мочевыводящих путей, бронхит, вирусная инфекция.
Со стороны иммунной системы: нечасто — гиперчувствительность.
Со стороны крови и лимфатической системы: часто — тромбоцитопения1, нейтропения, анемия, лимфопения; часто — фебрильная нейтропения, лейкопения; нечасто — гемолитико-уремический синдром; редко — тромботическая тромбоцитопеническая пурпура, тромботические микроангиопатии.
Со стороны обмена веществ и нарушение питания: часто — гипокалиемия, гипергликемия, снижение аппетита; часто — дегидратация, гиперкалиемия, гипомагниемия, гипонатриемия, гиперкальциемия, гипокальциемия, гипофосфатемия, гиперурикемия, гипоальбуминемия; нечасто — синдром лизиса опухоли.
Нарушения психики: очень часто — бессонница; часто — тревожность.
Со стороны нервной системы: очень часто — головокружение, периферическая нейропатия, головная боль; часто — парестезия, гипестезия; нечасто — острое нарушение мозгового кровообращения; редко — синдром обратимой задней энцефалопатии.
Со стороны органа зрения: часто — катаракта, снижение четкости зрения.
Со стороны сердца: часто — сердечная недостаточность1, фибрилляция предсердий, тахикардия, ощущение сердцебиения; нечасто — остановка сердца, инфаркт миокарда1, ишемия миокарда1, снижение фракции выброса левого желудочка, перикардит, в т.ч. экссудативный.
Со стороны сосудистой системы: очень часто — повышенное АД; часто — тромбоз глубоких вен, пониженное АД, гиперемия; нечасто — гипертонический криз; редко — осложненный гипертонический криз.
Со стороны дыхательной системы, органов грудной клетки и средостения: очень часто — одышка1, кашель; часто — тромбоэмболия легочной артерии, отек легких, носовое кровотечение, боль в ротоглотке, дисфония, стерторозное дыхание, легочная гипертония; нечасто — острый респираторный дистресс-синдром, интерстициальная болезнь легких, пневмония.
Со стороны пищеварительной системы: очень часто — рвота, диарея, запор, боли в животе, тошнота; часто — диспепсия, зубная боль; нечасто — перфорация ЖКТ.
Со стороны гепатобилиарной системы: часто — повышение активности АЛТ, АСТ и ГГТ, гипербилирубинемия; нечасто — печеночная недостаточность1, холестаз.
Со стороны кожи и подкожной клетчатки: часто — сыпь, зуд, эритема, гипергидроз.
Со стороны скелетно-мышечной системы и соединительной ткани: очень часто — боль в спине, артралгия, боли в конечностях, мышечные спазмы; часто — скелетно-мышечная боль, в т.ч. в груди, боль в костях, миалгия, мышечная слабость.
Со стороны почек и мочевыводящих путей: очень часто — повышение концентрации креатинина в крови; часто — почечная недостаточность, в т.ч. острая, нарушение функции почек, снижение почечного клиренса креатинина.
Общие расстройства и нарушения в месте введения: очень часто — инфузионные реакции, пирексия, периферические отеки, астения, повышенная утомляемость; часто — боль в груди, боль, реакции в месте введения, озноб; нечасто — полиорганная недостаточность.
Лабораторные показатели: часто — повышение концентрации С-реактивного белка, повышение концентрации мочевой кислоты в крови.
1 См. «Описание отдельных нежелательных реакций» ниже.
Описание отдельных нежелательных реакций
Сердечная недостаточность, инфаркт миокарда и ишемия миокарда. В клинических исследованиях карфилзомиба сердечная недостаточность, инфаркт миокарда и ишемия миокарда обычно возникали на ранних стадиях лечения (<5 циклов). Принципы клинического ведения кардиологических нарушений, возникающих на фоне лечения карфилзомибом, приведены в разделе «Меры предосторожности».
Одышка. Отмечалась примерно у 30% пациентов в клинических исследованиях карфилзомиба. В большинстве случаев одышка была несерьезной, разрешалась самостоятельно, редко требовала отмены лечения и отмечалась на ранних сроках (<3 циклов). Принципы клинического ведения одышки, возникающей на фоне лечения карфилзомибом, приведены в разделе «Меры предосторожности».
Артериальная гипертензия, включая гипертонические кризы. Сообщалось о развитии гипертонических кризов (включая осложненные) после введения карфилзомиба. Некоторые из этих событий закончились летальным исходом. О нежелательных реакциях повышения АД сообщалось у 20% пациентов в исследованиях, из которых 30% были степени тяжести 3 или выше, хотя гипертонический криз развился у <0,5% пациентов. Частота развития артериальной гипертензии была сравнима у пациентов с артериальной гипертензией в анамнезе или без таковой. Рекомендации по клиническому ведению пациентов с артериальной гипертензией, получающих карфилзомиб, приведены в разделе «Меры предосторожности».
Тромбоцитопения. Тромбоцитопения сообщалась примерно у 40% пациентов в клинических исследованиях карфилзомиба. Карфилзомиб вызывает тромбоцитопению за счет ингибирования высвобождения тромбоцитов из мегакариоцитов, что приводит к развитию классической цикличной тромбоцитопении с надиром, который отмечается на 8-й или 15-й дни каждого цикла длительностью 28 дней и обычно характеризуется восстановлением до исходных значений к началу следующего цикла терапии. Принципы клинического ведения тромбоцитопении, возникающей на фоне лечения карфилзомибом, приведены в разделе «Меры предосторожности».
Печеночная недостаточность. Случаи печеночной недостаточности, в т.ч. с летальным исходом, зарегистрированы у <1% пациентов в клинических исследованиях карфилзомиба. Принципы клинического ведения гепатотоксичности, возникающей на фоне лечения карфилзомибом, приведены в разделе «Меры предосторожности».
Нежелательные реакции, отмечавшиеся с повышенной частотой у пациентов, получавших карфилзомиб в комбинации с леналидомидом и дексаметазоном (КЛД). В клинических исследованиях у пациентов, получавших карфилзомиб в комбинации с леналидомидом и дексаметазоном, в сравнении с контрольной группой отмечалось повышение частоты следующих нежелательных реакций: нейтропения, катаракта, запор, вирусные инфекции и инфекции дыхательных путей, включая пневмонию, сыпь, зуд, эритема, гипергидроз, тромбоз глубоких вен, тромбоэмболия легочной артерии, инфаркт миокарда, электролитные нарушения, включая гипокалиемию, гипомагниемию, гипофосфатемию и гипокальциемию. Не поступало сообщений о повышенной частоте этих реакций у пациентов, получавших карфилзомиб в качестве монотерапии.
Особые группы пациентов
Пожилой возраст (≥75 лет). В целом, частота отдельных нежелательных явлений (включая сердечную недостаточность, см. «Меры предосторожности») в клинических исследованиях была выше у пациентов в возрасте ≥75 лет по сравнению с пациентами в возрасте <75 лет.
Печеночная недостаточность. Пациенты с печеночной недостаточностью не оценивались систематически.
Сердечная недостаточность. Пациенты с сердечной недостаточностью III и IV функционального класса согласно классификации Нью-Йоркской кардиологической ассоциации (NYHA), не включались в клинические исследования. Безопасность и эффективность применения карфилзомиба у этой популяции не оценивались.
Дети. Безопасность и эффективность применения карфилзомиба у детей не оценивались.
RxList.com
Следующие побочные реакции обсуждаются более детально в других разделах описания:
— кардиотоксичность (см. «Меры предосторожности»);
— острая почечная недостаточность (см. «Меры предосторожности»);
— синдром лизиса опухоли (см. «Меры предосторожности»);
— легочная токсичность (см. «Меры предосторожности»);
— легочная гипертензия (см. «Меры предосторожности»);
— одышка (см. «Меры предосторожности»);
— гипертензия (см. «Меры предосторожности»);
— венозный тромбоз (см. «Меры предосторожности»);
— инфузионные реакции (см. «Меры предосторожности»);
— тромбоцитопения (см. «Меры предосторожности»);
— гепатотоксичность и печеночная недостаточность (см. «Меры предосторожности»);
— тромботическая тромбоцитопеническая пурпура/гемолитико-уремический синдром (см. «Меры предосторожности»);
— синдром обратимой задней энцефалопатии (см. «Меры предосторожности»).
Результаты клинических испытаний
Так как клинические испытания проведены с различным набором условий, частота встречаемости побочных реакций, наблюдавшихся в этих исследованиях, может не совпадать с полученной в других исследованиях и с наблюдаемой в клинической практике.
Результаты изучения безопасности применения комбинации КЛД у пациентов с множественной миеломой
Безопасность комбинации КЛД оценивалась в открытом рандомизированном исследовании у пациентов с рецидивирующей множественной миеломой. Среднее число примененных циклов лечения составило 22 для комбинации КЛД и 14 для комбинации леналидомида с дексаметазоном (ЛД).
Летальный исход из-за побочных действий в течение 30 дней после применения последней дозы при терапии комбинацией КЛД наблюдался у 27 из 392 пациентов (7%) и у 27 из 389 пациентов (7%) при терапии комбинацией ЛД. Наиболее частыми причинами смерти у пациентов в обеих исследуемых группах (получавших КЛД против получавших ЛД) были побочные реакции со стороны сердца — 10 (3%) против 7 (2%), инфекция — 9 (2%) против 10 (3%), побочные реакции со стороны почек — 0 (0%) против 1 (<1%) и другие побочные реакции — 9 (2%) против 10 (3%). Серьезные побочные реакции отмечались у 60% пациентов, получавших комбинацию КЛД, и 54% пациентов в группе получавших комбинацию ЛД. Наиболее частыми серьезными побочными реакциями в группе получавших комбинацию КЛД по сравнению с группой получавших ЛД была пневмония (14 против 11%), инфекция дыхательных путей (4 против 1,5%), гипертермия (4 против 2%) и эмболия легочной артерии (3 против 2%).
Прекращение лечения из-за любой побочной реакции наблюдалось у 26% пациентов в группе получавших комбинацию КЛД против 25% в группе получавших комбинацию ЛД. Побочные реакции, приводившие к прекращению лечения карфилзомибом, наблюдались у 12% пациентов и наиболее часто включали пневмонию (1%), инфаркт миокарда (0,8%) и инфекции верхних дыхательных путей (0,8%).
Побочные реакции, возникавшие с частотой ≥10%
Ниже перечислены побочные реакции, наблюдавшиеся с частотой ≥10% в группе получавших комбинацию КЛД в циклах 1–12 комбинированной терапии. Данные приведены в следующем порядке: число случаев побочных реакций любой степени тяжести и со степенью тяжести ≥3 в группе получавших комбинацию КЛД, число случаев побочных реакций любой степени тяжести и со степенью тяжести ≥3 в группе получавших комбинацию ЛД. В скобках — в процентах от общего числа участников в каждой из исследуемых групп (КЛД — N=392, ЛД — N=389).
Со стороны крови и лимфатической системы: анемия — 138 (35%) и 53 (14%), 127 (33%) и 47 (12%); нейтропения — 124 (32%) и 104 (27%), 115 (30%) и 89 (23%); тромбоцитопения — 100 (26%) и 58 (15%), 75 (19%) и 39 (10%).
Со стороны ЖКТ: диарея — 115 (29%) и 7 (2%), 105 (27%) и 12 (3%); запор — 68 (17%) и 0, 53 (14%) и 1 (0%); тошнота — 60 (15%) и 1 (0%), 39 (10%) и 3 (1%).
Общие расстройства и нарушения в месте введения: повышенная утомляемость — 109 (28%) и 21 (5%), 104 (27%) и 20 (5%); гипертермия — 93 (24%) и 5 (1%), 64 (17%) и 1 (0%); периферический отек — 63 (16%) и 2 (1%), 57 (15%) и 2 (1%); астения — 53 (14%) и 11 (3%), 46 (12%) и 7 (2%).
Инфекции и инвазии: инфекции верхних дыхательных путей — 85 (22%) и 7 (2%), 52 (13%) и 3 (1%); назофарингит — 63 (16%) и 0 (14%), 43 (11%) и 0; бронхит — 54 (14%) и 5 (1%), 39 (10%) и 2 (1%); пневмония1 — 54 (14%) и 35 (9%), 43 (11%) и 27 (7%).
Со стороны обмена веществ и питания: гипокалиемия — 78 (20%) и 22 (6%), 35 (9%) и 12 (3%); гипокальциемия — 55 (14%) и 10 (3%), 39 (10%) и 5 (1%); гипергликемия — 43 (11%) и 18 (5%), 33 (9%) и 15 (4%).
Со стороны скелетно-мышечной системы и соединительной ткани: мышечные спазмы — 88 (22%) и 3 (1%), 73 (19%) и 3 (1%).
Со стороны нервной системы: периферические нейропатии NEC2 — 43 (11%) и 7 (2%), 37 (10%) и 4 (1%).
Нарушения психики: бессонница — 63 (16%) и 6 (2%), 50 (13%) и 8 (2%).
Со стороны органов дыхания, грудной клетки и средостения: кашель — 85 (22%) и 1 (0%), 46 (12%) и 0; одышка3 — 70 (18%) и 9 (2%), 58 (15%) и 6 (2%).
Со стороны кожи и подкожных тканей: сыпь — 45 (12%) и 5 (1%), 53 (14%) и 5 (1%).
Сосудистые нарушения: венозная эмболия и тромбоэмболия4 — 49 (13%) и 16 (4%), 22 (6%) и 9 (2%); гипертензия5 — 41 (11%) и 12 (3%), 15 (4%) и 4 (1%).
1 Включает предпочтительные термины «пневмония» и «бронхопневмония».
2 Предпочтительнее определенная с помощью тепловизионных комплексов NEC.
3 Включает предпочтительные термины «одышка» и «одышка при физической нагрузке».
4 Предпочтительные термины по классификации MedDRA.
5 Предпочтительные термины «гипертензия», «гипертонический криз».
В группе участников, получавших комбинацию КЛД, у 274 пациентов (70%) лечение продолжалось и после 12-го цикла; новых клинически значимых случаев опасных побочных реакций не наблюдалось.
Побочные реакции, наблюдавшиеся с частотой <10%
Со стороны крови и лимфатической системы: фебрильная нейтропения, лимфопения.
Сердечные нарушения: остановка сердца, сердечная недостаточность, ХСН, инфаркт миокарда, ишемия миокарда.
Со стороны органа зрения: катаракта, нечеткость зрения.
Со стороны ЖКТ: абдоминальная боль, боль в верхней области живота, диспепсия, зубная боль.
Общие расстройства и нарушения в месте введения: озноб, реакции в месте инфузии, полиорганные нарушения, боль.
Инфекции и инвазии: грипп, сепсис, инфекция мочевых путей, вирусная инфекция.
Со стороны обмена веществ и питания: дегидратация, гиперкалиемия, гиперурикемия, гипоальбуминемия, гипонатриемия, синдром лизиса опухоли.
Со стороны скелетно-мышечной системы и соединительной ткани: мышечная слабость, миалгия.
Со стороны нервной системы: гипестезия, парестезия, глухота.
Нарушения психики: беспокойство, делирий.
Со стороны почек и мочевыводящих путей: почечная недостаточность, в т.ч. острая, повреждение почек.
Со стороны органов дыхания, грудной клетки и средостения: одышка, носовое кровотечение, орофарингеальная боль, эмболия легочной артерии, отек легких.
Со стороны сосудов: тромбоз глубоких вен, гипотензия.
Побочные реакции степени 3 тяжести и выше, которые наблюдались в циклах 1–12 с частотой, различающейся ≥2% в обеих группах, включали нейтропению, тромбоцитопению, гипокалиемию и гипофосфатемию.
Ниже перечислены отклонения лабораторных показателей степени тяжести 3–4, наблюдавшиеся с частотой ≥10% в группе получавших комбинацию КЛД в циклах 1–12 комбинированной терапии. Данные приведены в следующем порядке: число случаев побочных реакций степени тяжести 3–4 в группе получавших комбинацию КЛД и число случаев побочных реакций степени тяжести 3–4 в группе получавших комбинацию ЛД. В скобках — в процентах от общего числа участников в каждой из исследуемых групп (КЛД — N=392, ЛД — N=389).
Уменьшение количества лимфоцитов: 182 (46%) и 119 (31%).
Уменьшение абсолютного количества нейтрофилов: 152 (39%) и 140 (36%).
Уменьшение концентрации фосфора: 122 (31%) и 106 (27%).
Уменьшение количества тромбоцитов: 101 (26%) и 59 (15%).
Уменьшение общего количества лейкоцитов: 97 (25%) и 71 (18%).
Уменьшение концентрации гемоглобина: 58 (15%) и 68 (18%).
Уменьшение концентрации калия: 41 (11%) и 23 (6%).
Безопасность карфилзомиба у пациентов с множественной миеломой, получавших монотерапию
Безопасность карфилзомиба оценивалась в клинических испытаниях с участием 598 пациентов с рецидивирующей и/или рефрактерной миеломой, получавших карфилзомиб в виде монотерапии в дозе 20 мг/м2 в 1-й день цикла 1, с увеличением дозы до 27 мг/м2 в 8-й день цикла 1 или в 1-й день цикла 2. Средний возраст этих пациентов составил 64 года (интервал 32–87 лет). Пациенты получали в среднем 5 (интервал 1–20) предшествующих схем лечения. Приблизительно 57% пациентов были мужского пола. Среднее число циклов стимулирования составило 4 (интервал 1–35).
Серьезные побочные реакции, независимо от причины их возникновения, отмечались у 50% пациентов в совокупности исследований карфилзомиба (N=598). Наиболее частыми серьезными побочными реакциями были пневмония (8%), острая почечная недостаточность (5%), прогрессирование заболевания (4%), гипертермия (3%), гиперкальциемия (3%), ХСН (3%), множественная миелома (3%), анемия (2%) и одышка (2%). У пациентов, получавших карфилзомиб, частота серьезных побочных реакций была выше в возрасте >65 лет и в возрасте >75 лет. Летальный исход из-за побочных действий в течение 30 дней после применения последней дозы наблюдался у 30 из 598 пациентов (5%), получавших монотерапию карфилзомибом. Эти побочные действия были связаны с сердечными нарушениями у 10 (2%), инфекциями у 8 (1%), почечными нарушениями у 4 (<1%) и другими побочными реакциями у 8 (1%) пациентов.
Ниже перечислены наиболее частые побочные реакции (≥10%), наблюдавшиеся при монотерапии карфилзомибом в дозе 20/27 мг/м2 (N=598). Данные приведены в следующем порядке: число случаев побочных реакций любой степени тяжести и число случаев побочных реакций ≥3-й степени тяжести; в скобках — в процентах от общего числа участников.
Со стороны крови и лимфатической системы: анемия — 291 (49%) и 141 (24%); тромбоцитопения — 220 (37%) и 152 (25%); нейтропения — 113 (19%) и 63 (11%); лимфопения — 85 (14%) и 73 (12%); лейкопения — 61 (10%) и 26 (4%).
Со стороны ЖКТ: тошнота — 211 (35%) и 7 (1%); диарея — 160 (27%) и 8 (1%); рвота — 104 (17%) и 4 (1%); запор — 90 (15%) и 1 (0%).
Общие расстройства и нарушения в месте введения: повышенная утомляемость — 238 (40%) и 25 (4%); гипертермия — 177 (30%) и 11 (2%), периферический отек — 118 (20%) и 1 (0%); лихорадка — 73 (12%) и 1 (0%), астения — 71 (12%) и 9 (2%).
Инфекции и инвазии: инфекция верхних дыхательных путей — 112 (19%) и 15 (3%); пневмония1 — 71 (12%) и 54 (9%).
Со стороны обмена веществ и питания: понижение аппетита — 89 (15%) и 2 (0%); гиперкальциемия — 68 (11%) и 26 (4%); гипокалиемия — 61 (10%) и 17 (3%).
Со стороны скелетно-мышечной системы и соединительной ткани: боль в спине — 115 (19%) и 19 (3%); артралгия — 83 (14%) и 5 (1%); боль в конечностях — 69 (12%) и 7 (1%); мышечные спазмы — 62 (10%) и 2 (0%); скелетно-мышечная боль — 60 (10%) и 12 (2%).
Со стороны нервной системы: головная боль — 141 (24%) и 7 (1%); головокружение — 64 (11%) и 5 (1%); периферическая нейропатия NEC2 — 62 (10%) и 5 (1%).
Психические нарушения: бессонница — 75 (13%) и 0.
Со стороны органов дыхания, грудной клетки и средостения: одышка3 — 202 (34%) и 21 (4%); кашель — 120 (20%) и 2 (0%); носовое кровотечение — 60 (10%) и 5 (1%).
Со стороны почек: почечная недостаточность — 76 (13%) и 49 (8%).
Сосудистые нарушения: гипертензия4 — 90 (15%) и 22 (4%).
1 Включает предпочтительные термины «пневмония» и «бронхопневмония».
2 Предпочтительнее определенная с помощью тепловизионных комплексов NEC.
3 Включает предпочтительные термины «одышка» и «одышка при физической нагрузке».
4 Предпочтительные термины «гипертензия», «гипертонический криз».
Побочные реакции, наблюдавшиеся с частотой <10%
Со стороны крови и лимфатической системы: фебрильная нейтропения.
Сердечные нарушения: остановка сердца, застойная сердечная недостаточность, инфаркт миокарда, ишемия миокарда.
Со стороны органа зрения: катаракта, нечеткость зрения.
Со стороны ЖКТ: абдоминальная боль, боль в верхней области живота, диспепсия, зубная боль.
Общие расстройства и нарушения в месте введения: реакция в месте инфузии, полиорганные нарушения, боль.
Гепатобилиарные нарушения: печеночная недостаточность.
Инфекции и инвазии: бронхит, грипп, назофарингит, инфекция дыхательных путей, сепсис, инфекция мочевых путей.
Со стороны обмена веществ и питания: гипергликемия, гиперкалиемия, гиперурикемия, гипоальбуминемия, гипокальциемия, гипомагниемия, гипонатриемия, гипофосфатемия, синдром лизиса опухоли.
Со стороны скелетно-мышечной системы и соединительной ткани: боль в груди, миалгия.
Со стороны нервной системы: гипестезия, парестезия.
Нарушение психики: беспокойство.
Со стороны почек и мочевыводящих путей: почечная недостаточность.
Со стороны органов дыхания, грудной клетки и средостения: одышка, орофарингеальная боль, отек легких.
Со стороны кожи и подкожных тканей: эритема, гипергидроз, зуд, сыпь.
Со стороны сосудов: случаи эмболии и тромбоза, венозные нарушения (включая тромбоз глубоких вен и легочную эмболию), гипотензия.
Побочные реакции степени тяжести 3 и выше, которые наблюдались с частотой >1%, включали фебрильную нейтропению, остановку сердца, ХСН, боль, сепсис, инфекцию мочевого тракта, гипергликемию, гиперкалиемию, гиперурикемию, гипоальбуминемию, гипокальциемию, гипонатриемию, гипофосфатемию, почечную недостаточность, в т.ч. острую, повреждение почек, отек легких и гипотензию.
Ниже перечислены отклонения лабораторных показателей степени тяжести 3–4, наблюдавшиеся с частотой >10% у пациентов, получавших карфилзомиб в виде монотерапии (в скобках — в процентах от общего числа участников, N=598).
Уменьшение количества тромбоцитов: 184 (31%).
Уменьшение количества лимфоцитов: 151 (25%).
Уменьшение концентрации Hb: 132 (22%).
Уменьшение общего количества лейкоцитов: 71 (12%).
Уменьшение концентрации натрия: 69 (12%).
Уменьшение абсолютного количества нейтрофилов: 67 (11%).
Опыт постмаркетинговых наблюдений
В постмаркетинговых наблюдениях применения карфилзомиба отмечались следующие побочные реакции: дегидратация, тромботическая тромбоцитопеническая пурпура/гемолитико-уремический синдром (ТТП/ГУС), синдром лизиса опухоли, включая летальные исходы, и синдром обратимой задней энцефалопатии. Так как эти данные получены в добровольном порядке у популяции неустановленного размера, не всегда представляется возможным оценить их частоту или установить причинную связь с экспозицией данного ЛС.
Карфилзомиб преимущественно метаболизируется пептидазой и эпоксидгидролазой, и как следствие, не ожидается влияние при одновременном введении ингибиторов и индукторов цитохрома Р450 на фармакокинетический профиль карфилзомиба. Не ожидается, что карфилзомиб оказывает влияние на экспозицию других ЛС.
Кардиотоксичность
При введении карфилзомиба отмечались случаи первичного развития или усугубления сердечной недостаточности (в частности ХСН, отек легких, снижение фракции выброса левого желудочка), облитерирующей кардиомиопатии, ишемии миокарда и инфаркта миокарда, включая случаи с летальным исходом. Летальные исходы вследствие остановки сердца возникали в течение суток после введения, и сообщалось о летальных случаях в результате сердечной недостаточности и инфаркта миокарда.
Хотя перед началом дозирования в цикле 1 необходима адекватная гидратация, также необходим мониторинг всех пациентов на предмет гиперволемии, особенно пациентов с риском развития сердечной недостаточности. При необходимости, у пациентов с сердечной недостаточностью или составляющих группу высокого риска данной патологии, может потребоваться коррекция общего объема инфузионной терапии.
При развитии нежелательных явлений со стороны сердца 3-й или 4-й степени необходимо отменить карфилзомиб до разрешения явлений и рассмотреть вопрос о возобновлении применения карфилзомиба в дозе, сниженной на 1 уровень на основании оценки соотношения польза/риск.
Риск сердечной недостаточности возрастает у пациентов пожилого возраста (≥75 лет). Пациенты с ХСН III и IV функционального класса по классификации NYHA, аритмией, нестабильной стенокардией, недавно перенесшие инфаркт миокарда и имевшие неконтролируемые лекарственной терапией нарушения проводимости, не включались в клинические исследования. Эти пациенты могут быть подвержены более высокому риску развития осложнений со стороны сердца и должны проходить полное медицинское обследование (в частности контроль АД, контроль признаков гиперволемии) перед началом терапии карфилзомибом, и находиться под наблюдением во время терапии.
Острая почечная недостаточность
У пациентов, получавших карфилзомиб, сообщалось о развитии острой почечной недостаточности. Острая почечная недостаточность регистрировалась более часто у пациентов с распространенной рецидивирующей и рефрактерной множественной миеломой, которые получали карфилзомиб в качестве монотерапии. Этот риск возрастал у пациентов со сниженными значениями рассчитанного по формуле Кокрофта-Голта клиренса креатинина перед началом лечения карфилзомибом. Необходим мониторинг функции почек с регулярной оценкой концентрации креатинина в сыворотке крови и/или расчетного клиренса креатинина. При необходимости снизить или отменить дозу.
Синдром лизиса опухоли (CЛО)
СЛО, в т.ч. с летальным исходом, отмечался у пациентов, получавших карфилзомиб. Пациенты, имеющие высокую опухолевую массу, должны рассматриваться как имеющие более высокий риск развития CЛO. Необходимо обеспечить хорошую гидратацию пациентов перед введением карфилзомиба в цикле 1 терапии, а также при необходимости в последующих циклах. У пациентов, имеющих высокий риск развития CЛО, следует рассмотреть вопрос об использовании средств, снижающих концентрацию мочевой кислоты в крови. В процессе лечения необходим мониторинг признаков CЛO, в т.ч. регулярная оценка концентрации электролитов в сыворотке крови, и адекватная коррекция выявленных изменений. Необходимо временное прекращение лечения карфилзомибом до разрешения СЛО.
Легочная токсичность
Острый респираторный дистресс-синдром, острая дыхательная недостаточность и острые диффузные инфильтрационные заболевания легких, такие как пневмония и интерстициальная болезнь легких, возникали у <1% пациентов, получавших карфилзомиб. Некоторые из этих состояний были летальными. В случае развития легочной токсичности, связанной с применением, карфилзомиб следует отменить.
Легочная гипертония
О развитии легочной гипертонии сообщалось у 1% пациентов, получавших карфилзомиб, и у <1% наблюдавшиеся явления были степени тяжести 3 или выше. Необходимо проведение оценки с визуализацией сердца или другими тестами при необходимости. Следует приостановить дозирование карфилзомиба в случае развития легочной гипертонии до разрешения или возврата к исходному состоянию и оценить индивидуальное соотношение польза/риск для возобновления применения карфилзомиба.
Диспноэ
О развитии одышки сообщалось у 28% пациентов, получавших карфилзомиб, менее чем у 4% пациентов развившееся диспноэ было степени тяжести 3 или выше. При развитии одышки следует исключить сердечно-легочные осложнения, включая сердечную недостаточность или легочные синдромы. При одышке степени тяжести 3 или 4, следует приостановить применение карфилзомиба до разрешения симптомов или возврата к исходному состоянию. Решение о продолжении терапии карфилзомибом должно приниматься на основании индивидуальной оценки соотношения польза/риск.
Артериальная гипертензия
При применении карфилзомиба сообщалось о развитии артериальной гипертензии, включая гипертонический криз или осложненный гипертонический криз. Некоторые из этих событий были летальными. У всех пациентов необходим регулярный мониторинг АД. При недостижении адекватного контроля АД, применение карфилзомиба следует приостановить. Решение о продолжении терапии карфилзомибом должно приниматься на основании индивидуальной оценки соотношения польза/риск.
Венозный тромбоз
Сообщалось о тромбоэмболии вен (включая тромбоз глубоких вен и тромбоэмболию легочной артерии) при применении карфилзомиба. В комбинированном исследовании частота тромбоэмболии вен в первых 12 циклах была 13% для группы карфилзомиба в комбинированной терапии и 6% для контрольной группы. При монотерапии карфилзомибом частота тромбоэмболии вен была 2%. Рекомендуется соответствующая профилактика тромбозов при надлежащей оценке предрасполагающих рисков, режима терапии и клинического статуса пациента.
Неизвестно, может ли карфилзомиб снижать эффективность пероральных контрацептивов. Вследствие повышенного риска развития венозного тромбоза на фоне применения карфилзомиба пациентам, применяющим пероральные контрацептивы или гормональные методы контрацепции, которые также могут повышать риск венозных тромбозов, рекомендуется рассмотреть альтернативные меры контрацепции.
Инфузионные реакции
Инфузионные реакции, в т.ч. жизнеугрожающие, отмечались у пациентов, получавших карфилзомиб. Симптомы могут включать повышение температуры тела, озноб, артралгию, миалгию, рвоту, слабость, затруднение дыхания, понижение АД, обморок, чувство стеснения грудной клетки или стенокардию. Эти реакции могут развиваться немедленно после или в течение 24 ч после введения карфилзомиба. С целью снижения частоты и степени тяжести данных реакций перед введением карфилзомиба производится введение дексаметазона в качестве премедикации либо в качестве части режима комбинированной терапии.
Тромбоцитопения
Карфилзомиб вызывает развитие тромбоцитопении с надиром, наблюдавшимся в 8-й и 15-й день каждого цикла длительностью 28 дней с последующим восстановлением до исходных значений к началу следующего цикла (см. «Побочные действия»). Необходим частый мониторинг количества тромбоцитов при лечении карфилзомибом. При необходимости следует снизить или отменить дозу.
Гепатотоксичность
Сообщались случаи гепатотоксичности, в т.ч. с летальным исходом. Карфилзомиб может вызывать повышение активности печеночных трансаминаз в сыворотке крови (см. «Побочные действия»). Необходим регулярный мониторинг активности печеночных ферментов вне зависимости от исходных значений. При необходимости следует снизить или отменить дозу.
Тромботическая тромбоцитопеническая пурпура/гемолитико-уремический синдром (ТТП/ГУС)
У пациентов, получавших карфилзомиб, регистрировались случаи ТТП/ГУС, в т.ч. с летальным исходом. Необходим мониторинг признаков и симптомов ТТП/ГУС. При подозрении на развитие данных состояний необходимо отменить карфилзомиб и проводить стандартное лечение, в т.ч. плазмаферез по клиническим показаниям. После исключения ТТП/ГУС возможно возобновление лечения карфилзомибом.
Безопасность возобновления лечения карфилзомибом у пациентов, у которых ранее отмечался ТТП/ГУС, неизвестна.
Синдром обратимой задней энцефалопатии (СОЗЭ)
СОЗЭ, ранее носивший название синдрома обратимой задней лейкоэнцефалопатии, представляет собой редкое неврологическое нарушение, которое может проявляться судорожными припадками, головной болью, заторможенностью, спутанностью сознания, слепотой, изменением уровня сознания, а также другими зрительными и неврологическими нарушениями, наряду с повышением АД, и диагноз подтверждается данными рентгенологических исследований нервной системы. При ранней диагностике и адекватном лечении возможно разрешение проявлений СОЗЭ. У пациентов, получавших карфилзомиб, сообщалось о случаях возникновения СОЗЭ. При подозрении на наличие СОЗЭ, необходимо отменить карфилзомиб. Безопасность возобновления лечения карфилзомибом у пациентов, у которых ранее отмечался СОЗЭ, неизвестна.
Отдельные группы пациентов
Дети. Безопасность и эффективность применения карфилзомиба у детей не установлены.
Пожилой возраст. В целом, частота отдельных нежелательных явлений (включая сердечную недостаточность) в клинических исследованиях была выше у пациентов в возрасте ≥75 лет по сравнению с пациентами в возрасте <75 лет.
Печеночная недостаточность. Пациенты с печеночной недостаточностью не оценивались систематически (см. «Фармакология»).
Нарушение функции почек. Коррекция начальной дозы не требуется для пациентов с нарушением исходной функции почек легкой, средней и тяжелой степени, а также находящихся на диализе. Поскольку выведение карфилзомиба в процессе диализа не исследовалось, его следует вводить после диализа (см. «Фармакология»).
Сердечная недостаточность. Пациенты с сердечной недостаточностью III и IV функционального класса по классификации NYHA не включались в клинические исследования. Безопасность и эффективность применения карфилзомиба в этой популяции не оценивались.
Влияние на способность управлять транспортными средствами, механизмами. Исследования влияния карфилзомиба на способность управлять транспортными средствами и механизмами не проводились. В клинических исследованиях наблюдались утомляемость, головокружение, обморок и/или снижение АД. Поэтому пациентам, получающим карфилзомиб, следует рекомендовать отказаться от управления транспортными средствами и работы с механизмами, если они испытывают любой из этих симптомов.
RxList.com
Кардиотоксичность
После применения карфилзомиба наблюдались случаи развития или ухудшения имеющейся сердечной недостаточности (например ХСН, отек легких, снижение фракции выброса), облитерирующей кардиомиопатии, ишемии миокарда и инфаркта миокарда, включая летальные исходы. В клинических исследованиях карфилзомиба такие случаи обычно наблюдались в начале курса терапии (<5 циклов). Смерть в результате остановки сердца наблюдалась в течение 1 дня применения карфилзомиба. В случаях кардиологических побочных явлений степени тяжести 3 или 4 следует отказаться от применения карфилзомиба до их разрешения и затем рассмотреть вопрос о возобновлении терапии в дозе на 1 уровень меньше, основываясь на оценке соотношения польза/риск.
Несмотря на то что адекватная гидратация является необходимым условием для применения каждой дозы в цикле 1, все пациенты должны обследоваться на случаи гиперволемии, в особенности пациенты, находящиеся в группе риска развития сердечной недостаточности. Клинически уместным является регулирование введения жидкости у пациентов с исходной сердечной недостаточностью или находящихся в группе риска.
У пациентов в возрасте ≥75 лет риск развития сердечной недостаточности повышается. В клинические испытания не отбирали пациентов, имеющих сердечную недостаточность III и IV функционального класса по классификации NYHA, недавно перенесших инфаркт миокарда и имеющих отклонения в состоянии, не поддающиеся медикаментозному лечению. Такаие пациенты подвержены более высокому риску развития сердечных осложнений.
Острая почечная недостаточность
У пациентов, получавших карфилзомиб, наблюдались случаи острой почечной недостаточности. В рандомизированном контролируемом испытании недостаточность функции почек (ХПН, почечная недостаточность, в т.ч. острая) наблюдались с частотой приблизительно 8%. Острая почечная недостаточность чаще отмечалась у пациентов с прогрессирующей рецидивирующей и рефрактерной множественной меланомой, которые получали монотерапию карфилзомибом. Риск ее развития был выше у пациентов с исходно сниженным расчетным клиренсом креатинина (вычисленным по формуле Кокрофта-Голта). Необходимо установить наблюдение за функцией почек с регулярным контролем уровня сывороточного креатинина и/или расчетного значения клиренса креатинина. В зависимости от клинической ситуации следует уменьшить дозу или прекратить лечение.
СЛО
У пациентов, получавших карфилзомиб, отмечались случаи СЛО, включая летальные. Пациенты с множественной миеломой и большим размером опухоли должны рассматриваться как имеющие более высокий риск развития СЛО. Необходимо убедиться в достаточной гидратации пациентов перед применением карфилзомиба в цикле 1 и при необходимости в последующих циклах. У пациентов с риском развития СЛО следует рассмотреть применение ЛС, понижающих уровень мочевой кислоты. Необходимо установить наблюдение за проявлениями СЛО во время лечения и немедленно купировать их, включая приостановку применения карфилзомиба до разрешения СЛО.
Легочная токсичность
У <1% пациентов, получавших карфилзомиб, наблюдались острый респираторный дистресс-синдром, острая респираторная недостаточность и острое диффузное инфильтрирующее заболевание легких, такое как пневмонит и интерстициальное заболевание легких. Некоторые случаи были летальными. При проявлении медикаментозной легочной токсичности применение карфилзомиба необходимо прекратить.
Легочная гипертензия
Приблизительно у 1% пациентов, получавших карфилзомиб, отмечались случаи легочной артериальной гипертонии (ЛАГ), менее чем у 1% пациентов эти случаи были степени тяжести 3 или выше. Необходимо оценивать случаи ЛАГ с визуализацией сердца и/или с применением других рекомендуемых тестов. При возникновении ЛАГ необходимо прекратить применение карфилзомиба до разрешения или возвращения показателей к исходному уровню; возобновление применения карфилзомиба зависит от оценки соотношения польза/риск.
Одышка
Одышка отмечалась у 28% пациентов, получавших карфилзомиб, и у 4% пациентов она была степени тяжести 3 или выше. Необходимо оценить эти случаи для исключения сердечно-легочных осложнений, включая сердечную недостаточность и легочные синдромы. Следует прекратить применение карфилзомиба при одышке степени тяжести 3 или 4 до разрешения или возвращения к исходному уровню. Возобновление применения карфилзомиба зависит от оценки соотношения польза/риск.
Гипертония
При применении карфилзомиба наблюдались случаи гипертензии, включая гипертонический криз, некоторые из этих случаев были летальными. У всех пациентов необходимо осуществлять регулярный контроль АД. Если гипертензия не поддается адекватному контролю, необходимо прекратить применение карфилзомиба и произвести ее оценку. Возобновление применения карфилзомиба зависит от оценки соотношения польза/риск.
Венозный тромбоз
При применении карфилзомиба отмечались случаи венозной тромоэмболии, включая тромбоз глубоких вен и легочную эмболию. В исследовании комбинаций ЛС частота случаев венозной тромбоэмболии в первые 12 циклов составила 13% в группе получавших карфилзомиб по сравнению с 6% в контрольной группе. При монотерапии карфилзомибом частота случаев венозной тромбоэмболии составила 2%. Рекомендуются профилактические меры предотвращения тромбообразования, которые основаны на оценке предшествующих факторов риска пациента, режима лечения и клинического статуса.
Инфузионные реакции
У пациентов, получающих карфилзомиб, наблюдались инфузионные реакции, включая состояния, угрожающие жизни. Симптомы включают лихорадку, озноб, артралгию, миалгию, гиперемию кожи лица, отек кожи лица, рвоту, слабость, сбивчивое дыхание, гипотензию, обморок, стеснение в груди или ангину. Эти симптомы могут возникнуть сразу после применения карфилзомиба или в период до 24 ч после его применения. Для уменьшения частоты и снижения тяжести инфузионных реакций следует применить дексаметазон до начала терапии карфилзомибом. Пациент должен быть проинформирован о риске и симптомах таких реакций и необходимости немедленно сообщать медицинскому персоналу об их возникновении.
Тромбоцитопения
Карфилзомиб вызывает тромбоцитопению с надиром тромбоцитов, наблюдавшимся между 8-м и 15-м днем каждого 28-дневого цикла, при этом уровень тромбоцитов возвращался к исходному обычно к началу следующего цикла (см. «Побочные действия»). Тромбоцитопения отмечалась приблизительно у 40% пациентов в клинических испытаниях с карфилзомибом. Необходимо частое определение количества тромбоцитов в период лечения карфилзомибом. При необходимости следует уменьшить дозу карфилзомиба или прекратить его применение.
Гепатотоксичность и печеночная недостаточность
В период лечения карфилзомибом отмечались случаи печеночной недостаточности, включая смертельные (<1%). Карфилзомиб может вызывать повышение уровня сывороточных трансаминаз. Требуется регулярный контроль ферментов печени. При необходимости следует уменьшить дозу карфилзомиба или прекратить его применение.
ТТП/ГУС
У пациентов, получавших карфилзомиб, отмечались случаи ТТП/ГУС, в т.ч. с летальным исходом. Необходим мониторинг признаков и симптомов ТТП/ГУС. При подтверждении диагноза следует остановить лечение карфилзомибом и произвести дальнейшую оценку. Если диагноз ТТП/ГУС исключен, лечение карфилзомибом может быть возобновлено. Безопасность возобновления терапии карфилзомибом у пациентов с предшествующими случаями ТТП/ГУС неизвестна.
СОЗЭ
У пациентов, получавших карфилзомиб отмечались случаи СОЗЭ. СОЗЭ представляет собой неврологическое нарушение, которое может проявляться судорогами, головной болью, заторможенностью, спутанностью сознания, слепотой, изменением уровня сознания, а также другими зрительными и неврологическими нарушениями, наряду с повышением АД; диагноз подтверждается данными нейрорадиологической оценки. Если диагноз СОЗЭ подтвержден или предполагается, следует прекратить применение карфилзомиба. Безопасность возобновления лечения карфилзомибом у пациентов с предшествующим СОЗЭ неизвестна.
Токсическое действие на эмбрион и плод
Основываясь на механизме действия и наблюдениях у животных, карфилзомиб может вызывать повреждение плода при применении у беременных женщин. Адекватные и хорошо контролируемые исследования по применению карфилзомиба у беременных женщин не проводились. В дозах, которые были ниже рекомендованных для пациентов, карфилзомиб обладал эмбриофетальной токсичностью у беременных кроликов.
Женщины с репродуктивным потенциалом должны быть предупреждены о необходимости избегать наступления беременности в период лечения карфилзомибом. Если карфилзомиб применяется в период беременности или беременность наступила в период лечения этим ЛС, пациентка должна быть проинформирована о потенциальной опасности для плода.
Особые группы пациентов
Дети. Безопасность и эффективность применения карфилзомиба у детей не установлены.
Пожилые пациенты. Из 598 пациентов, получавших карфилзомиб, 293 (49%) были в возрасте ≥65 лет и 96 (16%) — в возрасте ≥75 лет. Средний возраст составил 64 года. Частота серьезных побочных реакций у пациентов в возрасте <65 лет составила 44%, в возрасте от 65 до 74 лет — 55% и в возрасте ≥75 лет — 56%. В исследовании 2 (N=266) не наблюдалось значительных различий в эффективности между этими группами и пациентами более младшего возраста.
Из 392 пациентов, получавших карфилзомиб в комбинации с леналидомидом и дексаметазоном, 185 пациентов (47%) были в возрасте ≥65 лет и 43 пациента (11%) — ≥75 лет. Средний возраст составлял 64 года. Не наблюдалось значительных различий в эффективности между этими группами и пациентами более младшего возраста. Частота серьезных побочных реакций у пациентов в возрасте <65 лет составила 50%, в возрасте от 65 до 74 лет — 70% и в возрасте ≥75 лет — 74%.
Почечная недостаточность. У пациентов со слабой, умеренной или тяжелой почечной недостаточностью или находящихся на хроническом гемодиализе коррекция стартовой дозы не требуется. Фармакокинетические параметры и безопасность карфилзомиба оценивались в клиническом испытании на стадии 2 у пациентов с нормальной функцией почек и со слабой, умеренной и тяжелой почечной недостаточностью и у пациентов, находящихся на хроническом гемодиализе. В этом исследовании на фармакокинетические параметры не влияла степень исходной почечной недостаточности, в т.ч. у пациентов, находящихся на хроническом гемодиализе. Так клиренс карфилзомиба во время диализа не изучался, его следует применять после процедуры диализа.
Печеночная недостаточность. Безопасность, эффективность и фармакокинетические параметры карфилзомиба у пациентов с печеночной недостаточностью не оценивались. Из клинических испытаний с применением карфилзомиба были исключены пациенты с соотношением АЛТ/АСТ ≥3×ВГН и уровнем билирубина ≥2×ВГН.
Сердечная патология. В клинические испытания не отбирались пациенты с сердечной недостаточностью III и IV функционального класса по классификации NYHA или с недавно перенесеннным инфарктом миокарда (в интервале 3–6 мес по различным протоколам). Безопасность карфилзомиба в этой популяции не оценивалась.
- Интернет-аптека
- Лекарства
-
Препараты для лечения онкологических заболеваний
Товары из категории — Препараты для лечения онкологических заболеваний
Инструкция по применению
Цена в интернет-аптеке WER.RU: от 29 000
Фармакологические свойства
Кипролис – медикаментозное средство, действие которого направлено на борьбу с раковыми новообразованиями. Это результативное антибластомное средство нового поколения. Медикамент был протестирован и исследован в лучших мировых лабораториях, прежде чем попасть на фармацевтический рынок.
Препарат используют в комплексной терапии, сочетая его дополнительно с лекарствами Леналидомид и Дексаметазон. Медикамент применяется для лечения миеломной болезни, когда другие способы терапии оказались недействительными в целях терапии.
В состав препарата входит активный действующий компонент карфилзомиб, который способен распознавать злокачественные клетки в организме, производя на них необходимый эффект, блокируя их рост и развитие, а также останавливая ход болезни.
Медикаментозное средство Кипролис способно замедлить рост и развитие злокачественных раковых клеток, не затрагивая при этом нормальные и здоровые клетки организма. Медикамент оказывает лечебное действие уже через час после приема, вывод компонентов препарата из организма начинается спустя 24 часа после введения. Препарат рекомендуется применять при заболеваниях почек и печени.
Состав и форма выпуска
Медикаментозное средство изготавливается в виде порошка, который предназначен для приготовления раствора, который используется для введения в вену. Порошок имеет белый или желтый цвет. Использовать разведенное средство рекомендуется сразу, остатки требуется утилизировать в соответствии с санитарными нормами.
В состав препарата входят следующие компоненты:
Показания к применению
Медикаментозное средство Кипролис используется для лечения миеломной болезни. Медикамент используется в качестве комплексной терапии в сочетании с Дексаметазоном и Леналидомидом, когда другие способы терапии оказались неэффективными.
Международная классификация болезней (МКБ-10)
С.90. Множественная миелома и злокачественные плазмоклеточные новообразования.
Побочные эффекты
Употребление медикамента способно оказаться причиной проявления у пациента ряда побочных эффектов:
При проявлении побочных признаков рекомендуется прекратить прием медикамента и обратиться к лечащему врачу за терапевтической помощью.
Нельзя принимать медикамент в период вынашивания ребенка.
Противопоказания
Медикаментозное средство Кипролис нельзя принимать пациентам при:
Нельзя принимать лекарственное средство детям, не достигшим 18-летнего возраста.
Применение при беременности
При прохождении курса терапии медикаментом рекомендуется использовать надежные противозачаточные средства, чтобы минимизировать риск наступления беременности в этот период, так как компоненты лекарства могут спровоцировать отрицательное воздействие на развитие и рост плода.
Не следует употреблять медикамент в период вынашивания ребенка, поскольку действие препарата Кипролис может быть токсичным для развивающегося в утробе матери плода. Принимать медикамент в этот период можно только в том случае, если есть угроза жизни матери.
В период прохождения терапии медикаментом лучше отказаться от грудного вскармливания, так как нет сведений о передаче компонентов лекарства через грудное молоко.
Способ и особенности применения
Медикаментозное средство Кипролис используется для внутривенного введения посредством капельницы. Рекомендуемая начальная дозировка составляет 10 минут с интервалом в два дня. Курс терапии составляет три недели. После прохождения курса врачи рекомендуют сделать двенадцатидневный перерыв, а затем возобновить терапию. Количество курсов определяет лечащий врач после проведения обследования пациента, определения клинической картины заболевания и сбора всех анализов.
Медикамент рекомендуется использовать только под контролем лечащего врача. Разрешено внедрение терапии препаратом Кипролис в качестве комплексной терапии.
Пациентам, страдающим заболеваниями почек и печени, не требуется корректировка дозировки. Кроме этого медикамент можно принимать пожилым пациентам и детям, достигшим 18-летнего возраста.
Вся информация о рекомендуемых дозировках и продолжительности терапии содержится в инструкции по применению.
Способ использования лекарства:
Медикаментозное средство Кипролис используется для внутривенного введения при помощи капельницы. Вводить медикамент должен исключительно лечащий врач, который следить за стерильностью всех инструментов, используемых для введения фармсредства. Нельзя смешивать медикамент с другими лекарственными средствами и растворами. Каждый флакон с порошком после разведения можно использовать только один раз. Остатки с разведенным порошком рекомендуется утилизировать в соответствии с санитарными нормами.
Рекомендуемая дозировка рассчитывается, исходя из массы тела и общей площади поверхности тела больного. Точную дозировку может определить только лечащий врач.
Правила приготовления раствора:
Взаимодействие с другими лекарствами
Медикаментозное средство используется в качестве комплексной терапии в сочетании с такими лекарствами, как Леналидомид и Дексаметазон.
Использовать медикамент можно только под наблюдением лечащего врача, при этом важно следить за показателями работы всех жизненноважных органов и компонентов. Особое внимание рекомендуется уделить пациентам, у которых есть проблемы с сердцем и сосудами.
Если медикаментозное средство используется в качестве моно лечения, то необходимо до начала терапии прибегнуть к медицинской подготовке пациента при помощи дексаметазона. Он вводится при помощи внутривенной инъекции или принимается внутрь организма. Использовать дексаметазон необходимо как минимум за полчаса до начала терапии Кипролисом, но не ранее чем за четыре часа.
Передозировка
При излишней дозировке Кипролиса у пациента могут проявиться неприятные симптоматические признаки:
При передозировке лекарством пациенту нужно обратиться к лечащему врачу для получения необходимой терапевтической помощи.
Аналоги
У медикаментозного средства в виде Кипролиса имеется несколько аналогов по составу и фармакологическому воздействию:
Условия продажи
Медикаментозное средство продается в аптечных пунктах только по назначению лечащего врача при наличии рецептурного листа из медицинского учреждения.
Условия хранения
Хранить лекарство следует в изолированном от досягаемости детьми и проникновении любых источников света месте при температуре, не превышающей 8°С. Нельзя замораживать медикамент. Инструкция содержит подробную информацию о сроках годности и хранения.
Цены на Кипролис в Москве
Заберите заказ в в аптеке
WER (г. Москва)
Цена: от 29 000 руб.
Сертификаты и лицензии
Скачать мобильное приложение WER.RU
Выгодные предложения для подписчиков