Клиническая диетология детского возраста: руководство для врачей
Тема в разделе «Разное», создана пользователем StrangerEv, 23 май 2014.
-
Боровик Т.Э.
Клиническая диетология детского возраста: руководство для врачейИздательство: Медицинское Информационное Агентство (МИА)
Жанр: ПедиатрияКачество: Хорошее
Страниц: 608
Формат: pdf, fb2, epubВ руководстве обобщен многолетний опыт коллектива сотрудников отделения питания здорового и больного ребенка Научного центра здоровья детей РАМН. Освещаются основные принципы построения лечебных рационов при заболеваниях соматического и наследственного генеза. Дается характеристика лечебных свойств отдельных групп специализированных продуктов, их состав, предназначение и возможность использования в диетотерапии у детей при алиментарно-зависимых состояниях, функциональных нарушениях желудочно-кишечного тракта, заболеваниях почек, органов пищеварения, пищевой непереносимости, ожирении, сахарном диабете. Рассматриваются вопросы питания детей при острых кишечных инфекциях, даются рекомендации по использованию диетотерапии в острый период заболевания и в период реконвалесценции. Дается характеристика лечебных диет, используемых при наследственных нарушениях обмена веществ. Отдельный раздел работы посвящен вопросам организации питания детей в стационарах и санаториях. Приводятся характеристика и составы каталогоспециализированных лечебных продуктов направленного действия, выпускаемых отечественной и зарубежной промышленностью. Для врачей-педиатров амбулаторно-поликлинической службы, детских больниц и санаториев различного профиля, детских нутрициологов и диетврачей.
Вложения:
Поделиться этой страницей

Скачать книгу (fb2, 608 страниц, 3 094 Kb)
Жанр: Педиатрия
Издательство: Медицинское Информационное Агентство (МИА), 2008
В руководстве обобщен многолетний опыт коллектива сотрудников отделения питания здорового и больного ребенка Научного центра здоровья детей РАМН. Освещаются основные принципы построения лечебных рационов при заболеваниях соматического и наследственного генеза. Дается характеристика лечебных свойств отдельных групп специализированных продуктов, их состав, предназначение и возможность использования в диетотерапии у детей при алиментарно-зависимых состояниях, функциональных нарушениях желудочно-кишечного тракта, заболеваниях почек, органов пищеварения, пищевой непереносимости, ожирении, сахарном диабете. Рассматриваются вопросы питания детей при острых кишечных инфекциях, даются рекомендации по использованию диетотерапии в острый период заболевания и в период реконвалесценции. Дается характеристика лечебных диет, используемых при наследственных нарушениях обмена веществ. Отдельный раздел работы посвящен вопросам организации питания детей в стационарах и санаториях. Приводятся характеристика и составы каталогоспециализированных лечебных продуктов направленного действия, выпускаемых отечественной и зарубежной промышленностью. Для врачей-педиатров амбулаторно-поликлинической службы, детских больниц и санаториев различного профиля, детских нутрициологов и диетврачей.
В руководстве обобщен многолетний опыт коллектива сотрудников отделения питания здорового и больного ребенка Научного центра здоровья детей РАМН.
Освещаются основные принципы построения лечебных рационов при заболеваниях соматического и наследственного генеза. Дается характеристика лечебных свойств отдельных групп специализированных продуктов, их состав, предназначение и возможность использования в диетотерапии у детей при алиментарно-зависимых состояниях, функциональных нарушениях желудочно-кишечного тракта, заболеваниях почек, органов пищеварения, пищевой непереносимости, ожирении, сахарном диабете.
Рассматриваются вопросы питания детей при острых кишечных инфекциях, даются рекомендации по использованию диетотерапии в острый период заболевания и в период реконвалесценции. Дается характеристика лечебных диет, используемых при наследственных нарушениях обмена веществ.
Отдельный раздел работы посвящен вопросам организации питания детей в стационарах и санаториях. Приводятся характеристика и составы каталогоспециализированных лечебных продуктов направленного действия, выпускаемых отечественной и зарубежной промышленностью.
Для врачей-педиатров амбулаторно-поликлинической службы, детских больниц и санаториев различного профиля, детских нутрициологов и диетврачей.
Термин «педиатрическая диетология» (ПД), появившийся в последние годы в отечественной литературе [1], обозначает мультидисциплинарную область знаний, раскрывающую теоретические и практические аспекты (медицинские, физиолого-биохимические, гигиенические) проблемы питания детей. Опираясь на современные достижения биохимии, молекулярной биологии, биофизики, а в последние годы также на новые дисциплины – нутриметаболомику, нутригеномику, нутригенетику [2–5] и др., ПД разрабатывает теоретические и практические принципы питания детей. При этом ПД может быть условно разделена на несколько основных направлений: питание детей 1-го года жизни, питание беременных и кормящих женщин, питание детей раннего возраста, питание дошкольников и школьников, лечебное питание детей. Каждый из указанных разделов опирается на достижения фундаментальных наук, которые используются для изучения особенностей питания детей соответствующих возрастов. Задачей настоящей статьи является краткое рассмотрение основных достижений и проблем этих направлений.
Термин «педиатрическая диетология» (ПД), появившийся в последние годы в отечественной литературе [1], обозначает мультидисциплинарную область знаний, раскрывающую теоретические и практические аспекты (медицинские, физиолого-биохимические, гигиенические) проблемы питания детей. Опираясь на современные достижения биохимии, молекулярной биологии, биофизики, а в последние годы также на новые дисциплины – нутриметаболомику, нутригеномику, нутригенетику [2–5] и др., ПД разрабатывает теоретические и практические принципы питания детей. При этом ПД может быть условно разделена на несколько основных направлений: питание детей 1-го года жизни, питание беременных и кормящих женщин, питание детей раннего возраста, питание дошкольников и школьников, лечебное питание детей. Каждый из указанных разделов опирается на достижения фундаментальных наук, которые используются для изучения особенностей питания детей соответствующих возрастов. Задачей настоящей статьи является краткое рассмотрение основных достижений и проблем этих направлений.
Питание детей первого года жизни
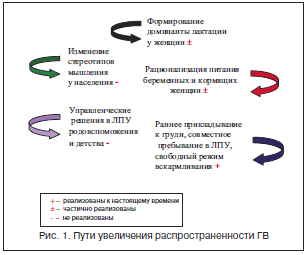
Это наиболее обширное и своеобразное направление ПД, что обусловлено особой ролью питания в данном возрастном периоде. Отсутствие запасов пищевых веществ и незрелость физиологических и метаболических процессов младенцев требуют постоянного сбалансированного поступления пищевых веществ как абсолютно необходимого условия не только здоровья, но и самой жизни ребенка [6]. Этим требованиям отвечает естественное вскармливание материнским молоком, которое является эволюционно закрепленным оптимальным способом питания младенцев. Материнское молоко не только обеспечивает детей всеми необходимыми пищевыми веществами в легкоусвояемой форме, но и оказывает положительное воздействие на психоэмоциональное развитие ребенка. В связи с этим одной из наиболее важных задач ПД являются теоретические исследования и разработка практических рекомендаций по поддержанию полноценной лактации у матерей. Исследования, проведенные нами и другими специалистами, позволили сформулировать основные направления работы по поддержке грудного вскармливания (ГВ) в РФ (рис. 1) [7, 8].
Следует подчеркнуть, что распространенность ГВ в РФ остается недостаточной, составляя в среднем по РФ в 4–5 мес. не более 40%. При этом распространенность ГВ варьирует в разных регионах, достигая в некоторых из них (Волгограде, Калмыкии, Красноярске) 80–90% [9, 10]. Это подтверждает нашу точку зрения о том, что основным фактором сохранения ГВ служит формирование устойчивой доминанты лактации, обеспечивающей поддержание ГВ, несмотря на различные неблагоприятные внешние обстоятельства (необходимость выхода на работу матери, усталость, заболевания и др.) [6, 8, 10, 11].
Другим интенсивно развивающимся направлением ПД является дальнейшее изучение состава и свойств женского молока. В последние годы выявлены новые компоненты грудного молока (ГМ) и оценена их биологическая роль. К числу таких компонентов относятся, в частности, полиненасыщенные жирные кислоты (ПНЖК) ω-6 и ω-3 семейств, пребиотики и пробиотики, нуклеотиды, каротиноид лютеин и др. [6].
Эти исследования важны не только с теоретической точки зрения как новые шаги к пониманию принципов жизнедеятельности младенцев, но и как основа для совершенствования состава и свойств заменителей женского молока, молочных смесей, составляющих основу искусственного вскармливания детей.
Интенсивные исследования, проведенные в последние десятилетия, позволили установить, что жирные кислоты ω-6 и ω-3 семейств выполняют в организме важнейшие, хотя и различные биологические функции. Эти функции связаны с их способностью служить предшественниками широкого спектра биологически активных веществ – эйкозаноидов, к числу которых относятся простагландины, простациклины, тромбоксаны и лейкотриены. Эти соединения, которые нередко называют тканевыми гормонами, проявляют многосторонние физиологические и метаболические эффекты, причем во многих случаях полярные. Так, тромбоксаны способствуют вазоконстрикции и повышают свертываемость крови, тогда как простациклины проявляют прямо противоположные эффекты. Следует особо подчеркнуть, что простагландины, присутствующие в женском молоке, принадлежат к числу ростовых факторов, необходимых для созревания и дифференцировки тонкого кишечника, а эйкозапентаеновая и докозагексаеновая жирные кислоты необходимы для нормального развития головного мозга и органа зрения младенцев [6, 12–15]. Сложность метаболических взаимоотношений, существующих между различными классами эйкозаноидов, усугубляется тем обстоятельством, что ключевым регуляторным звеном их образования из соответствующих предшественников, т.е. жирных кислот w-6 и w-3 семейств, служит одна и та же ферментная система (циклооксигеназа). Вследствие этого в организме существуют конкурентные отношения между тремя основными предшественниками синтеза различных эйкозаноидов – дигомо-у-линолевой (20:3, w-6), арахидоновой (20:4, w-6) и линоленовой (18:3, w-3) кислотами [6, 12, 13].
В условиях недостаточного созревания циклооксигеназы, в частности у недоношенных детей, синтез эйкозапентаеновой и докозагексаеновой жирных кислот, необходимых, как отмечалось, для нормального развития младенцев, резко снижается или прекращается. Поэтому недоношенные дети должны получать с пищей именно данные кислоты, а не их предшественника (линоленовую кислоту). В связи с этим были разработаны специализированные молочные смеси для недоношенных детей, содержащие в качестве добавок препараты рыбьего жира и масла, выделенные из одноклеточных грибов и водорослей как источники эйкозапентаеновой и докозагексаеновой жирных кислот. В последние годы смеси, обогащенные w-3 ПНЖК, используются также в питании доношенных детей первого года жизни [6, 16, 17].
В последние годы в питании детей широко используются пре- и пробиотики. Использование пребиотиков в детском питании основано на представлении о том, что кишечная микрофлора нуждается в постоянном обеспечении нутриентами и факторами роста [18], которые в случае вскармливания младенцев материнским молоком обозначаются термином «бифидогенные факторы» [6, 18]. Выявление природы этого фактора показало, что ведущая роль в бифидогенном действии молока принадлежит олигосахаридам женского молока [19, 20].
В женском молоке выявлено более 130 различных олигосахаридов. Их содержание составляет 12–14 г/л, так что они занимают 3-е место среди других нутриентов молока (после лактозы и жира). Примечательно, что содержание олигосахаридов в коровьем молоке существенно ниже (0,5–1,0 г/л). Большинство олигосахаридов включает галактозу, а также другие виды гексоз, аминосахаров и сиаловые кислоты. Доказано, что большая часть олигосахаридов женского молока не переваривается в верхних отделах ЖКТ и поступает в неизменном виде в толстый кишечник, где и служит субстратом для бифидо- и лактобактерий [19, 20]. Существует предположение, что эти компоненты олигосахаридов молока используются бифидобактериями непосредственно для построения их клеточных стенок. Однако физиологические эффекты олигосахаридов женского молока не исчерпываются их бифидогенным действием. Их другим важнейшим свойством является способность вступать в конкурентные взаимоотношения с патогенными микроорганизмами за связывание с кишечными рецепторами и тем самым оказывать защитное действие в отношении инфекций, преимущественно кишечных. Именно эти две функции олигосахаридов женского молока в сочетании с наличием в нем ряда других защитных факторов (макрофагов, иммуноглобулинов, лактоферрина и др.) позволяют говорить о протекторной роли женского молока в отношении развития кишечных инфекций у детей.
На основании изучения структуры олигосахаридов женского молока были синтезированы сходные с ними галактоолигосахариды (ГОС), которые в настоящее время широко используются в качестве функциональных компонентов молочных смесей – заменителей женского молока.
По своей структуре они сходны с олигосахаридами женского молока. ГОС являются субстратом для всех линий бифидобактерий, но не для всех линий лактобактерий [6, 21, 22].
Другая группа пребиотиков относится к фруктанам, которые включают инулин и олигофруктозу, или собственно фруктоолигосахариды (ФОС). Инулин представляет собой полимер, построенный из мономеров фруктозы и глюкозы. Он состоит из линейных цепей глюкозы-фруктозы, соединенных β-глюкозидной (2→1) связью в структуре с числом таких мономеров от 2 до 65 [23, 24]. Инулин получают, как правило, горячей экстракцией цикория. Он содержится также в топинамбуре, бананах, пшенице, луке, спарже и др.
ФОС включают глюкозо-фруктозную цепь (2<n<8) и фруктозу (2<n<9). Их получают путем гидролиза инулина. ФОС служат субстратом для бифидо- и лактобактерий.
Лактулоза – изомер лактозы, который, в отличие от самой лактозы, не расщепляется лактазой (β-галактозидазой) в тонком кишечнике младенцев и поступает в нерасщепленном виде в толстый кишечник, где служит субстратом бифидобактерий [6, 18].
Основные представления о биологических эффектах пребиотиков представлены в таблице 1 [6, 21, 22].
Как видно из таблицы, эти эффекты не ограничиваются основной функцией пребиотиков – служить субстратом для бифидо- и лактобактерий, но включают и другие важные эффекты. Наряду с бифидогенным действием, пребиотики стимулируют перистальтику кишечника, способствуют всасыванию кальция и тем самым снижают риск развития остеопороза, оказывают гипохолестеринемическое действие. «Бифидогенное» (а точнее, бифидо- и лактогенное) действие различных пребиотиков доказано в ряде исследований, проведенных как у детей (в т. ч. недоношенных младенцев) и взрослых, так и в опытах на животных, причем три из них выполнены в соответствии с требованиями доказательной медицины [21, 22, 25, 26].
В самые последние годы были получены данные, указывающие на новый аспект бифидогенного действия ГМ, связанный с обнаружением в нем не только пребиотиков-олигосахаридов, но и пробиотиков, что позволяет рассматривать его как симбиотический продукт. Вначале в женском молоке были выявлены лактобактерии, а в последние годы – живые бифидобактерии [27].
Было доказано, что обнаружение бифидобактерий в ГМ не является следствием контаминации молока бифидобактериями кожи или другими посторонними объектами [27, 28].
Дальнейшие исследования показали, что особый интерес среди различных видов лактобактерий, присутствующих в грудном молоке, представляют Lactobacillus fermentum Hereditum, которые продуцируют защитные соединения (короткоцепочечные жирные кислоты (КЦ ЖК) и глютатион), способствующие поддержанию структурной целостности клеток кишечника. В серии работ была доказана высокая пробиотическая активность и безопасность одного из видов лактобактерий – Lactobacillus fermentum, выделенного из женского молока, что послужило предпосылкой к созданию новой линии смесей, обогащенных пробиотиками, содержащимися в ГМ, и тем самым приближению их состава к составу ГМ – «золотому стандарту» питания младенцев [27–30].
Проведенные клинические исследования показали, что у детей, получавших смесь, содержащую Lactobacillus fermentum, общее число инфекций было на 30% ниже, чем в группе сравнения (частота 1,464 против 2,077 у детей, получавших смесь сравнения). Частота инфекций ЖКТ была также достоверно ниже (на 46%) у детей, получавших смесь с Lactobacillus fermentum (частота 0,196 против 0,363), а частота инфекций верхних дыхательных путей – на 27% ниже (соответственно 0,969 и 1,330) [29].
Представленные данные свидетельствуют о новом этапе развития проблемы пробиотиков и, в частности, их использовании в искусственном вскармливании младенцев [30].
Нуклеотиды – низкомолекулярные азотсодержащие соединения, присутствующие в значительных количествах в женском молоке. Ряд исследований показал, что они проявляют важные физиологические эффекты, среди которых в первую очередь следует указать на иммуностимулирующее действие, а также способность стимулировать рост и развитие кишечника и положительно влиять на функции печени. Исследования, проведенные в контролируемых условиях, показали, что обогащение заменителей женского молока нуклеотидами достоверно снижает частоту инфекционных заболеваний среди детей первого года жизни в сравнении с детьми, получавшими тот же заменитель, но не обогащенный нуклеотидами [31, 32].
Важным достижением ПД в последние годы явилось доказательство важной физиологической роли каротиноида – лютеина, содержащегося в женском молоке. Было показано, что лютеин играет важную роль в антиоксидантной защите нейросетчатки и оказывает протекторное действие в отношении голубого света (λ=476 нм), повреждающего нейросетчатку. Все это послужило основанием для создания адаптированных молочных смесей, обогащенных лютеином, и проведения контролируемых исследований, подтвердивших нормальную переносимость и способность таких смесей обеспечивать адекватный рост детей [33, 34].
Другим существенным вопросом вскармливания детей 1-го года жизни является вопрос о режиме вскармливания. В течение многих лет в нашей стране господствовал принцип кормления ребенка строго по часам, с соблюдением оптимальных перерывов между кормлениями. Однако проведенные нами исследования показали значительное преимущество свободного вскармливания (СВ) (вскармливания по требованию ребенка, т.е. прикладывание ребенка к груди столько раз и в такое время, в какое требует ребенок, включая ночные часы). Результаты исследований показали, что при свободном вскармливании объем лактации в первую неделю после родов в 1,5 и более раза выше, чем при вскармливании по часам, при этом «удельное» содержание (т.е. содержание в расчете на 1 мл молока) белков, жиров, витаминов, активность ряда ферментов не ниже, а в ряде случаев выше, чем при вскармливании по часам. Следствием этого является большая суммарная (суточная) секреция с молоком основных пищевых веществ. Тенденция к бо́льшему объему лактации и бо́льшей секреции с молоком пищевых веществ при свободном вскармливании, чем при вскармливании «по часам», сохраняется и в последующие периоды лактации [35, 36].
Свободное вскармливание оказывает положительное влияние на становление лактации, длительность ГВ, состояние здоровья и физическое развитие ребенка, его психоэмоциональное развитие [6, 35, 36].
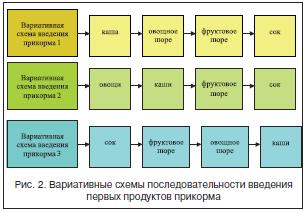
Одним из важных вопросов организации вскармливания детей 1-го года жизни является их обеспечение дополнительным (к женскому молоку или его заменителям) количеством нутриентов, обозначаемым в РФ как «прикорм» (beikost или complementary foods в обозначении зарубежных авторов). Традиционные для РФ многолетние дискуссии, касающиеся сроков и последовательности введения продуктов и блюд прикорма, к настоящему времени в известной мере стихли, и в педиатрическом сообществе преобладает следующая точка зрения на оптимальный срок введения прикорма, закрепленная в Национальной программе оптимизации вскармливания детей первого года жизни в Российской Федерации: дети, находящиеся на исключительно ГВ, могут обходиться без прикорма до 6 мес., дети на искусственном вскармливании нуждаются в прикорме в период с 4 до 6 мес. в зависимости от скорости их роста, состояния здоровья, аппетита и других факторов. Что касается последовательности введения продуктов и блюд прикорма, то контролируемое клинико-физиологическое исследование, проведенное в НИИ питания РАМН, подтвердило возможность изменения существующей схемы введения прикорма и введения в качестве первого продукта прикорма не фруктового сока, а безмолочной безглютеновой каши без сахара [37]. Эти данные были подтверждены затем в независимом исследовании, проведенном в НЦЗД РАМН. Учитывая полученные результаты, можно говорить о том, что вместо единой схемы введения прикорма, действующей в стране много лет [6], можно использовать вариативные, учитывающие индивидуальные особенности каждого ребенка [6, 37] (рис. 2).
Питание беременных женщин
Положение о том, что организация правильного питания беременных женщин является одним из важных условий нормального течения и благополучного исхода беременности, поддержания здоровья беременной женщины и обеспечения адекватного роста и развития плода, а затем новорожденного ребенка [6] является одним из ключевых в ПД. Оно приобрело особую значимость в свете развития концепции программирующего влияния особенностей питания в раннем детском возрасте на здоровье в последующие годы.
В соответствии с этой концепцией, впервые сформулированной в работах E. Widdowson (1963), J. Dorner (1974), D. Barker (1992–2000), A. Lucas (1991–2005), различные воздействия, в т.ч. алиментарные, в критические (или чувствительные) периоды раннего онтогенеза могут оказывать значительное влияние на здоровье человека в отдаленном периоде [38–40].
Неполноценное питание беременных женщин является одним из факторов, способствующих развитию анемий, гестозов и фетоплацентарной недостаточности, которая нередко является причиной перинатальной патологии [41–43].
При обосновании принципов рационального питания беременных женщин было указано на необходимость иметь в виду две стороны проблемы. С одной стороны, это рост и развитие плода, требующие его адекватного снабжения энергией и всем комплексом незаменимых и заменимых факторов питания; с другой – обеспечение всеми необходимыми пищевыми веществами самой беременной женщины с учетом физиологических изменений, происходящих в период беременности, и необходимости поддержания ее здоровья и комфортного самочувствия на всех этапах беременности.
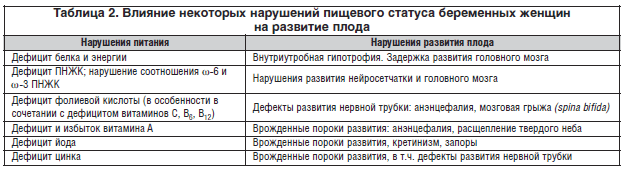
Установлено, что плод требует для адекватного роста и правильной дифференцировки органов и тканей строго определенных и сбалансированных количеств «строительных блоков», которыми служат для него многочисленные пищевые вещества. При этом неблагоприятные, и в т.ч. тератогенные эффекты, может вызвать не только дефицит, но и избыток пищевых веществ (табл. 2).
Классическим примером роли дефицита пищевых веществ в рационах беременных женщин в нарушении эмбрионального развития являются данные о тяжелых врожденных дефектах, возникающих при дефиците фолиевой кислоты.
Установлено, что именно дефицит этого нутриента лежит в основе таких тяжелых уродств плода, как анэнцефалия, мозговая грыжа, spina bifida. Указанные дефекты развития нервной трубки ежегодно возникают у 300–400 тыс. детей в мире. В то же время своевременное назначение женщинам чрезвычайно малых количеств фолиевой кислоты (200–400 мкг/сут.) является эффективным средством профилактики данной патологии.
Сходные дефекты развития нервной трубки могут возникать у плода при дефиците другого микронутриента – цинка.
Чрезвычайно актуальной является проблема адекватного обеспечения беременной женщины кальцием и железом.
Кальций абсолютно необходим ребенку для построения костей и зубов. Поэтому при его недостаточном поступлении в организм матери с пищей происходит мобилизация эндогенного кальция из костей, зубов и других тканей женщины, который и восполняет плоду дефицит пищевого кальция. Следствием этого может служить развитие остеопороза и поражение зубов (вплоть до их выпадения) у беременной женщины.
Что касается железа, то его достаточное поступление в организм беременной женщины является необходимым условием отложения его запасов в организме плода, что в свою очередь служит одним из основных факторов профилактики железодефицитной анемии у детей первого года жизни, широко распространенной среди российских детей.
Следует указать, что физиологические потребности беременной женщины меняются в разные сроки беременности. В первом триместре энерготраты женщины меняются относительно незначительно, поскольку, с одной стороны, женщина продолжает работать и вести активный образ жизни, а, с другой стороны, дополнительные потребности в энергии, необходимые для обеспечения роста плода, невелики, учитывая его небольшие размеры на этом этапе беременности. Основным условием правильного питания в данный период является достаточное разнообразие рациона и включение в него всех групп продуктов, а также обогащение его всеми необходимыми витаминами и микроэлементами.
В отличие от первого триместра беременности второй и третий триместры характеризуются значительными изменениями физиологических процессов и повышением потребности в энергии и пищевых веществах. Эти изменения обусловлены значительным увеличением размеров плода и необходимостью дополнительного его обеспечения пищевыми веществами и энергией, а также ростом плаценты.
В связи с этим во втором и третьем триместрах беременности необходимо повышать содержание в рационах питания белка, кальция, железа, пищевых волокон и, напротив, ограничивать потребление соли и жидкости.
Таким образом, основными принципами питания беременных женщин служат:
1. Полное удовлетворение физиологических потребностей женщин в энергии и всех пищевых веществах, в т.ч. аминокислотах, жирных кислотах, витаминах, минеральных солях, микроэлементах.
2. Максимальное разнообразие пищевых рационов с включением в них всех групп продуктов.
3. Сохранение пищевых стереотипов, если до наступления беременности питание женщины было достаточно адекватным.
4. Обеспечение дополнительного поступления с пищей:
• энергии, необходимой для роста плода, формирования плаценты, обеспечения перестройки метаболических процессов в организме женщины;
• белка, необходимого для роста плода, плаценты, матки, грудных желез;
• кальция и железа, необходимых для кальцификации скелета плода и формирования депо железа в организме матери и плода;
• пищевых волокон, необходимых для нормальной перистальтики кишечника.
5. Дополнительный прием витаминно-минеральных препаратов.
6. Ограниченное потребление соли и соленых продуктов, а также жидкости, способствующих развитию отеков.
7. Ограничение продуктов с высокой сенсибилизирующей активностью (облигатных аллергенов), а также продуктов, содержащих эфирные масла (лук, чеснок), специи и пряности, значительное число искусственных консервантов, красителей и стабилизаторов.
8. Щадящая кулинарная обработка.
9. Максимальный учет индивидуальных потребностей женщин.
10. Широкое использование специализированных продуктов питания для беременных женщин, обогащенных белком, эссенциальными жирными кислотами, витаминами, минеральными солями [6, 44, 45].
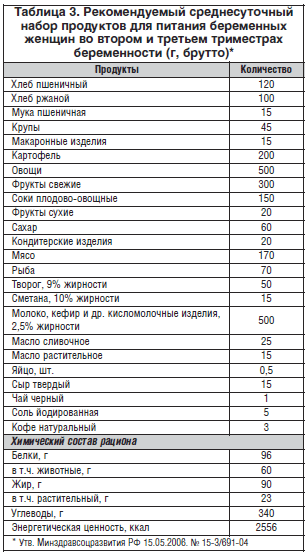
Исходя из этих принципов, нами был разработан примерный среднесуточный набор продуктов для питания беременных женщин во втором и третьем триместрах беременности (табл. 3).
Учитывая необходимость дополнительного поступления в организм женщин во втором и третьем триместрах беременности белка, пищевых волокон, витаминов, кальция и железа, целесообразно рекомендовать женщинам дополнительное включение в рацион специализированных продуктов.
Важным условием правильного питания женщины во время беременности, особенно во вторую ее половину, является щадящая кулинарная обработка (отваривание и тушение, но не жарение) мяса, рыбы, овощей, поскольку при обжаривании продуктов возникают перекиси липидов и продукты их дальнейшего распада, которые могут вызывать раздражение слизистой желудка и кишечника и инициировать усиление ПОЛ в организме беременной женщины, являющихся одним из патогенетических механизмов развития гестозов у женщин.
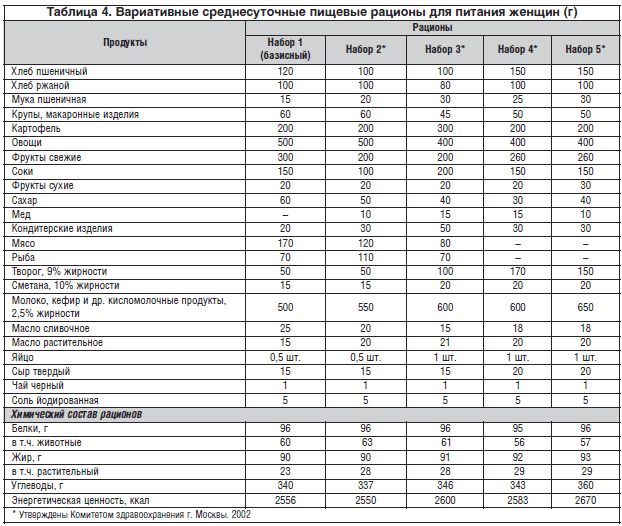
Серьезной проблемой является организация питания беременной женщины с явлениями токсикоза (тошнотой, рвотой и т.д.), сопряженного, как было отмечено, со значительными изменениями в пищевых пристрастиях, возникновением пищевых извращений и крайней изменчивостью аппетита. Нередко одним из основных нарушений аппетита у женщины в этом состоянии является негативное отношение к мясу на фоне хорошей переносимости молока и молочных продуктов, а также яиц и рыбы. В связи с этим нами было разработано 5 низокалорийных и низкобелковых рационов, различающихся, однако, по источникам животного белка, а также по содержанию некоторых других продуктов (табл. 4).
Как видно из таблицы, в рационе № 1 (базовый) мясо составляет около 40% от общего количества животных белков, тогда как в 4 и 5 рационах оно отсутствует вовсе. В то же время доля творога повышается с 14% в 1 рационе до 50% – в рационе № 5. В рационах № 3, 4 и 5 в 2 раза выше, чем в рационах 1, 2 количество яиц. Представленные наборы могут рассматриваться как один из подходов к индивидуализации питания беременных женщин с учетом состояния их здоровья, пищевых привычек; размера семейного бюджета; сезона года и других факторов, что соответствует современной тенденции к персонифицированному питанию здоровых и больных людей.
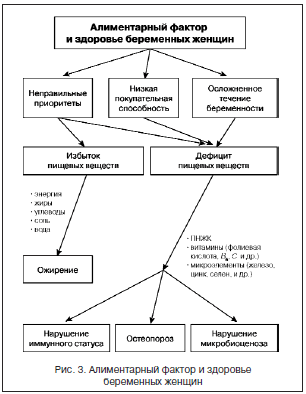
Следует подчеркнуть, что одной из важных причин нарушений питания женщин в период беременности является недостаточность знаний населения РФ о принципах и критериях здорового питания. В связи с этим обучение женщин принципам рационального питания может способствовать профилактике алиментарно-зависимых нарушений в период беременности. При этом чрезвычайно важно обеспечить непрерывность обучения женщин основам правильного питания, начиная с самого раннего возраста, а затем на разных этапах жизни и, безусловно, в период беременности, через систему школ молодых матерей. Следует указать, что несмотря на достаточно серьезную проработку и опыт использования принципов правильного питания беременных женщин, многие вопросы требуют дальнейшего изучения. К ним, в частности, относятся проблемы обеспечения адекватной массы тела, костной плотности, поддержка адекватного иммунного статуса (рис. 3).
Питание дошкольников и школьников
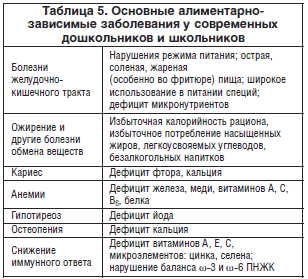
Наряду с проблемами питания детей 1-го года жизни и беременных женщин немалое место в ПД занимает в последние годы проблема питания дошкольников, и особенно школьников, в организованных коллективах, актуальность которой следует из многочисленных данных, указывающих на связь ряда заболеваний дошкольников и школьников с нарушением их питания (табл. 5) [6, 46].
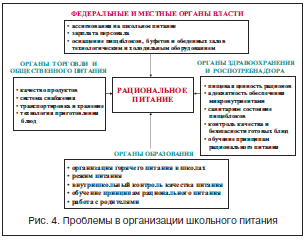
К числу наиболее значимых отклонений в состоянии питания дошкольников и школьников РФ относится избыточное потребление насыщенных жирных кислот [46, 47], сниженное потребление ω-3 ПНЖК, избыточное потребление соли, специй, сахара. Эти нарушения обусловлены неоптимальным построением рационов фактического питания, характеризующихся избыточным потреблением жирного мяса, продуктов фаст-фуд (чипсы, сухарики), колбасных изделий, продуктов и блюд, содержащих значительное количество соли, сладких безалкогольных напитков, кондитерских изделий. В связи с этим очевидна важная роль питания детей в ДОУ и школах, где они проводят значительную часть своего времени и, соответственно, должны получать значительную часть необходимой им энергии и нутриентов. Эта квота составляет 70–80% для воспитанников ДОУ и 50–60% – для учащихся обычных общеобразовательных школ [6, 48, 49]. При всей очевидности путей оптимизации их питания, заключающихся в обеспечении детей всеми необходимыми нутриентами, задача многократно усложняется в связи с многочисленными организационными и финансовыми проблемами, в особенности в случае организации школьного питания (рис. 4).
В частности, до настоящего времени остается спорным вопрос об оптимальном способе организации школьного питания, т.е. либо его максимальной централизации и индустриализации, при которой блюда готовят в крупных пищеблоках (школьно-базовых столовых и др.) и доставляют специализированным транспортом в школы, либо приготовлении пищи непосредственно в школах. Каждый из этих подходов имеет свои достоинства и недостатки [46, 50], что наглядно подтверждает эксперимент по совершенствованию организации школьного питания, который проходил в РФ в последние годы. Результаты эксперимента убедительно подтвердили возможность значительного улучшения организации школьного питания и, соответственно, состояния здоровья школьников как результат финансовой поддержки и, главное, внимания руководства регионов к проблеме школьного питания.
Важное место в ПД дошкольников и школьников занимает разработка нормативных документов, регламентирующих организацию питания этих контингентов детей. К числу таких документов относятся, в частности, упомянутые СанПиН 2.4.1.2660-10 «Санитарно-эпидемиологические требования к устройству, содержанию и организации режима работы в дошкольных организациях», СанПиН 2.4.5.2409-08 «Санитарно-эпидемиологические требования к организации питания обучающихся в общеобразовательных учреждениях, учреждениях начального и среднего профессионального образования», а также «Методические рекомендации по организации питания обучающихся (воспитанников) в образовательных учреждениях» (утв. Минздравсоцразвития РФ и Минобрнауки РФ, 2012).
Некоторые проблемы лечебного
питания детей
Наряду с рассмотренными вопросами питания здоровых детей и беременных женщин важное место в ПД занимают проблемы, связанные с лечебным питанием. При этом, так же как и в случае здоровых детей, подходы к диетотерапии детей первого года жизни существенно отличаются от подходов к диетотерапии детей более старшего возраста и взрослых. Это обусловлено, в первую очередь, особенностями физиологических и метаболических потребностей детей первого года жизни, идеальное удовлетворение которых возможно только при осуществлении вскармливания материнским молоком. Вторая причина, по существу являющаяся следствием первой, связана с особенностями патологии детей раннего возраста, в структуре которой значительное место занимают заболевания, обусловленные метаболической и функциональной незрелостью организма в этом возрасте и, в частности, незрелостью ферментативных процессов, регуляции проницаемости слизистой кишечника и других барьеров, иммунного ответа [6].
Особенностью диетотерапии детей первого года жизни является широкое использование специализированных продуктов питания промышленного выпуска, являющееся основой организации лечебного питания у этих детей.
Данные продукты включают:
1. Продукты для коррекции наследственных болезней обмена аминокислот и других метаболических нарушений. К ним относятся, в частности, продукты для питания детей с фенилкетонурией, метилмалоновой или пропионовой ацидемией, лейцинозом (болезнью кленового сиропа), глутаровой ацидурией 1-го типа, гистидинемией.
2. Продукты для лечения и профилактики пищевой непереносимости и пищевой аллергии (продукты на основе гидролизатов белка, белков сои, белков козьего молока и др.).
3. Безглютеновые продукты для детей с целиакией [6, 51, 52].
Широкий ассортимент продуктов лечебного питания промышленного выпуска и возможность их использования в педиатрической практике справедливо рассматриваются как одно из наиболее значимых достижений в ПД.
Что касается диетотерапии детей старшего возраста, то ее основные подходы в значительной мере сходны с подходами к диетотерапии взрослых людей, отличаясь от них, главным образом, количественными характеристиками, обусловленными возрастными особенностями детей.
В порядке иллюстрации приведем данные о значении диетотерапии в профилактике и лечении ожирения и гипертонической болезни у детей.
Распространенность ожирения в США и европейских странах прогрессивно растет в последние годы, что дает основание говорить об эпидемии ожирения. Изучение распространенности избыточной массы тела и ожирения, проведенное в последние годы в РФ, также указывает на их рост. В частности, средняя распространенность ожирения в РФ составила у мальчиков в 1994 г. 8,9%, в 2000 г. – 7% и в 2005 г. – 9%, а у девочек 4,9; 4 и 6% соответственно. Средние значения распространенности ожирения у дошкольников и школьников г. Москвы составляли в 2009 г. 9,6% – у мальчиков и 7,9% – у девочек. У мальчиков они максимальные в 5–9 лет (12–15%), а у девочек – в 5 и 10 лет (17 и 12,5% соответственно). В то же время у подростков 16–18 лет распространенность ожирения была минимальной (0–3%) [53].
Значительная частота ожирения и избыточной массы тела у детей делает чрезвычайно актуальной не только профилактику, но и совершенствование методов их лечения. Значительный опыт, накопленный в Клинике лечебного питания НИИ питания РАМН при обследовании и лечении более 1000 детей с ожирением и избыточной МТ, позволил разработать соответствующие стандарты диагностики и лечения этой патологии [54]. Приоритетные данные были получены при оценке включения в гипокалорийный рацион ω-3 ПНЖК (5 капсул рыбьего жира ежедневно в течение 2 нед.). Было показано, что прием в течение 2 нед. детьми ω-3 ПНЖК тормозил (по сравнению с контрольной группой) накопление эйкозапентаеновой кислоты в мембранах эритроцитов, имевшее место у детей с ожирением. Это предполагает снятие блока метаболизации данной кислоты в ее длинноцепочечные и противовоспалительные производные.
Впервые в нашей стране проведено определение двух видов эндоканнабиноидов – 2-архидоноилглицерола (АГ) и арахидоноилэтаноламида (АЭ) и доказано их присутствие в крови у здоровых детей и детей с ожирением. Обогащение рациона детей с ожирением ω-3 ПНЖК уменьшило в их крови уровень 2-АГ – основного эндогенного каннабиноида, участвующего в контроле аппетита и липогенеза, что может способствовать повышению эффективности диетотерапии у детей с ожирением [55].
Новым направлением ПД является разработка методов диетотерапии сердечно-сосудистых заболеваний и, в частности, артериальной гипертензии у детей. Это направление представляется важным как с точки зрения ранней профилактики артериальной гипертензии и эффективного подхода к снижению заболеваемости и смертности в старшем возрасте, так и с позиции совершенствования терапии артериальной гипертензии у детей, распространенность которой значительно возросла в РФ в последние годы [56].
Тем не менее, до самого последнего времени в РФ отсутствовали специализированные методы диетотерапии артериальной гипертензии у детей. В связи с этим нашим отделом совместно с детским клиническим санаторием «Малаховка» была разработана специальная диета для детей с оптимизированным жирнокислотным составом и доказана ее способность снижать артериальное давление у детей [57]. Очевидно, что эти исследования требуют продолжения и расширения применительно к другим видам сердечно-сосудистых заболеваний у детей.
Таким образом, представленные данные о некоторых направлениях теоретических и практических исследований в области ПД свидетельствует об интенсивном развитии этого раздела науки и эффективности использованных подходов для сохранения здоровья детей разного возраста.
Литература
1. Конь И.Я. Некоторые актуальные проблемы современной детской диетологии (нутрициологии) // Вопр. дет. диетологии. 2003. № 1 (1). С. 8–16.
2. Mutch D.M., Wahli W., Williamson G. Nutrigenomics and nutrigenetics: the emerging faces of nutrition. Review // The FASEB J. 2005. Vol. 19. P. 1602–1612.
3. Ferguson L.R. Nutrigenomics Approaches to Functional Foods. Review // J. Am. Diet. Assoc. 2009. Vol. 109. P. 452–458.
4. Fenech M.F., El-Sohemy A., Cahill L. et al. Nutrigenetics and Nutrigenomics: Viewpoints on Current status and Applications in Nutrition Research and Dietetics Practice // J. Nutrigenet. Nutrigenom. 2011. Vol. 4 (2). P. 69–89.
5. Nutrigenetics and Nutrigenomics / Еds. A.P. Simopoulos, J.M. Ordovas N.Y.: Karger, 2004.
6. Детское питание. Руководство для врачей / Под ред. В.А. Тутельяна, И.Я. Коня. – 3-е изд., перераб. и доп. М.: МИА, 2013. 744 с.
7. Воронцов И.М., Фатеева Е.М. Естественное вскармливание детей. Его значение и поддержка. СПб.: Фолиант, 1998.
8. Гмошинская М.В. Биологические и психологические аспекты грудного вскармливания // Вопр. дет. диетологии. 2007. № 5 (5). С. 40–45.
9. Абольян Л.В. Больница, доброжелательная к ребенку: реализация принципов ВОЗ и российских ЛПУ // Здравоохранение. 2011. № 1. С. 58–65.
10. Конь И.Я., Гмошинская М.В., Боровик Т.Э. и др. Результаты мультицентрового исследования особенностей вскармливания детей в основных регионах Российской Федерации. Сообщение 1. Распространенность грудного вскармливания и факторы, влияющие на продолжительность лактации // Вопр. дет. диетологии. 2006. № 4 (2). С. 5–8.
11. Гмошинская М.В. Актуальные вопросы поддержки грудного вскармливания в Российской Федерации // Вопр. дет. диетологии. 2008. Т. 6, № 1. С. 16–26.
12. Конь И.Я., Шилина Н.М., Вольфсон С.Б., Георгиева О.В. Использование полиненасыщенных жирных кислот в питании здоровых детей // Леч. врач. 2006. № 1. С. 42–47.
13. Шилина Н.М. Современные представления о роли полиненасыщенных жирных кислот в питании беременных женщин, здоровых и больных детей: новые аспекты // Вопр. питания. 2010. Т. 79 (5). С. 15–23.
14. Barman M., Johansson S., Hesselmar B. et al. High Levels of Both n-3 and n-6 Long-Chain Polyunsaturated Fatty Acids in Cord Serum Phospholipids Predict Allergy Development // PLOS ONE. 2013. Vol. 8(7): e67920. doi:10.1371/journal.pone.0067920.
15. Colombo J., Carlson S.E., Cheatham C.L. et al. Long-term effects of LCPUFA supplementation on childhood cognitive outcomes // Am. J. Clin. Nutr. 2013. Vol. 98(2). P. 403–412.doi:10.3945/ajcn.112.040766.
16. Koletzko B., Agostoni C., Carlson S. et al. Long chain polyunsaturated fatty acid (LC-PUFA) and perinatal development // Acta Paediatr. Scand. 2011. Vol. 90. P. 460–465.
17. Drover J., Hoffman D.R., Castaneda Y.S. et al. Three randomized controlled trials of early long-chain polyunsaturated Fatty Acid supplementation on means-end problem solving in 9-month-olds // Child. Dev. 2009. Vol. 80 (5). P. 1376–1384.
18. Gibson G.R., Roberfroid M.B. Dietary modulation of the human colonic microbiota – introducing the concept of prebiotic // J. Nutrition. 1995. Vol. 125. P. 1401–1412.
19. Kunz C., Koletzko B. et al. Nutritional and biochemical properties of human milk, part I. General aspects, proteins and carbohydrates // Clin. Perinatol. 1999. Vol. 26. P. 307–333.
20. Kunz C., Baier W. et al. Oligosaccharides in human milk: structural, functional, and metabolic aspects // Ann. Rev. Nutr. 2000. Vol. 20. P. 699–722.
21. Moro G., MinoliI., Mosca M. et al. Dosage related bifidogenic effects of galacto- and fructo-oligosaccharides in formula fed term infants // J. Pediatr. Gastroenterol. Nutr. 2002. Vol. 34. P. 291–295.
22. Boehm G., Fanaro S., Jelinek J. et al. Prebiotic concept for infant nutrition // Acta Paediatr. 2003. 91(441). Suppl. P. 64–67.
23. Roberfroid M., Robertson D. Effect of inulin and oligofructose on health and well-being // Brit. J. Nutr. 2005. Vol. 9 (Suppl. 1). P. 1–27.
24. Roberfroid M. Inulin-type fructans: functional food ingredient // J. Nutr. 2007. Vol. 137. P. 2493–2502.
25. Braegger C., Chmielevska A., Desci T. et al. Supplementation of infant formula with probiotics and/or prebiotics: a systematic review and comment by ESPGHAN Commitee on Nutrition // J. Pediatr. Gastroenterol. Nutr. 2010.
26. Конь И.Я., Сафронова А.И., Абрамова Т.В. и др. Каши с инулином в питании детей раннего возраста // Росс. вестн. перинатол. и педиатрии. 2012. № 3. С. 106–110.
27. Martín R., Jiménez E., Heilig H. et al. Isolation of bifidobacteria from breast milk and assessment of the bifidobacterial population by PCR-denaturing gradient gel electrophoresis and quantitative real-time PCR // Appl. Environ. Microbiol. 2009. Vol. 75. P. 965–969.
28. Solís G., de los Reyes-Gavilán С.G., Fernández N. et al. Establishment and development of lactic acid bacteria and bifidobacteria microbiota in breast-milk and the infant gut // Anaerobe. 2010. Vol. 16 (3). P. 307–310.
29. Maldonado J., Canabate F., Sempere L. et al. // The human milk probiotic Lactobacillus fermentum CECT 5716 reduces the incidence of gastrointestinal and upper respiratory tract infections in infants. A Randomised Controlled Trial comparing a prebiotic containing follow-on formula vs the same formula plus probiotic // J. Ped. Gastr. Nutr. 2012. Vol. 54(1). P. 55–61.
30. Конь И.Я., Абрамова Т.В. От пробиотиков в женском молоке к пробиотикам в молочных смесях // Вопр. дет. диетологии. 2012. № 6. С. 36–40.
31. Конь И.Я., Сорвачева Т.Н., Пашкевич В.В. и др. Нуклеотиды в питании детей грудного возраста. Результаты клинических испытаний адаптированной молочной смеси с нуклеотидами // Вопр. дет. диетологии. 2004. № 2 (2). С. 20–24.
32. Hawkes J.S., Gibson R.A., Roberton D. et al.. Effect of dietary nucleotide supplementation on growth and immune function in term infants: a randomized controlled tria // Eur. J. Clin. Nutr. 2006. Vol. 60(2). P. 254–264.
33. Конь И.Я. Современные представления о роли каротиноида — лютеина в питании детей раннего возраста // Педиатрия. 2012. Т. 91 (1). С. 96–102.
34. Zimmer J.P., Hammond B.R. Possible influences of lutein and zeaxanthin on the developing retina // Jr. Clin. Ophthalmol. 2007. Vol. 1 (1). P. 25–35.
35. Конь И.Я., Попович М.В., Фатеева Е.М. и др. Сравнительное изучение эффективности свободного режима грудного вскармливания и по часам // Рос. педиатр. журнал. 1999. № 4. С. 19–22.
36. Попович М.В., Фатеева Е.М., Конь И.Я. // Материалы Первого Всероссийского конгресса с международным участием «Питание детей XXI век». М., 2000. С. 49.
37. Конь И.Я., Гмошинская М.В., Абрамова Т.В. и др. Клинико-физиологическое обоснование новой схемы введения прикорма // Вопр. дет. диетологии. 2011. Т. 9 (3). С. 23–28.
38. von Bonsdorff M.B., Rantanen T., Sipilä S. et al. Birth size and childhood growth as determinants of physical functioning in older age: the helsinki birth cohort study // Am. J. Epidemiol. 2011. Vol. 174 (12). P. 1336–1344.
39. Dorner J. Ten ontogenetic theses for promotion of health and primary prevention of important diseases by a prenatal and early postnatal neuroendocrineimmune prophylaxis // Neuro Endocrinol. Lett. 2000. Vol. 21 (4). P. 265–267.
40. Lucas A. Growth and later health: a general perspective. Nestle Nutr. Workshop // Ser. Pediatr. Program. 2010. Vol. 65. P. 1–9.
41. Ladipo О.A. Nutrition in pregnancy; mineral and vitamin supplements // Am. J Clin. Nutr. 2000. Vol. 72. P. 280–290.
42. Fall C.H., Yajnik C.S., Rao S. et al. Micronutrients and fetal growth // J. Nutr. 2003. Vol. 133 (Suppl. 2). P. 1747–1456.
43. Тоточиа Н.Э., Бекетова Н.А., Коновалова Л.С. и др. Влияние витаминной обеспеченности на течение беременности // Вопр. дет. диет. 2011. Т. 9, № 3. С. 43–46.
44. Конь И.Я., Гмошинская М.В. Рациональное питание женщин во время беременности и основные подходы к использованию кисломолочных и пробиотических продуктов // Вопр. дет. диетологии. 2010. Т. 8, № 4. С. 76–82.
45. Салимова И.В., Конь И.Я., Гмошинская М.В., Демкина Е.Ю. Клинико-физиологическая оценка применения специализированного продукта для беременных женщин // Вопр. соврем. педиатрии. 2012. Т. 11, № 1. С. 103–106.
46. Конь И.Я. Актуальные проблемы организации питания школьников // Пищевая промышленность. 2008. № 2. С. 8.
47. Конь И.Я., Коростелева М.М., Шилина Н.М. Характеристика липидного компонента рациона питания детей дошкольного возраста // Вопр. дет. диетологии. 2008. № 6 (3). С. 5–8.
48. СанПиН 2.4.1.2660-10 «Санитарно-эпидемиологические требования к устройству, содержанию и организации режима работы в дошкольных организациях».
49. СанПиН 2.4.5.2409-08 «Санитарно-эпидемиологические требования к организации питания обучающихся в общеобразовательных учреждениях, учреждениях начального и среднего профессионального образования».
50. Конь И.Я., Волкова Л.Ю. Анализ опыта организации школьного питания в г. Москве: гигиенические аспекты. Материалы IV межрегиональной конференции «Воспитываем здоровое поколение». М., 2004. С. 12–18.
51. Руководство по лечебному питанию детей / Под ред. К.С. Ладодо. М.: Медицина, 2000. 384 с.
52. Клиническая диетология детского возраста / Под ред. Т.Э. Боровик, К.С. Ладодо. М.: ООО «Медицинское информационное агентство», 2008. 608 с.
53. Конь И.Я., Волкова Л.Ю., Коростелева М.М. и др. Распространенность ожирения у детей дошкольного и школьного возраста в Российской Федерации // Вопр. дет. диетологии. 2011. № 9 (4). С. 5–8.
54. Павловская Е.В., Багаева М.Э., Сурков А.Г. и др. Ожирение у детей — критерии диагностики и клинические проявления // Вопр. дет. диетологии. 2012. № 10(3). С. 18–22.
55. Шилина Н.М., Передеряев О.И., Нетунаева Е.А. и др. Эндоканнабиноиды в крови детей с ожирением: влияние омега-3 ПНЖК. Материалы XII Всероссийского Конгресса диетологов и нутрициологов «Питание и здоровье». М., 2010. С. 96.
56. Александров А.А., Розанов В.Б., Леонтьева И.В. Артериальная гипертензия у детей и подростков. М.: Рекламно-производственная компания «Викас-принт», 2010. 249 с.
57. Ларионова З.Г., Конь И.Я. Медико-биологическое обоснование и практические рекомендации по диетической коррекции эссенциальной артериальной гипертензии у детей школьного возраста // Вопр. дет. диетологии. 2007. № 5 (2). С. 51–59.
Книга «Клиническая диетология детского возраста: руководство для врачей»
Авторы: Боровик Т. Э., Ладодо К. С.
ISBN 978-5-9986-0225-2
Руководство посвящено актуальной проблеме — лечебному питанию детей. В нем обобщен многолетний научный и практический опыт коллектива сотрудников отделения питания здорового и больного ребенка Научного центра здоровья детей, а также ведущих специалистов в области педиатрии, работающих в медицинских университетах и научно-исследовательских центрах Российской Федерации. Подробно освещаются патогенез, клиническое течение, диагностика, лечение детей с различными соматическими, наследственными, хирургическими, инфекционными, неврологическими болезнями.
Особое внимание уделяется обоснованию, разработке и использованию лечебного питания в зависимости от вида патологии. Приводятся основные принципы построения лечебных рационов, дается характеристика лечебных свойств специализированных продуктов, их состав и возможность использования в диетотерапии при различных болезнях детского возраста. Подробно разбираются вопросы питания детей при алиментарно-зависимых состояниях, функциональном нарушении желудочно-кишечного тракта, заболеваниях почек, органов пищеварения, пищевой непереносимости, ожирении, острых кишечных инфекциях. Большое внимание уделено вскармливанию недоношенных и детей с перинатальной патологией центральной нервной системы. Впервые подробно рассмотрены особенности питания детей-спортсменов, а также проблема недостаточности питания, определение нутритивного статуса детей, парентеральное питание в педиатрии и детской хирургии.
Отдельная глава посвящена характеристике отечественных и зарубежных продуктов промышленного производства для питания детей раннего возраста — адаптированных молочных смесей, продуктов прикорма на зерновой, плодово-ягодной, овощной, мясной основах. Для врачей-педиатров, диетологов, преподавателей и студентов медицинских вузов.
Содержание книги «Клиническая диетология детского возраста: руководство для врачей» — Боровик Т. Э., Ладодо К. С.
Глава 1. Основные принципы питания больного ребенка
Глава 2. Использование материнского молока при трудностях
организации грудного вскармливания
2.1. Состояния, требующие частичного или полного вскармливания ребенка сцеженным грудным молоком
2.1.1. Гипогалактия
2.1.2. Лактостаз
2.1.3. Плоские или втянутые соски
2.1.4. Болезненность сосков при сосании ребенком, трещины сосков
2.1.5. Вяло сосущий ребенок
2.1.6. Кормление близнецов
2.1.7. Выход женщины на работу/учебу
2.1.8. Прием женщиной лекарств, не совместимых с кормлением грудью
2.2. Медицинские показания для кормления ребенка сцеженным грудным молоком
2.3. Создание индивидуального банка грудного молока
2.4. Грудное вскармливание детей с перинатальным поражением центральной нервной системы
Глава 3. Вскармливание недоношенных детей
3.1. Основные подходы к питанию недоношенных детей
3.2. Способы вскармливания недоношенных детей
3.2.1. Вскармливание детей, родившихся с массой тела более 2001 г (срок гестации 33 недели и более)
3.2.2. Вскармливание детей, родившихся с массой тела 1501–2000 г (срок гестации 30–33 недели)
3.2.3. Вскармливание детей, родившихся с массой тела 1001–1500 г (ОНМТ, срок гестации 28–30 недель)
3.2.4. Вскармливание детей, родившихся с массой тела менее 1000 г (ЭНМТ, срок гестации менее 28 недель)
3.3. Питание недоношенных детей после выписки из стационара
3.4. Введение прикорма преждевременно родившимся детям
Глава 4. Железодефицитные состояния у детей и их коррекция
4.1. Этиология железодефицитных состояний
4.2. Клинические проявления железодефицитных состояний
4.3. Лабораторные показатели обмена железа
4.4. Показатели запасов железа в организме
4.5. Лечебное питание при железодефицитных состояниях
4.6. Принципы лечения железодефицитных состояний
Глава 5. Рахит у детей
5.1. Этиологические и патогенетические факторы рахита
5.2. Клинико-лабораторная диагностика и классификация рахита
5.3. Антенатальная профилактика рахита
5.4. Постнатальная профилактика рахита
5.5. Лечение рахита
5.6. Гипервитаминоз D в практике педиатра
Глава 6. Недостаточность питания
6.1. Диетологическая коррекция недостаточности питания
6.2. Медикаментозная терапия при тяжелой недостаточности питания
6.3. Шкалы оценки риска развития недостаточности питания у детей
Глава 7. Функциональные нарушения желудочно-кишечного тракта у детей грудного возраста и их диетологическая коррекция
7.1. Синдром срыгиваний
7.2. Кишечные колики
7.3. Функциональные запоры
Глава 8. Лечебное питание при пищевой аллергии
8.1. Этиологические и патогенетические факторы пищевой аллергии
8.2. Распространенность пищевой аллергии
8.3. Клинические проявления пищевой аллергии
8.4. Основные пищевые аллергены
8.5. Перекрестные реакции к пищевым аллергенам
8.6. Диагностика пищевой аллергии
8.7. Основные принципы диетотерапии
8.8. Диетотерапия при пищевой аллергии у детей первого года жизни
8.8.1. Диетотерапия при аллергии к БКМ на фоне грудного вскармливания
8.8.2. Питание кормящей женщины при наличии аллергии к БКМ у ребенка
8.8.3. Диагностическое применение лечебной смеси
8.8.4. Диетотерапия при аллергии к БКМ на фоне смешанного или искусственного вскармливания
8.8.5. Выбор смеси при аллергии к БКМ
8.8.6. Специализированные смеси для детей с аллергией к БКМ
8.8.7. Тактика ведения больных на этапе расширения рациона
8.8.8. Организация прикорма
8.9. Питание детей старше года
8.10. Диетические методы коррекции рациона детей с пищевой аллергией, длительно находящихся на элиминационных диетах
8.11. Диетопрофилактика пищевой аллергии у детей раннего возраста
8.12. Питание матери в периоде беременности и лактации
8.13. Питание ребенка из группы риска аллергии
8.14. Пробиотики и пребиотики в профилактике аллергии
Глава 9. Лечебное питание при синдроме мальабсорбции
9.1. Питание при непереносимости углеводов
9.1.1. Лактазная недостаточность
9.1.1.1. Принципы лечения при лактазной недостаточности
9.1.2. Непереносимость сахарозы
9.1.3. Непереносимость моносахаридов
9.2. Питание при аллергической энтеропатии
9.3. Питание при целиакии и других формах непереносимости глютена
9.3.1. Организация лечебного питания при целиакии у детей. Безглютеновая диета
9.3.2. Современное представление о различных формах непереносимости глютена
9.4. Питание при муковисцидозе
9.4.1. Питание детей первого года жизни
9.4.2. Питание дошкольников и школьников
9.4.3. «Агрессивные» методы нутритивной поддержки больных МВ
9.5. Питание при болезни Крона
Литература
9.6. Питание при редких заболеваниях, проявляющихся синдромом мальабсорбции
Глава 10. Лечебное питание детей при заболеваниях органов пищеварения
10.1. Питание при заболеваниях желудка и двенадцатиперстной кишки
10.2. Питание при гастроэзофагеальной рефлюксной болезни
10.3. Питание при заболеваниях кишечника
10.3.1. Лечебное питание при запорах
10.3.2. Лечебное питание при заболеваниях кишечника, сопровождающихся диареей
10.4. Питание при заболеваниях печени и желчных путей
10.5. Питание при заболеваниях поджелудочной железы
Глава 11. Лечебное питание при заболеваниях почек
11.1. Лечебное питание при остром и хроническом пиелонефрите
11.2. Диетотерапия при остром и хроническом гломерулонефрите
11.3. Питание при хронической почечной недостаточности (хроническая болезнь почек III–V стадии)
11.4. Питание при острой почечной недостаточности
11.5. Пересадка почки
11.6. Питание при IgА-нефропатии (болезнь Берже)
11.7. Питание при нефролитиазе и кристаллурии
11.8. Питание детей при тубулопатиях
Глава 12. Ожирение: современное состояние, причины и питание детей с ожирением
12.1. Эпидемиология и причины ожирения
12.2. Внутриутробное программирование ожирения
12.3. Программирование ожирения на первом году жизни
12.4. Программирование ожирения у детей раннего возраста
12.5. Классификация ожирения
12.6. Диагностика ожирения
12.7. Питание детей с ожирением
12.8. Альтернативные подходы к диетотерапии
12.9. Медикаментозная терапия ожирения
12.10. Хирургическое лечение ожирения
12.11. Лечебная гимнастика
12.12. Профилактика ожирения у детей раннего возраста
12.12.1. Антенатальная профилактика
12.12.2. Профилактика ожирения на первом году жизни
12.12.3. Адекватный сон младенца как мера снижения риска ожирения
12.12.4. Регулирование темперамента, эмоциональности и беспокойства ребенка
12.12.5. Введение прикорма
12.13. Профилактика ожирения у детей старше года
Глава 13. Нарушения микробиоценоза кишечника, возможности их профилактики и диетической коррекции
13.1. Влияние кишечной микробиоты на здоровье человека
13.2. Особенности состава микробиоты кишечника при различной патологии
13.3. Влияние пищи на микробиценоз кишечника
13.4. Возможности диетической коррекции дисбиоза кишечника
13.5. Функциональные продукты пробиотического действия
13.6. Функциональные продукты пребиотического действия
Глава 14. Лечебное питание при наследственных нарушениях обмена веществ
14.1. Наследственные нарушения аминокислотного обмена и органические ацидурии
14.1.1. Клиническая характеристика наследственных аминоацидопатий и органических ацидурий
14.1.1.1. Фенилкетонурия
14.1.1.2. Другие формы гиперфенилаланинемии
14.1.1.3. Тирозинемия
14.1.1.4. Гомоцистинурия
14.1.1.5. Изовалериановая ацидемия
14.1.1.6. Метилмалоновая и пропионовая ацидемии
14.1.1.7. Глутаровая ацидурия
14.1.1.8. Болезнь кленового сиропа
14.1.1.9. Гистидинемия
14.1.2. Диетотерапия и специализированные лечебные продукты
14.1.2.1. Диетотерапия детей первого года жизни
14.1.2.2. Способ приготовления питания для больного ребенка грудного возраста
14.1.2.3. Особенности назначения прикорма
14.1.3. Лечебное питание детей старше года
14.1.4. Контроль эффективности лечения
14.1.5. Продолжительность диетического лечения
14.1.6. Профилактика синдрома материнской ФКУ
14.2. Наследственные нарушения обмена углеводов
14.2.1. Клиническая характеристика гликогенозов
14.2.2. Питание при гликогеновой болезни
14.3. Клиническая характеристика и диагностика галактоземии
14.3.1. Принципы диетотерапии
14.3.2. Организация диетотерапии детей первого года жизни
14.3.3. Особенности прикорма
14.3.4. Лечебное питание больных детей старше года
14.3.5. Медикаментозное лечение
14.3.6. Контроль эффективности диетотерапии
14.3.7. Отдаленные последствия классической галактоземии
Глава 15. Лечебное питание при болезнях нервной системы у детей
15.1. Нутритивная поддержка больных
15.2. Антропометрические измерения
15.3. Нутритивная поддержка
15.4. Сопутствующие состояния
15.5. Кетогенная диета в лечении эпилепсии у детей
Глава 16. Лечебное питание при острых кишечных инфекциях у детей
16.1. Классификация острых кишечных инфекций и критерии диагностики
16.2. Клинические критерии топического диагноза
16.3. Основные принципы и программа лечения
16.3.1. Регидрационная терапия
16.4. Диетотерапия
16.5. Ферментотерапия
16.5.1. Выбор ферментного препарата
Глава 17. Оценка нутритивного статуса детей
17.1. Клинические методы оценки состояния питания
17.2. Инструментальные методы оценки состояния питания
17.3. Лабораторные методы оценки состояния питания
17.3.1. Биохимический анализ крови и мочи
17.3.2. Клинический анализ крови
17.3.3. Исследование волос и ногтей
17.4. Оценка фактического питания
Глава 18. Энтеральная нутритивная поддержка в педиатрической практике
18.1. Определение потребности в основных нутриентах и энергии
18.2. Специализированные смеси для энтерального питания
18.3. Показания и выбор метода энтерального питания
18.4. Методы энтерального питания
18.5. Энтеральное питание больных в дооперационный период
18.6. Нутритивная поддержка больных в раннем послеоперационном периоде
Глава 19. Парентеральное питание в педиатрии и детской хирургии
19.1. Источники энергии
19.2. Источники азота
19.3. Фармаконутрицевтики
19.4. Осложнения парентерального питания
19.5. Алгоритм составления программы парентерального питания
Глава 20. Организация питания детей-спортсменов
20.1. Основные принципы питания юных спортсменов
20.2. Потребность в пищевых веществах и энергии у детей-спортсменов
20.3. Энергообеспечение физической нагрузки
20.4. Оценка нутритивного статуса юных спортсменов и контроль эффективности диетических мероприятий
20.5. Питание перед спортивной нагрузкой
20.6. Питание после спортивной нагрузки
20.7. Организация питьевого режима
20.8. Спортивные напитки
20.9. Питьевой режим
20.10. Базовый рацион детей и подростков, занимающихся спортом
20.11. Обогащенные продукты
20.12. Витамины и микроэлементы
20.13. Полиненасыщенные жирные кислоты
20.14. Пробиотики и пребиотики
20.15. Специализированные продукты
20.16. Алгоритм нутритивного обеспечения юных спортсменов на разных этапах тренировочного процесса
Глава 21. Витамины и минеральные вещества в питании и поддержании здоровья детей
21.1. Витамины: их роль и механизм действия
21.2. Минеральные вещества: их роль в питании и обмене веществ
21.3. Рекомендуемые нормы потребления витаминов, витаминоподобных соединений и минеральных веществ
21.4. Оценка обеспеченности организма витаминами и минеральными веществами
21.5. Методы оценки обеспеченности человека витаминами и минеральными веществами
21.5.1. Расчетные методы
21.5.2. Клинико-физиологические методы
21.5.3. Биохимические и физиологические методы
21.6. Обеспеченность витаминами и минеральными веществами детского населения России
21.7. Меры по профилактике дефицита и оптимизации витаминного статуса детей
21.8. Научные основы профилактического и лечебного применения витаминов
Глава 22. Продукты для питания детей раннего возраста
22.1. Детские молочные смеси
22.2. Детские каши промышленного выпуска
22.2.1. Каши монокомпонентные безмолочные безглютеновые
22.2.2. Каши монокомпонентные безмолочные глютенсодержащие
22.2.3. Каши поликомпонентные безмолочные безглютеновые
22.2.4. Каши поликомпонентные безмолочные глютенсодержащие
22.2.5. Каши монокомпонентные молочные безглютеновые
22.2.6. Каши монокомпонентные молочные глютенсодержащие
22.2.7. Каши поликомпонентные молочные безглютеновые
22.2.8. Каши поликомпонентные молочные глютенсодержащие
22.2.9. Каши с фруктовыми и овощными добавками
22.2.10. Жидкие каши с пребиотиками
22.3. Продукты на плодоовощной основе
22.3.1. Фруктовые и овощные соки
22.3.2. Фруктовые пюре
22.3.3. Овощные пюре
22.4. Продукты на мясной основе
Приложения
Приложение 1. Нормы физиологических потребностей в энергии и пищевых веществах для детей и подростков
Приложение 2. Рекомендуемые объемы блюд для детей различных возрастных групп
Приложение 3. Натуральные продукты питания, используемые в диетотерапии больных с наследственными нарушениями обмена аминокислот
Приложение 4. Низкобелковые и безбелковые продукты

![[IMG]](http://piratebooks.ru/attachments/klinicheskaya-dietologiya-detskogo-vozrasta.jpg)