Анестезия ксеноном — наркоз без осложнений и побочных эффектов
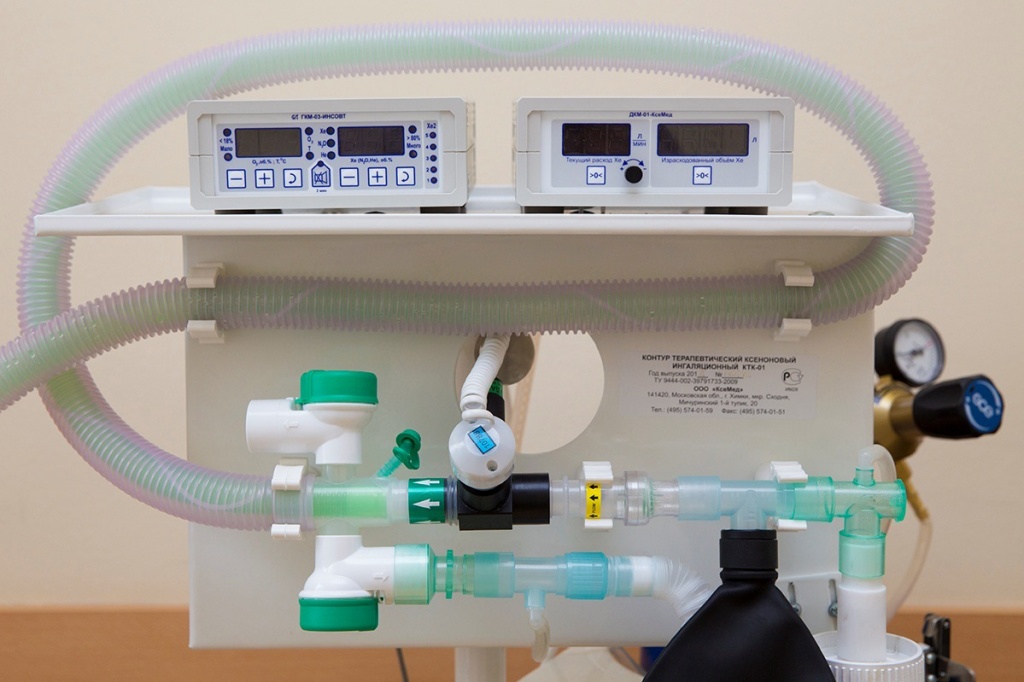
Ксеноновый терапевтический контур КТК-01 предназначен для подачи дыхательной смеси пациенту в процессе проведения лечебных мероприятий с использованием кислорода, ксенона или комбинации этих газов.
Благородный инертный газ ксенон (Xe) высочайшей степени очистки — 99,9999% выделяется из атмосферного воздуха, в котором он содержится в микро-концентрациях 0,000008%.
Ксенон очень легко переносится больными, не вызывает ни тошноты, ни рвоты, оказывает защитное действие на сердечно-сосудистую систему, мозг и печень. В отличие от других искусственно созданных анестетиков, ксенон как природный инертный газ абсолютно безопасен. Ксенон не оказывает влияния на репродуктивную функцию организма и не подавляет иммунитет.
По мнению специалистов-медиков, ксенон по своим свойствам близок к понятию идеального анестетика. Он не имеет запаха и цвета, не раздражает дыхательные пути. Его низкий коэффициент растворимости кровь/газ обеспечивает быстрый вход и выход из наркоза.
Технология безопасна
- Сохраняет естественные рефлексы, пациент остается в сознании.
- Ксенон не вызывает привыкания, полностью выводится из организма, не токсичен.
Седативный эффект Хе+О2
- Уменьшает чувство тревоги, беспокойства и страха.
- Стабилизирует функцию сердечно-сосудистой и дыхательной систем.
- Обеспечивает расслабление жевательных и скелетных мышц.
- Нормализуя психо-моторный и вегетативный компоненты болевой реакции пациента.
Анальгетический эффект Хе+О2
- Повышается порог болевой чувствительности и особенно — порог выносливости боли, что важно для потенцирования и пролонгирования применяющихся обезболивающих методов и средств, а также дает возможность для применения Хе+О2 в качестве самостоятельного обезболивания при лечении ряда стоматологических заболеваний.
- Обладает выраженным болеутоляющим эффектом (предоперационная подготовка, послеоперационное болеутоление и реабилитация).
Реабилитация Хе+О2
- Облегчает процесс лечения и работу врача.
- Уменьшает усталость пациента от процедуры, повышает настроение, обеспечивает продленное болеутоление до 4-6 часов и существенное уменьшение послеоперационного отека тканей.
- Купирование болевых синдромов челюстно-лицевой области, при диагностике и лечении нейро-стоматологических заболеваний.
Ксеноновый терапевтический контур КТК-01 — это комплект специально разработанной медицинской аппаратуры, предназначенный для подачи дыхательной смеси пациенту в процессе проведения лечебных мероприятий с использованием кислорода, ксенона или комбинации этих газов.
Седация и обезболивание ксеноном (Хе+О2) – в руки профессионалу!
Инновационная технология повышения эффективности и качества лечебно-диагностического процесса, а также снижения риска осложнений и сроков стоматологического лечения.
Технология основана на применении рационального сочетания методов и обезболивающих средств, включая ингаляцию ксенон-кислородной смеси, электронную анальгезию и многое другое.
Технология безопасна
Сохраняет естественные рефлексы, пациент остается в сознании.
Ксенон не вызывает привыкания, полностью выводится из организма, не токсичен для окружающего персонала.
Седативный эффект Хе+О2
Уменьшает чувство тревоги, беспокойства и страха, стабилизирует функцию сердечно-сосудистой и дыхательной систем, обеспечивает расслабление жевательных и скелетных мышц, нормализуя психо-моторный и вегетативный компоненты болевой реакции пациента.
Анальгетический эффект Хе+О2
Повышается порог болевой чувствительности и особенно – порог выносливости боли, что важно для потенцирования и пролонгирования применяющихся обезболивающих методов и средств, а также дает возможность для применения Хе+О2 в качестве самостоятельного обезболивания при лечении ряда стоматологических заболеваний.
Обладает выраженным болеутоляющим эффектом (предоперационная подготовка, послеоперационное болеутоление и реабилитация).
Реабилитация Хе+О2
Облегчает процесс лечения и работу врача.
Уменьшает усталость пациента от процедуры, повышает настроение, обеспечиваетпродленное болеутоление до 4-6 часов и существенное уменьшение послеоперационного отека тканей.
Купирование болевых синдромов челюстно-лицевой области, при диагностике и лечении нейро-стоматологических заболеваний.
Включение «ксеноновых» технологий в стандарты оказания помощи пациентам позволит повысить качество и эффективность лечения, уменьшить количество осложнений и сократить сроки лечения.
ФГБУ «Клиническая больница №1» (Волынская) УДП РФ
к.м.н. Н.И. Базий, к.м.н. С.В. Стеблецов, д.м.н. В.Н. Ардышев, д.м.н. В.В. Бояринцев.
В последние десятилетия отмечается значительное возрастание роли современных медицинских технологий и новых лекарственных средств в оказание помощи пациентам с заболеваниями нервной системы. На базе Клинической больницы №1 (Волынской) УДП РФ проводится исследование и активное внедрение в лечебную практику медицинского ксенона.
Этот инертный газ был открыт в 1898 году английскими учеными У.Рамзаем и М.Траверсом. Ксенон состоит из одноатомных молекул, не имеет ни запаха, ни цвета, не горит и не поддерживает горение, не взрывоопасен, слабо растворяется в воде. В организме ксенон не метаболизируется, находится в растворенном состоянии в плазме и выводится через легкие в неизменном виде через несколько минут. Все эти свойства позволяют использовать ксенон в медицинской практике в качестве эффективного и безопасного анестетика. Ксенон медицинский (КсеМед®) был впервые разрешен для медицинского применения в Российской Федерации приказом Министерства Здравоохранения № 363 от 08.10.1999 г. в качестве средства для общей анестезии. С конца 80х годов активно изучается анальгетический эффект этого газа (1). По данным В. Lachmann и А. Trouwborst анальгетический эффект ксенона осуществляется за счет блокады NMDA-глутаматных рецепторов, а также стимулирующего действия на ретикулярную формацию, активируя нисходящую ингибирующую антиноцицептивную систему, подавляющую активность нейронов задних рогов спинного мозга (1,2). По данным В.Preckel ксенон оказывает кардиопротективное действие после окклюзии коронарных сосудов, не нарушая сократительную функцию миокарда и вызывая только незначительное снижение частоты сердечных сокращений (3). В работах Homi H.M описаны нейропротекторные свойства ксенона (4,5), причем, в отличие от всех других известных ингаляционных анестетиков (6), проявляются они в субанестетических концентрациях (5,7). Особое место занимает ксенон в лечении алкогольной и наркотической зависимости. По данным исследования Б.Д. Цыганкова, С.А. Шамова (8) ксенон является эффективным корректором аффективных, интеллектуально-мнестических и психопатологических расстройств у наркологических больных на всех этапах течения заболевания.
В стационарных условиях терапевтического отделения применение медицинского ксенона оправдано с целью купирования болевых синдромов различной этиологии (в том числе заболевании периферической нервной системы — дорсалгиях, невралгиях тройничного нерва, при диабетических полиневропатиях, мигрени), в комплексной терапии невротических и неврозоподобных состояний сопровождающихся тревогой, беспокойством, эмоциональной напряженностью, повышенной раздражительностью, нарушением сна. Ксенон применяется в виде кислородно-ксеноновых ингаляций. Прием пищи прекращается не менее чем за 2 часа, а прием жидкостей — не менее чем за 1 час до ингаляционной процедуры. Кислородно-ксеноновая смесь (ККС) формируется в дыхательном аппарате — стационарном ксеноновом терапевтическом контуре КТК-01. Выбранная врачом концентрация ксенона и кислорода подается в дыхательный контур с комфортной для пациента скоростью потока. Во время сеанса пациент остается в контакте с врачом. Процедура проводится в положении лежа или полусидя. При самостоятельном дыхании пациенту надевают маску и начинают подавать газовую смесь. Процедура проводится до достижения клинических эффектов (легкого головокружения, нистагма, парастезии конечностей, улучшения настроения, гиперемии кожных покровов, купирование болей). Общая продолжительность процедуры с учетом подготовки аппаратуры и пациента составляет около 20-30 мин. Общий расход медицинского ксенона не превышает 4 литров. При этом основной (анальгетический) эффект наступает через несколько минут. При возобновлении боли, вегетативных проявлений ингаляцию можно повторить через 2-3 часа. Возможно достижение эффекта за один сеанс, однако, в большинстве случаев требуется проведение повторных ингаляций, назначаемых врачом. После ингаляции возможно появление осиплости голоса, «металлический» привкус во рту, изменение тембра голоса, сухость во рту, умеренная головная боль, которые проходят самостоятельно в течение 5 минут после окончания ингаляции. Противопоказания к проведению ксеноновых ингаляций основаны на способности ксенона диффузно проникать в ткани и заполнять свободные полости, увеличивая объем пневмоторакса, воздушного эмбола, паретичного кишечника. К ним относятся:
- Внутричерепные опухоли;
- Острые психические заболевания;
- Острые инфекционные заболевания;
- Острые заболевания брюшной полости, сопровождающиеся парезом кишечника;
- Травмы грудной клетки, черепно-мозговые травмы в остром периоде;
- Тяжелые заболевания легких с высоким риском развития пневмоторакса (пневмония; туберкулез);
- Тяжелое течение бронхиальной астмы;
- Миастения и другие заболевания со снижением тонуса мышц;
- АД выше 170100 мм.рт.ст.;
- Синдром обструктивного апноэ, средняя и тяжелая форма;
- Беременность и кормление грудью;
- ОНМК острый период ;
- Острый инфаркт миокарда, перикардиты.
Нами проводилось изучение эффективности ИККС (ингаляции кислородно-ксеноновой смеси) в комплексной терапии у 32 пациентов с выраженным болевым синдромом, обусловленным дегенеративными изменениями в шейно-грудном и пояснично-крестцовых отделах позвоночника. При неврологическом осмотре у всех пациентов отмечались мышечно-тонические нарушения, симптомы натяжения. Применение ИККС проводилось на фоне терапии НПВС, миорелаксантами, вазоактивной терапии, физиотерапии. Оценка болевого синдрома осуществлялась по критериям:
- визуальной аналоговой шкалы — ВАШ (Visual Analogue Scale (VAS) (Huskisson E. С., 1974)),
- вербальной рейтинговой шкалы оценки боли (Verbal Rating Scale (Frank A. J. М., Moll J. М. H., Hort J. F., 1982))
- вербальной описательной шкалы оценки боли (Verbal Descriptor Scale (Gaston-Johansson F., Albert М., Fagan E. et al., 1990))
У всех пациентов отмечался положительных эффект уже после первой ингаляции: снижение болевого синдрома разной степени выраженности. При этом наблюдался нарастающий положительный эффект каждой последующей процедуры. У 50 % больных на фоне комплексной терапии и 3 сеансов ИККС отмечался полный регресс болевого синдрома и очаговой неврологической симптоматики. Остальные пациенты с положительным эффектом выписаны для амбулаторного лечения. Следует отметить, что применение ИККС позволило сократить стационарное лечение этой категории пациентов в среднем на 4-5 дней.
Представляется эффективным и целесообразным применение ИККС у пациентов с мигренью и ее осложнениями. Мигрень проявляется характерными приступообразными пульсирующими головными болями обычно односторонней локализации продолжительностью от 4 до 72 ч. Приступ мигрени, длящийся более 72 ч, несмотря на лечение, определяется как мигренозный статус. Нами был отмечен выраженный положительный эффект единственной ингаляции ККС у пациентки с мигренозным статусом, получавшей ранее безрезультатно анальгетики, триптаны, бензодиазепины, НПВС. После 15 минутной ингаляции отмечался полный регресс болевого синдрома и выраженных вегетативных проявлений в виде тошноты, слезотечения.
Нарушение сна, особенно у пациентов старшего возраста, является одной из основных причин, снижающих качество жизни. Особенно остро эта проблема у пациентов длительно принимающих снотворные препараты, когда у пациентов происходит изменение толерантности к препарату, формируется психическая и физическая зависимость. Нами наблюдались трое пациентов, с инсомнией, получавших до поступления в стационар 2 таблетки зопиклона (15 мг) на ночь ежедневно и жалующихся на нарушение сна. Проведение пяти сеансов ИККС через день, позволили сначала снизить дозировку снотворного препарата до 1/2 т на ночь, а затем отменить препарат; при этом в день ингаляции необходимости в применении снотворного препарата не было.
Особое значение имеет применение ИККС у пациентов с болями, обусловленными метастатическим поражением костей скелета. Применения ИККС у троих таких пациентов с выраженным болевым синдромом позволил отказаться от приема наркотических анальгетиков в день ингаляции и последующие сутки. При этом не отмечалось абстинентного синдрома — негативных и болезненных проявлений — на отмену опиоидных препаратов.
Таким образом, применение ИККС в неврологической и терапевтической практике позволяет получать выраженный анальгетический эффект, снижает сроки купирования болевого синдрома, сокращает продолжительность стационарного лечения, нормализует сон, позволяет преодолевать болезненные проявления абстинентного синдрома. Представляется целесообразным более широкое внедрение этого перспективного метода лечения в клиническую практику.
Используемая литература:
- Lachmann B, Trouwborst A, Schairer W et al. Xenon anesthesia and its analgesic effects. In: Abstracts of the 9th World Congress on Anaesthetics. Vol 1. Washington, DC: World Congress on Anaesthetics, 1988: A0079.
- Utsumi J, Adachi T, Kurata J et al. Effect of xenon on central nervous system electrical activity during sevoflurane anaesthesia in cats: comparison with nitrous oxide. Br J Anaesth 1998; 80(5):628-633.
- Preckel B, Müllenheim J, Moloschavij A et al. Xenon administration during early reperfusion reduces infarct size after regional ischemia in the rabbit heart in vivo. Anesth Analg 2000; 91(6):1327-1332.
- Wilhelm S, Ma D, Maze M, Franks NP. Effects of xenon on in vitro and in vivo models of neuronal injury. Anesthesiology 2002; 96(6):1485-1491.
- Homi HM, Yokoo N, Ma D et al. The neuroprotective effect of xenon administration during transient middle cerebral artery occlusion in mice. Anesthesiology 2003; 99(4):876-881.
- Ma D, Yang H, Lynch J et al. Xenon attenuates cardiopulmonary bypass-induced neurologic and neurocognitive dysfunction in the rat. Anesthesiology 2003; 98(3):690-698.
- Miura Y, Grocott HP, Bart RD et al. Differential effects of anesthetic agents on outcome from near-complete but not incomplete global ischemia in the rat. Anesthesiology 1998; 89(2):391-400
- Цыганков Б.Д., Шамов С.А. и др. «Ингаляционная терапия медицинским ксеноном в наркологической практике». Учебно-методическое пособие для врачей. МГМСУ.- Москва, 2011г.-С.9-19
Введение
Метастатическое поражение головного мозга регистрируется у 8-10% онкологических больных, и по ряду причин этот показатель в настоящее время продолжает демонстрировать устойчиво растущий тренд [1].
Несмотря на достижения современной медицины, прогноз для этой группы пациентов остается крайне неблагоприятный, а средняя продолжительность жизни не превышает 3-11 месяцев в зависимости от прогностического класса и вариантов проводимого лечения [2][3].
«Золотым стандартом» радиотерапии при метастатическом поражении головного мозга длительное время считалось облучение всего головного мозга (ОВГМ). Основным преимуществом данного варианта лучевой терапии является профилактический эффект, реализуемый за счет воздействий на невыявленные микрометастазы головного мозга, что позволяет уменьшить вероятность появления новых очагов с 76 до 27%. Эта позиция подтверждена крупными клиническими исследованиями и имеет I уровень доказательности [4][5][6].
Однако ОВГМ имеет ряд существенных недостатков, одним из которых является неудовлетворительный уровень локального контроля, составляющий 41,7-46,4%. Кроме того, доказано, что после ОВГМ начинает развиваться атрофия, в основе которой лежит демиелинизация нервных волокон. Как следствие, более чем у 50% пациентов могут проявляться неврологические и ментальные нарушения, выраженность которых напрямую связана со степенью повреждения ткани мозга [7][8].
Таким образом, лечение очагового метастатического процесса головного мозга является сложной и очень актуальной задачей, далекой от своего окончательного решения.
Одним из вариантов улучшения качества локального контроля является подведение дополнительного локального облучения — буста (англ. boost), — что позволяет добиться эскалации дозы в зоне патологического очага и, как следствие, повысить эффект проводимой терапии. Крупное рандомизированное исследование RTOG 9508 показало, что сочетание тотального и локального облучения позволяет не только получить хороший уровень локального контроля, но и увеличить общую продолжительность жизни для пациентов с одиночными метастазами, однако подбор дозы и время проведения локального облучения остаются предметом дискуссий [9].
Перспективным методом воздействия на метаболизм головного мозга, набирающим популярность последнее время, является ксенонотерапия. В частности, было установлено нейротрофическое и нейропротекторное действие этого инертного газа. Основными свойствами, обеспечивающими клиническую эффективность, а также безопасность терапевтического воздействия медицинского ксенона, являются выраженный анальгетический, седативный и антистрессорный эффекты. Благодаря этим особенностям, ксенон используют в лечении острого нарушения мозгового кровообращения, при черепномозговой травме, отеке мозга и энцефалопатиях различного генеза [10].
Единичные исследования применения ксенона в онкологии показали уменьшение частоты токсических реакций и улучшение общесоматического статуса при проведении химиотерапии, а также, что немаловажно, отсутствие стимулирующего эффекта на опухолевую ткань [11].
По представленным литературным данным, сочетание буста и ксенонотерапии с ОВГМ представляется перспективным в плане улучшения переносимости лечения и увеличения противоопухолевого эффекта.
Цель работы — изучение переносимости курса лучевой терапии при добавлении к ОВГМ буста и ксенонотерапии у пациентов с одиночным метастатическим поражением головного мозга.
Материалы и методы
В исследование приняли участие 60 больных, получавших лечение в Ростовском научно-исследовательском онкологическом институте в период с 2013 по 2016 гг. Всем пациентам через 3-4 недели после хирургического удаления одиночного интракраниального метастаза проводилась лучевая терапия. В зависимости от тактики адъювантного лечения пациенты были разделены на 3 группы.
- (контрольную) группу составили 20 пациентов, которые получали дистанционную лучевую терапию (ДЛТ) в объеме только ОВГМ, разовой очаговой дозой (РОД) 2,4Гр 1 раз в день, в течение 3-х недель, всего 15 фракций. Суммарная очаговая доза — 40 Гр (ОВГМ).
- (1-я основная) группа — 20 человек, которым через 4-5 часов после ОВГМ подводился буст на ложе удаленного метастатического очага; РОД 0,6Гр суммарная, с учетом дозной нагрузки от ОВГМ, составляла 60 Гр (ОВГМ+boost).
- (2-я основная) группа — также 20 больных, получавших ДЛТ методологически аналогичную II группе, которым на протяжении курса облучения 2 раза в неделю проводилось ингаляционное введение ксеноно-кислородной смеси (ОВГМ+boost+Xe).
Процедуру проводили на аппарате контур терапевтический ксеноновый ингаляционный КТК-01. Через дыхательную маску в течение 5 минут пациенту давали дышать медицинским кислородом, затем в систему подавали ксенон при скорости потока 0,8 л/мин. Концентрация ксенона во вдыхаемой смеси составляла 20-25%. Длительность процедуры — 15-20 минут. На предлагаемую методику лучевого лечения получено решение о выдаче патента (патент РФ № 2599195 от 13.09.16). Исследование проведено в соответствие с международными стандартами GCP.
Больные сравниваемых групп были сопоставимы по основным клиническим параметрам. Соотношение мужчин и женщин в группах составляло 1:1. Средний возраст пациентов по группам — 54,2±7,3 лет, 57,1±6,7 лет и 50,4±9,2 лет соответственно для I, II и III групп (табл. 1).
Таблица/ Table 1
Характеристика клинического материала
Characteristics of the clinical material
|
ОВГМ(п=20) WBRT(n=20) |
ОВГМ+boost (n=20) WBRT+boost (n=20) |
ОВГМ+boost+Xe (n=20) WBRT+boost +Xe (n=20) |
Всего Total |
|
|---|---|---|---|---|
|
Пол / Sex |
||||
|
Мужской Male |
9(45%) |
10(50%) |
8(40%) |
27(45%) |
|
Женский Female |
11(55%) |
10(50%) |
12(60%) |
33(55%) |
|
Возраст / Age |
||||
|
30-39 лет 30-39 years |
2(10%) |
0 |
3(15%) |
5(8,3%) |
|
40-49 лет 40-49 years |
4(20%) |
4(20%) |
8(40%) |
16(26,7%) |
|
50-59 лет 50-59 years |
6(30%) |
9(45%) |
4(20%) |
19(31,7%) |
|
60-69 лет 60-69 years |
8(40%) |
6(30%) |
5(25%) |
19(31,7%) |
|
старше 70 лет above 70 years |
0 |
1(5%) |
0 |
1(1,7%) |
|
Локализация первичного очага / Localization of primary tumor |
||||
|
Рак молочной железы Breast cancer |
10(50%) |
5(25%) |
5(25%) |
20(33,3%) |
|
Рак легкого Lung cancer |
6(30%) |
7(35%) |
6(30%) |
19(31,7%) |
|
Меланома Melanoma |
3(15%) |
4(20%) |
3(15%) |
10(16,7%) |
|
Рак сигмовидной кишки Sigmoid colon cancer |
0 |
1(5%) |
2(10%) |
3(5%) |
|
Рак прямой кишки Rectal cancer |
1(5%) |
1(5%) |
0 |
2(3,3%) |
|
Рак почки Renal cancer |
0 |
2(10%) |
0 |
2(3,3%) |
|
Рак тела матки Uterine corpus cancer |
0 |
0 |
1(5%) |
1(1,6%) |
|
Рак шейки матки Cervical cancer |
1(5%) |
1(1,6%) |
||
|
Без первично выявленного очага Cancer of unknown primary |
0 |
0 |
2(10%) |
2(3,3%) |
|
Класс RPA / RPA classes |
||||
|
I класс I class |
12(60%) |
15(75%) |
13(65%) |
40(66,7%) |
|
II класс II class |
5(25%) |
4(20%) |
3(15%) |
12(20%) |
|
III класс III class |
3(15%) |
1(5%) |
4(20%) |
8 (13,3%) |
Основными локализациями первичного очага являлись опухоли молочной железы (20 из 60 (33,3%)) и рак легкого (19 из 60 (31,7%)). Третей по частоте причиной одиночного метастатического поражения головного мозга являлась меланома, её метастазы были выявлены у каждого 6-го пациента в I и III группах — по 3 из 20 (15%) и у каждого 5-го во II группе — 4 из 20 (20%). Среди других локализаций следует отметить рак толстой кишки, почки, женских половых органов.
При оценке локализации метастатического очага установлено, что наиболее часто встречались поражения лобной и теменной долей — 14 из 60 (23,3%) и 13 из 60 (21,7%) соответственно. Частота встречаемости метастазов в других отделах головного мозга была в среднем в два раза меньше и составляла 10-11,7%.
Оценка прогностического класса показала, что большая часть больных относилась к I классу RPA — 40 (66,7%) из 60. Внутри групп это составило 12 (60%), 15 (75%) и 13 (65%) пациентов для первой, второй и третий групп соответственно.
Количество пациентов, представлявших II класс RPA, было примерно в три раза меньше, чем I, а распределение по группам — относительно равномерным. Следует отметить, что количество наиболее тяжелых пациентов с самым неблагоприятным прогнозом (III класс) в третьей группе составило 4 (20%) и превосходило количество пациентов этого класса в первой — 3 (15%) и особенно во второй — 1 (5%) группах.
Оценка побочных и токсических реакций осуществлялась с помощью опросника Европейского Общества Исследования и Лечения Рака (EORTC) для определения качества жизни QLQ-C15 и его дополнения для пациентов с поражением головного мозга BN-20+2.
С целью оценки психологического статуса проводилось определение уровня личностной и ситуативной тревожности по методике Ч.Д. Спилбергера-Ю.Л. Ханина, а также уровня депрессии по шкале депрессивных состояний В. Зунга (в адаптации Т.И. Балашовой).
Для идентификации типа общих неспецифических адаптационных реакций использовали такой информативный критерий, как лейкограмма Шиллинга, подсчет которой производили на 200 клетках в мазках периферической крови, окрашенных по Романовскому-Гимза. В основе метода лежит экспериментально доказанная связь между гомеостазом и морфологическим составом крови. На основании лейкограммы выделяют 4 типа реакций: стресс, как вариант патологии (лимфоцитов меньше 20%), и физиологические антистрессорные реакции, а именно тренировка (лимфоцитов — 21-27%), спокойная (лимфоцитов — 28-33% и повышенная (лимфоцитов — 34-40%) активации, переактивация (лимфоцитов — выше 40%). Для удобства интерпретации данных рассчитывался коэффициент антистресс/стресс (к ас/с) как соотношение количества антистрессорных и стрессорных реакций.
Для оценки электрической активности головного мозга был использован переносной портативный телеметрический электроэнцефалограф-регистратор «Энцефалан-ЭЭГР-19/26» (Россия). В 19 монополярных отведениях проводилась регистрация электроэнцефалограммы (ЭЭГ) в состоянии спокойного бодрствования.
Статистическую обработку полученных результатов проводили на персональном компьютере с использованием пакета статистических программ «Statistica 10.0» с вычислением критерия достоверности Стьюдента (t), согласно которому, статистически значимым считалось различие с вероятностью безошибочного прогноза не менее 95%, т.е. p<0,05.
Результаты
При оценке побочных и токсических реакций к моменту завершения лечения, по данным опросника для определения качества жизни QLQ-C15, при оценке критерия «физическое здоровье» в I и II группах статистически значимых изменений не было. Достоверное улучшение наблюдалось только у пациентов, получавших ксенонотерапию, — с 67,4 до 90,0 баллов (табл. 2).
Таблица / Table 2
Динамика клинической симптоматики до и после проведения различных видов лучевой терапии по данным опросника для определения качества жизни QLQ-С15
Dynamics of the clinical symptomatology before and after different types of the radiotherapy according to Quality of Life Questionnaire QLQ-С15
|
QLQ-05 (в баллах) / QLQ-d5 (points ) |
||||||
|---|---|---|---|---|---|---|
|
ОВГМ WBRT |
ОВГМ+boost WBRT+boost |
ОВГМ+boost+Xe WBRT+boost +Xe |
||||
|
До лечения Before treatment |
После лечения After treatment |
До лечения Before treatment |
После лечения After treatment |
До лечения Before treatment |
После лечения After treatment |
|
|
Общее здоровье Global health |
53,4±5,1 |
57,0±5,6 |
62,3±8,9 |
63,3±8,3 |
51,7±5,4 |
55,0±4,2 |
|
Физическое здоровье Physical functioning |
69,8±7,6 |
82,4±8,3 |
76,7±9,0 |
73,3±8,1 |
67,4±6,6 |
90,0±8,9* |
|
Эмоциональное состояние Emotional functioning |
70,8±6,1 |
78,2±7,3 |
70,0±10,9 |
86,7±10,9 |
73,3±5,9 |
76,7±6,9 |
|
Усталость Fatigue |
36,7±4,7 |
43,8±5,1 |
40,0±4,5 |
46,3±4,3 |
43,3±3,0 |
48,3±3,4 |
|
Тошнота (рвота) Nausea (vomiting) |
13,3±2,1 |
20,0±3,6* |
10,7±1,2 |
23,4±2,3* |
13,3±2,1 |
16,7±3,3 |
|
Боль Pain |
36,8±3,9 |
33,3±3,2 |
28,4±2,4 |
25,7±2,5 |
33,3±3,9 |
13,3±1,2* |
|
Одышка Dyspnoea |
20,7±3,3 |
26,9±4,1 |
20,0±2,5 |
16,7±2,4 |
16,7±3,1 |
10,0±1,4* |
|
Нарушения сна Insomnia |
33,4±3,7 |
23,0±2,9* |
36,7±8,7 |
20,0±2,7* |
26,7±3,7 |
20,0±2,7 |
|
Отсутствие аппетита Appetite loss |
13,3±1,5 |
16,7±3,3 |
10,0±1,4 |
36,7±8,7* |
13,3±1,5 |
3,3±0,3* |
Примечание: * — достоверно при р <0,05 с данными до лечения.
Note: * — significant atр <0,05 compared with the data before the treatment.
Тошнота ожидаемо нарастала, в I группе (ОВГМ) показатель возрастал с 13,3 до 20,0 при добавлении буста (II группа) с 10,0 до 23,4 баллов. Вместе с тем, в группе с ксеноном не отмечено значимого увеличения этого параметра, динамика была всего с 13,3 до 16,7 баллов.
По критерию опросника «отсутствие аппетита» наблюдалось ухудшение во II группе с 10,0 до 36,7 баллов, что могло быть связано с дополнительной лучевой нагрузкой, а при использовании ксенона на фоне буста мы напротив увидели положительную динамику со снижением индекса в 4 раза с 13,3 до 3,3 баллов.
Также важно отметить, что только у пациентов, получавших ксенон, отмечалось достоверное уменьшение проявления болевого симптома к концу лечения с 33,3 до 13,3 баллов, в то время как в других группах этот показатель значимо не изменялся.
При оценке результатов опросника BN20+2, разработанного специально для пациентов с поражением головного мозга, были получены следующие результаты. Для таких шкал, как неуверенность в будущем, нарушения зрения и коммуникативные расстройства после лечения была отмечена положительная динамика в виде достоверного снижение индекса для всех групп больных (табл.3).
Таблица/ Table 3
Динамика клинической симптоматики до и после проведения различных видов лучевой терапии по данным опросника для определения качества жизни пациентов с патологией головного мозга BN20+2
Dynamics of the clinical symptomatology before and after different types of the radiotherapy according to Quality of Life Questionnaire-BN-20+2 for brain cancer patients
|
BN-20+2 (в баллах) / BN-20+2 (points) |
||||||
|---|---|---|---|---|---|---|
|
ОВГМ WBRT |
ОВГМ+boost WBRT+boost |
ОВГМ+boost+Xe WBRT+boost +Xe |
||||
|
До лечения Before treatment |
После лечения After treatment |
До лечения Before treatment |
После лечения After treatment |
До лечения Before treatment |
После лечения After treatment |
|
|
Неуверенность в будущем Future uncertainty |
33,4±4,7 |
23,2±4,1* |
36,7±5,3 |
20,0±3,7* |
31,7±3,6 |
21,7±2,0* |
|
Нарушения зрения Visual disorder |
26,5±2,9 |
16,3±1,5* |
20,0±2,5 |
6,7±0,5* |
32,3±3,3 |
16,7±1,4* |
|
Коммуникативные расстройства Communication disorder |
20,4±2,1 |
13,3±1,1* |
13,3±1,0 |
3,3±0,4* |
21,0±1,3 |
13,3±1,0* |
|
Нарушения двигательных функций Motor dysfunction |
16,7±2,2 |
13,4±1,6 |
16,7±1,7 |
20,0±2,5 |
26,7±4,2 |
6,4±0,6* |
|
Головная боль Headaches |
38,6±4,6 |
32,8±5,2 |
36,2±4,4 |
33,3±3,8 |
43,3±7,9 |
16,7 ± 1,9* |
|
Сонливость Sleepiness |
40,3±4,8 |
36,6±4,1 |
30,0±2,3 |
20,0±2,5* |
46,7±5,8 |
40,0±6,5 |
|
Выпадение волос Hair loss |
13,3±2,6 |
53,6±4,7* |
13,3±2,8 |
47,6±3,9* |
13,3±2,0 |
56,7±5,5* |
|
Кожный зуд Skin itch |
6,5±0,8 |
7,2±0,9 |
3,3±0,4 |
3,3±0,4 |
16,7±3,3 |
13,3±1,5 |
|
Нарушения координации Coordination disorder |
20,0±2,9 |
23,3±2,6 |
16,3±1,3 |
26,3±2,2* |
20,0±2,9 |
3,3±0,4* |
|
Способность концентрироваться Difficulty concentrating |
33,8±4,1 |
30,3±3,9 |
33,3±2,4 |
46,4±4,8* |
36,7±6,6 |
16,7±1,9* |
|
Общее самочувствие Global state of health |
20,2±1,9 |
23,3±3,3 |
26,7±4,9 |
30,0±2,8 |
20,0±2,5 |
3,3±0,6* |
|
Проблемы в семье Family troubles |
36,3±4,1 |
30,3±3,9 |
30,3±2,4 |
33,6±3,8 |
46,7±3,8 |
36,7±4,2 |
|
Нарушения памяти Memory problems |
20,0±2,5 |
23,3±2,4 |
26,6±4,9 |
23,8±2,8 |
26,6±2,9 |
16,8±1,9* |
Примечание: * — достоверно при р <0,05 с данными до лечения
Note: * — significant atр <0,05 compared with the data before the treatment
Позитивным моментом при использовании ксенона было статистически значимое уменьшение степени выраженности нарушения двигательных функций с 26,7 до 6,4 и нарушения координации с 20,0 до 3,3баллов. Кроме того, только у этих пациентов отмечено достоверно снижение критерия «головная боль» с 43,3 до 16,7 баллов, в то время как в других группах этот параметр значимо не изменялся.
При оценке психологического статуса были исследованы личностная и ситуативная тревожности, а также уровень депрессии. Исходно у 60-70% пациентов всех групп отмечался высокий уровень личностной тревожности. После лечения он ожидаемо не изменился.
Высокая ситуативная тревожность отмечалась у 40, 65 и 70% больных в I, II и III группах соответственно до лечения и снижалась к моменту его завершения. Для пациентов I группы динамика по данному показателю отсутствовала. Во II группе отмечена положительная динамика (с 65 до 45%). Наиболее ярко выраженное уменьшение показателя с 70 до 30% (p<0,05) было отмечено в группе с ксеноном.
Отсутствие депрессии до лечения регистрировалось в 40, 55, и 50% случаев в I, II и III группах соответственно. После лечения у больных всех групп сходно, в среднем, в 1,5 раза увеличилось число случаев отсутствия депрессии (60,75,80%), при этом лучший показатель (80%) был отмечен в группе с ксеноном; кроме того, количество случаев легкой депрессии у этих пациентов уменьшилось в 1,5раза, и наблюдалось полное отсутствие больных с маскировочной депрессией.
При оценке адаптационных реакций в I группе (ОВГМ) до лечения частота антистрессорных реакций («тренировка» и «спокойная активация») превышала частоту стресса в 4 раза и составляла 80% случаев. После проведения лечения частота хронического стресса увеличилась в 3 раза, достигнув 60%, при этом количество пациентов с реакцией тренировки и спокойной активации сократились в 2 раза, с 40 до 20%. Средний уровень лимфоцитов снизился с 25,2 до 20,8% (табл. 4).
Таблица/ Table 4
Структура адаптационных реакций у больных с метастатическим поражением мозга при проведении адъювантной терапии
Types of adaptive responses in patients with single brain metastasis during the adjuvant therapy
|
ОВГМ WBRT |
ОВГМ+boost WBRT+boost |
ОВГМ+boost+Xe WBRT+boost +Xe |
||||
|---|---|---|---|---|---|---|
|
До лечения Before treatment |
После лечения After treatment |
До лечения Before treatment |
После лечения After treatment |
До лечения Before treatment |
После лечения After treatment |
|
|
Стресс острый Acute stress reactions |
0 |
0 |
6,3 |
37,5 |
20,0 |
50,0 |
|
Стресс хронический Chronic stress |
20,0 |
60,0 |
12,5 |
43,6 |
10,0 |
20,0 |
|
Тренировка Training |
40,0 |
20,0 |
37,5 |
6,3 |
30,0 |
10,0 |
|
Спокойная активация Quiet activation |
40,0 |
20,0 |
18,7 |
6,3 |
20,0 |
10,0 |
|
Повышенная активация Increased activation |
0 |
0 |
18,7 |
0 |
10,0 |
10,0 |
|
Переактивация Hyperactivation |
0 |
0 |
6,3 |
6,3 |
10,0 |
0 |
|
|
25,5±3,2 |
20,8±4,0 |
26,0±3,1 |
11,3±1,2 |
22,7±4,1 |
13,9±5,2 |
|
к ас/с |
4,0 |
0,67 |
4,3 |
0,23 |
2,3 |
0,43 |
Примечание: о ЛФ,% — среднегрупповой уровень лимфоцитов, к ас/с — коэффициент антистресс/стресс.
Note: 
Во II группе, где пациенты получали ОВГМ с бустом на ложе метастатического очага, до начала лечения острый стресс встречался в 2 раза реже хронического — 6,3 и 12,5% соответственно. Реакции спокойной и повышенной активаций встречались в 18,7%, в два раза чаще регистрировалась реакция тренировки. Реакция переактивации наблюдалась у 6,3%.
К моменту завершения лечения во II группе (ОВГМ+boost) количество пациентов с острой стрессорной реакцией увеличилось в 6 раз по сравнению с началом лечения, доля реакций хронического стресса возросла в 3,5 раза, а суммарное количество стрессорных реакций превысило 80%. Кроме того, отмечено снижение среднегруппового уровня лимфоцитов с 26,0 до 11,3%.
Структура адаптационных реакций в III группе (ОВГМ+boost+Xe), пациенты которой дополнительно к лучевой терапии получали ксенон-кислородные ингаляции, до начала лечения не отличалась от таковой для I и II групп. Стрессовые реакции регистрировались у 30% пациентов, при этом острый стресс встречался в 2 раза чаще. Среди антистрессорных реакций преобладала реакция тренировки, которая встречалась в 1,5 и 2 раза чаще спокойной и повышенной активации.
К концу лечения количество острых стрессорных реакций увеличилось в 2,5 раза, а хронических в 2 раза. В 3 раза уменьшилось количество пациентов с реакцией тренировка, и в 2 раза с реакцией спокойной активации.
Межгрупповое сравнение коэффициента антистресс/ стресс позволило выявить, что во всех 3-х группах пациентов характер динамики был сходным, однако выраженность этих изменений была различной: наименьшая — в 5,3 раза (с 2,3 до 0,42) — в III-ей группе (ОВГМ+boost+Xe), близкая к ней — в 6 раз (с 4,0 до 0,67) — в I-ой (ОВГМ), наибольшая — в 18,7 раз (с 4,3 до 0,23) — во II-ой (ОВГМ+boost).
При оценке ЭЭГ выявлено, что в I группе к середине лечения отмечался рост мощности ЭЭГ в диапазонах альфа- (с 15,5 до 31,8мкВ2), тета- (с 5,2 до 8,3мкВ2), и бета-ритмов (с 2,4 до 5,8мкВ2). Во второй половине лечебного цикла и после его завершения отмечалось снижение мощности рассматриваемых волновых диапазонов. Так, в конце лечения мощность альфа-ритма составляла 24,2 мкВ2, тета-ритма — 8,5 мкВ2 и бета-ритма — 3,6 мкВ2. Мощность показателей дельта-волновой активности падала на протяжении курса лечения с 24,0 мкВ2 в начале лечения до 13,9 мкВ2 к моменту завершения лечения (рис.1).
Рисунок 1. Средние значения спектральной мощности ЭЭГ в диапазонах дельта-, тета-, альфа-, бета-ритмов до начала терапии, в середине курса терапии и после его завершения.
Примечание: * — достоверно при р <0,05.
Figure 1. The average measures of EEG spectral power in the range of delta-, theta-, alpha-, beta- rhythms before, in the middle and after the therapy.
Note: * — significant atр <0,05.
У пациентов II группы динамика показателей мощности тета- и бета-ритмов была схожа с показателями первой группы. К середине лечения отмечался рост с 6,3 до 11,7 мкВ2 для тета- и с 1,5 до 2,1 мкВ2 для бета-активности с последующим падением показателей до 8,1 мкВ2 и 1,6 мкВ2. Мощность дельта-ритма также снижалась на протяжении курса лечения с 10,0 вначале до 7,9 мкВ2 к моменту его завершения. По сравнению с фоном, после терапии установлено снижение мощности альфа-ритма с 14,1 до 11,3 мкВ2.
Анализ пространственных изменений спектральной мощности ЭЭГ у пациентов первой группы (ОВГМ) выявил усиление синхронизации ЭЭГ и наличие признаков общемозговых нарушений корково-подкорковых связей.
У пациентов II группы, получающих адъювантную лучевую терапию в объеме ОВГМ+boost, во время терапии установлено усиление синхронизации в диапазонах тета- и бета-ритмов, после завершения курса терапии, по сравнению с фоном, выявлено снижение мощности в диапазоне альфа-ритма. Процесс терапии сопровождался десинхронизацией ЭЭГ в большинстве анализируемых регионах и усиление синхронизации в области удаленного метастатического очага. После завершения терапии установлено общемозговое нарушение корково-гиппо- компальных связей на фоне снижения мощности ЭЭГ.
У пациентов III группы (ОВГМ+boost+Xe) во время терапии установлено увеличение мощности в дельта диапазоне и ее снижение после завершения терапии. Во время терапии выявлено прирост мощности дельта-ритма во всех анализируемых областях и десинхронизация диапазонов других ритмов в области удаленного метастатического очага. После завершения терапии по сравнению с фоновой ЭЭГ установлено снижение мощности дельта-активности в лобно-центральных и затылочных областях. В области удаленного метастатического очага отмечен прирост мощности дельта-активности и снижения мощности тета- и альфа-активности. Выявлено нарушение кортикально-подкорковых связей в области удаленного метастатического очага.
Обсуждение
Снижение уровня качества жизни у пациентов с метастатическим поражением головного мозга может быть вызвано как самим заболеванием, так и ятрогенными причинами. Изучение влияния различных типов адъювантной лучевой терапии на показатели соматического и психологического статуса позволило выявить ряд характерных особенностей.
Проведение ОВГМ ожидаемо вызывало статистически значимые изменения по критериям «тошнота» и «выпадение волос», что характерно для данного вида лучевой терапии. При этом подведение дополнительно локального облучения привило к ухудшению самочувствия. Отрицательная динамика во II группе (ОВГМ+boost) была отмечена по таким показателям как: «отсутствие аппетита», «сонливость», «нарушение координации» и «способность концентрироваться». Данные изменения свидетельствуют о повышении токсичности лечения при сочетании ОВГМ с бустом.
Напротив, в III группе (ОВГМ+boost+Xe) наблюдалась достоверно значимая положительная динамика по целому ряду показателей. Пациенты в этой группе отмечали улучшение «физического здоровья», уменьшение болевого симптома и отдышки, а также улучшение аппетита.
Применение ксенона позволило добиться значимого уменьшения степени выраженности нарушения двигательных функций и координации в 4,2 раза (с 26,7 до 6,4) и 6 раз (с 20 до 3,3) соответственно, а также уменьшить выраженность головных болей в 2,6 раза (с 43,3 до 16,7). Только у пациентов III группы на фоне ксенон-кислород- ных ингаляций отмечалось достоверное уменьшение нарушений по критериям: «память», «способности концентрироваться» — в 1,5 раза и в 2,2 раза (26 до 16) (36 до 16) и общее самочувствие — в 6 раз (20 до 3).
Столь разнонаправленная динамика показателей, характеризующих качество жизни пациентов, между II и III группами наглядно демонстрирует широкий спектр терапевтических возможностей медицинского ксенона.
Показатели личностной тревожности остались без изменений, так как данный критерий не может претерпевать коррекцию на столь непродолжительном (курс лечения 3-4 недели) промежутке времени. Более того, отсутствие динамики данного показателя говорит о достоверности полученных данных и корректности проведенного исследования.
При оценке показателей ситуативной тревожности в группе с ОВГМ не было получено значимых изменений, что касается групп с бустом, то динамика позитивных показателей III группы была в 2 раза (40 против 20) больше, чем во II. Данные особенности изменения личностных характеристик были обусловлены центральными анксиолитическими эффектами ксенона.
Оценка адаптационных реакций во всех трех группах до лечения свидетельствовала о сохранности потенциальных возможностей активации защитных систем организма. К моменту завершения терапии в I группе отмечено снижение уровня лимфоцитов, что являлось показателем агрессивного воздействия на организм. Смена антистрессорных реакций на стресс после завершения ОВГМ продемонстрировала реализацию умеренного напряжения интегральной адаптационной деятельности, ведущей к постепенному угнетению неспецифической сопротивляемости организма.
При завершении лечения во II группе, как видно из представленных данных, произошел существенный сдвиг в структуре адаптационных реакций: увеличение доли стрессорных реакций за счет переходов из физиологических типов реакций — спокойной и повышенной активации. Суммарное количество стрессорных реакций превысило 80%, демонстрируя негативное влияние на структуру адаптационных возможностей организма облучения всего головного мозга, усиленного бустом. Ярким подтверждением этому явилось падение среднегруппового уровня лимфоцитов.
Динамика показателей адаптационных реакций в III группе, в целом, тоже носила негативный характер, однако только у этих пациентов при завершении лечения была выявлена реакция повышенной активации, что является благоприятным прогностическим признаком.
Наиболее ярко стресслимитирующие и радиопротекторное свойства ксенона продемонстрировало изучение динамики коэффициента ас/с. К моменту завершения лечения наблюдалось резкое увеличение негативного критерия при добавлении к ОВГМ буста
(к ас/с = 18,7) по сравнению с ОВГМ в моноварианте (к ас/с = 6,0). Добавление ксенона к курсу лучевой терапии позволило добиться существенной положительной динамики (к ас/с = 5,3) при аналогичной лучевой нагрузке.
На основании анализа электроэнцефалограмм установлено, что ксенонотерапия, уменьшает негативное влияние облучения головного мозга на кортикальный электрогенез. Кроме того, установлен нейропротекторный эффект ксенона при ДЛТ, который заключался в снижении уровня функциональной активности мозга к середине курса лечения, на фоне которой изменения ЭЭГ имели локальный характер. По завершению курса лечения отмечено снижение мощности дельта-ритма и восстановление параметров других ритмов до фоновых значений, что позволяет говорить об активации компенсаторных механизмов.
Выводы
- Ксенонотерапия, является безопасным и эффективным методом оптимизации адъювантной лучевой терапии пациентов с одиночным метастатическим поражением головного мозга.
- Использование ксенонотерапии при облучении головного мозга позволяет улучшить качество жизни пациентов и уменьшить степень выраженности побочных и токсических реакций.
- Результаты объективных методов исследования свидетельствуют о стресслимитирующем и радио- протекторном свойствах ксенона.