Фармакологическое действие
Полностью гуманизированное моноклональное антитело [изотип иммуноглобулинов G1 (IgG1)], мишенью которого является фермент пропротеиновая конвертаза субтилизин-кексин типа 9 (PCSK9). Алирокумаб производится с помощью технологии рекомбинантной ДНК с использованием суспензионной культуры клеток яичника китайского хомячка.
Алирокумаб имеет молекулярную массу приблизительно 146 кДа.
PCSK9 связывается с рецепторами ЛПНП (Р-ЛПНП) на поверхности гепатоцитов, способствуя деградации Р-ЛПНП в печени. Р-ЛПНП являются главными рецепторами, которые выводят из системного кровотока циркулирующие ЛПНП, поэтому уменьшение количества Р-ЛПНП при связывании их с PCSK9 приводит к повышению концентрации Хc-ЛПНП в крови. Ингибируя связывание PCSK9 с Р-ЛПНП, алирокумаб увеличивает количество Р-ЛПНП для выведения ЛПНП, снижая, таким образом, концентрации Хc-ЛПНП в крови.
Р-ЛПНП также связывают богатые триглицеридами (ТГ) ремнантные ЛПОНП и ЛППП. Поэтому лечение алирокумабом может снижать концентрации этих ремнантных липопротеинов, о чем свидетельствует их уменьшение в аполипопротеине В (Апо В), холестерине липопротеинов, не являющихся липопротеинами высокой плотности (Хc-ЛПнеВП) и ТГ. Алирокумаб также снижает концентрации липопротеинов а (ЛП(а)), являющихся формой ЛПНП, которые связаны с аполипопротеином (а). Однако было показано, что Р-ЛПНП имеют низкую аффинность к ЛП(а), в связи с чем точный механизм, с помощью которого алирокумаб снижает ЛП(а), полностью не установлен.
В генетических исследованиях, проведенных у человека, были выявлены разновидности гена PCSK9 с мутациями потери или повышения функции. У пациентов с одним аллелем PCSK9 с мутацией потери функции отмечались более низкие концентрации Хс-ЛПНП, которые коррелировали со значительно более низкой частотой развития ИБС. У некоторых пациентов были выявлены мутации потери функции в двух аллелях, и у них отмечались очень низкие концентрации Хс-ЛПНП в крови с концентрациями в крови Хс-ЛПВП и ТГ в нормальном диапазоне. Наоборот, мутации повышения функции в гене PCSK9 были выявлены у пациентов с повышенными концентрациями Хс-ЛПНП в крови и клиническим диагнозом семейной гиперхолестеринемии.
Наблюдательный анализ показал, что без лечения концентрации Хс-ЛПНП в крови у пациентов с мутациями повышения функции в гене PCSK9 находились в диапазоне, подобном наблюдавшемуся у пациентов с более часто встречающимися мутациями, вызывающими гетерозиготную форму семейной гиперхолестеринемии (такими как мутации в гене Р-ЛПНП), демонстрируя центральную роль фермента PCSK9 в метаболизме Хс-ЛПНП и его концентрациях в крови. В многоцентровом двойном слепом, плацебо-контролируемом исследовании продолжительностью 14 недель 13 пациентов с гетерозиготной формой семейной гиперхолестеринемией, связанной с мутацией повышения функции в гене PCSK9, были рандомизированы в 2 группы: группу, получающую алирокумаб в дозе 150 мг 1 раз в 2 недели, и группу, получающую плацебо. Среднее значение концентрации Хс-ЛПНП в крови составляло 151.5 мг/дл. На второй неделе лечения среднее значение снижения исходной концентрации Хс-ЛПНП в крови составило 62.5% в группе пациентов, получавших алирокумаб, по сравнению с 8.8% у пациентов, получавших плацебо. На 8-й неделе лечения среднее значение снижения концентрации Хс-ЛПНП в крови от исходного значения у всех пациентов, получавших алирокумаб, составило 72.4%.
Большое количество исследований, проведенных у человека и животных, продемонстрировали центральную роль, которую играют повышенные концентрации Хс-ЛПНП в крови в начале и при прогрессировании атеросклероза. Другие липопротеины, содержащие Апо В-100, особенно богатые триглицеридами ремнантные липопротеины (образовавшиеся из ЛПОНП и ЛППП) и ЛП(а), также считаются способствующими развитию атеросклероза. Однако проведенные до настоящего времени исследования не выявили независимого влияния снижения концентраций этих липопротеинов на сердечно-сосудистую заболеваемость и смертность.
В исследованиях in vitro алирокумаб не индуцировал антитело-зависимую клеточно-опосредованную токсичность и комплемент-зависимую цитотоксичность (Fc-опосредованную эффекторную функцию), как в присутствии, так и в отсутствии PCSK9. У алирокумаба, связанного с PCSK9, не наблюдалось образования нерастворимых иммунных комплексов, способных связывать протеины комплемента.
Фармакокинетика
После п/к введения в дозе 50-300 мг среднее время достижения Cmax алирокумаба в сыворотке крови составляло 3-7 дней. Фармакокинетика алирокумаба после однократного п/к введения в дозе 75 мг в область живота, бедра или плеча была подобной. По данным популяционного анализа фармакокинетических показателей абсолютная биодоступность алирокумаба после п/к введения составляла 85%.
Незначительно большее (2.1-2.7-кратное), чем пропорциональное дозе, увеличение концентраций алирокумаба, наблюдалось при двукратном увеличении дозы с 75 мг до 150 мг 1 раз в 2 недели.
Равновесное состояние достигалось после введения 2-3 доз с двукратным коэффициентом накопления.
После в/в введения Vd алирокумаба составлял 0.04-0.05 л/кг, что указывает на распределение алирокумаба, главным образом, в системе кровообращения.
Предполагается, что алирокумаб расщепляется на небольшие пептиды и отдельные аминокислоты.
У алирокумаба наблюдались 2 фазы выведения. В низких концентрациях элиминация происходит преимущественно через насыщаемую связь с мишенью (PCSK9), в то время как при более высоких концентрациях элиминация алирокумаба происходит преимущественно через ненасыщаемый протеолитический путь. По данным популяционного анализа фармакокинетических показателей средний Т1/2 алирокумаба составлял 17-20 дней у пациентов, получавших алирокумаб в монотерапии подкожно в дозах 75 мг 1 раз в 2 недели или 150 мг 1 раз в 2 недели. При одновременном применении со статинами средний Т1/2 алирокумаба составлял 12 дней.
Показания активного вещества
АЛИРОКУМАБ
Для длительного лечения взрослых пациентов с первичной гиперхолестеринемией (несемейной и гетерозиготной формой семейной гиперхолестеринемии) или смешанной дислипидемией, включая пациентов с сахарным диабетом 2 типа, в дополнение к диете, для снижения концентрации Хс-ЛПНП, общего Хс, Хс-ЛПнеВП, аполипопротеина В (Апо В), триглицеридов и ЛП(а) и повышения концентраций Хс-ЛПВП и Апо А-1.
Применяют в комбинации со статинами (ингибиторами ГМГ-КоА-редуктазы) в сочетании или без сочетания с другой липид-модифицирующей терапией при невозможности достижения у пациентов целевой концентрации Хс-ЛПНП при приеме максимально допустимой дозы статинов;
Применяют в качестве монотерапии или как дополнение к другой, не содержащей статинов липид-модифицирующей терапии, у пациентов с непереносимостью статинов или при наличии противопоказаний к их применению.
Режим дозирования
Вводят п/к в область бедра, живота или плеча.
Рекомендуется каждый раз менять места инъекций. Не следует вводить в область активных кожных заболеваний или повреждений, таких как солнечные ожоги, кожная сыпь, воспаления кожи или кожные инфекции. Не следует вводить препарат в то же место, в которое вводились другие лекарственные препараты.
Начальная доза составляет 75 мг 1 раз в 2 недели. У пациентов, которым требуется большее снижение концентрации Хс-ЛПНП (>60%), начальная доза препарата может составлять 150 мг 1 раз в 2 недели.
Дозу следует подбирать индивидуально на основании таких параметров как исходные значения Хс-ЛПНП, цели терапии и ответ пациента на лечение. Концентрации липидов в крови можно оценивать через 4 недели после начала лечения или титрования дозы и проводить соответствующую коррекцию дозы.
Побочное действие
Со стороны иммунной системы: редко: — гиперчувствительность, аллергический васкулит.
Со стороны дыхательной системы: часто — субъективные симптомы и объективные признаки со стороны верхних дыхательных путей, включая боль в ротоглотке, ринорею, чихание.
Со стороны кожи и подкожных тканей: часто — кожный зуд; редко — крапивница, монетовидная экзема.
Прочие: часто — реакции в месте введения препарата, включая эритему/гиперемию, кожный зуд, отек, боль/болезненную чувствительность.
Противопоказания к применению
Беременность, период грудного вскармливания; возраст до 18 лет ; повышенная чувствительность к алирокумабу.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период лактации (грудного вскармливания).
Применение у детей
Препарат противопоказан для применения у детей и подростков в возрасте до 18 лет
Применение у пожилых пациентов
Препарат разрешен для применения у пожилых пациентов
Особые указания
С осторожностью следует применять у пациентов с почечной недостаточностью тяжелой степени и при печеночной недостаточности тяжелой степени.
Лекарственное взаимодействие
В клинических исследованиях при применении алирокумаба в комбинации с аторвастатином или розувастатином не наблюдалось каких-либо значимых изменений концентраций статинов в крови при повторных введениях алирокумаба, что указывает на то, что алирокумаб не влияет на изоферменты цитохрома Р450 (главным образом, изоферменты CYP3A4 и CYP2C9) и белки-транспортеры, такие как Р-гликопротеин (P-gp) и ОАТР (белок транспортер органических анионов).
Статины и другая липид-модифицирующая терапия, как известно, повышают синтез PCSK9, белка, являющегося мишенью алирокумаба. Повышение концентрации PCSK9 может привести к уменьшению системной экспозиции алирокумаба. Однако это не влияет на продолжительность его действия при применении 1 раз в 2 недели.
Прогнозный экономический эффект применения алирокумаба у пациентов с гиперхолестеринемией и высоким сердечно-сосудистым риском
Оценка экономической целесообразности включения алирокумаба в государственные программы возмещения для льготных категорий граждан.
На основании результатов опубликованных исследований проведена сравнительная оценка влияния на бюджет медицинских технологий с добавлением алирокумаба к терапии статинами и эзетимибом и стандартной терапии статинами и эзетимибом для вторичной профилактики после острого коронарного синдрома (ОКС) с горизонтом времени 2 года. Использовали Марковское моделирование и расчет прямых медицинских затрат. Для проверки устойчивости результатов проведен анализ чувствительности в отношении изменения стоимости алирокумаба. Стоимость болезни рассчитывали как совокупность прямых медицинских затрат (препараты, лечение сердечно-сосудистых заболеваний, аферез) и непрямых затрат (потери валового внутреннего продукта вследствие временной нетрудоспособности, сердечно-сосудистого заболевания или смертельного исхода).
Включение алирокумаба в программу государственного возмещения позволяет уменьшить нагрузку на бюджет на 49,05% у больных высокого сердечно-сосудистого риска, в том числе у больных семейной гиперхолестеринемией и рефрактерностью к стандартной гиполипидемической терапии. Экономия возникает в том числе за счет меньшей потребности в аферезе липидов плазмы крови при применении алирокумаба. Уменьшение финансового бремени болезни более чем на 50% в расчете на трудоспособное население при использовании алирокумаба ожидается за 2 года. Анализ чувствительности подтвердил устойчивость полученных результатов при искусственном увеличении цены препарата в 2,84 раза. Применение алирокумаба позволяет снизить бремя заболевания на 56,49%, или 7,78 млрд руб., в год для целевой группы за 2 года терапии по сравнению с текущей практикой лечения (с учетом непрямых затрат).
Полученные результаты позволяют считать включение алирокумаба в программы государственного (страхового) возмещения для вторичной профилактики после перенесенного ОКС экономически оправданным.
Многочисленные популяционные исследования свидетельствуют о том, что при применении гиполипидемических препаратов в реальной клинической практике необходимый (безопасный) уровень липидов крови не достигается у большинства пациентов [1-3]. Особое внимание уделяется тому факту, что даже у пациентов группы самого высокого риска, у которых должна проводиться наиболее «жесткая» вторичная профилактика, например, после острого коронарного синдрома (ОКС), стандартная гиполипидемическая терапия часто не обеспечивает целевой уровень холестерина липопротеидов низкой плотности (ЛНП) [4]. Как подчеркивают исследователи, одной из причин неэффективности вторичной профилактики статинами является возможная непереносимость высоких доз этих препаратов. Так, в клинических исследованиях частота миопатии, вызванной статинами, достигала 5%, а в обычной клинической практике это осложнение при использовании оптимальных доз статинов встречалось еще чаще [5,6]. Снижению эффективности вторичной профилактики сердечнососудистых событий, включая преждевременную смерть, может способствовать невыполнение больными врачебных рекомендаций, касающихся терапии статинами [7]. Более половины пациентов, нуждающихся в статинах, в первую очередь для профилактики повторных событий, получают субоптимальные дозы или вообще не принимают эти препараты [8], а среди оставшихся велика доля пациентов с высоким риском сердечно-сосудистой смерти (SCORE>20%) и низкой приверженностью к терапии статинами [9].
Не лучше обстоят дела с приемом гиполипидемических препаратов и у больных, перенесших первый ОКС. Перед выпиской из стационара таким пациентам практически всегда рекомендуют лечение статинами, однако через несколько лет эти препараты продолжают принимать не более 41% больных, да и то в низких, а, следовательно, малоэффективных, суточных дозах [10]. В европейских странах в течение года после выписки из стационара 40–75% пациентов, перенесших ОКС, также перестают принимать статины [11]. На приверженность к лечению влияют различные факторы, среди которых центральную роль играет поведение больного, который, сталкиваясь с побочными эффектами статинов или опасаясь их потенциальной токсичности, прекращает лечение или самостоятельно снижает дозу препарата. Опрос врачей свидетельствует о том, что и специалисты подвержены определенной инерции в принятии решения о терапии и нередко рекомендуют дозы, явно недостаточные для достижения целевого уровня липидов [12].
Особое внимание следует уделять больным сахарным диабетом 2 типа (СД), у которых чаще развиваются тяжелые сердечно-сосудистые события [13]. Так, вероятность ишемической болезни сердца (ИБС) у больных СД 2 типа по сравнению с другими категориями пациентов повышена в 2,0-3,0 раза, инфаркта миокарда – в 2,4-3,3 раза, инсульта – в 2,0 раза, а сердечно-сосудистой смерти — в 1,14 раза [14-16]. Такие больные нуждаются в эффективной гиполипидемической терапии, но около трети из них самостоятельно отказываются от приема статинов в течение года после назначения [17]. Кроме того, больным СД 2 типа почти в 3 раза чаще требуется повторная реваскуляризация коронарных артерий, которая ассоциируется с более высоким риском тяжелых осложнений [18,19].
Принципиально новым подходом к лечению дислипидемии является применение моноклональных антител, блокирующих фермент PCSK9, который регулирует деградацию (разрушение) рецептора к ЛНП [20]. Одним из таких препаратов является алирокумаб [21]. В рандомизированных клинических исследованиях лечение алирокумабом в дополнение к статинам и эзетимибу или в качестве альтернативы другим гиполипидемическим средствам вызывало значительное снижение уровня ЛНП и позволяло достичь целевых значений липидов крови [22]. Приверженность к лечению в течение как минимум 71 недели была почти 100%. При этом отклонение от интервала введения (раз в две недели) на 3 дня не сказывалось на терапевтическом эффекте [23]. По данным мета-анализа, снижение риска сердечнососудистых событий при лечении ингибиторами PCSK9, добавленными к комбинированной терапии статинами и эзетимибом, составило 51%, а при стандартной терапии статинами и эзетимибом – только 6% [24]. Соответственно, при оценке технологий в здравоохранении с применением этих схем коэффициенты числа возможных событий в течение 2 лет после ОКС составили 0,94 при стандартной фармакотерапии и 0,49 при применении алирокумаба [25]. Два препарата этого класса – алирокумаб и эволокумаб – с 2018 г. включены в Перечень жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП) [26].
Существенное увеличение доступности препаратах этой группы в нашей стране возможно на условиях государственного (страхового) возмещения. Ранее проведенный анализ [25] показал экономическую целесообразность включения алирокумаба в Перечень ЖНВЛП. Целью данного исследования была оценка экономической целесообразности включения алирокумаба в Перечень лекарственных препаратов для льготных категорий граждан (Перечень ОНЛС) для лечения пациентов высокого сердечно-сосудистого риска.
Материал и методы
В качестве целевой группы выбраны пациенты с семейной гиперхолестеринемией, перенесшие ОКС и реваскуляризацию миокарда в течение последнего года, рефрактерные к применению статинов и эзетимиба в максимальных переносимых дозах и нуждающиеся в аферезе липидов [27]. Расчетные данные показывают, что такие больные составляют не менее 19,4% от общего числа больных, перенесших ОКС [9]. Отечественные данные об интенсификации липидснижающей терапии у пациентов высокого сердечнососудистого риска отсутствуют, поэтому для проведения расчетов использовали данные, полученные в США [27].
Горизонт анализа составил 2 года в соответствии с принятой методикой [28] и данными клинических исследований алирокумаба [27]. При определении прямых затрат учитывали режимы применения анализируемых препаратов, указанные в соответствующих исследованиях [29,30] и в официальных инструкциях по медицинскому применению (табл. 1) [31]. В качестве препарата сравнения при оценке затрат на стандартную гиполипидемическую терапию рассматривали аторвастатин в максимальной дозе 80 мг/сут (включенный в Перечень ОНЛС) [26] в комбинации с эзетимибом в дозе 10 мг в сутки (не включен в ЖНВЛП).
| Препарат | Режим применения | Стоимость упаковки с 10% НДС (руб.) |
|---|---|---|
| Алирокумаб (Пралуэнт) (раствор для подкожного введения 75 или 150 мг/мл №2) | 1 инъекция каждые 2 нед. | 29 260,81 |
| Эзетимиб (Эзетрол) (таблетки 10 мг № 28) | 10 мг/сут длительно | 1 784,94 |
| Аторвастатин (Липримар) (таблетки 80 мг №30 | 80 мг/сут длительно | 1 095,50 |
Средняя стоимость эзетимиба (Эзетрол) рассчитана с учетом оптовой цены за вычетом максимальной оптовой надбавки и с учетом НДС [32]. Стоимости алирокумаба (Пралуэнт) и аторвастатина (Липримар) определены на основании Регистра предельных отпускных цен с учетом НДС [33].
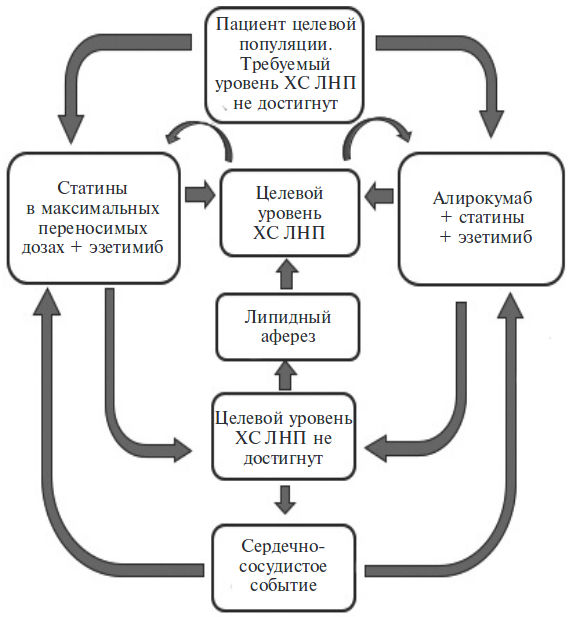
Анализ «влияние на бюджет». Анализ влияния на бюджет при включении алирокумаба в режимы фармакотерапии у пациентов целевой популяции проводили согласно утвержденным правилам [34] по сравнению с препаратами, уже включенными в Перечень ОНЛС. С использованием моделирования сравнивали две альтернативные медицинские технологии:
- текущий режим терапии с использованием статина в максимальных переносимых дозах и эзетемиба (целевых уровней ХС ЛНП достичь не удается);
- добавление к статинам и эзетимибу алирокумаба.
При недостаточной эффективности лечения показан аферез липидов плазмы крови, который проводится один раз в 2 недели. Модель Маркова, описывающая применение анализируемых технологий в рамках проводимого анализа, представлена на рис. 1.
Для анализа влияния на бюджет учитывали прямые затраты на лекарственные препараты и аферез и прямые затраты на лечение сердечно-сосудистых событий.
В табл. 2. приведены данные о частоте применения афереза у пациентов, получающих алирокумаб и плацебо (т.е. только на фоне стандартной терапии) [35]. Согласно Программе государственных гарантий бесплатного оказания гражданам медицинской помощи на 2018 г. [36] стоимость одного дня лечения аферезом липидов плазмы крови в условиях дневного стационара за счет средств ОМС составляет 14 619,50 руб. Согласно КСГ №34 «Лечение наследственных атерогенных нарушений липидного обмена с применением афереза (липидная фильтрация, афинная и иммуносорбция липопротеидов) в случае отсутствия эффективности базисной терапии» предусмотрен коэффициент затрат 5,07, что составляет в сумме 74 120,86 руб./1 сеанс [37].
| Процент выполненных процедур афереза от необходимого числа | Средневзвешенный процент пациентов, получающих аферез, принятый для расчета | Частота афе реза в группе алиро кумаба, % | Частота афе реза в группе сравнения (%) |
|---|---|---|---|
| Аферез не проводится | 0 | 63,4 | 0 |
| >0% — ≤25% | 12,5 | 17,1 | 0 |
| >25% — ≤50% | 37,5 | 12,2 | 14,3 |
| >50% — ≤75% | 62,5 | 2,4 | 23,8 |
| >75% — ≤100 | 87,5 | 2,4 | 33,3 |
| 100% | 100 | 2,4 | 28,6 |
При оценке частоты сердечно-сосудистых событий учитывали базовую вероятность их наступления в группе, экстраполированную на целевую группу с глобальной модели по оценке влияния на бюджет при включении препарата алирокумаб в схему лечения (табл. 3).
| Событие | Вероятность наступления в год, % | Стоимость законченного случая (руб.) |
|---|---|---|
| Примечание: *Среднее между осложненной и неосложненной формой.**Средняя стоимость при равной частоте осложнений: тромбоэмболии легочной артерии, фибрилляции предсердий (с оперативным пособием и без), сердечно-легочная недостаточность | ||
| Нефатальный инфаркт миокарда | 9 | 52 520,14* |
| Нестабильная стенокардия | 1 | 80 374,94** |
| Реваскуляризация миокарда | 36 | 207 418,08 |
| Нефатальный инсульт | 2 | 120 297,40 |
| Сердечно-сосудистая смерть | 4 | — |
По данным мета-анализа М. Silverman и соавт. [38], снижение риска сердечно-сосудистых событий при использовании ингибиторов PCSK9 составляет 51%, а при лечении статином и эзетемибом – 6%. Эти показатели учитывали при расчете частоты сердечно-сосудистых событий в группах пациентов, получающих стандартную терапию и алирокумаб. Затраты на лечение сердечно-сосудистых событий рассчитывали, исходя из стоимости лечения одного законченного случая согласно тарифному соглашению ОМС по Москве 2017 г. (табл. 3) [39].
При расчете затрат на терапию учитывали смертность пациентов, в связи с которой они выбывали из исследования. Было сделано допущение, что число случаев смерти распределяется равномерно в течение года. Анализ чувствительности проводили для проверки устойчивости полученных результатов основного сценария к изменению входного параметра – стоимости препарата алирокумаб. Анализ «стоимости болезни» включал кроме вышеперечисленных затрат оценку непрямых расходов (недополучение валового внутреннего продукта – ВВП). Непрямые затраты в виде потери ВВП по причине смерти пациентов на период дожития до возраста завершения экономической активности (72 года) рассчитывали в соответствии с требованиями нормативных документов [40]. Расчет проводили для группы из 1000 пациентов с последующим перерасчетом на 1 пациента.
Размер недополученного ВВП рассчитывали путем деления годового ВВП страны на численность работоспособного населения и число рабочих дней в году. ВВП за 2016 г. составил 85 880,6 млрд руб, занятое население – 72 392 600 человек, число рабочих дней в году – 247. Для анализа были приняты следующие сроки временной нетрудоспособности при наступлении сердечно-сосудистых событий (согласно стандартам оказания медицинской помощи): нефатальный инфаркт миокарда – 80 дней, реваскуляризация миокарда – 30 дней, нефатальный инсульт – 80 дней [25]. Непрямые расходы, связанные с оплатой временной нетрудоспособности, получены умножением стоимости одного дня на соответствующее количество дней. Недополученный ВВП вследствие стойкой утраты трудоспособности или преждевременной смерти определен как отношение ВВП к трудоспособному населению. В 2016 г. он составил 488 782 руб. на человека трудоспособного возраста [41]. Эти показатели, как и соответствующий параметр при ОКС [42], отнесены к непрямым расходам.
Анализ минимизации затрат. Алирокумаб сравнивали с другим ингибитором PCSK9, зарегистрированным в России, – эволокумабом, применяющимся по сходным показаниям [43]. При отсутствии различий в эффекте должен применяться вариант анализа «затраты-эффект» – анализ минимизации затрат (CMA – Cost Minimization Analysis). Стоимость эволокумаба (Репата, Амджен Мэньюфэкчуринг Лимитед, Пуэрто-Рико, США), 140 мг/мл, шприцы 1 мл, рассчитана согласно методике определения предельной отпускной цены производителя [44], поскольку препарат включен в Перечень ЖНВЛП на 2018 г. (на момент анализа цена еще не была зарегистрирована). Минимальная цена определена в Словакии и составляет 386 евро за 2 шприца по 140 мг [45] или 579 евро в месяц (с учетом необходимости 3 шприцов), что по курсу ЦБ РФ на момент анализа (69,64 руб.) [46] соответствует 40 321,56 руб. С учетом таможенных сборов в 3,2% стоимость месяца лечения составляет 41 611,84 руб, а с учетом НДС (10%) – 45 773,03 руб.
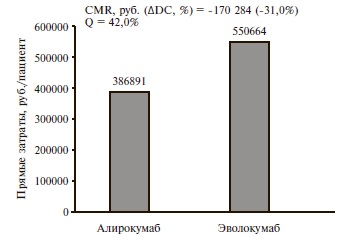
Определяли показатель минимизации затрат CMR (Cost Minimization Ratio), показывающий, на сколько применение менее затратной медицинской технологии позволяет снизить затраты на лечение пациента [47]. Также оценивали показатель упущенных возможностей Q, характеризующий объем терапии, который мог бы быть обеспечен при использовании менее затратной медицинской технологии. Упомянутые показатели рассчитывали по формулам: CMR=DC2-DC1 и Q=CMR/DC1 × 100%,где CMR – показатель минимизации затрат; DC1 – прямые затраты при применении менее дорогой медицинской технологии; DC2 – прямые затраты при более дорогой медицинской технологии; Q – показатель упущенных возможностей.
Результаты
Определение целевой группы пациентов. В России ежегодно диагностируют в среднем 520 000 случаев ОКС [42]. Среди них расчетная доля больных с семейной гиперхолестеринемией составляет 19,4% (100 880 человек). ОКС с давностью 1 год и проведенной реваскуляризацией можно ожидать у 36% (на основании опроса врачей кардиологов), или 36 317 пациентов. Экстраполируя данные по частоте приема статинов пациентами с ОКС (88%) на эту группу пациентов, можно ее ограничить до 31 959 человек. Согласно данным модели интенсификации липидснижающей терапии у пациентов высокого сердечно-сосудистого риска [23], назначение алирокумаба потребуется примерно 14% из этих пациентов. Таким образом, размер целевой группы был ограничен 4 474 пациентами с семейной гиперхолестеринемией, перенесшими ОКС в течение последнего года и рефрактерными к терапии статинами. Частоту сердечнососудистых событий рассчитывали в целевой группе пациентов в рамках горизонта исследования 2 года. Результаты оценки прямых медицинских затрат на лечение пациентов целевой группы приведены в табл. 4.
| Показатели | Статин + эзетимиб | Алирокумаб + статин+эзетимиб |
|---|---|---|
| Первый год | ||
| Лекарственные затраты | 160,50 | 1 877,82 |
| Затраты на аферез | 6 463,67 | 1 848,94 |
| Затраты на лечение сердечнососудистых событий | 59,01 | 30,64 |
| Суммарно за первый год | 6 683,18 | 3 729,82 |
| Второй год | ||
| Лекарственные затраты | 154,52 | 1 812,93 |
| Затраты на аферез | 6 022,85 | 1 008,64 |
| Затраты на лечение сердечнососудистых событий | 57,00 | 30,15 |
| Суммарно за второй год | 6 234,37 | 2 851,72 |
| Суммарные затраты за 2 года | ||
| Прямые медицинские затраты | 12 917,55 | 6 581,54 |
| Разница (%) | — | Разница (%) |
Результаты анализа влияния на бюджет свидетельствуют о снижении суммарных прямых затрат на лечение пациентов целевой группы при добавлении алирокумаба к липидснижающей терапии на 48,6%. Это обусловлено преимущественно снижением частоты назначения дорогостоящей процедуры афереза при включении алирокумаба в схему лечения. Результаты анализа показали, что включение алирокумаба в Перечень ОНЛС экономически обосновано.
Анализ чувствительности. Наибольший вклад в суммарные прямые затраты при стандартном варианте терапии вносят затраты на липидный аферез, в то время как затраты на лекарственную терапию не превышают 2,5% от общей суммы. При добавлении к терапии алирокумаба затраты на его применение также начинают вносить значимый вклад в общие затраты. Как было отмечено выше, стоимость процедуры липидного афереза регламентируется тарифным соглашением по программе ОМС на 2018 г. В связи с этим единственным входным параметром, способным значимо повлиять на результат, является цена алирокумаба. Кроме того, выше было показано, что добавление алирокумаба в схему терапии позволяет снизить затраты. В связи с этим анализ чувствительности проводили для проверки устойчивости полученных результатов основного сце нария к однонаправленному изменению входного параметра: повышению стоимости алирокумаба. Полу ченный результат оказался устойчивым к возрастанию цены на алирокумаб (табл. 5). Предлагаемый режим терапии с применением алирокумаба остается менее затратным при увеличении цены на алирокумаб в 2,84 раза (на 184%).
| Увеличение цены алирокумаба | Разница затрат при использовании алирокумаба по сравнению с текущим вариантом терапии | |
|---|---|---|
| млн руб. | % | |
| 0% | -6 278,2 | -48,61 |
| +50% | -4 579,58 | -35,45 |
| +100% | -2 880,35 | -22,30 |
| +150% | -1 181,11 | -9,14 |
| +184% | -25,63 | -0,20 |
Анализ стоимости болезни. Учитывали прямые и непрямые затраты. Как указано выше, размер недополученного ВВП при невыходе пациента на работу в 2016 г. равнялся 4 802,90 руб. Средний возраст пациентов в клинических исследованиях составил 60-62 года (61 год) [23]. При расчетах было сделано допущение, что только 20% пациентов целевой группы относились к занятым в данной возрастной категории. При оценке недополученного ВВП за период дожития до 72 лет рассчитывали потери ВВП по причине смерти пациентов в течение первого и второго года исследования, а также за период дожития, т.е. в течение 9 лет. Включение алирокумаба в схемы терапии пациентов целевой группы позволит снизить бремя заболевания на 7,73 млрд руб, или на 56,1%, за 2 года терапии (табл. 6).
| Показатели | Статин + эзетимиб | Алирокумаб + статин + эзетимиб |
|---|---|---|
| Первый год | ||
| Прямые медицинские затраты | 6 683,18 | 3 729,82 |
| Недополученный ВВП, в связи с временной потерей трудоспособност | 39,50 | 20,52 |
| Недополученный ВВП в результате смерти в рамках горизонта исследования | 19,61 | 9,99 |
| Второй год | ||
| Прямые медицинские затраты | 6 234,37 | 6 234,37 |
| Недополученный ВВП, в связи с временной потерей трудоспособности | 38,07 | 20,19 |
| Недополученный ВВП в результате смерти в рамках горизонта исследования | 58,46 | 30,48 |
| Потери ВВП за годы дожития | ||
| Недополученный ВВП за годы дожития до возраста потери экономической активности (72 года) | 702,54 | 369,42 |
| Суммарные затраты за 2 года | ||
| Стоимость болезни | 13 775,73 | 6 050,53 |
| Разница (%) | — | -56,49 |
Анализ минимизации затрат. Исходя из обоснованного научного предположения об одинаковой эффективности (доля пациентов, достигающих целевых значений ХС ЛНП) алирокумаба и еще одного зарегистрированного в России препарата этого класса – эволокумаба – мы проводили анализ минимизации затрат. При этом стоимость статинов и эзетимиба не учитывали, поскольку считается, что дозировки и эффекты этих препаратов одинаковы в выделенных нами гипотетических группах алирокумаба и эволокумаба. Согласно официальным инструкциям у пациентов с семейной гиперхолестеринемией алирокумаб применяется в дозе 150-300 мг в месяц (2 инъекции), а эволокумаб – в дозе 280 мг (2 инъекции) или 420 мг в месяц (3 инъекции). Исходя из этого были рассчитаны лекарственные затраты на 52-недельную терапию сравниваемыми препаратами с последующим определением показателей минимизации затрат и упущенных возможностей. Результаты сравнения приведены в рис. 2. Расчетные данные показывают, что терапия алирокумабом по сравнению эволокумабом у пациентов рассматриваемой целевой группы позволит снизить затраты на 170 284 руб. на 1 пациента в год (-31,0%) или пролечить с тем же эффектом на 42,0% больше больных.
Обсуждение
При проведении анализа минимизации затрат сравнивали два ингибитора PCSK9, зарегистрированные в РФ: алирокумаб и эволокумаб. Этот вид анализа использовался потому, что нам не удалось обнаружить в доступной литературе результатов прямых сравнительных клинических исследований этих препаратов. Непрямое же сравнение не позволяет выявить достоверных различий между их клиническим эффектом, оцениваемым по доле пациентов, достигающих целевых уровней липидов крови. Опубликованный систематизированный обзор, показавший преимущество эволокумаба перед алирокумабом по степени снижения уровня холестерина ЛНП [48], не может быть использован для фармакоэкономического анализа, по нескольким причинам:
1. В мета-анализ не были включены некоторые исследования, в частности, RUTHERFORD и RUTHER
FORD-2 [49,50], что могло исказить результат непрямого сравнения в пользу эволокумаба. В группе плацебо не наблюдалось значительного повышения уровня холестерина ЛНП, поэтому включение исследований RUTHERFORD в сетевой мета-анализ могло повлиять на оценку общей эффективности эволокумаба по сравнению с плацебо.
2. В анализе не учтено изменение эффективности при титровании дозы алирокумаба.
3. В группах плацебо в исследованиях эволокумаба, включенных в мета-анализ, отмечалось выраженное повышение содержания холестерина ЛНП (почти на 13%) [51], в то время как в исследованиях алирокумаба уровни холестерина ЛНП в группах плацебо были стабильными или менялись очень незначительно [52,53].
4. Выбор временных интервалов для оценки эффективности не позволяет сравнить эффективность алирокумаба в этом анализе. Так, в программе ODYSSEY эффективность алирокумаба оценивали через 24 недели терапии [51]. Поскольку все данные по эффективности эволокумаба приведены для периода 10-12 недель, он теоретически получает дополнительные преимущества перед алирокумабом, так как для него не учитывается эффективность на большем временном горизонте.
5. В рассматриваемых исследованиях пациенты получали различную базовую терапию и значительно отличались по клинико-демографическим характеристикам, что не позволяет достоверно судить о сравнительной эффективности анализируемых препаратов.
6. В мета-анализе изменения уровня холестерина ЛНП сравнивали с контролем, а не с исходным уровнем, как это было сделано при оценке первичных конечных точке в анализируемых исследованиях.
Выводы
1. Включение алирокумаба в Перечень ОНЛС экономически обосновано. За 2 года применение алирокумаба должно снизить нагрузку на бюджет на 49,05% при лечении пациентов высокого сердечно-сосудистого риска, в том числе с семейной гиперхолестеринемией и рефрактерностью к гиполипидемической терапии по сравнению с лечением статинами и эзетимибом.
2. Полученный результат является устойчивым к росту цены на алирокумаб на 184% (в 2,89 раза).
3. Применение алирокумаба позволяет снизить бремя заболевания на 56,49%, или 7,78 млрд руб, в целевой группе за 2 года терапии по сравнению с текущей практикой лечения.
4. Курсовая стоимость лечения алирокумабом на 31,0% ниже таковой эволокумабом, что может позволить снизить затраты на лечение 1 пациента на 170 284 руб. в год и пролечить дополнительно 42% пациентов.
Используемые источники
- Bongard V, Dallongeville J, Arveiler D. et al. Attainment of low-density lipoprotein cholesterol target in the French general population according to levels of cardiovascular risk: insights from the MONA LISA study. Arch Cardiovasc Dis 2013;106(2):93–102.
- Bruckert E, Ferrières J. Evidence supporting primary prevention of cardiovascular diseases with statins: gaps between updated clinical results and actual practice. Arch Cardiovasc Dis 2014;107(3):188–200.
- Antiochos P, Marques-Vidal P, Waeber G, Vollenweider P. Five year trends in dyslipidaemia prevalence and management in Switzerland: the CoLaus study. Nutr Metab Cardiovasc Dis 2015;25(11):1007–15.
- Yan AT, Yan RT, Tan M, et al. Contemporary management of dyslipidemia in high-risk patients: targets still not met. Am J Med 2006;119(8):676–83.
- Joy TR, Hegele R. A. Narrative review: statin-related myopathy. Ann Intern Med 2009;150(12):858–68.
- Fernandez G, Spatz E. S, Jablecki C, Phillips PS. Statin myopathy: a common dilemma not reflected in clinical trials. Cleve Clin J Med 2011;78(6):393–403.
- Nielsen SF, Nordestgaard BG. Negative statin-related news stories decrease statin persistence and increase myocardial infarction and cardiovascular mortality: a nationwide prospective cohort study. Eur Heart J 2016;37(11):908-16.
- Bittner V, Deng L, Rosenson RS, et al. Trends in the use of nonstatin lipid-lowering therapy among patients with coronary heart disease: a retrospective cohort study in the medicare population 2007 to 2011. J Am Coll Cardiol 2015;66(17): 1864–72.
- Gamboa CM, Safford MM, Levitan EB, et al. Statin underuse and low prevalence of LDL-C control among US adults at high risk of coronary heart disease. Am J Med Sci 2014;348(2):108–14.
- Толпыгина С.Н., Марцевич С.Ю. Изучение динамики частоты приема основных классов лекарственных препаратов, показанных при лечении пациентов с хронической ишемической болезнью сердца, с 2004 по 2014 г. данные регистра прогноз ИБС. Клиницист 2016;10(1): 29-35.
- Vonbank A, Agewall S, Kjeldsen KP, et al. Comprehensive efforts to increase adherence to statin therapy. Eur Heart . 2017 Jan 10. pii: ehw628.
- Krempf M, Simpson RJ, Ramey DR, et al. Patient and physician factors influence decision-making in hypercholesterolemia: a questionnaire-based survey. Lipids Health Dis 2015;14(1):45-7.
- Burggraaf B, Castro Cabezas M. Interventions in type 2 diabetes mellitus and cardiovascular mortality-An overview of clinical trials. Eur J Intern Med 2017;42:1-15.
- Дедов И.И., Александров А.A. Проблемы острого инфаркта миокарда у больных сахарным диабетом. Сахарный диабет 2008;1:4-10.
- Какорин С.В., Тулякова Э.В., Воронкова К.В., Мкртумян А.М. Острое нарушение мозгового кровообращения у больных сахарным диабетом 2 типа. Сахарный диабет 2013; (1):63–70.
- Sarwar N, Gao P, Seshasai SR, et al. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: a collaborative meta-analysis of 102 prospective studies. Lancet 2010;375:2215–22.
- Simpson SH, Lin M, Eurich DT. Community pharmacy-based inducement programs associated with better medication adherence: a cohort study. Ann Pharmacother 2017;51(8):630-9.
- Ярбеков Р.Р., Чигогидзе Н.А., Сигаев И.Ю., Керен М.А. Ближайшая и отдаленная эффективность чрескожного коронарного вмешательства у больных ИБС с многососудистым поражением коронарных артерий и сахарным диабетом II типа. Анналы хирургии 2014; 5:21-26.
- Голухова Е.З., Кузнецова Е.В. Реваскуляризация миокарда у больных ИБС в сочетании с сахарным диабетом 2 типа: обзор современных технологий. Сахарный диабет 2016; 19(5):406-13.
- Wong ND, Rosenblit PD, Greenfield RS. Advances in dyslipidemia management for prevention of atherosclerosis: PCSK9 monoclonal antibody therapy and beyond. Cardiovasc Diagn Ther 2017;7 (Suppl 1):S11-20.
- Robinson JG, Farnier M, Krempf M. et al. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med 2015;372(16):1489–99.
- El Shahawy M, Cannon CP, Blom DJ, et al. Efficacy and safety of Alirocumab versus ezetimibe over 2 years (from ODYSSEY COMBO II). Am J Cardiol 2017;17:31031-7.
- Farnier M, Colhoun HM, Sasiela WJ, et al. Long-term treatment adherence to the proprotein convertase subtilisin/kexin type 9 inhibitor alirocumab in 6 ODYSSEY Phase III clinical studies with treatment duration of 1 to 2 years. J Clin Lipidol 2017:S1933-2874.
- Silverman MG, Ference BA, Im K. Association between lowering LDL-C and cardiovascular risk reduction among different therapeutic interventions. A systematic review and meta-analysis. JAMA 2016; 316(12):1289-97.
- Зырянов С.К., Дьяков И.Н. Клинико-экономическая экспертиза алирокумаба при рефрактерности к стандартной гиполипидемической терапии. Качественная клиническая практика 2016;4:4-13.
- Распоряжение Правительства Российской Федерации No2323-р от 23.10.2017.
- Farnier M, Gaudet D, Valcheva V, et al. Efficacy of alirocumab in high cardiovascular risk populations with or without heterozygous familial hypercholesterolemia: Pooled analysis of eight ODYSSEY Phase 3 clinical program trials. Intern J Cardiol 2016;223:750–7.
- Методические рекомендации по оценке влияния на бюджет в рамках реализации программы государственных гарантий бесплатного оказания гражданам медицинской помощи. М, ФГБУ “Центр экспертизы и контроля качества медицинской помощи”, 2016, 27С.
- Landmesser U, Chapman MJ, Farnier M, et al. on behalf of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). European Society of Cardiology/European Atherosclerosis Society Task Force consensus statement on proprotein convertase subtilisin/kexin type 9 inhibitors: practical guidance for use in patients at very high cardiovascular risk. Eur Heart J 2016;0:1–11. doi:10. 1093/eurheartj/ehw480.
- Nanchen D, Gencer B, Auer R. et al. Prevalence and management of familial hypercholesterolaemia in patients with acute coronary syndromes. Europ Heart J 2015;36:2438–45.
- Инструкция по медицинскому применению лекарственного препарата Пралуэнт.
- http://pharmindex. ru, дата обращения 13.12.2017.
- http://grls. rosminzdrav. ru, дата обращения к ресурсу 19.01.2018.
- Об утверждении Правил формирования перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи. Постановление Правительства РФ от 28.08.2014 N871.
- Moriarty PM, Parhofer KG, Babirak SP, et al. Alirocumab in patients with heterozygous familial hypercholesterolaemia undergoing lipoprotein apheresis: the ODYSSEY ESCAPE trial. Eur Heart J 2016;37(48):3588-95.
- О Программе государственных гарантий бесплатного оказания гражданам медицинской помощи на 2018 год и на плановый период 2019 и 2020 годов. Постановление Правительства РФ No1492 от 08.12.2017.
- Методические рекомендации по способам оплаты медицинской помощи за счет средств обязательного медицинского страхования. Минздрав России, Федеральный ФОМС. Утверждены на заседании рабочей группы МЗ РФ, протокол заседания No55/11/19 от 14.11.2017; http://www. ttfoms. tomsk. ru/document/ обращение к ресурсу 11.12.2017.
- Silverman MG, Ference BA, Im K, et al. Association between lowering LDL-C and cardiovascular risk reduction among different therapeutic interventions: a systematic review and meta-analysis. JAMA 2016;316(12):1289-97.
- Тарифное соглашение на оплату медицинской помощи, оказываемой по территориальной программе обязательного медицинского страхования города Москвы на 2017 год от 29 декабря 2016 г.
- Приказ Минэкономразвития России No192, Минздравсоцразвития России No323н, Минфина России No 45н, Росстата No113 от 10. 04. 2012 «Об утверждении методологии расчета экономических потерь от смертности, заболеваемости и инвалидизации населения».
- Дедов И.И., Концевая А.В., Шестакова М.В. и др. Экономические затраты на сахарный диабет 2 типа и его основные сердечно-сосудистые осложнения в Российской Федерации. Сахарный диабет 2016;19(6):518-27.
- Концевая А.В., Калинина А.М., Колтунов И.Е., Оганов Р.Г. Социальноэкономический ущерб от острого коронарного синдрома в Pоссийской Федерации. РФК 2011;7(2):158-66.
- Инструкция по медицинскому применению лекарственного препарата Репата.
- Правила государственной регистрации и перерегистрации устанавливаемых производителями лекарственных препаратов предельных отпускных цен на лекарственные препараты, включенные в Перечень ЖНВЛП. Утверждены Постановлением Правительства РФ No865 от 29.10.2010 в редакции Постановления No979 от 15.09.2015.
- http://www. health. gov. sk/Clanok?zuuc-201712-lieky; обращение к ресурсу 11.12.2017.
- http://www. cbr. ru/currency_base/daily. aspx?date_req=11.12.2017; обращение к ресурсу 11.12.2017.
- Фармакоэкономика и фармакоэпидемиология – практика примемлемых решений. Ред. В.Б.Герасимов, А.Л.Хохлов, О.И.Карпов. М.: Медицина, 2005, 352 с.
- Toth PP, Worthy G, Gandra SR, et al. Systematic review and network meta-analysis on the efficacy of evolocumab and other therapies for the management of lipid levels in hyperlipidemia. J Am Heart Assoc 2017;6(10).
- Raal F, Scott R, Somaratne R, et al. Low-density lipoprotein cholesterol-lowering effects of AMG 145, a monoclonal antibody to proprotein convertase subtilisin/kexin type 9 serine protease in patients with heterozygous familial hypercholesterolemia: the Reduction of LDL-C with PCSK9 Inhibition in Heterozygous Familial Hypercholesterolemia Disorder (RUTHERFORD) randomized trial. Circulation 2012;126:2408–17.
- Raal FJ, Stein EA, Dufour R, et al. RUTHERFORD-2 Investigators. PCSK9 inhibition with evolocumab (AMG 145) in heterozygous familial hypercholesterolaemia (RUTHERFORD-2): a randomised, double-blind, placebo-controlled trial. Lancet 2015;385:331–40.
- Robinson JG, Nedergaard BS, Rogers WJ, et al; for the LAPLACE-2 Investigators. Effect of evolocumab or ezetimibe added to moderateor high-intensity statin therapy on LDL-C lowering in patients with hypercholesterolemia: the LAPLACE-2 randomized clinical trial. JAMA 2014;311:1870–82.
- Kereiakes DJ, Robinson JG, Cannon CP, et al. Efficacy and safety of the PCSK9 inhibitor alirocumab among high cardiovascular risk patients on maximally tolerated statin therapy: the ODYSSEY COMBO I study. Am Heart J 2015;169: 906e915e13.
- Robinson JG, et al. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med 2015;372(16):148
Версия на английском языке
По материалам Evolocumab [From the Medical Letter]. JAMA. doi: 10. 1001/jama. 2015. 14772. Sullivan D, Olsson AG, Scott R, et al. JAMA. 2012;308 (23): 2497-2506.
Shrank WH, Barlow JF, Brennan TA. JAMA. 2015;314 (14): 1443-1444.
Stein EA, Raal FJ. Curr Cardiol Rep. 2015;17 (11): 104.
Centers for Disease Control and Prevention
Новый тип лекарств для снижения уровня холестерина -ингибиторы PCSK9 (Evolocumab (INN, trade name Repatha)
Холестерин и сердечно-сосудистые заболевания
В кровотоке встречается несколько видов холестерина, к самым важным из них относятся: холестерин липопротеинов низкой плотности (ЛПНП), так называемый «плохой» холестерин, и холестерин липопротеинов высокой плотности (ЛПВП), который считают «хорошим». Высокая концентрация холестерина в крови обычно связана с высокой концентрацией ЛПНП. Высокая концентрация ЛПНП повышает риск появления бляшек внутри кровеносных сосудов, то есть заболевания под названием атеросклероз. Атеросклероз сосудов сердца или мозга может быть причиной инфарктов и инсультов, которые представляют собой 2 вида сердечно-сосудистых заболеваний). В настоящее время сердечно-сосудистые заболевания являются главной причиной смерти людей в США.
Снижение уровня холестерина за счет изменения образа жизни и приема соответствующих лекарств помогает уменьшить риск развития сердечно-сосудистых заболеваний и смерти от таких заболеваний. Некоторым людям будет достаточно здоровой диеты и регулярной физической нагрузки, другим могут потребоваться лекарства. Наиболее распространенные лекарства, применяемые для снижения уровня холестерина — статины, но у некоторых людей с высоким уровнем холестерина они не обеспечивают необходимого снижения уровня. Другие пациенты не могут принимать статины из-за побочных эффектов таких, как мышечная боль и проблемы с печенью.
Ингибиторы PCSK9: Новое лечение
Ингибиторы PCSK9 —это моноклональные антитела, белки, разработанные и созданные в лаборатории специально для распознавания другого белка и связывания с ним. Мишенью ингибиторов PCSK9 является белок, называемый PCSK9, который повышает концентрации ЛПНП. Когда ингибитор PCSK9 связывается с белком PCSK9, он останавливает его работу и снижает уровень ЛПНП.
Клинические испытания показали, что ингибиторы PCSK9 эффективно снижают концентрации ЛПНП. Три исследования, опубликованные в апреле 2015 г. , показали, что у пациентов, получавших стандартную терапию статинами для снижения уровня холестерина, при добавлении ингибитора PCSK9 уровень ЛПНП снижался на 60 %. В настоящее время Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов (Food and Drug Administration) США разрешено применение двух ингибиторов PCSK9: алирокумаба и эволокумаба. Их вводят под кожу каждые 2-4 недели, в форме таблеток для перорального применения они недоступны. Эти препараты значительно дороже, чем другие лекарства для снижения уровня холестерина.
Применение новых препаратов крайне ограничено. Ингибиторы PCSK9 можно применять вместе со статинам у людей с сердечно-сосудистыми заболеваниями с очень высоким риском инсульта или инфаркта, у которых не удается снизить уровень ЛПНП одними статинами. Также их можно применять вместо статинов при лечении пациентов, страдающих от серьезных побочных эффектов статинов. Кроме того, их можно применять у людей с очень высоким уровнем ЛПНП из-за генетического заболевания под названием семейная гиперхолестеринемия.
Будущие направления
Хотя снижение уровня ЛПНП и полезно, важно знать, способны ли ингибиторы PCSK9 улучшать результаты лечения сердечно-сосудистых заболеваний, то есть способны ли они снижать частоту инфарктов и инсультов и предотвращать развитие сердечной недостаточности. На данный момент утвердительные клинические данные отсутствуют. Сейчас проводятся исследования, делающие акцент на долгосрочных результатах лечения сердечно-сосудистых заболеваний, и результаты этих исследований в последующие несколько лет можно будет важны для определения того, станут ли ингибиторы PCSK9 применяться более широко в составе схем для снижения высокого уровня холестерина.
22 декабря 2015 г.
Статины — группа препаратов, которая широко используется для борьбы с атеросклерозом и понижения уровня холестерина. Их эффективность и количество побочных эффектов зависит от принадлежности конкретного лекарства к определённому поколению.
Атеросклероз — барьер на пути к долголетию
Отложение холестерина на стенках сосудов усугубляется с возрастом и при погрешностях в питании. Жировые бляшки сужают просвет сосудов и могут неожиданно оторваться; развитие атеросклероза повышает риск сердечно-сосудистых заболеваний и становится одной из главной причин преждевременной смерти. Чтобы уменьшить риск развития у пациента инфаркта или инсульта, ему при высоком показателе содержания холестерина назначают статины. Именно благодаря этим препаратам образование холестерина и его содержание в крови можно эффективно понизить, что закономерно приведёт к росту продолжительности жизни.
Механизм действия статинов
Все статины работают в печени, конкурируя с ферментом ГМГ-Коа-редуктазой. Так как этот фермент отвечает за синтез холестерина, приостановка его работы уменьшает концентрацию нежелательного вещества. Помимо снижения синтеза холестерина, статины повышают число рецепторов к ЛПНП (липопротеинам низкой плотности, известным под названием «плохой холестерин»), что ускоряет их захват клетками печени и сокращает поступление такой фракции липопротеинов в кровь. Обладают лекарства и противовоспалительным эффектом.
Статины не только снижают скорость роста атеросклеротических бляшек, но и увеличивают их стабильность, препятствуя разрыву.
Эффект самых сильных статинов развивается через неделю после начала приёма и становится оптимальным примерно через месяц. Тем не менее часто таблетки назначают пожизненно.
Приём таких лекарств курсами менее эффективен, чем постоянное и ежедневное использование; в то же время курсовой приём безопаснее, так как не даёт развиваться нежелательным явлениям.
Назначение статинов
Как было указано выше, основная роль препаратов этой группы — уменьшение концентрации в крови холестерина. По этой причине статины рекомендуют в состояниях, когда подобные результаты анализов могут снизить продолжительность жизни. В их список входят:
- высокий риск развития ишемической болезни сердца и уже сформированная ИБС;
- профилактика инсульта и инфаркта, реабилитация после инфаркта миокарда;
- сахарный диабет 2 типа;
- операции на сердце и сосудах;
- повышенное содержание холестерина в крови в случаях, когда диета и упражнения не смогли помочь.
Особое внимание уделяется ЛПНП: статины могут назначить, если концентрация в крови этой фракции липопротеинов превышает 4,9 ммоль/л. При диабете подходящим для выписывания лекарства уровнем может быть концентрация 1,8-4,0 ммоль/л. В индивидуальном порядке статины рекомендуют людям, жизнь которых содержит факторы риска: малоподвижный образ жизни, курение, высокое артериальное давление. Иногда профилактика требует назначения препаратов даже при нормальном уровне холестерина.
Риски и побочные эффекты
Когда пациенту выписывают статины от холестерина, польза и вред их могут быть рассмотрены за счёт анализа противопоказаний и побочных эффектов. Полезные качества препаратов уже очевидны и указаны выше. К отрицательным же относится риск специфических явлений, которые серьёзно могут омрачить жизнь больного. В их перечень входят:
- головная боль, бессонница, головокружение, апатия и слабость;
- тошнота, запор, нарушение в работе поджелудочной железы и печени;
- аллергические реакции, зуд, отёки;
- бронхит, ринит.
- учащённое мочеиспускание, выведение с мочой белка;
- боли в мышцах, очень редко — разрушение мышечной ткани;
- диабет 2 типа.
Вероятность появления побочных эффектов растёт с продолжительностью приёма и возрастом пациента. Оказывают влияние также сопутствующие заболевания и питание. Любые статины нельзя принимать при риске почечной и печёночной недостаточности, миопатии и острой патологии щитовидной железы. Представителями монголоидной расы лекарства переносятся хуже и в большой дозировке не назначаются.
Применение у детей и при беременности
Детям давать статины не стоит: их эффект на растущий организм изучен недостаточно, и польза может быть погашена осложнениями. Такие таблетки запрещены к приёму до 18 лет и могут назначаться только в случае семейной гиперхолестеринемии. Даже в таких случаях к назначению показаны далеко не все препараты.
Отдельно стоит отметить невозможность лечения статинами беременных; даже самые безопасные лекарства не выписывают при отсутствии адекватной контрацепции. Связано это с тем, что изменение синтеза холестерина может лишить ребёнка необходимых для развития веществ. При планировании беременности отменять статины нужно за месяц до её наступления, а кормить малыша грудным молоком при лечении матери статинами нельзя.
Особенности приёма
Несмотря на неприятные эффекты лечения, статины вполне способны продлить жизнь пациента на десяток лет. Для каждого больного дозировка подбирается индивидуально: важно найти грань между пользой и побочными эффектами. Пытаясь понять, как правильно принимать статины, в какое время и при каких условиях, пациенты могут руководствоваться определёнными советами.
Таблетки для лучшего усвоения правильно принимать раз в день, за пару часов до сна.
Статины глотают, запивая водой или любым соком кроме свежего грейпфрутового: тот способен вызвать серьёзные осложнения.
Другой важной рекомендацией является отказ от алкоголя. Иногда для снижения шансов на побочный эффект врач может порекомендовать курсовой приём с небольшими перерывами.
Лекарства разных поколений
Для каждого больного важно знать, какие статины от холестерина самые эффективные. Ответ на вопрос о выборе лучших напрямую зависит от принадлежности веществ к определённой группе. Лекарства первого поколения — природные или полусинтетические соединения, которые имеют больше всего побочных эффектов и не такие эффективные. Самыми безопасными считаются статины четвёртого поколения; впрочем, стоят они соответственно выше. Любые статины представлены на рынке как оригинальными препаратами, так и их дженериками, которые содержат те же самые действующие вещества, но могут отличаться по качеству. Несмотря на то, что лекарства последнего поколения выигрывают заранее, ниже можно увидеть названия самых актуальных статинов и из других групп.
Препараты первого поколения
Такие лекарства имеют большую доказательную базу: применение в течение многих лет помогло досконально изучить их побочные эффекты и влияние на организм. Уровень ЛПНП их приём снижает на 25-30%. К сожалению, всасываются статины первого поколения относительно плохо, а шанс вызвать рабдомиолиз (разрушение мышечной ткани) при их приёме выше.
| Название | Действующее вещество | Производитель | Средняя цена |
| Кардиостатин таблетки 20 или 40 мг | Ловастатин | НИЖФАРМ АО (Россия) | 305 руб. |
| Правастатин таблетки 10 мг или 20 мг | Правастатин | ВАЛЕНТА ФАРМАЦЕВТИКА ПАО (Россия) | 180 руб. |
| Липостат таблетки 10, 20 или 40 мг | Правастатин | Бристол-Майерс Сквибб (Франция) (Италия) | 170 руб. |
| Симвастатин таблетки, покрытые плёночной оболочкой, 10, 20 или 40 мг | Симвастатин | AUROBINDO PHARMA Ltd. (Индия) | 153 руб. |
| Вазилип таблетки, покрытые плёночной оболочкой, 10, 20 или 40 мг | Симвастатин | KRKA d.d. (Словения) | 303 руб. |
Преимущество статинов первой группы — их невысокая цена; она зависит от дозировки и числа таблеток в упаковке, так что приведённые в таблице цены — примерные. Логично, что упаковки с меньшим числом таблеток будут обходиться дешевле, однако из-за длительного курса лечения увеличат число обращений в аптеку и могут не быть выгодны экономически. Также стоит отметить, что популярный препарат могут выпускать несколько производителей, у каждого из которых свои цена и технология.
Препараты на основе ловастатина
Самым актуальным препаратом этой группы является Кардиостатин. Эффект от его приёма развивается примерно через 2 недели, максимальную пользу таблетки приносят примерно через 1-1,5 месяца лечения. Самая большая суточная дозировка Кардиостатина составляет 80 мг, а при одновременном приёме с иммунодепрессантами, фибратами или никотинамидом в день больному положено не больше 20 мг действующего вещества.
Неприятным побочным эффектом ловастатина становятся катаракта и атрофия зрительного нерва. Развитие рабдомиелоза может привести к острой почечной недостаточности, поэтому любые боли в мышцах без известной причины опасны и должны стать поводом для обращения к врачу.
Правастатин и его аналог
Также относясь к статинам первого поколения, Правастатин усваивается немного лучше ловастатина, но всё ещё наделён массой побочных эффектов. То же самое действующее вещество содержит Липостат. Препараты на основе правастатина начинают принимать с дозировки 10 мг (особенно это касается пожилых), а максимально назначают только 40 мг в день. Среди побочных эффектов правастатина замечены нарушение кроветворения, облысение и повышение чувствительности кожи к солнечному свету.
Симвастатин — лучший среди первых
Чаще всего из статинов первого поколения назначают Симвастатин. Всасывается он хорошо и относительно полно, побочных эффектов несколько меньше. Максимальная назначаемая доза Симвастатина — 40 мг в день, а начинают лечение порой с очень небольшого количества лекарства: всего лишь 5 мг. Совместимость с другими препаратами Симвастатина примерно соответствует таковой Кардиостатина. В качестве примера полного аналога можно привести Вазилип.
Выбирая между препаратами первого поколения, логично выбрать таблетки с симвастатином. Увы, даже самый прогрессивный и безопасный препарат из вышеназванной группы постепенно устаревает благодаря появлению более эффективных лекарств. Побеждая в своей категории, симвастатин не может быть конкурентом представителям других поколений даже несмотря на то, что таблетки с ним относительно дешёвые.
Препараты второго поколения
Здесь речь идёт о флувастатине и таблетках, которые его содержат. В настоящее время актуальны Лескол и его форма с усиленной дозировкой — Лескол форте. Выпускаются таблетки швейцарской фирмой NOVARTIS PHARMA AG, а их стоимость составляет примерно от 1726 до 2893 рублей. Флувастатин в Лесколе содержится в форме натриевой соли, которая легко и быстро всасывается.
Эффект от приёма Лескола начинает проявляться после двух недель лечения и выходит на максимум к первому месяцу приёма. Флувастатин дополнительно стимулирует выработку липопротеинов высокой плотности, а его хорошие показатели усвоения снижает риски при приёме.
Такой препарат могут назначать даже детям старше 9 лет с передавшимися по наследству проблемами или больным, которые перенесли трансплантацию органов.
Минус флувастатина — относительно слабая эффективность. В отличие от препаратов первого поколения, его нужно принимать большими дозами: от 40 до 80 мг. С соответствующей дозировкой выпускаются и таблетки: обычный Лескол продаётся с дозами 20 и 40 мг на таблетку, а в одной таблетке Форте содержится 80 мг действующего вещества.
Третье поколение
Более продвинутые статины — это препараты на основе аторвастатина и церивастатина; в настоящее время врачи обычно выписывают таблетки с аторвастатином. Такие лекарства по сравнению с первым поколением почти в два раза лучше снижают уровень ЛПНП, а заодно не дают холестерину образовываться из жировых отложений. Самая маленькая дозировка Аторвастатина почти не взаимодействует с другими препаратами, что облегчает лечение.
| Название | Действующее вещество | Производитель | Средняя цена |
| Липримар таблетки, покрытые плёночной оболочкой, 10, 20, 40 или 80 мг | Аторвастатин | PFIZER MANUFACTURING DEUTSCHLAND GmbH | 856 руб. |
| Аторвастатин таблетки, покрытые плёночной оболочкой, 10, 20, 40 или 80 мг | Аторвастатин | АЛСИ Фарма АО (Россия) | 213 руб. |
| Торвакард таблетки, покрытые плёночной оболочкой, 10, 20 или 40 мг | Аторвастатин | ZENTIVA k.s. (Чешская Республика) | 1030 руб. |
| Аторис таблетки, покрытые плёночной оболочкой, 10, 20 или 40 мг | Аторвастатин | KRKA d.d. (Словения) | 707 руб. |
| Тулип таблетки, покрытые плёночной оболочкой, 10, 20 или 40 мг | Аторвастатин | SANDOZ d.d. (Словения) | 709 руб. |
Препараты на основе аторвастатина заметно отличаются друг от друга по цене, работают примерно одинаково, но могут различаться по безопасности. Как и более ранние лекарства, они постепенно набирают эффект ко 2-4 неделе лечения. Самым лучшим из аналогов считают Липримар. Пить его можно в любое время суток; с приёмом пищи эффект тоже не связан. Как заметно по дозировкам, максимальная суточная доза препарата составляет 80 мг.
Аторвастатин считается самым продаваемым статином в мире.
Аторвастатин и его аналоги, как правило, переносятся хорошо: иногда даже лучше, чем препараты четвёртого поколения. Детям с семейной гиперхолестеринемией его можно назначать уже с 10 лет. Приём одновременно с фузидовой кислотой нежелателен — это повышает риск рабдомиелоза. В целом статины третьего поколения могут считаться оптимальными по соотношению между ценой и качеством. Назначаются они часто.
Максимум безопасности — четвёртое поколение
К группе самых современных лекарств относят таблетки на основе розувастатина и питавастатина. Превышая по эффективности третье поколение, они ещё реже вызывают побочные эффекты и требуют меньшей дозировки. Для адаптации организма к действию лекарства лечение рекомендуют начинать с самых малых доз и постепенно изменять порядок приёма в зависимости от результата.
| Название | Действующее вещество | Производитель | Средняя цена |
| Крестор таблетки, покрытые плёночной оболочкой, 5, 10 или 40 мг | Розувастатин | ASTRAZENECA UK Limited (Великобритания) | 2008 руб. |
| Розувастатин таблетки, покрытые плёночной оболочкой, 5, 10, 20 или 40 мг | Розувастатин | ИЗВАРИНО ФАРМА ООО (Россия) | 1173 руб. |
| Розукард таблетки, покрытые плёночной оболочкой, 10, 20 или 40 мг | Розувастатин | САНОФИ РОССИЯ АО (Россия) | 1010 руб. |
| Роксера таблетки, покрытые плёночной оболочкой, 5, 10, 15, 20, 30 или 40 мг | Розувастатин (в виде кальциевой соли) | KRKA d.d. (Словения) | 1200 руб. |
| Ливазо таблетки, покрытые плёночной оболочкой, 1, 2 или 4 мг | Питавастатин | RECORDATI IRELAND Ltd. (Ирландия) | 657 руб. |
Препараты четвёртого поколения не влияют на обмен углеводов, что положительно сказывается на их назначаемости больным сахарным диабетом. При диализе же их принимать нельзя: у таких пациентов статины могут навредить почкам. Как бы там ни было, а по многим параметрам вещества четвёртого поколения — лучшие.
Лидер среди статинов — розувастатин
Розувастатин считается самым эффективным: его назначают при повышенном уровне холестерина в тех случаях, когда другие статины не могут справиться с задачей. Свойства препарата позволяют заметно снизить побочные эффекты: для печени он токсичен в меньшей степени, а негативное влияние на мышцы даёт о себе знать редко. Лечение начинают с самой маленькой дозировки — 5 мг, которую в случае необходимости уменьшают вдвое. Не обходится и без минусов: из-за сравнительно недавнего поступления в медицинскую практику не все эффекты розувастина полностью изучены.
Среди всех препаратов, содержащих розувастатин, самым безопасным благодаря степени очистки считают Крестор.
Начинает работу розувастатин быстрее всех: его эффект можно увидеть уже через неделю. Среди таблеток с розувастатином стоит отдельно отметить Роксеру: препарат сочетает в себе неплохой уровень чистоты с хорошим усвоением благодаря кальциевой соли действующего вещества.
У этого препарата есть особая дозировка 30 мг для больных с нарушением работы печени. Имеет Крестор и другие сравнительно недорогие аналоги: к примеру, Розувастатин или Розукард.
Питавастатин — новейший и эффективный
Питавастатин обычно выписывают при непереносимости Розувастатина. Пока этот препарат редкий и изучен ещё хуже, но несёт в себе потенциал. Пьют его в совсем небольшой дозировке, начиная лечение с 1 мг в день. Изменять дозу нужно не раньше, чем через 4 недели приёма, а большинству пациентов помогают 2 мг полученного лекарства в сутки.
При выборе оптимального препарата четвёртого поколения предпочтение стоит отдать более изученному Розувастатину. В свою очередь, среди аналогичных препаратов с одинаковым составом на основе этого вещества место лидера легче отдать Крестору, который сочетает лучший уровень очистки и подтверждённый эффект. Роксера представляет интерес при ограниченном бюджете; заменить Крестор этим лекарством вполне можно.
Выбор лучшего средства
Эффективность препаратов разных поколений различается в разы: особенно это становится заметным, если сравнение проводить сразу между первым и четвёртым. Качество работы Крестора в 4 раза превышает возможности самого лучшего из первых препаратов — Симвастатина. Чем выше поколение, тем ниже вероятность того, что лечение принесёт вред, и лучше переносимость. Поэтому поиск самого хорошего лекарства нужно проводить между лидерами двух последних групп.
Липримар выигрывает по цене: лечение им обходится относительно недорого. В целом аторвастатин применялся шире и имеет большие наработки по предсказуемому результату. Так как больной вынужден принимать статины ежедневно на протяжении многих месяцев, выбор Липримара помогает согласовать результативность лечения, безопасность и бюджет. Тем не менее начинает работать препарат долго: скорость развития первоначального эффекта отстаёт от розувастатина чуть ли не в 2 раза.
Крестор, с другой стороны, эффективнее и может помогать в сложных случаях. Чаще всего розувастатин переносится лучше, а высокая скорость влияния на синтез холестерина позволяет ему одержать победу в соревновании на качество результата и уменьшение последствий. Вопрос остаётся только в цене.
Химическое название
5′-Дезокси-5-фтор-N-[(пентилокси)карбонил]цитидин
Химические свойства
Капецитабин – пиримидиновый антагонист, относится к группе противоопухолевых антиметаболитов. Производное фторпиримидина растворимо в воде, молекулярная масса = 359,3 грамма на моль.
Фармакологическое действие
Противоопухолевое.
Фармакодинамика и фармакокинетика
Вне организма вещество не обладает цитотоксическим действием. Только проникнув в ткани опухоли, начинает оказывать селективное цитотоксическое действие. В опухоли Капецитабин превращается в 5-фторурацил под действием вещества тимидинфосфорилазы (ангиогенный противоопухолевый фактор). Воздействие средства на здоровые ткани организма практически не происходит.
Активные метаболиты 5-ФУ активно повреждают клетки опухоли, используя 2 разных механизма. Первый из них, когда 5-фтор−2′-дезоксиуридина монофосфат (активные метаболит средства) и N-5-10-метилентетрагидрофолат ковалентно связываются с ферментом тимидилатсинтетазой и образуют третичный комплекс, что приводит к невозможности синтеза ДНК и деления клеток. Второй механизм обусловлен наличием ошибки в процессе синтеза РНК, когда ферменты ядра, отвечающие за транскрипцию РНК, по ошибке включают в нее второй активный метаболит 5-фторуридина трифосфат, вместо трифосфата. Это также приводит к нарушению процессинга РНК и синтеза белка в клетках опухоли.
После введения препарата в организм и его последовательной ферментной биотрансформации в клетках опухоли достигается высокая концентрация метаболитов. Концентрация в тканях опухоли обычно в 3,2 раза выше, чем в близлежащих тканях.
Активность процесса биотранcформации и образовавшихся метаболитов в 4 раза выше, чем аналогичные показатели в здоровых органах и тканях. Данные показатели наблюдались у больных раком толстой кишки, молочной железы, шейки матки, желудка и яичника.
В ходе клинических испытаний была подтверждена возможность использовать Капецитабин для лечения метастазирующего рака прямой и ободочной кишки.
Также высокую эффективность показала схема лечения: Капецитабин + доцетаксел при лечении различных видов рака молочной железы. Данная комбинация увеличивала выживаемость, частоту и продолжительность ремиссий.
Вещество не оказывает мутагенного влияния на клетки бактерий и млекопитающих. Однако обладает тератогенным действием, влияет на фертильность и повышает число смертей эмбрионов мышей, при использовании 198 мг на кг веса в сутки. Данный показатель у приматов наблюдался в дозировке 90 мг на кг веса в сутки.
После приема таблетированной формы средство полностью и быстро усваивается из желудочно-кишечного тракта и биотрансформируется в тканях опухоли. Максимальная концентрация достигается в течение 1,5-3,34 часов.
Первоначально средство гидролизуется в печени с помощью фермента карбоксилэстеразы до 5′-ДФЦТ, затем с помощью цитидиндезаминазы превращается в 5′-ДФУР, и далее под действием тимидинфосфорилазы до 5-фторурацила. 5-ФУ превращается в активные метаболиты ФУТФ, ФдУМФ и 5-фтор−5,6-дигидро-фторурацил. Последний вследствие расщепления пиримидинового кольца превращается в неактивные метаболиты.
Различные метаболиты имеют разную степень связывания с белками плазмы. Период полувыведения Капецитабина – 0,85 часов, его метаболитов – от 1 до,3,3 ч. Фармакокинетические параметры линейно зависят от принятой дозировки. Однако AUC 5-фторурацила на 35% увеличивается через 14 дней лечения.
Выводится средством преимущественно с мочой, незначительно – с калом. Значимого изменения фармакодинамики препарата в зависимости от возраста и состояния почек и печени не наблюдалось.
Показания к применению
Капецитабин используют:
- вместе с доцетакселом для лечения местнораспространенного или метастазирующего рака молочной железы, если курс препаратов антрациклинового ряда оказался малоэффективным;
- при раке ободочной кишки;
- для лечения колоректального метастазирующего рака;
- при распространенном раке желудка, пищевода или поджелудочной железы.
Противопоказания
Лекарство не назначают:
- лицам с аллергией на вещество или вспомогательные ингредиенты;
- если ранее у больного наблюдались реакции гиперчувствительности на фторафур, фторурацил, фторпиримидин;
- при серьезных заболеваниях почек;
- пациентам, ранее получавшим соривудин или его структурные аналоги;
- при дефиците дигидропиримидиндегидрогеназы.
Особую осторожность следует соблюдать в возрасте до 18 лет, при ИБС, пожилым лицам.
Побочные действия
Более, чем у 2% пациентов наблюдались:
- артралгия, болезненные ощущения в конечностях и пояснице, отек ног, миалгия;
- головокружение, головная боль, повышенная утомляемость, общая слабость и парестезии;
- анемия, повышенная температура тела;
- нарушение вкусовых ощущений, бессонница, астения, периферическая нейропатия, сонливость;
- кашель, болезненные ощущения в горле, одышка;
- понос, рвота, стоматит, тошнота, боли в эпигастральной области животе, запор, сухость во рту;
- конъюнктивит, слезливость и раздражение глаз;
- гиперпигментация, грибковые поражения ногтей;
- кандидоз ротовой полости, гипербилирубинемия;
- снижение аппетита и как следствие анорексия, несварение желудка, повышенное газообразование, изменение консистенции каловых масс;
- ладонно-подошвенный синдром, сухость кожных покровов, дерматиты, алопеция, высыпания на коже и зуд.
Реже проявлялись:
- энцефалопатия, атаксия, нарушение координации движений и равновесия, спутанность сознания;
- кардиалгия, стенокардия, внезапная смерть, кардиомиопатия;
- ишемия и инфаркт миокарда, сердечная недостаточность;
- тахикардия, аритмии, экстрасистолия;
- повышение и понижение артериального давления;
- флебит, панцитопения, тромбофлебит, угнетение функции кроветворения и деятельности костного мозга;
- общее снижение иммунитета, развитие грибковых, вирусных и бактериальных заболеваний, сепсис;
- диспноэ, эмболия сосудов легких, бронхоспазм, респираторный дистресс-синдром;
- эзофагит, гастрит, колит, кровотечения в ЖКТ, гепатит, печеночная недостаточность, дуоденит;
- боли в грудине и за грудиной, гипергликемия;
- повышенная чувствительность к свету, трещины на коже, ломкость и потеря цвета ногтей, онихолизис.
При использовании дополнительно доцетаксела наблюдались:
- дегидратация, быстрая потеря веса;
- кровотечения из носа, стеноз слезно-носового канала;
- боли и отечность в конечностях, артралгия, миалгия.
Капецитабин, инструкция по применению (Способ и дозировка)
Перорально. Таблетку необходимо проглотить не позже, чем через 30 минут после еды.
Курс лечения и схему приема должен назначать квалифицированный врач-онколог, который ранее уже имел опыт работы с данным препаратом.
При проведении монотерапии обычно используют по 1250 мг на м2 тела, 2 раза в день, через равные промежутки времени. Лекарство принимают по схеме 14 дней ежедневного приема таблеток + 7 дней перерыва, обычно используют 3 цикла.
При сочетании Капецитабина с доцетакселом используют такую же дозировку средства. Но после 14 дневной терапии, во время недельного перерыва назначают доцетаксел. Премедикация производится в соответствии с рекомендациями в инструкции к доцетакселу.
Если во время прохождения курса лечения заболеваний прогрессирует или же у пациента развиваются признаки тяжелой формы токсичности, то лекарство необходимо заменить.
Передозировка
Симптомами передозировки являются: рвота, мукозит, тошнота, кровотечения и раздражение желудочно-кишечного тракта, нарушения в работе костного мозга, иммуносупрессия, развитие инфекционных осложнений. Лечение проводят согласно проявившимся симптомам, специфического антидота нет.
Взаимодействие
Лекарство можно принимать совместно с паклитакселом, доцетакселом, фолинатом кальция.
С осторожностью следует сочетать препарат с антацидами алюминия и магния, они увеличивают плазменную концентрацию вещества и его активного метаболита.
При сочетании с циклофосфамидом усиливается цитотоксичность препарата.
Одновременный прием лекарства и кумариновых антикоагулянтов (варфарина, фенпрокумона) может привести к нарушениям свертываемости крови и кровотечениям. Иногда данные нарушения возникали после месяца лечения.
При сочетании средства с фенитоином, повышается концентрация последнего в плазме крови.
Соривудин и аналогичные препараты усиливают токсичность Капецитабина.
Условия продажи
По рецепту.
Условия хранения
Вдали от детей, в прохладном месте.
Срок годности
2 года.
Особые указания
Чтобы устранить побочные токсические эффекты используют симптоматическое лечение и проводят коррекцию дозировки. При развитии токсичности 2 или 3 степени прием вещества прекращают и продолжают лечение после исчезновения нежелательных эффектов. Также рекомендуется скорректировать дозировку средства.
При возникновении нейтропении прекращать прием лекарства не обязательно. Однако, в этом случае последующее лечение должно сопровождаться тщательным контролем состояния больного.
При первых же признаках развития дегидратации, которая особенно быстро может развиться у пациентов с анорексией, рвотой, поносом и астенией, ее необходимо устранить. Если возникла дегидратация 2 степени, то лечение следует прервать и провести регидратацию.
Если у пациента перед началом лечения количество нейтрофилов было менее 1,5х10^9 клеток на литр или тромбоцитов менее 100х10^9 клеток на литр, то нельзя проводить комбинированную терапию Капецитабином и доцетакселом.
Если во время лечения возник плевральный или перикардиальный выпот, то лекарство отменяют.
Пожилым
Применение у лиц пожилого возраста требует особой осторожности и контроля лечащего врача.
При беременности и лактации
Крайне не рекомендуется использование препарата беременными женщинами. Существует недостаточное количество исследований о безопасности лечения беременных женщин Капецитабином, вещество обладает тератогенными и фетотоксическими свойствами.
Неизвестно, выделяется ли препарат с молоком во время лактации. Поэтому кормление грудью рекомендуется прекратить.
Препараты, в которых содержится (Аналоги)
Совпадения по коду АТХ 4-го уровня:
Кабецин, Капецитабин-ТЛ, Кселода, Капецитабин, Капецитовер, Тутабин.
Отзывы о Капецитабине
Лекарства, содержащие Капецитабин – достаточно серьезные препараты, чаще всего вызывающие массу побочных эффектов. Тем не менее, судя по отзывам, они достаточно эффективны в борьбе с различными видами рака.
Некоторые отзывы о препарате Кселода:
- “… После приема таблеток развилась сильнейшая диарея, лечила ее в стационаре, потом появились высыпания на коже. Очень долго врач корректировал дозировку. Зато после нескольких курсов метастазы ушли, сейчас у меня ремиссия”;
- ”… У моей подруги обнаружили рак молочной железы, прописали это лекарство. Чтобы устранить тошноту и рвоту назначали параллельно противорвотные, Мильгамму, витамин А. Сейчас подруга пошла на поправку. Так здорово ее снова видеть активной и жизнерадостной”;
- ”… Лекарство достаточно дорогое, но моей тете, к сожалению не помогло. У нее был рак молочной железы в тяжелой форме, сначала были видимые улучшения, однако потом ситуация ухудшилась, врачи только разводили руками”.
Цена Капецитабина, где купить
Купить Капецитабин в составе препарата Кселода можно примерно за 3000 рублей, 60 таблеток по 150 мг.
Вещество Капецитабин, 500 мг, содержится в лекарственном средстве Тутабин. Его примерная стоимость 11500 рублей за 120 таблеток.
Пралуэнт — инструкция по применению
Синонимы, аналоги
Статьи
Описание предварительно заполненных одноразовых шприц-ручек и инструкция по их использованию
Описание предварительно заполненных одноразовых шприцев и инструкция по их использованию
Регистрационный номер:
ЛП-004078 — 240317
Торговое наименование препарата:
Пралуэнт
Международное непатентованное наименование:
алирокумаб
Лекарственная форма:
раствор для подкожного введения.
Состав:
В одном шприце/шприц-ручке с дозировкой 75 мг/мл содержится:
активное вещество: алирокумаб — 75,0 мг;
вспомогательные вещества: L-гистидин и L-гистидина гидрохлорида моногидрат — 1,241* мг, сахароза — 100,0 мг, полисорбат-20 — 0,1 мг, вода для инъекций — до 1,0 мл.
В одном шприце/шприц-ручке с дозировкой 150 мг/мл содержится:
активное вещество: алирокумаб — 150,0 мг;
вспомогательные вещества: L-гистидин и L-гистидина гидрохлорида моногидрат — 0,931* мг, сахароза — 100,0 мг, полисорбат-20 — 0,1 мг, вода для инъекций — до 1,0 мл.
* — суммарное количество L-гистидина и L-гистидина гидрохлорида моногидрата в пересчете на L-гистидин.
Описание:
Прозрачная или слегка опалесцирующая, бесцветная или желтоватого цвета жидкость.
Фармакотерапевтическая группа:
полностью гуманизированное моноклональное антитело (IgGl). Ингибитор пропротеиновой конвертазы субтилизинкексин типа 9 (PCSK9)
Код АТХ:
С10АХ14
Фармакологические свойства
Фармакодинамика
Алирокумаб является полностью гуманизированным моноклональным согласовано антителом [изотип иммуноглобулинов G1 (IgGl)], мишенью которого является фермент пропротеиновая конвертаза субтилизин-кексин типа 9 (PCSK9). Алирокумаб производится с помощью технологии рекомбинантной ДНК с использованием суспензионной культуры клеток яичника китайского хомячка.
Алирокумаб имеет молекулярную массу приблизительно 146 кДа.
Механизм действия
PCSK9 связывается с рецепторами липопротеинов низкой плотности (Р-ЛПНП) на поверхности гепатоцитов, способствуя деградации Р-ЛПНП в печени. Р-ЛПНП являются главными рецепторами, которые выводят из системного кровотока циркулирующие ЛПНП, поэтому уменьшение количества Р-ЛПНП при связывании их с PCSK9 приводит к повышению концентрации холестерина ЛПНП (ХС-ЛПНП) в крови. Ингибируя связывание PCSK9 с Р-ЛПНП, алирокумаб увеличивает количество Р-ЛПНП для выведения ЛПНП, снижая, таким образом, концентрации ХС-ЛПНП в крови.
Р-ЛПНП также связывают богатые триглицеридами (ТГ) ремнантные липопротеины очень низкой плотности (ЛПОНП) и липопротеины промежуточной плотности (ЛППП). Поэтому лечение алирокумабом может снижать концентрации этих ремнантных липопротеинов, о чем свидетельствует их уменьшение в аполипопротеине В (Апо В), холестерине липопротеинов, не являющихся липопротеинами высокой плотности (ХС-ЛПнеВП) и ТГ. Алирокумаб также снижает концентрации липопротеинов а (Лп(а)), являющихся формой ЛПНП, которые связаны с аполипопротеином (а). Однако было показано, что Р-ЛПНП имеют низкую аффинность к Лп(а), в связи с чем точный механизм, с помощью которого алирокумаб снижает Лп(а), полностью не установлен.
Генетические исследования
В генетических исследованиях, проведенных у человека, были выявлены разновидности гена PCSK9 с мутациями потери или повышения функции. У пациентов с одним аллелем PCSK9 с мутацией потери функции отмечались более низкие концентрации ХС-ЛПНП, которые коррелировали со значительно более низкой частотой развития ишемической болезни сердца. У некоторых пациентов были выявлены мутации потери функции в двух аллелях, и у них отмечались очень низкие концентрации ХС-ЛПНП в крови с концентрациями в крови ХС-ЛПВП и ТГ в нормальном диапазоне. Наоборот, мутации повышения функции в гене PCSK9 были выявлены у пациентов с повышенными концентрациями ХС-ЛПНП в крови и клиническим диагнозом семейной гиперхолестеринемии.
Наблюдательный анализ показал, что без лечения концентрации ХС-ЛПНП в крови у пациентов с мутациями повышения функции в гене PCSK9 находились в диапазоне, подобном наблюдавшемуся у пациентов с более часто встречающимися мутациями, вызывающими гетерозиготную форму семейной гиперхолестеринемии (такими как мутации в гене Р-ЛПНП), демонстрируя центральную роль фермента PCSK9 в метаболизме ХС-ЛПНП и его концентрациях в крови. В многоцентровом двойном слепом, плацебо-контролируемом исследовании продолжительностью 14 недель 13 пациентов с гетерозиготной формой семейной гиперхолестеринемией, связанной с мутацией повышения функции в гене PCSK9, были рандомизированы в 2 группы: группу, получающую алирокумаб в дозе 150 мг 1 раз в 2 недели, и группу, получающую плацебо. Среднее значение концентрации ХС-ЛПНП в крови составляло 151,5 мг/дл. На второй неделе лечения среднее значение снижения исходной концентрации ХС-ЛПНП в крови составило 62,5 % в группе пациентов, получавших алирокумаб, по сравнению с 8,8 % у пациентов, получавших плацебо. На 8-й неделе лечения среднее значение снижения концентрации ХС-ЛПНП в крови от исходного значения у всех пациентов, получавших алирокумаб, составило 72,4 %.
Фармакодинамические свойства
Алирокумаб является полностью гуманизированным моноклональным антителом, которое подавляет активность PCSK9 как в исследованиях in vitro, так и в системах моделей in vivo. Большое количество исследований, проведенных у человека и животных, продемонстрировали центральную роль, которую играют повышенные концентрации ХС-ЛПНП в крови в начале и прогрессировании атеросклероза. Другие липопротеины, содержащие Апо В-100, особенно богатые триглицеридами ремнантные липопротеины (образовавшиеся из ЛПОНП и ЛППП) и Лп(а), также считаются способствующими развитию атеросклероза. Однако проведенные до настоящего времени исследования не выявили независимого влияния снижения концентраций этих липопротеинов на сердечно-сосудистую заболеваемость и смертность.
В исследованиях in vitro, алирокумаб не индуцировал антитело-зависимую клеточно-опосредованную токсичность и комплемент-зависимую цитотоксичность (Fc-опосредованную эффекторную функцию), как в присутствии, так и в отсутствии PCSK9. У алирокумаба, связанного с PCSK9, не наблюдалось образования нерастворимых иммунных комплексов, способных связывать протеины комплемента.
Клиническая эффективность/клинические исследования
Эффективность алирокумаба была изучена в 10 исследованиях III фазы (5 плацебо-контролируемых и 5 эзетимиб-контролируемых исследований), включавших 5296 рандомизированных пациентов с гиперхолестеринемией (несемейной и гетерозиготной формой семейной) или смешанной гиперхолестеринемией, из них 3188 пациентов были рандомизированы для приема алирокумаба. Три из этих 10 исследований были проведены исключительно у пациентов с гетерозиготной формой семейной гиперхолестеринемии. Большинство пациентов в программе клинических исследований III фазы принимали одновременно липид-модифицирующую терапию, состоящую из максимально переносимых доз статинов в сочетании или без сочетания с другими липид-модифицирующими видами лечения и 1 г, имели высокий и очень высокий сердечно-сосудистыи риск.
Два исследования были проведены у пациентов, которые не получали одновременно статины, включая одно исследование у пациентов с документированной непереносимостью статинов.
Два исследования (LONG TERM и HIGH FH), включающие в общей сложности 2416 пациентов, были проведены только с дозой 150 мг 1 раз в 2 недели. Восемь исследований были проведены с дозой 75 мг 1 раз в 2 недели и критерием для повышения дозы до 150 мг 1 раз в 2 недели на 12-й неделе было недостижение пациентами целевого значения концентрации ХС-ЛПНП в крови, основанного на степени их сердечно-сосудистого риска на 8-й неделе лечения.
Исходные демографические характеристики были хорошо сбалансированными между группами алирокумаба и контроля. Возраст пациентов во всех исследованиях находился в диапазоне от 18 до 89 лет (средний возраст составлял 60 лет); 38 % пациентов были женского пола, большинство пациентов были белой расы, 5 % были негроидной расы, 2 % были представителями азиатской расы; среднее значение индекса массы тела (ИМТ) составляло 30 кг/м2. В клинических исследованиях III фазы 31 % пациентов имели сахарный диабет 2 типа и 64 % пациентов имели в анамнезе ишемическую болезнь сердца.
Главной конечной точкой эффективности во всех клинических исследованиях III фазы было среднее значение снижения концентрации ХС-ЛПНП в крови на 24-й неделе по сравнению с плацебо и эзетимибом. Все исследования соответствовали их главной конечной точке.
В целом, применение алирокумаба приводило также к статистически значимо большему значению процента снижения концентраций ОХ, ХС-ЛПнеВП, Апо В и Лп(а) по сравнению с плацебо/эзетимибом, независимо от того получали или нет пациенты статины. Алирокумаб также снижал концентрации ТГ и увеличивал концентрации ХС-ЛПВП и Апо А-1 по сравнению с плацебо.
Снижение концентрации ХС-ЛПНП в крови наблюдалось во всех возрастных группах, у лиц обоего пола, при разных показателях индекса массы тела (ИМТ), у лиц разных рас, и с разными исходными концентрациями ХС-ЛПНП в крови. Результаты по эффективности были единообразными у пациентов с гетерозиготной формой семейной гиперхолестеринемии, без гетерозиготной семейной гиперхолестеринемии, у пациентов со смешанной дислипидемией и пациентов с сахарным диабетом. Снижение концентраций ХС-ЛПНП в крови было единообразным, независимо от того, принимались или не принимались пациентами одновременно статины, и от доз последних.
В группе алирокумаба по сравнению с группами плацебо или эзетимиба на 12-й и 24-й неделе статистически значимо у более высокого процента пациентов была достигнута концентрация ХС-ЛПНП в крови, составляющая <70 мг/дл.
В исследованиях с использованием схем титрования дозы, основанных на соответствующих критериях, большинство пациентов достигали целевого значения концентрации ХС-ЛПНП в крови (основанного на их степени сердечно-сосудистого риска) на дозе 75 мг 1 раз в 2 недели, и большинство пациентов продолжали лечение в дозе алирокумаба 75 мг 1 раз в 2 недели. Липидоснижающий эффект алирокумаба наблюдался в пределах 15 дней после применения первой дозы, достижение максимального эффекта наблюдалось приблизительно на 4 неделе. Эффективность сохранялась на протяжении всей продолжительности исследуемого лечения (до 78 недель в исследовании LONG TERM).
После прекращения введения алирокумаба не наблюдалось «синдрома отмены» и концентрация ХС-ЛПНП в крови постепенно возвращалась к исходным показателям.
Фармакокинетика
Абсорбция
После подкожного введения препарата Пралуэнт в дозе опт 50 мг до 300 мг среднее время достижения максимальной концентрации алирокумаба в сыворотке крови составляло 3-7 дней.
Фармакокинетика алирокумаба после однократного подкожного введения в дозе 75 мг в область живота, бедра или плеча была подобной. По данным популяционного анализа фармакокинетических показателей абсолютная биодоступность алирокумаба после подкожного введения составляла 85 %.
Незначительно большее (2,1-2,7-кратное), чем пропорциональное дозе, увеличение концентраций алирокумаба, наблюдалось при двукратном увеличении дозы с 75 мг до 150 мг 1 раз в 2 недели.
Равновесное состояние достигалось после введения 2-3 доз с двукратным коэффициентом накопления.
Распределение
После внутривенного введения объем распределения алирокумаба составлял 0,04-0,05 л/кг, что указывает на распределение алирокумаба, главным образом, в системе кровообращения.
Метаболизм
Специальные исследования метаболизма не проводились, так как алирокумаб является белком. Предполагается, что алирокумаб расщепляется на небольшие пептиды и отдельные аминокислоты.
Выведение
У алирокумаба наблюдались 2 фазы выведения. В низких концентрациях элиминация происходит преимущественно через насыщаемую связь с мишенью (PCSK9), в то время как при более высоких концентрациях элиминация алирокумаба происходит преимущественно через ненасыщаемый протеолитический путь. По данным популяционного анализа фармакокинетических показателей средний период полувыведения алирокумаба составлял 17-20 дней у пациентов, получавших алирокумаб в монотерапии подкожно в дозах 75 мг 1 раз в 2 недели или 150 мг 1 раз в 2 недели. При одновременном применении со статинами, средний период полувыведения алирокумаба составлял 12 дней.
Особые группы пациентов
Пол
По данным популяционного анализа фармакокинетических показателей половая принадлежность пациентов не влияла на фармакокинетику алирокумаба.
Пациенты пожилого возраста
По данным популяционного анализа фармакокинетических показателей, возраст ассоциировался с небольшим различием в системной экспозиции алирокумаба в равновесном состоянии без влияния на его эффективность и безопасность.
Масса тела
По данным популяционного анализа фармакокинетических показателей масса тела оказывала незначительное влияние на системную экспозицию алирокумаба без влияния на его эффективность и безопасность.
Пациенты детского возраста
Фармакокинетические эффекты алирокумаба у пациентов детского возраста к настоящему моменту не изучались.
Нарушения функции печени
В клиническом исследовании I фазы при однократном подкожном введении алирокумаба в дозе 75 мг фармакокинетические показатели алирокумаба у пациентов с печеночной недостаточностью легкой и средней степени тяжести были аналогичными таковым у пациентов с нормальной функцией печени. Доступные данные по фармакокинетике алирокумаба у пациентов с печеночной недостаточностью тяжелой степени отсутствуют.
Нарушения функции почек
Так как нет сведений о том, что моноклональные антитела выводятся почками, не ожидается, что функциональное состояние почек повлияет на фармакокинетику алирокумаба. Популяционный анализ фармакокинетических показателей продемонстрировал, что нарушение функции почек легкой и средней степени тяжести не оказывало значимого воздействия на фармакокинетику алирокумаба. Данные по фармакокинетике алирокумаба у пациентов с тяжелыми нарушениями функции почек ограничены.
Расовая принадлежность
По данным популяционного анализа фармакокинетических показателей расовая принадлежность не оказывала влияния на фармакокинетику алирокумаба. После однократного подкожного введения алирокумаба в дозах 100-300 мг не наблюдалось значимых различий в системной экспозиции у здоровых добровольцев, являющихся японцами и представителями белой расы.
Показания к применению
Препарат Пралуэнт показан для длительного лечения взрослых пациентов с первичной гиперхолестеринемией (несемейной и гетерозиготной формой семейной гиперхолестеринемии) или смешанной дислипидемией, включая пациентов с сахарным диабетом 2 типа, в дополнение к диете, для снижения концентрации холестерина липопротеинов низкой плотности (ХС-ЛПНП), общего холестерина (общего-ХС), холестерина липопротеинов, не являющихся липопротеинами высокой плотности (ХС-ЛПнеВП), аполипопротеина В (Апо В), триглицеридов (ТГ) и липопротеина а (ЛПа) и повышения концентраций холестерина липопротеинов высокой плотности (ХС-ЛПВП) и аполипопротеина А-1 (Апо А-1). Препарат Пралуэнт показан:
- в комбинации со статинами (ингибиторами ГМГ-КоА-редуктазы) в сочетании или без сочетания с другой липид-модифицирующей терапией при невозможности достижения у пациентов целевой концентрации ХС-ЛПНП при приеме максимально допустимой дозы статинов;
- в монотерапии или как дополнение к другой, не содержащей статинов липид-модифицирующей терапии, у пациентов с непереносимостью статинов или при наличии противопоказаний к их применению.
Влияние препарата Пралуэнт на сердечно-сосудистую заболеваемость и смертность в настоящее время не установлено.
Противопоказания
- Повышенная чувствительность к алирокумабу или какому-либо вспомогательному веществу препарата.
- Беременность (эффективность и безопасность не установлены).
- Период грудного вскармливания (эффективность и безопасность не установлены).
- Детский возраст до 18 лет (эффективность и безопасность не установлены).
С осторожностью
- Почечная недостаточность тяжелой степени.
- Печеночная недостаточность тяжелой степени.
Применение при беременности и в период грудного вскармливания
Беременность
Отсутствуют данные по применению препарата Пралуэнт у беременных женщин.
Ожидается, что алирокумаб, как и другие антитела класса IgG, проникает через плацентарный барьер.
Во время беременности применение препарата Пралуэнт не рекомендуется.
Период грудного вскармливания
Неизвестно, проникает ли алирокумаб в грудное молоко у человека.
В связи с тем, что многие лекарственные препараты, и в том числе иммуноглобулины, проникают в грудное молоко у человека, применение препарата Пралуэнт у женщин в период грудного вскармливания не рекомендуется. При необходимости применения препарата Пралуэнт в данный период следует прекратить грудное вскармливание.
Способ применения и дозы
Начальная доза препарата Пралуэнт составляет 75 мг, которую вводят подкожно 1 раз в 2 недели. У пациентов, которым требуется большее снижение концентрации ХС-ЛПНП (> 60 %), начальная доза препарата Пралуэнт может составлять 150 мг, которую также вводят подкожно 1 раз в 2 недели.
Дозу препарата Пралуэнт следует подбирать индивидуально на основании таких параметров как исходные значения ХС-ЛПНП, цели терапии и ответ пациента на лечение. Концентрации липидов в крови можно оценивать через 4 недели после начала лечения или титрования дозы и проводить соответствующую коррекцию дозы.
В случае пропуска дозы пациент должен получить инъекцию, как можно скорее, и затем продолжить лечение через 2 недели со дня пропущенной дозы.
Особые группы пациентов
Дети
Безопасность и эффективность применения препарата Пралуэнт у детей в возрасте до 18 лет не установлены.
Пациенты пожилого возраста
У пациентов пожилого возраста коррекции дозы препарата Пралуэнт не требуется (см. раздел «Особые указания)».
Печеночная недостаточность
У пациентов с печеночной недостаточностью легкой или средней степени тяжести коррекции дозы препарата Пралуэнт не требуется. Данные по применению препарата Пралуэнт у пациентов с печеночной недостаточностью тяжелой степени отсутствуют.
Почечная недостаточность
У пациентов с почечной недостаточностью легкой или средней степени тяжести коррекции дозы препарата Пралуэнт не требуется. Данные по применению препарата у пациентов с почечной недостаточностью тяжелой степени ограничены.
Масса тела
Не требуется коррекции режима дозирования в зависимости от массы тела пациентов.
Правила введения препарата
Препарат Пралуэнт применяют в виде подкожных инъекций, проводимых в области бедра, живота или плеча, с помощью одноразовой предварительно заполненной шприц-ручки или одноразового предварительно заполненного шприца.
Рекомендуется менять места инъекций при проведении каждой инъекции.
Препарат Пралуэнт не следует вводить в области активных кожных заболеваний или повреждений, таких как солнечные ожоги, кожная сыпь, воспаления кожи или кожные инфекции.
Не следует вводить препарат Пралуэнт в то же место, в которое вводились другие лекарственные препараты.
Побочное действие
Представленные ниже данные по безопасности отражают применение алирокумаба у 3340 пациентов, большинство из которых имели высокий или очень высокий риск развития сердечно-сосудистых заболеваний, и которые получали алирокумаб в дозе 75 мг или 150 мг в виде подкожных инъекций 1 раз в 2 недели с продолжительностью лечения до 18 месяцев (включая 2408 пациентов, получавших лечение алирокумабом в течение 52 недель, и 639 пациентов, получавших лечение алирокумабом в течение не менее 76 недель). Данные по безопасности основаны на объединенных результатах 9 плацебо-контролируемых исследований (4 исследования фазы II и 5 исследований фазы III (все исследования у пациентов, одновременно принимающих статины), и 5 контролируемых эзетимибом исследований фазы III (в 3-х из которых пациенты одновременно принимали статины).
Наиболее частыми нежелательными реакциями (>1 % пациентов, получавших препарат Пралуэнт) были реакции в месте введения препарата, субъективные симптомы и объективные признаки со стороны верхних дыхательных путей и кожный зуд.
Наиболее частыми нежелательными реакциями, приводящими к прекращению лечения у пациентов, получавших препарат Пралуэнт, были реакции в месте введения препарата.
Не наблюдалось различий в отношении профиля безопасности между двумя дозами (75 мг 1 раз в 2 недели и 150 мг 1 раз в 2 недели), использованными в программе клинических исследований фазы III.
В контролируемых исследованиях 1158 пациентов (34,7%), получавшие препарат Пралуэнт, были в возрасте >65 лет, и 241 пациент (7,2%), получавшие препарат Пралуэнт, были в возрасте >75 лет. Не наблюдалось достоверных различий по безопасности и эффективности препарата по мере увеличения возраста пациентов.
Нежелательные реакции о которых сообщалось при применении препарата Пралуэнт в объединенных контролируемых исследованиях
Нежелательные реакции представлены в соответствии с частотой, классификация которой рекомендована Всемирной Организацией Здравоохранения: очень часто (>1/10), часто (от > 1/100 до <1/10), нечасто (от >1/1 000 до <1/100), редко (от >1/10 000 до <1/1 000), очень редко (<1/10000), частота неизвестна (частота не может быть определена на основании имеющихся данных).
Нарушения со стороны иммунной системы
Редко: гиперчувствительность, аллергический васкулит.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Часто: субъективные симптомы и объективные признаки со стороны верхних дыхательных путей, включая боль в ротоглотке, ринорею, чихание.
Нарушения со стороны кожи и подкожных тканей
Часто: кожный зуд.
Редко: крапивница, монетовидная экзема.
Общие расстройства и нарушения в месте введения
Часто: реакции в месте введения препарата, включая эритему/гиперемию, кожный зуд, отек, боль/болезненную чувствительность.
Описание отдельных нежелательных реакций
Реакции в месте введения препарата
Реакции в месте введения препарата, включая эритему/гиперемию, кожный зуд, отек, боль/болезненную чувствительность, отмечались у 6,1 % пациентов, получавших лечение алирокумабом, по сравнению с 4,1 % в контрольной группе. Большинство реакций в месте введения препарата были преходящими и слабо выраженными. Частота прекращения лечения вследствие развития реакций в месте введения была сопоставимой в обеих группах (0,2 % в группе алирокумаба по сравнению с 0,3 % в контрольной группе).
Генерализованные аллергические реакции
Генерализованные аллергические реакции чаще отмечались в группе алирокумаба, чем в контрольной группе, главным образом, с различием в частоте развития кожного зуда. Кожный зуд был обычно слабо выраженным и преходящим. Кроме этого, в контролируемых клинических исследованиях сообщалось о развитии редких и иногда серьезных аллергических реакций, таких как реакции гиперчувствительности, монетовидная экзема, крапивница и аллергический васкулит.
Значения ХС-ЛПНП <25 мг/дл
В объединенных контролируемых исследованиях у 796 пациентов из 3340 пациентов (23,8 %), получавших лечение препаратом Пралуэнт, отмечались два последовательно полученных значения концентрации ХС-ЛПНП в крови < 25 мг/дл, включая 288 пациентов (8,6 %) с двумя последовательно полученными значениями концентрации ХС-ЛПНП <15 мг/дл.
Эти случаи, главным образом, наблюдались, когда пациенты начинали и продолжали лечение препаратом Пралуэнт в дозе 150 мг 1 раз в 2 недели, независимо от исходных значений концентрации ХС-ЛПНП в крови или реакции на лечение.
Не было выявлено нежелательных реакций, связанных с этими значениями концентрации ХС-ЛПНП в крови.
Сердечно-сосудистые осложнения
В настоящее время продолжается исследование сердечно-сосудистых исходов, в котором главной конечной точкой являются подтвержденные экспертизой большие нежелательные сердечно-сосудистые осложнения (БНССО), такие как коронарная смерть, инфаркт миокарда, ишемический инсульт и нестабильная стенокардия, потребовавшая госпитализации.
При запланированном анализе объединенных исследований фазы III у 110 пациентов (3,5 %) в группе алирокумаба и у 53 пациентов (3 %) в контрольной группе (плацебо или активный контроль) наблюдались следующие, подтвержденные экспертизой, сердечно-сосудистые осложнения, развившиеся во время лечения: смерть, связанная с ишемической болезнью сердца, инфаркт миокарда, ишемический инсульт, нестабильная стенокардия, потребовавшая госпитализации, госпитализация по поводу хронической сердечной недостаточности и реваскуляризация. Подтвержденные БНССО наблюдались у 52 из 3182 пациентов (1,6 %) в группе алирокумаба и у 33 из 1792 пациентов (1,8%) в контрольной группе (плацебо и активный контроль).
При запланированном окончательном анализе клинического исследования LONG TERM подтвержденные экспертизой сердечно-сосудистые осложнения, развившиеся во время лечения, наблюдались у 72 из 1550 пациентов (4,6%) в группе алирокумаба и у 43 из 788 пациентов (5,1 %) в группе плацебо; подтвержденные экспертизой БНССО наблюдались у 27 из 1550 пациентов (1,7 %) в группе алирокумаба и у 26 из 788 пациентов (3,3 %) в группе плацебо. Отношения рисков (ОР) рассчитывали ретроспективно; для всех сердечно-сосудистых осложнений отношения рисков = 0,91 (95% ДИ, 0,62-1,34); для БНССО отношения рисков = 0,52 (95% ДИ, 0,31-0,90).
Смертность от всех причин
В клинических исследованиях фазы III смертность от всех причин составляла 0,6% (20 из 3182 пациентов) в группе алирокумаба и 0,9% (17 из 1792 пациентов) в контрольной группе. Главной причиной смертельных исходов были сердечно-сосудистые осложнения.
Иммуногенность/антитела к алирокумабу
Как и все другие протеины, применяющиеся для лечения, алирокумаб обладает потенциальной иммуногенностью. В исследованиях фазы III у 4,8 % пациентов, получавших лечение алирокумабом, отмечалось образование антител к алирокумабу (АА), по сравнению с 0,6 % в контрольной группе (плацебо и эзетимиб). У большинства этих пациентов наблюдались преходящие реакции образования АА с низкими титрами без нейтрализующей активности. По сравнению с пациентами, которые были АА-негативными, пациенты с АА-позитивным статусом не продемонстрировали различий в системной экспозиции алирокумаба, эффективности или безопасности, за исключением более высокой частоты развития реакций в месте введения препарата. Только у 1,2% пациентов в группе алирокумаба были выявлены нейтрализующие антитела. Большинство этих пациентов имело только один положительный результат анализа на наличие нейтрализующих антител; 10 пациентов (0,3%) имели два или более положительных результата анализа на наличие нейтрализующих антител. Данные у этих пациентов не подтверждают корреляции между наличием нейтрализующих антител и эффективностью в отношении снижения концентрации ХС-ЛПНП в крови и безопасностью.
Данные по иммуногенности зависят от чувствительности и специфичности методики их определения, а также от других факторов. Кроме этого, на наблюдаемую частоту АА-позитивного результата анализа оказывают влияние несколько факторов, включая обработку забранных проб крови, время забора крови, одновременно принимаемые лекарственные препараты и основное заболевание. По этим причинам сравнение частоты возникновения АА с частотой возникновения антител к другим препаратам может быть некорректным.
Передозировка
В контролируемых клинических исследованиях не было выявлено никаких изменений безопасности при более частом введении доз, чем рекомендованный режим дозирования 1 раз в 2 недели.
Взаимодействие с другими лекарственными средствами
Влияние алирокумаба на другие лекарственные средства
Так как алирокумаб является биологическим веществом, не ожидается каких-либо фармакокинетических эффектов алирокумаба на другие лекарственные препараты.
В клинических исследованиях при применении алирокумаба в комбинации с аторвастатином или розувастатином не наблюдалось каких-либо значимых изменений концентраций статинов в крови при повторных введениях алирокумаба, что указывает на то, что алирокумаб не влияет на изоферменты цитохрома Р450 (главным образом, изоферменты CYP3A4 и CYP2C9) и белки-транспортеры, такие как Р-гликопротеин (P-gp) и ОАТР (белок транспортер органических анионов).
Влияние других лекарственных средств на алирокумаб
Статины и другая липид-модифицирующая терапия, как известно, повышают синтез PCSK9, белка, являющегося мишенью алирокумаба. Повышение концентрации PCSK9 может привести к уменьшению системной экспозиции алирокумаба. Однако это не влияет на продолжительность действия препарата при применении алирокумаба 1 раз в 2 недели.
Особые указания
Аллергические реакции
В клинических исследованиях сообщалось о развитии генерализованных аллергических реакциях, включая зуд; также имелись сообщения о редких и иногда серьезных случаях аллергических реакций, таких как реакции гиперчувствительности, монетовидная экзема, крапивница и аллергический васкулит. При появлении симптомов и признаков серьезных аллергических реакций лечение препаратом Пралуэнт должно быть прекращено и следует начать проведение соответствующей симптоматической терапии.
Влияние на фертильность
Данные о неблагоприятном воздействии алирокумаба на фертильность отсутствуют.
Пожилые пациенты
Данные о применении алирокумаба у пациентов старше 75 лет ограничены. В контролируемых исследованиях 1158 пациентов (34,7%), получавших препарат Пралуэнт, были в возрасте >65 лет, и 241 пациент (7,2 %), получавших препарат Пралуэнт, были в возрасте >75 лет. Значимых различий в безопасности и эффективности препарата Пралуэнт с увеличением возраста не наблюдалось.
Почечная недостаточность
В клинических исследованиях количество пациентов с почечной недостаточностью тяжелой степени (клиренс креатинина <30 мл/мин/1,73 м2) было ограничено. Препарат Пралуэнт следует применять с осторожностью у пациентов с почечной недостаточностью тяжелой степени (см. раздел «С осторожностью»).
Печеночная недостаточность
Исследований алирокумаба у пациентов с печеночной недостаточностью тяжелой степени (класс С по шкале Чайлда-Пью) не проводились. Препарат Пралуэнт следует применять с осторожностью у данной категории пациентов (см. раздел «С осторожностью»).
Влияние на способность управлять транспортными средствами и механизмами
Препарат Пралуэнт не влияет или почти не влияет на способность управлять транспортными средствами и работать с механизмами.
Форма выпуска
Раствор для подкожного введения 75 мг/мл и 150 мг/мл.
По 1 мл в одноразовый шприц из прозрачного стекла (тип I), снабженный несъемной иглой из нержавеющей стали, защищенной колпачком из мягкого полимера.
По 1 шприцу в пластиковый блистер с покрытием.
По 1 блистеру или по 2 соединенных блистера или по 3 пары соединенных блистеров с инструкцией по применению в картонную пачку.
По 1 шприцу в шприц-ручку. По 1, 2 или 6 шприц-ручек с инструкцией по применению в картонную пачку, снабженную фиксатором.
Описание предварительно заполненных одноразовых шприц-ручек и инструкция по их использованию
Описание предварительно заполненных одноразовых шприцев и инструкция по их использованию
Условия хранения
Хранить при температуре от 2°С до 8°С. Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска
Отпускают по рецепту.
Производитель
Санофи Винтроп Индустрия, Франция (шприцы).
Юридическое лино, на имя которого выдано регистрационное удостоверение
АО Санофи-авентис груп, Франция.
Фасовщик (первичная упаковка)
Санофи Винтроп Индустрия, Франция (шприцы).
Упаковщик (вторичная (потребительская) упаковка) Санофи Винтроп Индустрия, Франция (шприцы).
Санофи-Авентис Дойчланд ГмбХ, Германия (шприц-ручки).
ЗАО «Санофи-Авентис Восток», Россия (шприц-ручки)
Выпускающий контроль качества
Санофи Винтроп Индустрия, Франция (шприцы).
Sanofi Winthrop Industrie, France.
1051 boulevard Industriel 76580 Le Trait, France.
Санофи-Авентис Дойчланд ГмбХ, Германия (шприц-ручки).
Sanofi-Aventis Deutschland GmbH, Germany.
Brueningstrasse 50/Industriepark Hoechst H500, H590, H600 65926 Frankfort am Main, Germany.
ЗАО «Санофи-Авентис Восток», Россия (шприц-ручки).
302516, Россия, Орловская область, Орловский район, с/п Болынекуликовское, ул. Ливенская, д. 1.
Претензии потребителей направлять по адресу в России:
Представительство АО «Санофи-авентис труп». 125009, г. Москва, ул. Тверская, 22.
В случае упаковки препарата на ЗАО «Санофи-Авентис Восток», Россия претензии потребителей направлять по адресу:
302516, Россия, Орловская область, Орловский район, с/п Болынекуликовское, ул. Ливенская, д. 1.
Купить Пралуэнт в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)