Фармакологическое действие
Высокоселективный конкурентный антагонист α1А-адренорецепторов, блокирует постсинаптические α1А-адренорецепторы, находящиеся в гладкой мускулатуре предстательной железы, шейке мочевого пузыря и простатической части мочеиспускательного канала. Снижает тонус гладкой мускулатуры предстательной железы, шейки мочевого пузыря и простатической части мочеиспускательного канала, улучшая отток мочи. Одновременно уменьшаются симптомы обструкции и раздражения, связанные с доброкачественной гиперплазией предстательной железы.
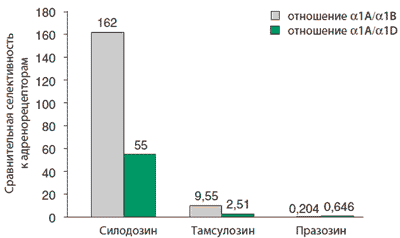
Сродство силодозина к α1А-адренорецепторам, расположенным в мочевом пузыре, в 162 раза превосходит его способность взаимодействовать с α1B-адренорецепторами, которые расположены в гладких мышцах сосудов. Благодаря высокой селективности, силодозин не вызывает клинически значимого снижения АД у пациентов с исходно нормальным АД.
Фармакокинетика
При приеме внутрь силодозин хорошо абсорбируется. Абсолютная биодоступность составляет 32%. Прием пищи снижает Cmax примерно на 30%, увеличивая время достижения Cmax примерно до 1 ч и оказывает минимальное влияние на AUC. Cmax 87±51 нг/мл, Tmax — 2.5 ч, средняя концентрация в моче 433±286 нг×ч/мл.
Vd силодозина составляет 0.81 л/кг. Силодозин связывается с белками плазмы на 96.6%.
Силодозин метаболизируется посредством глюкуронирования (с участием UGT2B7), с участием алкогольдегидрогеназы и альдегиддегидрогеназы, окислительных путей, в основном с участием CYP 3A4. Основной активный метаболит в плазме карбамоилглюкуронид (KMD-3213G) достигает плазменной концентрации в 4 раза большей, чем сам силодозин. Силодозин не обладает потенциалом индукции или ингибирования изоферментов цитохрома Р450.
33.5% силодозина выводится почками и 54.9% через кишечник. Клиренс силодозина составляет около 23.1 л/ч. Силодозин экскретируется в основном в виде метаболитов и в очень малом количестве в неизмененном виде с мочой. T1/2 силодозина и карбамоилглюкуронида составляет 11 ч и 18 ч соответственно.
Показания активного вещества
СИЛОДОЗИН
Доброкачественная гиперплазия предстательной железы.
Режим дозирования
Рекомендуемая доза — 8 мг 1 раз/сут, одновременно с приемом пищи, предпочтительно в одно и то же время суток. Необходимо проглатывать капсулу целиком, желательно запивая стаканом воды.
При лечении пациентов с почечной недостаточностью средней степени (КК от 30 до 50 мл/мин) рекомендуется в течение первой недели принимать препарат в дозе 4 мг/сут, при хорошей индивидуальной переносимости затем можно увеличить дозу до 8 мг/сут.
При почечной недостаточности тяжелой степени назначение силодозина не рекомендуется.
Побочное действие
Со стороны ЦНС: часто — головокружение; частота неизвестна — синкопе.
Со стороны сердечно-сосудистой системы: часто — ортостатическая гипотензия.
Со стороны дыхательной системы: часто — заложенность носа.
Со стороны пищеварительной системы: часто — диарея; нечасто — тошнота, сухость во рту.
Со стороны половой системы: очень часто — ретроградная эякуляция, анэякуляция; нечасто — снижение либидо, эректильная дисфункция.
Прочие: частота неизвестна — интраоперационный синдром «дряблой» радужки во время операций по поводу катаракты.
Противопоказания к применению
Почечная недостаточность тяжелой степени (КК <30 мл/мин); тяжелая печеночная недостаточность; детский и подростковый возраст до 18 лет; повышенная чувствительность к силодозину.
Особые указания
С осторожностью следует применять при почечной недостаточности средней степени тяжести (КК от 30 до 50 мл/мин).
Как и при использовании других альфа1-адреноблокаторов при лечении силодозином может наблюдаться снижение АД, ортостатическая гипотензия. При первых признаках ортостатической гипотензии (головокружение, слабость) пациент должен сесть или лечь и оставаться в этом положении до тех пор, пока симптомы ортостатической гипотензии не исчезнут.
Поскольку доброкачественная гиперплазия предстательной железы и опухоли предстательной железы имеют сходные симптомы и могут развиваться вместе, пациентам с подозрением на доброкачественную гиперплазию предстательной железы перед назначением препарата необходимо обследование для исключения опухолей предстательной железы.
У пациентов, принимающих или принимавших альфа1-адреноблокаторы, во время операции по поводу катаракты может возникать синдром «дряблой» радужки, что может привести к осложнениям во время операции. Необходимо прекращение лечения альфа1-адреноблокаторами за 1-2 недели до такой операции. Пациентам, которым назначена операция по поводу катаракты, не рекомендуется начинать лечение силодозином.
Влияние на способность к управлению транспортными средствами и механизмами
Возможно появление симптомов, связанных с ортостатической гипотензией (например, головокружения), поэтому до выяснения индивидуальной переносимости силодозина пациентам следует воздержаться от управления транспортными средствами и и других потенциально опасных видов деятельности.
Лекарственное взаимодействие
Не рекомендуется сочетание с другими альфа-адреноблокаторами из-за возможного потенцирования действия.
Совместное применение ингибиторов изофермента CYP3A4 (кетоконазола, кларитромицина, итраконазола, ритонавира) не рекомендуется, т.к. увеличивает концентрацию силодозина в плазме.
Ингибиторы ФДЭ5 (силденафил, тадалафил) при совместном применении могут повышать риск развития головокружения.
Гипотензивные препараты (бета-адреноблокаторы, антагонисты кальция, препараты, действующие на РААС, диуретики) при совместном применении могут усиливать ортостатическую гипотензию.
Силодозин
(Silodosinum)
Содержание
-
Структурная формула
-
Русское название
-
Английское название
-
Латинское название
-
Брутто формула
-
Фармакологическая группа вещества Силодозин
-
Код CAS
-
Торговые названия с действующим веществом Силодозин
Структурная формула
Русское название
Силодозин
Английское название
Silodosin
Латинское название
Silodosinum (род. Silodosini)
Брутто формула
C25H32F3N3O4
Фармакологическая группа вещества Силодозин
Код CAS
160970-54-7
Торговые названия с действующим веществом Силодозин
| Торговое название | Цена за упаковку, руб. |
|---|---|
| Урорек |
от 937.50 до 2155.00 |
Наш сайт использует файлы cookie, чтобы улучшить работу сайта, повысить его эффективность и удобство. Продолжая использовать сайт rlsnet.ru, вы соглашаетесь с условиями использования файлов cookie.
Силодозин
Silodosin
Фармакологическое действие
Силодозин — высокоселективный конкурентный антагонист α1A-адренорецепторов, которые в основном расположены в предстательной железе, в тканях дна и шейки мочевого пузыря, капсуле предстательной железы и простатической части мочеиспускательного канала. Блокада α1A-адренорецепторов снижает тонус гладкой мускулатуры в этих тканях, что ведёт к улучшению оттока мочи из мочевого пузыря.
Одновременно уменьшаются симптомы обструкции и раздражения, связанные с доброкачественной гиперплазией предстательной железы.
В исследованиях in vitro было показано, что сродство силодозина к α1A-адренорецепторам в 162 раза превосходит его способность взаимодействовать с альфа1в-адренорецепторами, которые расположены в гладких мышцах сосудов. Благодаря высокой селективности силодозин не вызывает клинически значимого снижения артериального давления у пациентов с исходно нормальным артериальным давлением.
Фармакокинетика
При приёме внутрь силодозин хорошо абсорбируется. Абсолютная биодоступность составляет 32 %. Приём пищи снижает максимальную плазменную концентрацию (Cmax) примерно на 30 %, увеличивая время её достижения (TCmax) примерно до 1 час и оказывает минимальное влияние на AUC (Area under the plasma drug concentration-time curve — площадь под кривой «концентрация-время»). Cmax 87 ± 51 нг/мл, TCmax — 2,5 часа, средняя концентрация в моче 433 ± 286 нг × ч/мл.
Объём распределения (Vd) силодозина составляет 0,81 л/кг. Силодозин связывается с белками плазмы на 96,6 %.
Силодозин биотрансформируется посредством глюкуронирования (с участием UGT2B7), с участием алкогольдегидрогеназы и альдегиддегидрогеназы, окислительных путей, в основном с участием CYP 3A4. Основной активный метаболит в плазме карбамоилглюкуронид (KMD-3213G) достигает плазменной концентрации в 4 раза большей, чем сам силодозин. Силодозин не обладает потенциалом индукции или ингибирования изоферментов цитохрома P450.
33,5 % силодозина выводится почками и 54,9 % через кишечник. Клиренс силодозина составляет около 23,1 л/ч. Силодозин экскретируется в основном в виде метаболитов и в очень малом количестве в неизменённом виде с мочой. Период полувыведения (T½) силодозина и карбамоилглюкуронида составляет 11 и 18 часов соответственно.
Показания
Доброкачественная гиперплазия предстательной железы.
Противопоказания
- Повышенная чувствительность к силодозину;
- почечная недостаточность тяжёлой степени (клиренс креатинина менее 30 мл/мин);
- тяжёлая печёночная недостаточность;
- детский и подростковый возраст до 18 лет.
С осторожностью
Лёгкая и умеренная почечная недостаточность (клиренс креатинина от 30 до 50 мл/мин).
Беременность и грудное вскармливание
Категория действия на плод по FDA — B.
Силодозин предназначен только для мужчин.
Способ применения и дозы
Рекомендуемая доза — 8 мг 1 раз/сут, одновременно с приёмом пищи, предпочтительно в одно и то же время суток. Необходимо проглатывать капсулу целиком, желательно запивая стаканом воды.
При лечении пациентов с почечной недостаточностью средней степени (клиренс креатинина от 30 до 50 мл/мин) рекомендуется в течение первой недели принимать препарат в дозе 4 мг/сут, при хорошей индивидуальной переносимости затем можно увеличить дозу до 8 мг/сут.
При почечной недостаточности тяжёлой степени назначение силодозина не рекомендуется.
Побочные действия
Ниже перечислены нежелательные побочные реакции, отмеченные во всех клинических исследованиях и на протяжении международного постмаркетингового опыта применения, в отношении которых существует причинная взаимосвязь, согласно классификации MedDRA в соответствии с поражением органов и систем органов и частотой развития: очень часто (>1/10), часто (от >1/100 до <1/10), нечасто (от >1/1 000 до <1/100), редко (от >1/10 000 до <1/1 000), очень редко (от <1/10 000), частота неизвестна (частота не может быть определена по доступным данным).
Со стороны иммунной системы
Очень редко — аллергические реакции: ангионевротический отёк лица, языка и гортани*.
Нарушения психики
Нечасто — снижение либидо.
Со стороны нервной системы
Часто — головокружение, редко: потеря сознания*; частота неизвестна — синкопе.
Со стороны сердца
Нечасто — тахикардия*, редко: ощущение сердцебиения*.
Со стороны сосудов
Часто — ортостатическая гипотензия; нечасто — снижение артериального давления*.
Со стороны дыхательной системы, органов грудной клетки и средостения
Часто — заложенность носа.
Со стороны желудочно- кишечного тракта
Часто — диарея; нечасто — тошнота, сухость во рту.
Со стороны гепатобилиарной системы
Нечасто — отклонение от нормы показателей функции печени*.
Со стороны кожи и подкожной клетчатки
Нечасто — сыпь*, кожный зуд*, крапивница*, лекарственный дерматит*.
Со стороны половых органов и молочной железы
Очень часто — ретроградная эякуляция, анэякуляция; нечасто — эректильная дисфункция.
Травмы, отравления и осложнения процедур
Частота неизвестна — интраоперационный синдром «дряблой» радужки во время операций по поводу катаракты.
* — побочные эффекты, зарегистрированные спонтанно в ходе международного постмаркетингового опыта применения (частота встречаемости была рассчитана исходя из встречаемости явлений в ходе клинических исследований I–IV фаз и неинтервенционных исследований).
Ортостатическая гипотензия: частота ортостатической гипотензии в плацебо-контролируемых клинических исследованиях составила 1,2 % в группе, принимающей силодозин и 1,0 % в группе, принимающей плацебо.
Ортостатическая гипотензия иногда может стать причиной обморока.
Интраоперационный синдром дряблой радужки (ИСДР) Сообщалось о развитии ИСДР во время операции по удалению катаракты.
Передозировка
Симптомы
Выраженное снижение артериального давления, компенсаторная тахикардия.
Лечение
Промывание желудка, приём активированного угля или осмотического слабительного, симптоматическая терапия, направленная на увеличение объёма циркулирующей крови, сосудосуживающие лекарственные средства. Контроль функции почек. Диализ малоэффективен из-за интенсивного связывания препарата с белками плазмы.
Взаимодействие
Силодозин активно метаболизируется, главным образом, посредством CYP3A4, алкоголь-дегидрогеназы и UGT2B7. Силодозин также является субстратом для P-гликопротеина. Вещества, которые ингибируют или индуцируют эти ферменты и переносчики, могут влиять на концентрацию силодозина и его активного метаболита в плазме.
Альфа-блокаторы
Достаточной информации о безопасности совместного приёма силодозина и других α-адреноблокаторов нет. Поэтому одновременный приём других антагонистов α-адренорецепторов не рекомендуется.
Ингибиторы CYP3A4
В исследовании взаимодействия было обнаружено 3,7-кратное повышение максимальной концентрации силодозина в плазме и 3,1-кратное усиление воздействия силодозина (то есть AUC) при одновременном введении сильнодействующего ингибитора CYP3A4 (кетоконазол 400 мг). Одновременное применение с мощными ингибиторами CYP3A4 (такими как кетоконазол, итраконазол и ритонавир) не рекомендуется.
При совместном приёме силодозина и умеренного ингибитора CYP3A4, например, дилтиазема, наблюдалось приблизительно 30 % увеличение AUC силодозина, но на значения Cmax и T½ влияния не было. Это изменение не является клинически важным, коррекция дозы не требуется.
Ингибиторы фосфодиэстеразы (ФДЭ) 5-го типа
Между силодозином и максимальной дозой силденафила или тадалафила наблюдалось только минимальное фармакодинамическое взаимодействие. В плацебо-контролируемом исследовании у 24 человек в возрасте 45–78 лет, получавших силодозин, одновременное назначение силденафила 100 мг или тадалафила 20 мг вызвало клинически не значимое среднее снижение систолического или диастолического артериального давления, что оценивалось при проведении ортостатической пробы (разница пульса лёжа и стоя). У пациентов старше 65 лет среднее снижение в различные моменты времени было между 5 и 15 мм рт.ст. (систолическое) и между 0 и 10 мм рт.ст. (диастолическое). Положительные результаты ортостатических проб были лишь незначительно более частыми во время совместного приёма препаратов, однако, симптоматического ортостаза или головокружения не было зафиксировано. Состояние пациентов, одновременно получающих ингибиторы ФДЭ-5 и препарат, должно контролироваться на возможное развитие нежелательных реакций.
Гипотензивные средства
В соответствии с программой клинического исследования многие пациенты получали сопутствующую терапию гипотензивными средствами (в основном, средствами, воздействующими на ренин-ангиотензиновую систему, β-блокаторами, антагонистами кальция и диуретиками) без повышения частоты ортостатической гипотензии. Тем не менее, необходимо принимать меры предосторожности при одновременном применении препарата с гипотензивными средствами. Состояние пациентов должно контролироваться на возможное развитие нежелательных реакций.
Дигоксин
При одновременном приёме силодозина 8 мг один раз в день не было отмечено существенного влияния на плато концентраций дигоксина, субстрата P-глико-протеина. Коррекция дозы не требуется.
Меры предосторожности
Как и при использовании других α1-адреноблокаторов при лечении силодозином может наблюдаться снижение артериального давления, ортостатическая гипотензия. При первых признаках ортостатической гипотензии (головокружение, слабость) пациент должен сесть или лечь и оставаться в этом положении до тех пор, пока симптомы ортостатической гипотензии не исчезнут.
Поскольку доброкачественная гиперплазия предстательной железы и опухоли предстательной железы имеют сходные симптомы и могут развиваться вместе, пациентам с подозрением на доброкачественную гиперплазию предстательной железы перед назначением препарата необходимо обследование для исключения опухолей предстательной железы.
У пациентов, принимающих или принимавших α1-адреноблокаторы, во время операции по поводу катаракты может возникать синдром «дряблой» радужки, что может привести к осложнениям во время операции. Необходимо прекращение лечения α1-адреноблокаторами за 1–2 недели до такой операции. Пациентам, которым назначена операция по поводу катаракты, не рекомендуется начинать лечение силодозином.
Влияние на способность к вождению автотранспорта и управлению механизмами
Не проводилось исследований влияния силодозина на способность управлять транспортными средствами и оборудованием. Пациентов следует информировать о возможных проявлениях симптомов, связанных с ортостатической гипотензией (например, головокружения), а в случае их возникновения воздержаться от управления транспортными средствами и занятий другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Классификация
-
АТХ
G04CA04
-
Фармакологические группы
-
Код МКБ 10
-
Категория при беременности по FDA
B
(нет риска в исследованиях, не связанных с человеком)
Информация о действующем веществе Силодозин предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Силодозин, содержатся в инструкции производителя, прилагаемой к упаковке.
Урорек (8 мг)
МНН: Силодозин
Производитель: Рекордати Индустрия Химика е Фармацевтика С.П.А.
Анатомо-терапевтическо-химическая классификация: Silodosin
Номер регистрации в РК:
№ РК-ЛС-5№020371
Информация о регистрации в РК:
20.02.2019 — бессрочно
- Скачать инструкцию медикамента
Торговое название
Урорек
Международное непатентованное название
Силодозин
Лекарственная форма
Капсулы твердые 4 мг, 8 мг
Состав
Одна таблетка содержит
активное вещество — силодозин 4.0 мг; 8.0 мг;
вспомогательные вещества: маннитол, крахмал прежелатинизированый (состоит из: крахмала прежелатинизированного (кукурузного) (Starch 1500ТМ) и крахмала прежелатинизированного (кукурузного) (РСSТМ РС-10)), натрия лаурилсульфат, магния стеарат;
состав желатиновой капсулы для дозировки 4 мг: желатин, титана диоксид (Е 171), железа (III) оксид желтый (Е 172).
состав желатиновой капсулы для дозировки 8 мг: желатин, титана диоксид (Е 171).
Описание
Твердые желатиновые капсулы желтого цвета размером № 3. Содержимое капсул – мелкокристаллический порошок от белого до светло-желтого цвета (для дозировки 4 мг).
Твердые желатиновые капсулы белого цвета размером № 0. Содержимое капсул – мелкокристаллический порошок от белого до светло-желтого цвета (для дозировки 8 мг).
Фармакотерапевтическая группа
Препараты для лечения доброкачественной гипертрофии простаты. Альфа-адреноблокаторы. Силодозин.
Код АТХ G04CA04
Фармакологические свойства
Фармакокинетика
Фармакокинетика силодозина и его основных метаболитов оценивалась у взрослых мужчин с и без доброкачественной гиперплазии предстательной железы после однократного и многократного применения в дозах от 0.1 мг до 48 мг в сутки. Фармакокинетика силодозина является линейной во всем диапазоне доз.
Действие основного метаболита в плазме, глюкуронида силодозина (KMD‑3213G), при равновесном состоянии приблизительно в 3 раза больше, чем действие исходного вещества. Силодозин и его глюкуронид достигают равновесного состояния через 3 и 5 дней лечения, соответственно.
Всасывание
Силодозин хорошо всасывается после перорального приема, абсорбция пропорциональна дозе. Абсолютная биодоступность составляет около 32 %. Пища снижает максимальную концентрацию (Сmax) примерно на 30 %, увеличивая время достижения максимальной концентрации (tmax) примерно до 1 ч и оказывает минимальное влияние на площадь под кривой «концентрация-время» (АUС). После перорального приема 8 мг один раз в день сразу после завтрака в течение 7 дней отмечены следующие фармакокинетические параметры: Сmax- 87±51 ng/ml (sd), tmax 2.5 часов (диапазон 1.0-3.0), AUC — 433±286 ng • h/ml.
Распределение
Объем распределения силодозина составляет 0,81 л/кг, связывание с белками плазмы составляет 96,6 %. Силодозин метаболизируется посредством глюкуронирования (с участием UGТ2В7), с участием алкогольдегидрогеназы и альдегид- дегидрогеназы, окислительных путей, в основном с участием СYРЗА4. Основной активный метаболит в плазме карбамоил- глюкуронид (КМD-3213G) достигает плазменной концентрации в 4 раза большей, чем сам силодозин. Связывание силодозина глюкуронида с белками плазмы составляет 91 %. Силодозин не обладает потенциалом индукции или ингибирования изоферментов цитохрома Р450.
Выведение
После перорального применения 14C‑маркированного силодозина, выведение радиоактивных веществ через 7 дней было, около 33,5 % силодозина выводится через почки и 54,9 % через кишечник. Клиренс силодозина составляет около 0,28 л/ч/кг. Силодозин экскретируется в основном в виде метаболитов и в очень малом количестве в неизмененном виде с мочой. Конечный период полувыведения Т1/2 силодозина и глюкуронида составляет 11 часов и 18 часов соответственно.
Особые группы пациентов
Пациенты пожилого возраста
Фармакокинетика силодозина и его основных метаболитов значительно не менялось у пожилых пациентов, клиренс силодозина не меняется у пациентов старше 75 лет.
Применение в педиатрии.
Лекарственное средство не рекомендуется детям и подросткам до 18 лет ввиду отсутствия данных по безопасности и эффективности.
Печеночная недостаточность
В исследовании однократной дозы фармакокинетики силодозина не менялось у 9 пациентов с печеночной недостаточностью средней степени (7-9 по шкале Чайлда-Пью) в сравнении с 9 здоровыми добровольцами. По результатам этого исследования следует применять с осторожностью, поскольку у пациентов были нормальные биохимические показатели, что указывает на нормальную метаболическую функцию, и их отнесли к категории пациентов с печеночной недостаточностью средней степени на основе асцита и печеночной энцефалопатии.
Почечная недостаточность
В исследовании однократной дозы действие силодозина (несвязанного) у пациентов с легкой степенью (n=8) и средней степенью почечной недостаточности (n=8) привело к повышению максимальной концентрации в 1.6 раза и средней концентрации препарата в моче в 1.7 раза в сравнении с пациентами с нормальной почечной функцией (n=8). У пациентов с тяжелой степенью почечной недостаточности (n=5) максимальная концентрация повышалась в 2.2 раза и средняя концентрация препарата в моче — в 3.7 раза. Действие основных метаболитов, глюкуронида силодозина и KMD3293, также усиливалось. Поскольку имеются только ограниченные данные в отношении применения препарата пациентами с почечной недостаточностью средней степени (n=35), рекомендуется начинать с уменьшенной дозы 4 мг.
Для пациентов с легкой почечной недостаточностью (клиренс креатинина > 50 — < 80 мл/мин) не требуется коррекция дозы. Для пациентов с почечной недостаточностью средней степени тяжести (клиренс креатинина > 30 < 50 мл/мин) рекомендуется низкая начальная доза — 4 мг. Для пациентов с тяжелой почечной недостаточностью (клиренс креатинина <30 мл/мин) назначение силодозина не рекомендуется.
Фармакодинамика
Силодозин является высокоселективным для α1A адренорецепторов, которые находятся, главным образом, в предстательной железе, шейке мочевого пузыря, капсуле предстательной железы и в предстательной части уретры. Блокирование этих α1A адренорецепторов вызывает расслабление гладких мышц этих тканей, что уменьшает сопротивление выходного отверстия мочевого пузыря, не влияя на сокращение гладких мышц-сжимателей. Это вызывает развитие раздражающего и обструктивного симптомов (симптомов со стороны нижних мочевыводящих путей), связанных с доброкачественной гиперплазией предстательной железы.
Силодозин обладает более низким сродством для α1B адренорецепторов, которые, главным образом, находятся в сердечно-сосудистой системе.
В исследованиях in vitro было показано, что сродство силодозина к α1A-адренорецепторам в 162 раза превосходит его способность взаимодействовать с α1В -адренорецепторами, которые расположены в гладких мышцах сосудов. Клиническая эффективность и безопасность
Свыше 800 пациентов с симптомами доброкачественной гиперплазии предстательной железы средней и тяжелой степени (по международной шкале оценки простатических симптомов, исходное значение≥13) принимали силодозин 8 мг один раз в сутки в двух плацебо контролируемых клинических исследованиях этапа III, проведенных в США, и в одном плацебо контролируемом и контролируемом по действующему препарату клиническом исследовании, проведенном в Европе. Во всех исследованиях пациентов, которые не реагировали на плацебо в течение 4 недель вводной фазы применения плацебо, методом случайной выборки отобрали для лечения препаратом – объектом исследования. Во всех исследованиях у пациентов, принимавших силодозин, быстрее уменьшались раздражающий и обструктивный симптомы, связанные с доброкачественной гиперплазией предстательной железы, в сравнении с плацебо по оценкам через 12 недель лечения.
В клиническом исследовании, контролируемом по действующему препарату, которое было проведено в Европе, применение 8 мг силодозина один раз в сутки не уступало применению тамсулозина 0.4 мг один раз в сутки: средняя откорректированная разница (95 % CI) в общем бале по шкале IPSS между лечением пациентов «без нарушения протокола», была 0.4 (от 0.4 до 1.1). Частота положительного ответа на лечение (т.е. улучшение общего балла по шкале IPSS минимум на 25 %) была значительно выше при применении силодозина (68 %) и тамсулозина (65 %), в сравнении с плацебо (53 %).
На долгосрочной открытой фазе дополнительного лечения этих контролируемых исследований, в которых пациенты принимали силодозин до 1 года, облегчение симптомов, вызванное силодозином на 12 неделе лечения, поддерживалось в течение 1 года.
На фазе IV клинического исследования, которое было проведено в Европе, со средним исходным общим баллом IPSS 18.9 пунктов, 77.1% пациентов отреагировали на силодозин (по оценкам изменения исходного значения общего балла IPSS не менее, чем на 25%). Приблизительно половина пациентов сообщала об облегчении большинства симптомов, на которые жаловались пациенты (т.е. частое мочеиспускание, ночные позывы, императивные позывы к мочеиспусканию, капельное выделение мочи и неполное опустошение мочевого пузыря), по оценкам опросников ICS-почты.
Значительное снижение артериального давления в положении лёжа на спине не наблюдалось во всех клинических исследованиях, которые были проведены в отношении силодозина.
Силодозин 8 мг и 24 мг в сутки не оказывал статистически значимого действия на интервалы ЭКГ или сердечную реполяризацию в отношении плацебо.
Блокада α1A -адренорецепторов снижает тонус гладкой мускулатуры в этих тканях, что ведет к улучшению оттока мочи из мочевого пузыря. Одновременно уменьшаются симптомы обструкции и раздражения, связанные с доброкачественной гиперплазией предстательной железы. Благодаря высокой селективности силодозин не вызывает клинически значимого снижения артериального давления (АД) у пациентов с исходно нормальным АД.
Показания к применению
— лечение признаков и симптомов доброкачественной гиперплазии предстательной железы у взрослых мужчин.
Способ применения и дозы
Капсулу следует принимать во время еды, предпочтительно в одно и то же время суток. Капсулу не следует крошить или жевать, капсулу необходимо проглатывать целиком, запивая стаканом воды.
Рекомендованная доза – по 1 капсуле Урорека 8 мг в сутки. Для отдельных категорий пациентов рекомендуется одна капсула Урорека 4 мг в сутки
Пациенты пожилого возраста
Для пациентов пожилого возраста корректировка дозы не требуется
Почечная недостаточность
Для пациентов с легкой степенью почечной недостаточности (клиренс креатинина ≥от 50 до ≤80 мл/мин) корректировка дозы не требуется.
Для пациентов со средней степенью почечной недостаточности (клиренс креатинина ≥от 30 до <50 мл/мин) рекомендуется начинать с дозы 4 мг в сутки, по истечении одной недели можно увеличить дозу до 8 мг в сутки, в зависимости от реакции пациента. Использование препарата для пациентов с тяжелой степенью почечной недостаточности (клиренс креатинина <30 мл/мин) корректировка дозы не требуется.
Печеночная недостаточность
Для пациентов с легкой и средней степенью печеночной недостаточности корректировка дозы не требуется.
Поскольку данные отсутствуют, использование препарата пациентами с тяжелой степенью печеночной недостаточности не рекомендуется.
Побочные действия
Безопасность силодозина оценивалась в четырех двойных слепых контролируемых клинических исследованиях II‑III фаз (с участием 931 пациента, которые принимали силодозин 8 мг один раз в сутки, и 733 пациентов, которые принимали плацебо) и в двух долгосрочных открытых исследованиях продленной фазы. В целом, 1,581 пациентов принимали силодозин в дозе 8 мг один раз в сутки. Из них 961 пациентов принимали препарат в течение 6 месяцев и 384 пациентов – в течение 1 года.
Самыми частыми побочными реакциями, о которых сообщалось в плацебо контролируемых клинических исследованиях при долгосрочном применении силидозина, были нарушения эякуляции, а именно, обратная эякуляция и анэякуляция (уменьшения объема эякуляции или ее отсутствие), с частотой 23%. Это может временно влиять на способность к зачатию. Такие нарушения исчезают через несколько дней после прекращения лечения.
Ниже перечислены нежелательные побочные реакции, отмеченные во всех клинических исследованиях и на протяжении международного постмаркетингового опыта применения, в отношении которых существует причинно-следственная связь, согласно классификации MedDRA в соответствии с поражением органов и систем органов и частотой развития: очень часто (≥1/10); часто (≥1/100 to <1/10); нечасто (≥1/1,000 to <1/100); редко (≥1/10,000 до <1/1,000); очень редко (<1/10,000), не известно (невозможно оценить по имеющимся данным). В каждой группы наблюдавшиеся побочные реакции представлены в порядке снижения степени серьезности.
Очень часто
— нарушения эякуляции, включая обратную эякуляцию и анаэкуляцию
Часто
— головокружение, ортостатическая гипотензия
— заложенность носа,
— диарея
Нечасто
— снижение либидо
— тахикардия1
— гипотензия1
— тошнота, сухость во рту
— ненормальные печеночные пробы1
— кожная сыпь1, зуд1, крапивница1, лекарственная сыпь1
— эректильная дисфункция
Редко
— обморок, потеря сознания1
— учащенная пульсация1
Очень редко
— аллергические реакции, включая отечность лица, проглатывание языка и отек глотки1
Не известно
— интраоперационный синдром дряблой радужки
1 – побочные реакции по добровольным отчетам в процессе международного пострегистрационного применения препарата (частота рассчитывалась по случаям, описанным в клинических исследованиях фазы I-IV и в неинтервенционных исследованиях).
Описание отдельных побочных реакций
Ортостатическая гипотензия
Частота возникновения ортостатической гипотензии в плацебо контролируемых клинических исследованиях была 1.2% при применении силодозина и 1.0% при применении плацебо. Ортостатическая гипотензия иногда приводила к обморокам.
Интраоперационный синдром дряблой радужки (IFIS)
Об IFIS сообщалось по результатам хирургических операций по поводу катаракты.
Отчеты о подозреваемых побочных реакциях
Сообщение о подозреваемых побочных реакциях после регистрации медицинского препарата очень важно. Оно позволяет продолжать контролировать соотношение польза/риск медицинского препарата
Противопоказания
— повышенная чувствительность к действующему веществу или к какому-либо вспомогательному веществу
-
ортостатическая гипотензия в анамнезе
-
печеночная недостаточность
— детский возраст до 18 лет
— почечная недостаточность (клиренс креатинина менее 10 мл/мин)
Лекарственные взаимодействия
Силодозин активно метаболизируется, особенно через CYP3A4, алкогольдегидразу и UGT2B7. Силодозин также является субстратом для P-гликопротеина. Вещества, которые подавляют (например, кетоконазол, итраконазол, ритонавир или циклоспорин) или вызывают появление (например, рифампицин, барбитураты, карбамазепин, фенитоин) таких ферментов и транспортеров, могут влиять на концентрацию силодозина и его активного метаболита в плазме.
Альфа-блокаторы
Соответствующая информация о безопасном применении силодозина вместе с другими антагонистами α‑адренорецепторов отсутствует. Следовательно, одновременное применение других антагонистов α‑адренорецепторов не рекомендуется.
Ингибиторы CYP3A4
В исследовании лекарственного взаимодействия, при одновременном применении силодозина и высокоактивного ингибитора CYP3A4 (кетоконазола 400 мг) наблюдалось повышение максимальных концентраций силодозина в плазме в 3.7 раза и повышение времени воздействия силодозина в 3.1 раза (средней концентрации в моче). Не рекомендуется одновременное применение высокоактивных ингибиторов CYP3A4 (например, кетоконазола, итраконазола, ритонавира или циклоспорина).
При одновременном применении силодозина и ингибитора CYP3A4 средней степени активности, например, дилтиазема, наблюдалось увеличение средней концентрации силодозина в моче приблизительно на 30%, однако максимальная концентрация и период полураспада не изменялись. Это изменение не имеет клинического значения, поэтому корректировка дозы не требуется.
Ингибиторы PDE‑5
Минимальные фармакодинамические взаимодействия наблюдались между силодозином и максимальными дозами силденафила или тадалафила. В плацебо контролируемом исследовании на 24 субъектах в возрасте 45-78 лет, которые получали силодозин, одновременное применение силденафила 100 мг или тадалафила 20 мг не вызывало клинически значимого уменьшения среднего систолического или диастолического кровяного давления по оценкам ортостатических исследований (стоя и лёжа). У субъектов старше 65 лет, среднее уменьшение в различных точках времени было между 5 и 15 мм рт. ст. (систолического) и между 0 и 10 мм рт. ст. (диастолического). Положительные ортостатические пробы были лишь немного более частыми во время одновременного применения лекарственных препаратов; однако, головокружение или другие симптомы не наблюдались. Состояние пациентов, принимающих ингибиторы PDE‑5 одновременно с силодозином, должно контролироваться на предмет возможных побочных реакций.
Гипотензивные препараты
В программе клинического исследования многие пациенты одновременно принимали гипотензивные препараты (большинство из них действовало на ренин-ангиотензиновую систему, бета-блокаторы, антагонисты кальция и диуретики) без повышения частоты ортостатической гипотензии. Тем не менее, рекомендуется проявлять осторожность при одновременном применении препарата с гипотензивными препаратами и контролировать состояние пациентов на предмет возможных побочных реакций.
Дигоксин
Равновесные уровни дигоксина, субстрата P‑гликопротеина, значительно не изменялись в результате одновременного применения силодозина 8 мг один раз в сутки. Корректировка дозы не требовалась.
Особые указания
Интраоперационный синдром дряблой радужки (IFIS)
IFIS (разновидность синдрома узкого зрачка) наблюдался во время хирургической операции по удалению катаракты у некоторых пациентов, принимающих α1‑блокаторы или ранее принимавших α1‑блокаторы. Это может осложнять подобные операции.
Не рекомендуется начинать лечение силодозином для пациентов, которым планируется провести хирургическую операцию по поводу катаракты. Рекомендуется прекращать лечение α1‑блокаторами за 1-2 недели до хирургической операции, однако, преимущества и продолжительность прекращения лечения до хирургической операции по поводу катаракты не установлены.
Во время оценки до проведения хирургической операции хирурги-офтальмологи и другие специалисты по офтальмологии должны учитывать, принимают ли пациенты, которым предстоит хирургическая операция по поводу катаракты, силодозин, чтобы обеспечить принятие соответствующих мер в отношении IFIS во время операции.
Ортостатическое действие
Частота ортостатического действия силодозина очень низкая. Однако у некоторых пациентов может произойти снижение кровяного давления, что в редких случаях приводит к обморокам. При первых признаках ортостатической гипотензии (например, постуральное головокружение), пациенту следует сесть или лечь, и оставаться в таком положении до тех пор, пока симптомы не исчезнут. Пациентам с ортостатической гипотензией лечение силодозином не рекомендовано.
Почечная недостаточность
Пациентам с тяжелой почечной недостаточностью (CLCR <30 мл/мин) лечение силодозином не рекомендуется.
Печеночная недостаточность
Поскольку данные в отношении применения препарата пациентами с тяжелой степенью печеночной недостаточности отсутствуют, использование силодозина такими пациентами не рекомендуется.
Рак предстательной железы
Поскольку у ДГПЖ и рака предстательной железы одинаковые симптомы, и они могут сосуществовать, пациенты, у которых подозревается ДГПЖ, должны пройти обследование до начала лечения силодозином, чтобы исключить рак предстательной железы. Пальцевое ректальное исследование и, если необходимо, определение простатического специфического антигена (PSA) должно быть выполнено перед началом лечения, и должно регулярно повторяться после этого.
Лечение силодозином приводит к уменьшению количества спермы во время оргазма, что может временно влиять на оплодотворяющую способность спермы. Такое действие прекращается после прекращения применения силодозина.
Беременность и грудное вскармливание
Силодозин предназначен только для мужчин.
Фертильность
В клинических исследованиях при применении силодозина наблюдалась эякуляция с пониженным количеством спермы или без спермы из-за фармакодинамических особенностей силодозина. Перед началом лечения пациента необходимо проинформировать о том, что это может произойти, и о том, что препарат влияет на оплодотворяющую способность спермы.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Урорек в незначительной или в средней степени может повлиять на способность управлять транспортными средствами и механизмами. Пациентов необходимо проинформировать о возможных симптомах, связанных с постуральной гипотензией (головокружение), и о том, что они должны быть осторожны в управлении транспортными средствами и механизмами.
Передозировка
Симптомы: тяжелая артериальная гипотензия.
Лечение: Применение силодозина в дозах до 48 мг/сутки оценивалось у здоровых мужчин. Постуральная гипотензия была побочной реакцией, ограничивающей дозу. Если прием препарата произошел недавно, эффективным будет промывание желудка. Если передозировка силодозина привела к гипотензии, необходимо провести сердечно-легочную реанимацию. Диализ, маловероятно, будет эффективным, поскольку силодозин высоко (96.6%) связывается с белками.
Форма выпуска и упаковка
По 10 капсул помещают в контурную ячейковую упаковку из непрозрачной пленки ПВХ/ПВДХ и фольги алюминиевой.
По 1, 3 или 5 контурных ячейковых упаковок вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в пачку из картона.
Условия хранения
Хранить в сухом, защищенном от света месте, при температуре не выше 30 0С, в оригинальной упаковке.
Хранить в недоступном для детей месте.
Срок хранения
3 года
Не применять по истечении срока годности.
Условия отпуска из аптек
По рецепту
Производитель
«Recordati Industria Chimica е Farmaceutica S.P.A.»
Via M. Civitali 1, 20148, Milan, Italy / Виа М. Чивитали 1, 20148, Милан, Италия
Владелец регистрационного удостоверения
«Recordati Ireland Ltd.»
Raheens East Ringaskiddy, Co. Cork, Ireland / Рахинз Ист, Рингаскидди, Ко. Корк, Ирландия
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции
Представительство ТОО «FIC MEDICAL» (ФИК МЕДИКАЛЬ) в Республике Казахстан, ул. Толе би 69, офис 33, 050000, Алматы, Казахстан
тел.: +7 (727) 272 93 08, факс: +7 (727) 272 90 25
e-mail: fic_kz@ficmedical.kz
| 310408641477976816_ru.doc | 92 кб |
| 591541781477977980_kz.doc | 113 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
Силодозин. Лечение симптомов доброкачественной гиперплазии предстательной железы
Статьи
Опубликовано в журнале:
«Drugs», 2011, № 71 (7), с. 897-907
Monique P. Curran
Adis, a Wolters Kluwer Business, Auckland, New Zealand
Резюме
Силодозин представляет собой антагонист a-адренорецепторов с высокой селективностью к подтипу a1A по сравнению с подтипом a1B.
В трёх исследованиях III фазы, проведённых в Европе и США у мужчин старше 50 лет, страдающих ДГПЖ, силодозин в дозе 8 мг 1 раз в сутки статистически значимо по сравнению с плацебо улучшал общий показатель по шкале IPSS, а также показатели IPSS, относящиеся к функциям накопления и опорожнения. В европейском исследовании силодозин был по меньшей мере столь же эффективен в отношении улучшения общего показателя IPSS, как и тамсулозин в дозе 0,4 мг 1 раз в сутки.
Согласно post hoc анализу, силодозин статистически достоверно превосходил плацебо (все три исследования III фазы) и тамсулозин (европейское исследование III фазы) в отношении одновременного уменьшения никтурии, частоты мочеиспускания и неполного опорожнения мочевого пузыря.
Долговременные открытые исследования продемонстрировали, что силодозин поддерживает ослабление симптомов ДГПЖ в течение 1 года.
Как правило, силодозин хорошо переносится, а нежелательные явления (НЯ) со стороны сердечно-сосудистой системы выражены минимально. Нарушения эякуляции (феномен, характерный для всего класса a1A-адреноблокаторов) — самый частый побочный эффект силодозина, однако лишь отдельные пациенты отказываются из-за этого НЯ от приема препарата.
Доброкачественная гиперплазия предстательной железы (ДГПЖ) — одно из самых распространенных заболеваний у мужчин; его частота нарастает с возрастом [1,2]. ДГПЖ—это гистологический диагноз; она характеризуется пролиферацией гладкомышечных и эпителиальных клеток в переходной зоне предстательной железы [3, 4]. Клинически ДГПЖ проявляется симптомами нижних мочевых путей (СНМП). СНМП разделяются на три категории: нарушения накопления мочи (симптомы раздражения), расстройства опорожнения (обструктивные симптомы) и симптомы, возникающие после мочеиспускания [5]. При тяжелой степени ДГПЖ наступает инфравезикальная обструкция, которая ведет к острой или хронической задержке мочи. СНМП, обусловленные ДГПЖ, могут значительно снижать качество жизни (КЖ), связанное со здоровьем [3].
Ведение пациентов с ДГПЖУ СПНМП зависит от тяжести симптомов и включает выжидательное наблюдение, медикаментозную терапию, минимально инвазивные вмешательства и, наконец, хирургическое лечение [2, 3, 6, 7]. Медикаментозное лечение состоит в назначение a1-адреноблокаторов (например, силодозина [Rapaflo®; Silodyx®; Silosin®; Thrupas®; Urief®; Urorec®], альфузозина, доксазозина, тамсулозина или теразозина) либо ингибиторов 5а-редуктазы (финастерида, дутастерида).
У человека описано три типа a1-адренорецепторов: a1A, a1B и a1D [8]. a1A-адренорецепторы (они локализуются в предстательной железе, в основании и шейке мочевого пузыря, а также в простатической части уретры) опосредуют сокращение гладкомышечных клеток в тканях этих органов [9, 10]. Первые из a1-адреноблокаторов были неселективными и часто вызывали нежелательные явления (например, ортостатическую гипотензию), обусловленные снижением АД. Лечение ДГПЖ высокоселективными a1A-адреноблокаторами редко сопровождается НЯ со стороны сердечно-сосудистой системы.
В настоящей статье анализируются фармакологические характеристики, терапевтическая эффективность, а также переносимость силодозина у мужчин с ДГПЖ. Использованы данные исследований, в которых силодозин применялся в дозе 8 мг 1 раз в сутки (эта доза одобрена в США [ 11 ] и Европе [12]).
Поиск медицинской литературы (опубликованной и неопубликованной) по терапии симптомов ДГПЖ силодозином, начиная с 1996 г., проводился по базам данных (включая MEDLINE, EMBASE и внутреннюю базу AdisBase), спискам литературы опубликованных статей, регистрам/базам данных клинических исследований и на веб-сайтах (в т. ч. на сайтах регионарных регуляторных органов и на сайте производителя препарата). Кроме того, у компании-производителя силодозина была затребована дополнительная информация (в т. ч. неопубликованные данные). Результаты поиска последний раз были обновлены 28 апреля 2011 г.
1. Фармакодинамический профиль
Механизм действия
- Силодозин представляет собой антагонист постсинаптических a1-адренорецепторов, которые находятся в капсуле предстательной железы, мочеиспускательном канале и треугольнике мочевого пузыря [13-19]. Блокада a1-адренорецепторов силодозином препятствует их связыванию с нейромедиатором норадреналином, в результате чего происходит расслабление гладкомышечной ткани мочевого пузыря и предстательной железы, что приводит к облегчению мочеиспускания.
- Исследования in vitro показали, что сродство силодозина к подтипу адренорецепторов a1A больше, чем к подтипам a1B (> 100 раз) и a1D— (> 50 раз) (рис. 1) [17, 18, 20, 21]. Предполагается, что повышенная избирательность силодозина в отношении a1A-адренорецепторов по сравнению с a1B-адренорецепторами снижает риск возникновения сердечно-сосудистых НЯ.
- Согласно результатам исследования in vitro, селективность силодозина в отношении a1A-адренорецепторов по сравнению с a1B-адренорецепторами примерно в 17 раз больше, чем у тамсулозина (см. рис. 1) [20].
- Как показал ряд исследований in vitro и in vivo, силодозин обладает большей селективностью в отношении тканей нижних мочевых путей по сравнению с тканями аорты, селезёнки и печени. [15, 20, 22, 23]. В исследовании in vitro [15] продемонстрировано, что сродство силодозина к ткани предстательной железы человека примерно в 200 раз выше, чем к ткани аорты. Согласно исследованию, в котором оценивалось сокращение гладкомышечных клеток в ответ на норадреналин, сродство силодозина к ткани предстательной железы человека в 100 раз выше, чем к ткани брыжеечной артерии человека [15].
Рис. 1. Селективность силодозина в отношении адренорецепторов подтипа а1Д по сравнению с подтипами a1В— и a1D-. Исследование связывания с рецепторами было выполнено на полученных от мышей клетках LM (tk-), на которых экспрессировались различные подтипы а1-адренорецепторов человека [20,21]
Влияние на уродинамику
- Силодозин быстро улучшает функцию опорожнения мочевого пузыря [24-26]. Анализ данных двух крупных исследований III фазы, в которых участвовали мужчины с ДГПЖ (более подробное описание дизайна см. в разд. 4), показал, что силодозин приводит к статистически значимо большему улучшению максимальной скорости потока мочи (Qmax) по срав нению с плацебо (2,8 vs 1,5 мл/с; р Согласно открытому несравнительному проспективному исследованию давления в мочевом пузыре и мочеиспускания у 57 мужчин с ДГПЖ, силодозин уменьшал инфравезикальную обструкцию [25]. Через 4 нед. лечения силодозином в дозе 8 мг/сут средний индекс инфравезикальной обструкции снизился статистически значимо — с 60,6 до 33,8 (рСилодозин улучшает функцию накопления мочевого пузыря [25]. В проспективном исследовании по изучению давления в мочевом пузыре и функции мочеиспускания показано, что средний объем мочевого пузыря в момент первого позыва к мочеиспусканию повысился со 113 (исходно) до 140 мл (через 4 нед. терапии силодозином). Подробности влияния силодозина на функцию накопления мочевого пузыря по данным исследований приводятся в разд. 4. Исследования in vivo наводят на мысль, что силодозин улучшает функцию накопления мочевого пузыря, подавляя активность афферентных С-волокон, идущих от мочевых путей; этот эффект опосредован антагонизмом препарата с а1D-адренорецепторами [27].
Влияние на сердечно-сосудистую систему
- Применение a1-адреноблокаторов связано с ортостатическим снижением АД, однако в клинических исследованиях силодозина частота возникновения ортостатической гипотензии была низкой (см. разд. 5).
- Анализ объединенных данных двух 12-не-дельных исследований III фазы, в которых участвовали мужчины с ДГПЖ (дизайн этих работ описан в разд. 4) [11], показал, что тест на ортостатическую гипотензию через 1 и 3 мин после вставания был положителен соответственно у 1,3 и 1,9 % из 466 пациентов, получавших силодозин, и у 0,4 и 0,4 % из 457 лиц, принимавших плацебо. Тесты на постуральную гипотензию проводились через 2-6 ч после приема препарата. Положительным результатом теста считалось снижение систолического артериального давления (САД) > 30 мм рт. ст., диастолического артериального давления (ДАД) > 20 мм рт. ст. или повышение ЧСС > 20 уд./мин. При использовании критериев снижения САД или ДАД > 20 мм рт. ст. либо изменения ЧСС > 20 уд./мин ортостатический тест был положительным у 1,5 и 3 % пациентов, принимавших силодозин, и у 0,8 и 0,4 % лиц, получавших плацебо, через 1 и 3 мин после вставания соответственно [11, 28]. Следует отметить, что ортостатическая гипотензия в анамнезе была одним из критериев исключения из этих исследований.
- Как показало исследование у 183 здоровых мужчин, силодозин не влияет на параметры ЭКГ, в частности на интервал QT [29]. 5-дневное лечение терапевтическими (8 мг/сут) или повышенными терапевтическими (24 мг/сут) дозами силодозина по сравнению с плацебо не привело к каким-либо статистически или клинически значимым изменениям ЧСС, сегмента PR. комплекса QRS или морфологии ЭКГ. Скорректированное среднее изменение между группами силодозина и плацебо по скорректированному интервалу QT от исходного к 5-му дню составило менее 5 мс во все моменты времени (-0,2 … +3,4 мс на фоне приема 8 мг/сут силодозина и -2,9 … +1,6 мс — при дозе 24 мг/сут), нижняя граница всех 90%-х доверительных интервалов была ниже 10 мс.
- У пациентов с ДГПЖ, получавших силодозин в рамках исследований III фазы или длительных исследований (см. разд. 5), клинически значимых изменений ЭКГ не отмечено [18, 24, 30].
Влияние на эякуляцию
- Нарушения эякуляции — ПЯ, характерное для всего класса a1-адреноблокаторов [31]. Антагонизм силодозина в отношении a1A-адренорецепторов, находящихся в семявыносящих протоках и семенных пузырьках, связан с нарушениями эякуляции, т. е. частичным или полным отсутствием выброса спермы; данные получены у здоровых добровольцев [32, 33]. После отмены силодозина средний объем эякулята восстанавливается [11, 12, 18,33].
- Частота нарушений эякуляции в исследованиях III фазы приведена в разд. 5.
2. Фармакокинетический профиль
- Силодозин быстро всасывается [11, 12]. Средние равновесные фармакокинетические параметры при приеме 8 мг/сут силодозина вместе с пищей у здоровых мужчин приведены в табл. 1. При наращивании дозы фармакокинетические параметры силодозина меняются линейно [11,12].
- Абсолютная биодоступность силодозина составляет приблизительно 32 % [11, 12].
- При приеме вместе с пищей пиковая концентрация в сыворотке Сmax снижается примерно на 30 %, время до достижения Сmax увеличивается примерно на 1 ч, однако площадь под фармакокинетической кривой (AUC) меняется незначительно [12]. Рекомендуется принимать силодозин вместе с пищей (см. разд. 6). Объем распределения силодозина равен 0,81 л/кг, препарат примерно на 97 % связывается с белками [12]. Силодозин не проникает в клетки крови [12].
- Силодозин метаболизируется УДФ-глюкуронозилтрансферазой-2В7 (UGT2B7), алкоголь- и альдегиддегидрогеназой, а также цитохромом Р450 ЗА4 (CYP3A4) [11, 12]. Основной циркулирующий метаболит силодозина — это конъюгат с глюкуроновой кислотой, который метаболически активен и имеет большую AUC, чем силодозин [11]. Силодозина глюкуронид связывается с белками на 91% [11].
- Силодозин экскретируется (преимущественно в виде метаболитов) с мочой (~ 34 %) и калом (~ 55 %) [12]. Период полу выведения (Т1/2) силодозина и его конъюгата с глюкуроновой кислотой составляет около 11 и 18 ч соответственно, что позволяет принимать препарат 1 раз в сутки (см. разд. 6) [12]. Суммарный клиренс силодозина равен 0,28 л/ч/кг [11].
- Фармакокинетический профиль силодозина и его метаболитов у пожилых пациентов (в т. ч. старше 75 лет) не меняется [12].
- Фармакологический профиль силодозина не меняется у пациентов с умеренным снижением функции печени (7-9 баллов по шкале Чайлда— Пью) по сравнению со здоровыми мужчинами [11, 12]. У больных с тяжелым нарушением функции печени фармакокинетика силодозина не изучалась.
- У мужчин с умеренным снижением функции почек по сравнению со здоровыми лицами AUC для общего силодозина (связанного и несвязанного) увеличивается примерно в 3 раза, а Т — в 2 раза [11, 12]. У пациентов со сниженной функцией почек по сравнению с лицами с нормальной функцией повышен уровень a1-кислого гликопротеида (который связывает силодозин); этот показатель положительно коррелирует с возрастанием общей концентрации силодозина в плазме [13]. Однако плазменная AUC для несвязанного силодозина (более чувствительный показатель повышенного риска НЯ) увеличивается в меньшей степени (примерно в 2 раза) [11, 12]. При умеренном снижении функции почек рекомендуется уменьшить дозу силодозина; при тяжелой почечной недостаточности применять силодозин не следует (см. разд. 6).
Таблица 1. Фармакокинетические показатели силодозина у 16 здоровых мужчин (средний возраст 55 лет), получавших 8 мг препарата 1 раз в сутки вместе с пищей в течение 7 дней [12]
| Показатель | Среднее значение |
| Cmax | 87 нг/мл |
| tmax | 2,5 ч |
| t1/2b | ~11 ч |
| AUC24 | 433 нг/ч/мл |
AUC24 — площадь под фармакокинетической кривой «концентрация–время» за 24 ч; Cmax — максимальная концентрация в плазме; t1/2b — период полувыведения; tmax — время до достижения Cmax.
3. Лекарственные взаимодействия
- Силодозин метаболизируется при посредстве ферментов CYP3A4, алкогольдегидрогеназы и UGT2B7, а также служит субстратом для гликопротеида Р, поэтому вещества, которые ингибируют или индуцируют эти ферменты, могут влиять на концентрацию в плазме силодозина и его метаболитов [11, 12].
- Прием силодозина вместе с ингибиторами CYP3A4 (например, кетоконазолом, итраконазолом или ритонавиром) или гликопротеида Р (например, циклоспорином) может увеличить Сгтх и AUC данного препарата. Поэтому силодозин не рекомендуется применять совместно с сильными ингибиторами С YP3A4 [11, 12]. Совместный прием силодозина и умеренного ингибитора CYP3A4 (например, дилтиазема) повышает AUC силодозина примерно на 30 %, но Cmax и Т1/2 при этом не меняются и коррекции дозы силодозина не требуется [12].
- Потенциальное взаимодействие между силодозином и другими антагонистами а-адренорецепторов не изучалось [11, 12]. Совместно применять эти препараты и силодозин не рекомендуется.
- Перекрестное исследование, в котором участвовали 22 мужчины в возрасте 45-78 лет с нормальным АД, продемонстрировало, что одновременное применение силодозина и ингибиторов фосфодиэстеразы-5 (например, силденафила и тадалафила в максимальной рекомендуемой дозе) не сопровождалось клинически значимыми изменениями САД, ДАД или ЧСС по данным ортостатических тестов [11,12, 34]. Всего было проведено 154 ортостатических теста в каждый 12-часовой период после совместного приема по одной дозе силодозина и силденафила, тадалафила или плацебо; число положительных на 1-й минуте ортостатических тестов составило 34, 35 и 34, на 3-йминуте—23,24 и 19 соответственно [34]. Максимальное среднее снижение ортостатического САД или ДАД либо повышение ортостатической ЧСС для силденафила по сравнению с плацебо к 1-й минуте составило — 1,3 мм рт. ст., -0,1 ммрт. ст. и +1,7 уд./мин соответственно. Максимальная разница между тадалафилом и плацебо равнялась -2,3 мм рт. ст. для САД, -2,2 мм рт. ст. для ДАД и +0,6 уд./мин для ЧСС.
4. Терапевтическая эффективность
Исследования III фазы
Характеристика больных и дизайн исследований
Эффективность силодозина у мужчин в возрасте 50 лет и старше с умеренными или тяжелыми симптомами ДГПЖ оценивалась в трех 12-недельных рандомизированных двойных слепых исследованиях III фазы, в которых использовались плацебо (американские [11, 12, 18, 24] и европейское исследования [11, 12, 18, 30]) или активный препарат сравнения (только европейское исследование [24, 30]).
Средний возраст участников равнялся 64-66 годам, большинство из них относилось к европеоидной расе (89 % в американских исследованиях и 100 % — в европейском) [11, 18, 24, 30]. Критерии включения и исключения перечислены в табл. 2.
Таблица 2. Критерии включения и исключения в исследованиях силодозина III фазы, касавшиеся мужчин с доброкачественной гиперплазией предстательной железы (см. также табл. 4, где приведена дальнейшая информация о дизайне этих исследований) [11, 12, 18, 24, 30]
| Первое американское [11, 18, 24], второе американское [11, 12, 18, 24] и европейское [12, 18, 30] исследования | ||
| Критерии включения | ОП IPSS ≥ 13 баллов Qmax 4-15 мл/с Минимальный объем выделенной мочи ≥ 125 мл |
|
| Критерии исключения | Объем остаточной мочи > 250 мл исключения (данные УЗИ) Ортостатическая гипотензия в анамнезе Некоторые заболевания (например, рак предстательной железы или мочевого пузыря) Прием препаратов (например, а-адреноблокаторов, ингибиторов 5а-редуктазы), могущих исказить результаты исследования |
|
| Американские | Европейское | |
| > 30 % снижение ОП IPSS или повышение Qmax на 3 мл/с во время вводного периода | > 25 % снижение ОП IPSS во время вводного периода | |
| IPSS — International Prostate Symptom Score; Qmax — максимальная скорость потока мочи; ОП — общий показатель. |
В двух исследованиях, проведенных в США, 923 мужчины были рандомизированы для получения 8 мг силодозина 1 раз в сутки вместе с пищей или плацебо [11, 12, 18, 24]. В европейском исследовании было рандомизировано 955 мужчин для приема 8 мг силодозина 1 раз в сутки вместе с пищей, тамсулозина в дозе 0,4 мг 1 раз в сутки или плацебо [12, 24, 30]. Во всех исследованиях 12-недельному периоду лечения предшествовал 4-недельный период приема плацебо.
Детали оценки эффективности в этих исследованиях приведены в табл. 3 [18, 24, 30]. Основным оцениваемым показателем во всех трех исследованиях III фазы было изменение общего показателя IPSS к 12-й неделе по сравнению с исходным.
Таблица 3. Оценка эффективности силодозина в исследованиях III фазы, в которых участвовали мужчины с доброкачественной гиперплазией предстательной железы [18,24,30]
| Описание | Показатель |
| IPSS | Общий показатель Сумма баллов по 7 вопросам (максимально 6 баллов каждый), оценивающих симптомы ДГПЖ Клинически значимым считалось снижение общего показателя IPSS > 4 баллов Шкала функции накопления мочевого пузыря Сумма баллов по 3 вопросам, оценивающих учащенное мочеиспускание, императивные позывы и никтурию Шкала нарушений мочеиспускания Сумма баллов по 4 вопросам, касающимся затрудненного начала мочеиспускания, неполного опорожнения мочевого пузыря, прерывистости мочеиспускания и вялой струи Качество жизни, связанное со здоровьем 8-й вопрос IPSS, ответ на который оценивается от 0 (отличное) до 6 баллов (ужасное) |
| Qmax | Максимальная скорость потока мочи в мл/с |
| Пациенты с ответом по IPSS | Доля пациентов (%) со снижением показателей IPSS ≥ 25 % по сравнению с исходными |
| Пациенты с ответом по Qmax | Доля пациентов (%) с повышением Qmax ≥ 30 % по сравнению с исходной |
| IPSS — International Prostate Symptom Score; Qm мальная скорость потока мочи. |
Результаты исследований
Сравнение с плацебо
- Силодозин более эффективно, чем плацебо, ослаблял симптомы ДГПЖ у мужчин старше 50 лет. Изменения общего показателя IPSS к 12-й неделе по сравнению с исходным во всех трех исследованиях III фазы для силодозина были статистически значимо большими, чем для плацебо (р Силодозин быстро ослабляет симптомы ДГПЖ [18, 24,30]. Через 3-4 дня силодозин по сравнению с плацебо вызывал статистически значимо более сильное снижение общего показателя IPSS (—4,2 vs -2,3; р В обоих американских исследованиях среднее изменение к 12-й неделе Qmax по сравнению с исходным значением было статистически значимо более выраженным у принимавших силодозин по сравнению с получавшими плацебо (р Согласно post hoc анализу всех трех исследований III фазы [14], доля пациентов, сообщивших об одновременном улучшении в от ношении неполного опорожнения мочевого пузыря, учащенного мочеиспускания и никтурии, среди получавших силодозин была выше, чем среди получавших плацебо; это касалось как изученной выборки в целом (30,5 vs 20,2 %; р У отдельных пациентов наличие нарушений эякуляции (см. разд. 5) может свидетельствовать о более высокой эффективность силодозина [31,35, 36]. Согласно post hoc анализу двух американских исследований III фазы, вероятность достичь улучшения общего показателя IPSS на 3 балла и более, а также Q — минимум на 3 мл/с к концу лечения была в 1,75 раза выше у 131 мужчины с нарушениями эякуляции во время терапии силодозином, чем у 335 пациентов, у которых такие нарушения не возникли (р = 0,0127) [35]. Для подтверждения этих выводов необходимы проспективные исследования, чтобы продемонстрировать статистически значимые различия результатов лечения силодозином у пациентов с нарушениями эякуляции и без них.
- В целом силодозин связан с улучшением качества жизни (КЖ). В европейском исследовании во все моменты времени улучшение КЖ вследствие симптомов, связанных с мочеиспусканием (8-й вопрос IPSS; см. табл. 3), было статистически более выражено у пациентов, получавших силодозин, по сравнению с пациентами, принимавшими плацебо (-1,1 vs -0,8 к 12-й неделе; р = 0,002) [30]. Кроме того, post hoc анализ показал, что силодозин по сравнению с плацебо статистически значимо улучшал КЖ в течение одного из 12-недельных американских исследований и на 1, 2 и 4-й неделях другого американского исследования (значение р не приводится) [18].
Таблица 4. Эффективность силодозина в дозе 8 мг 1 раз в сутки у мужчин с доброкачественной гиперплазией предстательной железы [11, 12, 18, 24, 30]. Исследования были рандомизированными двойными слепыми многоцентровыми и проводились в США или Европе. Доза тамсулозина составляла 0,4 мг/сут. Все препараты применялись в виде капсул. Анализы данных за 12-ю неделю касались популяции «intent-to-treat»; использовался перенос данных последнего наблюдения вперед
| Исследование | Препарат | Число пациентов | IPSS Общий показатель, баллы |
IPSS Функция накопления, баллы |
IPSS Нарушения мочеиспускания, баллы |
Qmax, мл/с | ||||
| исходно | среднее изменение vs исходно | исходно | среднее изменение vs исходно | исходно | среднее изменение vs исходно | исходно | среднее изменение vs исходно | |||
| Первое американское [11, 12, 18,24] | Силодозин | 233 | 22 | –6,5** | 9,3a | –2,3** | 12,0a | –4,2** | 9,0 | 2,2** |
| Плацебо | 228 | 21 | –3,6 | 9,3a | –1,4 | 12,0a | –2,2 | 9,0 | 1,2 | |
| Второе американское [11, 12, 18,24] | Силодозин | 233 | 21 | –6,3** | 9,3a | –2,4** | 12,0a | –3,9** | 8,4 | 2,9** |
| Плацебо | 229 | 21 | –3,4 | 9,3a | –1,3 | 12,0a | –2,1 | 8,7 | 1,9 | |
| Европейское [12, 18,30] | Силодозин | 371 | 19 | –7,0** | 7,9 | –2,5* | 11,3 | –4,5** | 10,78 | 3,8 |
| Тамсулозин | 376 | 19 | –6,7**,b | 7,9 | –2,4* | 11,0 | –4,2** | 10,27 | 3,5 | |
| Плацебо | 185 | 19 | –4,7 | 8,0 | –1,8 | 11,3 | –2,9 | 10,32 | 2,9 | |
| a Исходные значения в обоих исследованиях [24]. b Скорректированное среднее различие по общему показателю IPSS в популяции «per-protocol» было равно 0,4 (95% ДИ –0,4 … +1,1); это свидетельствует о том, что силодозин не уступал тамсулозину (пограничное значение не меньшей эффективности –1,5). IPSS — International Prostate Symptom Score; Qmax — максимальная скорость потока мочи. * p = 0,002 vs плацебо; ** p < 0,001 vs плацебо. |
Сравнение с тамсулозином
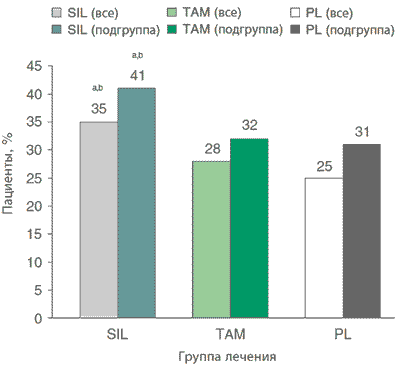
- Согласно данным европейского исследования, силодозин по меньшей мере не уступает по эффективности тамсулозину в отношении снижения общего показателя IPSS (см. табл. 4) [30]. Как силодозин, так и тамсулозин статистически значимо по сравнению с плацебо снижали показатели IPSS к 12-й неделе (р Доля пациентов с улучшением по шкале IPSS (определение приведено в табл. 3) была статистически значимо больше в группе силодозина (66,8 %) или тамсулозина (65,4 %), чем в группе плацебо (50,8 %; в обоих случаях p Согласно post hoc анализу европейского исследования, доля пациентов, которые сообщили об одновременном улучшении чувства неполного опорожнения мочевого пузыря, учащенного мочеиспускания и никтурии, была статистически значимо выше у принимавших силодозин по сравнению с получавшими тамсулозин или плацебо (в обоих случаях р
Рис. 2. Доля мужчин (%), сообщивших об одновременном ослаблении чувства неполного опорожнения мочевого пузыря, учащенного мочеиспускания и никтурии, согласно post hoc анализу европейского исследования III фазы (его дизайн подробно описан в разд. 4), в рамках которого пациенты получали силодозин (SIL), тамсулозин (ТАМ) или плацебо (PL) [14].. Приводятся данные для всех пациентов и для подгруппы пациентов, у которых имелось 2 и более мочеиспускания за ночь. a р bр
Длительное лечение
По завершении 12-й недели двойных слепых исследований III фазы пациенты могли продолжить лечение силодозином в дозе 8 мг/сут в рамках одного из двух длительных открытых исследований [18, 37]. После завершения американских исследований III фазы в первое из длительных исследований был набран 661 мужчина [37], а после завершения европейского исследования III фазы во второе длительное исследование было набрано 509 пациентов [18]. Хотя главной целью этих длительных исследований была оценка переносимости силодозина при длительном приеме, оценивалась также и его эффективность [18, 37].
- Длительное (до 52 нед.) лечение силодозином обеспечивало устойчивое ослабление симптомов ДГПЖ [18, 37]. У мужчин, ранее получавших силодозин в рамках 12-недельных двойных слепых исследований III фазы, улучшение общего показателя IPSS сохранялось и в ходе терапии силодозином в рамках 40-недельных длительных исследований. Среднее снижение показателей по шкале IPSS во время дли тельных исследований было небольшим: -1 балл в американском (р 2 баллов: -3,0 (р
5. Профиль переносимости
Информация о переносимости доступна из плацебоконтролируемых двойных слепых исследований (включивших 931 мужчину, получавшего 8 мг/сут силодозина, и 733 — плацебо) и двух открытых длительных исследований [11, 12, 14, 18, 24, 30, 37]. В общем анализе переносимости силодозина использованы данные 1581 пациента, принимавшего силодозин в дозе 8 мг/сут, 961 из которых получал препарат минимум 6 мес, а 384 — в течение 1 года [12, 18].
Общий профиль переносимости
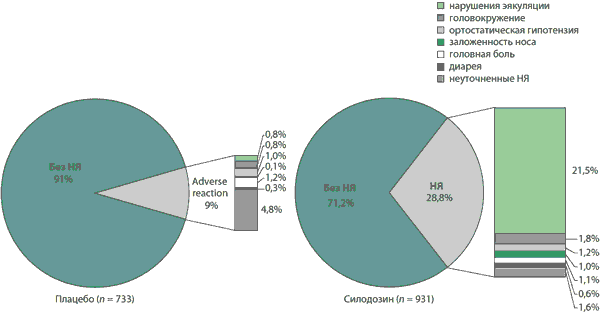
- В целом силодозин хорошо переносится [11, 12, 14, 18, 30, 37]. Анализ плацебо-контролируемых исследований показал, что НЯ наблюдались у 268/931 (28,8 %) пациентов, получавших силодозин, у 111/384 (28,9 %) — тамсулозин и у 66/733 (9 %) — плацебо [14, 18]. Согласно общему анализу переносимости, 32 % из 1581 мужчины, принимавшего силодозин, сообщили хотя бы об одном НЯ, возникшем во время лечения [14].
- Как показал анализ плацебо-контролируемых исследований, самыми частыми НЯ (> 1 %) при терапии силодозином были нарушения эякуляции, головокружение, ортостатическая гипотензия, заложенность носа, головная боль и диарея (рис. 3) [12, 14,18].
- Нарушения эякуляции — побочный эффект, характерный для всего класса антагонистов a1-адренорецепторов [31]. Нарушения эякуляции (также описываемые как ретроградная эякуляция согласно Medical Dictionary for Regulatory Activities [38]) были самым частым побочным эффектом (21,5 %) в плацебо-контролируемых исследованиях [12, 14, 18]. В европейском исследовании нарушения эякуляции значительно чаще отмечались при приеме силодозина (14 %), чем тамсулозина (2 %) или плацебо (1,1 %) (значение р не приводится) [18, 30]. Согласно общему анализу переносимости, о нарушении эякуляции сообщило 23,6 % из 1581 пациента, 3,9 % пациентов из-за этого НЯ прервали прием препарата. Нарушения эякуляции могут отрицательно сказаться на фертильности мужчины, однако они исчезают в течение нескольких дней после отмены препарата (см. разд. 1) [12].
- Интраоперационный синдром вялого зрачка (ИСВЗ, вариант синдрома малого зрачка) описан при операциях по поводу катаракты у некоторых больных, получавших антагонисты a1-адренорецепторов [12]. Силодозин не рекомендуется применять у пациентов, которым запланирована операция по поводу катаракты [12]. ИСВЗ зарегистрирован в длительном открытом американском исследовании (единственный случай) [11], а также при пострегистрационном наблюдении в Японии [18] — это произошло до того, как исследователи были предупреждены об этом НЯ. В европейском исследовании пациентов предупреждали о риске ИСВЗ, ни одного случая этого синдрома отмечено не было [30].
Профиль переносимости со стороны сердечнососудистой системы
- Профиль переносимости силодозина в этом отношении благоприятен [39]: так, частота ортостатической гипотензии в плацебо-контролируемых исследованиях составила 1,2 % для силодозина и 1 % для плацебо (см. рис. 3 и разд. 1) [11, 12, 18, 30]. Однако стоит отметить, что наличие ортостатической гипотензии в анамнезе было одним из критериев исключения из этих исследований (см. табл. 2). При наличии ортостатической гипотензии в анамнезе назначать силодозин не рекомендуется (см. разд. 6). В редких случаях снижение АД сопровождается обмороками [12].
- У пациентов, одновременно получавших антигипертензивные препараты (в большинстве случаев — средства, действующие на систему ренин-ангиотензин, антагонисты а-адренорецепторов, блокаторы кальциевых каналов и диуретики), силодозин не повышал частоту возникновения ортостатической гипотензии [14, 18]. В плацебо-контролируемых исследованиях ортостатическая гипотензия зарегистрирована у 1,7 % из 286 мужчин, получавших силодозин и антигипертензивные препараты, у 1,9 % из 212 — плацебо и антигипертензивные препараты, у 0,9 % из 645 получавших силодозин без антигипертензивных препаратов и у 0,6 % из 521 получавших плацебо без антигипертензивных препаратов [40]. Комбинированный анализ данных пациентов, которые получали силодозин во всех исследованиях, показал, что частота возникновения ортостатической гипотензии составила 1,4 % у 500 лиц, принимавших силодозин и антигипертензивные препараты, и у 1,2 % из 1081 человека, получавшего силодозин без таких препаратов [18, 40].
- Согласно данным плацебо-контролируемых и длительных исследований, терапия силодозином не была связана с клинически значимыми изменениями лабораторных показателей, основных физиологических показателей, а также параметров ЭКГ [18]. В европейском исследовании не отмечено клинически или статистически значимых изменений АД или ЧСС по сравнению с плацебо [30]. См. также разд. 1, где содержится обзор влияния силодозина на ЭКГ в исследовании у здоровых добровольцев.
Рис. 3. Доля участников (%) плацебо-контролируемых исследований, сообщивших о нежелательных явлениях. Данные получены из объединенного анализа рандомизированных двойных слепых плацебо-контролируемых исследований III фазы, в рамках которых мужчины с ДГПЖ получали силодозин в дозе 8 мг/сут (n = 931) или плацебо (n = 733) [14, 18]. Переносимость оценивалась у всех рандомизированных пациентов, которые получили по меньшей мере одну дозу силодозина или плацебо
6. Дозировка и прием
Доза силодозина, рекомендованная в США и Европе для облегчения симптомов ДГПЖ, составляет 8 мг внутрь 1 раз в сутки вместе с пищей, принимать препарат предпочтительно в одно и то же время [11, 12].
При умеренном снижении функции почек (клиренс креатинина 30-50 мл/мин) рекомендуется (США [11], Европа [12]) назначать 4 мг силодозина 1 раз в сутки. Согласно европейским рекомендациям [12], в зависимости от переносимости препарата у таких пациентов через 1 нед. приема дозу можно повысить до 8 мг 1 раз в сутки.
Силодозин не рекомендуется применять у пациентов с ортостатической гипотензией в анамнезе, а также в комбинации с другими антагонистами а-адренорецепторов [11, 12].
Симптомы рака предстательной железы и ДГПЖ частично совпадают, более того, эти заболевания могут развиваться одновременно, поэтому перед началом терапии силодозином пациента нужно обследовать, чтобы исключить наличие рака предстательной железы [11, 12].
Детальные сведения об использовании силодозина у особых групп больных, противопоказаниях, предосторожностях и лекарственных взаимодействиях содержатся в рекомендациях по применению, выпущенных производителем [11, 12].
7. Статус в настоящее время
Силодозин был зарегистрирован в 2006 г в Японии, в 2008 г. в США [11] и в 2009 г в Европе [18]. По данным 12-недельных клинических исследований III фазы, силодозин в дозе 8 мг 1 раз в сутки значительно превосходит плацебо и, по меньшей мере, не уступает тамсулозину в дозе 0,4 мг 1 раз в сутки по улучшению общего показателя IPSS, а также показателей IPSS, относящихся к функции накопления и опорожнения мочевого пузыря. Силодозин по сравнению с плацебо быстро облегчает симптомы ДГПЖ, причем улучшение общего показателя по шкале IPSS отмечалось уже в течение первой недели после начала приема силодозина. Устойчивый эффект силодозина продемонстрирован в двух длительных исследованиях, в которых более 900 пациентов получали силодозин минимум 6 мес, а у более 300 лиц продолжительность терапии составила 12 мес. Результаты post hoc анализов свидетельствуют, что силодозин статистически значимо превосходит плацебо (все три исследования) и тамсулозин (европейское исследование) по одновременному ослаблению никтурии, учащенного мочеиспускания и неполного опорожнения мочевого пузыря.
Силодозин в целом хорошо переносится, и риск возникновения осложнений со стороны сердечнососудистой системы минимален. Самым частым НЯ силодозина, зарегистрированным в клинических исследованиях, было нарушение эякуляции (НЯ, характерное для всего класса a1A-адреноблокаторов), однако лишь отдельные пациенты прерывали терапию из-за него.
Благодарности и конфликты интересов
Рукопись рецензировали: J.M. Flack, Wayne State University, Детройт (США); S. Gravas, Department of Urology, University Hospital of Larissa, Ларисса (Греция); M.C. Michel, Department of Pharmacology and Pharmacotherapy, Academic MedicalCenter, Амстердам (Нидерланды).
M.C. Michel — консультант в Recordati.
При подготовке настоящего обзора внешние источники финансирования не использовались. Во время внешнего рецензирования производителю препарата была предоставлена возможность комментировать эту статью. На основании полученных комментариев в статью внесены изменения, оправданные с научной и редакторской точек зрения.
Адрес для переписки: Monique P. Curran, Adis, a Wolters Kluwer Business, 41 Centorian Drive, Private Bag 65901, Mairangi Bay, North Shore 0754, Auckland, New Zealand.
ЛИТЕРАТУРА
1. Roehrborn CG. Male lower urinary tract symptoms (LUTS) and benign prostatic hyperplasia (BPH). Med Clin North Am 2011 Jan; 95(1): 87-100
2. Sausville J, Naslund M. Benign prostatic hyperplasia and prostate cancer: an overview for primary care physicians. Int J Clin Pract 2010 Dec; 64 (13): 1740-5
3. American Urology Association. American Urology Association guideline: management of benign prostatic hyperplasia (revised 2010) [online]. Available from URL: http://www. auanet.org [Accessed 2011 Mar 1]
4. National Institute of Diabetes and Digestive and Kidney Diseases. Prostate enlargement: benign prostatic hyperplasia. NIH, 2006; Publication no. 07-3012
5. Abrams P, Cardozo L, Fall M, et al. The standardisation of terminology of lower urinary tract function: report from the Standardisation Sub-committee of the International Continence Society. AmJ Obstet Gynecol 2002 Jul; 187 (1): 116-26
6. Chappie C. Overview of evidence for contemporary management of lower urinary tract symptoms presumed due to benign prostatic hyperplasia in males. Eur Urol 2010; Suppl. 9: 482-5
7. Nickel JC, Mendez-Probst CE, Whelan TF, et al. 2010 update: guidelines for the management of benign prostatic hyperplasia. Can Urol Assoc J 2010 Oct; 4 (5): 310-6
8. Guimaraes S, Moura D. Vascular adrenoceptors: an update. Pharmacol Rev 2001 Jun; 53 (2): 319-56
9. Michel MC. The pharmacological profile of the a1A-adrenoceptor antagonist silodosin. Eur Urol 2010; 4 Suppl. 9: 486-90
10. Roehrborn CG, Schwinn DA. a1-Adrenergic receptors and their inhibitors in lower urinary tract symptoms and benign prostatic hyperplasia. J Urol 2004 Mar; 171 (3): 1029-35
11. Watson Laboratories Inc. US prescribing information: Rapaflo® (silodosin) [online]. Available from URL: http://www.watson. com [Accessed 2011 Mar 2]
12. European Medicines Agency. Summary of product characteristics: Urorec® (silodosin) [online]. Available from URL: ema.europa.eu [Accessed 2011 Feb 20]
13. Yoshida M, Homma Y, Kawabe K. Silodosin, a novel selective a1A-adrenoceptor selective antagonist for the treatment of benign prostatic hyperplasia. Expert Opin Investig Drugs 2007 Dec; 16(12): 1955-65
14. Montorsi F. Profile of silodosin. Eur Urol 2010; 4 Suppl. 9: 491-5
15. Murata S, Taniguchi T, Takahashi M, et al. Tissue selectivity of KMD-3213, an a1-Adrenoreceptor antagonist, in human prostate and vasculature. J Urol 2000 Aug; 164 (2): 578-83
16. Yamada S, Kato Y, Okura T, et al. Prediction of a1-Adrenoceptor occupancy in the human prostate from plasma concentrations of silodosin, tamsulosin and terazosin to treat urinary obstruction in benign prostatic hyperplasia. Biol Pharm Bull 2007 Jul; 30 (7): 1237-41
17. Shibata K, Foglar R Horie K, et al. KMD-3213, a novel, potent a1A-adrenoceptor-selective antagonist: characterization using recombinant human a1-adrenoceptors and native tissues. Mol Pharmacol 1995 Aug; 48 (2): 250-8
18. European Medicines Agency. CHMP assessment report for Urorec®: procedure no EMEA/H/C/001092 [online]. Available from URL: ema.europa.eu [Accessed 2011 Mar 2]
19. Morishima S, Suzuki F, Nishimune A, et al. Visualization and tissue distribution of a1L-adrenoceptor in human prostate by the fluorescently labeled ligand Alexa-488-silodosin. J Urol 2009 Dec 22; 183:812-9
20. Tatemichi S, Kobayashi K, Maezawa A, et al. a1-Adrenoceptor subtype selectivity and organ specificity of silodosin (KMD-3213) [in Japanese]. Yakugaku Zasshi 2006 Mar; 126: 209-16
21. Lepor H. Pathophysiology of benign prostatic hyperplasia: insights from medical therapy for the disease. Rev Urol 2009 Fall; ll(Suppl. 1): S9-13
22. Akiyama K, Noto H, Nishizawa O, et al. Effect of KMD-3213, an а1Д-adrenoceptor antagonist, on the prostatic urethral pressure and blood pressure in male decerebrate dogs. Int J Urol 2001 Apr; 8 (4): 177-83
23. Yamada S, Okura T, Kimura R. In vivo demonstration of a1A-adrenoceptor subtype selectivity of KMD-3213 in rat tissues. J Pharmacol Exp Ther 2001 Jan; 296 (1): 160-7
24. Marks LS, Gittelman MC, Hill LA, et al. Rapid efficacy of the highly selective a1A-adrenoceptor antagonist silodosin in men with signs and symptoms of benign prostatic hyperplasia: pooled results of 2 phase 3 studies. J Urol 2009 Jun; 181 (6): 2634-40
25. Matsukawa Y, Gotoh M, Komatsu T, et al. Efficacy of silodosin for relieving benign prostatic obstruction: prospective pressure flow study. J Urol 2009 Dec; 182 (6): 2831-5
26. Kawabe K, Yoshida M, Homma Y Silodosin, a new a1A-adre- noceptor-selective antagonist for treating benign prostatic hyperplasia: results of a phase III randomized, placebo-controlled, double-blind study in Japanese men. BJU Int 2006 Nov; 98 (5): 1019-24
27. Yokoyama O, Ito H, Aoki Y, et al. Selective a1A-blocker improves bladder storage function in rats via suppression of C-fiber afferent activity. World J Urol 2010 Oct; 28 (5): 609-14
28. US Food and Drug Administration. New drug application: medical review (silodosin capsules) [online]. Available from URL: http://www.accessdata.fda.gov/drugsatfda_docs/ nda/2008/022206s000_MedR_Pl.pdf [Accessed 2011Mar 12]
29. Morganroth J, Lepor H, Hill LA, et al. Effects of the selective aiA-adrenoceptor antagonist silodosin on ECGs of healthy men in a randomized, double-blind, placebo- and moxifloxacin-controlled study. Clin Pharmacol Ther 2010 May; 87 (5): 609-13
30. Chappie CR, Montorsi F, Tammela TLJ. Silodosin therapy for lower urinary tract symptoms in men with suspect benign prostatic hyperplasia: results of an international, randomized, double-blind, placebo- and active-controlled clinical trial performed in Europe. Eur Urol 2011; 59: 342-52
31. Kaplan SA. Side effects of a-blocker use: retrograde ejaculation. Rev Urol 2009 Fall; 11 Suppl. 1: S14-8
32. Shimizu F, Taguri M, Harada Y, et al. Impact of dry ejaculation caused by highly selective alA-blocker: randomized, double-blind, placebo-controlled crossover pilot study in healthy volunteer men. J Sex Med 2010 Mar; 7 (3): 1277-83
33. Kobayashi K, Masumori N, Hisasue S, et al. Inhibition of seminal emission is the main cause of anejaculation induced by a new highly selective alA-blocker in normal volunteers. J Sex Med 2008 Sep; 5 (9): 2185-90
34. MacDiarmid SA, Hill LA, Volinn W, et al. Lack of pharmacodynamic interaction of silodosin, a highly selective aiA-adrenoceptor antagonist, with the phosphodiesterase-5 inhibitors sildenafil and tadalafil in healthy men. Urology 2010 Mar; 75 (3): 520-5
35. Roehrborn CG, Kaplan SA, Lepor H, et al. Symptomatic and urodynamic responses in patients with reduced or no seminal emission during silodosin treatment for LUTS and BPH. Prostate Cancer Prostatic Dis. Epub 2010 Dec 7
36. Homma Y, Kawabe K, Takeda M, et al. Ejaculation disorder is associated with increased efficacy of silodosin for benign prostatic hyperplasia. Urology 2010 Dec; 76 (6): 1446-50
37. Marks LS, Gittelman MC, Hill LA, et al. Silodosin in the treatment of the signs and symptoms of benign prostatic hyperplasia: a 9-month, open-label extension study. Urology 2009 Dec; 74 (6): 1318-22
38. MedDRAMSSO. Medical Dictionary for Regulatory Activities [online]. Available from URL: http://www.med dramsso.com/ index.asp [Accessed 2011 Mar 21]
39. Lepor H, Hill LA. Silodosin for the treatment of benign prostatic hyperplasia: pharmacology and cardiovascular tolerability Pharmacotherapy 2010 Dec; 30 (12): 1303-12
40. Silodosin 4 mg, 8 mg capsules; summary of clinical safety. Recordati; Milan, 2009 (Data on file)
- Длительное (до 52 нед.) лечение силодозином обеспечивало устойчивое ослабление симптомов ДГПЖ [18, 37]. У мужчин, ранее получавших силодозин в рамках 12-недельных двойных слепых исследований III фазы, улучшение общего показателя IPSS сохранялось и в ходе терапии силодозином в рамках 40-недельных длительных исследований. Среднее снижение показателей по шкале IPSS во время дли тельных исследований было небольшим: -1 балл в американском (р 2 баллов: -3,0 (р
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)