Содержание
-
Русское название
-
Английское название
-
Латинское название
-
Фармакологическая группа вещества Левилимаб
-
Нозологическая классификация
-
Фармакологическое действие
-
Характеристика
-
Фармакология
-
Применение вещества Левилимаб
-
Противопоказания
-
Ограничения к применению
-
Применение при беременности и кормлении грудью
-
Побочные действия вещества Левилимаб
-
Взаимодействие
-
Передозировка
-
Способ применения и дозы
-
Меры предосторожности
-
Особые указания
-
Источники информации
-
Торговые названия с действующим веществом Левилимаб
Русское название
Левилимаб
Английское название
Levilimab
Латинское название
Laevilimabum (род. Laevilimabi)
Фармакологическая группа вещества Левилимаб
Нозологическая классификация
Фармакологическое действие
—
иммунодепрессивное.
Характеристика
Рекомбинантное человеческое моноклональное антитело к рецепторам ИЛ-6.
Фармакология
Фармакодинамика
Левилимаб связывается и блокирует как растворимые, так и мембранные рецепторы ИЛ-6. Блокада обеих форм рецепторов позволяет предотвратить развитие ИЛ-6-ассоциированного провоспалительного каскада, в т.ч. препятствует активации антигенпрезентирующих клеток, В- и Т-лимфоцитов, моноцитов и макрофагов, эндотелиальных клеток и фибробластов и избыточной продукции других провоспалительных цитокинов. ИЛ-6 участвует в активации и поддержании местных воспалительных реакций (образование паннуса в синовиальной оболочке, стимуляция остеокластогенеза — эрозии хрящевой ткани, остеопороз), кроме того ИЛ-6 является единственным цитокином, непосредственно индуцирующим синтез острофазовых белков в гепатоцитах (С-реактивный белок, фибриноген, сывороточный амилоидный белок А (SAA), гепсидин, лептин).
Специфическая противовоспалительная активность левилимаба продемонстрирована в тестах in vitro и in vivo. Левилимаб оказывает антипролиферативное действие на культуру клеток DS-1, вызывая дозозависимое ингибирование роста клеток. На модели коллагениндуцированного артрита у яванских макак (Масаса fascicularis) многократное (1 раз в неделю в течение 7 нед) п/к введение левилимаба сопровождается снижением выраженности воспалительной реакции в суставах, что подтверждено при гистологическом исследовании (значимое снижение выраженности воспалительных и дегенеративных изменений хрящевой ткани). Кроме того, ИЛ-6 является ключевым цитокином в развитии массивного высвобождения цитокинов (цитокиновый шторм), а также в формировании острого респираторного дистресс-синдрома при тяжелых инфекционных заболеваниях, в т.ч. у пациентов с COVID-19.
Динамика фармакодинамических маркеров (нарастание концентрации растворимых рецепторов ИЛ-6, насыщение мембранных рецепторов ИЛ-6, нарастание ИЛ-6 и снижение концентрации С-реактивного белка) свидетельствует о высокоэффективной блокаде рецепторов ИЛ-6 левилимабом, что, в свою очередь, проявляется быстрым и выраженным снижением сывороточной концентрации С-реактивного белка, отражающим эффективное подавление воспалительного процесса у пациентов с активным ревматоидным артритом.
Фармакокинетика
Всасывание/распределение
При однократном п/к введении левилимаба пациентам с ревматоидным артритом он обнаруживается в сыворотке крови через 2–24 ч, и его концентрация нарастает, достигая максимальных значений через 96 ч, с последующим снижением.
При повторных введениях отмечается кумуляция левилимаба с увеличением Cmax.
Выведение
Значения показателей, характеризующих период элиминации (константа скорости элиминации, клиренс и T1/2), зависели от дозы левилимаба. Общий клиренс левилимаба после однократного введения в дозе 2,2 мг/кг составлял 35,288 мл/ч.
Особые группы пациентов
Почечная и печеночная недостаточность. Фармакокинетические данные у пациентов с почечной и печеночной недостаточностью отсутствуют.
Возраст старше 65 лет. Фармакокинетические данные у лиц в возрасте старше 65 лет отсутствуют.
Применение вещества Левилимаб
Угрожающий жизни острый респираторный дистресс-синдром, сопровождающийся повышенным высвобождением цитокинов.
Противопоказания
Гиперчувствительность к левилимабу; клинически значимые вирусные и бактериальные инфекции в острой фазе, включая туберкулез; печеночная недостаточность тяжелой степени тяжести (класс С по классификации Чайлд-Пью); почечная недостаточность тяжелой и терминальной степени тяжести (СКФ <30 мл/мин); беременность, кормление грудью; детский и подростковый возраст до 18 лет.
Ограничения к применению
Хронические и рецидивирующие инфекции или анамнестические указания на них; сопутствующие заболевания, предрасполагающие к развитию инфекций; период ранней реконвалесценции после тяжелых и среднетяжелых инфекционных заболеваний; недавно проведенная вакцинация живыми вакцинами; пациенты с печеночной недостаточностью легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью); пациенты с почечной недостаточностью средней степени тяжести (СКФ <60 и >30 мл/мин); пожилой возраст (отсутствуют данные клинических исследований).
В связи со способностью левилимаба подавлять реакции острой фазы воспаления следует проявлять особую осторожность с целью раннего выявления инфекционных заболеваний на фоне терапии.
Применение при беременности и кормлении грудью
Исследования влияния на плод у беременных женщин не проводились. Известно, что моноклональные антитела могут проникать через плацентарный барьер. Левилимаб противопоказан к применению во время беременности. Женщины детородного возраста и их половые партнеры должны использовать эффективные средства контрацепции в период проведения терапии левилимабом.
Неизвестно, проникает ли левилимаб в грудное молоко. Учитывая то, что IgG, к которым относится левилимаб, могут выделяться с грудным молоком, левилимаб противопоказан к применению в период грудного вскармливания.
Фертильность
Данные о влиянии левилимаба на фертильность у людей отсутствуют.
Побочные действия вещества Левилимаб
В рамках проведенных клинических исследований у пациентов с ревматоидным артритом левилимаб показал благоприятный профиль безопасности. Наиболее частыми нежелательными реакциями в проведенных клинических исследованиях были нейтропения, повышение активности АЛТ и уровня Хс крови. Спектр зарегистрированных нежелательных реакций, связанных с применением левилимаба, был ожидаемым для класса ингибиторов рецепторов ИЛ-6. Летальных исходов, связанных с применением левилимаба, в ходе клинических исследований не было.
Нежелательные реакции, приведенные ниже, представлены в соответствии с системно-органными классами по MedDRA. Нежелательные реакции зарегистрированы у пациентов, получавших левилимаб в рамках клинических исследований, и имеют определенную, вероятную или возможную степень связи с его применением. Частота классифицирована как очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<10000).
Инфекции и инвазии: нечасто — вирусные инфекции верхних дыхательных путей, пневмония, обострение хронического тонзиллита, латентный туберкулез.
Со стороны крови и лимфатической системы: очень часто — нейтропения; часто — лейкопения, лимфопения; нечасто — тромбоцитопения.
Со стороны сосудов: нечасто — повышение АД.
Общие нарушения и реакции в месте введения : часто — реакции в месте введения (в клинических исследованиях регистрировались местные реакции в виде эритемы и кожного зуда).
Данные лабораторных и инструментальных исследований: часто — повышение активности АЛТ, ACT, уровня Хс и триглицеридов крови, уровня билирубина крови, положительный результат анализа высвобождения интерферона гамма с антигеном Mycobacterium tuberculosis, положительный результат внутрикожного диагностического теста на туберкулез.
Взаимодействие
Данные о взаимодействии левилимаба с другими ЛС до настоящего времени не получены. Смешивание левилимаба с другими ЛС строго запрещено.
Передозировка
Симптомы: клинические данные о передозировке отсутствуют. Максимальная переносимая доза для человека не установлена. В клинических исследованиях при п/к введении левилимаба в максимальной дозе 2,9 мг/кг (около 217 мг при массе тела 75 кг) явлений дозолимитирующей токсичности не зарегистрировано.
Лечение: специфический антидот отсутствует. Лечение симптоматическое.
Способ применения и дозы
П/к, в виде двух инъекций.
Меры предосторожности
Применение левилимаба возможно только в условиях стационарной медицинской помощи.
При развитии побочного действия необходимо сообщать об этом в установленном порядке для осуществления мероприятий по фармаконадзору.
До начала применения левилимаба необходимо предоставить письменную информацию пациенту об эффективности и рисках, связанных с применением (в т.ч. влияние на эмбрион и плод) и получить письменное согласие на его применение.
Серьезные инфекции
Наличие таких потенциально тяжелых инфекций, как ВИЧ, активный гепатит В и/или С, сифилис, туберкулез, относится к противопоказаниям для назначения левилимаба.
Левилимаб не следует применять у пациентов с активным течением инфекционных заболеваний, включая локальные инфекции. Учитывая иммуносупрессивное действие левилимаба, его применение потенциально может приводить к обострению хронических инфекций и повышению риска первичного инфицирования.
При реактивации гепатита В применение левилимаба должно быть прекращено и назначена соответствующая противовирусная терапия.
Туберкулез
Пациентам с активным туберкулезом применение левилимаба противопоказано.
Перед назначением левилимаба и в ходе его применения необходимо проводить стандартный скрининг на туберкулез. Пациентам с латентным туберкулезом рекомендуется пройти стандартный курс противотуберкулезной терапии перед началом терапии левилимабом.
Лабораторные показатели
Нейтропения. В клинических исследованиях левилимаба отмечалось снижение числа нейтрофилов. Снижение абсолютного числа нейтрофилов (АЧН) не сопровождалось более высокой частотой развития инфекций, в т.ч. серьезных. Следует соблюдать осторожность при применении левилимаба у пациентов с АЧН <2×109/л. При снижении АЧН <0,5×109/л терапию левилимабом следует отменить. Следует оценивать число нейтрофилов через 4–8 нед после начала терапии и в дальнейшем, в соответствии с клинической практикой.
Тромбоцитопения. В клинических исследованиях левилимаба отмечалось снижение числа тромбоцитов. Снижение числа тромбоцитов не сопровождалось развитием кровотечений. Следует соблюдать осторожность при назначении левилимаба при числе тромбоцитов ниже 100×103/мкл. Лечение не рекомендуется при числе тромбоцитов <50×103/мкл. Следует оценивать число тромбоцитов через 4–8 нед после начала терапии и в дальнейшем, в соответствии с клинической практикой.
Ферменты печени. В клинических исследованиях левилимаба отмечалось повышение активности печеночных трансаминаз без признаков печеночной недостаточности. Частота возникновения подобных изменений может возрастать при совместном применении с ЛС, обладающими потенциальным гепатотоксическим действием (например, метотрексат). Следует соблюдать осторожность при назначении левилимаба пациентам с уровнем АЛТ или ACT, превышающим ВГН более чем в 1,5 раза. Следует оценивать уровень активности печеночных трансаминаз (АЛТ и ACT) через 4–8 нед после начала терапии и в дальнейшем, в соответствии с клинической практикой.
Изменение показателей липидного обмена. В клинических исследованиях левилимаба отмечалось повышение концентрации липидов (Хс и/или триглицериды). Следует оценивать показатели липидного обмена через 4–8 нед после начала терапии и в дальнейшем, в соответствии с клинической практикой. При ведении пациентов с гиперлипидемией следует руководствоваться национальными рекомендациями по лечению гиперлипидемии.
Реакции гиперчувствительности. При использовании левилимаба потенциально возможно развитие реакции гиперчувствительности. В рамках проведенных клинических исследований анафилактических реакций и реакций гиперчувствительности не зарегистрировано. Однако при использовании других блокаторов рецепторов ИЛ-6 регистрировались крапивница и другие реакции гиперчувствительности, в т.ч. анафилаксия. При возникновении анафилактических или других серьезных аллергических реакций применение левилимаба следует немедленно прекратить и начать соответствующую симптоматическую терапию.
Наличие алкогольной или наркотической зависимости. Наличие алкогольной или наркотической зависимости, а также психических расстройств может стать причиной несоблюдения пациентом графика лечения левилимабом, что, в свою очередь, может привести к снижению эффективности терапии. Необходимо более тщательное наблюдение за поведением пациентов с указанными состояниями в связи с отсутствием результатов клинических исследований и возможностью повышенного риска развития гепатотоксичности и других неблагоприятных последствий.
Иммуногенность. В ходе клинических исследований левилимаба при лечении ревматоидного артрита не наблюдалось выработки нейтрализующих антител.
Пациенты старше 65 лет. Данные об эффективности и безопасности применения левилимаба у пациентов старше 65 лет ограничены. Не предполагается наличия существенных возрастных различий в распределении и выведении левилимаба.
Нарушение функции почек и печени. Эффективность и безопасность левилимаба у этих категорий пациентов не изучались.
Пациенты моложе 18 лет, дети. Исследование эффективности и безопасности левилимаба у детей и лиц моложе 18 лет не проводилось.
Вакцинация. Не следует проводить иммунизацию живыми вакцинами в ходе лечения левилимабом, т.к. клиническая оценка безопасности данного взаимодействия в рамках клинических исследований не проводилась. Вакцинация живыми вакцинами до начала применения левилимаба, а также интервал между вакцинацией и началом терапии должны соответствовать действующим клиническим рекомендациям.
Влияние на способность управлять транспортными средствами и механизмами. Отсутствуют данные о влиянии левилимаба на способность управлять транспортными средствами и работать с машинами и (или) механизмами. Учитывая то, что при терапии другими блокаторами рецептора ИЛ-6 отмечались эпизоды головокружения, пациентам, испытывающим головокружение при применении левилимаба, рекомендуется не управлять транспортными средствами и механизмами до тех пор, пока головокружение не прекратится.
Особые указания
Левилимаб зарегистрирован по процедуре регистрации ЛС, предназначенных для применения в условиях угрозы возникновения, возникновения и ликвидации чрезвычайных ситуаций. Инструкция подготовлена на основании ограниченного объема клинических данных по применению и будет дополняться по мере поступления новых данных. Применение левилимаба возможно только в условиях стационарной медицинской помощи.
Источники информации
Обобщенные материалы www.grls.rosminzdrav.ru, 2020.
Торговые названия с действующим веществом Левилимаб
Rec.INN
зарегистрированное ВОЗ
Входит в состав препаратов:
список
Фармакологическое действие
Рекомбинантное человеческое моноклональное антитело к рецептору интерлейкина-6 (ИЛ-6). Левилимаб связывается и блокирует как растворимые (рИЛР), так и мембранные рецепторы ИЛ-6 (мИЛ-6Р). Блокада обеих форм рецептора позволяет предотвратить развитие ИЛ-6-ассоциированного провоспалительного каскада, в т.ч. препятствует активации антиген-представляющих клеток, В- и Т-лимфоцитов, моноцитов и макрофагов, эндотелиальных клеток и фибробластов, и избыточной продукции других провоспалительных цитокинов. ИЛ-6 участвует в активации и поддержании местных воспалительных реакций (образование паннуса в синовии, стимуляция остеокластогенеза — эрозии хрящевой ткани, остеопороз), кроме того ИЛ-6 — единственный цитокин, непосредственно индуцирующий синтез острофазовых белков в гепатоцитах: СРБ, фибриногена, сывороточного амилоидного белка А — SАА, гепсидина, лептина.
Специфическая противовоспалительная активность левилимаба продемонстрирована в тестах in vitro и in vivo. Левилимаб оказывает антипролиферативное действие на культуру клеток DS-1, вызывая дозозависимое ингибирование роста клеток.
На модели коллаген-индуцированного артрита у яванских макак (Macaca fascicularis) многократное (1 раз в неделю в течение 7 недель) п/к введение левилимаба сопровождается снижением выраженности воспалительной реакции в суставах, что подтверждено при гистологическом исследовании (значимое снижение выраженности воспалительных и дегенеративных изменений хрящевой ткани). Кроме того, ИЛ-6 является ключевым цитокином в развитии массивного высвобождения цитокинов («цитокинового шторма») у пациентов, получающих иммуносупрессивную терапию, включая деплецирующие агенты (в частности моноклональные антитела к рецепторам Т- и В-лимфоцитов), а также в формировании острого респираторного дистресс-синдрома при тяжелых инфекционных заболеваниях, в т.ч. у пациентов с COVID-19.
Динамика фармакодинамических маркеров (нарастание концентрации рИЛ6Р, насыщение мИЛ6Р, нарастание ИЛ-6 и снижение концентрации СРБ) свидетельствует о высокоэффективной нейтрализации рецепторов ИЛ-6 препаратом левилимаб, что в свою очередь проявляется быстрым и выраженным снижением сывороточной концентрации СРБ, отражающим эффективное подавление воспалительного процесса у пациентов с активным ревматоидным артритом.
Фармакокинетика
При однократном п/к введении левилимаба пациентам с ревматоидным артритом активное вещество обнаруживается в сыворотке крови в течение 2-24 ч, и его концентрация нарастает, достигая Cmax через 96 ч, с последующим снижением. Cmax левилимаба в сыворотке крови после первого введения при еженедельном ведении и введении 1 раз в 2 недели значимо не различалась и составляла 17543 [10975; 28323] нг/мл и 21168.5 [11248; 28338] нг/мл.
После первого введения левилимаба пациентам значения AUC(0-168 ч) составляли 1866231 [1297632-3719014] (нг/мл)×ч для группы пациентов с еженедельным введением и 2152996.5 [1323711-3081436] (нг/мл)×ч для группы с введением 1 раз в 2 недели. При многократном введении левилимаба значения AUC(0-2016 ч) составили 189580779 [134794695; 230680771] (нг/мл)×ч при введении 1 раз в неделю и 50763951 [34465213,5; 65810194,5] (нг/мл)×ч при введении 1 раз в 2 недели.
При повторных введениях левилимаба пациентам с ревматоидным артритом, показатель максимальной концентрации (Cmax-mult) нарастал и достигал значений 201024 [151563-246408] нг/мл при еженедельном введении и 51570 [37201-71740] нг/мл при введении 1 раз в 2 недели. При этом Тmax) составляло 1848 [1512; 2016] ч и 1848 [1512; 1848] ч при еженедельном введении и введении 1 раз в 2 недели соответственно.
Vd в равновесном состоянии составлял 7871.029 [4226.795; 13363.547] мл при введении 1 раз в неделю и 7130.453 [5532.978; 11387.959] мл при введении 1 раз в 2 недели.
О накоплении левилимаба при многократном введении свидетельствовал коэффициент кумуляции (AR), который составлял 10.932 [6.446; 14.178] для еженедельного введения, 2.593 [1.902; 4.164] для введения 1 раз в 2 недели.
При повторных введениях отмечается накопление левилимаба, с ростом Cmax в 6.5-14.2 раза при еженедельном введении и в 1.9-4.2 раза при введении 1 раз в 2 недели. Таким образом, п/к введение левилимаба 1 раз в неделю обеспечивает более высокую сывороточную концентрацию и экспозицию у пациентов с активным ревматоидным артритом.
Значения показателей, характеризующих период элиминации, зависели от дозы левилимаба, что говорит о нелинейной фармакокинетике препарата, обусловленной мишень-опосредованными распределением и элиминацией. Общий клиренс левилимаба после однократного введения в дозе 2.2 мг/кг составлял 35.288 мл/ч.
Показания активного вещества
ЛЕВИЛИМАБ
Угрожающий жизни острый респираторный дистресс-синдром, сопровождающийся повышенным высвобождением цитокинов.
Режим дозирования
Применяется под наблюдением врача.
Вводят п/к. Рекомендуемая доза — 324 мг однократно в виде двух инъекций по 162 мг каждая.
Побочное действие
Инфекции и инвазии: нечасто — вирусные инфекции верхних дыхательных путей, пневмония, обострение хронического тонзиллита, латентный туберкулез.
Со стороны крови и лимфатической системы: очень часто — нейтропения; часто — лейкопения, лимфопения; нечасто — тромбоцитопения.
Со стороны сердечно-сосудистой системы: нечасто — повышение АД.
Общие реакции: часто — реакции в месте введения.
Лабораторные данные: часто — повышение активности АЛТ, АСТ, повышение концентрации холестерина и триглицеридов в крови, положительный результат анализа высвобождения интерферона гамма с антигеном Mycobacterium tuberculosis, положительный результат внутрикожного диагностического теста на туберкулез.
Противопоказания к применению
Повышенная чувствительность к левилимабу; клинически значимые бактериальные инфекции в острой фазе, включая туберкулез; детский и подростковый возраст до 18 лет; беременность, грудное вскармливание; печеночная недостаточность тяжелой степени тяжести (класс С по классификации Чайлд-Пью; почечная недостаточность тяжелой и терминальной степени тяжести (СКФ<30 мл/мин).
С осторожностью
Следует соблюдать осторожность при назначении левилимаба пациентам с хроническими и рецидивирующими инфекциями или с указаниями в анамнезе на них; сопутствующими заболеваниями, предрасполагающими к развитию инфекций; в периоде ранней реконвалесценции после тяжелых и среднетяжелых инфекционных заболеваний; после недавно проведенной вакцинации живыми вакцинами; при назначении пациентам с печеночной недостаточностью легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью), пациентам с почечной недостаточностью средней степени тяжести (СКФ 30 мл/мин). В связи со способностью левилимаба подавлять реакции острой фазы воспаления следует проявлять особую осторожность с целью раннего выявления инфекционных заболеваний на фоне терапии.
В связи с ограниченными данными клинических исследований о применении левилимаба у пациентов пожилого возраста следует соблюдать осторожность при назначении препарата пациентам этой возрастной группы.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период грудного вскармливания.
Применение при нарушениях функции печени
Противопоказание: печеночная недостаточность тяжелой степени (класс С по классификации Чайлд-Пью).
Применение при нарушениях функции почек
Противопоказание: почечная недостаточность тяжелой степени и в терминальной стадии (СКФ<30 мл/мин).
Применение у детей
Противопоказано применение у детей и подростков в возрасте до 18 лет.
Применение у пожилых пациентов
В связи с ограниченными данными клинических исследований о применении левилимаба у пациентов пожилого возраста следует соблюдать осторожность при назначении препарата пациентам этой возрастной группы.
Особые указания
Применение препарата, содержащего левилимаб, возможно только в условиях стационарной медицинской помощи.
До начала приема препарата, содержащего левилимаб, необходимо предоставить письменную информацию пациенту об эффективности левилимаба и рисках, связанных с его применением (в т.ч. о риске влияния на эмбрион и плод), и получить письменное согласие на применение препарата.
Учитывая иммуносупрессивное действие левилимаба, терапия потенциально может приводить к обострению хронических инфекций и повышению риска первичного инфицирования. При реактивации гепатита В терапию левилимабом следует прекратить и назначить соответствующую противовирусную терапию.
Перед применением левилимаба и в ходе терапии необходимо проводить стандартный скрининг на туберкулез. Пациентам с латентным туберкулезом рекомендуется пройти стандартный курс противотуберкулезной терапии перед началом терапии левилимабом.
С осторожностью применять левилимаб у пациентов с АЧН <2×109/л. При снижении АЧН <0.5×109/л терапию левилимабом следует отменить. Следует оценивать число нейтрофилов через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической ситуацией.
С осторожностью применять левилимаб при числе тромбоцитов ниже 100×103/мкл. Лечение не рекомендуется при числе тромбоцитов <50×103/мкл. Следует оценивать число тромбоцитов через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Следует оценивать показатели активности печеночных трансаминаз (АЛТ и АСТ) через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Следует оценивать показатели липидного обмена через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Наличие алкогольной или наркотической зависимости, а также психических расстройств может стать причиной несоблюдения пациентом графика лечения левилимабом, что в свою очередь может привести к снижению эффективности терапии. Необходимо более тщательное наблюдение за пациентами с указанными состояниями в связи с отсутствием результатов клинических исследований у данной категории пациентов и возможностью повышенного риска развития гепатотоксичности и других неблагоприятных последствий.
При возникновении анафилактических или других серьезных аллергических реакций применение левилимаба следует немедленно прекратить и начать соответствующую симптоматическую терапию.
Влияние на способность к управлению транспортными средствами и механизмами
Пациентам, испытывающим головокружение при применении левилимаба не следует управлять транспортными средствами и работать с механизмами до тех пор, пока головокружение не прекратится.
Лекарственное взаимодействие
Не следует проводить иммунизацию живыми вакцинами в ходе лечения левилимабом, т.к. клиническая оценка безопасности данного взаимодействия в рамках клинических исследований не проводилась. Вакцинация живыми вакцинами до начала терапии левилимабом, а также интервал между вакцинацией и началом терапии должны соответствовать действующим клиническим рекомендациям.
Илсира — инструкция по применению
Синонимы, аналоги
Статьи
Данный лекарственный препарат зарегистрирован по процедуре регистрации препаратов, предназначенных для применения в условиях угрозы возникновения, возникновения и ликвидации чрезвычайных ситуаций. Инструкция подготовлена на основании ограниченного объема клинических данных по применению препарата и будет дополняться по мере поступления новых данных. Применение препарата возможно только в условиях стационарной медицинской помощи.
Регистрационный номер:
ЛП-006244
Торговое наименование:
ИЛСИРА®
Международное непатентованное или группировочное наименование:
левилимаб
Лекарственная форма:
раствор для подкожного введения
Состав
| Ингредиент: | В 1,0 мл | В предварительно наполненном шприце 0,9 мл |
| Действующее вещество: | ||
| Левилимаб | 180,0 мг | 162,0 мг |
| Вспомогательные вещества: | ||
| Натрия ацетата тригидрат | 0,436 мг | 0,392 мг |
| Глицин | 7,5 мг | 6,8 мг |
| Маннитол | 23,0 мг | 20,7 мг |
| Уксусная кислота ледяная | до pH 5,0 | до pH 5,0 |
| Вода для инъекций | до 1,0 мл | до 0,9 мл |
Описание
Прозрачный, желто-коричневого цвета раствор. Возможно наличие лёгкой опалесценции.
Фармакотерапевтическая группа
Иммунодепрессанты, ингибиторы интерлейкина.
Код по ATX:
L04AC
Фармакологические свойства
Фармакодинамика
Левилимаб – рекомбинантное человеческое моноклональное антитело к рецептору интерлейкина-6 (ИЛ-6). Левилимаб связывается и блокирует как растворимые (рИЛР), так и мембранные рецепторы ИЛ-6 (мИЛ6Р). Блокада обеих форм рецептора позволяет предотвратить развитие ИЛ-6-ассоциированного провоспалительного каскада, в том числе препятствует активации антигенпрезентирующих клеток, В- и Т-лимфоцитов, моноцитов и макрофагов, эндотелиальных клеток и фибробластов, и избыточной продукции других провоспалительных цитокинов. ИЛ-6 участвует в активации и поддержании местных воспалительных реакций (образование паннуса в синовии, стимуляция остеокластогенеза – эрозии хрящевой ткани, остеопороз), кроме того ИЛ-6 – единственный цитокин, непосредственно индуцирующий синтез острофазовых белков в гепатоцитах: СРБ, фибриногена, сывороточного амилоидного белка А – SAA, гипсидина, лептина.
Специфическая противовоспалительная активность левилимаба продемонстрирована в тестах in vitro и in vivo. Левилимаб оказывает антипролиферативное действие на культуру клеток DS-1, вызывая дозозависимое ингибирование роста клеток. На модели коллаген-индуцированного артрита у яванских макак (Масаса fascicularis) многократное (один раз в неделю в течение 7-ми недель) подкожное введение левилимаба сопровождается снижением выраженности воспалительной реакции в суставах, что подтверждено при гистологическом исследовании (значимое снижение выраженности воспалительных и дегенеративных изменений хрящевой ткани). Кроме того ИЛ-6 является ключевым цитокином в развитии массивного высвобождения цитокинов («цитокинового шторма») у пациентов, получающих иммуносупрессивную терапию включая деплецирующие агенты (в частности моноклональные антитела к рецепторам Т- и В-лимфоцитов), а также в формировании острого респираторного дистресс-синдрома при тяжелых инфекционных заболеваниях, в том числе у пациентов с COVID-19.
Динамика фармакодинамических маркеров (нарастание концентрации рИЛ6Р, насыщение мИЛ6Р, нарастание ИЛ-6 и снижение концентрации СРБ) свидетельствует о высокоэффективной нейтрализации рецепторов ИЛ-6 препаратом левилимаб, что в свою очередь проявляется быстрым и выраженным снижением сывороточной концентрации СРБ, отражающим эффективное подавление воспалительного процесса у пациентов с активным ревматоидным артритом.
Фармакокинетика
Всасывание/распределение
При однократном подкожном введении левилимаба пациентам с ревматоидным артритом, препарат обнаруживается в сыворотке крови пациентов в течение 2-24 часов, и его концентрация нарастает, достигая максимальных значений через 96 часов, с последующим снижением. Максимальная концентрация левилимаба в сыворотке крови (Сmax) после первого введения при еженедельном ведении и введении 1 раз в 2 недели значимо не различалась и составляла 17543 [10975; 28323] нг/мл и 21168,5 [11248; 28338] нг/мл.
После первого введения левилимаба пациентам значения AUC(0-168) составляли 1866231 [1297632-3719014] (нг/мл)·ч, для группы пациентов с еженедельным введением препарата и 2152996,5 [1323711-3081436] (нг/мл)·ч, для группы с введением препарата 1 раз в 2 недели. При многократном введении левилимаба значения суммарной площади под кривой концентрация – время рассчитанной в период 0-2016 ч после введения (AUC (0-2016)) составили 189580779 [134794695; 230680771] (нг/мл)·ч при введении 1 раз в неделю и 50763951 [34465213,5; 65810194,5] (нг/мл)·ч при введении 1 раз в 2 недели.
При повторных введениях левилимаба пациентам с ревматоидным артритом, показатель максимальной концентрации (Cmax-mult) нарастал и достигал значений 201024 [151563-246408] нг/мл при еженедельном введении препарата и 51570 [37201-71740] нг/мл при введении 1 раз в 2 недели. При этом время достижения максимальной концентрации (Тmax) составляло 1848 [1512; 2016] часов и 1848 [1512; 1848] часов при еженедельном введении препарата и введении 1 раз в 2 недели соответственно.
Стационарный объем распределения составляя 7871,029 [4226,795; 13363,547] мл при введении препарата 1 раз в неделю и 7130,453 [5532,978; 11387,959] мл при введении 1 раз в 2 недели.
О накоплении препарата при многократном введении свидетельствовал коэффициент кумуляции (AR), который составлял 10,932 [6,446; 14,178] для еженедельного введения препарата, 2,593 [1,902; 4,164] для введения 1 раз в 2 недели.
При повторных введениях отмечается накопление препарата, с ростом максимальной концентрации в 6,5-14,2 раза при еженедельном введении и в 1,9-4,2 раза при выведении препарат 1 раз в 2 недели. Таким образом, подкожное введение левилимаба 1 раз в неделю обеспечивает более высокую сывороточную концентрацию и экспозицию у пациентов с активным ревматоидным артритом.
Выведение
Значения показателей, характеризующих период элиминации (Kel, С1 и период полувыведения препарата), зависели от дозы левилимаба, что говорит о нелинейной фармакокинетике препарата, обусловленной мишень-опосредованными распределением и элиминацией. Общий клиренс левилимаба после однократного введения в дозе 2,2 мг/кг составлял 35,288 мл/час.
Пациенты с почечной и печеночной недостаточностью: фармакокинетические данные у больных с почечной и печеночной недостаточностью отсутствуют.
Пациенты в возрасте старше 65 лет: фармакокинетические данные у лиц в возрасте старше 65 лет отсутствуют.
Показания к применению
Угрожающий жизни острый респираторный дистресс-синдром, сопровождающийся повышенным высвобождением цитокинов.
Противопоказания
- Гиперчувствительность к левилимабу, а также к любому из вспомогательных веществ препарата.
- Клинически значимые бактериальные инфекции в острой фазе, включая туберкулез.
- Детский и подростковый возраст до 18 лет.
- Беременность, грудное вскармливание.
- Печеночная недостаточность тяжелой степени тяжести (класс С по классификации Чайлд-Пью. Почечная недостаточность тяжелой и терминальной степени тяжести (СКФ <30 мл/мин).
С осторожностью
Следует соблюдать осторожность при назначении левилимаба пациентам с хроническими и рецидивирующими инфекциями или с анамнестическими указаниями на них; сопутствующими заболеваниями, предрасполагающими к развитию инфекций; в периоде ранней реконвалесценции после тяжелых и среднетяжелых инфекционных заболеваний; после недавно проведенной вакцинации живыми вакцинами; при назначении пациентам с печеночной недостаточностью легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью), пациентам с почечной недостаточностью средней степени тяжести (СКФ <60 мл/мин и ≥30 мл/мин). В связи со способностью левилимаба подавлять реакции острой фазы воспаления следует проявлять особую осторожность с целю раннего выявления инфекционных заболеваний на фоне терапии.
В связи с ограниченными данными клинических исследований о применении левилимаба у пациентов пожилого возраста следует соблюдать осторожность при назначении препарата пациентам этой возрастной группы.
Применение при беременности и в период грудного вскармливания
Применение при беременности
Исследований влияния на плод у беременных женщин не проводилось. Известно, что моноклональные антитела могут проникать через плацентарный барьер. Препарат ИЛСИРА® противопоказан к применению во время беременности. Женщины детородного возраста и их половые партнеры должны использовать эффективные средства контрацепции в период проведения терапии левилимабом.
Применение в период грудного вскармливания
Неизвестно, проникает ли левилимаб в грудное молоко. Учитывая то, что иммуноглобулины класса G, к которым относится левилимаб, могут выделяться с грудным молоком, препарат ИЛСИРА® противопоказан к применению в период грудного вскармливания.
Влияние на фертильность
Данные о влиянии препарата на фертильность у людей отсутствуют.
Способ применения и дозы
Применение препарата ИЛСИРА® должно осуществляться под наблюдением врачей. Рекомендуемая доза препарат ИЛСИРА® составляет 324 мг однократно в виде двух подкожных инъекций по 162 мг каждая.
Указания по применению
Подготовка к проведению подкожной инъекции
На данном этапе не следует снимать колпачок шприца
Техника выполнения подкожной инъекции препарата ИЛСИРА® в преднаполненном шприце
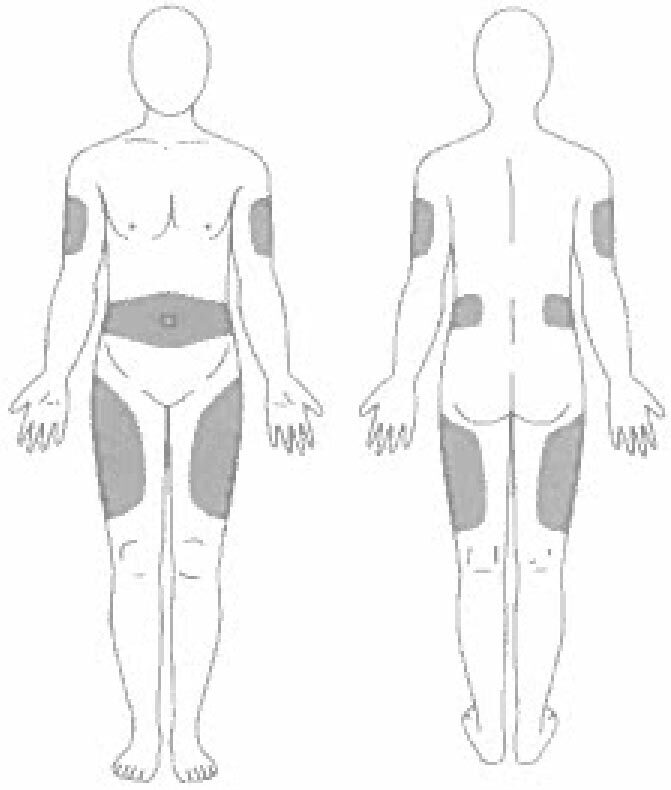
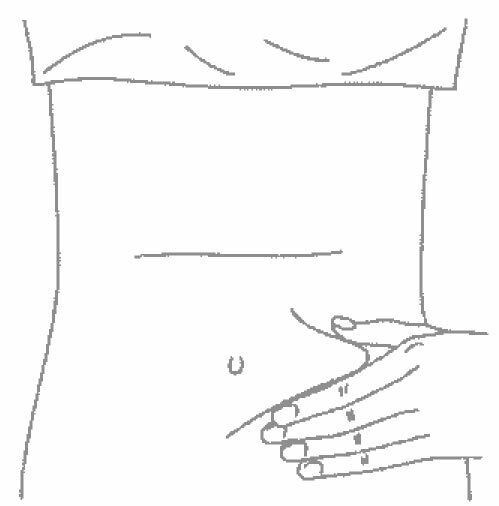
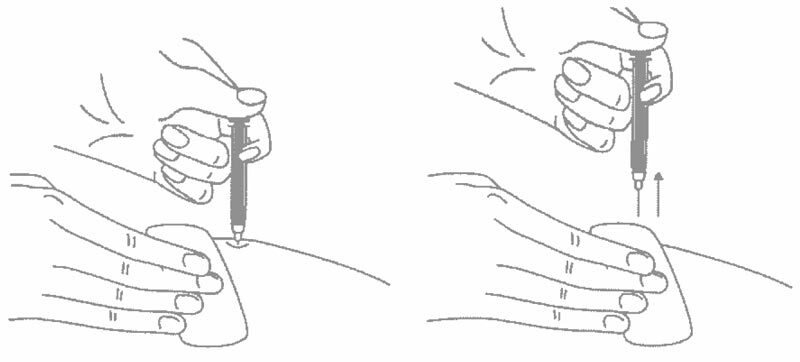
- Выберите место инъекции (передняя брюшная стенка (отступая не менее 5 см от пупка), передняя и боковая поверхность бедра или средняя треть наружной части плеча (возможные места для инъекций закрашены на рисунке ниже)).
- Места инъекций и стороны следует менять с каждой последующей процедурой инъекции.
- Нельзя вводить препарат в место на коже, где имеется болезненность, покраснение, уплотнение или кровоподтек. Эти признаки могут указывать на наличие инфекции.
- Место укола необходимо обработать спиртовой салфеткой круговыми движениями.
- Шприц не встряхивать.
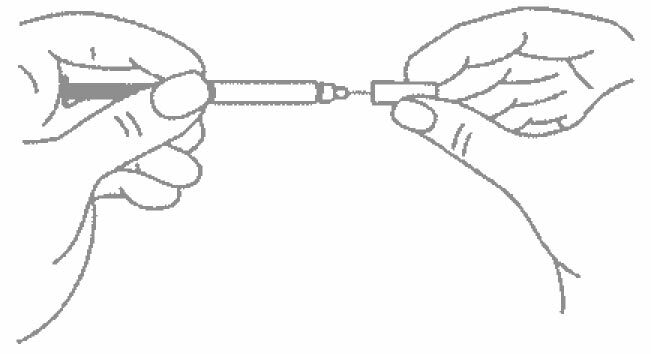
- Снимите колпачок с иглы, не дотрагиваясь до иглы и избегая прикосновения к другим поверхностям;
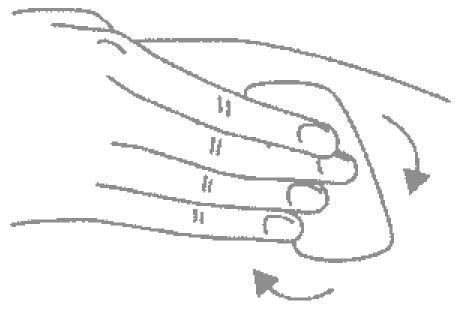
- Одной рукой возьмите в складку обработанную кожу.
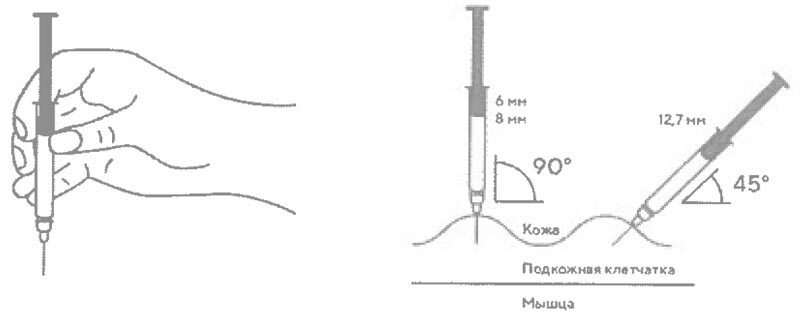
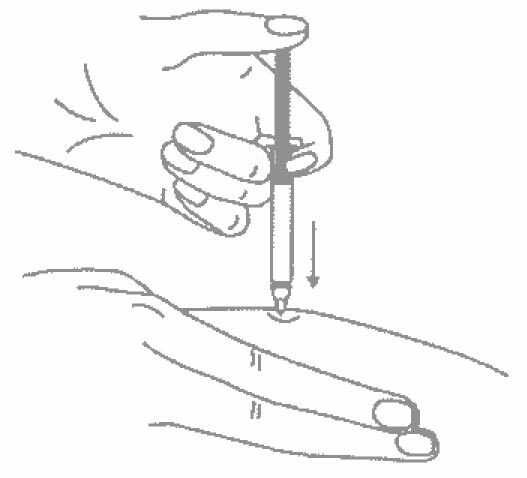
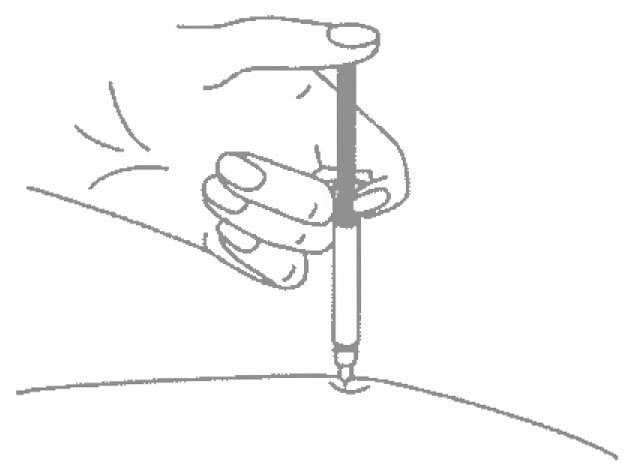
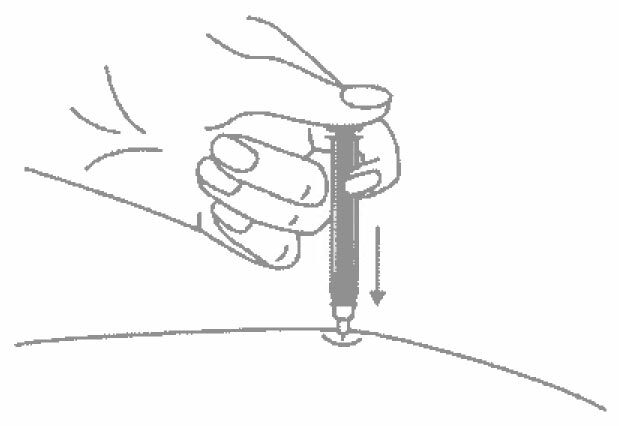
- В другую руку возьмите шприц, держа его градуированной поверхностью вверх. Введение препарата необходимо осуществлять под углом 45 или 90 градусов к поверхности кожи в зависимости от толщины кожи и выраженности подкожно-жирового слоя (у худощавых пациентов введение препарата осуществляется под углом 45 градусов, у пациентов с толщиной кожной складки более 1,5 см допустимо введение под углом 90 градусов).
- Одним быстрым движением полностью введите иглу в кожную складку.
- После введения иглы отпустите складку кожи.
- Введите весь раствор медленным постоянным надавливанием на поршень шприца в течение 2-5 секунд.
- Когда шприц будет пустым, выньте иглу из кожи под тем же углом.
- Кусочком марли слегка прижмите область инъекции в течение 10 секунд, но ни в коем случае не трите поверхность. Из места инъекции может выделиться небольшое количество крови. При желании можно воспользоваться пластырем.
- После инъекции шприц повторно не использовать.
Утилизация расходного материала
Неиспользованный раствор препарата, использованные шприцы, салфетки/ватные тампоны и другие расходные материалы подлежат утилизации с применением закрывающегося, устойчивого к проколам контейнера для острых предметов из пластика или стекла. Не допускайте хранения использованных шприцев в местах, доступных для детей.
Побочное действие
В рамках проведенных клинических исследований у пациентов с ревматоидным артритом препарат ИЛСИРА® показал благоприятный профиль безопасности. Наиболее частыми нежелательными реакциями в проведенных клинических исследованиях были нейтропения, повышение активности АЛТ и повышение уровня холестерина крови. Спектр зарегистрированных нежелательных явлений, связанных с применением препарата ИЛСИРА®, был ожидаемым для класса ингибиторов ИЛ6Р. Летальных исходов, связанных с терапией препаратом ИЛСИРА®, в ходе клинических исследований не было.
В данной инструкции нежелательные реакции представлены в соответствии с международным словарем нежелательных реакций MedDRA. Ниже приведен перечень нежелательных реакций, зарегистрированных у пациентов, получавших левилимаб в рамках клинических исследований, и имеющих определенную, вероятную или возможную степень связи с приемом препарата. Частота указана с учетом следующих критериев: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000), очень редко (≤10000).
| Системно-органный класс | Частота | Наименование реакции |
| Инфекции и инвазии | Нечасто | вирусные инфекции верхних дыхательных путей, пневмония, обострение хронического тонзиллита, латентный туберкулез. |
| Нарушения со стороны крови и лимфатической системы | Очень часто | нейтропения |
| Часто | лейкопения, лимфопения | |
| Нечасто | тромбоцитопения | |
| Нарушения со стороны сосудов | Нечасто | повышение артериального давления |
| Общие нарушения и реакции в месте введения | Часто | реакции в месте введения* |
| Лабораторные и инструментальные данные | Часто | повышение активности аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (ACT), повышение уровня холестерина и триглицеридов крови, повышение уровня билирубина крови, положительный результат анализа высвобождения интерферона гамма с антигеном Mycobacterium tuberculosis, положительный результат внутрикожного диагностического теста на туберкулез. |
| *В клинических исследованиях регистрировались местные реакции в виде эритемы и кожного зуда. |
Также в ходе клинической разработки регистрировались единичные нежелательные явления, для которых в настоящее время связь с применением левилимаба не установлена достоверно: воспаление очага кожного поражения, анемия, лимфаденит, лимфоцитоз, повышение уровня глюкозы крови, отклонение от нормы процедуры визуализации легких.
Передозировка
Клинические данные о передозировке отсутствуют. Максимальная переносимая доза для человека не установлена. В клинических исследованиях при подкожном введении левилимаба в максимальной дозе 2,9 мг/кг (около 217 мг при массе тела 75 килограммов) явлений дозолимитирующей токсичности не зарегистрировано.
Специфический антидот отсутствует. Лечение симптоматическое.
Взаимодействие с другими лекарственными препаратами
Сведений о наличии неблагоприятных лекарственных взаимодействий левилимаба с другими лекарственными препаратами до настоящего времени не получено.
Смешивание препарата с другими лекарственными средствами строго запрещено.
Особые указания
Применение препарата возможно только в условиях стационарной медицинской помощи.
При развитии побочного действия необходимо сообщать об этом в установленном порядке для осуществления мероприятии по фармаконадзору. До начала приема препарата ИЛСИРА® необходимо предоставить письменную информацию пациенту об эффективности препарата и рисках, связанных с его применением (в том числе о риске влияния на эмбрион и плод) и получить письменное согласие на применение препарата.
Серьезные инфекции
Наличие таких потенциально тяжелых инфекций как ВИЧ, активный гепатит В и (или) С, сифилис, туберкулез, относится к противопоказаниям для назначения левилимаба. Левилимаб не следует применять у пациентов с активным течением инфекционных заболеваний, включая локализованные инфекции. Учитывая иммуносупрессивное действие левилимаба, терапия этим препаратом потенциально может приводить к обострению хронических инфекций и повышению риска первичного инфицирования.
При реактивации гепатита В терапия левилимабом должна быть прекращена и назначена соответствующая противовирусная терапия.
Туберкулез
Пациентам с активным туберкулезом терапия препаратом ИЛСИРА® противопоказана. Перед назначением препарата ИЛСИРА® и в ходе терапии необходимо проводить стандартный скрининг на туберкулез. Пациентам с латентным туберкулезом рекомендуется пройти стандартный курс противотуберкулезной терапии перед началом терапии препаратом ИЛСИРА®.
Лабораторные показатели
Нейтропения
В клинических исследованиях препарата ИЛСИРА® отмечалось снижении числа нейтрофилов. Снижение абсолютного числа нейтрофилов (АЧН) не сопровождалось более высокой частотой развития инфекций, в том числе серьезных. Следует соблюдать осторожность при лечении препаратом ИЛСИРА® пациентов с АЧН <2×109/л. При снижении АЧН <0,5×109/л терапию препаратом ИЛСИРА® следует отменить. Следует оценивать число нейтрофилов через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Тромбоцитопения
В клинических исследованиях препарата ИЛСИРА® отмечалось снижении числа тромбоцитов. Снижение числа тромбоцитов не сопровождалось развитием кровотечений. Следует соблюдать осторожность при назначении терапии препаратом ИЛСИРА® при числе тромбоцитов ниже 100×103/мкл. Лечение не рекомендуется при числе тромбоцитов <50×103/мкл. Следует оценивать число тромбоцитов через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Ферменты печени
В клинических исследованиях препарата ИЛСИРА® отмечалось повышение активности «печеночных» трансаминаз без признаков печеночной недостаточности. Частота возникновения подобных изменений может возрастать при совместном использовании с препаратами, обладающими потенциальным гепатотоксическим действием (например, метотрексатом). Следует соблюдать осторожность при назначении терапии препаратом ИЛСИРА® у пациентов с показателями аланинаминотрансферазы (АЛТ) или аспартатаминотрансферазы (ACT), превышающими верхнюю границу нормы (ВГН) более чем в 1,5 раза. Следует оценивать показатели активности печеночных трансаминаз (АЛТ и ACT) через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Изменение показателей липидного обмена
В клинических исследованиях препарата ИЛСИРА® отмечалось повышение концентрации липидов (холестерин и(или) триглицериды). Следует оценивать показатели липидного обмена через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой. При ведении пациентов с гиперлипидемией следует руководствоваться национальными рекомендациями по лечению гиперлипидемии.
Реакции гиперчувствительности
При использовании левилимаба потенциально возможно развитие реакции гиперчувствительности. В рамках проведенных клинических исследований препарата ИЛСИРА® анафилактических реакций и реакций гиперчувствительности не зарегистрировано. Однако при использовании других ингибиторов ИЛ6Р регистрировались крапивница и другие реакции гиперчувствительности, в том числе анафилаксия. При возникновении анафилактических или других серьёзных аллергических реакций применение препарата ИЛСИРА® следует немедленно прекратить и начать соответствующую симптоматическую терапию.
Наличие алкогольной или наркотической зависимости
Наличие алкогольной или наркотической зависимости, а также психических расстройств может стать причиной несоблюдения пациентом графика лечения левилимабом, что, в свою очередь может привести к снижению эффективности терапии. Необходим более тщательное наблюдение за пациентами с указанными состояниями в связи с отсутствием результатов клинических исследований у данной категории пациентов и возможностью повышенного риска развития гепатотоксичности и других неблагоприятных последствий.
Иммуногенность
В ходе клинических исследований препарата ИЛСИРА® при лечении ревматоидного артрита выработки связывающих антител к левилимабу выявлено не было.
Пациенты в возрасте старше 65 лет
Данные об эффективности и безопасности препарата у пациентов в возрасте старше 65 лет ограничены. Не предполагается наличия существенных возрастных различий в распределении и выведении препарата.
Пациенты с нарушениями функции почек и печени
Эффективность и безопасность препарата у данной категории пациентов не изучались.
Пациенты моложе 18 лет, дети
Исследование эффективности и безопасности препарата у детей и лиц моложе 18 лет не проводилось.
Вакцинация
Не следует проводить иммунизацию живыми вакцинами в ходе лечения препаратом ИЛСИРА®, так как клиническая оценка безопасности данного взаимодействия в рамках клинических исследований не проводилась. Вакцинация живыми вакцинами до начала терапии препаратом ИЛСИРА®, а также интервал между вакцинацией и началом терапии должны соответствовать действующим клиническим рекомендациям.
Влияние на способность управлять транспортными средствами и механизмами
Отсутствуют данные о влиянии препарата ИЛСИРА® на способность управлять транспортными средствами и работать с машинами и (или) механизмами. Учитывая то, что при терапии другими ингибиторами рецептора ИЛ-6 отмечались эпизоды головокружения, пациентам, испытывающим головокружение при применении препарата ИЛСИРА®, рекомендуется не управлять транспортными средствами и механизмами до тех пор, пока головокружение не прекратится.
Форма выпуска
Раствор для подкожного введения 180 мг/мл.
По 0,9 мл в трехкомпонентные стерильные шприцы из бесцветного нейтрального стекла I гидролитического класса. Шприц, с одной стороны, имеет впаянную иглу для инъекций из нержавеющей стали, которая защищена пластмассовым колпачком с бутил каучуковым уплотнителем. Шприц укупорен эластичным уплотнителем на поршень и поршнем.
На каждый шприц наклеивают самоклеящуюся этикетку.
По 1 шприцу помещают в контурную ячейковую упаковку из пленки ПВХ.
По 2 и 4 контурных ячейковых упаковок вместе с инструкцией по применению помещают в пачку из картона.
Пачку дополнительно комплектуют спиртовыми салфетками в количестве 2 или 4 шт.
Условия хранения
При температуре от 2 до 8 °С в защищенном от света месте. Не замораживать!
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности.
Условия отпуска
Отпускают по рецепту.
Владелец регистрационного удостоверения
ЗАО «БИОКАД», Россия, 198515, г. Санкт-Петербург, Петродворцовый р-н, п. Стрельна, ул. Связи, д. 34, лит. А.
Производитель
ЗАО «БИОКАД», Россия, 198515, г. Санкт-Петербург, п. Стрельна, ул. Связи, д. 38, стр. 1.
Организация, принимающая претензии потребителей
ЗАО «БИОКАД», Россия, 198515, г. Санкт-Петербург, Петродворцовый р-н, п. Стрельна, ул. Связи, д. 34, лит. А.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Левилимаб
Levilimab
Фармакологическое действие
Левилимаб — рекомбинантное человеческое моноклональное антитело к рецептору интерлейкина-6 (ИЛ-6). Левилимаб связывается и блокирует как растворимые (рИЛР), так и мембранные рецепторы ИЛ-6 (мИЛ6Р). Блокада обеих форм рецептора позволяет предотвратить развитие ИЛ-6-ассоциированного провоспалительного каскада, в том числе препятствует активации антигенпрезентирующих клеток, B- и T-лимфоцитов, моноцитов и макрофагов, эндотелиальных клеток и фибробластов, и избыточной продукции других провоспалительных цитокинов. ИЛ-6 участвует в активации и поддержании местных воспалительных реакций (образование паннуса в синовии, стимуляция остеокластогенеза — эрозии хрящевой ткани, остеопороз), кроме того ИЛ-6 — единственный цитокин, непосредственно индуцирующий синтез острофазовых белков в гепатоцитах: СРБ, фибриногена, сывороточного амилоидного белка A — SAA, гипсидина, лептина.
Специфическая противовоспалительная активность левилимаба продемонстрирована в тестах in vitro и in vivo. Левилимаб оказывает антипролиферативное действие на культуру клеток DS-1, вызывая дозозависимое ингибирование роста клеток. На модели коллаген- индуцированного артрита у яванских макак (Macaca fascicularis) многократное (один раз в неделю в течение 7-ми недель) подкожное введение левилимаба сопровождается снижением выраженности воспалительной реакции в суставах, что подтверждено при гистологическом исследовании (значимое снижение выраженности воспалительных и дегенеративных изменений хрящевой ткани). Кроме того ИЛ-6 является ключевым цитокином в развитии массивного высвобождения цитокинов («цитокинового шторма») у пациентов, получающих иммуносупрессивную терапию включая деплецирующие агенты (в частности моноклональные антитела к рецепторам T- и B-лимфоцитов), а также в формировании острого респираторного дистресс-синдрома при тяжёлых инфекционных заболеваниях, в том числе у пациентов с COVID-19.
Динамика фармакодинамических маркеров (нарастание концентрации рИЛ6Р, насыщение мИЛ6Р, нарастание ИЛ-6 и снижение концентрации СРБ) свидетельствует о высокоэффективной нейтрализации рецепторов ИЛ-6 препаратом левилимаб, что в свою очередь проявляется быстрым и выраженным снижением сывороточной концентрации СРБ, отражающим эффективное подавление воспалительного процесса у пациентов с активным ревматоидным артритом.
Фармакокинетика
Всасывание/распределение
При однократном подкожном введении левилимаба пациентам с ревматоидным артритом, препарат обнаруживается в сыворотке крови пациентов в течение 2–24 часов, и его концентрация нарастает, достигая максимальных значений через 96 часов, с последующим снижением. Максимальная концентрация левилимаба в сыворотке крови (Cmax) после первого введения при еженедельном ведении и введении 1 раз в 2 недели значимо не различалась и составляла 17543 [10975; 28323] нг/мл и 21168,5 [11248; 28338] нг/мл.
После первого введения левилимаба пациентам значения AUC(0–168) составляли 1866231 [1297632–3719014] (нг/мл) × ч, для группы пациентов с еженедельным введением препарата и 2152996,5 [1323711–3081436] (нг/мл) × ч, для группы с введением препарата 1 раз в 2 недели. При многократном введении левилимаба значения суммарной площади под кривой концентрация — время рассчитанной в период 0–2016 ч после введения (AUC(0–2016)) составили 189580779 [134794695; 230680771] (нг/мл) × ч при введении 1 раз в неделю и 50763951 [34465213,5; 65810194,5] (нг/мл) × ч при введении 1 раз в 2 недели.
При повторных введениях левилимаба пациентам с ревматоидным артритом, показатель максимальной концентрации (Cmax–mult) нарастал и достигал значений 201024 [151563–246408] нг/мл при еженедельном введении препарата и 51570 [37201–71740] нг/мл при введении 1 раз в 2 недели. При этом время достижения максимальной концентрации (Tmax) составляло 1848 [1512; 2016] часов и 1848 [1512; 1848] часов при еженедельном введении препарата и введении 1 раз в 2 недели соответственно.
Стационарный объём распределения составляя 7871,029 [4226,795; 13363,547] мл при введении препарата 1 раз в неделю и 7130,453 [5532,978; 11387,959] мл при введении 1 раз в 2 недели.
О накоплении препарата при многократном введении свидетельствовал коэффициент кумуляции (AR), который составлял 10,932 [6,446; 14,178] для еженедельного введения препарата, 2,593 [1,902; 4,164] для введения 1 раз в 2 недели.
При повторных введениях отмечается накопление препарата, с ростом максимальной концентрации в 6,5–14,2 раза при еженедельном введении и в 1,9–4,2 раза при выведении препарат 1 раз в 2 недели. Таким образом, подкожное введение левилимаба 1 раз в неделю обеспечивает более высокую сывороточную концентрацию и экспозицию у пациентов с активным ревматоидным артритом.
Выведение
Значения показателей, характеризующих период элиминации (Kel, Cl и период полувыведения препарата), зависели от дозы левилимаба, что говорит о нелинейной фармакокинетике препарата, обусловленной мишень-опосредованными распределением и элиминацией. Общий клиренс левилимаба после однократного введения в дозе 2,2 мг/кг составлял 35,288 мл/час.
Пациенты с почечной и печёночной недостаточностью: фармакокинетические данные у больных с почечной и печёночной недостаточностью отсутствуют.
Пациенты в возрасте старше 65 лет: фармакокинетические данные у лиц в возрасте старше 65 лет отсутствуют.
Показания
Угрожающий жизни острый респираторный дистресс-синдром, сопровождающийся повышенным высвобождением цитокинов.
Левилимаб внесён в список препаратов упреждающей противовоспалительной терапии COVID-19 у взрослых пациентов.*
* См. подробнее Версия 16 (18.08.2021) — Временные методические рекомендации профилактики, диагностики и лечения новой коронавирусной инфекции (COVID-19) — Минздрав России.
Смотрите также код МКБ 10: U07.1 КОВИД-19 (COVID-19), вирус идентифицирован
Противопоказания
- Повышенная чувствительность к левилимабу;
- клинически значимые бактериальные инфекции в острой фазе, включая туберкулёз;
- детский и подростковый возраст до 18 лет;
- беременность;
- лактация;
- печёночная недостаточность тяжёлой степени тяжести (класс C по классификации Чайлд-Пью;
- почечная недостаточность тяжёлой и терминальной степени тяжести (СКФ <30 мл/мин).
С осторожностью
Следует соблюдать осторожность при назначении левилимаба пациентам с хроническими и рецидивирующими инфекциями или с анамнестическими указаниями на них; сопутствующими заболеваниями, предрасполагающими к развитию инфекций; в периоде ранней реконвалесценции после тяжёлых и среднетяжёлых инфекционных заболеваний; после недавно проведённой вакцинации живыми вакцинами; при назначении пациентам с печёночной недостаточностью лёгкой и средней степени тяжести (класс A и B по классификации Чайлд-Пью), пациентам с почечной недостаточностью средней степени тяжести (СКФ <60 мл/мин и >30 мл/мин). В связи со способностью левилимаба подавлять реакции острой фазы воспаления следует проявлять особую осторожность с целю раннего выявления инфекционных заболеваний на фоне терапии.
В связи с ограниченными данными клинических исследований о применении левилимаба у пациентов пожилого возраста следует соблюдать осторожность при назначении препарата пациентам этой возрастной группы.
Беременность и грудное вскармливание
Применение при беременности
Категория действия на плод по FDA — N.
Исследований влияния на плод у беременных женщин не проводилось. Известно, что моноклональные антитела могут проникать через плацентарный барьер. Левилимаб противопоказан к применению во время беременности. Женщины детородного возраста и их половые партнёры должны использовать эффективные средства контрацепции в период проведения терапии левилимабом.
Применение в период грудного вскармливания
Неизвестно, проникает ли левилимаб в грудное молоко. Учитывая то, что иммуноглобулины класса G, к которым относится левилимаб, могут выделяться с грудным молоком. Левилимаб противопоказан к применению в период грудного вскармливания.
Влияние на фертильность
Данные о влиянии препарата на фертильность у людей отсутствуют.
Способ применения и дозы
Применение препарата должно осуществляться под наблюдением врачей.
Применяется в виде подкожной инъекции (см. инструкцию соответствующей лекарственной формы).
Побочные действия
В рамках проведённых клинических исследований у пациентов с ревматоидным артритом препарат показал благоприятный профиль безопасности. Наиболее частыми нежелательными реакциями в проведённых клинических исследованиях были нейтропения, повышение активности АЛТ и повышение уровня холестерина крови. Спектр зарегистрированных нежелательных явлений, связанных с применением препарата, был ожидаемым для класса ингибиторов ИЛ6Р. Летальных исходов, связанных с терапией препаратом, в ходе клинических исследований не было.
В данной инструкции нежелательные реакции представлены в соответствии с международным словарём нежелательных реакций MedDRA. Ниже приведён перечень нежелательных реакций, зарегистрированных у пациентов, получавших левилимаб в рамках клинических исследований, и имеющих определённую, вероятную или возможную степень связи с приёмом препарата. Частота указана с учётом следующих критериев: очень часто (>1/10), часто (от >1/100 до <1/10), нечасто (от >1/1 000 до <1/100), редко (от >1/10 000 до <1/1 000), очень редко (<10 000).
| Системно-органный класс | Частота | Наименование реакции |
| Инфекции и инвазии | Нечасто | вирусные инфекции верхних дыхательных путей, пневмония, обострение хронического тонзиллита, латентный туберкулёз. |
| Нарушения со стороны крови и лимфатической системы | Очень часто | нейтропения |
| Часто | лейкопения, лимфопения | |
| Нечасто | тромбоцитопения | |
| Нарушения со стороны сосудов | Нечасто | повышение артериального давления |
| Общие нарушения и реакции в месте введения | Часто | реакции в месте введения* |
| Лабораторные и инструментальные данные | Часто | повышение активности аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (ACT), повышение уровня холестерина и триглицеридов крови, повышение уровня билирубина крови, положительный результат анализа высвобождения интерферона гамма с антигеном Mycobacterium tuberculosis, положительный результат внутрикожного диагностического теста на туберкулёз. |
| * В клинических исследованиях регистрировались местные реакции в виде эритемы и кожного зуда. |
Также в ходе клинической разработки регистрировались единичные нежелательные явления, для которых в настоящее время связь с применением левилимаба не установлена достоверно: воспаление очага кожного поражения, анемия, лимфаденит, лимфоцитоз, повышение уровня глюкозы крови, отклонение от нормы процедуры визуализации лёгких.
Передозировка
Клинические данные о передозировке отсутствуют. Максимальная переносимая доза для человека не установлена. В клинических исследованиях при подкожном введении левилимаба в максимальной дозе 2,9 мг/кг (около 217 мг при массе тела 75 килограммов) явлений дозолимитирующей токсичности не зарегистрировано.
Специфический антидот отсутствует. Лечение симптоматическое.
Взаимодействие
Сведений о наличии неблагоприятных лекарственных взаимодействий левилимаба с другими лекарственными препаратами до настоящего времени не получено.
Смешивание препарата с другими лекарственными средствами строго запрещено.
Меры предосторожности
Применение препарата возможно только в условиях стационарной медицинской помощи. При развитии побочного действия необходимо сообщать об этом в установленном порядке для осуществления мероприятий по фармаконадзору. До начала приёма препарата ИЛСИРА® необходимо предоставить письменную информацию пациенту об эффективности препарата и рисках, связанных с его применением в том числе о риске влияния на эмбрион и плод) и получить письменное согласие на применение препарата.
Серьёзные инфекции
Наличие таких потенциально тяжёлых инфекций как ВИЧ, активный гепатит B и(или) C, сифилис, туберкулёз, относится к противопоказаниям для назначения левилимаба. Левилимаб не следует применять у пациентов с активным течением инфекционных заболеваний, включая локализованные инфекции. Учитывая иммуносупрессивное действие левилимаба, терапия этим препаратом потенциально может приводить к обострению хронических инфекций и повышению риска первичного инфицирования.
При реактивации гепатита B терапия левилимабом должна быть прекращена и назначена соответствующая противовирусная терапия.
Туберкулёз
Пациентам с активным туберкулёзом терапия левилимабом противопоказана. Перед назначением левилимаба и в ходе терапии необходимо проводить стандартный скрининг на туберкулёз. Пациентам с латентным туберкулёзом рекомендуется пройти стандартный курс противотуберкулёзной терапии перед началом терапии левилимабом.
Лабораторные показатели
Нейтропения
В клинических исследованиях левилимаба отмечалось снижении числа нейтрофилов. Снижение абсолютного числа нейтрофилов (АЧН) не сопровождалось более высокой частотой развития инфекций, в том числе серьёзных. Следует соблюдать осторожность при лечении левилимабом пациентов с АЧН <2 × 109/л. При снижении АЧН <0,5 × 109/л терапию левилимабом следует отменить. Следует оценивать число нейтрофилов через 4–8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Тромбоцитопения
В клинических исследованиях левилимаба отмечалось снижении числа тромбоцитов. Снижение числа тромбоцитов не сопровождалось развитием кровотечений. Следует соблюдать осторожность при назначении терапии левилимабом при числе тромбоцитов ниже 100 × 103/мкл. Лечение не рекомендуется при числе тромбоцитов <50 × 103/мкл. Следует оценивать число тромбоцитов через 4–8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Ферменты печени
В клинических исследованиях левилимаба отмечалось повышение активности «печёночных» трансаминаз без признаков печёночной недостаточности. Частота возникновения подобных изменений может возрастать при совместном использовании с препаратами, обладающими потенциальным гепатотоксическим действием (например, метотрексатом). Следует соблюдать осторожность при назначении терапии левилимабом у пациентов с показателями аланинаминотрансферазы (АЛТ) или
аспартатаминотрансферазы (ACT), превышающими верхнюю границу нормы (ВГН) более чем в 1,5 раза. Следует оценивать показатели активности печёночных трансаминаз (АЛТ и ACT) через 4–8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Изменение показателей липидного обмена
В клинических исследованиях левилимаба отмечалось повышение концентрации липидов (холестерин и(или) триглицериды). Следует оценивать показатели липидного обмена через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой. При ведении пациентов с гиперлипидемией следует руководствоваться национальными рекомендациями по лечению гиперлипидемии.
Реакции гиперчувствительности
При использовании левилимаба потенциально возможно развитие реакции гиперчувствительности. В рамках проведенных клинических исследований левилимаба анафилактических реакций и реакций гиперчувствительности не зарегистрировано. Однако при использовании других ингибиторов ИЛ6Р регистрировались крапивница и другие реакции гиперчувствительности, в том числе анафилаксия. При возникновении анафилактических или других серьёзных аллергических реакций применение левилимаба следует немедленно прекратить и начать соответствующую симптоматическую терапию.
Наличие алкогольной или наркотической зависимости
Наличие алкогольной или наркотической зависимости, а также психических расстройств может стать причиной несоблюдения пациентом графика лечения левилимабом, что, в свою очередь может привести к снижению эффективности терапии. Необходим более тщательное наблюдение за пациентами с указанными состояниями в связи с отсутствием результатов клинических исследований у данной категории пациентов и возможностью повышенного риска развития гепатотоксичности и других неблагоприятных последствий.
Иммуногенность
В ходе клинических исследований левилимаба при лечении ревматоидного артрита выработки связывающих антител к левилимабу выявлено не было.
Пациенты в возрасте старше 65 лет
Данные об эффективности и безопасности препарата у пациентов возрасте старше 65 лет ограничены. Не предполагается наличия существенных возрастных различий в распределении и выведении препарата.
Пациенты с нарушениями функции почек и печени
Эффективность и безопасность препарата у данной категории пациентов не изучались.
Пациенты моложе 18 лет, дети
Исследование эффективности и безопасности препарата у детей и лиц моложе 18 лет не проводилось.
Вакцинация
Не следует проводить иммунизацию живыми вакцинами в ходе лечения левилимабом так как клиническая оценка безопасности данного взаимодействия в рамках клинических исследований не проводилась. Вакцинация живыми вакцинами до начала терапии левилимабом, а также интервал между вакцинацией и началом терапии должны соответствовать действующим клиническим рекомендациям.
Влияние на способность к вождению автотранспорта и управлению механизмами
Отсутствуют данные о влиянии левилимаба на способность управлять транспортными средствами и работать с машинами и (или) механизмами. Учитывая то, что при терапии другими ингибиторами рецептора ИЛ-6 отмечались эпизоды головокружения, пациентам, испытывающим головокружение при применении левилимаба, рекомендуется не управлять транспортными средствами и механизмами до тех пор, пока головокружение не прекратится.
Классификация
-
АТХ
L04AC25
-
Фармакологическая группа
-
Коды МКБ 10
-
Категория при беременности по FDA
N
(не классифицировано FDA)
Информация о действующем веществе Левилимаб предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Левилимаб, содержатся в инструкции производителя, прилагаемой к упаковке.
- Новиков П.И.
- Клиника им. Е.М. Тареева, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва
,
- Бровко М.Ю.
- Клиника им. Е.М. Тареева, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва
,
,
- Акулкина Л.А.
- Клиника им. Е.М. Тареева, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва
,
- Надточеева В.Б.
- Факультет фундамен- тальной медицины, МГУ им. М.В. Ломоносова
,
- Моисеев С.В.
- Клиника им. Е.М. Тареева, Первый МГМУ им. И.М. Сеченова (Сеченовский Университет), Москва
- DOI
- 10.32756/0869-5490-2021-3-67-75
- Количество просмотров
- 1684
Скачать статью в PDF
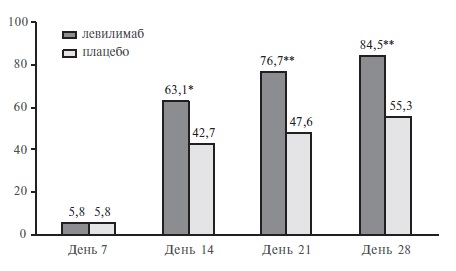
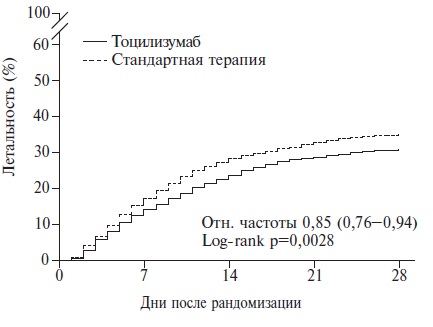
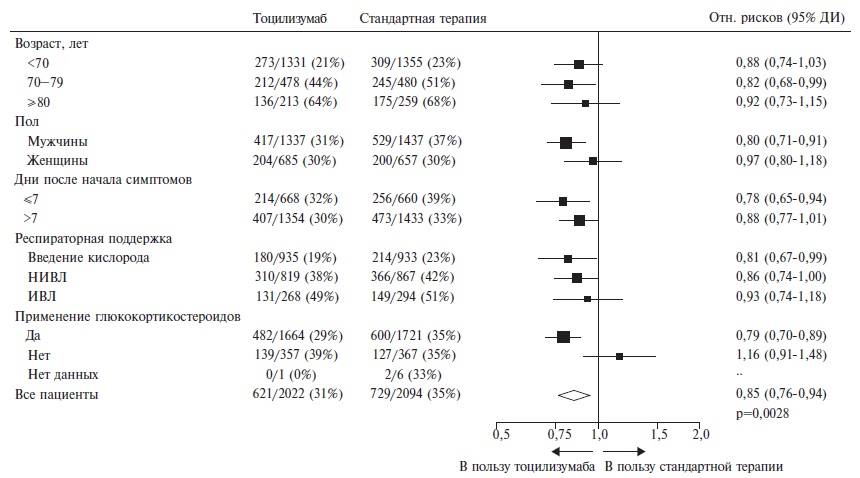
Левилимаб – это новый ингибитор интерлейкина (ИЛ)-6, разработанный фармацевтической компанией ЗАО “БИОКАД” и недавно зарегистрированный для патогенетической терапии синдрома высвобождения цитокинов при тяжелом течении COVID-19. Препарат представляет собой моноклональное антитело, блокирующее как растворимые, так и мембранные рецепторы ИЛ-6. Эффективность и безопасность левилимаба были установлены в рандомизированном, двойном слепом исследовании CORONA, в которое были включены 206 пациентов с COVID-19 ассоциированной пневмонией, у которых имелся по крайней мере один критерий тяжести заболевания, такой как увеличение частоты дыханий более 30 в минуту, снижение SpO2≤93% или PaO2/FiO2≤300 мм рт. ст., увеличение распространенности поражения легких более чем на 50% в течение 24-48 ч и др. Первичным критерием эффективности в этом исследовании была доля пациентов, состояние которых стабильно улучшилось по шкале ВОЗ (без дополнительных инъекций левилимаба открытым методом) на 14-й день после введения исследуемого препарата. По этому показателю левилимаб достоверно превосходил плацебо (63,1% и 42,7%,
соответственно; р=0,0017), а разница между группами сохранялась до конца 30-дневного наблюдения. Эффективность левилимаба подтверждалась и результатами анализа ряда вторичных показателей эффективности, таких как потребность в дополнительном введении ингибитора ИЛ-6 открытым методом и частота перевода в отделение реанимации и интенсивной терапии. Увеличения риска развития оппортунистических инфекций при введении левилимаба отмечено не было. В статье на основании случая успешного применения левилимаба у пациента с COVID-19 разбираются практические аспекты использования ингибиторов ИЛ-6 при этом заболевании.
С.В. Моисеев. Несмотря на ограничительные меры, которые принимаются по всему миру, и продолжающуюся вакцинацию число больных с COVID-19 продолжает увеличиваться, а во многих странах, включая Россию, периодически регистрируются подъемы заболеваемости, которые связывают с появлением мутировавших штаммов вируса и/или недостаточным охватом населения вакцинацией. Очевидно, что последняя не позволяет исключить возможность COVID-19, хотя значительно снижает риск развития инфекции и тяжесть ее течения [1]. В клинических исследованиях изучаются многочисленные лекарственные средства, которые обладают потенциальной активностью в отношении SARS-CoV-2, однако противовирусные препараты, характеризующиеся доказанной эффективностью в профилактике неблагоприятных исходов COVID-19, по-прежнему отсутствуют. В нашей стране для лечения SARS-CoV-2 инфекции широко используется фавипиравир, который в рандомизированном клиническом исследовании вызывал более быстрое улучшение состояния пациентов по сравнению со стандартной терапией [2], однако остается неясным, снижает ли этот препарат риск прогрессирования COVID-19 и, соответственно, частоту перевода на искусственную вентиляцию легких и смерти больных. При оценке перспектив лечения SARS-CoV2 инфекции необходимо учитывать, что эффекта от противовирусной терапии следует ждать только в случае раннего ее назначения (например, в первые 1-3 дня), когда у пациента продолжается репликация вируса и еще нет признаков чрезмерного воспалительного ответа, который определяет тяжесть течения заболевания. Следует отметить, что распространенная в нашей стране практика назначения антибиотиков пациентам с COVID-19 с первых дней инфекции не имеет какого-либо обоснования и смысла, так как антибактериальные средства не обладают противовирусной активностью, а риск вторичных бактериальных инфекций при COVID-19 не так велик, особенно при легком течении заболевания. При этом широкое применение антибиотиков сопровождается распространением резистентности среди бактериальных возбудителей, может привести к различным побочным эффектам, включая диарею и псевдомембранозный колит, и вынуждает чаще использовать резервные антибиотики на госпитальном этапе в случае присоединения бактериальной инфекции. Для подавления гипериммунного воспалительного ответа, вызванного SARS-CoV-2, в настоящее время применяют глюкокортикостероиды, прежде всего дексаметазон, и “антицитокиновые» препараты, в частности ингибиторы интерлейкина (ИЛ)-6, первые сообщения об эффективности которых при COVID-19 были опубликованы уже вскоре после начала пандемии в Китае и Италии, а затем и в других странах. Препараты этой группы представляют собой моноклональные антитела, которые взаимодействуют с рецепторами ИЛ-6 (тоцилизумаб и сарилумаб) или непосредственно с цитокином (олокизумаб). Российской компанией ЗАО “БИОКАД» разработан еще один ингибитор ИЛ-6 – левилимаб (Илсира), который блокирует как растворимые, так и мембранные рецепторы ИЛ-6. Эффективность и безопасность левилимаба изучаются у пациентов с ревматоидном артритом, а в Российской Федерации он был недавно одобрен для патогенетической терапии синдрома высвобождения цитокинов при тяжелом течении COVID-19. Что послужило основанием для регистрации левилимаба по этому показанию?
П.И. Новиков. Эффективность и безопасность левилимаба у госпитализированных пациентов с COVID-19 изучались в рандомизированном (1:1), двойном слепом, плацебо-контролируемом исследовании CORONA, которое проводилось в 12 российских центрах, включая перепрофилированные клиники Первого МГМУ им. И.М. Сеченова [3]. В исследование включали взрослых пациентов (18 лет и старше) с SARS-CoV-2 инфекцией, подтвержденной с помощью полимеразной цепной реакции, у которых имелись признаки пневмонии на компьютерной томограмме (КТ) органов грудной клетки и по крайней мере один показатель тяжести заболевания, в том числе увеличение частоты дыханий более 30 в минуту, снижение SpO2 ≤93% или PaO2/FiO2 ≤300 мм рт. ст., увеличение распространенности поражения легких более чем на 50% в течение 24-48 ч и др. Необходимость в искусственной вентиляции легких (ИВЛ) была критерием исключения из исследования, т.е. в него не включали пациентов, находившихся в критическом состоянии. Протокол исследования не допускал применение других моноклональных антител для лечения COVID-19. Пациентам основной группы в дополнение к стандартной терапии вводили подкожно левилимаб в дозе 324 мг (две инъекции по 162 мг одновременно), в то время как больные контрольной группы получали плацебо и стандартное лечение. В случае ухудшения состояния больных в обеих группах разрешалось дополнительное введение левилимаба в дозе 324 мг открытым методом. Исследование не обладало статистической мощностью, достаточной для сравнительного анализа летальности пациентов, поэтому первичным критерием эффективности было стойкое улучшение по шкале ВОЗ на 14-й день после введения исследуемого препарата. Эта шкала предполагает распределение больных с COVID-19 на 7 категорий: 1 – не госпитализировался/выписан, 2 – госпитализирован, но не требуются введение кислорода или другая медицинская помощь, 3 – госпитализирован, введение кислорода не требуется, но проводится другая терапия, 4 – госпитализирован, требуется введение кислорода, 5 – госпитализирован, требуются высокопоточная кислородотерапия или неинвазивная вентиляция легких (НИВЛ), 6 – госпитализирован, требуются ИВЛ или экстракорпоральная мембранная оксигенация (ЭКМО), 7 – смерть. Критерием стойкого улучшения было снижение категории по шкале по крайней мере на 2 (например, перевод пациента с ИВЛ на введение увлажненного кислорода через канюли или отсутствие необходимости в респираторной поддержке у больного, находившегося на НИВЛ) или достижение категорий 1 или 2 (выписка из стационара или отсутствие необходимости в кислородотерапии и другой медицинской помощи). Кроме того, изучались различные вторичные критерии эффективности, в том числе частота других исходов по указанной шкале, частота перевода в отделение реанимации и интенсивной терапии (ОРИТ), длительность лихорадки и госпитализации, изменения лабораторных признаков воспаления.
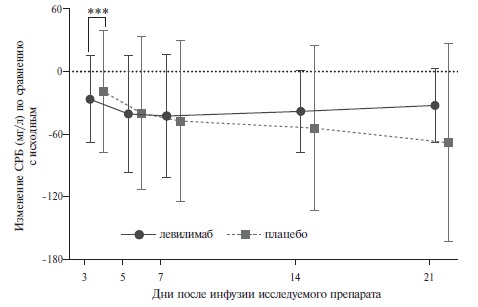
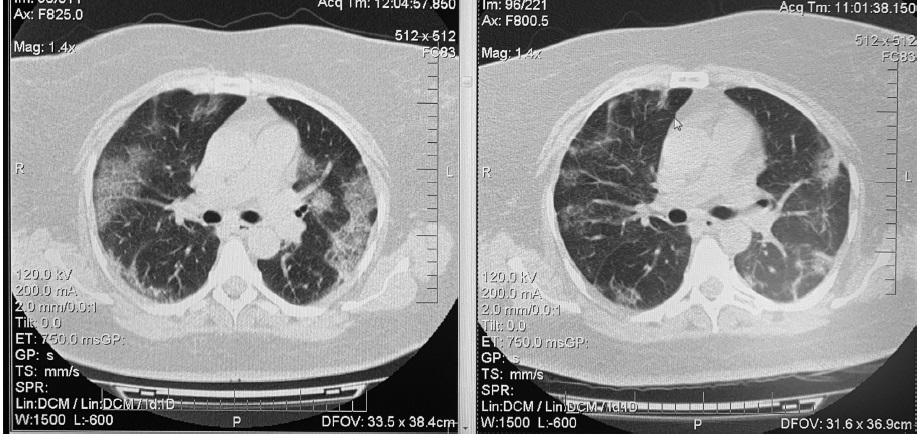
С апреля по август 2020 г. были рандомизированы 206 пациентов с COVID-19 ассоциированной пневмонией. Группы левилимаба и плацебо были сопоставимы по среднему возрасту (58,5 и 58,2 года, соответственно), хотя доля пациентов в возрасте ≥75 лет была достоверно выше в группе левилимаба (11,7% и 3,9%). Доля мужчин в двух группах составляла 56,3% и 49,5%, соответственно. В обеих группах практически все пациенты относились к категории 4 (58,3% и 61,2%, соответственно) или 3 (38,8% и 37,9%), т.е. получали увлажненный кислород или не нуждались в какой-либо респираторной поддержке. Доля пациентов, принимавших глюкокортикостероиды в обеих группах была очень низкой (4,9% и 8,7%, соответственно), так как исследование проводилось в начале пандемии, когда польза назначения препаратов этой группы вызывала сомнение. Увеличение содержания С-реактивного белка (СРБ), которое в настоящее время является одним из основных показаний к назначению ингибиторов ИЛ-6, не учитывалось при отборе пациентов в исследование CORONA, однако медиана этого показателя была высокой как в группе левилимаба, так и плацебо (39,8 и 46,0 мг/л, соответственно). При интерпретации результатов исследования необходимо учитывать тот факт, что 13 (12,6%) и 42 (40,8%) больным двух групп, соответственно, вводился левилимаб открытым методом в связи с ухудшением состояния в качестве “терапии спасения». Пациентов, получивших повторное введение левилимаба, считали не ответившими на терапию, а для оценки эффективности проводили анализ “non-responder imputation». Таким образом, значительная часть пациентов группы плацебо также получили инъекцию ингибитора ИЛ-6, что могло способствовать улучшению результатов терапии в контрольной группе и несколько нивелировать эффективность исследуемого препарата.
*p=0,0017, ** p<0,0001
На 14-й день доля пациентов, состояние которых стабильно улучшилось (без дополнительных инъекций левилимаба открытым методом), в группе левилимаба достоверно превосходила таковую в группе плацебо (63,1% и 42,7%, соответственно; р=0,0017). Таким образом, исследование CORONA подтвердило преимущество ингибитора ИЛ-6 перед контролем по первичному критерию эффективности. Выявленные различия между группами сохранялись на 21-й и 28-й дни наблюдения (рис. 1). Эффективность левилимаба подтверждалась и трехкратным снижением потребности в дополнительном введении исследуемого препарата открытым методом, а также результатами анализа ряда вторичных показателей эффективности. Например, на 5-й день доля пациентов, не нуждавшихся в оксигенотерапии, в основной группе была значительно выше, чем в группе плацебо (41,8% и 26,2%, соответственно; р=0,0186), а на 30-й день в группе левилимаба было выявлено значительное увеличение доли выписанных пациентов (84,5% и 55,3%, p<0,0001). При этом частота перевода пациентов в ОРИТ в основной группе была достоверно ниже, чем в группе плацебо (2,9% и 9,7%, соответственно; р=0,0449). Летальность в обеих группах была низкой и достоверно не отличалась между ними (1,9% и 1,0%, соответственно). Лабораторные признаки воспаления, в частности СОЭ и уровень СРБ, постепенно уменьшились в обеих группах, однако после введения левилимаба их динамика была более быстрой (рис. 2). Лечение ингибитором ИЛ-6 было относительно безопасным, в частности системные/оппортунистические инфекции в обеих группах встречались в единичных случаях, а тяжелая нейтропения или реакции гиперчувствительности зарегистрированы не были.
*** достоверные различия
С.В. Моисеев. Таким образом, клиническое исследование CORONA подтвердило, что введение левилимаба в дополнение к стандартной терапии по эффективности превосходит плацебо и вызывает улучшение клинического состояния у части больных COVID-19 ассоциированной пневмонией. Благоприятный эффект препарата проявлялся в течение первой недели после его введения и сохранялся до конца 30-дневного периода наблюдения. Примером успешного применения левилимуба у пациента с тяжелым течением COVID-19 может служить следующее наблюдение.
В.Б. Надточеева. Пациентка С., 56 лет, страдающая сахарным диабетом 2 типа, госпитализирована в отделение для лечения больных коронавирусной инфекцией клиники им. Е.М. Тареева 2 июля 2021 г. на седьмой день болезни с подтвержденной SARS-CoV-2 инфекцией (в мазке из носа и ротоглотки выявлена РНК вируса методом полимеразной цепной реакции). Заболела остро: повышение температуры тела до 39,1оС, резкая слабость, аносмия, малопродуктивный кашель. Амбу латорно получала фавипиравир, апиксабан (в дозе 2,5 мг два раза в сутки) и парацетамол, однако лихорадка и другие симптомы заболевания сохранялись. На 6-й день болезни появилась нарастающая одышка, в связи с чем пациентка была доставлена в клинику машиной скорой помощи.
При поступлении состояние средней тяжести. Тем пе ратура тела 38,8оС. SpO2 в покое 91%. После незначительной физической нагрузки SpO2 снижалась до 86-88%. При компьютерной томографии в обоих легких определялись множественные участки уплотнения легочной ткани от степени “матового стекла» до консолидации, ретикулярные изменения, утолщение междолькового интерстиция по типу “булыжной мостовой» (высокая вероятность COVID-19; КТ-3 степени). В отделении проводилось введение увлажненного кислорода через носовые канюли (10-12 л/мин). Начата терапия дексаметазоном в дозе 20 мг/сут внутривенно капельно, продолжен прием апиксабана. На второй день госпитализации температура тела 38,5оС. В общем анализе крови лейкоцитоз (12100 в мл), снижение количества лимфоцитов (450 в мл) и повышение СОЭ (37 мм/ч). Кроме того, выявлено увеличение содержания СРБ (337 мг/л) и ферритина (949 мкг/л) и активности ЛДГ (707 ед/л).
Учитывая нарастание дыхательной недостаточности, наличие высокой воспалительной активности и неэффективность глюкокортикостероидов в высокой дозе, пациентке однократно введен левилимаб в дозе 324 мг подкожно. В течение суток температура тела нормализовалась, а содержание СРБ снизилось до 260 мг/л, ферритина до 846 мкг/л. В течение последующих 3-5 дней отмечено нарастание SpO2 до 96% на воздухе, увеличение толерантности к физическим нагрузкам, а также нормализация содержания СРБ (1,6 мг/л), снижение активности ЛДГ (365 ед/л), концентрации ферритина (336 мкг/л), числа лейкоцитов (9600 в мл) и увеличение количества лимфоцитов (1400 в мл). Через неделю выявлена положительная динамика при компьютерной томографии органов грудной клетки в виде уменьшения зон “матового стекла» (до КТ-2 степени) (рис. 3). Пациентка выписана через 10 дней.
С.В. Моисеев. У пациентов, включенных в исследование CORONA, летальность в группах сравнения оказалась низкой. Это не позволило изучить эффективность препарата в профилактике смерти пациентов с COVID-19 от прогрессирующего поражения легких. Что известно о влиянии других ингибиторов ИЛ-6 на риск неблагоприятных исходов SARS-CoV-2 инфекции?
М.Ю. Бровко. Первые случаи успешного применения тоцилизумаба у пациентов с тяжелым течением COVID-19 были описаны в начале пандемии и послужили основанием для проведения большого числа неконтролируемых и контролируемых исследований препаратов этой группы. Хотя польза назначения ингибиторов ИЛ-6 представлялась очевидной, тем не менее, результаты клинических исследований оказались противоречивыми. Нерандомизированные исследования в основном демонстрировали эффективность тоцилизумаба [4,5]. Например, в ретроспективном американском исследовании STOP-COVID эффективность тоцилизумаба изучали у 3924 пациентов с COVID-19, поступивших в ОРИТ (62,8% мужчин, медиана возраста 62 года) [6]. 433 (11,0%) из них получили тоцилизумаб в течение первых 2 дней после госпитализации в ОРИТ. Лечение ингибитором ИЛ-6 ассоциировалось с достоверным снижением риска смерти на 29% по сравнению с контролем (отношение рисков 0,71, 95% ДИ 0,56-0,92). В то же время эффективность тоцилизумаба в профилактике неблагоприятных исходов COVID-19 ассоциированной пневмонии не была подтверждена в нескольких рандомизированных контролируемых исследованиях [7-9]. Так, в двойном слепом, рандомизированном, плацебоконтролируемом исследовании, проводившемся в США, эффективность тоцилизумаба изучали у 243 больных средне-тяжелой COVID-19 пневмонией (медиана возраста 59,8 лет) [9]. 84% из них получали оксигенотерапию. В течение 28 дней частота перевода на ИВЛ или смерти достоверно не отличалась между группами тоцилизумаба и плацебо (10,6% и 12,5%, соответственно). Лечение тоцилизумабом не привело также к уменьшению риска ухудшения состояния больных или сокращению длительности оксигенотерапии.
Тем не менее, опубликованы результаты нескольких крупных рандомизированных исследований, которые показали эффективность ингибиторов ИЛ-6 у пациентов с COVID-19 на основании анализа “твердых» конечных точек, таких как необходимость в ИВЛ и летальность. В исследовании EMPACTA у 389 рандомизированных госпитализированных больных с COVID-19 лечение тоцилизумабом привело к достоверному снижению риска интубации или смерти на 44% по сравнению с плацебо (отношение рисков 0,56; 95% ДИ 0,330,97) [10]. В исследовании REMAP-CAP у 803 больных с COVID-19, находившихся в ОРИТ в критическом состоянии, лечение тоцилизумабом или сарилумабом сопровождалось достоверным увеличением выживаемости в течение 90 дней по сравнению со стандартной терапией [11]. И, наконец, в самое крупное рандомизированное исследование RECOVERY, проводившееся в Великобритании, были включены 4116 пациентов с COVID-19 ассоциированной пневмонией, сопровождавшейся гипоксией и увеличением содержания СРБ ≥75 мг/л, которые получали тоцилизумаб (n=2022) или только стандартную терапию (n=2094) [12]. Частота применения глюкокортикостероидов составила в целом 82%, т.е. протокол стандартной терапии в этом исследовании соответствовал сложившейся к настоящему времени практике лечения госпитализированных пациентов с COVID-19. На момент рандомизации у 14% больных проводилась ИВЛ, у 41% – неинвазивная респираторная поддержка, включая высокопоточную оксигенотерапию и НИВЛ, а 45% пациентов нуждались только во введении кислорода. Во всей выборке лечение тоцилизумабом привело к достоверному снижению летальности пациентов на 15% (р=0,0028; рис. 4). Среди больных, которые исходно не нуждались в ИВЛ, в группе тоцилизумаба было выявлено достоверное снижение риска интубации или смерти на 16% по сравнению с контролем (p<0,0001). Результаты лечения были в целом сходными в различных выборках пациентов, выделенных в зависимости от демографических и клинических показателей (рис. 5), однако обращает на себя внимание достоверное снижение риска смерти при лечении тоцилизумабом на 21% у пациентов, получавших глюкокортикостероиды, и отсутствие подобного эффекта у больных, которым не проводилась терапия препаратами этой группы. Приведенные данные могут указывать на более высокую эффективность комбинированной терапии ингибиторами ИЛ-6 и глюкокортикостероидами, хотя протокол исследования RECOVERY не предполагал изучение этого вопроса.
С.В. Моисеев. Применение ингибиторов ИЛ-6, включая левилимаб, предусмотрено во временных методических рекомендациях по профилактике, диагностике и лечению новой коронаровирусной инфекции, которые постоянно обновляются Минздравом Российской Федерации на протяжении пандемии. В июне 2021 г. назначение тоцилизумаба для лечения COVID-19 было одобрено Американской администрацией по контролю за пищевыми продуктами и лекарствами (FDA) у взрослых пациентов и детей, получающих системные глюкокортикостероиды и нуждающихся в оксигенотерапии, НИВЛ, ИВЛ или ЭКМО. В каких случаях и когда следует применять левилимаб или другие ингибиторы ИЛ-6 у пациентов с COVID-19?
Л.А. Акулкина. В последнее время увеличилось количество пациентов с COVID-19, которые самостоятельно или по рекомендации врача начинают прием иммуносупрессивных препаратов, прежде всего глюкокортикостероидов, уже с первых дней инфекции. Подобная практика опасна, так как подавление иммунного ответа при продолжающейся репликации вируса может привести к прогрессированию заболевания. Данную гипотезу подтверждают результаты исследования RECOVERY, в котором изучались различные препараты, в том числе дексаметазон, у пациентов с COVID-19. В этом исследовании лечение дексаметазоном привело к достоверному снижению 28-дневной летальности (р<0,001) госпитализированных пациентов [13]. Благоприятный эффект препарата на выживаемость наблюдался у пациентов, находившихся на ИВЛ или получавших оксигенотерапию, но отсутствовал у больных, не нуждавшихся в респираторной поддержке, а также у пациентов, у которых симптомы инфекции сохранялись менее 7 дней. Таким образом, слишком раннее введение дексаметазона в этом исследовании не улучшало прогноз у пациентов с COVID-19. Это объясняется тем, что воспаление, в том числе вызванное увеличением выброса провоспалительных цитокинов, таких как ИЛ-1, ИЛ-6 и фактор некроза опухоли альфа, является нормальным ответом хозяина на вирусную инфекцию, который необходим для элиминации вируса. Однако у части больных, инфицированных SARS-CoV-2, вирус вызывает чрезмерный воспалительный ответ, который напоминает синдром выделения цитокинов, или “цитокиновый шторм», описанный при первичном и вторичном гемофагоцитарном лимфогистиоцитозе и синдроме активации макрофагов, а также при CAR-Tклеточной терапии онкологических заболеваний [14]. Следует отметить, что при тяжелом течении COVID-19 концентрации циркулирующих цитокинов могут быть значительно ниже, чем при “классическом» синдроме выделения цитокинов или остром респираторном дистресс синдроме другой этиологии [15]. Предложенные ранее критерии диагностики синдрома выделения цитокинов не вполне пригодны для диагностики этого состояния при COVID-19. Например, к числу критериев, включенных в HScore, отнесены двухили трехростковые цитопении (снижение содержания гемоглобина <9,2 г/дл, числа лейкоцитов ≤5000 в мл и/или тромбоцитов ≤110000 в мл) [16], которые при SARS-CoV-2 инфекции встречаются относительно редко [17,18], хотя лимфопения является одним из ключевых проявлений заболевания. Более того, при COVID-19 часто отмечается нейтрофильный лейкоцитоз, который ассоциировался с более тяжелым течением инфекции [19]. Соответственно, увеличение числа нейтрофилов при этом заболевании далеко не всегда является признаком присоединения бактериальной инфекции и основанием для назначения антибиотиков.
К настоящему времени различными группами авторов разработаны более специфичные для COVID-19 критерии диагностики синдрома выброса цитокинов, хотя общепринятые критерии по-прежнему отсутствуют. R. Caricchio и соавт. предложили использовать три группы критериев, отражающих (1) воспаление (увеличение содержания ферритина, СРБ, нейтрофилов) (2) гибель клеток и повреждение ткани (повышение активности печеночных аминотрансфераз, ЛДГ, D-димера, тропонина) и (3) преренальные электролитные нарушения (снижение анионного разрыва, увеличение содержания хлоридов, калия, креатинина) [20]. Использование указанных критериев позволило выделить пациентов с более тяжелым течением COVID-19, которое характеризовалось необходимостью в более длительной госпитализации и более высоким риском смерти. Кстати, увеличение абсолютного количества нейтрофилов более 11400 в мл авторы расценили как один из критериев диагностики синдрома выделения цитокинов при COVID-19.
B. Webb и соавт. при обследовании 299 госпитализированных пациентов с COVID-19 разработали шкалу cHIS, предназначенную для диагностики гипервоспалительного синдрома на основании анализа 6 критериев: лихорадка, активация макрофагов (гиперферритинемия), гематологические нарушения (увеличение отношения количества нейтрофилов и лимфоцитов), повреждение печени (активность ЛДГ или АСТ), коагулопатия (D-димер) и цитокинемия (СРБ, ИЛ-6 или триглицериды) [21]. Наличие по крайней мере двух из перечисленных критериев ассоциировалось с увеличением риска смерти или интубации.
На практике оценить целесообразность введения ингибиторов ИЛ-6 пациентам с COVID-19 часто несложно и без использования каких-либо шкал. Необходимость в назначении антицитокиновых препаратов обычно наблюдается на 6-9-й день болезни, если у пациента с КТ-признаками COVID-19 ассоциированной пневмонии сохраняется лихорадка и/или отмечается нарастание лабораторных признаков воспаления, в том числе содержания С-реактивного белка (до 100-400 мг/л и более), ферритина, фибриногена, ИЛ-6, а также D-димера, особенно в сочетании со снижением SpO2≤93%. Дополнительным доводом в пользу назначения ингибитора ИЛ-6 в подобных случаях может служить наличие факторов риска неблагоприятного течения COVID-19, таких как пожилой возраст, сахарный диабет, ожирение, ишемическая болезнь сердца [22,23].
В.Б. Надточеева. Показания к введению ингибиторов ИЛ-6 иллюстрирует приведенное выше наблюдение. У 56-летней пациентки в конце первой недели болезни выявлена COVID-19 ассоциированная пневмония (КТ3), сопровождавшаяся гипоксией (снижением SpO2 до 91% на воздухе), выраженной лимфопенией и высокой воспалительной активностью, в частности содержание СРБ увеличилось до 337 мг/л. Сохранение лихорадки после введения дексаметазона в дозе 20 мг/сут указывало на недостаточную эффективность глюкокортикостероида. На повышенный риск дальнейшего прогрессирования поражения легких при COVID-19 указывало наличие сахарного диабета 2 типа. Однократное подкожное введение левилимаба в дозе 324 мг уже в течение суток привело к нормализации температуры тела и улучшению состояния пациентки, а в течение последующих нескольких дней увеличилось SpO2, восстановилось количество лимфоцитов в крови и снизились лабораторные признаки воспаления. Умеренный лейкоцитоз мы расценивали как признак не бактериальной инфекции, а воспаления, поэтому лечение антибиотиками не проводилось. Снижение количества лейкоцитов на фоне противовоспалительной терапии подтверждало правильность выбранной тактики лечения.
С.В. Моисеев.. В настоящее время во всем мире для лечения COVID-19 широко применяют глюкокортикостероиды. Какова должна быть тактика назначения препаратов этой группы и ингибиторов ИЛ-6? С чего лучше начинать лечение?
В.И. Шоломова. В рандомизированных клинических исследованиях возможные варианты стратегии применения противовоспалительных препаратов у пациентов с COVID-19 не сравнивали. Данных о сравнительной эффективности глюкокортикостероидов и ингибиторов ИЛ-6 в профилактике неблагоприятных исходов заболевания также нет. Тем не менее, не вызывает сомнения, что глюкокортикостероиды обладают широким спектром противовоспалительной активности и дают необходимый эффект у значительной части пациентов с признаками синдрома выделения цитокинов. Глюкокортикостероиды подавляют экспрессию различных провоспалительных цитокинов и повышают выделение цитокинов, обладающих противовоспалительной активностью [24], поэтому их также можно считать антицитокиновыми препаратами, как и генно-инженерные биологические препараты или ингибиторы янускиназ. Основным недостатком глюкокортикостероидов являются различные побочные эффекты, однако они чаще встречаются при длительном лечении препаратами этой группы и не представляют особой проблемы при кратковременном применении глюкокортикостероидов, особенно в небольших дозах, у пациентов с COVID-19. Лечение дексаметазоном или другими глюкокортикостероидами может привести к декомпенсации сахарного диабета, однако гликемический профиль обычно улучшается после снижения дозы или отмены этих препаратов. Соответственно, с этих препаратов обычно и начинают лечение. Кстати, в исследовании RECOVERY, в котором изучался тоцилизумаб, практически все пациенты на момент рандомизации уже получали дексаметазон или другие глюкокортикостероиды. Введение ингибитора ИЛ-6 необходимо при отсутствии быстрого ответа на введение глюкокортикостероида и, тем более, при продолжающемся нарастании воспалительного ответа и/или появлении признаков гипоксии. У пациентов со сниженной SpO2, а также у больных, относящихся к группе риска, как в нашем наблюдении, лучше не ждать ответа на глюкокортикостероиды, а одновременно с ними сразу вводить ингибитор ИЛ-6.
М.Ю. Бровко. Если исходить из концепции “цитокинового шторма» как основы прогрессирования COVID19, то блокада действия различных цитокинов выглядит оправданной, хотя эффективность такого подхода в контролируемых исследованиях не изучалась и, соответственно, не доказана. При ревматических заболеваниях, таких как ревматоидный артрит, опыта комбинированной терапии различными генно-инженерными биологическими препаратами и/или ингибиторами янус-киназ также нет. Речь, конечно, не идет о глюкокортикостероидах, которые, как указано выше, сегодня являются компонентом терапии у большинства госпитализированных пациентов со средне-тяжелым и тяжелым течением COVID-19. Иногда комбинированная терапия является вынужденной мерой, например, в случае ухудшения состояния пациента, не ответившего на пероральный прием ингибитора янус-киназ, необходимо вводить ингибитор ИЛ-6. Различия механизмов действия ингибиторов ИЛ-6, по-видимому, не имеют большого значения, поэтому комбинированное применение разных препаратов этой группы, вряд ли, приведет к усилению эффекта по сравнению с таковым при введении одного и того же препарата. В исследовании CORONA, как и в других исследованиях ингибиторов ИЛ-6, допускалось повторное введение левилимаба открытым методом в случае отсутствия ответа на первую инъекцию исследуемого препарата двойным слепым методом. Как указано выше, доля пациентов, которым потребовалось повторное введение левилимаба, в основной группе составила около 12% и была в 3 раза меньше, чем в группе плацебо. Таким образом, почти в 90% случаев исследователи были удовлетворены результатами однократного введения ингибитора ИЛ-6. Конечно, этот показатель в достаточной мере условный и может существенно отличаться в разных выборках, так как результаты лечения любыми противовоспалительными препаратами в значительной степени зависят от тяжести течения COVID-19.
С.В. Моисеев. Необходимо ли измерять содержание ИЛ-6 при оценке показаний к введению ингибиторов этого цитокина?
М.Ю. Бровко. ИЛ-6 – это один из основных медиаторов воспаления. По данным нескольких мета-анализов, повышение концентрации этого цитокина ассоциировалось с более тяжелым течением и неблагоприятными исходами COVID-19, такими как госпитализация в ОРИТ и смерть [25-27]. Например, в одном из таких исследований у пациентов с осложненным течением COVID-19 содержание ИЛ-6 было почти в 3 раза выше, чем у больных с неосложненными формами заболевания [25]. По нашему опыту, увеличение содержания ИЛ-6 может предшествовать росту других лабораторных признаков воспаления, таких как СРБ, но на короткое время. Однако возможность планового определения концентрации ИЛ-6 имеется не во всех лечебных учреждениях, особенно при наличии большого потока пациентов с COVID-19. Да и измерение содержания этого цитокина не является обязательным, так как оценить необходимость во введении ингибиторов ИЛ-6 можно на основании клинической картины и изменений более доступных лабораторных маркеров, таких как СРБ и количество лимфоцитов в периферической крови. Как и другие лабораторные показатели, уровень ИЛ-6 является неспецифичным и повышается при воспалении любой природы, т.е. он не позволяет дифференцировать синдром выделения цитокинов при COVID-19 от бактериальной инфекции. Измерение содержания ИЛ-6 после введения левилимаба не имеет смысла, так как этот препарат блокирует рецепторы цитокина и не влияет на его содержание, которое обычно остается повышенным несмотря на положительную динамику других маркеров воспаления, в частности содержания СРБ или ферритина.
С.В. Моисеев. Тоцилизумаб выпускается в виде двух лекарственных форм – для внутривенного и подкожного введения, в то время как все остальные ингибиторы ИЛ-6 предназначены только для подкожного применения. Имеет ли значение путь введения этих препаратов при COVID-19?
П.И. Новиков. Однозначно ответить на этот вопрос сложно. С одной стороны, среди ингибиторов ИЛ-6 у пациентов с COVID-19 лучше всего изучен тоцилизумаб внутривенно, который применялся в большинстве рандомизированных и нерандомизированных клинических исследований. С другой стороны, всем больным с COVID-19, нуждающимся в ингибиторах ИЛ-6, вводить тоцилизумаб внутривенно нереально, учитывая дефицит этого препарата, который неизбежно усиливается во время подъемов заболеваемости, когда число госпитализированных пациентов быстро увеличивается. К настоящему времени накоплен опыт внутривенного введения подкожных форм ингибиторов ИЛ-6, хотя мы в своей практике чаще вводили их в соответствии с инструкцией по применению. В рандомизированных контролируемых исследованиях эффективность внутривенного и подкожного введения тоцилизумаба не сравнивали, а результаты нерандомизированных исследований оказались противоречивыми [4,28]. С.С. Боб кова и соавт. сопоставили результаты внутривенного (n=114) и подкожного (n=86) введения тоцилизумаба и подкожного применения левилимаба (n=100) и олокизумаба (n=100) у 400 пациентов с COVID-19 [29]. Все изученные ингибиторы ИЛ-6 вызывали сопоставимое снижение содержания СРБ через 24 ч после введения, а достоверных различий летальности между группами не выявили. Таким образом, в этом исследовании тоцилизумаб не имел преимуществ перед ингибиторами ИЛ-6 для подкожного применения. Доводом в пользу возможности подкожного введения левилимаба служат и результаты рандомизированного исследования CORONA, которое подтвердило преимущество препарата перед плацебо у пациентов с COVID-19. При выборе пути введения необходимо учитывать состояние больного. В более тяжелых случаях, особенно при быстром нарастании гипоксии, вероятно, имеет смысл отдать предпочтение внутривенному введению.
С.В. Моисеев. Тактика медикаментозного лечения средне-тяжелых и тяжелых форм COVID-19 по-прежнему вызывает много вопросов, однако все же в этом направлении удалось достичь существенного прогресса, который прежде всего связан с применением глюкокортикостероидов и ингибиторов ИЛ-6. Потребность в последних в российских лечебных учреждениях остается высокой, поэтому расширение арсенала ингибиторов ИЛ-6 благодаря появлению левилимаба, разработанного российской фармацевтической компанией, имеет очень важное значение. Необходимо подчеркнуть, что эффективность левилимаба в лечении COVID-19 была установлена в рандомизированном, плацебо-контролируемом исследовании, в то время как многие лекарственные средства, которые в свое время использовали или пытались использовать при SARS-CoV-2 инфекции (гидроксихлорохин, лопинавир/ритонавир и др.), не выдержали этого испытания.
Используемые источники
- Nogrady B. Mounting evidence suggests Sputnik COVID vaccine is safe andeffective. Nature 2021 Jul 6. doi: 10.1038/d41586-021-01813-2. Epub ahead of print. PMID: 34230663.
- Руженцова Т.А., Чухляев П.В., Хавкина Д.А. и др.. Эффективность и безопасность применения фавипиравира в комплексной терапии COVID-19 легкого и среднетяжелого течения. Инфекционные болезни: новости, мнения, обучение 2020;9(4):26-38 [Ruzhentsova TA, Chukhlyaev PV, Khavkina DA, et al. Efficacy and safety of favipiravir in a complex therapy of mild to moderate COVID-19. Infektsionnye bolezni: novosti, mneniya, obuchenie 2020;9(4): 26-38 (In Russ.)].
- Clinicaltriles.gov: https://clinicaltrials.gov/ct2/show/NCT04397562?term=levilimab&draw=2&rank=1.
- Guaraldi G, Meschiari M, Cozzi-Lepri A, et al. Tocilizumab in patients with severe COVID-19: a retrospective cohort study. Lancet Rheumatol 2020;2:e474–8.
- Menzella F, Fontana M, Salvarani C, et al. Efficacy of tocilizumab in patients with COVID-19 ARDS undergoing noninvasive ventilation. Crit Care
2020;24:589. - Gupta S, Wang W, Hayek SS, et al. Association between early treatment with tocilizumab and mortality among critically ill patients with COVID-19. JAMA Intern Med 2021;181(1):41-51.
- Salvarani C, Dolci G, Massari M, et al; for the RCT-TCZ-COVID-19 Study Group. Effect of tocilizumab vs standard of care on clinical worsening in patients hospitalized with COVID-19 pneumonia: a randomized clinical trial. JAMA Intern Med 2021;181(1):24-31
- Hermine O, Mariette X, Tharaux P-L, et al; for the CORIMUNO-19 Collaborative Group. Effect of tocilizumab vs usual care in adults hospitalized
with COVID-19 and moderate or severe pneumonia: a randomized clinical trial. JAMA Intern Med; 2021;181(1):32-40. - Stone JH, Frigault MJ, Serling-Boyd NJ, et al. Efficacy of tocilizumab in patients hospitalized with Covid-19. N Engl J Med 2020;10.1056/NEJMoa2028836. doi:10.1056/NEJMoa2028836.
- Salama C, Han J, Yau L, et al. Tocilizumab in patients hospitalized with Covid19 pneumonia. N Engl J Med 2021;384(1):20-30.
- REMAP-CAP Investigators, Gordon AC, Mouncey PR, Al-Beidh F, et al. Interleukin-6 receptor antagonists in critically ill patients with Covid-19. N Engl J Med. 2021;384(16):1491-502.
- RECOVERY Collaborative Group. Tocilizumab in patients admitted to hospital with COVID-19 (RECOVERY): a randomised, controlled, open-label, platform trial. Lancet. 2021;397(10285):1637-45.
- RECOVERY Collaborative Group, Horby P, Lim WS, Emberson JR, et al. Dexamethasone in Hospitalized Patients with Covid-19. N Engl J Med 2021; 384(8):693-704.
- Fajgenbaum DC, June CH. Cytokine Storm. N Engl J Med 2020;383(23):2255- 73.
- Sinha P, Matthay MA, Calfee CS. Is a “cytokine storm” relevant to COVID-19? JAMA Intern Med 2020;383(23):2255-73.
- Fardet L, Galicier L, Lambotte O. Development and validation of the HScore, a score for the diagnosis of reactive hemophagocytic syndrome. Arthritis Rheumatol 2014;66:2613–2620.
- Agbuduwe C, Basu S. Haematological manifestations of COVID-19: From cytopenia to coagulopathy. Eur J Haematol 2020;105(5):540-6.
- Cheung CKM, Law MF, Lui GCY, Wong SH, Wong RSM. Coronavirus Disease 2019 (COVID-19): A haematologist’s perspective. Acta Haematol 2021;144(1):10-23.
- Huang G, Kovalic AJ, Graber CJ. Prognostic value of leukocytosis and lymphopenia for Coronavirus Disease severity. Emerg Infect Dis 2020;26(8):1839-41.
- Caricchio R, Gallucci M, Dass C, et al. Preliminary predictive criteria for COVID-19 cytokine storm. Ann Rheum Dis 2021; 80(1):88-95.
- Webb BJ, Peltan ID, Jensen P, et al. Clinical criteria for COVID-19-associated hyperinflammatory syndrome: a cohort study. Lancet Rheumatol 2020;2:e754–6.
- Глыбочко П.В., Фомин В.В., Авдеев С.Н. и др. Клиническая характеристика 1007 больных тяжелой SARS-CoV-2 пневмонией, нуждавшихся в респираторной поддержке. Клин фармакол тер 2020;29(2):21-9 [Glybochko P, Fomin V, Avdeev S, et al. Clinical characteristics of 1007 intensive care unit patients with SARS-CoV-2 pneumonia. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2020;29(2):21-9 (In Russ.)].
- Глыбочко П.В., Фомин В.В., Моисеев С.В. и др. Исходы у больных с тяжелым течением COVID-19, госпитализированных для респираторной поддержки в отделения реанимации и интенсивной терапии. Клин фармаколтер 2020;29(3):25-36 [Glybochko P, Fomin V, Moiseev S, et al. Clinical outcomes of patients with COVID-19 admitted for respiratory support to the intensive care units in Russia. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther 2020; 29(3):25-36 (In Russ.)].
- Hardy RS, Raza K, Cooper MS. Therapeutic glucocorticoids: mechanisms of actions in rheumatic diseases. Nature Rev Rheumatol 2020;16(3):133-44.
- Coomes EA, Haghbayan H. Interleukin-6 in Covid-19: A systematic review and meta-analysis. Rev Med Virol 2020;30(6):1-9.
- Zhu J, Pang J, Ji P, et al. Elevated interleukin-6 is associated with severity of COVID-19: a meta-analysis. J Med Virol 2021;93(1):35-7.
- Aziz M, Fatima R, Assaly R. Elevated interleukin-6 and severe COVID-19: A meta-analysis. J Med Virol 2020;92(11):2283-5.
- Kaminski MA, Sunny S, Balabayova K, et al. Tocilizumab therapy for COVID19: A comparison of subcutaneous and intravenous therapies. Int J Infect Dis. 2020;101:59-64.
- Бобкова С.С., Жуков А.А., Проценко Д.Н. и др. Сравнительная эффективность и безопасность применения препаратов моноклональных антител к ИЛ-6 у пациентов с новой коронавирусной инфекцией COVID-19 тяжелого течения. Ретроспективное когортное исследование. Вестник интенсивной терапии им. А.И. Салтанова 2021;1:69–76 [Bobkova SS, Zhukov AA, Protsenko DN, et al. Comparative study of monoclonal anti-IL6 antibodies in severe new coronavirus disease COVID-19 patients. Annals of Critical Care 2021;1:69–76 (In Russ.)].
Версия на английском языке