Лоркасерин
Lorcaserin
Фармакологическое действие
Лоркасерин — анорексик, высокоселективный агонист 5НТ2С-рецепторов. Блокирует ощущение голода, позволяя пациентам чувствовать себя более сытыми от меньшего объёма еды.
Фармакокинетика
Всасывание
Время достижения максимальной плазменной концентрации (TCmax) — 1,5–2 часа (с задержкой на 1 час при введении с пищей, но не клинически значимо).
Биодоступность — не определено.
Одновременный приём с пищей увеличивает Cmax ~9 % и AUC (Area under the plasma drug concentration-time curve — площадь под кривой «концентрация-время») ~5 %.
Распределение
Связь с белками плазмы — 70 %.
Проникает в ЦСЖ и ЦНС.
Биотрансформация
Метаболизируется в печени множественными путями (обширно).
Метаболиты: сульфамат лорказерина является основным циркулирующим метаболитом (Cmax превышает лорказерин в 1–5 раз); N-карбамоилглюкуронид лорказерин является основным метаболитом в моче.
Основные метаболиты не проявляют фармакологической активности в отношении рецепторов серотонина.
Выведение
Период полувыведения (T½) — 11 часов.
Элиминация: с мочой — 92,3 % (в основном в виде метаболитов), с фекалиями — 2,2 %.
Показания
Лоркасерин применяется при лечении ожирения и поддержания веса тела только в составе комплексной терапии, предполагающей изменение образа жизни, включающего диетические ограничения и/или физическую нагрузку. Показан для пациентов со следующим индексом массы тела (ИМТ = масса тела в кг/(рост в м)2 ):
- пациенты без сопутствующих заболеваний — при ИМТ не менее 30 кг/м2
- пациенты с ИМТ не менее 27 кг/м, имеющие хотя бы одно сопутствующее заболевание, такие как артериальная гипертензия, сахарный диабет, дислипидемия.
Противопоказания
Повышенная чувствительность к лорказерину; беременность; лактация.
Беременность и грудное вскармливание
Применение при беременности
Категория действия на плод по FDA — X.
Адекватных и строго контролируемых исследований по безопасности применения лоркасерина при беременности у человека не проведено.
В исследовании на животных, при воздействии доз приблизительно в 44 раза превышающих максимально допустимую для человека человека, приводило к мертворождению и снижению жизнеспособности потомства. Все дозы снижали массу тела у потомства. Исследования на животных не выявили признаков тератогенности или эмбриолетальности, препарат не оказывал влияния на фертильность при дозах, в 29 раз превышающих максимально допустимую дозу для человека.
Применение лоркасерина у беременных женщин противопоказано; потеря веса может привести к повреждению плода.
Применение в период грудного вскармливания
Специальных исследований по безопасности применения лоркасерина в период грудного вскармливания не проведено.
Неизвестно, выделяется ли лоркасерин в человеческое грудное молоко. Последствия у грудного ребёнка неизвестны.
Применение противопоказано.
Способ применения и дозы
Внутрь по 10 мг 2 раза в день. Если вес пациента за первые 12 недель не снизился на 5 % или более, приём лоркасерина прекращается, так как вероятность того, у пациента будет достигнута и будет поддерживать клинически значимая потеря веса при продолжении лечения лоркасерином незначительна.
Побочные действия
- Тошнота;
- сухость во рту;
- запор;
- головная боль;
- головокружение;
- усталость.
Классификация
-
АТХ
A08AA11
-
Фармакологическая группа
-
Категория при беременности по FDA
X
(противопоказано)
Информация о действующем веществе Лоркасерин предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Лоркасерин, содержатся в инструкции производителя, прилагаемой к упаковке.
Современные лекарственные препараты в лечении ожирения
По данным Всемирной организации здравоохранения (ВОЗ), распространенность ожирения в мире за последние 40 лет увеличилась почти в 3 раза. За тот же период времени частота ожирения у детей и подростков в возрасте от 5 до 19 лет возросла с 1% до 7%. В докладе ВОЗ отмечается что, большая часть населения мира живет в тех странах, “где избыточная масса тела и ожирение убивают больше людей, чем недостаточная масса тела”. Ожирение ассоциируется с развитием различных хронических заболеваний, таких как сахарный диабет, дислипидемия и артериальная гипертония, увеличивающих риск инвалидизации и смерти. При наличии ожирения продолжительность жизни сокращается в среднем на 15 лет по сравнению с таковой у людей с нормальной массой тела. Кроме того, ожирение и ассоциированные с ним заболевания значительно увеличивают затраты системы здравоохранения. При лечении ожирения необходимо не только добиваться снижения массы тела, но и корректировать нарушения липидного и углеводного обмена, системы гемостаза и др., что необходимо учитывать при выборе лекарственных средств. В обзоре литературы обсуждаются современные возможности и опыт применения лекарственных препаратов для снижения массы тела.
Проблема ожирения затрагивается еще в трудах английского врача Томаса Сиденхэма, а в 1808 г. В. Каплен писал: «Жир, являющийся частью человеческого тела, способствует красоте, но в из бытке
является болезнью и может быть причиной многих фатальных эффектов» [1]. В ХIХ в. Чарльз Диккенс в
«Записках Пиквикского клуба» описывает у своего героя тяжелую степень ожирения, под влиянием которого человек
становится вялым, заторможенным и сонливым [1].
Развитию ожирения, которым в экономически развитых странах страдает около трети населения, способствуют алкоголь,
стресс, гиподинамия и переедание [2]. Рост числа заболевших установлен и в развивающихся странах, что связывают с
особенностями питания населения, а именно преобладанием в пище углеводов. В этих странах отмечается потребление
продуктов с повышенным содержанием жиров, сахаров и соли с высокой энергетической плотностью и низким содержанием
микронутриентов. Такое питание, как правило, дешевле, но имеет более низкую пищевую ценность. В сочетании с
невысоким уровнем физической активности это приводит к резкому росту распространенности ожирения, а проблема
неполноценного питания остается нерешенной [3,4]. Частота ожирения увеличивается с возрастом [4,5], однако в
некоторых исследованиях показана высокая распространенность ожирения среди хорошо успевающих в школе детей и
подростков, что обусловлено сидячим образом жизни [5]. Согласно некоторым данным, ожирение чаще встречается у
жителей городов, чем сельских жителей.
При морбидном ожирении частота субклинических и клинически значимых тревоги и депрессии достоверно выше, чем в
популяции: хотя бы одно психическое расстройство наблюдается более чем у половины людей с индексом массы тела
(ИМТ)>40 кг/м2. Больше всего исследований посвящено изучению связи ожирения с депрессивным расстройством
[6]. Его распространенность в течение жизни в популяции составляет около 17%, а у пациентов с ожирением – от 29 до
56% [6]. По мнению исследователей, рост распространенности некоторых заболеваний, в том числе рака и ожирения,
частично связан с тем, что люди стали жить дольше, а питаться хуже [7]. Риск развития ряда онкологических
заболеваний, таких рак толстой кишки, почек, легких, молочной железы и женских половых органов, повышается при
наличии ожирения, хотя механизмы этой связи до конца не изучены. Например, считается, что при раке толстой кишки
предрасполагающими факторами являются адинамия и прием жирной пищи, а при раке яичников и молочной железы –
гормональный дисбаланс [7].
В материалах İDF (Международная федерация диабета) 2005 г. отмечено изменение ряда критериев метаболического
синдрома, в том числе и изменение средней окружности талии в странах Европы и Азии, которая составила в среднем 80
см у женщин и 94 см у мужчин. В США этот показатель достиг 102 см у мужчин и 88 см у женщин, в странах Европы – >94
см и >80 см, в Южной Азии и Китае – >90 см и >80 см, в Японии – >85 см и >90 см, соответственно. По данным
исследования TURDEP-II (Turkish diabetes epidemiology study2010 год), в Турции этот показатель составил 91 см у
женщин и 94 см у мужчин [8].
По данным ВОЗ, в 2016 г. избыточной массой тела в мире страдали 1,9 млрд взрослых в возрасте 18 лет и старше, а
ожирением – 650 млн. При этом частота избыточной массы тела составила 39%, ожирения – 13%, в том числе 11% среди
мужчин и 15% среди женщин. В том же году количество детей и подростков в возрасте от 5 до 19 лет с избыточной массой
тела или ожирением превысило 340 млн. В 2019 г. количество детей в возрасте до 5 лет с избыточной массой тела или
ожирением составило 38 млн [9].
В 2015 г. среди 20 наиболее густонаселенных стран самая высокая стандартизированная частота ожирения среди взрослых
наблюдалась в Египте (35,3%), а среди детей – в США (12,7%). Частота ожирения среди взрослых была самой низкой во
Вьетнаме (1,6%), а среди детей – в Бангладеш (1,2%). В период с 1980 по 2015 г. стандартизированная по возрасту
частота ожирения увеличилась в 2 и более раз в 13 из 20 стран. В 2015 г. наибольшим количество детей с ожирением
было в Китае и Индии, а взрослых – в США и Китае [10].
Сложившуюся ситуацию назвать иначе как эпидемией нельзя, а в ближайшие годы можно ожидать только дальнейшего ее
усугубления. В принятой Всемирной ассамблеей здравоохранения в 2000 г. «Глобальной стратегии ВОЗ по питанию,
физической активности и здоровью» изложен перечень необходимых мер по поддержке здорового питания и регулярной
физической активности. В стратегии содержится призыв ко всем заинтересованным сторонам предпринимать действия на
глобальном, региональном и местном уровнях в целях улучшения режима питания и повышения уровня физической активности
населения [11]. В ноябре 2006 г. ВОЗ провела специальную Европейскую конференцию по проблемам ожирения, на которой
был принят ряд документов, призывающих правительства всех стран региона сообща бороться с этим состоянием [12].
Ожирение является не только косметической, но и медицинской проблемой [13]. Оно ассоциировано с рядом заболеваний,
чаще всего с артериальной гипертонией, сахарным диабетом 2 типа, дислипидемией, синдромом поликистозных яичников,
остеоартритом и синдромом обструктивного ночного апноэ. Первое клиническое руководство по диагностике и лечению
ожирения было предложено Национальным институтом здоровья США (NIH) [14]. При обследовании пациентов с ожирением
необходимо оценивать три показателя: индекс массы тела (ИМТ), окружность талии и риск сердечно-сосудистых исходов.
Критерием избыточной массы тела является значение ИМТ 25-29,9 кг/м2, а ожирения – 30 кг/м2 и
выше. В руководстве подчеркивается, что пациенты в возрасте 18 лет и старше с ИМТ ≥25 кг/м2 имеют более
высокий риск развития осложнений ожирения, таких как сахарный диабет 2 типа, сердечно-сосудистые заболевания,
заболевания системы дыхания и остеоартрит. Доказано также, что центральный тип ожирения является независимым
фактором риска атеросклероза и артериальной гипертонии. Эксперты NIH предложили разделять пациентов с избыточной
массой тела на три группы в зависимости от сердечно-сосудистого риска:
1. Пациенты с сахарным диабетом 2 типа, ишемической болезнью сердца, другими заболеваниями, связанными с
атеросклеротическим поражением сосудов, и синдромом обструктивного ночного апноэ относятся к группе очень высокого
риска сердечно-сосудистых осложнений и смертности.
2. Пациенты, имеющие один из перечисленных ниже сердечно-сосудистых факторов риска, а именно артериальную гипертонию
(систолическое АД≥140 мм рт. ст. или диастолическое АД≥90 мм рт. ст.), лечение антигипертензивными препаратами и
дислипидемия (уровень липопротеидов низкой плотности ≥160 мг/дл), а также женщины в возрасте ≥55 лет либо в
постменопаузе, относятся к группе высокого риска.
3. Пациенты с другими заболеваниями, такими как гинекологическая патология, остеоартрит, желчнокаменная болезнь,
относятся к группе среднего риска NIH рекомендует пациентам с ИМТ≥25 кг/м2, а также мужчинам и женщинам с
окружностью талии более 102 см и более 88 см, соответственно, имеющим два или более фактора риска из перечисленных
выше, снижать массу тела [15]
Ожирение перестало быть исключительно эндокринологической проблемой. К ведению пациентов с этой патологией
необходимо привлекать кардиологов, гастроэнтерологов, хирургов, реабилитологов, диетологов и специалистов по
профилактической медицине, но прежде всего терапевтов. Большинство врачей в своей практике сталкиваются с пациентами
с первичным ожирением, которые нуждаются в рекомендациях по его лечению [16]. Показанием к фармакотерапии ожирения
являются увеличение ИМТ >30 кг/м2 при отсутствии эффекта от диеты и изменения образа жизни, увеличение
ИМТ 27-29,9 кг/м2 при наличии сопутствующих заболеваний, таких как артериальная гипертония, дислипидемия
и гиперинсулинемия, а также абдоминальное ожирение с наследственной предрасположенностью к сахарному диабету 2 типа
[17].
Как же правильно организовать лечение ожирения? В основе подхода, предложенного Европейским региональным бюро ВОЗ в
2007 г. [18], лежит признание хронического характера ожирения и, следовательно, необходимости долгосрочного лечения.
Следует воздерживаться от методов, гарантирующих быстрое снижение массы тела (более 5 кг в месяц). Снижение уровня
лептина из-за резкого похудания приводит к компенсаторному увеличению приема пищи и повторной прибавке массы тела.
Первоначальная цель лечения – снижение массы тела на 10% от исходной за 6 месяцев. Она может быть достигнута путем
модификации образа жизни, включающего в себя диету с пониженным потреблением калорий и повышение физической
активности. Если изменение образа жизни недостаточно для достижения поставленной цели или не позволяет поддерживать
достигнутый результат на протяжении длительного времени, то возможно назначение фармакотерапии [19]. Необходимо
помнить о том, что применение препаратов для лечения ожирения без соблюдения диеты дает незначительный эффект
[20,21]. Противопоказаниями для медикаментозного лечения ожирения являются детский возраст, беременность и период
лактации. Ниже обсуждаются лекарственные средства, которые в настоящее время могут быть использованы для лечения
больных с ожирением [22].
Единственным препаратом, получившим беспрекословное одобрение Американской администрации по контролю за пищевыми
продуктами и лекарствами (FDA), является орлистат, связывающийся с гастроинтестинальной липазой и тем самым
предотвращающий всасывание жира из кишечника (табл. 1). Относится к группе препаратов периферического действия.
Орлистат блокирует всасывание около трети жиров, поступающих с пищей. В 2-летнем рандомизированном исследовании
XENDOS (XENical in the prevention of Diabetes in Obese Subjects) лечение орлистатом по сравнению с плацебо привело к
снижению массы тела в среднем на 8% [23]. При приеме орлистата обязательно назначение жирорастворимых витаминов
группы А, Д, К и Е с целью профилактики гиповитаминоза. При лечении препаратом отмечается снижение уровней
холестерина и триглицеридов, что связано с повышенным гидролизом последних. Орлистат следует принимать во время еды
или не позднее, чем через час после приема пищи. При приеме с тиреоидными препаратами необходим интервал в 4 часа.
Из побочных эффектов следует отметить метеоризм и диарею. Противо пока заниями к назначению орлистата являются
холестаз и мальабсорбция. Необходимо помнить, что чем меньше количество жира в потребляемой пище, тем ниже
вероятность развития побочных эффектов. Орлистат может применяться у людей пожилого возраста, а также после
бариатрических операций [23].
| Препарат (торговое название) | Механизм действия | Среднее снижение массы тела | Страны, в которых используется препарат |
|---|---|---|---|
| Орлистат (Ксеникал) | Ингибитор желудочной и поджелудочной липазы | 2,9-3,4 кг за 1 год | Россия, США, Европа |
| Сибутрамин (Редуксин) | Высвобождение норэпинефрина | 3,6 кг за 2-24 нед | Россия |
| Фентермин (Адипекс) | Высвобождение норэпинефрина | — | США, Европа |
| Фентермин-топиромат (Ксимиа | Высвобождение норэпинефрина и модулирование активности GABA A-рецепторов | 8,6 кг за 1 год | США, Европа |
| Лоркасерин (Белвик) | Агонист серотонинового рецептора | 3,6 кг за 1 год | США, Европа |
| Лираглутид (Саксенда) | Агонист глюкагоноподобного пептида | 5,8 кг за 1 год | Россия, США, Европа |
Еще одним лекарственным средством для лечения ожирения является препарат центрального действия сибутрамин, который
селективно ингибирует обратный захват норэпинефрина и серотонина в синапсах ЦНС, в результате чего увеличивается
время нахождения нейромедиаторов в синапсах и, соответственно, время нейротрансмиссии. Он не вызывает лекарственной
зависимости. Прием сибутрамина необходимо сочетать с гипокалорийной диетой. Несмотря на значительное снижение массы
тела при назначении сибутрамина, при его применении было отмечено увеличение риска сердечно-сосудистых осложнений, в
результате чего в 2010 г. его использование было запрещено в США [24]. Однако в России сибутрамин продолжает
использоваться для лечения ожирения [25]. С января 2008 г. он входит в список сильнодействующих препаратов, которые
отпускаются только по рецепту.
К представителям центральных симпатомимети ческих аноректиков относится также фентермин, оказывающий как
адренергическое, так и серотонинергическое действие. В клинических исследованиях было показано, что фентермин
вызывает сходное снижение массы тела как при непрерывном ежедневном его применении, так и при назначении короткими
курсами. Пациенты, получавшие фентермин в сочетании с гипокалорийной диетой, добивались более существенного снижения
массы тела по сравнению с пациентами, соблюдавшими только гипокалорийную диету [26]. Терапию фентермином следует
назначать пациентам с ИМТ >30 кг/м2 либо пациентам с ИМТ >27 кг/м2, имеющим факторы риска.
Противопоказания к назначению фентермина включают в себя легочную гипертензию, пороки сердца, гипертиреоз,
беременность и прием алкоголя. Препарат может вызывать тахикардию, повышение АД, головную боль, головокружение,
сухость во рту, бессонницу. Назначают в дозе от 15 до 37,5 мг 1 раз в день или по 8 мг 3 раза в день до еды [27].
К числу новых лекарственных средств, которые могут быть использованы для лечения ожирения, относится комбинированный
препарат фентермин/топиро мат [28]. Эффективность и безопасность его изучались в исследованиях EQUIP, CONQUER,
SEQUEL [29-31]. Прием препарата в течение года вызывал снижение массы тела на 7,5-9,3%. Первоначально его назначают
на 2 недели в дозе 3,75 мг топирамата и 23 мг фентермина, а в дальнейшем дозу увеличивают вдвое на последующие 2
недели. Противопоказаниями для приема фентермина/топиромата являются гипертиреоз, прием ингибиторов МАО и
беременность. Побочные эффекты включают в себя нарушение концентрации внимания, гиперестезию, когнитивные нарушения
и депрессию. Описаны случаи рождения детей с «волчьей пастью» при приеме препарата во время беременности. Следует
особо отметить, что во время применения препарата рекомендуется периодический контроль за электролитным обменом,
учитывая возможность изменения концентрации натрия и бикарбонатов в крови [28].
Завершена 2 фаза исследований комбинированной терапии бупропионом и налтрексоном. Бупропион ингибирует обратный
захват норадреналина и дофамина, а налтрексон блокирует опиоидные рецепторы [32]. Комбинация бупропиона и
налтрексона используется для лечения больных с ожирением, отказавшихся от курения в 18 странах Восточной Европы и
Турции. В связи с отсутствием достаточной информации о препарате FDA не рекомендовала его использование для лечения
ожирения в США. В 56-недельном исследовании применение комбинированного препарата привело к снижению массы тела на
6,1-9,3%. Побочные эффекты – головные боли, головокружения, запоры, сухость во рту, рвота, бессонница.
Противопоказания к приему бупропиона/налтрексона включают в себя неконтролируемую артериальную гипертонию,
эпилепсию, анорексию, хроническое применение или внезапное прекращение приема опиоидных препаратов, беременность. Не
рекомендуется прием с другими антидепрессантами [32].
Одними из перспективных препаратов для лечения ожирения считают аналоги глюкагоноподобного пептида 1 (GLP-1).
Лираглутид – пролонгированный препарат из группы GLP-1 аналогов. Он стимулирует высвобождение инсулина из
поджелудочной железы, способствуя улучшению контроля гликемии, а также стимулирует чувство насыщения и уменьшает
потребление пищи. Препарат первоначально использовался для лечения сахарного диабета 2 типа. В трех исследованиях
программы SCALE (SCALE OBESITY AND PREDIABET, SCALE DIABET, SCALE APNOE) участвовали 5700 пациентов. В исследовании
SCALE OBESITY у 3731 пациента с ожирением лечение лираглутидом в дозе 3 мг/сут в течение 56 недель привело к
снижению массы тела на 5-8%. В исследовании SCALE DIABET назначение лираглутида в дозе 3 мг/сут привело не только к
снижению массы тела, но и к стабилизации контроля гликемии. Противопоказаниями к приему препарата являются наличие в
анамнезе у пациентов семейных случаев медуллярного рака щитовидной железы и беременность, однако отметим, что он
разрешен к приему у лиц старше 65 лет, после бариатрических операций и при приеме алкоголя [33,34].
Перспективным препаратом для лечении ожирения у больных сахарным диабетом является аналог амилина прамлинтид. Амилин
дополняет роль инсулина в регуляции глюкозы, замедляет опорожнение желудка, уменьшает секрецию глюкагона. Назначение
прамлинтида с инсулином при сахарном диабете 1 типа оказывает действие и на массу тела. Недостатком препарата
является то, что он должен вводиться во время каждого приема пищи. Побочным эффектом является тошнота [35].
Представителем селективных агонистов рецепторов серотонина является лоркасерин, который относится к группе
црепаратов центрального действия. Эффект препарата достигается за счет тормозящего влияния на центр голода в
гипоталамусе. Разрешен к применению в США и Турции с 2013 года, но не зарегистрирован в странах Евросоюза. В
исследование BLOOM у 3182 пациентов с ожирением лечение лоркасерином в течение 1 года привело к снижению массы тела
на 5%, а в исследовании BLOOM-DM, проведенном у 604 пациентов с сахарным диабетом 2 типа и ожирением, прием
лоркасерина в течение 52 недель привел не только к снижению массы тела на 5%, но и к снижению показателей гликемии и
уровня гликогемоглобина, что сделало возможным его применение при сахарном диабете 2 типа. Побочными эффектами
являются головная боль, головокружения, сонливость и тошнота [36].
В настоящее время продолжаются клинические исследования еще ряда лекарственных средств для лечения ожирения. Одним
из них является сетилистат, ингибитор гастроинтестинальной и панкреатической липазы, имеющий сходный с орлистатом
механизм действия. В США и Европе завершены клинические исследования 3 фазы, а в Японии проводится исследование 3
фазы. В 12-недельном исследовании у пациентов с ожирением без сахарного диабета лечение сетилистатом, привело к
значительному снижению массы тела, а также сывороточных уровней общего холестерина и холестерина липопротеидов
низкой плотности по сравнению с контрольной группой [37]. При применении препарата у пациентов с ожирением и
диабетом было выявлено снижение уровней гликогемоглобина [38]. Побочные эффекты включали в себя тенезмы, нарушение
всасывания некоторых витаминов, в частности Д и Е, образование камней в почках и желчном пузыре. Ввиду увеличения
риска развития гипогликемии и кровотечения, препарат противопоказан лицам, получающим тиреоидные гормоны и варфарин
[37].
Еще один экспериментальный препарат – лептин, который представляет собой пептидный гормон жировой ткани. В переводе
с греческого означает «тонкий». Лептин циркулирует в крови в свободной и связанной формах. Уровень лептина в
сыворотке крови отражает суммарный энергетический резерв жировой ткани и может изменяться при кратковременных
нарушениях энергетического баланса и изменениях концентрации некоторых цитокинов и гормонов, также циркулирующих в
крови. Связывание лептина со специфическими рецепторами в гипоталамусе изменяет экспрессию ряда нейропептидов,
регулирующих нейроэндокринную функцию, потребление и расход энергии в организме. Поэтому лептин играет важную роль в
развитии ожирения и нарушений аппетита; считается, что он участвует в развитии нейроэндокринной ответной реакции на
голодание. В настоящее время лептин применяется для лечения липодистрофии. В связи с наличием данных о накоплении
жира при прекращении приема препарата FDA не рекомендует его для лечения ожирения. Увеличение дозы лептина не
приводит к увеличению степени снижения массы тела [39].
Грелин – аналог лептина, действующий непосредственно на ЦНС. Является одним из перспективных препаратов для лечения
ожирения. Вызывает снижение чувства голода, замедление всасывания жиров, предотвращение уменьшения энергетических
запасов организма. Уровень грелина прямо пропорционален уровню лептина [40].
Препарат ресвеватрол в эксперименте на мышах активировал окисление свободных жирных кислот, тем самым улучшая
чувствительность к инсулину [40].
Атомоксетин, ингибируя обратный захват норэпинефрина, резко уменьшает аппетит и снижает выраженность импульсивного
поведения, которое считают основным механизмом развития пищевых зависимостей [41]. Препарат используют для лечения
нарушений концентрации внимания с гиперактивностью. Высказано предположение, что он может найти применение и для
лечения ожирения.
Велнеперит – это мощный и селективный антагонист Y5-рецепторов нейропептида Y, который уменьшает чувство голода и
контролирует расход энергии в организме [41]. Препарат PF 04620110 катализирует реэстерификацию триглицеридов в
тонком кишечнике и тем самым уменьшает абсорбцию липидов в желудочно-кишечном тракте [41]. До 6% людей с тяжелым
ожирением, развивающимся в детском возрасте, имеют мутации в гене рецептора меланокортина 4-го типа (MC4R).
Недостаточность MC4R – самая распространенная причина моногенного ожирения у человека. Ген MC4R кодирует
нейрональный меланокортиновый рецептор, который является фактором регуляции пищевого поведения (подавляющим аппетит)
и энергетического баланса [42]. В настоящее время несколько препаратов (меланокортин-4, оксинтомодулин),
разработанные для целенаправленной терапии данного варианта ожирения, проходят клинические испытания.
Заключение
Расширение спектра препаратов, предназначенных для лечения ожирения, позволяет надеяться на улучшение
результатов борьбы с этим заболеванием. Следует отметить, что обобщенный алгоритм ведения пациента с ожирением,
сформированный на основе рекомендаций включает непрерывный контакт с больным на всех этапах оказания медицинской
помощи (диета, дозирование физической активности, помощь психолога, необходимость медикаментозного или
хирургического лечения). Только такой подход позволяет достичь устойчивого снижения массы тела и обеспечить
улучшение состояния здоровья пациента.
Используемые источники
- Салихова А.С., Фархутдинова Л.М., Аллабердина Д.У. Ожирение – эпидемия XXI века. История исследования и современный взгляд на проблему. Вестник медицинской академии РБ 2012;17(1):32-8 [Salikhova AS, Farkhutdinova LM, Allaberdina DU. Obesity – epidemic of the XXI century. Research history and modern view of the problem. Vestnik meditsinskoy akademii RB 2012;171):32-8 (In Russ.)].
- Raily J, Diouf A, Monyeki A. Determining the worldwide prevalence of obesity. Lancet 2018;391(10132):1773–4.
- Hodge A, Dowse G, Koki G. Modernity and obesity in coastal and highland Papua New Guinea. Intern J Obesity 1995;19(3):154-61.
- Hernandez B., Peterson K. Association of obesity with physical activity, TV program and other forms among children in Mexico. Intern J Obesity 1999;23(8):845.
- Olaya B, Moneta MV, Pez O, et al. Country level and individual correlates of overweight and obesity among primary school children a cross sectional study in seven European countries. BMC Public Health 2015;15:475.
- Stunkard AJ, Faith MS, Allison KC. Depression and obesity. Biol Psychiatry 2003;54:330-7.
- Calle EE, Rodrigues C, Walker-Thurmond K, Thun MJ. Overweight, obesity, and mortality from cancer in a prospectively studied cohort of US adults. N Engl J Med 2003;348;1625-38.
- Alberti KG, Zimmet P, Shaw J. The metabolic syndrome – a new worldwide definition. Lancet 2005;366:1059–62.
- World health organization WHO facts sheet on overweight and obesity Updates October 2017. http://www.whoint|mediacenter|factssheets||fs311|en (access date: 08.12.2017).
- The CBD 2015 Obesity Collaboration. Health effects of overweight and obesity in 195 countries over 25 years. N Engl J Med 2017:377:13-27.
- WHO: Obesity: preventing and managing the Global Epidemic: Report of a WHO Consultation Geneva, WHO technical Report Series 894, 2000.
- The challenge of obesity in the WHO European Region and the strategies for response. F.Branca, H.Nikogosian, T.Lobstein (eds). WHO, 2007. https://www.euro.who.int/__data/assets/pdf_file/0008/98243/E89858.pdf.
- Бурков С.Г., Ивлева А.Я. Избыточный вес и ожирение – проблема медицинская, а не косметическая. Ожирение и метаболизм 2010;3:15-9. [Burkov SG, Ivleva AYa. Overweight and obesity is a medical problem, not cosmetic. Ozhirenie i metabolizm 2010;3:15-9 (In Russ.)].
- National Institutes of Health. NHLBI Obesity Education Initiative Expert Panel on the Identification, Evaluation, and Treatment of Overweight and Obesity in Adults.Bethesda: NIH; 2000. The Practical Guide: Identification, Evaluation, and Treatment of Overweight and Obesity in Adults. www.nhlbi.nih.gov/files/docs/ guidelines/prctgd_c.pdf.
- MacLean PS, Wing R, Davidson T, et al. NIH working group report: Innovative research to improve maintenance of weight loss. Obesity (Silver Spring) 2015; 23(1):7-15.
- Мельниченко Г.А. Ожирение в практике эндокринолога. РМЖ 2001;9(2): 82–7 [Melnichenko GA. Obesity in the practice of an endocrinologist. RMZh 2001;9(2):82–7 (In Russ.)].
- US Preventative Services Task Force. Screening for Obesity in Adults. US Preventative Services Task Force: Rockville, MD, 2011.
- Obesity in the WHO European Region and strategies for addressing it. Summary. Copenhagen, WHO Regional Office for Europe, 2007. http://www.euro.who.int/InformationSources/Publications/Catalogue/20070220_ 1.
- Snow V, Barry P, Fitterman N, et al. Pharmacologic and surgical management of obesity in primary care: a clinical practice guideline from the American College of Physicians. Ann Intern Med 2005;142;525-31.
- Fujioka K. Management of obesity as a chronic disease; nonpharmacologic, pharmacologic and surgical options. Obes Res 2002;10(Suppl 2);116S-23S.
- Wasan KM, Looije NA. Emerging pharmacological approaches to the treatment of obesity. J Pharm Pharm Sci 2005:8:259-71.
- Yumuk V, Tsigos C, Toplak H. European guidelines for obesity management in adults Obes Facts 2015;8(6):402-24.
- Torgerson JS, Hampton J, Boldrin MN et al. XENical in the prevention of diabetes in obese subjects (XENDOS) study: a randomized study of orlistat as an adjunct to lifestyle changes for the prevention of type 2 diabetes in obese patients. Diabetes Care 2004;27;155-61.
- Payer J1, Hainer V, Ondrejka P, Kajtor Z. Sibutramin in obesity treatment (multicenter, open, prospective 12-month-long study). Vnitr Lek 2004;50(11):825-9.
- Аметов А.С. Отчет о программе ВЕСНА. Эффективное лечение ожирения – путь борьбы с эпидемией сахарного диабет. Эндокринология: новости, мнения и обучение 2013;2(3):12-16 [Ametov AS. Report on the program SPRING. Effectively treating obesity is the way to fight the diabetes mellitus epidemic. EHndokrinologiya: novosti, mneniya i obuchenie 2013;2(3):12-16 (In Russ.)].
- Hendricks EJ, Srisurapanont M, Schmidt SL, et al. Addiction potential of phentermine prescribed during long-term treatment of obesity. Int J Med Obes (Lond) 2014;38:292-8.
- Smith SM, Meyer M, Trindley KE. Phentermine-topiramate for the treatment of obesity Ann Pharmacother 2013;47(3)340-9.
- Allison DB, Gadde KM, Garvey VT, et al. Controlled release phentermine/topiromat ion severely obese adults: a randomized controlled trial (EQUIP). Obesity (Silver Spring) 2012;20:330-42.
- Gadde KM, Allison DB, Ryan DH, et al Effects of low dose, controlled release phentermine plus topiromate combination on weight and associated comorbidities in overweight and obese adults (CONQUER) a randomized placebo-controlled phase 3 trial. Lancet 2011;377:1341-52.
- Garvey WT, Ryan DH, Look M et al. Two year sustained weight loss and metabolic benefits with controlled release phentermine|topiromate in obese and overweight adults (SEQUEL) a randomized placebo-controlled, phase 3-extension study. Am J Clin Nutr 2012;95:297-308.
- Apovian CM, Rubin D. A randomized phase 3 trials of naltrexone SR bupropion SR on weight and obesity related risk factors (COR-II). Obesity (Silver Spring) 2016;21(5):935-43.
- Daniels GH, Hegedüs L, Marso SP, et al. LEADER 2: baseline calcitonin in 9340 people with type 2 diabetes enrolled in the Liraglutide Effect and Action in Diabetes: Evaluation of cardiovascular outcome Results (LEADER) trial: preliminary observations. Diabetes Obes Metab 2015;17(5):477-86.
- Astrup A, Carraro R, Finer N, et al. Safety, tolerability and sustained weight loss over 2 years with the once-daily human GLP-1 analog, liraglutide. Int J Obes (Lond) 2012;36:843-54.
- Smith SR, Aronne LJ, Burns CM, et al. Sustained weight loss following 12-month pramlintide treatment as an adjunct to lifestyle intervention in obesity. Diabetes Care 2008;31(9):1816–23.
- Thomsen WJ., Grottick AJ, Menzagh F, et al. Lorcaserin a novel selective human 5-hydroxytryptamine 2C agonist in vitro and in vivo pharmacological characterization. J Pharmacol Exp Ther 2008;325:577-87.
- Kopelman P, Bryson A, Hycling R, et al. Cetilistat (ATL-962), a novel lipase inhibitor: A 12-week randomized, placebo-controlled study of weight reduction in obese patients. Intern J Obes 2007;31:494-9.
- Kopelman P, de Groot G, Rissanen A et al. Weight loss, HbA1c reduction and tolerability of cetilistat in a randomized, placebo-controlled phase 2 trial in obese diabetics comparison with orlistat (Xenical). Obesity (Silver Spring) 2010;18(1): 105-15.
- Roujeaul C, Jockers R, Dam J. New pharmacological perspectives for the leptin receptor in the treatment of obesity. Front Endocrinol (Lausanne) 2014;5:167.
- Hainer V. Overview of new antiobesity drugs. Expert Opin Pharmacol 2014:14; 1975-78.
- Bhat SR, Sharma A. current drug targets in obesity pharmacotherapy – a review. Curr Drug Targets 2017;8:983-93.
- Lubrano-Berthelier C, Dubern B, Lacorte JM, et al. Melanocortin 4 receptor 983-993mutations in a large cohort of severely obese adults: prevalence, functional classification, genotype-phenotype relationship, and lack of association with binge eating. J Clin Endocrinol Metab 2006;91(5):1811-8.
Версия на английском языке
Лоркасерин — препарат для лечения ожирения и избыточной массы тела, снижающий аппетит за счет активации серотониновых рецепторов типа 5-HT2C, расположенных в центре регуляции аппетита в гипоталамусе. Препарат разрешен к применению в США (пока не зарегистрирован в Европе и РФ), однако врачи назначают его не слишком широко, опасаясь побочных эффектов со стороны сердечно-сосудистой системы. Эти опасения основаны на сходстве молекулы лоркасерина с другим более старым препаратом – фенфлурамином, вызывавшим повреждение клапанов сердца (утолщение створок, хорд).
Компания- производитель выпустило пресс-релиз с описанием основных результатов проспективного постмаркетингового исследования CAMELLIA-TIMI 61. В многоцентровое рандомизированное плацебо-контролируемое исследование было включено 12 тыс. пациентов с уже существующей патологией сердечно-сосудистой системы, либо с сахарным диабетом 2 типа. Сообщается, что частота первичной конечной точки сердечно-сосудистая смерть, ИМ и инсульт в группе приема лоркасерина 10 мг 2 раза в сутки не превышала таковую в группе плацебо. Кроме того, у принимающих данный препарат пациентов снижалась вероятность развития сахарного диабета 2 типа (если они ранее им не страдали). Также улучшался контроль таких факторов риска сердечно-сосудистых заболеваний, как артериальная гипертония, почечная функция, гипергликемия, гиперлипидемия. Прием лоркасерина сопровождался достоверным снижением массы тела, в том числе – у пациентов с сахарным диабетом и апноэ во время сна.
Полные данные планируется доложить на предстоящем Европейском Конгрессе Кардиологов и Конгрессе Европейской Ассоциации диабета.
В ранее проведенных исследованиях частота вновь возникшей клапанной патологии на фоне приема лоркасерина достоверно не отличалась от таковой по сравнению с плацебо.
По материалам:
Press Release: Eisai Inc. Announces Positive Topline Results from CAMELLIA-TIMI 61, a Large-Scale Cardiovascular Outcome Trial for the Anti-Obesity Agent BELVIQ®
http://eisai.mediaroom.com/2018-07-17-Eisai-Inc-Announces-Positive-Topline-Results-from-CAMELLIA-TIMI-61-a-Large-Scale-Cardiovascular-Outcome-Trial-for-the-Anti-Obesity-Agent-BELVIQ-R
Текст подготовлен к.м.н. Шахматовой О.О.
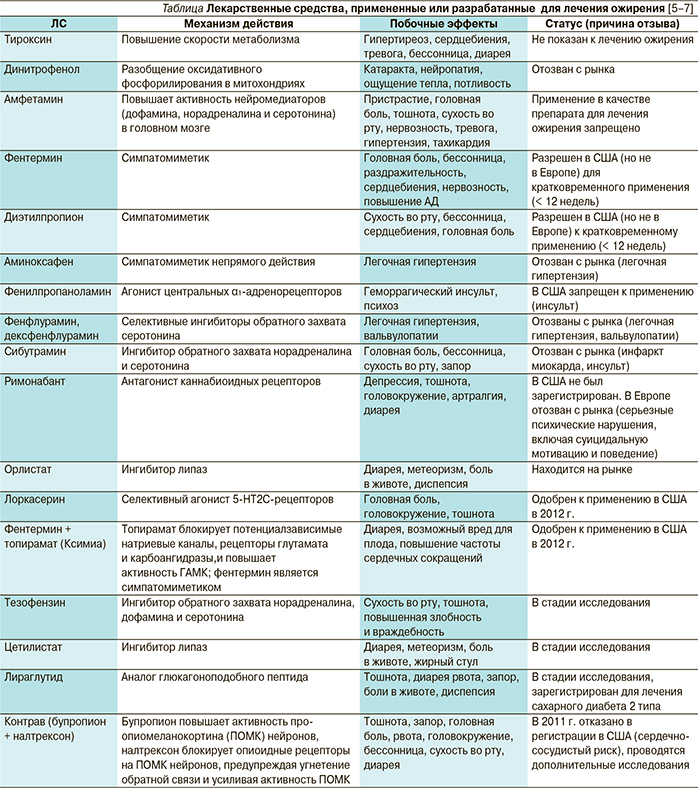
На фармацевтический рынок США поступило два новых препарата для лечения ожирения – Белвик (лоркасерин, Eisai/Arena Pharmaceuticals) и Ксимиа* (комбинация фентермина и топирамата с контролируемым высвобождением действующего вещества, Vivus). Оба препарата были одобрены к медицинскому применению год назад (в июне и июле 2012 г.) и стали первыми зарегистрированными в стране за последние 13 лет лекарственными средствами (ЛС) длительной терапии ожирения [1]. Регистрация лоркасерина и комбинации фентерамина с топираматом была отнесена журналом Nature к числу самых значимых достижений в области фармации в 2012 г. [2], что обусловлено широкой распространенностью ожирения, его клиническими, социальными и экономическими последствиями, а также недостатком препаратов с хорошим соотношением польза/риск для его лечения. Несмотря на многочисленные попытки разработать эффективные ЛС для лечения ожирения, большинство из них или не были одобрены к применению по данному показанию, или отозваны с рынка из-за серьезных нежелательных реакций (см. таблицу). После отзыва сибутрамина единственным ЛС, разрешенным к длительному применению больными ожирением, стал орлистат, тоже не лишенный серьезных недостатков (невысокая эффективность, желудочно-кишечные побочные эффекты, редкие случаи гепатотоксичности) [3, 4].
Лоркасерин и комбинация фентермин/топирамат не были одобрены FDA с первого раза. В 2010 г. FDA оценило соотношение польза/риск лоркасерина как неблагоприятное в связи с его недостаточной эффективностью в клинических исследованиях и повышенным риском развития некоторых опухолей (аденокарцином молочной железы у самок и астроцитом головного мозга у самцов), наблюдавшихся в экспериментах на крысах, а также риска развития вальвулопатий, психических, когнитивных и серотонинергических побочных эффектов [6].
Согласно стандартам FDA, препарат для лечения ожирения должен снижать массу тела в течение года не менее чем на 5 % по сравнению с плацебо, а число пациентов, у которых достигнуто 5-процентное снижение веса, должно не менее чем в 2 раза превышать таковое в группе плацебо [3]. Лоркасерин не отвечал первому критерию – среднее снижение веса при его применении составило 5,8 % по сравнению с 2,5 % в группе плацебо, т. е. разница между группами (3,3 %) не достигала необходимого уровня. Однако он удовлетворял другому критерию – число пациентов, у которых спустя 1 год лечения масса тела снизилась не менее чем на 5 %, составило в группе активного препарата 47 % по сравнению с 22 % в группе плацебо [8]. В письме производителю FDA определило клиническую эффективность препарата как «минимальную» [9]. Отказав в регистрации препарата в 2010 г., FDA рекомендовало производителю предоставить заключительный отчет исследования BLOOM-DM (Behavioral modification and Lorcaserin for Overweight and Obesity Management in Diabetes Mellitus) [10].
Результаты этого исследования, а также тщательный анализ других клинических и экспериментальных данных независимыми экспертами, показали, что применение лоркасерина позволяют достигать клинически значимого снижения массы тела, отвечающего требованиям регуляторных органов США, и ассоциировалось с рядом других благоприятных эффектов на кардиометаболические и антропометрические параметры, в т. ч. на артериальное давление, уровень холестерина ЛПНП, объем талии и гликированный гемоглобин у пациентов с сахарным диабетом [6, 8]. Также было показано, что опухоли молочной железы, выявленные у животных, значительно чаще носили доброкачественный характер, чем предполагали ранее [6]. Концентрации препарата в центральной нервной системе у людей были низкими [11], что позволило предположить низкую вероятность развития опухолей головного мозга у человека [5]. Результаты исследований in vitro указывали на то, что в рекомендуемых терапевтических дозах влияние лоркасерина на рецепторы 5-HT2B, стимуляция которых может приводить к развитию легочной гипертензии и вальвулопатиям, маловероятно [11]. В клинических испытаниях недостоверно повышенный риск вальвулопатий наблюдался лишь в одном из трех исследований III фазы (2,9 % в конце 52-й недели при применении в дозе 10 мг 2 р/сут против 0,5 % в группе плацебо, р = 0,122) [10]. По результатам анализа объединенных данных трех исследований (n = 5249), частота вальвулопатий достоверно не различалась в группах лоркасерина и плацебо [12]. Отношение рисков развития вальвулопатии при применении лоркасерина в разных дозах составляло от 1,03 до 1,16 и по крайней мере частично могло быть связано с более выраженным снижением массы тела в группе активного препарата.
На основании данных повторного анализа FDA пришло к заключению, что польза от применения лоркасерина превышает риски, и наряду с диетой и физической активностью рекомендовало его для длительного контроля веса взрослым лицам с индексом массы тела (ИМТ) 30 кг/м2 и более, а также лицам с ИМТ 27 кг/м2, имеющим по крайней мере одно из сопутствующих повышенному весу состояний, – сахарный диабет, артериальную гипертензию или дислипидемию. Следует отметить, что результаты голосования Консультативной комиссии FDA при повторном рассмотрении заявки на регистрацию лоркасерина не были единогласными (18 – «за», 4 – «против») – преимущественно из-за опасений по поводу сердечно-сосудистого риска.
Препарату присвоена категория IV в классификации контролируемых веществ Управления по борьбе с наркотиками (Drug Enforcement Agency) США (достаточно низкий потенциал развития зависимости). Это связано с тем, что стимуляция 5-HT2A-рецепторов может приводить к развитию галлюциногенных эффектов и эйфории, что наблюдалось в единичных случаях при применении лоркасерина [13]. В классификации безопасности применения во время беременности FDA он отнесен к категории X (выявлены нарушения развития плода или имеются доказательства риска отрицательного воздействия данного лекарства на плод человека, применение абсолютно противопоказано – не существует ситуаций, когда польза для матери превышала бы риск для плода) [14]. С целью повышения безопасности применения препарата в реальной медицинской практике FDA обязало производителя разработать стратегию REMS (Risk Evaluation and Mitigation Strategies), направленную на выявление рисков в пострегистрационном периоде, и внедрение адекватных мер по минимизации их последствий.
Примерно такой же путь к регистрации в США пришлось преодолеть комбинации фентермина и топирамата. При рассмотрении первой заявки FDA отказало в ее регистрации из-за соображений безопасности, несмотря на убедительные доказательства эффективности (средняя потеря веса в течение года – около 10 %) [15]. В частности, опасения членов Консультативной комиссии вызвали нежелательные явления со стороны сердечно-сосудистой системы, особенно повышение частоты сердечных сокращений в покое, а также психические расстройства, включая суицидальные мысли, когнитивные расстройства, в т. ч. нарушения памяти, врожденные аномалии и метаболический ацидоз [3]. FDA не потребовало от производителя проведения новых исследований, но запросило дополнительную информацию, позволяющую более точно оценить риски [16]. После повторного рассмотрения представленных материалов Консультативная комиссия подавляющим большинством голосов (20 против 2) рекомендовала одобрение применения комбинации фентермина и топирамата под новым торговым наименованием «Ксимиа» по тем же показаниям, что и лоркасерин, с рядом предостережений. В частности, в инструкции по медицинскому применению Ксимии подчеркивается, что ее влияние на сердечно-сосудистую заболеваемость и смертность не установлено. Фентермин/топирамат не рекомендован больным с нестабильной стенокардией и цереброваскулярной болезнью, при его применении необходимо мониторировать частоту сердечных сокращений [5].
Препарат отнесен к категории Х по классификации безопасности применения во время беременности. Это связано с повышенным риском тератогенности (преимущественно ротолицевые расщелины), выявленным при применении топирамата в виде монотерапии больных эпилепсией [17]. Ксимиа может также вызывать метаболический ацидоз, негативно влияющий на оксигенацию и развитие плода, и таким образом повышать риск других неблагоприятных исходов беременности, включая внутриутробную смерть. Кроме того, фентермин относится к контролируемым веществам: в классификации Управления по борьбе с наркотиками США он относится к категории III, т. е. риск развития зависимости при его применении оценивается выше, чем при применении лоркасерина. Для оценки и минимизации всех рисков, связанных с применением Ксимии, производителем разработана стратегия REMS.
В Европе, где требования регуляторных органов к регистрации препаратов для лечения ожирения отличаются большей строгостью, чем в США (10-процентное снижение массы тела от исходного уровня, которое должно поддерживаться на протяжении 1 года и на 5 % превышать уровень, достигнутый в группе плацебо) [15], обоим новым препаратам для лечения ожирения было отказано в регистрации. Производитель лоркасерина отозвал заявку на регистрацию препарата в Европе, указав в качестве причины невозможность решить с регуляторным агентством вопросы, касающиеся данных экспериментальных исследований, во временных рамках регистрационного процесса [18].
Однако возможно, что основной причиной отказа от регистрации в Евросоюзе является умеренная эффективность препарата, не удовлетворяющая критериям EMA. Что касается комбинации фентермина с топираматом, то EMA дважды отказывало в ее регистрации, потребовав от производителя провести дополнительные исследования по изучению его безопасности со стороны сердечно-сосудистой системы и ЦНС при долгосрочном применении [19].
Фармакологические свойства и результаты клинических исследований лоркасерина
Лоркасерин является мощным агонистом рецепторов 5-гидрокситриптамина (серотонина) с избирательным действием на 5-HT2C-рецепторы, расположенные преимущественно в центральной нервной системе, в т. ч. в гипоталамусе. Предполагают, что последние играют основную роль в серотонинэргическом контроле аппетита [20]. Стимуляция 5-HT2C-рецепторов в гипоталамусе приводит к устранению чувства голода и быстрому появлению ощущения насыщения даже после приема небольшого количества пищи. При этом сродство препарата к другим серотонинэргическим рецепторам 5-HT2A и 5-HT2B, соответственно, в 15 и 100 раз ниже, чем к 5-HT2C-рецепторам [11].
Эффективность и безопасность лоркасерина изучались в трех больших многоцентровых исследованиях III фазы клинических испытаний – BLOOM ((Behavioral Modification and Lorcaserin for Overweight and Obesity Management) (n = 3800) [21], BLOSSOM (Behavioral modification and Lorcaserin Second Study for Obesity Management) (n = 4008) [22] и BLOOM-DM (Behavioral Modification and Lorcaserin for Obesity and Overweight Management in Diabetes Mellitus) (n = 604) [10]. В первых двух препарат изучали на лицах с повышенной массой тела или ожирением без осложнений (т. н. здоровые), в третьем – у больных с повышенной массой тела/ожирением и сахарным диабетом. К концу 52-й недели применения лоркасерина снижение массы тела по отношению к плацебо составило у «здоровых» лиц в первом исследовании 3,6 кг (3,6 % массы тела) [21], во втором – 2,9 кг [22], у больных сахарным диабетом – 3,1 кг [10]. Пятипроцентное снижение массы тела было соответственно достигнуто у 27,2 %; 22,2 и 21,4 % участников, принимавших активный препарат. Согласно результатам мета-анализа рандомизированных контролируемых исследований препарата продолжительностью год, среднее снижение массы тела под его влиянием по отношению к плацебо составило 3,23 кг, снижение ИМТ – 1,16 кг/м² [23].
При применении лоркасерина в течение 8 и 12 недель соответствующие показатели снижения массы тела были равны 1,6 и 2,9 кг. Таким образом, полученные результаты существенно не отличались от результатов исследования неселективного агониста серотониновых рецепторов дексфенфлурамина [24], и предположение о том, что избирательное действие на 5-HT2C-рецепторы будет способствовать более выраженному влиянию на вес, не подтвердилось [15]. Лоркасерин в меньшей степени снижал массу тела, чем отозванные с рынка римонабант [25–27] или сибутрамин [28, 29].
В клинических исследованиях III фазы снижения массы тела не менее чем на 5 % удалось достичь лишь 45 % участников, получавших лоркасерин [30]. Однако его применение ассоциировалось с другими благоприятными эффектами – уменьшением объема талии, снижением АД, общего холестерина, холестерина ЛПНП, триглицеридов и гликированного гемоглобина у больных сахарным диабетом [10, 23].
Лоркасерин в целом хорошо переносился. Основной причиной выбывания из исследований (45–50 % пациентов) была недостаточная эффективность, а не проблемы с переносимостью [31]. В клинических исследованиях лоркасерин чаще по сравнению с плацебо вызывал головную боль, тошноту и головокружение, реже – диарею [23]. Применение лоркасерина ассоциировалось с повышенным риском острых нарушений зрения, легких депрессивных и когнитивных расстройств, включая нарушения памяти [21, 22]. При одновременном применении лоркасерина с другими серотонинэргическими или антидопаминергическими препаратами существует риск развития серотонинового синдрома [32]. Лоркасерин противопоказан беременным и женщинам, планирующим беременность, а также матерям, кормящим грудью.
Препарат рекомендуется отменять пациентам, которым в первые 12 недель лечения не удается достичь снижения массы тела на 5 %, т. к. клинические исследования показали, что в этом случае вероятность достижения эффекта при более длительной терапии крайне низка [31].
Фармакологические свойства и результаты клинических исследований комбинации фентермина с топираматом
Компоненты комбинации фентермин/топирамат давно используются в медицинской практике для снижения массы тела. Симпатомиметик фентермин официально разрешен в США только для кратковременного (до 12 недель) применения, т. к. его эффективность и безопасность при длительном использовании не изучались. Применение противоэпилептического препарата топирамата по данному показанию является off-label, хотя его способность снижать массу тела была показана в рандомизированных контролируемых исследованиях. Согласно результатам мета-анализа этих исследований, он достоверно снижает массу тела в среднем на 3,95 кг [33]. Точный механизм действия топирамата, приводящего к снижению массы тела, не известен. Предполагают, что он опосредован через блокаду потенциалзависимых натриевых каналов, рецепторов глутамата и митохондриальной карбоангидразы, повышение активности ГАМК [34]. Комбинация фентермина с топираматом вызывает подавление аппетита и усиливает ощущение насыщения [30]. Не исключено, что препарат также повышает затраты энергии, что было показано в экспериментах на животных [35].
Комбинация предназначена для однократного приема в сутки внутрь. В клинических исследованиях она изучалась в трех дозах – 3,75 мг фентермина/23 мг топирамата (низкая доза), 7,5/46 мг (средняя доза) и 15/92 мг (полная доза) соответственно.
В 6-месячном исследовании II фазы был продемонстрирован синергидный эффект компонентов комбинации, 42 % пациентов достигли снижения массы тела более чем на 10 % по сравнению с плацебо [23]. При сравнении с результатами клинических исследований других препаратов фентермин/топирамат по эффективности превосходил орлистат, сибутрамин и римонабант [25, 27, 36, 37], а также лоркасерин [38].
В трех больших клинических исследованиях III фазы с участием в общей сложности более 4500 взрослых лиц с ожирением, в т. ч. с сопутствующими заболеваниями (сахарный диабет 2 типа, гипертензия, дислипидемия), снижение массы тела не менее чем на 5 % по отношению к плацебо было достигнуто примерно 75 % участников, получавших фентермин/топирамат [30]. К концу 56-й недели лечения среднее снижение массы тела составляло 10,6 %, 8,4, и 5,1 % при применении доз 15/92 мг, 7,5/46 и 3,75/23 мг соответственно по сравнению с 2,5 % в группе плацебо (p < 0,0001) [38]. У участников, получавших активный препарат в средней и полной дозе, отмечено снижение по сравнению с группой плацебо систолического давления, уровня триглицеридов и инсулина натощак, повышение холестерина ЛПВП [3]. Снижение уровня общего холестерина и холестерина ЛПНП, а также диастолического давления наблюдалось только в подгруппе, получавшей фентермин/топирамат в дозе 15/92 мг. Благоприятное влияние препарата на массу тела сохранялось не менее двух лет [39].
Среди нежелательных явлений, зарегистрированных в клинических исследованиях, преобладали эффекты, характерные для компонентов комбинации, – сухость во рту, запор, бессонница, сердцебиения, головокружение, парестезии, нарушение внимания в сочетании с головной болью, нарушение вкусовых ощущений, алопеция и гипокалиемия. Из них с частотой более 5 % встречались парестезии, головокружение, нарушения вкуса, бессонница, запор и сухость во рту [38]. Препарат может провоцировать острые нарушения зрения и закрытоугольную глаукому. Возможно развитие симптомов депрессии, суицидальных мыслей и нарушение когнитивных функций, особенно в начале лечения. Так же как лоркасерин, фентермин/топирамат противопоказан беременным и кормящим грудью женщинам, а женщинам репродуктивного возраста в период лечения рекомендуется применение надежных средств контрацепции.
Таким образом, на рынке США появилось два новых препарата для лечения ожирения. Один из них, фентермин/топирамат, представляется более эффективным, чем все другие ЛС, применявшиеся для лечения ожирения, однако его эффективность, как и в целом эффективность фармакотерапии при данном состоянии, оценивается экспертами как умеренная [38]. Второй препарат – лоркасерин, по-видимому, по эффективности уступает фентермину/топирамату, но превосходит его по переносимости [40]. Поскольку непрямое сравнение результатов клинических исследований сложно и некорректно, это необходимо доказать в непосредственных сравнительных исследованиях. Кроме того, оба препарата вызывают опасения с точки зрения безопасности, особенно при длительном применении.
К существенным недостаткам обоих препаратов относится их неблагоприятное влияние на плод, требующее специального обучения женщин детородного возраста – значительной части потребителей ЛС для лечения ожирения [23]. Сумеют ли новые препараты внести существенный вклад в терапию ожирения и профилактику его осложнений, покажут новые клинические и фармакоэпидемиологические исследования, в т. ч. программы по выявлению и минимизации рисков, проводящиеся их производителями.
Е.А. Ушкалова – д.м.н., проф., кафедра общей и клинической фармакологии РУДН; e-mail: eushk@yandex.ru
Лиофилизат: желтая лиофилизированная масса или желтый порошок.
Растворитель: прозрачная и бесцветная жидкость.
1 флакон с лиофилизатом содержит:
Активное вещество: лорноксикам — 8,0 мг.
Вспомогательные вещества: маннитол, трометамол, динатрия эдетат.
1 ампула с растворителем содержит: вода для инъекций — 2,0 мл.
Нестероидные противовоспалительные и противоревматические средства, оксикамы.
Код лекарственного средства по АТХ
М01АС05
Фармакодинамика
Лорноксикам является нестероидным противовоспалительным средством с выраженными анальгезирующими свойствами, относится к классу оксикамов. В основе механизма действия лорноксикама лежит процесс подавления синтеза простагландинов (ингибирование изоферментов циклооксигеназы), что приводит к десенсибилизации периферических болевых рецепторов и, следовательно, к ингибированию воспаления. Предполагается, что существует центральное влияние на болевые рецепторы, которое не зависит от противовоспалительных эффектов.
Лорноксикам не влияет на показатели жизнедеятельности, такие как температура тела, частота дыхания, частота сердечных сокращений, артериальное давление, ЭКГ, спирометрия.
Анальгезирующие свойства лорноксикама были успешно продемонстрированы в нескольких клинических испытаниях во время разработки лекарственного средства.
Из-за местного раздражения желудочно-кишечного тракта и системного ульцерогенного эффекта, связанного с подавлением синтеза простагландинов, желудочно-кишечные осложнения являются частыми побочными эффектами при лечении лорноксикамом, как и другими нестероидными противовоспалительными средствами.
Фармакокинетика
Всасывание
Лорноксикам 8 мг порошок для инъекций предназначен для внутривенного (в/в), а также внутримышечного (в/м) введения. После внутримышечного введения максимальные концентрации в плазме крови достигаются примерно через 0,4 часа. Абсолютная биодоступность (рассчитанная по AUC) после внутримышечного введения составляет 97%.
Распределение
Лорноксикам находится в плазме в неизменном виде и в виде его гидроксилированного метаболита. Связывание лорноксикама с белками плазмы составляет 99% и не зависит от концентрации.
Биотрансформация
Лорноксикам активно метаболизируется в печени, главным образом, до неактивного метаболита 5-гидроксиллорноксикама путем гидроксилирования. Изоферемент CYP2C9 участвует в биотрансформации лорноксикама. Из-за генетического полиморфизма для этого фермента существуют медленные и быстрые метаболизаторы, которые могут привести к значительному повышению концентрации лорноксикама в плазме у медленных ме- таболизаторов. Гидроксилированный метаболит не проявляет фармакологической активности. Лорноксикам полностью метаболизируется, причем примерно 2/3 выводится через печень и 1/3 через почки в форме неактивного вещества.
В исследованиях на животных лорноксикам не приводил к индукции ферментов печени. По данным клинических испытаний не наблюдалось накопление лорноксикама после повторного применения в соответствии с рекомендуемыми дозировками. Этот результат был подтвержден данными мониторинга в одногодичных исследованиях.
Выведение
Средний период полувыведения исходного вещества составляет 3-4 часа. После перорального приема около 50% выводится с калом и 42% через почки, в основном в виде 5- гидроксиллорноксикама. Период полувыведения 5-гидроксиллорноксикама составляет около 9 часов после однократной или двукратной парентеральной дозы.
У пожилых пациентов старше 65 лет клиренс уменьшается на 30-40%. Помимо снижения клиренса, существенных изменений в кинетическом профиле лорноксикама у пожилых пациентов не наблюдалось.
Не наблюдалось значительного изменения кинетического профиля лорноксикама у пациентов с почечной или печеночной недостаточностью, кроме кумуляции у пациентов с хроническим заболеванием печени после 7 дней лечения с ежедневными дозами 12 и 16 мг.
Доклинические данные по безопасности
Доклинические данные не показывают особой опасности для человека, основанной на исследованиях фармакологии безопасности, токсичности повторных доз, генотоксичности и канцерогенности.
Лорноксикам стал причиной почечной токсичности, язвы желудочно-кишечного тракта в исследованиях токсичности при введении однократной и повторной дозы у нескольких видов.
По результатам исследований у животных, введение ингибиторов синтеза простагландинов приводит к учащению потерь до и после имплантации, а также к эмбриофетальной летальности. Кроме того, у животных, получавших ингибитор синтеза простагландинов в течение периода органогенеза, сообщалось об учащении случаев различных пороков развития, в том числе сердечно-сосудистых.
У крыс лорноксикам нарушал фертильность (влияя на овуляцию и имплантацию) и оказывал влияние на беременность и роды. У кроликов и крыс лорноксикам вызывал преждевременное закрытие артериального протока за счет ингибирования циклооксигеназы.
Кратковременное облегчение острой боли слабой и умеренной интенсивности.
Данный конкретный способ применения лекарственного средства должен быть применен только в случае, если необходимо быстрое купирование болевого синдрома или если пероральный или ректальный способ применения невозможен. Как правило, терапия должна включать только одну инъекцию только для начала терапии.
Для всех пациентов соответствующий режим дозирования должен быть основан на индивидуальном ответе на лечение.
Режим дозирования
Взрослые
Рекомендуемая доза: 8 мг внутривенно или внутримышечно. Суточная доза не должна превышать 16 мг. Некоторым пациентам может понадобиться дополнительное введение 8 мг в течение первых 24 часов.
Дети и подростки
Лорноксикам не рекомендуется применять у детей и подростков в возрасте до 18 лет в связи с отсутствием данных о безопасности и эффективности.
Пожилые пациенты
Для пожилых пациентов не требуется никаких специальных корректировок дозировки, кроме случаев нарушений функции почек и печени. Лорноксикам следует назначать с осторожностью, так как данная группа пациентов тяжелее переносит нежелательные реакции со стороны желудочно-кишечного тракта (см. раздел Меры предосторожности).
Почечная недостаточность
Для пациентов с почечной недостаточностью легкой или средней степени следует учитывать вопрос о снижении дозы.
Печеночная недостаточность
Для пациентов с печеночной недостаточностью следует учитывать вопрос о снижении дозы.
Нежелательные эффекты могут быть сведены к минимуму путем использования наименьшей эффективной дозы в течение минимального периода времени, необходимого для контроля симптомов (см. раздел Меры предосторожности).
Меры предосторожности при утилизации и другие указания по применению
Раствор для инъекций готовят путем растворения содержимого одного флакона в воде для инъекций непосредственно перед использованием. Приготовленный раствор представляет собой желтую прозрачную жидкость.
Если в лекарственном средстве имеются видимые признаки повреждения, его следует утилизировать в соответствии с местными требованиями.
Раствор вводят внутривенно или внутримышечно. Длительность внутривенного введения раствора должна составлять не менее 15 секунд, внутримышечного — не менее 5 секунд.
После приготовления раствора иглу заменяют. Внутримышечные инъекции делают достаточно длинной иглой для глубокого внутримышечного введения.
Наиболее часто нежелательными побочными эффектами НПВС являются эффекты со стороны желудочно-кишечного тракта. Возможно возникновение язвы желудка, перфорация или желудочно-кишечное кровотечение, в ряде случаев с летальным исходом, особенно у пожилых пациентов (см. раздел Меры предосторожности). Тошнота, рвота, диарея, метеоризм, запор, диспепсия, боли в животе, мелена, кровавая рвота, язвенный стоматит, обострение Колита и болезнь Крона (см. раздел Меры предосторожности) были зарегистрированы после применения НПВС. В редких случаях наблюдается гастрит.
Около 20% пациентов, принимающих лорноксикам, могут испытывать нежелательные реакции. Наиболее частыми побочными реакциями являются тошнота, диспепсия, расстройство желудка, боли в животе, рвота и диарея. По результатам доступных исследований эти симптомы, как правило, наблюдались у менее чем 10% пациентов.
Сообщается, что при лечении НПВС, наблюдались отек, гипертония и сердечная недостаточность.
Клинические испытания и эпидемиологические данные предполагают, что применение некоторых НПВС (особенно в высоких дозах и при длительном лечении) может повышать риск возникновения артериальных тромбозов (например, инфаркт миокарда или инсульт) (см. раздел Меры предосторожности).
Ниже перечислены нежелательные эффекты, которые выявились у более чем 0,05% из 6417 пациентов, получавших лечение в ходе проведения II, III и IV фазы.
Побочные реакции классифицируются в зависимости от частоты возникновения следующим образом: очень часто (≥1/10); часто (≥ 1/100 до <1/10), нечасто (≥ 1/1 000 до <1/100), редко (≥ 1/10 000 до <1/1 000), очень редко (<1/10 000), частота не известна (не может быть установлена по имеющимся данным).
Инфекционные и паразитарные заболевания:
Редко: фарингит.
Нарушения со стороны крови и лимфатической системы:
Редко: анемия, тромбоцитопения, лейкопения, увеличение времени кровотечения.
Очень редко: энхимозы, также НПВП могут вызывать потенциально тяжелые гематологические нарушения, например, нейтропению, агранулоцитоз, апластическую анемию и гемолитическую анемию (класс-специфические эффекты).
Нарушения со стороны иммунной системы:
Редко: гиперчувствительность, анафилактоидные и анафилактические реакции.
Нарушения со стороны обмена веществ и питания:
Нечасто: анорексия, изменение веса.
Нарушения психики
Нечасто: бессонница, депрессия.
Редко: спутанность сознания, нервозность, возбуждение.
Нарушения со стороны нервной системы:
Часто: слабая и преходящая головная боль, головокружение.
Редко: сонливость, парестезии, дисгевзия, тремор, мигрень.
Очень редко: асептический менингит у больных СКВ и смешанными заболеваниями соединительной ткани.
Нарушения со стороны органа зрения:
Нечасто: конъюнктивит.
Редко: нарушения зрения.
Нарушения со стороны органа слуха и лабиринтные нарушения:
Нечасто: головокружение, шум в ушах.
Нарушения со стороны сердца:
Нечасто: сердцебиение, тахикардия, отек, сердечная недостаточность.
Нарушения со стороны сосудов:
Нечасто: гиперемия, отек.
Редко: артериальная гипертензия, приливы, кровотечение, гематома.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения:
Нечасто: ринит.
Редко: одышка, кашель, бронхоспазм.
Желудочно-кишечные нарушения:
Часто: тошнота, боль в животе, диспепсия, диарея, рвота.
Нечасто: запор, метеоризм, отрыжка, сухость во рту, гастрит, язва желудка, боль верхней части живота, язва двенадцатиперстной кишки, язвенный стоматит.
Редко: мелена, рвота кровью, стоматит, эзофагит, гастроэзофагиальный рефлюкс, дисфагия, афтозный стоматит, глоссит, пептическая язва с перфорацией, желудочно-кишечное кровотечение.
Нарушения со стороны печени и желчевыводящих путей:
Нечасто: повышение биохимических показателей функции печени (АЛТ или ACT).
Редко: печеночная недостаточность.
Очень редко: гепатоцеллюлярное повреждение, которое может привести к печеночной недостаточности, гепатиту, желтухе и холестазу.
Нарушения со стороны кожи и подкожной клетчатки:
Нечасто: сыпь, зуд, гипергидроз, эритематозная сыпь, крапивница, отек Квинке, алопеция.
Редко: дерматит и экзема, пурпура.
Очень редко: отек и буллезные реакции, синдром Стивенса-Джонсона, токсический эпидермальный некролиз.
Нарушения со стороны скелетно-мышечной и соединительной ткани:
Нечасто: артралгия.
Редко: боль в костях, мышечный спазм, миалгия.
Нарушения со стороны почек и мочевыводящих путей:
Редко: никтурия, нарушения мочеиспускания, повышение уровня азота мочевины и креатинина в крови.
Очень редко: лорноксикам может вызвать острую почечную недостаточность у пациентов с нарушением функции почек в анамнезе, так как поддержание почечного кровотока зависит от почечных простагландинов (см. раздел «Меры предосторожности»). Развитие нефротоксичности в различных формах, включая нефрит и нефротический синдром, связано с применением НПВС (класс-специфический эффект).
Общие расстройства и нарушения в месте введения:
Нечасто: недомогание, отек лица.
Редко: астения.
В случае возникновения побочных реакций, в том числе не указанных в данной инструкции, необходимо прекратить прием лекарственного средства и обратиться к врачу.
— Повышенная чувствительность к лорноксикаму или к любому из вспомогательных компонентов.
— Тромбоцитопения.
— Аллергические реакции (такие, как астма, ринит, ангионевротический отек или крапивница) к другим НПВС, включая ацетилсалициловую кислоту.
— Тяжелая сердечная недостаточность.
— Желудочно-кишечные кровотечения, кровоизлияния в головной мозг или другие кровотечения.
— Желудочно-кишечные кровотечения или перфорации в анамнезе, связанные с предшествующей терапией НПВС.
— Острая пептическая язва/кровотечение или рецидивирующая пептическая язва/кровотечение в анамнезе.
— Тяжелая печеночная недостаточность.
— Тяжелая почечная недостаточность, прогрессирующие заболевания почек, подтвержденная гиперкалиемия.
— Третий триместр беременности (см. раздел Беременность и кормление грудью). Пациентам в возрасте до 18 лет.
В настоящее время нет данных по острой передозировке лорноксикамом, позволяющих определить последствия передозировки и рекомендовать специфические средства терапии. Тем не менее, можно ожидать, что после передозировки лорноксикамом могут возникнуть следующие симптомы: тошнота, рвота, церебральные симптомы (головокружение, нарушение зрения). Серьезными симптомами являются атаксия, вплоть до комы и судорог, поражения печени и почек и, возможно, нарушение коагуляции.
В случае действительной или предполагаемой передозировки следует отменить лекарственное средство. Лорноксикам быстро выводится из организма благодаря короткому периоду полувыведения. Лорноксикам не выводится диализом. Специфический антидот до сих пор неизвестен. Нарушения желудочно-кишечного тракта, например, можно лечить с помощью аналогов простагландинов или ранитидином.
При следующих заболеваниях лорноксикам можно назначать только после тщательной оценки соотношения пользы и риска:
Почечная недостаточность: лорноксикам следует назначать с осторожностью пациентам с легкой (сывороточный креатинин 150-300 моль/л) и до умеренной (сывороточный креатинин 300-700 моль/л) почечной недостаточностью из-за зависимости поддержания почечного кровотока от уровня почечных простагландинов. Лечение лорноксикамом следует прекратить, если почечная функция ухудшается во время лечения.
Функции почек должны контролироваться у пациентов, перенесших серьезную операцию, с сердечной недостаточностью, принимающих диуретические лекарственные средства, проходящие одновременное лечение лекарственными средствами, которые обладают известным или предполагаемым нефротоксическим действием.
Пациенты с нарушениями свертываемости крови:
рекомендуется тщательное клиническое наблюдение и лабораторная оценка (например, АПТВ).
Печеночная недостаточность (например, цирроз печени):
клинические наблюдения и лабораторный контроль через равные промежутки времени должны проводиться у пациентов с печеночной недостаточностью, поскольку после применения 12-16 мг ежедневно может происходить накопление лорноксикама (увеличение AUC). В других случаях печеночная недостаточность, скорее всего, не влияет на фармакокинетические параметры лорноксикама по сравнению со здоровыми лицами.
Пациенты пожилого возраста старше 65 лет:
рекомендуется контроль функции почек и печени. Следует соблюдать меры предосторожности у пожилых пациентов после операции.
Следует избегать совместного приема лорноксикама с другими НПВС, в том числе селективными ингибиторами цикл оксигеназы-2.
Нежелательные эффекты могут быть минимизированы путем использования минимальной эффективной дозы в течение кратчайшего периода времени, который необходим для контроля симптомов (см. раздел Способ применения и дозы).
Использовать с осторожностью при подтвержденном наличии Helicobacter pylori.
Желудочно-кишечные кровотечения, изъявления и перфорации:
— Желудочно-кишечные кровотечения, изъявления и перфорации, которые могут быть смертельными, возникали при использовании всех НПВС. Они возникали с или без предупреждающих симптомов или с предшествующей историей серьезных событий желудочно-кишечного тракта в любое время терапии.
— Риск кровотечений, язв или перфорации желудочно-кишечного тракта выше при увеличении дозы НПВС у пациентов с язвой в анамнезе, особенно если она осложнена кровотечением или перфорацией (см. раздел Противопоказания), и у пациентов пожилого возраста. Этим пациентам необходимо начинать лечение с наименьшей дозировки. Комбинированная терапия с защитными средствами (например, мизопростол или ингибиторы протонной помпы) должна рассматриваться для этих пациентов, а также для пациентов, которым необходима сопутствующая низкая доза ацетилсалициловой кислоты или других лекарственных средств, которые могут увеличить риск возникновения побочных реакций на желудочно-кишечный тракт. Рекомендуются регулярные клинические исследования через равные промежутки времени.
— Пациенты с желудочно-кишечной токсичностью в анамнезе, особенно пожилого возраста, должны информировать о любых необычных абдоминальных симптомах (особенно о признаках желудочно-кишечных кровотечений), особенно на начальных этапах лечения.
— Следует соблюдать осторожность у пациентов, дополнительно получающих лекарственные средства, которые могут увеличить риск изъявлений и кровотечений, такие как пероральные кортикостероиды, антикоагулянты (например, варфарин), селективные ингибиторы обратного захвата серотонина или антиагрегантные средства, такие как ацетилсалициловая кислота.
— Необходимо прекратить лечение, если у пациентов, получающих лорноксикам, возникает желудочно-кишечное кровотечение или изъявление.
— НПВС следует назначать с осторожностью пациентам с желудочно-кишечными заболеваниями в анамнезе (язвенный колит, болезнь Крона), поскольку течение болезни может обостриться.
— Чаще всего побочные эффекты на НПВС проявляются у пожилых людей, особенно желудочно-кишечные кровотечения и перфорация, которые могут иметь летальный исход.
Сердечно-сосудистые и цереброваскулярные эффекты:
— Необходимо соблюдать осторожность у пациентов с гипертензией и/или сердечной недостаточностью в анамнезе, так как в связи с терапией НПВС были зарегистрированы задержка жидкости и отеки.
— Соответствующий контроль и рекомендации необходимы для пациентов с гипертензией в анамнезе и/или застойной сердечной недостаточностью от легкой до умеренной степени, поскольку в связи с терапией НПВС были зарегистрированы задержка жидкости и отеки.
— Клинические исследования и эпидемиологические данные позволяют предположить, что применение некоторых НПВС (особенно в высоких дозах и при длительном лечении) может быть связано с повышением риска развития артериальных тромботических осложнений (например, инфаркта миокарда или инсульта). Имеется недостаточно данных, чтобы исключить такой риск для лорноксикама.
— Пациенты с неконтролируемой артериальной гипертензией, застойной сердечной недостаточностью, установленной ишемической болезнью сердца, заболеваниями периферических артерий и/или цереброваскулярными заболеваниями должны принимать лорноксикам только после проведения тщательной оценки польза-риск. Аналогичная оценка должна быть сделана до начала более длительного лечения пациентов с факторами риска сердечно-сосудистых заболеваний (например, артериальная гипертензия, гиперлипидемия, сахарный диабет, курение).
Одновременное лечение НПВС и гепарином в контексте спинальной или эпидуральной анестезии увеличивает риск развития спинальной/эпидуральной гематомы (см. раздел Лекарственное взаимодействие).
В связи с применением НПВС очень редко описывались тяжелые кожные реакции, некоторые из которых заканчиваются летальным исходом, включая эксфолиативный дерматит, синдром Стивенса-Джонсона и токсический эпидермальный некролиз (см. раздел Побочное действие). Пациенты, по-видимому, подвергаются наибольшему риску этих реакций на начальном этапе лечения, причем реакция возникает в большинстве случаев в течение первого месяца лечения. Прием лорноксикама следует прекратить при первом появлении кожной сыпи, поражений слизистой оболочки или любых других проявлений индивидуальной чувствительности.
Лорноксикам снижает агрегацию тромбоцитов и продлевает время кровотечения, поэтому следует соблюдать осторожность при назначении пациентам с повышенной склонностью к кровотечениям.
Совместное применение НПВС и такролимуса может увеличить риск нефротоксичности из-за снижения синтеза простациклина в почках. Поэтому следует тщательно контролировать функцию почек у пациентов, принимающих комбинированную терапию.
Как и в случае с большинством НПВС, иногда отмечалось повышение уровня сывороточных трансаминаз, повышение уровня билирубина в сыворотке или других показателей печени, а также повышение уровня креатинина и азота мочевины крови и другие изменения лабораторных показателей. Если эти отклонения становятся значительными или сохраняются, прием лорноксикама необходимо прекратить и провести соответствующее обследование.
Применение лорноксикама, как и любого другого лекарственного средства, которое, как известно, ингибирует циклооксигеназу/синтез простагландинов, может оказать отрицательное влияние на фертильность и не рекомендуется женщинам, которые планируют забеременеть. Женщинам, у которых возникают проблемы с зачатием или которые проходят обследование по поводу бесплодия, следует рассмотреть вариант отмены лорноксикама.
Беременность
Лорноксикам противопоказан в третьем триместре беременности, его также не следует применять в первом и втором триместре беременности и во время родов, так как нет данных клинических исследований по лечению во время беременности.
Недостаточно данных о применении лорноксикама беременными женщинами. Ингибирование синтеза простагландинов может отрицательно повлиять на беременность и/или развитие эмбриона/плода. Данные эпидемиологических исследований указывают на повышенный риск выкидыша и развития порока сердца после применения ингибиторов синтеза простагландинов на ранних сроках беременности. Считается, что риск повышается с увеличением дозы и продолжительности лечения. По данным исследований, у животных использование ингибиторов синтеза простагландинов приводит к увеличению пред- и постимплантационной потери, а также к эмбриофетальной летальности. В течение первого и второго триместра беременности ингибиторы синтеза простагландинов назначать не следует, только в случае явной необходимости.
Ингибиторы синтеза простагландинов, используемые в течение третьего триместра беременности, могут привести к сердечно-легочной токсичности у плода (с преждевременным закрытием артериального протока и легочной гипертензией) и вызвать нарушение функции почек, которая может привести к почечной недостаточности, и, следовательно, к уменьшению количества околоплодных вод. На последних сроках беременности ингибиторы синтеза простагландинов у матери и плода могут удлинять время кровотечения и подавлять сокращения матки, что может отсрочить или продлить роды. Поэтому применение лорноксикама противопоказано в третьем триместре беременности (см. раздел Противопоказания).
Лактация
Отсутствуют данные о выделении лорноксикама в грудное молоко женщины. Лорноксикам выделяется с молоком у крыс в период лактации в относительно высоких концентрациях. Поэтому лорноксикам не следует применять у кормящих женщин.
Пациенты, у которых наблюдается головокружение и/или сонливость при лечении лорноксикамом, должны воздержаться от управления автомобилем и другими механизмами.
Одновременное применение лорноксикама и:
— Циметидин: приводит к повышению концентрации лорноксикама в плазме крови (не обнаружено взаимодействие между лорноксикамом и ранитидином или лорноксикамом и антацидами.
— Антикоагулянты: НПВС могут усиливать действие коагулянтов, таких как варфарин (см. раздел Побочные действия).
— Фенпрокумон: снижение эффективности лечения фенпрокумоном.
— Гепарин: НПВС повышают риск развития спинальных или эпидуральных гематом при одновременном назначении гепарина в контексте спинальной или эпидуральной анестезии.
— Ингибиторы АПФ: может уменьшаться антигипертензивный эффект.
— Диуретики: снижение мочегонного и антигипертензивного действия петлевых и тиазидных диуретиков.
— Бета-блокаторы: снижение антигипертензивного эффекта.
— Дигоксин: снижение почечного клиренса дигоксина.
— Кортикостероиды: повышенный риск желудочно-кишечных язв или кровотечений (см. раздел Меры предосторожности).
— Хинолоновые антибиотики: повышенный риск судорог.
— Антиагреганты: повышенный риск желудочно-кишечных кровотечений.
— Другие НПВС: повышенный риск желудочно-кишечных кровотечений.
— Метотрексат: повышенный уровень метотрексата в сыворотке. Это может привести к повышенной токсичности. Если необходимо проведение совместной терапии, следует уделить внимание тщательному контролю.
— Селективные ингибиторы обратного захвата серотонина:
повышенный риск желудочно-кишечных кровотечений (см. раздел Меры предосторожности).
— Литий: НПВС подавляет почечный клиренс лития и, таким образом, могут повысить концентрацию лития в сыворотке крови сверх границ токсичности. Поэтому уровень лития в сыворотке требует постоянного контроля, особенно на начальном этапе лечения, при корректировке дозы, на завершающем этапе лечения.
— Циклоспорин: повышение концентрации циклоспорина в сыворотке крови. Нефротоксичность циклоспорина может усилиться за счет эффектов, опосредованных простагландинами почек. Во время комбинированного лечения почечная функция должна находиться под наблюдением.
— Лекарственные средства сульфонилмочевины: повышенный риск гипогликемии.
— Известные индукторы и ингибиторы изоферментов CYP2C9: лорноксикам (как и другие НПВС в зависимости от цитохрома Р450 2С9 (изофермент CYP2C9)) взаимодействует с известными индукторами и ингибиторами изоферментов CYP2C9 (см. раздел Фармакокинетика: Биотрансформация).
— Такролимус: увеличивает риск нефротоксичности из-за уменьшения синтеза простациклина в почках. Во время комбинированного лечения почечная функция должна находиться под наблюдением.
— Пеметрексед: НПВС могут снижать почечный клиренс пеметрекседа, в результате чего повышается почечная и желудочно-кишечная токсичность, а также риск миелосупрессии.
Хранить в оригинальной упаковке, в защищенном от света месте, при температуре не выше 25 °C.
Срок годности: 2 года.
Срок годности комплекта устанавливается по наименьшему сроку годности, входящих в состав комплекта компонентов.
Приготовленный раствор: химическая и физическая стабильность была продемонстрирована в течение 24 часов при 25 °C ± 2 °C.
С микробиологической точки зрения приготовленный раствор должен быть использован немедленно. Если лекарственное средство не используется сразу, то время и условия хранения приготовленного раствора являются ответственностью пользователя, и не должны превышать 24 часа при температуре от 2 °C до 8 °C, если только приготовление раствора не проводилось в контролируемых и валидированных асептических условиях.
Меры предосторожности при утилизации и другие указания по применению
Раствор для внутривенного или внутримышечного введения готовят непосредственно перед использованием путем растворения содержимого одного флакона водой для инъекций. Приготовленный раствор представляет собой желтую прозрачную жидкость.
Если лекарственное средство содержит видимые признаки повреждения, оно должно быть утилизировано в соответствии с местными требованиями.
Несовместимость
Учитывая отсутствие исследований совместимости, смешивание данного лекарственного средства с другими лекарственными средствами не допускается.
Флакон
Лиофилизат для приготовления раствора, содержащий 8 мг лорноксикама, во флаконах из темного стекла с резиновой пробкой из бромбутилкаучука и алюминиевым колпачком с пластиковым диском белого цвета. На флакон наклеивают этикетку.
Ампула
По 2 мл растворителя в ампулах из бесцветного стекла с кольцом излома. На ампулу наклеивают этикетку.
Комплектация 1
По одному флакону и одной ампуле в ячейковой упаковке. По одной, три, пять или десять ячейковых упаковок вместе с инструкцией по медицинскому применению помещают в пачку из картона.
Комплектация 2
По одной ячейковой упаковке с одним флаконом и одной ячейковой упаковке с одной ампулой; по одной ячейковой упаковке с тремя флаконами и одной ячейковой упаковке с тремя ампулами; по одной ячейковой упаковке с пятью флаконами и одной ячейковой упаковке с пятью ампулами; по две ячейковые упаковки с пятью флаконами и две ячейковые упаковки с пятью ампулами вместе с инструкцией по медицинскому применению помещают в пачку из картона.
Производитель
«К.О. Ромфарм Компани С.Р.Л.», Румыния, Илфов, 075100, г. Отопень, ул. Друмул Гэрий Отопень, №52 и ул. Ероилор, №1А / СООО «Лекфарм», Республика Беларусь, 223141, г. Логойск, ул. Минская, д. 2а, 2а/4
Владелец регистрационного удостоверения
СООО «Лекфарм», Республика Беларусь, 223141, г. Логойск, ул. Минская, д. 2а, к. 301, тел./факс: (01774)-53801, www.lekpharm.by