Укажите регион, чтобы мы точнее рассчитали условия доставки
Начните вводить название города, страны, индекс, а мы подскажем
Например:
Москва,
Санкт-Петербург,
Новосибирск,
Екатеринбург,
Нижний Новгород,
Краснодар,
Челябинск,
Кемерово,
Тюмень,
Красноярск,
Казань,
Пермь,
Ростов-на-Дону,
Самара,
Омск
Лучевая терапия (ЛТ) — один из методов лечения рака, при котором опухолевые клетки уничтожаются с помощью больших доз радиации. При воздействии ионизирующего излучения на клетку, химические связи в веществах разрушаются, клеточные структуры перестают работать корректно. Чаще всего повреждается генетический аппарат, благодаря чему клетка либо погибает сразу, либо через несколько циклов деления. Суть лучевой терапии в том, что здоровые клетки организма способны восстанавливаться после облучения гораздо быстрее, чем клетки злокачественной опухоли, которые находятся в процессе активного деления и более уязвимы. Таким образом, после курса лучевой терапии атипичные клетки постепенно уничтожаются, а здоровые восстанавливаются, поскольку им не был нанесен долгосрочный ущерб.
Похожее воздействие ионизирующего излучения в меньших дозах используется и в других распространенных медицинских обследованиях, например флюорографии или компьютерной томографии. Ранее ЛТ сильно уступала по частоте применения химиотерапии и хирургическому методу, но за последние два десятка лет благодаря техническому прогрессу радиотерапия вышла на новый уровень. Она может использоваться как самостоятельный вид лечения или применяться комплексно вместе с другими методами.
Когда назначают лучевую терапию?
Лучевая терапия на сегодняшний день используется для лечения многих видов онкологических заболеваний. И для некоторых больных она является единственным возможным методом лечения. Кроме того, ЛТ может уменьшить боли и симптомы сдавления здоровых органов.
Чаще всего врачи обращаются к этому методу при лечении рака:
- шейки матки;
- предстательной железы;
- молочной железы;
- легкого;
- простаты;
- мозга.
Существуют четыре различных вида применения лучевой терапии.
Первый вид — лечебная терапия. ЛТ используется как основной метод лечения, например, при опухолях, которые расположены во влагалище, в голове, шее или центральной нервной системе. Это часто происходит, если злокачественная опухоль была замечена на ранней стадии, а метастазы отсутствуют; либо при неоперабельной локализованной опухоли.
Второй вид — адъювантная терапия. Лучевая терапия используется в комбинации с другим методом для достижения максимального эффекта лечения. Например, хирургическое удаление новообразования может дополняться ЛТ. С помощью облучения уничтожают оставшиеся атипичные клетки, чтобы исключить рецидив. Этот вид лечения полезен при точечной локализации при небольшой распространенности атипичных новообразований.
Третий вид — неоадъювантная терапия. Облучение могут проводить до операции с целью уменьшить опухоль, чтобы в дальнейшем было проще ее удалить.
Четвертый вид — паллиативная терапия. Ее цель — облегчить состояние пациента, уменьшить симптомы, убрать боль. Например, паллиативную терапию проводят, чтобы облегчить прохождение пищи через пищевод, в котором разместилась опухоль. Этот вид лечения не излечивает пациента и часто применяется либо для облегчения жизни пациентов на поздней стадии рака, либо при острой необходимости (как в уже рассмотренном случае с пищеводом).
Проведение терапии
Схема терапии строго индивидуальна. Даже при лечении одного и того же вида рака у разных людей могут быть назначены разные схемы лечения. Это не должно настораживать или пугать. Терапия полностью зависит от вида рака и его стадии.
Различают несколько видов лучевой терапии в зависимости от вида воздействия:
- дистанционная;
- внутриполостная;
- внутритканевая.
Помимо этого, дистанционная ЛТ проводится с применением не только радиоактивных изотопов, но и более точных и безопасных ускорителей частиц. Радиохирургия на установках КиберНож и ГаммаНож получила широкое распространение в лечении опухолей позвоночника и головного мозга, а также локализованных опухолей других органов. С помощью линейного ускорителя проводится лечение фотонами (при опухолях внутри тела) и электронами (при поверхностных опухолях). Наиболее эффективным и безопасным видом воздействия считается протонная терапия. Особенность этого вида лечения в том, что можно контролировать максимальное высвобождение энергии на конкретном участке траектории полета частиц. Таким образом, снижается лучевая нагрузка на организм. Врач изучает историю болезни и выбирает для пациента оптимальный вариант облучения.
Дистанционная ЛТ
Чтобы свести вредоносное воздействие на здоровые клетки к минимуму, перед прохождением курса на тело пациента наносится специальная маркировка. Это происходит в процессе моделирования (разработки программы лечения). Моделирование производится с помощью рентгеновской КТ: врачи определяют зоны, которые необходимо подвергнуть облучению, и размечают маркером на коже пациента зоны облучения. Поскольку очень важно, чтобы были облучены только атипичные клетки, нужно следить за сохранностью маркировки.
Иногда в процессе лечения маркировку могут поменять. Это рутинная процедура, которая говорит лишь о продвижении в лечении, но никак не о том, что оно было неправильным.
Курс может длиться несколько недель с расчетом, что сеансы проводятся пять раз в неделю. Если речь идет о вспомогательном лечении, врач может назначить разовые сеансы.
Сама по себе процедура абсолютно безболезненна и напоминает рентгеновское обследование. Пребывание в кабинете может длиться до 45 минут, хотя само облучение обычно не превышает пяти минут. Все зависит от вида аппарата, процедуры, дозы излучения. Во время сеанса дистанционной ЛТ необходимо принять ту же позу, в которой наносили маркировку. Очень важно не двигаться, но дышать, моргать, сглатывать слюну можно. Во время настройки (которая зачастую длится дольше самого облучения) врача не будет в кабинете, однако он будет наблюдать за пациентом все время.
Внутриполостная ЛТ
В этом случае источник излучения помещается в очаг поражения. Так, контакт источника излучения непосредственно с опухолью повышает уровень воздействия радиации на злокачественную опухоль, а также понижает лучевую нагрузку на здоровые ткани. Таким образом, снижается риск возникновения осложнений в восстановительный период.
Внутритканевая ЛТ
Источник излучения вводят в жидком виде. Такая терапия может быть как низкодозной, так и высокодозной — в зависимости от характеристик опухоли. Как и в случае с внутриполостной ЛТ, здоровые ткани подвержены меньшему повреждению, хотя могут возникнуть и различные побочные эффекты.
Рекомендации во время терапии
Во время терапии кожа может стать очень чувствительной, могут появиться местные проявления. Вот несколько рекомендаций по уходу за облучаемым участком во время курса лучевой терапии:
1
Сохраняйте маркировку, нанесенную на тело в процессе разработки плана лечения. Если она начала стираться, ее необходимо немедленно обновить у персонала клиники.
2
Не используйте косметические и уходовые средства с ароматизаторами, а также дезодоранты (кроме роликового, если в нем не содержится алюминия и спирта).
3
Не стоит охлаждать/нагревать облучаемый участок: это может вызвать раздражение. В том числе нельзя подставлять зону облучения прямым солнечным лучам.
4
Проконсультируйтесь с врачом, прежде чем плавать в бассейне или естественном водоеме.
5
При возникновении зуда посоветуйтесь с врачом, какой крем следует использовать. Врач может рекомендовать кукурузную муку в качестве присыпки.
6
На зону облучения не должна давить одежда, ее нельзя сильно растирать. Поэтому одежда должна быть свободной. Нельзя накладывать повязку, бинт, пластырь на облученную кожу, кроме случаев, когда это назначает врач.
7
Мыть область облучения можно только теплой водой с детским мылом. Кожа должна быть сухой после обтирания, но не растирайте ее полотенцем.
8
Нельзя заниматься лечением побочных эффектов самостоятельно. С любыми вопросами и жалобами следует идти к врачу.
Помимо этого, врач может дать дополнительные рекомендации по уходу за кожей и деятельности во время курса лучевой терапии.
Побочные эффекты
Многих пациентов пугают возможные осложнения, последствия лучевой терапии, ведь радиация может уничтожить не только опухолевые клетки, но и здоровые ткани организма. Часто люди боятся, что их уровень радиации будет так высок, что они будут опасны для окружающих. Это не так. Пациент при прохождении курса ЛТ не становится источником радиоактивности, может взаимодействовать с окружающими, в том числе с детьми и беременными женщинами, половым партнером.
Некоторые пациенты вовсе не сталкиваются с побочными эффектами лучевой терапии. Кто-то обращается с жалобами общего характера и местными проявлениями. Общая лучевая реакция возникает не только в результате повреждения здоровых клеток, но и из-за интоксикации продуктами распада злокачественного новообразования. К жалобам общего характера относятся:
- слабость и быстрая утомляемость;
- раздражительность;
- головная боль;
- головокружение;
- тошнота.
Чаще всего эти побочные эффекты лучевой терапии проходят через несколько недель после окончания курса лечения.
Местные лучевые осложнения бывают разнообразными и зависят от того, какие ткани были облучены. Возможные нежелательные реакции тела:
- сухость и покраснение кожи;
- ломкость сосудов на месте, где была проведена ЛТ;
- мелкие кровотечения;
- зуд;
- ожоги кожи;
- выпадение волос в зоне облучения;
- ломкость ногтей;
- снижения показателей крови;
- язвенные изменения и воспаление слизистых оболочек.
Все побочные эффекты через некоторое время проходят. Однако пациент может минимизировать нежелательные реакции, если будет строго придерживаться указаний врачей. Важно с любыми побочными проявлениями сразу обращаться к лечащему врачу. На сегодняшний день существует большое количество препаратов и методик для снижения интенсивности побочных эффектов до полного их исчезновения.
Восстановление после лучевой терапии
Во время восстановительного периода пациентам рекомендуют побольше времени проводить на свежем воздухе, гулять. При необходимости могут быть назначены лекарственные препараты (часто — противовоспалительные и кроветворные средства). В зависимости от проявившихся симптомов назначают общеукрепляющую и прочие терапии.
После лучевой терапии следует уделять особое внимание рациону, следить за правильностью и сбалансированностью питания.
Основные рекомендации врачей по питанию после лучевой терапии:
2
Откажитесь от жареной, острой, копченой, консервированной пищи.
3
Снизьте потребление соли, а также тугоплавких жиров (содержатся в свинине, говядине, сливочном масле).
4
Исключите алкогольные напитки.
5
Употребляйте молоко с низким содержанием жира и творог.
6
Питайтесь часто, но небольшими порциями.
7
Отдавайте предпочтение высококалорийным напиткам, чтобы насытиться небольшим количеством (особенно актуально при отсутствии аппетита, тошноте).
8
Употребляйте больше овощей.
При длительном сохранении побочных эффектов, а также при возникновении любых вопросов обращайтесь к врачу и ни в коем случае не занимайтесь самолечением.
Лучевая терапия при раке — это метод лечения с использованием ионизирующих излучений. В настоящее время около 2/3 онкологических больных нуждается в этом виде лечения.
Лучевая терапия при раке назначается только при морфологической верификации диагноза, ее можно применять в качестве самостоятельного или комбинированного метода, а также в комплексе с химиотерапевтическими препаратами. В зависимости от стадии опухолевого процесса, радиочувствительности новообразования, общего состояния больного лечение может быть радикальным или паллиативным.

Что такое лучевая терапия при раке?
В основе применения ионизирующих излучений для лечения злокачественных новообразований лежит повреждающее действие на клетки и ткани, приводящее к их гибели при получении соответствующих доз.
Радиационная гибель клеток прежде всего связана с поражением ДНК-ядра, дезоксинуклеопротеидов и ДНК-мембранного комплекса, грубыми нарушениями в свойствах белков, цитоплазмы, ферментов. Таким образом, в облученных раковых клетках происходят нарушения во всех звеньях метаболических процессов. Морфологически изменения злокачественных новообразований могут быть представлены тремя последовательными стадиями:
- повреждение новообразования;
- ее разрушение (некроз);
- замещение погибшей ткани.
Гибель опухолевых клеток и их резорбция происходят не сразу. Поэтому эффективность лечения точнее оценивают лишь через некоторый промежуток времени после его завершения.
Радиочувствительность является внутренним свойством злокачественных клеток. Все органы и ткани человека чувствительны к ионизирующему излучению, но чувствительность их неодинакова, она меняется в зависимости от состояния организма и действия внешних факторов. Наиболее чувствительны к облучению кроветворная ткань, железистый аппарат кишечника, эпителий половых желез, кожи и сумки хрусталика глаза. Далее по степени радиочувствительности идут эндотелий, фиброзная ткань, паренхима внутренних органов, хрящевая ткань, мышцы, нервная ткань. Некоторые из новообразований перечислены в порядке снижения радиочувствительности:
- семинома;
- лимфоцитарная лимфома;
- другие лимфомы, лейкоз, миелома;
- некоторые эмбриональные саркомы, мелкоклеточный рак легкого, хориокарцинома;
- саркома Юинга;
- плоскоклеточный рак: высокодифференцированный, средней степени дифференцировки;
- аденокарцинома молочной железы и прямой кишки;
- переходноклеточный рак;
- гепатома;
- меланома;
- глиома, другие саркомы.
Чувствительность любого злокачественного новообразования к излучению зависит от специфических особенностей составляющих ее клеток, а также от радиочувствительности ткани, из которой произошло новообразование. Гистологическое строение является ориентировочным признаком прогнозирования радиочувствительности. На радиочувствительность влияют характер роста, размер и длительность ее существования. Радиочувствительность клеток в разные стадии клеточного цикла неодинакова. Наиболее высокой чувствительностью обладают клетки в фазе митоза. Наибольшей резистентностью — в фазе синтеза. Наиболее радиочувствительные новообразования, которые происходят из ткани, характеризующейся высоким темпом клеточного деления, с низкой степенью дифференцировки клеток, экзофитно растущие и хорошо оксигенированные. Более устойчивы к ионизирующему воздействию высокодифференцированные, крупные, длительно существующие опухоли с большим числом устойчивых к облучению аноксических клеток.
Для определения количества поглощенной энергии введено понятие дозы излучения. Под дозой понимают количество энергии, поглощенной в единице массы облученного вещества. В настоящее время в соответствии с Международной системой единиц (СИ) поглощенная доза измеряется в греях (Гр). Разовая доза — количество энергии, поглощенной за одно облучение. Толерантным (переносимым) уровнем дозы, или толерантной дозой, называют дозу, при которой частота поздних осложнений не превышает 5 %. Толерантная (суммарная) доза зависит от режима облучения и объема облучаемой ткани. Для соединительной ткани это значение принято равным 60 Гр при площади облучения 100 см2 при облучении ежедневно по 2 Гр. Биологическое действие излучения определяется не только величиной суммарной дозы, но и временем, в течение которого она поглощается.
Как проводится лучевая терапия при раке?
Лучевая терапия при раке подразделяется на две основные группы: методы дистанционного и методы контактного облучения.
- Дистанционная лучевая терапия при раке:
- статическая — открытыми полями, через свинцовую решетку, через свинцовый клиновидный фильтр, через свинцовые экранирующие блоки;
- подвижная — ротационная, маятниковая, тангенциальная, ротационно-конвергентная, ротационная с управляемой скоростью.
- Контактная лучевая терапия при раке:
- внутриполостной;
- внутритканевой;
- радиохирургический;
- аппликационный;
- близкофокусная рентгенотерапия;
- метод избирательного накопления изотопов в тканях.
- Сочетанная лучевая терапия при раке — сочетание одного из способов дистанционного и контактного облучения.
- Комбинированные методы лечения злокачественных новообразований:
- лучевая терапия при раке и хирургическое лечение;
- лучевая терапия при раке и химиотерапия, гормонотерапия.
Лучевая терапия при раке и ее эффективность может быть повышена путем усиления радиопоражаемости опухоли и ослабления реакций нормальных тканей. Различия в радиочувствительности новообразований и нормальных тканей называют радиотерапевтическим интервалом (чем выше терапевтический интервал, тем большая доза излучения может быть подведена к опухоли). Для увеличения последнего существует несколько способов селективного управления тканевой радиочувствительностью.
- Вариации дозы, ритма и времени облучения.
- Использование радиомодифицирующего действия кислорода — путем избирательного повышения радиочувствительности новообразования ее оксигенациеи и путем снижения радиочувствительности нормальных тканей созданием в них кратковременной гипоксии.
- Радиосенсибилизация опухоли с помощью некоторых химиопрепаратов.
Многие противоопухолевые препараты действуют на делящиеся клетки, находящиеся в определенной фазе клеточного цикла. При этом, кроме прямого токсического влияния на ДНК, они замедляют процессы репарации и задерживают прохожде-ние клеткой той или иной фазы. В фазе митоза, наиболее чувствительной к излучению, клетку задерживают винкаалкалоиды и таксаны. Гидроксимочевина тормозит цикл в фазе G1, более чувствительной к этому виду лечения по сравнению с фазой синтеза, 5-фторурацил — в S-фазе. В результате в фазу митоза одновременно приходит большее число клеток, и за счет этого усиливается повреждающее действие радиоактивного излучения. Такие препараты, как платина, при сочетании с ионизирующем воздействием тормозят процессы восстановления повреждений злокачественных клеток.
- Избирательная локальная гипертермия опухоли вызывает нарушение процессов пострадиационного восстановления. Сочетание радиоактивного облучения с гипертермией позволяет улучшить результаты лечения по сравнению с самостоятельным воздействием на новообразование каждого из этих способов. Такое сочетание используют при лечении больных меланомой, раком прямой кишки, молочной железы, опухолями головы и шеи, саркомами костей и мягких тканей.
- Создание кратковременной искусственной гипергликемии. Снижение рН в опухолевых клетках приводит к повышению их радиочувствительности за счет нарушения процессов пострадиационного восстановления в кислой среде. Поэтому гипергликемия обусловливает значительное усиление противоопухолевого действия ионизирующего излучения.
Большую роль в повышении эффективности такого метода лечения, как лучевая терапия при раке играет использование неионизирующих излучений (лазерное излучение, ультразвук, магнитные и электрические поля).
В онкологической практике лучевая терапия при раке используется не только как самостоятельный метод радикального, паллиативного лечения, но и значительно чаще как компонент комбинированного и комплексного лечения (различные комбинации с химио-, иммунотерапией, хирургическим и гормональным лечением).
Самостоятельно и в сочетании с химиотерапией лучевая терапия при раке чаще всего применяется при раке следующих локализаций:
- шейка матки;
- кожа;
- гортань;
- верхние отделы пищевода;
- злокачественные новообразования полости рта и глотки;
- неходжкинские лимфомы и лимфогранулематоз;
- неоперабельный рак легкого;
- саркома Юинга и ретикулосаркома.
В зависимости от последовательности применения ионизирующих излучений и оперативных вмешательств различают пред-, после- и интраоперационные методы лечения.
Предоперационная лучевая терапия при раке
В зависимости от целей, с которыми ее назначают, различают три основные формы:
- облучение операбельных форм злокачественных новообразований;
- облучение неоперабельных или сомнительно операбельных опухолей;
- облучение с отсроченным селективным оперативным вмешательством.
При облучении зон клинического и субклинического распространения опухоли перед оперативным вмешательством прежде всего добиваются летального повреждения наиболее высокозлокачественных пролиферирующих клеток, большая часть которых расположена в хорошо оксигенированных периферических участках новообразования, в зонах ее роста как в первичном очаге, так и метастазах. Летальные и сублетальные повреждения получают и неразмножающиеся комплексы раковых клеток, благодаря чему снижается их способность к приживлению в случае попадания в рану, кровеносные и лимфатические сосуды. Гибель опухолевых клеток в результате ионизирующего воздействия приводит к уменьшению размеров опухоли, отграничению ее от окружающих нормальных тканей за счет разрастания соединительнотканных элементов.
Указанные изменения в опухолях реализуются только при использовании в предоперационном периоде оптимальной очаговой дозы излучения:
- доза должна быть достаточной для того, чтобы вызвать гибель большей части клеток опухоли;
- не должна вызывать заметных изменений в нормальных тканях, приводящих к нарушению процессов заживления послеоперационных ран и увеличению послеоперационной смертности.
В настоящее время наиболее часто используют две методики предоперационного дистанционного облучения:
- ежедневное облучение первичной опухоли и регионарных зон в дозе 2 Гр до суммарной очаговой дозы 40 — 45 Гр в течение 4 — 4,5 недель лечения;
- облучение аналогичных объемов в дозе 4 — 5 Гр в течение 4 — 5 дней до суммарной очаговой дозы 20 — 25 Гр.
В случае применения первой методики операцию обычно выполняют спустя 2 — 3 недели после окончания облучения, а при использовании второй — спустя 1 — 3 дня. Последняя методика может быть рекомендована только для лечения больных с операбельными злокачественными опухолями.
Послеоперационная лучевая терапия при раке
Назначают ее в следующих целях:
- «стерилизация» операционного поля от рассеянных в процессе оперативного вмешательства злокачественных клеток и их комплексов;
- полное удаление оставшихся злокачественных тканей после неполного удаления опухоли и метастазов.
Послеоперационная лучевая терапия при раке обычно делается при раке молочной железы, пищевода, щитовидной железы, матки, фаллопиевых труб, вульвы, яичников, почки, мочевого пузыря, кожи и губы, при более распространенных формах рака органов головы и шеи, новообразованиях слюнных желез, раке прямой и толстой кишки, опухолях эндокринных органов. Хотя многие из перечисленных опухолей не являются радиочувствительными, этот вид лечения может уничтожить остатки опухоли после операции. В настоящее время расширяется применение органосохраняющих операций, особенно при раке молочной железы, слюнных желез и прямой кишки, при этом требуется радикальная послеоперационная ионизирующее лечение.
Лечение целесообразно начинать не ранее чем спустя 2 — 3 недели после оперативного вмешательства, т.е. после заживления раны и стихания воспалительных изменений в нормальных тканях.
Для достижения лечебного эффекта необходимо подведение высоких доз — не менее 50 — 60 Гр, а очаговую дозу на область неудаленной опухоли или метастазов целесообразно увеличивать до 65 — 70 Гр.
В послеоперационном периоде необходимо облучать зоны регионарного метастазирования опухоли, в которых не производили оперативное вмешательство (например, надключичные и парастернальные лимфатические узлы при раке молочной железы, подвздошные и парааортальные узлы при раке матки, парааортальные узлы при семиноме яичка). Дозы излучения могут быть в пределах 45 — 50 Гр. Для сохранения нормальных тканей облучение после операции нужно проводить с использованием метода классического фракционирования дозы — 2 Гр в сутки или средними фракциями (3,0 — 3,5 Гр) с добавлением суточной дозы на 2 — 3 фракции с интервалом между ними 4 — 5 часа.
Интраоперационная лучевая терапия при раке
В последние годы вновь повысился интерес к использованию дистанционного мегавольтного и внутритканевого облучения опухоли или ее ложа. Преимущества этого варианта облучения заключаются в возможности визуализации опухоли и поля облучения, удаления из зоны облучения нормальных тканей и реализации особенностей физического распределения быстрых электронов в тканях.
Эта лучевая терапия при раке применяется в следующих целях:
- облучение опухоли перед ее удалением;
- облучение ложа опухоли после радикальной операции или облучения остаточной ткани опухоли после нерадикальной операции;
- облучение нерезектабельной опухоли.
Однократная доза излучения на область ложа опухоли или операционной раны составляет 15 — 20 Гр (доза 13 + 1 Гр эквивалентна дозе 40 Гр, подведенной в режиме 5 раз в неделю по 2 Гр), которая не влияет на течение послеоперационного периода и вызывает гибель большинства субклинических метастазов и радиочувствительных клеток опухоли, которые могут диссеминировать во время операции.
При радикальном лечении основная задача заключается в полном уничтожении опухоли и излечении заболевания. Радикальная лучевая терапия при раке состоит в лечебном ионизирующем воздействии на зону клинического распространения опухоли и профилактическом облучении зон возможного субклинического поражения. Лучевая терапия при раке, проводимая преимущественно с радикальной целью, применяется в следующих случаях:
- рак молочной железы;
- рак полости рта и губы, глотки, гортани;
- рак женских половых органов;
- рак кожи;
- лимфомы;
- первичные опухоли мозга;
- рак предстательной железы;
- нерезектабельные саркомы.
Полное удаление опухоли чаще всего возможно на ранних стадиях заболевания, при небольших размерах опухоли с высокой радиочувствительностью, без метастазов или с единичными метастазами в ближайшие регионарные лимфатические узлы.
Паллиативная лучевая терапия при раке используется для максимального снижения биологической активности, торможения роста, уменьшения размеров опухоли.
Лучевая терапия при раке, проводимая преимущественно с паллиативной целью, применяется в следующих случаях:
- метастазы в кости и головной мозг;
- хроническое кровотечение;
- рак пищевода;
- рак легкого;
- для снижения повышенного внутричерепного давления.
При этом уменьшаются тяжелые клинические симптомы.
- Боль (боли в костях при метастазах рака молочной железы, бронхов или предстательной железы хорошо поддаются коротким курсам).
- Обструкция (при стенозе пищевода, ателектазе легкого или сдавлении верхней полой вены, при раке легкого, сдавлении мочеточника при раке шейки матки или мочевого пузыря паллиативная лучевая терапия часто дает положительный эффект).
- Кровотечение (вызывает большую тревогу и обычно наблюдается при распространенном раке шейки и тела матки, мочевого пузыря, глотки, бронхов и полости рта).
- Изъязвление (лучевая терапия может уменьшить изъязвление на грудной стенке при раке молочной железы, на промежности при раке прямой кишки, устранить неприятный запах и таким образом улучшить качество жизни).
- Патологический перелом (облучение больших очагов в опорных костях как метастатической природы, так и первичных при саркоме Юинга и миеломе может предупредить перелом; при наличии перелома лечению должна предшествовать фиксация пораженной кости).
- Облегчение неврологических нарушений (метастазы рака молочной железы в ретробульбарную клетчатку или сетчатку регрессируют под влиянием этого вида лечения, которая обычно также сохраняет зрение).
- Облегчение системных симптомов (миастения, обусловленная опухолью вилочковой железы, хорошо реагирует на облучение железы).
Когда лучевая терапия при раке противопоказана?
Лучевая терапия при раке не проводится при тяжелом общем состоянии больного, анемии (гемоглобин ниже 40%), лейкопении (менее 3- 109/л), тромбоцитопении (менее 109/л), кахексии, интеркуррентных заболеваниях, сопровождающихся лихорадочным состоянием. Противопоказана лучевая терапия при раке при активном туберкулезе легких, остром инфаркте миокарда, острой и хронической печеночной и почечной недостаточности, беременности, выраженных реакциях. Из-за опасности кровотечения или перфорации этот вид лечения не проводят при распадающихся опухолях; не назначают при множественных метастазах, серозных выпотах в полости и выраженных воспалительных реакциях.
Лучевая терапия при раке может сопровождаться возникновением как вынужденных, неизбежных или допустимых, так и недопустимых неожиданных изменений здоровых органов и тканей. В основе этих изменений лежит повреждение клеток, органов, тканей и систем организма, степень которого в основном зависит от величины дозы.
Повреждения по тяжести течения и времени их купирования подразделяют на реакции и осложнения.
Реакции — изменения, возникающие в органах и тканях в конце курса, проходящие самостоятельно или под влиянием соответствующего лечения. Они могут быть местными и общими.
Осложнения — стойкие, трудно ликвидируемые или остающиеся постоянно нарушения, обусловленные некрозом тканей и замещением их соединительной тканью, самостоятельно не проходят, требуют длительного лечения.
Новости онкологии
12.01.2022
Перерывы в радикальном курсе лучевой терапии: возможно ли «протиснуться» в терапевтическое окно?
Шейко Андрей Владимирович
Заведующий радиотерапевтическим отделением №2, врач-радиотерапевт, ГБУЗ ВО «Областной клинический онкологический диспансер», Владимир
Современная радиотерапия не приемлет разрывов в лечении. Потеря локального контроля за каждый незапланированный пропущенный день лечения сейчас ни у кого не вызывает сомнений. Однако реальность такова, что радиационным онкологам все чаще приходится сталкиваться с вынужденной остановкой радикального курса лучевой или химиолучевой терапии, например, в связи с инфицированием пациента COVID-19. Очень важным при этом является поиск грамотного баланса между риском высокой раково-специфической смертности ввиду отсрочки лечения и риском смертности от инфекционных интеркуррентных заболеваний при их незавершенном лечении или недостаточном периоде реабилитации [1]. Коронавирусная инфекция – лишь одна из многих причин, приводящих к вынужденной остановке в лечении.
Подливает масла в огонь и тот факт, что зачастую предельно важной оказывается общая продолжительность лечения. Так, при раке анального канала общая продолжительность терапии более 41 дня ставит под угрозу 5-летний локальный контроль независимо от того, включало ли лечение перерыв или нет (демпинг 5-летнего локального контроля составляет 12% для опухолей T1-2 и 31% при T3-4 [2,3]). Связь между общей продолжительностью лечения и его исходами при прочих плоскоклеточных раках (ОГШ, шейка матки, рак легкого) также неопровержима. Демпинг локального контроля может достигать 1-2% за каждый день продления времени терапии. Таким образом, в моделях плоскоклеточного рака пролонгация лечения означает потерю эффекта от 0,4-0,6 Гр за каждый пропущенный день [4]. К примеру, при злокачественных опухолях головы и шеи как короткие (4-8 дней), так и более длительные задержки в лечении (>8 дней) приводят к снижению абсолютной четырехлетней общей выживаемости на 4% и 12% (р<0,0001) соответственно [5].
Все онкологические пациенты могут быть условно разделены на следующие категории приоритета (определяющий фактор – потенциальное время удвоения опухолевых клеток Tpot) [6]:
- Категория 1: пациенты с ЗНО с быстрым Tpot и высоким уровнем доказательности негативного влияния разрыва в лечении на локальный контроль и выживаемость. Разрыв в радикальном лечении не должен превышать 2 дней:
- плоскоклеточный рак органов головы и шеи,
- немелкоклеточный рак легкого,
- мелкоклеточный рак легкого,
- плоскоклеточный рак шейки матки,
- плоскоклеточный рак пищевода,
- плоскоклеточный рак влагалища и вульвы,
- плоскоклеточный рак анального канала,
- аденокарцинома пищевода,
- медуллобластома и примитивные нейроэктодермальные опухоли.
- Категория 2: пациенты с ЗНО с более медленным Tpot. Разрыв в радикальном лечении не должен превышать 5 дней:
- рак молочной железы,
- рак мочевого пузыря,
- рак предстательной железы.
- Категория 3: пациенты, получающие паллиативное лечение, которым может потребоваться компенсирующая доза при перерыве более 7 дней.
Основные причины разрыва в лечении:
- Неисправность радиотерапевтического оборудования
- Государственные праздники
- Транспортные проблемы
- Социально-психологические проблемы
- Непереносимая токсичность лечения/осложнения на фоне лечения/интеркуррентные заболевания (в т.ч. COVID-19)
Методы профилактики разрывов в лечении:
- Неисправность радиотерапевтического оборудования: радиотерапевтическая служба должна иметь на балансе как минимум 2 линейных ускорителя, полностью укомплектованных штатом, с возможностью полной взаимозаменяемости, или иметь договоренность с другим радиотерапевтическим центром, который будет готов принять пациентов на лечение в случае необходимости.
- Государственные праздники: продолжать лечение приоритетных пациентов категории 1 в праздничные дни или эскалировать общую СОД в зависимости от типа опухоли, количества пропущенных дней, К-фактора, BED, Tpot и проч.
- Транспортные проблемы: онкологический центр в идеале должен иметь в штате служебный транспорт для пациентов или договоренность с волонтерскими организациями или со службами трансфера и такси.
- Социально-психологические проблемы: пациент должен быть полностью и в доступной форме проинформирован о необходимости ежедневного лечения, опасности и последствиях незапланированного перерыва, возможных лучевых реакциях, побочных явлениях и т.д., рекомендуется также иметь в штате онкопсихолога для помощи пациентам и их семьям.
- Непереносимая токсичность лечения/осложнения на фоне лечения/интеркуррентные заболевания (в т.ч. COVID-19): обучение пациента самоконтролю и наблюдению за собой в ходе ЛТ/ХЛТ, объяснение необходимости связи с лечащим врачом при первых признаках лучевых реакций и нежелательных явлений облучения; раннее выявление лучевых реакций на стадии grade I; ранняя медикаментозная поддержка и терапия лучевых реакций и проявлений острой токсичности ХЛТ; ранняя и своевременная терапия осложнений основного онкологического заболевания и интеркуррентных заболеваний; использование современных высокопрецизионных методик ЛТ с высоким градиентом дозы, возможностью сохранения органов риска, укорочения фракционного и общего времени лечения (IMRT, IMRT+SIB, VMAT).
Рекомендации по компенсации разрыва курса лучевой терапии представлены в таблице 1 [6,7].
Таблица 1. Методы компенсации разрыва курса лучевой терапии.
| Метод | Преимущества | Потенциальные трудности |
|---|---|---|
| Лечение в выходные дни | Возможность не выбиться из запланированных сроков лечения и запланированной СОД | Неприменимо для разрыва лечения в конце запланированного курса |
| Лечение 2 раза в день | См. выше | Высокий риск поздних лучевых осложнений при частом использовании двухфракционной схемы или при недостаточном временном интервале между фракциями (менее 6 часов) |
| Эскалация СОД на количество дней, равное разрыву в лечении | Возможность не выбиться из запланированных сроков лечения при сохранении прежнего ритма облучения 1 раз в день | Неприменимо для уже запланированных режимов гипофракционирования. Возможно негативное влияние на терапевтический индекс в связи с повышением риска поздних лучевых осложнений со стороны органов риска (при попытке компенсаторной эскалации СОД) или в связи с «недооблучением» первичной опухоли (при попытке соблюсти толерантость органов) |
| Эскалация СОД с укорочением количества фракций после разрыва | См. выше | См. выше |
| Принять неизбежность удлинения общего времени лечения и использовать эскалацию СОД для его минимизации | Хотя бы частичное восстановление изначально запланированного курса | Негативное влияние на терапевтический индекс: необходимо смириться с неизбежным снижением локального контроля и повышением риска поздних лучевых осложнений |
| См. пункт 5, но с использованием облучения 2 раза в день с небольшим итоговым удлинением общего времени лечения | См. выше | Негативное влияние на терапевтический индекс может быть не столь выраженным |
Алгоритм действий в случае состоявшегося разрыва в лечении напрямую зависит от кинетики и радиобиологии опухоли. Принципиальное значение имеет понимание таких показателей, как α/β опухоли, Tk или Tlag (время до ускоренной репопуляции/задержка роста опухоли), Tpot (потенциальное время удвоения опухолевых клеток), К-фактор (доза, эффект которой на репопуляцию клеточной массы «утрачен» за каждый 1 день разрыва лечения). Основные параметры, принимаемые во внимание при компенсации доз, представлены в таблице 2 [8].
Таблица 2. Параметры кинетики и радиобиологии опухолей при компенсаторном пересчете доз лучевой терапии.
| Тип ЗНО | α/β опухоли (Гр) | К-фактор (Гр за 1 день) | Tlag (дни) |
|---|---|---|---|
| Плоскоклеточные раки (в т.ч НМРЛ и аденокарцинома легкого)* | 10 Гр | 0,9 | 28 |
| Переходно-клеточные раки | 10 Гр | 0,36 | 35 |
| Аденокарцинома молочной железы (послеоперационная ЛТ) | 4 Гр | 0,6 | 21 |
| Аденокарцинома молочной железы (первичная) | 4 Гр | 0,3 или 0,6 (при перерыве >42 дней) |
21
42 |
| Аденокарцинома предстательной железы (высокодифференцированная) | 2 Гр | 0,3 | 42 |
| Аденокарцинома предстательной железы (умеренно- и низкодифференцированная) | 4 Гр | 0,5 | 42 |
| Прочие аденокарциномы | 4 Гр | 0,3 | 42 |
| Прочие ЗНО первой категории приоритета | 10 Гр | 0,9 | 28 |
* Для данного типа опухолей при коротких гипофракционированных режимах возможно использование К-фактора 0,36-0,6 Гр/день после перерыва в 21 день; при еще более коротких режимах (например, при плоскоклеточном раке кожи) предлагается использовать К-фактор = 0,15 Гр/день после перерыва в 14 дней.
Алгоритм действий в случае состоявшегося разрыва в лечении:
- Определить оставшееся время запланированного лечения и количество оставшихся «неотлеченных» фракций.
- Рассмотреть все возможные варианты «вписаться» в запланированный график лечения (лечение в выходные дни, 2 раза в день и т.д.).
- При невозможности соблюсти сроки:
-
рассчитать BED (биологическую эффективную дозу) для нормальных тканей на весь период запланированного курса по формуле
BED = Nd × [1 + d/(α/β)],
где N – количество запланированных фракций, d – доза за фракцию, рекомендуемое α/β – 3 Гр (для спинного мозга – 2 Гр);
- определить соответствующую BED нормальных тканей в период, предшествующий перерыву;
- определить разницу между BED1 и BED2, которая будет представлять из себя запас BED (post-gap BED)нормальных тканей на предстоящий компенсаторный период лечения;
- выбрать лечебные опции (гипофракционирование, лечение 2 раза в день, увеличение количества фракций и т.д.), которые бы максимально сократили продление общего времени лечения; затем – рассчитать СОД так, чтобы не превысить порог post-gap BED нормальных тканей;
-
рассчитать BED на опухоль с учетом продления сроков лечения по формуле
BED = Nd × [1 + d/(α/β)] – K × (T – Tdelay),
где Т – общая продолжительность лечения, Tdelay – время от начала лечения до начала ускоренной репопуляции, К – К-фактор;
- в зависимости от выбранного метода компенсации оценить окончательные фактические BED для опухоли и нормальных тканей (часто встречается клиническая дилемма сложного компромисса между превышением BED на нормальные ткани и демпингом BED на опухоль).
-
Таким образом, расчет компенсаторных доз при незапланированных перерывах в курсе лучевой терапии – процесс довольно сложный и трудоемкий. Попытки с помощью арифметических манипуляций «протиснуться» в терапевтическое окно между клинической пользой и осложнениями довольно часто грозят оказаться бесполезными и бессмысленными, особенно при плоскоклеточных раках с высоким α/β. Для некоторых опухолей до сих пор недостаточно убедительных данных об их кинетике (например, для рака анального канала величина К-фактора по разным данным литературы колеблется от 0,4 до 0,9 Гр). Перерыва в лечении и, как следствие, удлинения общего времени терапии необходимо избегать всеми возможными способами для сохранения адекватного локального контроля, безрецидивной выживаемости и других показателей. Компенсация перерыва в лечении при радикальном курсе лучевой терапии зачастую сомнительна по эффективности и чревата большим количеством ошибок и негативными последствиями на терапевтический индекс. Вклад химиотерапевтического компонента в биологию и кинетику рака также недостаточно убедительно изучен, поэтому расчет BED для опухоли и нормальных тканей в случае компенсаторного лечения может быть весьма затруднителен.
Источники:
- Yu D, Hu W, Chen L, Fu Z, Song Q, Li X. Effect of radiotherapy interruption due to COVID-19 outbreak. Radiother Oncol. 2021; 155: 1-2. doi:10.1016/j.radonc.2020.09.055.
- Graf R, Wust P, Hildebrandt B, et al. Impact of overall treatment time on local control of anal cancer treated with radiochemotherapy. Oncology. 2003; 65(1): 14-22. doi:10.1159/000071200.
- Rivin Del Campo E, Matzinger O, Haustermans K, et al. Pooled Analysis of external-beam RADiotherapy parameters in phase II and phase III trials in radiochemotherapy in Anal Cancer (PARADAC). Eur J Cancer. 2019; 121: 130-143. doi:10.1016/j.ejca.2019.08.022.
- Glynne-Jones R, Sebag-Montefiore D, Adams R, et al. «Mind the gap» – the impact of variations in the duration of the treatment gap and overall treatment time in the first UK Anal Cancer Trial (ACT I). Int J Radiat Oncol Biol Phys. 2011; 81(5): 1488-1494. doi:10.1016/j.ijrobp.2010.07.1995.
- Xiang M, Gensheimer MF, Pollom EL, et al. Prolongation of definitive head and neck cancer radiotherapy: Survival impact and predisposing factors. Radiother Oncol. 2021; 156: 201-208. doi:10.1016/j.radonc.2020.12.025.
- Timely delivery of radical radiotherapy: guidelines for the management of unscheduled treatment interruptions, fourth edition (2019).
- Dale RG, Hendry JH, Jones B, Robertson AG, Deehan C, Sinclair JA. Practical methods for compensating for missed treatment days in radiotherapy, with particular reference to head and neck schedules. Clin Oncol (R Coll Radiol). 2002; 14(5): 382-393. doi:10.1053/clon.2002.0111.
- Jones B, Dale R, Hopewell J. Additional Guidance on management of unscheduled treatment interruptions in patients during the COVID-19 pandemic (2020).
Комментарий эксперта
Деньгина Наталья Владимировна
Заведующая радиологическим отделением ГУЗ «Областной клинический онкологический диспансер», директор Центра лучевой терапии «R-Spei», член правления RUSSCO, главный редактор Газеты RUSSCO и сайта RosOncoWeb, кандидат медицинских наук, Ульяновск
Радиотерапевты, работающие более 7-8 лет по специальности, прекрасно помнят, как регулярно администрация учреждений по результатам годовых отчетов «строгала» нас за чрезмерно превышенный койко-день в радиологическом отделении. Пресловутый койко-день являлся неким почти безукоризненным, по мнению организаторов здравоохранения, показателем полноты и качества догоспитального обследования, организации работы отделения и адекватности оказываемой помощи. Этот показатель требовалось постоянно снижать – только не понятно, до каких нулей. По какой-то не укладывающейся в наших радиотерапевтических головах причине считалось, что чем меньше пациент пребывает на койке, тем правильнее лечат в данном отделении – и это при том, что помимо традиционных режимов фракционирования лучевой терапии, подразумевающих несколько недель лечения, рекомендованные руководствами, укороченные курсы применялись лишь в паллиативных целях. Гипофракционирование было робким, SBRT и СИБы (симультанные интегрированные бусты) – в зачаточном состоянии, а дозволенное гиперфракционирование укорачивало курс лишь на чуть. Появление нового оборудования, усложнение предлучевой подготовки, сложности оконтуривания и планирования и вовсе сделало уменьшение койко-дня невыполнимой задачей.
Что приходилось делать для поддержания «подобающего» по длительности койко-дня, дабы не навлечь на себя гнев вышестоящих контролирующих структур? Правильно, снижать его искусственно, выписывая пациентов, даже еще не закончивших полностью радикальный курс, делая перерыв, якобы, для купирования лучевых реакций, для «отдыха» пациента после завершения 1 этапа и т.д. Хорошо, если выписка происходила под выходные, и перерыв составлял не более 2-3 дней. В нынешних условиях, когда пациент перед каждой госпитализацией должен приносить целый список свежих анализов, в том числе и тех, которые делаются несколько дней, и пациент рискует пропасть на недели или даже месяцы по различным причинам, в т.ч. и причине ковида, подобная практика выглядит не просто бессмысленной – но и губительной. В тех центрах, где эту проблему осознают врачи и осведомленная администрация, отделения радиотерапии продолжают функционировать и облучать пациентов и в официальные нерабочие дни, включая гипертрофированные новогодние праздники, делая все, чтобы курс был непрерывным. И радиотерапевты, и администрация, и пациенты, и их родственники должны осознавать, что радикальный курс лечения должен быть завершен без перерывов, возможно, ценой более выраженных осложнений и необходимой поддерживающей терапии. Что 45 Гр при раке анального канала или 50 Гр при ОГШ – это не некий завершенный «1 этап радикального курса», а лишь его обломок, способный при последующем перерыве длительностью более 3 дней свести на нет все предыдущие усилия и полностью скомпрометировать как непосредственные, так и отдаленные результаты.
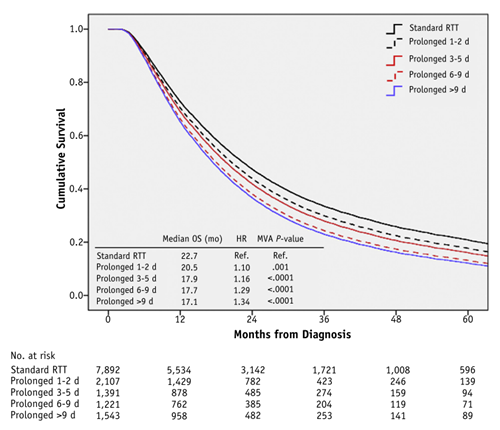
В качестве иллюстрации – данные крупного анализа из NCDB по результатам лечения больных местнораспространенным НМРЛ методом одновременной ХЛТ по протоколу (без перерывов) и с перерывами различной длительности. Число пациентов, включенных в анализ, впечатляет – 14154, из которых 6262 (44,2%) лечились с перерывами. Достаточно взглянуть на график (см. рисунок) и понять, насколько серьезно разрывы в лечебном курсе, даже, казалось бы, небольшие, достоверно укорачивают общую выживаемость больных НМРЛ.
Рисунок. Влияние перерывов в радикальном курсе лучевой терапии (в днях) на выживаемость больных [1].
Статья доктора Шейко, на мой взгляд – это не только напоминание о губительном влиянии перерывов в лечении на непосредственные и отдаленные результаты, но и практическое руководство к действию. Поскольку RUSSCO уже давно является сообществом, объединяющим представителей различных специальностей, включая немалое число радиотерапевтов, мы посчитали эту публикацию на сайте необходимой. Правильное построение плана радикальной ЛТ/ХЛТ и адекватное ведение пациентов, которые потенциально могут быть излечены от опухоли или иметь длительную ремиссию, жизненно важно, и каждый из нас, их врачующих, должен это осознавать.
Источник: McMillan MT, et al. Radiation Treatment Time and Overall Survival in Locally Advanced Non-small Cell Lung Cancer. Int J Radiation Oncol Biol Phys. 2017; 98(5): 1142-1152.
Лучевая терапия опухолей — один из наиболее известных терминов онкологии, подразумевающий использование ионизирующего излучения для разрушения опухолевых клеток.
Изначально лучевое лечение использовало принцип большей устойчивости здоровых клеток к воздействию радиации, в сравнении со злокачественными. При этом в зону расположения опухоли подавали высокую дозу излучения (за 20-30 сеансов), что приводило к разрушению ДНК клеток опухоли.
Развитие способов воздействия ионизирующего излучения на опухоль привело к изобретению новых направлений в радиационной онкологии. Например, радиохирургии (Гамма-нож, Кибер-нож), при которой высокая доза радиации однократно (либо за несколько сеансов) подается точно в границы новообразования и приводит к биологическому разрушению его клеток.
Эволюция медицинской науки и технологий лечения рака привела к тому, что классификация видов лучевого лечения (радиотерапии) довольно сложна. И пациенту, столкнувшемуся с лечением онкозаболевания, сложно самостоятельно определить, насколько подходит в его случае тип лучевого лечения опухолей, предложенный в конкретном онкоцентре России и зарубежья.
Данный материал призван дать ответы на наиболее частые вопросы пациентов и их близких о лучевой терапии. Тем самым повысить шансы каждого на получение того лечения, которое будет эффективным, а не того, которое ограничено парком медицинской техники конкретного лечебного учреждения в России или другой стране.
ВИДЫ ЛУЧЕВОЙ ТЕРАПИИ
Традиционно в радиотерапии выделяют три способа воздействия ионизирующего излучения на опухоль:
- дистанционное;
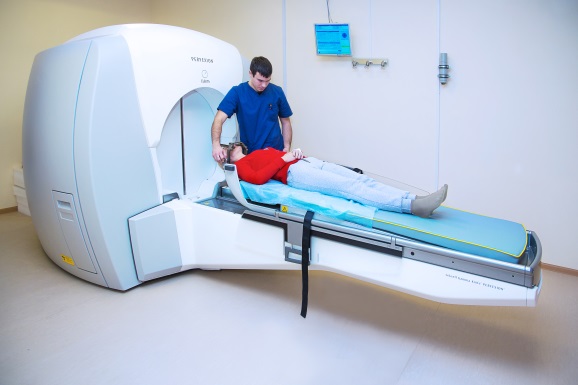
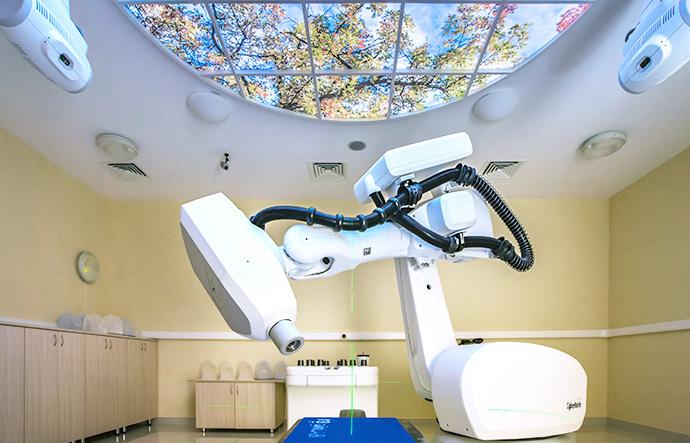
Наивысшего технического уровня достигло лучевое лечение, при котором доза излучения доставляется бесконтактно, с небольшого расстояния. Дистанционная лучевая терапия проводится как с использованием ионизирующего излучения радиоактивных радиоизотопов (современная медицина использует дистанционное излучение изотопов только при радиохирургии на Гамма-ноже, хотя в некоторых онкоцентрах России все еще можно встретить старые аппараты для радиотерапии работающие на изотопе кобальта), так и с применением более точных и безопасных ускорителей элементарных частиц (линейный ускоритель или синхроциклотрон при протонной терапии).
Так выглядят современные аппараты для дистанционного лучевого лечения опухолей (слева направо, сверху вниз): Линейный ускоритель, Гамма-нож, Кибер-нож, Протонная терапия
- контактное;
Брахитерапия — воздействие источников ионизирующего излучения (изотопов радия, йода, цезия, кобальта и др.) на поверхность опухоли, либо их вживление в объем новообразования.
Одно из “зерен” с радиоактивным материалом, вживляемых в опухоль при брахитерапии
Наиболее популярно применение брахитерапии для лечения опухолей, к которым имеется относительно простой доступ: рак шейки и тела матки, рак языка, рак пищевода и т.д.
- радионуклидное.
Радионуклидная лучевая терапия подразумевает собой введение микрочастиц радиоактивного вещества, накапливаемых тем или иным органом. Наибольшее развитие получила радиойодтерапия при которой вводимый радиоактивный йод накапливается в тканях щитовидной железы, разрушая опухоль и ее метастазы высокой (абляционной) дозой.
Некоторые из выделяемых в отдельные группы видов лучевого лечения, как правило, имеют в своей основе один из трех указанных выше способов. Например, интраоперационная лучевая терапия (ИОЛТ), проводимая на ложе удаленной опухоли во время хирургического вмешательства — это обычная лучевая терапия на линейном ускорителе меньшей мощности.
Виды дистанционной лучевой терапии
Эффективность радионуклидной лучевой терапии и брахитерапии зависит от точности расчета дозы и соблюдения технологического процесса, а приемы реализации этих методов не демонстрируют большого разнообразия. Но дистанционная лучевая терапия имеет массу подвидов, каждый из которых характеризуется своими особенностями проведения и показаниями для применения.
- радиохирургия
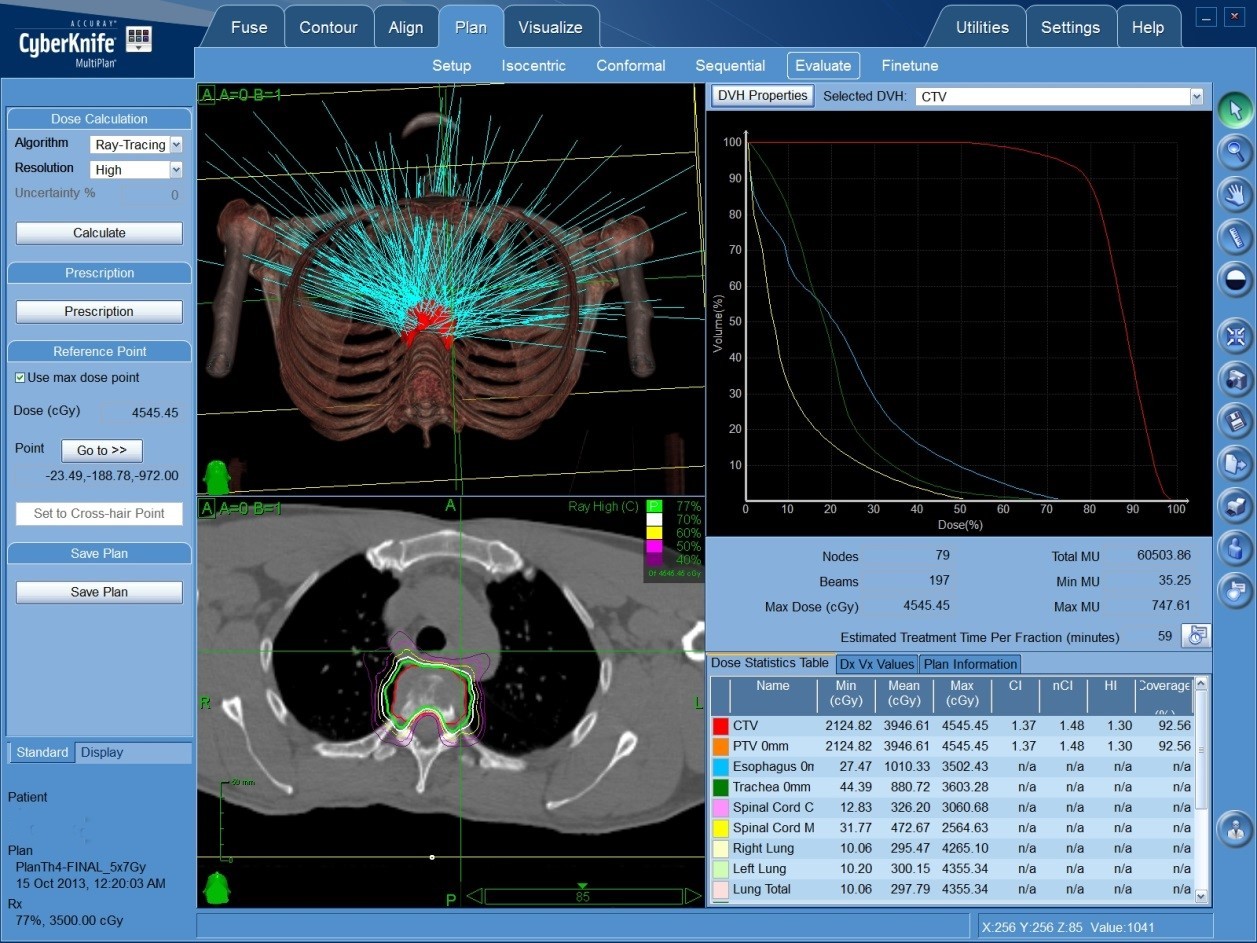
Высокая доза подводится единоразово, либо короткой серией фракций. Может проводиться на Гамма-ноже или Кибер-ноже, а также на некоторых линейных ускорителях.
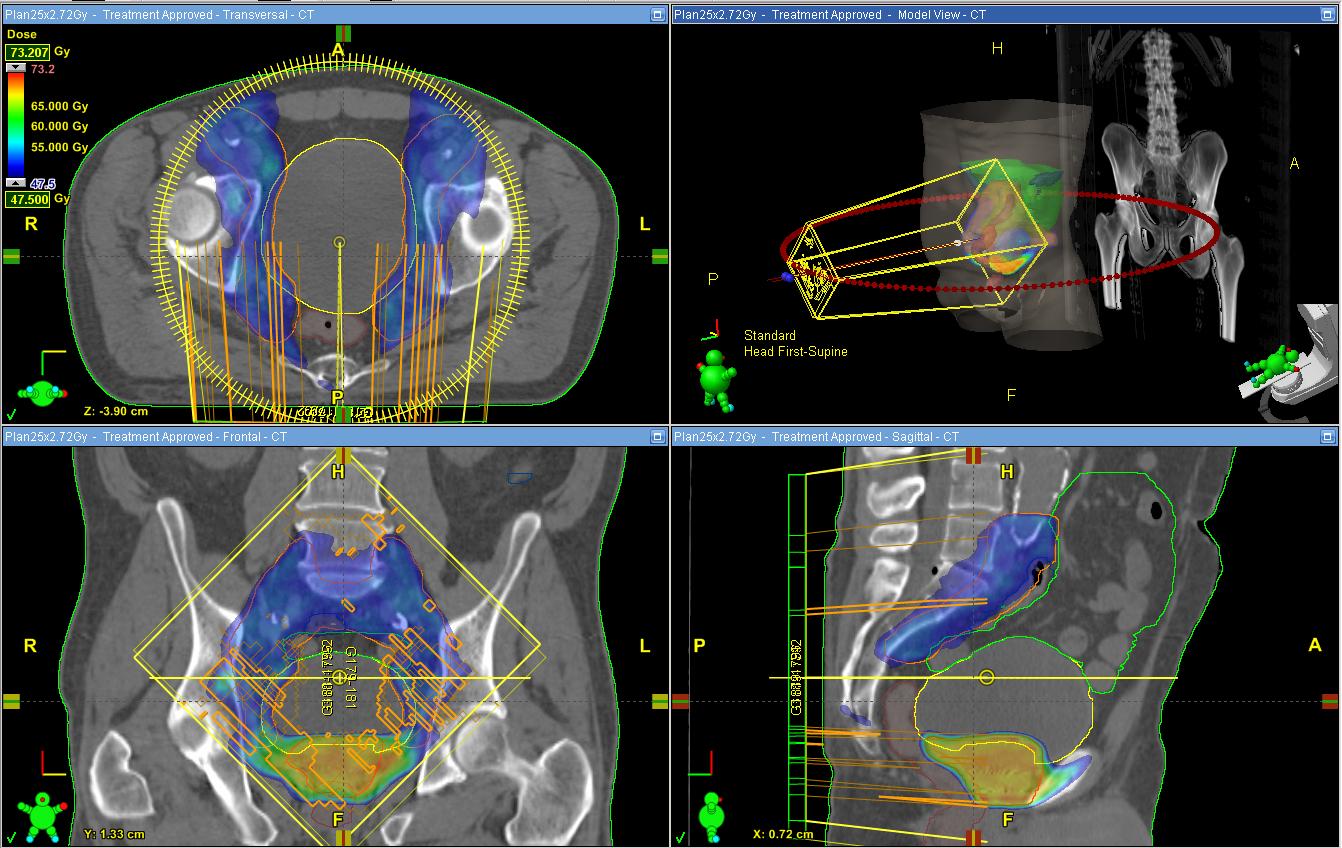
Один из примеров плана радиохирургии на Кибер-ноже. Множество тонких пучков (бирюзовые лучи в левой верхней части), пересекаясь в области расположения опухоли позвоночника, формируют зону высокой дозы ионизирующего излучения (зона внутри красного контура), которая складывается из дозы каждого отдельного луча.
Наибольшее распространение радиохирургия получила в лечении опухолей головного мозга и позвоночника (в том числе доброкачественных), являясь бескровной альтернативой традиционному хирургическому лечению на ранних стадиях. Успешно применяется и для лечения четко локализованных опухолей (рак почки, рак печени, рак легкого, увеальная меланома) и ряда неонкологических заболеваний, таких как сосудистые патологии (АВМ, каверномы), невралгии тройничного нерва, эпилепсии, болезни Паркинсона и др.).
- лучевая терапия на линейном ускорителе
Обычно, 23-30 сеансов лечения фотонами для опухолей внутри тела, либо электронами для поверхностных опухолей (например, базалиома).
Пример плана лучевой терапии при лечении рака простаты на современном линейном ускорителе (используется метод VMAT: RapidArc®). Высокая доза излучения, губительная для опухолевых клеток (зона, окрашенная в красные и желтые оттенки) складывается в зоне пересечения полей различной формы, поданных из различных положений. При этом здоровые ткани, которые окружают опухоль либо через которые проходит каждое из полей, получают толерантную дозу, не вызывающую необратимых биологических изменений.
Линейный ускоритель — важный компонент в составе сочетанного лечения опухолей любой стадии и любой локализации. Современные линейные ускорители, помимо возможностей модификации формы каждого из полей излучения для максимальной защиты здоровых тканей от радиации, могут агрегироваться с томографами для еще большей точности и скорости лечения.
- лучевая терапия на радиоизотопных аппаратах
Ввиду низкой точности эта разновидность лечения, практически не применяется в мире, а рассматривается по причине того, что значительная часть лучевой терапии в государственной онкологии России все еще проводится на таком оборудовании. Единственный из методов, не предлагаемый в МИБС.
Привет из 70-х — гамма-терапевтический аппарат “Рокус”. Это — не музейный экспонат, а оборудование, на котором проходят лечение пациенты одного из государственных онкоцентров
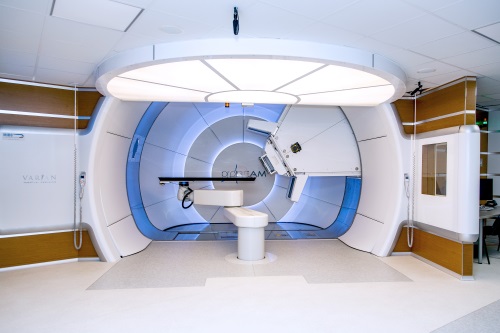
- протонная терапия
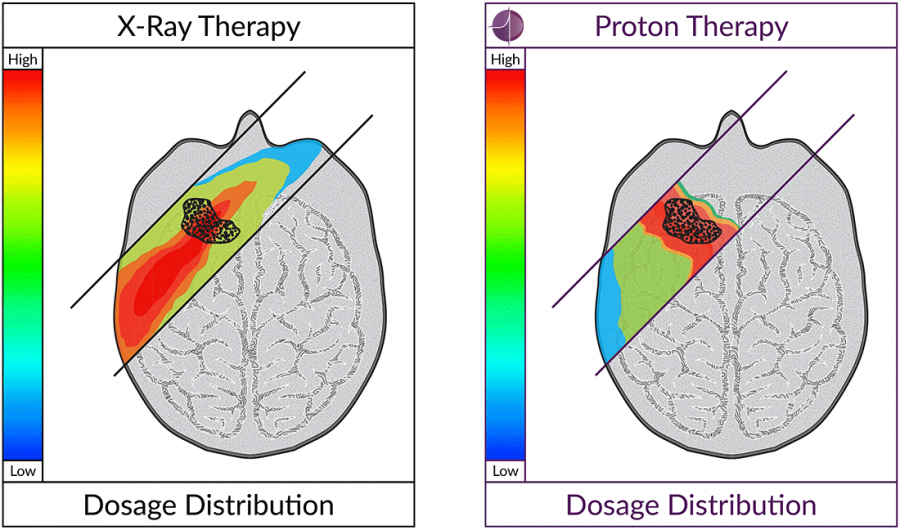
Наиболее эффективный, точный и безопасный вид воздействия на опухоль элементарными частицами протонами. Особенность протонов — высвобождение максимальной энергии на конкретном контролируемом участке траектории полета, что в разы снижает лучевую нагрузку на организм, даже в сравнении с современными линейными ускорителями.
Слева — прохождение поля фотонов при лечении на линейном ускорителе, справа — прохождение протонного пучка при протонной терапии.
Красная зона — зона максимальной дозы излучения, синяя и зеленые — зоны умеренного облучения.
Уникальность свойств протонной терапии делает этот метод лечения одним из наиболее эффективных в лечении опухолей у детей.
НАСКОЛЬКО БЕЗОПАСНА ЛУЧЕВАЯ ТЕРАПИЯ СЕГОДНЯ?
С момента изобретения радиотерапии основным аргументом противников этого метода лечения опухолей было воздействие радиации не только на объем опухолевого поражения, но и на здоровые ткани организма, которые окружают зону облучения или находятся на пути его прохождения при дистанционном лучевом лечении опухолей.
Но даже несмотря на ряд ограничений, которые существовали при применении первых установок для лучевого лечения опухолей, радиотерапия в онкологии с первых дней изобретения прочно занимает основное место в лечении различных типов и видов злокачественных новообразований.
Точное дозирование
Эволюция безопасности лучевой терапии начиналась с точного определения толерантных (не вызывающих необратимых биологических изменений) доз ионизирующего излучения для различных типов здоровых тканей организма. Одновременно с тем, как ученые научились контролировать (и дозировать) количество излучения, начались работы по управлению формой поля облучения.
Современные аппараты для лучевой терапии позволяют создавать зону высокой дозы излучения, отвечающую форме опухоли, из нескольких полей в зоне их пересечения. При этом форма каждого поля моделируется управляемыми многолепестковыми коллиматорами (специальное электромеханическое устройство, “трафарет”, принимающий заданные формы и пропускающий поле требуемой конфигурации). Поля подаются из различных позиций, что распределяет общую дозу радиации между различными здоровыми частями организма.
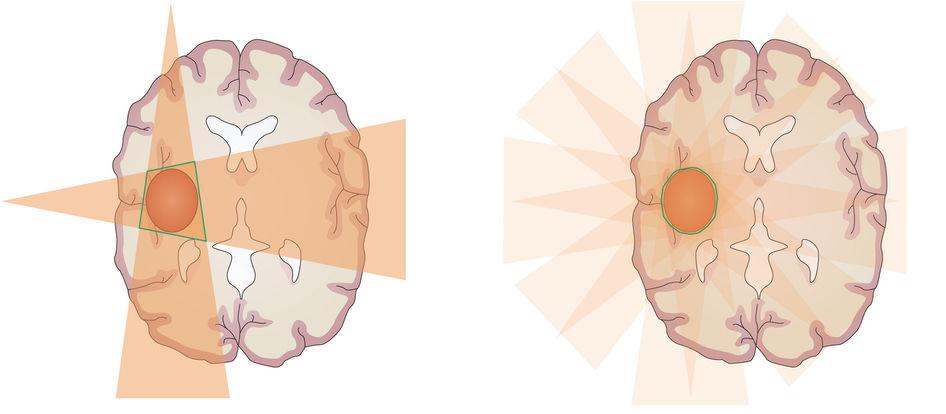
Слева — конвенциональная лучевая терапия (3D-CRT) — зона высокой дозы излучения (зеленый контур) сформирована на пересечении двух полей, она превышает объем расположения опухоли, что ведет к повреждению здоровых тканей, как в зоне пересечения, так и в зоне прохождения двух полей высокой дозы.
Справа — модулируемая по интенсивности лучевая терапия (IMRT) — зона высокой дозы, сформированная пересечением четырех полей. Ее контур максимально приближен к контуру новообразования, здоровые ткани на пути прохождения полей получают, как минимум, вдвое меньшую дозу. В настоящее время при IMRT не редкость применение десяти и более полей, что значительно снижает общую лучевую нагрузку.
Точное наведение
Ключевым в поиске решений, которые дали бы возможность нивелировать воздействие радиации на здоровые ткани организма, особенно при лечении опухолей сложной формы, стали разработки в направлении виртуальной симуляции лучевой терапии. Высокая точность компьютерной томографии (КТ) и магнитно-резонансной томографии (МРТ) позволяют не только четко определить наличие и контуры опухоли на каждом из множества снимков, но и воссоздать на специализированном программном обеспечении трехмерную цифровую модель взаимного расположения опухоли сложной формы и окружающих ее здоровых тканей. Этим достигается, в первую очередь, защита критически важных для работы организма структур (ствол головного мозга, пищевод, зрительный нерв и т.д.), даже минимальное облучение которых чревато серьезными побочными эффектами.
Контроль положения
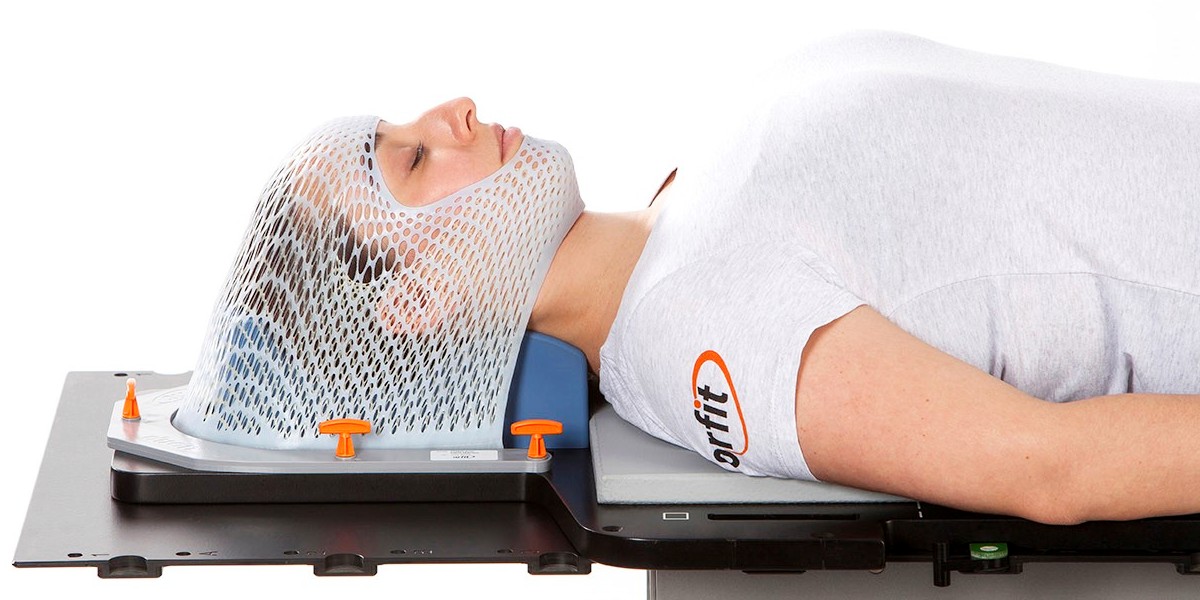
Ввиду того, что курс лучевой терапии предусматривает несколько десятков сеансов, важной составляющей точности и безопасности такого лечения является отслеживание смещения пациента во время каждого сеанса лечения (фракции). Для этого применяют фиксацию пациента специальными устройствами, эластичными масками, индивидуальными матрасами, а также инструментальный контроль за положением тела пациента относительно плана лечения и смещением “контрольных точек”: рентгенографический, КТ- и МРТ-контроль.
Фиксация положения пациента при лучевой терапии и радиохирургии эластичной маской, изготовленной индивидуально. Наркоз не требуется!
Точный выбор метода лучевого лечения
Отдельно следует рассмотреть такое направление повышения безопасности лучевой терапии, как использование индивидуальных свойств различных элементарных частиц.
Так, современные линейные ускорители кроме лучевого лечения фотонами, позволяют проводить электронотерапию (лучевую терапию электронами), при которой подавляющая часть энергии элементарных частиц, электронов, высвобождается в верхних слоях биологических тканей, не вызывая облучения более глубоких структур, находящихся под опухолью.
Аналогично, протонная терапия позволяет доставлять в опухоль элементарные частицы протоны, энергия которых максимальна лишь на коротком отрезке дистанции “полета”, соответствующем расположению опухоли в глубине организме.
Подобрать метод лечения, которое будет наиболее эффективным в каждом конкретном случае, может только врач, владеющий каждым из методов лучевой терапии.
ЛУЧЕВАЯ ТЕРАПИЯ — ВАЖНАЯ ЧАСТЬ СОЧЕТАННОГО ЛЕЧЕНИЯ ОПУХОЛЕЙ
Несмотря на успехи лучевой терапии в борьбе с локализованными опухолями, она — лишь один из инструментов современной онкологической помощи.
Наибольшую эффективность доказал комплексный подход к лечению рака, при котором лучевое лечение применяется в таких видах:
- предоперационный курс для уменьшения активности и объема опухоли (неоадъювантная лучевая терапия);
- послеоперационный курс для облучения зон, в которых невозможно достичь полного удаления опухоли, а также путей вероятного метастазирования, чаще всего, лимфатических узлов (адъювантная лучевая терапия);
- лучевая терапия при объемных метастатических поражениях, например, полное облучение головного мозга (WBRT) самостоятельно, либо в комбинации со стереотаксической радиохирургией (SRS) на Гамма-ноже или Кибер-ноже;
- паллиативное лечение для облегчения болей и общего состояния организма на терминальной стадии заболевания и т.д.
СКОЛЬКО СТОИТ ЛУЧЕВАЯ ТЕРАПИЯ?
Стоимость лучевого лечения зависит от индивидуальных особенностей клинического случая, вида радиотерапии, сложности формы опухоли, длительности и объема курса лучевой терапии, показанного пациенту.
На стоимость лучевой терапии (для сравнимых методик) влияют технические особенности процесса лечения, точнее, себестоимость подготовки и проведения лечения.
К примеру, курс лучевого лечения в региональном онкоцентре, включающий облучение двумя встречными квадратными полями после простого определения контуров опухоли на МРТ и нанесении маркером на кожу меток для примерной настройки положения поля, будет недорогим. Но прогноз и уровень побочных эффектов, присущие такому лечению — малоутешительны.
Поэтому стоимость лучевого лечения на современном линейном ускорителе, требующего затрат на приобретение и обслуживание высокотехнологичного оборудования, а также связанного с большим объемом работы квалифицированных специалистов (лучевых терапевтов, медицинских физиков), — оправданно выше. Но такое лечение эффективнее и безопаснее.
В МИБС мы достигаем высоких показателей эффективности лечения за счет обеспечения качества процесса на каждом из этапов: подготовки виртуальной трехмерной модели опухоли с дальнейшим определением контуров объемов максимальных и нулевых доз, расчетом и коррекцией плана лечения. Только после этого может быть начат курс лучевой терапии, во время каждой фракции которого применяется множество полей различных форм, “огибающих” здоровые ткани организма, и проводится многоступенчатая верификация положения пациента и самой опухоли.
ЛУЧЕВАЯ ТЕРАПИЯ В РОССИИ
Уровень отечественных онкологов, медицинских физиков, лучевых терапевтов, при условии постоянного повышения их квалификации (что является обязательным для специалистов МИБС), не уступает, а, зачастую, превосходит уровень ведущих мировых специалистов. Широкая клиническая практика позволяет быстро получать значительный опыт даже молодым специалистам, парк оборудования регулярно пополняется новейшими аппаратами для лучевого лечения от лидеров отрасли (даже в таких затратных сферах, как протонная терапия и радиохирургия).
Поэтому все чаще иностранные граждане, даже из тех стран, которые считаются традиционным “пунктом назначения” для выездного медицинского туризма из России, вдохновленные успехами российской медицины, выбирают лечение рака в частных онкоцентрах Российской федерации, в том числе, и в МИБС. Ведь стоимость лечения рака за границей (при сравнимом уровне качества) выше не из-за качества медицины, а из-за уровня заработных плат иностранных специалистов и накладных расходов, связанных с перелетом, проживанием пациента и его сопровождающих, услугами переводчиков и т.д.
При этом доступность качественной лучевой терапии для граждан России, в рамках гарантированного государством объема медицинской помощи, оставляет желать лучшего. Государственная онкология все еще недостаточно оснащена современной техникой для диагностики и лечения, бюджеты государственных онкоцентров не позволяют на должном уровне обучать специалистов, высокая загруженность сказывается на качестве подготовки и планирования лечения.
С другой стороны, схема работы страховой медицины в России формирует спрос на наиболее дешевые методы, обеспечивающие лишь базовый уровень качества лечения рака, не создавая спроса на высокотехнологичные методы лечения, к которым относятся радиотерапия, радиохирургия, протонная терапия. Это отражается в низком уровне квот на лечение в рамках программы медицинского страхования.
Исправить положение призваны эффективно управляемые частные онкологические центры, предлагающие пациентам ту тактику лечения, которая будет оптимальной как с точки зрения эффективности, так и с точки зрения стоимости.
Так выглядит Центр протонной терапии Медицинского института Березина Сергея (МИБС)
Если Вы стоите перед непростым выбором, где начать лечение рака, обратитесь в Онкологическую клинику МИБС. Наши специалисты предоставят квалифицированную консультацию относительно выбора подходящего метода лучевой терапии и другого лечения (в соответствии с лучшими стандартами мировой онкологии), прогноза и стоимости такого лечения.
В случае, если требуется необходимость проверить адекватность рекомендуемых в другом онкоцентре методов и плана лечения потребностям Вашего клинического случая, в любом из Центров МИБС (как в России, так и за ее пределами) Вам будет предложено “второе мнение” относительно установленного диагноза, рекомендованного состава и объема лечения.
Запишитесь сейчас!
Заведующий отделением нейрорадиологии.
Нейрохирург высшей категории, кандидат медицинских наук.
Действительный член Всемирного Общества пользователей Гамма-Ножа (LGKS).
Действительный член Европейского Общества функциональной и стереотаксической нейрохирургии (ESSFN).
Действительный член Образовательного комитета Международного Общества Стереотаксической Радиохирургии (ISRS) .
Доцент кафедры нейрохирургии Военно-Медицинской Академии им. С.М. Кирова.