1 мл раствора содержит:
активное вещество: инсулин глулизина – 3,49 мг, что соответствует 100ЕД человеческого инсулина.
вспомогательные вещества: m-крезол, трометамол, натрия хлорид, полисорбат 20 (Е432), натрия гидроксид (Е524), кислота хлористоводородная концентрированная, вода для инъекций.
Прозрачный, бесцветный раствор.
Препараты для лечения сахарного диабета. Инсулин и его аналоги короткого действия.
Код АТХ: А10АВ06.
Фармакодинамика
Апидра представляет собой лекарство созданное генно-инженерным методом. За основу взята структура молекулы человеческого инсулина, но в ней заменено несколько аминокислот, что обусловило особые свойства препарата: действие инсулина глулизина наступает быстро, длительность действия короче, чем у стандартного человеческого инсулина, сила действия равна таковой у стандартного человеческого инсулина.
Наиболее важным действием инсулина, а, следовательно, и Апидры является регуляция обмена глюкозы в организме. Инсулин и его аналоги снижают содержание глюкозы в крови, повышая усвоение тканями организма (особенно скелетной мускулатурой и жировой тканью), а также снижая образование глюкозы в печени. Инсулин подавляет расщепление жиров и белков тканей организма, одновременно усиливая образование белка.
При подкожном введении инсулина глулизина глюкозопонижающее действие начинается в пределах 10-20 минут. При внутривенном введении глюкозопонижающее действие инсулина глулизина и стандартного человеческого инсулина одинаково. Одна единица инсулина глулизина обладает такой же глюкозопонижающей активностью, что и одна единица стандартного человеческого инсулина.
Пропорциональность дозы
В исследовании с 18 пациентами мужского пола в возрасте 21-50 лет, страдающих сахарным диабетом 1 типа, инсулин глулизин в интервале терапевтических доз 0,075-0,15 ЕД/кг оказывал пропорциональный дозе глюкозопонижающий эффект, подобно человеческому инсулину. При использовании в дозах 0,3 ЕД/кг и выше отмечено уменьшение пропорциональности усиления глюкозопонижающего эффекта при повышении дозы.
Инсулин глулизин оказывает действие в два раза быстрее, чем стандартный человеческий инсулин и заканчивает глюкозопонижающее действие примерно на 2 часа раньше, чем стандартный человеческий инсулин.
В исследовании I фазы с участием больных сахарным диабетом 1 типа оценивали глюкозопонижающие свойства инсулина глулизина и стандартного человеческого инсулина, назначавшихся подкожно в дозе 0,15 ЕД/кг в различное время относительно 15-минутного стандартного приёма пищи. Результаты показывают, что инсулин глулизин, вводившийся за 2 минуты до еды, обеспечил такой же гликемический контроль что и стандартный человеческий инсулин, вводившийся за 30 минут до еды.
График № 1. Средний глюкозопонижающий эффект после 6 часов у 20 больных сахарным диабетом 1 типа
Инсулин глулизин, введённый за 2 минуты (глулизин – до) до начала еды в сравнении со стандартным человеческим инсулином, введённым за 30 минут (стандартный – 30 мин) до еды (график 1А).
Ожирение
В исследовании I фазы, проведённом с инсулином глулизином, лизпро и стандартным человеческим инсулином в популяции, страдающей ожирением, было продемонстрировано, что инсулин глулизин сохраняет свои свойства быстро действующего соединения, (см. график № 2).
График № 2. Скорость всасывания глюкозы после подкожного введения 0,3 ЕД/кг инсулина глулизина (ГЛУЛИЗИН), инсулина лизпро (ЛИЗПРО) и стандартного человеческого инсулина (СТАНДАРТНЫЙ) в популяции с ожирением.
Клинические исследования
Сахарный диабет 1 типа, взрослые
В 26-недельном клиническом исследовании III фазы, в котором сравнивали инсулин глулизин с инсулином лизпро, вводившихся подкожно незадолго (0-15 минут) до еды больным сахарным диабетом 1 типа, использовавших инсулин гларгин в качестве базального инсулина, инсулин глулизин был сопоставим с инсулином лизпро в отношении гликемического контроля, что отражалось в изменении гликозилированного гемоглобина от исходного уровня до конечного показателя. Наблюдались сопоставимые показатели глюкозы крови, измерявшиеся самими больными в ходе самоконтроля. В противоположность инсулину лизпро, увеличения дозы базального инсулина в случае применения инсулина глулизина не потребовалось.
12-недельное клиническое исследование III фазы, проведённое на больных сахарным диабетом 1 типа, получавших инсулин гларгин в качестве базального инсулина, показывает, что введение инсулина глулизина непосредственно после приёма пищи обеспечивает эффективность, которая сопоставима с таковой для инсулина глулизина, введённого непосредственно перед едой (0-15 минут), и стандартного инсулина (30-45 минут).
В ходе исследования наблюдалось значительно более выраженное снижение гликозилированного гемоглобина в группе с глулизином, вводимым до еды, по сравнению с группой стандартного инсулина.
Сахарный диабет 1 типа, дети и подростки
В 26-недельном клиническом исследовании III фазы сравнивали инсулин глулизин с инсулином лизпро, вводившихся подкожно незадолго (0-15 мин.) до еды детям (4-5 лет: n=9; 6-7 лет: n= 32 и 8-11 лет: n=149) и подросткам (12-17 лет: n= 382), страдавшим сахарным диабетом 1 типа и использовавшим инсулин гларгин или NPH в качестве базального инсулина. Инсулин глулизин был сопоставим с инсулином лизпро по уровню гликемического контроля, что выражалось в изменении величины гликозилированного гемоглабина (выражаемого как эквивалент HbA1c) от исходного до конечного показателя и в показателях глюкозы крови, измерявшихся самими больными.
Клиническая информация по назначению Апидры детям младше 6 лет ограничена.
Сахарный диабет 2 типа, взрослые
26-недельное клиническое исследование III фазы, последовавшее за 26-недельным клиническим исследованием безопасности, было проведено для сравнения инсулина глулизина (0-15 минут до еды) со стандартным человеческим инсулином (30-45 минут до еды), вводимых подкожно больным с сахарным диабетом 2 типа, использовавшим в качестве базального инсулин NPH. Средний индекс массы тела (BMI) больных составлял 34,55 кг/м2. Было показано, что инсулин глулизин был сопоставим со стандартным человеческим инсулином по изменению показателя гликолизированного гемоглобина от исходного уровня до конечного 6-месячного уровня (- 0,46 % для инсулина глулизина и — 0,30 % для стандартного человеческого инсулина, р=0,0029) и от исходного уровня до конечного 12-месячного уровня (- 0,23 % для инсулина глулизина и — 0,13% для стандартного человеческого инсулина, разница несущественна). В этом исследовании во время рандомизации большинство больных (79 %) смешивали стандартный инсулин короткого действия с Инсулином NPH непосредственно перед введением инъекции, а 58 % больных использовали таблетированные сахароснижающие препараты, им было дано указание продолжать их применение в той же дозе.
Раса и пол
В контролированных клинических исследованиях на взрослых в подгруппах, подобранных по расовому и половому признакам, инсулин глулизин не отличался по безопасности и эффективности.
Фармакокинетика
Замена аминокислоты аспарагина человеческого инсулина в позиции В3 на лизин и лизина в позиции В29 на глютаминовую кислоту обеспечили ускорение всасывания инсулина глулизина.
В исследовании с 18 пациентами мужского пола в возрасте 21-50 лет, страдавшими сахарным диабетом 1 типа, инсулин глулизин проявлял пропорциональность дозе при ранней, максимальной и общей экспозиции в дозовом интервале от 0,075 до 0,4 Ед/кг.
Всасывание и биодоступность
Фармакокинетические профили в организме здоровых добровольцев и больных диабетом (1 и 2 тип) наглядно показали, что всасывание инсулина глулизина было в два раза быстрее с достижением максимальной концентрации, примерно, в два раза выше, чем у стандартного человеческого инсулина (см. график № 3).
График № 3. Фармакокинетический профиль инсулина глулизина и стандартного человеческого инсулина у больных сахарным диабетом 1 типа после дозы 0,15 ЕД/кг.
Когда инсулин глулизин вводили подкожно в живот, плечо или бедро, графики концентрация-время были похожими, с несколько ускоренным всасыванием при введении в живот по сравнению с введением в бедро. Всасывание из области плеча находилось в промежуточном интервале (см. Дозировка и способ применения). Абсолютная биодоступность (70%) инсулина глулизина в различных областях введения инъекции была схожей и имела низкую вариабельность (11% CV) у одного и того же пациента.
Распределение и выведение
Распределение и выведение инсулина глулизина и стандартного человеческого инсулина после внутривенного введения сходны. После подкожного введения инсулин глулизин выводится быстрее, чем стандартный человеческий инсулин.
Особые группы больных
Нарушение почечной функции
В клиническом исследовании, проведённом с участием добровольцев без сахарного диабета и различной степенью нарушения почечной функции (клиренс креатинина > 80 мл/мин, 30-50 мл/мин, < 30 мл/мин), свойство инсулина глулизина оказывать быстрое действие, как правило, сохранялось. Однако, потребность в инсулине может снижаться в случае нарушения функции почек.
Нарушение печёночной функции
Фармакокинетические свойства у больных с нарушением функции печени не изучались.
Больные пожилого возраста
Данные по фармакокинетике больных пожилого возраста очень малочисленны.
Дети и подростки
Фармакокинетические и фармакодинамические свойства инсулина глулизина изучали на детях (7-11 лет) и подростках (12-16 лет), страдавших 1 типом сахарного диабета. Инсулин глулизин быстро всасывался в обеих группах больных с Тmax и Сmax как у взрослых (см. Дозировка и способ применения). При введении непосредственно перед приёмом пищи инсулин глулизин также как и у взрослых обеспечивал лучший контроль уровня глюкозы после еды, чем стандартный человеческий инсулин (см. Фармакодинамика).
Результаты доклинических испытаний на безопасность
Данные доклинических исследований не выявили иной токсичности, отличной от токсичности стандартного человеческого инсулина или имеющей значение для человека, кроме той, которая связана с глюкозопонижающим фармакодинамическим действием в крови (гипогликемия).
Сахарный диабет, требующий лечения инсулином, у взрослых, подростков и детей старше 6 лет.
Апидру следует вводить незадолго (0-15 мин) до или вскоре после приема пищи.
Апидру следует использовать в режимах, включающих инсулин среднего или длительного действия, или аналог базального инсулина (Лантус, инсулин гларгин), его можно использовать вместе с таблетированными сахароснижающими препаратами.
Дозировку Апидры подбирают индивидуально.
Эффективность лекарственного препарата указана в единицах. Эти единицы являются эксклюзивными для Апидра и не идентичны ME или единицам, используемым для выражения эффективности других аналогов инсулина.
Введение
Апидру следует вводить в подкожно-жировую клетчатку живота, плеча или бедра либо в подкожно-жировую клетчатку живота при длительной инфузии. Места инъекций и инфузий должны чередоваться при каждой новой инъекции в пределах, рекомендуемых областей для подкожного введения препарата. Скорость всасывания и, следовательно, время появления и продолжительность действия могут зависеть от места инъекции, физической нагрузки и других факторов. Подкожная инъекция в брюшную стенку обеспечивает несколько ускоренное всасывание по сравнению с другими местами введения инъекции (см. Фармакокинетика).
Следует следить за тем, чтобы препарат не попал в кровеносный сосуд. После инъекции место введения массировать не нужно. Необходимо обучить пациента правильной технике введения инъекции.
Препарат Апидра в картриджах предназначен только для подкожного введения при помощи многоразовых шприц-ручек. Сообщите своему врачу, если вам необходимо сделать инъекцию или инфузию инсулина другим способом.
Препарат Апидра в шприц-ручке СолоСтар® предназначен только для подкожного введения шприц-ручкой. Сообщите своему врачу, если вам необходимо сделать инъекцию или инфузию инсулина другим способом. Перед использованием шприц-ручки СолоСтар® необходимо внимательно прочитать инструкцию по ее применению.
Смешивание с инсулинами
Ввиду отсутствия исследований по совместимости, данный препарат не следует смешивать с другими лекарственными препаратами, за исключением человеческого инсулина NPH.
Особые группы больных
Нарушение функции почек
Фармакокинетические свойства инсулина глулизина обычно сохраняются у больных с нарушением почечной функции. Однако потребность в инсулине может снижаться при нарушении почечной функции (см. Фармакокинетика).
Нарушение функции печени
Фармакокинетические свойства инсулина глулизина у больных с нарушением функции печени не изучали. У больных с нарушением печёночной функции потребность в инсулине может снижаться ввиду сниженной способности к глюконеогенезу и сниженного метаболизма инсулина.
Больные пожилого возраста
Данные о фармакокинетике у больных пожилого возраста, страдающих сахарным диабетом, недостаточны. Нарушение почечной функции может привести к снижению потребности в инсулине.
Дети и подростки
Клиническая информация по назначению Апидры детям младше 6 лет ограничена.
Повышенная чувствительность к действующему веществу или к какому-либо из вспомогательных веществ, входящих в состав препарата.
Гипогликемия.
Перевод больного на новый тип или торговую марку инсулина должен проводиться под строгим медицинским наблюдением. Изменение формы выпуска, торговой марки (производитель), типа (стандартный, NPH, медленного действия и т.д.), происхождения (вид животного) и (или) производственной технологии может повлечь за собой изменение в дозировании. Может потребоваться корректировка дозы пероральных гипогликемических средств при одновременном лечении.
Неадекватное дозирование или прекращение лечения, особенно у инсулинозависимых больных диабетом, может стать причиной гипергликемии и диабетического кетоацидоза – угрожающих жизни состояний.
Гипогликемия
Время развития гипогликемии зависит от механизма действия используемых инсулинов и, следовательно, может измениться с изменением лечебного режима.
К состояниям, которые могут изменить ранние симптомы гипогликемии или ослабить их выраженность, относятся следующие: длительно существующий диабет, интенсивная терапия инсулином, диабетическая нейропатия, такие лекарственные препараты как β-блокаторы или переход с инсулина животного происхождения на человеческий. Может потребоваться корректирование дозы, если больной повысил свою физическую нагрузку или изменил распорядок приёма пищи. Выполнение физических упражнений сразу же после приема пищи может увеличить риск развития гипогликемии.
Если гипогликемия развивается после инъекции быстро действующих аналогов, то она может развиться раньше, по сравнению с инъекцией растворимого человеческого инсулина.
Если гипогликемические и гипергликемические реакции не корректируются, они могут вызвать потерю сознания, кому и смерть больного.
Потребность больного в инсулине может измениться во время болезни или эмоционального стресса.
Медицинские ошибки
Сообщалось о медицинских ошибках, когда другие инсулины, особенно инсулины пролонгированного действия, были случайно введены вместо инсулина глулизина. Этикетку инсулина необходимо всегда проверять перед каждой инъекцией, чтобы избежать медицинской ошибки между инсулином глулизином и другими инсулинами.
Комбинация Апидры и пиоглитазона
Сообщалось о случаях сердечной недостаточности, когда в комбинации с инсулином был использован пиоглитазон, особенно у пациентов с факторами риска развития сердечной недостаточности. Это необходимо принимать во внимание при назначении комбинации пиоглитазона и Апидры. При приеме комбинации данных препаратов необходимо наблюдение за пациентами в отношении появления признаков и симптомов сердечной недостаточности, увеличения веса и отеков.
Прием пиоглитазона должен быть прекращен, если происходит какое-либо ухудшение симптомов сердечной недостаточности.
Апидра в картриджах
Апидра в картриджах предназначена только для подкожного введения при помощи многоразовых шприц-ручек. Сообщите своему врачу, если вам необходимо сделать инъекцию или инфузию инсулина другим способом.
Картриджи Апидра следует использовать только со следующими шприц-ручками:
— JuniorSTAR, дозирующий препарат Апидра с шагом 0,5 ЕД
— OptiPen, ClikSTAR, Tactipen, Autopen 24, AllStar и AllStar PRO, дозирующие препарат Апидра с шагом 1 ЕД.
Картриджи не следует использовать с любой другой многоразовой шприц-ручкой, поскольку точность дозирования была установлена только для перечисленных ручек.
Не все перечисленные выше шприц-ручки могут быть представлены в стране.
Обращение со шприц-ручкой
Апидра в шприц-ручке СолоСтар® предназначена только для подкожного введения шприц-ручкой. Сообщите своему врачу, если вам необходимо сделать инъекцию или инфузию инсулина другим способом. Перед использованием шприц-ручки СолоСтар® необходимо внимательно прочитать инструкцию по ее применению.
Во время полета следует хранить препарат в ручном багаже, а не в багажном отсеке самолета (Замораживание инсулина не допускается! См. раздел «Условия хранения»).
Вспомогательные вещества
Апидра содержит метакрезол, который может вызывать аллергические реакции.
Беременность
Достаточной информации по применению инсулина глулизина беременными женщинами нет.
Ограниченное число данных об использовании инсулина глулизина беременными женщинами (сообщалось о менее 300 исходах беременности) не выявило никаких проблем безопасности применения препарата в ходе беременности или влияния на плод и новорожденного ребенка.
Доклинические исследования репродуктивности не выявили различий между инсулином глулизином и человеческим инсулином в их воздействии на беременность, эмбриональное (фетальное) развитие, роды и развитие в послеродовом периоде (см. Результаты доклинических испытаний на безопасность).
Назначая препарат беременным женщинам, нужно проявлять осторожность. Необходимо проводить тщательный мониторинг глюкозы.
На протяжении всей беременности необходимо поддерживать состояние метаболического равновесия у больных с ранее существовавшим или гестационным сахарным диабетом. Потребность в инсулине в первом триместре беременности может снижаться, она обычно, возрастает во втором и третьем триместрах. Сразу же после родов потребность в инсулине быстро снижается.
Грудное вскармливание
Неизвестно, проникает ли инсулин глулизин в грудное молоко, однако, обычно инсулин не проникает в грудное молоко и не всасывается после перорального приема.
Женщинам, кормящим грудью, может потребоваться корректировка дозы инсулина и диеты.
Гипогликемия, самая частая нежелательная реакция на инсулиновую терапию, может развиваться, если доза инсулина слишком высока по сравнению с потребностью в инсулине.
Следующие, связанные с применением препарата нежелательные реакции, наблюдавшиеся в ходе клинических исследований, представлены ниже по системам классов органов в порядке убывания их встречаемости (очень частые: >1/10; частые: > 1/100, <1/10; нечастые: > 1/1000, <1/100; редкие: > 1/10000, <1/1000; очень редкие: <1/10000), неизвестно (невозможно определить на основании имеющихся данных).
Внутри каждой частотной группы нежелательные реакции представлены в порядке убывания значимости.
| Наиболее часто | Часто | Нечасто | Редко | |
| Нарушения со стороны метаболизма и питания | гипогликемия | |||
| Нарушения со стороны кожи и подкожных тканей | реакции на месте введения инъекции и местные реакции повышенной чувствительности | липодистрофия | ||
| Изменения общего характера | системные реакции повышенной чувствительности |
Нарушения со стороны метаболизма и питания
Симптомы гипогликемии обычно развиваются внезапно. К ним относятся: холодный пот, холодная бледная кожа, усталость, раздражительность или тремор, тревога, необычная усталость или слабость, спутанность сознания, снижение концентрации внимания, сонливость, острое чувство голода, нарушения зрения, головная боль, тошнота и чувство усиленного сердцебиения.
Гипогликемия может принять выраженную форму и привести к потере сознания и (или) конвульсиям, и может привести к временному или постоянному нарушению функции головного мозга и даже к смерти.
Нарушения со стороны кожи и подкожных тканей
Местные реакции повышенной чувствительности (покраснение, отечность и зуд на месте инъекции) возможны во время лечения инсулином. Обычно эти реакции временные и исчезают при продолжающемся лечении.
Липодистрофия возможна на месте инъекции как последствие несоблюдения правила о смене места введения инъекции в пределах одной и той же области.
Изменения общего характера
К системным реакциям повышенной чувствительности относятся крапивница, чувство стеснения в груди, одышка, аллергический дерматит и зуд. Случаи тяжёлой генерализованной аллергии, в том числе анафилактическая реакция, могут угрожать жизни больного.
Возможно, развитие гипогликемии в результате избыточного действия инсулина по отношению к потреблению пищи и энергетическим затратам больного.
Специальные данные о передозировке инсулина глулизина отсутствуют. Тем не менее, гипогликемия может развиваться поэтапно.
Эпизоды лёгкой гипогликемии можно лечить с помощью перорального приёма глюкозы или сладостей. Следовательно, больным сахарным диабетом рекомендуется постоянно иметь при себе несколько кусочков сахара, конфеты, печенье или сладкий фруктовый сок. Эпизоды тяжёлой гипогликемии, когда больной теряет сознание, можно лечить глюкагоном (0,5 — 1 мг), вводимым внутримышечно или подкожно человеком, который получил соответствующий инструктаж, либо же лечить внутривенной глюкозой, вводимой медицинским работником. Следует также ввести глюкозу внутривенно, если в течение 10-15 минут нет реакции больного на глюкагон. После восстановления сознания рекомендуется пероральный приём углеводов во избежание рецидива.
После введения инъекции глюкагона необходимо наблюдение больного в стационаре с целью выяснения причины тяжёлой гипогликемии и предотвращения развития таких эпизодов в будущем.
Исследований фармакологических взаимодействий не проводилось. Исходя из опыта, полученного с другими подобными лекарственными препаратами, фармакологические взаимодействия, имеющие клиническое значение, маловероятны.
Информируйте врача о ВСЕХ принимаемых Вами лекарственных препаратах, даже если это происходит от случая к случаю!
Некоторые вещества влияют на метаболизм глюкозы, поэтому может потребоваться корректирование дозы инсулина глулизина и особо тщательное наблюдение.
К веществам, способным усиливать глюкозопонижающий эффект в крови и повышать склонность к гипогликемии, относятся пероральные препараты гипогликемического действия, ингибиторы ангиотензин-превращающего фермента, дизопирамид, фибраты, флуоксетин, ингибиторы МАО, пентоксифиллин, пропоксифен, салицилаты и сульфонамидные антибиотики.
К веществам, способным снижать глюкозопонижающую активность в крови, относятся глюкокортикостероидные гормоны, даназол, диазоксид, диуретики, глюкагон, изониазид, производные фенотиазина, соматропин, симпатомиметики (например, эпинефрин [адреналин], сальбутамол, тербуталин), гормоны щитовидной железы, эстрогены, прогестины (например, в оральных контрацептивах), ингибиторы протеазы и атипичные антипсихотические лекарственные препараты (например, оланзапин и клозапин).
Бета-блокаторы, клонидин, соли лития и алкоголь могут как усиливать, так и ослаблять глюкозопонижающую активность инсулина в крови. Пентамидин может вызывать гипогликемию, которая иногда переходит в гипергликемию.
Кроме того, под воздействием таких симпатолитических лекарственных препаратов, как β-блокаторы, клонидин, гуанетидин и резерпин, признаки адренергической противорегуляции могут быть слабо выраженными, либо отсутствовать.
Указания по совместимости
В связи с отсутствием исследований по совместимости данный препарат нельзя смешивать с другими лекарственными препаратами, кроме человеческого инсулина NPH.
Способность больного к концентрации внимания, его моторные реакции могут ухудшаться в результате гипогликемии или гипергликемии, или, к примеру, в результате нарушения зрения. Это представляет опасность в ситуациях, где выше указанные способности имеют особое значение (например, при управлении автомобилем или рабочими механизмами).
Следует предупреждать больных о необходимости принятия мер предосторожности во избежание развития гипогликемии во время управления транспортом. Это особо важно для тех, у кого симптомы-предвестники гипогликемии слабо выражены либо отсутствуют, либо для тех, у кого часты эпизоды гипогликемии. Необходимо принять решение о целесообразности управления автомобилем или рабочими машинами при таких обстоятельствах.
По 3 мл в картридж из прозрачного, бесцветного стекла (тип I). Картридж укупорен с одной стороны бромбутиловой пробкой и обжат алюминиевым колпачком, с другой стороны – бромбутиловым плунжером. По 5 картриджей в контурную ячейковую упаковку из ПВХ пленки и фольги алюминиевой. По 1 контурной ячейковой упаковке помещают вместе с инструкцией по применению в картонную пачку.
По 3 мл в картридже из прозрачного, бесцветного стекла (тип I). Картридж укупорен с одной стороны бромбутиловой пробкой и обжат алюминиевым колпачком, с другой стороны – бромбутиловым плунжером. Картридж вмонтирован в одноразовую шприц-ручку СолоСтар. По 5 шприц-ручек СолоСтар помещают в картонную пачку вместе с инструкцией по применению.
Хранить при температуре от + 2°С до + 8°С в защищенном от света месте.
Хранить в недоступном для детей месте.
Не замораживать! Не допускать прямого контакта контейнера с морозильной камерой или замороженными предметами.
Перед первым использованием шприц-ручку необходимо хранить при комнатной температуре в течение 1-2 часов.
После начала использования хранить при температуре не выше +25°С в картонной упаковке (но не в холодильнике).
2 года.
По истечении срока годности препарат применять нельзя.
Примечание: срок годности препарата после первого использования – 4 недели.
Рекомендуется отмечать на этикетке дату первого забора препарата.
По рецепту.
Производитель
Санофи-Авентис Дойчланд ГмбХ, Германия
(Sanofi-Aventis Deutschland GmbH, Germany)
Брюнингштрассе, 50.
D-65926, Франкфурт-на-Майне
ГЕРМАНИЯ
Претензии по качеству лекарственного препарата и сообщения о нежелательных реакциях направлять:
Представительство АО «Sanofi-Aventis Groupe» Французская Республика
в Республике Беларусь (Беларусь): 220004 Минск, ул. Димитрова 5, офис 5/2,
тел./факс: (375 17) 203 33 11.
в Республике Узбекистан (Узбекистан, Туркменистан, Таджикистан):
100015 Ташкент, ул. Ойбека, 24, офисный блок 3Д,
тел.: (998 71) 281 46 28/29, факс.: (998 71) 281 44 81.
в Республике Грузия (Грузия и Армения): 0103 Тбилиси, ул. Метехи, 22,
тел.: (995 59) 533 13 36
в Республике Казахстан (Кыргызстан): 050013 г. Алматы, ул. Фурманова, 187 «Б»,
Бизнес центр «STAR» 3й эт., тел.: +7 (727) 2445096/97, факс.: +7 (727) 2582596
Пожалуйста, внимательно и полностью прочитайте инструкцию перед первым использованием шприц-ручки. При необходимости перечитайте инструкцию перед последующими применениями шприц-ручки. Сохраняйте данную инструкцию, так как Вам может понадобиться перечитать её в будущем.
Перед началом использования шприц-ручки обсудите с Вашим лечащим врачом способ введения инсулина.
Шприц-ручка СолоСтар – это одноразовая шприц-ручка для инъекций инсулина, с помощью которой вы можете ввести дозу от 1 до 80 единиц с шагом в 1 единицу.
Схематическое изображение шприц-ручки
Рассмотрите шприц-ручку СолоСтар перед началом введения инсулина. Всегда проводите тест на безопасность перед использованием шприц-ручки.
Шприц-ручка может быть использована только в том случае, если раствор в ней прозрачный, бесцветный, не содержит видимых механических включений и по консистенции напоминает воду. Так как препарат представляет собой раствор, не требуется его предварительного перемешивания.
Перед первым использованием шприц-ручку СолоСтар надо выдержать при комнатной температуре в течение 1-2 часов.
Следует также удалить из шприц-ручки пузырьки воздуха перед инъекцией. Тщательно следуйте пошаговой инструкции по использованию шприц-ручки СолоСтар.
Пустые шприц-ручки СолоСтар не должны использоваться повторно и подлежат уничтожению.
Шприц-ручка СолоСтар должна использоваться только одним пациентом и не передаваться другому лицу.
Следует бережно обращаться со шприц-ручкой СолоСтар: оберегать от падений и прочих внешних воздействий (возможно повреждение картриджа, приводящее к поломке шприц- ручки). Если же это произошло, необходимо начать использование новой шприц-ручки СолоСтар.
Перед каждой инъекцией следует использовать новую иглу. Возможно использование игл, специально предназначенных для СолоСтар или подходящих к шприц-ручке. После инъекции игла снимается, и шприц-ручка хранится без иглы. Повторное использование игл не разрешается. Иглы также должны сниматься перед утилизацией шприц-ручки.
Шаг 1. Проверка инсулина
1 Проверьте надпись на этикетке Вашей шприц-ручки перед использованием, чтобы убедиться в правильном выборе инсулина. Шприц-ручка СолоСтар, содержащая Апидру, имеет корпус синего цвета и тёмно-синюю пусковую кнопку.
2 Снимите колпачок ручки.
3 Проверьте внешний вид инсулина. Раствор должен быть прозрачным и бесцветным. Не используйте шприц-ручку, если она содержит мутный раствор или видимые частицы.
Шаг 2. Установка иглы
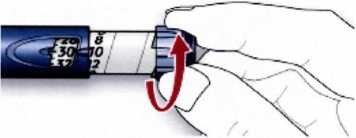
1 Снимите наружную защитную мембрану.
2 Присоедините иглу к шприц-ручке, при этом держите её прямо (навинтите или наденьте, в зависимости от вида иглы)
Не держите иглу под наклоном в момент присоединения к шприц-ручке. Это может привести к повреждению резиновой мембраны и протечке инсулина и к поломке иглы.
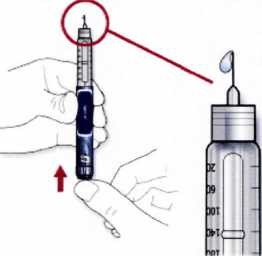
Шаг 3. Тест на безопасность
Данный тест должен проводиться перед каждой инъекцией.
1 Наберите дозу равную 2 единицам на селекторе дозы.
2 Снимите внешний защитный колпачок. Не выбрасывайте его, так как он понадобится Вам после проведения инъекции. Снимите внутренний защитный колпачок. Выбросьте его, так как он Вам больше не понадобится.
3 Удерживайте шприц-ручку иглой вверх.
4 Постучите пальцем по держателю картриджа для того, чтобы пузырьки воздуха поднялись вверх к игле.
5 Полностью нажмите на пусковую кнопку, чтобы выпустить дозу. Убедитесь в том, что выброс инсулина произошёл.
Возможно, Вам понадобится провести тест на безопасность несколько раз пока не произойдет выброс инсулина.
Если выброс инсулина не произошёл и после повторного проведения теста на безопасность, проверьте наличие пузырьков воздуха.
Если есть пузырьки воздуха, то тест на безопасность следует повторять до тех пор, пока они не исчезнут.
Если пузырьки воздуха отсутствуют, то, возможно, игла засорена. В данном случае, замените иглу.
Шаг 4. Установка и набор дозы инсулина
Вы можете установить дозу от 1 до 80 единиц с шагом в 1 единицу. Если вы нуждаетесь в дозе больше 80 единиц, вам следует ввести её в две или более инъекций.
1 Проверьте значение в окне-указателе дозы после проведения теста на безопасность. Оно должно быть равно «0».
2 Наберите требуемую Вам дозу (на примере ниже выбранная доза равно 30 единицам). Если Вы набрали неправильную дозу, поверните селектор дозы в обратном направлении до нужного значения.
Не нажимайте на пусковую кнопку во время выбора дозы, так как может произойти выброс инсулина, что в свою очередь приведет к неправильной дозировке.
Селектор дозы может быть повернут только на то количество единиц дозы, которое содержится в шприц-ручке, поэтому не пытайтесь поворачивать селектор дозы больше, чем это возможно. В том случае, если в шприц-ручке содержится недостаточное количество инсулина, Вы можете ввести недостающее количество с помощью новой шприц-ручки или введите всю дозу из новой шприц-ручки.
Шаг 5. Инъекция инсулина
1 Используйте способ введения, предписанный Вашим лечащим врачом.
2 Введите иглу в кожу.
3 До конца нажмите на пусковую кнопку. Значение дозы в окне-указателе дозы должно вернуться к значению «0».
4 Не извлекая иглу и удерживая пусковую кнопку, досчитайте до 10. Это необходимо для того, чтобы гарантировать полное введение дозы. Извлеките иглу.
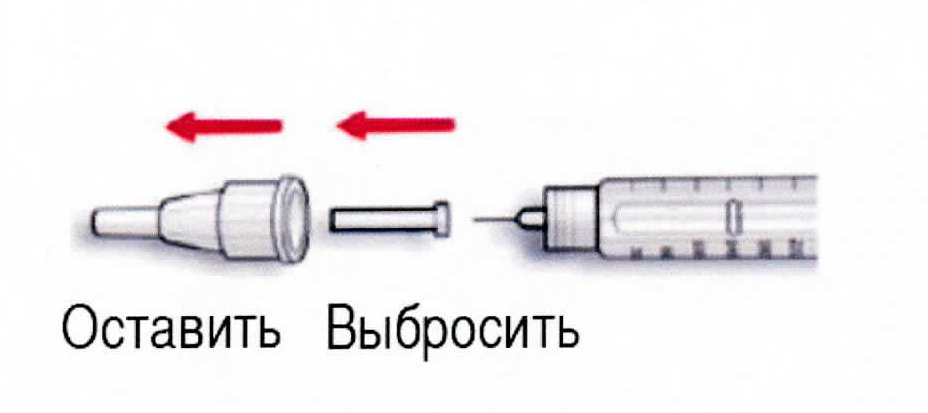
Шаг 6. Удаление иглы
Всегда отсоединяйте иглу после инъекции и храните шприц-ручку без иглы. Это позволит избежать загрязнения иглы, накоплению пузырьков воздуха в держателе картриджа и протекания инсулина.
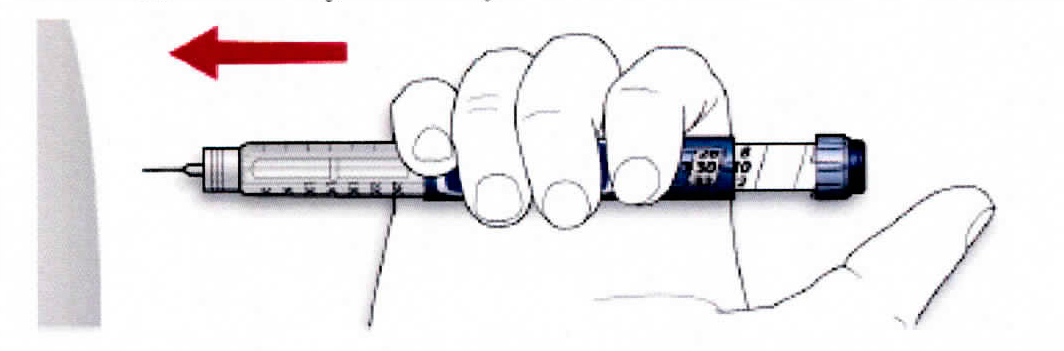
1 Для того, чтобы предотвратить случайное повреждение, наденьте внешний защитный колпачок на иглу.
2 Отсоедините иглу. Утилизируйте использованную иглу.
3 Оденьте колпачок на шприц-ручку.
Возулим-Н — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер
ЛП-000323
Торговое наименование препарата
Возулим-Н
Международное непатентованное наименование
Инсулин-изофан [человеческий генно-инженерный]
Лекарственная форма
суспензия для подкожного введения
Состав
В 1 мл препарата содержится:
Действующее вещество: инсулин человеческий (генно-инженерный) — 100 ME (4,00 мг);
Вспомогательные вещества: протамина сульфат — 0,40 мг, цинка оксид — 0,032 мг, метакрезол — 1,60 мг, фенол — 0,65 мг, глицерол — 16,32 мг, натрия гидроксид — 0,40 мг, натрия фосфат двузамещенный безводный — 2,08 мг, хлористоводородная кислота — 0,00072 мл, вода для инъекций — до 1 мл.
Описание
Белая суспензия, которая при стоянии расслаивается на прозрачную бесцветную или почти бесцветную надосадочную жидкость и осадок белого цвета. Осадок легко ресуспендируется при слабом встряхивании.
Фармакотерапевтическая группа
Гипогликемическое средство — инсулин средней продолжительности действия
Код АТХ
A10AC
Фармакодинамика:
Возулим-Н — препарат человеческого инсулина средней продолжительности действия, произведенный методом биотехнологии рекомбинантной ДНК с использованием штамма-продуцента Hansenula polymorpha. Взаимодействует со специфическим рецептором внешней цитоплазматической мембраны клеток и образует инсулин-рецепторный комплекс, стимулирующий внутриклеточные процессы, в т. ч. синтез ряда ключевых ферментов (гексокиназа, пируваткиназа, гликогенсинтаза и др.). Снижение содержания глюкозы в крови обусловлено повышением ее внутриклеточного транспорта, усилением поглощения и усвоения тканями, стимуляцией липогенеза, гликогеногенеза, снижением скорости продукции глюкозы печенью и др.
Продолжительность действия препаратов инсулина в основном обусловлена скоростью всасывания, которая зависит от нескольких факторов (например, от дозы, способа и места введения, толщины подкожно-жирового слоя, типа сахарного диабета), в связи с чем профиль действия инсулина подвержен значительным колебаниям, как у различных людей, так и у одного и того же человека.
Начало действия препарата — через 1 ч после введения, максимальный эффект — между 2 и 8 ч, продолжительность действия — до 24 ч.
Фармакокинетика:
Всасывание
Максимальная концентрация (Сmах) инсулина в плазме достигается в течение 2-18 ч после подкожного введения.
Распределение
Выраженного связывания с белками плазмы не отмечается, за исключением циркулирующих антител к инсулину (в случае их наличия). Не проникает через плацентарный барьер и в грудное молоко.
Метаболизм
Человеческий инсулин расщепляется под действием инсулиновой протеазы или инсулиназы, а также, возможно, под действием протеин-дисульфид-изомеразы. Предполагается, что в молекуле человеческого инсулина имеется несколько участков расщепления (гидролиза); однако ни один из метаболитов, образующихся вследствие расщепления, не является активным.
Выведение
Выводится почками (30-80%). Период полувыведения (Т1/2) определяется по скорости всасывания из подкожных тканей. Таким образом, Т1/2 скорее является мерой всасывания, а не собственно мерой выведения инсулина из плазмы (Т1/2 инсулина из кровотока равен всего нескольким минутам). Исследования показали, что Т1/2 составляет около 5-10 ч.
Показания:
Сахарный диабет, требующий проведения инсулинотерапии.
Противопоказания:
Повышенная чувствительность к инсулину или другим компонентам препарата.
Гипогликемия.
С осторожностью:
У пациентов с почечной недостаточностью, печеночной недостаточностью, выраженным стенозом коронарных и мозговых сосудов, пролиферативной ретинопатией, интеркуррентными заболеваниями; у пациентов пожилого возраста.
Беременность и лактация:
Беременность
Ограничений по применению инсулина во время беременности не существует, поскольку инсулин не проникает через плацентарный барьер.
Как гипогликемия, так и гипергликемия, которые могут развиваться в случаях недостаточно точно подобранной дозы инсулина, повышают риск возникновения пороков развития плода и внутриутробной гибели плода. Беременные женщины с сахарным диабетом в течение всей беременности должны находиться под наблюдением, у них необходимо осуществлять усиленный контроль концентрации глюкозы в крови; такие же рекомендации относятся и к женщинам, которые планируют беременность.
Потребность в инсулине обычно снижается в I триместре беременности и постепенно увеличивается во II и III триместрах.
После родов потребность в инсулине, как правило, быстро возвращается к уровню, который отмечался до беременности.
Период грудного вскармливания
Не существует ограничений для применения препарата Возулим-Н в период грудного вскармливания. Проведение инсулинотерапии женщинам в период грудного вскармливания не представляет опасности для ребенка. Однако может потребоваться коррекция дозы препарата и/или диеты.
Способ применения и дозы:
Препарат Возулим-Н предназначен для подкожного введения. Доза и время введения препарата определяются врачом индивидуально в каждом конкретном случае, на основании концентрации глюкозы в крови. В среднем суточная доза препарата колеблется от 0,3 до 1 МЕ/кг массы тела (зависит от индивидуальных особенностей пациента и концентрации глюкозы крови). Суточная потребность в инсулине может быть выше у пациентов с инсулинорезистентностью (например, в период полового созревания, а также у пациентов с ожирением), и ниже — у пациентов с остаточной эндогенной продукцией инсулина.
Температура вводимого инсулина должна соответствовать комнатной.
Препарат обычно вводится подкожно в область бедра. Инъекции можно делать также в область передней брюшной стенки, ягодиц или в плечо в проекции дельтовидной мышцы. При введении в область бедра достигается более медленное всасывание, чем при введении в другие области.
Необходимо постоянно менять места инъекций в пределах анатомической области, чтобы предотвратить развитие липодистрофии.
При подкожном введении инсулина необходимо проявлять осторожность, чтобы при инъекции не попасть в кровеносный сосуд. После инъекции не следует массировать место введения препарата.
Препарат Возулим-Н может вводиться как самостоятельно, так и в комбинации с препаратом инсулина короткого действия (Возулим-Р).
Картридж необходимо использовать только со шприц-ручкой.
Пациенты должны быть обучены правильному применению устройства для введения инсулина.
Коррекция дозы
Сопутствующие заболевания, особенно инфекционные и сопровождающиеся лихорадкой, обычно увеличивают потребность организма в инсулине. Коррекция дозы препарата может также потребоваться при наличии у пациента сопутствующих заболеваний почек, печени; нарушении функции надпочечников, гипофиза или щитовидной железы.
Необходимость в коррекции дозы также может возникнуть при изменении физической нагрузки или обычного режима питания пациента. Коррекция дозы может потребоваться при переводе пациента с одного вида инсулина на другой.
Побочные эффекты:
Наиболее часто встречающейся нежелательной реакцией при применении инсулина является гипогликемия. Частота возникновения гипогликемии изменяется в зависимости от популяции пациентов, режима дозирования препарата и контроля гликемии (см. «Описание отдельных нежелательных реакций»).
На начальной стадии инсулинотерапии могут возникать нарушение рефракции, периферические отеки и реакции в месте введения препарата (включающие боль, покраснение, крапивницу, воспаление, гематому, припухлость и зуд в месте инъекции). Эти симптомы обычно носят временный характер. Быстрое улучшение контроля гликемии может приводить к состоянию «острой болевой нейропатии», которая обычно является обратимой.
Интенсификация инсулинотерапии с резким улучшением контроля углеводного обмена может привести к временному ухудшению состояния диабетической ретинопатии, в то же время длительное улучшение контроля гликемии снижает риск прогрессирования диабетической ретинопатии.
Перечень нежелательных реакций представлен в таблице. Все представленные ниже нежелательные реакции распределены по группам согласно частоте развития в соответствии с MedDRA и системами органов. Частота развития нежелательных реакций определена как: очень часто (> 1/10); часто (> 1/100 до <1/10); нечасто (>1/1,000 до <1/100); редко (>1/10,000 до <1/1,000); очень редко (<1/10,000) и неизвестно (невозможно оценить на основании имеющихся данных).
|
Нарушения со стороны иммунной системы |
Нечасто — крапивница, кожная сыпь |
|
Очень редко — анафилактические реакции* |
|
|
Неизвестно — образование антител к инсулину |
|
|
Нарушения со стороны обмена веществ и питания |
Очень часто — гипогликемия* |
|
Нарушения со стороны нервной системы |
Очень редко — периферическая нейропатия («острая болевая нейропатия») |
|
Нарушения со стороны органа зрения |
Очень редко — нарушение рефракции |
|
Нечасто — диабетическая ретинопатия |
|
|
Нарушения со стороны кожи и подкожных тканей |
Нечасто — липодистрофия* |
|
Общие расстройства и нарушения в месте введения |
Нечасто — реакции в месте введения |
|
Нечасто — периферические отёки |
*См. «Описание отдельных нежелательных реакций»
Описание отдельных нежелательных реакций
Анафилактические реакции
Отмечены очень редкие реакции генерализованной гиперчувствительности, в том числе генерализованная кожная сыпь, зуд, повышенное потоотделение, желудочно-кишечные расстройства, ангионевротический отек, затруднение дыхания, учащенное сердцебиение, снижение артериального давления, а также обморок/потеря сознания, которые являются потенциально опасными для жизни.
Гипогликемия
Гипогликемия является наиболее частой нежелательной реакцией. Она может развиться, если доза инсулина слишком высока по отношению к потребности в инсулине. Тяжелая гипогликемия может приводить к потере сознания и/или судорогам, временному или необратимому нарушению функции головного мозга или даже к летальному исходу. Симптомы гипогликемии, как правило, развиваются внезапно. Они могут включать повышенное потоотделение, бледность кожных покровов, повышенную утомляемость, нервозность или тремор, чувство тревоги, необычную усталость или слабость, нарушение ориентации, снижение концентрации внимания, сонливость, выраженное чувство голода, нарушение зрения, головную боль, тошноту и учащенное сердцебиение.
Липодистрофия
Сообщалось о нечастых случаях развития липодистрофии. Липодистрофия может развиваться в месте введения препарата.
Передозировка:
При передозировке возможно развитие гипогликемии.
Определенной дозы, необходимой для передозировки инсулина, не установлено, однако гипогликемия может развиваться постепенно, если вводятся слишком высокие дозы инсулина по отношению к потребности пациента.
Легкую гипогликемию пациент может устранить сам, приняв внутрь глюкозу или сахаросодержащие продукты питания. Поэтому пациентам с сахарным диабетом рекомендуется постоянно носить с собой сахаросодержащие продукты (сахар, сладости, печенье или сладкий фруктовый сок).
В случае тяжелой гипогликемии, когда пациент находится без сознания, следует ввести от 0,5 мг до 1 мг глюкагона внутримышечно или подкожно (может вводить обученный человек), либо внутривенно 40% раствор декстрозы (глюкозы) (может вводить только медицинский работник). Также необходимо внутривенно ввести декстрозу в случае, если через 10-15 мин после введения глюкагона пациент не приходит в сознание. После восстановления сознания пациенту рекомендуется принять богатую углеводами пищу для профилактики рецидива гипогликемии.
Взаимодействие:
Имеется ряд лекарственных средств, которые влияют на потребность в инсулине.
Гипогликемическое действие инсулина усиливают неселективные бета-адреноблокаторы, хинидин, хинин, хлорохинин, ингибиторы моноаминооксидазы. ингибиторы ангиотензинпревращающего фермента, ингибиторы карбоангидразы, бромокриптин, сульфаниламиды, анаболические стероиды, тетрациклины, клофибрат, кетоконазол, мебендазол, пиридоксин, теофиллин, циклофосфамид, фенфлурамин, препараты лития, салицилаты.
Гипогликемическое действие инсулина ослабляют глюкагон, соматропин, эстрогены, пероральные контрацептивы, глюкокортикостероиды, препараты йодсодержащих тиреоидных гормонов, тиазидные диуретики, гепарин, трициклические антидепрессанты, симпатомиметики, даназол, клонидин, сульфинпиразон, эпинефрин, блокаторы Н1-гистаминовых рецепторов, блокаторы «медленных» кальциевых каналов, диазоксид, морфин, фенитоин, никотин.
Бета-адреноблокаторы могут маскировать симптомы гипогликемии и замедлять восстановление после гипогликемии.
Октреотид/ланреотид может как повышать, так и снижать потребность организма в инсулине.
Этанол (алкоголь) может усиливать или уменьшать гипогликемический эффект инсулина.
Несовместимость
Фармацевтически несовместим с растворами других лекарственных средств. Суспензию инсулина нельзя добавлять к растворам для инфузий.
Особые указания:
Нельзя применять препарат Возулим-Н, если после взбалтывания суспензия не становится белой или равномерно мутной.
На фоне терапии инсулином необходим постоянный контроль концентрации глюкозы в крови.
В случае недостаточного гликемического контроля или появления тенденции к эпизодам гипо- или гипергликемии, перед принятием решения о коррекции дозы инсулина следует проверить выполнение предписанного режима введения инсулина; удостовериться в том, что инсулин вводится в рекомендованную область; проверить правильность проведения техники инъекции и все другие факторы, которые могут повлиять на действие инсулина. Так как одновременный прием ряда препаратов может ослабить или усилить гипогликемическое действие препарата Возулим-Н (см. раздел «Взаимодействие с другими лекарственными средствами»), при его применении нельзя принимать другие препараты без специального разрешения врача.
Гипогликемия
Гипогликемия может развиться, если введена слишком высокая доза инсулина по отношению к потребности пациента.
Риск развития гипогликемии высок в начале лечения инсулином, при переходе на другой препарат инсулина, у пациентов с низкой поддерживающей концентрацией глюкозы в крови.
Причинами гипогликемии, помимо передозировки инсулина, могут быть: переход на другой препарат инсулина; пропуск приема пищи; рвота; диарея; увеличение физической активности; заболевания, снижающие потребность в инсулине (нарушения функции печени и почек, гипофункция коры надпочечников, гипофиза или щитовидной железы); смена места инъекции; потребление алкоголя; а также взаимодействие с другими лекарственными средствами.
Как и для всех препаратов инсулина, следует соблюдать особую осторожность, а также рекомендуется проводить тщательный контроль концентрации глюкозы в крови в случаях, когда эпизоды гипогликемии могут иметь особое клиническое значение — у пациентов с выраженным стенозом коронарных артерий или сосудов головного мозга (риск развития кардиальных или церебральных осложнений гипогликемии), а также у пациентов с пролиферативной ретинопатией, особенно если им не проводилась фотокоагуляция (риск преходящей потери зрения (амавроза) вследствие гипогликемии).
Необходимо сразу же информировать врача о развитии гипогликемии, для того чтобы он принял решение о необходимости коррекции дозы инсулина.
При определенных обстоятельствах симптомы-предвестники гипогликемии могут изменяться, становиться менее выраженными или отсутствовать. Такие ситуации встречаются у пациентов со значительным улучшением гликемического контроля; пациентов с постепенным развитием гипогликемии; пациентов пожилого возраста; пациентов с психическими расстройствами; при наличии нейропатии; при длительном течении сахарного диабета; при сопутствующей терапии другими лекарственными препаратами (см. раздел «Взаимодействие с другими лекарственными средствами»). Такие ситуации могут приводить к развитию тяжелой гипогликемии (с возможной потерей сознания) до того, как пациент осознает, что у него развивается гипогликемия. Соблюдение пациентами схемы дозирования и режима питания, правильное введение инсулина и знание симптомов-предвестников гипогликемии способствуют существенному снижению риска развития гипогликемии.
Гипергликемия
Недостаточная доза препарата или прекращение лечения, особенно при сахарном диабете 1 типа, несоблюдение диеты, повышенная потребность в инсулине в результате инфекционных или других заболеваний, снижение физической активности могут приводить к повышению концентрации глюкозы в крови (гипергликемии). Как правило, первые симптомы гипергликемии появляются постепенно, в течение нескольких часов или дней.
Симптомами гипергликемии являются чувство жажды, учащенное мочеиспускание, тошнота, рвота, сонливость, покраснение и сухость кожи, сухость во рту, потеря аппетита, а также появление запаха ацетона в выдыхаемом воздухе. Без соответствующего лечения гипергликемия у пациентов с сахарным диабетом 1 типа может приводить к развитию опасного для жизни диабетического кетоацидоза. При появлении первых признаков кетоацидоза необходимо срочное врачебное вмешательство. При смене врача (например, при госпитализации по поводу несчастного случая, заболевании во время отпуска) пациент должен сообщить врачу о том, что у него сахарный диабет.
У пациентов с почечной недостаточностью может быть снижена потребность в инсулине в результате изменения его метаболизма.
У пациентов с тяжелыми нарушениями функции печени также может быть снижена потребность в инсулине в результате изменения его метаболизма и уменьшения глюконеогенеза.
Дозу инсулина необходимо также корригировать при нарушении функции щитовидной железы, гипофункции коры надпочечников и гипофиза; у пациентов пожилого возраста.
Коррекция дозы инсулина может также потребоваться при увеличении интенсивности физической активности или изменении привычной диеты.
Сопутствующие заболевания, особенно инфекции и состояния, сопровождающиеся лихорадкой, увеличивают потребность в инсулине.
Перевод пациентов на другой тип инсулина или на инсулин другой компании-изготовителя должен осуществляться только под медицинским контролем. При изменении концентрации, производителя, типа, вида (человеческий инсулин, аналог человеческого инсулина) и/или метода изготовления может потребоваться изменение дозы инсулина.
Пациентам, переходящим на лечение препаратом Возулим-Н может потребоваться изменение дозы или увеличение частоты инъекций по сравнению с ранее применявшимися препаратами инсулина. Если при переводе пациентов на лечение препаратом Возулим-Н необходима коррекция дозы, это можно сделать уже при введении первой дозы или в первые недели или месяцы терапии.
Переход с одного вида инсулина на другой следует проводить под контролем концентрации глюкозы в крови.
Как и при лечении другими препаратами инсулина, могут развиваться реакции в месте введения, что проявляется болью, покраснением, крапивницей, воспалением, гематомой, отёчностью и зудом. Регулярная смена места инъекции в пределах одной и той же анатомической области поможет уменьшить симптомы или предотвратить развитие этих реакций. Реакции обычно исчезают в течение от нескольких дней до нескольких недель. В редких случаях может потребоваться отмена препарата Возулим-Н из-за реакций в месте введения.
Перед поездкой, связанной со сменой часовых поясов, пациент должен проконсультироваться со своим лечащим врачом, поскольку смена часового пояса означает, что пациент должен принимать пищу и вводить инсулин в другое время.
Препарат нельзя применять в инсулиновых насосах.
Одновременное применение препаратов инсулина и препаратов группы тиазолидиндиона Сообщалось о случаях развития хронической сердечной недостаточности при лечении пациентов тиазолидиндионами в комбинации с препаратами инсулина, особенно при наличии у таких пациентов факторов риска развития хронической сердечной недостаточности. Следует учитывать данный факт при назначении пациентам комбинированной терапии тиазолидиндионами и препаратами инсулина. При применении такой комбинированной терапии необходимо проводить медицинские обследования пациентов на предмет выявления у них признаков и симптомов хронической сердечной недостаточности, увеличения массы тела и наличия периферических отеков. В случае ухудшения у пациентов симптоматики сердечной недостаточности, лечение тиазолидиндионами необходимо прекратить.
Препарат снижает толерантность к алкоголю.
Влияние на способность управлять транспортными средствами и механизмами:
Способность пациентов к концентрации внимания и скорость реакции могут нарушаться во время гипогликемии, что может представлять опасность в тех ситуациях, когда эти способности особенно необходимы (например, при управлении транспортными средствами или работе с машинами и механизмами).
Пациентам необходимо рекомендовать предпринимать меры для предупреждения развития гипогликемии при управлении транспортными средствами. Это особенно важно для пациентов с отсутствием или снижением выраженности симптомов-предвестников развивающейся гипогликемии или с частыми эпизодами гипогликемии. В этих случаях следует рассмотреть целесообразность управления транспортными средствами и выполнения подобных работ.
Форма выпуска/дозировка:
Суспензия для подкожного введения, 100 МЕ/мл.
Упаковка:
По 3 мл в картриджи нейтрального стекла (тип I). На картридж наклеивают этикетку.
По 1 или 5 картриджей помещают в блистер из ПВХ/алюминиевой фольги.
По 10 мл во флаконы бесцветного нейтрального стекла, укупоренные резиновыми пробками и обжатые алюминиевыми колпачками с пластмассовой предохранительной крышкой.
Каждый флакон или каждый блистер с картриджем №1 или №5 помещают в картонную пачку вместе с инструкцией по применению.
Условия хранения:
Хранить в защищенном от света месте, при температуре от +2 °С до +8 °С. Не замораживать. Беречь от детей.
Находящийся в употреблении препарат следует хранить при температуре 15-25 °С не более 6 недель.
Срок годности:
2 года.
Не использовать после истечения срока годности, указанного на упаковке.
Условия отпуска
По рецепту
Производитель
Общество с ограниченной ответственностью «Добролек» (ООО «Добролек»), 115446, г. Москва, Коломенский проезд, д. 13 А, Россия
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
Вокхард Лимитед
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Описание препарата Апидра® СолоСтар® (раствор для подкожного введения, 100 ЕД/мл) основано на официальной инструкции, утверждено компанией-производителем в 2020 году
Дата согласования: 17.09.2020
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
- Отзывы
Фотографии упаковок

17.09.2020
Действующее вещество
ATX
Фармакологическая группа
Состав
| Раствор для подкожного введения, 100 ЕД/1 мл | 1 мл |
| активное вещество: | |
| инсулин глулизин | 100 ЕД (3,49 мг) |
| вспомогательные вещества: метакрезол (м-крезол); трометамол (трометамин); натрия хлорид; полисорбат 20; натрия гидроксид; хлористоводородная кислота; вода для инъекций |
Описание лекарственной формы
Прозрачная, бесцветная или почти бесцветная жидкость.
Фармакологическое действие
Фармакологическое действие
—
гипогликемическое.
Фармакодинамика
Инсулин глулизин является рекомбинантным аналогом человеческого инсулина, который по силе действия равен обычному человеческому инсулину. После п/к введения инсулин глулизин начинает действовать быстрее и имеет меньшую продолжительность действия, чем растворимый человеческий инсулин.
Наиболее важным действием инсулина и аналогов инсулина, включая инсулин глулизин, является регуляция обмена глюкозы. Инсулин снижает концентрацию глюкозы в крови, стимулируя поглощение глюкозы периферическими тканями, особенно скелетной мускулатурой и жировой тканью, а также ингибируя образование глюкозы в печени. Инсулин подавляет липолиз в адипоцитах и протеолиз и увеличивает синтез белка. Исследования, проведенные у здоровых добровольцев и пациентов с сахарным диабетом, показали, что при п/к введении инсулин глулизин начинает действовать быстрее и имеет меньшую продолжительность действия, чем растворимый человеческий инсулин. При п/к введении понижающее уровень глюкозы в крови действие инсулина глулизина начинается через 10–20 мин. При в/в введении эффекты снижения уровня глюкозы в крови инсулина глулизина и растворимого человеческого инсулина являются равными по силе. Одна единица инсулина глулизина имеет ту же самую глюкозопонижающую активность, что и одна единица растворимого человеческого инсулина.
В исследовании фазы I у пациентов с сахарным диабетом типа 1 оценивались глюкозопонижающие профили инсулина глулизина и растворимого человеческого инсулина, вводившиеся п/к в дозе 0,15 ЕД/кг в разное время по отношению к стандартному 15-минутному приему пищи.
Результаты исследования показали, что инсулин глулизин, введенный за 2 мин до приема пищи, обеспечивал такой же гликемический контроль после еды, что и растворимый человеческий инсулин, введенный за 30 мин до приема пищи. При введении за 2 мин до приема пищи инсулин глулизин обеспечивал лучший гликемический контроль после еды, чем растворимый человеческий инсулин, введенный за 2 мин до приема пищи. Инсулин глулизин, введенный через 15 мин после начала приема пищи, давал такой же гликемический контроль после еды, что и растворимый человеческий инсулин, вводимый за 2 мин до приема пищи.
Ожирение. Исследование фазы I, проводившееся с инсулином глулизином, инсулином лизпро и растворимым человеческим инсулином у группы пациентов с ожирением, продемонстрировало, что у этих пациентов инсулин глулизин сохраняет свои характеристики быстрого действия. В этом исследовании время достижения 20% от полного AUC составляло 114 мин — для инсулина глулизина, 121 мин — для инсулина лизпро и 150 мин — для растворимого человеческого инсулина, а AUC(0–2 ч), отражающее также раннюю глюкозопонижающую активность, составляла 427 мг/кг — для инсулина глулизина, 354 мг/кг — для инсулина лизпро и 197 мг/кг — для растворимого человеческого инсулина.
Клинические исследования
Сахарный диабет типа 1. В 26-недельном клиническом исследовании фазы III, в котором проводилось сравнение инсулина глулизина с инсулином лизпро, вводившимися п/к незадолго до еды (за 0–15 мин) пациентам с сахарным диабетом типа 1, использующим в качестве базального инсулина инсулин гларгин, инсулин глулизин был сопоставим с инсулином лизпро в отношении гликемического контроля, который оценивался по изменению концентрации гликозилированного гемоглобина (HbA1С) на момент конечной точки исследования в сравнении с исходом. Наблюдались сопоставимые значения глюкозы крови, определяемые путем самоконтроля. При введении инсулина глулизина, в отличие от лечения инсулином лизпро, не потребовалось повышения дозы базального инсулина.
12-недельное клиническое исследование III фазы, проведенное у пациентов с сахарным диабетом типа 1, получавших в качестве базальной терапии инсулин гларгин, показало, что эффективность введения инсулина глулизина непосредственно после еды была сопоставима с таковой при введении инсулина глулизина непосредственно перед приемом пищи (за 0–15 мин) или растворимого человеческого инсулина за 30–45 мин до еды.
В популяции пациентов, выполнивших протокол исследования, в группе пациентов, получавших перед едой инсулин глулизин, наблюдалось достоверно большее снижение HbA1С по сравнению с группой пациентов, получавших растворимый человеческий инсулин.
Сахарный диабет типа 2. 26-недельное клиническое исследование фазы III с последовавшим за ним 26-недельным продолжением в виде исследования по безопасности было проведено для сравнения инсулина глулизина (за 0–15 мин до приема пищи) с растворимым человеческим инсулином (за 30–45 мин до приема пищи), которые вводились п/к пациентам с сахарным диабетом типа 2, кроме этого использующих в качестве базального инсулин-изофан. Средний индекс массы тела пациентов составлял 34,55 кг/м2. Инсулин глулизин показал большее снижение концентрации HbA1c от исходного значения по сравнению с растворимым человеческим инсулином (-0,46% для инсулина глулизина и -0,30% для растворимого человеческого инсулина, p=0,0029). В этом исследовании большинство пациентов (79%) смешивали свой инсулин короткого действия с инсулином-изофаном непосредственно перед инъекцией. На момент рандомизации 58 пациентов использовали пероральные гипогликемические препараты и получили инструкции по продолжению их использования в той же дозе.
При проведении непрерывной п/к инфузии инсулина с помощью помпового устройства (при сахарном диабете типа 1) у 59 пациентов, получавших лечение препаратом Апидра® или инсулином аспарт, в обеих группах лечения наблюдалась низкая частота окклюзии катетера (0,08 окклюзий в месяц при применении препарата Апидра® и 0,15 окклюзий в месяц при применении инсулина аспарт), а также подобная частота реакций в месте введения (10,3% при применении препарата Апидра® и 13,3% при применении инсулина аспарт).
У детей и подростков с сахарным диабетом типа 1, которым в качестве базального инсулина один раз в день вечером вводили инсулин гларгин или два раза в день утром и вечером инсулин-изофан, при сравнении эффективности и безопасности лечения инсулином глулизином и инсулином лизпро при их п/к введении за 15 мин до приема пищи было показано, что гликемический контроль, частота развития гипогликемии, потребовавшей вмешательства третьих лиц, а также частота тяжелых гипогликемических эпизодов были сопоставимыми в обеих группах лечения. При этом через 26 нед лечения пациентам, получавшим лечение инсулином глулизином, для достижения гликемического контроля, сопоставимого с инсулином лизпро, потребовалось достоверно меньшее увеличение суточных доз базального инсулина, быстродействующего инсулина и суммарной дозы инсулина.
Расовое происхождение и пол. В контролируемых клинических исследованиях у взрослых не было показано различий в безопасности и эффективности инсулина глулизина при анализе подгрупп, выделенных по расовой принадлежности и полу.
Фармакокинетика
В инсулине глулизине замещение аминокислоты аспарагин человеческого инсулина в позиции В3 на лизин и лизина в позиции В29 на глутаминовую кислоту способствует более быстрой абсорбции.
Абсорбция и биодоступность. Фармакокинетические кривые AUC у здоровых добровольцев и пациентов с сахарным диабетом типа 1 и 2 продемонстрировали, что абсорбция инсулина глулизина по сравнению с растворимым человеческим инсулином была приблизительно в 2 раза быстрее с достижением до двух раз большей Cmax.
В исследовании, проведенном у пациентов с сахарным диабетом типа 1, после п/к введения инсулина глулизина в дозе 0,15 ЕД/кг Тmax составляло 55 мин, и Сmax в плазме крови составляла (82±1,3) μЕД/мл по сравнению с Tmax, составляющим 82 мин, и Cmax, составляющей (46±1,3) μЕД/мл, для растворимого человеческого инсулина. Среднее время пребывания в системном кровотоке у инсулина глулизина было короче (98 мин), чем у обычного человеческого инсулина (161 мин).
В исследовании у пациентов с сахарным диабетом типа 2 после п/к введения инсулина глулизина в дозе 0,2 ЕД/кг Сmax составляла 91 μЕД/мл с межквартильной широтой от 78 до 104 μЕД/мл.
При п/к введении инсулина глулизина в переднюю брюшную стенку, бедро или плечо (область дельтовидной мышцы) абсорбция была более быстрой при введении в переднюю брюшную стенку по сравнению с введением препарата в бедро. Скорость абсорбции из области дельтовидной мышцы была промежуточной. Абсолютная биодоступность инсулина глулизина после п/к введения составляла приблизительно 70% (73% — из области передней брюшной стенки; 71% — из области дельтовидной мышцы; 68% — из области бедра) в разных местах введения была подобной и имела низкую вариабельность между разными пациентами.
Распределение и выведение. Распределение и выведение инсулина глулизина и растворимого человеческого инсулина после в/в введения являются подобными объемам распределения, составляющим 13 и 22 л, и Т1/2, составляющим 13 и 18 мин соответственно.
После п/к введения инсулин глулизин выводится быстрее, чем растворимый человеческий инсулин с кажущимся Т1/2, составляющим 42 мин, по сравнению с кажущимся Т1/2 растворимого человеческого инсулина, составляющим 86 мин. При перекрестном анализе исследований инсулина глулизина как у здоровых лиц, так и у лиц с сахарным диабетом типа 1 и 2, кажущийся Т1/2 находился в диапазоне от 37 до 75 мин.
Специальные группы пациентов
Почечная недостаточность. В клиническом исследовании, проведенном у лиц без сахарного диабета с широким диапазоном функционального состояния почек (Cl креатинина >80 мл/мин, 30–50 мл/мин, <30 мл/мин), в целом быстрота наступления эффекта инсулина глулизина сохранялась. Однако потребность в инсулине при наличии почечной недостаточности может быть снижена.
Печеночная недостаточность. У пациентов с нарушениями функции печени фармакокинетические показатели не изучались.
Лица пожилого возраста. Имеются очень ограниченные данные по фармакокинетике инсулина глулизина у пожилых пациентов с сахарным диабетом.
Дети и подростки. Фармакокинетические и фармакодинамические свойства инсулина глулизина были исследованы у детей (7–11 лет) и подростков (12–16 лет) с сахарным диабетом типа 1. В обеих возрастных группах инсулин глулизин быстро абсорбируется с Тmax и Сmax, подобными таковым у взрослых. Как и у взрослых, при введении непосредственно перед тестом с приемом пищи инсулин глулизин обеспечивает лучший контроль глюкозы крови после еды, чем растворимый человеческий инсулин. Повышение концентрации глюкозы в крови после еды (AUC0–6 ч — площадь под кривой концентрация глюкозы в крови — время от 0 до 6 ч) составляла 641 мг/ч×дл — для инсулина глулизина и 801 мг/ч×дл — для растворимого человеческого инсулина.
Показания
Сахарный диабет, требующий лечения инсулином, у взрослых, подростков и детей старше 6 лет.
Противопоказания
гиперчувствительность к инсулину глулизину или к какому-либо из компонентов препарата;
гипогликемия.
С осторожностью следует применять у беременных.
Применение при беременности и кормлении грудью
Отсутствуют контролируемые клинические исследования по использованию препарата Апидра® СолоСтар® у беременных женщин.
Ограниченное количество данных, полученных по применению инсулина глулизина у беременных женщин (сообщалось о менее чем 300 исходах беременностей), не указывает на его неблагоприятное воздействие на течение беременности, внутриутробное развитие плода или на новорожденного ребенка. Репродуктивные исследования на животных не выявили каких-либо различий между инсулином глулизином и человеческим инсулином в отношении течения беременности, эмбрионального/фетального развития, родов и постнатального развития.
Применение препарата Апидра® СолоСтар® у беременных должно проводиться с осторожностью. Обязателен тщательный мониторинг концентрации глюкозы в крови и поддержание гликемического контроля.
Пациенткам с имевшимся до беременности или гестационным сахарным диабетом необходимо в течение всей беременности поддерживать гликемический контроль. Во время I триместра беременности потребность в инсулине может уменьшаться, а во время II и III триместров она, как правило, может увеличиваться. Сразу же после родов потребность в инсулине быстро снижается.
Неизвестно, экскретируется или нет инсулин глулизин в грудное молоко. Для женщин в период кормления грудью может потребоваться коррекция режима дозирования инсулина и диеты.
Способ применения и дозы
П/к, незадолго (за 0–15 мин) до или вскоре после приема пищи.
Препарат Апидра® СолоСтар® должен использоваться в схемах лечения, включающих в себя или инсулин средней продолжительности действия, или длительно действующий инсулин, или аналог инсулина длительного действия. Кроме этого, препарат Апидра® СолоСтар® может использоваться в сочетании с пероральными гипогликемическими препаратами.
Режим дозирования препарата Апидра® СолоСтар® подбирается индивидуально.
Введение препарата
Препарат Апидра® СолоСтар® вводится или с помощью п/к инъекции, или путем непрерывной инфузии в подкожно-жировую клетчатку с помощью помповой системы.
П/к инъекции препарата Апидра® СолоСтар® следует производить в область передней брюшной стенки, плеча или бедра, а введение препарата путем непрерывной инфузии в подкожно-жировую клетчатку производится в области передней брюшной стенки. Места инъекций и места инфузий в вышеупомянутых областях (передняя брюшная стенка, бедро или плечо) должны чередоваться при каждом новом введении препарата. На скорость абсорбции и, соответственно, на начало и продолжительность действия могут влиять: место введения, физическая нагрузка и другие изменяющиеся условия. П/к введение в брюшную стенку обеспечивает несколько более быструю абсорбцию, чем введение в другие вышеуказанные участки тела (см. раздел «Фармакокинетика»).
Следует соблюдать меры предосторожности для исключения попадания препарата непосредственно в кровеносные сосуды. После введения препарата нельзя производить массаж области введения. Пациенты должны быть обучены правильной технике проведения инъекций.
Смешивание с инсулинами
Препарат Апидра® СолоСтар® может смешиваться с человеческим инсулином-изофаном.
При смешивании препарата Апидра® СолоСтар® с человеческим инсулином-изофаном, препарат Апидра® СолоСтар® должен набираться в шприц первым. П/к инъекция должна производиться сразу же после смешивания. Смешанные вышеуказанные инсулины нельзя вводить в/в.
Помповое устройство для проведения непрерывной п/к инфузии
При использовании препарата Апидра® СолоСтар® с помповой системой для инфузии инсулина его нельзя смешивать с другими инсулинами или растворителями.
Препарат Апидра® может также вводиться с помощью помпового устройства для проведения непрерывной п/к инфузии инсулина. При необходимости препарат Апидра® может быть извлечен из картриджа шприц-ручки Апидра® СолоСтар® и быть использован для введения с помощью помпового устройства для проведения непрерывной п/к инфузии инсулина.
При этом набор для проведения инфузии и резервуар, которые используются с препаратом Апидра®, должны заменяться с соблюдением правил асептики, как минимум, каждые 48 ч. Эти рекомендации могут отличаться от общих инструкций в руководствах по использованию помповых устройств. Важно, чтобы пациенты следовали вышеуказанным специальным инструкциям по применению препарата Апидра®. Несоблюдение этих специальных инструкций по применению препарата Апидра® может привести к развитию серьезных нежелательных явлений.
Пациенты, которым препарат Апидра® вводится путем непрерывной п/к инфузии, должны иметь альтернативные системы для введения инсулина и должны быть обучены введению инсулина путем п/к инъекции (на случай поломки используемого помпового устройства).
При использовании препарата Апидра® с помповыми устройствами для проведения непрерывной п/к инфузии инсулина нарушение работы помпового устройства, неисправность набора для проведения инфузии или ошибки в обращении с ними могут быстро привести к развитию гипергликемии, кетоза и диабетического кетоацидоза. В случае развития гипергликемии или кетоза или диабетического кетоацидоза требуется быстрое выявление и устранение причин их развития.
Следует точно выполнять инструкции по правильному обращению с предварительно заполненными шприцами (см. раздел «Инструкции по использованию и обращению»).
Инструкция по использованию и обращению предварительно заполненной шприц-ручки СолоСтар®
Перед первым использованием шприц-ручку необходимо подержать при комнатной температуре 1–2 ч.
Перед использованием следует осмотреть картридж внутри шприц-ручки. Его следует использовать только в случае, если раствор прозрачен, бесцветен, не содержит видимых твердых частиц и по консистенции напоминает воду.
Пустые шприц-ручки СолоСтар® не должны использоваться повторно и подлежат уничтожению.
Для предотвращения инфицирования предварительно заполненная шприц-ручка должна использоваться только одним пациентом и не передаваться другому лицу.
Обращение со шприц-ручкой СолоСтар®
Перед использованием шприц-ручки СолоСтар® следует внимательно прочитать инструкцию по использованию.
Важная информация по использованию шприц-ручки СолоСтар®
Перед каждым использованием необходимо с осторожностью подсоединить новую иглу к шприц-ручке и провести тест на безопасность. Необходимо использовать только иглы, совместимые с СолоСтар®.
Необходимо принимать специальные меры предосторожности во избежание несчастных случаев, связанных с применением иглы, и возможностью переноса инфекции.
Ни в коем случае не использовать шприц-ручку СолоСтар® при ее повреждении или в том случае, если нет уверенности, что она будет работать надлежащим образом.
Всегда следует иметь в наличии запасную шприц-ручку СолоСтар® на случай потери или повреждения используемого экземпляра.
Инструкция по хранению
Если шприц-ручка СолоСтар® хранится в холодильнике, ее следует извлечь оттуда за 1–2 ч перед предполагаемой инъекцией, чтобы раствор принял комнатную температуру. Введение охлажденного инсулина является более болезненным.
Использованная шприц-ручка СолоСтар® должна подвергаться уничтожению.
Эксплуатация
Шприц-ручку СолоСтар® необходимо предохранять от пыли и грязи.
Внешнюю сторону шприц-ручки СолоСтар® можно очищать, протирая ее влажной тканью.
Не следует погружать в жидкость, промывать и смазывать шприц-ручку СолоСтар®, поскольку этим можно ее повредить.
Шприц-ручка СолоСтар® точно дозирует инсулин и безопасна в работе. Она также требует бережного обращения. Следует избегать ситуаций, при которых может произойти повреждение шприц-ручки СолоСтар®. Если есть подозрение, что экземпляр шприц-ручки СолоСтар® мог быть поврежден, необходимо использовать новую шприц-ручку.
Стадия 1. Контроль инсулина
Необходимо проверить этикетку на шприц-ручке СолоСтар® для того, чтобы убедиться, что он содержит соответствующий инсулин. После снятия колпачка шприца-ручки контролируют внешний вид содержащегося в ней инсулина: раствор инсулина должен быть прозрачен, бесцветен, не содержать видимых твердых частиц и по консистенции напоминать воду.
Стадия 2. Подсоединение иглы
Необходимо использовать только иглы, совместимые со шприц-ручкой СолоСтар®.
Для каждой последующей инъекции всегда применяют новую стерильную иглу. После удаления колпачка иглу необходимо осторожно установить на шприц-ручке.
Стадия 3. Испытание на безопасность
Перед введением каждой инъекции необходимо провести тест на безопасность и убедиться, что шприц-ручка и игла хорошо работают и пузырьки воздуха удалены.
Отмеряют дозу, равную 2 ЕД.
Наружный и внутренний колпачки иглы должны быть сняты.
Располагая шприц-ручку иглой вверх, осторожно постукивают по картриджу с инсулином пальцем таким образом, чтобы все пузырьки воздуха смещались по направлению к игле.
Нажимают (полностью) на кнопку введения инъекции.
Если инсулин появляется на кончике иглы, это означает, что шприц-ручка и игла работают правильно.
Если появления инсулина на кончике иглы не наблюдается, то стадия 3 повторяется до тех пор, пока инсулин не появится на кончике иглы.
Стадия 4. Выбор дозы
Доза может быть установлена с точностью до 1 ЕД, от минимальной дозы (1 ЕД) до максимальной (80 ЕД). Если необходимо ввести дозу, превышающую 80 ЕД, следует провести 2 или более инъекций.
Дозировочное окошко должно показывать «0» после завершения испытания на безопасность. После этого может быть установлена необходимая доза.
Стадия 5. Введение дозы
Пациент должен быть проинформирован о технике проведения инъекции медицинским работником.
Иглу необходимо ввести под кожу.
Кнопка введения инъекции должна быть нажата полностью. Она удерживается в этом положении в течение еще 10 с до момента извлечения иглы. Таким образом обеспечивается введение выбранной дозы инсулина полностью.
Стадия 6. Извлечение и выбрасывание иглы
Во всех случаях после каждой инъекции игла должна быть удалена и выброшена. Этим обеспечивается профилактика загрязнения и/или внесения инфекции, попадания воздуха в емкость для инсулина и утечки инсулина.
При удалении и выбрасывании иглы должны быть осуществлены специальные меры предосторожности. Необходимо соблюдать рекомендованные меры безопасности для удаления и выбрасывания игл (например техника надевания колпачка одной рукой) для того, чтобы уменьшить риск несчастных случаев, связанных с применением иглы, а также предотвратить инфицирование.
После удаления иглы следует закрыть шприц-ручку СолоСтар® колпачком.
Особые группы пациентов
Нарушение функции почек. Потребность в инсулине при почечной недостаточности может снижаться.
Нарушение функции печени. У пациентов с нарушением функции печени потребность в инсулине может снижаться из-за сниженной способности к глюконеогенезу и замедлению метаболизма инсулина.
Пациенты пожилого возраста. Имеющиеся данные по фармакокинетике у пациентов пожилого возраста с сахарным диабетом недостаточны. Нарушение функции почек в пожилом возрасте может привести к снижению потребности в инсулине.
Дети и подростки. Препарат Апидра® можно применять у детей старше 6 лет и подростков. Клиническая информация по применению препарата у детей моложе 6 лет ограничена.
Побочные действия
Наблюдавшиеся нежелательные реакции были реакциями, известными для этого фармакологического класса, и следовательно, общими для любых инсулинов.
Со стороны обмена веществ и питания: гипогликемия, наиболее частый нежелательный эффект инсулинотерапии, может возникать в случае применения слишком высоких доз инсулина, превышающих потребность в нем.
Симптомы развития гипогликемии обычно возникают внезапно. Однако обычно психоневрологическим нарушениям на фоне нейрогликопении (чувство усталости, необычная утомляемость или слабость, снижение способности к концентрации внимания, сонливость, зрительные расстройства, головная боль, тошнота, спутанность сознания или его потеря, судорожный синдром) предшествуют симптомы адренергической контррегуляции (активации симпато-адреналовой системы в ответ на гипогликемию): чувство голода, раздражительность, нервное возбуждение или тремор, беспокойство, бледность кожных покровов, холодный пот, тахикардия, выраженное сердцебиение (чем быстрее развивается гипогликемия и чем она тяжелее, тем сильнее выражены симптомы адренергической контррегуляции).
Эпизоды тяжелой гипогликемии, особенно повторяющиеся, могут приводить к поражению нервной системы. Длительная и выраженная гипогликемия может угрожать жизни пациентов, т.к. при нарастании гипогликемии возможен даже смертельный исход.
Со стороны иммунной системы:
Местные реакции гиперчувствительности на инсулин (гиперемия, отечность и зуд в месте инъекции инсулина). Эти реакции обычно исчезают через несколько дней или недель применения препарата. В некоторых случаях эти реакции могут быть не связаны с инсулином, а обусловлены раздражением кожи, вызванным антисептической обработкой ее перед инъекцией или неправильным проведением п/к инъекции (при нарушении правильной техники проведения п/к инъекции).
Системные реакции гиперчувствительности на инсулин. Такие реакции на инсулин (включая инсулин глулизин) могут например сопровождаться появлением сыпи по всему телу (в т.ч. сопровождающейся зудом), чувства стесненности в груди, удушья, снижения АД, учащения пульса или обильного потоотделения. Тяжелые случаи генерализованной аллергии, включая анафилактические реакции, могут угрожать жизни пациента.
Со стороны кожи и подкожной клетчатки: липодистрофия. Как и при применении любых других инсулинов, в месте инъекций может развиться липодистрофия, что может замедлить абсорбцию инсулина. Развитию липодистрофии может способствовать нарушение чередования мест введения инсулина, т.к. введение препарата в одно и то же место может способствовать развитию липодистрофии. Постоянное чередование мест инъекции в пределах одной из областей введения (область бедра, плеча, передней поверхности брюшной стенки) может способствовать уменьшению и профилактике развития этой нежелательной реакции.
Прочие: сообщалось о случайном введении других инсулинов по ошибке, особенно длительно действующих инсулинов, вместо инсулина глулизина.
Взаимодействие
Исследований по фармакокинетическим взаимодействиям не проводилось. На основании имеющихся эмпирических знаний в отношении других подобных лекарственных препаратов возникновение клинически значимых фармакокинетических взаимодействий маловероятно. Некоторые вещества могут влиять на метаболизм глюкозы, что может потребовать коррекции доз инсулина глулизина и особенно тщательного контроля за лечением.
К веществам, способным увеличивать гипогликемическое действие инсулина и увеличивать предрасположенность к гипогликемии, относятся: пероральные гипогликемические средства, ингибиторы ангиотензинпревращающего фермента, дизопирамид, фибраты, флуоксетин, ингибиторы моноаминоксидазы, пентоксифиллин, пропоксифен, салицилаты и сульфаниламидные противомикробные средства.
К веществам, способным уменьшать гипогликемическое действие инсулина, относятся: ГКС, даназол, диазоксид, диуретики, глюкагон, изониазид, производные фенотиазина, соматропин, симпатомиметики (например эпинефрин (адреналин), сальбутамол, тербуталин), гормоны щитовидной железы, эстрогены, гестагены (например в пероральных контрацептивных средствах), ингибиторы протеазы и антипсихотические лекарственные препараты (например оланзапин и клозапин).
Бета-адреноблокаторы, клонидин, соли лития или этанол могут или потенцировать, или ослаблять гипогликемическое действие инсулина. Пентамидин может вызывать гипогликемию c последующей гипергликемией.
Кроме того, под влиянием таких препаратов с симпатолитической активностью, как бета-адреноблокаторы, клонидин, гуанетидин и резерпин, симптомы рефлекторной адренергической активации могут быть менее выраженными или отсутствовать.
Указания по совместимости
В связи с отсутствием исследований по совместимости инсулин глулизин не следует смешивать с какими-либо другими препаратами, за исключением человеческого инсулина изофан.
При введении с помощью инфузионной помпы препарат Апидра® СолоСтар® не должен смешиваться с растворителями и другими препаратами инсулина.
Передозировка
Симптомы: при избытке дозы инсулина по отношению к потребности в нем, определяющейся потреблением пищи и энергозатратами, может развиться гипогликемия.
Отсутствуют специальные данные относительно передозировки инсулина глулизина. Однако при его передозировке возможно развитие гипогликемии.
Лечение: эпизоды легкой гипогликемии могут быть купированы с помощью приема глюкозы или продуктов, содержащих сахар. Поэтому рекомендуется, чтобы пациенты с сахарным диабетом постоянно имели при себе кусочки сахара, конфеты, печенье или сладкий фруктовый сок.
Эпизоды тяжелой гипогликемии с комой, судорогами и неврологическими расстройствами, во время которых пациент теряет сознание, могут быть купированы в/м или п/к введением 0,5–1 мг глюкагона, которое производится лицом, получившим соответствующие инструкции, или или в/в введением концентрированного (20%) раствора декстрозы (глюкозы) медицинским работником.
После восстановления сознания рекомендуется давать пациенту углеводы внутрь для предотвращения повторения гипогликемии, которая возможна после кажущегося клинического улучшения.
После введения глюкагона для установления причины тяжелой гипогликемии и предотвращения развития других подобных эпизодов пациент должен наблюдаться в стационаре.
Особые указания
Перевод пациента на новый тип инсулина или инсулин другого производителя должен осуществляться под строгим медицинским наблюдением, т.к. может потребоваться изменение дозировки вследствие изменения концентрации инсулина, торговой марки (производителя), типа инсулина (растворимый, инсулин-изофан и т.д.), вида инсулина (животного происхождения) и/или способа производства. Кроме того, может потребоваться коррекция сопутствующей пероральной гипогликемической терапии. Использование неадекватных доз инсулина или прекращение лечения, особенно у пациентов с сахарным диабетом типа 1, может привести к развитию гипергликемии и диабетического кетоацидоза — состояний, которые являются потенциально опасными для жизни.
Гипогликемия. Время, через которое развивается гипогликемия, зависит от скорости наступления эффекта используемых инсулинов и в связи с этим может изменяться при изменении схемы лечения. К условиям, которые могут изменить или сделать менее выраженными предвестники развития гипогликемии, относятся: длительное существование сахарного диабета, интенсификация инсулинотерапии, наличие диабетической нейропатии, прием некоторых лекарственных препаратов, таких как бета-адреноблокаторы, или перевод пациента с инсулина животного происхождения на человеческий инсулин.
Коррекция доз инсулина может также потребоваться в случае, если пациенты увеличивают физическую активность или изменяют свой обычный распорядок приема пищи. Физическая нагрузка, выполненная непосредственно после еды, может увеличить риск развития гипогликемии. По сравнению с растворимым человеческим инсулином после инъекции быстродействующих аналогов инсулина, гипогликемия может развиваться раньше.
Некомпенсированные гипогликемическая или гипергликемическая реакции могут привести к потере сознания, развитию комы или смертельному исходу.
Потребность в инсулине может изменяться при заболеваниях или эмоциональных перегрузках.
Срок годности препарата в одноразовой шприц-ручке Апидра® СолоСтар® после первого использования — 4 нед. Рекомендуется отмечать на этикетке дату первого введения препарата.
Шприц-ручку Апидра® СолоСтар® нельзя охлаждать перед использованием (инъекция охлажденного раствора является более болезненной).
После начала использования одноразовые шприц-ручки Апидра® СолоСтар® следует хранить при температуре не выше 25 °C в недоступном для детей месте, защищая от воздействия света.
Влияние на способность управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности. Гипергликемия и гипогликемия, а также зрительные расстройства, возникающие при их развитии, могут ухудшить способность к концентрации и замедлить психомоторные реакции пациента. Это может представлять риск при управлении им транспортными средствами и занятии другими потенциально опасными видами деятельности. Это особенно опасно у пациентов, у которых ослаблены или отсутствуют симптомы, предвещающие развитие гипогликемии, или имеются частые эпизоды гипогликемии. Это следует учитывать в каждом конкретном случае для принятия решения о возможности или невозможности для пациента управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности. Пациентам следует рекомендовать во время управления транспортными средствами принимать меры предосторожности для того, чтобы избегать возможности развития гипогликемии.
Форма выпуска
Раствор для подкожного введения, 100 ЕД/мл. В картриджах по 3 мл из прозрачного бесцветного стекла (тип I), вмонтированных в одноразовую шприц-ручку СолоСтар®. Картридж укупорен с одной стороны пробкой и обжат алюминиевым колпачком, с другой стороны — плунжером. По 5 шприц-ручек помещают в пачку картонную.
Производитель
1. Санофи-Авентис Дойчланд ГмбХ, Германия.
2. ЗАО «Санофи-Авентис Восток», Россия. 302516, Россия, Орловская обл., Орловский р-н, с/п Большекуликовское, ул. Ливенская, 1.
Претензии потребителей направлять по адресу представительства компании в России: 125009, Москва, ул. Тверская, 22.
Тел.: (495) 721-14-00; факс: (495) 721-14-11.
В случае производства препарата на ЗАО «Санофи-Авентис Восток», Россия, претензии потребителей направлять по адресу: 302516, Россия, Орловская обл., Орловский р-н, с/п Большекуликовское, ул. Ливенская, 1.
Тел./факс: +7 (486) 244-00-55.
Условия отпуска из аптек
По рецепту.
Условия хранения
В защищенном от света месте, при температуре 2–8 °C (не замораживать).
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Инструкции, которые необходимо
дать пациенту
Техника инъекции при применении
инсулина во флаконах
Не используйте Биосулин® Н,
если при перемешивании содержимого флакона согласно инструкции по применению
инсулин не становится однородно белым и мутным.
Не используйте Биосулин® Н,
если в нем после перемешивания имеются хлопья.
Не используйте Биосулин® Н,
если ко дну или стенкам флакона прилипли твердые белые частицы, создавая эффект
«морозного узора».
Если пациент использует только
один тип инсулина
1. Продезинфицируйте резиновую
мембрану флакона.
2. Наберите в шприц воздух в объеме,
соответствующем нужной дозе инсулина. Введите воздух во флакон с инсулином.
3. Переверните флакон со шприцем
вверх дном и наберите нужную дозу инсулина в шприц. Выньте иглу из флакона и
удалите воздух из шприца. Проверьте правильность набора дозы инсулина.
4. Сразу же делайте инъекцию.
Если пациенту необходимо смешать
два типа инсулина
1. Продезинфицируйте резиновые
мембраны флаконов.
2. Непосредственно перед набором
покатайте флакон с инсулином длительного действия («мутным») между ладонями до
тех пор, пока инсулин не станет равномерно белым и мутным.
3. Наберите в шприц воздух в объеме,
соответствующем дозе «мутного» инсулина. Введите воздух во флакон с «мутным»
инсулином и выньте иглу из флакона («мутный» инсулин на этом этапе пока не
набирайте).
4. Наберите в шприц воздух в объеме,
соответствующем дозе инсулина короткого действия («прозрачного»). Введите
воздух во флакон с «прозрачным» инсулином. Переверните флакон со шприцем вверх
дном и наберите нужную дозу «прозрачного» инсулина. Выньте иглу и удалите из
шприца воздух. Проверьте правильность набранной дозы.
5. Введите иглу во флакон с «мутным»
инсулином, переверните флакон со шприцем вверх дном и наберите нужную дозу
инсулина. Удалите из шприца воздух и проверьте правильность набранной дозы.
Сразу же делайте инъекцию набранной смеси инсулина.
6. Всегда набирайте инсулины в одной
и той же последовательности, описанной выше.
Техника инъекции при применении
инсулина в картриджах
Картридж с препаратом Биосулин® Н
предназначен для использования со шприц-ручкой БиоматикПен®. Пациент
должен быть предупрежден о необходимости внимательно придерживаться указаний в
инструкции по применению шприц-ручки для введения инсулина.
Перед использованием следует
убедиться, что на картридже с препаратом Биосулин® Н нет
никаких повреждений (например, трещин). Нельзя использовать картридж, если,
имеются какие-либо видимые повреждения. Не используйте Биосулин® Н,
если при перемешивании содержимого картриджа согласно инструкции по применению
инсулин не становится однородно белым и мутным.
Не используйте Биосулин® Н,
если в нем после перемешивания имеются хлопья. Не используйте Биосулин® Н,
если ко дну или стенкам картриджа прилипли твердые белые частицы, создавая
эффект «морозного узора».
После того, как картридж вставлен
в шприц-ручку, через окошко держателя картриджа должна быть видна цветная
полоска.
Перед тем, как поместить картридж
в шприц-ручку, следует перевернуть картридж вверх-вниз, чтобы стеклянный шарик
передвигался из конца в конец картриджа. Эту процедуру следует повторить не менее 10 раз,
пока вся жидкость не станет белой и равномерно мутной. Сразу после этого
необходимо сделать инъекцию.
Если картридж уже находится
внутри шприц-ручки, следует переворачивать ее с картриджем внутри вверх-вниз не
менее 10 раз. Эту процедуру необходимо повторять перед каждой инъекцией.
После инъекции игла должна
оставаться под кожей минимум 6 секунд. Следует держать кнопку в нажатом
состоянии до полного изъятия иглы из-под кожи, таким образом, обеспечивается
правильное введение дозы и ограничивается возможность попадания крови или лимфы
в иглу или в картридж с инсулином.
Картридж с препаратом Биосулин® Н
предназначается только для индивидуального использования и не подлежит
повторному наполнению.
Процедура инъекции
Двумя пальцами соберите складку
кожи, введите иглу в основание складки под углом около 45° и введите под кожу
инсулин.
После инъекции игла должна
оставаться под колеей как минимум 6 секунд для того, чтобы убедиться, что
инсулин введен полностью.
Если после удаления иглы на месте
укола выступает кровь, слегка прижмите место укола тампоном, смоченным дезинфицирующим
раствором (например, спиртом).
Необходимо менять места инъекций.
ИНСТРУКЦИЯ ПО ТЕХНИКЕ ИНЪЕКЦИИ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА Биосулин® Н, суспензия для подкожного
введения 100 МЕ/мл С ИСПОЛЬЗОВАНИЕМ ШПРИЦ-РУЧКИ БиоматикПен®2
(одноразовой для многократных
инъекций)
Внешний
вид и части шприц-ручки БиоматикПен®2

1 — колпачок, 2 — корпус, 3 —
окно указателя дозировки, 4 — кольцо установки дозы, 5 — пусковая кнопка
Перед использованием следует
убедиться, что на картридже с препаратом Биосулин® Н нет
никаких повреждений (например, трещин). Нельзя использовать шприц-ручку с
картриджем, если имеются какие-либо видимые повреждения. Не используйте
препарат, если при перемешивании содержимого картриджа согласно инструкции по
применению инсулин не становится однородно белым и мутным.
Не используйте шприц-ручку с
препаратом Биосулин® Н, если после перемешивания в картридже
имеются хлопья. Не используйте шприц-ручку с препаратом Биосулин® Н,
если ко дну или стенкам картриджа прилипли твердые белые частицы, создавая
эффект «морозного узора».
Обеспечение асептики при
проведении инъекции
Перед проведением инъекции
необходимо вымыть руки. Очень важно, чтобы руки и все необходимые для инъекции
приспособления были чистыми. Выбрать место для инъекции. Протереть кожу в месте
инъекции спиртовой салфеткой только после того, как доза инсулина была
установлена в шприц-ручке. Перед инъекцией дать высохнуть спирту в месте
инъекции.
|
Подготовка |
|
|
1. Перед первым использованием шприц-ручки Перед каждой инъекцией: 10 раз переверните |
|
|
Присоединение |
|
|
2. Перед использованием снимите защитный |
|
|
3. Снимите защитную пленку с наружного защитного колпачка иглы. Внимание! Для каждой инъекции используйте новую, стерильную иглу для |
|
|
4. Аккуратно и плотно навинтите иглу на |
|
|
5. Снимите наружный защитный колпачок иглы и |
|
|
6. Снимите и утилизируйте внутренний защитный колпачок иглы. Внимание! Игла шприц-ручки стерильна! Не касайтесь ее! Для каждой инъекции используйте новую иглу, чтобы предотвратить Чтобы избежать случайных уколов, никогда не |
|
|
Подготовка шприц-ручки к инъекции |
|
|
7. Поворачивая кольцо установки дозы по часовой |
|
|
8. Установите шприц-ручку |
|
|
9. |
|
|
10. На конце иглы должно Внимание! Чтобы доза была |
|
|
Установка необходимой дозы |
|
|
11. Убедитесь, что указатель Внимание! При вращении кольца установки Безопасный ограничитель. Доза препарата, которая |
|
|
Проведение инъекции |
|
|
12. Инъекция препарата должна Для введения установленной дозы Примечание: Вы можете прервать инъекцию Количество |
|
|
13. После инъекции игла должна Внимание! Невыполнение этих шагов может |
|
|
14. После извлечения иглы |
|
|
15. Отсоедините иглу, Внимание! Строго |
|
|
16. Закрывайте шприц-ручку защитным колпачком после каждого |
|
Дополнительная информация
Звуковые и тактильные сигналы
В процессе работы шприц-ручка
БиоматикПен®2 производит следующие звуковые и тактильные сигналы:
—
установка
необходимой дозы
При
вращении кольца установки дозы ощущается определенное физическое сопротивление
и слышны щелчки при наборе каждой единицы дозы.
—
инъекция
Процесс
введения лекарственного препарата из шприц-ручки БиоматикПен®2
сопровождается звуковым сигналом (трещотка), который прекращается, когда
препарат полностью введен (до значения «0» в окне указателя дозировки).
Правила хранения, использования и
утилизации
Шприц-ручка предназначена для
индивидуального использования и не может использоваться несколькими лицами.
Обращайтесь со шприц-ручкой
БиоматикПен®2 аккуратно.
Не допускайте попадания пыли и
влаги в шприц-ручку БиоматикПен®2.
После каждого применения
закрывайте шприц-ручку колпачком. Всегда держите шприц-ручку БиоматикПен®2
в индивидуальной упаковке без иглы.
Храните шприц-ручку БиоматикПен®2,
соблюдая указания по хранению лекарственного препарата.
Чистить шприц-ручку БиоматикПен®2
можно влажной тканью. Не применяйте спирт, растворители или другие чистящие
средства.
Никогда не погружайте шприц-ручку
БиоматикПен®2 в воду, поскольку это может привести к ее повреждению.
Предупреждения
Используйте шприц-ручку
БиоматикПен®2 только с иглами, совместимыми со шприц-ручкой, которые
рекомендует Ваш врач.
Препарат Биосулин Н должен
применяться только в качестве части терапии, которая предписана Вашим врачом, и
в установленной для Вас дозировке. Любые изменения должны производиться под
наблюдением врача.
Если у Вас будут вопросы в
отношении длины иглы, проконсультируйтесь с Вашим врачом или медицинским
персоналом.
Не подвергайте шприц-ручку
БиоматикПен®2 воздействию экстремальных температур, не оставляйте ее
под прямыми солнечными лучами или на холоде (например, в морозильнике). Храните
шприц-ручку БиоматикПен®2, иглы для шприц-ручки в недоступном месте
для детей и других лиц, которые не ознакомлены с правильным методом обращения.
В случаях непреднамеренного введения препарата или полученной травмы от укола
иглой следует немедленно обратиться за медицинской помощью!
Иглы шприц-ручки должны
использоваться только одним лицом, чтобы предотвратить передачу инфекционных заболеваний.
Используйте новую иглу
шприц-ручки для каждой инъекции, чтобы обеспечить стерильность. Снимайте иглу
шприц-ручки после введения инъекции, чтобы предотвратить утечку препарата,
попадание внутрь воздуха и возможное засорение иглы шприц-ручки. Избавляйтесь
от использованных игл шприц-ручки вместе с надетым на них защитным колпачком,
соблюдая указания изготовителя, чтобы они не могли нанести вред другим людям.
Никогда не используйте
шприц-ручку БиоматикПен®2, если у Вас есть сомнения в отношении ее
правильной работы.
Правила утилизации
Шприц-ручка БиоматикПен®2
не содержит компонентов, представляющих опасность для окружающей среды, и может
утилизироваться с обычным бытовым мусором.
Использованная шприц-ручка
БиоматикПен®2 должна утилизироваться только с отсоединенной иглой.
Таблица перевода показаний
указателя дозировки шприц-ручки БиоматикПен®2 в дозу препарата
Биосулин® Н, суспензия для подкожного введения 100 МЕ/мл:
|
Показания указателя дозировки |
Доза препарата Биосулин® Н, ME |
|
1. |
1. |
|
2. |
2. |
|
3. |
3. |
|
4. |
4. |
|
5. |
5. |
|
6. |
6. |
|
7. |
7. |
|
8. |
8. |
|
9. |
9. |
|
10. |
10. |
|
11. |
11. |
|
12. |
12. |
|
13. |
13. |
|
14. |
14. |
|
15. |
15. |
|
16. |
16. |
|
17. |
17. |
|
18. |
18. |
|
19. |
19. |
|
20. |
20. |
|
21. |
21. |
|
22. |
22. |
|
23. |
23. |
|
24. |
24. |
|
25. |
25. |
|
26. |
26. |
|
27. |
27. |
|
28. |
28. |
|
29. |
29. |
|
30. |
30. |
|
31. |
31. |
|
32. |
32. |
|
33. |
33. |
|
34. |
34. |
|
35. |
35. |
|
36. |
36. |
|
37. |
37. |
|
38. |
38. |
|
39. |
39. |
|
40. |
40. |
|
41. |
41. |
|
42. |
42. |
|
43. |
43. |
|
44. |
44. |
|
45. |
45. |
|
46. |
46. |
|
47. |
47. |
|
48. |
48. |
|
49. |
49. |
|
50. |
50. |
|
51. |
51. |
|
52. |
52. |
|
53. |
53. |
|
54. |
54. |
|
55. |
55. |
|
56. |
56. |
|
57. |
57. |
|
58. |
58. |
|
59. |
59. |
|
60. |
60. |
Инсулин-изофан [человеческий генно-инженерный]
суспензия для подкожного введения
1 мл препарата содержит:
активное вещество: инсулин человеческий 100 ME;
вспомогательные вещества: протамина сульфат 0,34 мг, глицерол (глицерин) 16 мг, фенол кристаллический 0,65 мг, метакрезол 1,6 мг, натрия гидрофосфата дигидрат 2,25 мг, вода для инъекций до 1 мл.
Суспензия белого цвета. При стоянии взвесь оседает. Жидкость над осадком прозрачная, бесцветная или почти бесцветная. Осадок легко ресуспендируется при осторожном встряхивании.
Гипогликемическое средство, инсулин средней продолжительности действия
АТХ A10AC01 инсулин человеческий
Фармакодинамика
Препарат Ринсулин® НПХ представляет собой человеческий инсулин средней продолжительности действия, полученный методом биотехнологии рекомбинантной ДНК, с более медленным началом действия и большей продолжительностью активности, чем у обычного человеческого инсулина. Основным действием инсулина является регуляция метаболизма глюкозы. Кроме того, он обладает анаболическим и антикатаболическим действием на различные ткани организма. В мышечной ткани происходит увеличение содержания гликогена, жирных кислот, глицерола, усиление синтеза белка и увеличение потребления аминокислот, но при этом происходит снижение гликогенолиза, глюконеогенеза, кетогенеза, липолиза, катаболизма белков и высвобождения аминокислот. Типичная кривая активности инсулина (кривая утилизации глюкозы) изображена на рисунке ниже в виде линии. Изменение времени действия и/или активности инсулина, которые могут наблюдаться у пациента, изображены в виде заштрихованной области.
Фармакокинетика
Фармакокинетика инсулина не отражает метаболического действия этого гормона.
Поэтому при рассмотрении активности инсулина более целесообразно ориентироваться на кривые утилизации глюкозы.
Индивидуальные изменения концентрации глюкозы в крови зависят от дозы, места введения и физической активности пациента.
В исследованиях фармакокинетики у здоровых добровольцев при подкожном введении человеческого инсулина-изофан в дозе 0,4 МЕ/кг медиана наступления максимального действия составляла около 6,5 часа (в диапазоне от 2,8 до 13 часов). Средний видимый период полувыведения человеческого инсулина-изофан составлял приблизительно 4,4 часа (диапазон 1-84 часа).
Сахарный диабет у пациентов, требующий проведения инсулинотерапии для поддержания нормальной концентрации глюкозы в крови.
— Повышенная чувствительность к инсулину человеческому и/или к любому из вспомогательных веществ препарата (если его не используют в рамках программы десенсибилизации).
— Гипогликемия.
— У пациентов с инсулиномой.
— Внутривенное введение препарата.
— У пациентов с риском развития гипокалиемии.
— При одновременном применении с тиазолидиндионом у пациентов с заболеваниями сердечно-сосудистой системы и наличием факторов риска развития хронической сердечной недостаточности.
В период беременности особенно важно поддерживать хороший гликемический контроль у пациенток, получающих терапию инсулином. Потребность в инсулине обычно снижается в течение I триместра и увеличивается в течение II и III триместров беременности. Пациентки с сахарным диабетом должны проконсультироваться с врачом в случае наступления или планирования беременности. Несмотря на отсутствие адекватных контролируемых клинических исследований применения препарата Ринсулин® НПХ у беременных, литературные данные свидетельствуют о том, что тщательный контроль гликемии у пациенток с сахарным диабетом обеспечивает значительное снижение риска возникновения пороков развития и внутриутробной гибели плода.
Сразу после родов потребность в инсулине резко снижается (повышенный риск развития гипогликемии). После родов обязателен тщательный мониторинг концентрации глюкозы в крови.
Отсутствуют данные в отношении проникновения препарата Ринсулин® НПХ в грудное молоко и нежелательных реакций у детей на грудном вскармливании, связанных с применением человеческого генно-инженерного инсулина-изофан.
У пациенток с сахарным диабетом в период грудного вскармливания может потребоваться коррекция дозы инсулина и/или диеты.
Хороший гликемический контроль поддерживает лактацию у пациенток с сахарным диабетом.
Доза препарата Ринсулин® НПХ определяется врачом индивидуально в зависимости от концентрации глюкозы в крови.
Препарат следует вводить подкожно.
Внутривенное введение препарата Ринсулин® НПХ противопоказано.
Способ применения
Температура вводимого препарата должна соответствовать комнатной.
Препарат вводят подкожно в область бедра, передней стенки живота, ягодиц или дельтовидной мышцы плеча. Места инъекций необходимо чередовать так, чтобы одно и то же место использовалось не чаще примерно одного раза в месяц. При подкожном введении инсулина необходимо проявлять осторожность, чтобы при инъекции не попасть в кровеносный сосуд. После инъекции не следует массировать место введения.
Пациенты должны быть обучены правильному использованию устройства для введения инсулина.
Режим введения инсулина должен определяться индивидуально.
Непосредственно перед использованием флакона Ринсулин® НПХ необходимо несколько раз прокатать между ладонями до полного ресуспендирования инсулина, пока он не приобретет вид однородной мутной жидкости или молока. Не следует энергично встряхивать, так как это может привести к появлению пены, которая может помешать правильному набору дозы.
Не следует применять инсулин, если в нем после перемешивания имеются хлопья, если ко дну или стенкам флакона прилипли твердые белые частицы, придавая ему вид замороженного. Правильно перемешанная суспензия должна быть однородно белой и мутной.
Возможно хранение находящегося в употреблении препарата при комнатной температуре (от 15 до 25 °C) не более 28 дней.
Используйте инсулиновый шприц, соответствующий концентрации вводимого инсулина.
Применение препарата в особых клинических группах
У детей и подростков до 18 лет
Применение препарата Ринсулин® НПХ не изучали у пациентов детского возраста. Как и у взрослых, дозировка препарата Ринсулин® НПХ у пациентов детского возраста должна быть индивидуальной с учетом обмена веществ пациента, цели лечения и результатов мониторинга концентрации глюкозы в крови.
У пожилых пациентов
Влияние возраста на фармакокинетику и фармакодинамику препарата Ринсулин® НПХ не изучалось. У пациентов пожилого возраста, применяющих любой препарат инсулина, имеется повышенный риск развития гипогликемии из-за сопутствующей патологии и полипрагмазии.
У пациентов с почечной недостаточностью
Фармакокинетика и фармакодинамика препарата Ринсулин® НПХ у пациентов с почечной недостаточностью не изучались. У пациентов с почечной недостаточностью имеется повышенный риск развития гипогликемии, может потребоваться более частая коррекция дозы препарата и более частый мониторинг концентрации глюкозы в крови.
У пациентов с печеночной недостаточностью
Фармакокинетика и фармакодинамика препарата Ринсулин® НПХ у пациентов с печеночной недостаточностью не изучались. У пациентов с печеночной недостаточностью имеется повышенный риск развития гипогликемии, может потребоваться более частая коррекция дозы препарата и более частый мониторинг концентрации глюкозы в крови.
Инструкции, которые необходимо дать пациенту
Нельзя применять препарат, если после взбалтывания суспензия не становится белой и равномерно мутной.
Техника инъекции при применении инсулина во флаконах
Если пациент применяет только один тип инсулина
1. Продезинфицируйте резиновую мембрану флакона
2. Наберите в шприц воздух в объеме, соответствующем нужной дозе инсулина. Введите воздух во флакон с инсулином.
3. Переверните флакон со шприцем вверх дном и наберите нужную дозу инсулина в шприц. Выньте иглу из флакона и удалите воздух из шприца. Проверьте правильность набора дозы инсулина.
4. Сразу же сделайте инъекцию.
Если пациенту необходимо смешать два типа инсулина
1. Продезинфицируйте резиновые мембраны флаконов.
2. Непосредственно перед набором покатайте флакон с инсулином длительного действия («мутным») между ладонями до тех пор, пока инсулин не станет равномерно белым и мутным.
3. Наберите в шприц воздух в объеме, соответствующем дозе «мутного» инсулина. Введите воздух во флакон с «мутным» инсулином и выньте иглу из флакона.
4. Наберите в шприц воздух в количестве, соответствующем дозе инсулина короткого действия («прозрачного»). Введите воздух во флакон с «прозрачным» инсулином. Переверните флакон со шприцем вверх дном и наберите нужную дозу «прозрачного» инсулина. Выньте иглу и удалите из шприца воздух. Проверьте правильность набранной дозы.
5. Введите иглу во флакон с «мутным» инсулином, переверните флакон со шприцем вверх дном и наберите нужную дозу инсулина. Удалите из шприца воздух и проверьте правильность набранной дозы. Сразу же сделайте инъекцию набранной смеси инсулина.
6. Всегда набирайте инсулины в одной и той же последовательности, описанной выше.
Процедура инъекции
— Необходимо продезинфицировать участок кожи, куда будет введен инсулин.
— Двумя пальцами соберите складку кожи, введите иглу в основание складки под углом около 45 градусов и введите под кожу инсулин.
— После инъекции игла должна оставаться под кожей как минимум 6 секунд, для того, чтобы убедиться, что инсулин введен полностью.
— Если после удаления иглы на месте укола выступает кровь, слегка прижмите место укола тампоном, смоченным дезинфицирующим раствором (например, спиртом).
— Необходимо менять места инъекций.
Гипогликемия является наиболее частой нежелательной реакцией, возникающей при инсулинотерапии. Тяжелая гипогликемия может привести к потере сознания и, в исключительных случаях, к смерти.
Местные аллергические реакции — возникают часто (≥1/100 до <1/10) и проявляются в виде гиперемии, отека или зуда в месте инъекции. Данные реакции обычно прекращаются в течение периода от нескольких дней до нескольких недель. В некоторых случаях эти реакции могут быть вызваны другими факторами, помимо применения инсулина, например, раздражением кожи очищающим агентом или неправильным проведением инъекций.
Системные аллергические реакции — возникают очень редко (<1/10000), но являются более серьезными, так как представляют собой генерализованную аллергическую реакцию на введение инсулина. Они могут проявляться сыпью по всему телу, одышкой, хрипами, снижением артериального давления, учащением пульса или повышенным потоотделением. Тяжелые случаи системных аллергических реакций могут быть угрожающими для жизни. В редких случаях при развитии тяжелой аллергической реакции на препарат Ринсулин® НПХ требуется немедленное проведение лечения.
Возможно, потребуется смена инсулина, либо проведение десенсибилизации.
Липодистрофия в месте введения развивается нечасто (≥1/1000 до <1/100).
У некоторых пациентов введение инсулина подкожно, в том числе препарата Ринсулин® НПХ, привело к возникновению липоатрофии или липогипертрофии.
Были выявлены случаи развития отеков, главным образом, при быстрой нормализации концентрации глюкозы в крови на фоне интенсивной инсулинотерапии при исходно неудовлетворительном гликемическом контроле.
Увеличение массы тела
Возможно увеличение массы тела при использовании некоторых методов лечения инсулином, в том числе препаратом Ринсулин® НПХ, что связано с анаболическим действием инсулина и снижением уровня глюкозурии.
Иммуногенность
Выработка антител, которые вступают в реакцию с человеческим инсулином, наблюдается при применении любых препаратов инсулина, в том числе препарата Ринсулин® НПХ.
Передозировка инсулином не имеет специфических признаков, так как концентрация глюкозы в плазме крови является результатом комплексного взаимодействия между концентрацией инсулина, доступностью глюкозы и другими метаболическими процессами. Гипогликемия может наблюдаться в результате избыточной активности инсулина относительно потребления пищи и энергетических затрат.
Гипогликемия может сопровождаться такими симптомами, как вялость, спутанность сознания, учащенное сердцебиение, головная боль, повышенное потоотделение и рвота. Легкие эпизоды гипогликемии купируются приемом внутрь декстрозы (глюкозы) либо продуктами, содержащими сахар. Поэтому пациентам рекомендуется постоянно иметь при себе сахаросодержащие продукты.
Коррекция гипогликемии средней тяжести может проводиться с помощью внутримышечного или подкожного введения глюкагона с последующим приемом внутрь углеводов после стабилизации состояния пациента. При отсутствии эффекта от введения глюкагона, необходимо проводить внутривенную инфузию концентрированных растворов декстрозы (глюкозы).
В случае коматозного состояния пациенту также следует ввести подкожно или внутримышечно глюкагон. При отсутствии глюкагона или эффекта от его применения, необходимо внутривенное введение концентрированных растворов декстрозы (глюкозы). Сразу же после восстановления сознания пациенту необходимо принять пищу, содержащую углеводы.
Может потребоваться дальнейший поддерживающий прием углеводов и наблюдение за пациентом, так как возможно возникновение рецидива гипогликемии.
При необходимости применения других лекарственных препаратов в дополнение к инсулину следует проконсультироваться с лечащим врачом.
Врач должен принимать во внимание возможность развития лекарственного взаимодействия и всегда интересоваться у пациентов о применяемых ими лекарственных препаратах.
Потребность в инсулине может увеличиваться за счет лекарственных препаратов с гипергликемическим действием, таких как глюкокортикостероиды, гормонозаместительная терапия щитовидной железы, гормон роста, даназол, бета2-адреномиметики (например, ритодрин, сальбутамол, тербуталин), тиазидные диуретики, адренокортикотропный гормон, неселективные α-симпатомиметики (эпинефрин, диазоксид), никотиновая кислота и ее производные, хлорпромазин (особенно в высоких дозах) и другие производные фенотиазина, антиретровирусные препараты, иммунодепрессанты (такролимус, циклоспорин, сиролимус), атипичные антипсихотики.
Потребность в инсулине может снижаться при приеме лекарственных препаратов с гипогликемическим действием, таких как пероральные гипогликемические препараты, салицилаты (например, ацетилсалициловая кислота), некоторые антидепрессанты (ингибиторы моноаминооксидазы), некоторые ингибиторы ангиотензинпревращающего фермента (каптоприл, эналаприл), блокаторы рецептора ангиотензина II, неселективные бета-блокаторы, антиаритмические препараты (такие как дизопирамид), фенфлурамин, α-адреноблокаторы, клонидин, фибраты, тетрациклины, пентамидин, противомалярийные препараты (хинин и т.д.), циметидин и ранитидин, селективные ингибиторы обратного захвата серотонина (СИОЗС), трициклические антидепрессанты (например, амитриптилин), сульфониламидные антибиотики.
Аналоги соматостатина (октреотид, ланреотид), производные салициловой кислоты, соли лития (редко) и алкоголь могут как уменьшать, так и увеличивать потребность в инсулине. Симптомы гипогликемии могут быть замаскированы или ослаблены на фоне совместного применения с β-адреноблокаторами, клонидином, гуанетидином и резерпином.
Перевод пациента на другой тип или препарат инсулина с другим торговым наименованием должен происходить под строгим медицинским наблюдением. Изменение типа (растворимый инсулин, инсулин-изофан или микс), концентрации, производителя инсулина, видовой принадлежности (животный, человеческий, аналоги человеческого инсулина) и/или метода производства (ДНК-рекомбинантный инсулин или инсулин животного происхождения) может привести к необходимости коррекции дозы препарата. Некоторым пациентам при переходе с инсулина животного происхождения на человеческий инсулин может потребоваться коррекция дозы. Это может произойти уже при первом введении человеческого инсулина или постепенно в течение нескольких недель или месяцев после перевода.
У некоторых пациентов при переводе с инсулина животного происхождения на человеческий симптомы-предвестники гипогликемии могут быть менее выражены или отличаться от тех, которые наблюдались у них на фоне введения инсулина животного происхождения. При нормализации концентрации глюкозы в крови, например, в результате интенсивной терапии инсулином, могут исчезнуть все или некоторые симптомы-предвестники гипогликемии, о чем пациенты должны быть проинформированы. Также симптомы-предвестники гипогликемии могут изменяться или быть менее выраженными при длительном течении сахарного диабета, диабетической нейропатии или лечении такими препаратами как бета-адреноблокаторы.
Без надлежащей коррекции, реакции гипогликемии и гипергликемии могут привести к потере сознания, коме или смерти.
Применение неадекватных доз или прекращение лечения, особенно у пациентов с сахарным диабетом 1 типа, может привести к гипергликемии и диабетическому кетоацидозу (состояниям, потенциально угрожающим жизни пациента).
Применение человеческого инсулина может провоцировать выработку антител, однако титр антител в таких случаях ниже, чем при применении очищенных инсулинов животного происхождения.
Потребность в инсулине может значительно меняться при заболеваниях надпочечников, гипофиза или щитовидной железы, а также при нарушении функции почек или печени.
При некоторых заболеваниях или при эмоциональном перенапряжении потребность в инсулине может увеличиваться. Коррекция дозы инсулина может также потребоваться при увеличении физической нагрузки или при изменении обычной диеты.
При применении препаратов инсулина в комбинации с препаратами группы тиазолидиндиона повышается риск развития отеков и хронической сердечной недостаточности, особенно у пациентов с заболеваниями сердечно-сосудистой системы и наличием факторов риска развития хронической сердечной недостаточности. При проведении комбинированной терапии инсулином и тиазолидиндионом за состоянием пациентов следует вести наблюдение на предмет возникновения симптомов и проявлений сердечной недостаточности, увеличения массы тела и появления отеков. Применение тиазолидиндиона должно быть прекращено при ухудшении симптомов заболевания сердечно-сосудистой системы.
У пациентов может снижаться концентрация внимания и скорость психомоторных реакций в результате развития гипогликемии. Это может представлять опасность в ситуациях, при которых эти способности особенно необходимы (например, управление транспортными средствами и механизмами).
Следует рекомендовать пациентам принимать меры предосторожности для того, чтобы избежать гипогликемии во время управления транспортными средствами. Это особенно важно для пациентов со слабо выраженными или отсутствующими симптомами- предвестниками гипогликемии или при частом развитии эпизодов гипогликемии. В таких случаях врач должен оценить целесообразность управления транспортными средствами и механизмами.
Суспензия для подкожного введения, 100 МЕ/мл.
10 мл препарата во флаконе из бесцветного стекла, герметично обкатанном колпачком комбинированным из алюминия и пластмассы с диском резиновым или укупоренном пробкой резиновой с обкаткой колпачком комбинированным из алюминия и пластмассы с отрывной пластиковой накладкой; по одному флакону с инструкцией по применению в пачке из картона.
В защищенном от света месте при температуре от 2 до 8 °C. Не замораживать.
Хранить в недоступном для детей месте.
3 года. Не применять по истечении срока годности.
По рецепту
Регистрационный номер
ЛС-001809
Дата регистрации
2011-03-30
Дата переоформления
2021-04-07
Владелец регистрационного удостоверения
Производитель
ГЕРОФАРМ-БИО ОАО
Россия
ГЕРОФАРМ ООО
Россия