Мидиана® (Midiana®) инструкция по применению
📜 Инструкция по применению Мидиана®
💊 Состав препарата Мидиана®
✅ Применение препарата Мидиана®
📅 Условия хранения Мидиана®
⏳ Срок годности Мидиана®
Описание лекарственного препарата
Мидиана®
(Midiana®)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для электронного издания справочника Видаль 2023
года, дата обновления: 2023.03.24
Владелец регистрационного удостоверения:
Контакты для обращений:
ГЕДЕОН РИХТЕР ОАО
(Венгрия)
Код ATX:
G03AA12
(Дроспиренон и этинилэстрадиол)
Лекарственная форма
| Мидиана® |
Таб., покр. пленочной оболочкой, 3 мг+0.03 мг: 21 или 63 шт. рег. №: ЛП-(000139)-(РГ-RU) Предыдущий рег. №: ЛСР-008855/10 |
Форма выпуска, упаковка и состав
препарата Мидиана®
Таблетки, покрытые пленочной оболочкой, белого или почти белого цвета, круглые, двояковыпуклые; на одной стороне гравировка «G63», другая сторона без гравировки; вид на поперечном разрезе белый или почти белый.
Вспомогательные вещества: лактозы моногидрат, крахмал кукурузный, крахмал кукурузный прежелатинизированный, повидон-К25, магния стеарат.
Состав пленочной оболочки (Опадрай II белый*): поливиниловый спирт, титана диоксид (E171), макрогол-3350, тальк, лецитин соевый.
* Код Colorcon 85G18490.
21 шт. — блистеры (1) — пачки картонные с футляром для хранения блистера.
21 шт. — блистеры (3) — пачки картонные с футляром для хранения блистера.
Фармакологическое действие
Препарат Мидиана® — комбинированный (эстроген + гестаген) пероральный контрацептивный препарат (КОК). Контрацептивный эффект КОК основан на взаимодействии различных факторов, наиболее важными из которых являются подавление овуляции, повышение вязкости секрета шейки матки и изменения в эндометрии.
При правильном применении индекс Перля (показатель, отражающий число беременностей у 100 женщин, применяющих контрацептив в течение одного года) составляет менее 1. При пропуске таблеток или неправильном применении индекс Перля может возрастать.
У женщин, принимающих КОК, менструальный цикл становится более регулярным, реже наблюдаются болезненные менструальноподобные кровотечения, уменьшается интенсивность и продолжительность кровотечения, в результате чего снижается риск железодефицитной анемии. Также имеются данные о снижении риска развития рака эндометрия и яичников при приеме КОК.
Дроспиренон, входящий в состав препарата Мидиана®, обладает антиминералокортикоидной активностью и способен предупреждать увеличение массы тела и появление других симптомов (например, отеков), связанных с эстрогензависимой задержкой жидкости. Дроспиренон оказывает положительное воздействие на предменструальный синдром. В сочетании с этинилэстрадиолом дроспиренон демонстрирует благоприятный эффект на липидный профиль, характеризующийся
повышением ЛПВП. Дроспиренон также обладает антиандрогенной активностью и способствует уменьшению угрей (акне), жирности кожи и волос (себореи). Эти особенности дроспиренона следует учитывать при выборе контрацептива женщинам с гормонозависимой задержкой жидкости, а также женщинам с акне и себореей.
Дроспиренон не обладает андрогенной, эстрогенной, глюкокортикоидной и антиглюкокортикоидной активностью. Все это в сочетании с антиминералокортикоидным и антиандрогенным действием обеспечивает дроспиренону биохимический и фармакологический профиль, сходный с естественным прогестероном.
Фармакокинетика
Дроспиренон
Всасывание
При приеме внутрь дроспиренон быстро и почти полностью абсорбируется. Cmax дроспиренона в плазме крови, равная 38 нг/мл, достигается через 1-2 ч после однократного приема. Биодоступность составляет 76-85%. Прием пищи не влияет на биодоступность дроспиренона.
Распределение
Дроспиренон связывается с альбумином плазмы крови и не связывается с глобулином, связывающим половые гормоны (ГСПГ), или кортикостероид-связывающим глобулином. Лишь 3-5% от общей концентрации активного вещества в плазме крови присутствует в виде свободного гормона. 95-97% вещества неспецифически связываются с альбумином. Индуцированное этинилэстрадиолом повышение ГСПГ не влияет на связывание дроспиренона белками плазмы крови. Средний кажущийся Vd составляет 3.7±1.2 л/кг.
Метаболизм
После перорального приема дроспиренон полностью метаболизируется. Большинство метаболитов в плазме крови представлены кислотными формами дроспиренона. Дроспиренон также является субстратом для окислительного метаболизма, катализируемого изоферментом CYP3A4. Скорость метаболического клиренса дроспиренона из плазмы крови составляет 1.5±0.2 мл/мин/кг.
Выведение
Концентрация дроспиренона в плазме крови снижается двухфазно. Вторая, окончательная фаза имеет T1/2 около 31 ч. В неизмененном виде дроспиренон экскретируется в следовых количествах. Метаболиты дроспиренона выводятся через ЖКТ и почками в соотношении примерно 1.2:1.4. T1/2 метаболитов дроспиренона составляет примерно 40 ч.
Равновесная концентрация
Концентрация ГСПГ не оказывает влияния на показатели фармакокинетики дроспиренона. При ежедневном применении препарата внутрь концентрация дроспиренона в плазме крови повышается в 2-3 раза, Css достигается через 8 дней приема препарата.
Фармакокинетика у особых групп пациентов
Пациентки с почечной недостаточностью. Исследования показали, что концентрация дроспиренона в плазме крови женщин с почечной недостаточностью легкой степени (КК — 50-80 мл/мин) при достижении равновесного состояния и у женщин с нормальной функцией почек (КК >80 мл/мин) сопоставимы. Тем не менее, у женщин с почечной недостаточностью средней степени тяжести (КК — 30-50 мл/мин) средняя концентрация дроспиренона в плазме крови была на 37% выше, чем у женщин с нормальной функцией почек. Не отмечено изменения концентрации калия в плазме крови при применении дроспиренона. Фармакокинетика дроспиренона не изучалась у пациенток с почечной недостаточностью тяжелой степени.
Пациентки с печеночной недостаточностью. У женщин с печеночной недостаточностью средней степени тяжести (класс В по шкале Чайлд-Пью) AUC сопоставима с соответствующим показателем у здоровых женщин с близкими значениями Cmax в фазе абсорбции и распределения. T1/2 дроспиренона у пациенток с печеночной недостаточностью средней степени тяжести оказался в 1.8 раз выше, чем у здоровых добровольцев.
У пациенток с печеночной недостаточностью средней степени тяжести отмечено снижение клиренса дроспиренона приблизительно на 50% по сравнению со здоровыми женщинами, при этом не отмечено различий в концентрации калия в плазме крови в изучаемых группах.
При сахарном диабете и сопутствующем применении спиронолактона (оба состояния расцениваются как факторы, предрасполагающие к развитию гиперкалиемии) не отмечалось повышения концентрации калия в плазме крови.
Можно заключить, что дроспиренон хорошо переносится пациентками с печеночной недостаточностью легкой и средней степени тяжести (класс В по шкале Чайлд-Пью).
Фармакокинетика дроспиренона не изучалась у пациенток с печеночной недостаточностью тяжелой степени.
Этническая принадлежность. Не установлено влияния этнической принадлежности (исследование проведено на группах женщин европеоидной расы и японок) на параметры фармакокинетики дроспиренона и этинилэстрадиола.
Этинилэстрадиол
Всасывание
Этинилэстрадиол после приема внутрь быстро и полностью абсорбируется. Cmax достигается в течение 1-2 ч и составляет около 100 пг/мл. Во время всасывания и «первого прохождения» через печень этинилэстрадиол метаболизируется, в результате чего его биодоступность при приеме внутрь составляет в среднем около 45% при высокой межиндивидуальной вариабельности — от 20 до 65%. Одновременный прием пищи в отдельных случаях сопровождается снижением биодоступности этинилэстрадиола на 25%.
Распределение
Этинилэстрадиол неспецифически, но прочно связывается с альбумином плазмы крови (около 98%) и индуцирует повышение концентрации в плазме крови ГСПГ. Предполагаемый Vd составляет 5 л/кг.
Метаболизм
Этинилэстрадиол подвергается значительному пресистемному метаболизму в кишечнике и печени. Этинилэстрадиол и его окислительные метаболиты первично конъюгированы с глюкуронидами или сульфатом. Скорость метаболического клиренса составляет около 5 мл/мин/кг.
Выведение
Снижение концентрации этинилэстрадиола в плазме крови носит двухфазный характер; первая фаза характеризуется T1/2 около 1 ч, вторая — 20 ч. Этинилэстрадиол практически не выводится в неизмененном виде. Метаболиты этинилэстрадиола выводятся почками и через кишечник в соотношении 4:6. T1/2 метаболитов составляет примерно 24 ч.
Равновесная концентрация
Состояние равновесной концентрации достигается во второй половине цикла приема препарата, когда концентрация этинилэстрадиола в плазме крови повышается на 40-110% по сравнению с применением разовой дозы.
Показания препарата
Мидиана®
- пероральная контрацепция.
Режим дозирования
Таблетки следует принимать внутрь по порядку, указанному на упаковке, каждый день примерно в одно и то же время, запивая небольшим количеством воды. Принимают по 1 таблетке в сутки непрерывно в течение 21 дня. Прием таблеток из следующей упаковки начинается после 7-дневного перерыва, во время которого обычно развивается менструальноподобное кровотечение (кровотечение «отмены»). Как правило, оно начинается на 2-3 день после приема последней таблетки и может не закончиться до начала приема таблеток из новой упаковки. Прием таблеток из новой упаковки следует начинать в один и тот же день недели, соответственно кровотечение «отмены» будет каждый месяц примерно в одно и то же время.
Начало приема препарата (гормональное контрацептивное средство не применялось в предыдущем месяце)
Прием препарата Мидиана® начинается в первый день менструального цикла (т.е. в первый день менструального кровотечения). Допускается начало приема на 2-5 день менструального цикла, но в этом случае рекомендуется дополнительно использовать барьерный метод контрацепции (например, презерватив) в течение первых 7 дней приема таблеток из первой упаковки.
При переходе с других комбинированных гормональных контрацептивных препаратов (КОК, вагинального кольца или трансдермального пластыря)
Предпочтительнее начинать прием препарата Мидиана® на следующий день после приема последней таблетки из предыдущей упаковки, но ни в коем случае не позднее следующего дня после обычного 7-дневного перерыва (для препаратов, содержащих 21 таблетку) или после приема последней не содержащей гормонов таблетки (для препаратов, в упаковке которых 28 таблеток). Прием препарата следует начинать в день удаления вагинального кольца или трансдермального пластыря, но не позднее дня, когда должно быть введено новое кольцо или наклеен новый пластырь.
При переходе с контрацептивов, содержащих только гестаген («мини-пили», инъекционные формы, имплантат) или с внутриматочной терапевтической системы с высвобождением гестагена
Перейти с «мини-пили» на препарат Мидиана® можно в любой день (без перерыва), с имплантата или внутриматочного контрацептива с гестагеном — в день его удаления, с инъекционной формы — со дня, когда должна быть сделана следующая инъекция. Во всех случаях в течение первых 7 дней приема таблеток необходимо использовать дополнительно барьерный метод контрацепции (например, презерватив).
После аборта, в т.ч. и самопроизвольного, в I триместре беременности
Начинать прием препарата можно немедленно — в день аборта. При соблюдении этого условия женщина не нуждается в дополнительной контрацепции.
После родов или прерывания беременности (в т.ч. самопроизвольного) во II триместре
Начинать прием препарата следует не ранее 21-28 дня после родов (при отсутствии грудного вскармливания) или сразу после прерывания беременности (в т.ч. самопроизвольного) во II триместре. Если прием начат позднее, необходимо использовать дополнительно барьерный метод контрацепции в течение первых 7 дней приема таблеток. Однако если половой контакт имел место до начала приема препарата, должна быть исключена беременность.
Прием пропущенных таблеток
Если опоздание в приеме препарата составило менее 12 ч, контрацептивная защита не снижается. Следует принять пропущенную таблетку как можно скорее, следующая таблетка принимается в обычное время.
Если опоздание в приеме таблеток составило более 12 ч, контрацептивная защита снижается. В случае пропуска таблетки необходимо помнить:
- прием препарата никогда не должен быть прерван более чем на 7 дней;
- 7 дней непрерывного приема таблеток требуются для достижения адекватного подавления гипоталамо-гипофизарно-яичниковой регуляции.
Соответственно, если опоздание в приеме таблеток превышает 12 ч (т.е. интервал с момента приема последней таблетки — более 36 ч), в зависимости от недели, когда пропущена таблетка, необходимо:
Первая неделя приема препарата
Принять последнюю пропущенную таблетку как можно скорее, как только женщина вспомнит об этом (даже если для этого нужно принять две таблетки одновременно). Следующую таблетку принимают в обычное время. В течение последующих 7 дней необходимо дополнительно использовать барьерный метод контрацепции (например, презерватив). Если половой контакт имел место в течение недели перед пропуском таблетки, необходимо учитывать возможность беременности.
Вторая неделя приема препарата
Необходимо принять последнюю пропущенную таблетку как можно скорее, как только женщина вспомнит об этом (даже если это означает прием двух таблеток одновременно). Очередную таблетку препарата следует принять на следующий день в обычное время. При условии, что женщина принимала таблетки правильно в течение 7 дней, предшествующих первой пропущенной таблетке, необходимости в использовании дополнительных методов контрацепции нет. В противном случае, а также при пропуске двух и более таблеток, необходимо дополнительно использовать барьерные методы контрацепции (например, презерватив) в течение последующих 7 дней.
Третья неделя приема препарата
Риск снижения контрацептивной надежности неизбежен из-за предстоящего перерыва в приеме таблеток. В этом случае необходимо придерживаться следующих рекомендаций:
- Если в течение 7 дней, предшествующих первой пропущенной таблетке, все таблетки были приняты правильно, нет необходимости использовать дополнительные методы контрацепции. При приеме пропущенных таблеток следует руководствоваться пунктами 1 или 2.
- Если в течение 7 дней, предшествующих первой пропущенной таблетке, режим приема препарата нарушался, то в течение последующих 7 дней необходимо дополнительно использовать барьерный метод контрацепции (например, презерватив) и в этом случае следует руководствоваться пунктом 1 для приема пропущенных таблеток.
- Необходимо принять пропущенную таблетку как можно скорее, как только женщина вспомнит об этом (даже если это означает прием двух таблеток одновременно). Следующие таблетки принимают в обычное время, пока не закончатся таблетки из текущей упаковки. Прием таблеток из следующей упаковки следует начинать сразу же без обычного 7-дневного перерыва. Кровотечение «отмены» маловероятно, пока не закончатся таблетки из второй упаковки, но могут отмечаться «мажущие» выделения и/или «прорывные» кровотечения в дни приема препарата.
- Можно также прервать прием таблеток из текущей упаковки, сделать перерыв на 7 или менее дней (включая дни пропуска таблеток), после чего начинать прием таблеток из новой упаковки.
Если женщина пропустила прием таблеток, и затем во время перерыва в приеме у нее нет кровотечения «отмены», необходимо исключить беременность.
Допускается прием не более двух таблеток в один день.
Рекомендации при желудочно-кишечных расстройствах
При тяжелых желудочно-кишечных расстройствах всасывание препарата может быть неполным, поэтому следует использовать дополнительные методы контрацепции.
Если в течение 3-4 ч после приема таблеток отмечается рвота или диарея, в зависимости от недели приема препарата следует ориентироваться на рекомендации при пропуске таблеток, указанные выше. Если женщина не хочет менять свою обычную схему приема и переносить начало менструации на другой день недели, дополнительную таблетку следует принять из другой упаковки.
Прекращение приема препарата
Прием препарата Мидиана® можно прекратить в любое время. Если женщина не планирует беременность, следует позаботиться о других методах контрацепции. Если планируется беременность, следует просто прекратить прием препарата и подождать естественного менструального кровотечения.
Отсрочка начала менструальноподобного кровотечения
Для того чтобы отсрочить начало менструальноподобного кровотечения, необходимо продолжить дальнейший прием таблеток из новой упаковки препарата без 7-дневного перерыва. Таблетки из новой упаковки можно принимать так долго, как это необходимо, в т.ч. до тех пор, пока таблетки из упаковки не закончатся. На фоне приема препарата из второй упаковки могут отмечаться «мажущие» кровянистые выделения из влагалища и/или «прорывные» маточные кровотечения. Возобновить прием препарата из очередной упаковки следует после обычного 7-дневного перерыва.
Изменение дня начала менструальноподобного кровотечения
Для того чтобы перенести день начала менструальноподобного кровотечения на другой день недели, женщине следует сократить ближайший 7-дневный перерыв в приеме таблеток на столько дней, на сколько женщина хочет. Чем короче перерыв в приеме таблеток, тем выше вероятность, что менструальноподобное кровотечение не наступит, и во время приема таблеток из второй упаковки будут наблюдаться «мажущие» выделения и/или «прорывные» кровотечения.
Особые группы пациенток
Девочки-подростки. Прием препарата Мидиана® показан только после наступления менархе. Имеющиеся данные не предполагают коррекции дозы у данной возрастной группы.
Пациентки пожилого возраста (старше 65 лет). Не применимо. Прием препарата не показан после наступления менопаузы.
Пациентки с почечной недостаточностью. Применение препарата Мидиана® у пациенток с острой почечной недостаточностью или почечной недостаточностью тяжелой степени противопоказано.
Пациентки с печеночной недостаточностью. Препарат противопоказан у пациенток с острыми и тяжелыми заболеваниями печени до нормализации показателей функциональных проб печени.
Побочное действие
Нежелательные реакции распределены по системно-органным классам в соответствии со словарем для регуляторной деятельности MedDRA с указанием частоты их возникновения согласно рекомендациям ВОЗ: часто (≥1/100 и <1/10), нечасто (≥1/1000 и <1/100), редко (≥10000 и <1000).
При применении комбинации дроспиренон+этинилэстрадиол сообщалось о следующих нежелательных реакциях.
* Расчетная частота по данным эпидемиологических исследований, охватывающих группу КОК.
Венозные и артериальные тромбоэмболические осложнения объединяют следующие нозологические формы: окклюзия периферических глубоких вен, тромбоз и тромбоэмболия/окклюзия легочных сосудов, тромбоз, эмболия и инфаркт/инфаркт миокарда/церебральный инфаркт и инсульт, не классифицированный как геморрагический.
Ниже перечислены нежелательные реакции с очень низкой частотой возникновения или с отсроченным развитием симптомов, которые считаются связанными с применением КОК.
Опухоли
- У женщин, применяющих КОК, очень незначительно повышена частота выявления рака молочной железы (РМЖ). Поскольку РМЖ редко встречается у женщин моложе 40 лет, повышение частоты рака у женщин, применяющих КОК, незначительно по отношению к общему риску возникновения РМЖ. Причинно-следственная связь с применением КОК не выявлена.
- Опухоли печени (доброкачественные и злокачественные).
Прочие состояния
- Наступление или ухудшение состояний, при которых связь с применением КОК не является неоспоримой: желтуха и/или зуд, связанные с холестазом; образование камней желчного пузыря; порфирия; эпилепсия; миома матки; системная красная волчанка; гемолитико-уремический синдром; болезнь Крона, язвенный колит; хорея Сиденгама; гестационный герпес; потеря слуха, связанная с отосклерозом.
- У женщин с наследственным ангионевротическим отеком экзогенные эстрогены могут вызвать или усилить симптомы ангионевротического отека.
- Нарушения функции печени.
- Нарушения толерантности к глюкозе или влияние на периферическую инсулинорезистентность.
- Хлоазма.
Противопоказания к применению
Прием комбинации дроспиренон + этинилэстрадиол противопоказан при наличии следующих заболеваний/состояний или факторов риска:
- венозный тромбоз или тромбоэмболия (ВТЭ), в т.ч. тромбоз глубоких вен (ТГВ) и тромбоэмболия легочной артерии (ТЭЛА), в настоящее время или в анамнезе;
- артериальный тромбоз или тромбоэмболия (АТЭ), в т.ч. инфаркт миокарда и инсульт; или продромальные состояния (транзиторная ишемическая атака, стенокардия);
- выявленная наследственная или приобретенная предрасположенность к ВТЭ или АТЭ, включая резистентность к активированному протеину С, гипергомоцистеинемию, дефицит антитромбина III, дефицит протеина С, дефицит протеина S, антифосфолипидные антитела (антитела к кардиолипину, волчаночный антикоагулянт);
- наличие выраженных или множественных факторов риска ВТЭ или АТЭ (курение в возрасте старше 35 лет, ожирение с ИМТ 30 кг/м2 и более, любая операция на нижних конечностях, в области таза или нейрохирургическое оперативное вмешательство, осложненные пороки клапанов сердца, фибрилляция предсердий), или одного серьезного фактора риска, такого как:
- неконтролируемая артериальная гипертензия;
- сахарный диабет с диабетической ангиопатией;
- тяжелая дислипопротеинемия;
- объемные оперативные вмешательства с длительной иммобилизацией;
- мигрень с очаговой неврологической симптоматикой в настоящее время или в анамнезе;
- хроническая почечная недостаточность тяжелой степени или острая почечная недостаточность;
- печеночная недостаточность, острые или хронические заболевания печени тяжелой степени (до нормализации показателей функциональных проб печени);
- опухоли печени (доброкачественные или злокачественные) в настоящее время или в анамнезе;
- диагностированные гормонозависимые злокачественные новообразования (в т.ч. половых органов или молочной железы) или подозрение на них;
- кровотечение из половых путей неясной этиологии;
- гиперчувствительность к дроспиренону, этинилэстрадиолу или какому-либо из вспомогательных веществ в составе препарата;
- гиперчувствительность к арахису или сое;
- беременность, в т.ч. предполагаемая;
- период грудного вскармливания;
- непереносимость лактозы, дефицит лактазы, синдром глюкозо-галактозной мальабсорбции;
- совместное применение с лекарственными препаратами, содержащими омбитасвир, паритапревир, ритонавир и дасабувир.
В случае выявления или развития впервые какого-либо из этих заболеваний/состояний или факторов риска на фоне применения препарата Мидиана® прием препарата следует прекратить.
С осторожностью
Следует тщательно взвешивать потенциальный риск и ожидаемую пользу применения КОК в каждом индивидуальном случае при наличии следующих заболеваний/состояний и факторов риска:
- факторы риска развития тромбоза и тромбоэмболий: курение, ожирение, дислипопротеинемия, контролируемая артериальная гипертензия, мигрень без очаговой неврологической симптоматики, пороки клапанов сердца, наследственная предрасположенность к тромбозу (тромбозы, инфаркт миокарда или нарушение мозгового кровообращения в возрасте менее 50 лет у кого-либо из ближайших родственников);
- другие заболевания, при которых могут отмечаться нарушения периферического кровообращения: сахарный диабет, системная красная волчанка, гемолитико-уремический синдром, болезнь Крона и язвенный колит, серповидно-клеточная анемия, флебит поверхностных вен;
- наследственный ангионевротический отек;
- гипертриглицеридемия;
- заболевания печени легкой и средней степени тяжести в анамнезе при нормальных показателях функциональных проб печени;
- заболевания, впервые возникшие или усугубившиеся во время беременности или на фоне предыдущего приема половых гормонов (в т.ч. желтуха и/или зуд, связанные с холестазом, холелитиаз, отосклероз с ухудшением слуха, порфирия, герпес во время беременности, хорея Сиденгама);
- послеродовый период.
Применение при беременности и кормлении грудью
Беременность
Прием комбинации дроспиренон + этинилэстрадиол в период беременности противопоказан. В случае диагностирования беременности на фоне применения препарата Мидиана® следует немедленно прекратить его прием. Многочисленные эпидемиологические исследования не выявили ни увеличения риска дефектов развития у детей, рожденных женщинами, получавшими половые гормоны до беременности, ни наличия тератогенного действия, когда половые гормоны принимались по неосторожности в ранние сроки беременности.
Период грудного вскармливания
Применение препарата Мидиана®, как и других КОК, может уменьшать количество грудного молока и изменять его состав, поэтому прием препарата противопоказан до прекращения грудного вскармливания. Небольшое количество половых гормонов и/или их метаболитов может проникать в грудное молоко и оказывать влияние на здоровье ребенка.
Применение при нарушениях функции печени
Противопоказано применение препарата при тяжелых заболеваниях печени (до нормализации печеночных проб) в настоящее время или в анамнезе; опухолях печени (доброкачественных или злокачественных), в настоящее время или в анамнезе.
С осторожностью: заболевания печени легкой и средней степени тяжести в анамнезе при нормальных показателях функциональных проб печени.
Применение при нарушениях функции почек
Применение препарата у пациенток с острой почечной недостаточностью или почечной недостаточностью тяжелой степени противопоказано.
Применение у детей
Прием препарата показан только после наступления менархе.
Применение у пожилых пациентов
Не применимо. Прием препарата не показан после наступления менопаузы.
Особые указания
Если какие-либо из состояний, заболеваний или факторов риска, указанных ниже, имеются в настоящее время, то следует тщательно взвесить потенциальный риск и ожидаемую пользу применения КОК, в т.ч. комбинации дроспиренон + этинилэстрадиол, в каждом индивидуальном случае и обсудить его с женщиной до начала приема препарата. В случае усугубления, усиления или первого проявления любого из этих состояний, заболеваний или факторов риска, женщина должна проконсультироваться со своим врачом для решения вопроса о прекращении приема препарата.
Риск развития ВТЭ и АТЭ
Результаты эпидемиологических исследований указывают на наличие взаимосвязи между применением КОК и повышением частоты развития венозных и артериальных тромбозов и тромбоэмболий (таких как ТГВ, ТЭЛА, инфаркт миокарда, цереброваскулярные нарушения). Данные заболевания регистрируются редко. Повышенный риск развития ВТЭ, связываемый с применением КОК, обусловлен наличием в его составе эстрогена. Лекарственные препараты, содержащие в качестве прогестагенного компонента левоноргестрел, норгестимат или норэтистерон, связаны с самым низким риском ВТЭ. При применении других КОК, таких как комбинация дроспиренон + этинилэстрадиол, риск развития ВТЭ в 2 раза выше. Выбор в пользу КОК с более высоким риском развития ВТЭ может быть сделан только после консультации с женщиной, позволяющей убедиться, что она полностью понимает риск ВТЭ, связанный с приемом данного контрацептива, влияние препарата на существующие у нее факторы риска и то, что риск развития ВТЭ максимален в первый год приема таких препаратов. Повышенный риск отмечается и при возобновлении применения КОК (после перерыва между приемами препарата в 4 недели и более). Повышенный риск развития ВТЭ присутствует преимущественно в течение первых 3 месяцев.
ВТЭ может оказаться жизнеугрожающей или привести к летальному исходу (в 1-2% случаев). ВТЭ, проявляющаяся в виде ТГВ и/или ТЭЛА, может произойти при применении любых КОК.
Крайне редко при применении КОК возникает тромбоз других кровеносных сосудов, например, печеночных, брыжеечных, почечных, мозговых вен и артерий или сосудов сетчатки глаза.
Симптомы ТГВ: односторонний отек нижней конечности или по ходу вены, боль или дискомфорт только в вертикальном положении или при ходьбе, локальное повышение температуры, покраснение или изменение окраски кожных покровов в пораженной нижней конечности.
Симптомы ТЭЛА: затрудненное или учащенное дыхание; внезапный кашель, в т.ч. с кровохарканием; острая боль в грудной клетке, которая может усиливаться при глубоком вдохе; чувство тревоги; сильное головокружение; учащенное или нерегулярное сердцебиение. Некоторые из этих симптомов (например, одышка, кашель) являются неспецифическими и могут быть истолкованы неверно как признаки других более часто встречающихся и менее тяжелых состояний (например, инфекция дыхательных путей).
АТЭ может привести к инсульту, окклюзии сосудов или инфаркту миокарда.
Симптомы инсульта: внезапная слабость или потеря чувствительности лица, конечностей, особенно с одной стороны тела, внезапная спутанность сознания, сильная или продолжительная головная боль без видимой причины, одно- или двухсторонняя потеря зрения; проблемы с речью и пониманием; внезапное нарушение походки, головокружение, потеря равновесия или координации движений; внезапная потеря сознания или обморок с судорожным приступом или без него.
Другие признаки окклюзии сосудов: внезапная боль, отечность и незначительная синюшность конечностей, «острый» живот.
Симптомы инфаркта миокарда: боль, дискомфорт, давление, тяжесть, чувство сжатия или распирания в груди или за грудиной, с иррадиацией в спину, челюсть, верхнюю конечность, область эпигастрия; холодный пот, тошнота, рвота или головокружение, выраженная слабость, тревога или одышка; учащенное или нерегулярное сердцебиение. АТЭ может оказаться жизнеугрожающей и привести к летальному исходу.
У женщин с сочетанием нескольких факторов риска или высокой выраженностью одного из факторов следует рассматривать возможность их взаимоусиления. В подобных случаях степень повышения риска может оказаться более высокой, чем при простом суммировании факторов. В этом случае прием комбинации дроспиренон + этинилэстрадиол противопоказан.
Риск развития тромбоза (венозного и/или артериального) и тромбоэмболии или цереброваскулярных нарушений повышается:
- с возрастом;
- у курящих женщин (с увеличением количества сигарет или повышением возраста риск нарастает, особенно в возрасте старше 35 лет);
- при наличии семейного анамнеза (например, ВТЭ или АТЭ у близких родственников или родителей в возрасте менее 50 лет). В случае наследственной или приобретенной предрасположенности женщина должна быть осмотрена соответствующим специалистом для решения вопроса о возможности приема КОК;
- при ожирении (с ИМТ более 30 кг/м2);
- при дислипопротеинемии;
- при артериальной гипертензии;
- при мигрени;
- при заболеваниях клапанов сердца;
- при фибрилляции предсердий;
- в случае длительной иммобилизации, серьезного хирургического вмешательства, любой операции на нижних конечностях, в области таза или обширной травмы. В этих случаях следует прекратить применение КОК (в случае планируемой операции, по крайней мере, за 4 недели до нее) и не возобновлять прием в течение 2 недель после полного восстановления мобильности женщины.
Временная иммобилизация (например, авиаперелет длительностью более 4 ч) также может являться фактором риска развития ВТЭ, особенно при наличии других факторов риска.
Вопрос о возможной роли варикозного расширения вен и тромбофлебита поверхностных вен в развитии ВТЭ остается спорным.
Следует учитывать повышенный риск развития тромбоэмболии в послеродовом периоде.
Нарушения периферического кровообращения также могут отмечаться при сахарном диабете, системной красной волчанке, гемолитико-уремическом синдроме, хронических воспалительных заболеваниях кишечника (болезнь Крона или язвенный колит) и серповидно-клеточной анемии.
Увеличение частоты и тяжести мигрени (что может предшествовать цереброваскулярным нарушениям) во время применения КОК является основанием для немедленного прекращения приема этих препаратов.
К биохимическим показателям, указывающим на наследственную или приобретенную предрасположенность к развитию венозного или артериального тромбоза относятся: резистентность к активированному протеину С, гипергомоцистеинемия, дефицит антитромбина III, дефицит протеина С, дефицит протеина S, антифосфолипидные антитела (антитела к кардиолипину, волчаночный антикоагулянт).
При оценке соотношения риска и пользы следует учитывать, что адекватное лечение соответствующего состояния/заболевания может уменьшить связанный с ним риск тромбоза.
Опухоли
Наиболее существенным фактором риска развития рака шейки матки (РШМ) является персистирующая папилломавирусная инфекция. Имеются сообщения о некотором повышении риска развития РШМ при длительном применении КОК. Однако связь с приемом КОК не доказана. Сохраняются противоречия относительно того, в какой степени эти данные связаны со скринингом на предмет патологии шейки матки или с особенностями полового поведения (более редкое применение барьерных методов контрацепции, большее количество половых партнеров).
Мета-анализ 54 эпидемиологических исследований показал, что имеется несколько повышенный относительный риск развития РМЖ, диагностированного у женщин, принимающих КОК в настоящее время (относительный риск 1.24). Повышенный риск постепенно исчезает в течение 10 лет после прекращения приема этих препаратов. В связи с тем, что РМЖ отмечается редко у женщин до 40 лет, увеличение количества случаев РМЖ у женщин, принимающих КОК в настоящее время или принимавших его недавно, является незначительным по отношению к общему риску этого заболевания. Его связь с приемом КОК не доказана. Наблюдаемое повышение риска может быть также следствием более ранней диагностики РМЖ у женщин, применяющих КОК (у них диагностируются более ранние клинические формы РМЖ, чем у женщин, не принимавших КОК), биологическим действием КОК или сочетанием обоих этих факторов.
В редких случаях на фоне применения КОК наблюдалось развитие доброкачественных, а в крайне редких — злокачественных опухолей печени, которые в отдельных случаях приводили к угрожающему жизни внутрибрюшному кровотечению. В случае появления сильных болей в области живота, увеличения печени или признаков внутрибрюшного кровотечения это следует учитывать при проведении дифференциального диагноза.
Прием высокодозированных КОК (0.05 мг этинилэстрадиола) снижает риск развития эндометриоидного рака и рака яичников. Применимость этого наблюдения к низкодозированным КОК требует подтверждения.
Злокачественные опухоли могут быть опасными для жизни или приводить к смертельному исходу.
Другие состояния
Депрессивное настроение и депрессия являются известной нежелательной реакцией при применении гормональных контрацептивов. Депрессия может быть серьезным расстройством и является известным фактором риска суицидального поведения и суицида. Женщинам следует посоветовать обратиться к своему врачу в случае появления изменений настроения и депрессивных симптомов, в т.ч. вскоре после начала лечения.
Дроспиренон является антагонистом альдостерона, обладающим калийсберегающими свойствами. В большинстве случаев не должно наблюдаться повышение концентрации калия в плазме крови. В клинических исследованиях у некоторых пациенток с почечной недостаточностью легкой или средней степени тяжести и сопутствующем приеме калийсберегающих препаратов концентрация калия в плазме крови во время приема дроспиренона незначительно повышалась. Поэтому необходимо контролировать концентрацию калия в плазме крови в течение первого цикла приема препарата у пациенток с почечной недостаточностью и при изначальной концентрации калия на ВГН, особенно при сопутствующем приеме калийсберегающих препаратов.
У женщин с гипертриглицеридемией (или наличием этого состояния в семейном анамнезе) во время приема КОК возможно повышение риска развития панкреатита.
Несмотря на то, что незначительное повышение АД было описано у многих женщин, принимающих КОК, клинически значимое повышение отмечалось редко. Тем не менее, если на фоне применения КОК развивается стойкое клинически значимое повышение АД, прием КОК следует прекратить и начать лечение артериальной гипертензии. Прием КОК может быть продолжен, если с помощью гипотензивной терапии достигнуты нормальные значения АД.
Следующие состояния, как сообщалось, развиваются или ухудшаются, как во время беременности, так и при приеме КОК, но их связь с приемом КОК не доказана: холестатическая желтуха и/или зуд, связанный с холестазом; формирование камней в желчном пузыре; порфирия; системная красная волчанка; гемолитико-уремический синдром; хорея Сиденгама; герпес во время беременности; потеря слуха, связанная с отосклерозом. Также описаны случаи болезни Крона и язвенного колита на фоне применения КОК.
У женщин с наследственными формами ангионевротического отека экзогенные эстрогены могут вызывать или ухудшать симптомы ангионевротического отека.
Острые или хронические нарушения функции печени могут потребовать отмены КОК до тех пор, пока показатели функции печени не вернутся в норму. Рецидив холестатической желтухи, развившейся впервые во время предшествующей беременности или предыдущего приема половых гормонов, требует прекращения приема КОК.
Хотя КОК могут оказывать влияние на инсулинорезистентность и толерантность к глюкозе, у пациенток с сахарным диабетом, применяющих низкодозированные КОК, как правило, коррекции дозы гипогликемических препаратов не требуется. Тем не менее, женщины с сахарным диабетом должны тщательно наблюдаться во время приема КОК.
Иногда может развиваться хлоазма, особенно у женщин с наличием в анамнезе хлоазмы беременных. Женщины со склонностью к хлоазме во время приема КОК должны избегать длительного пребывания на солнце и воздействия ультрафиолетового излучения.
Влияние на показатели функции печени
При проведении клинических исследований с участием пациенток, получающих курс терапии вирусного гепатита С (комбинацию лекарственных препаратов, содержащих омбитасвир, паритапревир, ритонавир, дасабувир в сочетании с рибавирином или без) повышение активности АЛТ более чем в 5 раз выше ВГН было зарегистрировано чаще у пациенток, применяющих этинилэстрадиолсодержащие КОК.
В случае необходимости проведения курса терапии данной комбинацией препаратов пациентка, применяющая комбинацию дроспиренон + этинилэстрадиол, должна быть переведена на альтернативные методы контрацепции (негормональные или контрацептивы, содержащие только гестаген) до начала лечения. Возобновить прием комбинации дроспиренон + этинилэстрадиол можно не раньше, чем через 2 недели после окончания курса терапии противовирусными препаратами.
Лабораторные тесты
Применение таких препаратов как дроспиренон + этинилэстрадиол может влиять на результаты некоторых лабораторных тестов, включая биохимические показатели функции печени, щитовидной железы, почек и надпочечников, концентрацию транспортных протеинов в плазме крови (например, транскортина, фракции липидов/липопротеидов, параметры углеводного метаболизма, коагуляции и фибринолиза). Эти изменения, как правило, остаются в пределах нормальных физиологических значений.
Дроспиренон увеличивает активность ренина плазмы и концентрацию альдостерона, что связано с его антиминералокортикоидным эффектом.
Снижение эффективности
Эффективность КОК может быть снижена в следующих случаях: в случае пропуска таблеток, желудочно-кишечных расстройств или в результате лекарственного взаимодействия.
Влияние на характер кровотечения
На фоне приема КОК могут отмечаться нерегулярные кровотечения («мажущие» кровянистые выделения и/или «прорывные» кровотечения), особенно в течение первых месяцев применения. Поэтому оценка любых нерегулярных кровотечений должна проводиться только после периода адаптации, составляющего приблизительно три цикла приема препарата.
Если нерегулярные кровотечения повторяются или развиваются после предшествующих регулярных циклов, следует провести тщательное обследование для исключения злокачественных новообразований или беременности.
У некоторых женщин во время перерыва в приеме таблеток может не развиться кровотечение «отмены». Если препарат принимался согласно рекомендациям, маловероятно, что женщина беременна. Тем не менее, если режим приема препарата нарушался, или если отсутствуют подряд два кровотечения «отмены», до продолжения его приема должна быть исключена беременность.
Медицинские осмотры
Перед началом или возобновлением приема препарата дроспиренон + этинилэстрадиол необходимо ознакомиться с анамнезом жизни и семейным анамнезом женщины, провести тщательное общемедицинское (включая измерение АД, определение ИМТ) и гинекологическое обследование (с обязательным обследованием молочных желез и цитологическим исследованием эпителия шейки матки), исключить беременность. Объем дополнительных исследований и частота контрольных осмотров определяется индивидуально. Обычно контрольные обследования следует проводить не реже 1 раза в 6 месяцев.
Необходимо помнить, что препарат не предохраняет от ВИЧ-инфекции (СПИД) и других заболеваний, передающихся половым путем.
Следует прекратить прием таблеток и немедленно проконсультироваться с врачом, если имеются возможные признаки тромбоза, инфаркта миокарда или инсульта: необычный кашель; необычно сильная боль за грудиной, отдающая в левую руку; неожиданно возникающая одышка, необычная, сильная и длительная головная боль или приступ мигрени; частичная или полная потеря зрения или двоение в глазах; нечленораздельная речь; внезапные изменения слуха, обоняния или вкуса; головокружение или обморок; слабость или потеря чувствительности в любой части тела; сильная боль в животе; сильная боль в нижней конечности или внезапно возникший отек любой из нижних конечностей.
Влияние на способность к управлению транспортными средствами и механизмами
Исследований влияния приема препарата на способность к управлению транспортными средствами и механизмами не проводилось.
Не выявлено никакого влияния на способность к управлению транспортными средствами и механизмами при приеме КОК.
Передозировка
О серьезных нарушениях при передозировке не сообщалось. На основании суммарного опыта применения КОК симптомы, которые могут отмечаться при передозировке: тошнота, рвота и кровотечение «отмены». Последнее может возникать у девочек, не достигших возраста менархе, при приеме препарата по неосторожности.
Лечение: специфического антидота нет. Следует проводить симптоматическое лечение.
Лекарственное взаимодействие
Влияние других лекарственных средств на комбинацию дроспиренон + этинилэстрадиол
Возможно взаимодействие с лекарственными средствами, индуцирующими микросомальные ферменты печени, в результате чего может увеличиваться клиренс половых гормонов, что в свою очередь, может приводить к «прорывным» маточным кровотечениям и/или снижению контрацептивного эффекта.
Индукция микросомальных ферментов печени может наблюдаться уже через несколько дней совместного применения и может сохраняться в течение 4 недель после отмены препарата-индуктора. Максимальная индукция ферментов обычно наблюдается в течение нескольких недель.
Женщинам, которые получают терапию препаратами-индукторами микросомальных ферментов печени одновременно с препаратом дроспиренон + этинилэстрадиол, следует временно использовать барьерный метод контрацепции или выбрать другой негормональный метод контрацепции. Барьерный метод контрацепции следует использовать в течение всего периода терапии препаратом-индуктором микросомальных ферментов и еще в течение 28 дней после его отмены.
Если применение препарата-индуктора продолжается после приема последней таблетки препарата дроспиренон + этинилэстрадиол из текущей упаковки, следует начинать прием таблеток из новой упаковки без обычного перерыва в приеме таблеток.
Для женщин, которым требуется длительная терапия такими препаратами, целесообразно рассмотреть другой надежный негормональный метод контрацепции.
Вещества, увеличивающие клиренс комбинации дроспиренон + этинилэстрадиол (ослабляющие эффективность путем индукции ферментов)
Фенитоин, барбитураты, примидон, карбамазепин, рифампицин, ритонавир, невирапин и лекарственные средства, используемые для лечения ВИЧ-инфекции (эфавиренз), и, возможно, также окскарбазепин, топирамат, фелбамат, гризеофульвин, а также препараты, содержащие зверобой продырявленный (Hypericum perforatum).
Вещества с различным влиянием на клиренс комбинации дроспиренон + этинилэстрадиол
При совместном применении с препаратом дроспиренон + этинилэстрадиол многие ингибиторы протеаз ВИЧ или вируса гепатита С и ненуклеозидные ингибиторы обратной транскриптазы могут как увеличивать, так и уменьшать концентрацию эстрогена или гестагена в плазме крови. В некоторых случаях это влияние может быть клинически значимо. В период терапии такими препаратами женщина должна дополнительно использовать барьерный метод контрацепции.
Вещества, снижающие клиренс КОК (ингибиторы ферментов)
Сильные и средней степени активности ингибиторы изофермента CYP3A4, такие как азольные антимикотики (например, итраконазол, вориконазол, флуконазол), верапамил, макролиды (например, кларитромицин, эритромицин), дилтиазем и грейпфрутовый сок могут повышать плазменные концентрации эстрогена или прогестагена, или их обоих.
Эторикоксиб в дозах 60 и 120 мг/сут при совместном приеме с КОК, содержащими 0.035 мг этинилэстрадиола, повышает концентрацию этинилэстрадиола в плазме крови в 1.4 и 1.6 раза соответственно.
Влияние комбинации дроспиренон + этинилэстрадиол на другие лекарственные препараты
КОК могут влиять на метаболизм других препаратов, что приводит к повышению (например, циклоспорина) или снижению (например, ламотриджина) их концентрации в плазме крови и тканях.
In vitro дроспиренон является слабым или средней степени активности ингибитором изоферментов системы цитохрома Р450 — CYP1A1, CYP2C9, CYP2C19 и CYP3A4.
На основании исследований взаимодействия in vivo у женщин-добровольцев, принимавших омепразол, симвастатин и мидазолам в качестве маркерных субстратов, можно заключить, что клинически значимое влияние 3 мг дроспиренона на метаболизм лекарственных препаратов, опосредованный ферментами цитохрома Р450, маловероятно.
In vitro этинилэстрадиол является обратимым ингибитором изоферментов CYP2C19, CYP1A1 и CYP1A2, а также необратимым ингибитором изоферментов CYP3A4/5, CYP2C8 и CYP2J2. В клинических исследованиях применение гормонального контрацептива, содержащего этинилэстрадиол, не приводило к какому-либо повышению или приводило лишь к небольшому повышению концентраций субстратов изофермента CYP3A4 в плазме крови (например, мидазолама); концентрации субстратов изофермента CYP1A2 в плазме крови могут возрастать незначительно (например, теофиллина) или умеренно (например, мелатонина и тизанидина).
Фармакодинамическое взаимодействие
Было показано, что совместное применение этинилэстрадиолсодержащих препаратов с противовирусными препаратами прямого действия, содержащим омбитасвир, паритапревир, ритонавир, дасабувир или их комбинацию, ассоциируется с повышением концентрации АЛТ в сравнении с ВГН у здоровых и инфицированных вирусом гепатита С женщин.
У пациенток с нормальной функцией почек сочетанное применение дроспиренона и ингибиторов АПФ или НПВП не оказывает значимого эффекта на концентрацию калия в плазме крови.
Одновременное применение комбинации дроспиренон + этинилэстрадиол с антагонистами альдостерона или калийсберегающими диуретиками не изучено. При совместном приеме с данными препаратами концентрацию калия в плазме крови необходимо контролировать в течение первого цикла приема.
Условия хранения препарата Мидиана®
Препарат следует хранить в недоступном для детей месте, в оригинальной упаковке (блистер в пачке) для того, чтобы защитить от света, при температуре не выше 25°С.
Срок годности препарата Мидиана®
Срок годности — 3 года. Не применять по истечении срока годности, указанного на упаковке.
Условия реализации
Препарат отпускают по рецепту.
Контакты для обращений
ГЕДЕОН РИХТЕР ОАО
(Венгрия)

|
|
ГЕДЕОН РИХТЕР ОАО Организация, принимающая претензии от потребителей |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Аналоги препарата
Анабелла®
(САНОФИ РОССИЯ, Россия)
Видора®
(ZENTIVA, Чешская Республика)
Видора® микро
(ZENTIVA, Чешская Республика)
Делсия®
(SUN PHARMACEUTICAL INDUSTRIES, Индия)
Джейна®
(SUN PHARMACEUTICAL INDUSTRIES, Индия)
Джес®
(BAYER, Германия)
Димиа®
(GEDEON RICHTER, Венгрия)
Изнель 30
(LUPIN, Индия)
Лея®
(САНОФИ РОССИЯ, Россия)
Модэлль® ПРО
(Teva Pharmaceutical Industries, Израиль)
Все аналоги
При наличии любого из перечисленных ниже состояний или факторов риска с женщиной следует обсудить целесообразность применения препарата Мидиана.
В случае ухудшения состояния или при впервые выявленном эпизоде возникновения любого из этих состояний или факторов риска женщину следует уведомить о необходимости обращения к своему лечащему врачу для решения вопроса о дальнейшем применении препарата Мидиана.
Нарушения со стороны системы кровообращения
Риск возникновения венозной тромбоэмболии (ВТЭ)
На фоне применения любого комбинированного гормонального контрацептива (КГК) увеличивается риск развития венозной тромбоэмболии (ВТЭ) по сравнению с отсутствием лечения. Применение препаратов, содержащих левоноргестрел, норгестимат или норэтистерон, связано с наименьшим риском возникновения ВТЭ. Для других препаратов, например, Мидиана, данный риск может быть в два раза выше. Решение о применении препарата, не относящегося к группе препаратов с наименьшим риском развития ВТЭ, должно быть принято только после обсуждения с женщиной в доступной для нее форме риска возникновения ВТЭ на фоне применения препарата Мидиана, влияния имеющихся у нее факторов риска на уровень данного риска и уведомления о том, что риск возникновения ВТЭ является самым высоким в первый год применения препарата. Имеются данные, указывающие на то, что риск увеличивается при повторном применении КГК после перерыва продолжительностью от 4 недель и более.
Среди женщин, не применяющих КГК и не являющихся беременными, частота возникновения ВТЭ составляет приблизительно 2 случая на 10 000 женщин в год. Однако у любой отдельно взятой женщины уровень риска может быть значительно выше, в зависимости от имеющихся у нее основных факторов риска (см. ниже).
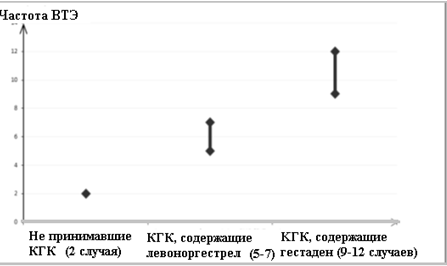
Согласно оценкам, частота развития ВТЭ среди женщин, применяющих КГК, содержащие дроспиренон, составляет 9-12 случаев на 10 000 женщин в год, что сопоставимо с 6 случаями у женщин, применяющих КГК, содержащие левоноргестрел.
В обоих случаях зарегистрированное количество случаев ВТЭ в год меньше ожидаемого количества случаев во время беременности или в послеродовом периоде.
В 1-2% случаев ВТЭ заканчивается летальным исходом.
Количество зарегистрированных явлений ВТЭ на 10 000 женщин в год
По вертикали — число зарегистрированных случаев ВТЭ на 10 000 женщин в год.
По горизонтали — женщины, не использующие КГК, использующие левоноргестрел-содержащие КГК, использующие дроспиренон-содержащие КГК.
Среди женщин, применявших КГК, были описаны крайне редкие случаи тромбоза других кровеносных сосудов, например, печеночных, мезентериальных, почечных или ретинальных вен и артерий.
Факторы риска развития ВТЭ
На фоне применения КГК риск развития венозных тромбоэмболических осложнений может значительно увеличиваться у женщин с дополнительными факторами риска, в особенности при наличии множественных факторов риска (см. таблицу).
Препарат Мидиана противопоказан женщинам с наличием множественных факторов риска, на основании которых ее можно отнести в группу высокого риска развития венозного тромбоза (см. раздел «Противопоказания»). При наличии у женщины нескольких факторов риска возможно, что увеличение риска больше, чем сумма отдельных факторов, и в этом случае следует учитывать общий риск развития ВТЭ. КГК не следует назначать, если соотношение польза/риск оценивается как отрицательное (см. раздел «Противопоказания»).
Таблица: Факторы риска развития ВТЭ
| Фактор риска | Комментарий |
| Ожирение (индекс массы тела свыше 30 кг/м2) | Значительное увеличение риска при повышении ИМТ.Особенно важно при наличии дополнительных факторов риска. |
| Длительная иммобилизация (включая авиаперелеты продолжительностью более4 часов), обширное хирургическое вмешательство, любое хирургическое вмешательство на нижних конечностях или органах малого таза, нейрохирургическое вмешательство или обширная травма | В этих ситуациях рекомендуется прекратить применение пластыря/мини-пили/вагинального кольца (в случае плановой операции, по крайней мере, за четыре недели до нее) и не возобновлять применение в течение двух недель после окончания иммобилизации. Для того чтобы избежать нежелательной беременности, следует использовать другой метод контрацепции.В том случае, если препарат Мидиана не был своевременно отменен, следует назначить антитромботическое лечение. |
| Примечание: временная иммобилизация, включая авиаперелеты продолжительностью более 4 часов, также может быть фактором риска развития ВТЭ, в особенности у женщин с наличием других факторов риска | |
| Отягощенный семейный анамнез (случаи венозной тромбоэмболии у братьев, сестер или родителей, особенно в относительно раннем возрасте, например моложе 50 лет). | При подозрении на наследственную предрасположенность до назначения КГК женщину следует направить на консультацию к соответствующему специалисту. |
| Другие заболевания, связанные с ВТЭ | Рак, системная красная волчанка, гемолитико-уремический синдром, хроническое воспалительное заболевание кишечника (болезнь Крона или неспецифический язвенный колит) и серповидно-клеточная анемия |
| Возраст | В особенности старше 35 лет |
He достигнуто единого мнения относительно возможной роли варикозного расширения вен и поверхностного тромбофлебита в возникновении или прогрессировании венозного тромбоза.
Следует учитывать повышенный риск развития тромбоэмболии при беременности и в особенности в первые 6 недель послеродового периода (для получения информации о применении во время беременности и в период грудного вскармливания см. раздел «Применение при беременности и в период грудного вскармливания»).
Симптомы ВТЭ (тромбоз глубоких вен и тромбоэмболия легочной артерии)
При возникновении соответствующих симптомов женщине необходимо в срочном порядке обратиться за медицинской помощью, при этом следует уведомить медицинского работника о том, что она применяет КГК.
Симптомами тромбоза глубоких вен (ТГВ) могут быть:
односторонняя отечность нижней конечности и/или стопы или наличие отечности по ходу вены на нижней конечности;
боль или болезненность в нижней конечности, которая может ощущаться только при стоянии или ходьбе;
повышение температуры пораженной нижней конечности; покраснение или изменение цвета кожи нижней конечности.
Симптомами тромбоэмболии легочной артерии (ТЭЛА) могут быть:
внезапное возникновение необъяснимой одышки или учащенного дыхания;
внезапный кашель, который может быть связан с кровохарканьем;
острая боль в груди;
выраженное головокружение;
частый или нерегулярный пульс.
Некоторые из этих симптомов (например, одышка, кашель) являются неспецифичными и по этой причине могут быть неверно интерпретированы как более распространенные или менее тяжелые явления (например, Инфекции дыхательных путей).
Другими признаками окклюзии сосудов могут быть: внезапная боль, отечность и незначительное посинение конечности.
При окклюзии сосудов сетчатки возникающие симптомы могут варьировать от нечеткости зрения без болевых ощущений до прогрессирующей потери зрения. Иногда может отмечаться резкая потеря зрения.
Риск развития артериальной тромбоэмболии (АТЭ)
В эпидемиологических исследованиях было установлено, что применение КГК связано с высоким риском развития артериальной тромбоэмболии (инфаркт миокарда) или цереброваскулярного заболевания (например, транзиторной ишемической атаки, инсульта). Артериальные тромбоэмболические осложнения могут приводить к смертельному исходу.
Факторы риска развития АТЭ
Риск развития артериальных тромбоэмболических осложнений или нарушения мозгового кровообращения на фоне применения КГК увеличивается при наличии факторов риска (см. таблицу). Препарат Мидиана противопоказан женщинам с наличием одного серьезного или множественных факторов риска развития АТЭ, на основании которых ее можно отнести в группу высокого риска развития артериального тромбоза (см. раздел «Противопоказания»). При наличии у женщины нескольких факторов риска возможно, что увеличение риска больше, чем сумма отдельных факторов, и в этом случае следует учитывать величину общего риска. КГК не следует назначать, если соотношение польза/риск оценивается как отрицательное (см. раздел «Противопоказания»).
Таблица: Факторы риска развития АТЭ
| Фактор риска | Комментарий |
| Возраст | В особенности старше 35 лет |
| Курение | Женщинам следует рекомендовать отказаться от курения в случае их желания применять КГК. Женщинам старше 35 лет, продолжающим курить, следует настоятельно рекомендовать другой метод контрацепции. |
| Артериальная гипертензия | |
| Ожирение (индекс массы тела свыше 30 кг/м2) | Значительное увеличение риска при повышении ИМТ.Особенно важно при наличии дополнительных факторов риска. |
| Отягощенный семейный анамнез (случаи артериальной тромбоэмболии у братьев, сестер или родителей, особенно в относительно раннем возрасте, например, моложе 50 лет). | При подозрении на наследственную предрасположенность до назначения КГК женщину следует направить на консультацию к соответствующему специалисту. |
| Мигрень | Увеличение частоты или тяжести мигрени во время использования КГК (что может предшествовать цереброваскулярным нарушениям) может быть основанием для немедленного прекращения приема этих препаратов. |
| Другие заболевания, связанные с нежелательными сосудистыми явлениями. | Сахарный диабет, гипергомоцистеинемия, клапанный порок сердца и фибрилляция предсердий, дислипопротеинемия и системная красная волчанка. |
Симптомы АТЭ
При возникновении соответствующих симптомов женщине необходимо в срочном порядке обратиться за медицинской помощью, при этом следует уведомить медицинского работника о том, что она применяет КГК.
Симптомами острого нарушения мозгового кровообращения могут быть:
внезапное онемение или слабость мышц лица, верхних или нижних конечностей, в особенности на одной стороне тела;
резкое нарушение походки, появление головокружения, нарушение равновесия или координации;
внезапное проявление спутанности сознания, нарушения речи или ее понимания; резкое нарушение зрения на один или оба глаза;
резкое появление тяжелой или продолжительной головной боли без известной причины;
потеря сознания или обморок с или без приступа судорог.
Проходящие симптомы указывают на то, что данное явление является транзиторной ишемической атакой (ТИА).
Симптомами ИМ могут быть:
боль, дискомфорт, чувство давления, тяжести, сжатия или распирания в грудной клетке, верхней конечности или ниже грудины;
дискомфорт, иррадиирующий в спину, нижнюю челюсть, горло, руку, желудок;
ощущение переполнения желудка, нарушения пищеварения или удушье;
потливость, тошнота, рвота или головокружение;
состояние крайней слабости, тревожность или одышка;
частый или нерегулярный пульс.
Наличие одного из серьезных факторов риска или множественных факторов риска заболевания артерий или вен соответственно может также быть противопоказанием. Следует рассмотреть возможность проведения антикоагулянтной терапии. Женщины, применяющие КГК, должны немедленно обращаться к врачу при возникновении симптомов возможного тромбоза. В случаях подозрения на тромбоз или подтвержденного тромбоза применение КГК необходимо прекратить. Необходимо подобрать адекватный метод контрацепции вследствие тератогенности антикоагулянтной терапии (кумарины).
Следует учитывать повышенный риск развития тромбоэмболии в послеродовом периоде (для получения дополнительной информации см. раздел «Применение при беременности и в период грудного вскармливания»).
Другие заболевания, которые связаны с тяжелой сосудистой патологией, включают сахарный диабет, системную красную волчанку, гемолитико-уремический синдром, хронические воспалительные заболевания кишечника (болезнь Крона или неспецифический язвенный колит) и серповидно-клеточную анемию.
Увеличение частоты или тяжести мигрени во время использования КГК (что может предшествовать цереброваскулярным нарушениям) может быть основанием для немедленного прекращения приема КГК.
Опухоли
Самым значительным фактором риска развития рака шейки матки является наличие инфекции, вызванной вирусом папилломы человека (ВПЧ). В некоторых эпидемиологических исследованиях сообщалось о повышенном риске развития рака шейки матки при длительном применении КГК (более 5 лет), однако сохраняются противоречивые мнения относительно того, в какой степени эти находки относятся к сопутствующим факторам, например, исследованию на наличие рака шейки матки или использованию барьерных методов контрацепции.
Мета-анализ данных 54 эпидемиологических исследований продемонстрировал, что имеется несколько повышенный относительный риск (RR=1,24) развития рака молочной железы, диагностированного у женщин, которые на момент исследования использовали КГК. Избыточный риск постепенно снижается в течение 10 лет после прекращения применения КГК. Поскольку рак молочной железы редко встречается у женщин моложе 40 лет, увеличение в последние годы количества случаев выявления рака молочной железы среди женщин, применявших ранее или применяющих в настоящее время КГК, является небольшим по отношению к общему риску развития рака молочной железы. Эти исследования не подтверждают наличия причинно-следственной связи между применением КГК и развитием рака молочной железы. Наблюдаемое повышение риска может быть следствием более ранней диагностики рака молочной железы у женщин, применяющих КГК, биологическим эффектом КГК или сочетанием обоих вариантов.
Среди женщин, когда-либо применявших КГК, была отмечена тенденция к меньшей выраженности клинических проявлений диагностированных случаев рака молочной железы, чем у женщин, никогда не использовавших КГК.
В редких случаях на фоне применения КГК наблюдалось развитие доброкачественных опухолей печени, а в еще более редких — злокачественных. В отдельных случаях эти опухоли вызывали опасное для жизни внутрибрюшное кровотечение. При дифференциальной диагностике опухоль печени нужно учитывать при появлении у женщины, применяющей КГК, сильной боли в верхних отделах живота, увеличении печени или признаках внутрибрюшного кровотечения.
Злокачественные опухоли могут быть опасными для жизни или приводить к смертельному исходу.
Другие состояния
Прогестероновый компонент препарата Мидиана является антагонистом альдостерона, обладающим калийсберегающими свойствами. В большинстве случаев не отмечается увеличения содержания калия в сыворотке крови. Тем не менее в клиническом исследовании у некоторых пациенток с легкими или умеренно выраженными нарушениями функции почек и сопутствующим применением калийсберегающих лекарственных препаратов при приеме дроспиренона происходило небольшое увеличение содержания калия в сыворотке крови. Таким образом, рекомендуется контролировать содержание калия в сыворотке крови в первом цикле приема препарата у пациенток с почечной недостаточностью и у пациенток со значениями содержания калия до лечения на уровне верхней границы нормы, а также в случаях одновременного назначения лекарственных препаратов, задерживающих калий в организме. Также см. раздел «Взаимодействие с другими лекарственными средствами».
У женщин с гипертриглицеридемией или семейным анамнезом данного нарушения нельзя исключить повышение риска развития панкреатита во время применения КГК.
Хотя небольшое повышение артериального давления было описано у многих женщин, применяющих КГК, клинически значимые повышения отмечались редко. Только в этих редких случаях оправдано немедленное прекращение применения КГК. Если во время применения КГК в случаях предшествующей артериальной гипертензии значения артериального давления постоянно повышены или значительно повышенное артериальное давление адекватно не отвечает на гипотензивную терапию, КГК следует отменить. При необходимости применение КГК может быть продолжено, если на фоне проведения гипотензивной терапии достигаются нормальные значения артериального давления.
Было отмечено, что следующие состояния развиваются или течение их усугубляется как во время беременности, так и на фоне применения КГК, однако их связь с применением КГК не доказана: желтуха и/или зуд, связанный с холестазом; конкременты желчного пузыря; порфирия; системная красная волчанка; гемолитико-уремический синдром; хорея Сиденгама; герпес беременных; потеря слуха, связанная с отосклерозом.
У женщин с наследственным ангионевротическим отеком экзогенные эстрогены могут вызывать или усиливать симптомы ангионевротического отека.
Острые или хронические нарушения функции печени могут потребовать прекращения использования КГК до тех пор, пока показатели функции печени не вернутся к норме.
Рецидивирующая холестатическая желтуха и/или вызванный холестазом зуд, которые развиваются впервые во время беременности или предыдущего приема половых гормонов, требуют прекращения применения КГК.
Хотя КГК могут оказывать влияние на периферическую резистентность к инсулину и толерантность к глюкозе, нет необходимости изменения терапевтического режима у пациенток с сахарным диабетом, использующих низкодозированные КГК (содержащие < 0,05 мг этинилэстрадиола). Тем не менее женщины с сахарным диабетом должны тщательно наблюдаться врачом, особенно в начале применения КГК.
Также сообщалось об усугублении течения эндогенной депрессии, эпилепсии, болезни Крона и неспецифического язвенного колита при использовании КГК.
Иногда может развиваться хлоазма, особенно у женщин, имевших хлоазму беременных в анамнезе. Женщины со склонностью к развитию хлоазмы во время применения КГК должны избегать длительного пребывания на солнце или воздействия ультрафиолетового излучения.
В одной таблетке препарата Мидиана содержится 48,17 мг лактозы моногидрата. Препарат не следует принимать пациенткам с редкими наследственными заболеваниями, такими как непереносимость лактозы, или нарушением всасывания глюкозы-галактозы.
В одной таблетке этого лекарственного препарата содержится 0,070 мг соевого лецитина. Данный препарат не следует принимать пациенткам с гиперчувствительностью к арахису или сое.
Медицинское обследование/консулътация
До начала применения или повторного назначения препарата Мидиана следует провести тщательный сбор анамнеза (включая семейный анамнез) и исключить беременность. Следует измерить артериальное давление, провести объективное обследование, руководствуясь информацией о противопоказаниях (см. раздел «Противопоказания») и особых указаниях и мерах предосторожности (см. раздел «Меры предосторожности»). Важно обратить внимание женщин на риск возникновения венозного и артериального тромбоза, включая риск применения препарата Мидиана по сравнению с другими КГК, на симптомы ВТЭ и АТЭ, а также на установленные факторы риска и предпринимаемые действия в случае подозрения на развитие тромбоза.
Необходимо, чтобы женщина внимательно прочла Инструкцию по медицинскому применению лекарственного средства и следовала представленным в ней рекомендациям. Частота и вид осмотров должны основываться на разработанных практических рекомендациях с их адаптацией для каждой конкретной женщины.
Следует предупредить женщину, что пероральные контрацептивы не предохраняют от ВИЧ-инфекции (СПИД) и других заболеваний, передающихся половым путем.
Снижение эффективности
Эффективность КГК может снижаться в случае пропуска таблеток, расстройств со стороны желудочно-кишечного тракта или при сопутствующем применении других лекарственных препаратов.
Контроль уменьшенного цикла
На фоне приема КГК могут отмечаться нерегулярные кровотечения (мажущие кровянистые выделения или прорывные кровотечения), особенно в течение первых месяцев использования. По этой причине оценка любых нерегулярных кровотечений является значимой только после периода адаптации, составляющего приблизительно три цикла.
Если нерегулярные кровотечения повторяются или развиваются после предшествующих регулярных циклов, следует исключить негормональные причины с проведением соответствующих диагностических мероприятий для исключения злокачественных новообразований или беременности. Они могут включать диагностическое выскабливание.
У некоторых женщин кровотечение «отмены» может не развиваться во время перерыва в приеме пероральных контрацептивов. Если КГК принимались согласно указаниям, описанным в разделе «Способ применения и дозы», то маловероятно, что у женщины наступит беременность. Тем не менее если до первого отсутствия кровотечения «отмены» КГК принимались не в соответствии с инструкцией или отсутствуют подряд два кровотечения «отмены», то до продолжения приема КГК должна быть исключена беременность.
Влияние на способность к управлению транспортными средствами и на работу с механизмами
Исследования по изучению влияния на способность управлять транспортными средствами и механизмами не проводились.
При наличии любого из перечисленных ниже состояний или факторов риска с женщиной следует обсудить целесообразность применения препарата Мидиана®.
В случае ухудшения состояния или при впервые выявленном эпизоде возникновения любого из этих состояний или факторов риска женщину следует уведомить о необходимости обращения к лечащему врачу для решения вопроса о дальнейшем применении препарата Мидиана®.
В случае возможного или подтвержденного венозного или артериального тромбоза показана отмена комбинированного гормонального контрацептива. В случае назначения антикоагулянтной терапии необходимо назначение альтернативного контрацептивного средства в связи с тератогенной активностью антикоагулянтной терапии (кумаринов).
Риск возникновения венозной тромбоэмболии (ВТЭ)
На фоне применения любого комбинированного гормонального контрацептива увеличивается риск развития ВТЭ по сравнению с отсутствием лечения. Применение препаратов, содержащих левоноргестрел, норгестимат или норэтистерон, связано с наименьшим риском возникновения ВТЭ. Для других препаратов, например, Мидиана®, данный риск может быть в 2 раза выше. Решение о применении препарата, не относящегося к группе препаратов с наименьшим риском развития ВТЭ, должно быть принято только после обсуждения с женщиной в доступной для нее форме риска возникновения ВТЭ на фоне применения препарата Мидиана®, влияния имеющихся у нее факторов риска на уровень данного риска и уведомления о том, что риск возникновения ВТЭ является самым высоким в первый год применения препарата. Имеются данные, указывающие на то, что риск увеличивается при повторном применении комбинированного гормонального контрацептива после перерыва продолжительностью от 4 недель и более.
Среди женщин, не применяющих комбинированные гормональные контрацептивы и не являющихся беременными, частота возникновения ВТЭ составляет приблизительно 2 случая на 10 000 женщин в год. Однако у любой отдельно взятой женщины уровень риска может быть значительно выше, в зависимости от имеющихся у нее основных факторов риска (см. ниже).
Согласно оценкам1, частота развития ВТЭ среди женщин, применяющих комбинированные гормональные контрацептивы, содержащие дроспиренон, составляет 9-12 случаев на 10 000 женщин в год, что сопоставимо с 62 случаями у женщин, применяющих комбинированные гормональные контрацептивы, содержащие левоноргестрел.
В обоих случаях зарегистрированное количество случаев ВТЭ в год меньше ожидаемого количества случаев во время беременности или в послеродовом периоде.
В 1-2% случаев ВТЭ заканчивается летальным исходом.
Количество зарегистрированных явлений ВТЭ на 10 000 женщин в год
По вертикали – число зарегистрированных ВТЭ на 10 000 женщин в год.
По горизонтали – женщины, не использующие КГК, использующие левоноргестрел-содержащие КГК, использующие дроспиренон-содержащие КГК.
Среди женщин, применявших комбинированные гормональные контрацептивы, были описаны крайне редкие случаи тромбоза других кровеносных сосудов, например, печеночных, мезентериальных, почечных или ретинальных вен и артерий.
1 Показатели частоты были установлены на основании всей совокупности данных эпидемиологических исследований с использованием относительных рисков для различных препаратов по сравнению с комбинированными гормональными контрацептивами, содержащими левоноргестрел.
2 Медиана диапазона 5-7 случаев на 10 000 женщин основана на величине относительного риска, составляющего приблизительно 2.3-3.6 для комбинированных гормональных контрацептивов, содержащих левоноргестрел, по сравнению со случаями, не связанными с применением препаратов.
Факторы риска развития ВТЭ
На фоне применения комбинированных гормональных контрацептивов риск развития венозных тромбоэмболических осложнений может значительно увеличиваться у женщин с дополнительными факторами риска, в особенности при наличии множественных факторов риска (см. Таблицу 1).
Препарат Мидиана® противопоказан женщинам с наличием множественных факторов риска, на основании которых ее можно отнести к группе высокого риска развития венозного тромбоза. При наличии у женщины нескольких факторов риска возможно, что увеличение риска больше, чем сумма отдельных факторов, в этом случае следует учитывать общий риск развития ВТЭ. Комбинированные гормональные контрацептивы не следует назначать, если соотношение польза/риск оценивается как отрицательное (см. раздел «Противопоказания»).
Таблица 1. Факторы риска развития ВТЭ
| Фактор риска | Комментарий |
| Ожирение (ИМТ свыше 30 кг/м2) | Значительное увеличение риска при повышении ИМТ. Особенно важно при наличии дополнительных факторов риска. |
| Длительная иммобилизация (включая авиаперелеты продолжительностью более 4 ч), обширное хирургическое вмешательство, любое хирургическое вмешательство на нижних конечностях или органах малого таза, нейрохирургическое вмешательство или обширная травма. Примечание: временная иммобилизация, включая авиаперелеты продолжительностью более 4 ч, также может быть фактором риска развития ВТЭ, в особенности у женщин с наличием других факторов риска. |
В этих ситуациях рекомендуется прекратить применение пластыря/мини-пили/вагинального кольца (в случае плановой операции, по крайней мере, за 4 недели до нее) и не возобновлять применение в течение 2 недель после окончания иммобилизации. Для того чтобы избежать нежелательной беременности, следует использовать другой метод контрацепции. В том случае, если препарат Мидиана® не был своевременно отменен, следует назначить антитромботическое лечение. |
| Отягощенный семейный анамнез (случаи венозной тромбоэмболии у братьев, сестер или родителей, особенно в относительно раннем возрасте, например моложе 50 лет). | При подозрении на наследственную предрасположенность до назначения комбинированного гормонального контрацептива женщину следует направить на консультацию к соответствующему специалисту. |
| Другие заболевания, связанные с ВТЭ | Рак, системная красная волчанка, гемолитико-уремический синдром, хроническое воспалительное заболевание кишечника (болезнь Крона или неспецифический язвенный колит) и серповидно-клеточная анемия. |
| Возраст | В особенности старше 35 лет. |
Нет единого мнения относительно возможной роли варикозного расширения вен и поверхностного тромбофлебита в возникновении или прогрессировании венозного тромбоза.
Следует учитывать повышенный риск развития тромбоэмболии при беременности и в особенности в первые 6 недель послеродового периода (для получения информации о применении во время беременности и в период грудного вскармливания см. раздел «Беременность и лактация»).
Симптомы ВТЭ (тромбоз глубоких вен и тромбоэмболия легочной артерии)
При возникновении соответствующих симптомов женщине необходимо в срочном порядке обратиться за медицинской помощью, при этом следует уведомить медицинского работника о том, что она применяет комбинированный гормональный контрацептив.
Симптомы тромбоза глубоких вен (ТГВ):
— односторонняя отечность нижней конечности и/или стопы или наличие отечности по ходу вены на нижней конечности;
— боль или болезненность в нижней конечности, которая может ощущаться только в положении стоя или ходьбе;
— повышение температуры пораженной нижней конечности, покраснение или изменение цвета кожи нижней конечности.
Симптомы тромбоэмболии легочной артерии (ТЭЛА):
— внезапное возникновение необъяснимой одышки или учащенного дыхания;
— внезапный кашель, который может быть связан с кровохарканьем;
— острая боль в груди;
— выраженное головокружение;
— частый или нерегулярный пульс.
Некоторые из этих симптомов (например, одышка, кашель) являются неспецифичными и по этой причине могут быть неверно интерпретированы как более распространенные или менее тяжелые явления (например, инфекции дыхательных путей).
Другими признаками окклюзии сосудов могут быть: внезапная боль, отечность и незначительное посинение конечности.
При окклюзии сосудов сетчатки возникающие симптомы могут варьировать от нечеткости зрения без болевых ощущений до прогрессирующей потери зрения. Иногда может отмечаться резкая потеря зрения.
Риск развития артериальной тромбоэмболии (АТЭ)
В эпидемиологических исследованиях было установлено, что применение комбинированных гормональных контрацептивов связано с высоким риском развития артериальной тромбоэмболии (инфаркт миокарда) или цереброваскулярного заболевания (например, транзиторной ишемической атаки, инсульта). Артериальные тромбоэмболические осложнения могут приводить к смертельному исходу.
Факторы риска развития АТЭ
Риск развития артериальных тромбоэмболических осложнений или нарушения мозгового кровообращения на фоне применения комбинированных гормональных контрацептивов увеличивается при наличии факторов риска (см. Таблицу 2). Препарат Мидиана® противопоказан женщинам с наличием одного серьезного или множественных факторов риска развития АТЭ, на основании которых ее можно отнести к группе высокого риска развития артериального тромбоза (см. раздел «Противопоказания»). При наличии у женщины нескольких факторов риска возможно, что увеличение риска больше, чем сумма отдельных факторов, и в этом случае следует учитывать величину общего риска. Комбинированные гормональные контрацептивы не следует назначать, если соотношение польза/риск оценивается как отрицательное.
Таблица 2. Факторы риска развития АТЭ.
| Фактор риска | Комментарии |
| Возраст | В особенности старше 35 лет |
| Курение | Женщинам следует рекомендовать отказаться от курения в случае их желания применять комбинированные гормональные контрацептивы. Женщинам старше 35 лет, продолжающим курить, следует настоятельно рекомендовать другой метод контрацепции. |
| Артериальная гипертензия | |
| Ожирение (ИМТ свыше 30 кг/м2) | Значительное увеличение риска при повышении ИМТ. Особенно важно при наличии дополнительных факторов риска. |
| Отягощенный семейный анамнез (случаи артериальной тромбоэмболии у братьев, сестер или родителей, особенно в относительно раннем возрасте, например моложе 50 лет). | При подозрении на наследственную предрасположенность до назначения комбинированного гормонального контрацептива женщину следует направить на консультацию к соответствующему специалисту. |
| Мигрень | Увеличение частоты или тяжести мигрени во время использования комбинированных гормональных контрацептивов (что может предшествовать цереброваскулярным нарушениям) может быть основанием для немедленного прекращения приема этих препаратов. |
| Другие заболевания, связанные с нежелательными сосудистыми явлениями. | Сахарный диабет, гипергомоцистеинемия, клапанный порок сердца и фибрилляция предсердий, дислипопротеинемия и системная красная волчанка. |
Симптомы АТЭ
При возникновении соответствующих симптомов женщине необходимо в срочном порядке обратиться за медицинской помощью, при этом следует уведомить медицинского работника о том, что она применяет комбинированный гормональный контрацептив.
Симптомы острого нарушения мозгового кровообращения:
— внезапное онемение или слабость мышц лица, верхних или нижних конечностей, в особенности на одной стороне тела;
— резкое нарушение походки, появление головокружения, нарушение равновесия или координации;
— внезапное проявление спутанности сознания, нарушения речи или ее понимания;
— резкое нарушение зрения на один или оба глаза;
— резкое появление тяжелой или продолжительной головной боли без известной причины;
— потеря сознания или обморок с или без приступа судорог.
Проходящие симптомы указывают на то, что данное явление является транзиторной ишемической атакой (ТИА).
Симптомами инфаркта миокарда могут быть:
— боль, дискомфорт, чувство давления, тяжести, сжатия или распирания в грудной клетке, верхней конечности или ниже грудины;
— дискомфорт с иррадиацией в спину, нижнюю челюсть, горло, руку, желудок;
— ощущение переполнения желудка, нарушения пищеварения или удушье;
— потливость, тошнота, рвота или головокружение;
— состояние крайней слабости, тревожность или одышка;
— частый или нерегулярный пульс.
Опухоли
В некоторых эпидемиологических исследованиях сообщалось о повышенном риске развития рака шейки матки при длительном применении комбинированных гормональных контрацептивов (более 5 лет), однако сохраняются противоречивые мнения относительно того, в какой степени эти находки относятся к сопутствующим эффектам полового поведения и других факторов, например, инфицирования вирусом папилломы человека (ВПЧ).
Мета-анализ данных 54 эпидемиологических исследований продемонстрировал, что имеется несколько повышенный относительный риск (RR=1.24) развития рака молочной железы, диагностированного у женщин, которые на момент исследования применяли комбинированные гормональные контрацептивы. Избыточный риск постепенно снижается в течение 10 лет после прекращения применения комбинированных гормональных контрацептивов. Поскольку рак молочной железы редко встречается у женщин моложе 40 лет, увеличение в последние годы количества случаев выявления рака молочной железы среди женщин, применявших ранее или применяющих в настоящее время комбинированные гормональные контрацептивы, является небольшим по отношению к общему риску развития рака молочной железы. Эти исследования не подтверждают наличия причинно-следственной связи между применением комбинированных гормональных контрацептивов и развитием рака молочной железы. Наблюдаемое повышение риска может быть следствием более ранней диагностики рака молочной железы у женщин, применяющих комбинированные гормональные контрацептивы, биологическим эффектом комбинированных гормональных контрацептивов или сочетанием обоих вариантов.
Среди женщин, когда-либо применявших комбинированные гормональные контрацептивы, была отмечена тенденция к меньшей выраженности клинических проявлений диагностированных случаев рака молочной железы, чем у женщин, никогда не использовавших комбинированные гормональные контрацептивы.
В редких случаях на фоне применения комбинированных гормональных контрацептивов наблюдалось развитие доброкачественных опухолей печени, а в еще более редких — злокачественных. В отдельных случаях эти опухоли вызывали опасное для жизни внутрибрюшное кровотечение. При дифференциальной диагностике опухоль печени нужно учитывать при появлении у женщины, применяющей комбинированные гормональные контрацептивы, сильной боли в верхних отделах живота, увеличении печени или признаках внутрибрюшного кровотечения.
Прием высокодозированных комбинированных гормональных контрацептивов (0.05 мг этинилэстрадиола) снижает риск развития эндометриоидного рака и рака яичников. Применимость этого наблюдения к низкодозированным комбинированным гормональным контрацептивам требует подтверждения.
Злокачественные опухоли могут быть опасными для жизни или приводить к смертельному исходу.
Другие состояния
Депрессивное настроение и депрессия являются известной нежелательной реакцией при применении гормональных контрацептивов (см. раздел «Побочное действие»). Депрессия может быть серьезным расстройством и является известным фактором риска суицидального поведения и суицида. Женщинам следует посоветовать обратиться к своему врачу в случае появления изменений настроения и депрессивных симптомов, в том числе, вскоре после начала лечения.
Прогестероновый компонент препарата Мидиана® является антагонистом альдостерона, обладающим калийсберегающими свойствами. В большинстве случаев не отмечается увеличения содержания калия в сыворотке крови. Тем не менее, в клиническом исследовании у некоторых пациенток с легкими или умеренно выраженными нарушениями функции почек и сопутствующим применением калийсберегающих лекарственных препаратов при приеме дроспиренона происходило небольшое увеличение содержания калия в сыворотке крови. Таким образом, рекомендуется контролировать содержание калия в сыворотке крови в первом цикле приема препарата у пациенток с почечной недостаточностью и у пациенток со значениями содержания калия до лечения на уровне верхней границы нормы, а также в случаях одновременного назначения лекарственных препаратов, задерживающих калий в организме. Также см. раздел «Лекарственное взаимодействие».
У женщин с гипертриглицеридемией или семейным анамнезом данного нарушения нельзя исключить повышение риска развития панкреатита во время применения КОК.
Хотя небольшое повышение АД было описано у многих женщин, применяющих КОК, клинически значимые повышения отмечались редко. Только в этих редких случаях оправдано немедленное прекращение применения КОК. Если во время применения комбинированных гормональных контрацептивов в случаях предшествующей артериальной гипертензии значения АД постоянно повышены, или значительно повышенное АД не удается контролировать применением антигипертензивных препаратов, комбинированные гормональные контрацептивы следует отменить. При необходимости применение комбинированных гормональных контрацептивов может быть продолжено, если на фоне проведения гипотензивной терапии достигаются нормальные значения АД.
Было отмечено, что следующие состояния развиваются или течение их усугубляется как во время беременности, так и на фоне применения КОК, однако их связь с применением комбинированных гормональных контрацептивов не доказана: желтуха и/или зуд, связанный с холестазом; конкременты желчного пузыря; порфирия; системная красная волчанка; гемолитико-уремический синдром; хорея Сиденгама; герпес беременных; потеря слуха, связанная с отосклерозом.
У женщин с наследственным ангионевротическим отеком экзогенные эстрогены могут вызывать или усиливать симптомы ангионевротического отека.
Острые или хронические нарушения функции печени могут потребовать прекращения применения КОК до тех пор, пока показатели функции печени не вернутся к норме.
Рецидивирующая холестатическая желтуха и/или вызванный холестазом зуд, которые развиваются впервые во время беременности или предыдущего приема половых гормонов, требует прекращения применения комбинированных гормональных контрацептивов.
Хотя комбинированные гормональные контрацептивы могут оказывать влияние на периферическую резистентность к инсулину и толерантность к глюкозе, нет необходимости изменения терапевтического режима у пациенток с сахарным диабетом, использующих низкодозированные комбинированные гормональные контрацептивы (содержащие <0.05 мг этинилэстрадиола). Тем не менее, женщин с сахарным диабетом следует тщательно наблюдать, особенно в начале применения комбинированных гормональных контрацептивов.
Также сообщалось об усугублении течения эндогенной депрессии, эпилепсии, болезни Крона и неспецифического язвенного колита при применении комбинированных гормональных контрацептивов.
Иногда может развиваться хлоазма, особенно у женщин, имевших хлоазму беременных в анамнезе. Женщины со склонностью к развитию хлоазмы во время применения комбинированных гормональных контрацептивов должны избегать длительного пребывания на солнце или воздействия ультрафиолетового излучения.
Медицинское обследование
До начала применения или повторного назначения препарата Мидиана® следует провести тщательный сбор анамнеза (включая семейный анамнез) и исключить беременность. Следует измерить АД, провести объективное обследование, руководствуясь информацией о противопоказаниях (см. раздел «Противопоказания»), особых указаниях и мерах предосторожности. Важно обратить внимание женщин на риск возникновения венозного и артериального тромбоза, включая риск применения препарата Мидиана® по сравнению с другими комбинированными гормональными контрацептивами, на симптомы ВТЭ и АТЭ, а также на установленные факторы риска и предпринимаемые действия в случае подозрения на развитие тромбоза.
Необходимо, чтобы женщина внимательно прочитала Инструкцию по медицинскому применению лекарственного средства и следовала представленным в ней рекомендациям. Частота и вид осмотров должны основываться на разработанных практических рекомендациях с их адаптацией для каждой конкретной женщины.
Следует предупредить женщину, что пероральные контрацептивы не предохраняют от ВИЧ-инфекции (СПИД) и других заболеваний, передающихся половым путем.
Снижение эффективности
Эффективность комбинированных гормональных контрацептивов может снижаться в случае пропуска таблеток (см. раздел «Режим дозирования»), расстройств со стороны ЖКТ (см. раздел «Режим дозирования») или при сопутствующем применении других лекарственных препаратов (см. раздел «Лекарственное взаимодействие»).
Контроль уменьшенного цикла
На фоне приема КОК могут отмечаться нерегулярные кровотечения (мажущие кровянистые выделения или «прорывные» кровотечения), особенно в течение первых месяцев использования. По этой причине оценка любых нерегулярных кровотечений является значимой только после периода адаптации, составляющего приблизительно три цикла.
Если нерегулярные кровотечения повторяются или развиваются после предшествующих регулярных циклов, следует исключить негормональные причины с проведением соответствующих диагностических мероприятий для исключения злокачественных новообразований или беременности. Они могут включать диагностическое выскабливание.
У некоторых женщин кровотечение «отмены» может не развиваться во время перерыва в приеме пероральных контрацептивов. Если комбинированные гормональные контрацептивы принимались согласно указаниям, описанным в разделе «Режим дозирования», то маловероятно, что у женщины наступит беременность. Тем не менее, если до первого отсутствия кровотечения отмены комбинированные гормональные контрацептивы принимались не в соответствии с инструкцией или отсутствуют подряд два кровотечения отмены, то до продолжения приема комбинированного гормонального контрацептива следует исключить беременность.
Повышение активности АЛТ
В ходе клинических исследований с участием пациенток, получавших по поводу инфекции вируса гепатита С омбитасвир/паритапревир/ритонавир и дасабувир с рибавирином или без него повышение активности трансаминазы (АЛТ) более чем в 5 раз в сравнении с верхней границей нормы (ВГН) значительно чаще отмечалось у женщин, принимавших препараты, содержащие этинилэстрадиол, например, комбинированные гормональные контрацептивы (см. разделы «Противопоказания» и «Лекарственное взаимодействие»).
Вспомогательные вещества
В одной таблетке препарата Мидиана® содержится 48.17 мг лактозы моногидрата. Препарат не следует принимать пациенткам с редкими наследственными заболеваниями, такими как непереносимость лактозы, полной лактазной недостаточностью или нарушением всасывания глюкозы-галактозы.
В одной таблетке препарата Мидиана® содержится 0.070 мг соевого лецитина. Данный препарат не следует принимать пациенткам с гиперчувствительностью к арахису или сое.
Влияние на способность к вождению автотранспорта и управлению механизмами
Исследования по изучению влияния на способность управлять транспортными средствами и механизмами не проводились.
МНН: Дроспиренон, Этинилэстрадиол
Производитель: Гедеон Рихтер ОАО
Анатомо-терапевтическо-химическая классификация: Дроспиренон и эстроген
Номер регистрации в РК:
№ РК-ЛС-5№017396
Информация о регистрации в РК:
25.02.2016 — бессрочно
Номер регистрации в РБ:
9647/11/16
Информация о регистрации в РБ:
27.04.2016 — бессрочно
- Скачать инструкцию медикамента
Торговое название
Мидиана®
Международное непатентованное название
Нет
Лекарственная форма
Таблетки, покрытые пленочной оболочкой, 3 мг/0.03 мг
Состав
Одна таблетка содержит
активные вещества — дроспиренона кристаллического 3,000 мг и этинилэстрадиола микронизированного 0,030 мг
вспомогательные вещества: лактозы моногидрат, крахмал кукурузный, крахмал кукурузный прежелатинизированный, повидон K-25, магния стеарат
состав пленочного покрытия: Опадрай II. Белый (85G18490): спирт поливиниловый, титана диоксид (E 171), макрогол 3350, тальк, лецитин соевый.
Описание
Таблетки круглой формы, с двояковыпуклой поверхностью, покрытые пленочной оболочкой белого или почти белого цвета, с гравировкой «G63» на одной стороне и гладкие с другой стороны.
Фармакотерапевтическая группа
Половые гормоны и модуляторы половой системы. Гормональные контрацептивы для системного использования. Прогестагены и эстрогены (фиксированные комбинации). Дроспиренон и эстрогены.
Код АТХ G03AA12
Фармакологические свойства
Фармакокинетика
Дроспиренон (3 мг)
Всасывание
При пероральном приеме дроспиренон быстро и почти полностью абсорбируется. Максимальная концентрация активного вещества в сыворотке, равная 37 нг/мл, достигается через 1-2 часа после однократного приема. Во время одного цикла приема максимальная равновесная концентрация дроспиренона в сыворотке составляет около 60 нг/мл и достигается через 7-14 часов. Биодоступность колеблется от 76 до 85%. Прием пищи не влияет на биодоступность дроспиренона.
Распределение
После перорального приема наблюдается двухфазное снижение уровня препарата в сыворотке, которое характеризуется периодом полувыведения 1,6±0,7 часа и 27,0±7,5 часа, соответственно. Дроспиренон связывается с сывороточным альбумином и не связывается с глобулином, связывающим половые гормоны (sex hormone binding globulin, SHBG), или кортикостероид-связывающим глобулином (corticoid binding globulin, CBG). Только 3-5% от общей сывороточной концентрации активного вещества представляет собой свободный гормон. Индуцированное этинилэстрадиолом повышение SHBG не влияет на связывание дроспиренона белками сыворотки. Средний кажущийся объем распределения составляет 3,7±1,2 л/кг.
Биотрансформация
После перорального приема дроспиренон экстенсивно метаболизируется. Большинство метаболитов в плазме представлены кислотными формами дроспиренона, производными с открытым лактоновым кольцом, и 4,5-дигидро-дросперинон-3-сульфатом, которые образуются без вовлечения системы Р450. Дроспиренон метаболизируется при малом участии цитохрома Р450 3А4.
Элиминация
Скорость метаболического клиренса дроспиренона в сыворотке составляет 1,5±0,2 мл/мин/кг. Дроспиренон экскретируется только в следовых количествах в неизмененном виде. Метаболиты дроспиренона экскретируются с фекалиями и мочой в соотношении примерно 1,2:1,4. Период полувыведения для экскреции метаболитов с мочой и фекалиями составляет примерно 40 часов.
Равновесная концентрация
Во время одного цикла лечения максимальная равновесная концентрация дроспиренона в сыворотке (примерно 70 нг/мл) достигается через 7-14 часов. Отмечается 2-3-х кратное увеличение уровня дроспиренона. Дальнейшее увеличение сывороточной концентрации дроспиренона отмечается через 1 – 6 циклов приёма, после чего увеличения концентрации не наблюдается.
Этинилэстрадиол (30 мкг)
Всасывание
Этинилэстрадиол после перорального приема, быстро и полностью абсорбируется. Максимальная концентрация в сыворотке крови после однократного приема 30 мкг лекарственного средства достигается через 1-2 часа и составляет около 100 пг/мл. Этинилэстрадиол подвергается выраженному пресистемному метаболизму с большой индивидуальной вариабельностью. Абсолютная биодоступность составляет приблизительно 45%.
Распределение
Кажущийся объем распределения составляет около 5 л/кг, степень связывания с белками плазмы крови — около 98%. Этинилэстрадиол индуцирует синтез SHBG и CBG в печени. При ежедневном приеме 30 мкг этинилэстрадиола концентрация SHBG в плазме крови повышается с 70 до примерно 350 нмоль/л.
Этинилэстрадиол в небольших количествах проникает в грудное молоко (примерно 0,02% от дозы).
Биотрансформация
Этинилэстрадиол полностью метаболизируется. Скорость метаболического клиренса составляет 5 мл/мин/кг.
Выведение
Этинилэстрадиол практически не выводится в неизмененном виде. Метаболиты этинилэстрадиола экскретируются с мочой и желчью в соотношении 4:6. Период полувыведения метаболитов составляет примерно 1 день. Элиминационный период полувыведения составляет 20 часов.
Равновесная концентрация
Состояние равновесной концентрации достигается в течение второй половины цикла лечения, при этом концентрация этинилэстрадиола в сыворотке крови увеличиваетя приблизительно 1,4-2,1 раза.
Отдельные категории населения
Влияние на функцию почек
Равновесная концентрация дроспиренона в сыворотке крови у женщин с легким нарушением функции почек (клиренс креатинина (КК) = 50-80 мл/мин) была сопоставима с таковой у женщин с нормальной функцией почек (КК > 80 мл/мин). Концентрация дроспиренона в сыворотке крови в среднем была на 37% выше у женщин с умеренно выраженным нарушением функции почек (КК = 30-50 мл/мин) по сравнению с таковой у женщин с нормальной функцией почек. Терапия дроспиреноном хорошо переносилась женщинами, как с легким, так и умеренно выраженным нарушением функции почек.
Лечение дроспиреноном не оказало клинически значимого влияния на содержание калия в сыворотке крови.
Влияние на функцию печени
У женщин с умеренным нарушением функции печени (класс В по шкале Чайлд-Пью) кривая зависимости средней концентрации лекарственного средства в плазме крови от времени соответствовала таковой у женщин с нормальной функцией печени. Значения Cmax, наблюдаемые в фазе абсорбции и распределения, были одинаковыми. Во время окончания фазы распределения снижение концентрации дроспиренона было примерно в 1,8 раз выше у добровольцев с умеренным нарушением функции печени по сравнении с лицами с нормальной функцией печени.
В исследований однократного применения общий клиренс (CL/f) у добровольцев с умеренным нарушением функции печени был снижен примерно на 50% по сравнении с лицами с нормальной функцией печени.
Отмеченное снижение клиренса дроспиренона у добровольцев с умеренным нарушением функции печени не приводит к каким-либо значимым различиям в отношении содержания калия в сыворотке крови.
Даже при сахарном диабете и сопутствующем применении спиронолактона (два фактора, которые могут спровоцировать гиперкалиемию у пациента) не отмечалось увеличения содержания калия в сыворотке крови выше верхней границы нормы.
Можно сделать вывод о том, что комбинация дроспиренон/этинилэстрадиол хорошо переносится пациентами с умеренным нарушением функции печени (класс В по Чайлд-Пью).
Этнические группы
Фармакокинетика дроспиренона и этинилэстрадиола при одно- и многократном применении была изучена у молодых здоровых женщин европейского и японского происхождения.
Клинически значимых различий зарегистрировано не было.
Фармакодинамика
Контрацептивный эффект препарата основывается на взаимодействии различных факторов, наиболее важными из которых являются торможение овуляции и изменения эндометрия.
Мидиана® – это комбинированный пероральный контрацептив, содержащий этинилэстрадиол и прогестин — дроспиренон. В терапевтической дозе, дроспиренон также обладает антиандрогенным и слабым антиминералокортикоидным свойствами. Он лишен какой-либо эстрогенной, глюкокортикоидной и антиглюкокортикоидной активности. В результате этого фармакологический профиль дроспиренона практически полностью соответствует профилю естественного гормона прогестерона.
В клинических исследованиях получены данные указывающие на то, что слабые антиминералокортикоидные свойства приводят к достижению слабого антиминералокортикоидного эффекта.
Показания к применению
— пероральная контрацепция
Решение о назначении препарата Мидиана®, таблетки, покрытые пленочной оболочкой, следует принимать с учетом имеющихся факторов риска у каждой женщины, в особенности при наличии венозной тромбоэмболии (ВТЭ), а также оценки риска развития ВТЭ на фоне применения препарата Мидиана®, таблетки, покрытые пленочной оболочкой, по сравнению с применением других комбинированных гормональных контрацептивов (КГК).
Способ применения и дозы
Таблетки необходимо принимать каждый день примерно в одно и то же время, при необходимости запивая небольшим количеством жидкости, в последовательности, указанной на упаковке. Необходимо принимать по одной таблетке в день в течение 21 дня подряд. Каждая следующая упаковка должна начинаться после 7-дневного интервала в приеме таблеток, в течение которого обычно наступает менструальноподобное кровотечение. Оно обычно начинается через 2-3 дня после приема последней таблетки и может не закончиться к моменту начала следующей упаковки.
Если ранее гормональные контрацептивы не использовались (в последний месяц)
Прием Мидианы® начинается в первый день естественного менструального цикла женщины (то есть в первый день менструального кровотечения).
В случае замены другого комбинированного гормонального контрацептива (КГК) (комбинированного перорального контрацептива (КОК), вагинального кольца или трансдермального пластыря):
Для женщины предпочтительно начать прием Мидианы® на следующий день после приема последней активной таблетки предыдущего КОК; в таких случаях прием Мидианы® не должен начинаться позднее следующего дня после обычного перерыва в приеме таблеток или приема неактивных таблеток предыдущего КОК. При замене вагинального кольца или трансдермального пластыря прием Мидианы® желательно начинать в день удаления предыдущего средства; в таких случаях прием Мидианы® должен начаться не позднее дня намеченной процедуры замены.
В случае замены метода с применением только прогестинов (мини-пили, инъекционные формы, имплантаты) или внутриматочной системы (ВМС) с высвобождением прогестинов
Женщина может перейти с мини-пили, содержащих только прогестины в любой день (с имплантата или ВМС — в день его удаления, с инъекционной формы — со дня, когда должна была быть сделана следующая инъекция). Однако во всех этих случаях желательно использовать дополнительно барьерный метод контрацепции в течение первых 7 дней приема таблеток.
После прерывания беременности в первом триместре
Женщина может начать прием немедленно. При соблюдении этого условия нет необходимости в дополнительных мерах контрацепции.
После родов или прерывания беременности во втором триместре
Женщине желательно начать прием Мидианы® на 21-28 день после родов или прерывания беременности во втором триместре. Если прием начат позднее, необходимо использовать дополнительно барьерный метод контрацепции в течение первых 7 дней приема таблеток. В случае наличия полового контакта до начала приема препарата должна быть исключена беременность или необходимо дождаться первой менструации.
Прием пропущенных таблеток
Если опоздание в приеме таблетки составило менее 12 часов, контрацептивная защита не снижается. Женщине необходимо принять таблетку как можно скорее, следующие таблетки принимаются в обычное время.
Если опоздание в приеме таблеток составило более 12 часов, контрацептивная защита может быть снижена. Коррекция пропущенных таблеток должна руководствоваться следующими двумя простыми правилами:
-
Прием таблеток нельзя прекращать более чем на 7 дней;
-
Чтобы достичь адекватного подавления гипоталамо-гипофизарно-яичниковой системы, необходимо 7 дней непрерывного приема таблеток.
Соответственно в ежедневной практике можно давать следующие советы:
Неделя 1
Необходимо принять последнюю пропущенную таблетку как можно скорее, даже если это означает прием двух таблеток одновременно. Следующую таблетку принимают в обычное время. Дополнительно должен быть использован барьерный метод контрацепции в течение следующих 7 дней. Если половое сношение имело место в течение 7 дней перед пропуском таблетки, необходимо учитывать вероятность наступления беременности. Чем больше таблеток пропущено и чем ближе этот пропуск к 7-дневному перерыву в приеме препарата, тем выше риск наступления беременности.
Неделя 2
Необходимо принять последнюю пропущенную таблетку как можно скорее, даже если это означает прием двух таблеток одновременно. Следующую таблетку принимают в обычное время. Если женщина в течение предшествующих 7 дней принимала таблетки правильно, нет необходимости использовать дополнительные средства контрацепции. Однако, если она пропустила более чем 1 таблетку, необходимо использовать дополнительные меры предосторожности в следующие 7 дней.
Неделя 3
Вероятность снижения контрацептивного эффекта значительна из-за предстоящего 7-дневного перерыва в приеме таблеток. Однако, корректируя расписание приема таблеток, можно предотвратить снижение контрацептивной защиты.
Если следовать любому из двух следующих советов, дополнительных способов контрацепции не понадобится, если в течение предшествующих 7 дней перед пропуском таблетки женщина принимала все таблетки правильно. Если это не так, она должна следовать первому из двух способов и также использовать дополнительные меры предосторожности в течение следующих 7 дней.
1. Необходимо принять последнюю пропущенную таблетку как можно скорее, даже если это означает прием двух таблеток одновременно. Следующую таблетку принимают в обычное время. Прием таблеток из новой упаковки должен быть начат, как только закончится текущая упаковка, то есть без перерыва между приемом двух упаковок. Вероятнее всего, кровотечения «отмены» не будет до окончания таблеток из второй упаковки, но могут наблюдаться мажущие кровянистые выделения или прорывное маточное кровотечение в дни приема таблеток.
2. Женщине можно рекомендовать прекратить прием таблеток из данной упаковки. Затем у нее будет 7 дневный перерыв в приеме таблеток, включая дни, когда она забывала принимать таблетки, и потом начать новую упаковку.
В случае пропуска в приеме таблеток и отсутствия в первый свободный от приема препарата интервал кровотечения «отмены» необходимо исключить беременность.
Рекомендации в случае возникновения нарушений со стороны желудочно-кишечного тракта
В случае тяжелых реакций со стороны желудочно-кишечного тракта (таких как рвота или диарея), всасывание может быть неполным, и необходимо применять дополнительные меры контрацепции.
В случае рвоты в пределах 3-4 часов после приема таблетки, необходимо как можно скорее принять новую, заменяющую таблетку. Новую таблетку при возможности необходимо принять в течение 12 часов после обычного времени приема. Если пропущено больше 12 часов, по возможности необходимо соблюдать правила приема препарата, указанные в разделе «Прием пропущенных таблеток». Если пациентка не хочет изменять нормальный режим приема препарата, она должна принять дополнительную таблетку (или несколько таблеток) из другой упаковки.
Как отсрочить кровотечение «отмены»
Для отсрочки дня начала менструации необходимо продолжить прием Мидианы® из новой упаковки без перерыва в приеме. Отсрочка возможна до окончания таблеток во второй упаковке.
Во время удлинения цикла могут отмечаться мажущие кровянистые выделения из влагалища или маточные прорывные кровотечения. Возобновить прием Мидианы® из новой пачки следует после обычного 7-дневного перерыва. Для переноса дня начала менструации на другой день недели обычного расписания следует укоротить ближайший перерыв в приеме таблеток на столько дней, на сколько это необходимо. Чем короче интервал, тем выше риск того, что кровотечения «отмены» не будет, а во время приема из следующей упаковки будут отмечаться прорывные кровотечения и мажущие кровянистые выделения (так же как в случае отсрочки начала менструации).
Отдельные категории пациентов
Дети и подростки
Прием препарата Мидиана®, таблетки, покрытые пленочной оболочкой, показан после первого менструального цикла. Данных о необходимости изменения дозы не получено.
Пожилые пациентки
Неприменимо. Препарат Мидиана®, таблетки, покрытые пленочной оболочкой, не показан после наступления менопаузы.
Пациентки с нарушениями функции печени
Препарат Мидиана®, таблетки, покрытые пленочной оболочкой, противопоказан у женщин с нарушением функции печени.
Пациентки с нарушением функции почек
Препарат Мидиана®, таблетки, покрытые пленочной оболочкой, противопоказан у женщин с тяжелой почечной недостаточностью или острой почечной недостаточностью.
Побочные действия
Часто (>1/100 дo <1/10)
— головная боль, мигрень
— депрессивное состояние, снижение настроения, эмоциональная лабильность
— тошнота
— нарушения менструального цикла, межменструальные кровотечения, боль в животе, боль в груди
— вагинальные выделения, кандидоз влагалища
— болезненность и напряженность молочных желез
Нечасто (>1/1 000 дo <1/100)
— акне, экзема, кожный зуд
— рвота, диарея
— гипертензия, гипотензия
— крапивница
— задержка жидкости в организме
— повышение массы тела
— снижение либидо
— алопеция
Редко (>1/10 000 дo <1/1 000)
— снижение веса
— бронхиальная астма
— снижение слуха
— секреция молочных желез
— повышение либидо
— тромбоэмболия, венозные тромбозы/тромбоэмболии, артериальные тромбозы/тромбоэмболии
— артериальная гипертензия
— опухоли печени
— болезнь Крона, неспецифический язвенный колит
— эпилепсия
— эндометриоз, миома матки
— порфирия
— системная красная волчанка
— герпес беременных
— хорея Сиденгама
— гемолитический уремический синдром
— холестатическая желтуха
— хлоазма
— ангионевротический отек
— узловатая эритема, мультиформная эритема
— плохая переносимость контактных линз
Противопоказания
— повышенная чувствительность к активным веществам или любому из вспомогательных веществ
— гиперчувствительность к арахису или сое
— наличие риска венозной тромбоэмболии (ВТЭ)
— наличие венозной тромбоэмболии в настоящее время (применение антикоагулянтов) или в анамнезе (например, тромбоз глубоких вен [ТГВ] или тромбоэмболия легочной артерии [ТЭЛА])
— установленная наследственная или приобретенная предрасположенность к развитию венозной тромбоэмболии, например резистентность к активированному протеину С (включая фактор V Лейдена), недостаточность антитромбина III, недостаточность протеина C, недостаточность протеина S
— обширное хирургическое вмешательство с длительной иммобилизацией
— высокий риск развития венозной тромбоэмболии вследствие наличия множественных факторов риска
— наличие риска артериальной тромбоэмболии (АТЭ) артериальная тромбоэмболия в настоящее время, в анамнезе (например, инфаркт миокарда) или предшествующее заболевание (например, стенокардия)
— цереброваскулярное заболевание: инсульт в текущем периоде, в анамнезе или предшествующее состояние (например, транзиторная ишемическая атака [ТИА])
— установленная наследственная или приобретенная предрасположенность к развитию артериальной тромбоэмболии, например гипергомоцистеинемия и наличие антифосфолипидных антител (антикардиолипиновые антитела, волчаночный антикоагулянт)
— мигрень с очаговой неврологической симптоматикой в анамнезе
— высокий риск артериальной тромбоэмболии вследствие наличия множественных факторов риска или наличие одного из следующих серьезных факторов риска: сахарный диабет с сосудистыми осложнениями, тяжелая артериальная гипертензия, выраженная дислипопротеинемия
— тяжелые заболевания печени (до нормализации «печеночных» проб) в настоящее время или в анамнезе
— тяжелая почечная недостаточность или острая почечная недостаточность
— опухоли печени (доброкачественные или злокачественные) в настоящее время или в анамнезе
— диагностированные гормонозависимые злокачественные заболевания половой системы (половых органов или молочных желез) или подозрение на них
— недиагностированное вагинальное кровотечение.
Лекарственные взаимодействия
Метаболизм в печени
Некоторые препараты вследствие индукции микросомальных ферментов способны увеличивать клиренс половых гормонов (фенитоин, барбитураты, примидон, карбамазепин и рифампицин; также возможно такое же влияние оксикарбазепина, топирамата, фелбамата, ритонавира, гризеофульвина и растительного средства на основе зверобоя (Hypericum perforatum)).
Сообщалось о возможном действии ингибиторов ВИЧ-протеаз (например, ритонавира) и ненуклеозидных ингибиторов обратной транскриптазы (например, невирапина) и их сочетаний на метаболизм в печени.
Кишечно-печеночная рециркуляция
Одновременное назначение с некоторыми антибиотиками, такими как пенициллины и тетрациклины, снижает кишечно-печеночную рециркуляцию эстрогенов, что может приводить к снижению концентрации этинилэстрадиола.
Женщины, получающие любые из вышеупомянутых классов лекарственных препаратов или отдельные активные вещества, должны использовать барьерный метод контрацепции в дополнение к Мидиане®, или перейти на любой другой метод контрацепции. Женщины, получающие постоянное лечение препаратами, содержащими активные вещества, влияющие на печеночные ферменты, в течение 28 дней после их отмены дополнительно должны использовать негормональный метод контрацепции. Женщины, принимающие антибиотики (кроме рифампицина или гризеофульвина) должны временно использовать барьерный метод контрацепции в дополнение к КОК, как во время приема препарата, так и в течение 7 дней после его отмены. Если сопутствующее применение лекарственного препарата начато в конце приема таблеток из упаковки препарата Мидианы®, прием таблеток из следующей упаковки должен быть начат без обычного перерыва в приеме.
Основные метаболиты дроспиренона в плазме человека образуются без вовлечения ферментов системы цитохрома Р450. Таким образом, ингибиторы этой ферментной системы не влияют на метаболизм дроспиренона.
Влияние Мидианы®, таблетки, покрытые пленочной оболочкой, на действие других лекарственных препаратов
Пероральные контрацептивы могут влиять на метаболизм отдельных других активных веществ. Кроме того, могут изменяться их концентрации в плазме и тканях – как повышаться (например, циклоспорин), так и снижаться (например, ламотриджин).
У женщин-добровольцев, принимающих омепразол, симвастатин и мидазолам в качестве индикаторов-субстратов, влияние дроспиренона в дозе 3 мг на метаболизм других активных веществ маловероятно.
Другие взаимодействия
У пациентов с почечной недостаточностью, одновременное назначение дроспиренона и ингибиторов АПФ или нестероидные противовоспалительные средства не оказывает существенного влияния на содержание калия в сыворотке крови. Однако, одновременное использование Мидианы® и антагонистов альдостерона или калийсберегающих диуретиков не изучалось. В этом случае необходимо исследование содержания калия в сыворотке крови в течение первого цикла приема препарата.
Примечание: Для выявления возможных лекарственных взаимодействий следует проводить анализ информации, представленной в инструкциях по медицинскому применению сопутствующих препаратов.
Лабораторные исследования
Прием гормонов для контрацепции может влиять на результаты отдельных лабораторных тестов, включая биохимические показатели функции печени, щитовидной железы, надпочечников и почек, а также уровни транспортных белков плазмы, таких как кортикостероидсвязывающий глобулин и липидно/липопротеиновые фракции, показатели углеводного обмена, коагуляции и фибринолиза. Изменения обычно происходят в пределах лабораторных норм.
Вследствие своей небольшой антиминералокортикоидной активности дроспиренон повышает активность ренина и альдостерона плазмы крови.
Особые указания
Меры предосторожности
При наличии любого из перечисленных ниже состояний или факторов риска с женщиной следует обсудит целесообразность применения препарата Мидиана®, таблетки, покрытые пленочной оболочкой.
В случае ухудшения состояния или при впервые выявленном эпизоде возникновения любого из этих состояний или факторов риска женщину следует уведомить о необходимости обращения к своему лечащему врачу для решения вопроса о дальнейшем применении препарата Мидиана®, таблетки, покрытые пленочной оболочкой.
Нарушения со стороны системы кровообращения
Риск возникновения венозной тромбоэмболии (ВТЭ)
На фоне применения любого комбинированного гормонального контрацептива (КГК) увеличивается риск развития венозной тромбоэмболии (ВТЭ) по сравнению с отсутствием лечения. Применение препаратов, содержащих левоноргестрел, норгестимат или норэтистерон, связано с наименьшим риском возникновения ВТЭ. Для других препаратов, например, Мидиана®, таблетки, покрытые пленочной оболочкой, данный риск может быть в два раза выше. Решение о применении препарата, не относящегося к группе препаратов с наименьшим риском развития ВТЭ, должно быть принято только после обсуждения с женщиной в доступной для нее форме риска возникновения ВТЭ на фоне применения препарата Мидиана®, таблетки, покрытые пленочной оболочкой, влияния имеющихся у нее факторов риска на уровень данного риска и уведомления о том, что риск возникновения ВТЭ является самым высоким в первый год применения препарата. Имеются данные, указывающие на то, что риск увеличивается при повторном применении КГК после перерыва продолжительностью от 4 недель и более.
Среди женщин, не применяющих КГК и не являющихся беременными, частота возникновения ВТЭ составляет приблизительно 2 случая на 10 000 женщин в год. Однако у любой отдельно взятой женщины уровень риска может быть значительно выше, в зависимости от имеющихся у нее основных факторов риска (см. ниже). Частота развития ВТЭ среди женщин, применяющих КГК, содержащие дроспиренон, составляет 9‑12 случаев на 10 000 женщин в год, что сопоставимо с 61 случаями у женщин, применяющих КГК, содержащие левоноргестрел.
В обоих случаях зарегистрированное количество случаев ВТЭ в год меньше ожидаемого количества случаев во время беременности или в послеродовом периоде.
В 1‑2% случаев ВТЭ заканчивается летальным исходом.
Среди женщин, применявших КГК, были описаны крайне редкие случаи тромбоза других кровеносных сосудов, например, печеночных, мезентериальных, почечных или ретинальных вен и артерий.
Факторы риска развития ВТЭ
На фоне применения КГК риск развития венозных тромбоэмболических осложнений может значительно увеличиваться у женщин с дополнительными факторами риска, в особенности при наличии множественных факторов риска.
Препарат Мидиана®, таблетки, покрытые пленочной оболочкой, противопоказан женщинам с наличием множественных факторов риска, на основании которых ее можно отнести в группу высокого риска развития венозного тромбоза. При наличии у женщины нескольких факторов риска, возможно, что увеличение риска больше, чем сумма отдельных факторов, и в этом случае следует учитывать общий риск развития ВТЭ. КГК не следует назначать, если соотношение польза/риск оценивается как отрицательное.
Факторы риска развития ВТЭ
|
Фактор риска |
Комментарий |
|
Ожирение (индекс массы тела свыше 30 кг/м²) |
Значительное увеличение риска при повышении ИМТ. Особенно важно при наличии дополнительных факторов риска. |
|
Длительная иммобилизация (включая авиаперелеты продолжительностью более 4 часов), обширное хирургическое вмешательство, любое хирургическое вмешательство на нижних конечностях или органах малого таза, нейрохирургическое вмешательство или обширная травма Примечание: временная иммобилизация, включая авиаперелеты продолжительностью более 4 часов, также может быть фактором риска развития ВТЭ, в особенности у женщин с наличием других факторов риска |
В этих ситуациях рекомендуется прекратить применение пластыря/мини-пили/вагинального кольца (в случае плановой операции, по крайней мере, за четыре недели до нее) и не возобновлять применение в течение двух недель после окончания иммобилизации. Для того чтобы избежать нежелательной беременности, следует использовать другой метод контрацепции. В том случае, если препарат Мидиана®, таблетки, покрытые пленочной оболочкой, не был своевременно отменен, следует назначить антитромботическое лечение. |
|
Отягощенный семейный анамнез (случаи венозной тромбоэмболии у братьев, сестер или родителей, особенно в относительно раннем возрасте, например моложе 50 лет). |
При подозрении на наследственную предрасположенность до назначения КГК женщину следует направить на консультацию к соответствующему специалисту. |
|
Другие заболевания, связанные с ВТЭ |
Рак, системная красная волчанка, гемолитико-уремический синдром, хроническое воспалительное заболевание кишечника (болезнь Крона или неспецифический язвенный колит) и серповидно-клеточная анемия |
|
С возрастом |
В особенности старше 35 лет |
Не достигнуто никакого согласия относительно возможной роли варикозного расширения вен и поверхностного тромбофлебита в возникновении или прогрессировании венозного тромбоза.
Следует учитывать повышенный риск развития тромбоэмболии при беременности и в особенности в первые 6 недель послеродового периода.
Симптомы ВТЭ (тромбоз глубоких вен и тромбоэмболия легочной артерии)
При возникновении соответствующих симптомов женщине необходимо в срочном порядке обратиться за медицинской помощью, при этом следует уведомить медицинского работника о том, что она применяет КГК.
Симптомами тромбоза глубоких вен (ТГВ) могут быть:
— односторонняя отечность нижней конечности и/или стопы или наличие отечности по ходу вены на нижней конечности;
— боль или болезненность в нижней конечности, которая может ощущаться только при стоянии или ходьбе;
— повышение температуры пораженной нижней конечности; покраснение или изменение цвета кожи нижней конечности.
Симптомами тромбоэмболии легочной артерии (ТЭЛА) могут быть:
— внезапное возникновение необъяснимой одышки или учащенного дыхания;
— внезапный кашель, который может быть связан с кровохарканьем;
— острая боль в груди;
— выраженное головокружение;
— частый или нерегулярный пульс.
Некоторые из этих симптомов (например, одышка, кашель) являются неспецифичными и по этой причине могут быть неверно интерпретированы как более распространенные или менее тяжелые явления (например, инфекции дыхательных путей).
Другими признаками окклюзии сосудов могут быть: внезапная боль, отечность и незначительное посинение конечности.
При окклюзии сосудов сетчатки возникающие симптомы могут варьировать от нечеткости зрения без болевых ощущений до прогрессирующей потери зрения. Иногда может отмечаться резкая потеря зрения.
Риск развития артериальной тромбоэмболии (АТЭ)
В эпидемиологических исследованиях было установлено, что применение КГК связано с высоким риском развития артериальной тромбоэмболии (инфаркт миокарда) или цереброваскулярного заболевания (например, транзиторной ишемической атаки, инсульта). Артериальные тромбоэмболические осложнения могут приводить к смертельному исходу.
Факторы риска развития АТЭ
Риск развития артериальных тромбоэмболических осложнений или нарушения мозгового кровообращения на фоне применения КГК увеличивается при наличии факторов риска. Препарат Мидиана®, таблетки, покрытые пленочной оболочкой, противопоказан женщинам с наличием 1 серьезного или множественных факторов риска развития АТЭ, на основании которых ее можно отнести в группу высокого риска развития артериального тромбоза. При наличии у женщины нескольких факторов риска, возможно, что увеличение риска больше, чем сумма отдельных факторов, и в этом случае следует учитывать величину общего риска. КГК не следует назначать, если соотношение польза/риск оценивается как отрицательное
Факторы риска развития АТЭ
|
Фактор риска |
Комментарий |
|
С возрастом |
В особенности старше 35 лет |
|
Курение |
Женщинам следует рекомендовать отказаться от курения в случае их желания применять КГК. Женщинам старше 35 лет, продолжающих курить, следует настоятельно рекомендовать другой метод контрацепции. |
|
Артериальная гипертензия |
|
|
Ожирение (индекс массы тела свыше 30 кг/м²) |
Значительное увеличение риска при повышении ИМТ. Особенно важно при наличии дополнительных факторов риска. |
|
Отягощенный семейный анамнез (случаи артериальной тромбоэмболии у братьев, сестер или родителей, особенно в относительно раннем возрасте, например моложе 50 лет). |
При подозрении на наследственную предрасположенность до назначения КГК женщину следует направить на консультацию к соответствующему специалисту. |
|
Мигрень |
Увеличение частоты или тяжести мигрени во время использования КГК (что может предшествовать цереброваскулярным нарушениям) может быть основанием для немедленного прекращения приема этих препаратов. |
|
Другие заболевания, связанные с нежелательными сосудистыми явлениями |
Сахарный диабет, гипергомоцистеинемия, клапанный порок сердца и фибрилляция предсердий, дислипопротеинемия и системная красная волчанка. |
При возникновении соответствующих симптомов женщине необходимо в срочном порядке обратиться за медицинской помощью, при этом следует уведомить медицинского работника о том, что она применяет КГК.
Симптомами острого нарушения мозгового кровообращения могут быть:
— внезапное онемение или слабость мышц лица, верхних или нижних конечностей, в особенности на одной стороне тела;
— резкое нарушение походки, появление головокружения, нарушение равновесия или координации;
— внезапное проявление спутанности сознания, нарушения речи или ее понимания;
— резкое нарушение зрения на один или оба глаза;
— резкое появление тяжелой или продолжительной головной боли без известной причины;
— потеря сознания или обморок с или без приступа судорог.
Проходящие симптомы указывают на то, что данное явление является транзиторной ишемической атакой (ТИА).
Симптомами ИМ могут быть:
— боль, дискомфорт, чувство давления, тяжести, сжатия или распирания в грудной клетке, верхней конечности или ниже грудины;
— дискомфорт, иррадиирующий в спину, нижнюю челюсть, горло, руку, желудок;
— ощущение переполнения желудка, нарушения пищеварения или удушье;
— потливость, тошнота, рвота или головокружение;
— состояние крайней слабости, тревожность или одышка;
— частый или нерегулярный пульс.
Наличие одного из серьезных факторов риска или множественных факторов риска заболевания артерий или вен, соответственно, может также быть противопоказанием. Следует рассмотреть возможность проведения антикоагулянтной терапии. Женщины, применяющие КГК, должны немедленно обращаться к врачу при возникновении симптомов возможного тромбоза. В случаях подозрения на тромбоз или подтвержденного тромбоза применение КГК необходимо прекратить. Необходимо подобрать адекватный метод контрацепции вследствие тератогенности антикоагулянтной терапии (кумарины).
Следует учитывать повышенный риск развития тромбоэмболии в послеродовом периоде.
Другие заболевания, которые связаны с тяжелой сосудистой патологией, включают сахарный диабет, системную красную волчанку, гемолитико-уремический синдром, хронические воспалительные заболевания кишечника (болезнь Крона или неспецифический язвенный колит) и серповидно-клеточную анемию.
Увеличение частоты или тяжести мигрени во время использования КГК (что может предшествовать цереброваскулярным нарушениям) может быть основанием для немедленного прекращения приема КГК.
Опухоли
Самым значительным фактором риска развития рака шейки матки является наличие инфекции, вызванной вирусом папилломы человека (ВПЧ). В некоторых эпидемиологических исследованиях сообщалось о повышенном риске развития рака шейки матки при длительном применении КГК (более 5 лет), однако сохраняются противоречивые мнения относительно того, в какой степени эти находки относятся к сопутствующим факторам, например, исследованию на наличие рака шейки матки или использованию барьерных методов контрацепции.
Мета-анализ данных 54 эпидемиологических исследований продемонстрировал, что имеется несколько повышенный относительный риск (RR=1,24) развития рака молочной железы, диагностированного у женщин, которые на момент исследования использовали КГК. Избыточный риск постепенно снижается в течение 10 лет после прекращения применения КГК. Поскольку рак молочной железы редко встречается у женщин моложе 40 лет, увеличение в последние годы количества случаев выявления рака молочной железы среди женщин, применявших ранее или применяющих в настоящее время КГК, является небольшим по отношению к общему риску развития рака молочной железы. Эти исследования не подтверждают наличия причинно-следственной связи между применением КГК и развитием рака молочной железы. Наблюдаемое повышение риска может быть следствием более ранней диагностики рака молочной железы у женщин, применяющих КГК, биологическим эффектом КГК или сочетанием обоих вариантов. Среди женщин, когда-либо применявших КГК, была отмечена тенденция к меньшей выраженности клинических проявлений диагностированных случаев рака молочной железы, чем у женщин, никогда не использовавших КГК.
В редких случаях на фоне применения КГК наблюдалось развитие доброкачественных опухолей печени, а в еще более редких – злокачественных. В отдельных случаях эти опухоли вызывали опасное для жизни внутрибрюшное кровотечение. При дифференциальной диагностике опухоль печени нужно учитывать при появлении у женщины, применяющей КГК, сильной боли в верхних отделах живота, увеличении печени или признаках внутрибрюшного кровотечения.
Злокачественные опухоли могут быть опасными для жизни или приводить к смертельному исходу.
Другие состояния
Прогестероновый компонент препарата Мидиана® является антагонистом альдостерона, обладающим калийсберегающими свойствами. В большинстве случаев не отмечается увеличения содержания калия в сыворотке крови. Тем не менее, в клиническом исследований у некоторых пациентов с легкими или умеренно выраженными нарушениями функции почек и сопутствующим применением калийсберегающих лекарственных препаратов при приеме дроспиренона происходило небольшое увеличение содержания калия в сыворотке крови. Таким образом, рекомендуется контролировать содержание калия в сыворотке крови в первом цикле приема препарата у пациентов с почечной недостаточностью и у пациентов со значениями содержания калия до лечения на уровне верхней границы нормы, а также в случаях одновременного назначения лекарственных препаратов, задерживающих калий в организме.
У женщин с гипертриглицеридемией или семейным анамнезом данного нарушения нельзя исключить повышение риска развития панкреатита во время применения КГК.
Хотя небольшое повышение артериального давления было описано у многих женщин, применяющих КГК, клинически значимые повышения отмечались редко. Только в этих редких случаях оправдано немедленное прекращение применения КГК. Если во время применения КГК в случаях предшествующей артериальной гипертензии, значения артериального давления постоянно повышены, или значительно повышенное артериальное давление адекватно не отвечает на гипотензивную терапию, КГК следует отменить. При необходимости, применение КГК может быть продолжено, если на фоне проведения гипотензивной терапии достигаются нормальные значения артериального давления.
Было отмечено, что следующие состояния развиваются или течение их усугубляется как во время беременности, так и на фоне применения КГК, однако их связь с применением КГК не доказана: желтуха и/или зуд, связанный с холестазом; конкременты желчного пузыря; порфирия; системная красная волчанка; гемолитико-уремический синдром; хорея Сиденгама; герпес беременных; потеря слуха, связанная с отосклерозом.
У женщин с наследственным ангионевротическим отеком экзогенные эстрогены могут вызывать или усиливать симптомы ангионевротического отека.
Острые или хронические нарушения функции печени могут потребовать прекращения использования КГК до тех пор, пока показатели функции печени не вернутся к норме. Рецидивирующая холестатическая желтуха и/или вызванный холестазом зуд, которые развиваются впервые во время беременности или предыдущего приема половых гормонов, требует прекращения применения КГК.
Хотя КГК могут оказывать влияние на периферическую резистентность к инсулину и толерантность к глюкозе, нет необходимости изменения терапевтического режима у пациенток с сахарным диабетом, использующих низкодозированные КГК (содержащие < 0,05 мг этинилэстрадиола). Тем не менее, женщины с сахарным диабетом должны тщательно наблюдаться врачом, особенно в начале применения КГК.
Также сообщалось об усугублении течения эндогенной депрессии, эпилепсии, болезни Крона и неспецифического язвенного колита при использовании КГК.
Иногда может развиваться хлоазма, особенно у женщин, имевших хлоазму беременных в анамнезе. Женщины со склонностью к развитию хлоазмы во время применения КГК должны избегать длительного пребывания на солнце или воздействия ультрафиолетового излучения.
В одной таблетке этого лекарственного препарата содержится 48,17 мг лактозы моногидрата. Препарат не следует принимать пациенткам с редкими наследственными заболеваниями, такими как непереносимость лактозы или нарушением всасывания глюкозы-галактозы.
В одной таблетке этого лекарственного препарата содержится 0,070 мг соевого лецитина. Данный препарат не следует принимать пациенткам с гиперчувствительностью к арахису или сое.
Медицинское обследование/консультация
До начала применения или повторного назначения препарата Мидиана®, таблетки, покрытые пленочной оболочкой, следует провести тщательный сбор анамнеза (включая семейный анамнез) и исключить беременность. Следует измерить артериальное давление, провести объективное обследование, руководствуясь информацией о противопоказаниях и особых указаниях и мерах предосторожности.
Важно обратить внимание женщин на риск возникновения венозного и артериального тромбоза, включая риск применения препарата Мидиана®, таблетки, покрытые пленочной оболочкой, по сравнению с другими КГК, на симптомы ВТЭ и АТЭ, а также на установленные факторы риска и предпринимаемые действия в случае подозрения на развитие тромбоза.
Необходимо, чтобы женщина внимательно прочла листок-вкладыш с информацией для пациента и следовала представленным в нем рекомендациям. Частота и вид осмотров должны основываться на разработанных практических рекомендациях с их адаптацией для каждой конкретной женщины.
Следует предупредить женщину, что пероральные контрацептивы не предохраняют от ВИЧ-инфекции (СПИД) и других заболеваний, передающихся половым путем.
Снижение эффективности
Эффективность КГК может снижаться в случае пропуска таблеток, расстройств со стороны желудочно-кишечного тракта или при сопутствующем применении других лекарственных препаратов.
Контроль уменьшенного цикла
На фоне приема КГК могут отмечаться нерегулярные кровотечения (мажущие кровянистые выделения или прорывные кровотечение), особенно в течение первых месяцев использования. По этой причине оценка любых нерегулярных кровотечений является значимой только после периода адаптации, составляющего приблизительно три цикла.
Если нерегулярные кровотечения повторяются или развиваются после предшествующих регулярных циклов, следует исключить негормональные причины с проведением соответствующих диагностических мероприятий для исключения злокачественных новообразований или беременности. Они могут включать диагностическое выскабливание.
У некоторых женщин кровотечение «отмены» может не развиваться во время перерыва в приеме пероральных контрацептивов. Если КГК принимались согласно указаниям, то маловероятно, что у женщины наступит беременность. Тем не менее, если до первого отсутствия кровотечения «отмены» КГК принимались не в соответствии с инструкцией, или отсутствуют подряд два кровотечения «отмены», то до продолжения приема КГК должна быть исключена беременность.
Беременность и период лактации
Препарат Мидиана®, таблетки, покрытые пленочной оболочкой, не показан во время беременности.
Если беременность наступила на фоне применения препарата Мидиана®, таблетки, покрытые пленочной оболочкой, его необходимо немедленно отменить. В ходе проведения расширенных эпидемиологических исследований не было выявлено ни увеличения риска врожденных дефектов у детей, чьи матери принимали КГК до беременности, ни тератогенного эффекта при непреднамеренном применении КГК во время беременности. Таких исследований с использованием препарата Мидиана®, таблетки, покрытые пленочной оболочкой, не проводилось.
В исследованиях на животных были выявлены побочные эффекты во время беременности и лактации. Основываясь на этих данных, нельзя исключить побочных эффектов, связанных с гормональным влиянием действующих соединений. Однако, исходя из совокупного опыта случайного применения КГК во время беременности, данных о реальном побочном действии у человека получено не было.
Доступные данные по применению препарата Мидиана®, таблетки, покрытые пленочной оболочкой, во время беременности слишком ограничены, чтобы можно было сделать заключение об отсутствии негативных эффектов препарата на беременность, здоровье плода или новорожденного. К настоящему времени не получено значимых данных эпидемиологических исследований.
При повторном назначении препарата Мидиана®, таблетки, покрытые пленочной оболочкой, следует учитывать высокий риск развития ВТЭ в послеродовом периоде.
Период лактации
КГК могут влиять на лактацию, поскольку они могут уменьшать количество грудного молока и изменять его состав. Таким образом, использование КГК обычно не рекомендуется до тех пор, пока кормящая женщина полностью не отлучит ребенка от груди. Небольшие количества контрацептивных гормонов или их метаболитов могут выделяться с грудным молоком во время применения КГК. Эти количества могут оказывать влияние на ребенка.
Особенности влияния лекарственного средства на способность управлять транспортным средством и потенциально опасными механизмами
Исследований, изучающих влияние препарата на способность вождения автомобиля и на работу с механизмами с повышенным риском травматизма, не проводилось.
Передозировка
Симптомы: тошнота, рвота, небольшое влагалищное кровотечение у молодых девушек.
Лечение: симптоматическое, специфического антидота не существует.
Форма выпуска и упаковка
По 21 таблетке в контурные ячейковые упаковки из пленки ПВХ/ПВДХ и фольги алюминиевой.
По 1 или 3 контурные ячейковые упаковки вместе с картонным футляром и инструкцией по медицинскому применению на государственном и русском языках помещают в картонную пачку.
Условия хранения
Хранить в оригинальной упаковке, в защищенном от света месте при температуре не выше 25 0С.
Хранить в недоступном для детей месте!
Срок хранения
3 года
Не использовать после истечения срока годности.
Условия отпуска из аптек
По рецепту
Наименование и страна организации-производителя
ОАО «Гедеон Рихтер»
1103 Будапешт, ул. Дёмрёи, 19-21, Венгрия
Наименование и страна владельца регистрационного удостоверения
ОАО «Гедеон Рихтер», Венгрия
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции:
Представительство ОАО «Гедеон Рихтер» в РК
E-mail: info@richter.kz Телефон: 8-(7272)-58-26-22, 8-(7272)-58-26-23
1
| 404993241477976293_ru.doc | 168 кб |
| 988042991477977491_kz.doc | 204 кб |
| 9647_11_16_i.pdf | 1.49 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники. «Центр экспертиз и испытаний в здравоохранении» МЗ РБ
Контрацепция.
Противопоказания
Препарат Мидиана® не должен назначаться при наличии какого-либо из состояний, перечисленных ниже. Если какие-либо из этих состояний развиваются впервые на фоне приема препарата, требуется его немедленная отмена.
- Наличие тромбозов вен в настоящее время или в анамнезе (тромбоз глубоких вен, тромбоэмболия легочной артерии);
- Наличие тромбозов артерий в настоящее время или в анамнезе (например, инфаркт миокарда) или предшествующих состояний (например, стенокардия и транзиторная ишемическая атака);
- Осложненные поражения клапанного аппарата сердца, фибрилляция предсердий, неконтролируемая артериальная гипертензия;
- Серьезное хирургическое вмешательство с длительной иммобилизацией;
- Курение в возрасте старше 35 лет;
- Печеночная недостаточность;
- Цереброваскулярные заболевания в настоящее время или в анамнезе;
- Наличие тяжелых или множественных факторов риска артериального тромбоза:
— Сахарный диабет с сосудистыми осложнениями;
— Выраженная артериальная гипертензия;
— Выраженная дислипопротеинемия; - Наследственная или приобретенная предрасположенность к венозным или артериальным тромбозам, такая как резистентность к АПС (активированному протеину С), недостаточность антитромбина III, недостаточность протеина С, недостаточность протеина S, гипергомоцистеинемия и наличие антифосфолипидных антител (антитела к кардиолипину, волчаночный антикоагулянт);
- Панкреатит, в том числе в анамнезе, если отмечалась выраженная гипертриглицеридемия;
- Тяжелые заболевания печени (до нормализации печеночных проб) в настоящее время или в анамнезе;
- Выраженная хроническая почечная недостаточность или острая почечная недостаточность;
- Опухоли печени (доброкачественные или злокачественные), в настоящее время или в анамнезе;
- Гормонозависимые злокачественные заболевания половой системы (половых органов, молочных желез) или подозрение на них;
- Кровотечение из влагалища неясного генеза;
- Мигрень с очаговой неврологической симптоматикой в анамнезе;
- Беременность или подозрение на нее;
- Период лактации;
- Гиперчувствительность к препарату или любому его компоненту;
- Наследственная непереносимость галактозы, лактазная недостаточность, глюкозо-галактозная мальабсорбция;
С осторожностью
Факторы риска развития тромбоза и тромбоэмболий: курение в возрасте до 35 лет, ожирение, дислипопротеинемия, контролируемая артериальная гипертензия, мигрень без очаговой неврологической симптоматики, неосложненные пороки клапанов сердца, наследственная предрасположенность к тромбозу (тромбозы, инфаркт миокарда или нарушение мозгового кровообращения в молодом возрасте у кого-либо из ближайших родственников); заболевания, при которых могут отмечаться нарушения периферического кровообращения: сахарный диабет, системная красная волчанка (СКВ), гемолитико-уремический синдром, болезнь Крона, язвенный колит, серповидно-клеточная анемия, флебит поверхностных вен; наследственный ангионевротический отек, гипертриглицеридемия, заболевания печени; заболевания, впервые возникшие или усугубившиеся во время беременности или на фоне предыдущего приема половых гормонов (в т.ч. желтуха и/или зуд, связанные с холестазом, холелитиаз, отосклероз с ухудшением слуха, порфирия, герпес во время беременности в анамнезе, малая хорея (болезнь Сиденгама), хлоазма, послеродовый период.
Беременность и период лактации
Во время беременности и лактации применение препарата Мидиана® противопоказано. Если беременность наступила на фоне гормональной контрацепции, необходима немедленная отмена препарата. Имеющиеся немногочисленные данные о непреднамеренном, по неосторожности, приеме комбинированных пероральных контрацептивов свидетельствуют об отсутствии тератогенного эффекта и увеличении риска для детей и женщин во время родов. Комбинированные пероральные контрацептивы влияют на лактацию, могут уменьшать количество и изменять состав грудного молока. Небольшие количества гормональных контрацептивов или их метаболитов обнаруживаются в молоке во время гормональной контрацепции и могут оказывать воздействие на ребенка. Применение комбинированных пероральных контрацептивов возможно после полного прекращения грудного вскармливания.
Способ применения и дозировка
Таблетки необходимо принимать каждый день примерно в одно и то же время, при необходимости запивая небольшим количеством жидкости, в последовательности, указанной на блистерной упаковке. Необходимо принимать по одной таблетке в день в течение 21 дня подряд. Прием таблеток из каждой последующей упаковки должен начинаться после 7-дневного интервала в приеме таблеток, в течение которого обычно наступает менструальноподобное кровотечение. Оно обычно начинается через 2-3 дня после приема последней таблетки и может не закончиться к моменту начала следующей упаковки.
Как принимать препарат Мидиана®
Если ранее гормональные контрацептивы не применялись (в последний месяц):
Прием комбинированных пероральных контрацептивов начинается в первый день естественного менструального цикла женщины (то есть в первый день менструального кровотечения).
В случае замены другого комбинированного перорального контрацептива, вагинального кольца или трансдермального пластыря:
Для женщины предпочтительно начать прием препарата Мидиана® на следующий день после приема последней активной таблетки предыдущего комбинированного перорального контрацептива; в таких случаях прием лекарственного средства Мидиана® не должен начинаться позднее следующего дня после обычного перерыва в приеме таблеток или приема неактивных таблеток ее предыдущего комбинированного перорального контрацептива. При замене вагинального кольца или трансдермального пластыря прием перорального контрацептива Мидиана® желательно начинать в день удаления предыдущего средства; в таких случаях прием препарата Мидиана® должен начаться не позднее дня намеченной процедуры замены.
В случае замены метода с применением только прогестинов (мини-пили, инъекционные формы, имплантаты) или внутриматочных контрацептивов с высвобождением прогестинов:
Женщина может перейти с мини-пили в любой день (с имплантата или внутриматочного контрацептива — в день его удаления, с инъекционной формы — со дня, когда должна была быть сделана следующая инъекция). Однако во всех этих случаях желательно использовать дополнительно барьерный метод контрацепции в течение первых 7 дней приема таблеток.
После прерывания беременности в первом триместре:
Женщина может начать прием немедленно. При соблюдении этого условия нет необходимости в дополнительных мерах контрацепции.
После родов или прерывания беременности во втором триместре:
Женщине желательно начать прием препарата Мидиана® на 21-28 день после родов или прерывания беременности во втором триместре. Если прием начат позднее, необходимо использовать дополнительно барьерный метод контрацепции в течение первых 7 дней приема таблеток. В случае наличия полового контакта до начала приема препарата должна быть исключена беременность или необходимо дождаться первой менструации.
Прием пропущенных таблеток
Если опоздание в приеме таблетки составило менее 12 часов, контрацептивная защита не снижается. Женщине необходимо принять таблетку как можно скорее, следующие таблетки принимаются в обычное время.
Если опоздание в приеме таблеток составило более 12 часов, контрацептивная защита может быть снижена. Тактика при пропуске приема препарата основывается на следующих двух простых правилах:
1. Прием таблеток нельзя прекращать более чем на 7 дней;
2. Чтобы достичь адекватного подавления гипоталамо-гипофизарно-яичниковой системы, необходимо 7 дней непрерывного приема таблеток.
Соответственно в ежедневной практике можно давать следующие советы:
Неделя 1
Необходимо принять последнюю пропущенную таблетку как можно скорее, даже если это означает прием двух таблеток одновременно. Следующую таблетку принимают в обычное время. Дополнительно должен быть использован барьерный метод контрацепции в течение следующих 7 дней. Если половое сношение имело место в течение 7 дней перед пропуском таблетки, необходимо учитывать вероятность наступления беременности. Чем больше таблеток пропущено и чем ближе этот пропуск к 7-дневному перерыву в приеме препарата, тем выше риск наступления беременности.
Неделя 2
Необходимо принять последнюю пропущенную таблетку как можно скорее, даже если это означает прием двух таблеток одновременно. Следующую таблетку принимают в обычное время. Если женщина в течение предшествующих 7 дней принимала таблетки правильно, нет необходимости использовать дополнительные средства контрацепции. Однако, если она пропустила более чем 1 таблетку, необходимо использовать дополнительные меры контрацепции в следующие 7 дней.
Неделя 3
Вероятность снижения контрацептивного эффекта значительна из-за предстоящего 7-дневного перерыва в приеме таблеток. Однако, корректируя расписание приема таблеток, можно предотвратить снижение контрацептивной защиты.
Если следовать любому из двух следующих советов, дополнительных способов контрацепции не понадобится, если в течение предшествующих 7 дней перед пропуском таблетки женщина принимала все таблетки правильно. Если это не так, она должна следовать первому из двух способов и также использовать дополнительные меры контрацепции в течение следующих 7 дней.
1. Необходимо принять последнюю пропущенную таблетку как можно скорее, даже если это означает прием двух таблеток одновременно. Следующую таблетку принимают в обычное время. Прием таблеток из новой упаковки должен быть начат, как только закончится текущая упаковка, то есть без перерыва между приемом двух упаковок. Вероятнее всего, кровотечения «отмены» не будет до конца второй упаковки, но могут наблюдаться мажущие кровянистые выделения или прорывное маточное кровотечение в дни приема таблеток.
2. Женщине можно рекомендовать прекратить прием таблеток из данной упаковки. Затем необходимо прекратить прием таблеток на 7 дней, включая дни, когда она забывала принимать таблетки, и потом начать прием таблеток из новой упаковки.
В случае пропуска в приеме таблеток и отсутствия в первый свободный от приема препарата интервал кровотечения «отмены» необходимо исключить беременность.
Советы в случае расстройств желудочно-кишечного тракта
В случае тяжелых реакций со стороны желудочно-кишечного тракта (таких как рвота или диарея), всасывание может быть неполным, и необходимо применять дополнительные меры контрацепции.
В случае рвоты в течение 3-4 часов после приема таблетки, необходимо как можно скорее принять новую, заменяющую таблетку. Новую таблетку при возможности необходимо принять в течение 12 часов после обычного времени приема. Если пропущено больше 12 часов, по возможности необходимо соблюдать правила приема препарата.
Прием пропущенных таблеток. Если пациентка не хочет изменять нормальный режим приема препарата, она должна принять дополнительную таблетку (или несколько таблеток) из другой упаковки.
Как отсрочить кровотечение «отмены»
Для отсрочки дня начала кровотечения «отмены» необходимо продолжить прием препарата Мидиана® из новой упаковки без перерыва в приеме. Отсрочка возможна до окончания таблеток во второй упаковке.
Во время удлинения цикла могут отмечаться мажущие кровянистые выделения из влагалища или прорывные маточные кровотечения. Возобновить прием препарата Мидиана® из новой пачки следует после обычного 7-дневного перерыва.
Для переноса дня начала кровотечения «отмены» на другой день недели обычного расписания следует укоротить ближайший перерыв в приеме таблеток на столько дней, на сколько это необходимо. Чем короче интервал, тем выше риск того, что кровотечения «отмены» не будет, а во время приема таблеток из второй упаковки будут отмечаться мажущие кровянистые выделения и прорывные маточные кровотечения (так же как в случае отсрочки начала кровотечения «отмены»).
Побочное действие
Во время одновременного применения дроспиренона и этинилэстрадиола сообщалось о следующих побочных реакциях:
Передозировка
Сведений о передозировке дроспиренон и этинилэстрадиол-содержащих препаратов не имеется. Однако возможно возникновение тошноты, рвоты и кровянистых выделений/кровотечений из влагалища. Специфического антидота нет. Следует проводить симптоматическое лечение.
Взаимодействие с другими лекарственными средствами
Взаимодействие между пероральными контрацептивами и другими лекарственными препаратами может приводить к прорывному маточному кровотечению и/или снижению контрацептивной надежности. В литературе описаны следующие виды взаимодействий:
Влияние на метаболизм в печени
Некоторые препараты вследствие индукции микросомальных ферментов способны увеличивать клиренс половых гормонов (фенитоин, барбитураты, примидон, карбамазепин и рифампицин; возможно такое же влияние окскарбазепина, топирамата, фелбамата, ритонавира, гризеофульвина и растительного средства на основе зверобоя продырявленного (Hypericum perforatum).
Сообщалось о возможном действии ингибиторов ВИЧ-протеазы (например, ритонавира) и ненуклеозидных ингибиторов обратной транскриптазы (например, невирапина) и их сочетаний на метаболизм в печени.
Влияние на кишечно-печеночную рециркуляцию
Клинические наблюдения показывают, что одновременное применение с некоторыми антибиотиками, такими как пенициллины и тетрациклины, снижает кишечно-печеночную рециркуляцию эстрогенов, что может приводить к снижению концентрации этинилэстрадиола.
Женщины, принимающие любые из вышеупомянутых классов лекарственных препаратов, должны использовать барьерный метод контрацепции в дополнение к препарату Мидиана® или перейти на любой другой метод контрацепции. Женщины, получающие постоянное лечение препаратами, содержащими активные вещества, влияющие на микросомальные ферменты печени, в течение 28 дней после их отмены дополнительно должны использовать негормональный метод контрацепции. Женщины, принимающие антибиотики (кроме рифампицина или гризеофульвина), должны временно использовать барьерный метод контрацепции в дополнение к комбинированному пероральному контрацептиву, как во время приема препарата, так и в течение 7 дней после его отмены. Если сопутствующее применение препарата начато в конце приема упаковки препарата Мидиана®, следующая упаковка должна быть начата без обычного перерыва в приеме.
Основной метаболизм дроспиренона в плазме человека осуществляется без вовлечения системы цитохрома Р450. Ингибиторы этой ферментной системы, таким образом, не влияют на метаболизм дроспиренона.
Влияние препарата Мидиана® на другие лекарственные препараты
Пероральные контрацептивы могут влиять на метаболизм других лекарственных средств. Кроме того, могут изменяться их концентрации в плазме и тканях – как повышаться (например, циклоспорин), так и снижаться (например, ламотриджин).
Основываясь на результатах исследований ингибирования in vitro и исследований взаимодействия in vivo у женщин-добровольцев, принимающих омепразол, симвастатин и мидазолам в качестве индикаторов-субстратов, влияние дроспиренона в дозе 3 мг на метаболизм других активных веществ маловероятно.
Другие взаимодействия
Имеется теоретическая возможность повышения концентрации сывороточного калия у женщин, получающих пероральные контрацептивы одновременно с другими лекарственными средствами, увеличивающими концентрацию калия в сыворотке крови: ингибиторы ангиотензинпревращающего фермента (АПФ), антагонисты рецепторов ангиотензина II, некоторые нестероидные противовоспалительные препараты (например, индометацин), калийсберегающие диуретики и антагонисты альдостерона. Однако в исследовании, оценивающем взаимодействие ингибитора АПФ с комбинацией дроспиренон+этинилэстрадиол у женщин с умеренной артериальной гипертензией, не было выявлено достоверного различия между сывороточными концентрациями калия у женщин, получавших эналаприл и плацебо.
Лабораторные исследования
Прием гормональных контрацептивов может влиять на результаты отдельных лабораторных тестов, включая биохимические показатели функции печени, щитовидной железы, надпочечников и почек, а также концентрацию транспортных белков плазмы, таких как кортикостероидсвязывающий глобулин и липидно/липопротеиновые фракции, показатели углеводного обмена, свертывания крови и фибринолиза. Изменения обычно происходят в пределах лабораторных норм.
Вследствие своей небольшой антиминералокортикоидной активности дроспиренон повышает активность ренина и концентрации альдостерона плазмы крови.
Особые указания
Меры предосторожности
Если какие-либо из состояний/факторов риска, указанных ниже, имеются в настоящее время, то следует тщательно взвешивать потенциальный риск и ожидаемую пользу применения комбинированного перорального контрацептива в каждом индивидуальном случае и обсудить его с женщиной до того, как она решит начать прием препарата. В случае утяжеления, усиления или первого проявления любого из этих состояний или факторов риска, женщина должна проконсультироваться со своим врачом, который может принять решение о необходимости отмены комбинированного перорального контрацептива.
Нарушения системы кровообращения
Частота венозной тромбоэмболии (ВТЭ) при использовании комбинированного перорального контрацептива с низкой дозой эстрогенов (< 50 мкг этинилэстрадиола, такие как, препарат Мидиана®) составляет примерно от 20 до 40 случаев на 100 000 женщин в год, что несколько выше, чем у женщин, не применяющих гормональные контрацептивы (от 5 до 10 случаев на 100 000 женщин), но ниже, чем у женщин во время беременности (60 случаев на 100 000 беременностей).
Дополнительный риск ВТЭ отмечается в течение первого года применения комбинированного перорального контрацептива. ВТЭ приводит к летальному исходу в 1-2 % случаев.
Эпидемиологические исследования также выявили связь между применением комбинированного перорального контрацептива и увеличением риска тромбоэмболии артерий. Описаны крайне редкие случаи тромбоза других кровеносных сосудов, например, печеночных, мезентериальных, почечных, сосудов головного мозга и сетчатки, как артерий, так и вен, у принимавших пероральные гормональные контрацептивы. Причинно-следственная связь возникновения данных побочных эффектов с приемом комбинированных пероральных контрацептивов не доказана.
Симптомы венозного или артериального тромбоза/тромбоэмболии или цереброваскулярного заболевания могут включать:
- Необычную одностороннюю боль и/или отек конечности;
- Внезапную сильную боль в груди, с или без иррадиации в левую руку;
- Внезапную одышку;
- Внезапный приступ кашля;
- Любую необычную, сильную, длительную головную боль;
- Внезапную частичную или полную потерю зрения;
- Диплопию;
- Нечленораздельную речь или афазию;
- Головокружение;
- Потерю сознания с или без судорожного припадка;
- Слабость или очень значительную потерю чувствительности, внезапно появившуюся с одной половины или в одной части тела;
- Двигательные нарушения;
- Симптом «острого живота».
Риск осложнений, связанных с ВТЭ при приеме комбинированного перорального контрацептива, увеличивается: - С возрастом;
- При наличии семейного анамнеза (венозной или артериальной тромбоэмболии у близких родственников или родителей в относительно молодом возрасте); если предполагается наследственная предрасположенность, женщине необходима консультация специалиста перед назначением комбинированного перорального контрацептива;
- После длительной иммобилизации, серьезного хирургического вмешательства, любой операции на ногах или обширной травмы. В этих ситуациях рекомендуется прекратить прием препарата (в случае плановой операции, по крайней мере, за четыре недели до нее) и не возобновлять прием в течение двух недель после окончания иммобилизации. Дополнительно возможно назначение антитромботической терапии, если прием пероральных гормональных контрацептивов не был прекращен в рекомендуемые сроки;
- При ожирении (индекс массы тела более 30 мг/м?);
Риск артериального тромбоза и тромбоэмболии при приеме комбинированного перорального контрацептива увеличивается:
- С возрастом;
- У курящих (женщинам старше 35 лет строго не рекомендуется курить, если они хотят применять комбинированные пероральные контрацептивы);
- При дислипопротеинемии;
- При артериальной гипертензии;
- При мигрени;
- При заболеваниях клапанов сердца;
- При фибрилляции предсердий.
Наличие одного из серьезных факторов риска или множественных факторов риска заболевания артерий или вен, соответственно, может быть противопоказанием. Женщины, применяющие комбинированные пероральные контрацептивы, должны немедленно обращаться к врачу при возникновении симптомов возможного тромбоза. В случаях подозрения на тромбоз или подтвержденного тромбоза прием комбинированного перорального контрацептива необходимо прекратить. Необходимо подобрать адекватный метод контрацепции вследствие тератогенности антикоагулянтной терапии (кумарины).
Следует учитывать повышенный риск тромбоэмболий в послеродовом периоде.
Другие заболевания, которые связаны с тяжелой сосудистой патологией, включают сахарный диабет, системную красную волчанку, гемолитико-уремический синдром, хронические воспалительные заболевания кишечника (болезнь Крона или язвенный колит) и серповидно-клеточную анемию.
Увеличение частоты и тяжести мигрени во время применения комбинированных пероральных контрацептивов (что может предшествовать цереброваскулярным нарушениям) может быть основанием для немедленного прекращения приема этих препаратов.
Опухоли
Самым значительным фактором риска развития рака шейки матки является инфицирование вирусом папилломы человека. В некоторых эпидемиологических исследованиях сообщалось о повышенном риске развития рака шейки матки при длительном применении комбинированных пероральных контрацептивов, однако сохраняются противоречивые мнения относительно того, в какой степени эти находки относятся к сопутствующим факторам, например, исследованию на наличие рака шейки матки или использованию барьерных методов контрацепции.
Мета-анализ 54 эпидемиологических исследований продемонстрировал, что имеется несколько повышенный относительный риск (ОР = 1,24) развития рака молочной железы, диагностированного у женщин, которые на момент исследования применяли комбинированные пероральные контрацептивы. Избыточный риск постепенно снижается в течение 10 лет после прекращения приема комбинированных пероральных контрацептивов. Поскольку рак молочной железы редко встречается у женщин моложе 40 лет, увеличение количества диагностированного в последние годы у женщин, принимавших или принимающих комбинированные пероральные контрацептивы, рака молочной железы является небольшим по отношению к общему риску развития рака молочной железы. Эти исследования не подтверждают причинно-следственной связи между приемом комбинированных пероральных контрацептивов и раком молочной железы. Наблюдаемое повышение риска может быть следствием более ранней диагностики рака молочной железы у женщин, применяющих комбинированные пероральные контрацептивы, биологическим эффектом комбинированных пероральных контрацептивов или комбинацией обоих вариантов. Раковые опухоли молочных желез у женщин, когда-либо принимавших комбинированные пероральные контрацептивы, были клинически менее выражены, чем у женщин, никогда их не принимавших.
В редких случаях на фоне применения комбинированных пероральных контрацептивов наблюдалось развитие доброкачественных опухолей печени, а в еще более редких – злокачественных. В отдельных случаях эти опухоли вызывали опасное для жизни внутрибрюшное кровотечение. При дифференциальной диагностике опухоли печени, нужно учитывать при появлении у женщины, принимающей комбинированные пероральные контрацептивы, сильной боли в верхних отделах живота, увеличения печени или признаков внутрибрюшного кровотечения.
Другие состояния
Прогестероновый компонент в препарате Мидиана® является антагонистом альдостерона, со свойством задерживать калий. В большинстве случаев не отмечается увеличения концентрации калия. Однако в клиническом исследовании у некоторых пациентов со слабой или умеренной почечной недостаточностью и одновременным назначением задерживающих калий лекарственных препаратов, при приеме дроспиренона концентрация калия в сыворотке незначительно, но увеличивалась. Таким образом, рекомендуется проверять концентрацию калия в сыворотке крови в первом цикле приема препарата у пациентов с почечной недостаточностью и значениями концентрации калия до лечения на верхней границе нормы, а также при одновременном применении лекарственных препаратов, задерживающих калий в организме.
У женщин с гипертриглицеридемией или семейным анамнезом по гипертриглицеридемии нельзя исключить повышение риска развития панкреатита во время приема комбинированных пероральных контрацептивов.
Хотя небольшое повышение артериального давления было описано у многих женщин, принимающих комбинированные пероральные контрацептивы, клинически значимые повышения отмечались редко. Только в редких случаях необходимо немедленное прекращение приема комбинированных пероральных контрацептивов. Если во время приема комбинированных пероральных контрацептивов у пациенток с артериальной гипертензией значения артериального давления постоянно повышены или не снижаются при приеме гипотензивных препаратов, прием комбинированных пероральных контрацептивов необходимо прекратить. При необходимости, прием комбинированных пероральных контрацептивов может быть продолжен, если с помощью гипотензивной терапии достигнуты нормальные значения артериального давления.
Следующие состояния развиваются или ухудшаются как во время беременности, так и при приеме комбинированных пероральных контрацептивов, но их связь с приемом комбинированных пероральных контрацептивов не доказана: желтуха и/или зуд, связанный с холестазом; формирование камней в желчном пузыре; порфирия; системная красная волчанка; гемолитико-уремический синдром; хорея Сиденгама; герпес во время беременности в анамнезе; потеря слуха, связанная с отосклерозом.
У женщин с наследственным ангионевротическим отеком экзогенные эстрогены могут вызвать или усилить симптомы ангионевротического отека.
При острых или хронических нарушениях функции печени может потребоваться прекращение применения комбинированных пероральных контрацептивов до тех пор, пока показатели функции печени не вернутся в норму. Рецидивирующая холестатическая желтуха и/или вызванный холестазом зуд, которые развиваются впервые во время беременности или предыдущего приема половых гормонов, требует прекращения приема комбинированных пероральных контрацептивов.
Хотя комбинированные пероральные контрацептивы могут оказывать влияние на периферическую резистентность к инсулину и толерантность к глюкозе, нет необходимости изменения терапевтического режима у больных сахарным диабетом, применяющих низкодозированные комбинированные пероральные контрацептивы (содержащие < 0,05 мг этинилэстрадиола). Тем не менее, женщины с сахарным диабетом должны тщательно наблюдаться врачом, особенно в начале приема комбинированных пероральных контрацептивов.
Также сообщалось об усилении эндогенной депрессии, эпилепсии, болезни Крона и язвенного колита при применении комбинированных пероральных контрацептивов. Иногда может развиваться хлоазма, особенно у женщин с хлоазмой во время беременности в анамнезе. Женщины со склонностью к хлоазме во время приема комбинированных пероральных контрацептивов должны избегать длительного пребывания на солнце и воздействия ультрафиолетового излучения.
Лекарственный препарат Мидиана® содержит 48,17 мг лактозы в одной таблетке. Пациенты с наследственной непереносимостью галактозы, лактазной недостаточностью или нарушениями всасывания глюкозы/галактозы, находящиеся на безлактозной диете, не должны принимать препарат.
Медицинское обследование/консультация
Перед началом применения гормональных контрацептивов необходимо проконсультироваться с лечащим гинекологом и пройти соответствующее медицинское обследование. Дальнейшее наблюдение и частота медицинских осмотров проводятся в индивидуальном порядке, но не реже 1 раза в 6 месяцев. Препарат Мидиана®, как и другие комбинированные пероральные контрацептивы, не предохраняет от ВИЧ-инфекции и других заболеваний, передающихся половым путем.
Снижение эффективности
Эффективность комбинированных пероральных контрацептивов может снижаться в случае пропуска таблеток, расстройств желудочно-кишечного тракта или при одновременном приеме других медицинских препаратов.
Контроль уменьшенного цикла
На фоне приема комбинированных пероральных контрацептивов могут отмечаться нерегулярные кровотечения (мажущие кровянистые выделения или прорывные маточные кровотечения), особенно в течение первых месяцев применения. Поэтому оценка любых нерегулярных кровотечений является значимой только после периода адаптации, составляющего, приблизительно, три цикла.
Если нерегулярные кровотечения повторяются или развиваются после предшествующих регулярных циклов, то должны быть рассмотрены негормональные причины и осуществлены адекватные диагностические мероприятия для исключения злокачественных новообразований или беременности. Они могут включать диагностическое выскабливание.
У некоторых женщин кровотечение «отмены» может не развиваться во время перерыва в приеме комбинированных пероральных контрацептивов. Если комбинированные пероральные контрацептивы принимались согласно указанным в инструкции правилам приема препарата, то наступление беременности маловероятно. Тем не менее, если до этого комбинированные пероральные контрацептивы принимались нерегулярно или, если отсутствуют подряд два кровотечения «отмены», до продолжения приема комбинированных пероральных контрацептивов должна быть исключена беременность.
Влияние на способность управления транспортными средствами и работу с техникой
Исследований, изучающих влияние препарата на способность вождения автомобиля, не проводилось.