Москва – 2016
Введение
Введение
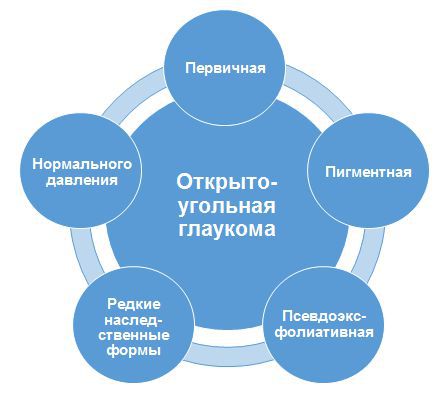
1.1. Первичная открытоугольная глаукома (ПОУГ)
1.1.1. Первичная открытоугольная глаукома (ПОУГ)
1.1.2. Глаукома нормального давления (ГНД)
1.1.3. Псевдоэксфолиативная глаукома (ПЭГ)
1.1.4. Пигментная глаукома (ПГ)
1.2. Глаукомы детского возраста
Введение
1.2.1. Первичная врожденная глаукома
1.2.2. Первичная инфантильная врожденная глаукома
1.2.3. Первичная ювенильная врожденная глаукома
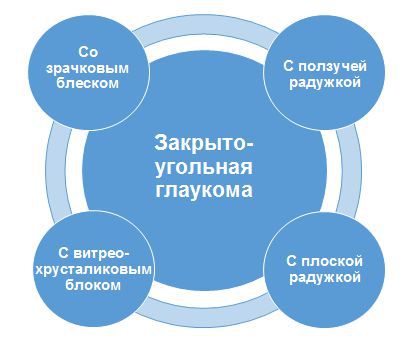
1.3. Первичная закрытоугольная глаукома
Введение
1.3.1. Закрытоугольная глаукома со зрачковым блоком
1.3.2. Закрытоугольная глаукома с плоской радужкой
1.3.3. Закрытоугольная глаукома с укорочением угла
передней камеры («ползучая глаукома»)
1.3.4. Глаукома с витреохрусталиковым блоком
(злокачественная глаукома)
1.3.5. Острый приступ закрытоугольной глаукомы (опг)
…показать весь список раздела, всего: 7 статей
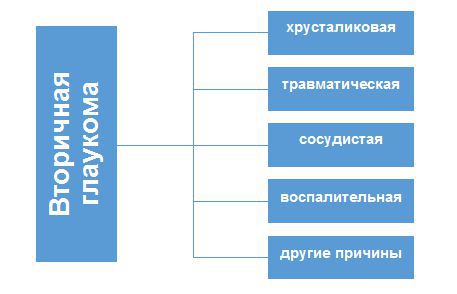
1.4. Вторичная глаукома
1.4.1. Воспалительная глаукома
1.4.2. Факогенная глаукома
1.4.3. Сосудистая глаукома
1.4.4. Травматическая (посттравматическая) глаукома
1.4.5. Медикаментозно-индуцированная (стероидная)
глаукома
1.5. Редкие формы глаукомы
Введение
1.5.1 Особенности эмбрио- и герантогенеза
иридоцилиарной системы, обусловливающие
формирование глаукомы
1.6. Приложение. глаукома и сочетанная патология
1.6.1. Рефрактерная глаукома
1.6.2. Азиатская глаукома
1.6.3. Глаукома и рефракция глаза
1.6.4. Тактика лечения глаукомы при катаракте
1.6.5. Глаукома при беременности
1.6.6. Глаукома и сахарный диабет
…показать весь список раздела, всего: 7 статей
1.7. Референтный диагноз
1.7. Референтный диагноз
Заключение
Заключение
Терминология и сокращения
Терминология и сокращения
Руководство издано и одобрено Межнациональным экспертным советом по проблемам глаукомы. Руководство разработано на основе консенсуса всех авторов. Том 2 содержит современное представление о различных формах глаукомы.
Руководство предназначено для обучающихся в системе послевузовского профессионального образования, студентам медицинских вузов, врачам общей практики и офтальмологам.
УДК 617.7-007.681(083.13)
ББК 56.7
ISBN 978-5-903624-35-5
Редакционная коллегия
Межнациональный экспертный совет по проблемам глаукомы
Алябьева Ж.Ю. (Россия)
Брежнев А.Ю. (Россия)
Веселовская Н.Н. (Украина)
Гришина Е.Е. (Россия)
Жеребки И.В. (Украина)
Кухар Н.В. (Украина)
Липатов Д.В. (Россия)
Егоров Е.А. (Россия) – председатель
Ботабекова Т.К. (Казахстан) — сопредседатель
Веселовская З.Ф. (Украина) — сопредседатель
Еричев В.П. (Россия) — сопредседатель
Куроедов А.В. (Россия) — ученый секретарь
Астахов Ю.С. (Россия)
Бездетко П.А. (Украина)
Бржеский В.В. (Россия)
Витовская О.П. (Украина)
Восканян Л.А. (Армения)
Головачев О.Г. (Грузия)
Джумова М.Ф. (Беларусь)
Жабоедов Г.Д. (Украина)
Завгородняя Н.Г. (Украина)
Иванова Н.В. (Украина)
Иманбаева С.С. (Кыргызстан)
Касимов Э.М. (Азербайджан)
Курилина Е.И. (Украина)
Куртов Б. К. (Таджикистан)
Кушнир В.Н. (Молдова)
Малаян А.С. (Армения)
Марченко Л.Н. (Беларусь)
Медведев М.А. (Кыргызстан)
Оганесян А.А. (Украина)
Садыкова Д.Н. (Таджикистан)
Сидиков З. У. (Узбекистан)
Ходжаев Н.С. (Россия)
Дополнительно привлеченные авторы (эксперты)
Пархоменко Е.Г. (Украина)
Петренко О.В. (Украина)
Рябцева А.А. (Россия)
Страхов В.В. (Россия)
Щуко А.Г. (Россия)
Юрьева Т.Н. (Россия)
Москва – 2016
© Межнациональный экспертный совет по проблемам глаукомы Россия, Азербайджан, Армения, Беларусь, Грузия, Казахстан, Кыргызстан, Молдова, Таджикистан, Туркменистан, Узбекистан, Украина, 2016
М.: Изд-во «Офтальмология», 2016.
Просмотров: 5387
Содержание:
1.1. Первичная открытоугольная глаукома (ПОУГ)
1.1.1.Первичная открытоугольная глаукома (ПОУГ)
1.1.1.1.Подозрение на первичную открытоугольную глаукому
1.1.1.2.Гипертензия глаза (офтальмогипертензия, ОГ)
1.1.1.2.1. ложная (РГО)
1.1.1.2.2. эссенциальная (РГО)
1.1.1.2.3. симптоматическая (РГО)
1.1.2.Глаукома нормального давления (ГНД)
1.1.3.Псевдоэксфолиативная глаукома (ПЭГ)
1.1.4.Пигментная глаукома (ПГ)
1.2. Глаукомы детского возраста
1.2.1.Первичная врожденная глаукома
1.2.2.Первичная инфантильная врожденная глаукома
1.2.3.Первичная ювенильная врожденная глаукома
1.3. Первичная закрытоугольная глаукома (ПЗУГ)
1.3.1.Первичная закрытоугольная глаукома со зрачковым блоком
1.3.2.Первичная закрытоугольная глаукома с плоской радужкой
1.3.3.«Ползучая» закрытоугольная глаукома
1.3.4.Первичная закрытоугольная глаукома с витреохруста-ликовым блоком
1.3.5.Острый приступ закрытоугольной глаукомы
1.3.6.Подострый приступ закрытоугольной глаукомы
1.4. Вторичная глаукома
1.4.1.Воспалительная глаукома
1.4.1.1.Глаукомоциклитический криз (синдром Краупа — Познера — Шлоссманна)
1.4.1.2. Увеит Фукса
1.4.2. Факогенная глаукома
1.4.2.1. Факотопическая глаукома
1.4.2.2. Факоанафилактическая глаукома
1.4.2.3. Глаукома «хрусталиковых масс»
1.4.2.4. Факоморфическая глаукома
1.4.2.5. Факолитическая глаукома
1.4.3. Сосудистая глаукома
1.4.3.1.Неоваскулярная глаукома
1.4.3.2.Флебогипертензивная глаукома
1.4.4.Травматическая (посттравматическая) глаукома
1.4.5.Медикаментозно-индуцированная (стероидная) глаукома
1.5. Редкие формы глаукомы
1.5.1 Особенности эмбрио и герантогенеза иридоцилиарной системы, обусловливающие формирование глаукомы
1.5.1.1.Глаукомы, ассоциированные с альтерацией радужной оболочки
1.5.1.1.1.Глаукома, связанная с врожденными аномалиями (аниридия, нейрофиброматоз)
1.5.1.1.2.Глаукома, связанная с мезенхимальным дисгенезом (задний эмбриотоксон, синдром Аксенфельда, синдром Ригера, синдром Петерса, синдром Франк – Каменецкого)
1.5.1.1.3.Вторичная закрытоугольная глаукома с прогрессирующим формированием эндотелиальной мембраны (иридокорнеальный эндотелиальный синдром, синдром Чандлера, синдром Когана – Риза, прогрессирующая эссенциальная мезодермальная атрофия радужки)
1.6. Приложение. Глаукома и сочетанная патология
1.6.1.Рефрактерная глаукома
1.6.2.«Азиатская» глаукома
1.6.3.Глаукома и рефракция глаза
1.6.3.1. Глаукома и миопия
1.6.3.2. Глаукома и гиперметропия
1.6.4.Тактика лечения глаукомы при катаракте
1.6.4.1.Глаукома афакичного и артифактичного глаза
1.6.5.Современные аспекты лечения глаукомы при беременности
1.6.6.Глаукома и сахарный диабет
1.6.6.1. Вторичная неоваскулярная глаукома
1.6.6.2. Взаимосвязь между сахарным диабетом и глаукомой
1.6.7.Особенности первичной открытоугольной глаукомы у больных злокачественными опухолями
1.7.Проблемы референтного диагноза глаукома
1. Marx-Gross S., Laubert-Reh D., Schneider A., Höhn R., Mirshahi A., Münzel T., Wild P.S., Beutel M.E., Blettner M., Pfeiffer N. The prevalence of glaucoma in young people. Dtsch Arztebl Int. 2017; 114:204-210. https://doi.org/10.3238/arztebl.2017.0204
2. Mathew S., Harris A., Ridenour C.M.,et al Management of glaucoma in pregnancy. J. Glaucoma. 2019; 28:937-944. https://doi.org/10.1097/IJG.0000000000001456
3. Strelow B., Fleischman D. Glaucoma in pregnancy: An update. Curr. Opin. Ophthalmol. 2020; 31:114-122. https://doi.org/10.1097/ICU.0000000000000641
4. Colãs-Tomãs T, López Tizón E. Ex-PRESS mini-shunt implanted in a pregnant patient with iridocorneal endothelial syndrome. Eur J Ophthalmol 2020; 30:NP25-NP28 https://doi.org/10.1177/1120672118820508
5. Razeghinejad MR, Masoumpour M, Eghbal MH, et al. Glaucoma surgery in pregnancy: A case series and literature review. Iran J Med Sci 2016; 41:437-445.
6. Tham Y-C, Li X, Wong TY, et al. Global prevalence of glaucoma and projections of glaucoma burden through 2040. Ophthalmology 2014; 121:2081–2090. https://doi.org/10.1016/j.ophtha.2014.05.013
7. Vaideanu D, Fraser S. Glaucoma management in pregnancy: A questionnaire survey. Eye 2007; 21:341-343. https://doi.org/10.1038/sj.eye.6702193
8. Kapetanakis V, Chan MP, Foster PJ, et al. Global variations and time trends in the prevalence of primary open angle glaucoma (POAG): a systematic review and meta-analysis. Br J Ophthalmol 2016; 100: 86-93. https://doi.org/10.1136/bjophthalmol-2015-307223
9. Green K., Phillips C.I., Cheeks L., Slagle T. Aqueous humor flow rate and intraocular pressure during and after pregnancy. Ophthalmic Res 1988; 20:353-357. https://doi.org/10.1159/000266751.
10. Wang C., Li A.L., Pang Y., Lei Y.Q., Yu L. Changes in intraocular pressure and central corneal thickness during pregnancy: A systematic review and Meta-analysis. Int J Ophthalmol 2017; 10:1573-1579. https://doi.org/10.18240/ijo.2017.10.15
11. Akar Y., Yucel I., Akar M.E., Zorlu G., Ari E.S. Effect of pregnancy on intraobserver and intertechnique agreement in intraocular pressure measurements. Ophthalmologica 2005; 219:36-42. https://doi.org/10.1159/000081781
12. Qureshi I.A., Xi X.R., Yaqob T. The ocular hypotensive effect of late pregnancy is higher in multigravidae than in primigravidae. Graefes Arch Clin Exp Ophthalmol 2000; 238:64-67. https://doi.org/10.1007/s004170050011
13. Tolunay HE, Özcan SC, Şükür YE, et al. Changes of intraocular pressure in different trimesters of pregnancy among Syrian refugees in Turkey: a cross-sectional study. Turk J Obstet Gynecol 2016; 13:67-70. https://doi.org/10.4274/tjod.40221
14. Kumari, Rashmi et al. “Management of glaucoma in pregnancy — balancing safety with efficacy.” Therapeutic advances in ophthalmology 2021; 13. https://doi.org/10.1177/25158414211022876
15. Paramjyothi P, Lakshmi ANR, Surekha D, et al. Physiological changes of intraocular pressure (IOP) in the second and third trimesters of normal pregnancy. J Clin Diagn Res 2011; 31:364-366.
16. Omoti AE, Waziri-Erameh JM, Okeigbemen VM. A review of the changes in the ophthalmic and visual system in pregnancy. Afr J Reprod Health 2008; 12:185-196.
17. Tehrani S. Gender difference in the pathophysiology and treatment of glaucoma. Curr Eye Res 2015; 40:191-200. https://doi.org/10.3109/02713683.2014.968935
18. Efe YK, Ugurbas SC, Alpay A, et al. The course of corneal and intraocular pressure during pregnancy. Can J Ophthalmol 2012; 47:150-154. https://doi.org/10.1016/j.jcjo.2012.01.004
19. Razeghinejad M.R., Tania Tai T.Y., Fudemberg S.J., Katz L.J. Pregnancy and glaucoma. Surv Ophthalmol 2011;56:324-335. https://doi.org/10.1016/j.survophthal.2010.11.008
20. Drake S.C., Vajaranant T.S. Evidence-based approaches to glaucoma management during pregnancy and lactation. Curr Ophthalmol Rep 2016; 4:198-205. https://doi.org/10.1007/s40135-016-0112-1
21. Garg P, Aggarwal P. Ocular changes in pregnancy. Nepal J Ophthalmol 2012; 4:150-161. https://doi.org/10.3126/nepjoph.v4i1.5867
22. Qureshi IA, Xi XR, Wu XD. Intraocular pressure trends in pregnancy and in the third trimester hypertensive patients. Acta Obstet Gynecol Scand 1996; 75:816-819. https://doi.org/10.3109/00016349609054709
23. Chawla S, Chaudhary T, Aggarwal S, et al. Ophthalmic considerations in pregnancy. Med J Armed Forces India 2013; 69:278-284. https://doi.org/10.1016/j.mjafi.2013.03.006
24. Dima AM. Eye and the pregnacy. Oftalmologia 2012; 56:20-26
25. Mendez-Hernandez C, Garcia-Feijoo J, Saenz-Frances F, et al. Topical intraocular pressure therapy effects on pregnancy. Clin Ophthalmol 2012; 6:1629-1632. https://doi.org/10.2147/OPTH.S36712
26. Егоров Е.А. и др. Межнациональное руководство по глаукоме. Том 2. Клиника глаукомы. Москва: 2016; 162-170
27. Coleman AL, Mosaed S, Kamal D. Medical therapy in pregnancy. J Glaucoma 2005; 14:414-416. https://doi.org/10.1097/01.ijg.0000177214.39244.da
28. Maul H, Longo M, Saade G, et al. Nitric oxide and its role during pregnancy: from ovulation to delivery. Curr Pharm Des 2003; 9:359-380. https://doi.org/10.2174/1381612033391784
29. Zimmerman TJ, Kooner KS, Kandarakis AS, et al. Improving the therapeutic index of topically applied ocular drugs. Arch Ophthalmol 1984; 102:551-553. https://doi.org/10.1001/archopht.1984.01040030429017
30. European Glaucoma Society. Terminology and guidelines for glaucoma, 4th Edition. Br J Ophthalmol 2017; 101:1-195.
31. Law R, Bozzo P, Koren G, et al. FDA pregnancy risk categories and the CPS: do they help or are they a hindrance? Can Fam Physician 2010; 56: 239-241.
32. Coroi MC, Bungau S, Tit M. Preservatives from the eye drops and the ocular surface. Rom J Ophthalmol 2015; 59(1):2-5.
33. da Silva Dal Pizzol T, Knop FP, Mengue SS. Prenatal exposure to misoprostol and congenital anomalies: systematic review and meta-analysis. Reprod Toxicol 2006; 22:666-671. https://doi.org/10.1016/j.reprotox.2006.03.015
34. Karim S.M. Physiological rôle of prostaglandins in the control of parturition and menstruation. J Reprod Fertil Suppl 1972; 16 Suppl. 16: 105–111. https://doi.org/10.1111/j.1749-6632.1971.tb53216.x
35. Sideris E.B., Yokochi K., Coceani F., Olley P.M. Prostaglandins and fetal cardiac output distribution in the lamb. Am. J. Physiol 1985; 248(6 Pt. 2):H853-858. https://doi.org/10.1152/ajpheart.1985.248.6.H853
36. Pellegrino M, D’Oria L, DeLuca C, et al. Glaucomadrugtherapy in pregnancy: literature review and teratology information service (TIS) case series. Curr Drug Saf 2018; 13:3-11. https://doi.org/10.2174/1574886312666171030125804
37. De Santis M., Lucchese A., Carducci B. et al. Latanoprost exposure in pregnancy. Am. J. Ophthalmol 2004; 138(2):305-306. https://doi.org/10.1016/j.ajo.2004.03.002
38. Printz M.P., Skidgel R.A., Friedman W.F. Studies of pulmonary prostaglandin biosynthetic and catabolic enzymes as factors in ductus arteriosus patency and closure. Evidence for a shift in products with gestational age. Pediatr Res 1984; 18(1):19-24.
39. Bausch+Lomb. VYZULTA (latanoprostene bunod ophthalmic solution) 0.024% [package insert]. Silver Spring, MD: US Food and Drug Administration, 2017.
40. Hoy SM. Latanoprostene Bunod Ophthalmic Solution 0.024%: a review in open-angle glaucoma and ocular hypertension. Drugs 2018; 78:773-780. https://doi.org/10.1007/s40265-018-0914-6
41. Weinreb RN, Ong T, Scassellati Sforzolini B, et al. A randomised, controlled comparison of latanoprostene bunod and latanoprost 0.005% in the treatment of ocular hypertension and open angle glaucoma: the VOYAGER study. Br J Ophthalmol 2015; 99: 738-745. https://doi.org/10.1136/bjophthalmol-2014-305908
42. Salim S. Glaucoma in pregnancy. Curr Opin Ophthalmol 2014; 25:93-97. https://doi.org/10.1097/ICU.0000000000000029
43. Naderan M. Ocular changes during pregnancy. J Curr Ophthalmol. 2018; 30(3):202-210. https://doi.org/10.1016/j.joco.2017.11.012
44. Schlote T. Mode of action, clinical profile and significance of betablockers in antiglaucoma therapy. Klin Monbl Augenheilkd 2013; 230:120-126. https://doi.org/10.1055/s-0032-1327784
45. Özcan KS, Güng B, Osmonov D, et al. Management and outcome of topical betablocker-induced atrioventricular block. Cardiovasc J Afr 2015; 26:210-213. https://doi.org/10.5830/CVJA-2015-030
46. Ersbøll AS, Hedegaard M, Søndergaard L, et al. Treatment with oral beta-blockers during pregnancy complicated by maternal heart disease increases the risk of fetal growth restriction. BJOG 2014; 121:618-626. https://doi.org/10.1111/1471-0528.12522
47. Xie RH, Guo Y, Krewski D, et al. Beta-blockers increase the risk of being born small for gestational age or of being institutionalised during infancy. BJOG 2014; 121:1090-1096. https://doi.org/10.1111/1471-0528.12678
48. Rayburn W.F., Zuspan F.P. Drug therapy in obstetrics and gynecology. 3rd ed. St. Louis, Mosby Year Book, 1992. pp. 194-197.
49. Brauner SC, Chen TC, Hutchinson BT, et al. The course of glaucoma during pregnancy: a retrospective case series. Arch Ophthalmol 2006; 124:1089-1094. https://doi.org/10.1001/archopht.124.8.1089
50. Ho JD, Hu CC, Lin HC. Antiglaucoma medications during pregnancy and the risk of low birth weight: a population-based study. Br J Ophthalmol 2009; 93:1283-1286. https://doi.org/10.1136/bjo.2008.157123
51. Киселева О.А., Якубова Л.В., Бессмертный А.М. Бета-блокаторы в современной терапии глаукомы. Обзор. Офтальмология 2013; 10(2):20-23.
52. Razeghinejad MR, Nowroozzadeh MH. Anti-glaucoma medication exposure in pregnancy: an observational study and literature review. Clin Exp Optom 2010; 93:458-465. https://doi.org/10.1111/j.1444-0938.2010.00526.x
53. Madadi P, Koren G, Freeman DJ, et al. Timolol concentrations in breast milk of a woman treated with glaucoma: calculation of neonatal exposure. J Glaucoma 2008; 17:329331. https://doi.org/10.1097/IJG.0b013e31815c3a5b
54. Wagenvoort AM, van Vugt JM, Sobotka M, et al. Topical timolol therapy in pregnancy: is it safe for the fetus. Teratology 1998; 58:258-262. https://doi.org/10.1002/(SICI)1096-9926(199812)58:6<258::AIDTERA7>3.0.CO;2-B
55. Brauner SC, Chen TC, Hutchinson BT, et al. The course of glaucoma during pregnancy: a retrospective case series. Arch Ophthalmol 2006; 124:1089-1094. https://doi.org/10.1001/archopht.124.8.1089
56. Morselli PL, Boutroy MJ, Bianchetti G, et al. Placental transfer and perinatal pharmacokinetics of betaxolol. Eur J Clin Pharmacol 1990; 38:477-483. https://doi.org/10.1007/BF02336687
57. Chung C.Y., Kwok A.K., Chung K.L. Use of ophthalmic medications during pregnancy. Hong Kong Med J 2004; 10:191-195.
58. Kuzelová M., Jurinová J., Jencová D. et al. Development of a withdrawal syndrome in a neonate after long-term therapy of the mother with metipranolol during pregnancy. Cesk Pediatr 1993; 48(10):608-610.
59. Киселева О.А., Якубова Л.В., Косакаян С.М. Василенкова Л.В. Влияние гипотензивных препаратов на течение беременности у пациенток с глаукомой: данные экспериментальных и клинических наблюдений. Эффективная фармакотерапия. Офтальмология 2018. 3(28):20–26.
60. American Academy of Pediatrics Committee on Drugs. Transfer of drugs and other chemicals into human milk. Pediatrics 2001; 108(3):776-789. https://doi.org/10.1542/peds.108.3.776.
61. Rama Sastry BV, Olubadewo J, Harbison RD, et al. Human placental cholinergic system. Occurrence, distribution and variation with gestational age of acetylcholine in human placenta. Biochem Pharmacol 1976; 25:425-431. https://doi.org/10.1016/0006-2952(76)90345-2
62. Walter L. The teratogenic activity of pilocarpine, pilocarpidine and their isomers, with special reference to the importance of steric configuration. J Exper 1956; 132:39-50.
63. King R.G., Gude N.M., Krishna B.R. et al. Human placental acetylcholine. Reprod Fertil Dev 1991; 3(4):405-411. https://doi.org/10.1071/rd9910405
64. Keränen A, Nykänen S, Taskinen J. Pharmacokinetics and side-effects of Clonidine. Eur J Clin Pharmacol 1978; 13:97-101. https://doi.org/10.1007/BF00609752
65. Holmes L.B., Kawanishi H., Munoz A. Acetazolamide: maternal toxicity, pattern of malformations, and litter effect. Teratology 1988; 37(4):335-342. https://doi.org/10.1002/tera.1420370407
66. Lee AG, Pless M, Falardeau J, et al. The use of acetazolamide in idiopathic intracranial hypertension during pregnancy. Am J Ophthalmol 2005; 139(5):855-859. https://doi.org/10.1016/j.ajo.2004.12.091
67. Rosenfeld C.R., Barton M.D., Meschia G. Effects of epinephrine on distribution of blood flow in the pregnant ewe. Am J Obstet. Gynecol 1976; 124(2):156-163. https://doi.org/10.1016/s0002-9378(16)33292-6
68. Netland P. Glaucoma medical therapy: principles and management. 2nd ed. New York, Oxford University Press, 2008. https://doi.org/10.1016/S0079-6123(08)01113-8
69. Wang SK, Chang RT. An emerging treatment option for glaucoma: Rho kinase inhibitors. Clin Ophthalmol 2014; 8:883-890. https://doi.org/10.2147/OPTH.S41000
70. Sethi HS, Naik M, Gupta VS. Management of glaucoma in pregnancy: risks or choices, a dilemma? Int J Ophthalmol 2016; 9:1684-1690. https://doi.org/10.18240/ijo.2016.11.24
71. Gardey-Levassort C., Ventura M.A., Thiroux G. et al. An attempt to identify – adrenoceptors in the human placenta. Dev Pharmacol Ther 1984; 7(1):85-88. https://doi.org/10.1159/000457233
72. Ozawa H, Azuma E, Shindo K, et al. Transient renal tubular acidosis in a neonate following transplacental acetazolamide. Eur J Pediatr 2001; 160: 321-322. https://doi.org/10.1007/pl00008441
73. Product information. Trusopt. Merck, 1999. West Point, PA. (Manufacturer’s information: Trusopt product monograph. Pennsylvania: Merck & Co Inc, West Point, 1999).
74. Hoffmanovã I, Sãnchez D. Metabolic acidosis and anaemia associated with dorzolamide in a patient with impaired renal function. Br J Clin Pharmacol 2018; 84:796-799. https://doi.org/10.1111/bcp.13499
75. Capino AC, Dannaway DC, Miller JL. Metabolic acidosis with ophthalmic dorzolamide in a neonate. J Pediatr Pharmacol Ther 2016; 21:256-259. https://doi.org/10.5863/1551-6776-21.3.256
76. Al-Saleem AI, Al-Jobair AM. Possible association between acetazolamide administration during pregnancy and multiple congenital malformations. Drug Des Devel Ther 2016; 10:1471-1476. https://doi.org/10.2147/DDDT.S99561
77. Falardeau J, Lobb BM, Golden S, et al. The use of acetazolamide during pregnancy in intracranial hypertension patients. J Neuroophthalmol 2013; 33:9-12. https://doi.org/10.1097/WNO.0b013e3182594001
78. Worsham G.F., Beckman E.N., Mitchell E.H. Sacrococcygeal teratoma in a neonate. Association with maternal use of acetazolamide. JAMA 1978; 240(3):251-252.
79. Mcbride W.G. The teratogenic action of drugs. Med. J. Aust 1963; 2:689-692.
80. Dieckmann W.J., Harrod J., Monardo A. The treatment of pre-eclamptic edema with acetazoleamide (diamox). Am J Obstet Gynecol 1957; 73(4):789-800. https://doi.org/10.1016/0002-9378(57)90388-5
81. Merlob P., Litwin A., Mor N. Possible association between acetazolamide administration during pregnancy and metabolic disorders in the newborn. Eur J Obstet Gynecol Reprod Biol 1990; 35(1):85-88. https://doi.org/10.1016/0028-2243(90)90146-r
82. Crane C.H. Effect on fetus of mother taking a diuretic. JAMA 1957; 165. https://doi.org/10.1097/MD.0000000000013185
83. Aerie Pharmaceuticals. Rhopressa (netarsudil ophthalmic solution) 0.02% [package insert]. Silver Spring, MD: US Food and Drug Administration, 2017.
84. Ergul M, Turgut NH, Sarac B, et al. Investigating the effects of the Rho-kinase enzyme inhibitors AS1892802 and fasudil hydrochloride on the contractions of isolated pregnant rat myometrium. Eur J Obstet Gynecol Reprod Biol 2016; 202:45-50. https://doi.org/10.1016/j.ejogrb.2016.04.031
85. Tahara M, Kawagishi R, Sawada K, et al. Tocolytic effect of a Rhokinase inhibitor in a mouse model of lipopolysaccharide-induced preterm delivery. Am J Obstet Gynecol 2005; 192:903-908. https://doi.org/10.1016/j.ajog.2004.09.016
86. Sherwood M.B., Migdal C.S., Hitchings R.A. et al. Initial treatment of glaucoma: surgery or medications. Surv Ophthalmol 1993; 37(4): 293-305.
87. Výborný P, Sičáková S, Flórová Z, et al. [Selective laser trabeculoplasty — Implication for medicament glaucoma treatment interruption in pregnant and breastfeeding women]. Cesk Slov Oftalmol 2017; 73:61-63.
88. Migdal C.S., Gregory W., Hitchings R. Long-term functional outcome after early surgery compared with laser and medicine in open-angle glaucoma. Ophthalmology 1994. 101(10):1651-1656. https://doi.org/10.1016/s0161-6420(94)31120-1
89. McIlraith I, Strasfeld M, Colev G, et al. Selective laser trabeculoplasty as initial and adjunctive treatment for open-angle glaucoma. J Glaucoma 2006; 15:124-130. https://doi.org/10.1097/00061198-200604000-00009
90. Wertheim M, Broadway DC. Cyclodiode laser therapy to control intraocular pressure during pregnancy. Br J Ophthalmol 2002; 86:1318-1319. https://doi.org/10.1136/bjo.86.11.1318
91. Fudemberg SJ, Myers JS, Katz LJ. Trabecular meshwork tissue examination with scanning electron microscopy: a comparison of micropulse diode laser (MLT), selective laser (SLT), and argon laser (ALT) trabeculoplasty in human cadaver tissue. Investig Ophthalmol Vis Sci 2008; 49:1236.
92. Johnson SM, Martinez M. Management of glaucoma in pregnancy and lactation. Surv Ophthalmol 2001; 45:449-454. https://doi.org/10.1016/s0039-6257(00)00209-5
93. Zehavi-Dorin T, Heinecke E, Nadkarni S, et al. Bilateral consecutive Xen gel stent surgery during pregnancy for uncontrolled early-onset primary open angle glaucoma. Am J Ophthalmol Case Rep 2019; 15:100510. https://doi.org/10.1016/j.ajoc.2019.100510
94. Ayyala RS, Zurakowski D, Smith JA, et al. A clinical study of the Ahmed glaucoma valve implant in advanced glaucoma. Ophthalmology 1998; 105:1968-1976. https://doi.org/10.1016/S0161-6420(98)91049-1
95. Flach A.J. The importance of eyelid closure and nasolacrimal occlusion following the ocular instillation of topical glaucoma medications, and the need for the universal inclusion of one of these techniques in all patient treatments and clinical studies. Trans Am Ophthalmol Soc 2008; 106:138-145.
96. Emanuel ME, Gedde SJ. Indications for a systemic work-up in glaucoma. Can J Ophthalmol 2014; 49:506-511. https://doi.org/10.1016/j.jcjo.2014.10.001
97. Nouri-Mahdavi K, Caprioli J. Evaluation of the hypertensive phase after insertion of the Ahmed Glaucoma Valve. Am J Ophthalmol 2003; 136:1001-1008. https://doi.org/10.1016/s0002-9394(03)00630-5
98. Pitukcheewanont O, Tantisevi V, Chansangpetch S, et al. Factors related to hypertensive phase after glaucoma drainage device implantation. Clin Ophthalmol 2018; 12: 1479-1486. https://doi.org/10.2147/OPTH.S166244
99. Lu LJ, Hall L, Liu J. Improving glaucoma surgical outcomes with adjunct tools. J Curr Glaucoma Pract 2018; 12:19-28. https://doi.org/10.5005/jp-journals-10028-1239
100. Heinonen OP, Sloane D, Shapiro S. Birth defects and drugs in pregnancy. Littleton, MA: Publishing Science Group, 1977, 357-365
101. Moore PA. Selecting drugs for the pregnant dental patient. J Am Dent Assoc 1998; 129:1281-1286. https://doi.org/10.14219/jada.archive.1998.0425
102. Zeyen T, Coppens G. Medical treatment: the pregnant and nursing woman. In: Giaconi JA, Law SK, Coleman AL, et al. (eds) Pearls of glaucoma management. Berlin, Springer, 2010. 203-205.
103. Morris S, Geh V, Nischal KK, et al. Topical dorzolamide and metabolic acidosis in a neonate. Br J Ophthalmol 2003; 87:1052-1053. https://doi.org/10.1136/bjo.87.8.1052
Дата публикации 9 апреля 2020Обновлено 29 июля 2021
Определение болезни. Причины заболевания
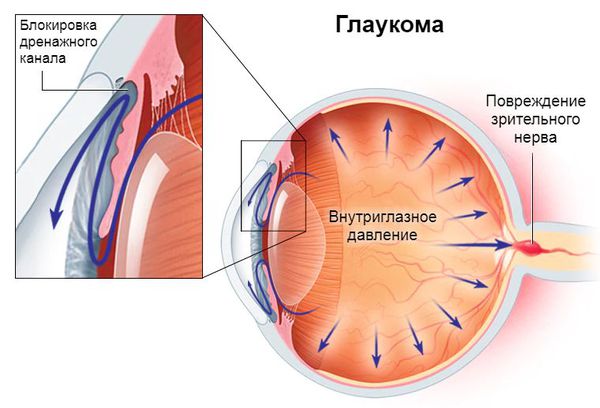
Глаукома — это большая группа заболеваний, при которых повышается внутриглазное давление (постоянно или периодически) [7]. Она представляет собой опасное прогрессирующее состояние, которое при отсутствии лечения неминуемо приведёт к слепоте.
Для любой формы глаукомы характерна триада признаков:
- Потеря участков поля зрения по глаукомному типу (от периферии к центру).
- Атрофия зрительного нерва с его экскавацией — расширением места его выхода и гибелью нервных клеток.
- Повышение уровня внутриглазного давления за пределы толерантного значения — индивидуальной нормы давления [4].
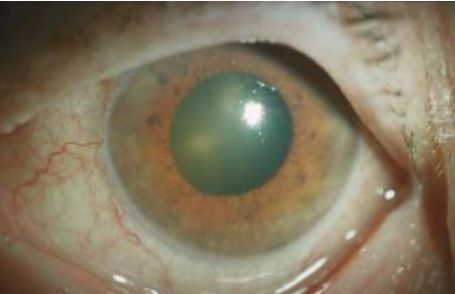
Впервые глаукома упоминается в «Афоризмах» Гиппократа примерно в 400 году до н. э. Её название происходит от греческого слова «glaukos» (водянистый синий, цвет морской воды, лазурный) из-за сходства с зелёным оттенком расширенного и неподвижного зрачка, который он приобретает на пике развития заболевания — острого приступа глаукомы. Отсюда же происходит и второе название глаукомы — «зелёная вода» или «зелёная катаракта» [10].
Больше тысячелетия назад глаукому описывал великий персидский учёный Авиценна. Это состояние он назвал «холодным воспалением» глаза, при котором в глазу скапливаются «дурные соки», исходящие не только из самого органа зрения, но и из сосудов тела [7][10]. На сегодняшний день глаукоме посвящены многочисленные статьи и клинические рекомендации, созданы целые врачебные сообщества, но она всё равно остаётся не до конца изученной болезнью.
В настоящее время заболеваемость глаукомой стремительно растёт во всем мире. Например, в РФ на начало 2016 года приходилось 897 больных на 100 тысяч взрослого населения, а в 2019 году — уже 1142 пациентов [2].
Глаукома — бесспорный лидер по причине слепоты. Количество людей, потерявших зрение на фоне этого состояния, только в нашей стране выросло за 20 лет на 0,8 млн человек, а количество слабовидящих — на 2,3 млн [3]. По данным федерального статистического наблюдения, в РФ в 2018 году было зарегистрировано около 1,3 млн пациентов с глаукомой, однако предполагается, что истинное число заболевших — вдвое больше. По данным зарубежных источников, в США более 2,25 млн граждан старше 40 лет имеют глаукому, а количество пациентов с двусторонней слепотой составляет 84-116 тысяч человек [7]. Если говорить о зоне риска, то в основном в ней находятся люди старше 40 лет, среди женщин заболеваемость составляет 56,6 %, среди мужчин — 43,4 % [7].
Распространенность врождённой глаукомы у детей колеблется в пределах одного случая на 10-12 тысяч новорождённых. Вместе с тем, в структуре глазной патологии её удельный вес достигает 0,1 %. Чаще встречается у мальчиков, чем у девочек (примерно 3:2) [9].
Группы риска по развитию глаукомы
До сих пор точные причины глаукомы не установлены, поэтому это заболевание принято рассматривать как многофакторное. Выделяют следующие факторы риска развития глаукомы (в частности её наиболее распространённой формы — первичной открытоугольной глаукомы):
- Возраст: чем старше человек, тем выше риск заболеть.
- Раса или этническая принадлежность: риск закрытоугольной глаукомы выше среди азиатов, чем среди европейцев и африканцев.
- Семейный анамнез глаукомы: установлена достоверная связь между риском развития первичной открытоугольной глаукомы у кровных родственников. По данным M. Shields, доля таких случаев составляет 21-50 % [15]. В настоящее время выявлено более 25 генов в генотипе, отвечающих за возникновение первичной открытоугольной глаукомы.
- Показатели внутриглазного давления: повышение цифр, нестабильность результатов, существенная разница между двумя глазами (более 2 мм рт. ст.).
- Центральная толщина роговицы: риск развития глаукомы увеличивается на 30-41 % при истончении роговицы на каждые 40 мкм.
- Перфузионное давление (уровень давления, за счёт которого происходит обмен между кровяным руслом и тканями организма): наличие или отсутствие лечения системной артериальной гипертензии у конкретного пациента.
- Заболевания глаз, включая близорукость или дальнозоркость.
- Общие заболевания: гипотиреоз, сахарный диабет, гипертония и др. [2].
Одним из факторов прогрессия глаукомы является нарушение сна. Это расстройство существует примерно у 70 % людей с глаукомой нормального давления [14].
В 85-90 % случаев появление врождённых форм глаукомы обычно связано с воздействием неблагоприятных факторов на плод во время внутриутробного развития: краснуха, корь, грипп или другие острые вирусные инфекции, перенесённые матерью во время беременности, а также токсоплазмоз, ионизирующие излучения, отравление солями тяжёлых металлов (например ртутью) и метаболические расстройства. Остальные 10-15 % случаев врождённой глаукомы — наследственные.
В последние годы всё большую актуальность приобретает проблема возникновения глаукомы у недоношенных детей. Так как развитие угла передней камеры завершается только к 38 неделе внутриутробного развития, дети, родившиеся раньше этого срока, относятся к группе риска развития глаукомы [9].
В ряде случаев глаукома является лишь проявлением общего состояния организма. Поэтому поиски причины развития этой болезни, вероятно, не должен ограничиваться рамками офтальмологии.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы глаукомы
Большинство пациентов с любыми формами глаукомы могут не подозревать о наличии заболевания, которое грозит им слепотой. На начальной стадии болезни конкретных симптомов, характерных для глаукомы, нет. Некоторые пациенты жалуются на снижение качества зрения, чувство напряжения в глазах, боли в области надбровных дуг, периодический туман перед глазами и постоянную сухость [2].
Длительность доклинической и начальной стадий, как правило, составляет 1-5 лет. Однако в некоторых случаях заболевание проходит все стадии вплоть до полной слепоты в течение 3-5 лет [2].
Как видит человек с глаукомой:
В более развитой стадии либо в стадии острого приступа часть пациентов видит яркие круги на источниках света («гало»), их беспокоит головная боль, боль и покраснение глаз, расширение зрачка, сердцебиение, тошнота. В нередких случаях пациенты узнают, что глаз полностью слепой только на приёме у врача. Иногда приступы проходят незаметно для пациента, либо он не связывает жалобы с глазами [7].
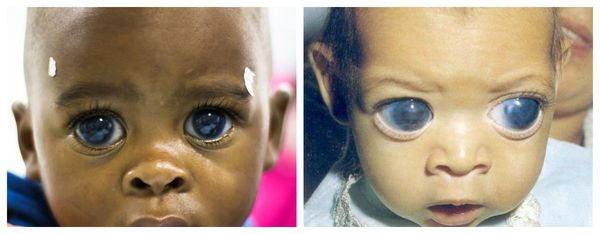
Врождённая глаукома проявляется светобоязнью, слезотечением, голубоватым цветом склеры, заметным увеличением глаза (большие «кукольные глаза»), в дальнейшем — отёком роговицы (помутнением) и увеличением её размеров (более 10,5 мм у новорождённых и более 12 мм после года). Печальным финалом заболевания является развитие «бычьего глаза» — чрезмерное увеличение глазного яблока [9].
Патогенез глаукомы
До настоящего времени механизм развития глаукомы полностью не изучен. Достоверно известно, что этот патологический процесс всегда развивается только в одном направлении — обратного пути нет.
Многие учёные отмечают влияние таких факторов на развитие глаукомы, как:
- апоптоз (гибель клеток);
- нарушение кровоснабжения в диске зрительного нерва;
- повышение внутриглазного давления — наиважнейший фактор.
Пока нет полного понимания, как именно регулируется внутриглазное давление и в чём причина его повышения. Но этот показатель, бесспорно, играет ключевую роль в развитии и прогрессировании глаукомы, так как его повышение приводит к гибели ганглиозных клеток сетчатки, которые способны вырабатывать нервные импульсы [2][7][12].
Существует несколько теорий глаукомного повреждения:
- Механическая теория — глаукомное повреждение возникает из-за прямой компрессии (сдавлении) зрительного нерва в отверстиях решётчатой пластинки диска.
- Ишемическая теория — повышенное внутриглазное давление негативно сказывается на кровоснабжении зрительного нерва.
- Дисрегуляторная теория — нарушение саморегуляции сосудистого тонуса независимо от внутриглазного давления приводит к патологическим изменениям зрительного нерва и сетчатки [2].
Также имеется некая схожесть патогенеза первичной открытоугольной глаукомы и нейродегенеративных заболеваний, связанных с возрастом (болезнью Альцгеймера, болезнью Пика и др.).
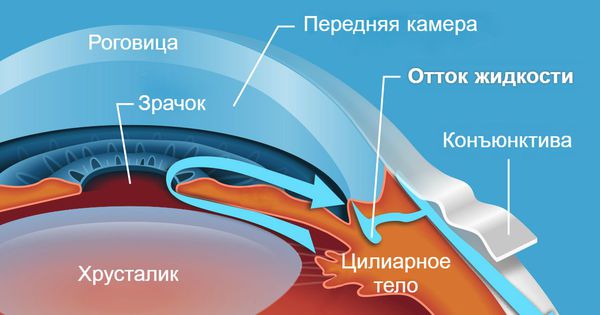
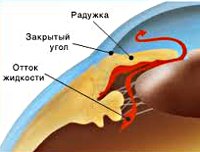
В случае закрытоугольных форм глаукомы механизм развития заключается в нарушении оттока жидкости в глазу вследствие полного либо частичного закрытия радужкой угла оттока. Невозможность оттока жидкости приводит к быстрому (в течение нескольких часов) и сильному (более 40 мм рт. ст.) повышению внутриглазного давления, что делает клиническую картину более яркой.
При врождённых формах, как правило, имеется аномалия развития глаза: отсутствие радужки (аниридия), уменьшенный глаз (микрофтальм), уменьшенная роговица (микрокорнеа), врождённое смещение хрусталика и т. д.
Многочисленные исследования свидетельствуют о том, что в механизме развития глаукомы также играют роль аутоиммунные механизмы, так как глаз имеет структуры, обладающие аутоантигенными свойствами (например хрусталик). Также у пациентов с глаукомой, особенно с прогрессирующим поражением, при нормальном уровне внутриглазного давления наблюдается снижение внутриглазного кровотока.
Стресс повышает внутриглазное давления при глаукоме в среднем в 2,8 раза. По некоторым данным, наличие выраженного психотравмирующего воздействия встречается в истории болезни примерно у 2/3 пациентов, страдающих этим заболеванием [14].
Классификация и стадии развития глаукомы
Глаукома представлена множеством вариантов течения.
По механизму увеличения внутриглазного давления выделяют:
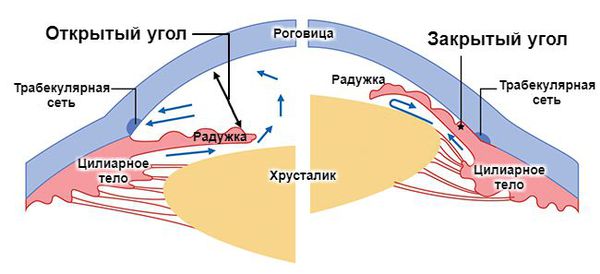
- открытоугольную форму — угол оттока внутриглазной жидкости открыт;
- закрытоугольную форму — угол оттока внутриглазной жидкости внутри закрыт.
Обе формы глаукомы подразделяют на другие формы. Они представлены на иллюстрациях ниже.
В западных странах пациенты чаще всего теряют зрение при открытоугольной глаукоме, а в Восточной Азии — вследствие закрытоугольной глаукомы [11].
По времени возникновению заболевания различают:
- врождённую глаукому (до 3 лет);
- инфантильную глаукому (в возрасте 3-10 лет);
- ювенильную глаукому (в возрасте 11-35 лет);
- глаукома взрослых (после 35 лет).
По степени выраженности патологического процесса (состоянию полей зрения и воронки зрительного нерва) выделяют четыре стадии заболевания:
- I — начальная стадия глаукомы;
- II — развитая стадия глаукомы;
- III — далеко зашедшая стадия глаукомы;
- IV — терминальная стадия.
По уровню стабилизации глазного давления выделяют:
- нормотензию — результаты измерения прибора (тонометра) не превышают 25 мм рт. ст.;
- умеренно повышенное давление — 26-32 мм рт. ст.;
- высокое внутриглазное давление — свыше 33 мм рт. ст.
По течению глаукома бывает стабилизированной и нестабилизированной [7].
По происхождению различают:
- первичную глаукому — возникает самостоятельно;
- вторичную глаукому — развивается вследствие других заболеваний глаз.
На долю первичной открытоугольной глаукомы приходится от 72,3 % до 96,1 % всех форм глауком [7]. Это наиболее часто встречающаяся форма.
Для вторичной глаукомы характерно большое количество факторов механизмов развития, а также клинических проявлений. Она всегда имеет первопричину — основное заболевание, а повышение внутриглазного давления является уже следствием этой болезни.
Осложнения глаукомы
Терминальная болящая глаукома
Большую часть среди всех слепых и слабовидящих пациентов составляют люди с терминальной стадией глаукомы. Однако слепота — это только вершина айсберга при данном заболевании. Проблемы возникают тогда, когда слепой глаз начинает постоянно болеть, не давая покоя ни днём, ни ночью.
Почему же в современной медицине при столь разнообразных методах лечения глаукома всё-таки доходит до апофеоза? Как показал анализ статей, практически всем больным на терминальной стадии заболевания выполняются различные операции, направленные на снижение внутриглазного давления — проникающая и непроникающая синустрабекулэктомия, операции с установкой дренажных устройств и др. Все они не давали стойкого эффекта и сопровождались различными осложнениями. Такие неблагоприятные исходы вызваны повышенной проницаемостью сосудов и активным образованием рубцов в созданных путях оттока внутриглазной жидкости.
Слепота и постоянная боль на терминальной стадии глаукомы долгие годы являлись показанием к удалению глазного яблока. Пытаясь сохранить его, врачи стали выполнять медикаментозную блокаду цилиарного нервного узла. Для этого в пространство за глазом вводился спиртовой раствор. Такая манипуляция давала лишь кратковременный обезболивающий эффект. Последующий рецидив болевого синдрома и повышение внутриглазного давления приводили к необходимости удаления глаза в 8,7-11,8 % случаев.
Сегодня на терминальной стадии глаукомы с целью сохранения глаза стали выполнять циклодеструктивные операции. Они также направлены на обезболивание и снижение внутриглазного давление [18].
Острый приступ глаукомы
Чаще всего данный приступ встречается при закрытоугольных формах, но иногда возникает и при декомпенсации открытоугольной глаукомы (резком подъёме внутриглазного давления), набухании катаракты (оводнении мутного хрусталика) и травмах глаза.
Провоцирующими факторами приступа могут быть: гипертонический криз, эмоциональный стресс, расширение или резкое сужение зрачка, длительная зрительная нагрузка вблизи, долгая работа с положением головы вниз. Больные при этом чувствуют сильные боли в глазу и соответствующей половине головы, у них резкое ухудшается зрение, появляются туман, пелена и радужные круги перед глазами. Характерным считается появление тошноты и рвоты.
Лечение острого приступа глаукомы должно проводиться врачом-офтальмологом только в условиях офтальмологического отделения. Самолечение недопустимо. Назначаются средства, снижающие внутриглазное давление, нанося их местно и принимая внутрь, минуя пищеварительный тракт. При невозможности купировать явления острого приступа глаукомы в течение 24 часов выполняется хирургическое лечение.
Диагностика глаукомы
Диагностика глаукомы основана на оценке сохранности структур зрительного нерва и зрительных функций [12]. Чем раньше будет выявлено заболевание, тем больше шансов предотвратить развитие структурных нарушений и необратимой потери зрения.
Стандартной процедурой является проверка остроты зрения. Для больных глаукомой это абсолютно не показательное обследование, так как даже в запущенном случае центральное зрение длительно остаётся высоким. Однако во время проверки врач сразу может заподозрить, что пациент входит в группу повышенного риска по развитию глаукомы, например, если у него имеется дальнозоркость в 4 дптр или же его зрение невозможно улучшить с помощью оптических средств (очков и контактных линз).
Важным методом является периметрия — оценка полей зрения. Этот показатель определяет состояние зрительной функции, которое невозможно проверить при обычной оценке остроты зрения, а также установить степень развития глаукомы [11]. Проведение периметрии осуществляется 1-3 раза в год, в зависимости от скорости ожидаемой прогрессии у пациентов из разных групп риска [1]. Выпадение новых участков в полях зрения является одним из важнейших признаков прогрессирования глаукомы.
Проводится периметрия в тёмной комнате на специальном приборе — ручном либо автоматическом (компьютерном) периметре. Для каждого глаза выполняется отдельное обследование. Во время компьютерной периметрии пациент фиксирует нажатием клавиши пульта появление вспышек в поле его зрения. В среднем периметрия занимает 10-40 минут.
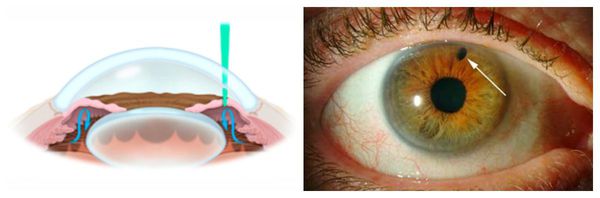
Биомикроскопия (осмотр на щелевой лампе) помогает оценить состояние роговицы, радужки, зрачка, хрусталика, а также благодаря специальной линзе осмотреть угол передней камеры — выполнить гониоскопию. Эта методика позволяет определить форму заболевания — открыт ли угол оттока жидкости внутри глаза либо закрыт. Она незаменима при травмах, подозрениях на опухоли (вторичная глаукома), после хирургического лечения и при врождённой глаукоме — гониоскопия является ключевым звеном в диагностике недоразвития угла.
Для взрослого пациента выполнить биомикроскопию довольно просто: после местной анестезии на глаз устанавливается специальная линза, после чего врач проводит осмотр на щелевой лампе. У детей эту процедуру выполнить сложнее. В силу возраста пациента невозможно посадить за щелевую лампу (например грудного малыша), также нередко ребёнок отказывается от осмотра — начинает плакать, злиться и т. д. Если стоит вопрос о проведении операции, то, дабы уменьшить количество общей анестезии, можно выполнить диагностику и хирургию за одну седацию (медикаментозный сон). Зачастую это проводится в условиях операционного блока и под общим наркозом [2].
Следующий важный этап диагностики — измерение внутриглазного давления. Есть множество приборов для измерения этого показателя. Их можно разделить на контактные и бесконтактные. Также разработаны модели для самостоятельного измерения, например модель ICare® HOME.
| Контактные методы измерения ВГД | Бесконтактные методы измерения ВГД |
|---|---|
| Тонометрия по Маклакову, Гольдману и Шиотцу | Аппарат Tono-pen |
| Аппарат Icare | Пневмотонометрия, индикатор ИГД |
У взрослого человека средний уровень внутриглазного давления (с вычетом тонометрической поправки каждого прибора) составляет 15-16 мм рт. ст. со стандартным отклонением примерно 3,0 мм рт. ст. [2]. Нормальное внутриглазное давление не должно превышать двух стандартных отклонений от среднего, т. е. 21 мм рт. ст. [1].
Нужно понимать, что каждая методика измерения внутриглазного давления имеет свою «норму результата». Бесконтактные тонометры в большинстве исследований показывают более низкие значения офтальмотонуса в среднем на 2-3 мм рт. ст. [16].
Проводить измерение внутриглазного давления необходимо до гониоскопии и расширения зрачка, иначе результаты исследования будут недостоверными. Рекомендуется выполнять несколько измерений внутриглазного давления. Одно измерение непоказательно: уровень внутриглазного давления меняется так же, как и уровень артериального давления. В течение дня колебания внутриглазного давления могут быть весьма значительными, причём у пациентов с глаукомой они больше, чем у здоровых людей. Например, на приёме у офтальмолога в 10:00 тонометрия может не показать повышение давления, однако вечером у пациента этот показатель может повыситься до 29 мм рт. ст. [2]. Иногда таких пациентов на приёме ошибочно расценивают как здоровых.
Суточная тонометрия может оказаться более полезной для диагностики глаукомы. Всего нужно выполнить не менее трёх утренних и трёх вечерних измерений. Конечно, в домашних условиях это не всегда возможно сделать. Раньше пациентов оформляли на стационарное лечение для суточной тонометрии, но сейчас такая практика встречается значительно реже.
В целом, качественного измерения внутриглазного давления в течение 1-2 суток достаточно для диагностики глаукомы. Более длительный мониторинг рекомендован пациентам, у которых при целевых цифрах глазного давления наблюдается выпадение полей зрения. Тогда врачи пытаются отследить «скачки» давления в вечернее время для подбора более адекватного лечения.
Также используется тонография по Нестерову: после измерения внутриглазного давления на роговицу помещают груз весом 15 г и через 4 минуты снова измеряют давление. Этот метод разработан в нашей стране. С помощью него можно определить коэффициент оттока внутриглазной жидкости, её выработку и минутный объём отекания, измерить внутриглазное давление и дополнительные параметры.
Далее выполняется осмотр глазного дна: на широкий либо узкий зрачок осматривается состояние зрительного нерва, размер его воронки (экскавации), цвет, форма, границы зрительного нерва (при глаукоме нерв приобретает серый оттенок). Пациенты с закрытоугольной глаукомой, выявленной при гониоскопии, осматриваются на узкий зрачок.
Осмотр проводится как прямым/непрямым офтальмоскопом, так и специальными (контактными и/или бесконтактными) линзами на щелевой лампе. Если врач диагностирует глаукому только по одному осмотру глазного дна, то такая ситуация характеризует не его мастерство, а запущенность заболевания.
Состояние зрительного нерва и ширины воронки его выхода (экскавации) обязательно наблюдается в динамике. Для этого можно использовать фотографирование глазного дна.
К дополнительным методам диагностики относятся:
- оптическая когерентная томография (ОКТ);
- гейдельбергская ретинотомография;
- УЗИ глаза.
ОКТ и гейдельбергская ретинотомография позволяют дополнительно оценить состояние зрительного нерва, окружающих его нервных волокон (перипапиллярных) и внутренних слоёв центральной оптической зоны сетчатки. Результаты ОКТ предоставляются в трёх видах: «в пределах нормы», «пограничный», «вне границ нормы». Они не являются диагнозом. Полученные результаты необходимо сопоставлять с клинической картиной во избежание ложных выводов, особенно в случае нестандартных вариантов строения дисков зрительного нерва. Некоторые ретинотомографы и ОКТ имеют специальные программы для сравнения результатов, выполненных в разное время на этом приборе. Это позволяет наглядно оценить развитие глаукомы. Частота повторных исследований зависит от скорости прогрессирования: при высоком риске процедура выполняется через три месяца после первого исследования, в остальных случаях — один раз в полгода [2].
УЗИ глаза может быть показано для определения профиля угла передней камеры. С его помощью можно увидеть закрытие угла и наличие новообразования. Этот метод не исключает гониоскопию, а дополняет её.
С учётом основных заболеваний, редких форм глаукомы, пациентам могут рекомендоваться дополнительные специальные обследования, например МРТ головного мозга, консультация генетика, невролога и др.
В целом план наблюдения пациента с глаукомой таков:
- При стабилизированном течении глаукомы и достижении нормального давления показано:
- не менее 1 раза в 6 месяцев проходить проверку остроты зрения и контроль внутриглазного давления;
- не менее 1 раза в 6-12 месяцев выполнять периметрию, гониоскопию и осмотр глазного дна.
- При нестабилизированном течении глаукомы на фоне нормального давления те же самые процедуры нужно проходить 1 раз в 3-6 месяцев, при нестабилизированном течении или отсутствии стабильных цифр давления — 1 раз в 1-2 месяца [2].
Лечение глаукомы
Успех в лечении глаукомы зависит от нескольких факторов и в первую очередь от знаний пациента о своём заболевании. Для больного глаукома кажется «мифической болезнью», которую каким-то образом «углядел врач». Ведь очень многие люди не ощущают никакой разницы до и после закапывания противоглаукомных капель. «А есть ли болезнь? — постоянно спрашивают пациенты. — Может врачам платят производители лекарств? Зачем постоянно тратить деньги на сомнительное лечение?».
Будет хорошо, если лечащий врач сразу доступно объяснит ситуацию. Но зачастую приём проходит быстро, слова, которые говорит врач, пациенту непонятны, и человек уходит с растерянными мыслями, не всегда осознавая, какую опасность таит его заболевание. Когда он появляется снова у врача через год-два (а то и позже), то неприятно удивляется, что проблема реально существует, но вот вернуть «съеденное» глаукомой зрение уже невозможно. Поэтому крайне важно серьёзно относиться к поставленному диагнозу и следовать рекомендациям врача.
Лечение всегда назначается пожизненно и отменять его на своё усмотрения нельзя.
Регулярное наблюдение — одно из ключевых составляющих в борьбе с глаукомой. Сам пациент не может отследить состояние его зрительного нерва, поэтому пренебрегать визитом к врачу пагубно. «Запущенная глаукома» — состояние полностью безвозвратное.
Одним из главных факторов лечения является индивидуальный подход, потому как под термином «глаукома» скрываются разные формы заболевания. Также особую играет роль возраст, в котором началась болезнь, сопутствующие заболевания, возможность самостоятельно закапывать капли и материальная сторона вопроса.
Если пациент понимает коварство болезни и осведомлён, что отказ от назначенной врачом терапии или её несоблюдение неминуемо приведёт к полной потере зрения, то мотивация лечиться возрастает и укрепляется. Больной должен понимать, что это не просто бездумное закапывание капель, а личная каждодневная борьба со слепотой.
Медикаментозное лечение
Сегодня медикаментозная терапия является вариантом начала лечения во многих случаях впервые выявленной глаукомы.
По механизму действия на внутриглазное давление препараты делят на:
- улучшающие отток внутриглазной жидкости;
- уменьшающие выработку внутриглазной жидкости.
Также важно понимать, что препараты делятся на:
- линию первого выбора — препараты, заслуженно рекомендованные и эффективные;
- линию второго выбора — препараты, назначение которых определяется индивидуальными особенностями и формой глаукомы, а также наличием общих заболеваний [1][4][7].
К препаратам первой линии относятся:
- Простогландины. Все препараты данной группы закапываются вечером один раз в сутки в одно и то же время, например в 19:00 (не перед сном).
- β-блокаторы. Кратность использования при лечении — 2 раза в сутки утром и вечером через 12 часов (например в 8:00 и 20:00).
Закапывание одного лекарства называется монотерапией. Как правило, именно с неё и начинают лечение. Если действия одного препарата недостаточно, давление остаётся высоким, тогда врачи используют комбинацию лекарств для достижения целевых цифр внутриглазного давления.
Сочетание препаратов может быть фиксированным, когда производитель заводским способом изготавливает флакон, содержащий сразу два препарата, либо назначается по отдельности. Фиксированная комбинация максимально удобна для пациента: один флакон и одно время закапывания снижает воздействие консервантов и «вымывание капель» при закапывании нескольких средств подряд.
Препараты и их комбинации подбираются врачом индивидуально в зависимости от формы глаукомы.
Основные требования к препарату либо их комбинациям:
- эффективность;
- состояние зрительных функций (если у пациента IV стадия глаукомы — лечение одно, если I стадия — другое);
- стабильность (сохранять действие в течение суток);
- минимум побочных эффектов;
- удобство в использовании (учитывая забывчивость пациента, его работу, ценовую категорию препарата и др.) [1][4].
У каждого препарата свои особенности применения, противопоказания и побочные эффекты. Поэтому лечение проводится под наблюдением врача-офтальмолога.
Медикаментозная терапия может сочетаться с другими методами лечения.
Лазерное лечение
В настоящее время разработана целая система лазерной хирургии. Её методы применимы к различным типам глаукомы и позволяют выполнять операцию без вскрытия глазного яблока [7]. При таких вмешательствах используется зелёный, сине-зелёный или красный YAG лазер.
Красный лазер активно используют при закрытоугольной глаукоме, особенно при блокировании путей оттока жидкости. С его помощью выполняется лазерная иридэктомия (иридотомия), которая позволяет создать ряд дополнительных отверстий в радужке.
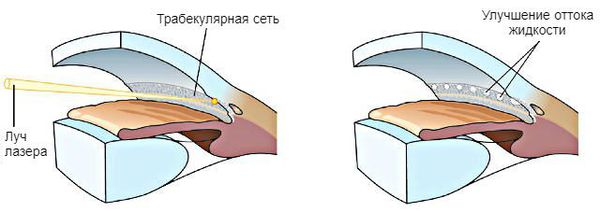
При первичной открытоугольной глаукоме в начальной и развитой стадии рекомендуется выполнение лазерной трабекулопластики — воздействие энергии лазера на клетки дренажной зоны. Такая процедура позволяет снизить внутриглазное давление при его умеренно повышенном уровне. Также она может выступать как альтернативный вариант начала лечения при невозможности назначения местной медикаментозной терапии: плохой переносимости препаратов, физических трудностях, связанных с закапыванием капель, и недоступностью препаратов.
Операция проводится амбулаторно, под местным обезболиванием, с использованием специальных линз, которые устанавливаются на глаз. В среднем внутриглазное давление после лазерной трабекулопластики может снизиться на 20-25 % (6-9 мм рт. ст.). По результатам AGIS (исследования по лечению продвинутых стадий глаукомы), такая операция чаще оказывается неэффективной у пациентов, моложе 40 лет. Повторная лазерная трабекулопластика возможна через год, если эффект от первой процедуры был продолжительным и достаточным для снижения внутриглазного давления [2].
В ряде случаев лазерное лечение не может заменить классическую операцию и не исключает классическое хирургическое лечение в дальнейшем.
Показания и противопоказания к лазерной хирургии
Лазерная иридэктомия проводится при закрытоугольной глаукоме, а трабекулопластика — при открытоугольной, чтобы снизить глазное давление. Также лазерная хирургия показана, если лечение каплями оказалось неэффективным или пациент не может их применять.
Противопоказания:
- беременность;
- воспалительные заболевания глаз, например конъюнктивит и кератит;
- выраженные дистрофия и отёк роговицы.
Хирургическое лечение
Хирургический метод лечения — наиболее эффективный способ нормализации внутриглазного давления и сохранения зрительных функций.
Операция по поводу глаукомы может показаться пациенту бесполезной, так как она практически не влияет на остроту зрения — только на внутриглазное давление. Это толкает многих больных оттягивать хирургическое лечение. Такая позиция в корне неверна: если пациенту показана операция по состоянию здоровья — её необходимо делать.
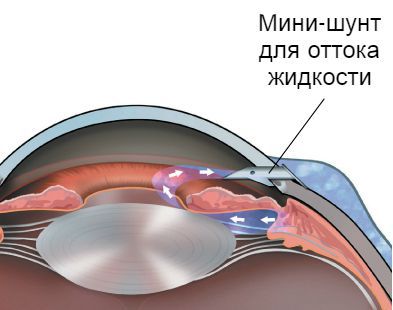
При закрытоугольной форме глаукомы проводится иридэктомия (создание сквозного отверстия в радужке) и иридоциклоретракция (разобщение части радужки и цилиарного тела с углом передней камеры); при врождённой — гониотомия (восстановление анатомии угла передней камеры) или варианты синусотрабекулэктомии (операция в области трабекулы); при открытоугольной форме глаукомы — различные варианты проникающих и непроникающих операций. В случае повторных операций используются дренажи и антиметаболиты, при терминальной стадии глаукомы — циклодеструктивные вмешательства [7][9].
Цель всех видов хирургии глаукомы — одна: создать дополнительные пути оттока внутриглазной жидкости, снизить и стабилизовать давление внутри глаза.
Показания к хирургической операции
Хирургическое лечение потребуется в следующих случаях:
- Капли и лазерная коррекция оказались неэффективными, т. е. с их помощью не удалось нормализовать внутриглазное давление. Часто при этом распадается ткань зрительного нерва и болезнь усиливается.
- Другие методы лечения недоступны, например пациент не может приобретать и/или самостоятельно закапывать капли, либо из-за непереносимости препаратов развивается токсическая реакция конъюнктивы.
- Поздняя стадия глаукомы, при которой высока вероятность потерять зрение.
- Врождённые формы болезни, связанные с анатомическими пороками.
- Вторичные формы глаукомы.
В каждом конкретном случае врач взвешивает риски и необходимость операции. Если эффективность хирургического лечения не очевидна, то проводить его не нужно. Решение об операции принимается на основании клинических рекомендаций, возраста пациента, его приверженности к лечению, стадии и скорости развития болезни.
Дополнительное медикаментозное лечение
Даже при идеальных значениях внутриглазного давления, достигнутых различными способами, у каждого пятого пациента продолжается распад зрительных функций. Важную роль в этом процессе играют сопутствующие заболевания — артериальная гипотензия, вазоспастический синдром, сахарный диабет и близорукость.
Это приводит к необходимости включать в комплексное лечение глаукомы нейропротективную терапию. Она включает в себя назначение внутрь либо парентерально (инъекционно) курсы препаратов, улучшающих кровоснабжение и питание зрительного нерва и головного мозга. Такие средства позволяют затормозить атрофический процесс.
Зачастую используют группу ноотропных препаратов (пирацетам, пикамилон), антиоксидантов (метилэтилпиридинол), биорегуляторов (ретиналамин), препараты сосудистого действия (циннаризин), магний и др. [10].
Физиотерапия при глаукоме
Бег и занятия йогой помогают снизить диастолическое («нижнее») кровяное давление, что способствует уменьшению внутриглазного давления. Также полезно ношение очков с зелёными стеклами. Как правило, «холодные» цвета (синий, сине-зелёный и фиолетовый) стимулируют работу парасимпатической нервной системы, что позволяет снизить внутриглазное давление [14].
Использование местной магнитотерапии оказывает стимулирующее воздействие на сетчатку глаза и внутричерепной отдел, отвечающий за процессы передачи импульса по зрительным нервам, способствует повышению биоэлектирической активности [17].
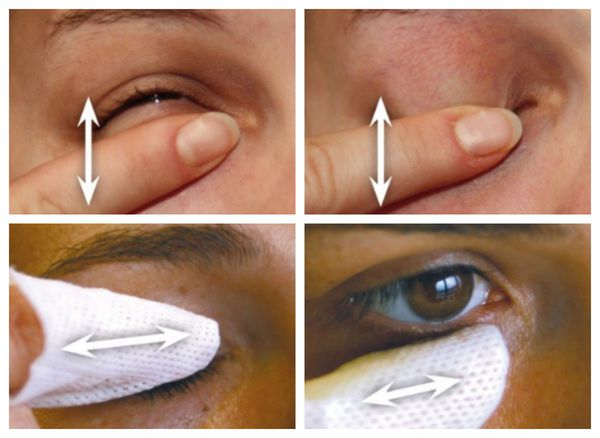
Иглорефлексотерапия по общим и специальным точкам возможна в качестве дополнения к комплексному лечению глаукомы. На течение глаукомного процесса благоприятно влияет массаж[14]. Ежедневное массирование глаз и глазниц помогает снизить внутриглазное давление, улучшить отток внутриглазной жидкости, лимфы и венозной крови. Также снижению внутриглазного давления способствует лечение психотропными препаратами и психорелаксация.
Любое дополнительное лечение всегда проводится одновременно с активной гипотензивной терапией (медикаментозной, лазерной, хирургической), которые позволяют нормализовать внутриглазное давление.
Прогноз. Профилактика
Глаукома — это заболевание, представляющее огромную угрозу зрению, с которым можно и нужно бороться. При неукоснительном соблюдении необходимого лечения всегда есть шанс, что слепота отступит.
Обследованию на глаукому подлежат:
- все люди старше 40 лет — обследование проводится раз в три года;
- все люди старше 35 лет с повышенным риском развития глаукомы (с офтальмологическим заболеваниями, перенесёнными операциями на глазу, сахарным диабетом, мерцательной аритмией, наследственной отягощённостью по глаукоме) — обследование проводится раз в год [7].
Для уточнения диагноза в случае подозрения на глаукому пациента могут направить в специализированный глаукомный кабинет для дообследования в рамках ОМС.
Все дети до года (на 1-2 месяце жизни) обязательно должны быть осмотрены окулистом для исключения врождённых заболеваний, в том числе и глаукомы.
Важную роль в профилактике глаукомы отводят регулярной медико-просветительной работе с населением для его информирования и настороженности, увеличение мотивации пациента к прохождению медицинских осмотров. Для пациентов с глаукомой и их родственников разработаны специальные сайты, которые помогают повышать знания о заболевании.
Так как заболеваемость глаукомой увеличивается, появляется необходимость в разработке Федеральной программы по профилактике развития глаукомной слепоты и восстановлении диспансеризации населения. В региональных поликлиниках «диспансерный день» для больных глаукомой сохраняется. Однако загруженность рабочего дня офтальмолога при установленной норме приёма 8-12 минут не позволяет врачу проводить диспансеризацию должным образом [7].
Глаукома первичная закрытоугольная
Версия: Клинические рекомендации РФ 2021 (Россия)
Категории МКБ:
Первичная закрытоугольная глаукома (H40.2)
Разделы медицины:
Офтальмология
Общая информация
Краткое описание
Разработчик клинической рекомендации
-
Общероссийская общественная организация «Ассоциация врачей-офтальмологов»
-
Общероссийская общественная организация «Общество офтальмологов России»
-
Межрегиональная общественная организация «Глаукомное общество»
Одобрено Научно-практическим Советом Минздрава РФ
Клинические рекомендации Глаукома первичная закрытоугольная
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: H40.2
Год утверждения (частота пересмотра): 2021
Возрастная категория: Взрослые
Год окончания действия: 2023
1. Краткая информация по заболеванию или состоянию (группы заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
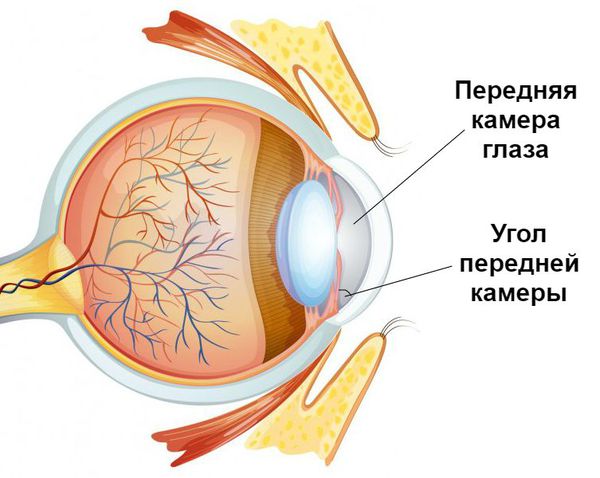
Первичная закрытоугольная глаукома (ПЗУГ) ‒ это заболевание, при котором причиной повышения внутриглазного давления (ВГД) становится препятствие оттоку водянистой влаги (ВВ) за счет частичной или полной блокады УПК корнем радужки, сопровождающееся следующими признаками [1,2]:
-
периодическим или постоянным повышением уровня ВГД;
-
атрофией зрительного нерва (с экскавацией);
-
характерными изменениями поля зрения (ПЗ);
-
закрытым УПК.
Термин «глаукома» используется в тех случаях, когда имеются признаки глаукомной оптической нейропатии. При закрытии угла и отсутствии признаков повреждения зрительного нерва рекомендуется использовать термины «подозрение на первичное закрытие угла» и «первичное закрытие угла» [3,4].
Подозрение на первичное закрытие угла (ППЗУ) – это состояние, при котором имеется два или более квадранта иридотрабекулярного (ИТК) контакта, без периферических передних синехий (ППС), без повышения уровня ВГД и признаков повреждения зрительного нерва.
Первичное закрытие угла (ПЗУ) – это состояние, при котором имеется два или более квадранта иридотрабекулярного (ИТК) контакта с развитием ППС, и/или повышение ВГД без признаков повреждения зрительного нерва.
Острый приступ закрытоугольной глаукомы (ОПЗГ) – это состояние, характеризующееся внезапным и полным закрытием УПК, резким повышением ВГД, которое при отсутствии неотложного лечения может привести к потере зрительных функций.
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статической класификации болезней и проблем, связанных со здоровьем
Глаукома (H40)
H40.2 – Первичная закрытоугольная глаукома
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 500 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
В широкой клинической практике используют классификацию ПЗУГ по следующим признакам [2]:
-
по механизму закрытия УПК выделяют:
— относительный зрачковый блок;
— плоская радужка;
— «ползучая глаукома»;
— витреохрусталиковый блок (злокачественная глаукома)
-
по клиническому течению [2]:
— острый приступ закрытоугольной глаукомы;
— интермиттирующая (подострая) закрытоугольная глаукома;
— хроническая закрытоугольная глаукома
-
по стадиям первичного закрытия угла (табл. 1)
— подозрение на первичное закрытие угла
— первичное закрытие угла
— первичная закрытоугольная глаукома
Таблица 1 – Классификация первичного закрытия угла по стадиям
По степени выраженности патологического процесса, уровню ВГД и течению болезни, ПЗУГ классифицируют так же, как и первичную открытоугольную глаукому (ПОУГ) [2].
-
по степени выраженности патологического процесса:
— начальная стадия глаукомы;
— развитая стадия глаукомы;
— далекозашедшая стадия глаукомы;
— терминальная стадия глаукомы
-
по течению болезни:
— стабилизированная — отсутствует отрицательная динамика в состоянии ДЗН и ПЗ при продолжительном наблюдении за больным (не менее 6 месяцев)
— нестабилизированная – при повторных исследованиях регистрируют отрицательную динамику структурных (ДЗН, нервные волокна сетчатки) и функциональных (ПЗ) показателей.
-
по уровню ВГД:
А ‒ ВГД в пределах нормальных значений (Р0 < 22 мм рт.ст., Pt< 25 мм рт.ст.);
В ‒ умеренно повышенное ВГД (от 22 ≤ Р0≤ 28 мм рт.ст., Pt — 26-32 мм рт.ст.);
С ‒ высокое ВГД (Р0 ≥ 29 мм рт.ст., Pt ≥33 мм рт.ст.).
По степени выраженности патологического процесса ПОУГ подразделяют на:
Таблица 2 — Классификационная схема стадий глаукомы [2].
Для диагностики стадий глаукомы важно не только определение перехода от одной стадии к другой, но и выявление и количественная оценка прогрессирования заболевания. Для этого необходимы классификации, в которых используют функциональные (периметрические интегральные индексы, полученные с помощью стандартной автоматизированной периметрии). При использовании метода САП применяется модифицированная классификация E. Hodapp, R. Parrish и D. Anderson (табл.3) [32,33].
Таблица 3 – Классификация стадий глаукомы по данным статической периметрии
Для исследования ПЗ (как указано в табл. 3) используется компьютерный периметр Humphrey или его аналоги.
Этиология и патогенез
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
При ПЗУГ закрытие УПК может быть обусловлено различными механизмами в предрасположенных к этому глазах. ПЗУГ необходимо дифференцировать от вторичной закрытоугольной глаукомы (ЗУГ), при которой УПК закрывается радужкой вследствие других заболеваний (увеит, неоваскулярная глаукома при диабете и тромбозе ЦВС, иридокорнеальный эндотелиальный синдром, факоморфическая глаукома, нанофтальм, сублюксация хрусталика, опухоли заднего отдела глаза и др.) [1,3,4].
Различают врожденные, приобретенные и демографические факторы риска развития ПЗУГ [1,3,4].
К врожденным факторам относятся:
-
мелкая ПК (менее 2,5 мм);
-
узкий профиль УПК;
-
короткая переднезадняя ось глаза;
-
большой переднезадний размер хрусталика;
-
малый диаметр роговицы;
-
малая кривизна роговицы;
-
рефракция (гиперметропическая рефракция часто сочетается с узким УПК);
-
переднее расположение цилиарного тела;
-
коричневый цвет радужки.
Приобретенные факторы риска:
-
увеличение объема хрусталика с возрастом;
-
возрастное уплощение радужки;
-
возрастная атрофия прикорневой зоны радужки;
-
скопление жидкости в заднем отделе стекловидного тела;
-
применение препаратов у лиц с предрасположенностью к закрытию УПК.
Демографические факторы риска:
-
возраст (в среднем заболевание проявляется в возрасте 60 лет; с годами распространенность возрастает) [5-7];
-
женский пол (женщины болеют чаще мужчин в соотношении 4:1) [8];
-
раса (чаще у коренных жителей Юго-Восточной Азии, Китая и эскимосов) [9,10];
-
семейный анамнез (родственники первой линии имеют повышенный риск развития заболевания, поскольку наследуют анатомически предрасполагающие факторы) [11,12].
В патогенезе ПЗУГ основную роль играет закрытие (блокада) УПК корнем радужки. По ведущему механизму закрытия УПК выделяют четыре основные формы ПЗУГ: со зрачковым блоком, с плоской радужкой, «ползучая», с витреохрусталиковым блоком (злокачественная).
Преобладающим механизмом первичного закрытия УПК приблизительно у 80-90% пациентов является относительный зрачковый блок. Относительный зрачковый блок может быть на глазах с любыми типами рефракции, но чаще встречается при гиперметропии, где глубина и объем передней камеры меньше, а контакт радужки с хрусталиком в области зрачка более плотный, чем при эмметропии. Увеличение аксиального размера хрусталика в течение жизни ведет к приближению его передней поверхности к роговице, в то время как экваториальный рост ослабляет связочный аппарат, позволяя иридохрусталиковой диафрагме смещаться кпереди. Оба фактора приводят к постепенному прогрессирующему сужению ПК. При расширении зрачка (4-6 мм) затрудняется отток ВГЖ из задней камеры в переднюю, что усиливает относительный зрачковый блок. Разница в давлении в камерах глаза еще больше усиливает адгезию радужки к УПК с образованием в дальнейшем периферических передних синехий (гониосинехий) [1-4].
ПЗУГ с плоской радужкой встречается редко. В этом случае радужка имеет плоский профиль, у корня она имеет избыточную толщину («валики») и находится напротив трабекулы. При расширении зрачка радужка «собирается» напротив УПК и закрывает его бухту. Чаще встречается у молодых миопов азиатской расы.
При плоской конфигурации радужки имеется преимущественно переднее расположение отростков цилиарного тела. После проведения иридэктомии радужка не отходит от УПК, так как удерживается отростками цилиарного тела, такое состояние принято называть синдромом плоской радужки [1,3,4].
ПЗУГ с укороченным углом («ползучая» глаукома) рассматривается зарубежными авторами в рамках «конфигурации плоской радужки», поскольку причиной является переднее расположение цилиарных отростков и иногда «плоское» строение радужки. В отечественной литературе выделяется отдельно. Характеризуется постепенной и прогрессирующей синехиальной блокадой УПК. Процесс начинается в верхнем отделе и распространяется циркулярно. ВГД обычно повышается, когда перекрывается более половины угла. До сих пор неясно, является ли «ползучая глаукома» следствием не выявленного преходящего закрытия угла или хронической терапии миотиками [2].
Витреохрусталиковый блок — «злокачественная глаукома» (ЗГ) редко встречающаяся, но крайне тяжелая по течению и прогнозу форма. К факторам риска развития ЗГ относятся: осевая гиперметропия, женский пол, микрофтальм, нанофтальм, передний микрофтальм, ЗУГ с высоким ВГД, длительное применение миотиков, послеоперационный увеит с экссудацией. В этих случаях, чаще у женщин молодого или среднего возраста, цилиарные отростки соприкасаются с экватором хрусталика, вызывая изменение направления тока ВВ в стекловидное тело (СТ) с образованием в нем дополнительных камер. Внутриглазная жидкость (ВГЖ) скапливается в заднем отделе глаза, в результате чего СТ и хрусталик смещаются вперед, блокируя полностью УПК. Может развиться как при наличии собственного хрусталика, так и в афакичных и артифакичных глазах, после лазерных или хирургических вмешательств, в глазах с очень мелкой ПК и гиперметропией [13-15].
Эпидемиология
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Первичная глаукома – является одна из ведущих причин слепоты в мире. Всемирная организация здравоохранения считает глаукому второй по распространенности причиной слепоты после катаракты. Именно первичная закрытоугольная глаукома (ПЗУГ) вызывает почти половину всех случаев слепоты вследствие глаукомы во всем мире [16].
Число больных глаукомой по всему миру в 2010 году составляла около 60,5 миллиона человек, из них 15,7 миллионов человек страдали от ПЗУГ. По прогнозам к 2020 году количество больных первичной глаукомой увеличится до 80 млн. человек, из них у 21 миллиона будет диагностирована ПЗУГ, а 5,3 миллиона могут ослепнуть вследствие заболевания [17].
Вопросы эпидемиологии и популяционного скрининга первичной закрытоугольной глаукомы (ПЗУГ) имеют значимые отличия от эпидемиологических и этнических характеристик первичной открытоугольной глаукомы (ПОУГ) [9].
Этническая принадлежность – является один из основных факторов, определяющих предрасположенность к первичному закрытию угла (ПЗУ). Популяционные исследования показывают, что ПЗУ чаще встречается у лиц азиатской, чем европейской расы. Данные последних исследований свидетельствуют о широкой распространенности ПЗУГ среди населения Индии [18-21], восточно-азиатских народов, за пределами Китая [22- 25], в Китае [26,27], в странах Юго-Восточной Азии [28].
Среди лиц в возрасте 40 лет и старше распространенность ПЗУ составляет от 0,1% у европейцев, до 1,4% у представителей азиатской расы [26, 29] и до 5% у инуитов Гренландии [9]. В популяции европейцев в возрасте старше 40 лет распространенность ПЗУГ составляет 0,4%. Три четверти пациентов составляют женщины. Количество пациентов с ПЗУГ в Европе составляет 1,6 миллиона человек, а в США 581 тысяча человек [30].
По данным федерального статистического наблюдения в Российской Федерации в 2018 году всего было зарегистрировано около 1,3 млн. пациентов с первичной глаукомой [31].
Клиническая картина
Cимптомы, течение
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клиническая картина ПЗУГ зависит от механизма закрытия угла и течения заболевания [1-4].
Относительный зрачковый блок – при биомикроскопии передняя камера, как правило, мельче средней глубины. При гониоскопии, в зависимости от стадии процесса, выявляют частичное или полное закрытие УПК. Для определения функциональной или органической блокады УПК применяют компрессионную пробу Форбса.
Плоская радужка – при биомикроскопии ПК средней глубины, однако, у корня радужка имеет избыточную толщину («валики», складка Фукса) и находится напротив трабекулы. По данным ультразвукового сканирования переднего отдела глаза при плоской конфигурации радужки имеется преимущественно переднее расположение отростков цилиарного тела, в связи с чем, после проведения иридэктомии радужка не отходит от УПК.
«Ползучая» глаукома – при гониоскопии УПК укорочен по всей окружности, но неравномерно в разных секторах. Радужка отходит не от цилиарного тела, а от склеральной шпоры или трабекулы на разных её уровнях в зависимости от высоты гониосинехий. ВГД обычно повышается, когда перекрывается более половины угла. Течение, как правило, хроническое, но могут быть эпизоды, напоминающие подострое течение ПЗУГ.
Витреохрусталиковый блок или ЗГ – диагноз ЗГ нередко бывает поставлен с опозданием в значительной мере из-за небольшой частоты возникновения заболевания, а также по причине схожести с некоторыми другими патологическими состояниями. ЗГ имеет характерные клинические признаки. Вследствие переднего сдвига иридохрусталиковой диафрагмы при ЗГ усиливается миопическая рефракция. Для ЗГ после антиглаукомных операций характерно отсутствие фильтрационной подушечки при отсутствии наружной фильтрации по причине несостоятельности швов конъюнктивы, подтвержденной пробой с флуоресцеином натрия. Передняя камера мелкая до щелевидной на всём протяжении или отсутствует даже при наличии иридэктомии. При длительном существовании корнеохрусталикового контакта развиваются передние синехии, декомпенсация роговицы. ВГД повышается быстро или постепенно по мере закрытия УПК. Повышение ВГД может происходить и на фоне активно функционирующей фильтрационной подушки. Назначение традиционной гипотензивной терапии не приводит к снижению офтальмотонуса, однако, назначение средств с мидриатическим и циклоплегическим действием может дать положительный эффект. При биомикроскопии, если оптические среды глаза прозрачны, в стекловидном теле можно увидеть свободные зоны, отграниченные полости, где накапливается ВГЖ. На афакичных глазах визуализируется контакт цилиарных отростков с передней поверхностью стекловидного тела. В афакичных и артифакичных глазах с ЗГ отмечается высокая плотность гиалоидной мембраны вследствие её тотальной облитерации с задней камерой глаза. Ультразвуковая эхография при ЗГ позволяет определить передне-заднюю длину глаза (часто меньше 22 мм), состояние цилиарного тела и отростков (размеры, расположение), определить состояние оболочек глаза и толщину хориоидеи. Ультразвуковое сканирование переднего отдела глаза позволяет определить взаиморасположение задней камеры, радужки, цилиарного тела, хрусталика, передней поверхности стекловидного тела, а также обнаружить переднюю ротацию цилиарных отростков и дополнительные полости в стекловидном теле.
Острый приступ закрытоугольной глаукомы. Провоцирующими факторами развития острого приступа считают лекарственный мидриаз, эмоциональное напряжение, пребывание в затемненном помещении, работу с наклоном головы, напряжение аккомодации, переохлаждение. Характерны жалобы пациента на головную боль, тошноту (редко рвоту), боль в глазу, снижение зрения, радужные круги. ВГД высокое, при биомикроскопии характерны гиперемия конъюнктивы, отек роговицы, отек радужки, ПК мелкая, водянистая влага теряет свою прозрачность (из-за выпота белка), зрачок расширен, приобретает зачастую неправильную форму, реакция зрачка на свет отсутствует. В связи с быстрым повышением офтальмотонуса и значительной компрессией корня радужки в корнеосклеральной зоне возникает сегментарное нарушение кровообращения в радиальных сосудах с признаками некроза и асептического воспаления. Клинически это проявляется образованием задних синехий по краю зрачка, появлением гониосинехий. После перенесенного приступа остается очаговая атрофия радужки, деформация и смещение зрачка. В хрусталике выявляют помутнения в виде белых пятен, расположенных преимущественно в передних и средних субкапсулярных слоях. Отек роговицы затрудняет осмотр деталей глазного дна, однако, можно рассмотреть отечный ДЗН, расширенные вены сетчатки; в некоторых случаях ‒ кровоизлияния в области ДЗН и парацентральных участках сетчатки. После снятия отека роговицы гониоскопия позволяет определить состояние УПК. Увеальная, неоваскулярная и другие вторичные ЗУГ могут протекать остро, маскируя первичный острый приступ. Для дифференциальной диагностики важно проводить гониоскопию на парном глазу: если там УПК открыт, значит это не острый приступ. Компрессионная гониоскопия по Форбсу позволит найти участок открытого УПК, где можно выполнить лазерную иридэктомию.
Интермиттирующая ПЗУГ. Характеризуется периодическими, умеренно выраженными болями в области глаза и затуманиванием зрения. Жалобы больного бывают неопределенными, усиливаются к вечеру и уменьшаются утром (предположительно, из-за того, что во время сна зрачок сужается и ВГД снижается). Если есть жалобы на цветные радужные круги (при катаракте – монохромные), это может быть признаком периодического отека роговицы. Поэтому даже при отсутствии на момент осмотра повышенного ВГД рекомендуется провести гониоскопию.
Клинические симптомы ГОН при хроническом течении ПЗУГ так же, как при ПОУГ начинаются с расширения физиологической экскавации. Постепенно происходит «прорыв» нейроретинального пояска (НРП) к краю зрительного нерва, атрофия сосудистой оболочки вокруг него. В поздней стадии экскавация становится тотальной и глубокой. Для ГОН также характерны очаговые поражения слоя нервных волокон сетчатки (СНВС), вертикальное расширение экскавации, асимметрия экскавации/диска, кровоизлияния на ДЗН [1,2].
Для качественной и количественной оценки параметров ДЗН, СНВС и внутренних слоев сетчатки в макулярной зоне используют инструментальную диагностику – оптическую когерентную томографию (ОКТ). Для ГОН характерны прогрессирующее уменьшение толщины СНВС в сочетании с сужением НРП, чаще в нижне- и верхневисочном секторах ДЗН [34].
Периметрия позволяет выявить изменения зрительных функций, которые не определяются при проверке остроты зрения (это субъективный метод, достоверность достигается повторными исследованиями в динамике). С помощью периметрии определяют, локализуют и дают количественную оценку степени потери ПЗ. Характерны как диффузные, так и очаговые изменения ПЗ. В начальной стадии болезни характерны расширение слепого пятна, очаговые поражения (скотомы) в парацентральном отделе, особенно часто в зоне Бьеррума, в редких случаях дефекты могут возникать на периферии височной половины ПЗ. При развитии болезни возможно появление дугообразных скотом, сливающихся со слепым пятном, назальной ступеньки, сужение периферических границ до трубчатого и остаточного ПЗ. Прогрессирование дефектов ПЗ характеризуется: наличием нового дефекта в ранее нормальном участке, углублением ранее существовавшего дефекта, расширением ранее существовавшей скотомы на смежные точки, наличием общего снижения чувствительности.
Диагностика
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Для определения стратегии лечения, направленной на сохранение зрения и качества жизни пациента особое значение имеют возможность точной диагностики ПЗУГ, оценка механизма развития, степени и стабилизации заболевания, а также своевременное обследование пациентов в группе риска для предупреждения дальнейшего закрытия УПК и развития острого приступа.
Критерии установления диагноза/состояния:
анамнез;
данные инструментальных исследований (визометрия, рефрактометрия, офтальмотонометрия, биомикроскопия глаза, гониоскопия, биомикроскопия глазного дна/офтальмоскопия)
-
Рекомендуется обследование пациентов из группы риска с целью своевременного выявления и предупреждения дальнейшего закрытия УПК и развития острого приступа [35-39].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
-
Рекомендуется обследование пациентов ПЗУ и ПЗУГ с целью определения механизма развития, течения и стадии болезни, выбора тактики лечения и динамического наблюдения для предотвращения клинически значимого прогрессирования заболевания [40-43].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
-
Рекомендуется собирать жалобы у пациентов ПЗУ и ПЗУГ с целью выявления симптомов, которые могут повлиять на выбор тактики дальнейшего ведения [5, 8, 44].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: чаще всего при ПЗУ и хроническом течении ПЗУГ жалобы могут отсутствовать. Характерные жалобы для острого и интермиттирующего течения заболевания: боль в глазу и соответствующей половины головы, покраснение глаза, нечеткое зрение, ореолы вокруг источника света, реже тошнота и/или рвота, сердцебиение, схваткообразная боль в животе.
-
Рекомендуется собирать анамнез у всех пациентов с целью выявления факторов, которые могут повлиять на выбор тактики ведения [8,38,39,45].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: следует выяснить наличие случаев ПЗУГ среди близких родственников, предыдущие заболевания глаз, хирургические вмешательства или травмы, приём препаратов провоцирующих острый приступ:антихолинэргические средства, психоаналептики (код N06) и входящие в них подгруппы – антидепрессанты (N06A), симпатомиметики центрального действия (N06BA), противопаркинсонические – центральные холиноблокаторы (N04A), антипсихотические препараты (N05A), антигистаминные препараты для системного применения (R06), зрительную работу при плохом освещении, длительную работу с наклоном головы, переохлаждение, наличие аллергии на лекарства, курение и употребление алкоголя/наркотиков, наличие сопутствующих системных заболеваний [45-48]. С целью систематизации полученных данных возможно использование «Опросного листа при подозрении на глаукому» и «Анкеты для выявления факторов риска глаукомы», представленных в Приложении Г1-Г2.
2.2 Физикальное обследование
Физикальное обследование для диагностики ПЗУГ не проводят.
2.3 Лабораторные диагностические исследования
Диагностических критериев ПЗУГ на основании данных клинического лабораторного обследования не используется.
2.4 Инструментальные диагностические исследования
-
Рекомендуется визометрия всем пациентам для оценки и мониторинга функционального состояния зрительного нерва и сетчатки [1,3,4].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: зрение следует проверять без расширения зрачка, и с наилучшей коррекцией на расстоянии и вблизи. Глаукома на поздней стадии может повлиять не только на периферическое, но и на центральное зрение. При остром приступе закрытоугольной глаукомы острота зрения резко снижена.
-
Рекомендуется рефрактометрия всем пациентам с целью определения риска развития ПЗУ и ПЗУГ и возможности нейтрализации аномалии рефракции для проведения периметрии [49-52].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
Комментарии: ПЗУ и ПЗУГ чаще сочетаются с гиперметропией, кроме конфигурации «плоской» радужки, где преимущественно встречается миопическая рефракция. Нейтрализация любой аномалии рефракции имеет решающее значение для точной периметрии.
-
Рекомендуется офтальмотонометрия всем пациентам для диагностики, мониторинга и контроля эффективности лечения, в том числе с целью выявления суточных колебаний ВГД [53-56].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии проводить измерение ВГД необходимо до гониоскопии. Рекомендуется проведение несколько измерений ВГД, с регистрацией времени проведения процедуры, что может быть важно для выявления суточных колебаний и подбора медикаментозной терапии [53-56]. Общее количество измерений, как правило, должно составлять не менее 3 утренних и 3 вечерних. Они могут проводиться дискретно, с перерывом в течение недели или 10 дней, возможно использование специальных хронобиологических схем [2].
-
Рекомендуется биомикроскопия глаза всем пациентам с факторами риска закрытия УПК, ПЗУ и ПЗУГ для оценки и мониторинга состояния сред и структур глаза [57-59].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: биомикроскопические изменения сред и структур глаза описаны в разделе 1.6. При биомикроскопии переднего отрезка для определения вероятности закрытия УПК возможно применение метода Ван Херика, который не является альтернативой гониоскопии. Узкой световой щелью освещают периферию роговицы под углом 600 максимально близко к лимбу. Визуализируют световую полосу оптического среза роговицы, полосу света на поверхности радужки и расстояние от внутренней поверхности роговицы до радужки. О ширине угла передней камеры судят по отношению толщины оптического среза роговицы (ОСР) к расстоянию «роговица – радужка» (РРР). При соотношении ОСР к РРР 1:1 – имеется низкая вероятность узкого угла УПК 35-45о, 1:1/2 – низкая вероятность узкого угла УПК 20-45о, 1:1/4 – возможность узкого угла УПК 20о, 1:меньше ¼ — возможность закрытого угла УПК 10о, 1:0 – УПК закрыт 0о[1,2,4].
-
Рекомендуется гониоскопия всем пациентам с факторами риска закрытия УПК, ПЗУ и ПЗУГ с целью определения состояния УПК и мониторинга изменений при последующих осмотрах [1,4,60,61].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
Комментарии: Гониоскопию обязательно проводить на обоих глазах. Необходима правильная посадка гониолинзы, особенно при компрессии, чтобы получить истинную картину УПК. Гониоскопию проводят в темном помещении с помощью короткого светового пучка (около 1 мм) на щелевой лампе, избегая попадания света в зону зрачка, что может расширить УПК. При отеке роговицы во время острого приступа глаукомы гониоскопия затруднена, в этом случае для дифференциальной диагностики важна оценка состояния УПК на парном глазу. Для оценки результатов гониоскопии можно использовать классификации Spaeth, Shaffer или Kanski [2,61,62].
-
Рекомендуется биомикроскопия глазного дна или офтальмоскопия всем пациентам ПЗУ и ПЗУГ для оценки изменений ДЗН и сетчатки и мониторинга изменений при последующих осмотра [1,4,63,64].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Расширение зрачка для детального осмотра глазного дна рекомендуется после иридэктомии. При отсутствии иридэктомии возможен осмотр глазного дна с широким зрачком (с использованием мидриатика короткого действия (мидриатические и циклоплегические средства (S01F)) при условии его последующего сужения под контролем врача для исключения потенциальной опасности развития острого приступа глаукомы.
-
Рекомендуется компьютерная периметрия пациентам ПЗУ и ПЗУГ с целью определения функциональных изменений и их мониторинга для контроля прогрессирования заболевания [1,4,65-67].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: В современной диагностике глаукомы периметрия остается важным и обязательным методом исследования для диагностики, наблюдения и лечения пациентов. В начальной и развитой стадиях ПЗУГ целесообразно проведение стандартной автоматизированной периметрии (САП) (пороговые программы в пределах 30, 24, 10º со стандартным белым стимулом), в далекозашедшей стадии приемлемой альтернативой может быть периметрия по Гольдману для определения периферических границ ПЗ, или использование тестов, предусмотренных для низкой остроты зрения со стимулом больше стандартного размера. Для более точной оценки прогрессирования изменений ПЗ у пациента предпочтительнее пользоваться одним и тем же типом прибора и тестом. Важным условием правильного определения границ поля зрения считают предварительное инструктирование пациента по проведению периметрии, а также коррекция рефракции перед тестированием. Для оценки результатов САП используют различные индексы, а также разные диагностические тесты, подтверждающие результаты компьютерного анализа прогрессирования при исследовании в динамике [66,67].
2.5 Иные диагностические исследования
-
Рекомендуется ультразвуковая кератопахиметрия пациентам ПЗУ и ПЗУГ с целью измерения центральной толщины роговицы (ЦТР) в оптической зоне для уточнения результатов тонометрических исследований и прогноза возможного прогрессирования глаукомы [68-71].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4)
Комментарии: среднее значение ЦТР составляет 540±30 мкм. Пациенты с ЦТР более 580 мкм нуждаются в коррекции в сторону понижения. Пациенты с ЦТР менее 520 мкм в коррекции тонометрических показателей в сторону повышения [57-60].
-
Рекомендуется оптическое исследование сетчатки с помощью компьютерного анализатора (оно же – оптическая когерентная томография, ОКТ) пациентам ПЗУ и ПЗУГ в начальной и развитой стадии на этапе диагностики и в ходе регулярного мониторинга с целью выявления количественных изменений ДЗН и сетчатки [72-75].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: ОКТ проводят дополнительно с целью количественной оценки ДЗН, СНВС и внутренних слоев макулы. Результаты визуализации ОКТ предоставляют в трех видах: «в пределах нормы», «пограничный», «вне границ нормы» ‒ и не могут быть клиническим диагнозом. Это статистические данные, результаты сравнения показателей пациента с нормативной базой данных прибора. Полученные результаты необходимо сопоставлять с клинической картиной во избежание ложных выводов, особенно, в случае нестандартных,атипичных вариантов ДЗН, показатели которых отсутствуют в базе. Ключевое значение при проведении ОКТ имеет первое исследование, важно его высокое качество, так как оценку прогрессирования в дальнейшем проводят при сравнении с исходным изображением.
-
Рекомендуется ультразвуковая биометрия глаза пациентам ПЗУ и ПЗУГ для определения размера переднезадней оси (ПЗО) глаза и количественной оценки глубины ПК [27,49,76,77].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: определение размера ПЗО глаза возможно с использованием ультразвукового или оптического биометров. Размер ПЗО меньше 20-21 мм считают фактором риска развития ПЗУГ. Также возможно определение глубины передней камеры: при витреохрусталиковом блоке и нанофтальме передняя камера мелкая или щелевидная, при зрачковом блоке ≤2,0 мм, при «плоской радужке» ≥2,5 мм.
-
Рекомендуется ультразвуковое сканирование переднего отдела глаза пациентам ПЗУ и ПЗУГ для оценки и мониторинга топографо-анатомического взаимоотношения иридоцилиарной зоны, цилиарного тела и хрусталика [78-81].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2)
Комментарии: Инструментальную оценку конфигурации УПК и количественной оценки структур переднего отрезка глаза, в том числе для дифференциальной диагностики, можно проводить с помощью ультразвукового сканирования и ОКТ переднего отрезка глаза. Ультразвуковое сканирование позволяет в режиме реального времени выполнить морфологическую оценку переднего отрезка глаза на глубине до 5 мм, методика контактная, но, в отличие от ОКТ, позволяет оценить состояние структур глаза за радужкой. При ОКТ исследовании длина волны инфракрасной области спектра позволяет получать сканы через роговицу и склеру до пигментного слоя радужки, возможно применение методики для оценки результатов провокационных тестов, преимуществом исследования считают его неинвазивность.
Для диагностики ПЗУ и ПЗУГ применяют нагрузочные провокационные тесты. Различают медикаментозные (с мидриатиками) и физиологические (темновая, с положением лица вниз) провокационные тесты. Специфичность тестов повышается при их комбинации. В настоящее время роль нагрузочных провокационных тестов невелика; используют их редко, так как положительный тест не гарантирует в дальнейшем закрытие УПК, а отрицательный не избавляет от острого приступа. Легкость и безопасность проведения лазерной иридэктомии снизила необходимость проведения провокационных тестов [2,4].
Лечение
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Метод лечения определяется причиной закрытия угла, и, поскольку чаще всего оно вызвано функциональным зрачковым блоком, всем пациентам, прежде всего, рекомендуется лазерная иридэктомия (ЛИ). У пациентов с ПЗУ или ПЗУГ консервативное лечение не должно использоваться в качестве замены лазерной или хирургической иридэктомии [1,4,82].
3.1 Консервативное лечение
-
Рекомендуется местная терапия противоглаукомными препаратами — парасимпатомиметиками (S01EB) пациентам ПЗУГ с впервые установленным диагнозом в качестве начального лечения до выполнения ЛИ для предотвращения острого или хронического закрытия УПК, устранения иридотрабекулярного контакта,
иулучшения оттока ВГЖ и снижения ВГД [1,83,84].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 3)
Комментарии. Медикаментозное лечение ПЗУГ начинают сразу после установления факта ПЗУ. Пилокарпин** 1% по 1-2 капли 1-2 раза в день назначают до выполнения ЛИ для профилактики ОПЗГ. Длительное назначение пилокарпина** может приводить к усилению зрачкового блока, стойкому миозу и развитию задних синехий. Назначение пилокарпина** больным ПЗУГ в постоянном режиме возможно при наличии остаточного закрытия УПК после ЛИ и/или лазерной гониопластики (ЛГП), и в тех случаях, когда назначение других групп противоглаукомных препаратов не снижает уровень ВГД до давления цели. При назначении пилокарпина** больным ПЗУГ с осевой гиперметропией, микрофтальмом, с несоответствием ПЗО и толщины хрусталика возможно развитие ЗГ [82,85].
Механизм действия, побочные эффекты и противопоказания к назначению парасимпатомиметиков представлены в таблице 4.
Таблица 4 – Характеристика фармакотерапевтической группы парасимпатомиметиков (м-холиномиметики)
-
Рекомендуется длительное назначение парасимпатомиметиков (S01EB) пациентам ПЗУГ с плоской радужкой для предотвращения дальнейшего развития гониосинехий и снижения ВГД [1, 86].
-
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии. При плоской радужке хроническое назначение парасимпатомиметиков рассматривается как альтернатива ЛГП.
-
Рекомендуется назначить местную
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии. Возможно назначение всех групп противоглаукомных препаратов с учетом противопоказаний (бета-адреноблокаторы (S01ED), ингибиторы карбоангидразы (S01EC), симпатомиметики для лечения глаукомы (S01EA), аналоги простагландина (S01EE). Суточную дозу, а также длительность курса лечения определяет врач в зависимости от уровня ВГД. Применение местных противоглаукомных препаратов возможно в комбинации друг с другом, а также в сочетании с лазерными и хирургическими методами лечения. Фиксированные лекарственные комбинации в целом предпочтительнее назначения препратов по отельности.
Режим дозирования бета-адреноблокаторов — по 1–2 капли в нижний конъюнктивальный свод больного глаза (глаз) 2 раза в сутки. Механизм действия, побочные эффекты и противопоказания БАБ представлены в таблице 5.
Таблица 5 – Характеристика фармакотерапевтической группы бета-адреноблокаторов
Режим дозирования ингибиторов карбоангидразы — бринзоламид 1% по 1 капле в нижний конъюнктивальный мешок больного глаза (глаз) 2 раза в сутки; дорзоламид** 2% по 1 капле в нижний конъюнктивальный свод больного глаза (глаз) 2-3 раза в сутки [1-4]. Механизм действия, побочные эффекты и противопоказания ингибиторов карбоангидразы представлены в таблице 6.
Таблица 6 – Характеристика фармакотерапевтической группы ингибиторов карбоангидразы
Режим дозирования симпатомиметика для лечения глаукомы (S01EA) бримонидина 0,15% — по 1 капле в нижний конъюнктивальный свод больного глаза (глаз) 3 раза в сутки, бримонидина 0,2% — по 1 капле 2 раза в сутки [1-4].
Механизм действия, побочные эффекты и противопоказания бримонидина представлены в таблице 7.
Таблица 7 – Характеристика фармакотерапевтической группы симпатомиметиков для лечения глаукомы.
Режим дозирования аналогов простагландина (S01EE) — по 1 капле в нижний конъюнктивальный свод больного глаза (глаз) 1 раз в сутки, желательно вечером [1-4]. Механизм действия аналогов простагландина (S01EE), побочные эффекты и противопоказания представлены в таблице 8.
Таблица 8 – Характеристика фармакотерапевтической группы аналогов простагландина [1-4, 172]
У пациентов в развитой стадии ПЗУГ и/или исходно очень высоком уровне ВГД возможен более быстрый переход на комбинированное лечение. Целесообразно комбинировать препараты с различным механизмом действия: улучшающие отток и снижающие секрецию ВГЖ. Предпочтительно назначение фиксированных комбинаций с целью уменьшения проблем, таких как снижение приверженности пациента к лечению при закапывании нескольких капель, снижение эффективности лечения из-за вымывания одного препарата другим, усиление действия консервантов. Не рекомендуется назначать одновременно две фиксированные комбинации. В настоящее время практически все доступные в России комбинации препаратов содержат бета-адреноблокаторы, что необходимо учитывать при их назначении пациентам с сердечно-легочной патологией [90-95].
-
Рекомендуются бесконсервантные гипотензивные капли пациентам ПЗУГ с патологией глазной поверхности, выраженной клиникой синдрома «сухого глаза», с дисфункцией мейбомиевых желез и хроническими аллергическими реакциями, а также тем, кому предстоит оперативное лечение ПЗУГ и в качестве стартовой терапии с целью снижения ВГД [96].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 3)
-
Рекомендуется коррекция местной терапии противоглаукомными препаратами беременным/кормящим пациенткам с ПЗУГ для снижения уровня ВГД с учетом риска тератогенного воздействия препаратов на плод, течение беременности и на новорожденного в период лактации [84].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: препараты для местного лечения ПЗУГ беременным/кормящим пациенткам назначают лишь в том случае, если потенциальная польза лечения оправдывает потенциальный риск для плода. Основные принципы назначения ЛС: использовать минимальное количество препаратов, достаточное для достижения давления цели, обсудить лечение с акушером-гинекологом и педиатром, уменьшить системное всасывание препарата (при легком нажатии пациентом на область внутреннего угла глаза или применении окклюдоров). Наиболее чувствительным периодом является первый триместр беременности из-за возможного тератогенного воздействия на плод систематически применяемых гипотензивных препаратов. Учитывая возможное снижение уровня ВГД в период беременности у некоторых пациенток, может рассматриваться временное прекращение местного гипотензивного лечения в условиях тщательного наблюдения. В период беременности возможно назначение бета-адреноблокатов, симпатомиметиков для лечения глаукомы (альфа 2-адреномиметиков), и/или ингибиторов карбоангидразы ИКА (местных). Аналоги простагландина следует использовать с осторожностью по причине влияния на тонус матки. Поэтому при появлении признаков гипертонуса матки необходимо прекратить их применение. На 9 месяце беременности бета-адреноблокаторы и симпатомиметики для лечения глаукомы (альфа 2-адреномиметики) следует отменить во избежание осложнений у новорожденного. Местные ингибиторы карбоангидразы могут быть продолжены. В период лактации предпочтительнее назначать местные ингибиторы карбоангидразы и аналоги простагландина. ЛИ может быть стартовым или дополнительным вмешательством у беременных и кормящих женщин. В некоторых случаях может быть рассмотрена АГО [84,97-99].
-
Рекомендуется назначать системные ингибиторы карбоангидразы пациентам ПЗУГ для купирования ОПЗГ, в комплексной терапии сложных случаев и в предоперационной подготовке для снижения уровня ВГД [1,100].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
Комментарии. Ацетазоламид** – системный ИКА, снижает секрецию ВГЖ цилиарным телом. Способ применения и дозы: внутрь по 250мг г 1-2 раза в день. При ОПЗГ – по 250 мг 4 раза в сутки. После 5 дней приема делают перерыв на 2 дня. При длительном применении необходимо назначение препараты калия (А12В) (калия аспарагинат + магния аспарагинат & и др.) и калийсберегающей диеты. При подготовке к операции назначают по 250-500 мг накануне и утром в день операции.
Противопоказания к применению: гиперчувствительность (в т.ч. к другим сульфаниламидам), гипонатриемия, гипокалиемия, недостаточность надпочечников, почечная и/или печеночная недостаточность, цирроз печени (риск развития энцефалопатии), мочекаменная болезнь (при гиперкальциурии), гиперхлоремический ацидоз, хроническая декомпенсированная закрытоугольная глаукома (при длительной терапии), сахарный диабет, уремия, кормление грудью. Нежелательные эффекты: парестезии, кожный зуд, гиперемия кожи, снижение аппетита, рвота, понос, снижение массы тела, гемолитическая анемия, лейкопения, агранулоцитоз, нарушение мочевыделения [1-2].
-
Рекомендуется назначать пероральные и парентеральные растворы с осмодиуритическим действием (В05ВС) пациентам ПЗУГ для купирования ОПЗГ, в комплексной терапии сложных случаев и в предоперационной подготовке для снижения уровня ВГД [2,3].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
Комментарии. Растворы с осмодиуритическим действием (B05BC) (маннитола раствор** 15%, глицерол раствор 50%) повышают осмотическое давление в крови, что сопровождается поступлением жидкости из тканей в кровь, в результате чего снижается внутричерепное и внутриглазное давление. Уменьшая реабсорбцию воды в проксимальных канальцах, эти препараты обладают диуретическим эффектом. Уровень ВГД на фоне применения осмотических средств снижается в среднем через 30 мин, максимальное действие развивается через 60 мин и продолжается в течение 4-6 ч. Режим дозирования: глицерол раствор 50% — внутрь 1-2 г/кг массы тела 1 раз в сутки, маннитола раствор** 15% внутривенно капельно в течение не менее 30 мин. по 1,5-2 г/кг массы тела. Нежелательные эффекты: рвота, тошнота, диарея, головокружение, судороги, гипотензия или гипертензия, тахикардия, нарушение мочевыделения, метаболические нарушения. С осторожностью: у больных сахарным диабетом [1-4].
-
Рекомендуется начинать неотложное комплексное лечение с применением местных противоглаукомных, кортикостероидных и нестероидных противовоспалительных препаратов и противовоспалительной терапии лечение с местной гипотензивной и противовоспалительной терапии пациентам ПЗУГ с ОПЗГ с целью снижения уровня ВГД и устранения отека роговицы [3].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии. Медикаментозное лечение острого приступа глаукомы включает в себя неотложное применение бета-адреноблокатов, ингибиторов карбоангидразы, симпатомиметиков для лечения глаукомы, парасимпатомиметиков, пероральных или внутривенных растворов с осмодиуритическим действием (B05BC), кортикостероидов (S01BA), нестероидных противовоспалительных препаратов (S01BC) и др. [1-4]. С учетом противопоказаний для каждого конкретного больного. Ингибиторы карбоангидразы, бета-адреноблокаторы или симпатомиметики для лечения глаукомы могут использоваться в качестве терапии первой линии либо самостоятельно, либо в комбинации. Бета-адреноблокаторы снижают уровень ВГД примерно на 20-30% в течение 1 часа после инстилляции; симпатомиметики для лечения глаукомы снижают ВГД примерно на 26% в течение 2 часов после инстилляции [101-103].
При ОПЗГ средства, подавляющие образование водянистой влаги, могут быть неэффективны при выраженной ишемии цилиарного тела. Парасимпатомиметики могут не сужать зрачок при уровне ВГД более 40 мм рт.ст. вследствие ишемии зрачкового сфинктера [104].
Интенсивное лечение парасимпатомиметиками больше не используют для лечения ОПЗГ по причине системных побочных эффектов (схваткообразной боли в животе и потливости) [1].
ЛИ или хирургическая иридэктомия, если лазерная процедура недоступна, при ОПЗГ должна быть выполнена как можно скорее. ЛИ возможна при купировании отека роговицы, на которое может потребоваться от нескольких часов до 1-2 суток. Риск развития осложнений при лазерной иридэктомии несопоставим с преимуществами процедуры. Правильное неотложное лечение приводит к купированию острого приступа глаукомы у большинства пациентов [4]. Комплекс мероприятий, рекомендованный при лечении ОПЗГ указаны в приложении Б.
-
Рекомендуется назначить антихолинэргические средства (S01FA), симпатомиметики (исключая противоглаукомные препараты) (S01FВ) пациентам ПЗУГ с осевой гиперметропией, микрофтальмом, с несоответствием размеров ПЗО и толщины хрусталика и с ЗГ после выполнения ЛИ на фоне назначения местных противоглаукомных препаратов с целью восстановления глубины ПК и снижения ВГД [13,105].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: При наличии зрачкового блока у пациентов ПЗУГ с осевой гиперметропией, микрофтальмом и ЗГ создание циклоплегии каплями атропина 1%** (или инъекциями атропина 0,1%**) вызывает паралич цилиарной мышцы, расширяется кольцо цилиарных отростков, натягиваются зонулярные волокна, хрусталик отодвигается кзади. Капли фенилэфрин 2,5% (или инъекции фенилэфрина 1%**) используют для подтягивания зонулярных волокон хрусталика путем стимуляции продольной мускулатуры цилиарного тела [86,105-107].
Атропин 1%** — м-холиноблокатор – это природный третичный амин. Влияет как на центральные, так и на периферические м-холинорецепторы. Вызывает мидриаз, паралич аккомодации, уменьшает секрецию слезной жидкости. При местном применении в офтальмологии максимальное расширение зрачка наступает через 30-40 мин и исчезает через 7-10 дней. Мидриаз, вызванный атропином**, не устраняется при инстилляции при инстилляции парасимпатомиметиков. Режим дозирования: при местном применении закапывают по 1-2 капли 1% раствора от 1 до 3 раз в день. Побочное действие при местном применении: гиперемия кожи век, гиперемия и отек конъюнктивы век и глазного яблока, фотофобия, сухость во рту, тахикардия. Противопоказания к применению: повышенная чувствительность к атропину**. Применение при беременности и кормлении: атропин** проникает через плацентарный барьер. При в/в введении при беременности или незадолго до родов возможно развитие тахикардии у плода. C осторожностью применять у пациентов с заболеваниями сердечно-сосудистой системы, при которых увеличение частоты сердечных сокращений может быть нежелательным; при атонии кишечника у больных пожилого возраста или ослабленных больных (возможно развитие непроходимости), при гипертрофии предстательной железы и задержке мочи.
Фенилэфрин 2,5% — альфа-адреномиметик. При местном применении сокращает дилататор зрачка, тем самым вызывая расширение зрачка, и гладкие мышцы артериол конъюнктивы. Побочное действие при местном применении: повышение или понижение АД, боль в области сердца, учащенное сердцебиение, тахикардия, сердечные аритмии, рефлекторная брадикардия, головная боль, головокружение, возбуждение, тошнота или рвота, угнетение дыхания, олигурия, ацидоз, бледность кожи, потливость.
Другие методы лечения
Так как у пациентов с ПЗУГ заболевание может прогрессировать, несмотря на кажущийся достаточный уровень ВГД, признается необходимость проведения таким больным нейропротекторного лечения (витаминно-минеральные комплексы, ноотропные препараты и др.), не связанных со снижением уровня ВГД [1,2]. Однако, доказательная база, достаточная для использования их в рутинной офтальмологической практике, еще не накоплена [107,108]. Альтернативные стратегии лечения ГОН (нейропротекция) являются предметом исследований и обсуждений [109].
3.2 Лазерное лечение
-
Рекомендуется выполнить ЛИ пациентам с ППЗУ, ПЗУ, ПЗУГ и ОПЗГ в качестве процедуры первого выбора для открытия или расширения УПК вне зависимости от уровня ВГД [1,110-112].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 3)
Комментарии: ЛИ является предпочтительным методом лечения для больных с подозрением на ПЗУ, ПЗУ, ПЗУГ и ОПЗГ непосредственно после установления диагноза [111]. Это процедура, позволяющая ВГЖ проходить непосредственно из задней камеры в переднюю через отверстия в радужке. ЛИ успешно устраняет относительную составляющую зрачкового блока, независимо от того, связано ли основное закрытие угла в первую очередь со зрачковым блоком или другим механизмом [113].
Показания для ЛИ: профилактика ОПЗГ, достижение давления цели, долгосрочный контроль ВГД, профилактика формирования гониосинехий и предотвращение дальнейшего закрытия УПК. Изменения конфигурации УПК после ЛИ можно количественно оценить с помощью гониоскопии или методов визуализации (ультразвуковое сканирование или ОКТ переднего отдела глаза) [114]. В случае остаточного закрытия УПК после ЛИ может иметь место прогрессирующее синехиальное закрытие УПК вследствие механизмов не зрачкового блока. ЛИ выполняется с помощью Nd: YAG и/или аргонового лазера. Используют инстилляционную анестезию. Пациенту за 30 минут до операции проводят медикаментозный миоз с помощью глазных капель 1% раствора пилокарпина** для уменьшения толщины радужной оболочки и облегчения перфорации [1]. Эффективность ЛИ у больных ПЗУГ зависит как от основного механизма закрытия УПК, так и от стадии заболевания, когда оно диагностируется. До 35% пациентов ПЗУГ имеют «закрытый угол» после ЛИ [38,115,116].
-
Рекомендуется назначить медикаментозную терапию пациентам с ПЗУГ с целью профилактики реактивной гипертензии ВГД после проведение ЛИ [117].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2)
Комментарии: Назначение противоглаукомных препаратов (парасимпатомиметиков, бета-адреноблокатов, ингибиторов карбоангидразы симпатомиметиков для лечения глаукомы, аналогов простагландина, осмотических диуретиков) может снизить степень выраженности реактивной гипертензии после ЛИ [118, 119].
-
Рекомендуется контроль ВГД через 1 час и через 2 недели после выполнения ЛИ пациентам с ППЗУ, ПЗУ, ПЗУГ для определения степени выраженности реактивной гипертензии [120].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2)
Комментарии: Реактивная гипертензия более выражена при обширном синехиальном закрытии УПК, вследствие затруднения оттока через оставшуюся открытой часть трабекулы частицами радужки и пигментом в результате ЛИ. Предшествующее назначение пилокарпина 1%** и инстилляция бримонидина 0,15-0,2% по 1-2 капли (при отсутствии противопоказаний к его применению у конкретного больного) за 1 час и/или непосредственно перед ЛИ снижает риск кровотечений из радужки и степень выраженности реактивной гипертензии [1-4, 121].
Использование глазных капель дексаметазона 0,1% может быть фактором, способствующим длительному повышение ВГД после ЛИ. Послеоперационные осложнения более характерны для лиц с темными толстыми радужками (чаще азиатской расы) [122,123].
Образование задних синехий и необратимый миоз после ЛИ возможны вследствие продолжительного назначения парасимпатомиметиков и/или недостаточной противовоспалительной терапии.
-
Рекомендуется выполнить комбинированное ЛИ и лазерную гониопластику (ЛГП) пациентам ПЗУГ с «плоской радужкой» с целью увеличения ширины УПК и снижения ВГД [124].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4)
Комментарии: ЛГП позволяет расширить профиль УПК за счет сокращения периферической части радужки. При наличии возможности, рекомендуется выполнять лазерную гониопластику после лазерной иридотомии. Показанием считают наличие хронической ПЗУГ, которая развивается длительное время, часто на фоне ранее существующей ПОУГ при наличии предрасполагающих к закрытию УПК факторов (гиперметропия, увеличение размеров хрусталика). При синдроме «плоской радужки» ЛГП иногда рассматривается как альтернатива хроническому назначению миотиков.
После процедуры ЛГП развиваются пигментированные ожоги радужки в местах коагуляции. Поскольку гониопластику часто выполняют пациентам с неглубокой ПК, могут возникать диффузные ожоги эндотелия роговицы. Серьезным осложнением считают дислокацию зрачка и стойкий мидриаз.
ЛГП выполняют зеленым или сине-зеленым аргоновым лазером. Анестезия местная. Пациенту за 30 минут до операции проводят медикаментозный миоз с помощью 1-2% раствора пилокарпина** [125].
-
Рекомендуется ЛТП пациентам ПЗУГ с открытым УПК не менее чем на 1800 окружности после ранее проведенной ЛИ для улучшения оттока внутриглазной жидкости через трабекулярную сеть и снижения ВГД [126,127].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2)
Комментарии: Возможно использование нескольких видов лазеров: Аргоновый/Диодный лазер; для селективной лазерной трабекулопластики — YAG лазер с модулируемой добротностью, с удвоенной частотой (532 нм). Анестезия местная [126,127].
Инстилляция симпатомиметиков для лечения глаукомы (селективных альфа 2-адреномиметиков) 0,15-0,2% или местных ингибиторов карбоангидразы 1-2% по 1-2 капли (при отсутствии противопоказаний к применению у конкретного больного) за 1 час и/или непосредственно перед ЛТП может снизить степень выраженности реактивной гипертензии [1,121,128].
-
Рекомендуется проведение лазерной транссклеральной циклокоагуляции пациентам с ПЗУГ с отсутствием предметного зрения при высоком ВГД и/или отсутствием эффекта от предшествующих проникающих АГО (в том числе дренажной хирургии) с целью снижения ВГД и/или купирования болевого синдрома [1,129-131].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
Комментарии: Лазерную транссклеральную циклокоагуляцию выполняют с помощью диодного лазера (810 нм). Используют местную и субтеноновую и/или ретробульбарную анестезию, общую анестезию — по показаниям. При проведении процедуры необходимо оценить возможные риски осложнений, в том числе послеоперационное воспаление, снижение зрения, гипотонию, субатрофию глазного яблока. Возможно проведение лазерной циклокоагуляции альтернативными методами: эндоскопическая и микроимпульсная циклокоагуляция [132,133].
-
Рекомендуется назначение противовоспалительной терапии из группы нестероидных противовоспалительных препаратов и/или кортикостероидов для профилактики послеоперационных осложнений (реактивная гипертензия, посткоагуляционный увеит, задние синехии) пациентам после ЛИ, ЛГП, ЛТП, лазерной трансклеральной циклокоагуляции [1].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: возможно назначение противовоспалительной терапии из группы нестероидных противовоспалительных препаратов (диклофенак 0,1%** по 1 капле 3-4 раза в день или индометацин – также по 1 капле 3-4 раза в день, или непафенак 0,1% по 1-2 капли 2 раза в день, или бромфенак 0,09% по 1 капле 1 раз в день) и/или глюкокортикостероидов (дексаметазон 0,1% по 1-2 капли 3 раза в день) за 1-2 дня до и в течение 7-14 дней после лазерных вмешательств [2].
3.3 Хирургическое лечение
-
Рекомендуется хирургическое лечение пациентам ПЗУГ и ОПЗГ после проведения ЛИ при прогрессировании синехиальной блокады УПК и высоком ВГД на медикаментозном режиме с целью предотвращения дальнейшего закрытия УПК, нормализации ВГД и достижения давления цели [1,3,4,134].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: при прогрессировании закрытия УПК и/или отсутствии давления цели у пациентов после проведения ЛИ, возможен выбор следующих хирургических вмешательств: 1) фистулизирующая операция (трабекулоэктомия (ТЭ)), 2) экстракция хрусталика, 3) комбинированное вмешательство – ТЭ/экстракция хрусталика.
-
Рекомендуется направлять к профильным специалистам за консультацией пациентов с сопутствующими системными заболеваниями и факторами риска системных осложнений перед выполнением оперативного лечения с целью выявления возможных противопоказаний к данному виду лечения или минимизирования риска осложнений [2].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
Рекомендуется ТЭ пациентам ПЗУГ после ЛИ с высоким уровнем ВГД, которое не может быть нормализовано каким-либо другим методом лечения; при недоступности соответствующей медикаментозной терапии; невозможности осуществления адекватного врачебного контроля за течением глаукомного процесса и приверженностью пациента, быстром прогрессировании заболевания с целью нормализации ВГД и достижения давления цели, предотвращения прогрессирования синехиальной блокады УПК [3,4,134,135].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: трабекулоэктомия при ПЗУГ эффективна, однако, в отличие от ПОУГ имеется значительный риск осложнений, особенно в анатомически предрасположенных глазах (маленькая ПЗО, гиперметропическая рефракция, мелкая ПК, глубоко посаженные глаза). В глазах, недавно перенесших ОПЗГ, дополнительные сложности создают гиперемированная конъюнктива, отечная роговица, мелкая ПК. Кроме того, повышается риск развития интраоперационной экспульсивной геморрагии и злокачественной глаукомы, а также прогрессирование катаракты [135,136].
-
Рекомендуется интра- и послеоперационная коррекция процессов избыточного рубцевания при ТЭ пациентам ПЗУГ с факторами риска рубцевания конъюнктивы, в том числе: молодой возраст, воспалительные заболевания глаза, продолжительная местная медикаментозная терапия с использованием нескольких препаратов, афакия, предшествующая интраокулярная хирургия в сроки менее трех месяцев, после операций с разрезом конъюнктивы, а также при неэффективной предшествующей фистулизирующей хирургии [137-139].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: интра- и послеоперационная коррекция избыточного рубцевания включает в себя усовершенствование этапов операции (применение вискоэластиков, регулируемых швов и др.), применение дренажей, процедуру нидлинга (от анг. needle – игла) – трансконъюнктивальную ревизию зоны фильтрации [137-139]. В каждом случае важно оценивать возможные риски и необходимость достижения более низкого ВГД при выборе метода коррекции избыточного рубцевания.
-
Рекомендуется экстракция хрусталика/факоэмульсификация (ФЭК) пациентам ПЗУГ с целью предотвращения прогрессирования закрытия УПК, улучшения зрительных функций и дополнительного снижения ВГД для нормализации ВГД и достижения давления цели [140-143].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: клинические исследования подтверждают положительные результаты ФЭК при ПЗУГ, включающие, увеличение глубины ПК, расширение УПК, а также дополнительное снижение ВГД [144-146]. Однако, до сих пор не определены четкие показания хирургии катаракты в комплексном лечении ПЗУГ, в том числе целесообразность удаления прозрачного хрусталика, как основного метода лечения вместо ЛИ и/или медикаментозного лечения. Хирургическое лечение катаракты при ПЗУГ, как правило, сложнее, и связано с повышенным риском развития осложнений по причине мелкой ПК, большого размера хрусталика, отека роговицы, недостаточного мидриаза зрачка, наличия задних синехий, меньшего количества эндотелиальных клеток, слабых зонулярных волокон, особенно после перенесенного острого приступа.
-
Рекомендуется комбинированное хирургическое лечение (экстракция хрусталика/ФЭК в сочетании с ТЭ) пациентам ПЗУГ при повышенном уровне ВГД на максимальном гипотензивном режиме с целью предотвращения прогрессирования закрытия УПК, улучшения зрительных функций, нормализации ВГД и достижения давления цели [147-149].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: экстракция хрусталика/ФЭК имеет менее выраженный гипотензивный эффект, чем в сочетании с ТЭ. В то же время сочетанная хирургия сопряжена с большим риском осложнений [150-152]. В каждом индивидуальном случае необходимо оценивать возможные риски и преимущества.
-
Рекомендуется хирургическая иридэктомия пациентам ПЗУГ при отсутствии технической возможности выполнения лазерной иридэктомии, выраженном отеке роговицы с целью предотвращения прогрессирования закрытия УПК и снижения ВГД [1,3,4].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Лазерная процедура предпочтительнее, поскольку исключает возможные осложнения хирургического вмешательства (мелкая ПК, образование гониосинехий, злокачественная глаукома, эндофтальмит).
-
Рекомендуется экстракция хрусталика с витрэктомией пациентам ЗГ при наличии собственного хрусталика при отсутствии эффективности от медикаментозного и лазерного лечения с целью предотвращения необратимых изменений в переднем отрезке глаза, восстановления правильного тока внутриглазной жидкости из задней камеры в переднюю, улучшения зрительных функций и снижения ВГД [1,105,153,154].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: хирургическое лечение ЗГ должно быть своевременно во избежание необратимых изменений в переднем отрезке глаза. Витрэктомию проводят не только с целью декомпрессии стекловидного тела, а также создания прямой связи между стекловидным телом и передней камерой [105,154]. Во время витрэктомии при необходимости в одной локализации проводят гиалоидотомию, капсулотомию и иридэктомию для создания полноценной связи между передней и задней камерами. Эффективность вмешательства оценивают по увеличению глубины передней камеры и снижению ВГД.
-
Рекомендуется витрэктомия пациентам ЗГ с афакией/артифакией при отсутствии эффективности от медикаментозного и лазерного лечения с целью предотвращения необратимых изменений в переднем отрезке глаза, восстановления правильного тока внутриглазной жидкости из задней камеры в переднюю, улучшения зрительных функций и снижения ВГД [1,105,153,154].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
-
Рекомендуется имплантация антиглаукоматозных дренажей пациентам ПЗУГ с целью достижения давления цели и предотвращения клинически значимого прогрессирования заболевания при неэффективности трабекулэктомии, выраженном рубцевании конъюнктивы, вследствие предшествующих операций на глазах на фоне заболеваний конъюнктивы или тканей глазной поверхности [1,3,155,156].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: дренажная хирургия рекомендована в наиболее сложных случаях. Выбор дренажного устройства зависит от технических возможностей и предпочтений хирурга. Технически использование дренажей при ПЗУГ сложнее, чем при ПОУГ и потенциально опаснее развитием серьезных осложнений. Их использование предпочтительнее у пациентов с предшествующими фильтрующими процедурами без достаточного гипотензивного эффекта.
-
Рекомендуется циклодеструктивная операция пациентам ПЗУГ с целью снижения ВГД и купирования болевого синдрома при отсутствии предметного зрения и высоком уровне ВГД с болевым синдромом [129-131].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
Комментарии: в современной антиглаукоматозной хирургии предпочтительно применение лазерных методов циклодеструкции, чем циклокриопексии. При проведении этих процедур необходимо оценить возможные риски развития осложнений, таких как послеоперационное воспаление, снижение зрения, гипотония, субатрофия глазного яблока.
-
Рекомендуется перед операцией максимальное снижение уровня ВГД с применением местных и системных противоглаукомных препаратов, при показаниях назначение антибактериальной, противовоспалительной терапии с целью предупреждения интра- и послеоперационных осложнений [2].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Рекомендуется применение местной (инстилляционной, ретробульбарной или субтеноновой) или при необходимости, общей анестезии пациентам перед началом хирургического вмешательства для обезболивания и предупреждения интраоперационных осложнений [157].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
Рекомендуется назначение пациентам после проведения хирургического вмешательства антибактериальной, противовоспалительной терапии из группы нестероидных противовоспалительных препаратов, глюкокортикостероидов, антихолинергических средств (S01FA), симпатомиметиков для профилактики послеоперационных осложнений [2].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Риск прогрессирования заболевания до поздней стадии выше у пациентов, не соблюдающих режим закапывания гипотензивных капель.
Перспективы лечения ПЗУГ с целью сохранения зрительных функций зависят от своевременного начала лечения и соблюдения оптимального режима гипотензивной терапии в соответствии с инструкцией к препарату и клинических рекомендаций на основе данных регулярного наблюдения.
У пациентов с начальной и развитой стадиями глаукомы сохраняются зрительные функции и умерено ухудшается качество жизни, в то время как далекозашедший процесс (из-за потери зрительных функций) приводит к значительному ухудшению качества жизни. Поэтому наиболее значимым для сохранения зрения и профилактики слепоты от глаукомы становится раннее выявление заболевания.
Медицинская реабилитация
4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
Медико-социальная реабилитация больных глаукомой должна включать не только послеоперационный этап, но все этапы ведения больного: диагностику, собственно лечение (терапевтическое и/или хирургическое), диспансерное наблюдение, психологическую реабилитацию, социальную адаптацию.
- Рекомендуется проведение реабилитации пациентов с ПЗУГ с целью предотвращения инвалидизации вследствие прогрессивного снижения зрительных функций: 1) своевременное назначение лечения; 2) регулярное диспансерное наблюдение врача-офтальмолога 3) адекватное медикаментозное лечение [2].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Рекомендуется амбулаторное наблюдение врачом-офтальмологом в течение 1-1,5 месяца всех пациентов ПЗУГ после хирургического лечения с целью профилактики и лечения послеоперационных осложнений [4,135,158].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Рекомендуется массаж глазного яблока и нидлинг фильтрационной подушки пациентам ПЗУГ после антиглаукомной операции (АГО) при выявлении признаков рубцевания вновь созданных путей оттока с целью восстановления пассажа ВГЖ и снижения ВГД [159,160].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Рекомендуется подбор средств оптической коррекции слабовидения пациентам со слабовидением с целью повышения качества жизни [2].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Госпитализация
6. Организация оказания медицинской помощи
Основные принципы организации медицинской помощи при остром приступе глаукомы:
1) Диагностика острого приступа глаукомы на догоспитальном этапе.
2) Проведение комплекса неотложных лечебных мероприятий на догоспитальном этапе.
3) Ранняя госпитализация при отсутствии купирования острого приступа глаукомы.
4) Проведение диагностических и неотложных лечебных мероприятий, патогенетического и симптоматического лечения на госпитальном этапе.
5) Мероприятия по профилактике острого приступа глаукомы на парном глазу и диспансерное наблюдение.
Основные принципы организации медицинской помощи при ПЗУГ:
Первичная специализированная медико-санитарная помощь оказывается врачом-офтальмологом в поликлиническом отделении медицинской организации.
Проведение лечения (лазерных вмешательств, медикаментозного консервативного или физиотерапевтического лечения) проводится в амбулаторных условиях, условиях дневного стационара или круглосуточного стационара.
Показание для плановой госпитализации в медицинскую организацию:
— необходимость выполнения оперативного лечения ПЗУГ и/или лазерного лечения и/или медикаментозного лечения при невозможности проведения лечения в амбулаторных условиях, условиях дневного стационара.
Показание для неотложной госпитализации в медицинскую организацию:
— не купируемый ОПЗГ.
— эндофтальмит, как осложнение АГО.
Показание к выписке пациента из медицинской организации:
1) завершение лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи, в условиях круглосуточного или дневного стационара при условии отсутствия осложнений, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, подтвержденный консилиумом медицинской организации;
3) необходимость перевода пациента в другую медицинскую организацию.
Профилактика
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Систематические обзоры или исследования, в которых получены данные об экономической эффективности скрининга для выявления ПЗУГ, также как и при ПОУГ отсутствуют, а публикации носят противоречивый характер [3,161-163].
-
Рекомендуется измерение ВГД гражданам при первом прохождении профилактического медицинского осмотра, далее в возрасте 40 лет и старше 1 раз в год с целью раннего выявления ПЗУГ [2,164].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Первый этап диспансеризации (скрининг) проводится с целью выявления у граждан признаков ПЗУГ, факторов риска, особенно при отягощенном семейном анамнезе; определения медицинских показаний к выполнению дополнительных обследований и осмотров врачом-офтальмологом для уточнения диагноза глаукомы.
-
Рекомендуется осмотр (консультация) врачом-офтальмологом населения с факторами риска закрытия УПК с целью раннего выявления ПЗУГ [1,2,4].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
-
Рекомендуется назначение ЛИ всем пациентам на парном глазу после перенесенного ОПЗГ с профилактической целью [165-169].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3).
Комментарии: На парном глазу после перенесенного ОПЗГ необходима незамедлительная ЛИ при наличии узкого УПК, так как примерно у половины пациентов имеется вероятность развития ОПЗГ в течение 5 лет [165-169].
-
Рекомендуется диспансерный осмотр всем пациентам ПЗУГ после ЛИ с целью предотвращения дальнейшего прогрессирования синехиальной блокады УПК [1,2,4].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
-
Рекомендуется мониторинг визометрии, офтальмотонометрии осуществлять не менее одного раза в 6 месяцев, периметрию, гониоскопию, офтальмоскопию – один раз в 6-12 месяцев пациентам при стабилизированном течении ПЗУГ на фоне достижения давления цели, отсутствия прогрессирования состояния УПК, ДЗН и поля зрения [1,2,4].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
-
Рекомендуются индивидуальная периодичность мониторинга пациентов с нестабилизированным течением ПЗУГ, в зависимости от особенностей течения глаукомного процесса, наличия сопутствующей патологии и используемых ЛС [1,2,4].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: у пациентов ПЗУГ, находящихся на медикаментозной терапии, определяют эффективность и любые побочные эффекты лечения; выявляют изменения и новые назначения других специалистов по системным показаниям, которые могут повлиять на лечение глаукомы; контролируют правильность соблюдения пациентом режима гипотензивной терапии глаукомы. Пациентам после хирургических вмешательств оценивают функциональный и гипотензивный эффект операции, корректируют послеоперационное лечение (антимикробное, противовоспалительное, репаративное и др.), осуществляют контроль и лечение другой офтальмологической патологии (катаракта, увеит, диабетическая ретинопатия, синдром сухого глаза и др.). У пациентов с наличием фильтрационной подушки должны оцениваться ее высота, ширина, наличие истончения, васкуляризации, инкапсулирования, активной фильтрации и инфицирования.
Каждый визит пациента сопровождается оценкой субъективного самочувствия больного, зрительных функций (трудности при вождении, темновая адаптация, проблемы с контрастной чувствительностью, чтением мелкого шрифта и оценкой расстояния до предметов), качества жизни и приверженности пациента к назначенному лечению. Переоценку факторов риска проводят при каждом посещении пациента.
При оценке качества жизни пациента акцент должен быть сделан на улучшение состояния больного. Возможно, использование вопросников по качеству жизни с оценкой бремени болезни и бремени лечения.
Информация
Источники и литература
-
Клинические рекомендации общероссийской общественной организации Ассоциация врачей-офтальмологов
- Клинические рекомендации общероссийской общественной организации Ассоциация врачей-офтальмологов — European Glaucoma Society Terminology and Guidelines for Glaucoma (4th Edition). Savona: PubliComm, 2014: 196.
Национальное руководство по глаукоме для практикующих врачей. Изд. 4-е, испр. и доп. / Под ред. Е.А. Егорова, В.П. Еричева. М.: ГЭОТАР-Медиа, 2019: 384.
World Glaucoma Association Consensus Statement: Angle Closure and Angle Closure Glaucoma / Eds. Weinreb R.N., Friedman D.S. The Netherlands: Kluger; 2006: 113.
Primary Angle Closure / American Academy of Ophthalmology Preferred Practice Pattern® Guidelines, San Francisco; 2015: 40.
Seah S.K., Foster P.J., Chew P.T. et al. Incidence of acute primary angle-closure glaucoma in Singapore. An island-wide survey. Arch Ophthalmol. 1997; 115(11): 1436-1440.
Foster P.J., Baasanhu J., Alsbirk P.H. et al. Glaucoma in Mongolia. A population-based survey in Hovsgol province, northern Mongolia. Arch Ophthalmol. 1996; 114(10): 1235-1241.
Bengtsson B. The prevalence of glaucoma. Br J Ophthalmol. 1981; 65(1): 46-49.
Wolfs R.C., Grobbee D.E., Hofman A., de Jong P.T. Risk of acute angle-closure glaucoma after diagnostic mydriasis in nonselected subjects: the Rotterdam Study. Invest Ophthalmol Vis Sci. 1997; 38(12): 2683-2687.
Congdon N., Wang F., Tielsch J.M. Issues in the Epidemiology and Population-Based Screening of Primary Angle-Closure Glaucoma. Surv Ophthalmol. 1992; 36(6): 411-423.
Lai J.S., Liu D.T., Tham C.C. et al. Epidemiology of acute primary angle-closure glaucoma in the Hong Kong Chinese population: prospective study. Hong Kong Med J. 2001; 7(2): 118-123.
Perkins E.S. Family studies in glaucoma. Br J Ophthalmol. 1974; 58(5): 529-535.
Leighton D.A. Survey of the first-degree relatives of glaucoma patients. Trans Ophthalmol Soc UK. 1976; 96(1): 28-32.
Ефимова М.Н. Злокачественная глаукома: диагностика, клиника, лечение. Глаукома. 2002; 1: 53-60.
Quigley H.A., Friedman D.S., Congdon N.G. Possible mechanisms of primary angle-closure and malignant glaucoma. J Glaucoma 2003; 12(2): 167-180.
Yue B.Y., Duvall J., Goldberg M.F. et al. Nanophthalmic sclera; morphologic and tissue culture studiem. Ophtalmology. 1986; 93(4): 534-541.
Resnikoff S., Pascolini D., Etyaale D. et al. Global data on visual impairment in the year 2002. WHO Bull. 2004; 82(11): 844-855.
Quigley H.A., Broman A.T. The number of persons with glaucoma worldwide in 2010 and 2020. Br J Ophthalmol. 2006; 90(3): 262-267.
Dandona L., Dandona R., Mandal P. et al. Angle closure glaucoma in an urban population in southern India. The Andhra Pradesh eye disease study. Ophthalmology. 2000; 107(9): 1710-1716.
Jacob A., Thomas R., Koshi S.P. et al. Prevalence of primary glaucoma in an urban south Indian population. Ind J Ophthalmol. 1998; 46(2): 81-86.
Ramakrishnan R., Nirmalan P.K., Krishnadas R. et al. Glaucoma in a rural population of southern India: the Aravind comprehensive eye survey. Ophthalmology. 2003; 110(8): 1484-1490.
Vijaya L., George R., Arvind H. et al. Prevalence of angle-closure disease in a rural southern Indian population. Arch Ophthalmol. 2006; 124(3): 403-409.
Shiose Y., Kitazawa Y., Tsukuhara S. et al. Epidemiology of glaucoma in Japan – A nationwide glaucoma survey. Jpn J Ophthalmol. 1991; 35(2): 133-135.
Foster P.J., Baasanhu J., Alsbrik P.H. et al. Glaucoma in Mongolia – A poplation-based survey in Hovsgol Province, Northern Mongolia. Arc Ophthalmol. 1996; 114(10): 1235-1241.
Foster P.J., Oen F.T., Machin D.S. et al.The prevalence of glaucoma in Chinese residents of Singapore. A cross-sectional population survey in Tanjong Pagar district. Arch Ophthalmol. – 2000; 118(8): 1105-1111.
Yamamoto T., Iwase A., Araie M., et al. The Tajimi Study report 2: prevalence of primary angle closure and secondary glaucoma in a Japanese population. Ophthalmology. 2001; 112(10): 1661-1669.
Foster P.J., Jonson G.J. Glaucoma in China: how big is the problem? Br J Ophthalmol. 2001; 85(11): 1277-1282.
Alsbirk P.H. Primary angle closure glaucoma. Oculometry, epidemiology, and genetics in a high risk population. Acta Ophthalmol. 1976; 127: 5-31.
Bourne R.A., Sukudom P., Foster P.J. et al. Prevalence of glaucoma in Thailand: a population based survey in Rom Klao District, Bangkok. Br J Ophthalmol. 2003; 87(9): 1069-1074.
Foster P.J., Buhrmann R., Quigley H.A., Johnson G.J. The definition and classification of glaucoma in prevalence surveys. Br J Ophthalmol. 2002; 86(2): 238-242.
Day A.C., Baio G., Gazzard G., et al. The prevalence of primary angle closure glaucoma in European derived populations: a systematic review. Br J Ophthalmol. 2012; 96(9): 1162-1167.
Общая заболеваемость взрослого населения России в 2018 году: Статистические материалы. Часть IV. [Электронный ресурс]. М.: 2019: 45-46. URL: https://www.rosminzdrav.ru/ministry/61/22/stranitsa-979/statisticheskie-informatsionnye-materialy/statisticheskiy-sbornik-2018-god (дата обращения: 20.04.2020)
Clinical decisions in glaucoma / E. Hodapp, R. Parrish, D. Anderson // St. Louis: The CV Mosby Co. 1993: 204.
Shah N.N., Bowd C., Medeiros F.A. et al. Combining structural and functional testing for detection of glaucoma. Ophthalmology. 2006; 113(9): 1593-1602.
Coleman A., Friedman D., Gandolfi S., Singh K., Tuulonen A. Levels of diagnostic studies. In Weinreb R.N., Greve E.L. (Eds.) / Glaucoma diagnosis: Structure and Function. Consensus series I. Amsterdam: Kugler Puplications. 2004: 9-12.
Alsbirk P.H. Early detection of primary angle-closure glaucoma. Limbal and axial chamber depth screening in a high risk population (Greenland Eskimos). Acta Ophthalmol. 1988; 66(5): 556-564.
Wilensky J.T., Kaufman P.L., Frohlichstein D. et al. Follow-up of angle-closure glaucoma suspects. Am J Ophthalmol. 1993; 115(3): 338-346.
Alsbirk P.H. Anatomical risk factors in primary angle-closure glaucoma. A ten-year follow-up survey based on limbal and axial anterior chamber depths in a high risk population. Int Ophthalmol. 1992; 16(4-5): 265-272.
Thomas R., George R., Parikh R. et al. Five year risk of progression of primary angle closure suspects to primary angle closure: a population based study. Br J Ophthalmol. 2003; 87(4): 450-454.
Amerasinghe N., Zhang J., Thalamuthu A. et al.The heritability and sibling risk of angle closure in Asians. Ophthalmology. 2011; 118(3): 480-485.
Lowe R.F. Aetiology of the anatomical basis for primary angle-closure glaucoma. Biometrical comparisons between normal eyes and eyes with primary angle-closure glaucoma. Br J Ophthalmol. 1970; 54(3): 161-169.
Congdon N.G., Quigley H.A., Hung P.T. et al. Screening techniques for angleclosure glaucoma in rural Taiwan. Acta Ophthalmol. 1996; 74(2): 113-119.
Wong T.Y., Foster P.J., Seah S.K., Chew P.T. Rates of hospital admissions for primary angle closure glaucoma among Chinese, Malays, and Indians in Singapore. Br J Ophthalmol. 2000; 84(9): 990-992.
Salmon J.F. Predisposing factors for chronic angle-closure glaucoma. Prog Retin Eye Res. 1999; 18(1): 121-132.
Lowe R.F. Acute angle-closure glaucoma. The second eye: an analysis of 200 cases. Br J Ophthalmol. 1962; 46(11): 641-650.
Subak-Sharpe I., Low S., Nolan W., Foster P.J. Pharmacological and environmental factors in primary angle-closure glaucoma. Br Med Bull. 2010; 93: 125-143.
Kong X., Chen Y., Chen X., Sun X. Influence of family history as a risk factor on primary angle closure and primary open angle glaucoma in a Chinese population. Ophthalmic Epidemiol. 2011; 18(5): 226-232.
Lachkar Y., Bouassida W. Drug-induced acute angle closure glaucoma. Curr. Opin. Ophthalmol. 2007; 18(2): 129-133.
Li J., Tripathi R.C., Tripathi B.J. Drug-induced ocular disorders. Drug Safety. 2008; 31(2): 127-141.
Wojciechowski R., Congdon N., Anninger W., Broman A.T. Age, gender, biometry, refractive error, and the anterior chamber angle among Alaskan Eskimos. Ophthalmology. 2003; 110(2): 365-375.
Kumar R.S., Tantisevi V., Wong M.H. et al. Plateau iris in Asian subjects with primary angle closure glaucoma. Arch Ophthalmol. 2009; 127(10): 1269-1272.
van Herick W., Shaffer R.N., Schwartz A. Estimation of width of angle of anterior chamber. Incidence and significance of the narrow angle. Am J Ophthalmol. 1969; 68(4): 626-629.
Lavanya R., Foster P.J., Sakata L.M. et al. Screening for narrow angles in the Singapore population: evaluation of new noncontact screening methods. Ophthalmology. 2008; 115(10): 1720-1727.
Bengtsson B., Leske M.C., Hyman L., Heijl A. Fluctuation of intraocular pressure and glaucoma progression in the early manifest glaucoma trial. Ophthalmology. 2007; 114(2): 205-209.
Caprioli J., Coleman A.L. Intraocular pressure fluctuation a risk factor for visual field progression at low intraocular pressures in the advanced glaucoma intervention study. Ophthalmology. 2008; 115(7): 1123-1129.
Bengtsson B., Heijl A. Diurnal IOP fluctuation: not an independent risk factor for glaucomatous visual field loss in high-risk ocular hypertension. Graefes Arch Clin Exp Ophthalmol. 2005; 243(6): 513-518.
Leske M.C., Heijl A., Hyman L. et al. Predictors of long-term progression in the early manifest glaucoma trial. Ophthalmology. 2007; 114(11): 1965-1972.
Thomas R., George T., Braganza A., Muliyil J. The flashlight test and Van Herick’s test are poor predictors for occludable angles. Aust N Z J Ophthalmol. 1996; 24(3): 251-256.
Foster P.J., Devereux J., Alsbirk P.H. et al. Detection of gonioscopically occludable angles and primary angle-closure glaucoma by estimation of limbal chamber depth in Asians: Modified grading scheme. Br J Ophthalmol. 2000; 84(2): 186-192.
Devereux J.G., Foster P.J., Baasanhu J. et al. Anterior chamber depth measurement as a screening tool for primary angle-closure glaucoma in an East Asian population. Arch Ophthalmol. 2000; 118(2): 257-263.
Spaeth G.L. The normal development of the human anterior chamber angle: a new system of descriptive grading. Trans. Ophthalmol. Soc. (UK). 1971; 91: 709-739.
Shaffer R.N. Gonioscopy anatomy of the angle of the anterior chamber of the eye. In. SRe, ed. In: Stereoscopic manual of gonioscopy. St. Louis, Mosby. 1962: 97.
Kanski JS, M. Glaukom In: Kanski J. SMe, ed. In: Lehrbuch der klinischen Ophthalmologie Stuttgart, New York Thieme, 1987.
Primary Open-Angle Glaucoma. Preferred Practice Pattern® Guidelines. San Francisco, CA: American Academy of Ophthalmology, 2015: 41-111.
Lin S.C., Singh K., Jampel H.D. et al. Optic nerve head and retinal nerve fiber layer analysis: a report by the American Academy of Ophthalmology. Ophthalmology. 2007; 114(10): 1937-1949.
Keltner J.L., Johnson C.A., Levine R.A. et al. Normal visual field test results following glaucomatous visual field end points in the Ocular Hypertension Treatment Study. Arch. Ophthalmol. 2005; 123(9): 1201-1206.
Chauhan B.C., McCormick T.A., Nicolela M.T., LeBlanc R.P. Optic disc and visual field changes in a prospective longitudinal study of patients with glaucoma: comparison of scanning laser tomography with conventional perimetry and optic disc photography. Arch Ophthalmol. 2001; 119(10): 1492-1499.
Miglior S., Zeyen T., Pfeiffer N. et al. Group. Results of the European Glaucoma Prevention Study / European Glaucoma Prevention Study (EGPS). Ophthalmology. 2005; 112(3): 366-375.
Aghaian E., Choe J.E., Lin S., Stamper R.L. Central corneal thickness of Caucasians, Chinese, Hispanics, Filipinos, African Americans, and Japanese in a glaucoma clinic. Ophthalmology. 2004; 111(12): 2211-2219.
Rahman M.L., Bunce C., Healey P.R. et al. Commingling analyses of central corneal thickness and adjusted intraocular pressure in an older Australian population. Invest Ophthalmol. Vis Sci. 2010; 51(5): 2512-2518.
Dueker D.K., Singh K., Lin S.C. et al. Corneal thickness measurement in the management of primary open-angle glaucoma: a report by the American Academy of Ophthalmology. Ophthalmology. 2007; 114(9): 1779-1787.
Medeiros F.A., Sample P.A., Zangwill L.M. et al. Corneal thickness as a risk factor for visual field loss in patients with preperimetric glaucomatous optic neuropathy. Am. J. Ophthalmol. 2003; 136(9): 805-813.
Kotowski J., Wollstein G., Ishikawa H., Schuman J.S. Imaging of the optic nerve and retinal nerve fiber layer: an essential part of glaucoma diagnosis and monitoring. Surv Ophthalmol. 2014; 59(4): 458-467.
Leung C.K. Diagnosing glaucoma progression with optical coherence tomography. Curr Opin Ophthalmol. 2014; 25(2): 104-111.
Miglior S., Zeyen T., Pfeiffer N. et al. Results of the European Glaucoma Prevention Study / European Glaucoma Prevention Study (EGPS) Group. Ophthalmology. 2005; 112(3): 366-375.
Lalezary M., Medeiros F.A., Weinreb R.N. et al. Baseline optical coherence tomography predicts the development of glaucomatous change in glaucoma suspects. Am. J. Ophthalmol – 2006; 142(4): 576-582.
- Клинические рекомендации общероссийской общественной организации Ассоциация врачей-офтальмологов — European Glaucoma Society Terminology and Guidelines for Glaucoma (4th Edition). Savona: PubliComm, 2014: 196.
Информация
АГО – антиглаукомная операция
БАБ — бета-адреноблокаторы
ВВ – водянистая влага
ВГД – внутриглазное давление
ВГЖ – внутриглазная жидкость
ГКС – ганглиозные клетки сетчатки
ДЗН – диск зрительного нерва
ЗГ – злокачественная глаукома
ЗУГ – закрытоугольная глаукома
ИКА – ингибиторы карбоангидразы
ИТК – иридотрабекулярный контакт
ЛГП – лазерная гониопластика
ЛИ – лазерная иридотомия/иридэктомия
ЛС – лекарственное средство
МКБ 10 – международная классификация болезней 10-го пересмотра
НРП – нейроретинальный поясок
ОКТ – оптическая когерентная томография
ОПЗГ – острый приступ закрытоугольной глаукомы
ОСР – оптический срез роговицы
ПЗ – поле зрения
ПЗО – переднезадняя ось глаза
ПЗУ – первичное закрытие угла
ПЗУГ – первичная закрытоугольная глаукома
ПК – передняя камера
ППЗУ – подозрение на первичное закрытие угла
ППС – периферические передние синехии
ПОУГ – первичная открытоугольная глаукома
РРР – расстояние «роговица — радужка»
САП – стандартная автоматизированная периметрия
СНВС – слой нервных волокон сетчатки
СТ – стекловидное тело
ТЭ – трабекулэктомия
УПК – угол передней камеры
ФЭК – факоэмульсификация
ЦТ – цилиарное тело
ЦТР –толщина роговицы в центральной оптической зоне
P0 – истинный уровень внутриглазного давления
Pt – тонометрический уровень внутриглазного давления
Биомикроскопия глаза – это метод прижизненного визуального исследования оптических сред и тканей глаза, основанный на создании контраста между освещенными и неосвещенными участками, проводимый при помощи щелевой лампы и дополнительных диагностических линз (в частности, для биомикроскопии глазного дна).
Глаукомная оптическая нейропатия (ГОН) – это аксонопатия, при которой поражение зрительного пути обусловлено повреждением аксонов ганглиозных клеток сетчатки в месте выхода их из глазного яблока в диске зрительного нерва (ДЗН).
Внутриглазное давление (ВГД) – давление жидкости внутри глаза, поддерживающее форму глазного яблока и обеспечивающее постоянство циркулирующих питательных веществ и нормальную трофику внутриглазных тканей.
Гониоскопия – это метод визуального исследования (осмотра) угла передней камеры глаза (УПК), проводят при помощи щелевой лампы и гониолинзы (гониоскопа).
Давление «цели» – это максимальное допустимое внутриглазное давление, при котором заболевание прогрессирует настолько медленно, что в течение всей жизни качество ее, связанное со зрением, остается на достаточно высоком уровне.
Метод Ван Херика – это метод исследования, который проводят при биомикроскопии для определения вероятности закрытия УПК. Тест позволяет косвенно оценить УПК и не может служить альтернативой гониоскопии.
Нейроретинальный поясок (НРП) ‒ это область между краем диска зрительного нерва и краем его экскавации, где сосредоточена основная масса аксонов ганглиозных клеток сетчатки.
Оптическая когерентная томография (ОКТ) ‒ это диагностический неинвазивный метод прижизненной визуализации, качественного и количественного анализа морфологических особенностей структур глазного дна, основанный на принципе световой интерферометрии.
Офтальмотонометрия – косвенный метод измерения уровня внутриглазного давления, величину офтальмотонуса при тонометрии определяют анализом данных деформации глаза тонометром и оценивают в миллиметрах ртутного столба (мм рт. ст.).
Проба Форбса – это метод гониоскопии с компрессией. Во время исследования гониоскопом надавливают на центральную часть роговицы, при этом жидкость передней камеры оттесняется к периферии и отдавливает прикорневую часть радужки назад. Проба Форбса положительная – если при надавливании открывается большая часть фильтрующей зоны. Проба Форбса отрицательная – если корень радужки при надавливании не оттесняется вследствие обширных синехий.
Стандартная автоматизированная периметрия (САП) – это компьютерная статическая периметрия, при которой исследуют светочувствительность в центральной зоне поля зрения с помощью белого стимула на белом фоне.
Критерии оценки качества медицинской помощи
Таблица 9.1 – Критерии оценки качества оказания неотложной помощи при ОПЗГ и уровни достоверности доказательств и убедительности рекомендации.
Таблица 9.2 – Критерии оценки качества оказания амбулаторно-поликлинической медицинской помощи и уровни достоверности доказательств и убедительности рекомендаций
1возможен иной вариант периметрии (кинетическая, кампиметрия) исходя из оснащения кабинета оборудованием, согласно Стандарту оснащения офтальмологического кабинета, предусмотренному «Порядком оказания медицинской помощи взрослому населению при заболеваниях глаза, его придаточного аппарата и орбиты» (Приказ Министерства здравоохранения РФ от 12.11.2012г. №902н)
Таблица 9.3 – Критерии оценки качества оказания медицинской помощи в дневном стационаре и уровни достоверности доказательств и убедительности рекомендаций
Таблица 9.4 – Критерии оценки качества оказания медицинской помощи в круглосуточном стационаре и уровни достоверности доказательств и убедительности рекомендаций
2исходя из оснащения оборудованием, в соответствии со Стандартом оснащения офтальмологического отделения/ Центра медицинского офтальмологического, предусмотренного «Порядком оказания медицинской помощи взрослому населению при заболеваниях глаза, его придаточного аппарата и орбиты» (Приказ Министерства здравоохранения РФ от 12.11.2012г. №902н).
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
-
Алексеев И.Б., д.м.н., профессор, профессор кафедры офтальмогии ФГБОУ ДПО «Российская медицинская академия непрерывного профессонального образования» Министерства здравоохранения Российской Федерации, член МОО «Глаукомное общество», член ООО «Общество офтальмологов России», Москва.
-
Антонов А.А., к.м.н., ведущий научный сотрудник отдела глаукомы ФГБНУ «НИИ глазных болезней», член ООО «Ассоциация врачей-офтальмологов», Москва.
-
Астахов Ю.С., д.м.н., профессор, профессор кафедры офтальмологии ГБОУ ВПО «Первый Санкт-Петербургский государственный медицинский университет им. И.П. Павлова», член ООО «Ассоциация врачей-офтальмологов», Санкт-Петербург.
-
Бессмертный А.М., д.м.н., старший научный сотрудник отдела глаукомы ФГБУ «НМИЦ глазных болезней им. Гельмгольца» Министерства здравоохранения Российской Федерации, член ООО «Ассоциация врачей-офтальмологов», Москва.
-
Брежнев А.Ю., к.м.н., доцент, ФГБОУ ВО «Курский государственный медицинский университет» Министерства здравоохранения Российской Федерации, ОБУЗ «Офтальмологическая клиническая больница — Офтальмологический центр», член МОО «Глаукомное общество», член ООО «Общество офтальмологов России», Курск.
-
Бржеский В.В., д.м.н., профессор, заведующий кафедрой офтальмологии ФГБОУ ВО СПбГПМУ Министерства здравоохранения Российской Федерации, член МОО «Глаукомное общество», член ООО «Общество офтальмологов России», Санкт-Петербург.
-
Газизова И.Р., д.м.н., ФГБНУ ИЭМ Медицинский научный центр, член МОО «Глаукомное общество», член ООО «Общество офтальмологов России», Санкт-Петербург.
-
Голубев С.Ю., к.м.н., руководитель цикла офтальмологии Филиала
ФГБОУ ВО «Военно-медицинская академия им. С.М. Кирова» Министерства обороны Российской Федерации, член ООО «Ассоциация врачей-офтальмологов», Москва. -
Догадова Л.П., к.м.н., профессор кафедры офтальмологии ФГБОУ ВО «Тихоокеанский государственный медицинский университет» Министерства здравоохранения Российской Федерации, Главный офтальмолог ДФО, член МОО «Глаукомное общество», член ООО «Общество офтальмологов России», Владивосток.
-
Егоров Е.А., д.м.н., профессор, заведующий кафедрой офтальмологии им. акад. А.П. Нестерова лечебного факультета ФГАОУ ВО РНИМУ им. Пирогова Министерства здравоохранения Российской Федерации, президент МОО «Глаукомное общество», член ООО «Общество офтальмологов России», Москва.
-
Еричев В.П., д.м.н., профессор, заведующий отделом глаукомы ФГБНУ «НИИ ГБ», вице-президент МОО «Глаукомное общество», член ООО «Общество офтальмологов России», Москва.
-
Золотарев А.В., д.м.н., доцент, заведующий кафедрой офтальмологии ФГБОУ ВО «Самарский государственный медицинский университет» Министерства здравоохранения Российской Федерации, главный врач ГБУЗ «Самарская областная клиническая офтальмологическая больница им. Т.И. Ерошевского», член ООО «Ассоциация врачей-офтальмологов», Самара.
-
Журавлева А.Н., к.м.н., научный сотрудник отдела глаукомы ФГБУ «НМИЦ глазных болезней им. Гельмгольца» Министерства здравоохранения Российской Федерации, член ООО «Ассоциация врачей-офтальмологов», Москва.
-
Карлова Е.В., д.м.н., ассистент кафедры офтальмологии ФГБОУ ВО «Самарский государственный медицинский университет», заведующая офтальмологическим отделением ГБУЗ «Самарская областная клиническая офтальмологическая больница им. Т.И. Ерошевского», член ООО «Ассоциация врачей-офтальмологов», Самара.
-
Косакян С.М., к.м.н., и.о. начальника отдела глаукомы ФГБУ «НМИЦ глазных болезней им. Гельмгольца» Министерства здравоохранения Российской Федерации, член ООО «Ассоциация врачей-офтальмологов», Москва.
-
Коновалова О.С., к.м.н., заведующая Тюменским Филиалом АО Екатеринбургский центр МНТК «Микрохирургия глаза», доцент кафедры хирургических болезней с курсом офтальмологии ФГБОУ ВО ТГМУ, член ООО «Ассоциация врачей-офтальмологов», Тюмень.
-
Куроедов А.В., д.м.н., начальник офтальмологического отделения ФКУ «ЦВКГ им. Мандрыка» Министерства обороны Российской Федерации, профессор кафедры офтальмологии им. акад. А.П. Нестерова лечебного факультета ФГАОУ ВО РНИМУ им. Пирогова Министерства здравоохранения Российской Федерации, член МОО «Глаукомное общество», член ООО «Общество офтальмологов России», Москва.
-
Лебедев О.И., д.м.н., профессор, заведующий кафедрой офтальмологии ФГБОУ ВО «Омский государственный медицинский университет» Минздрава России, член ООО «Ассоциация врачей-офтальмологов», Омск.
-
Ловпаче Дж.Н., к.м.н., независимый эксперт, ООО «Офтальмологическая клиника 3Z-МСК», член МОО «Глаукомное общество», член ООО «Общество офтальмологов России», Москва.
-
Малишевская Т.Н., д.м.н., начальник отдела аналитической работы ФГБУ «НМИЦ глазных болезней им. Гельмгольца» Министерства здравоохранения Российской Федерации, член ООО «Ассоциация врачей-офтальмологов», Москва.
-
Малюгин Б.Э., д.м.н., профессор, заместитель генерального директора по науке ФГАУ НМИЦ МНТК «Микрохирургия глаза» им. акад. Федорова Министерства здравоохранения Российской Федерации, Председатель ООО «Общество офтальмологов России», Москва
-
Петров С.Ю., д.м.н., начальник отдела глаукомы ФГБУ «НМИЦ глазных болезней им. Гельмгольца» Министерства здравоохранения Российской Федерации, член ООО «Ассоциация врачей-офтальмологов», Москва
-
Рябцева А.А., д.м.н., профессор, заведующая курсом офтальмологии при кафедре хирургии ФУВ МОНИКИ, руководитель отделения офтальмологии ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, член ООО «Ассоциация врачей-офтальмологов», Москва.
-
Селезнев А.В., к.м.н., доцент, ФГБОУ ВО «Ивановская государственная медицинская академия» Министерства здравоохранения Российской Федерации, член МОО «Глаукомное общество», член ООО «Общество офтальмологов России», Иваново.
-
Симонова С.В., к.м.н., руководитель организационно-методического отдела по офтальмологии ДЗМ ГКБ им. Боткина, филиал №1, член МОО «Глаукомное общество», член ООО «Общество офтальмологов России», Москва.
-
Соколовская Т.В., к.м.н., отдел хирургического лечения глаукомы, ФГАУ НМИЦ МНТК «Микрохирургия глаза» им. акад. Федорова Министерства здравоохранения Российской Федерации, член МОО «Глаукомное общество», член ООО «Общество офтальмологов России», Москва
-
Фурсова А.Ж., д.м.н., заслуженный врач РФ, заведующая офтальмологическим отделением ГБУЗ НСО «ГНОКБ», член ООО «Ассоциация врачей-офтальмологов», Новосибирск.
-
Юрьева Т.Н., д.м.н., профессор, заместитель директора по научной работе Иркутского филиала ФГАУ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова, член ООО «Ассоциация врачей-офтальмологов», Иркутск.
-
Якубова Л.В., к.м.н., старший научный сотрудник отдела глаукомы ФГБУ «НМИЦ глазных болезней им. Гельмгольца» Министерства здравоохранения Российской Федерации, член ООО «Ассоциация врачей-офтальмологов», Москва.
-
Ходжаев Н.С. д.м.н., профессор, заместитель генерального директора по организационной работе и инновационному развитию ФГАУ «Национальный медицинский исследовательский центр «МНТК «Микрохирургия глаза» им. академика С.Н. Федорова» МЗ России, член ООО «Общество офтальмологов России», Москва
Конфликт интересов отсутствует.
Приложение А2. Методология разработки клинических рекомендаций
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных, библиотечные ресурсы. Описание методов, использованных для сбора/селекции доказательств: доказательной базой для рекомендаций являются публикации, вошедшие в Кохрайновскую библиотеку, базы данных EMBASE и MEDLINE, а также монографии и статьи в ведущих специализированных рецензируемых отечественных медицинских журналах по данной тематике. Глубина поиска составляла 10 лет. Методы, использованные для оценки качества и силы доказательств: консенсус экспертов, оценка значимости в соответствии с рейтинговой схемой.
Целевая аудитория данных клинических рекомендаций:
-
Врачи-офтальмологи
-
Специалисты в области организаций здравоохранения и общественного здоровья
-
Ординаторы по специальности «Офтальмология» (31.08.59) и научно-педагогические кадры (аспиранты) по направлению подготовки «Клиническая медицина» (31.06.01), профиль – «Глазные болезни» (14.01.07)
-
Студенты медицинских Высших учебных заведений
Таблица 10.1 – Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
Таблица 10.2 – Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
Таблица 10.3 – Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Данные клинические рекомендации разработаны с учетом следующих документов:
-
Международная классификация болезней, травм и состояний, влияющих на здоровье, 10-го пересмотра (МКБ-10) (принята 43-ей Всемирной Ассамблеей Здравоохранения, 1990г.).
-
«О переходе органов и учреждений здравоохранения Российской Федерации на Международную статистическую классификацию болезней и проблем, связанных со здоровьем Х пересмотра» (в ред. Приказа Минздрава РФ от 12.01.1998г. №3) Приказ Министерства здравоохранения РФ от 27.05.1997г. №170.
-
«О направлении перечня добавленных и исключенных рубрик МКБ-10». Письмо Министерства здравоохранения РФ 05.12.2014г. №13-2/166
-
Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации» (с изменениями на 2 декабря 2019 года) от 21.11.2011г. № 323 Ф3.
-
Федеральный закон «О внесении изменений в статью 40 Федерального закона «Об обязательном медицинском страховании в Российской Федерации» и Федеральный̆ закон «Об основах охраны здоровья граждан в Российской Федерации» по вопросам клинических рекомендаций» от 19.12.2018г. №489 ФЗ.
-
«Об утверждении стандарта медицинской помощи больным с глаукомой» (стандарт медицинской помощи больным с глаукомой при оказании дорогостоящей (высокотехнологичной) медицинской помощи)). Приказ Министерства здравоохранения и социального развития РФ от 06.09.2005г. №549.
-
«Об утверждении стандарта медицинской помощи больным глаукомой» (стандарт медицинской помощи больным глаукомой при оказании амбулаторно-поликлинической помощи в 2007 году). Приказ Министерства здравоохранения и социального развития РФ от 13.10.2006г. №708.
-
«Об утверждении стандарта медицинской помощи больным с глаукомой (при оказании специализированной помощи)» (стандарт медицинской помощи больным с глаукомой (при оказании специализированной помощи). Приказ Министерства здравоохранения и социального развития РФ от 21.05.2007г. №350.
-
«Об утверждении Порядка возложения на фельдшера, акушерку руководителем медицинской организации при организации оказания первичной медико-санитарной помощи и скорой медицинской помощи отдельных функций лечащего врача по непосредственному оказанию медицинской помощи пациенту в период наблюдения за ним и его лечения, в том числе по назначению и применению лекарственных препаратов, включая наркотические лекарственные препараты и психотропные лекарственные препараты (с изменениями на 31 октября 2017 года)». Приказ Министерства здравоохранения РФ 23.03.2012г. №252н.
-
«Об утверждении стандарта специализированной медицинской помощи при глаукоме». Приказ Министерства здравоохранения РФ от 09.11.2012г. №862н.
-
«Об утверждении Порядка оказания медицинской помощи взрослому населению при заболеваниях глаза, его придаточного аппарата и орбиты». Приказ Министерства здравоохранения РФ от 12.11.2012г. №902н.
-
«Об утверждении стандарта первичной медико-санитарной помощи при остром приступе закрытоугольной глаукомы». Приказ Министерства здравоохранения Российской РФ от 24.12. 2012 г. № 1483н.
-
«Об утверждении стандарта специализированной медицинской помощи при остром приступе закрытоугольной глаукомы”. Приказ Министерства здравоохранения Российской РФ от 24.12.2012 г. № 1412н.
-
«Об утверждении стандарта первичной медико-санитарной помощи при глаукоме». Приказ Министерства здравоохранения Российской РФ от 29.12.2012г. №1700н.
-
«О порядке организации медицинской реабилитации». Приказ Министерства здравоохранения Российской РФ от 29.12.2012г. №1705н.
-
«Об утверждении Положения об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи (с изменениями от 27 августа 2015 года)». Приказ Министерства здравоохранения РФ от 02.12.2014г. №796н.
-
«Об утверждении критериев оценки качества медицинской помощи». Приказ Министерства здравоохранения РФ от 10.05.2017г. №203н.
-
«Об утверждении профессионального стандарта «Врач-офтальмолог». Приказ Министерства труда и социальной защиты РФ от 05.06.2017г. №470н.
-
«Об утверждении номенклатуры медицинских услуг» (с изменениями и дополнениями). Приказ Министерства здравоохранения РФ от 13.10.2017г. №804н.
-
«Об утверждении перечня медицинских изделий, имплантируемых в организм человека при оказании медицинской помощи, и перечня медицинских изделий, отпускаемых по рецептам на медицинские изделия при предоставлении набора социальных услуг (с изменениями на 8 октября 2019 года)» Распоряжение Правительства РФ от 31.12.2018г. №3053-р
-
«Об утверждении критериев формирования перечня заболеваний, состояний (групп заболеваний, состояний), по которым разрабатываются клинические рекомендации». Приказ Министерства здравоохранения РФ от 28.02.2019г. №101н.
-
«Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации». Приказ Министерства здравоохранения РФ от 28.02.2019г. №103н.
-
«Об утверждении порядка и сроков одобрения и утверждения клинических рекомендаций, критериев принятия научно-практическим советом решения об одобрении, отклонении или направлении на доработку клинических рекомендаций либо решения об их пересмотре». Приказ Министерства здравоохранения РФ от 28.02.2019г. №104н.
-
«Об утверждении порядка проведения профилактического медицинского осмотра и диспансеризации определенных групп взрослого населения». Приказ Министерства здравоохранения РФ от 13.03.2019г. №124н.
-
«Об утверждении Порядка организации оказания высокотехнологичной медицинской помощи с применением единой государственной информационной системы в сфере». Приказ Министерства здравоохранения РФ от 02.10.2019г. №824н.
-
«Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2020 год, перечня лекарственных препаратов для медицинского применения, в том числе лекарственных препаратов для медицинского применения, назначаемых по решению врачебных комиссий медицинских организаций, перечня лекарственных препаратов, предназначенных для обеспечения лиц, больных гемофилией, муковисцидозом, гипофизарным нанизмом, болезнью Гоше, а также минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи». Распоряжение Правительства РФ от 12.10.2019г. №2406-р.
-
«О Программе государственных гарантий бесплатного оказания гражданам медицинской помощи на 2020 год и на плановый период 2021 и 2022 годов». Постановление Правительства РФ от 07.12.2019г. №1610.
Приложение Б. Алгоритмы действий врача
Рис. Алгоритм ведения пациента с признаками закрытия УПК (Цит. по Primary Angle Closure / American Academy of Ophthalmology Preferred Practice Pattern® Guidelines, San Francisco; 2015: 40)
Мероприятия, рекомендованные при лечении острого приступа ЗУГ
1. Уложить больного на горизонтальную поверхность.
2. Закапать в больной глаз однократно бримонидин 0,15% или 0,2% по 1 капле, тимолол** 0,5% или бетаксолол 0,5% по 1 капле, дорзоламид** 2% или бринзоламид 1% по 1 капле (при отсутствии системных противопоказаний к их назначению) [1-4].
3. Дать внутрь таблетку ацетазоламид** 250-500 мг (применять с осторожностью у больных с мочекаменной болезнью).
4. Закапать в больной глаз капли дексаметазон 0,1% по 1-2 капли три раза с интервалом 5 минут.
5. При уровне ВГД ниже 40 мм рт.ст. закапать в больной глаз пилокарпин** 1% или 2% 1-2 капли 2-3 раза в течение часа.
6. Закапать пилокарпин** 1% или 2% по 1-2 капли однократно в парный глаз.
7. Купирование отека роговицы – местно декстроза 20-40% симптоматически [170-171].
8. Лечебная компрессия роговицы 4-х зеркальным гониоскопом, 20 секунд.
9. При отсутствии тенденции к купированию острого приступа – глицерол раствор 50% — внутрь 1-2 г/кг массы тела, маннитола раствор** 15% — внутривенно капельно в течение не менее 30 минут по 1,5-2 г/кг массы тела [1-4].
10. Анальгетики и противорвотные препараты при наличии боли и тошноты [2].
11. Лазерная иридэктомия после купирования острого приступа и отека роговицы.
12. Гониоскопия с компрессией, чтобы оценить протяженность закрытия УПК для решения вопроса о дальнейшей тактике лечения.
Приложение В. Информация для пациента
Глаукома – хроническое заболевание, при котором у лиц старше 40-50 лет развивается атрофия зрительного нерва, приводящая при прогрессировании к необратимому ухудшению зрения, в тяжелых случаях — к полной слепоте. Как правило, заболевание развивается на обоих глазах, но на втором глазу может проявиться через несколько месяцев или лет. В подавляющем большинстве случаев зрение снижается вследствие повышения внутриглазного давления за пределы индивидуального уровня.
В начальных стадиях при глаукоме отсутствует какая-либо симптоматика, пациент может обнаружить снижение зрения или появление участков (зон) локального ухудшения в поле зрения только тогда, когда процесс зашел далеко, и вылечить глаукомную атрофию зрительного нерва и вернуть утраченные функции невозможно.
Поэтому выявить глаукому на ранних стадиях можно только при визите к офтальмологу на плановый ежегодный осмотр (диспансеризации) или обращении в случае ухудшения зрения.
Жалобы характерны для острого приступа закрытоугольной глаукомы, при котором происходит внезапный, быстрый и неконтролируемый подъем внутриглазного давления, сопровождающееся болью в глазу, иррадиирущей в одноименную половину головы (лоб, висок), могут возникать тошнота, рвота, сердцебиение, повышение артериального давления, снижение остроты зрения, радужные круги вокруг источника света.
Острый приступ закрытоугольной глаукомы это неотложная ситуация и требует оказания экстренной медицинской помощи!
Без лечения острый приступ закрытоугольной глаукомы может закончится слепотой!
Основная цель лечения глаукомы — снижение внутриглазного давления, что позволяет стабилизировать процесс или замедлить его прогрессирование. Это может быть достигнуто ежедневным длительным (пожизненным) закапываем капель, а также применением лазерного и/или хирургического лечения. Показания к тому или иному методу лечения определяет врач. Пациент с глаукомой нуждается в постоянном наблюдении врача-офтальмолога и измерении внутриглазного давления не реже 1 раза в 3 мес.
При раннем выявлении глаукомы и адекватном лечении прогноз заболевания благоприятный, с сохранением зрительных функций. При отсутствии надлежащего врачебного контроля и несоблюдении рекомендаций по лечению глаукома грозит полной слепотой обоих глаз.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Опросный лист при подозрении на глаукому
Название на русском языке: Опросный лист при подозрении на глаукому
Оригинальное название (если есть): нет
Источник (официальный сайт разработчиков, публикация с валидацией): нет
— шкала оценки
— индекс
— другое (уточнить):_____________________________________________________
Назначение: ранняя диагностика глаукомы
1. Ваш отец, мать, брат, сестра больны глаукомой? Да/нет
2. Вы используете очки для дали сильнее — 4,0 диоптрий? Да/нет
2а. Вы используете очки для дали сильнее +3,0 диоптрий? Да/нет
3. Вы проходили ранее обследования на глаукому? Да/нет
4. У Вас регистрировали повышение ВГД ранее? Да/нет
5. Вы закапываете какие-либо глазные капли? Да/нет. Если да – уточните какие и в какой глаз/ не помню точно__________________
6. Вы закапывали ранее какие-либо глазные капли? Да/нет. Если да – уточните какие и в какой глаз/ не помню точно______________
7. Вам выполнялись глазные операции? Да/нет. Уточните: лазерная коррекция зрения, по поводу глаукомы, по поводу катаракты, не помню точно.
8. Вы испытывали периодически наличие радужных кругов при взгляде на источник света? Да/нет.
9. Вы применяли когда-либо препараты кортикостероидов? Да/нет. Уточните: в виде таблеток, инъекций, кожных мазей или кремов, глазных капель, затрудняюсь ответить.
10. У Вас бывают эпизоды низкого артериального давления? Да/нет. Какое было артериальное давление __/__ мм рт.ст.
11. У Вас бывают обмороки? Да/нет.
12. У Вас бывают головокружение? Да/нет.
13. Вы отмечали эпизоды резкого похолодания конечностей? Да/нет.
14. Вы страдаете мигренью? Да/нет.
15. Вы страдаете нарушениями сна? Да/нет.
16. Вы храпите? Да/нет.
17. У Вас были черепно-мозговые травмы? Да/нет.
18. Вы курите сигареты? Да/нет.
19. Вы употребляете алкоголь? Да/нет.
20. У Вас имеются заболевания щитовидной железы? Да/нет. Если да – уточните ________
21. У Вас имеется сахарный диабет? Да/нет. Если да – уточните 1 или 2 типа и какое лечение: диета, таблетки, инсулин.
Ключ (интерпретация): нет
Приложение Г 2. Анкета для выявления факторов риска глаукомы
Название на русском языке: Анкета для выявления факторов риска глаукомы
Оригинальное название (если есть): нет
Источник (официальный сайт разработчиков, публикация с валидацией): нет
— шкала оценки
— индекс
— другое (уточнить):_____________________________________________________
Назначение: выявление пациентов, находящихся в группе риска развития глаукомы для проведения своевременного обследование и ранней диагностики глаукомы.
ФИО, возраст _________________________
ВГД OD_______OS_______ мм рт.ст. (способ измерения____________________)
1. Есть ли у Вас кровные родственники с глаукомой (мама, папа, сестры, братья, дети) да/нет
2. Вы наблюдаетесь у эндокринолога по поводу заболеваний щитовидной железы? да/нет
3. Вы замечали радужные круги вокруг источников света? да/нет
4. Вы используете гормональные противовоспалительные средства? (кортикостероиды) да/нет
5. У Вас часто бывают холодные руки, ноги или беспокоит мигрень? да/нет
6. Вы храпите? да/нет
7. Вы пользуетесь очками для дали с большими диоптриями (+4,0 и больше, -4,0 и меньше) да/нет
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.

Детский офтальмолог, страбизмолог, офтальмохирург. Практикующий детский глазной хирург
Стаж 10 лет
Член Ассоциации офтальмологов страбизмологов, научный сотрудник Научно-исследовательского образовательного центра детской офтальмологии и страбизмологии при Международном центре аккредитации офтальмологов и оптометристов.
Записаться на прием
Глаукомой называют группу патологий глаза, которые сопровождаются статическим или периодическим спонтанным повышение внутриглазного давления сверх нормы. При отсутствии лечения это грозит развитием дефектов зрения, падением его остроты вплоть до атрофии зрительного нерва.
Внутри здорового глаза образуется водянистая влага – прозрачная жидкость, заполняющая переднюю и заднюю камеры глаза. Функция этой жидкости заключается в обеспечении питания хрусталика, стекловидного тела, эндотелия роговицы. За сутки глаз производит от 3 до 10 мл водянистой влаги, которая затем отводится в кровеносную систему через дренажные каналы передней камеры.
В норме приток и отток сбалансированы таким образом, что давление жидкости внутри глаза находится в пределах от 10 до 12 мм рт. ст. Нарушение отвода влаги приводит к её накоплению, вследствие чего внутриглазное давление повышается. Пережимаются кровеносные сосуды, происходит сбой питания сетчатки. Её клетки постепенно отмирают. Это негативно сказывается на зрительном нерве. Со временем он начинает разрушаться, что влечёт различные расстройства зрения вплоть до слепоты.
Исходя из причины нарушения оттока внутриглазной жидкости, различают две формы глаукомы:
- открытоугольная – угол передней камеры, через который отводится жидкость, открыт, но дренажная система не функционирует должным образом. В 90% случаев наблюдается именно этот тип глаукомы;
- закрытоугольная – встречается намного реже, основная группа риска – люди старше 30 лет, страдающие дальнозоркостью. Причиной является блокировка оттока радужкой в ответ на внешние раздражители, провоцирующие расширение зрачка (недостаточное освещение, капли). Вследствие этого водянистая влага не может попасть в дренажную сеть. Отмечается резкий рост внутриглазного давления, твердость глазного яблока, боль при надавливании
Симптомы и признаки глаукомы
На начальной стадии глаукома развивается практически бессимптомно, не доставляя пациенту какого-либо дискомфорта. Жалоб на ухудшение зрения или боль нет, изредка появляются радужные круги перед глазами, но этот симптом характерен для многих заболеваний. Уже на этом этапе могут развиваться необратимые изменения глазного нерва. Такое скрытое, латентное развитие приводит к позднему обращению за медицинской помощью. Своевременно выявить патологию можно только при условии регулярной профилактической проверки зрения.
Дальнейшее развитие не выявленной глаукомы приводит к появлению жалоб. Отмечается ухудшение периферического зрения, когда пациент перестает замечать объекты по бокам, хотя прямо перед собой видит хорошо. Это так называемое «тоннельное» зрение. Примечательно, что развивается оно асимметрично, то есть один глаз страдает больше другого, хотя поражены оба. Также отмечается:
- ухудшение зрения в сумерках;
- появление полупрозрачного или непрозрачного пятна в поле зрения;
- требуется больше времени для адаптации глаз при резком переходе в темноту со света;
- падение остроты зрения;
- иногда наблюдается нарушение правильного восприятия цветовой гаммы.
У больных с закрытоугольной формой глаукомы симптомы выражаются сильнее, особенно во время острого приступа, когда внутриглазное давление повышается резко, скачком. Больной жалуется:
- на туман перед глазами, размытость;
- покраснение глаз;
- резкую боль в глазу;
- головную боль в лобной и височной областях;
- слезотечение и светобоязнь;
- тошноту, рвоту.
Нередко острый приступ глаукомы больные ошибочно путают с мигренью, проявлением гипертонической болезни, отравлением, при которых наблюдаются схожие симптомы. Распознать приступ глаукомы можно по одному характерному признаку: из-за резкого повышение внутриглазного давления глазное яблоко становится очень твердым, плотным. Зрачок в это время расширен, неправильной формы, веки отечные, роговица мутнеет. При таком состоянии нужно как можно скорее обратиться в больницу, необходима помощь врача.
Диагностика глаукомы
Своевременная диагностика и наблюдение глаукомы в клинике осуществляется по следующим методикам исследования:
- Динамическая контурная тонометрия (ДТК) – сверхточное измерение уровня внутриглазного давления офтальмологическим тонометром. Тонометрия может выполняться при помощи аппарата, который пригоден для самостоятельного амбулаторного измерения. Это делает возможной суточную тонометрию, что значительно упрощает выбор медикаментов.
- Оптическая когерентная томография (ОКТ) – оценивается состояние сетчатки глаза и диска зрительного нерва, самый эффективный метод в современной офтальмологии. Целесообразность его применения подтверждена в мировой офтальмологии. Научные работы специалистов наглядно демонстрируют, что ОКТ является лидирующей методикой в определении начальной формы глаукомы.
- Цифровая фликер-периметрия – инновационный метод изучения поля зрения, единственный в своём роде, делает возможным обнаружение глаукомных нарушений в доклинический период. Совместное применение в связке с гейдельбергской ретинотомографией позволило выйти на новый уровень функциональной диагностики, характеризующийся избирательностью и сверхчувствительностью при определении глаукомы на ранней стадии.
- Офтальмоплетизмография – базовый метод диагностики кровоснабжения, основывающийся на непрерывном контроле объёма глазного яблока.
- Офтальмологи подтвердили на практике решающую роль данного исследования в мониторинге протекания глаукомы. Именно благодаря этому возможен достоверный прогноз.
- Тонография – определение движения внутриглазной жидкости и давления с одновременной графической регистрацией.
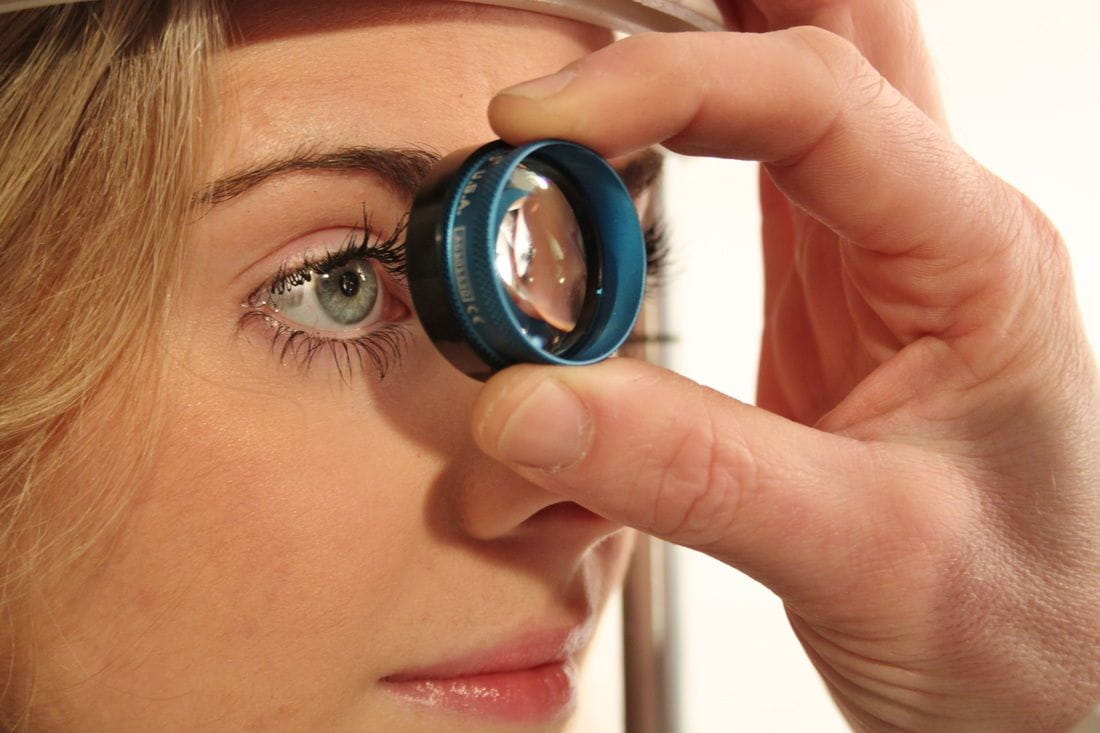
Причины глаукомы
Среди всех факторов, вызывающих возникновение глаукомы, основным является повышение внутриглазного давления (внутриглазная гипертензия). Среди других распространенных причин современная офтальмология называет:
- Генетическую предрасположенность – болезнь способна передаваться по наследству, но не в обязательном порядке;
- Аномалии внутриутробного развития – в таком случае глаукома будет врожденной;
- Близорукость – способствует появлению открытоугольной формы глаукомы;
- Дальнозоркость – содействует развитию закрытоугольной глаукомы;
- Систематический прием стероидных препаратов;
- Глазные болезни – воспаления (увеит, кератит, склерит и пр.), дистрофические изменения (прогрессирующая атрофия радужки, перенесенный гемофтальм);
- Тонкую роговицу – эта физиологическая особенность отмечается у многих больных;
- Травмы – различные повреждения (ожоги, ранения, контузии) провоцируют затруднение отвода внутриглазной жидкости;
- Сахарный диабет – дает осложнение в виде диабетической ретинопатии;
- Катаракту – если вовремя не выполнить оперативное лечение, то увеличенный хрусталик перекроет отток влаги;
- Осложнения после офтальмологических хирургических операций;
- Новообразования (опухоли).
Классификация глаукомы
Существует несколько классификаций глаукомы соответственно определенным параметрам, таким как происхождение, время, механизм или стадия развития, уровень внутриглазного давления, течение.
По происхождению:
- первичная глаукома – заболевание, развивающееся самостоятельно;
- вторичная глаукома — развивается как следствие или осложнение другого заболевания.
По времени развития:
- врождённая глаукома (развивается в возрасте до 3 лет);
- инфантильная (проявляется у детей от 3 до 10 лет);
- ювенальная (возникает в промежутке от 11 до 35 лет);
- глаукома взрослых.
По уровню внутриглазного давления:
- гипертензивная глаукома – сопровождается высоким внутриглазным давлением;
- нормотензивная глаукома – внутриглазное давление в пределах нормы.
По механизму развития:
- открытоугольная глаукома;
- закрытоугольная глаукома;
- глаукома с нарушенным развитием угла передней камеры.
По стадии изменений в зрительном нерве:
- начальная – границы поля зрения в норме либо сужены незначительно, самая благоприятная стадия для начала лечения;
- развитая – сужение поля зрения не больше 10 градусов, проявляются клинические симптомы, что облегчает диагностику;<
- далеко зашедшая – развивается уже несколько лет, есть ухудшение зрения, требует частого контроля и серьезного снижения внутриглазного давления;
- терминальная – зрение теряется полностью или сохраняется только светоощущение с неверной световой проекцией.
По течению:
- стабилизированная глаукома – если на протяжении полугода врачебного контроля не происходит ухудшения;
- нестабилизированная глаукома – отмечается прогрессирующее ухудшение.
Лечение глаукомы
Современная офтальмологическая практика располагает 3 методами лечения глаукомы: медикаментозным, лазерным и хирургическим.
Медикаментозное (консервативное) лечение глаукомы
Базируется на снижении внутриглазного давления и улучшении кровоснабжения органов зрения. Важной задачей для врача является нормализация обменных процессов в глазных тканях. С этой целью применяются медикаменты 3 видов:
- улучшающие отток внутриглазной жидкости;
- ингибирующие (угнетающие) выделение внутриглазной жидкости;
- комбинированные (косопт, фотил, нормоглаукон и др.).
Лечение глаукомы лазером
Лазерная иридотомия
У некоторых людей дренажная зона сужена в силу анатомических особенностей, что приводит к задержке жидкости и повышению давления. Процедура иридотомии с применением лазера заключается в формировании добавочного отверстия в периферии радужки (возле корня) с целью улучшения циркуляции внутриглазной жидкости в этой дренажной зоне. Конечная цель – контроль нормального внутриглазного давления. Искусственные отверстия крайне малы (0,5 мм) и незаметны косметически. Они остаются на всю жизнь, не вызывают дискомфорта.

Селективная лазерная трабекулопластика (СЛТ)
Новый уровень в офтальмологии, применение лазера для нанесения лазерных аппликатов, за счёт чего внутриглазное давление снижается так же, как при медикаментозном воздействии. Отличается абсолютной безвредностью и отсутствием травмирующего фактора. Не оказывает термического воздействия на окружающие ткани, не вызывает изменения их структуры. Опыт ведущих офтальмологов доказал эффективность методики СЛТ даже при проведении повторной операции на трабекуле, что недоступно при использовании прочих лазерных методик.
Проводится амбулаторно, под местной анестезией обезболивающими каплями, после осуществления необходимо несколько раз придти в больницу для контрольного осмотра.
Нужно понимать, что СЛТ не может целиком заменить лечение медикаментами или необходимое микрохирургическое вмешательство. Это невозможно ввиду многообразия клинических сценариев развития глаукомы и её чрезвычайно сложного патогенеза.
Лазерный трабекулоспазис
Улучшает работу дренажной зоны глаза, нормализирует ВГД. Путем дозированного воздействия на область дренажа достигается его активизация, облегчается выведение жидкости из глаза.
Неглубоко проникающая лазерная склероэктомия (НГСЭ)
Операция, при которой не раскрывается глазное яблоко. Во внутренней оболочке глаза создается специальный клапан для восстановления баланса внутриглазной жидкости. Процедура требует высочайшей точности, поскольку проводится вручную.
Часто все вышеперечисленные методики лечения при помощи лазера комбинируются для достижения максимального эффекта.
Хирургия глаукомы
К так называемым проникающим методам хирургического вмешательства относятся трабекулотомия и трабекулоэктомия. При проникающих операциях на участке трабекулярной сетки хирургическим путем удаляется часть трабекул для создания канала вывода водянистой влаги. Процедуры такого типа могут требовать госпитализации. После операций есть некоторые ограничения физической активности пациента, нужно избегать нагрузок.
Отдельно стоит выделить операции с использование микродренажей Eх-PRESS (Excessive Pressure Regulation Shunt System). Это относительно новая методика, заключающая в имплантации специального металлического устройства внутрь глаза. Методика довольно проста в исполнении, щадящая, имеет минимум послеоперационных осложнений
Успех хирургического лечения зависит от типа и стадии глаукомы, сопутствующих обстоятельств (катаракта), опыта хирурга и общего состояния пациента. Разные типы глаукомы требуют разных методик хирургического вмешательства.
Анализ современной мировой медицинской практики наглядно демонстрирует, что сохранение зрения при глаукоме реально. Уже применяются методы замедления развития патологии, значительно отдаляющие порог полной потери зрения. Но, как упоминалось выше, для этого критически важны: своевременная диагностика глаукомы, профессиональное лечение с сопутствующим тщательным мониторингом и соблюдение пациентом всех рекомендаций врача.
Какие врачи лечат глаукому
Лечением глаукомы занимаются врачи узкой специализации – офтальмологи. Врачи-офтальмологи проводят первичный прием, диагностические процедуры, назначают медикаментозную терапию, выполняют операции по лазерному и хирургическому лечению. Нужно заметить, что лечением глаукомы у детей занимаются детские офтальмологи. Такое разделение связано с тем, что детский организм, в частности зрительный аппарат, сильно отличается от взрослого.
Профессия врача-офтальмолога требует постоянного совершенствования, как в области теоретических знаний, так и в плане практических навыков. Врачи центра офтальмохирургии клиники АО «Медицина» обладают высокой квалификацией, многолетним стажем работы и солидным практическим опытом. Благодаря их профессионализму сотни пациентов сохранили способность в полной мере видеть окружающий мир, а значит – живут полноценной жизнью.
Показания
Показаниями к медикаментозной терапии является начальная стадия болезни, когда препараты в состоянии замедлить или приостановить её развитие. Если патология достигла более серьезного уровня развития, то необходимы процедуры лечения при помощи лазера. К показаниям для этого относятся следующие клинические ситуации:
- отсутствие положительного результата после проведения терапии открытоугольной формы болезни;
- наличие противопоказаний к препаратам, применяемым при медикаментозном методе лечения глаукомы;
- функциональный зрачковый блок при первичной и вторичной закрытоугольной глаукоме или смешанной форме;
- профилактика изменений во втором глазу при первичной закрытоугольной форме заболевания;
- предупреждение острых приступов глаукомы.
Проведение хирургического вмешательства рекомендуется при:
- поздних стадиях патологии, когда другие методы не дают результата;
- поступательном сужении поля зрения;
- негативной динамике течения болезни, неэффективной стабилизации процесса.
Противопоказания
При медикаментозном лечении:
- индивидуальная непереносимость препарата;
- устойчивость пациента к действию лекарственного средства;
- парадоксальный эффект – вместо снижения давления медикамент вызывает повышение.
При лазерном лечении:
- последние стадии глаукомы;
- терминальная фаза глаукоматозного процесса.
При хирургическом вмешательстве:
- некоторые сопутствующие офтальмологические патологии;
- если риск снижения остроты зрения превосходит ожидаемый позитивный результат операции.
Стоимость первичного приема, исследований и лечения при глаукоме
Узнать, какова цена первичного приема и диагностических процедур вы можете из таблицы. Что касается стоимости лечения, то в случае с глаукомой определить её заранее просто невозможно. Она формируется только после результатов диагностики и определения методов лечения. Ведь каждый клинический случай имеет свои особенности, которые требуют индивидуального подхода и разработки персональной тактики лечения для каждого пациента.
Многие пациенты ошибочно считают, что стоимость лечения глаукомы в Москве чрезмерно высока для них, но это не так. Одним из основных принципов лечения глаукомы является определение наиболее эффективной методики лечения с учетом финансовых возможностей больного.
Преимущества лечения глаукомы в клинике АО «Медицина»
Квалификация – прием, лечение и оперативное вмешательство выполняется квалифицированными врачами-офтальмологами высшей категории. Проводятся консультации с участием ведущих специалистов, профессоров, академиков. На базе клиники ведется научно-исследовательская и экспериментальная работа, внедряются передовые методики лечения.
Техническое обеспечение – АО «Медицина» (клиника академика Ройтберга) оснащена диагностическим и лечебным оборудованием последнего поколения. Благодаря этому диагностика выполняется в кратчайшие сроки, удается добиться максимально эффективных результатов лечения.
Одним из ключевых факторов эффективного наблюдения за динамикой лечения глаукомы у конкретного пациента стала компьютерная фиксация результатов проведённых исследований на всех этапах лечения. Это даёт возможность создания индивидуальной базы данных (для каждого отдельного случая), которая значительно облегчает сравнительный анализ и повышает его точность. Ведь учитывается много показателей, которые при сведении способны послужить основой для верного прогноза, а значит – выбора правильной тактики лечения.
Помните: изменения при глаукоме необратимы, чем раньше вы обратитесь к врачу, тем больший процент зрения удастся сохранить!
Введение
Тактика ведения пациентов с травматическими повреждениями глазного яблока остается открытым вопросом ввиду полиморфизма проявлений заболевания, наличия тяжелой сочетанной патологии, непредсказуемости течения заболевания, сложности диагностики и лечения, наличия интра- и послеоперационных осложнений, а также невозможности прогнозирования послеоперационных результатов (в большинстве случаев сопровождающихся нарушением гидродинамики глаза). Все вышеперечисленное способствует развитию гипертензии с последующим формированием посттравматической глаукомы (ПТГ). Распространенность ПТГ достигает 25–67% в структуре вторичной глаукомы [1].
По данным литературы, повышение внутриглазного давления (ВГД) в результате травматических повреждений глазного яблока наблюдается у 0,78–6,2% офтальмологических больных: на 1-м месте находятся проникающие ранения глаза (22,5%), на 2-м месте — контузии глаза (7,65%) [2]. Основными причинами ПТГ в результате тупой травмы глаза являются: рецессия угла передней камеры (УПК), гифема и ее последствия, повреждение хрусталика, а при проникающих повреждениях глаза или химических ожогах — вторичное закрытие УПК периферическими передними синехиями [1, 3]. Одним из значимых факторов, оказывающих существенное влияние на выраженность нарушений гидродинамики, является наличие и размер дефекта радужки [4]. По данным литературы, частота вторичной глаукомы у пациентов с травматической аниридией достигает 35% случаев, гипотония наблюдается в 25% случаев и только у 40% больных ВГД находится в пределах нормы [4]. При полной аниридии и поcттравматичеcком мидриазе глаукома развивается в 2 раза чаще, чем при частичной аниридии. Зачастую к манифестации вторичной глаукомы на фоне травмы радужной оболочки приводит имплантация иридохрусталиковой диафрагмы (ИХД), которая используется с целью закрытия дефекта радужной оболочки для восстановления ее диафрагмирующей функции.
Патогенез ПТГ
Патогенез вторичной ПТГ при травматической аниридии сложен и является многофакторным. Многие исследователи отводят главную роль нервно-сосудистому механизму [4]. Согласно другим авторам [5] важное значение имеет механическое нарушение регуляции офтальмотонуса вследствие затруднения оттока внутриглазной жидкости (ВГЖ), которое выявляется у 79% пациентов после травм глаза.
Основой патогенеза нарушений гидродинамики у пациентов с аниридией являются анатомические изменения переднего отрезка глаза. В результате потери всей или большей части радужки прекращается ее насосная функция в трабекулярной ткани УПК. Изменение натяжения трабекулы и уменьшение активной составляющей оттока ВГЖ влечет запустевание и органическое перерождение шлеммова канала. В ответ на травму и альтерацию различных структур переднего отрезка глаза инициируется воспаление, затем происходит клеточная пролиферация с формированием фиброза, что приводит к ретенции интрасклерального оттока. Рубцовые деформации цилиарной зоны вызывают атрофию цилиарного тела и способствуют снижению продукции ВГЖ, из-за чего возможна относительная компенсация гидродинамических показателей [5]. Р.А. Гундорова и соавт. [6] выделяют две формы посттравматической аниридической глаукомы: 1) гониоадгезивную, характеризующуюся образованием гониосинехий, приводящих к органическому блоку УПК и вызывающих значительную ретенцию оттока ВГЖ в травмированном глазу; 2) пролиферативную форму, связанную с образованием в полости глаза аномальных структур, таких как плотные фиброзные «аниридические» мембраны, иногда с неоваскуляризацией, образующиеся на месте передней гиалоидной мембраны. При формировании полной блокады зоны УПК развивается закрытоугольная или смешанная глаукома, если же этого не происходит, развивается открытоугольная глаукома [6, 7].
Н.П. Соболев и соавт. [4] изучали клинико-морфологические особенности иридоцилиарной зоны при помощи ультразвуковой биомикроскопии (УБМ) у пациентов со вторичной аниридической ПТГ. По данным УБМ, выполненной в сроки до 9 лет после травмы, выявлялись: фиброзные пленки, фиксированные к свободным краям цилиарных отростков; склеротическая деформация цилиарного тела и его отростков; спадение трабекулярной сети с элементами ее окклюзии остатками корня радужки; множественные кисты иридоцилиарной зоны. По результатам гистологических исследований авторами было отмечено, что в отдаленном послеоперационном периоде рубцовые процессы, несмотря на давность травмы, полностью не завершаются, что приводит к блокаде сформированных интрасклеральных путей оттока и низкому успеху антиглаукомных операций.
Одним из факторов, влияющих на выраженность нарушений гидродинамики, является повреждение радужки. В экспериментальном исследовании Н.А. Поздеевой и соавт. [8] проведено моделирование аниридии на кадаверных глазах. Было установлено, что большая часть всех случаев декомпенсации ВГД приходилась на глаза c полной аниридией и поcттравматичеcким мидриазом более 8 мм. Это объясняется тем, что при отсутствии насосной функции радужки спадаются ее межмышечные щели, что затрудняет отток ВГЖ по увеоcклеральному пути, а в сочетании с нарушением тока ВГЖ из передней камеры в трабекулярную сеть, при посттравматическом перерождении шлеммова канала, спадении его стенок, склерозе и облитерации путей оттока продуктами распада, в сочетании с гониоcинехиями, швартами с блокадой трабекулярной зоны цилиарными отростками и рубцовой деформацией зоны УПК возникает высокий процент развития ПТГ.
Лечение ПТГ
На сегодняшний день в мировой практике не существует общепринятого алгоритма лечения пациентов с ПТГ и аниридией. Выбор метода хирургического лечения таких пациентов происходит индивидуально, в зависимости от тяжести и характера повреждения дренажной зоны, размера дефекта радужной оболочки, а также от объема проведенного или запланированного оптико-реконструктивного вмешательства [8, 9].
Традиционные антиглаукомные операции (АГО) проникающего и непроникающего типа при ПТГ дают лишь временный эффект из-за усиленного рубцевания дренажной зоны, так как вызванные травмой фибропластические процессы не закончены и продолжаются еще длительное время, что приводит к рецидиву декомпенсации ВГД [10]. Наиболее часто в лечении рефрактерной ПТГ применяются фильтрирующие операции с использованием дренажей, усиливающие отток ВГЖ, а также операции, уменьшающие ее продукцию: криодеструкция цилиарного тела, эндоскопическая и транссклеральная циклофотокоагуляция (ЦФК) цилиарных отростков в микроимпульсном или непрерывном режиме [11].
Н.Ю. Горбуновой [12] в качестве способа лечения пациентов со вторичной рефрактерной глаукомой без рубеоза радужки предложено применение эксплантодренажа на основе полилактида (Глаутекс). В данной работе анализировали результаты хирургического лечения 129 пациентов с рефрактерной глаукомой, из них 24 пациента с ПТГ. При открытом УПК пациентам проводилась непроникающая глубокая склерэктомия, а при наличии гониосинехий большой протяженности — глубокая склерэктомия с имплантацией дренажа Глаутекс. Был выявлен стабильный гипотензивный эффект в сроки наблюдения до 12 мес. Н.Р. Тедеева [13] предложила метод увеосклерального дренирования с синустрабекулэктомией (СТЭ) с дренажом Глаутекс по собственной методике для пациентов с ПТГ. Разработанная операция обладает двойным механизмом улучшения оттока водянистой влаги: формирование канала в увеосклеральном пространстве усиливает отток, а наличие сформированных интрасклеральных пространств обеспечивает профилактику и длительное функционирование субконъюнктивальной фистулы, формируемой при СТЭ. После операции улучшение оттока связано с формированием ампулообразной бухты за счет смещения цилиарного тела от сформированной фистулы в трабекулярной зоне. В отдаленные сроки до 2 лет у всех пациентов ВГД сохранялось на уровне 15,3±2,67 мм рт. ст., в 12 случаях из 20 — без применения гипотензивной терапии.
В отдельных публикациях авторы отмечают, что при повреждениях радужки ввиду значительных посттравматических изменений в УПК формирование путей оттока ВГЖ из передней камеры недостаточно эффективно, и предполагают, что более оправдано проведение транcцилиарного дренирования для создания оттока из задней камеры глаза [14].
Наибольшую сложность представляет выбор метода лечения ПТГ у пациентов с посттравматической аниридией более 1/3 ткани радужки, сочетающейся с афакией и включающей имплантацию ИХД. Такой объем повреждения может привести к срыву компенсаторных механизмов, декомпенсации ранее оперированной глаукомы или к ее манифестации. Доказано, что частота развития глаукомы после имплантации ИХД зависит от места ее фиксации: c ИХД на капсуле хрусталика она возникает в 1,4 раза чаще, чем c ИХД, имплантированной в цилиарную зону c транccклеральным подшиванием и при интракапcулярной имплантации [8].
Более эффективным методом хирургического лечения ПТГ является имплантация дренажных устройств, среди которых наибольшее распространение получил клапан Ahmed [15, 16]. Согласно результатам применения клапана Ahmed у пациентов со вторичной глаукомой, возникшей после оптико-реконструктивного вмешательства, включавшего имплантацию ИХД, практически у всех пациентов в раннем послеоперационном периоде достигнута компенсация ВГД на уровне 16–19 мм рт. ст., на протяжении 1 года наблюдения величина ВГД оставалась стабильной. Авторы отмечают преимущества данного вида АГО: отсутствие гипотонии в послеоперационном периоде, минимальную травматизацию внутриглазных структур, формирование путей оттока вдали от рубцовых изменений роговицы и склеры [17]. Непроникающая СТЭ c транcцилиарным дренированием задней камеры глаза эффективна при рубцовых изменениях дренажной зоны и cубатрофичном цилиарном теле, но без грубых cклеро-конъюнктивальных сращений в зоне операции; при наличии cклеро-конъюнктивальных сращений в зоне операции, отечного или cубатрофичного цилиарного тела в сочетании или без рубцовых изменений в дренажной зоне — хирургия c имплантацией дренажного устройства Ahmed [8, 18].
Отечественные хирурги представили успешные результаты модифицированной имплантации клапана Ahmed в переднюю камеру у 41 пациента с ПТГ, 3 пациента были с афакией и аниридией, 5 — после имплантации ИХД. Был использован Т-образный разрез конъюнктивы и теноновой капсулы для профилактики постоперационного рубцевания последней. В отдаленные послеоперационные сроки (до 4 лет) у 40 больных сохранилась устойчивая нормализация ВГД. Однако авторы отмечают, что при сравнительном анализе отдаленных результатов СТЭ и клапана Ahmed при рефрактерной ПТГ у пациентов после СТЭ отмечен более длительный гипотензивный эффект благодаря усилению оттока ВГЖ за счет увеличения увеосклерального пространства и формирования интрасклеральных каналов, сообщающихся со склеральной фистулой и фильтрационной подушкой конъюнктивы [19]. Через 3–7 мес. после имплантации клапана Ahmed у 7 пациентов выявлено повышение ВГД, вызванное рубцеванием фильтрационной подушки конъюнктивы, инкапсуляцией капиллярной пластины клапана и смещением дренажной трубочки в склеральную фистулу [20]. В другом исследовании оценивали эффективность 3 разных методик имплантации клапана Ahmed у пациентов с ПТГ [21]: классической методики с введением дренажа в переднюю камеру, одновременной имплантацией клапана Ahmed и ИХД, сквозной кератопластикой с имплантацией ИХД и клапана Ahmed. К концу периода наблюдения (до 3 лет) у всех пациентов сохранялся уровень ВГД 17,3±3,4 мм рт. ст. Авторы указывают на эффективность клапана Ahmed при всех 3 вариантах лечения.
Американские исследователи представили данные о своем опыте лечения ПТГ с аниридией у 10 пациентов (17 глаз). Среднее предоперационное ВГД составляло 38 мм рт. ст. Трабекулэктомия была эффективна только у 1 пациента (1 глаз) (что составляет 9% случаев от выполненных операций); циклокриотерапия — на 5 глазах (эффективность — 25% случаев); имплантация дренажа Molteno — на 5 глазах (эффективность — 83%). Контролируемый уровень ВГД удалось достичь на 11 глазах. Авторы отметили, что дренаж Molteno эффективен для контроля ВГД при аниридии, когда предыдущие попытки контроля не увенчались успехом [22].
При закрытоугольной ПТГ, развивающейся вследствие передних периферических синехий, многие авторы рекомендуют применять транссклеральную ЦФК или эндоскопическую ЦФК (ЭЦФК). А.А. Маркова и соавт. [23] проанализировали результаты лечения пациентов с ПТГ с применением ЦФК (14 глаз) и ЭЦФК (18 глаз). При сравнении эффективности 2 данных методик в раннем послеоперационном периоде гипотензивный эффект был сопоставим, однако у 4 пациентов после ЦФК наблюдался недостаточный гипотензивный результат. Авторы отмечают, что оба метода при лечении больных с ПТГ приводят к значительному снижению ВГД, однако ЭЦФК показала себя как более прогнозируемый и контролируемый метод, что позволило избежать характерных осложнений в послеоперационном периоде.
Немецкие ученые [24] опубликовали результаты применения транссклеральной Nd-YAG-ЦФК у пациентов с рефрактерной глаукомой (27 глаз), из них было 8 пациентов с ПТГ и аниридией. В анамнезе у части пациентов (11 глаз) было проведение циклокриокоагуляции. Воздействие осуществлялось коаксиально через конъюнктиву на расстоянии от 1 до 1,5 мм от лимба, с энергией воздействия 3,8–4,2 Дж и экспозицией 10 мс. Фокус лазерного луча был помещен на 3,6 мм сзади с регулировкой фокуса на LASAG Microruptur. Средний период послеоперационного наблюдения составил 7,5 мес. После первой процедуры у пациентов с аниридией было отмечено снижение ВГД на 50% от исходного, а у 82% пациентов с предшествующей ЦФК ВГД стабилизировалось через 4 нед. (в среднем на 40% ниже предоперационных значений). Во всех случаях ВГД было снижено как минимум на 14 мм рт. ст. Клинически значимых осложнений не наблюдалось.
P.A. Bloom et al. [25] показали, что АГО с использованием дренажей, Nd-YAG-лазера и диодной лазерной ЦФК эффективно снижает ВГД за короткий период времени при рефрактерной глаукоме. При применении трубчатых дренажей возникал более выраженный гипотензивный эффект, однако увеличивалось количество осложнений. Результаты были лучше при ЭЦФК по сравнению как с СТЭ, так и с имплантацией дренажа. По данным K. Kaplowitz et al. [26], при сравнении результатов хирургического лечения рефрактерной глаукомы с помощью СТЭ, ЭЦФК и имплантации шунта выявлено сопоставимое снижение ВГД во всех 3 группах, но у пациентов после ЭЦФК показатели остроты зрения были более высокими.
Для достижения более выраженного пролонгированного гипотензивного эффекта было предложено комбинированное хирургическое лечение ПТГ с аниридией, включающее имплантацию Ex-press шунта в сочетании с транссклеральной ЦФК в микроимпульсном или непрерывном режиме. При данной операции создается дополнительный отток и уменьшение продукции ВГЖ [27].
Н.П. Соболев и соавт. [28] предложили способ комбинированного хирургического лечения вторичной глаукомы при посттравматической аниридии, заключающийся в применении диодного лазера при проведении транссклеральной ЦФК. В результате вмешательства уменьшается возможность чрезмерного лазерного воздействия при выраженном исходном истончении цилиарного тела, которое может привести к субатрофии глазного яблока и другим осложнениям. Представленная методика включает:
1) в нижней полусфере делают дозированную ЦФК, количество коагулятов которой зависит от степени атрофии цилиарного тела; 2) в верхнем сегменте выполняется АГО с применением Ex-PRESS Model Р-50. Предложенный метод позволяет дозировать гипотензивный эффект за счет снижения продукции ВГЖ, а также улучшает отток влаги передней камеры глаза. Результатом является сохранение зрительных функций, восстановление путей оттока ВГЖ и достижение стойкого гипотензивного эффекта.
Следует отметить, что ЦФК в непрерывном режиме, несмотря на достаточную эффективность, не является патогенетически обоснованным вмешательством при ПТГ и может привести к прогрессирующей атрофии цилиарного тела с развитием субатрофии глазного яблока и дистрофии роговицы. В последнее время одним из перспективных направлений в хирургии рефрактерной глаукомы при повреждениях радужной оболочки менее 1/3 является контактная транссклеральная диодлазерная ЦФК в режиме Micropulse. Данный метод в сравнении с традиционной непрерывно-волновой методикой считается более щадящим и безопасным [29–31].
Заключение
Накопленный опыт хирургического лечения больных с травматическими повреждениями радужной оболочки и других структур переднего отрезка глаза доказывает принципиальную возможность их успешной реабилитации. Однако лечение данной категории пациентов — сложный процесс, который может включать несколько этапов хирургического лечения. В связи с этим необходим дифференциальный подход к выбору тактики хирургического лечения ПТГ в зависимости от посттравматических изменений структур переднего отрезка глаза, а также гидродинамических показателей, что позволит снизить частоту возникновения послеоперационных осложнений, предотвратить развитие вторичной глаукомы и увеличить эффективность лечения.
Оптико-реконструктивные операции с имплантацией интраокулярных линз, зачастую с внекапсульной фиксацией, могут способствовать декомпенсации ВГД и прогрессированию вторичной глаукомы. Поэтому разработка хирургической тактики лечения вторичной глаукомы у пациентов с аниридией не потеряла своей актуальности и на сегодняшний день.
В случае декомпенсации ВГД в раннем послеоперационном периоде, при наличии сохранной ткани радужной оболочки более 1/3 ее протяженности, возможно выполнение непроникающей глубокой склерэктомии, с учетом того, что сформированные пути оттока будут функционировать ограниченное время, которого должно хватить для стихания воспалительной реакции, с нормализацией продукции ВГЖ и дальнейшей компенсацией ВГД. Также при повреждениях радужной оболочки возможно проведение транссклеральной ЦФК в микроимпульсном режиме, учитывая ее малую инвазивность, возможность дозирования эффекта и низкий процент послеоперационных осложнений. При обширных повреждениях с оставшейся протяженностью радужки менее 1/3 и сформировавшейся ПТГ наиболее патогенетически обоснованным является использование трубчатых дренажных устройств.
Сведения об авторах:
Соболев Николай Петрович — к.м.н., главный врач; ORCID iD 0000-0003-3413-1458.
Тепловодская Виктория Вячеславовна — к.м.н., врач-офтальмохирург; ORCID iD 0000-0002-0546-8433.
Соболева Мария Александровна — аспирант.
Судакова Екатерина Павловна — ординатор; ORCID iD 0000-0001-5654-5411.
ФГАУ НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России. 127486, Россия, г. Москва, Бескудниковский б-р, д. 59а.
Контактная информация: Судакова Екатерина Павловна, e-mail: sudakovaekp@gmail.com.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 26.08.2021.
About the authors:
Nikolay P. Sobolev — C. Sc. (Med.), Head Doctor; ORCID iD 0000-0003-3413-1458.
Viktoriya V. Teplovodskaya — C. Sc. (Med.), ophthalmic surgeon; ORCID iD 0000-0002-0546-8433.
Mariya A. Soboleva — postgraduate student.
Ekaterina P. Sudakova — clinical resident; ORCID iD 0000-0001-5654-5411.
S. Fyodorov Eye Microsurgery Federal State Institution, 59a, Beskudnikovskiy blvd, Moscow, 127486, Russian Federation.
Contact information: Ekaterina P. Sudakova, e-mail: sudakovaekp@gmail.com.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 26.08.2021.
Глаукома
Глаукома – хроническая патология глаз, характеризующаяся повышением внутриглазного давления, развитием оптической нейропатии и нарушениями зрительной функции. Клинически глаукома проявляется сужением полей зрения, болью, резью и ощущением тяжести в глазах, затуманиванием зрения, ухудшением сумеречного зрения, в тяжелых случаях слепотой. Диагностика глаукомы включает в себя периметрию, тонометрию и тонографию, гониоскопию, оптическую когерентную томографию, лазерную ретинотомографию. Лечение глаукомы требует использования антиглаукомных капель, применения методов лазерной хирургии (иридотомии (иридэктомии) и трабекулопластики) или проведения антиглаукоматозных операций (трабекулэктомии, склерэктомии, иридэктомии, иридоциклоретракции и др.).
Общие сведения
Глаукома – одно из самых грозных заболеваний глаз, приводящих к потере зрения. Согласно имеющимся данным, глаукомой страдают около 3 % населения, а у 15% незрячих людей во всем в мире глаукома послужила причиной слепоты. В группе риска по развитию глаукомы находятся люди старше 40 лет, однако в офтальмологии встречаются такие формы заболевания, как юношеская и врожденная глаукома. Частота заболевания значительно увеличивается с возрастом: так, врожденная глаукома диагностируется у 1 из 10-20 тыс. новорожденных; в группе 40-45-летних людей – в 0,1% случаев; у 50-60-летних – в 1,5% наблюдений; после 75 лет – более чем в 3% случаев.
Под глаукомой понимают хроническое заболевание глаз, протекающее с периодическим или постоянным повышением ВГД (внутриглазного давления), расстройствами оттока ВГЖ (внутриглазной жидкости), трофическими нарушениями в сетчатке и зрительном нерве, что сопровождается развитием дефектов поля зрения и краевой экскавации ДЗН (диска зрительного нерва). Понятием «глаукома» сегодня объединяют около 60 различных заболеваний, имеющих перечисленные особенности.
Глаукома
Причины глаукомы
Изучение механизмов развития глаукомы позволяет говорить о мультифакторном характере заболевания и роли порогового эффекта в ее возникновении. То есть для возникновения глаукомы необходимо наличие ряда факторов, которые в сумме вызывают заболевание.
Патогенетический механизм глаукомы связан с нарушением оттока внутриглазной жидкости, играющей ключевую роль в обмене веществ всех структур глаза и поддержании нормального уровня ВГД. В норме вырабатываемая ресничным (цилиарным) телом водянистая влага скапливается в задней камере глаза – щелевидном пространстве, расположенным позади радужки. 85-95% ВГЖ через зрачок перетекает в переднюю камеру глаза – пространство между радужкой и роговицей. Отток внутриглазной жидкости обеспечивается особой дренажной системой глаза, расположенной в углу передней камеры и образованной трабекулой и шлеммовым каналом (венозным синусом склеры). Через эти структуры ВГЖ оттекает в склеральные вены. Незначительная часть водянистой влаги (5-15%) оттекает дополнительным увеосклеральным путем, просачиваясь через ресничное тело и склеру в венозные коллекторы сосудистой оболочки.
Для поддержания нормального ВГД (18-26 мм рт. ст.) необходим баланс между оттоком и притоком водянистой влаги. При глаукоме это равновесие оказывается нарушенным, в результате чего в полости глаза скапливается избыточное количество ВГЖ, что сопровождается повышением внутриглазного давления выше толерантного уровня. Высокое ВГД, в свою очередь, приводит к гипоксии и ишемии тканей глаза; компрессии, постепенной дистрофии и деструкции нервных волокон, распаду ганглиозных клеток сетчатки и в конечном итоге – к развитию глаукомной оптической нейропатии и атрофии зрительного нерва.
Развитие врожденной глаукомы обычно связано с аномалиями глаз у плода (дисгенезом угла передней камеры), травмами, опухолями глаз. Предрасположенность к развитию приобретенной глаукомы имеется у людей с отягощенной наследственностью по данному заболеванию, лиц, страдающих атеросклерозом и сахарным диабетом, артериальной гипертонией, шейным остеохондрозом. Кроме этого, вторичная глаукома может развиваться вследствие других заболеваний глаз: дальнозоркости, окклюзии центральной вены сетчатки, катаракты, склерита, кератита, увеита, иридоциклита, прогрессирующей атрофии радужки, гемофтальма, ранений и ожогов глаз, опухолей, хирургических вмешательств на глазах.
Классификация
По происхождению различают первичную глаукому, как самостоятельную патологию передней камеры глаза, дренажной системы и ДЗН, и вторичную глаукому, являющуюся осложнением экстра- и интраокулярных нарушений.
В соответствии с механизмом, лежащим в основе повышения ВГД, выделяют закрытоугольную и открытоугольную первичную глаукому:
- при закрытоугольной глаукоме имеет место внутренний блок в дренажной системе глаза;
- при открытоугольной форме – угол передней камеры открыт, однако отток ВГЖ нарушен.
В зависимости от уровня ВГД глаукома может протекать в нормотензивном варианте (с тонометрическим давлением до 25 мм рт. ст.) или гипертензивном варианте с умеренным повышением тонометрического давления (26-32 мм рт. ст.) либо высоким тонометрическим давлением (33 мм рт. ст. и выше).
По течению глаукома может быть стабилизированной (при отсутствии отрицательной динамики в течение 6 месяцев) и нестабилизированной (при тенденции к изменениям поля зрения и ДЗН при повторных обследованиях).
По выраженности глаукомного процесса различают 4 стадии:
- I (начальная стадия глаукомы) – определяются парацентральные скотомы, имеется расширение оптического диска, экскавация ДЗН не доходит до его края.
- II (стадия развитой глаукомы) – поле зрения изменено в парцентральном отделе, сужено в нижне- и/или верхневисочном сегменте на 10° и более; экскавация ДЗН носит краевой характер.
- III (стадия далеко зашедшей глаукомы) – отмечается концентрическое сужение границ поля зрения, выявляется наличие краевой субтотальной экскавации ДЗН.
- IV (терминальная стадия глаукомы) – имеет место полная утрата центрального зрения либо сохранность светоощущения. Состояние ДЗН характеризуется тотальной экскавацией, деструкцией нейроретинального пояска и сдвигом сосудистого пучка.
В зависимости от возраста возникновения выделяют глаукому врожденную (у детей до 3-х лет), инфантильную (у детей от 3-х до 10-ти лет), ювенильную (у лиц в возрасте от 11-ти до 35-ти лет) и глаукому взрослых (у лиц старше 35-ти лет). Кроме врожденной глаукомы, все остальные формы являются приобретенными.
Симптомы глаукомы
Клиническое течение открытоугольной глаукомы, как правило, бессимптомное. Сужение поля зрения развивается постепенно, иногда прогрессирует в течение нескольких лет, поэтому нередко пациенты случайно обнаруживают, что видят только одним глазом. Иногда предъявляются жалобы на затуманивание взгляда, наличие радужных кругов перед глазами, головную боль и ломоту в надбровной области, снижение зрения в темноте. При открытой глаукоме обычно поражаются оба глаза.
В течении закрытоугольной формы заболевания выделяют фазу преглаукомы, острого приступа глаукомы и хронической глаукомы.
Преглаукома характеризуется отсутствием симптоматики и определяется при офтальмологическом обследовании, когда выявляется узкий или закрытый угол передней камеры глаза. При преглаукоме больные могут видеть радужные круги на свету, ощущать зрительный дискомфорт, кратковременную потерю зрения.
Острый приступ закрытоугольной глаукомы обусловлен полным закрытием угла передней камеры глаза. ВГД может достигать при этом 80 мм. рт. ст. и выше. Приступ может провоцироваться нервным напряжением, переутомлением, медикаментозным расширением зрачка, длительным пребыванием в темноте, долгой работой со склоненной головой. При приступе глаукомы появляется резкая боль в глазу, внезапное падение зрения вплоть до светоощущения, гиперемия глаз, потускнение роговицы, расширение зрачка, который приобретает зеленоватый оттенок. Именно поэтому типичному признаку заболевание получило свое название: «glaucoma» переводится с греческого как «зеленая вода». Приступ глаукомы может протекать с тошнотой и рвотой, головокружением, болями в сердце, под лопаткой, в животе. На ощупь глаз приобретает каменистую плотность.
Острый приступ закрытоугольной глаукомы является неотложным состоянием и требует скорейшего, в течение нескольких ближайших часов, снижения ВГД медикаментозным или хирургическим путем. В противном случае больному может грозить полная необратимая потеря зрения.
Со временем глаукома принимает хроническое течение и характеризуется прогрессирующим увеличение ВГД, рецидивирующими подострыми приступами, нарастанием блокады угла передней камеры глаза. Исходом хронической глаукомы служит глаукомная атрофия зрительного нерва и потеря зрительной функции.
Диагностика глаукомы
Раннее выявление глаукомы имеет важное прогностическое значение, определяющее эффективность лечения и состояние зрительной функции. Ведущее значение в диагностике глаукомы играет определение ВГД, детальное изучение глазного дна и ДЗН, исследование поля зрения, обследование угла передней камеры глаза.
Основными методами измерения внутриглазного давления служит тонометрия, эластотонометрия, суточная тонометрия, отражающая колебания ВГД в течение суток. Показатели внутриглазной гидродинамики определяются с помощью электронной тонографии глаза.
Неотъемлемой частью обследования при глаукоме является периметрия – определение границ поля зрения с помощью различных методик – изоптопериметрии, кампиметрии, компьютерной периметрии и др. Периметрия позволяет выявить даже начальные изменения полей зрения, которые не замечаются самим пациентом.
С помощью гониоскопии при глаукоме офтальмолог имеет возможность оценить строение угла передней камеры глаза и состояние трабекулы, через которую происходит отток ВГЖ. Информативные данные помогает получить УЗИ глаза.
Состояние ДЗН является важнейшим критерием оценки стадии глаукомы. Поэтому в комплекс офтальмологического обследования включается проведение офтальмоскопии — процедуры осмотра глазного дна. Для глаукомы характерно углубление и расширение сосудистой воронки (экскавации) ДЗН. В стадии далеко зашедшей глаукомы отмечается краевая экскавация и изменение цвета диска зрительного нерва.
Более точный качественный и количественный анализ структурных изменений ДЗН и сетчатки проводится с помощью лазерной сканирующей офтальмоскопии, лазерной поляриметрии, оптической когерентной томографии или гейдельбергской лазерной ретинотомографии.
Лечение глаукомы
Существует три основных подхода к лечению глаукомы: консервативный (медикаментозный), хирургический и лазерный. Выбор лечебной тактики определяется типом глаукомы. Задачами медикаментозного лечения глаукомы служат снижение ВГД, улучшение кровоснабжения внутриглазного отдела зрительного нерва, нормализация метаболизма в тканях глаза. Антиглаукомные капли по своему действию делятся на три большие группы:
- Препараты, улучшающие отток ВГЖ: миотики (пилокарпин, карбахол); симпатомиметики (дипивефрин); простагландины F2 альфа – латанопрост, травопрост).
- Средства, ингибирующие продукцию ВГЖ: селективные и неселективные ß-адреноблокаторы (бетаксолол, бетаксолол, тимолол и др.); a- и β-адреноблокаторы (проксодолол).
- Препараты комбинированного действия.
При развитии острого приступа закрытоугольной глаукомы требуется незамедлительное снижение ВГД. Купирование острого приступа глаукомы начинают с инстилляции миотика — 1% р-ра пилокарпина по схеме и р-ра тимолола, назначения диуретиков (диакарба, фуросемида). Одновременно с лекарственной терапией проводят отвлекающие мероприятия – постановку банок, горчичников, пиявок на височную область (гирудотерапию), горячие ножные ванны. Для снятия развившегося блока и восстановления оттока ВГЖ необходимо проведение лазерной иридэктомии (иридотомии) или базальной иридэктомии хирургическим методом.
Методы лазерной хирургии глаукомы довольно многочисленны. Они различаются типом используемого лазера (аргонового, неодимового, диодного и др.), способом воздействия (коагуляция, деструкция), объектом воздействия (радужка, трабекула), показаниями к проведению и т. д. В лазерной хирургии глаукомы широкое распространение получили лазерная иридотомия и иридэктомия, лазерная иридопластика, лазерная трабекулопластика, лазерная гониопунктура. При тяжелых степенях глаукомы может выполняться лазерная циклокоагуляция.
Не потеряли своей актуальности в офтальмологии и антиглаукоматозные операции. Среди фистулизирующих (проникающих) операций при глаукоме, наиболее распространены трабекулэктомия и трабекулотомия. К нефистулизирующим вмешательствам относят непроникающую глубокую склерэктомию. На нормализацию циркуляции ВГЖ направлены такие операции, как иридоциклоретракция, иридэктомия и др. С целью снижения продукции ВГЖ при глаукоме проводится циклокриокоагуляция.
Прогноз и профилактика глаукомы
Необходимо понимать, что полностью излечиться от глаукомы невозможно, однако данное заболевание можно держать под контролем. На ранней стадии заболевания, когда еще не произошли необратимые изменения, могут быть достигнуты удовлетворительные функциональные результаты лечения глаукомы. Бесконтрольное течение глаукомы приводит к необратимой потере зрения.
Профилактика глаукомы заключается в регулярных осмотрах окулистом лиц групп риска — с отягощенным соматическим и офтальмологическим фоном, наследственностью, старше 40 лет. Пациенты, страдающие глаукомой, должны находиться на диспансерном учете у офтальмолога, регулярно каждые 2-3 месяца посещать специалиста, пожизненно получать рекомендуемое лечение.
Глаукома — лечение в Москве
Первичная закрытоугольная глаукома вследствие кисты цилиарного тела. Клинический случай
https://doi.org/10.18008/1816-5095-2020-3-508-512
Полный текст:
- Аннотация
- Об авторах
- Список литературы
Аннотация
Представлен клинический случай возникновения закрытоугольной глаукомы вследствие закрытия УПК кистой цилиарного тела. Пациентка А., 42 года, обратилась с жалобами на чувство транзиторного затуманивания зрения правого глаза, ухудшение зрения в вечернее время. При первичном офтальмологическом осмотре максимально корригированная острота зрения на обоих глазах составляла 1,0, внутриглазное давление по данным пневмотонометрии: OD — 21 мм рт. ст., OS — 14,8 мм рт. ст. Со стороны переднего отрезка глазного яблока изменений при биомикроскопии не обнаружено. Учитывая асимметрию данных ВГД, пациентке были проведены следующие исследования: статическая периметрия, оптическая когерентная томография (ОКТ), флоуметрия с расчетом толерантного внутриглазного давления (ТВГД). По данным ОКТ и статической периметрии патологических отклонений выявлено не было. На левом глазу показатели флоуметрии находились в пределах нормальных значений, однако на правом глазу было определено существенное снижение показателей объемного глазного кровотока, увеличение показателя ВГД. При вычислении ТВГД нашли асимметрию значений. На левом глазу ТВГД соответствовало ВГД, а на правом — показатели ВГД превышали значение ТВГД. Отсутствие взаимосвязи морфофункциональных показателей и данных флоуметрии, не отягощенный наследственный анамнез по глаукоме, несоответствие показателей флоуметрии и возраста могли свидетельствовать о развитии ЗУГ, поэтому пациентка была направлена на УБМ. Эхографическая картина переднего отдела правого глаза характеризовалась уменьшением глубины передней камеры, частичным смещением периферической части радужки кпереди, небольшим сужением угла передней камеры, неравномерной задней камерой. В области отростчатой части цилиарного тела по меридиану 3 часов выявили объемное тонкостенное образование, анэхогенное, с четкими контурами и размерами: высота 4,3 мм, протяженность 4,8 мм. Корень радужки определялся за счет среднего прикрепления к цилиарному телу. В соответствии с этим был поставлен диагноз: OD — киста цилиарного тела, пациентка была направлена на консультацию по поводу возможного лазерного хирургического вмешательства.
Ключевые слова
Об авторах
Д. В. Анджелова
ФГБНУ «Научно-исследовательский институт глазных болезней»
Россия
доктор медицинских наук, старший научный сотрудник отдела современных методов лечения в офтальмологии,
ул. Россолимо, 11а, б, Москва, 119021
Э. Э. Казарян
ФГБНУ «Научно-исследовательский институт глазных болезней»
Россия
доктор медицинских наук, старший научный сотрудник отдела современных ме‑ тодов лечения в офтальмологии,
ул. Россолимо, 11а, б, Москва, 119021
Н. Ю. Школяренко
ФГБНУ «Научно-исследовательский институт глазных болезней»
Россия
кандидат медицинских наук, старший научный сотрудник отдела современных методов лечения в офтальмологии,
ул. Россолимо, 11а, б, Москва, 119021
Список литературы
1. Национальное руководство по глаукоме: для практикующих врачей. Под ред. проф. Е.А. Егорова, проф. Ю.А. Астахова, проф. В.П. Еричева. М.: ГЭОТАР-Медиа; 2015: 17.
2. Национальное руководство по глаукоме: Под редакцией проф. Е.А. Егорова, проф. Ю.А. Астахова, проф. А.Г. Щуко. М.: 2008: 2.
3. Аветисов С.Э. Офтальмология. Национальное руководство. М.: ГЭОТАР-Медиа; 2008: 944.
4. Грищук А.С., Юрьева Т.Н., Мищенко Т.С., Микова О.И. Эпидемиологические аспекты в изучении первичной глаукомы. Сибирский научный медицинский журнал. 2012;113(6):23–26.
5. Файзиева У.С. Закрытоугольная глаукома: диагностика, клиника и лечение. Российская офтальмология онлайн. 2012. URL: http://www.eyepress.ru/article.aspx1029
6. Lowe R.F., Ritch R. Angle-closure glaucoma: clinical types. In: Ritch R., Shields M.B., Krupin T. eds. The Glaucomas. V. 2. St. Louis: C.V. Mosby Co; 1996: 823–840.
7. Azuara-Blanco A., Spaeth G.L., Araujo S.V., Augsburger J.J., Terebuh A.K. Plateau iris syndrome associated with multiple ciliary body cysts. Report of three cases. Arch Ophthalmol. 1996;114(6):666–668. DOI: 10.1001/archopht.1996.01100130658004
8. Pathak-Ray V., Ahmed II K. Phaco-endocycloplasty: A novel technique for management of ring iridociliary cyst presenting as acute angle closure. Oman J Ophthalmology. 2016;9(1):63–65. DOI: 10.4103/0974-620X.176123
9. Аветисов С.Э., Мамиконян В.Р., Казарян Э.Э., Шмелева-Демир О.А., Мазурова Ю.В, Рыжкова Е.Г. и др. Новый скрининговый метод определения толерантного внутриглазного давления. Вестник офтальмологии. 2009;125:5:3–7.
10. Юсеф Н.Ю., Казарян Э.Э., Рафаэлян А.А., Сафонова Д.М., Школяренко Н.Ю., Матющенко А.Г. Влияние возраста на показатель индивидуальной нормы внутриглазного давления. Офтальмология. 2019;16(3):355–359.
11. Аветисов С.Э., Амбарцумян А.Р. Ультразвуковая визуализация кист плоской части цилиарного тела. Вестник офтальмологии. 2011;127(1):3–6.
12. Магарамов Д.А., Яровой А.А., Голубева О.В. Федоровские чтения. 2012: 157. https://eyepress.ru/article.aspx?11039
13. Егоров Е.А. Межнациональное руководство по глаукоме Т. 2. М.: 2016: 41–44.
14. Аветисов С.Э., Амбарцумян А.Р. Возможности ультразвуковой биомикроскопии в диагностике и мониторинге иридокорнеального эндотелиального синдрома. Современные технологии в медицине. 2012;2:57.
Рецензия
Просмотров: 709