Действующее вещество: сухой экстракт семян Glycine max (экстрагент — этанол 60-70%);
1 капсула содержит 100 мг сухого экстракта семян Glycine max (экстрагент — этанол 60-70%), содержащий 40 мг изофлавоноидов;
Вспомогательные вещества: масло кипрейна, глицерин моностеарат, лецитин;
Состав оболочки капсулы : желатин, глицерин, понсо 4R (E 124), титана диоксид (Е 171).
Капсулы мягкие.
Основные физико-химические свойства: мягкие овальные желатиновые капсулы красного цвета, содержащие маслянистую суспензию коричневого цвета.
Гормоны половых желез и препараты, применяемые при патологии половой сферы.
Код АТХ G03X A10.
Фармакологические.
Специфическая активность препарата связана с эстрогеноподобным действием производных изофлавоноидов сои (генистеин, даидзеин). Фитоэстрогены сои имеют дифенольну структуру, характерную для естественных и синтетических эстрогенов, поэтому способны конкурировать с эстрогеном за соответствующие рецепторы в мембранах клеток-мишеней. Механизм действия препарата обусловлен влиянием фитоэстрогенов преимущественно бета-эстрогеновые рецепторы, действие на альфа-эстрогеновые рецепторы в них меньше в 5-22 раза. Благодаря этому Онагрис, в отличие от синтетических эстрогеновых препаратов, значительно реже вызывает побочные реакции, обусловленные действием на альфа-эстрогеновые рецепторы (гиперплазия эндометрия, маточные кровотечения, изменения со стороны молочных желез, гиперкоагуляция и тромбоэмболические осложнения).
Фармакокинетика.
После приема внутрь изофлавоноиды сои активируются в толстом кишечнике путем отщепления сахарной части под действием ферментов гликозидаз кишечной микрофлоры. После дегликозування генистеин и даидзеин хорошо всасываются, попадают в печень, где происходит частичная конъюгация с глюкуроновой кислотой. Конъюгированная фракция фитоэстрогенов поступает в желчь, а дальше — в систему печеночной циркуляции, всасываясь повторно, что обеспечивает длительный период полувыведения и возможность однократного применения в сутки. Максимальная концентрация фитоэстрогенов в плазме крови составляет от 0,04 до 2,4 мкмоль / л и зависит от диеты (увеличивается при вегетарианской диете с большим содержанием продуктов сои). Вывод генистеина и даидзеину происходит в основном с мочой. Максимальная концентрация фитоэстрогенов в моче достигается через 24 часа после приема препарата. В неизмененном виде выводится до 30% изофлавоноидов.
Лечение климактерических расстройств, которые проявляются вегетативными симптомами (ощущение жара, приливы, сердцебиение, лабильность артериального давления), психическими и психосоматическими симптомами (бессонница, раздражительность, снижение работоспособности). Онагрис также применяют в комплексных схемах профилактики остеопороза и сердечно-сосудистых заболеваний, связанных с эстрогенодефицита в период ранней менопаузы.
Повышенная чувствительность к компонентам препарата, злокачественные новообразования тела матки и молочной железы к радикальному лечению.
Одновременное применение препарата с антибактериальными препаратами может привести к уменьшению клинической эффективности препарата.
Перед началом лечения необходимо посоветоваться с врачом. Без консультации врача не превышать рекомендованных доз препарата. Осторожно назначать женщинам с наличием фибромиомы матки и эндометриальная гиперпластических процессов. Такие женщины должны находиться под постоянным наблюдением гинеколога для своевременного выявления возможного прогрессирования заболевания. Лечение Онагрисом в таком случае необходимо прекратить и / или рассмотреть возможность сочетанного применения с гестагеном. После радикальной гистерэктомии по поводу злокачественного новообразования лечения Онагрисом необходимо проводить под постоянным наблюдением гинеколога, хотя данные, которые указывали бы на рецидив заболевания или уменьшение периода ремиссии под влиянием эстрогенов, отсутствуют. Нет ограничений в применении препарата после гистерэктомии по поводу фибромиомы. Учитывая слабую эстрогенной действие лекарственного средства, рекомендуется собрать у пациентки анамнез относительно одновременного применения пероральных контрацептивов.
Фитоэстрогены сои не следует применять в период беременности и кормления грудью.
Препарат применять по 1 капсуле в сутки. Клинический эффект, как правило, появляется через 2 недели после начала применения препарата. В случае недостаточного купирования симптомов заболевания суточную дозу увеличить до 2 капсул: 1 принимать утром, 2-ю — вечером. Курс лечения составляет не менее 4 месяцев. Для полного контроля над симптомами эстрогенодефицита, а также при применении препарата в комплексных схемах профилактики остеопороза и сердечно-сосудистых заболеваний препарат можно применять длительное время (до 4-7 лет). В случае необходимости длительного применения препарата следует проконсультироваться с врачом.
Препарат не следует применять детям.
Случаев передозировки препарата не зарегистрировано. Фитоэстрогены сои — нетоксичный продукт, поэтому даже при значительной передозировке маловероятно ожидать выраженных симптомов отравления. Крайне редко возможно развитие головной боли, диспепсических расстройств. В таких случаях необходим надзор за больным. ОСОБЫЕ.
Препарат хорошо переносится, побочные эффекты встречаются редко. Иногда могут возникать диспепсические расстройства в виде метеоризма, боли в животе и диареи. Возможны также аллергические реакции, вагинальные выделения, включая кровянистые, гиперплазия эндометрия, маточные кровотечения, изменения со стороны молочных желез, гиперкоагуляция, тромбоэмболические осложнения. В случае выявления нежелательных влияний или других негативных эффектов следует посоветоваться с врачом о возможности дальнейшего применения препарата.
2 года. Не использовать после истечения срока годности, указанного на упаковке.
Хранить при температуре не выше 30 в Хранить в недоступном для детей месте.
По 15 капсул в блистере из алюминиевой фольги, покрытой PVDC и наслоением PVC / PVDC, 2 блистера в пачке из картона.
По 20 капсул в блистере из алюминиевой фольги, покрытой PVDC и наслоением PVC / PVDC, по 3 блистера в пачке из картона.
Онагрис — натуральный препарат для лечения и профилактики климакса. Оказывает положительное влияние на симптомы климактерического синдрома: устраняет чувство жара и «приливы», ночное потоотделение, бессонницу, раздражительность, улучшает состояние кожи (устраняет сухость) и волос (уменьшает выпадение), устраняет сухость влагалища. Поскольку в период менопаузы из-за недостатка эстрогена в организме, возникает риск развития остеопороза и сердечно-сосудистых заболеваний, Онагрис рекомендуется для профилактики этих состояний.
Специфическая активность препарата связана с эстрогеноподобным действием производных изофлавоноидов сои (генистеин, даидзеин). Фитоэстрогены сои имеют дифенольную структуру, характерную для природных и синтетических эстрогенов, поэтому способны конкурировать с эстрогеном за соответствующие рецепторы в мембранах клеток-мишеней. Механизм действия препарата обусловлен влиянием фитоэстрогенов преимущественно на бета-эстрогеновые рецепторы, действие на альфа-эстрогеновые рецепторы в них меньше в 5–22 раза. Благодаря этому Онагрис, в отличие от синтетических эстрогеновых препаратов, значительно реже вызывает побочные реакции, обусловленные действием на альфа-эстрогеновые рецепторы (гиперплазия эндометрия, маточные кровотечения, изменения со стороны молочных желез, гиперкоагуляция и тромбоэмболические осложнения).
После приёма внутрь изофлавоноиды сои активизируются в толстом кишечнике путём отщепления сахарной части под воздействием ферментов гликозидаз кишечной микрофлоры. После дегликозирования генистеин и даидзеин хорошо всасываются, попадают в печень, где частично конъюгируют с глюкороновой кислотой. Конъюгированная фракция фитоэстрогенов попадает в жёлчь, а дальше — в систему энтерогепатической циркуляции, всасываясь повторно, что обеспечивает длительный период полувыведения препарата и возможность однократного приёма в сутки. Максимальная концентрация фитоэстрогенов в плазме крови составляет от 0,04 до 2,4 мкмоль/л и зависит от диеты (повышается при вегетарианской диете со значительным содержанием продуктов сои). Выведение генистеина и даидзеина происходит, в основном, с мочой. Максимальная концентрация фитоэстрогенов в моче отмечается через 24 часа после приёма препарата. В неизменённом виде выводится до 30% изофлавоноидов.
Показания к применению:
Онагрис предназначен для лечения климактерических расстройств, которые проявляются вегетативными симптомами (чувство жара, «приливы», ощущение сердцебиения, лабильность артериального давления), психическими и психосоматическими симптомами (бессонница, раздражительность, снижение работоспособности). Онагрис также применяют в комплексных схемах профилактики остеопороза и сердечно-сосудистых заболеваний, связанных с эстрогендефицитом в период ранней менопаузы.
Способ применения:
Препарат Онагрис применяют по одной капсуле в день. Клинический эффект, как правило, наблюдается через 2 недели после начала приёма препарата. В случае недостаточного купирования симптомов суточную дозу препарата повышают до двух капсул, одну принимают утром, другую — вечером. Курс лечения длится не менее 4-х месяцев. Для полного контроля над симптомами эстрогендефицита, а также при использовании препарата в комплексных схемах профилактики остеопороза и сердечно-сосудистых заболеваний препарат можно применять длительно (до 4-7 лет). При необходимости длительного применения препарата необходимо проконсультироваться с врачом.
Побочные действия:
Препарат Онагрис переносится хорошо, побочные эффекты встречаются редко. Иногда могут возникать диспепсические расстройства в виде метеоризма, боли в животе и диареи. В случаях появления нежелательных воздействий или других отрицательных эффектов посоветуйтесь с врачом по поводу дальнейшего применения препарата.
Противопоказания:
Онагрис противопоказан к применению при повышенной чувствительности к компонентам препарата, злокачественные новообразования тела матки и молочной железы до радикального лечения.
Надлежащие меры безопасности при применении. Перед началом лечения препаратом посоветуйтесь с врачом. Без консультации врача не превышайте рекомендуемые дозы препарата. Осторожно препарат назначают женщинам с наличием фибромиомы матки и эндометриальных гиперпластических процессов. Такие женщины должны находиться под постоянным наблюдением гинеколога для своевременного выявления возможного прогрессирования заболевания, лечение препаратом в таком случае необходимо отменить и/или рассмотреть возможность совместного применения с гестагеном. После радикальной гистерэктомии по поводу злокачественного новообразования лечение Онагрисом необходимо проводить под постоянным наблюдением гинеколога, хотя данных, указывающих на рецидив заболевания или уменьшение ремиссии под влиянием эстрогенов, нет. Нет ограничений в применении препарата после гистерэктомии по поводу фибромиомы.
Беременность:
Фитоэстрогены сои, входящие в состав препарата Онагрис не применяют во время беременности или кормления грудью.
Взаимодействие с другими лекарственными средствами:
Совместное применение препарата Онагрис с антибактериальными препаратами может привести к уменьшению клинического эффекта препарата.
Передозировка:
Случаи передозировки препарата Онагрис не зарегистрированы. Фитоэстрогены сои — нетоксичный продукт, поэтому даже при значительной передозировке маловероятно ожидать выраженных симптомов отравления. Очень редко возможно развитие головной боли, диспепсических расстройств, В таких случаях необходимо наблюдение за больным. Терапия симптоматическая.
Условия хранения:
Хранить при температуре не выше +30°С. Хранить в недоступном для детей месте.
Форма выпуска:
Капсулы мягкие 100 мг, № 30, № 60
Состав:
Действующее вещество: сухой экстракт семян Glycine max; 1 капсула содержит 100 мг сухого экстракта семян Glycine max, содержащий 40 мг изофлавоноидов; вспомогательные вещества: масло кипрейное, глицерола моностеарат, лецитин; состав капсулы: желатин, глицерин, понсо 4R (Е 124), титана диоксид Е 171).
Состав
діюча речовина: сухий екстракт насіння Glycine max (екстрагент – етанол 60-70%);
1 капсула містить: 100 мг сухого екстракту насіння Glycine max (екстрагент – етанол 60-70%), що містить 40 мг ізофлавоноїдів;
допоміжні речовини: олія кипрейна, гліцерол моностеарат, лецитин;
склад оболонки капсули: желатин, гліцерин, понсо 4R (E 124), титану діоксид (Е 171).
Лікарська форма
Капсули м?які.
Основні фізико-хімічні властивості: м’які овальні желатинові капсули червоного кольору, що містять маслянисту суспензію коричневого кольору.
Фармакотерапевтична група
Гормони статевих залоз і препарати, що застосовують при патології статевої сфери.
Код АТХ G03X A10.
Фармакологічні властивості
Фармакодинаміка.
Специфічна активність препарату пов’язана з естрогеноподібною дією похідних ізофлавоноїдів сої (геністеїн, даїдзеїн). Фітоестрогени сої мають дифенольну структуру, характерну для природних та синтетичних естрогенів, тому здатні конкурувати з естрогеном за відповідні рецептори в мембранах клітин-мішеней. Механізм дії препарату зумовлений впливом фітоестрогенів переважно на бета-естрогенові рецептори, дія на альфа-естрогенові рецептори в них менша в 5-22 рази. Завдяки цьому Онагріс, на відміну від синтетичних естрогенових препаратів, значно рідше спричиняє побічні реакції, зумовлені дією на альфа-естрогенові рецептори (гіперплазія ендометрія, маткові кровотечі, зміни з боку молочних залоз, гіперкоагуляція та тромбоемболічні ускладнення).
Фармакокінетика.
Після прийому внутрішньо ізофлавоноїди сої активуються в товстому кишечнику шляхом відщеплення цукрової частини під дією ферментів глікозидаз кишкової мікрофлори. Після деглікозування геністеїн та даїдзеїн добре всмоктуються, потрапляють у печінку, де відбувається часткова кон’югація із глюкуроновою кислотою. Кон’югована фракція фітоестрогенів надходить у жовч, а далі – в систему ентерогепатичної циркуляції, всмоктуючись повторно, що забезпечує тривалий період напіввиведення препарату та можливість одноразового застосування на добу. Максимальна концентрація фітоестрогенів у плазмі крові становить від 0,04 до 2,4 мкмоль/л і залежить від дієти (збільшується при вегетаріанській дієті зі значним вмістом продуктів сої). Виведення геністеїну та даїдзеїну відбувається в основному із сечею. Максимальна концентрація фітоестрогенів у сечі спостерігається через 24 години після прийому препарату. У незміненому вигляді виводиться до 30 % ізофлавоноїдів.
Показания
Лікування клімактеричних розладів, які проявляються вегетативними симптомами (відчуття жару, приливи, відчуття серцебиття, лабільність артеріального тиску), психічними та психосоматичними симптомами (безсоння, дратівливість, зниження працездатності). Онагріс також застосовують у комплексних схемах профілактики остеопорозу та серцево-судинних захворювань, пов’язаних із естрогенодефіцитом у період ранньої менопаузи.
Противопоказания
Підвищена чутливість до компонентів препарату, злоякісні новоутворення тіла матки та молочної залози до радикального лікування.
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Одночасне застосування препарату з антибактеріальними препаратами може призвести до зменшення клінічної ефективності препарату.
Особливості застосування
Перед початком лікування препаратом необхідно порадитися з лікарем. Без консультації лікаря не перевищувати рекомендованих доз препарату. Обережно призначати препарат жінкам із наявністю фіброміоми матки та ендометріальних гіперпластичних процесів. Такі жінки повинні перебувати під постійним наглядом гінеколога для своєчасного виявлення можливого прогресування захворювання. Лікування Онагрісом у такому разі необхідно припинити та/або розглянути можливість поєднаного застосування з гестагеном. Після радикальної гістеректомії з приводу злоякісного новоутворення лікування Онагрісом необхідно проводити під постійним наглядом гінеколога, хоча дані, які вказували б на рецидив захворювання або зменшення періоду ремісії під впливом естрогенів, відсутні. Немає обмежень у застосуванні препарату після гістеректомії з приводу фіброміоми. Враховуючи слабку естрогенну дію лікарського засобу, рекомендується зібрати у пацієнтки анамнез щодо одночасного застосування пероральних контрацептивів.
Способ применения и дозы
Препарат застосовувати по 1 капсулі на добу. Клінічний ефект, як правило, з’являється через 2 тижні після початку застосування препарату. У разі недостатнього купірування симптомів захворювання добову дозу препарату збільшити до 2 капсул: 1 приймати вранці, 2-гу – ввечері. Курс лікування становить не менше 4 місяців. Для повного контролю над симптомами естрогенодефіциту, а також при застосуванні препарату в комплексних схемах профілактики остеопорозу та серцево-судинних захворювань препарат можна застосовувати тривалий час (до 4-7 років). У разі необхідності тривалого застосування препарату слід проконсультуватися з лікарем.
Діти
Препарат не слід застосовувати дітям.
Побочные реакции
Препарат переноситься добре, побічні ефекти зустрічаються рідко. Інколи можуть виникати диспепсичні розлади у вигляді метеоризму, болю в животі та діареї. Можливі також алергічні реакції, вагінальні виділення, включаючи кров’янисті, гіперплазія ендометрія, маткові кровотечі, зміни з боку молочних залоз, гіперкоагуляція, тромбоемболічні ускладнення. У разі виявлення небажаних впливів або інших негативних ефектів слід порадитися з лікарем щодо можливості подальшого застосування препарату.
Передозировка
Випадків передозування препарату не зареєстровано. Фітоестрогени сої – нетоксичний продукт, тому навіть при значному передозуванні малоймовірно очікувати виражених симптомів отруєння. Вкрай рідко можливий розвиток головного болю, диспепсичних розладів. У таких випадках необхідний нагляд за хворим. Терапія симптоматична.
Применение в период беременности или кормления грудью
Фітоестрогени сої не слід застосовувати у період вагітності або годування груддю.
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами
Не впливає.
Условия хранения
Термін придатності
2 роки. Не застосовувати препарат після закінчення терміну придатності, зазначеного на упаковці.
Умови зберігання
Зберігати при температурі не вище 30 оС. Зберігати в недоступному для дітей місці.
Упаковка
По 15 капсул у блістері з алюмінієвої фольги, покритої PVDC та нашаруванням PVC/PVDC, 2 блістери в пачці з картону.
По 20 капсул у блістері з алюмінієвої фольги, покритої PVDC та нашаруванням PVC/PVDC, по 3 блістери в пачці з картону.
Категорія відпуску
Без рецепта.
Онагрис
На сайте нет в наличии товаров с торговым названием «Онагрис»
Редакторская группа
Дата создания: 27.04.2021
Дата обновления: 22.04.2023
Рецензент
Состав и форма выпуска
Состав:
действующее вещество: сухой экстракт семян Glycine max; 1 капсула содержит 100 мг сухого экстракта семян Glycine max, содержащий 40 мг изофлавоноидов; вспомогательные вещества: масло кипрейное, глицерола моностеарат, лецитин; состав капсулы: желатин, глицерин, понсо 4R (Е 124), титана диоксид Е 171).
Форма выпуска:
По 15 капсул в блистере, по 2 блистера в картонной пачке. По 20 капсул в блистере, по 3 блистера в картонной пачке.
Фармдействие
Фармакологические свойства. Специфическая активность препарата связана с эстрогеноподобным действием производных изофлавоноидов сои (генистеин, даидзеин). Фитоэстрогены сои имеют дифенольную структуру, характерную для природных и синтетических эстрогенов, поэтому способны конкурировать с эстрогеном за соответствующие рецепторы в мембранах клеток-мишеней. Механизм действия препарата обусловлен влиянием фитоэстрогенов преимущественно на бета-эстрогеновые рецепторы, действие на альфа-эстрогеновые рецепторы в них меньше в 5–22 раза. Благодаря этому Онагрис, в отличие от синтетических эстрогеновых препаратов, значительно реже вызывает побочные реакции, обусловленные действием на альфа-эстрогеновые рецепторы (гиперплазия эндометрия, маточные кровотечения, изменения со стороны молочных желез, гиперкоагуляция и тромбоэмболические осложнения).
После приёма внутрь изофлавоноиды сои активизируются в толстом кишечнике путём отщепления сахарной части под воздействием ферментов гликозидаз кишечной микрофлоры. После дегликозирования генистеин и даидзеин хорошо всасываются, попадают в печень, где частично конъюгируют с глюкороновой кислотой. Конъюгированная фракция фитоэстрогенов попадает в жёлчь, а дальше — в систему энтерогепатической циркуляции, всасываясь повторно, что обеспечивает длительный период полувыведения препарата и возможность однократного приёма в сутки. Максимальная концентрация фитоэстрогенов в плазме крови составляет от 0,04 до 2,4 мкмоль/л и зависит от диеты (повышается при вегетарианской диете со значительным содержанием продуктов сои). Выведение генистеина и даидзеина происходит, в основном, с мочой. Максимальная концентрация фитоэстрогенов в моче отмечается через 24 часа после приёма препарата. В неизменённом виде выводится до 30% изофлавоноидов.
Показания
Лечение климактерических расстройств, которые проявляются вегетативными симптомами (чувство жара, «приливы», ощущение сердцебиения, лабильность артериального давления), психическими и психосоматическими симптомами (бессонница, раздражительность, снижение работоспособности). Онагрис также применяют в комплексных схемах профилактики остеопороза и сердечно-сосудистых заболеваний, связанных с эстрогендефицитом в период ранней менопаузы.
Противопоказания
Повышенная чувствительность к компонентам препарата, злокачественные новообразования тела матки и молочной железы до радикального лечения.
Надлежащие меры безопасности при применении. Перед началом лечения препаратом посоветуйтесь с врачом. Без консультации врача не превышайте рекомендуемые дозы препарата. Осторожно препарат назначают женщинам с наличием фибромиомы матки и эндометриальных гиперпластических процессов. Такие женщины должны находиться под постоянным наблюдением гинеколога для своевременного выявления возможного прогрессирования заболевания, лечение препаратом в таком случае необходимо отменить и/или рассмотреть возможность совместного применения с гестагеном. После радикальной гистерэктомии по поводу злокачественного новообразования лечение Онагрисом необходимо проводить под постоянным наблюдением гинеколога, хотя данных, указывающих на рецидив заболевания или уменьшение ремиссии под влиянием эстрогенов, нет. Нет ограничений в применении препарата после гистерэктомии по поводу фибромиомы.
Особые указания
Применение в период беременности или кормления грудью. Фитоэстрогены сои не применяют во время беременности или кормления грудью.
Способность влиять на скорость реакции при управлении автотранспортом или работе с другими механизмами. Не влияет.
Дети. Препарат не применяют у детей.
Дозировка
Препарат применяют по одной капсуле в день. Клинический эффект, как правило, наблюдается через 2 недели после начала приёма препарата. В случае недостаточного купирования симптомов суточную дозу препарата повышают до двух капсул, одну принимают утром, другую — вечером. Курс лечения длится не менее 4-х месяцев. Для полного контроля над симптомами эстрогендефицита, а также при использовании препарата в комплексных схемах профилактики остеопороза и сердечно-сосудистых заболеваний препарат можно применять длительно (до 4-7 лет). При необходимости длительного применения препарата необходимо проконсультироваться с врачом.
Передозировка
Случаи передозировки препарата не зарегистрированы. Фитоэстрогены сои — нетоксичный продукт, поэтому даже при значительной передозировке маловероятно ожидать выраженных симптомов отравления. Очень редко возможно развитие головной боли, диспепсических расстройств, В таких случаях необходимо наблюдение за больным. Терапия симптоматическая.
Побочные действия
Препарат переносится хорошо, побочные эффекты встречаются редко. Иногда могут возникать диспепсические расстройства в виде метеоризма, боли в животе и диареи. В случаях появления нежелательных воздействий или других отрицательных эффектов посоветуйтесь с врачом по поводу дальнейшего применения препарата.
Взаимодействие
Совместное применение препарата с антибактериальными препаратами может привести к уменьшению клинического эффекта препарата.
Условия хранения
Хранить при температуре не выше +30°С. Хранить в недоступном для детей месте.
Срок годности — 2 года. Не применять препарат после окончания срока годности, указанного на упаковке.
Обратите внимание!
Описание препарата Онагрис на этой странице — упрощенная авторская версия сайта apteka911, созданная на основании инструкции/ий по применению. Перед приобретением или использованием препарата вы должны проконсультироваться с врачом и ознакомиться с оригинальной инструкцией производителя (прилагается к каждой упаковке препарата).
Информация о препарате предоставлена исключительно с ознакомительной целью и не должна быть использована как руководство к самолечению. Только врач может принять решение о назначении препарата, а также определить дозы и способы его применения.
Онагрис инструкция и описание
- Описание
- Цены в аптеках
ОНАГРИС
(ONAGRIS)
состав
действующее вещество: сухой экстракт семян Glycine max (экстрагент — этанол 60-70%);
1 капсула содержит 100 мг сухого экстракта семян Glycine max (экстрагент — этанол 60-70%), содержащий 40 мг изофлавоноидов;
Вспомогательные вещества: масло кипрейна, глицерин моностеарат, лецитин;
состав оболочки капсулы: желатин, глицерин, понсо 4R (E 124), титана диоксид (Е 171).
Лекарственная форма. Капсулы мягкие.
Основные физико-химические свойства: мягкие овальные желатиновые капсулы красного цвета, содержащие маслянистую суспензию коричневого цвета.
Фармакологическая группа. Гормоны половых желез и препараты, применяемые при патологии половой сферы.
Код АТХ G03X A10.
Фармакологические свойства.
Фармакодинамика.
Специфическая активность препарата связана с эстрогеноподобным действием производных изофлавоноидов сои (генистеин, даидзеин). Фитоэстрогены сои имеют дифенольну структуру, характерную для естественных и синтетических эстрогенов, поэтому способны конкурировать с эстрогеном за соответствующие рецепторы в мембранах клеток-мишеней. Механизм действия препарата обусловлен влиянием фитоэстрогенов преимущественно бета-эстрогеновые рецепторы, действие на альфа-эстрогеновые рецепторы в них меньше в 5-22 раза. Благодаря этому Онагрис, в отличие от синтетических эстрогеновых препаратов, значительно реже вызывает побочные реакции, обусловленные действием на альфа-эстрогеновые рецепторы (гиперплазия эндометрия, маточные кровотечения, изменения со стороны молочных желез, гиперкоагуляция и тромбоэмболические осложнения).
Фармакокинетика.
После приема внутрь изофлавоноиды сои активируются в толстом кишечнике путем отщепления сахарной части под действием ферментов гликозидаз кишечной микрофлоры. После дегликозування генистеин и даидзеин хорошо всасываются, попадают в печень, где происходит частичная конъюгация с глюкуроновой кислотой. Конъюгированная фракция фитоэстрогенов поступает в желчь, а далее — в систему печеночной циркуляции, всасываясь повторно, что обеспечивает длительный период полувыведения и возможность однократного применения в сутки. Максимальная концентрация фитоэстрогенов в плазме крови составляет от 0,04 до 2,4 мкмоль / л и зависит от диеты (увеличивается при вегетарианской диете с большим содержанием продуктов сои). Вывод генистеина и даидзеину происходит в основном с мочой. Максимальная концентрация фитоэстрогенов в моче достигается через 24 часа после приема препарата. В неизмененном виде выводится до 30% изофлавоноидов.
Клинические характеристики.
Показания.
Лечение климактерических расстройств, которые проявляются вегетативными симптомами (ощущение жара, приливы, сердцебиение, лабильность артериального давления), психическими и психосоматическими симптомами (бессонница, раздражительность, снижение работоспособности). Онагрис также применяют в комплексных схемах профилактики остеопороза и сердечно-сосудистых заболеваний, связанных с эстрогенодефицита в период ранней менопаузы.
Противопоказания.
Повышенная чувствительность к компонентам препарата, злокачественные новообразования тела матки и молочной железы до радикального лечения.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий.
Одновременное применение препарата с антибактериальными препаратами может привести к уменьшению клинической эффективности препарата.
Особенности применения.
Перед началом лечения необходимо посоветоваться с врачом. Без консультации врача не должна превышать рекомендованных доз препарата. Осторожно назначать женщинам с наличием фибромиомы матки и эндометриальных гиперпластических процессов. Такие женщины должны находиться под постоянным наблюдением гинеколога для своевременного выявления возможного прогрессирования заболевания. Лечение Онагрисом в таком случае необходимо прекратить и / или рассмотреть возможность сочетанного применения с гестагеном. После радикальной гистерэктомии по поводу злокачественного новообразования лечения Онагрисом необходимо проводить под постоянным наблюдением гинеколога, хотя данные, которые указывали бы на рецидив заболевания или уменьшение периода ремиссии под влиянием эстрогенов, отсутствуют. Нет ограничений в применении препарата после гистерэктомии по поводу фибромиомы. Учитывая слабую эстрогенной действие лекарственного средства, рекомендуется собрать у пациентки анамнез относительно одновременного применения пероральных контрацептивов.
Применение в период беременности или кормления грудью.
Фитоэстрогены сои не следует применять в период беременности и кормления грудью.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Не влияет.
Способ применения и дозы.
Препарат применять по 1 капсуле в сутки. Клинический эффект, как правило, появляется через 2 недели после начала приема препарата. В случае недостаточного купирования симптомов заболевания суточную дозу увеличить до 2 капсул: 1 принимать утром, 2-ю — вечером. Курс лечения составляет не менее 4 месяцев. Для полного контроля над симптомами эстрогенодефицита, а также при применении препарата в комплексных схемах профилактики остеопороза и сердечно-сосудистых заболеваний препарат можно применять длительное время (до 4-7 лет). В случае необходимости длительного применения препарата следует проконсультироваться с врачом.
Дети. Препарат не следует применять детям.
Передозировки.
Случаев передозировки препарата не зарегистрировано. Фитоэстрогены сои — нетоксичный продукт, поэтому даже при значительной передозировке маловероятно ожидать выраженных симптомов отравления. Крайне редко возможно развитие головной боли, диспепсические расстройства. В таких случаях необходим надзор за больным. Особенности применения.
Побочные реакции.
Препарат хорошо переносится, побочные эффекты встречаются редко. Иногда могут возникать диспепсические расстройства в виде метеоризма, боли в животе и диареи. Возможны также аллергические реакции, вагинальные выделения, включая кровянистые, гиперплазия эндометрия, маточные кровотечения, изменения со стороны молочных желез, гиперкоагуляция, тромбоэмболические осложнения. В случае выявления нежелательных влияний или других негативных эффектов следует посоветоваться с врачом о возможности дальнейшего применения препарата.
Срок годности. 2 года. Не использовать после истечения срока годности, указанного на упаковке.
Условия хранения.
Хранить при температуре не выше 30 ° С. Хранить в недоступном для детей месте.
Упаковка.
По 15 капсул в блистере из алюминиевой фольги, покрытой PVDC и наслоением PVC / PVDC, 2 блистера в пачке из картона.
По 20 капсул в блистере из алюминиевой фольги, покрытой PVDC и наслоением PVC / PVDC, по 3 блистера в пачке из картона.
Категория отпуска. Без рецепта.
Новости медицины:
Самые безопасные статины для снижения холестерина
Дата публикации: 22.06.2021
Высокое давлениеДля сердца и сосудовИнсультПри диабетеСердечная недостаточностьТаблеткиТаблеткиХолестерин
Содержание статьи
- Когда холестерин становится опасен
- Если повышен холестерин в крови: что делать
- Как снизить холестерин в крови
- Задайте вопрос эксперту по теме статьи
Каждая клетка практически всех живых организмов содержит холестерин (ХС) – жироподобную субстанцию, передающуюся по системе кровообращения. Без этого вещества невозможно нормальное функционирование нервной, иммунной, пищеварительной систем. Но при повышенных показателях ХС начинает откладываться на сосудистых стенках. Это приводит к образованию бляшек, сужающих сосуды и нарушающих их эластичность. Почему же растет уровень холестерина и как с ним бороться?
Когда холестерин становится опасен
Большая часть вещества (около 70-80%) вырабатывается организмом, и только его небольшая часть поступает извне. Но вредит здоровью не весь холестерин, а только «плохой» – липопротеид низкой плотности (ЛПНП). «Хороший» же необходим для транспортировки избыточного ХС из тканей к печени для переработки и выведения. Поэтому большая концентрация «хорошего» ХС полезна для организма.
При увеличении показателей ЛПНП переработка и выведение избытков ХС нарушается. Постепенно откладывающиеся на сосудистых стенках излишки вызывают атеросклероз, от которого страдают сосуды, снабжающие кровью почки, кишечник, нижние конечности. Повреждения сосудов, питающих мозг, вызывают такие симптомы, как головокружения, обмороки, а затем развивается инсульт. Опасен атеросклероз и для сердечно-сосудистой системы. Ухудшение проходимости сосудов приводит к ИБС (ишемическая болезнь сердца), а в будущем – к инфаркту миокарда.
Высокая концентрация ХС до момента развития серьезных патологий никак не отражается на самочувствии. Поэтому даже молодым людям рекомендуется периодически сдавать анализ на общий холестерин. И при отклонениях от нормы срочно принимать меры.
Если повышен холестерин в крови: что делать
Решать проблему нужно комплексно. Для выбора оптимальных методов борьбы с повышенным ХС обязательно проконсультируйтесь с кардиологом. На начальных стадиях снижения показателей нередко удается добиться без применения медикаментов. В зависимости от степени риска, врач может посоветовать:
- Отказаться от плохих привычек – курение и алкоголь в больших количествах негативно влияют на сосуды, поэтому не стоит создавать для них дополнительную нагрузку.
- Повысить физическую активность – самый простой способ поддерживать хорошее состояние сосудов. Полезна ежедневная кардионагрузка продолжительностью не менее 30 минут: ходьба, бег трусцой, велосипед. Выработать привычку больше двигаться помогут фитнес-часы.
- Снизить вес – высокий ХС – частый спутник повышенной массы тела. Ожирение увеличивает риск диабета, гипертонии, болезней сердца. Чтобы защитить себя от этих болезней, нужно постараться сбросить лишние килограммы.
- Пересмотреть рацион – отказаться от продуктов, в состав которых входят трансжиры (фастфуд, продукты вторичной переработки), употреблять побольше клетчатки, ввести в меню морскую рыбу, заменить черный чай зеленым. Также лучше отказаться от продуктов с высоким содержанием животных жиров: сливочное масло, жирное мороженое, сосиски и колбасы.
- Скорректировать режим. В исследовании, опубликованном SleepTrusted Source, исследователи обнаружили, что слишком большое или малое количество сна негативно влияет на уровень холестерина. Они обследовали группу из 1666 мужчин и 2329 женщин старше 20 лет. Сон менее пяти часов повышал уровень триглицеридов и снижал ЛПВП у женщин. Сон более восьми часов дал аналогичный результат. Мужчины оказались не так чувствительны к чрезмерному сну, как женщины.
В зависимости от состояния и результатов обследования, пациенту также может быть предложено медикаментозное лечение.
Нет времени читать длинные статьи? Подписывайтесь на нас в соцсетях: слушайте фоном видео и читайте короткие заметки о красоте и здоровье.
Мегаптека в соцсетях: ВКонтакте, Telegram, OK, Viber
Как снизить холестерин в крови
Для снижения ХС существует несколько групп препаратов, но стандартом лечения фактически считаются статины. В инструкции к средствам, содержащим эти вещества, говорится, что они снижают ЛПНП на 40-60% и способствуют повышению «хорошего» холестерина. Но при достаточно высокой эффективности, статины вызывают множество негативных реакций. Другая отрицательная сторона – принимать их после назначения придется постоянно. Поэтому врачи относятся к их применению с большой осторожностью, после всесторонней оценки всех рисков.
При каком холестерине надо начинать пить статины? Ответить на этот вопрос может только специалист после всестороннего обследования пациента. Идеальный уровень общего ХС не должен превышать 5,2 ммоль/л, а ЛПНП – 130 мг/дл. Но даже при повышенных показателях статины назначаются не всегда. При отсутствии высокой вероятности инфаркта или инсульта препараты не применяются. Если же в анамнезе присутствует сердечный приступ, они могут быть назначены даже при нормальном ЛПНП.
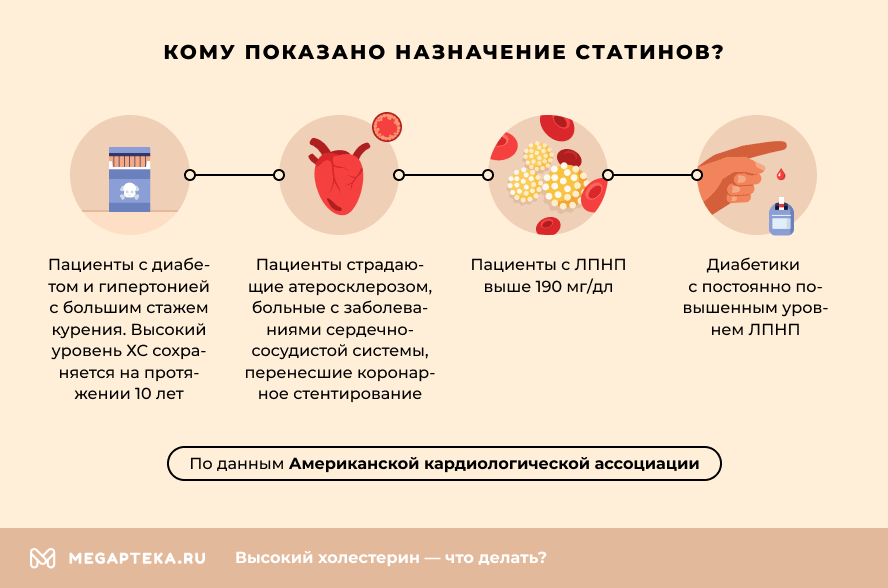
Американская кардиологическая ассоциация выделяет 4 группы пациентов, которым показано назначение этих лекарств. К ним относятся пациенты:
- С диабетом и гипертонией с большим стажем курения, у которых высокий уровень ХС сохраняется на протяжении последних 10 лет.
- Страдающих от атеросклероза. Также в эту группу входят больные с заболеваниями сердечно-сосудистой системы (ССС), перенесшие коронарное стентирование.
- С ЛПНП выше 190 мг/дл.
- Диабетики с постоянно повышенным уровнем ЛПНП.
Если пациент относится к одной или нескольким из этих групп, ему нужно принимать статины, начиная с низкой или средней дозировки. Возможно, изменив свой образ жизни и пересмотрев рацион, вам удастся снизить ХС без препаратов. Но, если статины были назначены, отказываться от их приема без консультации с кардиологом нельзя.
Относитесь к своему здоровью с максимальной ответственностью. Помните, что осложнения, вызываемые атеросклерозом, необратимы, полностью вылечить их невозможно. Лекарства не избавляют от уже имеющихся проблем, а лишь предотвращают развитие новых.
- «Cholesterol Medications», Американская кардиологическая ассоциация
- «Medicines for high cholesterol», Национальная служба здравоохранения Великобритании
- «Cholesterol-lowering Medicine», Центры по контролю и профилактике заболеваний США
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же Вы можете поделиться своим опытом с другими читателями Мегасоветов.
Выпускающий редактор
Эксперт-провизор
Поделиться мегасоветом
Понравилась статья? Расскажите маме, папе, бабушке и тете Гале из третьего подъезда
Гид по аналогам за подписку
подпишитесь на соцсети и напишите в сообщения «аналоги»
До вызова «скорой» или в первые сутки заболевания необходимо:
Если причина поноса – отравление, необходимо промыть желудок: выпить 0,5 л воды, можно чуть подсоленной или с содой, вызвать рвоту.
Принять средства для восполнения объема жидкости (3 л в сутки для взрослых).
Регидрон: выпить 0,5 л теплой воды, можно чуть подсоленной, вызвать рвоту;
Пить часто и маленькими глотками.
Принять энтеросорбенты (вбирают и выводят токсины):
- Активированный уголь: 4-8 таблеток 3-4 раза в сутки. Нельзя принимать при подозрении на желудочно-кишечное кровотечение, язвенный колит;
- Смекта: до 6 пакетиков в сутки;
- Энтеросгель: 1,5 столовые ложки 3 раза в сутки;
- Энтерол: 1 пакетик 2 раза в сутки.
Средства от боли при диарее — спазмолитики:
- Но-шпа;
- Дротаверин;
- Спазмалгон.
Средства от рвоты и диареи (если большая часть токсина уже вышла с рвотой и калом):
противорвотные средства: Мотилиум, Церукал;
против поноса: Лоперамид, Имодиум, Тримедат.
Нельзя применять при подозрении на инфекционную диарею, язвенный колит, колит после приема антибиотиков, внутреннее кровотечение, детям до 6 лет!
Средства от вздутия и диареи:
- Эспумизан;
- Активированный уголь;
- Симетикон.
При подозрении на кровотечение уложить больного, на живот поместить холод, вызвать «скорую».
Лечение диареи у взрослых
Общее в лечении всех видов диареи заключается в приеме препаратов, улучающих состояние тонкого кишечника:
энтеросорбентов: Смекта, Активированный уголь и др.;
вяжущих средств: Де-нол;
пробиотиков: Бификол, Линекс, Пробифор;
обволакивающих средств: Алмагель, Фосфалюгель.
Выбор дополнительных средств от поноса зависит от причины, его вызвавшей.
Этиотропное лечение экссудативной диареи
Для лечения бактериальной кишечной инфекции показаны противомикробные препараты:
- Нифуроксазид, Энтерофурил, Стопдиар. Подходят для лечения поноса у детей. Не влияют на нормальную флору;
- Фуразолидон (при дизентерии, лямблиозе, пищевых токсикоинфекциях);
- Сульгин (при дизентерии, колите, энтероколите);
- Фталазол (при колитах, гастроэнтеритах, дизентерии);
- Альфа нормикс (хроническое воспаление кишечника, диарея путешественников, кишечные инфекции).
При амебной дизентерии:
Метронидазол.
Лечение болезни Крона, язвенного колита: глюкокортикостероиды, иммуносупрессоры, препараты 5-аминосалициловой кислоты.
Этиотропное лечение секреторной диареи
При воспалении кишечника и холере для снижения гиперсекреции воды и солей назначается Гидрасек.
При хологенной (печеночной) диарее:
желчегонные средства: Гепабене;
связывающие желчные кислоты: Холестирамин;
спазмолитики;
сорбенты: Энтеросгель, Неосмектин;
гепатопротекторы: Фосфоглив, Эссенциале.
Для лечения нейроэндокринных опухолей – Сандостатин.
Этиотропное лечение осмотической диареи
Элиминационная диета – исключение пищевых аллергенов, непереносимых продуктов.
Ферментные препараты – восполняют недостаток ферментов при хронических заболеваниях пищеварительной системы:
- Панкреатин;
- Фестал;
- Мезим Форте;
- Креон.
Для лечения лямблиоза:
- Трихопол;
- Макмирор;
- Немозол.
Для лечения ротавирусной инфекции: энтеросорбенты, ферментные препараты, средства для восполнения жидкости, пробиотики. Антибиотики неэффективны.
Этиотропное лечение моторной диареи
Психотропные препараты применяются для устранения психогенного фактора в возникновении синдрома раздраженного кишечника.
Спазмолитики: Тримебутин, Дицетел.
Регуляторы моторики: Лоперамид.
Средства от диареи в дорогу
Расстройства стула столь часто возникают у путешествующих, что получили официальное название «диареи путешественников».
Вызвать диарею могут инфекционные возбудители (кишечная палочка), попадающие внутрь через немытые руки, пищу, питьевую воду, купание в бассейне, мясные блюда, постельное белье.
Рекомендуется взять с собой аптечку путешественника, в которую входят:
Энтеросорбенты:
Аттапульгит (по 150 мг до 6 раз за день);
Висмута субсалицилат (по 2 таблетки через 30 мин, 8 раз, курс — 2 дня).
Применяются при хорошем самочувствии и жидком стуле до 2-х раз в сутки. Если чаще, добавить прокинетики.
Прокинетики: Лоперамид, Имодиум.
При лихорадке, кровавом поносе Лоперамид не применять!
Если понос держится более 2 суток, добавить антимикробные препараты.
Антимикробные препараты:
- Норфлоксацин: 800 мг однократно или по 400 мг 2 раза в день, курс — 3 дня;
- Ципрофлоксацин: 750 мг однократно или по 500 мг 2 раза в день, курс — 3 дня;
- Офлоксацин (600 мг однократно или по 300 мг 2 раза в день, курс — 3 дня);
- Азитромицин: 1000 мг однократно или 500 мг 2 раза в сутки, курс — 1-3 дня.
Средства от обезвоживания: Регидрон и аналоги.
Ферментные препараты (при переедании, непривычной пище).
Диета при диарее у взрослого
При острой диарее рекомендуется отварной рис, овсяная каша, белые сухарики, бананы, картофельное пюре, зеленый чай, печеные яблоки. Эти продукты помогают закрепить понос.
При непереносимости продуктов (целиакия, лактазная недостаточность) – исключение их из рациона.
При вздутии живота нельзя потреблять продукты, усиливающие брожение: бобовые, жирные сорта мяса, свежая выпечка, сладости, сырые овощи и фрукты.
Во всех случаях исключается жирная, жареная, острая, чрезмерно соленая пища.
Читайте так же:
От чего возникает диарея и как ее лечить
Когда нужно вызывать неотложку при диарее
Тагриссо — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер: ЛП — 004492 — 181017
Торговое наименование: Тагриссо
Международное непатентованное наименование: осимертиниб
Лекарственная форма: таблетки, покрытые плёночной оболочкой
Состав
Одна таблетка, покрытая плёночной оболочкой, 40 мг содержит:
Действующее вещество: осимертиниба мезилат* 47,7 мг, что соответствует осимертинибу 40 мг.
Вспомогательные вещества: маннитол 147 мг, целлюлоза микрокристаллическая 37,5 мг, гипролоза с низкой степенью замещения 12,5 мг, натрия стеарилфумарат 5,0 мг; оболочка таблетки**,***: поливиниловый спирт 5,00 мг, титана диоксид 2,98 мг, макрогол 3350 2,53 мг, тальк 1.85 мг, краситель железа оксид желтый (Е 172) 0,113 мг, краситель железа оксид красный (Е 172) 0,028 мг, краситель железа оксид черный (Е 172) 0,008 мг.
Одна таблетка, покрытая плёночной оболочкой, 80 мг содержит:
Действующее вещество: осимертиниба мезилат* 95,4 мг, что соответствует осимертинибу 80 мг.
Вспомогательные вещества: маннитол 295 мг, целлюлоза микрокристаллическая 75,0 мг, гипролоза с низкой степенью замещения 25,0 мг, натрия стеарилфумарат 10,0 мг; оболочка таблетки**,***:: поливиниловый спирт 8,00 мг, титана диоксид 4,76 мг, макрогол 3350 4,04 мг, тальк 2,96 мг, краситель железа оксид желтый (Е 172) 0,180 мг, краситель железа оксид красный (Е 172) 0,044 мг, краситель железа оксид черный (Е 172) 0,012 мг.
*1.192 мг осимертиниба мезилата соответствует 1 мг осимертиниба.
**Компоненты могут добавляться в виде готовой смеси для формирования оболочки (Опадрай II бежевый).
***Для таблеток 40 мг целевое количество соответствует приблизительно 5 % (м/м) от массы ядра таблетки. Для таблеток 80 мг целевое количество соответствует приблизительно 4 % (м/м) от массы ядра таблетки.
Описание
Таблетки, покрытые плёночной оболочкой, 40 мг:
Круглые, двояковыпуклые таблетки, покрытые плёночной оболочкой светло-коричневого цвета, с гравировкой «AZ 40» на одной стороне.
Таблетки, покрытые плёночной оболочкой, 80 мг:
Овальные, двояковыпуклые таблетки, покрытые плёночной оболочкой светло- коричневого цвета, с гравировкой «AZ 80» на одной стороне.
Фармакотерапевтическая группа: противоопухолевое средство, протеинкиназы ингибитор.
Код ATX: L01XE35.
Фармакологические свойства
Фармакодинамика
Механизм действия и фармакодинамические эффекты
Механизм действия
Осимертиниб является ингибитором тирозинкиназы. Это необратимый ингибитор тирозинкиназы рецептора эпидермального фактора роста (EGFR), эффективный при наличии сенсибилизирующих мутаций гена EGFR и мутации Т790М. связанной с развитием резистентности к ингибиторам тирозинкиназы.
Фармакодинамические эффекты
В исследованиях in vitro было продемонстрировано, что осимертиниб обладает высокой активностью и ингибирующим действием в отношении EGFR во всех клинически значимых клеточных линиях немелкоклеточного рака легкого (HMPЛ), несущих сенсибилизирующие мутации EGFR и мутацию резистентности Т790М (кажущиеся полумаксимальные ингибирующие концентрации (IC50) 6-54 нмоль по отношению к фосфорилированному EGFR). Это приводит к подавлению клеточного роста, при этом значительно меньшая активность наблюдается в отношении клеточных линий, имеющих дикий тип EGFR (кажущиеся IC50 480 нмоль — 1.8 мкмоль по отношению к фосфорилированному EGFR). In vivo пероральный прием осимертиниба сопровождается уменьшением размера опухоли как в ксенографтах HMPЛ с активирующими мутациями EGFR и мутацией Т790М, так и в моделях опухолей легкого у трансгенных мышей.
Фармакокинетика
Параметры фармакокинетики осимертиниба определялись у здоровых добровольцев и пациентов с HMPЛ. По результатам анализа популяционной фармакокинетики кажущийся плазменный клиренс осимертиниба составляет 14,2 л/час, кажущийся объем распределения 986 л и период полувыведения примерно 48 часов. Значения AUC (площадь под кривой зависимости концентрации от времени) и максимальная концентрация (Сmах) увеличивались пропорционально принятой дозе в диапазоне доз от 20 до 240 мг. Прием осимертиниба один раз в сутки каждый день приводит к приблизительно трехкратному накоплению с достижением равновесного состояния к 15 дню приема. В равновесном состоянии плазменные концентрации обычно поддерживались в 1.6-кратном диапазоне в течение 24-часового междозового интервала.
Абсорбция
После приема внутрь медиана времени достижения максимальной концентрации осимертиниба в плазме (min-max) tmах составляет 6 (3-24) часов, а у некоторых больных максимальные концентрации достигались в течение первых 24 часов. Абсолютная биодоступность препарата Тагриссо не определялась. Согласно данным клинического фармакокинетического исследования у пациентов, получавших препарат в дозе 80 мг, прием пищи не оказывает клинически значимого влияния на биодоступность осимертиниба (AUC повышается на 6% (90% ДИ 5-19), а Сmах понижается на 7% (90% ДИ 19-6)). У здоровых добровольцев повышение рН желудочного сока за счет приема омепразола в течение 5 дней не влияло на экспозицию осимертиниба. принятого в форме таблетки 80 мг (AUC и Cmax увеличились на 7% и 2%, соответственно), а 90% ДИ для соотношения экспозиций укладывался в границы 80-125%.
Распределение
По данным популяционного анализа, средний объем распределения в равновесном состоянии (Vss/F) осимертиниба составляет 986 л, что свидетельствует о значительном распределении в тканях. Связь с белками плазмы не поддается измерению вследствие нестабильности, однако, основываясь на физико-химических свойствах осимертиниба, можно предполагать выраженную связь с белками. Было показано, что осимертиниб также может образовывать ковалентную связь с белками плазмы крысы и человека, сывороточным альбумином человека и крысы и гепатоцитами человека.
Метаболизм
Исследования in vitro показали, что осимертиниб метаболизируется, преимущественно, изоферментами цитохрома CYP3A4 и CYP3A5. При этом метаболизм с участием изофермента CYP3A4, вероятно, имеет меньшее значение. Могут существовать альтернативные пути метаболизма, которые не были полностью описаны. В исследованиях in vitro, на доклинических моделях и при пероральном приеме осимертиниба у человека в плазме были обнаружены два фармакологически активных метаболита: AZ7550 и AZ5104; AZ7550 продемонстрировал сходный с препаратом Тагриссо фармакологический профиль, в то время как AZ5104 обладал большей активностью по отношению как к мутированному, так и к дикому типу EGFR. Оба метаболита медленно появляются в плазме крови пациентов после приема препарата Тагриссо, и медиана (min-max) tmax составляет 24 (4 — 72) и 24 (6 — 72) часа, соответственно. В плазме крови неизмененный осимертиниб составляет 0,8%, а два его метаболита 0,08% и 0,07% общей радиоактивности, при этом основная доля радиоактивности ковалентно связана с белками плазмы крови. Геометрическое среднее экспозиции AZ5104 и AZ7550 на основе AUC составило примерно 10% от экспозиции осимертиниба в равновесном состоянии для каждого метаболита.
Основным путем метаболизма осимертиниба является окисление и деалкилирование. В образцах мочи и кала человека было обнаружено не менее 12 соединений, при этом на долю 5 соединений приходится более 1% принятой дозы, из которых неизмененный осимертиниб, AZ5104 и AZ7550 составляют приблизительно 1,9%, 6,6% и 2,7% дозы соответственно, в то время как аддукт цистеинила (М21) и неизвестный метаболит (М25) составляют 1,5% и 1,9% дозы соответственно.
По результатам исследований in vitro осимертиниб в клинически значимых концентрациях является конкурентным ингибитором изофермента CYP ЗА4/5, но не CYP1A2, 2А6, 2В6, 2С8, 2С9, 2С19, 2D6 и 2Е1. Согласно данным исследований in vitro, осимертиниб в клинически значимых концентрациях не подавляет UGT1A1 и UGT2B7 в печени. Возможно подавление активности UGT1A1 в кишечнике, однако клиническое значение этого процесса неизвестно.
Выведение
После однократного приема препарата внутрь в дозе 20 мг, 67,8% дозы выводилось через кишечник (1,2% в виде неизмененного вещества), а 14,2% принятой дозы (0,8% в виде неизмененного вещества) определялось в моче после сбора образцов мочи в течение 84 дней. Примерно 2% осимертиниба выводится в неизмененном виде — 0,8% почками и 1,2% — через кишечник.
Взаимодействия с транспортными белками
Исследования in vitro показали, что осимертиниб не является субстратом ОАТР1В1 и 0АТР1ВЗ. In vitro, осимертиниб в клинически значимых концентрациях не подавляет ОАТ1, ОАТЗ, ОАТР1В1, ОАТР1ВЗ и МАТЕ2К. Однако нельзя исключать взаимодействий с субстратами МАТЕ1 и ОСТ2.
Влияние осимертиниба на гликопротеин Р и белок резистентности рака молочной железы
По результатам исследований in vitro осимертиниб является субстратом гликопротеина Р (P-gp) и белка резистентности рака молочной железы (BCRP), но, маловероятно, что осимертиниб в клинически значимых дозах вступает в лекарственное взаимодействие с активными веществами. По данным исследований in vitro, осимертиниб является ингибитором BCRP и P-gp. Не изучались взаимодействия с ферментами, регулируемыми прегнан-Х-рецептором (PXR), кроме CYP3A4 (см. раздел «Взаимодействие с другими лекарственными средствами»).
Фармакокинетика у особых групп пациентов
В анализах популяционной фармакокинетики (n=778) не выявлено клинически значимых связей между рассчитанной равновесной экспозицией (AUCSS) и возрастом пациентов (диапазон: 21-89 лет), полом, этническим происхождением (включая пациентов европейской, азиатской популяции, в том числе, японцев, китайцев и пациентов, не относящихся к указанным группам) и курением (n=24 активные курильщики, n=232 бывшие курильщики). Анализ популяционной фармакокинетики показал, что масса тела являлся существенным ковариатом; наблюдалось изменение от — 20% до +30% AUCSS осимертиниба в диапазоне массы тела от 90 кг до 43 кг соответственно (от 95% до 5% квантилей) по сравнению с AUCSS при медиане массы тела 62 кг. Принимая во внимание предельные значения массы тела от < 43 кг до > 90 кг, доля метаболита AZ5104 варьировала от 11,8% до 9,6%, а метаболита AZ7550 от 12,8% до 9,9%, соответственно. Эти изменения экспозиции в зависимости от массы тела не считаются клинически значимыми.
Пациенты с нарушением функции печени
Осимертиниб элиминируется, в основном, печенью, поэтому у пациентов с нарушением функции печени может увеличиться его экспозиция. Фармакокинетические исследования с участием пациентов с нарушением функции печени не завершены. По результатам анализа данных популяционной фармакокинетики отсутствует связь между маркерами функции печени (аланинаминотрансфераза (AJIT), аспартатаминотрансфераза (ACT), билирубин) и экспозицией осимертиниба. Такой показатель функции печени как сывороточный альбумин влияет на фармакокинетические параметры осимертиниба. В клинические исследования не включались пациенты, у которых активность ACT или AJIT превышала верхнюю границу нормы (ВГН) более чем в 2,5 раза, а также пациенты, у которых активность ACT или АЛТ превышала ВГН за счет опухолевого поражения печени более чем в 5 раз. а также пациенты, у которых концентрация общего билирубина превышала ВГН более чем в 1,5 раза. По результатам фармакокинетического анализа экспозиция осимертиниба у 44 пациентов с нарушением функции печени легкой степени тяжести и 330 пациентов с нормальной функцией печени была схожей. Данные о применении препарата у пациентов с нарушением функции печени ограничены (см. раздел «Способ применения и дозы»).
Пациенты с нарушением функции почек
Фармакокинетические исследования с участием пациентов с нарушением функции почек не завершены. По данным популяционного фармакокинетического анализа, включавшего 330 пациентов с нарушением функции почек легкой степени тяжести (клиренс креатинина (КК) от 60 мл/мин до менее 90 мл/мин), 149 пациентов с нарушением функции почек средней степени тяжести (КК от 30 мл/мин до менее 60 мл/мин), 3 пациентов с нарушением функции почек тяжелой степени (КК от 15 мл/мин до менее 30 мл/мин) и 295 пациентов с нормальной функцией почек (КК не менее 90 мл/мин), во всех подгруппах экспозиция осимертиниба была сходной. Нарушение функции почек тяжелой степени может влиять на элиминацию лекарственных препаратов, которые выводятся через печень. Пациенты с КК менее 15 мл/мин в клинические исследования не включались.
Показания к применению
Местно-распространенный или метастатический немелкоклеточный рак легкого с мутацией Т790М в гене рецептора эпидермального фактора роста (EGFR) у взрослых пациентов.
Противопоказания
Повышенная чувствительность к осимертинибу или любому из компонентов препарата.
Беременность и период грудного вскармливания.
Нарушение функции почек тяжелой степени, терминальная стадия хронической почечной недостаточности, включая пациентов на гемодиализе.
Нарушение функции печени средней и тяжелой степени. Дети и подростки в возрасте до 18 лет (данные отсутствуют).
Прием препаратов зверобоя продырявленного на фоне терапии препаратом Тагриссо противопоказан.
Совместное применение мощных индукторов CYP3A (например, фенитоин. рифампицин и карбамазепин).
С осторожностью: интерстициальное заболевание легких, удлинение интервала QTc, совместное применение с умеренными индукторами CYP3A4 (например, бозетан, эфавиренз, этравирин, модафинил).
Применение при беременности и в период грудного вскармливания
Контрацепция у мужчин и женщин
Женщины с сохраненным репродуктивным потенциалом должны избегать наступления беременности во время терапии препаратом Тагриссо. Пациентам следует рекомендовать использовать эффективную контрацепцию и после завершения лечения данным препаратом: в течение, как минимум, 2 месяцев после окончания терапии для женщин и 4 месяцев для мужчин. Нельзя исключать риск снижения экспозиции гормональных контрацептивов.
Период беременности
Отсутствуют данные о применении осимертиниба у беременных женщин. Исследования на животных показали наличие репродуктивной токсичности (эмбриолетальность, задержка развития плода, смерть новорожденных). Учитывая механизм действия и доклинические данные, применение осимертиниба в период беременности может причинить вред плоду. Не следует применять препарат Тагриссо во время беременности.
Период грудного вскармливания
Неизвестно, выделяется ли осимертиниб или его метаболиты в грудное молоко. Недостаточно сведений об экскреции осимертиниба или его метаболитов в молоко животных. Однако осимертиниб и его метаболиты обнаруживались у щенков, получавших грудное вскармливание, что оказывало отрицательное влияние на их рост и выживание. Нельзя исключать риск для детей, получающих грудное вскармливание. Необходимо прекратить грудное вскармливание во время терапии препаратом Тагриссо.
Фертильность
Отсутствуют данные о влиянии препарата Тагриссо на фертильность человека. Согласно результатам исследований, проведенных на животных, осимертиниб влияет на мужские и женские репродуктивные органы, и может снижать фертильность.
Способ применения и дозы
Терапию препаратом Тагриссо следует начинать под контролем врача, имеющего опыт лечения противоопухолевыми лекарственными препаратами.
До назначения препарата Тагриссо у пациентов с местно-распространенным или метастатическим немелкоклеточным раком легкого должна быть подтверждена мутация Т790М в гене EGFR. Определение мутации Т790М в гене EGFR необходимо проводить с помощью валидированного теста (см. раздел «Особые указания»).
Дозы
Рекомендуемая доза осимертиниба — 80 мг один раз в сутки. Терапию продолжают до наступления прогрессирования заболевания или развития неприемлемой токсичности. Препарат следует принимать ежедневно в одно и то же время вне зависимости от приема пищи. В случае пропуска приема препарата пропущенную дозу следует принять в том случае, если до времени приема следующей дозы осталось не менее 12 часов.
Коррекция дозы препарата
В зависимости от индивидуальной переносимости препарата и нежелательных реакций, может потребоваться приостановка терапии и/или снижение дозы препарата. Рекомендуемая сниженная доза препарата составляет 40 мг один раз в сутки. В Таблице 1 приведены рекомендации по коррекции дозы препарата в случае нежелательных реакций.
Таблица 1. Коррекция дозы препарата Тагриссо в случае нежелательных реакций
| Орган- мишень | Нежелательная реакция1 | Коррекция дозы |
| Легкие | Интерстициальная болезнь легких/пневмонит | Прекращение терапии препаратом Тагриссо |
| Сердце | Удлинение интервала QTc более 500 мсек, отмеченное, по крайней мере, двукратно (при повторных регистрациях ЭКГ) | Приостановка терапии препаратом Тагриссо до уменьшения длительности интервала QTc ниже 481 мсек или до исходного значения (если исходная длительность интервала QTc была не менее 481 мсек), затем возобновление терапии со сниженной дозы препарата (40 мг) |
| Удлинение интервала QTc с признаками/симптомами серьёзной аритмии | Прекращение терапии препаратом Тагриссо | |
| Другой | Нежелательная реакция 3 степени или выше | Приостановка терапии препаратом Тагриссо на срок до 3 недель |
| При уменьшении степени нежелательной реакции с 3 степени или выше до 0-2 степени после приостановки терапии препаратом Тагриссо на срок до 3 недель | Возможно возобновление терапии препаратом Тагриссо в прежней дозе (80 мг) или в сниженной дозе (40 мг) | |
| Степень нежелательной реакции после приостановки терапии на 3 недели не уменьшилась с 3 или выше до 0-2 степени | Прекращение терапии препаратом Тагриссо |
1 Интенсивность нежелательных явлений указана согласно Общим терминологическим критериям нежелательных явлений (СТСАЕ) Национального института рака (NCI) версии
Особые группы пациентов
Не требуется корректировать дозу препарата в зависимости от возраста, массы тела, пола, этнической принадлежности и статуса курения (смотрите раздел «Фармакокинетика»).
Пациенты с нарушением функции печени
Клинические исследования по изучению фармакокинетики у пациентов с нарушением функции печени не завершены. Пациентам с нарушением функции печени легкой степени тяжести (концентрация общего билирубина не превышает ВГН, активность аспартатаминотрансферазы (ACT) превышает ВГН, или концентрация общего билирубина превышает ВГН, но менее 1,5 ВГН при любом значении активности ACT) коррекция дозы не рекомендуется, но следует с осторожностью применять препарат Тагриссо у таких пациентов. Эффективность и безопасность осимертиниба у пациентов с нарушением функции печени средней и тяжелой степени не изучалась, поэтому применение препарата Тагриссо у таких пациентов противопоказано (см. раздел «Фармакокинетика»).
Пациенты с нарушением функции почек
Клинические исследования по изучению фармакокинетики у пациентов с нарушением функции почек не завершены. Корректировать дозу препарата пациентам с нарушением функции почек легкой и средней степени тяжести не рекомендуется. Данные о применении осимертиниба у пациентов с нарушением функции почек тяжелой степени ограничены. Безопасность и эффективность осимертиниба не были установлены у пациентов с терминальной стадией почечной недостаточности (клиренс креатинина,
рассчитанный по формуле Коккрофта-Гаулта, менее 15 мл/мин) или получающих диализ, поэтому применение препарата Тагриссо у таких пациентов противопоказано (см. раздел «Фармакокинетика»).
Дети
Безопасность и эффективность препарата Тагриссо у детей и подростков в возрасте до 18 лет не установлены. Данные отсутствуют.
Способ применения
Внутрь.
Таблетки следует проглатывать целиком, запивая водой. Не следует делить, дробить или разжевывать таблетки.
Если пациенту сложно проглатывать таблетку, ее можно диспергировать в 50 мл негазированной воды. Другие жидкости использовать нельзя. Таблетку необходимо опустить в воду, не измельчая, помешивать до полного разрушения и тут же выпить полученную суспензию. Остатки смешать с дополнительными 100 мл воды и выпить полученную суспензию. Не следует использовать другие жидкости.
Суспензию препарата Тагриссо также можно вводить через назогастральный зонд. В этом случае суспензию готовят аналогичным способом, но таблетку диспергируют в 15 мл воды, а остатки препарата смешивают еще с 15 мл воды. Полученные 30 мл суспензии препарата необходимо ввести согласно инструкции производителя назогастрального зонда и промыть зонд соответствующим объемом воды. Диспергированный препарат и растворенные остатки следует ввести в течение 30 минут от момента погружения таблеток в воду.
Побочное действие
Обзор профиля безопасности
Информация о профиле безопасности препарата Тагриссо отражает опыт его применения у 690 пациентов HMPЛ с мутацией Т790М, которые ранее получали терапию ингибитором тирозинкиназы EGFR. Все эти пациенты принимали препарат в дозе 80 мг в сутки в рандомизированном исследовании III фазы (вторая линия терапии в исследовании AURA 3) и двух исследованиях, проводимых в одной группе (AURAex и вторая или последующие линии терапии в исследовании AURA 2). Большинство нежелательных реакций были 1 или 2 степени тяжести. Наиболее частыми нежелательными лекарственными реакциями были диарея (44%) и сыпь (41%). Нежелательные явления 3 и 4 степени тяжести в обоих исследованиях составили 26% и 2%, соответственно. 2,3% пациентов, получавших препарат Тагриссо в дозе 80 мг в сутки, потребовалось снижение дозы из-за развития нежелательных лекарственных реакций. У 6,5% пациентов терапия была прекращена из-за развития нежелательных реакций или отклонений в лабораторных показателях.
Список нежелательных реакций в виде таблицы
В Таблице 2 приведена частота нежелательных реакций, которые часто отмечались у пациентов, получивших хотя бы одну дозу препарата Тагриссо в клинических исследованиях AURAex (II фаза), AURA 2 и AURA 3.
Нежелательные лекарственные реакции перечислены по классу систем и органов, и внутри каждого класса распределены по частоте встречаемости, при этом первыми указаны наиболее частые реакции. Внутри каждой группы частоты встречаемости нежелательные лекарственные реакции представлены в порядке убывания серьёзности. Кроме того, соответствующие категории частоты каждой нежелательной лекарственной реакции определяются следующим образом: очень часто (≥1/10); часто (от ≥1/100 до <1/10); нечасто (от ≥1/1000 до <1/100); редко (от ≥1/10000 до <1/1000); очень редко (<1/10000); неизвестно (невозможно оценить по имеющимся данным).
Таблица 2. Нежелательные лекарственные реакции, отмеченные в исследованиях AURA1
| Классы систем и органов | Нежелательные лекарственные реакции | Суммарная частота нежелательных лекарственных реакций всех степеней СТСАЕ2 | Частота нежелательных лекарственных реакций 3-4 степени но СТСАЕ |
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | Интерстициальная болезнь легких3 | Часто (3,2%)4 | 1,3% |
| Нарушения со стороны желудочно-кишечного тракта | Диарея | Очень часто (44%) | 1% |
| Стоматит | Очень часто (15%) | 0% | |
| Нарушения со стороны органа зрения | Кератит5 | Нечасто (0,9%) | 0% |
| Нарушения со стороны кожи и подкожной клетчатки | Сыпь6 | Очень часто (41%) | 0,7% |
| Сухость кожи7 | Очень часто (29%) | 0% | |
| Паронихия8 | Очень часто (27%) | 0% | |
| Зуд9 | Очень часто (15%) | 0% | |
| Изменения параметров лабораторных и инструментальных исследований (результаты исследований, представленные как изменение степени по СТСАЕ) | Удлинение интервала QTc10 | Нечасто (0,7%) | |
| Снижение количества тромбоцитов11 | Очень часто (54%) | 2,1% | |
| Снижение количества лейкоцитов11 | Очень часто (66%) | 2,4% | |
| Снижение количества нейтрофилов11 | Очень часто (32%) | 4,3% |
1 Данные получены в исследованиях III фазы (AURA 3) и II фазы (AURAex и AURA 2); приведены сведения о явлениях, возникших у пациентов, получивших, как минимум, одну дозу препарата Тагриссо.
2 Общие терминологические критерии нежелательных явлений Национального института рака, версия 4.0.
3Включает случаи, отмеченные внутри групповых терминов: интерстициальная болезнь легких и пневмонит.
4Зарегистрировано 4 явления 5 степени СТСАЕ (летальные).
5Включает случаи, отмеченные внутри групповых терминов: кератит, точечный кератит, эрозия роговицы, эпителиальный дефект роговицы, дефект роговицы.
6Включает случаи, отмеченные внутри группового термина сыпь: сыпь, генерализованная сыпь, эритематозная сыпь, макулёзная сыпь, макуло-папулёзная сыпь, папулёзная сыпь, пустулёзная сыпь, эритема, фолликулит, акне, дерматит и акнеиформный дерматит.
7Включает случаи, отмеченные внутри групповых терминов: сухость кожи, трещины на коже, ксеродермия, экзема.
8Включает случаи, отмеченные внутри групповых терминов: заболевание ногтевого ложа, воспаление ногтевого ложа, болезненность ногтевого ложа, изменение цвета ногтей, заболевание ногтей, дистрофия ногтей, инфекция ногтей, бугристость ногтей, онихоклазия. онихолизис, онихомадезис, паронихия.
9Включает случаи, отмеченные внутри групповых терминов: зуд, генерализованный зуд, зуд век.
10Частота удлинения интервала QTcF > 500 мсек.
11Отражает частоту лабораторных отклонений, а не частоту отмеченных нежелательных явлений.
Таблица 3. Нежелательные лекарственные реакции, отмеченные в исследовании AURA 31
| Классы систем и органов | Тагриссо общая частота (N=279) | Химиотерапия (пеметрексед/цисплатин или пеметрексед/карбоплатин) общая частота (N=136) | ||
| Степень по NCI | Любая степень (%) | Степень 3 и выше (%) | Любая степень (%) | Степень 3 и выше (%) |
| Нежелательные лекарственные реакции | ||||
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | ||||
| Интерстициальная болезнь легких2,3 | 3,6 | 0,4 | 0,7 | 0,7 |
| Нарушения со стороны органа зрения | ||||
| Кератит4 | 1,1 | 0 | 0,7 | 0 |
| Нарушения со стороны желудочно-кишечного тракта | ||||
| Диарея | 41 | 1,1 | 11 | 1,5 |
| Стоматит | 15 | 0 | 15 | 1,5 |
| Нарушения со стороны кожи и подкожной клетчатки | ||||
| Сыпь5 | 34 | 0,7 | 5,9 | 0 |
| Сухость кожи6 | 23 | 0 | 4,4 | 0 |
| Паронихия7 | 22 | 0 | 1,5 | 0 |
| Зуд8 | 13 | 0 | 5,1 | 0 |
| Изменения параметров лабораторных и инструментальных исследований | ||||
| Удлинение интервала QTc 9 | 1,4 | 0 | 0,7 | 0 |
| Результаты исследований, представленные как изменение степени по СТСАЕ | ||||
| Снижение количества тромбоцитов10 | 46 | 0,7 | 48 | 7,4 |
| Снижение количества лейкоцитов10 | 61 | 1,1 | 75 | 5,3 |
| Снижение количества нейтрофилов10 | 27 | 2,2 | 49 | 12 |
1Данные получены в исследовании AURA 3 у пациентов, получивших хотя бы одну дозу препарата Тагриссо.
2Включает случаи, отмеченные внутри групповых терминов: интерстициальная болезнь легких и пневмонит.
3Зарегистрировано 1 явление 5 степени СТСАЕ (летальное).
4Включает случаи, отмеченные внутри групповых терминов: кератит, точечный кератит, эрозия роговицы, эпителиальный дефект роговицы, дефект роговицы.
5Включает случаи, отмеченные внутри группового термина сыпь: сыпь, генерализованная сыпь, эритематозная сыпь, макулёзная сыпь, макуло-папулёзная сыпь, папулёзная сыпь, пустулёзная сыпь, эритема, фолликулит, акне, дерматит и акнеиформный дерматит.
6Включает случаи, отмеченные внутри групповых терминов: сухость кожи, трещины на коже, ксеродермия, экзема.
7Включает случаи, отмеченные внутри групповых терминов: заболевания ногтей, заболевания ногтевого ложа, воспаление ногтевого ложа, болезненность ногтевого ложа, изменение цвета ногтей, заболевание ногтей, дистрофия ногтей, инфекция ногтей, бугристость ногтей, онихоклазия, онихолизис, онихомадезис, паронихия.
8Включает случаи, отмеченные внутри групповых терминов: зуд, генерализованный зуд,зуд век.
9Частота удлинения интервала QTcF > 500 мсек.
10Отражает частоту лабораторных отклонений, а не частоту отмеченных нежелательных явлений.
Профиль безопасности в исследованиях II фазы AURAex и AURA 2, в целом, соответствовал профилю безопасности у пациентов, получавших препарат Тагриссо в исследовании AURA 3. Новых или неожиданных проявлений токсичности отмечено не было, и побочные эффекты были сбалансированы по типу, тяжести и частоте.
Описание некоторых нежелательных реакций
Интерстициалъная болезнь легких
В исследованиях AURA частота интерстициальной болезни легких составила 8,2% у японских пациентов, 1,9% у других азиатских пациентов и 2,9% у неазиатских пациентов. Медиана времени до начала развития интерстициальной болезни легких и сходных нежелательных реакций составила 2,8 месяцев (см. раздел «Особые указания»).
Удлинение интервала QTc
Из 833 пациентов, получавших препарат Тагриссо 80 мг в исследованиях AURA, у 6 (0,7%) было отмечено значение интервала QTc более 500 мсек, а у 24 пациентов (2,9%) значение интервала QTc увеличилось более чем на 60 мсек от исходного значения. По данным фармакокинетического анализа, предполагается увеличение интервала QTc при увеличении концентрации препарата. Нарушений сердечного ритма, связанных с удлинением интервала QTc, в исследованиях AURA не отмечено (см. разделы «Фармакодинамика» и «Особые указания»).
Нежелательные явления со стороны желудочно-кишечного тракта
В исследованиях AURA диарея была отмечена у 43,5% пациентов, из которых у 36,8% была отмечена токсичность 1 степени, у 5.5% — 2 степени, у 1.0% — 3 степени. Проявлений токсичности 4 или 5 степени отмечено не было. Снижение дозы потребовалось 0,3% пациентов, временное прекращение приема препарата — 0,7% пациентов. В одном случае (0,1%) терапия была отменена. В исследовании AURA 3 медиана времени до начала нежелательного явления составила 22 дня. а средняя продолжительность для явления 2 степени — 5,5 дней.
Пациенты пожилого возраста
В исследовании AURA 3 (N=279), 41% пациентов были в возрасте 65 лет и старше; из них 15% были в возрасте 75 лет и старше. У пациентов в возрасте 65 лет и старше, по сравнению с пациентами в возрасте до 65 лет, чаще наблюдались нежелательные реакции, приводившие к изменению режима дозирования (приостановка терапии или отмена препарата) (5,3% и 4,2%. соответственно). Типы нежелательных реакций в зависимости от возраста не отличались. У пациентов более пожилого возраста чаще отмечались реакции 3 степени и выше, по сравнению с пациентами более молодого возраста (5,3% по сравнению с 2,4%). Эффективность терапии в этой группе пациентов не отличалась от таковой у более молодых пациентов. В исследованиях II фазы AURA были получены согласующиеся данные по эффективности и безопасности.
Передозировка
В клинических исследованиях I/II фазы ограниченное количество пациентов получали препарат в суточных дозах до 240 мг, при этом не было выявлено дозолимитирующей токсичности. У пациентов, получавших в этих исследованиях препарат Тагриссо в суточных дозах 160 мг и 240 мг, наблюдалось повышение частоты и тяжести некоторых типичных для ингибиторов тирозинкиназы EGFR нежелательных явлений (в основном, диареи и кожной сыпи), по сравнению с дозой 80 мг. Информация о случайных передозировках препарата у пациентов ограничена. Все случаи представляли собой отдельные эпизоды приема по ошибке пациентами дополнительной суточной дозы препарата Тагриссо без клинических последствий.
Специфическое лечение передозировки препарата Тагриссо отсутствует. При подозрении на передозировку прием препарата Тагриссо следует приостановить и начать симптоматическую терапию.
Взаимодействие с другими лекарственными средствами
Фармакокинетические взаимодействия
Мощные индукторы изофермента CYP3A4 могут уменьшить экспозицию осимертиниба. Осимертиниб может повысить экспозицию субстратов белка резистентности рака молочной железы (BCRP).
Активные вещества, которые могут повысить концентрацию осимертиниба в плазме
Исследования in vitro показали, что I фаза метаболизма осимертиниба протекает, в основном, с помощью изоферментов CYP3A4 и CYP3A5. В клиническом фармакокинетическом исследовании у пациентов, одновременно принимавших осимертиниб и итраконазол 200 мг два раза в сутки (мощный ингибитор CYP3A4), не отмечено клинически значимого влияния на экспозицию осимертиниба (площадь под кривой зависимости концентрации от времени (AUC) увеличилась на 24%, а Сmах понизилась на 20%). Поэтому ингибиторы CYP3A4, вероятно, не оказывают влияния на экспозицию осимертиниба. Дополнительные катализирующие ферменты не идентифицированы.
Активные вещества. которые могут понизить концентрацию осимертиниба в плазме
В клиническом фармакокинетическом исследовании значение AUC осимертиниба в равновесном состоянии понижалось на 78% у пациентов при одновременном применении с рифампицином (600 мг в сутки в течение 21 суток). Подобным образом, экспозиция метаболита AZ5104 уменьшалась на 82% (AUC) и 78% (Сшах). Совместное применение мощных индукторов CYP3A (например, фенитоин, рифампицин и карбамазепин) с препаратом Тагриссо противопоказно.
Умеренные индукторы CYP3A4 (например, бозетан, эфавиренз, этравирин, модафинил) могут также снижать экспозицию осимертиниба, поэтому, следует с осторожностью применять их одновременно с осимертинибом, и, по возможности, избегать такой комбинации препаратов. Клинические данные, позволяющие рекомендовать коррекцию дозы препарата Тагриссо, отсутствуют. Прием препаратов зверобоя продырявленного на фоне терапии препаратом Тагриссо противопоказан (см. раздел «Противопоказания»).
Влияние препаратов, снижающих кислотность желудочного сока, на осимертиниб
В клиническом фармакокинетическом исследовании совместное применение омепразола не приводило к клинически значимым изменениям экспозиции осимертиниба. Препараты, изменяющие рН желудка, можно применять одновременно с препаратом Тагриссо без ограничений.
Активные вещества, на концентрацию в плазме которых может влиять препарат Тагриссо
По данным исследований in vitro осимертиниб является конкурентным ингибитором BCRP транспортеров.
В клиническом фармакокинетическом исследовании совместное применение препарата Тагриссо с розувастатином (чувствительным субстратом BCRP) повышало AUC и Cmax розувастатина на 35% и 72%, соответственно. Необходимо тщательное наблюдение за пациентами, принимающими препараты, распределение которых зависит от BCRP, с узким терапевтическим индексом, на фоне терапии препаратом Тагриссо для исключения симптомов нарушения переносимости данных медикаментов в результате их возросшей экспозиции (см. раздел «Фармакокинетические свойства»).
В клиническом фармакокинетическом исследовании одновременное применение препарата Тагриссо с симвастатином (чувствительным субстратом CYP3A4) понижало AUC и Сmах симвастатина на 9% и 23%, соответственно. Эти изменения достаточно малы и, вероятно, не имеют клинического значения. Маловероятно возникновение фармакокинетических взаимодействий с субстратами изофермента CYP3A4. Не изучались взаимодействия с ферментами, регулируемыми PXR, кроме CYP3A4. Нельзя исключать риск снижения экспозиции гормональных контрацептивов при одновременном применении с препаратом Тагриссо.
Особые указания
Определение статуса мутации T790M в гене EGFR
При рассмотрении вопроса о назначении препарата Тагриссо в качестве терапии местно- распространенного или метастатического HMPЛ, важно определить статус мутации Т790М в гене EGFR. Статус мутации Т790М необходимо определять в опухолевой ДНК, полученной из образца ткани опухоли, или в циркулирующей опухолевой ДНК, полученной из образца плазмы крови, с помощью валидированного теста. Следует использовать только надежные, обоснованные и чувствительные методы исследования с подтвержденной диагностической значимостью в определении статуса мутации Т790М в ДНК опухоли (выделенной из образца ткани опухоли или плазмы крови). Выявление у пациента мутации Т790М в ткани опухоли или плазме крови свидетельствует о наличии показания для применения препарата Тагриссо. В случае отрицательного результата тестирования плазмы крови рекомендуется определение мутации в ткани опухоли для исключения возможного ложноотрицательного результата при анализе циркулирующей опухолевой ДНК.
Интерстициальная болезнь легких
При применении препарата Тагриссо в клинических исследованиях регистрировались тяжелые, жизнеугрожающие и летальные случаи интерстициальной болезни легких или сходных нежелательных реакций (например, пневмонит). В большинстве случаев при прекращении терапии состояние пациента улучшалось, или данная нежелательная реакция разрешалась. В клинические исследования не включались пациенты с интерстициальной болезнью легких в анамнезе, интерстициальной болезнью легких, вызванной приемом лекарственных препаратов, лучевым пневмонитом, требующим назначения глюкокортикостероидов. а также с любыми клиническими симптомами интерстициального заболевания легких (см. раздел «Побочное действие»).
Интерстициальная болезнь легких или сходные нежелательные реакции (например, пневмонит) отмечены у 3,5% пациентов и привели к летальному исходу у 0,6% из 833 пациентов, получавших препарат Тагриссо в клинических исследованиях AURA. Частота интерстициальной болезни легких составила 8,2% у японцев, 1,9% у других пациентов азиатской популяции и 2,9% у пациентов неазиатского происхождения (см. раздел «Побочное действие»).
Следует внимательно оценивать всех пациентов с острым развитием и/или необъяснимым ухудшением легочных симптомов (одышка, кашель, повышение температуры тела), чтобы исключить интерстициальную болезнь легких. Терапию препаратом Тагриссо следует приостановить на период обследования для уточнения этих симптомов. Если диагностирована интерстициальная болезнь легких, необходимо отменить терапию препаратом Тагриссо и начать соответствующее лечение.
Удлинение интервала QTc
При приеме препарата Тагриссо наблюдается удлинение интервала QTc. Удлинение интервала QTc может повысить риск развития желудочковых тахиаритмий (например, желудочковая тахикардия типа «пируэт») или наступления внезапной смерти. В исследованиях AURAex или AURA 2 не зарегистрировано нежелательных явлений, связанных с нарушением ритма сердца (см. раздел «Побочное действие»). Пациенты с клинически значимыми нарушениями ритма и проводимости при регистрации ЭКГ в покое (например, значение интервала QTc более 470 мсек), были исключены из этих исследований (см. раздел «Побочное действие»).
По возможности, следует избегать применения осимертиниба у пациентов с врожденным синдромом удлиненного интервала QT. Пациентам с хронической сердечной недостаточностью, нарушениями электролитного состава и пациентам, принимающим препараты, удлиняющие интервал QTc, следует периодически выполнять ЭКГ и определять концентрацию электролитов. Терапию необходимо приостановить у пациентов со значениями интервала QTc выше 500 мсек, выявленными хотя бы двукратно при повторных регистрациях ЭКГ, до уменьшения длительности интервала QTc менее 481 мсек или до исходного значения (если исходная длительность интервала QTc была не менее 481 мсек), а затем возобновить терапию с уменьшенной дозы препарата (см. Таблицу 1). Если на фоне удлинения интервала QT развивается желудочковая тахикардия по типу «пируэт», полиморфная желудочковая тахикардия или признаки/симптомы тяжелого нарушения ритма сердца, терапию осимертинибом следует отменить.
Нарушения сократимости сердца
Снижение фракции выброса левого желудочка (ФВЛЖ) не менее чем на 10% и до уровня менее 50% было отмечено у 4,0% пациентов (26/655), получавших препарат Тагриссо в клинических исследованиях, у которых ФВЛЖ оценивалась до начала терапии и, по крайней мере, однократно во время терапии. Доступные данные клинических исследований не позволяют сделать вывод о причинно-следственной связи снижения сократимости сердца с приемом препарата Тагриссо. Пациентам с факторами риска заболеваний сердца и сопуствующими состояниями, которые могут повлиять на ФВЛЖ. а также пациентам, у которых во время лечения возникают значимые кардиологические симптомы, следует контролировать функцию сердечно-сосудистой системы, в том числе, ФВЛЖ до начала лечения и на фоне терапии.
Кератит
Кератит был отмечен у 0,7% (n=6) из 833 пациентов, получавших препарат Тагриссо в исследованиях AURA. При появлении возможных симптомов кератита, таких как острое развитие или усиление воспаления глаз, слезотечения, светочувствительности, нечеткости зрения, боли в глазах и/или покраснения глаз необходимо срочно обратиться к офтальмологу (см. раздел «Способ применения и дозы». Таблица 1).
Влияние на способность к управлению транспортными средствами и механизмами
Препарат Тагриссо не оказывает влияния на способность к управлению транспортными средствами и механизмами.
Форма выпуска
Таблетки, покрытые плёночной оболочкой, 40 мг, 80 мг.
Для таблеток 40 мг: по 10 таблеток в перфорированном алюминиевом блистере. 3 блистера с инструкцией по медицинскому применению в картонной пачке с контролем первого вскрытия.
Для таблеток 80 мг: по 10 таблеток в перфорированном алюминиевом блистере. 1 или 3 блистера с инструкцией но медицинскому применению в картонной пачке с контролем первого вскрытия.
Хранение
При температуре не выше 25 °С.
Хранить в недоступном для детей месте.
Срок годности
2 года. Не применять по истечении срока годности.
Условия отпуска
По рецепту.
Наименование и юридический адрес держателя (владельца) регистрационного удостоверения
АстраЗенека АБ, SE-151 85 Содерталье. Швеция
AstraZeneca АВ, SE-151 85 Sodertalje, Sweden
Производитель
АстраЗенека АБ, ПЭТ Мультиперпес, Гартунаваген, Содерталье, 15185, Швеция
AstraZeneca АВ, PET Multipurpose, Gartunavagen, Sodertalje, 15185, Sweden
Фасовщик (первичная упаковка), упаковщик (вторичная (потребительская) упаковка), выпускающий контроль качества
АстраЗенека АБ, ПЭТ Пэкиджинг, Гартунаваген, Содерталье, 15185, Швеция
AstraZeneca АВ, PET Packaging, Gartunavagen, Sodertalje, 15185, Sweden
Наименование, адрес организации, уполномоченной держателем или владельцем регистрационного удостоверения лекарственного препарата для медицинского применения на принятие претензий от потребителя:
Представительство АстраЗенека ЮК Лимитед, Великобритания, в г. Москве и ООО АстраЗенека Фармасьютикалз 125284 Москва, ул. Беговая д. 3, стр. 1
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)