Дата публикации 1 июля 2020Обновлено 30 июня 2021
Определение болезни. Причины заболевания
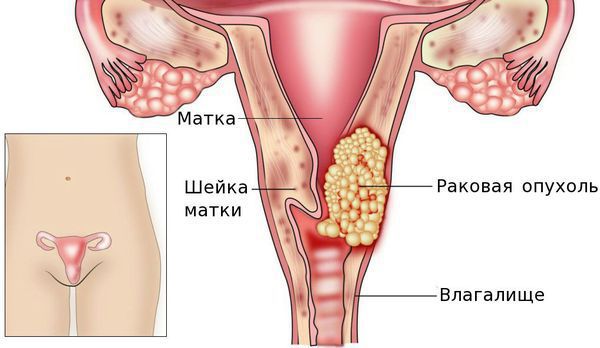
Рак шейки матки — это онкологическое заболевание, которое поражает слизистую оболочку шейки матки.
Заболевание чаще всего протекает без симптомов. Они появляются только при развитии осложнений.
В этих случаях к признакам рака шейки матки относятся: кровянистые выделения из половых путей, хронические боли малого таза и поясницы, нарушение менструального цикла, мочеиспускания и дефекации.
Распространённость рака шейки матки
Согласно статистике, рак шейки матки по распространённости занимает пятое место в популяции и четвёртое место — среди женщин. Ежегодно выявляется около 600 000 новых случаев и регистрируется около 300 000 смертей от рака шейки матки [9]. В России ежегодно выявляется около 20 000 случаев, смертность от заболевания в возрасте от 15 до 39 лет составляет 21,1 % [1].
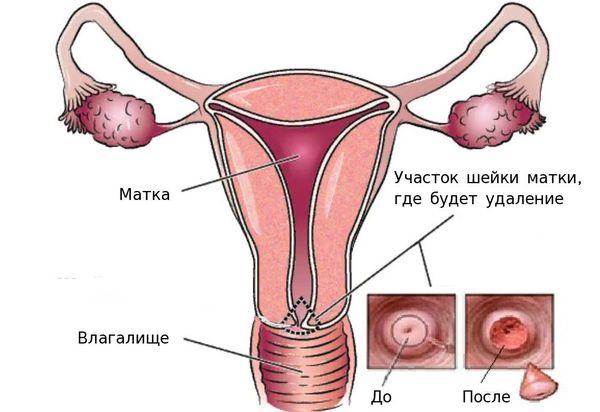
Анатомия матки:
Факторы риска
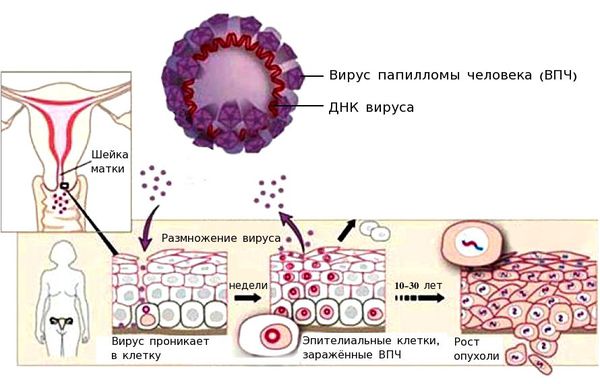
Возникновение рака шейки матки носит спорадический характер. Это значит, что данная патология не имеет наследственной природы, а возникает под влиянием факторов внешней среды. Основной причиной развития рака шейки матки является вирус папилломы человека.
В большинстве случаев выявляют ВПЧ 16 и 18 типа. Инфицированность ВПЧ в популяции, по данным различных исследований, составляет от 80 до 95 % [8]. Важно понимать, что решающее значение имеет не факт выявления папилломавирусной инфекции, а длительность её нахождения в организме.
Онкологическому заболеванию предшествует возникновение предраковых заболеваний, называемых интраэпителиальной неоплазией или дисплазией шейки матки. Это предраковое заболевание, которое без лечения часто переходит в рак. Развитие онкопатологии от стадии дисплазии до рака занимает 7–10 лет. В течение этого периода заболевание клинически никак себя не проявляет
Дисплазия шейки матки успешно диагностируется. Лечение чаще всего несложное, органосохраняющее, не нарушающее репродуктивную функцию и в большинстве случаев гарантирующее полное выздоровление. Поэтому возникновение рака является апофеозом упущенных возможностей, что делает отсутствие своевременного скрининга дисплазии и рака шейки матки актуальной проблемой для современной медицины и общества.
К факторам риска развития рака шейки матки относят:
- раннее начало половой жизни;
- частую смену половых партнеров;
- отказ от барьерного метода контрацепции;
- использование оральных контрацептивов;
- курение;
- наличие инфекций, передающихся половым путем;
- приём иммуносупрессивной терапии при аутоиммунных заболеваниях и лечении онкологических заболеваний других локализаций [2].
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы рака шейки матки
Заболевание чаще всего протекает без симптомов. Клиническая картина проявляется только в случае возникновения осложнений, которые выражаются следующими симптомами:
- кровянистые выделения из половых путей после полового контакта или гинекологического осмотра;
- кровянистые выделения из половых путей в период постменопаузы;
- межменструальные кровянистые выделения из половых путей;
- изменение характера менструальных выделений;
- обильные кровотечения, которые сложно остановить;
- выделения из половых путей с гнилостным запахом;
- хронические боли малого таза и поясницы;
- нарушение мочеиспускания и дефекации;
- отёки ног [1][2].
Патогенез рака шейки матки
Вирус папилломы человека проникает внутрь эпителиальной клетки, встраивается в её геном и начинает использовать её ресурсы для того, чтобы синтезировать свои белки и размножаться. При этом ВПЧ может повредить участки генов, которые отвечают за апоптоз (запрограммированную гибель клетки). При длительном пребывании вируса в организме риск повреждения участков генов и возникновения мутаций растёт. Мутации могут приводить к бесконтрольному делению клетки.
Раковым клеткам свойственен инвазивный рост, способность проникать в лимфатические и кровеносные сосуды и метастазировать — образовывать вторичные очаги опухолевого роста в других тканях.
Классификация и стадии развития рака шейки матки
Гистологически (по структуре тканей) выделяют следующие типы рака шейки матки:
- плоскоклетоный рак, возникающий из клеток эпителия цервикального канала и экзоцервикса (внешней части шейки матки, которая доступна для осмотра в зеркалах), доля его составляет около 70-80 % от всех случаев;
- аденокарцинома или железистый рак, возникающий из эпителия желёз шейки матки, составляет около 10-20 % от всех случаев;
- низкодифференцированный рак — 10 % всех случаев;
- другие гистологические типы злокачественных опухолей — менее 1 % (стекловидноклеточный рак, нейроэндокринные опухоли, аденобазальный рак и др.) [1][2][3].
Как и для любого другого злокачественного заболевания, для рака шейки матки разработана классификация TMN — международная классификация стадий злокачественных новообразований. С её помощью определяют распространённость опухолевого процесса.
Выделяют клиническую стадию и патоморфологическую. Клиническую стадию выставляют до начала лечения на основании данных осмотра, пальпации, кольпоскопии, биопсии шейки матки, выскабливания цервикального канала, урографии, цистоскопии, ректороманоскопии, компьютерной томографии грудной клетки, данных УЗИ, КТ и МРТ малого таза. От клинического стадирования зависит тактика лечения.
Патоморфологическое стадирование проводят после оперативного вмешательства на основании гистологического исследования, оно является наиболее точным и определяет дальнейшую тактику лечения и прогноз заболевания.
Также в клинической практике для определения стадии онкологического процесса используется классификация FIGO. Ниже представлена классификация по стадиям развития рака шейки матки (по FIGO, 2009 г.) и по распространённости опухолевого процесса (TMN, 2010 г.):
- Тх — недостаточно данных для оценки распространённости опухоли.
- Tis — рак на месте, это значит, что опухолевый процесс не проник через базальную мембрану, многие специалисты приравнивают к данной стадии дисплазию шейки матки тяжёлой степени (CIN III). По FIGO стадия 0.
- Т1 — распространение опухолевого процесса в пределах шейки матки. Стадия по FIGO 1.
- Т1а — инвазивная опухоль, не визуализируется, определяется только при гистологическом исследовании. Стадия по FIGO 1а.
- Т1а1 — инвазия в строму шейки не превышает 3 мм в глубину, горизонтальное распространение не более 7 мм. Стадия по FIGO 1а1.
- Т1а2 — инвазия в строму шейки от 3 до 5 мм, горизонтальное распространение не более 7 мм. Стадия по FIGO 1а2.
- T1b — клинически определяемое поражение большего размера, чем Т1а и Т1а2, то есть глубина инвазии более 5 мм или горизонтальное распространение более 7 мм. Стадия по FIGO 1b.
- T1b1 — опухоль менее 4 см. Стадия по FIGO 1b1.
- T1b2 — опухоль более 4 см. Стадия по FIGO 1b1.
- Т2 — распространение опухоли за пределы шейки матки, но без вовлечения параметрия (клетчатки, окружающей матку ). Стадия по FIGO 2.
- T2a — опухоль менее 4 см. Стадия по FIGO 2a.
- T2b — опухоль более 4 см. Стадия по FIGO 2b.
- Т3 — распространённость опухолевого процесса за пределы шейки матки с вовлечением стенок малого таза и нижней трети влагалища, а также случаи, сопровождаемые гидронефрозом (расширением почечных лоханок и чашечек, приводящих к нарушению функции почек). Стадия по FIGO 3.
- Т3а — опухоль, поражающая нижнюю треть влагалища. Стадия по FIGO 3a.
- T3b — опухоль, которая поражает стенку таза и/или приводит к гидронефрозу и нефункционирующей почке. Стадия по FIGO 3b.
- Т4 — опухоль, прорастающая в мочевой пузырь и прямую кишку. Стадия по FIGO 4а.
- MX — данных для оценки наличия отдалённых метастазов недостаточно.
- M1 — наличие отдалённых метастазов. Стадия по FIGO 4b.
- NX — данных для оценки распространённости опухолевого процесса в лимфатической системе недостаточно.
- N0 — нет признаков вовлечения регионарных лимфатических узлов (группа лимфоузлов, к которым идут лимфатические сосуды от поражённых органов).
- N1 — метастазы в регионарных лимфатических узлах [1][2].
Осложнения рака шейки матки
Осложнениями рака шейки матки являются:
- болевой синдром;
- синдром сдавления органов малого таза;
- кровотечения.
Болевой синдром появляется на поздних стадиях болезни, когда опухоль прорастает в тазовые нервные сплетения, тазовую брюшину и сдавливает соседние органы. Как правило, боли характеризуются как постоянные, ноющие и зачастую плохо поддающиеся терапии.
Синдром сдавления органов малого таза заключается в нарушении работы мочевыводящей системы и прямой кишки. Опухоль может приводить к ухудшению проходимости мочеточников, что приводит к гидронефрозу и нарушению функций почек. При сдавлении мочевого пузыря возникают боли внизу живота при мочеиспускании и учащаются позывы к мочеиспусканию. Нарушение функции прямой кишки проявляется болью при дефекации, изменениями формы стула и запорами. Сдавление вен и лимфатических сосудов может приводить к отёкам нижних конечностей.
Кровянистые выделения из половых путей могут появиться и на ранних стадиях. На поздних стадиях кровотечения становятся обильными, сложно купируются и часто становятся причиной смерти больных с раком шейки матки.
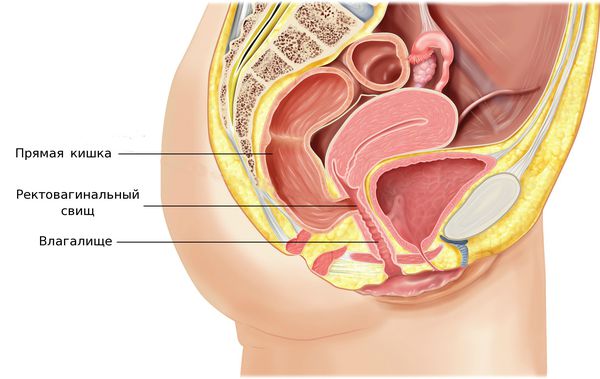
На поздних стадиях возможно формирование свищей между влагалищем и мочевым пузырем или влагалищем и прямой кишкой, которые проявляются в виде выделения мочи или каловых масс из половых путей [1][2][6].
Диагностика рака шейки матки
К какому врачу обратиться
Если появились симптомы, характерные для рака шейки матки, то нужно немедленно обратиться к гинекологу.
Диагноз «Рак шейки матки» ставят только на основании гистологического исследования ткани. Как правило, этому предшествуют:
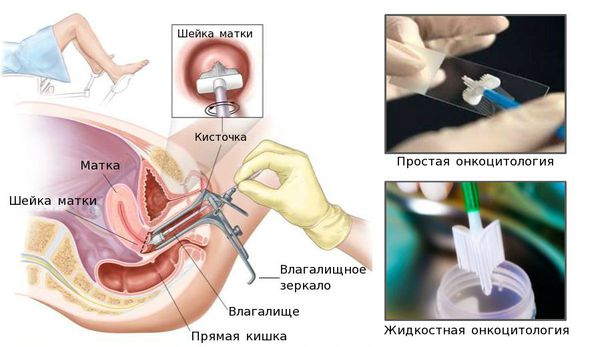
- взятие мазка на простую или жидкостную онкоцитологию (ПАП-тест, тест Папаниколау);
- анализ на вирус папилломы человека, проводимый методом ПЦР;
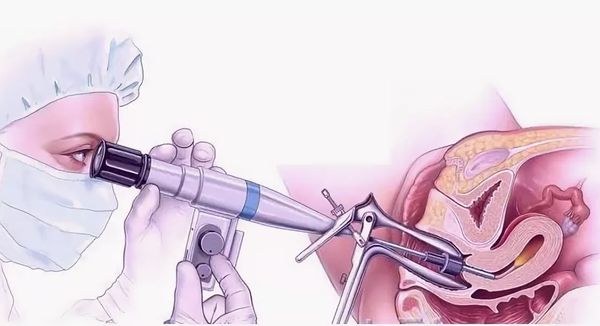
- гинекологический осмотр с кольпоскопией, или расширенная кольпоскопия (обычная «кольпоскопия» означает просто осмотр влагалища и шейки матки, а окраска йодом и уксусом — это уже расширенная кольпоскопия, сейчас под термином «кольпоскопия» всегда подразумевают «расширенную кольпоскопию»);
- биопсия шейки матки и/или выскабливание цервикального канала.
Скрининг
В России под скринингом рака шейки матки понимается мазок на онкоцитологию (тест Папаниколау, ПАП-тест). В возрасте от 21 до 65 лет его нужно делать раз в 3 года. Исследование выявляет дисплазию шейки матки — предраковое состояние, которое хорошо лечится.
Далее для определения стадии рака шейки матки, оценки распространённости опухоли и выбора оптимальной тактики лечения проводятся:
- УЗИ органов малого таза, брюшной полости, забрюшинного пространства;
- рентгенограмма органов грудной клетки;
- определение уровня онкомаркера SCC в сыворотке крови (при плоскоклеточном раке);
- МРТ малого таза с внутривенным контрастированием;
- КТ малого таза, брюшной полости, забрюшинного пространства.
В качестве дополнительных методов исследования используются:
- гистероскопия — эндоскопическое исследование полости матки и цервикального канала;
- цистоскопия — эндоскопическое исследование мочевого пузыря и уретры, рекомендовано выполнять при наличии жалоб, а также при распространении опухоли на переднюю стенку влагалища и при опухоли более 4 см;
- ректороманоскопия — эндоскопическое исследование прямой и сигмовидной кишки, проводят при наличии жалоб, при распространении опухоли на заднюю стенку влагалища, при опухоли более 4 см;
- экскреторная урография — рентгенологическое исследование, при котором контрастируются мочевыводящие пути (лоханки почек, мочеточники, мочевой пузырь, уретра);
- сцинтиграфия костей — рентгенологический метод, направленный на выявление метастазов в костях, выполняется при наличии жалоб;
- лапароскопия с лимфаденэктомией — оперативное вмешательство, направленное на взятие эксцизинной биопсии (орган удаляется целиком) лимфатических узлов для определения метастазов;
- ПЭТ-КТ — рентгенологическое исследование, направленное на выявление отдалённых метастазов и поражения лимфатических узлов, чаще используется для оценки эффективности терапии;
- МРТ головного мозга для определения метастазов в головном мозге, выполняется при наличии жалоб [1][2][6].
Лечение рака шейки матки
Объём лечебных мероприятий зависит от степени распространённости опухоли и стадии заболевания.
Хирургическое лечение
Гарантировать полное излечение может только хирургический метод. Когда радикальное лечение невозможно, применяют лучевую и химиотерапию.
Возможные виды хирургического вмешательства:
- конизация шейки матки — удаление части шейки матки в виде конуса, основание которого приходится на наружный зев, в пределах здоровой ткани;
- операция I типа — удаление матки с шейкой;
- операция II типа — удаление матки с шейкой, частью связок и региональных лимфатических узлов;
- операция III типа — удаление матки с шейкой, связками матки, лимфатическими узлами и верхней третью влагалища;
- трахелэктомия — удаление шейки матки с клетчаткой, верхней третью влагалища, регионарными лимфатическими узлами с наложением анастомоза (сообщения) между телом матки и влагалищем; целью такого рода вмешательства является попытка сохранить способность женщины к вынашиванию плода.
Лучевая терапия
Опухолевые клетки уничтожают с помощью высокоэнергетических рентгеновских лучей.
В зависимости от стадии рака лучевая терапия используется в двух направлениях:
- Как часть основного лечения. Для некоторых стадий лучевая терапия назначается как самостоятельный метод или как дополнение к хирургическому лечению. В большинстве случаев лучевая и химиотерапия проводятся вместе. Такой метод называется химиолучевым лечением и является предпочтительным, так как химиопрепараты усиливают действие облучения.
- Для лечения рака шейки матки на поздних стадиях (с метастазами) или при рецидиве опухоли.
Чаще всего применяют:
- Дистанционную лучевую терапию (ДЛТ, наружное облучение) — основной метод лечения рака шейки матки у пациенток, которые не перенесут химиолучевую терапию и операцию или отказались от неё. Лучевой аппарат не контактируют с телом, процедура безболезненна. Один сеанс длится всего несколько минут, однако подготовка занимает больше времени. Количество сеансов определяет врач-радиолог в зависимости от стадии заболевания, гистологического типа опухоли, а также факторов риска. Химиолучевая терапия наиболее часто выполняется с Цисплатином. Она занимает около пяти недель и проводится пять дней в неделю. Химиотерапия назначается одновременно с лучевой терапией, её частота зависит от конкретного препарата, например Цисплатин вводят один раз в неделю.
- Брахитерапия (внтуреннее облучение с влагалищным аппликатором). Радиоактивный элемент находится в специальном тубусе, который устанавливают во влагалище. Брахитерапия занимает существенно меньше времени, чем дистанционная лучевая терапия.
Осложнения лучевой терапии
При облучении органов малого таза лучевая терапия неизбежно воздействует на мочевой пузырь, прямую кишку, влагалище, яичники, меняя структуру здоровых тканей.
Наиболее часто возникают следующие осложнения:
- Лучевой цистит — сопровождается учащённым, иногда болезненным мочеиспусканием.
- Лучевой ректит — проявляется учащённым, жидким или кашицеобразным стулом, иногда с примесью крови.
- Нарушение менструального цикла — почти неизбежно возникает после нескольких сеансов облучения из-за необратимой гибели яичников.
- Боль и зуд в промежностии/или влагалище — появляется из-за истончения слизистой и кожи при лучевом воздействии. Эти осложнения затрудняют половую жизнь.
- Стеноз влагалища или прямой кишки — возникает из-за хронического воспаления (без профилактических мер) и дистрофических изменений при лечении. Может потребоваться хирургическое вмешательство.
Курение повышает риск побочных эффектов лучевой терапии и снижает её эффективность.
Химиотерапия при раке шейки матки
При химиотерапии препараты вводятся внутривенно или принимаются в таблетках. Не все пациентки со злокачественными опухолями шейки матки нуждаются в химиотерапии.
Она может быть рекомендована:
- как часть основного лечения (см. выше);
- как самостоятельный метод при рецидиве.
Основные лекарства: Цисплатин, Карбоплатин, Паклитаксел (Таксол), Топотекан — могут использоваться самостоятельно или в комбинации. Бевацизумаб (Авастин) — таргетный препарат, часто эффективно дополняет химиотерапию.
Лечение проводят циклами, которые сменяются периодами восстановления. Промежуток между капельницами обычно составляет 21 день [11].
Фотодинамическая терапия (ФДТ)
Эффективность ФДТ при лечении дисплазии и рака шейки матки — спорный вопрос, единого мнения у врачей о нём нет.
Можно выделить несколько проблем:
- Метод не стандартизирован, а значит и нет убедительных доказательств его эффективности.
- Не изучено, как ФДТ влияет на смежные органы, и нет данных об отдалённых последствиях.
- Отсутствует гистологическая верификация. Если операция подразумевает не только лечение, но и диагностику (стадирование), то при ФДТ определить точную стадию невозможно. Особенно эта проблема актуальна для лечения дисплазии тяжёлой степени, поскольку именно эту нишу активно пытаются занять сторонники ФДТ.
Лечение рака шейки матки в зависимости от стадий
Рак на месте или дисплазия тяжёлой степени (CIN III) — конизация шейки матки с возможным выскабливанием цервикального канала. Далее производится оценка краёв резекции, в случае отсутствия в них раковых клеток лечение считается достаточным.
Т1а, микроинвазивная карцинома — конизация шейки матки с выскабливанием цервикального канала с последующей гистологической оценкой краёв резекции [1][2].
Т1а1 — конизация шейки матки с выскабливанием цервикального канала с последующей гистологической оценкой краев резекции. При наличии сопутствующей гинекологической патологии (миома матки, аденомиоз, и др.) и при отсутствии необходимости сохранения фертильности проводят операцию первого типа (удаление матки). При наличии «положительного» края резекции конизацию шейки матки проводят повторно. При отсутствии возможности реконизации, пациентка ведётся как Т1В1 [1][2].
Т1а2 — модифицированное расширенное удаления матки (операция второго типа). При наличии противопоказаний к оперативному вмешательству возможно применение лучевой терапии. Для сохранения фертильности выполняют широкую конизацию шейки матки с лимфоадэнэктомией (лапароскопическим или влагалищным доступом) или трахелэктомию [1][2].
T1b1, T1b2 — расширенная экстирпация матки (операция третьего типа). В качестве альтернативного метода лечения может быть рассмотрена лучевая терапия с сохранением органа. Для сохранения фертильности может быть выполнена трахелэктомия. Далее оценивается риск развития рака: при высоком и промежуточном риске после операции проводится химиолучевая терапия [1][2].
T2a, T2b — возможны следующие варианты лечения:
- расширенная экстирпация матки (операция третьего типа);
- химиолучевое лечение;
- химиотерапия с последующей расширенной экстирпацией матки [1][2].
IIB-IVB — проводят химиолучевую терапию. При отсутствии поражения стенки таза одним из вариантов лечения является экзентерация малого таза (удаление мочевого пузыря, прямой кишки, матки с шейкой и придатками), особенно при наличии свищей. При наличии асимметричного отёка нижней конечности, болей в ноге, блокирования оттока мочи в мочеточнике, поражения стенки малого таза пациентке может быть предложена лишь паллиативная помощь (направленная не на излечение, а на облегчение симптомов)[1][2].
Реабилитация
Реабилитация зависит от того, как женщина перенесла химио- или лучевую терапию, и часто сводится к устранению осложнений. После завершения лечения пациенткам можно порекомендовать правильно питаться, принимать витамины, вести в меру активный образ жизни и посетить психолога.
Онкологический диагноз во многих случаях не является приговором. Ограничений после лечения не так уж и много, пациенткам можно и нужно вести здоровую и полноценную жизнь.
Прогноз. Профилактика
Прогноз при раке шейки матки зависит от стадии заболевания. В онкологии принято оценивать пятилетнюю выживаемость:
- при I стадии она составляет 88,8 %
- при II стадии — 74 %;
- при III стадии — 51,4 %;
- при IV стадии — 7,8 % [10].
Профилактика направлена на выявление проблемы на стадии предракового заболевания, когда возможно полное излечение и низкий риск рецидивирования.
Для этого рекомендовано проходить следующие обследования:
- мазок на онкоцитологию (пап-тест) — один раз в год;
- кольпоскопия — также один раз в год (в любой день, кроме дней менструации);
- ПЦР-диагностика на ВПЧ — при каждой смене полового партнера или один раз в пять лет.
Предотвращает ли прививка от ВПЧ рак шейки матки
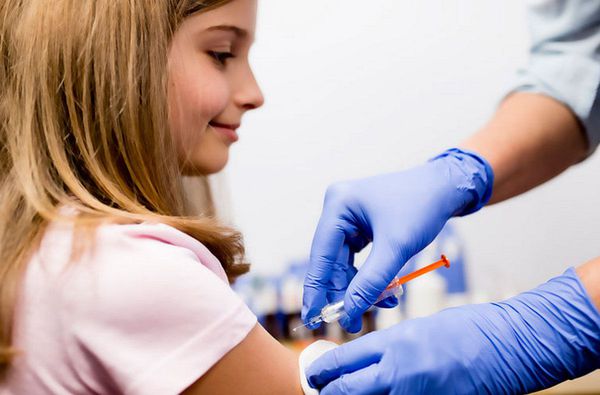
К методам специфической профилактики относится вакцинирование против ВПЧ детей в возрасте от 12 до 14 лет до начала половой жизни. Делать вакцину взрослым нецелесообразно, так как при начале половой жизни каждый взрослый сталкивается в ВПЧ с вероятностью в 87-97 %.
Разработаны различные типы вакцин, отличающиеся друг от друга количеством штаммов, от которых они защищают. На данный момент максимально эффективная вакцина действует против 6, 11, 16, 31, 33, 45, 52, 58 типов ВПЧ. Препарат вводится в дельтовидную мышцу три раза с интервалом в два месяца, а затем повторно через шесть месяцев. Однако, необходимо помнить, что вакцинация снижает риски возникновения рака шейки матки, но не является полной альтернативой скринингу.
За дополнение статьи благодарим Антона Ильина — онколога-гинеколога, научного редактора портала «ПроБолезни».
Рак шейки матки
Версия: Клинические протоколы МЗ РК — 2018 (Казахстан)
Категории МКБ:
Злокачественное новообразование шейки матки (C53)
Разделы медицины:
Онкология
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «1» марта 2019 года
Протокол №56
Рак шейки матки — это злокачественное новообразование шейки матки.
ВВОДНАЯ ЧАСТЬ:
Название протокола: Рак шейки матки
Код (ы) МКБ-10:
| МКБ-10 | |
| Код | Название |
| C53 | Злокачественное новообразование шейки матки |
| C53.0 | Внутренней части |
| C53.1 | Наружной части |
| C53.8 | Поражение шейки матки, выходящее за пределы одной и более вышеуказанных локализаций |
| C53.9 | Шейки матки неуточненной части |
Дата разработки/пересмотра протокола: 2015 год (пересмотр 2018 г.)
Сокращения, используемые в протоколе:
| АЛТ | аланинаминотрансфераза |
| АСТ | аспартатаминотрансфераза |
| АЧТВ | активированное частичное тромбопластиновое время |
| в/в | внутривенно |
| в/м | внутримышечно |
| ВОЗ | Всемирная Организация Здравоохранения |
| ВПЧ | вирус папилломы человека |
| ЖКТ | желудочно – кишечный тракт |
| ЗНО | злокачественное новообразование |
| ИФА | иммуноферментный анализ |
| КТ | компьютерная томография |
| ЛТ | лучевая терапия |
| МНО | международное нормализованное отношение |
| МРТ | магнитно-резонансная томография |
| ОАК | общий анализ крови |
| ОАМ | общий анализ мочи |
| п/к | подкожно |
| ПАП — тест | цитологическое исследование мазков методом окраски по Папаниколау, применяемое для определения состояния шейки матки |
| ПТИ | протромбиновый индекс |
| ПЭТ | позитронно –эмиссионная томография |
| РОД | разовая очаговая доза |
| РШМ | рак шейки матки |
| СОД | суммарно-очаговая доза |
| ССС | сердечно- сосудистая система |
| УЗДГ | ультразвуковое допплерография |
| УЗИ | ультразвуковое исследование |
| ЭКГ | электрокардиограмма |
| ЭхоКГ | эхокардиография |
| FIGO | International Federation Gynecology and Obstetrics |
| TNM | Tumor Nodulus Metastasis — международная классификация стадий злокачественных новообразований |
| CIN | цервикальная интраэпителиальная неоплазия |
Пользователи протокола: онкологи, онкогинекологи, акушер-гинекологи, хирурги, врачи общей практики, терапевты.
Категория пациентов: взрослые.
Шкала уровней доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). |
| D | Описание серии случаев или неконтролируемое исследование, или мнение экспертов. |
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 500 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Стадирование РШМ
Для определения стадии РШМ во всем мире используется клиническая классификация Международной Федерации Гинекологов и Акушеров (таблица 2), случаи подвергнутые хирургическому стадированию также классифицируются по TNM. В некоторых странах также используется классификация AJCC, однако несмотря на кажущееся многоообразие систем стадирования, все они идентичны и изменения в одной из них, непременно приводят к соответствующим изменениям в другой.
Таблица 2. Рак шейки матки – стадирование FIGO (2009) и TNM (8-е издание, 2017)
|
Стадия FIGO |
Категор ия по TNM |
|
| Первичная опухоль не может быть определена | Tx | |
| Нет проявлений первичной опухоли | T0 | |
| Преинвазивный рак (карцинома in situ) | Tis | |
| I | Опухоль ограничена маткой (распространение на тело матки не принимается во внимание) | T1 |
| IА | Инвазивный рак диагностируется только микроскопически (все макроскопически видимые поражения даже с поверхностной инвазией относятся к стадии 1В) | T1a |
| I А1 | Стромальная инвазия не более 3 мм в глубину и горизонтальное распространение не более 7 мм* | T1a1 |
| I А2 | Стромальная инвазия не более 5 мм в глубину и горизонтальное распространение не более 7 мм | T1a2 |
| IВ | Клинически видимые поражения шейки матки или микроскопическое поражение большее, чем 1А2/Т1А2 | T1b |
| I В1 | Клинически видимые поражения в наибольшем измерении не превышающие 4 см | T1b1 |
| I В2 |
Клинически видимые поражения в наибольшем измерении превышающие 4 см |
T1b2 |
| II | Опухоль ограничена телом матки без вовлечения стенок таза и нижней трети влагалища | T2 |
| II А | Без вовлечения параметриев | T2a |
| II А1 | Опухоль менее 4 см в наибольшем измерении | T2a1 |
| II А2 | Опухоль более 4 см в наибольшем измерении | T2a2 |
| II В | С вовлечением параметриев | T2b |
| III | Опухоль, достигающая костей таза и/или нижней трети влагалища и/или наличием гидронефроза или нефункционирующей почки | T3 |
| III А | Вовлечение нижней трети влагалища без вовлечения стенок таза | T3a |
| III В | Распространение до костей таза и/или наличием гидронефроза и/или немой почки | T3b |
| IV А | Прорастание слизистой оболочки мочевого пузыря и/или прямой кишки без выхода за пределы малого таза* | T4a |
| IV В | Отдаленные метастазы | T4b |
FIGO в 2006 году предложило внести изменения в стадирование, которые заключаются на делении стадии IIA по принципу стадии IB, которые вступили в силу с 1 января 2010 года.
Стадия 0 исключена из классификации FIGO в новой редакции.
Для выставления pN0 – необходимо исследование как минимум 6 лимфатических узлов, при отсутствии метастазов и меньшем количестве лимфатических узлов, также выставляется N0. Примечание: глубина инвазии не должна превышать мм от базальной мембраны плоского эпителия или поверхности железы, из которой она исходит. Глубина инвазии определяется измерением опухоли от места соединения эпителия и стромы от самого поверхностного участка до наиболее глубокого места инвазии. Инвазия в лимфо-васкулярное пространство не влияет на стадию.
Наличие буллезного отека слизистой оболочки не достаточно для отнесения заболевания к стадии Т4.
Правила стадирования РШМ
Стадирование рака шейки матки основано исключительно на клинической оценке, поэтому необходимо тщательное клиническое обследование абсолютно во всех случаях, в некоторых случаях в условиях анестезии. Следует помнить, что клиническая стадия не меняется в зависимости от последующих диагностических находок. При сомнении в выборе стадии, предпочтение отдается в пользу меньшей стадии. Для стадирования используются следующие методы обследования:
- Стадирование FIGO основано на использовании исключительно клинических данных (данные осмотра и кольпоскопии), рентгенографии грудной клетки, внутривенной урографии, биопсии и кюретажа цервикального канала и полости матки.
- Цистоскопия и ректоскопия могут использоваться для клинического стадирования, при подозрении на прорастание: морфологическое подтверждение обязательно.
- Лимфография, КТ, МРТ, ПЭТ, лапароскопия не могут быть использованы для клинического стадирования.
- При выявлении патологических изменений на внутривенной урографии случай должен быть отнесен к стадии IIIB.
- Региональными лимфатическими узлами для шейки матки являются парацервикальные, параметральные, под- чревные, запирательные, внутренние, наружные и общие подвздошные, пресакральные, сакральные.
- Находки, обнаруженные при дополнительных методах обследования, таких как лапароскопия, ультразвуковое исследование, КТ, МРТ, ПЭТ ценны для выбора метода лечения, но в связи с тем, что они не везде выполняются и интерпретация их зависит от квалификации врача, они не используются для клинического стадирования и их данные не меняют стадию заболевания.
Патоморфологическое (хирургическое) стадирование TNM.
Данные, полученные при тщательном морфологическом исследовании тканей, удаленных во время операции должны быть использованы для наиболее точной оценки распространенности процесса. Эти находки не позволяют вносить изменения в клиническую стадию, но должны быть использованы и отражены в протоколе патоморфологического стадирования. Для этих целей используется номенклатура TNM. Иногда РШМ может быть случайной находкой после гистерэктомия по иным показаниям – в подобных случаях клиническое стадирование не может быть проведено и эти случаи не включаются в терапевтическую статистику, но желательно, чтобы они сообщались отдельно. Первоначально установленная стадия не меняется при возникновении рецидива.
Сопоставление результатов лечения между клиниками и различными методами лечения возможно только при тщательном соблюдении всех правил стадирования.
Особенности стадирования
Диагноз стадий IAl и IA2 основывается исключительно на данных микроскопического исследования удаленных тканей (биопсийного материала – предпочтительно конуса шейки матки, который должен захватывать весь пораженный участок ). Глубина инвазии не должна быть > 5 мм от базальной мембраны либо от поверхности железы, из которой исходит образование. Горизонтальное распростра- нение не должно превышать 7 мм. Наличие васкулярной и/ или лимфатической инвазии не повышает стадию заболевания, но должно отражаться в диагнозе, поскольку может повлиять на выбор метода лечения в будущем.
Большие по размеру образования, видимые глазом, стадируются как IB. Как правило, невозможно оценить на глаз, имеется ли распространение на тело матки. Поэтому распространение на тело матки, подозреваемое клинически не должно приниматься в расчет.
Пациенты с распространением опухоли по направлению к стенке таза, которое определяется в виде короткого уплотненного участка, должны стадироваться как IIB. При клиническом стадировании невозможно достоверно оценить является ли укорочение влагалищных сводов и плотная инфильтрация в параметрии действительно опухолевой или воспалительной природы.
Третья стадия выставляется тогда, когда имеется инфильтрация до костей таза, либо непосредственный рост опухоли достигает костей таза. Наличие гидронефроза или нефункционирующей почки является следствием стеноза мочеточников опухолью и в таких случаях выставляется III стадия , даже если по данным других методов исследования опухоль может быть отнесена к I или II стадии.
Наличие буллезного отека не дает оснований отнести заболевание к IV стадии. Выдающиеся в просвет мочевого пузыря образования в виде гребней и борозд часто являются следствием во- влечения в опухолевый рост подслизистого слоя мочевого пузыря.
Наличие опухолевых клеток в смывах с мочевого пузыря требует дополнительного морфологического исследования для отнесения случая к стадии IVA.Определение степени дифференцировки
Определение степени дифференцировки инвазивного плоскоклеточного РШМ напрямую зависит от типа клеток и их морфологии, дифференцировки и строения опухоли . Определение степени дифференцировки аденокарцином основано на степени архитектоники опухоли, которая характеризуется количеством железистых структур (таблица 3).
Таблица 3. Градация плоскоклеточного рака и аденокарцином шейки матки
| Градация | Плоскоклеточный рак | Аденокарцинома |
|
Высокая степень дифференцировки G1 |
Основной клетончыйсостав– типичные ороговевающие крупные клетки. Большинство клеток (>75%) хорошо дифференцированы. Митотическая актиность низкая. Опухоль состоит из папиллярных и солидных экзофитных структур; Границы выполнены соединительными клетками. |
Опухоль содержит хорошо сформированные железы с сосочками. Клетки вытянутые с одинаковыми овальными ядрами; минимальная стратификация (менее трехрядов клеток в толщину). Митозы не частые. |
|
Умеренная дифференцировка G2 |
Тип клеток обычно – Неороговевающие крупные.Около 50% клеток хорошо дифференцированы; отдельные клетки имеют ороговение. Митотическая активность возрастает. Опухоли имеют инфильтрирующие границы; часто встречается нетипичное воспаление. |
Опухоли содержат сложные железы с частыми формированиями мостиков и крибр. Солидные участки встречаются часто, но все Еще занимают менее половины опухоли. Ядра более округленные и не равномерные; имеются микронуклеолы. Более частые митозы. |
|
Низкая дифференцировка G3 |
Основной клеточный состав – мелкие клетки. Клетки имеют базофильную цитоплазму с большим ядерно-цитоплазматическим соотношением. Размеры клеток и ядер одинаковые. Менее 25% клеток дифференцированы. Большое количество митозов, имеются патологические митозы. Опухоли обычно инфильтративные, со злокачественными клетками на границе. |
Опухоль содержит поля злокачественных клеток; видны редкие железы (<50%). Клетки крупные и неравномерные с плеоморфными ядрами. Встречаются случайные перстневидные клетки. Много митозов, в том числе аномальных. Выраженная десмоплазия и часты некрозы. |
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ
Диагностические критерии
Жалобы:
- Некоторые пациенты отмечают наличие в анамнезе преинвазивных заболеваний шейки матки, ВПЧ инфекцию высокого онкогенного риска;
- Водянистые и кровянистые выделения из половых путей;
- Боли внизу живота и в поясничной области тянущего характера;
- Наличие образования во влагалище.
Анамнез
Не существует патогномоничных жалоб для карциномы шейки матки. Как правило болезнь имеет выраженную преинвазивную стадию, которая может длиться от 1 года до 5 лет и более. Микроинвазивная карцинома шейки матки обнаруживается чаще всего при случайном обращении. Причиной обращения женщин с диагнозом рак шейки матки в стадии Ib1- IIa2 к гинекологу являются кровянистые выделения из половых путей. При более поздних стадиях (IIb-IVa) присоединяются жалобы на боли в поясничной области, внизу живота.
Физикальные обследования:
- Гинекологический осмотр: осмотр шейки матки на зеркалах (обнаружение опухоли шейки матки, визуальная оценка размеров);
- Кольпоскопия;
- Бимануальное исследование (оценка распространености опухоли).
Лабораторные исследования:
- цитологическое исследование (изменения эпителия шейки матки, выражающиеся в нарушении слоев эпителия, дис-комплексации его, появлении различных по величине и форме клеток с крупными гиперхромными ядрами и четко различимыми ядрышками. Иногда в цитоплазме таких клеток накапливается кератогиалин и они начинают ороговевать.);
- гистологическое исследование (для ороговевающего плоскоклеточного рака шейки матки характерно образование опухолевыми клетками керато -гиалиновых гранул и раковых жемчужин Фигуры митоза относительно редки. В неороговевающем плоскоклеточном раке клетки опухоли обычно овальные или полигональные, с эозинофильной цитоплазмой. Ядра могут быть довольно мономорфными или, напротив, иметь выраженный полиморфизм. Межклеточные мостики обычно не определяются. Фигуры митоза, в том числе атипичного, встречаются часто).
Цитологического исследования недостаточно для установления диагноза «рак шейки матки», всегда необходима гистологическая верификация.
Основные лабораторные методы исследования:
- общий анализ крови;
- общий анализ мочи;
- биохимическое исследование крови (общий белок, общий билирубин, АЛТ, АСТ, мочевина, креатинин, глюкоза, тимоловая проба);
- коагулограмма (протромбиновый индекс, время рекальцификации, тромботест, фибриноген, фибринолитическая активность, АЧТВ);
- анализ крови на ВИЧ;
- анализ крови на гепатиты В и С, сифилис.
Дополнительные лабораторные исследования:
- анализ крови на опухолевый маркер СА-125;
- бактериологическое исследование мазка из зева либо смывов из трахео-бронхиального дерева при наличии воспалительных заболеваний верхних и нижних дыхательных путей перед плановым оперативном вмешательстве.
Основные инструментальные исследования:
- взятие мазков на ПАП – тест. Оценка мазка по системе Бетесда:
- биопсия опухоли из зоны трансформации;
- УЗИ органов малого таза (образование шейки матки с возможной оценкой распространнености процесса в тело матки, во влагалище, мочевой пузырь или прямую кишку, определение размеров опухоли, повышенной васкуляризации);
- МРТ ОМТ: опухолевое образование шейки матки с оценкой размеров опухоли, распространенности процесса в тело матки, влагалище, мочевой пузярь, прямую кишку; оценка пораженности регионарных (тазовых, парааортальных) лимфоузлов.
- гинекологический осмотр: осмотр шейки матки на зеркалах;
- цитологическое исследование: рак/предрак шейки матки диагностируется во время профилактического осмотра/скрининга, когда при цитологическом исследовании определяется наличие атипичного мазка. Акушерка смотрового кабинета всех женщин с заключением цитологического исследования ASC, HSIL, AGC направляет на консультацию к врачу акушеру-гинекологу;
- кольпоскопия;
- биопсия шейки матки: биопсия со всех подозрительных участков;
- ЭКГ исследование;
- рентгенография органов грудной клетки в двух проекциях;
- УЗИ органов брюшной полости и забрюшинного пространства (для исключения патологии органов брюшной полости и забрюшинного пространства).
Дополнительные инструментальные исследования:
- цистоскопия (при подозрение на прорастание опухоли в мочевой пузырь);
- колоноскопия (при подозрение на прорастание опухоли в прямую кишку);
- магнитно-резонансная томография (определение распространнености);
- компьютерная томография (определение увеличенных забрюшинных лимфоузлов);
- сцинтиграфия (исключение метастатического поражения костей);
- позитро-эмиссионная томография;
- КТ органов грудной клетки с контрастированием (при наличии метастазов в легких);
- УЗИ органов брюшной полости и забрюшинного пространства (для исключения патологии органов брюшной полости и забрюшинного пространства);
- ЭхоКГ (по показаниям);
- УДЗГ (при сосудистых поражениях).
Показания для консультации специалистов:
Наличие в анамнезе сопутствующих заболеваний, которые могут оказать существенное влияние на выбор лечебной тактики , либо наличие конкурирующих медицинских состояний является показанием для проведения консультаций соответствующих узких специалистов для оценки рисков, разработки плана совместного ведения больных, а также проведения соответствующей коррекции в случае необходимости. Наиболее часто требуемые консультации:
- консультация кардиолога;
- консультация сосудистого хирурга;
- консультация гастроэнтеролога;
- консультация нейрохирурга (при наличии метастазов в головной мозг, позвоночник);
- консультация торакального хирурга (при наличии метастазов в легких);
- консультация эндокринолога (при наличии сопутствующей патологии эндокринных органов).
Диагностический алгоритм: (схема)
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований:
| Диагноз | Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Эктопия шейки матки |
-Выделения из половых путей -Участок псевдоэрозии ярко-красного цвета |
кольпоскопия взятие мазков на ПАП – тест |
Участок, покрытый множеством округлых или продолговатых красных сосочков, что создает эффект бархатистой поверхности . Ярко-красный цвет обусловлен сосудами подлежащей стромы, просвечивающими через один ряд цилиндрическихклеток. «Зонатрансформации» метаплазированный и незрелый многослойный плоский эпителий в зоне эктопии, открытые и закрытые протоки желез. |
| CIN |
-Видимые участки изменения шейки матки -Безболезненное -Выделения из половых путей. |
-кольпоскопия -взятие мазков на ПАП – тест -биопсия |
Кольпоскопическая картина: йоднегативная зона в виде белесоватой блестящей пленки с гладкой или бугристой поверхностью за счет развития рогового слоя эпителия. Окончательный диагноз устанавливают на основании гистологического исследования. |
Лечение
Препараты (действующие вещества), применяющиеся при лечении
| Амброксол (Ambroxol) |
| Амикацин (Amikacin) |
| Аминокапроновая кислота (Aminocaproic acid) |
| Аминофиллин (Aminophylline) |
| Апрепитант (Aprepitant) |
| Ацетилсалициловая кислота (Acetylsalicylic acid) |
| Бевацизумаб (Bevacizumab) |
| Бромгексин (Bromhexine) |
| Винорелбин (Vinorelbine) |
| Гемцитабин (Gemcitabine) |
| Гепарин (Heparin) |
| Глицирризиновая кислота (Glycyrrhizinic acid) |
| Гранисетрон (Granisetron) |
| Дарбэпоэтин альфа (Darbepoetin alfa) |
| Дексаметазон (Dexamethasone) |
| Декстран (Dextran) |
| Декстроза (Dextrose) |
| Диклофенак (Diclofenac) |
| Дифенгидрамин (Diphenhydramine) |
| Доцетаксел (Docetaxel) |
| Железа (III) гидроксид декстран (Ferric (III) hydroxide destrane) |
| Железа (III) гидроксид полимальтозат (Ferric (III) hydroxide polymaltosate) |
| Железа (III) гидроксид сахарозный комплекс (Ferric (III) hydroxide sacharose complex) |
| Железа карбоксимальтозат (Ferric carboxymaltosate) |
| Имипенем (Imipenem) |
| Инсулин человеческий (Insulin human) |
| Иринотекан (Irinotecan) |
| Ифосфамид (Ifosfamide) |
| Карбоплатин (Carboplatin) |
| Кетопрофен (Ketoprofen) |
| Комплекс аминокислот для парентерального питания (Complex of amino acids for parenteral nutrition) |
| Ленограстим (Lenograstim) |
| Липэгфилграстим (Lipegfilgrastim) |
| Метронидазол (Metronidazole) |
| Митомицин (Mitomycin) |
| Надропарин кальция (Nadroparin calcium) |
| Натрия хлорид (Sodium chloride) |
| Неостигмина метилсульфат (Neostigmine methylsulfate) |
| Нетупитант (Netupitant) |
| Оланзапин (Olanzapine) |
| Ондансетрон (Ondansetron) |
| Офлоксацин (Ofloxacin) |
| Паклитаксел (Paclitaxel) |
| Палоносетрон (Palonosetron) |
| Парацетамол (Paracetamol) |
| Пеметрексед (Pemetreksed) |
| Преднизолон (Prednisolone) |
| Пэгфилграстим (Pegfilgrastim) |
| Ролапитант (rolapitant) |
| Спиронолактон (Spironolactone) |
| Теофиллин (Theophylline) |
| Топотекан (Topotecan) |
| Тофизопам (Tofisopam) |
| Трамадол (Tramadol) |
| Трописетрон (Tropisetron) |
| Филграстим (Filgrastim) |
| Флуконазол (Fluconazole) |
| Фолиевая кислота (Folic acid) |
| Фосапрепитант (Fosaprepitant) |
| Фторурацил (Fluorouracil) |
| Фуросемид (Furosemide) |
| Цефазолин (Cefazolin) |
| Цефепим (Cefepime) |
| Цефтазидим (Ceftazidime) |
| Цефтриаксон (Ceftriaxone) |
| Цефуроксим (Cefuroxime) |
| Цианокобаламин (Cyanocobalamin) |
| Циластатин (Cilastatin) |
| Ципрофлоксацин (Ciprofloxacin) |
| Цисплатин (Cisplatin) |
| Эмпэгфилграстим (Empegfilgrastimum) |
| Эноксапарин натрия (Enoxaparin sodium) |
| Эпоэтин альфа (Epoetin alfa) |
| Эпоэтин бета (Epoetin Beta) |
| Эпоэтин тета (Epoetin theta) |
| Этамзилат (Etamsylate) |
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ
Немедикаментозное лечение:
- Диета при отсутствии сопутствующих заболеваний, ограничивающих питание — №15.
- При микроинвазивном раке шейки матки и CINIII проведение широкой конизации шейки матки с гистологическим исследованием краев резекции.
Медикаментозное лечение:
- Антикоагулянтная терапия у пациентов после полостных операций в течение 6 месяцев с целью профилактики тромбоэмболических осложнений.
- Надропарин кальция 0,3 мл, по 0,3 мл 1 раз в день п/к; или
- Эноксапарин натрия 0,2 мл, по 0,2 мл 1 раз в день п/к;
- Обработка шейки матки антисептическими растворами.
- Глицирризиновая кислота активированная спрей, гель вагинально 10 дней.
Хирургическое вмешательство: нет.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ
Цель лечения при карциноме шейки матки зависит от степени распространенности опухолевого процесса:
- При ранних и локализованных формах болезни основной задачей является ирадикация опухоли с максимальной терапевтической и экономической эффективностью при минимуме осложнений и сохранением качества жизни.
- При местно-распространенных и метастатических формах болезни необходимо стремиться соблюдать баланс между интенсивностью терапевтических воздействий и ожидаемой продолжительностью жизни, ожидаемой безрецидивной выживаемостью и самое главное – качеством жизни.
Таблица 4
| Стадия | Вид лечения |
| CIN III | Широкая конизация шейки матки/ тотальная гистерэктомия |
| IА1 | Широкая конизация шейки матки/ тотальная гистерэктомия |
| IА2 |
Тотальная гистерэктомия с/без придатков +тазовая лимфодиссекция (II тип по Priver)/ трахелэктомия+тазовая лимфодиссекция/ При противоказаниях к хирургическому лечению – лучевая терапия |
| IВ1 |
Радикальная гистерэктомия +тазовая лимфодиссекция (III тип по Priver) у молодых женщин с транспозицией яичников / ЛТ илиХЛТ по радикальной программе Группа высокого риска прогрессирования – адъювантная ХЛТ Группа промежуточного риска – адъювантная ЛТ Группа низкого риска – адъювантное лечение не проводится |
| IВ2- IIA |
Радикальная гистерэктомия +тазовая лимфодиссекция (III тип по Priver) у молодых женщин с транспозицией яичников / ХЛТ по радикальной программе / неоадъювантная ХТ+ Радикальная гистерэктомия III тип Группа высокого риска прогрессирования – адъювантная ХЛТ Группа промежуточного риска – адъювантная ЛТ Группа низкого риска – адъювантное лечение не проводится |
| IIВ-IVА | Химиолучевая терапия |
| IVА | Системная ХТ |
Немедикаментозное лечение:
- Режим больного при проведении консервативного лечения – общий.
- В ранний послеоперационный период – постельный или полупостельный (в зависимости от объема операции и сопутствующей патологии). В послеоперационном периоде – палатный.
- Диета стол – №15, после хирургического лечения – №1.
Лучевая терапия.
Виды лучевой терапии:
- дистанционная лучевая терапия;
- брахитерапия;
- 3D-конформное облучение;
- модулированная по интенсивности лучевая терапия (IMRT);
- подвижная дистанционная лучевая терапия;
- томотерапия на томоаппаратах;
- интраоперационная лучевая терапия;
- стереотаксическая радиохирургия и радиотерапия метастатических очагов.
Показания к лучевой терапии:
- опухоли в стадии IIа1-IVa;
- метастазы в регионарных лимфатических узлах и метастазами в общие подвздошные и парааортальные лимфоузлы;
- GOG более 120 (Табл. 8;)
- отказа пациента от операции;
- рецидив опухоли.
Лучевая терапия: стандартом лучевой терапии рака шейки матки стадии IB1/IIA1 (< 4 см в диаметре) является сочетанная лучевая терапия.
Адъювантное лечение после операции: риск возникновения рецидивов после радикального хирургического лечения высокий при наличии метастазов в лимфатических узлах, положительных краях резекции и наличии опухолевыхэлементов в параметриях (парацервикальных тканях). Адъювантная конкурентная химиолучевая терапия (используется 5FU + Cisplatin или Cisplatin) улучшает результаты лечения по сравнению с сочетанной лучевой терапией у данной категории больных [12] (УД –A).
Риск возникновения рецидивов увеличивается у пациентов с невовлеченными лимфатическими узлами при больших размерах опухоли, вовлечением лимфова-скулярного пространства и инвазией более 1/3 стромы шейки матки. У данной группы больных облучение малого таза снижает риск рецидивирования и увеличивает безрецидивную выживаемость по сравнению с больными, не получавшими адъювантное лечение после операции. Кроме того, послеоперационная лучевая терапия предпочтительна у больных с аденокарциномой шейки матки и железисто-плоскоклеточным раком шейки матки (УД – A).
Две кооперированные группы исследователей сообщили о приемлемых результатах послеоперационной лучевой терапии малыми полями, захватывающими область культи влагалища и параметральные ткани . Верхней границей облучения в данном случае является уровень S1-2, а не L5-S1 как при обычных полях (УД–C).
Томотерапия на томоаппаратах. Одним из вариантов высокотехнологичной лучевой терапии РТМ является Томотерапия – спиральное (гелическое “helical”) облучение, проводимое на специализированных линейных ускорителях – томоаппаратах. При их работе происходит одновременное ротационное движение во время сеанса облучения головки аппарата и лепестков (секторное IMRT) с одновременным поступательным продольным смещением стола. Спиральная томотерапия это сверхточная лучевая терапия управляемая по изображениям (IGRT), с помощью, которой осуществляется прецизионное подведение луча вращающего радиационного пучка к опухоли с одновременной защитой окружающих здоровых тканей, за счет визуализации и локализации анатомическихструктур на протяжении процесса лечения.Используемые в каждом направлении модулированные пучки, не только сверхточно фокусируется, но и характеризуется высокой конформностью. Существует много систем, которые позволяют создать сферическое распределение мелких доз, но томотерапия, позволяет изменить форму этой дозы при несферических и даже весьма сложных, вогнутых мишенях. Используются как стандартные методики фракционирования при подведении разовых и суммарных очаговых доз. Однако упор при томотерапии делается на гипофракционирование при РОД
<2,5 Гр.
Принципиально вопрос о назначении адъювантной лучевой/химиолучевой терапии при 1 стадии РШМ решается на основании бальной шкалы GOG, разработанной на основании крупного патолого-хирургического исследования (таблица 6).
Стадия IB2, IIA2 (опухоль > 4 см).
Методами выбора являются:
- Первичная конкурентная химиолучевая терапия (УД –А).
- Радикальная гистерэктомия с тазовой лимфаденэктомией (операция III типа), которая обычно дополняется адъювантной лучевой терапией.
- Неоадъювантная химиотерапия (2-3 курса химиотерапии на основе препаратов платины) с последующей радикальной гистерэктомией с тазовой лимфаденэктомией ± адъювантная послеоперационная лучевая или конкурентная химиолучевая терапия [17] (УД –C).
Стадия IVA
Возможно выполнение тазовой экзентерации на первом этапе, особенно при наличии пузырного или прямокишечного свища, что однако не является противопоказанием к проведению химиолучевой терапии по радикальной программе. (УД – С).
Стадия IVB и рецидивы
Рецидив может находиться в малом тазу (местные рецидивы), так и вне органов малого таза (отдаленные метастазы). При больших размерах первичной опухоли увеличивается количество пациентов с рецидивами в малом тазу и отдаленными метастазами. Большинство рецидивов возникает в первые два года и прогноз у данной категории больных неблагоприятный, большинство их них умирает от прогрессирования заболевания. Медиана выживаемости составляет семь месяцев. Основными симптомами РШМ при прогрессировании являются боли, отеки на ногах, анорексия, кровянистые выделения из половых путей, кахексия, психологические и другие проблемы. При выборе метода лечения и ведения данного контингента больных оптимальным является объединение усилий целой группы специалистов: онкогинекологов, радиологов, химиотерапевтов, психологов, нутриционистов, специально подготовленных медицинских сестер. Избавление от боли и других симптомов наряду со всесторонней поддержкой является основной задачей медицинского персонала.
Лучевая терапия по стадиям:
IB2, IIA2 (опухоль > 4 см)
Конкурентная химиолучевая терапия: наиболее широко используемый метод лечения – сочетанная лучевая терапия в сочетании с еженедельной конкурентной химиотерапией препаратами платины.
Рекомендуемые дозы лучевой терапии на точку А 85 – 90 Грей, на точку В 55 – 60 Грей. Цисплатин назначается в дозе 40 мг/м2 еженедельно на фоне дистанционного компонента лучевой терапии. У пациентов с метастазами в парааортальные и общие подвздошные лимфатические узлы необходимо расширение поля облучения до парааортальных зон. В настоящее время данные по токсичности конкурентной химиолучевой терапии, ассоциированной с расширением полей облучения малочисленны (УД –А).
Местнораспространенный рак шейки матки (включает стадии заболевания IIB, III и IVA)
Стандартным лечением является сочетанная лучевая терапия с конкурентной химиотерапией (УД – А).
При стадии IVA возможно выполнение тазовой экзентерации на первом этапе, особенно при наличии пузырного или прямокишечного свища, что однако не является противопоказанием к проведению химиолучевой терапии по радикальной программе (УД –С).
Лечение местнораспространенного рака шейки матки.
| Стадия | II B – IV A |
| Стадирование |
данные осмотра и кольпоскопии рентгенография грудной клетки внутривенная урография биопсия и кюретаж цервикального канала и полости матки Цистоскопия и ректоскопия (по показаниям), при подозрении на прорастание, последнее должно быть подтверждено морфологически МРТ, КТ, ПЭТ используются для выявления возможных метастазов в регионарных и парааортальных лимфатических узлах, данные МРТ не влияют на клиническую стадию заболевания |
|
Техника лучевой Терапии |
А. Первичная мишень: опухоль + матка B. Б. Вторичная мишень: тазовые и общие подвздошные лимфатические узлы Техника: 4-х польная Границы полей для дистанционного облучения: А. Опухоль определяется пальпаторно и при КТ (если возможно) + 2 см от края В. A-P поля: Латерально: 2 см латерально от костных границ таза Верхнее: граница позвонков L5 и S1 Нижнее: 2 см ниже запирательного отверстия либо 2 см ниже определяемой границы опухоли С. Латеральные поля: Переднее = индивидуально, определяется границами опухоли Заднее = индивидуально, определяется границами опухоли |
|
Дозы на первичную опухоль |
Дистанционное облучение в СОД 50 Грей/5-6 недель + внутриполостная терапия 30-35 Грей на точку А (для стадий IIB — IVA, 35-40 Грей) |
| Дозы на регионарные зоны метастазирования | Дистанционное облучение в СОД 50 Грей/5 недель |
| Общее время лечения | 6-7 недель |
| Конкурентная химиотерапия | Цисплатин 40 мг/м2 |
Техника и дозы облучения: дозы и поля облучения представлены в таблице 9. Облучение должно проводиться соответствующей энергией с равномерным распределением дозы (± 5%) между первичной опухолью и регионарными зонами метастазирования. Объем облучаемой опухоли должен определяться с помощью клинических методов исследования и КТ, где это возможно. Техника облучения состоит в использовании как минимум 4 полей. Брахитерапия может осуществляться как источниками низкой, так и высокой мощности. Стандартным лечением является сочетанная лучевая терапия с конкурентной химиотерапией на основе препаратов платинового ряда. Цисплатин назначается в дозе 40 мг/м2 1 раз в неделю на фоне проведения дистанционной лучевой терапии. Рекомендуемые дозы составляют от 85 до 90 Грей на точку А и от 55 до 60 Грей на точку В. У пациентов с метастазами в общих подвздошных и/или парааортальных лимфатиче- ских узлах необходимо решение вопроса о расширении полей облучения на парааортальную область (УД – C).
Стадия IVB и рецидивы
Возможные методы лечения рецидивов после первичной радикальной гистерэктомии (таблица 10): рецидивы в малом тазу после радикальной гистерэктомии могут лечиться как лучевой терапией, так и хирургически (тазовая экзентерация). Облучение по радикальной программе (± конкурентная химиотерапия) локализованных тазовых рецидивов после первичного хирургического лечения эффективно у значительного количества больных. Дозы и объем лучевой терапии должны определяться распространенностью заболевания.
Так, при микроскопических размерах опухоли обычная доза составляет 50 Грей при РОД 1,8 – 2,0 Грей с уменьшенными размерами полей облучения, а при больших по размеру опухолях доза составляет 64 – 66 Грей.
Местные рецидивы после хирургического лечения РШМ
| Рекомендации |
Уровень доказательности |
|
Лучевая терапия показана пациентам с местными рецидивами после радикальной гистерэктомии |
С |
|
Конкурентная химиолучевая терапия с включением Цисплатина с/без 5-Фторурацила улучшает результаты лечения |
В |
|
Тазовая экзентерация может быть альтернативой лучевои и химиолучевой терапии у больных с рецидивами, не распространяющимися на стенки таза, особенно при наличии свищей |
С |
Местные рецидивы после радикального курса лучевой терапии (таблица 9):
Радикальная гистерэктомия выполняется у пациентов с небольшими рецидивами (< 2 см в диаметре), ограниченными шейкой матки. Несмотря на увеличение количества осложнений при операциях после первичной лучевой терапии, в большинстве случаев нет необходимости накладывать колостомы.
Пациентки с центрально-локализованным рецидивом, вовлечением мочевого пузыря и прямой кишки при отсутствии интраперитонеальной диссеминации и отдаленных метастазов, наличии свободного пространства между шейкой матки и стенками таза являются потенциальными кандидатами для проведения тазовой экзентерации.
Триада симптомов – билатеральные лимфатические отеки нижних конечностей, ишиалгия, обструкция мочевыводящих путей свидетельствуют о неоперабельном процессе. Этой группе больных показано паллиативное и симптоматическое лечение.
Наиболее благоприятный прогноз при безрецидивном периоде более 6 месяцев, размере опухоли менее 3 см и отсутствии инфильтратов в параметриях. Показатели 5-летней выживаемости у данной группы больных колеблются в пределах от 30 до 60 %, а периоперационная летальность не превышает 10%.
Местные рецидивы после лучевой терапии РШМ
| Рекомендации |
Уровень доказательности |
|
Часть пациентов с небольшими размерами опухоли (< 2 см), ограниченными шейкой матки являются кандидатами для радикальной гистерэктомии |
С |
|
Пациенты с локализованными рецидивами при отсутствии отдаленных метастазов являются кандидатами для тазовой экзентерации |
С |
Отдаленные метастазы: лучевая терапия показана при симптомных метастазах опухоли в качестве паллиативного лечения, к примеру, при костных метастазах [37], увеличенных парааортальных, подключичных лимфатических узлах для купирования болевого синдрома или при метастазах в головной мозг. С точки зрения меньшей продолжительности жизни у пациентов с метастазами РШМ паллиативную радиотерапию следует проводить укрупненными фракциями в более короткие сроки по сравнению с радикальными курсами лучевой терапии.
Медикаментозное лечение
Химиотерапия
| Рекомендации | Уровень доказательности |
| Цисплатин/ Паклитаксел/ Бевацизумаб | А |
| Цисплатин/ Паклитаксел | |
| Топотекан/ Паклитаксел/ Бевацизумаб | |
| Карбоплатин/ Паклитаксел | С |
| Цисплатин/ Топотекан | |
| Топотекан/ Паклитаксел | |
| Цисплатин/ Гемцитабин | |
| Препараты для монохимиотерапии в качестве первой линии: | С |
| Цисплатин | |
| Карбоплатин | |
| Паклитаксел | |
| Препараты для монохимиотерапии в качестве второй линии: | С |
| Бевацизумаб | |
| Доцетаксел | |
| Фторурацил | |
| Гемцитабин | |
| Ифосфамид | |
| Иринотекан | |
| Митомицин | |
| Топотекан | |
| Пеметрексед | |
| Винорелбин |
Существует несколько видов химиотерапии, которые отличаются по цели назначения:
- неоадъювантная химиотерапия опухолей назначается до операции, с целью уменьшения неоперабельной опухоли для проведения операции, а так же для выявления чувствительности раковых клеток к препаратам для дальнейшего назначения после операции. Теоретическими предпосылками служат лучшая доставка лекарств к опухоли сосудами, неповрежденными вследствие лучевой терапии и операции.
- адъювантная химиотерапия назначается после хирургического лечения для предотвращения метастазирования и снижения риска рецидивов;
- самостоятельная химиотерапия назначается для уменьшения метастатических раковых опухолей;
- конкурентная — используется параллельно с облучением для достижения радиосенсибилизирующего эффекта; Таблица 6. Возможные препараты и варианты их комбинаций при распространенном и метастатическом раке шейки матки.
Антибактериальная терапия:
Цефазолин 1,0 гр, по 1,0 гр в/м 3 раза в день, 7 дней;
Цефтазидим 100мг, по 100мг в/м 3 раза в день, 7 дней;
Цефтриаксон 1,0 гр, по 1,0 гр в/м 2 раза в день, 7 дней;
Цефуроксим натрия 1,0гр, по 1,0гр в/м 2 раза в день, 7 дней;
Цефепим 1,0 гр, по 1,0 гр в/м 2 раза в день, 7 дней;
Имипенем + циластатин 500мг, по в/м 2 раза в день, 5-7 дней;
Амикацин 500мг, из расчета 10мг/кг в/м 2 раза в день, 7 дней;
Ципрофолоксацин 100мг, по 100мг в/в 2 раза в день, 5 – 7 дней;
Офлоксацин 0,2гр, по 0,2 гр в/в 2 раза в день, 7 дней;
Метронидазол 100 мл, по 100 мл в/в 2 раза в день, 5 дней.
Противогрибковая терапия:
Флуконазол 100 мг, по 100мг в/в – однократно.
Плазмозаменящая терапия:
Декстран 400мл, по 400 мл в/в 2 раза в день 2 – 3 дня.
Парентеральное питание:
Комплекс аминокислот для парентерального питания 500мл, по 500мл в/в 1 раз в день, 5 – 7 дней;
Декстроза 5% — 400мл, по 400мл в/в 2 раза в день, 5 – 7 дней.
Регидратационная терапия:
Натрия хлорид 0,9% — 400мл, по 400 мл в/в 2 – 3 раза в день. 5 – 7 дней.
Аналгетическая терапия:
Кетопрофен 1мл, по 1 мл, в/м 2 – 3 раза в день 5 – 7 дней;
Диклофенак натрия в/м 2 – 3 раза в день 7 – 10 дней;
Трамадола гидрохлорид 1 мл, по 1мл в/м 2 – 3 раза в день.
Гормональные терапия:
Преднизолон 30мг, по 30 – 60 – 90 мг в/в 1 раз в день 1 – 5 дней;
Дексаметазон 4 мг, по 4 – 8 – 12 – 16 – 20 мг 1 раз в день 1 – 5 дней;
Инсулин человеческий 40 ЕД, 4 – 6 ЕД 1 раз в день 2 – 10 дней.
Бронхолитиеская терапия:
Аминофиллин 10мл, по 6 – 10мг/кг/сут в/м 3 раза в день,10 дней;
Теофиллин 0,2гр, по 0,2 гр per os 2 – 4 раза в день, 10 – 15 дней.
Антикоагулянтная терапия:
Надропарин кальция 0,3 мл, по 0,3 мл 1 раз в день п/к;
Эноксапарин натрия 0,2 мл, по 0,2 мл 1 раз в день п/к;
Гепарин 10тысЕД, по 5000-10000 ЕД в/в или п/к 1 раз в день.
Муколитическая терапия:
Бромгексин 8 мг, по 8 мг per os 3 раза в день, 7 – 10 дней;
Амброксол 2 мл, по 2 мл в/м, 3 раза в день, 7 – 10 дней.
Седативная терапия:
Тофизопам 50 мг, по 50 мг per os 1 – 2 раза в день, 1 – 5 дней;
Неостигмина метилсульфат 1,0мл, по 1мл в/м 1 – 2 раза в день, 1 – 10 дней.
Жаропонижающая терапия:
Ацетилсалициловая кислота 0,5 гр, по 0,5 гр per os 2 раза в день;
Парацетамол 0,5гр, по 0,5 гр per os, 3 раза в день.
Гемостатическая терапия:
Аминокапроновая кислота 5% — 100мл, по 100 мл в/в 1 раз в день, 1 – 5 дней.
Этамзилат 12,5% — 2мл, по 2 мл в/м 2 раза в день, 1 – 5 дней.
Дицинон 1 мл, по 1,0 мл в/м 1 – 2 раза в день.
Диуретическая терапия:
Фуросемид 1% — 2 мл, по 2 мл в/м, в/в 1-3 раза в день, 1 –5 дней;
Спиронолактон 100мг, по 100 мг per os 1 раз в день, 5 – 14 дней.
Антианемическая терапия:
Железа (III) гидроксид полиизомальтозад по 100-200 мг в/м, в/в 3-5 раз в неделю;
Железа (III) гидроксид декстран по 100-200 мг в/м, в/в 3-5 раз в неделю;
Гемопоэтическая терапия
Представлена в разделе 5.3.6.
Антигистаминная терапия
Дифенгидрамин 1 мл – 10 мг, 10 мг в/м 1 – 2 раз в день;
Седативная терапия
Тофизопам 50 мг, по 50 мг per os 1 – 2 раза в день, 1 – 5 дней;
Неостигмина метилсульфат 1,0мл, по 1мл в/м 1 – 2 раза в день, 1 – 10 дней;
Сопроводительная терапия с целью профилактики и лечения побочных эффектов лекарственной терапии представлено в приложении 1.
Хирургическое вмешательство
Виды хирургических вмешательств:
- Широкая конизация шейки матки;
- Тотальная абдоминальная или влагалищная гистерэктомия;
- Абдоминальная модифицированная или радикальная гистерэктомия с тазовой/парааортальной лимфаденоэктомией;
- Влагалищная трахелэктомия;
- Хирургическое (лапароскопическое) стадирование;
- Радикальная трахелэктомия, дополненная экстраперитонеальным, трансперитонеальным либо лапароскопическим удалением тазовых лимфоузлов;
- Модифицированная экстраперитонеальная тотальная (задняя или передняя) экзентерация органов малого таза;
- Латерально-расширенная внутритазовая резекция.
Показания к хирургическому лечению:
- цитологически или гистологически верифицированные ЗНО шейки матки;
- при отсутствии противопоказании к хирургическому лечению.
Лечение в зависимости от стадии
Микроинвазивный рак
Диагноз рака шейки матки стадии IA1 или IA2 ставится исключительно на основании морфологического исследования конуса шейки матки с негативными краями резекции или на основе удаленного макропрепарата после трахелэктомии либо гистерэктомии. В случае обнаружения в краях резекции после конизации шейки матки CIN III или инвазивного рака необходима повторная конизация или лечение пациента как при стадии заболевания IB1. Вагиноскопия (кольпоскопом!) выполняется для исключения сопутствующей вагинальной интраэпитеальной неоплазии (VAIN) перед выбором метода лечения.
Стадия IA1
Основным методом лечения РШМ в данной стадии является тотальная абдоминальная или влагалищная гистерэктомия. При наличии влагалищной интраэпитеальной неоплазии необходимо удаление соответсвующей части влагалищной трубки. При необходимости сохранения фертильности возможно наблюдение после широкой конизации шейки матки с негативными краями резекции при условии проведения Пап -теста. Пап-тест проводится в сроки 6, 12 месяцев и в последующем ежегодно, если предыдущие два теста были отрицательными УД –B).
Стадия IA2
Существует определенная потенция к лимфогенному метастазированию у больных со стадией заболевания IA2, в связи с этим необходимо выполнение тазовой лимфаденэктомии во время хирургического лечения. Адекватной операцией для данных клинических случаев является модифицированная радикальная гистерэктомия (операция 2 типа) дополненная двусторонней тазовой лимфаденэктомией. При отсутствии лимфоваскулярной инвазии по данным предварительной биопсии возможно выполнение экстрафасциальной экстирпации (операция 1 типа) с тазовой лимфаденэктомией [11] (УД –С).
При желании сохранения фертильности возможными вариантами лечения являются:
- широкая конизация шейки матки, дополненная экстраперитонеальным либо лапароскопическим удалением тазовых лимфоузлов;
- радикальная трахелэктомия, дополненная экстраперитонеальным, трансперитонеальным либо лапароскопическим удалением тазовых лимфоузлов. Наблюдение данной группы больных главным образом основано на ежегодном Пап-тесте после двух отрицательных тестов в сроках 6 и 12 месяцев.
Относительный риск развития рецидива при 1 стадии РШМ после радикальной гистерэктомии.
| Признак | Значение | Относительный риск |
| Глубина инвазии в строму, в мм | ||
| Поверхностная | 3 | 1.0 |
| 4 | 3.0 | |
| 5 | 7.2 | |
| 6 | 14 | |
| 7 | 21 | |
| 8 | 26 | |
| 10 | 31 | |
| Средняя | 5 | 20 |
| 6 | 22 | |
| 7 | 23 | |
| 8 | 25 | |
| 10 | 28 | |
| 12 | 32 | |
| 14 | 36 | |
| Глубокая | 7 | 28 |
| 8 | 30 | |
| 10 | 34 | |
| 12 | 37 | |
| 14 | 41 | |
| 16 | 45 | |
| 18 | 49 | |
| 20 | 54 | |
| Клинический размер опухоли |
Не видимый |
1.0 |
| 1 | 1.6 | |
| 2 | 1.9 | |
| 3 | 2.4 | |
| 4 | 2.9 | |
| 6 | 4.4 | |
| 8 | 6.6 | |
| Лимфо-васкулярная инвазия | Есть | 1.7 |
| Нет | 1.0 |
- Сумма баллов GOG расчитывается умножением показателей относительного риска для глубины инвазии, размера опухоли и лимфо-васкулярной инвазии. Например, поверхностная опухоль с глубиной инвазии 7.0 мм, размером 2.0 см, с наличием ЛВИ будет иметь балл: 21 x 1.9 x 1.7 = 67.8
- Количество баллов ≤ 40 имеет низкий риск развития рецидива и поэтому не требует адъювантного облучения, количество баллов от 40 до 120 имеет средний риск, а более 120 – высокий риск и в таких случаях необходимо решить вопрос о адъювантной терапии.
Патоморфологическое исследование препарата при РШМ описано в приложении 2.
Случайные находки РШМ
Данные находки в основном относятся к случаям инвазивного РШМ, диагностированного после простой гистерэктомии, выполненной по иным показаниям. До начала лечения в таких ситуациях необходимо дополнительное обследование в объеме: КТ или МРТ органов малого таза и брюшной полости, рентгенография органов грудной клетки для уточнения распространенности процесса. Метод лечения должен определяться на основании данных морфологического исследования и рентгенологических находок. При отсутствии патологических находок:
- при стадии IA1 дополнительное лечение не проводиться.
- при стадии IA2 и выше, необходимо следующее лечение:
а) при положительных краях резекции, глубокой стромальной инвазии, вовлечении лимфоваскулярного пространства назначается конкурентная химиолучевая терапия (38).
б) у больных без глубокой стромальной инвазии, отрицательных краях резекции и отсутствии вовлечения лимфоваскулярного пространства выполняется радикальная параметрэктомия с верхней третью влагалища и лимфаденэктомией как альтернатива конкурентной химиолучевой терапии (УД –С).
РШМ во время беременности
В целом, лечение РШМ во время беременности основано на тех же принципах, что у небеременных женщин . Существует лишь несколько специальных рекомендаций. Конизация шейки матки выполняется только при подозрении на инвазивный рост по данным цитологического исследования и кольпоскопии в связи с высоким риском кровотечения, прерывания беременности или преждевременных родов . Важнейшим условием в определении тактики ведения беременных женщин с РШМ является мультидисциплинарный подход с привлечением неонатолога и акушера-гинеколога помимо радиолога и химиотерапевта. Необходимо участие самой женщины и ее партнера в принятии решения, следует учитывать их желание сохранить беременность.
У пациенток с подозрением на микроинвазивный РШМ отсрочка в лечении не наносит ущерба матери и проявляется достоверным повышением жизнеспособности плода.
Женщины со стадией заболевания IA1, подтвержденной при конизации и отрицательными краями резекции могут донашивать беременность и рожать через естественные родовые пути.
Метод родоразрешения при микроинвазивной карциноме шейке матки не влияет на исход заболевания.
При стадии заболевания IA2 и выше лечение необходимо подбирать индивидуально, главным образом решение о методе лечения и его сроках основано на стадии заболевания и сроке беременности. МРТ проводится с целью оценки распространенности процесса. В случае установления диагноза до 20 недель гестации лечение должно начинаться безотлагательно. Методом выбора является радикальная гистерэктомия с плодом in situ. При проведении химиолучевой терапии, как правило, прерывание беременности не проводиться, так как после начала лечения происходит самопроизвольный выкидыш.
При выявлении РШМ после 28 недельного срока беременности рекомендуется отсрочка лечения до получения жизнеспособного плода . Лечение РШМ в сроках от 20 до 28 недель беременности при стадии IA2 и IBI может быть отложено до получения жизнеспособного плода без значимого влияния на прогноз для матери. При стадии заболевания выше, чем IBI отсрочка в лечении значительно ухудшает прогноз и влияет на выживаемость.
Следует отметить, что не существует стандартов по определению срока, на которое можно отложить начало лечения. На практике период отсрочки зависит от стадии заболевания, морфологических находок, сроке беременности и желании родителей. При планировании сроков родоразрешения при местнораспространенном РШМ возможно принятие решения о назначении неоадъювантной химиотерапии с целью предупреждения дальнейшей прогрессии заболевания – требуется динамическое наблюдение! Родоразрешение проводиться не позднее 34 недель гестации.
Если образование шейки матки не было удалено во время диагностической конизации, предпочтительным методом родоразрешения является классическое кесарево сечение, несмотря на то, что несколько ретроспективных исследований продемонстрировали отсутствие влияния метода родоразрешения на прогноз РШМ.
Дальнейшее ведение:
Наибольшее количество рецидивов после лечения РШМ возникают в первые 3 года , этим обусловлена необходимость частого наблюдения больных после лечения. При наличии возможности “Follow up” визиты проводятся ежемесячно на протяжении первого года, раз в два месяца на втором году, раз в три месяца на третьем году, раз в четыре месяца на четвертом году и далее не реже чем один раз в полгода. При невозможности соблюдения плотного режима визитов “Follow up” допускаются визиты не реже одного раза в три месяца в течение первых трех лет, и каждые полгода с четвертого года наблюдения.
Минимальный объем исследований во время визита женщины состоит из:
- Осмотр в зеркалах;
- Гинекологический осмотр;
- Пап-тест;
- УЗИ малого таза – не чаще 1 раза в 3-6 месяцев.
Данные обследования проводятся при каждом “Follow up” визите. В течение первых трех лет наблюдения рекомендуется МРТ малого таза не реже 1-2 раз в год, КТ сканирование области забрюшинных лимфатических узлов брюшной полости и малого таза, рентгенография ОГК — не реже одного раза в год. Возможно использование ПЭТ/КТ при подозрении на прогрессирование болезни.
Всем пациентам обязательно участие в скрининговых программах, предоставляемых системой здравоохранения в соответствии с рекомендациями по возрасту.
Профилактика тромбоэмболичесих осложнений: эластическое бинтование нижних конечностей, продолжение антикоагулянтной терапии.
Инцентивная спирометрия у больных старшего возраста, дыхательная гимнастика и ЛФК в послеоперационном периоде, особенно в случаях ограничения физической активности.
Проведение послеоперационных перевязок по мере необходимости.
Индивидуальная работа с психологом.
Индикаторы эффективности лечения:
- «ответ опухоли» — регрессия опухоли после проведенного лечения;
- безрецидивная выживаемость (трех и пятилетняя);
- «качество жизни» включает кроме психологического, эмоционального и социального функционирования человека, физическое состояние организма больного.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для плановой госпитализации:
- Морфологически верифицированные злокачественные опухоли шейки матки при необходимости проведения специализированного лечения, паллиативного лечения и/или реабилитации.
Плановая госпитализация так же может осуществляться при необходимости реабилитационной и поддерживающей терапии в другие учреждения.
Показания для экстренной госпитализации:
Экстренные показания к госпитализации могут возникнуть при кровотечении, острой кишечной непроходимости и некоторых других более редких осложнениях опухолевого процесса.
- Кровотечение из половых путей;
- Острая кишечная непроходимость;
- Выраженный болевой синдром;
- Острая почечная недостаточность и др.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2018
- 1. Australian Institute of Health and Welfare 2008. Cervical screening in Australia 2005– 2006. Cancer series no. 41. Cat. no. CAN 36. Canberra: AIHW.
2. Webb JC, Key CR, Qualls CR, Smith HO. Population-based study of microinvasive adenocarcinoma of the uterine cervix. Obstet Gynecol 2001;97:701-706
3. Elliott P, Coppleson M, Russell P, Liouros P, Carter J. Macleod C et al. Early invasive (FIGO Stage IA) carcinoma of the cervix: a clinicopathologic study of 476 cases. Int J Gynecol Cancer 2000;10:42-52
6. Shepherd JH, Spencer C, Herod J, Ind TEJ. Radical vaginal trachelectomy as a fertility sparing procedure in women with early stage cervical cancer – cumulative pregnancy rate in a series of 123 women. BJOG 2006;113:719-7247. Landoni F, Maneo A, Colombo A, et al: Randomized study of radical surgery versus radiotherapy for stage IB-IIA cervical cancer. Lancet 1997;350:535-40
8. Querleu D, Morrow CP. Classification of radical hysterectomy. Lancet Oncol 2008;9:297.
9. Cibula D, Abu-Rustum NR, Benedetti-Panici P, et al. New classification system of radical hysterectomy: emphasis on a three-dimensional anatomic template for 3parametrial resection. Gynecol Oncol 2011;122:264-268.
10. Steed H, Rosen B, Murphy J. et al. Acomparison of laparoscopic-assisted radical vaginal hysterectomy and radical abdominal hysterectomy in the treatment of cervical cancer. Gynecol Oncol 2004;93:588-593
11. Peters III WA, Liu PY, Barrett II RJ et al: Concurrent chemotherapy and pelvic radiation therapy compared with pelvic radiation therapy alone as adjuvant therapy after radical surgery in high-risk early-stage cancer of the cervix. J Clin Oncol 2000;18(8):1606-13
12. Rotman M, Sedlis A, Piedmonte MR, Bundy B, Lentz SS, Muderspach LI, Zaino RJ: A phase III randomized trial of pelvic post-operative irradiation in Stage IB cervical carcinoma with poor prognostic features: Follow-up of a Gynecologic Oncology Group Study. Int J Rad Oncol Biol Phys 2006;65:169-176
13. Ohara K, Tsunoda M, Nishida M, Sugahara S, Hashimoto T, Shioyama Y et al. Use of small pelvic field instead of whole pelvic field in post-operative radiotherapy for nodenegative, high-risk stages I and II cervical squamous cell carcinoma. Int J Gynecol Cancer 2003;13:170-176
14. Adam E, Kaufman RH, Adler-Storthz K, et al. A prospective study of association of herpes simplex virus and human papillomavirus infection with cervical neoplasia in women exposed to diethylstilbestrol in utero. Int J Cancer. 1985;35:19-26.
15. American Cancer Society. Cancer Facts and Figures 2018. Atlanta, Ga: American Cancer Society; 2018.
16. American Joint Committee on Cancer. Cervix Uteri. In: AJCC Cancer Staging Manual. 7th ed. New York, NY: Springer; 2010:395-402.
17. Anderson TA, Schick V, Herbenick D, Dodge B, Fortenberry JD. A study of human papillomavirus on vaginally inserted sex toys, before and after cleaning, among women who have sex with women and men. Sex Transm Infect. 2014 Apr 16. [Epub ahead of print]
18. Arbyn M, Kyrgiou M, Simoens C, et al. Perinatal mortality and other severe adverse pregnancy outcomes associated with treatment of cervical intraepithelial neoplasia: meta-analysis. BMJ. 2008;337: a1284.
19. Ault KA. Future II study group. Effect of prophylactic human papillomavirus L1 virus-like-particle vaccine on risk of cervical intraepithelial neoplasia grade 2, grade 3, and adenocarcinoma in situ: A combined analysis of four randomised clinical trials. Lancet. 2007;369:1861-1868.
20. Bentivegna E, Maulard A, Pautier P, et al. Fertility results and pregnancy outcomes after conservative treatment of cervical cancer: A systematic review of the literature. Fertil Steril. 2016;106:1195-1211.
21. Castellsagué X, Bosch FX, Muñoz N, et al. Male circumcision, penile human papilloma virus infection, and cervical cancer in female partners. N Engl J Med. 2002;346:1105-1112.
22. Castellsagué X, Díaz M, Vaccarella S, et al. Intrauterine device use, cervical infection with human papillomavirus, and risk of cervical cancer: A pooled analysis of 26 epidemiological studies. Lancet Oncol. 2011;12:1023-1031.
23. Chaturvedi AK, Engels EA, Gilbert ES, et al. Second cancers among 104760 survivors of cervical cancer: Evaluation of long-term risk. J Natl Cancer Inst. 2007; 99:1634-1643.
24. Chaturvedi AK, Kleinerman RA, Hildesheim A, et al. Second cancers after squamous cell carcinoma and adenocarcinoma of the cervix. J Clin Oncol. 2009;27:967-973.
25. Cuzick J, Myers O, Hunt WC, et al. A population-based evaluation of cervical screening in the United States: 2008-2011. Cancer Epidemiol Biomarkers Prev. 2014;23:765-73.
26. Del Priore G, Gudipudi DK, Montemarano N, et al. Oral diindolylmethane (DIM): pilot evaluation of a nonsurgical treatment for cervical dysplasia. Gynecol Oncol. 2010;116:464-467
27. Klopp AH, Eifel PJ, Berek JS, Konstantinopoulos PA. Chapter 72: Cancer of the cervix, vagina, and vulva. In: DeVita VT, Hellman S, Rosenberg SA, eds. Cancer: Principles and Practice of Oncology 10th ed. Philadelphia, Pa: Lippincott Williams & Wilkins; 2015.
28. Ghosh C, Baker JA, Moysich KB, et al. Dietary intakes of selected nutrients and food groups and risk of cervical cancer. Nutr Cancer. 2008;60:331-341.
29. Gray RH, Serwadda D, Kong X, et al. Male circumcision decreases acquisition and increases clearance of high-risk human papillomavirus in HIV-negative men: A randomized trial in Rakai, Uganda. J Infect Dis. 2010;201:1455-1462.
30. Grimm C, Polterauer S, Natter C, et al. Treatment of cervical intraepithelial neoplasia with topical imiquimod: a randomized controlled trial. Obstet Gynecol. 2012;120:152-159.
31. Hatch EE, Herbst AL, Hoover RN, et al. Incidence of squamous neoplasia of the cervix and vagina in women exposed prenatally to diethylstilbestrol (United States). Cancer Causes Control. 2001;12:837-845.
32. Hernandez BY, Wilkens LR, Zhu X, et al. Transmission of human papillomavirus in heterosexual couples. Emerg Infect Dis. 2008;14:888-894.
33. Howlader N, Noone AM, Krapcho M, Miller D, Bishop K, Kosary CL, Yu M, Ruhl J, Tatalovich Z, Mariotto A, Lewis DR, Chen HS, Feuer EJ, Cronin KA (eds). SEER Cancer Statistics Review, 1975-2014, National Cancer Institute. Bethesda, MD, https://seer.cancer.gov/csr/1975_2014/, based on November 2016 SEER data submission, posted to the SEER web site, April 2017.
34. International Collaboration of Epidemiological Studies of Cervical Cancer. Cervical cancer and reproductive factors: Collaborative reanalysis of individual data on 16,563 women with cervical carcinoma and 33,542 women without cervical carcinoma from 25 epidemiological studies. Int J Cancer. 2006; 119:1108-1124.
35. International Collaboration of Epidemiological Studies of Cervical Cancer. Appleby P, Beral V, Berrington de González A, et al. Cervical cancer and hormonal contraceptives: Collaborative reanalysis of individual data for 16,573 women with cervical cancer and 35,509 women without cervical cancer from 24 epidemiological studies. Lancet. 2007;370:1609-1621.
36. Jhingran A, Russel AH, Seiden MV, et al. Cancers of the cervix, vagina and vulva. In: Abeloff MD, Armitage JO, Lichter AS, et al. Clinical Oncology. 5th ed. Philadelphia, Pa; Elsevier; 2008: 1534-1574.
37. Kataja V, Syrjänen S, Yliskoski M, et al. Risk factors associated with cervical human papillomavirus infections: a case-control study. Am J Epidemiol. 1993;138:735-745.
38. Kleinerman RA, Kosary C, Hildesheim A. New Malignancies Following Cancer of the Cervix Uteri, Vagina, and Vulva. In: Curtis RE, Freedman DM, Ron E, Ries LAG, Hacker DG, Edwards BK, Tucker MA, Fraumeni JF Jr. (eds). New Malignancies Among Cancer Survivors: SEER Cancer Registries, 1973-2000. National Cancer Institute. NIH Publ. No. 05-5302. Bethesda, MD, 2006. Accessed at http://seer.cancer.gov/archive/publications/mpmono/MPMonograph_complete.pdf on November 8, 2016.
39. Kosary CL. Cancer of the uterine cervix. In: Ries LAG, Young JL, Keel GE, Eisner MP, Lin YD, Horner M-J (editors). SEER Survival Monograph: Cancer Survival Among Adults: U.S. SEER Program, 1988-2001, Patient and Tumor Characteristics. National Cancer Institute, SEER Program, NIH Pub. No. 07-6215, Bethesda, MD, 2007.
40. Kreimer AR, González P, Katki HA, et al. Efficacy of a bivalent HPV 16/18 vaccine against anal HPV 16/18 infection among young women: A nested analysis within the Costa Rica Vaccine Trial. Lancet Oncol. 2011;12:862-870.
41. Kushi LH, Doyle C, McCullough M, Rock CL, et al. American Cancer Society Guidelines on nutrition and physical activity for cancer prevention: Reducing the risk of cancer with healthy food choices and physical activity. CA Cancer J Clin. 2012;62:30-67.
42. Kyrgiou M, Koliopoulos G, Martin-Hirsch P, et al. Obstetric outcomes after conservative treatment for intraepithelial or early invasive cervical lesions: Systematic review and meta-analysis. Lancet. 2006;367:489-498.
42. Krishnansu S. Tewari, M.D., Michael W. Sill, Ph.D., Harry J. Long, III, M.D., Richard T. Penson, M.D., Helen Huang, M.S., Lois M. Ramondetta, M.D., Lisa M. Landrum, M.D., Ana Oaknin, M.D., Thomas J. Reid, M.D., Mario M. Leitao, M.D., Helen E. Michael, M.D., and Bradley J. Monk, M.D. Improved Survival with Bevacizumab in Advanced Cervical Cancer. N Engl J Med 2014; 370:734-743; DOI: 10.1056/NEJMoa1309748
43. Committee F. FIGO staging for carcinoma of the vulva, cervix, and corpus uteri.Int J Gynaecol Obstet. 2014;125(2):97–8. doi:10.1016/j.ijgo.2014.02.003.
- 1. Australian Institute of Health and Welfare 2008. Cervical screening in Australia 2005– 2006. Cancer series no. 41. Cat. no. CAN 36. Canberra: AIHW.
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА
Список разработчиков:
- Кайдарова Диляра Радиковна – доктор медицинских наук, академик НАН РК, председатель правления АО «Казахский НИИ онкологии и радиологии» МЗ РК, президент Ассоциации онкологов РК.
- Чингисова Жанна Казбековна – доктор медицинских наук, заместитель председателя правления по клинической работе, АО «Казахский научно – исследовательский институт онкологии и радиологии».
- Кукубасов Ерлан Каирлыевич – кандидат медицинских наук, руководитель центра онкогинекологии АО «Казахский научно – исследовательский институт онкологии и радиологии».
- Тельгузиева Жаннат Ахметбековна – доктор медицинских наук, радиолог центра онкогинекологии АО «Казахский научно – исследовательский институт онкологии и радиологии».
- Курманова Анар Амангельдиевна, радиолог центра онкогинекологии АО «Казахский научно – исследовательский институт онкологии и радиологии».
- Шалбаева Раш Шарипбаевна – доктор медицинских наук, онколог-гинеколог центра онкогинекологии, АО «Казахский научно – исследовательский институт онкологии и радиологии».
- Уколова Елена Андреевна – онколог-химиотерапевт АО «Казахский научно – исследовательский институт онкологии и радиологии».
- Сатанова Алима Ринатовна – онколог-гинеколог АО «Казахский научно – исследовательский институт онкологии и радиологии.
- Бабажанова Анар Бейбитовна – клинический фармаколог Мангыстауского областного онкологического диспансера.
Указание на отсутствие конфликта интересов: нет.
Список рецензентов:
- Манамбаева Зухра Алпысбаевна – доктор медицинских наук, профессор кафедры онкологии НАО»Национальный медицинский университет».
- Есенкулова Сауле Аскеровна – доктор медицинских наук, доцент кафедры онкологии НАО «Национальный медицинский университет».
- Кудайбергенов Талгат Капаевич – доктор медицинских наук, профессор, директор по науке ИРМ.
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и вступления в действие или при наличии новых рекомендаций с уровнем доказательности.
Приложение 1
СОПРОВОДИТЕЛЬНАЯ ТЕРАПИЯ
Антиэметическая терапия
Тошнота и рвота являются одним из наиболее частых побочных эффектов химио- терапии (ХТ) и существенно ухудшают качество жизни больных.
Тошнота и рвота, сопутствующие химиотерапии, относятся к числу наиболее неприятных аспектов этого вида лечения (1,2). Не будучи самым серьезным побочным эффектом химиотерапии, рвота, тем не менее, сильно ухудшает качество жизни и снижает ощущение благополучия (1,3). В некоторых случаях пациенты откладывают или полностью прекращают химиотерапию из-за непереносимой тошноты и рвоты (1).
Кроме того, рвота, как таковая, может представлять угрозу здоровью, поскольку неконтролируемая рвота приводит к обезвоживанию, нарушению баланса метаболитов и к анорексии (4,5).
Факторы, связанные с терапией:
Высокая эметогенная способность некоторых препаратов,
Комбинированная терапия
Режим и способ введения препаратов
Высокие дозы химиотерапевтических препаратов (6).
Под уровнем эметогенности понимается риск развития рвоты у больных, получающих тот или иной цитостатик в монорежиме без противорвотной терапии. Например, высокий уровень эметогенности означает, что после введения препарата рвота будет развиваться более чем у 90 % больных. Классификация противоопухолевых препаратов в зависимости от уровня эметогенности по рекомендациям MASCC / ESMO представлена в табл. 1.
Таблица 1. Классификация противоопухолевых препаратов в зависимости от уровня эметогенности по рекомендациям MASCC / ESMO.
| Уровень эметогенности | Противоопухолевые препараты для внутривенного введения | Противоопухолевые препараты для приема per os |
| Высокий (рвота у 90 % больных и более) |
Цисплатин Мехлорэтамин Стрептозоцин Циклофосфан ≥ 1500 мг / м2 Кармустин (BCNU) Дакарбазин |
Гексаметилмеламин Прокарбазин |
|
Схема «АС»: • эпирубицин 100 мг / м2 или • доксорубицин 60 мг / м2 + – циклофосфамид 600 мг / м2 . 2) Режимы на основе карбоплатина |
||
| Умеренный (рвота у 30–90 % больных) |
Оксалиплатин Цитарабин > 1 г / м2 Карбоплатин Ифосфамид Циклофосфамид < 1500 мг / м2 Доксорубицин Даунорубицин Эпирубицин Идарубицин Иринотекан Азацитидин Бендамустиин Клофарабин Алемтузумаб Трабектидин Ромидепсин Тиотепа |
Циклофосфамид Темозоломид Винорельбин Иматиниб Кризотиниб Церитиниб Босутиниб |
| Низкий (рвота у 10–30 %) |
(Nab-) Паклитаксел Доцетаксел Митоксантрон Доксорубицин липосомальный Иксабепилон Топотекан Этопозид Пеметрексед Метотрексат Митомицин Гемцитабин Цитарабин ≤ 1000 мг / м2 5-фторурацил Винфлунин Темсиролимус Бортезомиб Цетуксимаб Трастузумаб(-эмтанзин) Панитумумаб Катумаксумаб Пертузумаб Афлиберцепт Ипилимумаб |
Капецитабин Тегафур Флюдарабин Этопозид Сунитиниб Эверолимус Лапатиниб Леналидомид Талидомид Афатиниб Дабрафениб Дазатиниб Ибрутиниб Олапариб Нилотиниб Пвзопаниб Регорафениб Вандетаниб Вариностат |
| Минимальный (< 10 % больных) |
Блеомицин Бусульфан 2-хлордеоксиаденозин Флюдарабин Винбластин Винкристин Винорельбин Бевацизумаб Офатумумаб Ниволумаб Пембролизумаб Пискантрон Пралатрексат |
Хлорамбуцил Гидроксиуреа L-фенилаланин мустард 6-тиогуанин Метотрексат Гефитиниб Эрлотиниб Сорафениб Мелфалан Вемурафениб Помалидомид Руксолитинб Висмодегиб |
ТИПЫ ТОШНОТЫ И РВОТЫ
По срокам и механизму развития выделяют 3 основных типа тошноты и рвоты, вызванной цитостатиками: острую, отсроченную и условно-рефлекторную (anticipatory – переводят также как «предшествующую», «преждевременную», «рвоту ожидания»), дополнительно выделяют неконтролируемую (breakthrough – «прорывную») и рефрактерную (7, 8).
Острая рвота развивается в первые 24 ч после химиотерапии, отличается высокой интенсивностью, редко сопровождается тошнотой.
Отсроченная рвота развивается на 2-е–5-е сутки после начала химиотерапии, менее интенсивна, чем острая, и, как правило, сопровождается постоянной тошнотой. Механизмы развития остаются неясными. Ведущая роль отводится субстанции P, серотонин имеет меньшее значение.
Условно-рефлекторная рвота представляет собой классический условный рефлекс на химиотерапию и / или сопутствующие ей манипуляции и окружающую обстановку. Формируется в тех случаях, когда противоопухолевая терапия сопровождается тошнотой и рвотой. Риск ее развития увеличивается пропорционально числу проведенных курсов и может сохраняться в течение длительного времени после окончания химиотерапии. Ведущую роль в формировании условного рефлекса играет многодневная умеренная или тяжелая тошнота. Лучшим методом профилактики условно-рефлекторной тошноты и рвоты является адекватная антиэметическая защита пациента уже с первого курса химиотерапии.
Неконтролируемая (breakthrough – «прорывная») тошнота и рвота развивается на фоне адекватной антиэметической профилактики и требует дополнительной коррекции. Рефрактерная рвота возникает на последующих циклах химиотерапии при неэффективности противорвотной профилактики и / или препаратов резерва на предыдущих курсах лечения.
ПРИНЦИПЫ СОВРЕМЕННОЙ ПРОТИВОРВОТНОЙ ТЕРАПИИ
1. Обязательность проведения, начиная с первого курса химиотерапии.
2. Введение антиэметиков до начала введения первого цитостатика.
3. Применение наиболее эффективных стандартных противорвотных комбинаций.
4. Применение каждого антиэметика, входящего в комбинацию, в адекватных дозах.
5. Соблюдение адекватной продолжительности противорвотной терапии.
6. Соблюдение необходимых для сохранения эффективной концентрации интервалов между приемами антиэметиков.
Критерием эффективности противорвотной терапии является полное отсутствие (полный контроль) рвоты и тошноты в течение 24 часов (период развития острой рвоты) с момента введения противоопухолевых препаратов.
Алгоритм профилактики и терапии тошноты и рвоты
1. Определить эметогенный потенциал назначенного режима ХТ.
2. Назначить профилактическую терапию, исходя из эметогенности режима ХТ.
3. Назначить лечение в случае развития тошноты и рвоты на фоне профилактической терапии.
4. Внести изменения в профилактическую терапию тошноты / рвоты на последующих циклах ХТ.
Антиэметики:
I. Антагонисты серотониновых рецепторов (5-HT3):
- Ондансетрон (УД — А)
- Гранисетрон (УД — А)
- Трописетрон (УД — А)
- Палоносетрон (УД — А)
II. Кортикостероиды: Дексаметазон (УД — А)
III. Антагонисты рецепторов NK1 :
- Апрепитант (УД — А)
- Фосапрепитант (УД — А)
- Ролапитант (УД — А)
- Нетупитант (УД — А)
IV. Антипсихотическое средство (нейролептик):
- Оланзапин (УД — А) (проявляет антагонизм в отношении серотониновых 5-НТ-, допаминовых и холинорецепторов).
Профилактика острой и отсроченной тошноты и рвоты при высокоэметогенной однодневной химиотерапии и при умеренно эметогенной однодневной химиотерапии.
В настоящее время наиболее эффективной антиэметической комбинацией при высокоэметогенной однодневной химиотерапии является комбинация противорвотных препаратов, включающая антагонистов NK1-рецепторов + антагонистов рецепторов серотонина (5-HT3) + дексаметазон.
Профилактика тошноты и рвоты, возникающей при проведении химиотерапии с умеренно эметогенным потенциалом, должна начинаться до начала химиотерапии и проводиться не менее 3 дней после проведения химиотерапии. Наиболее эффективной антиэметической комбинацией является комбинация противорвотных препаратов, включающая антагонистов рецепторов серотонина (5-HT3) + дексаметазон (табл 2,3) (9, 10).
Таблица 2. Обновленные рекомендации MASCC/ESMO 2016 ТРВХ.
Острая тошнота и рвота.
| Группы эметогенного риска | Антиэметики |
| Высокий (не АС) | 5-НТ3 + DEX+NK 1 |
| Высокий (АС) | 5-НТ3 + DEX+NK 1 |
| Карбоплатин | 5-НТ3 + DEX+NK 1 |
| Умеренный (кроме карбоплатина) | 5-НТ3 + DEX |
| Низкий | 5-НТ3 или DEX или DOP |
| Минимальный | Нет рутинной профилактики |
ТРВХ – тошноты и рвота, вызванная химиотерапией
MASCC — Multinational Association of Supportive Care in Cancer; ESMO – European Society for Medical Oncology
5-НТ3 — антогонисты серотиновых рецепторов
DEX— дексаметазон
NK 1 — антагонисты рецепторов нейрокинина такие как Апрепитант или
Фосапрепитант или
Ролапитант или NEPA (комбинация нетупитант и палоносетрон).
DOP— антогонист допаминовых рецепторов
ВНИМАНИЕ: Если антагонисты NK1 рецепторов недоступны при использовании схемы AC, палоносетрон является предпочтительным антагонистом 5-НТ3 рецепторов.
Таблица 3. Обновленные рекомендации MASCC/ESMO 2016 ТРВХ.
Отсроченная тошнота и рвота.
| Группы эметогенного риска | Антиэметики |
| Высокий (не АС) | DEX или (если APR 125мг для острой: (МСР+DEX) или (DEX+APR) |
| Высокий (АС) | Нет или (если APR 125мг для острой:APR+DEX) |
| Карбоплатин | Нет или (если APR 125мг для острой:APR) |
| Средний (не карбоплатин) | DEX можно использовать |
| Низкий | Профилактика не предусмотрена |
| Минимальный | Профилактика не предусмотрена |
DEX — дексаметазон
APR — апрепитант
MCP — метоклопромид
Ключевые обновления в рекомендациях по контролю ТРВХ, NCCN 2017:
Карбоплатин категоризируется как высокоэметогенный препарат при введении с площадью под кривой (ППК) ≥4, при введении с ППК <4, является умеренноэметогенным препаратом.
Инъекция подкожного гранисетрона пролонгированного действия теперь включена в рекомендации по профилактике тошноты и рвоты при высокоэмегоненной и умеренноэметогенной ХТ.
Новая схема профилактики ТРВХ из четырех препаратов теперь включена в рекомендации по профилактике ТРВХ при высокоэметогенной ХТ (11, 12).
Ключевые обновления в рекомендациях по контролю ТРВХ, ASCO 2017:
Взрослым пациентам, получающим высокоэметогенную химиотерапию цисплатином, либо комбиницией циклофосфамидов и антрациклина, к стандартному антиэметическому режиму (комбинация антагонистов рецепторов 5-НТ3 + антагонисты рецепторов NK1 + dex) следует добавить оланзапин.
Взрослым пациентам, получающим карбоплатин содержащую химиотерапию, а также детям, получающим высокоэметогенную химиотерапию, антагонисты рецепторов NK1 должны быть добавлены к стандартному антиэметическому режиму (комбинация антагонистов рецепторов 5-НТ3 + dex).
Если пациенты получают комбинацию антрациклина и циклофосфамида, прием дексаметазона можно ограничить с первым днем химиотерапии.Экспертная комиссия рекомендует начинать антиэметическую терапию с самой эффективной схемы, подходящей к химио- и радиотерапии, вместо того чтобы оценивать эметический ответ пациента на менее эффективную антиэметическую терапию (13).
Таблица 4. Обновленные рекомендации ASCO 2017.
Взрослые пациенты.
| Группы эметогенного риска | Антиэметики |
| Высокий (не АС) | 5-НТ3 + DEX* +NK 1+Olanzapine* |
| Высокий (АС) | 5-НТ3 + DEX* +NK 1+Olanzapine* |
| Карбоплатин | 5-НТ3 + DEX+NK 1 |
| Умеренный (кроме карбоплатина) | 5-НТ3 + DEX |
| Низкий | 5-НТ3 или DEX или DOP |
| Минимальный | Нет рутинной профилактики |
* — дексаметазон и оланзапин нужно продолжать на 2-4 день
Таблица 5. Рекомендуемые дозы антогонистов серотониновых рецепторов (5-НТ) для острой тошноты и рвоты.
| Препарат | Путь введения | Доза |
| Ондансетрон | в/в | 8мг или 0,15мг/кг |
| пероральный | 16мг* | |
| Гранисетрон | в/в | 1мг или 0,01мг/кг |
| пероральный | 2мг (или 1мг**) | |
| Трописетрон | в/в | 5мг |
| пероральный | 5мг | |
| Палоносетрон | в/в | 0,25мг |
| пероральный | 0,5мг |
* В рандомизированных исследованиях был протестирован режим 8 мг два раза в день.
** Некоторыми панелистами доза 1 мг более предпочтительна
Таблица 6. Рекомендуемые дозы кортикостероидов (дексаметазон)*
| Дексаметазон | Дозы и Кратность | |
| Высокий риск | Острая рвота | 20мг однократно (12мг когда используется апрепитант или нетупитант) )** |
| Отсроченная рвота | 8мг в течение 3-4 дней (8мг один раз в день когда используется апрепитант или нетупитант ) | |
| Умеренный риск | Острая рвота | 8 мг однократно |
| Отсроченная рвота |
8 мг ежедневно в течение 2-3 дней |
|
| Низкий риск | Острая рвота | 4-8 мг один раз в день |
* Несмотря на то, что другие кортикостероиды также являются эффективными антиэметиками, режим дозирования для дексаметазона, как препарата выбора, основан на широком распространении препарата, с несколькими формами дозирования
** Только 12 мг дексаметазона было исследовано с (фос) апрепитантами/нетупитантами в рандомизированных исследованиях
Таблица 7. Рекомендуемые дозы антагонистов NK1 рецепторов.
| Антагонисты NK1 Рецепторов | Дозы и кратность |
|
Апрепитант* и фосапрепитант острая рвота |
Апрепитант 125мг внутрь однократно в день химиотерапии* -или- Фосапрепитант 150 в/в, однократно в день химиотерапии |
|
Апрепитант* и фосапрепитант отсроченная рвота |
Апрепитант 80мг внутрь однократно в течении 2-х дней после химиотерапии |
| Ролапитант | 180мг внутрь однократно в день химиотерапии |
| Нетупитант | 300 мг нетупитант / 0,5 мг палоносетрон перорально один раз в день химиотерапии |
* Апрепитант 165 мг, одна доза перед химиотерапией (не применяется на 2-3 день). Рекомендовано ЕМА и другими органами.
Рекомендации по профилактики преждевременной тошноты и рвоты
Наилучший подход для профилактики преждевременной рвоты это наилучший контроль над острой и отсроченной рвотой.
Психотерапия, особенно прогрессивное обучение мышечной релаксации, систематическая десенситизация и гипноз, могут быть использованы для лечения преждевременной тошноты и рвоты.
Только бензодиазепины уменьшают частоту преждевременной тошноты и рвоты, но их эффективность имеет тенденцию к снижению при продолжающейся химиотерапии.
Кардиотоксичность
Кардиотоксичность возникает в основном при лечении антрациклинами- доксорубицин, фарморубицин, даунорубицин- и редко при использовании других препаратов: циклофосфамид, фторурацил, этопозид, тенипозид, паклитаксел, трастузумаб, лапатиниб. Различные препараты по разному воздействуют на сердечно- сосудистую систему в связи с неодинаковым механизмом кардиотоксичости: препараты, вызывающие снижение сократительной или расслабляющей функции миокарда(антрациклины), препараты, вызыващие или обостряющие ишемию(фторурацил, винкристин, винбластин, цисплатин), препараты, влияющие на проводящую систему, в результате чего возникает аритмия/ блокада проводимости(антрациклины, паклитаксел).
Основной способ предупреждения развития кардиотоксичности I типа(необратимые повреждения) при лечени анрациклинами- соблюдение предельных суммарных доз препаратов(доксорубицин ˃550мг/м2, фарморубицин ˃720мг/м2), использование пегилированного липосомного доксорубиина (келикс ˃900мг /м2). Необходмио раннее выявление кардиотоксичности с помощью Эхо КГ и ЭКГ(для пациентов всех возрастов при планировании системной ХТ препаратами антрациклинового ряда, трастузумабом- перед каждым введением, при назначении препаратов таксанового ряда, циклофосфамид, лапатиниб, этопозид, фторурацил- каждые 3 месяца).
При снижении Фракции выброса до 55-50%, необходима отсрочка введения химиопрепаратов до восстановления ФВ в норму, консультация кардиолога.
При снижении ФВ 50% и менее необходима отсрочка системного лечения до 3 месяцев, проведение коррегирующего лечения по назначению кардиолога.
Колониестимулирующая терапия:
Целесообразность назначения Г-КСФ для стимуляции кроветворения и преодоления миелосупрессии при фебрильной нейтропении (ФН) изучалась в нескольких рандомизированных исследованиях. На основании имеющихся данных сделаны следующие выводы относительно роли Г-КСФ в период ФН:
- Г-КСФ статистически значимо снижает длительность нейтропении на 1–2 дня;
- Г-КСФ не сокращает продолжительность лихорадки и длительность антибактериальной (АБ) терапии в случае развития ФН;
- Г-КСФ не снижает стоимости лечения одного эпизода ФН.
- Г-КСФ могут применяться в случае высокого риска ФН при состояниях, сопровождающихся повышенной смертностью, таких как гипотония, сепсис, пневмония, инфекции тканей, системная грибковая инфекция, длительная нейтропении (>7 дней) или глубокой нейтропении.
Большинство медицинских онкологических сообществ (NCCN, ASCO, EORTC, RUSSCO) рекомендуют использовать следующие Г-КСФ: липэгфилграстим, эмпэгфилграстим, пэгфилграстим (филграстим, соединенный с полиэтиленгликолем), филграстим (негликозилированный Г-КСФ), ленограстим (гликозилированный Г-КСФ). Липэгфилграстим, эмпэгфилграстим и пэгфилграстим представляют собой препараты пролонгированного действия и вводятся однократно после курса ХТ. Пролонгированное действие обусловлено тем, что препарат не выводится с мочой и дольше циркулирует в крови.
Таблица 8. Перечень препаратов Г-КСФ
| МНН | Группа КСФ | Режим введения |
|
Филграстим (УД — А) |
Рекомбинантный человеческий негликолизированный Г-КСФ | 5 мкг/кг массы тела 1 раз/сут. п/к или в/в ежедневно через 24–72 часа после последнего дня ХТ до необходимого стабильного АЧН |
|
Пэгфилграстим (УД — А) |
Рекомбинантный пегилированный Г-КСФ (филграстим), конъюгированный с полиэтиленгликолем, пролонгированного действия | 6 мг (без учета массы тела) однократно п/к не ранее чем через 24 часа и не позднее 14-ых сут. после курса ХТ |
|
Липэгфилграстим (УД — А) |
Гликопегилированный Г-КСФ пролонгированного действия | 100 мкг/кг или 6 мг (без учета массы тела) п/к однократно через 24 ч после окончания цикла ХТ |
|
Эмпэгфилграстим (УД — А) |
Ковалентный коньюгат филграстима с одной молекулой полиэтиленгликоля, пролонгированного действия | 7,5 мг (без учета массы тела) п/к однократно не ранее чем через 24 часа и не позднее 14-ых сут. после курса ХТ |
|
Ленограстим (УД — А) |
Рекомбинантный человеческий гликолизированный Г-КСФ | 19,2 млн. МЕ (или 150 мкг) на м² поверхности тела (0,64 млн. МЕ или 5 мкг на кг массы тела) в день п/к или в/в ежедневно через 24–72 часа после последнего дня ХТ до достижения необходимого стабильного АЧН |
(УД — А)
Таблица 9. Показания для назначения колониестимулирующих факторов
| Первичная профилактика | Вторичная профилактика |
|
|
|
!!! Первичная профилактика Г-КСФ не показана во время ХЛТ на область грудной клетки, так как увеличивает частоту миелосупрессии и риск осложнений и смерти. |
Коррекция анемии:
Анемия при новообразованиях (В63.0 код по МКБ 10) определяется как снижение концентрации Hb ниже нормального значения (обычно 120 г/л) и может быть обусловлена как наличием самой опухоли, так и ее лечением. Слабая степень анемии представляет собой снижение концентрации Hb в диапазоне от 100 до 119 г/л, анемия средней степени – концентрация Hb от 80 до 99 г/л, тяжелая анемия – концентрация Hb ниже 80 г/л.
Таблица 10. Препараты рекомендованные для лечения анемии у онкологических больных
| Группа препарата | Препарат, рекомендованная доза |
| Эритропоэзстимулирующие препараты (УД — А) |
Эпоэтин альфа 150 МЕ/кг × 3 раза в нед. п/к 12 000 МЕ × 3 раза в нед. п/к 40 000 МЕ × 1 раз в нед. п/к |
| Эпоэтин бета 30 000 МЕ × 1 раз в нед. п/к | |
| Эпоэтин тета 20 000 МЕ × 1 раз в нед. п/к | |
|
Дарбэпоэтин альфа 2,25 мкг/кг × 1 раз в нед. п/к 500 мкг × 1 раз в 3 нед. п/к |
|
| Препараты железа (УД — А) |
Железа [III] гидроксид сахарозный комплекс 200 мг × 3 раза в нед. в/в струйно 7 мг железа/кг массы тела, в однократной дозе не более 500 мг железа, в/в инфузия не менее 3,5 часов |
|
Железа карбоксимальтозат 200 мг железа × 3 раза в нед. в/в струйно 20 мг максимального железа/кг массы тела в однократной дозе не более 1000 мг, в/в капельно не менее 15 мин. |
|
|
Железа [III] гидроксид декстран 100–200 мг × 2–3 раза в нед. в/в струйно 20 мг/кг железа в/в инфузия 4–6 часов |
|
| Витамины | Цианкобаламин (Витамин В12) 0,5 мг/мл – 1,0 мл, п/к через день |
| Фолиевая кислота 2 мг/сут. внутрь |
Медикаментозное лечение, оказываемое на этапе скорой медицинской помощи:
Гемостатическая терапия;
Аминокапроновая кислота 5% -100мл, по 100 мл в/в 1 раз в день;
Этамзилат 12,5%-2мл, по 2 мл в/м 2 раза в день;
Дицинон 1 мл, по 1,0 мл в/м 1 – 2 раза в день.
Жаропонижающая терапия;
Ацетилсалициловая кислота 0,5 гр, по 0,5 гр peros2 раза в день;
Парацетамол0,5гр, по 0,5 гр peros, 3 раза в день.
Аналгетическая терапия;
Кетопрофен 1мл, по 1 мл, в/м 2-3 раза в день;
Диклофенак натрия в/м 2 – 3 раза;
Трамадола гидрохлорид 1 мл, по 1мл в/м 2 – 3 раза в день;
Гормональные терапия
Преднизолон 30мг, по 30 – 60 – 90 мг в/в 1 раз в день;
Дексаметазон 4 мг, по 4 – 8 – 12 – 16 – 20 мг 1 раз в день;
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Шейкой матки называется выступающая часть органа, которая находится внутри половых путей. В этой области женской репродуктивной системы могут возникать различные опухоли – доброкачественные и злокачественные.
Специализированный Санкт-Петербургский «Центр патологии шейки матки и вульвы» на базе «Университетской Клиники» предлагает самые современные методы диагностики на новейших видеокольпоскопах и все варианты органосохраняющего лечения женской репродуктивной системы! Лазерное и радиоволновое лечение на современных лазерных и радиоволновых установках!
Причины возникновения опухолей шейки матки
- Воспалительные процессы. Научные исследования показали, что онкология редко возникает на здоровых тканях. В большинстве случаев ей предшествует воспаление матки, шейки и влагалища.
- Инфицирование папилломавирусом. Этот возбудитель вызывает диспластические (предраковые) поражения. Возникает дисплазия (CIN), сначала имеющая поверхностный характер, а затем проникающая в более глубокие ткани. В результате возникает рак на месте (карцинома in situ), который потом переходит в инвазивную форму, прорастающую вглубь и дающую метастазы по всему организму.
- Фоновые поражения слизистой – эрозии (эктопии), эктропион (выворот слизистой), кондиломы (генитальные бородавки).
- Кератозы – лейкоплакия и эритроплакия, относящиеся к предраковым патологиям. При этих болезнях на слизистой образуются плотные очаги белого или красного цвета.
- Гормональные нарушения.
- Климактерический и предклимактерический периоды.
- Микротравмы тканей, вызванные абортами.
Онкологию провоцируют курение, работа с вредными веществами (канцерогенами), стрессы, беспорядочные незащищенные половые контакты.
В какой части шейки матки могут возникать опухоли
Новообразования могут поражать:
- Наружную слизистую (эктоцервикс).
- Цервикальный канал (эндоцервикс), соединяющий матку и влагалище.
- Мышцы и другие внутренние ткани.
- Перешеек матки – участок, расположенный между шейкой и телом матки.
- Культю шейки, оставшуюся после операций на матке, – здесь могут образоваться рецидивы удаленных опухолей.
- Окружающие ткани – позадишеечные и позадибрюшинные.
В штате Университетской клиники два онкогинеколога, четыре специалиста по патологии шейки матки. Все врачи прошли обучение по методам диагностики и лечения патологии шейки матки и вульвы и раннему выявлению рака этих органов. Наши лучшие врачи.
Доброкачественные опухоли шейки матки
- Миомы, образованные из мышечного слоя. Представляют собой узлы разного размера. Могут увеличиваться в размерах, вызывая слишком длительные и обильные месячные, бесплодие, боль, проблемы с мочеиспусканием и дефекацией.
- Аденофибромы и аденомиомы – доброкачественные новообразования, состоящие из клеток желез шейки и соединительной или мышечной ткани. Увеличиваясь, вызывают менструальную дисфункцию, боли, запоры, задержку мочи, проблемы с беременностью.
- Герминогенные новообразования, развившиеся из первичных половых клеток, которые во время внутриутробного развития девочки формируют органы репродуктивной системы. Эти образования не растут, не болят, но могут стать причиной бесплодия и невынашивания.
- Полипы – доброкачественные опухолевидные наросты на слизистой. Кровоточат после интимной близости и спринцеваний.
- Кисты – представляют собой протоки желёз, закупоренные слизью. Во время осмотра выглядят как светлые наросты на шейке. Могут лопаться с образованием язв, инфицирование которых приводит к тяжелым воспалительным процессам.
- Невусы – пигментные пятна, которые могут располагаться на любой части тела, в том числе на шейке матки. Опасны переходом в крайне агрессивный рак – меланому.
Новообразования могут быть единичными, множественными и иметь разный размер. От этих особенностей зависит метод их лечения.
Злокачественные опухоли шейки матки
- Плоскоклеточный рак – карцинома развивается из клеток плоского эпителия, образующего эктоцервикс. Существует несколько видов плоскоклеточного рака, отличающихся степенью злокачественности, скоростью роста и образования метастаз.
- Железистые злокачественные опухоли аденокарциномы формируются из эндоцервикса – тканей цервикального канала, проходящего внутри шейки.
- Карциноиды – редкие варианты рака шейки матки, имеющие медленный рост и долго не дающие метастазы.
- Саркомы шейки матки могут возникать из мышц, нервов, лимфатических, сосудистых и других клеток. В отличие от рака, появлению сарком не предшествуют предраковые заболевания. Возникают они не только у женщин, но и подростков и даже девочек.
- Меланомы – редкие, но крайне опасные онкопатологии. Быстро растут и дают метастазы.
- Переходные формы рака, состоящие из нескольких типов клеток.
- Недифференцируемые агрессивные новообразования, клеточные структуры которых настолько изменены, что невозможно определить, из какой ткани они образовались.
Дистанционная или очная оценка консультация опытным врачом, специалистом по патологии шейки матки и вульвы, гинекологом высшей квалификационной категории с назначением лечения в одной из лучших гинекологических клиник Санкт-Петербурга за 2000 рублей. Инновационные методы комплексного лечения, эрозии, дисплазии, псевдоэрозии, кондиломы, лейкоплакии, круароза вульвы, склерозирующего лихена.
Классификация опухолей шейки матки
Онкопатологии этой репродуктивной области отличаются разной степенью дифференцированности. Чем она выше, тем агрессивнее новообразование и быстрее оно растет:
- Высокодифференцированные новообразования (G1) имеют клетки, мало отличающиеся по своей структуре и свойствам от доброкачественных. Имеют наиболее благоприятное течение, медленно растут и поздно дают метастазы.
- Средняя степень дифференцированности (G2) присуща образованиям, имеющим среднюю степень злокачественности и умеренный рост. Они агрессивнее и опаснее высокодифференцированных.
- Низкодифференцированные (G3) – самые агрессивные формы онкологии, характеризующиеся быстрым ростом и ранним проявлением метастаз.
Степень дифференцированности клеток определяют лабораторным путем с помощью клеточного анализа.
Новообразования шейки матки делятся по типу роста:
- Экзофитные, выступающие над поверхностью слизистой. Могут быть похожи на бородавки, цветную капусту или выступающие наросты. Увеличиваясь в размерах, перекрывают цервикальный канал и сдавливают соседние органы.
- Эндофитные – распространяющиеся вглубь тканей. Злокачественные узлы разрушают ткани и сосуды шейки, приводя к кровотечениям, опасным для жизни. Могут выглядеть как язвы различных размеров.
- Смешанные – распространяются одновременно в глубь тканей и наружу. Часто бывают агрессивными и быстрорастущими.
Опухоли могут менять тип роста – некоторые вначале выглядят как наросты на шейке, а затем распадаются, превращаясь в язву.
Новообразования разделяют по их расположению:
- Ретроперитонеальные находятся в окружающей клетчатке. Их рост сопровождается отслоением брюшины от позвоночника, что приводит к сильным болям.
- Ретроцервикальные – располагаются на задней части шейки. Во время роста давят на прямую кишку, вызывая проблемы с дефекацией. Могут прорастать в кишечник.
- Антецервикальные новообразования расположены на передней части шейки. Разрастаясь, они давят на мочевой пузырь и мочеиспускательный канал, приводя к нарушениям выделения мочи.
- Субперитонеальные – расположены на перешейке матки. Их рост сопровождается отслоением брюшины от передней брюшной стенки, что вызывает боль даже на самых ранних стадиях.
- Парацервикальные – находятся в боковых отделах шейки.
Стадии развития злокачественных опухолей
Злокачественные новообразования делятся по стадиям развития. Чем она выше, тем тяжелее лечение и хуже прогноз.
Tis (опухоль на месте). Нулевая стадия, которая выявляется только во время лабораторной диагностики анализов. Онкология, обнаруженная на этой стадии, лечится с практически 100% прогнозом выживаемости.
Проверка эрозии на рак за один визит со скидкфой 30% за 4900 рублей. Включено: консультация врача специалиста по патологии шейки матки, цифровая высокоточная видеокольпоскопия, комплексный анализ на онкогенный ВПЧ, современное цитологическое исследование (жидкостная цитология). Иформация здесь!
1 стадия – начало интенсивного роста. На этом этапе новообразования выявляются в тканях, отправленных в лабораторию после операции, например после конизации – удаления участка, пораженного предраковыми патологиями. К этой стадии относятся образования размером до 7 мм. Имеют относительно благоприятный прогноз лечения.
| Стадия | Описание |
| IA, Т1а | Малоинвазивные (микроинвазивные), имеющие очень небольшие размеры |
| Т1а1,IA1 | Распространившиеся в глубину на 3-4 мм |
| Т1а2, IA2 | Распространившиеся в глубину на 5 мм |
2 стадия. Патологические очаги видны при гинекологическом осмотре. Стадия присваивается образованиям, проникшим в ткани не глубже 5 мм.
| Стадия | Описание |
| Т1в1, IB1 | Размер меньше 4 см |
| T1b2, IB2 | Размер больше 4 см |
3 стадия – онкологический процесс распространился на влагалище и таз. Новообразование может перекрыть пути оттока мочи, приводя к гидронефрозу – скоплению урины в почке, вызванному невозможностью оттока мочи. Иногда почка полностью перестает функционировать.
| T3a, IIIIA | Процесс перешел во влагалище, но не затронул стенки таза |
| T3b, IIIB | Злокачественная опухоль распространилась на тазовую область и перекрыла пути оттока мочи |
4 стадию присваивают запущенной, часто неоперабельной онкологии, перешедшей на соседние органы.
| T4a, IVA | Образование поразило тазовые органы, но не вышло за его пределы |
| T4b, IVB | Злокачественный процесс вышел за границы тазовой области |
Другие обозначения, применяемые при классификации
| Обозначение | Расшифровка |
| М0 | Метастазы не обнаружены. Это значит, что онкология пока не дала вторичные очаги в других органах |
| М1 | Обнаружены метастазы в легких, печени, позвоночнике |
| N0 | Лимфатические узлы не поражены – в них нет злокачественных клеток |
| N1 | Поражение лимфоузлов. В начале поражаются ближайшие, а затем отдаленные. При раке шейки матки могут обнаруживаться злокачественные клетки в подключичных лимфатических узлах (вирховский метастаз). |
Классификация опухолей шейки матки по МКБ-10
В международном классификаторе МКБ-10 злокачественным и доброкачественным опухолям шейки матки присвоено несколько кодов.
| Тип опухоли | Уточнение | Обозначение по МКБ-10 |
| Карцинома in situ | Общее обозначение | D06 |
| Внутренней части шейки | D06.0 | |
| Наружной части | D06.1 | |
| Других частей | D06.7 | |
| Неуточненная | D06.9 | |
| Злокачественное новообразование | Общее обозначение | C53 |
| Внутренней части шейки | C53.0 | |
| Наружной части | C53.1 | |
| Других частей | ||
| Выходящее за пределы одной области | C53.8 | |
| Неуточненное | C53.9 | |
| Миома (леомиома) | Общее обозначение | D25.0 |
| Неуточненная | D25.9 | |
| Полипы шейки матки | N84.1 | |
| Эмбриональная киста | Q51.6 | |
| Другие доброкачественные новообразования | D26.0 |
Симптомы опухолей шейки матки
Небольшие злокачественные узлы не вызывают жалоб. Однако по мере их роста и разрушения тканей появляются кровотечения – первый симптом болезни. Выделение крови может быть разной интенсивности – от нескольких капель до достаточно большого объема.
Возникают обильные прозрачные или мутные бели – еще один признак онкологии. Выделения вызываются поражением желёз и разрушением лимфатических сосудов. В выделениях могут наблюдаться кровянистые прожилки. При распаде злокачественного новообразования бели становятся гнойными, с неприятным запахом.
Больных беспокоят боли, усиливающиеся по мере роста опухолевого узла. Болезненные ощущения возникают внизу живота, в пояснице, крестце, паховой области. На терминальных стадиях боль настолько сильна, что требует назначения наркотических препаратов.
Наблюдаются отеки, вызванные нарушением оттока лимфы и крови из нижних конечностей. При метастазах в печень развивается водянка живота – асцит, – сопровождающаяся скоплением жидкости в брюшной полости.
Нарушение функции соседних органов вызывают не только злокачественные опухоли, но и крупные доброкачественные. Они сдавливают пути оттока мочи, кишечник, нервы, сосуды.
Онкопатологии приводят к появлению свищей, соединяющих шейку матки с прямой кишкой и органами мочевыделения. У больных возникает примесь крови в кале и моче.
Третья-четвёртая стадия онкологии сопровождаются симптомами и признаками общего отравления (интоксикации) организма – слабостью, тошнотой, ухудшением аппетита, повышением температуры, похудением.
По мере появления метастаз появляются боль справа под ребрами в области печени, кровь в мокроте. Эти признаки указывают на запущенный онкологический процесс.
Диагностика опухолей шейки матки
- Гинекологический осмотр – врач осматривает слизистую шейки, на которой могут обнаруживаться наросты, язвы, кисты и предраковые очаги. Крупные новообразования выявляются во время двуручного исследования, при котором врач ощупывает матку и придатки.
- Видеокольпоскопия. При этом исследовании половые пути осматривают с помощью прибора кольпоскопа, снабженного источником света и видеокамерой. Полученное изображение передаётся на монитор, и врач может детально осмотреть экзоцервикс.
- Диагностические пробы с уксусной кислотой и йодными растворами, проводимые во время кольпоскопии. Воздействие этих препаратов на слизистую делает патологические очаги лучше видимыми и позволяет точнее определить их размеры.
- Гистероскопия – осмотр эндоцервикса и внутренней поверхности матки. Назначается при подозрении на злокачественные образования матки, шейки и перешейка. Дает возможность увидеть патологические очаги, не обнаруживаемые при гинекологическом осмотре на зеркалах.
- Мазок на цитологию, выявляющий раковые и предраковые клетки. Применяется при подозрении на злокачественные новообразования и при профилактических осмотрах.
- УЗИ органов малого таза, во время которого обнаруживаются опухоли, расположенные в различных отделах репродуктивной системы. Выглядят они как тёмные или пестрые очаги различного размера. Злокачественные образования отличаются отсутствием четких очертаний и размытыми контурами. Исследование позволяет увидеть поражение соседних органов и лимфатических узлов.
- Диагностическое выскабливание цервикального канала. Полученные образцы отправляют в лабораторию, где исследуют на рак и предрак.
- Биопсия – взятие небольших фрагментов тканей с подозрительных участков на гистологию (клеточный анализ).
- Сдача крови на онкомаркеры. Обнаружение этих веществ в крови указывает на возможное наличие рака. Исследуются маркеры:
- SCC – максимальная концентрация – 1,5 нг/мл.
- Cyfra-21-1 – максимальный показатель – 3,3 нг/л.
Современные методы диагностики выявляют новообразования на самых ранних стадиях, когда их еще можно вылечить. Главное – регулярно посещать гинеколога и следить за состоянием репродуктивной системы.
Биопсия шейки матки, самый достоверный метод диагностики доброкачественной патологии шейки матки и рака без боли за 6200 рублей. Включено: биопсия прицельная радиоволновая под контролем цифровой видеокольпоскопии, гистологическое исследование с определением перспектив злокачественного развития патологии.
Лечение опухолей шейки матки
Для лечения доброкачественных новообразований – миом, аденофибром, аденомиом, – имеющих небольшие размеры, назначают комбинированные оральные контрацептивы, нормализующие гормональный фон. Применяются и другие препараты, подбираемые для каждой пациентки. Крупные образования удаляют.
Кисты и полипы убирают с помощью лазера или радиоволнового метода. Эти методы не вызывают образования рубцов и деформацию тканей, поэтому могут назначаться женщинам, которые еще планируют беременность и роды.
Злокачественные образования удаляют. При распространённых формах проводится удаление матки, поражённых лимфоузлов и яичников. При онкологии применяют химио-, лучевую и гормональную терапию, которую зачастую сочетают с операцией.
Профилактика заключается в своевременном обращении к врачу, регулярной сдаче анализов, прохождении УЗИ, лечении предраковых патологий и воспалительных процессов.
Эффективность лечебных мероприятий при онкологии напрямую зависит от времени обращения. Заговорить опухоли или убрать их с помощью других немедицинских способов невозможно. Промедление только усложнит лечение и ухудшит прогноз.
При подозрении на опухоли или предраковые состояния шейки матки нужно обратиться в «Университетскую клинику». Здесь работают опытные гинекологи-онкологи и имеется необходимое лечебно-диагностическое оборудование.
Комплексное ежегодное обследование для женщин за 3900 рублей: прием+мазки+УЗИ гинекологическое. Информация здесь!