Гипермаркет для медиков

Время работы (по Москве)
пн • вт • ср • чт • пт • сб • вс
9-20
Звонок по России бесплатный

Остеопороз. Руководство
| Артикул | NF0024487 |
|---|
| ISBN |
978-5-9704-7145-6 |
|---|---|
| Издательство |
ГЭОТАР-Медиа |
| Автор |
Под ред. О.М. Лесняк |
| Год |
2023 |
| Страниц |
752 |
| Переплет |
твердый |
2970 руб.
В наличии
-
Описание
-
Комментарии
Второе издание руководства по остеопорозу (первое вышло в 2016 г.) включает как обновленные главы, входившие в первое издание, так и обширный новый материал, отражающий быстрое развитие науки и появление новых теоретических и клинических данных в области метаболических заболеваний скелета. Появились главы по ювенильному и пременопаузному остеопорозу, новым технологиям инструментальной диагностики, вторичному остеопорозу при разных хронических заболеваниях и др. Книга освещает широкий круг вопросов, начиная от эпидемиологии и патогенеза заболевания и заканчивая обсуждением организации служб профилактики повторных переломов.
Руководство подготовлено мультидисциплинарным коллективом отечественных и зарубежных специалистов в области остеопороза и предназначено широкому кругу врачей терапевтических и хирургических специальностей, а также организаторам здравоохранения. Помимо этого, руководство будет полезно студентам, ординаторам, фельдшерам и медицинским сестрам.
Укажите регион, чтобы мы точнее рассчитали условия доставки
Начните вводить название города, страны, индекс, а мы подскажем
Например:
Москва,
Санкт-Петербург,
Новосибирск,
Екатеринбург,
Нижний Новгород,
Краснодар,
Челябинск,
Кемерово,
Тюмень,
Красноярск,
Казань,
Пермь,
Ростов-на-Дону,
Самара,
Омск
Отрывок из книги «Руководство по натуральной медицине» — Пиццорно Дж. Е., Мюррей М. Т. Купить книгу
Клиническая картина
• Обычно протекает бессимптомно до появления сильной боли в спине.
• Распространен у женщин в постменопаузе и мужчин старше 70 лет или принимающих ингибиторы ароматазы и глюкокортикоиды.
• Отсутствие травматических переломов бедра и позвонка.
• Уменьшение роста.
• Определяется как Т-критерий на уровне —2,5 или ниже минеральной плотности кости (МПК) у молодого здорового взрослого.
Общие положения
• Остеопороз (ОП) является наиболее распространенным заболеванием костей у людей и представляет серьезную угрозу для здоровья женщин в постменопаузальном периоде. Особенности включают: низкую костную массу, ухудшение микроархитектуры костной ткани, хрупкость костей, снижение прочности костей и повышенный риск переломов.
• Каждый год в США происходит приблизительно 1,5 млн переломов вследствие остеопороза (ОП), из которых 250 тыс. переломов бедра.
• После остеопоротического перелома бедра риск смерти женщины удваивается; риск смерти мужчины увеличивается втрое.
• -2096 пациентов, перенесших остеопоротический перелом шейки бедра, умирают в последующие 6 мес, 50 % выживших не смогут ходить без посторонней помощи, а 25% нуждаются в длительном домашнем уходе.
Хотя по прогнозам афроамериканцы являются этнической группой с наименьшим риском ОР, заболевание встречается у 53 % афроамериканских женщин и 24% афроамериканских мужчин. Это означает, что более чем у половины всех афроамериканских женщин и у четверти всех афроамериканских мужчин развивается остеопения или остеопороз.
• У белой расы риск низкой костной массы и ОП еще выше; в настоящее время прогнозируется развитие заболевания у 77% женщин и у 4396 мужчин.
• Латиноамериканцы, однако, страдают в наибольшей степени: 86% латиноамериканских женщин и 53% латиноамериканских мужчин теряют столько костной ткани, что риск переломов остеопороза значительно возрастает.
• С 2015 до 2025 г. у латиноамериканцев ожидается увеличение частоты переломов вследствие остеопороза на 175%. Более 50 % патологических переломов отмечается у женщин с остеопенией, к тому же эта группа женщин, перенесших патологический перелом, подвержена такому же риску переломов, что и женщины с ОП.
• Переломы позвонков грудного и (или) поясничного отдела вызывают боль, уменьшение роста и выраженный кифоз или деформацию грудного отдела позвоночника с ограничением объема движений, изменением походки, ограничением функции легких и проблем, связанных с пищеварением. Перелом позвоночника предполагает увеличение риска последующих переломов позвоночника как минимум в 5-7 раз.
• Депрессия, тревожность, низкая самооценка и потеря зубов тоже являются следствием остеопороза.
Патофизиология
• Ремоделирование кости — это процесс резорбции (разрушения) костной ткани и ее формирования. При резорбции кости остеокласты вызывают ферментативное растворение минералов и белков. Остеобласты образуют белковый матрикс коллагена для реминерализации и формирования кости. Ремоделирование кости обычно представляет собой равновесие между ее резорбцией и формированием. Дисбаланс между удалением и замещением приводит к потере костной ткани и риску перелома.
• Костная масса быстро увеличивается в детском возрасте; это увеличение ярко выражено в позднем подростковом периоде, но продолжается и после 20 лет. У женщин процесс формирования костной ткани завершается к 17 годам. Пик костной массы приходится на 28 лет, после чего происходит ее медленная потеря со скоростью 0,4 % в год, главным образом в области шейки бедренной кости. После менопаузы потеря костной ткани ускоряется на 2 % каждый год в первые 5—10 лет. Этот процесс продолжается у женщин старше 70 лет с гораздо меньшей скоростью.
Факторы риска остеопороза
• Генетические факторы: уровень пика костной ткани определяется генетическими факторами. Переломы в анамнезе у родственников первой степени родства повышает риск переломов. Молодые дочери женщин с ОП переломами и родственники первой степени родства с ОП обладают субнормальной костной массой. Чернокожие женщины обладают большей костной массой по сравнению с белыми женщинами. На сегодняшний день доступно геномное исследование, позволяющее определить предрасположенность к дефекту рецепторов витамина D (VDR). Женщины с дефектом VDR требуют значительно большего уровня витамина D, предпочтительнее в виде D3. Новый ключевой генетический фактор: полиморфизм сайтов VDR, часть которых может обладать повышенной потребностью в витамине D.
• Дефицит витамина D: роль витамина D в поддержании нормального состояния костной ткани недооценивается. Плотность кости напрямую связана с 25-гидроксихолекальциферолом [25(ОН)D3] и обратно пропорциональна переломам всех типов.
• Дефицит витамина К; остеокальцин, который вводит кальций (Са) в кость, и матриксный белок Gla, который предотвращает отложение кальция в артериях, являются витамин-К-зависимыми белками.
• Образ жизни: образ жизни, гормональные факторы, Са, прием витаминов D и К2 физические упражнения, возраст менархе, регулярность менструального цикла, а также употребление алкоголя и табака оказывают большее влияние, чем генетические факторы, которые составляют всего 30 % риска развития ОП. Требования в период достижения пика костной массы: сбалансированная диета, адекватные калории, постоянный прием белка и Са на протяжении всей жизни. Са, Mg, витамин К2 и витамин D3 имеют критически важное значение для пожилых женщин. Потребности в Са с возрастом меняются: после 65 лет организм женщины усваивает на 50 % меньше Са, чем в молодости. Активность ферментов почек, продуцирующих активный витамин D, снижается.
• Пищевой белок: высокое потребление животного, а не растительного белка связано с повышенным риском перелома костей предплечья. Красное мясо является источником кислоты, вызывая высвобождение солей из кости для создания кислотного баланса и поддержания кислотнощелочного гомеостаза. Диета, богатая фруктами, овощами и растительными белками, является щелочной диетой.
• Курение: сигареты содержат большое количество кадмия и никотина, которые вызывают потерю костной ткани. Курящие женщины теряют костную ткань быстрее, обладают более низкой костной массой и характеризуются более высокой частотой переломов. У курильщиц менопауза наступает на 2 года раньше. Курение повышает печеночный клиренс эстрогенов.
• Алкоголь: употребление 200 мл алкоголя в день (злоупотребление) повышает риск падений и перелома бедренной кости. Умеренный прием алкоголя снижает риск перелома бедренной кости у пожилых женщин; алкоголь в небольших дозах замедляет резорбцию кости, повышая уровень эстрадиола и экскрецию серотонина.
• Отсутствие физической активности: лица с высокой активностью обладают большей костной массой; длительное пребывание в постели или прикованность к инвалидной коляске вызывает стремительную потерю кости. Упражнения снижают риск ОП за счет стимуляции остеобластов.
Гормональные факторы остеопороза
• Менопауза: все женщины утрачивают костную ткань, однако ускоренная потеря происходит в первые 5 лет менопаузы. Снижение уровня эстрогена уменьшает скорость резорбции кости. Чем раньше это происходит до наступления среднего возраста менопаузы (51 год), тем быстрее кости утрачивают защитный эффект эндогенного эстрогена. Преждевременная менопауза (до 40 лет), позднее менархе в подростковом возрасте, периоды аменореи из-за низкого уровня эстрогена в репродуктивном возрасте (например, гипоталамическая аменорея) или частые менструации повышают риск развития остеопороза. Костная масса позвоночника у женщин, пропустивших до половины ожидаемых менструальных периодов, на 120/0 меньше; у женщин, пропустивших более половины периодов, костная масса на 31 % меньше костной массы здоровых женщин из контрольной группы.
• Концентрация Са в крови строго поддерживается в узких границах. Снижение запускает повышенную секрецию паратгормона (ПТГ) и снижает секрецию кальцитонина щитовидной и паращитовидными железами. Избыток Са запускает сниженную секрецию ПТГ и повышает секрецию кальцитонина.
• ПТГ повышает содержание Са в сыворотке, увеличивая катаболизм остеокластов в кости, снижает экскрецию Са почками, повышает всасывание Са в кишечнике и повышает преобразование в почках 25-(OH)D3 дополнительные факторы
Чем больше факторов риска, тем выше потенциальное снижение костной массы и риск переломов. Факторы риска сами по себе не включают адекватную оценку низкой костной массы, но помогают при клинической оценке рисков для разработки оптимальной стратегии профилактики. Риск для каждой женщины — это наиболее важный параметр здоровья костей в будущем. Заболевания и лекарственные препараты могут нарушать нормальный метаболизм кости.
• Вторичные причины потери костной ткани:
— лекарственные препараты: ингибиторы ароматазы, цитотоксические препараты, избыточная терапия гормонами щитовидной железы, агонисты гонадотропин-релизинг фактора или его аналоги, некоторые антиконвульсанты при длительном приеме (например, фенитоин), применение глюкокортикоидов более З мес;
— генетические нарушения: гемохроматоз, гипофосфатазия, несовершенный остеогенез, талассемия, нарушения баланса Са, экскреция Са с мочой; — эндокринопатии: избыток кортизола, синдром Кушинга, гипертиреоз, недостаточность гонад, первичный гиперпаратиреоз, гиперкальциурия, дефицит витамина D, заболевания желчного пузыря, СД(1), гипоталамическая аменорея, преждевременная недостаточность яичников;
— заболевания ЖКТ: первичный билиарный цирроз, мальабсорбция, гипохлоргидрия, непереносимость лактозы, целиакия, болезнь Крона, тотальная гастрэктомия, шунтирование желудка;
— другие заболевания: анкилозирующий спондилоартрит, хроническая почечная недостаточность, лимфома и лейкоз, множественная миелома, нервная анорексия, булимия, ревматоидный артрит.
Диагностические принципы остеопороза
• Обследование всех женщин в постменопаузальном периоде на факторы риска — анамнез, физикальное обследование, диагностические тесты. Цели обследования: выявить женщин с риском ОП или переломов, диагностировать ОП и (или) определить тяжесть ОП, исключить все вторичные причины потери костной ткани, определить факторы риска падений и травм.
• Диагностика рисков переломов ВОЗ по шкале оценки рисков переломов FRAX: анамнез пациента (личный анамнез переломов после 40 лет, анамнез переломов шейки бедра у родителей, курение, злоупотребление алкоголем, прием глюкокортикоидов, ревматоидный артрит или другие вторичные причины ОП), тест на плотность кости и калькулятор рисков FRAX являются инструментами для определения риска переломов. Необходимо использовать калькулятор FRAX для ПМ женщин с низкой плотностью костной ткани, но без ОП. Он определяет вероятность развития ОП в ближайшие 10 лет и вероятность перелома шейки бедра. Калькулятор риска FRAX доступен в онлайн-версии.
• для выявления факторов риска акцентируйте внимание на анамнезе и физикальном обследовании. Физические признаки ОП: уменьшение роста более чем на 3,8 см (необходимо измерять рост ежегодно). Выраженный кифоз в грудном отделе позвоночника, кариес, потеря зубов, рецессии десен, боль в пояснице.
• Рентгенологическое исследование МПК: исследование МПК — наилучший метод диагностики ОП. Золотым стандартом диагностики является ДЭРА. К другим методам относятся: КТ, УЗИ пяточной кости, рентгенография; ни одно из этих исследований не является идеальным с точки зрения диагностики и последующего наблюдения.
• Необходимо регистрировать массу тела, чтобы выявить женщин с низким ИМТ и, следовательно, с повышенным риском низкой МПК. Расспросите и обследуйте пациента на предмет острой или хронической боли в пояснице, признаках болезненности при перкуссии и исследовании плотности кости. Оцените риск падений, который повышается с приемом лекарств, влияющих на равновесие и координацию; мышечную слабость, нарушение зрения, падения, обмороки, потери сознания в анамнезе, трудность при стоянии или ходьбе, артрит/или нейропатия нижних конечностей.
Тест на минеральную плотность кости
• Тест МПК — это оптимальный метод подтверждения диагноза ОП. Существует несколько методик измерения МПК, но золотым стандартом остается ДЭРА.
• ДЭРА дает меньшее облучение, чем рентгенография или КТ. Этот метод может измерять плотность бедренной кости и позвоночника. Предпочтительное место измерения для исследования МПК — бедренная кость, особенно у пациентов старше 60 лет, поскольку измерения в области позвонков ненадежны из-за внекостной оссификации. Исследования позвоночника могут быть полезны у женщин в постменопаузальном периоде, у которых потери костной ткани выше из-за низкого уровня эстрогена. Периферические локализации ДЭРА дают точный, не менее полезный результат. Они могут не коррелировать с риском переломов и показателями МПК, полученными при исследованиях бедренной кости и позвоночника.
• Рекомендации Североамериканского общества менопаузы (NAMS) по показаниям к исследованию ДЭРА:
— женщины в постменопаузальном периоде с вторичными причинами потери костной ткани (например, лечение стероидами, гиперпаратиреоз);
— рентгенологические признаки остеопении;
— все женщины в возрасте 65 лет и старше;
— женщины в постменопаузальном периоде (возраст 50 лет и старше) с дополнительными факторами риска [перелом после менопаузы, вес ниже 56 кг, перелом бедренной кости в анамнезе, курение, ревматоидный артрит, употребление более 2 единиц алкоголя в день (одна единица = 354 мл пива, 118 мл вина или 30 мл крепкого алкогольного напитка)];
— женщины в постменопаузальном периоде (независимо от возраста) с патологическими переломами после менопаузы, низким весом тела, переломом позвоночника или бедренной кости в семейном анамнезе.
• Отчет о результатах теста на МПК: стандартное отклонение Z-балла или Т-балла. Z-балл основан на стандартном отклонении от среднего значения МПК у женщин той же возрастной группы. Т-балл основан на среднем значении пика МПК у здоровых молодых женщин. Критерии ВОЗ для диагностики ОП определяются с помощью Т-баллов.
Лабораторные исследования метаболизма кости
• Биохимические маркеры обмена костной ткани:
— анализ мочи на выявление продуктов распада костной ткани (перекрестносвязанный N-телопептид коллагена 1-го типа или деоксипиридин);
— оценка обмена кости связана с потерей костной ткани; не предназначена для диагностики ОП или мониторинга потери костной ткани;
— использование ДЭРА для измерения МПК; анализ мочи на определение резорбции костной ткани, чтобы измерить скорость обмена;
— уменьшение маркеров распада в моче за 2-летний период расширило число методов измерения МПК, но значение маркеров в клинической практике еще не подтверждено.
• Дополнительные исследования вторичных причин потери МПК: Са, суточный Са в моче, ПТГ, тиреостимулирующий гормон, свободный тироксин, альбумин сыворотки, щелочная фосфатаза сыворотки, СОЭ, общий анализ крови и уровень витамина D. Непрямые тесты на определение абсорбции Ca. уровень желудочной кислотности и витамина 1).
Терапевтические принципы остеопороза
Цели лечения и предотвращения остеопороза:
• сохранение адекватной костной массы;
• сохранение прочности костей;
• предотвращение хрупкости костей;
• предотвращение разрушения микроархитектоники костной ткани;
• предотвращение или уменьшение риска переломов.
Вероятно, можно было бы в значительной степени предотвратить остеопороз, однако в настоящее время нет соответствующих фармакологических препаратов. Число пролеченных больных на одного излеченного для предотвращения одного перелома бедренной кости у женщин в возрасте от 55 до 64 лет составляет 4406 для бифосфонатов (БФ). В случае деносумаба необходимо лечить 334 женщины в течение З лет, чтобы предотвратить один перелом бедренной кости. Невзирая на эти факты, руководство Североамериканского общества менопаузы (NAMS) рекомендует фармакотерапию в следующих случаях:
• все женщины в постменопаузальном периоде с предшествующим ОП или переломом бедренной кости либо позвоночника;
• все женщины, у которых значения МПК в поясничном отделе позвоночника, шейке бедра или всего тазобедренного сустава составляют —2,5 и ниже;
• все женщины в постменопаузальном периоде, Т-балл которых составляет от —1,0 до -2,5, а также с 10-летним риском, основанным на калькуляторе результатов FRAX для основных переломов ОП (позвоночник, тазобедренный сустав, плечо или запястье) и равным как минимум 20 % для перелома шейки бедра и как минимум 3 % — при высоком риске.
Фармакотерапия: многочисленные препараты для лечения ОП [например, БФ, селективные модуляторы эстрогеновых рецепторов (СМЭР), ралоксифен, ПТГ, эстрогены и киьцитонин]. Эти препараты, за исключением эстрогена, изучались на предмет влияния на переломы только у пациентов с клиническим диагнозом ОП или диагнозом ОП, поставленным на основании МПК. Абсолютное снижение риска переломов было самым значительным у женщин с высоким риском переломов.
Лекарственная терапия
• ГЗТ: эстроген-заместительная терапия (ЭЗТ) и ГЗТ снижают скорость обмена и резорбции костной ткани. ЭЗТ может снижать скорость резорбции у женщин в период пременопаузы. ЭЗТ и ГЗТ снижают риск на 54%. ЭЗТ и ГЗТ более эффективны для снижения риска переломов, если их прием начинают в первые 5 лет менопаузы. Если принимать эти препараты более 10 лет, они дают еще большее снижение риска — 75 % для переломов запястья и 73% для переломов шейки бедра. Системные пероральные или трансдермальные эстрогены и эстроген-прогестерон в стандартных дозах повышают МПК во всех отделах у женщин в постменопаузальном периоде. Средняя разница МПК после 2 лет лечения составляет 6,8% для пояснично-крестцового отдела и 4,1 % — для шейки бедра. Дневная доза 0,625 мг конъюгированных конских эстрогенов с прогестероном или без него (медроксипрогестерона ацетат или пероральный микронизированный прогестерон), принимаемая в течение З лет, может повысить МПК позвоночника на 3,5-5,096, МПК тазобедренного сустава — на 1,7 %. ГЗТ может снизить риск перелома шейки бедра (34%), перелома позвоночника (3496) и переломов других костей (24%). Даже дозы ниже стандартных доз эстрогена могут увеличить МПК позвоночника и шейки бедра на 1-396 (например, при их систематическом поступлении через вагинальное кольцо). Стандартные дозы эстрогена или эстроген-прогестерона могут снизить риск переломов у женщин в постменопаузальном периоде на 27%. Несмотря на эти исследования, препараты, содержащие только эстроген или эстроген-прогестерон, разрешены только для профилактики, а не для лечения постменопаузального ОП, поскольку возрастает риск рака молочной железы, тромбов, инсультов, несмертельных инфарктов миокарда, желчнокаменной болезни, болезненности молочных желез, маточных кровотечений и головных болей. Необходим индивидуальный подход к лечению с определением соотношения риск/польза. ГЗТ и ЭЗТ лучше всего действуют в первые 5-10 лет после менопаузы. Оптимальная и максимальная длительность применения еще не установлены. ЭЗТ и ГЗТ не рассматриваются как первичное длительное лечение, за исключением женщин, не переносящих БФ, или женщин, у которых симптоматика не поддается лечению другими препаратами.
• БФ: ингибируют остеокласты, уменьшая резорбцию костной ткани. Необходимо повышать МПК позвоночника и тазобедренного сустава у женщин в постменопаузальном периоде независимо от их возраста. Несмотря на мнение о том, что БФ снижают риск переломов позвоночника у женщин с ОП на 40-70%, а частоту переломов шейки бедра и других переломов — на 50%, эти показатели ненадежны, как было показано выше при описании NNT. Большинство БФ в США (алендронат, ибандронат и ризендронат) предназначены только для перорального ежедневного или периодического приема. Золендроновая кислота назначается внутривенно (в/в). Ответ в форме МПК дает сходные результаты при еженедельном пероральном введении алендроната и ризендроната, ежемесячном пероральном введении ибандроната и ризендроната и внутривенном введении ибандроната раз в З мес. Применяйте БФ с осторожностью, взвешивая потенциальную пользу и серьезный риск. Неразрешенные вопросы, связанные с БФ, касаются качества кости; у некоторых пациентов возможно увеличение частоты переломов в отдаленном периоде и потенциальное чрезмерное подавление обмена костной ткани в отдаленном периоде, что приводит к ломкости костей. Проблемные случаи: нетипичные, плохо заживающие переломы; атипичные переломы бедренной кости. Реакция врачей на эти жалобы: перерыв в приеме препарата, частота и длительность которого в настоящее время изучается. Другие проблемы, связанные с БФ: ОП нижней челюсти (остеонекроз нижней челюсти) у пациентов, принимающих высокие дозы БФ внутривенно, и пациентов, получающих лучевую терапию при раке головы и шеи. Характеристики остеонекроза нижней челюсти: длительное (более 6—8 мес) заживание повреждений ротовой полости после операций или удаления зубов. Его частота при внутривенном введении БФ у пациентов без облучения шеи — 12%. Частота случаев, связанных с ротовой полостью, — 0,03-0,06 %. Тем не менее операции в ротовой полости повышают заболеваемость в 7 раз. Спорным остается вопрос, нужно ли прекращать прием БФ перед удалением зубов. Многие практические врачи приостанавливают прием БФ до заживления ран в ротовой полости. Редкие долговременные осложнения приема БО. остеопоротические переломы тела бедренной кости, которые проявляются в виде болей в области бедренной кости в продромальном периоде и могут быть двусторонними. Использование БФ в настоящее время ограничено максимум до 5 лет, для возможности ремоделирования кости. Тщательно наблюдайте за МПК, чтобы убедиться в стабильно минимальной потере костной ткани после прекращения приема БФ. Применение БФ в течение 5 лет может обеспечить такую же длительную защиту, как и при лечении БФ, длящемся более 5 лет. Побочные эффекты пероральных БФ: нарушения со стороны верхних отделов ЖКТ (например, дисфагия, эзофагит, язвы пищевода и желудка). Меры предосторожности: гипокальциемия и нарушения со стороны почек, редкие преходящие гриппоподобные состояния при больших пероральных и внутривенных дозах. Тщательно соблюдайте инструкции по применению. Основная польза: снижение боли
и страданий, улучшающее качество жизни; спасение жизней (переломы головки бедренной кости). Используйте инструмент FRAX для определения риска переломов при низком МПК, но еще не развившемся ОП. Используйте БФ только по показаниям, при правильном лечении и мониторинге нежелательных явлений, а также нарушении ремоделирования кости и только тогда, когда натуральные методы не дают положительных результатов.
• СМЭР: нестероидные агонисты и (или) антагонисты эстрогена.
Ралоксифен (60 мг ежедневно) разрешен для профилактики и лечения ОП и является единственным СМЭР, разрешенным в настоящее время для лечения ОП. Ралоксифен может значительно улучшить показатель МПК на 1,6-2,696 для поясничного отдела и на 1,2—2,1 % — для шейки бедра.
• ПТГ: анаболик, который назначают в виде ежедневных подкожных инъекций, стимулирующих формирование остеобластов и повышающих плотность трабекул кости у женщин с ОП. Терипаратид (Форстео) разрешен для лечения ОП у женщин в постменопаузальном периоде. В дозе 20 мкг на инъекцию ежедневно терипаратид повышал ПМК поясничного отдела позвоночника на 8,6% и ПМК шейки бедра — на 3,5% по сравнению с плацебо. Он также снижал частоту новых переломов позвоночника на 65% и других костей — на 5396. К сожалению, даже хроническое интермиттирующее повышение ПТГ на фоне стандартной дозы терипаратида (20 мкг в день), как оказалось, вызывает ряд нежелательных побочных эффектов: тошноту, судороги в ногах и головокружения, кальциемию, гиперкальциурию и гиперурицемию с гипермагниемией. Кроме того, в связи с развитием остеогенной саркомы (крайне агрессивного рака кости) практически у половины животных в исследованиях на крысах терипаратид идет с «черной рамкой» FDA, предупреждающей о его потенциальных долгосрочных побочных эффектах. К тому же хроническое повышение ПТГ вызывает снижение когнитивных функций.
• Кальцитонин: разрешен для лечения, но не для профилактики постменопаузального ОП; доступен в виде назального спрея и подкожных инъекций. Интраназальный спрей в дозе 200 МЕ ежедневно в течение 5 лет у женщин в постменопаузальном периоде с ОП снижал риск новых переломов позвоночника на 33 % по сравнению с плацебо. Эффекта в отношении тазобедренного сустава и невертебральных переломов не наблюдалось. Кальцитонин в виде спрея может также уменьшать боль в костях, связанную с компрессионными переломами позвоночника.
• Исследуются новые методы лечения: некоторые из них в настоящее время еще недоступны в США [например, тиболон и пероральный ранелат стронция (Protelos)]. Деносумаб (Пролиа), человеческое моноклональное антитело к активатору лиганда к рецептору RANk (ядерного фактора каппа В), разрешен к применению и показан для лечения женщин в постменопаузальном периоде, подверженных высокому риску ОП переломов, или женщин с непереносимостью либо неэффективностью других методов лечения. Препараты, находящиеся в стадии разработки: СМЭР и полноразмерный ПТГ.
Факторы, связанные с образом жизни
Подход, основанный только на образе жизни, неэффективен для предотвращения потери ПМК и переломов, однако он дает основу для натуральных методов лечения, направленных на профилактику и лечение ОП. Курение ускоряет потерю костной ткани и снижает костную массу. У курящих женщин менопауза наступает на 2 года раньше, чем у некурящих. У курящих женщин, находящихся в постменопаузальном периоде, выше частота переломов. У курильщиц может быть повышен риск переломов шейки бедра, особенно среди женщин старше 60 лет. Курение в анамнезе увеличивает риск будущих переломов независимо от МПК. Умеренное употребление алкоголя связано с повышением МПК у женщин в постменопаузальном периоде, однако употребление более семи единиц алкоголя в неделю влечет за собой повышенный риск падений. Употребление более двух единиц алкоголя в день повышает риск ОП переломов (одна единица = 350 мл пива, 118 мл вина или 30 мл крепкого спиртного напитка).
• Физические упражнения: физическая активность — главный определяющий фактор плотности кости. Один час умеренной нагрузки З раза в неделю предотвращает потерю костной ткани и повышает костную массу у женщин в постменопаузальном периоде. И поднятие тяжестей, и силовые тренировки положительно влияют на развитие кости, ее функцию и поддержание нормального состояния. Женщины, практикующие физические упражнения, могут повысить ПМК позвоночника на 2%. У женщин с постоперационной менопаузой, принимающих эстроген, подключение силовых тренировок улучшает МПК. Определенные упражнения не обязательно могут повышать МПК, однако они могут снизить риск переломов вследствие падений. Упражнения, направленные на укрепление мышц и улучшение равновесия, уменьшают риск падений и связанных с этим травм на 75% у женщин в возрасте 75 лет и старше. Неподвижность удваивает скорость выведения Са с мочой и калом, приводя к отрицательному балансу Са. Наиболее эффективный способ укрепления костей — это физическая активность. Простые силовые упражнения: ходьба или тай-чи. Простые укрепляющие упражнения: гантели или эспандеры. Проконсультируйтесь со специалистами, которые посоветуют эффективные упражнения, безопасные виды физических упражнений и упражнения, которых следует избегать.
Пищевые факторы
К диетическим факторам, которые могут быть предполагаемой причиной ОП, относятся следующие.
• Низкое содержание Са, витамина Кт Mg, высокий уровень употребления фосфора.
• Диета с высоким содержанием белка.
• Окисляющая диета.
• Высокий уровень потребления соли (половина ацидоза, спровоцированного диетой — большая часть которого нейтрализуется за счет изъятия Са из костей, — вызвана избыточным употреблением соли, что отрицательно влияет на выделение кислоты почками).
• Дефицит микроэлементов.
• Вегетарианская диета (лакто-вегетарианская и веганская): более
низкий риск ОП. Костная масса вегетарианцев не отличается от всеядных пациентов в 30, 40 и 50 лет, но отличается в более позднем возрасте. Снижение случаев ОП у вегетарианцев вызвано снижением потери костной ткани в более позднем возрасте. Диета с высоким содержанием белка и фосфатов повышает экскрецию Са с мочой. Повышение суточного потребления белка с 47 до 142 г удваивает выделение Са с мочой. Противоположная точка зрения: диета с высоким содержанием белка повышает экскрецию Са с мочой и выработку кислоты, вызывая отрицательный баланс Са только в случае неадекватного суточного приема. Лучше повышать потребление Са в совокупности с фруктами и овощами для создания ощелачивающего эффекта, чем уменьшать поступление белка. Разумный компромисс: старайтесь обеспечить потребление как минимум 20 г белка в день, особенно у лиц старше 80 лет, но не превышая 60 г. Ключевым фактором в данном случае является системное рН-влияние пищевых продуктов. Пищевой ацидоз, типичный при употреблении пищи с высоким содержанием белка и соли, заставляет организм нормализовать РН за счет буферизации Са, изъятого из костей. Введение добавок Са может предотвратить избыточную потерю костной ткани, однако они могут усилить образование кальцинатов в почках у пациентов с предрасположенностью к этому. Возможная стратегия, помогающая снизить риск образования камней в почках, — использование цитрата Са.
• Соляная кислота: Са должен подвергаться ионизации со стороны желудочной кислоты, чтобы произошло его всасывание. Слабая ионизация Са — главная проблема карбоната Са. Снижение кислотности желудочного сока происходит у 40% женщин в постменопаузальном периоде, однако эффект повышения РН достигается только в случае, когда слабо растворимые соли Са, такие как Са карбонат, принимаются утром натощак. Голодающие пациенты с недостаточной кислотностью желудочного сока усваивают только 4% принятого внутрь Са в виде карбоната, в то время как нормальная кислотность желудочного сока обеспечивает всасывание 2296. Предпочтительные предварительно ионизированные формы Са: цитрат, лактат или глюконат. В случае сниженной кислотности 45% Са всасывается при приеме формы цитрата. Однако если Са принимается с пищей, наблюдается небольшое отличие в его абсорбции даже у пожилых пациентов с атрофическим гастритом или пациентов, принимающих антагонисты Нгрецепторов.
• Сахар: после употребления рафинированного сахара экскреция Са с мочой увеличивается. Среднестатистический американец употребляет 125 г сахарозы, 50 г кукурузного сиропа и других простых сахаров, стакан газированного напитка с фосфатами и высокую дозу белка ежедневно.
• Безалкогольные напитки: содержат много фосфатов, но не кальция. Потребление на одного человека в США: 450 мл/сут. Безалкогольные напитки — главный фактор риска нарушения кальцификации растущих костей у детей. Уровень Са в крови обратно пропорционален числу бутылок безалкогольных напитков, выпитых за неделю.
• Зеленые листовые овощи: употребление в пищу зеленых листовых овощей (например, шпината, листовой капусты, петрушки, салата) предотвращают развитие ОП. Это богатые источники широкого спектра витаминов и минералов, входящих в состав здоровых костей (Са, витамин Кр бор).
• Изофлавоноиды сои: данные о потенциальной способности белков сои или ее изофлавоноидов изменять метаболизм и резорбцию костной ткани противоречивы и недостаточно подтверждены. Соевые бобы содержат фитоэстрогены (генистеин, даидзеин и глицитеин), по молекулярной структуре аналогичные 17+-эстрадиолу. Связывание изофлавоноидов с эстрогенными рецепторами происходит преимущественно с эстрогенными [3-рецепторами, указывая на то, что изофлавоноиды действуют как селективные модуляторы эстрогенных рецепторов. Даидзеин обладает молекулярным сходством с препаратом иприфлавон, который используется в Европе для лечения ОП. Иприфлавон — это БАД, используемая в США. МПК является золотым стандартом в области параметров, определяющих риск нетравматических переломов и обмена костной ткани, и является независимым прогностическим фактором. Соя может сыграть определенную роль в замедлении костного обмена и повышении МПК у женщин благодаря ее эстрогенному эффекту на костную ткань. Различные варианты дозы, длительности приема и рецептуры препаратов на основе сои, а также различные выборки пациентов — возможные причины противоречивых результатов относительно влияния изофлавоноидов на обмен костной ткани и КМП. Однако важным фактором является и способ всасывания изофлавоноидов в кишечнике. Существенный эффект на пептиды в моче наблюдается у азиатских женщин, отсутствующий, однако, у женщин европеоидной расы. Возможно, это происходит из-за превращения даидзеина в его активный метаболит эквол под воздействием кишечной флоры и в связи с тем, что только 1/3 белых женщин способна метаболизировать изофлавоноиды в эквол, в то время как такая способность есть у половины азиатских женщин. Изофлавоноиды сои могут также оказывать больший эффект у женщин в постменопаузальном периоде, чем у женщин в периодах пре- или перименопаузы. Недооцененное влияние со стороны соевых продуктов может быть связано с количеством Са в некоторых из них или в диетах, содержащих соевые продукты. Рациональный клинический совет: необходимо увеличить содержание соевых продуктов в качестве профилактики ОП у женщин в пре-, пери- и постменопаузе. Всем женщинам с высоким риском ОП необходимо назначать добавки сои, чтобы суточная доза изофлавоноидов составляла 90 мг ежедневно.
Биологически активные добавки
Кость нуждается в постоянном поступлении многих питательных веществ. дефицит любого из них отрицательно влияет на здоровье костей. Помимо витамина К и бора кости необходимы следующие:
• Кальций: адекватное потребление кальция необходимо очень молодым женщинам и пожилым людям. Тем не менее кальций лишь незначительно эффективен в замедлении потери МПК у женщин в перименопаузе и в ранней менопаузе. БАДЫ могут улучшить эффективность фармацевтических агентов, предназначенных для лечения потери костной массы. Более высокое потребление кальция и добавки (от 500 до 2000 мг/сут) не связаны с более низкой частотой переломов бедра. Кальций в дозе 1000 мг + 400 МЕ витамина D в день снижает переломы бедра на 29% по сравнению с плацебо. У женщин в постменопаузальном периоде добавки кальция снижают потерю костной массы на 5096 в непозвоночных частях скелета. Действие наиболее выражено у женщин, у которых исходное потребление кальция было низким, у пожилых женщин и у женщин с установленным ОП. Потеря позвоночной кости была уменьшена при приеме от 1000 до 2000 мг кальция в день в течение года. Кальций в рационе необходим на протяжении всей жизни женщины; потребность возрастает с возрастом из-за меньшей абсорбции и конверсии кальция почками. Однако только добавление кальция не предотвращает ускоренную потерю костной массы, происходящую вскоре после менопаузы. Спустя 10 лет после менопаузы добавка кальция снова помогает уменьшить возрастную потерю костной массы. Адекватное поступление кальция имеет большое значение, но существует риск передозировки. Кальций является лишь одним из многих факторов питания и образа жизни, которые влияют на здоровье костей.
• Витамин D: поддерживает баланс кальция, усиливая всасывание в кишечнике. Повышенная абсорбция кальция снижает опосредованную ПТГ резорбцию кости. В США основными источниками витамина D являются обогащенные молочные продукты. Потребление снижается с возрастом. Дозы витамина D должны быть достаточными для повышения уровня в сыворотке до эффективного диапазона. Тем не менее у пожилых женщин в постменопаузальном периоде даже неадекватная доза от 700 до 800 МЕ в день связана со сниженным риском переломов бедра и других непозвоночных костей. Витамин D в сочетании с добавками кальция снижает уровень потери костной массы, особенно у пожилых женщин.
Витамин D также улучшает мышечную силу и равновесие, тем самым снижая риск падения.
• Магний: может быть так же важен для профилактики и лечения ОП, как и добавка кальция. Женщины с ОП имеют более низкий уровень магния в костной ткани, чем женщины без ОП. Дефицит магния у человека связан с пониженным уровнем наиболее активного витамина D в сыворотке также наблюдаемым при ОП. Механизм: либо фермент, ответственный за превращение в зависит от магния, либо магний опосредует секрецию ПТГ и кальцитонина. Прием в дозе от 250 до 750 мг (в виде гидроксида магния) в течение года несколько улучшал МПК. Магний является кофактором щелочной фосфатазы, участвует в минерализации костей. У женщин с ОП часто встречается низкий уровень магния, а его дефицит связан с аномальными кристаллами минералов кости. У некоторых женщин со сниженной МПК частота переломов не повышается, возможно, из-за того, что их минеральные кристаллы кости имеют высокое качество, отчасти из-за высокого содержания магния в тканях. У женщин в постменопаузальном периоде добавление магния в дозе от 250 до 750 мг в день в течение 6 мес с последующим приемом 250 мг в день в течение 6—18 мес без добавления кальция увеличило МПК.
• Стронций: нерадиоактивный элемент почвы, физически и химически похожий на углерод. Ранелат стронция специально используется для терапии ОП в клинических испытаниях, но недоступен в США. Стронций в больших дозах стимулирует формирование костей и уменьшает их резорбцию. Данные клинических испытаний непоследовательны. Клиническое исследование: среди женщин в постменопаузальном периоде с переломами позвонков в анамнезе частота новых деформаций позвоночника была самой низкой (38,896) при самой низкой дозе стронция. Хлорид стронция является наиболее распространенной формой в США, но он не был исследован. Из-за потенциальных побочных эффектов более высоких доз, включая рахит, дефекты минерализации костей и нарушение метаболизма витамина D, целесообразно использовать низкие дозы, пока не будут проведены дополнительные исследования.
• Цинк: необходим для образования остеобластов и остеокластов. цинк усиливает биохимическое действие витамина D и поддерживает синтез костных белков. Дефицит цинка обнаруживается в сыворотке и кости пожилых людей с ОП.
• Медь: дефицит вызывает аномальное развитие костей у растущих детей и способствует ОП. Добавка меди ингибирует резорбцию кости: З мг в день в течение 2 лет значительно снижали потерю костной массы у женщин в постменопаузальном периоде.
• Марганец: дефицит марганца является скрытым, но важным фактором при ОП. Он вызывает снижение отложения кальция в кости и стимулирует выработку мукополисахаридов, обеспечивая основу для кальцификации.
• Цинк, медь и марганец: эта комбинация с кальцием может быть более эффективной, чем один кальций, для предотвращения потери костной массы у женщин в постменопаузальном периоде.
• Бор: добавки снижают экскрецию кальция и магния с мочой и повышают уровень 17-(3-эстрадиола и тестостерона в сыворотке у женщин в постменопаузальном периоде. Добавки бора помогут предотвратить потерю костной массы.
• Кремний: во время роста костей и ранней кальцификации кремний поддерживает связи между коллагеном и протеогликанами. Бедные кремнием рационы вызывают аномальное развитие черепа и задержку роста у животных; добавки кремния позволяют частично предотвратить потерю трабекулярной кости.
• Фолиевая кислота и витамин В12; высокий уровень гомоцистеина может способствовать потере костной массы. Гомоцистеин, продукт расщепления метионина, стимулирует развитие ОП, если он не выводится из организма. Женщины с высоким гомоцистеином имеют в 2 раза более высокий риск непозвоночных переломов, вызванных ОП, чем женщины с низким гомоцистеином. Тем не менее нет никакой связи между уровнем гомоцистеина и МПК шейного или поясничного отдела. Это говорит о том, что риск пе реломов является результатом ухудшенного состояния кости. Фолат способствует реметилированию гомоцистеина до метионина. Его добавление женщинам в постменопаузальном периоде снижает уровень гомоцистеина. В12 также снижает уровень гомоцистеина. Исследуемая дозировка: 5 мг фолата + 1500 мкг В12 в течение 2 лет снижали частоту переломов бедра на 78 0/0 по сравнению с плацебо.
• Витамин В6: также помогает контролировать уровень гомоцистеина. У людей с гомоцистинурией добавка В6 нормализует повышенный уровень гомоцистеина. Дефицит Вб может замедлить заживления перелома, нарушить рост хряща, вызвать образование дефектной кости и усилить ОП. Вб может влиять на выработку прогестерона и оказывать синергетический эффект на чувствительную к эстрогену ткань. Дефицит Вб распространен даже среди здоровых людей.
• Витамин С: способствует образованию и сшиванию некоторых структурных белков в кости. Дефицит аскорбата может вызвать ОП. Цинга, вызванная дефицитом витамина С, также связана с аномалиями костей.
• Витамины К1 и К2 (менахинон): противовоспалительное действие К1 помогает предотвратить чрезмерную активацию остеокластов. К2 требуется для активации 2 белков, необходимых для регуляции кальция: остеокальцина, который приносит ионы кальция к костной ткани, что способствует образованию кристаллов кальция, и матричного белка Gla, который предотвращает отложение кальция в сосудистой сети. Витамин К2 необходим для формирования, ремоделирования и восстановления костей, потому что остеокальцин является зависимым от витамина К белком. Низкое потребление витамина К увеличивает риск переломов шейки бедра у женщин. Формы витамина К: витамин К1 (филлохинон), МК-4 (форма витамина К) и МК-7 (форма витамина К2 с более длинной цепью). Низкое потребление витамина К связано с повышенной потерей костной массы у пожилых людей. Метаанализ рандомизированных контролируемых исследований добавок К1 или МК-4 в высокой дозе 45 мг/сут (15 мг каждые 6—8 ч) в течение более 6 мес показал снижение потери костной массы. Рекомендуемое потребление: от 90 до 120 мкг в день, однако оптимальная защитная доза и форма витамина К не установлены. В большинстве исследований МК-4 использовался в дозах, в 400 раз превышающих рекомендации для К1, и в них принимали участие исключительно японские женщины в постменопаузальном периоде, что исказило результаты в пользу японской диеты и генетики. МК-7 содержится в натто (самая высокая концентрация в ферментированных соевых бобах) и сыре, а в более низких концентрациях — в мясе и молочных продуктах. Небольшие количества могут вырабатываться полезными для здоровья кишечными бактериями из поступающего с пищей витамина Кр если запасы К1 в организме превышают потребности в выработке факторов свертывания крови. МК-7 является более мощной и биодоступной формой с гораздо более длительным периодом полувыведения, чем МК-4. В качестве ежедневной добавки (0,22 ммоль в день) МК-7 более эффективен в отношении карбоксилирования остеокальцина, чем МК-4. МК-7 показывает более длительное время удержания и более высокий уровень в сыворотке при длительном приеме. Менахиноны с более длинной цепью (МК-7) являются более гидрофобными, увеличивая период полувыведения. У японских женщин в постменопаузальном периоде потребление натго имеет обратную связь с частотой переломов бедра. Вероятной причиной противоречивых клинических результатов является эффект, затрудняющий интерпретацию статуса витамина D. На результаты влияет его дефицит.
• Иприфлавон: полусинтетический изофлавоноид, аналогичный изофлавоноидам сои и одобренный в Японии, Венгрии и Италии для лечения и профилактики ОП. Он продемонстрировал впечатляющие результаты в клинических исследованиях. Иприфлавон (200 мг З раза в день) увеличил измерения МПК на 2 и 5,896 через 6 и 12 мес у женщин с ОП. Иприфлавон (600 мг в день) вызывал увеличение МПК на 696 через 12 мес, в то время как МПК в контрольной группе снизился на 0,3 0/0. Встречающиеся в природе изофлавоноиды, такие как генистеин и даидзеин, содержащиеся в сое, могут обеспечивать аналогичные преимущества. Учитывая преимущества соевых изофлавоноидов против рака молочной железы, рекомендуется употребление соевых продуктов. Механизм действия: усиление действия кальцитонина (см. ранее) на метаболизм кальция. Иприфлавон не оказывает эстрогеноподобного действия. Самое последнее и обширное исследование не показало положительных результатов. Иприфлавон может не играть важную роль в лечении ОП. Он может быть более подходящим для женщин с остеопенией или для профилактики, но не для лечения ОП. Частота снижения количества лимфоцитов и отсутствия эффекта требует тщательного взвешивания риска и пользы. Иприфлавон может быть рекомендован для терапии женщин, у которых другие методы лечения ОП недопустимы, не переносятся или противопоказаны. Необходим мониторинг МПК, чтобы подтвердить пользу; следует контролировать уровень лимфоцитов для выявления побочных эффектов.
Фитотерапия
• Зеленый чай (Camellia sinensis): потребление зеленого чая может защитить от ОП. Зеленый чай богат полифенолами и является основным источником витамина К1. Дозировка: от З до 5 чашек в день, обеспечивающая 250 мг полифенолов (катехинов) ежедневно, или экстракт зеленого чая, обеспечивающий такое же количество полифенолов. Полифенолы зеленого чая нарушали резорбцию кости и стимулировали активность остеобластов в лабораторных экспериментах.
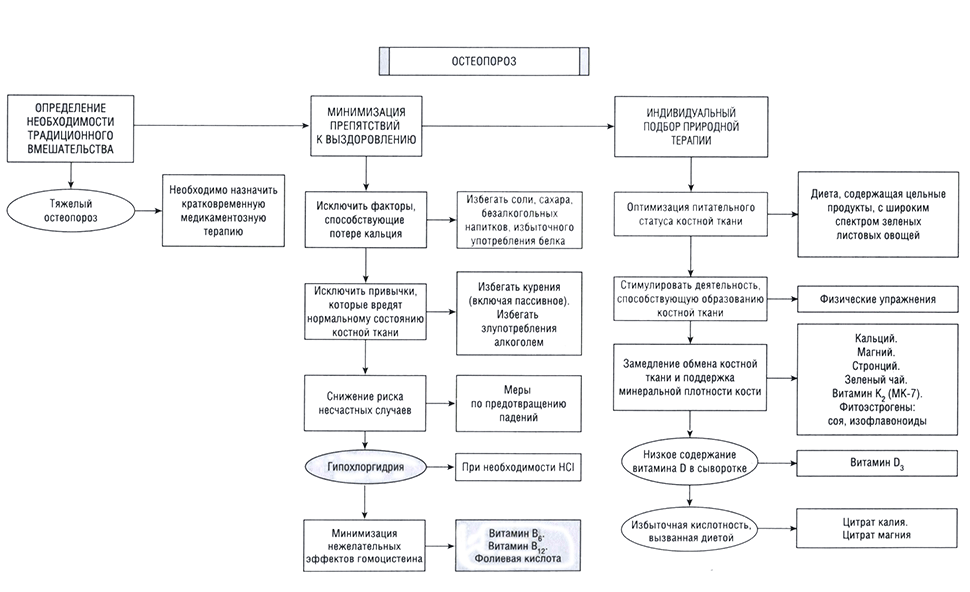
Протокол лечения
Наиболее эффективным подходом к ОП является профилактика. Необходимо оптимизировать пиковую массу кости в молодые годы и минимизировать последующую ее потерю в пожилом возрасте. Чтобы максимизировать пиковую массу кости (даже с наследственными и другими немодифицируемыми факторами риска), необходимы правильный образ жизни, полноценное питание и упражнения с умеренным весом в детстве и подростковом возрасте. Также необходимо исключить курение и чрезмерное потребление алкоголя. Улучшение образа жизни и добавки могут снизить риск у многих женщин, но не у всех. для женщин с уже установленным диагнозом факторы питания и образа жизни служат дополнением к традиционным методам лечения. Основные задачи: предотвратить потерю костной массы и снизить риск переломов. В случаях фактического ОП (в сравнении с остеопенией) необходимо использовать следующие рекомендации в сочетании с соответствующим традиционным лечением, включая отпускаемые по рецепту лекарства:
• упражнения: поднятие тяжестей 4 раза в неделю, а также силовые тренировки и (или) тренировки со свободными весами 2 раза в неделю;
• привычки:
— употребление менее 7 единиц алкоголя в неделю;
— исключение курения, в том числе пассивного;
— меры по предотвращению падений;
рацион: сбалансированная диета с акцентом на достаточное количеств белка; ежедневное употребление соевых изофлавонов, зеленых листовых овощей; достаточное количество кальция, магния, витаминов D и Следует избегать факторов, которые способствуют выведению кальция из организма (например, соль, сахар, избыток белка и безалкогольные напитки).
Биологически активные добавки
• ВМК.
• Основные БАДы:
— кальций: 1000—1200 мг в день;
— магний: 350—500 мг в день;
— витамин В3: от 2000 до 5000 МЕ/сут (измеряют уровень в крови и корректируют дозу соответственно);
— витамин В : 25—50 мг в день;
— фолат, оптимально 5-МТГФ: 800 мкг в день;
— витамин Вт; 800 мкг в день;
— витамин К2 (МК-7): 100 мкг в день;
— рыбий жир: 1000 мг ЭПК и ДГК в день;
— изофлавоноиды сои: 90 мг в день или иприфлавон: 600 мг в день; — стронций: от 170 до 680 мг 1 раз в день (см. описание выше).
Фитотерапевтические средства
• Зеленый чай: от З до 5 чашек в день или экстракт зеленого чая, содержащий от 250 до 300 мг полифенолов (катехинов) в день.
Отрывок из книги «Руководство по натуральной медицине» — Пиццорно Дж. Е., Мюррей М. Т. Купить книгу
Купить книгу «Руководство по натуральной медицине» — Пиццорно Дж. Е., Мюррей М. Т.
В книге рассмотрены актуальные вопросы применения немедикаментозных средств в лечении различных заболеваний. В основу изложения материала положен нозологический принцип, раскрывающий современный взгляд на клиническую картину, этиологию и патогенез различных заболеваний. В отличие от большинства медицинских справочников и руководств, в этом издании представлены основы лечебного питания, которые демонстрируют эффективность и механизмы лечебного действия пищевых и биологически активных веществ. Особое внимание уделено применению в лечебном питании специализированных пищевых продуктов, в частности биологически активных добавок к пище. Освещены механизмы их действия, а также использование в лечении (диетотерапии) сердечно-сосудистых заболеваний, сахарного диабета, ожирения, болезней костно-суставной системы, заболеваний желудочно-кишечного тракта, кожи и других патологий. Наряду с питанием значительное место отведено фитотерапии, физиотерапии, лечебной физкультуре, психологическим методам воздействия. В конце каждого раздела, посвященного определенному заболеванию, приведен краткий протокол лечения немедикаментозными средствами.
Содержание книги «Руководство по натуральной медицине» — Джозеф Е. Пиццорно, Майкл Т.
Алкогольная зависимость
Артериальная гипертензия
Астма
Атеросклероз
Атопический дерматит (экзема)
Афтозный стоматит (афтозные язвы/афтоид/язвенный стоматит)
Аффективные расстройства
Бактериальный синусит
Бесплодие, женское
Бесплодие, мужское
Бессонница
Болезни пародонта
Болезнь Альцгеймера
Болезнь Паркинсона
Бронхит и пневмония
Вагиниты
Варикозное расширение вен
Вирусный гепатит
ВИЧ/СПИД: принципы и методы природной медицины
Воспалительные заболевания кишечника
Воспалительные заболевания органов малого таза
Выпадение волос у женщин
Герпетиформный дерматит
Гипертиреоз
Гипогликемия
Гипотиреоз
Глаукома: острая (закрытоугольная) и хроническая (открытоугольная)
Глютенчувствительная целиакия
Дисплазия шейки матки
Доброкачественная гиперплазия предстательной железы
Желчнокаменная болезнь
Застойная сердечная недостаточность
Здоровье беременных и первичная профилактика болезней у взрослых
Инфекционная диарея
Камни в почках
Кистевой туннельный синдром
Крапивница
Красный плоский лишай
Лейкоплакия
Макулярная дегенерация
Менопауза
Меноррагия
Мигрень
Миома матки
Многоформная эритема
Нарушение пищеварения
Обыкновенные и конглобатные угри
Ожирение
Остеоартроз
Остеопороз
Отит среднего уха
Подагра
Порфирии
Предменструальный синдром
Проктологические заболевания
Простой герпес
Протозойная инфекция кишечника и системные заболевания
Псориаз
Рак: комплексная немедикаментозная поддержка
Рассеянный склероз
Ревматоидный артрит
Розацеа
Сахарный диабет
Себорейный дерматит
Сенильная (возрастная) катаракта
Синдром гипервентиляции / Дисфункциональное дыхание
Синдром дефицита внимания с гиперактивностью
Синдром раздраженного кишечника
Синдром фибромиалгии
Синдром хронической усталости
Стенокардия
Стрептококковый фарингит
Трихомониаз
Фиброзно-кистозная мастопатия
Хронический кандидоз
Цистит
Эндометриоз
Эпилепсия
Язвенная болезнь
Посмотреть примеры страниц из книги «Руководство по натуральной медицине» — Пиццорно Дж. Е., Мюррей М. Т. Купить книгу
Информация и материалы, представленные на настоящем сайте, носят научный, справочно-информационный и аналитический характер, предназначены исключительно для специалистов здравоохранения, не направлены на продвижение товаров на рынке и не могут быть использованы в качестве советов или рекомендаций пациенту к применению лекарственных средств и методов лечения без консультации с лечащим врачом.
Лекарственные препараты, информация о которых содержится на настоящем сайте, имеют противопоказания, перед их применением необходимо ознакомиться с инструкцией и проконсультироваться со специалистом.
Мнение Администрации может не совпадать с мнением авторов и лекторов. Администрация не дает каких-либо гарантий в отношении cайта и его cодержимого, в том числе, без ограничения, в отношении научной ценности, актуальности, точности, полноты, достоверности научных данных представляемых лекторами или соответствия содержимого международным стандартам надлежащей клинической практики и/или медицины основанной на доказательствах. Сайт не несет никакой ответственности за любые рекомендации или мнения, которые могут содержаться, ни за применимость материалов сайта к конкретным клиническим ситуациям. Вся научная информация предоставляется в исходном виде, без гарантий полноты или своевременности. Администрация прикладывает все усилия, чтобы обеспечить пользователей точной и достоверной информацией, но в то же время не исключает возможности возникновения ошибок.
1. Мельниченко Г.А., Белая Ж.Е., Рожинская Л.Я., Торопцова Н.В., Алексеева Л.И., Бирюкова Е.В., Гребенникова Т.А., Дзеранова Л.К., Древаль А.В., Загородний Н.В., Ильин А.В., Крюкова И.В., Лесняк О.М., Мамедова Е.О., Никитинская О.А., Пигарова Е.А., Родионова С.С., Скрипникова И.А., Тарбаева Н.В., и др. Федеральные клинические рекомендации по диагностике, лечению и профилактике остеопороза. Проблемы эндокринологии. 2017;63(6):392-426. doi: 10.14341/probl2017636392-426.
2. Camacho PM, Petak SM, Binkley N, Clarke BL, Harris ST, Hurley DL, Kleerekoper M, Lewiecki EM, Miller PD, Narula HS, Pessah-Pollack R, Tangpricha V, Wimalawansa SJ, Watts NB. American association of clinical endocrinologists and American college of endocrinology clinical practice guidelines for the diagnosis and treatment of postmenopausal osteoporosis – 2016. Endocr Pract. 2016;22(Suppl 4):1-42. doi: 10.4158/EP161435.GL.
3. Kanis JA, Cooper C, Rizzoli R, Reginster J-Y; Scientific Advisory Board of the European Society for Clinical and Economic Aspects of Osteoporosis (ESCEO) and the Committees of Scientific Advisors and National Societies of the International Osteoporosis Foundation (IOF). European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int. 2019;30(1):3-44. doi: 10.1007/s00198-018-4704-5.
4. Raman-Wilms L. Book review: Guidelines for preclinical evaluation and clinical trials in osteoporosis. Annals of Pharmacotherapy. 1999;33(12):1377-1378. doi: 10.1177/106002809903301207.
5. AAOS.org [Internet]. Rosemont (IL): American Association of Orthopaedic Surgeons; Orthopaedic Care of Patients with Fragility Fractures. American Association of Orthopaedic Surgeon Position Statement, Doc. No. 1159, December 2009 [updated 2016 Sep; cited 2021 Jul 26]. Available from: https://www.aaos.org/uploadedFiles/1159%20Orthopaedic%20Care%20of%20Patients%20with%20Fragility%20Fractures.pdf.
6. Kanis JA on behalf of the WHO Scientific Group. Assessment of osteoporosis at the primary health-care level. Technical Report. Sheffield (UK): University of Sheffield (UK), WHO Collaboraiting Centre; 2008 [cited 2021 Jul 26]. Available from: https://www.sheffield.ac.uk/FRAX/pdfs/WHO_Technical_Report.pdf.
7. Consensus development conference: diagnosis, prophylaxis, and treatment of osteoporosis. Am J Med. 1993;94(6):646-650. doi: 10.1016/0002-9343(93)90218-e.
8. Михайлов Е.Е., Беневоленская Л.И. Руководство по остеопорозу. – М.: БИНОМ. Лаборатория знаний; 2003.
9. Лесняк О.М., Ершова О.Б. Аудит состояния проблемы остеопороза в странах Восточной Европы и Центральной Азии 2010. Naturaprint: International Osteoporosis Foundation (CH); 2011. Доступно по: https://www.iofbonehealth.org/sites/default/files/PDFs/Audit%20Eastern%20Europe_Central%20Asia/Eastern_European_Central_Asian_Audit_2010-RU.pdf. Ссылка активна на 26.07.2021.
10. Дедов И.И., Мельниченко Г.А., Белая Ж.Е., Рожинская Л.Я. Остеопороз – от редкого симптома эндокринных болезней до безмолвной эпидемии XX-XXI века. Проблемы эндокринологии. 2011;57(1):35-45. doi: 10.14341/probl201157135-45.
11. Ершова О.Б., Белова К.Ю., Белов М.В., Лесняк О.М. Эпидемиология переломов проксимального отдела бедренной кости у городского населения Российской Федерации: результаты многоцентрового исследования. / Материалы научно-практической конференции «Остеопороз – важнейшая мультидисциплинарная проблема здравоохранения XXI века». Форум остеопороза; Санкт-Петербург, 2012, сент. 23-25. – С. 23-27.
12. Меньшикова Л.В., Храмцова Н.А., Ершова О.Б. Ближайшие и отдаленные исходы переломов проксимального отдела бедра у лиц пожилого возраста и их медико-социальные последствия (по данным многоцентрового исследования). Остеопороз и остеопатии. 2002;5(1):8-11.
13. Добровольская О.В., Торопцова Н.В., Лесняк О.М. Экономические аспекты осложненного остеопороза: стоимость лечения в течение первого года после перелома. Современная ревматология. 2016;10(3):29-34.
14. Бахтиярова С.А., Бортник С.Б., Лесняк О.М., Кузнецова Н.Л. Сравнительная оценка социальных последствий перелома проксимального отдела бедра и инфаркта миокарда у пациентов старшего возраста. Остеопороз и остеопатии. 2003;(Приложение):45.
15. Lesnyak O, Ershova O, Belova K, Gladkova E, Sinitsina O, Ganert O, Romanova M, Khodirev V, Johansson H, McCloskey E, Kanis JA. Epidemiology of fracture in the Russian Federation and the development of a FRAX® model. Arch Osteoporos. 2012;7:67-73. doi: 10.1007/s11657-012-0082-3.
16. Cosman F, de Beur SJ, LeBoff MS, Lewiecki EM, Tanner B, Randall S, Lindsay R; National Osteoporosis Foundation. Clinician’s guide to prevention and treatment of osteoporosis. Osteoporos Int. 2014;25(10):2359-2381. doi: 10.1007/s00198-014-2794-2.
17. Shepstone L, Lenaghan E, Cooper C, Clarke S, Fong-Soe-Khioe R, Fordham R, Gittoes N, Harvey I, Harvey N, Heawood A, Holland R, Howe A, Kanis JA, Marshall T, O’Neill T, Peters T, Redmond N, Torgerson D, Turner D, et al.; SCOOP Study Team. Screening in the community to reduce fractures in older women (SCOOP): a randomised controlled trial. Lancet. 2018;391(10122):741-747. doi: 10.1016/S0140-6736(17)32640-5.
18. Turner DA, Khioe RFS, Shepstone L, Lenaghan E, Cooper C, Gittoes N, Harvey NC, Holland R, Howe A, McCloskey E, O’Neill TW, Torgerson D, Fordham R; SCOOP Study Team. The cost-effectiveness of screening in the community to reduce osteoporotic fractures in older women in the UK: economic evaluation of the SCOOP study. J Bone Miner Res. 2018;33(5):845-851. doi: 10.1002/jbmr.3381.
19. Hippisley-Cox J, Coupland C. Predicting risk of osteoporotic fracture in men and women in England and Wales: prospective derivation and validation of QFractures Scores. BMJ. 2009;339:b4229. doi: 10.1136/bmj.b4229.
20. Hoff M, Meyer HE, Skurtveit S, Langhammer A, Søgaard AJ, Syversen U, Dhainaut A, Skovlund E, Abrahamsen B, Schei B. Validation of FRAX® and the impact of self-reported falls among elderly in a general population: the HUNT study, Norway. Osteoporos Int. 2017;28(10):2935-2944. doi: 10.1007/s00198-017-4134-9.
21. Fraser L-A, Langsetmo L, Berger C, Ioannidis G, Goltzman D, Adachi JD, Papaioannou A, Josse R, Kovacs CS, Olszynski WP, Towheed T, Hanley DA, Kaiser SM, Prior J, Jamal S, Kreiger N, Brown JP, Johansson H, Oden A, et al.; CaMos Research Group. Fracture prediction and calibration of a Canadian FRAX® tool: a population-based report from CaMos. Osteoporos Int. 2011;22(3):829-837. doi: 10.1007/s00198-010-1465-1.
22. Leslie WD, Lix LM, Johansson H, Oden A, McCloskey E, Kanis JA; Manitoba Bone Density Program. Independent clinical validation of a Canadian FRAX® tool: fracture prediction and model calibration. J Bone Miner Res. 2010;25(11):2350-2358. doi: 10.1002/jbmr.123.
23. Jiang X, Gruner M, Trémollieres F, Pluskiewicz W, Sornay-Rendu E, Adamczyk P, Schnatz PF. Diagnostic accuracy of FRAX® in predicting the 10-year risk of osteoporotic fractures using the USA treatment thresholds: A systematic review and meta-analysis. Bone. 2017;99:20-25. doi: 10.1016/j.bone.2017.02.008.
24. Marques A, Ferreira RJ, Santos E, Loza E, Carmona L, Pereira da Silva JA. The accuracy of osteoporotic fracture risk prediction tools: A systematic review and meta-analysis. Ann Rheum Dis. 2015;74(11):1958-1967. doi: 10.1136/annrheumdis-2015-207907.
25. Kanis J, Johnell O, Oden A, Johansson H, McCloskey E. FRAX® and the assessment of fracture probability in men and women from the UK. Osteoporos Int. 2008;19(4):385-397. doi: 10.1007/s00198-007-0543-5.
26. Lindsay R, Silverman SL, Cooper C, Hanley DA, Barton I, Broy SB, Licata A, Benhamou L, Geusens P, Flowers K, Stracke H, Seeman E. Risk of new vertebral fracture in the year following a fracture. JAMA. 2001;285(3):320-323. doi: 10.1001/jama.285.3.320.
27. Gehlbach S, Saag KG, Adachi JD, Hooven FH, Flahive J, Boonen S, Chapurlat RD, Compston JE, Cooper C, Díez-Perez A, Greenspan SL, LaCroix AZ, Coen Netelenbos J, Pfeilschifter J, Rossini M, Roux C, Sambrook PN, Silverman S, Siris ES, et al. Previous fractures at multiple sites increase the risk for subsequent fractures: the Global Longitudinal Study of Osteoporosis in Women. J Bone Miner Res. 2012;27(3):645-653. doi: 10.1002/jbmr.1476.
28. Edwards BJ, Bunta AD, Simonelli C, Bolander M, Fitzpatrick LA. Prior fractures are common in patients with subsequent hip fractures. Clin Orthop Relat Res. 2007;461:226-230. doi: 10.1097/BLO.0b013e3180534269.
29. Ross PD, Davis JW, Epstein RS, Wasnich RD. Pre-existing fractures and bone mass predict vertebral fracture incidence in women. Ann Intern Med. 1991;114(11):919-923. doi: 10.7326/0003-4819-114-11-919.
30. Gallagher JC, Genant HK, Crans GG, Vargas SJ, Krege JH. Teriparatide reduces the fracture risk associated with increasing number and severity of osteoporotic fractures. J Clin Endocrinol Metab. 2005;90(3):1583-1587. doi: 10.1210/jc.2004-0826.
31. Marcus R, Wang O, Satterwhite J, Mitlak B. The skeletal response to teriparatide is largely independent of age, initial bone mineral density, and prevalent vertebral fractures in postmenopausal women with osteoporosis. J Bone Miner Res. 2003;18(1):18-23. doi: 10.1359/jbmr.2003.18.1.18.
32. Kanis JA, Barton IP, Johnell O. Risedronate decreases fracture risk in patients selected solely on the basis of prior vertebral fracture. Osteoporos Int. 2005;16(5):475-482. doi: 10.1007/s00198-004-1698-y.
33. Johnell O, Kanis JA, Black DM, Balogh A, Poor G, Sarkar S, Zhou C, Pavo I. Association between baseline risk factors and vertebral fracture risk in the Multiple Outcomes of Raloxifene Evaluation (MORE) study. J Bone Miner Res. 2004;19(5):764-772. doi: 10.1359/JBMR.040211.
34. Kanis JA, Johansson H, Oden A, McCloskey EV. A meta-analysis of the effect of strontium ranelate on the risk of vertebral and non-vertebral fracture in postmenopausal osteoporosis and the interaction with FRAX®. Osteoporos Int. 2011;22(8):2347-2355. doi: 10.1007/s00198-010-1474-0.
35. Kanis JA, Johnell O, De Laet C, Johansson H, Oden A, Delmas P, Eisman J, Fujiwara S, Garnero P, Kroger H, McCloskey EV, Mellstrom D, Melton LJ, Pols H, Reeve J, Silman A, Tenenhouse A. A meta-analysis of previous fracture and subsequent fracture risk. Bone. 2004;35(2):375-382. doi: 10.1016/j.bone.2004.03.024.
36. Klotzbuecher CM, Ross PD, Landsman PB, Abbott 3rd TA, Berger M. Patients with prior fractures have an increased risk of future fractures: a summary of the literature and statistical synthesis. J Bone Miner Res. 2000;15(4):721-739. doi: 10.1359/jbmr.2000.15.4.721.
37. Schousboe JT, Ensrud KE, Nyman JA, Kane RL, Melton 3rd LJ. Potential cost-effective use of spine radiographs to detect vertebral deformity and select osteopenic post-menopausal women for amino-bisphosphonate therapy. Osteoporos Int. 2005;16(12):1883-1893. doi:10.1007/s00198-005-1956-7.
38. Gallagher JC, Sai AJ. Bone: is screening for secondary causes of osteoporosis worthwhile? Nat Rev Endocrinol. 2010;6(7):360-362. doi: 10.1038/nrendo.2010.86.
39. Barzel US. Recommended testing in patients with low bone density. J Clin Endocrinol Metab. 2003;88(3):1404-1405. doi: 10.1210/jc.2002-021951.
40. Tannenbaum C, Clark J, Schwartzman K, Wallenstein S, Lapinski R, Meier D, Luckey M. Yield of laboratory testing to identify secondary contributors to osteoporosis in otherwise healthy women. J Clin Endocrinol Metab. 2002;87(10):4431-4437. doi: 10.1210/jc.2002-020275.
41. Cerdá Gabaroi D, Peris P, Monegal A, Albaladejo C, Martínez MA, Muxí A, Martínez de Osaba MJ, Surís X, Guañabens N. Search for hidden secondary causes in postmenopausal women with osteoporosis. Menopause. 2010;17(1):135-139. doi: 10.1097/gme.0b013e3181ade8e5.
42. Deutschmann HA, Weger M, Weger W, Kotanko P, Deutschmann MJ, Skrabal F. Search for occult secondary osteoporosis: impact of identified possible risk factors on bone mineral density. J Intern Med. 2002;252(5):389-397. doi: 10.1046/j.1365-2796.2002.01040.x.
43. Priemel M, von Domarus C, Klatte TO, Kessler S, Schlie J, Meier S, Proksch N, Pastor F, Netter C, Streichert T, Püschel K, Amling M. Bone mineralization defects and vitamin D deficiency: histomorphometric analysis of iliac crest bone biopsies and circulating 25-hydroxyvitamin D in 675 patients. J Bone Miner Res. 2010;25(2):305-312. doi: 10.1359/jbmr.090728.
44. Eastell R, Barton I, Hannon RA, Chines A, Garnero P, Delmas PD. Relationship of early changes in bone resorption to the reduction in fracture risk with risedronate. J Bone Miner Res. 2003;18(6):1051-1056. doi: 10.1359/jbmr.2003.18.6.1051.
45. Hochberg MC, Greenspan S, Wasnich RD, Miller P, Thompson DE, Ross PD. Changes in bone density and turnover explain the reductions in incidence of nonvertebral fractures that occur during treatment with antiresorptive agents. J Clin Endocrinol Metab. 2002;87(4):1586-1592. doi: 10.1210/jcem.87.4.8415.
46. Bone HG, Hosking D, Devogelaer JP, Tucci JR, Emkey RD, Tonino RP, Rodriguez-Portales JA, Downs RW, Gupta J, Santora AC, Liberman UA; Alendronate Phase III Osteoporosis Treatment Study Group. Ten years’ experience with alendronate for osteoporosis in postmenopausal women. N Engl J Med. 2004;350(12):1189-1199. doi: 10.1056/NEJMoa030897.
47. Black DM, Schwartz AV, Ensrud KE, Cauley JA, Levis S, Quandt SA, Satterfield S, Wallace RB, Bauer DC, Palermo L, Wehren LE, Lombardi A, Santora AC, Cummings SR; FLEX Research Group. Effects of continuing or stopping alendronate after 5 years of treatment: the Fracture Intervention Trial Long-term Extension (FLEX): a randomized trial. JAMA. 2006;296(24):2927-2938. doi: 10.1001/jama.296.24.2927.
48. Delmas PD, Eastell R, Garnero P, Seibel MJ, Stepan J; Committee of Scientific Advisors of the International Osteoporosis Foundation. The use of biochemical markers of bone turnover in osteoporosis. Committee of Scientific Advisors of the International Osteoporosis Foundation. Osteoporos Int. 2000;11(Suppl 6):S2-17. doi: 10.1007/s001980070002.
49. Vasikaran S, Eastell R, Bruyère O, Foldes AJ, Garnero P, Griesmacher A, McClung M, Morris HA, Silverman S, Trenti T, Wahl DA, Cooper C, Kanis JA; IOF-IFCC Bone Marker Standards Working Group. Markers of bone turnover for the prediction of fracture risk and monitoring of osteoporosis treatment: a need for international reference standards. Osteoporos Int. 2011;22(2):391-420. doi: 10.1007/s00198-010-1501-1.
50. Johansson H, Odén A, Kanis JA, McCloskey EV, Morris HA, Cooper C, Vasikaran S; IFCC-IOF Joint Working Group on Standardisation of Biochemical Markers of Bone Turnover. A meta-analysis of reference markers of bone turnover for prediction of fracture. Calcif Tissue Int. 2014;94(5):560-567. doi: 10.1007/s00223-014-9842-y.
51. Bauer DC, Black DM, Bouxsein ML, Lui L-Y, Cauley JA, de Papp AE, Grauer A, Khosla S, McCulloch CE, Eastell R; Foundation for the National Institutes of Health (FNIH) Bone Quality Project. Treatment-related changes in bone turnover and fracture risk reduction in clinical trials of anti-resorptive drugs: a meta-regression. J Bone Miner Res. 2018;33(4):634-642. doi: 10.1002/jbmr.3355.
52. Ravn P, Hosking D, Thompson D, Cizza G, Wasnich RD, McClung M, Yates AJ, Bjarnason NH, Christiansen C. Monitoring of alendronate treatment and prediction of effect on bone mass by biochemical markers in the early postmenopausal intervention cohort study. J Clin Endocrinol Metab. 1999;84(7):2363-2368. doi: 10.1210/jcem.84.7.5847.
53. Fink E, Cormier C, Steinmetz P, Kindermans C, Le Bouc Y, Souberbielle JC. Differences in the capacity of several biochemical bone markers to assess high bone turnover in early menopause and response to alendronate therapy. Osteoporos Int. 2000;11(4):295-303. doi: 10.1007/PL00004183.
54. Bauer DC, Black DM, Garnero P, Hochberg M, Ott S, Orloff J, Thompson DE, Ewing SK, Delmas PD; Fracture Intervention Trial Study Group. Change in bone turnover and hip, non-spine, and vertebral fracture in alendronate-treated women: the fracture intervention trial. J Bone Miner Res. 2004;19(8):1250-1258. doi: 10.1359/JBMR.040512.
55. Delmas PD, Recker RR, Chesnut 3rd CH, Skag A, Stakkestad JA, Emkey R, Gilbride J, Schimmer RC, Christiansen C. Daily and intermittent oral ibandronate normalize bone turnover and provide significant reduction in vertebral fracture risk: results from the BONE study. Osteoporos Int. 2004;15(10):792-798. doi: 10.1007/s00198-004-1602-9.
56. Reginster JY, Gieschke R. Clinical utility of a pharmacostatistical model for ibandronate in postmenopausal osteoporosis. Curr Drug Metab. 2006;7(7):827-836. doi: 10.2174/138920006778520624.
57. Krege JH, Lane NE, Harris JM, Miller PD. P1NP as a biological response marker during teriparatide treatment for osteoporosis. Osteoporos Int. 2014;25(9):2159-2171. doi: 10.1007/s00198-014-2646-0.
58. Imaz I, Zegarra P, González-Enríquez J, Rubio B, Alcazar R, Amate JM. Poor bisphosphonate adherence for treatment of osteoporosis increases fracture risk: systematic review and meta-analysis. Osteoporos Int. 2010;21(11):1943-1951. doi: 10.1007/s00198-009-1134-4.
59. Bergmann P, Body J-J, Boonen S, Boutsen Y, Devogelaer J-P, Goemaere S, Kaufman J-M, Reginster J-Y, Gangji V; Members of Advisory Board on Bone Markers. Evidence-based guidelines for the use of biochemical markers of bone turnover in the selection and monitoring of bisphosphonate treatment in osteoporosis: a consensus document of the Belgian Bone Club. Int J Clin Pract. 2009;63(1):19-26. doi: 10.1111/j.1742-1241.2008.01911.x.
60. Burch J, Rice S, Yang H, Neilson A, Stirk L, Francis R, Holloway P, Selby P, Craig D. Systematic review of the use of bone turnover markers for monitoring the response to osteoporosis treatment: the secondary prevention of fractures, and primary prevention of fractures in high-risk groups. Health Technol Assess. 2014;18(11):1-180. doi: 10.3310/hta18110.
61. Dresner-Pollak R, Parker RA, Poku M, Thompson J, Seibel MJ, Greenspan SL. Biochemical markers of bone turnover reflect femoral bone loss in elderly women. Calcif Tissue Int. 1996;59(5):328-333. doi: 10.1007/s002239900135.
62. Ross PD, Knowlton W. Rapid bone loss is associated with increased levels of biochemical markers. J Bone Miner Res. 1998;13(2):297-302. doi: 10.1359/jbmr.1998.13.2.297.
63. Hansen MA, Overgaard K, Riis BJ, Christiansen C. Role of peak bone mass and bone loss in postmenopausal osteoporosis: 12 year study. BMJ. 1991;303(6808): 961-964. doi: 10.1136/bmj.303.6808.961.
64. Garnero P, Sornay-Rendu E, Duboeuf F, Delmas PD. Markers of bone turnover predict postmenopausal forearm bone loss over 4 years: the OFELY study. J Bone Miner Res. 1999;14(9):1614-1621. doi: 10.1359/jbmr.1999.14.9.1614.
65. Tian A, Ma J, Feng K, Liu Z, Chen L, Jia H, Ma X. Reference markers of bone turnover for prediction of fracture: a meta-analysis. J Orthop Surg Res. 2019;14(1):68. doi: 10.1186/s13018-019-1100-6.
66. Schousboe JT, Bauer DC, Nyman JA, Kane RL, Melton LJ, Ensrud KE. Potential for bone turnover markers to cost-effectively identify and select post-menopausal osteopenic women at high risk of fracture for bisphosphonate therapy. Osteoporos Int. 2007;18(2):201-210. doi: 10.1007/s00198-006-0218-7.
67. Boonen S, Body J-J, Boutsen Y, Devogelaer J-P, Goemaere S, Kaufman J-M, Rozenberg S, Reginster J-Y. Evidence-based guidelines for the treatment of postmenopausal osteoporosis: a consensus document of the Belgian Bone Club. Osteoporos Int. 2005;16(3):239-254. doi: 10.1007/s00198-004-1812-1.
68. McNabb BL, Vittinghoff E, Schwartz AV, Eastell R, Bauer DC, Ensrud K, Rosenberg E, Santora A, Barrett-Connor E, Black DM. BMD changes and predictors of increased bone loss in postmenopausal women after a 5-year course of alendronate. J Bone Miner Res. 2013;28(6):1319-1327. doi: 10.1002/jbmr.1864.
69. Bauer DC, Schwartz A, Palermo L, Cauley J, Hochberg M, Santora A, Cummings SR, Black DM. Fracture prediction after discontinuation of 4 to 5 years of alendronate therapy: the FLEX study. JAMA Intern Med. 2014;174(7):1126-1134. doi: 10.1001/jamainternmed.2014.1232.
70. Cosman F, Cauley JA, Eastell R, Boonen S, Palermo L, Reid IR, Cummings SR, Black DM. Reassessment of fracture risk in women after 3 years of treatment with zoledronic acid: when is it reasonable to discontinue treatment? J Clin Endocrinol Metab. 2014;99(12):4546-4554. doi: 10.1210/jc.2014-1971.
71. Bauer DC, Garnero P, Hochberg MC, Santora A, Delmas P, Ewing SK, Black DM; Fracture Intervention Research Group. Pretreatment levels of bone turnover and the antifracture efficacy of alendronate: the fracture intervention trial. J Bone Miner Res. 2006;21(2):292-299. doi: 10.1359/JBMR.051018.
72. Seibel MJ, Naganathan V, Barton I, Grauer A. Relationship between pretreatment bone resorption and vertebral fracture incidence in postmenopausal osteoporotic women treated with risedronate. J Bone Miner Res. 2004;19(2):323-329. doi: 10.1359/JBMR.0301231.
73. Yamamoto T, Tsujimoto M, Hamaya E, Sowa H. Assessing the effect of baseline status of serum bone turnover markers and vitamin D levels on efficacy of teriparatide 20 μg/day administered subcutaneously in Japanese patients with osteoporosis. J Bone Miner Metab. 2013;31(2):199-205. doi: 10.1007/s00774-012-0403-z.
74. Kanis JA, Melton 3rd LJ, Christiansen C, Johnston CC, Khaltaev N. The diagnosis of osteoporosis. J Bone Miner Res. 1994;9(8):1137-1141. doi: 10.1002/jbmr.5650090802.
75. Nevitt MC, Ettinger B, Black DM, Stone K, Jamal SA, Ensrud K, Segal M, Genant HK, Cummings SR. The association of radiographically detected vertebral fractures with back pain and function: a prospective study. Ann Intern Med. 1998;128(10):793-800. doi: 10.7326/0003-4819-128-10-199805150-00001.
76. Yamamoto M, Yamaguchi T, Yamauchi M, Kaji H, Sugimoto T. Diabetic patients have an increased risk of vertebral fractures independent of BMD or diabetic complications. J Bone Miner Res. 2009;24(4):702-709. doi: 10.1359/jbmr.081207.
77. Siminoski K, Jiang G, Adachi JD, Hanley DA, Cline G, Ioannidis G, Hodsman A, Josse RG, Kendler D, Olszynski WP, Ste Marie L-G, Eastell R. Accuracy of height loss during prospective monitoring for detection of incident vertebral fractures. Osteoporos Int. 2005;16(4):403-410. doi: 10.1007/s00198-004-1709-z.
78. van Staa TP, Leufkens HG, Abenhaim L, Zhang B, Cooper C. Oral corticosteroids and fracture risk: relationship to daily and cumulative doses. Rheumatology (Oxford). 2000;39(12):1383-1389. doi: 10.1093/rheumatology/39.12.1383.
79. Dede AD, Tournis S, Dontas I, Trovas G. Type 2 diabetes mellitus and fracture risk. Metabolism. 2014;63(12):1480-1490. doi: 10.1016/j.metabol.2014.09.002.
80. Xu W, Perera S, Medich D, Fiorito G, Wagner J, Berger LK, Greenspan SL. Height loss, vertebral fractures, and the misclassification of osteoporosis. Bone. 2011;48(2):307-311. doi: 10.1016/j.bone.2010.09.027.
81. Kamimura M, Nakamura Y, Sugino N, Uchiyama S, Komatsu M, Ikegami S, Kato H, Taguchi A. Associations of self-reported height loss and kyphosis with vertebral fractures in Japanese women 60 years and older: a cross-sectional survey. Sci Rep. 2016;6:29199. doi: 10.1038/srep29199.
82. Mikula AL, Hetzel SJ, Binkley N, Anderson PA. Validity of height loss as a predictor for prevalent vertebral fractures, low bone mineral density, and vitamin D deficiency. Osteoporos Int. 2017;28(5):1659-1665. doi: 10.1007/s00198-017-3937-z.
83. Genant HK, Wu CY, van Kuijk C, Nevitt MC. Vertebral fracture assessment using a semiquantitative technique. J Bone Miner Res. 1993;8(9):1137-1148. doi: 10.1002/jbmr.5650080915.
84. Genant HK, Jergas M. Assessment of prevalent and incident vertebral fractures in osteoporosis research. Osteoporos Int. 2003;14(Suppl 3):S43-55. doi: 10.1007/s00198-002-1348-1.
85. Kazawa N. T2WI MRI and MRI-MDCT correlations of the osteoporotic vertebral compressive fractures. Eur J Radiol. 2012;81(7):1630-1636. doi: 10.1016/j.ejrad.2011.04.052.
86. Baum T, Karampinos DC, Liebl H, Rummeny EJ, Waldt S, Bauer JS. High-resolution bone imaging for osteoporosis diagnostics and therapy monitoring using clinical MDCT and MRI. Curr Med Chem. 2013;20(38):4844-4852. doi: 10.2174/09298673113206660279.
87. Lenchik L, Rogers LF, Delmas PD, Genant HK. Diagnosis of osteoporotic vertebral fractures: importance of recognition and description by radiologists. AJR Am J Roentgenol. 2004;183(4):949-958. doi: 10.2214/ajr.183.4.1830949.
88. Grigoryan M, Guermazi A, Roemer FW, Delmas PD, Genant HK. Recognizing and reporting osteoporotic vertebral fractures. Eur Spine J. 2003;12 Suppl 2 (Suppl 2):S104-112. doi: 10.1007/s00586-003-0613-0.
89. Papadakis AE, Karantanas AH, Papadokostakis G, Petinellis E, Damilakis J. Can abdominal multi-detector CT diagnose spinal osteoporosis? Eur Radiol. 2009;19(1):172-176. doi: 10.1007/s00330-008-1099-2.
90. Papadakis AE, Karantanas AH, Papadokostakis G, Damilakis J. Assessment of the morpho-densitometric parameters of the lumbar pedicles in osteoporotic and control women undergoing routine abdominal MDCT examinations. J Bone Miner Metab. 2011;29(3):352-358. doi: 10.1007/s00774-010-0227-7.
91. Baum T, Grande Garcia E, Burgkart R, Gordijenko O, Liebl H, Jungmann PM, Gruber M, Zahel T, Rummeny EJ, Waldt S, Bauer JS. Osteoporosis imaging: effects of bone preservation on MDCT-based trabecular bone microstructure parameters and finite element models. BMC Med Imaging. 2015;15:22. doi: 10.1186/s12880-015-0066-z.
92. Damilakis J, Adams JE, Guglielmi G, Link TM. Radiation exposure in X-ray-based imaging techniques used in osteoporosis. Eur Radiol. 2010;20(11):2707-2714. doi: 10.1007/s00330-010-1845-0.
93. Kanis JA, Harvey NC, Cooper C, Johansson H, Odén A, McCloskey EV; Advisory Board of the National Osteoporosis Guideline Group. A systematic review of intervention thresholds based on FRAX®: A report prepared for the National Osteoporosis Guideline Group and the International Osteoporosis Foundation. Arch Osteoporos. 2016;11(1):25. doi: 10.1007/s11657-016-0278-z.
94. Merlijn T, Swart KMA, van der Horst HE, Netelenbos JC, Elders PJM. Fracture prevention by screening for high fracture risk: a systematic review and meta-analysis. Osteoporos Int. 2020;31(2):251-257. doi: 10.1007/s00198-019-05226-w.
95. Rubin KH, Rothmann MJ, Holmberg T, Høiberg M, Möller S, Barkmann R, Glüer CC, Hermann AP, Bech M, Gram J, Brixen K. Effectiveness of a two-step population-based osteoporosis screening program using FRAX®: the randomized Risk-stratified Osteoporosis Strategy Evaluation (ROSE) study. Osteoporos Int. 2018;29(3):567-578. doi: 10.1007/s00198-017-4326-3.
96. Kanis JA, McCloskey EV, Johansson H, Strom O, Borgstrom F, Oden A; National Osteoporosis Guideline Group. Case finding for the management of osteoporosis with FRAX – assessment and intervention thresholds for the UK. Osteoporos Int. 2008;19(10):1395-1408. doi: 10.1007/s00198-008-0712-1.
97. Kanis J, Johnell O, De Laet C, Jonsson B, Oden A, Oglesby AK. International variations in hip fracture probabilities: implications for risk assessment. J Bone Miner Res. 2002;17(7):1237-1244. doi: 10.1359/jbmr.2002.17.7.1237.
98. De Laet CE, Van Hout BA, Burger H, Weel AE, Hofman A, Pols HA. Hip fracture prediction in elderly men and women: validation in the Rotterdam study. J Bone Miner Res. 1998;13(10):1587-1593. doi: 10.1359/jbmr.1998.13.10.1587.
99. Kanis JA, Delmas P, Burckhardt P, Cooper C, Torgerson D. Guidelines for diagnosis and management of osteoporosis. The European Foundation for Osteoporosis and Bone Disease. Osteoporos Int. 1997;7(4):390-406. doi: 10.1007/BF01623782.
100. Kanis JA, McCloskey EV, Johansson H, Cooper C, Rizzoli R, Reginster J-Y; Scientific Advisory Board of the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) and the Committee of Scientific Advisors of the International Osteoporosis Foundation (IOF). European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int. 2013;24(1):23-57. doi: 10.1007/s00198-012-2074-y.
101. Lekamwasam S, Adachi JD, Agnusdei D, Bilezikian J, Boonen S, Borgström F, Cooper C, Diez Perez A, Eastell R, Hofbauer LC, Kanis JA, Langdahl BL, Lesnyak O, Lorenc R, McCloskey E, Messina OD, Napoli N, Obermayer-Pietsch B, Ralston SH, et al.; Joint IOF-ECTS GIO Guidelines Working Group. A framework for the development of guidelines for the management of glucocorticoid-induced osteoporosis. Osteoporos Int. 2012;23(9):2257-2276. doi: 10.1007/s00198-012-1958-1.
102. Алексеева Л.И., Баранова И.А., Белова К.Ю., Ершова О.Б., Зазерская И.Е., Зоткин Е.Г., Лесняк О.М., Никитинская О.А., Рожинская Л.Я., Скрипникова И.А., Смирнов А.В., Щеплягина Л.А. Клинические рекомендации по профилактике и ведению больных с остеопорозом. – Ярославль: Литера; 2012. – С. 23.
103. Никитинская О.А., Торопцова Н.В. Оценка риска переломов с использованием модели FRAX® (ретроспективное десятилетнее исследование). Альманах клинической медицины. 2014;(32):50-55. doi: 10.18786/2072-0505-2014-32-50-55.
104. My.NOF.org [Internet]. Washington, DC (USA): National Osteoporosis Foundation (NOF) (US); International Society for Clinical Densitometry (ISCD). Recommendations to DXA manufacturers for FRAX® implementation [cited 2021 Jul 26]. Available from: https://my.nof.org/file/bonesource/FRAX-Implementation-Guide.pdf.
105. Kanis JA, Johansson H, Odén A, McCloskey EV. Guidance for the adjustment of FRAX® according to the dose of glucocorticoids. Osteoporos Int. 2011;22(3):809-816. doi: 10.1007/s00198-010-1524-7.
106. Kanis JA, Johansson H, Odén A, Johnell O, De Laet C, Melton 3rd LJ, Tenenhouse A, Reeve J, Silman AJ, Pols HAP, Eisman JA, McCloskey EV, Mellstrom D. A meta-analysis of prior corticosteroid use and fracture risk. J Bone Miner Res. 2004;19(6):893-899. doi: 10.1359/JBMR.040134.
107. van Staa TP, Leufkens HGM, Cooper C. The epidemiology of corticosteroid-induced osteoporosis: a meta-analysis. Osteoporos Int. 2002;13(10):777-787. doi: 10.1007/s001980200108.
108. Ferrari SL, Abrahamsen B, Napoli N, Akesson K, Chandran M, Eastell R, El-Hajj Fuleihan G, Josse R, Kendler DL, Kraenzlin M, Suzuki A, Pierroz DD, Schwartz AV, Leslie WD; Bone and Diabetes Working Group of IOF. Diagnosis and management of bone fragility in diabetes: an emerging challenge. Osteoporos Int. 2018;29(12):2585-2596. doi: 10.1007/s00198-018-4650-2.
109. Leslie WD, Johansson H, McCloskey EV, Harvey NC, Kanis JA, Hans D. Comparison of methods for improving fracture risk assessment in diabetes: The Manitoba BMD registry. J Bone Miner Res. 2018;33(11):1923-1930. doi: 10.1002/jbmr.3538.
110. Baleanu F, Bergmann P, Hambye AS, Dekelver C, Iconaru L, Cappelle SI, Moreau M, Paesmans M, Karmali R, Body J-J. Assessment of bone quality with trabecular bone score in type 2 diabetes mellitus: A study from the FRISBEE cohort. Int J Clin Pract. 2019;73(5):e13347. doi: 10.1111/ijcp.13347.
111. Johansson H, Odén A, Johnell O, Jonsson B, De Laet C, Oglesby A, McCloskey EV, Kayan K, Jalava T, Kanis JA. Optimization of BMD measurements to identify high risk groups for treatment – a test analysis. J Bone Miner Res. 2004;19(6):906-913. doi: 10.1359/jbmr.2004.19.6.906.
112. Tosteson ANA, Melton 3rd LJ, Dawson-Hughes B, Baim S, Favus MJ, Khosla S, Lindsay RL; National Osteoporosis Foundation Guide Committee. Cost-effective osteoporosis treatment thresholds: the United States perspective. Osteoporos Int. 2008;19(4):437-447. doi: 10.1007/s00198-007-0550-6.
113. Leslie WD, Morin S, Lix LM, Johansson H, Oden A, McCloskey E, Kanis JA; Manitoba Bone Density Program. Fracture risk assessment without bone density measurement in routine clinical practice. Osteoporos Int. 2012;23(1):75-85. doi: 10.1007/s00198-011-1747-2.
114. Leslie WD, Majumdar SR, Lix LM, Johansson H, Oden A, McCloskey E, Kanis JA; Manitoba Bone Density Program. High fracture probability with FRAX® usually indicates densitometric osteoporosis: implications for clinical practice. Osteoporos Int. 2012;23(1):391-397. doi: 10.1007/s00198-011-1592-3.
115. Kanis JA, Odén A, Johnell O, Johansson H, De Laet C, Brown J, Burckhardt P, Cooper C, Christiansen C, Cummings S, Eisman JA, Fujiwara S, Glüer C, Goltzman D, Hans D, Krieg M-A, La Croix A, McCloskey E, Mellstrom D, et al. The use of clinical risk factors enhances the performance of BMD in the prediction of hip and osteoporotic fractures in men and women. Osteoporos Int. 2007;18(8):1033-1046. doi: 10.1007/s00198-007-0343-y.
116. Kyriakos G, Vidal-Casariego A, Fernández-Martínez MN, Blanco-Suárez MD, Ballesteros-Pomar MD, Cano-Rodríguez I. Impact of the NOGG and NOF guidelines on the indication of bone mineral density in routine clinical practice. J Clin Densitom. 2015;18(4):533-538. doi: 10.1016/j.jocd.2015.08.001.
117. Kanis JA, McCloskey EV, Johansson H, Strom O, Borgstrom F, Oden A; National Osteoporosis Guideline Group. Case finding for the management of osteoporosis with FRAX® – assessment and intervention thresholds for the UK. Osteoporos Int. 2008;19(10):1395-1408. doi: 10.1007/s00198-008-0712-1.
118. Johansson H, Kanis JA, Odén A, Johnell O, McCloskey E. BMD, clinical risk factors and their combination for hip fracture prevention. Osteoporos Int. 2009;20(10):1675-1682. doi: 10.1007/s00198-009-0845-x.
119. Johansson H, Kanis JA, Odén A, Compston J, McCloskey E. A comparison of case-finding strategies in the UK for the management of hip fractures. Osteoporos Int. 2012;23(3):907-915. doi: 10.1007/s00198-011-1864-y.
120. Kanis JA, Adams J, Borgström F, Cooper C, Jönsson B, Preedy D, Selby P, Compston J. The cost-effectiveness of alendronate in the management of osteoporosis. Bone. 2008;42(1):4-15. doi: 10.1016/j.bone.2007.10.019.
121. Cummings SR, Karpf DB, Harris F, Genant HK, Ensrud K, LaCroix AZ, Black DM. Improvement in spine bone density and reduction in risk of vertebral fractures during treatment with antiresorptive drugs. Am J Med. 2002;112(4):281-289. doi: 10.1016/s0002-9343(01)01124-x.
122. Chen P, Miller PD, Delmas PD, Misurski DA, Krege JH. Change in lumbar spine BMD and vertebral fracture risk reduction in teriparatide-treated postmenopausal women with osteoporosis. J Bone Miner Res. 2006;21(11):1785-1790. doi: 10.1359/jbmr.060802.
123. North American Menopause Society. Management of postmenopausal osteoporosis: position statement of the North American Menopause Society. Menopause. 2002;9(2):84-101. doi: 10.1097/00042192-200203000-00003.
124. Leib ES, Lewiecki EM, Binkley N, Hamdy RC; International Society for Clinical Densitometry. Official positions of the International Society for Clinical Densitometry. J Clin Densitom. 2004;7(1):1-6. doi: 10.1385/jcd:7:1:1.
125. Baim S, Binkley N, Bilezikian JP, Kendler DL, Hans DB, Lewiecki EM, Silverman S. Official Positions of the International Society for Clinical Densitometry and executive summary of the 2007 ISCD Position Development Conference. J Clin Densitom. 2008;11(1):75-91. doi: 10.1016/j.jocd.2007.12.007.
126. Shepherd JA, Blake GM. T-scores and Z-scores. J Clin Densitom. 2007;10(4):349-350. doi: 10.1016/j.jocd.2007.08.006.
127. Watts NB, Leslie WD, Foldes AJ, Miller PD. 2013 International Society for Clinical Densitometry Position Development Conference: Task Force on Normative Databases. J Clin Densitom. 2013;16(4):472-481. doi: 10.1016/j.jocd.2013.08.001.
128. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. Report of a WHO Study Group. World Health Organ Tech Rep Ser. 1994;843:1-129.
129. Kelly TL. Bone mineral density reference databases for American men and women. J Bone Miner Res. 1990;5(Suppl 2):S249.
130. Hanson J. Standardization of femur BMD. J Bone Miner Res. 1997;12(8):1316-1317. doi: 10.1359/jbmr.1997.12.8.1316.
131. Kanis JA, McCloskey EV, Johansson H, Oden A, Melton 3rd LJ, Khaltaev N. A reference standard for the description of osteoporosis. Bone. 2008;42(3):467-475. doi: 10.1016/j.bone.2007.11.001.
132. Nelson HD, Haney EM, Chou R, Dana T, Fu R, Bougatsos C (Pacific Northwest (Oregon) Evidence-based Practice Center, Portland, OR). Screening for Osteoporosis: Systematic Review to Update the 2002 US Preventive Services Task Force Recommendation. Rockville (MD): Agency for Healthcare Research and Quality (US);2010. Report No.:10-05145-EF-1. Contract No.: 290-2007-10057-I-EPC3.
133. Melton LJ 3rd, Chrischilles EA, Cooper C, Lane AW, Riggs BL. Perspective. How many women have osteoporosis? J Bone Miner Res. 1992;7(9):1005-1010. doi: 10.1002/jbmr.5650070902.
134. Bonnick SL. Bone densitometry in clinical practice. 2nd ed. Totowa (NJ): Humana Press, Inc.; 2004. doi: 10.1007/978-1-59259-659-1.
135. McCloskey EV, Odén A, Harvey NC, Leslie WD, Hans D, Johansson H, Barkmann R, Boutroy S, Brown J, Chapurlat R, Elders PJM, Fujita Y, Glüer C-C, Goltzman D, Iki M, Karlsson M, Kindmark A, Kotowicz M, Kurumatani N, et al. A meta-analysis of trabecular bone score in fracture risk prediction and its relationship to FRAX®. J Bone Miner Res. 2016;31(5):940-948. doi: 10.1002/jbmr.2734.
136. Bousson V, Bergot C, Sutter B, Levitz P, Cortet B; Scientific Committee of the Groupe de Recherche et d’Information sur les Ostéoporoses. Trabecular bone score (TBS): available knowledge, clinical relevance, and future prospects. Osteoporos Int. 2012;23(5):1489-1501. doi: 10.1007/s00198-011-1824-6.
137. ISCD.org [Internet]. Middletown, CT (USA): International Society for Clinical Densitometry. 2019 Official Positions – Adult [updated 2019 May 28; cited 2021 Jul 26]. Available from: http://www.iscd.org/official-positions/2013-iscd-official-positions-adult.
138. Black DM, Cummings SR, Karpf DB, Cauley JA, Thompson DE, Nevitt MC, Bauer DC, Genant HK, Haskell WL, Marcus R, Ott SM, Torner JC, Quandt SA, Reiss TF, Ensrud KE. Randomised trial of effect of alendronate on risk of fracture in women with existing vertebral fractures. Fracture Intervention Trial Research Group. Lancet. 1996;348(9041):1535-1541. doi: 10.1016/s0140-6736(96)07088-2.
139. Cummings SR, Black DM, Thompson DE, Applegate WB, Barrett-Connor E, Musliner TA, Palermo L, Prineas R, Rubin SM, Scott JC, Vogt T, Wallace R, Yates AJ, LaCroix AZ. Effect of alendronate on risk of fracture in women with low bone density but without vertebral fractures: results from the Fracture Intervention Trial. JAMA. 1998;280(24):2077-2082. doi: 10.1001/jama.280.24.2077.
140. Orwoll E, Ettinger M, Weiss S, Miller P, Kendler D, Graham J, Adami S, Weber K, Lorenc R, Pietschmann P, Vandormael K, Lombardi A. Alendronate for the treatment of osteoporosis in men. N Engl J Med. 2000;343(9):604-610. doi: 10.1056/NEJM200008313430902.
141. Saag KG, Emkey R, Schnitzer TJ, Brown JP, Hawkins F, Goemaere S, Thamsborg G, Liberman UA, Delmas PD, Malice MP, Czachur M, Daifotis AG. Alendronate for the prevention and treatment of glucocorticoid-induced osteoporosis. Glucocorticoid- induced osteoporosis intervention study group. N Engl J Med. 1998;339(5):292-299. doi: 10.1056/NEJM199807303390502.
142. McClung MR, Geusens P, Miller PD, Zippel H, Bensen WG, Roux C, Adami S, Fogelman I, Diamond T, Eastell R, Meunier PJ, Reginster J-Y; Hip Intervention Program Study Group. Effect of risedronate on the risk of hip fracture in elderly women. Hip Intervention Program Study Group. N Engl J Med. 2001;344(5):333-340. doi: 10.1056/NEJM200102013440503.
143. Boonen S, Orwoll ES, Wenderoth D, Stoner KJ, Eusebio R, Delmas PD. Once-weekly risedronate in men with osteoporosis: results of a 2-year, placebo-controlled, double-blind, multicenter study. J Bone Miner Res. 2009;24(4):719-725. doi: 10.1359/jbmr.081214.
144. Eastell R, Devogelaer JP, Peel NF, Chines AA, Bax DE, Sacco-Gibson N, Nagant de Deuxchaisnes C, Russell RG. Prevention of bone loss with risedronate in glucocorticoid-treated rheumatoid arthritis patients. Osteoporos Int. 2000;11(4):331-337. doi: 10.1007/s001980070122.
145. Chesnut CH 3rd, Skag A, Christiansen C, Recker R, Stakkestad JA, Hoiseth A, Felsenberg D, Huss H, Gilbride J, Schimmer RC, Delmas PD; Oral Ibandronate Osteoporosis Vertebral Fracture Trial in North America and Europe (BONE). Effects of oral ibandronate administered daily or intermittently on fracture risk in postmenopausal osteoporosis. J Bone Miner Res. 2004;19(8):1241-1249. doi: 10.1359/JBMR.040325.
146. Miller PD, McClung MR, Macovei L, Stakkestad JA, Luckey M, Bonvoisin B, Reginster J-Y, Recker RR, Hughes C, Lewiecki EM, Felsenberg D, Delmas PD, Kendler DL, Bolognese MA, Mairon N, Cooper C. Monthly oral ibandronate therapy in postmenopausal osteoporosis: 1-year results from the MOBILE study. J Bone Miner Res. 2005;20(8):1315-1322. doi: 10.1359/JBMR.050313.
147. Recker RR, Ste-Marie LG, Langdahl B, Czerwinski E, Bonvoisin B, Masanauskaite D, Rowell L, Felsenberg D. Effects of intermittent intravenous ibandronate injections on bone quality and micro- architecture in women with postmenopausal osteoporosis: the DIVA study. Bone. 2010;46(3):660-665. doi: 10.1016/j.bone.2009.11.004.
148. Harris ST, Blumentals WA, Miller PD. Ibandronate and the risk of non-vertebral and clinical fractures in women with postmenopausal osteoporosis: results of a meta-analysis of phase III studies. Curr Med Res Opin. 2008;24(1):237-245. doi: 10.1185/030079908×253717.
149. Black DM, Delmas PD, Eastell R, Reid IR, Boonen S, Cauley JA, Cosman F, Lakatos P, Leung PC, Man Z, Mautalen C, Mesenbrink P, Hu H, Caminis J, Tong K, Rosario-Jansen T, Krasnow J, Hue TF, Sellmeyer D, et al.; HORIZON Pivotal Fracture Trial. Once-yearly zoledronic acid for treatment of postmenopausal osteoporosis. N Engl J Med. 2007;356(18):1809-1822. doi: 10.1056/NEJMoa067312.
150. Boonen S, Reginster J-Y, Kaufman J-M, Lippuner K, Zanchetta J, Langdahl B, Rizzoli R, Lipschitz S, Dimai HP, Witvrouw R, Eriksen E, Brixen K, Russo L, Claessens F, Papanastasiou P, Antunez O, Su G, Bucci-Rechtweg C, Hruska J, et al. Fracture risk and zoledronic acid therapy in men with osteoporosis. N Engl J Med. 2012;367(18):1714-1723. doi: 10.1056/NEJMoa1204061.
151. Reid DM, Devogelaer JP, Saag K, Roux C, Lau C-S, Reginster J-Y, Papanastasiou P, Ferreira A, Hartl F, Fashola T, Mesenbrink P, Sambrook PN; HORIZON investigators. Zoledronic acid and risedronate in the prevention and treatment of glucocorticoid-induced osteoporosis (HORIZON): a multicentre, double-blind, double-dummy, randomised controlled trial. Lancet. 2009;373(9671):1253-1263. doi: 10.1016/S0140-6736(09)60250-6.
152. Lyles KW, Colón-Emeric CS, Magaziner JS, Adachi JD, Pieper CF, Mautalen C, Hyldstrup L, Recknor C, Nordsletten L, Moore KA, Lavecchia C, Zhang J, Mesenbrink P, Hodgson PK, Abrams K, Orloff JJ, Horowitz Z, Eriksen EF, Boonen S; HORIZON Recurrent Fracture Trial. Zoledronic acid and clinical fractures and mortality after hip fracture. N Engl J Med. 2007;357(18):1799-1809. doi: 10.1056/NEJMoa074941.
153. McClung M, Miller P, Recknor C, Mesenbrink P, Bucci-Rechtweg C, Benhamou C-L. Zoledronic acid for the prevention of bone loss in postmenopausal women with low bone mass: a randomized controlled trial. Obstet Gynecol. 2009;114(5):999-1007. doi: 10.1097/AOG.0b013e3181bdce0a.
154. Reid IR, Horne AM, Mihov B, Stewart A, Garratt E, Wong S, Wiessing KR, Bolland MJ, Bastin S, Gamble GD. Fracture prevention with zoledronate in older women with osteopenia. N Engl J Med. 2018;379(25):2407-2416. doi: 10.1056/NEJMoa1808082.
155. Cummings SR, Martin JS, McClung MR, Siris ES, Eastell R, Reid IR, Delmas P, Zoog HB, Austin M, Wang A, Kutilek S, Adami S, Zanchetta J, Libanati C, Siddhanti S, Christiansen C; FREEDOM Trial. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med. 2009;361(8):756-765. doi: 10.1056/NEJMoa0809493.
156. Langdahl BL, Teglbjærg CS, Ho P-R, Chapurlat R, Czerwinski E, Kendler DL, Reginster J-Y, Kivitz A, Lewiecki EM, Miller PD, Bolognese MA, McClung MR, Bone HG, Ljunggren Ö, Abrahamsen B, Gruntmanis U, Yang Y-C, Wagman RB, Mirza F, et al. A 24-month study evaluating the efficacy and safety of denosumab for the treatment of men with low bone mineral density: results from the ADAMO trial. J Clin Endocrinol Metab. 2015;100(4):1335-1342. doi: 10.1210/jc.2014-4079.
157. Orwoll E, Teglbjærg CS, Langdahl BL, Chapurlat R, Czerwinski E, Kendler DL, Reginster J-Y, Kivitz A, Lewiecki EM, Miller PD, Bolognese MA, McClung MR, Bone HG, Ljunggren Ö, Abrahamsen B, Gruntmanis U, Yang Y-C, Wagman RB, Siddhanti S, et al. A randomized, placebo-controlled study of the effects of denosumab for the treatment of men with low bone mineral density. J Clin Endocrinol Metab. 2012;97(9):3161-3169. doi: 10.1210/jc.2012-1569.
158. Saag KG, Pannacciulli N, Geusens P, Adachi JD, Messina OD, Morales-Torres J, Emkey R, Butler PW, Yin X, Lems WF. Denosumab vs risedronate in glucocorticoid-induced osteoporosis: final results of a twenty four-month randomized, double-blind, double-dummy trial. Arthritis Rheumatol. 2019;71(7):1174-1184. doi: 10.1002/art.40874.
159. Gnant M, Pfeiler G, Dubsky PC, Hubalek M, Greil R, Jakesz R, Wette V, Balic M, Haslbauer F, Melbinger E, Bjelic-Radisic V, Artner-Matuschek S, Fitzal F, Marth C, Sevelda P, Mlineritsch B, Steger GG, Manfreda D, Exner R, et al.; Austrian Breast and Colorectal Cancer Study Group. Adjuvant denosumab in breast cancer (ABCSG-18): a multicentre, randomised, double-blind, placebo-controlled trial. Lancet. 2015;386(9992):433-443. doi: 10.1016/S0140-6736(15)60995-3.
160. Smith MR, Egerdie B, Hernández Toriz N, Feldman R, Tammela TLJ, Saad F, Heracek J, Szwedowski M, Ke C, Kupic A, Leder BZ, Goessl C; Denosumab HALT Prostate Cancer Study Group. Denosumab in men receiving androgen-deprivation therapy for prostate cancer. N Engl J Med. 2009;361(8):745-755. doi: 10.1056/NEJMoa0809003.
161. Amiche MA, Albaum JM, Tadrous M, Pechlivanoglou P, Lévesque LE, Adachi JD, Cadarette SM. Efficacy of osteoporosis pharmacotherapies in preventing fracture among oral glucocorticoid users: a network meta-analysis. Osteoporos Int. 2016;27(6):1989-1998. doi: 10.1007/s00198-015-3476-4.
162. Coskun Benlidayi I. Denosumab in the treatment of glucocorticoid-induced osteoporosis. Rheumatol Int. 2018;38(11):1975-1984. doi: 10.1007/s00296-018-4106-1.
163. Yamaguchi Y, Morita T, Kumanogoh A. The therapeutic efficacy of denosumab for the loss of bone mineral density in glucocorticoid-induced osteoporosis: a meta-analysis. Rheumatol Adv Pract. 2020;4(1):rkaa008. doi: 10.1093/rap/rkaa008.
164. Yanbeiy ZA, Hansen KE. Denosumab in the treatment of glucocorticoid-induced osteoporosis: a systematic review and meta-analysis. Drug Des Devel Ther. 2019;13:2843-2852. doi: 10.2147/DDDT.S148654.
165. Miller PD, Bolognese MA, Lewiecki EM, McClung MR, Ding B, Austin M, Liu Y, San Martin J; Amg Bone Loss Study Group. Effect of denosumab on bone density and turnover in postmenopausal women with low bone mass after long-term continued, discontinued, and restarting of therapy: a randomized blinded phase 2 clinical trial. Bone. 2008;43(2):222-229. doi: 10.1016/j.bone.2008.04.007.
166. Mandema JW, Zheng J, Libanati C, Perez Ruixo JJ. Time course of bone mineral density changes with denosumab compared with other drugs in postmenopausal osteoporosis: a dose-response-based meta-analysis. J Clin Endocrinol Metab. 2014;99(10):3746-3755. doi: 10.1210/jc.2013-3795.
167. Brown JP, Prince RL, Deal C, Recker RR, Kiel DP, de Gregorio LH, Hadji P, Hofbauer LC, Alvaro-Gracia JM, Wang H, Austin M, Wagman RB, Newmark R, Libanati C, San Martin J, Bone HG. Comparison of the effect of denosumab and alendronate on BMD and biochemical markers of bone turnover in postmenopausal women with low bone mass: a randomized, blinded, phase 3 trial. J Bone Miner Res. 2009;24(1):153-161. doi: 10.1359/jbmr.0809010.
168. Choi N-K, Solomon DH, Tsacogianis TN, Landon JE, Song HJ, Kim SC. Comparative safety and effectiveness of denosumab versus zoledronic acid in patients with osteoporosis: a cohort study. J Bone Miner Res. 2017;32(3):611-617. doi: 10.1002/jbmr.3019.
169. Kendler DL, Roux C, Benhamou CL, Brown JP, Lillestol M, Siddhanti S, Man H-S, San Martin J, Bone HG. Effects of denosumab on bone mineral density and bone turnover in postmenopausal women transitioning from alendronate therapy. J Bone Miner Res. 2010;25(1):72-81. doi: 10.1359/jbmr.090716.
170. Tsai JN, Uihlein AV, Burnett-Bowie S-AM, Neer RM, Zhu Y, Derrico N, Lee H, Bouxsein ML, Leder BZ. Comparative effects of teriparatide, denosumab, and combination therapy on peripheral compartmental bone density, microarchitecture, and estimated strength: the DATA-HRpQCT Study. J Bone Miner Res. 2015;30(1):39-45. doi: 10.1002/jbmr.2315.
171. Broadwell A, Chines A, Ebeling PR, Franek E, Huang S, Smith S, Kendler D, Messina O, Miller PD. Denosumab safety and efficacy among participants in the FREEDOM Extension Study with mild to moderate chronic kidney disease. J Clin Endocrinol Metab. 2021;106(2):397-409. doi: 10.1210/clinem/dgaa851.
172. Meier C, Uebelhart B, Aubry-Rozier B, Birkhäuser M, Bischoff-Ferrari HA, Frey D, Kressig RW, Lamy O, Lippuner K, Stute P, Suhm N, Ferrari S. Osteoporosis drug treatment: duration and management after discontinuation. A position statement from the SVGO/ASCO. Swiss Med Wkly. 2017;147:w14484. doi: 10.4414/smw.2017.14484.
173. Miller PD, Pannacciulli N, Brown JP, Czerwinski E, Nedergaard BS, Bolognese MA, Malouf J, Bone HG, Reginster J-Y, Singer A, Wang C, Wagman RB, Cummings SR. Denosumab or zoledronic acid in postmenopausal women with osteoporosis previously treated with oral bisphosphonates. J Clin Endocrinol Metab. 2016;101(8):3163-3170. doi: 10.1210/jc.2016-1801.
174. McClung MR. Inhibition of RANKL as a treatment for osteoporosis: preclinical and early clinical studies. Curr Osteoporos Rep. 2006;4(1):28-33. doi: 10.1007/s11914-006-0012-7.
175. Белая Ж.Е., Рожинская Л.Я. Новые направления в терапии остеопороза – применение моноклональных человеческих антител к RANKL (Деносумаб). Остеопороз и остеопатии. 2011;14(2):23-26. doi: 10.14341/osteo2011223-26.
176. Neer RM, Arnaud CD, Zanchetta JR, Prince R, Gaich GA, Reginster J-Y, Hodsman AB, Eriksen EF, Ish-Shalom S, Genant HK, Wang O, Mitlak BH. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med. 2001;344(19):1434-1441. doi: 10.1056/NEJM200105103441904.
177. Orwoll ES, Scheele WH, Paul S, Adami S, Syversen U, Diez-Perez A, Kaufman JM, Clancy AD, Gaich GA. The effect of teriparatide [human parathyroid hormone (1-34)] therapy on bone density in men with osteoporosis. J Bone Miner Res. 2003;18(1):9-17. doi: 10.1359/jbmr.2003.18.1.9.
178. Saag KG, Shane E, Boonen S, Marín F, Donley DW, Taylor KA, Dalsky GP, Marcus R. Teriparatide or alendronate in glucocorticoid-induced osteoporosis. N Engl J Med. 2007;357(20):2028-2039. doi: 10.1056/NEJMoa071408.
179. Saag KG, Zanchetta JR, Devogelaer J-P, Adler RA, Eastell R, See K, Krege JH, Krohn K, Warner MR. Effects of teriparatide versus alendronate for treating glucocorticoid-induced osteoporosis: thirty-six-month results of a randomized, double-blind, controlled trial. Arthritis Rheum. 2009;60(11):3346-3355. doi: 10.1002/art.24879.
180. Liu C-L, Lee H-C, Chen C-C, Cho D-Y. Head-to-head comparisons of bisphosphonates and teriparatide in osteoporosis: a meta-analysis. Clin Invest Med. 2017;40(3):E146-E157. doi: 10.25011/cim.v40i3.28394.
181. Wang Y-K, Qin S-Q, Ma T, Song W, Jiang R-Q, Guo J-B, Li K, Zhang Y-M. Effects of teriparatide versus alendronate for treatment of postmenopausal osteoporosis: A meta-analysis of randomized controlled trials. Medicine (Baltimore). 2017;96(21):e6970. doi: 10.1097/MD.0000000000006970.
182. Kendler DL, Marin F, Zerbini CAF, Russo LA, Greenspan SL, Zikan V, Bagur A, Malouf-Sierra J, Lakatos P, Fahrleitner-Pammer A, Lespessailles E, Minisola S, Body J-J, Geusens P, Möricke R, López-Romero P. Effects of teriparatide and risedronate on new fractures in post-menopausal women with severe osteoporosis (VERO): a multicentre, double-blind, double-dummy, randomised controlled trial. Lancet. 2018;391(10117):230-240. doi: 10.1016/S0140-6736(17)32137-2.
183. Body J-J, Gaich GA, Scheele WH, Kulkarni PM, Miller PD, Peretz A, Dore RK, Correa-Rotter R, Papaioannou A, Cumming DC, Hodsman AB. A randomized double-blind trial to compare the efficacy of teriparatide [recombinant human parathyroid hormone (1–34)] with alendronate in postmenopausal women with osteoporosis. J Clin Endocrinol Metab. 2002;87(10):4528-4535. doi: 10.1210/jc.2002-020334.
184. Hadji P, Zanchetta JR, Russo L, Recknor CP, Saag KG, McKiernan FE, Silverman SL, Alam J, Burge RT, Krege JH, Lakshmanan MC, Masica DN, Mitlak BH, Stock JL. The effect of teriparatide compared with risedronate on reduction of back pain in postmenopausal women with osteoporotic vertebral fractures. Osteoporos Int. 2012;23(8):2141-2150. doi: 10.1007/s00198-011-1856-y.
185. Miller PD, Shergy WJ, Body J-J, Chen P, Rohe ME, Krege JH. Longterm reduction of back pain risk in women with osteoporosis treated with teriparatide compared with alendronate. J Rheumatol. 2005;32(8):1556-1562. PMID: 16078334.
186. EMA.europa.eu [Internet]. London (UK): European Medicines Agency Press Office; EMEA recommends changes in the product Information for Protelos/Osseor due to the risk of severe hypersensitivity reactions. EMEA/417458/2007 [updated 2007 November 16; cited 2021 Jul 26]. Available from: https://www.ema.europa.eu/en/documents/press-release/emea-recommends-changes-product-information-protelos/osseor-due-risk-severe-hypersensitivity-reactions_en.pdf.
187. EMA.europa.eu [Internet]. London (UK): European Medicines Agency; Recommendation to restrict the use of Protelos/Osseor (strontium ranelate). EMA/258269/2013 [updated 2013 April 26; cited 2021 Jul 26]. Available from: https://www.ema.europa.eu/en/documents/press-release/recommendation-restrict-use-protelos/osseor-strontium-ranelate_en.pdf.
188. EMA.europa.eu [Internet]. London (UK): European Medicines Agency; Protelos/Osseor to remain available but with futher restrictions. EMA 235924/2014 [updated 2014 September 18; cited 2021 Jul 26]. Available from: https://www.ema.europa.eu/en/documents/referral/protelos-osseor-article-20-procedure-protelos/osseor-remain-available-further-restrictions_en.pdf.
189. O’Donnel S, Cranney A, Wells GA, Adachi JD, Reginster J-Y. Strontium ranelate for preventing and treating postmenopausal osteoporosis. Cochrane Database Syst Rev. 2006;2006(4):CD005326. doi: 10.1002/14651858.CD005326.pub3.
190. Adler RA, El-Hajj Fuleihan G, Bauer DC, Camacho PM, Clarke BL, Clines GA, Compston JE, Drake MT, Edwards BJ, Favus MJ, Greenspan SL, McKinney Jr R, Pignolo RJ, Sellmeyer DE. Managing osteoporosis in patients on long-term bisphosphonate treatment: Report of a Task Force of the American Society for Bone and Mineral Research. J Bone Miner Res. 2016;31(1):16-35. doi:10.1002/jbmr.2708.
191. Black DM, Reid IR, Boonen S, Bucci-Rechtweg C, Cauley JA, Cosman F, Cummings SR, Hue TF, Lippuner K, Lakatos P, Leung PC, Man Z, Martinez RL, Tan M, Ruzycky ME, Su G, Eastell R. The effect of 3 versus 6 years of zoledronic acid treatment of osteoporosis: A randomized extension to the HORIZON-Pivotal Fracture Trial (PFT). J Bone Miner Res. 2012;27(2):243-254. doi: 10.1002/jbmr.1494.
192. Black DM, Reid IR, Cauley JA, Cosman F, Leung PC, Lakatos P, Lippuner K, Cummings SR, Hue TF, Mukhopadhyay A, Tan M, Aftring RP, Eastell R. The effect of 6 versus 9 years of zoledronic acid treatment in osteoporosis: A randomized second extension to the HORIZON-Pivotal Fracture Trial (PFT). J Bone Miner Res. 2015;30(5):934-944. doi: 10.1002/jbmr.2442.
193. Dennison EM, Cooper C, Kanis JA, Bruyère O, Silverman S, McCloskey E, Abrahamsen B, Prieto-Alhambra D, Ferrari S; IOF Epidemiology/Quality of Life Working Group. Fracture risk following intermission of osteoporosis therapy. Osteoporos Int. 2019; 30(9):1733-1743. doi: 10.1007/s00198-019-05002-w.
194. Bone HG, Wagman RB, Brandi ML, Brown JP, Chapurlat R, Cummings SR, Czerwiński E, Fahrleitner-Pammer A, Kendler DL, Lippuner K, Reginster J-Y, Roux C, Malouf J, Bradley MN, Daizadeh NS, Wang A, Dakin P, Pannacciulli N, Dempster DW, et al. 10 years of denosumab treatment in postmenopausal women with osteoporosis: results from the phase 3 randomised FREEDOM trial and open-label extension. Lancet Diabetes Endocrinol. 2017;5(7):513-523. doi: 10.1016/S2213-8587(17)30138-9.
195. Bone HG, Bolognese MA, Yuen CK, Kendler DL, Miller PD, Yang Y-C, Grazette L, San Martin J, Gallagher JC. Effects of denosumab treatment and discontinuation on bone mineral density and bone turnover markers in postmenopausal women with low bone mass. J Clin Endocrinol Metab. 2011;96(4):972-980. doi: 10.1210/jc.2010-1502.
196. Bone HG, Chapurlat R, Brandi M-L, Brown JP, Czerwinski E, Krieg M-A, Mellström D, Radominski SC, Reginster J-Y, Resch H, Ivorra JAR, Roux C, Vittinghoff E, Daizadeh NS, Wang A, Bradley MN, Franchimont N, Geller ML, Wagman RB, et al. The effect of three or six years of denosumab exposure in women with postmenopausal osteoporosis: results from the FREEDOM extension. J Clin Endocrinol Metab. 2013;98(11):4483-4492. doi: 10.1210/jc.2013-1597.
197. Anagnostis P, Paschou SA, Mintziori G, Ceausu I, Depypere H, Lambrinoudaki I, Mueck A, Perez-Lopez FR, Rees M, Senturk LM, Simoncini T, Stevenson JC, Stute P, Trémollieres FA, Goulis DG. Drug holidays from bisphosphonates and denosumab in postmenopausal osteoporosis: EMAS position statement. Maturitas. 2017;101:23-30. doi: 10.1016/j.maturitas.2017.04.008.
198. Белая Ж.Е., Bilezikian J.P., Ершова О.Б., Лесняк О.М., Марченкова Л.А., Родионова С.С., Рожинская Л.Я., Торопцова Н.В., Юренева С.В. Возможности длительной терапии постменопаузального остеопороза: обзор результатов клинических исследований деносумаба и резолюция совета экспертов российской ассоциации по остеопорозу (РАОП). Остеопороз и остеопатии. 2018;21(1):17-22. doi: 10.14341/osteo9760.
199. Brown JP, Roux C, Törring O, Ho P-R, Beck Jensen J-E, Gilchrist N, Recknor C, Austin M, Wang A, Grauer A, Wagman RB. Discontinuation of denosumab and associated fracture incidence: analysis from the Fracture Reduction Evaluation of Denosumab in Osteoporosis Every 6 Months (FREEDOM) trial. J Bone Miner Res. 2013;28(4):746-752. doi:10.1002/jbmr.1808.
200. Popp AW, Zysset PK, Lippuner K. Rebound-associated vertebral fractures after discontinuation of denosumab – from clinic and biomechanics. Osteoporos Int. 2016;27(5):1917-1921. doi:10.1007/s00198-015-3458-6.
201. Tsourdi E, Langdahl B, Cohen-Solal M, Aubry-Rozier B, Eriksen EF, Guañabens N, Obermayer-Pietsch B, Ralston SH, Eastell R, Zillikens MC. Discontinuation of denosumab therapy for osteoporosis: a systematic review and position statement by ECTS. Bone. 2017;105:11-17. doi: 10.1016/j.bone.2017.08.003.
202. Tsourdi E, Langdahl B, Cohen-Solal M, Aubry-Rozier B, Eriksen EF, Guañabens N, Obermayer-Pietsch B, Ralston SH, Eastell R, Zillikens MC. Discontinuation of Denosumab therapy for osteoporosis: A systematic review and position statement by ECTS. Bone. 2017;105:11-17. doi: 10.1016/j.bone.2017.08.003.
203. Tsourdi E, Zillikens MC, Meier C, Body J-J, Rodriguez EG, Anastasilakis AD, Abrahamsen B, McCloskey E, Hofbauer LC, Guañabens N, Obermayer-Pietsch B, Ralston SH, Eastell R, Pepe J, Palermo A, Langdahl B. Fracture risk and management of discontinuation of denosumab therapy: a systematic review and position statement by ECTS. J Clin Endocrinol Metab. 2020;dgaa756. doi: 10.1210/clinem/dgaa756.
204. Koldkjær Sølling AS, Harsløf T, Kaal A, Rejnmark L, Langdahl B. Hypercalcemia after discontinuation of long-term denosumab treatment. Osteoporos Int. 2016;27(7):2383-2386. doi: 10.1007/s00198-016-3535-5.
205. Leder BZ, Tsai JN, Uihlein AV, Wallace PM, Lee H, Neer RM, Burnett-Bowie S-AM. Denosumab and teriparatide transitions in postmenopausal osteoporosis (the DATA-Switch study): extension of a randomised controlled trial. Lancet. 2015;386(9999):1147-1155. doi: 10.1016/S0140-6736(15)61120-5.
206. Ebina K, Hashimoto J, Kashii M, Hirao M, Kaneshiro S, Noguchi T, Tsukamoto Y, Yoshikawa H. The effects of switching daily teriparatide to oral bisphosphonates or denosumab in patients with primary osteoporosis. J Bone Miner Metab. 2017;35(1):91-98. doi: 10.1007/s00774-015-0731-x.
207. Rittmaster RS, Bolognese M, Ettinger MP, Hanley DA, Hodsman AB, Kendler DL, Rosen CJ. Enhancement of bone mass in osteoporotic women with parathyroid hormone followed by alendronate. J Clin Endocrinol Metab. 2000;85(6):2129-2134. doi: 10.1210/jcem.85.6.6614.
208. Diez-Perez A, Adachi JD, Agnusdei D, Bilezikian JP, Compston JE, Cummings SR, Eastell R, Eriksen EF, Gonzalez-Macias J, Liberman UA, Wahl DA, Seeman E, Kanis JA, Cooper C; IOF CSA Inadequate Responders Working Group. Treatment failure in osteoporosis. Osteoporos Int. 2012;23(12):2769-2774. doi: 10.1007/s00198-012-2093-8.
209. Gaál J, Bender T, Varga J, Horváth I, Kiss J, Somogyi P, Surányi P. Overcoming resistance to bisphosphonates through the administration of alfacalcidol: results of a 1-year, open follow-up study. Rheumatol Int. 2009;30(1):25-31. doi: 10.1007/s00296-009-0892-9.
210. Harris ST, Watts NB, Genant HK, McKeever CD, Hangartner T, Keller M, Chesnut 3rd CH, Brown J, Eriksen EF, Hoseyni MS, Axelrod DW, Miller PD. Effects of risedronate treatment on vertebral and nonvertebral fractures in women with postmenopausal osteoporosis: a randomized controlled trial. Vertebral Efficacy With Risedronate Therapy (VERT) Study Group. JAMA. 1999;282(14):1344-1352. doi: 10.1001/jama.282.14.1344.
211. Reginster J-Y, Minne HW, Sorensen OH, Hooper M, Roux C, Brandi ML, Lund B, Ethgen D, Pack S, Roumagnac I, Eastell R. Randomized trial of the effects of risedronate on vertebral fractures in women with established postmenopausal osteoporosis. Vertebral Efficacy with Risedronate Therapy (VERT) Study Group. Osteoporos Int. 2000;11(1):83-91. doi: 10.1007/s001980050010.
212. Meunier PJ, Roux C, Seeman E, Ortolani S, Badurski JE, Spector TD, Cannata J, Balogh A, Lemmel E-M, Pors-Nielsen S, Rizzoli R, Genant HK, Reginster J-Y. The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis. N Engl J Med. 2004;350(5):459-468. doi: 10.1056/NEJMoa022436.
213. British Orthopaedic Association, British Geriatrics Society. The care of patients with fragility fracture. London: Chandlers Printers Ltd.; 2007 Sep. 73 p. Available from: https://www.bgs.org.uk/sites/default/files/content/attachment/2018-05-02/Blue%20Book%20on%20fragility%20fracture%20care.pdf.
214. Association of Anaesthetists of Great Britain and Ireland; Griffiths R, Alper J, Beckingsale A, Goldhill D, Heyburn G, Holloway J, Leaper E, Parker M, Ridgway S, White S, Wiese M, Wilson I. Management of proximal femoral fractures 2011: Association of Anaesthetists of Great Britain and Ireland. Anaesthesia. 2012;67(1):85-98. doi: 10.1111/j.1365-2044.2011.06957.x.
215. Загородний Н.В., Голухов Г.Н., Волна А.А., и др. Диагностика и лечение переломов проксимального отдела бедра у лиц пожилого и старческого возраста. Методические рекомендации. Москва: Издательство РУДН; 2012.
216. Roche JJW, Wenn RT, Sahota O, Moran CG. Effect of comorbidities and postoperative complications on mortality after hip fracture in elderly people: prospective observational cohort study. BMJ. 2005;331(7529):1374. doi: 10.1136/bmj.38643.663843.55.
217. Kates SL, Mendelson DA, Friedman SM. Co-managed care for fragility hip fractures (Rochester model). Osteoporos Int. 2010;21(Suppl 4):S621-625. doi: 10.1007/s00198-010-1417-9.
218. Silverman SL, Kupperman ES, Bukata SV, Members of IOF Fracture Working Group. Fracture healing: a consensus report from the International Osteoporosis Foundation Fracture Working Group. Osteoporos Int. 2016;27(7):2197-2206. doi: 10.1007/s00198-016-3513-y.
219. Oliver D, Connelly JB, Victor CR, Shaw FE, Whitehead A, Genc Y, Vanoli A, Martin FC, Gosney MA. Strategies to prevent falls and fractures in hospitals and care homes and effect of cognitive impairment: systematic review and meta-analyses. BMJ. 2007;334(7584):82. doi: 10.1136/bmj.39049.706493.55.
220. Schmidt K, Hübscher M, Vogt L, Klinkmüller U, Hildebrandt HD, Fink M, Banzer W. [Influence of spinal orthosis on gait and physical functioning in women with postmenopausal osteoporosis.] Orthopäde. 2012;41(3):200-205. doi: 10.1007/s00132-011-1867-6. German.
221. Pfeifer M, Begerow B, Minne HW. Effects of a new spinal orthosis on posture, trunk strength, and quality of life in women with postmenopausal osteoporosis: a randomized trial. Am J Phys Med Rehabil. 2004;83(3):177-186. doi: 10.1097/01.phm.0000113403.16617.93.
222. Jin YZ, Lee JH. Effect of brace to osteoporotic vertebral fracture: a meta-analysis. J Korean Med Sci. 2016;31(10):1641-1649. doi: 10.3346/jkms.2016.31.10.1641.
223. Valentin GH, Pedersen LN, Maribo T. Wearing an active spinal orthosis improves back extensor strength in women with osteoporotic vertebral fractures. Prosthet Orthot Int. 2014;38(3):232-238. doi: 10.1177/0309364613497393.
224. Matussek J, Boluki D, Füssel S, Grifka J. [Orthotic methods for osteoporosis and osteoporotic vertebral fracture.] Orthopäde. 2010;39(4):387-396. doi: 10.1007/s00132-010-1596-2. German.
225. Shariatzadeh H, Modaghegh BS, Mirzaei A. The effect of dynamic hyperextension brace on osteoporosis and hyperkyphosis reduction in postmenopausal osteoporotic women. Arch Bone Jt Surg. 2017;5(3):181-185. PMID: 28656166.
226. Snow-Harter C, Bouxsein ML, Lewis BT, Carter DR, Marcus R. Effects of resistance and endurance exercise on bone mineral status of young women: a randomized exercise intervention trial. J Bone Miner Res. 1992;7(7):761-769. doi: 10.1002/jbmr.5650070706.
227. Vainionpää A, Korpelainen R, Leppäluoto J, Jämsä T. Effects of high-impact exercise on bone mineral density: a randomized controlled trial in premenopausal women. Osteoporos Int. 2005;16(2):191-197. doi: 10.1007/s00198-004-1659-5.
228. Yu H-S, Kim J-J, Kim H-W, Lewis MP, Wall I. Impact of mechanical stretch on the cell behaviors of bone and surrounding tissues. J Tissue Eng. 2016;7:2041731415618342. doi: 10.1177/2041731415618342.
229. Kelley GA, Kelley KS, Tran ZV. Exercise and lumbar spine bone mineral density in postmenopausal women: a meta-analysis of individual patient data. J Gerontol A Biol Sci Med Sci. 2002 Sep;57(9):M599-604. doi: 10.1093/gerona/57.9.m599.
230. Michael YL, Whitlock EP, Lin JS, Fu R, O’Connor EA, Gold R, US Preventive Services Task Force. Primary care- relevant interventions to prevent falling in older adults: a systematic evidence review for the U.S. Preventive Services Task Force. Ann Intern Med. 2010;153(12):815-825. doi: 10.7326/0003-4819-153-12-201012210-00008.
231. Howe TE, Shea B, Dawson LJ, Downie F, Murray A, Ross C, Harbour RT, Caldwell LM, Creed G. Exercise for preventing and treating osteoporosis in postmenopausal women. Cochrane Database Syst Rev. 2011;(7):CD000333. doi: 10.1002/14651858.CD000333.pub2.
232. Sherrington C, Whitney JC, Lord SR, Herbert RD, Cumming RG, Close JCT. Effective exercise for the prevention of falls: a systematic review and meta-analysis. J Am Geriatr Soc. 2008;56(12):2234-2243. doi: 10.1111/j.1532-5415.2008.02014.x.
233. Howe TE, Rochester L, Neil F, Skelton DA, Ballinger C. Exercise for improving balance in older people. Cochrane Database Syst Rev. 2011;(11):CD004963. doi: 10.1002/14651858.CD004963.pub3.
234. Li W-C, Chen Y-C, Yang R-S, Tsauo J-Y. Effects of exercise programmes on quality of life in osteoporotic and osteopenic postmenopausal women: a systematic review and meta-analysis. Clin Rehabil. 2009;23(10):888-896. doi: 10.1177/0269215509339002.
235. Smith É, Carroll Á. Bone mineral density in adults disabled through acquired neurological conditions: a review. J Clin Densitom. 2011;14(2):85-94. doi: 10.1016/j.jocd.2010.12.002.
236. Dawson-Hughes B, Mithal A, Bonjour J-P, Boonen S, Burckhardt P, Fuleihan GE-H, Josse RG, Lips P, Morales-Torres J, Yoshimura N. IOF position statement: vitamin D recommendations for older adults. Osteoporos Int. 2010;21(7):1151-1154. doi:10.1007/s00198-010-1285-3.
237. DIPART (Vitamin D Individual Patient Analysis of Randomized Trials) Group. Patient level pooled analysis of 68500 patients from seven major vitamin D fracture trials in US and Europe. BMJ. 2010;340:b5463. doi: 10.1136/bmj.b5463.
238. Tripkovic L, Lambert H, Hart K, Smith CP, Bucca G, Penson S, Chope G, Hyppönen E, Berry J, Vieth R, Lanham-New S. Comparison of vitamin D2 and vitamin D3 supplementation in raising serum 25-hydroxyvitamin D status: a systematic review and meta-analysis. Am J Clin Nutr. 2012;95(6):1357-1364. doi: 10.3945/ajcn.111.031070.
239. Hassan AB, Hozayen RF, Alotaibi RA, Tayem YI. Therapeutic and maintenance regimens of vitamin D3 supplementation in healthy adults: A systematic review. Cell Mol Biol (Noisy-le-grand). 2018;64(14):8-14. PMID: 30511630.
240. Kearns MD, Alvarez JA, Tangpricha V. Large, single-dose, oral vitamin D supplementation in adult populations: a systematic review. Endocr Pract. 2014;20(4):341-351. doi: 10.4158/EP13265.RA.
241. Tabatabaeizadeh S-A, Avan A, Bahrami A, Khodashenas E, Esmaeili H, Ferns GA, Abdizadeh MF, Ghayour-Mobarhan M. High dose supplementation of vitamin D affects measures of systemic inflammation: reductions in high sensitivity C-reactive protein level and neutrophil to lymphocyte ratio (NLR) distribution. J Cell Biochem. 2017;118(12):4317-4322. doi: 10.1002/jcb.26084.
242. Esfandiari A, Pourghassem Gargari B, Noshad H, Sarbakhsh P, Mobasseri M, Barzegari M, Arzhang P. The effects of vitamin D3 supplementation on some metabolic and inflammatory markers in diabetic nephropathy patients with marginal status of vitamin D: A randomized double blind placebo controlled clinical trial. Diabetes Metab Syndr. 2019;13(1):278-283. doi: 10.1016/j.dsx.2018.09.013.
243. Dalle Carbonare L, Valenti MT, Del Forno F, Piacentini G, Pietrobelli A. Vitamin D daily versus monthly administration: bone turnover and adipose tissue influences. Nutrients. 2018;10(12):1934. doi: 10.3390/nu10121934.
244. Venugopal Y, Hatta SFWM, Musa N, Rahman SA, Ratnasingam J, Paramasivam SS, Lim LL, Ibrahim L, Choong K, Tan AT, Chinna K, Chan SP, Vethakkan SR. Maintenance vitamin D3 dosage requirements in Chinese women with post menopausal osteoporosis living in the tropics. Asia Pac J Clin Nutr. 2017;26(3):412-420. doi: 10.6133/apjcn.042016.10.
245. Пигарова Е.А., Рожинская Л.Я., Белая Ж.Е., Дзеранова Л.К., Каронова Т.Л., Ильин А.В., Мельниченко Г.А., Дедов И.И. Клинические рекомендации Российской ассоциации эндокринологов по диагностике, лечению и профилактике дефицита витамина D у взрослых. Проблемы эндокринологии. 2016;62(4):60-84. doi: 10.14341/probl201662460-84.
246. Heaney RP, Davies KM, Chen TC, Holick MF, Barger-Lux MJ. Human serum 25-hydroxycholecalciferol response to extended oral dosing with cholecalciferol. Am J Clin Nutr. 2003;77(1):204-210. doi: 10.1093/ajcn/77.1.204.
247. Broe KE, Chen TC, Weinberg J, Bischoff-Ferrari HA, Holick MF, Kiel DP. A higher dose of vitamin D reduces the risk of falls in nursing home residents: a randomized, multiple-dose study. J Am Geriatr Soc. 2007;55(2):234-239. doi: 10.1111/j.1532-5415.2007.01048.x.
248. Institute of Medicine of the National Academies, Committee to Review Dietary Reference Intakes for Vitamin D and Calcium; Ross AC, Taylor CL, Yaktine AL, Del Valle HB, editors. Dietary Reference Intakes for Calcium and Vitamin D. Washington, DC: The National Academy Press; 2011.
249. Web-Ion [Internet]. Химический состав пищевых продуктов, используемых в Российской Федерации [ссылка активна на 26.07.2021]. Доступен по ссылке: http://web.ion.ru/food/FD_tree_grid.aspx.
250. Boonen S, Bischoff-Ferrari HA, Cooper C, Lips P, Ljunggren O, Meunier PJ, Reginster J-Y. Addressing the musculoskeletal components of fracture risk with calcium and vitamin D: a review of the evidence. Calcif Tissue Int. 2006;78(5):257-270. doi: 10.1007/s00223-005-0009-8.
251. Tang BMP, Eslick GD, Nowson C, Smith C, Bensoussan A. Use of calcium or calcium in combination with vitamin D supplementation to prevent fractures and bone loss in people aged 50 years and older; a meta-analysis. Lancet. 2007;370(9588):657-666. doi: 10.1016/S0140-6736(07)61342-7.
252. Richy F, Dukas L, Schacht E. Differential effects of D-hormone analogs and native vitamin D on the risk of falls: a comparative meta-analysis. Calcif Tissue Int. 2008;82(2):102-107. doi: 10.1007/s00223-008-9102-0.
253. Del Valle E, Negri AL, Fradinger E, Canalis M, Bevione P, Curcelegui M, Bravo M, Puddu M, Marini A, Ryba J, Peri P, Rosa Diez G, Sintado L, Gottlieb E. Weekly high-dose ergocalciferol to correct vitamin D deficiency/insufficiency in hemodialysis patients: a pilot trial. Hemodial Int. 2015;19(1):60-65. doi: 10.1111/hdi.12209.
254. Mager DR, Jackson ST, Hoffmann MR, Jindal K, Senior PA. Vitamin D supplementation and bone health in adults with diabetic nephropathy: the protocol for a randomized controlled trial. BMC Endocr Disord. 2014;14:66. doi: 10.1186/1472-6823-14-66.
255. Baber RJ, Panay N, Fenton A, IMS Writing Group. 2016 IMS Recommendations on women’s midlife health and menopause hormone therapy. Climacteric. 2016;19(2):109-150. doi: 10.3109/13697137.2015.1129166.
256. Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML, Jackson RD, Beresford SAA, Howard BV, Johnson KC, Kotchen JM, Ockene J, Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principle results from the Women’s Health Initiative randomized controlled trial. JAMA. 2002;288(3):321-333. doi: 10.1001/jama.288.3.321.
257. Ettinger B, Ensrud K, Wallace R, Johnson KC, Cummings SR, Yankov V, Vittinghoff E, Grady D. Effects of ultralow-dose transdermal estradiol on bone mineral density: a randomized clinical trial. Obstet Gynecol. 2004;104(3):443-451. doi: 10.1097/01.AOG.0000137833.43248.79.
258. de Villiers TJ, Hall JE, Pinkerton JV, Cerdas Pérez S, Rees M, Yang C, Pierroz DD. Revised Global Consensus Statement on Menopausal Hormone Therapy. Climacteric. 2016;19(4):313-315. doi: 10.1080/13697137.2016.1196047.
259. McLellan AR, Reid DM, Forbes K, Reid R, Campbell C, Gregori A, Raby N, Simpson A. Effectiveness of strategies for the secondary prevention of osteoporotic fractures in Scotland (CEPS 99/03). Glasgow (UK): NHS Quality Improvement Scotland; 2004.
260. Akesson K, Marsh D, Mitchell PJ, McLellan AR, Stenmark J, Pierroz DD, Kyer C, Cooper C, IOF Fracture Working Group. Capture the Fracture: a Best Practice Framework and global campaign to break the fragility fracture cycle. Osteoporos Int. 2013;24(8):2135-2152. doi: 10.1007/s00198-013-2348-z.
261. Hagino H, Sawaguchi T, Endo N, Ito Y, Nakano T, Watanabe Y. The risk of a second hip fracture in patients after their first hip fracture. Calcif Tissue Int. 2012;90(1):14-21. doi: 10.1007/s00223-011-9545-6.
262. Dell R. Fracture prevention in Kaiser Permanente Southern California. Osteoporos Int. 2011;22 Suppl 3:457-460. doi: 10.1007/s00198-011-1712-0.
263. Nakayama A, Major G, Holliday E, Attia J, Bogduk N. Evidence of effectiveness of a fracture liaison service to reduce the re-fracture rate. Osteoporos Int. 2016;27(3):873-879. doi: 10.1007/s00198-015-3443-0.
264. Marsh D, Akesson K, Beaton DE, Bogoch ER, Boonen S, Brandi M-L, McLellan AR, Mitchell PJ, Sale JEM, Wahl DA, IOF CSA Fracture Working Group. Coordinator-based systems for secondary prevention in fragility fracture patients. Osteoporos Int. 2011;22(7):2051-2065. doi: 10.1007/s00198-011-1642-x.
265. Ganda K, Mitchell PJ, Seibel MJ. Chapter 3 – Models of Secondary Fracture Prevention: Systematic Review and Metaanalysis of Outcomes. In: Seibel MJ, Mitchell PJ, editors. Secondary Fracture Prevention: An International Perspective. London: Academic Press; 2019. p. 33-62. doi: 10.1016/B978-0-12-813136-7.01001-2.
266. Ganda K, Puech M, Chen JS, Speerin R, Bleasel J, Center JR, Eisman JA, March L, Seibel MJ. Models of care for the secondary prevention of osteoporotic fractures: a systematic review and meta-analysis. Osteoporos Int. 2013;24(2):393-406. doi: 10.1007/s00198-012-2090-y.
267. Huntjens KMB, van Geel TACM, van den Bergh JPW, van Helden S, Willems P, Winkens B, Eisman JA, Geusens PP, Brink PRG. Fracture liaison service: impact on subsequent nonvertebral fracture incidence and mortality. J Bone Joint Surg Am. 2014;96(4):e29. doi: 10.2106/JBJS.L.00223.
268. Hawley S, Javaid MK, Prieto-Alhambra D, Lippett J, Sheard S, Arden NK, Cooper C, Judge A, REFReSH study group. Clinical effectiveness of orthogeriatric and fracture liaison service models of care for hip fracture patients: population-based longitudinal study. Age Ageing. 2016;45(2):236-242. doi: 10.1093/ageing/afv204.
269. Majumdar SR, Lier DA, Rowe BH, Russell AS, McAlister FA, Maksymowych WP, Hanley DA, Morrish DW, Johnson JA. Cost-effectiveness of a multifaceted intervention to improve quality of osteoporosis care after wrist fracture. Osteoporos Int. 2011;22(6):1799-1808. doi: 10.1007/s00198-010-1412-1.
270. McLellan AR, Wolowacz SE, Zimovetz EA, Beard SM, Lock S, McCrink L, Adekunle F, Roberts D. Fracture liaison services for the evaluation and management of patients with osteoporotic fracture: a cost-effectiveness evaluation based on data collected over 8 years of service provision. Osteoporos Int. 2011;22(7):2083-2098. doi: 10.1007/s00198-011-1534-0.
271. Reginster J-Y, Seeman E, De Vernejoul MC, Adami S, Compston J, Phenekos C, Devogelaer JP, Diaz Curiel M, Sawicki A, Goemaere S, Sorensen OH, Felsenberg D, Meunier PJ. Strontium ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis: Treatment of Peripheral Osteoporosis (TROPOS) study. J Clin Endocrinol Metab. 2005;90(5):2816-2822. doi: 10.1210/jc.2004-1774.
272. Thompson K, Rogers MJ, Coxon FP, Crockett JC. Cytosolic entry of bisphosphonate drugs requires acidification of vesicles after fluid-phase endocytosis. Mol Pharmacol. 2006;69(5):1624-1632. doi: 10.1124/mol.105.020776.
273. Dunford JE, Rogers MJ, Ebetino FH, Phipps RJ, Coxon FP. Inhibition of protein prenylation by bisphosphonates causes sustained activation of Rac, Cdc42, and Rho GTPases. J Bone Miner Res. 2006;21(5):684-694. doi:10.1359/jbmr.060118.
274. FDA.gov [Internet]. Silver Spring (MD): U.S. Food and Drug Administration Drug Safety Communication. New contraindication and updated warning on kidney impairment for Reclast (zoledronic acid); c2011 [updated 2018 Feb 08; cited 2021 Jul 26]. Available from: https://www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-new-contraindication-and-updated-warning-kidney-impairment-reclast
275. Khosla S, Burr D, Cauley J, Dempster DW, Ebeling PR, Felsenberg D, Gagel RF, Gilsanz V, Guise T, Koka S, McCauley LK, McGowan J, McKee MD, Mohla S, Pendrys DG, Raisz LG, Ruggiero SL, Shafer DM, Shum L, et al.; American Society for Bone and Mineral Research. Bisphosphonate-associated osteonecrosis of the jaw: report of a task force of the American Society for Bone and Mineral Research. J Bone Miner Res. 2007;22(10):1479-1491. doi: 10.1359/jbmr.0707onj.
276. Marie PJ. Signaling pathways affecting skeletal health. Curr Osteoporos Rep. 2012;10(3):190-198. doi: 10.1007/s11914-012-0109-0.
277. Tashjian Jr AH, Chabner BA. Commentary on clinical safety of recombinant human parathyroid hormone 1-34 in the treatment of osteoporosis in men and postmenopausal women. J Bone Miner Res. 2002;17(7):1151-1161. doi: 10.1359/jbmr.2002.17.7.1151.
278. Vahle JL, Sato M, Long GG, Young JK, Francis PC, Engelhardt JA, Westmore MS, Linda Y, Nold JB. Skeletal changes in rats given daily subcutaneous injections of recombinant human parathyroid hormone (1-34) for 2 years and relevance to human safety. Toxicol Pathol. 2002;30(3):312-321. doi: 10.1080/01926230252929882.
279. Miller PD, Schwartz EN, Chen P, Misurski DA, Krege JH. Teriparatide in postmenopausal women with osteoporosis and mild or moderate renal impairment. Osteoporos Int. 2007;18(1):59-68. doi: 10.1007/s00198-006-0189-8.
280. Nielsen SP, Slosman D, Sørensen OH, Basse-Cathalinat B, De Cassin P, Roux CR, Meunier PJ. Influence of strontium on bone mineral density and bone mineral content measurements by dual X-ray absorptiometry. J Clin Densitom. 1999;2(4):371-379. doi: 10.1016/s1094-6950(06)60402-2.
281. Recker RR, Marin F, Ish-Shalom S, Möricke R, Hawkins F, Kapetanos G, de la Peña MP, Kekow J, Farrerons J, Sanz B, Oertel H, Stepan J. Comparative effects of teriparatide and strontium ranelate on bone biopsies and biochemical markers of bone turnover in postmenopausal women with osteoporosis. J Bone Miner Res. 2009;24(8):1358-1368. doi: 10.1359/jbmr.090315.