Фармакологическое действие
Противоопухолевое средство. Панитумумаб — рекомбинантное человеческое моноклональное антитело (Ig G2), обладающее высокой аффинностью и специфичностью к рецепторам фактора эпидермального роста (EGFR).
Рецептор EGF стимулирует рост нормальных эпителиальных клеток, включая клетки кожи и волосяных фолликулов, и экспрессируется на различных типах опухолевых клеток. Панитумумаб связывается с лиганд-связывающим доменом рецептора EGF и ингибирует процесс аутофосфорилирования, который индуцируется всеми известными лигандами рецептора EGF.
Связывание панитумумаба с рецептором EGF приводит к интернализации рецептора, ингибированию процессов клеточного роста, индукции апоптоза и уменьшению продукции интерлейкина-8 и фактора роста эндотелия сосудов.
Гены KRAS (гомолог вирусного онкогена крысиной саркомы Кирстена 2) и NRAS (гомолог нейробластомы вирусного онкогена RAS) относятся к семейству онкогенов RAS. Гены KRAS и NRAS кодируют небольшой гуанозинтрифосфат-связывающий белок, который участвует в трансдукции сигнала. KRAS и NRAS активируется различными сигналами, в т.ч. и от рецептора EGF, и в свою очередь, стимулирует синтез других внутриклеточных белков, вовлеченных в процессы клеточной пролиферации, выживаемости и ангиогенеза.
Активирующие мутации генов RAS часто происходят в различных опухолевых клетках человека и играют определенную роль, как в процессе онкогенеза, так и в прогрессии опухоли.
Исследования in vitro и in vivo у животных показали, что панитумумаб ингибирует рост и выживаемость опухолевых клеток, экспрессировавших EGFR. Не наблюдалось противоопухолевой активности панитумумаба в экспериментах с ксенотрансплантатами опухолей человека, не экспрессировавшими EGFR. Добавление панитумумаба к лучевой, химио- или другой таргетной терапии в исследованиях на животных приводило к усилению противоопухолевого эффекта по сравнению с только лучевой, химио- или таргетной терапией.
Как и все терапевтические протеины, панитумумаб обладает потенциальной иммуногенностью. Продукцию нейтрализующих антител к панитумумабу оценивали с помощью двух различных скрининговых систем иммуноанализа для определения связанных антител к панитумумабу.
Фармакокинетика
Фармакокинетика панитумумаба носит нелинейный характер при применении панитумумаба в качестве монотерапии или в комбинации с химиотерапией.
После однократного введения панитумумаба в виде 1-часовой инфузии AUC возрастала в большей степени, чем это характерно для прямо пропорциональной дозозависимости, а клиренс панитумумаба снижался с 30.6 до 4.6 мл/сут/кг при увеличении дозы от 0.75 до 9 мг/кг. Однако при введении панитумумаба в дозах свыше 2 мг/кг характер увеличения AUC был близок к пропорциональной дозозависимости.
При дозе 6 мг/кг 1 раз в 2 недели в виде 1-часовой инфузии Css панитумумаба достигается к третьей инфузии при средних значениях максимальной (± стандартное отклонение [SD]) и минимальной концентраций 213 ± 59 и 39 ± 14 мкг/мл соответственно. Среднее значение (± SD) AUC0-t и клиренса были равны 1306 ± 374 мкг×сут/мл и 4.9 ± 1.4 мл/кг/сут соответственно. T1/2 панитумумаба составил приблизительно 7.5 сут (разброс: от 3.6 до 10.9 сут).
Показания активного вещества
ПАНИТУМУМАБ
Лечение метастатического колоректального рака (мКРР) у взрослых пациентов с генами RAS дикого типа в опухоли: в качестве 1-й линии терапии в комбинации с режимами, содержащими фторурацил, кальция фолинат и оксалиплатин (FOLFOX) или фторурацил, кальция фолинат и иринотекан (FOLFIRI); в качестве 2-й линии терапии в комбинации с режимом, содержащим фторурацил, кальция фолинат и иринотекан (FOLFIRI) у пациентов, получавших ранее химиотерапию 1-й линии на основе фторпиримидина (исключая иринотекан); в качестве монотерапии при неэффективности режимов химиотерапии на основе фторпиримидина, оксалиплатина и иринотекана.
Режим дозирования
Вводят в/в в виде инфузии с помощью инфузионного насоса. Доза составляет 6 мг/кг 1 раз в 2 недели. При развитии дерматологических реакций требуется коррекция дозы или отмена панитумумаба (в зависимости от степени токсичности и переносимости).
Лечение рекомендуется продолжать до прогрессирования заболевания.
Побочное действие
Инфекции и инвазии: очень часто — конъюнктивит, паронихия; часто — кожные высыпания пустулезные, воспаление подкожной клетчатки, инфекция мочевыводящих путей, фолликулит, локализованная инфекция; нечасто — инфекция глаза, инфекция века.
Со стороны крови и лимфатической системы: очень часто — анемия; часто — лейкопения.
Со стороны иммунной системы: часто — гиперчувствительность; нечасто — анафилактическая реакция.
Со стороны обмена веществ: очень часто — гипокалиемия, гипомагниемия, снижение аппетита, уменьшение массы тела; часто — гипокальциемия, дегидратация, гипергликемия, гипофосфатемия.
Психические нарушения: очень часто — бессонница; часто — тревожность.
Со стороны нервной системы: часто — головная боль, головокружение.
Со стороны органа зрения: часто — блефарит, рост ресниц, усиление слезотечения, гиперемия глаза, сухость глаз, зуд глаз,
раздражение глаза; нечасто — язвенный кератит, кератит, раздражение века.
Со стороны сердечно-сосудистой системы: часто — тахикардия, тромбоз глубоких вен, гипотензия, гипертензия, гиперемия; нечасто — цианоз.
Со стороны дыхательной системы: очень часто — диспноэ, кашель; часто — тромбоэмболия легочной артерии,
носовое кровотечение; нечасто — интерстициальная болезнь легких, бронхоспазм, сухость слизистой оболочки полости носа.
Со стороны пищеварительной системы: очень часто — диарея, тошнота, рвота, боли в животе, стоматит, запор; часто — Ректальное кровотечение, сухость во рту, диспепсия, афтозные язвы, хейлит, ГЭРБ; нечасто — обветренность губ;
сухость губ.
Со стороны кожи и подкожной клетчатки: очень часто — акнеформный дерматит, кожная сыпь, эритема, кожный зуд, сухость кожи, трещины кожи, акне, алопеция; часто — язвенные поражения кожи, эксфолиативные поражения кожи, эксфолиативные кожные высыпания, дерматит, папулезные кожные высыпания, зудящие кожные высыпания, эритематозные кожные высыпания, генерализованные кожные высыпания, макулезные кожные высыпания, макуло-папулезные кожные высыпания, повреждения кожи, кожная токсичность, корки, гипертрихоз, онихоклазия, нарушение со стороны ногтей, гипергидроз, синдром ладонно-подошвенной эритродизестезии; нечасто — токсический эпидермальный некролиз, синдром Стивенса-Джонсона, некроз кожи, ангионевротический отек, гирсутизм, вросший ноготь, онихолиз.
Со стороны костно-мышечной системы: очень часто — боль в спине; часто — боли в конечности.
Общие реакции: очень часто — утомляемость, пирексия, астения, мукозиты, периферические отеки.
Противопоказания к применению
Повышенная чувствительность к панитумумабу в анамнезе; интерстициальный пневмонит или фиброз легких; почечная недостаточность; печеночная недостаточность; комбинация с оксалиплатин-содержащим режимом химиотерапии у пациентов с мКРР и мутациями в генах RAS или пациентам с мКРР с неуточненным статусом мутаций в генах RAS; детский и подростковый возраст до 18 лет; беременность, период грудного вскармливания.
С осторожностью
Кератит, язвенный кератит, выраженная сухость глаз.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период грудного вскармливания.
Применение при нарушениях функции печени
Исследований фармакокинетики у пациентов с нарушением функции печени не проводилось.
Применение при нарушениях функции почек
Исследований фармакокинетики у пациентов с нарушением функции почек не проводилось.
Применение у детей
Противопоказано применение у детей и подростков в возрасте до 18 лет.
Применение у пожилых пациентов
Различий безопасности или эффективности панитумумаба у пациентов пожилого возраста (> 65 лет) не наблюдалось. Однако отмечалось увеличение количества серьезных нежелательных явлений у пожилых пациентов, получавших панитумумаб в комбинации с химиотерапией.
Особые указания
В период лечения следует контролировать возникновение дерматологических реакций и проводить соответствующую симптоматическую терапию. Для уменьшения выраженности данных реакций пациентам рекомендуется ограничить инсоляцию и использовать солнцезащитную одежду.
Во время инфузии возможны анафилактические реакции, бронхоспазм, артериальная гипотензия. В таких случаях инфузию следует немедленно прекратить. Сообщается о развитии реакций гиперчувствительности, включая ангионевротический отек, более чем через 24 после инфузии.
При применении ингибиторов EGFR наблюдались интерстициальные заболевания легких, развитие острых или ухудшение имеющихся легочных симптомов. При возникновении таких симптомов лечение панитумумабом следует прервать и провести соответствующее обследование. Если наличие пневмонита или легочных инфильтратов подтвердится, то панитумумаб следует отменить, а пациент должен получить соответствующую терапию.
У пациентов с тяжелой диареей и дегидратацией наблюдались нарушения функции почек.
В период лечения следует контролировать состояние зрения.
В период лечения следует контролировать электролитный баланс, особенно содержание магния в крови.
Безопасность применения в педиатрии не изучена.
Влияние на способность к управлению транспортными средствами и механизмами
В случае развития нежелательных реакций со стороны органов зрения и/или снижения способности к концентрации внимания и быстроты реакции, пациентам рекомендуется воздержаться от управления транспортными средствами или работы со сложным оборудованием до разрешения указанных нежелательных реакций.
Лекарственное взаимодействие
Не рекомендуется сочетанное применение панитумумаба с режимом химиотерапии, включающим бевацизумаб, т.к. возможно увеличение частоты токсичности и случаев летального исхода.
Вектибикс — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛСР-007740/09
Торговое наименование препарата:
Вектибикс
Международное непатентованное наименование:
панитумумаб
Лекарственная форма:
концентрат для приготовления раствора для инфузий
Состав
1 мл концентрата содержит:
активное вещество: панитумумаб — 20 мг;
вспомогательные вещества: натрия ацетата тригидрат — 6,8 мг, натрия хлорид — 5,8 мг, уксусная кислота ледяная — до рН 5,8, вода для инъекций — достаточное количество.
Описание
Прозрачная или слегка опалесцирующая бесцветная жидкость; может содержать полупрозрачные или белые аморфные белковые частицы.
Фармакотерапевтическая группа
Противоопухолевое средство, моноклональные антитела.
Код АТХ:
L01XC08
Фармакологические свойства
Фармакодинамика
Механизм действия
Панитумумаб представляет собой рекомбинантное человеческое моноклональное антитело (IgG2), обладающее высокой аффинностью и специфичностью к рецепторам эпителиального фактора роста человека (EGFR). Рецептор EGF — это трансмембранный гликопротеин из семейства рецепторов тирозинкиназ I типа, которое включает также EGFR (HER1/c-ErbB-1), HER2, HER3 и HER4. Рецептор EGF стимулирует рост нормальных эпителиальных клеток, включая клетки кожи и волосяных фолликулов, и экспрессируется на различных типах опухолевых клеток.
Панитумумаб связывается с лиганд-связывающим доменом рецептора EGF и ингибирует процесс аутофосфорилирования, который индуцируется всеми известными лигандами рецептора EGF. Связывание панитумумаба с рецептором EGF приводит к интернализации рецептора, ингибированию процессов клеточного роста, индукции апоптоза и уменьшению продукции интерлейкина-8 и фактора роста эндотелия сосудов.
Гены KRAS (гомолог вирусного онкогена крысиной саркомы Кирстена 2) и NRAS (гомолог нейробластомы вирусного онкогена RAS) относятся к семейству онкогенов RAS. Гены KRAS и NRAS кодируют небольшой гуанозинтрифосфат-связывающий белок, который участвует в трансдукции сигнала. KRAS и NRAS активируется различными сигналами, в том числе и от рецептора EGF, и в свою очередь, стимулирует синтез других внутриклеточных белков, вовлеченных в процессы клеточной пролиферации, выживаемости и ангиогенеза.
Активирующие мутации генов RAS часто происходят в различных опухолевых клетках человека и играют определенную роль, как в процессе онкогенеза, так и в прогрессии опухоли.
Фармакодинамические эффекты
Исследования in vitro и in vivo на животных показали, что панитумумаб ингибирует рост и выживаемость опухолевых клеток, экспрессировавших EGFR. Не наблюдалось противоопухолевой активности панитумумаба в экспериментах с ксенотрансплантатами опухолей человека, не экспрессировавшими EGFR. Добавление панитумумаба к лучевой, химио- или другой таргетной терапии в исследованиях на животных приводило к усилению противоопухолевого эффекта по сравнению с только лучевой, химио- или таргетной терапией.
Кожные реакции (в том числе проявления на ногтях) отмечались у пациентов, получавших препарат Вектибикс или другие ингибиторы EGFR, и, как известно, ассоциированы с фармакологическими эффектами терапии (см. разделы «Способ применения и дозы» и «Побочное действие»).
Иммуногенность
Как и все терапевтические протеины, панитумумаб обладает потенциальной иммуногенностью. Продукцию анти-панитумумаб антител оценивали с помощью двух различных скрининговых систем иммуноанализа для определения связывающих анти-панитумумаб антител (ИФА -иммуноферментный анализ, который позволяет определить высокоаффинные антитела, и биосенсорный иммуноанализ, позволяющий определить высоко- и низкоаффинные антитела). Пациентам, чья сыворотка оказывалась положительной в любом из двух тестов скринингового иммуноанализа, проводился также биологический тест in vitro для обнаружения нейтрализующих антител.
В качестве монотерапии:
- Выявляемость связывающих антител (за исключением случаев выявления антител до введения препарата и временно положительных) составляла < 1%, как было установлено с помощью анализа ИФА методом кислотной диссоциации, и 3,8%, как было установлено с помощью иммунологического анализа Biacore;
- Выявляемость нейтрализующих антител (за исключением случаев выявления антител до введения препарата и временно положительных) составляла < 1%;
- При сравнении с пациентами, у которых антитела не вырабатывались, взаимосвязь между наличием анти-панитумумаб антител и изменениями фармакокинетических параметров, эффективности и безопасности препарата не отмечена.
В комбинации с режимами химиотерапии на основе иринотекана или оксалиплатина:
- Выявляемость связывающих антител (за исключением случаев выявления антител до введения препарата) составляла 1%, как было установлено с помощью анализа ИФА методом кислотной диссоциации, и < 1%, как было установлено с помощью иммунологического анализа Biacore;
- Выявляемость нейтрализующих антител (за исключением случаев выявления антител до введения препарата) составляла < 1%;
- Не было обнаружено никаких доказательств изменения профиля безопасности у пациентов с положительным результатом теста на антитела к препарату Вектибикс.
Определение образования антител зависит от чувствительности и специфичности используемого метода. На положительный результат по определению антител могут оказать влияние различные факторы, включая метод проведения анализа, методику отбора и подготовку образцов, время забора проб, прием сопутствующих лекарственных препаратов и характер основного заболевания, поэтому сравнение частоты возникновения антител к другим препаратам может приводить к недостоверным результатам.
Фармакокинетика
При применении препарата Вектибикс в качестве монотерапии или в комбинации с химиотерапией фармакокинетика препарата носит нелинейный характер.
После однократного введения панитумумаба в виде 1-часовой инфузии площадь под кривой «концентрация-время» (AUC) возрастала в большей степени, чем это характерно при дозопропорциональной зависимости, а клиренс (CL) панитумумаба снижался с 30,6 до 4,6 мл/сут/кг при увеличении дозы от 0,75 до 9 мг/кг. Однако при введении панитумумаба в дозах свыше 2 мг/кг характер увеличения AUC был близок к дозопропорциональной зависимости.
При соблюдении рекомендованного режима дозирования (6 мг/кг 1 раз в 2 недели в виде 1-часовой инфузии) равновесная концентрация панитумумаба достигается к третьей инфузии при средних значениях максимальной (± стандартное отклонение [SD]) и минимальной концентраций 213 ± 59 и 39 ± 14 мкг/мл, соответственно. Среднее значение (± SD) AUC0-T и клиренса были равны 1306 ± 374 мкг x сут/мл и 4,9 ± 1,4 мл/кг/сут, соответственно. Период полувыведения препарата составил приблизительно 7,5 суток (разброс: от 3,6 до 10,9 суток).
Был выполнен популяционный анализ фармакокинетики с целью оценки потенциального влияния отдельных ковариат на параметры фармакокинетики панитумумаба. Результаты его показали, что возраст (в диапазоне 21-88 лет), пол, раса, функция печени и почек, применение сопутствующих химиотерапевтических препаратов и интенсивность окрашивания мембран EGFR (1+, 2+, 3+) в опухолевых клетках не оказывают явного влияния на фармакокинетику панитумумаба.
Исследований фармакокинетики панитумумаба у пациентов с нарушением функций почек или печени не проводилось.
Показания к применению
Лечение метастатического колоректального рака (мКРР) у взрослых пациентов с генами RAS дикого типа в опухоли:
- в качестве первой линии терапии в комбинации с режимами, содержащими фторурацил, кальция фолинат и оксалиплатин (FOLFOX) или фторурацил, кальция фолинат и иринотекан (FOLFIRI);
- в качестве второй линии терапии в комбинации с режимом, содержащим фторурацил, кальция фолинат и иринотекан (FOLFIRI) у пациентов, получавших ранее химиотерапию первой линии на основе фторпиримидина (исключая иринотекан);
- в качестве монотерапии при неэффективности режимов химиотерапии на основе фторпиримидина, оксалиплатина и иринотекана.
Противопоказания
- Пациенты с анамнезом тяжелых или угрожающих жизни реакций гиперчувствительности к действующему веществу или любому из вспомогательных веществ препарата, перечисленных в разделе «Состав» (см. раздел «Особые указания»);
- Пациенты с интерстициальным пневмонитом или фиброзом легких (см. раздел «»);
- Комбинация препарата Вектибикс с оксалиплатин-содержащим режимом химиотерапии противопоказана пациентам с мКРР и мутациями в генах RAS или пациентам с мКРР с неуточненным статусом мутаций в генах RAS (см. раздел «Особые указания»);
- Пациенты с почечной и печеночной недостаточностью (эффективность и безопасность применения не установлены);
- Детский возраст до 18 лет (эффективность и безопасность применения не установлены; см. раздел «Способ применения и дозы»);
- Беременность и период грудного вскармливания (эффективность и безопасность применения не установлены; см. раздел «Применение при беременности и в период грудного вскармливания»).
С осторожностью
- У пациентов с кератитом, язвенным кератитом или выраженной сухостью глаз (см. раздел «Особые указания»).
Применение при беременности и в период грудного вскармливания
Беременность
Достоверные данные о применении препарата Вектибикс у беременных отсутствуют. В исследованиях на животных была продемонстрирована репродуктивная токсичность препарата. Потенциальный риск ее у человека не известен. Рецептор EGF участвует в контроле пренатального развития плода и играет определенную роль в процессах нормального органогенеза, пролиферации и дифференцировки клеток развивающегося эмбриона. Таким образом, препарат Вектибикс может оказывать потенциальный вред для плода при применении у беременных женщин.
Известно, что человеческие антитела IgG способны проникать через плацентарный барьер, поэтому панитумумаб может проникать из организма матери в развивающийся организм плода. Поэтому женщины с сохранной репродуктивной функцией во время лечения препаратом Вектибикс и в течение 2 месяцев после его окончания должны использовать адекватные меры контрацепции. Если препарат Вектибикс используется в процессе беременности, или беременность развилась на фоне терапии, необходимо разъяснить пациентке потенциальный риск прерывания беременности и потенциальный вред для плода.
Грудное вскармливание
Неизвестно, проникает ли панитумумаб в грудное молоко. Так как человеческие антитела IgG проникают в грудное молоко, можно предположить, что панитумумаб может также проникать в грудное молоко. Возможность всасывания препарата и его потенциальный вред для ребенка не установлены. В период лечения препаратом Вектибикс и в течение 2 месяцев после его окончания кормление грудью не рекомендуется.
Влияние на фертильность
В экспериментах было показано обратимое действие препарата на менструальный цикл и снижение плодовитости самок обезьян. В связи с этим панитумумаб может оказывать влияние на возможность развития беременности у женщин.
Способ применения и дозы
Терапию препаратом Вектибикс необходимо проводить под контролем врача, имеющего опыт проведения противоопухолевого лечения. Перед началом терапии препаратом Вектибикс необходимо подтверждение гена RAS дикого типа (KRAS и NRAS). Мутационный статус гена должен быть определен лабораторией, имеющей опыт соответствующих исследований, с использованием валидированных методик обнаружения мутаций KRAS (в экзонах 2, 3 и 4) и NRAS (в экзонах 2, 3 и 4).
Режим дозирования
Рекомендуемая доза препарата Вектибикс составляет 6 мг/кг массы тела и вводится 1 раз в 2 недели.
При развитии тяжелых (≥ 3 степени) дерматологических реакций может потребоваться следующий режим модификации дозы препарата Вектибикс:
Применение у отдельных популяций пациентов
Безопасность и эффективность препарата Вектибикс не оценивались у пациентов с почечной или печеночной недостаточностью.
Отсутствуют клинические данные, позволяющие обосновать необходимость коррекции дозы препарата в пожилом возрасте.
Дети
Опыт применения препарата Вектибикс у детей отсутствует.
Способ введения
Вектибикс необходимо вводить в виде внутривенной инфузии с помощью инфузионного насоса.
Перед проведением инфузии препарат Вектибикс должен быть разведен специалистом здравоохранения в 9 мг/мл (0,9%) растворе натрия хлорида для инъекций в асептических условиях до получения конечной концентрации не более 10 мг/мл. Не встряхивать или не взбалтывать сильно флакон. Флакон с препаратом Вектибикс следует визуально оценить перед применением. Раствор должен быть бесцветным и может содержать полупрозрачные или белые аморфные белковые частицы (которые удаляются фильтром инфузионной системы). Не следует вводить препарат Вектибикс, описание которого отличается от приведенного выше. При помощи гиподермальной иглы размера 21G или меньше из флакона с препаратом забирается необходимое количество препарата Вектибикс для получения дозы 6 мг/кг, которое затем растворяют в общем объеме 100 мл. Не использовать безыгольные приспособления (например, переходники для флаконов) для извлечения препарата из флакона. Конечная концентрация не должна превышать 10 мг/мл. Дозы выше, чем 1000 мг следует растворить в 150 мл 9 мг/мл (0,9%) раствора натрия хлорида для инъекций. Полученный разведенный раствор необходимо перемешать осторожным переворачиванием, не встряхивать.
Не наблюдалось несовместимости между препаратом Вектибикс и 9 мг/мл (0,9%) раствором натрия хлорида для инъекций в инфузионных пакетах из поливинилхлорида или полиолефина.
Препарат Вектибикс следует вводить в периферический зонд или постоянный катетер через встроенный фильтр с размером пор 0,2 или 0,22 мкм с низкой степенью связывания белков. Рекомендованная длительность инфузии составляет приблизительно 60 минут. Если первая инфузия переносится хорошо, последующие инфузии могут производиться в течение 30-60 минут. Длительность введения препарата в дозах свыше 1000 мг должна составлять приблизительно 90 минут (инструкции по обращению приведены в подразделе «Особые меры предосторожности при применении и утилизации»).
До и после введения препарата Вектибикс, инфузионную систему необходимо промыть раствором натрия хлорида, чтобы избежать смешивания препарата Вектибикс с другими лекарственными препаратами или растворами для внутривенного введения.
В случае возникновения инфузионных реакций может потребоваться снижение скорости инфузии препарата Вектибикс (см. раздел «Особые указания»).
Препарат Вектибикс не должен вводиться струйно или болюсно.
Побочное действие
Обзор профиля безопасности препарата
Согласно результатам анализа данных всех пациентов с мКРР, принимавших участие в клинических исследованиях и получавших препарат Вектибикс в режиме монотерапии и в комбинации с химиотерапией (n = 2224) наиболее частыми нежелательными реакциями были кожные реакции, наблюдавшиеся приблизительно в 94% случаев. Эти реакции обусловлены фармакологическими свойствами препарата Вектибикс и обычно имеют легкую или среднюю степень тяжести; только в 23% случаев дерматологические реакции носят тяжелый характер (степень тяжести 3, по классификации NCI-CTC) и < 1% жизнеугрожающие (степень 4 по NCI-CTC). Медицинские меры в случае кожных реакций, включая рекомендации по коррекции дозы, приведены в разделе «Особые указания».
Наиболее частыми нежелательными реакциями, возникавшими у ≥ 20% пациентов, были расстройства желудочно-кишечного тракта [диарея (46%), тошнота (39%), рвота (26%), запор (23%) и боль в животе (23%)]; общие реакции [повышенная утомляемость (35%), пирексия (21%)]; нарушения обмена веществ и питания [снижение аппетита (30%)]; инфекции и инвазии [паронихия (20%)]; и патология кожи и подкожной ткани [сыпь (47%), акнеформный дерматит (39%), зуд (36%), эритема (33%) и сухость кожи (21%)].
Табличный перечень нежелательных реакций
Нежелательные реакции, наблюдавшиеся у пациентов с мКРР, получавших панитумумаб в качестве монотерапии или в комбинации с химиотерапией в клинических исследованиях (n = 2224), а также в спонтанных сообщениях, приведены ниже. Нежелательные эффекты представлены по степени убывания серьезности.
2 См. раздел «Особые указания» (инфузионные реакции).
3 См. раздел «Особые указания» (осложнения со стороны легких).
4 Некроз кожи, синдром Стивенса-Джонсона, токсический эпидермальный некролиз и язвенный кератит являются нежелательными реакциями панитумумаба, отмечавшимися в процессе его применения после регистрации. Максимальная частота этих нежелательных реакций оценивалась на основе верхней границы 95% доверительного интервала для точечной оценки с учетом рекомендаций регуляторных органов для оценки частоты нежелательных реакций в спонтанных сообщениях. Максимальное значение частоты, рассчитанное на основе верхней границы 95% доверительного интервала для точечной оценки, составило 3/2224 (или 0,13%).
Профиль безопасности препарата Вектибикс в комбинации с химиотерапией согласуется с зарегистрированными нежелательными реакциями препарата Вектибикс (используемого в монотерапии) и проявлениями фоновой токсичности химиотерапии. Новых проявлений токсичности или усугубления ранее известных проявлений токсичности помимо ожидаемых аддитивных эффектов не наблюдалось. Кожные реакции соответствовали наиболее часто отмечавшимся нежелательным реакциям у пациентов, получавших панитумумаб, в комбинации с химиотерапией. Другими проявлениями токсичности, отмечавшимися с большей частотой по сравнению с использованием препарата в монотерапии, являлись гипомагниемия, диарея и стоматит. Эти проявления токсичности нечасто приводили к досрочному завершению терапии препаратом Вектибикс или химиотерапии.
Описание отдельных нежелательных реакций
Нарушения со стороны пищеварительной системы
В большинстве случаев диарея имела легкую или умеренную степень тяжести. Сообщалось о тяжелых случаях диареи (степень 3 и 4 по NCI-CTC) у 2% пациентов, принимавших препарат Вектибикс в качестве монотерапии, и у 16% пациентов, принимавших препарат Вектибикс в комбинации с химиотерапией.
Сообщалось о развитии острой почечной недостаточности на фоне диареи тяжелой степени и обезвоживания (см. раздел «Особые указания»).
Инфузионные реакции
Во всех клинических исследованиях моно- и комбинированной терапии мКРР (n = 2224) реакции на инфузию (развивающиеся в течение 24 часов с момента первого введения препарата), симптомами/признаками которых могли являться озноб, повышение температуры тела или диспноэ, отмечались приблизительно у 5% пациентов, получавших препарат Вектибикс, из которых 1% были тяжелыми (3 и 4 степени NCI-CTC).
Сообщалось о случае развития летального ангионевротического отека у пациента с рецидивирующим метастатическим плоскоклеточным раком головы и шеи, леченого препаратом Вектибикс. Фатальное осложнение развилось при возобновлении терапии после предшествующего эпизода развития ангионевротического отека. Обе реакции зафиксированы спустя более 24 часов после введения препарата (см. разделы «Противопоказания» и «Особые указания»). О реакциях гиперчувствительности, развившихся более чем через 24 часа после инфузии, также сообщалось и в пострегистрационный период.
Данные клинического ведения реакций на инфузию приведены в разделе «Особые указания».
Нарушения со стороны кожи и подкожно-жировой клетчатки
Кожная сыпь, наиболее часто локализованная на лице, верхней части грудной клетки и спине, однако в некоторых случаях распространялась и на конечности. Как следствие тяжелых дерматологических реакций отмечали также развитие инфекционных осложнений, таких как сепсис, в редких случаях с летальным исходом, воспаление подкожной клетчатки и местные абсцессы, требующие хирургического вмешательства и дренирования. Медиана времени до развития первых проявлений дерматологических реакций составила 10 дней, а медиана времени до их разрешения с момента последнего введения препарата Вектибикс — 31 день.
Паронихиальное воспаление сопровождалось припухлостью латеральных ногтевых валиков пальцев рук и ног.
Дерматологические реакции (включая воздействие на ногти), наблюдавшиеся у пациентов, получавших препарат Вектибикс или другие ингибиторы EGFR, являются известными фармакологическими эффектами данных препаратов.
Во всех клинических исследованиях кожные реакции наблюдались приблизительно у 94% пациентов, получавших препарат Вектибикс в качестве монотерапии или в комбинации с химиотерапией (n = 2224). В основном это были сыпь и угревидный дерматит почти всегда легкого или умеренного характера. О тяжелых кожных реакциях (степень 3 по NCI-CTC) сообщалось у 23% пациентов, а о жизнеугрожающих кожных реакциях (степень 4 по NCI-CTC) -у < 1% пациентов. У пациентов, получавших препарат Вектибикс, регистрировались жизнеугрожающие и летальные инфекционные осложнения, включавшие некротизирующий фасциит и сепсис (см. раздел «Особые указания»).
Данные клинического ведения дерматологических реакций, включая рекомендации по изменению дозы, приведены в разделе «Особые указания».
В пострегистрационный период применения сообщалось о редких случаях развития некрозов кожи, синдрома Стивенса-Джонсона и токсического эпидермального некролиза (см. раздел «Особые указания»).
Офтальмологическая токсичность
Сообщалось о серьезных случаях кератитов и язвенных кератитов, которые могут приводить к перфорации роговицы (см. раздел «Особые указания»).
Другие особые популяции
Не наблюдалось различий в безопасности и эффективности у пациентов пожилого возраста (≥ 65 лет), получавших монотерапию препаратом Вектибикс. Однако было зарегистрировано увеличение числа серьезных нежелательных реакций у пожилых пациентов, получавших терапию препаратом Вектибикс в комбинации с режимами химиотерапии FOLFIRI (45% по сравнению с 32%) или FOLFOX (52% по сравнению с 37%), по сравнению с получавшими только химиотерапию (см. раздел «Особые указания»). Наиболее частыми серьезными нежелательными явлениями были диарея у пациентов, получавших препарат Вектибикс в комбинации с режимами FOLFOX или FOLFIRI, дегидратация и тромбоэмболия легочной артерии — у пациентов, получавших препарат Вектибикс в комбинации с режимом FOLFIRI.
Нет данных, касающихся безопасности применения препарата Вектибикс пациентами с почечной и печеночной недостаточностью.
Передозировка
В клинических исследованиях препарат использовался в дозах до 9 мг/кг. Были зарегистрированы случаи превышения рекомендованной терапевтической дозы (12 мг/кг) приблизительно в 2 раза. Наблюдались нежелательные эффекты, такие как токсические реакции со стороны кожи, диарея, дегидратация и повышенная утомляемость, что соответствовало профилю безопасности препарата в рекомендованной дозе.
Взаимодействие с другими лекарственными препаратами
Данные исследования о взаимодействии препарата Вектибикс и иринотекана у пациентов с мКРР показали, что фармакокинетические свойства иринотекана и его активного метаболита, SN-38, не меняются при одновременном введении препаратов. Результаты перекрестного сравнительного исследования показали, что схемы, включающие в себя иринотекан (IFL или FOLFIRI), не влияют на фармакокинетические свойства панитумумаба.
Вектибикс не должен назначаться в комбинации с режимом химиотерапии IFL или режимами химиотерапии, включающими бевацизумаб. При назначении панитумумаба в комбинации с IFL, наблюдалась высокая частота возникновения диареи тяжелой степени (см. раздел «Особые указания») и увеличивалась частота токсичности и летальных исходов при назначении панитумумаба в комбинации с режимом химиотерапии, включавшей бевацизумаб (см. раздел «Особые указания»).
Комбинация препарата Вектибикс с химиотерапией на основе оксалиплатина противопоказана пациентам с мКРР и мутациями RAS, а также пациентам с мКРР с неизвестным статусом RAS. В клиническом исследовании у пациентов с мутациями RAS в опухоли, которые получали панитумумаб и химиотерапию FOLFOX, отмечалось укорочение выживаемости без прогрессирования заболевания и общей выживаемости (см. раздел «Особые указания»).
Фармацевтическая несовместимость
Данный препарат не следует применять с другими лекарственными средствами, кроме указанных в подразделе «Особые меры предосторожности при применении и утилизации».
Особые указания
Отслеживаемость
С целью улучшения отслеживаемости биологических лекарственных препаратов следует точно записывать название и номер серии вводимого препарата.
Нежелательные реакции со стороны мягких тканей и кожи
Дерматологические реакции — фармакологический эффект, характерный для ингибиторов EGFR, регистрируются практически у всех пациентов (приблизительно 94%), получающих препарат Вектибикс. Тяжелые кожные реакции (3 степени согласно классификации NCI-CTC) отмечались у 23% пациентов, жизнеугрожающие кожные реакции (4 степени NCI-CTC) — у < 1% пациентов, принимавших препарат Вектибикс в качестве монотерапии и в комбинации с химиотерапией (n = 2224) (см. раздел «Побочное действие»). При развитии у пациента кожных реакций степени 3 (Общие терминологические критерии оценки нежелательных явлений CTCAE, версия 4.0) или более выраженной степени, либо расцененных как непереносимые, см. рекомендации по модификации дозы в разделе «Способ применения и дозы».
В клинических исследованиях после развития тяжелых кожных реакций (в том числе стоматита) имели место инфекционные осложнения, в том числе сепсис и некротизирующий фасциит, которые в редких случаях приводили к смерти, а также к образованию абсцессов, требовавших вскрытия и дренирования. Пациенты, у которых отмечались тяжелые кожные реакции или проявления токсичности со стороны мягких тканей, либо демонстрировавшие усугубление данных реакций на фоне терапии препаратом Вектибикс, должны наблюдаться на предмет развития воспалительных или инфекционных последствий (в том числе воспаление подкожной клетчатки и некротизирующего фасциита), а при наличии соответствующих клинических показаний должна быть начата соответствующая терапия. Жизнеугрожающими и летальными инфекционными осложнениями являлись некротизирующий фасциит и сепсис, которые отмечались у пациентов, получавших препарат Вектибикс. Редкие случаи синдрома Стивенса-Джонсона и токсического эпидермального некролиза отмечались у пациентов в пострегистрационном периоде, принимавших препарат Вектибикс. Временная отмена или прекращение применения препарата Вектибикс необходимы при развитии кожной токсичности или токсичности мягких тканей, ассоциированных с развитием тяжелых или жизнеугрожающих воспалительных или инфекционных осложнений.
Лечение и ведение дерматологических реакций должно быть основано на тяжести проявлений и может включать в себя увлажняющие, солнцезащитные средства (солнцезащитный фильтр ≥ 15 UVA и UVB), а также кремы с глюкокортикостероидами (не выше 1% гидрокортизона) для применения на пораженных участках и/или пероральные антибиотики (например, доксициклин). Также пациентам с признаками сыпи/дерматологической токсичности рекомендуется использовать солнцезащитные средства и головные уборы, ограничить пребывание на солнце, поскольку солнечный свет может усилить любые возможные кожные реакции.
Пациентам может быть рекомендовано наносить увлажняющие, солнцезащитные средства на лицо, руки, ноги, шею, спину и грудь каждое утро, а на ночь наносить крем, содержащий глюкокортикостероид, на лицо, руки, ноги, шею, спину и грудь во время проведения лечения.
Осложнения со стороны легких
Пациенты с наличием в анамнезе или имеющие признаки интерстициального пневмонита или фиброза легких исключались из клинических исследований. Случаи интерстициальных заболеваний легких с летальными исходами и без, возникали, преимущественно, в японской популяции. Поэтому при остром возникновении или ухудшении легочных симптомов лечение препаратом Вектибикс должно быть приостановлено и незамедлительно начато изучение возникших симптомов. При обнаружении интерстициальных заболеваний легких препарат Вектибикс следует временно отменить и назначить соответствующее лечение. У пациентов с интерстициальным пневмонитом или легочным фиброзом в анамнезе необходимо оценить отношение вероятной пользы применения препарата к риску осложнений со стороны легких.
Нарушения водно-электролитного баланса
У некоторых пациентов отмечалось прогрессивное снижение сывороточных концентраций магния, приводившее к тяжелой (степень 4) гипомагниемии. Необходим периодический мониторинг состояния пациентов на предмет развития гипомагниемии и сопутствующей гипокальциемии перед началом лечения препаратом Вектибикс, и после лечения до 8 недель после его окончания (см. раздел «Побочное действие»). При необходимости рекомендован прием препаратов магния.
Также отмечались нарушения баланса других электролитов, включая гипокалиемию. Рекомендуется мониторинг и соответствующий адекватный прием данных электролитов.
Инфузионные реакции
В клинических исследованиях монотерапии и комбинированной терапии мКРР (n = 2224), инфузионные реакции, в том числе тяжелые инфузионные реакции (возникавшие в течение 24 часов после инфузии), отмечались у пациентов, получавших препарат Вектибикс (степень 3 и 4 по NCI-CTC).
В пострегистрационных исследованиях сообщалось о серьезных инфузионных реакциях, включая редкие пострегистрационные сообщения о летальных исходах. В случае возникновения тяжелой или жизнеугрожающей реакции в процессе инфузии или в любое время после ее завершения [например, при возникновении бронхоспазма, ангионевротического отека, гипотензии, потребности в парентеральной терапии или анафилаксии], необходимо полностью отменить препарат Вектибикс (см. разделы «Противопоказания» и «Побочное действие»).
У пациентов с легкими или умеренными (степень 1 и 2 по CTCAE версии 4.0) инфузионными реакциями следует уменьшить скорость инфузии на протяжении всей инфузии. Рекомендуется сохранять сниженную скорость инфузии в ходе всех последующих инфузий.
Сообщалось о реакциях гиперчувствительности, возникавших более чем через 24 часа после инфузии, включая ангионевротический отек со смертельным исходом, развившийся более чем через 24 часа после инфузии. Следует предупредить пациентов о возможности позднего развития реакции и проинструктировать обращаться к своему лечащему врачу в случае возникновения симптомов реакции гиперчувствительности.
Острая почечная недостаточность
Острая почечная недостаточность отмечена у пациентов с тяжелой диареей и дегидратацией. Пациенты должны быть проинструктированы о необходимости немедленно обратиться за медицинской помощью при развитии тяжелой диареи.
Препарат Вектибикс в комбинации с химиотерапией на основе иринотекана, фторурацила болюсно и кальция фолината (режим IFL)
У пациентов, получавших препарат Вектибикс в комбинации с режимом IFL [болюсное введение фторурацила (500 мг/м2), кальция фолината (20 мг/м2) и иринотекана (125 мг/м2)], отмечалась высокая частота тяжелой диареи (см. раздел «Побочное действие»). Поэтому следует избегать использования препарата Вектибикс в комбинации с режимом IFL (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Препарат Вектибикс в комбинации с бевацизумабом и режимами химиотерапии
У пациентов, получавших препарат Вектибикс в комбинации с бевацизумабом и химиотерапией, отмечалось укорочение выживаемости без прогрессирования заболевания и повышение частоты летальных исходов. Кроме того, в группах терапии препаратом Вектибикс в комбинации с бевацизумабом и химиотерапией отмечалось повышение частоты тромбоэмболии легочной артерии, инфекций (преимущественно кожных), диареи, электролитных нарушений, тошноты, рвоты и дегидратации. Препарат Вектибикс не должен применяться в комбинации с химиотерапией, включающей бевацизумаб (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Препарат Вектибикс в комбинации с химиотерапией на основе оксалиплатина у пациентов с мКРР и мутациями RAS, а также с неуточненным статусом RAS
Комбинация препарата Вектибикс с химиотерапией на основе оксалиплатина противопоказана пациентам с мКРР и мутациями RAS, а также пациентам с мКРР с неуточненным статусом мутаций генов RAS (см. раздел «Противопоказания»).
Отмечалось сокращение выживаемости без прогрессирования заболевания (ВБП) и общей выживаемости (ОВ) у пациентов с мутациями KRAS (в экзоне 2) в опухоли и дополнительными мутациями RAS (KRAS [в экзонах 3 и 4] или NRAS [в экзонах 2, 3, 4]), получавших панитумумаб в комбинации с инфузионным режимом, содержащим фторурацил, кальция фолинат и оксалиплатин (FOLFOX) по сравнению с пациентами, получавшими только FOLFOX.
Оценка мутационного статуса RAS должна определяться с использованием валидированного метода в лаборатории, имеющей опыт выполнения подобных исследований (см. раздел «Способ применения и дозы»). Если препарат Вектибикс должен использоваться в комбинации с режимом FOLFOX, рекомендуется определение мутационного статуса в лаборатории, принимающей участие в программе внешнего обеспечения качества оценки статуса RAS, либо дикий тип должен быть подтвержден результатами двукратного анализа.
Офтальмологическая токсичность
Отмечались серьезные случаи кератита и язвенного кератита, которые могут приводить к перфорации роговицы. Пациенты, у которых отмечаются признаки и симптомы, свидетельствующие о наличии кератита, в том числе острые или усугубляющиеся: воспалительные изменения глаза, слезотечение, светобоязнь, снижение четкости зрения, боли в глазу и/или покраснения глаза, должны быть немедленно направлены к офтальмологу.
При подтверждении диагноза язвенного кератита терапию препаратом Вектибикс необходимо временно или полностью прекратить. При постановке диагноза кератита необходимо тщательно соотнести пользу и риски продолжения терапии.
Препарат Вектибикс должен использоваться с осторожностью у пациентов, имевших в анамнезе кератит, язвенный кератит или выраженную сухость глаза. Использование контактных линз также является фактором риска развития кератита и изъязвлений.
Пациенты с показателем общего состояния 2 по шкале ECOG, получавших препарат Вектибикс в комбинации с химиотерапией
Для пациентов с мКРР, имеющих показатель 2 по шкале ECOG, рекомендуется проведение оценки соотношения польза-риск до начала применения препарата Вектибикс в комбинации с химиотерапией. У пациентов со статусом ECOG 2 не выявлено положительное соотношение польза-риск.
Пожилые пациенты
Различий безопасности или эффективности препарата Вектибикс в монотерапии у пациентов пожилого возраста (≥ 65 лет) не наблюдалось. Однако отмечалось увеличение количества серьезных нежелательных реакций у пожилых пациентов, получавших препарат Вектибикс в комбинации с химиотерапией FOLFIRI или FOLFOX, по сравнению с применением только режимов химиотерапии (см. раздел «Побочное действие»).
Предупреждение о вспомогательных веществах
Данный препарат содержит 3,45 мг натрия в 1 мл, что соответствует 0,17% от рекомендованного ВОЗ максимального суточного потребления натрия для взрослого человека, составляющего 2 г.
Особые меры предосторожности при применении и утилизации
Препарат Вектибикс следует вводить в периферический зонд или постоянный катетер через встроенный фильтр с размером пор 0,2 или 0,22 мкм с низкой степенью связывания белков.
Разведенный раствор
Вектибикс не содержит антимикробных консервантов или бактериостатических агентов. Препарат должен быть использован непосредственно после разведения. Если препарат не был использован сразу после разведения, пользователь несет ответственность за время и условия его хранения до следующего введения (не более 24 часов при температуре 2 °C — 8 °C). Не замораживать разведенный раствор.
Препарат Вектибикс предназначен только для однократного использования.
Флакон и оставшийся в нем раствор лекарственного препарата необходимо утилизировать после однократного применения.
Весь неиспользованный остаток препарата и расходные материалы должны утилизироваться в соответствии с надлежащими требованиями.
Влияние на способность управлять транспортными средствами, механизмами
Вектибикс может оказывать влияние на способность управлять транспортными средствами и на работу с механизмами. В случае развития нежелательных реакций со стороны органов зрения и/или снижения способности к концентрации внимания и быстроты реакции, пациентам рекомендуется воздержаться от управления транспортными средствами или работы со сложным оборудованием до разрешения указанных нежелательных реакций препарата.
Форма выпуска
Концентрат для приготовления раствора для инфузий 20 мг/мл.
Флакон содержит 5 мл (100 мг/5 мл) или 20 мл (400 мг/20 мл) концентрата для приготовления раствора для инфузий.
Маркированный флакон из прозрачного стекла гидролитического класса I с эластомерной пробкой, алюминиевым колпачком и отламывающимся полипропиленовым колпачком.
По 1 флакону помещают в контурную ячейковую упаковку и затем в пачку картонную вместе с инструкцией по применению. Для контроля первого вскрытия на каждую пачку наклеивают две прозрачные защитные этикетки, имеющие продольную цветную полосу.
Условия хранения
Хранить при температуре от 2°C до 8°C.
Не замораживать.
Хранить в оригинальной упаковке для защиты от света.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не использовать по истечении срока годности, указанного на упаковке.
Условия отпуска
Отпускают по рецепту.
Производитель
Производитель готовой лекарственной формы / Фасовщик (первичная упаковка)
Амджен Мэньюфэкчуринг Лимитед,
Роуд 31, Км 24.6, Джанкос, Пуэрто-Рико, 00777, Соединенные Штаты Америки.
Упаковщик (вторичная (потребительская) упаковка) /Выпускающий контроль качества
Амджен Европа Б.В.,
Минервум 7061, NL-4817 ZK Бреда, Нидерланды или
Амджен Технолоджи (Айрлэнд) Анлимитед Компани,
Поттери Роуд, Дан Лэйри, Графство Дублин, Ирландия или
ООО «Добролек», Россия,
115446, г. Москва, Коломенский проезд, д. 13А.
Организация, принимающая претензии от потребителей
ООО «Амджен»
123112, Москва, Пресненская набережная, д.8, строение 1, 7 этаж
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздравсоцразвития России
Корниецкая А.Л.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Токсичность и эффективность панитумумаба при метастатическом колоректальном раке
Авторы:
Дешкина Т.И., Корниецкая А.Л., Болотина Л.В.
Как цитировать:
Дешкина Т.И., Корниецкая А.Л., Болотина Л.В. Токсичность и эффективность панитумумаба при метастатическом колоректальном раке. Онкология. Журнал им. П.А. Герцена.
2013;2(6):51‑55.
Deshkina TI, Kornietskaia AL, Bolotina LV. Toxicity and efficacy of panitumumab in metastatic colorectal cancer. P.A. Herzen Journal of Oncology. 2013;2(6):51‑55. (In Russ.)

Колоректальный рак (КРР) занимает одну из лидирующих позиций в структуре заболеваемости и смертности от злокачественных новообразований в развитых странах мира [1].
Несомненно, более агрессивная хирургическая тактика, появление и широкое внедрение в клиническую практику новых лекарственных агентов позволили добиться значительных успехов в лечении не только местно-распространенных, но и метастатических форм заболевания. Однако, если при III стадии общая 5-летняя выживаемость в среднем достигает 60%, то при IV стадии опухолевого процесса этот показатель не превышает 5—8,1% [2, 3]. Актуальность проблемы остается тем более острой, что у 25% больных к моменту установления диагноза выявляются висцеральные метастазы, наиболее часто поражающие печень и легкие [2, 3]. Вместе с тем даже в такой ситуации проведение адекватного комбинированного лечения, включающего химиотерапию и радикальное удаление метастазов, позволяет увеличить общую 5-летнюю выживаемость до 25—47% [4—7]. Таким образом, проведение периоперационной химиотерапии не только улучшает общую выживаемость в группе больных с исходно резектабельными метастазами КРР, но и, в случае достижения необходимого объективного ответа, позволяет увеличить число больных, которым можно выполнить хирургическое удаление метастазов, а при его невозможности продлевает жизнь пациентов в среднем в 3 раза [8—11].
Новый этап в лечении генерализованного КРР был обозначен благодаря применению таргетной терапии.
Панитумумаб — полностью человеческое моноклональное антитело к рецептору эпидермального фактора роста EGFR, связывание с которым блокирует активацию сигнального каскада, что способствует снижению пролиферации и выживаемости раковых клеток, а также подавляет ангиогенез, метастазирование и может приводить к прекращению опухолевого роста [12].
Эффективность панитумумаба впервые была продемонстрирована при использовании в качестве третьей—четвертой линии терапии метастатического КРР после прогрессирования на фторпиримидинах, оксалиплатине и иринотекане. Анализ результатов исследования показал статистически значимое увеличение времени до прогрессирования заболевания (ВДП) и относительное снижение риска прогрессирования или смерти на 46% (HR=0,54, p<0,0001). При этом впервые в рамках данного исследования было показано значение мутации KRAS, которая встречается в 30—50% случаев КРР и при наличии которой полностью отсутствует эффект от терапии ингибиторами EGFR [12, 13].
Дальнейшее изучение панитумумаба в качестве первой и второй линии терапии также продемонстрировало положительные результаты.
В исследовании III фазы PRIME пациентам генерализованным КРР, ранее не получавшим химиотерапию по поводу диссеминации заболевания, проводилось лечение по одной из альтернативных схем: стандартный режим FOLFOX-4 против FOLFOX-4 + панитумумаб. У больных с диким типом KRAS достигнуто достоверное увеличение медианы времени до прогрессирования c 8,0 до 9,6 мес, а также зарегистрирована тенденция к улучшению общей выживаемости и частоты объективных ответов. Напротив, в группе больных с мутантным типом KRAS добавление панитумумаба к химиотерапии привело к достоверному ухудшению результатов лечения [14]. Следует отметить, что частота резекций метастазов была примерно одинаковой в обеих группах.
В исследовании AMG-181 оценивалась эффективность комбинации панитумумаб + FOLFIRI в качестве второй линии терапии у больных, ранее получавших терапию фторпиримидинами по поводу генерализованного КРР. У части пациентов помимо фторпиримидинов уже использовался оксалиплатин и/или авастин. На момент первичного анализа медиана ВДП у пациентов с KRAS дикого типа в исследуемом режиме составила 5,9 мес по сравнению с группой только химиотерапии — 3,9 мес, что явилось статистически значимым. В случае мутантного типа KRAS медиана ВДП в группе панитумумаб + FOLFIRI составила 5 мес по сравнению с 4,9 мес группы контроля. Различия общей выживаемости были статистически незначимы. Схожая тенденция наблюдалась и при оценке выживаемости: медиана выживаемости составила 14,5 мес против 12,5 мес в пользу группы таргетной терапии (у пациентов с диким типом KRAS) и 11,8 мес против 11,1 мес в случае мутантного типа. Объективный ответ у пациентов с диким типом KRAS зафиксирован в 35% случаев при проведении ПХТ в сочетании с панитумумабом, что имело выраженное преимущество по сравнению с только одной химиотерапией (объективный ответ составил 10%). В случае мутации KRAS разницы частоты объективных ответов не наблюдалось [15].
Специфическим проявлением токсичности при использовании ингибиторов EGFR, в том числе и панитумумаба, являются кожные реакции, которые наблюдаются практически у 100% пациентов в той или иной степени выраженности, и заключаются в развитии акнеподобной сыпи, зуда, сухости кожи, трещин и паронихий. Следует отметить, что в большинстве исследований имеется прямая корреляция между интенсивностью сыпи, что отражает степень блокады EGFR в кератиноцитах, и эффективностью проводимого лечения.
Проявления кожной токсичности крайне редко угрожают жизни, однако зачастую существенно ухудшают качество жизни больных, приводя к отказу от лечения. В настоящее время проведено несколько исследований по изучению кожной токсичности, однако окончательный алгоритм профилактики и лечения так и не разработан [16].
Приводим два клинических наблюдения больных, получавших таргетную терапию панитумумабом.
Больной Т., 53 года. В течение многих лет беспокоили запоры. Летом 2010 г. впервые возник эпизод острой кишечной непроходимости, которая разрешилась самостоятельно. За медицинской помощью не обращался. С этого времени присоединились жалобы на слабость, снижение массы тела, лихорадку до 38 °С.
При выполнении УЗИ брюшной полости в июле 2011 г. выявлено метастатическое поражение печени. Обратился в МНИОИ им. П.А. Герцена, где при комплексном дообследовании обнаружена опухоль в сигмовидной кишке, практически полностью обтурирующая ее просвет (гистологически — высокодифференцированная аденокарцинома). По данным спиральной компьютерной томографии (СКТ) органов брюшной полости метастазы субтотально занимали правую и левую доли печени, их максимальный размер достигал в паренхиме левой доли 10,7×8,1 см, в правой доле в SVII—VIII — 11,4×6,0 и 8,2×6,9 см соответственно.
8 августа 2011 г. выполнено хирургическое вмешательство в объеме резекции сигмовидной кишки. Морфологическое исследование: рак сигмовидной кишки IV стадии T3N0M1. Для решения дальнейшей тактики лечения проведен генетический анализ. В полимеразной цепной реакции с последующим секвенированием мутации во 2-м экзоне гена KRAS не обнаружено. С учетом размеров метастатических очагов в печени в послеоперационном периоде рекомендовано проведение паллиативной ПХТ в сочетании с таргетной терапией ингибиторами EGFR.
В связи с выраженным ослабленным состоянием больного, обусловленным длительной интоксикацией и невозможностью нормального питания, период реабилитации затянулся на 2 мес. За это время отмечено дальнейшее прогрессирование заболевания в виде роста очагов в печени и появления асцита. Лишь с конца октября 2011 г. начато проведение ПХТ по схеме FOLFOX-4 и таргетной терапии панитумумабом в дозе 6 мг/кг. После 3 курсов лечения при контрольном обследовании динамика оказалась неоднозначной: с одной стороны, отмечалось уменьшение асцита и маркера СА 125, с другой стороны, рост маркеров РЭА и СА 19-9 и увеличение очагов в печени (в правой доле до 15,8×7,8×9,3 см, в левой доле — до 10,7×7,1×5,5 см).
В этой связи решено было изменить схему проводимой ПХТ на монотерапию иринотеканом и продолжить таргетную терапию панитумумабом.
Уже через 2 нед после первого введения панитумумаба у больного появилась угревая сыпь на коже лица, подбородка, груди и спины (рис. 1).
В середине декабря 2011 г. (через 2 мес после начала таргетной терапии) у больного при госпитализации для проведения очередного курса отмечен подъем температуры до фебрильных цифр. При осмотре на коже живота и спины выявлены два крупных карбункула размером 5—6 см в диаметре. Очередное введение вектибикса было пропущено. От назначения системной антибактериальной терапии решено было воздержаться в связи с субтотальным метастатическим поражением печени и крайне неудовлетворительными показателями биохимического анализа крови в виде повышения уровня печеночных трансаминаз 2—3-й степени по критериям NCI-CTC. Произведено вскрытие карбункулов и обработка раневой поверхности растворами антисептиков. Через 5 дней местного применения растворов антисептиков отмечено заживление, после чего таргетная терапия была продолжена (рис. 2).
В конце января 2012 г. у больного появились жалобы на сухость кожных покровов, в особенности кожи ладоней и стоп.
В дальнейшем стали образовываться трещины и возникли паронихии. С течением времени отмечалось волнообразное возникновение все новых и новых элементов угревой сыпи, однако они были поверхностны и не причиняли существенных неудобств.
Лишь в мае 2012 г. вновь появились два крупных фурункулезных образования на коже руки и щеки, сопровождавшиеся крайне выраженной местной воспалительной реакцией, в связи с чем помимо локальных обработок решено было добавить пероральный прием антибиотиков из группы защищенных пенициллинов (рис. 3).
Кроме отмеченных токсических реакций, у больного отмечалась лишь незначительная гастроинтестинальная токсичность (диарея и тошнота I степени), которая легко купировалась и не приводила к отсрочке лечения или редукции доз препаратов.
Следует отметить, что столь выраженная кожная токсичность в полной мере коррелировала с эффективностью проводимого лечения. С ноября 2011 г. по август 2012 г. в общей сложности проведено 18 курсов монохимиотерапии иринотеканом и таргетная терапия вектибиксом в течение 10 мес, сопровождавшаяся выраженной положительной динамикой в виде частичного ответа со стороны очагов в печени — 53% по критериям RECIST (рис. 4),
Подводя итог, хотелось бы обратить внимание на то, что, начиная лечить больного со столь массивным метастатическим поражением печени, трудно было поверить в вероятность какого-либо успеха. Однако больной живет уже более 1 года с момента постановки диагноза; кроме того, у него продолжает нарастать положительная динамика.
В следующем клиническом наблюдении мы хотим проиллюстрировать возможности применения панитумумаба совместно с химиотерапией в рамках периоперационной химиотерапии колоректального рака.
Больная М., 62 года. Наблюдается в МНИОИ им. П.А. Герцена с 1999 г. с диагнозом: первично-множественный метахронный рак: 1) рак левой молочной железы IIIВ стадии T4bN1M0, состояние после комплексного лечения в 1999 г. (2 курса CAF + О+ ЛТ + 4 курса CAF + ГТ тамоксифен) без прогрессирования; 2) рак эндометрия IB стадии T1бN0M0, состояние после хирургического лечения в июне 2010 г. без прогрессирования.
С ноября 2011 г. появились слабость, чувство дискомфорта в верхних отделах живота. В связи с присоединившейся анемией проведено комплексное обследование. Выявлена опухоль восходящего отдела толстой кишки и метастатическое поражение печени — на границе VIII и IV сегментов метастаз 52×42 мм, муфтообразно охватывающий среднюю печеночную вену и прилежащий к нижней полой вене.
25 апреля 2012 г. выполнена правосторонняя гемиколэктомия. Гистологическое заключение: опухоль слепой кишки — изъязвленная умереннодифференцированная аденокарцинома толстой кишки, прорастающая все слои стенки. Метастазы рака в двух лимфатических узлах, в печени метастаз аденогенного рака с очагами некроза. Материал предыдущих исследований пересмотрен. Метастаз в печени по своему морфологическому строению более всего соответствует опухоли кишки. При генетическом исследовании в 1-м экзоне гена Kras мутаций не обнаружено. С учетом размеров и локализации метастатических очагов в печени больной в рамках комбинированного лечения начато проведение периоперационной химиотерапии по схеме FOLFIRI с добавлением панитумумаба в дозе 6 мг/кг. С июня по сентябрь 2012 г. проведено 6 курсов лекарственного лечения.
Через 2 нед после первого введения панитумумаба у больной отмечено появление пустулезной сыпи на коже лица, волосистой части головы, груди и спины (рис. 5).
Объективный ответ проводимого лечения напрямую коррелировал с кожной токсичностью. Так, отмечено снижение уровня опухолевых маркеров — РЭА с 9,4 нг/мл до 2,0 нг/мл и СА 19-9 с 433,9 ед/мл до 19,4 ед/мл. При СКТ-исследовании органов брюшной полости зарегистрирована выраженная положительная динамика: очаг на границе VIII и IV сегментов уменьшился до 22×16 мм (рис. 6).
В настоящее время пациентке планируется проведение оперативного этапа лечения на печени с последующим продолжением химиотерапии.
Приведенные наблюдения показали, что добавление панитумумаба к химиотерапии при колоректальном раке сопряжено с существенным улучшением эффективности последней. Но, как правило, эффективность лечения сопровождается развитием явлений кожной токсичности различной степени тяжести. В связи с тем, что подобные проявления могут существенно ухудшить качество жизни больных, у части из них, особенно при длительном введении ингибиторов EGFR, может возникнуть необходимость в проведении сопроводительного лечения, чтобы не допустить отмены противоопухолевой терапии. Все это обусловливает важность создания и внедрения в клиническую практику алгоритма профилактики и лечения кожной токсичности для пациентов получающих анти-EGFR-терапию.
Каждый 1 мл концентрата содержит 20 мг панитумумаба.
Каждый флакон для однократного применения содержит:
Активное вещество: 100 мг панитумумаба в 5 мл.
Вспомогательные вещества: натрия хлорид, натрия ацетата тригидрат, уксусная кислота ледяная (для регулирования рН), вода для инъекций.
При подготовке препарата в соответствие с инструкцией, приведенной в разделе «Меры предосторожности при утилизации и прочих манипуляциях», конечная концентрация панитумумаба не должна превышать 10 мг/мл.
Панитумумаб представляет собой полностью человеческое моноклональное антитело IgG2, полученное из клеточной линии млекопитающих (яичники китайского хомячка) путем рекомбинантной ДНК-технологии.
Вспомогательные вещества обладают известным эффектом.
Каждый мл концентрата содержит 0,150 ммоль натрия, что составляет 3,45 мг натрия.
Концентрат для приготовления раствора для инфузий (стерильный концентрат).
Бесцветный раствор, может содержать полупрозрачные или белые видимые аморфные белковые частицы панитумумаба.
Противоопухолевое средство, моноклональные антитела.
Код ATX: L01XC08.
Фармакологические свойства
Фармакодинамика
Механизм действия
Панитумумаб представляет собой рекомбинантное, полностью человеческое IgG2 моноклональное антитело, которое обладает высоким сродством и специфичностью к рецепторам эпидермального фактора роста человека (ЭФР). ЭФР – трансмембранный гликопротеин из семейства рецепторов тирозинкиназ типа I, включая ЭФР (HERl/c-ErbB-1), HER2, HER3 и HER4. Рецептор ЭФР стимулирует рост нормальных эпителиальных клеток, включая клетки кожи и волосяных фолликулов, и экспрессируется на различных типах опухолевых клеток.
Панитумумаб связывается с лиганд-связывающим доменом рецептора ЭФР и ингибирует рецептор аутофосфорилирования, индуцированный всеми известными лигандами рецептора ЭФР. Связывание панитумумаба с рецептором ЭФР приводит к интернализации рецептора, ингибированию роста клеток, индукции апоптоза и снижению продукции интерлейкина-8 и фактора роста эндотелия сосудов.
KRAS (гомолог вирусного онкогена крысиной саркомы Кирстена 2) и NRAS (гомолог нейробластомы вирусного онкогена RAS) относятся к семейству онкогенов RAS. Гены KRAS и NRAS кодируют небольшой гуанозинтрифосфат-связывающий белок, участвующий в трансдукции сигнала. Различные сигналы, в том числе из рецептора ЭФР, активируют KRAS и NRAS, которые, в свою очередь, стимулируют синтез других внутриклеточных белков для стимулирования клеточной пролиферации, выживаемости клеток и ангиогенеза.
Активирующие мутации генов RAS часто происходят в различных опухолевых клетках человека и играют определенную роль как в процессе онкогенеза, так и в прогрессии опухоли.
Фармакодинамические эффекты
Исследования in vitro и in vivo на животных показали, что панитумумаб ингибирует рост и выживаемость опухолевых клеток, экспрессирующих рецептор ЭФР. Не наблюдалось каких-либо противоопухолевых эффектов панитумумаба в ксенотрансплантатах опухоли человека, лишенных экспрессии рецептора ЭФР. Добавление панитумумаба к лучевой терапии, химиотерапии или другим таргетным терапевтическим агентам в исследованиях на животных увеличивало противоопухолевые эффекты по сравнению с лучевой терапией, химиотерапией или только таргетными препаратами.
Дерматологические реакции (включая воздействие на ногти), наблюдаемые у пациентов, получавших Вектибикс или другие ингибиторы рецепторов ЭФР, как известно, связаны с фармакологическими эффектами терапии (смотрите разделы «Способ применения и дозы» и «Побочные реакции»).
Иммуногенность
Как и для всех терапевтических протеинов, существует потенциал для иммуногенности. Данные по разработке антител против панитумумаба оценивались с использованием двух различных скрининговых систем иммуноанализа для определения связанных антител к панитумумабу (иммуноферментный анализ, который позволяет определить высокоаффинные антитела и иммуноанализ Биосенсор, который позволяет определить антитела с высокой и низкой аффинностью).
Для пациентов, у которых сыворотка показала положительный результат при скрининговом иммуноанализе, проводился также биологический тест in vitro для обнаружения нейтрализующих антител.
В качестве монотерапии:
выявляемость связанных антител (за исключением выявления антител у пациентов до введения препарата и временно положительных) составляла < 1 %, как было установлено с помощью ИФА и 3,8 %, как было установлено с помощью иммунологического анализа Биокор;
выявляемость нейтрализующих антител (за исключением выявления антител у пациентов до введения препарата и временно положительных) составляла < 1 %;
при сравнении с пациентами, у которых антитела не вырабатывались, не наблюдалась взаимосвязь между наличием нейтрализующих антител к панитумумабу и изменениями фармакокинетических параметров, эффективностью и безопасностью.
В комбинации с химиотерапией на основе иринотекана или оксалиплатина:
выявляемость связанных антител (за исключением положительных пациентов до введения препарата) составляла 1 %, как было установлено с помощью ИФА и < 1 %, как было установлено с помощью анализа Биокор;
частота нейтрализующих антител (исключая пациентов с положительной реакцией) составила < 1 %;
не было обнаружено никаких доказательств изменения профиля безопасности у пациентов, у которых был положительный результат теста на антитела к Вектибиксу.
Обнаружение образования антител зависит от чувствительности и специфичности анализа. На положительный результат по определению антител может оказать влияние ряд факторов, включая метод анализа, метод отбора проб, время забора проб, прием сопутствующих препаратов и характер основного заболевания, поэтому сравнение частоты возникновения антител к панитумумабу может быть недостоверным.
Клиническая эффективность в монотерапии
Эффективность Вектибикса в монотерапии у пациентов с метастазирующим колоректальным раком (мКРР), у которых наблюдается прогрессия заболевания на фоне или после предшествующих курсов химиотерапии, была изучена в открытом несравнительном исследовании (585 пациентов) и в двух рандомизированных контролируемых исследованиях по сравнению с наилучшей поддерживающей терапией (463 пациента) и по сравнению с цетуксимабом (1010 пациентов).
Многоцентровое, рандомизированное, контролируемое исследование было проведено у 463 пациентов с метастатической карциномой ободочной или прямой кишки, экспрессирующей рецепторы ЭФР, после подтверждения прогрессирования на оксалиплатин или иринотекан-содержащей химиотерапии. Пациенты были рандомизированы в соотношении 1:1, для получения Вектибикса в дозе 6 мг/кг один раз в две недели вместе с наилучшей поддерживающей терапии (не включая химиотерапию) или только наилучшей поддерживающей терапии. Пациенты получали лечение до прогрессирования заболевания или до развития непереносимой токсичности. При прогрессировании заболевания пациенты, которые получали только наилучшую поддерживающую терапию, имели право на переход в сопутствующее исследование для получения терапии Вектибиксом в дозе 6 мг/кг один раз в две недели.
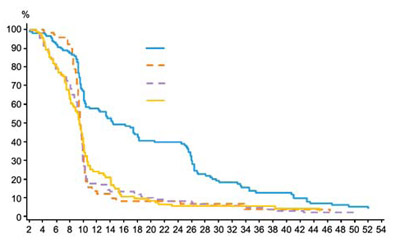
Первичной конечной точкой была выживаемость без прогрессирования (ВБП). Ретроспективно исследование было проанализировано на статус мутаций в генах KRAS во 2 экзоне (дикий тип KRAS по сравнению с мутированным типом KRAS). Образцы опухоли, полученные при первичной резекции колоректального рака, были проанализированы на наличие семи наиболее распространенных активирующих мутаций в кодоне 12 и 13 гена KRAS. 427 пациентов (92 %) были оценены для определения KRAS статуса, 184 из которых имели мутацию. Результаты эффективности, полученные из независимого анализа, представлены в таблице ниже. Не наблюдалась разница в общей выживаемости (ОВ) между двумя группами.
| Популяция KRAS дикого типа (экзон 2) | Популяция мутантного KRAS (экзон 2) | |||
| Вектибикс + наилучшая поддерживающая терапия (n = 124) | Наилучшая поддерживающая терапия (n = 119) | Вектибикс + наилучшая поддерживающая терапия (n = 84) | Наилучшая поддерживающая терапия (n = 100) | |
| Частота объективного ответа n (%) | 17 % | 0 % | 0 % | 0 % |
| Частота ответа | 22 % | 0 % | ||
| (оценивалась исследователем)а (95 % CI) | (14, 32) | (0,4) | ||
| Стабилизация заболевания | 34 % | 12 % | 12 % | 8 % |
| ВБП | ||||
| Относительный риск (95 % ДИ) | 0,49 (0,37, 0,65), р < 0,0001 | 1,07 (0,77, 1,48), р = 0,6880 | ||
| Медиана (недели) | 16,0 | 8,0 | 8,0 | 8,0 |
ДИ – доверительный интервал
а У пациентов из группы наилучшей поддерживающей терапии, которые перешли в группу панитумумаба после прогрессирования заболевания (95 % ДИ)
В эксплоративном анализе дополнительных мутаций образцов опухоли, полученных в данном исследовании, у 11 из 72 пациентов (15 %) с диким типом RAS в опухоли, которые получали панитумумаб, наблюдался объективный ответ по сравнению с 1 из 95 пациентов (1 %) с мутантным RAS статусом опухоли.
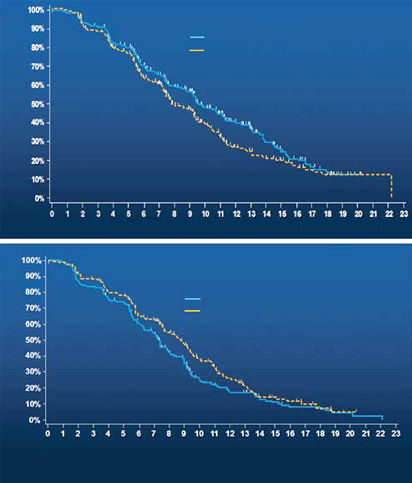
Кроме того, терапия панитумумабом ассоциировалась с улучшением ВБП по сравнению с поддерживающей терапией у пациентов с диким типом RAS в опухоли (относительный риск (ОР) = 0,38 [95 % ДИ: 0,27, 0,56]), но не у пациентов с мутантным типом RAS (ОР = 0,98 [95 % ДИ: 0,73, 1,31]). Эффективность Вектибикса также оценивалась в открытом исследовании у пациентов с мКРР с диким типом KRAS (экзон 2). В общей сложности 1010 пациентов, рефрактерных к химиотерапии, были рандомизированы в соотношении 1:1 для получения Вектибикса или цетуксимаба, чтобы протестировать, что Вектибикс не уступает цетуксимабу. Первичной конечной точкой была общая выживаемость (ОВ). Вторичными конечными точками являлись – ВБП и частота объективного ответа (ЧОО).
Результаты данного исследования представлены в таблице ниже.
| Популяция KRAS дикого типа (экзон 2) | Вектибикс(n = 499) | Цетуксимаб(n = 500) |
| ОВ | ||
| Медиана (месяцы) (95 % ДИ) | 10,4 (9,4, 11,6) | 10,0 (9,3, 11,0) |
| Относительный риск (95 % ДИ) | 0,97 (0,84, 1,11) | |
| ВБП | ||
| Медиана (месяцы) (95 % ДИ) | 4,1 (3,2, 4,8) | 4,4 (3,2, 4,8) |
| Относительный риск (95 % ДИ) | 1,00 (0,88, 1,14) | |
| ЧОО | ||
| n (%) (95 % ДИ) | 22 % (18 %, 26 %) | 20 % (16 %, 24 %) |
| Относительный риск (95 % ДИ) | 1,15 (0,83, 1,58) |
В целом, профиль безопасности панитумумаба был сходен с цетуксимабом, в частности, в отношении кожной токсичности. Однако инфузионные реакции чаще наблюдались при применении цетуксимаба (13 % по сравнению с 3 %), а нарушения электролитного баланса было более частым при применении панитумумаба, особенно гипомагниемия (29 % против 19 %).
Клиническая эффективность в комбинации с химиотерапией
Среди пациентов с мКРР и диким типом RAS показатели ВБП, ОВ и ЧОО были лучше для пациентов, которые получали панитумумаб в комбинации с химиотерапией (FOLFOX или FOLFIRI) по сравнению с только лишь с химиотерапией. Пациенты с дополнительными мутациями RAS помимо KRAS (экзон 2) не получали каких-либо преимуществ при добавлении панитумумаба к FOLFIRI, кроме того, у этих пациентов наблюдался неблагоприятный эффект при добавлении панитумумаба к FOLFOX. BRAF мутации в экзоне 15 являются прогностическим маркером неблагоприятного исхода. Мутации BRAF не являются предиктивным маркером эффективности панитумумаба в комбинации с FOLFOX или FOLFIRI.
Первая линия терапии в комбинации с FOLFOX
Эффективность Вектибикса в комбинации с оксалиплатином, 5-фторурацилом (5-ФУ) и лейковорином (FOLFOX) оценивали в рандомизированном контролируемом исследовании у 1183 пациентов с мКРР, первичной конечной точкой была ВБП. Вторичными конечными точками являлись ОВ, ЧОО, время до ответа, время до прогрессирования и продолжительность ответа. Исследование было проспективно проанализировано по статусу мутаций в генах KRAS (экзон 2), который был оценен у 93 % пациентов.
Предварительно запланированный ретроспективный анализ осуществлен у 641 пациента из 656 пациентов с диким типом KRAS (экзон 2) для мКРР. Образцы опухолей пациентов с KRAS (экзон 2) дикого типа (кодоны 12/13) были исследованы на наличие дополнительных мутаций RAS в экзоне 3 KRAS (кодон 61) и экзоне 4 (кодоны 117/146), а также экзоне 2 NRAS (кодоны 12/13), экзоне 3 (кодон 61) и экзоне 4 (кодоны 117/146), экзоне 15 BRAF (кодон 600). Выявляемость этих дополнительных RAS мутаций в популяции KRAS дикого типа экзон 2 составила примерно 16 %.
Результаты эффективности в зависимости от статуса мутаций RAS представлены в таблице ниже.
| Вектибикс + FOLFOX (месяцы) Медиана (95 % ДИ) | FOLFOX (месяцы) Медиана (95 % ДИ) | Разница (месяцы) | Отношение рисков (95 % ДИ) | |
| Популяция с диким типом RAS | ||||
| ВБП | 10,1 (9,3, 12,0) | 7,9 (7,2, 9,3) | 2,2 | 0,72 (0,58, 0,90) |
| ОВ | 26,0 (21,7, 30,4) | 20,2 (17,7, 23,1) | 5,8 | 0,78 (0,62, 0,99) |
| Популяция с мутантным типом RAS | ||||
| ВБП | 7,3 (6,3, 7,9) | 8,7 (7,6, 9,4) | -1,4 | 1,31 (1,07, 1,60) |
| ОВ | 15,6 (13,4, 17,9) | 19,2 (16,7, 21,8) | -3,6 | 1,25 (1,02, 1,55) |
Затем были идентифицированы дополнительные мутации в KRAS и NRAS экзоне 3 (кодон 59) (n = 7). Диагностический анализ показал аналогичные результаты по сравнению с результатами предыдущей таблицы.
Комбинация с FOLFIRI
Эффективность Вектибикса во второй линии терапии в комбинации с иринотеканом, 5-фторурацилом (5-ФУ) и лейковорином (FOLFIRI) оценивали в рандомизированном контролируемом исследовании у 1186 пациентов с мКРР. В качестве первичных конечных точек были выбраны ОВ и ВБП. Вторичные конечные точки включали ЧОО, время до ответа, время до прогрессирования и продолжительность ответа. Исследование было проспективно проанализировано по статусу мутаций KRAS (экзон 2), который был оценен у 91 % пациентов.
Предварительно запланированный ретроспективный анализ осуществлен у 586 пациентов из 597 пациентов с мКРР и диким типом KRAS (экзон 2), образцы опухолей у данных пациентов были исследованы на выявление дополнительных RAS и BRAF мутаций, как было описано ранее. Выявляемость RAS/BRAF мутаций составила 85 % (1014 из 1186 рандомизированных пациентов). Количество дополнительных RAS мутаций (экзоны KRAS 3, 4 и экзоны 2, 3, 4 NRAS) в популяции KRAS дикого типа (экзон 2) составило примерно 19 %. Частота мутации BRAF в экзоне 15 для популяции KRAS дикого типа (экзон 2) составила примерно 8 %.
Результаты эффективности в зависимости от статуса мутаций RAS представлены в таблице ниже.
| Вектибикс + FOLFIRI(месяцы)Медиана (95 % ДИ) | FOLFIRI (месяцы)Медиана (95 % ДИ) | Отношение рисков (95 % ДИ) | |
| Популяция с диким типом RAS | |||
| ВБП | 6,4(5,5, 7,4) | 4,6(3,7, 5,6) | 0,70(0,54, 0,91) |
| ОВ | 16,2(14,5, 19,7) | 13,9(11,9, 16,0) | 0,81(0,63, 1,02) |
| Популяция с мутантным типом RAS | |||
| ВБП | 4,8(3,7, 5,5) | 4,0(3,6, 5,5) | 0,86(0,70, 1,05) |
| ОВ | 11,8(10,4, 13,1) | 11,1(10,2, 12,4) | 0,91(0,76, 1,10) |
Эффективность препарата Вектибикс в первой линии в комбинации с FOLFIRI оценивалась в несравнительном исследовании у 154 пациентов, первичной конечной точкой являлась частота объективного ответа (ЧОО). Вторичные конечные точки включали ВБП, время до ответа, время до прогрессирования и продолжительность ответа.
Предварительно запланированный ретроспективный анализ дополнительных RAS мутаций осуществлен у 143 пациентов из 154 пациентов с мКРР и диким типом KRAS (экзон 2), частота дополнительных RAS мутаций (KRAS экзоны 3, 4 и NRAS экзоны 2, 3, 4) в популяции KRAS дикого типа (экзон 2) составила приблизительно 10 %.
Результаты эффективности в зависимости от статуса мутаций RAS по данным первичного анализа представлены в таблице ниже.
| Панитумумаб + FOLFIRI | ||
| RAS дикого типа (n = 69) | RAS мутантного типа (n = 74) | |
| ЧОО (%) (95 % ДИ) | 59(46, 71) | 41(30, 53) |
| Медиана ВБП (месяцы) (95 % ДИ) | 11,2(7,6, 14,8) | 7,3(5,8, 7,5) |
| Медиана продолжительности ответа (месяцы) (95 % ДИ) | 13,0(9,3, 15,7) | 5,8(3,9, 7,8) |
| Медиана времени до прогрессирования (месяцы) (95 % ДИ) | 13,2(7,8, 17,0) | 7,3(6,1, 7,6) |
Первая линия терапии в комбинации с бевацизумабом и химиотерапией на основе оксалиплатина или иринотекана
В рандомизированном открытом контролируемом клиническом исследовании пациенты с метастатическим колоректальным раком получали химиотерапию оксалиплатином или иринотеканом и бевацизумаб с добавлением или без панитумумаба в первой линии терапии (n = 1053 (n = 823 – оксалиплатин, n = 230 – иринотекан)). Терапия панитумумабом была прекращена после получения статистически достоверного ухудшения ВБП по результатам промежуточного анализа.
Основной целью исследования было сравнение ВБП в группе оксалиплатина. По результатам финального анализа относительный риск для ВБП составил 1,27 (95 % ДИ: 1,06, 1,52). Медиана ВБП составила 10,0 (95 % ДИ: 8,9, 11,0) в группе с панитумумабом и 11,4 (95 % ДИ: 10,5, 11,9) месяцев в группе без панитумумаба, соответственно. Наблюдалось увеличение смертности в группе панитумумаба. Относительный риск для общей выживаемости составил 1,43 (95 % ДИ: 1,11, 1,83). Медиана общей выживаемости составила 19,4 (95 % ДИ: 18,4, 20,8) в группе, получающей панитумумаб и 24,5 (95 % ДИ: 20,4, 24,5) и в группе без панитумумаба, соответственно.
Дополнительный анализ данных в зависимости от статуса мутаций в гене KRAS (экзон 2) не выявил пациентов, которые бы получали пользу от добавления панитумумаба к комбинации с оксалиплатином или иринотеканом и бевацизумабом. Для подгруппы KRAS дикого типа в группе оксалиплатина относительный риск для ВБП составил 1,36 с 95 % ДИ: 1,04–1,77. Для мутантного подтипа KRAS относительный риск для ВБП составил 1,25 с 95 % ДИ: 0,91–1,71. Тенденция к улучшению ОВ в группе контроля наблюдалась у пациентов с KRAS дикого типа на фоне оксалиплатина (относительный риск = 1,89; 95 % ДИ: 1,30, 2,75). Наблюдалась тенденция к ухудшению показателя выживаемости при применении панитумумаба и иринотекана, независимо от мутационного статуса KRAS. В целом, лечение панитумумабом в сочетании с химиотерапией и бевацизумабом ассоциируется с неблагоприятным профилем польза/риск, независимо от статуса мутаций генов KRAS в опухоли.
Детская популяция пациентов
Европейское агентство по лекарственным средствам временно отложило представление результатов исследования Вектибикса во всех подгруппах педиатрической популяции при колоректальном раке (смотрите раздел «Способ применения и дозы» для информации применения в детской популяции).
Фармакокинетика
Вектибикс применяется в качестве монотерапии или в комбинации с химиотерапией, фармакокинетика носит нелинейный характер.
После однократного введения панитумумаба в виде 1-часовой инфузии площадь под кривой «концентрация-время» (AUC) возрастала в большей степени, чем при дозопропорциональной зависимости, клиренс препарата снижался с 30,6 до 4,6 мл/день/кг при увеличении дозы с 0,75 до 9 мг/кг. Однако при введении панитумумаба в дозах свыше 2 мг/кг характер увеличения AUC был близок к дозопропорциональной зависимости.
При соблюдении рекомендуемого режима дозирования (6 мг/кг 1 раз в 2 недели в виде 1-часовой инфузии) равновесная концентрация панитумумаба достигалась к третьей инфузии при средних значениях максимальной (± стандартное отклонение) и минимальной концентраций 213 ± 59 и 39 ± 14 мкг/мл соответственно. Среднее значение (± стандартное отклонение) AUC0-tau и клиренса были равны 1306 ± 374 мкг∙день/мл и 4,9 ± 1,4 мл/кг/день соответственно. Период полувыведения препарата составил примерно 7,5 дня (диапазон: 3,6–10,9 дня).
Фармакокинетический анализ для популяций проводился с целью изучения потенциальных эффектов выбранных независимых переменных на фармакокинетику панитумумаба. Результаты показывают, что возраст (21–88), пол, раса, функции печени и почек, применение сопутствующих химиотерапевтических препаратов и интенсивное ЭФР окрашивания мембраны (1+, 2+, 3+) в опухолевых клетках не оказывала явного влияния на фармакокинетику панитумумаба.
Не проводились какие-либо клинические исследования для изучения фармакокинетики панитумумаба у пациентов с печеночной или почечной недостаточностью.
Вектибикс показан для лечения взрослых пациентов с метастатическим колоректальным раком (мКРР) и диким типом RAS в опухоли:
в первой линии терапии в комбинации с режимами FOLFOX или FOLFIRI;
во второй линии терапии в комбинации с режимом FOLFIRI у пациентов, которые получили химиотерапию на основе фторпиримидина (за исключением иринотекана);
в качестве монотерапии после отсутствия эффекта от химиотерапии на основе фторпиримидина, оксалиплатина и иринотекана.
Пациенты с тяжелой или угрожающей жизни гиперчувствительностью к активной субстанции или компонентам препарата (смотрите раздел «Меры предосторожности»).
Пациенты с интерстициальным пневмонитом или фиброзом легких (смотрите раздел «Меры предосторожности»).
Комбинация Вектибикса с химиотерапией, на основе оксалиплатина, противопоказана пациентам с мКРР и мутациями в генах RAS или пациентам, у которых статус мутаций в генах RAS неизвестен (смотрите раздел «Меры предосторожности»).
Применение во время беременности и кормления грудью
Беременность
Данные о применении Вектибикса у беременных отсутствуют. Исследования на животных показали репродуктивную токсичность. Рецептор ЭФР участвует в контроле пренатального развития и играет роль в процессах нормального органогенеза, пролиферации и дифференциации в развивающемся эмбрионе. Следовательно, Вектибикс может оказать потенциальное вредное воздействие на плод при введении его беременным женщинам.
Известно, что человеческий IgG проникает через плацентарный барьер, поэтому панитумумаб может проникать из организма матери в развивающийся организм плода. Женщины детородного возраста должны применять соответствующие средства контрацепции во время лечения с применением Вектибикса и в течение 2-х месяцев после введения последней дозы. Если Вектибикс применяется во время беременности или если пациентка забеременела при получении данного лекарственного средства, она должна быть проконсультирована о возможном риске потери беременности и о потенциальном риске для плода.
Кормление грудью
Неизвестно, проникает ли панитумумаб в грудное молоко человека. Поскольку человеческий IgG проникает в материнское молоко, можно предположить, что панитумумаб также может проникать в грудное молоко. Возможность всасывания препарата и его потенциальный вред для ребенка не установлены. В период лечения Вектибиксом и в течение 2 месяцев после введения последней дозы не рекомендуется кормление грудью.
Фертильность
Исследования на животных показали обратимое влияние на менструальный цикл и снижение женской плодовитости у обезьян. Панитумумаб может оказывать влияние на способность женщины забеременеть.
Применение Вектибикса должно находиться под контролем врача, имеющего опыт применения противоопухолевых средств. Перед началом лечения Вектибиксом, необходимо подтвердить отсутствие мутаций генов RAS (KRAS и NRAS) в опухоли. Мутационный статус должен определяться опытной лабораторией с использованием валидированных методов тестирования для обнаружения мутаций в генах KRAS (экзоны 2, 3 и 4) и NRAS (экзоны 2, 3 и 4).
Вектибикс следует вводить в виде внутривенной инфузии с помощью инфузионного насоса в периферический зонд или постоянный катетер через встроенный фильтр 0,2 или 0,22 мкм с низкой степенью связывания белков. Рекомендуемое время инфузии составляет приблизительно 60 минут. Если первая инфузия переносится хорошо, то последующие инфузии могут быть введены в течение 30–60 минут. Дозы выше чем 1000 мг следует вводить в течение примерно 90 минут (смотрите раздел «Меры предосторожности при утилизации и прочих манипуляциях»).
Линию для инфузии следует промывать раствором хлорида натрия до и после введения Вектибикса, чтобы избежать смешивания с другими лекарственными средствами или внутривенными растворами.
Снижение скорости инфузии для Вектибикса может быть необходимо в случае развития инфузионных реакций (смотрите раздел «Меры предосторожности»).
Вектибикс нельзя вводить внутривенно струйно или болюсно.
Инструкцию по разведению лекарственного средства перед введением смотрите в разделе «Меры предосторожности при утилизации и прочих манипуляциях».
Дозирование
Рекомендуемая доза Вектибикс составляет 6 мг/кг массы тела один раз в день каждые две недели. Перед инфузией Вектибикс необходимо развести в растворе хлорида натрия 9 мг/мл (0,9 %) до конечной концентрации, которая не должна превышать 10 мг/мл (смотрите раздел «Меры предосторожности при утилизации и прочих манипуляциях»).
Корректировка дозы Вектибикса может быть необходима в случае серьезных (≥ 3 степени) дерматологических реакций (смотрите раздел «Меры предосторожности»).
Применение в специальных популяциях пациентов
Педиатрическая популяция
Вектибикс не предназначен для лечения колоректального рака у детей.
Пожилые пациенты (≥ 65 лет)
Нет соответствующих клинических данных по режиму дозирования у пожилых пациентов.
Пациенты с поражением почек
Безопасность и эффективность Вектибикса не изучалась у пациентов с почечной недостаточностью.
Пациенты с поражением печени
Безопасность и эффективность Вектибикса не изучалась у пациентов с печеночной недостаточностью.
Способы введения
Меры предосторожности при утилизации и прочих манипуляциях
Вектибикс предназначен только для однократного применения. Вектибикс должен быть разведен медицинским работником в 9 мг/мл (0,9 %) растворе хлорида натрия с использованием асептической техники. Не встряхивайте и сильно не взбалтывайте флакон. Вектибикс должен быть осмотрен визуально перед введением. Раствор должен быть бесцветным и может содержать полупрозрачные или белые видимые аморфные белковые частицы (которые могут быть удалены во время фильтрации). Не вводите Вектибикс, если его описание не соответствует указанному выше. Используйте гиподермальную иглу диаметром 21 калибр или меньше, введите необходимое количество Вектибикса в дозе 6 мг/кг. Не применяйте устройства без иглы (например, адаптер для флаконов) для извлечения содержимого флакона. Разведите в общем объеме 100 мл. Конечная концентрация не должна превышать 10 мг/мл. Доза, которая превышает 1000 мг, должна быть разведена в 150 мл раствора хлорида натрия 9 мг/мл (0,9 %) (смотрите раздел «Способ применения и дозы»). Разведенный раствор необходимо перемешать с помощью легкого покачивания, не трясите флакон. Не наблюдается несовместимости между Вектибиксом и раствором хлорида натрия 9 мг/мл (0,9 %) в мешках из поливинилхлорида или полиолефина.
Любые неиспользованные лекарственные препараты или отходы следует утилизировать в соответствие с локальными требованиями.
Несовместимость
Этот лекарственный препарат нельзя смешивать с другими лекарственными средствами, кроме указанных в разделе «Меры предосторожности при утилизации и прочих манипуляциях».
Побочные реакции
Общие данные по профилю безопасности
На основании анализа данных для всех пациентов, которые получали Вектибикс при мКРР в качестве монотерапии и в комбинации с химиотерапией в рамках клинических исследований (n = 2588), наиболее часто сообщаемыми побочными реакциями были реакции со стороны кожи, которые встречались у 93 % пациентов. Эти реакции связаны с фармакологическими эффектами Вектибикса, большинство из них были легкой или средней степени тяжести с 25 % тяжелых (класс 3 NCI-CTC) и < 1 % угрожающих жизни (4-й класс NCI-CTC) реакциями. Для клинической коррекции дерматологических реакций, включая рекомендации по коррекции дозы, смотрите раздел «Меры предосторожности». Наиболее часто сообщаемыми побочными реакции, возникающими у > 20 % пациентов, были желудочно-кишечные расстройства [диарея (50 %), тошнота (41 %), рвота (27 %), запор (23 %) и боль в животе (23 %)]; общие заболевания [усталость (37 %), гипертермия (20 %)]; нарушение обмена веществ и расстройства пищеварения [анорексия (27 %)]; инфекции и инвазии [паронихия (20 %)]; заболевания кожи и подкожной клетчатки [сыпь (45 %), угревой дерматит (39 %), зуд (35 %), эритема (30 %) и сухость кожи (22 %)].
Таблица побочных реакций
Данные в таблице ниже описывают побочные реакции, которые сообщались пациентами с мКРР, которые получали панитумумаб в качестве монотерапии или в комбинации с химиотерапией (n = 2588) в рамках клинических исследований, а также из спонтанных отчетов. В каждой группе, побочные эффекты представлены по мере уменьшения степени тяжести.
| Побочные реакции | |||||
| Система организма MedDRA | Очень часто(≥ 1/10) | Часто(≥ 1/100 – < 1/10) | Нечасто(≥ 1/1000 – < 1/100) | Редко(≥ 1/10 000 – < 1/1000) | Частота неизвестна* |
| Инфекции и инвазии | Паронихия1 | Пустулезная сыпьЦеллюлит1Инфекции мочевыводящих путейФолликулитЛокализованная инфекция | Инфекция глазИнфекция век | ||
| Заболевания крови и лимфатической системы | Анемия | Лейкопения | |||
| Заболевания иммунной системы | Гиперчувствительность1 | Анафилактические реакции | |||
| Нарушения метаболизма и обмена веществ | ГипокалиемияАнорексияГипомагниемия | ГипокальциемияДегидратацияГипергликемияГипофосфатемия | |||
| Психиатрические заболевания | Бессонница | Тревожность | |||
| Заболевания нервной системы | Головная боль Головокружение | ||||
| Заболевания глаз | Конъюнктивит | БлефаритУсиление роста ресницПовышенное слезотечениеГиперемия глазного яблокаСухость глазЗуд глазРаздражение глаз | Раздражение век Кератит1 | Язвенный кератит1 | |
| Заболевания сердца | Тахикардия | Цианоз | |||
| Заболевания сосудов | Тромбоз глубоких венГипотензияГипертензияПриливы | ||||
| Заболевания органов дыхания, грудной клетки и средостения | Одышка, кашель | Эмболия легочной артерииНосовое кровотечение | БронхоспазмСухость слизистой оболочки носа | Интерстициальные заболевания легких3 | |
| Заболевания желудочно-кишечного тракта | Диарея1ТошнотаРвотаБоль в животеСтоматитЗапор | Ректальное кровотечениеСухость слизистой ротовой полостиДиспепсияАфтозный стоматитХейлитГастроэзофагеальная рефлюкснаяболезнь | Трещины губСухость губ | ||
| Заболевания кожи и подкожной клетчатки | Акнеформный дерматитСыпь1,2ЭритемаЗудСухость кожиКожные трещиныАкнеАлопеция | Синдром ладонно-подошвенной эритродизэстезииКожные язвыШелушение кожиГипертрихозОнихоклазияЗаболевания ногтейГипергидрозДерматит | Ангионевротический отек1ГирсутизмВросший ноготьОнихолизис | Некроз кожи1Синдром Стивенса-Джонсона1Токсический эпидермальный некролиз1 | |
| Заболевания мышечно-скелетной и соединительной ткани | Боли в спине | Боли в конечностях | |||
| Общие заболевания и состояния места ввода препарата | УтомляемостьПирексияАстенияВоспаление слизистойПериферические отеки | Боль в области грудиБольОзноб | Инфузионные реакции1 | ||
| Исследования | Снижение массы тела | Снижение концентрации магния в крови |
1 Смотрите раздел «Описание отдельных побочных реакций» ниже
2 Сыпь, которая является наиболее частым симптомом кожной токсичности, может развиваться в виде эксфолиативной сыпи, папулезной сыпи, эритематозной сыпи, генерализованной сыпи, макулезной сыпи, макулопапулезной сыпи, на фоне зуда, сухости и других повреждений кожи
3 Смотрите раздел «Меры предосторожности. Осложнения со стороны легких»
* Частота не может быть определена из имеющихся данных.
Профиль безопасности Вектибикса в сочетании с химиотерапией включал побочные реакции для Вектибикса (в качестве монотерапии) и фоновую токсичность химиотерапии. Не наблюдалось новых случаев токсичности или усугубления ранее известных случаев токсичности, кроме ожидаемых аддитивных эффектов. Наиболее часто возникали кожные реакции у пациентов, получавших панитумумаб в сочетании с химиотерапией. Другие реакции, которые наиболее часто встречались у пациентов при монотерапии, включали гипомагнезиемию, диарею и стоматит. Данные побочные реакции нечасто приводили к прекращению применения Вектибикса или химиотерапии.
Описание отдельных побочных реакций
Заболевания желудочно-кишечного тракта
Диарея, если сообщалась, была в основном легкой или умеренной степени тяжести. Тяжелая диарея (класс 3 и 4 по NCI-CTC) сообщалось у 2 % пациентов, получавших Вектибикс в качестве монотерапии, у 17 % пациентов, получавших Вектибикс в сочетании с химиотерапией. Сообщалось об острой почечной недостаточности у пациентов, у которых развивалась диарея и обезвоживание (смотрите раздел «Меры предосторожности»).
Инфузионные реакции
В клинических исследованиях мКРР при монотерапии и комбинированной терапии (n = 2588) инфузионные реакции (которые развивались в течение 24 часов после любой инфузии), которые включали такие симптомы/признаки, как озноб, лихорадка, одышка, сообщались примерно у 4 % пациентов, получающих Вектибикс, 1 % из этих реакций были тяжелыми (3 и 4 степень по NCI-CTC). Сообщалось о развитии случая летального ангионевротического отека у пациента с рецидивирующим метастатическим плоскоклеточным раком головы и шеи при применении Вектибикса в рамках клинических исследований. Летальный случай произошел в результате развития ангионевротического отека при возобновлении терапии; оба случая произошли больше чем через 24 часа после введения препарата (смотрите разделы «Противопоказания» и «Меры предосторожности»). Реакции гиперчувствительности, которые развивались спустя 24 часа после инфузии, также сообщались в постмаркетинговый период. Для клинического управления реакциями, связанными с инфузией, смотрите раздел «Меры предосторожности».
Заболевания кожи и подкожной клетчатки
Кожная сыпь чаще всего локализовалась на лице, груди и спине, но в некоторых случаях распространялась и на конечности. Как следствие развития тяжелых реакций со стороны кожи и подкожной клетчатки, отмечались инфекционные осложнения, включая сепсис, в редких случаях с летальным исходом, целлюлит и локальные абсцессы, требующие хирургических вмешательств и дренажа. Среднее время до развития первых симптомов дерматологических реакций составляло 10 дней, а среднее время для их разрешения после введения последней дозы Вектибикса составляло 28 дней.
Паронхиальное воспаление сопровождалось припухлостью латеральных ногтевых валиков пальцев рук и ног.
Дерматологические реакции (включая воздействие на ногти) наблюдались у пациентов, получающих Вектибикс или другие ингибиторы рецептора ЭФР, и являлись известными фармакологическими эффектами терапии.
В клинических исследованиях кожные реакции наблюдались у 93 % пациентов, получавших Вектибикс как монотерапию или в сочетании с химиотерапией (n = 2588). Эти реакции включали преимущественно сыпь и угреподобный дерматит, в основном от легкой до средней степени тяжести.
Тяжелые (3 степень по NCI-CTC) кожные реакции были зарегистрированы у 34 % пациентов, угрожающие для жизни (4 степень по NCI-CTC) кожные реакции встречались у < 1 % пациентов, которые получали Вектибикс в сочетании с химиотерапией (n =1536). Угрожающие жизни и летальные инфекционные осложнения, включая некротизирующий фасциит и сепсис, наблюдались у пациентов, получавших Вектибикс (смотрите раздел «Меры предосторожности»).
Для клинического управления кожными реакциями, включая рекомендации по корректировке дозы, смотрите раздел «Меры предосторожности».
В постмаркетинговом периоде сообщались редкие случаи некроза кожи, синдрома Стивенса-Джонсона и токсического эпидермального некролиза (смотрите раздел «Меры предосторожности»).
Офтальмологическая токсичность
Несерьезные случаи кератита наблюдались у 0,2–0,7 % пациентов в клинических исследованиях. В постмаркетинговом периоде тяжелые случаи кератита и язвенного кератита сообщались редко (смотрите раздел «Меры предосторожности»).
Другие специальные популяции
Не наблюдалось каких-либо различий в безопасности или эффективности у пожилых пациентов (≥ 65 лет) при получении Вектибикса в качестве монотерапии. Однако было зафиксировано увеличение числа серьезных побочных реакций у пожилых пациентов, получающих Вектибикс в сочетании с FOLFIRI (45 % по сравнению с 37 %) или FOLFOX (52 % по сравнению с 37 %) по сравнению только с химиотерапией (смотрите раздел «Меры предосторожности»). Наиболее частыми серьезными побочными реакциями были диарея у пациентов, получавших Вектибикс в сочетании с FOLFOX или FOLFIRI, а также обезвоживание и легочная эмболия при применении Вектибикса в сочетании с FOLFIRI.
Безопасность Вектибикса не изучалась у пациентов с почечной или печеночной недостаточностью.
Сообщения о предполагаемых побочных реакциях
Важное значение имеют сообщения о предполагаемых побочных реакциях после регистрации лекарственного средства.
Это позволяет продолжать мониторинг баланса польза/риск для лекарственного препарата. Просим специалистов здравоохранения сообщать о любых предполагаемых побочных реакциях в Республиканское унитарное предприятие «Центр экспертиз и испытаний в здравоохранении» в отдел «Республиканская клинико-фармакологическая лаборатория».
Доза до 9 мг/кг была протестирована в клинических исследованиях. Имелись сообщения о передозировке, доза превышала рекомендуемую терапевтическую дозу примерно в два раза (12 мг/кг). Среди наблюдаемых побочных реакций были токсичность кожи, диарея, обезвоживание и усталость, что соответствовало профилю безопасности в рекомендуемых дозах.
Данные из исследований по взаимодействию Вектибикса и Иринотекана у пациентов с мКРР показали, что фармакокинетика иринотекана и его активного метаболита SN-38 не изменяется при совместном введении препаратов. Результаты сравнительного исследования показали, что схемы, содержащие иринотекан (IFL или FOLFIRI), не влияют на фармакокинетику панитумумаба.
Вектибикс нельзя вводить в комбинации с химиотерапией IFL или с химиотерапией, содержащей бевацизумаб. Наблюдался высокий уровень реакций, таких как тяжелая диарея, когда панитумумаб вводили в комбинации с IFL (смотрите раздел «Меры предосторожности»), повышенная токсичность и смертность наблюдались при сочетании панитумумаба с бевацизумабом и химиотерапией (смотрите разделы «Меры предосторожности» и «Фармакодинамика»).
Комбинация Вектибикса с химиотерапией на основе оксалиплатина противопоказана для пациентов с мКРР с мутантным типом RAS или в случае, когда статус RAS для мКРР неизвестен. В клинических исследованиях наблюдалось ухудшение выживаемости без прогрессирования и общей выживаемости у пациентов с мутантным типом RAS в опухоли, которые получали панитумумаб и FOLFOX (смотрите разделы «Меры предосторожности» и «Фармакодинамика»).
Предосторожность при применении
Дерматологические реакции и токсическое воздействие на мягкие ткани
Дерматологические реакции – фармакологический эффект, наблюдаемый для рецептора эпидермального фактора роста (ЭФР), развиваются практически у всех пациентов (приблизительно 90 %), получавших лечение с применением Вектибикса. Тяжелые (3 степень по NCI-CTC) кожные реакции отмечались у 34 %, кожные реакции, угрожающие жизни (4 степень NCI-CTC) наблюдались у < 1 % пациентов, получивших Вектибикс в сочетании с химиотерапией (n = 1536) (смотрите раздел «Побочные реакции»). Если у пациента развиваются дерматологические реакции 3 степени (СТСАЕ v 4.0) или выше, или которые считаются недопустимыми, рекомендуется следующая корректировка дозы:
| Развитие симптома(-ов) со стороны кожи: степень ≥ 31 | Введение Вектибикса | Исход | Корректировка дозы |
| Первый случай возникновения | Отмена 1 или 2 доз | Улучшение (степень < 3) | Возобновление инфузии в дозе 100 % от исходной |
| Нет улучшения | Прекращение | ||
| Второй случай возникновения | Отмена 1 или 2 доз | Улучшение (степень < 3) | Возобновление инфузии в дозе 80 % от исходной |
| Нет улучшения | Прекращение | ||
| Третий случай возникновения | Отмена 1 или 2 доз | Улучшение (степень < 3) | Возобновление инфузии в дозе 60 % от исходной |
| Нет улучшения | Прекращение | ||
| Четвертый случай возникновения | Прекращение | – | – |
1 Реакции 3 степени и выше считаются тяжелыми или жизнеугрожающими
В клинических исследованиях сообщалось о развитии тяжелых дерматологических реакций (включая стоматиты), инфекционных осложнениях, в том числе сепсисе и некротизирующем фасциите, которые в редких случаях приводили к летальному исходу, а также о локальных абсцессах, которые требовали хирургического вмешательства и дренажа. Пациенты, у которых на фоне применения Вектибикса развивались тяжелые дерматологические реакции или токсическое воздействие на мягкие ткани, а также у которых наблюдалось ухудшение течения дерматологических реакций, должны наблюдаться на предмет развития воспалительных или инфекционных осложнений (включая целлюлит и некротизирующий фасциит); при необходимости таким пациентам должно быть назначено соответствующее лечение.
У пациентов, получающих Вектибикс, наблюдались осложнения, угрожающие жизни или приводящие к летальному исходу, в том числе некротизирующий фасциит и сепсис. Редкие случаи синдрома Стивенса-Джонсона и токсического эпидермального некролиза сообщались у пациентов, получавших лечение Вектибиксом в постмаркетинговом периоде. Отмена или прекращение применения Вектибикса в случае токсического воздействия на кожу и мягкие ткани связано с тяжелыми или угрожающими жизни воспалением или инфекционными осложнениями.
Лечение дерматологических реакций должно подбираться в зависимости от тяжести симптомов и может включать увлажняющие крема, солнцезащитные крема (SPF > 15 UVA и UVB) и стероидные мази (содержащие не более 1 % гидрокортизона), которые наносятся на пораженные участки и/или перорально принимаемые антибиотики. Также рекомендуется, чтобы пациенты, у которых развивается сыпь / дерматологическая токсичность, носили солнцезащитный крем и шляпы и ограничивали пребывание на солнце, так как воздействие солнечных лучей может усугубить любые кожные реакции.
Профилактическое лечение кожных реакций, включающее применение увлажняющего крема для кожи, солнцезащитного крема (SPF > 15 UVA и UVB), местного стероидного крема (не более 1 % гидрокортизона) и перорального антибиотика (например, доксициклин) может быть полезным при лечении дерматологических реакций. Пациентам рекомендуется применять увлажняющий крем и солнцезащитный крем для лица, рук, ног, шеи, спины и грудной клетки каждое утро во время лечения, а также рекомендуется наносить крем с содержанием стероидов на лицо, руки, ноги, шею, спину и область груди каждый вечер во время лечения.
Осложнения со стороны легких
Пациенты, у которых наблюдался интерстициальный пневмонит или фиброз легких, а также отмечались данные заболевания в анамнезе, исключались из клинических исследований. Случаи интерстициальных заболеваний легких, как с летальным исходом, так и без, наблюдались, в основном, в японской популяции. В случае острого начала или в случае ухудшения легочных симптомов, следует прекратить введение Вектибикса, а также необходимо начать тщательное исследование данной симптоматики: Если диагностировано интерстициальное заболевание легких, следует прекратить применение Вектибикса, и начать соответствующее лечение. У пациентов с интерстициальным пневмонитом или фиброзом легких в анамнезе, необходимо тщательно оценить преимущества применения панитумумаба и риск возникновения легочных осложнений.
Нарушение электролитного баланса
У некоторых пациентов наблюдается постепенное снижение уровня магния в сыворотке крови, что приводит к тяжелой (4 степень) гипомагнеземии.
Пациенты должны периодически наблюдаться на наличие гипомагнеземии и сопутствующей гипокальциемии до начала применения Вектибикса и периодически после начала лечения на протяжении 8 недель после завершения лечения (смотрите раздел «Побочные реакции»). При необходимости рекомендуется использовать препараты магния.
Также наблюдались другие нарушения электролитного баланса, включая гипокалиемию. Также рекомендуется мониторинг и применение этих веществ, как рекомендуется выше.
Инфузионные реакции
В клинических исследованиях мКРР при монотерапии и комбинированной терапии (n = 2588) инфузионные реакции (которые развивались в течение 24 часов после любой инфузии), сообщались примерно у 4 % пациентов, получающих Вектибикс, < 1 % из этих реакций были тяжелыми (3 и 4 степень по NCI-CTC). В постмаркетинговом периоде сообщались серьезные реакции, связанные с инфузией, включая случаи со смертельным исходом. Если развивается серьезная или угрожающая жизни реакция во время инфузии или в любое время после инфузии (например, бронхоспазм, ангиодистрофия, гипотензия, необходимость парентеральных вмешательств или анафилаксия), применение Вектибикса необходимо прекратить (смотрите раздел «Противопоказания» и «Побочные реакции»).
У пациентов, у которых развились инфузионные реакции легкой или средней степени тяжести (СТСАЕ v 4.0, 1 и 2 степень), должна быть уменьшена скорость инфузии. При всех последующих инфузиях также рекомендуется придерживаться более низкой скорости инфузии.
Сообщалось о реакциях гиперчувствительности, которые возникали более чем через 24 часа после инфузии, включая смертельный случай ангиодистрофии, которая произошла более чем через 24 часа после инфузии. Пациенты должны быть проинформированы о возможности начала поздней реакции, а также иметь контакты своего врача, чтобы сообщить о симптомах развившейся реакции гиперчувствительности.
Острая почечная недостаточность
Острая почечная недостаточность наблюдается у пациентов, у которых развивается тяжелая диарея и обезвоживание. Пациентам, страдающим тяжелой диареей, следует проконсультироваться с врачом.
Вектибикс в сочетании с химиотерапией, содержащей иринотекан, 5-фторурацил болюсно и лейковорин (IFL)
У пациентов, получающих Вектибикс в сочетании с режимом IFL [болюсно 5-фторурацил (500 мг/м2), лейковорин (20 мг/м2) и иринотекан (125 мг/м2)] отмечалась высокая частота тяжелой диареи (смотрите раздел «Побочные реакции»), поэтому следует избегать применения Вектибикса в сочетании с IFL (смотрите раздел «Взаимодействие с другими лекарственными средствами»).
Вектибикс в комбинации с бевацизумабом и химиотерапией
В рандомизированном открытом многоцентровом исследовании, в котором приняли участие 1053 пациентов, оценивалась эффективность применения химиотерапии на основе бевацизумаба и оксалиплатина или иринотекана с применением Вектибикса или без него при использовании в первой линии терапии при мКРР. У пациентов, получающих Вектибикс в сочетании с бевацизумабом и химиотерапией. Большая частота случаев легочной эмболии, инфекций (преимущественно дерматологического происхождения), диареи, дисбаланса электролитов, тошноты, рвоты и дегидратации наблюдались также в группах лечения с использованием Вектибикса в комбинации с бевацизумабом и химиотерапией. Дополнительный анализ данных эффективности в зависимости от статуса KRAS не идентифицировал подмножество пациентов, которые применяли Вектибикс в сочетании с оксалиплатином или химиотерапией на основе иринотекана и бевацизумаба.
Наблюдалась тенденция к ухудшению показателя выживаемости при применении Вектибикса в подклассе KRAS дикого типа в подгруппе бевацизумаба и оксалиплатина, а также в группе применения Вектибикса с бевацизумабом и иринотеканом, независимо от мутационного статуса KRAS. Поэтому Вектибикс не следует вводить в сочетании с химиотерапией на основе бевацизумаба (смотрите разделы «Взаимодействие с другими лекарственными средствами» и «Фармакодинамика»).
Вектибикс в сочетании с химиотерапией на основе оксалиплатина у пациентов с мКРР с мутантным типом RAS, или для которых RAS статус опухоли неизвестен
Комбинация Вектибикс с оксалиплатин-содержащей химиотерапией противопоказана для пациентов с мКРР с мутантным типом RAS или для которых RAS статус опухоли неизвестен (смотрите раздел «Способ применения и дозы» и «Фармакодинамика»).
При первичном анализе исследования (n = 1183, 656 пациентов с KRAS дикого типа (экзон 2) и 440 пациентов с мутациями KRAS), изучавшего эффективность панитумумаба в сочетании с 5-фторурацилом, лейковорином и оксалиплатином (FOLFOX) по сравнению только лишь с FOLFOX в качестве первой линии терапии мКРР, наблюдалось уменьшение времени выживаемости без прогрессирования и общей выживаемости у пациентов с мутациями KRAS, которые получали панитумумаб и FOLFOX (n = 221) по сравнению с только лишь FOLFOX (n = 219).
Предварительно запланированный ретроспективный анализ дополнительных мутаций RAS (KRAS [экзоны 3 и 4] или NRAS [экзоны 2, 3, 4]) у 641 пациента из 656 пациентов с диким типом KRAS (экзон 2) в опухоли выявили дополнительные мутации у 16 % (n = 108) пациентов. Сокращение ВБП и ОВ наблюдается у пациентов с мутантными опухолями RAS, которые получали панитумумаб и FOLFOX (n = 51) по сравнению с одним только FOLFOX (n = 57).
Статус RAS должен определяться в лаборатории с помощью валидированного метода (смотрите раздел «Способ применения и дозы»). Если Вектибикс будет применяться в комбинации с FOLFOX, тогда рекомендуется, чтобы мутационный статус определялся в лаборатории, которая участвует в Программе обеспечения внешнего качества RAS или статус дикого типа подтверждался в повторном тесте.
Офтальмологическая токсичность
Серьезные случаи кератита и язвенного кератита редко сообщались в постмаркетинговом периоде. Пациенты, имеющие признаки и симптомы, указывающие на кератит, как острый, так и ухудшение: воспаление глаз, слезотечение, светочувствительность, помутнение зрения, боль в глазах и/или покраснение глаз, должны незамедлительно обращаться к офтальмологу. Если диагноз язвенного кератита подтвержден, лечение Вектибиксом должно быть приостановлено или прекращено. Если диагностирован кератит, должны оцениваться польза и риск от продолжения лечения. Вектибикс следует использовать с осторожностью у пациентов с кератитом, язвенным кератитом или тяжелой сухостью глаз в анамнезе. Использование контактных линз также является фактором риска для развития кератита и язв.
Пациенты с функциональным статусом 2 по шкале ECOG, получавшие Вектибикс в сочетании с химиотерапией
Для пациентов с функциональным статусом 2 по шкале ECOG рекомендуется оценить баланс польза/риск до начала применения Вектибикса в сочетании с химиотерапией для лечения мКРР. Положительный баланс польза/риск не был зарегистрирован у пациентов функциональным статусом 2 по шкале ECOG.
Пожилые пациенты
Не наблюдалось каких-либо различий в безопасности или эффективности у пожилых пациентов (≥ 65 лет) при применении Вектибикс в качестве монотерапии. Однако отмечалось увеличение количества серьезных побочных реакций у пожилых пациентов, которые получали Вектибикс в сочетании с FOLFIRI или FOLFOX по сравнению с одной только химиотерапией (смотрите раздел «Побочные реакции»).
Прочие меры предосторожности
Препарат содержит 0,150 ммоль натрия (что соответствует 3,45 мг натрия) на мл концентрата. Это необходимо принимать во внимание пациентам, которые находятся на натрий-контролируемой диете.
Влияние на управление транспортными средствами и прочими механизмами
Если у пациентов во время лечения развиваются симптомы, которые оказывают влияние на орган зрения и/или на способность концентрироваться и реагировать, рекомендуется, чтобы они не водили или не использовали механизмы до тех пор, пока симптомы не исчезнут.
Флаконы
3 года.
Разведенный раствор
Вектибикс не содержит каких-либо противомикробных консервантов или бактериостатических агентов. Препарат должен быть использован сразу же после разведения. Если препарат не был использован сразу после разведения, пользователь несет ответственность за время и условия его хранения до следующего введения (не более 24 часов при температуре 2–8 °С). Не замораживать разведенный раствор.
Хранить при температуре от 2 °C до 8 °C.
Не замораживать.
Хранить в оригинальной упаковке для защиты от света.
Условия хранения разведенного раствора препарата смотрите в разделе «Срок годности».
Хранить в недоступном для детей месте.
Форма выпуска
Флакон из прозрачного стекла гидролитического класса I с эластомерной пробкой, алюминиевым колпачком и отламывающейся пластмассовой крышечкой типа «Flip off».
Один флакон содержит 100 мг панитумумаба в 5 мл концентрата для приготовления раствора для инфузий.
1 флакон в упаковке с инструкцией по медицинскому применению.
Отпускается по рецепту врача.
Выпуск партии
Amgen Europe B.V.
Минервум 7061
НЛ-4817 ЗК Бреда
Нидерланды
Владелец регистрационного удостоверения
Amgen Europe B.V.
Минервум 7061
НЛ-4817 ЗК Бреда
Нидерланды
Официальный представитель в Республике Беларусь
Представительство ООО «AlenMed Promotion» (Латвия) в Республике Беларусь
220020, Минск, пр. Победителей, 103, 7-й этаж, помещение 4
Тел: +375 17 308-73-84
Факс: +375 17 308-73-88
Следующая информация предназначена только для специалистов системы здравоохранения
Вектибикс предназначен только для однократного применения. Вектибикс должен быть разведен медицинским работником в 9 мг/мл (0,9 %) растворе хлорида натрия с использованием асептической техники. Не встряхивайте и сильно не взбалтывайте флакон. Вектибикс должен быть осмотрен визуально перед введением. Раствор должен быть бесцветным и может содержать полупрозрачные или белые видимые аморфные белковые частицы (которые могут быть удалены во время фильтрации). Не вводите Вектибикс, если его описание не соответствует указанному выше. Используйте гиподермальную иглу диаметром 21 калибр или меньше, введите необходимое количество Вектибикса в дозе 6 мг/кг. Не применяйте устройства без иглы (например, адаптер для флаконов) для извлечения содержимого флакона. Разведите в общем объеме 100 мл. Доза, которая превышает 1000 мг, должна быть разведена в 150 мл раствора хлорида натрия 9 мг/мл (0,9 %). Конечная концентрация не должна превышать 10 мг/мл. Разведенный раствор необходимо перемешать с помощью легкого покачивания, не трясите флакон. Уничтожьте флакон и любой раствор, который остался во флаконе, после однократного применения.
Линию для инфузии следует промывать раствором хлорида натрия до и после введения Вектибикса, чтобы избежать смешивания с другими лекарственными средствами или внутривенными растворами.
Вектибикс следует вводить в виде внутривенной инфузии с помощью инфузионного насоса в периферический зонд или постоянный катетер через встроенный фильтр 0,2 или 0,22 мкм с низкой степенью связывания белков. Рекомендуемое время инфузии составляет приблизительно 60 минут. Дозы выше чем 1000 мг следует вводить в течение примерно 90 минут.
Не наблюдается несовместимости между Вектибиксом и раствором хлорида натрия 9 мг/мл (0,9 %) в мешках из поливинилхлорида или полиолефина.
Вектибикс (20 мг/мл (100 мг/5 мл))
МНН: Панитумумаб
Производитель: Амджен Мэньюфэкчуринг Лимитед
Анатомо-терапевтическо-химическая классификация: Panitumumab
Номер регистрации в РК:
№ РК-ЛС-5№020049
Информация о регистрации в РК:
22.02.2018 — 22.02.2023
- Скачать инструкцию медикамента
Торговое название
Вектибикс
Международное непатентованное название
Панитумумаб
Лекарственная форма
Концентрат для приготовления раствора для инфузий 20 мг/мл (100 мг/5 мл, 400 мг/20 мл)
Состав
Один флакон содержит
активное вещество — панитумумаб 100 мг (5 мл) или 400 мг (20 мл),
вспомогательные вещества: натрия ацетата тригидрат, натрия хлорид, кислота уксусная ледяная (для регулирования pH), вода для инъекций.
Описание
Прозрачная, бесцветная жидкость, может содержать полупрозрачные или белые аморфные белковые частицы.
Фармакотерапевтическая группа
Противоопухолевые препараты. Противоопухолевые препараты другие. Моноклональные антитела. Панитумумаб.
Код АТХ L01XC08
Фармакологические свойства
Фармакокинетика
При назначении Вектибикса в качестве монотерапии или в комбинации с химиотерапией, фармакокинетика препарата носит нелинейный характер.
После однократного введения панитумумаба в виде 1-часовой инфузии, площадь под кривой «концентрация-время» (AUC) возрастала в большей степени, чем это характерно при дозопропорциональной зависимости, а клиренс препарата снижался с 30.6 до 4.6 мл/сут/кг при увеличении дозы от 0.75 до 9 мг/кг. Однако при введении панитумумаба в дозах свыше 2 мг/кг, характер увеличения AUC был близок к дозопропорциональной зависимости.
При соблюдении рекомендуемого режима дозирования (6 мг/кг 1 раз в 2 недели в виде 1-часовой инфузии), равновесные концентрации панитумумаба достигались к третьей инфузии при средних значениях максимальной (± стандартное отклонение) и минимальной концентраций 213 ± 59 и 39 ± 14 мкг/мл, соответственно. Среднее значение (± стандартное отклонение) AUC0-τ и клиренса были равны 1306 ± 374 мкг•сут/мл и 4.9 ± 1.4 мл/кг/сут, соответственно. Период полувыведения препарата составил приблизительно 7.5 суток (разброс: от 3.6 до 10.9 суток).
Была проведена совокупность анализов фармакокинетики для изучения потенциального влияния выбранных категорий на фармакокинетику панитумумаба.
Результаты анализа фармакокинетики в отдельных группах пациентов показали, что возраст (21-88 лет), пол, раса, функция печени и почек, применение сопутствующих химиотерапевтических препаратов, интенсивность иммуногистохимических реакций с рецепторами ЭФР (интенсивность окрашивания мембран (1+, 2+, 3+)) в опухолевых клетках, не оказывают явного влияния на фармакокинетику панитумумаба.
Исследования фармакокинетики панитумумаба у пациентов с нарушением функций почек или печени не проводились.
Фармакодинамика
Механизм действия
Панитумумаб представляет собой рекомбинантное, полностью человеческое моноклональное антитело IgG2, обладающее высоким сродством и специфичностью к рецепторам эпидермального фактора роста человека (ЭФР). Рецептор ЭФР – это трансмембранный гликопротеин из семейства рецепторов тирозинкиназ I типа, которое включает также HER1/c-ErbB-1, HER2, HER3 и HER4. Рецептор ЭФР стимулирует рост нормальных эпителиальных клеток, включая клетки кожи и волосяных фолликулов, и экспрессируется на различных типах опухолевых клеток.
Панитумумаб связывается с лиганд-связывающим доменом рецептора ЭФР и ингибирует процесс аутофосфорилирования, который индуцируется всеми известными лигандами рецептора ЭФР. Связывание панитумумаба с рецептором ЭФР приводит к интернализации рецептора, ингибированию процессов клеточного роста, индукции апоптоза и уменьшению продукции интерлейкина-8 и фактора роста эндотелия сосудов.
Гены KRAS (гомолог вирусного онкогена крысиной саркомы Кирстена 2) и NRAS (гомолог нейробластомы вирусного онкогена RAS) относятся к семейству онкогенов RAS. Гены KRAS и NRAS кодируют небольшой гуанозинтрифосфат-связывающий белок, который участвует в трансдукции сигнала. KRAS и NRAS активируются различными сигналами, в том числе и от рецептора ЭФР, и, в свою очередь, стимулирует синтез других внутриклеточных белков, вовлеченных в процессы клеточной пролиферации, выживаемости и ангиогенеза.
Активирующие мутации генов RAS часто происходят в различных опухолевых клетках человека и играют определенную роль, как в процессе онкогенеза, так и в прогрессии опухоли.
Фармакодинамические эффекты
Результаты in vitro анализов и эксперименты на животных in vivo показали, что панитумумаб ингибирует рост и уменьшает выживаемость опухолевых клеток, экспрессирующих рецептор ЭФР. Противоопухолевое действие панитумумаба на ксенотрансплантант человеческой опухоли, не экспрессирующей рецептор ЭФР, описано не было. В экспериментах на животных, добавление панитумумаба к режиму облучения, химиотерапии или другой таргетной терапии, увеличивало противоопухолевый эффект по сравнению с только режимом облучения, химиотерапии или таргетной терапии.
Дерматологические реакции (включая воздействие на ногти), наблюдавшиеся у пациентов, получавших Вектибикс или другие ингибиторы рецепторов ЭФР, являются известными фармакологическими эффектами данных препаратов (см. разделы «Способ применения и дозы» и «Побочные действия»).
Иммуногенность
Как и все терапевтические протеины, панитумумаб обладает потенциальной иммуногенностью. Продукцию нейтрализующих антител к панитумумабу оценивали с помощью двух различных скрининговых систем иммуноанализа для определения связанных антител к панитумумабу (ИФА — иммуноферментный анализ, который позволяет определить высокоаффинные антитела, и Биосенсор, позволяющий определить высоко- и низкоаффинные антитела). Пациентам, чья сыворотка оказывалась положительной на наличие антител в любом скрининговом иммуноанализе, проводился также биологический тест in vitro для обнаружения нейтрализующих антител.
В качестве монотерапии:
-
Частота выявления связанных антител (за исключением случаев выявления антител до введения препарата и временно положительных) составляла < 1%, как было установлено с помощью анализа ИФА и 3.8%, как было установлено с помощью иммунологического анализа Биокор;
-
Частота выявления нейтрализующих антител (за исключением случаев выявления антител до введения препарата и временно положительных) составляла < 1%;
-
При сравнении с пациентами, у которых антитела не вырабатывались, взаимосвязь между наличием нейтрализующих антител к панитумумабу и изменениями фармакокинетических параметров, эффективности и безопасности препарата не отмечена.
В комбинации с режимами химиотерапии на основе иринотекана или оксалиплатина:
-
Частота выявления связанных антител (за исключением случаев выявления антител до введения препарата и временно положительных) составляла 1.0%, как было установлено с помощью анализа ИФА и < 1% как было установлено с помощью анализа Биокор;
-
Частота выявления нейтрализующих антител (за исключением случаев выявления антител до введения препарата и временно положительных) составляла < 1%;
-
Не было обнаружено никаких доказательств изменения профиля безопасности у пациентов с положительным результатом теста на антитела к Вектибиксу.
Определение антител зависит от чувствительности и специфичности используемого метода. На положительный результат по определению антител могут оказать влияние различные факторы, включая метод проведения анализа, методику отбора образцов, время забора проб, прием сопутствующих препаратов и характер основного заболевания, поэтому сравнение частоты возникновения антител к панитумумабу с данным показателем для других препаратов может быть недостоверным.
Клиническая эффективность в качестве монотерапии
В клиническом исследовании, применение Вектибикса у пациентов с метастатическим колоректальным раком (мКРР) с диким типом гена KRAS, у которых наблюдалась прогрессия заболевания на фоне или после предшествующих курсов химиотерапии на основе фторпиримидина, оксалиплатина или иринотекана, приводит к значительному увеличению выживаемости без прогрессирования (ВБП). У пациентов с мутантным типом гена KRAS не было отмечено положительного влияния на ВБП.
Эффективность Вектибикса также оценивалась в открытом клиническом исследовании у пациентов с мКРР с диким типом гена KRAS (экзон 2). Всего 1010 пациентов, резистентных к химиотерапии, были рандомизированы в соотношении 1:1 на получение Вектибикса и цетуксимаба для определения отсутствия превосходства цетуксимаба над Вектибиксом. Первичной конечной точкой была общая выживаемость (ОВ). Вторичные ключевые точки включали выживание без прогрессирования (ВБП) и частоту объективного ответа (ЧОО).
Первичная конечная точка показала преимущество общей выживаемости (номинальное значение ZPC -3.19, p=0.0007) в пользу Вектибикса. Ожидаемый эффект лечения цетуксимабом по ОВ, сохраняемый Вектибиксом, был 106% (95% ДИ: 82%, 130%).
Клиническая эффективность в комбинации с химиотерапией
У пациентов с мКРР с диким типом генов RAS, панитумумаб в комбинации с химиотерапией (FOLFOX или FOLFIRI) показал преимущество в ВБП, ОВ и ЧОО по сравнению с монотерапией FOLFIRI.
Для пациентов с дополнительными мутациями RAS после KRAS экзона 2, не было продемонстрировано пользы от добавления панитумумаба к FOLFIRI и продемонстрирован негативный эффект добавления панитумумаба к FOLFOX у этих пациентов. Мутации BRAF в экзоне 15 предопределяли негативный исход лечения. Мутации BRAF не предопределяли исход лечения панитумумаба в комбинации с FOLFOX или FOLFIRI.
Терапия первой линии с FOLFOX
В клиническом исследовании, применение Вектибикса в комбинации с режимом химиотерапии на основе оксалиплатина, фторурацила (5-ФУ) и кальция фолината (FOLFOX), у пациентов с метастатическим колоректальным раком (мКРР) с диким типом гена KRAS, приводит к значительному увеличению выживаемости без прогрессирования (ВБП) по сравнению с монотерапией FOLFOX. Другие ключевые конечные точки включали: общую выживаемость (ОВ), частоту объективного ответа (ЧОО), время до прогрессирования (ВДП) и продолжительность ответа.
Был проведен предопределенный ретроспективный анализ 641 из 656 пациентов с мКРР с диким типом гена KRAS (экзон 2). Первичной целью этого анализа было изучение эффекта лечения панитумумабом в комбинации с FOLFOX по сравнению с монотерапией FOLFOX у пациентов с диким типом генов RAS (KRAS и NRAS экзоны 2, 3 и 4) или диким типом генов RAS и BRAF (KRAS и NRAS экзоны 2, 3 и 4 и BRAF экзон 15). В данном анализе частота дополнительных мутаций RAS в диком типе гена KRAS (экзон 2) была примерно 16%.
Последующий предопределенный анализ определил (n = 7) дополнительные мутации KRAS и NRAS в экзоне 3 (кодон 59). Анализ с включением кодона 59, также показал прогнозируемый негативный исход лечения панитумумабом.
Комбинация с FOLFIRI
В клиническом исследовании, эффективность Вектибикса во второй линии в комбинации с иринотеканом, 5-фторурацилом (5-ФУ) и кальция фолинатом (FOLFIRI) оценивали по ключевым конечным точкам — общая выживаемость (ОВ) и выживаемость без прогрессирования (ВБП). Другие ключевые конечные точки включали: частоту объективного ответа (ЧОО), время до ответа (ВДО), время до прогрессирования (ВДП) и продолжительность ответа.
Был проведен предопределенный ретроспективный анализ 586 пациентов из 597 пациентов с мКРР с диким типом гена KRAS (экзон 2) с исследованием образцов опухолей этих пациентов на дополнительные мутации RAS и BRAF, как было описано ранее. Установление мутаций RAS/BRAF было проведено у 85% пациентов (1014 из 1186 рандомизированных пациентов). Встречаемость этих дополнительных мутаций RAS (KRAS экзоны 3, 4 и NRAS экзоны 2, 3, 4) в популяции с диким типом гена KRAS (экзон 2), была примерно 19%. Встречаемость мутаций в BRAF экзоне 15, в популяции с диким типом гена KRAS (экзон 2), была примерно 8%.
Эффективность Вектибикса в терапии первой линии в комбинации с FOLFIRI, была оценена в не сравнительном исследовании у 154 пациентов с первичной конечной точкой — частота объективного ответа (ЧОО). Другие ключевые точки включали выживание без прогрессирования (ВБП), время до ответа, время до прогрессии (ВДП) и продолжительность ответа.
Был проведен предопределенный ретроспективный анализ 143 из 154 пациентов с мКРР с диким типом гена KRAS (экзон 2) и образцы опухоли этих пациентов были протестированы на дополнительные мутации RAS. Встречаемость этих дополнительных мутаций RAS (KRAS экзоны 3, 4 и NRAS экзоны 2, 3, 4) в диком типе KRAS (экзон 2) была примерно 10%.
В данном анализе мутации BRAF предопределяли негативный исход лечения, связанный с уменьшением ВБП и ОВ у пациентов с мКРР с диким типом гена KRAS в экзоне 2, независимо от группы лечения. Данные также показывают, что мутации BRAF не предопределяют дополнительную пользу эффекта лечения панитумумабом. У пациентов с мКРР с диким типом генов RAS, было показано преимущество в ВБП, ОВ и ЧОО в группе пациентов, получающих панитумумаб в комбинации с FOLFIRI по сравнению с монотерапией FOLFIRI. Для пациентов с дополнительными мутациями RAS после KRAS экзона 2, не было продемонстрировано пользы от добавления панитумумаба к FOLFIRI.
Терапия первой линии в комбинации с химиотерапией на основе бевацизумаба и оксалиплатина или иринотекана
У пациентов с мКРР с KRAS дикого типа, было продемонстрировано статистически значимое увеличение ВБП в группе пациентов, получавших Вектибикс. Применение панитумумаба в комбинации с бевацизумабом с химиотерапией на основе оксалиплатина или иринотекана связано с неблагоприятным соотношением польза-риск независимо от статуса мутации по гену KRAS.
Показания к применению
Вектибикс показан для лечения взрослых пациентов с метастатическим колоректальным раком (мКРР) с диким типом генов RAS:
-
в первой линии терапии в комбинации с режимом FOLFOX или FOLFIRI
-
в терапии второй линии в комбинации с режимом FOLFIRI для пациентов, получавших химиотерапию первой линии на основе фторпиримидина (без иринотекана)
-
в качестве монотерапии после неудачи химиотерапии на основе фторпиримидина, оксалиплатина или иринотекана
Способ применения и дозы
Лечение препаратом Вектибикс должно проводиться врачом, имеющим опыт назначения противоопухолевых препаратов. Необходимо проводить определение статуса генов RAS (KRAS и NRAS) перед началом лечения препаратом Вектибикс. Определение статуса мутации должно проводиться опытными врачами-лаборантами с использованием валидированных методов для определения мутаций KRAS (экзоны 2, 3 и 4) и NRAS (экзоны 2, 3 и 4).
Режим дозирования
Рекомендуемая доза Вектибикса составляет 6 мг/кг массы тела 1 раз в 2 недели. Перед проведением инфузии, Вектибикс разводят в 9 мг/мл (0.9%) растворе натрия хлорида для инъекций, до получения концентрации не более 10 мг/мл.
Особые группы пациентов
Безопасность и эффективность Вектибикса не оценивали у пациентов с нарушениями функций почек или печени.
В случае назначения препарата людям пожилого возраста, коррекция дозы не требуется (клинические данные отсутствуют).
Дети
Вектибикс не показан для лечения колоректального рака у детей.
Дерматологические реакции
При развитии дерматологических реакций 3 или выше степени тяжести (CTCAE v 4.0) или непереносимой дерматологической реакции, рекомендуется ввести следующее изменение дозы:
|
Возникновение кожных симптомов: ≥ степени 31 |
Введение препарата Вектибикс |
Результат |
Регулировка дозы |
|
Первый случай возникновения |
Отмена 1 или 2 доз |
Снижение интенсивности реакции (< 3 степени) |
Возобновление инфузии в дозе, составляющей 100% от первоначальной дозы |
|
Улучшения не наступило |
Прекращение |
||
|
Второй случай возникновения |
Отмена 1 или 2 доз |
Снижение интенсивности реакции (< 3 степени) |
Возобновление инфузии в дозе, составляющей 80% от первоначальной дозы |
|
Улучшения не наступило |
Прекращение |
||
|
Третий случай возникновения |
Отмена 1 или 2 доз |
Снижение интенсивности реакции (< 3 степени) |
Возобновление инфузии в дозе, составляющей 60% от первоначальной дозы |
|
Улучшения не наступило |
Прекращение |
||
|
Четвертый случай возникновения |
Прекращение |
— |
— |
1 Реакции 3 степени и выше считаются тяжелыми или жизнеугрожающими.
Инструкции по приготовлению и введению препарата
Перед проведением инфузии Вектибикс разводят в 9 мг/мл (0.9%) растворе натрия хлорида для инъекций в асептических условиях. Не рекомендуется встряхивать или сильно взбалтывать флакон. Не следует вводить препарат, если наблюдается изменение цвета содержимого флакона. Из флакона с препаратом отбирают необходимое количество Вектибикса для получения дозы 6 мг/кг, которое затем разводят в общем объеме 100 мл. Конечная концентрация не должна превышать 10 мг/мл. Дозы выше, чем 1000 мг необходимо разводить в 150 мл 9 мг/мл (0.9%) раствора натрия хлорида для инъекций. Полученный раствор перемешивают осторожным переворачиванием флакона, не встряхивают.
Не было описано различий между использованием для разведения препарата Вектибикс 9 мг/мл (0.9%) раствора натрия хлорида для инъекций в пакетах из поливинилхлорида или полиолефиновых пакетах.
Любой неиспользованный медицинский продукт или использованные материалы, должны быть утилизированы в соответствии с локальными требованиями.
Вектибикс должен вводиться внутривенно с помощью инфузионного насоса в периферический зонд или постоянный катетер через встроенный фильтр 0.2 или 0.22 мкм с низкой степенью связывания белков. Рекомендуемая длительность инфузии составляет приблизительно 60 минут. Если первая инфузия переносится хорошо, последующие инфузии могут проводиться в течение 30-60 минут. Длительность введения препарата в дозах свыше 1000 мг должна составлять приблизительно 90 минут.
До и после введения Вектибикса, инфузионную систему необходимо промыть раствором натрия хлорида, чтобы избежать смешивания Вектибикса с другими лекарственными препаратами или растворами для внутривенно введения.
В случае возникновения инфузионных реакций может потребоваться снижение скорости инфузии препарата Вектибикс.
Не вводить Вектибикс струйно или болюсно.
Побочные действия
Наиболее частыми нежелательными реакциями при применении Вектибикса в режиме монотерапии и в комбинации с химиотерапией, были дерматологические реакции, наблюдавшиеся приблизительно в 93% случаев. Эти реакции обусловлены фармакологическими свойствами препарата Вектибикс и обычно имеют легкую или среднюю степень тяжести; только в 25% случаев дерматологические реакции носят тяжелый характер (степень тяжести 3 по классификации NCI-CTC) и < 1% — жизнеугрожающие (степень тяжести 4 по NCI-CTC). Клиническое ведение кожных реакций, включая рекомендации по коррекции дозы, приведены в разделе «Особые указания».
Очень частыми нежелательными реакциями, возникавшими у ≥ 20% пациентов, были расстройства желудочно-кишечного тракта [диарея (50%), тошнота (41%), рвота (27%), запор (23%) и боль в животе (23%)]; общие реакции [повышенная утомляемость (37%), пирексия (20%)]; нарушения обмена веществ и питания [анорексия (27%)]; инфекции и инвазии [паронихия (20%)]; и патология кожи и подкожной ткани [сыпь (45%), акнеформный дерматит (39%), зуд (35%), эритема (30%) и сухость кожи (22%)].
Ниже приведены данные по нежелательным реакциям, наблюдавшимся в клинических исследованиях у пациентов с мКРР, получавших панитумумаб в качестве монотерапии или в комбинации с химиотерапией (n=2588) и случаи, о которых сообщалось при применении препарата в рутинной клинической практике.
Профиль безопасности Вектибикса в комбинации с химиотерапией включает зарегистрированные нежелательные реакции Вектибикса (в качестве монотерапии) и токсичности базовой химиотерапии. Не наблюдалось новых случаев токсичности, а также усугубления ранее указанных случаев возникновения токсичности, кроме ожидаемых аддитивных эффектов. Дерматологические реакции были наиболее частыми нежелательными реакциями, наблюдаемыми у пациентов, принимающих панитумумаб в комбинации с химиотерапией. Другие нежелательные реакции, чаще всего наблюдаемые у пациентов, получавших препарат в качестве монотерапии, включали гипомагниемию, диарею и стоматит. Эти нежелательные реакции в отдельных случаях требовали отмены Вектибикса или химиотерапии.
Частота возникновения нежелательных реакций определена следующим образом: очень часто (≥ 1/10), часто (от ≥ 1/100 до < 1/10), редко (≥ 1/1000 до < 1/100), очень редко (≥1/10,000 до <1/1000) и частота неизвестна (не может быть оценена по имеющимся данным).
Очень часто
-
паронихия1
-
анемия
-
гипокалиемия, анорексия, гипомагниемия
-
бессонница
-
конъюнктивит
-
одышка, кашель
-
диарея1, тошнота, рвота, боль в животе, стоматит, запор
-
акнеформный дерматит, сыпь1,2, эритема, кожный зуд, сухость кожи, кожные трещины, угревая сыпь, алопеция
-
боли в спине
-
повышенная утомляемость, пирексия, астения, воспаление слизистой оболочки, периферические отеки
-
снижение веса
Часто
-
пустулезная сыпь, целлюлит1, инфекции мочевыводящих путей, фолликулит, местная инфекция
-
лейкопения
-
гиперчувствительность1
-
гипокальциемия, дегидратация, гипергликемия, гипофосфатемия
-
чувство страха, головная боль, головокружение
-
блефарит, усиление роста ресниц, повышенное слезотечение, гиперемия глазного яблока, сухость глаз, зуд глаз, раздражение глаз
-
тахикардия
-
тромбоз глубоких вен, гипотензия, гипертензия, приливы
-
эмболия легочной артерии, носовые кровотечения
-
ректальное кровотечение, сухость слизистой ротовой области, диспепсия, афтозный стоматит, хейлит, гастроэзофагеальная рефлюксная болезнь
-
синдром ладонно-подошвенной эритродизестезии, кожные язвы, шелушение кожи, гипертрихоз, онихоклазия, заболевания ногтей, гипергидроз, дерматит
-
боль в конечностях
-
боль в груди, боль, озноб
-
снижение уровня магния в крови
Редко
-
инфекции глаз, инфекции век, раздражение глазного века, кератит1
-
цианоз
-
бронхоспазм, сухость слизистой оболочки носа
-
трещины на губах, сухость губ
-
ангионевротический отек1, гирсутизм, вросший ноготь, онихолизис
-
инфузионные реакции1
Очень редко
-
анафилактические реакции1
-
язвенный кератит1
-
некроз кожи1
-
синдром Стивенса-Джонсона1
-
токсический эпидермальный некролиз1
Частота неизвестна
-
интерстициальные заболевания легких3
1 см. раздел «Описание отдельных нежелательных реакций», приведенный ниже.
2 в основном сыпь включает кожную токсичность, шелушение кожи, эксфолиативную сыпь, папулезную сыпь, зудящую сыпь, эритематозную сыпь, генерализованную сыпь, макулезную сыпь, макулопапулезную сыпь, повреждения кожи.
3 см. раздел «Особые указания»
Описание отдельных нежелательных реакций
Расстройства пищеварительной системы
В большинстве случаев сообщалось о диарее легкой или умеренной степеней тяжести. Сообщалось о тяжелых случаях диареи (степени тяжести 3 и 4 по NCI-CTC) у 2% пациентов, получавших Вектибикс в качестве монотерапии и у 17% пациентов, получавших Вектибикс в комбинации с химиотерапией.
Сообщалось о развитии острой почечной недостаточности на фоне диареи тяжелой степени и дегидратации (см. раздел «Особые указания»).
Инфузионные реакции
В клинических исследованиях монотерапии мКРР (n=2588), инфузионные реакции (развивающиеся в течение 24 ч с момента первого введения препарата) наблюдались приблизительно у 4% пациентов, получавших Вектибикс, из которых < 1% были тяжелыми (степени тяжести 3 и 4 по NCI-CTC).
Сообщалось о развитии летального ангиневротического отека у пациента с рецидивирующим метастатическим плоскоклеточным раком головы и шеи, получавшего лечение Вектибиксом во время клинического исследования. Фатальное осложнение развилось при возобновлении терапии после предшествующего эпизода развития ангионевротического отека; обе реакции развились более чем через 24 часа после введения препарата. О реакциях гиперчувствительности, развивающихся более чем через 24 часа после инфузии, также сообщалось и при применении в рутинной клинической практике.
Подробности клинического ведения инфузионных реакций указаны в разделе «Особые указания».
Нарушения со стороны кожи и подкожно жировой клетчатки
Кожная сыпь наиболее часто локализовалась на лице, верхней части грудной клетки и спине, однако в некоторых случаях распространялась и на конечности. Как следствие тяжелых дерматологических реакций, отмечали также развитие инфекционных осложнений, таких как сепсис, в редких случаях, с летальным исходом, целлюлит и местные абсцессы, требующие хирургического вмешательства и дренирования. Медиана времени до развития первых проявлений дерматологических реакций составила 10 дней, а медиана времени до их разрешения с момента последнего введения Вектибикса – 28 дней.
Паронихиальное воспаление сопровождалось припухлостью латеральных ногтевых валиков пальцев рук и ног.
Дерматологические реакции (включая воздействие на ногти), наблюдавшиеся у пациентов получавших Вектибикс или другие ингибиторы рецепторов ЭФР, являются известными фармакологическими эффектами данных препаратов.
Во всех клинических исследованиях кожные реакции наблюдались у 93% пациентов, получавших Вектибикс в качестве монотерапии или в комбинации с химиотерапией (n=2588). В основном это были сыпь и угревидный дерматит почти всегда легкого или умеренного характера. Сообщалось о тяжелых кожных реакциях (степень тяжести 3 по NCI-CTC) у 34% пациентов и жизнеугрожающих кожных реакциях (степень тяжести 4 по NCI-CTC) у < 1% пациентов, получавших Вектибикс в комбинации с химиотерапией (n=1536). У пациентов, получавших Вектибикс, наблюдались жизнеугрожающие и смертельные осложнения, включая некротизирующий фасциит и сепсис (см. раздел «Особые указания»).
Подробности клинического ведения дерматологических реакций, включая рекомендации по изменению дозы, см. разделы «Особые указания» и «Способ применения и дозы».
При применении в рутинной клинической практике сообщалось о редких случаях развития некрозов кожи, синдрома Стивенса-Джонсона и токсического эпидермального некролиза (см. раздел «Особые указания»).
Офтальмологическая токсичность
Несерьезные случаи кератитов наблюдались у 0.2 – 0.7% пациентов, участвовавших в клинических исследованиях. При применении в рутинной клинической практике сообщалось о серьезных случаях кератитов и/или язвенных кератитов (см. раздел «Особые указания»).
Дети
Нет каких-либо данных о применении препарата Вектибикс у детей, поэтому Вектибикс нельзя использовать для лечения пациентов моложе 18 лет.
Другие особые популяции
У пациентов пожилого возраста (≥ 65 лет), получавших монотерапию Вектибиксом, не наблюдалось различий в безопасности и эффективности. Однако было зарегистрировано увеличение числа серьезных нежелательных реакций у пожилых пациентов, получавших терапию Вектибиксом в комбинации с FOLFIRI (45% относительно 37%) или FOLFOX (52% относительно 37%) по сравнению с применением только химиотерапии (см. раздел «Особые указания»). Наиболее часто развивающейся серьезной нежелательной реакцией у пациентов, принимающих Вектибикс в комбинации с FOLFOX или FOLFIRI, была диарея; дегидратация и тромбоэмболия легочной артерии были отмечены у пациентов, принимающих Вектибикс в комбинации с FOLFIRI.
Нет данных, касающихся безопасности применения Вектибикса пациентами с почечной и печеночной недостаточностью.
Противопоказания
-
серьезные или жизнеугрожающие реакции гиперчувствительности к любому из компонентов препарата в анамнезе
-
интерстициальный пневмонит или фиброз легких
-
в комбинации с режимом химиотерапии на основе оксалиплатина у пациентов с мКРР с мутантным типом генов RAS или у пациентов с мКРР с неуточненным типом генов RAS (см. раздел «Особые указания»)
Лекарственные взаимодействия
Исследования о взаимодействии Вектибикса и иринотекана у пациентов с мКРР показали, что фармакокинетические свойства иринотекана и его активного метаболита SN-38, не изменяются при одновременном введении препаратов. Результаты перекрестного сравнительного исследования показали, что режимы, включающие иринотекан (ИФЛ или FOLFIRI), не влияют на фармакокинетические свойства панитумумаба.
Не рекомендуется сочетанное назначение Вектибикса с режимом химиотерапии по схеме ИФЛ и с режимами химиотерапии, включающими бевацизумаб. При назначении панитумумаба в комбинации с ИФЛ, наблюдалось высокая частота диареи тяжелой степени и увеличивалась частота токсичности и летальных исходов при назначении панитумумаба в комбинации с режимом химиотерапии, включавшей бевацизумаб (см. разделы «Особые указания» и «Фармакодинамика»).
Вектибикс не следует назначать в комбинации с химиотерапией, содержащей оксалиплатин, пациентам с мКРР с мутантными генами RAS, или в случае неуточненного статуса RAS. В ходе клинического исследования у пациентов с мутантным типом гена RAS, получавших панитумумаб и FOLFOX, отмечалось ухудшение показателей выживаемости без прогрессирования и общей выживаемости (см. разделы «Особые указания» и «Фармакодинамика»).
Особые указания
Нежелательные реакции со стороны мягких тканей и кожных покровов
Дерматологические реакции – класс-эффект ингибиторов рецептора ЭФР, обусловленный фармакологическими свойствами – легкой и умеренной степеней наблюдались практически у всех пациентов (приблизительно 90%), получавших Вектибикс. Сообщалось о тяжелых кожных реакциях (степень тяжести 3 по NCI-CTC) у 34% пациентов и жизнеугрожающих кожных реакциях (степень тяжести 4 по NCI-CTC) у < 1% пациентов, получавших Вектибикс в комбинации с химиотерапией (n=1536) (см. раздел «Побочные действия»). В случае развития тяжелой дерматологической реакции (≥ степени 3) может потребоваться коррекция дозы препарата Вектибикса (см. раздел «Способ применения и дозы»).
Сообщалось о развитии тяжелых дерматологических реакций (включая стоматиты), инфекционных осложнений, включая сепсис и некротизирующий фасциит, в редких случаях приводящих к летальному исходу, и местных абсцессах, требующих оперативного вмешательства. Пациенты, у которых на фоне лечения Вектибиксом развивались тяжелые дерматологические реакции или реакции со стороны мягких тканей, или ухудшалось течение дерматологических реакций, должны наблюдаться на предмет развития воспалительных или инфекционных осложнений (включая целлюлит и некротизирующий фасциит); при необходимости таким пациентам следует назначить соответствующее лечение. У пациентов, получавших Вектибикс, наблюдались жизнеугрожающие и смертельные осложнения, включая некротизирующий фасциит и сепсис. При применении в рутинной клинической практике у пациентов, получавших Вектибикс, наблюдались редкие случаи развития синдрома Стивенса-Джонсона и токсического эпидермального некролиза. В случае возникновения нежелательных реакций со стороны мягких тканей или кожных покровов, связанных с тяжелыми или жизнеугрожающими воспалительными или инфекционными осложнениями, необходимо отложить или отменить лечение Вектибиксом.
Лечение дерматологических реакций должно быть основано на тяжести проявлений и может включать в себя увлажняющие, солнцезащитные средства (солнцезащитный фильтр > 15 УФА и УФВ), а также крема, содержащие стероиды (процент гидрокортизона не выше 1%) для применения на пораженных участках и/или пероральные антибиотики. Также, пациентам с признаками сыпи/дерматологической токсичности, рекомендуется использовать солнцезащитные средства и головные уборы, ограничить пребывание на солнце, поскольку солнечный свет может усилить любые возможные кожные реакции.
Профилактический уход за кожей включает в себя увлажняющие, солнцезащитные средства (солнцезащитный фильтр > 15 УФА и УФВ), крема, содержащие стероиды (процент гидрокортизона не выше 1%) и пероральные антибиотики (например, доксициклин), используемые при лечении дерматологических реакций. Во время проведения лечения пациентам следует наносить увлажняющие и солнцезащитные средства на лицо, руки, ноги, шею, спину и грудь каждое утро, а на ночь наносить крем, содержащий стероид на лицо, руки, ноги, шею, спину и грудь.
Осложнения со стороны легких
Пациенты с интерстициальными заболеваниями или фиброзом легких в анамнезе, не включались в клинические исследования. Случаи интерстициальных заболеваний легких, с летальными исходами и без, возникали, в основном, у японской популяции. При возникновении или ухудшении легочных симптомов лечение Вектибиксом должно быть приостановлено и выявленные симптомы незамедлительно и тщательно изучены. При диагностировании интерстициальных заболеваний легких, Вектибикс следует временно отменить и назначить пациенту соответствующее лечение. У пациентов с интерстициальным пневмонитом или легочным фиброзом в анамнезе, или признаками интерстициального пневмонита или легочного фиброза, необходимо оценить вероятную пользу применения препарата и риск развития осложнений со стороны легких.
Нарушения электролитного баланса
У некоторых пациентов отмечалось прогрессивное снижение сывороточных концентраций магния, приводившее к тяжелой (степень тяжести 4) гипомагниемии. Необходим периодический мониторинг состояния пациентов на предмет развития гипомагниемии и сопутствующей гипокальциемии перед началом лечения Вектибиксом и, периодически, в течение 8 недель после его окончания (см. раздел «Побочные действия»). При необходимости, рекомендован прием препаратов магния.
Также отмечались нарушения баланса других электролитов, включая гипокалиемию. Рекомендуется проводить указанный выше мониторинг и соответствующее адекватное поддержание этих электролитов.
Инфузионные реакции
Во всех клинических исследованиях монотерапии и комбинированной терапии мКРР (n=2588), инфузионные реакции (возникавшие в течение 24 часов после инфузии) отмечались у 4% пациентов, получавших Вектибикс, из которых < 1% были тяжелыми (степени тяжести 3 и 4 по NCI-CTC).
При применении в рутинной клинической практике сообщалось о серьезных инфузионных реакциях, включая редкие сообщения о летальных исходах. В случае возникновения тяжелой или жизнеугрожающей реакции во время или после инфузии [например, при возникновении бронхоспазма, ангионевротического отека, гипотензии с необходимостью парентерального применения препаратов или анафилаксии] прием Вектибикса следует временно прекратить.
У пациентов с легкими или умеренными (степени тяжести 1 и 2 по CTCAE v 4.0) инфузионными реакциями, следует уменьшить скорость инфузии на протяжении всей инфузии. Рекомендуется сохранять сниженную скорость инфузии в ходе всех последующих инфузий.
Сообщалось о реакциях гиперчувствительности, возникавших более чем через 24 часа после инфузии, включая ангионевротический отек со смертельным исходом, развившийся более чем через 24 часа после инфузии. Следует предупредить пациентов о возможности позднего развития реакции и проинструктировать о необходимости обращаться к своему лечащему врачу в случае возникновения симптомов реакции гиперчувствительности.
Острая почечная недостаточность
Острая почечная недостаточность была отмечена у пациентов с тяжелыми диареей и дегидратацией. Пациенты с тяжелой диареей должны быть проинструктированы о необходимости незамедлительного обращения к врачу.
Применение Вектибикса в комбинации с режимом химиотерапии на основе иринотекана, 5-фторурацила (болюсно) и кальция фолината (ИФЛ)
У пациентов принимающих Вектибикс в комбинации с режимом химиотерапии на основе ИФЛ [болюсно 5-фторурацил (500 мг/м2), кальция фолинат (20 мг/м2) и иринотекан (125 мг/м2)] наблюдалась высокая частота возникновения диареи тяжелой степени. В связи с этим, необходимо избегать применения Вектибикса в комбинации с ИФЛ.
Применение Вектибикса в комбинации с режимом химиотерапии на основе бевацизумаба
В клиническом исследовании при применении Вектибикса в комбинации с режимом химиотерапии на основе бевацизумаба, наблюдалось сокращение выживаемости без прогрессирования и увеличение летальных исходов. Также при применении Вектибикса в комбинации с режимом химиотерапии на основе бевацизумаба, увеличивалась частота возникновения легочной эмболии, инфекционных осложнений (в основном дерматологических), диареи, нарушений электролитого баланса, тошноты, рвоты и дегидратации. При применении Вектибикса в комбинации с режимом химиотерапии на основе бевацизумаба и оксалиплатина, наблюдалась тенденция к снижению выживаемости у пациентов с диким типом гена KRAS; при применении Вектибикса в комбинации с режимом химиотерапии на основе бевацизумаба и иринотекана также наблюдалась тенденция к ухудшению выживаемости у пациентов с мКРР, независимо от статуса мутации гена KRAS. Поэтому, Вектибикс не должен применяться в комбинации с режимом химиотерапии на основе бевацизумаба (см. раздел «Лекарственные взаимодействия»).
Вектибикс в комбинации с режимом химиотерапии на основе оксалиплатина у пациентов с мКРР с мутантным типом генов RAS или неуточненным статусом RAS опухоли
Вектибикс не следует назначать в комбинации с режимом химиотерапии на основе оксалиплатина пациентам с мКРР с мутантными генами RAS или в случае неуточненного статуса RAS опухоли (см. разделы «Противопоказания» и «Фармакологические свойства»). В первичном анализе исследования отмечалось значительное сокращение выживаемости без прогрессирования (ВБП) и уменьшение общего времени выживаемости (ОВ) у пациентов с мутантным геном KRAS, получавших панитумумаб и FOLFOX (n=221) и только FOLFOX (n=219).
Предопределенный ретроспективный анализ 641 из 656 пациентов с мКРР с диким типом гена KRAS (экзон 2), установил дополнительные мутации RAS (KRAS [экзоны 3 и 4] или NRAS [экзоны 2, 3, 4]) у 16% (n=108) пациентов. Сокращение ВБП и ОВ наблюдалось у пациентов с мКРР с мутантным типом генов RAS, получающих панитумумаб в комбинации с FOLFOX (n = 51) по сравнению с монотерапией FOLFOX (n= 57).
Определение статуса мутации генов RAS должно проводиться опытными врачами-лаборантами с использованием валидированной методики (см. раздел «Способ применения и дозы»).
В случае применения Вектибикса в комбинации с FOLFOX, рекомендуется проводить определение мутантного статуса в лаборатории, участвующей в программе Надлежащего определения статуса гена RAS или дикий тип гена должен быть подтвержден проведением испытания в двух повторах.
Офтальмологическая токсичность
При применении в рутинной клинической практике очень редко сообщалось о серьезных случаях кератитов и язвенных кератитов.
Пациенты, у которых наблюдаются указанные ниже признаки и симптомы кератитов, такие как острая форма или ухудшение состояния, должны незамедлительно быть направлены на обследование врачом-офтальмологом: воспалительные заболевания глаз, слезотечение, чувствительность к свету, снижение четкости зрения, болезненность и/или покраснение глаз.
При подтверждении диагноза язвенный кератит, применение Вектибикса должно быть приостановлено или прекращено. При подтверждении диагноза кератит, необходимо принять решение о возможности продолжения лечения на основании соотношения «польза и риск».
У пациентов с кератитом, язвенным кератитом или синдромом сухости глаз тяжелой степени в анамнезе, следует применять Вектибикс с осторожностью. Использование контактных линз также является фактором риска возникновения кератитов и язвенных кератитов.
Пациенты с функциональным статусом 2 по шкале ECOG, получавшие терапию Вектибиксом в комбинации с химиотерапией
Для пациентов с мКРР и со статусом ECOG 2, рекомендуется проведение оценки соотношения «польза-риск» до начала применения Вектибикса в комбинации с химиотерапией. У пациентов со статусом ECOG 2, не выявлено положительное соотношение «польза-риск».
Пожилые пациенты
У пациентов пожилого возраста (≥ 65 лет), получавших монотерапию Вектибиксом, не наблюдалось различий в безопасности и эффективности. Однако было зарегистрировано увеличение числа серьезных нежелательных реакций у пожилых пациентов, получавших Вектибикс в комбинации с режимом химиотерапии FOLFIRI или FOLFOX, по сравнению с применением только режима химиотерапии.
Другие меры предосторожности
Препарат содержит 0.150 ммоль натрия (что соответствует 3.45 мг натрия) на 1 мл концентрата. Это следует учитывать пациентам, находящимся на строгой натриевой диете.
Беременность и период кормления грудью
Беременность
Достаточное количество данных по применению Вектибикса у беременных отсутствует. Эксперименты на животных показали наличие репродуктивной токсичности. Потенциальный риск для человека неизвестен. Не рекомендуется применение препарата во время беременности. Рецептор ЭФР участвует в контроле перинатального развития плода и играет определенную роль в процессах нормального органогенеза, пролиферации и дифференцировки клеток развивающегося эмбриона. Таким образом, Вектибикс может оказывать потенциальный вред для плода при назначении беременным женщинам.
Известно, что человеческие антитела IgG способны проникать через плацентарный барьер, поэтому панитумумаб может проникать из организма матери в развивающийся организм плода. Поэтому женщины с сохраненной репродуктивной функцией во время лечения Вектибиксом и в течение 2 месяцев после его окончания должны использовать надежные средства контрацепции. При применении Вектибикса во время беременности или если беременность развилась на фоне терапии препаратом, необходимо разъяснить пациентке потенциальный риск прерывания беременности и потенциальный риск для плода.
Пациенткам, у которых беременность наступила во время лечения препаратом Вектибикс, просьба зарегистрироваться в Программе Наблюдения Беременности компании Амджен. Для регистрации в программе наблюдения, пациентки и врачи, у которых они находятся под наблюдением, могут позвонить по телефону, указанному в конце настоящей инструкции.
Период кормления грудью
Неизвестно, проникает ли панитумумаб в грудное молоко. Так как человеческие антитела IgG проникают в грудное молоко, можно предположить, что панитумумаб может также проникать в грудное молоко. Возможность всасывания препарата и его потенциальный вред для ребенка не установлены. В период лечения Вектибиксом и в течение 2 месяцев после его окончания кормление грудью не рекомендуется.
Пациенткам, кормящим во время лечения препаратом Вектибикс, просьба зарегистрироваться в Программе Наблюдения за Кормящими женщинами компании Амджен. Для регистрации в программе наблюдения, пациентки или врачи, у которых они находятся под наблюдением, могут позвонить по телефону, указанному в конце настоящей инструкции.
Фертильность
В экспериментах на животных было показано обратимое действие препарата на менструальный цикл и снижение фертильности самок обезьян. В связи с этим, панитумумаб может оказывать влияние на возможность развития беременности у женщин.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
В случае развития нежелательных реакций со стороны органов зрения и/или снижения способности к концентрации внимания и быстроты реакции, пациентам рекомендуется воздержаться от управления транспортными средствами или работы со сложным оборудованием до разрешения указанных нежелательных реакций препарата.
Передозировка
Симптомы: в клинических исследованиях назначались дозы до 9 мг/кг. Описаны случаи превышения в 2 раза рекомендованной терапевтической дозы (12 мг/кг). Выявленные нежелательные реакции включали токсические реакции со стороны кожи, диарею, дегидратацию и повышенную утомляемость, что соответствует профилю безопасности препарата в рекомендуемой дозе.
Лечение: в случае передозировки лечение симптоматическое.
Форма выпуска и упаковка
Концентрат для приготовления раствора для инфузий 20 мг/мл.
Флакон содержит 5 мл (100 мг/5 мл) или 20 мл (400 мг/20 мл) концентрата для приготовления раствора для инфузий.
Флакон из прозрачного стекла гидролитического класса I с эластомерной пробкой 13 мм, алюминиевым колпачком и отламывающимся полипропиленовым колпачком. По 1 флакону помещают в контурную ячейковую упаковку и затем в пачку картонную вместе с инструкцией по медицинскому применению на государственном и русском языках. На каждую пачку наклеивают две прозрачные защитные этикетки – контроль первого вскрытия, имеющие продольную цветную полосу.
Условия хранения
Хранить при температуре от 2C до 8C.
Не замораживать.
Хранить в оригинальной упаковке для защиты от света.
Вектибикс не содержит антимикробных консервантов или бактериостатических агентов. Препарат должен быть использован сразу после разведения. Если препарат не был использован сразу, пользователь несет ответственность за время и условия его хранения до следующего использования, но не более чем 24 часа при температуре 2C – 8C. Не замораживать разведенный раствор.
Хранить в недоступном для детей месте!
Срок хранения
3 года
Не использовать по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
По рецепту
Производитель
Амджен Мэньюфэкчуринг Лимитед
Роуд 31, Километр 24.6
Джанкос, PR 00777‑4060
Пуэрто-Рико, США
Упаковщик
Амджен Европа Б.В.
Минервум 7061
NL- 4817 ZK Бреда
Нидерланды
Владелец регистрационного удостоверения
Амджен Европа Б.В.
Нидерланды
Адрес организации, принимающей на территории Республики Казахстан претензии по качеству лекарственных средств и сообщения о побочных действиях от потребителей
ТОО «Глобал Мед »
Астана, 010000, проспект Туран, 34, Казахстан
Тел./Факс: +7 717 290 17 21
email: info@globalmed.kz
______________________________________
ИНСТРУКЦИЯ РФ ПО МЕДИЦИНСКОМУ ПРИМЕНЕНИЮ ЛЕКАРСТВЕННОГО ПРЕПАРАТА
ВЕКТИБИКС
Регистрационный номер: ЛСР-007740/09
Торговое наименование препарата: Вектибикс
Международное непатентованное наименование: панитумумаб
Лекарственная форма: концентрат для приготовления раствора для инфузий
СОСТАВ
1 мл концентрата содержит:
активное вещество: панитумумаб — 20 мг;
вспомогательные вещества: натрия ацетата тригидрат – 6,8 мг, натрия хлорид – 5,8 мг, уксусная кислота ледяная – до рН 5,8, вода для инъекций – достаточное количество.
ОПИСАНИЕ
Прозрачная или слегка опалесцирующая бесцветная жидкость; может содержать полупрозрачные или белые аморфные белковые частицы.
ФАРМАКОТЕРАПЕВТИЧЕСКАЯ ГРУППА
Противоопухолевое средство, моноклональные антитела.
Код АТХ: L01XC08
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
Фармакодинамика
Механизм действия
Панитумумаб представляет собой рекомбинантное человеческое моноклональное антитело (IgG2), обладающее высокой аффинностью и специфичностью к рецепторам эпителиального фактора роста человека (EGFR). Рецептор EGF – это трансмембранный гликопротеин из семейства рецепторов тирозинкиназ I типа, которое включает также EGFR (HER1/c-ErbB-1), HER2, HER3 и HER4. Рецептор EGF стимулирует рост нормальных эпителиальных клеток, включая клетки кожи и волосяных фолликулов, и экспрессируется на различных типах опухолевых клеток.
Панитумумаб связывается с лиганд-связывающим доменом рецептора EGF и ингибирует процесс аутофосфорилирования, который индуцируется всеми известными лигандами рецептора EGF. Связывание панитумумаба с рецептором EGF приводит к интернализации рецептора, ингибированию процессов клеточного роста, индукции апоптоза и уменьшению продукции интерлейкина-8 и фактора роста эндотелия сосудов.
Гены KRAS (гомолог вирусного онкогена крысиной саркомы Кирстена 2) и NRAS (гомолог нейробластомы вирусного онкогена RAS) относятся к семейству онкогенов RAS. Гены KRAS и NRAS кодируют небольшой гуанозинтрифосфат-связывающий белок, который участвует в трансдукции сигнала. KRAS и NRAS активируется различными сигналами, в том числе и от рецептора EGF, и в свою очередь, стимулирует синтез других внутриклеточных белков, вовлеченных в процессы клеточной пролиферации, выживаемости и ангиогенеза.
Активирующие мутации генов RAS часто происходят в различных опухолевых клетках человека и играют определенную роль, как в процессе онкогенеза, так и в прогрессии опухоли.
Фармакодинамические эффекты
Исследования in vitro и in vivo на животных показали, что панитумумаб ингибирует рост и выживаемость опухолевых клеток, экспрессировавших EGFR. Не наблюдалось противоопухолевой активности панитумумаба в экспериментах с ксенотрансплантатами опухолей человека, не экспрессировавшими EGFR. Добавление панитумумаба к лучевой, химио- или другой таргетной терапии в исследованиях на животных приводило к усилению противоопухолевого эффекта по сравнению с только лучевой, химио- или таргетной терапией.
Кожные реакции (в том числе проявления на ногтях) отмечались у пациентов, получавших препарат Вектибикс или другие ингибиторы EGFR, и, как известно, ассоциированы с фармакологическими эффектами терапии (см. разделы «Способ применения и дозы» и «Побочное действие»).
Иммуногенность
Как и все терапевтические протеины, панитумумаб обладает потенциальной иммуногенностью. Продукцию анти-панитумумаб антител оценивали с помощью двух различных скрининговых систем иммуноанализа для определения связывающих анти-панитумумаб антител (ИФА — иммуноферментный анализ, который позволяет определить высокоаффинные антитела, и биосенсорный иммуноанализ, позволяющий определить высоко- и низкоаффинные антитела). Пациентам, чья сыворотка оказывалась положительной в любом из двух тестов скринингового иммуноанализа, проводился также биологический тест in vitro для обнаружения нейтрализующих антител.
В качестве монотерапии:
- Выявляемость связывающих антител (за исключением случаев выявления антител до введения препарата и временно положительных) составляла < 1%, как было установлено с помощью анализа ИФА методом кислотной диссоциации, и 3,8%, как было установлено с помощью иммунологического анализа Biacore;
- Выявляемость нейтрализующих антител (за исключением случаев выявления антител до введения препарата и временно положительных) составляла < 1%;
- При сравнении с пациентами, у которых антитела не вырабатывались, взаимосвязь между наличием анти-панитумумаб антител и изменениями фармакокинетических параметров, эффективности и безопасности препарата не отмечена.
В комбинации с режимами химиотерапии на основе иринотекана или оксалиплатина:
- Выявляемость связывающих антител (за исключением случаев выявления антител до введения препарата) составляла 1%, как было установлено с помощью анализа ИФА методом кислотной диссоциации, и < 1%, как было установлено с помощью иммунологического анализа Biacore;
- Выявляемость нейтрализующих антител (за исключением случаев выявления антител до введения препарата) составляла < 1%;
- Не было обнаружено никаких доказательств изменения профиля безопасности у пациентов с положительным результатом теста на антитела к препарату Вектибикс.
Определение образования антител зависит от чувствительности и специфичности используемого метода. На положительный результат по определению антител могут оказать влияние различные факторы, включая метод проведения анализа, методику отбора и подготовку образцов, время забора проб, прием сопутствующих лекарственных препаратов и характер основного заболевания, поэтому сравнение частоты возникновения антител к другим препаратам может приводить к недостоверным результатам.
Фармакокинетика
При применении препарата Вектибикс в качестве монотерапии или в комбинации с химиотерапией фармакокинетика препарата носит нелинейный характер.
После однократного введения панитумумаба в виде 1-часовой инфузии площадь под кривой «концентрация-время» (AUC) возрастала в большей степени, чем это характерно при дозопропорциональной зависимости, а клиренс (CL) панитумумаба снижался с 30,6 до 4,6 мл/сут/кг при увеличении дозы от 0,75 до 9 мг/кг. Однако при введении панитумумаба в дозах свыше 2 мг/кг характер увеличения AUC был близок к дозопропорциональной зависимости.
При соблюдении рекомендованного режима дозирования (6 мг/кг 1 раз в 2 недели в виде 1‑часовой инфузии) равновесная концентрация панитумумаба достигается к третьей инфузии при средних значениях максимальной (± стандартное отклонение [SD]) и минимальной концентраций 213 ± 59 и 39 ± 14 мкг/мл, соответственно. Среднее значение (± SD) AUC0-t и клиренса были равны 1306 ± 374 мкг•сут/мл и 4,9 ± 1,4 мл/кг/сут, соответственно. Период полувыведения препарата составил приблизительно 7,5 суток (разброс: от 3,6 до 10,9 суток).
Был выполнен популяционный анализ фармакокинетики с целью оценки потенциального влияния отдельных ковариат на параметры фармакокинетики панитумумаба. Результаты его показали, что возраст (в диапазоне 21-88 лет), пол, раса, функция печени и почек, применение сопутствующих химиотерапевтических препаратов и интенсивность окрашивания мембран EGFR (1+, 2+, 3+) в опухолевых клетках не оказывают явного влияния на фармакокинетику панитумумаба.
Исследований фармакокинетики панитумумаба у пациентов с нарушением функций почек или печени не проводилось.
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
Лечение метастатического колоректального рака (мКРР) у взрослых пациентов с генами RAS дикого типа в опухоли:
- в качестве первой линии терапии в комбинации с режимами, содержащими фторурацил, кальция фолинат и оксалиплатин (FOLFOX) или фторурацил, кальция фолинат и иринотекан (FOLFIRI);
- в качестве второй линии терапии в комбинации с режимом, содержащим фторурацил, кальция фолинат и иринотекан (FOLFIRI) у пациентов, получавших ранее химиотерапию первой линии на основе фторпиримидина (исключая иринотекан);
- в качестве монотерапии при неэффективности режимов химиотерапии на основе фторпиримидина, оксалиплатина и иринотекана.
ПРОТИВОПОКАЗАНИЯ
- Пациенты с анамнезом тяжелых или угрожающих жизни реакций гиперчувствительности к действующему веществу или любому из вспомогательных веществ препарата, перечисленных в разделе «Состав» (см. раздел «Особые указания»);
- Пациенты с интерстициальным пневмонитом или фиброзом легких (см. раздел «Особые указания»);
- Комбинация препарата Вектибикс с оксалиплатин-содержащим режимом химиотерапии противопоказана пациентам с мКРР и мутациями в генах RAS или пациентам с мКРР с неуточненным статусом мутаций в генах RAS (см. раздел «Особые указания»);
- Пациенты с почечной и печеночной недостаточностью (эффективность и безопасность применения не установлены);
- Детский возраст до 18 лет (эффективность и безопасность применения не установлены; см. раздел «Способ применения и дозы»);
- Беременность и период грудного вскармливания (эффективность и безопасность применения не установлены; см. раздел «Применение при беременности и в период грудного вскармливания»).
С ОСТОРОЖНОСТЬЮ
- У пациентов с кератитом, язвенным кератитом или выраженной сухостью глаз (см. раздел «Особые указания»).
Применение при Беременности и в период ГРУДНОГО ВСКАРМЛИВАНИЯ
Беременность
Достоверные данные о применении препарата Вектибикс у беременных отсутствуют. В исследованиях на животных была продемонстрирована репродуктивная токсичность препарата. Потенциальный риск ее у человека не известен. Рецептор EGF участвует в контроле пренатального развития плода и играет определенную роль в процессах нормального органогенеза, пролиферации и дифференцировки клеток развивающегося эмбриона. Таким образом, препарат Вектибикс может оказывать потенциальный вред для плода при применении у беременных женщин.
Известно, что человеческие антитела IgG способны проникать через плацентарный барьер, поэтому панитумумаб может проникать из организма матери в развивающийся организм плода. Поэтому женщины с сохранной репродуктивной функцией во время лечения препаратом Вектибикс и в течение 2 месяцев после его окончания должны использовать адекватные меры контрацепции. Если препарат Вектибикс используется в процессе беременности, или беременность развилась на фоне терапии, необходимо разъяснить пациентке потенциальный риск прерывания беременности и потенциальный вред для плода.
Грудное вскармливание
Неизвестно, проникает ли панитумумаб в грудное молоко. Так как человеческие антитела IgG проникают в грудное молоко, можно предположить, что панитумумаб может также проникать в грудное молоко. Возможность всасывания препарата и его потенциальный вред для ребенка не установлены. В период лечения препаратом Вектибикс и в течение 2 месяцев после его окончания кормление грудью не рекомендуется.
Влияние на фертильность
В экспериментах было показано обратимое действие препарата на менструальный цикл и снижение плодовитости самок обезьян. В связи с этим панитумумаб может оказывать влияние на возможность развития беременности у женщин.
СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ
Терапию препаратом Вектибикс необходимо проводить под контролем врача, имеющего опыт проведения противоопухолевого лечения. Перед началом терапии препаратом Вектибикс необходимо подтверждение гена RAS дикого типа (KRAS и NRAS). Мутационный статус гена должен быть определен лабораторией, имеющей опыт соответствующих исследований, с использованием валидированных методик обнаружения мутаций KRAS (в экзонах 2, 3 и 4) и NRAS (в экзонах 2, 3 и 4).
Режим дозирования
Рекомендуемая доза препарата Вектибикс составляет 6 мг/кг массы тела и вводится 1 раз в 2 недели.
При развитии тяжелых (≥ 3 степени) дерматологических реакций может потребоваться следующий режим модификации дозы препарата Вектибикс:
|
Возникновение кожных симптомов: |
Введение препарата Вектибикс |
Результат |
Коррекция дозы |
|---|---|---|---|
|
Первый случай возникновения |
Отмена 1 или 2 доз |
Снижение интенсивности реакции (< 3 степени) |
Возобновление инфузии в дозе, составляющей 100% от первоначальной дозы |
|
Улучшения не наступило |
Прекращение |
||
|
Второй случай возникновения |
Отмена 1 или 2 доз |
Снижение интенсивности реакции (< 3 степени) |
Возобновление инфузии в дозе, составляющей 80% от первоначальной дозы |
|
Улучшения не наступило |
Прекращение |
||
|
Третий случай возникновения |
Отмена 1 или 2 доз |
Снижение интенсивности реакции (< 3 степени) |
Возобновление инфузии в дозе, составляющей 60% от первоначальной дозы |
|
Улучшения не наступило |
Прекращение |
||
|
Четвертый случай возникновения |
Прекращение |
— |
— |
1 Реакции 3 степени и выше считаются тяжелыми или жизнеугрожающими
Применение у отдельных популяций пациентов
Безопасность и эффективность препарата Вектибикс не оценивались у пациентов с почечной или печеночной недостаточностью.
Отсутствуют клинические данные, позволяющие обосновать необходимость коррекции дозы препарата в пожилом возрасте.
Дети
Опыт применения препарата Вектибикс у детей отсутствует.
Способ введения
Вектибикс необходимо вводить в виде внутривенной инфузии с помощью инфузионного насоса.
Перед проведением инфузии препарат Вектибикс должен быть разведен специалистом здравоохранения в 9 мг/мл (0,9%) растворе натрия хлорида для инъекций в асептических условиях до получения конечной концентрации не более 10 мг/мл. Не встряхивать или не взбалтывать сильно флакон. Флакон с препаратом Вектибикс следует визуально оценить перед применением. Раствор должен быть бесцветным и может содержать полупрозрачные или белые аморфные белковые частицы (которые удаляются фильтром инфузионной системы). Не следует вводить препарат Вектибикс, описание которого отличается от приведенного выше. При помощи гиподермальной иглы размера 21G или меньше из флакона с препаратом забирается необходимое количество препарата Вектибикс для получения дозы 6 мг/кг, которое затем растворяют в общем объеме 100 мл. Не использовать безыгольные приспособления (например, переходники для флаконов) для извлечения препарата из флакона. Конечная концентрация не должна превышать 10 мг/мл. Дозы выше, чем 1000 мг следует растворить в 150 мл 9 мг/мл (0,9%) раствора натрия хлорида для инъекций. Полученный разведенный раствор необходимо перемешать осторожным переворачиванием, не встряхивать.
Не наблюдалось несовместимости между препаратом Вектибикс и 9 мг/мл (0,9%) раствором натрия хлорида для инъекций в инфузионных пакетах из поливинилхлорида или полиолефина.
Препарат Вектибикс следует вводить в периферический зонд или постоянный катетер через встроенный фильтр с размером пор 0,2 или 0,22 мкм с низкой степенью связывания белков. Рекомендованная длительность инфузии составляет приблизительно 60 минут. Если первая инфузия переносится хорошо, последующие инфузии могут производиться в течение 30-60 минут. Длительность введения препарата в дозах свыше 1000 мг должна составлять приблизительно 90 минут (инструкции по обращению приведены в подразделе «Особые меры предосторожности при применении и утилизации»).
До и после введения препарата Вектибикс, инфузионную систему необходимо промыть раствором натрия хлорида, чтобы избежать смешивания препарата Вектибикс с другими лекарственными препаратами или растворами для внутривенного введения.
В случае возникновения инфузионных реакций может потребоваться снижение скорости инфузии препарата Вектибикс (см. раздел «Особые указания»).
Препарат Вектибикс не должен вводиться струйно или болюсно.
ПОБОЧНОЕ ДЕЙСТВИЕ
Обзор профиля безопасности препарата
Согласно результатам анализа данных всех пациентов с мКРР, принимавших участие в клинических исследованиях и получавших препарат Вектибикс в режиме монотерапии и в комбинации с химиотерапией (n = 2224) наиболее частыми нежелательными реакциями были кожные реакции, наблюдавшиеся приблизительно в 94% случаев. Эти реакции обусловлены фармакологическими свойствами препарата Вектибикс и обычно имеют легкую или среднюю степень тяжести; только в 23% случаев дерматологические реакции носят тяжелый характер (степень тяжести 3, по классификации NCI-CTC) и < 1% жизнеугрожающие (степень 4 по NCI-CTC). Медицинские меры в случае кожных реакций, включая рекомендации по коррекции дозы, приведены в разделе «Особые указания».
Наиболее частыми нежелательными реакциями, возникавшими у ≥ 20% пациентов, были расстройства желудочно-кишечного тракта [диарея (46%), тошнота (39%), рвота (26%), запор (23%) и боль в животе (23%)]; общие реакции [повышенная утомляемость (35%), пирексия (21%)]; нарушения обмена веществ и питания [снижение аппетита (30%)]; инфекции и инвазии [паронихия (20%)]; и патология кожи и подкожной ткани [сыпь (47%), акнеформный дерматит (39%), зуд (36%), эритема (33%) и сухость кожи (21%)].
Табличный перечень нежелательных реакций
Нежелательные реакции, наблюдавшиеся у пациентов с мКРР, получавших панитумумаб в качестве монотерапии или в комбинации с химиотерапией в клинических исследованиях (n = 2224), а также в спонтанных сообщениях, приведены ниже. Нежелательные эффекты представлены по степени убывания серьезности.
|
Нежелательные реакции |
|||
|---|---|---|---|
|
Класс систем органов по классификации MedDRA |
Очень часто |
Часто |
Нечасто < 1/100) |
|
Инфекции и инвазии |
Конъюнктивит Паронихия1 |
Кожные высыпания пустулезные, воспаление подкожной клетчатки1, инфекция мочевыводящих путей, фолликулит, локализованная инфекция |
Инфекция глаза, инфекция века |
|
Нарушения со стороны крови и лимфатической системы |
Анемия |
Лейкопения |
|
|
Нарушения со стороны иммунной системы |
Гиперчувствительность1 |
Анафилактическая реакция2 |
|
|
Нарушения со стороны обмена веществ и питания |
Гипокалиемия, гипомагниемия, снижение аппетита |
Гипокальциемия, дегидратация, гипергликемия, гипофосфатемия |
|
|
Психические нарушения |
Бессонница |
Тревожность |
|
|
Нарушения со стороны нервной системы |
Головная боль, головокружение |
||
|
Нарушения со стороны органа зрения |
Блефарит, рост ресниц, усиление слезотечения, гиперемия глаза, сухость глаз, зуд глаз, раздражение глаза |
Язвенный кератит1,4, кератит1, раздражение века |
|
|
Кардиологические нарушения |
Тахикардия |
Цианоз |
|
|
Нарушения со стороны сосудистой системы |
Тромбоз глубоких вен, гипотензия, гипертензия, гиперемия |
||
|
Респираторные, торакальные и медиастинальные нарушения |
Диспноэ, кашель |
Тромбоэмболия легочной артерии, носовое кровотечение |
Интерстициальная болезнь легких3, бронхоспазм, сухость слизистой оболочки полости носа |
|
Нарушения со стороны пищеварительной системы |
Диарея1, тошнота, рвота, боли в животе, стоматит, запор |
Ректальное кровотечение, сухость во рту, диспепсия, афтозные язвы, хейлит, гастроэзофагеальная рефлюксная болезнь |
Обветренность губ, сухость губ |
|
Нарушения со стороны кожи и подкожной клетчатки1 |
Акнеформный дерматит, кожная сыпь, эритема, кожный зуд, сухость кожи, трещины кожи, акне, алопеция |
Язва кожи, эксфолиации кожи, эксфолиативные кожные высыпания, дерматит, папулезные кожные высыпания, зудящие кожные высыпания, эритематозные кожные высыпания, генерализованные кожные высыпания, макулезные кожные высыпания, макулопапулезные кожные высыпания, повреждения кожи, кожная токсичность, корки, гипертрихоз, онихоклазия, нарушение со стороны ногтей, гипергидроз, синдром ладонно-подошвенной эритродизестезии |
Токсический эпидермальный некролиз1,4, синдром Стивенса-Джонсона1,4, некроз кожи1,4, ангионевротический отек1, гирсутизм, вросший ноготь, онихолиз |
|
Нарушения со стороны костно-мышечной системы и соединительной ткани |
Боль в спине |
Боли в конечности |
|
|
Системные нарушения и осложнения в месте введения |
Утомляемость, пирексия, астения, воспаление слизистых, периферические отеки |
Боли в грудной клетке, боль, озноб |
|
|
Травмы, отравления и осложнения процедур |
Инфузионная реакция1 |
||
|
Изменения результатов лабораторных и инструментальных исследований |
Снижение массы тела |
Снижение концентрации магния в крови |
1 См. подраздел «Описание отдельных нежелательных реакций».
2 См. раздел «Особые указания» (инфузионные реакции).
3 См. раздел «Особые указания» (осложнения со стороны легких).
4 Некроз кожи, синдром Стивенса-Джонсона, токсический эпидермальный некролиз и язвенный кератит являются нежелательными реакциями панитумумаба, отмечавшимися в процессе его применения после регистрации. Максимальная частота этих нежелательных реакций оценивалась на основе верхней границы 95% доверительного интервала для точечной оценки с учетом рекомендаций регуляторных органов для оценки частоты нежелательных реакций в спонтанных сообщениях. Максимальное значение частоты, рассчитанное на основе верхней границы 95% доверительного интервала для точечной оценки, составило 3/2224 (или 0,13%).
Профиль безопасности препарата Вектибикс в комбинации с химиотерапией согласуется с зарегистрированными нежелательными реакциями препарата Вектибикс (используемого в монотерапии) и проявлениями фоновой токсичности химиотерапии. Новых проявлений токсичности или усугубления ранее известных проявлений токсичности помимо ожидаемых аддитивных эффектов не наблюдалось. Кожные реакции соответствовали наиболее часто отмечавшимся нежелательным реакциям у пациентов, получавших панитумумаб, в комбинации с химиотерапией. Другими проявлениями токсичности, отмечавшимися с большей частотой по сравнению с использованием препарата в монотерапии, являлись гипомагниемия, диарея и стоматит. Эти проявления токсичности нечасто приводили к досрочному завершению терапии препаратом Вектибикс или химиотерапии.
Описание отдельных нежелательных реакций
Нарушения со стороны пищеварительной системы
В большинстве случаев диарея имела легкую или умеренную степень тяжести. Сообщалось о тяжелых случаях диареи (степень 3 и 4 по NCI-CTC) у 2% пациентов, принимавших препарат Вектибикс в качестве монотерапии, и у 16% пациентов, принимавших препарат Вектибикс в комбинации с химиотерапией.
Сообщалось о развитии острой почечной недостаточности на фоне диареи тяжелой степени и обезвоживания (см. раздел «Особые указания»).
Инфузионные реакции
Во всех клинических исследованиях моно- и комбинированной терапии мКРР (n = 2224) реакции на инфузию (развивающиеся в течение 24 часов с момента первого введения препарата), симптомами/признаками которых могли являться озноб, повышение температуры тела или диспноэ, отмечались приблизительно у 5% пациентов, получавших препарат Вектибикс, из которых 1% были тяжелыми (3 и 4 степени NCI-CTC).
Сообщалось о случае развития летального ангионевротического отека у пациента с рецидивирующим метастатическим плоскоклеточным раком головы и шеи, леченого препаратом Вектибикс. Фатальное осложнение развилось при возобновлении терапии после предшествующего эпизода развития ангионевротического отека. Обе реакции зафиксированы спустя более 24 часов после введения препарата (см. разделы «Противопоказания» и «Особые указания»). О реакциях гиперчувствительности, развившихся более чем через 24 часа после инфузии, также сообщалось и в пострегистрационный период.
Данные клинического ведения реакций на инфузию приведены в разделе «Особые указания».
Нарушения со стороны кожи и подкожно-жировой клетчатки
Кожная сыпь, наиболее часто локализованная на лице, верхней части грудной клетки и спине, однако в некоторых случаях распространялась и на конечности. Как следствие тяжелых дерматологических реакций отмечали также развитие инфекционных осложнений, таких как сепсис, в редких случаях с летальным исходом, воспаление подкожной клетчатки и местные абсцессы, требующие хирургического вмешательства и дренирования. Медиана времени до развития первых проявлений дерматологических реакций составила 10 дней, а медиана времени до их разрешения с момента последнего введения препарата Вектибикс – 31 день.
Паронихиальное воспаление сопровождалось припухлостью латеральных ногтевых валиков пальцев рук и ног.
Дерматологические реакции (включая воздействие на ногти), наблюдавшиеся у пациентов, получавших препарат Вектибикс или другие ингибиторы EGFR, являются известными фармакологическими эффектами данных препаратов.
Во всех клинических исследованиях кожные реакции наблюдались приблизительно у 94% пациентов, получавших препарат Вектибикс в качестве монотерапии или в комбинации с химиотерапией (n = 2224). В основном это были сыпь и угревидный дерматит почти всегда легкого или умеренного характера. О тяжелых кожных реакциях (степень 3 по NCI‑CTC) сообщалось у 23% пациентов, а о жизнеугрожающих кожных реакциях (степень 4 по NCI-CTC) — у < 1% пациентов. У пациентов, получавших препарат Вектибикс, регистрировались жизнеугрожающие и летальные инфекционные осложнения, включавшие некротизирующий фасциит и сепсис (см. раздел «Особые указания»).
Данные клинического ведения дерматологических реакций, включая рекомендации по изменению дозы, приведены в разделе «Особые указания».
В пострегистрационный период применения сообщалось о редких случаях развития некрозов кожи, синдрома Стивенса-Джонсона и токсического эпидермального некролиза (см. раздел «Особые указания»).
Офтальмологическая токсичность
Сообщалось о серьезных случаях кератитов и язвенных кератитов, которые могут приводить к перфорации роговицы (см. раздел «Особые указания»).
Другие особые популяции
Не наблюдалось различий в безопасности и эффективности у пациентов пожилого возраста (≥ 65 лет), получавших монотерапию препаратом Вектибикс. Однако было зарегистрировано увеличение числа серьезных нежелательных реакций у пожилых пациентов, получавших терапию препаратом Вектибикс в комбинации с режимами химиотерапии FOLFIRI (45% по сравнению с 32%) или FOLFOX (52% по сравнению с 37%), по сравнению с получавшими только химиотерапию (см. раздел «Особые указания»). Наиболее частыми серьезными нежелательными явлениями были диарея у пациентов, получавших препарат Вектибикс в комбинации с режимами FOLFOX или FOLFIRI, дегидратация и тромбоэмболия легочной артерии — у пациентов, получавших препарат Вектибикс в комбинации с режимом FOLFIRI.
Нет данных, касающихся безопасности применения препарата Вектибикс пациентами с почечной и печеночной недостаточностью.
ПЕРЕДОЗИРОВКА
В клинических исследованиях препарат использовался в дозах до 9 мг/кг. Были зарегистрированы случаи превышения рекомендованной терапевтической дозы (12 мг/кг) приблизительно в 2 раза. Наблюдались нежелательные эффекты, такие как токсические реакции со стороны кожи, диарея, дегидратация и повышенная утомляемость, что соответствовало профилю безопасности препарата в рекомендованной дозе.
ВЗАИМОДЕЙСТВИЕ С ДРУГИМИ ЛЕКАРСТВЕННЫМИ ПРЕПАРАТАМИ
Данные исследования о взаимодействии препарата Вектибикс и иринотекана у пациентов с мКРР показали, что фармакокинетические свойства иринотекана и его активного метаболита, SN-38, не меняются при одновременном введении препаратов. Результаты перекрестного сравнительного исследования показали, что схемы, включающие в себя иринотекан (IFL или FOLFIRI), не влияют на фармакокинетические свойства панитумумаба.
Вектибикс не должен назначаться в комбинации с режимом химиотерапии IFL или режимами химиотерапии, включающими бевацизумаб. При назначении панитумумаба в комбинации с IFL, наблюдалась высокая частота возникновения диареи тяжелой степени (см. раздел «Особые указания») и увеличивалась частота токсичности и летальных исходов при назначении панитумумаба в комбинации с режимом химиотерапии, включавшей бевацизумаб (см. раздел «Особые указания»).
Комбинация препарата Вектибикс с химиотерапией на основе оксалиплатина противопоказана пациентам с мКРР и мутациями RAS, а также пациентам с мКРР с неизвестным статусом RAS. В клиническом исследовании у пациентов с мутациями RAS в опухоли, которые получали панитумумаб и химиотерапию FOLFOX, отмечалось укорочение выживаемости без прогрессирования заболевания и общей выживаемости (см. раздел «Особые указания»).
Фармацевтическая несовместимость
Данный препарат не следует применять с другими лекарственными средствами, кроме указанных в подразделе «Особые меры предосторожности при применении и утилизации».
ОСОБЫЕ УКАЗАНИЯ
Отслеживаемость
С целью улучшения отслеживаемости биологических лекарственных препаратов следует точно записывать название и номер серии вводимого препарата.
Нежелательные реакции со стороны мягких тканей и кожи
Дерматологические реакции — фармакологический эффект, характерный для ингибиторов EGFR, регистрируются практически у всех пациентов (приблизительно 94%), получающих препарат Вектибикс. Тяжелые кожные реакции (3 степени согласно классификации NCI‑CTC) отмечались у 23% пациентов, жизнеугрожающие кожные реакции (4 степени NCI-CTC) – у < 1% пациентов, принимавших препарат Вектибикс в качестве монотерапии и в комбинации с химиотерапией (n = 2224) (см. раздел «Побочное действие»). При развитии у пациента кожных реакций степени 3 (Общие терминологические критерии оценки нежелательных явлений CTCAE, версия 4.0) или более выраженной степени, либо расцененных как непереносимые, см. рекомендации по модификации дозы в разделе «Способ применения и дозы».
В клинических исследованиях после развития тяжелых кожных реакций (в том числе стоматита) имели место инфекционные осложнения, в том числе сепсис и некротизирующий фасциит, которые в редких случаях приводили к смерти, а также к образованию абсцессов, требовавших вскрытия и дренирования. Пациенты, у которых отмечались тяжелые кожные реакции или проявления токсичности со стороны мягких тканей, либо демонстрировавшие усугубление данных реакций на фоне терапии препаратом Вектибикс, должны наблюдаться на предмет развития воспалительных или инфекционных последствий (в том числе воспаление подкожной клетчатки и некротизирующего фасциита), а при наличии соответствующих клинических показаний должна быть начата соответствующая терапия. Жизнеугрожающими и летальными инфекционными осложнениями являлись некротизирующий фасциит и сепсис, которые отмечались у пациентов, получавших препарат Вектибикс. Редкие случаи синдрома Стивенса-Джонсона и токсического эпидермального некролиза отмечались у пациентов в пострегистрационном периоде, принимавших препарат Вектибикс. Временная отмена или прекращение применения препарата Вектибикс необходимы при развитии кожной токсичности или токсичности мягких тканей, ассоциированных с развитием тяжелых или жизнеугрожающих воспалительных или инфекционных осложнений.
Лечение и ведение дерматологических реакций должно быть основано на тяжести проявлений и может включать в себя увлажняющие, солнцезащитные средства (солнцезащитный фильтр > 15 UVA и UVB), а также кремы с глюкокортикостероидами (не выше 1% гидрокортизона) для применения на пораженных участках и/или пероральные антибиотики (например, доксициклин). Также пациентам с признаками сыпи/дерматологической токсичности рекомендуется использовать солнцезащитные средства и головные уборы, ограничить пребывание на солнце, поскольку солнечный свет может усилить любые возможные кожные реакции.
Пациентам может быть рекомендовано наносить увлажняющие, солнцезащитные средства на лицо, руки, ноги, шею, спину и грудь каждое утро, а на ночь наносить крем, содержащий глюкокортикостероид, на лицо, руки, ноги, шею, спину и грудь во время проведения лечения.
Осложнения со стороны легких
Пациенты с наличием в анамнезе или имеющие признаки интерстициального пневмонита или фиброза легких исключались из клинических исследований. Случаи интерстициальных заболеваний легких с летальными исходами и без, возникали, преимущественно, в японской популяции. Поэтому при остром возникновении или ухудшении легочных симптомов лечение препаратом Вектибикс должно быть приостановлено и незамедлительно начато изучение возникших симптомов. При обнаружении интерстициальных заболеваний легких препарат Вектибикс следует временно отменить и назначить соответствующее лечение. У пациентов с интерстициальным пневмонитом или легочным фиброзом в анамнезе необходимо оценить отношение вероятной пользы применения препарата к риску осложнений со стороны легких.
Нарушения водно-электролитного баланса
У некоторых пациентов отмечалось прогрессивное снижение сывороточных концентраций магния, приводившее к тяжелой (степень 4) гипомагниемии. Необходим периодический мониторинг состояния пациентов на предмет развития гипомагниемии и сопутствующей гипокальциемии перед началом лечения препаратом Вектибикс, и после лечения до 8 недель после его окончания (см. раздел «Побочное действие»). При необходимости рекомендован прием препаратов магния.
Также отмечались нарушения баланса других электролитов, включая гипокалиемию. Рекомендуется мониторинг и соответствующий адекватный прием данных электролитов.
Инфузионные реакции
В клинических исследованиях монотерапии и комбинированной терапии мКРР (n = 2224), инфузионные реакции, в том числе тяжелые инфузионные реакции (возникавшие в течение 24 часов после инфузии), отмечались у пациентов, получавших препарат Вектибикс (степень 3 и 4 по NCI-CTC).
В пострегистрационных исследованиях сообщалось о серьезных инфузионных реакциях, включая редкие пострегистрационные сообщения о летальных исходах. В случае возникновения тяжелой или жизнеугрожающей реакции в процессе инфузии или в любое время после ее завершения [например, при возникновении бронхоспазма, ангионевротического отека, гипотензии, потребности в парентеральной терапии или анафилаксии], необходимо полностью отменить препарат Вектибикс (см. разделы «Противопоказания» и «Побочное действие»).
У пациентов с легкими или умеренными (степень 1 и 2 по CTCAE версии 4.0) инфузионными реакциями следует уменьшить скорость инфузии на протяжении всей инфузии. Рекомендуется сохранять сниженную скорость инфузии в ходе всех последующих инфузий.
Сообщалось о реакциях гиперчувствительности, возникавших более чем через 24 часа после инфузии, включая ангионевротический отек со смертельным исходом, развившийся более чем через 24 часа после инфузии. Следует предупредить пациентов о возможности позднего развития реакции и проинструктировать обращаться к своему лечащему врачу в случае возникновения симптомов реакции гиперчувствительности.
Острая почечная недостаточность
Острая почечная недостаточность отмечена у пациентов с тяжелой диареей и дегидратацией. Пациенты должны быть проинструктированы о необходимости немедленно обратиться за медицинской помощью при развитии тяжелой диареи.
Препарат Вектибикс в комбинации с химиотерапией на основе иринотекана, фторурацила болюсно и кальция фолината (режим IFL)
У пациентов, получавших препарат Вектибикс в комбинации с режимом IFL [болюсное введение фторурацила (500 мг/м2), кальция фолината (20 мг/м2) и иринотекана (125 мг/м2)], отмечалась высокая частота тяжелой диареи (см. раздел «Побочное действие»). Поэтому следует избегать использования препарата Вектибикс в комбинации с режимом IFL (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Препарат Вектибикс в комбинации с бевацизумабом и режимами химиотерапии
У пациентов, получавших препарат Вектибикс в комбинации с бевацизумабом и химиотерапией, отмечалось укорочение выживаемости без прогрессирования заболевания и повышение частоты летальных исходов. Кроме того, в группах терапии препаратом Вектибикс в комбинации с бевацизумабом и химиотерапией отмечалось повышение частоты тромбоэмболии легочной артерии, инфекций (преимущественно кожных), диареи, электролитных нарушений, тошноты, рвоты и дегидратации. Препарат Вектибикс не должен применяться в комбинации с химиотерапией, включающей бевацизумаб (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Препарат Вектибикс в комбинации с химиотерапией на основе оксалиплатина у пациентов с мКРР и мутациями RAS, а также с неуточненным статусом RAS
Комбинация препарата Вектибикс с химиотерапией на основе оксалиплатина противопоказана пациентам с мКРР и мутациями RAS, а также пациентам с мКРР с неуточненным статусом мутаций генов RAS (см. раздел «Противопоказания»).
Отмечалось сокращение выживаемости без прогрессирования заболевания (ВБП) и общей выживаемости (OВ) у пациентов с мутациями KRAS (в экзоне 2) в опухоли и дополнительными мутациями RAS (KRAS [в экзонах 3 и 4] или NRAS [в экзонах 2, 3, 4]), получавших панитумумаб в комбинации с инфузионным режимом, содержащим фторурацил, кальция фолинат и оксалиплатин (FOLFOX) по сравнению с пациентами, получавшими только FOLFOX.
Оценка мутационного статуса RAS должна определяться с использованием валидированного метода в лаборатории, имеющей опыт выполнения подобных исследований (см. раздел «Способ применения и дозы»). Если препарат Вектибикс должен использоваться в комбинации с режимом FOLFOX, рекомендуется определение мутационного статуса в лаборатории, принимающей участие в программе внешнего обеспечения качества оценки статуса RAS, либо дикий тип должен быть подтвержден результатами двукратного анализа.
Офтальмологическая токсичность
Отмечались серьезные случаи кератита и язвенного кератита, которые могут приводить к перфорации роговицы. Пациенты, у которых отмечаются признаки и симптомы, свидетельствующие о наличии кератита, в том числе острые или усугубляющиеся: воспалительные изменения глаза, слезотечение, светобоязнь, снижение четкости зрения, боли в глазу и/или покраснения глаза, должны быть немедленно направлены к офтальмологу.
При подтверждении диагноза язвенного кератита терапию препаратом Вектибикс необходимо временно или полностью прекратить. При постановке диагноза кератита необходимо тщательно соотнести пользу и риски продолжения терапии.
Препарат Вектибикс должен использоваться с осторожностью у пациентов, имевших в анамнезе кератит, язвенный кератит или выраженную сухость глаза. Использование контактных линз также является фактором риска развития кератита и изъязвлений.
Пациенты с показателем общего состояния 2 по шкале ECOG, получавших препарат Вектибикс в комбинации с химиотерапией
Для пациентов с мКРР, имеющих показатель 2 по шкале ECOG, рекомендуется проведение оценки соотношения польза-риск до начала применения препарата Вектибикс в комбинации с химиотерапией. У пациентов со статусом ECOG 2 не выявлено положительное соотношение польза-риск.
Пожилые пациенты
Различий безопасности или эффективности препарата Вектибикс в монотерапии у пациентов пожилого возраста (≥ 65 лет) не наблюдалось. Однако отмечалось увеличение количества серьезных нежелательных реакций у пожилых пациентов, получавших препарат Вектибикс в комбинации с химиотерапией FOLFIRI или FOLFOX, по сравнению с применением только режимов химиотерапии (см. раздел «Побочное действие»).
Предупреждение о вспомогательных веществах
Данный препарат содержит 3,45 мг натрия в 1 мл, что соответствует 0,17% от рекомендованного ВОЗ максимального суточного потребления натрия для взрослого человека, составляющего 2 г.
Особые меры предосторожности при применении и утилизации
Препарат Вектибикс следует вводить в периферический зонд или постоянный катетер через встроенный фильтр с размером пор 0,2 или 0,22 мкм с низкой степенью связывания белков.
Разведенный раствор
Вектибикс не содержит антимикробных консервантов или бактериостатических агентов. Препарат должен быть использован непосредственно после разведения. Если препарат не был использован сразу после разведения, пользователь несет ответственность за время и условия его хранения до следующего введения (не более 24 часов при температуре 2 °C ‑ 8 °C). Не замораживать разведенный раствор.
Препарат Вектибикс предназначен только для однократного использования.
Флакон и оставшийся в нем раствор лекарственного препарата необходимо утилизировать после однократного применения.
Весь неиспользованный остаток препарата и расходные материалы должны утилизироваться в соответствии с надлежащими требованиями.
ВЛИЯНИЕ НА СПОСОБНОСТЬ УПРАВЛЯТЬ ТРАНСПОРТНЫМИ СРЕДСТВАМИ, МЕХАНИЗМАМИ
Вектибикс может оказывать влияние на способность управлять транспортными средствами и на работу с механизмами. В случае развития нежелательных реакций со стороны органов зрения и/или снижения способности к концентрации внимания и быстроты реакции, пациентам рекомендуется воздержаться от управления транспортными средствами или работы со сложным оборудованием до разрешения указанных нежелательных реакций препарата.
ФОРМА ВЫПУСКА
Концентрат для приготовления раствора для инфузий 20 мг/мл.
Флакон содержит 5 мл (100 мг/5 мл) или 20 мл (400 мг/20 мл) концентрата для приготовления раствора для инфузий.
Маркированный флакон из прозрачного стекла гидролитического класса I с эластомерной пробкой, алюминиевым колпачком и отламывающимся полипропиленовым колпачком.
По 1 флакону помещают в контурную ячейковую упаковку и затем в пачку картонную вместе с инструкцией по применению. Для контроля первого вскрытия на каждую пачку наклеивают две прозрачные защитные этикетки, имеющие продольную цветную полосу.
УСЛОВИЯ ХРАНЕНИЯ
Хранить при температуре от 2°C до 8°C.
Не замораживать.
Хранить в оригинальной упаковке для защиты от света.
Хранить в недоступном для детей месте!
СРОК ГОДНОСТИ
3 года.
Не использовать по истечении срока годности, указанного на упаковке.
УСЛОВИЯ ОТПУСКА
Отпускают по рецепту.
ПРОИЗВОДИТЕЛЬ
Производитель готовой лекарственной формы / Фасовщик (первичная упаковка)
Амджен Мэньюфэкчуринг Лимитед,
Роуд 31, Км 24.6, Джанкос, Пуэрто-Рико, 00777, Соединенные Штаты Америки.
Упаковщик (вторичная (потребительская) упаковка) / Выпускающий контроль качества
Амджен Европа Б.В.,
Минервум 7061, NL-4817 ZK Бреда, Нидерланды или
Амджен Технолоджи (Айрлэнд) Анлимитед Компани,
Поттери Роуд, Дан Лэйри, Графство Дублин, Ирландия или
ООО «Добролек», Россия,
115446, г. Москва, Коломенский проезд, д. 13А.
ОРГАНИЗАЦИЯ, ПРИНИМАЮЩАЯ ПРЕТЕНЗИИ ОТ ПОТРЕБИТЕЛЕЙ
ООО «Амджен»
123112, Москва, Пресненская набережная, д.8, строение 1, 7 этаж
Тел: +7 (495) 745 0478
Факс: +7 (499) 995 1965
| 652955561477976856_ru.doc | 225.5 кб |
| 071349631477978015_kz.doc | 235.5 кб |
| Инструкция_Вектибикс_РФ.docx | 0.06 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
Введение
Колоректальный рак (КРР) в настоящее время занимает 3-е место в мире в структуре заболеваемости злокачест- венными опухолями, уступая лишь раку легкого и раку молочной железы. Примерно у половины пациентов на мо- мент постановки диагноза или позже развивается диссе- минация процесса. Еще 30 лет назад единственным дос- тупным для лечения метастатического КРР (МКРР) препа- ратом был 5-фторурацил (5-ФУ), а средняя продолжитель- ность жизни больных МКРР составляла около 12 мес. Новые химиотерапевтические препараты, такие как ирино- текан и оксалиплатин, в сочетании с инфузиями 5-ФУ (режимы FOLFIRI и FOLFOX) позволили увеличить этот показатель до 20 мес. С 1990-х годов арсенал химиотерапевта пополняется новым классом противоопухолевых средств — моноклональными антителами. В настоящее время для лечения МКРР применяются две группы данных препара- тов: угнетающие опухолевый неоангиогенез и блокирующие рецепторы эпидермального фактора роста (EGFR). Моноклональное антитело к сосудистому эндотелиальному фактору роста (VEGF) — бевацизумаб, добавленное к химиотерапии, увеличивает время до прогрессирования и продолжительность жизни по сравнению только с химиотерапией. Другим перспективным направлением является терапия, направленная против EGFR.
EGFR входит в состав семейства трансмембранных ре- цепторов HER, в которое также входят her-2/neu, EGFR3 и EGFR4. Факторами (лигандами), активирующими EGFR, являются трансформирующий фактор роста-а, эпидермальный фактор роста, амфирегулин и эпирегулин. После взаимодействия лиганда с EGFR происходит его гомо или гетеродимеризация, что приводит к аутофосфорилированию ряда тирозинкиназ. Далее сигналы каскадно передаются в ядро клетки, регулируя клеточный рост, пролиферацию, ангиогенез, инвазию и метастазирование.
Среди анти-EGFR-антител в настоящее время доступны два препарата: цетуксимаб и панитумумаб (Вектибикс). Основное их отличие заложено в структуре. Так, цетуксимаб представляет собой химерное моноклональное антитело к EGFR и на 34% состоит из мышиных антител, что может вызывать нежелательную иммунологическую реакцию. Панитумумаб является на 100% человеческим иммуноглобулином G2 (IgG2) и обладает большей аффинностью к EGFR, чем его натуральные лиганды. Меньшая иммуногенность препарата позволила в 3 раза снизить частоту выраженных инфузионных реакций по сравнению с цетуксимабом, а также отказаться от премедикации.
В данной статье будут рассмотрены эффективность и переносимость панитумумаба при терапии МКРР.
Исследования I фазы
Проведены 2 больших исследования I фазы. В одном из них приняли участие 84 пациента с различными резистентными к стандартной терапии опухолями [1]. Часть больных получали препарат в дозе 6 мг/кг каждые 2 нед, другая — 9 мг/кг каждые 3 нед. Среди 11 включенных в исследование больных МКРР отмечены 2 частичные регрессии и 5 стабилизаций. Основной дозозависимой токсичностью была кожная сыпь.
В другом исследовании 96 пациентов получали панитумумаб в дозе 0,01-5 мг/кг еженедельно, 6 мг/кг каждые 2 нед или 9 мг/кг каждые 3 нед [2]. Максимально переносимая доза не была достигнута, основной токсичностью также была кожная сыпь. Среди 39 пациентов МКРР частичные ремиссии зафиксированы у 13%.
Независимо от режима введения фармакокинетика препарата была сходной: концентрации препарата в сыво- ротке не различались, время полужизни составляло 6-8 дней.
Выведение панитумумаба, как и нормальных иммуноглобулинов, осуществляется двумя путями: ретикулоэндотелиальной системой или путем связывания с рецепторами. Не отмечено влияния на фармакокинетику препарата таких параметров, как возраст, пол, раса, функция почек и печени.
В настоящее время наиболее часто применяемой дозой является 6 мг/кг каждые 2 нед. Однако в случае 3-недельных режимов возможна и дозировка 9 мг/кг каждые 3 нед.
Исследования II фазы
Основываясь на обещающей активности панитумумаба в исследованиях I фазы при МКРР, было проведено 3 исследования II фазы. Суммарно в них приняли участие 350 пациентов МКРР, получившие ранее 1-3 линии химиотерапии с включением 5-ФУ, оксалиплатина и/или иринотекана [3-5].
В одном из исследований применялась доза 2,5 мг/кг еженедельно, в двух других — 6 мг/кг каждые 2 нед. Вне зависимости от режима введения эффективность панитумумаба оказалась сходной: частота объективного ответа составила 4-14%, стабилизации — 21-35%. Медиана времени до прогрессирования была около 8 нед, а медиана продолжительности жизни варьировала в пределах 7,4-10,1 мес.
Основной токсичностью была кожная сыпь, отмечен- ная у 95% больных. Реже встречалось поражение ногтей (около 30%) и глаз (8-17%, все степени). Среди других видов токсичности преобладали диарея (около 25%, включая 1-3% III степени) и гипомагнезиемия (около 10%, включая 3% III степени). При этом частота выраженных инфузион- ных реакций III степени не превышала 1%.
Проанализирована эффективность терапии в зависи- мости от уровня экспрессии EGFR, определяемой иммуно-гистохимически. Оказалось, что эффекты одинаково часто регистрировались как при EGFR+, так и EGFR—опухолях. Время до прогрессирования также не различалось.
Рандомизированные исследования III фазы
Монотерапия в сравнении с симптоматической терапией
Первым рандомизированным исследованием панитумумаба, на основании которого он был зарегистрирован в США и Европе, было сравнение его в качестве монотерапии с симптоматической терапией у больных МКРР, полу- чавших ранее фторпиримидины, иринотекан и оксалиплатин. В исследовании участвовали 463 больных с экспрессией EGFR, панитумумаб назначался в дозе 6 мг/кг каждые 2 нед [6]. Основной задачей исследования было улучшение выживаемости до прогрессирования. Назначение панитумумаба достоверно повысило частоту объективных ответов с 0 до 10% (p<0,001), стабилизации заболевания – с 10% до 27% и выживаемость до прогрессирования – с 7,3 нед до 8 нед (p<0,001) по сравнению с аналогичными показателями при симптоматической терапии. Возросла и токсичность: выраженные (III и IV степени) побочные реакции в группе панитумумаба развились у 33% и 2% больных соответственно, тогда как в контрольной группе они наблюдались у 18% и 2%. Кроме типичной кожной сыпи, увеличилась частота диареи (с 11% до 21%, все степени), общей слабости (с 15% до 24%, все степени) и гипомагниемии (с 1% до 36%, все степени). Лишь у 1 больного имела место инфузионная реакция III степени на панитумумаб.
При прогрессировании заболевания 176 (76%) пациентов из группы симптоматической терапии начали терапию панитумумабом (crossover), что, по-видимому, и привело к отсутствию различий в продолжительности жизни. Эффективность панитумумаба у больных «симптоматиче- ской» группы, переведенных на панитумумаб, соответствовала таковой в группе первоначально получавших панитумумаб. Медиана продолжительности жизни в обеих группах составила 6,3 мес. Таким образом, в группе пациентов, уже получивших всю активную химиотерапию, панитумумаб достоверно улучшил выживаемость до прогрессирования и частоту объективных ответов по сравнению с одной симптоматической терапией.
Факторы, предсказывающие эффективность терапии панитумумабом
С целью предсказания эффективности панитумумаба и цетуксимаба исследовали разные молекулярные факторы. На ранних этапах казалось, что наиболее подходящим кандида- том на эту роль является определение экспрессии EGFR на поверхности опухолевых клеток, как это широко используется для определения чувствительности к трастузумабу и гор- монотерапии при раке молочной железы. Однако уже в исследованиях II фазы не было выявлено зависимости между эффективностью панитумумаба и уровнем экспрессии EGFR.
Мутация K-RAS
Ген K-RAS является важным участником в передаче сигналов от рецептора EGFR в ядро клетки. Около 40% аденокарцином толстой кишки имеют его мутацию, в результате ген начинает передавать активирующие сигналы даже при отсутствии стимулирующих сигналов со стороны EGFR. Впервые предсказывающее значение мутации K-RAS было продемонстрировано в упомянутом исследовании III фазы монотерапии панитумумабом в сравнении с сим- птоматической терапией. Оказалось, что при отсутствии мутации K-RAS добавление панитумумаба достоверно увеличивало медиану выживаемости до прогрессирования с 7,3 до 12,3 нед (p<0,001) и частоту объективного ответа с 0 до 17%, а частоту стабилизаций заболевания – с 12% до 34% по сравнению с симптоматической терапией. В то же время наличие мутации K-RAS предсказывало неэффективность терапии панитумумабом, результаты которой не отличались от таковых в группе симптоматической тера- пии (частота объективного ответа 0%, медиана выживаемости до прогрессирования 7,2–7,3 мес) (рис. 1) [7].
Кроме того, в некоторых исследованиях выявлено нега- тивное влияние цетуксимаба и панитумумаба на эффек- тивность терапии у больных с мутацией гена K-RAS [8, 9]. В настоящее время тестирование на наличие мутации гена K-RAS в 12 и 13 кодонах является обязательным перед назначением анти-EGFR-антител.
Другие молекулярные факторы прогноза
В качестве других молекулярных факторов прогноза в ретроспективных анализах показано негативное значение мутации B-RAF и числа копий гена K-RAS. B-RAF является геном, располагающимся ниже K-RAS в цепочке пере- дачи сигнала от EGFR к ядру. Мутация B-RAF может иметь место лишь при отсутствии мутации K-RAS, что обуслов- ливает резистентность к терапии цетуксимабом и панитумумабом [10].
Увеличение числа копий гена K-RAS – другой фактор, определяющий неэффективность терапии анти-EGFR-антителами [11]. Однако все эти данные требуют подтверждения в проспективных исследованиях перед тем, как рекомендовать их использование в рутинной практике.
Кожная сыпь
Важным клиническим фактором, предсказывающим ответ на анти-EGFR-терапию, является кожная сыпь. Чем выше ее степень, тем лучше результаты терапии. Впервые это было показано для низкомолекулярных ингибиторов тирозинкиназ EGFR (гефитиниб, эрлотиниб) у больных раком легкого.
В исследовании III фазы монотерапии панитумумабом в сравнении с симптоматической терапией была выявлена прямая корреляция между выраженностью сыпи и выживаемостью до прогрессирования [12].
Панитумумаб в комбинации с химиотерапией
2-я линия химиотерапии
Эффективность панитумумаба во 2-й линии химиотерапии была определена в большом рандомизированном исследовании III фазы. В исследовании приняли участие 1083 пациента с прогрессированием заболевания в течение не более 6 мес после завершения 1-й линии химиотерапии [13]. В 1-й линии химиотерапии 100% больных получили фторпиримидины, а около 70% – и оксалиплатин. Основной задачей исследования было улучшение выживаемости до прогрессирования и продолжительности жизни больных без мутации K-RAS. Пациентов рандомизировали на лечение по программе FOLFIRI + панитумумаб 6 мг/кг в 1-й день каждого курса (каждые 2 нед) или на одну химиотерапию FOLFIRI. Лечение продолжалось до прогрессирования или развития токсичности.
Среди 1083 включенных в исследование больных 597 (55%) не имели мутацию K-RAS, и эффективность терапии была оценена в данной субпопуляции. Добавление панитумумаба достоверно улучшило частоту объективного ответа с 10% до 35% и выживаемости до прогрессирования с 3,9 мес до 5,9 мес (относительный риск – HR=0,73; 95% доверительный интервал – 95% ДИ 0,59–0,90; p=0,004). Кро- ме того, наблюдалась тенденция и к улучшению продолжительности жизни с 12,5 мес до 14,5 мес (HR=0,85; 95% ДИ 0,70–1,04; p=0,12), однако не достигшая статистической значимости. У пациентов с мутацией K-RAS добавление панитумумаба не повлияло на результаты терапии, и все показатели эффективности были сходны с таковыми при применении только одного режима FOLFIRI (табл. 1).
Таблица 1. Панитумумаб в комбинации с FOLFIRI во второй линии химиотерапии: эффективность в зависимости от статуса K-RAS
| Показатель | Режим | Количество больных | ОЭ, % | Медиана PFS, мес | Медиана продолжительности больных жизни, мес |
|---|---|---|---|---|---|
| Нет мутации K-RAS | FOLFIRI + панитумумаб | 303 | 35 | 5,9 | 14,5 |
| FOLFIR | 294 | 10 | 3,9; p=0,004 | 12,5; p=0,12 | |
| Есть мутация K-RAS | FOLFIRI + панитумумаб | 238 | 13 | 5,0 | 11,8 |
| FOLFIRI | 248 | 14 | 4,9; р=0,14 | 11,1; p=0,55 |
Примечание. См. здесь и в табл. 2: ОЭ – общий объективный эффект; PFS – выживаемость без прогрессирования.
Ценой улучшения результатов лечения явился рост частоты побочных явлений за счет специфической для панитумумаба токсичности. Так, частота кожной сыпи III–IV степени повысилась с 2% до 37%, диареи – с 9% до 14%, а гипо- магнезиемии – менее чем с 1% до 3%. Тем не менее частота летальных осложнений в обеих группах была одинаковой. Вновь обратила на себя внимание низкая (менее 1%) часто- та инфузионных реакций III–IV степени на панитумумаб.
1-я линия химиотерапии
В этом году были представлены результаты другого рандомизированного исследования – PRIME, в котором срав- нивали комбинацию FOLFOX + панитумумаб 6 мг/кг каж- дые 2 нед c режимом FOFLOX в качестве 1-й линии терапии больных МКРР. В исследовании участвовали 1183 пациента, из которых 656 (55%) не имели мутации K-RAS [8]. Основной задачей исследования было улучшение выживаемости до прогрессирования в зависимости от статуса KRAS. У больных без мутации K-RAS добавление панитумумаба позволило достоверно увеличить медиану выживаемости до прогрессирования с 8,0 мес до 9,6 мес (HR=0,80, 95% ДИ 0,66–0,97; p=0.02). Также отмечена тенденция и к улучшению продолжительности жизни (p=0,16), однако окончательный анализ продолжительности жизни еще преждевременен. Частота объективных ответов увеличилась незначительно – с 48% до 55% (табл. 2).
| Исследование |
Режим | Количество больных | ОЭ, % | Медиана PFS, мес | Медиана продолжительности больных жизни, мес |
|---|---|---|---|---|---|
| 1-я линия | |||||
| PRIME, Douillard, 2009 г. | FOLFOX + панитумумаб | 325 | 55 | 9,6 | Не достигнута |
| FOLFOX | 331 | 48 | 8,0; ОР=0,80; p=0,02 | 18,8; ОР=0,83; p=0,16 | |
| 2-я линия | |||||
| AMG-181, Peeters, 2009 г. | FOLFIRI + панитумумаб | 303 | 35 | 5,9 | 14,5 |
| FOLFIRI | 294 | 10 | 3,9; ОР=0,73; p=0,004 | 12,5; ОР=0,85; p=0,12 | |
| 3-я линия | |||||
| Amado, 2008 г. | Панитумумаб | 124 | 17 | 2,87 | 8,1 |
| симптоматическая терапия | 119 | 0 | 1,7; ОР=0,45; p=0,001 | 7,6; p>0,05 (был crossover) |
Таблица 2. Панитумумаб при лечении МКРР: результаты рандомизированных исследований (анализ пациентов без мутации K-RAS)
Интересные результаты получены у пациентов с мута- цией K-RAS. Оказалось, что панитумумаб не только не улучшал, но даже ухудшал результаты терапии, по сравне- нию с таковыми при применении одного режима FOLFOX. Выживаемость до прогрессирования снизилась с 8,8 мес до 7,3 мес (p=0,02), а медиана продолжительности жизни – с 18,7 мес до 15,1 мес (p=0,004; рис. 2). Механизм воз- можного негативного влияния панитумумаба у больных с мутацией гена K-RAS не известен.
Рис. 2. PFS в зависимости от наличия мутации гена K-RAS:
FOLOX ± панитумумаб в 1-й линии химиотерапии МКРР:
а – отсутствие мутации K-RAS, б – наличие мутации K-RAS.
Таким образом, применение панитумумаба в комбинации с режимами FOLFOX и FOLFIRI в первой и второй линиях химиотерапии позволяет достоверно улучшить частоту объективных ответов и показатели выживаемости до прогрессирования у больных без мутации гена KRAS.
Совместное применение бевацизумаба и анти-EGFR-антител
Бевацизумаб и анти-EGFR-антитела в комбинации с химиотерапией улучшают результаты лечения по сравнению с одной химиотерапией. Обладая разными механизмами действия и отличающимся токсическим профилем, их совместное применение выглядело перспективным. Многоцентровое исследование III фазы PACCE предполагало рандомизацию больных в группы химиотерапия + бева- цизумаб 5 мг/кг или химиотерапия + бевацизумаб 5 мг/кг + панитумумаб 6 мг/кг. В качестве химиотерапии приме- няли как режимы на основе оксалиплатина (823 пациента), так и иринотекана (230). Основной задачей исследования было улучшение выживаемости до прогрессирования в группе с оксалиплатином. Исследование было досрочно приостановлено после планового промежуточного анализа, который показал ухудшение выживаемости до прогрессирования с 11,4 мес до 10,0 мес (HR=1,27; 95% ДИ 1,06–1,52) и продолжительности жизни с 24,5 мес до 19,4 мес в группе панитумумаб + бевацизумаб по сравнению с одним бевацизумабом [14]. Первоначально негативные результаты исследования объясняли большей токсичностью в экспериментальной группе: частота кожной сыпи III–IV степени увеличилась с 1% до 36%, диареи III–IV степени – с 13% до 24%, инфекции III–IV степени – с 10% до 19%. Однако в сходном исследовании CAIRO-2, в котором сравнивали режимы XELOX + бевацизумаб или XELOX + бевацизумаб + цетуксимаб, выживаемость до прогрессирования в группе с цетуксимабом также оказалась ниже [15]. При этом токсичность в обеих группах была сравнимой. По-видимому, существует определенный антагонизм между двумя классами таргетных препаратов, механизм которого еще следует установить.
Имеющиеся данные 2 исследований свидетельствуют о недопустимости одновременного применения бевацизумаба и анти-EGFR антител (панитумумаба и цетуксимаба).
Кожная токсичность панитумумаба: профилактика, лечение
Кожная токсичность является типичной для панитуму- маба и развивается у подавляющего(более 90%) большинства больных, включая 10–12% III–IV степени [8, 13]. Патогенез кожной токсичности не известен. Известно, что высокая экспрессия EGFR наблюдается в кератиноцитах, кожных и волосяных фолликулах. Возможно, что блокирование EGFR приводит к апоптозу в этих клетках. Клинически кожная токсичность представлена (в порядке уменьшения частоты) акнеформной сыпью, сухостью, образованием трещин, паронихий, изменением ногтей. Сыпь обычно появляется в первые 2–4 нед после начала терапии панитумумабом, при продолжении терапии степень ее выраженности часто уменьшается. Специфической терапии не существует. В качестве мер профилактики рекомендуется избегать инсоляции, чаще пользоваться увлажняющими кремами. Топические кортикостероиды эффективны лишь в острой фазе, помогая снять зуд. Длительное их использование может лишь усугубить сухость и вызвать истончение кожи. Выраженная (III–IV степени) кожная токсичность чаще всего ассоциирована с присоединением вторичной бактериальной инфекции и требует местного или системного назначения антибиотиков.
В рандомизированном исследовании II фазы STEPP (Skin Toxicity Evaluation Protocol with Panitumumab) изучали возможность профилактики кожной токсичности посредством раннего назначения терапии (увлажняющее кожу средство, 1% гидрокортизоновая мазь и доксицик- лин внутрь). Пациенты в качестве второй линии химиотерапии получали FOLFIRI + панитумумаб 6 мг/кг каждые 2 нед или иринотекан + панитумумаб 9 мг/кг каждые 3 нед [16]. В исследование были включены 95 больных: часть из них с начала химиотерапии получали описанное выше профилактическое лечение сыпи в течение последующих 6 нед, тогда как у остальных данная терапия начиналась лишь при появлении кожной токсичности. Профилактика кожной токсичности позволила более чем в 2 раза снизить ее частоту (II степень и более: с 62% до 29%) к 6-й не- деле лечения по сравнению с ее отсроченным лечением. Интересно, что кроме кожной токсичности также более чем в 2 раза уменьшилась частота диарей и нейтропений.
Заключение
В лечении МКРР за последнюю пару десятилетий про-изошел значительный прогресс. Кроме появления новых химиотерапевтических препаратов, арсенал химиотера- певта пополнился двумя классами таргетных препаратов – моноклональными антителами, блокирующими неоангиогенез, и EGFR. Одним из представителей последнего является панитумумаб. Панитумумаб представляет собой полностью человеческий IgG2, связывающийся с EGFR. У больных МКРР, получавших ранее оксалиплатин, иринотекан и фторпиримидины, панитумумаб при монотерапии достоверно увеличивает выживаемость до прогрессирования по сравнению с одной симптоматической терапией. В этом же исследовании впервые было показано, что эффект панитумумаба реализуется только у больных без мутации гена K-RAS.
В 2009 г. стали доступны результаты сразу 2 рандомизированных исследований, изучавших роль панитумумаба в комбинации с химиотерапией в 1-й и 2-й линиях МКРР. В обоих исследованиях панитумумаб достоверно увеличил выживаемость до прогрессирования больных без мутации K-RAS. Была также выявлена тенденция и к увеличению продолжительности жизни.
Попытка улучшить результаты лечения МКРР путем совместного применения бевацизумаба и анти-EGFR-антител не увенчалась успехом: в 2 исследованиях показано ухудшение результатов при их одновременном назначении.
В настоящее время панитумумаб для монотерапии заре- гистрирован в Евросоюзе и Российской Федерации у больных МКРР без мутации K-RAS, получавших ранее оксалиплатин, иринотекан и фторпиримидины. Однако, основываясь на результатах успешного применения препарата в 1-й и 2-й линиях, в ближайшее время следует ожидать расширение показаний к его применению.
Авторы: А.А.Трякин, С.А.Тюляндин
Отделение клинической фармакологии и химиотерапии РОНЦ им. Н.Н.Блохина РАМН, Москва
Журнал «Современная онкология №4 2009 г.»
Литература
- Stephenson J, Cohn A, Crawford J et al. Administration of panitumumab (Pmab) every two weeks (Q2W) as a 30-min or 60-min infusion: safety and pharmacokinetics (PK) from a phase 1 study in patients with solid tumors. Gastrointestinal Cancers Symposium, Orlando, 2007; Abstr. 368.
- Weiner L, Belldegrun A, Crawford J et al. Updated results from a dose and schedule study of Panitumumab (ABX-EGF) monotherapy in patients with advanced solid malignancies. Clin Cancer Res 2008; 14: 502–8.
- Hecht J, Patnaik A, Berlin J et al. Panitumumab monotherapy in patients with previously treated metastatic colorectal cancer. Cancer 2007; 110: 980–7.
- Hecht R, Mitchell E, Baranda J et al. Panitumumab (Pmab) efficacy in patients (pts) with metastatic colorectal cancer (mCRC) with low or undetectable levels of epidermal growth factor receptor (EGFr): Final efficacy and KRAS analyses. Gastrointestinal Cancers Symposium, Orlando, 2008; Poster 343.
- Yoshino T, Muro K, Doi T et al. Phase 2 study of Panitumumab (Pmab)monotherapy in Japanese patients (pts) with metastatic colorectal cancer (mCRC) after the failure of fluoropyrimidine, irinotecan (CPT- 11) and oxaliplatin (OHP) chemotherapy. Gastrointestinal Cancers Symposium, Orlando, 2008; Abstr. 366.
- Van Cutsem E, Peeters M, Siena S et al. Open-label phase III trial of panitumumab plus best supportive care compared with best supportive care alone in patients with chemotherapy-refractory metastatic colorectal cancer. J Clin Oncol 2007; 25: 1658–64.
- Amado R, Wolf M, Peeters M et al. Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. J Clin Oncol 2008; 26: 1626–34.
- Douillard J, Siena S, Cassidy J et al. Randomized Phase 3 Study of Panitumumab with FOLFOX4 vs FOLFOX4 Alone as First-line Treatment in Patients with Metastatic Colorectal Cancer: the PRIME Trial. Eur J Cancer 2009; 7(3 suppl): 10LBA.
- Bokemeyer C, Bondarenko I, Hartmann J et al. KRAS status and efficacy of first-line treatment of patients with metastatic colorectal cancer (mCRC) with FOLFOX with or without cetuximab: The OPUS experience. J Clin Oncol 2008; 26: (suppl); abstr 4000.
- Di Nicolantonio F, Martini M, Molinari F et al. Wild-type BRAF is required for response to panitumumab or cetuximab in metastatic colorectal cancer. J Clin Oncol 2008; 26: 5705–12.
- Moroni M, Veronese S, Benvenuti S et al. Gene copy number for epidermal growth factor receptor (EGFR) and clinical response to antiEGFR treatment in colorectal cancer: a cohort study. Lancet Oncol 2005; 6: 279–86.
- Humblet Y, Peeters M, Siena S et al. Association of skin toxicity (ST) severity with clinical outcomes and health-related quality of life (HRQoL) with panitunumab (Pmab). American Society of Clinical Oncology, Chicago, 2007; Abstr. 4038.
- Peeters M, Price T, Hotko Y et al. Randomized phase 3 study of panitumumab with FOLFIRI vs FOLFIRI alone as second-line treatment (tx) in patients (pts) with metastatic colorectal cancer (mCRC). Eur J Cancer 2009; 7(3 suppl): 14LBA.
- Hecht J, Mitchell E, Chidiac T et al. A randomized phase IIIB trial of chemotherapy, bevacizumab, and panitumumab compared with chemotherapy and bevacizumab alone for metastatic colorectal cancer. J Clin Oncol 2008; 27: 672–80.
- Punt C, Tol J, Rodenburg CJ et al. Randomized phase III study of capecitabine, oxaliplatin, and bevacizumab with or without cetuximab in advanced colorectal cancer (ACC), the CAIRO2 study of the Dutch Colorectal Cancer Group (DCCG). J Clin Oncol 2008; 26 (Suppl); abstr LBA4011. Mitchell E, Lacouture M, Shearer H et al. Final STEPP results of prophylacatic versus reactive skin toxicity (ST) treatment (tx) for panitumumab (pmab)-related ST in patients (pts) with metastatic colorectal cancer (mCRC). J Clin Oncol 2009; 27 (18 suppl); abstr CRA4027.
1 мл концентрата содержит:
активное вещество: панитумумаб — 20 мг;
вспомогательные вещества:
натрия ацетата тригидрат — 6,8 мг, натрия хлорид — 5,8 мг, уксусная кислота ледяная — до рН 5,8, вода для инъекций — достаточное количество.
Прозрачная или слегка опалесцирующая бесцветная жидкость; может содержать полупрозрачные или белые аморфные белковые частицы.
Противоопухолевое средство, моноклональные антитела.
Код АТХ: L01XC08
Фармакодинамика
Механизм действия
Панитумумаб представляет собой рекомбинантное человеческое моноклональное антитело (IgG2), обладающее высокой аффинностью и специфичностью к рецепторам эпителиального фактора роста человека (EGFR). Рецептор EGF — это трансмембранный гликопротеин из семейства рецепторов тирозинкиназ I типа, которое включает также EGFR (HER1/c-ErbB-1), HER2, HER3 и HER4. Рецептор EGF стимулирует рост нормальных эпителиальных клеток, включая клетки кожи и волосяных фолликулов, и экспрессируется на различных типах опухолевых клеток.
Панитумумаб связывается с лиганд-связывающим доменом рецептора EGF и ингибирует процесс аутофосфорилирования, который индуцируется всеми известными лигандами рецептора EGF. Связывание панитумумаба с рецептором EGF приводит к интернализации рецептора, ингибированию процессов клеточного роста, индукции апоптоза и уменьшению продукции интерлейкина-8 и фактора роста эндотелия сосудов.
Гены KRAS (гомолог вирусного онкогена крысиной саркомы Кирстена 2) и NRAS (гомолог нейробластомы вирусного онкогена RAS) относятся к семейству онкогенов RAS. Гены KRAS и NRAS
кодируют небольшой гуанозинтрифосфат-связывающий белок, который участвует в трансдукции сигнала. KRAS и NRAS
активируется различными сигналами, в том числе и от рецептора EGF, и в свою очередь, стимулирует синтез других внутриклеточных белков, вовлеченных в процессы клеточной пролиферации, выживаемости и ангиогенеза.
Активирующие мутации генов RAS часто происходят в различных опухолевых клетках человека и играют определенную роль, как в процессе онкогенеза, так и в прогрессии опухоли.
Фармакодинамические эффекты
Исследования in vitro и in vivo на животных показали, что панитумумаб ингибирует рост и выживаемость опухолевых клеток, экспрессировавших EGFR. Не наблюдалось противоопухолевой активности панитумумаба в экспериментах с ксенотрансплантатами опухолей человека, не экспрессировавшими EGFR. Добавление панитумумаба к лучевой, химио- или другой таргетной терапии в исследованиях на животных приводило к усилению противоопухолевого эффекта по сравнению с только лучевой, химио- или таргетной терапией.
Кожные реакции (в том числе проявления на ногтях) отмечались у пациентов, получавших препарат Вектибикс или другие ингибиторы EGFR, и, как известно, ассоциированы с фармакологическими эффектами терапии (см. разделы «Способ применения и дозы» и «Побочное действие»).
Иммуногенность
Как и все терапевтические протеины, панитумумаб обладает потенциальной иммуногенностью. Продукцию анти-панитумумаб антител оценивали с помощью двух различных скрининговых систем иммуноанализа для определения связывающих анти-панитумумаб антител (ИФА — иммуноферментный анализ, который позволяет определить высокоаффинные антитела, и биосенсорный иммуноанализ, позволяющий определить высоко- и низкоаффинные антитела). Пациентам, чья сыворотка оказывалась положительной в любом из двух тестов скринингового иммуноанализа, проводился также биологический тест in vitro для обнаружения нейтрализующих антител.
В качестве монотерапии:
- Выявляемость связывающих антител (за исключением случаев выявления антител до введения препарата и временно положительных) составляла <1%, как было установлено с помощью анализа ИФА методом кислотной диссоциации, и 3,8%, как было установлено с помощью иммунологического анализа Biacore;
- Выявляемость нейтрализующих антител (за исключением случаев выявления антител до введения препарата и временно положительных) составляла <1%;
- При сравнении с пациентами, у которых антитела не вырабатывались, взаимосвязь между наличием анти-панитумумаб антител и изменениями фармакокинетических параметров, эффективности и безопасности препарата не отмечена.
В комбинации с режимами химиотерапии на основе иринотекана или оксалиплатина:
- Выявляемость связывающих антител (за исключением случаев выявления антител до введения препарата) составляла 1%, как было установлено с помощью анализа ИФА методом кислотной диссоциации, и <1%, как было установлено с помощью иммунологического анализа Biacore;
- Выявляемость нейтрализующих антител (за исключением случаев выявления антител до введения препарата) составляла <1%;
- Не было обнаружено никаких доказательств изменения профиля безопасности у пациентов с положительным результатом теста на антитела к препарату Вектибикс.
Определение образования антител зависит от чувствительности и специфичности используемого метода. На положительный результат по определению антител могут оказать влияние различные факторы, включая метод проведения анализа, методику отбора и подготовку образцов, время забора проб, прием сопутствующих лекарственных препаратов и характер основного заболевания, поэтому сравнение частоты возникновения антител к другим препаратам может приводить к недостоверным результатам.
Фармакокинетика
При применении препарата Вектибикс в качестве монотерапии или в комбинации с химиотерапией фармакокинетика препарата носит нелинейный характер.
После однократного введения панитумумаба в виде 1-часовой инфузии площадь под кривой «концентрация-время» (AUC) возрастала в большей степени, чем это характерно при дозопропорциональной зависимости, а клиренс (CL) панитумумаба снижался с 30,6 до 4,6 мл/сут/кг при увеличении дозы от 0,75 до 9 мг/кг. Однако при введении панитумумаба в дозах свыше 2 мг/кг характер увеличения AUC был близок к дозопропорциональной зависимости.
При соблюдении рекомендованного режима дозирования (6 мг/кг 1 раз в 2 недели в виде 1‑часовой инфузии) равновесная концентрация панитумумаба достигается к третьей инфузии при средних значениях максимальной (± стандартное отклонение [SD]) и минимальной концентраций 213 ± 59 и 39 ± 14 мкг/мл, соответственно. Среднее значение (± SD) AUC0-t и клиренса были равны 1306 ± 374 мкг•сут/мл и 4,9 ± 1,4 мл/кг/сут, соответственно. Период полувыведения препарата составил приблизительно 7,5 суток (разброс: от 3,6 до 10,9 суток).
Был выполнен популяционный анализ фармакокинетики с целью оценки потенциального влияния отдельных ковариат на параметры фармакокинетики панитумумаба. Результаты его показали, что возраст (в диапазоне 21-88 лет), пол, раса, функция печени и почек, применение сопутствующих химиотерапевтических препаратов и интенсивность окрашивания мембран EGFR (1+, 2+, 3+) в опухолевых клетках не оказывают явного влияния на фармакокинетику панитумумаба.
Исследований фармакокинетики панитумумаба у пациентов с нарушением функций почек или печени не проводилось.
Лечение метастатического колоректального рака (мКРР) у взрослых пациентов с генами RAS
дикого типа в опухоли:
- в качестве первой линии терапии в комбинации с режимами, содержащими фторурацил, кальция фолинат и оксалиплатин (FOLFOX) или фторурацил, кальция фолинат и иринотекан (FOLFIRI);
- в качестве второй линии терапии в комбинации с режимом, содержащим фторурацил, кальция фолинат и иринотекан (FOLFIRI) у пациентов, получавших ранее химиотерапию первой линии на основе фторпиримидина (исключая иринотекан);
- в качестве монотерапии при неэффективности режимов химиотерапии на основе фторпиримидина, оксалиплатина и иринотекана.
- Пациенты с анамнезом тяжелых или угрожающих жизни реакций гиперчувствительности к действующему веществу или любому из вспомогательных веществ препарата, перечисленных в разделе «Состав» (см. раздел «Особые указания»);
- Пациенты с интерстициальным пневмонитом или фиброзом легких (см. раздел «Особые указания»);
- Комбинация препарата Вектибикс с оксалиплатин-содержащим режимом химиотерапии противопоказана пациентам с мКРР и мутациями в генах RAS или пациентам с мКРР с неуточненным статусом мутаций в генах RAS (см. раздел «Особые указания»);
- Пациенты с почечной и печеночной недостаточностью (эффективность и безопасность применения не установлены);
- Детский возраст до 18 лет (эффективность и безопасность применения не установлены; см. раздел «Способ применения и дозы»);
- Беременность и период грудного вскармливания (эффективность и безопасность применения не установлены; см. раздел «Применение при беременности и в период грудного вскармливания»).
С осторожностью
- У пациентов с кератитом, язвенным кератитом или выраженной сухостью глаз (см. раздел «Особые указания»).
Беременность
Достоверные данные о применении препарата Вектибикс у беременных отсутствуют. В исследованиях на животных была продемонстрирована репродуктивная токсичность препарата. Потенциальный риск ее у человека не известен. Рецептор EGF участвует в контроле пренатального развития плода и играет определенную роль в процессах нормального органогенеза, пролиферации и дифференцировки клеток развивающегося эмбриона. Таким образом, препарат Вектибикс может оказывать потенциальный вред для плода при применении у беременных женщин.
Известно, что человеческие антитела IgG способны проникать через плацентарный барьер, поэтому панитумумаб может проникать из организма матери в развивающийся организм плода. Поэтому женщины с сохранной репродуктивной функцией во время лечения препаратом Вектибикс и в течение 2 месяцев после его окончания должны использовать адекватные меры контрацепции. Если препарат Вектибикс используется в процессе беременности, или беременность развилась на фоне терапии, необходимо разъяснить пациентке потенциальный риск прерывания беременности и потенциальный вред для плода.
Грудное вскармливание
Неизвестно, проникает ли панитумумаб в грудное молоко. Так как человеческие антитела IgG проникают в грудное молоко, можно предположить, что панитумумаб может также проникать в грудное молоко. Возможность всасывания препарата и его потенциальный вред для ребенка не установлены. В период лечения препаратом Вектибикс и в течение 2 месяцев после его окончания кормление грудью не рекомендуется.
Влияние на фертильность
В экспериментах было показано обратимое действие препарата на менструальный цикл и снижение плодовитости самок обезьян. В связи с этим панитумумаб может оказывать влияние на возможность развития беременности у женщин.
Терапию препаратом Вектибикс необходимо проводить под контролем врача, имеющего опыт проведения противоопухолевого лечения. Перед началом терапии препаратом Вектибикс необходимо подтверждение гена RAS
дикого типа (KRAS и NRAS). Мутационный статус гена должен быть определен лабораторией, имеющей опыт соответствующих исследований, с использованием валидированных методик обнаружения мутаций KRAS (в экзонах 2, 3 и 4) и NRAS
(в экзонах 2, 3 и 4).
Режим дозирования
Рекомендуемая доза препарата Вектибикс составляет 6 мг/кг массы тела и вводится 1 раз в 2 недели.
При развитии тяжелых (≥3 степени) дерматологических реакций может потребоваться следующий режим модификации дозы препарата Вектибикс:
| Возникновение кожных симптомов: ≥3 степени1 | Введение препарата Вектибикс | Результат | Коррекция дозы |
| Первый случай возникновения | Отмена 1 или 2 доз | Снижение интенсивности реакции (<3 степени) | Возобновление инфузии в дозе, составляющей 100% от первоначальной дозы |
| Улучшения не наступило | Прекращение | ||
| Второй случай возникновения | Отмена 1 или 2 доз | Снижение интенсивности реакции (<3 степени) | Возобновление инфузии в дозе, составляющей 80% от первоначальной дозы |
| Улучшения не наступило | Прекращение | ||
| Третий случай возникновения | Отмена 1 или 2 доз | Снижение интенсивности реакции (<3 степени) | Возобновление инфузии в дозе, составляющей 60% от первоначальной дозы |
| Улучшения не наступило | Прекращение | ||
| Четвертый случай возникновения | Прекращение | — | — |
1 Реакции 3 степени и выше считаются тяжелыми или жизнеугрожающими
Применение у отдельных популяций пациентов
Безопасность и эффективность препарата Вектибикс не оценивались у пациентов с почечной или печеночной недостаточностью.
Отсутствуют клинические данные, позволяющие обосновать необходимость коррекции дозы препарата в пожилом возрасте.
Дети
Опыт применения препарата Вектибикс у детей отсутствует.
Способ введения
Вектибикс необходимо вводить в виде внутривенной инфузии с помощью инфузионного насоса.
Перед проведением инфузии препарат Вектибикс должен быть разведен специалистом здравоохранения в 9 мг/мл (0,9%) растворе натрия хлорида для инъекций в асептических условиях до получения конечной концентрации не более 10 мг/мл. Не встряхивать или не взбалтывать сильно флакон. Флакон с препаратом Вектибикс следует визуально оценить перед применением. Раствор должен быть бесцветным и может содержать полупрозрачные или белые аморфные белковые частицы (которые удаляются фильтром инфузионной системы). Не следует вводить препарат Вектибикс, описание которого отличается от приведенного выше. При помощи гиподермальной иглы размера 21G или меньше из флакона с препаратом забирается необходимое количество препарата Вектибикс для получения дозы 6 мг/кг, которое затем растворяют в общем объеме 100 мл. Не использовать безыгольные приспособления (например, переходники для флаконов) для извлечения препарата из флакона. Конечная концентрация не должна превышать 10 мг/мл. Дозы выше, чем 1000 мг следует растворить в 150 мл 9 мг/мл (0,9%) раствора натрия хлорида для инъекций. Полученный разведенный раствор необходимо перемешать осторожным переворачиванием, не встряхивать.
Не наблюдалось несовместимости между препаратом Вектибикс и 9 мг/мл (0,9%) раствором натрия хлорида для инъекций в инфузионных пакетах из поливинилхлорида или полиолефина.
Препарат Вектибикс следует вводить в периферический зонд или постоянный катетер через встроенный фильтр с размером пор 0,2 или 0,22 мкм с низкой степенью связывания белков. Рекомендованная длительность инфузии составляет приблизительно 60 минут. Если первая инфузия переносится хорошо, последующие инфузии могут производиться в течение 30-60 минут. Длительность введения препарата в дозах свыше 1000 мг должна составлять приблизительно 90 минут (инструкции по обращению приведены в подразделе «Особые меры предосторожности при применении и утилизации»).
До и после введения препарата Вектибикс, инфузионную систему необходимо промыть раствором натрия хлорида, чтобы избежать смешивания препарата Вектибикс с другими лекарственными препаратами или растворами для внутривенного введения.
В случае возникновения инфузионных реакций может потребоваться снижение скорости инфузии препарата Вектибикс (см. раздел «Особые указания»).
Препарат Вектибикс не должен вводиться струйно или болюсно.
Обзор профиля безопасности препарата
Согласно результатам анализа данных всех пациентов с мКРР, принимавших участие в клинических исследованиях и получавших препарат Вектибикс в режиме монотерапии и в комбинации с химиотерапией (n=2224) наиболее частыми нежелательными реакциями были кожные реакции, наблюдавшиеся приблизительно в 94% случаев. Эти реакции обусловлены фармакологическими свойствами препарата Вектибикс и обычно имеют легкую или среднюю степень тяжести; только в 23% случаев дерматологические реакции носят тяжелый характер (степень тяжести 3, по классификации NCI-CTC) и <1% жизнеугрожающие (степень 4 по NCI-CTC). Медицинские меры в случае кожных реакций, включая рекомендации по коррекции дозы, приведены в разделе «Особые указания».
Наиболее частыми нежелательными реакциями, возникавшими у ≥20% пациентов, были расстройства желудочно-кишечного тракта [диарея (46%), тошнота (39%), рвота (26%), запор (23%) и боль в животе (23%)]; общие реакции [повышенная утомляемость (35%), пирексия (21%)]; нарушения обмена веществ и питания [снижение аппетита (30%)]; инфекции и инвазии [паронихия (20%)]; и патология кожи и подкожной ткани [сыпь (47%), акнеформный дерматит (39%), зуд (36%), эритема (33%) и сухость кожи (21%)].
Табличный перечень нежелательных реакций
|
Нежелательные реакции |
|||
| Класс систем органов по классификации MedDRA |
Очень часто (≥1/10) |
Часто (≥1/100 — <1/10) |
Нечасто (≥1/1000 — <1/100) |
| Инфекции и инвазии |
Конъюнктивит Паронихия1 |
Кожные высыпания пустулезные, воспаление подкожной клетчатки1, инфекция мочевыводящих путей, фолликулит, локализованная инфекция |
Инфекция глаза, инфекция века |
| Нарушения со стороны крови и лимфатической системы | Анемия | Лейкопения | |
| Нарушения со стороны иммунной системы | Гиперчувствительность1 | Анафилактическая реакция2 | |
| Нарушения со стороны обмена веществ и питания |
Гипокалиемия, гипомагниемия, снижение аппетита |
Гипокальциемия, дегидратация, гипергликемия, гипофосфатемия |
|
| Психические нарушения | Бессонница | Тревожность | |
| Нарушения со стороны нервной системы |
Головная боль, головокружение |
||
| Нарушения со стороны органа зрения |
Блефарит, рост ресниц, усиление слезотечения, гиперемия глаза, сухость глаз, зуд глаз, раздражение глаза |
Язвенный кератит1,4, кератит1, раздражение века |
|
| Кардиологические нарушения | Тахикардия | Цианоз | |
| Нарушения со стороны сосудистой системы |
Тромбоз глубоких вен, гипотензия, гипертензия, гиперемия |
||
| Респираторные, торакальные и медиастинальные нарушения |
Диспноэ, кашель |
Тромбоэмболия легочной артерии, носовое кровотечение |
Интерстициальная болезнь легких3, бронхоспазм, сухость слизистой оболочки полости носа |
| Нарушения со стороны пищеварительной системы |
Диарея1, тошнота, рвота, боли в животе, стоматит, запор |
Ректальное кровотечение, сухость во рту, диспепсия, афтозные язвы, хейлит, гастроэзофагеальная рефлюксная болезнь |
Обветренность губ, сухость губ |
| Нарушения со стороны кожи и подкожной клетчатки1 |
Акнеформный дерматит, кожная сыпь, эритема, кожный зуд, сухость кожи, трещины кожи, акне, алопеция |
Язва кожи, эксфолиации кожи, эксфолиативные кожные высыпания, дерматит, папулезные кожные высыпания, зудящие кожные высыпания, эритематозные кожные высыпания, генерализованные кожные высыпания, макулезные кожные высыпания, макулопапулезные кожные высыпания, повреждения кожи, кожная токсичность, корки, гипертрихоз, онихоклазия, нарушение со стороны ногтей, гипергидроз, синдром ладонно-подошвенной эритродизестезии |
Токсический эпидермальный некролиз1,4, синдром Стивенса-Джонсона1,4, некроз кожи1,4, ангионевротический отек1, гирсутизм, вросший ноготь, онихолиз |
| Нарушения со стороны костно-мышечной системы и соединительной ткани | Боль в спине | Боли в конечности | |
| Системные нарушения и осложнения в месте введения |
Утомляемость, пирексия, астения, воспаление слизистых, периферические отеки |
Боли в грудной клетке, боль, озноб |
|
| Травмы, отравления и осложнения процедур | Инфузионная реакция1 | ||
| Изменения результатов лабораторных и инструментальных исследований | Снижение массы тела | Снижение концентрации магния в крови |
1 См. подраздел «Описание отдельных нежелательных реакций».
2 См. раздел «Особые указания» (инфузионные реакции).
3 См. раздел «Особые указания» (осложнения со стороны легких).
4 Некроз кожи, синдром Стивенса-Джонсона, токсический эпидермальный некролиз и язвенный кератит являются нежелательными реакциями панитумумаба, отмечавшимися в процессе его применения после регистрации. Максимальная частота этих нежелательных реакций оценивалась на основе верхней границы 95% доверительного интервала для точечной оценки с учетом рекомендаций регуляторных органов для оценки частоты нежелательных реакций в спонтанных сообщениях. Максимальное значение частоты, рассчитанное на основе верхней границы 95% доверительного интервала для точечной оценки, составило 3/2224 (или 0,13%).
Профиль безопасности препарата Вектибикс в комбинации с химиотерапией согласуется с зарегистрированными нежелательными реакциями препарата Вектибикс (используемого в монотерапии) и проявлениями фоновой токсичности химиотерапии. Новых проявлений токсичности или усугубления ранее известных проявлений токсичности помимо ожидаемых аддитивных эффектов не наблюдалось. Кожные реакции соответствовали наиболее часто отмечавшимся нежелательным реакциям у пациентов, получавших панитумумаб, в комбинации с химиотерапией. Другими проявлениями токсичности, отмечавшимися с большей частотой по сравнению с использованием препарата в монотерапии, являлись гипомагниемия, диарея и стоматит. Эти проявления токсичности нечасто приводили к досрочному завершению терапии препаратом Вектибикс или химиотерапии.
Описание отдельных нежелательных реакций
Нарушения со стороны пищеварительной системы
В большинстве случаев диарея имела легкую или умеренную степень тяжести. Сообщалось о тяжелых случаях диареи (степень 3 и 4 по NCI-CTC) у 2% пациентов, принимавших препарат Вектибикс в качестве монотерапии, и у 16% пациентов, принимавших препарат Вектибикс в комбинации с химиотерапией.
Сообщалось о развитии острой почечной недостаточности на фоне диареи тяжелой степени и обезвоживания (см. раздел «Особые указания»).
Инфузионные реакции
Во всех клинических исследованиях моно- и комбинированной терапии мКРР (n=2224) реакции на инфузию (развивающиеся в течение 24 часов с момента первого введения препарата), симптомами/признаками которых могли являться озноб, повышение температуры тела или диспноэ, отмечались приблизительно у 5% пациентов, получавших препарат Вектибикс, из которых 1% были тяжелыми (3 и 4 степени NCI-CTC).
Сообщалось о случае развития летального ангионевротического отека у пациента с рецидивирующим метастатическим плоскоклеточным раком головы и шеи, леченого препаратом Вектибикс. Фатальное осложнение развилось при возобновлении терапии после предшествующего эпизода развития ангионевротического отека. Обе реакции зафиксированы спустя более 24 часов после введения препарата (см. разделы «Противопоказания» и «Особые указания»). О реакциях гиперчувствительности, развившихся более чем через 24 часа после инфузии, также сообщалось и в пострегистрационный период.
Данные клинического ведения реакций на инфузию приведены в разделе «Особые указания».
Нарушения со стороны кожи и подкожно-жировой клетчатки
Кожная сыпь, наиболее часто локализованная на лице, верхней части грудной клетки и спине, однако в некоторых случаях распространялась и на конечности. Как следствие тяжелых дерматологических реакций отмечали также развитие инфекционных осложнений, таких как сепсис, в редких случаях с летальным исходом, воспаление подкожной клетчатки и местные абсцессы, требующие хирургического вмешательства и дренирования. Медиана времени до развития первых проявлений дерматологических реакций составила 10 дней, а медиана времени до их разрешения с момента последнего введения препарата Вектибикс — 31 день.
Паронихиальное воспаление сопровождалось припухлостью латеральных ногтевых валиков пальцев рук и ног.
Дерматологические реакции (включая воздействие на ногти), наблюдавшиеся у пациентов, получавших препарат Вектибикс или другие ингибиторы EGFR, являются известными фармакологическими эффектами данных препаратов.
Во всех клинических исследованиях кожные реакции наблюдались приблизительно у 94% пациентов, получавших препарат Вектибикс в качестве монотерапии или в комбинации с химиотерапией (n=2224). В основном это были сыпь и угревидный дерматит почти всегда легкого или умеренного характера. О тяжелых кожных реакциях (степень 3 по NCI‑CTC) сообщалось у 23% пациентов, а о жизнеугрожающих кожных реакциях (степень 4 по NCI-CTC) — у <1% пациентов. У пациентов, получавших препарат Вектибикс, регистрировались жизнеугрожающие и летальные инфекционные осложнения, включавшие некротизирующий фасциит и сепсис (см. раздел «Особые указания»).
Данные клинического ведения дерматологических реакций, включая рекомендации по изменению дозы, приведены в разделе «Особые указания».
В пострегистрационный период применения сообщалось о редких случаях развития некрозов кожи, синдрома Стивенса-Джонсона и токсического эпидермального некролиза (см. раздел «Особые указания»).
Офтальмологическая токсичность
Сообщалось о серьезных случаях кератитов и язвенных кератитов, которые могут приводить к перфорации роговицы (см. раздел «Особые указания»).
Другие особые популяции
Не наблюдалось различий в безопасности и эффективности у пациентов пожилого возраста (≥65 лет), получавших монотерапию препаратом Вектибикс. Однако было зарегистрировано увеличение числа серьезных нежелательных реакций у пожилых пациентов, получавших терапию препаратом Вектибикс в комбинации с режимами химиотерапии FOLFIRI (45% по сравнению с 32%) или FOLFOX (52% по сравнению с 37%), по сравнению с получавшими только химиотерапию (см. раздел «Особые указания»). Наиболее частыми серьезными нежелательными явлениями были диарея у пациентов, получавших препарат Вектибикс в комбинации с режимами FOLFOX или FOLFIRI, дегидратация и тромбоэмболия легочной артерии — у пациентов, получавших препарат Вектибикс в комбинации с режимом FOLFIRI.
Нет данных, касающихся безопасности применения препарата Вектибикс пациентами с почечной и печеночной недостаточностью.
В клинических исследованиях препарат использовался в дозах до 9 мг/кг. Были зарегистрированы случаи превышения рекомендованной терапевтической дозы (12 мг/кг) приблизительно в 2 раза. Наблюдались нежелательные эффекты, такие как токсические реакции со стороны кожи, диарея, дегидратация и повышенная утомляемость, что соответствовало профилю безопасности препарата в рекомендованной дозе.
Данные исследования о взаимодействии препарата Вектибикс и иринотекана у пациентов с мКРР показали, что фармакокинетические свойства иринотекана и его активного метаболита, SN-38, не меняются при одновременном введении препаратов. Результаты перекрестного сравнительного исследования показали, что схемы, включающие в себя иринотекан (IFL или FOLFIRI), не влияют на фармакокинетические свойства панитумумаба.
Вектибикс не должен назначаться в комбинации с режимом химиотерапии IFL или режимами химиотерапии, включающими бевацизумаб. При назначении панитумумаба в комбинации с IFL, наблюдалась высокая частота возникновения диареи тяжелой степени (см. раздел «Особые указания») и увеличивалась частота токсичности и летальных исходов при назначении панитумумаба в комбинации с режимом химиотерапии, включавшей бевацизумаб (см. раздел «Особые указания»).
Комбинация препарата Вектибикс с химиотерапией на основе оксалиплатина противопоказана пациентам с мКРР и мутациями RAS, а также пациентам с мКРР с неизвестным статусом RAS. В клиническом исследовании у пациентов с мутациями RAS в опухоли, которые получали панитумумаб и химиотерапию FOLFOX, отмечалось укорочение выживаемости без прогрессирования заболевания и общей выживаемости (см. раздел «Особые указания»).
Фармацевтическая несовместимость
Данный препарат не следует применять с другими лекарственными средствами, кроме указанных в подразделе «Особые меры предосторожности при применении и утилизации».
Отслеживаемость
С целью улучшения отслеживаемости биологических лекарственных препаратов следует точно записывать название и номер серии вводимого препарата.
Нежелательные реакции со стороны мягких тканей и кожи
Дерматологические реакции — фармакологический эффект, характерный для ингибиторов EGFR, регистрируются практически у всех пациентов (приблизительно 94%), получающих препарат Вектибикс. Тяжелые кожные реакции (3 степени согласно классификации NCI‑CTC) отмечались у 23% пациентов, жизнеугрожающие кожные реакции (4 степени NCI-CTC) — у <1% пациентов, принимавших препарат Вектибикс в качестве монотерапии и в комбинации с химиотерапией (n=2224) (см. раздел «Побочное действие»). При развитии у пациента кожных реакций степени 3 (Общие терминологические критерии оценки нежелательных явлений CTCAE, версия 4.0) или более выраженной степени, либо расцененных как непереносимые, см. рекомендации по модификации дозы в разделе «Способ применения и дозы».
В клинических исследованиях после развития тяжелых кожных реакций (в том числе стоматита) имели место инфекционные осложнения, в том числе сепсис и некротизирующий фасциит, которые в редких случаях приводили к смерти, а также к образованию абсцессов, требовавших вскрытия и дренирования. Пациенты, у которых отмечались тяжелые кожные реакции или проявления токсичности со стороны мягких тканей, либо демонстрировавшие усугубление данных реакций на фоне терапии препаратом Вектибикс, должны наблюдаться на предмет развития воспалительных или инфекционных последствий (в том числе воспаление подкожной клетчатки и некротизирующего фасциита), а при наличии соответствующих клинических показаний должна быть начата соответствующая терапия. Жизнеугрожающими и летальными инфекционными осложнениями являлись некротизирующий фасциит и сепсис, которые отмечались у пациентов, получавших препарат Вектибикс. Редкие случаи синдрома Стивенса-Джонсона и токсического эпидермального некролиза отмечались у пациентов в пострегистрационном периоде, принимавших препарат Вектибикс. Временная отмена или прекращение применения препарата Вектибикс необходимы при развитии кожной токсичности или токсичности мягких тканей, ассоциированных с развитием тяжелых или жизнеугрожающих воспалительных или инфекционных осложнений.
Лечение и ведение дерматологических реакций должно быть основано на тяжести проявлений и может включать в себя увлажняющие, солнцезащитные средства (солнцезащитный фильтр >15 UVA и UVB), а также кремы с глюкокортикостероидами (не выше 1% гидрокортизона) для применения на пораженных участках и/или пероральные антибиотики (например, доксициклин). Также пациентам с признаками сыпи/дерматологической токсичности рекомендуется использовать солнцезащитные средства и головные уборы, ограничить пребывание на солнце, поскольку солнечный свет может усилить любые возможные кожные реакции.
Пациентам может быть рекомендовано наносить увлажняющие, солнцезащитные средства на лицо, руки, ноги, шею, спину и грудь каждое утро, а на ночь наносить крем, содержащий глюкокортикостероид, на лицо, руки, ноги, шею, спину и грудь во время проведения лечения.
Осложнения со стороны легких
Пациенты с наличием в анамнезе или имеющие признаки интерстициального пневмонита или фиброза легких исключались из клинических исследований. Случаи интерстициальных заболеваний легких с летальными исходами и без, возникали, преимущественно, в японской популяции. Поэтому при остром возникновении или ухудшении легочных симптомов лечение препаратом Вектибикс должно быть приостановлено и незамедлительно начато изучение возникших симптомов. При обнаружении интерстициальных заболеваний легких препарат Вектибикс следует временно отменить и назначить соответствующее лечение. У пациентов с интерстициальным пневмонитом или легочным фиброзом в анамнезе необходимо оценить отношение вероятной пользы применения препарата к риску осложнений со стороны легких.
Нарушения водно-электролитного баланса
У некоторых пациентов отмечалось прогрессивное снижение сывороточных концентраций магния, приводившее к тяжелой (степень 4) гипомагниемии. Необходим периодический мониторинг состояния пациентов на предмет развития гипомагниемии и сопутствующей гипокальциемии перед началом лечения препаратом Вектибикс, и после лечения до 8 недель после его окончания (см. раздел «Побочное действие»). При необходимости рекомендован прием препаратов магния.
Также отмечались нарушения баланса других электролитов, включая гипокалиемию. Рекомендуется мониторинг и соответствующий адекватный прием данных электролитов.
Инфузионные реакции
В клинических исследованиях монотерапии и комбинированной терапии мКРР (n=2224), инфузионные реакции, в том числе тяжелые инфузионные реакции (возникавшие в течение 24 часов после инфузии), отмечались у пациентов, получавших препарат Вектибикс (степень 3 и 4 по NCI-CTC).
В пострегистрационных исследованиях сообщалось о серьезных инфузионных реакциях, включая редкие пострегистрационные сообщения о летальных исходах. В случае возникновения тяжелой или жизнеугрожающей реакции в процессе инфузии или в любое время после ее завершения [например, при возникновении бронхоспазма, ангионевротического отека, гипотензии, потребности в парентеральной терапии или анафилаксии], необходимо полностью отменить препарат Вектибикс (см. разделы «Противопоказания» и «Побочное действие»).
У пациентов с легкими или умеренными (степень 1 и 2 по CTCAE версии 4.0) инфузионными реакциями следует уменьшить скорость инфузии на протяжении всей инфузии. Рекомендуется сохранять сниженную скорость инфузии в ходе всех последующих инфузий.
Сообщалось о реакциях гиперчувствительности, возникавших более чем через 24 часа после инфузии, включая ангионевротический отек со смертельным исходом, развившийся более чем через 24 часа после инфузии. Следует предупредить пациентов о возможности позднего развития реакции и проинструктировать обращаться к своему лечащему врачу в случае возникновения симптомов реакции гиперчувствительности.
Острая почечная недостаточность
Острая почечная недостаточность отмечена у пациентов с тяжелой диареей и дегидратацией. Пациенты должны быть проинструктированы о необходимости немедленно обратиться за медицинской помощью при развитии тяжелой диареи.
Препарат Вектибикс в комбинации с химиотерапией на основе иринотекана, фторурацила болюсно и кальция фолината (режим IFL)
У пациентов, получавших препарат Вектибикс в комбинации с режимом IFL [болюсное введение фторурацила (500 мг/м2), кальция фолината (20 мг/м2) и иринотекана (125 мг/м2)], отмечалась высокая частота тяжелой диареи (см. раздел «Побочное действие»). Поэтому следует избегать использования препарата Вектибикс в комбинации с режимом IFL (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Препарат Вектибикс в комбинации с бевацизумабом и режимами химиотерапии
У пациентов, получавших препарат Вектибикс в комбинации с бевацизумабом и химиотерапией, отмечалось укорочение выживаемости без прогрессирования заболевания и повышение частоты летальных исходов. Кроме того, в группах терапии препаратом Вектибикс в комбинации с бевацизумабом и химиотерапией отмечалось повышение частоты тромбоэмболии легочной артерии, инфекций (преимущественно кожных), диареи, электролитных нарушений, тошноты, рвоты и дегидратации. Препарат Вектибикс не должен применяться в комбинации с химиотерапией, включающей бевацизумаб (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Препарат Вектибикс в комбинации с химиотерапией на основе оксалиплатина у пациентов с мКРР и мутациями RAS, а также с неуточненным статусом RAS
Комбинация препарата Вектибикс с химиотерапией на основе оксалиплатина противопоказана пациентам с мКРР и мутациями RAS, а также пациентам с мКРР с неуточненным статусом мутаций генов RAS (см. раздел «Противопоказания»).
Отмечалось сокращение выживаемости без прогрессирования заболевания (ВБП) и общей выживаемости (OВ) у пациентов с мутациями KRAS
(в экзоне 2) в опухоли и дополнительными мутациями RAS (KRAS
[в экзонах 3 и 4] или NRAS [в экзонах 2, 3, 4]), получавших панитумумаб в комбинации с инфузионным режимом, содержащим фторурацил, кальция фолинат и оксалиплатин (FOLFOX) по сравнению с пациентами, получавшими только FOLFOX.
Оценка мутационного статуса RAS должна определяться с использованием валидированного метода в лаборатории, имеющей опыт выполнения подобных исследований (см. раздел «Способ применения и дозы»). Если препарат Вектибикс должен использоваться в комбинации с режимом FOLFOX, рекомендуется определение мутационного статуса в лаборатории, принимающей участие в программе внешнего обеспечения качества оценки статуса RAS, либо дикий тип должен быть подтвержден результатами двукратного анализа.
Офтальмологическая токсичность
Отмечались серьезные случаи кератита и язвенного кератита, которые могут приводить к перфорации роговицы. Пациенты, у которых отмечаются признаки и симптомы, свидетельствующие о наличии кератита, в том числе острые или усугубляющиеся: воспалительные изменения глаза, слезотечение, светобоязнь, снижение четкости зрения, боли в глазу и/или покраснения глаза, должны быть немедленно направлены к офтальмологу.
При подтверждении диагноза язвенного кератита терапию препаратом Вектибикс необходимо временно или полностью прекратить. При постановке диагноза кератита необходимо тщательно соотнести пользу и риски продолжения терапии.
Препарат Вектибикс должен использоваться с осторожностью у пациентов, имевших в анамнезе кератит, язвенный кератит или выраженную сухость глаза. Использование контактных линз также является фактором риска развития кератита и изъязвлений.
Пациенты с показателем общего состояния 2 по шкале ECOG, получавших препарат Вектибикс в комбинации с химиотерапией
Для пациентов с мКРР, имеющих показатель 2 по шкале ECOG, рекомендуется проведение оценки соотношения польза-риск до начала применения препарата Вектибикс в комбинации с химиотерапией. У пациентов со статусом ECOG 2 не выявлено положительное соотношение польза-риск.
Пожилые пациенты
Различий безопасности или эффективности препарата Вектибикс в монотерапии у пациентов пожилого возраста (≥65 лет) не наблюдалось. Однако отмечалось увеличение количества серьезных нежелательных реакций у пожилых пациентов, получавших препарат Вектибикс в комбинации с химиотерапией FOLFIRI или FOLFOX, по сравнению с применением только режимов химиотерапии (см. раздел «Побочное действие»).
Предупреждение о вспомогательных веществах
Данный препарат содержит 3,45 мг натрия в 1 мл, что соответствует 0,17% от рекомендованного ВОЗ максимального суточного потребления натрия для взрослого человека, составляющего 2 г.
Особые меры предосторожности при применении и утилизации
Препарат Вектибикс следует вводить в периферический зонд или постоянный катетер через встроенный фильтр с размером пор 0,2 или 0,22 мкм с низкой степенью связывания белков.
Разведенный раствор
Вектибикс не содержит антимикробных консервантов или бактериостатических агентов. Препарат должен быть использован непосредственно после разведения. Если препарат не был использован сразу после разведения, пользователь несет ответственность за время и условия его хранения до следующего введения (не более 24 часов при температуре 2°C — 8°C). Не замораживать разведенный раствор.
Препарат Вектибикс предназначен только для однократного использования.
Флакон и оставшийся в нем раствор лекарственного препарата необходимо утилизировать после однократного применения.
Весь неиспользованный остаток препарата и расходные материалы должны утилизироваться в соответствии с надлежащими требованиями.
Вектибикс может оказывать влияние на способность управлять транспортными средствами и на работу с механизмами. В случае развития нежелательных реакций со стороны органов зрения и/или снижения способности к концентрации внимания и быстроты реакции, пациентам рекомендуется воздержаться от управления транспортными средствами или работы со сложным оборудованием до разрешения указанных нежелательных реакций препарата.
Концентрат для приготовления раствора для инфузий 20 мг/мл.
Флакон содержит 5 мл (100 мг/5 мл) или 20 мл (400 мг/20 мл) концентрата для приготовления раствора для инфузий.
Маркированный флакон из прозрачного стекла гидролитического класса I с эластомерной пробкой, алюминиевым колпачком и отламывающимся полипропиленовым колпачком.
По 1 флакону помещают в контурную ячейковую упаковку и затем в пачку картонную вместе с инструкцией по применению. Для контроля первого вскрытия на каждую пачку наклеивают две прозрачные защитные этикетки, имеющие продольную цветную полосу.
Хранить при температуре от 2°C до 8°C.
Не замораживать.
Хранить в оригинальной упаковке для защиты от света.
Хранить в недоступном для детей месте!
3 года.
Не использовать по истечении срока годности, указанного на упаковке.
Отпускают по рецепту.
Производитель
Производитель готовой лекарственной формы / Фасовщик (первичная упаковка)
Амджен Мэньюфэкчуринг Лимитед,
Роуд 31, Км 24.6, Джанкос, Пуэрто-Рико, 00777, Соединенные Штаты Америки.
Упаковщик (вторичная (потребительская) упаковка) / Выпускающий контроль качества
Амджен Европа Б.В.,
Минервум 7061, NL-4817 ZK Бреда, Нидерланды или
Амджен Технолоджи (Айрлэнд) Анлимитед Компани,
Поттери Роуд, Дан Лэйри, Графство Дублин, Ирландия или
ООО «Добролек», Россия,
115446, г. Москва, Коломенский проезд, д. 13А.
Огранизация, принимающая претензии от потребителей
ООО «Амджен»
123112, Москва, Пресненская набережная, д.8, строение 1, 7 этаж
Тел: +7 (495) 745 0478
Факс: +7 (499) 995 1965
Панитумумаб
Panitumumab
Фармакологическое действие
Панитумумаб представляет собой рекомбинантное человеческое моноклональное антитело (IgG2), обладающее высокой аффинностью и специфичностью к рецепторам эпителиального фактора роста человека (EGFR). Рецептор EGF — это трансмембранный гликопротеин из семейства рецепторов тирозинкиназ I типа, которое включает также EGFR (HER1/c-ErbB-1), HER2, HER3 и HER4. Рецептор EGF стимулирует рост нормальных эпителиальных клеток, включая клетки кожи и волосяных фолликулов, и экспрессируется на различных типах опухолевых клеток.
Панитумумаб связывается с лиганд-связывающим доменом рецептора EGF и ингибирует процесс аутофосфорилирования, который индуцируется всеми известными лигандами рецептора EGF. Связывание панитумумаба с рецептором EGF приводит к интернализации рецептора, ингибированию процессов клеточного роста, индукции апоптоза и уменьшению продукции интерлейкина-8 и фактора роста эндотелия сосудов.
Гены KRAS (гомолог вирусного онкогена крысиной саркомы Кирстена 2) и NRAS (гомолог нейробластомы вирусного онкогена RAS) относятся к семейству онкогенов RAS. Гены KRAS и NRAS кодируют небольшой гуанозинтрифосфат-связывающий белок, который участвует в трансдукции сигнала. KRAS и NRAS активируется различными сигналами, в том числе и от рецептора EGF, и в свою очередь, стимулирует синтез других внутриклеточных белков, вовлечённых в процессы клеточной пролиферации, выживаемости и ангиогенеза.
Активирующие мутации генов RAS часто происходят в различных опухолевых клетках человека и играют определённую роль, как в процессе онкогенеза, так и в прогрессии опухоли.
Фармакодинамика
Исследования in vitro и in vivo на животных показали, что панитумумаб ингибирует рост и выживаемость опухолевых клеток, экспрессировавших EGFR. Не наблюдалось противоопухолевой активности панитумумаба в экспериментах с ксенотрансплантатами опухолей человека, не экспрессировавшими EGFR. Добавление панитумумаба к лучевой, химио- или другой таргетной терапии в исследованиях на животных приводило к усилению противоопухолевого эффекта по сравнению с только лучевой, химио- или таргетной терапией.
Кожные реакции (в том числе проявления на ногтях) отмечались у пациентов, получавших панитумумаб или другие ингибиторы EGFR, и, как известно, ассоциированы с фармакологическими эффектами терапии.
Иммуногенность
Как и все терапевтические протеины, панитумумаб обладает потенциальной иммуногенностью. Продукцию анти-панитумумаб антител оценивали с помощью двух различных скрининговых систем иммуноанализа для определения связывающих анти-панитумумаб антител (ИФА — иммуноферментный анализ, который позволяет определить высокоаффинные антитела, и биосенсорный иммуноанализ, позволяющий определить высоко- и низкоаффинные антитела). Пациентам, чья сыворотка оказывалась положительной в любом из двух тестов скринингового иммуноанализа, проводился также биологический тест in vitro для обнаружения нейтрализующих антител.
В качестве монотерапии:
- Выявляемость связывающих антител (за исключением случаев выявления антител до введения препарата и временно положительных) составляла <1 %, как было установлено с помощью анализа ИФА методом кислотной диссоциации, и 3,8 %, как было установлено с помощью иммунологического анализа Biacore;
- Выявляемость нейтрализующих антител (за исключением случаев выявления антител до введения препарата и временно положительных) составляла <1 %;
- При сравнении с пациентами, у которых антитела не вырабатывались, взаимосвязь между наличием анти-панитумумаб антител и изменениями фармакокинетических параметров, эффективности и безопасности препарата не отмечена.
В комбинации с режимами химиотерапии на основе иринотекана или оксалиплатина:
- Выявляемость связывающих антител (за исключением случаев выявления антител до введения препарата) составляла 1 %, как было установлено с помощью анализа ИФА методом кислотной диссоциации, и <1 %, как было установлено с помощью иммунологического анализа Biacore;
- Выявляемость нейтрализующих антител (за исключением случаев выявления антител до введения препарата) составляла <1 %;
- Не было обнаружено никаких доказательств изменения профиля безопасности у пациентов с положительным результатом теста на антитела к панитумумабу.
Определение образования антител зависит от чувствительности и специфичности используемого метода. На положительный результат по определению антител могут оказать влияние различные факторы, включая метод проведения анализа, методику отбора и подготовку образцов, время забора проб, приём сопутствующих лекарственных препаратов и характер основного заболевания, поэтому сравнение частоты возникновения антител к другим препаратам может приводить к недостоверным результатам.
Фармакокинетика
При применении панитумумаба в качестве монотерапии или в комбинации с химиотерапией фармакокинетика препарата носит нелинейный характер.
После однократного введения панитумумаба в виде 1-часовой инфузии площадь под кривой «концентрация-время» (AUC) возрастала в большей степени, чем это характерно при дозопропорциональной зависимости, а клиренс (CL) панитумумаба снижался с 30,6 до 4,6 мл/сут/кг при увеличении дозы от 0,75 до 9 мг/кг. Однако при введении панитумумаба в дозах свыше 2 мг/кг характер увеличения AUC был близок к дозопропорциональной зависимости.
При соблюдении рекомендованного режима дозирования (6 мг/кг 1 раз в 2 недели в виде 1‑часовой инфузии) равновесная концентрация панитумумаба достигается к третьей инфузии при средних значениях максимальной (± стандартное отклонение [SD]) и минимальной концентраций 213 ± 59 и 39 ± 14 мкг/мл, соответственно. Среднее значение (±SD) AUC0–t и клиренса были равны 1306 ± 374 мкг•сут/мл и 4,9 ± 1,4 мл/кг/сут, соответственно. Период полувыведения препарата составил приблизительно 7,5 суток (разброс: от 3,6 до 10,9 суток).
Был выполнен популяционный анализ фармакокинетики с целью оценки потенциального влияния отдельных ковариат на параметры фармакокинетики панитумумаба. Результаты его показали, что возраст (в диапазоне 21–88 лет), пол, раса, функция печени и почек, применение сопутствующих химиотерапевтических препаратов и интенсивность окрашивания мембран EGFR (1+, 2+, 3+) в опухолевых клетках не оказывают явного влияния на фармакокинетику панитумумаба.
Исследований фармакокинетики панитумумаба у пациентов с нарушением функций почек или печени не проводилось.
Показания
Лечение метастатического колоректального рака (мКРР) у взрослых пациентов с генами RAS дикого типа в опухоли:
- в качестве первой линии терапии в комбинации с режимами, содержащими фторурацил, кальция фолинат и оксалиплатин (FOLFOX) или фторурацил, кальция фолинат и иринотекан (FOLFIRI);
- в качестве второй линии терапии в комбинации с режимом, содержащим фторурацил, кальция фолинат и иринотекан (FOLFIRI) у пациентов, получавших ранее химиотерапию первой линии на основе фторпиримидина (исключая иринотекан);
- в качестве монотерапии при неэффективности режимов химиотерапии на основе фторпиримидина, оксалиплатина и иринотекана.
Противопоказания
- Гиперчувствительность;
- Пациенты с интерстициальным пневмонитом или фиброзом лёгких;
- Комбинация панитумумаба с оксалиплатин-содержащим режимом химиотерапии противопоказана пациентам с мКРР и мутациями в генах RAS или пациентам с мКРР с неуточнённым статусом мутаций в генах RAS;
- Пациенты с почечной и печёночной недостаточностью (эффективность и безопасность применения не установлены);
- Детский возраст до 18 лет (эффективность и безопасность применения не установлены);
- Беременность и период грудного вскармливания (эффективность и безопасность применения не установлены).
С осторожностью
- У пациентов с кератитом, язвенным кератитом или выраженной сухостью глаз.
Беременность и грудное вскармливание
Беременность
Достоверные данные о применении панитумумаба у беременных отсутствуют. В исследованиях на животных была продемонстрирована репродуктивная токсичность препарата. Потенциальный риск её у человека не известен. Рецептор EGF участвует в контроле пренатального развития плода и играет определённую роль в процессах нормального органогенеза, пролиферации и дифференцировки клеток развивающегося эмбриона. Таким образом, панитумумаб может оказывать потенциальный вред для плода при применении у беременных женщин.
Известно, что человеческие антитела IgG способны проникать через плацентарный барьер, поэтому панитумумаб может проникать из организма матери в развивающийся организм плода. Поэтому женщины с сохранной репродуктивной функцией во время лечения панитумумабом и в течение 2 месяцев после его окончания должны использовать адекватные меры контрацепции. Если панитумумаб используется в процессе беременности, или беременность развилась на фоне терапии, необходимо разъяснить пациентке потенциальный риск прерывания беременности и потенциальный вред для плода.
Грудное вскармливание
Неизвестно, проникает ли панитумумаб в грудное молоко. Так как человеческие антитела IgG проникают в грудное молоко, можно предположить, что панитумумаб может также проникать в грудное молоко. Возможность всасывания препарата и его потенциальный вред для ребёнка не установлены. В период лечения панитумумабом и в течение 2 месяцев после его окончания кормление грудью не рекомендуется.
Влияние на фертильность
В экспериментах было показано обратимое действие препарата на менструальный цикл и снижение плодовитости самок обезьян. В связи с этим панитумумаб может оказывать влияние на возможность развития беременности у женщин.
Способ применения и дозы
Режим дозирования индивидуальный, в зависимости от лекарственной формы.
Побочные действия
Обзор профиля безопасности препарата
Согласно результатам анализа данных всех пациентов с мКРР, принимавших участие в клинических исследованиях и получавших панитумумаб в режиме монотерапии и в комбинации с химиотерапией (n = 2224) наиболее частыми нежелательными реакциями были кожные реакции, наблюдавшиеся приблизительно в 94 % случаев. Эти реакции обусловлены фармакологическими свойствами панитумумаба и обычно имеют лёгкую или среднюю степень тяжести; только в 23 % случаев дерматологические реакции носят тяжёлый характер (степень тяжести 3, по классификации NCI-CTC) и < 1 % жизнеугрожающие (степень 4 по NCI-CTC). Медицинские меры в случае кожных реакций, включая рекомендации по коррекции дозы, приведены в разделе «Меры предосторожности».
Наиболее частыми нежелательными реакциями, возникавшими у ≥ 20 % пациентов, были расстройства желудочно-кишечного тракта [диарея (46 %), тошнота (39 %), рвота (26 %), запор (23 %) и боль в животе (23 %)]; общие реакции [повышенная утомляемость (35 %), пирексия (21 %)]; нарушения обмена веществ и питания [снижение аппетита (30 %)]; инфекции и инвазии [паронихия (20 %)]; и патология кожи и подкожной ткани [сыпь (47 %), акнеформный дерматит (39 %), зуд (36 %), эритема (33 %) и сухость кожи (21 %)].
Табличный перечень нежелательных реакций
Нежелательные реакции, наблюдавшиеся у пациентов с мКРР, получавших панитумумаб в качестве монотерапии или в комбинации с химиотерапией в клинических исследованиях (n = 2224), а также в спонтанных сообщениях, приведены ниже. Нежелательные эффекты представлены по степени убывания серьёзности.
|
Нежелательные реакции |
|||
|
Класс систем органов по классификации MedDRA |
Очень часто (≥1/10) |
Часто (≥1/100 — <1/10) |
Нечасто (≥1/1000 — <1/100) |
|
Инфекции и инвазии |
Конъюнктивит Паронихия1 |
Кожные высыпания пустулёзные, воспаление подкожной клетчатки1, инфекция мочевыводящих путей, фолликулит, локализованная инфекция |
Инфекция глаза, инфекция века |
|
Нарушения со стороны крови и лимфатической системы |
Анемия |
Лейкопения |
|
|
Нарушения со стороны иммунной системы |
Гиперчувствительность1 |
Анафилактическая реакция2 |
|
|
Нарушения со стороны обмена веществ и питания |
Гипокалиемия, гипомагниемия, снижение аппетита |
Гипокальциемия, дегидратация, гипергликемия, гипофосфатемия |
|
|
Психические нарушения |
Бессонница |
Тревожность |
|
|
Нарушения со стороны нервной системы |
Головная боль, головокружение |
||
|
Нарушения со стороны органа зрения |
Блефарит, рост ресниц, усиление слезотечения, гиперемия глаза, сухость глаз, зуд глаз, раздражение глаза |
Язвенный кератит1,4, кератит1, раздражение века |
|
|
Кардиологические нарушения |
Тахикардия |
Цианоз |
|
|
Нарушения со стороны сосудистой системы |
Тромбоз глубоких вен, гипотензия, гипертензия, гиперемия |
||
|
Респираторные, торакальные и медиастинальные нарушения |
Диспноэ, кашель |
Тромбоэмболия лёгочной артерии, носовое кровотечение |
Интерстициальная болезнь легких3, бронхоспазм, сухость слизистой оболочки полости носа |
|
Нарушения со стороны пищеварительной системы |
Диарея1, тошнота, рвота, боли в животе, стоматит, запор |
Ректальное кровотечение, сухость во рту, диспепсия, афтозные язвы, хейлит, гастроэзофагеальная рефлюксная болезнь |
Обветренность губ, сухость губ |
|
Нарушения со стороны кожи и подкожной клетчатки1 |
Акнеформный дерматит, кожная сыпь, эритема, кожный зуд, сухость кожи, трещины кожи, акне, алопеция |
Язва кожи, эксфолиации кожи, эксфолиативные кожные высыпания, дерматит, папулезные кожные высыпания, зудящие кожные высыпания, эритематозные кожные высыпания, генерализованные кожные высыпания, макулёзные кожные высыпания, макулопапулёзные кожные высыпания, повреждения кожи, кожная токсичность, корки, гипертрихоз, онихоклазия, нарушение со стороны ногтей, гипергидроз, синдром ладонно-подошвенной эритродизестезии |
Токсический эпидермальный некролиз1,4, синдром Стивенса-Джонсона1,4, некроз кожи1,4, ангионевротический отек1, гирсутизм, вросший ноготь, онихолиз |
|
Нарушения со стороны костно-мышечной системы и соединительной ткани |
Боль в спине |
Боли в конечности |
|
|
Системные нарушения и осложнения в месте введения |
Утомляемость, пирексия, астения, воспаление слизистых, периферические отеки |
Боли в грудной клетке, боль, озноб |
|
|
Травмы, отравления и осложнения процедур |
Инфузионная реакция1 |
||
|
Изменения результатов лабораторных и инструментальных исследований |
Снижение массы тела |
Снижение концентрации магния в крови |
1 См. подраздел «Описание отдельных нежелательных реакций».
2 См. раздел «Меры предосторожности» (инфузионные реакции).
3 См. раздел «Меры предосторожности» (осложнения со стороны лёгких).
4 Некроз кожи, синдром Стивенса-Джонсона, токсический эпидермальный некролиз и язвенный кератит являются нежелательными реакциями панитумумаба, отмечавшимися в процессе его применения после регистрации. Максимальная частота этих нежелательных реакций оценивалась на основе верхней границы 95 % доверительного интервала для точечной оценки с учётом рекомендаций регуляторных органов для оценки частоты нежелательных реакций в спонтанных сообщениях. Максимальное значение частоты, рассчитанное на основе верхней границы 95 % доверительного интервала для точечной оценки, составило 3/2224 (или 0,13 %).
Профиль безопасности панитумумаба в комбинации с химиотерапией согласуется с зарегистрированными нежелательными реакциями панитумумаба (используемого в монотерапии) и проявлениями фоновой токсичности химиотерапии. Новых проявлений токсичности или усугубления ранее известных проявлений токсичности помимо ожидаемых аддитивных эффектов не наблюдалось. Кожные реакции соответствовали наиболее часто отмечавшимся нежелательным реакциям у пациентов, получавших панитумумаб, в комбинации с химиотерапией. Другими проявлениями токсичности, отмечавшимися с большей частотой по сравнению с использованием препарата в монотерапии, являлись гипомагниемия, диарея и стоматит. Эти проявления токсичности нечасто приводили к досрочному завершению терапии панитумумабом или химиотерапии.
Описание отдельных нежелательных реакций
Нарушения со стороны пищеварительной системы
В большинстве случаев диарея имела лёгкую или умеренную степень тяжести. Сообщалось о тяжёлых случаях диареи (степень 3 и 4 по NCI-CTC) у 2 % пациентов, принимавших панитумумаб в качестве монотерапии, и у 16 % пациентов, принимавших панитумумаб в комбинации с химиотерапией.
Сообщалось о развитии острой почечной недостаточности на фоне диареи тяжёлой степени и обезвоживания (см. раздел «Меры предосторожности»).
Инфузионные реакции
Во всех клинических исследованиях моно- и комбинированной терапии мКРР (n = 2224) реакции на инфузию (развивающиеся в течение 24 часов с момента первого введения препарата), симптомами/признаками которых могли являться озноб, повышение температуры тела или диспноэ, отмечались приблизительно у 5 % пациентов, получавших панитумумаб, из которых 1 % были тяжёлыми (3 и 4 степени NCI-CTC).
Сообщалось о случае развития летального ангионевротического отёка у пациента с рецидивирующим метастатическим плоскоклеточным раком головы и шеи, леченого панитумумабом. Фатальное осложнение развилось при возобновлении терапии после предшествующего эпизода развития ангионевротического отёка. Обе реакции зафиксированы спустя более 24 часов после введения препарата (см. разделы «Противопоказания» и «Меры предосторожности»). О реакциях гиперчувствительности, развившихся более чем через 24 часа после инфузии, также сообщалось и в пострегистрационный период.
Данные клинического ведения реакций на инфузию приведены в разделе «Меры предосторожности».
Нарушения со стороны кожи и подкожно-жировой клетчатки
Кожная сыпь, наиболее часто локализованная на лице, верхней части грудной клетки и спине, однако в некоторых случаях распространялась и на конечности. Как следствие тяжёлых дерматологических реакций отмечали также развитие инфекционных осложнений, таких как сепсис, в редких случаях с летальным исходом, воспаление подкожной клетчатки и местные абсцессы, требующие хирургического вмешательства и дренирования. Медиана времени до развития первых проявлений дерматологических реакций составила 10 дней, а медиана времени до их разрешения с момента последнего введения панитумумаба — 31 день.
Паронихиальное воспаление сопровождалось припухлостью латеральных ногтевых валиков пальцев рук и ног.
Дерматологические реакции (включая воздействие на ногти), наблюдавшиеся у пациентов, получавших панитумумаб или другие ингибиторы EGFR, являются известными фармакологическими эффектами данных препаратов.
Во всех клинических исследованиях кожные реакции наблюдались приблизительно у 94 % пациентов, получавших панитумумаб в качестве монотерапии или в комбинации с химиотерапией (n = 2224). В основном это были сыпь и угревидный дерматит почти всегда лёгкого или умеренного характера. О тяжёлых кожных реакциях (степень 3 по NCI‑CTC) сообщалось у 23 % пациентов, а о жизнеугрожающих кожных реакциях (степень 4 по NCI-CTC) — у <1 % пациентов. У пациентов, получавших панитумумаб, регистрировались жизнеугрожающие и летальные инфекционные осложнения, включавшие некротизирующий фасциит и сепсис (см. раздел «Меры предосторожности»).
Данные клинического ведения дерматологических реакций, включая рекомендации по изменению дозы, приведены в разделе «Меры предосторожности».
В пострегистрационный период применения сообщалось о редких случаях развития некрозов кожи, синдрома Стивенса-Джонсона и токсического эпидермального некролиза (см. раздел «Меры предосторожности»).
Офтальмологическая токсичность
Сообщалось о серьёзных случаях кератитов и язвенных кератитов, которые могут приводить к перфорации роговицы (см. раздел «Меры предосторожности»).
Другие особые популяции
Не наблюдалось различий в безопасности и эффективности у пациентов пожилого возраста (≥65 лет), получавших монотерапию панитумумабом. Однако было зарегистрировано увеличение числа серьёзных нежелательных реакций у пожилых пациентов, получавших терапию панитумумабом в комбинации с режимами химиотерапии FOLFIRI (45 % по сравнению с 32 %) или FOLFOX (52 % по сравнению с 37 %), по сравнению с получавшими только химиотерапию (см. раздел «Меры предосторожности»). Наиболее частыми серьёзными нежелательными явлениями были диарея у пациентов, получавших панитумумаб в комбинации с режимами FOLFOX или FOLFIRI, дегидратация и тромбоэмболия лёгочной артерии — у пациентов, получавших панитумумаб в комбинации с режимом FOLFIRI.
Нет данных, касающихся безопасности применения панитумумаба пациентами с почечной и печёночной недостаточностью.
Передозировка
Симптомы
При превышении рекомендованной терапевтической дозы приблизительно в 2 раза наблюдались токсические реакции со стороны кожи, диарея, дегидратация и повышенная утомляемость, что соответствовало профилю безопасности препарата в рекомендованной дозе.
Лечение
Симптоматическая терапия.
Взаимодействие
Данные исследования о взаимодействии панитумумаба и иринотекана у пациентов с мКРР показали, что фармакокинетические свойства иринотекана и его активного метаболита, SN-38, не меняются при одновременном введении препаратов. Результаты перекрёстного сравнительного исследования показали, что схемы, включающие в себя иринотекан (IFL или FOLFIRI), не влияют на фармакокинетические свойства панитумумаба.
Панитумумаб не должен назначаться в комбинации с режимом химиотерапии IFL или режимами химиотерапии, включающими бевацизумаб. При назначении панитумумаба в комбинации с IFL, наблюдалась высокая частота возникновения диареи тяжёлой степени и увеличивалась частота токсичности и летальных исходов при назначении панитумумаба в комбинации с режимом химиотерапии, включавшей бевацизумаб.
Комбинация панитумумаба с химиотерапией на основе оксалиплатина противопоказана пациентам с мКРР и мутациями RAS, а также пациентам с мКРР с неизвестным статусом RAS. В клиническом исследовании у пациентов с мутациями RAS в опухоли, которые получали панитумумаб и химиотерапию FOLFOX, отмечалось укорочение выживаемости без прогрессирования заболевания и общей выживаемости.
Меры предосторожности
Общие указания
Лечение панитумумабом должно производиться под контролем лечащего врача, имеющего опыт назначения противоопухолевых препаратов.
Определение экспрессии немутантного KRAS должно проводиться опытными врачами-лаборантами с использованием валидированной методики.
Нежелательные реакции со стороны мягких тканей и кожи
Дерматологические реакции — фармакологический эффект, характерный для ингибиторов EGFR, регистрируются практически у всех пациентов (приблизительно 94 %), получающих панитумумаб. Тяжёлые кожные реакции (3 степени согласно классификации NCI‑CTC) отмечались у 23 % пациентов, жизнеугрожающие кожные реакции (4 степени NCI-CTC) — у <1 % пациентов, принимавших панитумумаб в качестве монотерапии и в комбинации с химиотерапией (n = 2224). При развитии у пациента кожных реакций степени 3 (Общие терминологические критерии оценки нежелательных явлений CTCAE, версия 4.0) или более выраженной степени, либо расценённых как непереносимые, см. рекомендации по модификации дозы в инструкции соответствующей лекарственной формы.
В клинических исследованиях после развития тяжёлых кожных реакций (в том числе стоматита) имели место инфекционные осложнения, в том числе сепсис и некротизирующий фасциит, которые в редких случаях приводили к смерти, а также к образованию абсцессов, требовавших вскрытия и дренирования. Пациенты, у которых отмечались тяжёлые кожные реакции или проявления токсичности со стороны мягких тканей, либо демонстрировавшие усугубление данных реакций на фоне терапии панитумумабом, должны наблюдаться на предмет развития воспалительных или инфекционных последствий (в том числе воспаление подкожной клетчатки и некротизирующего фасциита), а при наличии соответствующих клинических показаний должна быть начата соответствующая терапия. Жизнеугрожающими и летальными инфекционными осложнениями являлись некротизирующий фасциит и сепсис, которые отмечались у пациентов, получавших панитумумаб. Редкие случаи синдрома Стивенса-Джонсона и токсического эпидермального некролиза отмечались у пациентов в пострегистрационном периоде, принимавших панитумумаб. Временная отмена или прекращение применения панитумумаба необходимы при развитии кожной токсичности или токсичности мягких тканей, ассоциированных с развитием тяжёлых или жизнеугрожающих воспалительных или инфекционных осложнений.
Лечение и ведение дерматологических реакций должно быть основано на тяжести проявлений и может включать в себя увлажняющие, солнцезащитные средства (солнцезащитный фильтр > 15 UVA и UVB), а также кремы с глюкокортикостероидами (не выше 1 % гидрокортизона) для применения на поражённых участках и/или пероральные антибиотики (например, доксициклин). Также пациентам с признаками сыпи/дерматологической токсичности рекомендуется использовать солнцезащитные средства и головные уборы, ограничить пребывание на солнце, поскольку солнечный свет может усилить любые возможные кожные реакции.
Пациентам может быть рекомендовано наносить увлажняющие, солнцезащитные средства на лицо, руки, ноги, шею, спину и грудь каждое утро, а на ночь наносить крем, содержащий глюкокортикостероид, на лицо, руки, ноги, шею, спину и грудь во время проведения лечения.
Осложнения со стороны лёгких
Пациенты с наличием в анамнезе или имеющие признаки интерстициального пневмонита или фиброза лёгких исключались из клинических исследований. Случаи интерстициальных заболеваний лёгких с летальными исходами и без, возникали, преимущественно, в японской популяции. Поэтому при остром возникновении или ухудшении лёгочных симптомов лечение панитумумабом должно быть приостановлено и незамедлительно начато изучение возникших симптомов. При обнаружении интерстициальных заболеваний лёгких панитумумаб следует временно отменить и назначить соответствующее лечение. У пациентов с интерстициальным пневмонитом или лёгочным фиброзом в анамнезе необходимо оценить отношение вероятной пользы применения препарата к риску осложнений со стороны лёгких.
Нарушения водно-электролитного баланса
У некоторых пациентов отмечалось прогрессивное снижение сывороточных концентраций магния, приводившее к тяжёлой (степень 4) гипомагниемии. Необходим периодический мониторинг состояния пациентов на предмет развития гипомагниемии и сопутствующей гипокальциемии перед началом лечения панитумумабом, и после лечения до 8 недель после его окончания. При необходимости рекомендован приём препаратов магния.
Также отмечались нарушения баланса других электролитов, включая гипокалиемию. Рекомендуется мониторинг и соответствующий адекватный приём данных электролитов.
Инфузионные реакции
В клинических исследованиях монотерапии и комбинированной терапии мКРР (n = 2224), инфузионные реакции, в том числе тяжёлые инфузионные реакции (возникавшие в течение 24 часов после инфузии), отмечались у пациентов, получавших панитумумаб (степень 3 и 4 по NCI-CTC).
В пострегистрационных исследованиях сообщалось о серьёзных инфузионных реакциях, включая редкие пострегистрационные сообщения о летальных исходах. В случае возникновения тяжёлой или жизнеугрожающей реакции в процессе инфузии или в любое время после её завершения [например, при возникновении бронхоспазма, ангионевротического отёка, гипотензии, потребности в парентеральной терапии или анафилаксии], необходимо полностью отменить панитумумаб.
У пациентов с лёгкими или умеренными (степень 1 и 2 по CTCAE версии 4.0) инфузионными реакциями следует уменьшить скорость инфузии на протяжении всей инфузии. Рекомендуется сохранять сниженную скорость инфузии в ходе всех последующих инфузий.
Сообщалось о реакциях гиперчувствительности, возникавших более чем через 24 часа после инфузии, включая ангионевротический отёк со смертельным исходом, развившийся более чем через 24 часа после инфузии. Следует предупредить пациентов о возможности позднего развития реакции и проинструктировать обращаться к своему лечащему врачу в случае возникновения симптомов реакции гиперчувствительности.
Острая почечная недостаточность
Острая почечная недостаточность отмечена у пациентов с тяжёлой диареей и дегидратацией. Пациенты должны быть проинструктированы о необходимости немедленно обратиться за медицинской помощью при развитии тяжёлой диареи.
Панитумумаб в комбинации с химиотерапией на основе иринотекана, фторурацила болюсно и кальция фолината (режим IFL)
У пациентов, получавших панитумумаб в комбинации с режимом IFL [болюсное введение фторурацила (500 мг/м2), кальция фолината (20 мг/м2) и иринотекана (125 мг/м2)], отмечалась высокая частота тяжёлой диареи. Поэтому следует избегать использования панитумумабf в комбинации с режимом IFL.
Панитумумаб в комбинации с бевацизумабом и режимами химиотерапии
У пациентов, получавших панитумумаб в комбинации с бевацизумабом и химиотерапией, отмечалось укорочение выживаемости без прогрессирования заболевания и повышение частоты летальных исходов. Кроме того, в группах терапии панитумумабом в комбинации с бевацизумабом и химиотерапией отмечалось повышение частоты тромбоэмболии лёгочной артерии, инфекций (преимущественно кожных), диареи, электролитных нарушений, тошноты, рвоты и дегидратации. Панитумумаб не должен применяться в комбинации с химиотерапией, включающей бевацизумаб.
Панитумумаб в комбинации с химиотерапией на основе оксалиплатина у пациентов с мКРР и мутациями RAS, а также с неуточненным статусом RAS
Комбинация панитумумаба с химиотерапией на основе оксалиплатина противопоказана пациентам с мКРР и мутациями RAS, а также пациентам с мКРР с неуточнённым статусом мутаций генов RAS.
Отмечалось сокращение выживаемости без прогрессирования заболевания (ВБП) и общей выживаемости (OВ) у пациентов с мутациями KRAS (в экзоне 2) в опухоли и дополнительными мутациями RAS (KRAS [в экзонах 3 и 4] или NRAS [в экзонах 2, 3, 4]), получавших панитумумаб в комбинации с инфузионным режимом, содержащим фторурацил, кальция фолинат и оксалиплатин (FOLFOX) по сравнению с пациентами, получавшими только FOLFOX.
Оценка мутационного статуса RAS должна определяться с использованием валидированного метода в лаборатории, имеющей опыт выполнения подобных исследований. Если панитумумаб должен использоваться в комбинации с режимом FOLFOX, рекомендуется определение мутационного статуса в лаборатории, принимающей участие в программе внешнего обеспечения качества оценки статуса RAS, либо дикий тип должен быть подтверждён результатами двукратного анализа.
Офтальмологическая токсичность
Отмечались серьёзные случаи кератита и язвенного кератита, которые могут приводить к перфорации роговицы. Пациенты, у которых отмечаются признаки и симптомы, свидетельствующие о наличии кератита, в том числе острые или усугубляющиеся: воспалительные изменения глаза, слезотечение, светобоязнь, снижение чёткости зрения, боли в глазу и/или покраснения глаза, должны быть немедленно направлены к офтальмологу.
При подтверждении диагноза язвенного кератита терапию панитумумабом необходимо временно или полностью прекратить. При постановке диагноза кератита необходимо тщательно соотнести пользу и риски продолжения терапии.
Панитумумаб должен использоваться с осторожностью у пациентов, имевших в анамнезе кератит, язвенный кератит или выраженную сухость глаза. Использование контактных линз также является фактором риска развития кератита и изъязвлений.
Пациенты с показателем общего состояния 2 по шкале ECOG, получавших панитумумаб в комбинации с химиотерапией
Для пациентов с мКРР, имеющих показатель 2 по шкале ECOG, рекомендуется проведение оценки соотношения польза-риск до начала применения панитумумаба в комбинации с химиотерапией. У пациентов со статусом ECOG 2 не выявлено положительное соотношение польза-риск.
Пожилые пациенты
Различий безопасности или эффективности панитумумаба в монотерапии у пациентов пожилого возраста (≥ 65 лет) не наблюдалось. Однако отмечалось увеличение количества серьёзных нежелательных реакций у пожилых пациентов, получавших панитумумаб в комбинации с химиотерапией FOLFIRI или FOLFOX, по сравнению с применением только режимов химиотерапии.
Влияние на способность к вождению автотранспорта и управлению механизмами
Панитумумаб может оказывать влияние на способность управлять транспортными средствами и на работу с механизмами. В случае развития нежелательных реакций со стороны органов зрения и/или снижения способности к концентрации внимания и быстроты реакции, пациентам рекомендуется воздержаться от управления транспортными средствами или работы со сложным оборудованием до разрешения указанных нежелательных реакций препарата.
Классификация
-
АТХ
L01XC08, L01FE02
-
Фармакологическая группа
-
Коды МКБ 10
Информация о действующем веществе Панитумумаб предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Панитумумаб, содержатся в инструкции производителя, прилагаемой к упаковке.
Панитумумаб
(Panitumumabum)
Содержание
-
Русское название
-
Английское название
-
Латинское название
-
Брутто формула
-
Фармакологическая группа вещества Панитумумаб
-
Код CAS
-
Торговые названия с действующим веществом Панитумумаб
Русское название
Панитумумаб
Английское название
Panitumumab
Латинское название
Panitumumabum (род. Panitumumabi)
Брутто формула
C6398H9878N1694O2016S48
Фармакологическая группа вещества Панитумумаб
Код CAS
339177-26-3
Торговые названия с действующим веществом Панитумумаб
Наш сайт использует файлы cookie, чтобы улучшить работу сайта, повысить его эффективность и удобство. Продолжая использовать сайт rlsnet.ru, вы соглашаетесь с условиями использования файлов cookie.