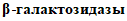Пластина биохимическая, дифференцирующая энтеробактерий (ПБДЭ), выделенных в ходе бактериологического анализа, до вида по 20 биохимическим признакам. Представляет собой полимерную пластину с 20 лунками, содержащими высушенные среды с субстратами для 20 тестов: выявление уреазы, β-D-галактозидазы, лизиндекарбоксилазы, орнитиндекарбоксилазы, аргининдигидролазы; образования сероводорода, индола, ацетоина; ферментацию глюкозы, сахарозы, маннита, малоната, цитрата, цитрата натрия с глюкозой, инозитола, сорбитола, арабинозы, мальтозы.
Состав набора:
1. Платина полимерная с 20 лунками, пластина помещена в полимерный пенал. Каждая лунка содержит субстрат для биохимического дифференцирующего теста.
2. Альфа-нафтол, флакон
3. Пара-диметиламинобензальдегид, флакон.
4. Хлорид железа (3+) гексагидрат, флакон.
5. Калия гидроксид, флакон.
6. Буферный раствор, сухой порошок для приготовления, флакон
7. Вазелиновое масло, флакон.
8. Таблица биохимических свойств энтеробактерий и карта кодов.
Срок годности : 1 год
Вы можете задать любой интересующий вас вопрос по товару или работе магазина.
Наши квалифицированные специалисты обязательно вам помогут.
Все представленные на сайте товары вы можете приобрести как физ. лицо (с ограничениями), так и юр. лицо. Заключаем договоры на комплексную поставку на персональных условиях.
Обратите внимание: изображение товара на сайте может отличаться от фактического изображения товара. При этом качество товара остается неизменным и удовлетворяет заявленным техническим характеристикам в соответствие с нормативной технической документацией.
Производитель оставляет за собой право вносить изменения в конструкцию и комплектацию изделий без предварительного уведомления. Вся представленная на сайте информация, касающаяся продукции, носит информационный характер и ни при каких условиях не является публичной офертой, определяемой положениями Статьи 437 (2) Гражданского кодекса Российской Федерации.
Для получения уточняющей информации, пожалуйста, обращайтесь по телефонам, указанным в разделе «Контакты» или запросом на эл. почту info@himreactiv.ru
Пластины
для биохимической идентификации
энтеробактерий (ПБДЭ)
Внешний
вид:
белая пластиковая пластина-планшет с
20 конусообразными лунками и крышкой.
Каждая лунка содержит субстрат для
биохимического дифференцирующего
теста, стабилизированный поливиниловым
спиртом.
Спецификация
согласно ТУ 9398-019-05941003-2008:
|
Жепеза (III |
кристаллическая |
|
α-нафтол |
кристаллическая |
|
Пара-диметиламинобензалъдегид |
кристаллический |
|
Калия |
белые |
|
Фосфатно-солевой |
кристаллическая |
|
Мacлo |
прозрачная |
|
Микробиологическая |
допустим |
Применение:
пластины рассчитаны на
дифференциацию до вида 20 культур
микроорганизмов семейства Enterobacteriaceae,
выделенных в ходе бактериологического
анализа. Время
анализа – от 18 до 24 часов.
Комплектность
набора:
• Платина
с 20 лунками в пенале.
• Альфа-нафтол,
флакон
• Пара-диметиламинобензальдегид,
флакон.
• Хлорид
железа (3+) гексагидрат, флакон.
• Калия
гидроксид, флакон.
• Буферный
раствор, сухой порошок для приготовления,
флакон
• Вазелиновое
масло, флакон.
• Таблица
биохимических свойств энтеробактерий
и карта кодов.
Условия
хранения: в
соответствии с ТУ ПБДЭ хранят при
температуре от 2 до 25 °С в сухом, защищённом
от света месте. Замораживание не
допускается.
Гарантийный
срок хранения:
12
месяцев.
Страна происхождения: РОССИЯ.
- Цены
- Отзывы
Инструкция Пластина биохимическая дифференцирующая энтеробактерии
Пластина биохимическая дифференцирующая энтеробактерии цена, наличие, где купить?
Ниже вы можете найти самые лучшие цены на Пластина биохимическая дифференцирующая энтеробактерии в России.
Показать цены «Пластина биохимическая дифференцирующая энтеробактерии» на карте
| Аптека | Количество | Цена, р. |
|---|
Отзывы
Отзывы размещают посетители сайта. ИнфоЛек не несет ответственности за информацию в отзывах. Описание препарата предоставлено на нашем сайте для ознакомления и не является руководством к самолечению. Перед применением необходима консультация врача.
СЕЛЕКТИВНЫЕ СРЕДЫ
Среда Эндо
Селективная среда для энтеробактерий. Выпускается в сухом виде. Состоит из агара, основного фуксина, сульфата натрия, фосфата натрия, лактозы.
Для посевов используют свежеприготовленную среду.
В 100 мл дистиллированной воды растворяют 5 г сухой среды, кипятят при постоянном помешивании 2 — 3 мин и разливают по чашкам Петри.
Для предотвращения образования большого количества конденсата среду после кипячения охлаждают до 50 °C. Готовая среда имеет розовый цвет.
Колонии лактозоположительных штаммов красные, лактозоотрицательных — бесцветные или слегка розоватые.
Готовая среда чувствительна к свету, поэтому после приготовления она не подлежит продолжительному хранению. Подсушивать и хранить среду следует в темном месте.
Для подавления роения (подвижности) бактерий рода Proteus, к 100 мл готовой среды Эндо добавляют 3 мл медицинской желчи.
Агар Плоскирева
Селективная среда для сальмонелл.
Выпускается в сухом виде. Состоит из агара с желчными солями, цитрата натрия, тиосульфата натрия, фосфата натрия, лактозы, нейтрального красного, бриллиантового зеленого, соды кальцинированной, йода, хлорида натрия.
Готовая среда прозрачная или розовато-желтого цвета.
Лактозоположительные сальмонеллы образуют колонии красного цвета, лактозоотрицательные — бесцветные.
Висмут-сульфит агар
Селективная среда для сальмонелл.
Выпускается в сухом виде. Состоит из агара, гидролизата рыбы, глюкозы, цитрата висмута, сульфита натрия, соли Мора, фосфата натрия, бриллиантового зеленого.
Готовая среда имеет зеленоватую окраску.
Сальмонеллы, продуцирующие сероводород, образуют черные колонии с прокрашиванием агара под колонией в черный цвет. Сальмонеллы, не продуцирующие сероводород, образуют бесцветные или зеленовато-коричневые колонии.
Среда Левина
Селективная среда для энтеробактерий.
К 100 мл расплавленного и охлажденного до 60-70 °C 2%-го агара Хоттингера (pH 7,2 — 7,4) добавляют 2 мл 0,5%-го водного раствора метиленового синего (подогретого на водяной бане до 60 — 70 °C), 1,5 мл 2%-го раствора эозина, 2 г лактозы и 0,2 г двуосновного фосфорнокислого калия (KH2PO4).
Перемешивают, разливают по чашкам, подсушивают. Перед добавлением в среду раствора красителей стерилизуют текучим паром 3 дня по 30 мин.
Готовая среда имеет фиолетовый цвет.
Колонии эшерихий синего или черного цвета, сальмонелл — бесцветные или розовые, протея — оранжевые, с измененным цветом среда вокруг колонии.
Кровяной агар (5%-ный)
Расправляют определенное количество 2%-ного мясопептонного стерильного агара, охлаждают его до температуры 45 °C и прибавляют дефибринированную или цельную стерильно взятую кровь (к 95 мл агара добавляют 5 мл крови).
Добавляют кровь при соблюдении правил стерильности. Готовую среду разливают в стерильные чашки Петри, дают ей застыть и подсушивают в термостате. Слой агара должен быть равномерно окрашен в красный цвет.
Приложение 5
ДИФФЕРЕНЦИАЛЬНО-ДИАГНОСТИЧЕСКИЕ СРЕДЫ
Среда Штерна
Используют для дифференциации сальмонелл.
К 1000 мл МПБ или бульона Хоттингера добавляют 2,5 мл 10%-го насыщенного спиртового раствора основного фуксина, 16,6 мл 10%-го водного раствора сульфита натрия (Na2SO4) и 10 мл глицерина.
Разливают по пробиркам и стерилизуют 15 мин при 112 °C.
Готовая среда имеет желтую окраску.
Если испытуемая культура относится к Salmonella typhimurium, которая способна ферментировать глицерин, то среда приобретает фиолетовый оттенок.
Среда Биттера
Используют для дифференциации сальмонелл.
В 1000 мл дистиллированной воды растворяют 0,05 г пептона, 0,5 г трехосновного лимоннокислого натрия (цитрат натрия), 5 г хлорида натрия, 5 г рамнозы (или арабинозы). Кипятят на водяной бане 3 — 5 мин, фильтруют через бумажный фильтр. Разливают по пробиркам и стерилизуют 30 мин при 112 °C или текучим паром 3 дня по 30 мин.
Если испытуемая культура относится к сальмонеллам, способным ферментировать рамнозу или арабинозу (S. typhimurium), то при добавлении к суточной культуре (выращенной на данной среде) 2 капель 0,5%-го спиртового раствора метилового красного среда приобретает красную окраску.
Среда для посева по Свену — Гарду
Используют для выявления у сальмонелл специфической фазы жгутикового антигена.
К 1000 мл МПБ или бульона Хоттингера добавляют 8 г агара и растворяют путем кипячения на водяной бане. Устанавливают pH 7,2 — 7,4, фильтруют через бумажный фильтр и стерилизуют 30 мин при 121 °C.
Среды, содержащие органические кислоты
Предназначены для дифференциации сальмонелл по их способности расщеплять органические кислоты (тартраты, мукат, цитрат натрия).
В 1000 мл дистиллированной воды растворяют 10 г пептона, добавляют 8 мл 0,1 н. раствора гидроокиси натрия, 12 мл 0,2%-го водного раствора бромтимолового синего, 10 г D-тартрата (или одну из следующих кислот: 5 г L-тартрата, 5 г мезо-тартрата, 10 г муката, 10 г цитрата натрия). Устанавливают pH 7,4, разливают в пробирки и стерилизуют 20 мин при 112 °C. Готовая среда сине-зеленого цвета.
При положительной реакции в процессе инкубации среда с культурой приобретает зелено-желтую или мутно-белую окраску.
Для получения более отчетливых результатов в конце срока инкубации в пробирки с сомнительной или отрицательной реакцией добавляют несколько капель насыщенного раствора ацетата свинца, в результате при отрицательной реакции выпадает обильный осадок до 2/3 объема среды, при положительной — выпавший осадок незначителен.
Среда с триптофаном
Используют для определения у бактерий наличия триптофандезаминазы.
В 1000 мл дистиллированной воды растворяют 2 г DL-триптофана. Устанавливают pH 6,7 — 6,9.
Для определения способности бактерий к дезаминированию триптофана испытуемую агаровую культуру бактериологической петлей вносят в пробирку 0,5 мл раствора триптофана и инкубируют 30 мин при 37 °C, после чего вносят каплю 10%-го водного раствора хлорида железа трехвалентного (FeCl3).
При положительной реакции среда приобретает темно-красную окраску, при отрицательной — желтую.
Пептон-глицериновый агар
Используют для выявления у серратий пигмента продигиозина.
В 900 мл дистиллированной воды растворяют кипячением 5 г пептона и 20 г агара, после добавляют 10 мл глицерина. Доводят объем до 1000 мл дистиллированной водой и стерилизуют 30 мин при 110 °C.
Приложение 6
СРЕДА БЛАУРОККА (МОДИФИЦИРОВАННАЯ, ПЕЧЕНОЧНАЯ)
Предназначена для выделения и культивирования бифидобактерий.
Состав:
|
печеночный экстракт |
— 1 л; |
|
агар-агар |
— 0,75 г: |
|
пептон сухой (ТУ-13805-76) |
— 10 г; |
|
лактоза (ТУ-6-09-2293-72) |
— 10 г; |
|
цистин |
— 100 мл; |
|
NaCl |
— 5 г. |
Приготовление.
Берут 0,5 кг свежей говяжьей печени, очищают от пленок, измельчают и заливают 1 л дистиллированной воды, кипятят в течение часа. Затем содержимое отстаивают и фильтруют через ватно-марлевый фильтр, доводят дистиллированной водой до первоначального объема.
В полученный печеночный экстракт добавляют предварительно растопленный агар-агар, пептон и цистин, устанавливают pH = 8,1 — 8,2 (для подщелачивания используют 18 — 20%-ный раствор NaOH) и кипятят 15 мин. Затем отстаивают 30 мин и фильтруют. Фильтрат доводят дистиллированной водой до 1 л и добавляют лактозу.
Среду разливают по флаконам 50 — 100 мл и стерилизуют 50 мин текучим паром и 30 мин при 0,5 атм. Перед употреблением среду разливают в пробирки по 10 — 15 мл и прогревают в водяной бане 40 мин при 100 °C.
Показатели среды: аммонийный азот — 70 — 80 мг%, pH = 7,2 — 7,4.
Среда МРС-2 (полужидкая)
Предназначена для выделения и культивирования лактобактерий.
Состав:
агар-порошок по ГОСТ 16280-70;
марганец сернокислый 5H2O по ГОСТ 435-77;
цистеин солянокислый ТУ 6-09 7400-77;
магний сернокислый 7H2O по ГОСТ 4523-77;
калий фосфорнокислый двузамещенный 12H2O по ГОСТ 2493-75;
глюкоза по ГОСТ 18321-77;
пептон сухой ферментативный по ГОСТ 13805-76;
твин-80;
автолизат дрожжевой (дрожжи хлебопекарные по ГОСТ 171-81);
вода дистиллированная по ГОСТ 6709-72;
молоко по Богданову 2:1 (молоко коровье по ГОСТ 13277-79);
натрия гидроокись по ГОСТ 4328-77;
кислота уксусная ледяная по ГОСТ 61-75.
Приготовление.
50,0 мг марганца сернокислого, 200 мл цистеина солянокислого, 200 мг магния сернокислого, 2,0 г калия фосфорнокислого двухзамещенного, 20,0 г глюкозы растворяют в 200 мл дистиллированной воды в порядке записи. Отдельно растворяют 10 г пептона в 100 мл кипящей дистиллированной воды, добавляют 1 мл твина-80. Смешивают обе части среды. Добавляют 50 мл дрожжевого автолизата, 0,5 л молока по Богданову и 0,2 — 0,3%-ного агар-агара.
Устанавливают pH = 6,2 — 6,6 20%-ным раствором NaOH и ледяной уксусной кислотой. Нагревают до кипения. Фильтруют через ватно-марлевый фильтр. Разливают в пробирки и стерилизуют 30 мин при 100 °C и 20 мин при 110 °C.
Приложение 7
ИНСТРУКЦИЯ
ПО ПРИМЕНЕНИЮ ПЛАСТИНЫ БИОХИМИЧЕСКОЙ ДИФФЕРЕНЦИРУЮЩЕЙ
ЭНТЕРОБАКТЕРИИ (ПБДЭ)
(BIOCHEMICAL DIFFERENTIATION PLATE OF ENTEROBAKTERIA)
ПБДЭ — система одноразового использования для дифференциации микроорганизмов семейства энтеробактерий.
ПБДЭ — позволяет определить следующие биохимические свойства: утилизацию цитрата натрия как в присутствии сахара (модификация цитратной среды Симмонса), малоната натрия, глюкозы, лактозы, маннита, сахарозы, инозита, сорбита, арабинозы, мальтозы, образование индола, сероводорода, ацетилметила, карбинола (отношение к реакции Фогеса — Проскауэра), наличие уреазы, 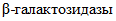
ПБДЭ представляет собой помещенную в планшет панель с 20 конусообразными лунками, на дно которых нанесены соответствующие субстраты с индикаторами, стабилизированные поливиниловым спиртом. Панель и планшет изготовлены из нейтральной полимерной пленки путем вакуум-формования.
Субстраты с индикатором вносят в лунки в жидком виде, затем высушивают и стерилизуют.
Биологические свойства
Специфическое действие препарата заключается в возможности дифференцировать микроорганизмы на основе определения ферментативных систем по их действию на соответствующие субстраты (углеводы, аминокислоты и т.п.).
Назначение
ПБДЭ предназначена для определения биохимической активности микроорганизмов семейства Enterobacteriaceae, выделяемых в ходе бактериологического исследования и дифференциации представителей данного семейства до вида.
Способ применения
Идентификацию культур, выделяемых непосредственно из нативного материала, производят со скошенного мясо-пептонного агара или со среды Олькеницкого (Клиглера). Используют культуры, выращенные в течение (21 +/- 3) ч при температуре (37 +/- 1) °C.
Если выделенная культура микроорганизма находилась какое-либо время на хранении при комнатной температуре или в холодильнике, производят предварительный посев ее на мясо-пептонный бульон. Посевы инкубируют в течение (3 +/- 1) ч при температуре (37 +/- 1) °C, затем осуществляют пересев культуры на скошенный мясо-пептонный агар.
Готовят суспензию культуры микроорганизма в стерильном 0,85% растворе хлористого натрия, pH (6,00 + 0,050) и доводят мутность суспензии до 10 единиц по отраслевому стандартному образцу для визуального определения мутности бактерийных взвесей, стеклянному.
При отсутствии отраслевого стандартного образца в 4 мл стерильного 0,85% раствора хлористого натрия вносят исследуемую (2 — 3 петли) культуру до появления видимой мутности.
Проведение исследования
1. Вскрывают упаковку.
2. Регистрируют на выступающем конце донышка планшета номер засеваемого штамма.
3. Открывают крышку планшета и располагают его на столе.
4. Добавляют пипеткой вместимостью 1 мл по 0,5 мл микробной суспензии во все лунки панели, кроме лунки для обнаружения сероводорода, куда вносят только одну каплю (0,05 мл) суспензии.
5. Заливают лунку для обнаружения сероводорода 0,1 мл растопленного и охлажденного до температуры (39 +/- 1) °C мясо-пептонного бульона, содержащего 0,6% агара. <*>
———————————
<*> Для получения четких результатов необходимо добиться осуществления более быстрой диффузии субстрата в инокулят. Особенно это относится к тесту на выявление сероводорода. Поэтому необходимо перемешать концом раскапывающей пипетки субстрат, инокулят и мясо-пептонный бульон, содержащий 0,<…>% агара, а затем производить требуемые инструкцией манипуляции.
6. Для создания анаэробных условий в лунки для определения наличия лизиндекарбоксилазы, орнитиндекарбоксилазы, аргининдигидролазы и образования сероводорода добавляют 1 — 2 капли стерильного вазелинового масла.
7. Закрывают крышку планшета.
8. Выдерживают ПБДЭ в течение (20 +/- 2) ч при температуре (37 +/- 1) °C.
9. После окончания инкубации открывают крышки планшетов и в лунки добавляют следующие компоненты:
— для выявления фенилаланиндезаминазы добавляют 1 каплю 10%-ого раствора хлорного железа (железо треххлористое 6-водное по ГОСТ 4147-74);
— для определения ацетилметилкарбинола — 1 каплю 6%-ого раствора 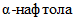
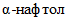
— для выявления индола — 1 каплю реактива Эрлиха.
Учет результатов
1. Учет результатов проводят визуально в соответствии с цветовым указателем, приложенным к ПБДЭ, через (4 +/- 1) и (20 +/- 2) ч инкубации при температуре (37 +/- 1) °C. <**>
———————————
<**> Иногда учет теста на обнаружение 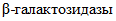
2. Выявление образования ацетилметилкарбинола осуществляют через (15 +/- 5) мин после закапывания реактивов. <***>
———————————
<***> Для избежания явления высыхания лунок за время инкубации в термостате рекомендуется заливать воду в донышко планшета.
Форма выпуска
ПБДЭ, запаянные в полиэтиленовую пленку, уложены в картонные коробки размером 200x120x40 мм по 5 штук или в коробки размером 200x120x80 мм по 10 штук.
Обезвреживание
ПБДЭ обезвреживают автоклавированием в течение 15 мин при температуре (121 +/- 1) °C или в 3%-ном растворе перекиси водорода в течение (18 +/- 3) ч.
Условия хранения и транспортирования
Хранят препарат с относительной влажностью воздуха не более 60% при температуре (20 +/- 5) °C. Срок годности 1 год. Транспортирование всеми видами крытого транспорта.
Рекламации на качество препарата направляют в Государственный научно-исследовательский институт стандартизации и контроля медицинских и биологических препаратов им. Л.А. Тарасевича (121002, Москва, Сивцев Вражек, 41, телефон 241-39-22) и в адрес предприятия, изготовившего препарат (603600, Нижний Новгород, Грузинская, 44, телефон 33-40-07).
Цветовой указатель учета реакции на ПБДЭ
|
N |
Тесты |
Сокращения |
Положительная реакция |
Отрицательная реакция |
|
1. |
Утилизация цитрата натрия |
ЦН |
Зеленый, синий |
Желтый, слабо-зеленый |
|
2. |
Утилизация малоната натрия |
МН |
-«- |
Желтый |
|
3. |
Утилизация цитрата натрия с глюкозой |
ЦНГ |
Зеленый, фиолетовый, бурый |
Желтый, желто-коричневый |
|
4. |
Наличие лизиндекарбоксилазы |
ЛИЗ |
Зеленый, синий |
Желтый, слабо-зеленый |
|
5. |
Наличие аргининдигидролазы |
АРГ |
-«- |
-«- |
|
6. |
Наличие орнитиндекарбоксилазы |
ОРН |
-«- |
-«- |
|
7. |
Наличие фенилаланиндезаминазы |
ФА |
-«- |
-«- |
|
8. |
Образование индола |
ИНД |
Розовый |
Бесцветный |
|
9. |
Образование ацетилметилкарбинола |
АМК |
Розовый, малиновый |
-«- |
|
10. |
Наличие уреазы |
УР |
-«- |
Желтый |
|
11. |
Образование сероводорода |
H2S |
Черный |
Желтый |
|
12. |
Утилизация глюкозы |
ГЛ |
Желтый |
Красный |
|
13. |
Наличие |
|
-«- |
Бесцветный |
|
14. |
Утилизация лактозы |
ЛАК |
-«- |
Красный |
|
15. |
Утилизация маннита |
МТ |
-«- |
-«- |
|
16. |
Утилизация сахарозы |
САХ |
-«- |
-«- |
|
17. |
Утилизация инозита |
ИН |
-«- |
-«- |
|
18. |
Утилизация сорбита |
СОР |
-«- |
-«- |
|
19. |
Утилизация арабинозы |
АР |
-«- |
-«- |
|
20. |
Утилизация мальтозы |
МАЛ |
-«- |
-«- |
Приложение 8
ИНСТРУКЦИЯ
ПО ПРИМЕНЕНИЮ СИСТЕМ ИНДИКАТОРНЫХ БУМАЖНЫХ ДЛЯ ИДЕНТИФИКАЦИИ
МИКРООРГАНИЗМОВ СЕМЕЙСТВА ENTEROBACTERIACEAE (СИБ)
(Indicatory paper systems for identification
of microorganisms of Enterobacteriaceae family)
Системы индикаторные бумажные (СИБ) для идентификации микроорганизмов семейства Enterobacteriaceae представляют собой диски или полоски хроматографической бумаги, содержащие определенные количества субстрата в сочетании с соответствующим индикатором, стабилизированные пленкообразующим покрытием — поливиниловым спиртом.
СИБ используют взамен дифференциально-диагностических сред при изучении биохимических свойств микроорганизмов.
Выпускают в наборе из 13 тестов для межродовой и видовой дифференциации энтеробактерий: СИБ с сорбитом, инозитом, лизином, орнитином, цитратом натрия, малонатом натрия, для выявления 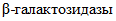
Набор обеспечивает проведение 50 анализов.
Назначение
Определение ферментативной активности микроорганизмов семейства Enterobacteriaceae и их идентификация.
Биологические свойства
Специфическое действие препарата заключается в возможности дифференцировать энтеробактерии на основе определения ферментативных систем по их действию на соответствующие субстраты.
Способ применения
Основные требования, предъявляемые при работе с СИБ:
— исследования проводят с чистой культурой, а также с отдельными колониями непосредственно с чашек с дифференциально-диагностическими средами (среда Эндо, Плоскирева, висмут-сульфит агар);
— в опытные пробирки с 0,9% раствором хлорида натрия (pH 7,3 +/- 0,1) или фосфатно-буферным раствором (pH 5,5 +/- 0,2), в зависимости от изучаемого теста вносят полную петлю культуры, выросшей на поверхности мясо-пептонного агара в течение 18 — 24 ч при температуре (37 +/- 1) °C. При определении утилизации углеводов и многоатомных спиртов может быть использована микробная взвесь в количестве 2 — 3 капель (3 — 4 мл 0,9% раствора хлорида натрия смывают культуру с поверхности скошенного агара);
— погружение дисков в пробирки производят обожженным пинцетом;
— учет результатов реакций предварительный и окончательный, приведен в таблице;
— критерием правильности учета реакции должны быть четкие различия в окраске по сравнению с контролем (за исключением аминокислот, где в опытной пробирке слабое зеленое окрашивание свидетельствует об отрицательном результате, в то время как в контроле диски с аминокислотами окрашены в желтый цвет);
— основные ошибки при применении СИБ возникают при несоблюдении режима pH применяемых питательных сред, при использовании посуды, обработанной различными моющими порошками и недостаточно отмытой;
— для ускоренного получения четких результатов необходимо соблюдение температурного режима термостата (37 +/- 1) °C.
1. Определение оксидазной активности
Культуру, выросшую на поверхности мясо-пептонного агара в течение 18 — 24 ч при температуре (37 +/- 1) °C, растирают петлей на индикаторной бумажке, помещенной в чашку Петри. На одной бумажке можно исследовать 10 — 14 культур (не более).
2. Определение утилизации углеводов и многоатомных спиртов
В пробирке с 0,3 мл стерильного 0,9%-ного раствора хлорида натрия (pH 7,3 +/- 0,1) суспендируют полную петлю культуры, выросшей на поверхности мясо-пептонного агара в течение 18 — 24 ч при температуре (37 +/- 1) °C, или вносят 2 — 3 капли микробной взвеси. Затем погружают диск с соответствующим углеводом или многоатомным спиртом. Среда в пробирках в результате быстрой диффузии в нее индикатора становится красной. В случае необходимости учета газообразования рекомендуется использовать небольшой комочек стерильной гигроскопической ваты, который помещают в пробирку для определения утилизации глюкозы. В качестве контроля служат диски, погруженные в пробирки со стерильным 0,9%-ным раствором хлорида натрия. Инкубируют пробирки при температуре (37 +/- 1) °C.
3. Определение активности
В пробирке с 0,3 мл стерильного 0,9%-ного раствора хлорида натрия (pH 7,3 +/- 0,1) суспендируют полную петлю культуры, выросшей на поверхности мясо-пептонного агара в течение 18 — 24 ч при температуре (37 +/- 1) °C, затем в эту взвесь помещают индикаторный диск и инкубируют при температуре (37 +/- 1) °C. В качестве контроля используют диск, помещенный в пробирку со стерильным 0,9%-ным раствором хлорида натрия.
4. Определение индолообразования с помощью индикаторных
бумажных полосок
В пробирке с 0,3 мл стерильного 0,9%-ного раствора хлорида натрия (pH 7,3 +/- 0,1) суспендируют полную петлю культуры, выросшей на поверхности мясо-пептонного агара в течение 18 — 24 ч при температуре (37 +/- 1) °C. Полоску для обнаружения индола складывают по намеченной на ней линии вдвое и пинцетом опускают на дно пробирки так, чтобы длинный бесцветный конец погрузился в суспензию, а короткий конец, имеющий зеленовато-серую окраску, находился над поверхностью суспензии. Посевы инкубируют при температуре (37 +/- 1) °C. В качестве контроля используют полоску, помещенную в пробирку со стерильным 0,9%-ным раствором хлорида натрия.
5. Определение уреазной активности
В пробирке с 0,3 мл стерильного 0,9%-ного раствора хлорида натрия (pH 7,3 +/- 0,1) суспендируют полную петлю культуры, выросшей на поверхности мясо-пептонного агара в течение 18 — 24 ч при температуре (37 +/- 1) °C, затем в эту взвесь погружают индикаторный диск с мочевиной и инкубируют при температуре (37 +/- 1) °C. В качестве контроля используют диск, помещенный в пробирку со стерильным 0,9%-ным раствором хлорида натрия.
6. Определение активности декарбоксилаз лизина, орнитина
В пробирке с 0,3 мл стерильного фосфатно-солевого буферного раствора (pH 5,5 +/- 0,2) суспендируют полную петлю культуры, выросшей на поверхности мясо-пептонного агара в течение 18 — 24 ч, при температуре (37 +/- 1) °C, затем в эту взвесь погружают индикаторный диск с одной из аминокислот (лизином, орнитином), вносят 0,2 мл стерильного вазелинового масла и инкубируют при температуре (37 +/- 1) °C.
В качестве контроля используют диски с соответствующими аминокислотами, погруженные в пробирки со стерильным фосфатно-солевым буферным раствором (pH 5,5 +/- 0,2) с добавлением 0,2 мл стерильного вазелинового масла.
7. Определение активности фенилаланиндезаминазы
В пробирке с 0,3 мл стерильного 0,9%-ного раствора хлорида натрия (pH 7,3 +/- 0,1) суспендируют полную петлю культуры, выросшей на поверхности мясо-пептонного агара в течение 18 — 24 ч при температуре (37 +/- 1) °C, затем в эту взвесь погружают диск с фенилаланином и инкубируют при температуре (37 +/- 1) °C. В качестве контроля используют диск, помещенный в пробирку со стерильным 0,9-ным раствором хлорида натрия. После инкубации в течение 1 — 2 ч в пробирки помещают индикаторные диски с хлоридом железа (III).
8. Определение образования сероводорода
Индикаторный диск помещают в бактериологическую пробирку на поверхность мясо-пептонного агара, содержащего 0,5 — 0,7% агара микробиологического (pH 7,3 +/- 0,1), засеянного уколом культурой, выросшей на поверхности мясо-пептонного агара в течение 18 — 24 ч при температуре (37 +/- 1) °C, что позволяет одновременно определять подвижность. Пробирки инкубируют при температуре (37 +/- 1) °C. В качестве контроля используют пробирку со стерильным мясо-пептонным агаром, на поверхность которого помещают индикаторный диск.
9. Определение утилизации цитрата и малоната натрия
В пробирке с 0,3 мл стерильного фосфатно-солевого буферного раствора (pH 5,5 +/- 0,2) суспендируют полную петлю культуры, выросшей на поверхности мясо-пептонного агара в течение 18 — 24 ч при температуре (37 +/- 1) °C, затем в эту взвесь погружают индикаторный диск с цитратом или малонатом натрия и инкубируют при температуре (37 +/- 1) °C. В качестве контроля используют диски, помещенные в пробирки со стерильным фосфатно-солевым буферным раствором (pH 5,5 +/- 0,2)
10. Определение ацетилметилкарбинола
(реакция Фогес — Проскауэра)
В пробирке с 0,3 мл стерильного фосфатно-солевого буферного раствора (pH 5,5 +/- 0,2) суспендируют полную петлю культуры, выросшей на поверхности мясо-пептонного агара в течение 18 — 24 ч при температуре (37 +/- 1) °C, затем в эту взвесь помещают субстратный диск, погруженный в пробирку со стерильным 0,9%-ным раствором хлорида натрия. Через 18 — 24 ч инкубации при температуре (37 +/- 1) °C в пробирки закапывают по 1 — 2 капли 6%-ного спиртового раствора 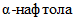
Примечание: 6%-ный раствор 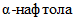
Учет результатов
Учет результатов исследований проводят визуально в соответствии с таблицей.
Учет результатов исследований
|
Тесты |
Цвет субстрата в растворенном виде |
Срок учета результатов |
Результат |
|
|
положительный |
отрицательный |
|||
|
Наличие оксидазы |
серовато-сиреневый |
30 — 60 с |
синее окрашивание |
серое окрашивание |
|
Утилизация углеводов и многоатомных спиртов |
красный |
5 — 18 ч |
окрашивание в желтый или оранжевый цвет |
красный цвет |
|
Наличие |
бесцветный |
1 — 5 ч |
желтый цвет |
окрашивание отсутствует |
|
Образование индола |
бесцветный |
от 40 мин до 2 ч |
окрашивание короткого конца в розово-малиновый цвет |
окрашивание отсутствует |
|
Наличие уреазы |
бесцветный |
от 40 мин до 2 ч |
окрашивание в розово-красный цвет |
окрашивание отсутствует |
|
Наличие декарбоксилаз лизина, орнитина |
желтый |
5 — 18 ч |
окрашивание в синий или интенсивно-зеленый цвет |
желтый или светло-зеленый цвет |
|
Наличие фенилаланиндезаминазы |
бесцветный |
1 — 2 ч |
Через 10 — 15 с после помещения индикаторного диска с хлоридом железа |
|
|
зеленое окрашивание |
окрашивание отсутствует |
|||
|
Образование сероводорода |
кремовый |
5 — 18 ч |
черный цвет |
окрашивание отсутствует |
|
Утилизация цитрата и малоната натрия |
оранжевый |
5 — 18 ч |
малиново-красный |
желтый или оранжевый |
|
Реакция Фогеса — Проскауэра |
бесцветный |
18 — 24 ч |
Через 15 — 20 мин после закапывания по 1 — 2 капли 6%-ного раствора |
|
|
малиново-красный |
окрашивание отсутствует |
Обезвреживание
Использованные СИБ обезвреживают автоклавированием в течение 15 минут при температуре (120 +/- 1) °C или выдерживают в 6%-ном растворе перекиси водорода в течение (18 +/- 1) ч.
Форма выпуска
СИБ-диски выпускаются во флаконах, СИБ-полоски в стеклянных пробирках на 50 анализов.
Набор комплектуют в картонные пачки (12 флаконов и 2 пробирки). К набору СИБ прилагается стерильный фосфатно-солевой буферный раствор (pH 5,5 +/- 0,2).
Условия хранения и транспортирования
Хранить в темном помещении с относительной влажностью воздуха не более 60%, при температуре 4 — 25 °C. Транспортировать всеми видами крытого транспорта при температуре от минус 20 до 25 °C.
Срок годности
Срок годности СИБ 2 года.
Рекламации на качество СИБ направлять в Государственный научно-исследовательский институт стандартизации и контроля медицинских биологических препаратов им. Л.А. Тарасевича (121002, г. Москва, Сивцев Вражек, 41, тел. 241-39-22) и в адрес предприятия, изготовившего препарат (603600, г. Нижний Новгород, Грузинская, 44, тел. 34-19-45).
Скачать документ целиком в формате PDF