Ишемический инсульт и транзиторная ишемическая атака у взрослых
Версия: Клинические рекомендации РФ 2021 (Россия)
Категории МКБ:
Инфаркт мозга (I63), Преходящие транзиторные церебральные ишемические приступы [атаки] и родственные синдромы (G45), Сосудистые мозговые синдромы при цереброваскулярных болезнях (I60-I67+)(G46)
Разделы медицины:
Неврология
Общая информация
Краткое описание
Всероссийское общество неврологов
Национальная ассоциация по борьбе с инсультом
Ассоциация нейрохирургов России
МОО Объединение нейроанестезиологов и нейрореаниматологов
Союз реабилитологов России
Клинические рекомендации
Ишемический инсульт и транзиторная ишемическая атака у взрослых
Возрастная группа: взрослые
Год утверждения: 2021
Определение заболевания или состояния (группы заболеваний или состояний)
Ишемический инсульт — эпизод неврологической дисфункции, вызванный фокальным инфарктом головного мозга.
Инфаркт головного мозга — фокальный ишемический некроз вещества головного мозга.
Критерии:
1. Патологоанатомические, нейровизуализационные или другие объективные данные, свидетельствующие о фокальном ишемическом повреждении в определенном сосудистом бассейне головного мозга или
2. Клинические данные, свидетельствующие о фокальном ишемическом повреждении в определенном сосудистом бассейне головного мозга с симптоматикой, сохраняющейся ≥ 24 часов или до наступления летального исхода, причем другие возможные причины исключены.
Асимптомный («немой») инфаркт головного мозга — нейровизуализационные или патологоанатомические признаки инфаркта без наличия острого неврологического дефицита в анамнезе, связанного с данным очагом. «Немые» инфаркты преимущественно небольших размеров, обнаруживаются в 10 – 38% случаев ишемического инсульта у взрослых пациентов.
Транзиторная ишемическая атака – транзиторный эпизод неврологической или ретинальной дисфункции вследствие фокальной ишемии ГМ без формирования морфологических признаков инфаркта ГМ.
Инсульт, вызванный церебральным венозным тромбозом — инфаркт или кровоизлияние в головном мозге, обусловленный тромбозом церебральных венозных структур. Симптомы или признаки, вызванные обратимым отеком без формирования инфаркта или кровоизлияния, не расцениваются как инсульт [1, 2].
Злокачественный инфаркт мозга — ишемический инсульт, при котором происходит отек инфарктной зоны, что ведет к дислокации структур головного мозга с риском височно-тенториального вклинения. Злокачественное течение характерно для обширных (массивных) форм ишемического инсульта. При злокачественном инфаркте в бассейне средней мозговой артерии зона инфаркта обычно составляет не менее 50% бассейна кровоснабжения средней мозговой артерии [3, 4]. При злокачественном ишемическом инсульте мозжечка зона инфаркта обычно составляет не менее 1/3 полушария мозжечка или не менее 24 см3 [5, 6, 7, 8].
Область фокальной ишемии головного мозга – зона инфаркта и ишемической полутени (пенубры) [9].
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Преходящие (транзиторные) церебральные ишемические приступы (атаки) и родственные им синдромы (G45):
G45.0 — Синдром вертебробазилярной артериальной системы
G45.1 — Синдром сонной артерии (полушарный)
G45.2 — Множественные и двусторонние синдромы церебральных артерий
G45.3 — Преходящая слепота
G45.4 — Транзиторная глобальная амнезия
G45.8 — Другие транзиторные церебральные ишемические атаки и связанные с ними синдромы
G45.9 — Транзиторная церебральная ишемическая атака неуточненная
Сосудистые мозговые синдромы при васкулярно-церебральных болезнях (160-167) (G46*):
G46.0 ⃰ — Синдром средней мозговой артерии (166,0+)
G46.1⃰ — Синдром передней мозговой артерии (166,1+)
G46.2⃰ — Синдром задней мозговой артерии (166,2+)
G46.3 ⃰ — Синдром инсульта в стволе головного мозга (160-167+)
Синдромы: ⃰Бенедикта, ⃰Клода, ⃰Фовилля, ⃰Мийара — Гублера, ⃰Валенберга — Захарченко, ⃰ Вебера и др.
G46.4 ⃰ — Синдром мозжечкового инсульта (160-167+)
G46.5 ⃰ — Чисто двигательный лакунарный синдром (160-167+)
G46.6 ⃰ — Чисто чувствительный лакунарный синдром (160-167+)
G46.7 ⃰ — Другие лакунарные синдромы (160-167+)
G46.8* — Другие сосудистые синдромы головного мозга при васкуло-церебральных болезнях (160-167+)
Инфаркт мозга, вызванный тромбозом прецеребральных артерий (I63.0):
I63.1 — Инфаркт мозга, вызванный эмболией прецеребральных артерий
I63.2 — Инфаркт мозга, вызванный неуточненной закупоркой или стенозом прецеребральных артерий
I63.3 — Инфаркт мозга, вызванный тромбозом мозговых артерий
I63.4 — Инфаркт мозга, вызванный эмболией мозговых артерий
I63.5 — Инфаркт мозга, вызванный неуточненной закупоркой или стенозом мозговых артерий
I63.6 — Инфаркт мозга, вызванный тромбозом вен мозга, непиогенный
I63.8 — Другой инфаркт мозга
I63.9 — Инфаркт мозга неуточненный
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 500 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
В настоящее время общепризнанной классификацией патогенетических подтипов ишемического инсульта является классификация TOAST [45]. Выделяют пять патогенетических подтипов ишемического инсульта: атеротромботический (вследствие атеросклероза крупных артерий), кардиоэмболический, лакунарный (вследствие окклюзии перфорантной артерии), инсульт другой установленной этиологии и инсульт неустановленной этиологии.
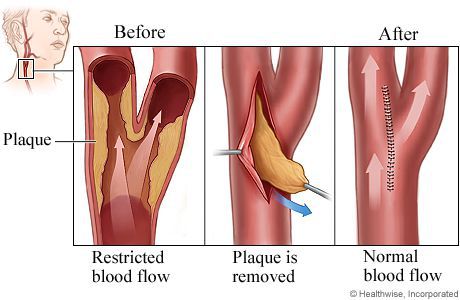
Атеротромботический (вследствие атеросклероза крупных артерий) патогенетический подтип ишемического инсульта диагностируют у пациентов с ипсилатеральным пораженному полушарию стенозом более 50% или окклюзией одной из магистральных артерий головы.
Критерии
Клиническая картина соответствует поражению коры головного мозга (афазия, двигательные нарушения и др.) или мозжечка.
В анамнезе – ТИА в аффектированном артериальном бассейне, шум при аускультации на сонных артериях, снижение их пульсации.
Наличие в анамнезе перемежающейся хромоты.
По данным КТ или МРТ – повреждение коры головного мозга, мозжечка или субкортикальный полушарный инфаркт более 1,5 см в диаметре.
По данным дуплексного сканирования и/или цифровой субтракционной ангиографии — стеноз более 50% или окклюзия интра- или экстракраниальной артерии ипсилатеральной пораженному полушарию.
Исключены потенциальные источники кардиогенной эмболии.
Диагноз атеротромботического патогенетического подтипа ИИ не может быть установлен, если изменения церебральных артерий при дуплексном сканировании или цифровой субтракционной ангиографии минимальны или отсутствуют.
Кардиоэмболический патогенетический подтип ишемического инсульта диагностируют у пациентов с окклюзией церебральных артерий вследствие кардиогенной эмболии.
Критерии
Наличие кардиального источника эмболии высокого или среднего риска (таб. 1).
По данным КТ или МРТ – повреждение коры головного мозга, мозжечка или субкортикальный полушарный инфаркт более 1,5 см в диаметре.
Предшествующие ТИА или ИИ в более чем одном артериальном бассейне.
Исключена потенциальная артериоартериальная эмболия.
Ишемический инсульт у пациентов со средним риском кардиальной эмболии при отсутствии других причин расценивают как кардиоэмболический патогенетический подтип.
Таблица 1. Кардиальные источники эмболии высокого и среднего риска
Лакунарный (вследствие окклюзии мелкой перфорантной артерии) патогенетический подтип ишемического инсульта верифицируют на основании следующих критериев.
Критерии
Наличие в клинической картине одного из традиционных лакунарных синдромов (чисто двигательный инсульт; чисто чувствительный инсульт; сенсомоторный инсульт; синдром дизартрии с неловкостью руки; синдром атактического гемипареза и т.д.) и отсутствие нарушений корковых функций.
Наличие в анамнезе гипертонической болезни или сахарного диабета.
Субкортикальные/стволовые повреждения диаметром менее 1,5 см по данным КТ/МРТ или нейровизуализационные изменения отсутствуют.
Отсутствие потенциальных источников кардиогенной эмболии или стеноза ипсилатеральной мозговой артерии более 50%.
Критериями постановки диагноза инсульта другой установленной этиологии являются.
Пациенты с редкими причинами ишемического инсульта (фибромускулярная дисплазия, васкулит, болезнь моя-моя, гипергомоцистеинемия, серповидноклеточная анемия, тромбофилии, диссекция церебральных артерий, CADASIL, болезнь Фабри, дефицит протеина С или S, мутация Лейдена, антифосфолипидный синдром и др.).
По данным КТ/МРТ головного мозга выявляется инфаркт мозга любого размера и любой локализации
При диагностических исследованиях – выявлена одна из редких причин инфаркта мозга
Исключены кардиальные источники эмболии и атеросклеротическое поражение церебральных артерий.
Инсульт неустановленной этиологии определяют у пациентов с неполным обследованием, с неустановленной причиной ишемического инсульта, а также у пациентов с двумя и более потенциальными причинами инсульта (например, пациент с фибрилляцией предсердий и ипсилатеральным стенозом сонной артерии > 50%).
Эмболический инсульт из неустановленного источника — концепция ИИ с неустановленным источником эмболии (Embolic Stroke of Undetermined Source, ESUS) [46].
Констатируют у пациентов с нелакунарным криптогенным ишемическим инсультом, у которых эмболия является наиболее вероятной причиной инсульта.
Критерии
Ишемический нелакунарный инсульт, выявленный при КТ/МРТ.
Отсутствуют атеросклеротические стенозы с более чем 50% окклюзии экстра- или интракраниальных артерий ипсилатеральных очагу ишемии.
Отсутствуют кардиогенные источники эмболии высокого риска (фибрилляция предсердий, трепетание предсердий, интракардиальные тромбы, протезы клапанов сердца, миксома или другие опухоли сердца, митральный стеноз, недавний (менее 4 недель) инфаркт миокарда, снижение фракции выброса левого желудочка менее с чем 30%, клапанные вегетации или инфекционный эндокардит).
Отсутствуют другие причины инсульта (артериит, диссекция, мигрень/вазоспазм и др.).
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
ТИА/ Артериальный инсульт
Этиологические факторы и патогенез ТИА связаны, в основном, с тремя основными механизмами локальной церебральной ишемии: церебральной эмболией (гетерогенные источники эмболов), стеноокклюзирующими поражениями брахиоцефальных или интракраниальных артерий, которые приводят к локальным нарушениям гемодинамики при временной декомпенсации коллатерального кровотока.
Регресс неврологической симптоматики связан с восстановлением МК (55 мл/100 г/мин) после обратимой локальной ишемии ткани мозга, которая развивается при снижении объемного кровотока до 19 мл/100 г/мин. При дальнейшем снижение МК ниже критического порога ишемии формируется инфаркт мозга, который определяется, преимущественно по данным МРТ головного мозга с использованием диффузионно-взвешенных изображений и градиентных Т2*-взвешенных изображений. Длительность неврологической симптоматики более 30 мин увеличивает вероятность развития инфаркта мозга [10].
Этиология ишемического инсульта подробно представлена в разделе «Классификация церебрального ишемического инсульта».
Патогенез фокальной церебральной ишемии (в бассейне отдельных артерий вследствие тромбоза или эмболии) описывается классической триадой Вирхова: снижение скорости кровотока, повреждение сосудистой стенки и повышение свёртываемости крови. Острая фокальная ишемия мозга вызывает определенную последовательность молекулярно-биохимических изменений в веществе мозга, способных привести к тканевым нарушениям, заканчивающимся гибелью клеток (инфарктом мозга). Характер изменений зависит от величины снижения мозгового кровотока, длительности этого снижения, а также от чувствительности вещества мозга к ишемии.
В норме объемный мозговой кровоток составляет 50 — 55 мл крови на 100 г вещества мозга в минуту. Умеренное снижение кровотока (≈ 40 мл/100 г/мин) сопровождается селективной экспрессией генов и изменением процессов синтеза белка. Более выраженное снижение кровотока (до 30 мл на 100 г/мин) сопровождается активацией анаэробного гликолиза и развитием лактатацидоза. При снижении объемного мозгового кровотока до 20 мл на 100 г/мин развивается глутаматная эксайтотоксичность и увеличивается содержание внутриклеточного кальция, что запускает механизмы структурного повреждения мембран и других внутриклеточных образований. При значительной ишемии (до 10 мл на 100 г/мин) происходит аноксическая деполяризация мембран, гибель клеток обычно наступает в течение 6 — 8 мин [11, 12, 13, 14].
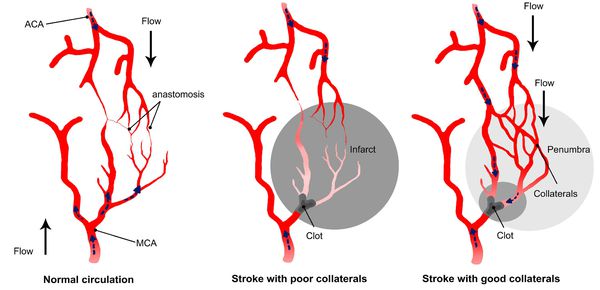
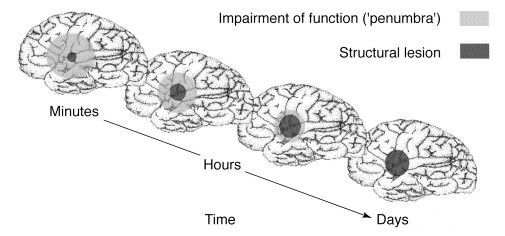
При фокальной ишемии головного мозга степень снижения скорости мозгового кровотока различна (в центре очага — полное прекращение, по направлению к периферии скорость увеличивается до нормальной). Область вещества головного мозга, в которой кровоток снизился до величины менее 10 — 12 мл/100 г в минуту называется зоной «некроза»/«ядерная зона инфаркта». Изменения в мозговой ткани сопровождаются выраженным энергодефицитом, потерей ионного градиента, деполяризацией мембран с необратимым повреждением клеток (в виде разрушения мембраны клетки, митохондрий и деструкции ДНК). В большинстве случаев некроз в ядерной зоне инфаркта формируется в течение 5 минут после окклюзии артерии [11, 12, 13, 14]. Располагающееся вокруг ядерной зоны инфаркта вещество головного мозга, где величина МК составляет от 15 мл/100 г в минуту до 20 мл/100 г в минуту называется зоной «пенумбры» (ишемическая полутень — лат. paene- «почти» и umbra «тень»). В зоне «пенумбры» мозговая ткань функционально неактивна (недостаточно энергетического субстрата для адекватного функционирования), но жизнеспособна (сохранена структурная целостность нейронов и глиальных клеток).
Зона ишемической полутени включает области, которые восстанавливаются самостоятельно («доброкачественная олигемия») и участки, которые без успешной реперфузионной терапии, превращаются в инфаркт головного мозга.Ключевую роль в трансформации зоны «пенумбры» в очаг некроза играет длительность ишемии и степень снижения МК. Скорость необратимого повреждения мозговой ткани определяется также показателями кислородотранспортных свойств крови (анемия, нарушения оксигенации гемоглобина и его химических свойств), электролитного баланса, осмотического давления, температуры, содержания глюкозы и состоянием коллатерального кровотока [15, 16]. Принцип «время – мозг» (англ. Time is brain) отражает быстрый темп гибели клеток мозговой ткани под действием неблагоприятных факторов. Концепция ишемической полутени обосновывает необходимость экстренного оказания медицинской помощи пациентам с острыми нарушениями мозгового кровообращения [11, 12, 13, 14].
При обширной зоне ишемии, занимающей не менее 50% бассейна кровоснабжения СМА, заболевание может сопровождаться выраженным отеком с масс-эффектом и внутричерепной гипертензией, смещением структур головного мозга с развитием височно-тенториального вклинения. Причиной большинства таких инсультов является кардиоэмболическая или тромботическая окклюзия внутренней сонной артерии или М1 СМА. Такое осложненное течение инсульта является злокачественным и встречается у 36 — 78% пациентов с массивным полушарным ишемическим инсультом [18, 19]. Отек головного мозга с выраженным масс-эффектом и неврологическим ухудшением может развиваться как в течение 24 — 36 часов с момента дебюта инсульта, так и более постепенно (в течение нескольких дней – недели) [4, 20]. Каскад местных воспалительных реакций с участием иммунных клеток и провоспалительных цитокинов ведет к значительному повреждению мозга, нарушению гематоэнцефалического барьера и определяет запуск вазогенного компонента церебрального отека. У 25% пациентов со злокачественным инсультом отек мозга начинается уже в первые сутки заболевания [21, 22]. У пациентов со злокачественным инсультом летальность достигает 78% (при проведении только медикаментозного лечения) [4].
Венозный инсульт
Тромбоз церебральных вен и синусов твердой мозговой оболочки является одной из редких причин инсульта, которая зачастую остается нераспознанной [23]. Частота случаев венозного инсульта колеблется от 0,22 до 1,57 на 100000 (соотношение частоты встречаемости у женщин и мужчин 3/1 [24, 25, 26]. Гендерные различия могут быть обусловлены повышенным риском тромбоза церебральных вен и синусов твердой мозговой оболочки, связанным с беременностью, послеродовым периодом, а также с приемом пероральных контрацептивов [27]. Тромбоз церебральных вен или синусов твердой мозговой оболочки препятствует оттоку крови от тканей головного мозга, что приводит к повышению венозного и капиллярного давления с последующим нарушением гематоэнцефалического барьера, вазогенным отеком и пассажем плазмы в интерстициальное пространство. Дальнейший рост ВЧД может приводить к венозным кровоизлияниям вследствие разрыва венул и капилляров [28].
Наиболее частыми факторами риска тромбоза церебральных вен и синусов твердой мозговой оболочки являются: протромботические состояния (как генетические, так и приобретенные); прием пероральных контрацептивов; беременность и послеродовый период; наличие злокачественных новообразований; инфекция; травма головы [23].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Инсульт — преобладающая причина инвалидизации населения (3,2 на 1000 населения) [29]. По данным Национального регистра инсульта 31% пациентов, перенесших инсульт, нуждаются в посторонней помощи для ухода за собой, 20% не могут самостоятельно ходить. Лишь 8% выживших пациентов могут вернуться к прежней работе [29]. Согласно данным эпидемиологического исследования инсульта методом территориально-популяционного регистра, заболеваемость инсультом в 2010 г. составила 3,27 случая на 1000 населения, смертность — 0,96 на 1000 населения. Отношение ишемических инсультов к геморрагическим составило 5:1. Средний возраст развития инсульта — 66,7 лет (63,7 года у мужчин и 69,4 года у женщин). Абсолютное число инсультов у пациентов в возрасте до 67 лет выше у мужчин, а в более старшем возрасте выше у женщин [30]. К 2016 году заболеваемость инсультом снизилась до 2,85 на 1000 населения (по сравнению с 2009 годом на 30%), смертность составила 0,4 на 1000 населения (уменьшилась на 220%).
Заболеваемость повторным инсультом составляет 0,79 на 1000 населения. Доля ишемического инсульта среди повторных инсультов составляет 87,5%, инсульта неуточненной этиологии – 4,6%. Показатель распространенности повторного инсульта среди всех инсультов — 25,5% [31].
Согласно результатам популяционных исследований, частота встречаемости атеротромботического ИИ составляет 16%, кардиоэмболического ИИ — 29%, лакунарного ИИ — 16%, инсульта вследствие более редких причин — 3%, инсульта неизвестной этиологии — 36% случаев. Риск повторного инсульта в течение первых 30 суток заболевания выше при атеротромботическом инсульте по сравнению с остальными патогенетическими вариантами ИИ [32].
Встречаемость злокачественного инфаркте в бассейне СМА составляет около 3% от всех случаев ИИ [33]. В среднем в Российской Федерации злокачественный инфаркт в бассейне СМА каждый год развивается у 15000 человек. Встречаемость злокачественного инфаркта мозжечка составляет около 0,5% от всех случаев ИИ [33]. В среднем в Российской Федерации злокачественный инфаркт мозжечка каждый год развивается примерно у 2500 человек.
Традиционно, инсульт считался заболеванием, встречающимся у старшей возрастной группы, однако частота выявления его у молодых растет с 1980-х годов [34]. Это связано с повсеместным распространением и совершенствованием методов нейровизуализации, возросшей распространенностью факторов риска сердечно-сосудистых заболеваний и ростом употребления запрещенных наркотиков. Частота инсульта у пациентов младше 45 лет составляет от 3,4 до 11,3 на 100000 населения в год[35]. Причины и факторы риска инсульта у молодых существенно отличаются от таковых, встречающихся у пожилых пациентов. У молодых пациентов чаще диагностируются врожденные и приобретенные заболевания сердца, болезни крови, васкулопатии, наследственные заболевания, прием наркотиков. У пожилых пациентов более распространены артериальная гипертензия, курение, сахарный диабет и гиперхолестеринемия, хотя, эти факторы риска также присутствуют и в молодом возрасте [36, 37].
Редкие причины ишемического инсульта/ТИА описаны в разделе «Классификация церебрального ишемического инсульта».
Инсульт у женщин во время беременности и в послеродовом периоде
Частота случаев ИИ во время беременности и в послеродовом периоде составляет 11 — 34 на 100000 родов в год. Это более высокий показатель годовой заболеваемости ИИ по сравнению с частотой случаев ИИ у женщин аналогичного репродуктивного возраста (годовая заболеваемость 10,7 случаев на 100000) [38, 39, 40]. Максимальная частота случаев ИИ приходится на послеродовой период — 50% случаев, тогда как непосредственно перед родами развивается около 40% случаев ИИ и во время родов — 10% случаев ИИ. Для улучшения качества профилактики ишемического инсульта во время беременности и родов необходимо, наряду с «общими» факторами риска ишемического инсульта, учитывать «дополнительные» факторы риска ИИ, которые появляются в эти периоды: возраст старше 35 лет, мигрень с аурой, артериальная гипертония беременных, инфекционные осложнения после родов [41, 42, 43, 44].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
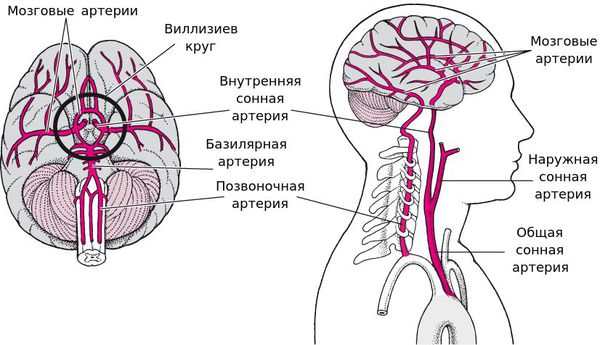
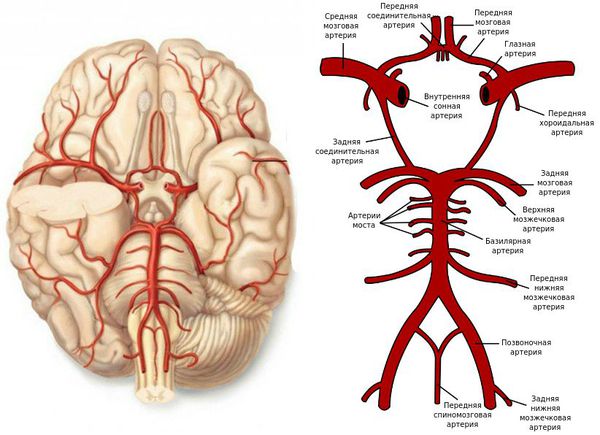
Клиническая картина ТИА/ишемического церебрального инсульта определяется территорией кровоснабжения пораженного сосуда. Нарушения кровообращения в каротидной системе развивается чаще (80 – 85% случаев), чем в вертебрально-базилярной системе (15 – 20% случаев).
Каротидные синдромы
Синдром внутренней сонной артерии. Клинические проявления при нарушении кровотока по внутренней сонной артерии во многом определяются развитостью коллатерального кровообращения и уровнем окклюзии. Поражение экстракраниального отдела внутренней сонной артерии, как правило, характеризуется умеренно выраженной неврологической симптоматикой и часто проявляется в виде ТИА или малых инсультов.
При этом может отмечаться мозаичный характер клинических проявлений. При окклюзии в области отхождения глазной артерии или проксимальнее этого участка характерно развитие офтальмоплегического синдрома Денни – Броуна, который характеризуется слепотой на стороне очага (вследствие ишемии сетчатки и зрительного нерва) и центральной гемиплегией или гемипарезом, иногда в сочетании с гемигипестезией на противоположной стороне. При окклюзии интракраниального отдела внутренней сонной артерии часто отмечается выраженная неврологическая симптоматика с развитием контралатеральных гемипарезов, гемигипестезии, нарушением высших психических функций.
Синдром передней мозговой артерии. Передняя мозговая артерия является одной из основных ветвей внутренней сонной артерии и кровоснабжает медиальную поверхность лобной и теменной долей, парацентральную дольку, частично – глазничную часть лобной доли, наружную поверхность верхней лобной извилины, передние две трети мозолистого тела, переднее бедро внутренней капсулы, скорлупу, бледный шар, частично гипоталамическую область. Нарушение кровообращения в бассейне передней мозговой артерии вызывает развитие контралатерального центрального гемипареза с преобладанием в нижних конечностях, при этом парез в ноге более выражен в дистальных отделах, а в руке – в проксимальных. Часто отмечаются симптомы орального автоматизма, хватательные рефлексы, психические расстройства (дурашливость, аспонтанность, неопрятность, абулия и др.), нарушения памяти. При поражении парацентральной дольки могут иметь место нарушения мочеиспускания и дефекации. Чувствительные нарушения отмечаются редко.
Синдром парацентральной артерии. Парацентральная артерия является ветвью передней мозговой артерии и кровоснабжает парацентральную дольку, верхние отделы пред- и постцентральных извилин. Клиническая картина при ее окклюзии складывается из контралатерального пареза преимущественно дистальных отделов нижних конечностей, иногда с чувствительными нарушениями там же и нарушением контроля мочеиспускания и дефекации.
Синдром мозолисто-краевой артерии. При нарушении кровообращения в данном бассейне отмечаются апатоабулический синдром, лобная апраксия, снижение памяти.
Синдром средней мозговой артерии. При окклюзии проксимального отдела СМА развивается тотальный инфаркт. Возникают контралатеральные очагу поражения гемиплегия или гемипарез, гемигипестезия, гемианопсия. Гемипарез обычно бывает в большей степени выражен в верхних конечностях. При поражении коркового центра взора возможен парез взора в сторону, противоположную очагу поражения. При инфарктах в доминантном полушарии могут развиваться различные виды афазий – эфферентная и афферентная моторные афазии, сенсорная афазия, их сочетание.
Медиальные инфаркты в бассейне глубоких ветвей СМА приводит к формированию, синдрома трех «геми» (гемиплегия, гемианестезия, гемианопсия). Нарушение кровообращения в латеральных ветвях средней мозговой артерии, в том числе в корковых ветвях, формирует образование латеральных инфарктов. Клиническая картина при этом достаточно вариабельна, неврологический дефект, как правило, менее выражен, при очагах в левом полушарии характерны афатические нарушения речи.
Злокачественный инсульт в бассейне СМА развивается при массивном полушарном инсульте, характерным является грубая очаговая полушарная симптоматика по гемитипу. В самом начале заболевания уровень бодрствования обычно соответствует ясному сознанию/умеренному оглушению. Характерен глубокий гемипарез: в руке мышечная сила не выше 1 балла, в ноге — не более 2 баллов, патологический рефлекс Бабинского в паретичной конечности. В случае поражения доминантного полушария развивается тотальная афазия, недоминантного полушария — анозогнозия. Патогномоничным неврологическим симптомом является корковый парез взора, пациент смотрит на очаг, характерна гемианопсия. При злокачественном течении через 1,5 – 3,0 сут от начала заболевания развивается полушарный отек, а в клинической картине начинает превалировать дислокационный синдром в виде прогредиентного угнетения уровня бодрствования, появления анизокории, двустороннего патологического рефлекса Бабинского, нарушения функций дыхания и системной гемодинамики. У молодых пациентов дислокационный синдром может проходить с развитием внутричерепной гипертензии, в таком случае, пока пациент еще бодрствует, он предъявляет жалобы на нарастающую головную боль, тошноту, рвоту. Декомпенсация дислокационного синдрома (угнетение бодрствования до комы) в первые сутки заболевания происходит у 25% пациентов, и у 70% пациентов – в первые 48 часов от начала инсульта. Частота и время летальности имеет бимодальную характеристику. Ранний пик приходится на 3 — 6-е сутки, поздний пик – на 2 — 3-й неделе после инсульта. Причиной смерти в ранний период является транстенториальное вклинение на фоне рефрактерной ВЧГ. Отсроченная летальность связана с ассоциированными осложнениями в виде пневмонии, острой сердечной недостаточности, инфекционными осложнениями и пр.
Синдром передней ворсинчатой артерии (синдром Монакова): наблюдаются контралатеральные очагу гемипарез, гемианопсия, гемианестезия, также возможны вазомоторные нарушения в паретичных конечностях.
Синдромы нарушения кровообращения в вертебрально-базилярной системе
Синдром позвоночной артерии. При поражении экстракраниальных отделов позвоночной артерии (атеросклеротические бляшки в области отхождения позвоночной артерии от подключичной артерии, расслоение стенки артерии, спондилез и остеохондроз шейного отдела позвоночника и др.) клиническая картина характеризуется мозаичностью поражения различных отделов мозгового ствола и мозжечка. Могут наблюдаться вестибулярные расстройства, нарушение статики и координации, иногда поражение мостового центра взора и зрительные нарушения.
Синдром Хесслера развивается при окклюзии парамедианных ветвей позвоночной артерии. Он характеризуется поражением чувствительных путей в покрышке продолговатого мозга на разном уровне. Выделяют следующие варианты синдрома: каудальный – инфаркт располагается латеральнее ядра и корешка подъязычного нерва, поражается спиноталамический путь, при этом развивается контралатеральная очагу гемигипалгезия; средний – развивается контралатеральная гемигипалгезия в сочетании с нарушением глубокой чувствительности, гемиатаксией (поражение медиальной петли и вестибуломозжечковых путей); верхний – наблюдается тотальная контралатеральная гемигипестезия или гемианестезия, иногда в сочетании со снижением слуха вследствие формирования очага повреждения в области слияния медиальной и латеральной петель.
Синдром задней нижней мозжечковой артерии (боковой синдром продолговатого мозга, синдром Валленберга – Захарченко): альтернирующий синдром – на стороне поражения отмечается парез мягкого неба и мышц глотки, гипестезия на лице, снижение роговичного рефлекса, гемиатаксия, синдром Клода Бернара – Горнера, нистагм при взгляде в сторону очага. На противоположной стороне отмечается снижение болевой и температурной чувствительности. Кроме того, в клинической картине могут присутствовать тошнота, рвота, головокружение, икота.
Медуллярные инфаркты продолговатого мозга. Возникают при нарушении кровоснабжения продолговатого мозга ветвями позвоночной артерии. При медиальных инфарктах отмечается синдром Джексона, при латеральных инфарктах – варианты синдрома Валленберга – Захарченко.
Синдром базилярной артерии (сидром Кубика – Адамса): сочетание центрального тетрапареза, нарушений чувствительности по проводниковому типу, поражение черепных нервов на уровне моста, реже на уровне среднего мозга. У большинства пациентов отмечается нарушение сознания, дыхательные расстройства. Зрачки могут быть узкими (при очаге в мосте) или широкими (при поражении глазодвигательного нерва). Нередко отмечается расхождение глазных яблок по горизонтали или по вертикали (синдром Гертвига – Мажанди). При нарушении кровотока в базилярной артерии или ее парамедианных ветвях могут возникать различные альтернирующие синдромы.
Синдром «изолированного человека» (синдром «запертого человека», синдром деафферентации, «locked-in-syndrom») возникает при двустороннем инфаркте в бассейне базилярной артерии с поражением основания моста. В клинической картине наблюдаются тетраплегия или тетрапарез, псевдобульбарный синдром, паралич мимических и жевательных мышц при сохранности всех видов чувствительности. Сознание пациента сохранно, отмечается полная обездвиженность при возможных вертикальных движениях взора и мигательных движениях. Сохраняется способность по команде открывать и закрывать глаза.
Синдром передней нижней мозжечковой артерии. Могут отмечаться симптомы поражение ядра лицевого нерва, синдром Клода Бернара – Горнера, нистагм, мозжечковая атаксия на стороне поражения, дизартрия, гипестезия на лице, иногда контралатерально очагу – гемипарез.
Синдром верхней мозжечковой артерии. Развиваются атаксия, интенционный тремор, синдром Клода Бернара – Горнера, контралатерально – центральный парез лицевой мускулатуры и половины языка, гемигипестезия, иногда поражение блокового нерва и парез взора в сторону очага.
Инфаркты среднего мозга. Характерны расширенные зрачки без реакции на свет, анизокория, расходящееся косоглазие, ограничение движения взора по вертикали, центральные парезы вплоть до тетраплегии. Возможны нарушение сна и бодрствования, синдром акинетического мутизма, галлюциноз Лермитта. При медиальном инфаркте среднего мозга развиваются синдромы Вебера, Бенедикта, верхнего и нижнего красного ядра. Дорсальный инфаркт проявляется офтальмоплегией (одно- или двусторонней), синдромом Парино.
Клиническая картина при ИИ мозжечка определяется бассейном пораженной мозжечковой артерии. В структуре ИИ поражение бассейна задней нижней мозжечковой артерии встречается в 40 – 50% случаев, бассейна верхней мозжечковой артерии — в 30 – 40%, бассейна передней нижней мозжечковой артерии — в 3 – 6%, одновременно двух смежных сосудистых бассейнов — в 15%. Инфаркты в зоне смежного кровоснабжения, между бассейнами, встречаются крайне редко [47, 48, 49].
Злокачественный инфаркт мозжечка обычно возникает при поражении всего бассейна верхней мозжечковой или задней нижней мозжечковой артерии, наиболее часто в бассейне задней нижней мозжечковой артерии при острой окклюзии позвоночной артерии [8]. Поскольку проксимальные отделы мозжечковых артерий участвуют в кровоснабжении стволовых структур, в случае выключения их у устья может наблюдаться разнообразная стволовая симптоматика: альтернирующие синдромы, нарушение бодрствования, нарушения дыхания и т. д. В случае ишемии в бассейне задней нижней мозжечковой артерии в клинической картине превалируют вестибулярные нарушения в виде головокружения (80%), тошноты (60%), характерна головная боль в шейно-затылочной области (64%), нарушение походки (70%), атаксия в конечностях (50%), нистагм, редко дизартрия.
При изолированном поражении мозжечка в бассейне верхней мозжечковой артерии в клинической картине превалируют координаторные расстройства, связанные с поражением зубчатых ядер. Симптоматика в этом случае обычно представлена атаксией в конечностях (у 73% пациентов), нарушением походки (у 70% пациентов), дизартрией (у 60% пациентов), тошнотой (у 40% пациентов), головокружением (у 37% пациентов), нистагмом (у 7% пациентов) [50].
В клинической картине инфаркта в бассейне передней нижней мозжечковой артерии частым специфичным симптомом является потеря слуха на стороне инфаркта. Среди других симптомов встречаются атаксия в конечностях, нарушение походки, головокружение, тошнота, нистагм [51].
В случае злокачественного течения обширного инфаркта мозжечка происходит постепенное нарастание отека зоны инфаркта, что приводит к развитию масс-эффекта с компрессией ликворопроводящих путей и ствола. Клиническое ухудшение обычно развивается на 2 – 3-и сутки от начала заболевания и, в первую очередь, проявляется прогрессирующим снижением уровня бодрствования, появлением геми- или тетрапареза, глазодвигательными нарушениями. Обычно в течение 24 ч от начала ухудшения у пациентов развивается кома [52]. При снижении бодрствования у пациента с обширным инфарктом мозжечка необходимо определить, что является причиной неврологического ухудшения — острая окклюзионная гидроцефалия, прямая компрессия ствола очагом ишемии или их сочетание, первичная ишемия ствола или внечерепные причины [53].
Установление причины ухудшения определяет тактику лечения. Для острой окклюзионной гидроцефалии при злокачественном течении инфаркта мозжечка характерно прогрессирующее снижение уровня бодрствования, часто сочетающееся с поражением гомолатерального отводящего нерва и парезом взора вверх [54, 55]. Симптомами компрессии ствола очагом инфаркта мозжечка являются появление гомолатерального гемипареза или тетрапареза, одно- или двустороннего патологического рефлекса Бабинского, горизонтального пареза взора, расходящегося косоглазия, прогрессирующего ухудшения уровня бодрствования. Возможно появление симптомов поражения черепных нервов мостомозжечкового угла, различных ядер черепных нервов, расположенных в стволе, появление бульбарного синдрома. Симптомами восходящего транстенториального вклинения являются парез взора вверх, угнетение бодрствования до комы, появление анизокории, сменяющейся максимальным миозом, развитие децеребрации [56, 57]. Проявлением вклинения миндалин мозжечка в большое затылочное отверстие с компрессией продолговатого мозга являются нарушения дыхания и гемодинамики, бодрствования.
Синдром бифуркации базилярной артерии: отмечается двусторонняя слепота, иногда двусторонняя гемианопсия с сохранением центрального зрения, в ряде случаев корковая слепота (синдром Антона). Могут также наблюдаться изменение зрачковых рефлексов, надъядерный парез взора вверх, птоз, нарушение сна, галлюцинации, амнезия, гемибаллизм.
Синдром задней мозговой артерии: может развиваться гомонимная контралатеральная гемианопсия с сохранением центрального зрения, иногда в сочетании со зрительной агнозией, при очагах в левом полушарии – с алексией и акалькулией. При поражении лимбической области наблюдаются нарушения сна, вегетативные расстройства, нарушение памяти на текущие события. Иногда отмечается контралатеральная гемигипестезия.
Синдром таламоколенчатой артерии: развивается контралатеральный преходящий гемипарез без повышения мышечного тонуса, гемигипестезия с гемидизестезией, таламические боли, иногда гиперкинезы с возможным формированием «таламической руки и трофические нарушения.
Двусторонние инфаркты таламусов: характерно коматозное состояние и двустороннее нарушение корково-спинномозговых связей. Инфаркты в заднемедиальных отделах таламусов характеризуются более длительным коматозным состоянием, которое может сменяться хроническим вегетативным состоянием или акинетическим мутизмом. Часто также может иметь место парез взора вверх, иногда вниз.
Инсульт вследствие тромбоза церебральных вен и синусов твердой мозговой оболочки: характерны общемозговые симптомы — головная боль (усиливающаяся при приеме Вальсальвы или в горизонтальном положении пациента) [58], нарушение зрения вследствие внутричерепной гипертензии, нарушение сознания, а также могут отмечаться фокальные или генерализованные эпилептические приступы.
В зависимости от продолжительности неврологической симптоматики выделяют малый инсульт (инсульт с обратимым неврологическим дефицитом) или ишемический инсульт со стойкими остаточными явлениями. Малый инсульт характеризуется нарушением неврологических функций более 24 часов, но менее 3 недель. При ишемическом инсульте со стойкими остаточными явлениями неврологическая симптоматика сохраняется более одного месяца.
В остром периоде инсульта, постепенное или ступенеобразном нарастание неврологической симптоматики свидетельствует о «прогрессирующем инсульте» или об инсульте в развитии. Если неврологическая симптоматика стабилизировалась и не прогрессирует в течение, по крайней мере, одной недели, или постепенно регрессирует имеет место «завершившийся инсульт».
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний), медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза ишемического инсульта и транзиторной ишемической атаки
Клиническая картина является основой для диагностики ишемического инсульта и транзиторной ишемической атаки. Указанные в разделе Клиническая картина синдромы являются клиническим критериями установления данных заболеваний.
Продолжительность клинического дефицита менее 24 часов является основным критерием установления преходящего нарушения мозгового кровообращения. Несмотря на типичную продолжительность большинства случаев транзиторных ишемических атак менее 30 — 60 минут, нет убедительных данных, показывающих, что альтернативный временной порог лучше или более полезен, чем 24 часа [2].
Компьютерная и магнитно-резонансная томография головного мозга являются важными инструментами в диагностике ишемического инсульта и транзиторной ишемической атаки. Однако следует помнить об ограничениях нейровизуализации, особенно при использовании ее в качестве преобладающего или единственного источника информации.
Инфаркт головного мозга должен оставаться патологоанатомическим термином, так как он не может быть надежно идентифицирован с помощью нейровизуализации и что точная идентификация инфаркта обычно не требуется для оптимизации результатов лечения пациентов.
Жалобы и анамнез
- Рекомендуется получить данные о наличии или отсутствии нарушений двигательной, чувствительной сферы, нарушении когнитивных функций, включая речь, неврологических симптомов, связанных с нарушением функции того или иного черепно-мозгового нерва, таких как слабость мышц, нарушения чувствительности [11, 12, 13, 59, 60].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 5).
Комментарии: Пациенты могут не предъявлять жалоб в связи с речевыми нарушениями, расстройствами сознания, нарушением критики к своему состоянию.
- Рекомендуется получить данные о наличии или отсутствии острых, или хронических заболеваний/состояний сердечно-сосудистой системы, предшествующих нарушениям функций ЦНС [59, 60, 61].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Факторы риска, ассоциированные с повышенной частотой развития ишемического инсульта: артериальная гипертензия любого происхождения, заболевания сердца, мерцательная аритмия, инфаркт миокарда, дислипопротеинемия, сахарный диабет, бессимптомное поражение сонных артерий, наследственная предрасположенность, табакокурение, низкий уровень физической активности, неправильное питание, злоупотребление алкогольными напитками, длительное психоэмоциональное напряжение или острый стресс.
- Рекомендуется обратить особое внимание на время появления, скорость и динамику нарушений двигательной, чувствительной сферы, когнитивных функций, включая речь, неврологических симптомов, связанных с нарушением функции того или иного черепно-мозгового нерва, в так же общемозговых симптомов [12, 13, 60, 62, 63].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Время от развития заболевания до поступления пациента в стационар является определяющим для определения возможности проведения тромболитической терапии. При злокачественном инфаркте мозжечка начало заболевания острое, обычно на фоне общего благополучия. В самом начале заболевания бодрствование не нарушено. Пациенты предъявляют жалобы на остро возникшее головокружение, нарушение координации, нарушение артикуляции. Некоторые пациенты также предъявляют жалобы на, головную боль в шейно-затылочной области. По мере развития отека головного мозга большинство пациентов активно жалоб не предъявляет, а просто перестают бодрствовать по мере развития острой гидроцефалии и/или прямой компрессии ствола головного мозга. Некоторые пациенты перед нарушением бодрствования могут предъявлять жалобы на нарастающую головную боль, тошноту, рвоту.
- Рекомендуется получить данные о наличии или отсутствии сопутствующих заболеваний и применяемых лекарственных препаратов [60, 62, 63].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: сопутствующие заболевания и прием некоторых лекарственных препаратов могут быть противопоказанием или ограничением проведения отдельных видов терапевтических воздействий, а также могут быть факторами риска развития осложнений инсульта, что определяет их прогнозирование и проведение профилактических мероприятий.
Физикальное обследование
- Рекомендуется осмотр пациента с предположительным диагнозом ИИ/ТИА врачом-неврологом не позднее 10 минут от момента поступления пациента в стационар. Результаты клинического осмотра рекомендуется сопоставлять с результатами балльной оценки по Шкале тяжести инсульта Национальных институтов здоровья CША (NIHSS, Приложение Г1) с целью объективной оценки тяжести неврологического дефицита пациента [60, 62, 63, 64].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Использование шкалы NIHSS позволяет количественно оценить тяжесть инсульта, проследить динамику состояния, она используется при определении показаний и противопоказаний к проведению тромболитической терапии. Особое внимание следует обратить на тестирование менингеальных симптомов, так как они не представлены в шкале NIHSS. Для выбора адекватного состоянию пациента метода экстренной нейровизуализации (бесконтрастная КТ или МРТ) провести быстрое прицельное неврологическое обследование пациента без применения неврологических шкал.
- Рекомендуется всем пациентам с предположительным диагнозом ИИ/ТИА не позднее 3 часов момента поступления в стационар (до применения седатирующих препаратов) выполнить оценку уровня бодрствования с использованием шкалы комы Глазго (см. Приложение Г7) и балльную оценку неврологического статуса по Шкале тяжести инсульта Национальных институтов здоровья CША (NIHSS, Приложение Г1) с целью объективной оценки уровня бодрствования и тяжести неврологического дефицита пациентов [60, 61, 62, 63, 64].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: Использование указанных шкал позволяет количественно оценивать степень выраженности нарушений сознания, тяжесть неврологической симптоматики, оценивать динамику, определять тактику терапии и ее коррекцию [60, 62, 63, 64].
- Рекомендуется всем пациентам с предположительным диагнозом «ТИА и ишемический инсульт» обязательно проводить исходную оценку дыхания и функции легких, [60, 62, 63, 64].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется всем пациентам с предположительным диагнозом «ТИА и ишемический инсульт» проводить исходную оценку функции глотания для выявления ранних признаков дисфагии. Исходную оценку функции глотания предпочтительно проводить с использованием теста оценки глотания. Тест на дисфагию («трехложечная проба» с использованием пульсоксиметра) следует проводить в течение первых 24 часов пребывания пациента в стационаре [60, 62, 63, 64].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Наличие дисфагии в 3 — 11 раз увеличивает риск аспирационной пневмонии и риск внезапной смерти. При невозможности тестирования функции глотания или выявлении дисфагии показана установка назогастрального зонда для осуществления нутритивной поддержки.
- Рекомендуется обратить особое внимание на симптомы и признаки, которые могут прогнозировать острый инфаркт миокарда, кровотечение, повторный инсульт, гипертонические кризы, аспирационную пневмонию, сердечную и почечную недостаточность [60, 62, 63, 64].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется всем пациентам с предположительным или верифицированном диагнозом ишемический инсульт при наличии симптомов нарушения мышечного тонуса и двигательной функции сопоставлять результаты клинического осмотра с результатами балльной оценки по шкалам MRC и Эшворт (см. Приложение Г2 и Приложение Г3) с целью объективной оценки степени выраженности этих симптомов для подбора адекватной терапии пациентов [59].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: Использование шкал позволяет количественно оценивать двигательный дефицит и мышечный тонус, что необходимо для подбора адекватной терапии, оценки эффективности лечебных мероприятий их своевременной коррекции [59, 60, 62, 63, 64].
Лабораторные диагностические исследования
- Рекомендуется всем пациентам — кандидатам на реперфузионную терапию экстренное (20 минут от момента поступления в стационар) исследование уровня глюкозы в крови, исследование уровня тромбоцитов в крови для определения противопоказаний к проведению ТЛТ [59, 60, 62, 63, 64].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: выраженное снижение или повышение уровня глюкозы крови влияет на течение инсульта, что определяет необходимость его контроля и требует своевременной коррекции.
- Рекомендуется всем пациентам с предположительным диагнозом «ТИА и ишемический инсульт» обязательные лабораторные тесты (таб. 3). Результаты должны быть предоставлены в течение 3 часов с момента поступления [12, 13, 14, 60, 62, 63, 64].
Таблица 3. Обязательные лабораторные тесты у пациентов с предположительным диагнозом «ТИА и ишемический инсульт»
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Последовательность проведения анализов зависит от типа инсульта и его вероятной этиологии [12, 13, 14, 59, 60, 62, 63, 64]. Определение этих показателей необходимо для контроля за состоянием пациента, своевременного выявления осложнений. Для сокращения числа манипуляций по взятию венозной крови в первые сутки госпитализации рекомендуется проводить все исследования из крови, взятой при поступлении пациента, результаты должны быть предоставлены в течение 3 часов с момента поступления. Другие анализы, например, определение международного нормализованного отношения, активированного частичного тромбопластинового времени и исследование уровня тромбоцитов в крови, могут быть необходимыми, при подозрения на коагулопатию. Учитывая крайне низкий риск неожиданных отклонений числа тромбоцитов или показателей свертываемости крови в популяции, не следует задерживать начало терапии путем внутривенного введения алтеплазы** ради ожидания результатов общего (клинического) анализа крови или коагулограммы (ориентировочное исследование системы гемостаза)в случае отсутствия причин для ожидания получения отклоняющихся результатов.
Инструментальные диагностические исследования
Нейровизуализация головного мозга
- Рекомендуется всем пациентам с признаками ОНМК в экстренном порядке проведение бесконтрастной КТ головного мозга или МРТ головного мозга, получение результатов исследования (заключения) в течение 40 минут от момента поступления пациента в стационар для дифференциальной диагностики формы ОНМК с целью определения тактики лечения [12, 13, 14].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 1).
Комментарии: Уменьшение интервала времени с момента поступления в стационар до начала нейровизуализационного исследования головного мозга может способствовать сокращению времени до начала терапии и, соответственно лучшему клиническому исходу заболевания. Выполнение КТ или МРТ без контрастного усиления является надежным и быстрым способом для исключения острого внутричерепного кровоизлияния, как абсолютного противопоказания к последующей тромболитической терапии и/или тромбэкстракции в первые часы инсульта. Подострые и хронические внутричерепные кровоизлияния, а также очаги ишемии в стволе головного мозга более точно, по сравнению с КТ, диагностируются методом МРТ, в частности, с помощью Т1-и Т2*-взвешенных изображений.
КТ является высокоспецифичным методом ранней диагностики ишемического повреждения головного мозг. В большинстве случаев КТ без контраста позволяет получить необходимую информацию для принятия решения о выборе тактики в острейшем периоде.
МРТ актуальна в диагностике инсультов в вертебрально-базилярном бассейне, лакунарных и небольших корковых очагов.
При применении этих методов решаются следующие диагностические задачи [12, 13, 14, 60, 62, 63, 64].
1. Выявление томографических признаков, указывающих на ранние (косвенные) признаки ишемического поражения.
2. Выявление томографических признаков, исключающих ишемический характер очагового поражения вещества головного мозга (контузия, новообразование, абсцесс и пр.).
3. Выявление внутричерепных кровоизлияний и связанных с ними осложнений.
- Рекомендуется использовать дополнительную модальность — диффузионно-взвешенное изображение (ДВИ b 500 / b 1000) для раннего выявления признаков ишемического поражения вещества головного мозга при проведении МРТ головного мозга [12].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: Изменения на МРТ головного мозга в режиме ДВИ, характерные для цитотоксического отека, появляются спустя 2 — 4 часа после развития критического снижения церебральной гемоперфузии и сохраняются в течение 5 — 7 суток, после чего на их месте формируется область необратимого поражения мозга, обусловленная разрушением вещества головного мозга. ДВИ МРТ, в отличие от других модальностей МРТ или КТ, позволяет надежно диагностировать формирование повторного инфаркта мозга на фоне ишемических изменений, состоявшихся ранее. Использование градиентных Т2*-взвешенных изображений МРТ позволяет выявлять как острые (на высокопольных томографах), так и перенесенные ранее внутримозговые кровоизлияния, обнаружение которых связано с парамагнитными свойствами продуктов распада крови — деоксигемоглобина и гемосидерина [12, 60, 62, 63, 64].
Выявление участков отложения гемосидерина в тканях мозга ретроспективно подтверждает факт перенесенного нарушения мозгового кровообращения по геморрагическому типу, в т.ч. субклинические с небольшим объемом поражения вещества мозга [60, 62, 63, 64]. У 20 – 25% пациентов с диагнозом направления ТИА обнаруживается острое ишемическое повреждение по данным ДВИ. Тем не менее, с экономической точки зрения, рутинное использование ДВИ-МРТ у всех пациентов в остром периоде ИИ нецелесообразно, требуются дополнительные исследования для выявления показаний для включения ДВИ-МРТ модальности в программу обследования пациента с ИИ/ТИА.
Расширение диагностического поиска с получением КТ или МРТ перфузионно взвешенного изображения (ПВИ), при наличии показаний, не должно сопровождаться задержкой процедуры внутривенного тромболизиса (в/в введения алтеплазы**). РКИ по изучению результатов в/в введения алтеплазы** у пациентов с ИИ и выявленными на МРТ ВММК не проводились, в связи с чем отсутствуют данные об эффективности тромболитической терапии при ВММК. Два метаанализа, в которых изучался риск симптомного внутримозгового кровоизлияния (сВМК) после внутривенного введения алтеплазы** при наличии ВММК, показали, что возникновение сВМК чаще наблюдается у тех пациентов, у которых при первичном обследовании были выявлены признаки ВММК.
- Рекомендуется всем пациентам с верфицированным диагнозом ИИ выполненить определение патогенетического варианта ишемического инсульта по критериям TOAST с целью оптимизации тактики лечения и вторичной профилактики острых сосудистых событий [45].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
- Не рекомендуется использовать в качестве критерия для отказа от реперфузионной терапии объем и наличие ранних косвенных признаков церебральной ишемии по данным КТ или МРТ головного мозга при отсутствии других противопоказаний у пациентов [65, 66, 67].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарии: В исследовании rtPA, проведенном Национальным институтом неврологических расстройств (National Institute of Neurological Disorders, NINDS), показано отсутствие влияния ряда нейровизуализационных признаков на нативной КТ при поступлении пациента в стационар на выраженность терапевтического эффекта алтеплазы**:
— ранние ишемические изменения (утрата четкой границы между серым/белым веществом, гиподенсивность или компрессия ликворных пространств),
— балл по шкале ASPECTS (Приложение Г9) для оценки ранних КТ изменений при инсульте, а также выраженность лейкоареоза [53].
В исследованиях ECASS II и IST-3 не было выявлено связи с исходными показателями ASPECTS [65, 67]. Пациенты с гиподенсивностью более одной трети бассейна средней мозговой артерии (СМА) на исходной КТ были исключены из исследований ECASS I и ECASS II, но не из исследований NINDS rtPA и IST-3.
- Не рекомендуется использовать признак повышенной плотности СМА по данным КТ головного мозга, как критерий для отказа от в/в введения алтеплазы** при отсутствии противопоказаний к системному тромболизису [65, 69, 70].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарии: РКИ, в которых изучалось в/в введение алтеплазы** при ИИ, показали отсутствие статистически значимой взаимосвязи между обнаружением повышенной плотности СМА по данным исходной КТ и последующими клиническими исходами ОНМК после тромболитической терапии. Через 3 — 6 мес от дебюта ОНМК степень функциональной независимости/инвалидизации после ТЛТ у пациентов с выявленным симптомом гиперплотной СМА перед ТЛТ и без такового достоверно не различалась [65, 69, 70].
- Рекомендуется отбор пациентов для ТЛТ после выполнения МРТ головного мозга в режиме ДВИ с целью выявления «DWI/FLAIR» несоответствия (т.е. получение подтверждения очага ишемии на МРТ в режиме ДВИ и отсутствие признаков повреждения вещества головного мозга на МРТ в режиме FLAIR), если время появления симптомов ОНМК точно не установлено, но предположительно, не превышает нескольких часов [71, 72, 73, 74, 75, 76, 77, 78].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
- Рекомендуется проводить повторную КТ головного мозга для уточнения объема инфаркта и наличия факта латеральной и/или аксиальной дислокации головного мозга пациентам при злокачественном инфаркте головного мозга на фоне острой закупорки проксимального сегмента СМА [21].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 4).
Комментарии: в остром периоде инсульта при КТ-негативных данных, полученных в первые 8 часов заболевания у пациента с грубым гемипарезом и парезом взора, необходимо выполнение КТ головного мозга повторно, для прицельного поиска ранних косвенных признаков массивной полушарной ишемии: сдавление субарахноидальных пространств и повышение плотности сигнала от ствола СМА.
- Рекомендуется при выявлении при КТ головного мозга очага ишемии, занимающего более 50% бассейна СМА, повторять КТ головного мозга через 12 часов, через 24 часа, через 48 часов с целью своевременного выявления признаков развития отека и дислокации вещества головного мозга [21].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 4).
- Рекомендуется при выявлении на КТ головного мозга аксиальной дислокации более 2 мм в первые 24 ч от начала заболевания или более 7 мм в первые 48 ч от начала заболевания трактовать течение инсульта как злокачественное [79].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 4).
Визуализация сосудов головного мозга
- Рекомендуется всем пациентам, с верифицированным диагнозом ишемический инсульт, которые являются потенциальными кандидатами на проведение внутрисосудистой реканализации, проведение компьютерно-томографической ангиографии или магнитно-резонансной ангиографии с целью определения окклюзионного поражения вне- и/или внутричерепной артерии [536, 537].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: Использование компьютерно-томографической ангиографии и магнитно-резонансной ангиографии позволяет выявлять окклюзии и стенозы церебральных сосудов, а также оценивать варианты строения виллизиева круга и других сосудистых структур. Ангиография позволяет определить место и причину окклюзии и выявить пациентов с высоким риском повторного инсульта. Знание анатомии сосудов и информация о наличии внечерепных расслоений, стенозов и окклюзий сосудов может помочь при планировании эндоваскулярных вмешательств или при выявлении пациентов, для которых такой вид терапии является неподходящим из-за извилистости сосудов или из-за невозможности получить доступ к внутричерепным сосудам. Неконтрастная МР-ангиография обладает наименьшей достоверностью [12, 13, 14, 59, 60, 62, 63, 64].
- Рекомендуется оценка церебральной перфузии с помощью компьютерно-томографической перфузии головного мозга, магнитно-резонансной томографии или магнитно-резонансной диффузии головного мозга у пациентов — кандидатов на проведения эндоваскулярной терапии с давностью симптомов ИИ в пределах периода от 6 до 24 часов от момента эпизода ИИ, при наличии окклюзии крупного сосуда в каротидном бассейне, с целью повышения эффективности отбора пациентов для механической тромбэктомии, если все другие критерии отбора пациентов были строго соблюдены [538, 539].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: В исследовании DAWN (Clinical Mismatch in the Triage of Wake Up and Late Presenting Strokes Undergoing Neurointervention With Trevo, Клиническое несоответствие при отборе пациентов, проснувшихся с инсультом или поздно поступивших, для проведения нейроинтервенции с использованием устройства Trevo) использовали расхождение клинической визуализации (комбинация балла по шкале NIHSS и результатов визуализации путем компьютерно-томографической перфузии головного мозга или магнитно-резонансной диффузии головного мозга) в качестве критерия пригодности для отбора пациентов с окклюзией крупного сосуда каротидного бассейна для проведения механической тромбэктомии в пределах периода от 6 до 24 часов с последнего известного момента, когда пациент находился в нормальном состоянии. Это исследование продемонстрировало общую пользу в отношении функционального исхода через 90 дней в экспериментальной группе [84]. В исследовании DEFUSE 3 (Diffusion and Perfusion Imaging Evaluation for Understanding Stroke Evolution, Оценка диффузии и перфузии с помощью визуализации для понимания развития инсульта) использовали несоответствие между перфузией и ядром инсульта, а также максимальный размер ядра, определяемый путем визуализации, в качестве критериев отбора пациентов с окклюзией крупного сосуда каротидного бассейна, находящихся в пределах периода от 6 до 16 часов с последнего известного момента, когда пациент находился в нормальном состоянии, для проведения механической тромбэктомии. Показан лучший функциональный исход через 90 дней в экспериментальной группе [85]. Польза была независимо продемонстрирована для подгруппы пациентов, соответствовавших критериям пригодности исследования DAWN, а также для подгруппы, которая не соответствовала этим критериям. Исследования DAWN и DEFUSE 3 являются единственными РКИ, в которых была продемонстрирована польза механической тромбэктомии в период более 6 часов после возникновения инсульта. Поэтому для отбора пациентов следует использовать только критерии пригодности, использованные в этих исследованиях (NIHSS> 6 баллов, наличие проксимальной артериальной окклюзии, малый объем ядра инфаркта, сохранность коллатерального кровотока). В клинической практике необходимо строго следовать критериям пригодности, использованным в исследованиях DAWN и DEFUSE 3 [82, 83, 84].
- Рекомендуется всем пациентам с ишемическим инсультом проведение дуплексного сканирования брахиоцефальных артерий с цветным допплеровским картированием кровотока для визуализации атеросклеротической бляшки, оценки ее морфологического состояния и поверхности, опасности повторной эмболии [540].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 1).
Комментарий: Сочетание дуплексного сканирования брахиоцефальных артерий с цветным допплеровским картированием кровотока, позволяющее одновременно оценить локальные структурные изменения (сосуд) и функциональные (кровоток) изменения, существенно увеличивают диагностическую ценность исследования, составляющую для поражения МАГ всех степеней выраженности 85 — 95% по сравнению с ангиографией [86, 87, 88, 89, 90].
- Рекомендуется пациентам с верифицированным ишемическим инсультом у кандидатов на проведение реканализации и/или эндоваскулярной терапии с давностью симптомов ИИ в пределах периода от 6 до 24 часов от момента эпизода ИИ проведение дуплексного сканирования интракраниальных отделов брахиоцефальных артерий с целью оценки состояния внутримозгового кровотока [541, 542].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 5).
Комментарий: Дуплексное сканирование интракраниальных отделов брахиоцефальных артерий позволяет неинвазивно оценить состояние и степень реканализации внутримозговых сосудов и не имеет противопоказаний к использованию [91, 92, 93, 94, 95, 96, 97, 98, 99].
Другие инструментальные методы обследования
- Рекомендуется проведение ЭКГ всем пациентам с ТИА и ишемическим инсультом при госпитализации [59, 60,62, 63, 64].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5).
Комментарии: Всем пациентам с ИИ/ТИА необходимо проведение ЭКГ в 12 отведениях, для диагностики аритмий и ишемических изменений миокарда [64].
- Рекомендуется проведение холтеровского мониторирования сердечного ритма пациентам с ТИА/ИИ при наличии нарушений ритма сердца и неустановленным патогенетическим вариантом инсульта, пациентам с подозрением на кардиоэмболический вариант подтипа ИИ/ТИА (размеры очага, мультифокальность поражения, наличие ТИА более чем в одном сосудистом бассейне, отсутствие значимых изменений БЦА и сосудов основания мозга) целесообразно проведение холтеровского мониторирования сердечного ритма не менее 72 часов [62, 63].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 5).
Комментарий: Длительное мониторирование ЭКГ у 44% пациентов выявляет перманентные или эпизодические предсердные аритмии тех типов, которые известны, как причины церебральной эмболии, и только 45% обнаруживаются на ЭКГ покоя.
- Рекомендуется проведение эхокардиографии, в том числе чреспищеводной эхокардиографии у пациентов с ТИА/ИИ с целью обнаружения скрытых кардиальных источников эмболии без явных заболеваний сердца и для анатомической верификации источников эмболии у лиц с известным заболеванием сердца [514].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 1).
Комментарии: эхокардиография способна обнаруживать потенциальный кардиальный источник церебральной эмболии у 10 — 14% пациентов с ИИ, чрезпищеводная эхокардиография — у 40% пациентов с ИИ [100, 101, 102, 103, 104, 105, 514].
Клинико-инструментальный мониторинг
- Рекомендуется проведение инвазивного мониторинга системной (катетеризация артерий конечностей) и легочной (катетеризация органных артерий) гемодинамики, внутричерепной гипертензии (ВЧГ) (установка субдурального или желудочкового датчика внутричерепного давления), микродиализа, оценки тканевой оксигенации и температуры мозга по специальным показаниям пациентов со злокачественным течение ишемического инсульта, в процессе интенсивной терапии различных критических состояний [59, 60, 62, 63, 64].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 5).
Комментарии: Инвазивный мониторинг проводится пациентам обычно в отделении нейрореанимации, когда требуется агрессивная гемодинамическая и волемическая коррекция.
- Рекомендуется проведение клинико-инструментального мониторинга, включающего клинические, инструментальные и лабораторные методы исследования, всем пациентам с ТИА и ишемическим инсультом в острейшем периоде заболевания. Длительность мониторинга определяется состоянием пациента (минимальная продолжительность мониторинга не менее 24 часов) [12, 13, 14, 59, 60, 62, 63, 64].
Уровень убедительности рекомендаций C(уровень достоверности доказательств — 5).
Комментарии: Клинико-инструментального мониторинг обеспечивает объективный контроль за состоянием пациента и более точный, дифференцированный подход к проводимой терапии. Длительность и кратность клинического мониторинга (в том числе: визуальное исследование при патологии центральной нервной системы и головного мозга, исследование чувствительной и двигательной сферы при патологии центральной нервной системы и головного мозга), суточного прикроватного мониторирования жизненных функций и параметров, ультразвуковой допплерографии транскраниальных артерий методом мониторирования с микроэмболодетекцией, электроэнцефалографии, лабораторного мониторинга (в том числе: общий (клинический) анализ крови развернутый, биохимический общетерапевтический анализ крови, исследование кислотно-основного состояния и газов крови, уровня натрия, калия, хлоридов в крови, коагулограммы (ориентировочное исследование системы гемостаза), общий (клинический) анализ мочи), определяется тяжестью состояния пациента, включая основное и сопутствующее заболевание, наличие осложнений. Мониторинг более 72 часов проводится по специальным показаниям: при фибрилляции предсердий (с проведением эмболодетекции), снижении уровня бодрствования, нарастании неврологического дефицита, наличии кардиореспираторными заболеваний в анамнезе и др.
Иные диагностические исследования
Отсутствуют.
Дифференциальный диагноз
Дифференциальная диагностика с клиническими состояниями, имитирующими церебральный ишемический инсульт
Состояния, имитирующие ишемический инсульт или «маски» инсульта, наблюдаются в 3% случаев, наиболее частыми из них являются эпилепсия и конверсивные расстройства. Для правильной постановки диагноза следует уделять внимание тщательному сбору анамнеза. Если у самого пациента невозможно собрать анамнестические данные, необходимо задать интересующие вопросы его родственникам.
Основные состояния/заболевания, имитирующие ИИ, представлены в таблице 2.
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
1. Консервативная терапия
Под базисной терапией подразумеваются основные терапевтические стратегии, направленные на стабилизацию состояния тяжело больных пациентов и коррекцию тех нарушений, которые могут осложнить восстановление неврологических функций. Базисная терапия включает поддержание функций дыхания и кровообращения, коррекцию метаболических и волемических нарушений, контроль уровня артериального давления, профилактику и лечение таких состояний, как судороги, венозные тромбозы, дисфагия, аспирационные пневмонии и другие инфекционные осложнения, коррекцию повышенного внутричерепного давления.
- Рекомендуется всем пациентам с верифицированным дигнозом ИИ/ТИА начать лечение в условиях блока (палаты) интенсивной терапии/ отделения реанимации не позднее 60 минут от момента поступления пациентов в стационар [108].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
- Рекомендуется проведение мониторинга неврологического статуса, частоты сердечных сокращений, артериального давления, температуры тела и сатурации кислородом в течение 24 — 72 часов у пациентов с сохраняющейся общемозговой и очаговой неврологической симптоматикой [106, 107, 108, 110].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: Общепринятой практикой является активный мониторинг неврологического статуса и таких жизненно важных показателей, как артериальное давление, пульс, уровень глюкозы и температура тела. Для оценки неврологического статуса могут быть использованы такие общепризнанные неврологические шкалы, как Шкала Инсульта NIH [109]. Исходя из рандомизированных клинических испытаний, не существует прямых указаний, с какой частотой должен выполняться мониторинг показателей. Однако в исследованиях, касающихся организации отделений для лечения острых нарушений мозгового кровообращения [108], практиковалось наблюдение и обследование как минимум каждые 4 часа в течение первых 72 часов от начала заболевания.
1.1.1. Дыхательные пути, дыхание и оксигенация
- Рекомендуется поддержание проходимости дыхательных путей и искусственная, либо вспомогательная вентиляция легких пациентам с острым инсультом при снижении уровня сознания или развитии бульбарной дисфункции, которая приводит к нарушениям функционирования дыхательных путей [111, 112, 113].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
- Рекомендуется рассмотреть возможность ранней интубации трахеи с целью профилактики вторичного гипоксического повреждения мозга у пациентов с инсультом и оценкой по шкале комы Глазго (GCS, Приложение Г7) < 9 баллов, признаками повышенного внутричерепного давления, генерализованными судорожными приступами, инфарктом мозга, занимающим > 2/3 территории средней мозговой артерии, наличием смещения срединных структур при нейровизуализации [112, 113].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
- Рекомендуется подача дополнительного кислорода пациентам с ИИ и ТИА, со снижением сатурации кислорода < 94% методом пульсоксиметрии, с целью поддержания сатурации крови кислородом > 94% [114].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
- Не рекомендуется подача дополнительного кислорода при отсутствии гипоксии [115, 116].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
Комментарии: Не было выявлено благоприятного влияния на функциональный исход через 90 дней при подаче кислорода через назальную канюлю со скоростью 2 л/мин (исходная сатурация O2 > 93%) или 3 л/мин (исходная сатурация O2 ≤ 93%) непрерывно в течение 72 часов или по ночам в течение 3 ночей.
- Не рекомендуется проведение гипербарической оксигенации у пациентов с ишемическим инсультом, за исключением случаев, когда инсульт вызван воздушной эмболией [117, 118].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
1.1.2. Артериальное давление
- Не рекомендуется снижение артериального давления у пациентов с ишемическим инсультом, которые не получают реперфузионную терапию, при отсутствии у них выраженной артериальной гипертензии (> 200/110 мм рт. ст.) [119, 120, 121].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Раннее лечение артериальной гипертензии у пациентов с острым ишемическим инсультом может быть необходимым при сопутствующих заболеваниях (острое коронарное событие, острая сердечная недостаточность, расслаивающая аневризма аорты, преэклампсия/эклампсия и др.). Тем не менее, важно иметь в виду, что чрезмерное снижение АД может усугубить церебральную ишемию [122]. Пациентам со значительным повышением АД (> 200/110 мм рт. ст.), не имеющим показаний для реперфузионной терапии, рекомендуется снижение АД на 15% в течение первых 24 часов от начала инсульта. У пациентов с предшествующей артериальной гипертензией рекомендуется постепенное и плавное снижение уровня АД, стабилизация и поддержание уровня АД на 15 – 20 мм рт. ст. выше уровня среднего уровня АД (при наличии анамнестических данных). Обычно АД снижают до цифр 180/100 – 105 мм рт. ст. у пациентов с гипертонической болезнью в анамнезе, а в остальных случаях – до уровня 160 – 180/90 – 100 мм рт. ст. Целесообразно продолжение гипотензивной терапии, начатой до дебюта ОНМК. Пациентам, получавшим гипотензивную терапию до инсульта, целесообразно ее возобновление через 24 часа от начала ОНМК при отсутствии специфических противопоказаний и стабилизации неврологического и соматического статуса. Начало или возобновление гипотензивной терапии в течение первых 48 – 72 часов после наступления ишемического инсульта у пациентов с выраженной артериальной гипертензией (> 220/120 мм рт. ст.), не получавших реперфузионную терапию, при отсутствии сопутствующих заболеваний, требующих интенсивной гипотензивной терапии, безопасно, но не снижает уровень смертности и не влияет на функциональный исход [119, 120, 123, 124].
- Рекомендуется проводить коррекцию гипотензии и гиповолемии для поддержания системного уровня перфузии, необходимого для поддержания функционирования органов [522, 523].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Комментарии: Исследований, направленных на оценку коррекции низкого АД у пациентов с инсультом, не проводилось. В систематическом анализе [125], посвященном сравнению коллоидов с кристаллоидами, шансы смертельного исхода или зависимости были сходными. Клинически значимая польза или вред не могут быть исключены. Данные, которыми можно было бы руководствоваться для определения объема и продолжительности парентерального введения жидкости, отсутствуют. Также отсутствуют исследования, в которых проводили бы сравнение различных изотонических жидкостей. Большинство пациентов с инсультом при поступлении в стационар обезвожены, что может быть плохим прогностическим признаком, связанным с неблагоприятным исходом заболевания [126]. Несмотря на ограниченную доказательность клинических исследований, внутривенная инфузионная терапия обычно является частью лечения острого инсульта, особенно у пациентов с риском дегидратации (пациенты с угнетением уровня сознания и нарушением функции глотания).
- Не рекомендуется лекарственно индуцированная гипертензия для пациентов с ишемическим инсультом, кроме отдельных пациентов с флюктуирующими симптомами и низким систолическим артериальным давлением, которые не являются кандидатами на реперфузионную терапию, у которых возможно рассмотреть стратегию повышения систолического артериального давления с целью усиления коллатерального кровообращения и предотвращения раннего неврологического ухудшения [127, 128].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3).
- Рекомендуется обеспечить понижение уровня АД, пациентам с повышенным АД, которые по остальным критериям подходят для проведения системной тромболитической терапии, до следующих показателей: систолическое АД < 185 мм рт. ст., диастолическое АД < 110 мм рт. ст. до начала системной тромболитической терапии [129, 130, 131, 132, 133].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
Комментарии: В РКИ, включавших в/в введение алтеплазы**, были установлены следующие требования: систолическое АД < 185 мм рт. ст., диастолическое АД < 110 мм рт. ст. до начала терапии; в течение, как минимум, первых 24 часов после терапии АД должно поддерживаться на уровне < 180/105 мм рт. ст. При необходимости коррекции гипертензии предпочтение следует отдавать препаратам короткого действия, вводимым внутривенно. Некоторые наблюдательные исследования указывают на то, что риск возникновения кровотечений после введения алтеплазы** выше у пациентов с более высоким уровнем АД [129, 130, 131, 132], а также у пациентов с более выраженными колебаниями АД [134, 135]. Точные значения АД, при которых увеличивается риск возникновения кровотечений после тромболитической терапии, неизвестны, хотя показано, что в случае успешной реканализации повышение АД связано с большим риском внутричерепного кровоизлияния любого типа [133]. Поэтому целесообразным является поддержание АД на целевом уровне, использованном в РКИ, в которых изучали ВВ ТЛТ.
- Рекомендуется поддержание АД на уровне < 140/80 мм рт. ст. в течение первых 24 часов после реперфузионной терапии, с достижением полной реканализации (TICI 3), в сочетании с полным регрессом симптоматики; при достижении частичной реканализации (TICI 2), сопровождающейся регрессом неврологического дефицита, либо полной реканализации (TICI 3) без сопутствующего регресса симптоматики, рекомендуется поддерживать АД < 160/90 мм рт. ст. [133].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
- Рекомендовано поддержание АД на уровне ≤ 185/110 мм рт. ст. у пациентов, которым планируется проведение механической тромбэмболэктомии, и которые не получали внутривенную тромболитическую терапию [84, 136, 137, 138, 139, 140].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Из 6 РКИ, в которых была независимо продемонстрирована клиническая польза механической тромбэктомии с использованием стент-ретривера при проведении ее в течение периода < 6 часов после возникновения инсульта, в 5 РКИ (REVASCAT, SWIFT PRIME, EXTEND-IA, THRACE и MR CLEAN [136, 137, 138, 139, 140] был установлен критерий непригодности проведения процедуры — АД > 185/110 мм рт. ст. В шестом РКИ, ESCAPE [141] не был установлен критерий непригодности для проведения процедуры на основании АД. В исследовании DAWN [84] также использовали критерий исключения АД > 185/110 мм рт. ст. Данные РКИ, касающиеся оптимальных подходов к поддержанию надлежащего уровня АД в этих условиях, отсутствуют. Поскольку у подавляющего большинства пациентов, включенных в эти РКИ, уровень АД перед проведением процедуры поддерживали на уровне ниже 185/110 мм рт. ст., целесообразным является использование этого уровня в качестве целевого.
- Не рекомендуется назначение препаратов, обладающих сосудорасширяющими свойствами (нитроглицерин**, теофиллин и его аналоги, блокаторы кальциевых каналов) пациентам с острым ишемическим инсультом [142, 143, 144].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
1.1.3. Водно-электролитный баланс
- Рекомендуется регулярный мониторинг жидкостного и электролитного баланса у пациентов с тяжелым инсультом или с расстройствами глотания [524, 525, 526].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
- Не рекомендуется использование гипотонических и гипоосмолярных растворов, в том числе раствора декстрозы**, в раннем периоде инсульта [125, 145, 146].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
- Не рекомендуется расширение объема циркулирующей крови за счет гемодилюции при лечении пациентов с острым ишемическим инсультом [147, 148].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
- Не рекомендуется введение альбумина** в высоких дозах при лечении пациентов с острым ишемическим инсультом [125,149].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
1.1.4. Температура
- Рекомендуется всем пациентам с предположительным или установленным диагнозом ИИ или ТИА при наличии гипертермии (температура тела более 38 °C) провести обследование с целью выявления причины гипертерми, после чего должны быть предприняты соответствующие терапевтические меры. Пациентам с гипертермией после инсульта рекомендуется назначение препаратов из группы анальгетиков и антипиретиков для снижения температуры тела [150, 151, 152, 153].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
Комментарии: Гипертермия является частым осложнением и встречается у до 50% пациентов с острым ишемическим инсультом [154] и, как было показано, сопровождается плохим исходом лечения [151, 152]. Гипертермия также увеличивает потребность в кислороде и может усугубить сердечную или легочную недостаточность, а также может вызвать психические изменения у пациентов с заболеваниями головного мозга. В крупномасштабном, ретроспективном, когортном исследовании, проведенном в период с 2005 по 2013 гг., в которое включали пациентов, поступавших в отделения интенсивной терапии в Австралии, Новой Зеландии и Великобритании, было показано, что максимальная температура в течение первых 24 часов < 37 °C и > 39 °C была связана с повышенным риском внутрибольничной смерти по сравнению с нормотермией согласно данным, полученным у 9366 пациентов с ИИ [153]. Исследование QASC показало, что внедрение протоколов лечения лихорадки, дисфагии и гипергликемии, улучшило результаты лечения и привело к снижению смертности и инвалидизации на 16% через 90 дней и в стационаре [155]. Хотя было невозможно точно определить, какой из трех компонентов этого вмешательства оказал благотворное влияние, множественный логистический регрессионный анализ показал, что основными детерминантами были гипергликемия и лечение лихорадки [156].
- Рекомендуется поиск сопутствующей инфекции при повышении температуры тела более 37,5 °C [153,157, 158].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3).
- Не рекомендуется профилактическое применение антибиотиков при ишемическом инсульте [159, 160, 161, 162, 163].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
- Не рекомендуется применение индуцированной гипотермии при лечении пациентов с ишемическим инсультом [164, 165, 166].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
Комментарии: Гипотермия является многообещающей нейропротекторной стратегией, однако польза при лечении пациентов с ИИ не подтверждена. Большинство исследований указывают на то, что индукция гипотермии связана с увеличением риска инфекции, включая пневмонию. Терапевтическая гипотермия может применяться только в условиях клинических исследований.
- Не рекомендуется рутинная профилактика гипертермии с помощью препаратов из группы анальгетиков и антипиретиков, в качестве средства для улучшения функционального исхода и/или выживаемости, у пациентов с ишемическим инсультом и нормотермией [167, 168].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
1.1.5. Гликемия
- Рекомендуется устранение гипергликемии, а также проведение тщательного мониторинга для предотвращения возникновения гипогликемии у пациентов с ИИ. Предпочтительный подход к лечению гипергликемии заключается в использовании инсулинотерапии для достижения целевого уровня глюкозы между 7,8 и 10,0 ммоль/л, избегая более интенсивного снижения уровня гликемии, которое может привести к более высокому риску гипогликемии [170, 172, 527].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: Имеющиеся доказательства указывают на то, что устойчивая гипергликемия, сохраняющаяся в течение первых 24 часов пребывания в стационаре после ОИИ, связана с более неблагоприятными исходами, по сравнению с нормогликемией. Существуют убедительные доказательства, что высокий уровень глюкозы в острой фазе инсульта является независимым предиктором увеличения размера инфаркта, плохого функционального исхода и более высокого риска смерти [169]. Хотя и на меньшем количестве данных, было однозначно показано, что гипергликемия независимо связана с плохим функциональным исходом также у пациентов с острым геморрагическим инсультом и церебральным венозным тромбозом [170, 171, 172, 173, 174]. Исследование QASC показало, что внедрение протоколов лечения лихорадки, дисфагии и гипергликемии, улучшило результаты лечения и привело к снижению смертности и инвалидизации на 16% через 90 дней и в стационаре [155]. Хотя было невозможно точно определить, какой из трех компонентов этого вмешательства оказал благотворное влияние, множественный логистический регрессионный анализ показал, что основными детерминантами были гипергликемия и лечение лихорадки [156].
- Не рекомендуется жесткий контроль гликемии с помощью рутинного введения инсулинов и их аналогов внутривенно, в качестве средства для улучшения функционального результата, выживаемости или для замедления темпов роста инфаркта, у пациентов с ишемическим инсультом [527].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: Опубликованный метаанализ, оценивающий оптимальную цель для гликемического контроля у пациентов в критических состояниях, показал, что целевые уровни глюкозы < 5,5 ммоль/л и 6 – 7,9 ммоль/л были связаны с более высоким риском гипогликемии по сравнению с целевым уровнем 7,9 – 9,9 ммоль/л [164].
- Рекомендуется проводить коррекцию гипогликемии (уровень глюкозы в крови менее 3,7 ммоль/л), у пациентов с ИИ [175].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
Комментарии: Уровни глюкозы ниже 3,7 ммоль/л в течение первых 24 часов после дебюта были связаны с неблагоприятными функциональными исходами инсульта.
1.1.6. Питание
- Рекомендуется проведение скрининга дисфагии перед кормлением у пациентов с ишемическим инсультом [176].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
Комментарий: скрининг дисфагии должен проводить логопед.
- Рекомендуется начинать энтеральное питание при церебральном инсульте в течение 7 дней [178, 179].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
Комментарии: Расчет объема и состава питания рекомендуется проводить с участием врача-диетолога, нутрициолога, либо другого специалиста, прошедшим подготовку по искусственному питанию пациентов в критических состояниях. Необходимо обеспечивать ежедневную дефекацию с применением стимулирующих средств и приемов механического опорожнения кишечника.
- Рекомендуется устанавливать назогастральные зонды при дисфагии в острейшей фазе инсульта (в течение первых 7 дней) для кормления, а у пациентов с ожидаемой длительной дисфагией (> 2 – 3 нед) — чрескожную гастростому [178, 179].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2).
- Рекомендуется ввести протокол гигиены полости рта для снижения риска развития пневмонии после инсульта [180, 181, 182, 183].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3).
1.1.7. Профилактика тромбоза глубоких вен
- Не рекомендуется использовать компрессионные чулки у пациентов с ишемическим инсультом [183].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
- Рекомендуется перемежающаяся пневматическая компрессия в дополнение к стандартной терапии (ацетилсалициловая кислота** и гидратация) для неподвижных пациентов с ишемическим инсультом [184, 185].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2).
Комментарии: Метод не рекомендуется к использованию у пациентов с открытыми ранами на ногах и должен применяться с осторожностью у пациентов с уже существующим тромбозом глубоких вен, сердечной недостаточностью, тяжелыми заболеваниями периферических сосудов или спутанным сознанием, когда попытки встать могут привести к падению и травме [184, 185].
- Рекомендуется профилактическая антикоагуляция гепарином натрия (5000 единиц п/к 2 или 3 раза в день) или надропарином кальция для неподвижных пациентов с ишемическим инсультом, у которых преимущества снижения риска венозной тромбоэмболии достаточно высоки, чтобы компенсировать повышенный риск внутричерепных и внечерепных кровотечений, связанных с их использованием [186, 187, 188].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
- Рекомендуется рассмотреть надропарин кальция вместо гепарина натрия из-за большего снижения риска тромбоза глубоких вен, большего удобства, снижения затрат на персонал и комфорта пациента, связанных с однократной суточной дозой, по сравнению с многократными ежедневными инъекциями, если было принято решение о том, что показана профилактическая антикоагуляция [184, 186].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
Комментарии: Преимущества надропарина кальция должны быть сопоставлены с более высоким риском экстракраниального кровотечения, более высокими затратами на лекарства и рисками у пожилых пациентов с плохой функцией почек [184, 186].
1.1.8. Прочая терапия и уход
- Рекомендуется консультация врача-уролога всем пациентам с недержанием мочи. Не рекомендуется при нарушении функции нижних мочевыводящих путей рутинная установка постоянного мочевого катетера из-за повышения риска уроинфекции [189].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 1).
Комментарии: В остром периоде ИИ одной из форм нарушения мочеиспускания является ургентное недержание мочи (НМ). Выявлена чёткая взаимосвязь наличия ургентного недержания мочи и тяжёлых двигательных и ментальных нарушений. Причиной ургентного НМ при инсульте является детрузорная гиперактивность вследствие утраты ингибирующего влияния корковых центров на рефлекс мочеиспускания. В случаях отсутствия остаточной мочи рекомендуется назначение троспия хлорида, который являются препаратом выбора с доказанной эффективностью для лечения нейрогенной детрузорной гиперактивности. Целесообразно использование наружных кондомных мочеприемников у мужчин и памперсов у женщин. Другой формой нарушения функции нижних мочевыводящих путей может быть задержка мочеиспускания. Показана кратковременная (не более 7 дней) катетеризация уретры в асептических условиях. Не рекомендуется рутинная установка постоянного мочевого катетера из-за повышения риска уроинфекции. Предпочтительна перемежающаяся катетеризация при контроле диуреза, оценке остаточного объем мочи посредством УЗИ, документированном учете объемов самостоятельного мочеиспускания или объемов мочи при прерывистой катетеризации.
- Рекомендуется регулярно проводить осмотр кожных покровов с объективной оценкой риска пролежней у пациентов с ишемическим инсультом [192].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется свести к минимуму или устранить трение кожи, уменьшить давление на ее поверхность, обеспечив соответствующую опору, избегать чрезмерного увлажнения и сухости, поддерживать достаточный уровень питания кожи. Также рекомендуется регулярная обработка, высокий уровень гигиены и использование специальных матрасов и подушек для инвалидных колясок и сидений до восстановления мобильности пациентов [192].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
1.1.9. Терапия прогрессирующего отека мозга и других осложнений
Отек, сопровождающийся объемным эффектом, является главной причиной ухудшения состояния и смерти у пациентов с большими супратенториальными инфарктами. Угрожающий жизни отек головного мозга обычно развивается между 2-ми и 5-ми сутками от начала ИИ, хотя у третьей части пациентов нарастание неврологической симптоматики может отмечаться в течение 24 часов после появления симптоматики.
- Рекомендуется проводить лечение, направленное на снижение риска отека и осуществлять тщательный мониторинг признаков неврологического ухудшения в первые дни после инсульта у пациентов с обширным инфарктом мозга [13, 59, 60, 61,193].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: Для снижения риска отека мозга необходимо придерживаться базовых принципов коррекции внутричерепной гипертензии, которые включают в себя: возвышенное положение головного конца кровати на 15 — 45 градусов, укладка головы пациента по средней линии, исключение чрезмерного сгибания и разгибания шеи, купирование рвоты, судорог, дрожи, коррекцию возбуждения, проведение адекватной анальгезии, коррекцию гипертемии, поддержание нормовентиляции, устранение артериальной гипотензии, ограничение использования гипоосмолярных растворов, в том числе из группы АТХ B05BB Растворы, влияющие на водно-электролитный баланс, и растворов декстрозы из группы АТХ B05BA03 Углеводы [13, 59, 60, 61,193].
- Рекомендуется ранняя консультация врача-нейрохирурга при высоком риске развития злокачественного отека мозга [194, 195].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
- Рекомендуется осмотерапия для лечения предполагаемого повышенного внутричерепного давления, при ухудшении клинической картины [196].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
- Рекомендуется в качестве временной терапии – кратковременная мягкая гипервентиляция (целевой уровень рСО2 = 30 – 34 мм рт. ст.) у пациентов с ухудшением неврологического статуса в результате отека мозга [197].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Не рекомендуется применение гипотермии при ишемическом отеке головного мозга или мозжечка [198].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
- Не рекомендуется применение производных барбитуровой кислоты при ишемическом отеке головного мозга или мозжечка [528].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
- Не рекомендуется применять глюкокортикоиды (обычно назначаемые в высоких дозах) при лечении пациентов с отеком головного мозга и повышенным внутричерепным давлением, наблюдающимися при инсульте, по причине отсутствия доказательств эффективности и повышения потенциального риска инфекционных осложнений [199].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
1.2. Дифференцированная терапия
1.2.1. Реперфузионные технологии
Современные разрешенные к применению у пациентов с ИИ реперфузионные технологии.
• Внутривенная, медикаментозная тромболитическая терапия.
• Механическая тромбэкстракция – тромбэмболэктомия – (тромбаспирация).
• Этапная реперфузия – «rtPA – bridging» – комбинация ВВ ТЛТ и механической реканализации (ВВ ТЛТ + ТЭ (ТА)): при окклюзии крупного сосуда проведение ВВ ТЛТ, в случае неэффективности – последующая механическая реканализация.
1.2.2. Внутривенная тромболитическая терапия
- Рекомендуется проведение внутривенной тромболитической терапии, путем введения алтеплазы** для пациентов, у которых лечение может быть начато в течение 4,5 часов после возникновения симптомов ишемического инсульта или последнего известного времени, когда у пациента не наблюдалось этих симптомов [73, 200, 201].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Комментарии: Подробная последовательность действий, показания и противопоказания к ВВ ТЛТ, особенности ведения пациентов представлены в протоколе реперфузионной терапии [202].
- Рекомендуется минимизировать временные потери и максимально быстро начинать ВВ ТЛТ пациентам с ишемическим инсультом, имеющим показания для ВВ ТЛТ и при отсутствии у них противопоказаний к ВВ ТЛТ [73]. Оптимальное время проведения ВВ ТЛТ не позднее 40 минут от момента установления диагноза [587]
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Комментарии: Польза от ВВ ТЛТ зависит от времени, прошедшего от начала заболевания [203, 204, 205, 206, 207]. Проводить оценку пациента по шкале NIHSS должен опытный невролог, прошедшим обучение по использованию данной шкалы, а результат КТ – опытный радиолог, либо должна использоваться система автоматизированной оценки визуализационных изображений, при оценке противопоказаний к ВВ ТЛТ.
- Рекомендуется не задерживать начало экстренной реперфузионной терапии с внутривенным введением алтеплазы**, в некоторых случаях, ради ожидания результатов общего анализа крови или анализов свертывания крови, в случае достоверного отсутствия причин для ожиданий получения отклоняющихся результатов, учитывая низкий риск непредвиденных отклонений числа тромбоцитов или показателей свертываемости крови в популяции [73].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
- Рекомендуется внутривенное введение алтеплазы** в дозе 0,9 мг/кг (максимальная доза 90 мг) в течение 60 минут, при этом первые 10% дозы вводят струйно в течение 1 минуты) [73, 200, 201, 204, 208, 209, 210, 211].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
Комментарии: Безопасность и эффективность такой терапии при ее проведении в течение первых 4,5 часов после возникновения инсульта, надежно подтверждается объединенными данными, полученными в нескольких РКИ [73, 200,201], а также обширным опытом, накопленным во многих странах [204]. Исследование (ECASS-III), специально направленное на оценку эффективности внутривенного введения алтеплазы** в течение 3 и 4,5 часов с момента возникновения симптомов [210], а также объединенный анализ данных о внутривенном введении алтеплазы** в течение различных по продолжительности периодов, полученных в нескольких исследованиях [73, 200,201], поддерживают значимость проведения ВВ ТЛТ в течение периода до 4,5 часов после возникновения симптомов. В исследовании ECASS-III исключали пациентов в возрасте старше 80 лет; пациентов, получавших варфарин**, независимо от значения международного нормализованного отношения; пациентов, имеющих в анамнезе одновременно сахарный диабет и предыдущий ишемический инсульт, а также пациентов с очень тяжелыми инсультами (балл по шкале NIHSS > 25), в связи с предполагаемым избыточным риском внутричерепного кровоизлияния во всех этих случаях. Однако тщательный анализ доступных опубликованных данных, приведенный в научном заявлении AHA (Американской ассоциации по инсульту), указывает на то, что эти критерии исключения, применявшиеся в ходе исследования, могут быть необоснованными в клинической практике [208]. Польза внутривенного введения алтеплазы** для взрослых пациентов с симптомами инвалидизирующего инсульта, независимо от возраста и степени тяжести инсульта, надлежащим образом установлена [209, 211].
- Рекомендуется рассмотреть вопрос об использование #сниженной дозы алтеплазы** (0,6 мг/кг) у пациентов старше 80 лет, у лиц азиатской расы, у пациентов, получающих антагонисты витамина K и прямые ингибиторы фактора Xa (за исключением пациентов, получавших дабигатрана этексилат**, у которых выполнена нейтрализация антикоагулянтного эффекта путем введения идаруцизумаба), ингибиторы агрегации тромбоцитов, и у пациентов с высоким риском геморрагической трансформации, но не имеющих противопоказаний для выполнения ВВ ТЛТ [212, 213].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
Комментарии: Данный подход находится вне рамок одобренной МЗ РФ инструкции по медицинскому применению препарата алтеплаза**, базируется на результатах многоцентровых рандомизированных клинических исследований) [212]. Более низкая доза внутривенно введенной алтеплазы** (0,6 мг/кг) ассоциирована с меньшим количеством симптомных геморрагических трансформаций [213].
- Не рекомендуется внутривенное введение дефибринирующих средств (относятся к группе B01AD Ферментные препараты АТХ-классификации) или внутривенного введения фибринолитических средств (относятся к группе B01AD Ферментные препараты АТХ-классификации), отличных от алтеплазы** и тенектеплазы**, у пациентов с ишемическим инсультом при проведении ВВ ТЛТ [74, 78, 214, 529, 530, 531, 532, 533, 534].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2).
Комментарий: Не была подтверждена большая или меньшая эффективность тенектеплазы**, вводимой в дозе 0,4 мг/кг в виде однократной внутривенной струйной инъекции, в сравнении с алтеплазой** [214], однако это лекарственное средство может рассматриваться в качестве альтернативы алтеплазы** у пациентов с незначительными неврологическими нарушениями и без значительных внутричерепных окклюзий, а также у пациентов, которым предстоит экстренное эндоваскулярное вмешательство с целью механической реваскуляризации.
- Рекомендуется проведение ВВ ТЛТ у пациентов с «ночным инсультом» (с неизвестным временем возникновения симптомов), при выявлении DWI/FLAIR несоответствия (выявление очага на МРТ в режиме DWI и его отсутствие на МРТ в режиме FLAIR) [215].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
Комментарии: Данные крупномасштабного исследования WAKE-UP [215], в котором оценивалась эффективность и безопасность ВВ ТЛТ при инсульте после пробуждения (ИПП), свидетельствуют о том, что в ситуации, когда точно не известно время начала заболевания, проведение ТЛТ после предварительной МРТ сопровождается более благоприятными функциональными исходами. При наличии ишемического повреждения головного мозга по данным диффузионно-взвешенной МРТ и отсутствии гиперинтенсивности в паренхиме по данным МРТ в режиме FLAIR, можно предположить, что давность возникновения инсульта не превышает 4,5 часов, что, в свою очередь, позволяет назначить пациентам внутривенно алтеплазу**. Такой подход к решению вопроса о назначении ВВ ТЛТ у пациентов с ИПП позволяет добиться увеличения количества пациентов с более благоприятными 90-дневными функциональными исходами (0 или 1 балл по модифицированной шкале Рэнкина, Приложение Г6), по сравнению с плацебо (53,3% против 41,8%).
- Рекомендуется во время прохождения пациентом с ишемическим инсультом фибринолитической терапии соблюдать готовность по предотвращению потенциально нежелательных эффектов, включая осложнения, связанные с кровотечениями и ангионевротическим отеком, который может вызвать обструкцию дыхательных путей [216, 217 — 227].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
- Рекомендуется использование антитромботической терапии в течение первых 24 часов после внутривенного введения алтеплазы** (в сочетании с ТЭ/ТА или без таковой) при наличии сопутствующих состояний, относительно которых известно, что такая терапия, проводимая без внутривенного введения алтеплазы**, обеспечивает существенную пользу, или известно, что отказ от такой терапии вызывает существенный риск [228].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
- Рекомендуется выполнение ВВ ТЛТ у пациентов, получающих прямые ингибиторы тромбина и прямые ингибиторы фактора Xa (дабигатрана этексилат**, ривароксабан**, апиксабан**), если есть убедительные данные о том, что последняя доза препарата принята более 48 часов и при условии нормальной функцией почек (клиренс креатинина > 80 мл/мин по Кокрофту — Голту) [229, 230].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 5).
Комментарии: Выполнение ВВ ТЛТ противопоказано пациентам, находящимся в состоянии гипокоагуляции. Принимая во внимание, что период полувыведения прямых ингибиторов тромбина и прямых ингибиторов фактора Xa у пациентов с нормальной функцией почек не превышает 17 часов [230]. 48 часов после приема последней дозы препарата является тем периодом, по истечении которого антикоагулянтный эффект препарата у пациента с нормальной функцией почек (клиренс креатинина >80 мл/мин) уже отсутствует [194].
- Рекомендуется выполнение ВВ ТЛТ пациентам, получающих дабигатрана этексилат**, у которых с момента приема последней дозы препарата прошло от 12 до 48 часов, либо клиренс креатинина менее 80 мл/мин., либо неизвестно время приема последней дозы, если значения тромбинового времени находятся в пределах референсного диапазона локальной лаборатории [229, 230].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 5).
Комментарии: Период полувыведения дабигатрана этексилата** у пациентов с нормальной функцией почек (клиренс креатинина >80 мл/мин) не превышает 12 — 17 часов [230]. Если с момента приема последней дозы препарата прошло менее 48 часов, антикоагулянтный эффект препарата может присутствовать. У пациентов, с нарушением функции почек период полувыведения дабигатрана этексилат**удлиняется, в связи с чем, даже в ситуации, когда с момента последней дозы прошло более 48 часов, нельзя исключить возможность присутствия антикоагулянтного эффекта препарата. В связи с этим в указанных клинических группах пациентов рекомендуется оценка тромбинового времени, которая позволит исключить присутствие антикоагулянтного эффекта дабигатрана этексилата**. Тромбиновое время является тестом, наиболее чувствительным к действию дабигатрана этексилата**. Нормальные значения тромбинового времени позволяют полностью исключить присутствие дабигатрана этексилата** в плазме крови.
- Рекомендуется выполнение ВВ ТЛТ после нейтрализации антикоагулянтного эффекта дабигатрана этексилата** с помощью введения специфического антагониста (идаруцизумаба) пациентам, получающих дабигатрана этексилат**, у которых с момента приема последней дозы препарата прошло от 12 до 48 часов, либо клиренс креатинина менее 80 мл/мин., либо неизвестно время приема последней дозы, а значения тромбинового времени выходят за пределы верхней границы референсного диапазона местной лаборатории [231, 232, 233].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 4).
Комментарий: Повышение тромбинового времени у пациента, получающего дабигатрана этексилат**, свидетельствует о присутствии антикоагулянтного эффекта дабигатрана этексилата**. Идаруцизумаб является специфическим антагонистом дабигатрана этексилата**. Введение идаруцизумаба позволяет быстро и устойчиво нейтрализовать действие дабигатрана этексилата**, что было убедительно продемонстрировано в исследовании RE-VERSE AD. Возможность применения идаруцизумаба для нейтрализации антикоагулянтного эффекта дабигатрана этексилата** перед выполнением внутривенного тромболизиса у пациентов с острым ишемическим инсультом продемонстрирована в серии клинических случаев [231, 232, 233].
- Не рекомендуется выполнение ВВ ТЛТ при отсутствии возможности введения специфического антагониста к дабигатрана этексилату** (идаруцизумаба) у пациентов, получающих дабигатрана этексилат**, у которых с момента приема последней дозы препарата прошло от 12 до 48 часов, либо клиренс креатинина менее 80 мл/мин, либо неизвестно время приема последней дозы, а значения тромбинового времени выходят за пределы верхней границы референсного диапазона местной лаборатории [229, 230].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 5).
Комментарий: Тромбиновое время является тестом, самым чувствительным к антикоагулянтному эффекту дабигатрана этексилата**. Значения тромбинового времени, выходящие за верхнюю границу референсного диапазона, свидетельствуют о возможности присутствия дабигатрана этексилата** в плазме крови и наличии его антикоагулянтного эффекта. В такой ситуации выполнение ВВ ТЛТ, ассоциировано с серьезными геморрагическими рисками и не рекомендуется.
- Рекомендуется выполнение ВВ ТЛТ пациентам, получающих дабигатрана этексилат**, у которых с момента приема последней дозы препарата прошло менее 12 часов, после нейтрализации антикоагулянтного эффекта дабигатрана этексилата** с помощью введения специфического антагониста (идаруцизумаба) [231, 232, 233].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 5).
Комментарий: Период полувыведения дабигатрана этексилата** составляет от 12 до 17 часов [230]. В связи с этим в ситуации, когда с момента приема последней дозы дабигатрана этексилата** прошло менее 12 часов, с высокой вероятностью предполагается присутствие препарата в плазме крови и, соответственно, наличие его антикоагулянтного эффекта. Введение идаруцизумаба позволяет быстро и устойчиво нейтрализовать действие дабигатрана этексилата**, что было убедительно продемонстрировано в исследовании RE-VERSE AD. Возможность применения идаруцизумаба для нейтрализации антикоагулянтного эффекта дабигатрана этексилата** перед выполнением ВВ ТЛТ у пациентов с острым ишемическим инсультом продемонстрирована серией в серии клинических случаев [231, 232, 233].
- Не рекомендуется выполнение ВВ ТЛТ пациентам, получающих дабигатрана этексилат**, у которых с момента приема последней дозы препарата прошло менее 12 часов, при отсутствии возможности введения специфического антагониста к дабигатрана этексилату** (идаруцизумаба) [229, 230, 231, 232, 233].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 5).
Комментарий: Период полувыведения дабигатрана этексилата** составляет от 12 до 17 часов [230]. В связи с этим в ситуации, когда с момента приема последней дозы дабигатрана этексилата** прошло менее 12 часов, с высокой вероятностью предполагается присутствие препарата в плазме крови и, соответственно, наличие его антикоагулянтного эффекта. В случае отсутствия возможности нейтрализации антикоагулянтного эффекта дабигатрана этексилата** с помощью идаруцизумаба, выполнение тромболизиса не рекомендуется, поскольку пациент рассматривается как находящийся в состоянии гипокоагуляции.
- Рекомендуется проведение ВВ ТЛТ пациентам, получающих прямые ингибиторы фактора Ха свертывания крови (ривароксабан**, апиксабан**, эдоксабан), у которых с момента приема последней дозы препарата прошло от 12 до 48 часов, либо клиренс креатинина менее 80 мл/мин., либо неизвестно время приема последней дозы, при условии отсутствия определяемой анти-Ха активности плазмы крови [229, 230].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 5).
Комментарии: Периоды полувыведения прямых ингибиторов фактора Ха у пациентов с нормальной функцией почек (клиренс креатинина > 80 мл/мин) не превышают 14 часов [230]. Если с момента приема последней дозы препарата прошло менее 48 часов, антикоагулянтный эффект препарата может присутствовать. У пациентов с нарушением функции почек период полувыведения Ха может быть удлинен, в связи с чем, даже в ситуации, когда с момента последней дозы прошло более 48 часов, нельзя исключить возможность присутствия антикоагулянтного эффекта препарата. В связи с этим в указанных клинических группах пациентов рекомендуется проведение тестов, позволяющих исключить присутствие антикоагулянтного эффекта. Единственным лабораторным тестом, который позволяет достаточно точно оценить присутствие или отсутствие антикоагулянтного эффекта прямых ингибиторов фактора Ха, является оценка анти-Ха активности плазмы крови. В случае выявления определяемого уровня анти-Ха активности плазмы крови пациент должен рассматриваться как находящийся в состоянии гипокоагуляции. С учетом отсутствия специфического антагониста, позволяющего нейтрализовать антикоагулянтный эффект препаратов, выполнение ВВ ТЛТ у таких пациентов не рекомендуется.
- Не рекомендуется проведение ВВ ТЛТ пациентам, получающих прямые ингибиторы фактора Ха свертывания крови (ривароксабан**, апиксабан**, эдоксабан), у которых с момента приема последней дозы препарата прошло менее 12 часов [229, 230].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 5).
Комментарий: Периоды полувыведения прямых ингибиторов фактора Ха у пациентов с нормальной функцией почек находятся в пределах от 5 до 14 часов в зависимости от возраста пациента и конкретного препарата [230]. В связи с этим в ситуации, когда с момента приема последней дозы ривароксабана**, эдоксабана или апиксабана** прошло менее 12 часов, с высокой вероятностью предполагается присутствие препарата в плазме крови и, соответственно, наличие его антикоагулянтного эффекта. С учетом отсутствия специфического антагониста, позволяющего нейтрализовать антикоагулянтный эффект препаратов, выполнение внутривенного тромболизиса у таких пациентов не рекомендуется.
- Рекомендуется начало ВВ ТЛТ немедленно после введения идаруцизумаба и последующего забора образца крови для экстренного определения тромбинового времени, не дожидаясь готовности результата измерения тромбинового времени, пациентам с ишемическим инсультом, получавших дабигатрана этексилат**, которым было выполнено введение специфического антагониста (идаруцизумаба). В случае если полученные значения тромбинового времени будут превышать верхнюю границу референсного диапазона местной лаборатории, рекомендуется остановить выполнение ВВ ТЛТ [231, 232, 233].
Уровень убедительности рекомендации C (уровень достоверности доказательств – 5).
Комментарий: Согласно результатам исследований специфического антагониста к дабигатрану этексилату** препарата идаруцизумаб (I — III фазы), нейтрализация эффекта дабигатрана этексилата** достигается немедленно после внутривенного введения идаруцизумаба [234, 235]. В связи с этим инициация ВВ ТЛТ может быть произведена немедленно после окончания инфузии идаруцизумаба и последующего забора образца для определения тромбинового времени, не дожидаясь готовности результатов последнего.
1.2.3. Механическая реканализация с применением эндоваскулярных устройств
1.2.3.1. Внутрисосудистые вмешательства в каротидной системе
- Рекомендуется при наличии показаний выполнять внутрисосудистые вмешательства (ВСТЭ) в каротидной системе как можно раньше, не дожидаясь окончания введения тромболитика (относится к группе B01AD Ферментные препараты АТХ-классификации) или клинического эффекта от проводимой ТЛТ [236, 237].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств — 1).
Комментарий: Современные метаанализы рандомизированных исследований ВСТЭ при ОНМК по ишемическому типу в каротидной системе свидетельствуют о более высокой эффективности внутрисосудистых вмешательств в сравнении со стандартной терапией при наличии верифицированной окклюзии крупной интракраниальной артерии [236, 237, 238, 239].
Как показывают систематические обзоры рандомизированных исследований с метаанализом, внутривенная тромболитическая терапия доказанно улучшает функциональные исходы на 90 сутки у пациентов с ОНМК по ишемическому типу в каротидной системе [240, 241], аналогичные данные получены применительно к внутрисосудистой тромбоэмболэктомии при верифицированной окклюзии крупной интракраниальной артерии в каротидной системе [236]. к показал метаанализ результатов 5 рандомизированных исследований, применение ВСТЭ было одинаково эффективно как в группе подвергшихся внутрисосудистому вмешательству в сочетании с ТЛТ, так и без ТЛТ в сравнении со стандартной терапией [236]. В метаанализе индивидуальных данных 7 многоцентровых рандомизированных исследований (1764 пациента, HERMES collaboration) [242] аналогичным образом не было выявлено различий в улучшении функционального статуса или хорошего функционального исхода у пациентов, подвергшихся ВСТЭ в сочетании с ВТТ и без ВТТ. Многоцентровые рандомизированные исследования, в которых бы прямо сравнивались ВСТЭ и ВСТЭ в сочетании с ВТТ у пациентов с ишемическим инсультом и окклюзией крупной интракраниальной артерии (SWIFT-DIRECT), пока не завершены. С учетом доказанной эффективности ВСТЭ и ВТТ оба метода реперфузии должны применяться по установленным показаниям (параллельное независимое применение).
- Рекомендуется использовать для выполнения ВСТЭ стент-ретриверы, аспирационные катетеры или их комбинации, в отношении которых доказаны эффективность и безопасность при восстановлении перфузии не менее чем половины бассейна СМА (Модифицированная шкала восстановления перфузии при ишемическом инсульте (mTICI, Приложение Г10) mTICI 2b — 3), т.к. максимальная реперфузия обеспечивает лучший функциональный исход [237, 243 — 245].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 1).
Комментарий: Систематические обзоры рандомизированных исследований с метаанализом [237, 243] показали, что тромбэктомия с применением стент-ретривера улучшает 90-суточные функциональные исходы в сравнении с консервативной терапией и не увеличивает риск симптомного внутричерепного кровоизлияния. Систематический обзор с метаанализом, включавший 1273 пациента из 9 исследований преимущественно обсервационного характера, показал, что тромбаспирация может приводить к лучшим функциональным исходам, меньшей частоте осложнений и имеет тенденцию к более быстрому выполнению вмешательства в сравнении с тромбэктомией стент-ретривером при одинаковой частоте успешной реперфузии [246]. Данные об отсутствии различий в эффективности и безопасности между применением стент-ретривера и аспирационной техники получены в систематических обзорах с метаанализом [244, 245], а также в рандомизированном многоцентровом исследовании ASTER [247], где было показано, что обе техники не различаются по функциональным исходам и летальности через 3 месяца, частоте симптомных внутричерепных кровоизлияний. Таким образом, тромбаспирация (включая случаи использования стент-ретривера при ее неэффективности) является сопоставимой альтернативой стент-ретриверам.
- Рекомендуется выполнение ВСТЭ при верифицированной окклюзии магистральной интракраниальной артерии в каротидной системе (ВСА, СМАМ1-М2, ПМАА1) втечение 6 часов (время от развития ОНМК по ишемическому типу до пункции артерии) у пациентов, соответствующих критериям отбора А: NIHSS ≥ 6, возраст > 18 лет, по данным нативной бесконтрастной КТ головного мозга и/или МРТ голового мозга с МРТ-последовательностью DWI при очаге ишемии менее 1⁄3 бассейна СМА или ASPECTS ≥ 6 [236].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 2).
Комментарий: Метаанализ индивидуальных данных из 7 рандомизированных исследований (728 пациентов) показал значимое снижение вероятности реперфузии с увеличением времени от поступления в стационар до пункции артерии (относительное снижение составило 22% на каждый час), а так же с увеличением времени от визуализации до пункции (26% в час) [248].
Другой метаанализ индивидуальных данных 7 многоцентровых рандомизированных исследований (1764 пациента) продемонстрировал уменьшение шанса хорошего функционального исхода ВСТЭ в каротидной системе при увеличении времени от визуализации до реперфузии [242].
Как показывает систематический обзор рандомизированных исследований с метаанализом [236], исходы ВСТЭ в каротидной системе через 90 суток свидетельствуют о пользе как в группе, подвергшейся рандомизации в группу внутрисосудистого вмешательства в первые 5 часов, так и более чем через 5 часов, однако во второй группе большинство пациентов были рандомизированы менее чем через 420 минут (7 часов), что не позволяет экстраполировать данные на пациентов, у которых вмешательство было бы начато более чем через 8 часов от начала ОНМК. Другой метаанализ рандомизированных исследований [239] свидетельствует о лучших исходах после ВСТЭ в каротидной системе в сравнении со стандартной терапией, если время от инсульта до пункции артерии находилось в пределах 7,3 часов.
В метаанализах рандомизированных исследований [236, 249] отмечены улучшение 90-суточного функционального исхода при ВСТЭ из ВСА и при проксимальной окклюзии СМА М1 и тенденция к улучшению функциональных исходов при дистальной окклюзии СМА М1 и СМА М2, но эффективность ВСТЭ в сравнении со стандартной терапией при окклюзии СМА М2 оставалась недоказанной. В более позднем метаанализе [250] было показано улучшение функциональных исходов при выполнении ВСТЭ в группе с проксимальной окклюзией М2 сегмента СМА в сравнении со стандартной терапией, при этом сравнение техник контактной аспирации и стент-ретривера при окклюзии М2 сегмента СМА в исследовании ASTER не выявило различий в частоте успешной реперфузии и функциональных исходах через 90 суток [251].
- Рекомендуется индивидуальный отбор пациентов на выполнение ВСТЭ при выявлении большого объема ядра ишемии (более 1/3 бассейна СМА или более 50 — 70 см3, ASPECTS 3 — 5) в течение первых 6 часов для улучшения функционального исхода ОНМК, с учетом более высокой вероятности геморрагической трансформации очага ишемии и меньшей вероятности хорошего функционального исхода [242, 249].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 2).
Комментарий: Один из метаанализов [236] подтверждает, что чем ниже показатель ASPECTS, тем меньше частота хороших функциональных исходов на 90 сутки, однако различий между группами с ASPECTS 9 — 10 и 6 — 8 не было отмечено; эффективность ВСТЭ в группе пациентов с ASPECTS 5 и менее не была изучена.
Более поздние метаанализы в рамках HERMES collaboration (1764 пациента) [242, 249] показали, что ВСТЭ в каротидной системе позволяет достичь лучших функциональных исходов через 90 суток в сравнении с медикаментозной терапией в группах пациентов с объемом очага ишемии более 33% территории средней мозговой артерии, а также с ASPECTS 3 — 5 при более высоком риске симптомного внутричерепного кровоизлияния. Хотя размер ядра ишемии был независимым предиктором хорошего функционального исхода и функционального улучшения, преимущество ВСТЭ над стандартной медикаментозной терапией в улучшении функционального исхода у пациентов через 90 суток было установлено во всех подгруппах при реперфузии mTICI 2b — 3 без различий по частоте внутричерепных кровоизлияний.
Сочетание объема ядра ишемии, возраста и время от визуализации до реперфузии оказывает влияние на функциональный исход ВСТЭ через 90 суток, при этом увеличение ядра ишемии на каждые 10 см3, возраста на 5 лет или времени от визуализации до реперфузии на 30 минут снижают шансы на функциональное улучшение приблизительно на 20%.
Имеющиеся серии наблюдений так же подтверждают улучшение исходов при ВСТЭ до 6 часов при ASPECTS менее 7 [252] или менее 6 [253], при этом отмечено увеличение риска симптомного внутричерепного кровоизлияния и отсутствие эффекта ВТТ [253].
Рандомизированные исследования, направленные на определение показаний к ВСТЭ при большом очаге ишемии, на сегодняшний день не завершены.
- Рекомендуется выполнение ВСТЭ при верифицированной окклюзии магистральной интракраниальной артерии в каротидной системе в течение 6 — 16 часов у пациентов, соответствующих критериям с объема ишемизированной ткани к объему ядра ишемии ≥ 1,8 [254, 255].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 2).
Комментарий: Расчет объема несовпадения желательно проводить с помощью программ автоматической обработки изображений (RAPID, eASPECTS или сопоставимые методики), под объемом несовпадения понимают разницу между объемом ядра ишемии и объемом зоны поражения с TMax > 6 секунд [254]. Если МР-перфузия выполнена неадекватно, объем ядра ишемии при МР-диффузии <25 мл является достаточным критериям включения без оценки объема несовпадения или отношения.
По результатам метаанализа объединенных данных 4 рандомизированных исследований (ESCAPE, REVASCAT, DEFUSE-3 и DAWN) [255], охвативших 518 пациентов (267 подверглись ВСТЭ) с медианой времени от инсульта до рандомизации 10,8 часов, механическая тромбэкстракция была эффективна за пределами 6 часов при сравнении с «лучшей медикаментозной терапией». Было отмечено, что отбор осуществлялся преимущественно на основе ограничения ядра ишемии по данным нейровизуализации, хотя критерии включения отличались в подвергшихся анализу рандомизированных исследованиях [255].
- Рекомендуется выполнение ВСТЭ при верифицированной окклюзии магистральной интракраниальной артерии в каротидном бассейне в течение 16 — 24 часов при соответствии критериям группы С: окклюзия ВСА или СМА М1, в возрасте 18 — 80 лет при NIHSS 10 – 19 объем ядра ишемии < 31 см3, при NIHSS ≥ 20 баллов объем ядра ишемии 31 — 50 см3; в возрасте старше 80 лет NIHSS ≥ 10 баллов и объем ядра ишемии < 21 см3 [256].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 2).
Комментарий: В многоцентровом рандомизированном контролируемом исследовании DAWN [256], у пациентов с дебютом ОНМК за пределами 6–часового «терапевтического окна», но не превышающем 24 часа до вмешательства, продемонстрировано улучшение функциональных исходов на 90 сутки посте ВСТЭ из ВСА и проксимальной части СМА М1 в сочетании с медикаментозной терапией в первые 6 — 24 часа в сравнении с только медикаментозной терапией при отборе пациентов на основе тяжести инсульта и объема очага ишемии. При выявлении несоответствия между клиническим дефицитом и размером инфаркта Результаты ВСТЭ через 6 — 24 часов после инсульта не отличались от результатов ВСТЭ в пределах первых 6 часов.
- Рекомендуется выполнение ВСТЭ в каротидном бассейне у пациентов с дебютом ОНМК во время сна или за 6 — 24 часа до поступления, соответствующим критериям отбора в период 0 — 6 часов и дополнительным условиям: объем ядра ишемии менее 50 — 70 см3, заполнение пиальной артериальной сети бассейна СМА > 50% при КТ-ангиографии, МРТ-ДВИ ASPECTS ≥ 6 [257, 258, 259].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 3).
Комментарий: В обсервационном исследовании [257] , включавшем 249 пациентов, в группе с «утренним инсультом» и дебютом 6 — 24 часа назад (63 человека) было показано, что у пациентов в возрасте старше 18 лет с оценками mRs 0 — 1, NIHSS> 11, ASPECTS> 6 при наличии окклюзии крупной артерии по данным СКТА) функциональные исходы на 90 сутки, частота симптомных внутричерепных кровоизлияний, доля успешных реперфузий, 90-суточная летальность значимо не отличались от пациентов, оперированных по стандартным показаниям в течение первых 6 часов от начала инсульта.
Совместный анализ регистров NASA и TRACK [258], включавший 830 пациентов, подвергшихся ВСТЭ в каротидной системе с применением стент-ретриверов показал одинаковую эффективность и безопасность ВСТЭ до и после 6 часов от появления первых симптомов ИИ при условии тщательного отбора кандидатов.
В серии наблюдений (25 пациентов) [260], подвергшихся ВСТЭ позднее 12 часов от начала ОНМК по ишемическому типу (медиана времени до пункции артерии 14 часов 40 минут) хорошие функциональные исходы ИИ на 90 сутки были получены у 52% пациентов при отсутствии симптомных внутричерепных кровоизлияний. Пациенты отбирались на основании размера очага ишемии (ASPECTS 6 — 10) и наличию хорошего коллатерального кровотока в соответствии с критериями ESCAPE [138] (коллатеральное заполнение более 50% пиальной артериальной сети СМА).
Польза ВСТЭ у пациентов с большим очагом ишемии (ASPECTS < 6, объем более 50 см3, более 33% бассейна СМА), выполненной через 6 — 24 часа от дебюта ОНМК, точно не установлена. В проспективном многоцентровом когортном исследовании SELECT [259], включавшем 105 пациентов с крупным ядром ишемии (ASPECTS 5 и менее или объем более 50 см3) в первые 24 часа после ишемического инсульта было продемонстрировано увеличение частоты хороших функциональных исходов на 90 сутки в группе ВСТЭ (mRs 0 — 2, 31%) в сравнении с медикаментозной терапией (mRs 0 — 2, 14%). Также в группе ВСТЭ отмечен меньший рост и меньший финальный размер зоны ишемии, при этом шанс хорошего функционального исхода на 90 сутки уменьшался на 42% при увеличении объема ядра на каждые 10 см3 и на 40% при увеличении времени до лечения на каждый час. Среди пациентов с объемом ядра ишемии более 100 см3 ни у одного не наблюдалось хорошего функционального исхода.
- Рекомендуется выполнение ВСТЭ в каротидной системе всем пациентам старше 18 лет, в том числе пациентам старше 80 лет [236].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 2).
Комментарий: По данным систематического обзора рандомизированных исследований с метаанализом [236] эффективность ВСТЭ была одинакова у мужчин и женщин и не снижалась в группе старше 80 лет.
- Рекомендуется индивидуальный отбор пациентов — кандидатов на выполнение ВСТЭ при наличии окклюзии крупной интракраниальной артерии в каротидной системе и не тяжелого неврологического дефицита (NIHSS < 6 баллов) [261, 262].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 2).
Комментарий: Необходимо учитывать уровень окклюзии артерии, выраженность коллатерального кровотока, наличие инвалидизирующего неврологического дефицита, а также риск неблагоприятного функционального восстановления при отсутствии реперфузионной терапии. Систематический обзор рандомизированных исследований с метаанализом [236] показал сопоставимый эффект по всему спектру тяжести неврологических расстройств (по NIHSS), хотя в группе 10 и менее баллов отмечена меньшая разница между применением ВСТЭ в сравнении со стандартной терапией (возможно, по причине малочисленности группы). В двух метаанализах результатов внутрисосудистой терапии у пациентов с негрубым неврологическим дефицитом (NIHSS < 6 [261, 262]) выполнение ВСТЭ приводило к улучшению 90-суточных функциональных исходов ИИ в сравнении с медикаментозной терапией, однако сопровождалось достоверно большим количеством симптомных либо асимптомных внутричерепных кровоизлияний.
- Рекомендуется осуществлять выбор метода анестезии (общая анестезия или седация) при выполнении ВСТЭ в каротидной системе с учетом состояния пациента, предпочтений оперирующего хирурга и протокола, принятого в лечебном учреждении [263].
Уровень убедительности рекомендаций A (уровень достоверности доказательств — 2).
Комментарий: Среди преимуществ ВСТЭ без общей анестезии указываются возможность оценки неврологического статуса во время вмешательства, упрощение требований к проведению интенсивной терапии и снижение стоимости манипуляции.
Крупный метаанализ от группы HERMES Collaboration [264] включал индивидуальные данные 7 рандомизированных исследований о 797 пациентах, подвергшихся ВСТЭ, из них 236 — под общей анестезией. По данным метаанализа, даже после корректировки по основным прогностическим показателям, худшие исходы после ВСТЭ были связаны с общей анестезией. Серьезными недостатками исследования являлись отсутствие рандомизации по виду анестезии и формализованного протокола анестезии во включенных в него исследованиях, неизвестной доли вмешательств под общей анестезией по показаниям и по выбору специалиста [265].
В более позднем систематическом обзоре рандомизированных исследований с применением метаанализа [263] исследованы данные трех одноцентровых рандомизированных исследований, проведенных специально для оценки влияния вида анестезии на исход ВСТЭ. Общее количество пациентов составило 368 (183 под общей анестезией и 185 в условиях седации). Выполнение ВСТЭ под общей анестезией в сравнении с седацией было связано с достоверно меньшей инвалидизацией через 3 месяца после вмешательства. Интересным представляется тот факт, что по результатам метаанализа при выполнении ВСТЭ под общей анестезией в сравнении с седацией наблюдалась более высокая частота эффективной реперфузии (mTICI 2b — 3, 72,7% и 63,3% соответственно), вероятно, за счет отсутствия движений пациента в ходе вмешательства. Несмотря на проведение общей анестезии, время, затраченное на различные этапы оказания помощи, статистически и клинически значимо не различалось между группами, а средняя задержка в группе общей анестезии в сравнении с группой оперированных под седацией составила всего 6 минут.
- Рекомендуется ангиопластика и стентирование экстракраниальных отделов сонных артерий в сочетании с ВСТЭ (при эшелонированном поражении) при их атеросклеротическом стенозирующем поражении или диссекции для обеспечения доступа к интракраниальному тромботическому поражению мозговой артерии [266, 267, 268].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 2).
Комментарий: Целью выполнения ВСТЭ и каротидной ангиопластики со стентированием при эшелонированном поражении является устранение гемодинамически значимого сужения/окклюзии или предотвращения повторной окклюзии, при этом очередность определяется выбором оперирующего хирурга, но более целесообразно выполнять сначала ВСТЭ, а затем каротидную ангиопластику со стентированием [267] .
В одном систематическом обзоре с метаанализом, включавшем 1000 пациентов из 23 исследований [269], было показано отсутствие различий по частоте успешной реваскуляризации, хороших функциональных исходов и летальности через 90 суток при выполнении неотложной каротидной ангиопластики при тандемном поражении, при этом увеличивались время оперативного вмешательства и риск осложнений. В другом систематическом обзоре с метаанализом (237 пациентов из 11 исследований) [267] было показано, что неотложная каротидная ангиопластика со стентированием в сочетании с ВСТЭ увеличивает частоту симптомных внутричерепных кровоизлияний, но не оказывает значимого влияния на летальность. В то же время данные регистра TITAN демонстрируют, что в группе пациентов, подвергшихся ВСТЭ и каротидной ангиопластике со стентированием с назначением антиагрегантной терапии чаще достигалась успешная реперфузия и хороший функциональный исход через 90 суток [268], а предшествующее проведение внутривенной тромболитической терапии у пациентов с тандемным поражением не влияет на частоту геморрагических осложнений и исход [270]. В многоцентровом исследовании, включавшем 395 пациентов [266], было продемонстрировано, что проведение ВТТ и каротидная ангиопластика со стентированием при тандемном поражении в каротидной системе были предикторами успешной реперфузии при ВСТЭ.
- Рекомендуется назначение двойной антиагрегантной терапии после выполнения каротидной ангиопластики со стентированием, в том числе после проведения внутривенной тромболитической терапии [535].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 4).
Комментарий: В нерандомизированном сравнительном исследовании отмечено, что применение двойной антиагрегантной терапии не повышало вероятность симптомного внутричерепного кровоизлияния, при этом клопидогрел** был более безопасен, чем тикагрелор**[271].
1.2.3.2. Внутрисосудистые вмешательства в вертебрально-базилярной системе
- Рекомендуется выполнение ВСТЭ при острой окклюзии основной артерии как можно раньше в течение 24 часов от начала ОНМК по ишемическому типу [272, 273, 274].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 2).
Комментарий: В крупном систематическом обзоре с применением метаанализа [272], были показаны лучшие функциональные исходы и частота реканализации у пациентов с острой окклюзией базилярной артерии с применением ВСТЭ в сравнении с группами интраартериального тромболизиса и ВТТ. У пациентов с окклюзией основной артерии успешная реперфузия является важным предиктором функционального исхода на 90 сутки, доля mRs 0 — 2 может достигать 36,8 — 44,8% [273, 274].
ВСТЭ в ВББ в первые 6 часов позволяет достичь достоверно лучших функциональных исходов, чем в более поздний период [272, 275], тем не менее, имеются доказательства эффективности ее применения в течение первых 24 часов [276].
- Рекомендовано при наличии множественного интракраниального атеросклеротического поражения мозговых артерий дополнять ВСТЭв вертебрально-базилярной системе баллонной ангиопластикой и/или интракраниальным стентированием артерий каротидной системы [277, 278].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 4).
Комментарий: В нескольких сериях было показано, что ВСТЭ в ВББ одинаково эффективна у пациентов с отсутствием интракраниального атеросклеротического поражения и его наличием, при этом в последнем случае могут успешно применяться баллонная ангиопластика и стентирование [277, 278].
- Рекомендуется применение стент-ретривера, аспирационной тромбэктомии или комбинации этих методов для выполнения ВСТЭ в вертебрально-базилярной системе [273, 279].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 4).
Комментарий: По данным нескольких исследований [272, 274], не было выявлено различий между стент-ретриверами и аспирационной тромбэктомией ни по эффективности, ни по безопасности использования при окклюзии основной артерии. В то же время имеются данные о том, что применение техники ADAPT (direct-aspiration firstpass technique) при окклюзии основной артерии позволяет достичь существенно более высокой частоты полной реперфузии и сократить время вмешательства в сравнении со стент-ретриверами [273]. Для реперфузии в задних отделах артериального круга могут успешно применяться комбинированные методики ВСТЭ (SAVE) [279]. Выбор метода осуществляется оперирующим хирургом индивидуально.
1.3 Антитромбоцитарная терапия (АТ)
Основной целью АТ является прекращение тромбообразования на стадии формирования тромбоцитарных агрегатов [280]. Современные ингибиторы агрегации тромбоцитов значительно различаются по механизму действия и, соответственно, антитромбоцитарный эффект различных лекарственных препаратов у пациентов неодинаков. Новые ингибиторы агрегации тромбоцитов, обладающие высокой антитромбоцитарной дезагрегантной активностью (прасугрел, тикагрелор**) связаны с более высоким риском внутричерепных геморрагий, особенно у пожилых пациентов или пациентов с малой массой тела. Существует документированная индивидуальная чувствительность к антиагрегантной терапии ацетилсалициловой кислотой** или клопидогрелем** у пациентов и здоровых испытуемых. Блокирующие свойства ингибиторов агрегации тромбоцитов могут быть минимальными, или утрачиваться со временем, что связано со снижением эффективности или резистентностью к ингибиторам агрегации тромбоцитов. Однако, прежде чем искать причину резистентности к АТ, необходимо исключить низкую приверженность или некомплаентность пациентов к приему ингибиторов агрегации тромбоцитов. Особенно тщательно необходимо подходить к этому вопросу при повышенной агрегации тромбоцитов по данным лабораторных анализов пациентов. Резистентность к АТ зависит от влияния целого ряда клинических, фармакокинетических, клеточных и генетических факторов:
- Низкая абсорбция при назначении неадекватной дозы или при использовании кишечнорастворимых форм ацетилсалициловой кислоты**. У ацетилсалициловой кислоты** с защитным покрытием, антитромбоцитарные свойства выражены слабее, чем у обычной растворимой формы и это встречается у лиц с ожирением, у которых вероятность неэффективности приема низких доз ацетилсалициловой кислоты** в виде покрытых оболочкой таблеток достигает 40%.
- Взаимодействие с другими препаратами
- Метаболические факторы. Острый или хронический (локальный или генерализованный) воспалительный процесс, (например, обусловленный метаболическими нарушениями при ожирении, СД, заболевания ЖКТ) сопровождается гиперцитокинемией и изменением тромбоцитопоэза (ретикулярные суперактивные тромбоциты). Появление в крови суперактивных тромбоцитов с повышенным содержанием белков и числа P2Y12-рецепторов служит фактором риска тромботических событий, что является причиной сниженной эффективности ингибиторов агрегации тромбоцитов. Гипергликемия ведет к снижению эффективности антиагрегантной терапии за счет реактивации свободных радикалов. Гиперхолестеринемия ослабляет влияние ацетилсалициловой кислоты** на тромбин, чем меньше содержание в крови холестерина (<4,14 ммоль/л), тем лучше антитромбоцитарный эффект ацетилсалициловой кислоты**. Повышение в крови катехоламинов уменьшает антитромбоцитарный эффект ацетилсалициловой кислоты**.
- Клеточные факторы — включают недостаточное подавление функции ЦОГ-1 тромбоцитов, а также повышенную экспрессию м-РНК ЦОГ-2 тромбоцитов и эндотелиальных клеток. Образование 8-iso-PGF2α, являющегося продуктом превращения в организме арахидоновой кислоты, может также снизить эффективность ацетилсалициловой кислоты**, связываясь с рецепторами к тромбоксану. Резолвины, метаболиты омега-3-полиненасыщенных жирных кислот, образующиеся в результате ацетилирования ЦОГ-2 под действием ацетилсалициловой кислоты**, оказывают противовоспалительное действие. Дефицит этих веществ также может ослаблять терапевтический эффект ацетилсалициловой кислоты**.
- Генетическими факторы – полиморфизм генов рецепторов тромбоцитов PL(А1A2). Наличие аллеля PLA2 ассоциируется с большим сродством гликопротеиновых рецепторов IIb/IIIa к фибриногену, что может приводить к более выраженному тромбообразованию. Повышение резистентности к ацетилсалициловой кислоте** может иметь полиморфизм генов тромбоцитарных рецепторов к коллагену и фактору Виллебранда, а также единичные нуклеотидные полиморфизмы гена Р2Y1.
Эффективная стратегия преодоления частичной или полной резистентности к клопидогрелу** и ацетилсалициловой кислоте** пока не установлена: показана польза коррекции гликемии, холестеринемии, соблюдения режима приема препаратов и сведения к минимуму нежелательного межлекарственного взаимодействия. В настоящее время нет убедительных данных в пользу увеличения дозы ацетилсалициловой кислоты** для преодоления резистентности. Вероятно, при индивидуальной резистентности к ацетилсалициловой кислоте**, преобладает преимущественно АДФ-зависимый путь активации тромбоцитов, в связи с чем терапия клопидогрелем** может оказаться более эффективной. Для определения индивидуальной чувствительности к ингибиторам агрегации тромбоцитов возможно проведение индивидуального лабораторного контроля эффективности АТ, в частности агрегометрии. Коррекция оптимальной дозы клопидогрела возможна после лабораторной оценки индивидуальной агрегации тромбоцитов.
- Рекомендуется пациентам любого возраста с верифицированным диагнозом ИИ назначение ингибитора агрегации тромбоцитов — ацетилсалициловой кислоты** в первые 24 — 48 часов от появления первых симптомов ИИ, с целью ранней профилактики повторного ОНМК по ишемическому типу и снижения риска летальности [515].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Комментарии: Пациентам, получавшим алтеплазу** внутривенно, назначение ацетилсалициловой кислоты** обычно откладывается до 24 ч после ВТЛТ, но решение о более раннем назначении ацетилсалициловой кислоты** может быть рассмотрено с учетом сопутствующей соматической патологии у пациента и оценки индивидуальный риск/польза. Риск геморрагического инсульта или геморрагической трансформации инфаркта мозга при назначении ацетилсалициловой кислоты** незначителен.
Безопасность и эффективность ацетилсалициловой кислоты** для ранней профилактики повторного ИИ или ТИА, а также снижения риска госпитальной летальности установлено в двух крупных мультицентровых РКИ при применении доз 160 и 300 мг ацетилсалициловой кислоты** [515]. У пациентов с дисфагией, после тщательной оценки риск кровотечения и гастротоксичности/польза, возможно введение ЛС через назогастральный зонд (растворимые таблетки ацетилсалициловой кислоты** 75/300 мг) или ректально (суппозитории ацетилсалициловой кислоты** 150 мг). Согласно клиническим исследованиям, оптимальные соотношение снижение риска гастротоксичности/снижение риска острых сосудистых событий у пациентов наблюдается в диапазоне доз ацетилсалициловой кислоты** 75 — 150 мг/сут. При противопоказаниях к ацетилсалициловой кислоте**, возможно назначение других, альтернативных антитромбоцитарных ЛС, вместе с тем данные об использовании альтернативных антитромбоцитарных препаратов для ранней профилактики повторного ИИ ограничены.
- Не рекомендуется пациентам с верифицированным ишемическим инсультом, при наличии показаний и отсутствии противопоказаний к ВТЛТ или другим реперфузионным технологиям назначение ацетилсалициловой кислоты** в качестве заместительной терапии [60, 61].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
- Не рекомендуется назначение ацетилсалициловой кислоты** или других ингибиторов агрегации тромбоцитов в качестве сопутствующей терапии в течение первых 24 часов после проведения внутривенного тромболизиса с целью снижения риска кровотечений [60, 61].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
- Рекомендуется пациентам с некардиоэмболическим патогенетическим вариантом ИИ и легкой очаговой неврологической симптоматикой (NIHSS ≤3 балла), которым не проводилась ВТЛТ, а также пациентам с ТИА при высоком риске формирования ИИ (счет по шкале ABCD2 ≥ 4 баллов) назначение ДАТ (ацетилсалициловая кислота** и клопидогрел**) в течение первых 24 часов после эпизода ИИ с последующей продолжительностью курса ДАТ в течение 21 дня с целью профилактики повторного ИИ в течение 90 дней с момента появления первых симптомов ИИ [520, 521].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарии: В РКИ «CHANCE» эффективность комбинированной антитромбоцитарной терапии клопидогрелом** (в начальной дозе 300 мг/сут., затем 75 мг/сут в течение 90 дней) и ацетилсалициловой кислотой** в низких дозах (75 мг/сут в течение первых 3 недель) сравнивали с плацебо плюс ацетилсалициловая кислота** (75 мг/сут в течение 90 дней) у 5170 пациентов. Частота клинически значимых кровотечений и геморрагического инсульта не увеличилась. В РКИ «POINT» оценивали эффективность ДАТ (клопидогрел** 1 сутки — 600 мг/сут, 2 — 90 сут — 75 мг/сут; ацетилсалициловая кислота** 50 – 325 мг/сут) по сравнению с монотерапией ацетилсалициловой кислотой** (50 – 325 мг/сут) у 4881 пациентов с ОНМК. Эффективность ДАТ была связана с достоверным уменьшением частоты острых ишемических сосудистых событий в течение первых 7 дней и 30 дней по сравнению с монотерапией ацетилсалициловой кислотой**. Вместе с тем, при продолжительности ДАТ более 7 дней отмечено увеличение риска нефатальных неинтракраниальных геморрагий. В РКИ «POINT» не выявлено дополнительных преимуществ длительности курса ДАТ более 30 дней.
- Не рекомендуется пациентам, перенесшим малый ИИ (NIHSS ≤ 5 баллов) или ТИА высокого риска (счет по шкале ABCD2 ≥ 4 баллов) проведение антитромбоцитарной терапии тикагрелором вместо терапии ацетилсалициловой кислотой с целью профилактики острых ишемических сосудистых событий из-за отсутствия доказательной базы [288].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Эффективность и безопасность монотерапии (1 — 90 день от эпизода ОНМК) тикагрелором (180 мг/сут) по сравнению с ацетилсалициловой кислотой** (стартовая доза 300 мг/сут, затем 100 мг/сут) исследована в мультицентровом, двойном слепом, плацебоконтролируемое РКИ «SOCRATES», включавшем 13199 пациентов с ОНМК по ишемическому типу (малый ИИ с негрубой очаговой неврологической симптоматикой, NIHSS ≤ 5 баллов или ТИА с высоким риском формирования ИИ, счет по шкале ABCD2 ≥ 4 балла). Согласно результатам РКИ «SOCRATES» преимущество применения тикагрелора** для снижения риска острых ишемических сосудистых событий по сравнению с ацетилсалициловой кислотой** не доказано [288]. Тикагрелор и ацетилсалициловая кислота** имели одинаковый профиль безопасности в отношении риска клинически значимых геморрагических осложнений и неблагоприятных клинических исходов. При применении тикагрелора** чаще отмечались незначительные кровотечения и одышка по сравнению с ацетилсалициловой кислотой** [288]. Вероятно, при наличии у пациента противопоказаний к назначению ацетилсалициловой кислоты**, альтернативным препаратом может быть тикагрелор**.
Предварительные результаты (III фаза) исследования THALES показали, что применение ДАТ (тикагрелор в комбинации с аспирином) по сравнению с монотерапией аспирином связано с уменьшением риска повторного ИИ и смерти на протяжении 30 дней от эпизода ОНМК, однако при ДАТ тяжелые кровотечения отмечались чаще [588].
- Рекомендуется комбинированная антиагрегантная терапия клопидогрелом** и ацетилсалициловой кислотой** пациентам, перенесшим ишемический инсульт с сопутствующей нестабильной стенокардией/не–Q–образующим инфарктом миокарда, после ангиореконструктивных операций (например, стентирования сонных артерий) или мультифокальным атеросклерозом с целью профилактики ИИ/ТИА [287].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
Комментарии: Двойная антитромбоцитарной терапии по сравнению с монотерапией ацетилсалициловой кислотой** снижает относительный риск всех ИИ на 20% (p <0,0001), без увеличения риска внутричерепной геморрагии. Ацетилсалициловая кислота** не изменяет эффекта клопидогрела**, ингибирующего АДФ-индуцируемую агрегацию тромбоцитов, но клопидогрел** потенциирует влияние ацетилсалициловой кислоты** на коллаген-индуцируемую агрегацию тромбоцитов. Между клопидогрелом** и ацетилсалициловой кислотой** возможно фармакодинамическое взаимодействие, которое приводит к повышению риска кровотечения. Использование ИПП одновременно с двойной антиагрегантной терапией у пациентов с высоким риском поражения ЖКТ оправдана, поскольку массивная антитромботическая терапия резко увеличивает риск эрозивно-язвенного поражения и кровотечений.
- Не рекомендуется назначение пациентам, перенесшим ИИ, тройной комбинации ингибиторов агрегации тромбоцитов (клопидогрел**, ацетилсалициловой кислоты** и дипиридамола) с целью вторичной профилактики ИИ/ТИА в связи с высоким риском геморрагических осложнений и отсутствием доказанного снижения риска ИИ/ТИА [517].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
1.4. Антикоагулятная терапия
Для профилактики повторного нарушения мозгового кровообращения пациенты с высоким риском эмболии сердечного происхождения должны получать антикоагулянтную терапию. Вместе с тем пациенты, перенесшие церебральный инсульт, обладают особым риском развития геморрагических осложнений при проведении ранней антитромботической терапии. Поэтому, перед началом антикоагулянтной терапии необходимо оценить соотношение польза/риск осложнений с учетом наличия доказанных кардиальных источников церебральной эмболии, риска ранней повторной эмболии и риска геморрагических осложнений. При оценке индивидуального риска кровотечения необходимо также учитывать, что прямые ингибиторы тромбина и прямые ингибиторы фактора Xa реже вызывают внутричерепные и ЖКТ кровотечения по сравнению с варфарином** [289].
- Не рекомендуется назначение антикоагулянтов в качестве сопутствующей терапии в течение 24 часов после проведения внутривенного тромболизиса [59, 60, 61, 62, 63, 193, 210].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: В большинстве случаев при отсутствии противопоказаний к терапии антикоагулянтами терапевтическая эффективность ингибиторов агрегации тромбоцитов для профилактики ИИ/ТИА при ФП сомнительна [290].
- Не рекомендуется ранняя антикоагулянтная терапия состояний, не связанных с цереброваскулярной патологией, у пациентов с инсультом средней тяжести вследствие высокого риска развития тяжелых внутричерепных геморрагических осложнений [59, 60, 61, 210].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
- Рекомендуется применении в качестве препаратов первого ряда прямые ингибиторы тромбина и прямые ингибиторы фактора Xa пациентам любого возраста с неклапанной ФП, перенесшим ИИ для вторичной профилактики ИИ/ТИА, имеющей преимущество перед монотерапией ацетилсалициловой кислотой** или антагонистами витамина К [291, 292, 293].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарии: У прямых ингибиторов тромбина и прямых ингибиторов фактора Xa меньшие риск церебральных кровотечений, чем при терапии варфарином**. Используются стандартизированные дозы: для дабигатрана этексилата**– 150 или 110 мг 2; раза в сутки, для апиксабана** – 5 или 2,5 мг 2 раза в сутки, для ривароксабана** – 20/15 мг в сутки. Исследование МНО не требуется. Ривароксабан** должен приниматься с пищей для улучшения биодоступности. Апиксабан** и ривароксабан** могут быть измельчены и вводится через зонд. При оценке безопасности, на фоне приема апиксабана** отмечено достоверно меньшее число больших кровотечений. Эффективность и безопасность апиксабана** не зависели от возраста пациентов и от степени снижения функции почек [294].
- Рекомендуется пациентам любого возраста, перенесшим кардиоэмболический ИИ при наличии ревматического митрального стеноза независимо от наличия ФП и размера левого предсердия, протезированными клапанами, тромбозом левых отделов сердца даже при синусовом ритме — длительная терапия препаратами антагонистами витамина K, прямыми ингибиторами тромбина и прямыми ингибиторами фактора Xa (препаратом выбора является варфарин**) с целью вторичной профилактике ИИ и системных эмболий [295, 296, 518].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Комментарии: Важнейшим условием успешности терапии варфарином** является достижение целевого уровня международного нормализованного отношения (МНО) — 2,0 при возможном диапазоне (2,0 — 3,0). У пациентов с протезированными клапанами сердца МНО поддерживается на уровне 3,0 (2,5 — 3,5). При применении антагонистов витамина К (варфарин**), может отмечаться высокая вариабельность МНО у пациета, обусловленная взаимодействием с пищей и лекарствами, в связи с этим необходим регулярный лабораторный контроль за МНО. При наличии противопоказаний к антикоагулянтам могут быть назначены ингибиторы агрегации тромбоцитов — ацетилсалициловая кислота**, клопидогрел**, а также дипиридамола медленного высвобождения в сочетании с ацетилсалициловой кислотой** [297].
1.5. Лекарственная терапия, направленная на нейропротекцию и улучшение восстановления неврологических функций
С позиций доказательной медицины, назначение подобной категории препаратов не является абсолютно обоснованным (с уровнем убедительности рекомендаций А и уровнем достоверности доказательств – 1), поэтому, в настоящее время, не существует «золотого стандарта» метаболической терапии ишемического инсульта. Вместе с тем, по данным отечественных и зарубежных РКИ накопленный положительный опыт клинического применения препаратов с различным метаболическим действием позволяют рассматривать эту группу лекарственных средств как перспективную и направленную на улучшение функционального исхода заболевания.
- Рекомендуется применение препарата – «депротеинизированный гемодериват крови телят» пациентам пожилого возраста (старше 60 лет) с острым супратенториальным инфарктом мозга, с различной степенью тяжести неврологического дефицита (NIHSS 3 — 18 баллов) и постинсультными когнитивными нарушениями за исключением синдрома грубой и тотальной афазии с целью улучшения восстановления когнитивных функций и снижения риска ПИД в восстановительном периоде ИИ. Лечение следует начинать в течение первых 7 дней после эпизода ОНМК с внутривенных инфузий (один раз в сутки). Препарат вводят в дозе 2000 мг/250 мл в форме раствора для инъекций (0,9% раствор натрия хлорида** 250 мл/200 мг) до 20 инфузий, с последующим переходом на пероральный прием препарата в дозе 1200 мг/сут в течение шести месяцев [298].
Уровень убедительности рекомендаций В (уровень достоверности – 2).
Комментарии: Клиническая эффективность препарата опосредована комплексным мультимодальным механизмом действия, включающим в себя антигипоксантный, нейропротективный эффекты и положительное воздействие на микроциркуляцию. Эти эффекты базируется на неспецифической стимуляции клеточного метаболизма, связанной с активацией окислительного фосфорилирования, синтеза углеводов и белков, увеличением концентрации аденозинтрифосфата, аденозиндифосфата, фосфокреатина, глутамата, аспартата, гамма-аминомасляной кислоты. По данным РКИ безопасность препарата удовлетворительная [298].
- Рекомендуется пациентам, перенесшим ИИ в системе ВСА, вне острого периода заболевания применение #винпоцетина** в составе комплексной медикаментозной терапии с целью улучшения процессов церебральной микрогемоциркуляции и функционального исхода заболевания. Препарат назначается в виде капельной инфузии (скорость инфузии не должна превышать 80 капель/мин), однократно 1 мг/кг массы тела на 500 мл. изотонического раствора натрия хлорида, длительность курса 14 дней [543].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: Механизм действия винпоцетина** основан на комплексном нормализующем влиянии препарата на церебральный кровоток и метаболические процессы в ткани мозга: обладает неселективным вазодилататорным эффектом, уменьшает агрегацию тромбоцитов, влияет на деформируемость и эластичность эритроцитов, окислительно-восстановительные процессы, способствует утилизации глюкозы, стимулирует метаболизм норадреналина и серотонина в тканях мозга, уменьшает процессы нейровоспаления опосредованные цитокинами и матриксной протеазой в кровеносных сосудах головного мозга [544]. Назначение винпоцетина** требует особой осторожности у пациентов со стенооклюзирующим поражением экстра- и интракраниальных сосудов головного мозга вследствие возможного формирования синдрома обкрадывания в каротидной или в вертебробазилярной системе.
В пожилом и старческом возрасте чувствительность мозговых сосудов к вазодилататорному действию винпоцетина возрастает, что обусловлено сенсибилизацией системы аденилатциклазы-цАМФ при старении. В большинстве случаев у винпоцетина** не наблюдается лекарственного взаимодействия, однако, следует помнить о невозможности его одновременного применения (парентерально) с гепарином натрия. При применении винпоцетина на фоне гепаринотерапии повышается риск развития геморрагических осложнений.
- Рекомендуется назначение #глицина** в дозе 1 – 2 г/сут в течение первых 5 суток от момента эпизода ишемического инсульта (начиная с шестого часа после развития первых симптомов ИИ) пациентам c ОНМК по ишемическому типу в каротидной системе, находящимся в общем удовлетворительном состоянии, состоянии средней тяжести или тяжелом состоянии. Препарат назначается с целью улучшения противоишемической защиты мозга, улучшения восстановления нарушенных неврологических функций и снижения риска 30-дневной летальности [302].
Уровень убедительности рекомендаций В (уровень достоверности – 2).
Комментарии: Молекулярной основой действия препарата является эффект амплификации метаболических и нейротрансмиттерных процессов, регуляция глициновой и глутаматной рецепции, альфа1-адренолитическое действие. Глицин** является центральным нейромедиатором тормозного типа действия и универсальным коньюгатом низкомолекулярных токсических соединений. Глицин** ограничивает токсическое действие возбуждающих аминацидергических нейротрансмиттеров (аспартат, глутамат), способствует связыванию высвобождающихся в процессе церебральной ишемии альдегидов и фенолов. Активация синтеза глутатиона приводит к увеличению компенсаторных возможностей клетки в период окислительного стресса [303].
- Рекомендуется назначение #метионил-глутамил-гистидил-фенилаланил-пролил-глицил-пролина** в дозе 12 и 18 мг/сут 1% раствора (интраназально) в течение первых 5 суток от момента эпизода полушарного ИИ пациентам любых возрастных групп с легким, умеренным и тяжелым неврологическим дефицитом (NIHSS менее 18 баллов) c целью улучшения восстановления неврологических функций [304, 305].
Уровень убедительности рекомендаций С (уровень достоверности – 3).
Комментарии: Препарат является синтетическим аналогом фрагмента АКТГ, лишенного гормональной активности, относится к классу регуляторных пептидов. Фармакологический эффект связан с устранением дисбаланса цитокинов вследствие достоверного уменьшения уровня индукторов воспаления и повышения содержания противовоспалительных и нейротрофических факторов, что приводит к угнетению локальной воспалительной реакции и улучшению трофического обеспечения мозга в остром периоде инсульта.
- Не рекомендуется назначение нимодипина** (прием внутрь, в/в введение) пациентам в остром периоде ИИ в связи с отсутствием согласованного нейропротективного эффекта по данным РКИ [306, 307, 308].
Уровень убедительности рекомендаций В (уровень достоверности – 1).
- Рекомендуется назначение #инозин+никотинамид+рибофлавин+янтарной кислоты** пациентам среднего, пожилого и старческого (до 85 лет) возраста вне зависимости от локализации сосудистого поражения мозга с целью более полного восстановления нарушенных неврологических функций. Лечение следует начинать в первые 10 суток с использования парентеральной формы препарата 20 мл (в 400 мл 0,9% раствора натрия хлорида**) дважды в сутки, а затем 11 — 35 сутки – пероральной формы (850 мг дважды в день) [309, 310, 311, 312].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: Инозин+никотинамид+рибофлавин+янтарная кислота** — препарат, фармакологические эффекты которого обусловлены комплексным воздействием входящих в состав препарата компонентов (антигипоксантное, антиоксидантное и энергокорректирующее действия). Фармакологические эффекты связаны с улучшением процессов дыхания в клетках, повышением активности факторов антиоксидантной защиты, активацией процессов метаболизма глюкозы и кислорода, синтеза белка внутри клеток и гамма-аминомасляной кислоты в нейронах.
- Рекомендуется назначение полипептидов коры головного мозга скота** пациентам среднего и пожилого возраста с ишемическим инсультом в каротидной системе (тяжесть неврологического дефицита менее 20 баллов NIHSS) с целью более полного восстановления нарушенных неврологических функций. Лечение следует проводить по схеме: 2 курса внутримышечных инъекций препарата 20 мг (10 + 10) в течение 10 суток ИИ с перерывом в 10 суток [313, 314].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2).
Комментарии: Комплекс полипептидов и нейромедиаторов, способный оказывать тканеспецифичное воздействие на кору головного мозга, нормализовывать соотношение возбуждающих и тормозящих аминокислот в головном мозге, регулировать содержание дофамина и серотонина.
- Рекомендуется применение церебролизина** пациентам различных возрастных групп вне зависимости от локализации сосудистого поражения мозга с целью улучшения функционального исхода заболевания к 3 месяцу заболевания. Препарат следует назначать в течение первых 12 часов от эпизода ИИ по схеме: 30 мл один раз в сутки в течение 10 суток (внутривенно капельно) [545,546].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2).
Комментарии: Церебролизин** представляет собой смесь пептидов с низкой молекулярной массой и свободных аминокислот, полученных из мозга свиней. Препарат обладает плейотропным механизмом действия, оптимизирует энергетический метаболизм мозга и гомеостаз кальция, стимулирует внутриклеточный синтез белка, замедляет процессы глутамат-кальциевого каскада и перекисного окисления липидов и, соответственно, оказывает нейропротективное, нейротрофическое и нейрорегенеративное действие на ткань мозга. В доклинических исследованиях показано, что препарат уменьшает размер инфаркта мозга и способствует восстановлению нарушенных неврологических функций. По данным последнего Кокрановского обзора нет абсолютной согласованности результатов о влиянии церебролизина** на регресс неврологического дефицита в остром периоде ИИ [545].
- Рекомендуется назначение цитиколина** пациентам любых возрастных групп с целью улучшения функционального исхода к 3 месяцу заболевания [547].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: Цитиколин** (ЦДФ-холин) стимулирует биосинтез фосфолипидов мембран нейронов, нормализует энергетические процессы в митохондриях, улучшает холинергическую трансмиссию. Препарат препятствует развитию эксайтотоксичности, блокируя вызванный ишемией выброс глутамата, ингибируя таким образом глутаматиндуцированный апоптоз. Цитиколин**, с одной стороны, увеличивает обратный захват глутамата, снижая его синаптическую концентрацию при острой ишемии, с другой стороны, в фазе восстановления, наоборот, увеличивает его
концентрацию, способствуя улучшению когнитивных функций у пациентов [321].
Согласно результатам Кокрановского обзора, включившим 10 РКИ применения цитиколина в остром периоде ИИ (перорально и/или внутривенно в диапазоне доз от 500 до 2000 мг в день), не было получено достоверного влияния на регресс неврологического дефицита к 3 месяцу заболевания. Однако в отдельных РКИ сообщалось о значимом улучшении функционального восстановления пациентов к 3 месяцу заболевания.
Достоверность как положительных, так и отрицательных результатов РКИ трудно оценить, так как в основном представлены РКИ с высоким риском систематической ошибки. Профиль безопасности цитиколина неизвестен [547].
- Рекомендуется назначение холина альфосцерата** пациентам различных возрастных групп с целью уменьшение неврологического дефицита и увеличение способности пациентов к самообслуживанию [322, 323].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3).
Комментарии: Холина альфосцерат** оказывает нейропротективное действие благодаря увеличению синтеза ацетилхолина и участия в синтезе фосфатидилхолина, что в итоге улучшает синаптическую, в том числе холинергическую нейротрансмиссию. В организме активный компонент препарата расщепляется на холин и глицерофосфат являясь предшественником фосфолипидов мембран, участвует в анаболических процессах, ответственных за мембранный и фосфолипидный синтез, оказывая положительное влияние на функциональное состояние мембранных структур путем улучшения цитоскелета нейронов. Важным преимуществом препарата является прямое сохранение эндогенного пула ацетилхолина [11].
- Рекомендуется назначение этилметилгидроксипиридина сукцината** пациентам среднего, пожилого и старческого (до 80 лет) возраста, перенесшим ИИ в каротидной системе, с наличием легкого, умеренного и тяжелого неврологического дефицита (NIHSS 5 — 20 баллов) с целью улучшения восстановления неврологических функций. Препарат назначают по схеме: внутривенно капельно по 500 мг/сут в течение первых 10 суток от эпизода ИИ, а затем перорально по 1 таблетке (125 мг) 3 раза в сутки в течение 8 недель [324, 325].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
Комментарии: Препарат является ингибитором свободнорадикальных процессов и мембранопротектором, оказывает позитивное влияние на реологические показатели крови, уменьшает эндотелиальную дисфункцию и улучшает параметры липидного спектра, подавляет ПОЛ, повышает активность супероксиддисмутазы, повышает соотношение липид-белок, уменьшает вязкость мембраны, увеличивает ее текучесть.
Модулирует активность мембраносвязанных ферментов (Ca2+-независимой ФДЭ, аденилатциклазы, ацетилхолинэстеразы), рецепторных комплексов (бензодиазепинового, ГАМК, ацетилхолинового), что способствует их связыванию с лигандами, сохранению структурно-функциональной организации биомембран, транспорта нейромедиаторов и улучшению синаптической передачи.
Декомпрессивная краниотомия — единственный метод хирургического лечения злокачественного ишемического инфаркта. Принятие решения о выполнении декомпрессивной краниотомии проводится мультидисциплинарной бригадой, включающей нейрохирурга, невролога, нейрореаниматолога.
- Рекомендуется проведение декомпрессивной краниотомии у пациента со злокачественным инсультом в бассейне СМА при наличии показаний [548].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 1).
Комментарии: Декомпрессивная краниотомия показана при:
■ уровне бодрствования по ШКГ 9 баллов и более;
■ поперечной дислокации более 2 мм в первые 24 часа инсульта или более 7 мм в первые 48 часов инсульта;
■ молодом возрасте пациента (< 60 лет);
■ изолированной ишемии бассейна СМА;
■ срок инсульта не более 48 часов;
■ отсутствии тяжелой соматической патологии;
■ отсутствии геморрагической трансформации с формированием внутримозговых гематом с масс-эффектом.
Интраоперационно проводится внутривенное введение антибиотиков широкого спектра. Допустимо выполнение декомпрессивной краниотомии, если в процессе предоперационной подготовки нарушение бодрствования углубилось до 7 баллов по ШКГ.
Если на этапе предоперационной подготовки развилось нарушение бодрствования до глубокой комы, проведение операции уже бесперспективно.
- Рекомендуется пациентам в возрасте моложе 60 лет с односторонним инфарктом бассейна средней мозговой артерии при ухудшении неврологической симптоматики в течение 48 ч, несмотря на медикаментозную терапию, выполнить декомпрессионную краниотомию со вскрытием твердой мозговой оболочки, поскольку это позволяет снизить смертность почти на 50% и улучшить результаты последующей реабилитации [326, 327].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2)
Комментарии: Объединенный анализ 93 пациентов включенных в исследования DECIMAL (decompressive craniectomy in malignant middle cerebral artery infarcts), DESTINY (decompressive surgeryf or the treatment of malignant infarction of the middle cerebral artery) и HAMLET (hemicraniectomy after middle cerebral artery infarction with life-threatening edema trial) [326, 327] показал, что по сравнению с контрольной группой через год у пациентов в группе декомпрессионной хирургии было больше пациентов с баллом по модифицированной шкале Рэнкина (mRS, Приложение Г6) < 4 или < 3 и был более высокий процент выживших (NNTs 2, 4 и 2, соответственно). Не отмечалось положительной динамики у пациентов, перенесших хирургическое лечение в вегетативном состоянии (mRS 5). Систематический обзор 12 обсервационных ретроспективных исследований выявил в качестве плохого предрасполагающего фактора возраст старше 50 лет. Время хирургического вмешательства, сторона инфаркта, клинические признаки вклинения и вовлечение других сосудистых территорий не сильно ухудшают конечный результат.
- Рекомендуется проведение декомпрессивной краниотомии и вентрикулостомии у пациента со злокачественным инфарктом мозжечка при наличии показаний [18, 59, 196].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: Изолированная вентрикулостомия показана при:
— развитии острой окклюзионной гидроцефалии по данным КТ;
— уровне бодрствования по ШКГ 10 баллов;
— отсутствии клинических и КТ-признаков компрессии ствола головного мозга;
Декомпрессивная краниотомия задней черепной ямки в сочетании с вентрикулостомией показаны при:
— развитии признаков прямой компрессии ствола по данным КТ (часто в сочетании с острой окклюзионной гидроцефалии);
— уровне бодрствования по ШКГ менее 10 баллов;
— наличие клинических признаков компрессии ствола головного мозга;
— отсутствие ишемии ствола головного мозга.
Интраоперационно проводится внутривенное введение антибиотиков широкого спектра. Если на этапе предоперационной подготовки развилось нарушение бодрствования до атонической комы, проведение операции уже бесперспективно.
3. Эпилептические приступы в период после ИИ и постинсультная эпилепсия (ПЭ)
Церебральный инсульт является одним из наиболее частых причин эпилепсии у пожилых. Распространенность эпилептических приступов после ОНМК имеет 2 пика – в течение первых суток и в период от 6 месяцев до года [329].
Ранние или острые симптоматические (спровоцированные) приступы, в том числе серии приступов (2 и более в сутки) развиваются в первые 7 суток от эпизода ИИ [330, 331].
Эпилептический статус (ЭС) есть результат либо отказа механизмов, отвечающих за прекращение приступов, либо инициации механизмов, которые ведут к аномально пролонгированным приступам (после достижения временной точки t1). ЭС может привести к долгосрочным последствиям (после достижения временной точки t2), в том числе повреждению и смерти нейронов, повреждению нейрональных сетей (в зависимости от типа приступов и их продолжительности). Точка t1 обозначает время, когда должно быть начато лечение (5 минут для билатеральных тонико-клонических приступов и). Точка t2 обозначает крайнюю границу временного промежутка, в течение которого статус должен быть купирован (30 минут для билатеральных тонико-клонических приступов и 60 минут для фокальных приступов) [332]. ЭС, возникший в течение 7 суток после ИИ, вследствие цитотоксических метаболических изменений в очаге ишемии, а также воздействия патологического очага на сохранные структуры мозга является симптоматическим [332, 333]. ОНМК, в том числе ИИ, являются наиболее частой причиной симптоматического ЭС у взрослых (14 — 22% всех симптоматических ЭС), в особенности в пожилом возрасте (36 — 61%) и характеризуется высокой смертностью (около 35%), в особенности при длительном статусе и среди пожилых пациентов [334, 335].
Поздние (неспровоцированные) приступы развиваются спустя 7 суток и более после эпизода ИИ [330]. Патогенез этих приступов связан с отсроченно формирующимися последствиями ИИ.
Диагноз постинсультной эпилепсии устанавливается при регистрации не менее двух неспровоцированных эпилептических приступов с интервалом более 24 ч. Наличие единственного неспровоцированного эпилептического приступа не менее чем через 1 месяц после инсульта позволяет расценить риск повторения приступов как высокий, поставить диагноз эпилепсии и начать лечение с назначением противоэпилептических препаратов [336, 337]. Постинсультная эпилепсия развивается в среднем у 2 — 11% пациентов, перенесших ОНМК, реже при ИИ в сравнении с геморрагическим ОНМК [335].
Факторы риска
Симптоматические приступы и ЭС
Тяжесть ИИ (более высокая сумма баллов по шкале NINSS, оценка более 3 баллов по модифицированной шкале Рэнкин), супратенториальная локализация инфаркта мозга, очаг поражения в бассейне ПСМА и/или СМА, наличие геморрагического компонента инфаркта мозга, кардиоэмболический характер ИИ, возраст пациента менее 65 лет [338, 339].
Поздние приступы и постинсультная эпилепсия
Факторы риска включают в себя перечисленные выше, а также наличие острых симптоматических приступов и, в особенности, поздних приступов, зарегистрированных ранее [329, 337, 338, 340, 341]. Больший риск в отношении развития приступов после ОНМК имеют пациенты с суммой баллов по шкале NINSS от 6 до 10 [343].
Типы постинсультных эпилептических приступов
Постинсультные приступы, как правило, характеризуются фокальным началом, с нарушением сознания или без, с моторными симптомами или без, с переходом в билатеральные клонико-тонические судороги [338, 343, 344]. Клиническая картина постинсультных приступов во многих случаях представляет сложности для диагностики и интерпретации, особенно при немоторных кратковременных приступах. Необходимо тщательное наблюдение за пациентами и мониторинг ЭЭГ, хотя однозначной взаимосявязи между эпилептиформной активностью на ЭЭГ и эпилептическими приступами не установлено [345, 346].
Эпилептический статус — наиболее часто регистрируется судорожный ЭС с фокальными моторными приступами с вовлечением паретичных конечностей, а также ЭС с билатеральными тонико-клоническими приступами с фокальным началом, однако возможно развитие и бессудорожного ЭС [347]. Эпилептический статус после ИИ является жизнеугрожающей ситуацией, сопровождается высокой летальностью и требует незамедлительного интенсивного лечения в условиях нейрореанимации.
- Рекомендуется проводить дифференциальную диагностику между эпилептическим и неэпилептическим генезом пароксизмальных состояний при отсутствии типичной клинической картины эпилептических приступов: приступах с генерализованным или неизвестным началом; с утратой сознания без судорог; с пароксизмальными двигательными, когнитивными, эмоциональными, вегетативными и поведенческими нарушениями; с отсутствием корреляции между очагом поражения и клинической картиной пароксизмального состояния [329].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 5).
Комментарии: Дифференциальный диагноз проводится с синкопальными (кардиогенными и ортостатическими) и гипоксическими приступами, поведенческими, психиатрическими, сон-ассоциированными расстройствами, пароксизмальными двигательными нарушениями, психогенными приступами, и некоторыми другими состояниями. Также необходимо исключить развитие повторного церебрального инсульта или ТИА.
- Рекомендуется пациентам с неспровоцированными ЭП проведение ЭЭГ по стандартному протоколу с нагрузочными пробами (длительностью не менее 30 минут безартефактной записи ЭЭГ), а также, проведение электроэнцефалографии с видеомониторингом с целью выявления и локализации эпилептиформных изменений на ЭЭГ [346, 348].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 5).
Комментарии: При постинсультной эпилепсии на ЭЭГ чаще всего регистрируется региональное фокальное замедление, лобная перемежающаяся ритмическая дельта-активность (FIRDA). Типичная эпилептиформная активность фиксируется редко и включает в себя периодические латерализованные эпилептиформные разряды (PLED), региональные острые волны [335, 349].
- Рекомендуется пациентам в остром периоде ИИ с наличием пароксизмальных состояний с нетипичной клинической картиной/снижением уровня бодрствования проведение ЭЭГ (длительностью не менее 30 минут) или проведение электроэнцефалографии с видеомониторингом с целью дифференциальной диагностики эпилептических приступов без моторных проявлений и бессудорожного эпилептического статуса [343, 350].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5).
Комментарии: При длительной регистрации ЭЭГ приступы в остром периоде ОНМК фиксируются у 6 — 27% пациентов. ЭЭГ в течение 30 — 60 минут позволяет зафиксировать эпилептические приступы без моторных проявлений или бессудорожный эпилептический статус (при наличии таковых) в 48 — 58% случаев, в течение 24 — 48 ч – в 80 — 95% случаев [350].
- Рекомендуется пациентам с постинсультными эпилептическими приступами проведение КТ или МРТ головного мозга: при возникновении СЭП или СЭС рекомендуется КТ головного мозга с целью исключения геморрагического инсульта или геморрагического компонента ИИ, повторного ОНМК (при возможности в режиме КТ-перфузии) [351, 352, 353].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5).
Комментарии: МРТ головного мозга является более чувствительным методом для исключения иных (кроме ОНМК) причин эпилептических приступов. При неспровоцированных ЭП или ЭС рекомендуется МРТ головного мозга не менее 1,5 Тесла с целью уточнения диагноза и оптимизации тактики лечения [335, 349].
- Рекомендуется при острых симптоматических приступах в качестве препарата первого выбора назначение диазепама** в дозе 10 мг внутривенно [354].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5).
Комментарии: При назначении диазепама** внутривенно необходимо учитывать возможность угнетения дыхания вплоть до его остановки, а также снижения АД и нарастания уровня седации, в особенности у пожилых пациентов.
- Рекомендуется пациентам с ИИ при остром симптоматическом эпилептическом статусе начинать лечение с внутривенного введения диазепама** [358].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: #Диазепам** вводится внутривенно в дозе 0,2 — 0,5 мг/кг (при этом повторное введение возможно в течение 20 минут, а суммарная доза не должна превышать 20 мг). Терапию следует начинать: при билатеральных тонико-клонических приступах через 5 минут, при фокальных приступах не позже чем через 10 минут [355, 358]. При назначении #диазепама** внутривенно необходимо учитывать возможность угнетения дыхания вплоть до его остановки, а также снижения АД и нарастания уровня седации, в особенности у пожилых пациентов.
Лечение эпилептического статуса проводится в соответствии со стандартными рекомендациями в максимально короткие сроки с учетом высокой смертности пожилых пациентов при ЭС. Статус должен быть купирован в течение 30 минут (при билатеральных тонико-клонических приступах) и в течение 60 минут (при фокальных приступах) [355].
- Не рекомендуется назначение противоэпилептических препаратов после ИИ в качестве профилактики постинсультной эпилепсии [356].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 2).
Комментарии: Непродолжительное (недели) назначение противоэпилептических препаратов возможно по индивидуальным показаниям, например, у больных с тяжелой сопутствующей патологией, когда велик риск ее усугубления при повторении приступов.
- Рекомендуется пациентам с установленным диагнозом постинсультной эпилепсии в качестве препарата первого ряда назначение леветирацетама** [359].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 1).
Комментарии: Препарат целесообразно назначать в монотерапии. Необходимо учитывать возможный седативный эффект препарата, либо, наоборот, появление раздражительности и возбуждения на фоне его применения, в особенности у пожилых пациентови у пациентов с нарушением функции почек.
- Рекомендуется пациентам с установленным диагнозом постинсультной эпилепсии в качестве препарата первого ряда назначение ламотриджина** [359].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 1).
Комментарии: Препарат целесообразно назначать в монотерапии. Необходимо постепенное увеличение дозы препарата с учетом возможного развития аллергических реакций. Ламотриджин** назначают с осторожностью при наличии у пациента нарушений сердечного ритма.
- Рекомендуется пациентам с установленным диагнозом постинсультной эпилепсии назначение эсликарбазепина [357].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 4).
Комментарии: Препарат целесообразно назначать в монотерапии. Необходимо учитывать возможность развития гипонатриемии.
- Рекомендуется пациентам с установленным диагнозом постинсультной эпилепсии назначение габапентина [357, 362].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 4).
- Рекомендуется пациентам с установленным диагнозом постинсультной эпилепсии в качестве препарата первого ряда назначение зонисамида [362].
Уровень убедительности рекомендаций C (уровень достоверности доказательств —5).
Комментарии: Все вышеперечисленные препараты целесообразно назначать в монотерапии. Предпочтение следует отдавать препаратам с хорошей переносимостью и минимальным лекарственным взаимодействием. Карбамазепин** и вальпроевая кислота** эффективны, однако уступают приведенным выше препаратам вследствие лекарственного взаимодействия. Выбор препарата для лечения постинсультной эпилепсии зависит от целого ряда факторов, в том числе возраста пациента, наличия сопутствующих заболеваний, приема иных препаратов. Показана лучшая переносимость леветирацетама** и ламотриджина** в сравнении с карбамазепином** [360; 361].
Пожилым пациентам с учетом снижения функции почек, накопления коморбидных заболеваний рекомендуется начинать терапию с более низких доз препаратов, выбирать более низкий темп титрации, по возможности использовать пролонгированные формы и монотерапию [339]. Могут применяться любые другие противоэпилептические препараты, зарегистрированные в РФ для терапии фокальных приступов: вальпроевая кислота**, окскарбазепин**, фенобарбитал**, топирамат**, примидон, прегабалин** , фенитоин** и клоназепам** [362].
4. Постинсультная депрессия
Постинсультная депрессии диагностируется при наличии у пациента классической «депрессивной триады» — снижения настроения, моторной и идеаторной активности. В соответствии с МКБ-10 постинсультная депрессия должна диагностироваться как «Непсихотическое депрессивное расстройство в связи с сосудистым заболеванием головного мозга» F06.3. Для ее лечения назначаются антидепрессанты в комплексе с психосоциальной реабилитацией и психотерапией. В качестве препаратов первой линии, как правило, назначаются СИОЗС [363, 364, 365, 366, 369, 370, 389]. Целесообразно начать терапию антидепрессантами с минимальных доз, особенно у пациентов пожилого и старческого возраста, постепенно увеличивая дозу до терапевтической под контролем выраженности побочных эффектов. Длительность лечения обычно составляет не менее 6 мес.
- Рекомендуется консультация врача-психиатра пациентам, перенесшим ИИ с признаками аффективных расстройств для диагностики постинсультной депрессии [367- 371].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
- Рекомендуется назначение пациентам с постинсульной депрессией флуоксетина** в качестве препарата выбора с целью этиотропной терапии [372, 373].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 2).
Комментарии: Рекомендуемая дозировка флуоксетина** для терапии постинсультной депрессии составляет 20 мг, с возможным постепенным увеличением дозировки до 60 мг в сутки. К побочным эффектам флуоксетина** можно отнести: сексуальную дисфукцию, бессонницу, седацию, головную боль, тремор, головокружения, гипергидроз, нарушение секреции антидиуретического гормона [549].
- Рекомендуется назначение сертралина** в качестве препарата выбора пациентам с постинсульной депрессией с целью этиотропной терапии [370, 372, 374, 375, 550, 551].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: Согласно РКИ наибольшие эффективность и переносимость, наименьшая частота случаев досрочного прекращения лечения наблюдались при использовании сертралина. Терапевтический диапазон сертралина** достаточно широк и составляет от минимальной ежедневной разовой дозы 50 мг до максимальной ежедневной разовой дозы 200 мг. Подбор дозы ЛС определяется тяжестью постинсультной депрессии. Преимущество сертралина** по сравнению с другими препаратами группы СИОЗ связано с одновременным влиянием как на компоненты депрессивного состояния, так и на тревожное расстройство. К побочным эффектам относятся такие явления как: сексуальная дисфукция, бессонница, седация, головная боль, тремор, головокружения, гипергидроз, редко гипонатриемия (в основном у пожилых пациентов и обычно обратимая при прекращении приема сертралина), нарушение секреции антидиуретического гормона [549].
- Рекомендуется назначение пароксетина** в качестве препарата выбора пациентам с постинсульной депрессией с целью этиотропной терапии [368, 375, 376].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
Комментарии: Лечение постинсультной депрессии пароксетином** в терапевтических дозировках (20 — 50 мг) эффективно при постинсультной депрессии, в том числе на дистанции 6 — 12 недель. К побочным эффектам пароксетина** относятся: сексуальная дисфукция, бессонница, седация, головная боль, тремор, головокружения, гипергидроз, повышение массы тела, нарушение секреции антидиуретического гормона [549]. Вследствие риска повышения массы тела назначения пароксетина** следует проводить с осторожностью пациентам с избыточной массой тела.
- Рекомендуется применение эсциталопрама в качестве препарата выбора с целью этиотропной терапии у пациентов с постинсульной депрессией [376, 377, 551].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Согласно РКИ эсциталопрам продемонстрировал хорошую терапевтическую эффективность и переносимость, наименьшую частоту случаев досрочного прекращения лечения, фармакологические эффекты ЛС наблюдались в диапазоне доз5 – 20 мг/сут. При длительной терапии эсциталопрамом (10 — 20 мг/сут в течение 12 мес) показано улучшение когнитивных функций, особенно вербальной и зрительной памяти у пациентов, перенесших ИИ [552]. К побочным эффектам относятся такие явления как: сексуальная дисфукция, бессонница, седация, головная боль, тремор, головокружения, гипергидроз, редко гипонатриемия (в основном у пожилых пациентов и обычно обратимая при прекращении приема эсциталопрама), нарушение секреции антидиуретического гормона [549].
- Рекомендуется использование дулоксетина в качестве препарата выбора с целью этиотропной терапии у пациентов с постинсульной депрессией [375, 551].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: Дулоксетин относится к группе селективных ингибиторов обратного захвата серотонина и норадреналина (СИОЗСН, входящие в группу «Прочие антидепрессанты», согласно АТХ-классификации), т.е. селективно блокирует обратный захват, в том числе норадреналина, одновременно с серотонином. Терапевтический диапазон дулоксетина составляет от 60 мг/сут до 120 мг/сут в зависимости от тяжести проявления депрессивного состояния. Применение дулоксетина эффективно в отношении постинсультной депрессии, однако его профиль переносимости оказался хуже, чем у препаратов группы СИОЗС. К побочным эффектам дулоксетина относятся: тошнота, диарея, снижение аппетита, сухость во рту, запор (дозозависимый эффект, нарушения сна, седация, головокружение, сексуальная дисфункция, потливость, повышение артериального давления, задержка мочи [549].
- Рекомендуется назначения циталопрама в качестве препарата выбора с целью этиотропной терапии у пациентов с постинсультной депрессией [378].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: Назначение циталопрама начинается с дозировок в 20 мг/сут с возможным постепенным увеличением дозы до 40 мг/сут в значимости от тяжести депрессии. К побочным эффектам циталопрама относятся: сексуальная дисфукция, бессонницу, седация, головная боль, тремор, головокружение, гипергидроз, нарушение секреции антидиуретического гормона [549].
- Не рекомендуется применение трициклических антидепрессантов в качестве препаратов первой линии пациентам с постинсультной депрессией в связи с высоким риском развития побочных эффектов, а также с учетом наличия альтернативных терапевтических тактик [379, 380].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Побочные реакции, связанные с антихолинергическими и антиадренергической эффектами трициклических антидепрессантов такими как глаукома, спутанность сознания, задержка мочи, гипотония, головокружение не позволяют использовать ТЦА в качестве препаратов первой линии, несмотря на хороший терапевтический эффект в отношении постинсультной депрессии по сравнению с СИОЗС или СИОЗС + психотерапия. Назначение ТЦА при неэффективности СИОЗС должно решаться с учетом оценки индивидуальный риск/польза у пациента.
5. Постинсультная тревога
Диагноз тревожного расстройства у пациентов, перенесших инсульт в соответствии с МКБ-10 должен определяться как «Органическое тревожное расстройство в связи с сосудистым заболеванием головного мозга» F06.41. Частота развития тревожного расстройства у пациентов, перенесших ИИ может достигать 22% случаев, при этом существенно ухудшается функциональный исход заболевания [589]. В большинстве случаев постинсультная тревога ассоциирована с депрессией, поэтому лечение тревожных расстройств осуществляется антидепрессантами.
- Рекомендуется консультация врача-психиатра с целью ранней клинической диагностики тревожного расстройства у пациентов, перенесших ишемический инсульт [364, 367, 383, 384, 553, 554].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
- Рекомендуется пациентам с установленным постинсультным тревожным расстройством назначение антидепрессантов из группы СИОЗС в качестве препаратов выбора целью уменьшения симптомов тревожного расстройства [388, 390, 392].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Терапия антидепрессантами из группы СИОЗС целесообразна у данной группы пациентов ввиду высокой коморбидности тревоги и депрессии.
- Рекомендуется пациентам с постинсультным тревожным расстройством в начале терапии временное добавление производных бензодиазепинов с целью облегчения симптомов заболевания и применения более низких начальных доз СИОЗС [387, 388].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: производные бензодиазепинов назначаются в минимальных дозировках длительностью не более 14 дней. Не рекомендуется длительное применение производных бензодиазепинов, так как это может привести к избыточной седации, атаксии, имеется риск развития зависимости [549].
- Рекомендуется пациентам с постинсультной тревогой назначение буспирона с целью купирования симптомов тревожного расстройства [392, 393].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 1).
Комментарии: Рекомендуемая начальная суточная доза составляет 15 мг, дозировку можно повышать по 5 мг в сутки каждые 2 — 3 дня при отсутствии противотревожного эффекта. Максимальная однократная дозировка составляет 30 мг; максимальная суточная доза не должна превышать 60 мг. К побочным эффектам буспирона относятся: головная боль, раздражительность, седация, возбуждение, тошнота, беспокойство [549].
- Рекомендуется пациентам с постинсультным тревожным расстройством при наличии сопутствующего болевого синдрома назначение прегабалина** в связи с одновременным влиянием препарата на симптомы тревоги и противоболевым действием. [394].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 2).
Комментарии: Механизм действия препарата заключается в связывании с альфа-2-дельта-субъединицей потенциалзависимых кальциевых каналов, что блокирует передачу болевых импульсов, связывает пресинаптические N и P/Q кальциевые каналы, уменьшая их чрезмерную активность, таким образом снижая нейромедиаторную трансмиссию, что приводит к снижению проявления тревожной симптоматики. Режим дозирования: начальная доза — 150 мг/сут. В зависимости от достигнутого эффекта и переносимости, через 3 – 7 дней дозу можно увеличить до 300 мг/сут. Длительное применение препарата безопасно для пациента. К побочным эффектам прегабалина** относятся такие явления, как: седация, головокружение, тремор, дизартрия, парестезии, нарушение памяти, нарушение координации, нарушение внимания, спутанность сознания, эйфория, раздражительность, сухость во рту, запор, увеличение веса, повышенный аппетит, метеоризм, помутнение зрения, диплопия, периферические отеки, снижение либидо, эректильная дисфункция [549].
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
- Рекомендуется первоочередная транспортировка пациентов с предположительным диагнозом ТИА и ишемическим инсультом и предварительное информирование принимающего стационара [13, 59, 60, 61, 64, 193].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5).
Комментарии: Диспетчеры и выездной персонал СМП должны быть обучены простым методикам диагностики инсульта (тест «лицо – рука – речь). Пациент с подозрением на инсульт и ТИА должен быть без промедления доставлен в ближайший стационар с отделением острых нарушений мозгового кровообращения, где оказывается круглосуточная экстренная помощь.
- Рекомендуется госпитализация всех пациентов с предположительным диагнозом ТИА и ишемическим инсультом, минуя приемное отделение, через кабинет компьютерной томографии в блок интенсивной терапии на срок не менее 24 часов [13, 59, 60, 61, 64, 193].
Уровень убедительности рекомендаций B(уровень достоверности доказательств –1).
- Рекомендуется при отсутствии возможности круглосуточной расшифровки данных КТ или МРТ применять систему телерентгенологии для своевременного просмотра сканов КТ или МРТ при подозрении на острый инсульт [512, 586].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 2).
- Рекомендуется всем пациентам с диагнозом ишемический инсульт при наличии симптомов, которые приводят к нутритивной недостаточности (нарушение уровня бодрствования, дисфагия, отсутствие аппетита) обеспечение нутритивной поддержки [59, 60, 62, 63, 64].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 5).
Комментарии: Голодание или недостаточное питание приводит к активизации катаболических процессов и ухудшает течение инсульта, является предиктором плохого функционального восстановления и высокой смертности. Определение потребности в калорийности питания проводится на основании ориентировочного расчета 30 ккал/кг массы тела. Используют сбалансированные питательные смеси при зондовом питании, или общий больничный стол с суточным калоражем около 2000 ккал. Не целесообразно применение пищевых добавок.
- Рекомендуется применение добавок с кальцием/витамином D пациентам с ишемическим инсультом с риском падения [13, 59, 60, 61, 513].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Медицинская реабилитация на всех трех этапах должна проводится с интенсивностью, соизмеримой с ожидаемой пользой и переносимостью пациентами мероприятий по медицинской реабилитации [395, 396, 397]. Цель реабилитации должна быть специализирована, количественно измеряема, достижима и учитывать индивидуальные требования пациента. Реабилитационные мероприятия должны включать по показаниям кинезотерапию, эрготерапию, логопедию, контроль дисфагии, нутритивную поддержку, занятия по коррекции когнитивных функций, управление эмоциональным статусом, в том числе, консультирование пациентов, семей и опекунов, физические методы, фармакологическое лечение.
Мероприятия, рекомендуемые на всех трех этапах медицинской реабилитации
- Рекомендуется, проводить мероприятия по медицинской реабилитации пациентов специалистам мультидисциплинарной реабилитационной команды специалистов (МДРК), с целью снижения смертности и зависимости от посторонней помощи пациентов с инсультом [395, 396, 397, 402, 433].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
- Рекомендуется в целях коррекции плана реабилитации и оценки достигнутых результатов проведение координации работы мультидисциплинарной реабилитационной команды, участия пациента, членов его семьи, лиц, осуществляющих уход за пациентом, с регулярным обсуждением процесса, целей и задач реабилитации, осуществляемой врачом физической и реабилитационной медицины (врачом-реабилитологом) [395, 396, 397, 402, 433].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3).
- Рекомендуется, с целью увеличения эффективности и безопасности реабилитационного процесса, осуществлять мероприятия по медицинской реабилитации в специализированных реабилитационных отделениях с использованием специального оборудования и материалов в соответствии с санитарно-гигиеническими нормами и правилами эксплуатации используемого оборудования и материалов для медицинских реабилитационных подразделений [192, 403, 404, 405, 406].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
- Рекомендуется, осуществлять совместный контроль за диагностикой и верификацией осложнений ИИ (аспирация, нутритивный дефицит, состояние кожных покровов, нарушение мочеиспускания, иммобилизационным синдром, болевой синдром центрального и периферического генеза, нарушения мышечного тонуса, контрактуры) членами мультидисциплинарной реабилитационной команды для уменьшения степени тяжести основного заболевания пациента [192, 403, 404, 405, 406, 407, 408, 409, 410, 411, 412, 413, 414, 415, 416, 418, 419, 420, 421, 447].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется врачам физической и реабилитационной медицины определять критерии результата медицинской реабилитации, которые будут использоваться в процессе реабилитации специалистами мультидисциплинарной реабилитационной команды с целью увеличения эффективности реабилитационного процесса [395, 397, 401, 402, 440].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3).
- Рекомендуется для повышения эффективности мероприятий по медицинской реабилитации и приверженности пациента к лечению специалистам мультидисциплинарной реабилитационной команды планировать продолжительность и интенсивность реабилитационных мероприятий в соответствии с целями реабилитационной терапии, конкретными потребностями и состоянием пациента, по согласованию с ним и его семьей/опекуном [432, 433].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3).
- Рекомендуется, чтобы индивидуальная программа реабилитации пациента, перенесшего ИИ, включала мультидисциплинарный подход в диагностике состояния пациента и возможность коррекции структуры, функции, ограничения активности и участия, а также личностных факторов, факторов окружающей среды в категориях Международной классификации функционирования (МКФ) [401, 422, 440, 441, 433, 447].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Комментарии: Для диагностики нарушений функции, структур, ограничения деятельности и ограничения участия, личностных факторов и факторов среды пациентов с инсультом должны использоваться стандартизованные и валидные методы диагностики, а также инструменты оценки, предусмотренные МКФ. На всех этапах медицинской реабилитации должен использоваться следующий минимальный перечень кодов МКФ: b110 функции сознания, b114 функции ориентированности, b 117 интеллектуальные функции, b130 волевые и побудительные функции, b134 функция сна, b140 функция внимания, b144 функция памяти, b152 функция эмоций, b156 функция восприятия, b160 функция мышления, b164познавательные функции высокого уровня, b167 умственные функции речи, b210 функция зрения, b230 функция слуха, b235 вестибулярные функции, b280 ощущение боли, b310 функции голоса, b320 функция артикуляции, b330функции беглости и ритма речи, b410 функции сердца , b420 функции артериального давления, b430 функции системы крови, b440 функция дыхания, b510 функция приема нутриентов, b515 функция пищеварения, b525 функция дефекации, b530 функция сохранения массы тела, b620 функция мочеиспускания, b710 функции подвижности суставов, b730 функции мышечной силы, b735 функции мышечного тонуса, b750 моторно-рефлекторные функции, b760 контроль произвольных двигательных функций; b765 непроизвольные двигательные функции [441, 442]. Для диагностики структур организма используется следующий минимальный перечень кодов МКФ: s110 структура головного мозга, s320 структура рта, s330 структура глотки s340 структура гортани, s410 структура сердечно-сосудистой системы, s430 структура дыхательной системы, s710 структуры головы и области шеи, s720 структура области плеча, s730 структура верхней конечности, s740 структура таза, s750 структура нижней конечности, s760 структура туловища, s810 структура кожи [441, 443].
- Рекомендуется для диагностики нарушений функции, структур, ограничения деятельности и ограничения участия, личностных факторов и факторов среды пациентов с ИИ специалистами мультидисциплинарных реабилитационных команд использовать стандартизованные и валидные методы диагностики, а также инструменты оценки, предусмотренные МКФ [349, 432, 433, 447].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
- Рекомендуется при высокой вероятности аспирации пациентам с инсультом проводить инструментальную оценку ее наличия и уточнения физиологических причин дисфагии при выборе лечебного подхода [177, 179, 180, 447, 457, 463].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
- Рекомендуется регулярно проводить осмотр кожных покровов пациента с ИИ с объективной оценкой риска развития пролежней с использованием валидизированных шкал [286, 444, 445].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: В острейшем и остром периоде инсульта рекомендуется применять все меры по профилактике повреждения кожи и пролежней. Это включает в себя минимизацию трения и уменьшение давления на поверхность кожи за счет правильного позиционирования в постели или кресле с использование специальных матрасов, подушек, валиков и столиков, создающих опору.
Рекомендуется включение в индивидуальный план реабилитации аэробных низкоинтенсивных циклических упражнений пациентам с ишемическим инсультом для увеличения толерантности к нагрузкам, улучшения состояние сердечно-сосудистой системы и снижения риска повторного церебрального инсульта [411, 466].
- Рекомендуется включение в индивидуальный план реабилитации аэробных низкоинтенсивных циклических упражнений пациентам с ишемическим инсультом для увеличения толерантности к нагрузкам, улучшения состояние сердечно-сосудистой системы и снижения риска повторного церебрального инсульта [411, 466].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
- Рекомендуется нутритивная поддержка пациентам после инсульта при имеющейся потребности в повышении калорийности питания для улучшения восстановительных процессов и снижения риска летальных исходов [179, 426].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 5).
Комментарии: Недостаточное питание приводит к активизации катаболических процессов и ухудшает течение инсульта, является предиктором плохого функционального восстановления и высокой смертности. Определение потребности в калорийности питания проводится на основании ориентировочного расчета 30 ккал/кг массы тела. Используют сбалансированные питательные смеси при зондовом питании, или общий больничный стол с суточным калоражем около 2000 ккал.
- Рекомендуется при нарушении функции мочеиспускания у пациентов с инсультом проведение оценки типа дисфункции мочевого пузыря, и на этой основе формирование индивидуальной программы восстановления, включающей побуждение пациента к регулярному опорожнению мочевого пузыря, упражнения для мышц тазового дна, периодическую катетеризацию, антихолинергическое лечение и модификацию образа жизни [399, 405, 420].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 1).
- Рекомендуется, чтобы все пациенты с инсультом были обследованы на коммуникативные расстройства, которые включают афазию, дизартрию и речевую апраксию, и получали речевую и языковую терапию, индивидуально подобранную в соответствии с их потребностями [395, 399, 406, 447].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 5).
- Рекомендуется проведение речевой терапии пациентам с ишемическим инсультом при наличии синдрома дизартрии и/или афазии с целью уменьшение речевых и когнитивных нарушений [395, 412, 413, 415].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: Цели реабилитации в стационаре лечения заключаются в том, чтобы ускорить восстановление когнитивных и коммуникативных функций, выделить положительные компенсационные стратегии, обучить и проконсультировать пациентов и лиц, осуществляющих уход, относительно когнитивных и коммуникативных нарушений и их последствий. Такие нарушения относятся к числу сложных дефицитов и требуют мультидисциплинарного подхода к лечению; для таких нарушений не существует оптимальных методов лечения: терапия состоит из комбинации переобучения и компенсационных методов лечения.
- Рекомендуется своевременная оценка врачом ФРМ потребности в технических средствах реабилитации, таких как трость, костыли или инвалидное кресло-коляска, для обеспечения эффективной мобильности и безопасности пациентов после ИИ [402, 403, 438, 439].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется проведение тренировок по улучшению персональных навыков повседневной активности, в зависимости от индивидуальных потребностей и с учётом функционального дефицита всем пациентам, перенёсшим инсульт, с целью уменьшения зависимости и расширения повседневной активности [407].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 1).
Комментарии: При отсутствии возможности организации специальной эргозоны для проведения таких тренировок рекомендуется включение элементов эрготерапии в комплексы лечебной гимнастики и терапии ограничением движения. Тренировки могут начинаться уже в остром периоде инсульта (в зависимости от состояния пациента).
Первый этап ( I ) медицинской реабилитации в отделениях реанимации, интенсивной терапии и специализированных сосудистых отделениях
- Рекомендуется начинать медицинскую реабилитацию пациентам с ИИ не позднее 48 часов от момента поступления в стационар при отсутствии противопоказаний к используемым методам для предупреждения осложнений и увеличения функциональной активности [395, 397, 400, 402, 404, 423, 424, 425, 426].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: Ранняя мобилизация – элемент реабилитационного процесса для пациентов с инсультом на всех этапах медицинской реабилитации. Ранняя мобилизация – процесс улучшения функциональной активности пациента, в частности способности к поворотам в постели, возможности садиться, вставать, делать шаги в как можно более ранние сроки. Минимальная, но самостоятельная мышечная активность предупреждает развитие атрофии мышц, как раннего признака иммобилизационного синдрома.
Реабилитационные действия по мобилизации делятся в зависимости степени участия пациента на активные для способных к кооперации с членами МДБ и пассивные для пациентов с низким количественным и/или измененным качественным уровнем сознания. К пассивным процедурам относятся движения во всех суставах, соответствующих их физиологическому объему, которые производятся специалистом ЛФК.
- Рекомендуется начинать мобилизацию не ранее 24 ч от начала инсульта, с целью увеличения вероятности благоприятного исхода через 3 месяца [395, 423, 424].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
- Рекомендуется для профилактики повреждений кожи, развития контрактур и подготовки к вертикализации в течение острейшего периода ИИ (1 — 5 сутки ИИ) менять не реже, чем каждые 2 часа положение конечностей и туловища пациентов по отношению к горизонтальной плоскости в зависимости от статуса вертикализированности пациентов [402, 404, 424, 427, 445].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Позиционирование может проводиться с 1 суток пребывания пациента в ОРИТ с перерывами на сон. Позиционирование используется для гравитационной стимуляции перераспределением жидкости при подъеме головного конца.
Головной конец всегда должен быть приподнят не ниже 30 градусов. Последовательное изменение положения тела пациента осуществляется на 3 секционной кровати с формированием позы в соответствии со статусом вертикализации (поднятый головной конец, опущенный ножной конец) с 1 суток постоянно. В ходе процедур производится непрерывный мультимодальный мониторинг с целью раннего выявления симптомов, ограничивающих или останавливающих дальнейшее проведение мобилизации.
- Рекомендуется начинать активную или пассивную мобилизацию, а также мышечную тренировку так рано, как только это позволит клиническое состояние пациента [402, 411, 423, 424].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется, при отсутствии противопоказаний, начинать вертикализацию со 2-х суток пребывания в отделении реанимации и интенсивной терапии для пациентов с целью раннего выявления симптомов, ограничивающих или останавливающих дальнейшее проведение мобилизации [404, 423, 424].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Этот раздел мобилизации занимает особое место в ранней реабилитации, так как существенно уменьшает отрицательные эффекты постельного режима и готовит пациента к скорейшему переводу из ОРИТ в другое отделение.
Вертикализация представляет собой увеличение угла подъема головного конца с последующим опусканием ножного конца. Увеличение гравитационного градиента (ГГ) происходит в среднем через 15 минут при отсутствии симптомов, ограничивающих или останавливающих дальнейшее проведение мобилизации. При достижении 900 возможен переход на уровень пассивного пересаживания в кресло. Положение сидя помогает поддерживать центральную и периферическую перфузию, приемлемый уровень сатурации крови, предотвращать развитие пневмонии, улучшает мышечный метаболизм, препятствует венозному стазу и тромбозу глубоких вен голени.
- Рекомендуется у пациентов с инсультом в первые 3 часа госпитализации проведение начального скрининга дисфагии медицинским персоналом с использованием теста 3-х глотков для принятия решения о способе питания «ничего через рот» [177, 399, 434, 447].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2).
- Рекомендуется осуществлять гигиену ротовой полости пациента с инсультом, что снижает риск пневмонии [180, 399, 403, 447].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарий: Ограниченное число исследований подтвеждает, что введение протокола интенсивной гигиены ротовой полости может уменьшить риск аспирационной пневмонии. У пациентов в остром периоде инсульта Sørensen и соавторы показали, что вмешательства, включающие стандартизированный скрининг дисфагии, диету и стандартизированную гигиену с антибактериальной сывороткой, содержащей хлоргексидин, уменьшают риск пневмонии, (7% против 28%) в сравнении с исторической контрольной группой в которой пациенты несистематически скринировались на наличие дисфагии в течение 24 часов и получали несистематическую гигиену рта без применения хлоргексидина. Кокрановский обзор, который включил 3 исследования установил, что уход за полостью рта и деконтаминационный гель в сравнении с уходом за полостью рта с использованием плацебосодержащего геля уменьшает заболеваемость пневмонией в интервенционной группе (р = 0,03).
- Рекомендуется уточнять анамнестические данные о функции кишечника у остро госпитализированных пациентов с инсультом, в частности: сроки последней дефекации (до инсульта), практику ухода за кишечником до развития инсульта [399, 434].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 5).
- Рекомендуется выполнение врачом неврологом оценки состояния пациента по шкале Рэнкин (Приложение Г6) в первые 24 часа от момента поступления в стационар и на момент выписки из стационара для определения критериев исхода этапа медицинской реабилитации [486].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется начинать индивидуальную нутритивную поддержку пациентов с ИИ, не позднее 24 часов от момента поступления в стационар с последующей ежедневной коррекцией с целью профилактики питательной недостаточности [426].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется обучение членов мультидисциплинарной реабилитационной команды, пациентов с ишемическим инсультом и членов семей правильному обращению с паретичной рукой для профилактики возникновения боли и сублюксации плечевого сустава [401, 402, 403, 404, 406, 428].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 1).
- Рекомендуется этапное использование ортезов или статических регулируемых туторов (фиксирующих устройств) при формирующихся контрактурах локтевого и лучезапястного суставов умеренной и легкой степени выраженности у пациентов с ИИ [410].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3).
- Рекомендуется для облегчения самостоятельной гигиены пациентов специалисту по физической реабилитации осуществлять сплинтование паретичной руки/лучезапястного сустава в покое [395, 397, 556].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется для профилактики контрактуры при выраженном парезе руки создавать условия для сохранения объема движения руки, используя позиционирование в антиспастическом паттерне [395, 400, 406].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется применять стратегии защиты плечевых суставов, такие как правильное позиционирование, поддержка при выполнении движений и регулярную гигиену кожных покровов руки на ранней стадии восстановления, чтобы предотвратить или свести к минимуму боль в плече и подвывих [401, 406, 428].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется у обездвиженных пациентов с инсультом применение прерывистой пневмокомпрессии в дополнение к стандартной терапии для снижения риска тромбоза глубоких вен при отсутствии противопоказаний [5, 6, 58, 590].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: Перемежающаяся пневматическая компрессия или устройства последовательного сжатия предназначены для стимулирования потока крови за счет прерывистого оказывания давления на икроножных мышцы и сосуды. Один Кокрановский систематический обзор, включающий 2 небольших исследования, в том числе 177 субъектов, продемонстрировал несущественную тенденцию к более низкому риску тромбоза глубоких вен (OR, 0,45; 95% ДИ 0,19 — 1,10) без явного влияния на уровень смертности (ОР, 1,04; 95% ДИ 0,37 — 2,89). CLOTS (Clots in Legs or stockings After Stroke) 3 — многоцентровое исследование, в котором было зарегистрировано 2867 пациентов в 94 центрах в Соединенном Королевстве и проводилось сравнение использования пневмокомпрессии с обычным уходом без пневмокомпрессии с регулярным уходом пациентов с инсультом с ограниченной активностью для профилактики венозной тромбоэмболии. Среди пациентов, получавших перемежающую пневмокомпрессию, наблюдалось статистически значимое улучшение выживаемости до 6 месяцев (HR, 0,86, 95% ДИ, 0,73 — 0,99, р = 0,042), но без уменьшения инвалидности. Метаанализ, включающий это испытания, и 2 меньших испытания подтвердили эти результаты [5, 6, 58, 84, 85].
- Рекомендуется пациентам, которым была проведена rTPA, отложить проведение профилактики тромбоза глубоких вен на 24 часа [399, 438].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Второй этап ( II ) медицинской реабилитации в условиях отделений медицинской реабилитации стационара
- Рекомендуется пациентов, не имеющих возможности самостоятельного перемещения, общения и самообслуживания, но имеющих перспективу восстановления функции, активности и участия, направлять на реабилитацию в условиях круглосуточного стационара [398, 402, 403].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется использовать функциональную электромиостимуляцию мышц у пациентов после ИИ для улучшения моторной функции верхней конечности и увеличения скорости ходьбы [397, 431, 476].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
- Рекомендуется проведение позиционирования плечевого сустава в положении максимальной наружной ротации не менее 30 минут в день у пациентов с выраженным парезом верхней конечности после ИИ для профилактики развития контрактуры в плечевом суставе [448, 458, 471].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется проведение позиционирования паретичных конечностей пациентам с ИИ в антиспастическом паттерне для профилактики развития суставных контрактур и уменьшения тонуса [395, 397, 400].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется проводить мониторинг диуреза, оценку остаточного объема мочи посредством УЗИ, документированный учет объемов самостоятельного мочеиспускания для оценки уровня гидратации и определения режима прерывистой катетеризации [405, 420, 421, 447].
Уровень убедительности рекомендаций В (Уровень достоверности доказательств — 1).
Комментарий: Примерно от 40% до 60% пациентов после инсульта, включая острый период, имеют недержание мочи, и до 25% пациентов после выписки из стационара. В 1 год, 15% остаются с недержанием мочи. Возраст, интеллект и моторные нарушения являются факторами риска развития недержания. Недостаток информированности о недержания мочи у пациента коррелирует с летальностью. У многих пациентов нарушение мочеиспускания регрессирует. Управление функцией тазовых органов является неотъемлемой частью процесса реабилитации.
- Рекомендуется, чтобы пациентам с недостаточностью функции дефекации после инсульта была разработана программа восстановления функции кишечника, включающая сбалансированную диету с достаточным потреблением жидкости, физические упражнения и регулярный запланированный установленный порядок опорожнения кишечника. Установленный порядок опорожнения кишечника может включать расписание дефекации, использование свечей или клизм, массаж живота, ректальную стимуляцию [399, 434].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств — 5).
- Рекомендуется участие врача ФРМ в реализации программы вторичной профилактики разработанной специалистом неврологом для пациента с ИИ с целью повышения ее эффективности [395, 398, 457].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется провести стандартную оценку активности повседневной жизни и действий по самообслуживанию, коммуникационных способностей и функциональной мобильности при планировании объема дальнейшего ухода за пациентами с ишемическим инсультом с целью поддержания оптимального уровня независимости [485].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
- Рекомендуется пациентам с центральным параличом/парезом верхней и/или нижней конечности при наличии показаний включение ботулинотерапии в комплексную программу лечения постинсультной спастичности с целью уменьшения мышечного тонуса, улучшения пассивной функции верхней или нижней конечности, улучшения самообслуживания и снижения болевого синдрома, связанного со спастичностью. При включении в программу инъекций ботулинического токсина типа A-гемагглютинин комплекс** рекомендуется провести оценку возможной пользы/риска ухудшения двигательной функции [446, 448, 449, 570, 571].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: Согласно результатам метаанализов [446, 448, 449, 567, 571] включение в комплексную реабилитацию ботулинотерапии снижает спастичность при центральном парезе верхней и нижней конечности, болевой синдром, мышечные спазмы, увеличивает скорость ходьбы. Период действия ботулинического токсина типа A-гемагглютинин комплекс**, составляющий 12 — 24 недели, следует использовать как «терапевтическое окно» для реализации интенсивных методов физической реабилитации на фоне снижения мышечного гипертонуса [450]. Вместе с тем, в настоящее время не определена эффективность и безопасность применения больших доз ботулинического токсина типа A-гемагглютинин комплекс** при выраженной спастичности, оптимальные дозы и точки введения препарата в различные мышцы-мишени, а также оптимальные сроки проведения ботулинотерапии. Ботулинотерапия назначается пациентам с фокальной/мультифокальной спастичностью по определенным показаниям: степень спастичности по модифицированной шкале Эшворта (Ashworth, 1964) [Приложение Г3] ≥ 2 баллов, при этом ботулинотерапия не эффективна при фиксированных контрактурах в суставах, так как объем движения в суставе не увеличивается. Во время проведения ботулинотерапии необходимо проводить клинический мониторинг для исключения локальных и системных побочных эффектов ботулинотерапии. Эффективность применения ботулинического токсина типа A-гемагглютинин комплекс** при постинсультной спастичности верхней конечности (≥ 2 баллов по модифицированной шкале Эшворта, Приложение Г3) показана в клинических исследованиях высокого класса доказательности с участием более 1500 пациентов ИИ [448, 449].
- Рекомендуется использование пероральных миорелаксантов центрального действия (тизанидина**, баклофена**, толперизона), в составе комплексной антиспастической терапии пациентам с генерализованной или мультифокальной спастичностью с целью уменьшая мышечного тонуса и мышечных спазмов, улучшения двигательной функции, предупреждения формирования контрактур и повышения эффективности реабилитации [451, 452, 453, 455, 563].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2).
Комментарии: Для лучшего терапевтического эффекта пациентам с центральным параличом/парезом верхней и/или нижней конечности при наличии показаний необходимо обеспечить комплексную программу коррекции постинсультной спастичности, включающей несколько технологий (кинезотерапию, массаж, ортезирование, физиотерапевтические методики, медикаментозную терапию). Выбор медикаментозных препаратов зависит от тяжести, анатомического распространения спастичности (мультифокальная, генерализованная, региональная), наличия сопутствующих заболеваний. При негрубой спастичности применение пероральных миорелаксантов, как правило, приводит к положительному терапевтическому эффекту.
Миорелаксанты центрального действия обычно не комбинируют. Лечение миорелаксантами начинают с минимальной дозы, затем ее медленно повышают для достижения эффекта. Однако, при длительном применении препаратов их эффективность снижается, при этом повышения дозировок миорелаксантов приводит к усилению системного эффекта препаратов и к увеличению частоты побочных эффектов.
Тизанидин**. Механизм действия препарата связан с подавлением полисинаптических рефлексов на уровне спинного мозга, что связывают с уменьшением высвобождения возбуждающих аминокислот из пресинаптических терминалей спинальных интернейронов, а также стимуляцией α2-адренорецепторов. На передачу возбуждения в нервно-мышечных синапсах тизанидин** не влияет. Показано умеренное центральное аналгезирующее действие препарата и эффективность при болезненных мышечных спазмах. Для оптимального клинического эффекта препарата требуется индивидуальный подбор дозы методом титрования с учетом выраженности спастичности, уменьшения боли, частоты мышечных спазмов и ассоциативных реакций. Стартовая доза тизанидина** находится в диапазоне 2 — 4 мг. При необходимости дозу препарата постепенно повышаются на 2 — 4 мг каждые 2 — 4 дня, максимальная рекомендуемая доза составляет 36 мг/сутки. Согласно клиническому исследованию зависимости между дозой тизанидина**, концентрацией в плазме крови и антиспастическим эффектом ЛП, наиболее эффективным оказался режим дозирования 4 — 8 мг 3 раза в день [568]. Необходимо соблюдать осторожность при комбинации тизанидина** с антигипертензивными препаратами из-за возможности дополнительного снижения АД.
Баклофен**. Препарат является аналогом гамма-аминомасляной кислоты, связываясь с пресинаптическими ГАМК-рецепторами, приводит к уменьшению выделения глутамата и аспартата, вызывает подавление как моно- так и полисинаптической активности на спинальном уровне и приводит к снижению гипертонуса. Баклофен** эффективен при болезненных мышечных спазмах, оказывает также центральное аналгезирующее и противотревожное действие. Баклофен** плохо проникает через ГЭБ, поэтому для контроля синдрома постинсультной спастичности пероральный прием баклофена часто неэффективен в связи с необходимостью назначения высоких доз препарата, которые могут провоцировать системные побочные эффекты: сонливость, спутанность сознания, головную боль, головокружение.. Баклофен** с осторожностью назначают пациентам пожилого возраста. Стартовая доза баклофена** составляет 15 мг/сут (в три приема), затем дозу увеличивают на 5 мг каждые 3 дня день до получения желаемого эффекта, максимальная доза баклофена** составляет 100 мг/сут.
Толперизон. Механизм действия полностью не выяснен. Толперизон обладает высокой аффинностью к нервной ткани, достигая наибольших концентраций в стволе головного мозга, спинном мозге и периферической нервной системе. Основной эффект толперизона опосредован торможением моно- и полисинаптической активности на спинальном уровне. Толперизон обладает слабыми свойствами α-адренергических антагонистов и антимускариновым действием. Препарат хорошо переносится пожилыми пациентами, не обладает кардиотоксическим действием, лишен седативного эффекта. Стартовая доза толперизона 150 мг 3 раза в сутки, не требуется титрование дозы. Для быстрого эффекта препарат вводится внутримышечно по 1 мл (100 мг) два раза в сутки или внутривенно по 1 мл один раз в сутки. Суточная доза толперизона обычно составляет 450 мг /сут перорально (в три приема); или внутримышечно 200 мг/сут (в 2 приема), а внутривенно — 100 мг/сут (один раз в день). Согласно РКИ, доза при которой часто возникали системные нежелательные побочные реакции (сонливость, кома, судороги и возбуждение) составляла 1500 мг/сут [564].
При грубой фокальной/региональной спастичности применение пероральных миорелаксантов мало эффективно, поэтому приоритет отдается другим терапевтическим стратегиям [569].
- Рекомендуется пациентам с генерализованной или региональной спастичностью при неэффективности консервативного лечения грубого спастического синдрома применение интратекальной баклофеновой терапии с целью уменьшения спастичности [448, 456].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2).
Комментарии: Интратекальной терапия баклофеном** с использованием имплантируемых помп является высокоэффективным методом коррекции грубого спастического синдрома, с возможностью регуляции терапевтического эффекта. Снижение мышечного тонуса ≥ 1 балл по модифицированной шкале Эшворта свидетельствует о положительном терапевтическом эффекте. Однако высокая стоимость лечения, а также вероятность развития тяжелых осложнений вследствие нарушения инфузии препарата накладывают определенные ограничения на клиническое использование этого метода.
- Рекомендуется разрабатывать индивидуальную комплексную программу восстановительного лечения для пациентов с синдромом постинсультной боли в области плеча с учетом патогенетических факторов и тяжести болевого синдрома, включающую фармакотерапию и коррекцию костно-суставной и мышечной системы плечевого пояса [397, 458, 459].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: Синдром постинсультной боли может быть связан с несколькими патогенетическими факторами, включающими локальное повреждение околосуставных тканей, миогенную боль из лестничных мышц, нейропатическую боль, включая комплексный регионарный болевой синдром, боль центральную постинсультную и при спастичности. Для измерения интенсивности боли используют визуально-аналоговую шкалу (ВАШ, Приложение 11). В зависимости от характера болевого синдрома в плече могут применяться различные алгоритмы терапии: инъекции глюкокортикоидов в плечевой и/или субакромиальный суставы, блокаду надлопаточного нерва, электростимуляцию мышц плеча, инъекции ботулинического токсина типа A-гемагглютинин комплекс** в подлопаточную и/или грудные мышцы, применение плечевых ортезов, нестероидные противовоспалительные препараты, массаж и щадящие мобилизационные техники для плечевых мышц, иглорефлексотерапия [397, 458, 459].
- Рекомендуется проводить тренировки верхних конечностей и туловища, включающие цель-ориентированные движения с большим количеством повторов, у пациентов со спастическим парезом после ИИ, с целью улучшения двигательного контроля и восстановления сенсомоторной функции конечности [480].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
- Рекомендуется в качестве адъювантного метода реабилитации проведение мысленных тренировок с представлением движения пациентам с постинсультным центральным парезом руки любой степени выраженности, в раннем и позднем восстановительном периодах ИИ [461, 480].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
Комментарии: Включение тренировок представлением движения в комплексную двигательную реабилитацию повышает эффективность восстановления движений руки, что было показано в исследованиях с участием более 500 пациентов. Влияние данной терапии на улучшение базовых навыков самообслуживания не выявлено [460].
- Рекомендуется пациентам с постинсультным парезом мышц руки различной степени тяжести включение в программу комплексной двигательной реабилитации (2-й и 3-й этапы медицинской реабилитации) курса тренировок с применением технологии кинестетического представления движения при использовании интерфейса мозг-компьютер с экзоскелетом кисти с целью улучшения двигательной функции руки как в проксимальных, так и дистальных отделах [558, 559, 560].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2).
Комментарии: В основе применения медицинской технологии «Неинвазивный интерфейс мозг – компьютер (ИМК) – экзоскелет кисти» лежат мысленные тренировки с парадигмой представления движения (например, раскрыть кисть), которые повышают эффективность комплексной терапии, направленной на улучшения двигательной функции руки [459]. Технология ИМК с экзоскелетом кисти позволяет пациенту получить объективную информацию о ходе и качестве мысленных тренировок и быстрее обучиться их правильному выполнению, так как в ходе тренировок пациенту предъявляются сразу два вида обратной связи: визуальная обратная связь — при распознавании нейрокомпьютерным интерфейсом ЭЭГ-сигналов мозга, соответствующих представлению движения, происходит изменение цвета индикатора на мониторе, и кинестетическая обратная связь — раскрытие кисти с помощью экзоскелета [557, 559].
Предварительные результаты многоцентрового слепого контролируемого исследования iMove показали, что применение технологии кинестетического представления движения под контролем ИМК с экзоскелетом кисти в течение 2 — 3 недель у пациентов с парезом руки увеличивает долю пациентов с клинически значимым улучшением двигательной функции руки не зависимо от исходной тяжести пареза и возраста пациентов [559].
Клиническая эффективность тренировок кинестетического представления движения при использовании ИМК с экзоскелетом кисти показана при занятиях по 20 — 40 минут 5 раз в неделю в течение 2 недель [557, 559]. Способность к обучению кинестетическому представлению движения и управлению интерфейсом мозг-компьютер не зависит от возраста пациентов, патогенетического варианта и давности ИИ (вне острого периода инсульта), а также локализации очага поражения ткани мозга при условии, что у пациентов сохранено понимание обращенной речи и отсутствуют выраженные нейродинамические нарушения. Вероятно, улучшение двигательной функции руки у пациентов с различной степенью постинсультного пареза руки при применении технологии «Неинвазивный интерфейс мозг – компьютер (ИМК) – экзоскелет кисти» связано с улучшением процессов нейропластичности в сенсомоторной области коры головного мозга.
- Рекомендуется применение аппаратной (электромеханической и роботизированной) реабилитации пациентам с парезом верхней конечности после ИИ с целью улучшения активности в повседневной деятельности (в период до трёх месяцев после инсульта), увеличения мышечной силы и улучшения функции руки (независимо от давности инсульта) [462].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Комментарии: Эффективность аппаратной (электромеханической и роботизированной) реабилитации моторной функции верхней конечности, показана в Кокрановском систематическом обзоре (45 РКИ с участием 1619 пациентов) [462].
- Рекомендуется в раннем и позднем реабилитационном периоде ишемического инсульта проведение зеркальной терапии пациентам с гемипарезом любой степени выраженности, но, в особенности, при плегии и грубом парезе, в качестве дополнительного метода реабилитации [592].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 2).
Комментарии: Зеркальная терапия продемонстрировала эффективность в отношении восстановления движений руки после инсульта в исследованиях с участием в общей сложности более 500 пациентов. В ряде исследований показано влияние зеркальной терапии на улучшение базовых навыков самообслуживания. Зеркальная терапия является одним из базовых методом двигательной реабилитации пациентов с плегией кисти, в первую очередь в связи с невозможностью проведения у данной категории больных большинства других видов реабилитационных вмешательств.
- Рекомендуется применение технологий виртуальной реальности у пациентов в восстановительном периоде инсульта с легкой или умеренной степенью пареза верхней конечности и/или спастичности, дополнительно к базовым методам физической реабилитации, с целью улучшения повседневной двигательной активности [474, 480].
Уровень убедительности рекомендации B (уровень достоверности доказательств – 1).
Комментарии: Эффективность технологии виртуальной реальности в качестве дополнительного метода показана в РКИ с участием более 500 пациентов. Для достижения терапевтического эффекта необходимо не менее 15 часов тренировок.
Исследования не выявили увеличение силы в пальцах кисти при сжатии предметов во время тренировок в виртуальной реальности, но было показано увеличение бытовой активности в целом.
- Рекомендуется применение терапии ограничением движения или её модифицированной версии пациентам с центральным парезом руки при условии сохранного произвольного разгибания в запястье 20˚ и в пальцах 10˚ с целью увеличения силы и объёма движения [459].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 1).
Комментарии: Выбор пациентов с наличием произвольного разгибания запястья и пальцев следует рассматривать как ключевой фактор, определяющий потенциал для преодоления феномена «привычки неиспользования» паретичной руки. В позднем восстановительном периоде заболевания длительность ограничения движений интактной руки должна составлять 90% времени бодрствования пациента с продолжительностью интенсивных тренировок 6 часов в день на протяжении 10 рабочих дней в течение 2 недель. При режиме дозирования терапии ограничением движения от 60 до 72 часов в течение 2 недель получены лучшие результаты восстановления функции паретичной руки (манипуляции с предметами) [459].
- Рекомендуется использовать междисциплинарный подход, включающий фармакотерапию, физические упражнения, физиотерапевтические методы и психотерапию с целью коррекции болевого синдрома у больных с ишемическим инсультом [467].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется применение нейроразвивающей Бобат-терапии (Neurodevelopmental Treatment — NDT/Bobath) в комплексной терапии, направленной на повышение мышечной силы, вертикализацию из положения сидя, баланс, способность ходить и активность руки [399, 400, 411, 448, 478, 591].
Уровень убедительности рекомендации С (уровень достоверности доказательств –2).
- Рекомендуется пациентам с нарушением функции ходьбы для оценки эффективности реабилитационных мероприятий на втором и третьем этапах медицинской реабилитации применять клинически значимые интегральные показатели скорости и дистанции ходьбы [470, 561, 562].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 2).
Комментарий: Для улучшения мобильности пациентов необходимо формировать и разделять базовые цели: восстановление способности ходьбы при ее невозможности, улучшение функции ходьбы при ее ограничении, увеличение скорости, дистанции ходьбы, восстановление равновесия [470, 562]. Скорость и длительность ходьбы (дистанция) – основные клинические критерии оценки эффективности реабилитации ходьбы после инсульта. Скорость — количественный показатель производительности ходьбы, валидная и чувствительная ее оценка. Скорость ходьбы в норме составляет 1 — 1,4 м/с, является достоверным предиктором восстановления двигательной функции: скорость ходьбы < 0,4 м/с — передвижение возможно только в домашних условиях и связано с текущей инвалидизацией; от 0,4 до 0,8 м/с — характеризует ограниченное передвижение в условиях сообщества, скорость > 0,8 м/с – возможность нормального функционирования в условиях сообщества с незначительными ограничениями. Скорость ходьбы стала методом стратификации лиц с неврологическими нарушениями и критерием оценки результатов в клинических испытаниях. Стратификация важна для прогнозирования функционального исхода и определения клинической значимости изменений. Скорость ходьбы используется для оценки эффективности реабилитационных методов, что достоверно подтверждено дизайном исследований высокого качества. Так, например, в метаанализе J. Mehrholz и соавт. (2018), скорость ходьбы определена как важный критерий оценки эффективности методов реабилитации. При этом скорость ходьбы используется в исследованиях как основная конечная точка оценки эффективности реабилитационных мероприятий при восстановлении функции ходьбы, в том числе и для пациентов, перенесших инсульт. Скорость ходьбы может измеряться различными методами – метод 3Д видеоанализа, лазерная гониометрия с измерением скорости ходьбы, различные сенсорные дорожки для измерения скорости ходьбы, 10 метровый тест ходьбы [470, 561, 562].
- Рекомендуется использование адаптивного (сплинты) и вспомогательного оборудования для повышения безопасности и повышения активности в повседневной жизни пациентов, если другие методы недоступны или не могут быть освоены пациентом [395].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется проведение силовых тренировок пациентам с ишемическим инсультом в позднем восстановительном и резидуальном периодах с целью увеличения силы тренируемой группы мышц [466, 593].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: Силовые тренировки являются адъювантным методом и, поэтому, должны быть компонентом комплексной реабилитации, так как они влияют на мышечную силу, но не на двигательное обучение/переобучение. При силовых тренировках важны правильный выбор тренируемых групп мышц и настороженность в отношении развития или увеличения спастичности. Основное воздействие должно осуществляться на мышцы-антагонисты спастичных мышц.
- Рекомендуется проведение тренировок по улучшению инструментальных навыков повседневной активности в зависимости от индивидуальных потребностей и с учётом функционального дефицита для пациентов, перенесших ишемический инсульт с целью восстановления двигательных функций и трудовой адаптации [407].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 1).
- Рекомендуется использовать тренировку ходьбы с разгрузкой массы тела, в том числе с применением роботизированных устройств, для пациентов с ишемическим инсультом, неспособных к самостоятельной ходьбе с целью восстановления мобильности [444].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 1).
Комментарий: Основные мероприятия восстановления утраченной способности ходьбы у данной группы пациентов – это максимально возможное количество повторений движений ходьбы. Это осуществляется при включении в реабилитационные программы роботизированного оборудования. При использовании роботизированной поддержки ходьбы различают два терапевтических принципа: подход на основе конечного эффектора, где фиксация ног пациента происходит неподвижно внизу на дорожке, и свободно имитируются различные виды движений в коленном и тазобедренном суставах и второй терапевтический принцип – это принцип экзоскелета, где дополнительно фиксируются и роботизированно контролируются движения в коленном и тазобедренном суставах. Оба терапевтического подхода используют системы частичной разгрузки веса пациента и систему обратной связи. До настоящего времени не получено убедительных доказательств преимущества одного подхода перед другим, дискуссия продолжается. Получены убедительные доказательства преимуществ роботизированного подхода реабилитации перед конвенциональным тренингом (ходьба по земле, подготовительные упражнения сидя, полное отсутствие ассистент-механического тренинга ходьбы).
- Рекомендуется для пациентов с ишемическим инсультом использование медицинской беговой дорожки (с или без поддержки массы тела), использование велотренажеров, в том числе с сопротивлением движению, голосовых команд для побуждения выполнения фаз ходьбы, биологической обратной связи, функциональной электростимуляции, роботизированных устройств, обеспечение контроля за адекватностью реакции сердечно-сосудистой и дыхательной систем на предъявляемую нагрузку с целью улучшения функции ходьбы [470, 471].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
- Рекомендуется использование виртуальной реальности для пациентов с ишемическим инсультом, имеющих нарушения функции ходьбы с целью повышения эффективности занятий по улучшению ходьбы [473].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1).
- Рекомендуется проведение оценки равновесия, когнитивных функций, социальных факторов и индивидуальной программы тренировки равновесия для пациентов, перенесших инсульт, с целью профилактики падений пациентов и обучения лиц, осуществляющих уход за ними [479, 481].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3).
- Рекомендуется проводить мероприятия, направленные на тренировку баланса (упражнения «сидеть-стоять», включая БОС, занятия на стабилоплатформе, обучение с использованием виртуальной реальности) для контроля постурального тонуса и смещения центра масс, распределения веса тела, статические и динамические занятия на стабилоплатформе, использование виртуальной реальности пациентам с высоким риском падений после ИИ для уменьшения нарушений равновесия и риска падений [481, 482].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Для улучшения равновесия менее эффективна изолированная статическая тренировка равновесия: например, только статические занятия на стабилоплатформе без изменения угла наклона и движения платформы по сравнению с динамической тренировкой равновесия во время ходьбы. Так же эффективна динамическая тренировка равновесия в контексте повседневной жизни, например, перенос предметов в быту во время движения.
- Рекомендуется своевременные подбор и использование пациентом технических средств реабилитации (например, трость, костыли, инвалидное кресло-коляска и т.д.) пациентам с двигательными нарушениями после инсульта с целью обеспечения эффективной мобильности и безопасности. Необходимость применения технических средствах реабилитации оценивается при участии врача ФРМ [395, 438, 439].
Уровень убедительности рекомендаций С (уровень достоверности доказательств –2).
- Рекомендуется, чтобы все пациенты с инсультом были обследованы на когнитивный дефицит по Монреальской шкале оценки когнитивных функций, включая синдром игнорирования (или односторонний neglect), а также влияние выявленных нарушений на повседневную деятельность [399, 403, 406, 432, 433].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
- Рекомендуется когнитивная реабилитация пациентам после инсульта с нарушением когнитивных (умственных) функций с целью уменьшения этих нарушений [483, 484].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3).
- Рекомендуется, чтобы все пациенты с инсультом были обследованы на наличие афазии, дизартрии и апраксии речи [395, 399, 406, 447].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется проведение индивидуально подобранной речевой и языковой терапии пациентам после инсульта с нарушением функции речи (афазия, дизартрия, речевая апраксия) в соответствии с тяжестью и типом речевых нарушений для уменьшения выраженности речевых расстройств [412, 413, 464].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: В дополнение к обычной логопедической и лингвистической коррекции возможно проведение компьютер — основанной терапии, групповой речевой терапии, тренинга партнерского общения пациентам с афазией для улучшения речи и навыков общения.
- Рекомендуется пациентам с нарушением зрительно-пространственного гнозиса использование мультимодальной аудиовизуальной пространственной тренировки, включая технологии виртуальной реальности с целью улучшения обзора пространства [482].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2).
- Рекомендуется проведение пациентам с ИИ комплексной когнитивной реабилитации с целью регресса синдрома неглекта [417].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).Третий этап ( III ) медицинской реабилитации в амбулаторных условиях
- Рекомендуется пациентов самостоятельных в самообслуживании, перемещении и общении, в том числе с использованием технических средств реабилитации направлять для медицинской реабилитации в отделения медицинской реабилитации во внестационарных условиях [398, 402, 403, 434, 447].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 2).
- Рекомендуется включать комплексную оценку двигательных функций постинсультных пациентов в динамике, используя стандартизированные шкалы по оценки силы мышц (Medical Research Council), мышечного тонуса (Modified Ashworth Scale), баланса (Berg Balance Scale – BBS), походки (Dinamic gait index) [465, 470, 472].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 2).
- Рекомендуется использование телемедицинских технологий для обеспечения преемственного реабилитационного лечения после перехода пациентов с ИИ от стационарного этапа реабилитации к амбулаторному, особенно для пациентов, живущих в отдаленных районах, с целью расширения доступа к медицинскому обслуживанию и реабилитации [382, 395, 397, 426, 435, 436, 437].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: Телеконсультации становится общепринятой альтернативой связи лицом к лицу для людей с недостаточностью общения или ограниченных в перемещении. Несколько исследований показали осуществимость и эффективность телереабилитации, особенно для поддержания приобретенных в ходе предыдущих этапов лечения навыков по самообслуживанию, мобильности и речевому общению.
- Рекомендуется проведение инъекций ботулинического токсина типа A-гемагглютинин комплекс** пациентам с фокальной спастичностью мышц верхней конечности и/или нижней конечности ≥ 2 баллов по модифицированной шкале Эшворта с целью уменьшения спастичности, улучшения пассивной функции, самообслуживания и снижения болевого синдрома, связанного со спастичностью, начиная с раннего восстановительного периода после инсульта [446, 447, 450].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Комментарии: Эффективность ботулинотерапиии при постинсультной спастичности верхней конечности показана во многих клинических исследованиях с участием более 1500 пациентов после ИИ с высоким классом доказательности [446, 447].
Кроме того, в одном РКИ была показана эффективность применения иньекций ботулинического токсина типа A-гемагглютинин комплекс** в дозе 1000 ЕД в отношении восстановления активных движений в верхней конечности [450]. Эффективность применения ботулинического токсина типа A-гемагглютинин комплекс** при ранней постинсультной спастичности верхней и нижней конечности была продемонстрирована в рамках метаанализа по данным оценки 6 РКИ. В рамках метаанализа было отмечено статистически значимое снижение мышечного тонуса (р = 0,0002) и тенденция к снижению выраженности боли, ассоциированной со спастическим парезом (р = 0,13).
- Рекомендовано совместно с ботулинотерапией проведение физической реабилитации пациентам с постинсультной спастичностью мышц верхней конечности и/или нижней конечности ≥ 2 баллов по модифицированной шкале Эшворта с целью улучшения моторной функции (Приложение Г3) [395, 396, 450, 451].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: Период действия ботулинического токсина типа A-гемагглютинин комплекс** в течение 12 — 24 недель и снижение мышечного тонуса в течение этого времени, следует использовать в качестве «терапевтического окна» для восстановления моторной функции конечности на фоне применения методов физической реабилитации [450].
- Рекомендуется применять стратегии защиты суставов, такие как правильное позиционирование, поддержка при выполнении движений и регулярную гигиену кожных покровов руки на ранней стадии восстановления, чтобы предотвратить или свести к минимуму боль в плече и подвывих плечевого сустава [399, 403, 406, 445].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
- Рекомендуется высокочастотная чрезкожная электронейростимуляция (ЧЭНС) в качестве адъювантного метода в двигательной реабилитации пациентов с постинсультным парезом руки и давностью инсульта более 1 месяца, в позднем восстановительном периоде инсульта и в период остаточных явлений [460].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Под сенсорной (ЧЭНС) подразумевают электрическую стимуляцию периферического нерва сериями импульсов продолжительностью 0,125 — 1мс с частотой 80 — 100 Гц (высокочастотная ЧЭНС), которая вызывает сенсорный, но не двигательный ответ, либо с частотой 1 — 5 — 10 Гц (низкочастотная ЧЭНС), которая кроме сенсорного ответа вызывает сокращение мышцы. Используется в основном для снятия болевого синдрома. Согласно систематическому обзору Laufer и соавт. (2011), включившемуданные 15 исследований с участием в общей сложности более 400 пациентов, в большинстве работ показана эффективность метода в отношении хотя бы одного из оцениваемых показателей, однако размер эффекта невелик. Кроме того, значительно варьирует методология ЧЭНС в отношении локализации электродов, частоты и длительности импульсов, силы тока, длительности сеансов (от 20 мин до 2 ч), частоты сеансов (от 1 до 6 раз в неделю) и продолжительности курса терапии (от единичного сеанса до сеансов в течение 8 недель).
- Рекомендуется низкочастотная пассивная нейромышечная электростимуляция (НМЭС) или ЭМГ-НМЭС сгибателей и разгибателей запястья и пальцев в качестве адъювантного метода при цели реабилитации, связанной с восстановлением движений кисти и пальцев у пациентов с давностью инсульта менее 6 месяцев [460].
Уровень убедительности рекомендаций С (Уровень достоверности доказательств — 5).
Комментарии: Низкочастотная НМЭС, в отличие от сенсорной электронейростимуляции, способна вызвать моторный ответ, то есть мышечное сокращение. При этом стимуляция производится в низкочастотном диапазоне (10 — 50 Гц), а электроды накладываются над двигательными концевыми пластинками (областями высокой концентрации нервно-мышечных синапсов). Низкочастотная НМЭС может быть пассивной или вызываемой доступной сохранной мышечной активностью (зарегистрированной с помощью электромиографии, ЭМГ-НМЭС) или положением конечности в пространстве (регистрируется с помощью акселерометра). Последние две техники используются в том числе для предоставления обратной связи пациенту и увеличения его вовлеченности в процесс целенаправленных тренировок, когда возможно генерировать мышечное сокращение, но его сила не достаточна (функциональная НМЭС).
Согласно систематическому обзору, НМЭС в сочетании со стандартной двигательной реабилитацией эффективна в отношении увеличения объема активного движения и, в ряде случаев, мышечной силы. Низкочастотная пассивная НМЭС разгибателей запястья и пальцев также может применяться для временного снижения спастичности в качестве адъювантного метода [102].
- Рекомендуется в целях купирования гемиплегической боли в плече, после тщательного осмотра/оценки этиологических факторов применять по показаниям: глюкокортикоидные инъекции в плечевой и/или субакромиальный суставы, блокаду надлопаточного нерва, электростимуляцию мышц плеча, инъекции ботулинического токсина типа A-гемагглютинин комплекс** в подлопаточную и/или грудные мышцы, применение плечевых ортезов, системных противовоспалительных препаратов, массаж и щадящие мобилизационные техники для плечевых мышц, иглорефлексотерапию [399, 397, 403, 410, 458, 475].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3).
- Рекомендуются в качестве дополнения к комплексной терапии постинсультной спастичности применение электромагнитной стимуляции мышц (ЭМС) или вибрационного массажа спастичных мышц конечностей с целью временного уменьшения мышечного гипертонуса [452, 448].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3).
- Рекомендуется проведение оценки равновесия, когнитивных функций, социальных факторов и индивидуальной программы тренировки равновесия для пациентов, перенесших инсульт, с целью профилактики падений пациентов и обучения лиц, осуществляющих уход за ними [479, 481].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3).
- Рекомендуется применение гидротерапии в восстановительном периоде инсульта для пациентов, перенесших инсульт при отсутствии противопоказаний с целью улучшения функционального статуса пациента [485].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
- Рекомендуется использование музыкальной терапии пациентам, перенесшим инсульт, имеющим когнитивные и эмоционально-волевые нарушения для улучшения вербальной памяти и эмоциональной стабилизации пациентов [427].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2).
- Рекомендуется использовать роботизированные комплексы для восстановления функции кисти и пальцев рекомендованы пациентам с инсультом с нарушением мелкой моторики (кроме плегии) в любом реабилитационном периоде в дополнение к базовым методам физической реабилитации [462].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Роботизированные комплексы для восстановления функции кисти и пальцев получили широкое распространение и внедрение в практику сравнительно недавно, в связи с чем отмечается недостаток клинических исследований для подтверждения их эффективности.
- Рекомендуется применение терапии индуцированным ограничением для пациентов с давностью инсульта более 6 — 12 месяцев. Длительность ограничения движений интактной руки должна составлять 90% времени бодрствования с продолжительностью интенсивных тренировок 6 часов в день на протяжении 10 рабочих дней в течение 2 недель [459].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 1).
Комментарии: Данная схема CIMT является классической и наиболее изученной для пациентов в позднем реабилитационном периоде. В зависимости от состояния пациента c инсультом и возможностей учреждения могут быть рекомендованы и другие режимы дозирования ограничения движений интактной руки при давности инсульта более 6 — 12 месяцев: 60 — 72 часа в течение 2 недель; 20 — 56 часов в течение 2 недель; 30 часов в течение 3 недель; 15 — 30 часов в течение 10 недель. При этом, наиболее выраженный эффект в отношении способности держать, переносить и совершать другие манипуляции с предметами наблюдается при режиме дозирования от 60 до 72 часов в течение 2 недель.
- Рекомендуется пациентам с инсультом с нарушениями походки использование ортеза голеностопного сустава и фунциональной электростимуляции чтобы компенсировать свисание стопы и улучшить подвижность, паретическую кинематику лодыжки и колена, кинетику и энергозатраты при ходьбе [438, 470, 472].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
- Рекомендуется, чтобы компьютер-основанная терапия, CIMT терапия, групповая речевая терапия, тренинг партнерского общения, повторяющаяся транскраниальная магнитная стимуляция, локальная нейромиостимуляция использовались для пациентов после инсульта с афазией для улучшения речи и навыков общения в дополнение к обычной логопедической и лингвистической коррекции [469, 477, 464].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
- Рекомендуется рассмотреть возможность использования стратегий обучения компенсаторным когнитивным навыкам для улучшения внимания, памяти и управляющих функций, а также внутренних (например, стратегии кодирования и извлечения, обучение самоэффективности) и внешних (вспомогательные технологии, компьютеры, устройства подсказки, блокноты) компенсаторных стратегий для улучшения функций памяти после инсульта [464, 454].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Санаторно-курортное лечение, методы медицинской реабилитации, основанные на использовании природных лечебных факторов
- Рекомендуется применение морской воды (с минерализацией 35 — 37 г/л, высокой плотности (от 1020 до 1030 кг/м³) и слабощелочной pH (7,5) у пациентов, перенесших инсульт (Рэнкин 3). Лечение проводится на протяжении 2 недель, всего 10 сеансов (по 5 сеансов — каждую неделю). Продолжительность каждого сеанса составляет 45 минут. Сеансы проводятся под контролем физио(бальнео)терапевта в бассейне с морской водой глубиной не более 140 см. Температура воды должна составлять 32 °C, а температура окружающей среды — 24 °C [565].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: Согласно результатам квазиэкспериментального проспективного исследования [565], проведенного у 62 пациентов, перенесших инсульт, достоверно доказано, что двухнедельный интенсивный курс водной терапии и талассотерапии эффективен для уменьшения выраженности боли, улучшения функционального статуса и общего самочувствия пациентов. Программа лечения полностью проводится в бассейне, специально созданном для разработки техник водной терапии. Первоначально проводятся упражнения для адаптации пациента, а в заключительной части реализуются техники растяжения и расслабления на плаву.
- Рекомендуется форест-терапия у пациентов с давностью перенесенного инсульта более 1 года, страдающих постинсультной депрессией и тревогой, при наличии противопоказаний к приему антидепрессантов. Лечение проводится на протяжении 5 дней [566].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2).
Комментарии: Форест-терапия осуществляется в рекреационных зонах (в т.ч. на особо охраняемых природных территориях и природных объектах). Согласно результатам рандомизированного клинического и проспективного исследования [566], проведенного у 59 пациентов, перенесших инсульт, достоверно доказано уменьшение клинических проявлений постинсультной депрессии и тревоги после сеансов форест-терапии.
Госпитализация
Организация оказания медицинской помощи
- Рекомендуется при подозрении на ОНМК у пациента обращение за экстренной медицинской помощью через систему скорой медицинской помощи (СМП). Диспетчеры службы СМП должны рассматривать вызовы по поводу церебрального инсульта как приоритетные для максимального ускорения прибытия медицинского персонала к пациенту с ОНМК [491, 492, 493].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
Комментарии: По данным исследований обращение пациентов в службу СМП статистически значимо связано с ранним поступлением в отделение неотложной помощи (время с момента возникновения симптомов до момента поступления в медицинское учреждение ≤ 3 часов), быстрым проведением обследования (больше пациентов с временем с момента поступления до момента проведения визуализационного обследования ≤ 25 минут)), более быстрым началом лечения (введения лекарственных средств англ. door-to-needle, ≤ 60 минут).
- Рекомендуется для экстренной догоспитальной диагностики церебрального инсульта использование диспетчерами и персоналом выездных бригад СМП простых догоспитальных шкал инсульта, таких как «лицо – рука – речь – тест» (англ. Face Arm Speech Test, FAST) [582].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: Догоспитальные шкалы инсульта незначительно различаются по точности и в целом в полевых условиях не позволяют диагностировать до 30% ОНМК. Все перечисленные шкалы инсульта имеют высокую чувствительность в диапазоне от 74% до 97%. Специфичность коротких тестов, таких как FAST (13%) и CPSS (24 – 79%) ниже, чем у шкал, включающих большее количество субтестов, таких как LAPSS (85 – 97%), MASS (74 – 86%) и OPPS (86%), за исключением Med PACS (33%) и ROSIER (18%) [335]. Важно отметить, что существующие упрощенные шкалы инсульта для догоспитального этапа не чувствительны для выявления инсультов в заднем бассейне мозгового кровообращения. Несмотря на низкое качество доказательств, рекомендации присвоен уровень сильной, поскольку возможная выгода от выявления потенциальных жертв инсульта явно перевешивает любой возможный вред при минимальных затратах ресурсов.
- Рекомендуется медицинскому персоналу СМП уведомлять заранее принимающее медицинское учреждение о том, что ожидается прибытие пациента с подозрением на ОНМК, с целью быстрой мобилизации необходимых больничных ресурсов до прибытия пациента [502].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
Комментарии: Предварительное уведомление СМП связано с увеличением вероятности начала лечения алтеплазой** в течение 3 часов и меньшими показателями времени с момента поступления до момента проведения визуализационного обследования (26 минут в сравнении с 31 минутой), меньшими показателями времени DTN (78 минут в сравнении 80 минутами), и меньшими показателями времени с момента возникновения симптомов до момента начала введения лекарственных средств.
- Рекомендуется на региональном уровне (медицинская организация) обеспечение возможности маршрутизации пациента с церебральным инсультом в рамках двухуровневой системы помощи: (1) первичные учреждения, способные оказывать экстренную помощь, включая в/в введение алтеплазы**, (2) региональные центры, которые могут обмениваться диагностической информацией, проводить эндоваскулярную терапию ИИ и нейрохирургические вмешательства, включая все необходимые перипроцедурные действия и, в которые, в случае необходимости, может быть организована быстрая транспортировка пациентов из первичных учреждений [503, 504].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
- Рекомендуется пациентам с предварительным диагнозом «ОНМК» при давности появления первых симптомов, предположительно, не ранее 4 — 4,5 ч до момента обращения, обеспечение максимально быстрой транспортировки в ближайшее медицинское учреждение, где может быть проведено в/в введение алтеплазы** [505, 506].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
- Рекомендуется разработать алгоритмы сортировки и протоколы маршрутизации, направленные на обеспечение быстрой доставки пациентов с предварительным диагнозом «ОНМК» в стационар соответствующего уровня помощи [506, 507, 508, 509].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарий: Программы разрабатываются руководителями службы СМП, в сотрудничестве с органами местного, регионального и федерального уровня управления, а также при участии органов здравоохранения и местных экспертов.
- Рекомендуется специалистам в области организации здравоохранения и общественного здоровья разработать общественные образовательные программы, ориентированные на информирование населения о системе оказания медицинской помощи при церебральном ишемическом инсульте и необходимости быстрого обращения за экстренной медицинской помощью при начале заболевании. Эти программы должны быть направлены на информирование различных социально-демографические групп населения [510, 511, 583].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Комментарии: Информационные кампании для населения целесообразно проводить не реже чем 1 раз в 6 месяцев. РКИ, изучающие влияние информационных кампаний на интервал между появлением симптомов и обращением за медицинской помощью, не проводились. Только одно, Берлинское исследование острых инсультов [334], было кластерным РКИ с большим количеством методологических ограничений, другие исследования были наблюдательными. В большинстве исследований сообщалось о статистически значимом сокращении времени на догоспитальном этапе после информационной кампании. Данной рекомендации присвоен уровень убедительной, несмотря на очень низкое качество доказательств, потому что возможная выгода от раннего распознавания симптомов инсульта среди населения в целом и немедленного обращения за медицинской помощью явно перевешивает любой возможный вред.
- Рекомендуется при подозрении на ОНМК у пациента обращение за экстренной медицинской помощью через систему скорой медицинской помощи (СМП). Диспетчеры службы СМП должны рассматривать вызовы по поводу церебрального инсульта как приоритетные для максимального ускорения прибытия медицинского персонала к пациенту с ОНМК [491, 492, 493].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
Комментарии: По данным исследований обращение пациентов в службу СМП статистически значимо связано с ранним поступлением в отделение неотложной помощи (время с момента возникновения симптомов до момента поступления в медицинское учреждение ≤ 3 часов), быстрым проведением обследования (больше пациентов с временем с момента поступления до момента проведения визуализационного обследования ≤ 25 минут)), более быстрым началом лечения (введения лекарственных средств англ. door-to-needle, ≤ 60 минут).
- Рекомендуется проведение систематических образовательных программ по организации медицинской помощи, диагностике и лечения пациентов с церебральным инсультом для врачей, персонала больниц и службы СМП с целью повышения качества медицинской помощи [493].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Рекомендуется всем пациентам (при отсутствии сахарного диабета или заболеванием почек) при повышении уровня систолического АД более 140 мм рт. ст. и/или диастолического АД более 90 мм рт. ст. проведение регулярного скрининга АД и соответствующая терапия при артериальной гипертензии (модификация образа жизни и медикаментозная терапия) с целью снижения риска острых ишемических событий [12, 13, 59, 60, 193].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: Повышенное АД вносит наибольший самостоятельный вклад в популяционный сердечно-сосудистый риск, и контроль АД занимает центральное место в любой успешной стратегии снижения риска инсульта. Установлено, что при повышении диастолического АД на каждые 10 мм рт. ст. риск развития инсульта возрастает в 1,95 раза. Оптимальный уровень систолического АД — 140 мм рт. ст. и диастолического АД — 90 мм рт. ст. Для пациентов с АГ, сахарным диабетом или заболеванием почек целевые значения АД составляют < 130/80 мм рт. ст. Применение препаратов различных классов, включая диуретики, бета-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента (ИАПФ), блокаторы кальциевых каналов и антагонисты ангиотензина II, вызывает сходную редукцию риска инсульта и кардиальных событий.
- Рекомендуется профилактика и лечение сахарного диабета (СД), так как это заболевание независимо увеличивает риск ишемического инсульта в 1,8 — 6 раз. Коррекцию уровня глюкозы крови рекомендуется осуществлять изменением образа жизни и назначением индивидуальной фармакотерапии [13, 59, 60, 61, 487, 488].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: Нарушение толерантности к глюкозе также является независимым фактором риска инсульта. Однако нормализация уровня глюкозы крови, интенсивный гликемический контроль (целевой уровень гликированного гемоглобина < 7,0%) не приводит к дополнительному уменьшению риска инсульта, хотя и сопровождается уменьшением числа случаев инфаркта миокарда (ИМ) и смертельных исходов.
- Рекомендуется для уменьшения риска первого инсульта у взрослых пациентов с СД при гиперлипидемии применение ингибиторов ГМГ-КoA-редуктазы (статинов) или фибратов [12, 13, 14, 59, 60, 193].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: пациенты с сахарным диабетом (СД) характеризуются прогрессирующим течением атеросклероза и преобладанием проатерогенных факторов риска, прежде всего, таких, как АГ и нарушения липидного обмена.
- Рекомендуется коррекция уровня холестерина (ХС) (изменение образа жизни, гиполипидемические (гипохолестеринемические и гипотриглицеридемические) препараты). У пациентов с коронарной патологией рекомендуется отдавать предпочтение лечению ингибиторами ГМГ-КoA-редуктазы (статинами) [13, 59, 60, 61, 487, 488].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: доказана прямая связь между повышенным уровнем ХС и увеличением риска ишемического инсульта. Также выявлена обратная связь между значениями ХС липопротеинов высокой плотности и риском ишемического инсульта. Применение ингибиторов ГМГ-КoA-редуктазы (статинов) у лиц с коронарной патологией сопровождается снижением относительного риска ишемического инсульта на 19 — 32%. Польза применения гиполипидемической терапии с помощью других препаратов (фибратов, никотиновой кислоты и эзетимиба) для профилактики инсульта не доказана.
- Рекомендуется отказ от курения [13, 59, 60, 61, 487, 488].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется отказ от злоупотребления алкоголем [13, 59, 60, 61, 487, 488].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется рациональное питание при наличии заболеваний сердечно-сосудистой системы соблюдение диеты с ограничением поваренной соли и ненасыщенных жиров, обогащенной богатыми клетчаткой фруктами и овощами [13, 59, 60, 61, 487, 488].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется лицам, имеющим повышенный индекс массы тела, диета и повышение физической активности для снижения веса [13, 59, 60, 61, 487, 488].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется при малоподвижном образе жизни повышение физической активности, связанное с выполнение программ физических упражнений легкой интенсивности: здоровые взрослые всех возрастов должны тратить 2 — 2,5 часа в неделю на обычную физическую активность или аэробную тренировку умеренной интенсивности или 1,5 — 2 часа на более интенсивные физические упражнения [13, 59, 60, 61, 487, 488].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: Недостаточная физическая активность связана с повышенным риском общей смертности, сердечно-сосудистой смертности, сердечно-сосудистой заболеваемости и инсульта. По данным мировых исследований, риск инсульта или смерти среди физически активных мужчин и женщин в среднем на 25 — 30% ниже по сравнению с наименее активными людьми. Протективный эффект физических нагрузок может быть обусловлен снижением АД и благоприятным воздействием на другие факторы риска сердечно-сосудистых заболеваний, включая СД и избыточную массу тела.
Профилактика вторичная
Основные направления вторичной профилактики ишемического инсульта/ТИА направлены на коррекцию модифицируемых факторов риска и включают как нелекарственные методы (например, модификацию образа жизни), так и лекарственную терапию (антигипертензивные, антитромботические средства, гиполипидемическую терапию) и хирургические методы лечения.
- Рекомендуется раннее (не позднее 48 часов ОНМК) начало вторичной профилактики ТИА и ишемического инсульта [13, 59, 60, 61, 489, 490].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: у пациентов, перенесших ишемический инсульт или ТИА, риск развития повторных инсультов повышен почти в 10 раз и составляет около 25 — 30%. Риск повторного инсульта наиболее высок в первые несколько недель от его развития, повторной ТИА – в течение первых трех дней. В связи с этим вторичная профилактика должна быть начата как можно раньше: сразу после диагностики ТИА и не позднее 48 часов после развития ишемического инсульта. Индивидуализированная вторичная профилактика инсульта уменьшает риск развития повторного нарушения мозгового кровообращения на 20 — 30%.
Нелекарственные методы вторичной профилактики ишемического инсульта
- Рекомендуется отказ от курения [13, 59, 60, 61, 487, 488].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется отказ от злоупотребления алкоголем [13, 59, 60, 61, 487, 488].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется лицам, имеющим повышенный индекс массы тела, диета для снижения веса [13, 59, 60, 61, 487, 488].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется лечение расстройств дыхания во сне (сонные апноэ) при помощи чрезмасочной аппаратной СРАР–терапии (СИПАП-вентиляции), обеспечивающей поддержание постоянного положительного давления воздухоносных путей, что позволяет нормализовать ночное дыхание и улучшить дневное самочувствие пациентов с синдромом сонных апноэ [13, 59, 60, 61, 487, 488].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Лекарственные методы вторичной профилактики ишемического инсульта (См. разделы Лечение: антитромбоцитарная терапия и Лечение: антикоагулянтная терапия)
- Рекомендуются для снижения риска повторного ОНМК скрининг АД и соответствующая антигипертензивная терапия [13, 59, 60, 61, 489, 490].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Могут быть использованы различные классы антигипертензивных средств с учетом индивидуальных особенностей; рекомендуется включение в терапию диуретиков, комбинации диуретика и ингибитора ангиотензипревращающего фермента. Применение эпросартана, более эффективно во вторичной профилактике ИИ и ТИА, чем применение нитрендипина. Рекомендуются целевые значения АД < 130/80 мм рт. ст. для пациентов с АГ, сахарным диабетом или заболеванием почек [13, 59, 60, 61, 489, 490].
- Рекомендуется пациентам, перенесшим некардиоэмболический ишемический инсульт/ТИА, длительное проведение антитромбоцитарной терапии с целью вторичной профилактики ОНМК по ишемическому типу, а также других сосудистых событий. [13, 59, 60, 61, 487, 488, 516, 577]:
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: Выбор схемы антитромбоцитарной терапии индивидуален и зависит от профиля факторов риска пациента, особенностей клинической ситуации (наличие фоновых и сопутствующих заболеваний, включая сосудистую коморбидность), а также стоимости препаратов и приверженности пациента к лечению. При отсутствии специальных показаний у пациентов (например, ИБС/ОКС, операции коронарной реваскуляризации), требующих назначения ДАТТ, включающей ацетилсалициловую кислоту** в комбинации с различными ингибиторами P2Y12-рецепторов, обычно назначается:
— монотерапия ацетилсалициловой кислотой**# в дозе от 75 до 300 мг в сутки или клопидогрелом** в дозе 75 мг в сутки;
— ДАТТ ацетилсалициловой кислотой** в дозе 25 мг и дипиридамолом 200 мг с модифицированным высвобождением 2 раза в сутки.
Небольшое преимущество клопидогрела** над ацетилсалициловой кислотой** наиболее значимо у пациентов с сахарным диабетом, мультифокальным атеросклерозом.
Клопидогрел** в организме подвергается печеночному метаболизму, контролируемому цитохромом P450 (CYP) 3A4 с образованием активного компонента. Вещества, стимулирующие, подавляющие или выступающие в качестве субстрата для цитохрома P450, могут оказывать влияние на его эффективность. Эритромицин и олеандомицин, являясь ингибиторами цитохрома P450 (CYP) 3A4, подавляют антиагрегантные свойства клопидогрела**. Рифампицин** стимулирует P450 (CYP) 3A4 и усиливает эффективность препарата. Ингибиторы ГМГ-КoA-редуктазы (статины) метаболизируются в организме с помощью цитохрома P450 (CYP) 3A4 и оказывают влияние на действие клопидогрела**. Аторвастатин**, ловастатин и симвастатин** ослабляют эффект клопидогрела**. Правастатин и флувастатин, которые не подвергаются в организме метаболизму с помощью цитохрома P450 (CYP) 3A4, не оказывают влияние на действие клопидогрела**.
- Рекомендуется назначение варфарина** пациентам, перенесшим кардиоэмболический инсульт вследствие клапанной фибрилляции предсердий (механические клапаны сердца, митральный стеноз средней/тяжелой степени, биологические протезы в первые 6 месяцев после установки) с целью профилактики повторных ТИА/ИИ. Терапевтический диапазон МНО составляет 2,0 – 3,0. Назначение НОАК таким пациентам не показано. Целевые значения МНО у пациентов с механическими протезами клапанов сердца могут быть выше в зависимости от вида протеза, его позиции и наличия дополнительных факторов риска тромбоэмболических осложнений [13, 59, 60, 61, 487, 488, 579].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарий: У пациентов с фибрилляцией предсердий и механическим протезом клапанов сердца в митральной позиции целевые значения МНО при назначении варфарина** должны составлять 2,5 – 3,5. Для пациентов с ФП и с ревматическим поражением митрального клапана и/или механическими клапанными протезами, в настоящее время, единственным методом лечения с доказанной безопасностью является терапия антагонистами витамина К.
- Рекомендуется профилактика повторных ТИА/ИИ у пациентов с неклапанной фибрилляцией предсердий прямыми ингибиторами тромбина и прямыми ингибиторами фактора Xa, которые не уступают по эффективности варфарину**, но имеют более низкую частоту внутричерепных кровотечений. Применение прямых ингибиторов тромбина и прямых ингибиторов фактора Xa не требует, в отличие от варфарина**, регулярного контроля МНО [13, 59, 60, 61, 487, 488, 578, 579].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: Дабигатрана этексилат** назначается по 150 мг или 110 мг (при клиренсе креатинина 30 — 50 мл/мин) в сутки в два приема, в дозе 150 мг 2 раза в сутки дабигатрана этексилат** значительнее, чем варфарин**, снижает частоту повторного ИИ. Кроме того, дабигатрана этексилат** рекомендуется использовать для профилактики ТГВ и ТЭЛА в дозе 150 мг х 2 раза в день. Ривароксабан** рекомендуется применять по 20 мг или 15 мг (при клиренсе креатинина 30 — 50 мл/мин) один раз в сутки.
Кроме того, ривароксабан** может быть использован для профилактики и лечения ТГВ и ТЭЛА. Апиксабан** рекомендуется применять по 5 мг или 2,5 мг (при 2 и более из нижеперечисленных критериев: возраст 80 лет и старше, вес 60 кг и меньше, уровень креатинина 133 ммоль/л и больше) 2 раза в сутки. Если не показана антикоагулянтная терапия необходимо проводить терапию ингибиторами агрегации тромбоцитов
- Рекомендуется назначение гиполипидемической терапии с терапевтическим режимом, при котором достигается снижение уровня ХС ЛНП ≥ 50% по сравнению с исходным уровнем, а уровень ХС ЛНП ≤ 1,4 ммоль/л (<55 мг/дл) для пациентов, перенесших ТИА/ИИ, относящихся к категории очень высокого риска сердечно-сосудистых заболеваний и достижение целевого уровня холестерина липопротеидов низкой плотности — ХС ЛНП, как минимум < 1,4 ммоль/л (при оптимальных значениях ХС ЛНП ≤ 1,0 ммоль/л) для пациентов экстремального риска с целью уменьшения риска острых ишемических событий и прогрессирования атеросклеротического процесса [13, 59, 60, 61, 487, 488, 572 — 575, 580].
Убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: Пациентов относят к категории «очень высокого риска сердечно-сосудистых заболеваний» при наличии документированного перенесённого одного из сердечно-сосудистых заболеваний: ИИ/ТИА, острый коронарный синдром, стабильная стенокардия, поражения периферических артерий, а также чрескожное коронарное вмешательство, коронарное шунтирование или другие операции на артериях. по данным обследований – значимая АСБ по данным КАГ/КТ/ УЗДС (стеноз ≥ 50% в двух коронарных артериях; стеноз сонной артерии >50%). К экстремальному риску следует отнести: сочетание клинически значимого сердечно-сосудистого заболевания, вызванного атеросклерозом с СД 2 типа и/или с семейной гиперхолестеринемией; сердечно-сосудистое осложнения у пациента с атеросклеротическим сердечно-сосудистым заболеванием, несмотря на оптимальную гиполипидемическую терапию и/или достигнутый уровень ХС ЛНП ≤ 1,4 ммоль/л; два или более сердечно-сосудистых осложнения в течение 2 лет, несмотря на оптимальную гиполипидемическую терапию и/или достигнутый уровень ХС ЛНП ≤ 1,4 ммоль/л. У пациентов с экстремальным риском представляется оптимальным достижение более низкого целевого уровня ХС ЛНП ≤ 1,0 ммоль/л. для целей вторичной профилактики ИИ/ТИА, однако, в настоящее время убедительная доказательная база подобного снижения ХС ЛНП отсутствует, что не позволяет рекомендовать его в качестве обязательного [576]. Пациентам экстремального и очень высокого риска рекомендуется поддержание здорового образа жизни и одновременное назначение липидснижающей терапии [576]. До начала гиполипидемической терапии важно уточнить причину дислипидемии.
Гиполипидемические средства включают ингибиторы ГМГ-КoA-редуктазы (статины), ингибиторы всасывания ХС в кишечнике, ингибиторы PCSK9 (пропротеиновая конвертаза субтилизин-кексинового типа 9), фибраты, препараты, содержащие n-3 полиненасыщенные жирные кислоты. Схема лечения, при которой достигается снижение уровня ХС ЛНП ≥ 50% по сравнению с исходным уровнем, а целевой уровень ХС ЛНП ≤ 1,4 ммоль/л (< 55 мг/дл), как правило, включает интенсивную монотерапию статинами.
Суточная доза статинов при интенсивной терапии для снижения ХС ЛНП ≥ 50% составляет для аторвастатина, 40 – 80 мг, для розувастатина, 20 – 40 мг [572, 573, 574, 575]. Терапия статинами должна быть назначена не позднее первых трех дней от эпизода ИИ. Ответ пациента на терапию статинами рекомендуется оценивать через 6-8 недель после начала приема/изменении дозы препарата. Если целевой уровень ХС-ЛНП в соответствии с категорией риска при монотерапии статинами не достигнут, следует рассмотреть возможность комбинированной терапии.
- Рекомендуется регулярно контролировать уровень глюкозы с достижением уровня глюкозы, близкого к нормальному (5,6 ммоль/л). Коррекцию гликемии рекомендуется сочетать с гипоуглеводной диетой и повышением физической активности, назначением индивидуальной фармакотерапии [13, 59, 60, 61, 487, 488, 581].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2).
Хирургические методы вторичной профилактики ишемического инсульта
- Рекомендуется операция каротидная эндартерэктомия пациентам с гемодинамически значимыми стенозами сонных артерий 70 — 99% на базе центров с показателями периоперационных осложнений менее 6% [13, 59, 60, 61, 487, 488].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5).
Комментарии: рекомендуется каротидная эндартерэктомия симптомной артерии в течение 6 месяцев от момента ОНМК (при стенозе 70 — 99% диаметра ВСА гомолатеральному инфаркту или ТИА). Рекомендуется как можно более раннее выполнение операций каротидная эндартерэктомия после ишемического события, в идеале – в течение первых двух недель. Каротидная эндартерэктомия симптомной артерии может быть проведена при умеренной степени (50 — 69% диаметра) стеноза ВСА при отсутствии выраженных сочетанных заболеваний, наличии дополнительных факторов риска, например, у мужчин [13, 59, 60, 61, 487, 488].
- Рекомендуется эндоваскулярное закрытие овального окна у пациентов с криптогенным инсультом [13, 59, 60, 61, 487, 488].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Информация
Источники и литература
-
Клинические рекомендации Всероссийского общества неврологов
- 1. Easton JD, Saver JL, Albers GW, Alberts MJ, Chaturvedi S, Feldmann E, Hatsukami
TS, Higashida RT, Johnston SC, Kidwell CS, Lutsep HL, Miller E, Sacco RL. Definition and
evaluation of transient ischemic attack: a scientific statement for healthcare professionals from
the American Heart Association/American Stroke Association Stroke Council; Council on
Cardiovascular Surgery and Anesthesia; Council on Cardiovascular Radiology and Intervention;
Council on Cardiovascular Nursing; and the Interdisciplinary Council on Peripheral Vascular
Disease. Stroke. 2009;40:2276–2293.
2. Sacco RL, Kasner SE, Broderick JP, Caplan LR, Connors JJ, Culebras A, Elkind MS,
George MG, Hamdan AD, Higashida RT, Hoh BL, Janis LS, Kase CS, Kleindorfer DO, Lee JM,
Moseley ME, Peterson ED, Turan TN, Valderrama AL, Vinters HV; on behalf of the American
Heart Association Stroke Council, Council on Cardiovascular Surgery and Anesthesia, Council
on Cardiovascular Radiology and Intervention, Council on Cardiovascular and Stroke Nursing,
Council on Epidemiology and Prevention, Council on Peripheral Vascular Disease, and Council
on Nutrition, Physical Activity and Metabolism. An updated definition of stroke for the 21st
century: a statement for healthcare professionals from the American Heart Association/American
Stroke Association. Stroke. 2013;44:2064–2089.
3. Dohmen C. Identification and clinical impact of impaired cerebrovascular
autoregulation in patients with malignant middle cerebral artery infarction. Stroke 2007; 38: 56-
61.
4. Hacke W. Malignant’ middle cerebral artery territory infarction: clinical course and
prognostic signs. Arch. Neurol 1996; 53:309-315.
5. Верещагин Н.В., Пирадов М.А. Интенсивная терапия острых нарушений
мозгового кровообращения // Медицинская газета. — 1999. — № 43. – C.2-3.
6. Andoh T, Sakai N, Yamada H, Hattori T, Miwa Y, Hirata T, Tanabe Y, Ohkuma A,
Funakoshi T, Takada M. Cerebellar infarction: analysis of 33 cases. // Stroke. – 1987. – Vol.
18(5). – P. 849-855.
7. Koh M, Phan T, Atkinson J, Wijdicks E. Neuroimaging in deteriorating patients with
cerebellar infarcts and mass effect // Stroke. – 2000. – Vol.31. – P. 2062-2067.
8. Sypert G, Alvord E. Cerebellar infarction. A clinicopathological study //. Acta
Neurochir (Wien). – 1984. – Vol. 71(3). – P. 295-306. 9. E. Bandera, M. Botteri, Cerebral Blood Flow Threshold of Ischemic Penumbra and
Infarct Core in Acute Ischemic Stroke. A Systematic Review. Stroke. 2006;37:1334-1339.
10. Smith, Wade S.; Johnston, S. Claiborne; Hemphill, III, J. Claude (2019).
«Cerebrovascular Diseases». In Jameson, J. Larry; Fauci, Anthony S.; Kasper, Dennis L.; Hauser,
Stephen L.; Longo, Dan L.; Loscalzo, Joseph (eds.). Harrison’s Principles of Internal Medicine
(20th ed.)
11. Гусев Е.И., Скворцова В.И. Ишемия головного мозга, М.: Медицина, 2001. —
328 с.
12. Zhang XH, Liang HM. Systematic review with network meta-analysis: Diagnostic
values of ultrasonography, computed tomography, and magnetic resonance imaging in patients
with ischemic stroke. Medicine (Baltimore). 2019 Jul;98(30):e16360. doi:
10.1097/MD.0000000000016360. PMID: 31348236; PMCID: PMC6709059.
13. Provost C, Soudant M, Legrand L, Ben Hassen W, Xie Y, Soize S, Bourcier R,
Benzakoun J, Edjlali M, Boulouis G, Raoult H, Guillemin F, Naggara O, Bracard S, Oppenheim
C. Magnetic Resonance Imaging or Computed Tomography Before Treatment in Acute Ischemic
Stroke. Stroke. 2019 Mar;50(3):659-664. doi: 10.1161/STROKEAHA.118.023882. PMID:
30744542.
14. Hacke W, Donnan G, Fieschi C, Kaste M, von Kummer R, Broderick JP, Brott T,
Frankel M, Grotta JC, Haley EC Jr, Kwiatkowski T, Levine SR, Lewandowski C, Lu M, Lyden
P, Marler JR, Patel S, Tilley BC, Albers G, Bluhmki E, Wilhelm M, Hamilton S; ATLANTIS
Trials Investigators; ECASS Trials Investigators; NINDS rt-PA Study Group Investigators.
Association of outcome with early stroke treatment: pooled analysis of ATLANTIS, ECASS, and
NINDS rt-PA stroke trials. Lancet. 2004 Mar 6;363(9411):768-74. doi: 10.1016/S0140-
6736(04)15692-4. PMID: 15016487.
15. Evolving Paradigms in Neuroimaging of the Ischemic Penumbra Chelsea S. Kidwell,
MD; Jeffry R. Alger, PhD; Jeffrey L. Saver, MD, Stroke.2004;35[suppl I]:2662-2665.
16. H.S. Markus Cerebral perfusion and stroke. J Neurol Neurosurg Psychiatry
2004;75:353–361.
17. Liebeskind DS, Jüttler E, Shapovalov Y, Yegin A, Landen J, Jauch EC Cerebral
Edema Associated With Large Hemispheric Infarction. Stroke. 2019;50(9):2619. Epub 2019 Aug
20.
18. Крылов В.В., Никитин А.С., Дашьян В.Г., Буров С.А., Петриков С.С., Асратян
С.А. Хирургия массивного ишемического инсульта. – М.: ГЭОТАР-Медиа, 2016. 19. Wijdicks E., Diringer M. Middle cerebral artery territory infarction and early brain
swelling: progression and effect of age on outcome. Mayo Clin. Proc 1998;.73(9): 829-836.
20. Schwab S, Aschoff A, Spranger M, Albert F, Hacke W The value of intracranial
pressure monitoring in acute hemispheric stroke. Neurology. 1996;47(2):393.;
21. Никитин А.С., Крылов В.В., Буров С.А., Петриков С.С., Асратян С.А.,
Камчатнов П.Р., Кемеж Ю.В., Белков М.В., Завалишин Е.Е. Дислокационный синдром у
больных со злокачественным течением массивного ишемического инсульта. Журнал
неврологии и психиатрии имени С.С.Корсакова 2015; 3 Спецвыпуск «Инсульт»: 20-26.
22. Qureshi A.I., Suarez J., Yahia A.M. et al. Timing of neurological deterioration in
massive middle cerebral artery infarction: a multicenter review. Crit. Care Med 2003; 31: 272-
277.
23. Saposnik G, Barinagarrementeria F, Brown RD Jr, Bushnell CD, Cucchiara B,
Cushman M, deVeber G, Ferro JM, Tsai FY Diagnosis and management of cerebral venous
thrombosis: a statement for healthcare professionals from the American Heart
Association/American Stroke Association. Stroke. 2011;42(4):1158. Epub 2011 Feb 3.
24. Ferro JM, Correia M, Pontes C, Baptista MV, Pita F Cerebral vein and dural sinus
thrombosis in Portugal: 1980-1998. Cerebrovasc Dis. 2001;11(3):177.
25. Coutinho JM, Zuurbier SM, Aramideh M, Stam J The incidence of cerebral venous
thrombosis: a cross-sectional study. Stroke. 2012 Dec;43(12):3375-7. Epub 2012 Sep 20.
26. Coutinho JM, Ferro JM, Canhão P, Barinagarrementeria F, CantúC, Bousser MG,
Stam J Cerebral venous and sinus thrombosis in women. Stroke. 2009;40(7):2356. Epub 2009
May 28.
27. Stam J Thrombosis of the cerebral veins and sinuses. N Engl J Med.
2005;352(17):1791.
28. Gotoh M, Ohmoto T, Kuyama H Experimental study of venous circulatory
disturbance by dural sinus occlusion. ActaNeurochir (Wien). 1993;124(2-4):120.
29. Медико-демографические показатели Российской Федерации в 2012 году` 2013:
Стат. справочник/Минздрав России. – М., 2013. – 180 c.
30. Стаховская Л.В., Клочихина О.А., Богатырева М.Д., Чугунова С.А. Анализ
эпидемиологических показателей повторных инсультов в регионах Российской Федерации
(по итогам территориально-популяционного регистра 2009–2014 гг.). Consilium Medicum.
2016; 18 (9): 8–11. 31. Стаховская Л.В., Ключихина О.А., Богатырева М.Д., Коваленко В.В.
Эпидемиология инсульта в России по результатам территориально-популяционного
регистра (2009-2010). Журнал неврологии и психиатрии, 2013, №5, с. 4-10.
32. Petty G.W., Brown R.D. et al. Ischemic Stroke Subtypes A Population-Based Study of
Functional Outcome, Survival, and Recurrence. Stroke. 2000;31:1062.
33. Никитин А.С., Асратян С.А., Смирнов Д.С., Кемеж Ю.В., Урванцева О.М.
Распространенность массивного ишемического инсульта в отдельном региональном
сосудистом центре. Неврологический журнал. 2017. Т. 22. № 1. С. 33-36.
34. Putaala J, Metso AJ, Metso TM, Konkola N, Kraemer Y, Haapaniemi E, Kaste M,
Tatlisumak T Analysis of 1008 consecutive patients aged 15 to 49 with first-ever ischemic stroke:
the Helsinki young stroke registry. Stroke. 2009;40(4):1195. Epub 2009 Feb 26.
35. Kristensen B, Malm J, Carlberg B, Stegmayr B, Backman C, Fagerlund M, Olsson T
Epidemiology and etiology of ischemic stroke in young adults aged 18 to 44 years in northern
Sweden. Stroke. 1997;28(9):1702.
36. Leys D, Bandu L, Hénon H, Lucas C, Mounier-Vehier F, Rondepierre P, Godefroy O
Clinical outcome in 287 consecutive young adults (15 to 45 years) with ischemic stroke.
Neurology. 2002;59(1):26.
37. Ji R, Schwamm LH, Pervez MA, Singhal AB Ischemic stroke and transient ischemic
attack in young adults: risk factors, diagnostic yield, neuroimaging, and thrombolysis. JAMA
Neurol. 2013 Jan;70(1):51-7.
38. Petitti DB, Sidney S, Quesenberry CP Jr, Bernstein A. Incidence of stroke and
myocardial infarction in women of reproductive age. Stroke 1997; 28:280.
39. James AH, Bushnell CD, Jamison MG, Myers ER. Incidence and risk factors for
stroke in pregnancy and the puerperium. Obstet Gynecol 2005; 106:509.
40. Davie CA, O’Brien P. Stroke and pregnancy. J Neurol Neurosurg Psychiatry 2008;
79:240.
41. Lanska DJ, Kryscio RJ. Risk factors for peripartum and postpartum stroke and
intracranial venous thrombosis. Stroke 2000; 31:1274.
42. Miller EC, Gallo M, Kulick ER, et al. Infections and Risk of Peripartum Stroke
During Delivery Admissions. Stroke 2018; 49:1129.
43. Ackerson T, Adeoye OM, Brown M, et al. AHA / ASA Guideline 2018
Guidelines for the Early Management of Patients With Acute Ischemic Stroke.; 2018.
doi:10.1161/STR.0000000000000158. 44. Wabnitz A, Bushnell C. Migraine, cardiovascular disease, and stroke during
pregnancy: systematic review of the literature. Cephalalgia 2015; 35:132.
45. Adams H, Bendixen B, Kappelle J et al. Classification of subtype of acute ischemic
stroke. Definitions for use in a multicenter clinical trial. Stroke 1993; 24; 1:35-40.
46. Robert G. Hart, Luciana Catanese, Kanjana S. Perera, George Ntaios, Stuart J.
Connolly. Embolic Stroke of Undetermined Source A Systematic Review and Clinical Update.
Stroke. 2017;48:867-872.
47. Amarenco P., Kase C., Rosengart A. et al. Very small (border zone) cerebellar
infarcts, distribution, causes, mechanisms and clinical features // Brain. — 1993. — Vol. 116. —
N. 1. — P. 161–186.
48. Bussaka H., Sakamoto Y., Hatanaka Y. et al. Cerebellar infarction; the fi ndings of
CT, MRI and cerebral angiography // Rinsho Hoshasen. — 1990. — Vol. 35. — N. 4. — P. 445–
451.
49. Milandre L., Brosset C., Gouirand R., Khalil R. Pure cerebellar infarction. Thirty
cases. Presse Med. 1992 Oct 10;21(33):1562-5.
50. Kase C., Norrving B., Levine S. et al. Cerebellar infarction. Clinical and anatomic
observation in 66 cases // Stroke. — 1993. — Vol. 24. — P. 76–83.
51. Lee H., Sohn S., Jung D. et al. Sudden deafness and anterior inferior cerebellar artery
infarction // Stroke. — 2002. — Vol. 33. — P. 2807–2812.
52. Hornig C., Rust D., Busse O. et al. Space-occupying cerebellar infarction. Clinical
course and prognosis // Stroke. — 1994. — Vol. 25. — N. 2. — P. 372–374
53. Czernicki T., Marchel A. Results of treatment of cerebellar infarctions // Neurol
Neurochir Pol. — 2004. — Vol. 38. — N. 1. — P. 37–43.
54. Greenberg J., Skubick D., Shenkin H. Acute hydrocephalus in cerebellar infarct and
hemorrhage // Neurology. — 1979. — Vol. 29. — P. 409–413.
55. Khan M., Polyzoidis K., Adegbite A., McQueen J. Massive cerebellar infarction:
conservative management // Stroke. — 1983. — Vol. 14. — P. 745–751.
56. Cuneo R., Caronna J., Pitts L. et al. Upward transtentorial herniation: seven cases and
a literature review // Arch Neurol. — 1979. — Vol. 36. — N. 10. — P. 618–623.
57. Yamazaki M., Hashimoto T., Haruta S., Yanagisawa N. A case of transtentorial
upward herniation due to cerebellar infarction manifesting upward gaze palsy as an initial sign //
No To Shinkei. — 1993. — Vol. 45. — N. 2. — P. 183–187.
- 1. Easton JD, Saver JL, Albers GW, Alberts MJ, Chaturvedi S, Feldmann E, Hatsukami
Информация
Список сокращений
АВК – антагонисты витамина К
АГ – артериальная гипертония
АД – артериальное давление
АЧТВ – активированное частичное тромбопластиновое время
БИТР – блок интенсивной терапии и реанимации
ВВ ТЛТ – внутривенная тромболитическая терапия
ВСА – внутренняя сонная артерия
ВТЭО – венозные тромбоэмболические осложнения
ВЧГ – внутричерепная гипертензия
ВЧД – внутричерепное давление
ГМ — головной мозг
ДВИ – диффузионно-взвешенное изображение
ДКТ — декомпрессивная краниотомия
ДС — дислокационный синдром
ЗМА — задняя мозговая артерия
ЗЧЯ – задняя черепная ямка
ИАПФ – ингибиторы ангиотензинпревращающего фермента
ИВЛ — искусственная вентиляция легких
ИИ — ишемический инсульт
ИМ – инфаркт миокарда
ИМТ – индекс массы тела
КТ – компьютерная томография
КТА – компьютерно-томографическая ангиография
МК — мозговой кровоток
МНО – международное нормализованное отношение
МОД – минутный объем дыхания
МРА – магнитно-резонансная ангиография
МРТ – магнитно-резонансная томография
ОКС – острый коронарный синдром
ОНМК – острое нарушение мозгового кровообращения
ООГ – острая окклюзионная гидроцефалия
ПВИ – перфузионно-взвешенное изображение
ПКН — постинсультные когнитивные нарушения
ПИД — постинсультная деменция
ПМА — передняя мозговая артерия
ПСО – первичное сосудистое отделение
РСЦ – региональный сосудистый центр
сВМК — симптомное внутримозговое кровоизлияние
СД – сахарный диабет
СМА – средняя мозговая артерия
СМП – скорая медицинская помощь
СЧЯ — средняя черепная ямка
ТА — тромбаспирация
ТГВ – тромбоз глубоких вен
ТИА – транзиторная ишемическая атака
ТЛТ – тромболитическая терапия
ТМО — твердая мозговая оболочка
ТЭ — тромбэмболэктомия
ТЭЛА – тромбоэмболия легочной артерии
ФП – фибрилляция предсердий
ХС – холестерин
ЦПД – центральное перфузионное давление
ЭКГ – электрокардиография
ЭЭГ — электроэнцефалография
rtPA – рекомбинантный тканевой активатор плазминогена
Термины и определения
Базисная терапия — это комплекс мероприятий, направленных на нормализацию жизненно важных функций – дыхания, кровообращения, борьбу с отеком мозга, купирование эпилептических приступов и вегетативных нарушений, коррекцию гипергликемии и гипертермии, профилактику тромбоэмболических и инфекционных осложнений.
Геморрагическая трансформация — формирование в зоне инфаркта головного мозга внутримозговой гематомы с масс-эффектом или множественных гематом с масс-эффектом (с общим объемом не менее 20 см3).
Декомпрессивная краниотомия – это операция, при которой резецируют обширный участок костей свода черепа. В случае злокачественного инсульта в бассейне СМА резекцию костей черепа проводят в лобно-височно-теменной области. Эту операцию выполняют при отеке головного мозга, при котором необходимо экстренно устранить жизнеугрожающую дислокацию головного мозга.
Декомпрессивная краниотомия задней черепной ямки – операцию выполняют при отеке мозжечка, при котором необходимо экстренно устранить жизнеугрожающую компрессию ствола головного мозга.
Дифференцированная терапия проводится в соответствии с патогенетическим вариантом острого ишемического инсульта, локализацией и объемом очага поражения головного мозга и включает реперфузию (медикаментозную и/или с помощью интервенционной реваскуляризации), нейропротекцию и вторичную профилактику церебрального инсульта.
Доказательная медицина – подход к медицинской практике, при котором решения о применении профилактических, диагностических и лечебных мероприятий принимаются исходя из имеющихся доказательств их эффективности и безопасности, а такие доказательства подвергаются поиску, сравнению, обобщению и широкому распространению для использования в интересах пациентов.
Злокачественный ишемический инсульт — инфаркт головного мозга, при котором происходит отек инфарктной зоны, что ведет к дислокации структур головного мозга с риском сдавления ствола головного мозга. Злокачественное течение характерно для обширных (массивных) форм ишемического инсульта.
Острая окклюзионная гидроцефалия — острое нарушение оттока ликвора по желудочковой системе головного мозга. Возникает при закупорке или сдавлении ликворопроводящих путей, приводит к острому расширению желудочков головного мозга и повреждению ствола мозга.
Рабочая группа – двое или более людей одинаковых или различных профессий, работающих совместно и согласованно в целях создания клинических рекомендаций, и несущих общую ответственность за результаты данной работы.
Уровень достоверности доказательств – отражает степень уверенности в том, что найденный эффект от применения медицинского вмешательства является истинным.
Уровень убедительности рекомендаций – отражает не только степень уверенности в достоверности эффекта вмешательства, но и степень уверенности в том, что следование рекомендациям принесет больше пользы, чем вреда в конкретной ситуации.
Критерии оценки качества медицинской помощи
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
1. Акжигитов Ренат Гайясович, к.м.н., заместитель директора ГБУЗ «Научно-практический психоневрологический центр имени З.П. Соловьева» Департамента здравоохранения города Москвы.
2. Алекян Баград Гегамович, д.м.н., академик РАН, главный специалист Минздрава России по рентгенэндоваскулярной диагностике и лечению, профессор кафедры сердечно-сосудистой хирургии ФГАОУ ВО «Первый Московский государственный медицинский университет имени И.М. Сеченова» Министерства здравоохранения Российской Федерации, член президиума Национальной ассоциации по борьбе с инсультом.
3. Алферова Вера Вадимовна, д.м.н., ведущий научный сотрудник кафедры неврологии, нейрохирургии и медицинской генетики ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Министерства здравоохранения Российской Федерации, член президиума Всероссийского общества неврологов.
4. Белкин Андрей Августович, д.м.н., профессор, главный внештатный невролог г. Екатеринбурга, главный внештатный специалист по медицинской реабилитации Уральского федерального округа Министерства здравоохранения Российской Федерации, председатель Наблюдательного Совета АНО «Клинический Институт Мозга», член правления МОО «Объединение нейроанестезиологов и нейрореаниматологов», руководитель комитета клинических рекомендаций Общероссийской общественной организации содействия развитию медицинской реабилитологии «Союз реабилитологов России».
5. Беляева Ирина Анатольевна, д.м.н., профессор кафедры неврологии, нейрохирургии и медицинской генетики ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Министерства здравоохранения Российской Федерации.
6. Бойцов Сергей Анатольевич, д.м.н., профессор, член-корреспондент РАН, генеральный директор ФГБУ «Национальный медицинский исследовательский центр кардиологии» Министерства здравоохранения Российской Федерации, главный специалист по профилактической медицине Министерства здравоохранения Российской Федерации, член президиума Российского общества неврологов, вице-президент Российского кардиологического общества.
7. Вознюк Игорь Алексеевич, д.м.н., профессор кафедры и клиники нервных болезней им. М.И. Аствацатурова ФГБВОУ ВО «Военно-медицинская академия им. С. М. Кирова» Министерства обороны Российской Федерации, руководитель отдела острой цереброваскулярной патологии и неотложной неврологии ГБУ «Санкт-Петербургский научно-исследовательский институт им. И.И. Джанелидзе», член правления Всероссийского общества неврологов, член правления Национальной ассоциации по борьбе с инсультом.
8. Виноградов Олег Иванович, д.м.н., заведующий кафедрой неврологии с курсом нейрохирургии ФГБУ «Национальный медико-хирургический Центр имени Н.И. Пирогова» Министерства здравоохранения Российской Федерации, член Всемирной организации инсульта.
9. Герасименко Марина Юрьевна, д.м.н., профессор, главный внештатный специалист по санаторно-курортному лечению Министерства здравоохранения Российской Федерации, директор ФГБУ «Национальный медицинский исследовательский центр реабилитации и курортологии» Министерства здравоохранения Российской Федерации.
10. Гераскина Людмила Александровна — д.м.н., ведущий научный сотрудник 2-го неврологического отделения ФГБНУ «Научный центр неврологии».
11. Гехт Алла Борисовна, д.м.н., профессор, директор ГБУЗ «Научно-практический психоневрологический центр имени З.П. Соловьева» Департамента здравоохранения города Москвы, профессор кафедры неврологии, нейрохирургии и медицинской генетики ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Министерства здравоохранения Российской Федерации, член президиума Национальной ассоциации по борьбе с инсультом, ученый секретарь Всероссийского общества неврологов.
12. Гусев Евгений Иванович, д.м.н., академик РАН, заведующий кафедрой неврологии, нейрохирургии и медицинской генетики ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Министерства здравоохранения Российской Федерации, президент Национальной Ассоциации по борьбе с инсультом, президент Всероссийского общества неврологов.
13. Дашьян Владимир Григорьевич, д.м.н., профессор кафедры нейрохирургии и нейрореанимации ФГБОУ ВО «Московский государственный медико-стоматологический университет имени А.И. Евдокимова», член Ассоциации нейрохирургов России.
14. Джинджихадзе Реваз Семенович, к.м.н., руководитель отделения нейрохирургии ФУВ ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М. Ф. Владимирского», член Ассоциации нейрохирургов России
15. Древаль Олег Николаевич, д.м.н., профессор, заведующий кафедрой нейрохирургии ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации, член Ассоциации нейрохирургов России
16. Иванова Галина Евгеньевна, д.м.н., профессор, главный специалист по медицинской реабилитации Министерства здравоохранения Российской Федерацией, зав. кафедрой медицинской реабилитации ФДПО ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Министерства здравоохранения Российской Федерации, председатель президиума Общероссийской общественной организации содействия развитию медицинской реабилитологии «Союз реабилитологов России», член ревизионной комиссии Национальной ассоциации по борьбе с инсультом
17. Кольцов Иван Алексеевич – научный сотрудник НИЛ сосудистых заболеваний головного мозга ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Министерства здравоохранения Российской Федерации
18. Коновалов Александр Николаевич, д.м.н., академик РАН, профессор кафедры неврологии, нейрохирургии и медицинской генетики ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Министерства здравоохранения Российской Федерации, член правления Национальной ассоциации по борьбе с инсультом, президент ассоциации нейрохирургов России.
19. Крылов Владимир Викторович, д.м.н., академик РАН, главный внештатный специалист по нейрохирургии Министерства здравоохранения Российской Федерации, директор клинического медицинского центра Московского государственного медико-стоматологического университета имени А.И. Евдокимова.
20. Котов Сергей Викторович, д.м.н., профессор, заведующий кафедрой неврологии ФУВ ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М. Ф. Владимирского», председатель общества неврологов Московской области, член правления Национальной ассоциации по борьбе с инсультом.
21. Кочетов Анатолий Глебович, д.м.н., профессор, президент Ассоциации специалистов и организаций лабораторной службы «Федерация лабораторной медицины».
22. Лебедева Анна Валерьяновна, д.м.н., профессор кафедры неврологии, нейрохирургии и медицинской генетики ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Министерства здравоохранения Российской Федерации, член президиума Всероссийского общества неврологов, член Российской противоэпилептической лиги.
23. Лянг Ольга Викторовна, к.б.н., секретарь профильной экспертной комиссии Министерства здравоохранения Российской Федерации по клинической лабораторной диагностике, доцент кафедры госпитальной терапии с курсом клинической лабораторной диагностики ФГАОУ ВПО «Российский университет дружбы народов» Министерства здравоохранения Российской Федерации.
24. Мартынов Михаил Юрьевич, д.м.н., член-корреспондент РАН, главный внештатный специалист по неврологии Министерства здравоохранения Российской Федерации, профессор кафедры неврологии, нейрохирургии и медицинской генетики ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Министерства здравоохранения Российской Федерации, учёный секретарь Всероссийского общества неврологов, член правления Национальной ассоциации по борьбе с инсультом.
25. Мельникова Елена Валентиновна, д.м.н., главный внештатный специалист Министерства здравоохранения Российской федерации по медицинской реабилитации в Северо-Западном федеральном округе, профессор кафедры неврологии и нейрохирургии ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. И.П. Павлова» Министерства здравоохранения Российской Федерации, член правления Национальной ассоциации по борьбе с инсультом
26. Мусин Рашит Сяитович, д.м.н., профессор кафедры нервных болезней лечебного факультета ФГБОУ ВО «Московский государственный медико-стоматологический университет имени А.И. Евдокимова» Министерства здравоохранения Российской Федерации.
27. Никитин Андрей Сергеевич, к.м.н., доцент кафедры нейрохирургии и нейрореанимации ФГБОУ ВО «Московский государственный медико-стоматологический университет имени А.И. Евдокимова» Министерства здравоохранения Российской Федерации, член Ассоциации нейрохирургов России
8. Одинак Мирослав Михайлович, д.м.н., член-корреспондент РАН, профессор кафедры ФГБВОУ ВПО «Военно-медицинская академия им. С. М. Кирова» Министерства обороны Российской Федерации.
29. Павлов Николай Александрович, к.м.н., ведущий научный сотрудник кафедры неврологии, нейрохирургии и медицинской генетики ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Министерства здравоохранения Российской Федерации, член президиума Всероссийского общества неврологов.
30. Парфенов Владимир Анатольевич, д.м.н., профессор, заведующий кафедрой нервных болезней, директор клиники нервных болезней ФГАОУ ВО «Первый Московский государственный медицинский университет имени И.М. Сеченова» Министерства здравоохранения Российской Федерации, член правления Национальной ассоциации по борьбе с инсультом, член президиума Московского и Всероссийского обществ неврологов.
31. Петриков Сергей Сергеевич, д.м.н., профессор РАН, директор ГБУЗ «Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского» Департамента здравоохранения г. Москвы, профессор кафедры нейрохирургии и нейрореанимации ФГБОУ ВО «Московский государственный медико-стоматологический университет имени А.И. Евдокимова» Министерства здравоохранения Российской Федерации, президент Межрегиональной Общественной Организации «Объединение нейроанестезиологов и нейрореаниматологов».
32. Пирадов Михаил Александрович, д.м.н., академик РАН, профессор, директор ФГБНУ «Научный центр неврологии», член президиума Всероссийского общества неврологов, член президиума Национальной ассоциации по борьбе с инсультом.
33. Покровский Анатолий Владимирович, д.м.н., академик РАН, профессор, руководитель отделения хирургии сосудов ФГБУ «Национальный медицинский исследовательский центр хирургии им. А.В. Вишневского» Министерства здравоохранения Российской Федерации, заведующий кафедрой ангиологии, сосудистой и рентгенэндоваскулярной хирургии ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации, президент Российского общества ангиологов и сосудистых хирургов, член президиума Национальной ассоциации по борьбе с инсультом.
34. Рачин Андрей Петрович –д.м.н., профессор, заместитель директора по научной работе, зав. отделом нейрореабилитации и клинической психологии ФГБУ «Национальный медицинский исследовательский центр реабилитации и курортологии» Министерства здравоохранения Российской Федерации.
35. Ридер Флора Кирилловна, к.м.н., ведущий научный сотрудник ГБУЗ «Научно-практический психоневрологический центр имени З.П. Соловьева» Департамента здравоохранения города Москвы
36. Скоромец Александр Анисимович, д.м.н., академик РАН, главный внештатный специалист по неврологии Комитета по здравоохранению г. Санкт-Петербург, заведующий кафедрой неврологии ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. И.П. Павлова»Министерства здравоохранения Российской Федерации, член президиума Национальной ассоциации по борьбе с инсультом, член президиума Всероссийского общества неврологов.
37. Сорокоумов Виктор Александрович,д.м.н., профессор кафедры неврологии ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. И.П. Павлова» Министерства здравоохранения Российской федерации.
38. Стаховская Людмила Витальевна, д.м.н., профессор кафедры неврологии, нейрохирургии и медицинской генетики ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Министерства здравоохранения Российской Федерации, 1-й вице-президент Национальной ассоциации по борьбе с инсультом, член президиума Российского общества неврологов.
39. Стулин Игорь Дмитриевич, д.м.н., профессор, заведующий кафедрой нервных болезней лечебного факультета ФГБОУ ВО «Московский государственный медико-стоматологический университет имени А.И. Евдокимова» Министерства здравоохранения Российской Федерации.
40. Танашян Маринэ Мовсесовна — член-корреспондент РАН, профессор, д.м.н., Заслуженный деятель науки Российской Федерации, заместитель директора по научной работе, руководитель 1-го неврологического отделения ФГБНУ «Научный центр неврологии».
41. Фесюн Анатолий Дмитриевич – д.м.н., профессор, директор ФГБУ «Национальный медицинский исследовательский центр реабилитации и курортологии» Министерства здравоохранения Российской Федерации
42. Федин Анатолий Иванович, д.м.н., профессор, заведующий кафедрой неврологии ФДПО ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Министерства здравоохранения Российской Федерации, член президиума Всероссийского общества неврологов, член правления Национальной ассоциации по борьбе с инсультом.
43. Фидлер Михаил Сергеевич, ассистент кафедры неврологии, нейрохирургии и медицинской генетики ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Министерства здравоохранения Российской Федерации.
44. Фонякин Андрей Викторович — д.м.н., профессор, ведущий научный сотрудник, руководитель лаборатории кардионеврологии ФГБНУ «Научный центр неврологии».
45. Хасанова Дина Рустемовна, д.м.н., профессор, главный специалист по ангионеврологии Министерства здравоохранения Республики Татарстан, профессор кафедры, неврологии и нейрохирургии ФПК и ППС ФГБОУ ВО «Казанский государственный медицинский университет» Министерства здравоохранения Российской Федерации, член правления Национальной ассоциации по борьбе с инсультом.
46. Харитонова Татьяна Витальевна, к.м.н., старший научный сотрудник ГБУ СПб НИИ Скорой помощи им. И.И. Джанелидзе
47. Шамалов Николай Анатольевич, д.м.н., главный внештатный специалист по медицинской реабилитации Министерства здравоохранения Российской Федерации по Центральному федеральному округу, главный внештатный невролог Департамента здравоохранения г. Москвы, директор НИИ цереброваскулярной патологии и инсульта ФГБУ «Федеральный центр мозга и нейротехнологий ФМБА», ответственный секретарь Национальной ассоциации по борьбе с инсультом.
48. Янишевский Станислав Николаевич, д.м.н., профессор кафедры и клиники нервных болезней им. М.И. Аствацатурова ФГБВОУ ВО «Военно-медицинская академия им. С. М. Кирова» Министерства обороны Российской Федерации.
49. Ясаманова Альбина Николаевна, д.м.н., профессор кафедры неврологии, нейрохирургии и медицинской генетики и заведующая НИЛ сосудистых заболеваний головного мозга ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Министерства здравоохранения Российской Федерации.
Все члены рабочей группы заявили об отсутствии финансовой или нематериальной заинтересованности по теме разработанной клинической рекомендации. Член(ы) рабочей группы, сообщившие об обстоятельства, которые могут повлечь за собой конфликт интересов, был(и) исключен(ы) из обсуждения разделов, связанных с областью конфликта интересов.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
1. Врачи-неврологи
2. Врачи-нейрохирурги
3. Врачи-реабилитологи
4. Врачи-терапевты
5. Врачи общей практики (семейные врачи)
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
1. Приказ Министерства здравоохранения Российской Федерации от 29 декабря 2012 г. № 1740н «Об утверждении стандарта специализированной медицинской помощи при инфаркте мозга»
2. Приказ Министерства здравоохранения Российской Федерации от 28 декабря 2012 г. № 1622н «Об утверждении стандарта специализированной медицинской помощи при фибрилляции и трепетании предсердий»
3. Приказ Министерства здравоохранения Российской Федерации от 24 декабря 2012 г. № 1513н «Об утверждении стандарта скорой медицинской помощи при болезнях, характеризующихся повышенным кровяным давлением»
4. Приказ Министерства здравоохранения Российской Федерации от 20 декабря 2012 г. № 1282н «Об утверждении стандарта скорой медицинской помощи при инсульте»
5. Приказ Министерства здравоохранения РФ от 15 ноября 2012 г. N 928н «Об утверждении Порядка оказания медицинской помощи больным с острыми нарушениями мозгового кровообращения»
Приложение Б. Алгоритмы действий врача
Алгоритм ведения пациента с ИИ
Приложение В. Информация для пациента
Инсульт – это острое заболевание головного мозга, вызванное разрывом или закупоркой сосуда, кровоснабжающего его.
Признаками инсульта считаются внезапное возникновение слабости мышц лица или конечностей, особенно на одной половине тела, нарушение чувствительности чаще также на одной половине, затруднение произношения или понимания речи. В тяжёлых случаях бывает потеря сознания.
Распознать заболевание возможно на месте, немедля. Для этого используется тест «УЗП». Для этого попросите пострадавшего:
У — улыбнуться. Улыбка может быть кривая, уголок губ с одной стороны может быть направлен вниз, а не вверх, лицо может быть перекошено.
З — заговорить. Речь может быть невнятная, или отсутствует понимание задания.
П — поднять обе руки. Руки поднимаются не одинаково или одна не поднимается совсем.
Очень важно отметить, что все перечисленные симптомы возникают ВНЕЗАПНО (ОСТРО)! Если пострадавший затрудняется выполнить какое-то из этих заданий, необходимо немедленно вызвать скорую помощь, описать симптомы и указать время начала заболевания прибывшим на место медикам. До приезда «скорой» пациента необходимо уложить удобно, голова и плечи должны лежать на возвышение, чтобы не было сгибания, расстегнуть стесняющую одежду, дать достаточный приток свежего воздуха. Ничего не давать в рот, лечение пациента с инсультом осуществляется только в больнице в специализированном отделении.
После проведенного курса лечения в стационаре при выписке пациенту рекомендуют продолжить лечение, которое включает прием препаратов, для предотвращения повторного инсульта, и средства, способствующие восстановлению нарушенных функций. Пациент должен неукоснительно выполнять все рекомендации врача, который будет наблюдать его в течение необходимого времени. При появлении каких-либо новых симптомов следует незамедлительно обратиться за медицинской помощью.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Шкала инсульта Национальных институтов здоровья
Название на русском языке: Шкала инсульта Национальных институтов здоровья.
Оригинальное название: National Institutes of Health Stroke Scale.
Источник: Measurements of acute cerebral infarction: a clinical examination scale. T.Brott, H.P. AdamsJr, C.P. Olinger, J.R. Marler, W.G. Barsan, J. Biller, J. Spilker, R. Holleran, R.Eberle, and V. Hertzberg. Stroke. 1989;20:864–870. https://doi.org/10.1161/01.STR.20.7.864.
Официальный сайт разработчиков: https://nihstrokescale.org/
Шкала в РФ не валидизирована, для ее использования необходимо специальное обучение.
Тип: шкала оценки.
Назначение: оценка тяжести неврологического дефицита, может использоваться для оценки эффективности терапии.
Содержание (шаблон):
1а. Уровень сознания. Исследователь должен выставить соответствующий балл, даже если оценка затруднена вследствие наличия интубационной трубки, языкового барьера, оротрахеальной травмы, повязки. Три балла выставляется только в том случае, если в ответ на болевой стимул у пациента не возникает двигательных реакций (исключение – защитные знаки). Задайте пациенту два или три общих вопроса касательно обстоятельств его поступления в стационар. Основываясь на полученных ответах, оцените результаты. Помните, что не следует помогать пациенту.
0=ясное сознание, пациент реагирует на осмотр незамедлительно
1=оглушение, при легкой стимуляции пациент реагирует на осмотр
2= сопор, требуются повторные стимуляции пациента для ответной реакции, или при отсутствии эффекта необходимо проводить более интенсивную стимуляцию с целью получения нестереотипного двигательного ответа 3=кома, ответная реакция только в виде рефлекторных двигательных актов либо самопроизвольные двигательные акты, либо полное отсутствие реакции со стороны пациента, атония, арефлексия.
1b. Уровень сознания. Вопросы. Спросить у пациента: «Какой сейчас месяц? Сколько Вам лет?» Близкие, но неверные ответы не засчитываются. Пациенты с афазией и/или снижением уровня бодрствования, которые не могут правильно ответить на два поставленных вопроса, получат 2 балла. Пациенты, которые не могут говорить вследствие эндотрахеальной интубации, оротрахеальной травмы, тяжелой дизартрии, ввиду языкового барьера, либо по другим причинам (кроме афазии) получат 1 балл. Засчитывается только первая попытка, не допускается вербальная и невербальная помощь со стороны врача.
0=правильный ответ на два вопроса
1=правильный ответ на один вопрос
2=ни на один вопрос не дан правильный ответ
1с. Уровень сознания. Выполнение команд. Необходимо попросить пациента закрыть и открыть глаза, сжать кисть непаретичной руки в кулак, а затем разжать. Если для оценки данного пункта не может быть использована рука пациента, то можно заменить данную команду другой. Если пациент не может понять команды, то задание может быть продемонстрировано ему. Пациенты с травмой, ампутацией или другим физическим дефектом должны быть оценены при помощи одной шаговой команды. Засчитывается только первая попытка. Вопросы задаются также только один раз.
0=обе команды выполнены правильно
1=одна команда выполнена верно
2=ни одна команда не выполнена правильно
2. Движения глазных яблок. Учитываются только горизонтальные движения глазных яблок. Оцениваются самостоятельные или рефлекторные (окулоцефалический рефлекс) движения глазных яблок. Проведение калорического теста не допускается. Если у пациента имеется содружественное отведение глазных яблок, которое пациент может самостоятельно преодолеть, либо при помощи вызывания окулоцефалического рефлекса, выставляется 1 балл. В случае наличия у пациента изолированного пареза мышц глазного яблока, иннервируемых III, IV или VI парами черепных нервов, выставляется 1 балл.
Движения глазных яблок должны исследоваться у всех пациентов, в том числе и у пациентов с афазией. Пациенты с травмой глазного яблока, повязкой, предшествующей слепотой или другими расстройствами остроты или полей зрения должны быть обследованы при помощи вызывания окулоцефалического рефлекса. С целью выявления частичного пареза взора рекомендуется установить зрительный контакт со стороны пациента и походить из стороны в сторону относительно пациента.
0=норма
1=частичный парез взора, преодолеваемый пациентом либо при помощи вызывания окулоцефалического рефлекса
2=тоническое отведения глазных яблок, не преодолеваемое вызыванием окулоцефалического рефлекса
3. Поля зрения. Поля зрения (верхние и нижние квадранты) исследуются отдельно.
При необходимости может использоваться счет пальцев или внезапное появление в поле зрения пациента зрительного стимула (палец исследователя). Во время проведения тестирования пациент должен смотреть в лицо исследователю, однако, если он следит за движением пальцев, это может оцениваться как нормальная положительная реакция. При наличии односторонней слепоты или энуклеации, поля зрения оцениваются в здоровом глазу. При наличии четко очерченного выпадения поля зрения в виде верхнее- или нижнеквадрантной гемианопсии выставляется 1 балл. В случае слепоты пациента по каким-либо другим причинам выставляется 3 балла. Также должна быть выполнена синхронная двусторонняя стимуляция. Если в результате выявляются различия (уменьшение поля зрения в сторону больного глаза), выставляется 1 балл и результаты теста используются для ответа на вопрос №11. Два балла соответствуют случаям полной гемианопсии, а наличие какого-либо частичного нарушения поля зрения, включая квадрантную гемианопсию, соответствует 1 баллу.
0=норма
1=частичная гемианопсия
2=полная гемианопсия
3=билатеральная гемианопсия (слепота, включая корковую)
4. Парез лицевой мускулатуры. Используя вербальные и невербальные приемы, попросите пациента показать зубы, поднять брови, закрыть глаза, зажмурить глаза.
Допускается демонстрация данных команд врачом. Оцените симметричность болевой гримасы в ответ на болевой стимул у пациентов, которые не могут Вас понять. В случае наличия повязки на лице, оротрахеальной интубации или других барьеров они должны быть удалены (насколько это возможно) на время оценки.
0=норма
1=минимальный парез, асимметрия лица в виде сглаженности носогубной складки, асимметрия при улыбке
2=частичный паралич (частичный или полный паралич нижней мимической мускулатуры)
3=полный паралич нижней и верхней мимической мускулатуры с одной или 2-х сторон (полное отсутствие движений в верхней и нижней мимической мускулатуре)
5а. Движения в верхних конечностях (левая рука). Конечности пациента необходимо установить в следующем положении: вытянуть руки (ладонями вниз) под углом 90 градусов (если пациент сидит) или 45 градусов (если пациент лежит на спине).
Каждая конечность оценивается поочередно, начиная с непаретичной руки. Допускается демонстрация выполнения приема врачом у пациентов с афазией. Не допускается нанесение болевых стимулов. В случае ампутации конечности или поражения плечевого сустава, исследователь должен выставить в соответствующей графе UN (untestable). Четко считайте вслух до десяти и демонстрируйте счет на пальцах так, чтобы пациент это видел.
Начинайте считать, как только отпустите конечность пациента.
0=конечность удерживается под углом 90 или 45 градусов в течение 10 секунд без малейшего опускания
1=конечность опускается в течение 10 секунд, но не касается постели или другой опоры
2= конечности не могут сохранять поднятое положение (опускаются на постель или другую опору в течение 10 секунд), но производят некоторое сопротивление силе тяжести
3=конечности падают без сопротивления силе тяжести, имеются минимальные движения
4=нет активных движений в конечности
UN=ампутация конечности или повреждение плечевого сустава
5b. Движения в верхних конечностях (правая рука).
6a. Движения в нижних конечностях (левая нога). Конечности устанавливаются в соответствующее положение: под углом 30 градусов в положении лежа на спине.
Допускается демонстрация выполнения приема врачом у пациентов с афазией. Нанесение болевых стимулов не допускается. Каждая конечность оценивается поочередно, начиная с непаретичной ноги. Только в случае ампутации конечности или повреждения тазобедренного сустава, исследователь должен выставить в соответствующей графе UN (untestable). Четко считайте вслух до пяти и демонстрируйте счет на пальцах так, чтобы пациент это видел. Начинайте считать, как только отпустите конечность пациента.
0=конечность удерживается в течение 5 секунд под углом 30 градусов без малейшего опускания
1=конечность опускается в течение 5 секунд, но не касается постели или другой опоры
2=конечности не могут сохранять поднятое положение (опускаются на постель или другую опору в течение 5 секунд), но производят некоторое сопротивление силе тяжести
3= конечности падают без сопротивления силе тяжести, но присутствуют минимальные движения
4= нет активных движений в конечности
UN=ампутация конечности или повреждение тазобедренного сустава
6b. Движения в нижних конечностях (правая нога).
7. Атаксия конечностей. Оцениваются односторонние мозжечковые симптомы.
Тест проводится с открытыми глазами. В случае наличия какого-либо дефекта зрения проведите тестирование в ненарушенном поле зрения. Атаксия будет отсутствовать у пациента, который не понимает, что от него требуется или парализован. В случае повреждения суставов или ампутации конечности выставляется UN (untastable). Попросите пациента выполнить пальце-носовую, пальце-пальцевую и пяточно-коленную пробы обеими конечностями. В случае слепоты необходимо исключить пальце-пальцевую пробу.
Пациент с афазией часто будет способен выполнить тест нормально, если перед этим исследователь подвигает конечностью.
0=симптомы атаксии отсутствуют
1=симптомы атаксии присутствуют в 1 конечности
2=симптомы атаксии присутствуют в 2 конечностях
8. Чувствительные нарушения. Учитывается только снижение чувствительности, обусловленное настоящим заболеванием. Исследователь должен подвергнуть тестированию как можно больше участков тела пациента (лицо; руки, кроме кистей; ноги, кроме стоп; туловище). У пациентов в сопоре и/или с афазией выставляется 1 балл, у пациентов с инсультом в стволе мозга и билатеральным нарушением чувствительности – 2 балла. Если пациент не реагирует на внешние раздражители и имеется тетраплегия, то выставляются 2 балла, так же как и при нарушении уровня сознания до комы.
0=нет чувствительных нарушений
1=умеренное снижение чувствительности; с пораженной стороны пациент ощущает несильный укол булавкой или тупую боль от укола
2=сильная или полная потеря чувствительности; пациент не ощущает прикосновения в области лица, рук и ног.
9. Афазия. Пациента просят описать прилагаемую картинку, перечислить изображенные на листе бумаги предметы и прочесть предложения из прилагаемого списка.
В случае слепоты пациента, он должен назвать предметы, взяв их в руку, повторить что-либо за исследователем или сказать что-либо самостоятельно. Интубированного пациента следует просить отвечать письменно. Три балла следует выставлять только в том случае, если пациент не реагирует ни на одну команду и не отвечает на вопросы. Легкая форма афазии оценивается в 1 балл. Для правильного выбора между 1 и 2 баллами используйте предлагаемые материалы; предполагается, что пациент, пропустивший более 2/3 предлагаемых для этого предметов или выполнивший небольшое количество простых команд, получит 2 балла. В случае коматозного состояния выставляется 3 балла.
0=нет афазии
1=легкая или умеренная афазия
2=тяжелая афазия
3=тотальная афазия
10. Дизартрия.
Если состояние пациента оценивается как нормальное, он должен быть способен адекватно разговаривать, отвечая на просьбу исследователя прочесть что-либо или повторить слова из прилагаемого списка. В случае наблюдения у пациента признаков тяжелой афазии, четкость артикуляции оценивается в процессе спонтанной речи. Только если пациент интубирован или существует какое-либо другое физическое препятствие речи, состояние пациента оценивается 9 баллами и исследователь должен предоставить четкое письменное объяснение причины невозможности оценить состояние пациента. Не сообщайте пациенту причину проведения его/ее тестирования.
Для тестирования всех пациентов пользуйтесь предлагаемым списком слов и не сообщайте им, что вы проводите тест проверки ясности речи. Как правило, при неотчетливом произношении одного или нескольких слов такое состояние оценивается как нормальное. Ноль баллов выставляется пациентам, которые читают все слова внятно.
Пациенты, страдающие афазией или те, кто не читает, оцениваются на основании качества их спонтанной речи или повторения произносимых исследователем вслух слов. Два балла ставят в тех случаях, когда пациента совершенно невозможно понять или пациентам, которые молчат.
0 = норма
1 = дизартрия от слабой до умеренной; пациент нечетко произносит как минимум несколько слов; в худшем случае, произносимые им слова можно понять с трудом.
2 = сильная дизартрия; речь пациента настолько невнятна, что не воспринимается вовсе при отсутствии или непропорционально имеющейся афазии; или пациент молчит (не способен изъясняться членораздельно).
UN = пациент интубирован или присутствует какая-либо другая физическая преграда, препятствующая способности говорить.
11. Угнетение восприятия или невнимание (ранее использовали термин «игнорирование»)
Для выявления игнорирования (невнимания) достаточно информации, полученной в ходе выполнения предыдущих тестов. Если в силу тяжелого нарушения зрения у пациента одновременная двусторонняя визуальная стимуляция проведена быть не может, но реакция на кожные стимулы нормальная, то его состояние оценивается как нормальное.
Если у пациента афазия, но, по всем признакам, он внимательно следит за голосом с двух сторон, то его состояние оценивается как нормальное. Наличие зрительного пространственного игнорирования, или анозогнозия, расценивается как патология.
Поскольку патология оценивается в баллах только в случае ее наличия, данный пункт тестируется всегда.
Можно предположить, что при оценке этого пункта возможна значительная вариация мнений исследователей, т.к. все неврологи используют несколько различающиеся методы для тестирования игнорирования. Поэтому, в целях повышения достоверности исследования проводите только двустороннюю одновременную стимуляцию на визуальные и тактильные стимулы. При одностороннем игнорировании стимулов обеих модальностей оценивайте невнимание как 2, а при одностороннем игнорировании стимула одной модальности – как 1. Если пациент в сознании, но демонстрирует какой-либо другой ярко-выраженный тип игнорирования, оценивайте уровень невнимания как 1.
0= отсутствие отклонений
1= угнетение реакции (игнорирование, невнимание) при одновременной двусторонней стимуляции на стимулы одной из перечисленных модальностей (зрительные, тактильные, слуховые, пространственные)
2= выраженное одностороннее игнорирование или игнорирование стимулов более чем одной модальности; пациент не узнает (не различает) собственную руку или другие ориентиры только с одной стороны.
Ключ (интерпретация): максимальное количество баллов – 42. Отсутствие неврологического дефицита соответствует 0 баллов.
Пояснения: Пункты шкалы оцениваются по порядку. Недопустимо инструктировать пациента, даже если это противоречит обычной клинической практике. Фиксируется первая реакция пациента. Оценивается только настоящая реакция пациента, а не его (по-вашему) возможные действия. Необходимо отмечать все имеющиеся у больного симптомы, включая те из них, которые могли возникнуть вследствие ранее перенесенных инсультов.
Для изучения речевой продукции пациента просят описать события на картинке, назвать предметы, прочесть предложения и слова, представленные оценивающим врачом.
Для оценки афазии возможно использование следующих предложений:
— ты знаешь, как;
— спуститься с небес на землю;
— я вернулся с работы домой;
— возле обеденного стола в столовой комнате;
— они слышали его выступление по радио вчера вечером.
Для выявления дизартрии возможно использование следующих слов:
— мама;
— тип-топ;
— нефть;
— танкист и таксист;
— неуклюжесть;
— оркестр;
— футболист.
Иллюстрации для описания пациентами в ходе обследования, предложения для оценки афазии, а также слова для выявления дизартрии применимы только условно, до разработки и валидации русскоязычной версии шкалы NIHS, с учетом национальных культурологических особенностей.
Приложение Г2. Шкала оценки двигательного дефицита
Название на русском языке: Шкала оценки двигательного дефицита.
Оригинальное название: Medical Research Council.
Источник: Aids to the examination of the peripheral nervous system — MRC Memorandum No.45 (superseding War Memorandum No.7), Medical Research Council (Great Britain). Nerve Injuries Committee. H.M. Stationery Office, 1943. Measurements of acute cerebral infarction: a clinical examination scale. T. Brott, H.P.Adams Jr, C.P. Olinger, J.R. Marler, W.G. Barsan, J. Biller, J. Spilker, R. Holleran, R. Eberle, V.Hertzberg. Stroke. 1989;20:864–870. https://doi.org/10.1161/01.STR.20.7.864.
Официальный сайт разработчиков: https://mrc.ukri.org/research/facilities-andresources-
for-researchers/mrc-scales/mrc-muscle-scale/
Шкала в РФ не валидизирована.
Тип: шкала оценки.
Назначение: оценка степени выраженности двигательного дефицита.
Ключ (интерпретация): максимальное количество баллов – 5 соответствует нормальной мышечной силе. Отсутствие всех движений соответствует 0 баллов.
Пояснения: у пациентов с уровнем силы в руке выше 3 целесообразно применять аппаратную динамометрию для уточнения силы в руке.
Приложение Г3. Модифицированная шкала Эшворта
Название на русском языке: модифицированная шкала Эшворта.
Оригинальноеназвание: Modified Ashworth Scale.
Источник: Bohannon R.W., Smith M.B. Interrater reliability of a modified Ashworth scale of muscle spasticity. Physical Therapy 1987; 67(2): 206-7. DOI: 10.1093/ptj/67.2.206. Валидизирована в РФ: Супонева Н.А., Юсупова Д.Г., Ильина К.А., Мельченко Д.А., Бутковская А.А., Жирова Е.С., Таратухина А.С., Зимин А.А., Зайцев А.Б., Клочков А.С., Люкманов Р.Х., Котов, Смоленский А.М., Хижникова А.Е., Гатина Г.А., Кутлубаев М.А.,Пирадов М.А. Валидация Модифицированной шкалы Эшворта (Modified Ashworth Scale) в России. Анналы клинической и экспериментальной неврологии 2020; 14(1): 89–96. DOI: 10.25692/ACEN.2020.1.10
Тип: шкала оценки.
Назначение: оценки повышенного мышечного тонуса у пациентов после перенесенного нарушения мозгового кровообращения.
Ключ (интерпретация): максимальное количество баллов – 4 соответствует значительному повышению мышечного тонуса. Отсутствие повышенного мышечного тонуса соответствует 0 баллов.
Пояснения: перед проведением исследования попросите пациента расслабиться.
Пациент должен лежать на спине. При исследовании мышцы-сгибателя придайте конечности положение наибольшего сгибания и максимально разогните ее за 1 секунду (скажите про себя «одна тысяча один»). При исследовании мышцы-разгибателя придайте конечности положение наибольшего разгибания и максимально согните ее за 1 секунду (скажите про себя «одна тысяча один»). Определите баллы, используя приведенные ниже правила.
Приложение Г4. Шкала возбуждения-седации Ричмонда
Название на русском языке: шкала возбуждения-седации Ричмонда.
Оригинальное название: Richmond Аgitation–Sedation Scale.
Источник: Sessler C.N., Gosnell M.S., Grap M.J., Brophy G.M., O’Neal P.V., Keane K.A., Tesoro E.P., Elswick R.K. The Richmond Agitation-Sedation Scale: validity and reliability in adult intensive care unit patients. Am J Respir Crit Care Med. 2002;166(10):1338–1344.
Не валидизирована в РФ.
Тип: шкала оценки.
Назначение: оценка психомоторного возбуждения больного или уровня глубины седации.
Содержание (шаблон):
Ключ (интерпретация):
Процедура оценки по Шкале RASS
1. Наблюдение за пациентом
— Если он бодрствует, спокоен и внимателен? — 0 баллов.
— Есть ли у пациента, признаки поведения, характеризующееся беспокойством или волнением — оценка от +1 до +4 баллов с использованием критериев, перечисленных выше, в описании.
2. Если пациент сонлив, попросите его громким голосом, назвав по имени, открыть глаза и посмотреть на Вас. Повторите это несколько раз, если это необходимо. Попросите пациента задержать взгляд.
— Если с пациентом возможен зрительный контакт, который сохраняется в течение более 10 секунд — оценка — 1 балл.
— Если с пациентом возможен зрительный контакт, но это не поддерживается в течение 10 секунд — оценка — 2 балла.
— Если пациент производит какое-либо движение в ответ на голос, за исключением зрительного контакта — оценка — 3 балла.
3. Пациент не реагирует на голос. Проведите физическую стимуляцию, путем встряхивания за плечо, и растирания грудины.
— Если пациент отвечает какими-либо движениями на физическую стимуляцию — оценка — 4 балла.
— Если пациент не реагирует на голос или физическую стимуляцию — оценка — 5 баллов.
Пояснения: оценка по шкале зависит от остроты слуха и зрения пациента и не подходит для пациентов с тяжелыми нарушениями. Шкала чаще используется при искусственной вентиляции легких во избежание избыточного или недостаточного седативного эффекта от препаратов.
Приложение Г5. Индекс мобильности Ривермид
Название на русском языке: индекс мобильности Ривермид.
Оригинальное название: Rivermead mobility index.
Источник: The Rivermead Mobility Index: a further development of the Rivermead Motor Assessment. F.M. Collen, D.T. Wade, G.F. Robb, C.M. Bradshaw. International Disability Studies. Apr-Jun 1991;13(2):50-4. doi: 10.3109/03790799109166684.
Не валидизирована в РФ.
Тип: индекс.
Назначение: индекс мобильности Ривермид относится к простым, легко осуществимым тестам, измеряющим не только ходьбу, но и подвижность больного.
Ключ (интерпретация): значение индекса может составлять от 0 (невозможность самостоятельного выполнения каких-либо произвольных движений) до 15 (возможность пробежать 10 метров).
Пояснения: значение индекса соответствует баллу, присвоенному вопросом, на который врач может дать положительный ответ в отношении пациента.
Приложение Г6. Модифицированная шкала Рэнкина
Название на русском языке: модифицированная шкала Рэнкина.
Оригинальное название: Modified Rankin Scale.
Источник: Rankin J. “Cerebral vascular accidents in patients over the age of 60.” Scott Med J 1957;2:200-15. Van Swieten JC, Koudstaal PJ, Visser MC, Schouten HJ, van Gijn J. “Interobserver agreement for the assessment of handicap in stroke patients.” Stroke 1988;19(5):604-7. Валидизирована в РФ: Супонева Н.А., Юсупова Д.Г., Жирова Е.С., Мельченко Д.А., Таратухина А.С., Бутковская А.А., Ильина К.А., Зайцев А.Б., Зимин А.А., Клочков А.С., Люкманов Р.Х., Калинкина М.Э., Пирадов М.А., Котов-Смоленский А.М., Хижникова А.Е. Валидация модифицированной шкалы Рэнкина (The Modified Rankin Scale, MRS) в России. Неврология, нейропсихиатрия, психосоматика. 2018;10(4):36-39. https://www.neurology.ru/sites/default/files/assets/documents/2019/02/shkala-r_1.pdf
Тип: шкала.
Назначение: оценка общей инвалидизации, независимо от того, была ли инвалидизация вызвана инсультом или другим заболеванием. Шкала позволяет дать примерную оценку степени зависимости больного от помощи других лиц.
Содержание (шаблон):
Ключ (интерпретация): 0 баллов соответствует отсутствию у пациента ограничений жизнедеятельности, в том числе незначительных.
1 балл соответствует отсутствию у пациента существенных нарушений, несмотря на наличие некоторых симптомов. Пациент может выполнять все свои обычные действия и обязанности.
2 балла соответствуют легкой степени инвалидности. Пациент не способен выполнять прежние действия, но может справляться с повседневными обязанностями без посторонней помощи.
3 балла соответствуют умеренной степени инвалидности. Пациент нуждается в некоторой посторонней помощи, но может самостоятельно ходить (в том числе с использованием приспособлений для ходьбы или ходунков).
4 балла соответствуют выраженной степени инвалидности. Пациент не способен ходить и обслуживать себя без посторонней помощи.
5 баллов соответствуют тяжелой степени инвалидности. Пациент прикован к постели, страдает недержанием мочи и кала. Требуется постоянный уход.
Пояснения: специалист, выполняющий оценку, не должен пытаться разделить инвалидизацию в виду инсульта и инвалидизацию по другим причинам.
Приложение Г7. Шкала комы Глазго
Название на русском языке: шкала комы Глазго.
Оригинальное название: Glasgow Coma Scale.
Источник: Teasdale G, Murray G, Parker L, Jennett B: Adding up the Glasgow Coma Score. Acta Neurochir. Suppl. (Wien) 28:13–6, 1979. https://www.glasgowcomascale.org/Валидизирована в РФ: https://www.glasgowcomascale.org/downloads/GCSAssessment-Aid-Russian.pdf
Тип: шкала.
Назначение: оценка уровня сознания у пациентов отделений реанимации и интенсивной терапии.
Содержание (шаблон):
Приложение Г8. Шкала оценки органной недостаточности, связанной с сепсисом
Название на русском языке: шкала оценки органной недостаточности, связанной с сепсисом.
Оригинальное название: Sepsis-related Organ Failure Assessment (SOFA).
Источник: Vincent JL, Moreno R, Takala J, Willatts S, Mendonca A, Bruining H. The SOFA (Sepsis-related Organ Failure Assessment) score to describe organ dysfunction/failure. On behalf of the Working Group on Sepsis-Related Problems of the European Society of Intensive Care Medicine. IntensiveCareMed. 1996;22(7):707–710. doi: 10.1007/BF01709751.
Не валидизирована в РФ.
Тип: шкала.
Назначение: динамическая оценка органной дисфункции у пациентов с сепсисом, находящихся в отделениях реанимации и интенсивной терапии.
Содержание (шаблон):
Ключ (интерпретация): в основу шкалы SOFA положена оценка дисфункции шести органных систем: дыхательной, сердечно-сосудистой, печеночной, коагуляционной, почечной и неврологической от легкой дисфункции (0 баллов) до тяжелой недостаточности (4 балла). Общий балл по шкале SOFA равен сумме баллов всех 6 параметров. Чем больше общий бал, тем более выражена мультиорганная дисфункция.
— PaO2 — парциальное давление кислорода в артериальной крови, в мм рт. ст.;
— FiO2 — фракция кислорода во вдыхаемой газовой смеси, % (0,21-1,00);
— PaO2/ FiO2 — индекс оксигенации, мм рт. ст.;
— тромбоциты — × 109/л;
— билирубин — мкмоль/л;
— ср.АД – среднее артериальное давление. Формула для расчета среднего артериального давления: АД среднее = АД диастолическое + (АД систолическое — АД диастолическое)/3;
— адренергические препараты назначены как минимум на 1 час в дозе мкг на кг в минуту;
— ЦНС – балл по шкале комы Глазго;
— креатинин — мкмоль/л.
Приложение Г9. Шкала Alberta stroke program early CT score (ASPECTS)
Название на русском языке:
Оригинальное название: Alberta Stroke Program Early CT Score Источник: Barber, P. A., Demchuk, A. M., Zhang, J., & Buchan, A. M. (2000). Validity and reliability of a quantitative computed tomography score in predicting outcome of hyperacute stroke before thrombolytic therapy. The Lancet, 355(9216), 1670–1674. doi:10.1016/s0140-6736(00)02237-6.
Не валидизирована в РФ.
Тип: шкала.
Назначение: стандартизация выявления и описания распространения гиподенсивных участков ишемического повреждения головного мозга в бассейне средней мозговой артерии.
Ключ (интерпретация): при отсутствии изменений значение шкалы составляет 10 баллов. За каждый участок, имеющий признаки ранних ишемических изменений, вычитается один балл. Значение 0 баллов означает диффузное поражение всей территории кровоснабжения средней мозговой артерии.
Пояснения: ASPECTS является 10-балльной топографической РКТ-шкалой, применяемой у пациентов с ишемическим инсультом в бассейне средней мозговой артерии (СМА). Территория кровоснабжения средней мозговой артерии на двух аксиальных срезах (один на уровне таламуса и базальных ядер, другой — ростральнее сразу над базальными ядрами) делится на 10 участков.
Оцениваемые участки:
C — хвостатое ядро (Caude)
L — чечевицеобразное ядро (Lentiform nucleus)
IC — внутренняя капсула (Internal capsule)
I — островковая доля (Insular cortex)
М1: «передняя СМА-кора»
M2: «СМА кора латеральнее островка»
M3: «задняя СМА — кора»
M4: «передняя СМА — территория СМА ростральнее М1»
M5: «боковая СМА — территории MCA ростральнее М2»
M6: «задняя СМА — территория ростральнее M3»
Участки М1–М3 находятся на уровне базальных ядер, участки М4 – М6 — на уровне желудочков непосредственно над базальными ядрами).
Приложение Г10. Модифицированная шкала восстановления перфузии при ишемическом инсульте (mTICI)
Название на русском языке: Модифицированная шкала восстановления перфузии при ишемическом инсульте.
Оригинальное название: Modified treatment in cerebral ischemia (mTICI) score.
Источник: Zaidat OO, Yoo AJ, Khatri P et-al. Recommendations on angiographic revascularization grading standards for acute ischemic stroke: a consensus statement. Stroke. 2013;44 (9): 2650-63. doi:10.1161/STROKEAHA.113.001972;
Almekhlafi MA, Mishra S, Desai JA, et al. Not All “Successful” Angiographic Reperfusion Patients Are an Equal Validation of a Modified TICI Scoring System. Interventional Neuroradiology. 2014;20(1):21-27. doi:10.15274/INR-2014-10004
Не валидизирована в РФ.
Тип: шкала.
Назначение: Оценка восстановления кровотока на церебральных ангиограммах после эндоваскулярной реваскуляризации у пациентов с острым ишемическим инсультом.
Ключ (интерпретация): Технической целью выполнения ВСТЭ является достижение реперфузии mTICI 2b/3. Для повышения вероятности благоприятного исхода ИИ оптимально достижение уровня реперфузии mTICI 2с/3.
Приложение Г11. Визуально аналоговая шкала оценки боли
Название на русском языке: Визуально-аналоговая шкала боли (ВАШ)
Оригинальное название: Visual Analog Scale for Pain (VAS Pain)
Источник: J Clin Nurs. 2005 Aug;14(7):798-804. doi: 10.1111/j.1365-2702.2005.01121.x. Pain: a review of three commonly used pain rating scales Amelia Williamson 1, Barbara Hoggart
Affiliations expand DOI: 10.1111/j.1365-2702.2005.01121.x
Официальный сайт разработчиков: Визуальная аналоговая шкала (как графическая оценочная шкала ) была впервые опубликована в 1921 году компанией Hayes & Patterson как новый метод оценки рабочих их начальством; два года спустя Фрейд представил более подробный список преимуществ и недостатков визуальных аналоговых шкал. — https://deru.xcv.wiki/wiki/Visuelle_Analogskala
Шкала в РФ валидизирована, для ее использования необходимо специальное обучение.
Источник: Методические рекомендации для Пилотного проекта «Развитие системы медицинской реабилитации в Российской Федерации» «Практическое применение оценочных шкал в медицинской реабилитации», 2015-2016, с.91
Тип: шкала оценки.
Назначение: оценка интенсивности боли
Содержание (шаблон):
Время на заполнения теста: 1 — 5 минут.
ВАШ боли используется для оценки интенсивности боли без учета ее причин и локализации. Она является субъективным инструментом оценки боли и, главным образом, используется для ведения пациентом с болью. Данная шкала может быть использована для статистики, но с определенными оговорками. В Пилотном проекте необходимо оценить предложенные локализации (см. таблицу ниже). Если боль другой локализации, то следует вписать локализацию. У кардиологических пациентов оценивается боль в грудной клетке связанная с стернотомией после операции аортокоронарного шунтирования.
Оценка по ВАШ боли проводится только если пациент способен понять задание. Таким образом, если пациент с сенсорной афазией, или без сознания, у больного выраженный когнитивный дефицит, то он по данной шкале не оценивается. При наличии контакта с больным, но больной не может говорить (пациент заинтубирован, грубая дизартрия и др.) следует использовать альтернативные каналы коммуникации (сжимание кисти в кулак, движение глазами, письмо и др.). Если у больного нет боли, то во всех графах таблицы указывается 0 баллов.
Если у больного имеется болевой синдром следует предложить больному вести дневник боли (дважды в день утром и вечером оценивать интенсивность боли по ВАШ и записывать это). Использование дневника боли позволяет лучше осознать проблему боли пациентом и таким образом ускорить процесс избавления от нее. То есть использование дневника не только позволяет объективизировать боль и переживания больного, но и обладает лечебным эффектом.
Следует обратить внимание невролога, что при оценке по ВАШ боли необходимо четко объяснить, что является максимальной интенсивностью боли, а что полным ее отсутствием. Так 0 баллов ставиться, когда у больного нет неприятных ощущений и переживаний, связанных с болью и хорошее настроение. 10 баллов – это очень сильная боль, которую невозможно терпеть. Она настолько сильная, что не позволяет пациенту шевельнуться или говорить.
Приложение Г12. Шкала равновесия Берга
Название на русском языке: Шкала равновесия Берга
Оригинальное название: Berg Balance Scale – BBS
Официальный сайт разработчиков: https://ru.xcv.wiki/wiki/Berg_Balance_Scale
Источник:
Супонева Н.А., Юсупова Д.Г., Зимин А.А., Зайцев А.Б., Яцко К.А., Мельченко Д.А., Римкевичус А.А., Жирова Е.С., Таратухина А.С., Ризванова А.С., Гатина Г.А., Калинкина М.Э., Пирадов М.А., Берг К. Валидация Шкалы баланса Берг в России. Неврология, нейропсихиатрия, психосоматика, 2021;13(3):12–18. DOI: 10.14412/2074-2711-2021-3-12-18
Blum, Lisa; Korner-Bitensky, Nicol (May 2008). «Usefulness of the Berg Balance Scale in Stroke Rehabilitation: A Systematic Review». Physical Therapy. 88 (5): 559–566. doi:10.2522/ptj.20070205. PMID 18292215.
Downs S, Marquez J, Chiarelli P (2013). «The Berg Balance Scale has high intra- and inter-rater reliability but absolute reliability varies across the scale: a systematic review». J Physiotherapy. 59 (2): 93–99. doi:10.1016/s1836-9553(13)70161-9. PMID 23663794.
Berg KO, Wood-Dauphinee SL, Williams JI, Maki B (1992). «Measuring balance in the elderly: validation of an instrument». Can J Public Health. 83 Suppl 2: S7–11. PMID 1468055.
Stevenson TJ (2001). «Detecting change in patients with stroke using the Berg Balance Scale» (PDF). Aust J Physiother. 47 (1): 29–38. doi:10.1016/s0004-9514(14)60296-8. PMID 11552860. Archived from the original (PDF) on 2015-05-26.
Валидизирована в РФ.
Тип: шкала оценки.
Назначение: клинический тест способностей человека к статическому и динамическому равновесию, тест для определения функциональной мобильности человека
Содержание (шаблон):
Тест занимает 15–20 минут и состоит из 14 простых задач, связанных с балансом, от вставания из положения сидя до вставания на одну ногу. Степень успеха в достижении каждой задачи оценивается от нуля (неспособен) до четырех (независимо), а окончательной мерой является сумма всех оценок. Оборудование, необходимое для проведения исследования: линейка, два стула (один с подлокотниками, один без), ступенька или степ-платформа, секундомер или часы с секундной стрелкой, 4.5 метра свободного пространства.
1.Способность вставать из положения «сидя» (пациенту необходимо встать, при возможности, не использовать руки для поддержки):
4 балла – способность независимо встать, не используя руки и сохранять устойчивость;
3 балла – способность независимо встать, используя руки;
2 балла – способность после нескольких попыток независимо встать, используя руки;
1 балл – потребность в легкой помощи, для того чтобы встать или сохранять равновесие;
0 баллов – потребность в средней или максимальной помощи, для того чтобы встать.
2. Способность стоять без поддержки (пациенту необходимо простоять две минуты без поддержки):
4 балла – способность стоять 2 минуты без поддержки;
3 балла – способность стоять 2 минуты под контролем;
2 балла – способность стоять 30 секунд без поддержки;
1 балл – требуется несколько попыток, чтобы стоять 30 секунд без поддержки;
0 баллов – невозможность выдерживать 30 секунд стоя без помощи.
Если исследуемый в состоянии выдержать 2 минуты стоя без поддержки, то пункт № 3 оценивается в 4 балла.
3. Способность сидеть без поддержки спины и опорой стопами на пол или на табурет. Пациент должен сидеть, не используя руки в течение 2 минут.
4 балла – способность уверенно сидеть 2 минуты;
3 балла – способность сидеть 2 минуты при контроле;
2 балла – способность сидеть 30 секунд;
1 балл – способность сидеть 10 секунд;
0 баллов – невозможность сидеть без поддержки 10 секунд.
4. Способность сесть из положения стоя.
4 балла – способность уверенно садиться с минимальным использованием рук;
3 балла – способность садиться с помощью рук;
2 балла – способность садиться с опорой икроножной области о стул;
1 балл – садиться независимо, но движение вниз не контролирует;
0 баллов – потребность в помощи, для того чтобы сесть.
5. Пересаживание. Пациенту необходимо пересесть с одного стула на другой, стоящий рядом двумя путями: используя подлокотники, и без использования подлокотников.
4 балла – способность уверенно пересаживаться с незначительным использованием рук;
3 балла – способность уверенно пересаживаться с использованием рук;
2 балла – способность пересаживаться с устными советами и/или контролем;
1 балл – потребность помощи одного человека;
0 баллов – потребность помощи двух человек, для помощи или контроля.
6. Способность стоять без поддержки с закрытыми глазами. Пациент должен стоять с закрытыми глазами в течение 10 секунд.
4 балла – способность уверенно стоять 10 секунд;
3 балла – способность стоять 10 секунд с контролем;
2 балла – способность стоять 3 секунды;
1 балл – невозможность закрыть глаза на 3 секунды, но уверенное выполнение;
0 баллов – потребность в помощи, для того чтобы избежать падения;
7. Способность стоять без поддержки со стопами, сведенными вместе.
4 балла – способность стоять уверенно 1 минуту;
3 балла – способность стоять 1 минуту с контролем;
2 балла – способность стоять в течение 30 секунд;
1 балл – потребность в помощи, для того чтобы поставить вместе стопы, но способность устоять 15 секунд в требуемом положении;
0 баллов – потребность в помощи, для того чтобы поставить вместе стопы и невозможность устоять 15 секунд в требуемом положении.
8. Наклон вперед с вытянутой рукой в положении стоя. Рука пациента должна быть поднята на 90°, затем необходимо вытянуть пальцы и дотянуться вперед насколько возможно. Исследователь размещает линейку у кончиков пальцев, когда рука – поднята вперед. Пальцы не должны касаться линейки, при наклоне вперед. Регистрируется расстояние, – на которое, при наклоне вперед, переместились кончики пальцев пациента. Если возможно, то попросите, чтобы исследуемый выполнил тест, используя обе руки, чтобы избежать ротации позвоночника.
4 балла – может уверенно наклониться вперед более чем на 25 см (10 дюймов);
3 балла – может наклониться вперед более чем на 12.5 см (5 дюймов);
2 балла – может наклониться вперед более чем на 5 см (2 дюйма);
1 балл – наклоняется вперед, но требует контроля;
0 баллов – падение при попытке выполнить тест / требуется поддержка постороннего лица.
9. Поднять объект с пола из положения стоя.
4 балла – способность уверенно поднять тапок;
3 балла – способность поднять тапок, под контролем;
2 балла – невозможность поднять обувь, остается расстояние — 2-5cм (1-2 дюйма) и при этом сохраняется равновесие без поддержки;
1 балл – невозможность поднять обувь, при попытках выполнения теста требуется контроль;
0 баллов – невозможность попытки поднять обувь /требуется помощь, чтобы избежать падения.
10. Способность оглянуться и посмотреть назад, через правое и через левое плечо в положении стоя. Пациенту необходимо повернуться через левое плечо так, чтобы увидеть то, что находится непосредственно позади него. Затем повторить поворот через правое плечо. Исследователь может выбрать объект, на который нужно смотреть, непосредственно позади обследуемого.
4 балла – уверенный взгляд кзади с обеих сторон и вес тела перемещается;
3 балла – уверенный взгляд кзади с одной стороны, с другой меньшее смещение веса;
2 балла – поворот только боком, равновесие сохраняется;
1 балл – при повороте требуется контроль;
0 баллов – требуется помощь, чтобы избежать падения.
11. Поворот на 360°. Повернитесь кругом. Пауза. Теперь повернитесь в обратном направлении.
4 балла – способность уверенно поворачиваться 360° за 4 секунды или меньше;
3 балла – способность уверенно поворачиваться 360° за 4 секунды или меньше только в одну сторону;
2 балла – способность успешно поворачиваться 360°, но медленно;
1 балл – потребность в контроле или устном совете;
0 – потребность в помощи, при повороте.
12. Способность стоять одной ногой на стуле без поддержки. Пациенту необходимо поместить поочередно каждую ногу на стул/табурет, повторить четыре раза.
4 балла – способность уверенно сделать 8 шагов за 20 секунд;
3 балла – способность уверенно сделать 8 шагов, но более чем за 20 секунд;
2 балла – способность сделать 4 шага без помощи, но под контролем;
1 балл – способность сделать более 2 шагов, но с минимальной помощью;
0 балла – потребность в помощи, чтобы избежать падения / невозможность выполнить попытку.
13. Способность стоять при тандемном расположении стоп. Пациенту необходимо поставить одну стопу непосредственно перед другой. Если это невозможно, то попробуйте отступить достаточно далеко вперед. Чтобы оценка составила 3 балла, длина шага должна превысить длину стопы, при расположении стоп на ширине плеч.
4 балла – способность помещать стопы в тандемное положение и без поддержки стоять 30 секунд;
3 балла – способность помещать одну стопу перед другой без поддержки и стоять 30 секунд;
2 балла – способность сделать маленький шаг без поддержки и держать 30 секунд;
1 балл – нуждается в помощи, чтобы сделать шаг, но может устоять 15 секунд;
0 балов – падение, при шаге или стоя.
14. Способность стоять на одной ноге.
4 балла – способность без поддержки поднять ногу и стоять более 10 секунд;
3 балла – способность без поддержки поднять ногу и стоять 5-10 секунд;
2 балла – способность без поддержки поднять ногу и стоять 3 секунды или более;
1 балл – попытка поднять ногу, неспособность ее удержать 3 секунды, равновесие сохраняется;
Расшифровка шкалы:
I группа – оценка составляет от 0 до 20 баллов и соответствует передвижению с помощью инвалидного кресла.
II группа – оценка составляет от 21 до 40 баллов и соответствует ходьбе с опорой
III группа – оценка составляет от 41 до 56 баллов и соответствует полной независимости при передвижении.
Суммарный балл ≥ 45 баллов – низкий риск падений.
Суммарный балл < 45баллов – высокий риск падений.
БЛАНК ТЕСТА
Шкала баланса Берг (the Berg Balance Scale)
Пациент: _________________________
Врач: ____________________________
Дата: ____________________________
Равновесие
Всего: ____________
Приложение Г13. Индекс динамической походки.
Название на русском языке: Индекс динамической походки
Оригинальное название: Dynamic Gait Index– DGI
Сайт разработчиков: https://www.physio-pedia.com/Dynamic_Gait_Index
Источник:
1. Воловец С. А., Сергеенко Е. Ю., Даринская Л. Ю., Поляев Б. А., Яшинина Ю. А., Исаева М. А., Житарева И. В., Лобов А. Н., Панова Т. И. Современный подход к восстановлению постурального баланса у пациентов с последствиями острого нарушения мозгового кровообращения. Вопросы курортологии, физиотерапии и лечебной физической культуры. 2018;95(2):4-9. https://doi.org/10.17116/kurort20189524-9
2. Patla A, Shumway-Cook A. «Dimensions of mobility: defining the complexity and difficulty associated with community mobility.» J Aging Phys Act. 1999;7:7–19.
3. Jonsdottir J., Cattaneo D. «Reliability and Validity of the Dynamic Gait Index in Persons With Chronic Stroke». Archives of Physical Medicine and Rehabilitation 88(11):1410-5. 2007. DOI: 10.1016/j.apmr.2007.08.109
4. Shumway-Cook A., Taylor C. S., Matsuda P. N., Studer M. T., Whetten B. K. «Expanding the scoring system for the Dynamic Gait Index.» Phys Ther. 2013 Nov;93(11):1493-506. doi: 10.2522/ptj.20130035. Epub 2013 Jun 27.
5. Shumway-Cook A., Taylor C. S., Matsuda P. N. «Investigating the validity of the environmental framework underlying the original and modified Dynamic Gait Index.» Phys Ther. 2015 Jun;95(6):864-70. doi: 10.2522/ptj.20140047. Epub 2014 Dec 18.
Не валидизирована в РФ.
Тип: шкала оценки.
Назначение: разработан для изучения способности пациентов поддерживать функциональный баланс во время выполнения действий во время ходьбы
Тест занимает 15 минут и состоит из 8 простых задач, связанных с балансом во время ходьбы, от ходьбы по ровной поверхности до поочередного вставания на ступень, с имитацией подъёма по лестнице.
Степень успеха в достижении каждой задачи оценивается от нуля (Серьезное
ухудшение) до трёх (Норма), а окончательной мерой является сумма всех оценок. Оборудование, необходимое для проведения исследования: коробка из под обуви , конусы (2), лестница (ступенька), прямое свободное пространство 20 метров (15 дюймов ширина (38,1 см).
1. Ходьба по ровной поверхности. Пациент должен идти с обычной скоростью до следующей отметки 6 и 10 метров. Отмечается самый худший вариант выполнения.
3 балла – норма: может уверенно пройти 6 метров с нормальной скоростью и паттерном ходьбы, без использования дополнительных приспособлений
2 балла – легкие нарушения: может уверенно пройти 6 метров, используя дополнительные приспособления, с более медленной скоростью и с умеренно выраженными отклонениями во время ходьбы.
1 балл – умеренные нарушения: может пройти 6 метров, с медленной скоростью, неправильный паттерн ходьбы, с признаками неустойчивости.
0 баллов – выраженные нарушения: не может пройти 6 метров, без посторонней помощи, выраженные отклонения во время ходьбы или неустойчивость.
2. Изменение скорости при ходьбе. Пациент начинает идти в своем нормальном темпе (1,5 метра), по команде «Идите», идет быстрее, с максимальной скоростью (1,5 метра). По команде, «медленно», идет с минимальной для него скоростью (1,5 метра).
3 балла – норма: способность плавно изменять скорость ходьбы без потери равновесия или отклонения от курса. Определяется существенное различие между нормальной, быстрой и медленной скоростями ходьбы.
2 балла – легкое нарушение: способность изменить скорость ходьбы, при умеренных отклонениях от курса, или при их отсутствии, неспособность достигнуть существенного изменения в скорости ходьбы, или использование вспомогательных приспособлений.
1 балл – умеренные нарушение: способность выполнить только небольшие изменения скорости ходьбы, или выполнить изменения скорости с существенными отклонениями от курса, или изменить скорость, с потерей равновесия, но с дальнейшим его восстановлениям и продолжением ходьбы.
0 баллов – выраженное нарушение: неспособность изменить скорость, или потеря равновесие и необходимость касаться стены или посторонней помощи.
3. Ходьба с поворотами головы в горизонтальной плоскости. Пациент начинает идти в своем нормальном темпе. По команде ―смотрите направо, продолжает идти прямо, и поворачивает голову вправо. Продолжает смотреть направо, пока не будет команды ―смотрите влево, после чего продолжает идти прямо и поворачивает голову влево. Необходимо держать голову повернутой влево, пока не будет команда ―смотрите прямо―, после продолжает идти прямо, и вернуть голову в исходное положение.
3 балла – норма: выполняет повороты головы плавно без изменений походки.
2 балла – легкие нарушения: способность выполнять повороты плавно с небольшим изменением скорости ходьбы, то есть, незначительная дезинтеграция плавности ходьбы или использование помощи при ходьбе.
1 балл – умеренные нарушения: способность выполнить повороты головы с умеренным изменением скорости походки, замедлением, шаткостью, но последующим восстановлением равновесия и продолжением ходьбы.
0 баллов – выраженные нарушения: способность выполнить задачу с выраженными нарушениями ходьбы: шаткость с отклонением более 38 см от курса, потеря равновесия, остановки, поддержка за стены.
4. Ходьба с вертикальными поворотами головы. Пациент начинает идти в нормальном темпе. По команде ―смотрите вверх продолжает идти прямо и поднимает голову вверх. Пациент продолжает смотреть вверх, по команде ―смотрите вниз, продолжает идти прямо и наклоняет голову вниз. Продолжает смотреть вниз, по команде ―смотрите прямо― продолжает идти прямо, затем повернуть голову в исходное положение.
3 балла – норма: способность выполнить повороты головы плавно без изменения походки.
2 балла – легкие нарушения: способность выполнить повороты плавно с небольшим изменением скорости ходьбы, то есть, незначительной дезинтеграцией плавности походки или использования помощи.
1 балл – умеренные нарушения: способность выполнить повороты головы с умеренным изменением скорости ходьбы, замедлением, шаткостью, но последующим восстановлением равновесия и продолжением ходьбы.
0 баллов – выраженные нарушения: способность выполнить задачу с выраженными нарушениями ходьбы: шаткость с отклонением более 38 см от курса, потеря равновесия, остановки, поддержка за стены.
5. Ходьба с последующим поворотом кругом. Пациент начинает идти в нормальном темпе. По команде ―поворот пациент должен повернуться так быстро как сможет на 180° и остановится. Отмечается самый худший вариант выполнения.
3 балла – норма: способность выполнить поворот за 3 секунды без потери равновесия.
2 балла – легкие нарушения: способность выполнить поворот более чем за 3 секунды, но без потери равновесия.
1 балл – умеренные нарушения: поворот выполняется медленно, требует вербального контроля, требует несколько маленьких дополнительных шагов, для сохранения равновесия и остановки.
0 баллов – выраженные нарушения: невозможность повернуться, поворот и остановка требуют дополнительной помощи.
6. Перешагивание препятствия. Пациент начинает идти в нормальном темпе, затем перешагнуть коробку из-под обуви, ее нельзя обходить. Продолжает идти. Отмечается самый худший вариант выполнения.
3 балла – норма: способность перешагнуть препятствие без потери скорости.
2 балла – легкие нарушения: способность перешагнуть препятствие с замедлением ходьбы и подбором шагов.
1 балл – умеренные нарушения: для выполнения задания требуется остановка или вербальный контроль.
0 баллов – выраженные нарушения: невозможность выполнить задание без дополнительной помощи.
7. Ходьба, огибая препятствия. Больной начинает идти в нормальном темпе, когда подойдет к первому конусу (на расстоянии 1.8 метра) должен обойти его справа, когда подойдет ко второму конусу (на расстоянии 1.8 метра) обойдет его слева. Отмечается самый худший вариант выполнения.
3 балла – норма: способность обойти препятствия без потери скорости и шаткости при ходьбе.
2 балла – легкие нарушения: способность перешагнуть обойти препятствия с замедлением ходьбы и подбором шагов.
1 балл – умеренные нарушения: для выполнения задания требуется значительное замедление или вербальный контроль.
0 баллов – выраженные нарушения: невозможность выполнить задание без дополнительной помощи.
8. Шаги. Пациент должен подняться по лестнице, как обычно, если требуется, держится за перила. Поднявшись на пролет, должен повернуться и спуститься вниз. Отмечается самый худший вариант выполнения.
3 балла – норма: подъем и спуск с чередованием ног, без поддержки за перила.
2 балла – легкие нарушения: подъем и спуск с чередованием ног, с поддержкой за перила.
1 балл – умеренные нарушения: ходьба с постановкой двух стоп на ступеньку, с поддержкой за перила.
0 – выраженные нарушения: невозможность выполнить задание.
Расшифровка шкалы:
I группа – оценка от 0 до 18 баллов включительно – высокий риск падения больного при ходьбе.
II группа – оценка от 19 до 22 баллов – низкий риск падения при ходьбе
III группа – оценка от 22 до 24 баллов – безопасная ходьба
Индекс динамической походки (Dynamic Gait Index– DGI)
Пациент: _________________________
Врач: ____________________________
Дата: ____________________________
Всего: ____________
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Развивающийся инсульт
Инсульт представляет собой острое заболевание, которое сопровождается гибелью клеток головного мозга вследствие острого нарушения мозгового кровообращения. Он проявляется общемозговыми и локальными симптомами. Развитие инсульта возможно по двум сценариям: либо после 24 часов от начала заболевания его признаки сохраняются, либо наступает летальный исход.

Диагностическое обследование при развивающемся инсульте включает:
- выяснение жалоб и истории развития заболевания;
- неврологическое обследование;
- анализы крови (определение уровня ферментов и глюкозы крови, состояния свёртывающей и противосвёртывающей системы).
- допплерография – исследование кровотока в сосудах шеи и головного мозга;
- компьютерная томография помогает различать ишемический и геморрагический инсульты;
- магнитно-резонансная томография информативней при развивающемся инсульте;
- магнитно-резонансная ангиография и компьютерная ангиография – неинвазивные способы оценки сонных артерий и артерий головного мозга;
- электрокардиограмма позволяет оценить состояние сердечной мышцы;
- эхокардиография (ЭхоКГ) – метод исследования, при помощи которого врачи Юсуповской больницы определяют тромбы в полостях сердца, что позволяет оценить степень риска развития повторного инсульта.
Записаться на консультацию
Виды инсультов головного мозга
Наиболее часто встречается ишемический инсульт (инфаркт) мозга – 85% случаев, геморрагический инсульт встречается в 15% случаев. Инсульты в неврологии могут быть вызваны несколькими причинами:
- образованием тромбоэмболов при заболеваниях сердца;
- острым нарушением кровообращения в шейных и крупных мозговых артериях;
- нарушением кровообращения в мелких артериях мозга при остром течении процесса.
Классификация инсультов в неврологии
Инсульты классифицируют по причинам нарушения кровообращения и по продолжительности неврологической симптоматики. В Юсуповской больнице больному будет назначено диагностическое обследование, которое позволит очень быстро и точно определить вид инсульта и зону поражения мозга. При поступлении больного в клинике проводится ряд исследований по назначению врача:
|
МРТ – магнитно-резонансная томография |
КТ – компьютерная томография |
|
ультразвуковая доплерография |
церебральная ангиография |
Классификация ишемического инсульта (инфаркта) мозга:
- гемореологическая закупорка сосудов мозга. Такое состояние развивается при повышении свертываемости крови, слипании тромбоцитов;
- эмболический инсульт. Встречается в 20% случаев ишемического инсульта, развивается при закупорке артерии эмболами (внутрисосудистыми субстратами), которые поступают в мелкие сосуды из более крупных кровеносных сосудов;
- атеротромботический инсульт. Обнаруживается у 50% пациентов с ишемическим инсультом. На месте атеросклеротической бляшки формируется тромб, приводящий к закупорке сосуда;
- лакунарный инсульт. Артериальная гипертензия приводит к развитию атеросклероза, вызывающего сужение небольших артерий и снижение кровообращения участков мозга. Встречается в 25% случаев;
- гемодинамический инсульт. Вызывает патологическое состояние резкое сужение крупного сосуда мозга из-за падения артериального давления при сердечной недостаточности. Происходит прекращение поступления крови к участку мозга, развивается ишемический инсульт.

Классификация геморрагических инсультов:
- излияние крови при разрыве сосуда в ткани мозга – паренхиматозное кровоизлияние;
- образование гематомы в желудочках мозга – внутрижелудочковое кровоизлияние;
- кровоизлияние в полость между мягкими мозговыми оболочками и паутинной оболочкой называется субарахноидальным;
- довольно редко встречаются эпидуральные, субдуральные и смешанные формы кровоизлияний.
Классификация по продолжительности неврологической симптоматики:
- малый инсульт – проявление симптоматики от суток до трех недель. Восстановление от суток до трех недель;
- транзиторная ишемическая атака – симптомы наблюдаются продолжительностью около суток, восстановление в течение суток;
- завершенный ишемический инсульт – более трех недель наблюдаются симптомы заболевания, восстановления не происходит более трех недель.
Периоды инсульта
Среди огромного числа неврологических заболеваний инсульт выступает самой важной проблемой. Кровоизлияние в головной мозг приводит к нарушению внутричерепного кровообращения, некрозу нейронов и нарушениям жизненно важных функций организма.
При ишемическом инсульте наблюдается целый ряд процессов, приводящих в комплексе к гибели нейронов. Разрушение клеток происходит на фоне отека мозга. При этом мозг увеличивается в объеме и возрастает внутричерепное давление.
По причине набухания клеток наблюдается смещение височной доли, а также ущемление среднего мозга.
Также может происходить сдавливание продолговатого мозга по причине вклинивания миндалин мозжечка в большое затылочное отверстие. Данный процесс довольно часто приводит к летальному исходу. Поэтому крайне важна ранняя госпитализация больного.
При появлении первых признаков ишемического инсульта медицинская помощь должна быть оказана в течение первых трех часов, в противном случае прогнозы неутешительные.
Выделяют несколько периодов ишемического инсульта:
- острейший;
- острый;
- ранний восстановительный период инсульта;
- поздний восстановительный;
- стадия остаточных явлений.
В первые три часа возможно восстановить кровоток и исключить или снизить гибель нейронов путем использования тромболитиков. Также возможно введение препаратов в саму зону инсульта, что позволяет предупредить развитие осложнений.
Затем врачи предпринимают меры по восстановлению давления, проводят регидратацию, дегидратацию и оксигенотерапию.
В острейший период инсульта ( от 4-х до 5-ти часов после приступа) пациент должен находиться под чутким наблюдением врача в условиях стационара.
Период до 14-ти дней после приступа считается острым. Пациент продолжает проходить лечение в специализированном отделении больницы. Он проходит курс медикаментозной терапии, направленной на:
- уменьшение отека головного мозга;
- поддержание в норме вязкости и свертываемости крови;
- поддержание нормальной работы сердечно-сосудистой системы;
- предотвращение рецидивов;
- поддержание в норме артериального давления.

Ранний восстановительный период
Ранним восстановительным периодом считается период от 2-х до 6-ти месяцев после инсульта. На данном этапе проводят комплексное лечение:
- пациент принимает препараты согласно индивидуальной схеме лечения;
- в случае нарушения речи с больным работает логопед;
- назначаются различные манипуляции для восстановления чувствительности конечностей и других частей тела ( массажи, ванны, акупунктура и другие);
- лечебная физкультура – метод способствует укреплению связок и мышц.
Поздний восстановительный период
Поздний восстановительный период — это время спустя полгода после инсульта. На данном этапе уже видны результаты лечения и реабилитационных мероприятий, пройденных в ранний восстановительный период.
У пациента восстанавливается чувствительность пальцев, улучшается моторика. Крайне важно не прекращать комплекс процедур. Реабилитация после инсульта – длительный и трудоемкий процесс.
Период остаточных явлений
Время от одного до двух лет после перенесенного инсульта считается остаточным периодом. На данном этапе важно соблюдать все предписания врача и проводить меры профилактики повторного инсульта.
Реабилитологи и неврологи Юсуповской больницы составляют программу лечения и реабилитации индивидуально для каждого пациента, что позволяет достигать высоких результатов по восстановлению после инсульта.

Мнение эксперта
Автор: Владимир Владимирович Захаров
Врач-невролог, доктор медицинских наук, профессор, руководитель центра диагностики и лечения нарушений памяти
По статистике, предоставляемой ВОЗ, инсульт занимает 3 место по распространенности среди всех неврологических заболеваний. Врачи отмечают ежегодный прирост заболеваемости. В России каждый год регистрируется 400 тысяч новых случаев инсульта. Более 30% из них заканчивается летальным исходом. Острое нарушение мозгового кровообращения не является заболеванием, свойственным людям пожилого возраста. Болезнь может диагностироваться у 5-летних детей. Отличительной особенностью пожилого возраста считается большее количество предрасполагающих к развитию инсульта факторов.
В Юсуповской больнице диагностика нарушения мозгового кровообращения проводится с помощью современного медицинского оборудования. КТ и МРТ позволяют оценить размеры патологического очага, его локализацию, а также тип инсульта. Лечение разрабатывается индивидуально для каждого пациента. Используемые препараты отвечают стандартам качества и безопасности. При необходимости выполняется оперативное вмешательство. В реабилитационный период каждому пациенту назначаются курс физиотерапии и комплекс лечебной физкультуры. Опытные массажисты прорабатывают мышцы, способствуя восстановлению утраченных функций.
Известны следующие причины инсульта:
- возраст. В группу риска развития инсульта входят пожилые люди, особенно те, которые имеют высокое артериальное давление, ведут малоподвижный образ жизни, имеют избыточный вес, курят или злоупотребляют спиртными напиткам. В настоящее время всё чаще инсульт развивается у лиц молодого возраста;
- пол. В большинстве возрастных групп инсульт чаще встречается у мужчин, чем у женщин. Однако он тяжелее протекает и чаще заканчивается летальным исходом у женщин. Это связано с употреблением контрацептивов, гормональным дисбалансом и эмоциональной неуравновешенностью женщин;
- семейный анамнез. В большинстве случаев ближайшие родственники пациентов, страдающих инсультом, перенесли острое нарушение мозгового кровообращения;
- курение. У лиц, выкуривающих больше 20 сигарет в день, риск развития инсульта повышается в 2 раза;
- питание. Преобладание в рационе насыщенных жиров, лёгких углеводов и избыточного количества поваренной соли способствует повышению артериального давления, являющегося основным фактором геморрагического инсульта;
- недостаточная физическая активность. Отсутствие регулярных физических упражнений увеличивает риск ожирения, усиливает нарушение циркуляции крови, что способствует развитию инсульта.
- употребление наркотических веществ. Наркотики, особенно метамфитамин и кокаин, являются основным фактором развития инсульта у молодых людей. Анаболические стероиды, которые часто принимают спортсмены, также увеличивают вероятность инсульта.
- заболевания сердца и сосудов. Люди, страдающие заболеваниями сердечно-сосудистой системы, особенно сопровождающимися нарушением ритма сердечной деятельности, и патологией периферических сосудов подвергаются повышенному риску развития инсульта;
- перенесенный инсульт в 10 раз повышает риск острого нарушения мозгового кровообращения;
- артериальная гипертензия является причиной 70% инсультов. У пациентов, страдающих гипертонической болезнью, в 10 раз выше риск развития инсульта, чем у людей с нормальным давлением.
- высокий уровень холестерина увеличивает риск развития атеросклероза церебральных артерий и нарушения кровотока по мозговым сосудам;
- ишемическая болезнь сердца повышает риск инсульта. Препятствующие свёртыванию крови препараты, которые используются в лечении заболеваний сердечно-сосудистой системы, растворяют сгустки крови, но и увеличивают риск развития геморрагического инсульта.
- фибрилляция предсердий – основной фактор риска развития инсульта, связанный с нарушением сердечного ритма. У 2-4% пациентов с фибрилляцией предсердий без предвестников нарушения мозгового кровотечения развивается инсульт.
Последствия инсульта – нарушение двигательной, речевой, зрительной, когнитивной функции, расстройства чувствительности. Их предотвращает в Юсуповской больнице команда специалистов, в состав которой входят неврологи, кардиологи, логопеды, психотерапевты, реабилитологи.
Некоторые последствия инсульта при адекватной медицинской помощи поддаются лечению и восстановлению. К числу данных последствий относятся судороги, которые появляются у женщин и мужчин после ишемического или геморрагического инсульта.
Развитие судорожного синдрома вызвано гибелью нейронов головного мозга и формированием очага некроза. Ответной реакцией организма на данный процесс является активация других нейронов для восстановления кровообращения и прекращения патологического процесса. Некротические ткани заменяются полостью, заполненной жидкостью, при образовании кисты человек не ощущает дискомфорта. Однако при раздражении кистой нейронов могут происходить судороги.
После инсульта судороги могут проявляться у больных в виде:
- онемения одной или обеих конечностей одновременно, чувство деревянной ноги или руки;
- сокращения мышц лица и шеи, результатом чего становится «маскообразное лицо», запрокидывание головы на одну сторону или асимметрия лица с одной стороны;
- сокращения мышц лица на фоне онемения конечностей.
Некоторые пациенты после инсульта испытывают небольшой тремор, другие больные отмечают краткосрочные судороги во всем теле.

Температура после инсульта
Температура при инсульте – это показатель кровоизлияния в мозг, геморрагического инсульта. При ишемическом инсульте температура в большинстве случаев немного пониженная, при геморрагическом инсульте температура повышается.
Своевременная медицинская помощь снижает риск развития тяжелых осложнений. После инсульта сложно бороться с высокой температурой – жаропонижающие средства могут усугубить состояние больного с геморрагическим инсультом, при ишемическом инсульте вызвать геморрагическую трансформацию.
Температура после инсульта: причины и лечение
Температура при инсульте – это очень важный показатель состояния больного. По нему наиболее часто определяют степень поражения головного мозга у пациента. Предельно допустимыми считаются показания температуры до 38 градусов.
Исследования инсультов показали, что большая часть пациентов с инсультом при поступлении в клинику имели нормальную среднюю температуру. У пациентов с обширными инсультами температура начинала подниматься через несколько часов (4-6) до 40 градусов. У пациентов с инсультами средней тяжести температура поднималась до 40 градусов через 12 часов после инсульта. Легкая степень инсульта чаще всего проходит без температуры или с несущественным подъемом температуры.
Осложнения после инсульта
После инсульта часто происходит повышение температуры из-за следующих осложнений:
- повреждение произошло на обширном участке головного мозга;
- развился отек тканей головного мозга;
- во время инсульта был поврежден центр терморегуляции в мозге;
- осложнение после инсульта – пневмония;
- развилась аллергическая реакция на медикаменты.
В случаях, когда причиной повышения температуры является её центральный генез, врачи выполняют краниоцеребральную гипотермию. Проводится охлаждение головного мозга через наружные покровы головы с помощью специальной аппаратуры. Этот метод усиливает устойчивость мозга к кислородному голоданию, снижает риск развития отека мозга, купирует имеющийся отек, снижает температуру тканей.
Признаки и симптомы после инсульта
Симптомы инсульта во многом зависят от причины заболевания. Первыми признакам инсульта являются следующие симптомы:
- внезапное онемение или слабость в руке или ноге, на одной стороне тела;
- спутанность сознания;
- сильная головная боль;
- нарушение речи;
- снижение остроты зрения;
- головокружение;
- потеря равновесия или координации.
Скорость появления симптомов ишемического инсульта может указывать на его происхождение: если острое нарушение мозгового кровообращения вызвано эмболией, заболевание внезапное. Головная боль и судороги могут развиваться в течение секунды после тромбоэмболии артерии.
У пациентов с последствиями инсульта выделяют три основных вида нарушений:
- повреждение, дефект. Выделяют следующие повреждения после перенесенного инсульта: двигательные, когнитивные, эмоционально-волевые, речевые, зрительные, чувствительные, сексуальные и тазовые расстройства;
- нарушение способности. Выражаются в нарушении ходьбы и самообслуживания;
- нарушение социального функционирования. Выражается в ограничении осуществления той социальной роли, которая до болезни была нормой для пациента.

Симптомы после инсульта проходят в том случае, если врачи своевременно начинают реабилитационные мероприятия. При поступлении пациента в клинику неврологии Юсуповской больницы в процесс реабилитации включается команда, которая состоит из следующих специалистов:
- неврологи;
- терапевты;
- специалисты по кинезотерапии;
- афазиологи;
- массажисты;
- физиотерапевты;
- иглотерапевты;
- психологи;
- специалисты по биологической обратной связи.
Боли при инсульте в мышцах
Боли в мышцах после инсульта, лечение которого должно быть незамедлительным, возникают у большинства пациентов. Болезненность в мышцах может мешать восстановлению организма. Постинсультная боль может быть стратегической или таламической. Стратегическая боль возникает в той области головного мозга, которая управляет ощущениями, в частности болью, ее проявление обусловлено спазмами. Таламическая боль появляется после инсульта в одной половине тела через несколько месяцев после нарушения кровообращения.
Возникновение боли после инсульта может быть связано с различными факторами. Неврологи с реабилитологами советуют пациентам придерживаться рекомендаций, которые предотвратят наступление данного состояния. Меры профилактики боли после инсульта в мышцах:
- не принимать горячие ванны;
- предпочитать одежду из натуральных материалов, не носить легкую одежду;
- находиться в комфортном положении и не допускать плотной группировки тела;
- не допускать давления на пораженную сторону;
- использовать специальные приспособления для парализованных и ослабленных конечностей;
- фиксировать при сидении парализованную руку, чтобы боль, локализованная в плече, не усугублялась;
- при передвижении желательна поддержка другого человека.
Важно при боли в ногах после инсульта доверять лечение квалифицированным неврологам и реабилитологам.
Особенности инсульта у пожилых людей
Возраст — один из значимых факторов развития острых сосудистых патологий головного мозга, нарушающих кровообращение. Заболевания кровеносных сосудов у пожилых людей проходят гораздо тяжелее, чем у молодых. Это связано с физиологическими изменениями в организме, и в частности, в центральной нервной системе, такими как:
|
уменьшение объема и массы головного мозга |
истончение лептоменингеальных оболочек |
|
старческая атрофия нейронов |
дегенеративные изменения белого вещества |
|
снижение функциональной активности нейронов |
гибель нейронов, вызванная электролитическим дисбалансом |
|
уменьшение гематоэнцефалического барьера |
патологические изменения мозговых желудочков |
Около 80 % случаев инсульта диагностируются у людей старше 70 лет. И, к сожалению, прогноз на выздоровление очень часто неблагоприятный. Последствия инсульта у пожилых людей трудно спрогнозировать, так как таким пациентам сложно подобрать эффективную терапию.
Причины инсульта у пожилых людей
Среди причин развития инсульта у пожилых людей различают этиологические факторы и факторы риска. Первые вызывают сам недуг, а вторые повышают вероятность возникновения патологии. К основным причинам острых нарушений кровотока в головном мозге относятся:
- артериальная гипертензия;
- васкулиты и ангиопатии;
- неправильный приём препаратов, влияющих на свёртываемость крови;
- новообразования в клетках нервных или соединительных тканей;
- изменения ритма сердцебиения;
- атеросклероз каротидных артерий;
- гормональный дисбаланс, повышающий риск образования тромбов.
Среди главных факторов риска инсульта у людей пожилого возраста можно выделить:
- половую принадлежность (статистически обширным кровяным излияниям в мозг больше подвержены мужчины);
- наличие сердечно-сосудистых заболеваний;
- повышение уровня холестерина в составе крови;
- микроинсульты в анамнезе.
Как правило, инсульту предшествуют определенные сосудистые и сердечные заболевания. Одними из них являются системный атеросклероз и мерцательные аритмии, развивающиеся в возрасте 85 лет.
Данное заболевание представляет собой неоднородные бляшки, образовывающиеся в средних и крупных артериях, в том числе и мозговых. Пожилой и старческий возраст являются главными факторами риска развития атеросклероза.
Нарушения сердечного ритма, приводящие к нерегулярному сердцебиению, свидетельствуют о наличии мерцательной аритмии. Синусовый узел не справляется с координацией сердечного ритма, из-за чего верхние камеры хаотично мерцают. В итоге кровь поступает в желудочки в недостаточном количестве. Основными симптомами мерцательной аритмии являются:
- дрожь в грудной клетке;
- учащенное сердцебиение;
- нерегулярный сердечный ритм;
- одышка;
- болевые ощущения в груди;
- головокружение;
- быстрая утомляемость, сонливость;
- повышенная тревожность и беспокойство.
Многие люди десятилетиями живут с этим заболеванием. Оно не является прямой угрозой жизни, но при достижении человеком пожилого возраста приводит к ряду осложнений, среди которых и инсульт.
С возрастом церебральное кровообращение ухудшается. Эти нарушения объясняются естественными старческими изменениями, из-за которых компенсаторные резервы организма снижаются. В результате стенки сосудов становятся ломкими, внутреннюю оболочку артерий поражают атеросклеротические бляшки, учащаются случаи резких скачков артериального давления.
Последствия инсульта у пожилых пациентов (старше 70 лет) очень опасны для жизни и в корне меняют её. Первый эпизод разрыва мозгового сосуда приводит к коме больше чем в половине случаев. Восстановительный процесс после острого нарушения церебрального кровообращения тяжелый и длительный.
В большинстве случаев заболевание проявляется почти сразу. Лишенные нормального кровоснабжения, клетки головного мозга отмирают, что сопровождается следующими симптомами:
- резкая головная боль;
- головокружение;
- обморочное состояние, кратковременная потеря сознания;
- нарушение координации движений;
- ухудшение речи и произношения (заторможенность, ухудшение дикции, невозможность воспроизводить звуки);
- снижение зрения, потемнение в глазах, размытость и нечеткость изображений;
- спутанное сознание, рассеянность;
- дезориентация в пространстве.
Признаки инсульта у пожилых людей имеют некоторые особенности. Сосудистая катастрофа в мозгу наступает независимо от времени суток, но чаще развивается ранним утром или вечером. У возрастных больных состояние часто ухудшается постепенно, в течение нескольких дней. Это связано с тем, что мозговое кровоизлияние протекает достаточно медленно.

Последствия инсульта у пожилых
Повреждения головного мозга как ишемического, так и геморрагического типа влекут за собой тяжелые осложнения. Многие пациенты старше 70 лет до конца жизни не могут избавиться от приобретенных нарушений и восстановить потерянные функции.
Степень тяжести постинсультных состояний зависит от:
- локализации повреждения;
- объема кровоизлияния.
Если речь идет о пожилых больных, то в любом случае последствия будут значимыми. Многим пациентам от 70 до 85 лет грозит инвалидность, связанная с двигательными и когнитивными расстройствами:
- частичный или полный паралич;
- сильные нарушения мелкой моторики;
- ухудшение глотания или полная неспособность глотать;
- снижение памяти или её потеря;
- дезориентация во времени и пространстве;
- деменция, снижение умственных способностей;
- невозможность читать, писать и разговаривать.
Последствия инсульта у пожилых людей носят стойкий характер. Им подвержены более половины пациентов, пострадавших от разрыва сосуда в мозгу. Больные становятся полностью зависимыми от других из-за того, что не могут ухаживать за собой самостоятельно.
Врачи составляют индивидуальные реабилитационные программы с учётом возраста пациентов, этапа реабилитации, степени выраженности неврологического дефицита, состояния соматической сферы, эмоционально-волевой сферы и когнитивных функций. К реабилитации привлекают пациента, его близких и родных.
Основными неврологическими симптомами инсульта, при которых требуется реабилитация, являются:
- двигательные нарушения и нарушения ходьбы;
- речевые нарушения;
- нарушения когнитивных функций.
Запишитесь на приём к неврологу Юсуповской больницы, позвонив по телефону. После обследования врачи составят индивидуальную программу реабилитации, направленную на восстановление утраченных функций.
Стоимость реабилитации после инсульта
От 20.000 рублей в сутки, в зависимости от выбранного типа размещения и индивидуальных особенностей пациента.
Предварительный план лечения составляет профильный специалист.

Врач-невролог, ведущий специалист отделения неврологии
Список литературы
- МКБ-10 (Международная классификация болезней)
- Юсуповская больница
- Клиническая неврология с основами медико-социальной экспертизы. СПб.: ООО «Медлайн-Медиа», 2006.
- Широков, Е. А. Инсульт, инфаркт, внезапная смерть. Теория сосудистых катастроф / Е.А. Широков. — М.: Кворум, 2010. — 244 c.
- Виленский, Б. С. Инсульт: профилактика, диагностика и лечение / Б.С. Виленский. — Москва: Высшая школа, 1999. — 336 c.
Профильные специалисты
Консультация заведующего отделением неврологии, первичная 6 050 руб.
Консультация заведующего отделением неврологии, повторная 5 170 руб.
Консультация ведущего специалиста отделения неврологии, первичная 5 500 руб.
Консультация ведущего специалиста отделения неврологии, повторная 4 620 руб.
Дата публикации 12 июля 2018Обновлено 3 апреля 2023
Определение болезни. Причины заболевания
Инсульт — это собирательный термин, обозначающий несколько типов нарушения мозгового кровообращения: ишемический инсульт (он же инфаркт мозга), геморрагический инсульт (кровоизлияние в мозг), венозный инфаркт, субарахноидальное кровоизлияние (кровотечение в пространство между внутренним и средним слоем тканей, покрывающих головной мозг).
Первая помощь при инсульте
Помощь человеку с подозрением на инсульт необходимо оказать как можно скорее.
- Срочно наберите 103 и вызовите скорую. Во время звонка сообщите оператору, что есть подозрение на инсульт, укажите пол и возраст пациента.
- Посмотрите на часы и зафиксируйте время начала симптомов. Эта информация будет важна для врачей.
- Помогите пациенту занять безопасное положение: лечь на бок, слегка приподняв голову (можно положить под голову валик из одежды).
- Обеспечьте поступление свежего воздуха. Расстегните одежду, развяжите галстук, откройте окно.
- Не давайте пациенту никаких лекарств! Разные типы инсульта сложно отличить, но лечатся они совершенно по-разному: например, при геморрагическом инсульте с разрывом сосуда аспирин сильно навредит.
- Не пытайтесь напоить, накормить больного или заставить его встать. У человека может быть нарушена функции глотания, и он подавится. При попытке встать из-за нарушения координации пациент может упасть снова и получить травму.
- До приезда скорой внимательно наблюдайте за человеком на предмет любых изменений в его состоянии. Будьте готовы рассказать врачам о симптомах и о том, когда они начались. Обязательно укажите, упал ли человек или ударился головой. Это важно для определения тактики лечения.
- При сохранности речи до приезда скорой постарайтесь выяснить у пациента, когда появились симптомы, какими хроническими заболеваниями он болеет и какие лекарства принимает. Если есть возможность, соберите документы с заключениями других врачей. Эта информация сэкономит медикам время.
- В некоторых случаях целесообразно самостоятельно доставить больного в ближайшую больницу, если вы не уверены в оперативности бригады. Обсудите это решение с оператором экстренных служб.
В Российской Федерации ежегодно переносят инсульт более 450 000 человек [8].
Ишемический инсульт — это отмирание участка ткани головного мозга в результате недостаточного снабжения головного мозга кровью и кислородом вследствие закупорки артерии.
Поражения сосудов головного мозга принято делить на две группы:
- Закупорка сосудов (ишемия, инфаркт), которая приводит к размягчению участка мозгового вещества вследствие уменьшения кровоснабжения. Причиной такой закупорки могут быть образование тромбов на атеросклеротической бляшке (тромбоз), попадание тромбов, которые образовались в другом органе (эмболия), расслоение (диссекция) церебральных артерий, артериит (воспаление стенок артерий).
- Кровоизлияние (геморрагический инсульт) при разрыве мозгового сосуда с пропитыванием излившейся кровью части мозгового вещества.
Далее в этой статье будет рассмотрена первая группа — ишемические инсульты.
Атеротромботический ишемический инсульт — этот инсульт возникает вследствии закупорки сосуда головного мозга тромбом.
Тромбоэмболический ишемический инсульт — развивается в случае закупорки сосуда тромбом из периферического источника. Тромб чаще образуется в сердце.
Причины инсульта
Причины возникновения ишемического инсульта:
- атеросклероз — чаще всего развивается после 60 лет;
- гипертоническая болезнь — частый этиологический фактор при инсультах, при гипертонической болезни инсульты развиваются в стадии артериосклеротических изменений;
- изменения коагулирующих свойств крови (гиперпротромбинемия), которые способствуют развитию тромбозов;
- мерцательная аритмия — самая частая причина тромбоэмболии церебральных артерий;
- нарушение проходимости вен головного мозга — редкая причина возникновения ишемического инсульта.
Причины инсульта в молодом возрасте: диссекции артерий, коагулопатии на фоне, например, антифосфолипидного синдрома или приёма оральных контрацептивов, церебральные артерииты на фоне системных ревматических заболеваний или инфекционных процессов, тромбоэмболы от вегетаций на клапанах сердца у наркоманов с эндокардитом.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы ишемического инсульта
Инсульт всегда внезапен и скоротечен, к нему нельзя быть готовым. Очаговые (нарушения движения, чувствительности, речи, координации, зрения) и общемозговые (нарушение сознания, тошнота, рвота, головная боль), неврологические симптомы ишемического инсульта возникают неожиданно и мгновенно, длятся более суток, могут стать причиной смерти.
Как распознать инсульт у человека
Первые признаки инсульта:
- Человек не может выполнить просьбу улыбнуться, поскольку мимика лица нарушена. Его улыбка будет кривой, одна сторона опущена.
- Речь невнятная, размытая, может даже показаться, что с вами пытается разговаривать пьяный.
- Затруднительно поднять руки на один уровень. По тому, какая рука находится ниже, можно определить поражённую сторону.
- У человека с инсультом не получится высунуть язык. Он будет западать.
При появлении любого из перечисленных признаков следует вызвать скорую помощь. С момента появления первых симптомов инсульта до введения препаратов должно пройти не более 4,5 часов, поэтому важна быстрая госпитализация.
Изменения глаз:
- один зрачок расширен;
- глазные яблоки двигаются хаотично;
- зрачки не реагируют на движение;
- больной ощущает сдавливание глаз, окружающие предметы и люди могут казаться раздвоенными.
Также при инсульте могут наблюдаться и другие симптомы:
- Головокружение из-за поражения вестибулярных центров нервной системы.
- Нарушение зрения: двоение предметов, сужение или выпадение полей зрения.
- Онемение конечностей с одной стороны.
- Слабость в половине тела.
- Нарушение глотания и речи. Так, больной начинает невнятно выговаривать слова, заикаться, а в некоторых случаях и вовсе не может ничего сказать.
- Изменение походки и нарушение координации. В этом состоянии больному тяжело даже самостоятельно встать.
- Во время потери сознания могут появляться судороги.
В тяжёлых случаях врачи отмечают такие признаки инсульта, как кратковременная потеря памяти и коматозное состояние.
В отличие от ишемического инсульта, возникающего из-за нарушения тока крови по какой-либо мозговой артерии, геморрагический инсульт развивается в результате разрыва кровеносного сосуда. Эти виды инсульта различаются по проявлениям и требуют различной лечебной стратегии. Самые яркие симптомы геморрагического инсульта — внезапная сильная головная боль. Этот вид инсульта встречается в 20 % случаев всех инсультов [9].
По глубине неврологического дефекта и времени регрессирования неврологической симптоматики выделяют:
- транзиторную ишемическую атаку — полное восстановление происходит в течение 24 часов;
- малый инсульт — клинические симптомы исчезают в течение трёх недель, то есть когда завершается цикл патогенетических изменений в очаге ишемии;
- завершившийся инсульт — сохранение симптомов более трёх недель [11].
Клиническая картина инсульта зависит от пострадавшего сосуда и уровня развившейся закупорки.
Поражение средней мозговой артерии (СМА)
Непроходимость СМА по причине эмболии или стеноза нарушает движение крови во всём регионе данной артерии и выражается:
- полным или частичным расстройством речи (афазией);
- параличом мышц одной половины тела (гемиплегией);
- снижением чувствительности одной половины тела (гемигипестезией);
- невозможностью содружественного движения глаз в горизонтальном направлении (парезом взора) контрлатерально.
В случае закупорки верхних ветвей СМА возникает расстройство речи (афазия) вследствие поражения двигательного центра мозга (центр Брока) с гемипарезом конечностей преимущественно руки и мимической мускулатуры нижней половины лица с противоположной стороны от поражённого полушария головного мозга.
Если непроходимы нижние ветви СМА, то развивается нарушение восприятия речи (афазия Вернике) с нарушением движений руки и мимических мышц нижней трети лица контрлатерально от поражённого полушария головного мозга.
Поражение передней мозговой артерии (ПМА)
Эмболия ПМА вызывает:
- слабость конечностей (гемипарез) с противоположной стороны, при этом в ноге слабость больше, чем в руке;
- симптом Робинсона (безусловный хватательный рефлекс), увеличение пирамидного тонуса мышц, апраксия контрлатерально (нарушение движений по своей цели — например, больной подносит стакан с водой не ко рту, а к уху);
- нарушение волевого импульса (абулию);
- потерю способности ходить или стоять (абазию);
- назойливое повторение фразы, действия или эмоции (персеверацию);
- недержание мочи.
Иногда обе ПМА отходят от единого ствола, и если происходит его закупорка, то развиваются тяжёлые неврологические расстройства.
Бывают клинические случаи, когда непроходимость ПМА не проявляется неврологической симптоматикой, так как есть анастомоз (соединения артерий внутри черепа между собой и соединение внутренних и наружных артерий).
Поражение сонной артерии (СА)
Стенозирование СА и разрушение атеросклеротических бляшек становится причиной эмболов.
Иногда окклюзия СА не вызывает неврологическую симптоматику по причине компенсированного коллатерального кровообращения.
Если же очаговые неврологические нарушения возникли, то они являются следствием падения кровотока в бассейне СМА или её части.
Выраженный стеноз ВСА и дефицит коллатерального кровообращения поражают конечные отделы СМА, ПМ, а иногда и ЗМА.
Поражение задней мозговой артерии (ЗМА)
Причиной закупорки ЗМА может быть как эмболия, так и тромбоз. Чаще возникают неврологические симптомы:
- альтернирующий гемипарез или гемиплегия;
- верхнеквадрантная двухсторонняя слепота в половине полей зрения,
- амнезия;
- дислексия (проблемы с чтением) без дисграфии (навыки письма в норме);
- амнестическая афазия (в том числе и цветовая);
- парез (паралич) глазодвигательного нерва на своей стороне;
- непроизвольные движения и атаксия (несогласованные движения при отсутствии мышечной слабости) на противоположной от очага поражения стороне.
Поражение артерий вертебро-базилярного бассейна (ВББ)
Причиной ухудшения кровотока в ВББ становится атеросклероз, тромбоз или эмболия.
Окклюзия ветвей основной (базилярной) артерии (БА) вызывает дисфункцию моста ствола мозга и мозжечка с одной стороны.
На стороне инсульта развивается атаксия, слабость мимических мышц лица, мышц глаза, нистагм (неконтролируемые колебательные движения глаз), головокружение, гиперкинез мягкого нёба, ощущение движения предметов в пространстве, а противоположно — слабость конечностей и гипестезия. При полушарном инсульте на своей стороне — парез взора, с противоположной — слабость конечностей, на стороне очага — слабость мимических мышц лица, мышц глаза, нистагм, головокружение, тошнота, рвота, потеря слуха или шум в ушах, гиперкинез мягкого нёба и ощущение движения предметов в пространстве.
Процесс стенозирования или закупорки ствола основной БА проявляется двухсторонней очаговой неврологической симптоматикой в виде тетраплегии, парезом взора в горизонтальной плоскости, мозговой комой или дэкортикальным синдромом. Такая же клиника будет и при окклюзии двух позвоночных артерий и при поражении доминирующей позвоночной артерии, если через неё шло основное кровоснабжение мозговых структур. Окклюзия основной артерии вызывает смерть от дисфункции дыхательного центра в стволе ГМ.
Стенозирование и закупорка позвоночных артерий(ПА), проходящих в черепе, даёт неврологическую очаговую симптоматику, свойственную клинике дисфункции продолговатого мозга, в виде головокружения, дисфагии (расстройства глотания), сиплости голоса, симптома Горнера и падением чувствительности на своей стороне, а с противоположной стороны нарушена болевая и температурная чувствительность. Похожая симптоматика возникает и при поражении задненижней мозжечковой артерии (ЗМА).
Инфаркт мозжечка (ИМ)
Инфаркт мозжечка проявляется нистагмом (неконтролируемыми колебательными движениями глаз), нарушением координации движений, головокружением, тошнотой, рвотой.
Лакунарные инфаркты (ЛИ)
ЛИ в большинстве случаев возникают у людей, страдающих сахарным диабетом и гипертонической болезнью, по причине липогиалинозного поражения с закупоркой лентикулостриарных артерий головного мозга.
Закупорка таковых сосудов ведёт к формированию небольших глубинно расположенных ЛИ с последующим образованием кисты на этом месте.
Эмболия или атеросклеротическая бляшка может также перекрыть сосуд. Течение ЛИ может быть бессимптомным или проявляться собственным симптомокомплексом.
Инсульт спинного мозга
Состояние, при котором нарушается кровообращение спинного мозга, называют инсультом спинного мозга. Это заболевание редкое, также имеет геморрагическую и ишемическую разновидности. Предвестники инсульта:
- острая спинная боль, на фоне которой появляется слабость конечностей, нарушается их чувствительность;
- перестают естественно функционировать некоторые внутренние органы, чаще всего проявляется сбоем дефекации, мочеиспускания;
- паралич рук и ног, а также ощущение боли в них.
Признаки комы
В некоторых случаях после болезни развивается кома, её симптомы:
- внезапная потеря сознания;
- лицо приобретает багровый цвет;
- дыхание громкое, слышны хрипы;
- напряжённый пульс, увеличено давление;
- сужение зрачков и их вялая реакция на свет;
- снижение мышечного тонуса;
- недержание мочи.
Инсульт может привести к непоправимым последствиям, свидетельствовать о которых будут:
- полное отсутствие какой-либо реакции при попытках приведения человека в чувства;
- снижение температура тела;
- отсутствует реакция зрачков.
Патогенез ишемического инсульта
Главным фактором, определяющим последствия окклюзирующего процесса питающих мозг артерий, является не величина выключенной артерии и даже не её роль в кровоснабжении мозга, а состояние коллатерального кровообращения.
При хорошем его состоянии полная закупорка даже нескольких сосудов может протекать почти бессимптомно, а при плохом стеноз сосуда вызывает выраженные симптомы.[11]
Последовательность изменений ткани мозга после инсульта принято некоторыми авторами рассматривать как «ишемический каскад», который заключается в:
- снижении мозгового кровотока;
- глутаматной эксайтотоксичности (цитотоксическое действие возбуждающих медиаторы глутамата и аспартата);
- внутриклеточном накоплении кальция;
- активации внутриклеточных ферментов;
- повышении синтеза NO и развитии оксидантного стресса;
- экспрессии генов раннего реагирования;
- отдалённых последствиях ишемии (реакция местного воспаления, микроваскулярные нарушения, повреждение гематоэнцефалического барьера):
- апоптозе (генетически запрограммированной клеточной гибели).
При локальной ишемии мозга происходит формирование зоны вокруг участка с необратимыми изменениями — «ишемической полутени» (пенумбра). Кровоснабжение в ней ниже уровня, который необходимим для нормального функционирования, но выше, чем критический порог необратимых изменений. Морфологические изменения в области пенумбры не наблюдаются. Гибель клеток приводит к расширению зоны инфаркта. Однако эти клетки на протяжении определённого времени способны сохранять свою жизнеспособность. Окончательно зона инфаркта формируется спустя 48-56 часов.
Классификация и стадии развития ишемического инсульта
Согласно МКБ-10 выделяют следующие виды ишемического инсульта (по причине):
- инфаркт мозга (ИМ), вызванный тромбозом прецеребральных артерий;
- ИМ, вызванный эмболией прецеребральных артерий;
- ИМ, вызванный неуточнённой закупоркой или стенозом прецеребральных артерий;
- ИМ, вызванный тромбозом мозговых артерий;
- ИМ, вызванный эмболией мозговых артерий;
- ИМ, вызванный неуточнённой закупоркой или стенозом мозговых артерий;
- ИМ, вызванный тромбозом вен мозга, непиогенный;
- другой ИМ;
- ИМ неуточнённый.
По локализации инсульта выделяют:
- поражение внутренней сонной артерии;
- поражение позвоночных артерий и их ветвей, основной артерии и ветви;
- средней мозговой артерии;
- передней мозговой артерии;
- задней мозговой артерии.
По стороне поражения:
- правой половине головного мозга — страдают преимущественно двигательные функции,нарушение движения в левых конечностях;
- в левой половине головного мозга — характерны проблемы с логикой, речью, заторможенность, нарушение движения в правых конечностях.
По характеру поражения:
- лёгкой степени тяжести — неврологическая симптоматика выражена незначительно, регрессирует в течение трёх недель;
- средней степени тяжести — преобладание очаговой неврологической симптоматики над общемозговой, отсутствуют расстройства сознания;
- тяжёлый инсульт — протекает с выраженными общемозговыми нарушениями, угнетением сознания, грубым очаговым неврологическим дефицитом.
Осложнения ишемического инсульта
Возникающие осложнения при инсульте определены тяжёлым состоянием больного и ограниченной его возможностью к самостоятельному обслуживанию и передвижению.
Возможные осложнениями ишемического инсульта:
- Тромбоэмболия лёгочной артерии — тяжелейшее осложнение инсульта. С целью профилактики, больному надевают ортопедические компрессионные чулки или применяют специальные устройства для пневмокомпресси ног.
- Пневмония. Профилактика этого осложнения направлена на поддержание свободного состояния верхних дыхательных путей, уход за полостью рта, поворачивание больного каждые два часа во избежание застоя в лёгких, своевременное назначение антибиотиков.
- Пролежни — серьёзная проблема для больных, переносящих инсульт. Профилактику пролежней необходимо начинать с первых дней заболевания. Для этого необходимо следить за чистотой белья, устранять складки на постельном белье, обрабатывать тело комфортным спиртом, присыпать тальком складки кожи, подкладывать круги под крестец и пятки. Профилактика пролежней требует поворота больного с интервалом не реже 2-3 часов.
- Контрактура — ограничение движения в суставе. Профилактику контрактур начинают при первой возможности, выполняя пассивные движения парализованными конечностями. Во избежание развития мышечных контрактур при наличии гемипареза или гемиплегии парализованные конечности укладывают в положении, противоположном обычной позе Вернике-Манна [3].
- Потеря памяти или проблемы с мышлением. Многие люди, перенесшие инсульт, испытывают потерю памяти, у других возникают трудности с мышлением, проблемы с речью, в том числе с её пониманием, чтением или письмом.
- Эмоциональные проблемы. Людям, перенесшим инсульт, труднее контролировать свои эмоции или у них может развиться депрессия и изменения в поведении [10].
Также необходимо следить за мочеиспусканием, вовремя катетеризировать мочевой пузырь. В случае запора назначают клизму.
При стабилизации общего состояния проводят пассивную гимнастику, общий массаж мышц. По мере стабилизации переходят к обучению больных сидению, самостоятельному стоянию, ходьбе и навыкам самообслуживания.
Диагностика ишемического инсульта
Анамнез и клиническая картина дают достаточно данных для постановки диагноза, но для дифференциального диагноза необходимы дополнительные исследования, так как правильно выставленный диагноз в случае инсульта — залог своевременной и квалифицированной помощи.
Важно на ранней стадии заболевания отличить ишемический инсульт от кровоизлияния, а также от кровоизлияния в область ишемического инсульта. Для достижения этих целей проводят компьютерную томографию (КТ).
Высокочувствительным методом диагностики ишемического инсульта в начале заболевания является магнитно-резонансная томография (МРТ), но, по сравнению с КТ, она менее чувствительна к острым состояниям, особенно если есть кровоизлияние. С помощью МРТ можно увидеть артерии головного мозга, не используя контраст, что значительно безопасней, чем контрастная ангиография.
КТ в остром периоде (до суток) ишемического инсульта менее чувствительна, так как с её помощью в этом периоде невозможно оценить ишемический инсульт, его часто просто не видно. КТ при поступлении пациента в стационар проводят с целью исключения геморрагического инсульта и проведения тромболитической терапии. А вот с помощью МРТ можно распознать как ишемический, так и геморрагический инсульты на любых сроках.
Спинномозговая пункция может дать диагностическую информацию, если нет аппаратов МРТ или КТ. Субарахноидальные кровоизлияния и внутримозговые кровоизлияния могут дать кровь в спинномозговой жидкости (СМЖ). Однако она не всегда попадает в СМЖ. Например, при небольших паренхиматозных или геморрагических кровоизлияниях кровь появится в СМЖ через двое-трое суток. Иногда при спинномозговой пункции в ликвор попадает сопутствующая кровь, поэтому при сомнении следует набрать ликвор в несколько пробирок. При лабораторном анализе выявится уменьшение эритроцитов в каждой последующей пробирке.
При планировании операции используют церебральную ангиографию. Это надёжный и хорошо апробированный метод, особенно если используется доступ через плечевую или бедренную артерии.
Позитронно-эмиссионная томография позволяет увидеть инсульт до КТ по мозговому метаболизму, но метод малодоступен.
Чреспищеводная ЭхоКГ (исследование сосудов и сердца посредством ввода специального датчика в пищевод) обнаруживает источник эмболии в крупном сосуде: изъязвленную бляшку, пристеночный тромб.
Мерцательная аритмия с пароксизмами может спровоцировать эмболию, но не проявляться клинически — выявляется холтеровским мониторингом ЭКГ.
Лечение ишемического инсульта
Общие мероприятия
При лечении ишемического инсульта принято не снижать артериальное давление быстро, если оно высокое, особенно в первые дни заболевания. Низкое артериальное давление следует повысить — этим занимаются врачи, не давайте самостоятельно пациенту никаких лекарств.
Несдерживаемая сильная рвота — частая проблема в периоде сразу после инсульта, особенно при поражении в бассейне основной артерии. Это создаёт проблемы в питании больного. Если рвота не прекращается, или есть дисфагия, то ставят зонд для питания. Нехватку электролитов восполняют инфузионной терапией. Следует внимательно отслеживать проходимость дыхательных путей.
Тромболитическая терапия
Тромболитическая терапия — это единственная терапия ишемического инсульта в остром периоде, эффективность которой доказана в крупных исследованиях.
С момента появления первых симптомов инсульта до введения тромболитика должно пройти не более 4,5 часов, поэтому важна быстрая госпитализация.
Окклюзия сосудов происходит в артериальном или венозном русле. Тромботические лекарства растворяют тромб, но препарат необходимо доставить в зону тромбоза.
Тромболитические средства впервые появились в 40-х годах XX века. Активная разработка лекарств этой группы привела к тому, что в настоящее время выделяют пять поколений тромболитиков:
- Первые тромболитики — это природные вещества, которые переводят плазмаген в плазмин, тем самым вызывают активное кровотечение. Выделяют эти ингредиенты из крови. Данную группу лекарств используют редко, так как возможно сильное кровотечение. К этому поколению относят: Фибринолизин, Стрептокиназа, Урокиназа, Стрептодеказа, Тромбофлюкс.
- Второе поколение — это вещества, полученные на основе достижений генной инженерии с помощью бактерий. Это поколение лекарств хорошо изучено, у них практически отсутствуют побочные эффекты. Действуют непосредственно на тромбы. К этому поколению относят: Алтеплаза, Актилизе, Проурокиназа, Гемаз. Пуролаза, Метализе.
- Третье поколение — эти препараты способны быстро находить тромб и более продолжительно на него воздействовать. Максимально эффективны в первые три часа: Ретеплаза, Тенектеплаза, Ланотеплаза, Антистреплаза, Антистрептолаза.
- Четвёртое поколение — эти препараты находятся в разработке, отличаются быстрым и интенсивным воздействием на тромб. Недостаточно изучены.
- Пятое поколение — это совмещение натуральных и рекомбинантных активных веществ.
В фазе восстановления, когда состояние больного практически всегда в той или иной степени улучшается, важное значение имеет логопедическая помощь, а также трудотерапия и ЛФК.
Инфузионная терапия
Антикоагулянты (гепарин и непрямые антикоагулянты) назначают только тогда, когда предписания врача заведомо будут выполняться, и есть возможность следить за свёртываемостью крови [8].
Антикоагулянты
Антикоагулянты препятствуют образованию нитей фибрина и тромбообразованию, способствуют прекращению роста уже образовавшихся тромбов, а также воздействию на тромбы эндогенных фибринолитических ферментов [11].
Лечение антикоагулянтами может быть начато только после исключения внутримозгового кровотечения.
Прямые коагулянты: гепарин и его производные, прямые ингибиторы тромбина, а также селективные ингибиторы фактора Х (Фактор Стюарта — Прауэра — одного из факторов свёртывания крови).
Непрямые антикоагулянты:
- Антагонисты витамина К: фениндион (фенилин), варфарин (варфарекс), аценокумарол (синкумар);
- Гепарин и его производные: гепарин, антитромбин III, далтепарин (фрагмин), эноксапарин (анфибра, гемапаксан, клексан, эниксум), надропарин (фраксипарин), парнапарин (флюксум), сулодексид (ангиофлюкс, вессел дуэ ф), бемипарин (цибор);
- Прямые ингибиторы тромбина: бивалирудин (ангиокс), дабигатрана этексилат (прадакса);
- Селективные ингибиторы фактора Х: апиксабан (эликвис), фондапаринукс (арикстра), ривароксабан (ксарелто).
Антиагреганты
Назначение антиагрегантов позволяет улучшить прохождение жидкости в тканях мозга и предотвратить развитие острого нарушения кровоснабжения головного мозга [6].
Антиагреганты не позволяют тромбоцитам склеиваться, тем самым препятствуют формированию тромбов.
Классификация антиагрегантов по механизму действия:
- аспирин, индобуфен, трифлюза (прекращают действие циклооксигеназы-1, ЦОГ-1);
- тиклопидин, клопидогрел, празугрел, тикагрелор, кангрелор (прекращают работу рецептора АДФ Р2Y12 на тромбоцитарных мембранах);
- абциксимаб, монофрам, эптифибатид, тирофибан; ксимелофибан, орбофибан, сибрафибан, лотрафибан и другие (антагонисты гликопротеинов (GP) Iib/IIIa);
- дипиридамол и трифлюзал (ингибиторы цАМФ фосфодиэстеразы);
- илопрост (усилитель аденилатциклазы);
- ифетробан, сулотробан и другие (подавляют рецептор ТХА2/PGH2);
- атопаксар, ворапаксар (противодействуют рецептору AR (protease activated receptors) тромбина).
Аспирин — часто используемый препарат из этой группы. Если антикоагулянты противопоказаны, то можно использовать антиагреганты.
В недавнем исследовании было выявлено, что пациенты, которые принимали тирофибан (агграстат), лучше восстанавливались после инсульта без непроходимости крупных или средних сосудов головы, чем те, кто принимал аспирин [12].
Хирургическое лечение
Каротидная эндартерэктомия — это профилактическая хирургическая операция, которая проводится с целью удаления атеросклеротических бляшек из arteria carotis communis (общей сонной артерии).
При развитии мозжечкового инсульта со сдавлением ствола мозга с целью сохранить жизнь больного выполняют хирургическую операцию для снятия внутричерепного давления в задней черепной ямке.
Противоотёчная терапия
По поводу применения кортикостероидов при ишемическом инсульте существуют разные и достаточно противоположные мнения, но всё же они активно пользуются врачами для уменьшения отёка мозга: назначают дексаметазон 10 мг внутривенно струйно или внутримышечно, затем по 4 мг внутривенно или внутримышечно каждые 4-6 часов.
Осмотические средства. Маннитол — повышает осмолярность плазмы, тем самым жидкость из тканей, в том числе и из головного мозга, перемещается в кровяное русло, создаётся выраженный мочегонный эффект, и из организма выводится большое количество жидкости. Отмена может дать рикошетный эффект.
Противосудорожные средства
Их необходимо назначать при развитии ишемического инсульта с эпилептическими припадками.
Реабилитация после инсульта
Реабилитационные мероприятия начинают уже в раннем периоде заболевания и продолжают после выписки из стационара. Они включают в себя не только проведение медикаментозного лечения, массажа, лечебной физкультуры, логопедических занятий, но и требуют привлечения других специалистов по психологической, социальной и трудовой реабилитации.
Наряду с восстановлением нарушенных функций, реабилитация включает:
- профилактику постинсультных осложнений;
- профилактику повторных инсультов.
Основные принципы реабилитации после инсульта:
- раннее начало реабилитационных мероприятий;
- систематичность и длительность, что возможно при хорошо организованном поэтапном построении реабилитации;
- включение в реабилитационный процесс специалистов различных профилей, индивидуализация реабилитационных программ;
- активное участие в реабилитационном процессе самого больного, его близких и родных.
Длительность реабилитации определяется сроками восстановления нарушенных функций. Восстановление двигательных функций происходит в основном в первые 6 месяцев после инсульта. В этот период проведение интенсивной двигательной реабилитации наиболее эффективно. Восстановительное лечение больных с афазией должно быть более длительным и проводиться в течение первых 2-3 лет после инсульта.
Комплексность реабилитации состоит в использовании не одного, а нескольких методов, направленных на преодоление дефекта.
При двигательных нарушениях комплекс реабилитации включает:
- методы кинезотерапии (пассивную и активную гимнастику, обучение ходьбе и навыкам самообслуживания);
- коррекцию нарушения двигательной функции с помощью биологической обратной связи и электростимуляцию с помощью обратной связи;
- методы преодоления спастичности и лечение артропатий.
При речевых нарушениях основным являются регулярные занятия со специалистом по восстановлению речи, чтения и письма (логопедом-афазиологом или нейропсихологом).
Наиболее оптимальна следующая модель этапной реабилитации после инсульта:
1-й этап — реабилитация начинается в ангионеврологическом (или в обычном неврологическом отделении клинической больницы), куда больной доставляется машиной скорой помощи;
2-й этап — по окончании острого периода (первые 3-4 недели) возможны следующие варианты направления больных:
- 1-й вариант — больной с полным восстановлением нарушенных функций выписывается на амбулаторное долечивание или переводится в санаторий;
- 2-й вариант — больной с выраженным двигательным дефицитом, к концу острого периода ещё самостоятельно не передвигающийся или передвигающийся с большим трудом, нуждающийся в посторонней помощи при самообслуживании, переводится в реабилитационное отделение той больницы, куда он был доставлен машиной скорой помощи;
- 3-й вариант — больные с умеренным и лёгким двигательным дефектом, самостоятельно передвигающиеся в пределах больницы, элементарно обслуживающие себя, переводятся в реабилитационный центр. В реабилитационный центр переводятся также больные, которые за время пребывания в реабилитационном отделении больницы (2-й вариант) научились самостоятельно ходить и элементарно обслуживать себя в быту.
3-й этап — амбулаторная реабилитация: реабилитация в специальных реабилитационных санаториях и на дому.
Амбулаторную реабилитацию осуществляют на базе реабилитационных отделений поликлиник или восстановительных кабинетов или в форме «дневного стационара» при реабилитационных отделениях больниц и реабилитационных центрах. В реабилитационных санаториях могут находиться больные, полностью себя обслуживающие и самостоятельно передвигающиеся не только в помещении, но и вне его. Тем больным, которые не могут самостоятельно добраться до поликлиники или дневного стационара, реабилитационную помощь (занятия с методистом лечебной физкультуры и занятия по восстановлению речи) оказывают на дому, обязательно обучая родственников.
Противопоказания и ограничения к проведению активной реабилитации
Следующие сопутствующие заболевания ограничивают или препятствуют проведению активной двигательной реабилитации:
- частые приступы стенокардии;
- сердечная недостаточность;
- высокое и плохо снижаемое артериальное давление;
- хронические лёгочные заболевания: бронхиальная астма с частыми приступами, обструктивный бронхит;
- тяжёлые формы сахарного диабета;
- рак;
- острые воспалительные заболевания;
- некоторые болезни и патологии опорно-двигательного аппарата: тяжёлые артриты и артрозы, ампутированные конечности.
Психозы, выраженные когнитивные нарушения (деменция) являются ограничением для проведения не только двигательной, но и речевой реабилитации.
Существуют ограничения для восстановительного лечения в обычных реабилитационных центрах: крайне ограниченная подвижность больных (отсутствие самостоятельного передвижения и самообслуживания), нарушение контроля функций тазовых органов, нарушение глотания. Реабилитацию таким больным, а также пациентам с выраженными сердечной и лёгочной патологиями проводят в реабилитационных отделениях, расположенных на базе крупных клинических многопрофильных больниц, по специальным реабилитационным программам.
Прогноз. Профилактика
Прогноз для жизни больного зависит от:
- зоны поражения и объёма мозга, «выключенного» ишемическим процессом;
- наличия сопутствующих заболеваний, не позволяющих организму справиться с этим тяжёлым заболеванием.
По данным ВОЗ (Всемирной Организации Здравоохранения), от 20 до 50 % пациентов после инсульта умирают в течение первого месяца. Смертность зависит от типа инсульта, тяжести, возраста, сопутствующей патологии и эффективности лечения осложнений [7].
Профилактика. Принято считать, что здоровый образ жизни, нормированный труд и своевременный отдых значительно снижают риск заболевания ишемическим инсультом.
К факторам, провоцирующим инсульт, относят гипертоническую болезнь, курение табака, атеросклероз, сахарный диабет, кардиальную патологию, болезни свёртывающей системы крови, системные заболевания соединительной ткани.
Своевременно начатая реабилитация, снижает риск инвалидизации и значительно улучшает качество жизни.
За дополнение статьи благодарим врача-невролога Маркова Сергея Анатольевича.