Описание препарата Пролиа® (раствор для подкожного введения, 60 мг/мл) основано на официальной инструкции, утверждено компанией-производителем в 2019 году
Дата согласования: 03.10.2019
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Отзывы
Действующее вещество
ATX
Фармакологическая группа
Состав
| Раствор для подкожного введения | 1 мл |
| каждый предварительно заполненный шприц (ПЗШ) содержит | |
| активное вещество: | |
| деносумаб | 60 мг |
| вспомогательные вещества: сорбитол (Е420) — 47 мг; уксусная кислота ледяная — 1 мг; полисорбат 20 — 0,1 мг; натрия гидроксид — до рН 5–5,5; вода для инъекций — до 1 мл |
Описание лекарственной формы
Прозрачная жидкость, от бесцветного до светло-желтого цвета, практически свободная от видимых включений.
Фармакологическое действие
Фармакологическое действие
—
корректирующее метаболизм костной и хрящевой ткани.
Фармакодинамика
Механизм действия. Деносумаб представляет собой полностью человеческое моноклональное антитело (IgG2), обладающее высокой аффинностью и специфичностью к RANKL (лиганд к рецептору RANK), и тем самым препятствует активации этих рецепторов RANK на поверхности остеокластов и их предшественников. Предотвращение связывания лиганда RANK с рецептором RANK ингибирует созревание, функционирование и выживаемость остеокластов, что уменьшает костную резорбцию в кортикальном и губчатом слое кости.
Фармакодинамические эффекты.Терапия препаратом Пролиа® приводила к быстрому снижению скорости ремоделирования костной ткани, достигая минимальных (снижение на 85%) показателей концентрации маркера резорбции костной ткани — сывороточных С-телопептидов (СТХ) I типа в течение 3 дней. Снижение концентрации СТХ сохранялось в интервале между введениями препарата. В конце каждого интервала дозирования степень снижения концентрации СТХ частично нивелировалась приблизительно до ≥45% по сравнению с максимальным снижением концентрации СТХ ≥87% (диапазон — 45–80%), что отражает обратимость эффектов препарата Пролиа® в отношении костного метаболизма при снижении концентрации препарата в сыворотке. Эти эффекты сохранялись на протяжении всего периода терапии. Концентрации маркеров костной резорбции обычно достигали исходных значений, наблюдавшихся до начала терапии, в течение 9 мес после введения последней дозы препарата. После возобновления терапии препаратом степень снижения концентрации СТХ была сходна со степенью снижения концентрации СТХ в начале курса лечения деносумабом.
Иммуногенность. В клинических исследованиях не наблюдалось продукции нейтрализующих антител к деносумабу. Используя метод чувствительного иммунологического анализа, было показано, что у <1% пациентов, получавших деносумаб на протяжении до 5 лет, регистрировались ненейтрализующие связывающие антитела при отсутствии признаков изменения параметров фармакокинетики, токсичности или клинического ответа.
Дети. Европейское агентство по оценке ЛС отказалось от требования предоставить результаты исследований препарата Пролиа® во всех субпопуляциях пациентов детского возраста для лечения потери костной массы, на фоне аблативной терапии половыми гормонами, а также в субпопуляции детей в возрасте младше 2 лет для лечения остеопороза. Информация о применении препарата у детей приведена в разделе «Способ применения и дозы».
Фармакокинетика
Всасывание. После п/к введения в дозе 1 мг/кг, приблизительно соответствующей зарегистрированной дозе 60 мг, значения AUC составили 78% по сравнению с в/в введением препарата в той же дозе. При п/к введении препарата в дозе 60 мг Cmax деносумаба в сыворотке крови составляла 6 мкг/мл (диапазон — 1–17 мкг/мл) и достигалась в течение 10 дней (диапазон — 2–28 дней).
Метаболизм. Деносумаб состоит только из аминокислот и углеводов в виде нативного Ig, и элиминация с помощью печеночных метаболических механизмов маловероятна. Поэтому предполагается, что выведение препарата происходит стандартными путями расщепления Ig, результатом которых является распад до малых пептидов и отдельных аминокислот.
Выведение. После достижения Cmax деносумаба в сыворотке крови концентрация препарата снижается с T1/2 26 дней (размах вариации — 6–52 дня) в течение 3 мес (диапазон — 1,5–4,5 мес). У 53% пациентов через 6 мес после введения последней дозы деносумаба его концентрация в крови не поддавалась количественному определению. Не наблюдалось кумулирования препарата или изменения параметров фармакокинетики с течением времени при п/к многократном введении деносумаба в дозе 60 мг в течение 6 мес. Продукция связывающих антител к деносумабу, аналогичная как у мужчин, так и у женщин, не оказывала влияния на параметры фармакокинетики деносумаба. Возраст (28–87 лет), раса и стадия заболевания (низкая костная масса, остеопороз, рак предстательной железы или рак молочной железы) не оказывают значительного влияния на параметры фармакокинетики деносумаба. Наблюдалась тенденция к снижению экспозиции препарата (AUC и Cmax) с повышением массы тела. Однако данная тенденция не расценивалась как клинически значимая, поскольку фармакодинамические эффекты (оценка которых осуществлялась по значениям концентраций маркеров метаболизма костной ткани и повышения МПКТ) были аналогичны в широком диапазоне значений массы тела.
Линейность фармакокинетики. В исследованиях применения деносумаба в различных дозах была продемонстрирована нелинейная дозозависимая фармакокинетика, со снижением клиренса препарата при увеличении дозы или концентрации; однако приблизительно дозопропорциональное увеличение экспозиции наблюдалось при применении доз 60 мг и выше.
Отдельные группы пациентов
Дети. Фармакокинетика препарата у детей не оценивалась.
Почечная недостаточность. В исследовании у 55 пациентов с различной степенью тяжести почечной дисфункции, включая пациентов, получавших диализную терапию, было показано, что степень выраженности почечной недостаточности не влияла на параметры фармакокинетики деносумаба.
Печеночная недостаточность. Не проводилось специальных исследований у пациентов с печеночной недостаточностью. Как правило, моноклональные антитела не выводятся при помощи печеночных метаболических механизмов. Предполагается, что печеночная недостаточность не оказывает влияния на параметры фармакокинетики деносумаба.
Показания
лечение постменопаузного остеопороза и остеопороза у мужчин при повышенном риске переломов. У женщин в постменопаузе Пролиа® значительно снижает риск вертебральных, невертебральных переломов и переломов бедра;
лечение потери костной массы у женщин, получающих терапию ингибиторами ароматазы по поводу рака молочной железы, и мужчин с раком предстательной железы, получающих гормондепривационную терапию, при повышенном риске переломов. У мужчин с раком предстательной железы, получающих гормондепривационную терапию, Пролиа® значительно снижает риск вертебральных переломов;
лечение потери костной массы, связанной с длительной терапией системными глюкокортикоидами, у взрослых пациентов при повышенном риске переломов.
Противопоказания
гиперчувствительность к любому из компонентов препарата;
гипокальциемия (см. «Особые указания»);
беременность;
период грудного вскармливания;
детский возраст до 18 лет.
Применение при беременности и кормлении грудью
Данные о применении деносумаба в период беременности ограничены. В исследованиях на животных была продемонстрирована репродуктивная токсичность препарата. Препарат Пролиа® не следует применять в период беременности и репродуктивном периоде у женщин, не использующих контрацептивы. Женщинам рекомендуется избегать наступления беременности во время терапии и минимум 5 мес после завершения терапии препаратом. Любые эффекты препарата Пролиа®, вероятно, будут более выражены в течение II и III триместров беременности, поскольку моноклональные антитела проникают через плаценту, и степень их проникновения линейно возрастает по мере увеличения срока беременности, а наибольшие значения отмечаются в течение III триместра.
Неизвестно, проникает ли деносумаб в грудное молоко. В исследованиях на генетически модифицированных мышах с выключенным геном RANKL («нокаутные мыши») было показано, что отсутствие RANKL (мишени деносумаба; см. «Фармакодинамика») в период беременности может оказывать влияние на созревание молочных желез, приводя к нарушению лактации в послеродовом периоде. Решение о необходимости прекращения грудного кормления или прекращения терапии препаратом Пролиа® следует принимать с учетом пользы грудного кормления для ребенка и пользы терапии для матери.
Влияние на фертильность. Данные о влиянии деносумаба на фертильность у человека отсутствуют. Исследования на животных не продемонстрировали прямого или косвенного негативного влияния препарата на фертильность.
Способ применения и дозы
П/к. Введение препарата должно осуществляться лицом, обученным технике выполнения инъекции. Особые меры предосторожности при применении и утилизации — см. «Особые указания».
Доза. Рекомендуемая доза препарата Пролиа® составляет 60 мг, которая вводится путем п/к инъекции 1 раз в 6 мес в бедро, живот или плечо. Во время курса лечения необходимо принимать препараты кальция и витамина D в адекватных дозах (см. «Особые указания»). Оптимальная длительность терапии остеопороза антирезорбтивными препаратами (деносумаб и бисфосфонаты) не установлена. Необходимость продолжения терапии периодически должна переоцениваться с учетом пользы и потенциальных рисков применения деносумаба у каждого конкретного пациента, и в частности через 5 лет и более после начала применения препарата (см. «Особые указания»).
Особые группы пациентов
Дети. Применение препарата Пролиа® у детей (в возрасте до 18 лет) не рекомендуется, поскольку безопасность и эффективность препарата у данной возрастной группы пациентов не установлены. Ингибирование лиганда RANK/RANK (RANKL) в исследованиях на животных ассоциировалось с ингибированием роста костей и отсутствием прорезывания зубов.
Пожилые пациенты (в возрасте ≥65 лет). Коррекции дозы препарата у пожилых пациентов не требуется.
Нарушение функции почек. Не требуется коррекции дозы препарата у пациентов с нарушением функции почек (рекомендации по мониторингу концентрации кальция — см. «Особые указания»). Отсутствуют данные о применении препарата у пациентов с тяжелым нарушением функции почек (СКФ <30 мл/мин) и получающих длительную терапию системными глюкокортикоидами.
Нарушение функции печени. Безопасность и эффективность использования деносумаба у пациентов с нарушением функции печени не установлены (см. «Фармакокинетика»).
Инструкция по использованию предварительно заполненных шприцев с препаратом Пролиа®
Необходимо прочитать данную инструкцию перед использованием препарата Пролиа® в предварительно заполненном шприце с защитным устройством для иглы:
— очень важно, чтобы перед тем, как пациент приступит к самостоятельным инъекциям, его лечащий врач или медицинская сестра подробно проинструктировали его по технике выполнения инъекции;
— Пролиа® вводится п/к (п/к инъекция);
— следует сообщить врачу, если у пациента есть аллергия на латекс (колпачок иглы предварительно заполненного шприца состоит из производного латекса);
— не снимать серый колпачок с иглы предварительно заполненного шприца, пока пациент не готов к инъекции;
— не использовать предварительно заполненный шприц, если он упал на твердую поверхность. Использовать новый предварительно заполненный шприц и сообщить об этом лечащему врачу или медицинской сестре;
— не пытаться активировать защитное устройство предварительно заполненного шприца перед инъекцией;
— не пытаться снять прозрачное защитное устройство с предварительно заполоненного шприца перед инъекцией.
В случае возникновения вопросов по применению препарата следует обращаться к лечащему врачу или медицинской сестре.
Шаг 1. Подготовка шприца
А. Извлечь контурную ячейковую упаковку с предварительно заполненным шприцем из упаковки и подготовить все необходимое для инъекции: спиртовые салфетки, ватный тампон или марлевую салфетку, пластырь и контейнер для острых отходов (не включены в упаковку).
Для более комфортной инъекции оставить предварительно заполненный шприц при комнатной температуре в течение примерно 30 мин перед инъекцией. Тщательно вымыть руки с мылом. Расположить предварительно заполненный шприц и другие необходимые расходные материалы на чистой, хорошо освещенной поверхности.
Не пытаться подогревать шприц в горячей воде или микроволновой печи.
Не оставлять предварительно заполненный шприц под прямыми солнечными лучами.
Не встряхивать предварительно заполненный шприц.
Хранить предварительно заполненный шприц в недоступном для детей месте.
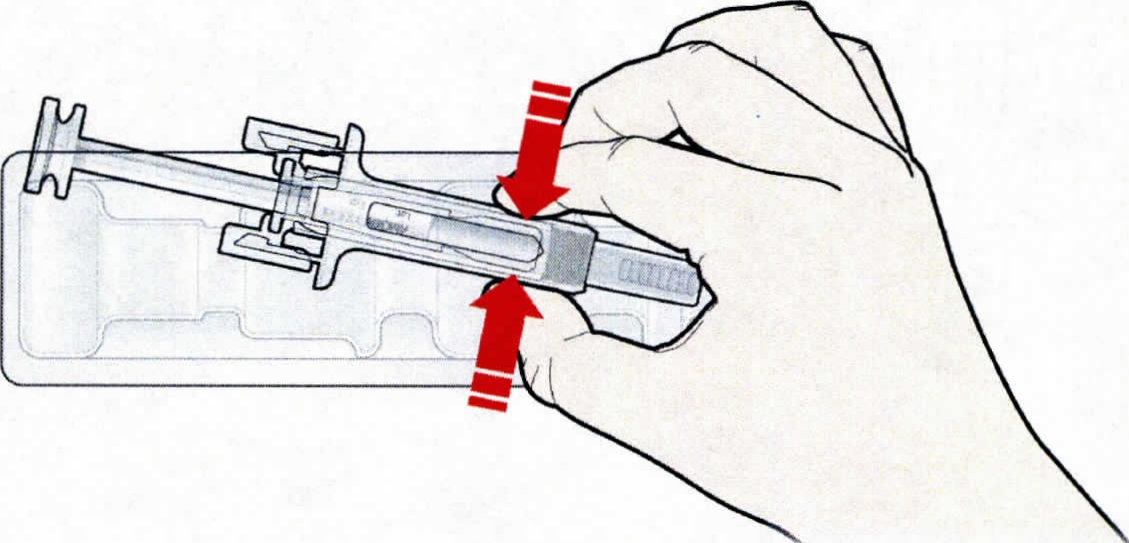
B. Открыть контурную ячейковую упаковку, потянув за этикетку. Для извлечения предварительно заполненного шприца из контурной ячейковой упаковки взяться за защитное устройство.
Взять шприц, как показано на рисунке.
В целях безопасности:
— не браться за плунжер;
— не браться за серый колпачок иглы.
С. Проверить препарат и предварительно заполненный шприц.
Не использовать предварительно заполненный шприц, если:
— препарат мутный или содержит посторонние частицы. Раствор должен быть прозрачным, бесцветным или светло-желтым;
— любая из частей повреждена или сломана;
— серый колпачок иглы отсутствует или неплотно надет;
— истек последний день указанного на этикетке месяца срока годности.
Сообщить лечащему врачу или медицинской сестре обо всех перечисленных случаях.
Шаг 2. Подготовка места инъекции
А. Тщательно вымыть руки. Подготовить и обработать место инъекции.
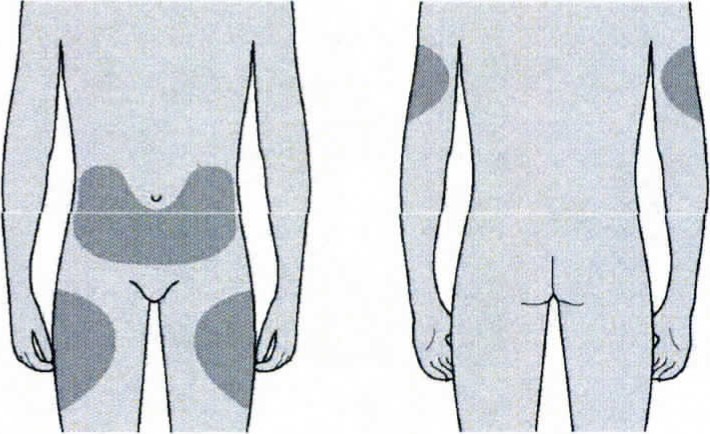
Для инъекции можно использовать верхнюю часть бедра; живот, за исключением области вокруг пупка, примерно 5 см; наружную поверхность плеча (только если инъекцию пациенту делает кто-то другой).
Обработать место инъекции смоченным в спирте тампоном. Дать коже высохнуть.
Не дотрагиваться до места инъекции перед инъекцией.
Не использовать для инъекций области, где кожа тонкая, с гематомой, покрасневшая или жесткая. Избегать инъекций в области со шрамами или растяжками.
B. Осторожно потянуть серый колпачок с иглы без скручивания, по направлению от корпуса шприца.
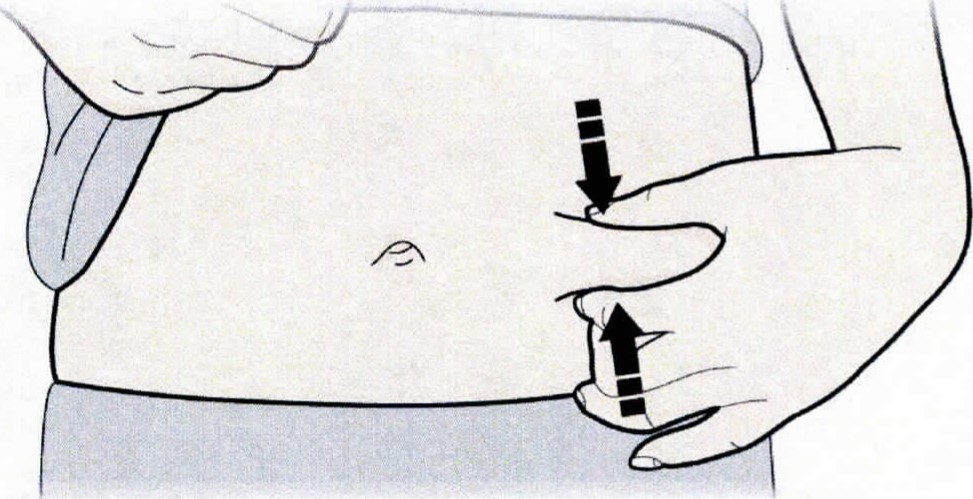
С. Зажать место инъекции для получения упругой поверхности. Важно удерживать кожу зажатой при проведении инъекции.
Шаг 3. Введение
А. Зажать кожу, ввести иглу в кожу. Не дотрагиваться до обработанной области инъекции.
В. Медленно и плавно надавливать на поршень до тех пор, пока пациент не почувствует или не услышит щелчок. Важно надавливать на поршень до щелчка для введения всей дозы.
С. Отпустить большой палец, затем извлечь шприц из кожи. После того, как пациент отпустит поршень, защитное устройство предварительно заполненного шприца покроет иглу. Не надевать серый колпачок иглы обратно на предварительно заполненный шприц.
Шаг 4. Окончание
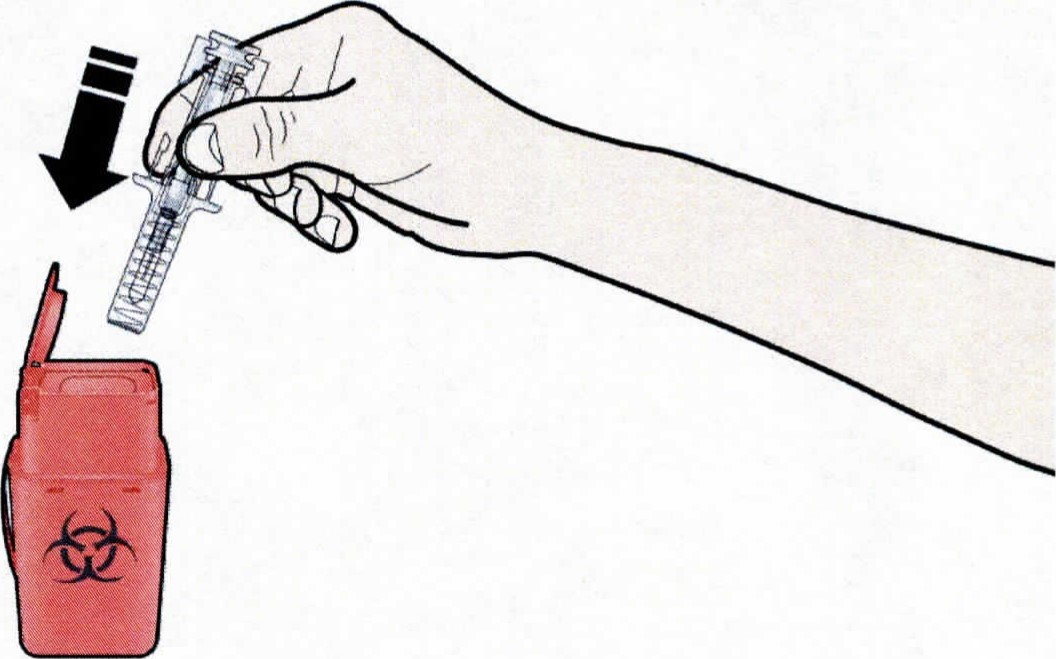
А. Выбросить использованный предварительно заполненный шприц и другие сопутствующие материалы в контейнер для острых отходов. Лекарственные препараты должны быть утилизированы в соответствии с надлежащими требованиями. Спросить у врача или провизора, как уничтожить препарат, если он больше не требуется, не нанося ущерба окружающей среде. Эти меры помогут защитить окружающую среду. Хранить шприцы и сопутствующие материалы в недоступном для детей месте.
Не использовать предварительно заполненный шприц повторно.
Не сдавать предварительно заполненный шприц на переработку и не выбрасывать его с бытовым мусором.
В. Осмотреть место инъекции. Если в месте инъекции выступит кровь, прижать к нему ватный тампон или бинт. Не растирать место инъекции. При необходимости заклеить место инъекции пластырем.
Инструкция по введению препарата Пролиа® в ПЗШ
Здесь приводится информация по правильному проведению инъекции предварительно заполненным шприцем. Очень важно, чтобы перед тем, как пациент приступит к самостоятельным инъекциям, лечащий врач, медицинская сестра подробно проинструктировали пациента по технике выполнения инъекции. Необходимо тщательно вымыть руки перед выполнением инъекции. При возникновении вопросов по технике выполнения инъекции, следует обратиться к лечащему врачу или медицинской сестре.
Перед началом инъекции: внимательно прочитать все инструкции перед использованием предварительно заполненного шприца.
Не использовать ПЗШ, если колпачок был удален.
Как использовать ПЗШ для п/к инъекций?
Пациент должен ввести все содержимое ПЗШ Пролиа® (1 мл) однократно и повторить инъекцию через 6 мес, как назначено лечащим врачом.
Оборудование
Для самостоятельной инъекции пациенту потребуется:
1. Новый предварительно заполненный шприц с препаратом Пролиа®.
2. Спиртовые салфетки или подобные материалы.
Что необходимо сделать до самостоятельного введения Пролиа® п/к?
1. Достать шприц из холодильника. Не брать предварительно заполненный шприц за поршень или защитный колпачок, это может повредить устройство.
2. Предварительно заполненный шприц оставить вне холодильника для достижения комнатной температуры. Это позволит сделать инъекцию более комфортной. Не подогревать предварительно заполненный шприц каким-либо другим способом (например, в микроволновой печи или горячей воде). Не оставлять шприц под прямыми солнечными лучами.
3. Не встряхивать предварительно заполненный шприц.
4. Не снимать колпачок с предварительно заполненного шприца до тех пор, пока пациент не готов к инъекции.
5. Проверить срок годности предварительно заполненного шприца на упаковке. Не использовать предварительно заполненный шприц, если истек последний день указанного на этикетке месяца срока годности.
6. Проверить внешний вид препарата Пролиа®. Раствор должен быть прозрачным, бесцветным или светло-желтым. Если раствор помутнел или окрашен иначе, препарат использовать нельзя.
7. Выбрать комфортное, хорошо освещенное место и чистую поверхность, где можно удобно расположить все необходимые материалы.
8. Тщательно вымыть руки.
Как правильно выбрать место для инъекции?
Лучше всего делать инъекции в верхнюю часть бедра и живот. Если инъекции делает кто-то другой, можно использовать наружную поверхность плеча.
Как правильно сделать инъекцию?
1. Продезинфицировать место инъекции с помощью спиртовой салфетки.
2. Во избежание загиба иглы, аккуратно потянуть колпачок с иглы сразу без скручивания, как показано на рисунках. Не дотрагиваться до иглы и не нажимать на поршень.
3. Если внутри предварительно заполненного шприца видны маленькие пузырьки воздуха, нет необходимости удалять их перед инъекцией. Введение раствора с пузырьками воздуха является безопасным.
4. Зажать кожу (не сдавливая) между большим и указательным пальцами. Ввести иглу в кожу полностью, как показывал доктор или медицинская сестра.
5. Медленно и плавно надавливать на поршень, одновременно придерживая кожную складку. Надавливать на поршень следует до тех пор, пока шприц не опустеет.
6. Извлечь иглу из кожи и отпустить кожную складку.
7. Если выступит кровь в месте инъекционного прокола, аккуратно стереть ее ватным тампоном или салфеткой. Не растирать место инъекции. При необходимости заклеить место инъекции пластырем.
8. Использовать 1 ПЗШ только для одной инъекции. Не использовать оставшийся в шприце препарат.
При возникновении проблем обратиться за помощью или советом к лечащему врачу или медицинской сестре.
Уничтожение использованных шприцев
Не надевать обратно колпачок на использованный шприц.
Хранить использованный шприц в недоступном для детей месте.
Использованный шприц должен быть утилизирован в соответствии с надлежащими требованиями.
Спросить у врача или провизора, как уничтожить препарат, если он больше не требуется, не нанося ущерба окружающей среде.
Побочные действия
Заключение по профилю безопасности препарата
К наиболее частым побочным действиям (отмечавшимися более чем у одного из 10 пациентов) относятся скелетно-мышечные боли и боли в конечностях. Сообщалось о нечастых случаях воспаления подкожно-жировой клетчатки и редких случаях гипокальциемии, гиперчувствительности, остеонекроза челюсти и атипичных переломах бедренной кости (см. «Особые указания» и «Описание отдельных нежелательных реакций»).
Табличный перечень нежелательных реакций
Нежелательные реакции, выявленные в клинических исследованиях II и III фазы у пациентов с остеопорозом и раком молочной железы или раком простаты, получавших гормондепривационную терапию, а также спонтанные сообщения, представлены в таблице ниже. Нежелательные реакции представлены согласно классификации (см. таблицу): очень часто — ≥1/10; часто — ≥1/100 и <1/10; нечасто —≥1/1000 и <1/100; редко — ≥1/10000 и <1/1000; очень редко — <1/10000.
Таблица
Нежелательные реакции, отмечавшиеся у пациентов с остеопорозом и раком молочной железы или раком предстательной железы, получавших гормондепривационную терапию
| Класс системы органов по классификации MedDRA | Частота | Нежелательная реакция |
| Инфекции и инвазии | Часто | Инфекции мочевыводящих путей |
| Часто | Инфекции верхних дыхательных путей | |
| Нечасто | Дивертикулит1 | |
| Нечасто | Воспаление подкожно-жировой клетчатки1 | |
| Нечасто | Инфекции уха | |
| Со стороны иммунной системы | Редко | Реакции гиперчувствительности1 |
| Редко | Анафилактическая реакция1 | |
| Со стороны обмена веществ и питания | Редко | Гипокальциемия1 |
| Со стороны нервной системы | Часто | Ишиас |
| Со стороны ЖКТ | Часто | Запор |
| Часто | Дискомфорт в животе | |
| Со стороны кожи и подкожной клетчатки | Часто | Сыпь |
| Часто | Экзема | |
| Со стороны костно-мышечной системы и соединительной ткани | Очень часто | Боль в конечностях |
| Очень часто | Скелетно-мышечная боль1 | |
| Редко | Остеонекроз челюсти (ОНЧ)1 | |
| Редко | Атипичный перелом бедренной кости1 | |
| Нечасто | Множественные переломы позвоночника (МПП) вследствие отмены лечения препаратом Пролиа®1 | |
| Неизвестно | Остеонекроз наружного слухового прохода2 |
1См. «Описание отдельных нежелательных реакций».
2См. «Особые указания».
В обобщенном анализе данных всех плацебо-контролируемых исследований II и III фазы, сообщалось о развитии гриппоподобного заболевания с частотой 1,2% в группе с деносумабом и 0,7% — в группе плацебо. Этот дисбаланс был установлен в обобщенном анализе данных и не был обнаружен при стратифицированном анализе.
Описание отдельных нежелательных реакций
Гипокальциемия. В двух плацебо-контролируемых исследованиях III фазы у женщин с постменопаузным остеопорозом, приблизительно у 0,05% пациентов (2 из 4050) снижалась концентрация кальция в сыворотке крови (<1,88 ммоль/л) после введения препарата Пролиа®. Не сообщалось о снижении концентрации кальция в сыворотке крови (ниже 1,88 ммоль/л) в двух плацебо-контролируемых клинических исследованиях III фазы у пациентов, получавших гормондепривационную терапию, или в плацебо-контролируемом клиническом исследовании III фазы у мужчин с остеопорозом. В постмаркетинговых исследованиях отмечались редкие случаи тяжелой симптоматической гипокальциемии, преимущественно у пациентов с повышенным риском развития гипокальциемии, получавших препарат Пролиа®; при этом большинство случаев отмечалось в течение первых недель после начала терапии. Примерами клинических проявлений тяжелой симптоматической гипокальциемии являются удлинение интервала QT, тетания, судорожные припадки и изменение психического статуса (см. «Особые указания»). Симптомами гипокальциемии в исследованиях деносумаба являлись парестезия или скованность мышц, мышечные подергивания, спазмы или судорожные сокращения мышц.
Инфекции кожи. Частота сообщений о развитии инфекций кожи в плацебо-контролируемых клинических исследованиях III фазы была идентична у женщин с постменопаузным остеопорозом (в группе лечения препаратом Пролиа® — 1,5%; 59 из 4050, в группе плацебо — 1,2%; 50 из 4041); у мужчин с остеопорозом (в группе плацебо — 0,8%; 1 из 120; в группе с препаратом — 0%; 0 из 120); у пациентов с раком молочной железы и раком предстательной железы, получающих гормондепривационную терапию (в группе плацебо — 1,7%; 14 из 845; в группе лечения препаратом Пролиа®— 1,4%; 12 из 860). Кожные инфекции, требующие госпитализации, были отмечены у 0,1% (3 из 4041) пациентов с постменопаузным остеопорозом в группе плацебо и у 0,4% (16 из 4050) пациентов в группе лечения препаратом Пролиа®. Преимущественно это были случаи воспаления подкожно-жировой клетчатки. О серьезных случаях инфекций кожи сообщалось со сходной частотой в группах плацебо (0,6%; 5 из 845) и группах лечения препаратом Пролиа® (0,6%; 5 из 860) в исследованиях рака молочной железы и рака предстательной железы.
ОНЧ. Отмечались редкие случаи ОНЧ: у 16 из включенных 23148 пациентов, принимавших участие в клинических исследованиях применения препарата у пациентов с остеопорозом, раком молочной железы или раком предстательной железы, получавших гормондепривационную терапию (см. «Особые указания»). 13 из этих случаев ОНЧ отмечались у женщин с постменопаузным остеопорозом, участвовавших в расширенном клиническом исследовании III фазы и продолжавших терапию препаратом Пролиа® в течение до 10 лет. Частота ОНЧ составила 0,04% — в течение 3 лет; 0,06% — в течение 5 лет и 0,44% — в течение 10 лет терапии препаратом Пролиа®. Риск развития ОНЧ возрастал по мере увеличения длительности терапии препаратом Пролиа®.
Атипичные переломы бедренной кости. В клинических исследованиях остеопороза у пациентов в группе лечения, получавшей препарат Пролиа®, были зарегистрированы редкие случаи атипичных переломов бедренной кости (см. «Особые указания»).
МПП вследствие отмены лечения препаратом Пролиа®. В клинических исследованиях остеопороза зарегистрированы случаи МПП вследствие отмены лечения препаратом Пролиа®, в особенности у пациентов с переломами позвоночника в анамнезе.
Дивертикулит. В плацебо-контролируемом клиническом исследовании III фазы у пациентов с раком предстательной железы, получавших гормондепривационную терапию, отмечен дисбаланс в сообщениях о развитии дивертикулита (1,2% — в группе лечения деносумабом, 0% — в группе плацебо). Частота развития дивертикулита была сравнима в группах исследований, включавших женщин в постменопаузе или мужчин с остеопорозом, а также у женщин, получавших терапию ингибиторами ароматазы по причине неметастатического рака молочной железы.
Реакции гиперчувствительности. В постмаркетинговых исследованиях у пациентов, получающих препарат Пролиа® в пострегистрационном периоде, редко сообщалось о реакциях гиперчувствительности, связанных с препаратом, включая сыпь, крапивницу, отек лица, эритему и анафилактические реакции.
Скелетно-мышечная боль. Скелетно-мышечные боли, в т.ч. тяжелые, отмечались у пациентов, получавших препарат Пролиа®, в постмаркетинговых исследованиях. В клинических исследованиях скелетно-мышечные боли регистрировались очень часто, как в группе лечения деносумабом, так и в группе плацебо. Скелетно-мышечная боль, приводившая к досрочному завершению участия в исследовании, отмечалась нечасто.
Использование в других особых популяциях
Почечная недостаточность. В клинических исследованиях у пациентов с тяжелой почечной недостаточностью (Cl креатинина <30 мл/мин) или пациентов, получавших диализ, отмечался более высокий риск развития гипокальциемии при отсутствии приема препаратов кальция. Пациентам с тяжелой почечной недостаточностью или пациентам, получающим диализ, важно принимать препараты кальция и витамина D (см. «Особые указания»).
Взаимодействие
В исследовании лекарственного взаимодействия препарат Пролиа® не оказывал влияния на параметры фармакокинетики мидазолама, который метаболизируется изоферментом CYP3A4. Это означает, что препарат Пролиа® не должен оказывать влияние на параметры фармакокинетики ЛС, метаболизирующихся с участием CYP3A4.
Отсутствуют клинические данные о совместном применении деносумаба и ЗГТ эстрогенами, вероятность данного фармакодинамического взаимодействия расценивается как низкая. У женщин с постменопаузным остеопорозом предшествующая терапия алендроновой кислотой не оказывала влияния на параметры фармакокинетики и фармакодинамики деносумаба согласно данным переходного исследования (с алендроновой кислоты на деносумаб).
Фармацевтическая несовместимость. В связи с отсутствием результатов исследований по совместимости данный препарат не следует применять с другими ЛС.
Передозировка
Не регистрировалось случаев передозировки в клинических исследованиях.
В клинических исследованиях деносумаб вводился в дозах до 180 мг, каждые 4 нед (суммарная доза в течение 6 мес — до 1080 мг), при этом дополнительных нежелательных реакций не наблюдалось.
Особые указания
Препараты кальция и витамина D. Всем пациентам рекомендуется прием препаратов кальция и витамина D в адекватных дозах во время терапии препаратом Пролиа®.
Меры предосторожности при использовании
Гипокальциемия. Важно выявить пациентов с риском развития гипокальциемии. Гипокальциемия должна быть скорректирована приемом препаратов кальция и витамина D в адекватных дозах до начала терапии. Рекомендуется мониторинг концентрации кальция перед введением каждой дозы препарата у пациентов, предрасположенных к развитию гипокальциемии, в течение 2 нед после введения первой дозы. При развитии симптомов гипокальциемии в течение курса терапии (см. «Побочные действия»), необходимо оценить концентрацию кальция в крови. Пациенты должны быть предупреждены о необходимости сообщать при появлении симптомов, указывающих на гипокальциемию. В постмаркетинговых исследованиях отмечались случаи тяжелой симптоматической гипокальциемии (см. «Побочные действия») которые чаще всего регистрировались в течение первых недель после начала терапии, однако их развитие возможно и в более поздние сроки. Одновременная терапия ГКС является дополнительным фактором риска развития гипокальциемии.
Почечная недостаточность. У пациентов с тяжелым нарушением функции почек (имеющие Cl креатинина <30 мл/мин) или получающих диализ существует повышенный риск развития гипокальциемии. Риск развития гипокальциемии и сопутствующего увеличения уровня паратиреоидного гормона возрастает с увеличением степени тяжести нарушения функции почек. Данным пациентам особенно важно принимать препараты кальция и витамина D в адекватных дозах, а также проводить регулярный мониторинг концентрации кальция в крови (см. выше).
Инфекции кожи и подкожно-жировой клетчатки. У пациентов, получающих препарат Пролиа®, возможно развитие кожных инфекций и воспаления подкожно-жировой клетчатки, требующих госпитализации (см. «Побочные действия»). Пациентам следует сообщить о необходимости немедленного обращения за медицинской помощью при появлении признаков или симптомов воспаления подкожно-жировой клетчатки.
ОНЧ. Были зарегистрированы редкие случаи ОНЧ у пациентов, получавших препарат Пролиа® для лечения остеопороза (см. «Побочные действия»). Необходимо отложить начало терапии/проведение нового курса терапии у пациентов с незажившими открытыми повреждениями мягких тканей полости рта. Перед началом терапии деносумабом у пациентов с наличием сопутствующих факторов риска необходимо проведение стоматологического обследования и превентивных стоматологических мероприятий, а также индивидуальная оценка соотношения пользы и рисков терапии деносумабом. При оценке индивидуального риска развития ОНЧ у пациента необходимо учитывать следующие факторы риска:
— активность лекарственного препарата, ингибирующего резорбцию костной ткани (увеличение риска для сильнодействующих препаратов);
— способ введения (увеличение риска при парентеральном введении) и суммарная доза антирезорбтивной терапии;
— злокачественные опухоли, сопутствующая патология (например, анемия, коагулопатии, инфекции), курение;
— сопутствующая терапия (кортикостероиды, химиотерапия, ингибиторы ангиогенеза, лучевая терапия области головы и шеи);
— недостаточная гигиена полости рта, болезни пародонта, плохо подобранные зубные протезы, наличие стоматологических заболеваний в анамнезе, инвазивные стоматологические процедуры (например, экстракция зубов).
Во время лечения деносумабом всем пациентам следует поддерживать надлежащую гигиену полости рта, проходить регулярные стоматологические осмотры, а также немедленно сообщать о любых нежелательных симптомах со стороны ротовой полости, таких как подвижность зубов, боль, отек, незаживающие поражения слизистой или наличие выделений. В процессе терапии инвазивные стоматологические процедуры следует проводить только после тщательной оценки; необходимо избегать выполнения данных процедур непосредственно перед введением и/или сразу после введения препарата Пролиа®.
План лечения пациентов с ОНЧ должен быть разработан совместно с лечащим врачом и стоматологом или челюстно-лицевым хирургом с опытом лечения данной патологии. Следует рассмотреть вопрос о временном прекращении терапии до разрешения данного состояния и устранения факторов риска во всех случаях, когда это возможно.
Остеонекроз наружного слухового канала. На фоне терапии деносумабом отмечались случаи остеонекроза наружного слухового прохода. Возможными факторами риска данного состояния являются применение стероидов и химиотерапия, и/или местные факторы риска, такие как инфекция или травма. Возможность развития остеонекроза наружного слухового канала следует рассматривать у пациентов, принимающих деносумаб, у которых имеются симптомы со стороны уха, включая хронические инфекции уха.
Атипичные переломы бедра. Атипичные переломы бедренной кости отмечались у пациентов, принимающих Пролиа® (см. «Побочные действия»). Атипичные переломы бедренной кости могут возникать при небольших травмах или отсутствии травм в подвертельной или диафизарной проксимальной части бедренной кости. На рентгенологических снимках эти переломы обычно имеют характерный внешний вид. Об атипичных переломах бедренной кости также сообщалось у пациентов с определенными сопутствующими заболеваниями и состояниями (например, недостаток витамина D, ревматоидный артрит, гипофосфатазия) и у пациентов, получающих некоторые виды терапии (например, бисфосфонаты, ГКС, ингибиторы протонной помпы). Эти случаи также наблюдались и в отсутствии антирезорбтивной терапии. Подобные переломы, связанные с приемом бисфосфонатов, часто имеют двусторонний характер; поэтому у пациентов, получающих терапию деносумабом, при выявлении перелома бедренной кости, необходимо обследование бедра с противоположной стороны. Следует рассмотреть вопрос о прекращении лечения препаратом Пролиа® у пациентов с подозрением на атипичный перелом бедра, с учетом индивидуальной оценки соотношения пользы и риска. Во время лечения Пролиа® пациентов следует предупредить о необходимости информирования о новых или необычных болях в области бедренной кости, тазобедренной кости или паховой области. Пациенты, у которых возникают такие симптомы, должны быть обследованы на наличие неполных переломов бедренной кости.
МПП вследствие отмены лечения препаратом Пролиа®, в особенности у пациентов с переломами позвоночника в анамнезе. Пациентов следует проинструктировать о том, что нельзя прерывать терапию препаратом Пролиа® без консультации с лечащим врачом. Перед отменой лечения препаратом Пролиа® необходимо провести индивидуальную оценку соотношения польза/риск. В случае отмены лечения препаратом Пролиа® необходимо рассмотреть перевод на альтернативную антирезорбтивную терапию.
Длительная антирезорбтивная терапия. Длительная антирезорбтивная терапия (как деносумабом, так и бисфосфонатами) может способствовать повышению риска развития таких осложнений, как остеонекроз челюсти и атипичные переломы бедра, вследствие выраженного подавления процессов ремоделирования кости (см. «Способ применения и дозы»).
Одновременное применение других ЛС, содержащих деносумаб. Пациенты, получающие терапию препаратом Пролиа®, не должны получать одновременно другие содержащие деносумаб лекарственные препараты (для профилактики осложнений со стороны костной ткани у взрослых с сóлидными опухолями, метастазирующими в кость).
Сухой натуральный каучук. Колпачок иглы предварительно заполненного шприца содержит сухой натуральный каучук (производное латекса), который может вызывать аллергические реакции.
Предупреждения в отношении вспомогательных веществ. Данный препарат содержит 47 мг сорбитола в 1 мл раствора. Следует учитывать аддитивный эффект одновременного применения препаратов, содержащих сорбитол (или фруктозу), а также поступления сорбитола (или фруктозы) с пищей. Данный препарат содержит менее 1 ммоль натрия (23 мг) в 60 мг, т.е. может расцениваться как несодержащий натрия.
Особые меры предосторожности при применении и утилизации. Перед введением следует оценить раствор на предмет наличия включений или изменения цвета. Раствор нельзя использовать при помутнении, наличии взвешенных частиц или изменении цвета. Не встряхивать. Чтобы избежать дискомфорта в месте введения, следует довести препарат до комнатной температуры (до 25 °C) перед инъекцией, а затем медленно ввести все содержимое предварительно заполненного шприца. Любое количество неиспользованного препарата или неиспользованных материалов должно быть утилизировано в соответствии с надлежащими требованиями.
Влияние на способность управлять транспортными средствами, механизмами. Исследований влияния препарата Пролиа® на способность к управлению автомобилем и работе с механизмами не проводилось.
Форма выпуска
Предварительно заполненные шприцы с раствором для п/к введения 60 мг/мл.
Раствор для п/к введения 60 мг/мл в одноразовом ПЗШ 1 мл из стекла I гидролитического класса с иглой 27G из нержавеющей стали, эластомерным колпачком и эластомерным плунжером, ламинированным фторполимером (с защитным устройством для иглы или без него). Маркированный шприц помещают в пачку картонную.
ПЗШ может быть дополнительно помещен в контурную ячейковую упаковку с термоэтикеткой. Каждую контурную ячейковую упаковку помещают в пачку картонную вместе с карточкой для пациента с описанием техники инъекции (для ПЗШ — с защитным устройством для иглы). Пачка картонная снабжена отрывной карточкой-напоминанием с двумя напоминающими наклейками. На каждую пачку наклеивают прозрачные защитные этикетки, имеющие продольную цветную полосу — контроль первого вскрытия.
Пролиа® представляет собой стерильный продукт и не содержит консервантов.
Производитель
Амджен Мэньюфэкчуринг Лимитед, Пуэрто-Рико, Роуд 31, Км 24,6, Джанкос, Пуэрто-Рико, 00777.
Выпускающий контроль качества. Амджен Европа Б.В., Нидерланды Минервум 7061,4817 ZK Бреда, Нидерланды или Амджен Технолоджи (Айрлэнд) Анлимитед Компани, Поттери Роуд, Дан Лэйри, графство Дублин, Ирландия.
Или
ООО «Добролек», 115446, Москва, Коломенский пр., 13А.
Организация, принимающая претензии от потребителей ООО «Амджен». 123112, Москва, Пресненская наб., 8, стр. 1, 7-й эт.
Тел.: (495) 745-04-78; факс: (499) 995-19-65.
Условия отпуска из аптек
По рецепту.
RU-P-MLTP-0919-078239
Условия хранения
При температуре 2–8 °C в оригинальной упаковке (не замораживать).
Хранить в оригинальной упаковке для защиты от света. Не встряхивать. После изъятия из холодильника Пролиа® может храниться при комнатной температуре не выше 25°С в оригинальной упаковке не более 30 дней.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Деносумаб представляет собой полностью человеческое моноклональное антитело (IgG2), обладающее высокой аффинностью и специфичностью к лиганду рецептора активатора ядерного фактора каппа В (RANKL) и тем самым препятствует активации единственного рецептора RANKL — активатора ядерного фактора кВ (RANK), расположенного на поверхности остеокластов и их предшественников. Таким образом, предотвращение взаимодействия RANKL/RANK ингибирует образование, активацию и продолжительность существования остеокластов. В результате деносумаб уменьшает костную резорбцию и увеличивает массу и прочность кортикального и трабекулярного слоев кости.
Фармакодинамические эффекты
Назначение деносумаба в дозе 60 мг приводило к быстрому уменьшению сывороточных концентраций маркера резорбции костной ткани — 1С-телопептида (СТХ) — приблизительно на 70% в течение 6 ч после п/к введения и приблизительно на 85% в течение последующих 3 дней. Уменьшение концентрации СТХ оставалось стабильным в 6-месячном интервале между дозированием. Скорость снижения концентрации СТХ в сыворотке крови частично уменьшалась при снижении концентрации деносумаба в сыворотке крови, что отражает обратимость влияния деносумаба на ремоделирование кости. Данные эффекты наблюдались на протяжении всего курса лечения. Соответственно физиологической взаимосвязи процессов образования и резорбции при ремоделировании костной ткани наблюдалось уменьшение содержания маркеров образования кости (например, костноспецифической щелочной фосфатазы и сывороточного N-концевого пропептида коллагена 1 типа) с первого месяца после введения первой дозы деносумаба. Маркеры ремоделирования кости (маркеры образования кости и резорбции кости), как правило, достигали концентраций периода до начала лечения не позднее, чем через 9 месяцев после приема последней дозы препарата. После возобновления лечения деносумабом степень снижения концентраций СТХ была сходна со степенью снижения концентрации СТХ в начале курса лечения деносумабом.
Было показано, что перевод с лечения алендроновой кислотой (средняя продолжительность применения — 3 года) на деносумаб приводит к дополнительному снижению концентрации СТХ в сыворотке по сравнению с группой женщин в постменопаузе с низкой костной массой, продолжавших лечение алендроновой кислотой. В то же время изменения содержания кальция в сыворотке были одинаковыми в обеих группах.
В экспериментальных исследованиях ингибирование RANK/RANKL одновременно со связыванием остеопротегерина с Fc-фрагментом (OPG-Fc), приводило к замедлению роста кости и нарушению прорезывания зубов. Поэтому, лечение деносумабом может тормозить рост костей с открытыми зонами роста у детей и приводить к нарушениям прорезывания зубов.
Иммуногенность
Деносумаб — человеческое моноклональное антитело, поэтому, как и для других лекарственных средств белковой природы существует теоретический риск иммуногенности. Более чем 13 000 пациентов были обследованы на предмет образования, связывающих антител с использованием метода чувствительной электрохемилюминесценции в сочетании с иммунологическим анализом. Менее чем у 1% пациентов, принимавших деносумаб в течение 5 лет, определялись антитела (включая существовавшие ранее, транзиторные и растущие). Серопозитивные пациенты были далее обследованы на предмет образования нейтрализующих антител, используя хемилюминесцентный анализ в культуре клеток in vitro, нейтрализующих антител не обнаружено. Не было выявлено изменений фармакокинетического профиля, токсического профиля или клинического ответа, обусловленных образованием антител.
Клиническая эффективность
Лечение остеопороза в постменопаузе
У женщин с постменопаузным остеопорозом Пролиа увеличивает минеральную плотность кости (МПК), уменьшает частоту переломов шейки бедра, вертебральных и невертебральных переломов. Эффективность и безопасность деносумаба в лечении постменопаузного остеопороза была доказана в исследовании, длительностью 3 года. Результаты исследования показывают, что деносумаб существенно, в сравнении с плацебо снижает риск возникновения вертебральных и невертебральных переломов, переломов шейки бедра у женщин с остеопорозом в постменопаузе. В исследование было включено 7808 женщин, из которых у 23% отмечались часто встречающиеся переломы позвонков. Все три конечные точки эффективности в отношений переломов достигали статистически значимых значений, оцениваемых по предварительно заданной последовательной схеме тестирования.
Снижение риска возникновения новых вертебральных переломов при применении деносумаба в течение более чем 3 лет оставалось стабильным и значимым. Риск снижался независимо от 10-летней вероятности возникновения крупных остеопоротических переломов. На снижение риска также не влияли наличие часто встречающихся переломов позвонков в анамнезе, невертебральные переломы, возраст, пациентов, МПК, уровень ремоделирования кости и предшествующая терапия по поводу остеопороза.
У женщин старше 75 лет в постменопаузе деносумаб уменьшал частоту возникновения новых вертебральных переломов, и, по данным post hoc анализа, уменьшал частоту переломов шейки бедра.
Уменьшение частоты возникновения невертебральных переломов наблюдалось независимо от 10-летней вероятности возникновения крупных остеопоротических переломов.
Деносумаб существенно, по сравнению с плацебо, увеличивал МПК во всех анатомических областях. МПК определяли через 1 год, 2 и 3 года после начала терапии. Сходное влияние на МПК отмечено в поясничном отделе позвоночника независимо от возраста, расовой принадлежности, индекса массы тела (ИМТ), МПК и ремоделирования кости.
Гистологические исследования подтвердили нормальную архитектонику кости и, как и ожидалось, снижение костного ремоделирования по сравнению с плацебо. Не отмечено патологических изменений, включая фиброз, остеомаляцию и нарушение архитектоники костной ткани.
Клиническая эффективность при лечении потери костной массы, вызванной гормондепривационной терапией или терапией ингибиторами ароматазы
Лечение потери костной массы, вызванной депривацией андрогенов
Эффективность и безопасность деносумаба при лечении потери костной массы, ассоциированной со снижением концентрации андрогенов, были доказаны в 3-х летнем исследовании включавшем 1 468 пациентов с неметастатическим раком предстательной железы.
Существенное увеличение МПК определяли в поясничном отделе позвоночника, всей бедренной кости, шейке бедренной кости, вертеле бедренной кости спустя 1 месяц после приема первой дозы. Увеличение МПК в поясничном отделе позвоночника не зависело от возраста, расовой принадлежности, географического региона, ИМТ, начальных значений МПК, ремоделирования кости; продолжительности проведения гормондепривационной терапии и наличия вертебрального перелома в анамнезе.
Деносумаб значительно уменьшал риск возникновения новых вертебральных переломов на протяжении 3 лет применения. Уменьшение риска наблюдалось через 1 год и через 2 года после начала терапии. Деносумаб также снижал риск возникновения более чем одного остеопоротического перелома любой локализации.
Лечение потери костной массы, у женщин, получающих терапию ингибиторами ароматазы по поводу рака молочной железы
Эффективность и безопасность деносумаба в лечении потери костной массы, вызванной адъювантной терапией ингибитором ароматазы, оценивалась в 2-летнем исследовании, включавшем 252 пациентки с неметастатическим раком молочной железы. Деносумаб значительно увеличивал МПК во всех анатомических областях, по сравнению с плацебо, в течение 2 лет. Увеличение МПК наблюдалось в поясничном отделе позвоночника спустя месяц после приема первой дозы. Положительное влияние на МПК в люмбальном отделе позвоночника отмечали вне зависимости от возраста, продолжительности терапии ингибитором ароматазы, ИМТ, предшествующей химиотерапии, предшествующего использования селективного модулятора рецепторов эстрогена (СМРЭ) и времени, прошедшего от начала менопаузы.
Каждый предварительно заполненный шприц содержит:
Активное вещество: 60 мг деносумаба.
Вспомогательные вещества: уксусная кислота ледяная, натрия гидроксид (для доведения уровня рН), сорбитол (Е420), полисорбат 20, вода для инъекций.
Раствор для инъекций.
Прозрачный раствор от бесцветного до светло-желтого цвета, практически свободный от включений.
Средства для лечения заболеваний костей. Прочие средства, влияющие на структуру и минерализацию костей.
Код АТХ: М05ВХ04
Фармакодинамика
Механизм действия
Деносумаб представляет собой человеческое моноклональное антитело (IgG2), обладающее высокой аффинностью и специфичностью к лиганду рецептора активатора ядерного фактора каппа В (RANKL) и тем самым препятствует активации рецептора RANK, расположенного на поверхности остеокластов и их предшественников. Предотвращение взаимодействия RANKL/RANK ингибирует образование, активацию и выживаемость остеокластов, приводя к уменьшению костной резорбции в кортикальных и трабекулярных слоях кости.
Фармакодинамические эффекты
Лечение препаратом Пролиа® приводило к быстрому снижению скорости ремоделирования кости, достигая минимальных (снижение на 85%) сывороточных концентраций маркера костной резорбции – 1С-телопептида (СТХ) в течение 3 дней. Уменьшение концентрации СТХ оставалось стабильным в интервале между введениями препарата. В конце каждого интервала дозирования выраженность снижения концентрации СТХ в сыворотке крови частично уменьшалась от максимального снижения ≥ 87% до приблизительно ≥ 45% (диапазон 45-80%), что отражает обратимость влияния Пролиа® на ремоделирование кости при снижении концентрации деносумаба в сыворотке крови. Данные эффекты наблюдались на протяжении всего курса лечения. Маркеры ремоделирования кости, как правило, достигали концентраций периода до начала лечения не позднее, чем через 9 месяцев после введения последней дозы препарата. После возобновления лечения деносумабом степень снижения концентраций СТХ была сходна со степенью снижения концентрации СТХ в начале курса лечения деносумабом.
Иммуногенность
По данным клинических исследований во время применения деносумаба не наблюдалось образования нейтрализующих антител. С помощью метода чувствительного иммуноанализа было показано, что менее чем у 1 % пациентов, получавших деносумаб в течение периода времени до 5 лет, определялись не нейтрализующие связывающие антитела без признаков влияния на фармакокинетический профиль, токсичность или клинический ответ.
Клиническая эффективность и безопасность у женщин в постменопаузе с остеопорозом
Эффективность и безопасность Пролиа®, вводимого каждые 6 месяцев в течение трех лет, исследовались на женщинах с постменопаузальным остеопорозом ( 7808 женщин в возрасте 60-91 год, из которых у 23,6% отмечались часто встречающиеся переломы позвонков) с исходной минеральной плотностью костей (Т-критерий) в поясничном отделе позвоночника или бедре между -2,5 и -4,0 и средней абсолютной 10-летней вероятностью возникновения переломов 18,60% (децили: 7,9-32,4%) для крупных остеопоротических переломов и 7,22% (децили: 1,4-14,9%) для переломов бедра. Женщины с другими заболеваниями или находящиеся на терапии, которая может оказывать влияние на кости, были исключены из исследования. Дополнительно женщины ежедневно получали кальций (не менее 1 000 мг) и витамин D (не менее 400 МЕ).
Влияние на вертебральные переломы
Пролиа® значительно снижает риск появления новых вертебральных переломов через 1, 2 и 3 года после начала терапии (р < 0,0001) (смотрите таблицу 1 ниже).
Таблица 1 Влияние Пролиа® на риск новых вертебральных переломов
| Количественное соотношение женщин с переломами (%) |
Снижение абсолютного риска (%) (95% CI) |
Снижение относительного риска (%) (95% CI) |
||
|
Плацебо n=3906 |
Пролиа® n=3902 | |||
| 0-1 год | 2,2 | 0,9 | 1,4 (0,8, 1,9) | 61 (42, 74)** |
| 0-2 года | 5,0 | 1,4 | 3,5 (2,7, 4,3) | 71 (61 79)** |
| 0-3 года | 7,2 | 2,3 | 4,8 (3,9, 5,8) | 68 (59,74)* |
*р < 0,0001, **р < 0,0001 — исследовательский анализ
Влияние на перелом бедра
Пролиа® показала 40% относительное снижение (0,5% снижение абсолютного риска) риска перелома бедра в течение трех лет (p < 0,05). Частота перелома бедра составила 1,2% в группе плацебо по сравнению с 0,7% в группе приема Пролиа® через 3 года после начала лечения.
Post hoc анализ показал 62% снижение относительного риска перелома бедра (1,4% снижение абсолютного риска, р < 0,01) у женщин > 75 лет, получавших лекарственное средство Пролиа®.
Влияние на все клинические переломы
Лечение препаратом Пролиа® значительно снижало частоту переломов всех типов/групп (смотрите таблицу 2 ниже).
Таблица 2 Влияние Пролиа® на риск клинических переломов после трех лет лечения
|
Количественное соотношение женщин с переломами (%)+ |
Снижение абсолютного риска (%) (95% Cl) |
Снижение относительного риска (%) (95% CI) |
||
| Плацебо n=3906 | Пролиа® n=3902 | |||
|
Любой клинический перелом1 |
10,2 | 7,2 | 2,9 (1,6, 4,2) | 30 (19, 41)*** |
| Клинический вертебральный перелом | 2,6 | 0,8 | 1,8 (1,2, 2,4) | 69 (53, 80)*** |
|
Невертебральный перелом2 |
8,0 | 6,5 | 1,5 (0,3, 2,7) | 20 (5, 33) ** |
| Большой невертебральный перелом3 | 6,4 | 5,2 | 1,2 (0,1, 2,2) | 20 (3, 34)* |
| Большой остеопоротический перелом4 | 8,0 | 5,3 | 2,7 (1,6, 3,9) | 35 (22, 45) *** |
*р ≤ 0,05; **р = 0,0106 (вторичная конечная точка, включенная в корректировку множества),
*** р ≤ 0,0001
*Частота возникновения побочной реакции на основе оценки Каплана-Мейера через 3 года.
1 Включая клинические вертебральные и невертебральные переломы.
2 За исключением переломов позвонков, черепа, нижней челюсти, пясти, фаланг пальцев руг и ног, лицевых переломов.
3 Включая переломы таза, дистального отдела бедра, проксимального отдела большеберцовой кости, ребер, проксимального отдела плечевой кости, костей предплечья и бедра.
4 Включая клинические вертебральные переломы, переломы бедра, костей предплечья, плечевой кости, в соответствии с определением ВОЗ.
У женщин с исходной минеральной плотностью кости шейки бедра ≤ -2,5. Пролиа® снижала риск невертебральных переломов (35% снижение относительного риска, 4,1% снижение абсолютного риска, р < 0,001, исследовательский анализ).
Снижение в частоте новых вертебральных переломов, переломов бедра и невертебральных переломов через 3 года приема препарата Пролиа® наблюдалось независимо от 10-летней вероятности возникновения переломов до начала лечения.
Влияние на минеральную плотность костей
Препарат Пролиа® значительно увеличивал минеральную плотность костей во всех анатомических областях, по сравнению с плацебо, через 1, 2 и 3 года лечения. Увеличение минеральной плотности кости наблюдалось на 9,2% в поясничном отделе позвоночника, на 6,0% в бедре, на 4,8% в шейке бедра, на 7,9% в вертеле бедренной кости, на 3,5% в дистальном отделе лучевой кости и на 4,1% в среднем во всех костях через 3 года после начала лечения (р < 0,0001 для всех значений).
В клинических исследованиях, оценивающих влияние отмены Пролиа®, минеральная плотность костей практически возвращалась к уровню до начала лечения и оставалась выше уровня плацебо в течение 18 месяцев после введения последней дозы. Полученные данные указывают на то, что для поддержания клинического эффекта требуется продолжительное лечение препаратом Пролиа®. Возобновление терапии препаратом Пролиа® приводило к увеличению минеральной плотности костей, схожим с тем, которое наблюдалось при первом введении препарата.
Открытое расширенное клиническое исследование лечения постменопаузального остеопороза
4550 пациентов (2343 получали Пролиа® и 2207 плацебо), которые пропустили не более одной дозы исследуемого препарата в базовом исследовании, описанном выше, и пришедшие на визит к врачу через 36 месяцев после начала исследования, согласились принять участие в семилетнем мультинациональном, мультицентровом, открытом, расширенном несравнительном исследовании долгосрочной безопасности и эффективности препарата Пролиа®. Все женщины в расширенном исследовании получали Пролиа® 60 мг каждые 6 месяцев, а также ежедневно принимали кальций (не менее 1 г) и витамин D (не менее 400 МЕ). В общей сложности 2626 пациентов (58% женщин, включенных в расширенное исследование, т.е. 34% женщин, включенных в базовое исследование) завершили расширенное исследование.
У пациентов, получавших Пролиа® на протяжение 10 лет исходная минеральная плотность костей увеличилась по сравнению с исходным уровнем в расширенном исследовании на 21,7% в поясничном отделе позвоночника, на 9,2% в бедре, на 9,0% в шейке бедра, на 13,0% в вертеле бедра и на 2,8% в дистальном отделе лучевой кости. Среднее значение Т-критерия минеральной плотности костей поясничного отдела позвоночника в конце исследования составляло -1,3 у пациентов, получавших лечение в течение 10 лет.
В качестве конечной точки безопасности оценивалась частота переломов, но эффективность в предотвращении переломов не может быть оценена из-за большого количества прекращения лечения и открытого дизайна исследования. Кумулятивная частота новых вертебральных и невертебральных переломов составила примерно 6,8% и 13,1% соответственно у пациентов, которые получали лечение деносумабом в течение 10 лет (n=1278). У пациентов, которые не завершили исследование по каким-либо причинам, наблюдалась более высокая частота переломов при лечении.
В ходе расширенного исследования было зафиксировано 13 подтвержденных случаев остеонекроза челюсти и 2 случая атипичных переломов шейки бедра.
Клиническая эффективность и безопасность у мужчин с остеопорозом
Эффективность и безопасность применения лекарственного средства Пролиа®, вводимого однократно каждые 6 месяцев, оценивалась в исследовании продолжительностью 1 год, включавшем 242 мужчин в возрасте от 31 до 84 лет. Из исследования были исключены лица с рСКФ (расчетная скорость клубочковой фильтрации) < 30 мл/мин/1,73 м2. Все мужчины дополнительно получали кальций (не менее 1 000 мг) и витамин D (не менее 800 МЕ) ежедневно.
Первичной переменной эффективности являлось процентное изменение минеральной плотности кости в поясничном отделе позвоночника, эффективность в предотвращении переломов не оценивалась. Лекарственное средство Пролиа® значительно увеличило минеральную плотность кости во всех анатомических областях по сравнению с плацебо через 12 месяцев после начала лечения: на 4,8% в поясничном отделе, на 2,0% в бедре, на 2,2% в шейке бедра, на 2,3% в вертеле бедренной кости, на 0,9% в дистальном отделе лучевой кости (р < 0,05 для всех значений). Препарат Пролиа® увеличил минеральную плотность кости в поясничном отделе позвоночника по сравнению с исходным значением у 94,7% мужчин через год лечения. Значительное увеличение минеральной плотности кости в поясничном отделе, бедре, шейке бедра и вертеле бедренной кости наблюдалось через 6 месяцев после начала лечения (р < 0,0001).
Гистология костей у постменопаузальных женщин и мужчин с остеопорозом
Гистология костей оценивалась у 62 женщин с постменопаузальным остеопорозом или с низкой костной массой, которые ранее не проходили лечения по поводу остеопороза либо были переведены с терапии алендронатом с последующим применением препарата Пролиа® в течение 1-3 года. 59 женщин участвовали в исследовании с биопсией костей через 24 месяца (n=41) и/или 84 месяца (n=22) лечения в рамках расширенного клинического исследования у женщин с остеопорозом в постменопаузе. Гистология костей также оценивалась у 17 мужчин с остеопорозом через год лечения Пролиа®. Результаты биопсии костей показали нормальную архитектонику и качество кости без признаков нарушения минерализации, образования волокнистой кости или фиброза костного мозга. Результаты гистоморфометрии в расширенном исследовании у женщин в постменопаузе с остеопорозом показали, что антирезорбтивный эффект Пролиа®, который определялся по частоте активации и уровню формирования костной ткани, сохранялся в течение долгого времени.
Клиническая эффективность и безопасность у пациентов с потерей костной массы, вызванной депривацией андрогенов
Эффективность и безопасность Пролиа®, вводимого каждые 6 месяцев в течение трех лет, исследовались на мужчинах с гистологически подтвержденным неметастатическим раком предстательной железы, получающих андроген-депривационную терапию (1468 пациентов в возрасте 48-97 лет), которые были подвержены повышенному риску переломов (пациенты в возрасте > 70 лет, или пациенты в возрасте < 70 лет с минеральной плотностью костей в поясничном отделе, в бедре или шейке бедра Т-критерий < -1,0 или с наличием остеопоротических переломов в анамнезе). Все пациенты ежедневно получали кальций (не менее 1 000 мг) и витамин D (не менее 400 МЕ).
Препарат Пролиа® значительно увеличивал минеральную плотность костей во всех анатомических областях, по сравнению с плацебо, через 3 года лечения. Увеличение МПК наблюдалось на 7,9% в поясничном отделе позвоночника, на 5,7% в бедре, на 4,9% в шейке бедра, на 6,9% в вертеле бедренной кости, на 6,9% в дистальном отделе лучевой кости и на 4,7% во всем теле (р < 0,0001 для всех значений). В проспективно запланированном исследовательском анализе значительное увеличение минеральной плотности костей в поясничном отделе позвоночника, бедре, шейке бедра и вертеле бедренной кости наблюдалось через 1 месяц после введения начальной дозы.
Пролиа® продемонстрировала значительное снижение относительного риска новых вертебральных переломов: 85% (1,6% снижение абсолютного риска) через год, 69% (2,2% снижение абсолютного риска) через 2 года и 62% (2,4% снижение абсолютного риска) через 3 года (р < 0,01 для всех значений).
Клиническая эффективность и безопасность у пациентов с потерей костной массы, вызванной адъювантной терапией ингибиторами ароматазы
Эффективность и безопасность Пролиа®, вводимого каждые 6 месяцев в течение двух лет, оценивалась у женщин с неметастатическим раком молочной железы (252 пациентки в возрасте 35-84 лет) и исходными значениями минеральной плотности костей Т-критерий между -1,0 и -2,5 для поясничного отдела позвоночника, бедра или шейки бедра. Все женщины ежедневно дополнительно получали не менее 1 000 мг кальция и не менее 400 МЕ витамина D.
Первичной переменной эффективности являлось процентное изменение минеральной плотности костей в поясничном отделе позвоночника. Эффективность в отношении переломов не оценивалась. Препарат Пролиа® значительно увеличивал минеральную плотность костей во всех анатомических областях, по сравнению с плацебо, через 2 года лечения. Увеличение МПК наблюдалось на 7,6% в поясничном отделе позвоночника, на 4,7% в бедре, на 3,6% в шейке бедра, на 5,9 % в вертеле бедренной кости, на 6,1% в дистальном отделе лучевой кости и на 4,2% в среднем в костях (р < 0,0001 для всех значений).
Детская популяция
Европейское агентство по лекарственным средствам отказалось от обязательства представить результаты исследований Пролиа® во всех подгруппах детской популяции при лечении потери костной массы, связанной с аблативной терапией половыми гормонами, а также в подгруппе детского населения в возрасте до 2 лет при лечении остеопороза. Информацию о применении в детской популяции смотрите в разделе «Способ применения и дозы».
Фармакокинетика
Всасывание
После подкожного введения деносумаба в дозе 1,0 мг/кг, что приблизительно соответствует утвержденной дозе 60 мг, экспозиция, определяемая по площади под кривой концентрации (AUC) составила 78% в сравнении с внутривенным введением в той же дозе. При подкожном введении дозы 60 мг максимальная концентрация деносумаба (Сmах) в сыворотке – 6 мкг/мл (диапазон 1-17 мкг/мл) наблюдалась через 10 дней (диапазон 2-28 дней).
Биотрансформация
Деносумаб состоит из аминокислот и углеводов, как естественный иммуноглобулин, поэтому маловероятно, что препарат выводится через механизмы печеночного метаболизма. Ожидается, что метаболизм деносумаба будет происходить по пути клиренса иммуноглобулинов, с распадом на небольшие пептидные цепи и отдельные аминокислоты.
Выведение
После достижения Сmах содержание препарата в сыворотке крови снижалось с периодом полувыведения 26 дней (диапазон 6-52 дня) и далее в течение 3 месяцев (диапазон 1,5 4,5 месяцев). У 53% пациентов деносумаб не обнаруживался в сыворотке крови после 6 месяцев от последнего введения препарата.
Не наблюдалось изменений фармакокинетических параметров деносумаба, а также кумуляции за всё время введения многократных подкожных доз препарата по 60 мг каждые 6 месяцев. На фармакокинетику деносумаба не оказывало влияния формирование связывающих антител к деносумабу. Фармакокинетика была схожа у мужчин и женщин. Возраст (28-87 лет), раса, стадия заболевания (остеопения или остеопороз, рак предстательной или молочной железы) не оказывали значительного влияния на фармакокинетику деносумаба.
На основании показателей AUC и Сmах была выявлена тенденция к снижению экспозиции препарата у пациентов с более высокой массой тела. Однако данная тенденция не является клинически значимой, так как фармакодинамические эффекты, оцениваемые по маркерам ремоделирования кости и повышению минеральной плотности костей, оставались постоянными в различных весовых категориях больных.
Линейность/нелинейность
В ходе исследований по изучению дозозависимости была продемонстрирована нелинейная дозозависимая фармакокинетика деносумаба с уменьшением клиренса препарата при увеличении дозы или концентрации, но приблизительно пропорциональное дозозависимое увеличение экспозиции препарата наблюдается при применении доз 60 мг и выше.
Отдельные группы пациентов
Пациенты с почечной недостаточностью
В исследовании у 55 пациентов с различной степенью почечной дисфункции, включая пациентов, находящихся на диализе, степень почечной недостаточности не оказывала влияния на фармакокинетику деносумаба.
Печеночная недостаточность
Исследований влияния печеночной недостаточности на фармакокинетику деносумаба не проводилось. Как правило, моноклональные антитела не выводятся посредством механизмов печеночного метаболизма. Поэтому ожидается, что печеночная недостаточность не оказывает влияния на фармакокинетику деносумаба.
Применение у детей
Фармакокинетика у детей не изучалась.
• Лечение остеопороза у женщин в постменопаузальном периоде и у мужчин с повышенным риском переломов. У женщин в постменопаузальном периоде Пролиа® значительно снижает риск вертебральных, невертебральных переломов и переломов бедра.
• Лечение потери костной массы, вызванной гормон-депривационной терапией при раке предстательной железы у мужчин с повышенным риском переломов (см. раздел «Фармакодинамика»). У данной категории пациентов Пролиа® значительно снижает риск вертебральных переломов.
Повышенная чувствительность к активной субстанции или к любому из компонентов препарата.
Гипокальциемия (см. раздел «Меры предосторожности»).
Беременность
Нет адекватных данных по применению деносумаба во время беременности. Репродуктивная токсичность была продемонстрирована в исследованиях на макаках, которым во время беременности вводили дозы препарата с AUC, в 119 раз превышающей рекомендуемые для клинического применения у человека.
Пролиа®не рекомендуется для применения у беременных женщин.
Лактация
Не известно, выводится ли деносумаб через грудное молоко. Эксперименты на мышах с выключенным геном RANKL («нокаутные мыши») показали, что отсутствие RANKL (являющегося мишенью деносумаба, см. «Фармакодинамика») может вызвать нарушение созревания молочной железы, что может приводить к ослаблению послеродовой лактации. Решение о прекращении грудного вскармливания или отмене терапии препаратом Пролиа® должно приниматься с учетом пользы грудного вскармливания для новорожденного и пользы лечения для матери.
Фертильность
Данных о воздействии деносумаба на фертильность человека не получено. Исследования на животных указывают на отсутствие прямого или косвенного негативного воздействия на фертильность.
Доза
Рекомендуемая доза препарата Пролиа® – одна подкожная инъекция 60 мг в бедро, живот или плечо каждые 6 месяцев.
В течение курса лечения требуется дополнительно принимать адекватные дозы препаратов кальция и витамина D (см. раздел «Меры предосторожности»).
Не было установлено оптимальной общей продолжительности антирезорбтивного лечения остеопороза (включая деносумаб и бисфосфонаты). Необходимость продолжения лечения следует периодически пересматривать индивидуально для каждого на основе преимуществ и потенциальных рисков деносумаба, особенно после 5 или более лет применения (см. раздел «Меры предосторожности»).
Применение у отдельных групп пациентов
Детская популяция
Препарат Пролиа® не рекомендован к применению в педиатрии (< 18 лет), так как эффективность и безопасность Пролиа® не изучались в этой возрастной группе. В исследованиях на животных ингибирование RANК/RANК лиганда (RANKL) связывали с ингибированием роста костей и нарушением прорезывания зубов.
Пожилые (≥ 65 лет)
Не требуется коррекции режима дозирования препарата у пожилых пациентов.
Почечная недостаточность
Не требуется коррекции режима дозирования препарата у пациентов с почечной недостаточностью (см. рекомендации по мониторингу уровня кальция в разделе «Меры предосторожности»).
Печеночная недостаточность
Эффективность и безопасность деносумаба у пациентов с нарушением функции печени не изучались (см. раздел «Фармакокинетика»).
Способ введения
Для подкожного введения.
Инъекция должна выполняться лицом, предварительно обученным технике выполнения инъекции.
Инструкция по использованию, по введению и уничтожению препарата приведена в конце настоящей инструкции.
Инструкция по использованию
• Следует оценить раствор перед введением на предмет наличия включений или изменения цвета, Раствор нельзя использовать при помутнении или изменении цвета.
• Не встряхивать.
• Чтобы избежать дискомфорта в месте введения, следует дождаться шприца до комнатной температуры (до 25 °С) перед инъекцией и вводите препарат медленно.
• Введите все содержимое предварительно заполненного шприца.
Любые количества неиспользованного препарата или неиспользованные материалы должны быть уничтожены в соответствии с локальными требованиями.
Несовместимость
Так как данные по исследованиям совместимости отсутствуют, не следует смешивать препарат с другими лекарственными средствами.
Резюме профиля безопасности
Наиболее частыми побочными реакциями при лечении препаратом Пролиа® (наблюдаются у более одного из 10 пациентов) являются мышечноскелетная боль и боль в конечности. Были получены сообщения о нечастых случаях целлюлита и редких случаях гипокальциемии, гиперчувствительности, остеонекроза челюсти и атипичных переломов бедра (см. раздел «Меры предосторожности» и раздел «Побочное действие — Описание отдельных нежелательных реакций») у пациентов, получавших препарат Пролиа®
Выявленные побочные реакции
Данные в таблице 3 ниже описывают побочные реакции, о которых сообщалось в фазах II и III клинических исследований у пациентов с остеопорозом, с раком молочной или предстательной железы, находящихся на гормон-депривационной терапии, и/или в спонтанных отчетах.
Частота возникновения побочных реакций определена следующим образом (смотрите таблицу 3 ниже): очень часто (≥ 1 из 10), часто (≥ 1 из 100 и < 1 из 10), нечасто (≥ 1 из 1000 и < 1 из 100), редко (≥ 1 из 10 000 и < 1 из 1 000), очень редко (< 1 из 10 000). В каждой группе систем органов и частоты сообщений нежелательные реакции приводятся в порядке убывания степени серьезности.
Таблица 3 Побочные реакции у пациентов с остеопорозом и раком молочной или предстательной железы, находящихся на гормон-депривационной терапии
|
Класс системы органов по MedDRA |
Частота |
Нежелательная реакция |
| Инфекционные и паразитарные заболевания |
Часто Часто Нечасто Нечасто Нечасто |
Инфекции мочевыводящих путей Инфекции верхних дыхательных путей Дивертикулит1 Целлюлит1 Инфекции уха |
| Со стороны иммунной системы |
Редко Редко |
Гиперчувствительность к лекарственному средству1 Анафилактическая реакция1 |
|
Нарушения со стороны обмена веществ и питания |
Редко |
Гипокальциемия1 |
| Со стороны нервной системы | Часто | Ишиас |
|
Со стороны желудочно-кишечного тракта |
Часто Часто |
Запор Желудочно-кишечный дискомфорт |
|
Со стороны кожи и подкожно-жировой клетчатки |
Часто Часто |
Сыпь Экзема |
|
Со стороны скелетно-мышечной системы и соединительной ткани |
Очень часто Очень часто Редко Редко Частота неизвестна |
Боль в конечностях Мышечноскелетная боль1 Остеонекроз челюсти1 Атипичные переломы бедра1 Остеонекроз наружного слухового прохода2 |
1 См. раздел «Описание отдельных нежелательных реакций»
2 См. раздел «Меры предосторожности»
В объединенном анализе данных, полученных в ходе фаз II и III плацебо-контролируемых исследований, о гриппоподобных реакциях сообщалось с частотой 1,2% для деносумаба и 0,7% для плацебо. Несмотря на то, что данная диспропорция была выявлена в объединенном анализе, она не была выявлена в ходе стратифицированного анализа.
Описание отдельных нежелательных реакций
Гипокальциемия
В двух плацебо-контролируемых клинических исследованиях фазы III у женщин с постменопаузальным остеопорозом примерно у 0,05% (2 из 4050) пациенток после введения Пролиа® наблюдалось снижение уровня кальция в сыворотке (менее 1,88 ммоль/л). О снижении уровня кальция в сыворотке (менее 1,88 ммоль/л) не сообщалось ни в двух плацебо-контролируемых клинических исследованиях фазы III у пациентов, находящихся на гормон-депривационной терапии, ни в плацебоконтролируемом клиническом исследовании фазы III у мужчин с остеопорозом.
При применении в клинической практике сообщалось о редких случаях тяжелой симптоматической гипокальциемии, преимущественно у пациентов с повышенным риском гипокальциемии, получающих препарат Пролиа® большинство случаев наблюдались в первые недели начала терапии. Клинические проявления тяжелых симптомов гипокальциемии включали удлинение интервала QT, тетанию, судороги и изменение психического состояния (см. раздел «Меры предосторожности»). Симптомы гипокальциемии в клинических исследованиях деносумаба включали парестезию или ригидность мышц, судорожные сокращения, спазмы и мышечные судороги.
Кожные инфекции
В плацебо-контролируемых клинических исследованиях фазы III общая частота возникновения кожных инфекций была сравнима в группе плацебо и в группе Пролиа® у женщин с постменопаузальньш остеопорозом (плацебо [1,2%, 50 из 4041], Пролиа® [1,5%, 59 из 4050]), у мужчин с остеопорозом (плацебо [0,8%, из 120], Пролиа® [0%, 0 из 120]), у пациентов с раком молочной или предстательной железы, находящихся на гормон-депривационной терапии (плацебо [1,7%, 14 из 845], Пролиа® [1,4%, 12 из 860]).
О кожных реакциях, потребовавших госпитализации, сообщалось у 0,1% (3 из 41) женщин с постменопаузальным остеопорозом, получавших плацебо по сравнению с 0,4% (16 из 4050) женщин, получавших Пролиа®. В большинстве случаев, сообщения касались целлюлита. Частота кожных реакций, относящихся к серьезным, была сравнима в группе плацебо (0,6%, 5 из 845) и группе Пролиа® (0,6%, 5 из 860) в исследованиях пациентов с раком молочной и предстательной железы.
Остеонекроз челюсти
В клинических исследованиях у пациентов с остеопорозом, а также у пациентов с раком молочной или предстательной железы, получающих гормон-депривационную терапию (общее количество пациентов 23148), поступали редкие сообщения об остеонекрозе челюсти (у 16 пациентов) в ходе лечения препаратом Пролиа® (см. раздел «Меры предосторожности»). 13 из этих случаев остеонекроза челюсти развились у женщин с остеопорозом в постменопаузальном периоде во время III фазы расширенного клинического исследования после применения Пролиа® на протяжении 10 лет. Частота остеонекроза челюсти составила 0,04% через 3 года, 0,06% через 5 лет и 0,44% через 10 лет применения Пролиа®. Риск развития остеонекроза челюсти увеличивается с продолжительностью применения Пролиа
Атипичные переломы бедра
В программе клинических исследований по остеопорозу сообщалось о редких случаях атипичных переломов бедра у пациентов, получавших Пролиа® (см. раздел «Меры предосторожности»).
Дивертикулит
В одном плацебо-контролируемом исследовании фазы III у пациентов с раком простаты, находящихся на андроген-депривационной терапии, была обнаружена диспропорция в проявлении дивертикулита (1,2% для деносумаба, 0% для плацебо). Частота дивертикулита была сравнима между группами лечения в исследовании у женщин в постменопаузальном периоде или мужчин с остеопорозом и у женщин, находящихся на терапии ингибиторами ароматазы по поводу лечения неметастатического рака молочной железы.
Реакции гиперчувствительности к препарату
В ходе пост-маркетинговых исследований применения препарата Пролиа® сообщалось о редких случаях проявления гиперчувствительности, включая сыпь, крапивницу, отек лица, эритему и анафилактические реакции.
Мышечноскелетная боль
В ходе пост-маркетингового наблюдения были получены сообщения о появлении мышечноскелетной боли, включая тяжелые случаи, у пациентов, получающих препарат Пролиа®. В клинических исследованиях мышечноскелетная боль фиксировалась как очень частая побочная реакция в группах плацебо и деносумаба. Прекращение лечения в связи с появлением мышечноскелетной боли было нечастым.
Особые группы пациентов
Почечная недостаточность
В клинических исследованиях было показано, что у пациентов с тяжелой почечной недостаточностью (клиренс креатинина <30мл/мин) или находящихся на диализе существует повышенный риск развития гипокальциемии в отсутствии восполнения кальция. Таким пациентам важно дополнительно принимать препараты кальция и витамин D (см. раздел «Меры предосторожности»).
Информирование о подозреваемых побочных реакциях
Предоставление информации о подозреваемых побочных реакциях, выявленных после регистрации, имеет большое значение, так как позволяет проводить постоянный мониторинг баланса пользы и риска лекарственного средства. Сообщить о любых подозреваемых побочных реакциях специалисты области здравоохранения могут в Республиканское унитарное предприятие «Центр экспертиз и испытаний в здравоохранении», подразделение «Республиканская клинико-фармакологическая лаборатория».
В клинических исследованиях не отмечено случаев передозировки препарата. В клинических исследованиях вводили дозы деносумаба до 180 мг каждые 4 недели (кумулятивная доза до 1080 мг за 6 месяцев). Каких-либо дополнительных побочных реакций зафиксировано не было.
По данным исследования лекарственного взаимодействия препарат Пролиа® не влияет на фармакокинетику мидазолама, который метаболизируется с помощью цитохрома Р450 3А4 (CYP3А4). Это свидетельствует об отсутствии влияния Пролиа® на фармакокинетику лекарственных средств, которые метаболизируются с помощью CYP3А4.
Клинических данных о совместном применении деносумаба и гормон-замещающей терапии (с эстрогенами) нет, однако потенциал фармакодинамического взаимодействия считается низким.
Данные исследования переключения с алендроната на деносумаб позволяют сделать вывод о том, что фармакокинетика и фармакодинамика деносумаба у женщин с постменопаузальным остеопорозом не зависит от предшествующей терапии алендронатом.
Прием кальция и витамина D
Всем пациентам важно принимать адекватные дозы кальция и витамина D.
Меры предосторожности при использовании
Гипокальциемия
Важно выявить пациентов с риском гипокальциемии. Гипокальциемия должна быть скорректирована адекватным приемом препаратов кальция и витамина D перед началом терапии деносумабом. Рекомендуется мониторинг концентрации кальция у пациентов перед каждым дозированием, а у пациентов, предрасположенных к гипокальциемии, в течение двух недель после первой дозы. При появлении у любого пациента симптомов гипокальциемии в ходе лечения препаратом Пролиа® (см. раздел «Побочное действие» для симптомов) необходимо измерить уровень кальция. Пациентам следует сообщить о необходимости информировать врача о симптомах, указывающих на гипокальциемию.
В пост-маркетинговых исследованиях применения препарата сообщалось о случаях развития тяжелой симптоматической гиопкальциемии (см. раздел «Побочное действие»), которые чаще всего наблюдались в течение первых недель после начала терапии, однако могут возникать и позже.
Кожные инфекции
У пациентов, получающих Пролиа®, могут развиться инфекции кожи (преимущественно целлюлит), требующие госпитализации (см. раздел «Побочное действие»). Пациентов следует проинструктировать о незамедлительном обращении за медицинской помощью в случае развития симптомов и признаков целлюлита.
Остеонекроз челюсти
Имеются редкие сообщения о развитии остеонекроза челюсти у пациентов, получавших лекарственное средство Пролиа® для лечения остеопороза (см. раздел «Побочное действие»).
Начало лечения/ новый курс лечения следует отложить у пациентов с имеющимися открытыми повреждениями мягких тканей в ротовой полости. Пациентам, относящимся к группе риска в связи с наличием сопутствующих факторов, следует пройти стоматологическое обследование и сделать все необходимые профилактические стоматологические процедуры перед началом лечения. Таким пациентам требуется индивидуальная оценка пользы-риска начала лечения деносумабом.
Необходимо принимать во внимание следующие факторы при оценке риска развития у пациента остеонекроза челюсти:
• активность лекарственного средства, ингибирующего костную резорбцию (повышение риска для высокоактивных соединений), способ введения (повышение риска при парентеральном введении) и суммарная доза терапии костной резорбции.
• онкологические заболевания, сопутствующие заболевания (например, анемия, коагулопатии, инфекции), курение.
• сопутствующая терапия: кортикостероиды, химиотерапия антиангиогенные ингибиторы, лучевая терапию области головы и шеи.
• плохая гигиена рта, пародонтоз, плохо подобранные зубные протезы, стоматологические заболевания в анамнезе, инвазивные стоматологические процедуры (например, удаление зубов).
В ходе лечения всем пациентам следует соблюдать меры надлежащей гигиены полости рта, проходить регулярное обследование у стоматолога и немедленно сообщать о появлении симптомов в ротовой полости, таких как подвижность зубов, боль, припухлость, незаживающие поражения слизистой или наличие выделений, развившихся в ходе лечения деносумабом. Во время лечения инвазивные стоматологические процедуры следует проводить только после тщательной оценки, при этом их следует избегать в периоды, находящиеся во временной близости с введением препарата Пролиа®.
В случае появления остеонекроза челюсти в ходе терапии препаратом Пролиа® план лечения пациентов должен быть подготовлен совместно лечащим врачом и стоматологом или стоматологом-хирургом, имеющим опыт лечения остеонекроза челюсти. Необходимо рассмотреть возможность временного прекращения лечения до разрешения заболевания и устранения факторов риска в случаях, когда это возможно.
Остеонекроз наружного слухового прохода
Остеонекроз наружного слухового прохода сообщался при применении деносумаба. Возможные факторы риска для развития остеонекроза наружного слухового прохода включают использование стероидов и химиотерапии и/или локальные факторы риска, такие как инфекция или травма. Следует учитывать возможность развития остеонекроза слухового прохода у пациентов, получающих деносумаб, у которых имеются симптомы со стороны органа слуха, включая хронические инфекции уха.
Атипичные переломы бедра
У пациентов, получавших деносумаб, сообщалось о случаях атипичных переломов бедра (см. раздел «Побочное действие»). Атипичные переломы бедра могут возникать при небольших травмах или при их отсутствии в подвертельной или диафизальной области бедра. Эти переломы характеризуются специфическими рентгенологическими признаками. Об атипичных переломах бедра также сообщалось у пациентов с определенными сопутствующими состояниями (например, дефицитом витамина D, ревматоидным артритом, гипофосфатазией) и при применении определенных лекарств (например, бисфосфонатов, глюкокортикоидов, ингибиторов протонной помпы). Такие явления также возникали без антирезорбтивной терапии. Подобные переломы, связанные с приемом бисфосфонатов, часто являются двусторонними; поэтому у пациентов, получающих терапию деносумабом при выявлении перелома бедренной кости необходимо обследовать бедро с противоположной стороны. Следует рассмотреть вопрос о прекращении лечения Пролиа® у пациентов с подозрением на атипичный перелом бедра с учетом индивидуальной оценки пользы и риска. Во время лечения деносумабом пациентов следует предупредить о необходимости уведомления о новых или необычных случаях боли в бедренной кости, бедре или паховой области с такими симптомами необходимо обследовать на наличие неполных переломов.
Продолжительное антирезорбтивное лечение
Продолжительное антирезорбтивное лечение (включая как деносумаб, так и бисфосфонаты) может способствовать увеличению риска неблагоприятных исходов, таких как остеонекроз челюсти и атипичные переломы бедра из-за значительного подавления ремоделирования кости (см. раздел «Способ применения и дозы»).
Параллельное лечение другими деносумаб-содержащими препаратами
Пациенты, находящиеся на лечении препаратом Пролиа®, не должны получать других деносумаб-содержащих лекарственных средств (для предотвращения костных осложнений у взрослых с метастазами солидных опухолей в кости).
Нарушение функции почек
У пациентов с тяжелой почечной недостаточностью (клиренс креатинина < 30 мл/мин) или находящихся на диализе существует повышенный риск развития гипокальциемии. Риск развития гипокальциемии и сопутствующего увеличения уровня паратиреоидного гормона возрастает с увеличением степени нарушения функции почек. Таким пациентам особенно важно принимать адекватные дозы кальция и витамин D, а также проводить регулярный мониторинг уровня кальция.
Сухой натуральный каучук
Колпачок иглы предварительно заполненного шприца содержит сухой натуральный каучук (производное латекса), который может вызвать аллергические реакции.
Меры предосторожности в отношении вспомогательных веществ
Лекарственный препарат содержит сорбитол и не должен использоваться у пациентов с редким наследственным заболеванием непереносимости фруктозы.
Данное лекарственное средство содержит менее 1 ммоль натрия (23 мг) на 60 мг, т.е. практически не содержит натрия.
Пролиа® не оказывает влияния или оказывает крайне незначительное влияние на способность управлять транспортными средствами и механизмами.
3 года.
Не использовать по окончании срока годности.
Хранить при температуре 2-8 °С. Не замораживать.
Хранить в оригинальной упаковке для защиты от света.
Не встряхивать.
После извлечения из холодильника Пролиа® может храниться при температуре не выше 25°С в оригинальной упаковке не более 30 дней. Препарат следует использовать в течение 30 дней.
Хранить в недоступном для детей месте.
Раствор для подкожного введения 60 мг/мл в одноразовом предварительно заполненном шприце (ПЗШ) 1 мл из стекла I гидролитического класса с иглой 27G из нержавеющей стали, эластомерным колпачком и эластомерным плунжером, ламинированным фторполимером (с защитным устройством для иглы или без него).
Маркированный шприц помещают в картонную пачку вместе с инструкцией по применению.
ПЗШ может быть дополнительно помещен в блистер. Каждый блистер помещают в картонную пачку вместе с инструкцией по применению.
По рецепту.
Производитель, ответственный за выпускающий контроль качества
Амджен Европа БВ.
Минервум 7061
NL-4817 ZK Бреда
Нидерланды
Владелец регистрационного удостоверения
Амджен Европа БВ.
Минервум 7061
NL-4817 ZK Бреда
Нидерланды
Официальный представитель в Республике Беларусь
Представительство ООО «AlenMed Promotion» (Латвия) в Республике Беларусь
220020, г. Минск, пр.Победителей, 103 7-й этаж, помещение 4 тел.: +375 17 308-73-84
Факс: +375 17 308-73-88
В этом разделе приводится информация по правильному проведению инъекции предварительно заполненным шприцем. Очень важно, чтобы перед тем, как Вы приступите к самостоятельным инъекциям, Ваш лечащий врач, медицинская сестра подробно проинструктировали Вас по технике выполнения инъекции. Тщательно вымойте руки перед выполнением инъекции. Если у Вас возникнут вопросы по технике выполнения инъекции, то обратитесь к Вашему лечащему врачу или медицинской сестре.
Перед началом инъекции
Внимательно прочитайте все инструкции перед использованием ПЗШ.
НЕ используйте ПЗШ, если колпачок был удален.
Как использовать предварительно заполненный шприц?
Ваш врач назначил вам препарат Пролиа® ПЗШ для подкожных инъекций. Вы должны ввести все содержимое шприца (1 мл) однократно и повторить инъекцию через 6 месяцев, как назначено лечащим врачом.
Оборудование:
Для самостоятельной инъекции Вам потребуется:
• новый ПЗШ препарата Пролиа®.
• смоченные спиртом тампоны или сходные материалы.
Что Вы должны сделать до самостоятельного введения Пролиа® подкожно?
1. Достать шприц из холодильника.
НЕ берите ПЗШ за поршень или защитный колпачок, это может повредить устройство.
2. ПЗШ можно оставить вне холодильника для достижения комнатной температуры. Это позволит сделать инъекцию более комфортной.
НЕ подогревайте ПЗШ каким-либо другим способом (например, в микроволновой печи либо в горячей воде).
НЕ оставляйте шприц под прямыми солнечными лучами.
3. НЕ встряхивайте ПЗШ.
4. НЕ снимайте колпачок с ПЗШ до тех пор, пока Вы не готовы к инъекции.
5. Проверить срок годности ПЗШ. Срок годности указан на упаковке как «ГОДЕН до».
НЕ используйте ПЗШ, если истек последний день указанного на этикетке месяца срока годности.
6. Проверить внешний вид препарата Пролиа®. Раствор должен быть прозрачным, бесцветным или светло-желтым. Если раствор помутнел или окрашен иначе, препарат использовать нельзя.
7. Выбрать комфортное, хорошо освещенное место и чистую поверхность, где можно удобно расположить все необходимые материалы.
8. Тщательно вымыть руки.
Как правильно выбрать место для инъекции?
Лучше всего делать инъекции в верхнюю часть бедра и в живот.
Если инъекции Вам делает кто-то другой, можно использовать наружную поверхность плеча.
Как правильно сделать инъекцию?
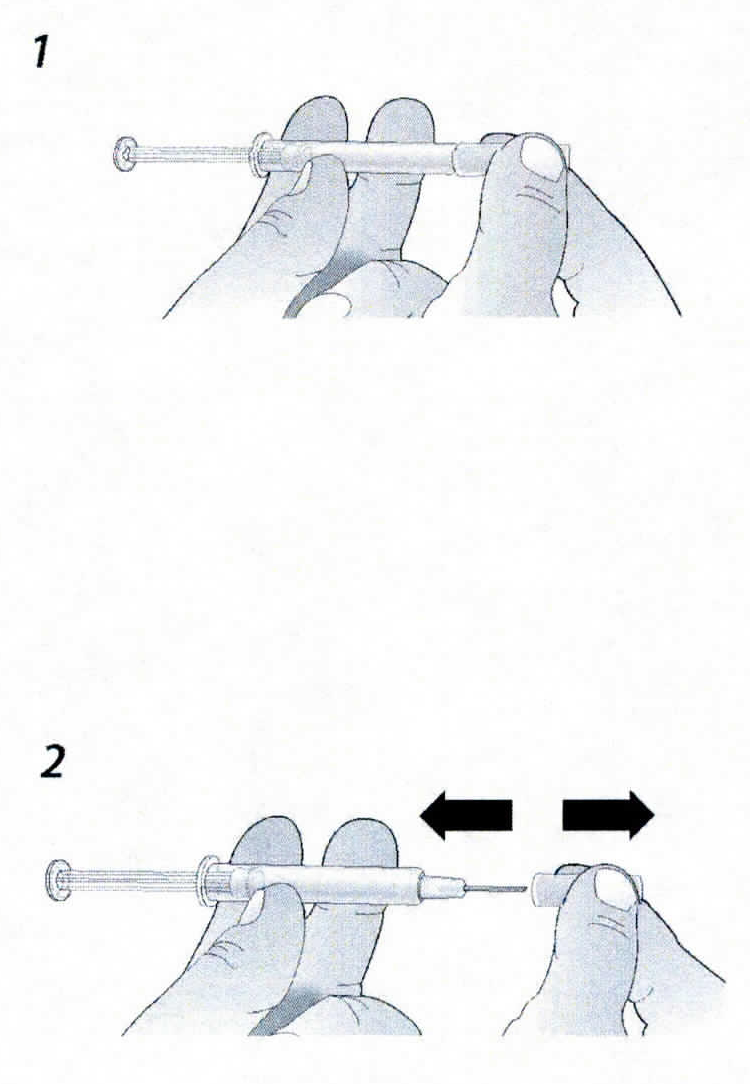
2. Во избежание загиба иглы, аккуратно потяните колпачок с иглы сразу без скручивания, как показано на рисунках 1 и 2.
НЕ дотрагивайтесь до иглы и не нажимайте на поршень.
3. Если внутри ПЗШ видны маленькие пузырьки воздуха, нет необходимости удалять их перед инъекцией. Введение раствора с пузырьками воздуха является безопасным.
4. Зажмите кожу (не сдавливая) между большим и указательным пальцами. Введите иглу в кожу полностью, как показывал Вам доктор или медицинская сестра.
5. Медленно и плавно надавливайте на поршень, одновременно придерживая кожную складку. Надавливать на поршень следует до тех пор, пока шприц не опустеет.
6. Извлеките иглу из кожи, и отпустите кожную складку.
7. Если выступит кровь в месте инъекционного прокола, аккуратно стереть ее ватным тампоном или тканью. Не растирайте место инъекции. При необходимости, заклейте место инъекции пластырем.
8. Используйте один ПЗШ только для одной инъекции. НЕ используйте оставшийся в шприце препарат.
Помните: При возникновении проблем, обратитесь за помощью или советом к лечащему врачу или медицинской сестре.
Уничтожение использованных шприцев
• надевайте обратно колпачок на использованный шприц.
• Храните использованный шприц в недоступном для детей месте.
• Использованный шприц должен быть утилизирован в соответствии с местными правилами. Спросите у врача или провизора, как уничтожить препарат, если он больше не требуется. Эти меры помогут защитить окружающую среду.
| Руководство по частям шприца | |
| Перед использованием | После использования |
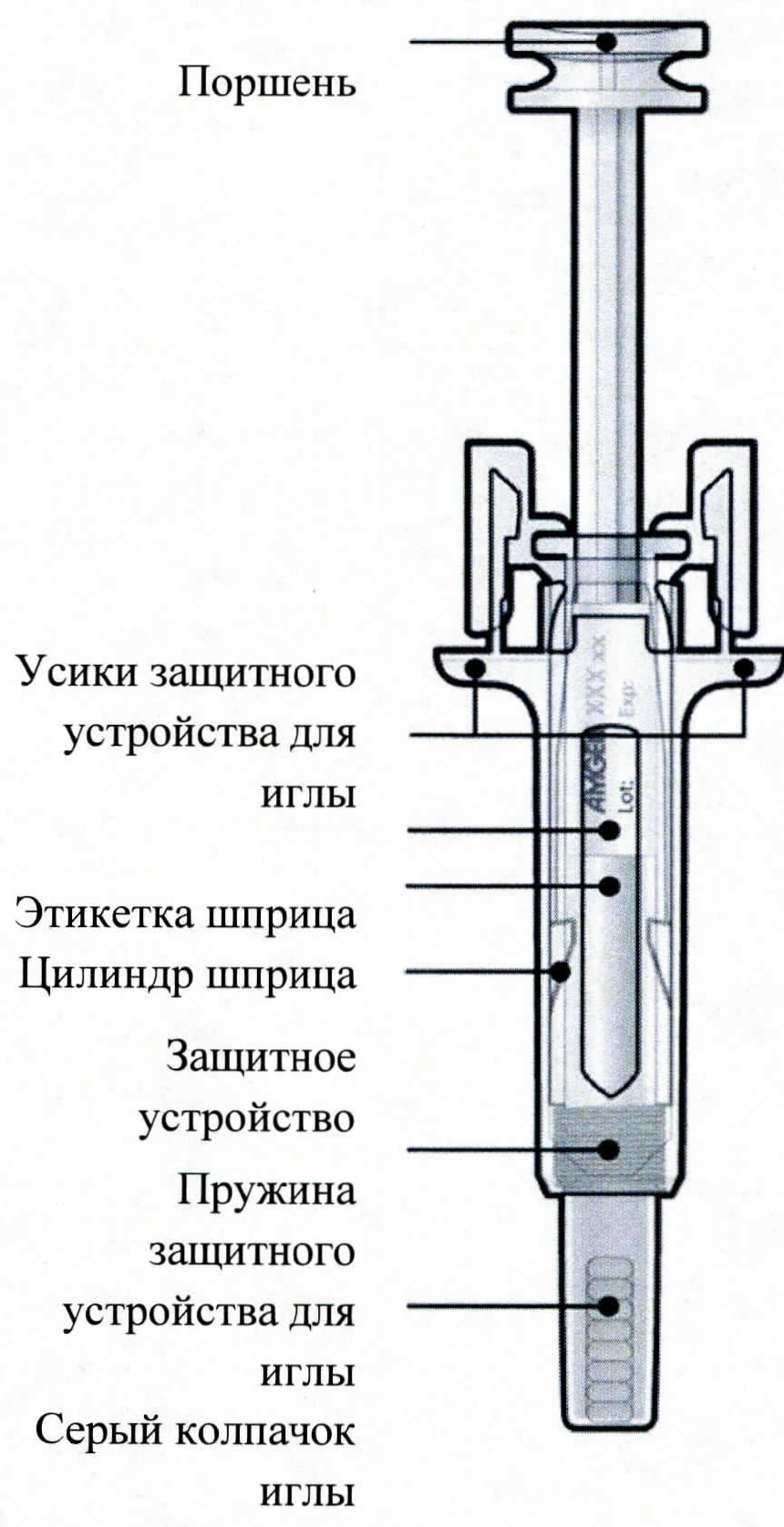 |
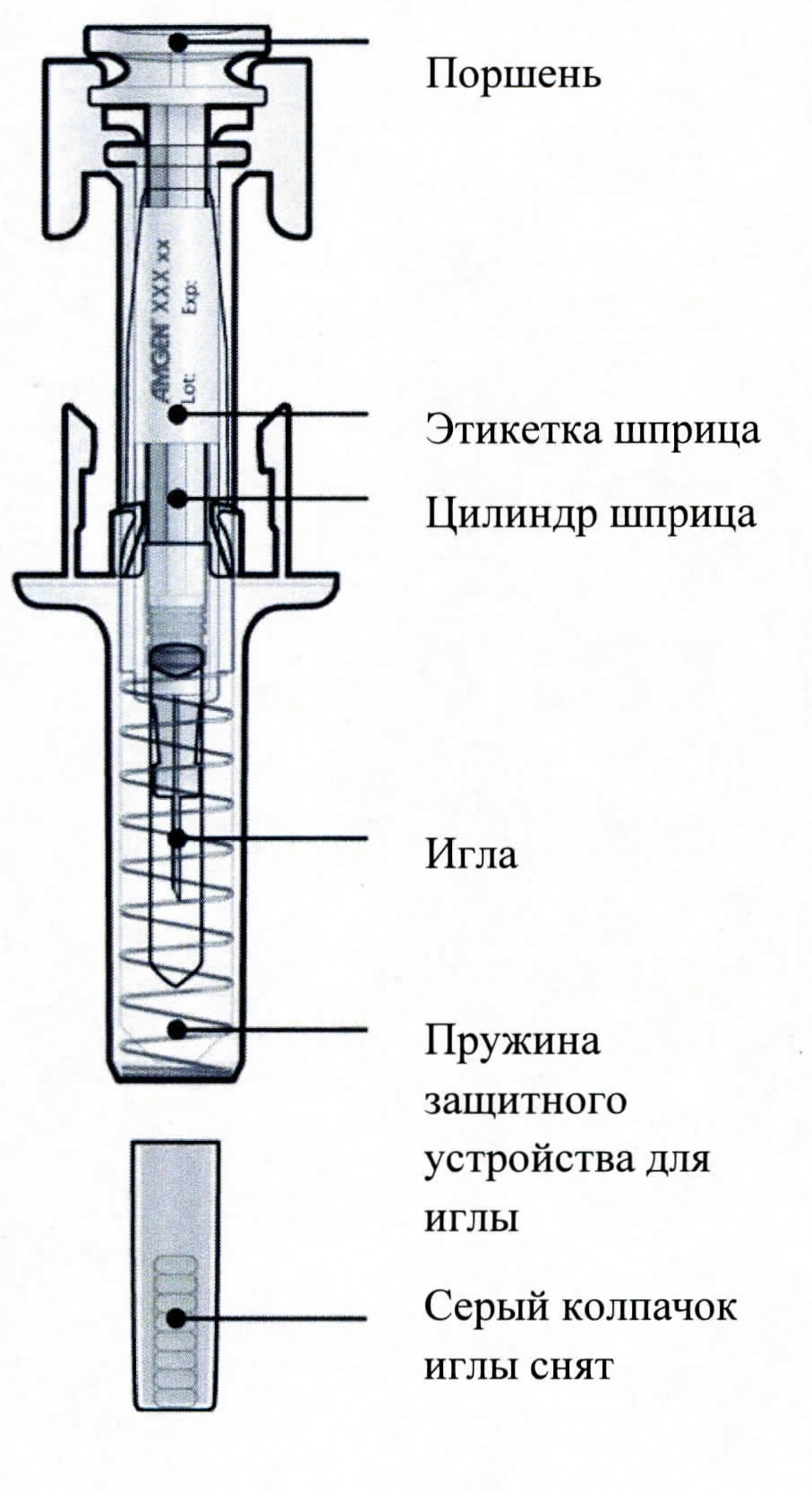 |
|
Важно |
|
| Внимательно прочитайте данную инструкцию перед использованием препарата Пролиа® в предварительно заполненном шприце с защитным устройством для иглы: • Очень важно, чтобы перед тем, как Вы приступите к самостоятельным инъекциям, ваш лечащий врач или медицинская сестра подробно проинструктировали Вас по технике выполнения инъекции. • Пролиа®вводится подкожно (подкожная инъекция). • Сообщите Вашему врачу, если у Вас есть аллергия на латекс (колпачок иглы предварительно заполненного шприца состоит из производного латекса). ✗ Не снимайте серый колпачок с иглы предварительно заполненного шприца, пока вы не готовы к инъекции. ✗ Не используйте предварительно заполненный шприц, если он упал на твердую поверхность. Используйте новый предварительно заполненный шприц и сообщите об этом Вашему лечащему врачу или медицинской сестре. ✗ Не пытайтесь активировать защитное устройство предварительно заполненного шприца перед инъекцией. ✗ Не пытайтесь снять прозрачное защитное устройство с предварительно заполненного шприца перед инъекцией. В случае возникновения вопросов, обращайтесь к Вашему лечащему врачу или медицинской сестре. |
| Шаг 1: Подготовка | |
| А | Извлеките контурную ячейковую упаковку с предварительно заполненным шприцем из упаковки и подготовьте все, что необходимо для инъекции. Также подготовьте смоченные спиртом салфетки, ватные тампоны или бинт и пластырь (не прилагаются к шприцу). |
| Для более комфортной инъекции, оставьте предварительно заполненный шприц при комнатной температуре, в течение примерно 30 минут перед инъекцией. Тщательно вымойте руки с мылом. Расположите предварительно заполненный шприц на чистой, хорошо освещенной поверхности. ✗ Не пытайтесь подогревать шприц в горячей воде или микроволновой печи. ✗ Не оставляйте предварительно заполненный шприц под прямыми солнечными лучами. ✗ Не встряхивайте предварительно заполненный шприц. • Храните предварительно заполненный шприц в недоступном для детей месте. |
| В |
Откройте контурную ячейковую упаковку, потянув за этикетку. Для извлечения предварительно заполненного шприца из контурной ячейковой упаковки, возьмитесь за защитное устройство |
|
|
| С |
Проверьте препарат и предварительно заполните шприц. |
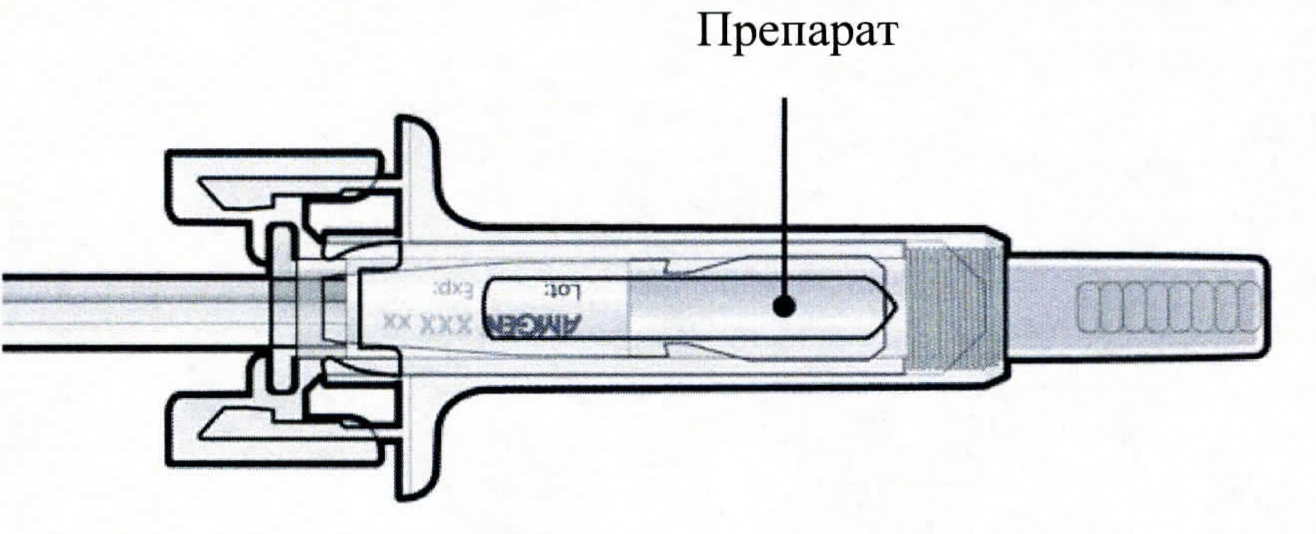
|
|
|
✗ Не используйте предварительно заполненный шприц, если: • Препарат мутный или содержит посторонние частицы. Раствор должен быть прозрачным, бесцветным или светло-желтым. • Любая из частей повреждена или сломана. • Серый колпачок иглы отсутствует или неплотно надет. • Истек последний день указанного на этикетке месяца срока годности. Сообщите Вашему лечащему врачу или медицинской сестре обо всех перечисленных случаях. |
| Шаг 2: Подготовка места инъекции |
|
| А |
Тщательно вымойте руки. Подготовьте и обработайте место инъекции. |
|
|
| В |
Осторожно потяните серый колпачок с иглы без скручивания, по направлению от шприца. |
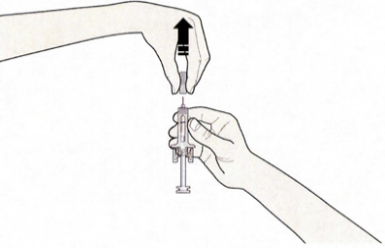
|
| С | Зажмите место инъекции для получения упругой поверхности |
|
|
|
Шаг 3: Введение |
|
| А | Зажмите кожу. ВВЕДИТЕ иглу в кожу. |
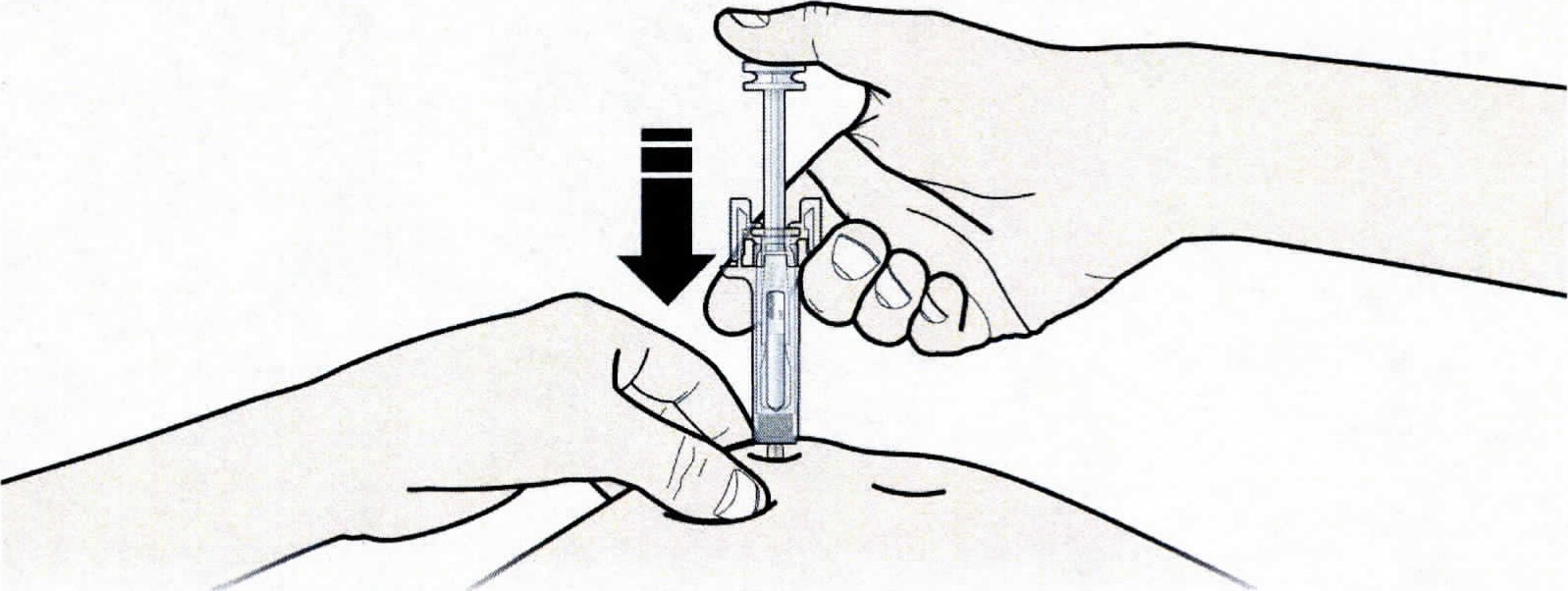 ✗ Не дотрагивайтесь до обработанной области инъекции. |
|
Шаг 4: Окончание |
|
| А |
Выбросите использованный предварительно заполненный шприц и другие сопутствующие материалы в соответствии с местными правилами. |
|
|
|
| В | Осмотрите место инъекции. |
|
Если в месте инъекции выступит кровь, прижмите к нему ватный тампон или бинт. Не растирайте место инъекции. При необходимости, заклейте место инъекции пластырем. |
Пролиа — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер: ЛП-000850
Международное непатентованное название: деносумаб
Лекарственная форма: раствор для подкожного введения.
Состав
Каждый предварительно заполненный шприц содержит:
Активное вещество: 60 мг деносумаба в 1 мл раствора (60 мг/мл).
Вспомогательные вещества: сорбитол (Е420) – 47 мг, уксусная кислота ледяная – 1 мг, полисорбат 20 – 0,1 мг, натрия гидроксид – до рН 5,0 – 5,5, вода для инъекций – до 1 мл.
Описание
Прозрачная жидкость, от бесцветного до светло-желтого цвета, практически свободная от видимых включений.
Фармакотерапевтическая группа
Препараты для лечения заболеваний костей – другие препараты, влияющие на структуру и минерализацию кости. Моноклональные антитела.
Код АТХ: M05BX04
Фармакологические свойства
Фармакодинамика
Механизм действия
Деносумаб представляет собой полностью человеческое моноклональное антитело (IgG2), обладающее высокой аффинностью и специфичностью к лиганду рецептора активатора ядерного фактора каппа B (RANKL) и тем самым препятствует активации единственного рецептора RANKL – активатора ядерного фактора κB (RANK), расположенного на поверхности остеокластов и их предшественников. Таким образом, предотвращение взаимодействия RANKL/RANK ингибирует образование, активацию и продолжительность существования остеокластов. В результате деносумаб уменьшает костную резорбцию и увеличивает массу и прочность кортикального и трабекулярного слоёв кости.
Фармакодинамические эффекты
Применение деносумаба в дозе 60 мг приводило к быстрому уменьшению сывороточных концентраций маркера резорбции костной ткани – 1С-телопептида (СТХ) – приблизительно на 70% в течение 6 часов после подкожного введения и приблизительно на 85% в течение последующих 3 дней. Уменьшение концентрации СТХ оставалось стабильным в 6-месячном интервале между введениями. Скорость снижения концентрации CTX в сыворотке крови частично уменьшалась при снижении концентрации деносумаба в сыворотке крови, что отражает обратимость влияния деносумаба на ремоделирование кости. Данные эффекты наблюдались на протяжении всего курса лечения. Соответственно физиологической взаимосвязи процессов образования и резорбции при ремоделировании костной ткани наблюдалось уменьшение содержания маркеров образования кости (например, костноспецифической щелочной фосфатазы и сывороточного N-концевого пропептида коллагена I типа) с первого месяца после введения первой дозы деносумаба.
Маркеры ремоделирования кости (маркеры образования кости и резорбции кости), как правило, достигали концентраций периода до начала лечения не позднее, чем через 9 месяцев после введения последней дозы препарата. После возобновления лечения деносумабом степень снижения концентраций СТХ была сходна со степенью снижения концентрации СТХ в начале курса лечения деносумабом.
Было показано, что перевод с лечения алендроновой кислотой (средняя продолжительность применения – 3 года) на деносумаб приводит к дополнительному снижению концентрации СТХ в сыворотке по сравнению с группой женщин в постменопаузе с низкой костной массой, продолжавших лечение алендроновой кислотой. В то же время изменения содержания кальция в сыворотке были одинаковыми в обеих группах.
В экспериментальных исследованиях ингибирование RANK/RANKL одновременно со связыванием остеопротегерина с Fc-фрагментом (OPG-Fc), приводило к замедлению роста кости и нарушению прорезывания зубов. Поэтому, лечение деносумабом может тормозить рост костей с открытыми зонами роста у детей и приводить к нарушениям прорезывания зубов.
Иммуногенность
Деносумаб – человеческое моноклональное антитело, поэтому, как и для других лекарственных средств белковой природы существует теоретический риск иммуногенности.
Более чем 13000 пациентов были обследованы на предмет образования связывающих антител с использованием метода чувствительной электрохемилюминесценции в сочетании с иммунологическим анализом. Менее чем у 1% пациентов, принимавших деносумаб в течение 5 лет, определялись антитела (включая существовавшие ранее, транзиторные и растущие).
Серопозитивные пациенты были далее обследованы на предмет образования нейтрализующих антител, используя хемилюминисцентный анализ в культуре клеток in vitro, нейтрализующих антител не обнаружено. Не было выявлено изменений фармакокинетического профиля, токсического профиля или клинического ответа, обусловленных образованием антител.
Клиническая эффективность
Лечение остеопороза в постменопаузе
У женщин с постменопаузальным остеопорозом Пролиа® увеличивает минеральную плотность кости (МПК), уменьшает частоту переломов шейки бедра, вертебральных и невертебральных переломов. Эффективность и безопасность деносумаба в лечении постменопаузального остеопороза была доказана в исследовании, длительностью 3 года.
Результаты исследования показывают, что деносумаб существенно, в сравнении с плацебо, снижает риск возникновения вертебральных и невертебральных переломов, переломов шейки бедра у женщин с остеопорозом в постменопаузе. В исследование было включено 7808 женщин, из которых у 23,6% отмечались часто встречающиеся переломы позвонков. Все три конечные точки эффективности в отношении переломов достигали статистически значимых значений, оцениваемых по предварительно заданной последовательной схеме тестирования.
Снижение риска возникновения новых вертебральных переломов при применении деносумаба в течение более чем 3 лет оставалось стабильным и значимым. Риск снижался независимо от 10-летней вероятности возникновения крупных остеопоротических переломов.
На снижение риска также не влияли наличие часто встречающихся переломов позвонков в анамнезе, невертебральные переломы, возраст пациентов, МПК, уровень ремоделирования кости и предшествующая терапия по поводу остеопороза.
У женщин старше 75 лет в постменопаузе деносумаб уменьшал частоту возникновения новых вертебральных переломов, и, по данным post hoc анализа, уменьшал частоту переломов шейки бедра.
Уменьшение частоты возникновения невертебральных переломов наблюдалось независимо от 10-летней вероятности возникновения крупных остеопоротических переломов.
Деносумаб существенно, по сравнению с плацебо, увеличивал МПК во всех анатомических областях. МПК определяли через 1 год, 2 и 3 года после начала терапии. Сходное влияние на МПК отмечено в поясничном отделе позвоночника независимо от возраста, расовой принадлежности, индекса массы тела (ИМТ), МПК и ремоделирования кости.
Влияние лечения препаратом Пролиа® на случаи возникновения новых вертебральных и невертебральных переломов в течение года оценивались в рамках 5-ти летнего расширенного исследования общей продолжительностью 8 лет. При лечении препатом Пролиа® сохраняется низкий риск возникновения новых вертебральных и невертебральных переломов, а также продолжает увеличиваться МПК по сравнению с иходным уровнем в поясничном отделе позвоночника, всей бедренной кости, шейки бедра и вертеле бедренной кости на протяжении 5 лет.
Гистологические исследования лечения препаратом Пролиа® продолжительностью 5 лет, подтвердили нормальную архитектонику и, как и ожидалось, снижение костного ремоделирования по сравнению с плацебо. Не отмечено патологических изменений, включая фиброз, остеомаляцию и нарушение архитектоники костной ткани.
Клиническая эффективность при лечении потери костной массы, вызванной гормон-депривационной терапией или терапией ингибиторами ароматазы.
Лечение потери костной массы, вызванной депривацией андрогенов Эффективность и безопасность деносумаба при лечении потери костной массы, ассоциированной со снижением концентрации андрогенов, были доказаны в 3-х летнем исследовании, включавшем 1468 пациентов с неметастатическим раком предстательной железы.
Существенное увеличение МПК определяли в поясничном отделе позвоночника, всей бедренной кости, шейке бедренной кости, вертеле бедренной кости спустя 1 месяц после введения первой дозы. Увеличение МПК в поясничном отделе позвоночника не зависело от возраста, расовой принадлежности, географического региона, ИМТ, начальных значений МПК, ремоделирования кости; продолжительности проведения гормон-депривационной терапии и наличия вертебрального перелома в анамнезе.
Деносумаб значительно уменьшал риск возникновения новых вертебральных переломов на протяжении 3 лет применения. Уменьшение риска наблюдалось через 1 год и через 2 года после начала терапии. Деносумаб также снижал риск возникновения более чем одного остеопоротического перелома любой локализации.
Лечение потери костной массы, у женщин, получающих терапию ингибиторами ароматазы по поводу рака молочной железы
Эффективность и безопасность деносумаба в лечении потери костной массы, вызванной адъювантной терапией ингибитором ароматазы, оценивалась в 2-х летнем исследовании, включавшем 252 пациентки с неметастатическим раком молочной железы.
Деносумаб значительно увеличивал МПК во всех анатомических областях, по сравнению с плацебо, в течение 2 лет. Увеличение МПК наблюдалось в поясничном отделе позвоночника спустя месяц после введения первой дозы. Положительное влияние на МПК в люмбальном отделе позвоночника отмечали вне зависимости от возраста, продолжительности терапии ингибитором ароматазы, ИМТ, предшествующей химиотерапии, предшествующего использования селективного модулятора рецепторов эстрогена (СМРЭ) и времени, прошедшего от начала менопаузы.
Лечение остеопороза у мужчин
Эффективность и безопасность Пролиа® в лечении остеопороза у мужчин была продемонстрирована в исследовании, продолжительностью 12 месяцев, включавшем 242 пациента со сниженной костной массой, с базовым уровнем Т-показателя МПК между -2,0 и -3,5 в поясничном отделе позвоночника или шейки бедра. Также включались мужчины с Т-показателем МПК между -1,0 и -3,5 для поясничного отдела позвоночника или шейки бедра и переломами в анамнезе. Мужчины с другими заболеваниями (такими как ревматоидный артрит, остеогенез и болезнь Педжета) или лечением, которое может оказывать влияние на кость, были исключены из исследования.
Лечение препаратом Пролиа® в течение 1 года значительно увеличивало МПК по сравнению базовыми значениями в поясничном отделе позвоночника и всех отделах скелета (проксимальный отдел бедра, дистальный отдел лучевой кости). Пролиа® увеличивала МПК поясничного отдела позвоночника до 4,8%, МПК бедра до 2,0%, МПК вертела бедренной кости до 2,3%, МПК шейки бедренной кости до 2,2%, периферический 1/3 радиус МПК до 0,9%, в сравнении с плацебо.
Увеличение в МПК поясничного отдела позвоночника, бедра и вертела бедренной кости наблюдались через 6 месяцев.
Устойчивые эффекты на МПК поясничного отдела позвоночника наблюдались независимо от возраста, расы, массы тела/индекса массы тела (ИМТ), МПК и уровня резорбции кости.
Гистология кости и гистоморфометрия
Качественные гистологические оценки показывали нормальную архитектонику и качество кости, без каких-либо дефектов минерализации костной ткани или фиброза костного мозга у пациентов, получавших Пролиа®.
Фармакокинетика
При подкожном введении деносумаб характеризуется нелинейной фармакокинетикой, дозозависимой в широком диапазоне доз, и дозозависимым увеличением экспозиции для дозы в 60 мг (или 1 мг/кг) и выше.
Всасывание
После подкожного введения деносумаба в дозе 60 мг биодоступность составила 61 % и максимальная концентрация деносумаба (Cmax) – 6 мкг/мл (диапазон 1-17 мкг/мл), данные параметры наблюдались через 10 дней (диапазон 2-28 дней). После достижения Cmax содержание препарата в сыворотке крови снижалось с периодом полувыведения 26 дней (диапазон 6-52 дня) и далее в течение 3 месяцев (диапазон 1,5 -4,5 месяцев). У 53% пациентов деносумаб не обнаруживался в сыворотке крови после 6 месяцев от последнего введения препарата.
Распределение
Не наблюдалось изменений фармакокинетических параметров деносумаба, а также кумуляции за всё время введения многократных доз препарата по 60 мг каждые 6 месяцев.
Метаболизм
Деносумаб состоит из аминокислот и углеводов, как обычный иммуноглобулин. На основании данных доклинических исследований, ожидается, что метаболизм деносумаба будет происходить по пути клиренса иммуноглобулинов, результатом которого будет распад на небольшие пептидные цепи и отдельные аминокислоты.
В исследовании, 17 женщин с постменопаузальным остеопорозом получали мидазолам (2 мг внутрь) через две недели после однократной инъекции деносумаба (60 мг подкожно), что соответствует времени достижения максимальных фармакодинамических эффектов деносумаба. Деносумаб не влиял на фармакокинетику мидазолама, метаболизирующегося изоферментом CYP3A4 цитохрома P450. Следовательно, деносумаб не должен изменять фармакоконетику препаратов, метаболизирующихся изоферментом CYP3A4.
Выведение
На основании доклинических данных, выведение деносумаба будет происходить по пути выведения всех иммуноглобулинов, результатом которого будет распад на небольшие пептидные цепи и отдельные аминокислоты.
Отдельные группы пациентов
Пациенты пожилого возраста (возраст 65 лет или старше)
Возраст не оказывает значимого влияния на фармакокинетику деносумаба по данным фармакокинетического анализа в популяции пациентов от 28 лет до 87 лет.
Дети и подростки (до 18 лет)
Фармакокинетика у детей не изучалась.
Расовая принадлежность
Фармакокинетика деносумаба не зависит от расовой принадлежности.
Пациенты с почечной недостаточностью
В исследовании на 55 пациентах с различной степенью почечной недостаточности, включая пациентов, находящихся на диализе, степень почечной недостаточности не оказывала влияния на фармакокинетику и фармакодинамику деносумаба; поэтому не требуется коррекции режима дозирования деносумаба при хронической почечной недостаточности.
Хроническая печеночная недостаточность
Исследований влияния недостаточности функции печени на фармакокинетику деносумаба не проводилось.
Показания для применения
- Лечение постменопаузального остеопороза.
- Лечение потери костной массы у женщин, получающих терапию ингибиторами ароматазы по поводу рака молочной железы и у мужчин, с раком предстательной железы, получающим гормон-депривационную терапию.
- Лечение сенильного остеопороза у мужчин.
Противопоказания
Повышенная чувствительность к любому из компонентов препарата.
Гипокальциемия.
Применение в период беременности и грудного вскармливания
Беременность
Нет каких-либо данных по применению препарата во время беременности. Пролиа® не рекомендуется для применения у беременных женщин.
Деносумаб не вызывал снижения фертильности у яванских макак при экспозиции к препарату в 100 раз выше экспозиции у человека (60 мг раз в 6 месяцев).
В исследовании на яванских макаках не отмечено негативного воздействия на организм матери или плод в течение периода, эквивалентного первому триместру экспозиции к деносумабу на дозах, в 99 раз превышающих дозу у человека (60 мг раз в 6 месяцев). В этом исследовании не оценивалось формирование лимфатических узлов плода.
В другом исследовании на яванских макаках, получавших деносумаб в течение беременности, при экспозиции, в 119 раз превышающей таковую у человека (60 мг раз в 6 месяцев), наблюдалось увеличение частоты рождения мертвого плода и постнатальной смертности; аномальный рост костей при сниженной прочности кости, сниженный гемопоэз и нарушение формирования зубов; отсутствие периферических лимфатических узлов; и снижение роста новорожденного. Не отмечено негативного воздействия на организм матери до родов; редко у матери наблюдались нежелательные реакции во время родов. Развитие молочной железы матери было нормальным.
Эксперименты на мышах с выключенным геном показали, что отсутствие RANKL может влиять на созревание молочной железы, что может приводить к ослаблению лактации.
Грудное вскармливание
Неизвестно, выводится ли деносумаб в грудное молоко. Поскольку известно, что потенциально деносумаб может вызывать нежелательные реакции у детей грудного возраста, необходимо или прекратить грудное вскармливание, или отменить препарат.
Способ применения и дозы
Введение
Проведение инъекции препарата требует предварительного обучения – см. рекомендации по введению препарата, приведенные в конце настоящей инструкции.
Доза
Рекомендуемая доза препарата Пролиа® – одна подкожная инъекция 60 мг каждые 6 месяцев.
В течение курса лечения рекомендуется дополнительно принимать препараты кальция и витамин D.
Применение у отдельных групп пациентов
Дети
Препарат Пролиа® не рекомендован к применению в педиатрии, так как эффективность и безопасность данного препарата не изучались в этой возрастной группе.
Пациенты пожилого возраста
Основываясь на имеющихся данных об эффективности и безопасности препарата в данной возрастной группе, не требуется коррекции режима дозирования препарата (см. раздел «Фармакокинетика», подраздел «Отдельные группы пациентов»).
Почечная недостаточность
Основываясь на имеющихся данных об эффективности и безопасности препарата в данной группе пациентов, не требуется коррекции режима дозирования препарата (см. раздел «Фармакокинетика», подраздел «Отдельные группы пациентов»).
У пациентов с тяжелой почечной недостаточностью (клиренс креатинина <30 мл/мин) или находящихся на диализе существует большой риск развития гипокальциемии. Таким пациентам необходимо дополнительно принимать препараты кальция и витамин D.
Печеночная недостаточность
Эффективность и безопасность не изучались.
Инструкция по использованию
Следует оценить раствор перед введением на предмет наличия включений или изменения цвета. Раствор нельзя использовать при помутнении или изменении цвета.
Не встряхивать.
Чтобы избежать дискомфорта в месте введения, следует согреть раствор до комнатной температуры (до 25°C) перед инъекцией, а затем медленно ввести все содержимое предварительно заполненного шприца. Шприц с остатками препарата выбросить.
Подробные рекомендации по самостоятельному подкожному введению препарата включены в данную инструкцию по медицинскому применению.
Любые количества неиспользованного препарата или неиспользованные материалы должны быть уничтожены в соответствии с местными требованиями.
Побочное действие
Заключение по профилю безопасности препарата
По результатам четырех плацебо-контролируемых исследований третьей фазы профиль безопасности препарата Пролиа® сходен при применении у женщин в постменопаузальном периоде и у пациентов со злокачественными новообразованиями молочных желез или предстательной железы, получавших гормон-депривационную терапию.
При применении препарата Пролиа® нечасто сообщалось о развитии целлюлита, редких случаях гипокальциемии, гиперчувствительности и остеонекроза челюсти, и редких случаях развития атипичных переломов бедренной кости (см. раздел «Особые указания» и описание отдельных нежелательных реакций данного раздела).
Нежелательные реакции, зарегистрированные в исследованиях фаз 2 и 3, включавших пациенток в постменопаузе и получавших гормон-депривационную терапию, а также спонтанные сообщения, полученные в пострегистрационный период, приведены в таблице ниже.
Частота возникновения определена следующим образом: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000), на основании общего коэффициента встречаемости. В каждой группе систем органов и частоты сообщений, нежелательные реакции приводятся по убыванию степени серьезности.
| Класс системы органов | Частота | Нежелательная реакция |
| Инфекции и инвазии | Часто | Инфекции мочевыводящих путей |
| Часто | Респираторные инфекции | |
| Нечасто | Дивертикулит1 | |
| Нечасто | Воспаление подкожной клетчатки1 | |
| Нечасто | Инфекции уха | |
| Со стороны иммунной системы | Редко | Реакции гиперчувствительности1 |
| Со стороны метаболизма и электролитного обмена | Редко | Гипокальциемия1 |
| Со стороны нервной системы | Часто | Ишиалгия |
| Со стороны органа зрения | Часто | Катаракта1 |
| Со стороны системы пищеварения | Часто | Запор |
| Со стороны кожи и подкожно-жировой клетчатки | Часто | Сыпь |
| Часто | Экзема | |
| Со стороны костно-мышечной системы и соединительной ткани | Очень часто | Боль в конечностях |
| Редко | Остеонекроз челюсти1 | |
| Редко | Атипичный перелом бедренной кости1 |
1 см. описание отдельных нежелательных реакций.
В обобщенном анализе данных, из всех плацебо-контролируемых исследований II и III фазы, о развитии гриппоподобного синдрома сообщалось с общим коэффициентом встречаемости 1,2% для деносумаба и 0,7% для плацебо. Этот дисбаланс был установлен в обобщенном анализе данных и не обнаружен при стратифицированном анализе.
Описание отдельных нежелательных реакций
Гипокальциемия
В двух плацебо-контролируемых исследованиях третьей фазы, включавших женщин в постменопаузальном периоде, у приблизительно 0,05% пациентов (2 из 4050) уменьшались концентрации кальции в сыворотке крови (менее 1,88 ммоль/л) после введения препарата. Не сообщалось о снижении концентраций кальция в сыворотке крови (ниже 1,88 ммоль/л) в двух плацебо-контролируемых исследованиях, включавших пациентов, получавших гормон-депривационную терапию.
При применении в рутинной клинической практике сообщалось о редких случаях тяжелой симптоматической гипокальциемии у пациентов с повышенным риском гипокальциемии, получающих препарат Пролиа®.
Инфекции кожи
Частота сообщений о развитии инфекций кожи была сравнима для групп препарата Пролиа® (1,5%, 59 из 4050]) и плацебо [1,2%, 50 из 4041] в контролируемых исследованиях третьей фазы у женщин с постменопаузальным остеопорозом и у пациентов, получающих гормон-депривационную терапию по поводу рака молочной железы или предстательной железы (плацебо [1,7%, 14 из 845] в сравнении с группой препарата Пролиа® [1,4%, 12 из 860]).
Кожные инфекции, потребовавшие госпитализации развивались у 0,1% (3 из 4041) пациенток с постменопаузальным остеопорозом в группе плацебо и у 0,4% (16 из 4050) пациенток группы препарата Пролиа®. Это преимущественно были случаи целлюлита. О серьезных случаях инфекций кожи сообщалось со сходной частотой в группах плацебо (0,6%, 5 из 845) и препарата Пролиа® (0,6%, 5 из 860) в исследованиях с гормон-депривационной терапией.
Остеонекроз челюсти
В клинических исследованиях остеопороза (пролечено 9768 пациентов более одного года), зарегистрированы редкие сообщения о развитии остеонекроза челюсти в группе препарата Пролиа® (см. раздел «Особые указания»).
Атипичные переломы бедренной кости
В клинических исследованиях остеопороза зарегистрированы редкие случаи атипичных переломов бедренной кости у пациентов в группе, получавшей препарат Пролиа® (см. раздел «Особые указания»).
Катаракта
В одном из плацебо-контролируемых исследований III фазы у пациентов с раком предстательной железы, получавших гормон-депривационную терапию, отмечен дисбаланс сообщений о развитии катаракты (4,7% в группе деносумаба, 1,2% в группе плацебо).
Подобного дисбаланса не зарегистрировано в исследованиях, включавших женщин в постменопаузе или у женщин, получавших терапию ингибиторами ароматазы по поводу рака молочной железы.
Дивертикулит
В одном из плацебо-контролируемых исследований III фазы у пациентов с раком предстательной железы, получавших гормон-депривационную терапию, отмечен дисбаланс сообщений о развитии дивертикулита (1,2% в группе деносумаба, 0% в группе плацебо).
Частота развития дивертикулита была сравнимой в группах исследований, включавших женщин в постменопаузе или у женщин, получавших терапию ингибиторами ароматазы по поводу рака молочной железы.
Реакции гиперчувствительности
У пациентов, получающих препарат Пролиа® в пострегистрационном периоде, редко сообщалось о реакциях гиперчувствительности, связанных с вводимым препаратом, включая сыпь, крапивницу, отек лица, эритему и анафилактические реакции.
Костно-мышечная боль
У пациентов, получающих препарат Пролиа®, сообщалось о костно-мышечной боли, включая тяжелой степени.
Другие отдельные группы пациентов
В клинических исследованиях, включавших пациентов с тяжелой почечной недостаточностью (клиренс креатинина <30 мл/мл) или диализных пациентов, отмечался более высокий риск развития гипокальциемии при отсутствии добавок кальция.
Пациентам этой группы важно принимать препараты кальция и витамина D (см. раздел «Особые указания»).
Передозировка
В клинических исследованиях не отмечено случаев передозировки препарата.
В клинических исследованиях вводили дозы деносумаба до 180 мг каждые 4 недели (кумулятивная доза до 1080 мг в 6 месяцев).
Взаимодействие с другими лекарственными препаратами
Пролиа® (60 мг подкожно) не влияет на фармакокинетику мидазолама, метаболизирующегося изоферментом CYP3A4 цитохрома P450, что показывает отсутствие влияния на фармакокинетику препаратов, метаболизирующихся по этому пути (см. раздел «Фармакокинетика»).
Фармацевтическая несовместимость
Препарат не следует смешивать с другими лекарственными средствами.
Особые указания и меры предосторожности при применении
Рекомендуется прием препаратов кальция и витамина D во время применения препарата Пролиа®.
Гипокальциемия может быть скорректирована приемом препаратов кальция и витамина D в адекватных дозах перед началом терапии деносумабом. Рекомендуется мониторинг концентрации кальция во время терапии у пациентов, предрасположенных к гипокальциемии, особенно в первые недели после начала терапии (см. раздел «Побочное действие»).
У пациентов, получающих препарат Пролиа®, могут развиться инфекции кожи и ее придатков (преимущественно воспаление подкожной клетчатки), в отдельных случаях требующие госпитализации. О таких реакциях чаще сообщалось для группы деносумаба (0.4%) чем группы плацебо (0.1%) (см. раздел «Побочное действие»). При этом общая частота возникновения кожных инфекций сравнима в группах деносумаба и плацебо.
Пациентов следует проинструктировать незамедлительно обратиться за врачебной помощью в случае развития симптомов и признаков воспаления подкожной клетчатки.
У пациентов с распространенным раком, получавших 120 мг деносумаба каждые 4 недели сообщалось о развитии случаев остеонекроза челюсти. Имеются отдельные сообщения о развитии остеонекроза челюсти на дозе 60 мг каждые 6 месяцев (см. раздел «Побочное действие»).
Недостаточная гигиена полости рта и инвазивные стоматологические процедуры (например, удаление зубов), являлись факторами риска развития ОНЧ у пациентов, получающих препарат Пролиа® в клинических исследованиях.
Перед началом терапии важно оценить пациентов в отношении факторов риска развития ОНЧ. При выявлении факторов риска, перед терапией препаратом Пролиа® рекомендуется провести обследование полости рта и зубов с проведением соответствующих профилактических стоматологических мероприятий. Во время лечения препаратом Пролиа® следует поддерживать адекватную гигиену полости рота.
Во время лечения препаратом Пролиа® следует избегать инвазивных стоматологических процедур. При необходимости таких процедур, решение по плану лечения каждого пациента должно приниматься совместно с лечащим врачом на основании индивидуальной оценки соотношения польза/риск.
Пациенты с подозрением на развитие ОНЧ, или у которых ОНЧ развился во время лечения препаратом Пролиа®, должны находиться под наблюдением стоматолога или челюстно-лицевого хирурга. У пациентов с ОНЧ, развившимся во время применения препарата Пролиа®, может быть принято решение о временном прекращении лечения до разрешения состояния, на основании индивидуальной оценки соотношения риск/польза.
Атипичные переломы бедренной кости отмечались у пациенток в группе препарата Пролиа®.
Атипичные переломы бедренной кости – подвертельные или диафизарные переломы проксимальной части бедренной кости – могут появляться при минимальной травме или без травмы и могут быть билатеральными. На снимках эти переломы обычно имеют характерный внешний вид. Об атипичных переломах бедренной кости также сообщалось у пациентов с сопутствующими заболеваниями и состояниями (например, недостаток витаминов, ревматоидный артрит, гипофосфатазия), и у пациентов, получающих некоторые виды терапии (например, бисфосфонаты, глюкокортикостероиды, ингибиторы протонного насоса).
Эти случаи также наблюдались и в отсутствии антирезорбтивной терапии. Следует проинструктировать пациентов, получающих препарат Пролиа®, о необходимости сообщать о возникновении новой или необычной боли в бедре, тазобедренном суставе или паху.
Пациенты, у которых возникают такие симптомы, должны быть обследованы на наличие трещины бедренной кости и также должно быть исследовано контралатеральное бедро.
Лица с аллергией на латекс не должны касаться резинового колпачка иглы (производное латекса).
Пролиа® содержит такое же активное вещество (деносумаб), как и Эксджива™. Пациенты, получающие Пролиа®, не должны принимать препарат Эксджива™.
Влияние на способность к вождению автотранспорта и к обращению с техникой
Исследований влияния на способность к вождению автотранспортных средств и управлению механизмами не проводилось.
Форма выпуска
Раствор для подкожного введения 60 мг/мл в одноразовом предварительно заполненном шприце (ПЗШ) 1 мл из стекла I гидролитического класса c иглой 27G из нержавеющей стали, эластомерным колпачком и эластомерным плунжером, ламинированным фторполимером (с защитным устройством для иглы или без него). Маркированный шприц помещают в пачку картонную, вместе с инструкцией по применению.
ПЗШ может быть дополнительно помещен в контурную ячейковую упаковку с термоэтикеткой.
Каждую контурную ячейковую упаковку помещают в пачку картонную вместе с инструкцией по применению и карточкой для пациента с описанием техники инъекции (для ПЗШ с защитным устройством для иглы).
Пачка картонная снабжена отрывной карточкой-напоминанием с двумя напоминающими наклейками.
На каждую пачку наклеивают прозрачные защитные этикетки – контроль первого вскрытия, имеющие продольную цветную полосу.
Пролиа® представляет собой стерильный продукт и не содержит консервантов.
Условия хранения
Хранить при температуре 2-8°C. Не замораживать.
Хранить в оригинальной упаковке для защиты от света.
Не встряхивать.
Хранить в недоступном для детей месте!
После изъятия из холодильника Пролиа® может храниться при комнатной температуре не выше 25°C в оригинальной упаковке не более 30 дней.
Срок годности
3 года. Не использовать по окончании срока годности, указанного на упаковке.
Условия отпуска из аптек
По рецепту.
Производитель
Амджен Европа Б.В.
Минервум 7061
NL-4817 ZK Бреда
Нидерланды
В случае упаковки на Российской производственной площадке
Производитель
Амджен Европа Б.В.
Минервум 7061
NL-4817 ZK Бреда
Нидерланды
Упаковано: ООО «Добролек»,115446, Москва, Коломенский проезд, 13А.
Представитель в России
ООО «Амджен»
123317, Москва, Пресненская набережная, д.8, строение 1, 7ой этаж
Инструкции по введению препарата Пролиа® в предварительно заполненном шприце с защитным устройством для иглы
Купить Пролиа в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Пролиа®
МНН: Денозумаб
Производитель: Амджен Мэньюфэкчуринг Лимитед
Анатомо-терапевтическо-химическая классификация: Denosumab
Номер регистрации в РК:
№ РК-БП-5№018769
Информация о регистрации в РК:
03.02.2017 — 03.02.2022
Информация о реестрах и регистрах
Информация по ценам и ограничения
Предельная цена закупа в РК:
59 189.52 KZT
- Скачать инструкцию медикамента
Торговое название
Пролиа®
Международное непатентованное название
Денозумаб
Лекарственная форма
Раствор для подкожного введения, 60 мг/мл
Состав
1 мл раствора содержит
активное вещество – денозумаб 60 мг,
вспомогательные вещества: сорбитол (Е420), уксусная кислота ледяная, полисорбат 20, натрия гидроксид, вода для инъекций.
Описание
Прозрачный раствор от бесцветного до светло-желтого цвета, практически свободный от включений, может содержать следы частиц от полу-прозрачного до белого цвета.
Фармакотерапевтическая группа
Препараты для лечения заболеваний костей. Другие препараты, влияющие на структуру и минерализацию костей. Денозумаб.
Код АТХ M05BX04
Фармакологические свойства
Фармакокинетика
Денозумаб характеризуется нелинейной фармакокинетикой, дозо-зависимой в широком диапазоне доз и дозо-зависимым увеличением экспозиции при подкожном введении дозы 60 мг (1 мг/кг) и выше.
Всасывание
При подкожном введении денозумаба в дозе 60 мг (или 1 мг/кг) его биодоступность составляет 61 %. Максимальная концентрация денозумаба (Cmax) наблюдается через 10 дней после введения (диапазон 2-28 дней) и составляет 6 мкг/мл (диапазон 1-17 мкг/мл).
Метаболизм
Денозумаб состоит из аминокислот и углеводов, как обычный иммуноглобулин. Маловероятно, что денозумаб выделяется посредством печеночного метаболизма. Метаболизм и выведение денозумаба происходит по пути клиренса иммуноглобулинов, результатом которого является распад на небольшие пептидные цепи и отдельные аминокислоты.
Выведение
После достижения Cmax содержание препарата в сыворотке крови снижается с периодом полувыведения 26 дней (диапазон 6-52 дня) и далее в течение 3 месяцев (диапазон 1,5-4,5 месяцев). У 53 % пациентов денозумаб не обнаруживался в сыворотке крови после 6 месяцев от момента последнего приёма препарата.
Не наблюдается изменений фармакокинетических параметров денозумаба, а также кумуляции за всё время приема многократных доз препарата по 60 мг каждые 6 месяцев. На фармакокинетику препарата не оказывало влияния образование связывающих антител к денозумабу.
Фармакокинетика денозумаба имеет сходные показатели у мужчин и женщин.
Фармакокинетика денозумаба не зависит от степени заболевания (потери костной массы или остеопороза; онкологических заболеваний простаты или молочной железы).
Была выявлена корреляция между избыточной массой тела и концентрацией лекарственного средства на основе показателей AUC и Cmax. Однако, данная корреляция не считается клинически важной, поскольку фармакодинамические эффекты, прослеживаемые по маркерам ремоделирования кости и увеличению минеральной плотности кости, были неизменными в широком диапазоне массы тела. Таким образом, масса тела пациента (диапазон от 36 до 140 кг) не оказывает значимого влияния на фармакокинетику денозумаба.
Отдельные группы пациентов
Возраст не оказывает значимого влияния на фармакокинетику денозумаба по данным анализа в популяции пациентов от 28 до 87 лет.
Дети и подростки (до 18 лет)
Фармакокинетика у детей не изучалась.
Расовая принадлежность
Фармакокинетика денозумаба не зависит от расовой принадлежности у женщин в постменопаузе и у пациентов с раком молочной железы, находящихся на гормональной терапии.
Пациенты с почечной недостаточностью
В исследовании на 55 пациентах с различной степенью почечной дисфункции, включая пациентов, находящихся на диализе, степень почечной недостаточности не оказывала влияния на фармакокинетику и фармакодинамику денозумаба; поэтому не требуется коррекции режима дозирования денозумаба при хронической почечной недостаточности.
Хроническая печеночная недостаточность
Исследований влияния недостаточности функции печени на фармакокинетику денозумаба не проводилось. В целом, моноклональные антитела не выводятся посредством печеночного метаболизма, таким образом, печеночная патология не оказывает влияния на фармакокинетику денозумаба.
Фармакодинамика
Механизм действия
Препарат Пролиа® представляет собой полностью человеческое моноклональное антитело (IgG2) с массой около 147 кДа, обладающее высокой аффинностью и специфичностью к лиганду рецептора активатора ядерного фактора κB (RANKL). Связываясь с RANKL – трансмембранным или растворимым белком, играющим важную роль в формировании, функционировании и выживании остеокластов (клеток, отвечающих за резорбцию костной ткани), Пролиа® препятствует активации единственного рецептора RANKL — активатора ядерного фактора κB (RANK), расположенного на поверхности остеокластов и их предшественников. Таким образом, предотвращение взаимодействия RANKL/RANK ингибирует образование, активацию и продолжительность жизни остеокластов. В результате препарат Пролиа® уменьшает костную резорбцию и увеличивает массу и прочность кортикального и трабекулярного слоёв кости.
Фармакодинамические эффекты
Назначение препарата Пролиа® в дозе 60 мг приводит к быстрому уменьшению сывороточных концентраций маркера резорбции костной ткани — 1С-телопептида (СТХ) — приблизительно на 85 % в течение последующих 3 дней. Уменьшение концентрации СТХ остается стабильным в 6-месячном интервале между дозированием. Скорость снижения концентрации CTX в сыворотке крови частично уменьшается при снижении концентрации денозумаба в сыворотке с максимального уровня в ≥ 87 % до ≥ 45 % (в пределах от 45 до 80 %), что отражает обратимость влияния препарата Пролиа® на ремоделирование кости. Данные эффекты наблюдались на протяжении всего курса лечения. После возобновления лечения препаратом Пролиа® степень снижения концентраций СТХ была сходна со степенью снижения концентрации СТХ в начале курса лечения денозумабом.
Соответственно физиологической взаимосвязи процессов образования и резорбции при ремоделировании костной ткани, наблюдалось уменьшение содержания маркеров образования кости (например, костно-специфической щелочной фосфатазы и сывороточного N-терминального пропептида коллагена I типа) с первого месяца после введения первой дозы препарата Пролиа®. После завершения терапии препаратом Пролиа®, маркеры ремоделирования костной ткани достигали уровней, которые на 40-60 % превышали значения, имевшие место перед лечением, но возвращались к начальным значениям в течение 12 месяцев.
В экспериментальных исследованиях ингибирование RANK/RANKL одновременно со связыванием остеопротегерина с Fc-фрагментом (OPG-Fc), приводило к замедлению роста кости и нарушению прорезывания зубов. Поэтому лечение препаратом Пролиа® может тормозить рост костей с открытыми зонами роста у детей и приводить к нарушениям прорезывания зубов.
Иммуногенность
Денозумаб – человеческое моноклональное антитело, поэтому, как и для других терапевтических протеинов, существует теоретический риск его иммуногенности. Более чем 13 000 пациентов были обследованы на предмет образования связывающих антител с использованием метода чувствительной электрохемилюминесценции в сочетании с иммунологическим анализом. Менее чем у 1 % пациентов, принимавших
препарат Пролиа® в течение 5 лет, определялись антитела (включая существовавшие ранее, транзиторные и растущие). Серопозитивные пациенты были далее обследованы на предмет образования нейтрализующих антител, используя хемилюминисцентный анализ в культуре клеток in vitro; нейтрализующих антител обнаружено не было. Не было выявлено изменений фармакокинетического профиля, токсического профиля или клинического ответа, обусловленных образованием антител.
Частота образования антител в большой степени зависит от чувствительности и специфичности метода анализа. Кроме этого, наблюдаемые случаи положительных результатов на антитела (включая нейтрализующие) обусловлены рядом факторов, включая методологию анализа, процедуру работы с образцами, время отбора образцов, совместно принимаемые препараты, предрасполагающие фоновые заболевания. По этим причинам, сравнение частоты образования антител к денозумабу с частотой образования антител к другим препаратам может быть недостоверным.
Клиническая эффективность и безопасность
Лечение постменопаузального остеопороза у женщин
У женщин с постменопаузальным остеопорозом препарат Пролиа® увеличивает минеральную плотность кости (МПК), уменьшает частоту переломов шейки бедра, вертебральных и невертебральных переломов. Результаты многоцентрового 3-х летнего исследования FREEDOM у женщин с наличием или отсутствием переломов на этапе включения в исследование, с исходным уровнем Т-критерия минеральной плотности поясничного отдела позвоночника или бедренной кости от -2,5 до -4, показали, что денозумаб в сравнении с плацебо снижает риск возникновения вертебральных и невертебральных переломов и переломов шейки бедра. Общее количество обследованных женщин составило 7 808 в возрасте 60-91 год, из которых у 23,6 % отмечались часто встречающиеся переломы позвонков.
Таблица 1. Эффект применения препарата Пролиа® на возникновение новых вертебральных переломов у женщин с постменопаузальным остеопорозом
|
Процент соотношения женщин с переломами (%)* |
Абсолютный показатель снижения риска переломов (%) (95 % ДИ)** |
Относительный показатель снижения риска переломов (%) (95 % ДИ)** |
||
|
Плацебо n = 3,906 |
Пролиа® n = 3,902 |
|||
|
0-1 год |
2,2 |
0,9 |
1,4 (0,8; 1,9) |
61 (42, 74) |
|
0-2 годы |
5,0 |
1,4 |
3,5 (2,7; 4,3) |
71 (61,79) |
|
0-3 годы |
7,2 |
2,3 |
4,8 (3,9; 5,8) |
68 (59, 74) |
* Цифры основаны на общих показателях переломов для каждого периода.
** Значения снижений абсолютного и относительно риска получены методом Мантеля-Гензеля с корректировкой на возрастные группы.
Пролиа® эффективно снижает риск новых морфометрических вертебральных переломов независимо от возраста, исходного уровня ремоделирования костной ткани, базового показателя МПК, наличия переломов в анамнезе, предыдущего использования препаратов для лечения остеопороза.
Через 3 года после начала терапии препаратом Пролиа® переломы тазобедренного сустава имелись у 1,2 % пациенток из группы плацебо и у 0,7 % женщин, принимавших Пролиа®. Абсолютное снижение риска переломов тазобедренного сустава (с корректировкой по возрасту) через 3 года составило 0,3 %, а относительное снижение риска – 40 %, (p = 0,04).
Терапия препаратом Пролиа® приводила к значительному сокращению числа невертебральных переломов (таблица 2).
Таблица 2. Эффект применения препарата Пролиа® на возникновение невертебральных переломов на протяжении 3 лет
|
Женщины с переломами (%)+ |
Абсолютное снижение риска (%)* (95 % ДИ) |
Относительное снижение риска (%)* (95 % ДИ) |
||
|
Плацебо n = 3,906 |
Пролиа® n = 3,902 |
|||
|
Невертебральные переломы1 |
8.0 |
6,5 |
1,5 (0,3; 2,7) |
20 (5,33)** |
+ Цифры получены с помощью метода Каплана-Мейера.
1 Кроме переломов позвоночника (шейного, грудного и поясничного отдела), верхней и нижней челюсти, лица, запястья, пальцев рук и ног
* p-значение = 0,01.
Лечение препаратом Пролиа® значительно увеличивает МПК во всех анатомических областях (данные наблюдений через 3 года). МПК выросла на 8,8 % в поясничном отделе позвоночника, на 6,4 % во всем тазобедренном суставе и на 5,2 % в шейке бедра. Сходное влияние на минеральную плотность кости отмечено в поясничном отделе позвоночника независимо от возраста, расовой принадлежности, индекса массы тела (ИМТ), минеральной плотности кости и ремоделирования кости.
После прекращения применения Пролиа®, МПК возвращалась к исходным уровням в течение 12 месяцев.
В 115 образцах биопсии гребня подвздошной кости у 92 женщин с постменопаузальным остеопорозом (образцы получены через 24 и/или 36 месяцев; 53 образца в группе Пролиа®, 62 образца в группе плацебо) гистологические исследования подтвердили нормальную архитектонику и качество костной ткани без признаков дефектов, вызванных минерализацией, незрелости костной ткани или фиброза костного мозга.
По сравнению с плацебо, терапия препаратом Пролиа® приводила к почти полной инактивации ремоделирования костной ткани и заметно сокращала скорость роста костей. Однако, долговременные последствия подобного подавления ремоделирования костной ткани, все еще не известны.
Увеличение костной массы у мужчин с остеопорозом
Эффективность и безопасность применения препарата Пролиа® у мужчин была продемонстрирована в 1-летнем рандомизированном, двойном слепом плацебо-контролируемом многоцентровом исследовании у мужчин с потерей костной массы с исходным уровнем Т-критерия МПК между -2,0 и -3,5 в поясничной области позвоночного столба или шейки бедра. Также были вовлечены мужчины с Т-критерием МПК от -1,0 до -3,5 тех же областей и с наличием переломов в анамнезе. Всего было обследовано 242 мужчины в возрасте от 31 до 84 лет, которые были разделены на две группы – группа плацебо (121 пациент) или группа, принимавшая препарат Пролиа® (121 пациент), когда пациенты получали подкожную инъекцию каждые 6 месяцев в комбинации с ежедневным приемом препаратов кальция (минимум 1 г) и витамином D (минимум 800 МЕ).
Использование препарата Пролиа® значительно увеличивало МПК у пациентов через 1 год: на 4,8 % (+0,9 % для плацебо, +5,7 % для Пролиа®; (95 % ДИ: 4,0; 5,6); p < 0,0001) в поясничном отделе позвоночника, на 2,0 % (+0,3 % для плацебо, +2,4 % для Пролиа®) во всем тазобедренном суставе, и на 2,2 % (0,0 % для плацебо, +2,1 % для Пролиа®) в шейке бедра. Аналогичные эффекты на МПК наблюдались в поясничном отделе позвоночника независимо от возраста, расовой принадлежности, исходного значения МПК, концентраций тестостерона и скорости ремоделирования костной ткани.
Гистологические исследования подтвердили нормальную архитектонику кости с отсутствием дефектов минерализации костной ткани. Не отмечено патологических изменений, включая фиброз, остеомаляцию и нарушение архитектоники костной ткани.
По сравнению с плацебо, терапия денозумабом заметно сокращала скорость роста костей. Однако, долговременные последствия подобного подавления ремоделирования костной ткани, все еще не известны.
Клиническая эффективность при лечении потери костной массы, вызванной гормональной терапией
-
Лечение потери костной массы, у мужчин, получающих гормонодепривационную терапию при неметастатическом раке предстательной железы
Эффективность и безопасность препарата Пролиа® при лечении потери костной массы, ассоциированной со снижением концентрации андрогенов, были доказаны в 3-летнем, рандомизированном (1:1), двойном слепом, плацебо-контролируемом, международном исследовании. Мужчины в возрасте до 70 лет имели базовый Т-критерий МПК от -1,0 до -4,0 в поясничном отделе позвоночника, всём тазобедренном суставе и шейке бедра, либо имели в анамнезе переломы вследствие остеропороза. Средний базовый показатель Т-критерия МПК в поясничном отделе позвоночника составил -0,4. В исследовании участвовали 1486 пациентов в возрасте от 48 до 97 лет (средний возраст 76 лет). Мужчины были разбиты на две группы, в одной из которых пациенты получали подкожные инъекции плацебо (n = 734), а в другой – инъекции Пролиа® 60 мг (n = 734) каждые 6 месяцев (в общей сложности 6 доз). Все пациенты получали препараты кальция (минимум 1000 мг в сутки) и витамин D (минимум 400 МЕ).
Первичным критерием эффективности являлось процентное изменение базового значения Т-критерия МПК в поясничном отделе позвоночника, наблюдаемое через 24 месяца. К вторичным показателям эффективности относились количество новых вертебральных переломов, появившихся через 36 месяцев, диагностированных двумя независимыми рентгенологами. Через 2 года уровень Т-критерия МПК в поясничном отделе позвоночника был выше у пациентов, получавших Пролиа®, по сравнению с группой плацебо [-1,0 % для плацебо, +5,6 % для Пролиа®; разница между плацебо и Пролиа® 6,7 % (95 % ДИ: 6,2; 7,1); p < 0,0001].
Для приблизительно 62% пациентов, продолживших проходить обследования в течение 3 лет, разница в показателях Т-критерия МПК между плацебо и Пролиа® через 3 года составила 7,9 % (-1,2 % для плацебо, +6,8 % для Пролиа®) в поясничном отделе позвоночника, 5,7 % (-2,6 % для плацебо, +3,2 % для Пролиа®) во всем тазобедренном суставе, и 4,9 % (-1,8 % для плацебо, +3,0 % для Пролиа®) в шейке бедра. Аналогичные эффекты на МПК наблюдались в поясничном отделе позвоночника.
Пролиа® значительно снижает количество новых вертебральных переломов, появившихся в течение 3 лет (p = 0,0125).
-
Лечение потери костной массы, у женщин, получающих терапию ингибиторами ароматазы по поводу рака молочной железы
Эффективность и безопасность препарата Пролиа® оценивалась в многоцентровом исследовании, включавшем 252 пациентки в возрасте 35-84 года с раком молочной железы и потерей костной массы, вызванной адъювантной терапией ингибитором ароматазы. Первичным критерием эффективности являлось процентное изменение базового значения МПК в поясничном отделе позвоночника, наблюдаемое через 12 месяцев. Через 1 год уровень Т-критерия МПК в поясничном отделе позвоночника был выше у пациентов, получавших Пролиа®, по сравнению с группой плацебо [-0,7 % для плацебо, +4,8 % для Пролиа®; разница между плацебо и Пролиа® 5,5 % (95 % ДИ: 4,8; 6,3); p < 0,0001].
Для приблизительно 81% пациенток, продолживших проходить обследования в течение 2 лет, разница в показателях Т-критерия МПК между плацебо и Пролиа® через 2 года составила 7,6 % (-1,4 % для плацебо, +6,2 % для Пролиа®) в поясничном отделе позвоночника, 4,7 % (-1,0 % для плацебо, +3,8 % для Пролиа®) во всем тазобедренном суставе, и 3,6 % (-0,8 % для плацебо, +2,8 % для Пролиа®) в шейке бедра.
Показания к применению
— лечение постменопаузального остеопороза у женщин с повышенным риском переломов (наличие в анамнезе остеопоротических переломов или нескольких факторов риска переломов); у пациентов с неудачным опытом предыдущей терапии остеопороза или имеющих непереносимость к существующим препаратам для лечения остеопороза
— увеличение костной массы у мужчин с остеопорозом с повышенным риском переломов (наличие в анамнезе остеопоротических переломов или нескольких факторов риска переломов); у пациентов с неудачным опытом предыдущей терапии остеопороза или имеющих непереносимость к существующим препаратам для лечения остеопороза
— лечение потери костной массы у мужчин, получающих гормонодепривационную терапию при неметастатическом раке предстательной железы
— лечение потери костной массы у женщин, получающих адъювантную терапию ингибиторами ароматазы при раке молочной железы.
Способ применения и дозы
Введение препарата Пролиа® должно осуществляться медицинским персоналом.
Доза
Рекомендуемая доза препарата Пролиа® – одна подкожная инъекция 60 мг через каждые 6 месяцев. Инъекция вводится в верхнюю часть руки, бедра или живота.
Подробную инструкцию по введению см. в приложении, вложенном в упаковку.
Правила введения препарата
Пациенты с аллергией на латекс не должны прикасаться к серому резиновому колпачку иглы предварительно заполненного шприца, который содержит натуральный каучук.
Не встряхивать!
Перед инъекцией препарат следует вынуть из холодильника и, во избежание дискомфорта в месте введения, согреть раствор до комнатной температуры, не вынимая его из упаковки (до 25 °C). Обычно эта процедура занимает от 15 до 30 минут. Не нагревать препарат каким-либо иным образом.
Медленно ввести все содержимое предварительно заполненного шприца.
Для минимизации риска случайного укола иглой, предварительно заполненный шприц с препаратом Пролиа® снабжен устройством защиты, которое автоматически активируется для закрывания иглы после завершения инъекции.
Поставляемый в упаковке предварительно заполненный шприц Пролиа® может отличаться от изображенного на рисунке.
В течение курса лечения ежедневно рекомендуется дополнительно принимать препараты кальция (1000 мг) и витамин D3 (400 МЕ).
Если доза препарата пропущена, необходимо восполнить ее сразу же по мере возможности. Следующая инъекция должна быть сделана через 6 месяцев после получения последней дозы.
Применение у отдельных групп пациентов
Дети и подростки до 18 лет
Препарат Пролиа® не рекомендован к применению в педиатрии, так как эффективность и безопасность данного препарата не изучались в этой возрастной группе. Терапия препаратом Пролиа® может негативно влиять на рост костной массы у детей с открытыми зонами роста и замедлять процесс прорезывания зубов.
Пациенты пожилого возраста
Основываясь на имеющихся данных об эффективности и безопасности препарата в данной возрастной подгруппе, не требуется коррекции режима дозирования препарата. Однако нельзя исключить повышение чувствительности к денозумабу у некоторых пациентов пожилого возраста.
Почечная недостаточность
Для пациентов с почечной недостаточностью, не требуется коррекции режима дозирования препарата.
В клинических исследованиях у пациентов с тяжелой почечной недостаточностью (клиренс креатинина < 30 мл/мин) или находящихся на диализе, установлен большой риск развития гипокальциемии. В отношении таких пациентов настоятельно рекомендуется проводить клинический контроль уровней кальция, фосфора и магния. Таким пациентам необходимо дополнительно принимать препараты кальция и витамина D3.
Печеночная недостаточность
Эффективность и безопасность не изучались.
Побочные действия
К наиболее распространенным побочным реакциям, наблюдаемым у пациенток с постменопаузальным остеопорозом, относятся боль в спине, боль в конечностях, костно-мышечная боль, гиперхолестеринемия и цистит.
К наиболее распространенным побочным реакциям, наблюдаемым у мужчин с остеопорозом, относятся боль в спине, артралгия и назофарингит.
Самыми распространенными (≥ 10 % пациентов) побочными реакциями на препарат Пролиа® у пациентов с потерей костной массы в результате гормонодепривационной терапии при неметастатическом раке предстательной железы или адъювантной терапии ингибиторами ароматазы при раке молочной железы, являются артралгия и боль в спине. В клинических исследованиях также сообщалось о болях в конечностях и костно-мышечной боли.
К наиболее распространенным нежелательным реакциям, приводящим к прекращению приема Пролиа® у пациенток с постменопаузальным остеопорозом, относятся боль в спине и запор.
По данным клинических исследований
В связи с тем, что клинические исследования проводятся при различных условиях, частоту побочных реакций на препарат во время клинических исследований нельзя напрямую сравнивать с частотой реакций в исследованиях другого препарата, и она может не совпадать с частотой, наблюдаемой в клинической практике.
Постменопаузальный остеопороз
Безопасность применения препарата Пролиа® для лечения постменопаузального остеопороза оценивалась в ходе 3-летнего рандомизированного, двойного слепого, плацебо-контролируемого, международного исследования с участием 7808 женщин в возрасте от 60 до 91 года. 3876 женщин получали плацебо, и 3886 пациенток использовали препарат Пролиа® (подкожные инъекции 60 мг каждые 6 месяцев). Всем пациенткам назначались препараты кальция (минимум 1000 мг в сутки) и витамин D (минимум 400 МЕ в сутки).
Показатель общей смертности составил 2,3 % (n = 90) в группе плацебо и 1,8 % (n = 70) в группе Пролиа®. Показатель несмертельных серьезных нежелательных явлений составил 24,2 % в группе плацебо и 25,0 % в группе Пролиа®. Число пациентов, выбывших из исследования по причине нежелательных явлений, было равно 2,1 % и 2,4 % в группах плацебо и Пролиа®, соответственно. Ниже перечислены нежелательные реакции, наблюдавшиеся у ≥ 2 % пациенток с постменопаузальным остеопорозом более часто в группе Пролиа® по сравнению с группой плацебо.
Нарушения со стороны крови и лимфатической системы
— анемия: 3,3 % в группе Пролиа®, 2,8 % в группе плацебо
Нарушения со стороны сердца
— стенокардия: 2,6 % в группе Пролиа®, 2,2 % в группе плацебо
— фибрилляция предсердий: 2,0 % в группе Пролиа®, 2,0 % в группе плацебо
Нарушения со стороны органа слуха и равновесия
— вертиго: 5,0 % в группе Пролиа®, 4,8 % в группе плацебо
Нарушения со стороны желудочно-кишечного тракта
— боль в верхней части живота: 3,3 % в группе Пролиа®, 2,9 % в группе плацебо
— метеоризм: 2,2 % в группе Пролиа®, 1,4 % в группе плацебо
— гастроэзофагеальный рефлюкс: 2,1 % в группе Пролиа®, 1,7 % в группе плацебо
Общие расстройства и реакции в месте введения
— периферический отек: 4,9 % в группе Пролиа®, 4,0 % в группе плацебо
— астения: 2,3 % в группе Пролиа®, 1,9 % в группе плацебо
Инфекционные и паразитарные заболевания
— цистит: 5,9 % в группе Пролиа®, 5,8 % в группе плацебо
— инфекции верхних дыхательных путей: 4,9 % в группе Пролиа®, 4,3 % в группе плацебо
— пневмония: 3,9 % в группе Пролиа®, 3,9 % в группе плацебо
— фарингит: 2,3 % в группе Пролиа®, 2,0 % в группе плацебо
— опоясывающий герпес (опоясывающий лишай): 2,0 % в группе Пролиа®, 1,9 % в группе плацебо
Нарушения со стороны обмена веществ и лабораторные изменения
— гипокальциемия: 1,7 % в группе Пролиа®, 0,4 % в группе плацебо
— гиперхолестеринемия: 7,2 % в группе Пролиа®, 6,1 % в группе плацебо
Нарушения со стороны скелетно-мышечной и соединительной ткани
— боль в спине: 34,7 % в группе Пролиа®, 34,6 % в группе плацебо
— боль в конечностях: 11,7 % в группе Пролиа®, 11,1 % в группе плацебо
— костно-мышечная боль: 7,6 % в группе Пролиа®, 7,5 % в группе плацебо
— костная боль: 3,7 % в группе Пролиа®, 3,0 % в группе плацебо
— миалгия: 2,9 % в группе Пролиа®, 2,4 % в группе плацебо
— остеоартрит позвоночника: 2,1 % в группе Пролиа®, 1,7 % в группе плацебо
Нарушения со стороны нервной системы
— ишиалгия: 4,6 % в группе Пролиа®, 3,8 % в группе плацебо
Нарушения психики
— бессонница: 3,2 % в группе Пролиа®, 3,1 % в группе плацебо
Нарушения со стороны кожи и подкожных тканей
— сыпь: 2,5 % в группе Пролиа®, 2,0 % в группе плацебо
— зуд: 2,2 % в группе Пролиа®, 2,1 % в группе плацебо
— реакции гиперчувствительности, включая сыпь, крапивницу, отек лица, эритему и анафилактические реакции
Серьезные инфекции
Экспрессия лиганда рецептора-активатора ядерного фактора κ-В (RANKL) происходит в активированных лимфоцитах Т и В, а также в лимфатических узлах. Поэтому ингибиторы RANKL, включая препарат Пролиа®, могут повышать риск инфекций. В клиническом исследовании с участием 7808 женщин с постменопаузальным остеопорозом, число случаев инфекций составило:
— серьезные инфекции, которые могут привести к смерти: 0,2 % в группе Пролиа®, 0,2 % в группе плацебо
— несмертельные серьезные инфекции: 4,0 % в группе Пролиа®, 3,3 % в группе плацебо
— случаи госпитализации по причине серьезных инфекций желудка: 0,9 % в группе Пролиа®, 0,7 % в группе плацебо; мочевыводящих путей: 0,7 % в группе Пролиа®, 0,5 % в группе плацебо; и уха: 0,1 % в группе Пролиа®, 0,0 % в группе плацебо
— эндокардит: у 3 пациенток в группе Пролиа®, 0 пациентов в группе плацебо
— кожные инфекции, включая рожу и целлюлит, требующие госпитализации: 0,4 % в группе Пролиа®, < 0,1 % в группе плацебо
— оппортунистические инфекции: одинакова в обеих группах
Дерматологические реакции
— дерматит, экзема, сыпь: 10,8 % в группе Пролиа®, 8,2 % в группе плацебо (p<0,0001)
Большинство нежелательных реакций не было связано с местом инъекции.
Остеонекроз челюсти
— были зафиксированы случаи остеонекроза челюсти
Атипичные подвертельные и диафизарные переломы
— отмечались случаи атипичных переломов
Панкреатит
— панкреатит: 0,2 % в группе Пролиа®, 0,1 % в группе плацебо. Период времени от приема препарата до возникновения был различным.
Вновь выявленные злокачественные новообразования
Общее число случаев появления новых злокачественных образований составило 4,3 % в группе плацебо и 4,8 % в группе Пролиа®. Сообщалось о злокачественных новообразованиях в молочной железе: 0,9 % в группе Пролиа®, 0,7 % в группе плацебо; репродуктивной системе: 0,5 % в группе Пролиа®, 0,2 % в группе плацебо; и желудочно-кишечном тракте: 0,9 % в группе Пролиа®, 0,6 % в группе плацебо. Причинно-следственная связь с приемом препарата не была установлена.
Остеопороз у мужчин
Безопасность применения препарата Пролиа® для лечения мужчин с остеопорозом оценивалась в ходе 1-летнего рандомизированного, двойного слепого, плацебо-контролируемого исследования. В общей сложности 120 пациентов получали плацебо, и 120 пациентов получали Пролиа® (подкожные инъекции 60 мг каждые шесть месяцев). Всем пациентам назначались препараты кальция (минимум 1000 мг в сутки) и витамин D (минимум 800 МЕ в сутки).
Общая смертность составила 0,8 % (n = 1) в группе плацебо и 0,8 % (n = 1) в группе Пролиа®. Несмертельные серьезные нежелательные явления наблюдались у 7,5 % пациентов из группы плацебо и у 8,3 % пациентов из группы Пролиа®. Число пациентов, выбывших из исследования по причине нежелательных явлений, составило 0 % и 2,5 % в группах плацебо и Пролиа®, соответственно.
К нежелательным реакциям, наблюдавшимся у мужчин с остеопорозом, относились:
— боль в спине: 6,7 % в группе плацебо, 8,3 % в группе Пролиа®
— артралгия: 5,8 % в группе плацебо, 6,7 % в группе Пролиа®
— назофарингит: 5,8 % в группе плацебо, 6,7 % в группе Пролиа®
— эпидермальные и кожные нежелательные явления (дерматит, экзема, сыпь): 3,3 % в группе плацебо, 4,2 % в группе Пролиа®
— панкреатит: 0,8 % в группе плацебо, 0,8 % в группе Пролиа®
— злокачественные новообразования (рак предстательной железы, базально-клеточная карцинома): 0 % в группе плацебо, 3,3 % в группе Пролиа®.
Лечение потери костной массы, у мужчин, получающих гормонодепривационную терапию при неметастатическом раке предстательной железы
Безопасность применения препарата Пролиа® для лечения потери костной массы у мужчин с неметастатическим раком предстательной железы, получающих гормонодепривационную терапию, оценивалась в ходе 3-летнего рандомизированного, двойного слепого, плацебо-контролируемого, международного исследования с участием 1468 пациентов в возрасте от 48 до 97 лет. 725 пациентов получали плацебо, и 731 пациент использовал препарат Пролиа® (подкожные инъекции 60 мг каждые шесть месяцев). Всем пациентам назначались препараты кальция (минимум 1000 мг в сутки) и витамин D (минимум 400 МЕ в сутки).
Число серьезных нежелательных явлений составило 30,6 % в группе плацебо и 34,6 % в группе Пролиа®. Количество пациентов, выбывших из исследования по причине нежелательных явлений, составило 6,1 % и 7,0 % в группах плацебо и Пролиа®, соответственно.
Лечение потери костной массы, у женщин, получающих адъювантную терапию ингибиторами ароматазы при раке молочной железы.
Безопасность применения препарата Пролиа® для лечения потери костной массы у женщин с неметастатическим раком молочной железы, получающих терапию ингибиторами ароматазы, оценивалось в ходе 2-летнего рандомизированного, двойного слепого, плацебо-контролируемого, международного исследования с участием 252 женщин в возрасте от 35 до 84 лет. 120 женщин получали плацебо, и 129 пациенток получали Пролиа® (подкожные инъекции 60 мг каждые шесть месяцев). Всем пациенткам назначались препараты кальция (минимум 1000 мг в сутки) и витамин D (минимум 400 МЕ в сутки).
Число серьезных нежелательных явлений составило 9,2 % в группе плацебо и 14,7 % в группе Пролиа®. Количество пациентов, выбывших из исследования по причине нежелательных явлений, составило 4,2 % и 0,8 % в группах плацебо и Пролиа®, соответственно.
К побочным реакциям, наблюдавшимся у ≥ 10 % пациентов, получавших гормонодепривационную терапию по поводу рака предстательной железы, и пациенток, получавших терапию ингибиторами ароматазы по поводу рака молочной железы, которые встречались более часто в группе Пролиа® по сравнению с группой плацебо, относились:
— артралгия: 13,0 % в группе плацебо и 14,3 % в группе Пролиа®
— боль в спине: 10,5 % в группе плацебо и 11,5 % в группе Пролиа®
— боли в конечностях: 7,7 % в группе плацебо и 9,9 % в группе Пролиа®
— костно-мышечные боли: 3,8 % в группе плацебо и 6,0 % в группе Пролиа®
— катаракта: 1,2 % в группе плацебо и 4,7 % в группе Пролиа®
— гипокальциемия: 0 % в группе плацебо и 2,4 % в группе Пролиа®
Опыт пострегистрационного применения
Так как пострегистрационные сообщения о побочных реакциях поступают от населения в добровольном порядке, не всегда представляется возможным достоверно оценить частоту этих реакций и установить причинно-следственную связь с приемом препарата.
За время пострегистрационного применения препарата Пролиа® сообщалось о следующих нежелательных реакциях:
— Реакции повышенной чувствительности, связанные с использованием препарата: анафилаксия, сыпь, крапивница, отек лица, эритема.
— гипокальциемия (тяжелая симптоматическая гипокальциемия).
Противопоказания
— повышенная чувствительность к денозумабу или любому из компонентов препарата
— гипокальциемия
— детский и подростковый возраст до 18 лет
— наследственная непереносимость фруктозы
— беременность и период лактации
Лекарственные взаимодействия
В специальном исследовании 17 женщинам с постменопаузальным остеопорозом назначался мидазолам внутрь в дозе 2 мг через 2 недели после инъекции препарата Пролиа® (60 мг/кг подкожно), что соответствовало времени максимальных фармакодинамических эффектов денозумаба. Денозумаб не оказал какого-либо влияния на фармакокинетику мидозалама, который метаболизируется цитохромом Р450 3А4 (CYP3A4). Данный факт подтверждает, что денозумаб не оказывает влияния на фармакокинетические показатели препаратов, метаболизирующихся системой CYP3A4.
Данные по совместному применению препарата Пролиа® и гормональной заместительной терапии (эстрогены) отсутствуют, тем не менее, предполагаемое взаимодействие незначительно.
Предварительная терапия женщин алендронатом не влияет на фармакокинетику и фармакодинамику денозумаба.
Особые указания
Препарат Пролиа® содержит то же активное вещество (денозумаб), что и препарат ИКСГЕВА, поэтому, пациенты получающие терапию препаратом Пролиа®, не должны применять препарат ИКСГЕВА.
Гиперчувствительность
Использование препарата Пролиа® было связано с развитием серьезных реакций повышенной чувствительности, включая анафилаксию. Симптомы включают в себя пониженное артериальное давление, одышку, чувство стеснения в горле, отек лица и верхних дыхательных путей, зуд и крапивницу. В случае появления анафилактических или других клинически значимых аллергических реакций необходимо начать симптоматическую терапию и прекратить прием препарата Пролиа®.
Гипокальциемия и минеральный обмен веществ
Использование препарата Пролиа® может вызвать обострение гипокальциемии. Рекомендуется адекватный прием препаратов кальция и витамина D всеми пациентами во время применения препарата Пролиа®. Предшествующая гипокальциемия должна быть устранена перед началом терапии препаратом Пролиа®.
Для пациентов с предрасположенностью к гипокальциемии и нарушением минерального обмена веществ (наличие в анамнезе гипопаратиреоза, операций на щитовидной и паращитовидной железе, синдромов мальабсорбции, резекции тонкой кишки, тяжелой почечной недостаточности [клиренс креатинина < 30 мл/мин], диализ), настоятельно рекомендуется осуществлять контроль уровней кальция и минералов (фосфора и магния) в течение всего периода лечения, и особенно в первые несколько недель от начала применения препарата Пролиа®.
Гипокальциемия, возникающая после приема препарата Пролиа®, представляет собой значительный риск для пациентов с тяжелой почечной недостаточностью [клиренс креатинина < 30 мл/мин], а также людей, получающих диализ. Пациенты с тяжелой почечной недостаточностью, в том числе получающие диализ, должны быть проинформированы о симптомах гипокальциемии и важности поддержания адекватных уровней кальция с помощью препаратов кальция и витамина D.
Серьезные инфекции
Экспрессия лиганда рецептора-активатора ядерного фактора κ-В (RANKL) происходит в активированных лимфоцитах Т и В, а также в лимфатических узлах. Поэтому ингибиторы RANKL, включая препарат Пролиа®, могут повышать риск развития серьезных инфекций, требующих госпитализации:
— кожные инфекции
— инфекции брюшной полости
— инфекции мочевыводящих путей
— инфекции уха
— эндокардит.
Пациентам следует рекомендовать немедленно обращаться за медицинской помощью в случае появления признаков и симптомов серьезных инфекций, включая целлюлит.
Пациенты, принимающие иммунодепрессанты вместе с препаратом Пролиа®, а также люди с пониженным иммунитетом находятся в группе повышенного риска развития серьезных инфекций. Перед началом использования препарата Пролиа® такими пациентами необходимо провести оценку профиля «польза-риск». При появлении у пациентов серьезных инфекций врачи должны оценить обоснованность дальнейшего использования Пролиа®.
Кожные инфекции
У пациентов, получающих препарат Пролиа®, могут развиться инфекции кожи и ее придатков (преимущественно целлюлит), в отдельных случаях требующие госпитализации. Частота возникновения кожных инфекций сравнима в группах денозумаба и плацебо (0,4 % и 0,1 % соответственно).
В случае развития симптомов и признаков целлюлита, пациент должен сообщить об этом врачу.
В клиническом исследовании отмечались случаи эпидермальных и кожных нежелательных явлений, включая дерматит, экзему и сыпь. Большинство таких реакций не было связано с местом инъекции.
В случае появления тяжелых симптомов следует рассмотреть возможность прерывания терапии препаратом Пролиа®.
Остеонекроз челюсти
У пациентов, принимавших Пролиа®, отмечались редкие случаи развития остеонекроза челюсти.
Остеонекроз челюсти, который может появляться спонтанно, как правило, связан с удалением зубов и/или задержкой лечения местной инфекции.
Перед началом терапии препаратом Пролиа® врач должен провести стандартное обследование ротовой полости. Рекомендуется проводить осмотр и профилактическую санацию полости рта и зубов перед началом терапии препаратом Пролиа® у пациентов, имеющих факторы риска развития остеонекроза челюсти: инвазивные стоматологические процедуры (удаление зубов, зубные имплантаты, хирургия ротовой полости); онкологические пациенты; пациенты, получающие совместную терапию другими препаратами (химиотерапия, кортикостероиды); пациенты с несанированной ротовой полостью и сопутствующими заболеваниями (периодонтальные и/или другие предшествующие болезни зубов, анемия, коагулопатия, инфекции, плохо подогнанные зубные протезы). В течение курса лечения препаратом Пролиа® пациенты должны проводить надлежащую гигиену и санацию полости рта.
В случае необходимости проведения инвазивной стоматологической процедуры, план лечения каждого конкретного пациента определяется на основании клинической оценки лечащего врача и/или стоматолога с применением индивидуальной оценки пользы и рисков для пациента.
Пациенты с подозрением на остеонекроз челюсти или развитием данного заболевания в процессе использования препарата Пролиа® должны пройти обследование у стоматолога или челюстно-лицевого хирурга. Обширное стоматологическое вмешательство в этом случае может привести к обострению заболевания. По результатам оценки пользы и риска врач должен принять решение о возможном прекращении использования Пролиа®.
Аллергия на латекс
Лица с аллергией на латекс не должны касаться резинового колпачка иглы (производное латекса).
Атипичные переломы бедра
У пациентов, принимающих препарат Пролиа®, наблюдались атипичные переломы бедренной кости. Эти переломы могут возникать в любом месте тела бедренной кости, начиная от малого вертела до надмыщелковой области и имеют поперечную или поперечно-косую ориентацию без признаков раздробления. Причинно-следственная связь между препаратом и переломами установлена не была, так как такие переломы также возникают у пациентов с остеопорозом, которые не получали антирезорбтивные препараты.
Атипичные переломы бедра в большинстве случаев не связаны с травмами (или связаны с минимальными травмами) поврежденной области. Они могут быть двусторонними, и многие пациенты сообщают о продромальной боли в пораженной области, как правило, тупой, ноющей боли в бедре, возникающей за несколько недель или месяцев до появления перелома. В ряде отчетов сообщается о том, что пациенты также получали глюкокортикоиды (например, преднизолон) на момент появления перелома.
Во время терапии препаратом Пролиа®, пациентам следует рекомендовать сообщать о новых или необычных болевых ощущениях в бедрах, тазобедренном суставе или паху. Пациенты с болями в тазобедренном суставе или паху должны пройти обследование на возможное наличие атипичных переломов и неполных переломов бедра. Пациенты с атипичными переломами бедра также должны обследоваться на предмет наличия признаков и симптомов в контралатеральной конечности. Следует рассмотреть возможность прерывания терапии препаратом Пролиа® на основании индивидуальной оценки соотношения «польза-риск».
Подавление ремоделирования костной ткани
В клинических исследованиях с участием женщин с постменопаузальным остеопорозом, терапия препаратом Пролиа® приводила к значительному подавлению ремоделирования костной ткани, подтверждаемому маркерами обновления костной ткани и гистоморфометрией костной ткани. Значимость этих наблюдений и эффект продолжительной терапии препаратом Пролиа® не известны. Долгосрочные последствия подавления ремоделирования костной ткани различной степени тяжести, наблюдаемого при использовании препарата, могут способствовать развитию нежелательных реакций, включая остеонекроз челюсти, атипичные переломы и замедление излечения перелома. Пациенты должны контролироваться на предмет развития подобных последствий.
Пациенты с непереносимостью фруктозы не должны принимать препарат Пролиа®.
Препарат Пролиа® содержит 23 мг натрия, таким образом, данный продукт может считаться «не содержащим соли».
Фертильность
Нет данных.
Беременность и период лактации
Нет каких-либо данных по применению препарата Пролиа® во время беременности. Пролиа® противопоказана для применения у беременных женщин.
В случае, если беременность наступила во время лечения препаратом Пролиа®, пациентка должна быть осведомлена о потенциальном риске для плода, терапию необходимо прекратить, а пациентка должна проинформировать лечащего врача о факте наступления беременности.
Неизвестно, проникает ли денозумаб в грудное молоко. В связи с возможными побочными реакциями на препарат, либо препарат Пролиа®, либо грудное вскармливание должно быть отменено.
Использование мужчинами
Использование препарата Пролиа® может наносить вред плоду.
Уровень содержания денозумаба в семенной жидкости неизвестен. В случае незащищенного полового контакта мужчины, принимающего денозумаб, с беременной женщиной существует возможность воздействия препарата на плод. Риск вреда для плода является незначительным. Мужчины, получающие препарат Пролиа® и имеющие беременных партнерш, должны быть осведомлены о данном риске.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Негативного влияния на способность к управлению автомобилем и механизмами не обнаружено.
Передозировка
В клинических исследованиях вводили дозы денозумаба до 180 мг каждые 4 недели (кумулятивная доза до 1080 мг в 6 месяцев) — не отмечено случаев передозировки препарата.
Форма выпуска и упаковка
Раствор для подкожного введения, 60 мг/мл.
По 1 мл препарата в одноразовом предварительно заполненном шприце (ПЗШ) объемом 1 мл из стекла типа I c иглой 27G из нержавеющей стали, эластомерным колпачком и эластомерным плунжером, ламинированным фторполимером (с защитным устройством для иглы или без него). Маркированный шприц помещают в картонную пачку вместе с инструкцией по применению на государственном и русском языках.
ПЗШ может быть дополнительно помещен в контурную ячейковую упаковку с термоэтикеткой. Каждую ячейковую упаковку помещают в картонную пачку вместе с инструкцией по применению на государственном и русском языках.
Условия хранения
Хранить при температуре от 2 °C до 8 °C. Не замораживать.
Хранить в оригинальной упаковке для защиты от света.
После изъятия из холодильника препарат может храниться при комнатной температуре не выше 25 °C в оригинальной упаковке не более 30 дней.
Хранить в недоступном для детей месте!
Срок хранения
3 года
Не использовать после истечения срока годности
Условия отпуска из аптек
По рецепту
Производитель
Амджен Мэньюфэкчуринг Лимитед,
Стэйт Роуд 31, Километр 24.6, Янкос 00777- 4060, Пуэрто-Рико
Упаковщик
Амджен Европа Б.В.,
Минервум 7061, Бреда, 4817 ZK, Нидерланды
Владелец регистрационного удостоверения
Амджен Европа Б.В.,
Минервум 7061, Бреда, 4817 ZK, Нидерланды
Пролиа является зарегистрированной торговой маркой Amgen Inc., под лицензией группы компаний ГлаксоСмитКляйн.
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции (товара)
Представительство ГлаксоСмитКляйн Экспорт Лтд в Казахстане
050059, г. Алматы, ул. Фурманова, 273
Номер телефона: +7 727 258 28 92, +7 727 259 09 96
Номер факса: + 7 727 258 28 90
Адрес электронной почты: kaz.med@gsk.com
Утвержденную версию инструкции по медицинскую применению смотрите также на сайте www.dari.kz
Қосымша / Приложение
|
Кездейсоқ кіргізіп алудан қорғайтын автоматты құрылғысы бар алдын ала толтырылған еккішпен (АТЕ) инъекция жасау туралы ақпарат |
Информация по проведению инъекции предварительно заполненным шприцем (ПЗШ) с автоматическим устройством защиты от случайного укола |
|||||||||||||||
|
Пайдалануға дейін / До использования |
Пайдаланудан кейін / После использования |
|||||||||||||||
|
|
|
Маңызды! |
Важно! |
|
|
Пролиа® препаратын қолданар алдында төменде берілген маңызды ақпаратпен танысып шығу керек! |
Перед применением препарата Пролиа® следует ознакомиться с нижеприведенной важной информацией! |
|
|
Қолдан қатты беткейге түсіп кеткен АТЕ қолдануға болмайды. Жаңа АТЕ пайдаланыңыз. Инъекция алдында АТЕ бөлшектеуге немесе сақтандырғышты іске қосуға әрекеттенбеңіз. Егер иненің қалпақшасы алынып қалса немесе сақтандырғышы іске қосылып қойса, АТЕ пайдаланбаңыз. |
НЕ следует применять ПЗШ, выпавший из рук на твердую поверхность. Используйте новый ПЗШ. НЕ пытайтесь разбирать ПЗШ или активировать предохранитель перед инъекцией. НЕ используйте ПЗШ, если колпачок был удален, или предохранитель иглы был активирован. |
|
|
Алдын ала толтырылған еккішті қалай пайдаланады? Инъекцияға мыналар қажет: Пролиа® препаратымен жаңа АТЕ, спиртке шыланған мақта тампондар. 1. Еккішті тоңазытқыштан алып шығу керек. 2. Инъекция өте жайлы болу үшін АТЕ бөлме температурасында қалдырылу керек. АТЕ қандай да бір өзге тәсілмен (мысалы, микротолқынды пеште немесе ыстық суда) қыздырмаңыз. Еккішті тіке түсетін күн сәулесі астында қалдырмаңыз. 3. АТЕ сілкімеңіз. 4. Сіз инъекцияға дайын болғанша, АТЕ қалпақшасын алып тастамаңыз. 5. АТЕ жарамдылық мерзімін тексеріңіз. Жарамдылық мерзімі қаптамасында көрсетілген. Сақтау мерзімі көрсетілген айдың соңғы күнінен соң АТЕ пайдаланбаңыз. 6. Жайлы, жақсы жарықтандырылған жер мен таза беткей таңдап алыңыз. 7. Қолыңызды мұқият жуыңыз. 8. Пішінді қаптамасынан термозаттаңбасын алып тастаңыз. Суретте көрсетілгендей, пішінді қаптамасынан АТЕ суырып алу үшін АТЕ-ні қорғағыш құрылғысынан ұстап шығарыңыз: |
Как использовать предварительно заполненный шприц? Для инъекции потребуется: новый ПЗШ препарата Пролиа®, смоченные спиртом ватные тампоны. 1. Следует достать шприц из холодильника. 2. Следует оставить ПЗШ при комнатной температуре для более комфортной инъекции. НЕ подогревайте ПЗШ каким-либо другим способом (например, в микроволновой печи либо в горячей воде). НЕ оставляйте шприц под прямыми солнечными лучами. 3. НЕ встряхивайте ПЗШ. 4. НЕ удаляйте колпачок ПЗШ до тех пор, пока Вы не готовы к инъекции. 5. Проверьте срок годности ПЗШ. Срок годности указан на упаковке. НЕ используйте ПЗШ после последнего дня указанного месяца хранения. 6. Выберите комфортное, хорошо освещенное место и чистую поверхность. 7. Тщательно вымойте руки. 8. Удалите термоэтикетку с контурной упаковки. Возьмите ПЗШ за защитное устройство для выемки ПЗШ из контурной упаковки как показано на рисунке: |
|
|
|
|
|
Осында көрсетілгендей ұстаңыз |
/ Возьмитесь, как показано здесь |
|
|
9. Пролиа® препаратының сыртқы түрін тексеріңіз. Ерітінді мөлдір, түссіз немесе ашық-сары болуы тиіс. АТЕ пайдалануға болмайды, егер: — ерітінді лайланса, өзгеше боялса немесе бөгде бөлшектері болса — АТЕ бүлінсе немесе онда сызат болса |
9. Проверьте внешний вид препарата Пролиа®. Раствор должен быть прозрачным, бесцветным или светло-желтым. НЕ следует использовать ПЗШ, если: — раствор помутнел, окрашен иначе или содержит инородные частицы — ПЗШ поврежден или на нем видна трещина |
|
|
Кіндік маңынан 5 см аумаққа инъекция салуға болмайды / Следует избегать инъекции в область 5 см вокруг пупка |
Инъекция салатын жерді қалай дұрыс таңдау керек? Инъекцияны бәрінен бұрын санның, іштің жоғарғы тұсына немесе қолдың жоғарғы жағына салған дұрыс. Как правильно выбрать место для инъекции? Лучше всего делать инъекции в верхнюю часть бедер, живота или верхнюю часть руки |
|
|
Егер Сіз инъекция жасамақ болған аумақ қызарып, ісіп немесе қатайып кетсе, инъекцияға басқа жерді таңдаған дұрыс. Терінің тыртықтанған және керілген аумағына инъекция салмаңыз. |
Если область, куда Вы собрались делать инъекцию, покраснела, отекла или затвердела, следует выбрать другое место инъекции. Не производите инъекцию в область шрамов и растяжек на коже. |
|
|
Инъекция қалай жасалады? 1. Инъекция орнын спиртке шыланған тампонмен зарарсыздандырыңыз. Терінің кебуін күте тұрыңыз. Инъекцияға дейін ол жерге тиіспеңіз. |
Как производить инъекцию? 1. Продезинфицируйте место инъекции с помощью смоченного в спирте тампона. Подождите, пока кожа высохнет. Не прикасайтесь к месту до инъекции. |
|
|
2. Инені майыстырып алмас үшін, суретте көрсетілгендей, инеден қалпақшасын бұрамастан мұқият шешіңіз. Инеге тиіспеңіз және поршеньді баспаңыз. |
2. Во избежание изгиба иглы, аккуратно снимите колпачок с иглы без скручивания, как показано на рисунке. НЕ дотрагивайтесь до иглы и не нажимайте на поршень. |
|
|
3. Теріні бас бармақ пен сұқ саусақ арасында жиырып (қыспай) ұстаңыз. Инъекция кезінде тері қатпарын жіберіп алмаңыз. |
3. Зажмите кожу (не сдавливая) между большим и указательным пальцами. Во время инъекции не отпускайте кожную складку. |
|
|
4 . Инені енгізіңіз. Препаратты бұлшықеттерге немесе қан тамырларына енгізбеңіз. |
4. Введите иглу. Не вводите препарат в мышцы или кровеносные сосуды. |
|
|
5 . Поршеньді, бір мезгілде тері қатпарын ұстап тұрып, баяу басыңыз. Поршеньді өзіне тән сыртылы естілгенше тұрақты қысым түсіріп, баяу басып тұрады. Поршеньді сыртылдан соң да еккіш босап қалғанша басуды жалғастырыңыз. |
5. Плавно надавите на поршень, одновременно придерживая кожную складку. Надавливать на поршень следует медленно и с постоянным давлением, до характерного щелчка. Продолжайте давление на поршень даже после щелчка, пока шприц не опустеет. |
|
|
Доза түгел жеткізілу үшін сыртылдан соң поршеньді басып тұруды жалғастыру маңызды. |
Важно продолжать давление на поршень после щелчка для доставки всей дозы. |
|
|
6. Поршеньді босатыңыз, инені теріден шығарып алып, тері қатпарын жіберіңіз. |
6. Отпустите поршень, удалите иглу из кожи и отпустите кожную складку. |
|
|
Поршень босаған соң қорғағыш құрылғы инені жабады.
|
После освобождения поршня защитное устройство покроет иглу.
|
|
|
7. Егер сақтандырғыш іске қосылмаса, Сіздің инъекцияны толық жасамаған болуыңыз мүмкін. Егер Сіз дозаны толық алмадым деп есептесеңіз, Өз емдеуші дәрігеріңізге қоңырау шалыңыз. 8. Егер инъекция егілген жерден қан ақса, оны мақта тампонмен немесе матамен мұқият сүртіңіз. Инъекция орнын уқаламаңыз. Қажет болса, инъекция жасалған жерге бұласыр жапсыруға болады. 9. Бір инъекция үшін тек бір АТЕ пайдаланыңыз. Еккіште қалған препаратты пайдаланбаңыз. |
7. Если предохранитель не активировался, возможно, что Вы не выполнили инъекцию полностью. Позвоните Вашему лечащему врачу, если Вы считаете, что Вы не получили полную дозу. 8. Если выступит кровь в месте инъекционного прокола, аккуратно сотрите ее ватным тампоном или тканью. Не растирайте место инъекции. При необходимости можно заклеить место инъекции пластырем. 9. Используйте один ПЗШ только для одной инъекции. НЕ используйте оставшийся в шприце препарат. |
|
|
Пайдаланылған еккіш жергілікті талаптарға сай жойылуы тиіс. Бұл шаралар қоршаған ортаны қорғауға көмектеседі. Пайдаланылған еккішті балалардың қолы жетпейтін жерде сақтаңыз. |
Использованный шприц должен быть утилизирован в соответствии с местными требованиями. Эти меры помогут защите окружающей среды. Храните использованный шприц в недоступном для детей месте. |
|
|
|
| 703000071477977122_ru.doc | 2129 кб |
| 737300901477978289_kz.doc | 2133.5 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники