Ракстан-сановель — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер
ЛСР-001834/08
Торговое наименование препарата
Ракстан-Сановель
Международное непатентованное наименование
Флурбипрофен
Лекарственная форма
таблетки покрытые оболочкой
Состав
каждая таблетка содержит:
активное вещество: флурбипрофен 100 мг.
вспомогательные вещества: лактозы моногидрат, целлюлоза микрокристаллическая, кроскармелоза натрия, гипролоза, магния стеарат, кремния диоксид коллоидный. оболочка: краситель опадрай синий (лактозы моногидрат, гипролоза, титана диоксид, макрогол 4000, индигокармин).
Описание
Продолговатые двояковыпуклые таблетки, покрытые оболочкой голубого цвета с двусторонней риской.
Фармакотерапевтическая группа
нестероидный противовоспалительный препарат (НПВП)
Код АТХ
M01AE09
Фармакодинамика:
Нестероидный противовоспалительный препарат, оказывает противовоспалительное, анальгезирующее и жаропонижающее действие. Основной механизм действия связан с угнетением синтеза простагландинов за счет блокирования циклооксигеназ (ЦОГ-1 и ЦОГ-2). В реализации терапевтического действия препарата участвуют и другие механизмы снижения чувствительности тканей к медиаторам воспаления.
Фармакокинетика:
После приема внутрь хорошо и полностью всасывается из пищеварительного тракта и достигает максимальной концентрации в плазме (в среднем 15 мкг/мл) через 1-2 ч. Прием пищи не влияет на биодоступность препарата. Период полувыведения в среднем составляет 6 часов. Связь с белками плазмы — более 99%. Флурбипрофен почти полностью метаболизируется и выводится в основном почками (глюкурониды и сульфатированные конъюгаты): 20% в неизменном виде.
Показания:
- Заболевания опорно-двигательного аппарата: ревматоидный и подагрический артрит, анкилозирующий спондилоартрит. ревматическое поражение мягких тканей;
- Болевой синдром слабой и умеренной интенсивности: артралгия, миалгия, радикулит, невралгия, зубная боль, головная боль, травмы и ожоги;
- Посттравматический и послеоперационный болевой синдром, сопровождающийся воспалением
- Дисменорея.
Противопоказания:
- повышенная чувствительность к флурбипрофену и другим НПВП;
- эрозивно-язвенные поражения желудочно-кишечного тракта (в фазе обострения);
- кровотечения из желудочно-кишечного трактаи цереброваскулярные кровотечения;
- бронхиальная астма в сочетании с полипозом слизистой носа;
- декомпенсированная хроническая сердечная недостаточность;
- лечение послеоперационной боли после проведения аорто-коронарного шунтирования;
- нарушения гемостаза (в т.ч. гемофилия, удлинение времени кровотечения, склонность к кровотечениям);
- выраженная печеночная или почечная недостаточность;
- детский возраст до 15 лет;
- беременность и период лактация.
С осторожностью:
Анемия, нарушения кроветворения, бронхиальная астма, хроническая сердечная недостаточность, артериальная гипертензия, ишемическая болезнь сердца, отечный синдром, печеночная и/или почечная недостаточность, алкоголизм, воспалительные заболевания кишечника, дивертикулит, эрозивно-язвенные заболевания желудочно- кишечного тракта вне обострения, сахарный диабет, состояние после обширных хирургических вмешательств, индуцируемая порфирия, пожилой возраст.
Способ применения и дозы:
Внутрь.
Суточную дозу 150-200 мг: следует распределить на 2-3 приема в день. Пациентам с острыми симптомами или во время обострения болезни суточную дозу кратковременно (2-3 дня) можно увеличить до 300 мг.
Дисменорея:
в начале 100 мг, с последующим приемом 50 или 100 мг каждые 4 или 6 часов. Максимальная суточная доза препарата не должна превышать 300 мг.
Побочные эффекты:
Со стороны пищеварительной системы: чаще 1% — тошнота, рвота, изжога, диарея, запор, боль в животе, метеоризм, повышение уровня “печеночных” ферментов, желудочно-кишечное кровотечение,
реже 1% — пептическая язва с возможными осложнениями (кровотечение, перфорация), гастрит, желтуха, мелена, появление крови в рвотных массах, поражение пищевода, афтозный стоматит, глоссит, гепатит.
Со стороны нервной системы: чаще 1% — головная боль, головокружение, тревожность, нарушение сна, усиление рефлексов, тремор, амнезия, астения, депрессия, сомноленция;
реже 1% — атаксия, ишемическое поражение мозга, слабость, парестезии, судороги.
Со стороны органов чувств: чаще 1% — нарушения зрения (нечеткость зрения, диплопия, скотома), шум в ушах, снижение слуха; реже 1% — конъюнктивит, нарушение обоняния и вкуса;
взаимосвязь с использованием препарата не установлена — повышение внутриглазного давления, кровоизлияния в сетчатку, ретробульбарный неврит.
Со стороны кожных покровов: чаще 1% — кожный зуд, кожная сыпь; реже 1% — алопеция, крапивница, экзема, токсический дерматит, многоформная экссудативная эритема, в т.ч. синдром Стивенса-Джонсона, токсический эпидермальный некролиз (синдром Лайелла), повышенная фоточувствительность.
Со стороны мочеполовой системы: чаще 1% — задержка жидкости, инфекции мочевыводящей системы;
реже 1% — гематурия, повышение уровня мочевой кислоты, интерстициальный нефрит, почечная недостаточность.
Со стороны органов кроветворения и иммунной системы: реже 1% — анемия (в том числе гемолитическая и апластическая анемии), снижение уровня гемоглобина и гематокрита, тромбоцитопеническая пурпура, лейкопения, тромбоцитопения, эозинофилия, агранулоцитоз.
Со стороны дыхательной системы: чаще 1% — ринит; реже 1% — кашель, бронхоспазм. Со стороны сердечно-сосудистой системы: реже 1% — повышение артериального давления, вазо дилатация, отеки, застойная сердечная недостаточность; взаимосвязь с использованием препарата не установлена — стенокардия, аритмия, инфаркт миокарда.
Аллергические реакции: реже 1% — анафилактоидные реакции, анафилактический шок (обычно развивается стремительно), отек губ и языка, аллергический васкулит.
Иные: реже 1% — лихорадка, озноб.
Передозировка:
Симптомы передозировки: угнетение дыхания, тошнота, боль в эпигастральной области, головная боль, головокружение.
Лечение: промывание желудка и симптоматическое лечение.
Специфического антидота на флурбипрофен не существует.
Взаимодействие:
Флурбипрофен может снижать эффективность ингибиторов ангиотензин-
превращающего фермента.
Совместное использование препарата с антикоагулянтами (например, варфарин) приводит к повышению риска развития серьезного кровотечения.
Одновременное использование с ацетилсалициловой кислотой приводит к значительному снижению концентрации препарата в сыворотке крови.
Увеличивает вероятность возникновения побочных эффектов других нестероидних противовоспалительных препаратов и глюкокортикостероидные средства
(кровотечения в желудочно-кишечном тракте), токсичность метотрексата и нефротоксичность циклоспорина.
Флурбипрофен уменьшает гипотензивную активность бета-блокаторов.
Снижает эффект диуретиков (фуросемид, тиазидные диуретики), на фоне калийсберегающих диуретиков усиливается риск гиперкалиемии.
Особые указания:
Во время длительного лечения необходим контроль картины периферической крови и функционального состояния печени и почек. Как и другие НПВП препарат может влиять на фертильность, о чем следует предупреждать женщин, планирующих беременность (снижается вероятность наступления беременности). Во время лечения следует воздерживаться от занятий потенциально опасными видами деятельности, требующими повышенного внимания и быстроты психических и двигательных реакций.
Форма выпуска/дозировка:
Таблетки, покрытые оболочкой 100 мг
Упаковка:
5 таблеток в блистер из ПВХ-алюминиевой фольги. По 6 блистеров помещают в картонную пачку вместе с инструкцией по применению
Условия хранения:
В сухом, защищенном от света месте при температуре не выше 30°С.
Хранить в недоступном для детей месте.
Срок годности:
4 года. Не использовать позже срока, указанного на упаковке.
Условия отпуска
По рецепту
Производитель
Сановель Фармако-индустриальная торговая компания, Silivri Ilcesi, Balaban Mahallesi, Cihaner Sokagi, № 10, 34580, Istanbul Ili, Turkey, Турция
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
Сановель Фармако-индустриальная торговая компания
Купить Ракстан-сановель в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Ракстан-Сановель (таблетки, покрытые оболочкой, 100 мг), инструкция по медицинскому применению РУ № ЛСР-001834/08
Дата последнего изменения: 09.09.2021
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Нозологическая классификация (МКБ-10)
- Фармакологическая группа
- Лекарственная форма
- Состав
- Описание лекарственной формы
- Фармакокинетика
- Фармакодинамика
- Показания
- Противопоказания
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
- Отзывы
Действующее вещество
ATX
Фармакологическая группа
Лекарственная форма
Таблетки,
покрытые оболочкой.
Состав
Состав
на одну таблетку
Действующее вещество:
Флурбипрофен
100,0 мг;
Вспомогательные вещества:
Лактозы
моногидрат 124,50 мг, целлюлоза микрокристаллическая 55,0 мг,
кроскармеллоза натрия 7,30 мг, гипролоза 9,80 мг, магния стеарат
1,30 мг, кремния диоксид коллоидный 2,10 мг.
Оболочка:
Опадрай II
синий OY-L-20906 (лактозы моногидрат 36,00%, гипролоза 28,00%, титана диоксид
22,705%, макрогол 4000 10,00%, индигокармин (%11–14) 2,580%, индигокармин
(%30–36) 0,715%) 10,0 мг.
Описание лекарственной формы
Продолговатые
двояковыпуклые таблетки, покрытые оболочкой голубого цвета с двусторонней
риской.
Фармакокинетика
После
приема внутрь хорошо и полностью всасывается из пищеварительного тракта и
достигает максимальной концентрации в плазме (в среднем 15 мкг/мл) через
1–2 ч. Прием пищи не влияет на биодоступность препарата. Период
полувыведения в среднем составляет 6 часов. Связь с белками плазмы —
более 99%. Флурбипрофен почти полностью метаболизируется и выводится
в основном почками (глюкурониды и сульфатированные конъюгаты): 20% в
неизменном виде.
Фармакодинамика
Нестероидный
противовоспалительный препарат, оказывает противовоспалительное,
анальгезирующее и жаропонижающее действие. Основной механизм действия связан
с угнетением синтеза простагландинов за счет блокирования циклооксигеназ
(ЦОГ‑1 и ЦОГ‑2). В реализации терапевтического действия
препарата участвуют и другие механизмы снижения чувствительности тканей к
медиаторам воспаления.
Показания
Противопоказания
–
Повышенная
чувствительность к флурбипрофену и другим НПВП;
–
Эрозивно-язвенные
поражения желудочно-кишечного тракта (в фазе обострения);
–
Кровотечения из
желудочно-кишечного тракта и цереброваскулярные кровотечения;
–
Бронхиальная
астма в сочетании с полипозом слизистой носа;
–
Декомпенсированная
хроническая сердечная недостаточность;
–
Лечение
послеоперационной боли после проведения аортокоронарного шунтирования;
–
Нарушения
гемостаза (в т.ч. гемофилия, удлинение времени кровотечения, склонность
к кровотечениям);
–
Выраженная
печеночная или почечная недостаточность;
–
Детский возраст
до 15 лет;
–
Беременность и
период лактация.
С осторожностью
Анемия,
нарушения кроветворения, бронхиальная астма, хроническая сердечная
недостаточность, артериальная гипертензия, ишемическая болезнь сердца, отечный
синдром, печеночная и/или почечная недостаточность, алкоголизм, воспалительные
заболевания кишечника, дивертикулит, эрозивно-язвенные заболевания
желудочно-кишечного тракта вне обострения, сахарный диабет, состояние после
обширных хирургических вмешательств, индуцируемая порфирия, пожилой возраст.
Способ применения и дозы
Внутрь.
Суточную
дозу 150–200 мг: следует распределить на 2–3 приема в день. Пациентам
с острыми симптомами или во время обострения болезни суточную дозу
кратковременно (2–3 дня) можно увеличить до 300 мг.
Дисменорея:
В
начале 100 мг, с последующим приемом 50 или 100 мг каждые 4 или
6 часов. Максимальная суточная доза препарата не должна превышать
300 мг.
Побочные действия
Со стороны пищеварительной системы:
Чаще 1%
— тошнота, рвота, изжога, диарея, запор, боль в животе, метеоризм, повышение
уровня «печеночных» ферментов, желудочно-кишечное кровотечение;
Реже 1%
— пептическая язва с возможными осложнениями (кровотечение, перфорация),
гастрит, желтуха, мелена, появление крови в рвотных массах, поражение пищевода,
афтозный стоматит, глоссит, гепатит.
Со стороны нервной системы:
Чаще 1%
— головная боль, головокружение, тревожность, нарушение сна, усиление
рефлексов, тремор, амнезия, астения, депрессия, сомноленция;
Реже 1% — атаксия,
ишемическое поражение мозга, слабость, парестезии, судороги.
Со стороны органов чувств:
Чаще 1% — нарушения
зрения (нечеткость зрения, диплопия, скотома), шум в ушах, снижение слуха;
Реже 1%
— конъюнктивит, нарушение обоняния и вкуса;
Взаимосвязь с использованием препарата не установлена
— повышение внутриглазного давления, кровоизлияния в сетчатку, ретробульбарный
неврит.
Со стороны кожных покровов:
Чаще 1%
— кожный зуд, кожная сыпь;
Реже 1%
— алопеция, крапивница, экзема, токсический дерматит, многоформная
экссудативная эритема, в т.ч. синдром Стивенса-Джонсона, токсический
эпидермальный некролиз (синдром Лайелла), повышенная фоточувствительность.
Со стороны мочеполовой системы:
Чаще 1%
— задержка жидкости, инфекции мочевыводящей системы;
Реже 1%
— гематурия, повышение уровня мочевой кислоты, интерстициальный нефрит,
почечная недостаточность.
Со стороны органов кроветворения и иммунной системы:
Реже 1%
— анемия (в том числе гемолитическая и апластическая анемии), снижение уровня
гемоглобина и гематокрита, тромбоцитопеническая пурпура, лейкопения,
тромбоцитопения, эозинофилия, агранулоцитоз.
Со стороны дыхательной системы:
Чаще 1%
— ринит;
Реже 1%
— кашель, бронхоспазм.
Со стороны сердечно-сосудистой системы:
Реже 1%
— повышение артериального давления, вазодилатация, отеки, застойная сердечная
недостаточность;
Взаимосвязь с использованием препарата не установлена
— стенокардия, аритмия, инфаркт миокарда.
Аллергические реакции:
Реже 1%
— анафилактоидные реакции, анафилактический шок (обычно развивается
стремительно), отек губ и языка, аллергический васкулит.
Иные:
Реже 1%
— лихорадка, озноб.
Взаимодействие
Флурбипрофен
может снижать эффективность ингибиторов ангиотензин-превращающего фермента.
Совместное
использование препарата с антикоагулянтами (например, варфарин) приводит
к повышению риска развития серьезного кровотечения.
Одновременное
использование с ацетилсалициловой кислотой приводит к значительному
снижению концентрации препарата в сыворотке крови.
Увеличивает
вероятность возникновения побочных эффектов других нестероидных
противовоспалительных препаратов и глюкокортикостероидные средства (кровотечения
в желудочно-кишечном тракте), токсичность метотрексата и нефротоксичность
циклоспорина.
Флурбипрофен
уменьшает гипотензивную активность бета-блокаторов.
Снижает
эффект диуретиков (фуросемид, тиазидные диуретики), на фоне
калийсберегающих диуретиков усиливается риск гиперкалиемии.
Передозировка
Симптомы передозировки:
Угнетение
дыхания, тошнота, боль в эпигастральной области, головная боль, головокружение.
Лечение:
Промывание
желудка и симптоматическое лечение.
Специфического
антидота на флурбипрофен не существует.
Особые указания
Во
время длительного лечения необходим контроль картины периферической крови и
функционального состояния печени и почек. Как и другие НПВП препарат может
влиять на фертильность, о чем следует предупреждать женщин, планирующих
беременность (снижается вероятность наступления беременности). Во время лечения
следует воздерживаться от занятий потенциально опасными видами
деятельности, требующими повышенного внимания и быстроты психических и
двигательных реакций.
Форма выпуска
Таблетки,
покрытые оболочкой по 100 мг.
По
5 таблеток в блистер из ПВХ-алюминиевой фольги. По 2, 3 или 6 блистеров вместе
с инструкцией по применению помещают в картонную пачку.
Условия отпуска из аптек
Условия хранения
При
температуре не выше 25 °С.
Хранить
в недоступном для детей месте.
Срок годности
4
года.
Не
использовать позже срока, указанного на упаковке.
Заказ в аптеках
Выбор региона:
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Отзывы


или
Ракстан-Сановель (Raxtan-Sanovel)
💊 Состав препарата Ракстан-Сановель
✅ Применение препарата Ракстан-Сановель
Описание активных компонентов препарата
Ракстан-Сановель
(Raxtan-Sanovel)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2022.03.31
Владелец регистрационного удостоверения:
Код ATX:
M01AE09
(Флурбипрофен)
Лекарственная форма
| Ракстан-Сановель |
Таб., покр. оболочкой, 100 мг: 30 шт. рег. №: ЛСР-001834/08 |
Форма выпуска, упаковка и состав
препарата Ракстан-Сановель
5 шт. — упаковки ячейковые контурные (6) — пачки картонные.
Клинико-фармакологическая группа:
НПВС
Фармако-терапевтическая группа:
НПВП
Фармакологическое действие
НПВС. Обладает выраженной анальгезирующей, противовоспалительной и жаропонижающей активностью. Механизм действия связан с ингибированием ЦОГ и угнетением синтеза простагландинов. Тормозит агрегацию тромбоцитов.
Фармакокинетика
После приема внутрь хорошо и полностью всасывается из ЖКТ. Cmax достигается через 1.5 ч. Связывание с белками плазмы составляет более 90%. Метаболизируется в печени. T1/2 около 6 ч. Выводится почками: 20% — в неизменном виде, остальное – в виде метаболитов.
Показания активных веществ препарата
Ракстан-Сановель
Для приема внутрь: ревматоидный артрит, деформирующий остеоартроз, анкилозирующий спондилит, острый бурсит и тендовагинит, повреждения мягких тканей; болевой синдром (слабой и средней интенсивности): артралгия, миалгия, невралгия, мигрень, зубная и головная боль, альгодисменорея, боль при травмах, ожогах; лихорадочный синдром при простудных и инфекционных заболеваниях.
Для местного применения: качестве симптоматического средства для облегчения боли в горле при инфекционно-воспалительных заболеваниях полости рта и глотки.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Внутрь или для рассасывания в соответствующей лекарственной форме.
Доза и частота применения зависят от показаний и применяемой лекарственной формы.
Побочное действие
Со стороны пищеварительной системы: диспепсия (тошнота, рвота, изжога, диарея), НПВС-гастропатия, абдоминальные боли, нарушение функции печени; при длительном применении в больших дозах — изъязвление слизистой оболочки ЖКТ, кровотечение (желудочно-кишечное, геморроидальное, из десен).
Со стороны сердечно-сосудистой системы: повышение АД, тахикардия, сердечная недостаточность.
Со стороны системы кроветворения: редко – анемия (железодефицитная, гемолитическая, апластическая), агранулоцитоз, лейкопения, тромбоцитопения.
Со стороны ЦНС и периферической нервной системы: головная боль, головокружение, сонливость или бессонница, астения, депрессия, амнезия, тремор, возбуждение, редко – атаксия, парестезии, нарушение сознания.
Со стороны мочевыделительной системы: тубулоинтерстициальный нефрит, отечный синдром, нарушение функции почек.
Аллергические реакции: кожная сыпь, зуд, крапивница, бронхоспазм, фотосенсибилизация, отек Квинке, анафилактический шок.
Прочие: снижение слуха, шум в ушах, усиление потоотделения.
Противопоказания к применению
Повышенная чувствительность к флурбипрофену и другим НПВС; эрозивно-язвенные поражения ЖКТ в фазе обострения, «аспириновая триада» (бронхиальная астма, вазомоторный ринит, непереносимость ацетилсалициловой кислоты), кровотечения из ЖКТ, цереброваскулярное кровоизлияние, сердечная недостаточность, отеки, артериальная гипертензия, нарушения гемостаза (в т.ч. гемофилия, гипокоагуляция), тяжелая печеночная недостаточность, тяжелая почечная недостаточность, подтвержденная гиперкалиемия, лечение послеоперационной боли после проведения аортокоронарного шунтирования, беременность, период грудного вскармливания; для приема внутрь — дети до 15 лет.
С осторожностью
Анемия, бронхиальная астма, нарушения кроветворения, хроническая сердечная недостаточность, артериальная гипертензия, ИБС, отечный синдром, печеночная и/или почечная недостаточность, хронический алкоголизм, воспалительные заболевания кишечника, дивертикулит, эрозивно-язвенные поражения ЖКТ в фазе ремиссии, сахарный диабет, состояния после обширных хирургических вмешательств, индуцируемая порфирия, пожилой возраст.
Применение при беременности и кормлении грудью
Флурбипрофен противопоказан к применению при беременности и в период грудного вскармливания.
Применение при нарушениях функции печени
Противопоказано применение при тяжелой печеночной недостаточности.
Применение при нарушениях функции почек
Противопоказано применение при тяжелой почечной недостаточности.
Применение у детей
Противопоказан прием внутрь у детей до 15 лет.
Применение у пожилых пациентов
С осторожностью применять у пациентов пожилого возраста.
Особые указания
Во время приема флурбипрофена необходим периодический контроль картины периферической крови и времени кровотечения.
Влияние на способность к управлению транспортными средствами и механизмами
Во время лечения следует воздерживаться от занятий потенциально опасными видами деятельности, требующими повышенного внимания и быстроты психических и двигательных реакций.
Лекарственное взаимодействие
Индукторы микросомального окисления в печени (фенитоин, этанол, барбитураты, рифампицин, фенилбутазон, трициклические антидепрессанты) увеличивают продукцию гидроксилированных активных метаболитов.
При одновременном применении флурбипрофен снижает эффективность урикозурических препаратов, усиливает действие антикоагулянтов (повышает риск кровотечений), антиагрегантов, фибринолитиков, побочные эффекты минералокортикоидов, ГКС, эстрогенов; снижает эффективность гипотензивных и мочегонных средств; усиливает гипогликемический эффект производных сульфонилмочевины.
Ацетилсалициловая кислота повышает концентрацию препарата в плазме, ранитидин – снижает.
Антациды и колестирамин снижают абсорбцию флурбипрофена.
При одновременном применении флурбипрофен увеличивает концентрацию в крови препаратов лития, метотрексата.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Магнитогорская ул, 1А/25, Ростов-на-Дону, Ростовская обл (Пятерочка)
Советской Конституции ул, 14/3к1, Новошахтинск, Ростовская обл
Таганрогская ул, 145, Ростов-на-Дону, Ростовская обл
Кирова ул, 7/1, Батайск, Ростовская обл
Энгельса ул, 19, Белая Калитва, Ростовская обл
Строителей ул, 84, Усть-Донецкий рп, Ростовская обл
Ипподромный пер, 2, Вешенская ст-ца, Шолоховский р-н, Ростовская обл
Калинина ул, 318/1, Семикаракорск, Ростовская обл
Южная ул, 30Л, Матвеев Курган п, Ростовская обл
Ворошилова ул, 140А, Егорлыкская ст-ца, Ростовская обл
Мостовая ул, 4Б, Кривянская ст-ца, Октябрьский р-н, Ростовская обл
Доватора ул, 118, Ростов-на-Дону, Ростовская обл
Вернигоренко ул, 39, Новошахтинск, Ростовская обл
Ленина ул, 222Г, Таганрог, Ростовская обл
Социалистическая ул, 13А, Цимлянск, Ростовская обл
Мичурина ул, 8 а, Персиановский п, Октябрьский р-н, Ростовская обл
Мадояна ул, 94, Ростов-на-Дону, Ростовская обл
Комсомольская ул, 27А, Новобатайск с, Кагальницкий р-н, Ростовская обл
ШАХТЫ, Переулок Украинский, д. 21
Советская ул, 204, Шахты, Ростовская обл
Введение
Боль в области нижней части спины (БНЧС) предполагает неприятные ощущения или дискомфорт в области, располагающейся между нижними ребрами и ягодичными складками, с проекцией или без проекции в нижнюю конечность и возникает ежегодно у 25–40% людей во всем мире, а вероятность того, что в течение жизни у человека возникнет острая БНЧС, составляет 70% [1]. Острая БНЧС продолжается не больше 6 нед., в случае рациональной терапии или вследствие естественных причин (саногенез) регрессирует, но примерно у трети больных хронизируется — сохраняется более года, а еще примерно у 50–80% больных в первый год после неполного купирования острой БНЧС те или иные симптомы основного заболевания (дорсопатия, сакроилеит и др.) повторяются [1, 2].
Острая боль может быть первичной или вторичной (обострение хронически протекающего заболевания); в любом случае она инициируется триггерами, формирующимися вследствие развития дегенеративно-дистрофических процессов в дугоотростчатых суставах, межпозвонковых дисках и крестцово-подвздошном сочленении, а также стеноза позвоночного канала и др. Несмотря на повсеместное применение нейровизуализационного обследования (МРТ, КТ пояснично-крестцового отдела позвоночника) в дифференциальной диагностике патогенетических форм острой БНЧС, достоверной корреляции между выявленными по данным МРТ изменениями и степенью выраженности болевого синдрома, снижением качества жизни, а также психоэмоциональными расстройствами у данной категории пациентов выявлено не было [3, 4].
Учитывая главенство воспалительной составляющей в генезе острой БНЧС, в базовую схему медикаментозного лечения пациентов данного профиля обычно включают нестероидные противовоспалительные препараты (НПВП), миорелаксанты, витамины группы В, хондропротекторы и лечебные блокады, что позволяет дезактивировать триггеры боли и предупредить хронизацию болевого синдрома и других проявлений основного заболевания (например, нарушение статической и динамической функции позвоночника) [2]. Базовая терапия, как правило, дополняется немедикаментозными методами лечения, такими как мануальная терапия, массаж, кинезиологическое тейпирование, лечебная гимнастика, вытяжение позвоночника, физиотерапия, направленные на постепенное увеличение двигательных возможностей больного, коррекцию осанки и неадаптивного двигательного стереотипа.
Однако разные НПВП неодинаково контролируют острую БНЧС, особенно в части длительности обезболивающего эффекта и качества жизни пациента во время лечения.
Цель исследования: анализ эффективности (скорость наступления, сила и продолжительность обез-боливания) и безопасности НПВП Ракстан-сановель (флурбипрофен, далее — Ракстан) в комплексном лечении пациентов с острой БНЧС. Выбор данного препарата обусловлен тем, что флурбипрофен обладает выраженным обезболивающим и противовоспалительным действием при высокой биодоступности [4].
Материал и методы
Для реализации поставленной цели на территории Российской Федерации было проведено многоцентровое постмаркетинговое обсервационное исследование. Препарат Ракстан назначался в рамках рутинной клинической практики согласно утвержденной локальной инструкции по применению препарата с указанием доз, продолжительности терапии, популяции и показаний.
Критерии включения в исследование:
возраст пациентов от 18 до 65 лет;
длительность БНЧС не менее 1 нед. и не более 6 нед. независимо от наличия данных о БНЧС в анамнезе;
интенсивность боли по ВАШ не менее 30 баллов;
отсутствие указаний на непереносимость флурбипрофена в анамнезе;
подписанное пациентом информированное согласие на участие в наблюдательной программе.
Критерии невключения в исследование:
применение НПВП менее чем за 1 мес. до момента включения в программу;
наличие органических заболеваний нервной системы, психических заболеваний или онкологической патологии;
гиперчувствительность к исследуемому препарату или вспомогательным компонентам, в том числе к другим НПВП или ацетилсалициловой кислоте;
эрозивно-язвенные поражения или воспалительные заболевания ЖКТ в стадии обострения;
бронхиальная астма в сочетании с полипозом слизистой носа;
тяжелая почечная и печеночная недостаточность;
применение антидепрессантов, антиконвульсантов, опиоидных анальгетиков в период проведения исследования;
беременность или лактация;
лечение глюкокортикоидами в течение последних 2 мес.;
другие состояния, которые делали участие пациента в исследовании невозможным (по мнению исследователя).
Критерии исключения из исследования. Пациент считался исключенным из исследования, если его участие было прекращено до завершения планируемых визитов/оценок, указанных в протоколе. Пациенты могли быть исключены из исследования по любой из следующих причин: развитие нежелательных явлений, непереносимость препарата Ракстан, добровольный отказ пациента от участия, по решению исследователя, другие причины.
В программу были включены 210 пациентов с острой БНЧС, не требующей хирургического лечения. Большинство пациентов составили женщины (количественная пропорция мужчин и женщин 1:1,4); средний возраст 43,5 [29; 57] года с длительностью заболевания 14,4±6,3 сут.
Спондилоартрит на уровне поясничного отдела позвоночника оказался преимущественным триггером боли у 105 (50%) пациентов, поражение крестцово-подвздошного сочленения — у 39 (18,6%), дегенеративно-дистрофические изменения межпозвонкового диска — у 66 (31,4%). Наибольшее количество (68%) пациентов в обеих группах имели умеренный уровень боли с оценкой по ВАШ 45–74 баллов, 20% — сильную боль (75–100 баллов по ВАШ).
До включения в программу все пациенты в полном объеме были проинформированы об условиях участия в программе и подписали форму информированного согласия.
Пациенты, включенные в исследование, были случайным образом (методом конвертов) рандомизированы в 2 однотипные группы. В контрольной группе (КГ) применялась стандартная схема лечения в течение 10 дней: медикаментозная терапия — любой неселективный НПВП, кроме изучаемого препарата (диклофенак по 50 мг 3 р/сут у 70% пациентов и мелоксикам по 15 мг/сут у 30%), миорелаксанты в дозах, рекомендованных в инструкции по применению препарата; немедикаментозная терапия — физические упражнения или физиотерапия (пациенты могли получать один из этих методов лечения или их комбинацию) по усмотрению врача. В основной группе (ОГ) для купирования болевого синдрома использовался Ракстан (по 100 мг 2 р/сут) в сочетании с другой необходимой сопутствующей терапией — миорелаксантами, физическими упражнениями и физиотерапией. Каждый пациент, включенный в исследование, находился под наблюдением в течение 10 дней приема препаратов, а также последующие 2 нед. (всего 4 визита: визит 0 — скрининг, визит 1 — через 1 нед. от начала лечения, визит 2 — через 2 нед. от начала лечения, визит 3 — через 2 нед. после завершения лечения).
Первичной конечной точкой исследования являлась оценка степени снижения интенсивности болевого синдрома после курса лечения препаратом Ракстан (10 дней) по ВАШ в сравнении с другими НПВП. Минимальное клинически значимое различие (МКЗР) для показателя ВАШ составляет 15 пунктов, или 30%. В качестве вторичных конечных точек приняты оценка динамики качества жизни и длительность бессимптомного периода после курса лечения на основании общепринятых критериев:
оценка интенсивности боли и связанных с ней функциональных расстройств по опроснику Роланда — Морриса (МКЗР для показателя составляет 5 пунктов);
определение качества жизни по опроснику EQ-5D-5L;
впечатления врача и пациента об эффективности лечения (7-балльная система оценки общего клинического впечатления по шкале CGI);
наличие или отсутствие БНЧС через 2 нед. после окончания лечения.
Особое внимание уделялось контролю безопасности применения исследуемого препарата. Каждое нежелательное явление было задокументировано со ссылкой на интенсивность, дату начала, продолжительность, частоту, лечение, результаты, изменения и дату окончания.
Все данные о включенных пациентах вводили в специально разработанные индивидуальные регистрационные карты для статистической обработки результатов и были обезличены для сохранения конфиденциальности пациентов. Для статистического анализа полученные в ходе исследования данные вносили в базу, сформированную на основе программного обеспечения Excel. Для статистического анализа результатов исследования использовали общепринятые методы из пакета программ Statisticа 7.0 (StatSoft, Inc., США) в соответствии с рекомендациями по обработке результатов медико-биологических исследований [17]. Для сравнительного анализа качественных параметров пользовались критерием χ2 или критерием Фишера. Значимость различий между количественными величинами оценивали по критерию t Стьюдента в модификации Уэлча (для нормально распределенных величин) или критерию Манна — Уитни (в случае непараметрических данных). Пороговый уровень значимости был принят равным 0,05. Сравнение показателей по ВАШ в группах между визитами осуществляли с использованием непараметрического критерия Вилкоксона для зависимых выборок и теста Краскела — Уоллиса. Разницу терапевтического эффекта между визитами оценивали с помощью теста Бхапкара с поправкой Бонферрони для всех парных сравнений.
Результаты исследования
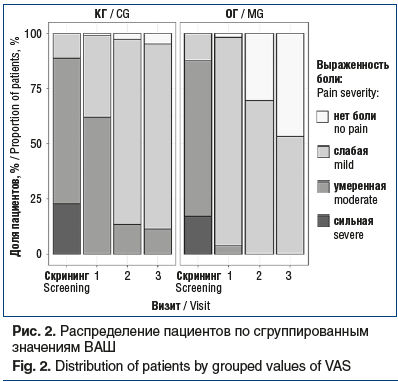
Группы были сопоставимы по половому составу (χ2=0,02, p=0,088), большинство составили женщины — 60 и 62 пациентки в КГ и ОГ соответственно. Средний возраст пациентов КГ составил 44 [33; 52] года, ОГ — 46 [29; 57] лет (p=0,43, критерий Манна — Уитни). Все пациенты завершили исследование. Базовое среднее значение интенсивности боли во всей выборке (n=210) по ВАШ составило 60 [50; 70] мм; в рассматриваемых группах по 60 [50; 70] мм, что соответствовало «умеренно выраженной» боли и не имело достоверного различия между группами (p=0,833, критерий Манна — Уитни). При этом количество больных из общей выборки со слабой интенсивностью боли (5–44 мм) составило 25 (12%), умеренной (45–74 мм) — 143 (68%), сильной (75–100 мм) — 42 (20%).
В обеих группах от проводимого лечения получен достоверный позитивный эффект по ВАШ, причем улучшение оцениваемых параметров в ОГ оказалось значимо выше на всех визитах (рис. 1). На момент завершения исследования (визит 3, через 2 нед. после терапии) в ОГ отмечался значимо более полный контроль над БНЧС по данным ВАШ по сравнению с КГ — количество (доля) больных с отсутствием боли и слабой болью было статистически значимо выше. Оценка по ВАШ составила 20 [20; 30] мм в КГ и 5 [0; 10] мм — в ОГ (рис. 1, 2). При межгрупповом сравнении на каждом визите получены статистически значимые различия (критерий Манна — Уитни, p<0,0001).
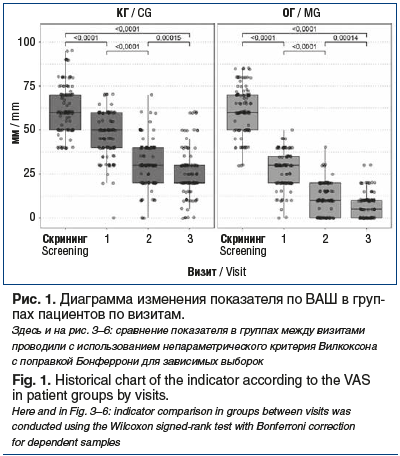
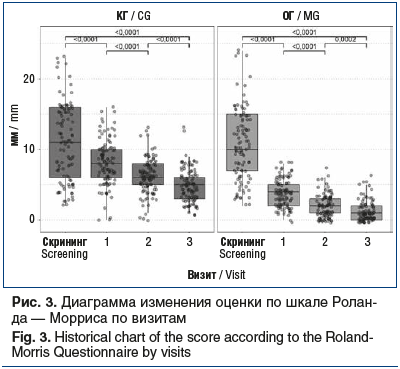
Согласно данным опросника Роланда — Морриса интенсивность острой БНЧС была непосредственно связана с функциональными расстройствами у пострадавших, исходная оценка в КГ составила 11 [6; 16], в ОГ — 10 [7; 15] (p=0,496). В процессе лечения в обеих группах наблюдалось клинически и статистически значимое снижение значений показателя между визитами (p<0,0001); однако эффективность снижения функциональных расстройств по шкале Роланда — Морриса между группами статистически значимо различалась на всех визитах (критерий Манна — Уитни, p<0,0001). Так, в ОГ уже на визите 2 рассматриваемый показатель составил 2 [1; 3], в то время как у больных КГ — 6 [5; 8]; величина эффекта снижения относительно исходных значений составила 0,868 и 0,641 соответственно. К визиту 3 значения показателя в ОГ и КГ были равны 1 [0; 2] и 5 [3; 6] соответственно (рис. 3).
Снижение интенсивности болевого синдрома и уменьшение степени функциональных нарушений у обследованных больных в обеих группах коррелировало с позитивными изменениями общего клинического впечатления врача по опроснику CGI в виде статистически значимого снижения тяжести расстройств между 1-м и 3-м визитами (p<0,0001): у больных ОГ с 2 [1; 2] до 1 [1; 1], у больных КГ с 4 [3; 4] до 3 [2; 3] (рис. 4). При этом эффективность терапевтического снижения тяжести расстройств по шкале CGI между группами достоверно различалась на визите 2 по абсолютным значениям (p=0,0041) и на визите 3 по относительным (p=0,047).

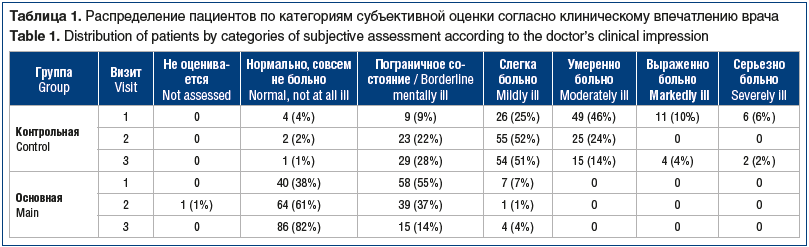
Для системного анализа эффективности терапии по общему клиническому впечатлению врача больные в обеих группах были распределены по категории «тяжесть состояния» (табл. 1). Как видно из представленных данных, количество больных в категориях субъективной оценки «нормально, совсем не больно», «пограничное состояние», «слегка больно» было значительно большим в ОГ; а больных в категориях субъективной оценки «умеренно больно», «выраженно больно» и «серьезно больно» не было совсем. Анализ перераспределения пациентов между категориями тяжести по шкале CGI показал статистическую значимость (p<0,0001, тест Бхапкара) в обеих группах между визитами 1 и 3.
Аналогичные позитивные изменения общего клинического впечатления по опроснику CGI выявлены с точки зрения пациентов. В обеих группах (рис. 5) наблюдалось статистически значимое снижение тяжести расстройств, вызванных острой БНЧС, по данным оценки общего клинического впечатления пациента по опроснику CGI между 1-м (в ОГ — 2 [1; 2], в КГ — 3 [3; 4]) и 2-м (в ОГ — 1 [1; 2], в КГ — 3 [2; 3]) (p<0,001) и 1-м и 3-м (в ОГ — 1 [1; 2], в КГ — 3 [2; 3]) визитами (p<0,0001).

Кроме сравнительного анализа отдельных параметров состояния здоровья больных с острой БНЧС (ВАШ, шкала функциональных нарушений Роланда — Морриса, общее клиническое впечатление по опроснику CGI) особое внимание было уделено оценке конечного терапевтического эффекта по мнению врача, в соответствии с которым больные распределялись на следующие категории: «значительное улучшение», «умеренное улучшение», «минимальное (незначительное) улучшение, которое не меняет состояние больного», «без эффекта или ухудшение» (табл. 2).

В обеих группах наблюдался статистически значимый терапевтический эффект между 1-м (в ОГ — 54 человека со значительным улучшением, 51 — с умеренным; в КГ — 6 и 30 человек соответственно) и 2-м (в ОГ — 79 человек со значительным улучшением, 25 — с умеренным; в КГ — 3 и 56 человек соответственно) визитами по тесту Бхапкара с поправкой Бонферрони для всех парных сравнений (p<0,01) и между визитами 1 и 3 (в ОГ 89 человек со значительным улучшением, 16 — с умеренным; в КГ — 4 и 55 человек соответственно) (p<0,01).
Изменение терапевтического эффекта между визитами 2 и 3 было статистически незначимо в обеих группах (в ОГ р=0,935, в КГ р=0,072). Однако на каждом визите наблюдались статистически значимые (p<0,01) различия между группами; более того, отсутствие эффекта или ухудшение на последнем визите наблюдалось у 8 (7,6%) пациентов КГ, в то время как в ОГ таких больных не было.
Острая БНЧС, по данным опросника EQ-5D-5L, влияла на качество жизни больных, особенно на подвижность (умеренное влияние у 42,9% пациентов), уход за собой (умеренное влияние у 38,6%), привычную повседневную деятельность (умеренное влияние у 38,1%) и дискомфорт (умеренное влияние у 39,5%). При этом только у 25,2% больных выявлено минимальное влияние на формирование тревоги/депрессии, а крайне серьезное влияние обнаружено в части некоторых показателей (уход за собой, привычная повседневная деятельность, дискомфорт, тревога/депрессия) в 1,9–7,6% случаев (табл. 3).
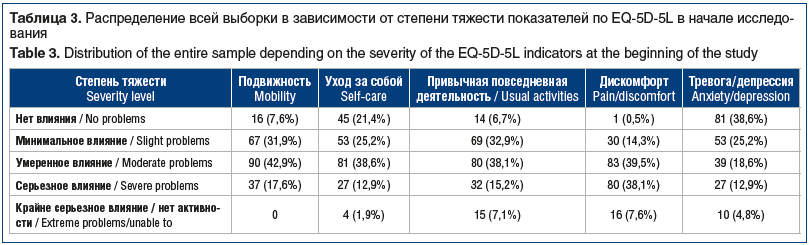
В процессе лечения в обеих группах наблюдалось статистически значимое улучшение качества жизни пациентов по данным опросника EQ-5D-5L относительно скрининга на визитах 2 и 3 (табл. 4). В КГ на визите 3 сохранялось от 2 до 4 пациентов (2–4%) с крайне серьезным влиянием по всем показателям опросника (подвижность, уход за собой, привычная повседневная деятельность, дискомфорт, тревога/депрессия) и от 16 до 29 (15–27%) — с умеренным влиянием.

В ОГ к визиту 3 отсутствовали пациенты с серьезным влиянием, а умеренное влияние на качество жизни наблюдалось в единичных случаях (1%). При этом на визитах 2 и 3 различия показателей (подвижность, уход за собой, привычная повседневная деятельность, дискомфорт, тревога/депрессия) между группами были статистически значимыми (тест Бхапкара, р<0,0001 с поправкой на множественные сравнения Бонферрони). На этапе скрининга статистической значимости достигали только различия показателей «дискомфорт» и «тревога/депрессия» (р=0,017, р=0,32 соответственно).
Изменение тяжести нарушений согласно опроснику EQ-5D-5L в каждой группе на визитах 2 и 3 по сравнению с базовым значением, полученным на этапе скрининга, во всех случаях было статистически значимым (p<0,0001).
С учетом представленных выше данных закономерным было статистически значимое улучшение общего состояния здоровья на основании суммарного балла по опроснику EQ-5D-5L в обеих группах между скрининговым визитом и визитами 2 и 3 (p<0,0001). Динамика общего состояния здоровья по EQ-5D-5L статистически значимо (p<0,0001) различалась в обеих группах: суммарный балл на визите 2 в ОГ составил 75 [70; 80], в КГ — 60 [50; 65], на визите 3 — 85 [75; 90] и 60 [55; 70] соответственно (рис. 6). Это свидетельствует в пользу большей терапевтической эффективности противовоспалительного препарата Ракстан в составе комплексной терапии больных с острой БНЧС.

Кроме этого, включение препарата Ракстан в комплексное лечение острой БНЧС позволило добиться значительного сокращения количества нежелательных реакций, которые обычно свойственны препаратам группы НПВП: в ОГ, принимавшей исследуемый препарат, не было зафиксировано ни одной нежелательной реакции, в то время как в КГ они отмечены у 4 пациентов (у 1-го — тошнота, боль в желудке; у 2-го — тошнота, головокружение; у 3-го — боль в желудке, диарея; у 4-го — тошнота), что потребовало применения симптоматических средств лечения. Данное обстоятельство представляется очень важным аргументом в пользу выбора препарата Ракстан, поскольку нежелательные реакции отрицательно влияют на приверженность пациентов терапии и на долгосрочный прогноз развития основного заболевания, сопровождающегося острой БНЧС.
Обсуждение
Выполненное исследование согласуется с современной доктриной рациональной терапии острой БНЧС, в основе которой лежит применение НПВП, обладающих противоболевым и противовоспалительным действием, в качестве препаратов первой линии. Несмотря на относительную сопоставимость выраженности обезболивающего действия различных НПВП, назначаемых в терапевтических дозировках, соотношение противоболевого и противовоспалительного эффектов данных лекарственных средств может различаться, что следует учитывать при выборе оптимального препарата для конкретного пациента с острой БНЧС [5, 6].
Особенно это связано с тем, что качественное купирование острых болевых синдромов при патологии позвоночника является обязательным условием для профилактики хронизации боли вследствие «лечебно-обусловленного истощения ноцицептивного трафика». Поэтому проблема выбора НПВП в зависимости от патогенетического варианта дорсопатии с учетом анализа триггеров боли (структурных изменений опорно-двигательного аппарата позвоночника) находится в стадии интенсивного изучения [2, 3, 5, 6].
Флурбипрофен (Ракстан) — производное фенилпропионовой кислоты — является типичным представителем НПВП. Данный препарат угнетает активность циклооксигеназ 1-го и 2-го типов, подавляя реакции арахидонового каскада и ингибируя синтез как простагландинов, так и тромбоксана A2, что позволяет ему оказывать мощное системное противоболевое и противовоспалительное действие. Флурбипрофен отличается от других НПВП длительной историей клинического применения, которая насчитывает несколько десятилетий, так же как и некоторые другие широко используемые в клинической практике препараты данной группы, например диклофенак [7, 8].
Проведенные клинические исследования позволили установить высокую терапевтическую эффективность флурбипрофена (быстрое наступление обезболивающего эффекта и продолжительное действие) для купирования острой боли средней и высокой интенсивности наряду с высоким профилем безопасности и хорошей переносимостью [7]. Особенно это относится к такой распространенной группе заболеваний, как дорсопатии.
В одном из исследований, включившем 40 пациентов с хронической дорсалгией, проведен сравнительный анализ эффективности флурбипрофена (20 пациентов получали его по 100 мг 2 р/сут в течение 4 нед.) и плацебо в отношении влияния на выраженность болевого синдрома, сроки купирования боли, результаты лечения по мнению самого пациента и лечащего врача, выраженность депрессивных проявлений, а также значимость влияния заболевания на качество жизни больного [7]. Авторами установлено, что флурбипрофен приводит к более полному и раннему купированию болевого синдрома, более раннему расширению возможности самообслуживания по сравнению с группой больных, получавших плацебо. Кроме того, лечение флурбипрофеном оказалось более эффективным по сравнению с плацебо, по мнению как врача, так и больного; а нежелательные явления одинаково часто регистрировались в обеих группах.
Аналогичный профиль результатов получен в нашем исследовании с участием 210 пациентов с острой БНЧС. Все пациенты были случайным образом рандомизированы на 2 однотипные группы: ОГ, в которой для лечения больных в составе комплексной терапии использовался флурбипрофен, и КГ, в которой для лечения больных в составе комплексной терапии использовались другие НПВП. В большинстве (68%) случаев боль характеризовалась как умеренная. Разница в темпах снижения выраженности боли по ВАШ между группами была очевидна уже с визита 1 (7 дней от начала лечения) и в среднем составляла 20 баллов на каждом последующем визите. К концу наблюдения средняя разница между группами составляла 19 баллов (75%) по ВАШ в пользу больных ОГ; в частности, на визите 3 90% пациентов ОГ достигли нулевого уровня боли по ВАШ, в то время как в КГ — только 50%.
Кроме того, пациенты, получавшие Ракстан, через 2 нед. после окончания лечения (визит 3) продемонстрировали 100% отсутствие рецидива болевого синдрома после курса лечения препаратом — ни у одного пациента не было отмечено рецидива болевого синдрома.
Кроме обезболивающего эффекта, большое значение имеет оценка безопасности флурбипрофена. Так, в одном из исследований на основании анализа данных 200 пациентов (средний возраст 52,7 (22–72) года, 71% — женщины) с остеоартритом (n=50), ревматоидным артритом (n=130), анкилозирующим спондилитом (n=20), которые ежедневно принимали по 200 мг флурбипрофена, были получены убедительные доказательства безопасности данного препарата [8]. Это согласуется с результатами нашего и других исследований [9].
Существенным преимуществом флурбипрофена является умеренное хондропротективное действие, что очень важно при лечении дорсопатий, поскольку, к сожалению, некоторые представители НПВП негативно влияют на костную и хрящевую ткань, что продемонстрировано в условиях эксперимента и в клинических исследованиях [10, 11]. Применение флурбипрофена способно замедлять резорбцию костной ткани, предупреждать внекостное накопление солей кальция, что предотвращает оссификацию связок при остеоартрите [12, 13]. Наличие указанных свойств флурбипрофена дает веские основания рассматривать его не только как обезболивающее лекарственное средство, но и как болезньмодифицирующее средство, замедляющее прогрессирование спондилоартрита. В связи с этим становится понятным более значительное снижение степени функциональных нарушений, связанных с острой БНЧС, у больных ОГ по опроснику Роланда — Морриса: в среднем улучшение повседневной активности составило 69% (41,6 балла), в то время как в КГ — 24% (14,3 балла).
Наше прямое сравнительное исследование — первое в своем роде, в котором предпринята попытка оценить эффективность и безопасность кратковременного применения флурбипрофена в лечении пациентов с острой БНЧС. Поэтому была проведена оценка эффективности терапии на основании общего клинического впечатления врача и пациента по опроснику CGI; в ОГ 86 пациентов из 105 оценили свое состояние как «полностью нормальное», в то время как в КГ только 1 пациент дал такую оценку. В свою очередь, индекс эффективности лечения статистически значимо различался между группами на каждом визите; к окончанию курса терапии значительное улучшение и ремиссия наблюдались у 89 пациентов ОГ, в то время как в КГ — лишь у 4 пациентов, а у 50% пациентов этой группы удалось добиться только частичной ремиссии. Отсутствие эффекта или ухудшение на последнем визите в КГ наблюдалось у 8 (7,6%) пациентов, тогда как в ОГ таких пациентов не было, что позволяет рассматривать флурбипрофен в качестве препарата выбора для лечения пациентов с острой БНЧС.
Одним из преимуществ флурбипрофена, по нашим данным и сведениям других авторов, является низкий риск лекарственных взаимодействий, что обеспечило возможность его применения в комбинации с другими средствами противоболевого действия (миорелаксанты, витамины группы В), а также хорошая переносимость [14].
Заключение
Таким образом, кратковременное (до 10 сут) применение флурбипрофена (Ракстан-сановель) в дозе 200 мг/сут эффективно и безопасно при острой БНЧС. Данный препарат уменьшает выраженность болевого синдрома (по ВАШ), увеличивает повседневную активность пациентов и улучшает качество их жизни (по опросникам Роланда — Морриса и EQ-5D-5L) уже к 7-м суткам лечения достоверно значительнее, чем другие НПВП, в частности диклофенак. С учетом отсутствия нежелательных явлений (по нашим данным) это позволяет рекомендовать флурбипрофен в качестве эффективного обезболивающего средства для широкой клинической практики.
Сведения об авторах:
Данилов Алексей Борисович — д.м.н., заведующий кафедрой нервных болезней ИПО ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0003-2958-4479.
Меркулова Дина Мироновна — д.м.н., профессор, врач-невролог высшей квалификационной категории, главный невролог Центральной дирекции здравоохранения — филиала ОАО «РЖД», руководитель Неврологического центра им. Б.М. Гехта ЧУЗ «Центральная клиническая больница «РЖД-медицина»; 129128, Россия, г. Москва, ул. Будайская, д. 2; ORCID iD 0000-0003-0368-683X.
Живолупов Сергей Анатольевич — д.м.н., полковник медицинской службы, профессор кафедры нервных болезней Военно-медицинской академии имени С.М. Кирова; 194044, Россия, г. Санкт-Петербург, ул. Академика Лебедева, д. 6, литера Ж; ORCID iD 0000-0003-0363-102X.
Девликамова Фарида Ильдусовна — д.м.н., профессор кафедры неврологии и мануальной терапии КГМА — филиала ФГБОУ ДПО РМАНПО Минздрава России; 420012, Россия, г. Казань, ул. Муштари, д. 11.
Доронин Борис Матвеевич — д.м.н., профессор, заведующий кафедрой неврологии ФГБОУ ВО НГМУ Минздрава России; 630091, Россия, г. Новосибирск, Красный пр-т, д. 52; ORCID iD 0000-0001-7213-759X.
Широков Василий Афанасьевич — д.м.н., профессор кафедры нервных болезней с курсом нейрохирургии, мануальной терапии ФГБОУ ВО УГМУ Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 3; ведущий научный сотрудник ФБУН ЕМНЦ ПОЗРПП Роспотребнадзора; 620014, Россия, г. Екатеринбург, ул. Попова, д. 30; ORCID iD 0000-0003-1461-1761.
Балязина Елена Викторовна — д.м.н., профессор кафед-ры неврологии и нейрохирургии с курсом мануальной терапии и рефлексотерапии ФПК и ППС ФГБОУ ВО РостГМУ Минздрава России; 344022, Россия, г. Ростов-на-Дону, пер. Нахичеванский, д. 29; ORCID iD 0000-0002-9967-4405.
Комаров Александр Николаевич — д.м.н., доцент кафедры фундаментальной и клинической неврологии и нейрохирургии РНИМУ им. Н.И. Пирогова Минздрава России; 117437, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-5373-4006.
Контактная информация: Данилов Алексей Борисович, e-mail: danilov@intermeda.ru.
Источник финансирования: исследование проведено при поддержке «ASFARMA Медикал Дентал Урюнлер Ве Илач Санайи Тиджарет Аноним Ширкети» в г. Москве.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 23.07.2022.
Поступила после рецензирования 16.08.2022.
Принята в печать 08.09.2022.
About the authors:
Alexey B. Danilov — Dr. Sc. (Med.), Head of the Department of Nervous System Diseases, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8 Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0003-2958-4479.
Dina M. Merkulova — Dr. Sc. (Med.), Professor, neurologist, Chief Neurologist of the Central Directorate of Health Care — Branch of JSC «Russian Railways», Head of the B.M. Gekht Neurological Center, Central Clinical Hospital «Russian Railways-Medicine»; 2, Budayskaya str., Moscow, 129128, Russian Federation; ORCID iD 0000-0003-0368-683X.
Sergey A. Zhivolupov — Dr. Sc. (Med.), Colonel of the Medical Service, Professor of the Department of Nervous Diseases; S.M. Kirov Military Medical Academy; 6Zh, Academician Lebedev str., St. Petersburg, 194044, Russian Federation; ORCID iD 0000-0003-0363-102X.
Farida I. Devlikamova — Dr. Sc. (Med.), Professor of the Department of Neurology and Manual Therapy, Kazan State Medical Academy — Branch of the Russian Medical Academy of Continuous Professional Education; 11, Mushtari str., Kazan, 420012, Russian Federation.
Boris M. Doronin — Dr. Sc. (Med.), Professor, Head of the Department of Neurology, Novosibirsk State Medical University; 52, Krasnyi prospect, Novosibirsk, 630091, Russian Federation; ORCID iD 0000-0001-7213-759X.
Vasily A. Shirokov — Dr. Sc. (Med.), Professor of the Department of Nervous Diseases with Faculty of Neurosurgery and Manual Therapy, Ural State Medical University; 3, Repin str., Yekaterinburg, 620028, Russian Federation; Leading Researcher of the Medical Research Center for Prevention and Health Protection of Workers of Industrial Enterprises of Rospotrebnadzor; 30, Popov str., Yekaterinburg, 620014, Russian Federation; ORCID iD 0000-0003-1461-1761.
Elena V. Balyazina — Dr. Sc. (Med.), Professor of the Department of Neurology and Neurosurgery with Faculty of Manual Therapy and Reflexology of the ATF and Faculty Staff, Rostov State Medical University; 29, Nakhichevanskiy lane, Rostov-on-Don, 344022, Russian Federation; ORCID iD 0000-0002-9967-4405.
Alexander N. Komarov — Dr. Sc. (Med.), Associate Professor of the Department of Fundamental and Clinical Neurology and Neurosurgery, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0001-5373-4006.
Contact information: Alexey B. Danilov, e-mail: danilov@intermeda.ru.
Funding Source: the study was conducted with the support of ASFARMA Medikal Dental Urunler ve Ilac Sanayi Ticaret Anonim Shirketi.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 23.07.2022.
Revised 16.08.2022.
Accepted 08.09.2022.

