Артериальная гипертензия у взрослых
Версия: Клинические рекомендации РФ 2018-2020 (Россия)
Категории МКБ:
Вторичная гипертензия (I15), Гипертензивная [гипертоническая] болезнь с преимущественным поражением сердца и почек (I13), Гипертензивная [гипертоническая] болезнь с преимущественным поражением почек (I12), Гипертензивная болезнь сердца [гипертоническая болезнь сердца с преимущественным поражением сердца] (I11), Эссенциальная [первичная] гипертензия (I10)
Разделы медицины:
Кардиология
Общая информация
Краткое описание
Российское кардиологическое общество
Клинические рекомендации
Артериальная гипертензия у взрослых
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: I10/ I11/ I12/ I13/ I15
Возрастная группа: взрослые
Год утверждения: 2020
Определение заболевания или состояния (группы заболеваний, состояний)
Артериальная гипертензия (АГ) — синдром повышения систолического АД (далее — САД) ≥140 мм рт. ст. и/или диастолического АД (далее — ДАД) ≥90 мм рт. ст.
Гипертоническая болезнь (далее — ГБ) — хронически протекающее заболевание, основным проявлением которого является повышение АД, не связанное с выявлением явных причин, приводящих к развитию вторичных форм АГ (симптоматические АГ). Термин «гипертоническая болезнь», предложенный Г. Ф. Лангом в 1948 г., соответствует терминам «эссенциальная гипертензия» и «артериальная гипертензия», используемым за рубежом. ГБ преобладает среди всех форм АГ, ее распространенность превышает 90%.
Вторичная (симптоматическая) АГ — АГ, обусловленная известной причиной, которую можно устранить с помощью соответствующего вмешательства.
Гипертонический криз — cостояние, вызванное значительным повышением АД, ассоциирующееся с острым поражением органов-мишеней, нередко жизнеугрожающим, требующее немедленных квалифицированных действий, направленных на снижение АД, обычно с помощью внутривенной терапии
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Болезни, характеризующиеся повышенным кровяным давлением (I10, I11, I12, I13, I15):
I10 — Эссенциальная [первичная] гипертензия:
Высокое кровяное давление;
Гипертензия (артериальная) (доброкачественная) (эссенциальная) (злокачественная) (первичная) (системная).
I11 — Гипертензивная болезнь сердца [гипертоническая болезнь сердца с преимущественным поражением сердца];
I11.0 — Гипертензивная [гипертоническая] болезнь с преимущественным поражением сердца с (застойной) сердечной недостаточностью:
Гипертензивная [гипертоническая] сердечная недостаточность.
I11.9 — Гипертензивная [гипертоническая] болезнь с преимущественным поражением сердца без (застойной) сердечной недостаточности:
Гипертензивная болезнь сердца без дополнительных уточнений (БДУ).
I12 — Гипертензивная [гипертоническая] болезнь с преимущественным поражением почек:
Артериосклероз почек
Артериосклеротический нефрит (хронический) (интерстициальный);
Гипертензивная нефропатия;
Нефросклероз.
I12.0 — Гипертензивная [гипертоническая] болезнь с преимущественным поражением почек с почечной недостаточностью:
Гипертоническая почечная недостаточность.
I12.9 — Гипертензивная [гипертоническая] болезнь с преимущественным поражением почек без почечной недостаточности:
Почечная форма гипертонической болезни БДУ.
I13 — Гипертензивная [гипертоническая] болезнь с преимущественным поражением сердца и почек.
I13.0 — Гипертензивная [гипертоническая] болезнь с преимущественным поражением сердца и почек с (застойной) сердечной недостаточностью.
I13.1 — Гипертензивная [гипертоническая] болезнь с преимущественным поражением почек с почечной недостаточностью.
I13.2 — Гипертензивная [гипертоническая] болезнь с преимущественным поражением сердца и почек с (застойной) сердечной недостаточностью и почечной недостаточностью.
I13.9 — Гипертензивная [гипертоническая] болезнь с преимущественным поражением сердца и почек неуточненная.
I15 — Вторичная гипертензия.
I15.0 — Реноваскулярная гипертензия.
I15.1 — Гипертензия вторичная по отношению к другим поражениям почек.
I15.2 — Гипертензия вторичная по отношению к эндокринным нарушениям.
I15.8 — Другая вторичная гипертензия.
I15.9 — Вторичная гипертензия неуточненная.
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 500 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Классификация заболевания или состояния (группы заболеваний, состояний)
АГ классифицируют по степени, которая определяется уровнем АД у нелеченных пациентов; стадии, которая определяется наличием сахарного диабета (СД), поражения органов-мишеней (ПОМ) и ассоциированных клинических состояний (АКС); категории риска развития сердечно-сосудистых осложнений, которая учитывает уровень АД, сопутствующие факторы риска (ФР), наличие СД, ПОМ, АКС.
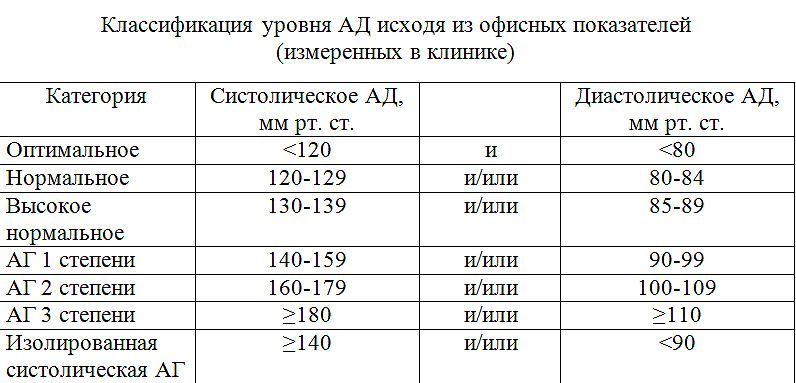
Классификация уровней АД у лиц старше 18 лет представлена в таблице П2, Приложение Г1. Категорию АД определяют по результатам его трехкратного измерения в положении пациента сидя. Используют средние значения САД и ДАД, определенных при двух последних измерениях. Изолированная систолическая гипертензия классифицируется на степени 1, 2 или 3 в зависимости от значения САД. Если значения САД и ДАД попадают в разные категории, то степень АГ оценивается по более высокой категории.
Выделение 3 стадий АГ (Таблица П1, Приложение Г3) основано на наличии поражения органов-мишеней (ПОМ), ассоциированных клинических состояний, сахарного диабета и хронической болезни почек. Стадия АГ не зависит от уровня АД.
Выделяются 3 стадии гипертонической болезни.
Стадия I — отсутствие ПОМ и АКС, возможное наличие факторов риска
Факторы СС риска у пациентов с АГ:
— Пол (мужчины > женщин);
— Возраст ≥55 лет у мужчин, ≥65 лет у женщин;
— Курение (в настоящем или прошлом; курение в прошлом следует рассматривать как фактор риска при отказе от курения в течение последнего года);
— Дислипидемия (принимается во внимание каждый из представленных показателей липидного обмена): ОХС >4,9 ммоль/л и/или ХС ЛПНП >3,0 ммоль/л и/или ХС ЛПВП у мужчин — <1,0 ммоль/л (40 мг/дл), у женщин — <1,2 ммоль/л (46 мг/дл) и/или триглицериды >1,7 ммоль/л;
— Мочевая кислота (≥360 мкмоль/л у женщин, ≥420 мкмоль/л у мужчин);
— Нарушение гликемии натощак: глюкоза плазмы натощак 5,6–6,9 ммоль/л;
— Нарушение толерантности к глюкозе;
— Избыточная масса тела (ИМТ 25-29,9 кг/м2) или ожирение (ИМТ ≥ 30 кг/м2);
— Семейный анамнез развития ССЗ в молодом возрасте (< 55 лет для мужчин и <65 лет для женщин);
— Развитие АГ в молодом возрасте у родителей или в семье;
— Ранняя менопауза;
— Малоподвижный образ жизни;
— Психологические и социально-экономические факторы;
— Частота сердечных сокращений в покое >80 ударов в минуту.
Стадия II подразумевает наличие бессимптомного поражения органов-мишеней, связанного с АГ и/или ХБП С3 (СКФ 30–59 мл/мин), и/или СД без поражения органов-мишеней и предполагает отсутствие АКС.
• Артериальная жесткость:
Пульсовое давление (ПД) (у пожилых пациентов) ≥60 мм рт. ст.
Каротидно-феморальная СПВ >10 м/с
• Электрокардиографические (ЭКГ) признаки ГЛЖ на (индекс Соколова–Лайона > 35 мм, или амплитуда зубца R в отведении aVL ≥11 мм, корнельское произведение >2440 мм x мс или корнельский вольтажный индекс >28 мм для мужчин и >20 мм для женщин);
• Эхокардиографические признаки ГЛЖ (индекс массы ЛЖ (масса ЛЖ, г/рост, м) формула ASE для пациентов с избыточной массой тела и ожирением: для мужчин >50 г/м2,7, для женщин >47 г/м2,7; индексация на площадь поверхности тела (масса ЛЖ/рост, м2) для пациентов с нормальной массой тела: >115 г/м2(мужчины) и > 95 г/м2 (женщины);
• Альбуминурия 30–300 мг/24 ч или отношения альбумин-креатинин 30–300 мг/г или 3,4-34 мг/ммоль (предпочтительно в утренней порции мочи);
• ХБП С3 стадии с СКФ >30–59 мл/мин/1,73 м2;
• Лодыжечно-плечевой индекс <0,9;
• Выраженная ретинопатия: наличие кровоизлияний, экссудатов или отека соска зрительного нерва.
Стадия III определяется наличием АКС, в том числе ХБП С4–С5 стадии, и/или СД с поражением органов-мишеней.
СД (рассматривается как дополнительное состояние, усугубляющее риск) [31]: глюкоза плазмы натощак ≥7,0 ммоль/л при двух последовательных измерениях и/или HbA1c ≥6,5%, и/или глюкоза плазмы после нагрузки или при случайном определении ≥11,1 ммоль/л.
Стадии АГ имеют уточняющий характер по поражениям органов-мишеней и сопутствующей патологии.
На основании уровня АД, наличия ФР, ПОМ, АКС, СД выделяют 4 категории риска СС осложнений: низкий (риск 1), умеренный (риск 2), высокий (риск 3) и очень высокий (риск 4) (Приложение Г2, таблица П12). Наиболее значимым является определение категории риска у пациентов с гипертонической болезнью I и II стадий.
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний, состояний)
Предрасполагающие факторы Этиология АГ остается не до конца выясненной, но выявлен ряд факторов, тесно и независимо связанных с повышением АД:
• возраст — увеличение возраста ассоциировано с повышением частоты АГ и уровня АД (прежде всего систолического) [10];
• избыточная масса тела и ожирение способствуют повышению АД;
• наследственная предрасположенность — повышение АД встречается приблизительно в 2 раза чаще среди лиц, у которых один или оба родителя имели АГ. Эпидемиологические исследования показали, что около 30% вариаций АД в различных популяциях обусловлены генетическими факторами [11].
• избыточное потребление натрия (>5 г/день) [12];
• злоупотребление алкоголем;
• гиподинамия.
Стойкое и длительное повышение АД обусловлено изменением соотношения трех гемодинамических показателей:
• повышением общего периферического сосудистого сопротивления (ОПСС);
• увеличением сердечного выброса (минутного объема);
• увеличением объема циркулирующей крови (ОЦК).
Наиболее важными патогенетическими звеньями формирования и прогрессирования эссенциальной АГ (ГБ) являются [13-16]:
• активация симпатоадреналовой системы (САС) (реализуется преимущественно через альфа- и бета-адренорецепторы);
• активация ренин-ангиотензин-альдостероновой системы (РААС); в т.ч. повышение продукции минералокортикоидов (альдостерона и др.), инициируемое, в частности, гиперактивацией почечной РААС;
• нарушение мембранного транспорта катионов (Nа+, Са2+, К+);
• увеличение реабсорбции натрия в почках;
• дисфункция эндотелия с преобладанием продукции вазоконстрикторных субстанций (тканевого ангиотензина-II, эндотелина) и снижением выработки депрессорных соединений (брадикинина, NО, простациклина и др.);
• структурные изменения сосудистой стенки артерий мышечного (резистивного) и эластического типа, в том числе вследствие низкоинтенсивного неинфекционного воспаления;
• нарушение микроциркуляции (снижение плотности капилляров);
• нарушение барорецепторного звена системы центральной регуляции уровня АД;
• повышение жесткости крупных сосудов.
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний, состояний)
Распространенность АГ среди взрослого населения составляет 30–45% [17]. Распространенность АГ не зависит от уровня дохода и одинакова в странах с низким, средним и высоким уровнями дохода [17]. В российской популяции среди мужчин в возрасте 25–65 лет распространенность АГ несколько выше (в некоторых регионах она достигает 47%), тогда как среди женщин распространенность АГ — около 40% [18]. Распространенность АГ увеличивается с возрастом, достигая 60% и выше у лиц старше 60 лет [17]. Поскольку наблюдаемое увеличение продолжительности жизни сопровождается постарением населения и, соответственно, увеличением количества малоподвижных пациентов с избыточной массой тела, прогнозируется, что распространенность АГ будет расти во всем мире. Согласно прогнозу, к 2025 году число пациентов АГ увеличится на 15–20% и достигнет почти 1,5 миллиардов [19].
АГ является ведущим фактором риска развития сердечно-сосудистых (СС) (инфаркт миокарда, инсульт, ишемическая болезнь сердца (ИБС), хроническая сердечная недостаточность), цереброваскулярных (ишемический или геморрагический инсульт, транзиторная ишемическая атака) и почечных (хроническая болезнь почек (ХБП)) заболеваний [20–22].
Взаимосвязь артериального давления с риском развития сердечно-сосудистых, цереброваскулярных и почечных осложнений
Повышенное АД является основным фактором развития преждевременной смерти и причиной почти 10 миллионов смертей и более чем 200 миллионов случаев инвалидности в мире [20–22]. Уровень САД ≥140 мм рт. ст. ассоциируется с повышением риска смертности и инвалидности в 70% случаев, при этом наибольшее число смертей в течение года, связанных с уровнем САД, возникают вследствие ИБС, ишемических и геморрагических инсультов [21].Между уровнем АД и риском сердечно-сосудистых заболеваний (ССЗ) существует прямая связь. Эта связь начинается с относительно низких значений — 110–115 мм рт. ст. для САД и 70–75 мм рт. ст. для ДАД [22].
Повышенные уровни АД, измеренные в медицинском учреждении или вне его, имеют прямую и независимую связь с частотой развития большинства СС событий (геморрагического инсульта, ишемического инсульта, инфаркта миокарда, внезапной смерти, сердечной недостаточности и заболеваний периферических артерий), а также терминальной почечной недостаточности [23]. Все больше данных свидетельствуют о тесной связи АГ с увеличением частоты развития фибрилляции предсердий [24], а также когнитивной дисфункции и деменции. Повышение АД в среднем возрасте ассоциируется с развитием когнитивных нарушений и деменции в пожилом возрасте, а интенсивная терапия артериальной гипертензии с достижением целевых цифр АД уменьшает риски развития умеренных когнитивных нарушений и возможной деменции [25, 26].
Прямая связь между повышенным уровнем АД и риском СС событий продемонстрирована для всех возрастных [27] и этнических групп [28]. У пациентов старше 50 лет САД является более сильным предиктором событий, чем ДАД [27, 29]. Высокое ДАД ассоциируется с увеличением риска СС событий и чаще является повышенным у более молодых (<50 лет) пациентов. ДАД имеет тенденцию к понижению во второй половине жизни вследствие увеличения артериальной жесткости, тогда как САД, как фактор риска, приобретает в этот период еще большее значение [29]. У пациентов среднего возраста и пожилых повышение пульсового давления (ПД) (которое представляет собой разницу между САД и ДАД) оказывает дополнительное негативное влияние на прогноз [20, 30].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний, состояний)
В большинстве случаев АД повышается бессимптомно, и АГ обнаруживают лишь в ходе объективного исследования пациента. В тех случаях, когда жалобы есть, они неспецифичны (головная боль, головокружение, сердцебиение и т.д.). При симптоматической гипертонии жалобы обусловлены основным заболеванием:
Синдром обструктивного апноэ во сне: храп, головная боль по утрам, сонливость в дневное время, нарушение памяти, внимания, неполноценный ночной сон;
Первичный гиперальдостеронизм: мышечная слабость, полиурия, полидипсия, запоры;
Феохромоцитома: пароксизмальная АГ, головная боль, профузная потливость, сердцебиение, лабильное повышение АД, ортостатическая гипотония;
Синдром Иценко–Кушинга: лунообразное лицо, плетора, жировой горбик, гирсутизм, центральное ожирение, атрофия кожи, багровые стрии, синяки, нарушения углеводного обмена;
Заболевания щитовидной железы: симптомы тиреотоксикоза или гипотиреоза;
Коарктация аорты: головная боль, холодные конечности, боль в ногах при физических нагрузках, носовые кровотечения.
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний), медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза:
Диагноз АГ на основании СМАД устанавливается в соответствии с пороговыми значениями, указанными в таблице П9, Приложение Г2 [32]. Мониторинг АД в домашних условиях рекомендуется при недоступности метода СМАД или из-за предпочтений пациента. При этом диагноз АГ устанавливается в соответствии с пороговыми значениями, указанными в таблице П9, Приложение Г2 [32].
В случае если диагноз важен для экспертизы трудоспособности или определения годности к военной службе, а также годности к профессиональной деятельности, необходима объективизация с помощью постановки СМАД.
Диагностика АГ включает следующие этапы:
• выяснение жалоб и сбор анамнеза;
• повторные измерения АД;
• объективное обследование;
• лабораторно-инструментальные методы исследования: рутинные на первом этапе и сложные — на втором этапе обследования (по показаниям);
• исключение вторичных (симптоматических) АГ при необходимости;
• оценка общего сердечно-сосудистого риска.
• Всем пациентам при измерении уровня АД в медицинском учреждении рекомендуется классифицировать его на оптимальное, нормальное, высокое нормальное артериальное давление или артериальную гипертензию 1–3-й степени [21, 22].
ЕОК/ЕОАГ нет (УУР С, УУД 5)
Комментарий. Повышение АД, измеренного в медицинском учреждении выше 140 и/или 90 мм рт. ст. (таблица П2, Приложение Г1) на двух разных визитах, за исключением тяжелой АГ (АГ 3-й степени, особенно у пациентов высокого риска) и/или повышения АД при измерении вне медицинского учреждения (по данным СМАД и/или ДМАД) при условии экономической и логистической целесообразности [32–37] (таблица П7, Приложение Г2).
У всех пациентов с впервые диагностированным гипертоническим кризом, необходимо выявить причину повышения АД, в т.ч. симптоматическую АГ.
У всех пациентов при выявлении повышения АД в медицинском учреждении необходимо два измерения АД на двух разных визитах для постановки диагноза АГ (таблица П2, Приложение Г1) [21;32].
На каждом визите должно быть проведено не менее двух измерений АД с интервалом в 1-2 мин и еще одно дополнительное измерение при разнице между первыми двумя более 10 мм рт. ст. Уровень АД — это среднее из последних двух измерений.
- Проведение методов измерения АД вне медицинского учреждения (СМАД и ДМАД) рекомендуется в отдельных клинических ситуациях: при выявлении гипертонии белого халата и маскированной АГ с целью оценки эффективности лечения и выявлении возможных побочных эффектов [21, 32, 38].
ЕОК/ЕОАГ IA (УУР C, УДД 5)
- Рекомендуется при установлении диагноза учитывать возможность вторичной (симптоматической) формы АГ и проводить диагностические мероприятия, направленные на ее исключение при наличии следующих признаков [39, 138, 220] (таблица П3, Приложение Г2):
o АГ 2-й степени у пациентов моложе 40 лет или любое повышение АД у детей
o Внезапное острое развитие АГ у пациентов с ранее документированной стойкой нормотонией
o Резистентная АГ
o АГ 3-й степени или гипертонический криз
o Признаки значительных изменений в органах-мишенях
o Клинические или лабораторные признаки, позволяющие подозревать эндокринные причины АГ или ХБП
o Клинические симптомы СОАС
o Симптомы, позволяющие заподозрить феохромоцитому, или семейный анамнез данной опухоли
ЕОК/ЕОАГ нет (УУР A, УДД 1)
Комментарии. Вторичные АГ выявляются у 5–10% пациентов с АГ [39]. Для диагностики вторичных форм АГ важно детальное обследование пациента, начиная с рутинных методов: опроса, осмотра, лабораторной диагностики, до выполнения сложных инструментальных методов (Таблица П3, Приложение Г2).
Принципы формулировки диагноза при АГ
• Необходимо указать стадию гипертонической болезни (Таблица П1, Приложение Г3).
• Степень повышения АД (степень АГ (Таблица 2, Приложение Г1) обязательно указывается у пациентов с впервые диагностированной АГ. Если пациент принимает антигипертензивную терапию, то в диагнозе указывается наличие контроля АД (контролируемая/неконтролируемая АГ).
• При формулировании диагноза максимально полно должны быть отражены ФР, ПОМ, ССЗ, ХБП и категория сердечно-сосудистого риска (таблицы П1 и П2, Приложение Г3).
• Указание целевого уровня АД для данного пациента
Примеры формулировки диагноза:
1. ГБ I стадии. Степень АГ 1. Гиперлипидемия. Риск 2 (средний). Целевое АД <130/<80 мм рт. ст.
2. ГБ II стадии. Неконтролируемая АГ. Нарушенная гликемия натощак. Гиперлипидемия. ГЛЖ. Риск 3 (высокий) Целевое АД <130/<80 мм рт. ст.
3. ГБ II стадии. Неконтролируемая АГ. Гиперлипидемия. Ожирение II степени. Нарушение толерантности к глюкозе. ГЛЖ. Альбуминурия высокой степени. Риск 4 (очень высокий). Целевое АД 130-139/<80 мм рт. ст.
4. ИБС. Стенокардия напряжения III ФК. Постинфарктный кардиосклероз (2010г). ГБ III стадии. Неконтролируемая АГ. Риск 4 (очень высокий). Целевое АД <130/<80 мм рт. ст.
5. ГБ III стадии. Контролируемая АГ. Ожирение I степени. Сахарный диабет 2-го типа, целевой уровень гликированного гемоглобина ≤7,5%. ХБП С4 стадии, альбуминурия А2. Риск 4 (очень высокий). Целевое АД 130–139/< мм рт. ст.
Принципы измерения АД
- Скрининг АГ путем измерения АД в медицинском учреждении и регистрация полученных цифр АД в медицинской документации рекомендован всем пациентам с 18 лет [33, 40] (Таблица П1, Приложение Г2).
ЕОК/ЕОАГ IВ (УУР А, УДД 1)
- Для определения степени и стабильности повышения уровня АД рекомендовано проводить измерения АД в медицинском учреждении (таблица П2, Приложение Г1) у всех пациентов с повышением АД [33, 40, 42].
EОК/ЕОАГ IВ (УУР А, УДД 1)
Комментарии. Клиническое измерение АД имеет наибольшую доказательную базу для диагностики АГ и оценки эффективности антигипертензивной терапии (АГТ). Точность измерения АД и, соответственно, диагностика АГ, определение ее степени тяжести зависят от соблюдения правил по измерению АД (Таблица П1, Приложение Г1).
- Рекомендуется проводить измерения АД в медицинском учреждении на обеих руках, по крайней мере, во время первого визита пациента для выявления возможного поражения артерий (в первую очередь атеросклеротического), ассоциированного с более высоким СС риском [41].
EОК/ЕОАГ IА (УУР А, УДД 2)
Комментарии. При разнице показателей АД на правой и левой руке более 15 мм рт. ст. вероятно атеросклеротическое поражение сосудов. При выявленной разнице показателей между правой и левой руками в дальнейшем рекомендуется проводить измерения на руке с более высоким АД.
- Определение АД, измеренного вне медицинского учреждения (СМАД или ДМАД) для постановки диагноза или контроля эффективности АГТ рекомендуется в ряде клинических ситуаций, указанных в таблице П7, Приложение Г2 [40, 42–46].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
Комментарии. Преимущества и недостатки каждого метода измерения АД суммированы в таблице П8, Приложение Г2. Диагностические критерии АГ по данным СМАД приведены в таблице П9, Приложение Г2. Результаты СМАД и ДМАД могут помочь в диагностике АГ, но не заменяют повторные измерения АД в лечебном учреждении. Следует обратить внимание, что критерии диагностики АГ по результатам клинического измерения АД, СМАД и ДМАД (таблица П2, приложение Г1 и таблица П9 приложение Г2).
Оценка сердечно-сосудистого риска
- Базовый скрининг на наличие ПОМ рекомендовано проводить у всех пациентов с АГ. Расширенное обследование рекомендовано в том случае, когда выявление ПОМ повлияет на выбор терапевтической тактики [21, 22].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
Комментарии. Для выявления поражения сердца всем пациентам целесообразно проводить регистрацию электрокардиограммы (ЭКГ) с расчетом индексов гипертрофии ЛЖ, в случае расширенного обследования — ЭхоКГ с определением индекса массы миокарда левого желудочка. Для выявления поражения почек у всех оценивают протеинурию/альбуминурию, концентрационную функцию и мочевой осадок; при расширенном обследовании выполняется УЗИ почек и допплерография почечных артерий. Для выявления поражения сосудов рекомендовано выполнение фундоскопии, расчет пульсового давления (ПД) у пожилых, оценка лодыжочно-плечевого индекса (ЛПИ), скорость пульсовой волны (СПВ) и обследования для выявления атеросклеротических бляшек в брахиоцефальных, почечных и подвздошно-бедренных сосудах при расширенном обследовании (таблицы П4 и П5, приложение Г2).
- Всем пациентам с АГ рекомендуется оценка общего сердечно-сосудистого риска (ССР) — выявление ФР, ПОМ и АКС, СД, ХБП, которые влияют на прогноз (таблица П10, Приложение Г2). Для оценки степени риска развития ССО рекомендуется обследование с целью оценки состояния органов-мишеней в соответствии с действующими клиническими рекомендациями [47].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
Комментарии. Величина АД является важнейшим, но не единственным фактором, определяющим тяжесть АГ, прогноз пациента и тактику лечения. Большое значение имеет оценка общего ССР, степень которого зависит от величины АД, наличия или отсутствия сопутствующих ФР, субклинического поражения органов-мишеней и наличия АКС и СД. Повышенный уровень АД, наличие ФР и ПОМ взаимно усиливают влияние друг на друга, что приводит к увеличению степени ССР, превышающего сумму отдельных его компонентов. Комплексный подход к оценке сердечно-сосудистого риска приведен в таблице П10 приложения Г2.
Оценка риска по шкале SCORE (Таблица П11, Приложение Г2) является одним из вариантов алгоритма оценки суммарного сердечно-сосудистого риска у пациентов с ГБ I–II стадии, т.е. не имеющих установленных ССЗ, ХБП и СД.
Пациенты с ГБ III стадии, имеющие документированное ССЗ атеросклеротического генеза (под атеросклеротическим ССЗ подразумевают ишемическую болезнь сердца, ишемический инсульт или транзиторное нарушение мозгового кровообращения, ишемию нижних конечностей), включая бессимптомный атеросклероз при визуализации, СД 1-го или 2-го типа, очень высокие значения по отдельным факторам риска (в том числе АГ 3-й степени) или ХБП 3–5-й стадий по умолчанию относятся к категории высокого или очень высокого риска по глобальной шкале 10-летнего риска сердечно-сосудистых осложнений (Таблица П12, Приложение Г2). Внутри категории очень высокого риска введена категория экстремального риска. К экстремальному риску следует относить:
сочетание клинически значимого сердечно-сосудистого заболевания, вызванного атеросклерозом, с СД 2 типа и/или СГХС;
сердечно-сосудистое осложнение у пациента с атеросклеротически сердечно-сосудистым заболеванием, несмотря на оптимальную гиполипидемическую терапию и/или достигнутый уровень ХС ЛНП ≤1,5 ммоль/л;
2 и более сердечно-сосудистых осложнения в течение 2 лет.
Акцент на значимость выявления поражения ФР и органов-мишеней для корректной оценки сердечно-сосудистого риска — одна из ключевых особенностей современных рекомендаций. Бессимптомное ПОМ может существенно увеличивать риск у пациентов с АГ. Наибольшая польза от детальной оценки ПОМ может наблюдаться у пациентов среднего возраста, у молодых пациентов с АГ 1-й степени, пациентов с высоким нормальным АД. Необходимо подчеркнуть важность оценки функции почек по показателям скорости клубочковой фильтрации (СКФ), альбуминурии и количественной оценки гипертрофии левого желудочка (ГЛЖ). Основная цель выявления ПОМ — правильное определение категории риска [48]. Первостепенное значение оценка ПОМ имеет у больных с низким и умеренным риском, меньшее значение — при высоком и очень высоком риске. Характер органного поражения не играет решающей роли в выборе режима антигипертензивной терапии, но регресс ПОМ — суррогатный маркер среднесрочной эффективности АГТ [49].
Для выявления ПОМ целесообразно использовать дополнительные методы исследования (таблица П5, приложение Г2): сердца (ЭхоКГ с определением индекса массы миокарда левого желудочка), почек (количественное определение альбуминурии/протеинурии, определение скорости клубочковой фильтрации), сосудов (наличие атеросклеротических бляшек в брахиоцефальных, почечных и подвздошно-бедренных сосудах, определение лодыжечно-плечевого индекса (ЛПИ), каротидно-феморальной скорости пульсовой волны (СПВ).
Наличие ПОМ способствует дальнейшему прогрессированию ССЗ, что существенно увеличивает риск смерти у таких пациентов по сравнению с пациентами, у которых имеются только ФР (Таблица П2, Приложение Г3). Риск возрастает с увеличением числа органных поражений, ассоциированных с АГ. Уровень СС риска у ряда пациентов может быть выше, чем он определен по стандартной системе стратификации (Таблица П1, Приложение Г3):
— при малоподвижном образе жизни у пациентов с центральным ожирением (увеличение относительного риска, ассоциированного с ожирением, более выражено у молодых, чем у пожилых пациентов);
— у лиц с низким социальным статусом;
— у пациентов с повышенным уровнем аполипопротеина В, липопротеина (а) и уровня С-реактивного белка, определенного высокочувствительным методом.
Как в общей популяции, так и у пациентов АГ необходимо учитывать факторы, повышающие СС риск (таблица П13, Приложение Г2). Такие модифицирующие факторы приобретают особое значение у пациентов, относящихся к категории умеренного риска. Наличие модифицирующих факторов может привести к изменению категории риска на более высокую и, соответственно, повлиять на решение о старте и выборе терапии.
- Пациентам с АГ, которые не соответствуют категориям высокого или очень высокого риска при оценке по глобальной шкале 10-летнего СС риска (Таблица П12, Приложение Г2), рекомендуется проводить оценку СС риска по шкале SCORE (Приложение Г) [49, 50].
ЕОК/ЕОАГ IВ (УУР С, УДД 4)
Комментарии. Пациенты с АГ с диагностированным ССЗ, включая бессимптомные атеросклеротические бляшки со стенозом ≥50%, выявленные при визуализации, сахарным диабетом 1-го и 2-го типа, значимо повышенным единственным фактором риска (в том числе — с АГ 3-й степени) или хронической болезнью почек (ХБП, стадии 3–5) автоматически относятся к категориям очень высокого (риск СС смертности ≥10%) или высокого (СС смертность 5–10%) 10-летнего СС риска.
Жалобы и анамнез
Многие пациенты с повышенным АД могут не иметь никаких жалоб. Симптомы (головные боли, одышка, боль в груди, кровотечение из носа, субъективное головокружение, отеки, расстройство зрения, ощущение жара, потливость, приливы), встречающиеся при АГ неспецифичны и могут наблюдаться при других заболеваниях.
При наличии перечисленных симптомов у любого пациента необходимо в процессе его обследования учитывать возможность диагностированной АГ.
- Рекомендуется собирать полный медицинский и семейный анамнез для оценки семейной предрасположенности к АГ и ССЗ [51, 52].
ЕОК/ЕОАГ нет (УУР С, УДД 4)
Комментарии. Сбор анамнеза включает сбор сведений о наличии ФР, субклинических симптомов ПОМ, наличии в анамнезе ССЗ, ЦВБ, ХБП и вторичных форм АГ, образе жизни, предшествующем опыте лечения АГ (таблица П3, Приложение Г1).
Физикальное обследование
- Всем пациентам с АГ рекомендуется определение антропометрических данных для выявления избыточной массы тела/ожирения, оценка неврологического статуса и когнитивной функции, исследование глазного дна для выявления гипертонической ретинопатии, пальпация и аускультация сердца и сонных артерий, пальпация и аускультация периферических артерий для выявления патологических шумов, сравнение АД между руками хотя бы однократно [21].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
Комментарии. Объективное исследование пациента с АГ направлено на выявление ФР, признаков вторичных форм АГ и ПОМ. В таблице П3, Приложение Г2 суммированы основные положения и требования к клиническому обследованию пациента.
- Всем пациентам с АГ рекомендуется пальпировать пульс в покое для измерения его частоты и ритмичности с целью выявления аритмий [21; 32; 43].
ЕОК/ЕОАГ IС (УУР В, УДД 2)
Лабораторная диагностика
Для установления диагноза АГ лабораторная диагностика не требуется, однако, она необходима с целью исключения вторичных форм АГ, выявления ПОМ, оценки СС риска, и сопутствующей патологии, влияющей на эффективность лечения и качество жизни пациента.
- Всем пациентам с АГ с целью исключения вторичной гипертензии рекомендуется проведение общего (клинического) анализа крови (гемоглобин/гематокрит, лейкоциты, тромбоциты) [21, 22].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
- Для выявления предиабета, СД и оценки сердечно-сосудистого риска всем пациентам с АГ рекомендуется исследование уровня глюкозы в венозной крови [53,54,55,56,57, 302].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
Комментарии. При значениях глюкозы ≥ 6,1 ммоль/Л следует повторно определить ее уровень во всех случаях, кроме несомненной гипергликемии с острой метаболической декомпенсацией или очевидными симптомами. В качестве теста, подтверждающего гипергликемию, может быть определение гликированного гемоглобина (НвА1с). Диагноз СД устанавливают на основании двух цифр, находящихся в диабетическом диапазоне: дважды определенный HbA1c или однократное определение HbA1c и однократное определение уровня глюкозы крови. Значения перечисленных параметров оценки гликемии выше нормальных, но ниже диабетических, указывают на наличие предиабета. Пероральный глюкозотолерантный тест (ПГТТ) проводится в сомнительных случаях для уточнения диагноза СД, а также для выявления предиабета. Гликированный гемоглобин (НвА1с) может быть использован для диагностики СД и предиабета, если метод его определения сертифицирован в соответствии с National Glycohemoglobin Standartization Program (NGSP), или International Federation of Clinical Chemists (IFCC) и стандартизованного в соответствии с референсными значениями, принятыми в Diabetes Control and Complications Trial (DCCT). При наличии СД рекомендуется стратификация пациента в категорию высокого или очень высокого сердечно-сосудистого риска.
- Всем пациентам с АГ для выявления нарушения функции почки оценки сердечно-сосудистого риска рекомендуются исследование уровня креатинина в сыворотке крови и расчет скорости клубочковой фильтрации (СКФ) в мл/мин/1,73м2 по формуле Chronic Kidney Disease Epidemiology (CKD-EPI) [58] в специальных калькуляторах (Таблица П3, Приложение Г3) [21, 22, 58].
ЕОК/ЕОАГ IВ (УУР B, УДД 2)
Комментарии. Выполняется у всех пациентов с АГ для выявления ХБП в связи с тем, что снижение СКФ <60 мл/мин/1,73м2 является значимым прогностическим фактором при АГ [60] и в связи с наличием доказанной связи между даже незначительным снижением СКФ и повышением сердечно-сосудистой смертности [61, 62]. Формула CKD-EPI включает те же 4 переменные, что и формула MDRD. Формула CKD-EPI дает меньше погрешностей, чем формула MDRD, особенно при СКФ≥60 мл/мин/1,73 м2, и характеризуется несколько меньшим разбросом данных и бόльшей точностью. Значительная часть (но не все) исследований в Северной Америке, Европе показали, что формула CKD-EPI дает более точные результаты, чем формула MDRD, особенно при высокой СКФ [63]. Меньшая погрешность формулы CKD-EPIпо сравнению с формулой MDRD отражает более высокую рСКФ в большей части возрастного диапазона и значений креатинина, особенно у лиц молодого возраста, женщин и представителей европеоидной расы [64].
- Всем пациентам с АГ для выявления заболеваний почек и оценки СС риска рекомендуется проводить общий (клинический) анализ мочи с микроскопическим исследованием осадка мочи, количественной оценкой альбуминурии или отношения альбумин/креатинин (оптимально) [64, 65].
ЕОК/ЕОАГ IВ (УУР В, УДД 2)
Комментарии. Выполняется у всех пациентов с АГ в связи с тем, что повреждение почек является значимым прогностическим фактором при АГ, наличием доказанной связи между выявлением альбуминурии и повышением середечно-сосудистой смертности [60, 61, 64, 66]. Суточная экскреция альбумина с мочой ≥30 мг/сут ассоциирована с повышенным риском осложнений ХБП [64]. В мета-анализе Консорциума по прогнозу ХБП обнаружены ассоциации между СЭА ≥30 мг/сут при исследовании тест-полосками, с риском общей смертности и смертности от ССЗ, почечной недостаточности прогрессирования ХБП в общей популяции и в популяциях с повышенным риском развития ССЗ. Соотношение альбумин/креатинин в моче (предпочтительно в утренней порции) 30–300 мг/г; 3,4–34 мг/ммоль является маркером повреждения почек [64].
- Всем пациентам с АГ для стратификации риска и выявления нарушений липидного обмена рекомендуется исследование уровня общего холестерина (ОХС), холестерина липопротеинов высокой плотности (ХС-ЛВП), холестерина липопротеинов низкой плотности (ХС-ЛНП) (прямое измерение или расчетно) и триглицеридов (ТГ) в крови [21, 67, 68].
ЕОК/ЕОАГ нет (УУР В, УДД 2)
Комментарии. Выполняется у всех пациентов с АГ для стратификации риска [67, 68], а также в связи с высокой распространенностью дислипидемии в популяции пациентов с АГ и положительным эффектом коррекции дислипидемии на СС риск у пациентов с АГ [21, 22].
- Всем пациентам с АГ для выявления электролитных нарушений и дифференциального диагноза с вторичной АГ рекомендуется исследование уровня калия и натрия в крови [21, 22].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
Комментарии. Выполняется у всех пациентов с АГ для выявления электролитных нарушений в связи с доказанной взаимосвязью между уровнем калия и натрия сыворотки крови и уровнем АД [69, 70].
- Всем пациентам с АГ для выявления гиперурикемии рекомендуется исследование уровня мочевой кислоты в крови [71].
ЕОК/ЕОАГ нет (УУР А, УДД 2)
Комментарии. Выполняется у всех пациентов с АГ в связи с тем, что уровень мочевой кислоты является значимым прогностическим фактором при АГ, а также наличием доказанной связи между гиперурикемией и повышением сердечно-сосудистой смертности [71-73].
Инструментальная диагностика
Проведение инструментальных методов диагностики является необходимым для исключения вторичных форм АГ, выявления поражения органов-мишеней, оценки сердечно-сосудистого риска, и сопутствующей патологии, влияющей на эффективность лечения и качество жизни пациента.
- Всем пациентам с АГ для выявления ГЛЖ и определения СС риска рекомендуется проведение 12-канальной ЭКГ [21, 22, 78, 297].
ЕОК/ЕОАГ IВ (УУР В, УДД 1)
Комментарии. Выполняется у всех пациентов с АГ для выявления гипертрофии левого желудочка (ГЛЖ) и определения сердечно-сосудистого риска [74–84]. ГЛЖ характеризуют индекс Соколова–Лайона (SV1+RV5-6 >35 мм); амплитуда зубца R в Корнельский показатель (RaVL+SV3) >20 мм для женщин, (RAVL+SV3) >28 мм для мужчин; Корнельское произведение (RAVL+SV5) мм х QRS мс> 2440 мм х мс [21, 22]. Несмотря на то, что ЭКГ является менее чувствительным методом диагностики ГЛЖ по сравнению с ЭхоКГ [80, 82, 84], она незаменима для документирования сердечного ритма, ЧСС и выявления аритмий.
- Пациентам с АГ при наличии изменений на ЭКГ или симптомов/признаков дисфункции левого желудочка рекомендуется проведение ЭхоКГ для выявления степени ГЛЖ [21, 22, 81].
ЕОК/ЕОАГ IВ (УУР B, УДД 2)
Комментарии. В таблице П6 (Приложение Г2) приведены эхокардиографические критерии для диагностики изменений левых отделов сердца [85].
- Пациентам с АГ в сочетании с ЦВБ или признаками атеросклеротического поражения сосудов других локализаций, при указании в анамнезе на преходящую слабость в конечностях с одной стороны или онемение половины тела, а также мужчинам старше 40 лет, женщинам старше 50 лет и пациентам с высоким общим сердечно-сосудистым риском (Таблица П12, Приложение Г2) рекомендуется дуплексное сканирование брахиоцефальных артерий для выявления атеросклеротических бляшек/стенозов внутренних сонных артерий [21, 298].
ЕОК/ЕОАГ IВ (УУР В, УДД 1)
Комментарии. О наличии бляшки говорит толщина комплекса интима-медиа (КИМ)>1,5 мм или локальное увеличение толщины на 0,5 мм или на 50%, по сравнению со значением КИМ в прилежащих участках сонной артерии [21].
- Рекомендуется определение ЛПИ в целях уточнения категории риска пациентам с симптомами значимого атеросклероза артерий нижних конечностей или пациентам умеренного риска, у которых положительные результаты данного исследованияприведут к изменению категории риска [86, 87].
ЕОК/ЕОАГ IIbВ (УУР B, УДД 2)
- Всем пациентам с нарушением функции почек, альбуминурией и при подозрении на вторичную АГ рекомендуется проведение УЗИ (ультразвукового исследования) почек и дуплексного сканирования артерий почек с целью оценки размеров, структуры, а также наличия врожденных аномалий почек или стеноза почечных артерий [60, 61, 64].
ЕОК/ЕОАГ IIaC (УУР В, УДД 1)
- Пациентам с АГ 2–3-й степеней, всем пациентам с сахарным диабетом и АГ рекомендуется проводить исследование глазного дна врачом-офтальмологом (геморрагии, экссудаты, отек соска зрительного нерва) для выявления гипертонической ретинопатии [21, 89].
ЕОК/ЕОАГ IС (УУР С, УДД 4)
Комментарии. Гипертоническая ретинопатия, выявленная с помощью фундоскопии (осмотра глазного дна), имеет высокую прогностическую значимость при АГ [88–90]. Обнаружение кровоизлияний в сетчатку, микроаневризм, твердых экссудатов, папиллоэдемы указывает на тяжелую гипертоническую ретинопатию и значимо коррелирует с плохим прогнозом. Изменения, характерные для ранних стадий ретинопатии, не имеют существенного прогностического значения и характеризуются низкой воспроизводимостью. Фундоскопия также показана, если диагноз важен для экспертизы трудоспособности или определения годности к военной службе.
- Пациентам с АГ при наличии неврологических симптомов и/или когнитивных нарушений рекомендуется выполнение КТ или МРТ головного мозга для исключения инфарктов мозга, микрокровоизлияний и повреждений белого вещества и других патологических образований [21, 91, 92].
ЕОК/ЕОАГ IIаВ (УУР А, УДД 1)
Комментарии. Гиперинтенсивные очаги в белом веществе головного мозга и бессимптомные инфаркты ассоциированы с прогрессированием когнитивной дисфункции и повышением риска инсульта в связи с дегенеративной и сосудистой деменцией.
Иные диагностические исследования
Иные диагностические исследования в рамках диагностики АГ не предусмотрены, возможно расширение диагностических исследований по решению врача в зависимости от клинической ситуации и состояния пациента.
- Когнитивные нарушения у пожилых пациентов частично ассоциированы с АГ, в связи с чем у пожилых пациентов с анамнезом, позволяющим предположить ранний когнитивный дефицит, рекомендована оценка когнитивной функции с использованием теста MMSE (MiniMentalStateExamination) [93, 94].
ЕОК/ЕОАГ нет (УУР A, УДД 1)
Лечение
Лечение, включая медикаментозную и немедикаментозную терапию, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Решение о тактике лечения рекомендуется принимать в зависимости от исходного уровня АД и общего сердечно-сосудистого риска. Показания к АГТ суммированы в таблице П1, Приложение Г4.
- Всем пациентам с АГ 1-й степени рекомендуется проводить мероприятия по изменению (оздоровлению) образа жизни с целью нормализации АД и коррекции факторов риска [21, 95, 96].
ЕОК/ЕОАГ IIаB (УУР B, УДД 1)
Комментарии. Подробный подход к изменению образа жизни с целью снижения СС риска представлен в разделе «Немедикаментозное лечение АГ».
Показания к антигипертензивной терапии
(Таблица П2, Приложение Г4)
- Пациентам с АГ 2-й или 3-й степени при любом уровне СС риска рекомендуется незамедлительное начало антигипертензивной лекарственной терапии для снижения риска развития сердечно-сосудистых осложнений, СС смерти одновременно с рекомендациями по изменению образа жизни [59, 110].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- Пациентам с АГ 1-й степени, относящимся к категориям низкого/умеренного риска без признаков ПОМ (оценка риска по шкале SCORE (Таблица П11, Приложение Г2) рекомендуется начинать антигипертензивную лекарственную терапию в том случае, если у них сохраняется повышенное АД, несмотря на мероприятия по изменению образа жизни в течение 3 месяцев [21, 22, 97].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- Пациентам с АГ 1-й степени, относящимся к категории высокого риска (оценка риска по шкале SCORE (Приложение Г3) при неосложненной АГ или при наличии ПОМ, рекомендуется незамедлительное начало антигипертензивной лекарственной терапии одновременно с рекомендациями по изменению образа жизни [21, 22, 97].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- Пациентам с высоким нормальным АД (130–139/85–89 мм рт. ст.) рекомендуется начало АГТ при очень высоком уровне СС риска вследствие наличия ССЗ (особенно ИБС) (Таблица П12, Приложение Г2) [21, 22, 99].
ЕОК/ЕОАГ IIbA (УУР А, УДД 1)
- Пожилым пациентам с АГ (даже в возрасте >80 лет), находящимся в удовлетворительном физическом состоянии, рекомендуется изменение образа жизни и АГТ при уровне САД ≥160 мм рт. ст. [21, 22, 100]. Пожилым пациентам (>65 лет, но не >80 лет), находящимся в удовлетворительном физическом состоянии (без синдрома старческой астении), если их САД соответствует показателям АГ 1-й степени (140–159 мм рт. ст.), рекомендуются изменение образа жизни и АГТ при хорошей переносимости [21, 22, 100, 101, 102, 235].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- Рекомендуется рассмотреть возможность назначения АГТ пожилым пациентам с синдромом старческой астении при удовлетворительной переносимости [100, 101, 235].
ЕОК/ЕОАГ IIbB (УУР A, УДД 1)
- У пациентов старше 80 лет не рекомендуется отменять антигипертензивную лекарственную терапию, при условии, что эта терапия хорошо переносится, не сопровождается ортостатической гипотонией, развитием/усугублением гериатрических синдромов и снижением функционального статуса в связи с доказанными преимуществами в отношении СС смертности [21, 22, 101, 103, 104].
ЕОК/ЕОАГ IIIA (УУР А, УДД 1)
Целевые уровни артериального давления
- Всем пациентам с АГ, получающим лечение, независимо от возраста и степени риска, рекомендуется в качестве первого целевого уровня снижать АД до значений <140/90 мм рт. ст., а при условии хорошей переносимости — до целевого уровня 130/80 мм рт. ст. или ниже, в связи с доказанными преимуществами в плане снижения риска сердечно-сосудистых осложнений [59, 105, 107].
ЕОК/ЕОАГ IA (УУР A, УДД 1)
- Пациентам моложе 65 лет и без ХБП, получающих антигипертензивную терапию, рекомендуется снижать САД до значений 120–130 мм рт. ст., в связи с доказанным влиянием вмешательства на СС риск [59, 103, 106, 107, 108].
ЕОК/ЕОАГ IA (УУР A, УДД 1)
- Пациентам 65 лет и старше без старческой астении, получающим антигипертензивную терапию, вне зависимости от уровня СС риска и наличия ССЗ рекомендуется снижать САД до целевых значений 130–139 мм рт. ст., при условии хорошей переносимости. [59, 103, 107, 108].
ЕОК/ЕОАГ IA (УУР A, УДД 1)
Комментарии. Всем пациентам в возрасте ≥65 лет, получающим антигипертензивную терапию, при каждом визите к врачу рекомендуется проводить оценку возможных нежелательных явлений.
- Всем пациентам с АГ вне зависимости от возраста, уровня риска и наличия сопутствующих заболеваний рекомендуется снижать ДАД до целевых значений 70–79 мм рт. ст. (таблица П3, Приложение Г4) [107, 109, 110].
ЕОК/ЕОАГ IIaB (УУР B, УДД 2)
Комментарии. Следует учитывать, что нижняя граница безопасности установлена в связи с результатами исследований, проведенных преимущественно в группах пациентов высокого и очень высокого риска (пожилые с коморбидностью, установленными ССЗ, в том числе — лица с ИБС, заболеванием периферических артерий. Таким образом, в общей популяции пациентов с АГ, верятно, нет необходимости в коррекции лечения при уровне САД <120 мм рт. ст. и ДАД <70 мм рт. ст. при его хорошей переносимости.
Немедикаментозное лечение АГ
Мероприятия по изменению образа жизни рекомендуются всем пациентам с АГ. Немедикаментозные методы лечения АГ способствуют снижению АД, уменьшают потребность в антигипертензивных препаратах (АГП) и повышают их эффективность, позволяют осуществлять коррекцию ФР, проводить первичную профилактику АГ у пациентов с высоким нормальным АД и имеющих ФР [114, 115].
- Всем пациентам с АГ для улучшения контроля заболевания рекомендуется ограничение употребления соли до <5 г в сутки [116–119].
ЕОК/ЕОАГ IA (УУР A, УДД 1)
Комментарии. Избыточное потребление соли может играть существенную неблагоприятную роль в развитии рефрактерной АГ. Стандартное потребление соли во многих странах составляет от 9 до 12 г/сутки (80% потребляемой соли приходится на так называемую «скрытую соль»), уменьшение ее потребления до 5 г/сутки у пациентов АГ ведет к снижению САД на 4–5 мм рт. ст. Влияние ограничения натрия более выражено у пациентов пожилого и старческого возраста, у пациентов с СД, МС и ХБП.
- Всем пациентам с АГ для улучшения контроля заболевания рекомендуется ограничить употребления алкоголя (менее 14 единиц в неделю для мужчин, менее 8 единиц в неделю для женщин*) и избегать хронического злоупотребления алкоголем [21, 22, 120].
ЕОК/ЕОАГ IA (УУР A, УДД 1)
Комментарии. Одной единицей употребления алкоголя следует считать 10 мл или 8 г чистого спирта, что соответствует 125 мл вина или 250 мл пива.
- Всем пациентам с АГ для улучшения метаболических показателей рекомендуется увеличить употребление овощей, свежих фруктов, рыбы, орехов и ненасыщенных жирных кислот (оливковое масло), молочных продуктов низкой жирности, уменьшить употребление мяса [121].
ЕОК/ЕОАГ IA (УУР А, УДД 1)
Комментарии. Необходимо увеличение потребления растительной пищи, содержания в рационе калия, кальция (в овощах, фруктах, зерновых) и магния (в молочных продуктах), а также уменьшение потребления жиров животного происхождения. Пациентам с АГ следует рекомендовать употребление рыбы не реже двух раз в неделю и 300–400 г в сутки свежих овощей и фруктов.
- Всем пациентам с АГ рекомендуется контролировать массу тела для предупреждения развития ожирения (индекс массы тела (ИМТ) ≥30 кг/м2 или окружность талии >102 см у мужчин и >88 см у женщин) и достижение ИМТ в пределах 20–25 кг/м2; окружности талии <94 см у мужчин и <80 см у женщин с целью снижения АД и уменьшения СС риска [122–124].
ЕОК/ЕОАГ IA (УУР А, УДД 1)
Комментарии. У лиц с ожирением уменьшение массы тела на 5–10% от исходной приводит к достоверному снижению риска развития ССО.
- Всем пациентам с АГ в связи с доказанным положительным эффектом на уровень СС смертности рекомендуются регулярные аэробные физические упражнения (не менее 30 минут динамических упражнений умеренной интенсивности 5–7 дней в неделю) [125, 126].
ЕОК/ЕОАГ IA (УУР А, УДД 2)
Комментарии. Пациентам с АГ следует рекомендовать умеренные аэробные нагрузки (ходьба, скандинавская ходьба, езда на велосипеде, плавание, фитнес). Влияние изометрической силовой нагрузки на уровень АД и СС риск до конца не ясно.
- Всем пациентам с АГ в связи с доказанным негативным эффектом курения на уровень смертности рекомендуются прекращение курения, психологическая поддержка и выполнение программ по прекращению курения [127–129].
ЕОК/ЕОАГ IB (УУР А, УДД 2)
Медикаментозная терапия АГ
Общие принципы медикаментозной терапии
Основой антигипертензивной терапии для снижения АД и уменьшения числа СС событий являются 5 классов антигипертензивных препаратов: ингибиторы АПФ (ИАПФ), блокаторы рецепторов ангиотензина-II (БРА), бета-адреноблокаторы (ББ), блокаторы кальциевых каналов (АК) и диуретики (тиазидные — гидрохлортиазид, и тиазидоподобные — хлорталидон и индапамид).
Противопоказания к назначению основных антигипертензивных препаратов суммированы в таблице П4, Приложение Г4.
- Всем пациентам с АГ (кроме пациентов низкого риска с АД<150/90 мм рт. ст., пациентов ≥80 лет, пациентов с синдромом старческой астении) в качестве стартовой терапии рекомендована комбинация антигипертензивных препаратов, предпочтительно фиксированная, для улучшения приверженности к терапии. Предпочтительные комбинации должны включать блокатор ренин-ангиотензиновой системы (РААС) (ингибитор АПФ или БРА) и дигидропиридиновый АК или диуретик (Приложение Б2) [130–134].
ЕОК/ЕОАГ IA (УУР А, УДД 1)
Комментарии. Многочисленными РКИ показано, что монотерапия эффективно снижает АД лишь у ограниченного числа пациентов АГ, большинству пациентов для контроля АД требуется комбинация как минимум из двух препаратов. Метаанализ более 40 исследований показал, что комбинация двух препаратов из любых двух классов антигипертензивных средств усиливает степень снижения АД намного сильнее, чем повышение дозы одного препарата. Еще одно преимущество комбинированной терапии — возможность физиологического и фармакологического синергизма между препаратами разных классов, что может не только лежать в основе более выраженного снижения АД и лучшей переносимости. Комбинированная терапия позволяет также подавить контррегуляторные механизмы повышения АД. Все преимущества комбинированной терапии присущи только рациональным комбинациям АГП. К ним относятся: ИАПФ + диуретик; БРА + диуретик; ИАПФ + АК; БРА + АК, дигидропиридиновый АК + ББ, АК + диуретик, ББ + диуретик. На практике могут быть использованы и другие комбинации пяти основных классов антигипертензивных средств при наличии индивидуальных показаний. При наличии клинической целесообразности, с учетом особенностей клинического течения заболевания, коморбидной патологии, переносимости лечения и профиля побочных эффектов, а также при наличии предпочтений пациента, связанных с его личным позитивным или негативным опытом, и, соответственно с учетом ожидаемой приверженности к лечению врач имеет право назначать любой антигипертензивный препарат, который зарегистрирован для лечения АГ в РФ, как в монотерапии, так и в комбинации. При этом отклонение от стандартных схем терапии требует соответствующего объяснения в истории болезни.
К запрещенным комбинациям относится комбинация двух блокаторов РААС.
Фиксированные комбинации повышают приверженность к лечению. Однако такие лекарственные формы не входят в формуляры многих учреждений и в списки жизненно важных лекарственных препаратов, что делает сложным их назначение пациентам в стационаре и льготным категориям пациентов, поэтому если у пациента достигнут целевой уровень АД в пределах установленных значений и наблюдается хорошая приверженность к лечению, то нет необходимости его перевода со свободной на фиксированные комбинации. Свободные комбинации могут быть использованы также по организационным соображениям, в частности с целью обеспечения доступности препаратов для пациента.
Шаги АГТ предполагают возможность или использования более высоких дозировок в комбинации, или сразу переход на 3-компонентную схему лечения. Оба подхода допустимы на этапе 2-компонентной схемы, но они должны обеспечить достижение целевого АД в течение 3 месяцев с шагом титрации дозы приблизительно 4 недели.
Следует подчеркнуть, что в реальной практике на 1 шаге терапии необходимо назначать препараты в оптимальных терапевтических дозах, которые могут обеспечить достижение целевого АД в указанные сроки. В этом случае при недостижении целевого АД рациональным будет переход на следующий шаг. До перехода на 4-компонентную схему необходимо использование трех препаратов в максимальных дозах при хорошей переносимости.
У 15–20% пациентов контроль АД может быть не достигнут при использовании 3 препаратов. В этом случае используется комбинация из 4 и более АГП. Однако в случаях резистентной АГ при добавлении каждого нового препарата необходимо контролировать их эффективность, и неэффективные АГП следует отменять, а не сохранять в рамках постепенного усиления многокомпонентной АГТ.
К рекомендуемым комбинациям трех антигипертензивных препаратов относятся: ИАПФ + АК + диуретик; БРА + АК + диуретик.
По показаниям, при наличии особых условий можно использовать и другие комбинации: ИАПФ + дигидропиридиновый АК + ББ; БРА + дигидропиридиновый АК + ББ; ИАПФ + диуретик + ББ; БРА + диуретик + ББ; дигидропиридиновый АК + диуретик + ББ.
Целевые уровни АД являются рекомендованными для достижения в каждой подгруппе пациентов, но важнейшим принципом их достижения является соблюдение безопасности и сохранения качества жизни пациента. Поэтому скорость достижения целевых значений и степень снижения АД может быть скорректирована у конкретного пациента в зависимости от конкретной клинической ситуации. При этом плохая переносимость снижения АД может быть основанием для более медленной титрации доз и числа назначаемых препаратов, равно как и при хорошей переносимости АД, может быть снижено до более низких значений, чем рекомендовано в среднем. Недостижение целевого АД в указанные сроки не является ошибочным, если это продиктовано клинической необходимостью. Если врач считает, что препятствием к достижению целевого АД является плохая приверженность пациента, это должно находить отражение в медицинской документации и должны быть предприняты и зафиксированы меры по повышению приверженности. В этих случаях недостижение целевого уровня не должно считаться дефектом оказания помощи.
- Пациентам, не достигшим целевого АД на фоне двойной комбинированной терапии, рекомендуется тройная комбинация, как правило, блокатора РААС с АК и тиазидовым/тиазидоподобным диуретиком, предпочтительно в форме фиксированной комбинации [135, 136].
ЕОК/ЕОАГ IА (УУР В, УДД 1)
- Пациентам с АГ, не достигшим целевого АД на фоне тройной комбинированной терапии, рекомендуется добавление спиронолактона (подробнее в разделе 3.6.11.) [106, 137, 138, 169].
ЕОК/ЕОАГ IB (УУР А, УДД 1)
Комментарии. При непереносимости спиронолактона рекомендуется назначение других диуретиков (эплеренона, хлорталидона, петлевых диуретиков, в т.ч в более высоких дозах), ББ, альфа-адреноблокаторов или препаратов центрального действия. [139].
- Всем пациентам с АГ не рекомендуется назначение комбинации двух блокаторов РААС вследствие повышенного риска развития гиперкалиемии, гипотензии и ухудшения функции почек [21, 139, 145, 146].
ЕОК/ЕОАГ IIIА (УУР A, УДД 1)
Основные классы препаратов для лечения артериальной гипертензии
Ингибиторы ангиотензинпревращающего фермента и антагонисты рецепторов ангиотензина II
ИАПФ и БРА — среди наиболее часто используемых классов антигипертензивных препаратов, обладающие сходной эффективностью в отношении сердечно-сосудистых осложнений и смертности по сравнению как друг с другом, так и с другими классами АГТ [59, 140–142]. БРА по сравнению с другими классами характеризуются более низкой частотой отмены из-за побочных эффектов, сопоставимой с плацебо [143, 144].
ИАПФ и БРА снижают альбуминурию в большей степени, чем другие антигипертензивные препараты, и эффективно замедляют прогрессирование диабетической и недиабетической ХБП [99]. По данным метаанализов, блокаторы РААС — единственные из всех антигипертензивных препаратов доказанно снижают риск терминальной ХБП.
ИАПФ и БРА эффективно предотвращают или приводят к обратному развитию ПОМ (ГЛЖ, ремоделирование мелких артерий) на фоне соответствующего снижения АД [140]. Оба препарата снижают риск пароксизмов ФП, что может быть обусловлено улучшением функции ЛЖ и более эффективным регрессом структурных изменений ЛЖ [140]. ИАПФ и БРА показаны пациентам с перенесенным ИМ, ХСНнФВ.
ИАПФ ассоциированы с умеренным повышением риска ангионевротического отека, особенно у представителей негроидной расы. У таких пациентов следует отдавать предпочтение БРА.
Для всех пациентов с АГ в связи с наличием абсолютных противопоказаний не рекомендуется назначение ИАПФ и БРА при беременности, высокой гиперкалиемии (≥5,5 ммоль/л), двухстороннем стенозе почечных артерий, стенозе почечной артерии единственной почки, у беременных и кормящих женщин и ангионевротическом отеке в анамнезе.
Блокаторы кальциевых каналов
Все АК метаболически нейтральны и не оказывают отрицательного действия на углеводный, липидный и пуриновый обмен. Помимо антигипертензивного, они оказывают антиангинальное и органопротективное действие, тормозят агрегацию тромбоцитов. В целом их влияние на СС риск схоже с другими классами антигипертензивных препаратов [59, 140]. При этом АК обладают большим эффектом в отношении профилактики инсультов, чем этого можно было ожидать только от антигипертензивного эффекта, однако они менее эффективны в отношении профилактики СНнФВ [59, 140].
Не рекомендуется (абсолютное противопоказание) назначение недигидропиридиновых АК при атриовентрикулярной блокаде 2–3-й степени, ХСН снизкой ФВ ЛЖ. Для дигидропиридиновых АК абсолютных противопоказаний нет.
Диуретики тиазидные и тиазидоподобные
Диуретики оказывают выраженный антигипертензивный эффект и остаются краеугольным камнем антигипертензивной терапии. Их эффективность в предотвращении всех вариантов СС осложнений и смертности подтверждена в РКИ и метаанализах [147]. Диуретики более эффективно предотвращают СН, чем другие классы препаратов [140]. В настоящее время ведутся дискуссии о том, следует ли предпочесть тиазидоподобные диуретики классическим тиазидным диуретикам, хотя их превосходство не было подтверждено в РКИ с прямым сравнением. Недавний метаанализ плацебо-контролируемых РКИ показал сходные эффекты трех типов диуретиков на СС исходы [147]. Таким образом, в отсутствие прямых сравнительных исследований и с учетом того, что гидрохлортиазид является компонентом многих фиксированных комбинаций, можно рекомендовать равноценное использование тиазидов, хлорталидона и индапамида.
И тиазидные, и тиазидоподобные диуретики снижают уровень сывороточного калия и имеют менее благоприятный профиль безопасности, чем блокаторы РААС [147, 148]. Они также могут способствовать повышению инсулинорезистентности и риска развития СД. Недавно проведенные исследования показали, что снизить негативное влияние тиазидов на метаболизм глюкозы можно добавлением калийсберегающего диуретика [149]. И тиазидные, и тиазидоподобные диуретики характеризуются снижением антигипертензивной эффективности при СКФ менее 45 мл/мин, а при СКФ менее 30 мл/мин препараты становятся неэффективными. В этом случае в качестве альтернативы следует использовать петлевые диуретики.
- У пациентов, не достигших целевого АД при приеме моно- или комбинированной АГТ, не включавшей диуретики, рекомендуется назначение низких доз тиазидных или тиазидоподобных диуретиков в составе комбинированной терапии с БРА, ИАПФ и АК для усиления АГЭ и достижения целевого АД [150–152].
ЕОК/ЕОАГ IB (УУР А, УДД 1)
Комментарии. Подагра и бессимптомная гиперурикемия являются абсолютным противопоказанием к назначению гидрохлортиазида и хлорталидона и относительным противопоказанием для индапамида.
Антагонисты минералокортикоидных рецепторов
АГЭ антагонистов минералокортикоидных рецепторов (АМКР) (спиронолактон, эплеренон) связан с тем, что они, имея стероидную структуру, конкурентно по отношению к альдостерону, связываются с его рецепторами, блокируя биологические эффекты альдостерона.
Cпиронолактон оказывает положительный эффект при сердечной недостаточности и резистентной АГ. Эплеренон также продемонстрировал положительный эффект при сердечной недостаточности и резистентной АГ и может использоваться как альтернатива спиронолактону. Для лечения АГ используются низкие суточные дозы АМКР (25–50 мг). Не рекомендуется (абсолютное противопоказание) назначение антагонистов альдостероновых рецепторов при нарушении функции почек с СКФ<30 мл/мин/1,73 м2 из-за повышения риска гиперкалиемии и ухудшения функции почек.
Бета-адреноблокаторы. АГЭ ББ обусловлена их способностью блокировать β1- и β2-адренорецепторы и уменьшать адренергическое влияние на сердце (снижение частоты и силы сердечных сокращений), а также снижать секрецию ренина (блокада β1-рецепторов юкстагломерулярного аппарата).
- ББ рекомендованы в качестве антигипертензивной терапии при наличии особых клинических ситуаций: например, стенокардии, перенесенного инфаркта миокарда, сердечной недостаточности [21, 22].
ЕОК ЕОАГ IA (УУР С, УДД 5)
Комментарии. ББ — один из пяти основных классов АГП. Предпочтительными ситуациями для их назначения являются симптомная стенокардия напряжения, перенесенный ИМ, ХСН с низкой фракцией выброса, ФП, аневризма аорты, контроль ЧСС, а также лечение АГ у женщин детородного возраста, особенно планирующих беременность. ББ — гетерогенный класс препаратов. В отдельных исследованиях продемонстрированы неодинаковые эффекты классических и вазодилатирующих ББ в отношении центрального АД, артериальной ригидности, риска развития СД, исходов при ХСН. РКИ по сопоставлению эффективности ББ с разными свойствами у пациентов с АГ не проводились. У физически активных пациентов и при наличии у них МС, НТГ рекомендованы ББ с вазодилатирующим эффектом, не оказывающие отрицательного влияния на инсулинорезистетность.
В многоцентровых исследованиях была показана несколько меньшая эффективность ББ по предупреждению инсульта в сравнении с другими АГП [153]. Однако все эти данные были получены при анализе исследований, где применялся атенолол. В отношении небиволола, карведилола и высокоселективных ББ (бисопролол и метопролол замедленного высвобождения) нет данных по влиянию на жесткие конечные точки [147].
Абсолютное противопоказание для назначения ББ — синоатриальная, атриовентрикулярная блокада 2–3-й степени, синдром слабости синусового узла и бронхиальная астма.
Другие (дополнительные) классы антигипертензивных препаратов
В целом антигипертензивные препараты, не относящиеся к пяти основным классам (например, препараты центрального действия, альфа-адреноблокаторы), не рекомендуются для рутинного применения при АГ, но остаются препаратами резерва, например, для применения при резистентной гипертензии при неэффективности остальных препаратов [21].
Агонисты имидазолиновых рецепторов (моксонидин) стимулируют имидазолиновые рецепторы, расположенные в вентролатеральном отделе продолговатого мозга. В отличие от других классов АГП, для моксонидина не проводились РКИ с использованием жестких конечных точек. С учетом результатов исследования ALMAZ [154], показавшего, что моксонидин повышает чувствительность тканей к инсулину у пациентов с избыточной массой тела, мягкой АГ и инсулинорезистентностью и нарушением углеводного обмена, назначение моксонидина возможно при ведении пациентов с АГ, ожирением и инсулинорезистентностью. Несмотря на отсутствие в рекомендациях данного класса препаратов среди основных, нет оснований для отмены такой терапии пациентам, которые уже получают данную группу препаратов при условии их хорошей эффективности и переносимости.
- Моксонидин для лечения АГ рекомендуется пациентам с МС или ожирением в комбинации с ИАПФ, БРА, АК и диуретиками при недостаточной эффективности классических комбинаций [154–156].
ЕОК/ЕОАГ нет (УУР B, УДД 3)
Комментарии. Не рекомендовано (абсолютное противопоказание) назначение агонистов имидазолиновых рецепторов при синдроме слабости синусового узла, синоатриальной, атриовентрикулярной блокаде 2–3-й степени, выраженной брадикардии с ЧСС менее 50 в минуту, ХСН (III–IV ФК).
Альфа-адреноблокаторы. Альфа-адреноблокаторы улучшают углеводный и липидный обмены, повышают чувствительность тканей к инсулину, улучшают почечную гемодинамику. Ввиду того, что эти препараты вызывают постуральную гипотензию, их с осторожностью применяют у пациентов с диабетической нейропатией и у пациентов старше 65 лет. Предпочтительным показанием для этого класса препаратов является наличие у пациентов с АГ доброкачественной гиперплазии предстательной железы.
- Альфа-адероноблокаторы рекомендуются при резистентной АГ (подробнее в разделе 3.6.11.), в качестве четвертого препарата к комбинации ИАПФ/БРА, АК, диуретика (при непереносимости спиронолактона**) [137].
ЕОК/ЕОАГ нет (УУР B, УДД 2)
Аппаратное лечение артериальной гипертензии
- Денервация почечных артерий (ренальная денервация) не рекомендована для лечения артериальной гипертензии в рутинной практике, пока не будет доступно больше данных относительно их эффективности и безопасности [157, 158].
ЕОК/ЕОАГ нет (УУР С, УДД 5)
Комментарии. Денервация почечных артерий может выполнятьсядля предотвращения эффектов симпатической нервной системы в отношении почечного сосудистого сопротивления, высвобождения ренина и реабсорбции натрия [159]. Для лечения пациентов с резистентной АГ были предложены минимально инвазивные методы катетерной денервации почек с помощью радиочастотной стимуляции, ультразвука или периваскулярной инъекции нейротоксичных веществ, например, этилового спирта [160]. Однако клинические данные относительно антигипертензивной эффективности ренальной денервации неоднозначны и требуют дальнейшего изучения.
Лечение артериальной гипертензии в отдельных клинических ситуациях
Артериальная гипертензия и сахарный диабет
- Пациентам с АГ в сочетании с СД рекомендуется начинать антигипертензивную терапию при значениях АД, измеренного в медицинском учреждении ≥140/90 мм рт. ст. [107, 157, 158]
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- Пациентам с АГ в сочетании с СД, получающим АГП, в связи с доказанными преимуществами в снижении СС риска рекомендуется:
— в качестве целевого уровня снижать САД у пациентов моложе 65 лет до значений 130 мм рт. ст. и ниже при хорошей переносимости, но не ниже 120 мм рт. ст. [107, 157, 159]
ЕОК/ЕОАГ IА (УУР А, УДД 1)
— у пожилых пациентов (≥65 лет) с СД целевой уровень САД составляет 130–139 мм рт. ст. [107, 157, 160]
ЕОК/ЕОАГ IА (УУР А, УДД 1)
— целевой уровень ДАД у всех пациентов с АГ и СД составляет <80 мм рт. ст., но не ниже 70 мм рт. ст. [21, 22].
ЕОК/ЕОАГ IС (УУР С, УДД 5)
- Всем пациентам с АГ и СД рекомендуется начинать лечение с комбинации блокатора РААС с АК или тиазидным/тиазидоподобным диуретиком в связи с наилучшим влиянием этих комбинаций на частоту достижения целевого АД и снижение СС риска, а также нефропротективным потенциалом блокаторов РААС [106–107, 165].
ЕОК/ЕОАГ IА (УУР А, УДД 2)
Комментарии. Сочетание СД и АГ заслуживает особого внимания, поскольку оба заболевания существенно увеличивают риск развития микро- и макрососудистых поражений, включая диабетическую нефропатию, инсульт, ИБС, ИМ, ХСН, атеросклероз периферических артерий, и способствуют увеличению СС смертности. При лечении пациентов АГ с СД необходимо контролировать все имеющиеся у пациента ФР, включая дислипидемию (назначение гиполипидемической терапии). Развитие диабетической нефропатии сопровождается очень высоким риском развития ССО, при этом необходимы контроль АД и уменьшение протеинурии до минимально возможных значений.
Артериальная гипертензия и хроническая болезнь почек
- Пациентам с ХБП рекомендуется начинать лечение (изменение образа жизни и лекарственную терапию) вне зависимости от наличия сахарного диабета при уровне АД, измеренного в медицинском учреждении, ≥140/90 мм рт. ст. (Приложение Б3) [165, 166].
ЕОК/ЕОАГIА (УУР С, УДД 4)
- Пациентам с диабетической и недиабетической ХБП рекомендуется снижать САД до значений 130–139 мм рт. ст. в связи с доказанными преимуществами в снижении риска сердечно-сосудистых событий [168].
ЕОК/ЕОАГ IА (УУР С, УДД 4)
Комментарии. Следует назначать индивидуализированную терапию в зависимости от ее переносимости и влияния на функцию почек и уровень электролитов
- Блокаторы РААС рекомендуются в качестве компонента терапевтической стратегии при наличии альбуминурии высокой степени или протеинурии, как более эффективные препараты для уменьшения выраженности альбуминурии [167, 168].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- Всем пациентам с АГ и ХБП в качестве начальной терапии рекомендуется комбинация блокатора РААС с АК или диуретиком в связи с наилучшим влиянием данных комбинаций на частоту достижения целевого АД и снижение СС риска [165].
ЕОК/ЕОАГ IА (УУР А, УДД 2)
Комментарии. АГ является важнейшим фактором риска развития и прогрессирования хронической болезни почек (ХБП) любой этиологии; адекватный контроль АД замедляет ее развитие. В свою очередь, ХБП является важным независимым фактором риска развития и прогрессирования ССЗ, в том числе фатальных. У пациентов, получающих почечную заместительную терапию гемодиализом, АГ существенно влияет на выживаемость. Для ведения таких пациентов крайне важно точное и правильное измерение АД, однако АД до сеанса гемодиализа может не отражать средний уровень АД, так как большие колебания натрия и воды в организме способствуют большей вариабельности АД. Доказано, что АД, измеренное методом ДМАД, более информативно, чем показатели АД перед сеансом гемодиализа.
У пациентов с терминальной стадией ХБП, находящихся на диализе, снижение САД и ДАД сопровождается уменьшением частоты СС осложнений и общей смертности. Пациентам, находящимся на гемодиализе, можно назначать все АГП, при этом их дозы зависят от стабильности гемодинамики и способности конкретного препарата проходить через диализные мембраны. Петлевые диуретики — препараты выбора среди диуретиков при терминальной ХБП.
При использовании АМКР, особенно в комбинации с блокатором РААС, необходим более тщательный контроль функции почек и уровня калия (опасность гиперкалиемии).
Артериальная гипертензия и ишемическая болезнь сердца
Пациентам с АГ в сочетании с ИБС рекомендуется:
- Пациентам моложе 65 лет, без ХБП, получающим антигипертензивную терапию, в связи с доказанными преимуществами в снижении риска СС событий рекомендуется снижать САД до целевого уровня ≤130 мм рт. ст. при хорошей переносимости, но не <120 мм рт. ст. (Приложение Б4) [157, 170].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- У пожилых пациентов (≥65 лет) и/или с наличием ХБП рекомендовано снижать САД до целевых значений 130–139 мм рт. ст. [157, 170].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- Снижать ДАД до целевых значений <80 мм рт. ст., но не <70 мм рт. ст. [299]
ЕОК/ЕОАГ IА (УУР А, УДД 3)
- Пациентам с АГ с перенесенным инфарктом миокарда рекомендуется назначение ББ и блокаторов РААС в качестве составной части терапии для снижения риска СС смертности [171].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- Пациентам с АГ и симптомами стенокардии рекомендуется назначение ББ и/или АК. [171].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
Артериальная гипертензия, гипертрофия левого желудочка и сердечная недостаточность
- Пациентам с АГ в сочетании с сердечной недостаточностью (СН) (с низкой или сохраненной фракцией выброса) рекомендуется назначение АГТ при уровне АД ≥140/90 мм рт. ст. в связи с доказанными преимуществами в отношении снижения СС смертности [172].
ЕОК/ЕОАГ IIaB (УУР C, УДД 5)
Комментарии. У пациентов с АГ и СН с сохранной функцией левого желудочка при назначении АГТ возможно использование всех основных лекарственных средств, поскольку ни один из препаратов не продемонстрировал свое превосходство над другими в отношении улучшения СС исходов [21, 22].
- Пациентам с АГ в сочетании с СН со сниженной ФВ в качестве АГТ рекомендуется использовать ИАПФ или БРА, а также ББ, диуретиков и/или АМКР при необходимости [171, 173] (Приложение Б5).
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- При недостаточном контроле АД пациентам с СН и АГ рекомендуется рассмотреть возможность добавления к терапии дигидропиридиновых АК для достижения целевого АД [21, 22].
ЕОК/ЕОАГ IIbC (УУР C, УДД 5)
- Пациентам с АГ и СН с сохраненной ФВ рекомендуется руководствоваться теми же пороговыми и целевыми значениями АД, что и при сниженной ФВ [174–176].
ЕОК/ЕОАГ IIaB (УУР С, УДД 5)
- Всем пациентам с ГЛЖ рекомендуется назначение блокаторов РААС в комбинации с АК или диуретиком в связи с доказанным влиянием на процессы ремоделирования ЛЖ [177].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- У пациентов с АГ и ГЛЖ моложе 65 лет и при отсутствии ХБП рекомендуется снижать САД до значений 120–130 мм рт. ст. в связи с доказанными преимуществами в отношении снижения СС исходов и смертности [107, 178–180].
ЕОК/ЕОАГ IIaB (УУР А, УДД 1)
Артериальная гипертензия, фибрилляция предсердий и другие аритмии
Ведение пациентов с АГ в сочетании с фибрилляцией предсердий проводится в соответствии с действующими клиническими рекомендациями.
- Всех пациентов с ФП рекомендуется обследовать для исключения АГ [181].
ЕОК/ЕОАГ IC (УУР C, УДД 5)
- Пациентам с АГ и ФП при необходимости контроля ЧСС в качестве компонента АГТ рекомендуется назначать ББ или недигидропиридиновые АК (Приложение Б6) [181].
ЕОК/ЕОАГ IIaB (УУР C, УДД 5)
Комментарии. Индивидуальный выбор доз ББ или недигидропиридиновых АК препаратов должен быть ориентирован на целевые значения ЧСС не выше 110 в минуту в состоянии покоя [182].
- Пациентам с АГ в сочетании с ФП при числе баллов по шкале CHA2DS2-Vasc ≥2 для мужчин и ≥3 для женщин рекомендуется проводить профилактику инсульта с помощью пероральных антикоагулянтов (шкала предсталена в Таблице 4, Приложение Г3) [183].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- Назначение пероральных антикоагулянтов рекомендовано пациентам с ФП, имеющим 1 балл по шкале CHA2DS2-VASc, учитывая индивидуальные особенности и предпочтения пациента [182,184].
ЕОК/ЕОАГ IIaB (УУР C, УДД 5)
Комментарии. Развитие ФП у пациентов АГ ухудшает прогноз заболевания, значимо повышает риск развития инсульта (кардиоэмболического генеза) и сердечной недостаточности. АГ — самое распространенное сопутствующее заболевание у пациентов с ФП. В отсутствие противопоказаний пациенты ФП должны получать пероральные антикоагулянты для профилактики инсульта и других эмболий. Адекватный контроль АГ у пациентов, получающих антикоагулянты, способствует снижению частоты кровотечений. Оральные антикоагулянты следует применять с осторожностью у пациентов со значительно повышенным АД (САД ≥180 мм рт. ст. и/или ДАД ≥100 мм рт. ст.), при этом необходимо применить срочные меры для достижения контроля АД; целью является снижение САД как минимум <140 мм рт. ст., ДАД <90 мм рт. ст. Целесообразно оценить возможность снижения САД до <130 мм рт. ст. [181, 185].
Артериальная гипертензия и цереброваскулярная болезнь
- Пациентам с внутримозговой гематомой и САД < 200 мм рт. ст. не рекомендуется незамедлительное снижение АД для профилактики осложнений (в том числе гипоперфузии головного мозга или увеличения размеров очага поражения) [186-192].
ЕОК/ЕОАГ IIIA (УУР A, УДД 2)
- Пациентам с внутримозговой гематомой при САД ≥220 мм рт. ст. рекомендовано осторожное снижение АД до уровня <180 мм рт. ст. с помощью в/в терапии для профилактики осложнений (в том числе гипоперфузии головного мозга или увеличения размеров очага поражения) [191, 192].
ЕОК/ЕОАГ IIaB (УУР С, УДД 5)
- Пациентам c острым ишемическим инсультом рутинное снижение АД не рекомендуется для профилактики осложнений (в том числе гипоперфузии головного мозга) [190-195].
ЕОК/ЕОАГ IIIA (УУР A, УДД 1)
- Пациентам с острым ишемическим инсультом, которым планируется проведение внутривенной тромболитической терапии, АД рекомендуется осторожно снизить и поддерживать на <180/105 мм рт. ст. в течение как минимум 24 часов после тромболизиса в связи с доказанными преимуществами в отношении прогноза неврологического восстановления [193, 196, 197].
ЕОК/ЕОАГ IIaB (УУР С, УДД 3)
- Пациентам с САД ≥ 220 и/или ДАД ≥120 мм рт. ст., которым не проводился тромболизис, рекомендуется рассмотреть возможность целесообразности лекарственной терапии с целью снижения АД на 15% в течение первых суток после инсульта принимается на основании оценки клинической ситуации [21, 22, 193].
ЕОК/ЕОАГ IIbC (УУР C, УДД 5)
- Пациентам с АГ, перенесшим острое цереброваскулярное нарушение, с целью сокращения риска повторного острого нарушения мозгового кровообращения (ОНМК) назначение АГТ рекомендовано сразу после транзиторной ишемической атаки (ТИА) и через несколько дней после ишемического инсульта [185, 198, 199].
ЕОК/ЕОАГ IА (УУР С, УДД 4)
- Всем пациентам с АГ после ишемического инсульта или ТИА моложе 65 лет и без ХБП рекомендуется снижать САД до целевых значений 120–130 мм рт. ст. в связи с доказанными преимуществами в отношении снижения СС смертности [108, 185, 199, 200].
ЕОК/ЕОАГ IIaB (УУР B, УДД 2)
- АГТ, направленная на снижение риска инсульта и рекомендованная всем пациентам с ЦВБ, включает блокатор РААС в сочетании с АК или тиазидоподобным диуретиком [108, 153, 198].
ЕОК/ЕОАГ IA (УУР А, УДД 1)
Комментарии. У пациентов АГ с ЦВБ (дисциркуляторная энцефалопатия II–III степени и/или ТИА/инсульт в анамнезе, гемодинамически значимый стеноз магистральных брахиоцефальных артерий) не следует резко снижать АД, так как у части пациентов может быть плохая индивидуальная переносимость более низких уровней АД вследствие нарушения ауторегуляции сосудов головного мозга. У этих пациентов целесообразно применение этапной (ступенчатой) схемы снижения АД.
Артериальная гипертензия у пациентов с заболеванием периферических артерий
- Пациентам с АГ в сочетании с периферическим атеросклерозом, учитывая высокий риск инфаркта миокарда, инсульта, сердечной недостаточности и сердечно-сосудистой смерти, рекомендуется назначение АГТ с достижением целевого АД <140/90 мм рт. ст. [21, 22, 107, 171, 201–203].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- Всем пациентам с АГ в сочетании с атеросклерозом периферических артерий в качестве начальной терапии рекомендуется назначать комбинацию блокатора РААС и АК или диуретика [21, 22, 201, 202].
ЕОК/ЕОАГ IIaВ (УУР А, УДД 1)
- Пациентам с атеросклерозом сонных артерий рекомендуется назначать АК и блокаторы РААС, так как препараты данных групп более эффективно замедляют прогрессирование атеросклероза, чем диуретики и ББ [21, 22, 201–205].
ЕОК/ЕОАГ нет (УУР А, УДД 1)
Комментарии. На основании данных РКИ установлено, что контроль АГ замедляет прогрессирование атеросклероза сонных артерий. АК, ИАПФ и их комбинация в этом случае более эффективны, чем диуретики и ББ [204, 205]. Следует учитывать, что пациенты с каротидным атеросклерозом имеют высокий риск атероэмболического инсульта и СС осложнений, в связи с чем АГТ должна сочетаться с назначением статинов и антитромбоцитарных препаратов. Снижение АД у пациентов с двусторонним стенозом сонных артерий следует проводить осторожно, начиная с монотерапии и тщательно отслеживая побочные эффекты [21, 22].
- У пациентов с периферическим атеросклерозом рекомендуется рассмотреть возможность назначения ББ в качестве АГТ, особенно при наличии показаний к их применению для снижения выраженности симптоматики [21, 22].
ЕОК/ЕОАГ IIbC (УУР С, УДД 5)
Артериальная гипертензия у пациентов с заболеваниями легких
- Пациентам с АГ в сочетании с бронхиальной астмой (БА) и/или ХОБЛ с целью достижения целевого уровня АД в качестве стартовой АГТ не рекомедовано назначение ББ, рекомендуется назначение блокаторов РААС и АК [206–211].
ЕОК/ЕОАГ нет (УУР B, УДД 1)
Комментарии. Сочетание АГ с ХОБЛ и/или бронхиальной астмой обуславливает особенности проведения АГТ.
Пациентам с БА и/или ХОБЛ назначение петлевых и тиазидных диуретиков требует осторожности, в связи с высокой вероятностью развития гипокалиемии при их совместном применении с β2-агонистами и особенно — системными стероидами.
ББ могут стать причиной развития бронхоспазма, особенно неселективные, в связи с чем не должны рутинно назначаться пациентам с ХОБЛ и противопоказаны пациентам с БА. Ряд исследований, проведенных у ограниченного числа пациентов, показали, что применение небольших доз высокоселективных ББ не ухудшает и может даже несколько улучшать бронхиальную проходимость [210].
Применение АК у пациентов с ХОБЛ и/или БА безопасно и даже способствует снижению гиперреактивности бронхов и повышению бронходилатирующего эффекта β2-агонистов. Таким образом, наравне с изменением образа жизни (в первую очередь — отказом от курения) в качестве стартовой АГТ предопочтительно использование блокаторов РААС и АК. При недостижении целевого АД или наличии сопутствующих заболеваний с соответствующими показаниями можно рассмотреть добавление/назначение тиазидных или тиазидоподобных диуретиков и высокоселективных ББ [21, 22].
Пациенты с АГ с бронхообструктивной патологией часто применяют бронхолитические и глюкокортикостероидные (ГКС) препараты. Системное и длительное применение ГКС способствует повышению АД. При применении ингаляционных ГКС подобные эффекты незначительны.
Артериальная гипертензия и синдром обструктивного апноэ сна
- Для улучшения контроля АГ у пациентов с синдромом обструктивного апноэ во время сна (СОАС) рекомендуется применение CPAP (“сипап”) — терапии (от англ. Constant Positive Airway Pressure), заключающейся в создании непрерывного положительного давления в дыхательных путях аппаратным методом) [21].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
Комментарии. СОАС характеризуется периодическим спадением верхних дыхательных путей на уровне глотки и прекращением легочной вентиляции при сохраняющихся дыхательных усилиях во время сна с последовательным снижением насыщения кислородом крови, грубой фрагментацией сна и выраженной дневной сонливостью. При СОАС, особенно тяжелой степени (индекс апноэ/гипопноэ >30), происходит активация СНС, что приводит к повышению или недостаточному снижению АД в ночные часы, развитию эндотелиальной дисфункции, оксидативного стресса и увеличению риска развития ССО. На наличие СОАС должны быть обследованы пациенты с АГ с ожирением, резистентностью к АГТ, у которых по результатам СМАД имеется недостаточное снижение или повышение АД в ночные часы. Признаками, позволяющими заподозрить СОАС, являются: беспокойный, «неосвежающий» сон; учащенное ночное мочеиспускание; дневная сонливость; разбитость, утренние головные боли; хроническая усталость; снижение памяти и внимания; громкий, прерывистый храп; остановки дыхания во сне; увеличение массы тела и снижение потенции.
Для скрининга СОАС можно использовать опросник шкалы сонливости по Эпфорт (Epworth Sleepiness Scale) (Таблица П5, Приложение Г3), компьютерную пульсоксиметрию.
Для постановки диагноза и оценки степени тяжести СОАС проводится респираторное или кардиореспираторное мониторирование. Золотой стандарт выявления СОАС — полисомнографическое исследование.
Лечение пациентов с СОАС включает снижение веса у пациентов с ожирением, отказ от курения, приема транквилизаторов и снотворных препаратов, а также проведение мероприятий, направленных на обеспечение свободного носового дыхания. Основной метод лечения пациентов с СОАС — CPAP терапия (создание постоянного положительного давления воздуха в дыхательных путях — Continuous Positive Airways Pressure). При CPAP терапии поток нагнетаемого под давлением воздуха предотвращает спадение верхних дыхательных путей. Для СРАР терапии применяются аппараты с индивидуальными режимами вентиляции, обеспечивающими максимально эффективное их использование [212].
Артериальная гипертензия в периоперационном периоде
- При впервые выявленной АГ перед плановым хирургическим вмешательством рекомендуется провести обследование в объеме, предусмотренном п. 2 данных рекомендаций, с целью выявления ПОМ и оценки CC риска [21].
ЕОК/ЕОАГ IС (УУР C, УДД 5)
- Всем пациентам с АГ рекомендуется избегать существенных колебаний АД (более 10%) в периоперационном периоде [21, 213, 214].
ЕОК/ЕОАГ IС (УУР B, УДД 2)
Комментарии. Можно не откладывать некардиохирургическое вмешательство у пациентов с АГ 1–2-й степени (САД<180 мм рт. ст. и ДАД <110 мм рт. ст.) [21].
- Пациентам с АГ, длительно получающим ББ, рекомендуется продолжить терапию в периоперационном периоде для контроля АД. [215, 216].
ЕОК/ЕОАГ IВ (УУР А, УДД 3)
- Резкая отмена ББ или препаратов центрального действия (например, клонидина) потенциально опасна и не рекомендуется [217, 218].
ЕОК/ЕОАГ IIIВ (УУР С, УДД 4)
- Пациентам с АГ перед некардиохирургическим вмешательством для снижения риска интраоперационной гипотензии рекомендуется временная отмена блокаторов РААС [21].
ЕОК/ЕОАГ IIaC (УУР С, УДД 5)
Резистентная артериальная гипертензия
Резистентная к терапии АГ (т.е. резистентная АГ) устанавливается на основании следующих критериев:
— соблюдение мероприятий по изменению образа жизни и лечение с использованием оптимальных (или максимальных переносимых) доз трех и более лекарственных препаратов, включая ингибитор АПФ или БРА, АК и диуретик не приводит к снижению САД и ДАД до значений <140 мм рт. ст. и/или <90 мм рт. ст. соответственно;
— неадекватность контроля АД подтверждена с помощью СМАД и/или ДМАД;
— подтверждена приверженность пациента к лечению
— исключены причины псевдорезистентности и причины вторичной АГ.
Прежде чем диагностировать резистентную АГ, необходимо исключить причины псевдорезистентности:
— низкая приверженность к назначенной терапии является частой причиной псевдорезистентности, она выявляется у ≤50% пациентов, которых обследовали с помощью методов прямого мониторинга контроля приема препаратов, этот показатель прямо зависит от количества назначенных таблеток [219].
— феномен «белого халата» (при котором АД, измеренное в медицинском учреждении, повышено, но по данным СМАД или ДМАД уровень АД контролируется) встречается нередко, в связи с чем рекомендуется подтвердить наличие АГ с помощью СМАД или ДМАД до установления диагноза резистентной АГ.
— нарушение правил измерения АД в медицинском учреждении, включая использование манжеты меньшего размера, может привести к ложному выявлению повышенного АД.
— выраженный кальциноз плечевой артерии, особенно у пожилых пациентов.
— клиническая инертность, приводящая к назначению нерациональных комбинаций и неадекватных доз АГП.
Другие причины резистентной гипертензии:
— образ жизни, включая ожирение или быструю прибавку веса, чрезмерное употребление алкоголя или поваренной соли.
— применение вазопрессоров или веществ, способствующих задержке натрия, препаратов, назначенных по поводу сопутствующих заболеваний, растительных препаратов, употребление наркотиков (кокаин и т.п.) или анаболических стероидов
— СОАС
— выраженное ПОМ, особенно ХБП или жесткость крупных артерий [21, 22].
Истинная резистентная АГ встречается, не более чем в 10% случаев среди всей популяции пациентов АГ, однако в отдельных группах пациентов, например, с ХБП, ее распространенность может доходить до 30% [21,220]. Истинная резистентная АГ часто наблюдается у пациентов с ожирением, метаболическим синлромом, СД, СОАС, множественным ПОМ, при вторичных формах АГ. Тяжелое ПОМ (выраженная ГЛЖ, снижение функции почек, атеросклеротическое поражение артерий) способствует развитию резистентности к лечению.
- Всем пациентам с резистентной АГ рекомендовано усиление мероприятий по изменению образа жизни, особенно ограничение употребления соли с целью достижения целевого уровня АД [221].
ЕОК/ЕОАГ IВ (УУР В, УДД 2)
- Всем пациентам с резистентной АГ рекомендовано добавление к проводимой терапии спиронолактона** в дозах 25-50 мг/сут для достижения целевого уровня АД [137, 222, 223].
ЕОК/ЕОАГ IВ (УУР А, УДД 1)
Комментарии. При непереносимости спиронолактона рекомендовано добавление других диуретиков, включающих эплеренон, более высокие дозы тиазидных/тиазидоподобных диуретиков, или петлевые диуретики, или добавление бисопролола или доксазозина. Применение спиронолактона, эплеренона противопоказано пациентам с СКФ ≤ 30 мл/мин и концентрацией калия в плазме ≥ 5 ммоль/л из-за риска гиперкалиемии. Петлевые диуретики следует использовать вместо тиазидных/тиазидоподобных при СКФ <30 мл/мин.
Артериальная гипертензия «белого халата»
- Пациентам с АГ «белого халата» рекомендуется проводить мероприятия по изменению образа жизни, направленные на уменьшение СС риска [21, 22].
ЕОК/ЕОАГ IС (УУР А, УДД3)
- Всем пациентам с АГ «белого халата» рекомендуется проводить регулярные обследования (не менее 1 раза в 2 года) с периодическим мониторированием АД, вне медицинского учреждения [21, 22, 224–230].
ЕОК/ЕОАГ IС (УУР B, УДД 2)
Комментарии. АГ «белого халата» диагностируется при выявлении повышенного АД, измеренного в медицинском учреждении и нормальных показателей АД, измеренного вне медицинского учреждения. АГ «белого халата» может иметь место у многих людей с повышением клинического АД, особенно с АГ 1-й степени, а также у очень пожилых пациентов (>50%) [21, 22]. По сравнению со здоровыми лицами АГ «белого халата» ассоциируется с более высокой распространенностью метаболических факторов риска и ПОМ. Она также ассоциирована с более высоким риском развития сахарного диабета типа 2 и устойчивой АГ, а также с повышенным сердечно-сосудистым риском [227–230]. Различают «эффект белого халата», являющийся дополнительным прессорным ответом (реакцией) у пациента с АГ на измерение АД (реакция тревоги), чаще наблюдаемый в условиях медицинской организации.
- Для пациентов с АГ «белого халата» рекомендуется рассмотреть возможность медикаментозной антигипертензивной терапии при наличии признаков ПОМ или высоком/очень высоком СС риске (раздел 2.3, Таблица П11, Приложение Г2 и Таблица П12, Приложение Г2) [21, 22].
ЕОК/ЕОАГ IIbC (УУР C, УДД 5)
Комментарии. Для остальных пациентов с АГ «белого халата» рутинная медикаментозная терапия не рекомендована [21, 22].
«Маскированная» артериальная гипертензия
«Маскированная» гипертензия (МГ) (скрытая гипертензия) диагностируется у пациентов с нормальными показателями АД, измеренного в медицинском учреждении, но с повышенными значениями АД, измеренного вне медицинского учреждения. У таких пациентов метаболические факторы риска и ПОМ, встречается чаще, чем у пациентов с истинной нормотензией [37, 228–231]. Проблему представляет диагностика «маскированной» АГ, поскольку большинство скрининговых программ основано на использовании показателей АД, измеренного в медицинском учреждении, которое является нормальным. «Маскированная» АГ чаще встречается у молодых пациентов, чем у пожилых, а также у тех, чьи показатели клинического АД находятся в пределах значений высокого нормального АД (130–139/80–89 мм рт. ст.). Она редко встречается у лиц с показателями клинического АД <130/80 мм рт. ст. «Маскированная» АГ ассоциируется с повышением риска прогрессирования заболевания до стойкой АГ, повышенной частотой развития СД типа 2 и наличием ПОМ [21, 22]. Уровень отдаленного риска развития фатальных и нефатальных СС событий приближается к значению этого показателя у пациентов с устойчивой АГ [37, 38, 98, 232–233].
- Всем пациентам с «маскированной» АГ рекомендуются мероприятия по изменению образа жизни с целью уменьшения СС риска [21, 22].
ЕОК/ЕОАГ IС (УУР C, УДД 5)
- Всем пациентам с «маскированной» АГ рекомендуется регулярное наблюдение, включающее периодическое мониторирование показателей АД, измеренного вне медицинского учреждения [21, 22, 230, 232].
ЕОК/ЕОАГ IС (УУР C, УДД 4)
- Всем пациентам с «маскированной» АГ рекомендуется проведение антигипертензивной медикаментозной терапии, учитывая прогностическое значение высоких значений АД, измеренного вне медицинского учреждения [38, 228, 232].
ЕОК/ЕОАГ IIaC (УУР А, УДД 2)
- Пациентам с неконтролируемой «маскированной» АГ (не достигнут контроль АД, измеренного вне медицинского учреждения), получающим медикаментозное лечение, рекомендуется усиление АГТ с целью снижения СС риска [230, 232].
ЕОК/ЕОАГ IIaC (УУР А, УДД 2)
Артериальная гипертензия у молодых пациентов (<50 лет)
АГ у молодых пациентов характеризуется более высокой частотой повышения ДАД и изолированной диастолической АГ [97]. При обследовании пациентов этой возрастной группы, особенно при наличии тяжелой АГ, следует учитывать, что вероятность обнаружения вторичной гипертензии, может достигать 10% [21].
- Всем пациентам моложе 50 лет при наличии АГ 2 и 3 степени, а также АГ 1 степени в сочетании с множественными ФР, ПОМ, СД, сердечно-сосудистыми, цереброваскулярными или почечные заболеваниями следует назначать АГТ одновременно с рекомендациями по изменению образа жизни в соответствии с общими принципами[21].
ЕОК/ЕОАГ нет (УУР С, УДД 5)
Комментарии.В связи с тем, что ранее назначение АГТ может предотвратить более тяжелую АГ и развитие ПОМ в будущем, молодым пациентам с АГ 1 степени при отсутствии ФР, ПОМ и ССЗ можно обсуждать назначение АГТ наравне с изменениями образа жизни [21]. При этом целевой уровень АД составляет 120-130/70-79 мм рт. ст. (см. раздел 3.2). В случае, если принимается решение о немедикаментозной коррекции АД или пациент отказывается принимать АГТ, необходимо дать подробные рекомендации по изменению образа жизни и длительно наблюдать пациента, так как со временем АД неизбежно будет расти [21].
Артериальная гипертензия у пожилых пациентов (≥65 лет)
- У пациентов 65 лет и старше с АГ, обратившихся за медицинской помощью в учреждения амбулаторного или стационарного типа, рекомендуется проводить скрининг синдрома старческой астении с использованием опросника «Возраст не помеха» (Приложение Г3, таблица П6), поскольку выявление старческой астении может влиять на тактику АГТ и уровень целевого АД [9].
ЕОК/ЕОАГ нет (УУР А, УДД 1)
- Пациентам >65 лет с АГ рекомендуется назначение антигипертензивной терапии с использованием любого из основных классов АГП [238, 239].
ЕОК/ЕОАГ нет (УУР В, УДД 1)
Комментарии. Пациенты старше 65 лет должны получать АГТ в соответствии с общим алгоритмом, приведенном в Приложении Б2. У пациентов очень пожилого возраста (>80 лет) может быть целесообразно начинать лечение с монотерапии. У всех пожилых пациентов комбинированную терапию следует начинать с минимальных доз препаратов. При отсутствии дополнительных показаний следует избегать назначения петлевых диуретиков и альфа-адреноблокаторов, так как они увеличивают риск падений [240, 241]. При лечении пожилых пациентов целевое АД составляет 130-139/70-79 мм рт. ст. при переносимости [21].
До назначения и в процессе приема АГТ необходим тщательный мониторинг функции почек для выявления ее возможного ухудшения вследствие АД-обусловленного снижения почечной перфузии. Всех пациентов 65 лет и старше, особенно старше 80 лет, и пациентов со старческой астенией необходимо тщательно наблюдать на предмет возможного развития ортостатической гипотензии (при необходимости — использовать СМАД) и мониторировать переносимость и развитие возможных побочных эффектов [21]. Не рекомендуется отмена медикаментозной АГТ на основании возраста, даже при достижении 80 лет, при условии, что лечение хорошо переносится.
При лечении пациентов 65 лет и старше необходимо учитывать методические рекомендации МР 103 «Фармакотерапия у пациентов пожилого и старческого возраста».
Изолированная систолическая артериальная гипертензия
Изолированная систолическая АГ: повышение САД ≥140 мм рт. ст. при ДАД <90 мм рт. ст.
Наиболее распространена у пожилых пациентов (до 29,4%), может встречаться и у пациентов молодого (1,8% среди пациентов 18–39 лет) и среднего возраста (6% среди пациентов 40–60 лет) [242, 243]. В основе развития ИСАГ лежат артериолосклероз и повышение артериальной ригидности, эндотелиальная дисфункция, провоспалительная активность, кальцификация эластина. Наблюдается у пожилых, пациентов с СД, ХБП, остеопорозом с кальцификацией сосудов [244]. ИСАГ независимо ассоциирована с риском неблагоприятных СС исходов и смертности [245, 246].
Пороговым значением САД для начала АГТ является ≥140 мм рт. ст. Лечение пациентов с ИСАГ проводят в соответствии с алгоритмом антигипертензивной терапии, при этом необходимо ориентироваться на уровень САД, а нормальное значение ДАД не должно препятствовать назначению оптимального лечения для достижения целевого САД [21, 31].
Помимо истинной ИСАГ, у некоторых молодых здоровых людей, чаще у мужчин, может выявляться ложная ИСАГ 1-й степени, сопровождающаяся нормальными показателями центрального САД за счет чрезмерной амплификации периферического САД [247]. Показано, что у молодых пациентов с ИСАГ сердечно-сосудистый риск аналогичен риску пациентов с высоким нормальным АД, причем, риск развития ИСАГ ассоциирован с курением [248].
На основании имеющихся данных молодым пациентам с изолированной систолической АГ 1-й степени следует рекомендовать мероприятия по изменению образа жизни (особенно прекращение курения); необходимость назначения АГТ на настоящий момент не доказана; показано длительное наблюдение, поскольку у многих из них в дальнейшем возможно развитие стойкой АГ [21].
Артериальная гипертензия при беременности и лактации
Выделяют следующие клинические варианты АГ при беременности [21]:
— АГ, развившаяся до беременности (хроническая АГ — ХАГ) — АГ, определяемая до беременности или проявившаяся до 20 нед. беременности и персистирующая более 6 недель после родов. АГ, диагностированная после 20-й недели гестации и не исчезнувшая в течение 6 недель после родов, также классифицируется как существовавшая ранее АГ, но уже ретроспективно;
— Гестационная артериальная гипертензия (ГАГ) — состояние, индуцированное беременностью и проявляющееся повышением АД ≥140/90 мм рт. ст. впервые после 20 нед., со спонтанной нормализацией АД в течение 6 нед. после родов АД;
— Преэклампсия (ПЭ) — гестационная АГ с протеинурией >300 мг/сут или альбумин/креатинин в разовой порции мочи >30 мг/ммоль, в ряде случаев с проявлениями полиорганной недостаточности.
— ХАГ, осложненная преэклампсией.
- Беременным женщинам, имеющим ФР, ПОМ, СД или поражение почек, рекомендуется проведение СМАД для подтверждения АГ [43, 228].
ЕОК/ЕОАГ нет (УУР B, УДД 1)
- Женщинам с гестационной АГ, преэклампсией или хронической АГ, сопровождающейся субклиническим ПОМ, рекомендуется начинать лекарственную терапию при САД ≥140 мм рт. ст. или ДАД ≥90 мм рт. ст. с целью снижения СС риска [21, 22].
ЕОК/ЕОАГ IС (УУР C, УДД 5)
- Беременным женщинам с повышением АД без наличия признаков ПОМ, преэклампсии и АКС с целью снижения СС риска начало лекарственной терапии рекомендуется при САД ≥150 мм рт. ст. или ДАД ≥95 мм рт. ст. [21, 22].
ЕОК/ЕОАГ IС (УУР C, УДД 5)
Комментарии. Цель лечения беременных с АГ — предупредить развитие осложнений, обусловленных высоким уровнем АД, обеспечить сохранение беременности, нормальное развитие плода и успешные роды. Целевой уровень АД для беременных <140/90 мм рт. ст. Следует не допускать развития эпизодов гипотонии, чтобы не ухудшить плацентарный кровоток.
- Беременных женщин с САД ≥ 170 и ДАД ≥ 110 мм рт. ст. рекомендуется срочно госпитализировать и расценивать данное состояние как гипертонический криз [21, 22].
ЕОК/ЕОАГ IС (УУР C, УДД 5)
Комментарии. Главное правило при лечении гипертонического криза (ГК)у беременных — контролируемое снижение САД до <160 И ДАД до <105 мм рт. ст. Для пероральной терапии следует использовать метилдопу или нифедипин замедленного высвобождения. Для лечения преэклампсии с отеком легких препаратом выбора является нитроглицерин, длительность его применения не должна составлять более 4 часов, из-за отрицательного воздействия на плод и риска развития отека мозга у матери. Применение диуретиков не показано, т.к. при преэклампсии уменьшается объем циркулирующей крови. Для предотвращения эклампсии и лечения судорог рекомендовано в/в введение сульфата магния.
- Женщинам с высоким риском преэклампсии с целью ее профилактики рекомендуется назначать малые дозы (150 мг) аспирина с 12-й недели беременности и до 36-й недели, при условии низкого риска желудочно-кишечных кровотечений [236].
ЕОК IA (УУР В, УДД 2)
Комментарии. Высокий риск преэклампсии отмечается у женщин с АГ во время предыдущей беременности, ХБП, аутоиммунными заболеваниями (системной красной волчанкой или антифосфолипидным синдромом), СД 1-го или 2-го типа, хронической АГ; к умеренному — первая беременность, возраст ≥40 лет, интервал между беременностями более 10 лет, ИМТ ≥35 кг/ м2 на первом визите, семейный анамнез преэклампсии и многоплодная беременность.
- Беременным женщинам с АГ в качестве АГТ с целью контроля уровня АД рекомендуется назначение лекарственных препаратов с замедленным высвобождением лекарственного вещества (метилдопа**) [237, 250].
ЕОК/ЕОАГ IB (УУР А, УДД 2)
- Беременным женщинам с АГ в качестве АГТ с целью контроля уровня АД рекомендуется назначение лекарственных препаратов с замедленным высвобождением лекарственного вещества (нифедипин**) [237, 250].
ЕОК/ЕОАГ IC (УУР А, УДД 2)
Комментарии
. Резервными препаратами для плановой АГТ у беременных женщин с АГ являются верапамил и бисопролол. АГТ должна быть продолжена в течение 12 недель после родов, особенно у женщин с ПЭ и при рождении недоношенных детей. Можно использовать любые классы АГП, согласно алгоритму АГТ, с рациональным выбором препаратов при лактации и учитывая то, что метилдопа не рекомендована к назначению в связи с повышением риска послеродовой депрессии.
- Не рекомендовано назначение ИАПФ, БРА и прямых ингибиторов ренина при беременности в связи с риском развития врожденных уродств и гибели плода [237, 250, 251].
ЕОК/ЕОАГ IIIC (УУР C, УДД 5)
- Женщинам с АГ в репродуктивном возрасте с риском наступления незапланированной беременности не рекомендуется назначение блокаторов РААС в связи с риском развития врожденных уродств и гибели плода [21, 22, 237, 251].
ЕОК/ЕОАГ IIIC (УУР C, УДД 4)
Препараты для оральной контрацепции и заместительной гормональной терапии и артериальная гипертензия
- Не рекомендуется применять оральные контрацептивы (ОК) женщинам с неконтролируемой АГ [252, 253].
ЕОК/ЕОАГ нет (УУР B, УДД 3)
Комментарии. Комбинированные пероральные контрацептивные препараты, содержащие эстрогены и прогестины, могут приводить к повышению АД и развитию АГ приблизительно у 5% пациенток [254, 255]. При назначении оральных контрацептивов (ОК) следует оценивать риски и преимущества, наличие сопутствующих факторов СС риска (особенно курения) у конкретной пациентки. Необходимо тщательно контролировать уровень АД [256, 257]. Отмена ОК может улучшить контроль АД у женщин с АГ [252]. Прием ОК женщинами с АГ диктует необходимость их тщательного выбора и начала приема после сопоставления риска и пользы индивидуально у каждой пациентки.
Заместительная гормональная терапия не противопоказана женщинам с АГ при условии контроля АД с помощью АГП [21]. Не рекомендуется назначение гормональной заместительной терапии и селективных модуляторов рецепторов к эстрогенам с целью первичной или вторичной профилактики ССЗ.
Артериальная гипертензия и эректильная дисфункция
- Всем пациентам с АГ и наличием эректильной дисфункции (ЭД) для коррекции эндотелиальной дисфункции рекомендовано назначение ингибиторов фосфодиэстеразы-5, даже тем из них, которые получают несколько АГП (за исключением альфа-адреноблокаторов и нитратов в связи с опасностью ортостатической гипотонии) [258, 259].
ЕОК/ЕОАГ нет (УУР B, УДД 2)
Комментарии.ЭД у мужчин с АГ встречается чаще, чем у лиц с нормальным АД. ЭД считается независимым ФР сердечно-сосудистых событий и смертности, ассоциированным с ПОМ. Сбор анамнеза у пациентов АГ должен включать оценку половой функции. Изменение (оздоровление) образа жизни может уменьшить степень ЭД. Современные препараты (БРА, ИАПФ, АК и вазодилатирующие ББ) не влияют на эректильную функцию. Адекватный контроль АГ способствует ее улучшению.
Артериальная гипертензия и противоопухолевая терапия
АГ является наиболее частым сопутствующим ССЗ по данным онкологических регистров, при этом повышение АД выявляется более чем у трети пациентов [260]. Это может быть связано с высокой распространенностью АГ в той возрастной категории, в которой наиболее часто встречаются и онкологические заболевания. Однако это также обусловлено прессорным эффектом двух групп широко используемых противоопухолевых препаратов: ингибиторов фактора роста эндотелия сосудов (бевацизумаб, сорафениб, сунитиниб и пазопаниб) и ингибиторов протеасом (карфизомиб [261]).
Повышение АД выявлялось у большого числа пациентов (≤30%), получающих терапию вышеописанными противоопухолевыми препаратами. Этот эффект часто наблюдается в течение первого месяца после начала лечения.
- Рекомендовано контролировать офисное АД еженедельно в течение первого цикла терапии ингибиторами фактора роста эндотелия сосудов (бевацизумаб, сорафениб, сунитиниб и пазопаниб) или ингибиторами протеасом (карфизомиб) у пациентов со злокачественными новообразованиями и каждые 2–3 нед. в дальнейшем [262]. После завершения первого цикла лечения, при условии стабильных значений АД, его следует измерять во время рутинных посещений врача или с помощью ДМАД.
ЕОК/ЕОАГ нет (УУР С, УДД 5)
- В случае развития АГ (≥140/90 мм рт. ст.) или повышения ДАД на ≥20 мм рт. ст. по сравнению с исходным уровнем на фоне терапии ингибиторами фактора роста эндотелия сосудов (бевацизумаб, сорафениб, сунитиниб и пазопаниб) или ингибиторами протеасом (карфизомиб) у пациентов рекомендовано начать или оптимизировать антигипертензивную терапию. Предпочтительными являются блокаторы РААС и дигидропиридиновые АК[263, 264].
ЕОК/ЕОАГ нет (УУР С, УДД 5)
Комментарии
: Хотя противоопухолевая терапия имеет очевидный приоритет, следует рассмотреть возможность ее прерывания в случаях чрезмерно высоких показателей АД, несмотря на многокомпонентную терапию, при наличии симптомов, обусловленных АГ, или при развитии ССС, требующего немедленного снижения АД [263, 264].
Коррекция сопутствующих факторов сердечно-сосудистого риска
- Пациентам с АГ и очень высоким или экстремальным СС риском рекомендовано назначение статинов для достижения целевого ХС-ЛНП ≤1,4 ммоль/л или его снижение на ≥50% от исходного [265–267].
ЕОК/ЕОАГ IВ (УУР А, УДД 1)
- Пациентам с АГ и высоким СС риском рекомендовано назначение статинов для достижения целевого ХС-ЛНП ≤1,8 ммоль/л или его снижение на ≥50% от исходного [266, 267].
ЕОК/ЕОАГ IВ (УУР А, УДД 1)
Комментарии. У пациентов с низким риском можно рассмотреть назначение статинов для достижения целевого ХС-ЛНП ≤3,0 ммоль/л. У пациентов с умеренным риском можно рассмотреть назначение статинов для достижения целевого ХС-ЛНП ≤2,6 ммоль/л.
- Пациентам с АГ с целью вторичной профилактики СС событий рекомендуется назначение ацетилсалициловой кислоты в низких дозах [268].
ЕОК/ЕОАГ IА (УУР А, УДД 1)
- Пациентам с АГ не рекомендуется назначение ацетилсалициловой кислоты с целью первичной профилактики при отсутствии ССЗ в связи с недоказанными преимуществами данного вмешательства в отношении снижения СС риска [268].
ЕОК/ЕОАГ IIIA (УУР A, УДД 1)
Неотложные состояния при артериальной гипертензии: гипертонический криз
Гипертонический криз (ГК) — cостояние, при котором значительное повышение АД (до 3 степени) ассоциируется с острым поражением органов-мишеней, нередко жизнеугрожающим, требующее немедленных квалифицированных действий, направленных на снижение АД, обычно с помощью внутривенной терапии [269]. При определении тяжести поражения органов скорость и степень повышения АД могут быть так же важны, как и абсолютный уровень АД [270]. Можно выделить следующие типичные проявления гипертонических кризов:
— Пациенты со злокачественной АГ: тяжелая АГ (чаще 3-й степени) ассоциируется с изменениями на глазном дне (кровоизлияния и/или отек соска зрительного нерва), микроангиопатией и диссеминированным внутрисусосудистым свертыванием. Может приводить к энцефалопатии (примерно в 15% случаев) [271], ОСН, острому ухудшению функции почек [272–275].
— Пациенты с тяжелой АГ, ассоциированной с другими клиническими состояниями, требующими неотложного снижения АД: расслоение аорты, острая ишемия миокарда, ОСН
— Пациенты с внезапным повышением АД на фоне феохромоцитомы, ассоциированным с ПОМ
— Беременные с тяжелой АГ или преэклампсией.
Ранее использовавшийся термин «неосложненный гипертонический криз», описывавший пациентов со значительным повышением АД, но без признаков острых изменений в органах-мишенях [276], в настоящее время не рекомендован к использованию. В данной группе пациентов снижение АД обычно может проводиться в амбулаторных условиях, чаще всего путем назначения пероральной терапии в соответствии со стандартным алгоритмом, представленным выше. У этих пациентов необходимо проводить строгий контроль цифр АД до достижения целевых значений.
- Лечение пациентов с ГК рекомендуется проводить в отделении неотложной кардиологии или палате интенсивной терапии [22].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
Комментарии. При наличии инсульта целесообразна безотлагательная госпитализация в палату интенсивной терапии неврологического отделения или нейрореанимацию сосудистого центра.
- Осмотр врачом-терапевтом или врачом-кардиологом рекомендуется проводить не позднее 10 минут от момента поступления в стационар [22].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
- ЭКГ рекомендуется проводить при ГК не позднее 15 минут от момента поступления в стационар [22].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
Комментарии. Рутинное обследование при всех возможных вариантах криза включает фундоскопию, ЭКГ, общий анализ крови, определение фибриногена, креатинина, рСКФ, электролитов, ЛДГ, гаптоглобин, оценку альбуминурии и микроскопию осадка мочи, тест на беременность у женщин детородного возраста. Специфическое обследование по показаниям может включать определение тропонина, МВ-КФК, НУП, рентгенографию органов грудной клетки, ЭХО-КГ, КТ-ангиографию аорты и ее ветвей, КТ или МРТ головного мозга, УЗИ почек, исследование мочи на наркотики (метамфетамины, кокаин) [269].
- При ГК терапию антигипертензивными лекарственными препаратами внутривенно рекомендуется проводить не позднее 15 минут от момента поступления в стационар [22, 278].
ЕОК/ЕОАГ нет (УУР A, УДД 1)
Комментарии. При лечении гипертонического криза для своевременной коррекции терапии в соответствии с изменениями АД оптимальным представляется в/в назначение препарата с коротким периодом полувыведения. Быстрое неконтролируемое снижение АД не рекомендовано, так как может привести к осложнениям [277].
У пациентов со злокачественной АГ можно рассмотреть осторожное пероральное назначение иАПФ, БРА или ББ, так как почечная ишемия приводит к активации РААС. Лечение следует начинать с очень низких доз в условиях стационара, поскольку такие пациенты могут быть очень чувствительны к данным препаратам.
Для лечения ГК используются следующие парентеральные препараты:
— Вазодилататоры:
o нитроглицерин (предпочтителен при ОКС и острой левожелудочковой недостаточности);
o нитропруссид натрия (является препаратом выбора при острой гипертонической энцефалопатии).
— ИАПФ: эналаприлат (предпочтителен при острой левожелудочковой недостаточности);
— ББ (метопролол предпочтителен при расслаивающей аневризме аорты и ОКС);
— диуретики (фуросемид при острой левожелудочковой недостаточности);
— альфа-адреноблокаторы (урапидил);
— нейролептики (дроперидол).
- В остром периоде инсульта вопрос о необходимости снижения АД и его оптимальной величине рекомендуется решать совместно с врачом-неврологом, индивидуально для каждого пациента [22].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
Комментарии. Пациенты с инсультом требуют особого подхода, т.к. избыточное и/или быстрое снижение АД может привести к нарастанию ишемии головного мозга.
- В большинстве других случаев врачам рекомендуется обеспечить быстрое, но не более чем на 25% от исходных значений, снижение АД за первые 2 часа от момента поступления в стационар [22].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
Комментарии. Рекомендуются следующие сроки и выраженность снижения АД [270, 278]:
— У пациентов со злокачественной АГ с или без почечной недостаточности среднее давление должно быть снижено на 20–25% от исходного в течение нескольких часов
— У пациентов с гипертонической энцефалопатией рекомендовано немедленное снижение среднего АД на 20–25% от исходного
— У пациентов с ОКС рекомендовано немедленное снижение САД ниже 140 мм рт. ст.
— У пациентов с кардиогенным отеком легких рекомендовано немедленное снижение САД ниже 140 мм рт. ст.
— У пациентов с расслоением аорты рекомендовано немедленное снижение САД ниже 120 мм рт. ст. и ЧСС ниже 60 уд/мин.
— У пациенток с эклампсией и тяжелой преэклампсией или HELLP-синдромом рекомендовано немедленное снижение САД ниже 160 мм рт. ст. и ДАД ниже 105 мм рт. ст.
Пациенты с ГК являются группой высокого риска [279, 280] и должны быть скринированы на наличие вторичной АГ. Выписка из стационара осуществляется при достижении безопасного стабильного уровня АД на фоне перорального приема препаратов. Наблюдение в амбулаторных условиях следует проводить хотя бы раз в месяц до достижения целевого АД. Далее рекомендуется длительное регулярное наблюдение специалистом.
Медицинская реабилитация
Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
- Для всех пациентов с АГ рекомендована разработка индивидуального плана реабилитационных мероприятий, включающий в себя рекомендации по достижению целевого АД, самоконтролю АД, повышению приверженности к лечению, питанию, физической активности, контролю веса [287].
ЕОК/ЕОАГ нет (УУР B, УДД 2)
- С целью снижения риска сердечно-сосудистых осложнений всем пациентам с АГ рекомендованы, по крайней мере, 150 мин (2 часа 30 мин) в неделю аэробной физической активности умеренной интенсивности или 75 мин (1 час 15 мин) в неделю аэробной физической активности высокой интенсивности [281, 300-301].
ЕОК/ЕОАГ нет (УУР B, УДД 1)
Комментарии. Умеренная физическая нагрузка — это такая нагрузка, которую можно выдержать в течение 1 часа, а интенсивная физическая нагрузка та, при которой через 30 минут появляется усталость [281]. Во время проведения физических нагрузок обязателен контроль АД.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Динамическое наблюдение — чрезвычайно важная составляющая медицинской помощи пациентам с АГ, задачами которого являются: поддержание целевых уровней АД, контроль выполнения врачебных рекомендаций по коррекции ФР, контроль за соблюдением режима приема АГП, оценка состояния органов-мишеней.
При стабильном течении АГ приемлемой альтернативой визитам в медицинское учреждение могут быть ДМАД [292, 294–296].
Все рекомендации, даваемые пациенту, должны быть ясными, четкими и соответствовать его интеллектуальному уровню.
С целью обеспечить осознанное участие пациента в лечебно-профилактическом процессе и повысить эффективность лечения целесообразно для ряда пациентов, для которых устных рекомендаций недостаточно, продублировать их в письменном виде.
- Всем пациентам с высоким нормальным АД (130–139/85–89 мм рт. ст.) рекомендуется изменение образа жизни [21, 22, 98].
ЕОК/ЕОАГ IА (УУР C, УДД 5)
- Рекомендуется всем пациентам с АГ в рамках диспансерного наблюдения проводить оценку факторов риска и ПОМ не реже, чем 1 раз в год [21].
ЕОК/ЕОАГ нет (УУР 5, УДД С)
Комментарии. У пациентов с высоким нормальным АД или АГ «белого халата» нередко выявляются дополнительные факторы риска, ПОМ, а также высокий риск развития устойчивой АГ [282–286], поэтому даже при отсутствии лечения пациентов необходимо регулярно наблюдать (по крайней мере, ежегодно) для оценки клинического АД, АД, измеренного вне медицинского учреждения и СС риска. При ежегодных визитах следует обращать внимание на рекомендации по изменению образа жизни, которые являются методом адекватной терапии таких пациентов.
- Всем пациентам с АГ, которым была назначена АГТ, рекомендуется проводить плановые визиты к врачу для оценки переносимости, эффективности и безопасности лечения, а также контроля выполнения врачебных рекомендаций [21, 289, 290].
ЕОК/ЕОАГ нет (УУР B, УДД 1)
Комментарии. Визиты проводятся с интервалом в 3–4 недели до достижения целевого уровня АД (при отсутствии других причин более частых визитов). Целевое АД должно быть достигнуто в течение 3 месяцев.
- Всем пациентам с АГ, принимающим АГТ, при ее недостаточной эффективности рекомендуется производить замену ранее назначенного АГП или присоединять другой АГП. При отсутствии эффективного снижения АД на фоне 2-компонентной терапии рекомендуется присоединение третьего препарата (одним из трех препаратов, как правило, должен быть диуретик) с обязательным последующим контролем эффективности, безопасности и переносимости комбинированной терапии [21].
ЕОК/ЕОАГ нет (УУР C, УДД 5)
Комментарии. Целевые уровни АД являются рекомендованными для достижения в каждой подгруппе пациентов, но важнейшим принципом их достижения является соблюдение безопасности и сохранения качества жизни пациента. Поэтому скорость достижения целевых значений и степень снижения АД могут быть скорректированы у конкретного пациента в зависимости от конкретной клинической ситуации. При этом плохая переносимость снижения АД может быть основанием для более медленной титрации доз и числа назначаемых препаратов, равно как и при хорошей переносимости АД может быть снижено до более низких значений, чем рекомендовано в среднем. Недостижение целевого АД в указанные сроки не является ошибочным, если это продиктовано клинической необходимостью. Если врач считает, что препятствием к достижению целевого АД является плохая приверженность пациента, это должно находить отражение в медицинской документации и должны быть предприняты и зафиксированы меры по повышению приверженности. В этих случаях недостижение целевого уровня не должно считаться дефектом оказания помощи.
- Пациентам с высоким и очень высоким сердечно-сосудистым риском (таблица П10, Приложение Г2 и таблица П12, Приложение Г2), а также для пациентов, получающих только немедикаментозное лечение, и для лиц с низкой приверженностью к лечению после достижения целевого уровня АД на фоне проводимой терапии последующие визиты к врачу рекомендуется проводить не реже, чем один раз в 3 месяца; визиты для пациентов со средним и низким риском, которые регулярно измеряют АД дома, рекомендуется проводить с интервалом в 4–6 месяцев [288].
ЕОК/ЕОАГ нет (УУР С, УДД 2)
- Пациентам с АГ для повышения приверженности к проводимой АГТ рекомендуется проведение ДМАД и ведение дневников с указанием доз принимаемых препаратов и уровня АД [21, 289, 290].
ЕОК/ЕОАГ нет (УУР B, УДД 1)
- Пациентам с АГ для повышения эффективности и приверженности к проводимой АГТ рекомендуется проведение телемониторинга показателей системной гемодинамики с телеметрической передачей результатов измерения АД непосредственно в лечебное учреждение для оперативной обработки информации и оперативного принятия решения [291–293].
ЕОК/ЕОАГ нет (УУР В, УДД 1)
- Рекомендуется при динамическом наблюдении особое внимание уделять показателям АД в ночные часы (особенно у пациентов с метаболическим синдромом (МС), сахарным диабетом (СД), синдромом обструктивного апноэ во время сна (СОАС), хронической болезнью почек (ХБП) 3–5-й ст.) и ранние утренние часы с целью снижения риска таких осложнений, как ИМ, инсульт [21, 34, 35].
ЕОК/ЕОАГ нет (УУР В, УДД 2)
Информация
Источники и литература
-
Клинические рекомендации Российского кардиологического общества
- 1. Rosenberg WM, Gray JA et al. Evidence based medicine: what it is and what it isn’t. BMJ 1996, January; 312 (7023): 71–72. 2. Федеральный закон от 21.11.2011 № 323-ФЗ (ред. от 03.04.2017) «Об основах охраны здоровья граждан в Российской Федерации». 3. Эпидемиологический словарь, 4-е издание. Под ред. Джона М. Ласта для Международной эпидемиологической ассоциации. М., 2009. 316 с.
4. Федеральное агентство по техническому регулированию и метрологии. Национальный стандарт Российской Федерации. ГОСТР 52379-2005. Надлежащая клиническая практика. Москва, 2005 5. Федеральный закон от 12.04.2010 № 61-ФЗ (ред. от 03.07.2016) «Об обращении лекарственных средств».
6. Jansen RW, Lipsitz LA. Postprandial hypotension: epidemiology, pathophysiology, and clinical management. Ann Int Med 1995;122(4):286–295. 7. Малая медицинская энциклопедия. М.: Медицинская энциклопедия, 1991—96 гг. [Электронный ресурс]. Режим доступа:http://dic.academic.ru/dic.nsf/enc_medicine/28878/Синдром 8. Андреева Н. С., Реброва О. Ю., Зорин Н. А. и др. Системы оценки достоверности научных доказательств и убедительности рекомендаций: сравнительная характеристика и перспективы унификации. Медицинские технологии. Оценка и выбор. 2012. №. 4. С. 10–24.
9. Общероссийская общественная организация «Российская ассоциация геронтологов и гериатров». Клинические рекомендации «Старческая астения». 2018. 10. Rapsomaniki E et al. Blood pressure and incidence of twelve cardiovascular diseases: lifetime risks, healthy life-years lost, and age-specific associations in 1• 25 million people. The Lancet 383.9932 (2014):1899–1911. 11. Ehret GB, Caulfield MJ. Genes for blood pressure: an opportunity to understand hypertension. Eur Heart J 2013;34:951–961. 12. Elliott P, Stamler J, Nichols R, et al. Intersalt revisited: further analyses of 24 hour sodium excretion and blood . pressure within and across populations. Intersalt Cooperative Research Group. . BMJ 1996;312:1249–1253. 13. Кушаковский М. С. Эссенциальная гипертензия (гипертоническая болезнь). Причины, механизмы, клиника, лечение. СПб., 2002. 14. Ланг Г. Ф. Гипертоническая болезнь. М.: Медгиз, 1950. 459 с. 15. Постнов Ю. В., Орлов С. Н. Первичная гипертензия как патология клеточных мембран. М.: Медицина, 1987. 192 с. 16. Мясников А. Л. Гипертоническая болезнь. М.: Медгиз, 1954. 17. Распространенность факторов риска неинфекционных заболеваний в российской популяции в 2012–2013 гг. Результаты исследования ЭССЕ-РФ. Кардиоваскулярная терапия и профилактика 2014; 13(6):4–11. 18. Бойцов С. А., Баланова Ю. А., Шальнова С. А., Деев А. Д. и др. Артериальная гипертония среди лиц 25–64 лет: распространенность, осведомленность, лечение и контроль. По материалам исследования ЭССЕ. Кардиоваскулярная терапия и профилактика. 2014;4:4-14.do1.org/10.15829/1728-8800-2014-4-4-14. 19. Kearney PM, Whelton M, Reynolds K, et al. Global burden of hypertension: analysis of worldwide data. Lancet 2005;365:217–223. 20. Franklin SS, Lopez VA, Wong ND, et al. Single versus combined blood pressure components and risk for cardiovascular disease: the Framingham Heart Study. Circulation 2009;119:243–250. 21. Williams B, Mancia G, Spiering W et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension. JHypertens 2018;36(10):1953–2041.
22. Чазова И. Е., Жернакова Ю. В. [от имени экспертов]. Клинические рекомендации. Диагностика и лечение артериальной гипертонии. Системные гипертензии. 2019;16 (1):6–31. 23. Lewington S, Clarke R, Qizilbash N et al. Age-specific relevance of usual blood pressure to vascular mortality: a meta-analysis of individual data for one million adults in 61 prospective studies. Lancet 2002;360:1903–1913. 24. Lip GYH, Coca A, Kahan T, et al. Hypertension and cardiac arrhythmias: executive summary of a consensus document from the European Heart Rhythm Association (EHRA) and ESC Council on Hypertension, endorsed by the Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS), and Sociedad Latinoamericana de Estimulacion Cardiaca y Electrofisiologia (SOLEACE). Eur Heart J Cardiovasc Pharmacother 2017;3:235–250. 25. Gottesman RF, Albert MS, Alonso A, et al. Associations between midlife vascular risk factors and 25-year incident dementia in the Atherosclerosis Risk in Communities (ARIC) cohort. JAMA Neurol 2017;74:1246–1254. 26. Rovio SP, Pahkala K, Nevalainen J et al. Cardiovascular risk factors from childhood and midlife cognitive performance: the Young Finns study. J Am Coll Cardiol 2017;69:2279–2289. 27. Vishram JK, Borglykke A, Andreasen AH, et al, MORGAM Project. Impact of age on the importance of systolic and diastolic blood pressures for stroke risk: the MOnica, Risk, Genetics, Archiving, and Monograph (MORGAM) project. Hypertension 2012;60:1117–1123. 28. Brown DW, Giles WH, Greenlund KJ. Blood pressure parameters and risk of fatal stroke, NHANES II mortality study. Am J Hypertens 2007;20:338–341. 29. Franklin SS, Khan SA, Wong ND, et al. Is pulse pressure useful in predicting risk for coronary heart disease? The Framingham heart study. Circulation 1999;100:354–360. 30. Domanski M, Mitchell G, Pfeffer M, Neaton JD, Norman J, Svendsen K, Grimm R, Cohen J, Stamler J, MRFIT Research Group. Pulse pressure and cardiovascular disease-related mortality: follow-up study of the Multiple Risk Factor Intervention Trial (MRFIT). JAMA 2002;287:2677–2683. 31. Кобалава Ж. Д., Конради А. О., Недогода С. В. и др. Меморандум экспертов Российского кардиологического общества по рекомендациям Европейского общества кардиологов/Европейского общества по артериальной гипертензии по лечению артериальной гипертензии 2018 г. Российский кардиологический журнал. 2018;(12):131–42. 32. Lewington S, Clarke R, Qizilbash N, et al. Age-specific relevance of usual blood pressure to vascular mortality: a meta-analysis of individual data for one million adults in 61 prospective studies. Lancet 2002; 360:1903–1913.
33. Reino-Gonzalez S. et al. How in-office and ambulatory BP monitoring compare: A systematic review and meta-analysis. – 2017. 34. Kollias A., Ntineri A., Stergiou G. S. Association of night-time home blood pressure with night-time ambulatory blood pressure and target-organ damage: a systematic review and meta-analysis //Journal of hypertension. – 2017. – Т. 35. – №. 3. – С. 442-452. 35. Fagard RH, Celis H, Thijs L, et al. Daytime and night-time blood pressure as predictors of death and cause-specific cardiovascular events in hypertension. Hypertension 2008; 51:55–61. 36. Ward AM, Takahashi O, Stevens R, Heneghan C. Home measurement of blood pressure and cardiovascular disease: systematic review and meta-analysis of prospective studies. J Hypertens 2012; 30:449–456. 37. Mancia G, Facchetti R, Bombelli M, et al. Long-term risk of mortality associated with selective and combined elevation in office, home and ambulatory blood pressure. Hypertension 2006; 47:846–853. 38. Fagard RH, Cornelissen VA. Incidence of cardiovascular events in white-coat, masked and sustained hypertension vs. true normotension: a meta-analysis. J Hypertens 2007; 25:2193–219. 39. Rimoldi SF, Scherrer U, Messerli FH. Secondary arterial hypertension: when, who, and how to screen? Eur Heart J 2014;35:1245–1254. 40. Albasri A. et al. A comparison of blood pressure in community pharmacies with ambulatory, home and general practitioner office readings: systematic review and meta-analysis //Journal of hypertension. – 2017. – Т. 35. – №. 10. – С. 1919. 41. Clark CE, Taylor RS, Shore AC, et al. Association of a difference in systolic blood pressure between arms with vascular disease and mortality: a systematic review and meta-analysis. Lancet 2012;379:905–914. 42. Sega R, Facchetti R, Bombelli M, et al.Prognostic value of ambulatory and home blood pressures compared with office blood pressure in the general population: follow-up results from the Pressioni Arteriose Monitorate e Loro Associazioni (PAMELA) study. Circulation 2005;111:1777–1783. 43. Shi Y. et al. Resting heart rate and the risk of hypertension and heart failure: a dose–response meta-analysis of prospective studies //Journal of hypertension. – 2018. – Т. 36. – №. 5. – С. 995-1004. 44. Salles GF, Reboldi G, Fagard RH, et al. Prognostic effect of the nocturnal blood pressure fall in hypertensive patients: the Ambulatory Blood pressure Collaboration in patients with Hypertension (ABC-H) meta-analysis. Hypertension 2016;67:693–700.
45. Ward AM, Takahashi O, Stevens R, Heneghan C. Home measurement of blood pressure and cardiovascular disease: systematic review and meta-analysis of prospective studies. J Hypertens 2012;30:449–56. 46. Tucker KL, Sheppard JP, Stevens R et al. Self-monitoring of blood pressure in hypertension: a systematic review and individual patient data meta-analysis. PLoS Med 2017;14:e1002389. 47. Parati G, Stergiou G, O’Brien E, et al, European Society of Hypertension Working Group on Blood Pressure Monitoring and Cardiovascular Variability. European Society of Hypertension practice guidelines for ambulatory blood pressure monitoring. J Hypertens 2014;32:1359–1366. 48. Sehestedt T, Jeppesen J, Hansen TW, et al. Risk prediction is improved by adding markers of subclinical organ damage to SCORE. Eur Heart J 2010;31:883–891. 49. Volpe M, Battistoni A, Tocci G, et al. Cardiovascular risk assessment beyond systemic coronary risk estimation: a role for organ damage markers. J Hypertens 2012;30:1056–1064. 50. Conroy, R. M., et al. Estimation of ten-year risk of fatal cardiovascular disease in Europe: the SCORE project. European heart journal 24.11 (2003): 987–1003. 51. Hunt SC, Williams RR, Barlow GK. A comparison of positive family history definitions for defining risk of future disease. J Chronic Dis 1986; 39:809–821. 52. Friedman GD, Selby JV, Quesenberry CP Jr, et al Precursors of essential hypertension: body weight, alcohol and salt use and parental history of hypertension. Prev Med 1988;17:387–402. 53. Дедов И. И. и др. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Сахарный диабет 1S (2019). 54. Cosentino F, Grant P, Aboyans V et al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD: The Task Force for diabetes, pre-diabetes, and cardiovascular diseases of the European Society of Cardiology (ESC) and the European Association for the Study of Diabetes (EASD). Eur Heart J 2019, published online on 31 August 2019. 55. Emerging Risk Factors Collaboration. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: a collaborative meta-analysis of 102 prospective studies. The Lancet 375.9733 (2010): 2215–2222. 56. Wilson PW, Cupples CF, Kannel WB. Is hyperglycemia associated with cardiovascular disease? The Framingham Study. Amer. Heart J 1991;121:586–90. 57. Izzo R, de Simone G, Trimarco V. et al. Hypertensive target organ damage predicts incident diabetes mellitus. EurHeartJ. epub 27 June 2013. 58. Matsushita K. et al. Comparison of risk prediction using the CKD-EPI equation and the MDRD study equation for estimated glomerular filtration rate //Jama. – 2012. – Т. 307. – №. 18. – С. 1941-1951.
59. Ettehad D, Emdin CA, Kiran A, et al. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis. Lancet 2016;387:957–967. 60. De Haan M. W. et al. Renovascular disease in patients with hypertension: detection with duplex ultrasound //Journal of human hypertension. – 2002. – Т. 16. – №. 7. – С. 501. 61. Mahmoodi, Bakhtawar K., et al. Associations of kidney disease measures with mortality and end-stage renal disease in individuals with and without hypertension: a meta-analysis. The Lancet 380.9854 (2012):1649–1661. 62. Van Der Velde M. et al. Lower estimated glomerular filtration rate and higher albuminuria are associated with all-cause and cardiovascular mortality. A collaborative meta-analysis of high-risk population cohorts. Kidney international 79.12 (2011): 1341–1352. 63. Earley A, Miskulin D, Lamb EJ et al. Estimating equations for glomerular filtration rate in the era of creatinine standardization: a systematic review. Ann Intern Med 2012; 156: 785–795. 64. Zachrisson K. et al. Duplex ultrasound for identifying renal artery stenosis: direct criteria re-evaluated //Acta Radiologica. – 2017. – Т. 58. – №. 2. – С. 176-182. 65. Matsushita K. et al. Kidney measures beyond traditional risk factors for cardiovascular prediction: A collaborative meta-analysis //The lancet. Diabetes & endocrinology. – 2015. – Т. 3. – №. 7. – С. 514. 66. Gerstein HC, Mann JF, Yi Q, Zinman B, et al. HOPE Study Investigators. Albuminuria and risk of cardiovascular events, death, and heart failure in diabetic and nondiabetic individuals. JAMA 2001;286:421–426. 67. Boekholdt SM et al. Association of LDL cholesterol, non–HDL cholesterol, and apolipoprotein B levels with risk of cardiovascular events among patients treated with statins: a meta-analysis //Jama. — 2012. — Т. 307. — №. 12. — С. 1302-1309. 68. Guo X. et al. Prehypertension: a meta-analysis of the epidemiology, risk factors, and predictors of progression //Texas heart institute journal. – 2011. – Т. 38. – №. 6. – С. 643. 69. Geleijnse JM, Kok FJ, Grobbee DE. Blood pressure response to changes in sodium and potassium intake: a metaregression analysis of randomised trials. Journal of human hypertension 17.7(2003):471. 70. Macdonald JE, Struthers AD. hat is the optimal serum potassium level in cardiovascular patients? Journal of the American College of Cardiology 43.2 (2004):155–161. 71. Wang J. et al. Hyperuricemia and risk of incident hypertension: a systematic review and meta-analysis of observational studies //PloS one. – 2014. – Т. 9. – №. 12. – С. e114259. 72. Grayson PC et al. Hyperuricemia and incident hypertension: a systematic review and meta‐analysis.. Arthritis care & research 63.1 (2011):102–110.
73. Palmer TM et al. Association of plasma uric acid with ischaemic heart disease and blood pressure: mendelian randomisation analysis of two large cohorts. Bmj 347 (2013): f4262. 74. Schillaci, G., Battista, F., & Pucci, G. (2012). A review of the role of electrocardiography in the diagnosis of left ventricular hypertrophy in hypertension. Journal of electrocardiology, 45(6), 617–623. 75. Kahn S, Frishman WH, Weissman S et al. Left ventricular hypertrophy on electrocardiogram: prognostic implications from a 10-year cohort study of older subjects: a report from the Bronx Longitudinal Aging Study. J Am Geriatr Soc 1996;44:524–529. 76. Lonn E, Mathew J, Pogue J et al. Relationship of electrocardiographic left ventricular hypertrophy to mortality and cardiovascular morbidity in high-risk patients. Eur J Cardiovasc Prevent Rehab. 2003;10:420–428. 77. Bacharova L, Schocken D, Estes EH, Strauss D. The role of ECG in the diagnosis of left ventricular hypertrophy. Curr Cardiol Rev 2014;10:257–261. 78. Lehtonen AO, Puukka P, Varis J et al. Prevalence and prognosis of ECG abnormalities in normotensive and hypertensive individuals. J Hypertens 2016;34:959–966.
- 1. Rosenberg WM, Gray JA et al. Evidence based medicine: what it is and what it isn’t. BMJ 1996, January; 312 (7023): 71–72. 2. Федеральный закон от 21.11.2011 № 323-ФЗ (ред. от 03.04.2017) «Об основах охраны здоровья граждан в Российской Федерации». 3. Эпидемиологический словарь, 4-е издание. Под ред. Джона М. Ласта для Международной эпидемиологической ассоциации. М., 2009. 316 с.
Информация
Список сокращений
АГ — артериальная гипертензия
АГП — антигипертензивные препараты
АГТ — антигипертензивная лекарственная терапия
АГЭ — антигипертензивный эффект
АД — артериальное давление
АИР — агонисты имидазолиновых рецепторов
АК — антагонисты кальция (блокаторы кальциевых каналов)
АКС — ассоциированное клиническое состояние
АЛТ — аланинаминотрансфераза
АМКР — антагонисты минералокортикоидных рецепторов
АПФ — ангиотензинпревращающий фермент
АСТ — аспартатаминотрансфераза
БА — бронхиальная астма
ББ — бета-адреноблокатор
БРА — блокатор рецепторов ангиотензина
БСК — болезни системы кровообращения
ГБ — гипертоническая болезнь
ГК — гипертонический криз
ГКС — глюкокортикостероиды
ГЛЖ — гипертрофия левого желудочка
ДАД — диастолическое артериальное давление
ДМАД — домашнее мониторирование артериального давления
ЕОК/ЕОАГ — Европейское общество кардиологов/Европейское общество артериальной гипертонии
ИААГ — изолированная амбулаторная артериальная гипертензия
ИАПФ — ингибитор ангиотензинпревращающего фермента
ИБС — ишемическая болезнь сердца
ИММЛЖ — индекс массы миокарда левого желудочка
ИМТ — индекс массы тела
ИСАГ — изолированная систолическая артериальная гипертензия
КТ — компьютерная томография
ЛЖ — левый желудочек
ЛП — левое предсердие
ЛПИ — лодыжечно-плечевой индекс
МРТ — магнитно-резонансная томография
МС — метаболический синдром
НТГ — нарушенная толерантность к глюкозе
ОК — оральные контрацептивы
ОКС — острый коронарный синдром
ОПСС — общее периферическое сосудистое сопротивление
ОХС — общий холестерин
ОЦК — объем циркулирующей крови
ПД — пульсовое давление
ПОМ — поражение органов-мишеней
РААС — ренин-ангиотензин-альдостероновая система
РКИ — рандомизированные клинические исследования
РФ — Российская Федерация
САД — систолическое артериальное давление
САС — симпато-адреналовая система
СД — сахарный диабет
СКФ — скорость клубочковой фильтрации
СМАД — суточное мониторирование артериального давления
СНС — симпатическая нервная система
СОАС — синдром обструктивного апноэ во время сна
СПВ — скорость пульсовой волны
СС — сердечно-сосудистый
ССЗ — сердечно-сосудистые заболевания
ССО — сердечно-сосудистые осложнения
ТГ — триглицериды
ТИА — транзиторная ишемическая атака
УДД — уровень достоверности доказательств
УЗИ — ультразвуковое исследование
УУР — уровень убедительности рекомендаций
ФВ — фракция выброса
ФК — функциональный класс
ФП — фибрилляция предсердий
ФР — фактор риска
ХБП — хроническая болезнь почек
ХОБЛ — хроническая обструктивная болезнь легких
ХПН — хроническая почечная недостаточность
ХС ЛВП — холестерин липопротеинов высокой плотности
ХС ЛНП — холестерин липопротеинов низкой плотности
ХСН — хроническая сердечная недостаточность
ЦАД — центральное артериальное давление
ЦВБ — цереброваскулярная болезнь
ЧСС — частота сердечных сокращений
ЭД — эректильная дисфункция
ЭКГ — электрокардиограмма
ЭхоКГ — эхокардиография
CKD-EPI — ChronicKidneyDiseaseEpidemiology Collaboration
ESC/ESH — European society of cardiology/European society of hypertension
MDRD — Modification of Diet in Renal Disease
SCORE — Systemic coronary risk evaluation
Термины и определения
Артериальная гипертензия (АГ) — синдром повышения клинического артериального давления (АД) при гипертонической болезни и симптоматических АГ выше пороговых значений, определенных в результате эпидемиологических и рандомизированных контролируемых исследований, продемонстрировавших связь с повышением сердечно-сосудистого риска и целесообразность и пользу лечения, направленного на снижение АД ниже этих уровней АД.
АГ у молодых — повышение АД выше пороговых значений у лиц моложе 50 лет
Высокое нормальное АД — давление в диапазоне систолического АД (САД) от 130 до 139 мм рт. ст. и/или диастолического АД (ДАД) от 85 до 89 мм рт. ст.
Гипертония белого халата — форма АГ, при которой повышение АД ≥140 и/или ≥90 мм рт. ст. отмечается только на приеме у врача, а при измерении АД методом домашнего мониторирования АД (ДМАД) и/или суточного мониторирования АД (СМАД) показатели АД — в пределах нормальных значений. Доказательная медицина — надлежащее, последовательное и осмысленное использование современных наилучших доказательств (результатов клинических исследований) в сочетании с индивидуальным клиническим опытом и c учетом ценностей и предпочтений пациента в процессе принятия решений о состоянии здоровья и лечении пациента [1].
Заболевание — состояние, возникающее в связи с воздействием патогенных факторов, нарушение деятельности организма, работоспособности, способности адаптироваться к изменяющимся условиям внешней и внутренней среды при одновременном изменении защитно-компенсаторных и защитно-приспособительных реакций и механизмов организма [2].
Изолированная систолическая АГ–повышение САД ≥140 мм рт. ст. при уровне ДАД <90 мм рт. ст.
Исход — любой возможный результат, возникающий от воздействия причинного фактора, профилактического или терапевтического вмешательства, все установленные изменения состояния здоровья, возникающие как следствие вмешательства [3].
Клиническое исследование — любое исследование, проводимое с участием человека в качестве субъекта для выявления или подтверждения клинических и/или фармакологических эффектов исследуемых продуктов и/или выявления нежелательных реакций на исследуемые продукты, и/или изучения их всасывания, распределения, метаболизма и выведения с целью оценить их безопасность и/или эффективность [4].
Конфликт интересов — ситуация, при которой у медицинского или фармацевтического работника при осуществлении ими профессиональной деятельности возникает личная заинтересованность в получении лично либо через представителя компании материальной выгоды или иного преимущества, которое влияет или может повлиять на надлежащее исполнение ими профессиональных обязанностей вследствие противоречия между личной заинтересованностью медицинского работника или фармацевтического работника и интересами пациента [2].
Лекарственные препараты — лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности [5].
Маскированная (скрытая) АГ — форма гипертонии, особенностью которой являются нормальные показатели клинического АД (<140/90 мм рт. ст.) и повышенные — по данным СМАД и/или ДМАД.
Медицинское вмешательство — выполняемые медицинским работником и иным работником, имеющим право на осуществление медицинской деятельности, по отношению к пациенту, затрагивающие физическое или психическое состояние человека и имеющие профилактическую, диагностическую, лечебную, реабилитационную или исследовательскую направленность виды медицинских обследований и (или) медицинских манипуляций, а также искусственное прерывание беременности [2].
Изменение образа жизни — мероприятия, направленные на нормализацию веса и характера питания, двигательной активности, целью которых является снижение сердечно-сосудистого риска.
Оптимальное АД — САД менее 120 ммрт. ст. и/или ДАД менее 80 мм рт. ст.
Очень пожилые пациенты — пациенты в возрасте ≥ 80 лет. Пациент — физическое лицо, которому оказывается медицинская помощь или которое обратилось за оказанием медицинской помощи независимо от наличия у него заболевания и от его состояния [2].
Нормальное АД — давление в диапазоне САД 120–129 мм рт. ст. и/или ДАД 80–84 мм рт. ст.
Пожилые пациенты — пациенты, которым от 65 лет до 79 лет.
Постпрандиальная гипотензия — снижение систолического АД более, чем на 20 мм рт. ст. в течение двух часов после приема пищи при нахождении в положении лежа или сидя [6].
Постуральная гипотензия — снижение САД на 20 мм рт. ст. и более и/или ДАД — на 10 мм рт. ст. и более в первые 3 мин при переходе из горизонтального в вертикальное положение.
Псевдорезистентная АГ — случаи резистентной АГ, в которых не могут быть исключены причины плохого контроля АД: эффект «белого халата», плохая приверженность к лечению, неправильно подобранная терапия, неправильное измерениеАД, выраженная кальцификация артерий, регулярный прием препаратов, повышающих АД, факторы образа жизни, наличие синдрома обструктивного апноэ во время сна.
Пульсовое давление — разница между САД и ДАД.
Рабочая группа по разработке/актуализации клинических рекомендаций — коллектив специалистов, работающих совместно и согласованно в целях разработки/актуализации клинических рекомендаций и несущих общую ответственность за результаты данной работы.
Резистентная АГ — диагностируется в случаях, когда назначение трех антигипертензивных препаратов (включая диуретик) в оптимальных или максимально переносимых дозах не приводит к достижению целевого АД ниже 140 и/или 90 мм рт. ст. у приверженных к лечению пациентов. При этом отсутствие контроля АД подтверждено измерением АД вне медицинского учреждения (СМАД или ДМАД), а вторичные причины АГ исключены.
Синдром — устойчивая совокупность ряда симптомов с единым патогенезом [7].
Состояние — изменения организма, возникающие в связи с воздействием патогенных и (или) физиологических факторов и требующие оказания медицинской помощи [2].
Уровень достоверности доказательств — степень уверенности в том, что полученный эффект от применения медицинского вмешательства является истинным [8].
Уровень убедительности рекомендаций — степень уверенности в достоверности эффекта вмешательства и в том, что следование рекомендациям принесет больше пользы, чем вреда в конкретной ситуации [8].
Фиксированная комбинация лекарственных препаратов — сочетание двух и более разных классов препаратов в одной таблетке.
Хроническая болезнь почек — наднозологическое понятие, объединяющее всех пациентов с признаками повреждения почек и/или снижением функции, оцениваемой по величине скорости клубочковой фильтрации, которые сохраняются в течение 3 и более месяцев.
Хроническая алкогольная интоксикация — комплекс физиологических, поведенческих и когнитивных явлений, при которых употребление алкогольных напитков начинает занимать более важное место в системе ценностей человека, чем другие формы поведения, которые ранее были более важными для него.
Синдром старческой астении — гериатрическийсиндром, характеризующийся возраст-ассоциированным снижением физиологического резерва и функций многих систем организма, приводящий к повышенной уязвимости организма пожилого человека к воздействию эндо- и экзогенных факторов и высокому риску развития неблагоприятных исходов для здоровья, потери автономности и смерти [9].
Целевой уровень АД — уровень АД, различный для разных групп пациентов с АГ, достижение которого в процессе лечения позволяет добиться наиболее благоприятного соотношения польза (снижение сердечно-сосудистого (СС) риска) — риск (неблагоприятные эффекты).
Организация оказания медицинской помощи
Показания для плановой госпитализации:
- неясность диагноза и необходимость в специальных методах исследования (использование диагностических процедур, проведение которых невозможно или нецелесообразно в условиях поликлиники) для уточнения причины повышения АД (исключение симптоматических АГ);
- трудности в подборе медикаментозной терапии (сочетанная патология, частые гипертонические кризы);
- рефрактерная АГ.
Показания для экстренной госпитализации:
- гипертонический криз, не купирующийся на догоспитальном этапе;
- гипертонический криз при феохромоцитоме;
- гипертонический криз с выраженными явлениями гипертонической энцефалопатии;
- осложнения АГ, требующие интенсивной терапии: инсульт, ОКС, субарахноидальное кровоизлияние, острые нарушения зрения, отек легких, расслоение аорты, почечная недостаточность, эклампсия.
Показания к выписке пациента из стационара:
- установленный диагноз симптоматической АГ или ГБ с использованием специальных методов исследования при уточнении причины повышения АД;
- подобранная медикаментозная терапия при сочетанной патологии и/или частых гипертонических кризах с достижением целевого уровня АД или снижение АД на 25–30% от исходных значений на момент выписки из стационара;
- купированный гипертонический криз, отсутствие осложнений, требующих интенсивной терапии, стабилизация уровня АД.
Иные организационные технологии
При анализе работы медицинской организации с пациентами с АГ целесообразно анализировать следующие показатели:
- процент пациентов, достигших целевого АД менее 140/90 мм рт. ст. и 130/80 мм рт. ст. через 3, 6 и 12 месяцев наблюдения;
- процент пациентов, получающих комбинированную антигипертензивную терапию.
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Снижение АД, достижение и удержание его на целевом уровне является ключевым фактором, влияющим на прогноз и улучшающим сердечно-сосудистые исходы у пациентов с АГ.
Другими важными целями при лечении АГ являются:
— максимальное снижение риска развития ССО и смерти;
— коррекция всех модифицируемых ФР (курение, дислипидемия, гипергликемия, ожирение);
— предупреждение, замедление темпа прогрессирования и/или уменьшение ПОМ;
— лечение сопутствующих заболеваний (ИБС, ХСН, СД, ФП, ХБП).
Критерии оценки качества медицинской помощи
| № | Критерий качества |
EОК Класс и уровень |
Да/ нет |
| 1 | Установлен диагноз АГ согласно рекомендациям. Зафиксировано повышение офисного (клинического) АД выше 140 и/или 90 мм рт. ст. на повторных визитах, либо на основании СМАД (среднее за 24 часа ≥130 мм и/или ≥80 мм рт. ст.) | IA | Да/нет |
| 2 | Выполнен общий анализ крови | — | Да/нет |
| 3 | Выполнен биохимический анализ крови (креатинин, расчетная скорость клубочковой фильтрации, глюкоза, калий, натрий, мочевая кислота, ОХ, ЛПНП, ТГ, ЛПВП) | IB | Да/нет |
| 4 | Выполнен общий анализ мочи | IB | Да/нет |
| 5 | Выполнена качественная оценка протеинурии тест-полоской или количественное определение альбуминурии | IB | Да/нет |
| 6 | Выполнена ЭКГ в 12 отведениях | IB | Да/нет |
| 7 | Даны рекомендации по модификации образа жизни (ограничение потребления натрия, увеличение физической активности, снижение избыточной массы тела, отказ от курения, ограничение потребления алкоголя) | IA | Да/нет |
| 8 | Поставлен клинический диагноз с указанием стадии заболевания, степени повышения АД (при отсутствии терапии), категории риска, наличия ПОМ и АКС | — | Да/нет |
| 9 | У пациентов с АГ 1-й степени, относящимся к категориям низкого/среднего риска, начата антигипертензивная лекарственная терапия одним из препаратов рекомендованных классов после 3-го месяца модификации образа жизни | IA | Да/нет |
| 10 | Лицам с АГ второй степени и выше назначена комбинированная двухкомпонентная антигипертензивная терапия сразу после постановки диагноза и проведена ее интенсификация для достижения целевого АД. | IA | Да/нет |
| 11 | Достигнут целевой уровень САД<140 мм рт. ст. и ДАД < 90 мм рт. ст. через 3 месяца от начала лечения. При недостижении целевого АД приведено объяснение необходимости индивидуального уровня АД и скорости его снижения (плохая переносимость, побочные эффекты лекарственной терапии, низкая приверженность пациента к лечению, включая невыполнения рекомендаций врача, необходимость ревизии поставленного диагноза для исключения симптоматической АГ, наличие сопутствующей патологии или лекарственной терапии, затрудняющей контроль АД) | IA | Да/нет |
| 12 | Пациент взят под диспансерное наблюдение | — | Да/нет |
Типичными дефектами при оказании медицинской помощи пациентам с АГ являются:
при сборе анамнеза:
• не уточнены характер начала заболевания, продолжительность, особенности течения заболевания;
• отсутствуют сведения об эффективности ранее проводимой терапии, о возможном приеме пациентами других, помимо антигипертензивных, лекарственных препаратов: глюкокортикоидных гормонов, цитостатиков, нестероидных противовоспалительных препаратов, оральных контрацептивов и др.
• отсутствуют сведения о наличии менопаузы у женщин, характере питания, статусе курения, семейном анамнезе ранних сердечно-сосудистых заболеваний, осложнений АГ;
• отсутствие сведений о наличии предшествующих госпитализаций.
при обследовании пациентов:
• неполное физическое, лабораторное и инструментальное обследование, что приводит к недооценке возможности наличия симптоматической АГ, неверной оценке ПОМ и СС риска;
• отсутствие развернутого клинического диагноза, с указанием стадии гипертонической болезни, степени повышения АД (степени АГ при впервые выявленной АГ), с максимально полным отражением ФР, ПОМ, ССЗ, ХБП и категории сердечно-сосудистого риска;
• необоснованное и неверное установление стадии ГБ и степени АГ, категории риска;
• отсутствие сведений о наличии у пациента ПОМ, сопутствующих заболеваний и факторов риска;
при проведении лечения:
• измерение АД на высоте эффекта АГТ;
• назначение нерациональных комбинаций АГП, в неверном режиме и отсутствие интенсификации антигипертензивной терапии;
• недооценка наличия сопутствующей патологии, влияющей на выбор антигипертензивной терапии;
при обеспечении преемственности:
• отсутствие назначения повторных визитов для контроля АД;
• несвоевременная постановка на диспансерный учет;
• нерегулярность диспансерных осмотров.
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
Президиум рабочей группы:
- Кобалава Ж. Д.
- Конради А. О.
- Недогода С. В.
- Шляхто Е. В.
Другие члены рабочей группы:
- Арутюнов Г. П.,
- Баранова Е. И.,
- Барбараш О. Л.,
- Бойцов С. А.,
- Вавилова Т. В.,
- Виллевальде С. В.,
- Галявич А. С.,
- Глезер М. Г.,
- Гринева Е. Н.,
- Гринштейн Ю. И.,
- Драпкина О. М.,
- Жернакова Ю. В.,
- Звартау Н. Э.,
- Кисляк О. А.,
- Козиолова Н. А.,
- Космачева Е. Д.,
- Котовская Ю. В.,
- Либис Р. А.,
- Лопатин Ю. М.,
- Небиридзе Д. В.,
- Недошивин А. О.
- Остроумова О. Д.,
- Ощепкова Е. В.,
- Ратова Л. Г.,
- Скибицкий В. В.,
- Ткачева О. Н.,
- Чазова И. Е,
- Чесникова А. И.,
- Чумакова Г. А.,
- Шальнова С. А.,
- Шестакова М. В.,
- Якушин С. С.,
- Янишевский С. Н.
Члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов. В случае сообщения о наличии конфликта интересов член(ы) рабочей группы был(и) исключен(ы) из обсуждения разделов, связанных с областью конфликта интересов.
Приложение А2. Методология разработки клинических рекомендаций
Представленные Рекомендации разработаны на основе Рекомендаций РМОАГ 2019 г. по диагностике и лечению артериальной гипертензии и Рекомендаций по лечению артериальной гипертензии Европейского общества кардиологов 2018 года [28, 29].
В Рекомендациях, основанных на результатах крупнейших эпидемиологических, рандомизированных клинических исследований и метаанализов, обобщены и изложены основные принципы лечения пациентов с АГ в целом и в особых клинических ситуациях. Основная цель Рекомендаций — облегчить принятие решения при выборе оптимальной стратегии лечения конкретного пациента с АГ. Тем не менее окончательное решение о лечении должно быть принято с учетом индивидуальных особенностей механизмов развития и течения заболевания (например, солечувствительность, вторичный гиперальдостеронизм, индивидуальная чувствительность к АГП).
Целевая аудитория данных клинических рекомендаций:
1. Врач-кардиолог.
2. Врач-терапевт.
3. Врач общей практики.
4. Врач-эндокринолог.
5. Врач-невролог
Вследствие того, что члены Российского кардиологического общества входят в состав Европейского общества кардиологов и также являются его членами, все рекомендации Европейского общества кардиологов (ЕОК) формируются с участием российских экспертов, которые являются соавторами европейских рекомендаций. Таким образом, существующие рекомендации ЕОК отражают общее мнение ведущих российских и европейских кардиологов. В связи с этим формирование Национальных рекомендаций проводилось на основе рекомендаций ЕОК, с учетом национальной специфики, особенностей обследования, лечения, учитывающие доступность медицинской помощи. По этой причине в тексте настоящих клинических рекомендаций, одновременно использованы две шкалы оценки достоверности доказательств тезисов рекомендаций: уровни достоверности доказательств ЕОК с УУР и УДД. Добавлены классы рекомендаций ЕОК, позволяющие оценить необходимость выполнения тезиса рекомендаций (Таблицы 1, 2, 3, 4,5 ).
Таблица 1/А2 — Шкала оценки классов рекомендаций Европейского общества кардиологов (ЕОК).
Таблица 2/А2 — Шкала оценки уровней достоверности доказательств Европейского общества кардиологов (ЕОК).
Таблица 3/А2 — Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
Уровни достоверности доказательств (УДД) Приказ Министерства здравоохранения Российской Федерации от 28.02.2019 № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации» |
|
| 1 | Систематический обзор рандомизированных клинических исследований с применением метаанализа |
| 2 | Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа |
| 3 | Нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследование «случай–контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 4/А2. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
Таблица 5/А2. Шкала оценки уровней убедительности рекомендаций(УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
Уровень убедительности рекомендации (УРР), Приказ Министерства здравоохранения Российской Федерации от 28.02.2019 № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации» (Зарегистрирован 08.05.2019 № 54588) |
|
| А | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| В | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными). |
| С | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными). |
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию — не реже чем один раз в три года или при появлении новой информации о тактике ведения пациентов с данным заболеванием. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими некоммерческими профессиональными организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов инструкции по применению лекарственного препарата
1. Приказ Министерства здравоохранения Российской Федерации от 15 ноября 2012 г. № 918н «Об утверждении Порядка оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями».
2. Стандарт медицинской помощи больным эссенциальной первичной артериальной гипертензией (при оказании специализированной помощи), утвержден приказом Министерства здравоохранения и социального развития Российской Федерации от 13 июня 2007г. № 419.
3. Приказ Министерства здравоохранения Российской Федерации от 15 июля 2016 г. № 520н «Об утверждении критериев оценки качества медицинской помощи»
4. Приказ Министерства здравоохранения Российской Федерации от 28.02.2019 № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации» (Зарегистрирован 08.05.2019 № 54588)
Приложение Б. Алгоритмы действий врача
Приложение Б2. Алгоритм лечения АГ I–II стадий
Этот алгоритм подходит для большинства пациентов с ПОМ, а также может быть использован при лечении пациентов с цереброваскулярной болезнью, СД или заболеваниями периферических артерий.
Приложение Б3. Стратегия лекарственной терапии при сочетании АГ и ХБП
1У пациентов с ХБП, получающих антигипертензивную терапию, особенно ИАПФ или БРА, можно ожидать повышения уровня креатинина. Значительное повышение уровня креатинина на фоне назначения блокаторов РААС требует обследования пациента для исключения реноваскулярного заболевания.
2Диуретик — тиазидный или тиазидоподобный диуретик. Оценить целесообразность назначения петлевых диуретиков у пациентов с отеками.
3Риск гиперкалиемии при назначении спиронолактона, особенно при исходной СКФ <45 мл/мин/1,73 м2 и уровне калия 4,5 ммоль/л.
Приложение Б4. Стратегия лекарственной терапии при сочетании АГ и ИБС
Приложение Б5. Стратегия лекарственной терапии при сочетании АГ и ХСН со сниженной ФВ левого желудочка
Приложение Б6. Стратегия лекарственной терапии при сочетании АГ и ФП
Оральные антикоагулянты должны быть назначены по показаниям в соответствии с оценкой риска по CHA2DS2Vasc при отсутствии противопоказаний.
Приложение В. Информация для пациентов
Гипертоническая болезнь — заболевание, основным симптомом которого является повышение артериального давления выше 140/90 мм рт. ст., что приводит к поражению мозга, сердца, почек.
Только 50% людей̆ с повышенным артериальным давлением знают, что больны, из них систематически лечатся далеко не все. Нелеченная гипертоническая болезнь опасна осложнениями, главные из которых — инсульт, инфаркт миокарда, сердечная недостаточность, почечная недостаточность.
Главным фактором снижения риска смерти, инсульта и инфаркта миокарда является контроль АД и поддержание его на уровне как минимум <140/90 мм рт. ст., поэтому важен самоконтроль АД в домашних условиях с использованием сертифицированных аппаратов для измерения АД.
При этом необходимо выполнение следующих правил:
• перед измерением АД необходимы минимум 5 мин отдыха в положении сидя;
• сидеть во время измерения АД нужно с полной опорой стоп на пол, не перекрещивая и не поджимая ноги, положив руку на стол так, чтобы наложенная на плечо манжета была на уровне сердца, спина и рука с манжетой должны быть расслаблены;
• необходимо выполнять минимум 2 последовательных измерения АД утром и вечером ежедневно, хотя бы за 7 дней до планового визита к врачу или после изменения терапии; следует записывать результаты измерений в дневник самоконтроля;
• минимум за 30 мин до измерения АД не следует курить и употреблять кофеинсодержащие напитки;
• во время измерения АД одежда не должна плотно охватывать плечо, создавая складки и дополнительную компрессию.
Пациент и члены его семьи должны владеть методикой измерения АД, уметь вести дневник АД с записью цифр.
Если пациент получает антигипертензивные препараты, он должен быть осведомлен об ожидаемом эффекте, изменениях самочувствия и качестве жизни в ходе терапии, возможных побочных эффектах и способах их устранения.
Пациент должен знать об имеющихся у него и членов его семьи сердечно-сосудистых факторах риска — это курение, избыточная масса тела, психоэмоциональный стресс, малоподвижный образ жизни, повышенный уровень холестерина. Влияние указанных факторов риска может быть снижено. Особенно важна коррекция изменяемых факторов риска при наличии у пациента и членов его семьи некорригируемых факторов риска, к которым относятся: наличие в семейном анамнезе ранних мозговых инсультов, инфарктов ммммиокарда, сахарного диабета; мужской пол; пожилой возраст; физиологическая или хирургическая менопауза у женщин.
Коррекцию факторов риска требуется проводить не только пациенту, но и членам его семьи. Она осуществляется путем реализации программ семейной первичной профилактики и воспитания, составленных врачом.
• индекс массы тела (Кетле) = масса тела в килограммах/(рост в м2)
15–19,9 кг/м2 — недостаточная масса тела;
20–24,9 кг/м2 — нормальная масса тела (целевой уровень);
25–29,9 кг/м2- избыточная масса тела;
30–39,9 кг/м2 — ожирение;
40 кг/м2 — выраженное ожирение.
• индекс талия/бедра (ИТБ): ИТБ = ОТ/ОБ, где ОТ (окружность талии) — наименьшая окружность, измеренная над пупком; ОБ (окружность бедер) — наибольшая окружность, измеренная на уровне ягодиц.
0,8–0,9 — промежуточный тип распределения жировой ткани,
< 0,8 — гиноидный (бедренно-ягодичный),
>0,9 — андроидный (абдоминальный);
• Интерпретация уровня холестерина плазмы:
— целевой уровень ХС ЛНП для пациентов с очень высоким риском < 1,8 ммоль/л или его снижение не менее чем на 50% от исходного уровня, если он находился в диапазоне 1,8-3,5 ммоль/л (70–135 мг/дл)
— целевой уровень ХС ЛНП для пациентов с высоким риском < 2,6 ммоль/л или его снижение не менее чем на 50% от исходного уровня, если он находился в диапазоне 2,6–5,2 ммоль/л (100–200 мг/дл)
— целевой уровень ХС ЛНП для пациентов с низким и умеренным риском по шкале SCORE <3 ммоль/л
— ЛПВП >1,2 ммоль/л (у женщин), >1,0 ммоль/л (у мужчин),
— триглицеридов < 1,7 ммоль/л
• уровень глюкозы в плазме натощак не выше 6,1 ммоль/л;
• уровень мочевой кислоты сыворотки крови<420 мкмоль/л (у мужчин), < 360 мкмоль/л (у женщин).
Советы пациенту и его семье:
• Достаточным считается сон не менее 7 часов в сутки.
• Масса тела должна приближаться к идеальной (ИМТ менее 25 кг/м2). Для этого суточная калорийность пищи в зависимости от массы тела и характера работы должна составлять от 1500 до 2000 ккал. Потребление белка — 1 г/кг массы тела в сутки, углеводов — до 50г/сут, жиров — до 80 г/сут. Желательно вести дневник питания. Пациенту настоятельно рекомендуется избегать жирных, сладких блюд, отдавать предпочтение овощам, фруктам, злаковым и хлебу грубого помола.
• Потребление соли надо ограничить до 5 г/сут. Рекомендовано не подсаливать пищу, заменять соль другими веществами, улучшающими вкус пищи (соусы, небольшие количества перца, уксуса и др.) В соли содержится натрий, который приводит к задержке воды в организме, и как следствие, повышению артериального давления. Так же влияет большое содержание натрия в колбасах, консервах, солениях и копченых мясных продуктах.
• Следует увеличить потребление калия (его много в свежих фруктах, овощах, кураге, печеном картофеле). Соотношение К+/Nа+сдвигается в сторону К+ при преимущественно вегетарианской диете.
• Необходимо прекратить или ограничить курение.
• Потребление алкоголя следует ограничить до 30 мл/сут в пересчете на абсолютный этанол. Крепкие спиртные напитки лучше заменить красными сухими винами.
• При гиподинамии (сидячая работа > 5 ч/сут, физическая активность < 10 ч/нед) — регулярные физические тренировки не менее 4 раз в неделю продолжительностью 30–45 минут. Предпочтительны индивидуально приемлемые для пациента нагрузки: пешие прогулки, теннис, езда на велосипеде, ходьба на лыжах, работа в саду, плавание. При физической нагрузке число сердечных сокращений должно увеличиваться не более чем на 20–30 в 1 мин.
• Психоэмоциональный стресс на производстве и в быту контролируется правильным образом жизни. Следует ограничить продолжительность рабочего дня и домашних нагрузок, избегать ночных смен, командировок.
• Женщинам, больным гипертонической болезнью, надо отказаться от приема пероральных контрацептивов.
• Юношам, занимающимся спортом, нельзя злоупотреблять пищевыми добавками для наращивания мышечной массы и исключить прием анаболических стероидов.
Приложение Г1. Правила измерения АД, классификация уровней АД и основная информация, которая должна быть получена при сборе анамнеза
Таблица П1/Г1. Правила измерения АД
Измерение артериального давления в кабинете врача
АД — артериальное давление, САД — систолическое артериальное давление; ДАД — диастолическое артериальное давление.
Таблица П2/Г1. Классификация АД, измеренного в медицинском учреждении, и определение степеней гипертензии
САД — систолическое артериальное давление; ДАД — диастолическое артериальное давление.
Таблица П3/Г1. Основная информация, которая должна быть получена при сборе анамнеза
Приложение Г2. Принципы диагностики и оценки сердечно-сосудистого риска
Таблица П1/Г2. Скрининг и диагностика артериальной гипертензии
Таблица П2/Г2. Частые причины вторичных гипертензий
| Причина | Распространенность среди пациентов АГ | Возможные симптомы и признаки | Обследование |
| Синдром обструктивного апноэ во время сна | 5–10% | Храп; ожирение (но может встречаться при отсутствии ожирения); сонливость днем | Шкала Эпворта и полисомнография |
| Ренопаренхиматозные заболевания | 2–10% | Бессимптомное течение; сахарный диабет; гематурия, протеинурия, никтурия; анемия, образование почек при поликистозе у взрослых | Креатинин и электролиты плазмы, СКФ; анализ мочи на кровь и белок, отношение альбумин/креатинин мочи; ультразвуковое исследование почек |
| Реноваскулярные заболевания | |||
| Атеросклероз почечных артерий | 1–10% | Пожилые; диффузный атеросклероз (особенно периферических артерий); диабет; курение; рецидивирующий отек легких; шум в проекции почечных артерий. | Дуплексное сканирование почечных артерий или КТ-ангиография или МР-ангиография |
| Фибромускулярная дисплазия почечных артерий | Молодые; чаще у женщин; шум в проекции почечных артерия | ||
| Эндокринные причины | |||
| Первичный альдостеронизм | 5–15% |
Спонтанная или индуцированная диуретиками гипокалиемия, гипертензия в сочетании с надпочечниковой инсиденталомой, или синдромом сонного апноэ или семейным анамнезом гипертензии в раннем возрасте (до 40 лет), семейным анамнезом первичного гиперальдостеронизма (родственники 1-й линии родства) |
Ренин, альдостерон плазмы (исследование проводят на нормокалиемии и через 6 недель после отмены верошпирона); трактуют результаты с учетом антигипертензивой терапии, которую получает пациент |
| Феохромоцитома | <1% | Периодические симптомы: эпизоды повышения АД, головная боль, потливость, сердцебиения и бледность; лабильное АД; подъемы АД могут быть спровоцированы приемом препаратов (ББ, метоклопрамида, симпатомиметиков, опиоидов, трициклических антидепрессантов) | Метанефрины в плазме или суточной моче |
| Синдром Кушинга | <1% | Лунообразное лицо, центральное ожирение, атрофия кожи, стрии, диабет, длительный прием стероидов | Проба с 1 мг дексаметазона, и/или кортизол слюны в 23:00–00:00, и/или суточная экскреция свободного кортизола с мочой — исключить прием глюкокортикоидов! |
| Заболевания щитовидной железы (гипер- или гипотиреоз) | 1–2% | Признаки и симптомы гипер- или гипотиреоза | Оценка функции щитовидной железы (ТТГ, Т4, Т3) |
| Гиперапаратиреоз | <1% | Гиперкальциемия, гипофосфатемия | Паратгормон, уровень кальция |
| Акромегалия | Увеличение акральных частей тела, укрупнение и огрубление черт лица, потливость | Инсулиноподобный фактор роста (ИФР-1) сыворотки крови | |
| Другие причины | |||
| Коарктация аорты | <1% | Обычно выявляется у детей или подростков; разница АД (≥20/10 мм рт. ст.) между верхними и нижними конечностями и/или между правой и левой рукой и задержка радиально-феморальной пульсации; низкий ЛПИ; систолический шум в межлопаточной области; узурация ребер при рентгенографии | Эхокардиография |
Таблица П3/Г2. Основные требования к физическому обследованию
| Антропометрические показатели |
| Определение веса и роста с помощью калиброванных приборов, расчет ИМТ |
| Окружность талии |
| Признаки ПОМ |
| Неврологическое обследование и оценка когнитивного статуса |
| Фундоскопия для выявления гипертонической ретинопатии |
| Пальпация и аускультация сердца, сонных и почечных артерий |
| Пальпация периферических артерий |
| Определение АД на обеих руках (как минимум однократно) |
| Вторичные гипертензии |
| Осмотр кожных покровов: признаки нейрофиброматоза (феохромоцитома) |
| Пальпация почек для исключения их увеличения при поликистозе |
| Аускультация сердца и почечных артерий для выявления шумов, являющихся признаком коарктации аорты или реноваскулярной гипертензии |
| Сравнение пульсации на радиальных и бедренных артериях для выявления задержки пульсовой волны при коарктации аорты |
|
Признаки синдрома Кушинга (сочетание 2 или более симптомов): центральное ожирение, проксимальная мышечная слабость, подкожные кровоизлияния, широкие и глубокие стрии, необъяснимый остеопороз, гипокалиемия, вновь начавшийся СД, аменорея, инсиденталома надпочечника |
|
Признаки акромегалии увеличение акральных частей тела, укрупнение и огрубление черт лица, потливость |
|
Признаки заболеваний щитовидной железы (синдром гипотиреоза): склонность к брадикардии; плохая переносимость холода (зябкость); нарушения стула по типу запора; диффузная алопеция, раннее поседение волос, дистрофии ногтевых пластин (важен факт появления в недавнем анамнезе, возможен неудачный опыт лечения у дерматолога); нарушения менструальной функции у женщин (по типу олиго-, опсо-, аменореи), анамнез бесплодия, невынашивания беременности) |
|
Признаки заболеваний щитовидной железы (синдром тиреотоксикоза): • склонность к тахикардии (нарушения ритма в анамнезе — фибрилляция и трепетание предсердий, суправентрикулярные тахикардии, частые наджелудочковые и желудочковые экстрасистолии); • плохая переносимость тепла; • потливость, кожа влажная, горячая • потеря массы тела • диарея; • нарушения менструальной функции у женщин (по типу олиго-, опсо-, аменореи), анамнез бесплодия, невынашивания беременности); • глазные симптомы: Грефе — отставание верхнего века от края роговицы при движении глазного яблока вниз. Кохера — отставание движения глазного яблока от такового верхнего века при взгляде вверх, в связи с чем обнаруживается участок склеры между верхним веком и радужкой. Краузе — усиленный блеск глаз. Дальримпля — широкое раскрытие глазных щелей — «удивленный взгляд». Розенбаха — мелкое и быстрое дрожание опущенных или слегка сомкнутых век. Штельвага — редкие и неполные мигательные движения всочетании с ретракцией верхнего века. Мебиуса — нарушение конвергенции. Меланодермия в области век (симптом Еллинека) • эндокринная офтальмопатия — выраженный экзофтальм, нередко имеющий несимметричный характер, диплопия при взгляде в одну из сторон или вверх, слезотечение, ощущение песка в глазах, отечность век. • тремор пальцев вытянутых рук, иногда всего тела (симптом телеграфного столба). |
|
Признаки гиперпаратиреоза: • нефролитиаз, • вторичный остеопороз, • мышечная слабость, • боли в мышцах. |
Таблица П4/Г2. Рутинное обследование пациентов с АГ
| Гемоглобин и/или гематокрит |
| Глюкоза и гликозилированный гемоглобин |
| Липиды крови: ОХС, ХС ЛНП, ХС ЛВП |
| Триглицериды |
| Калий, натрий |
| Мочевая кислота |
| Креатинин и расчетная СКФ |
| Показатели функции печени |
| Анализ мочи: микроскопия осадка, качественная оценка протеинурии тест-полоской, отношение альбумин–креатинин в разовой порции мочи (оптимально) |
| ЭКГ в 12 отведениях |
Таблица П5/Г2.Обследование для выявления поражения органов-мишеней
| Показание и интерпретация | |
| Первичные тесты для выявления ПОМ | |
| ЭКГ в 12 отведениях | Скрининг для выявления ГЛЖ и других возможных аномалий, а также для документирования сердечного ритма и выявления аритмий |
| Отношение альбумин–креатинин в разовой порции мочи | Для выявления альбуминурии, что указывает на возможное поражение почек |
| Креатинин и расчетная СКФ | Для выявления поражения почек |
| Фундоскопия | Для выявления гипертонической ретинопатии, особенно у больных АГ 2-й или 3-й степеней |
| Детальное обследование для выявления ПОМ | |
| Эхокардиография | Для оценки структуры и функции сердца, если эта информация может повлиять на выбор тактики лечения |
| УЗИ сонных артерий | Для выявления наличия атеросклеротических бляшек или стенозов сонных артерий, особенно у пациентов с ЦВБ или признаками поражения сосудов других локализаций |
| Ультразвуковое и допплеровское исследование брюшной полости |
– Для оценки размеров и структуры почек (например, рубцовые изменения) и исключения обструктивного поражения мочевыводящих путей как причины ХБП и АГ – Оценить состояние брюшной аорты, исключить аневризму и поражение сосудов – Обследовать надпочечники для исключения аденомы или феохромоцитомы (для тщательного обследования предпочтительно выполнить КТ или МРТ); – Допплеровское исследование почечных артерий для исключения реноваскулярных заболеваний, особенно при выявлении асимметрии размеров почек |
| СПВ | Показатель аортальной жесткости и артериосклероза |
| ЛПИ | Скрининг для выявления атеросклероза нижних конечностей |
| Оценка когнитивных функций | Для оценки когнитивных функций у больных с признаками их нарушений |
| Визуализация головного мозга | Для оценки наличия ишемического или геморрагического повреждения головного мозга, особенно у пациентов с ЦВБ в анамнезе или признаками ухудшения когнитивных функций |
Сокращения: АГ — артериальная гипертензия, ГЛЖ — гипертрофия левого желудочка, КТ — компьютерная томография, ЛПИ — лодыжечно-плечевой индекс, МВП — мочевыводящие пути, МРТ — магнитно-резонансная томография, ПООГ — поражение органов-мишеней, опосредованное гипертензией, СКФ — скорость клубочковой фильтрации, СПВ — скорость пульсовой волны, ХБП — хроническая болезнь почек, ЦВБ — цереброваскулярная болезнь, ЭКГ — электрокардиограмма.
Таблица П6/Г2. Эхокардиографические критерии гипертрофии левого желудочка, концентрического ремоделирования, размеров полости левого желудочка и дилатации левого предсердия
ГЛЖ — гипертрофия левого желудочка, ЛЖ — левый желудочек, ЛП — левое предсердие, ОТС — относительная толщина стенок, ПТТ — площадь поверхности тела.
Таблица П7/Г2. Клинические показания для домашнего (ДМАД) и суточного мониторирования АД (СМАД)
СМАД — суточное мониторирование АД; ДМАД — домашнее мониторирование АД
Таблица П8/Г2. Сравнение методов суточного и домашнего мониторирования артериального давления
| СМАД | ДМАД |
|
Преимущества: Позволяет идентифицировать гипертензию «белого халата» и маскированную гипертензию Более существенная прогностическая значимость Ночные измерения Измерения проводятся в условиях реальной жизни Дополнительное прогностическое значение разных фенотипов АД Большой объем информации на основании одного исследования, включая краткосрочную вариабельность АД |
Преимущества: Позволяет идентифицировать гипертензию «белого халата» и маскированную гипертензию Дешевизна и широкая доступность Измерения в домашних условиях, которые предоставляют больший комфорт, чем кабинет врача Вовлечение пациента в процесс измерения АД Легко выполнимо, может быть использовано в течение длительного периода времени для оценки вариабельности АД от дня ко дню |
|
Недостатки: Дороговизна и иногда ограниченная доступность Может доставлять дискомфорт |
Недостатки: Возможно только статичное измерение АД Возможны ошибки измерений Отсутствие ночных измерений |
АД — артериальное давление, СМАД — суточное мониторирование артериального давления, ДМАД — домашнее мониторирование артериального давления.
Таблица П9/Г2. Определение артериальной гипертензии в зависимости от метода измерения АД: измеренного в медицинском учреждении, СМАД или ДМАД
Таблица П10/Г2. Этапы оценки сердечно-сосудистого риска
| Этапы обследования | Необходимые процедуры |
| Клиническая оценка | Выявление пациентов высокого и очень высокого риска на основании документированных ССЗ, СД, ХБП 3–5-й стадий, чрезмерного повышения отдельных факторов риска, семейной гиперхолестеринемии или высокого риска по SCORE |
| Оценка 10-летнего риска по шкале SCORE | Проводить оценку риска по SCORE рекомендовано у бессимптомных лиц старше 40 лет, без анамнеза ССЗ, СД, ХБП, семейной гиперхолестирнемии или повышения ХС-ЛНП >4,9 ммоль/л (>190 мг/дл) |
| Оценка факторов, изменяющих риск | У отдельных пациентов низкого или умеренного риска целесообразно оценвать дополнительные факторы, которые могут повлиять на стратификацию по риску и выбор тактики лечения: повышение аполипопротеина В, липопротеина (а) или С-реактивного белка, семейный анамнез ранних атеросклеротических ССЗ, выявление атеросклеротической бляшки |
| Стратификация риска сердечно-сосудистых осложнений у пациентов с АГ | На основании уровня АД, наличия ФР, ПОМ, АКС, ХБП 3–5-й стадий, СД |
АГ — артериальная гипертензия, АД — артериальное давление, АКС — ассоциированное клиническое состояние, ПОМ — поражение органов-мишеней, СД — сахарный диабет, ССЗ — сердечно-сосудистое заболевание, ХБП — хроническая болезнь почек, ХС-ЛНП — холестерин липопротеинов низкой плотности, ФР — факторы риска.
Приложение Г3. Шкала SCORE
Название на русском языке: Шкала SCORE
Оригинальное название (если есть): SCORE scale (Systematic COronary Risk Evaluation)
Источник (официальный сайт разработчиков, публикация с валидацией): http://www.heartscore.org/ru_RU
Тип (подчеркнуть):
— шкала оценки
— индекс
— вопросник
— другое (уточнить):
Назначение: клинический инструмент для оценки риска смертельного сердечно-сосудистого заболевания в течение 10 лет. Настоящая шкала разработана для стран с высоким уровнем смертности от ССЗ (включая Россию) на основании следующих факторов: возраст, пол, курение, уровень систолического АД и ОХС. Уровень ХС ЛВП не учитывается. Общая оценка риска с помощью SCORE рекомендуется у бессимптомных взрослых старше 40 лет, без ССЗ, СД, ХБП или СГХС.
Содержание (шаблон):
Ключ (интерпретация): Уровень суммарного СС риск по шкале SCORE: менее 1% — низкий. от 1 до 4% — средний или умеренно повышенный. от 5% до 9% — высокий. >10% — очень высокий.
Пояснения: нет
Таблица П12/Г2. Шкала глобальной оценки 10-летнего сердечно-сосудистого риска
1 ИБС: стенокардия напряжения 3-4 ФК, нестабильная стенокардия, перенесенный инфаркт миокарда, ишемический инсульт, ЧКВ, операция КШ, ангиопластика сонных артерий или артерий нижних конечностей, каротидная эндартерэктомия, подвздошно-бедренное, бедренно-подколенное шунтирование.
2 Инфаркт миокарда, нестабильная стенокардия, перемежающаяся хромота, транзиторная ишемическая атака/ишемический инсульт.
3 Назначение статинов в максимально переносимых дозах в сочетании с эзетимибом.
АГ — артериальная гипертензия, ХБП — хроническая болезнь почек, СКФ — скорость клубочковой фильтрации, ТИА — транзиторная ишемическая атака, CCЗ — сердечно-сосудистые заболевания, АСБ – атеросклеротическая бляшка, СГХС – семейная гиперхолестеринемия, ФР – фактор риска.
Таблица П13/Г2. Модифицирующие факторы, способствующие увеличению сердечно-сосудистого риска
Приложение Г3.1. Классификация стадий и стратификация риска при АГ
Таблица П1/Г3. Классификация стадий АГ в зависимости от уровней артериального давления, наличия факторов СС риска, поражения органов, обусловленного гипертензией, и наличия сопутствующих заболеваний
Таблица П2/Г3. Факторы, определяющие сердечно-сосудистый риск и стадию заболевания у пациентов с АГ
а — факторы риска, учтенные в шкале SCORE, b — Протеинурия и снижение СКФ являются независимыми факторами риска.
Таблица П3/Г3. Расчет СКФ по формуле CKD-EpidemiologyCollaboration 2009*
Калькулятор СКФ: https://www.kidney.org/professionals/KDOQI/gfr_calculator
Таблица П4/Г3. CHA2DS2-VASс. Шкала оценки риска тромбоэмболических осложнений у пациентов с фибрилляцией/трепетанием предсердий
Название на русском языке: CHA2DS2-VASс. Шкала оценки риска тромбоэмболических осложнений у пациентов с фибрилляцией/трепетанием предсердий
Оригинальное название (если есть): CHA2DS2-VASс
Источник (официальный сайт разработчиков, публикация с валидацией): Olesen, Jonas Bjerring, et al. Validation of risk stratification schemes for predicting stroke and thromboembolism in patients with atrial fibrillation: nationwide cohort study. Bmj 342 (2011): d124.
Тип (подчеркнуть):
— шкала оценки
— индекс
— вопросник
— другое (уточнить):
Назначение: клинический инструмент для прогнозирования риска ишемического инсульта и системного тромбоэмболизма при фибрилляции предсердий
Содержание (шаблон):
Ключ (интерпретация):
Пояснения: нет
Таблица П5/Г3. Шкала сонливости Эпворта (Epworth)
Название на русском языке: Шкала сонливости Эпворта
Оригинальное название (если есть): Epworth Sleepiness Scale
Источник (официальный сайт разработчиков, публикация с валидацией): https://epworthsleepinessscale.com/about-the-ess/
Тип (подчеркнуть):
— шкала оценки
— индекс
— вопросник
— другое (уточнить):
Назначение: серия вопросов, которые используют для изучения воздействия сна на дневной образ жизни.
Насколько вероятно то, что вы можете задремать или уснуть в ситуациях, описанных ниже, по сравнению с ощущением обычной усталости?
Речь идет об обычном вашем состоянии в последнее время. Даже если вы не были в подобных ситуациях в последнее время, то постарайтесь представить себе, как бы эти ситуации повлияли на вас. Используйте эту шкалу и выбирете наиболее подходящее число для каждой ситуации.
0 — никогда бы не заснул/не задремал
1 — очень небольшая вероятность заснуть или задремать
2 — вероятно, засну или задремлю
3 — большая вероятность заснуть или задремать
Ключ (интерпретация):
1 — 6 баллов: Нормальный сон
7 — 8 баллов: Умеренная сонливость
9 — 24 баллов: Аномальная (возможно, патологическая) сонливость
Пояснения: нет
Таблица П6/Г3. Опросник «Возраст не помеха»
Название на русском языке: Возраст не помеха
Оригинальное название (если есть):
Источник (официальный сайт разработчиков, публикация с валидацией): Общероссийская общественная организация «Российская ассоциация геронтологов и гериатров «Клинические рекомендации «Старческая астения» 2018 г.
Тип (подчеркнуть):
— шкала оценки
— индекс
— вопросник
— другое (уточнить):
Назначение: серия вопросов, которые используют для изучения воздействия сна на дневной образ жизни.
Содержание (шаблон):
Ключ (интерпретация):
за каждый положительный ответ начисляется 1 балл.
3 балла и более — высокая вероятность синдрома старческой астении, необходима консультация гериатра
1–2 балла — вероятен синдром старческой астении (преастения)
0 баллов — нет ССА
Пояснения: * имеется в виду непреднамеренное снижение веса. Если пациент похудел намеренно — за счет соблюдения специальной диеты или регулярной физической активности, балл не засчитывается.
Приложение Г4. принципы антигипертензивной терапии и диспансерное наблюдение больных с АГ
Таблица П1/Г4. Начало антигипертензивной терапии (изменение образа жизни и лекарственные препараты) при различных значениях АД, измеренного в медицинском учреждении
Таблица П2/Г4. Показания к началу антигипертензивной терапии в зависимости от возраста и сопутствующих заболеваний
Таблица П3/Г4. Целевые значения АД, измеренного в медицинском учреждении, в зависимости от возраста и сопутствующих заболеваний.
аОтносится к пациентам с инсультом в анамнезе, а не к показателям АД в остром периоде инсульта.
bЦелевые значения могут меняться у пожилых пациентов с синдромом старческой астении.
Таблица П4/Г4. Противопоказания к назначению отдельных классов антигипертензивных препаратов
Таблица П5/Г4. Алгоритм диспансерного наблюдения больных АГ с контролируемым артериальным давлением на фоне приема антигипертензивных лекарственных препаратов [292]
| Заболевание, состояние | Регулярность профилактических посещений | Рекомендуемые вмешательства и методы исследования во время профилактических посещений |
| АГ 1-й степени без ПОМ, ССЗ, ЦВБ и ХБП |
Не менее 1 раза в год при контроле АД на уровне целевых значений. При стабильном течении возможно наблюдение в отделении/кабинете медицинской профилактики При рефрактерной АГ I-II степени пациент наблюдается у врача-кардиолога; при отсутствии возможности наблюдения у врача-кардиолога — у врача-терапевта/участкового врача. |
— сбор жалоб и анамнеза, активный опрос на наличие, характер и выраженность боли в грудной клетке и одышки при физической нагрузке, эпизодов кратковременной слабости в конечностях, онемения половины лица или конечностей, об объеме диуреза — уточнение факта и характера приема антигипертензивных препаратов — уточнение факта приема гиполипидемических, антиагрегантных и гипогликемических препаратов при наличии показаний — опрос и краткое консультирование по поводу курения, характера питания, физической активности — измерение АД при каждом посещении — анализ данных ДМАД — общий осмотр и объективное обследование, включая пальпацию периферических сосудов и аускультацию подключичных, сонных, почечных и бедренных артерий, измерение индекса массы тела и окружности талии при каждом посещении — глюкоза плазмы крови натощак не реже 1 раза в год (допускается экспресс-метод) — общий холестерин не реже 1 раза в год (допускается экспресс-метод) — оценкасуммарного сердечно-сосудистого риска по шкале SCORE — холестерин липопротеинов низкой плотности, холестерин липопротеинов высокой плотности, триглицериды в сыворотке при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года — калий и натрий сыворотки при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года — креатинин сыворотки (с расчетом СКФ) при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года — анализ мочи на микроальбуминурию при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года
— ЭКГ в 12 отведениях с расчетом индекса Соколова-Лайона и Корнельского показателя не реже 1 раза в год — ЭхоКГ с определением ИММЛЖ и диастолической функции при взятии под диспансерное наблюдение, в последующем по показаниям, но не менее 1 раза в 2 года при отсутствии достижения целевых значений АД и наличии признаков прогрессирования гипертрофии левого желудочка по данным расчета индекса Соколова–Лайона и Корнелльского показателя — дуплексное сканирование сонных артерий у мужчин старше 40 лет, женщин старше 50 лет при ИМТ>30 кг/м2 и более и общем холестерине >5 ммоль/л и более при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раз в 3 года с целью определения ТИМ и наличия атеросклеротических бляшек* — измерение скорости пульсовой волны на каротидно-феморальном участке артериального русла при взятии под диспансерное наблюдение, в последующем по показаниям, но не реже 1 раза в 3 года при отсутствии достижения целевых значений АД* — корректировка терапии (при необходимости) — объяснение пациенту и/или обеспечение его памяткой по алгоритму неотложных действий при жизнеугрожающем состоянии, вероятность развития которого у пациента наиболее высокая |
| АГ 2–3-й степени с ПОМ, но без ССЗ, ЦВБ и ХБП | Не менее 2 раз в год |
— сбор жалоб и анамнеза, активный опрос на наличие, характер и выраженность боли в грудной клетке и одышки при физической нагрузке, эпизодов кратковременной слабости в конечностях, онемения половины лица или конечностей, об объеме диуреза — уточнение факта и характера приема антигипертензивных препаратов — уточнение факта приема гиполипидемических, антиагрегантных и гипогликемических препаратов при наличии показаний — опрос и краткое консультирование по поводу курения, характера питания, физической активности — измерение АД при каждом посещении — анализ данных ДМАД — общий осмотр и объективное обследование, включая пальпацию периферических сосудов и аускультацию подключичных, сонных, почечных и бедренных артерий, измерение индекса массы тела и окружности талии при каждом посещении — гемоглобин и/или гематокрит при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года — глюкоза плазмы натощак не реже 1 раза в год (допускается экспресс-метод) — общий холестерин не реже 1 раза в год (допускается экспресс-метод) — холестерин липопротеинов низкой плотности, холестерин липопротеинов высокой плотности, триглицериды в сыворотке при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года — калий и натрий сыворотки при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года — мочевая кислота сыворотки при взятии под диспансерное наблюдение, далее по показаниям — креатинин сыворотки (с расчетом СКФ) при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года — анализ мочи на микроальбуминурию при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года — ЭКГ в 12 отведениях с расчетом индекса Соколова–Лайона и Корнелльского показателя не реже 1 раза в год — ЭхоКГ с определением ИММЛЖ и диастолической функции при взятии под диспансерное наблюдение, в последующем по показаниям, но не реже 1 раза в год при отсутствии достижения целевых значений АД и наличии признаков прогрессирования гипертрофии левого желудочка по данным расчета индекса Соколова–Лайона и Корнельского показателя — дуплексное сканирование сонных артерий у мужчин старше 40 лет, женщин старше 50 лет при ИМТ>30 кг/м2 и более и общем холестерине >5 ммоль/л и более при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года с целью определения ТИМ и наличия атеросклеротических бляшек* — УЗИ почек и дуплексное сканирование почечных артерий при наличии обоснованного подозрения на их патологию* — лодыжечно-плечевой индекс при наличии обоснованного подозрения на стеноз сосудов нижних конечностей* — консультация окулиста на предмет наличия кровоизлияний или экссудата на глазном дне, отека соска зрительного нерва при взятии под ДН и по показаниям — оценка суммарного сердечно-сосудистого риска по таблице величины риска при АГ и по шкале SCORE (при интерпретации уровня риска приоритет отдается более высокому показателю) — корректировка терапии (при необходимости) — объяснение пациенту и/или обеспечение его памяткой по алгоритму неотложных действий при жизнеугрожающем состоянии, вероятность развития которого у пациента наиболее высокая |
| АГ 1–3-й степени с ССЗ, ЦВБ и ХБП | Не менее 2 раз в год |
— сбор жалоб и анамнеза, активный опрос на наличие, характер и выраженность боли в грудной клетке и одышки при физической нагрузке, эпизодов кратковременной слабости в конечностях, онемения половины лица или конечностей, об объеме диуреза — уточнение факта приема антигипертензивных препаратов — уточнение факта приема гиполипидемических, антиагрегантных и гипогликемических препаратов при наличии показаний — опрос и краткое консультирование по поводу курения, характера питания, физической активности — измерение АД при каждом посещении — анализ данных ДМАД — уточнение характера гипотензивной терапии и терапии по поводу других ССЗ, ЦВБ и ХБП — общий осмотр и объективное обследование, включая пальпацию периферических сосудов и аускультацию подключичных, сонных, почечных и бедренных артерий, измерение индекса массы тела и окружности талии при каждом посещении — гемоглобин и/или гематокрит при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года — глюкоза плазмы натощак не реже 1 раза в год (допускается экспресс-метод) — общий холестерин не реже 1 раза в год (допускается экспресс-метод) — холестерин липопротеинов низкой плотности, холестерин липопротеинов высокой плотности, триглицериды в сыворотке при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в 2 года — калий и натрий сыворотки при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в год -мочевая кислота сыворотки при взятии под диспансерное наблюдение, далее по показаниям — креатинин сыворотки (с расчетом СКФ) при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в год — анализ мочи с микроскопией осадка и определением белка в моче не реже 1 раза в год — анализ на микроальбуминурию при взятии под диспансерное наблюдение, далее по показаниям, но не реже 1 раза в год — ЭКГ в 12 отведениях с расчетом индекса Соколова–Лайона и Корнелльского показателя не реже 2 раз в год — ЭхоКГ с определением ИММЛЖ и диастолической функции при взятии под диспансерное наблюдение, в последующем по показаниям, но не менее 1 раза в год при отсутствии достижения целевых значений АД и наличии признаков прогрессирования гипертрофии левого желудочка при расчете индекса Соколова–Лайона и Корнелльского показателя — дуплексное сканирование сонных артерий у мужчин старше 40 лет, женщин старше 50 лет не реже 1 раза в 2 года с целью определения ТИМ и наличия атеросклеротических бляшек* -УЗИ почек при взятии под диспансерное наблюдение, далее по показаниям при наличии обоснованного подозрения на развитие или прогрессирование ХБП* — дуплексное сканирование почечных артерий при наличии обоснованного подозрения на их патологию* — лодыжечно-плечевой индекс при наличии обоснованного подозрения на стеноз сосудов нижних конечностей* — дуплексное сканирование подвздошных и бедренных артерий при наличии обоснованного подозрения на их патологию* — консультация окулиста на предмет наличия кровоизлияний или экссудата на глазном дне, отека соска зрительного нерва при взятии под ДН и по показаниям — оценка суммарного сердечно-сосудистого риска по таблице величины риска при АГ и по шкале SCORE (при интерпретации уровня риска приоритет отдается более высокому показателю) — корректировка терапии (при необходимости) -объяснение пациенту и/или обеспечение его памяткой по алгоритму неотложных действий при жизнеугрожающем состоянии, вероятность развития которого у пациента наиболее высокая |
Приложение Г5. Иные
Таблица П1/Г5. Распространенность и типичные причины вторичных гипертензий в различных возрастных группах
| Возрастная группа | Частота (%) | Типичные причины |
| Дети (<12 лет) | 70–85 |
Ренопаренхиматозные заболевания Коарктация аорты Моногенные заболевания |
| Подростки (12–18 лет) | 10-15 |
Ренопаренхиматозные заболевания Коарктация аорты Моногенные заболевания |
| Молодые (19–40 лет) | 5-10 |
Ренопаренхиматозные заболевания Фибромускулярная дисплазия Недиагностированные моногенные заболевания |
| Средний возраст (41–65 лет) | 5-15 |
Первичный альдостеронизм Обструктивное ночное апноэ Синдром Кушинга Феохромоцитома Ренопаренхиматозные заболевания Атеросклероз почечных артерий |
| Пожилые(>65 лет) | 5-10 |
Атеросклероз почечных артерий Ренопаренхиматозные заболевания Заболевания щитовидной железы |
Таблица П2/Г5. Редкие генетические причины вторичных артериальных гипертензий
АРП активность ренина плазмы, КАП концентрация альдостерона плазмы, КРП концентрация ренина плазмы.
Таблица П3/Г5. Лекарственные препараты и другие субстанции, приводящие к повышению артериального давления
| Препарат/субстанция | |
| Оральные контрацептивы | Особенно с содержанием эстрогенов; вызывают АГ у 5% женщин, обычно легкую, но возможна и тяжелая |
| Препараты для снижения веса | Например, фенилпропаноламин и сибутрамин |
| Назальные противоотечные препараты | Например, фенилэфрина гидрохлорид и нафазолина гидрохлорид |
| Стимуляторы | Амфетамины, кокаин, экстази; обычно вызывают острый подъем АД, а не хроническую АГ |
| Лакрица | Хроническое избыточное употребление лакрицы приводит к проявлениям, похожим на гиперальдостеронизм за счет стимуляции минералокортикоидных рецепторов и угнетения метаболизма кортизола |
| Иммуносупрессанты | Например, циклоспорин А (такролимус оказывает меньшее действие на АД, а рапамицин практически его не имеет) и стероиды (например, кортикостероиды и гидрокортизон) |
| Нестероидные противовоспалительные препараты | |
| Антиангиогенные противоопухолевые препараты | Например, ингибиторы эндотелиального сосудистого фактора роста (бевацизумаб), ингибиторы тирозинкиназы (сунитиниб) и сорафениб |
| Другие препараты и субстанции, способные повышать АД | Анаболические стероиды, эритропоэтин, растительные препараты (эфедра и марихуана) |
Таблица П4/Г5. Мероприятия, которые могут повысить приверженность пациентов с артериальной гипертензией к лекарственной терапии
| На уровне врача |
| Предоставление пациенту информации о рисках при АГ и преимуществах терапии, согласование стратегии лечения, направленной на поддержание нормального АД с использованием рекомендаций по изменению образа жизни и назначения фиксированных комбинаций; использование информационных материалов, программ обучения, консультирование с помощью компьютерных технологий |
| Получение обратной связи в отношении соблюдения рекомендаций и наличия улучшения |
| Оценка и разрешение индивидуальных проблем, препятствующих высокой приверженности к лечению |
| Сотрудничество с другими медицинскими сотрудниками |
| На уровне пациента |
| Самоконтроль АД (в том числе телемониторирование) |
| Групповые занятия и тренинги |
| Рекомендации в сочетании с мотивационными стратегиями |
| Использование систем напоминания |
| Получение поддержки семьи и общества |
| Обеспечение лекарственными препаратами на рабочем месте |
| На уровне лекарственной терапии |
| Упрощение схем приема препарата, предпочтение — фиксированным комбинациям и стратегии «одной таблетки» |
| Упаковки с системой напоминаний |
| На уровне системы здравоохранения |
| Поддержка развития систем мониторирования (телефонные контакты, посещения на дому, телемониторинг результатов домашнего контроля АД) |
| Финансовая поддержка системы взаимодействия между различными представителями системы здравоохранения (например, фармацевты и медицинские сестры) |
| Система компенсации стратегии «одной таблетки» |
| Развитие национальных баз данных, включая данные о назначении лекарственных препаратов, доступных для врачей и фармацевтов |
| Доступность препаратов |
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
ОГЛАВЛЕНИЕ
Список сокращений
1. Предисловие
2. Основные термины и определения
3. Эпидемиология и классификация артериальной гипертонии (АГ)
3.1 Классификация вторичных форм АГ (ВтАГ)
4. Диагностика
4.1 Общие подходы к диагностике и лечению АГ
4.2 Скрининг и диагностика ВтАГ
4.3 Оценка общего сердечно-сосудистого риска при ВтАГ
5. Формулировка диагноза ВтАГ
6. Тактика лечения АГ
6.1 Общие принципы ведения больных с ВтАГ
6.1.1 Показания к назначению антигипертензивной терапии
6.1.2 Целевые уровни артериального давления
6.1.3 Мероприятия по изменению образа жизни
6.1.4 Антигипертензивная терапия. Тактика моно- и комбинированной антигипертензивной терапии
6.1.5 Терапия для коррекции факторов риска и сопутствующих заболеваний
6.1.6 Тактика лечения при экстренных и неотложных состояниях, обусловленных АГ
7. Вторичные почечные артериальные гипертонии
7.1 Определение
7.2 Эпидемиология
7.3 Классификация
7.4 Скрининг. Категории пациентов высокого риска
7.5 Диагностика
7.6 Лечение
7.7 Дальнейшее наблюдение
7.8 Прогноз
8. Реноваскулярная артериальная гипертония
8.1 Основные понятия и определения
8.2 Эпидемиология и классификация
8.3 Клиническая картина
8.4 Скрининг и диагностика
8.5 Лечение
8.6 Дальнейшее наблюдение и прогноз
9. Эндокринные артериальные гипертонии
9.1 Первичный гиперальдостеронизм
9.1.1 Определение
9.1.2 Эпидемиология и классификация
9.1.3 Клиническая картина
9.1.4 Скрининг и диагностика
9.1.4.1 Методы лабораторной диагностики
9.1.4.2 Методы топической диагностики
9.1.4.3 Генетическое тестирование
9.1.5 Лечение
9.1.6 Дальнейшее наблюдение и прогноз
9.2 Болезнь Иценко-Кушинга и другие формы гиперкортицизма
9.2.1 Определения
9.2.2 Эпидемиология
9.2.3 Классификация
9.2.4 Скрининг
9.2.5 Диагностика
9.2.5.1 Клиническая картина и осложнения эндогенного гиперкортицизма (ЭГ)
9.2.5.2 Лабораторная диагностика
9.2.5.2.1 Лабораторная диагностика факта наличия ЭГ
9.2.5.2.2 АКТГ-зависимый ЭГ и АКТГ-независимый ЭГ
9.2.5.3 Инструментальная диагностика
9.2.5.3.1 АКТГ-зависимый гиперкортицизм
9.2.5.3.2 АКТГ-независимый гиперкортицизм
9.2.5.4 Диагностика осложнений ЭГ
9.2.6 Лечение
9.2.6.1 Хирургическое лечение
9.2.6.2 Радиотерапевтическое или радиохирургическое лечение
9.2.6.3 Медикаментозное лечение ЭГ
9.2.6.4 Лечение осложнений ЭГ
9.2.7 Дальнейшее наблюдение и прогноз
9.3 Феохромоцитома/параганглиома
9.3.1 Определения
9.3.2 Эпидемиология и классификация
9.3.3 Клиническая картина
9.3.4 Скрининг и диагностика
9.3.4.1 Методы лабораторной диагностики
9.3.4.2 Методы топической диагностики
9.3.4.3 Генетическое тестирование
9.3.5 Лечение
9.3.6 Дальнейшее наблюдение
9.3.7 Прогноз
9.4 Заболевания щитовидной железы
9.4.1 Тиреотоксикоз
9.4.1.1 Определения
9.4.1.2 Эпидемиология и классификация
9.4.1.3 Скрининг и диагностика
9.4.1.3.1 Лабораторные диагностические исследования при тиреотоксикозе
9.4.1.3.2 Инструментальные диагностические исследования при тиреотоксикозе
9.4.1.3.3 Дополнительные диагностические исследования
9.4.1.4 Лечение
9.4.1.5 Дальнейшее наблюдение и прогноз
9.4.2 Гипотиреоз
9.4.2.1 Определения
9.4.2.2 Эпидемиология и классификация
9.4.2.3 Скрининг и диагностика
9.4.2.3.1 Лабораторные и инструментальные диагностические исследования при гипотиреозе
9.4.2.3.2 Дополнительные диагностические исследования
9.4.2.4 Лечение
9.4.2.5 Дальнейшее наблюдение и прогноз
10. Артериальная гипертония при поражении крупных артериальных сосудов
10.1. Неспецифический аортоартериит
10.1.1 Определение
10.1.2 Эпидемиология и классификация
10.1.3 Клиническая картина
10.1.4 Диагностика
10.1.5 Лечение
10.1.6 Дальнейшее наблюдение и прогноз
10.2. Коарктация аорты
10.2.1 Определения
10.2.2 Эпидемиология и классификация
10.2.3 Клиническая картина
10.2.4 Диагностика
10.2.5 Лечение
10.2.6 Дальнейшее наблюдение и прогноз
11. Синдром обструктивного апноэ сна
11.1 Определение
11.2 Эпидемиология
11.3 Классификация
11.4 Скрининг. Категории пациентов высокого риска
11.5 Диагностика
11.6 Лечение (медикаментозное, хирургическое)
11.7 Дальнейшее наблюдение и прогноз
12. Лекарственные формы артериальной гипертонии
12.1 Определение
13. Приложения
Список сокращений
АГ – артериальная гипертония (гипертензия)
АД – артериальное давление
АГП – антигипертензивные препараты
АГТ – антигипертензивная терапия
АИТ – аутоиммунный тиреоидит
АКТГ – адренокортикотропный гормон
А/Кр – отношение концентраций альбумина и креатинина в моче
АРП – активность ренина плазмы
АРС – альдостерон-рениновое соотношение
АСПА – атеросклеротический стеноз почечных артерий
АТ-ТПО – антитела к тиреопероксидазе
БАБ – бета-адреноблокатор
БГ – болезнь Грейвса
БИК – болезнь Иценко-Кушинга
БКК – блокаторы кальциевых каналов (антагонисты кальция)
БРА – блокатор рецепторов ангиотензина II
ВтАГ – вторичные АГ
ВтГ – вторичный гипотиреоз
ГБ – гипертоническая болезнь
ГК – глюкокортикоиды
ГЛЖ – гипертрофия левого желудочка
ДАД – диастолическое артериальное давление
ДН – диабетическая нефропатия
ИАПФ – ингибитор ангиотензинпревращающего фермента
ИАГ – индекс апноэ/гипопноэ
ИБС – ишемическая болезнь сердца
ИГА – идиопатический гиперальдостеронизм
ИМ – инфаркт миокарда
ИММЛЖ – индекс массы миокарда левого желудочка
ИМТ – индекс массы тела
КА – катехоламины
КАП – концентрация альдостерона плазмы
КоА – коарктация аорты
КТ – компьютерная томография
ЛГ – легочная гипертензия
ЛЖ – левый желудочек сердца
ЛПИ – лодыжечно-плечевой индекс
ЛС – лекарственные средства
МЙБГ – метайодбензилгуанидин
МРА – магнитно-резонансная ангиография
МТЗ – многоузловой токсический зоб
МРТ – магнитно-резонансная томография
МС – метаболический синдром
МСКТ – мультиспиральная компьютерная томография
МЭН – множественная эндокринная неоплазия
НАА – неспецифический аортоартериит
НПВП – нестероидные противовоспалительные препараты
ОБ/Кр – отношение концентраций общего белка и креатинина в моче
ОПП – острое повреждение почек
ОК – оральные контрацептивы
ОКС – острый коронарный синдром
ОХС – общий холестерин
ПА – почечные артерии
ПАП-терапия – терапия положительным давлением в дыхательных путях
ПГА – первичный гиперальдостеронизм
ПКР – прямая концентрация ренина
ПОМ – поражение органов-мишеней
ПИР – прямые ингибиторы ренина
ПЭТ – позитронно-эмиссионная томография
РАС – ренин-ангиотензиновая система
РААС – ренин-ангиотензин-альдостероновая система
РАГ – резистентная артериальная гипертония
РВАГ – реноваскулярная артериальная гипертония
РЙТ – радиойодтерапия (терапия натрием йодидом (131йод))
РКИ – рандомизированные контролируемые исследования
рТТГ – рецептор тиреотропного гормона
САД – систолическое артериальное давление
СД – сахарный диабет
СКАД – самоконтроль артериального давления
СКФ – скорость клубочковой фильтрации
СМАД – суточное мониторирование артериального давления
СНС – симпатическая нервная система
СОАС – синдром обструктивного апноэ во время сна
ССВЗК – сравнительный селективный венозный забор крови
ССЗ – сердечно-сосудистые заболевания
ССО – сердечно-сосудистые осложнения
ССР – сердечно-сосудистый риск
СГ – субклинический гипотиреоз
CТ3 – свободный трийодтиронин
CТ4 – свободный тироксин
СФ – семейные формы ПГА
ТГ – триглицериды
ТИА – транзиторная ишемическая атака
ТК – тиреотоксический криз
ТПН – терминальная почечная недостаточность
ТТГ – тиреотропный гормон гипофиза
УЗДГ – ультразвуковая допплерография
УЗИ – ультразвуковое исследование
ФМД – фибромышечная дисплазия
ФП – фибрилляция предсердий
ФР – фактор риска
ФРК – фракционный резерв кровотока
ФХЦ/ПГ – феохромоцитома и параганглиома
ХБП – хроническая болезнь почек
ХОБЛ – хроническая обструктивная болезнь легких
ХПН – хроническая почечная недостаточность
ХС ЛПВП – холестерин липопротеидов высокой плотности
ХС ЛПНП – холестерин липопротеидов низкой плотности
ХСН – хроническая сердечная недостаточность
ЦВБ – цереброваскулярные болезни
ЧСС – частота сердечных сокращений
ЩЖ – щитовидная железа
ЭГ – эндогенный гиперкортицизм
ЭКГ – электрокардиография
ЭхоКГ – эхокардиография
α-АБ – α-адреноблокаторы
HbA1c – гликированный гемоглобин
KDIGO – Kidney Disease Improving Global Outcomes
MDRD – Modification of Diet in Renal Disease
SCORE – Systemic coronary risk evaluation
1. ПРЕДИСЛОВИЕ
Артериальная гипертония (АГ), как в нашей стране, так и за рубежом, является одной из актуальных медико-социальных проблем, что обусловлено широкой распространенностью этого заболевания, высоким риском сердечно-сосудистых осложнений (ССО) и недостаточным контролем за проводимой медикаментозной терапией.
АГ может иметь различное происхождение: у большинства больных наблюдается гипертоническая болезнь и у значительно меньшего числа (в 5-25% случаев) – вторичные (симптоматические) формы АГ (ВтАГ), обусловленные заболеваниями почек, крупных артериальных сосудов, эндокринных желез и другими потенциально обратимыми причинами повышения артериального давления (АД). ВтАГ часто возникают в молодом возрасте, отличаются тяжестью течения, резистентностью к проводимой медикаментозной терапии, высокой частотой развития ССО. Своевременная правильная диагностика способствует выбору адекватной лечебной тактики, что особенно важно при ВтАГ, подлежащих хирургическому лечению – устранению причин повышения АД с последующей нормализацией АД или улучшением течения АГ.
В последние годы наблюдается увеличение частоты выявления ВтАГ, что в значительной мере определяется разработкой новых методических подходов с применением более современных лабораторных и инструментальных методов диагностики. Однако в ряде случаев вторичные формы АГ остаются недиагностированными или правильный диагноз ставится только через 5-10 лет от начала заболевания, что приводит к необратимым изменениям в органах-мишенях и резистентности АГ к антигипертензивной терапии (АГТ). Существует необходимость в повышении осведомленности широкого круга врачей о современных диагностических возможностях АГ различной этиологии.
До настоящего времени ни в нашей стране, ни за рубежом не разработаны единые рекомендации, обобщающие современные подходы специалистов разного профиля к диагностике и лечению ВтАГ. Основная цель настоящих рекомендаций – улучшение ранней диагностики ВтАГ, своевременное проведение скрининга в учреждениях первичного звена здравоохранения.
Рекомендации включают разделы, в которых рассмотрены общие для всех форм АГ диагностические подходы, а также разделы по диагностике и подходам к лечению наиболее распространенных ВтАГ.
При изложении общих подходов к диагностике ВтАГ обращено внимание на важность проведения диагностических исследований, позволяющих оценить общие для всех форм АГ факторы риска (ФР) ССО, определяющие прогноз заболевания, разработать тактику оптимальной комплексной терапии. При изложении характера течения наиболее распространенных нозологических форм вторичных АГ уделено внимание клиническим особенностям течения АГ, риску развития ССО. Особое внимание обращено на важность проведения широкого диагностического скрининга на начальных этапах диагностики, возможность применения доступных в амбулаторных условиях критериев, способствующих формированию целевых категорий пациентов, имеющих наибольшую вероятность, высокий риск наличия ВтАГ, и проведению у них в дальнейшем в условиях специализированных стационаров углубленного обследования для уточнения диагноза и определения тактики лечения.
При разработке настоящих рекомендаций проведен анализ последних версий национальных и международных рекомендаций и консенсусов, а также международных исследований, монографий и журнальных публикаций по отдельным нозологиям, составляющим спектр ВтАГ.
Необходимо подчеркнуть, что рекомендации не рассматривают все аспекты диагностики и лечения ВтАГ и не предназначены для лечения конкретного пациента. Представлены основные принципы диагностики и лечения отдельных форм ВтАГ, учитывающие результаты ряда клинических исследований. Вместе с тем решение о ведении пациента должно быть персонализированным и учитывать индивидуальные особенности течения заболевания.
В ходе разработки рекомендаций использованы принципы доказательной медицины. В зависимости от обоснованности, рекомендации различаются по классам и уровням доказательности в соответствии с руководствами Европейского общества кардиологов (ЕОК), Европейского общества по артериальной гипертонии (ЕОАГ) и Российского медицинского общества по артериальной гипертонии (РМОАГ). При некоторых редких формах ВтАГ отсутствует убедительная доказательная база, в этих случаях доказательность данных основывается на согласованном мнении экспертов. Классы рекомендаций и уровни доказательности представлены в таблице 1.
В подготовке рекомендаций в качестве авторов-составителей принимали участие ведущие специалисты – кардиологи, эндокринологи, нефрологи, обладающие клиническим опытом, имеющие также опыт написания клинических рекомендаций по отдельным нозологическим формам ВтАГ.
Разработанные клинические рекомендации предназначены для широкого круга специалистов – врачей общей практики, терапевтов, кардиологов, эндокринологов, нефрологов, хирургов.
|
Классы рекомендаций |
Определение |
Предлагаемая формулировка |
|
I |
Данные и/или всеобщее согласие, что конкретный метод лечения или процедура полезны, эффективны, имеют преимущества |
Рекомендуется/показано |
|
II |
Противоречивые данные и/или расхождение мнений о пользе эффективности конкретного метода лечения или процедуры |
|
|
IIa |
Большинство данных/мнений говорит о пользе/эффективности |
Целесообразно применять |
|
IIb |
Данные/мнения не столь убедительно говорят о пользе/эффективности |
Можно применять |
|
III |
Данные и/или всеобщее согласие, что конкретный метод лечения или процедура не являются полезными или эффективными, а в некоторых случаях могут приносить вред |
Не рекомендовано |
|
Уровни доказательности |
||
|
А |
Данные многочисленных рандомизированных клинических исследований или метаанализов |
|
|
В |
Данные одного рандомизированного контролируемого исследования или крупных нерандомизированных исследований |
|
|
С |
Согласованное мнение экспертов и/или небольшие исследования, ретроспективные исследования, регистры |
2. ОСНОВНЫЕ ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
Артериальная гипертония (АГ) – повышение систолического артериального давления (САД) ≥ 140 мм рт. ст. и/или диастолического (ДАД) ≥ 90 мм рт. ст.
Гипертоническая болезнь (ГБ) – хронически протекающее заболевание, развивающееся у большинства больных АГ, при котором повышение АД не связано с выявлением явных причин. ГБ соответствует терминам «эссенциальная» или «первичная» АГ, принятым за рубежом.
Вторичные (симптоматические) АГ (ВтАГ) – формы АГ, обусловленные заболеваниями почек, крупных артериальных сосудов, эндокринных желез и другими потенциально обратимыми причинами повышения АД.
Рубрики МКБ-10:
Болезни, характеризующиеся повышенным кровяным давлением (I10-I15):
- I10. Эссенциальная (первичная) гипертензия.
- I15. Вторичная гипертензия.
3. ЭПИДЕМИОЛОГИЯ И КЛАССИФИКАЦИЯ АГ
АГ является актуальной медико-социальной проблемой, что обусловлено широкой распространенностью этого заболевания, высоким риском ССО и недостаточным контролем за проводимой медикаментозной терапией [1].
АГ может иметь различное происхождение: в большинстве случаев наблюдается ГБ, значительно реже (в 5-25% случаев) выявляются ВтАГ, при которых АГ является лишь одним из симптомов поражения почек, крупных артериальных сосудов, эндокринных желез. Своевременная диагностика и адекватное лечение ВтАГ способствуют нормализации АД. Наблюдаются различия в распространенности отдельных форм ВтАГ в разных возрастных группах [2]. У детей и подростков частота развития ВтАГ может достигать 70-85%, в данной возрастной группе преимущественно диагностируют почечные паренхиматозные заболевания, коарктацию аорты, наследственные формы АГ. У лиц пожилого возраста с распространенным атеросклерозом чаще развивается реноваскулярная АГ (РВАГ) вследствие атеросклеротического стеноза почечных артерий [2] (табл. 2).
|
Группы по возрасту |
Случаи АГ (%) |
Наиболее частая этиология |
|
Дети (до 12 лет) |
70-85 |
Почечные паренхиматозные заболевания Коарктация аорты |
|
Подростки (12-18 лет) |
10-15 |
Почечные паренхиматозные заболевания Коарктация аорты |
|
Молодой возраст (19-39 лет) |
5 |
Дисфункция щитовидной железы Фибромышечная дисплазия Почечные паренхиматозные заболевания |
|
Средний возраст (40-64 лет) |
8-12 |
Альдостерома надпочечников Дисфункция щитовидной железы Синдром обструктивного апноэ сна Синдром Кушинга Феохромоцитома |
|
Пожилые (65 лет и старше) |
17 |
Атеросклеротический стеноз почечных артерий Хроническая почечная недостаточность Гипотиреоз |
* исключены диетические и лекарственные причины повышения АД и фактор риска ожирение
* excluding dietary and drug causes and the risk factor of obesity
Распространенность ВтАГ возрастает по мере утяжеления АГ, что подтверждает важность анализа степени тяжести АГ, соответственно уровню АД, как при ГБ, так и при ВтАГ [3],[4] (табл. 3).
|
Категории АД |
САД |
ДАД |
|
|
Оптимальное |
< 120 |
и |
< 80 |
|
Нормальное |
120 – 129 |
и/или |
80 – 84 |
|
Высокое нормальное |
130 – 139 |
и/или |
85 – 89 |
|
АГ 1-й степени |
140 – 159 |
и/или |
90 – 99 |
|
АГ 2-й степени |
160 – 179 |
и/или |
100 – 109 |
|
АГ 3-й степени |
≥ 180 |
и/или |
≥ 110 |
|
ИСАГ |
≥ 140 |
и |
< 90 |
Примечание: ИСАГ – изолированная систолическая АГ, должна классифицироваться на 1, 2, 3-ю степени, согласно уровню систолического АД
Note: Isolated systolic hypertension is graded 1, 2, 3 according to systolic BP values in the ranges indicated
В большинстве случаев у пациентов с ВтАГ при отсутствии своевременной диагностики и адекватного лечения отмечается неконтролируемое течение АГ, развивается резистентная к терапии АГ (РАГ), при которой назначение оптимальных доз 3-x и более антигипертензивных препаратов (АГП) различных классов, включая диуретик, не приводит к достижению целевого уровня АД [3][4][5][6][7]. Для некоторых ВтАГ характерна особенно высокая распространенность РАГ, среди них: реноваскулярная АГ при атеросклеротическом стенозе почечных артерий, ренопаренхиматозные АГ, первичный гиперальдостеронизм, синдром обструктивного апноэ сна. Несколько реже РАГ развивается при фибромышечной дисплазии почечных артерий, коарктации аорты, синдроме Кушинга, феохромоцитоме и некоторых других ВтАГ [8] (табл. 4).
|
Вторичная причина АГ |
Распространённость а |
Распространённость б |
|
Синдром обструктивного апноэ сна |
> 5 – 15% |
> 30% |
|
Почечная паренхиматозная болезнь |
1,6 – 8,0% |
2 – 10% |
|
Стеноз почечных артерий |
1,0 – 8,0% |
2,5 – 20% |
|
Первичный альдостеронизм |
1,4 – 10% |
6 – 23% |
|
Заболевания щитовидной железы |
1 – 2% |
1 – 3% |
|
Синдром Кушинга |
0,5% |
< 1% |
|
Феохромоцитома |
0,2 – 0,5% |
< 1% |
|
Коарктация аорты |
< 1% |
< 1% |
Примечание: а Распространенность у больных с контролируемой АГ, б Распространенность у больных с резистентной АГ
Note: a Prevalence in in controlled hypertensive patients, b Prevalence in patients with resistant hypertension
Длительное неконтролируемое течение АГ при некоторых формах ВтАГ приводит к развитию синдрома злокачественного течения АГ, который характеризуется стабильно высоким уровнем АД, особенно диастолического, выраженными изменениями глазного дна (нейроретинопатия, кровоизлияния), быстрым прогрессированием заболевания, развитием тяжелых осложнений: нарушений мозгового кровообращения, острой левожелудочковой недостаточности, ухудшения функции почек с развитием хронической почечной недостаточности [9]. Наличие синдрома злокачественного течения АГ во всех случаях диктует необходимость установления причины АГ, особенно при подозрении на наличие патологии, подлежащей хирургическому лечению (РВАГ, гормонально активные опухоли). В последнее десятилетие злокачественное течение АГ наблюдается реже, чем в прежние годы, что, вероятно, связано с улучшением диагностики ВтАГ, разработкой более эффективных способов контроля АД.
Для ВтАГ характерна высокая распространенность поражения органов-мишеней (ПОМ) и ассоциированных клинических состояний, непропорциональных степени тяжести АГ, кроме того, при некоторых ВтАГ осложненное течение обусловлено влиянием ряда специфических факторов (при первичном гиперальдостеронизме, вторичных почечных АГ), что позволяет рассматривать этих пациентов как категорию лиц высокого сердечно-сосудистого риска (ССР) [10].
С учетом клинических проявлений, характерных в целом для всех ВтАГ, а также клинических симптомов и особенностей течения, характерных для отдельных нозологий, разработаны критерии, на основании которых можно предположить наличие ВтАГ [3][8] (табл. 5).
|
Пациенты молодого возраста (< 40 лет) с АГ 2-й степени или с развитием АГ любой степени в детском возрасте |
|
Резистентная АГ |
|
Внезапное ухудшение течения АГ у пациентов с ранее контролируемой АГ |
|
Тяжелая АГ (3-й степени) или неотложные состояния (гипертонический криз), обусловленные АГ, требующие госпитализацию в отделение неотложной терапии |
|
Наличие выраженного поражения органов-мишеней, непропорционального степени тяжести АГ |
|
Клинические или биохимические признаки, свидетельствующие о наличии эндокринной формы АГ или хронической болезни почек (ХБП), или признаки синдрома обструктивного апноэ сна |
3.1 Классификация ВтАГ
Общепринятая классификация вторичных форм АГ в настоящее время отсутствует. Выделяют следующие основные формы симптоматических систоло-диастолических АГ в зависимости от их этиологии [1][9][11][12]:
- вторичные почечные АГ;
- реноваскулярная АГ
- эндокринные формы АГ;
- АГ при поражениях крупных артериальных сосудов и сердца;
- нейрогенные вторичные АГ, обусловленные органическими поражениями центральной нервной системы;
- АГ на фоне приема лекарственных средств или экзогенных веществ.
В последние годы к основным формам ВтАГ относят также синдром обструктивного апноэ во время сна.
Различные вторичные формы АГ могут быть обусловлены рядом нозологий, спектр которых неуклонно расширяется. В настоящее время установлено более 15 эндокринных нозологий, связанных с развитием ВтАГ [12]. Вместе с тем можно выделить основные заболевания, этиологически связанные с развитием АГ [12][14].
К развитию вторичных почечных АГ («ренопаренхиматозных АГ») приводят: гломерулярные, тубулоинтерстициальные и сосудистые заболевания (см. Приложение 3).
К развитию реноваскулярной АГ приводят: атеросклероз; фибромышечная дисплазия; неспецифический аортоартериит; гематомы и опухоли, сдавливающие почечные артерии; врожденная патология: атрезия и гипоплазия почечных артерий, ангиомы и артериовенозные фистулы, аневризмы.
Эндокринные АГ развиваются при: поражении коры надпочечников (гиперсекреция минералокортикоидов – первичный и идиопатический гиперальдостеронизм, семейные формы (СФ) гиперальдостеронизма; при опухоли, продуцирующей дезоксикортикостерон, редких генетически обусловленных формах АГ с проявлениями минералокортикоидной активности (синдромах Геллера, Лиддла, Гордона); при гиперсекреции глюкокортикоидов – синдром Иценко-Кушинга); поражении мозгового вещества надпочечников (гиперсекреция катехоламинов – феохромомцитома); нарушении функции щитовидной железы (ЩЖ) (гипотиреоз, тиреотоксикоз); при гиперпаратиреозе; при поражении гипофиза (болезнь Иценко-Кушинга, акромегалия).
АГ, обусловленные поражением крупных артериальных сосудов, чаще вызваны атеросклерозом, коарктацией аорты, стенозирующим поражением аорты и брахиоцефальных артерий при неспецифическом аортоартериите.
Нейрогенные АГ развиваются при органических поражениях центральной нервной системы, повышении внутричерепного давления: опухоли, травмы, энцефалит, полиомиелит, очаговые ишемические поражения.
Синдром обструктивного апноэ во время сна – ассоциирован с развитием АГ, в настоящее время рассматривается как возможная причина развития ВтАГ (см. Раздел «Синдром обструктивного апноэ сна») [15].
К лекарственным средствам и экзогенным веществам, способным вызвать АГ, относят гормональные противозачаточные средства, кортикостероиды, симпатомиметики, минералокортикоиды, кокаин, пищевые продукты, содержащие тирамин или ингибиторы моноаминоксидазы, нестероидные противовоспалительные средства, циклоспорин, эритропоэтин и некоторые другие средства [16].
4. ДИАГНОСТИКА
4.1 Общие подходы к диагностике и лечению АГ
После выявления АГ, определения степени и стабильности повышения АД следует обследовать пациентов на предмет исключения ВтАГ или идентификации её формы. Диагностика АГ любой этиологии основывается на следующих основных подходах: 1) анализе анамнеза заболевания, 2) физикальном обследовании, 3) проведении лабораторно-инструментальных методов исследования – более простых на начальном амбулаторном этапе и более сложных на последующих этапах обследования. Этапность обследования учитывает проведение скрининга и дальнейшей диагностики на разных уровнях: амбулаторном уровне, в условиях стационара и по показаниям в специализированном центре.
4.2 Скрининг и диагностика ВтАГ
Анамнез и физикальное обследование
Скрининг на выявление вторичных форм заболевания у больных АГ основан на анализе характерных для некоторых ВтАГ клинических симптомов, данных анамнеза и физикального обследования [2][8][9][11][12][13]. Важно выявить некоторые общие клинические проявления, которые могут свидетельствовать о наличии ВтАГ (табл. 6).
Полученные сведения позволяют уже на раннем, амбулаторном этапе предположить вторичный характер АГ и определить дальнейшую последовательность обследования [3][12].
|
1. Данные анамнеза |
|
|
2. Данные физикального обследования |
|
Лабораторные и инструментальные методы исследования
Всем пациентам с АГ для оценки общего ССР на первом этапе рекомендуется проводить рутинные лабораторные методы обследования. Определены более простые и доступные методы исследования, которые являются обязательными для всех больных АГ, а также дополнительные методы, которые проводятся по соответствующим показаниям [3][4]. К числу обязательно рекомендуемых исследований, выполняемых на начальном этапе обследования, относятся: общий анализ крови и мочи; определение глюкозы в плазме крови (натощак); определение общего холестерина (ОХС), холестерина липопротеидов высокой плотности (ХС ЛПВП), холестерина липопротеидов низкой плотности (ХС ЛПНП), триглицеридов (ТГ); калия и натрия в сыворотке крови, концентрации мочевой кислоты в сыворотке крови, альбуминурии, особенно у лиц с ожирением, метаболическим синдромом (МС) и сахарным диабетом (СД); креатинина, с расчетом скорости клубочковой фильтрации (СКФ). Всем пациентам с АГ и избыточной массой тела или ожирением, и/или при уровне глюкозы в плазме крови натощак 5,6 ммоль/л (100 мг/дл) и более рекомендуется проведение перорального теста толерантности к глюкозе и/или определение гликированного гемоглобина (HbA1c).
Всем пациентам с АГ для выявления гипертрофии миокарда левого желудочка (ГЛЖ) и других поражений сердца рекомендуется проведение электрокардиографии (ЭКГ) в 12 стандартных отведениях.
По показаниям проводят дополнительные инструментальные исследования для уточнения формы ВтАГ, оценки ПОМ, сопутствующих заболеваний и выявления дополнительных ФР ССО [3,4]. Рекомендовано проведение эхокардиографии (ЭхоКГ), ультразвукового исследования (УЗИ) почек, консультация окулиста – исследование сосудов глазного дна (при тяжелом течении АГ – исключение нейроретинопатии). При ВтАГ обоснована важность проведения суточного мониторирования АД (СМАД) – оценка суточного ритма и вариабельности АД, контроль эффективности проводимой АГТ, а также самоконтроля АД (СКАД). Для обоснования диагноза ВтАГ и определения тактики лечения в большинстве случаев требуется проведение углубленного обследования: инструментального, гормонального, генетического [14]. Целенаправленное обследование в зависимости от предполагаемой формы ВтАГ и соответствующее лечение проводят в условиях специализированного стационара. Показания к дополнительным и углубленным методам исследования и объем этих исследований при различных формах ВтАГ представлены в соответствующих разделах настоящих рекомендаций.
4.3 Оценка общего сердечно-сосудистого риска при ВтАГ
Оценка общего ССР у больных АГ важна для определения прогноза и тактики лечения. Степень ССР зависит от уровня АД, сопутствующих ФР, наличия сердечно-сосудистых заболеваний (ССЗ), цереброваскулярной болезни (ЦВБ), ХБП, сахарного диабета. Факторы, влияющие на прогноз, применяемые для стратификации общего ССР, представлены в Приложении 1.
Этиологическая связь ВтАГ с поражением различных органов, с активацией ряда гормональных систем, высокий уровень АД (в большинстве случаев АГ 2–3-й степени), значительная распространенность резистентного течения АГ, высокий уровень других ФР, ПОМ, ССЗ, ЦВБ – все эти факторы позволяют рассматривать пациентов с ВтАГ в рамках категорий высокого и очень высокого риска [10]. Для определения тактики лечения данной категории пациентов формальная оценка риска по шкале SCORE не требуется [3][4]. Критерии стратификации ССР у пациентов с АГ представлены в Приложении 2.
5. ФОРМУЛИРОВКА ДИАГНОЗА ВтАГ
При формулировании диагноза отдельных форм ВтАГ следует указывать установленную этиологию, степень АГ (при нахождении в стационаре – на момент поступления), а также ФР и ассоциированные клинические состояния, ССР. У пациентов, получающих АГТ, указывается достигнутая степень АГ [4].
Пример диагностического заключения:
Феохромоцитома правого надпочечника. Степень АГ 3, ГЛЖ. Риск 4 (очень высокий).
6. ТАКТИКА ЛЕЧЕНИЯ АГ
Цель лечения
Основная цель лечения всех форм АГ состоит в максимальном снижении риска развития фатальных и нефатальных сердечно-сосудистых, цереброваскулярных и почечных осложнений. Для достижения этой цели требуется не только снижение АД до целевых уровней, но и коррекция всех модифицированных ФР (курение, дислипидемия, гипергликемия, ожирение и др.), предупреждение или замедление темпа прогрессирования и/или уменьшения выраженности ПОМ, а также лечение имеющихся сопутствующих заболеваний [4].
6.1 Общие принципы ведения больных с ВтАГ
6.1.1 Показания к назначению антигипертензивной терапии
После установления диагноза, уточняющего этиологию ВтАГ, определяется тактика лечения: медикаментозного или хирургического. АГТ проводят как при формах ВтАГ, подлежащих хирургическому лечению в составе патогенетической медикаментозной терапии, так и на всех этапах ведения пациентов с хирургически устранимой этиологией АГ: в предоперационном периоде, а также в послеоперационном периоде в случаях резидуальной АГ и отсутствия достижения целевых значений АД.
Решение вопроса о начале АГТ при всех формах АГ, показания к назначению АГТ определяются индивидуально на основании степени АГ и величины общего (суммарного) ССР [3][4]. Рекомендуемая тактика начала АГТ (модификация образа жизни и лекарственная терапия) при различной степени тяжести АГ представлена на рисунке 1.
|
Высокое нормальное АД 130-139/85-89 мм рт. ст. |
АГ 1-й степени 140-159/90-99 мм рт. ст. |
АГ 2-й степени 160-179/100-109 мм рт. ст. |
АГ 3-й степени АД ≥ 180/110 мм рт. ст. |
| ↓ | ↓ | ↓ | ↓ |
|
Изменение образа жизни |
Изменение образа жизни |
Изменение образа жизни |
Изменение образа жизни |
| ↓ | ↓ | ↓ | ↓ |
|
Рассмотреть медикаментозную терапию у пациентов с очень высоким риском, с ССЗ, особенно при ишемической болезни сердца (ИБС) |
Немедленная медикаментозная терапия у пациентов с высоким и очень высоким риском, с ССЗ, заболеваниями почек или ПОМ |
Немедленная медикаментозная терапия всем пациентам |
Немедленная медикаментозная терапия всем пациентам |
| ↓ | ↓ | ↓ | |
|
Медикаментозная терапия у пациентов с низким/умеренным риском без ССЗ, заболеваний почек или ПОМ через 3-6 мес. изменения образа жизни, если АД не достигло целевых уровней |
Цель лечения – достижение контроля АД в течение 3 мес. |
Цель лечения – достижение контроля АД в течение 3 мес. |
Рисунок 1. Тактика ведения пациентов с АГ
Figure 1. Management of patients with AH
Специальные исследования показаний к АГТ при ВтАГ не проводились. Учитывая, что пациенты с ВтАГ составляют категории высокого и очень высокого риска, целесообразно рекомендовать подходы к их лечению, разработанные в целом для пациентов с АГ с учетом данных категорий ССР.
Незамедлительное начало АГТ рекомендовано пациентам с АГ 2-й или 3-й степени параллельно с мероприятиями по модификации образа жизни. Такая же тактика рекомендована пациентам с АГ 1-й степени и высоким риском ССО [3][4]. Именно у этих категорий пациентов в большинстве случаев диагностируют вторичные формы АГ.
|
Рекомендации |
Класс * |
Уровень * |
|
Пациентам с АГ 2-й и 3-й степени рекомендуется незамедлительное назначение АГТ наряду с изменением образа жизни независимо от степени ССР [17][18] |
I |
A |
|
У пациентов с АГ 1-й степени и высоким ССР или с доказанным ПОМ рекомендовано немедленное начало медикаментозной АГТ одновременно с изменением образа жизни [19][20] |
I |
A |
*здесь и далее: класс рекомендаций и уровень доказательности
*here and below, the class of recommendations and the level of evidence
Показания, определяющие конкретную тактику ведения при различных формах ВтАГ, представлены в соответствующих разделах данных рекомендаций.
6.1.2 Целевые уровни АД
Целевым для всех категорий пациентов является уровень АД < 140/90 мм рт. ст. [21][22]. Снижение АД до 130/80 мм рт. ст. или ниже возможно при условии, что лечение хорошо переносится. У пожилых пациентов (старше 65 лет) целевое систолическое АД должно быть между 130 и 140 мм рт. ст., а диастолическое АД – ниже 80 мм рт. ст. [23]. Систолическое АД на фоне лечения у всех категорий пациентов не должно быть ниже 120 мм рт. ст., а ДАД – 70 мм рт. ст. [3][4]. Темпы снижения АД определяются индивидуально. При плохой переносимости рекомендуется постепенное снижение АД до целевых значений в несколько этапов за 2-4 недели с последующим возможным поддержанием на достигнутом уровне для адаптации пациента к более низким величинам АД. Использование этапной (ступенчатой) схемы снижения АД с учетом индивидуальной переносимости позволяет избежать эпизодов гипотонии, с которыми связано увеличение риска развития ИМ и инсульта. Такой подход особенно важен при ВтАГ у пациентов с длительным анамнезом резистентной АГ и сопутствующим ПОМ. Специальные рандомизированные контролируемые исследования (РКИ) по определению целевых значений АГ при большинстве ВтАГ не проводились. Целевые значения АД при ренопаренхиматозных АГ представлены в соответствующем разделе данных рекомендаций.
|
Рекомендации |
Класс |
Уровень |
|
Всем пациентам с АГ рекомендовано снижение АД < 140/90 мм рт. ст. При условии хорошей переносимости значения АД могут быть ниже 130/80 мм рт. ст., но не ниже 120/70 мм рт. ст. [17] |
I |
A |
|
Пациентам с АГ старше 65 лет рекомендовано поддерживать САД в диапазоне 130–139 мм рт. ст. [17][24][25][26] |
I |
A |
6.1.3. Мероприятия по изменению образа жизни
Всем пациентам с АГ рекомендованы немедикаментозные методы лечения АГ, которые включают коррекцию образа жизни, питания, ограничение потребления поваренной соли менее 5 г/сут, увеличение физической активности, ограничение потребления алкоголя, отказ от курения [3][4]. Немедикаментозные методы лечения способствуют снижению АД, уменьшают потребность в АГП и повышают их эффективность, позволяют осуществить коррекцию ФР.
Особая важность немедикаментозных методов лечения обоснована в составе комбинированной АГТ при РВАГ, обусловленной атеросклеротическим стенозом почечных артерий, при симптоматических почечных АГ, гиперкортицизме, при сопутствующих заболеваниях: метаболическом синдроме, СД, ожирении [27].
6.1.4 Медикаментозная терапия. Тактика моно- и комбинированной АГТ
Для лечения ВтАГ рекомендованы те же пять основных классов АГТ, что и для лечения ГБ.
|
Рекомендации |
Класс |
Уровень |
|
Рекомендованы 5 основных классов АГП: ингибиторы ангиотензинпревращающего фермента (ИАПФ), блокаторы рецепторов ангиотензина II (БРА), блокаторы кальциевых каналов (БКК), диуретики и бета-адреноблокаторы (БАБ) [3][4][17][18][28] |
I |
A |
Все эти классы препаратов могут применяться для начальной и поддерживающей терапии. В многочисленных исследованиях доказана способность этих классов АГП предупреждать развитие ССО, контролировать АГ, обеспечивать органопротекцию. По данным проведенных метаанализов, общее влияние на сердечно-сосудистые исходы и смертность были одинаковы на фоне лечения всеми пятью классами АГП, и все они рекомендованы в качестве основы для АГТ [3][4].
В качестве дополнительных классов АГП для комбинированной терапии могут применяться α-адреноблокаторы (α-АБ), агонисты имидазолиновых рецепторов и прямые ингибиторы ренина (ПИР). Для этих классов АГП не проводились крупные РКИ с целью оценки их влияния на конечные точки, они были изучены в обсервационных исследованиях, где были установлены показания их предпочтительного назначения.
Существуют клинические ситуации, в которых предпочтение следует отдавать тому или иному классу АГП [3][4]. Преимущественные показания к назначению отдельных классов АГП при различных формах ВтАГ обсуждаются в соответствующих разделах данных рекомендаций.
Различные классы АГП имеют абсолютные и относительные противопоказания к их назначению, что важно учитывать при их применении (табл. 7).
|
Препарат |
Противопоказания |
|
|
абсолютные |
относительные |
|
|
Диуретики (тиазидные / тиазидоподобные, например, хлорталидон и индапамид) |
|
|
|
БАБ |
|
|
|
БКК дигидропиридиновые |
─ |
|
|
БКК недигидропиридиновые |
|
|
|
ИАПФ |
|
|
|
БРА |
|
|
* Повышен риск острого снижения функции почек, возможно применение по особым показаниям при условии регулярного контроля за уровнем креатинина сыворотки крови (см. раздел Реноваскулярная АГ).
* There is an increased risk of acute decrease in kidney function; it is possible to use it for special indications, provided that the serum creatinine level is regularly monitored (see the section Renovascular hypertension).
Для большинства пациентов с АГ, особенно при ВтАГ, в качестве начальной терапии рекомендуется комбинированная АГТ из двух препаратов, предпочтительно, включающая блокаторы РАС (ИАПФ или БРА) в сочетании с БКК или диуретиком (рис. 2).
|
Начальная терапия: двойная комбинация |
ИАПФ или БРА + БКК или диуретик |
Монотерапия для пациентов низкого риска, очень пожилых (> 80 лет) или ослабленных пациентов |
|
↓ |
||
|
Шаг 2 тройная комбинация |
ИАПФ или БРА + БКК + диуретик |
|
|
↓ |
||
|
Шаг 3 тройная комбинация + спиронолактон или другой препарат |
Резистентная АГ Добавить спиронолактон (25-50 мг 1 раз в сутки) или другой диуретик, α-АБ или БАБ |
Направить в специализированный центр для дообследования |
|
БАБ могут быть назначены на любом этапе лечения при наличии особых показаний: сердечная недостаточность, стенокардия, перенесенный ИМ, ФП¸ беременность (планирование беременности) |
Рисунок 2. Тактика комбинированной АГТ для достижения целевого АД
Figure 2. Tactics of combination antihypertensive therapy (AHT) to achieve the target blood pressure (BP)
При рациональной (эффективной) комбинированной АГТ в большинстве случаев назначение препаратов с различными механизмами действия позволяет добиться целевого АД, а также подавить контррегуляторные механизмы повышения АД и минимизировать количество побочных эффектов. Целесообразно применение фиксированных комбинаций АГП в одной таблетке, такая тактика повышает приверженность больных к лечению [29]. Дополнительные классы АГП могут применяться в качестве 4-й или 5-й линии выбора.
Не рекомендовано применение нерациональной комбинированной АГТ, при использовании которой не происходит потенцирования антигипертензивного эффекта препаратов и/или усиливаются побочные эффекты при их совместном применении. К таким комбинациям относятся сочетания разных лекарственных средств, относящихся к одному классу АГТ; БАБ + недигидропиридиновый БКК; ИАПФ + калийсберегающий диуретик; БАБ + препарат центрального действия.
У пациентов с резистентной АГ показано, что включение в комбинированную АГТ небольших доз (25–50 мг) спиронолактона обеспечивает дополнительное снижение АД [30]. На фоне приема антагонистов минералокортикоидных рецепторов следует регулярно определять уровень калия и концентрацию креатинина в сыворотке крови, учитывая возможность ухудшения функции почек, особенно при одновременном приеме спиронолактона и блокатора РАС. Использование спиронолактона для лечения РАГ должно быть ограничено пациентами с показателем рСКФ > 45 мл/мин и концентрацией калия в плазме менее 4,5 ммоль/л [3][4].
Важная составная часть лечения ВтАГ – патогенетическая терапия основного заболевания – при патологии почек, дисфункции щитовидной железы, гиперкортицизме, васкулитах (представлено в соответствующих разделах данных рекомендаций). Без этиологического (где возможно) и патогенетического лечения достижение целевых значений АД значительно затруднено.
|
Рекомендации |
Класс |
Уровень |
|
Комбинированная АГТ рекомендована большинству пациентов с АГ в качестве начальной терапии. Предпочтительные комбинации должны включать блокатор РАС (ИАПФ или БРА) с БКК или диуретиком. Могут быть использованы и другие комбинации пяти основных классов АГТ [29][31][32] |
I |
A |
|
Рекомендуется начинать АГТ с двойной комбинации препаратов, желательно в фиксированных в одной таблетке дозах препаратов, что улучшает приверженность к лечению [29][33] |
I |
B |
|
Рекомендуется назначать БАБ в комбинации с любым из других основных классов АГП при наличии определенных клинических ситуаций, например, стенокардии, постинфарктного кардиосклероза, сердечной недостаточности или при необходимости контроля ЧСС [31] |
I |
A |
|
Рекомендуется при отсутствии достижения контроля АД комбинацией двух АГП перейти на комбинацию из трех АГП, обычно блокатора РАС с БКК и тиазидным (тиазидоподобным) диуретиком, предпочтительно в форме фиксированной комбинации [34] |
I |
A |
|
Пациентам с РАГ рекомендуется добавление низких доз спиронолактона к существующему лечению. При непереносимости спиронолактона рекомендуется добавление к текущей терапии эплеренона, амилорида, БАБ или α-АБ [30][35] |
I |
B |
|
Не рекомендуется применение комбинации двух блокаторов РАС [36] |
III |
A |
6.1.5 Терапия для коррекции факторов риска и сопутствующих заболеваний
При многих ВтАГ течение заболевания ассоциировано с ожирением, нарушениями углеводного обмена, дислипидемией, гиперурикемией, метаболическим синдромом, наблюдается высокая частота развития ССО. Пациентам с АГ умеренного и высокого риска, а также с ССЗ применение только АГТ недостаточно для снижения ССР. Терапия, направленная на коррекцию ФР и сопутствующих заболеваний – важная составная часть медикаментозного лечения этой категории больных АГ.
Основная тактика гиполипидемической терапии у больных высокого и очень высокого риска ССО заключается в назначении статина в максимально переносимой дозе для достижения целевых уровней ХС ЛПНП [27][37][38]. Всем пациентам с АГ рекомендовано применение аспирина в низких дозах (75–150 мг/сут) с целью вторичной профилактики ССО и ЦВБ: при наличии в анамнезе перенесенного ИМ, ишемического инсульта или транзиторной ишемической атаки (ТИА) [39]. Не рекомендуется назначать аспирин для первичной профилактики пациентам с АГ без ССЗ [39].
6.1.6 Тактика лечения при экстренных и неотложных состояниях, обусловленных АГ
Экстренные и неотложные состояния нередко осложняют течение ВтАГ и представляют собой ситуации, при которых тяжелая АГ (3-й степени) ассоциируется с острым поражением органов, что нередко является жизнеугрожающим и требует немедленных квалифицированных действий, направленных на снижение АД, обычно с помощью внутривенной терапии [40]. При определении тяжести поражения органов скорость и степень повышения АД могут быть так же важны, как и абсолютный уровень АД [41]. К неотложным состояниям относят гипертонические кризы, их характеризует остро возникшее выраженное повышение АД, сопровождающееся клиническими симптомами, требующее немедленного контролируемого его снижения с целью предупреждения ПОМ. Осложненный гипертонический криз сопровождается жизнеугрожающими осложнениями, появлением или усугублением ПОМ.
Чаще всего в экстренной помощи нуждаются пациенты с тяжелым, нередко осложненным гипертоническим кризом – характерным проявлением феохромоцитомы; пациенты с тяжелой, резистентной, злокачественной АГ, связанной с другими клиническими состояниями, которые требуют срочного снижения АД: острое расслоение аорты, острая ишемия миокарда или острая сердечная недостаточность; пациенты с острым повышением АД вследствие приема симпатомиметиков (амфетамин, кокаин).
Пациентам с осложненным гипертоническим кризом показана госпитализация и лечение в отделении неотложной кардиологии [40]. Для уточнения диагноза, характера и степени ПОМ предусмотрен диагностический алгоритм, включающий лабораторные и инструментальные методы исследования [4].
Тактика лечения при осложненном гипертоническом кризе: рекомендуется обеспечить быстрое, но не более чем на 25% снижение АД, вопрос о степени и скорости дальнейшего снижения АД решается в каждом случае индивидуально. Для экстренного снижения АД используются парентеральные препараты [4]. Применяют вазодилататоры: нитроглицерин (предпочтителен при остром коронарном синдроме (ОКС) и острой левожелудочковой недостаточности); нитропруссид натрия (является препаратом выбора при острой гипертонической энцефалопатии); БАБ: метопролол, эсмолол (предпочтительны при расслаивающей аневризме аорты и ОКС); α-АБ (урапидил); диуретики (фуросемид при острой левожелудочковой недостаточности); нейролептики (дроперидол – с осторожностью, учитывать возможность выраженной артериальной гипотонии, потенцирует действие АГП, противопоказан при феохромоцитоме); ИАПФ (эналаприлат).
7. ВТОРИЧНЫЕ ПОЧЕЧНЫЕ АРТЕРИАЛЬНЫЕ ГИПЕРТОНИИ
7.1 Определение
Вторичные почечные АГ – группа вторичных, то есть обусловленных известной и потенциально устранимой причиной АГ, вызванных заболеваниями паренхимы и микрососудистого русла почек. Для их обозначения также используют термин «ренопаренхиматозные АГ», отличая их от группы РВАГ, связанных с нарушением кровотока в магистральных сосудах почек.
Рубрика по МКБ-10:
I15.1 Гипертензия вторичная по отношению к другим поражениям почек.
7.2 Эпидемиология
Почечные АГ приобретают всё бо́льший вес вследствие старения населения, неуклонного роста распространённости в популяции ХБП, в особенности диабетической нефропатии (ДН). Частота АГ у пациентов с заболеваниями почек существенно превышает показатели общей популяции и нарастает по мере прогрессирования ХБП: при СКФ ≥ 60 мл/мин/1,73 м2 она составляет 40%, при СКФ < 60 мл/мин/1,73 м2 частота АГ резко увеличивается, достигая 75% при СКФ < 30 мл/мин/1,73 м2, а у больных с терминальной почечной недостаточностью (ТПН) она превышает 90% [42][43][44][45].
АГ занимает важное место в клинической картине различных заболеваний почек (табл. 
7.3 Классификация
Выделяют три клинических варианта ренопаренхиматозной АГ в соответствии с основными нефрологическими синдромами, в структуру которых входит повышение АД.
Остронефритический синдром характерен для острого и многих форм хронического гломерулонефрита. Он включает, кроме АГ, гематурию, выраженную протеинурию, иногда – транзисторную дисфункцию почек. В рамках остронефритического синдрома АГ отражает активность иммуновоспалительного повреждения почек и может иметь обратимый характер в результате успешной иммуносупрессивной терапии.
Синдром ишемической нефропатии развивается при нефропатиях, ассоциированных с антифосфолипидным синдромом, тромботическими микроангиопатиями, системной склеродермией. Для этой формы вторичной почечной АГ характерно сочетание выраженного повышения АД с ранним нарушением функции почек при отсутствии значительной протеинурии и изменений мочевого осадка. Данная форма вторичной почечной АГ также потенциально обратима – своевременное назначение антикоагулянтной и другой патогенетической терапии во многих случаях позволяет добиться частичного снижения или полной нормализации АД.
Вторичная почечная АГ в рамках синдрома хронической почечной недостаточности (ХПН) формируется на поздних стадиях нефропатии любого генеза вследствие выраженного нефросклероза с утратой большей части функционально активной паренхимы почек. Это приводит не только к необратимому снижению способности почек регулировать АД, но и усугублению нарушений липидного, углеводного, пуринового обмена, развитию анемии, костно-минеральных нарушений с кальцинозом магистральных артерий и утратой их эластичности, накоплению в организме уремических токсинов, провоспалительных цитокинов, повреждающих эндотелий. Каждый из этих факторов вносит самостоятельный вклад в формирование АГ и развитие её резистентности к лечению. У больных c ТПН в результате успешной заместительной почечной терапии (ЗПТ) в некоторых случаях возможна полная нормализация АД, напротив, при плохой переносимости диализа возникают особые формы нарушений гемодинамики, связанные исключительно с данной процедурой – интрадиализная АГ и интрадиализная гипотония.
Для определения категории тяжести повреждения почек и нарушения их функции используют общепринятые подходы, сформулированные в клинических рекомендациях по ведению ХБП [46][47][48] (см. Приложения 4,5).
7.4 Скрининг. Категории пациентов высокого риска
О вторичном почечном генезе АГ косвенно свидетельствуют некоторые её клинические особенности и наличие ФР ХБП (табл. 8). Однако независимо от наличия данных ФР всем больным с впервые выявленной АГ показано клинико-лабораторное обследование, позволяющее выявить признаки повреждения и дисфункции почек.
|
|
|
|
|
|
|
|
|
|
Наиболее убедительно судить о вторичном характере АГ по отношению к заболеванию почек позволяет соотношение времени появления признаков ХБП и повышения АД. Вторичная почечная АГ возникает либо одновременно с первыми проявлениями заболевания почек, либо на поздних его стадиях по мере снижения функции. Для ХБП вторичной по отношению к эссенциальной АГ характерна иная стадийность: постепенное нарастание альбуминурии спустя несколько лет от начала стойкого повышения АД с последующим развитием медленно прогрессирующего снижения скорости клубочковой фильтрации. Однако на практике при отсутствии регулярных обследований бывает трудно установить истинное время развития АГ и ХБП. Более надёжный критерий – сопоставление АГ и клинической симптоматики ХБП. Если повышенное АД укладывается в картину перечисленных выше трёх основных нефрологических синдромов (остронефритического, ишемической нефропатии и ХПН), если есть параллели в ответе на проводимую патогенетическую терапию со стороны ХБП и АГ, это позволяет с уверенностью классифицировать АГ как вторичную почечную. Ввиду широкой распространённости эссенциальной АГ и ХБП в общей популяции нередки случаи, когда самостоятельное заболевание почек (например, гломерулонефрит) развивается у человека, длительно страдавшего ГБ. Поэтому даже если проявления ХБП возникают у пациента с уже имеющейся некоторое время АГ, которая при первичном обследовании классифицирована как эссенциальная, нельзя механистически относить признаки повреждения и дисфункции почек к симптоматике исключительно ГБ. Для исключения гломерулонефрита и других первичных заболеваний почек в таких случаях необходима консультация нефролога. Если в результате обследования будет установлено развитие заболевания почек как новой нозологии на фоне предсуществующей ГБ, то и АГ с данного момента должна реклассифицироваться как вторичная почечная, а подходы к её лечению должны быть пересмотрены в соответствии с данными рекомендациями.
Возможно также сочетание ХБП и АГ в рамках системных заболеваний (СД, МС, аутоиммунные заболевания соединительной ткани и васкулиты), которые одновременно поражают и сердечно-сосудистую систему, и почки. Хотя и АГ, и ХБП в данном случае являются следствиями основного системного заболевания, однако наличие ХБП, особенно нарушения функции почек, меняет клинические характеристики АГ и подходы к её коррекции, которые должны соответствовать принципам лечения вторичной почечной АГ.
Наличие ХБП существенно изменяет спектр ФР неблагоприятных исходов у больных с АГ и относительное влияние каждого из них на прогноз. Появляются «почечные» ФР – повышенная альбуминурия и снижение функции почек, приводящее к комплексу костно-минеральных нарушений, анемии, которые вызывают ремоделирование магистральных артерий и миокарда. Традиционные «фремингемские» ФР не теряют своего неблагоприятного влияния, однако их относительный вес существенно уступает «почечным» ФР. Поэтому использование шкалы SCORE или Фремингемской методики расчёта ССР при ХБП даёт искаженные (существенно заниженные по сравнению с реальными исходами больных) результаты [49]. Шкала стратификации комбинированного риска прогрессирования ХБП и развития ССО (см. Приложение 6) была разработана экспертами KDIGO [46] на основании метаанализа 45 когорт (в общей сложности 1 555 332 обследованных). С высокой степенью доказательности было установлено, что степень снижения СКФ и выраженность альбуминурии независимым образом определяют риск развития неблагоприятных почечных и сердечно-сосудистых исходов. Отсутствие в шкале KDIGO традиционных изменяемых факторов риска ССО – гиперлипидемии, ожирения, курения и самого уровня АД – не умаляет необходимости их коррекции для улучшения прогноза, но отражает факт доминирования почечных ФР, которых может быть достаточно для развития неблагоприятных исходов даже при полном отсутствии фремингемских ФР.
|
Рекомендации |
Класс |
Уровень |
|
Всем пациентам с впервые выявленной АГ рекомендуется выполнить комплексное клинико-лабораторное обследование состояния почек с целью исключения её почечного генеза |
I |
С |
|
Всем пациентам с выявленной ранее эссенциальной АГ в случае изменения её течения – резкого нарастания тяжести, формирования резистентности к эффективной ранее терапии, а также появления отдельных клинических симптомов поражения почек или признаков системного аутоиммунного заболевания рекомендуется повторить комплексное клинико-лабораторное обследование состояния почек в связи с возможным развитием нового первичного заболевания почек, требующего реклассифицировать АГ как вторичную почечную |
I |
С |
|
Рекомендуется для стратификации комбинированного риска прогрессирования ХБП и развития ССО у больных с вторичной почечной АГ использовать шкалу KDIGO (Kidney Disease: Improving Global Outcomes) [46], которая учитывает уровень СКФ и величину альбуминурии/протеинурии |
I |
А |
7.5 Диагностика
Диагностика вторичной почечной АГ на первом этапе состоит из общетерапевтического обследования, цель которого – выявить наличие ХБП, выраженность повреждения и дисфункции почек, оценить в соответствии со шкалой KDIGO (см. Приложение 6) риск развития ТПН и ССО, определить показания к консультации нефролога. Оно включает базовые исследования состояния почек, но не даёт возможности установить нозологическую форму ХБП. Второй этап – специализированное нефрологическое обследование, имеющее целью установить нозологический диагноз, подобрать этиотропное и патогенетическое лечение.
Общетерапевтическое обследование проводится врачом-терапевтом или кардиологом. При анализе жалоб, данных анамнеза необходимо обращать особое внимание на наличие характерных для вторичной почечной АГ особенностей гипертонического синдрома, наличие ФР и симптомов ХБП, а для этого: уточнять и сопоставлять давность развития АГ и первых признаков повреждения, дисфункции почек, оценивать стабильность течения АГ, чувствительность к лечению; выявлять и фиксировать жалобы на изменение внешнего вида мочи и расстройства мочевыделения, наличие отёков, изменения веса, связанные с задержкой жидкости; выяснять наличие хронических системных заболеваний, при которых могут поражаться почки; уточнять наличие в анамнезе изменений в анализах мочи, признаков нарушений функции почек и их структурных изменений по данным лучевых методов диагностики, перенесённых операций на почках, у женщин – почечных осложнений беременности; тщательно исследовать фармакологический анамнез: фиксировать факт регулярного и частого (каждую неделю и чаще) приёма анальгетиков, нестероидных противовоспалительных препаратов (НПВП) и других средств, обладающих способностью вызывать повреждение почек, учитывать использование в прошлом рентгеноконтрастных препаратов. При осмотре необходимо обращать внимание: на наличие кожных высыпаний, характерных для системных заболеваний; на изменения суставов; на наличие отёков, гидроторакса, асцита. Большое значение имеет вес (как показатель наличия МС) и его резкие изменения, характерные для отёчного синдрома, аутоиммунных заболеваний, паранеопластического синдрома. При физическом исследовании пациента с АГ следует фиксировать признаки поражения периферических артерий, асимметрию пульса и АД, проводить аускультацию в проекции брюшной аорты и почечных артерий для выявления возможных стенозов (с целью дифференциальной диагностики реноваскулярной и ренопаренхиматозной АГ). Измерение АД при подозрении на вторичный почечный характер АГ проводится в соответствии с универсальными правилами регистрации АД. По данным СМАД, при хроническом гломерулонефрите у половины больных отмечается недостаточное снижение АД в ночные часы, а у каждого пятого – инверсия суточного ритма АД, когда средненочное АД выше среднедневного, что коррелирует независимым образом с неблагоприятным прогнозом [50][51]. При пограничных значениях АД это может приводить к гиподиагностике АГ и неадекватной (недостаточно интенсивной) тактике лечения.
Методы лабораторной диагностики
Общий анализ крови позволяет выявить анемию, которая может быть следствием как самого заболевания почек, так и системного заболевания с вторичным поражением почек, лейкоцитоз в сочетании с повышением скорости оседания эритроцитов, лейкопения, изменения лейкоцитарной формулы характерны для инфекций, в том числе почек, аутоиммунных системных заболеваний, гемобластозов. Тромбоцитопения может быть признаком системной красной волчанки, тромботических микроангиопатий, поражений печени с системными проявлениями. Анемия или панцитопения может быть следствием интоксикаций органическими растворителями, солями тяжелых металлов, злоупотребления анальгетиками и другими препаратами, вызывающими интерстициальный нефрит.
Клинический анализ мочи: выявление протеинурии позволяет диагностировать ХБП любой природы, но наиболее высокие значения протеинурии характерны для гломерулярных заболеваний почек. Количественная оценка протеинурии важна также для прогноза прогрессирования заболевания почек, выбора тактики патогенетического лечения заболевания почек, антигипертензивной и нефропротективной терапии, оценки её эффективности. Микрогематурия может быть связана с целым рядом причин разной степени угрозы. Впервые выявленная гематурия, а также персистирующая изолированная гематурия (без протеинурии) требуют обязательной консультации уролога. Лейкоцитурия может отмечаться при инфекциях мочевых путей и пиелонефрите, туберкулезе почек, аутоиммунных и токсико-аллергических поражениях инвестиция почек. Выявленные изменения в общем анализе мочи могут потребовать уточняющих дополнительных исследований мочи на стадии нефрологического обследования. Тест на альбуминурию является высокочувствительным методом диагностики не только вторичного повреждения почек при ГБ, но и диабетической нефропатии, нефропатии, ассоциированной с МС, которые приводят к развитию вторичной почечной АГ. При заболеваниях почек любой природы тест на альбуминурию более точно отражает тяжесть повреждения почек при уровне общего белка в моче ниже 0,5 г/л. При значениях протеинурии ≥ 0,5 г/л проведение теста на альбуминурию в дополнение к общему анализу мочи считается нерациональным, поскольку в данном диапазоне значений уровень общего белка с достаточной достоверностью отражает тяжесть поражения почек.
На сегодня креатинин остаётся важнейшим биомаркером нарушения функции почек. Однако уровень его в сыворотке крови зависит от ряда факторов, ориентируясь на него можно проводить лишь грубую оценку функции почек. Для исключения гиподиагностики и более точного определения функции почек необходимо рассчитать СКФ с помощью уравнений CKD-EPI (табл. 9), учитывающих возможные погрешности. Этот метод позволяет оценить стадию ХБП, что крайне важно для прогноза и тактики ведения. Широко применявшиеся в прошлом уравнения Cockroft-Gault, MDRD существенно уступают в точности оценки СКФ уравнениям CKD-EPI.
|
Метод |
Достоинства |
Ограничения |
|
Формула CKD-EPI для расчёта СКФ по уровню креатинина сыворотки для взрослых (для детей – формула Schwartz) |
Доступность, удобство – не нужно собирать суточную мочу |
У людей с нестандартной мышечной массой дает неточные результаты |
|
Формула CKD-EPI для расчёта СКФ по уровню цистатина С сыворотки |
Нивелирует влияние мышечной массы на точность определения |
Очень высокая стоимость. Применение цистатина С не исключает погрешности измерения СКФ |
|
Оценка СКФ по клиренсу креатинина в пробе Реберга |
Более точная оценка функции, позволяет непосредственно исследовать СКФ |
Трудоёмка – нужен сбор суточной мочи. Более высокая стоимость. Погрешности в сборе и измерении объема мочи приводят к ошибкам |
|
Радиоизотопное исследование с определением клиренса 51Cr-EDTA, 99mTc-DTPA и др. |
Наиболее точное исследование функции, позволяет раздельно оценить работу правой и левой почки |
Очень высокая стоимость, нужна радиоизотопная лаборатория, требуется введение изотопа |
Определение уровня мочевины сыворотки существенно дополняет исследование креатинина, поскольку она является хоть менее специфичным и точным, но более динамичным показателем, иногда повышающимся раньше креатинина при поражении почек, и отражает состояние обмена азота. Показатели углеводного, липидного обмена имеют особое значение при вторичных почечных АГ, поскольку нарушение функции почек, наличие выраженной протеинурии, нефротического синдрома, их усугубляет. С другой стороны, они имеют ключевую роль в диагностике нефропатий, ассоциированных с СД, МС, гиперурикемией (уратная нефропатия).
Инструментальные методы диагностики
Базовым инструментальным методом оценки структуры почек является УЗИ как безопасный, доступный и диагностически ценный метод исследования структуры почек. Этот метод позволяет выявить следующие нарушения, которые могут указывать на почечный генез АГ: аномалии почек; изменение объёма, формы, внешних контуров и диффузные изменения паренхимы почек; очаговые изменения паренхимы почек; расширение и деформация, уплотнение чашечно-лоханочной системы, камни. Кроме того, позволяет также выявить асимметрию изменений почек, характерную в большей степени для вазоренальной АГ, для пиелонефрита, туберкулёза, некоторых врождённых аномалий. При гломерулонефритах и других гломерулопатиях, интерстициальных нефритах, сосудистых нефропатиях с поражением сосудов малого калибра наблюдается картина симметричного и диффузного поражения обеих почек. На этапе специализированного обследования данные, полученные при УЗИ, проверяют и уточняют с помощью более совершенных методов лучевой диагностики. Ультразвуковая допплерография (УЗДГ) позволяет оценивать состояние кровотока в почечных, сегментарных, междолевых, дуговых артериях, почечных венах, косвенно судить о состоянии почечной микроциркуляции.
Специализированное нефрологическое обследование
Этап общетерапевтического обследования позволяет установить лишь сам факт наличия ХБП и оценить, к какой категории риска её прогрессирования относится пациент. Задача специализированного нефрологического обследования – провести дифференциальный диагноз, верифицировать вторичный характер АГ по отношению к заболеванию почек, установить нозологическую форму ХБП, разработать план этиотропной, патогенетической и нефропротективной терапии. У пациентов с СКФ ниже 60 мл/мин/1,73 м2, альбуминурией ≥ 300 мг/л, протеинурией ≥ 0,5 г/л, множественными кистами в почках вероятность вторичной почечной АГ особенно велика, они характеризуются высоким или очень высоким риском развития ТПН, поэтому в этих случаях консультация нефролога является строго обязательной. Наблюдение нефролога с ранних стадий заболевания почек существенно замедляет темпы прогрессирования ХБП и повышает выживаемость пациентов на этапе заместительной почечной терапии [52]. Нефрологическое обследование может включать в себя целый ряд дополнительных лабораторных и инструментальных методов в соответствии с нефрологическими клиническими рекомендациями по ХБП и для отдельных нозологий [48]. Среди причин вторичной почечной АГ могут быть крупные кисты, расположенные в воротах почки и нарушающие кровоток, обструктивная нефропатия, опухоль почки – заболевания, требующие урологического обследования и лечения.
|
Рекомендации |
Класс |
Уровень |
|
Целесообразно для уточнения тяжести АГ и планирования тактики АГТ дополнять стандартное измерение АД в медицинском учреждении данными СМАД и СКАД [50][51] |
IIa |
В |
|
Рекомендуется всем пациентам с подозрением на вторичный почечный генез АГ проведение общего анализа крови, клинического анализа мочи и теста на альбуминурию, проведение биохимического исследования крови с определением концентрации креатинина, мочевины и последующим расчётом СКФ с помощью уравнений CKD-EPI, а также исследование концентрации мочевой кислоты, калия, ОХС и его фракций, ТГ, глюкозы [42] |
I |
А |
|
Рекомендуется всем пациентам с подозрением на вторичный почечный генез АГ проведение УЗИ почек для выявления их возможного повреждения |
I |
С |
|
Целесообразно всем пациентам с подозрением на ренопаренхиматозный генез АГ проведение УЗДГ сосудов почек для дифференциальной диагностики с РВАГ |
IIa |
С |
|
Всем пациентам с АГ, у которых на этапе общетерапевтического обследования выявлен хотя бы один из следующих признаков ХБП: СКФ ниже 60 мл/мин/1,73 м2, альбуминурия ≥ 300 мг/г, либо протеинурия ≥ 0,5 г/л, множественные кисты в почках по данным УЗИ – рекомендуется первичная консультация нефролога и специализированное нефрологическое обследование [42] |
I |
А |
|
Всем пациентам с АГ, у которых на этапе общеклинического обследования выявлен хотя бы один из следующих признаков поражения почек и мочевых путей: гематурия (моча цвета «мясных помоев», повышенный уровень эритроцитов в общем анализе мочи или пробе Нечипоренко, эритроцитарные цилиндры в моче), обнаружение по данным УЗИ камней, солидных образований почек, крупных и имеющих признаки атипии кист, признаков обструкции мочевых путей – рекомендуется первичная консультация уролога |
I |
А |
7.6 Лечение
Лечение пациентов с вторичной почечной АГ преследует двуединую цель снижения риска ССО и предотвращения прогрессирования ХБП с развитием ТПН. С точки зрения потенциального влияния как на сердечно-сосудистые, так и почечные исходы решаются такие важные вопросы, как определение целевого АД, выбор препаратов и их комбинаций. Лечение включает этиотропную (где возможна) и патогенетическую терапию основного заболевания почек, которая проводится по соответствующим для данной нозологии клиническим рекомендациям [48], собственно АГТ, которая имеет свои особенности по сравнению с терапией ГБ, нефропротективное (замедляющее прогрессирование ХБП) и дополнительное лечение, направленное на коррекцию метаболических нарушений, усугубляющих риск ССО, и осложнений ХБП. Определение тактики коррекции АГ у больных, получающих заместительную почечную терапию, требует отдельного рассмотрения [53] и в данных рекомендациях не рассматривается.
В ранних клинических исследованиях, посвящённых нефропротекции, было показано, что контроль АД, более строгий по сравнению с принятым тогда стандартным контролем АД (ниже 140/90 мм рт. ст.) обеспечивает торможение прогрессирования ХБП у больных с высоким уровнем протеинурии [54]. Поэтому целевой уровень АД определяли в зависимости от уровня альбуминурии/протеинурии [42][55]. В более поздних исследованиях было показано, что с точки зрения кардиопротекции и общего прогноза строгий контроль АД обладает универсальными преимуществами – в том числе у пациентов с невысокой протеинурией [56]. Принятый в последние годы курс на более строгий контроль АД со смещением целевого уровня с < 140/90 мм рт. ст. до < 130/80 мм рт. ст. [57], а в некоторых клинических рекомендациях < 120/80 мм рт. ст. [58] требует особо тщательного подхода к оценке безопасности терапии, исключения эпизодов гипотонии. Нижняя граница оптимальных значений САД – 110 мм рт. ст. впервые была обозначена в клинических рекомендациях KDOQI по контролю АД при ХБП [59] на основании метаанализа, показавшего U-образную зависимость риска ухудшения функции почек от уровня САД: оказались неблагоприятны цифры как выше 130, так и ниже 110 мм рт. ст. [60]. При низких цифрах АД вследствие централизации кровотока развивается ишемия почек, приводящая к их повреждению. Большое значение для выявления нестабильности АД на фоне терапии, эпизодов гипотонии имеет СМАД, а также СКАД.
Немедикаментозные методы лечения
Всем пациентам с вторичной почечной АГ показаны нелекарственные методы лечения, эффективно дополняющие медикаментозную антигипертензивную, нефро- и кардиопротективную терапию. Установлено, что низконатриевая диета (менее 2 г или 90 ммоль натрия, что соответствует 5 г хлорида натрия) у пациентов, получающих БРА, приводит к дополнительному снижению АД, а также альбуминурии или протеинурии.
Разработаны соответствующие рекомендации по диетическим ограничениям при ХБП разной этиологии [61][62][63], показано благоприятное влияние отказа от курения на прогноз пациентов с ХБП [63], исследовано влияние потребления алкоголя на риск развития ХБП [64], не вызывает сомнения, что его потребление в больших дозах негативно влияет и на состояние почек. В большинстве случаев ХБП благоприятным считают расширенное потребление воды. Неоправданное ограничение потребления жидкости ведёт к гиповолемии, сопровождается уменьшением перфузии почек и развитием их хронической ишемии и ряду неблагоприятных последствий [65]. Важно подчеркнуть, что в условиях гиповолемии существенно повышается риск побочных эффектов препаратов, подавляющих РАС, составляющих основу лечения пациентов с вторичной почечной АГ. Неблагоприятное значение сниженного потребления жидкости в отношении риска развития ХБП было показано в эпидемиологических исследованиях [66]. Было также показано, что между потреблением жидкости и риском неблагоприятных почечных исходов у больных с уже имеющейся ХБП существует U-образная зависимость [67]. Необходимы дальнейшие исследования для уточнения оптимального водного режима у пациентов с уже имеющейся ХБП. Избыточное потребление белка приводит к нарушению почечной гемодинамики, развитию клубочковой гипертензии и гиперфильтрации, высокой альбуминурии, которые способствуют прогрессированию ХБП. Поэтому пациентам с ХБП С1-С2 не рекомендуется превышать стандартное потребление белка (1,0-1,2 г/кг/сут). Пациентам со сниженной функцией почек необходимо ограничивать потребление белка с пищей, поскольку он не только ускоряет темпы прогрессирования ХБП, но и усугубляет характерные для поздних её стадий нарушения азотистого, фосфорно-кальциевого обмена, гиперкалиемию и метаболический ацидоз [68]. Решение о назначении малобелковых диет принимает нефролог с учётом риска возможных осложнений. При назначении обычной малобелковой диеты важно, чтобы 2/3 потребляемого белка составлял белок высокой биологической ценности (животные белки, соевые продукты). Строгая малобелковая диета должна обязательно сочетаться с приёмом препарата незаменимых аминокислот и их кетоаналогов [68].
Нарушение функции почек ведёт к повышению уровня мочевой кислоты сыворотки крови, задержке калия и фосфора, что негативно сказывается на состоянии сердечно-сосудистой системы, паращитовидных желёз, опорно-двигательного аппарата. Поэтому продукты, богатые пуриновыми основаниями, калием, фосфором, противопоказаны пациентам с вторичной почечной АГ. Дозированные физические нагрузки показаны всем пациентам с ХБП, кроме больных с нефротическим синдромом, острой почечной недостаточностью. Упражнения, связанные со значительным сотрясением тела, нежелательны людям, склонным к опущению почки. Занятия физкультурой должны быть регулярными и равномерно распределены в течение недели – как минимум по 30 минут в день 5-7 раз в неделю или по часу 3 раза в неделю.
Медикаментозное лечение
Все больные с вторичной почечной АГ нуждаются в обязательном применении медикаментозного лечения. Для достижения целевого АД при ХБП требуется в среднем более 3 препаратов [57]. Желательно добиваться достижения целевого АД в течение первых 3 месяцев лечения. Гиперактивация РАС является ключевым механизмом развития вторичной почечной АГ, при этом она участвует в прогрессировании ХБП, ремоделировании миокарда и сосудов эластического типа. Подавление РАС с использованием ИАПФ или БРА снижает протеинурию и риск развития ТПН, однако данные эффекты зависят от исходного уровня протеинурии [69][70]. На сегодняшний день доказаны преимущества назначения препаратов, подавляющих РАС, перед другими АГП у пациентов с недиабетическими нефропатиями с очень высокой альбуминурией (категория А3), у больных с ХБП при сахарном диабете и уровнем альбуминурии А2-А3. У больных с недиабетическими нефропатиями с альбуминурией категории А2 польза от преимущественного назначения препаратов, подавляющих РАС, не так очевидна. ХБП с альбуминурией категории А1 (< 30 мг/сут) на сегодня не рассматривается в качестве аргумента в пользу предпочтения ИАПФ или БРА другим АГП. На стадии лечения диализом, когда угрозы гиперкалиемии уже нет, препараты, блокирующие РАС, могут быть назначены с целью коррекции АГ и кардиопротекции.
Побочные эффекты ИАПФ и БРА в отношении почек развиваются вследствие чрезмерного снижения клубочкового давления в условиях сниженной перфузии клубочков (при нарушении проходимости почечных артерий, застойной сердечной недостаточности, гиповолемии). Подавление продукции альдостерона предрасполагает к гиперкалиемии. Поэтому мониторинг креатинина и калия сыворотки необходим на всем протяжении лечения данными препаратами, даже в случае начальной хорошей переносимости. ФР резкого повышения уровня креатинина сыворотки на фоне приёма ИАПФ или БРА являются пожилой возраст, выраженный атеросклероз, застойная сердечная недостаточность, ХБП С3б-С5, регулярный приём анальгетиков, НПВП, ухудшающих почечный кровоток. Одним из путей снижения риска данного осложнения является адекватный водный режим, исключение гиповолемии. С целью профилактики и коррекции гиперкалиемии применяют низкокалиевую диету, петлевые диуретики и калийсвязывающие энтеросорбенты.
Уровень креатинина и калия сыворотки крови определяют перед первым назначением препарата, подавляющего РАС, затем через 5-7 дней для оценки динамики. В случае прироста уровня креатинина на ≥ 30% от исходного уровня необходимо приостановить приём данного препарата и провести исследование почечной гемодинамики с помощью УЗДГ. При развитии гиперкалиемии также необходимо приостановить приём препарата, подавляющего РАС, и принять меры для нормализации уровня калия (строгая низкокалиевая диета, назначение салуретиков и энтеросорбентов, селективно связывающих калий). Подобным же образом оценивают динамику уровня креатинина и калия сыворотки после увеличения дозы препарата, подавляющего РАС, или его замены на другой представитель данной группы, а также в ходе диспансерного наблюдения (см. «Дальнейшее наблюдение»). При развитии стойкой тенденции к гиперкалиемии у пациента, получающего ИАПФ, целесообразна его замена на один из БРА, при использовании которых повышений уровня калия сыворотки встречается значительно реже. В случае прироста уровня креатинина на ≥ 30% от исходного уровня попытка замены ИАПФ на БРА нецелесообразна, поскольку данное нежелательное явление в равной мере характерно для обеих групп препаратов.
Дополнительное назначение тиазидного или петлевого мочегонного в 1,5-2 раза усиливает антигипертиензивный и антипротеинурический эффект препаратов, подавляющих РАС [71]. БКК, в отличие от мочегонных, являются метаболически нейтральными, их действие не ослабевает, а безопасность остаётся высокой на поздних стадиях ХБП. Комбинация ИАПФ с БКК способствует замедлению прогрессирования ХБП [72][73]. При необходимости более интенсивного лечения может быть использована тройная комбинация, включающая присоединение к данной комбинации диуретика, по показаниям – представителей других групп АГП. Комбинации ИАПФ + БРА, ИАПФ + ПИР, БРА + ПИР, считают нерациональными, поскольку такая тактика связана со значительным повышением риска острой почечной недостаточности и гиперкалиемии [74][75]. При СКФ 60 мл/мин/1,73 м2 нарушается фармакокинетика препаратов с преимущественно почечным путём выведения, возникает риск передозировки даже при использовании средних терапевтических доз, поэтому следует отдавать предпочтение средствам с преимущественно печёночным путём выведения. Антагонисты альдостерона не рекомендуются к использованию при ХБП С4-5 из-за высокого риска гиперкалиемии (табл. 10).
|
Стадия ХБП |
Особенности антигипертензивной терапии |
|
С3а |
Требуется осторожность при назначении препаратов с преимущественно почечным путём выведения. ИАПФ и БРА: умеренно повышенный риск гиперкалиемии. Тиазидные мочегонные: эффективность умеренно снижена, риск гиперурикемии высокий. Петлевые мочегонные: высокая эффективность; назначаются в небольших дозах, повышенный риск гиперурикемии. Антагонисты альдостерона: повышенный риск гиперкалиемии. |
|
С3б |
Нежелательно назначение препаратов с преимущественно почечным путем выведения. ИАПФ и БРА: высокий риск гиперкалиемии. Тиазидные мочегонные: эффективность низкая, риск гиперурикемии очень высокий. Петлевые мочегонные: эффективность умеренно снижена (может потребоваться увеличение дозы), высокий риск гиперурикемии. Антагонисты альдостерона: высокий риск гиперкалиемии. |
|
С4-С5 (до диализа) |
Крайне нежелательно назначение препаратов с преимущественно почечным путём выведения. ИАПФ и БРА: очень высокий риск гиперкалиемии*, повышен риск резкого снижения функции почек. Тиазидные мочегонные: не применяются из-за неэффективности и опасности уратного криза. Петлевые мочегонные: диуретики выбора; эффективность снижена, высокий риск гиперурикемии Антагонисты альдостерона: назначение не рекомендуется |
* – высокий риск гиперкалиемии не является противопоказанием к назначению данных препаратов, однако при этом необходим строгий контроль за соблюдением низкокалиевой диеты. Риск гиперкалиемии снижается при их сочетании с петлевыми диуретиками и калийсвязывающими энтеросорбентами
* – high risk of hyperkalemia is not a contraindication to prescribing these drugs, however, strict monitoring of low-potassium diet compliance is necessary. The risk of hyperkalemia can be reduced when combined with loop diuretics and potassium-binding enterosorbents
Наличие выраженной дисфункции почек не только вызывает развитие таких осложнений как костно-минеральные нарушения, анемия, но и привносит ряд ограничений и особенностей в традиционную тактику лечения нарушений липидного, углеводного и пуринового обмена, отражённых в клинических рекомендациях по ведению ХБП [48].
|
Рекомендации |
Класс |
Уровень |
|
Всем пациентам с вторичной почечной АГ при стойком повышении САД ≥ 130 или ДАД ≥ 80 мм рт. ст. вне зависимости от категории альбуминурии и функции почек, наличия СД рекомендуется начинать АГТ и добиваться достижения уровня САД < 130 и ДАД < 80 мм рт. ст. при условии хорошей переносимости [55][56] |
I |
А |
|
При проведении АГТ пациентам с вторичной почечной АГ рекомендуется избегать снижения САД до уровня ниже 110 мм рт. ст., резких колебаний АД, эпизодов ортостатической и ночной гипотонии. В случае развития регулярных эпизодов гипотонии в результате антигипертензивного лечения необходимо пересмотреть его тактику и установить более высокие цифры целевого САД (до 140 мм рт. ст.) [60] |
I |
В |
|
Всем пациентам с вторичной почечной АГ рекомендуется ограничение потребления соли, легкодоступных углеводов, животных жиров, отказ от курения и других вредных привычек в соответствии с общими рекомендациями по лечению АГ [61][62][63][76] |
I |
С |
|
Всем больным с АГ при ХБП, за исключением пациентов с состояниями, связанными с задержкой жидкости, целесообразно потребление воды в количестве 1,8-2,0 л в сутки [65][66] |
IIa |
С |
|
Всем пациентам с нефрогенной АГ необходимо избегать высокобелковых диет (≥ 1,3 г/кг/сут). Больным с ХБП С3а-5 (не получающим диализа) рекомендуется ограничение потребления белка, степень которого определяется стадией и клиническими особенностями ХБП [68] |
I |
А |
|
Всем пациентам с нефрогенной АГ в сочетании с гиперурикемией, гиперкалиемией, гиперфосфатемией рекомендуется ограничение потребления продуктов, богатых, соответственно, пуриновыми основаниями, калием или фосфором |
I |
А |
|
Всем пациентам с нефрогенной АГ целесообразно регулярно заниматься лечебной физкультурой с учётом состояния сердечно-сосудистой системы и переносимости нагрузок |
IIa |
В |
|
Всем пациентам с нефрогенной АГ, начиная с первых стадий, показано медикаментозное лечение – назначение АГТ с постепенным увеличением доз и числа применяемых препаратов в случае недостижения целевого АД |
I |
А |
|
Пациентам с нефрогенной АГ при исходном уровне АД ≥ 140/90 мм рт. ст. целесообразно сразу начинать с комбинированной АГТ |
IIa |
В |
|
Пациентам с нефрогенной АГ и ХБП С1-С4 А3 без СД рекомендуется начинать АГТ с назначения препарата, подавляющего РАС (ИАПФ либо БРА) |
I |
А |
|
Пациентам с нефрогенной АГ и ХБП С1-С4 А2 без СД целесообразно начинать АГТ с назначения препарата, подавляющего РАС (ИАПФ либо БРА) |
IIa |
С |
|
Пациентам с нефрогенной АГ и ХБП С1-С4 А2-А3 с СД рекомендуется начинать АГТ с назначения препарата, подавляющего РАС (ИАПФ либо БРА) |
I |
А |
|
Пациентам с нефрогенной АГ, которым назначен препарат, подавляющий РАС (ИАПФ либо БРА), необходимо регулярно контролировать уровень креатинина и калия сыворотки крови |
I |
А |
|
Больным с вторичной почечной АГ, нуждающимся в комбинированной АГТ, целесообразно комбинировать препарат, подавляющий РАС (ИАПФ или БРА), с диуретиком и/или БКК |
IIa |
В |
|
Больным с вторичной почечной АГ не рекомендуется комбинированная терапия ИАПФ + БРА, ИАПФ + ПИР, БРА + ПИР [74][75] |
III |
В |
|
При назначении АГТ больным с вторичной почечной АГ и нарушенной функцией почек следует отдавать предпочтение препаратам с печёночным путём выведения. При ХБП С3а-С3б необходимо отдавать предпочтение петлевым диуретикам перед тиазидными. При ХБП С4-С5 назначение тиазидных мочегонных и антагонистов альдостерона противопоказано |
I |
В |
7.7 Дальнейшее наблюдение
Рациональная частота контрольных лабораторных исследований и консультаций нефролога определяется в соответствии с категорией риска прогрессирования ХБП и развития ССО (см. Приложение 6).
|
Рекомендации |
Класс |
Уровень |
|
Всем пациентам с вторичной почечной АГ рекомендуются регулярные обследования терапевтом с проведением общего анализа крови, общего анализа мочи, биохимического анализа сыворотки крови, включая определение концентрации креатинина с расчётом СКФ по уравнениям CKD-EPI, концентрации мочевины, мочевой кислоты, калия, ОХС, ТГ, глюкозы – при ХБП низкого и умеренного риска по шкале KDIGO не реже 1 раза в год, при ХБП высокого риска не реже 1 раза в 6 месяцев, при ХБП очень высокого риска не реже 1 раза в 3 месяца. УЗИ почек пациентам всех категорий риска рекомендуется повторять ежегодно или чаще – когда это требуется согласно клиническим рекомендациям для данной нозологической формы ХБП [46][48] |
I |
В |
|
Пациентам с вторичной почечной АГ при ХБП высокого и очень высокого риска прогрессирования показано регулярное наблюдение нефролога – при высоком риске не реже 1 раза в год, при очень высоком риске не реже 1 раза в 6 месяцев [46][48] |
I |
В |
7.8 Прогноз
Наиболее частыми неблагоприятными исходами, анализируемыми в клинических исследованиях при АГ и ХБП, являются: смерть по любой причине, смерть от ССО, развитие острого повреждения почек, ТПН, требующей заместительной почечной терапии. Риск развития всех перечисленных неблагоприятных исходов при ХБП определяется её основными характеристиками – выраженностью альбуминурии/протеинурии и дисфункции почек (см. Приложение 4) [46][48]. Скорость постепенного естественного снижения СКФ вследствие возрастных инволютивных изменений почек составляет 1-2 мл/мин/1,73 м2 в год [46][48]. Всё, что превышает эти значения у пациентов с ХБП, может быть расценено как её прогрессирование. Адекватная патогенетическая терапия первичного заболевания почек, достижение целевого АД и назначение АГП с антипротеинурическим действием (ИАПФ, БРА) позволяет, как правило, снизить выраженность протеинурии в 1,5-2 раза от исходного уровня. Персистирование выраженной протеинурии и, тем более, её нарастание, несмотря на терапию, свидетельствует о резистентности к лечению и связано с ускорением темпов прогрессирования ХБП и дальнейшим повышением риска ССО. Коррекция АГ и назначение препаратов, подавляющих РАС, (ИАПФ, БРА), а также коррекция костно-минеральных нарушений и анемии на поздних стадиях ХБП направлены на торможение ремоделирования миокарда и артерий эластического типа. Развитие данных осложнений АГ и ХБП имеет крайне неблагоприятное значение для общего и сердечно-сосудистого прогноза. Их оценку и коррекцию проводят согласно соответствующим клиническим рекомендациям [48].
|
Рекомендации |
Класс |
Уровень |
|
Течение вторичной почечной гипертонии может быть расценено как неблагоприятное при наличии одного или нескольких следующих признаков: снижение СКФ более чем на 2 мл/мин/1,73 м2 в год, нарастание альбуминурии/протеинурии с переходом пациента в более высокую категорию риска, развитие и нарастание признаков гипертрофии миокарда левого желудочка, повышение жёсткости стенки артерий эластического типа [46][48] |
IIa |
С |
8. РЕНОВАСКУЛЯРНАЯ АРТЕРИАЛЬНАЯ ГИПЕРТОНИЯ
8.1 Основные понятия и определения
Реноваскулярная артериальная гипертония (РВАГ) – вторичная форм АГ, которая развивается вследствие стенозирования почечных артерий (ПА), нарушения магистрального кровотока в ПА без первичного поражения паренхимы почек и мочевыводящих путей [77].
Ишемическая болезнь почек (ишемическая нефропатия) представляет собой опосредованное ишемией хроническое повреждение паренхимы почек вследствие двустороннего стеноза ПА или одностороннего стеноза ПА единственной почки, проявляющееся в стойком снижении СКФ < 60 мл/мин/1,73 м2 [78][79].
Рубрика МКБ 10:
I15.0 Реноваскулярная гипертензия.
8.2 Эпидемиология и классификация
Распространенность РВАГ среди всех форм АГ составляет 1-8%. Наиболее распространенной причиной РВАГ является атеросклеротический стеноз почечных артерий (АСПА), на его долю приходится около 90% случаев стенозов ПА [79][80]. АСПА чаще встречается у мужчин, распространенность его возрастает в старших возрастных группах. Распространенность АСПА среди больных с тяжелой, резистентной к терапии АГ может достигать 25-30%. Распространенность АСПА составляет 10-15% у пациентов с АГ в возрасте старше 50 лет. АСПА часто сочетается с атеросклеротическими поражениями сосудистых бассейнов другой локализации: в 18% у больных АГ выявлены поражения коронарных артерий, а в 25% – поражение периферических артерий [81]. При атеросклеротической РВАГ отмечена высокая распространенность нарушений обмена липидов, СД II типа и курения [79]. В 18-20% случаев имеет место двусторонний стеноз ПА или стеноз ПА единственной функционирующей почки. Другие причины стеноза ПА и развития РВАГ: фиброзно-мышечная дисплазия (ФМД), расслоение или инфаркт ПА, артериит Такаясу, лучевой фиброз и обструкция ПА эндоваскулярными стент-графтами аорты и другие более редкие причины [77][80][81][82][83][84].
Помимо разделения стенозов ПА по этиологии, существует классификация по степени стенозирования ПА. Согласно консенсусу экспертов, ангиографический стеноз ПА диаметром > 70% считается тяжелым, а стеноз диаметром от 50% до 70% считается стенозом умеренной степени тяжести с неопределенным гемодинамическим значением. Также выделяют одно- и двусторонние стенозы ПА и стенозы дополнительных артерий.
8.3 Клиническая картина
РВАГ атеросклеротического генеза имеет ряд особенностей, которые отличают ее от АГ на фоне стеноза ПА другой этиологии. Для АСПА характерна различная клиническая картина, включающая бессимптомные нарушения, диагностируемые при визуализации почек, РВАГ, обычно характеризующуюся тяжелым течением, и хроническую ишемическую нефропатию, характеризующуюся патологическим ремоделированием почечной ткани. Ключевая роль в патогенезе РВАГ принадлежат активации ренин-ангиотензин-альдостероновой системы (РААС), которая возрастает по мере прогрессирования АСПА и уменьшения почечного кровотока, что приводит к ряду гемодинамических, воспалительных, фиброзных изменений, прогрессирующему ремоделированию структуры почек, развитию неконтролируемого течения АГ. В большинстве случаев при АСПА наблюдается высокая АГ [79]. Характерен прогностически неблагоприятный суточный профиль АД, что проявляется отсутствием адекватного снижения АД в ночные часы. Активация РААС, симпатической нервной системы (СНС), высокая АГ, неблагоприятный суточный профиль АД способствуют ПОМ и развитию ССО, что характерно для прогрессирующего течения с развитием ишемической болезни почек (ИБП) [79][85]. При сочетании ИБП с распространенным атеросклерозом наблюдаются клинические симптомы, связанные с коронарным, церебральным и периферическим атеросклерозом. Неконтролируемое течение АГ может осложняться развитием инфаркта миокарда, острым нарушением мозгового кровообращения. Нередко развиваются эпизоды рецидивирующего отёка легких. Клинические проявления ишемической нефропатии заключаются в снижении СКФ, иногда в появлении невысокой протеинурии. Снижение СКФ регистрируется примерно в половине случаев стенозирующих поражений ПА. В дальнейшем может регистрироваться одно- или двустороннее уменьшение размеров почек, обусловленное нефросклерозом [78].
8.4 Скрининг и диагностика
Диагностика РВАГ основывается на анализе клинических симптомов заболевания, анамнестических данных, результатах лабораторных и инструментальных исследований. Некоторые клинические проявления, особенности течения заболевания позволяют предположить стеноз ПА как возможную причину РВАГ. Категории пациентов с данными проявлениями подлежат скринингу для дальнейшего, более детального обследования [78][82][85][86][87]. Клинические ситуации, позволяющие заподозрить стеноз ПА, представлены в таблице 11.
|
|
|
|
|
|
|
|
Ранней и правильной диагностике ВРАГ способствует анализ данных анамнеза и клинических проявлений (табл. 11). Осмотр пациентов должен включать аускультацию артерий, определение пульса и измерение АД на всех четырех конечностях. Аускультация в проекции ПА, аорты и ее ветвей в части случаев выявляет наличие систолического шума [77][80].
Лабораторные методы исследования направлены на выявление характерных изменений: гиперкреатининемии, снижения СКФ, гиперкалиемии, дислипидемии [85]. Все пациенты с АСПА и РВАГ подлежат регулярному обследованию, направленному на выявление сердечно-сосудистых ФР, ПОМ, сопутствующих состояний в соответствии с рекомендациями по ведению больных АГ [79].
Неинвазивные и инвазивные методы инструментального исследования. Инструментальные методы исследования у пациентов с подозрением на ВРАГ включают в себя проведение УЗИ почек и дуплексного сканирования ПА, КТ ангиографию с контрастированием ПА, МР-ангиографию и рентгеноконтрастную ангиографии ПА. УЗИ почечного артериального кровотока рекомендовано применять как метод первой линии скрининга стеноза ПА [78][87]. При проведении УЗИ почек и дуплексного сканирования с цветовым картированием ПА измеряются такие показатели гемодинамики, как пиковая (систолическая) скорость кровотока, индекс почечной резистентности (ренально-аортальное отношение), а также его значения, которые демонстрируют относительно достоверную корреляцию с ангиографической картиной [88][89]. Чувствительность метода во многом зависит от оператора и от конституциональных особенностей пациента и достигает 85%, а специфичность – 92% [90][91]. Чувствительность и специфичность МР-ангиографии, достигают 94-97% и 85-93%, соответственно. Этот метод успешно применяется в качестве скрининга у пациентов со стенозом ПА и дает более точную характеристику ПА и их строения, однако в сравнении с рентгеноконтрастной ангиографией данный метод способен переоценивать степень стеноза [92][93]. Проведение КТ с контрастированием ПА является высокоинформативным (92-98%) и чувствительным (64-100%) методом диагностики, и этот метод также рекомендован в качестве скрининга. Его недостатком является невозможность оценки остаточного просвета артерии при выраженном кальцинозе стенок сосуда [88].
На сегодняшний день «золотым стандартом» диагностики и определения показаний для оперативного лечения является субтракционная ангиография ПА. Рентгеноконтрастная ангиография не является скрининговым методом диагностики у пациентов с подозрением на стеноз ПА и выполняется только при наличии признаков стеноза ПА по данным неинвазивных методов диагностики [94][95]. Основным преимуществом данного метода является возможность наиболее точно установить наличие и степень стеноза при помощи дополнительных методов определения значимости стеноза, таких как систолический градиент давления, фракционный резерв кровотока (ФРК) [96][97].
|
Метод исследования |
Параметры |
Класс |
Уровень |
|
УЗИ [88][89] |
Пиковая систолическая скорость в почечной артерии/ пиковая систолическая скорость в аорте > 3,5 Пиковая систолическая скорость в почечной артерии > 200 см/сек Конечно-диастолическая скорость в почечной артерии > 90 см/сек Снижение почечного резистивного индекса < 0,7 |
I |
A |
|
КТ-ангиография [88] МР-ангиография [92][93] |
Уменьшение диаметра почечной артерии более 50% (умеренный), более 70% (выраженный или гемодинамически значимый стеноз) |
I |
B |
|
Селективная ангиография [97] Градиент давления [97] Фракционный резерв кровотока [97] |
Уменьшение диаметра почечной артерии более 50% (умеренный стеноз), более 70% (выраженный или гемодинамически значимый стеноз) > 20 мм рт. ст. ≤ 0,80 |
IIb |
B |
Нефросцинтиграфия с каптоприлом так же, как и определение активности ренина в почечной и кубитальной вене, а также каптоприловый тест с ренином (определение активности ренина плазмы (АРП) до и после применения каптоприла), не рекомендуются в качестве скрининговых методов диагностики РВАГ [78][97].
Для умеренных стенозов ПА рекомендовано использование дополнительных методов физиологической оценки значимости стенозов с целью определения их гемодинамической значимости. Инвазивные методы оценки гемодинамической значимости стеноза ПА включают измерение среднего и систолического градиента давления, определение соотношения давления в дистальном сегменте ПА к давлению в аорте на протяжении всего сердечного цикла и измерение ФРК. Систолический градиент давления более 20 мм рт. ст. имеет большую чувствительность и специфичность, чем ангиографический процент стеноза в прогнозе снижения степени АД после эндоваскулярной реваскуляризации ПА. ФРК имеет достоверно установленные границы нормы 0,80. Пороговая величина разделяет ишемическое и неишемическое значение ФРК для данного измерения. При значении ФРК меньше 0,80 стеноз, как правило, способен провоцировать ишемию паренхимы почек [96][97].
|
Рекомендации |
Класс |
Уровень |
|
Проведение ангиографии ПА целесообразно у пациентов с ИБС и многососудистым поражением коронарных артерий [94] |
IIa |
B |
|
Проведение ангиографии ПА можно рассматривать при наличии диагностических критериев, указанных в таблице 11, во время проведения коронароангиографии и ангиографии других сосудистых бассейнов [95] |
IIb |
A |
|
Проведение ангиографии ПА целесообразно рассматривать в случае выявления признаков стеноза ПА по данным ультразвукового дуплексного сканирования, МСКТ или МР-ангиографии, с целью оценки значимости стеноза ПА, если предполагается проведение эндоваскулярного или хирургического лечения [97] |
IIa |
A |
Ангиографическое исследование несет низкий риск осложнений, однако процедура проводится с осторожностью при развитии ХПН ввиду повышения риска развития контраст-индуцированной нефропатии. В случае, если ангиография проводится пациенту с уровнем креатинина крови, не превышающим 176 мкмоль/л (2 мг/дл), риск осложнений, связанных с процедурой, не меняется, при более высоких значениях риск повышается. Для профилактики контраст-индуцированной нефропатии эффективно использование низкоосмолярных контрастов, проведение периоперационной профилактики [78].
8.5 Лечение
Пациенты с РВАГ атеросклеротического генеза с учетом ПОМ и сочетанной сердечно-сосудистой патологии составляют категории высокого риска ССО, и вне зависимости от выбора метода лечения во всех случаях обоснована тактика оптимального лечения, сочетающая немедикаментозные методы лечения с учетом установленных факторов ССР и комплексную медикаментозную терапию, включающую применение гиполипидемической терапии, антитромбоцитарных лекарственных средств и АГП [84][86][98][99][100].
Медикаментозное лечение
Все пять основных классов АГТ способны эффективно контролировать АД при РВАГ. В большинстве случаев показана комбинированная АГТ, включающая применение препаратов, блокирующих РАС. Ключевая роль гиперактивации РАС при АСПА в прогрессировании поражения почек, эффективность ИАПФ и БРА в обеспечении контроля АД, кардиопротекции, нефропротекции, улучшении прогноза по развитию ССО обосновывают важность применения этих классов АГТ при РВАГ атеросклеротической этиологии [80]. В настоящее время применение ИАПФ и БРА рекомендовано для лечения РВАГ при одностороннем стенозе ПА, кроме того, в последние годы показания к применению этих препаратов расширились: может быть также рассмотрена возможность их применения при выраженном двустороннем стенозе ПА при условии тщательного динамического наблюдения за функциональным состоянием почек [87]. С учетом нефропротективной эффективности блокаторов РАС, такая тактика особенно обоснована в составе комбинированной АГТ при резистентном течении АГ и ПОМ. У большинства больных РВАГ отмечена хорошая переносимость терапии блокаторами РАС, однако в редких случаях на фоне лечения этими препаратами и устранения вазоконстрикторного эффекта ангиотензина II на постгломерулярные артериолы наблюдалась гипоперфузия дистальнее стеноза, ухудшение функции почек, развитие острого повреждения почек. В большинстве случаев эти повреждения носили преходящий, обратимый характер, после отмены блокаторов РАС функция почек восстанавливалась. Рассматривая возможность применения препаратов, блокирующих РАС при выраженном двустороннем стенозе ПА, эксперты указывают на недостаточно высокий класс (IIb) и уровень доказательности (B), основанный на нескольких нерандомизированных исследованиях, продемонстровавших эффективность и хорошую переносимость этих препаратов [87]. Возможность применения блокаторов РАС при двустороннем стенозе ПА или при стенозе ПА единственной функционирующей почки требует особого внимания, осторожности, анализа ФР ухудшения функции почек на фоне проводимого лечения и нуждается в дальнейшем обосновании [80][87][97]. Тактика контроля уровня креатинина и калия в сыворотке крови при назначении блокаторов РАС представлена в главе 7 «Вторичные почечные АГ».
|
Рекомендации |
Класс |
Уровень |
|
При РВАГ рекомендовано применение БКК, БАБ, диуретиков [78][87] |
I |
B |
|
ИАПФ или БРА могут быть рекомендованы при РВАГ, ассоциированной с односторонним стенозом ПА [78][87][101][102] |
I |
B |
|
Применение ИАПФ или БРА может быть рассмотрено при выраженном двустороннем стенозе ПА или при стенозе ПА единственной функционирующей почки при хорошей переносимости лечения и тщательном наблюдении за функцией почек [87][101][102] |
IIb |
B |
При определении целевых значений снижения АД следует полагаться на рекомендации по целевому АД при ХБП (см. раздел «Вторичные почечные АГ»). Отдельно исследований по данной проблеме при РВАГ не проводилось [78].
Эндоваскулярное лечение
Влияние реваскуляризации ПА на контроль АД, функцию почек и выживаемость. Результаты проведенных крупных рандомизированных контролируемых исследований по анализу эффективности контроля АГ не продемонстрировали различий между эндоваскулярным лечением и оптимальной медикаментозной терапией, кроме незначительного снижения количества принимаемых АГП на фоне эндоваскулярного лечения. По влиянию на функции почек ни в одном крупном рандомизированном исследовании не было продемонстрировано преимущества эндоваскулярного лечения над оптимальной медикаментозной терапией. Не было выявлено преимуществ эндоваскулярного лечения и по влиянию на заболеваемость и смертности от ССЗ [103].
Определены клинические ситуации, при которых оправдано проведение реваскуляризации ПА. Реваскуляризацию ПА рекомендовано проводить в следующих случаях:
- Целесообразно рассматривать вопрос о проведении эндоваскулярного лечения ПА у пациентов с ФМД и неконтролируемой АГ. Баллонная ангиопластика со стентированием ПА у пациентов с ФМД является методом выбора [87].
- Кандидатами на проведение реваскуляризации ПА могут быть пациенты с застойной сердечной недостаточностью и нестабильной стенокардией. Эндоваскулярное лечение ПА показано больным со стенозом ПА и развитием рецидивирующих обострений СН, а также с внезапным необъяснимым отёком лёгких. Чрескожная реваскуляризация гемодинамически значимого стеноза может быть выполнена пациентам с нестабильной стенокардией [87].
- Чрескожная реваскуляризация ПА может быть выполнена пациентам с двусторонним гемодинамически значимым стенозом ПА, а также при одностороннем стенозе нормально функционирующей почки [87].
- Чрескожная реваскуляризация ПА имеет преимущества над оптимальной медикаментозной терапией и показана при внезапном и стойком ухудшении течения ранее контролируемой АГ, рефрактерной, злокачественной АГ, при остром снижении функции почек на фоне применения блокаторов РАС и при наличии гемодинамически значимого одно- или двустороннего стеноза ПА [87].
Обращено внимание на необходимость тщательного отбора больных для проведения эндоваскулярного лечения пациентов со стенозом ПА и РВАГ, в том числе на оценку степени стеноза не только по данным количественной ангиографии, но также при помощи методов физиологической оценки гемодинамической значимости стеноза.
|
Рекомендации |
Класс |
Уровень |
|
Пациентам с острым коронарным синдромом, отеком легких и стенозом ПА 70-90% с постстенотическим градиентом > 20 мм рт. ст., ФРК ≤ 0,8; либо стенозом > 90% целесообразно рассмотреть эндоваскулярное лечение ПА [87][97][104][105] |
IIa |
B |
|
Пациентам с двусторонним стенозом ПА и постстенотическим градиентом > 20 мм рт. ст., ФРК ≤ 0,8; размерами почки > 7 см (длина от полюса до полюса) и ХБП С4 целесообразно рассмотреть эндоваскулярное лечение ПА [104][105] |
IIa |
B |
|
Пациентам с ХБП С4 с тяжелым двусторонним стенозом ПА или тяжелым стенозом ПА единственной функционирующей почки целесообразно рассмотреть эндоваскулярное лечение ПА [97][104][106] |
IIa |
B |
|
Пациентам с неконтролируемой АГ на фоне приема оптимальной медикаментозной терапии с тяжелым стенозом ПА целесообразно рассмотреть эндоваскулярное лечение ПА [96][97][107] |
IIa |
B |
|
У пациентов с рецидивирующей СН и односторонним умеренным стенозом ПА и постстенотическим градиентом > 20 мм рт. ст., ФРК ≤ 0,8 рекомендовано рассмотреть эндоваскулярное лечение ПА [97][106][107] |
I |
B |
|
Пациентам с ФМД и неконтролируемой АГ целесообразно рассмотреть вопрос о проведении эндоваскулярного лечения ПА [108] |
IIa |
B |
Хирургическое лечение
К операциям сосудистой реконструкции для лечения стенозов ПА в основном прибегают в тех случаях, когда по тем или иным причинам не может быть выполнено эндоваскулярное лечение [78][109]. Для проведения хирургической реваскуляризации разработаны соответствующие показания и обоснован ряд хирургических вмешательств [110].
8.6 Дальнейшее наблюдение и прогноз
Все пациенты с АСПА и РВАГ подлежат длительному наблюдению и регулярному обследованию для оценки в динамике ПОМ, функции почек, адекватного контроля АД и сопутствующей патологии. Для оценки проходимости стента рекомендуется контрольная визуализация с помощью дуплексного сканирования ПА [84].
Ожидаемая продолжительность жизни у пациентов с РВАГ атеросклеротического генеза снижается вследствие развития ССО [111].
При прогрессирующем снижении функции почек до терминальной стадии ХБП показатели смертности возрастают. Эффективный медикаментозный контроль АД и липидного профиля, применение оптимальной медикаментозной терапии позволяют снизить риск развития как почечных, так и ССО.
Особенности диагностики и лечения РВАГ, обусловленной другими, более редкими причинами, представлены в соответствующих руководствах.
9. ЭНДОКРИННЫЕ АРТЕРИАЛЬНЫЕ ГИПЕРТОНИИ
9.1 ПЕРВИЧНЫЙ ГИПЕРАЛЬДОСТЕРОНИЗМ
9.1.1 Определение
Первичный гиперальдостеронизм (ПГА) – собирательное понятие, включающее группу заболеваний, обусловленных гиперпродукцией минералокортикоидного гормона коры надпочечников – альдостерона, автономной или полуавтономной по отношению к ренин-ангиотензиновой системе.
Рубрики МКБ-10:
Гиперальдостеронизм (Е 26)
- Е 26.0 Первичный гиперальдостеронизм.
- Е 26.9 Гиперальдостеронизм неуточненный.
9.1.2 Эпидемиология и классификация
ПГА включает в себя гетерогенную группу распространенных спорадических форм и более редких семейных форм заболевания. В настоящее время эта группа включает формы, подлежащие хирургической коррекции: альдостерому, значительно реже – карциному коры надпочечника и первичную (одностороннюю) гиперплазию коры надпочечника, а также формы, при которых контроль АГ достигается назначением медикаментозной терапии: идиопатический (псевдопервичный) гиперальдостеронизм (ИГА) при двусторонней гиперплазии коры надпочечников и редкие СФ ПГА I–IV типов [112][113][114]. Проведенные в последние десятилетия исследования свидетельствуют о более широкой, чем считали ранее, распространенности ПГА. По сводным данным, распространенность ПГА варьирует в зависимости от обследуемой когорты и критериев, используемых для диагностики, составляя 5–20% среди всей популяции больных АГ [112][114][115][116]. Основные формы ПГА и их распространенность представлены в таблице 12 [117][118].
|
Формы ПГА |
Распространенность среди всех форм ПГА |
|
|
1. |
Альдостерома коры надпочечника |
30% |
|
2. |
Идиопатический (псевдопервичный) гиперальдостеронизм (двусторонняя гиперплазия коры надпочечника) |
60% |
|
3. |
Первичная (односторонняя) гиперплазия коры надпочечника |
2% |
|
4. |
Семейные формы ПГА: • СФ ПГА I типа (гиперальдостеронизм, корригируемый глюкокортикоидами) • СФ ПГА II типа (альдостерома или двусторонняя гиперплазия) • СФ ПГА III типа • СФ ПГА IV типа • ПГА с синдром PASNA |
1-6% < 1% < 6% < 1% < 0,1% Единичные наблюдения |
|
5. |
Карцинома, продуцирующая альдостерон |
< 1% |
|
6. |
Альдостерома или карцинома вненадпочечниковой локализации |
< 0,1% |
Установлена связь распространенности ПГА со степенью тяжести АГ: она возрастает по мере увеличения степени тяжести АД с 3,9% при АГ 1-й степени до 13,2% при АГ 3-й степени [119]. Наибольшая распространенность ПГА, достигающая 12–24%, наблюдается при резистентном течении АГ [120][121][122]. Синдром злокачественного течения АГ наблюдается у 7,8% больных с альдостеромой.
Опухолевые формы ПГА: в большинстве случаев – аденомы (альдостеромы) клубочковой зоны коры надпочечников, секретирующие минералокортикоидный гормон – альдостерон, чаще имеют небольшой размер (1–2 см), преимущественно – односторонние опухоли, но могут быть и двусторонними, чаще диагностируются у женщин в возрасте 30–40 лет. Распространенность альдостером среди всей популяции АГ – не более 1% [121]. Альдостеромы могут быть диагностированы в случаях выявления инциденталом надпочечника, распространенность их среди инциденталом колеблется в пределах 2–10% [113][122]. Карцинома коры надпочечников, секретирующая альдостерон, – редкая причина ПГА, может достигать больших размеров. Прогностически протекает неблагоприятно.
Формы ПГА, протекающие при гиперплазии коры надпочечников: ИГА выявляется при двусторонней диффузной или диффузно-узелковой гиперплазии коры надпочечников – наиболее частая форма ПГА (до 60% всех случаев ПГА), её диагностируют в 6, 4% случаев у больных АГ [123]. Первичная гиперплазия коры надпочечника – преимущественно односторонняя гиперплазия и гиперфункция клубочковой зоны коры надпочечника. Распространенность – не более 2–5% среди всех случаев ПГА. Заболевание чаще встречается у мужчин (в 80%), в среднем в возрасте 45 лет [124]. Первичный генез данной патологии обосновывается ремиссией АГ и нормализацией продукции альдостерона после односторонней адреналэктомии [125].
Распространенность наследственных форм заболевания составляет 1–6% среди всех форм ПГА. В настоящее время идентифицированы 4 формы ПГА с аутосомно-доминантным наследованием: они включают СФ ГПА, I–IV типов, а также ПГА с синдром PASNA (primary aldosteronism with seizure and neurologic abnormalities) – синдромом, связанный с генетическими мутациями, зарегистрирован в единичных наблюдениях у детей с неврологическими расстройствами, судорожным синдромом [126]. Среди наследственных форм ПГА наиболее изучена СФ ПГА I типа или ПГА, корригируемый глюкокортикоидами – моногенная форма ПГА [118][126]. Эта СФ ГПА наследуется по аутосомно-доминантному типу, составляет 1% среди всех форм ПГА и обусловлена развитием гибридной мутации, которая приводит к образованию химерного гена CYP11B1/CYP11B2, при этом гиперсекреция альдостерона зависит от эндогенной секреции адренокортикотропного гормона (АКТГ). Именно этой особенностью регуляции определяется важность своевременной диагностики этиологии АГ у этих пациентов: назначение глюкокортикоидов приводит к подавлению секреции альдостерона и нормализации АД.
9.1.3 Клиническая картина
Клинические проявления опухолевых и неопухолевых форм ПГА не имеют существенных различий и связаны с АГ, гиперальдостеронемией и гипокалиемией. К характерным для ПГА проявлениям относят нейромышечные и почечные симптомы. Гиперсекреция альдостерона ведет к увеличению реабсорбции натрия, избыточной экскреции калия и к снижению содержания калия в сыворотке крови, что приводит к развитию гипокалиемии и связанных с ней основных клинических проявлений ПГА. При уровне калия сыворотки крови 3,5–3,6 ммоль/л диагностируют нейромышечные и почечные проявления гипокалиемии, метаболические изменения, регистрируемые на ЭКГ [11][127]. Характерные нейромышечные симптомы ПГА: мышечная слабость, боль в мышцах, парестезии, судороги мышц верхних и нижних конечностей, чаще в ночные часы. Почечные симптомы: полиурия, никтурия, гипоизостенурия, щелочная реакция мочи, умеренная альбуминурия. Эти симптомы могут иметь непостоянный, преходящий характер. В некоторых случаях наблюдается малосимптомное течение заболевания, преобладают проявления гипертонической энцефалопатии. Гипокалиемия (менее 3,5 ммоль/л) не является постоянным проявлением ПГА, её диагностируют только в части случаев (в 9–37%) [115], чаще – у пациентов с альдостеромой (в 48%) [123]. В остальных случаях ПГА может преобладать нормокалиемия [128]. Артериальная гипертония у большинства больных является постоянным симптомом. Гиперволемия в сочетании с задержкой натрия рассматривается как основной патогенетический механизм минералокортикоидной АГ. У большинства больных ПГА наблюдается тяжелая АГ [113][119][120][129]. В части случаев АГ приобретает кризовый вариант течения [130]. При наследственной форме заболевания – СФ ПГА I типа – АГ часто развивается в детском возрасте и характеризуется тяжелым течением с развитием цереброваскулярных осложнений, отягощенным семейным анамнезом по АГ [126].
В редких случаях ПГА может протекать с нормальным уровнем АД, этот фенотип связан с повышенным риском развития АГ (субклинический или неклассический ПГА) [131].
Помимо непосредственного влияния на развитие АГ, гиперсекреция альдостерона при ПГА ассоциирована с эндотелиальной дисфункцией, нарушением эластических свойств артерий, развитием периваскулярного фиброза, ремоделированием миокарда. При ПГА чаще, чем при эссенциальной АГ, регистрируются ПОМ, более тяжелые в сопоставлении со степенью тяжести и продолжительностью АГ. Кроме того, чаще, чем при эссенциальной АГ с нормальной секрецией альдостерона и при сопоставимом уровне АД, течение заболевания осложняется развитием ССО, инсульта, ИБС, сердечной недостаточности, СД, МС [132]. ПГА ассоциирован с повышенным риском развития ФП, распространенность её достигает 7,1–7,3% [133]. Повреждающие эффекты гиперсекреции альдостерона проявляются независимо от уровня АД и формируют изменения, которые характеризуют пациентов с ПГА как категорию высокого и очень высокого ССР.
9.1.4 Скрининг и диагностика
Основные задачи диагностики ПГА:
- Определение вероятности наличия у пациентов с АГ ПГА.
- Установление диагноза – верификация клинико-морфологической формы ПГА и определение тактики лечения.
- Исследование состояния органов-мишеней и стратификация риска ССО с целью обоснованного выбора комплексной медикаментозной терапии и обеспечения органопротекции.
Обследование проводят в соответствии с принятыми этапами диагностического поиска: на первом этапе, проведение которого возможно в амбулаторных условиях, проводят скрининг – диагностический поиск, направленный на определение вероятности наличия клинико-биохимических проявлений ПГА среди категорий пациентов с относительно высокой распространенностью этой патологии [113][121][128][134] (табл. 13).
|
|
|
|
|
|
|
|
|
|
По мнению некоторых экспертов, показания для скрининга целесообразно расширить, и ранее предлагалось также проводить скрининг на ПГА при АГ у пациентов с диагностированным синдромом обструктивного апноэ сна (СОАС), однако проведение скрининга у этой категории пациентов в настоящее время в полной мере не обосновано [118].
При проведении скрининга среди целевых категорий пациентов, имеющих наибольшую вероятность развития ПГА, на начальных этапах диагностики анализируют клинические проявления заболевания, наличие гипокалиемии, не связанной с приемом диуретиков, метаболические изменения по данным ЭКГ [127]. Скрининг на первом этапе может быть затруднен в случаях малосимптомного течения заболевания при отсутствии гипокалиемии и невысоком уровне АД. Проведение скрининга в группах пациентов с высокой распространенностью ПГА позволяет снизить риск «пропущенных» случаев заболевания. Несмотря на относительно высокую распространенность ПГА и наличие показаний, скрининг среди представленных категорий больных АГ находится на невысоком уровне и не превышает 8–13% [135].
9.1.4.1 Методы лабораторной диагностики
При выявлении показаний к дальнейшему обследованию проводят скрининг по показателям РААС.
Скрининг по показателям РААС
Исследование показателей РААС позволяет на этапе скрининга определить основные, общие для неоднородной группы ПГА, диагностические критерии: неадекватно повышенный уровень концентрации альдостерона плазмы (КАП) по сравнению с низкой АРП, которая не подвержена стимулирующим воздействиям. Эти критерии в целом характеризуют группу ПГА – все формы ПГА разной этиологии. Исходя из этого, при проведении скринингового обследования анализируют КАП, АРП (или прямую концентрацию ренина – ПКР), а также, при необходимости, соотношение этих величин – альдостерон-рениновое соотношение (АРС) [112][113][114][116][128]. По разным данным, величина показателя АРС колеблется в широком диапазоне пороговых величин в пределах ≥ 20–40 (нг/дл)/(нг/мл/ч) [113][115][119][135]. Целесообразным считают оценивать критерий АРС не изолированно, а в сочетании с уровнем КАП более 15–20 нг/дл [113][121]. Предположить возможность наличия ПГА можно при анализе абсолютных значений АРП менее 1 нг/мл/час (или ПКР ниже референсного значения) и КАП ≥ 10 нг/дл (более 277 пмоль/л) [117].
Уровень АРП – основной опорный диагностический критерий, который на этапе скрининга позволяет дифференцировать первичный (низкорениновый) и вторичный гиперальдостеронизм, при котором уровень АРП повышен и является стимулом для секреции альдостерона [12][117].
Низкий уровень АРП может наблюдаться при ряде состояний, и для выявления истинной супрессии АРП проводят различные стимулирующие РАС пробы (низконатриевую диету, диуретики) [113][127]. Часто применяют тест часовой ходьбы, который позволяет выявить больных с достоверно низкой АРП: уровень АРП, не превышающий 1 нг/мл/ч после стимулирующей нагрузки, принят за критерий низкорениновой АГ. Важно учитывать, что на параметры РААС оказывают влияние многочисленные медикаментозные и физиологические факторы, недооценка которых может приводить к диагностическим неточностям, ошибкам и повлиять на результаты исследования [113][134][136].
Разнонаправленное воздействие некоторых лекарственных средств на уровень КАП и АРП представлено в таблице 14.
|
Медикаменты |
Влияние на КАП |
Влияние на АРП |
Влияние на АРС |
|
БАБ |
↓ |
↓↓ |
↑ (ЛП) |
|
Агонисты альфа-адренорецепторов (клонидин, метилдопа) |
↓ |
↓↓ |
↑ (ЛП) |
|
Диуретики (тиазидные, петлевые) |
→↑ |
↑↑ |
↓ (ЛО) |
|
Калийсберегающие диуретики |
↑ |
↑↑ |
↓ (ЛО) |
|
ИАПФ |
↓ |
↑↑ |
↓ (ЛО) |
|
БРА |
↓ |
↑↑ |
↓ (ЛО) |
|
БКК (ДП) |
→↓ |
↑ |
↓ (ЛО) |
|
ПИР |
↓ |
↓ |
↑ (ЛП) |
|
НПВС |
↓ |
↓↓ |
↑ (ЛП) |
|
Стероиды |
↓ |
→↓ |
↑ (ЛП) |
|
СИОЗС |
↑ |
↑ |
↓ (ЛО) |
Примечание: ↑ – повышение; ↓ – понижение; → – без изменения.
ЛП – ложноположительный; ЛО – ложноотрицательный;
НПВС – нестероидные противовоспалительные средства;
БКК (ДП) – блокаторы кальциевых каналов (дигидропиридины);
ПИР – прямые ингибиторы ренина;
СИОЗС – селективные ингибиторы обратного захвата серотонина.
Note: ↑ – increases levels; ↓ – decreases levels; → – no change.
ЛП – false positive (FP); ЛО – false negative (FN),
НПВС – nonsteroidal anti-inflammatory drugs (NSAIDs),
БКК (ДП) – calcium channel blockers, dihydropyridines (CCB (DHPs);
ПИР – direct renin inhibitors (DRI);
СИОЗС – selective serotonin reuptake inhibitors (SSRIs).
Уровень КАП подвержен колебаниям и зависит от ряда факторов: времени суток проводимого исследования, от выраженности гипокалиемии, фазы менструального цикла и приема контрацептивов, отмечены также индивидуальные колебания КАП в пределах 20–30% [113][117]. На величину АРП влияет возрастной фактор (супрессия АРП у пожилых), а также различный солевой режим [113][127]. Для исключения медикаментозных воздействий на величину КАП и уровень ренина, как минимум за 2 недели до исследования отменяют прием лекарственных средств, влияющих на них. Антагонисты минералокортикоидных рецепторов отменяют не менее чем за 4 недели до исследования [118]. По показаниям при тяжелой АГ допускается прием препаратов с минимальным влиянием на РААС: α-АБ (празозин, доксазозин), недигидропиридиновых БКК (верапамил), а также моксонидина [113][114]. При невозможности отмены АГТ при тяжелом течении АГ с сопутствующей патологией (ИБС, ХСН) допускается возможность исследования показателей РААС на фоне проводимой терапии с учетом направленности влияния отдельных препаратов на показатели РААС [113]. Интерпретация полученных результатов при таком подходе значительно затруднена, и в большинстве случаев требуется повторное исследование КАП и АРП с соблюдением соответствующих ограничений и учета всех факторов, влияющих на величину этих параметров [113].
Важно учитывать, что низкорениновые формы АГ могут протекать не только с высокой, но также и с нормальной или незначительно повышенной продукцией альдостерона. В этих случаях необходимо проводить дифференциальный диагноз для уточнения этиологии АГ. Возможная этиология: низкорениновые формы ГБ (эссенциальной АГ); редкие генетически обусловленные синдромы: синдром Лиддла, синдром Геллера, псевдогипоальдостеронизм 2-го типа (синдром Гордона), синдром мнимого избытка минералокортикоидов и некоторые другие редкие причины [12][13].
Установление окончательного диагноза, верификация клинико-морфологических форм ПГА и определение дальнейшей тактики лечения проводят в условиях специализированных стационаров. Применяются методы диагностики, направленные на выявление односторонних форм ПГА, подлежащих хирургическому лечению (альдостерома, первичная гиперплазия коры надпочечника), и двусторонних (идиопатический гиперальдостеронизм), требующих медикаментозного лечения.
Диагностические тесты
Диагностические нагрузочные пробы позволяют выявить нарушения функционального состояния РААС в виде неадекватной реакции на нагрузки, установить автономность секреции альдостерона опухолью от влияния РАС и зависимости этой секреции от АКТГ [113][127].
Рекомендовано проведение одного или нескольких из основных четырех диагностических тестов, подавляющих в норме секрецию альдостерона: тест с натриевой нагрузкой (увеличение потребления натрия в количестве более 200 ммоль на протяжении 3-х дней); тест с инфузией физиологического раствора (внутривенная четырехчасовая инфузия 2 л 0,9% физиологического раствора); тест с супрессией альдостерона флудрокортизоном; тест с каптоприлом 25–50 мг. Методика проведения этих тестов представлена в соответствующих публикациях [113][117].
Эти тесты позволяют в большинстве случаев установить отсутствие снижения КАП при наличии альдостеромы и адекватное её снижение при остальных формах ПГА. Применение теста с натриевой нагрузкой и с инфузией физиологическим раствором имеет ограничения: проведение их не рекомендовано при высоком АД, сердечной недостаточности.
С диагностической целью также предложен тест четырехчасовой ходьбы (постуральный тест), основанный на суточных колебаниях секреции альдостерона в зависимости от секреции АКТГ. При автономной от РАС секреции альдостерона аденомой и главенствующим влиянием АКТГ максимальный уровень КАП определяется в утренние часы, и далее характерно снижение его к 12–13 часам. В отличие от больных с альдостеромой, при остальных формах ПГА в большинстве случаев наблюдается адекватная стимуляция альдостерона (на 50–60%), опосредованная чувствительностью к ангиотензину II [127][136][137]. Точность этого теста составляет 85%. Специфичность при диагностике односторонних форм ПГА достигает 100% [137]. Ограничение диагностической точности связано с зависимыми от ангиотензина II альдостеромами – со случаями, при которых, несмотря на супрессию ренина, отмечается повышенная чувствительность к ангиотензину II, стимулирующему уровень альдостерона [135]. При проведении функциональных тестов во всех случаях ПГА наблюдаются исключения из общей закономерности. В настоящее время ни одни из рассмотренных тестов нельзя отнести к «золотому стандарту», позволяющему дифференцировать отдельные формы ПГА. Выбор конкретного диагностического теста зависит от состояния пациента (уровня АД, согласия пациента), а также основывается на врачебном опыте проведения отдельных диагностических проб.
|
Рекомендации |
Класс |
Уровень |
|
ГПА включает в себя гетерогенную группу распространенных спорадических форм и более редких СФ [113][114] |
I |
А |
|
Рекомендовано проведение cкрининга в группах пациентов с относительно высокой распространенностью ПГА, имеющих наибольшую вероятность развития ПГА (представлены в табл. 12) [113][114][121][128][134] |
I |
В |
|
На начальном этапе скрининга у категорий пациентов высокого риска целесообразно использовать общие для неоднородной группы ПГА диагностические критерии, основанные на исследовании абсолютных значений АРП (или ПКР), КАП, а также АРС [12][117] |
IIа |
В |
|
У пациентов с положительным первичным тестом скрининга (ваявление низкоренинового гиперальдоетронизма (АРП < 1 нг/мл/ч или ПКР ниже референсного значения), целесообразно проведение диагностического теста, направленного на подавление уровня КАП (для подтверждения/исключения автономной секреции альдостерона) [113][117] |
IIа |
В |
9.1.4.2. Методы топической диагностики
Методы топической диагностики направлены на визуализацию и на оценку характера структурных изменений в надпочечниках.
Во всех случаях у больных АГ с выявленной при проведении скрининга гиперальдостеронемией и супрессией АРП показано проведение КТ или МРТ надпочечников. МРТ не имеет преимуществ по сравнению с КТ в плане выявления изменений в надпочечниках при ПГА [138]. Достоинством этих методов является возможность определения локализации и размера объемного образования, что особенно важно при выявлении опухоли более 4 см в диаметре – исключение злокачественных образований [113]. Ограничения КТ в выявлении патологии надпочечников: выявление и интерпретация результатов затруднены при небольших (менее 1 см в диаметре) альдостеромах, множественных или двусторонних альдостеромах, при двусторонних макроузелковых гиперпластических изменениях, что может приводить к ложноотрицательным (22% случаев) или ложноположительным результатам (25% случаев). Кроме того, важно учитывать возможность выявления гормонально неактивных образований (инциденталом), особенно у лиц старше 35 лет [113]. КТ и МРТ не позволяют судить о функциональной гормональной активности выявленных изменений, во всех случаях требуется сопоставление с показателями РААС.
Сравнительный селективный венозный забор крови (ССВЗК) – флебография центральных надпочечниковых вен со сравнительным исследованием концентрации альдостерона с обеих сторон – ведущий метод оценки функциональной активности структурных изменений в надпочечниках [113]. Этот метод рассматривают как «золотой стандарт» в дифференциальной диагностике различных форм ПГА. Чувствительность и специфичность ССВЗК при выявлении стороны локализации альдостеромы составляет 95% и 100%, соответственно. ССВЗК позволяет дифференцировать односторонние поражения надпочечника, подлежащие хирургическому лечению, от двусторонних, может подтвердить сторону локализации альдостером малых размеров, а также позволяет отличить гормонально неактивные опухоли от альдостером. Метод рекомендован пациентам с ПГА, которым по результатам нагрузочных тестов и КТ показана адреналэктомия [113]. Исследование является технически сложным, должно проводиться опытным интервенционным специалистом в условиях специализированного центра. Технический подход и критерии положительного результата исследования разнообразны и представлены в соответствующих рекомендациях [138].
|
Рекомендации |
Класс |
Уровень |
|
Проведение КТ надпочечников целесообразно всем пациентам с установленным ПГА с целью уточнения характера структурных изменений и исключения больших (диаметром более 4 см) новообразований – карцином коры надпочечника, продуцирующих альдостерон [113][114] |
IIa |
B |
|
ССВЗК является ключевым диагностическим тестом и рекомендован для подтверждения односторонней гиперсекреции альдостерона – выявления пациентов с ПГА, которым показана односторонняя лапароскопическая адреналэктомия [112][114][138] |
I |
B |
|
Проведение ССВЗК показано только в случаях установленного диагноза ПГА, при согласии пациента и отсутствии противопоказаний к хирургическому лечению [112][113][114] |
I |
B |
|
ССВЗК целесообразно проводить только в стандартизованных условиях, в специализированных центрах [112][113] |
IIа |
B |
9.1.4.3 Генетическое тестирование
Генетическое тестирование методом полимеразной цепной реакции позволяет провести раннюю диагностику моногенной формы заболевания – СФ ПГА I типа, что позволяет своевременно назначить патогенетически обоснованное лечение и избежать развития ССО [113][114][119][126].
|
Рекомендации |
Класс |
Уровень |
|
Пациентам с диагностированным ПГA в возрасте до 20 лет, а также с отягощенным семейным анамнезом по наличию ПГА или инсультов у родственников в молодом возрасте (до 40 лет), рекомендовано проведение генетического тестирования с целью выявления СФ ПГА I типа (ГПА, корригируемый глюкокортикоидами) [114][126] |
I |
B |
Предложено также проведение генетического тестирования у детей с ПГА для исследования мутации KCNJ5 с целью исключения СФ ПГА 3 типа, для которых характерно тяжелое течение заболевания, резистентная к терапии АГ [126].
9.1.5 Лечение
Целенаправленная дифференциальная диагностика, верификация клинико-морфологических форм ПГА позволяет определить тактику лечения – хирургического при односторонней патологии (альдостерома, первичная /односторонняя/ гиперплазия коры надпочечника) и медикаментозного – при двусторонних гиперпластических и опухолевых изменениях в надпочечниках.
Хирургическое лечение
Односторонняя эндоскопическая адреналэктомия является оптимальным методом лечения больных с диагностированной односторонней патологией [138]. Устранение причины гиперальдостеронемии в большинстве случаев приводит к нормализации уровня КАП, возрастанию АРП [12][113]. В 50-80% случаев наблюдается нормализация или значительное снижение АД [139]. В части случаев удаление альдостеромы, несмотря на нормализацию секреции альдостерона, не приводит к улучшению течения АГ, что связано с длительным анамнезом АГ, степенью тяжести АГ до операции, выраженными органными поражениями в органах-мишенях и рядом других причин [138]. Хирургическое лечение односторонних форм ПГА должно устранить избыточную секрецию альдостерона у всех пациентов. Сохранение гиперальдостеронемии после адреналэктомии свидетельствует о том, что первоначальный диагноз был неверен, и у пациента были двусторонние, а не односторонние изменения в надпочечниках [138][139]. В таких случаях показана комбинированная АГТ.
Медикаментозное лечение
Медикаментозная АГТ проводится по показаниям при опухолевых и неопухолевых формах ПГА. При диагностированной альдостероме АГТ применяется в следующих случаях: в предоперационном периоде для адекватного контроля АД и гипокалиемии; при отказе пациента от хирургического лечения или когда сопутствующая патология делает маловероятным его применение; при резидуальной АГ после односторонней адреналэктомии [12][138][140].
АГТ показана во всех случаях ПГА, обусловленного двусторонней патологией: при ИГА, двусторонних альдостеромах, СФ ПГА [113][138]. При этих формах ПГА для достижения целевых уровней АД необходимо использовать АГП из рекомендованных основных и дополнительных классов в виде моно- или комбинированной терапии в зависимости от степени тяжести АГ, ПОМ и сопутствующих клинических состояний [12][138]. При всех формах ГПА медикаментозная терапия должна быть нацелена не только на снижение АД, но и на устранение неблагоприятных эффектов альдостерона: формирование эндотелиальной дисфункции, развитие ССО. В первую очередь фармакотерапия включает применение антагонистов минералкорикоидных рецепторов – спиронолактона или эплеренона (в случаях плохой переносимости спиронолактона), поскольку они эффективно контролируют АГ, корректируют метаболические нарушения, ПОМ и снижают риск ССО и прогрессирования почечной недостаточности [138][141]. Рекомендован прием спиронолактона в начальной дозе 12,5–25 мг/сут в 1–2 приема с последующим постепенным повышением при необходимости до суточной дозы 100 мг [113]. При назначении спиронолактона или эплеренона важно оценивать функциональное состояние почек: учитывать риск развития гиперкалиемии при ХБП 3 стадии. При ХБП 4 стадии следует избегать назначения этих препаратов [113].
При СФ ГПА I типа показано назначение глюкокортикоидов с целью частичной супрессии секреции АКТГ гипофизом, что способствует адекватному контролю АД и нормализации гиперальдостеронемии [112][114][126][142]. Рекомендован прием глюкокортикоидов в малых дозах: дексаметазон в дозе 0,125–0,25 мг/день или преднизолон – 2,5–5 мг/день, предпочтительнее в вечерние часы с целью супрессии высокого уровня АКТГ в ранние утренние часы. При тяжелом течении АГ монотерапия глюкокортикоидами может не приводить к адекватному снижению АД, требуется присоединение антагонистов минералокортикоидных рецепторов и других АГП, чаще – БКК [142].
|
Рекомендации |
Класс |
Уровень |
|
При установленном диагнозе односторонних клинико-морфологических формах ПГА рекомендовано проведение односторонней эндоскопической адреналэктомии [113][114][138] |
I |
B |
|
При ПГА, обусловленном двусторонними гиперпластическими или опухолевыми изменениями в надпочечниках, а также при односторонних структурных изменениях, когда хирургическое лечение не показано в связи с высоким операционным риском, целесообразно применение спиронолактона в комбинации с другими АГП. В качестве альтернативы возможно применение эплеренона [113][138][139] |
IIа |
B |
9.1.6 Дальнейшее наблюдение и прогноз
После проведения хирургического лечения показан контроль целевых значений АД, в случаях резидуальной АГ – контроль показателей РААС, по показаниям – проведение методов визуализации надпочечников.
Пациенты с ПГА подлежат длительному наблюдению во всех случаях проведения медикаментозной терапии (контроль целевых значений АД, лечение сопутствующих ССО).
При ранней диагностике и адекватном хирургическом лечении альдостером прогноз заболевания благоприятный. При длительном анамнезе заболевания, резидуальной АГ прогноз определяется наличием ПОМ и ССО.
9.2 БОЛЕЗНЬ ИЦЕНКО—КУШИНГА И ДРУГИЕ ФОРМЫ ГИПЕРКОРТИЦИЗМА
9.2.1 Определения
Болезнь Иценко-Кушинга (БИК) – это тяжелое нейроэндокринное заболевание, обусловленное хронической гиперпродукцией АКТГ опухолью гипофиза. Увеличение секреции АКТГ, в свою очередь, приводит к хронической повышенной выработке кортизола корой надпочечников и развитию симптомокомплекса ЭГ [143][144][145].
АКТГ-эктопированный синдром – это симптомокомплекс гиперкортицизма, развивающийся вследствие избыточной продукции АКТГ опухолью внегипофизарной локализации.
Синдром Иценко-Кушинга – в русскоязычной литературе термин используется для обозначения доброкачественной опухоли надпочечника, секретирующей кортизол; в англоязычной литературе объединяет весь симптомокомплекс гиперкортицизма.
Экзогенный гиперкортицизм – симптомокомплекс гиперкортицизма, который развивается вследствие приема супрафизиологических доз глюкокортикоидных гормонов.
Эндогенный гиперкортицизм (ЭГ) – симптомокомплекс клинических проявлений, отражающий избыточную секрецию кортизола опухолью надпочечника или за счет вторичной стимуляции надпочечника АКТГ вследствие опухоли гипофиза или АКТГ-секретирующей опухоли другой локализации. Настоящий термин объединяет все нефизиологические варианты эндогенной избыточной продукции кортизола.
Рубрики МКБ-10:
E24.0 Болезнь Иценко-Кушинга гипофизарного происхождения.
E24.3 Эктопический АКТГ-синдром.
E24.4 Кушингоидный синдром, вызванный алкоголем.
E24.8 Другие состояния, характеризующиеся кушингоидным синдромом.
E24.9 Синдром Иценко-Кушинга неуточненный.
9.2.2 Эпидемиология
БИК является чрезвычайно редкой патологией [143][144][145][146]. Заболеваемость БИК варьирует по различным источникам от 1,2-2,4 случаев на миллион населения в год по данным исследований в Европейских странах [145][147][148], до 6,2-7,6 случаев на миллион населения по данным работ из США [149]. При этом БИК является наиболее частой причиной (80-85% случаев) органической гиперпродукции кортизола – ЭГ. В 10-20% случаев ЭГ развивается из-за первичной патологии надпочечников, в 5-10% случаев – вследствие АКТГ-продуцирующей нейроэндокринной опухоли любой внегипофизарной локализации (медуллярный рак ЩЖ, рак клеток островков Лангерганса, феохромоцитома, рак яичников, яичек, предстательной железы; карциноид легких, бронхов, тимуса, аппендикса, опухоли желудочно-кишечного тракта, мочевого пузыря, околоушных и слюнных желез и т.д.). Распространенность БИК составляет 39,1 случаев на 1 млн, заболеваемость 1,2–2,4 случая на 1 млн населения в год [143][144][145][147].
Исследовательские работы, направленные на поиск ЭГ в группах потенциального риска, свидетельствуют о значительно более высокой распространенности заболевания, чем ожидалось. Так, среди пациентов моложе 40 лет с рефрактерной или плохо контролируемой артериальной гипертонией ЭГ был подтвержден в 4-9% случаев [150][151].
9.2.3 Классификация
БИК следует отличать от АКТГ-эктопированного синдрома, причиной которого является АКТГ-секретирующая опухоль любой локализации, кроме гипофизарной. Кроме того, от БИК и АКТГ-эктопированного синдрома следует отличать различные формы АКТГ-независимого гиперкортицизма: синдром Иценко-Кушинга, под которым обычно подразумевается избыточная секреция кортизола самими надпочечниками без внешней стимуляции (табл. 15) [143][144].
ЭГ следует отличать от экзогенного, который обусловлен длительным приемом глюкокортикоидов (ГК) в супрафизиологических дозах.
Необходимо учитывать, что клинические и лабораторные проявления гиперкортицизма возможны при отсутствии истинного заболевания, как следствие повышения активности гипоталамо-гипофизарно-надпочечниковой оси на фоне физиологической реакции при определенных патологических и физиологических состояниях. В подобных случаях может отмечаться умеренно выраженный гиперкортицизм, а результаты первичных диагностических тестов оказываются ложноположительными и не всегда позволяют отвергнуть ЭГ.
|
Эндогенный |
Функциональный (Псевдокушинг) |
|
1. АКТГ-зависимый |
1. Состояния или заболевания, сопровождающиеся клиническими и лабораторными признаками |
|
|
|
2. АКТГ-независимый |
2. Без клинических проявлений, но с лабораторными признаками |
|
|
Выделяют также субклинический гиперкортицизм – это изменение лабораторных показателей, соответствующих гиперкортицизму, у пациентов с доброкачественным новообразованием надпочечников при отсутствии клинических проявлений.
9.2.4 Скрининг
Категории пациентов высокого риска
Скрининг для исключения ЭГ можно применять в следующих когортах пациентов [143][144][146][147][148][149][150][151][152][153] (табл. 16).
|
Группы риска |
|
Молодые люди с необычными для их возраста проявлениями (например, остеопороз с низкотравматичными переломами, сахарный диабет и ожирение, АГ, аменорея у женщин и снижение полового влечения у мужчин, быстрая прибавка массы тела в сочетании с выраженной общей и мышечной слабостью); |
|
Пациенты с характерными изменениями внешности и множеством разнообразных клинических проявлений гиперкортицизма; |
|
Дети, у которых отмечается задержка роста в сочетании с увеличением массы тела; |
|
Пациенты со случайно выявленным новообразованием надпочечника; |
|
Пациенты любого возраста с плохо контролируемым сахарным диабетом и/или АГ в сочетании с ожирением или быстрой прибавкой массы тела; пациенты с переломами тел позвонков, особенно множественными переломами в возрасте до 65 лет |
Группы высокого риска были определены существующими международными клиническими рекомендациями [144], а также целым рядом исследований активного скрининга в когортах пациентов с клиническими симптомами ЭГ [143][144][149][151].
9.2.5 Диагностика
Диагноз гиперкортицизма основывается на характерной клинической картине, лабораторных показателях и инструментальных исследованиях, позволяющих не только подтвердить факт гиперпродукции кортизола, но и определить источник патологических проявлений, а также выявить осложнения заболевания.
9.2.5.1 Клиническая картина и осложнения ЭГ
Клинические проявления и осложнения ЭГ затрагивают большинство органов и систем пациента, сведения о которых приведены в таблице 17 [143][144][149].
|
Клинические проявления |
Частота встречаемости (%) |
|
Избыточная масса тела или ожирение |
71–96 |
|
Жалобы на общую слабость |
70,6 |
|
Мышечная слабость |
64 |
|
Матронизм (яркий румянец на щеках) |
55 |
|
Яркие широкие стрии (передняя брюшная стенка, бедра, подмышечные области и т.д.) |
48 |
|
Нарушения менструального цикла, снижение полового влечения |
38–69 |
|
Головная боль |
38 |
|
Гирсутизм |
34 |
|
Алопеция |
8–30 |
|
Сухость кожи |
17 |
|
Избыточная потливость |
17 |
|
Отеки |
15 |
|
Психиатрические симптомы (депрессия, галлюцинации, бред) |
13 |
|
Петехии (легкое образование синяков) |
10 |
|
Выраженные гиперпигментации |
4,5 |
|
Нарушения памяти |
4,5 |
Ключевые осложнения ЭГ и частота их нарушений, по данным различных исследований, суммирована в таблице 18 [143][144][150][151].
|
Осложнение |
Распространенность (%) |
|
Ожирение |
25–100 |
|
Нарушения толерантности к углеводам/ сахарный диабет |
7–64 / 11–47 |
|
Дислипидемия |
12–72 |
|
Артериальная гипертензия |
25–93 |
|
Тромбозы и тромбоэмболии |
6–20 |
|
Инфекционные осложнения |
21–51 |
|
Патологические переломы и остеопороз |
11–76 |
|
Миопатия |
42–83 |
|
Психиатрические осложнения: депрессия/ тревожность/ биполярные расстройства |
50–81/66/30 |
|
Гипогонадизм у мужчин и женщин |
43–80 |
|
Нефролитиаз |
10 |
|
Ишемическая болезнь сердца |
7 |
|
Цереброваскулярная болезнь |
7 |
Сердечно-сосудистые осложнения ЭГ
Активный гиперкортицизм ассоциируется с 2-5-кратным увеличением смертности по сравнению с общей популяцией, в основном за счет ССО [143][144][145][147][148]. Действительно, для гиперкортицизма характерна своеобразная клиническая картина, осложненная рядом сопутствующих заболеваний, преимущественно включающих системную АГ в сочетании с висцеральным ожирением, нарушением толерантности к глюкозе и дислипидемией, формирующими метаболический синдром [148]. АГ осложняет течение эндогенного гиперкортицизма в 80-90% случаев [143][146]. По сравнению с общей популяцией у лиц с гиперкортицизмом вероятность развития сердечной недостаточности в 6 раз выше, инфаркта миокарда – в 2,1 раза, риск инсульта – в 4-5 раз [147][148].
В патогенез АГ при гиперкортицизме вовлечена активация РААС, возрастание минералокортикоидной активности через конкурентную активацию рецепторов избытком глюкокортикоидов и гиперэргические реакции симпатической и вазоконстрикторной систем. Важную роль играют нарушенная сосудистая реактивность по отношению к вазоконстрикторам, повышенная чувствительность бета-адренорецепторов к катехоламинам, супрессия механизмов вазодилятации. АГ в рамках гиперкортицизма носит постоянный характер.
Диагностику ЭГ можно разделить на три этапа:
- лабораторное подтверждение эндогенной гиперпродукции кортизола;
- дифференциальная диагностика АКТГ-зависимого и АКТГ-независимого ЭГ;
- дифференциальная диагностика БИК и АКТГ-эктопированного синдрома.
9.2.5.2 Лабораторная диагностика
Лабораторная диагностика факта наличия ЭГ
Пациентам с клиническими симптомами гиперкортицизма перед проведением лабораторных исследований для установления ЭГ в первую очередь целесообразно исключить прием экзогенных ГК и состояний функционального гиперкортицизма (табл. 15). Согласно литературным данным, 1–3% взрослого населения получает терапию ГК [154].
АКТГ-зависимый ЭГ и АКТГ-независимый ЭГ
Для диагностики ЭГ целесообразно проведение как минимум двух лабораторных тестов первой линии (исследование уровня свободного кортизола в слюне, собранной в 23:00, или исследование уровня общего кортизола в крови, взятого в 23:00, и/или исследование уровня общего кортизола в крови или исследование уровня свободного кортизола в слюне, взятой утром после приема 1 мг дексаметазона накануне в 23:00 и/или исследование уровня свободного кортизола в суточной моче) [155][156][157][158][159][160].
|
Рекомендации |
Класс |
Уровень |
|
Целесообразно определение свободного кортизола в слюне в 23 часа [143][144][155][156][157][158] |
IIа |
B |
|
Целесообразно определение свободного кортизола в суточной моче [143][144] |
IIа |
B |
|
Целесообразно определение кортизола крови в 23 часа [143][144] |
IIа |
B |
|
Целесообразно определение кортизола крови в 8 часов после приема 1 мг дексаметазона накануне в 23 часа [143][44] |
IIа |
B |
Тесты можно подбирать в зависимости от доступности и образа жизни пациента. При исследовании кортизола в суточной моче важно предварительно оценить нарушение функции почек.
Если хотя бы два теста из вышеперечисленных тестов являются положительными в отношении ЭГ, следующим этапом необходимо уточнить АКТГ-зависимый или независимый характер гиперкортицизма. Для АКТГ-зависимого ЭГ характерен нормальный или повышенный уровень АКТГ в утренние часы, в то время как для АКТГ-независимого ЭГ, то есть первичной патологии надпочечников, характерен подавленный уровень АКТГ (менее 5-10 пг/мл) [158][159][160].
Для дифференциальной диагностики АКТГ-зависимого гиперкортицизма – БИК или АКТГ-эктопический синдром – при невозможности провести селективный забор крови из нижних каменистых синусов (см. Рекомендации по инструментальной диагностике АКТГ-зависимого ЭГ) проводят большой ночной тест с дексаметазоном (8 мг дексаметазона в 22-23 часа, на следующее утро в 8 часов исследуют кровь на кортизол). Снижение уровня кортизола более, чем на 60% может свидетельствовать о центральном генезе гиперкортицизма (чувствительность теста 65-80%, специфичность 60-80%) [143][144][154].
9.2.5.3 Инструментальная диагностика
Целью инструментальной диагностики при гиперкортицизме является поиск источника повышенной продукции АКТГ или кортизола.
АКТГ-зависимый гиперкортицизм
При АКТГ-зависимом гиперкортицизме наиболее часто повышение АКТГ обусловлено опухолью или гиперплазией гипофиза, которому свойственна секреция АКТГ.
При АКТГ-эктопии источником высокой продукции АКТГ служит новообразование любого органа, который в норме не секретирует АКТГ.
|
Рекомендации |
Класс |
Уровень |
|
Рекомендовано МРТ головного мозга с контрастным усилением: при выявлении аденомы гипофиза (не менее 6 мм) целесообразно установить БИК [143][144] |
I |
B |
|
Рекомендована (по показаниям) флебография – двухсторонний селективный забор крови на АКТГ из нижних каменистых синусов в базальных условиях при коэффициенте синус/периферия > 2,0 – устанавливается БИК, менее 2,0 – рекомендован поиск источника АКТГ-эктопического синдрома [143][159] |
I |
B |
|
Целесообразно проведение МСКТ органов грудной клетки, средостения, МСКТ или МРТ брюшной полости, малого таза, УЗИ ЩЖ – поиск опухоли, продуцирующей АКТГ [143][144] |
IIа |
B |
|
Целесообразно сканирование организма с помощью соматостатин-рецепторной сцинтиграфии в режиме «все тело» с 99mTc-тектротидом и/или совмещенная позитронно-эмиссионная томография (ПЭТ) и КТ с DOTA-конъюгированным радиофармпрепаратом (68Ga-DOTA-TATE) [159][160] – поиск источника АКТГ-эктопии [154][159] |
IIа |
B |
АКТГ-независимый гиперкортицизм
При АКТГ-независимом гиперкортицизме источником повышенной секреции кортизола при подавленном (низком) уровне АКТГ является патологически измененный надпочечник.
|
Рекомендации |
Класс |
Уровень |
|
В случае установления факта приема ГК в любой форме целесообразна полная отмена этих препаратов (в том числе, заместительной терапии ГК при подозрении на рецидив БИК) с переоценкой необходимости обследований после периода выведения используемого препарата, а также необходима компенсация или нивелирование состояния функционального гиперкортицизма [143][144][153] |
IIа |
B |
|
При лабораторном подтверждении ЭГ и уровне АКТГ в утренние часы более или равном 10 пг/мл (или не ниже референсного интервала) устанавливается АКТГ-зависимый ЭГ, и наоборот при АКТГ менее 10 пг/мл – целесообразно дальнейшее обследование в отношении АКТГ-независимого гиперкортицизма [143][144][146] |
IIа |
B |
|
При уровне АКТГ менее 10 пг/мл со значительной долей вероятности диагностируется АКТГ-независимый гиперкортицизм, целесообразно проведение МСКТ надпочечников для выявления аденомы, макро- или крупноузловой гиперплазии, или адренокортикального рака [1][2][4] |
IIа |
B |
9.2.5.4 Диагностика осложнений ЭГ
Ввиду множества системных проявлений ЭГ пациенты нуждаются в комплексном ведении командой специалистов, где наряду с диспансерным ведением врачом-эндокринологом, пациентам рекомендуется приём (осмотр, консультация) врачей разного профиля: кардиолога, гинеколога, уролога, психотерапевта, гастроэнтеролога, нейрохирурга [143][146][154].
|
Рекомендации |
Класс |
Уровень |
|
Для диагностики системных осложнений БИК можно применять комплексное обследование сердечно-сосудистой системы (измерение АД, регистрация ЭКГ, по показаниям –ЭхоКГ, холтеровское мониторирование ЭКГ ), костно-мышечной системы (рентгенография грудного и поясничного отдела позвоночника в боковой проекции, рентгеноденситометрия поясничного отдела позвоночника и проксимального отдела бедренной кости) и состояния надпочечников и мочеполовой системы (КТ забрюшинного пространства, УЗИ органов малого таза), желудочно-кишечного тракта (эзофагогастродуоденоскопия, УЗИ брюшной полости) [143][144][145][146] |
IIb |
B |
9.2.6 Лечение
9.2.6.1 Хирургическое лечение
|
Рекомендации |
Класс |
Уровень |
|
Всем пациентам с впервые установленным диагнозом БИК прежде всего целесообразно проводить нейрохирургическое лечение – удаление новообразования гипофиза трансназальным доступом с использованием видеоэндоскопических технологий в высокоспециализированном центре [143][154] |
IIa |
А |
|
При неэффективности первого нейрохирургического вмешательства целесообразна повторная операция – удаление новообразования гипофиза трансназальным доступом с использованием видеоэндоскопических технологий в высокоспециализированном центре не ранее чем через 6 месяцев [143][144][145][146][154] |
IIа |
В |
|
При неэффективности всех методов лечения, или невозможности их проведения, или для спасения жизни пациента при крайне тяжелом течении гиперкортицизма (уровень кортизола в суточной моче более чем в 10 раз выше верхней границы референсных значений и наличие жизнеугрожающих осложнений) можно применить двустороннюю эндоскопическую адреналэктомию [143][144][145][146] |
IIb |
В |
|
Пациентам с АКТГ-независимым гиперкортицизмом целесообразно проводить одностороннюю адреналэктомию, а при микро-макроузловой гиперплазии надпочечников – проведение двухсторонней эндоскопической адреналэктомии [143][144][145][146] |
IIа |
А |
9.2.6.2 Радиотерапевтическое или радиохирургическое лечение
Стереотаксические методы облучения являются методами выбора при лечении пациентов с инфильтративно-растущими аденомами, которые распространяются на структуры хиазмально-селлярной области и основания черепа: зрительные пути, кавернозные синусы, сосуды виллизиева круга [143][144][154]. Среднее время до достижения ремиссии при использовании стереотаксической техники – 12 месяцев.
9.2.6.3 Медикаментозное лечение ЭГ
Для медикаментозного контроля ЭГ используются препараты с различным механизмом действия. Однако все препараты за исключением пасиреотида не имеют зарегистрированных показаний для лечения БИК или других форм гиперкортицизма в РФ [154][161].
Действие других препаратов, которые могут применяться, направлено на снижение выработки кортизола в надпочечниках (кетоконазол, метирапон, митотан) или на блокаду рецепторов в надпочечниках (мифепристон), некоторые из них применяются «off label» (кетоконазол, мифепристон), так как первоначально разрабатывались для лечения других патологий [143][154].
|
Рекомендации |
Класс |
Уровень |
|
Лучевая терапия (радиотерапия, радиохирургия) целесообразна для пациентов, у которых нейрохирургическое лечение было неэффективным или его проведение невозможно [143][144][145][146] |
IIа |
B |
|
Применение пасиреотида целесообразно для лечения БИК у пациентов старше 18 лет при неэффективности или невозможности проведения нейрохирургического лечения [161] |
IIа |
B |
|
Терапию препаратами, действие которых направлено на снижение выработки кортизола в надпочечниках (кетоконазол, метирапон, митотан) или на блокаду рецепторов в надпочечниках (мифепристон), можно применять «off label» для лечения БИК [154][161] |
IIb |
В |
9.2.6.4 Лечение осложнений ЭГ
Рекомендованы мероприятия по изменению образа жизни, терапия для коррекции ФР и сопутствующих заболеваний.
Для коррекции дислипидемии – назначение статинов, достижение целевых уровней ХС ЛПНП. Лечение нарушений углеводного обмена – сахароснижающие препараты, в том числе инсулинотерапия, согласно рекомендациям по лечению сахарного диабета.
Лечение АГ – рациональная комбинированная АГТ. Важно оценивать как возможные лекарственные взаимодействия, так и противопоказания, связанные с гиперкортизолемией. Эффективна комбинация ИАПФ или БРА с БКК. При резистентной АГ возможно применение α-АБ [162][163][164].
Гипокалиемия: поскольку внутривенное введение калия увеличивает риск гиперкалиемии и может вызвать боль и флебит, внутривенное введение калия должно быть зарезервировано для пациентов с тяжелой гипокалиемией, гипокалиемическими изменениями на ЭКГ или симптомами гипокалиемии, или для тех, кто не переносит пероральную форму, обычно достаточно 20 ммоль в день. Оправданно начинать внутривенную терапию препаратами калия при снижении уровня калия в сыворотке крови до 2,5 ммоль/л.
|
Рекомендации |
Класс |
Уровень |
|
В качестве средств симптоматической АГТ можно применять препараты всех основных классов, как правило, в виде комбинированной терапии. С учетом патогенеза АГ в качестве препаратов первого выбора для коррекции АД применяют препараты из группы ИАПФ или БРА в комбинации с БКК, к которым при отсутствии достижения целевых значений АД присоединяют антагонисты минералокортикоидных рецепторов (верошпирон, эплеренон), α-АБ, с осторожностью применяют БАБ (предпочтение высокоселективным БАБ – небиволол, бисопролол), тиазидные и петлевые диуретики (опасность усиления гиперкальциурии и гипокалиемии) [162][163][164] |
IIb |
B |
9.2.7 Дальнейшее наблюдение и прогноз
После достижения ремиссии ЭГ потребность в медикаментозном лечении АГ и/или сахарного диабета, может быть изменена вплоть до полной отмены гипотензивных и сахароснижающих препаратов. В ряде случаев, особенно у пациентов после 50 лет, можно продолжить лечение остеопороза, хотя после достижения ремиссии гиперкортицизма нарушения костного метаболизма подвергаются обратному развитию.
|
Рекомендации |
Класс |
Уровень |
|
Наблюдение за пациентами с ЭГ может быть длительное, в ряде случаев пожизненное, так как возможны рецидивы заболевания [143][146][154] |
IIb |
B |
Прогноз благоприятный при достижении ремиссии гиперкортицизма, что, как правило, удается достичь в 80% случаях при БИК в руках опытного нейрохирурга, до 100% – при доброкачественной кортизол-секретирующей аденоме надпочечника. В остальных случаях эндогенного гиперкортицизма процент ремиссии и вероятность рецидива, как правило, выше. При эффективной нейрохирургической операции АД нормализуется у 60% пациентов, y 40% гипертония становится более легко контролируемой [163][164]. После двусторонней адреналэктомии регресс АГ наблюдался у 64% больных [165]. У некоторых пациентов сохраняется повышенный ССР после 30 лет наблюдения. Данный риск, возможно, является следствием длительного влияния избытка кортизола: смертность была повышена у пациентов, у которых заболевание длилось более 3 лет до достижения ремиссии [165]. При персистенции заболевания вероятность неблагоприятных сердечно-сосудистых событий возрастает, что требует жесткого контроля АГ.
9.3 ФЕОХРОМОЦИТОМА/ПАРАГАНГЛИОМА
9.3.1 Определения
Феохромоцитома (ФХЦ) – редкая нейроэндокринная опухоль мозгового слоя надпочечников, состоящая из хромаффинных клеток, секретирующая катехоламины (КА): адреналин, норадреналин, дофамин.
Параганглиома (ПГ) – опухоль, состоящая из вненадпочечниковой хромаффинной ткани симпатических паравертебральных ганглиев грудной клетки, брюшной полости и малого таза. ПГ также могут развиваться в парасимпатических ганглиях шеи и основания черепа, в большинстве случаев они не продуцируют КА.
Рубрика МКБ-10:
E27.5 Гиперфункция мозгового слоя надпочечников.
9.3.2 Эпидемиология и классификация
Опухоли хромаффинной ткани в 80-85% случаев представляют собой ФХЦ надпочечниковой локализации, в 15-25% – вненадпочечниковые ПГ. Распространенность феохромоцитомы и параганглиомы (ФХЦ/ПГ) составляет 0,2-0,6% среди всех форм АГ и менее 0,05% в общей популяции. Ежегодная заболеваемость ФХЦ/ПГ составляет около 2-8 случаев на миллион жителей в год [166][167][168][169]. Эти опухоли наблюдаются в любом возрасте, наиболее часто – в возрасте от 40 до 60 лет. У детей с АГ распространенность ФХЦ/ПГ достигает 25%. Диагноз ФХЦ/ПГ может быть пропущен в течение жизни; аутопсийные исследования показывают невыявленные опухоли у 0,05–0,1% пациентов. Диаметр опухолей варьирует от 1 до 15 см и более, медиана – 4,5 см. У большинства пациентов диагностируют одностороннюю ФХЦ (81-89%) или одиночную ПГ (7–18%) [168]. ФХЦ/ПГ могут быть спорадическими или обнаруживаться в контексте наследственных синдромов. Доля пациентов с ФХЦ/ПГ, диагностированными на основании генетического скрининга, составляет 5-12%. Семейные (наследственные) ФХЦ/ПГ часто мультифокальные и двусторонние. Среди пациентов с инциденталомой надпочечника около 7% представляют собой ФХЦ [167]. За последние десятилетия отмечено возрастание уровня заболеваемости ФХЦ/ПГ, что связывают с увеличением доли диагностированных инциденталом [169][170]. Согласно современной концепции, ФХЦ/ПГ не классифицируются как доброкачественные и злокачественные, поскольку все они могут иметь злокачественный потенциал [171][172]. Выделяют метастатические и неметастатические ФХЦ/ПГ. Метастатические опухоли определяют не по обычным морфологическим и иммуногистохимическим критериям, а по наличию метастазов в нехромаффинной ткани, их выявляют в 15-25% случаев у пациентов с первичными ФХЦ/ПГ [173].
Важность своевременной диагностики ФХЦ/ПГ определяется рядом факторов: при отсутствии своевременного адекватного лечения гиперсекреция КА опухолью приводит к ССО и летальным исходам; ФХЦ/ПГ обладают злокачественным потенциалом и могут метастазировать; при наследственных формах заболевания обнаружение ФХЦ/ПГ у пробанда способствует более ранней диагностике и лечению у других членов семьи [166].
9.3.3 Клиническая картина
Клинические симптомы заболевания определяются эффектами секретируемых гормонов и активных веществ и отличаются большим разнообразием проявлений [167][168][172][174]. Для ФХЦ/ПГ в большинстве случаев характерны пароксизмальные симптомы различной степени тяжести и частоты, обусловленные эпизодической секреторной активностью. Такие симптомы могут возникать спонтанно или могут быть спровоцированы различными триггерами. Описаны такие симптомы, как сердцебиение (53%), беспокойство (46%), потливость (41%), головные боли (37%), усталость (28%), ортостатические симптомы (27%), ощущение жара/приливов крови (24%), тошнота (22%), потеря веса (16%), бледность (12%). Полное отсутствие симптомов регистрируют в 9% случаев [169]. Наиболее характерна триада симптомов: выраженные сердцебиения, потливость, головная боль [166][167][174][175][176]. Эти симптомы выявляются у большинства больных с ФХЦ/ПГ, однако наличие всех трёх признаков у одного больного встречается реже – только у пятой части пациентов [168][169][170]. В 40% случаев пароксизмальные проявления отсутствуют, течение заболевания может быть малосимптомным [170][175].
Артериальная гипертония выявляется в 90–95% случаев и в значительной мере определяет особенности течения заболевания. Выделяют следующие варианты клинического течения ФХЦ/ПГ [9][169][174][175][177]: кризовое (пароксизмальное) течение – гипертонические кризы наблюдаются у 40-50% больных, у части из них они могут возникать на фоне повышенного или нормального АД; постоянная (стабильная) персистирующая АГ без гипертонических кризов имеет место у 30-60% больных. АГ может приобретать неконтролируемое, резистентное к АГТ течение [178]; в некоторых случаях наблюдается ортостатическая гипотония. Нормальный уровень АД выявляется у 13-27% больных [169][170].
При кризовом повышении АД отмечается очень быстрое, в течение нескольких минут, нарастание его уровня, который может достигать 250-300/130-150 мм рт. ст. Гипертонический криз обычно сопровождается разнообразными симптомами: приступами головной боли (в 80%), часто пульсирующего характера, которая локализуется в лобной или затылочной областях и нередко сопровождается тошнотой и рвотой; чрезмерной потливостью (в 57%), бледностью кожных покровов, реже – их гиперемией; чувством безотчетного страха; ощущением выраженных сердцебиений (в 64%), при этом тахикардия может отсутствовать [175]. У части больных регистрируются нарушения ритма сердца. Часто наблюдаются расстройства зрения, слуха, повышение температуры тела, боли в груди или животе, парестезии, судороги, учащенное мочеиспускание. Все эти проявления могут сочетаться в различных комбинациях. У большинства больных при гипертоническом кризе возникают изменения в клинической картине крови: обнаруживается гипергликемия, лейкоцитоз, эозинофилия. Характерная особенность гипертонического криза – кратковременность (продолжительность гипертонического криза чаще не более 30-60 мин.) и самокупируемость (гипертонический криз обычно заканчивается внезапно, АД быстро нормализуется).
Кризовое повышение АД может быть спровоцировано некоторыми факторами (табл. 19) [166][167][174][175][179]: пальпацией области локализации опухоли, физической нагрузкой, психическим перенапряжением, гипервентиляцией, натуживанием. Возможна также провоцирующая роль некоторых лекарственных препаратов, алкоголя и пищевых продуктов (тирамин в некоторых сырах, кофе, копчености и др.), а также диагностических методов и процедур: ангиографии, интубации трахеи, оперативных вмешательств, экстракции зуба, травмы.
Учащение эпизодов гиперсекреции КА может привести к развитию состояния «неуправляемой гемодинамики», при котором чередуются эпизоды резко повышенного и пониженного АД, трудно поддающиеся медикаментозной коррекции, развивается тенденция к прогрессирующей гипотонии, возникает угроза развития катехоламинового шока [177][180].
Характерные для ФХЦ/ПГ особенности АГ, по данным СМАД: выраженная вариабельность и нарушение циркадного ритма АД, в ряде случаев отсутствует адекватное снижение АД в ночные часы [181].
Более чем в одной трети случаев регистрируют различные ССО [169][179][181]: возникают нарушения ритма сердца, некоронарогенные некрозы миокарда, диагностируют различные кардиомиопатии (дилятационную, гипертрофическую, кардиомиопатию Такацубо), острую сердечную недостаточность, нарушения мозгового кровообращения. Другие возможные органные поражения: висцеральная ишемия, нейроретинопатия, почечная недостаточность, мультисистемный криз [176].
Характер течения АГ и клинические проявления различаются в зависимости от выраженности избыточной продукции КА и от преобладания секреции норадреналина или адреналина [169]. Наряду с КА, ФХЦ/ПГ могут секретировать многочисленные пептиды, что приводит к разнообразным клиническим проявлениям: гиперкортицизму, полицитемии, гиперкальцемии. В 15-30% диагностируют нарушения углеводного обмена. В 20-40% случаев выявляют СД 2 типа и снижение ИМТ менее 25 кг/м2 с симптомами избытка КА или без них [167][182].
ФХЦ/ПГ может быть составной частью наследственных синдромов, которые имеют ряд клинических особенностей и полиорганных проявлений [167][183][184][185]. Минимум шесть различных синдромов, наследуемых по аутосомно-доминантному типу, имеют четкие клинические признаки. Наиболее распространенные проявления синдромов, ассоциированных с ФХЦ/ПГ, представлены в Приложении 7.
9.3.4 Скрининг и диагностика
Ранняя диагностика ФХЦ/ПГ имеет решающее значение для предотвращения жизнеугрожающих ССО при отсутствии адекватного хирургического лечения. Основные задачи диагностики ФХЦ/ПГ на начальном этапе – определение вероятности наличия данного заболевания. Разработаны показания для скрининга больных с целью возможного выявления ФХЦ/ПГ среди категорий пациентов с клиническими симптомами и проявлениями заболевания, которые могут указывать на необходимость дальнейшего лабораторного обследования (табл. 19) [166][167][172][175].
|
Диагноз ФХЦ основывается на анализе анамнеза заболевания, отягощенного семейного анамнеза (вероятность наследственного заболевания), клинических проявлений (особенно симптомов пароксизмального типа), данных физикального обследования, лабораторных и инструментальных методов, позволяющих визуализировать опухоль, уточнить её локализацию. При наличии соответствующих показаний проводится генетическое тестирование для выявления генов, ассоциированных с ФХЦ.
Клинические симптомы могут возникать изолированно, а учитывая их неспецифический характер, диагностика иногда представляет собой очень трудную задачу.
При физикальном обследовании обращает на себя внимание бледность кожных покровов лица и груди, холодные и влажные конечности. Больные обычно худые, возбужденные. При осмотре могут быть обнаружены некоторые внешние проявления, наблюдаемые при семейных формах ФХЦ/ПГ. Пальпация объемного образования, обнаруженного в области живота, может вызвать гипертонический криз. Ортостатическая гипотония и тахикардия также позволяют заподозрить ФХЦ/ПГ.
9.3.4.1 Методы лабораторной диагностики
Наиболее высокая чувствительность (97-98%) достигается при определении в плазме крови свободных метанефринов и/или фракционированных метанефринов в суточной моче. В настоящее время это основной тест, рекомендованный экспертами для скрининга в алгоритме диагностики ФХЦ/ПГ [166][167][172][183]. Исследование метанефринов плазмы требует соблюдения определенных условий: следует учитывать особенности взятия крови, положения больного [166][167][183]. Важное диагностическое значение имеют уровень повышения и характер секреции метанефринов. Повышение уровня любого метаболита в плазме более чем в два раза выше верхнего порогового значения или увеличение содержания двух или более метаболитов встречается более чем у 80% пациентов с ФХЦ/ПГ [167]. Следует учитывать, что некоторые лекарственные препараты могут вызывать ложно завышенные результаты тестов [166][167].
Измерение КА в моче и ванилилминдальной кислоты – методы, применяемые ранее, они недостаточно надежны, могут давать ложноположительные результаты и в настоящее время не используются [166][175][183]. Диагностическая значимость применяемых ранее в клинической практике фармакологических проб (адренолитические средства) также в настоящее время не считается достаточно убедительной. При проблемах интерпретации результатов исследования показателей метанефринов, ложноположительных результатах проводят дополнительное исследование – подавляющий тест с клонидином с измерением норметанефрина плазмы [166][167][172][177][183]. В некоторых случаях при получении сомнительных результатов – “серой зоны” уровня метанефринов – приемлема выжидательная тактика [172].
Всем пациентам с положительным результатом тестирования и установления факта гиперпродукции метанефринов опухолью на следующем этапе диагностики уточняют её локализацию, используя методы топической диагностики.
|
Рекомендации |
Класс |
Уровень |
|
В качестве метода первичной диагностики ФХЦ/ПГ рекомендовано определение свободных метанефринов плазмы или фракционированных метанефринов суточной мочи [166][167][168][172][183] |
I |
А |
|
Для определения метилированных производных КА (метанефрина, норметанефрина и метокситирамина) в биологических жидкостях целесообразно использовать метод жидкостной хроматография с масс-спектрометрией или электрохимический анализ [166][167][168][172][183] |
IIа |
В |
|
Забор крови для определения уровня метанефринов целесообразно проводить в положении лежа после 30-минутного горизонтального положения с использованием соответствующих данному положению референсных интервалов [166][167][168][183] |
IIа |
В |
|
Всем пациентам с положительным результатом тестирования рекомендуется углубленное обследование для исключения или подтверждения ФХЦ/ПГ [167][183] |
I |
B |
9.3.4.2 Методы топической диагностики
Проведение методов топической диагностики ФХЦ/ПГ (КТ или МРТ) рекомендовано только при наличии лабораторных данных о диагностически значимом повышении метанефринов [166][183][184]. Методом выбора в топической диагностике ФХЦ/ПГ органов грудной клетки, брюшной полости и малого таза является КТ [166][183]. Чувствительность КТ с контрастированием для уточнения локализации ФХЦ/ПГ достигает 88-100%. Так как большинство ФХЦ/ПГ локализуются в брюшной полости, в первую очередь рекомендовано проведение КТ данной области. При вненадпочечниковой, рецидивирующей, метастатической опухоли чувствительность КТ ниже, чем МРТ. Для параганглиом головы и шеи чувствительность МРТ достигает 90-95%. В редких случаях ФХЦ/ПГ могут не выявляться методом анатомической визуализации (особенность локализации, небольшой размер опухоли). Такие опухоли могут быть обнаружены только функциональными методами исследования при применении сцинтиграфии с мета-¹²³I-бензилгуанидином (¹²³I-МЙБГ) или мета-¹³¹I-бензилгуанидином (¹³¹I-МЙБГ) – аналогом гуанидина, сходным по структуре с норадреналином [166][167]. Определены также показания к применению ПЭТ для выявления ФХЦ/ПГ [166][167][186].
9.3.4.3 Генетическое тестирование
Наследственная предрасположенность к генетически детерминированным ФХЦ может достигать 20%. Всем пациентам с ФХЦ/ПГ показано рассмотрение вопроса о проведении генетического обследования [166][167][183][186]. Учитывая высокую стоимость, тотальный скрининг всех точек возможных мутаций нецелесообразен. Генетический скрининг, выбор метода функциональной визуализации должны проводиться персонализировано, с учетом мутации и связанной с ней характеристики ФХЦ/ПГ [166][167][183].
Важный этап установления диагноза ФХЦ/ПГ – дифференциальная диагностика с широким спектром клинических состояний различной этиологии, что может представлять значительные трудности при всех вариантах её клинического течения, и требует тщательного анализа клинических проявлений заболевания и результатов проведенного обследования [12].
|
Рекомендации |
Класс |
Уровень |
|
Топическая диагностика ФХЦ/ПГ рекомендована только при наличии лабораторных данных о диагностически значимом повышении метанефринов [166][183][184] |
I |
B |
|
В качестве метода выбора в топической диагностике ФХЦ/ПГ органов грудной клетки, брюшной полости и малого таза целесообразно применять метод КТ, обладающий лучшим пространственным разрешением и цифровой информацией о плотности опухоли на всех фазах исследования при сравнении с МРТ [166][183] |
IIа |
В |
|
Проведение МРТ рекомендовано пациентам при параганглиомах головы и шеи, а также при строгом индивидуальном ограничении лучевой нагрузки [166][183] |
I |
В |
|
Сцинтиграфию с ¹²³I или ¹³¹I–МЙБГ целесообразно применять при подозрении на метастатическое поражение, вненадпочечниковую (за исключением ФХЦ/ПГ головы и шеи) или рецидивирующую ФХЦ/ПГ, при перспективе терапевтического использования ¹³¹I–МЙБГ [183][184] |
IIа |
А |
|
При метастатической ФХЦ/ПГ целесообразно применение ПЭТ с 18F–фтордезоксиглюкозой в сочетании с КТ (ПЭТ/КТ с 18F–ФДГ), которая обладает большей чувствительностью по сравнению со сцинтиграфией с¹²³I–МЙБГ [167][183][184][186] |
IIа |
В |
|
Для всех пациентов с ФХЦ/ПГ рекомендовано рассмотрение вопроса о проведении генетического обследования, которое должно основываться на конкретных фенотипических признаках заболевания и данных семейного анамнеза [167][183][185][186] |
I |
В |
9.3.5 Лечение
Тактика лечения должна быть индивидуальной, учитывать клинический статус пациента, особенности опухоли.
Показания к лечению должны быть индивидуальными и обсуждаться в многопрофильной команде на основе характеристик пациента (возраста, сопутствующих заболеваний), локализации первичной опухоли, локального и отдаленного распространения, профиля секреции гормонов, скорости роста опухоли, визуализации и генетического профиля. Мультидисциплинарный подход, включающий специалистов в области эндокринологии, онкологии, кардиологии, лучевой терапии, хирургии имеет первостепенное значение [172].
Хирургическое лечение – единственный радикальный метод лечения ФХЦ/ПГ. Предоперационная подготовка, а также периоперационнное ведение пациентов с ФХЦ/ПГ, включает проведение медикаментозной терапии для обеспечения адекватного контроля АД и снижения риска периоперационных осложнений [166][167][168][172][174][179][182].
Консервативное лечение в предоперационном периоде основано на медикаментозной терапии, включающей применение α-АБ (доксазозин, празозин, теразозин), которые должны быть назначены минимум за 7-14 дней до операции [166][167][168][183]. По показаниям, в дальнейшем на фоне последних возможно присоединение БАБ. Применение монотерапии БАБ без достаточной блокады α-АБ может привести к резкому повышению АД и состоянию неуправляемой гемодинамики [168][174]. Применяются также α- β-АБ (карведилол), БКК [175]. Для купирования гипертонического криза применяют внутривенно натрия нитропруссид, фентоламин [174][179]. Критерии эффективности АГТ в предоперационном периоде включают: нормализацию уровня АД (менее 130/80 мм рт. ст.), достижение целевой ЧСС (60-70 ударов в мин), ликвидацию индуцированного избытком КА гиповолемического синдрома [166][167][168]. Определение целевых гемодинамических значений проводят в соответствии с возрастом пациента и наличием сердечно-сосудистой патологии.
Для выбора наиболее подходящей хирургической тактики требуется тщательное предоперационное планирование. При локализации опухоли в области надпочечников рекомендовано проведение лапароскопической адреналэктомии. При параганглиоме эндоскопическая операция требует большого опыта хирурга, в большинстве случаев предпочтителен открытый доступ [166][168][172]. После операции необходим мониторинг АД и ЧСС для выявления послеоперационной гипотонии, требующей вазопрессорной поддержки.
Более подробно особенности хирургического лечения ФХЦ/ПГ, злокачественных и наследственных ФХЦ/ПГ, показания к другим методам лечения (дистанционная лучевая терапия, химиотерапия, абляционная терапия) представлены в соответствующих рекомендациях [168][172][173].
|
Рекомендации |
Класс |
Уровень |
|
Всем пациентам с подозрением на ФХЦ/ПГ целесообразно проведение предоперационной подготовки α-АБ. Исключением являются пациенты с гормонально-неактивными опухолями головы и шеи [166][167][168] |
IIа |
B |
|
Рекомендуется предоперационная подготовка α-АБ и, по показаниям, БАБ до достижения критериев её эффективности, которые включают: нормализацию уровня АД, достижение целевой ЧСС, ликвидацию гиповолемического синдрома, индуцированного избытком КА [166][167][168] |
I |
В |
|
Пациентам с надпочечниковой ФХЦ целесообразно проводить лапароскопическую адреналэктомию. Для больших (более 8 см) и инвазивных опухолей предпочтителен открытый доступ во избежание повреждения капсулы опухоли и её диссеминирования. Эндоскопическое удаление вненадпочечниковых ФХЦ/ПГ целесообразно только в специализированных ведущих хирургических центрах, исключительно для неинвазивных параганглиом малого размера [166][168][172] |
IIа |
В |
|
Пациентам с ФХЦ/ПГ целесообразно обследование и лечение в специализированных центрах экспертного уровня [166][183] |
IIа |
B |
9.3.6 Дальнейшее наблюдение
Своевременно проведенное радикальное хирургическое лечение по поводу доброкачественной ФХЦ/ПГ благоприятно сказывается на течении заболевания. Улучшение течения АГ наблюдается в 38-94% случаев [182][187]. В 51-79% случаев выявляют персистирующую АГ. Отмечена значительная положительная динамика в гликемических нарушениях, выявленных до операции, обратимость кардиомиопатий.
Цель послеоперационного наблюдения – установление полной резекции ФХЦ/ПГ. Выявление повышенных послеоперационных уровней метанефринов указывает на наличие персистирующего заболевания.
В послеоперационном периоде проводят лабораторное обследование для исключения рецидива и метастазирования ФХЦ/ПГ, курацию сопутствующих заболеваний в рамках выявленных наследственных синдромов. При резидуальной АГ – медикаментозный контроль АД и сопутствующих ССО [172]. В настоящее время не разработаны конкретные протоколы последующего послеоперационного наблюдения. Для констатации успешного удаления ФХЦ/ПГ после восстановительного периода (через 2-4 недели после операции) показано определение метанефринов в плазме или в моче, в дальнейшем их определение целесообразно проводить ежегодно для исключения рецидива ФХЦ/ПГ. Определение метанефринов во время наблюдения только у пациентов с АГ и адренергическими симптомами нецелесообразно, поскольку эти проявления имеют низкую чувствительность и специфичность для прогнозирования рецидива ФХЦ/ПГ [186].
Дальнейшее длительное послеоперационное наблюдение является обязательным для всех пациентов, так как все они считаются подверженными риску рецидива опухоли, а клиническое течение заболевания заметно варьирует, особенно при ФХЦ/ПГ, связанных с наследственными синдромами [167][168]. Целесообразна персонализированная оценка риска рецидива заболевания, основанная на возрасте, результатах генетических тестов, локализации и размере опухоли [186]. Методы мониторинга для скрининга метастатических рецидивов или новых поражений: ежегодное физикальное и лабораторное обследование (метанефрины плазмы или мочи), по показаниям – визуализирующие тесты [172][186]. Десятилетнее послеоперационное наблюдение показано для всех пациентов с резецированными ФХЦ/ПГ и пожизненное персонализированное наблюдение для пациентов с наследственными формами заболевания; такое последующее наблюдение должно проводиться мультидисциплинарной группой специалистов разного профиля в специализированном центре [167][168][186].
|
Рекомендации |
Класс |
Уровень |
|
Целесообразно ежегодное лабораторное обследование для исключения рецидива и метастазирования ФХЦ/ПГ, курация сопутствующих заболеваний в рамках выявленных наследственных синдромов [168][186] |
IIа |
B |
|
Целесообразно наблюдение в течение не менее 10 лет для скрининга рецидива заболевания у всех пациентов, оперированных по поводу ФХЦ/ПГ. Пациентам с высоким риском (молодые, с наследственными синдромами, большими ФХЦ/ПГ) целесообразно пожизненное ежегодное наблюдение [167][168][172][186] |
IIа |
С |
9.3.7 Прогноз
Прогноз при ФХЦ/ПГ неоднороден. После проведения радикального хирургического лечения главным прогностическим фактором является факт рецидива и метастазирования опухоли. Частота метастатического поражения колеблется в пределах от 1% до 79%, в зависимости от локализации и размера опухоли, возраста при постановке диагноза и генотипа [172][182].
При наследственных формах ФХЦ/ПГ, имеющих наибольший потенциал злокачественности и склонность к рецидивированию, общее состояние пациентов и прогноз заболевания отягощаются наличием сопутствующей опухолевой патологии. Своевременная диагностика ФХЦ и сопутствующих синдромальных проявлений определяет прогноз заболевания, дальнейшую тактику лечения и наблюдения.
9.4 ЗАБОЛЕВАНИЯ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
9.4.1 ТИРЕОТОКСИКОЗ
9.4.1.1 Определения
Тиреотоксикоз — синдром, обусловленный избыточным содержанием тиреоидных гормонов в крови и их токсическим действием на различные органы и ткани.
Диффузный токсический зоб (болезнь Грейвса) — аутоиммунное заболевание, развивающееся вследствие выработки стимулирующих антител к рецептору тиреотропного гормона (рТТГ), клинически проявляющееся диффузным поражением ЩЖ с развитием синдрома тиреотоксикоза в сочетании с экстратиреоидной патологией (эндокринная офтальмопатия, претибиальная микседема, акропатия).
Узловой/многоузловой токсический зоб (МТЗ) — заболевание, клинически проявляющееся узловым поражением ЩЖ с развитием тиреотоксикоза вследствие автономного, независимого от тиреотропного гормона (ТТГ) функционирования узловых образований ЩЖ.
Рубрики МКБ-10:
Е05.0 Тиреотоксикоз с диффузным зобом.
Е05.1 Тиреотоксикоз с токсическим одноузловым зобом.
Е05.2 Тиреотоксикоз с токсическим многоузловым зобом.
E05.5 Тиреотоксический криз или кома.
Причинами развития тиреотоксикоза могут быть экстратиреоидные заболевания: эктопия тиреоидной ткани (струма оварии, метастатический вариант дифференцированного рака ЩЖ, эктопия тиреоидной ткани в корень языка) – Е05.3, передозировка тиреоидных гормонов – Е05.4. К редким причинам тиреотоксикоза относят гиперсекрецию ТТГ – E05.8.
9.4.1.2 Эпидемиология и классификация
Наиболее частыми причинами тиреотоксикоза являются болезнь Грейвса (БГ) и МТЗ. В 2001 г. распространенность тиреотоксикоза в России составила 18,4 случая на 100 000 населения [188]. По данным Американской тиреоидной ассоциации, в 2011 г. распространенность тиреотоксикоза составила 1,2-1,6%, явного тиреотоксикоза — 0,5-0,6% и субклинического — 0,7-1,0% [189]. БГ является наиболее распространенной причиной тиреотоксикоза в богатых йодом географических районах, где ежегодно регистрируется 20-30 случаев на 100 000 человек. МТЗ развивается, преимущественно, у лиц, проживающих в йододефицитных районах.
|
Степень тяжести |
Критерии |
|
Субклинический тиреотоксикоз |
Устанавливается преимущественно на основании данных гормонального исследования при стертой клинической картине. Определяется сниженный (подавленный) уровень ТТГ при нормальных показателях свободного тироксина (CТ4) и свободного трийодтиронина (CТ3) |
|
Манифестный тиреотоксикоз |
Имеются развернутая клиническая картина заболевания и характерные гормональные сдвиги — сниженный уровень ТТГ при высоком уровне CТ4 и/или CТ3 |
|
Осложненный тиреотоксикоз |
Имеются тяжелые осложнения: ФП, АГ, сердечная недостаточность, тромбоэмболические осложнения, надпочечниковая недостаточность, токсический гепатит, дистрофические изменения паренхиматозных органов, психоз, кахексия и др. |
9.4.1.3 Скрининг и диагностика
Целесообразно проводить скрининг у пациентов с АГ, у которых на основании клинической картины можно заподозрить тиреотоксикоз [191].
Диагноз тиреотоксикоза основывается на характерной клинической картине, лабораторных показателях и инструментальных исследованиях. Клиническая диагностика тиреотоксикоза подразумевает выявление симптомов нарушения функции ЩЖ, пальпаторную оценку размеров и структуры ЩЖ, выявление сопутствующих заболеваний и осложнений тиреотоксикоза (табл. 20) [190].
Жалобы и анамнез
Пациенты с тиреотоксикозом предъявляют жалобы на повышенную возбудимость, плаксивость, беспокойство, нарушение сна, суетливость, нарушение концентрации внимания, слабость, потливость, сердцебиения, дрожь в теле, потерю веса. Нередко больные отмечают увеличение ЩЖ, частый стул, нарушение менструального цикла, снижение потенции. При анализе жалоб и анамнеза обращают внимание на симптомы, связанные с поражением сердечно-сосудистой системы: тахикардию, НРС, признаки СН, оценивают наличие и длительность течения АГ.
Физикальное обследование
Внешние проявления: пациенты выглядят встревоженными, беспокойными, суетливыми. Кожные покровы горячие и влажные. На отдельных участках кожи иногда определяют депигментированные очаги (витилиго). Волосы тонкие и ломкие, ногти мягкие, исчерченные и ломкие. ЩЖ в 80% случаев при БГ диффузно увеличена. При наложении на нее фонендоскопа можно выслушать систолический шум, что вызвано значительным усилением кровоснабжения органа. При МТЗ в ЩЖ пальпируются узловые образования.
При тиреотоксикозе развиваются многочисленные поражения органов и систем. Диагностируют ряд гемодинамических изменений, приводящих к повышенному риску ССО [191][192][193]. Сердечно-сосудистая система: развивается тахикардия, снижение системного сосудистого сопротивления, увеличение сердечного выброса, почечного перфузионного давления, активация РААС. При осмотре выявляются синусовая тахикардия, систолический шум на верхушке сердца, повышение АД. АГ выявляют в 20-30% случаев, диагностируют изолированную систолическую АГ, увеличение пульсового АД. Нарушения ритма сердца включают ФП – у 5–15% пациентов, реже выявляют трепетание предсердий (1,2–2,3%), суправентрикулярную экстрасистолию (5–7%), пароксизмальную тахикардию (0,2–3,3% случаев). ФП развивается не только у лиц с манифестным, но и субклиническим тиреотоксикозом, особенно имеющих сопутствующую сердечно-сосудистую патологию. У больных с тиреотоксикозом и ФП повышен риск тромбоэмболических осложнений. В редких случаях встречается синусовая брадикардия. Это может быть связано с врожденными изменениями, либо с истощением функции синусового узла и развитием синдрома его слабости. У пациентов с тиреотоксикозом функциональный резерв сердца значительно снижен, что определяет развитие СН, которая является ведущей причиной повышенной смертности от ССЗ как при манифестном, так и при субклиническом гипертиреозе [192]. Явный гипертиреоз ассоциирован с повышенным риском ИБС, инсульта и смертности от ССЗ, а субклинический гипертиреоз – с повышенным риском ИБС [193]. В большинстве случаев пациенты с тиреотоксикозом составляют категорию лиц высокого ССР [194].
Желудочно-кишечный тракт: несмотря на повышенный аппетит, для тиреотоксикоза характерно прогрессирующее снижение массы тела. Опорно-двигательный аппарат: нарушения проявляются нарастающей слабостью, проксимальной мышечной атрофией, тремором мелких мышечных групп всего тела, развитием периодических транзиторных параличей и парезов, повышением риска переломов. ЦНС: отмечаются увеличение скорости прохождения рефлексов, тремор пальцев вытянутых рук.
9.4.1.3.1 Лабораторные диагностические исследования при тиреотоксикозе
|
Рекомендации |
Класс |
Уровень |
|
Рекомендуется определение базального уровня ТТГ как первоначального скринингового теста у пациентов с клиникой тереотоксикоза [195][196][197][198] |
I |
С |
|
Рекомендуется определение уровня тиреоидных гормонов: CТ4 и CТ3 в сыворотке крови при низком уровне ТТГ [195][196][197][198] |
I |
С |
|
Рекомендуется определение антител к рТТГ у пациентов с наличием тиреотоксикоза для диагностики и дифференциальной диагностики БГ и МТЗ [197] |
I |
А |
При манифестном тиреотоксикозе концентрация ТТГ должна быть низкой (< 0,1 мЕ/л), содержание в сыворотке CТ4 и CТ3 — повышенным. При субклиническом тиреотоксикозе при низком уровне ТТГ уровни CТ4 и CТ3 в сыворотке крови в пределах нормы. Антитела к рТТГ являются специфическими биомаркерами БГ.
9.4.1.3.2 Инструментальные диагностические исследования при тиреотоксикозе
|
Рекомендации |
Класс |
Уровень |
|
Рекомендуется проведение УЗИ ЩЖ всем пациентам с БГ и МТЗ [195][196][197][199] |
I |
С |
|
Рекомендуется проведение КТ шеи, МРТ шеи при больших размерах зоба и/или загрудинном расположении зоба для исключения компрессии трахеи и пищевода [195][196][197][199] |
I |
С |
|
Рекомендуется проведение сцинтиграфии ЩЖ всем пациентам с МТЗ для дифференциальной диагностики с БГ [190] |
I |
С |
9.4.1.3.3 Дополнительные диагностические исследования
В связи с возможностью сопутствующих заболеваний, высокой вероятностью осложнений тиреотоксикоза, необходимостью оценки и коррекции сердечно-сосудистых ФР, влияющей на выбор тактики лечения, необходимо проведение дополнительного обследования при планировании лечения [192][193][198]. Рекомендовано проведение 12 канальной ЭКГ с оценкой сердечного ритма, частоты сердечных сокращений. По показаниям, особенно при обследовании больных с ФП и АГ, проводят суточное мониторирование ЭКГ по Холтеру, ЭхоКГ, СМАД [200].
|
Рекомендации |
Класс |
Уровень |
|
Рекомендуется проведение ЭКГ в покое лицам с диагностированным тиреотоксикозом для скрининга сердечно-сосудистой патологии [192][193][198][199] |
I |
С |
|
Целесообразно проведение осмотра врачом-кардиологом пациентов c АГ, нарушениями ритма сердца (ФП, экстрасистолией), сердечной недостаточностью [192][193][199][200] |
IIa |
B |
9.4.1.4 Лечение
В настоящее время существует три метода лечения тиреотоксикоза с диффузным/узловым токсическим зобом: консервативное лечение; хирургическое лечение; терапия радиоактивным йодом 131I [201][202].
|
Рекомендации |
Класс |
Уровень |
|
Рекомендуется независимо от выбора метода лечения всегда начинать терапию тиреотоксикоза с назначения антитиреоидных препаратов [203][204] |
I |
B |
|
Целесообразно назначение БАБ пациентам с тиреотоксикозом на период до достижения эутиреоза, а зачастую и на более длительный срок [205] |
IIa |
B |
Тиамазол является препаратом выбора для всех пациентов, которым планируется проведение консервативного лечения. БАБ показаны всем пациентам с тиреотоксикозом с ЧСС в покое более 90 уд/мин или при сопутствующей сердечно-сосудистой патологии [205]. БАБ: пропранолол (20–40 мг каждые 6 ч) или селективные БАБ более длительного действия (атенолол, бисопролол) назначаются для контроля адренергических симптомов, таких как учащенное сердцебиение и тремор, АГ, особенно на ранних стадиях до начала действия антитиреоидных препаратов. При эффективном лечении тиреотоксикоза АД часто нормализуется, после достижения эутиреоза синусовый ритм чаще всего восстанавливается. У больных с предшествующим заболеванием сердца или более длительным течением ФП синусовый ритм восстанавливается гораздо реже.
Лечение тиреотоксического криза
Тиреотоксический криз (ТК) — опасное состояние, угрожающее жизни больного. Это состояние проявляется резким увеличением выраженности симптомов тиреотоксикоза. Диагностические критерии ТК включают лихорадку, выраженную синусовую тахикардию (более 130 уд/мин), аритмию, АГ, острую сердечную недостаточность, возбуждение, бред, психоз, ступор, кому, тошноту, рвоту, диарею, печеночную недостаточность [206][207]. Тахикардия при ТК (ЧСС более или равная 150 уд/мин) ассоциирована с повышенной смертностью. Для контроля сердечного ритма рекомендовано применение БАБ: эсмолола (внутривенно), бисопролола. При ФП по показаниям применяют антикоагулянты. Более подробно лечение ССО при ТК изложено в соответствующих рекомендациях [206].
|
Рекомендации |
Класс |
Уровень |
|
Рекомендуется использовать мультимодальный подход к лечению пациентов с БГ и ТК, включающий терапию антитиреоидными препаратами, введение системных глюкокортикоидов, БАБ, АГП, ликвидацию гипоксии, гипертермии, дегидратации, реанимационные мероприятия, симптоматическую терапию, пищевую поддержку, респираторную помощь и мониторинг в отделении интенсивной терапии [206][207] |
I |
A |
9.4.1.5 Дальнейшее наблюдение и прогноз
План наблюдения. Все пациенты с клиническими и лабораторными признаками тиреотоксикоза должны быть направлены на консультацию к эндокринологу для проведения дифференциальной диагностики различных форм тиреотоксикоза и определения тактики лечения. В дальнейшем пациента может наблюдать врач общей практики и при необходимости может консультировать эндокринолог. Пациенты с тиреоидной кардиопатией, нарушением ритма сердца, АГ должны наблюдаться у кардиолога или терапевта. Консервативное лечение БГ проводится в течение 12-18 месяцев. В случае рецидива тиреотоксикоза решается вопрос о радикальном лечении. Пациенты с МТЗ после нормализации CТ3 и CТ4 направляются на РЙТ или оперативное лечение.
Показания для госпитализации в медицинскую организацию:
- декомпенсация тиреотоксикоза (плановая госпитализация);
- осложненные формы тиреотоксикоза: ФП, сердечная недостаточность, тромбоэмболические осложнения, надпочечниковая недостаточность, токсический гепатит, дистрофические изменения паренхиматозных органов, психоз, кахексия и др. (экстренная госпитализация);
- тиреотоксический криз (экстренная госпитализация).
Прогноз
При адекватном лечении тиреотоксикоза прогноз благоприятный. Вовремя начатое адекватное лечение способствует более быстрому восстановлению эутиреоидного состояния и предотвращает развитие осложнений. Поражение сердечно-сосудистой системы при тиреотоксикозе определяет тяжесть и прогноз заболевания. При достижении стойкого эутиреоза удается устранить ФП и снизить риск ССО. При нелеченном тиреотоксикозе, отсутствии нормализации тиреоидных гормонов на фоне проводимого лечения, несоблюдении рекомендаций врача повышается риск развития аритмий, недостаточности кровообращения, тромбоэмболических осложнений.
9.4.2 ГИПОТИРЕОЗ
9.4.2.1 Определения
Гипотиреоз – дефицит тиреоидных гормонов в организме.
Первичный гипотиреоз – гипотиреоз, резвившийся вследствие поражения (деструкции) самой ЩЖ. Наиболее часто гипотиреоз развивается вследствие аутоиммунного тиреоидита, а также после медицинских манипуляций (ятрогенный) – послеоперационный или в исходе РЙТ.
Манифестный гипотиреоз – повышенный уровень ТТГ при одновременном снижении СТ4 ниже референсного интервала.
Субклинический гипотиреоз (СГ) – повышенный уровень ТТГ при уровне СТ4 в пределах референсного интервала.
Вторичный гипотиреоз (ВтГ) – клинический синдром, развивающийся вследствие недостаточной продукции ТТГ при отсутствии первичной патологии самой ЩЖ.
Аутоиммунный тиреоидит (АИТ) – это аутоиммунное заболевание, приводящее к развитию гипотиреоза вследствие деструкции ткани ЩЖ.
Рубрики МКБ-10:
E03.1. Врожденный гипотиреоз без зоба.
E03.2. Гипотиреоз, вызванный медикаментами и другими экзогенными веществами.
E03.3. Постинфекционный гипотиреоз.
E03.4. Атрофия щитовидной железы (приобретенная).
E03.5. Микседематозная кома.
E03.8. Другие уточненные гипотиреозы.
E03.9. Гипотиреоз неуточненный.
E89.0. Гипотиреоз, возникший после медицинских процедур.
9.4.2.2 Эпидемиология и классификация
Первичный гипотиреоз является одним из наиболее распространенных эндокринных заболеваний. В среднем частота новых случаев спонтанного гипотиреоза составляет у женщин 3,5 случая на 1000 человек в год, а гипотиреоза в результате радикального лечения тиреотоксикоза – 0,6 случая на 1000 человек в год [208]. ВтГ – редкое заболевание, его распространенность в популяции варьирует от 1:16 000 до 1:100 000 населения в зависимости от возраста и этиологии [209].
Классификация гипотиреоза по этиологии — таблица 21, по тяжести — таблица 22.
|
Первичный (заболевания ЩЖ) |
АИТ; хирургическое удаление ЩЖ; РЙТ; гипотиреоз при подостром, послеродовом, «безболевом» тиреоидите; тяжелый йодный дефицит; аномалии развития ЩЖ (дисгенезия и эктопия) |
|
Вторичный (гипоталамо-гипофизарная патология) |
Крупные опухоли гипоталамо-гипофизарной области Травматическое или лучевое повреждение гипофиза Инфекционные, инфильтративные процессы Нарушение синтеза ТТГ и/или тиреолиберина |
|
Степень тяжести |
Лабораторные изменения |
Клиническая картина |
|
Субклинический |
ТТГ повышен, СТ4 в норме |
Бессимптомное течение или только неспецифические симптомы |
|
Явный (манифестный) |
ТТГ повышен, СТ4 снижен |
Присутствуют характерные симптомы гипотиреоза, возможно и бессимптомное течение |
|
Осложненный гипотиреоз |
ТТГ повышен, СТ4 снижен |
Развёрнутая клиническая картина гипотиреоза. Отмечают тяжёлые осложнения: полисерозит, АГ, сердечная недостаточность, энцефалопатия, микседематозная кома и др. |
9.4.2.3 Скрининг и диагностика
Скрининг на предмет гипотиреоза следует проводить у пациентов с АГ при любых клинических симптомах гипотиреоза [191].
Диагностика
Жалобы, анамнез, физикальное обследование
Наиболее часто встречающиеся симптомы гипотиреоза: выраженная утомляемость, сонливость, сухость кожных покровов, выпадение волос, замедленная речь, отечность лица, пальцев рук и ног, запоры, снижение памяти, зябкость, охриплость голоса, подавленное настроение. Нередко у пациентов доминируют симптомы со стороны какой-то одной системы, поэтому в таких случаях диагностируются заболевания – «маски». «Кардиологические маски«: диастолическая АГ, гиперлипидемия, гидроперикард. Тиреоидные гормоны оказывают положительный инотропный и хронотропный эффекты на сердце и повышают потребление миокардом кислорода. Гемодинамические эффекты гипотиреоза контрастируют с проявлениями гипертиреоза и включают снижение сердечного выброса, пульсового АД, ударного объёма, частоты сердечных сокращений, повышение системного сосудистого сопротивления [194][210].
Характерно развитие гипоренинемии, повышенной сольчувствительности, гиперволемии. СГ ассоциирован с повышенным риском развития АГ. При явном гипотиреозе в 30% случаев диагностируют диастолическую АГ, выявляют также маскированную АГ – в 26% случаев при субклиническом и в 15% случаев при явном гипотиреозе [194][211].
Гипотиреоз – частая вторичная причина дислипидемии: повышены уровни ОХС, ХС ЛПНП, ТГ, низкие или нормальные значения ХС ЛПВП [194]. Развивается эндотелиальная дисфункция, статус гиперкоагуляции, повышена ригидность артерий. Метаболические и гемодинамические эффекты гипотиреоза сопряжены с высоким риском ССО [194][210]. Дислипидемия, связанная с гипотиреозом, повышает риск развития атеросклероза, ИБС и инфаркта миокарда, особенно при уровне ТТГ 10 мЕд/л и более. Отмечен также повышенный риск развития ХСН.
Помимо сердечно-сосудистой системы, при гипотиреозе также могут наблюдаться поражения ряда других органов и систем, что сопровождается соответствующими симптомами – «масками» гипотиреоза: «гастроэнтерологические»: хронические запоры, желчнокаменная болезнь, хронический гепатит («желтуха» в сочетании с повышением уровня трансаминаз); «ревматологические»: полиартрит, полисиновит, прогрессирующий остеоартроз; «дерматологические»: алопеция, онихолизис, гиперкератоз; «психиатрические»: депрессия, деменция; «гинекологические»: дисфункциональные маточные кровотечения, бесплодие [190].
9.4.2.3.1 Лабораторные и инструментальные диагностические исследования при гипотиреозе
Диагноз явного (манифестного) гипотиреоза устанавливают при повышении уровня ТТГ и снижении СТ4 ниже референсного интервала; диагноз СГ – при повышении уровня ТТГ и уровне СТ4 в пределах референсного интервала. Ультразвуковые изменения, характерные для АИТ, могут появляться раньше, чем выявляется в крови повышение уровня антител к тиреопероксидазе (АТ-ТПО).
|
Рекомендации |
Класс |
Уровень |
|
Рекомендовано использовать диагностические признаки, сочетание которых позволяет установить АИТ как причину гипотиреоза: первичный гипотиреоз (явный или стойкий субклинический); наличие АТ-ТПО и ультразвуковые признаки аутоиммунной патологии [208][212][213] |
I |
B |
|
Целесообразно при впервые выявленном повышении уровня ТТГ и нормальном СТ4 проведение повторного исследования уровней ТТГ, СТ4 через 2-3 месяца, а также определение содержания АТ-ТПО [212] |
IIa |
B |
|
Диагноз ВтГ устанавливается на основании снижения уровня СТ4 в сыворотке крови ниже референсного диапазона в сочетании с неадекватно низким/ низконормальным уровнем ТТГ при двукратном исследовании [209] |
IIb |
С |
|
Целесообразно проведение УЗИ ЩЖ при впервые выявленном гипотиреозе [213] |
IIa |
B |
9.4.2.3.2 Дополнительные диагностические исследования
В связи с возможностью сопутствующих заболеваний, высокой вероятностью ССО, необходимостью оценки и коррекции сердечно-сосудистых ФР, требуется проведение дополнительного обследования при планировании лечения [192]. Рекомендовано проведение 12 канальной ЭКГ с оценкой сердечного ритма, ЧСС. По показаниям: суточное мониторирование ЭКГ по Холтеру, ЭхоКГ, СМАД [200].
|
Рекомендации |
Класс |
Уровень |
|
Рекомендовано проведение ЭКГ в покое лицам с диагностированным гипотиреозом для скрининга сердечно-сосудистой патологии [192][194] |
I |
B |
|
Целесообразно проведение осмотра врачом-кардиологом пациентов c АГ, нарушениями ритма сердца (ФП, экстрасистолией), сердечной недостаточностью [192][194] |
IIa |
B |
9.4.2.4 Лечение гипотиреоза
Левотироксин натрия является препаратом выбора заместительной терапии гипотиреоза в силу его эффективности, длительного опыта применения, высокой биодоступности, благоприятном профиле нежелательных явлений, простоте приёма.
|
Рекомендации |
Класс |
Уровень |
|
Рекомендуется назначать заместительную терапию всем пациентам с установленным диагнозом манифестного гипотиреоза. Препаратом выбора для заместительной терапии является левотироксин натрия [214] |
I |
А |
|
Рекомендуется терапию левотироксином натрия пациентам пожилого возраста начинать с небольших доз с постепенным повышением под контролем уровня ТТГ [214] |
I |
B |
|
Можно назначать заместительную терапию левотироксином натрия пациентам с повышением уровня ТТГ в крови более 10 мЕд/л, а также в случае как минимум двукратного выявления уровня ТТГ между 4-10 мЕд/л [215] |
IIb |
С |
Передозировка левотироксина натрия с развитием медикаментозного тиреотоксикоза является ФР ФП и остеопороза у женщин постменопаузального возраста [214][215]. С учетом низкоренинового статуса, характерного для АГ при гипотиреозе, предпочтительно применение БКК и диуретиков, натрийзависимый характер АГ определяет важность диеты с низким содержанием натрия [210].
На фоне адекватной заместительной терапии в большинстве случаев нормализуется АД, улучшаются характеристики сосудистой ригидности, достигается коррекция дислипидемии [194].
9.4.2.5 Дальнейшее наблюдение и прогноз
В силу неспецифичности симптомов очень часто плохое самочувствие у пациентов сохраняется и после компенсации гипотиреоза. В связи с этим оценка адекватности заместительной терапии проводится по уровню ТТГ. На эффективность лечения может оказывать влияние комплаентность пациента, т.е. готовность выполнять назначения врача. Пациенты с тиреоидной кардиопатией, нарушением ритма сердца, АГ, недостаточностью кровообращения должны наблюдаться у кардиолога или терапевта.
Прогноз определяется наличием у пациента сопутствующей тяжелой соматической патологии.
10. АРТЕРИАЛЬНАЯ ГИПЕРТОНИЯ ПРИ ПОРАЖЕНИИ КРУПНЫХ АРТЕРИАЛЬНЫХ СОСУДОВ
Наиболее распространенным поражением аорты и ее ветвей является атеросклероз. Локализация атеросклеротического стеноза в устье и по ходу почечных артерий приводит к развитию вторичной АГ – РВАГ (см. гл. Реноваскулярная АГ). Значительно реже этиология вторичной АГ связана с развитием коарктации аорты и с поражение аорты и крупных артерий при неспецифическом аортоартериите (НАА).
10.1 НЕСПЕЦИФИЧЕСКИЙ АОРТОАРТЕРИИТ
10.1.1 Определение
Неспецифический аортоартериит (НАА) – хронический васкулит, протекающий с поражением аорты и магистральных артерий, развитием стенозирования артерий и ишемией соответствующих органов. Это заболевание описывается также под названиями: артериит Такаясу, средний аортальный синдром, болезнь отсутствия пульса, артериит молодых женщин, панартериит.
Рубрика МКБ 10:
M31.4 Синдром дуги аорты [Такаясу].
10.1.2 Эпидемиология и классификация
Точные данные о распространенности НАА отсутствуют, приводятся сведения о выявлении 1,2-2,6 случаев заболевания на 1 миллион населения. НАА в 2-3 раза чаще наблюдается у женщин, чем у мужчин, обычно болезнь развивается в молодом возрасте: от 20 до 40 лет, описаны также случаи заболевания НАА у детей в возрасте 8-12 лет [216][217][218]. Выделяют различные типы поражения аорты при НАА в зависимости от локализации и распространенности поражений ветвей дуги и торакоабдоминального сегмента аорты, почечных и висцеральных ветвей, в разных сочетаниях [216]. По характеру течения воспалительного процесса выделяют острую, подострую и хроническую стадии НАА.
10.1.3 Клиническая картина
Клинические проявления заболевания отличаются большим разнообразием и обусловлены как обострением (активностью) заболевания, так и вовлечением в патологический процесс различных сосудистых бассейнов с клиническими проявлениями ишемии соответствующих органов [11][216][217][218]. Основные клинические симптомы заболевания могут быть представлены в виде 10 синдромов [216]: синдром общевоспалительных реакций; синдром поражения ветвей дуги аорты; синдром стенозирования торакоабдоминальной аорты, или коарктационный синдром; синдром РВАГ; синдром абдоминальной ишемии; синдром поражения бифуркации аорты; коронарный синдром; синдром аортальной недостаточности; синдром поражения легочной артерии; аневризматический синдром. В остром периоде заболевания наблюдаются неспецифические проявления, характерные для любого воспалительного процесса (повышение температуры тела, слабость, миалгии, артралгии и др.). Характерно появление тянущих болей в проекции пораженных артерий, чаще – на шее по ходу общих сонных артерий или в эпигастральной области по ходу брюшного отдела аорты. По мере прогрессирования заболевания для НАА характерно одновременное множественное и вместе с тем сегментарное поражение с формированием стенозов и окклюзий. Часто не прослеживается зависимости между выраженными морфологическими изменениями аорты и ее ветвей и клиническими проявлениями заболевания, которые могут быть довольно скудными, что объясняется компенсаторными возможностями коллатерального кровообращения. В результате выраженные нарушения гемодинамики могут быть длительное время полностью или частично компенсированы.
Особого внимания заслуживают клинические проявления, связанные с ухудшением кровоснабжения головного мозга, миокарда и с формированием АГ [216][217][218][219][220]. АГ наблюдается в 45-85% случаев у больных НАА [216][221][222]. Частота РВАГ в России при НАА составляет 42-58% [216]. Наиболее частые причины, приводящие к развитию АГ при НАА, следующие: стенотические поражения одной или обеих ПА с развитием РВАГ; коарктационный синдром; множественный характер поражения брахиоцефальных артерий с развитием АГ церебро-ишемического генеза [216]. В большинстве случаев при сочетанных типах поражения артерий причина развития АГ при НАА носит смешанный характер. НАА на протяжении длительного времени может протекать без явных клинических симптомов, и единственным проявлением заболевания может быть АГ [217]. В большинстве случаев наблюдается высокая АГ, резистентная к проводимой АГТ [222]. Высокая неконтролируемая АГ утяжеляет течение заболевания и является прогностически неблагоприятным фактором [219][223]. Прогрессирование АГ приводит к снижению компенсаторных возможностей органов-мишеней и развитию ССО и ЦВБ.
10.1.4 Диагностика
Диагноз НАА ставится по совокупности клинических проявлений, лабораторных и визуализирующих методах исследования. Разнообразие и неспецифичность клинических симптомов НАА часто сопряжены с многочисленными диагностическими ошибками. Частота ошибочных диагнозов при первичном осмотре достигает 80,7% [216]. Правильный диагноз устанавливается в среднем через 5-8 лет с момента первых проявлений заболевания. На начальном этапе диагностика базируется на анализе клинических проявлений, результатах аускультации, определения пульсации и АД на артериях верхних и нижних конечностей [216][224][225]. Отмечается отсутствие пульсации на одной или обеих лучевых артериях, наличие систолического шума в надключичной области при поражении подключичных артерий, над общими сонными артериями. При аускультации у большинства больных с поражениями ПА над их проекцией выслушивается систолический шум. При сочетанном характере поражения при НАА истинный уровень АД можно определить ориентируясь не только на его величину на верхних конечностях (АД на руках может не определяться), но и на нижних конечностях. При этом следует учитывать, что уровень системного АД на бедре превышает данный показатель на плече в среднем на 15-20% [216]. Специфические биологические маркеры НАА отсутствуют [218]. Для оценки активной фазы заболевания анализируют биомаркеры воспаления (C-реактивный белок и скорость оседания эритроцитов), эти показатели повышаются примерно у 70% пациентов в острой фазе и у 50% в хронической фазе заболевания [226]. Решающее значение для установления диагноза имеет визуализация всей аорты. Методы инструментальной диагностики: дуплексное сканирование артерий, мультиспиральная компьютерная ангиография (МСКТ-ангиграфия) и МР-ангиография, ПЭТ, по показаниям – рентгеноконтрастная ангиография [216][218][226][227].
10.1.5 Лечение
Больные НАА подлежат комплексному лечению, включающему медикаментозные (купирование воспалительного процесса, АГТ) и хирургические методы лечения. Для лечения АГ у больных НАА применяется та же тактика, что и при лечении категории пациентов высокого риска при ГБ [216][218][222]. Однако следует отметить, что крупных исследований, изучающих эффективность отдельных классов АГП, у больных НАА не проводилось. Особого внимания требует тактика лечения НАА с АГ церебро-ишемического генеза при множественном поражении брахиоцефальных артерий. Недооценка состояния мозгового кровотока, церебральной ишемии и неадекватная АГТ могут привести к гипоперфузионным поражениям мозга (ТИА, ишемическим инсультам) [216].
Патогенетическая терапия направлена на подавление иммунопатологических реакций, лежащих в основе заболевания, проводится в соответствии с общими принципами лечения системных васкулитов [216][218][227]. Учитывая редкость заболевания и отсутствие РКИ, рекомендации по патогенетическому лечению НАА имеют низкий или очень низкий уровень доказательности [227].
Хирургическое лечение проводится по показаниям только после достижения лабораторной и морфологической ремиссии НАА [216][227], причем морфологическая ремиссия наступает позже – через 3-4 месяца после стойкой нормализации лабораторных показателей [216]. При РВАГ после успешной хирургической реваскуляризации ПА в большинстве случаев отмечается положительная динамика АГ [216]. В некоторых случаях по показаниям проводят эндоваскулярное лечение стенозов пораженных артерий. В отдаленные сроки наблюдения в 40% случаев имеет место прогрессирование или рецидив заболевания с развитием рестенозов, что требует повторных вмешательств [216][221]. Рецидив стеноза чаще наблюдался после эндоваскулярного лечения [225].
10.1.6 Дальнейшее наблюдение и прогноз
Показано длительное диспансерное наблюдение не реже 2 раз в год, включающее определение степени активности воспалительного процесса лабораторными методами, проведение дуплексного сканирования артерий, выявление возможных рецидивов НАА, по показаниям – проведение адекватной противовоспалительной терапии [216][218][221][227]. Рецидив воспаления возможен через любой интервал после проведенного оперативного лечения. Обоснована важность диагностики НАА на ранних этапах развития патологического процесса и тактика длительного многолетнего послеоперационного наблюдения для своевременного предупреждения рецидивов заболевания и развития осложнений.
Прогностически неблагоприятное течение заболевания связано с неконтролируемой АГ, обусловленной стенозами ПА или торакоабдоминальной аорты, сердечно-сосудистыми и цереброваскулярными осложнениями, наличием аортальной регургитации, аневризмы аорты [216][228].
10.2 КОАРКТАЦИЯ АОРТЫ
10.2.1 Определения
Коарктация аорты (КоА) – это врожденное сужение верхней части нисходящей грудной аорты, граничащей с областью впадения открытого артериального протока (перешейка аорты).
Рекоарктация аорты – рецидив обструкции кровотока по дуге аорты в отдаленные сроки после хирургической коррекции КоА.
Рубрика МКБ 10:
Q25.1 Коарктация аорты.
10.2.2 Эпидемиология и классификация
Коарктация аорты – редкая вторичная форма АГ, составляет менее 1% всех случаев АГ. В 60-70% случаев сочетается с другими врожденными пороками сердца и сосудов, включая открытый артериальный проток, гипоплазию дистальных отделов дуги аорты, двустворчатый аортальный клапан, пороки митрального клапана, дефекты межжелудочковой перегородки и другие аномалии развития сердца и магистральных сосудов [229]. КоА в 2-5 раз чаще встречается у мужчин, чем у женщин. КоА классифицируют в соответствии с сопутствующими врожденными пороками и особенностями гемодинамики. Выделяют критическую (предуктальную) и некритическую КоА [230].
10.2.3 Клиническая картина
Течение заболевания в грудном возрасте и в более старшем возрасте различно, поэтому выделяют два варианта течения: у грудных детей и у подростков и взрослых [231]. Особенности течения КоА у детей представлены в соответствующих рекомендациях [230]. С возрастом при некритической КоА течение заболевания переходит в фазу относительной компенсации, выражающуюся в развитии многочисленных межсистемных коллатералей. В клинической картине заболевания доминирует АГ, которая регистрируется на верхних конечностях. У взрослых КоА обнаруживают обычно при врачебном осмотре. Жалобы пациентов с КоА появляются в возрасте старше 15 лет, в период стабилизации АД. Их можно условно разделить на три группы [229][230][232]: жалобы, обусловленные АГ в проксимальном отделе аорты – выше места ее сужения (головные боли, носовые кровотечения); жалобы, связанные с перегрузкой миокарда левого желудочка (боли в области сердца, сердцебиение, одышка); жалобы, обусловленные недостаточным кровообращением в нижней половине тела, особенно при физической нагрузке (быстрая утомляемость, слабость в нижних конечностях, боли и судороги в мышцах ног). У большинства больных наблюдается высокая АГ, в ряде случаев развивается резистентное к АГТ течение АГ [233].
10.2.4 Диагностика
Анализируют данные анамнеза, клинические проявления, результаты инструментальных исследований. Физикальное обследование: при осмотре обращает на себя внимание диспропорция мышечной системы пояса верхних и нижних конечностей. При пальпации выявляются признаки развитого коллатерального кровообращения: усиленная пульсация сосудов на шее, в надключичной области, в области межреберных артерий и артерий на спине вокруг лопатки. Над всей поверхностью сердца выслушивается грубый систолический шум. Пальпаторно пульсация на нижних конечностях в большинстве случаев ослаблена или вообще не определяется. Разница АД на верхних и нижних конечностях – ведущий симптом, позволяющий диагностировать данное заболевание: АД на нижних конечностях не определяется или оказывается значительно ниже, чем на верхних конечностях [231][232]. Если АД регистрируется, то систолическое АД на нижних конечностях оказывается на 50-60 мм рт. ст. ниже, чем на верхних, пульсовое АД повышено [229]. Выявление градиента АД «правая рука – нога» более 20 мм рт. ст. свидетельствует в пользу гемодинамически значимой КоА [230][234]. С целью определения степени тяжести АГ показан контроль АД не только в состоянии покоя, но и по данным СМАД [230][235]. Диагноз подтверждается при проведении методов инструментальной диагностики: ЭхоКГ, УЗДГ верхних и нижних конечностей, МРТ и КТ ангиографии, рентгеноконтрастной ангиографии [230][234].
|
Рекомендации |
Класс |
Уровень |
|
С целью определения гемодинамической и клинической значимости КоА рекомендовано проводить симметричную сравнительную пальпацию периферических артерий и измерение АД на 4-х конечностях с последующим определением разницы полученных величин [229][230][236] |
I |
A |
|
Рекомендовано проведение ЭхоКГ с определением степени и характера обструкции на границе дуги и нисходящей аорты, наличия и гемодинамической значимости открытого артериального протока, анатомии дуги аорты, размеров восходящей аорты и ее клапанного кольца, анатомии клапана аорты и гемодинамики [229][230][236] |
I |
B |
10.2.5 Лечение
Наличие КоА является показанием к хирургическому/ эндоваскулярному лечению [229,230,235]. Хирургические методики коррекции представлены в соответствующих публикациях и рекомендациях [230][237]. Проведенные исследования свидетельствуют об эффективности хирургического лечения КоА в плане улучшения течения АГ [238]. Оптимальный возраст для проведения хирургического лечения – первый год жизни [229]. Однако за последние 10 лет обоснованы возможность и преимущества хирургического восстановления в старших возрастных группах, в том числе у пациентов старше 50 лет [237][238].
В части случае в послеоперационном периоде может наблюдаться рецидив АГ, связанный с механической обструкцией – развитием рекоарктации аорты [237][239]. В таких случаях рассматривается возможность повторного хирургического лечения, предпочтительна транслюминальная баллонная ангиопластика [230]. При отсутствии связи рецидива АГ с механической обструкцией для нормализации АД применяется АГТ в соответствии с рекомендациями по контролю АГ [229].
Резидуальная АГ и большая потребность в АГТ чаще наблюдалось в случаях проведения хирургического лечения в возрасте старше 30 лет [229].
10.2.6 Дальнейшее наблюдение и прогноз
После устранения КоА отмечено улучшение течения АГ, однако в части случаев наблюдается резидуальная АГ, по прошествии 5-10 лет нередко развивается рецидив АГ, что способствует формированию сердечно-сосудистых и цереброваскулярных осложнений [229]. Пациенты даже после успешной операции должны быть под постоянным наблюдением кардиолога на протяжении всей жизни. В структуру наблюдения должны быть включены ежегодные рутинные методы исследования: СМАД, ЭхоКГ. Все пациенты после хирургического или эндоваскулярного лечения должны тщательно обследоваться один раз в год для установления эффективности проведенного лечения, определения показаний к назначению АГТ, коррекции других ФР ССО [230][240].
Естественное течение КоА определяется вариантом сужения аорты, наличием других врожденных пороков и в целом имеет неблагоприятный прогноз. Средняя продолжительность жизни при отсутствии своевременного лечения – 30-35 лет. Больные погибают от осложнений АГ, которая приобретает резистентное к терапии течение. При своевременном хирургическом лечении КоА и адекватном контроле АД в большинстве случаев удаётся достичь хороших отдаленных результатов.
|
Рекомендации |
Класс |
Уровень |
|
Взрослым пациентам с КоА и клиническими проявлениями вследствие дисфункции ЛЖ, выраженной АГ или ишемии нижних конечностей целесообразно выполнение открытых хирургических или эндоваскулярных вмешательств [230][236][240] |
IIа |
B |
|
Пациентам после хирургической коррекции КоА рекомендован контроль АД на руках и ногах с целью оценки градиента давления и оценки эффективности выполненной операции, а также целесообразности назначения/продолжения АГТ [230][240] |
I |
B |
|
Пациентам после хирургической коррекции КоА в рамках амбулаторного эхокардиографического обследования рекомендуется оценивать характер кровотока по дуге аорты и наличие градиента давления в области анастомоза, морфофункциональные параметры левого желудочка и митрального клапана, а также клапана аорты и субаортального пространства [230] |
I |
B |
|
Пациентам после хирургической коррекции КоА, в случае сохранения резидуальной АГ, целесообразно проведение обследований согласно клиническим рекомендациям по АГ [230][240] |
IIb |
C |
11. СИНДРОМ ОБСТРУКТИВНОГО АПНОЭ СНА
11.1 Определение
Синдром обструктивного апноэ сна (СОАС) – распространенное хроническое заболевание, характеризующееся рецидивирующим коллапсом верхних дыхательных путей во время сна, вызывающим периодические эпизоды апноэ/гипопноэ, гипоксемию и нарушение сна [241].
СОАС характеризуется:
(1) cсочетанием не менее 5 эпизодов нарушения дыхания обструктивного типа в час во время сна (обструктивными апноэ, гипопноэ и/или связанными с дыхательными усилиями активациями) и следующими диагностическими критериями (А и/или Б):
А) Чрезмерная дневная сонливость, которая не может быть объяснена другими факторами.
Б) Два или более из следующих симптомов, которые не объясняются другими факторами:
а. Удушье или одышка во сне
- Периодические пробуждения
- Неосвежающий сон
д. Дневная усталость
е. Нарушение концентрации и внимания
Или (2) наличием более 15 эпизодов нарушения дыхания обструктивного типа в час во время сна (обструктивными апноэ, гипопноэ и/или связанными с дыхательными усилиями активациями) даже при отсутствии сопутствующих симптомов или нарушений [242].
Рубрика МКБ-10:
G47.3 Апноэ во сне.
11.2 Эпидемиология
СОАС является одним из наиболее распространенных типов нарушений сна, однако данные эпидемиологических исследований сильно различаются, что может быть связано, как с методологическими особенностями проведения исследований, так и включением различных популяций, различными диагностическими критериями и различной оценкой тяжести. В крупных эпидемиологических исследованиях распространенность СОАС по данным разных источников варьирует от 15 до 30% у мужчин и от 10 до 15% у женщин [243].
В недавно опубликованном исследовании, в котором математически анализировалось глобальное бремя СОАС, была продемонстрирована широкая географическая вариабельность показателей распространенности СОАС: от 7,8% (Гонконг) до 77,2% (Малайзия) для легкой степени СОАС и от 4,8% (Ирландия и Израиль) до 36,6% (Швейцария) для средней и тяжелой степени СОАС. Распространенность СОАС не была связана с экономическим развитием внутри стран и не ограничивалось конкретными континентами [244].
У пациентов терапевтического профиля распространенность СОАС достигает 15% и увеличивается с возрастом, независимо от других ФР, включая избыточную массу тела и ожирение [245]. Среди пациентов с ССЗ распространенность нарушений дыхания во сне может достигать 70–80% [241][246]. Крупных эпидемиологических данных по распространенности СОАС в Российской Федерации в настоящий момент нет. По данным исследования ЭССЕ-РФ, среди взрослых россиян храп (как один из ведущих симптомов СОАС) отмечают 58% мужчин и 52% женщин [247]. По данным исследования The ARKHsleep, проведенного на базе поликлиники города Архангельск, было выявлено: общая распространенность СОАС 48,9% [45,8–51,9], распространенность среднетяжелой степени СОАС 18,1% [15,9–20,6] и тяжелой 4,5% [3,2–5,8] [248].
СОАС часто рассматривается как причина симптоматической или РАГ [249]. Приблизительно у 50% пациентов с СОАС имеется сопутствующая АГ. В ряде исследований была выявлена высокая распространенность АГ у пациентов с СОАС по сравнению с контрольной группой, даже после коррекции на другие ФР, такие как возраст и ожирение. В проспективных исследованиях также был продемонстрирован повышенный риск возникновения АГ у пациентов с СОАС. Большинство исследований подтверждают дозозависимый эффект между тяжестью СОАС и вероятностью развития АГ [250][251].
Основные патофизиологические механизмы развития АГ на фоне СОАС реализуются за счет: интермиттирующей гипоксии, нарушения структуры сна, реакции активации головного мозга, колебаний внутригрудного давления, что приводит к развитию гиперактивации СНС, периферической вазоконстрикции, повышению активности РААС, изменению чувствительности барорецепторных рефлексов, развитию хронического воспаления, оксидативного стресса, эндотелиальной дисфункции [252].
11.3 Классификация
Классификация СОАС строится на оценке индекса апноэ/гипопноэ сна (ИАГ) [253]: 5 < ИАГ > 14 – легкая степень; 15 < ИАГ > 29 – средняя степень; ИАГ > 30 – тяжелая степень.
11.4 Скрининг
Скрининг на предмет наличия нарушений дыхания во время сна может быть проведен с применением различных анкетных шкал: опросник STOP-Bang, Берлинский опросник, модифицированный опросник Страдлинга, шкала сонливости Эпфорт [254]. Однако около 50% пациентов с тяжелой формой СОАС не сообщают о симптомах, характерных для СОАС, и эта пропорция еще выше у пациентов с СОАС и ССЗ, которые часто в первую очередь сообщают о симптомах основного ССЗ, поэтому чувствительность и специфичность опросных шкал у данной категории пациентов не позволяет широко их внедрять в клиническую практику как единственный диагностический инструмент [255].
Ни один из опросников не превосходит тщательный сбор анамнеза и физикальное обследование, а их низкая точность делает их несовершенным диагностическим инструментом [254].
Категории пациентов высокого риска
- Старший возраст. Распространенность СОАС увеличивается с юношеского возраста до шестого-седьмого десятилетия, а затем, по-видимому, выходит на плато.
- Мужской пол. СОАС встречается в два-три раза чаще у мужчин, чем у женщин, однако в пери- и постменопаузе гендерные различия нивелируются.
- Ожирение. Риск СОАС коррелирует с индексом массы тела (ИМТ).
- Черепно-лицевые аномалии и аномалии верхних дыхательных путей (аномальный размер верхней или короткой размер нижней челюсти, широкое черепно-лицевое основание, а также гипертрофия миндалин и аденоидов и др.) повышают вероятность наличия СОАС.
- Курение, семейный анамнез СОАС, носовая обструкция различной этиологии.
Распространенность СОАС также увеличивается у пациентов с различными заболеваниями [255]: АГ (особенно неконтролируемая, резистентная); ФП; ХСН; легочная гипертензия; ХПН; хроническая обструктивная болезнь легких; инсульт, ТИА (в анамнезе); беременность; акромегалия; гипотиреоз; синдром поликистоза яичников; болезнь Паркинсона.
11.5 Диагностика
Основные симптомы, характерные для СОАС:
— Дневная сонливость
— Невосстанавливающий сон
— Громкий храп
— Остановки дыхания (со слов партнера по постели)
— Пробуждение с удушьем или одышкой
— Ночное беспокойство
— Бессонница с частыми пробуждениями
— Нехватка концентрации
— Когнитивный дефицит
— Изменения в настроении
— Утренние головные боли
— Яркие, странные или угрожающие сны
— Никтурия
Дневная сонливость является частым симптомом СОАС. Сонливость – это неспособность оставаться полностью бодрствующим или бдительным во время фазы бодрствования цикла сон-бодрствование. Однако дневная сонливость может быть недооценена из-за хронического его характера, а также пациент может использовать такие термины, как слабость, усталость, низкий уровень энергии и другое. Оценка дневной сонливости проводится с помощью шкалы сонливости Эпфорт [256].
При физикальном обследовании следует обратить внимание на: ожирение, сужение верхних дыхательных путей (микрогнатия, ретрогнатия, гипертрофия миндалин, язычка, макроглассия и др.), окружность шеи > 43 см (для мужчин), > 40 см (для женщин) и окружность талии > 100,5 см (для мужчин), > 95,5 см (для женщин), признаки и симптомы сопутствующих соматических состояний и осложнений.
Инструментальные методы исследования
СОАС не является клиническим диагнозом и для постановки диагноза необходимо провести объективное тестирование [254].
Полисомнография в условиях лаборатории сна является золотым стандартом диагностики, однако для пациентов с высокой предтестовой вероятностью СОАС средней и тяжелой степени возможно проведение исследований в домашних условиях (кардиореспираторное мониторирование, респираторное мониторирование, компьютерная сомнография) при условии отсутствия других состояний, которые могут приводить к нарушениям дыхания во время сна не обструктивного характера (ХОБЛ GOLD 2-4 стадии, ХСН NYHA III-IV, нейромышечные заболевания, характеризующиеся слабостью дыхательных мышц, применение опиоидных анальгетиков, нарушения мозгового кровообращения в анамнезе, гиповентиляционные синдромы).
При отрицательном, неубедительном или технически неадекватном исследовании, проведенном в домашних условиях, для верификации диагноза СОАС необходимо провести полисомнографию [254].
11.6 Лечение (медикаментозное, хирургическое)
Целями терапии СОАС являются устранение признаков и симптомов СОАС, улучшение качества сна и качества жизни, нормализация ИАГ и уровня насыщения оксигемоглобина.
СОАС следует рассматривать как хроническое заболевание, требующее длительного междисциплинарного лечения.
- Изменение образа жизни (снижение/контроль массы тела и физическая активность) следует рассматривать как неотъемлемую часть лечения всех пациентов с СОАС, включая пациентов с СОАС и АГ, поскольку у таких пациентов очень часто встречаются ожирение и малоподвижный образ жизни.
- Позиционная терапия. Во время диагностического исследования сна у некоторых пациентов наблюдается позиционно-зависимый СОАС (обычно появление нарушений дыхания или увеличение их частоты в положении на спине). Сон в положении не на спине (например, на боку) может скорректировать или улучшить СОАС у таких пациентов, однако не всегда может быть использован как единственный вариант терапии.
- Избегание употребления алкоголя. Пациентам с СОАС рекомендовано избегать употребления алкоголя даже в дневное время, так как алкоголь может угнетать центральную нервную систему, усугублять СОАС, усиливать сонливость и способствовать увеличению веса.
- Сопутствующие препараты. Любой врач, назначающий лечение пациенту, должен быть проинформирован о том, что у пациента есть СОАС (особенно нелеченый), поскольку ряд препаратов (особенно с угнетающим действием на центральную нервную систему) при наличии альтернативы не должны применятся у данной категории пациентов (напр., бензодиазепины)
Терапия положительным давлением в дыхательных путях (ПАП-терапия) является основой лечения взрослых с СОАС. Механизм ПАП-терапии включает поддержание положительного трансмурального давления в глотке, так что внутрипросветное давление превышает окружающее давление, осуществляет стабилизацию верхних дыхательных путей за счет увеличения объема легких в конце выдоха, что в результате предотвращает респираторные события из-за коллапса верхних дыхательных путей [257].
Данные рандомизированных исследований и метаанализов демонстрируют, что ПАП-терапия снижает частоту респираторных событий во время сна, уменьшает дневную сонливость, снижает риск дорожно-транспортных происшествий, улучшает качество сна и жизни при различных степенях тяжести заболевания, а также улучшает промежуточные сердечно-сосудистые конечные точки [258][259].
Однако в настоящий момент ни в одном рандомизированном контролируемом исследовании не было продемонстрировано преимущество ПАП-терапии в снижении сердечно-сосудистых событий (например, смертности от ССЗ, острого инфаркта миокарда, инсульта и др.) и целесообразность использования ПАП-терапии исключительно с целью профилактики сердечно-сосудистых событий [260].
Результаты рандомизированных исследований и метаанализы показали, что эффективное лечение СОАС с использованием ПАП-терапии ассоциировано со снижением системного АД. Выявлено снижение уровня как систолического САД, так и ДАД, как во время сна, так и во время бодрствования: САД от 2 до 2,5 мм рт. ст., ДАД на 1,5-2 мм рт. ст. на фоне эффективной ПАП-терапии. У пациентов с резистентной АГ отмечается более значимая динамика уровня АД: от 4,7 до 7,2 мм рт. ст. для САД и 2,9-4,9 мм рт. ст. для ДАД [261][262][263].
ПАП-терапия должна быть рекомендована пациентам с выраженными симптомами апноэ сна или тяжёлой гипоксемией, а также при определенных клинических ситуациях с доказанной эффективностью ПАП-терапии, в том числе у пациентов с АГ [7][264].
Альтернативными вариантами терапии могут рассматриваться: применение внутриротовых приспособлений, хирургическое лечение патологии верхних дыхательных путей, стимуляция подъязычного нерва.
11.7 Дальнейшее наблюдение и прогноз
СОАС требует долгосрочного и междисциплинарного лечения. Пациенты, находящиеся на терапии (ПАП-терапия) должны проходить регулярное наблюдение для оценки эффективности, приверженности к терапии, побочных эффектов, развития осложнений, связанных с СОАС. Пациенты после снижения веса, хирургического лечения должны находиться под наблюдением для переоценки ФР и выявления возможного возврата симптомов СОАС [265].
Прогноз определяется тяжестью нарушений дыхания во время сна, наличием ПОМ и ассоциированных клинических состояний. При своевременной диагностике и лечении нарушений дыхания во время сна на фоне адекватного контроля АД снижается риск развития ССО.
|
Рекомендации |
Класс |
Уровень |
|
У больных с атеросклерозом, ожирением и АГ рекомендован регулярный скрининг на предмет наличия невосстанавливающего сна (например, получение ответа на вопрос: «Как часто у Вас были сложности с засыпанием, поддержанием сна или слишком длительным сном?») |
I |
C |
|
ПАП-терапия рекомендована пациентам с СОАС при наличии дневной сонливости, ухудшении качества жизни, связанным со сном |
I |
A |
|
ПАП-терапия может применяться у пациентов с СОАС и АГ [261][262][263] |
IIа |
B |
12. ЛЕКАРСТВЕННЫЕ ФОРМЫ АРТЕРИАЛЬНОЙ ГИПЕРТОНИИ
12.1 Определение
Лекарственная артериальная гипертония – форма вторичной АГ, при которой стойкое повышение АД вызвано приемом лекарственных средств (ЛС) и других веществ [266].
Лекарственно-индуцированная АГ часто является обратимой или, как минимум, корректируемой проблемой. У лиц с исходно нормальным уровнем АД это может быть причиной развития вторичной АГ. Поэтому очень важен тщательный сбор анамнеза с оценкой принимаемых ЛС, использования безрецептурных ЛС и растительных добавок, что поможет установить возможную вторичную причину повышения АД. У пациентов с диагностированной АГ данные ЛС могут являться причиной недостижения целевого уровня АД, снижения эффектов АГТ и способствовать развитию резистентного течения АГ. Наиболее часто лекарственно-индуцируемую АГ вызывают стероиды, НПВП, симпатомиметические препараты, стимуляторы ЦНС, рекомбинантный человеческий эритропоэтин, антидепрессанты, иммуносупрессоры, некоторые продукты растительного происхождения, пищевые добавки.
При лекарственно-индуцируемых формах АГ можно выделить три основных патофизиологических механизма, приводящие к повышению АД: увеличение объема циркулирующей крови, усиление симпатической активности и прямое вазоспастическое действие на сосудистую стенку [267].
Наиболее распространенные ЛС и другие вещества, которые могут повышать АД, представлены в таблице 23 [16][268].
|
Лекарственные средства |
Механизм повышения АД |
|
НПВП |
Натрийуретический эффект с последующей задержкой жидкости и увеличением объема циркулирующей крови; повышение общего периферического сосудистого сопротивления за счет увеличения синтеза эндотелина-1; ингибирование синтеза простагландинов Е2 и I2, обладающих вазодилатирующими свойствами, а также натрийуретическим эффектом |
|
ГК (гидрокортизон, преднизолон, дексаметазон) |
Натрийуретический эффект с последующей задержкой жидкости и увеличением объема циркулирующей крови; увеличение сердечного выброса |
|
Оральные контрацептивы (эстрогены, прогестины) |
Натрийуретический эффект с последующей задержкой жидкости и увеличением объема циркулирующей крови |
|
Назальные адреномиметики (гидрохлорид фенилэфрина и гидрохлорид нафазолина) |
Действие на адренергические рецепторы путем ингибирования фосфодиэстеразы; ингибирование обратного захвата катехоламинов; ингибирование непрямого действия разрушения катехоламинов |
|
Иммуносупрессанты (циклоспорин, такролимус – меньше влияет на АД) |
Вазоспастическое действие |
|
Лакрица |
Хроническое чрезмерное употребление имитирует гиперальдостеронизм, стимулирует минералокортикоидные рецепторы |
|
Стимулирующие препараты (амфетамин, кокаин, экстази) |
Активация СНС; обычно вызывают острое повышение АД, а не стойкую хроническую АГ |
Несмотря на различные механизмы, за счет которых ЛС могут вызывать повышение АД, следует учитывать общие рекомендации ведения данных пациентов [266]:
- Рекомендуется рутинный мониторинг АД для раннего выявления АГ.
- Следует регулярно оценивать необходимость продолжения лечения ЛС, способствующими повышению АД. Целесообразно рассмотреть вопрос о замене или снижении дозы данного ЛС.
- При необходимости длительного или постоянного приема ЛС, способствующих повышению АД и развитии АГ, показано назначение АГТ.
13. ПРИЛОЖЕНИЯ
|
ФР |
Характеристика |
|
Пол |
мужской > женский |
|
Возраст |
≥ 55 лет у мужчин, ≥ 65 лет у женщин |
|
Курение (текущее или в прошлом в течение года) |
Да |
|
Липидный обмен |
Дислипидемии (принимается во внимание каждый из представленных показателей липидного обмена) |
|
ОХС ХС ЛПНП ХС ЛПВП ТГ |
> 4,9 ммоль/л (190 мг/дл) и/или > 3,0 ммоль/л (115 мг/дл) • у мужчин < 1,0 ммоль/л (40 мг/дл) • у женщин< 1,2 ммоль/л (46 мг/дл) > 1,7 ммоль/л (150 мг/дл) |
|
Мочевая кислота |
• у мужчин ≥420 мкмоль/л • у женщин ≥360 мкмоль/л |
|
Глюкоза плазмы натощак |
5,6–6,9 ммоль/л (101–125 мг/дл) |
|
Нарушение толерантности к глюкозе |
7,8–11,0 ммоль/л |
|
Ожирение |
ИМТ ≥ 30 кг/м2 |
|
Абдоминальное ожирение |
Окружность талии: • у мужчин ≥ 102 см • у женщин ≥ 88 см (для лиц европейской расы) |
|
Семейный анамнез ранних ССЗ |
• у мужчин < 55 лет • у женщин < 65 лет |
|
Ранняя менопауза (< 45 лет) |
Да |
|
ЧСС > 80 уд/мин в покое |
Да |
|
Субклиническое ПОМ |
|
|
Пульсовое давление (у лиц пожилого и старческого возраста) |
≥ 60 мм рт. ст. |
|
ЭКГ-признаки ГЛЖ |
Индекс Соколова–Лайона SV1+RV5–6 > 35 мм Корнельский показатель (RAVL+SV3): • для мужчин ≥ 28 мм • для женщин ≥ 20 мм, (RAVL+SV3) Корнельское произведение (RAVL+SV3) мм × QRS мс > 2440 мм × мс |
|
ЭхоКГ-признаки ГЛЖ |
ИММЛЖ (формула ASE) индексация на рост в м2,7: • мужчины > 50 г/м2,7 • женщины > 47 г/м2,7 индексация на ППТ может использоваться у пациентов с нормальной массой тела • у мужчин > 115 г/м2 • у женщин > 95 г/м2 |
|
Скорость пульсовой волны («каротидно-феморальной») |
> 10 м/с |
|
Лодыжечно-плечевой индекс систолического давления |
< 0,9 |
|
ХБП С3а-С3б |
СКФ, рассчитанная по уравнениям CKD-EPI, (2009 г.), 30–59 мл/мин/1,73 м2 |
|
Высокая альбуминурия |
30–300 мг/сут или отношение альбумина к креатинину – 30–300 мг/г; (3,0–30 мг/ммоль) |
|
Тяжелая ретинопатия |
Кровоизлияния или экссудаты, отек соска зрительного нерва |
|
СД |
|
|
Глюкоза плазмы натощак, и/или HbA1c, и/или Глюкоза плазмы после нагрузки Глюкоза плазмы при случайном определении |
≥ 7,0 ммоль/л в двух измерениях подряд и/или ≥ 6,5% и/или ≥ 11,1 ммоль/л и/или ≥11,1 ммоль/л |
|
ССЗ, ЦВБ или почечные заболевания |
|
|
ЦВБ |
Ишемический инсульт, геморрагический инсульт, ТИА |
|
ИБС |
ИМ, стенокардия, коронарная реваскуляризация методом чрескожного коронарного вмешательства или аортокоронарного шунтирования |
|
Сердечная недостаточность |
II–III стадии по Василенко–Стражеско |
|
Клинически значимое поражение периферических артерий |
Атеросклеротическая бляшка (стеноз ≥ 50%) |
|
ХБП |
IV стадии с рСКФ < 30 мл/мин/1,73 м2; протеинурия (> 300 мг/сут) |
|
Фибрилляция предсердий |
Да |
|
Стадия АГ |
ФР, ПОМ, заболевания |
АД, мм рт. ст. |
||
|
АГ 1-й степени |
АГ 2-й степени |
АГ 3-й степени |
||
|
САД 140-159 и/или ДАД 90-99 |
САД 160-179 и/или ДАД 100-109 |
САД ≥ 180 и/или ДАД 110 |
||
|
Стадия I (неосложненная) |
Других ФР нет |
Низкий риск |
Умеренный риск |
Высокий риск |
|
1-2 ФР |
Умеренный риск |
Высокий риск |
Высокий риск |
|
|
3 и более ФР |
Высокий риск |
Высокий риск |
Высокий риск |
|
|
Стадия II (бессимптомная) |
Субклиническое ПОМ, ХБП III стадии или СД |
Высокий риск |
Высокий риск |
Очень высокий риск |
|
Стадия III (осложненная) |
ССЗ, ЦВБ, ХБП ≥ IV стадии или СД с ПОМ или ФР |
Очень высокий риск |
Очень высокий риск |
Очень высокий риск |
|
Гломерулярные |
|
|
Характеризуются, как правило, выраженной протеинурией, возможен нефротический синдром. Быстрое прогрессирование, являются ведущей причиной ТПН в популяции. Может потребоваться биопсия почки для дифференциальной диагностики |
|
|
Тубулоинтерстициальные |
|
|
Умеренный мочевой синдром, ранние и выраженные канальцевые нарушения. Роль семейного анамнеза (наследственные тубулопатии, поликистоз), токсических факторов, ятрогений |
|
|
Сосудистые (ишемические) |
|
|
Незначительный мочевой синдром. Раннее снижение СКФ |
|
|
Стадия |
СКФ |
Описание |
|
Уровень, мл/мин/1,73 м2 |
||
|
С1 |
> 90 |
Оптимальная или повышенная * |
|
С2 |
60-89 |
Незначительно сниженная * |
|
С3а |
45-59 |
Умеренно сниженная |
|
С3б |
30-44 |
Существенно сниженная |
|
С4 |
15-29 |
Резко сниженная |
|
С5 |
< 15 |
Терминальная почечная недостаточность ** |
Примечание:
* при СКФ ≥ 60 мл/мин/1,73 м2 для диагностики ХБП обязательным является наличие признаков повреждения почек
** Если пациент с терминальной почечной недостаточностью получает лечение диализом, используются обозначения ХБП 5Д (т.е. диализ). Для больных с трансплантированной почкой стадия ХБП индексируется в зависимости от функции трансплантата (от С 1 до С 5), а в конце добавляется буква Т.
Note:
* at GFR ≥ 60 ml/min/1,73 m2, evidence of kidney damage is mandatory for the diagnosis of CKD
** if a patient with ESRD is receiving dialysis treatment, the designation CKD 5D (i.e. dialysis) is used. For patients with a kidney transplant, the CKD stage is indexed depending on the function of the graft (from G1 to G5), and the letter T is added at the end.
|
Категория Показатель, |
Норма или незначительно повышенная |
Высокая |
Очень высокая* |
|
Альбуминурия: |
|||
|
Суточная экскреция альбумина, мг/сут |
< 30 |
30-300 |
> 300 |
|
А/Кр в разовой порции мочи, мг/ г |
< 30 |
30-300 |
> 300 |
|
А/Кр в разовой порции мочи, мг/ммоль |
< 3 |
3-30 |
> 30 |
|
Протеинурия: |
|||
|
Суточная экскреция общего белка |
< 150 |
150-500 |
> 500 |
|
ОБ/Кр в разовой порции мочи, мг/г |
< 150 |
150-500 |
> 500 |
|
ОБ/Кр в разовой порции мочи, мг/ммоль |
< 15 |
15-50 |
> 50 |
|
Тест-полоски на протеинурию |
«нет» или «следы» |
«следы» или «+» |
«+» и более |
Примечание:
А/Кр – отношение концентраций альбумина и креатинина, ОБ/Кр – отношение концентраций общего белка и креатинина
* – включая нефротический синдром, при котором суточная экскреция альбумина > 2200 мг/сут, А/Кр > 2200 мг/г или 220 мг/ммоль, суточная протеинурия > 3500 мг/сут, ОБ/Кр > 3500 мг/г или 350 мг/ммоль
Note:
A/Cr – the ratio of albumin and creatinine concentrations, TP/Cr – the ratio of total protein and creatinine concentrations
* – including nephrotic syndrome, in which 24h excretion of albumin > 2200 mg/24h, A/Cr > 2200 mg/g or 220 mg/mmol, 24h proteinuria > 3500 mg/24h, TP/Cr > 3500 mg/g or 350 mg/mmol
|
Стадии ХБП |
СКФ, мл/мин/1,73 м2 |
Альбуминурия* |
|||
|
А1 |
А2 |
А3 |
|||
|
Оптимальная или незначительно повышенная |
Высокая |
Очень высокая |
|||
|
< 30 мг/г < 3 мг/ммоль |
30-300 мг/г 3-30 мг/ммоль |
> 300 мг/г > 30 мг/ммоль |
|||
|
С1 |
≥ 90 |
Высокая или оптимальная |
Низкий** |
Умеренный |
Высокий |
|
С2 |
60-89 |
Незначительно снижена |
Низкий** |
Умеренный |
Высокий |
|
С3а |
45-59 |
Умеренно снижена |
Умеренный |
Высокий |
Очень высокий |
|
С3б |
30-44 |
Существенно снижена |
Высокий |
Очень высокий |
Очень высокий |
|
С4 |
15-29 |
Резко |
Очень высокий |
Очень высокий |
Очень высокий |
|
С5 |
< 15 |
ТПН |
Очень высокий |
Очень высокий |
Очень высокий |
Примечание:
* – альбуминурия определяется как отношение альбумин/креатинин в разовой (предпочтительно утренней) порции мочи; альбуминурия > 300 мг/г примерно соответствует уровню протеинурии > 0,5 г/л. СКФ – рассчитывается по формуле CKD-EPI.
** – низкий риск – т.е. как в общей популяции. При отсутствии признаков повреждения почек категории СКФ С1 или С2 не удовлетворяют критериям ХБП.
Note:
* – albuminuria is defined as albumin/creatinine ratio in a casual (preferably morning) urine sample; albuminuria > 300 mg/g roughly corresponds to proteinuria > 0.5 g/L. GFR is calculated using the CKD-EPI formulas.
** – low risk – i.e. as in general population. In the absence of evidence of kidney damage, GFR categories G1 or G2 do not meet the criteria for CKD.
|
МЭН 2А |
Медуллярный рак щитовидной железы, первичный гиперпаратиреоз, кожные амилоидные лихенификации |
|
МЭН 2Б |
Медуллярный рак щитовидной железы, деформации скелета, ганглионейроматоз |
|
Болезнь фон Гиппеля-Линдау (VHL-синдром) |
Гемангиобластомы ЦНС и сетчатки, карцинома почки, кисты и нейроэндокринные опухоли поджелудочной железы, опухоль эндолимфатического мешочка среднего уха, папиллярная цистаденома придатка яичка и широкой связки матки |
|
Нейрофиброматоз I типа |
Кожный нейрофиброматоз, гиперпигментация подмышечной и/или паховой области, пигментные пятна цвета «кофе с молоком», гамартомы радужной оболочки глаза (узелки Лиша), костные аномалии, глиомы ЦНС |
1. Egan B.M., Kjeldsen S.E., Grassi G. et al. The global burden of hypertension exceeds 1.4 billion people: should a systolic blood pressure target below 130 become the universal standard? J Hypertens. 2019;37(6):1148- 1153. doi: 10.1097/HJH.0000000000002021
2. Viera A.J., Neutze D.M. Diagnosis of secondary hypertension: an age-based approach. Am Fam Physician. 2010;82(12):1471-1478
3. Williams B., Mancia G., Spiering W. et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension: The Task Force for the management of arterial hypertension of the European Society of Cardiology and the European Society of Hypertension [published correction appears in J Hypertens. 2019 Jan;37(1):226]. J Hypertens. 2018;36(10):1953-2041. doi: 10.1097/HJH.0000000000001940
4. Чазова И.Е., Жернакова Ю.В. от имени экспертов. Клинические рекомендации. Диагностика и лечение артериальной гипертонии. Системные гипертензии. 2019; 16 (1): 6–31. doi: 10.26442/2075082X.2019.1.190179
5. Calhoun D.A., Jones D., Textor S. et al. Resistant hypertension: diagnosis, evaluation, and treatment: a scientific statement from the American Heart Association Professional Education Committee of the Council for High Blood Pressure Research. Circulation 2008;117(25):e510–526. doi: 10.1161/CIRCULATIONAHA.108.189141
6. Carey R.M., Calhoun D.A., Bakris G.L. et al. Resistant Hypertension: Detection, Evaluation, and Management: A Scientific Statement From the American Heart Association. Hypertension. 2018;72(5):e53-e90. doi: 10.1161/HYP.0000000000000084
7. Аксенова А.В., Сивакова О.А., Блинова Н.В. и соавт. Консенсус экспертов Российского медицинского общества по артериальной гипертонии по диагностике и лечению резистентной артериальной гипертонии. Терапевтический архив. 2021;93(9):1018–1029. doi: 10.26442/00403660.2021.09.201007.
8. Rimoldi S.F., Scherrer U., Messerli F.H. Secondary arterial hypertension: when, who, and how to screen? Eur Heart J. 2014 May 14;35(19):1245- 54. doi: 10.1093/eurheartj/eht534
9. Арабидзе Г.Г. Симптоматические артериальные гипертонии. В кн.: Болезни сердца и сосудов. Под ред. Е.И. Чазова. – М.: Медицина, 1992;3:196-226.
10. Cingolani O.H. Cardiovascular risks and organ damage in secondary hypertension. Endocrinol Metab Clin North Am. 2019 Dec;48(4):657- 666. doi: 10.1016/j.ecl.2019.08.015
11. Ратнер Н.А. Артериальные гипертонии. М.: Медицина,1974. – 415 с.
12. Чихладзе Н.М. Симптоматические (вторичные) артериальные гипертонии: диагностика и лечение. М.: Медицинское информационное агентство, 2018. — 168 с. ISBN 978-5-907098-01-5
13. Young W.F. Jr., Calhoun D.A., Lenders J.W.M. et al. Screening for Endocrine Hypertension: An Endocrine Society Scientific Statement, Endocrine Reviews, 2017;38(2):103–122. doi: 10.1210/er.2017-00054
14. Rossi G.P., Bisogni V., Rossitto G. et al. Practice Recommendations for Diagnosis and Treatment of the Most Common Forms of Secondary Hypertension. High Blood Press Cardiovasc Prev. 2020;27(6):547-560. doi: 10.1007/s40292-020-00415-9
15. Pedrosa R.P., Drager L.F., Gonzaga C.C. et al. Obstructive sleep apnea: the most common secondary cause of hypertension associated with resistant hypertension. Hypertension. 2011 Nov;58(5):811-7. doi: 10.1161/HYPERTENSIONAHA.111.179788
16. Grossman E., Messerli F.H. Drug-induced hypertension: an unappreciated cause of secondary hypertension. Am J Med. 2012 Jan;125(1):14-22. doi: 10.1016/j.amjmed.2011.05.024
17. Ettehad D., Emdin C.A., Kiran A. et al. Blood pressure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis. Lancet. 2016 Mar 5;387(10022):957-967. doi: 10.1016/S0140-6736(15)01225-8. Epub 2015 Dec 24.
18. Thomopoulos C, Parati G, Zanchetti A. Effects of blood pressure lowering on outcome incidence in hypertension: 7. Effects of more vs. less intensive blood pressure lowering and different achieved blood pressure levels — updated overview and meta-analyses of randomized trials. J Hypertens. 2016 Apr;34(4):613-22. doi: 10.1097/HJH.0000000000000881
19. Sundström J., Arima H., Jackson R. et al. Blood Pressure Lowering Treatment Trialists’ Collaboration. Effects of blood pressure reduction in mild hypertension: a systematic review and meta-analysis. Ann Intern Med. 2015 Feb 3;162(3):184-91. doi: 10.7326/M14-0773
20. Zanchetti A., Grassi G., Mancia G. When should antihypertensive drug treatment be initiated and to what levels should systolic blood pressure be lowered? A critical reappraisal. J Hypertens. 2009 May;27(5):923-34. doi: 10.1097/HJH.0b013e32832aa6b5
21. Arguedas J.A., Leiva V., Wright J.M. Blood pressure targets in adults with hypertension. Cochrane Database Syst Rev. 2020 Dec 17;12(12):CD004349. doi: 10.1002/14651858.CD004349.pub3
22. Unger T., Borghi C., Charchar F. et al. 2020 International Society of Hypertension global hypertension practice guidelines. J Hypertens. 2020 Jun;38(6):982-1004. doi: 10.1097/HJH.0000000000002453
23. Chen T., Shao F., Chen K. et al. Time to Clinical Benefit of Intensive Blood Pressure Lowering in Patients 60 Years and Older With Hypertension: A Secondary Analysis of Randomized Clinical Trials. JAMA Intern Med. 2022 Jun 1;182(6):660-667. doi: 10.1001/jamainternmed.2022.1657. Erratum in: JAMA Intern Med. 2022 Jul 5;:null.
24. Odden M.C., McClure L.A., Sawaya B.P. et al. Achieved Blood Pressure and Outcomes in the Secondary Prevention of Small Subcortical Strokes Trial. Hypertension. 2016 Jan;67(1):63-9. doi: 10.1161/HYPERTENSIONAHA.115.06480. Epub 2015 Nov 9. PMID: 26553236
25. Qaseem A., Wilt T.J., Rich R. et al. Clinical Guidelines Committee of the American College of Physicians and the Commission on Health of the Public and Science of the American Academy of Family Physicians. Pharmacologic Treatment of Hypertension in Adults Aged 60 Years or Older to Higher Versus Lower Blood Pressure Targets: A Clinical Practice Guideline From the American College of Physicians and the American Academy of Family Physicians. Ann Intern Med. 2017 Mar 21;166(6):430- 437. doi: 10.7326/M16-1785. Epub 2017 Jan 17. Erratum in: Ann Intern Med. 2018 Apr 3;168(7):530-532.
26. Garrison S.R., Kolber M.R., Korownyk C.S. et al. Blood pressure targets for hypertension in older adults. Cochrane Database Syst Rev. 2017 Aug 8;8(8):CD011575. doi: 10.1002/14651858.CD011575.pub2
27. Чазова И.Е., Шестакова М.В., Жернакова Ю.В. Российское медицинское общество по артериальной гипертонии. Рекомендации по ведению больных артериальной гипертонией с метаболическими нарушениями и сахарным диабетом 2-го типа. Системные гипертензии. 2020;17(1):7–45. doi: 10.26442/2075082X.2020.1.200051
28. Brunström M., Carlberg B. Association of Blood Pressure Lowering With Mortality and Cardiovascular Disease Across Blood Pressure Levels: A Systematic Review and Meta-analysis. JAMA Intern Med. 2018 Jan 1;178(1):28-36. doi: 10.1001/jamainternmed.2017.6015
29. MacDonald T.M., Williams B., Webb D.J. et al. British Hypertension Society Programme of Prevention And Treatment of Hypertension With Algorithm-based Therapy (PATHWAY). Combination Therapy Is Superior to Sequential Monotherapy for the Initial Treatment of Hypertension: A Double-Blind Randomized Controlled Trial. J Am Heart Assoc. 2017 Nov 18;6(11):e006986. doi: 10.1161/JAHA.117.006986
30. Williams B., MacDonald T.M., Morant S.V. et al. British Hypertension Society programme of Prevention And Treatment of Hypertension With Algorithm based Therapy (PATHWAY) Study Group. Endocrine and haemodynamic changes in resistant hypertension, and blood pressure responses to spironolactone or amiloride: the PATHWAY-2 mechanisms substudies. Lancet Diabetes Endocrinol 2018;6(6):464-475. doi: 10.1016/S2213-8587(18)30071-8
31. Wald D.S., Law M., Morris J.K. et al. Combination therapy versus monotherapy in reducing blood pressure: meta-analysis on 11,000 participants from 42 trials. Am J Med. 2009 Mar;122(3):290-300. doi: 10.1016/j.amjmed.2008.09.038
32. Dahlöf B., Sever P.S., Poulter N.R. et al. ASCOT Investigators. Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm (ASCOT-BPLA): a multicentre randomised controlled trial. Lancet. 2005 Sep 10-16;366(9489):895- 906. doi: 10.1016/S0140-6736(05)67185-1
33. Gupta A.K., Arshad S., Poulter N.R. Compliance, safety, and effectiveness of fixed-dose combinations of antihypertensive agents: a metaanalysis. Hypertension. 2010 Feb;55(2):399-407. doi: 10.1161/HYPERTENSIONAHA.109.139816
34. Volpe M., Christian Rump L., Ammentorp B., Laeis P. Efficacy and safety of triple antihypertensive therapy with the olmesartan/amlodipine/ hydrochlorothiazide combination. Clin Drug Investig. 2012 Oct 1;32(10):649-64. doi: 10.1007/BF03261919
35. Liu L., Xu B., Ju Y. Addition of spironolactone in patients with resistant hypertension: A meta-analysis of randomized controlled trials. Clin Exp Hypertens. 2017;39(3):257-263. doi: 10.1080/10641963.2016.
36. ONTARGET Investigators, Yusuf S., Teo K.K., et al. Telmisartan, ramipril, or both in patients at high risk for vascular events. The New England Journal of Medicine. 2008 Apr;358(15):1547-1559. doi: 10.1056/nejmoa0801317
37. Catapano A.L., Graham I., De Backer G. et al. ESC Scientific Document Group. 2016 ESC/EAS Guidelines for the Management of Dyslipidaemias. Eur Heart J. 2016 Oct 14;37(39):2999-3058. doi: 10.1093/eurheartj/ehw272
38. Ежов М.В., Сергиенко И.В., Аронов Д.М. и др. Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации VI пересмотр. Атеросклероз и дислипидемии. 2017;3(28):5–22.
39. Inzucchi S.E., Bergenstal R.M., Buse J.B. et al. Management of hyperglycaemia in type 2 diabetes: a patient-centered approach. Position statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia. 2012 Jun;55(6):1577-96. doi: 10.1007/s00125-012-2534-0
40. van den Born B.H., Lip G.Y.H., Brguljan-Hitij J. et al. ESC Council on hypertension position document on the management of hypertensive emergencies. Eur Heart J Cardiovasc Pharmacother. 2019 Jan 1;5(1):37- 46. doi: 10.1093/ehjcvp/pvy032
41. Vaughan C.J., Delanty N. Hypertensive emergencies. Lancet. 2000 Jul 29;356(9227):411-7. doi: 10.1016/S0140-6736(00)02539-3
42. Кутырина И.М., Швецов М.Ю., Фомин В.В. и соавт. Клинические рекомендации. Диагностика и лечение артериальной гипертензии при хронической болезни почек. Клиническая нефрология. 2015;(4):4- 29.
43. Ridao N., Luño J., García de Vinuesa S. et al. Prevalence of hypertension in renal disease. Nephrol Dial Transplant. 2001;16 Suppl 1:70-73. http://www.ncbi.nlm.nih.gov/pubmed/18457801
44. Boesen E.I., Kakalij R.M. Autoimmune-Mediated Renal Disease and Hypertension. Vol 135.; 2021:2165-2196. doi: 10.1042/CS20200955
45. Кутырина И.M., Мартынов С.A., Швецов М.Ю. Артериальная гипертония при хроническом гломерулонефрите: частота выявления и эффективность лечения. Терапевтический архив. 2004;(9):10- 15.
46. Kidney Disease Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney Int. 2013;Suppl (3 (1)):1- 150. doi: 10.1038/ki.2013.243
47. Моисеев В.С., Мухин Н.А., ред. Национальные рекомендации. Сердечно-сосудистый риск и хроническая болезнь почек: стратегии кардионефропротекции. Клиническая нефрология. 2014;(2):4-29.
48. Шилов Е.М., Смирнов А.В., Козловская Н.Л., ред. Нефрология. Клинические Рекомендации. ГЭОТАР-Медиа; 2016.
49. Weiner D.E., Tighiouart H., Elsayed E.F. et al. The Framingham predictive instrument in chronic kidney disease. J Am Coll Cardiol. 2007;50(3):217- 224. doi: 10.1016/j.jacc.2007.03.037
50. Мартынов С.А., Швецов М.Ю., Кутырина И.М. Нарушения суточного ритма артериального давления у больных хроническим гломерулонефритом. Терапевтический архив. 2006;(1):23-27.
51. Rahman M., Wang X., Bundy J.D. et al. Prognostic Significance of Ambulatory BP Monitoring in CKD: A Report from the Chronic Renal Insufficiency Cohort (CRIC) Study. J Am Soc Nephrol. 2020;31(11):2609- 2621. doi: 10.1681/ASN.2020030236
52. Chen T.K., Knicely D.H., Grams M.E. Chronic Kidney Disease Diagnosis and Management: A Review. JAMA. 2019;322(13):1294-1304. doi: 10.1001/JAMA.2019.14745
53. Sarafidis P.A., Persu A., Agarwal R. et al. Hypertension in dialysis patients: a consensus document by the European Renal and Cardiovascular Medicine (EURECA-m) working group of the European Renal Association-European Dialysis and Transplant Association (ERA-EDTA) and the Hypertension and the Kidney. Nephrol Dial Transplant. 2017;32(4):620-640. doi: 10.1093/NDT/GFW433
54. Lv J., Ehteshami P., Sarnak M.J. et al. Effects of intensive blood pressure lowering on the progression of chronic kidney disease: a systematic review and meta-analysis. CMAJ. 2013;185(11):949-957. doi: 10.1503/cmaj.121468
55. KDIGO Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease. Kidney Int. 2012;2(5):337-414.
56. SPRINT Research Group, Wright J.T., Williamson J.D., et al. A Randomized Trial of Intensive versus Standard Blood-Pressure Control. N Engl J Med. 2015;373(22):2103-2116. doi: 10.1056/NEJMoa1511939
57. Whelton P.K., Carey R.M., Aronow W.S. et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ ASH/ASPC/NMA/PCNA guideline for the prevention, detection, evaluation, and management of high blood pressure in adults a report of the American College of Cardiology/American Heart Association Task Force on Clinical pr. Hypertension. 2018;71(6):E13-E115. doi: 10.1161/HYP.0000000000000065/-/DC2
58. Cheung A.K., Chang T.I., Cushman W.C. et al. KDIGO 2021 Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease. Kidney Int. 2021;99(3S):S1-S87. doi: 10.1016/J.KINT.2020.11.003
59. National Kidney Foundation. K/DOQI clinical practice guidelines on hypertension and antihypertensive agents in chronic kidney disease. Am J Kidney Dis. 2004;43(1-290)
60. Jafar T.H., Stark P.C., Schmid C.H. et al. Progression of chronic kidney disease: the role of blood pressure control, proteinuria, and angiotensinconverting enzyme inhibition: a patient-level meta-analysis. Ann Intern Med. 2003;139(4):244-252. http://www.ncbi.nlm.nih.gov/pubmed/12965979
61. Cobb M., Pacitti D. The Importance of Sodium Restrictions in Chronic Kidney Disease. J Ren Nutr. 2018;28(5):e37-e40. doi: 10.1053/j.jrn.2018.02.001
62. Cibulka R., Racek J. Metabolic disorders in patients with chronic kidney failure. Physiol Res. 2007;56(6):697-705. doi: 10.33549/PHSIOLRES.931128
63. Lee S., Kang S., Joo Y.S. et al. Smoking, Smoking Cessation, and Progression of Chronic Kidney Disease: Results From KNOW-CKD Study. Nicotine Tob Res. 2021;23(1):92-98. doi: 10.1093/NTR/NTAA071
64. Li Y., Zhu B., Song N. et al. Alcohol consumption and its association with chronic kidney disease: Evidence from a 12-year China health and Nutrition Survey. Nutr Metab Cardiovasc Dis. 2022;32(6):1392-1401. doi: 10.1016/J.NUMECD.2022.02.012
65. Lotan Y., Daudon M., Bruyère F. et al. Impact of fluid intake in the prevention of urinary system diseases: a brief review. Curr Opin Nephrol Hypertens. 2013;22 Suppl 1(Suppl 1):S1-10. doi: 10.1097/MNH.0b013e328360a268
66. Sontrop J.M., Dixon S.N., Garg A.X. et al. Association between water intake, chronic kidney disease, and cardiovascular disease: a crosssectional analysis of NHANES data. Am J Nephrol. 2013;37(5):434-442. doi: 10.1159/000350377
67. Wagner S., Merkling T., Metzger M., et al. Water intake and progression of chronic kidney disease: the CKD-REIN cohort study. Nephrol Dial Transplant. 2022;37(4):730-739. doi: 10.1093/NDT/GFAB036
68. Ikizler T.A., Burrowes J.D., Byham-Gray L.D., et al. KDOQI Clinical Practice Guideline for Nutrition in CKD: 2020 Update. Am J Kidney Dis. 2020;76(3):S1-S107. doi: 10.1053/J.AJKD.2020.05.006
69. Ruggenenti P., Perna A., Gherardi G., et al. Renal function and requirement for dialysis in chronic nephropathy patients on long-term ramipril: REIN follow-up trial. Lancet. 1998;352:1252-1256.
70. Brenner B.M., Cooper M.E., de Zeeuw D., et al. Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy. N Engl J Med. 2001;345(12):861-869. doi: 10.1056/NEJMOA011161
71. Vogt L., Waanders F., Boomsma F. et al. Effects of dietary sodium and hydrochlorothiazide on the antiproteinuric efficacy of losartan. J Am Soc Nephrol. 2008;19(5):999-1007. doi: 10.1681/ASN.2007060693
72. Bakris G.L., Sarafidis P.A., Weir M.R., et al. Renal outcomes with different fixed-dose combination therapies in patients with hypertension at high risk for cardiovascular events (ACCOMPLISH): a prespecified secondary analysis of a randomised controlled trial. Lancet. 2010;375(9721):1173- 1181. doi: 10.1016/S0140-6736(09)62100-0
73. Ohno S., Ishii A., Yanagita M. et al. Calcium channel blocker in patients with chronic kidney disease. Clin Exp Nephrol. 2022;26(3):207-215. doi: 10.1007/S10157-021-02153-1
74. Fried L.F., Emanuele N., Zhang J.H., et al. Combined angiotensin inhibition for the treatment of diabetic nephropathy. N Engl J Med. 2013;369(20):1892-1903. doi: 10.1056/NEJMoa1303154
75. Maione A., Navaneethan S.D., Graziano G., et al. Angiotensinconverting enzyme inhibitors, angiotensin receptor blockers and combined therapy in patients with micro- and macroalbuminuria and other cardiovascular risk factors: a systematic review of randomized controlled trials. Nephrol Dial Transplant. 2011;26(9):2827-2847. doi: 10.1093/ndt/gfq792
76. Dickinson H.O., Mason J.M., Nicolson D.J., et al. Lifestyle interventions to reduce raised blood pressure: a systematic review of randomized controlled trials. J Hypertens. 2006;24(2):215-233. doi: 10.1097/01.hjh.0000199800.72563.26
77. Покровский А.В., Богатов Ю.П. Вазоренальная гипертония. Гл. в кн.: Руководство по артериальной гипертонии. Под ред. Е.И.Чазова, И.Е.Чазовой. М.: МедиаМедика, 2005; 95-117.
78. Шилов Е.М., Батюшкин М.М. Реноваскулярная артериальная гипертензия и ишемическая болезнь почек. В кн.: Нефрология. Клинические рекомендации. Под ред. Е.М.Шилова, А.В.Смирнова, Н.Л. Козловской. M.: ГЭОТАР-Медиа, 2016; 449-460.
79. Мухин Н.А., Фомин В.В. Атеросклеротический стеноз почечных артерий. В кн.: Руководство по атеросклерозу и ишемической болезни сердца. Под ред. Е.И Чазова, В.В. Кухарчука, С.А. Бойцова. Media Medica, 2007; 248-273.
80. Herrmann S.M., Textor S.C. Renovascular Hypertension. Endocrinol Metab Clin North Am. 2019 Dec;48(4):765-778. doi: 10.1016/j.ecl.2019.08.007
81. de Mast Q., Beutler J.J. The prevalence of atherosclerotic renal artery stenosis in risk groups: a systematic literature review. J Hypertens. 2009 Jul;27(7):1333-40. doi: 10.1097/HJH.0b013e328329bbf4
82. Boutari C., Georgianou E., Sachinidis A. et al. Renovascular Hypertension: Novel Insights. Curr Hypertens Rev. 2020;16(1):24-29. doi: 10.2174/1573402115666190416153321
83. Mousa A.Y., Campbell J.E., Stone P.A. et al. Short- and long-term outcomes of percutaneous transluminal angioplasty/stenting of renal fibromuscular dysplasia over a ten-year period. J Vasc Surg. 2012 Feb;55(2):421-7. doi: 10.1016/j.jvs.2011.09.006
84. Tafur-Soto J.D., White C.J. Renal artery stenosis. Cardiology Clinics 2015; 33(1):59–73. doi: 10.1016/j.ccl.2014.09.006
85. Фомин В.В., Кутырина И.М., Швецов М.Ю. Ишемическая болезнь почек. В кн.: Нефрология. Национальное руководство. Краткое издание. Гл. ред. Н.А Мухин. – М.: «ГЭОТAР-Медиа», 2014. – C. 377-386.
86. Jennings C.G., Houston J.G., Severn A. et al. Renal artery stenosis-when to screen, what to stent? Curr Atheroscler Rep. 2014 Jun;16(6):416. doi: 10.1007/s11883-014-0416-2.
87. Aboyans V., Ricco J.B., Bartelink M.E.L. et al. ESC Scientific Document Group. 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS): Document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteriesEndorsed by: the European Stroke Organization (ESO) The Task Force for the Diagnosis and Treatment of Peripheral Arterial Diseases of the European Society of Cardiology (ESC) and of the European Society for Vascular Surgery (ESVS). Eur Heart J. 2018 Mar 1;39(9):763- 816. doi: 10.1093/eurheartj/ehx095
88. AbuRahma A.F., Yacoub M. Renal imaging: duplex ultrasound, computed tomography angiography, magnetic resonance angiography, and angiography. Semin Vasc Surg. 2013 Dec;26(4):134-43. doi: 10.1053/j.semvascsurg.2014.06.001
89. Chi Y.W., White C.J., Thornton S. et al. Ultrasound velocity criteria for renal in-stent restenosis. J Vasc Surg. 2009 Jul;50(1):119-23. doi: 10.1016/j.jvs.2008.12.066
90. Schäberle W., Leyerer L., Schierling W. et al. Ultrasound diagnostics of renal artery stenosis. Gefässchirurgie. 2016; 1(21):4–13. doi: 10.1007/s00772-015-0060-3
91. Fananapazir G., McGahan J.P., Corwin M.T. et al. Screening for Transplant Renal Artery Stenosis: Ultrasound-Based Stenosis Probability Stratification. AJR Am J Roentgenol. 2017 Nov;209(5):1064-1073. doi: 10.2214/AJR.17.17913
92. Tan K.T., van Beek E.J., Brown P.W. et al. Magnetic resonance angiography for the diagnosis of renal artery stenosis: a meta-analysis. Clin Radiol. 2002 Jul;57(7):617-24. doi: 10.1053/crad.2002.0941
93. Bley T., Francois C., Schiebler M. Non-contrast-enhanced MRA of renal artery stenosis: validation against DSA in a porcine model. European Radiology 2016;26(2):547–55. doi: 10.1007/s00330-015-3833-x
94. Weber-Mzell D. Coronary anatomy predicts presence or absence of renal artery stenosis. A prospective study in patients undergoing cardiac catheterization for suspected coronary artery disease. European Heart Journal, 2002;23(21):1684–1691. doi: 10.1053/euhj.2002.3314
95. Kim D., Porter D. H., Brown R. et al. Renal Artery Imaging: A Prospective Comparison of Intra-Arterial Digital Subtraction Angiography with Conventional Angiography. Angiology.1991;42(5):345–357. doi: 10.1177/000331979104200501
96. Safian R.D. Renal artery stenosis. Prog Cardiovasc Dis. 2021 MarApr;65:60-70. doi: 10.1016/j.pcad.2021.03.003
97. Klein A.J., Jaff M.R., Gray B.H. et al. SCAI appropriate use criteria for peripheral arterial interventions: An update. Catheter Cardiovasc Interv. 2017 Oct 1;90(4):E90-E110. doi: 10.1002/ccd.27141
98. Balafa O., Kalaitzidis R., Siamopoulos K.C. Optimal medical management in patients with renovascular hypertension. Am J Cardiovasc Drugs. 2013 Apr;13(2):71-8. doi: 10.1007/s40256-013-0011-x
99. Hackam D.G., Spence J.D., Garg A.X. et al. Role of renin-angiotensin system blockade in atherosclerotic renal artery stenosis and renovascular hypertension. Hypertension. 2007 Dec;50(6):998-1003. doi: 10.1161/HYPERTENSIONAHA.107.097345
100. Manaktala R., Tafur-Soto J.D., White C.J. Renal Artery Stenosis in the Patient with Hypertension: Prevalence, Impact and Management. Integr Blood Press Control. 2020 Jun 2;13:71-82. doi: 10.2147/IBPC.S248579.
101. Evans K.L., Tuttle K.R., Folt D.A. et al. Use of renin-angiotensin inhibitors in people with renal artery stenosis. Clin J Am Soc Nephrol. 2014 Jul;9(7):1199-206. doi: 10.2215/CJN.11611113
102. Chrysochou C., Foley R.N., Young J.F. et al. Dispelling the myth: the use of renin-angiotensin blockade in atheromatous renovascular disease. Nephrol Dial Transplant. 2012 Apr;27(4):1403-9. doi: 10.1093/ndt/gfr496
103. Chen Y., Pan H., Luo G. et al. Use of percutaneous transluminal renal angioplasty in atherosclerotic renal artery stenosis: a systematic review and meta-analysis. J Int Med Res. 2021 Jan;49(1):300060520983585. doi: 10.1177/0300060520983585
104. Parikh S.A., Shishehbor M.H., Gray B.H. et al. SCAI expert consensus statement for renal artery stenting appropriate use. Catheter Cardiovasc Interv. 2014 Dec 1;84(7):1163-71. doi: 10.1002/ccd.25559
105. Mangiacapra F., Trana C., Sarno G. et al. Translesional pressure gradients to predict blood pressure response after renal artery stenting in patients with renovascular hypertension. Circ Cardiovasc Interv. 2010 Dec;3(6):537-42. doi: 10.1161/CIRCINTERVENTIONS.110.957704
106. Zeller T., Müller C., Frank U. et al. Stent angioplasty of severe atherosclerotic ostial renal artery stenosis in patients with diabetes mellitus and nephrosclerosis. Catheter Cardiovasc Interv. 2003 Apr;58(4):510-5. doi: 10.1002/ccd.10435
107. Mitchell J.A., Subramanian R., White C.J. et al. Predicting blood pressure improvement in hypertensive patients after renal artery stent placement: renal fractional flow reserve. Catheter Cardiovasc Interv. 2007 Apr 1;69(5):685-9. doi: 10.1002/ccd.21095
108. Trinquart L., Mounier-Vehier C., Sapoval M. et al. Efficacy of revascularization for renal artery stenosis caused by fibromuscular dysplasia: a systematic review and meta-analysis. Hypertension. 2010 Sep;56(3):525-32. doi: 10.1161/HYPERTENSIONAHA.110.152918. Epub 2010 Jul 12.
109. Steuer J., Bergqvist D., Björck M. Surgical Renovascular Reconstruction for Renal Artery Stenosis and Aneurysm: Long-Term Durability and Survival. European Journal of Vascular and Endovascular Surgery. 2018; 57(4):562-568. doi: 10.1016/j.ejvs.2018.09.014
110. Зотиков А.Е., Белоярцев Д.Ф. Хирургия поражений почечных артерий. Гл. в кн. Хирургия почечных сосудов. Под ред. Ревишвили А.Ш., Покровского А.В., Зотикова А.Е. М.: Фонд «Русские Витязи», 2021; 36-48.
111. Conlon P.J., Little M.A., Pieper K. et al. Severity of renal vascular disease predicts mortality in patients undergoing coronary angiography. Kidney Int. 2001 Oct;60(4):1490-7. doi: 10.1046/j.1523-1755.2001.00953.x
112. Young W.F. Primary aldosteronism: renaissance of a syndrome. Clin Endocrinol (Oxf). 2007;66(5):607-18. doi: 10.1111/j.1365-2265.2007.02775.x
113. Funder J.W., Carey R.M., Mantero F. et al. The Management of Primary Aldosteronism: Case Detection, Diagnosis, and Treatment: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2016;101(5):1889-1916. doi: 10.1210/jc.2015-4061
114. Rossi G.P., Bisogni V., Bacca A.V. et al. The 2020 Italian Society of Arterial Hypertension (SIIA) practical guidelines for the management of primary aldosteronism. Int J Cardiol Hypertens. 2020;5. doi: 10.1016/j.ijchy.2020.100029
115. Mulatero P., Stowasser M., Loh K.C. et al. Increased diagnosis of primary aldosteronism, including surgically correctable forms, in centers from five continents. J Clin Endocrinol Metab. 2004;89:1045-50. doi: 10.1210/jc.2003-031337
116. Meng Z., Zhou L., Dai Z. et al. The Quality of Clinical Practice Guidelines and Consensuses on the Management of Primary Aldosteronism: A Critical Appraisal. Front Med (Lausanne). 2020;7:136. doi: 10.3389/fmed.2020.00136
117. Young W.F. Jr. Diagnosis and treatment of primary aldosteronism: practical clinical perspectives. J Intern Med. 2019;285(2):126-148. doi: 10.1111/joim.12831
118. Mulatero P., Monticone S., Deinum J. et al. Genetics, prevalence, screening and confirmation of primary aldosteronism: a position statement and consensus of the Working Group on Endocrine Hypertension of The European Society of Hypertension. J Hypertens. 2020 Oct;38(10):1919- 1928. doi: 10.1097/HJH.0000000000002510.
119. Mosso L., Carvajal C., González A. et al. Primary aldosteronism and hypertensive disease. Hypertension. 2003;42(2):161-5. doi: 10.1161/01.HYP.0000079505.25750.11
120. Douma S., Petidis K., Doumas M. et al. Prevalence of primary hyperaldosteronism in resistant hypertension: a retrospective observational study. Lancet. 2008 Jun 7;371(9628):1921-6. doi: 10.1016/S0140-6736(08)60834-X. Erratum in: Lancet. 2008 Dec 13;372(9655):2022.
121. Schmiemann G., Gebhardt K., Hummers-Pradier E. et al. Prevalence of hyperaldosteronism in primary care patients with resistant hypertension. J Am Board Fam Med. 2012;25:98-103. doi: 10.3122/jabfm.2012.01.110099
122. Чихладзе Н.М. Первичный гиперальдостеронизм как возможная причина резистентного течения артериальной гипертонии. Системные гипертензии. 2020; 17 (4): 20–23. doi: 10.26442/2075082X.2020.4.200338
123. Rossi G.P., Bernini G., Caliumi C. et al. A prospective study of the prevalence of primary aldosteronism in 1,125 hypertensive patients. J Am Coll Cardiol. 2006;48(11):2293-300. doi:10.1016/j.jacc.2006.07.059
124. Woo K., Waisman J., Melamed J. et al. Primary aldosteronism caused by unilateral adrenal hyperplasia. Rev Urol. 2000 Spring;2(2):100-4.
125. Goh B.K., Tan Y.H., Chang K.T. et al. Primary hyperaldosteronism secondary to unilateral adrenal hyperplasia: an unusual cause of surgically correctable hypertension. A review of 30 cases. World J Surg. 2007;31(1):72-79. doi: 10.1007/s00268-005-0594-8
126. Zennaro M.C., Jeunemaitre X. SFE/SFHTA/AFCE consensus on primary aldosteronism, part 5: Genetic diagnosis of primary aldosteronism. Ann Endocrinol (Paris). 2016;77(3):214-9. doi: 10.1016/ando.2016.02.00
127. Шхвацабая И.К., Чихладзе Н.М. Гиперальдостеронизм и артериальная гипертония. – М.: Медицина, 1984. 136 с.
128. Baguet J.P., Steichen O., Mounier-Véhier C. et al. SFE/SFHTA/ AFCE consensus on primary aldosteronism, part 1: Epidemiology of PA, who should be screened for sporadic PA? Ann Endocrinol (Paris). 2016;77(3):187-91. doi: 10.1016/j.ando.2016.01.006
129. Amar L., Plouin P.F., Steichen O. Aldosterone-producing adenoma and other surgically correctable forms of primary aldosteronism. Orphanet J Rare Dis. 2010;5:9. doi: 10.1186/1750-1172-5-9
130. Чихладзе Н.М. Характер течения артериальной гипертонии при низкорениновом гиперальдостеронизме. Системные гипертензии. 2019;16(4):22–26. doi: 10.26442/2075082X.2019.4.190574
131. Brown J.M., Robinson-Cohen C., Luque-Fernandez M.A. et al. The Spectrum of Subclinical Primary Aldosteronism and Incident Hypertension: A Cohort Study. Ann Intern Med. 2017;167(9):630-641. doi: 10.7326/M17-0882
132. Monticone S., D’Ascenzo F., Moretti C. et al. Cardiovascular events and target organ damage in primary aldosteronism compared with essential hypertension: a systematic review and meta-analysis. Lancet Diabetes Endocrinol. 2018;6(1):41-50. doi: 10.1016/S2213-8587(17)30319-4
133. Pan C.T., Tsai C.H., Chen Z.W. et al. Atrial Fibrillation in Primary Aldosteronism. Horm Metab Res. 2020;52(6):357-365. doi: 10.1055/a1141-5989
134. Чихладзе Н.М. Первичный гиперальдостеронизм: показания для скрининга. Терапевтический архив. 2022;94(1):107–113. doi: 10.26442/00403660.2022.01.201324
135. Monticone S., Burrello J., Tizzani D. et al. Prevalence and Clinical Manifestations of Primary Aldosteronism Encountered in Primary Care Practice. J Am Coll Cardiol. 2017;69(14):1811-20. doi: 10.1016/j.jacc.2017.01.052
136. Ganguly A., Dowdy A.J., Luetscher J.A. et al. Anomalous postural response of plasma aldosterone concentration in patients with aldosteroneproducing adrenal adenoma. J Clin Endocrinol Metab. 1973. Vol. 36. N 2.P. 401-4.
137. Teresa Fuss C., Brohm K., Fassnacht M. et al. Reassessment of Postural Stimulation Testing as a Simple Tool to Identify a Subgroup of Patients With Unilateral Primary Aldosteronism. J Clin Endocrinol Metab. 2022 Jan 18;107(2):e865-e873. doi: 10.1210/clinem/dgab611
138. Mulatero P., Sechi L.A., Williams T.A. et al. Subtype diagnosis, treatment, complications and outcomes of primary aldosteronism and future direction of research: a position statement and consensus of the Working Group on Endocrine Hypertension of the European Society of Hypertension. J Hypertens. 2020;38(10):1929-1936. doi: 10.1097/HJH.0000000000002520
139. Williams T.A., Lenders J.W.M., Mulatero P. et al. Outcomes after adrenalectomy for unilateral primary aldosteronism: an international consensus on outcome measures and analysis of remission rates in an international cohort. Lancet Diabetes Endocrinol. 2017;5(9):689-699. doi: 10.1016/S2213-8587(17)30135-3
140. Karagiannis A., Tziomalos K., Kakafika A.I. et al. Medical treatment as an alternative to adrenalectomy in patients with aldosterone-producing adenomas. Endocr Relat Cancer. 2008;15(3):693-700. doi: 10.1677/ERC-08-0094
141. Sechi L.A., Colussi G.L., Novello M. et al. Mineralocorticoid Receptor Antagonists and Clinical Outcomes in Primary Aldosteronism: As Good as Surgery? Horm Metab Res. 2015;47(13):1000-1006. doi: 10.1055/s0035-1565128
142. Чихладзе Н.М., Фаворова О.О., Чазова И.Е. Семейная форма гиперальдостеронизма I типа: клиническое наблюдение и обзор литературы. Терапевтический архив. 2018;90(9):115-22. doi: 10.26442/terarkh2018909115-122
143. Мельниченко Г.А., Дедов И.И., Белая Ж.Е. и соавт. Болезнь Иценко-Кушинга: клиника, диагностика, дифференциальная диагностика, методы лечения. Проблемы Эндокринологии. 2015; 61(2): 55–77. doi: 10.14341/proderalbl201561255-77
144. Nieman L.K., Biller B.M.K., Findling J.W. et al. The diagnosis of Cushing’s syndrome: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2008;93(5):1526-1540. doi: 10.1210/jc.2008-0125.
145. Feelders R., Sharma S., Nieman L. Cushing’s syndrome: epidemiology and developments in disease management. CLEP 2015: 281. doi: 10.2147/CLEP.S44336
146. Марова Е.И., Белая Ж.Е., Малыгина А.А. и соавт. Болезнь Иценко-Кушинга (учебное пособие). — М.: ФГБУ “НМИЦ эндокринологии” Минздрава России, 2021. — 40 с.
147. Lindholm J., Juul S., Jørgensen J.O.L. et al. Incidence and Late Prognosis of Cushing’s Syndrome: A Population-Based Study 1. The Journal of Clinical Endocrinology & Metabolism 2001;86(1):117–123. doi: 10.1210/jcem.86.1.7093
148. Etxabe J., Vazquez J.A. Morbidity and mortality in Cushing’s disease: an epidemiological approach. Clin Endocrinol 1994;40(4):479–484. doi: 10.1111/j.1365-2265.1994.tb02486.x
149. Broder M.S., Neary M.P., Chang E. et al. Incidence of Cushing’s syndrome and Cushing’s disease in commercially-insured patients < 65 years old in the United States. Pituitary 2015;18(3):283–289. doi: 10.1007/s11102-014-0569-6
150. Trifanescu R., Carsote M., Caragheorgheopol A. et al. Screening for secondary endocrine hypertension in young patients. Maedica (Bucur). 2013;8(2):108–115.
151. Omura M., Saito J., Yamaguchi K. et al. Prospective study on the prevalence of secondary hypertension among hypertensive patients visiting a general outpatient clinic in Japan. Hypertens Res. 2004;27(3):193–202. doi: 10.1291/hypres.27.193
152. Белая Ж.Е., Рожинская Л.Я., Драгунова Н.В. и соавт. Метаболические осложнения эндогенного гиперкортицизма. Выбор пациентов для скрининга. Ожирение и Метаболизм. – 2013(1). – 29–34.
153. Valassi E., Santos A., Yaneva M. et al. ERCUSYN Study Group. The European Registry on Cushing’s syndrome: 2-year experience. Baseline demographic and clinical characteristics. Eur J Endocrinol. 2011 Sep;165(3):383-92. doi: 10.1530/EJE-11-0272
154. Дедов И.И., Мельниченко Г.А. Эндокринология. Национальное Руководство. 2-е изд. — М.: ГЭОТАР-Медиа; 2018.
155. Белая Ж.Е., Малыгина А.А., Гребенникова Т.А. и соавт. Диагностические возможности исследования кортизола слюны в ходе малой пробы с дексаметазоном. Ожирение и метаболизм. 2020;17(1):13- 21. doi: 10.14341/omet10117
156. Белая Ж.Е., Ильин А.В., Мельниченко Г.А. и соавт. Автоматизированный электрохемилюминесцентный метод определения кортизола в слюне для диагностики эндогенного гиперкортицизма среди пациентов с ожирением. Ожирение и метаболизм. 2011;27(2):56-63.
157. Sereg M., Tőke J., Patócs A. et al. Diagnostic performance of salivary cortisol and serum osteocalcin measurements in patients with overt and subclinical Cushing’s syndrome. Steroids 2011;76(1–2):38–42. doi: 10.1016/j.steroids.2010.08.007
158. Hong A.R., Kim J.H., Hong E.S. et al Limited Diagnostic Utility of Plasma Adrenocorticotropic Hormone for Differentiation between Adrenal Cushing Syndrome and Cushing Disease. Endocrinol Metab 2015;30(3):297. doi: 10.3803/EnM.2015.30.3.297
159. Liu Z., Zhang X., Wang Z. et al. High positive predictive value of the combined pituitary dynamic enhanced MRI and high-dose dexamethasone suppression tests in the diagnosis of Cushing’s disease bypassing bilateral inferior petrosal sinus sampling. Sci Rep 2020;10(1):14694. doi: 10.1038/s41598-020-71628-0
160. Pinelli S., Barbot M., Scaroni C. et al. Second-Line Tests in the Diagnosis of Adrenocorticotropic Hormone-Dependent Hypercortisolism. Ann Lab Med 2021;41(6):521–531. doi: 10.3343/alm.2021.41.6.521
161. Colao A., Petersenn S., Newell-Price J. et al. A 12-Month Phase 3 Study of Pasireotide in Cushing’s Disease. N Engl J Med.2012;366(10):914–924. doi: 10.1056/NEJMoa1105743
162. Barbot M., Ceccato F., Scaroni C. The Pathophysiology and Treatment of Hypertension in Patients With Cushing’s Syndrome. Front Endocrinol (Lausanne). 2019 May 21;10:321. doi: 10.3389/fendo.2019.00321
163. Isidori A.M., Graziadio C., Paragliola R.M. et al, ABC Study Group. The hypertension of Cushing’s syndrome: controversies in the pathophysiology and focus on cardiovascular complications. J Hypertens. 2015 Jan;33(1):44-60. doi: 10.1097/HJH.0000000000000415
164. Cicala M.V., Mantero F. Hypertension in Cushing’s syndrome: from pathogenesis to treatment. Neuroendocrinology. 2010;92 Suppl 1:44-9. doi: 10.1159/000314315
165. Ritzel K., Beuschlein F., Mickisch A., Osswald A. et. al. Outcome of Bilateral Adrenalectomy in et alCushing’s Syndrome: A Systematic Review. The Journal of Clinical Endocrinology & Metabolism 2013; 98(10): 3939– 3948. doi: 10.1210/jc.2013-1470
166. Lenders J.W.M., Duh Q.-Y., Eisenhofer G. et al. Pheochromocytoma and paraganglioma: An endocrine society clinical practice guideline. J Clin Endocrinol Metab. 2014;99(6):1915-1942. doi: 10.1210/jc.2014-1498
167. Lenders J.W.M., Kerstens M.N., Amar L., et al. Genetics, diagnosis, management and future directions of research of phaeochromocytoma and paraganglioma: a position statement and consensus of the Working Group on Endocrine Hypertension of the European Society of Hypertension. J Hypertens. 2020;38(8):1443-1456. doi: 10.1097/HJH.0000000000002438
168. Calissendorff J., Juhlin C.C., Bancos I. et al. Pheochromocytomas and Abdominal Paragangliomas: A Practical Guidance. Cancers (Basel). 2022 Feb 12;14(4):917. doi: 10.3390/cancers14040917
169. Falhammar H., Kjellman M., Calissendorff J. Initial clinical presentation and spectrum of pheochromocytoma: a study of 94 cases from a single center. Endocr Connect. 2018;7(1):186-192. doi: 10.1530/EC-17-0321
170. Ebbehoj A., Stochholm K., Jacobsen S.F. et al. Incidence and Clinical Presentation of Pheochromocytoma and Sympathetic Paraganglioma: A Population-based Study. J. Clin. Endocrinol. Metab. 2021;106:e2251– e2261. doi: 10.1210/clinem/dgaa965
171. Mete O., Asa S.L., Gill A.J. et al. Overview of the 2022 WHO Classification of Paragangliomas and Pheochromocytomas. Endocr Pathol. 2022 Mar;33(1):90-114. doi: 10.1007/s12022-022-09704-6
172. Garcia-Carbonero R., Matute Teresa F., Mercader-Cidoncha E. et al. Multidisciplinary practice guidelines for the diagnosis, genetic counseling and treatment of pheochromocytomas and paragangliomas. Clin Transl Oncol. 2021 Oct;23(10):1995-2019. doi: 10.1007/s12094-021-02622-9
173. Fishbein L., Del Rivero J., Else T. et al. The North American Neuroendocrine Tumor Society Consensus Guidelines for Surveillance and Management of Metastatic and/or Unresectable Pheochromocytoma and Paraganglioma. Pancreas. 2021;50(4):469-493. doi: 10.1097/MPA.0000000000001792
174. Zuber S.M., Kantorovich V., Pacak K. Hypertension in pheochromocytoma: characteristics and treatment. Endocrinol Metab Clin North Am. 2011 Jun;40(2):295-311, vii. doi: 10.1016/j.ecl.2011.02.002
175. Bravo E.L., Tagle R. Pheochromocytoma: state-of-the-art and future prospects. Endocr Rev. 2003;24(4):539-553. doi: 10.1210/er.2002-0013
176. Geroula A., Deutschbein T., Langton K. et al. (2019). Pheochromocytoma and paraganglioma: clinical feature-based disease probability in relation to catecholamine biochemistry and reason for disease suspicion. European Journal of Endocrinology, 181(4):409-420. doi: 10.1530/EJE-19-0159
177. Мохорт Т.В., Велесевич Е.И., Мохорт Е.Г.(2016). Феохромоцитома: современные подходы к диагностике и лечению. Медицинские новости. 2016;(4):3-10.
178. Calhoun D.A., Jones D., Textor S. et al.; American Heart Association Professional Education Committee. Resistant hypertension: diagnosis, evaluation, and treatment: a scientific statement from the American Heart Association Professional Education Committee of the Council for High Blood Pressure Research. Circulation. 2008 Jun 24;117(25):e510-26. doi: 10.1161/CIRCULATIONAHA.108.189141
179. Y-Hassan S., Falhammar H. Cardiovascular Manifestations and Complications of Pheochromocytomas and Paragangliomas. J Clin Med. 2020 Jul 30;9(8):2435. doi: 10.3390/jcm9082435
180. Бельцевич Д.Г., Трошина Е.А., Юкина М.Ю. Феохромоцитома. Проблемы эндокринологии . 2010; 56 (1), 63-71. doi: 10.14341/probl201056163-71
181. Zelinka T., Pacák K., Widimský J. Jr. Characteristics of blood pressure in pheochromocytoma. Ann N Y Acad Sci. 2006 Aug;1073:86-93. doi: 10.1196/annals.1353.009
182. Falhammar H., Kjellman M., Calissendorff J. Treatment and outcomes in pheochromocytomas and paragangliomas: a study of 110 cases from a single center. Endocrine. 2018;62(3):566-575. doi: 10.1007/s12020-018-1734-x
183. Мельниченко Г.А., Трошина Е.А., Бельцевич Д.Г. и соавт. Клинические рекомендации Российской Ассоциации эндокринологов по диагностике и лечению феохромоцитомы/параганглиомы. Эндокринная хирургия. 2015;9(3):15-33. doi: 10.14341/serg2015315-33
184. Antonio K., Valdez M.M.N., Mercado-Asis L., et al. Pheochromocytoma/ paraganglioma: recent updates in genetics, biochemistry, immunohistochemistry, metabolomics, imaging and therapeutic options. Gland Surg. 2020 Feb;9(1):105-123. doi: 10.21037/gs.2019.10.25
185. Юкина М.Ю., Трошина Е.А., Бельцевич Д.Г. Наследственные синдромы, ассоциированные с феохромоцитомой. Часть 1. Терапевтический архив. 2015;87(9):102-105. doi: 10.17116/terarkh2015879102-105
186. Plouin P.F., Amar L., Dekkers O.M., et al. Guideline Working Group European Society of Endocrinology Clinical Practice Guideline for longterm follow-up of patients operated on for a phaeochromocytoma or a paraganglioma. Eur. J. Endocrinol. 2016;174:G1–G10. doi: 10.1530/EJE16-0033
187. Weismann D., Liu D., Bergen T., et al. Hypertension and hypertensive cardiomyopathy in patients with a relapse-free history of phaeochromocytoma. Clin. Endocrinol. 2015;82(2):188–196. doi: 10.1111/cen.12536
188. Bahn R.S., Burch H.B., Cooper D.S. et al. Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the american thyroid association and American association of clinical endocrinologists. Endocr. pract. 2011;17(3):456-520. doi: 10.4158/ep.17.3.456
189. Ross D.S., Burch H.B., Cooper D.S. et al. 2016 American Thyroid Association guidelines for diagnosis and management of hyperthyroidism and other causes of thyrotoxicosis. Thyroid. 2016;26(10):1343-1421. doi: 10.1089/thy.2016.0229
190. Российская ассоциация эндокринологов. Национальные рекомендации: Тиреотоксикоз с диффузным зобом (диффузный токсический зоб, болезнь Грейвса–Базедова), узловым/многоузловым зобом. М.; 2014.
191. William F. Young Jr., Calhoun D.A. et al. Screening for Endocrine Hypertension: An Endocrine Society Scientific Statement. Endocrine Reviews. 2017;3(2):103-122. doi: 10.1210/er.2017-00054
192. Selmer C., Olesen J.B., Hansen M.L. et al. Subclinical and overt thyroid dysfunction and risk of all-cause mortality and cardiovascular events: a large population study. J Clin Endocrinol Metab. 2014;99(7):2372-2382. doi: 10.1210/jc.2013-4184
193. Sohn S.Y., Lee E., Lee M.K. et al. The association of overt and subclinical hyperthyroidism with the risk of cardiovascular events and cardiovascular mortality: meta-analysis and systematic review of cohort studies. Endocrinol Metab (Seoul). 2020;35(4):786-800. doi: 10.3803/EnM.2020.728
194. Berta, E., Lengyel, I., Halmi, S. et al. Hypertension in Thyroid Disorders. Front. Endocrinol. 2019;10:482. doi: 10.3389/fendo.2019.00482
195. Kahaly G.J., Olivo P.D. Graves’ disease. N Engl J Med. 2017;376(2):184. doi: 10.1056/NEJMc1614624
196. Tozzoli R., Bagnasco M., Giavarina D. et al. TSH receptor autoantibody immunoassay in patients with Graves’ disease: improvement of diagnostic accuracy over different generations of methods: systematic review and meta-analysis. Autoimmun Rev. 2012;12(2):107–113. doi: 10.1016/j.autrev.2012.07.003
197. Kahaly G.J., Bartalena L., Hegedus L. The American Thyroid Association/ American Association of Clinical Endocrinologists guidelines for hyperthyroidism and other causes of thyrotoxicosis: a European perspective. Thyroid. 2011;21(6):585–591. doi: 10.1089/thy.2011.2106.ed3
198. Collet T.H., Gussekloo J., Bauer D.C. et al. Thyroid Studies Collaboration: Subclinical hyperthyroidism and the risk of coronary heart disease and mortality. Arch Intern Med. 2012;172(10):799–809. doi: 10.1001/archinternmed.2012.402
199. Bartalena L., Burch H.B., Burman K.D. et al. A 2013 European survey of clinical practice patterns in the management of Graves ‘disease. Clin Endocrinol. 2016;84(1):115–120. doi: 10.1111/cen.12688
200. Чазова И.Е., Голицын С.П., Жернакова Ю.В. и соавт. Ведение пациентов с артериальной гипертонией и фибрилляцией предсердий. Системные гипертензии. 2021;18(3):105–128. doi: 10.26442/2075082X.2021.3.201077
201. Corvilain B., Hamy A., Brunaud L. et al. Treatment of adult Graves’ disease. Ann Endocrinol (Paris) (2018). doi: 10.1016/j.ando.2018.08.003
202. Kahaly G.J., Bartalena L., Hegedüs L. et al. 2018 European Thyroid Association Guideline for the Management of Graves’ Hyperthyroidism. Eur Thyroid J. 2018;7:167–186. doi: 10.1159/000490384
203. Brito J.P., Schilz S., Singh Ospina N. et al. Antithyroid drugs – the most common treatment for Graves’ disease in the United States: a nationwide population-based study. Thyroid. 2016;26(8):1144–1145. doi: 10.1089/thy.2016.0222
204. Biondi B., Bartalena L., Cooper D.S. et al. The 2015 European Thyroid Association guidelines on diagnosis and treatment of endogenous subclinical hyperthyroidism. Eur Thyroid J. 2015;4(3):149–163. doi: 10.1159/000438750
205. Tagami T., Yambe Y., Tanaka T. et al. BBGD Study Group. Shortterm effects of beta-adrenergic antagonists and methimazole in new-onset thyrotoxicosis caused by Graves’ disease. Intern Med. 2012;51(17):2285– 2290. doi: 10.2169/internalmedicine.51.7302
206. Satoh T., Isozaki O., Suzuki A. et al. 2016 guidelines for the management of thyroid storm from the Japan Thyroid Association and Japan Endocrine Society (first edition). Endocr J. 2016;63:1025–1064. doi: 10.1507/endocrj.EJ16-0336
207. Isozaki O., Satoh T., Wakino S. et al. Treatment and management of thyroid storm: analysis of the nationwide surveys: the taskforce committee of the Japan Thyroid Association and Japan Endocrine Society for the establishment of diagnostic criteria and nationwide surveys for thyroid storm. Clin Endocrinol. 2016;84:912–918. doi: 10.1111/cen.12949
208. Meyerovitch J., Rotman-Pikielny P., Sherf M. et al. Serum thyrotropin measurements in the community: five-year follow-up in a large network of primary care physicians. Arch Intern Med. 2007;167(14):1533–8. doi: 10.1001/archinte.167.14.1533.
209. Persani L., Cangiano B., Bonorni M. The diagnosis and management of central hypothyroidism in 2018. Endocr Connect. 2019;8(2):44-54. doi: 10.1530/EC-18-0515
210. Mazza A., Beltramello G., Armigliato M. et al. Arterial hypertension and thyroid disorders: What is important to know in clinical practice? Ann Endocrinol. 2011;72:296–303. doi: 10.1016/j.ando.2011.05.004
211. Piantanida E., Gallo D., Veronesi G. et al. Masked hypertension in newly diagnosed hypothyroidism: a pilot study. J Endocrinol Invest. 2016;39(10):1131-1138. doi: 10.1007/s40618-016-0488-7.
212. Surks M.I., Ortiz E., Daniels G. et al. Subclinical thyroid disease: scientific review and guidelines for diagnosis and management. Jama. 2004;291(2):228-238. doi: 10.1001/jama.291.2.228
213. Raber W., Gessl A., Nowotny P. et al. Thyroid ultrasound versus antithyroid peroxidase antibody determination: a cohort study of four hundred fifty-one subjects. Thyroid. 2002; 12(8):725-731. doi: 10.1089/105072502760258712
214. McAninch E.A., Rajan K.B., Miller C.H. et al. Systemic thyroid hormone status during levothyroxine therapy in hypothyroidism: a systematic review and meta-analysis. J Clin Endocrinol Metab. 2018;103(12):4533- 4542. doi: 10.1210/jc.2018-01361
215. Jonklaas J., Bianco A.C., Bauer A.J. et al. Guidelines for the treatment of hypothyroidism: prepared by the American thyroid association task force on thyroid hormone replacement. Thyroid. 2014 Dec;24(12):1670-751. doi: 10.1089/thy.2014.0028
216. Покровский А.В., Зотиков А.Е., Юдин В.И. Неспецифический аортоартериит (болезнь Такаясу). М.: ИРИСЪ, 2002.
217. Arnaud L., Haroche J., Limal N. et al. Takayasu arteritis in France: a singlecenter retrospective study of 82 cases comparing white, North African, and black patients. Medicine (Baltimore). 2010;89(1):1-17. doi: 10.1097/MD.0b013e3181cba0a3
218. Saadoun D., Bura-Riviere A., Comarmond C. et al. French recommendations for the management of Takayasu’s arteritis. Orphanet J Rare Dis. 2021 Jul 21;16(Suppl 3):311. doi: 10.1186/s13023-021-01922-1
219. Mammeri A., Guermaz R., Hatri A. et al. L’hypertension artérielle au cours de la maladie de Takayasu: à propos d’une série monocentrique de 279 patients [Hypertension during Takayasu’s disease: An Algerian single center experience of 279 patients]. Ann Cardiol Angeiol (Paris). 2017;66(3):154-158. doi: 10.1016/j.ancard.2017.04.006
220. Чихладзе, Н. М., Сивакова, О. А., Чазова, И. Е. Клинические проявления поражения сердечно-сосудистой системы при неспецифическом аортоартериите. Системные гипертензии. 2008;5(4)22-24. doi: 10.26442/SG28828
221. Ham S.W., Kumar S.R., Rowe V.L. et al. Disease progression after initial surgical intervention for Takayasu arteritis. J Vasc Surg. 2011;54(5):1345- 1351. doi: 10.1016/j.jvs.2011.04.044
222. Чихладзе Н.М. Артериальная гипертония у больных неспецифическим аортоартериитом. Системные гипертензии. 2018;15(2):43– 48. doi: 10.26442/2075-082X_2018.2.43-48.
223. Ying S., Sifan W., Yujiao W. et al. Clinical characteristics, imaging phenotypes and events free survival in Takayasu arteritis patients with hypertension. Arthritis Res Ther. 2021;23(1):196. Published 2021 Jul 21. doi: 10.1186/s13075-021-02579-8
224. Арабидзе Г.Г., Абугова С.П., Матвеева Л.С и соавт. Клинические аспекты болезни Такаясу (215 наблюдений). Терапевт. Архив. 1980;5:124– 129.
225. Maksimowicz-McKinnon K., Clark T.M., Hoffman G.S. Limitations of therapy and a guarded prognosis in an American cohort of Takayasu arteritis patients. Arthritis Rheum. 2007;56(3):1000-1009. doi:10.1002/art.22404
226. Erbel R., Aboyans V., Boileau C. et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases: Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult. The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC). Eur Heart J. 2014 Nov 1;35(41):2873-926. doi: 10.1093/eurheartj/ehu281
227. Maz M., Chung S.A., Abril A. et al. 2021 American College of Rheumatology/ Vasculitis Foundation Guideline for the Management of Giant Cell Arteritis and Takayasu Arteritis. Arthritis Rheumatol. 2021 Aug;73(8):1349-1365. doi: 10.1002/art.41774
228. Águeda A.F., Monti S., Luqmani R.A. et al. Management of Takayasu arteritis: a systematic literature review informing the 2018 update of the EULAR recommendation for the management of large vessel vasculitis. RMD Open 2019;5:e001020. doi: 10.1136/rmdopen-2019-001020
229. Сторжаков Г.И. Артериальные гипертонии при пороках сердца и аорты. В кн.: Руководство по артериальной гипертонии. Под ред. Е.И.Чазова, И.Е.Чазовой. – М.: Медиа Медика, 2005. – С. 1.
230. Клинические рекомендации. Коарктация аорты. МЗ РФ, 2020
231. Бураковский В.И. и соавт. Врожденные пороки сердца. В кн.: Сердечно-сосудистая хирургия. Под ред. Бураковского В.И. и Бокерии Л.А. – М.:Медицина. 1996. – C. 299-312.
232. Покровский А.В. Коарктация аорты. В кн.: Заболевания аорты и ее ветвей. – М.: Медицина, 1979. – C. 269-302.
233. Hemels M.E., Hoendermis E.S., van Melle J.P. et al. Therapy refractory hypertension in adults: aortic coarctation has to be ruled out. Neth Heart J. 2011 Mar;19(3):107-111. doi: 10.1007/s12471-011-0074-8
234. Erbel R., Aboyans V., Boileau, C. et al. The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC), European Heart Journal, Volume 35, Issue 41, 1 November 2014, Pages 2873–2926. doi: 10.1093/eurheartj/ehu281
235. Stout K.K., Daniels C.J., Aboulhosn J.A. et al. 2018 AHA/ACC guideline for the management of adults with congenital heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2019;139:e698–e800. doi: 10.1161/CIR.0000000000000603
236. Hiratzka L.F., Bakris G.L., Beckman J.A. et al. 2010 ACCF/AHA/AATS/ ACR/ASA/SCA/SCAI/SIR/STS/SVM guidelines for the diagnosis and management of patients with Thoracic Aortic Disease: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, American Association for Thoracic Surgery, American College of Radiology, American Stroke Association, Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiology, Society of Thoracic Surgeons, and Society for Vascular Medicine [published correction appears in Circulation. 2010 Jul 27;122(4):e410]. Circulation. 2010;121(13):e266-e369. doi: 10.1161/CIR.0b013e3181d4739e
237. Ильин А.С., Теплов П.В., Сакович В.А. Коарктация аорты как патология сердечно-сосудистой системы. Наши возможности в хирургии. Сибирское медицинское обозрение. 2018;(3): 24-33. doi: 10.20333/2500136-2018-3-24-33
238. Vohra H.A., Adamson L., Haw M.P. Does surgical correction of coarctation of the aorta in adults reduce established hypertension? Interact Cardiovasc Thorac Surg. 2009;8(1):123-127. doi:10.1510/icvts.2008.185736
239. Bhat M.A., Neelakandhan K.S., Unnikrishnan M. et al. Fate of hypertension after repair of coarctation of the aorta in adults. Br J Surg. 2001;88(4):536- 538. doi: 10.1046/j.1365-2168.2001.01745.x
240. Torok R.D., Campbell M.J., Fleming G.A. et al. Coarctation of the aorta: Management from infancy to adulthood. World J Cardiol. 2015;7(11):765- 775. doi: 10.4330/wjc.v7.i11.765
241. Parati G., Lombardi C., Hedner J. et al.; European Respiratory Society; EU COST ACTION B26 members. Position paper on the management of patients with obstructive sleep apnea and hypertension: joint recommendations by the European Society of Hypertension, by the European Respiratory Society and by the members of European COST (COoperation in Scientific and Technological research) ACTION B26 on obstructive sleep apnea. J Hypertens. 2012 Apr;30(4):633-46. doi: 10.1097/HJH.0b013e328350e53b
242. Sateia M.J. International classification of sleep disorders-third edition: highlights and modifications. Chest. 2014 Nov;146(5):1387-1394. doi: 10.1378/chest.14-0970
243. Young T., Palta M., Dempsey J. et al. Burden of sleep apnea: rationale, design, and major findings of the Wisconsin Sleep Cohort study. WMJ. 2009 Aug;108(5):246-9.
244. Benjafield A.V., Ayas N.T., Eastwood P.R. et al. Estimation of the global prevalence and burden of obstructive sleep apnoea: a literature-based analysis. Lancet Respir Med. 2019;7:687–98. doi: 10.1016/S2213-2600(19)30198-5
245. Lindberg E., Gislason T. Epidemiology of sleep-related obstructive breathing. Sleep Med Rev. 2000 Oct;4(5):411-33. doi: 10.1053/smrv.2000.0118
246. Аксенова А.В., Елфимова Е.М., Галицин П.В. и др. Значение компьютерной пульсоксиметрии в практике врача-кардиолога. Системные гипертензии. 2014;11(4):26-30.
247. Бочкарев М.В., Коростовцева Л.С., Фильченко И.А. и соавт. Жалобы на нарушения дыхания во сне и факторы риска сердечно-сосудистых заболеваний в регионах России: данные исследования ЭССЕ-РФ. Рос кардиол журн. 2018;6:152–158.
248. Khokhrina A., Andreeva E., Degryse J.M. The prevalence of sleepdisordered breathing in Northwest Russia: The ARKHsleep study. Chron Respir Dis. 2020 Jan-Dec;17:1479973120928103. doi: 10.1177/1479973120928103
249. Nieto F.J., Young T.B., Lind B.K. et al. Association of sleep-disordered breathing, sleep apnea, and hypertension in a large community-based study. Sleep Heart Health Study. JAMA. 2000 Apr 12;283(14):1829- 36. doi: 10.1001/jama.283.14.1829. Erratum in: JAMA 2002 Oct 23- 30;288(16):1985.
250. Peppard P.E., Young T., Palta M. et al. Prospective study of the association between sleep-disordered breathing and hypertension. N Engl J Med. 2000 May 11;342(19):1378-84. doi: 10.1056/NEJM200005113421901
251. Lavie P., Herer P., Hoffstein V. Obstructive sleep apnoea syndrome as a risk factor for hypertension: population study. BMJ. 2000 Feb 19;320(7233):479-82. doi: 10.1136/bmj.320.7233.479.
252. Tokunou T., Ando S.I. Recent advances in the management of secondary hypertension-obstructive sleep apnea. Hypertens Res. 2020 Dec;43(12):1338-1343. doi: 10.1038/s41440-020-0494-1
253. Sleep-related breathing disorders in adults: recommendations for syndrome definition and measurement techniques in clinical research. The Report of an American Academy of Sleep Medicine Task Force. Sleep. 1999 Aug 1;22(5):667-89.
254. Kapur V.K., Auckley D.H., Chowdhuri S. et al. Clinical Practice Guideline for Diagnostic Testing for Adult Obstructive Sleep Apnea: An American Academy of Sleep Medicine Clinical Practice Guideline. J Clin Sleep Med. 2017 Mar 15;13(3):479-504. doi: 10.5664/jcsm.6506
255. Somers V.K., White D.P., Amin R. et al. Sleep apnea and cardiovascular disease: an American Heart Association/American College of Cardiology Foundation Scientific Statement from the American Heart Association Council for High Blood Pressure Research Professional Education Committee, Council on Clinical Cardiology, Stroke Council, and Council on Cardiovascular Nursing. J Am Coll Cardiol. 2008 Aug 19;52(8):686-717. doi: 10.1016/j.jacc.2008.05.002
256. Johns M.W. Daytime sleepiness, snoring, and obstructive sleep apnea. The Epworth Sleepiness Scale. Chest. 1993 Jan;103(1):30-6. doi: 10.1378/chest.103.1.30
257. Jordan A.S., McSharry D.G., Malhotra A. Adult obstructive sleep apnoea. Lancet. 2014 Feb 22;383(9918):736-47. doi: 10.1016/S0140-6736(13)60734-5
258. Giles T.L., Lasserson T.J., Smith B.J. et al. Continuous positive airways pressure for obstructive sleep apnoea in adults. Cochrane Database Syst Rev. 2006 Jan 25;(1):CD001106. doi: 10.1002/14651858.CD001106. pub2. Update in: Cochrane Database Syst Rev. 2006;(3):CD001106.
259. Walia H.K., Thompson N.R., Pascoe M. et al. Effect of Positive Airway Pressure Therapy on Drowsy Driving in a Large Clinic-Based Obstructive Sleep Apnea Cohort. J Clin Sleep Med. 2019 Nov 15;15(11):1613-1620. doi: 10.5664/jcsm.8024
260. US Preventive Services Task Force. Screening for Obstructive Sleep Apnea in Adults: US Preventive Services Task Force Recommendation Statement. JAMA. 2022;328(19):1945–1950. doi: 10.1001/jama.2022.20304
261. Liu L., Cao Q., Guo Z. et al. Continuous positive airway pressure in patients with obstructive sleep apnea and resistant hypertension: a meta-analysis of randomized controlled trials. J Clin Hypertens (Greenwich). 2016 Feb;18(2):153-8. doi: 10.1111/jch.12639
262. Montesi S.B., Edwards B.A., Malhotra A. et al. The effect of continuous positive airway pressure treatment on blood pressure: a systematic review and meta-analysis of randomized controlled trials. J Clin Sleep Med. 2012 Oct 15;8(5):587-96. doi: 10.5664/jcsm.2170
263. Litvin A.Y., Sukmarova Z.N., Elfimova E.M. et al. Effects of CPAP on «vascular» risk factors in patients with obstructive sleep apnea and arterial hypertension. Vasc Health Risk Manag. 2013;9:229-235. doi: 10.2147/VHRM.S40231
264. Patil S.P., Ayappa I.A., Caples S.M. et al. Treatment of Adult Obstructive Sleep Apnea with Positive Airway Pressure: An American Academy of Sleep Medicine Clinical Practice Guideline. J Clin Sleep Med. 2019 Feb 15;15(2):335-343. doi: 10.5664/jcsm.7640
265. Epstein L.J., Kristo D., Strollo P.J Jr., et al. Adult Obstructive Sleep Apnea Task Force of the American Academy of Sleep Medicine. Clinical guideline for the evaluation, management and long-term care of obstructive sleep apnea in adults. J Clin Sleep Med. 2009 Jun 15;5(3):263-76.
266. Grossman A., Messerli F.H., Grossman E. Drug induced hypertension—An unappreciated cause of secondary hypertension. Eur J Pharmacol. 2015 Sep 15;763(Pt A):15-22. doi: 10.1016/j.ejphar.2015.06.027
267. Lovell A.R., Ernst M.E. Drug-Induced Hypertension: Focus on Mechanisms and Management. Curr Hypertens Rep. 2017 May;19(5):39. doi: 10.1007/s11906-017-0736-z. PMID: 28451850.
268. Aronow W.S. Drug-induced causes of secondary hypertension. Ann Transl Med. 2017 Sep;5(17):349. doi: 10.21037/atm.2017.06.16
Дата публикации 30 октября 2017Обновлено 26 апреля 2021
Определение болезни. Причины заболевания
Основной критерий артериальной гипертонии (или артериальной гипертензии) как целой группы заболеваний — стабильное, то есть выявленное при неоднократных измерениях в разные дни, повышение артериального давления (АД). Вопрос о том, какое именно АД считать повышенным, не так прост, как может показаться. Дело в том, что среди практически здоровых людей диапазон значений АД достаточно широк. Результаты длительного наблюдения за людьми с разными уровнями АД показали, что уже начиная с уровня 115/75 мм рт. ст., каждое дополнительное увеличение АД на 10 мм рт. ст. сопровождается увеличением риска развития болезней сердечно-сосудистой системы ( прежде всего, ишемической болезни сердца и инсульта) [1]. Однако пользу от современных методов лечения артериальной гипертонии удалось доказать в основном лишь для тех пациентов, у которых АД превышало значение 140/90 мм рт. ст. Именно по этой причине договорились считать это пороговое значение критерием для выделения артериальной гипертонии.
Повышением артериального давления могут сопровождаться десятки различных хронических заболеваний, и гипертоническая болезнь — лишь одно из них, но самое частое: примерно 9 случаев из 10. Диагноз ГБ устанавливается в тех случаях, когда имеется стабильное повышение АД, но при этом никаких иных заболеваний, которые приводят к повышению АД, не обнаруживается.
Гипертоническая болезнь — это болезнь, для которой стабильное повышение АД служит основным ее проявлением. Факторы риска, увеличивающие вероятность ее развития, были установлены при наблюдениях за большими группами людей. Помимо имеющейся у некоторых людей генетической предрасположенности, среди таких факторов риска находятся:
- ожирение;
- малоподвижность;
- избыточное потребление поваренной соли, алкоголя;
- хронический стресс;
- курение.
В общем, все те особенности, которые сопутствуют современному городскому образу жизни в индустриально развитых странах [2]. Именно поэтому гипертоническая болезнь считается заболеванием, связанным с образом жизни, и его целенаправленные изменения к лучшему должны всегда рассматриваться в рамках программы лечения гипертонической болезни в каждом индивидуальном случае.
Какие же еще заболевания сопровождаются повышением артериального давления? Это многие заболевания почек (пиелонефрит, гломерулонефрит, поликистоз, диабетическая нефропатия, стеноз (сужение) почечных артерий и др.), ряд эндокринных болезней (опухоли надпочечников, гипертиреоз, болезнь и синдром Кушинга), синдром обструктивного апноэ во сне [3], некоторые другие, более редкие болезни [4]. Регулярный прием таких лекарств, как, например, глюкокортикостероиды, нестероидные противовоспалительные препараты, оральные контрацептивы тоже может приводить к стойкому повышению АД [5]. Перечисленные выше заболевания и состояния приводят к развитию так называемых вторичных, или симптоматических, артериальных гипертензий. Врач устанавливает диагноз гипертонической болезни, если в ходе беседы с пациентом, выяснения истории развития болезни, осмотра, а также по результатам некоторых, в основном, несложных лабораторных и инструментальных методов исследования, диагноз какой-либо из вторичных артериальных гипертензий представляется маловероятным.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы артериальной гипертензии
Повышенное артериальное давление само по себе у многих людей не проявляется какими-либо субъективными ощущениями. Если же повышенное АД сопровождается симптомами, это может быть ощущение тяжести в голове, головная боль, мелькание перед глазами, тошнота, головокружение, неустойчивость при ходьбе, а также ряд других симптомов, довольно неспецифичных для повышенного артериального давления. Перечисленные выше симптомы гораздо отчетливее проявляют себя при гипертоническом кризе — внезапном значительном подъеме АД, приводящем к явному ухудшению состояния и самочувствия.
Можно было бы и дальше перечислять через запятую возможные симптомы ГБ, но особой пользы в этом нет. Почему? Во-первых, все эти симптомы неспецифичны для гипертонической болезни (т.е. могут встречаться как по отдельности, так и в различных сочетаниях и при других болезнях), а во-вторых, для констатации наличия артериальной гипертонии важен сам факт стабильного повышения артериального давления. А выявляется это не оценкой субъективных симптомов, а только при измерениях АД, причем неоднократных. Имеется в виду, во-первых, что «за один присест» следует измерять АД дважды или трижды (с небольшим перерывом между измерениями) и принимать за истинное АД среднее арифметическое из двух или трех измеренных значений. Во-вторых, стабильность повышения АД (критерий диагностики гипертонической болезни как хронического заболевания) следует подтвердить при измерениях в разные дни, желательно с интервалом не менее недели.
В случае развития гипертонического криза симптомы будут обязательно, иначе это не гипертонический криз, а просто бессимптомное повышение АД. И симптомы эти могут быть как те, что перечислены выше, так и другие, более серьезные — о них говорится в разделе «Осложнения».
Симптоматические (вторичные) артериальные гипертензии развиваются в рамках других болезней, и поэтому их проявления, помимо собственно симптомов повышенного АД (если таковые имеются), зависят от основного заболевания. Например, при гиперальдостеронизме это может быть мышечная слабость, судороги и даже преходящие (длятся часы — сутки) параличи в мышцах ног, рук, шеи. При синдроме обструктивного апноэ сна — храп, остановки дыхания во сне, дневная сонливость.
Если гипертоническая болезнь с течением времени — обычно многих лет — приводит к поражению различных органов (их в данном контексте называют «органы-мишени»), то это может проявиться снижением памяти и интеллекта, инсультом либо преходящим нарушением мозгового кровообращения, увеличением толщины стенок сердца, ускоренным развитием атеросклеротических бляшек в сосудах сердца и других органов, инфарктом миокарда или стенокардией, снижением скорости фильтрации крови в почках и т. д. Соответственно, клинические проявления будут обусловлены уже этими осложнениями, а не повышением АД как таковым.
Патогенез артериальной гипертензии
При гипертонической болезни нарушение регуляции сосудистого тонуса и повышенное артериального давления являются основным содержанием этой болезни, так сказать, ее «квитэссенцией». Такие факторы, как генетическая предрасположенность, ожирение, малоподвижность, избыточное потребление поваренной соли, алкоголя, хронический стресс, курение и ряд других, в основном, связанных с особенностями образа жизни, приводят с течением времени к нарушению функционирования эндотелия — внутреннего слоя артериальных сосудов толщиной в один клеточный слой, который активно участвует в регуляции тонуса, а значит, и просвета сосудов. Тонус сосудов микроциркуляторного русла, а значит и объем местного кровотока в органах и тканях, автономно регулируются эндотелием, а не непосредственно центральной нервной системой [6]. Это система местной регуляции АД. Однако имеются и другие уровни регуляции АД — центральная нервная система, эндокринная система и почки (которые реализуют свою регуляторную роль тоже во многом благодаря способности участвовать в гормональной регуляции на уровне целостного организма). Нарушения в этих сложных регуляторных механизмах приводят, в целом, к снижению способности всей системы тонко подстраиваться под постоянно изменяющиеся потребности органов и тканей в кровоснабжении.
Со временем развивается стойкий спазм мелких артерий, а в дальнейшем их стенки изменяются настолько, что уже неспособны вернуться в исходное состояние. В более крупных сосудах из-за постоянно повышенного артериального давления ускоренными темпами развивается атеросклероз. Стенки сердца становятся толще, развивается гипертрофия миокарда, а затем и расширение полостей левого предсердия и левого желудочка [7]. Повышенное давление повреждает почечные клубочки, их количество уменьшается и, как следствие, снижается способность почек к фильтрации крови. В мозге из-за изменения кровоснабжающих его сосудов также происходят негативные изменения — появляются мелкие очаги кровоизлияний, а также мелкие участки некроза (гибели) клеток мозга [8]. При разрыве атеросклеротической бляшки в сосуде достаточно крупного размера происходит тромбоз, просвет сосуда перекрывается, это приводит к инсульту.
Классификация и стадии развития артериальной гипертензии
Гипертоническая болезнь в зависимости от величины повышенного АД разделяют на три степени [9]. Кроме того, с учетом повышения риска сердечно-сосудистых заболеваний в масштабе «годы-десятилетия» уже начиная с уровня АД выше 115/75 мм рт. ст., выделяют еще несколько градаций уровня артериального давления.
Если значения систолического и диастолического АД попадают в разные категории, то степень артериальной гипертонии оценивается по наивысшему из двух значений, причем неважно — систолическому или диастолическому. Степень повышения АД при диагностике гипертонической болезни устанавливают при неоднократных измерениях в разные дни.
В нашей стране продолжают выделять стадии гипертонической болезни [10], в то время как в Европейских рекомендациях по диагностике и лечению артериальной гипертонии какие-либо стадии не упоминаются. Выделение стадий призвано отразить этапность течения гипертонической болезни от ее начала до появления осложнений.
Этих стадий три:
- I стадия подразумевает, что пока еще нет явного поражения тех органов, которые наиболее часто поражаются при этой болезни: отсутствует увеличение (гипертрофия) левого желудочка сердца, нет значительного снижения скорости фильтрации в почках, которая определяется с учетом уровня креатинина в крови, в моче не выявляется белок альбумин, не обнаруживается утолщение стенок сонных артерий или атеросклеротические бляшки в них, и т. д. Такое поражение внутренних органов обычно протекает бессимптомно.
- Если есть хотя бы один из перечисленных признаков, диагностируют II стадию гипертонической болезни.
- Наконец, о III стадии гипертонической болезни говорят тогда, когда имеется хотя бы одно сердечно-сосудистое заболевание с клиническими проявлениями, связанное с атеросклерозом (инфаркт миокарда, инсульт, стенокардия напряжения, атеросклеротическое поражение артерий нижних конечностей), или, например, серьезное поражение почек, проявляющееся выраженным снижением фильтрации и/или значительной потерей белка с мочой.
Не всегда эти стадии закономерно сменяют одна другую: например, человек перенес инфаркт миокарда, а через несколько лет присоединилось повышение АД — получается, у такого больного гипертоническая болезнь сразу III стадии. Смысл выделения стадий в основном состоит в том, чтобы ранжировать больных по степени риска сердечно-сосудистых осложнений. От этого зависят и лечебные мероприятия: чем выше риск, тем интенсивнее проводимое лечение. Риск при формулировке диагноза оценивают четырьмя градациями. При этом 4-ая градация соответствует наибольшему риску.
Осложнения артериальной гипертензии
Цель лечения гипертонической болезни — не «сбивание» повышенного артериального давления, а максимальное снижение риска сердечно-сосудистых и других осложнений в долговременном аспекте, поскольку этот риск — опять-таки, при оценке в масштабе «годы-десятилетия» — увеличивается на каждые дополнительные 10 мм рт. ст. уже от уровня АД 115/75 мм рт. ст. Имеются в виду такие осложнения, как инсульт, ишемическая болезнь сердца, сосудистая деменция (слабоумие), хроническая почечная и хроническая сердечная недостаточность, атеросклеротическое поражение сосудов нижних конечностей.
Большинство больных гипертонической болезнью до поры до времени ничего не беспокоит, поэтому у них нет особой мотивации лечиться, регулярно принимая определенный минимум лекарственных препаратов и изменив образ жизни на более здоровый. Однако в лечении гипертонической болезни не существует каких-то одноразовых мероприятий, которые бы позволили навсегда забыть об этой болезни, ничего более не делая для ее лечения.
Диагностика артериальной гипертензии
С диагностикой артериальной гипертонии как таковой все обычно обстоит довольно просто: для этого требуется лишь неоднократно зарегистрированное АД на уровне 140/90 мм рт. ст. и выше. Но гипертоническая болезнь и артериальная гипертония — не одно и то же: как уже говорилось, повышением АД может проявляться целый ряд заболеваний, и гипертоническая болезнь — только одно из них, хотя и самое частое. Врач, проводя диагностику, с одной стороны, должен убедиться в стабильности повышения АД, а с другой — оценить вероятность того, не является ли повышение АД проявлением симптоматической (вторичной) артериальной гипертонии.
Для этого на первом этапе диагностического поиска врач выясняет, в каком возрасте впервые начало повышаться АД, нет ли таких симптомов, как, например, храп с остановками дыхания во сне, приступы мышечной слабости, необычные примеси в моче, приступы внезапного сердцебиения с потливостью и головной болью и т.д. Имеет смысл уточнить, какие лекарственные препараты и биодобавки принимает пациент, т.к. в некоторых случаях именно они могут привести к повышению АД или усугублению уже повышенного. Несколько рутинных (выполняемых практически всем пациентам с повышенным АД) диагностических тестов, наряду со сведениями, полученными в ходе беседы с врачом, помогают оценить вероятность некоторых форм вторичной гипертонии: общий анализ мочи, определение в крови концентрации креатинина и глюкозы, а иногда — калия и других электролитов. В целом же, с учетом невысокой распространенности вторичных форм артериальной гипертонии (около 10% от всех ее случаев) для дальнейшего поиска этих заболеваний как возможной причины повышенного АД надо иметь веские основания. Поэтому, если на первом этапе диагностического поиска не обнаруживается существенных данных в пользу вторичного характера артериальной гипертонии, то в дальнейшем считается, что АД повышено за счет гипертонической болезни. Это суждение может быть иногда впоследствии пересмотрено по мере появления новых данных о пациенте.
Помимо поиска данных за возможный вторичный характер повышения АД, врач устанавливает наличие факторов риска сердечно-сосудистых заболеваний (это нужно для оценки прогноза и более целенаправленного поиска поражения внутренних органов), а также, возможно, уже существующих болезней сердечно-сосудистой системы или их бессимптомного поражения — это влияет на оценку прогноза и стадии гипертонической болезни, выбор лечебных мероприятий. С этой целью, помимо беседы с пациентом и его осмотра, выполняется ряд диагностических исследований (например, электрокардиография, эхокардиография, ультразвуковое исследование сосудов шеи, при необходимости — некоторые другие исследования, характер которых определяется уже полученными о пациенте медицинскими данными).
Суточное мониторирование АД с помощью специальных компактных приборов позволяет оценить изменения АД в ходе привычного для пациента образа жизни. Данное исследование необходимо не во всех случаях — в основном, если измеренное на приеме у врача АД значительно отличается от измеренного дома, при необходимости оценить ночное АД, при подозрении на эпизоды гипотонии, иногда — для оценки эффективности проводимого лечения.
Таким образом, одни диагностические методы при обследовании пациента с повышенным АД применяются во всех случаях, к применению других методов подходят более избирательно, в зависимости от уже полученных о пациенте данных, для проверки предположений, возникших у врача в ходе предварительного обследования.
Лечение артериальной гипертензии
В отношении немедикаментозных мер, направленных на лечение гипертонической болезни, больше всего убедительных доказательств накоплено о положительной роли снижения потребления поваренной соли, уменьшения и удержания на этом уровне массы тела, регулярных физических тренировках (нагрузках), не более чем умеренном употреблении алкоголя, а также об увеличении содержания в рационе овощей и фруктов. Только все эти меры эффективны как часть долговременных изменений того нездорового образа жизни, который и привел к развитию гипертонической болезни. Так, например, снижение массы тела на 5 кг приводило к снижению АД в среднем на 4,4/3,6 мм рт. ст. [9] — вроде бы, немного, но в сочетании с другими вышеперечисленными мерами по оздоровлению образа жизни эффект может оказаться весьма значительным.
Оздоровление образа жизни обосновано практически для всех больных гипертонической болезнью, а вот медикаментозное лечение показано хотя и не всегда, но в большинстве случаев. Если больным с повышением АД 2 и 3 степеней, а также при гипертонической болезни любой степени с высоким рассчитанным сердечно-сосудистым риском медикаментозное лечение назначают обязательно (его долговременная польза продемонстрирована во многих клинических исследованиях), то при гипертонической болезни 1 степени с низким и средним рассчитанным сердечно-сосудистым риском польза такого лечения не была убедительно доказана в серьезных клинических испытаниях. В таких ситуациях возможную пользу от назначения медикаментозной терапии оценивают индивидуально, учитывая предпочтения пациента. Если, несмотря на оздоровление образа жизни, повышение АД у таких пациентов сохраняется на протяжении ряда месяцев при повторных визитах к врачу, необходимо вновь переоценить необходимость применения лекарств. Тем более, что величина расчетного риска часто зависит от полноты обследования пациента и может оказаться значительно выше, чем это представлялось вначале. Почти во всех случаях лечения гипертонической болезни стремятся добиться стабилизации АД ниже 140/90 мм рт. ст. Это не означает, что оно в 100% измерений будет находиться ниже этих значений, но чем реже АД при измерении в стандартных условиях (описанных в разделе «Диагностика») будет превышать этот порог, тем лучше. Благодаря такому лечению значительно уменьшается риск сердечно-сосудистых осложнений, а гипертонические кризы если и случаются, то гораздо реже, чем без лечения. Благодаря современным лекарственным препаратам те негативные процессы, которые при гипертонической болезни неизбежно и подспудно разрушают со временем внутренние органы (прежде всего, сердце, мозг и почки), эти процессы замедляются или приостанавливаются, а в ряде случаев их можно даже обернуть вспять.
Из лекарственных препаратов для лечения гипертонической болезни основными являются 5 классов лекарств [9]:
- мочегонные (диуретики);
- антагонисты кальция;
- ингибиторы ангиотензинпревращающего фермента (названия оканчиваются на -прил);
- антагонисты рецепторов ангиотензина II (названия оканчиваются на -сартан);
- бета-адреноблокаторы.
В последнее время особенно подчеркивается роль в лечении гипертонической болезни первых четыре классов лекарств. Бета-адреноблокаторы тоже используются, но в основном тогда, когда их применения требуют сопутствующие заболевания — в этих случаях бета-блокаторы выполняют двойное предназначение.
В наши дни предпочтение отдается комбинациям лекарственных препаратов, так как лечение каким-то одним из них редко приводит к достижению нужного уровня АД. Существуют также фиксированные комбинации лекарственных препаратов, которые делают лечение более удобным, так как пациент принимает лишь одну таблетку вместо двух или даже трех. Подбор нужных классов лекарственных препаратов для конкретного пациента, а также их доз и частоты приема проводится врачом с учетом таких данных о пациенте, как уровень АД, сопутствующие заболевания и др.
Благодаря многогранному положительному действию современных лекарств лечение гипертонической болезни подразумевает не только снижение АД как такового, но и защиту внутренних органов от негативного воздействия тех процессов, которые сопутствуют повышенному АД. Кроме того, поскольку главная цель лечения — максимально снизить риск ее осложнений и увеличить продолжительность жизни, то может потребоваться коррекция уровня холестерина в крови, прием средств, снижающих риск тромбообразования (которое приводит к инфаркту миокарда или инсульту), и т. д. Отказ от курения, как бы банально это ни звучало, позволяет многократно снизить имеющиеся при гипертонической болезни риски инсульта и инфаркта миокарда, затормозить рост атеросклеротических бляшек в сосудах. Таким образом, лечение гипертонической болезни подразумевает воздействие на болезнь по многим направлениям, и достижение нормального артериального давления — лишь одно из них.
Прогноз. Профилактика
Суммарный прогноз определяется не только и не столько фактом повышенного артериального давления, сколько количеством факторов риска сердечно-сосудистых заболеваний, степенью их выраженности и длительностью негативного воздействия.
Такими факторами риска являются:
- курение;
- повышенный уровень холестерина в крови;
- высокое АД;
- ожирение;
- малоподвижный образ жизни;
- возраст (с каждым прожитым после 40 лет десятилетием риск возрастает);
- мужской пол и другие.
При этом важны не только интенсивность воздействия факторов риска (например, курение 20 сигарет в день, несомненно, хуже, чем 5 сигарет, хотя и то, и другое связано с ухудшением прогноза), но и длительность их воздействия. Для людей, которые еще не имеют явных сердечно-сосудистых заболеваний, кроме гипертонической болезни, оценить прогноз можно с помощью специальных электронных калькуляторов, один из которых учитывает пол, возраст, уровень холестерина в крови, АД и курение. Электронный калькулятор SCORE пригоден для оценки риска смерти от сердечно-сосудистых заболеваний в ближайшие 10 лет от момента оценки риска. При этом получаемый в большинстве случаев невысокий в абсолютных числах риск может производить обманчивое впечатление, т.к. калькулятор позволяет рассчитать именно риск сердечно-сосудистой смерти. Риск же нефатальных осложнений (инфаркт миокарда, инсульт, стенокардия напряжения, и др.) в разы выше. Наличие сахарного диабета увеличивает риск по сравнению с рассчитанным с помощью калькулятора: для мужчин в 3 раза, а для женщин — даже в 5 раз.
В отношении профилактики гипертонической болезни можно сказать, что, поскольку известны факторы риска ее развития (малоподвижность, лишний вес, хронический стресс, регулярное недосыпание, злоупотребление алкоголем, повышенное потребление поваренной соли и другие), то все изменения образа жизни, уменьшающие воздействие этих факторов, снижают и риск развития гипертонической болезни. Однако снизить этот риск совсем до нуля вряд ли возможно — есть факторы, которые от нас не зависят совсем или зависят мало: генетические особенности, пол, возраст, социальное окружение, некоторые другие. Проблема состоит в том, что о профилактике гипертонической болезни люди начинают задумываться в основном тогда, когда они уже нездоровы, а АД уже в той или иной степени повышено. А это уже вопрос не столько профилактики, сколько лечения.