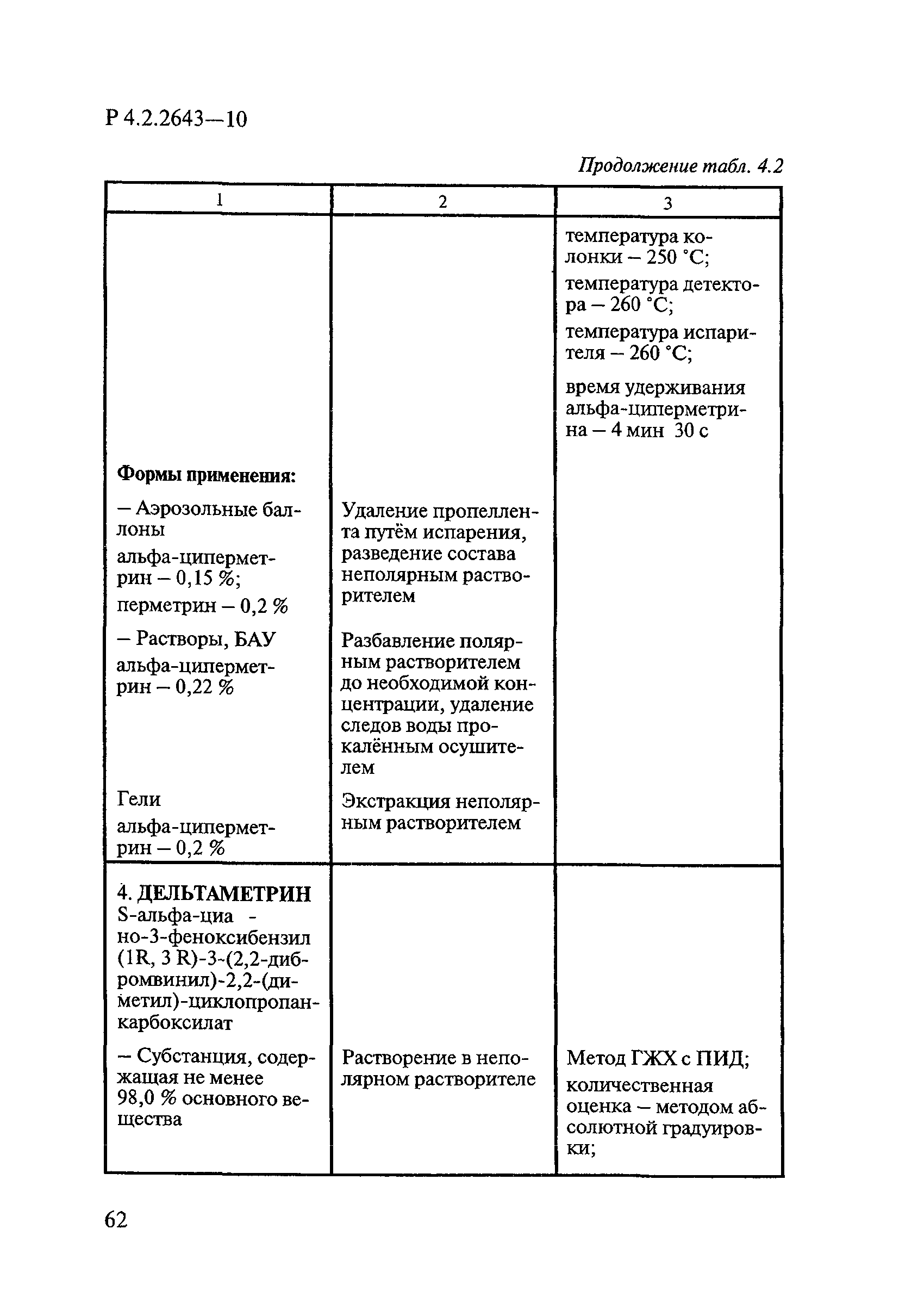
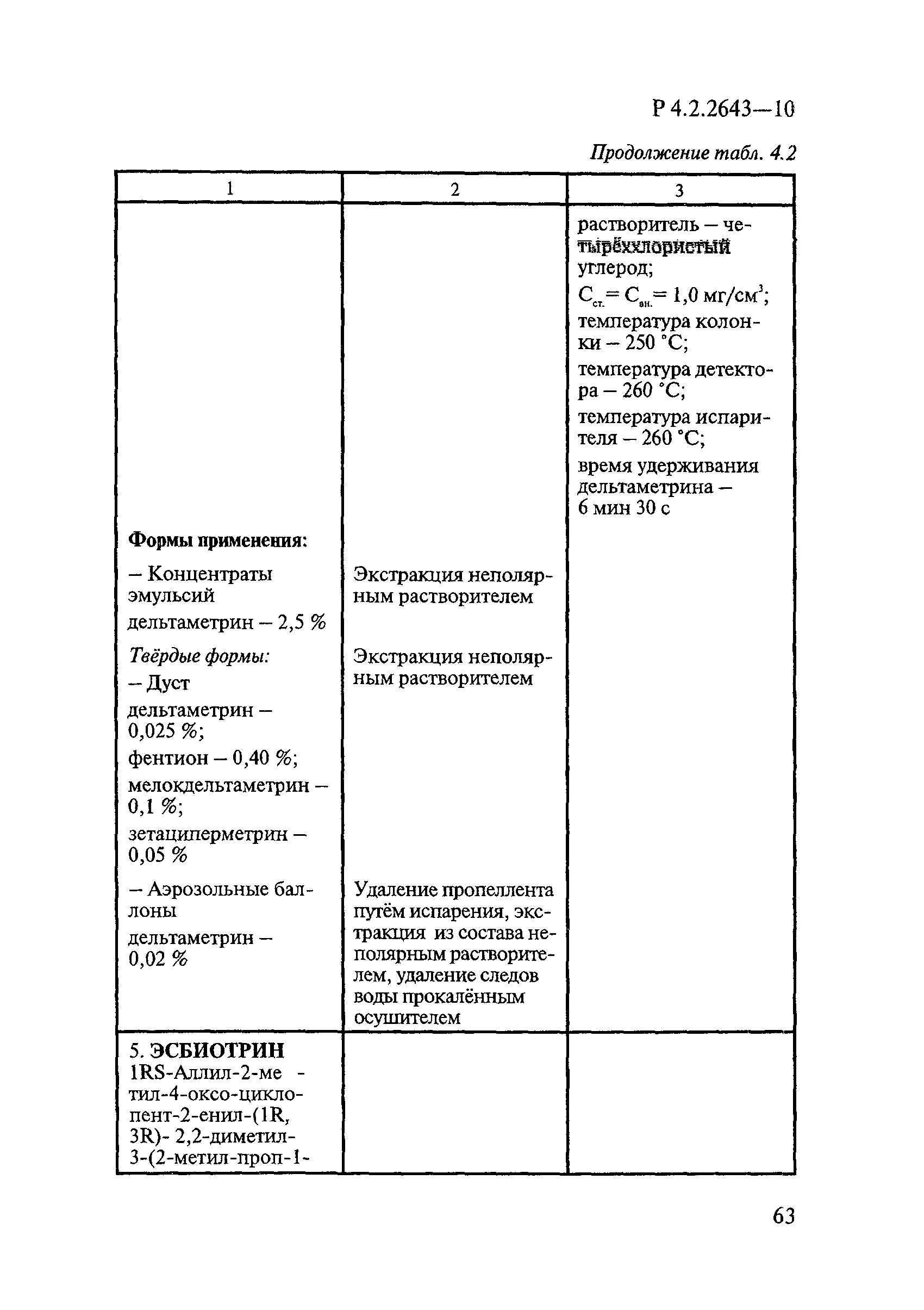
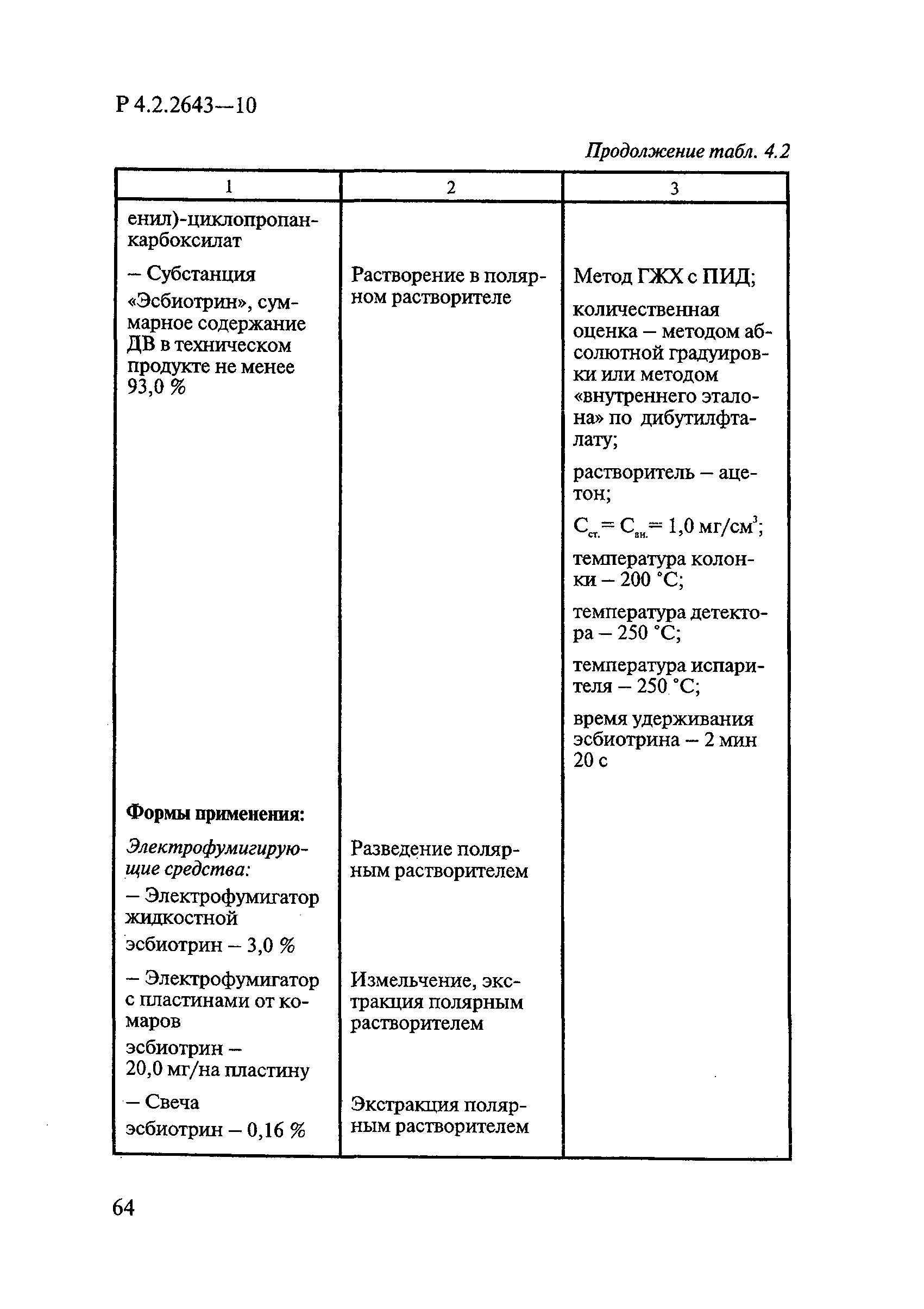
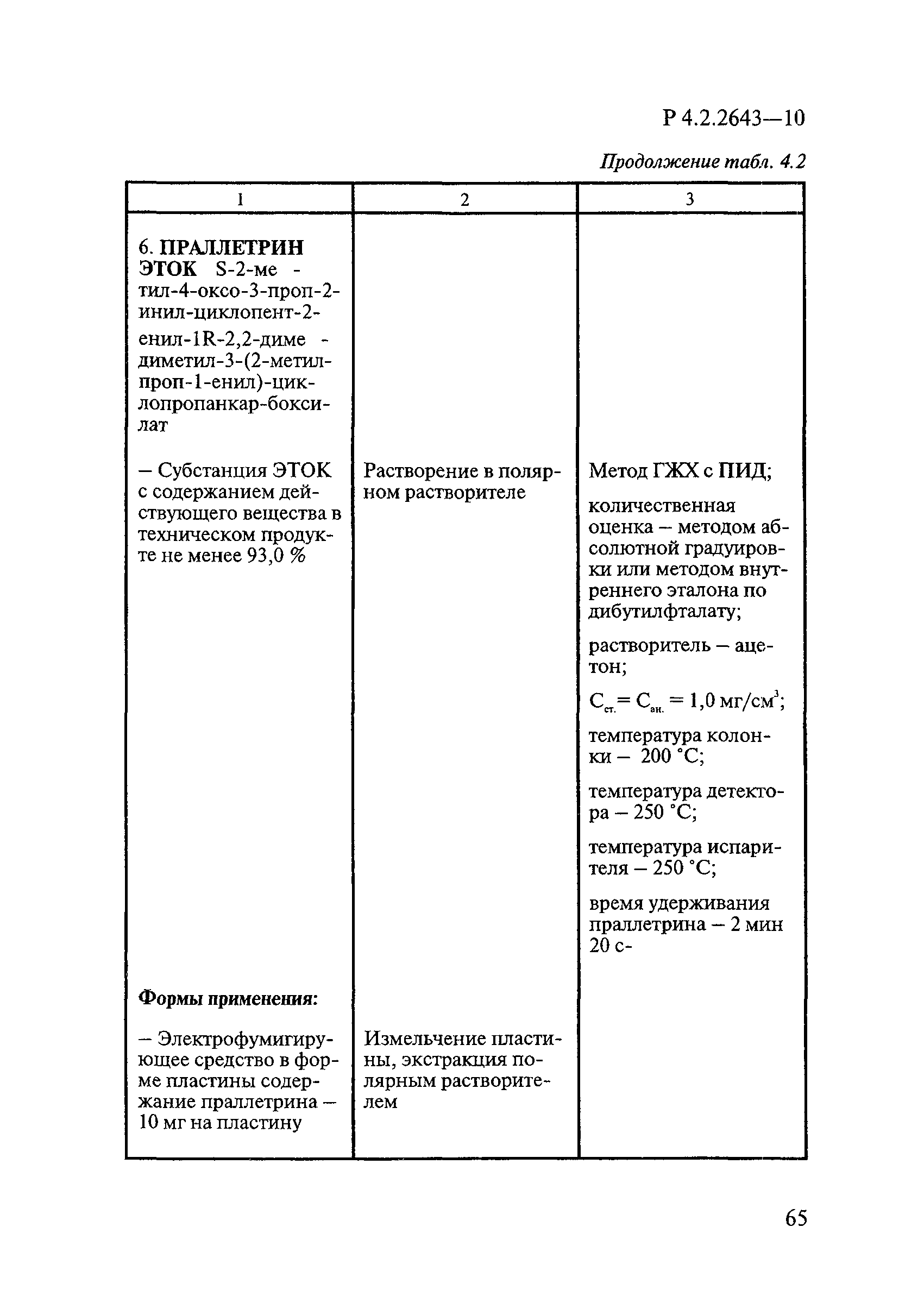
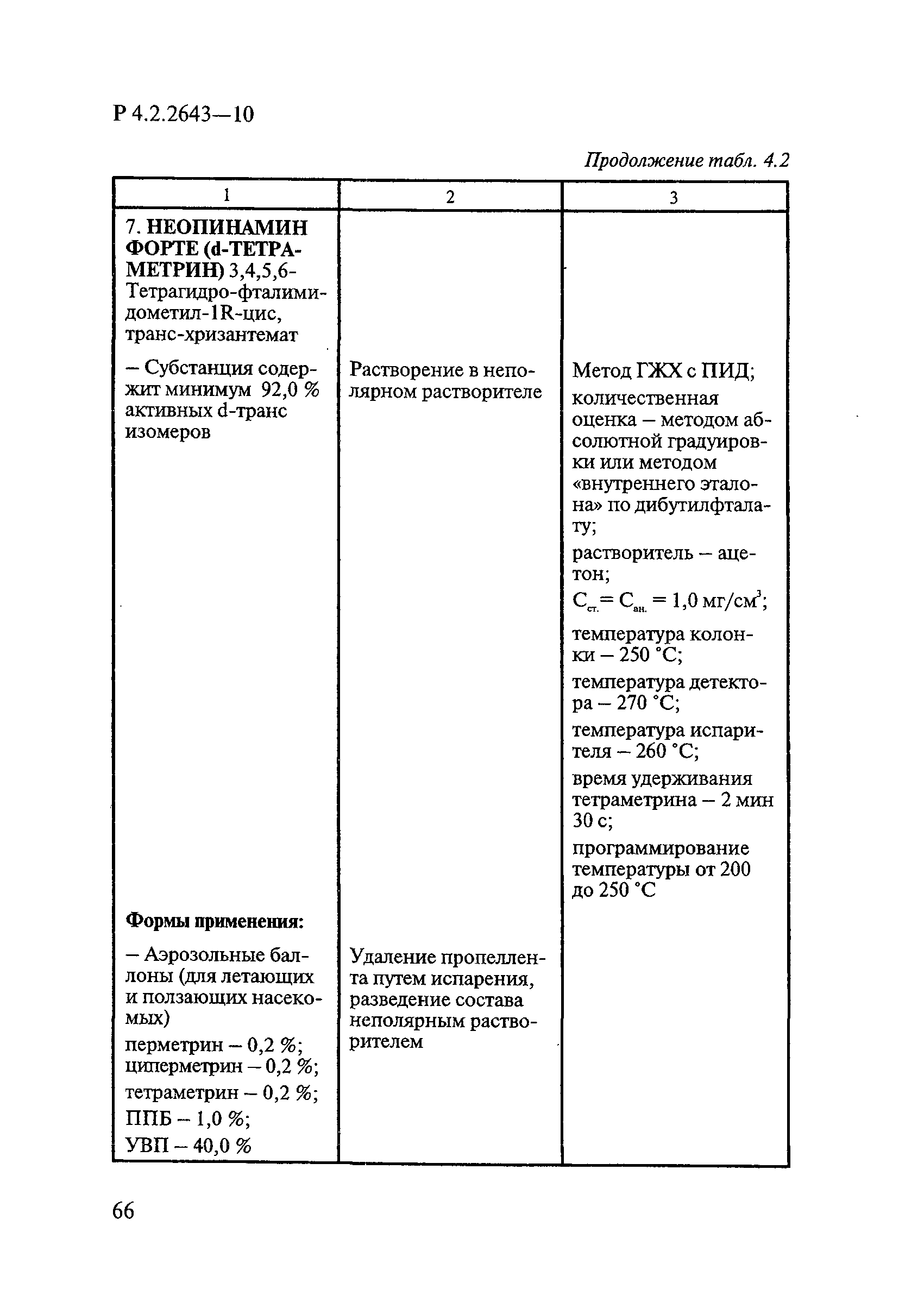
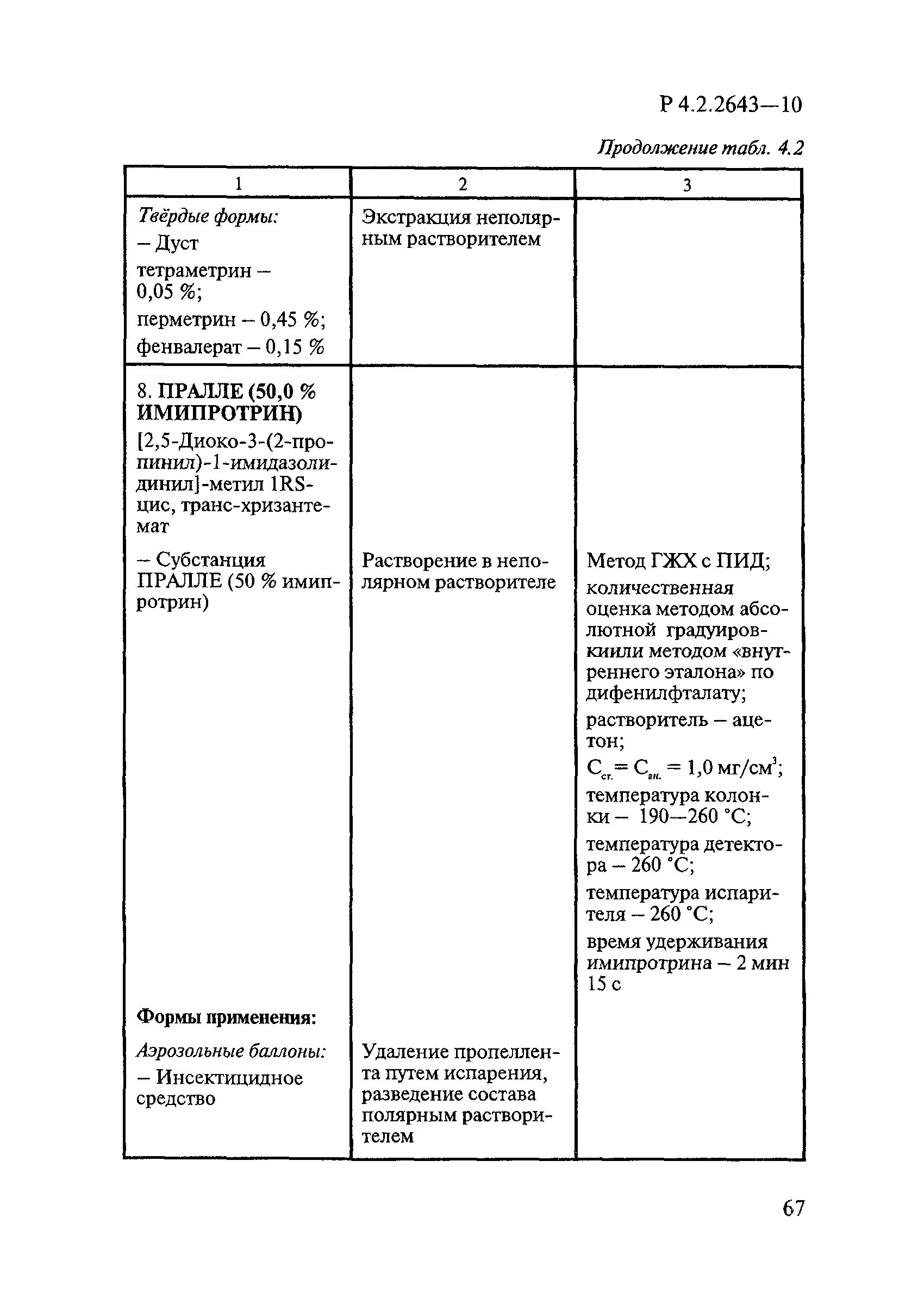
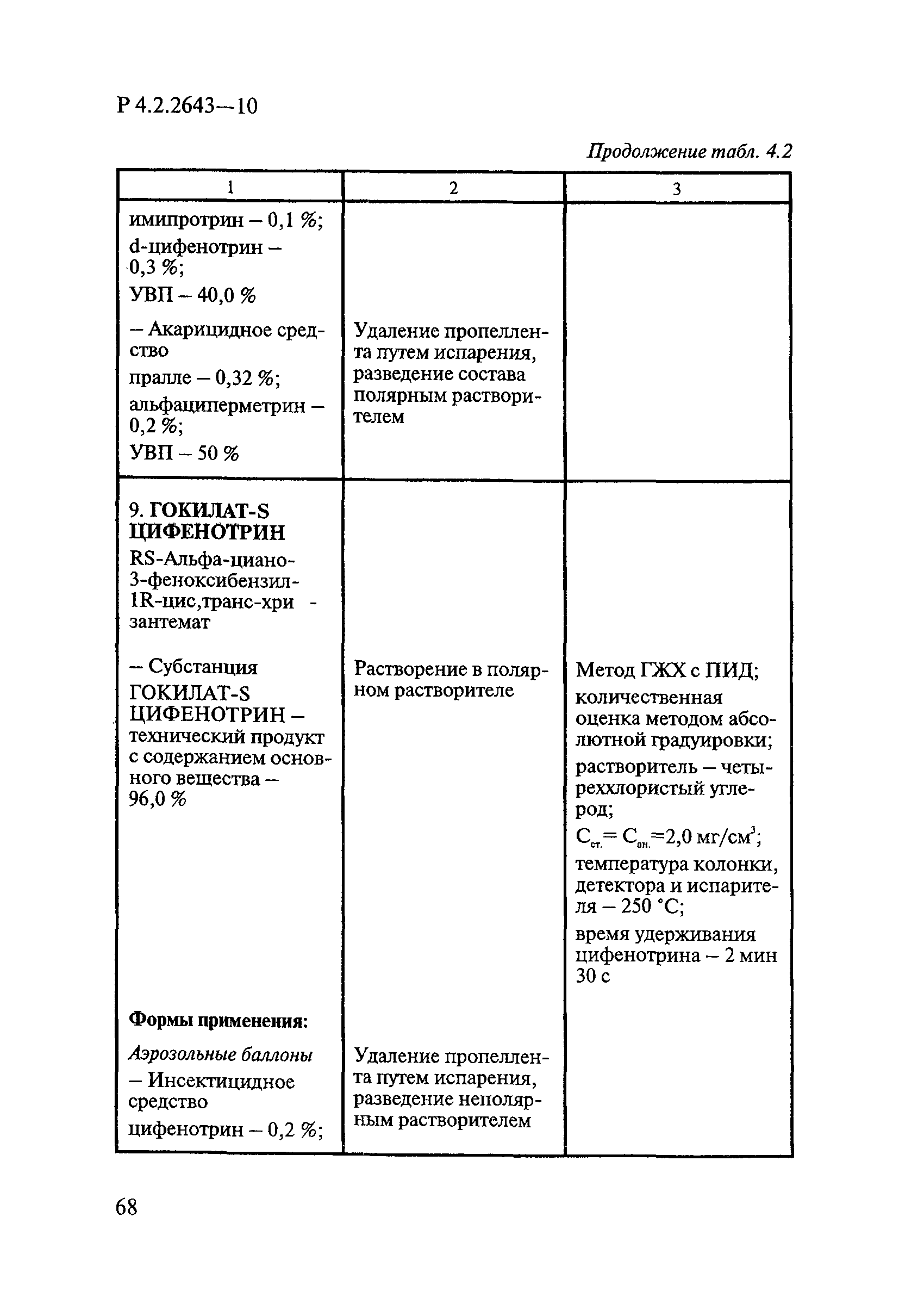
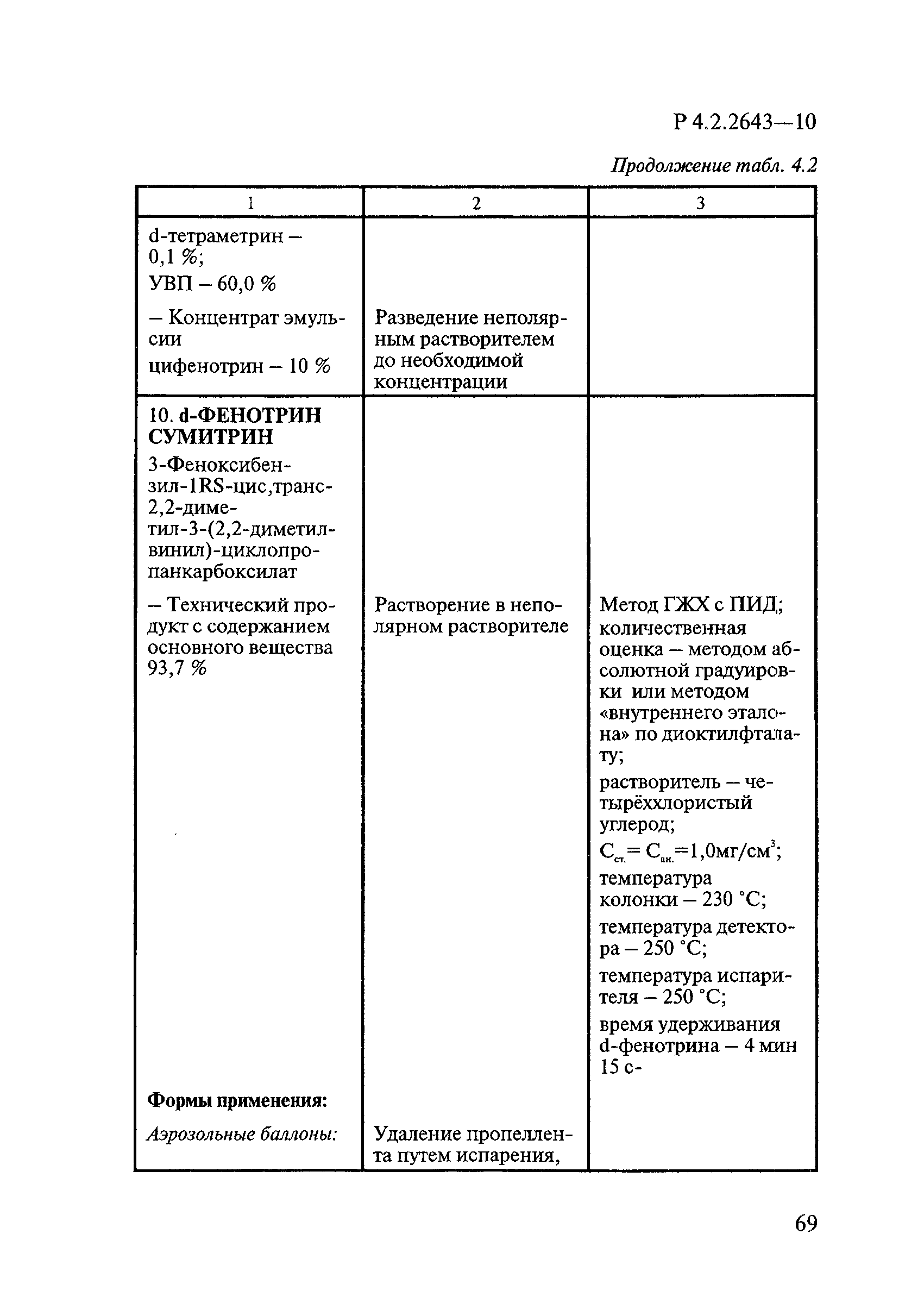
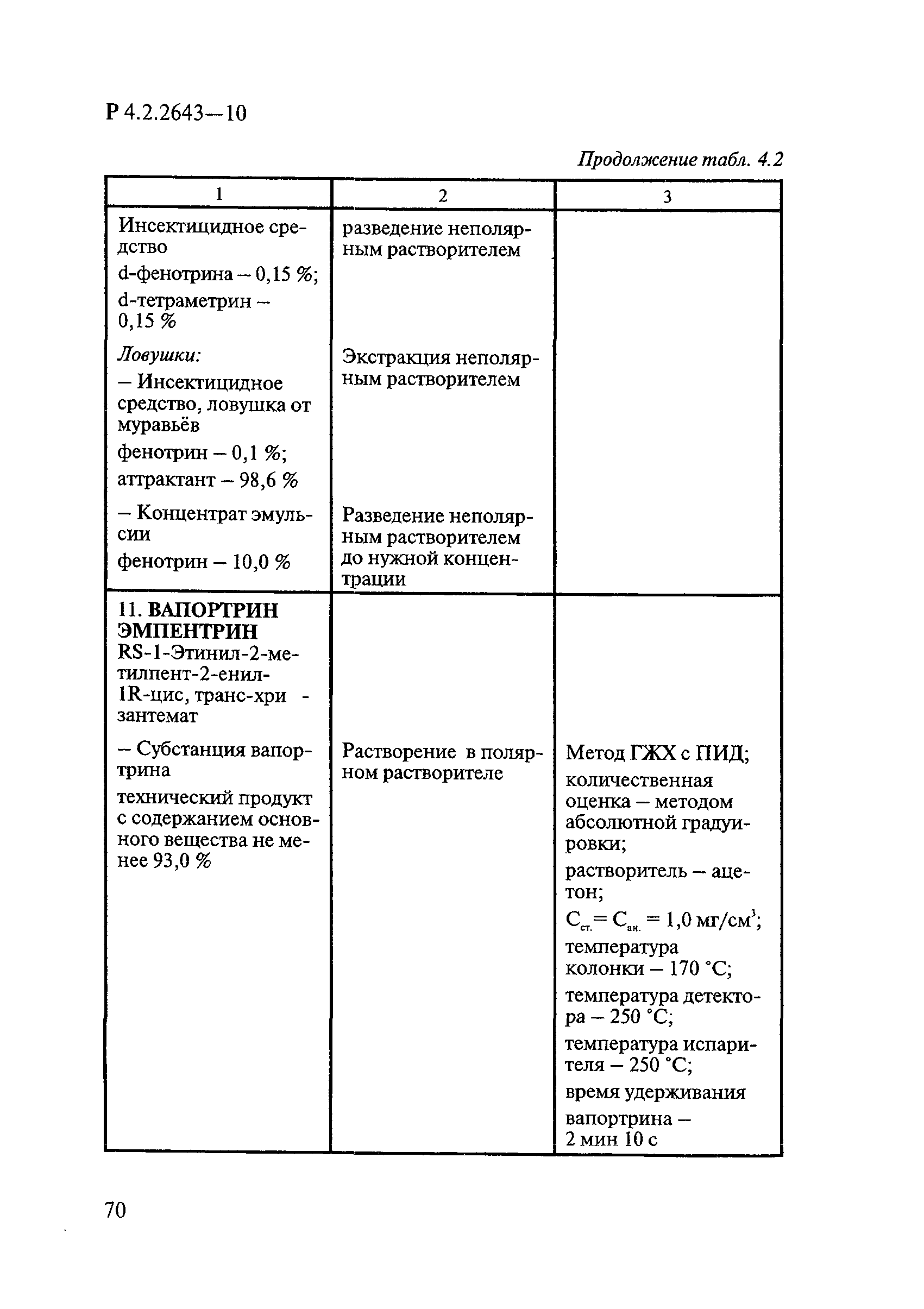
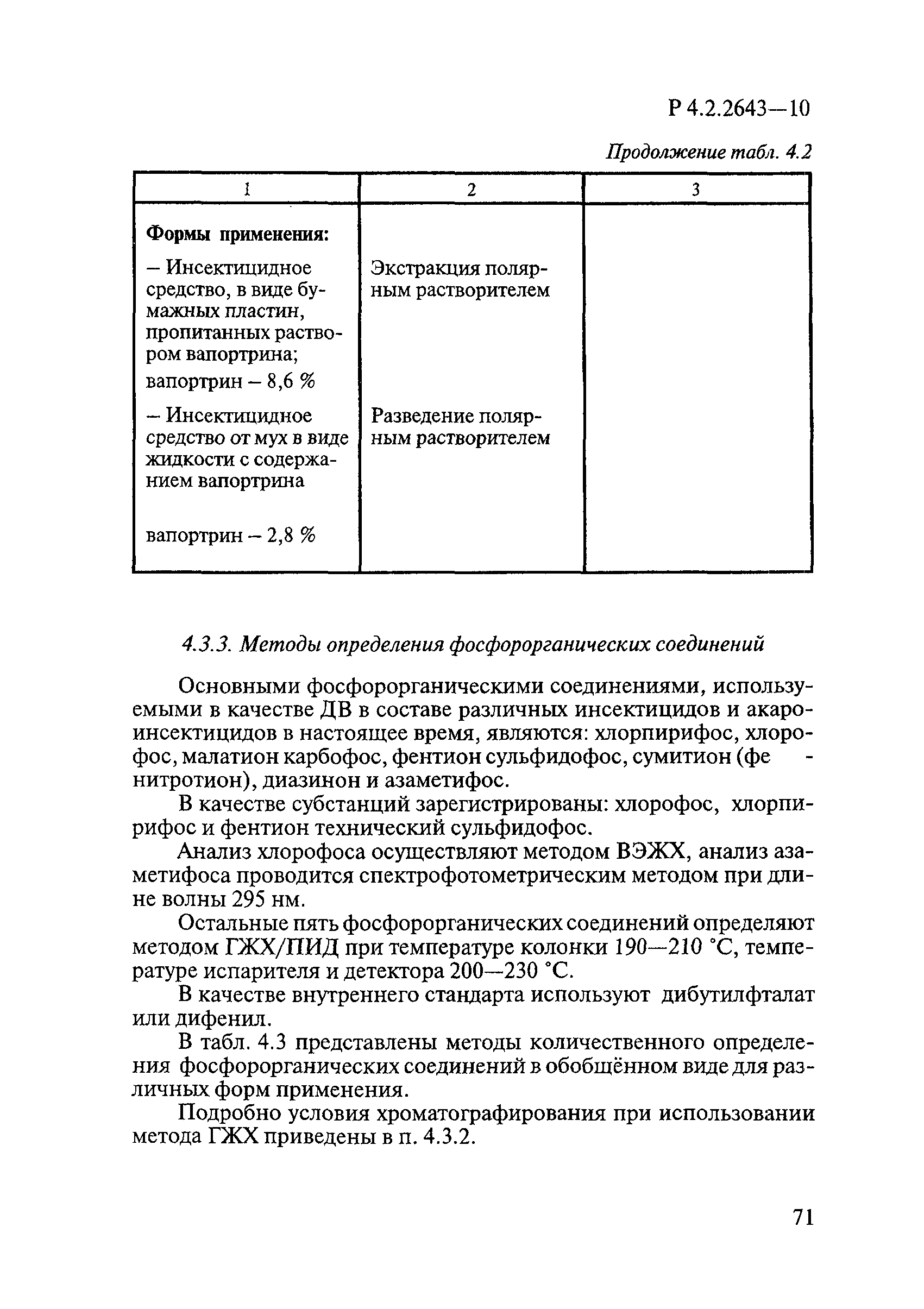
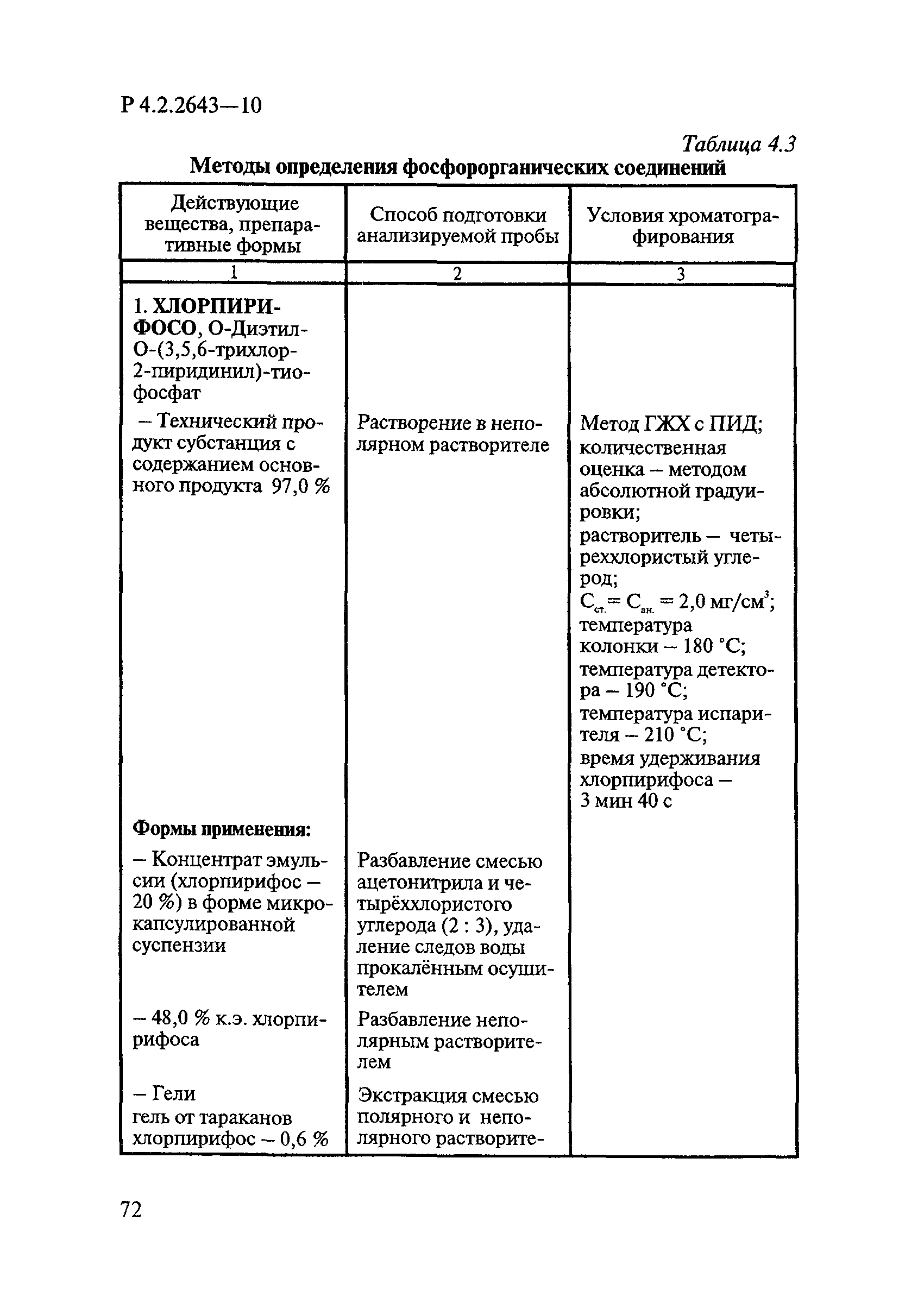
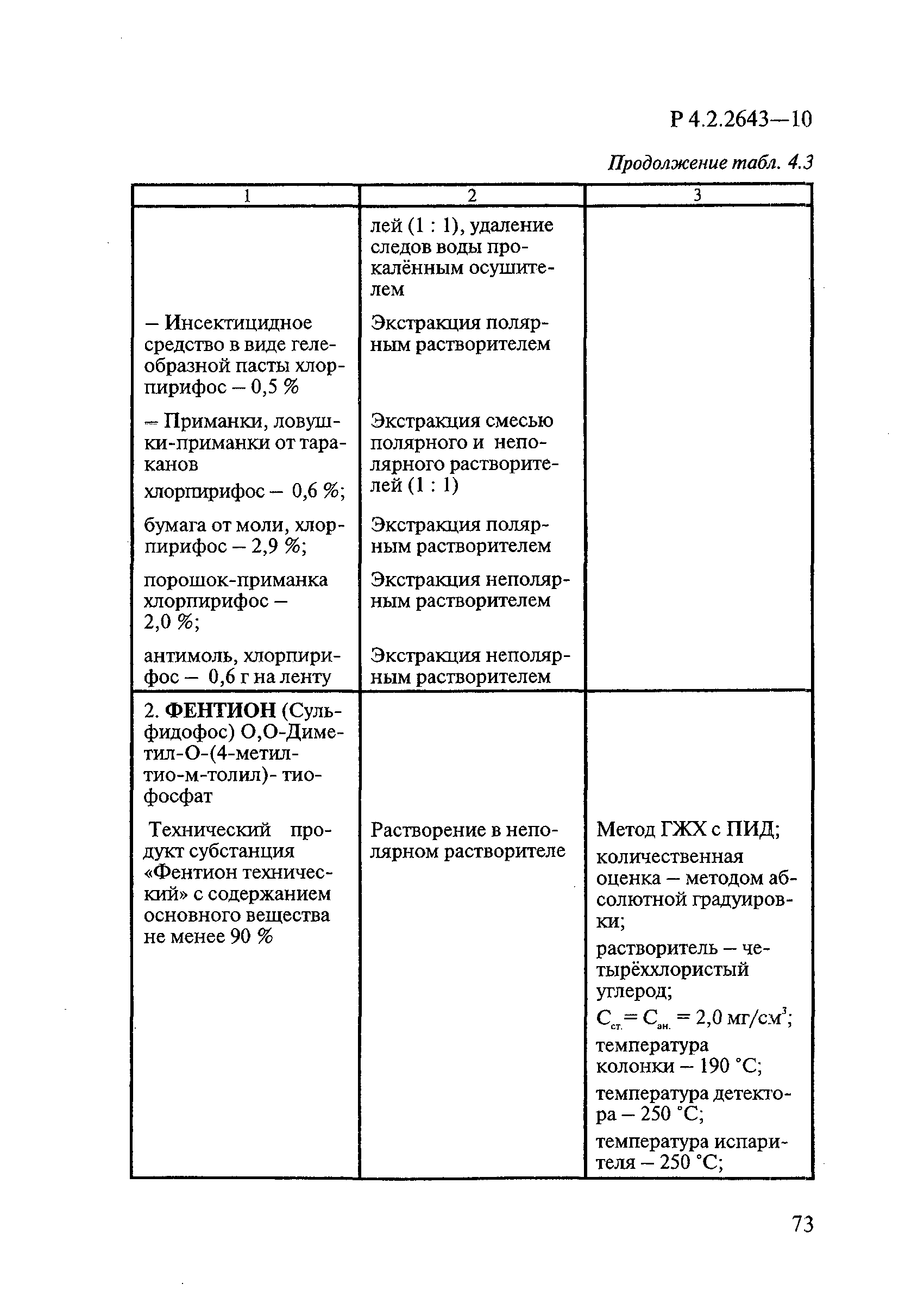
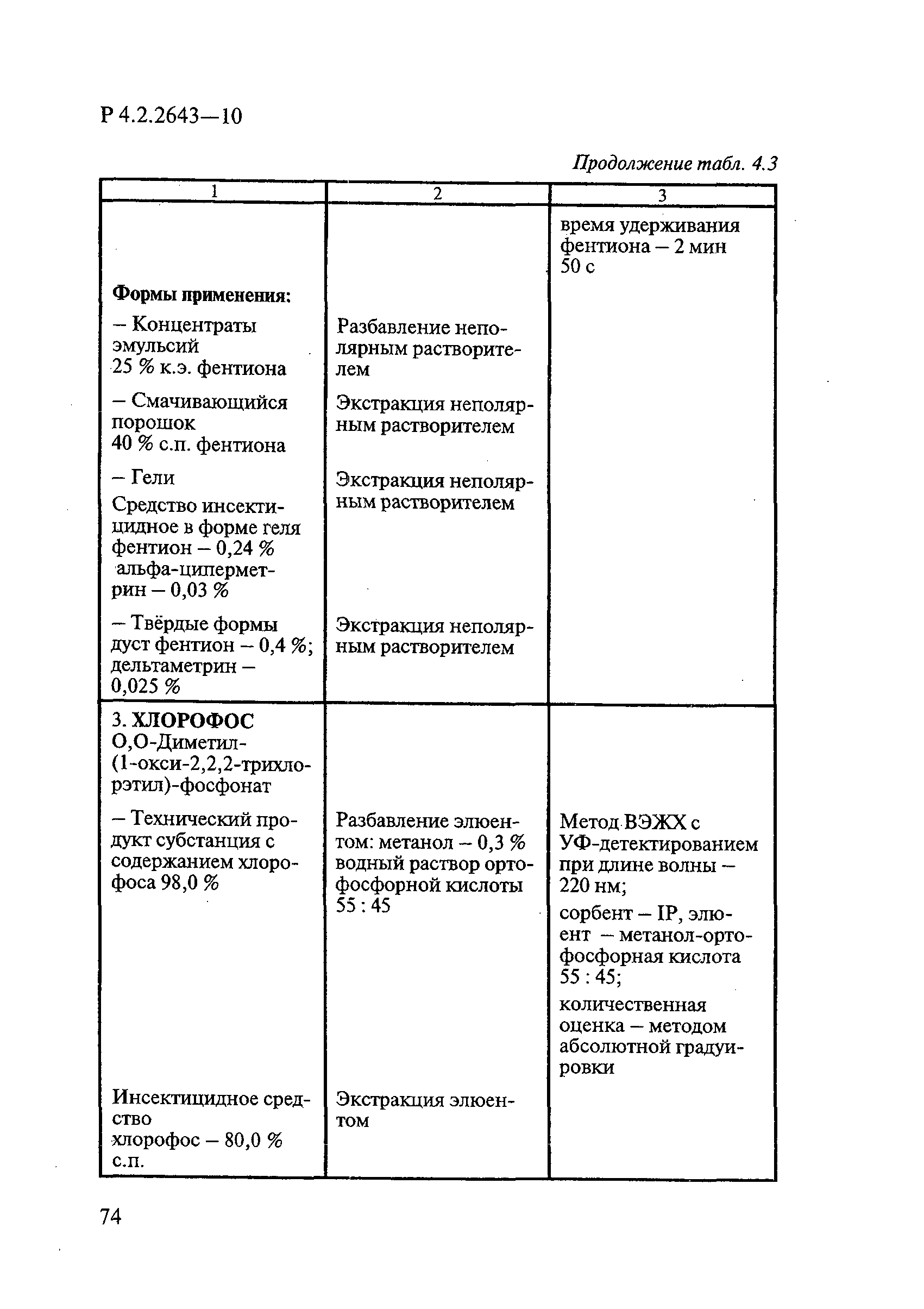
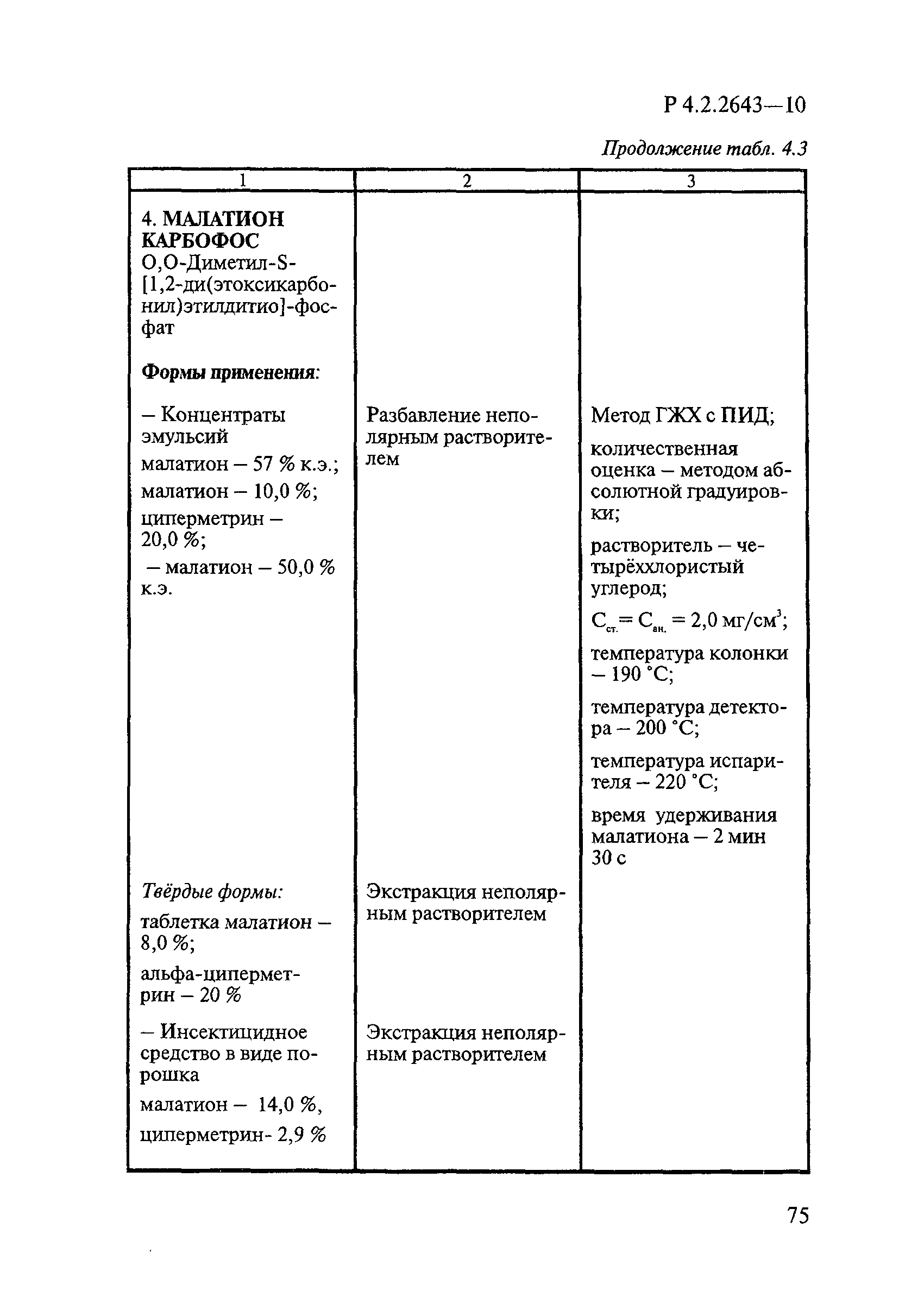
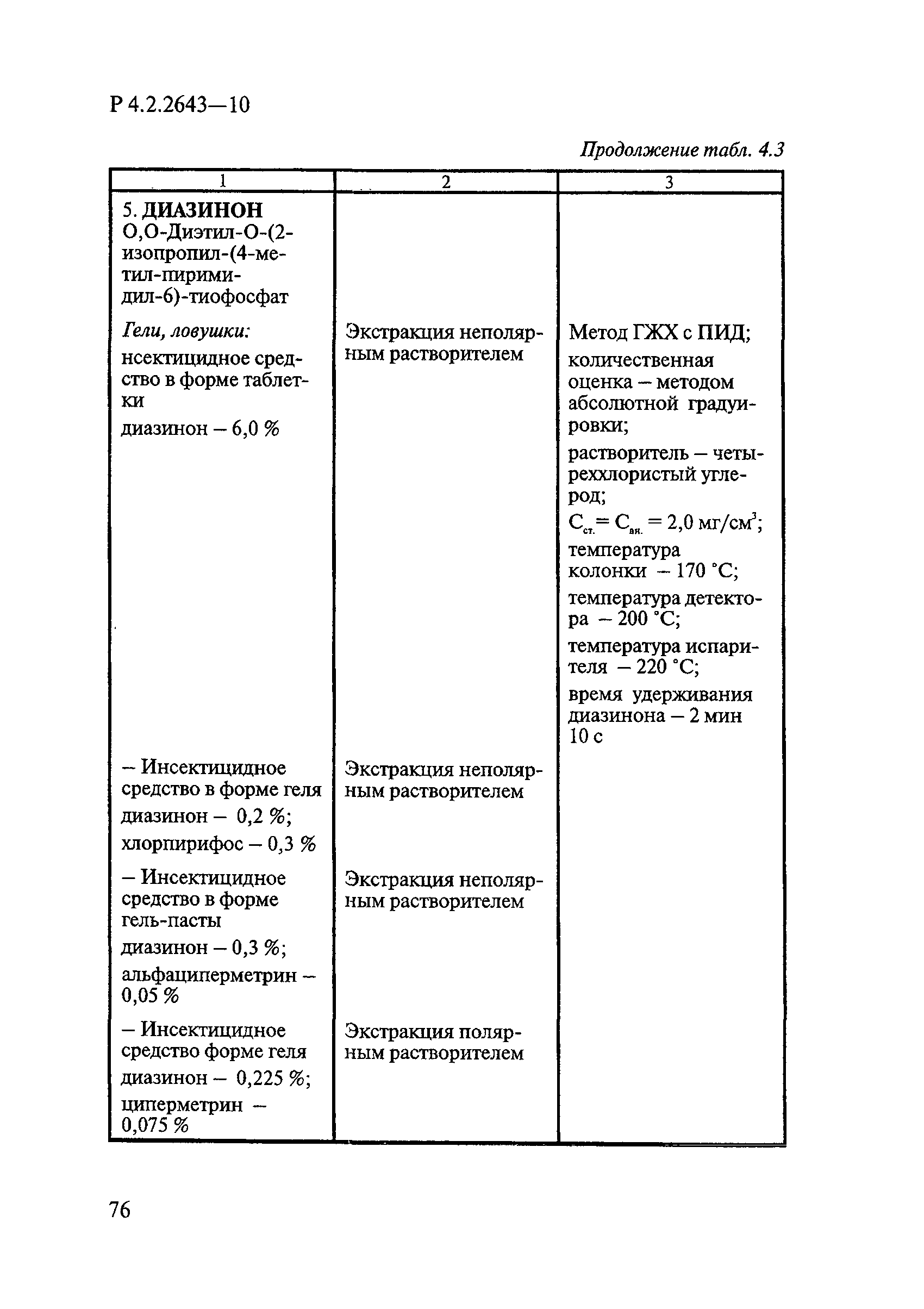
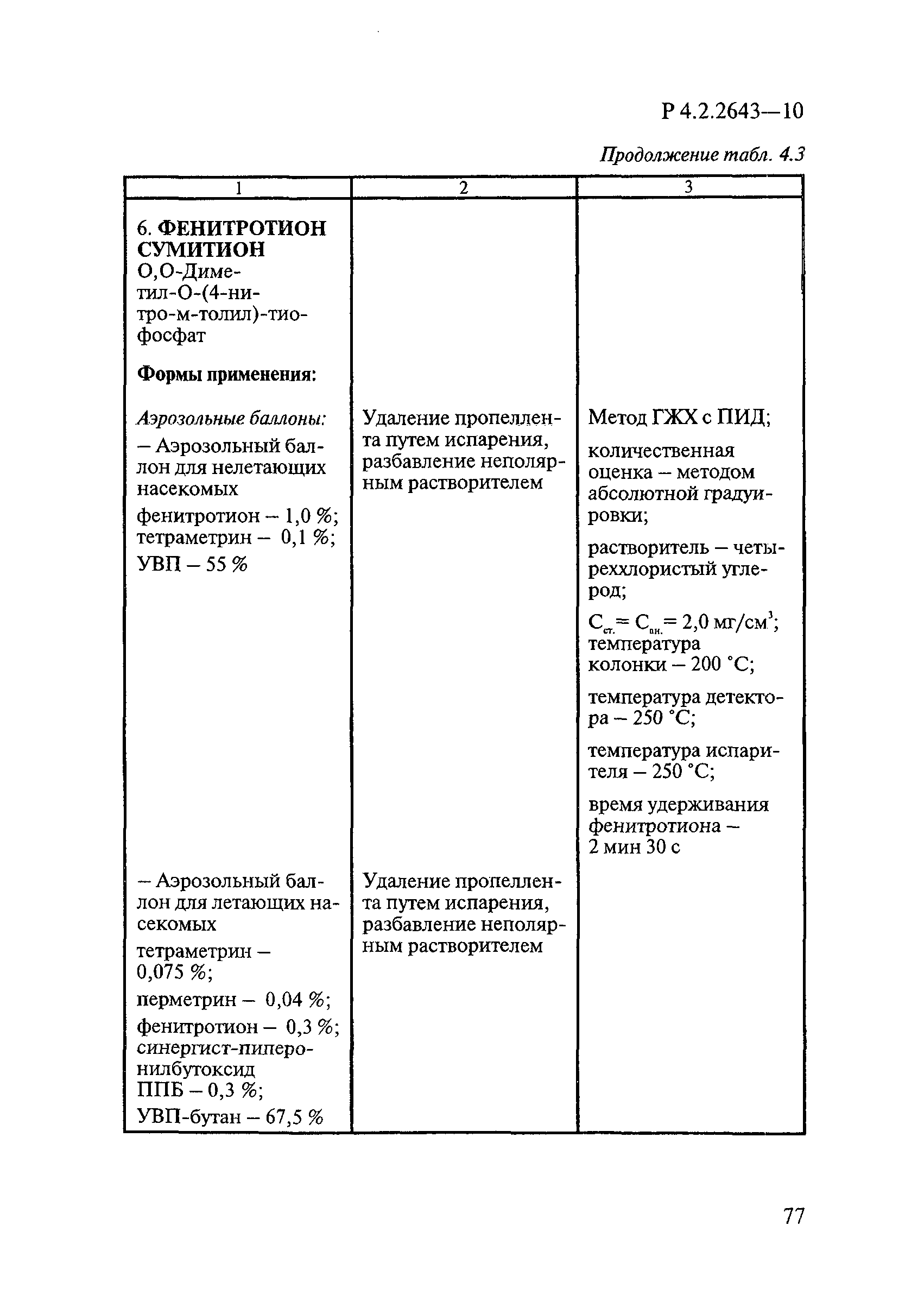
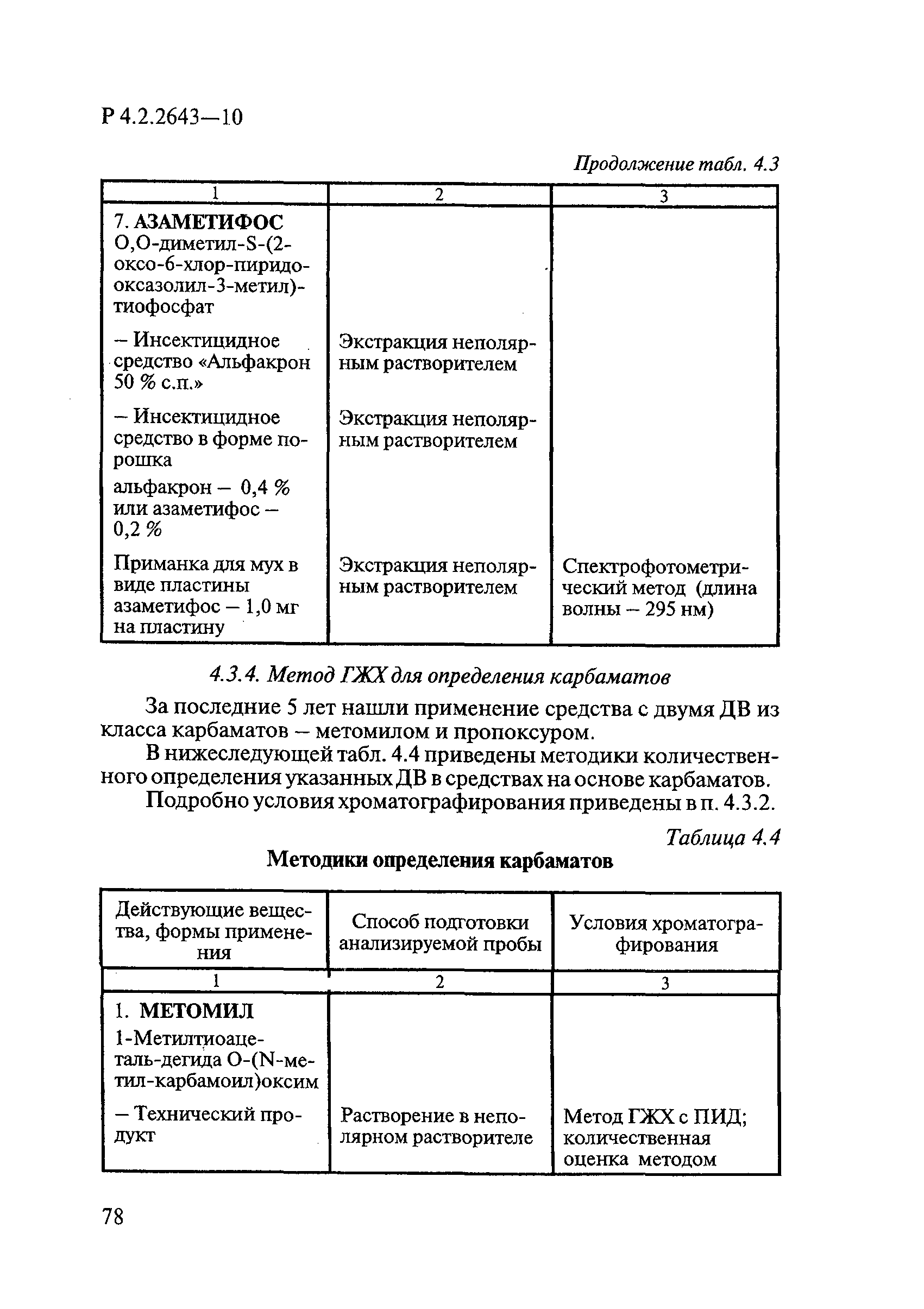
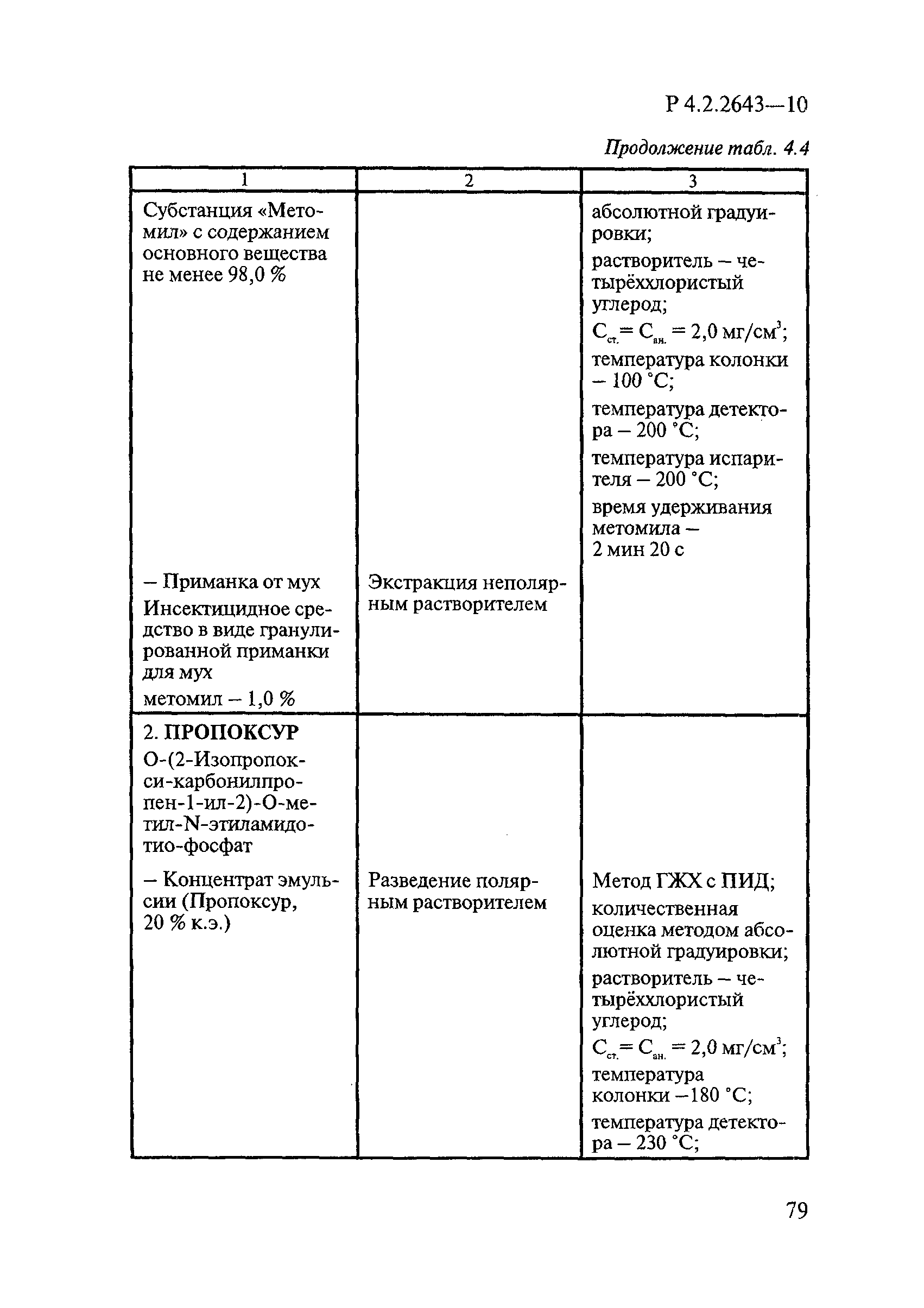
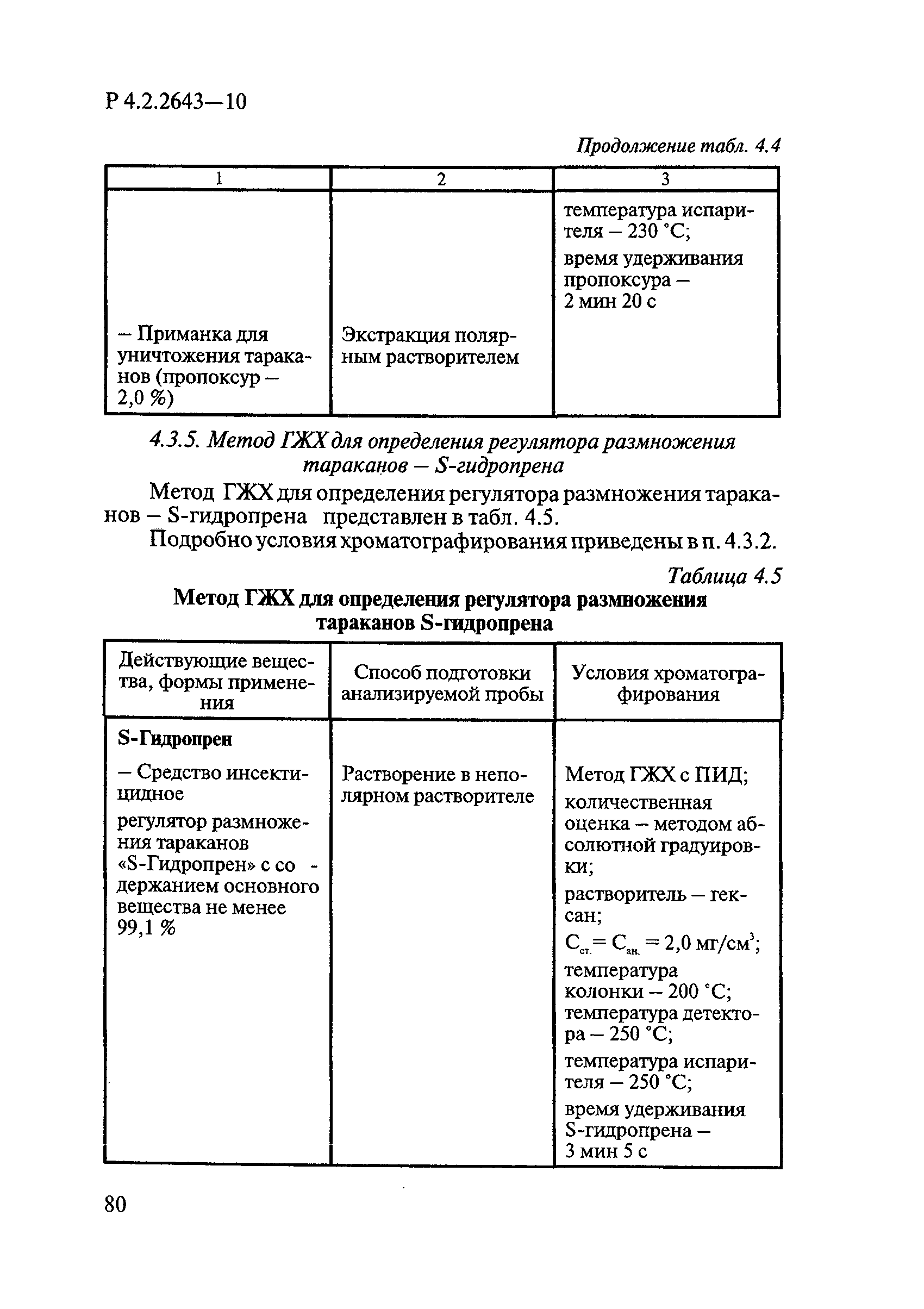
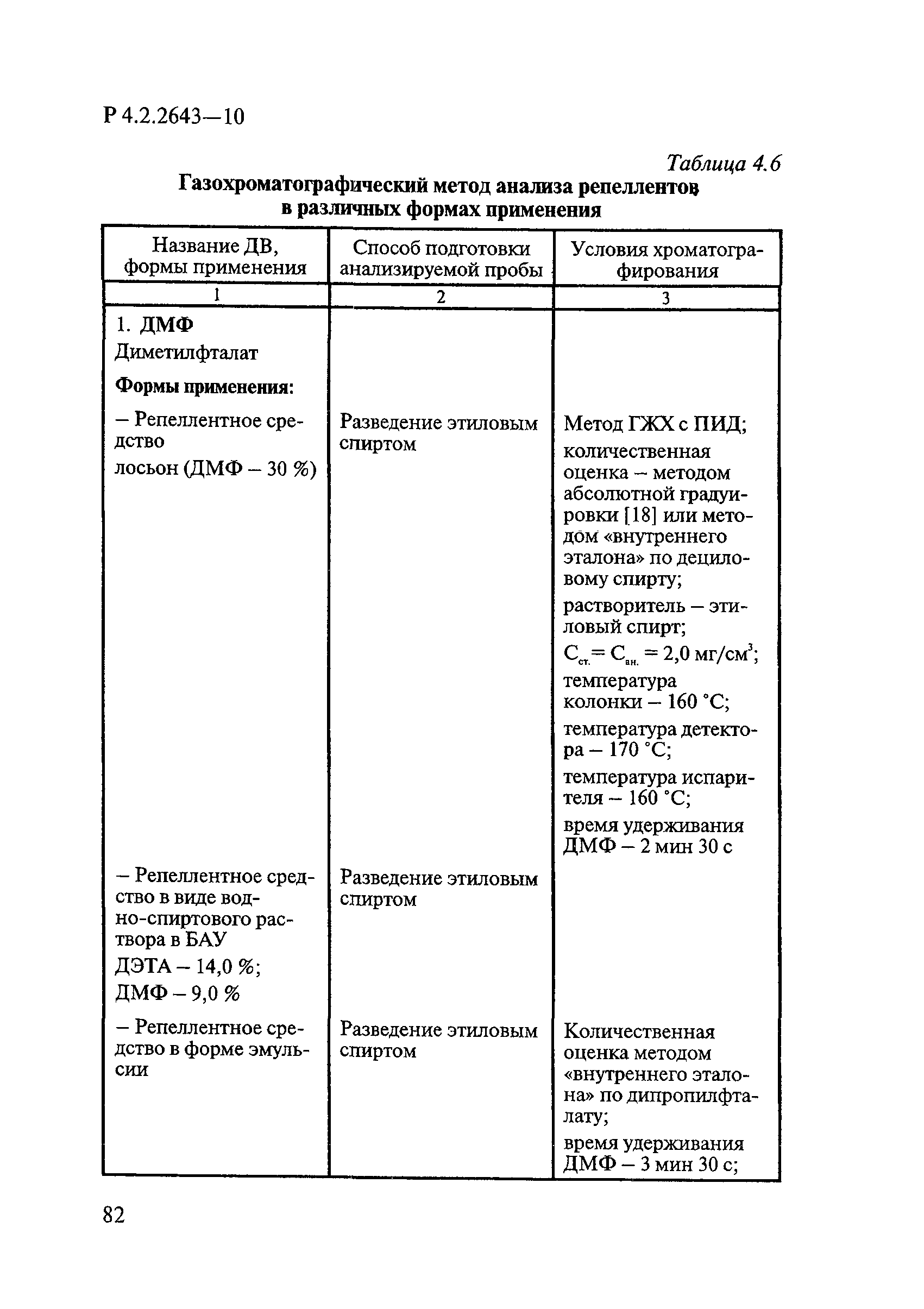
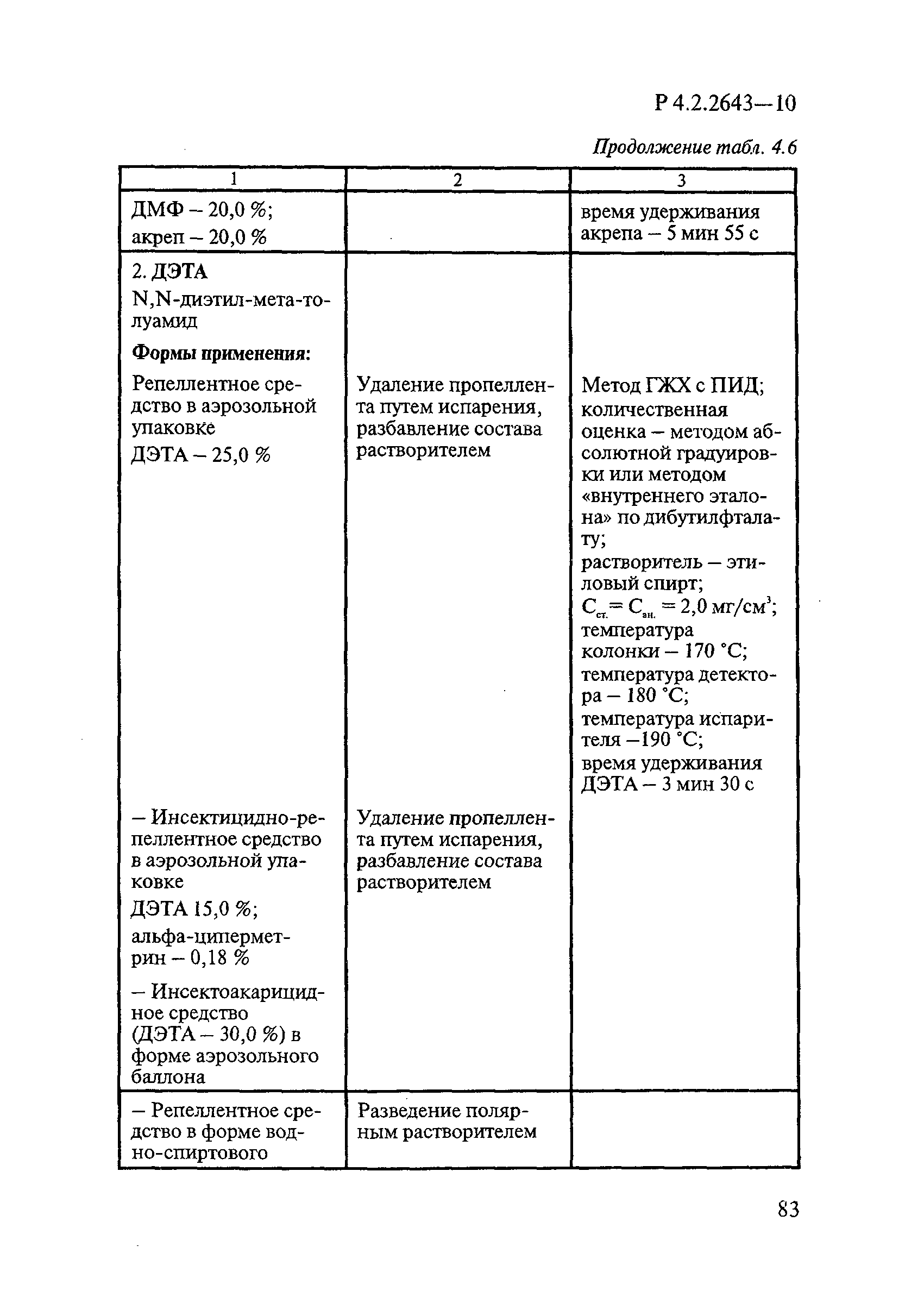
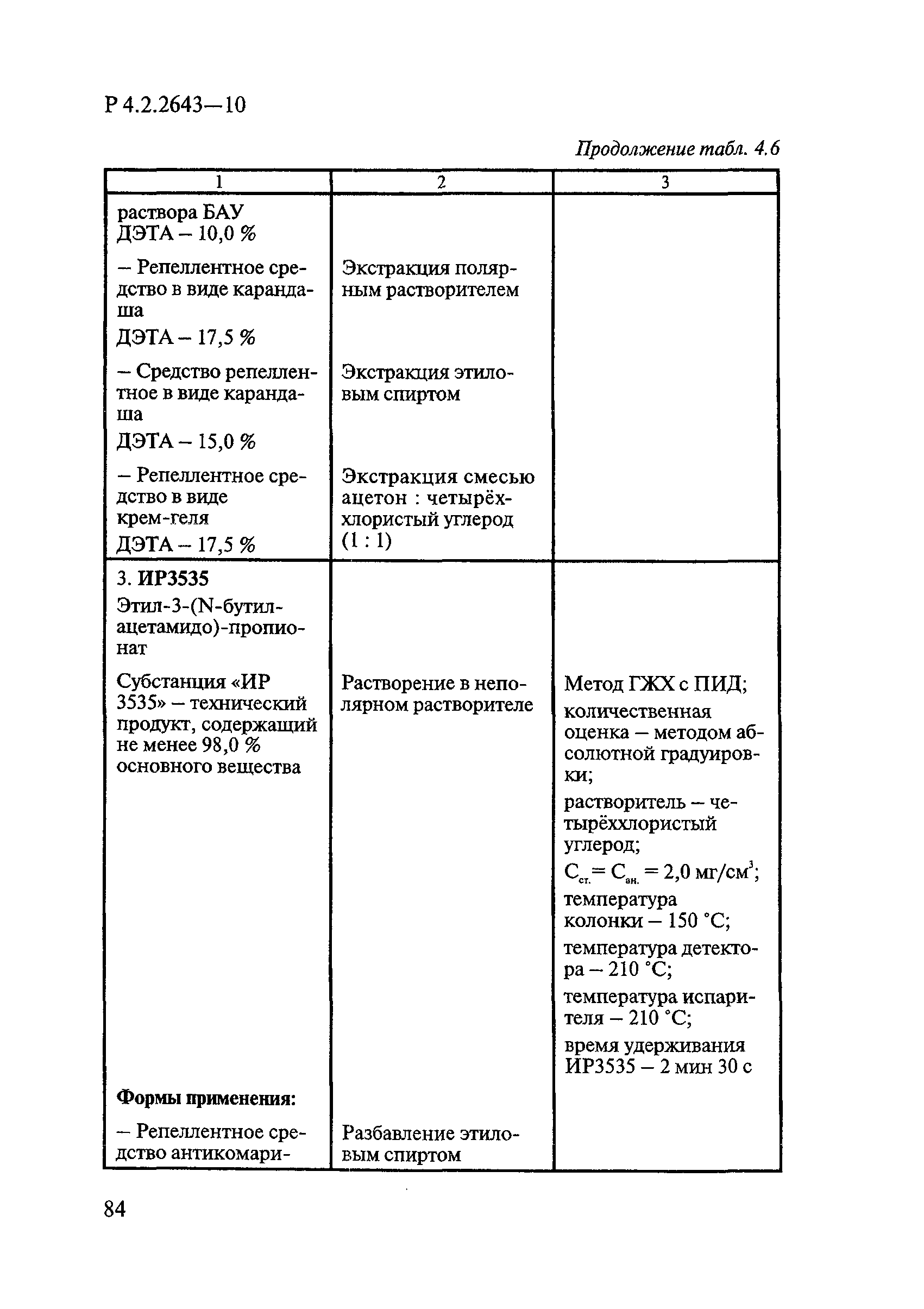
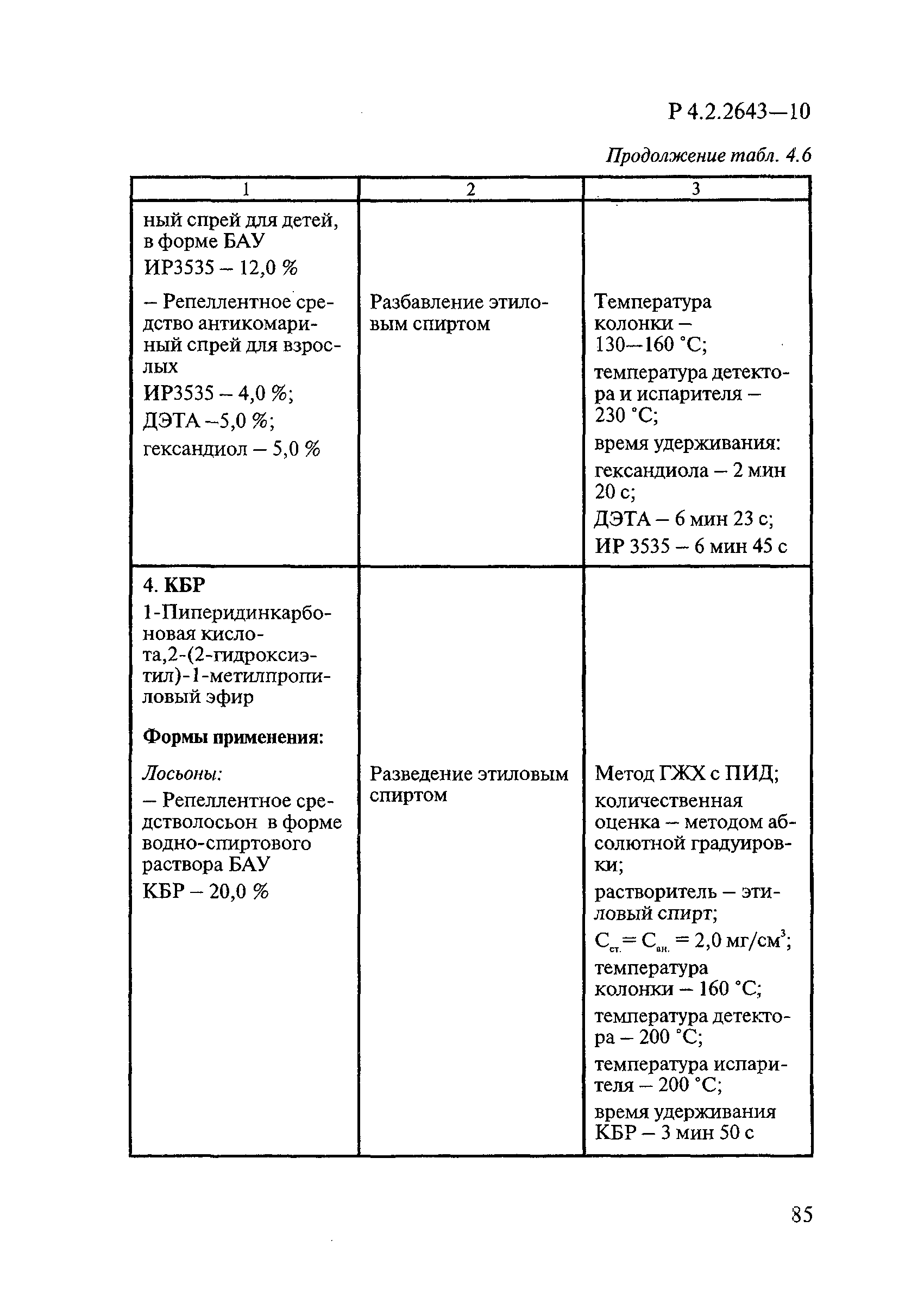
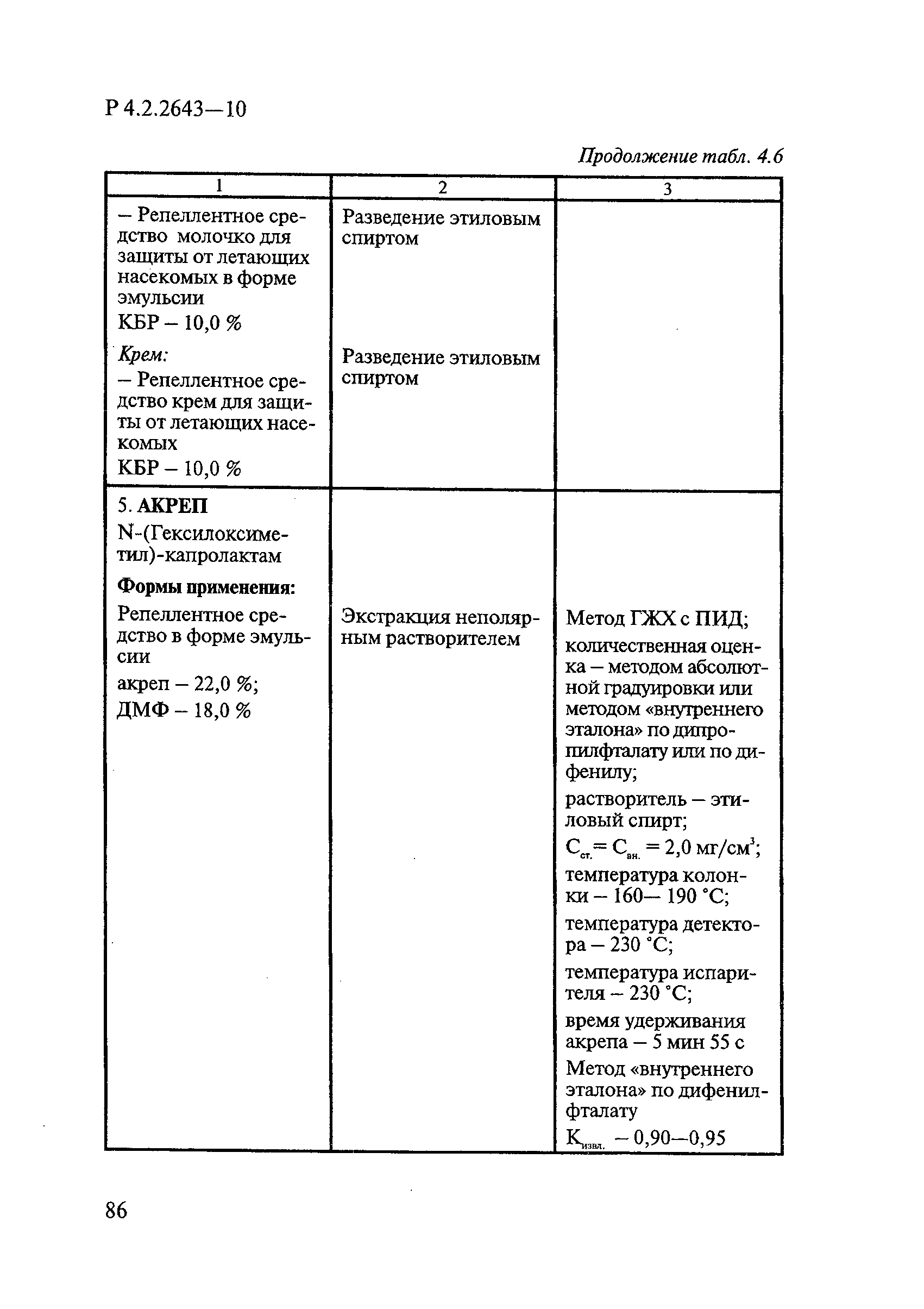
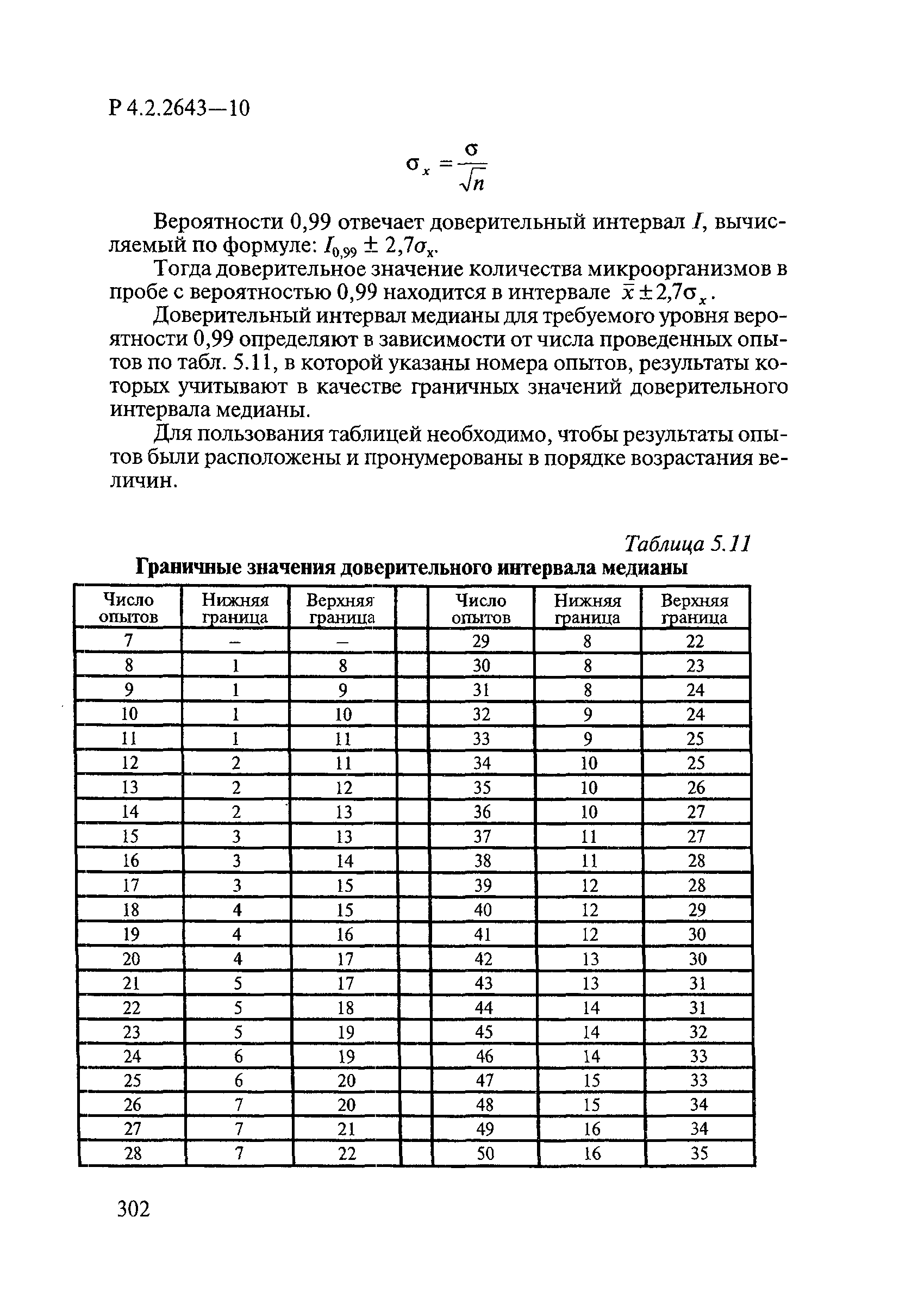
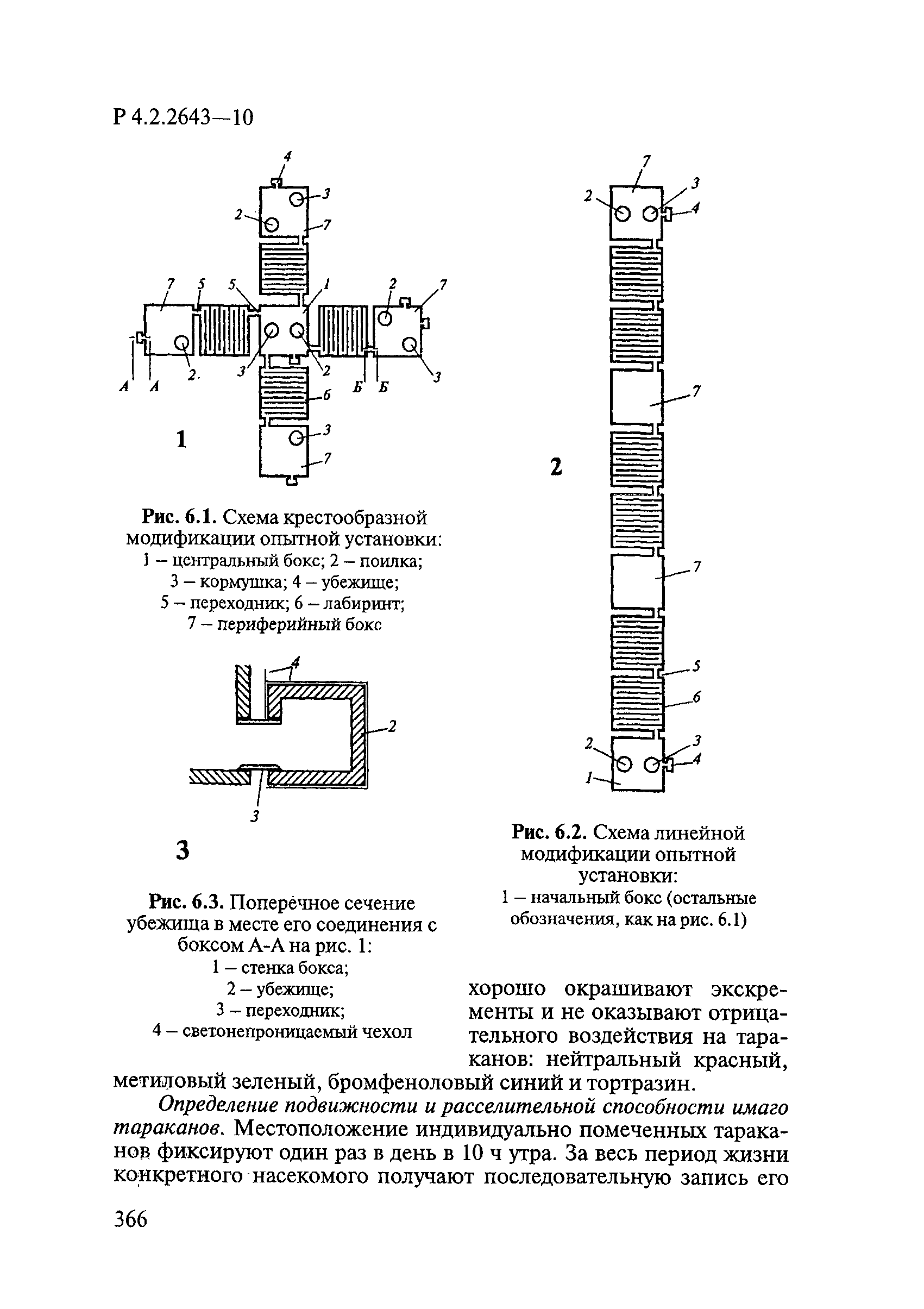
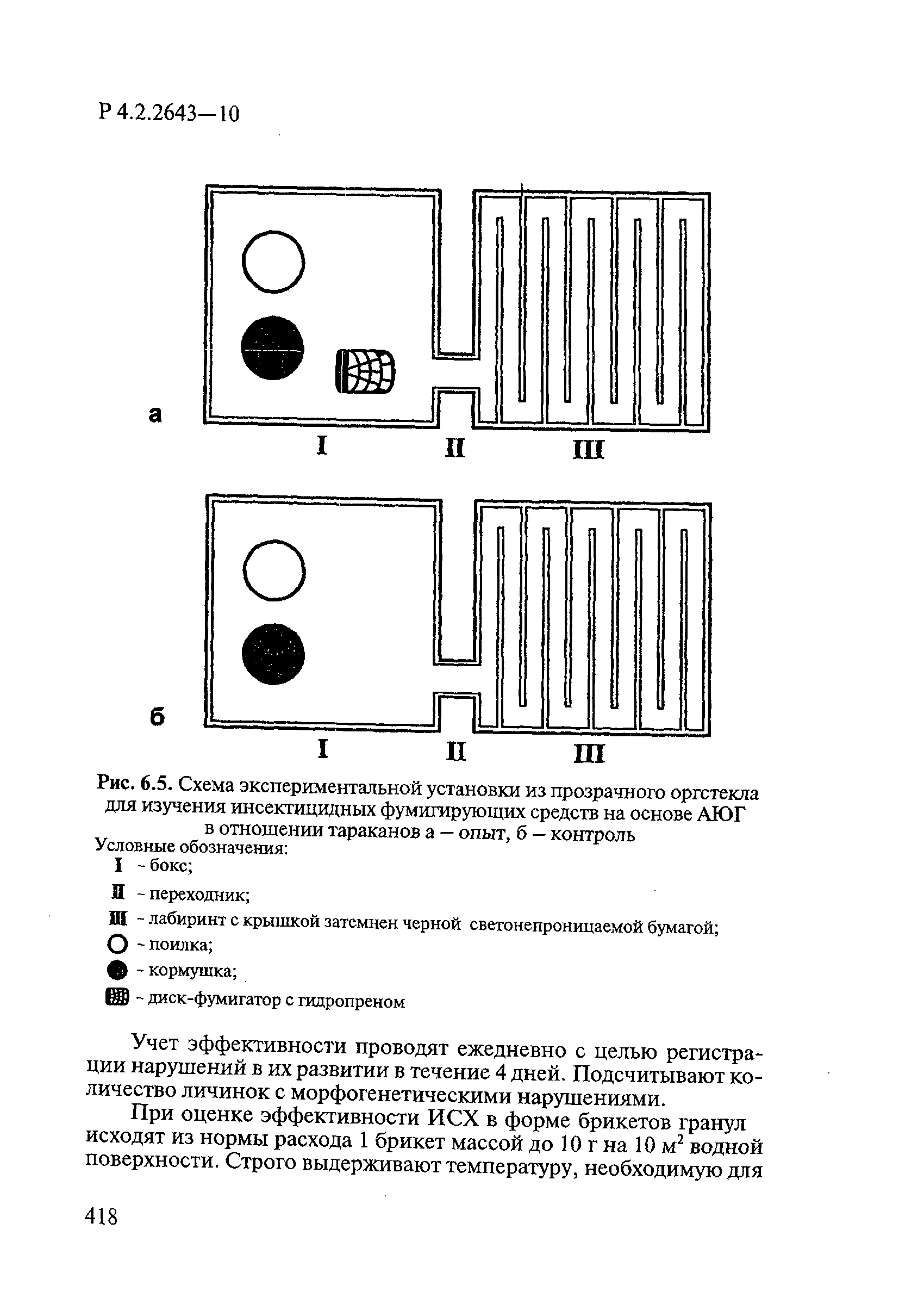
ГОСТ Р 58151.4-2018
Группа Т58
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
СРЕДСТВА ДЕЗИНФИЦИРУЮЩИЕ
Методы определения показателей эффективности
Disinfectants. Methods for determining efficiency factor
ОКС 11.080.20*
________________
* Поправка (ИУС N 8-2018)
Дата введения 2019-01-01
Предисловие
1 РАЗРАБОТАН Федеральным бюджетным учреждением науки «Научно-исследовательский институт дезинфектологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 339 «Безопасность сырья, материалов и веществ»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 5 июня 2018 г. N 317-ст
4 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
ВНЕСЕНА поправка, опубликованная в ИУС N 8, 2018 год
Поправка внесена изготовителем базы данных
1 Область применения
Настоящий стандарт распространяется на химические дезинфицирующие средства (далее ДС) и устанавливает методы исследования дезинфицирующих средств для разработки эффективных режимов дезинфекции, обеспечивающих эпидемиологическую безопасность жизни и здоровья населения, охрану окружающей среды и предупреждение действий, вводящих в заблуждение потребителей путем предоставления недостоверной информации о средствах.
Настоящий стандарт распространяется на методы исследований эффективности дезинфицирующих средств, предназначенных для обеззараживания поверхностей в помещениях, мебели, аппаратов, приборов, санитарно-технического оборудования, транспортных средств; белья и других изделий из текстильных материалов; посуды столовой, лабораторной и др., контаминированных бактериями (включая микобактерии), грибами и вирусами, с целью разработки режимов их дезинфекции.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 6709 Вода дистиллированная. Технические условия
ГОСТ 11683 Пиросульфит натрия технический. Технические условия
ГОСТ 27068 Реактивы. Натрий серноватистокислый (натрия тиосульфат) 5-водный. Технические условия
ГОСТ 32770 Добавки пищевые. Эмульгаторы пищевых продуктов. Термины и определения
ГОСТ Р 56990 Химические дезинфицирующие средства и антисептики. Дезинфицирующие средства. Критерии и показатели эффективности
ГОСТ Р 56994 Дезинфектология и дезинфекционная деятельность. Термины и определения
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов и классификаторов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячно издаваемого информационного указателя «Национальные стандарты» за текущий год. Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений. Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены термины по ГОСТ Р 56994.
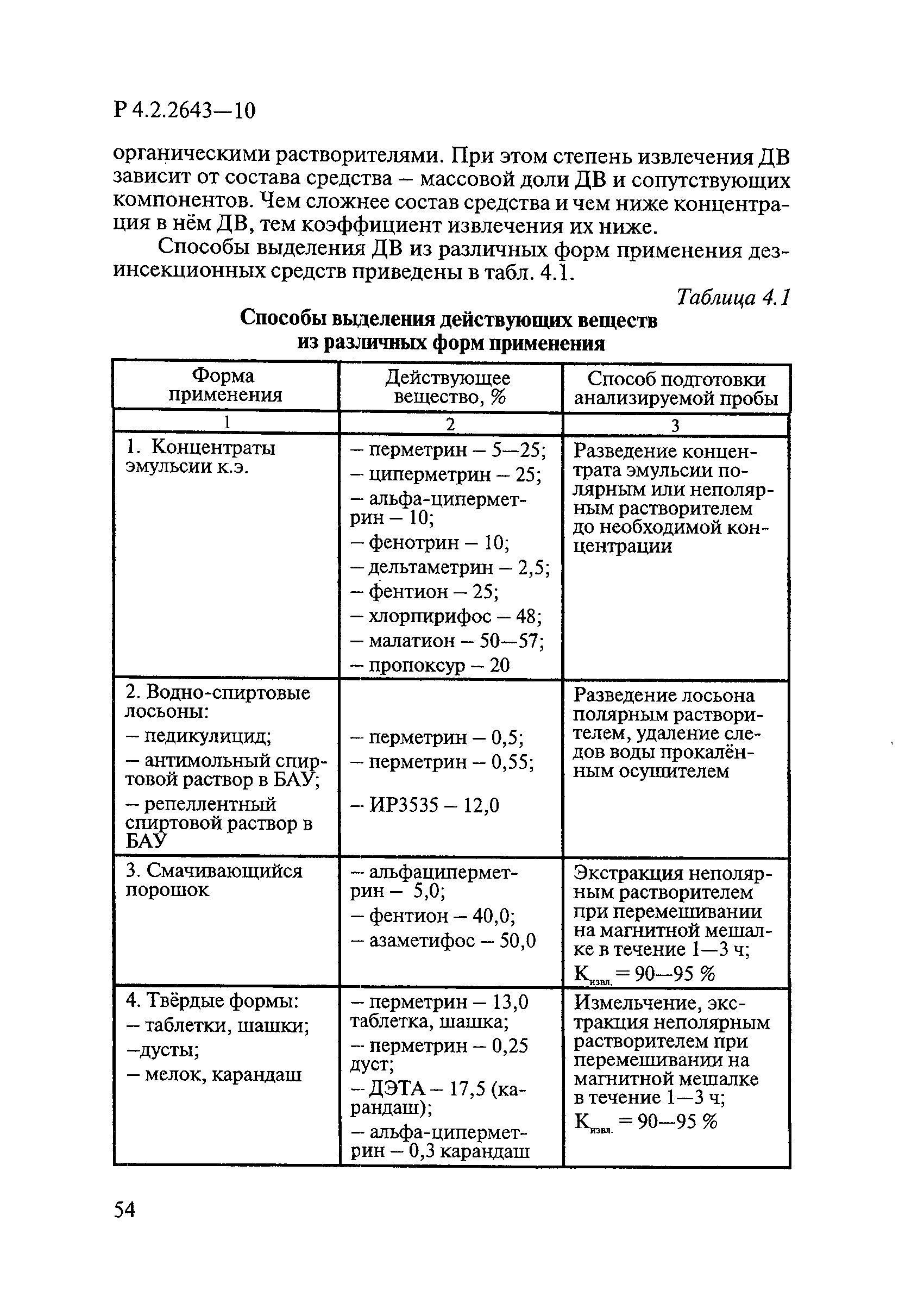
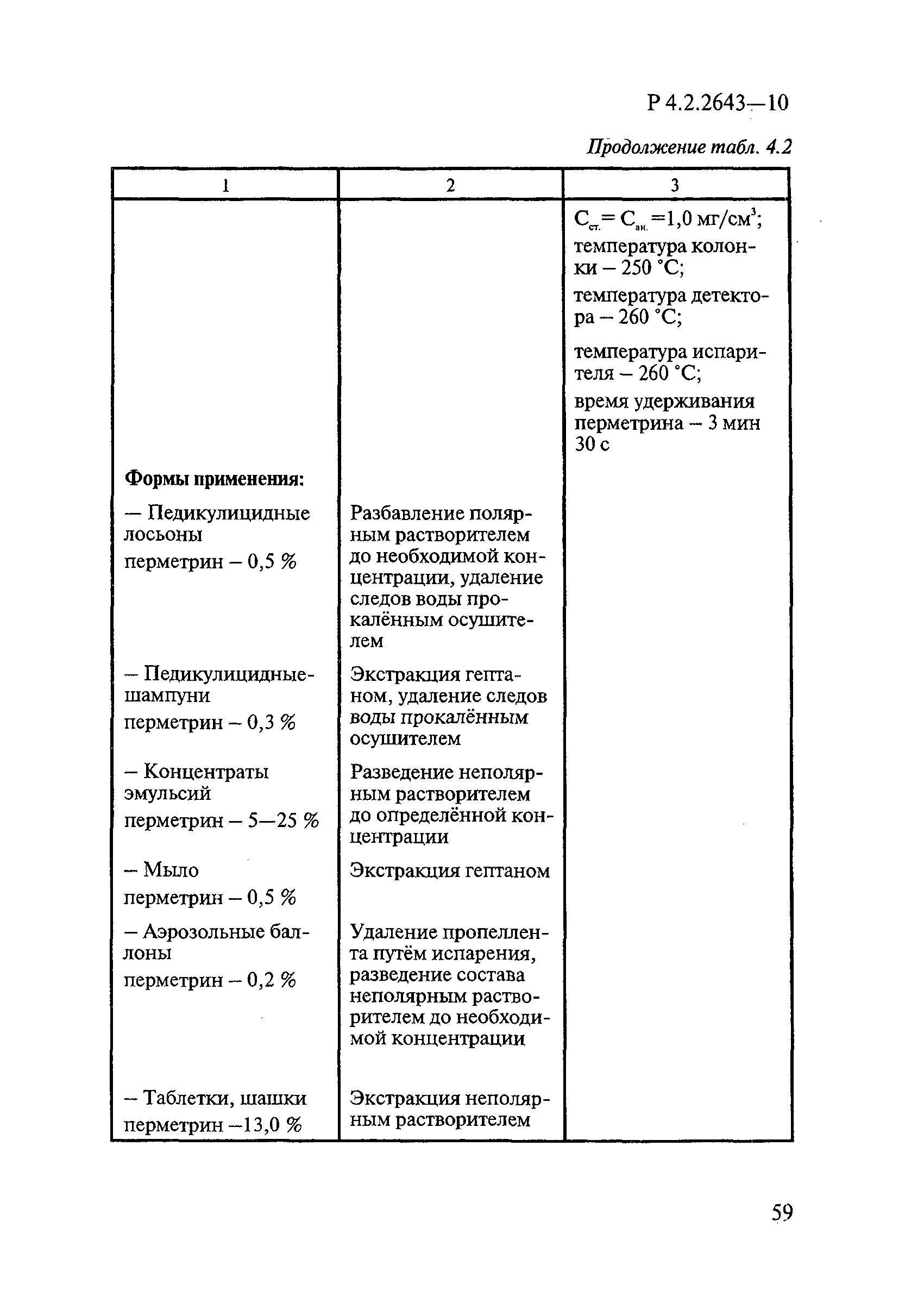
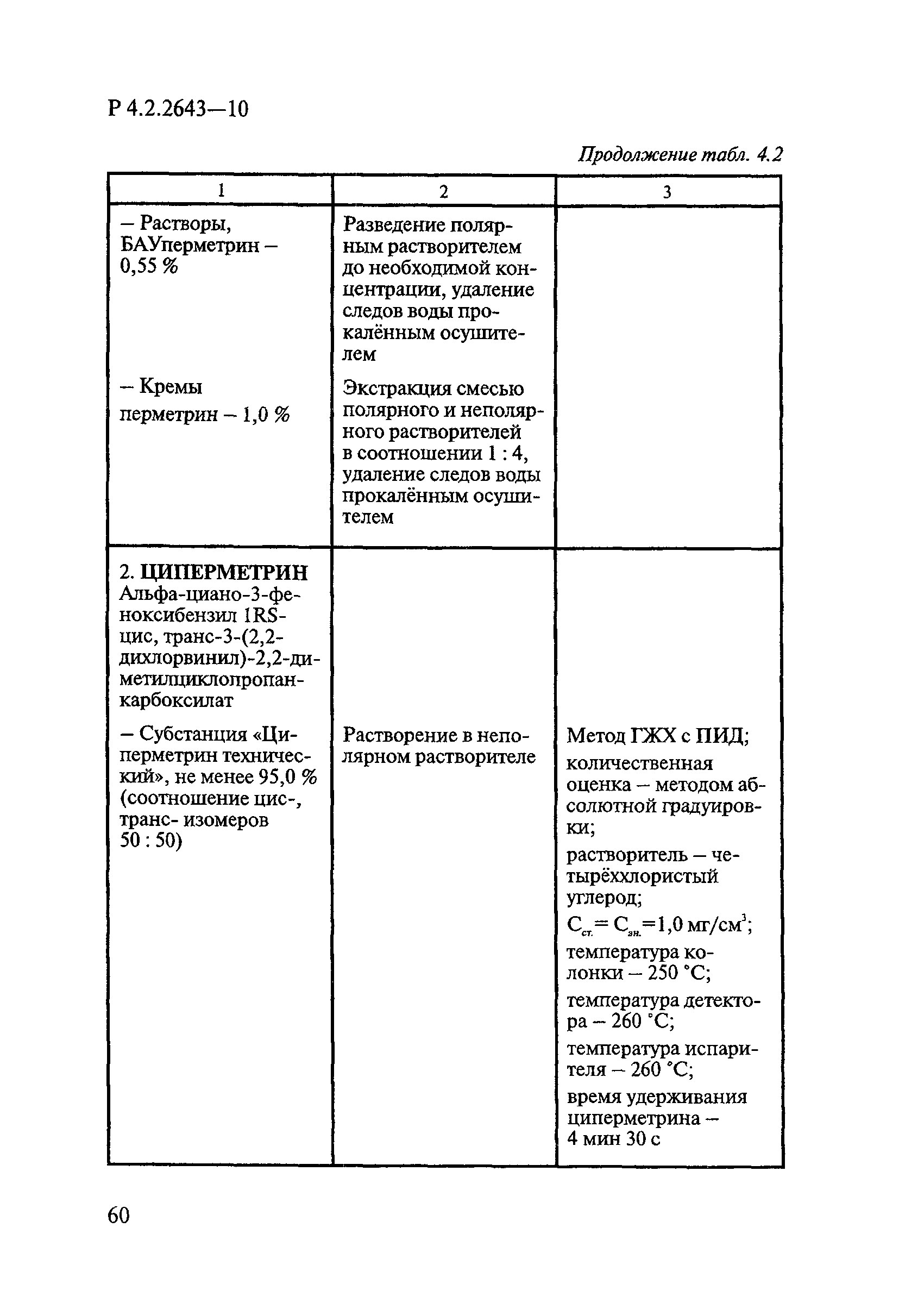
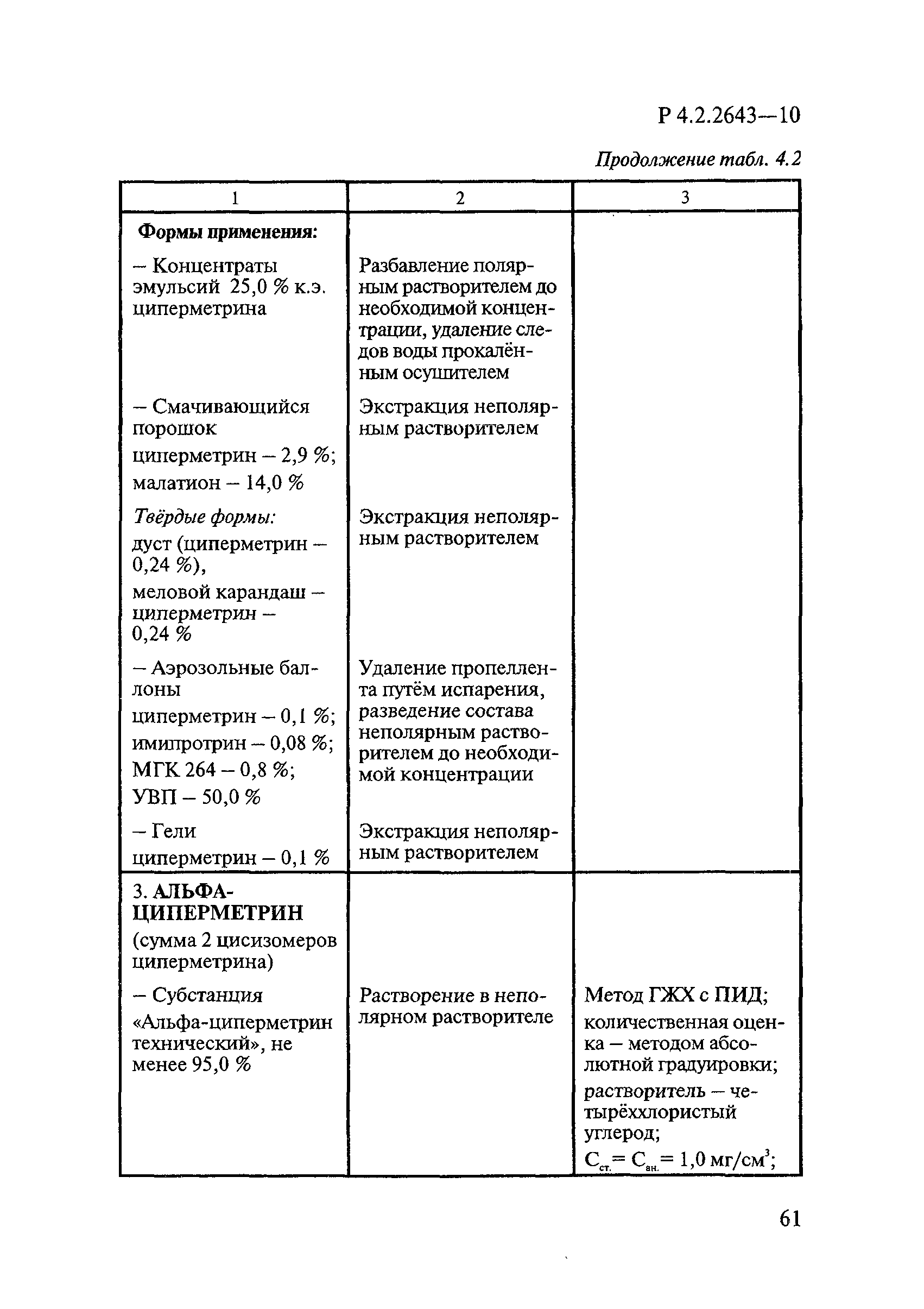
4 Микробиологические методы исследований и критерии оценки эффективности дезинфицирующих средств
4.1 Общие положения
Объем микробиологических исследований определяют в соответствии с предполагаемой сферой применения дезинфицирующих средств (ДС).
Микробиологические исследования начинают только после получения результатов химико-аналитических исследований, подтверждающих соответствие средства требованиям нормативно-технической документации (НТД): технических условий — на отечественные средства, спецификации — на зарубежные.
Критерии эффективности ДС установлены в ГОСТ Р 56990.
4.2 Приготовление рабочих растворов ДС и их субстанций
Рабочие растворы ДС и их субстанций готовят непосредственно перед проведением исследований, за исключением изучения стабильности рабочих растворов в процессе хранения.
При изучении ДС, производимых в форме гранул, порошков, таблеток и др., рабочие растворы используют только после полного растворения действующих веществ (ДВ) ДС, если не указано на возможность выпадения осадка.
Для оценки антимикробного действия субстанций и ДС в лабораторных условиях и исследования эффективности ДС, предназначенных для обеззараживания различных объектов, растворы готовят на стерильной питьевой воде.
Для приготовления раствора определенной концентрации и нужного объема необходимое количество сухого ДС или жидкого концентрата вносят в пробирку (колбу) соответствующего или превосходящего объема и добавляют расчетное количество воды, тщательно размешивают и закрывают пробкой.
Пример — Для приготовления 1% раствора 1 г средства растворяют в 100 мл воды.
Отмечают время полного растворения и внешний вид приготовленного рабочего раствора.
Температура растворов ДС должна быть в пределах 20±2°С (если по условиям эксперимента не рекомендована другая температура) независимо от температуры окружающей среды. Для поддержания требуемой температуры используют водяную баню.
При испытании ДС в практических условиях рабочие растворы готовят на нестерильной питьевой воде комнатной температуры (20±2°С) или умеренно повышенной температуры (45-50°С).
Для приготовления раствора необходимой концентрации навеску средства или отмеренное количество жидкого концентрата вносят в соответствующую емкость, добавляют воду, размешивают и закрывают крышкой. Работу с раствором начинают после полного растворения ДВ. Рабочие растворы из ДС в форме таблеток готовят путем добавления в отмеренный объем воды определенного числа таблеток
Пример — 1 таблетка на 10 л воды.
Рабочие растворы субстанций и ДС готовят с соблюдением мер предосторожности. Если ДВ относится к летучим веществам и представляет опасность при ингаляционном воздействии, растворы готовят в вытяжном шкафу или в отдельном помещении, оборудованном приточно-вытяжной вентиляцией, в респираторе РУ 60М или РПГ-67, кожу рук защищают резиновыми перчатками, глаза — защитными очками.
Исследуемые ДС (перед, во время и после исследований) хранят в соответствии с требованиями технических условий или спецификации; при отсутствии таковых — в соответствии с нормативными документами.
4.3 Применение нейтрализаторов действующих веществ
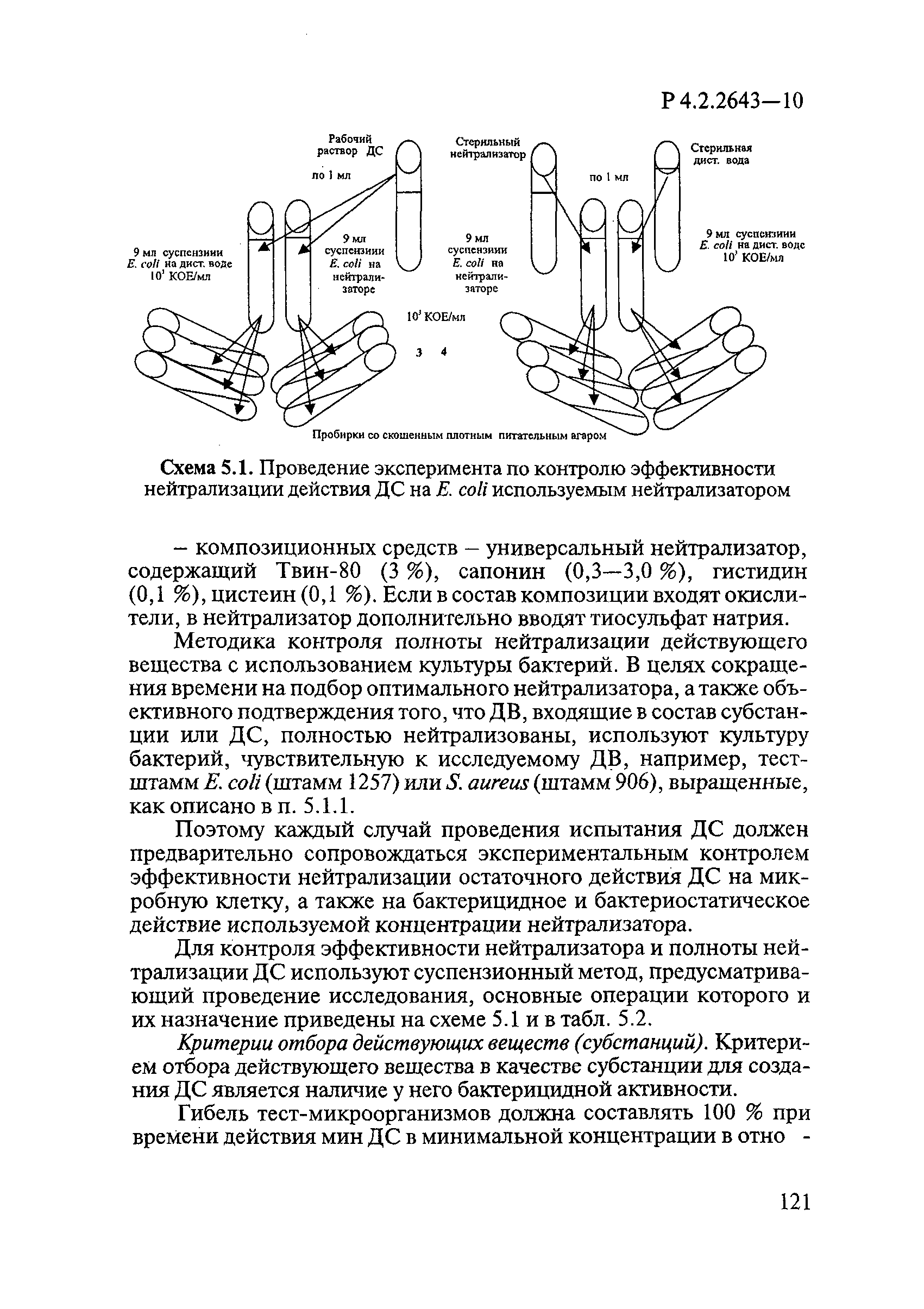
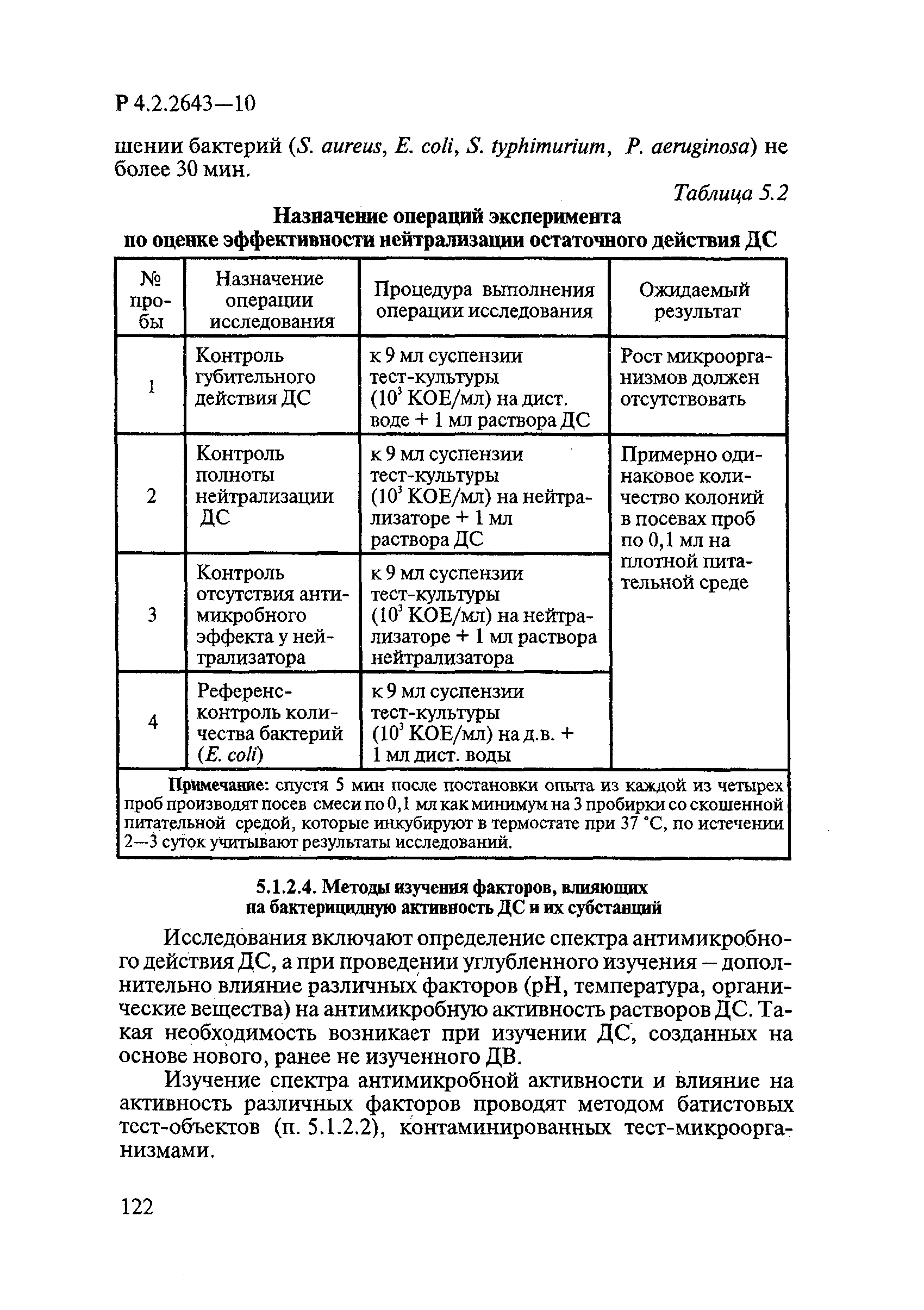
Для разграничения биоцидного и биостатического действий ДС при определении антимикробной активности и эффективности применяют нейтрализаторы, исключающие остаточное атимикробное действие.
Для нейтрализации антимикробного действия ДС из различных химических групп применяют следующие нейтрализаторы:
— для галоидактивных (хлор-, бром- и йодактивные) и кислородактивных (перекись водорода, ее комплексы с солями, надуксусная кислота, озон) — 0,1-1,0% растворы тиосульфата натрия по ГОСТ 27068;
— для четвертичных аммониевых солей (алкилдиметилбензиламмоний хлорид, дидецилдиметиламмоний хлорид и др.), производных гуанидина (полигексаметиленгуанидин гидрохлорид, хлоргексидин биглюконат и др.) — 0,1-1,0% растворы лаурилсульфата натрия (сульфонол) [1]), растворы лаурилсульфата натрия с 10% обезжиренного молока или универсальный нейтрализатор;
— для альдегидов (глутаровый альдегид, глиоксаль, формальдегид, ортофталевый альдегид) — 1,0% раствор пиросульфита (метабисульфита) натрия по ГОСТ 11683 или универсальный нейтрализатор;
— для кислот — щелочи в эквивалентном количестве;
— для щелочей — кислоты в эквивалентном количестве;
— для спиртов — разведение в воде до недействующей концентрации;
— для композиционных средств — универсальный нейтрализатор, содержащий Твин 80 по ГОСТ 32770 3%, сапонин 0,3-3%, гистидин — 0,1%, цистеин — 0,1%.
Если в состав композиции входят окислители, в нейтрализатор дополнительно вводят тиосульфат натрия по ГОСТ 27068.
В качестве универсального нейтрализатора при изучении туберкулоцидного действия используют нейтрализующий бульон по Ди-Ингли.
Растворы нейтрализаторов готовят в асептических условиях, применяя для этого стерильную дистиллированную воду по ГОСТ 6709.
При невозможности соблюдения асептических условий приготовления нейтрализаторов допускают стерилизацию готовых растворов автоклавированием при 1,1 атм. (121°С) в течение 15 мин.
Температура растворов нейтрализаторов должна быть 20°С, независимо от температуры окружающей среды.
Готовые растворы должны использоваться в день приготовления. Допускается хранение готовых растворов при температуре 4°С в течение 48 ч.
Исследование эффективности ДС проводят в зависимости от концентрации ДВ, времени воздействия, нормы расхода, характера объекта, вида его загрязнения, температуры, способа и кратности обработки по [2].
5 Методы изучения и оценки бактерицидной активности дезинфицирующих средств
5.1 Требования к тест-микроорганизмам
При изучении бактерицидной активности дезинфицирующих субстанций и ДС в качестве тест-микроорганизмов используют:
— Escherichia coli (штамм 1257);
— Pseudomonas aeruginosa (штамм АТСС 27853);
— Salmonella typhimurium (штамм 00074 NCTC=13311 АТСС) — для оценки бактерицидной активности в отношении грамотрицательных бактерий;
— Staphylococcus aureus (штамм 906) — для оценки бактерицидной активности в отношении грамположительных бактерий.
Или другие микроорганизмы, обладающие аналогичной устойчивостью к ДС.
Тест-микроорганизмы должны иметь типичные биохимические, морфологические, тинкториальные, культуральные и ферментативные свойства, присущие данному виду, и обладать стандартной устойчивостью к эталонным ДС.
Музейные культуры микроорганизмов хранят при температуре 3-10°С в ампулах (после лиофильной сушки) или на плотных питательных средах (посев уколом) под слоем стерильного вазелинового масла с толщиной слоя 1,5-3 мм, рабочие культуры — на скошенном агаре или в бульоне.
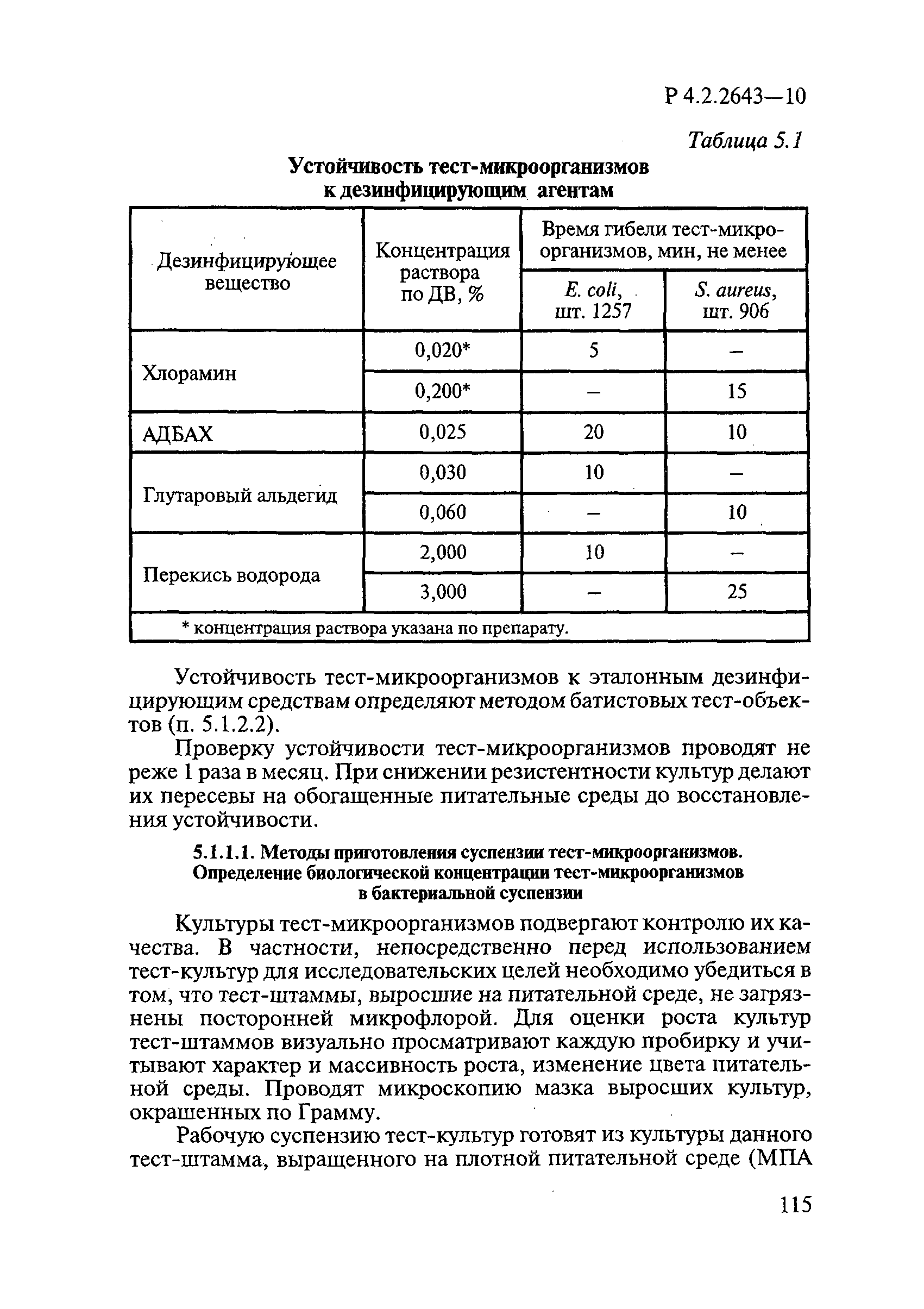
Проверку устойчивости тест-микроорганизмов проводят не реже 1 раза в месяц по [2]. При снижении резистентности культур делают их пересевы на обогащенные питательные среды до восстановления устойчивости.
Тест-микроорганизмы культивируют при температуре 37°С в течение 18-24 ч на следующих питательных средах:
— казеиновом бульоне;
— мясо-пептонном бульоне;
— агаре Эндо;
— казеиновом агаре;
— мясо-пептонном агаре.
5.2 Методы приготовления суспензии тест-микроорганизмов. Определение биологической концентрации тест-микроорганизмов в бактериальной суспензии
Перед изучением бактерицидной активности ДС культуры тест-микроорганизмов подвергают контролю их качества. Перед использованием тест-культур для исследовательских целей проверяют отсутствие среди тест-микроорганизмов, выросших на питательной среде, посторонней микрофлоры. Для оценки роста тест-микроорганизмов визуально просматривают каждую пробирку и учитывают характер и массивность роста, изменение цвета питательной среды. Проводят микроскопию мазка выросших тест-микроорганизмов, окрашенных по Граму.
Рабочую суспензию тест-микроорганизмов готовят из культуры данного тест-штамма, выращенного на плотной питательной среде (МПА или казеиновый агар) при температуре (37±1)°С в течение 18-24 ч. Для приготовления бактериальной взвеси культуру смывают с агара стерильной питьевой водой. Полученную взвесь тест-микроорганизмов фильтруют через ватно-марлевый фильтр и разводят стерильной питьевой водой до концентрации 2×109 клеток в 1 мл, соответствующей по мутности 20 единицам мутности отраслевого стандартного образца ОСО 42-28-84-11 (20 ME) или 6 единицам Мак-Фарланда, определяемых с помощью денситометра.
В связи с тем, что суспензия может содержать наряду с живыми мертвые микроорганизмы, необходимо определять биологическую концентрацию фактического количества живых клеток в приготовленной суспензии для корректировки и обеспечения требуемых уровней контаминации тест-объектов жизнеспособными микроорганизмами.
Определение биологической концентрации тест-микроорганизмов выполняют методом последовательных десятикратных разведений суспензии тест-микроорганизма в стерильной питьевой воде с последующим высевом суспензии в чашки Петри с плотной питательной средой (казеиновый агар, агар Эндо, МПА). После определенного времени инкубации при соответствующей температуре проводят подсчет выросших колониеобразующих единиц (КОЕ) и определяют количество жизнеспособных бактерий в 1 мл суспензии.
5.3 Исследование бактерицидной эффективности ДС, предназначенных для обеззараживания поверхностей в помещениях, мебели, аппаратов, приборов, санитарно-технического оборудования, транспортных средств и других объектов
Исследования проводят в зависимости от вида поверхностей, их положения (горизонтальное, вертикальное), способа и кратности обработки.
В качестве тест-поверхностей используют поверхности размером 10×10 см из различных материалов:
— гладкие;
— шероховатые;
— впитывающие;
— не впитывающие.
Пример — Деревянные, оштукатуренные, окрашенные масляной, силикатной, водоэмульсионной или клеевой краской; оклеенные обоями, поверхности из линолеумных покрытий, окрашенного или неокрашенного металла — нержавеющая хром-никелевая кислотостойкая сталь, из пластика, стекла, искусственной или натуральной кожи, облицовочной плитки — кафельной и метлахской, фаянса.
Для исследования используют не менее 5 видов поверхностей. Набор тест-поверхностей для исследований определяют по назначению средства.
В качестве тест-микроорганизмов используют S.aureus и E.coli, при необходимости дополнительно используют S.typhimurium, P.aeruginosa или другие виды бактерий.
Перед контаминацией тест-микроорганизмами поверхности подвергают механической очистке — моют водой с мылом и щеткой (за исключением поверхностей, оклеенных обоями и окрашенных клеевой краской). Последние протирают несколько раз стерильной салфеткой, увлажненной стерильной питьевой водой.
Высушенные поверхности располагают горизонтально и на них пипеткой наносят взвесь тест-микроорганизмов из расчета 0,5 мл 2-миллиардной микробной взвеси на площадь в 100 см и равномерно распределяют ее по поверхности стеклянным шпателем. Поверхности подсушивают (до полного высыхания) при температуре 18-20°С и относительной влажности воздуха 50-60%, затем обрабатывают дезинфицирующим раствором.
При изучении эффективности обеззараживания горизонтально располагают:
— линолеум;
— плитку метлахскую;
— искусственную кожу;
— натуральную кожу.
Вертикально располагают:
— дерево, окрашенное масляной или другими видами красок;
— поверхности, оклеенные обоями;
— пластик;
— кафельную плитку;
— фаянсовую плитку;
— стекло.
Для имитации загрязнения поверхностей используют белковое или фекальное загрязнение: 40% инактивированной сыворотки, 40% фекальной эмульсии (при разработке режимов обеззараживания санитарно-технического оборудования).
Обработку поверхностей проводят способами протирания или орошения (крупнокапельное и аэрозольное).
Для определения нормы расхода при однократной обработке дезинфицирующий раствор наносят с помощью пипетки на поверхность размером 10х10 см при применении способа протирания в количестве 1,0, 1,5 или 2,0 мл, а при крупнокапельном орошении наносят с помощью дозатора 1,5-3,0 мл. При аэрозольном методе обработки изучают эффективность обеззараживания при норме расхода 1-100 мл/м (в зависимости от вида аэрозольного генератора и применяемой аэрозольной насадки). Многократное протирание или орошение проводят с интервалом между обработками 5-15-30 мин.
Время обеззараживания поверхностей определяют в интервале от 5 до 120 мин. Выбор экспозиции зависит от назначения и рекомендуемых условий применения ДС.
Контрольные поверхности обрабатывают стерильной водопроводной водой так же и из того же расчета, что и опытные.
Исследования проводят при температуре 18-20°С. При необходимости оценивают эффективность обеззараживания поверхностей при повышенной до 50°С или пониженной до минус 30°С температуре (исследования проводят в термо- или холодильной камере).
Контроль эффективности обеззараживания тест-поверхностей проводят следующим образом: марлевой салфеткой (размером 5×5 см), смоченной в растворе соответствующего для данного дезинфицирующего средства нейтрализатора, тщательно протирают тест-поверхность, затем ее погружают в 10 мл этого же нейтрализатора, находящегося в пробирках с бусами. Время отмыва марлевой салфетки 10 мин при постоянном встряхивании. Отмывную жидкость сеют (на 2-3 чашки по 0,1-0,2 мл в каждую) на твердые дифференциально-диагностические питательные среды.
Допустимо проводить исследования с использованием тест-поверхностей размером 5х5 см из тех же материалов, что и тест-поверхности 10х10 см. Этот метод можно использовать при оценке чувствительности к ДС микроорганизмов, выделенных с объектов окружающей среды.
Тест-поверхности помещают на дно стерильной чашки Петри и пипеткой наносят на них 0,1 мл 2-миллиардной микробной взвеси (площадь поверхности 25 см), равномерно распределяют ее по поверхности стерильным шпателем, не допуская отекания суспензии за пределы тест-объекта, затем подсушивают, приоткрыв чашку Петри (до полного высыхания) при температуре плюс 18-22°С и относительной влажности 40-60%, после чего обрабатывают раствором ДС так же, как указано выше. После окончания экспозиции чашки с тест-объектами заливают 10 мл раствора нейтрализатора, соответствующего данному ДС, и делают несколько круговых движений чашкой для лучшего смачивания тест-объекта. Через несколько минут стерильным пинцетом переворачивают тест-объект и повторяют круговые движения. После контакта нейтрализатора с тест-объектом в течение 10 мин снова делают несколько круговых движений чашкой, затем стерильным пинцетом удаляют тест-объект из чашки и сбрасывают его в емкость с дезинфицирующим раствором с целью дальнейшего обеззараживания. Если тест-объект обработан способом погружения в дезинфицирующий раствор, то по завершении экспозиции его переносят в чашку Петри с 10 мл раствора нейтрализатора на 10 мин, после чего извлекают и сбрасывают в емкость с дезинфицирующим раствором для обеззараживания.
Нейтрализатор из чашки Петри сеют (на 2-3 чашки по 0,1-0,2 мл в каждую) на твердые дифференциально-диагностические питательные среды либо заливают чашку с нейтрализатором растопленным и остуженным до 45°С агаром.
Посевы помещают для выращивания в термостате при температуре (37±1)°С. Учет результатов проводят в течение 1-2 суток путем подсчета количества выросших колоний, затем рассчитывают плотность контаминации 100 см поверхности и процент обеззараживания, принимая количество колоний, снятых с контрольных поверхностей, за 100%.
Критерий эффективности обеззараживания поверхностей — не менее 99,99% гибели тест-микроорганизмов.
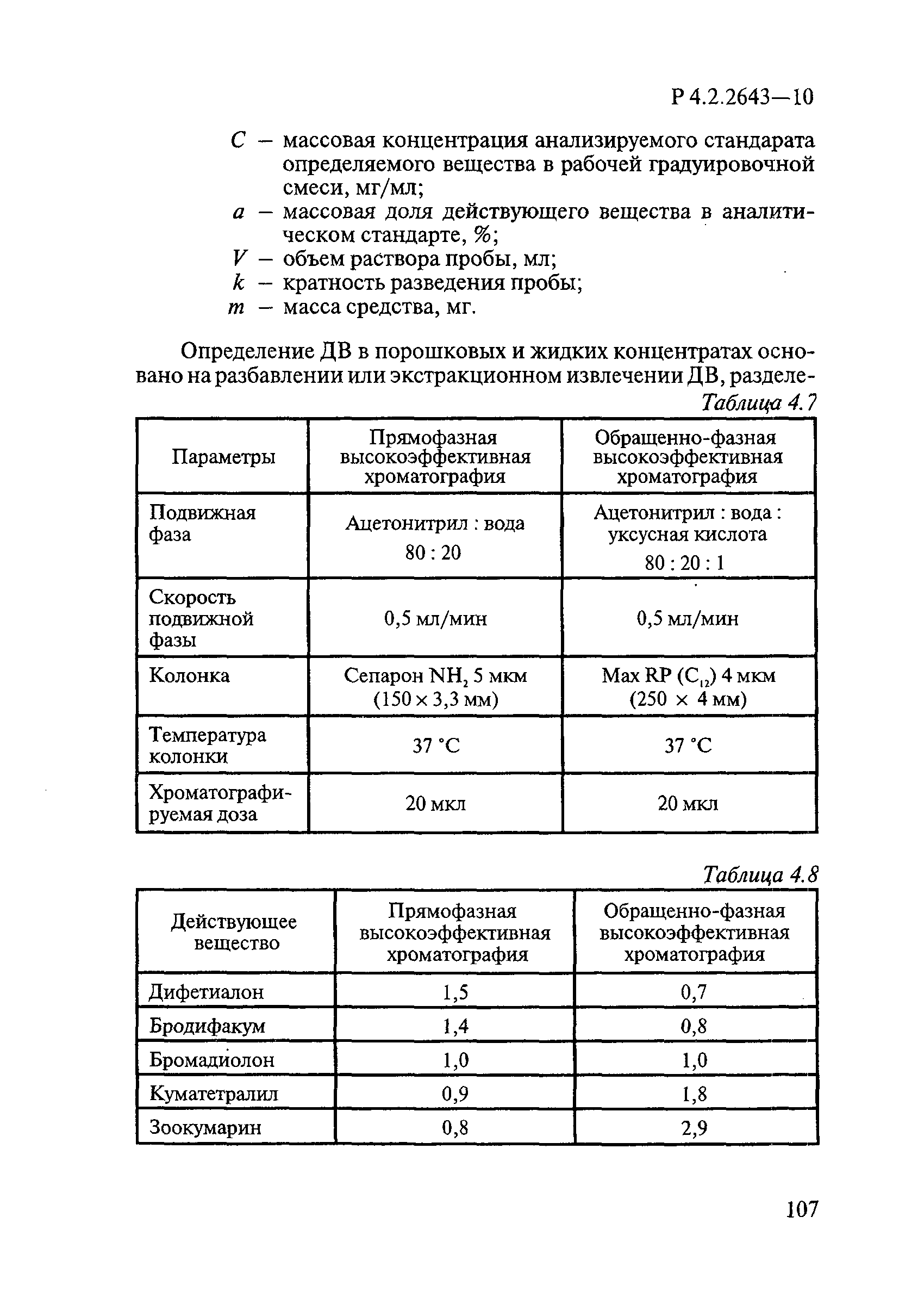
Таблица 1 — Показатели эффективности ДС при обработке поверхностей
|
Показатель |
Значение показателя |
|
Критерий эффективности |
99,99% гибель тест-культуры |
|
Время гибели S.aureus, E.coli, S.typhimurium, Paeruginosa |
Не более 120 мин |
5.4 Исследование бактерицидной эффективности ДС, предназначенных для обеззараживания белья
Эффективность обеззараживания белья ДС определяют с помощью тест-объектов, представляющих собой кусочки ткани из бязи размером 2х2 см. В качестве тест-культур используют S.aureus и E.coli.
При разработке режима обеззараживания загрязненного белья к суспензии микроорганизмов перед контаминацией тест-объектов добавляют 40% инактивированной сыворотки (6 мл 2-миллиардной взвеси тест-культуры смешивают с 4 мл инактивированной сыворотки) или 40% фекальной эмульсии (6 мл 2-миллиардной взвеси тест-культуры смешивают с 4 мл фекальной эмульсии). Для приготовления фекальной эмульсии 8 г фекалий растирают в ступке с 20 мл воды. Контаминированные тест-объекты подсушивают в термостате при 37°С в течение 20-25 мин или 1,5-2 ч при комнатной температуре до полного высыхания.
Стерильные тест-объекты пропитывают 2-миллиардной взвесью тест-микроорганизмов из расчета 20 мл на 10 тест-объектов и подсушивают в термостате. Далее контаминированные тест-объекты помещают в стерильные бязевые мешочки размером 5х8 см по 2 штуки в каждый.
При разработке режимов обеззараживания белья, не загрязненного выделениями, белье погружают в емкость с дезинфицирующим раствором из расчета 4 л раствора на 1 кг сухого белья.
При разработке режимов обеззараживания белья, загрязненного выделениями, белье погружают в емкость с дезинфицирующим раствором из расчета 5 л раствора на 1 кг сухого белья.
Белье погружают в раствор последовательно, без воздушных полостей между вещами, препятствующих процессу дезинфекции. Мешочки с контаминированными тест-объектами распределяют между слоями белья (сверху, в середине, внизу). Через заданное время воздействия ДС извлекают по 1 мешочку с каждого уровня, стерильным пинцетом вынимают тест-объекты, переносят их в раствор нейтрализатора на 5 мин, промывают 5 мин в стерильной питьевой воде и помещают в жидкие питательные среды. В контрольных опытах вместо дезинфицирующего раствора используют стерильную питьевую воду.
Показатели эффективности обеззараживания белья приведены в таблице 2.
Таблица 2 — Критерии эффективности обеззараживания белья
|
Показатель |
Значение показателя |
|
Критерий эффективности |
100% гибель тест-культуры |
|
Время обеззараживания белья без видимых загрязнений, контаминированного S.aureus, E.coli |
Не более 120 мин |
|
Время обеззараживания белья, загрязненного выделениями и контаминированного S.aureus, E.coli |
Не более 240 мин |
5.5 Исследование бактерицидной эффективности ДС, предназначенных для обеззараживания посуды
В зависимости от назначения ДС исследования проводят при обеззараживании посуды столовой и кухонной, лабораторной и из-под выделений.
В качестве тест-объектов при разработке режимов обеззараживания столовой и кухонной посуды используют:
— тарелки из различных материалов (фарфор, фаянс, алюминий, стекло, пластик, посуда, покрытая эмалью);
— стаканы из различных материалов (фарфор, фаянс, алюминий, стекло, пластик, посуда, покрытая эмалью);
— кружки из различных материалов (фарфор, фаянс, алюминий, стекло, пластик, посуда, покрытая эмалью);
— столовые приборы — ножи, вилки, ложки из различных материалов (нержавеющая сталь, алюминий, пластик);
— лабораторную посуду — предметные и покровные стекла, пипетки, пробирки, чашки Петри, планшеты для иммунологического анализа и др.;
— посуду из-под выделений — подкладные судна, мочеприемники, горшки, плевательницы и др. или тест-объекты их имитирующие.
В качестве тест-микроорганизмов при контаминации столовой посуды используют S.aureus, E.coli.
Для имитации загрязнения чайной посуды используют кисель (к 10 г киселя добавляют 1 мл 2-миллиардной микробной взвеси), лабораторной посуды — 40% инактивированной сыворотки, посуды из-под выделений — 40% фекальную эмульсию или мокроту, контаминированные тест-микроорганизмами (на 10 мл — 1 мл 2х млрд. взвеси).
Перед контаминацией микроорганизмами посуду и столовые приборы подвергают механической очистке — моют водой с мылом и щеткой. Посуду располагают горизонтально, наносят пипеткой взвесь тест-микроорганизмов из расчета 0,5 мл 2 млрд. взвеси на площадь в 100 см и равномерно распределяют ее по поверхности посуды стеклянным шпателем. Столовые приборы для контаминации погружают в бактериальную суспензию на 1-2 мин, оставляя незараженными их ручки.
Посуду подсушивают (до полного высыхания) при комнатной температуре 18-20°С и относительной влажности воздуха 50-60%, затем обрабатывают дезинфицирующим раствором.
Для разработки режимов обеззараживания посуды с остатками пищи до ее контаминации микробную взвесь смешивают с овсяной, манной или другой кашей, сваренной на молоке со сливочным маслом (к 10 г каши добавляют 1 мл 2-миллиардной микробной взвеси).
Обработку столовой, чайной, лабораторной посуды и столовых приборов проводят способом погружения в дезинфицирующий раствор. Растворы готовят на питьевой воде. Температура испытуемого раствора 18-20°С. При необходимости изучают эффективность растворов, имеющих температуру 50°С.
Контролем служит аналогично контаминированная посуда, которую погружают в такой же объем стерильной питьевой воды.
Дезинфицирующий раствор должен полностью и с избытком покрыть всю посуду и приборы (из расчета не менее 2 л на 1 комплект).
Через определенные интервалы времени извлекают из дезинфицирующего раствора по одному предмету и стерильной марлевой салфеткой (размер 5×5 см), смоченной в растворе нейтрализатора, соответствующего данному ДС; тщательно протирают зараженную часть каждого предмета, погружают салфетку в 10 мл этого же нейтрализатора, находящегося в пробирках с бусами. Время отмыва марлевой салфетки 10 мин при постоянном встряхивании. После отмыва марлевую салфетку погружают в соответствующую жидкую питательную среду. Отмывную жидкость сеют на 2-3 чашки по 0,2-0,5 мл в каждую на твердые питательные среды.
Посевы помещают в термостат при температуре 37°С и учитывают через 2 суток.
Время обеззараживания посуды определяют в интервале от 15 до 240 мин в зависимости от вида тест-микроорганизма и наличия загрязнения.
Критерий эффективности обеззараживания — не менее 100%.
Таблица 3 — Показатели эффективности обеззараживания посуды
|
Микроорганизм |
Объекты обеззараживания |
Эффективность (%) — время обеззараживания (мин) |
|
S.aureus, E.coli |
Столовая посуда без остатков пищи |
100% — не более 60 мин |
|
S.aureus, E.coli, S.typhimurium |
Столовая посуда с остатками пищи |
100% — не более 120 мин |
|
S.aureus, E.coli |
Лабораторная посуда |
100% — не более 120 мин |
|
E.coli, S.typhimurium |
Посуда из-под выделений |
100% — не более 240 мин |
6 Методы изучения и оценки туберкулоцидной активности дезинфицирующих средств
6.1 Требования к тест-микроорганизмам
Исследование и оценку туберкулоцидной и микобактерицидной (в отношении непатогенных микобактерий) активности ДС проводят, используя в качестве тест-микроорганизмов следующие:
— агаровую культуру Mycobacterium terrae для оценки активности ДС и разработки режимов их применения при обеззараживании объектов в отношении возбудителя туберкулеза и микобактериозов;
— агаровую культуру Mycobacterium tuberculosis для подтверждения эффективности разработанных режимов применения ДС в отношении возбудителей туберкулеза и микобактериозов в практических условиях.
Тест-микобактерии должны иметь типичные морфологические, культуральные, биохимические, тинкториальные и ферментативные свойства, присущие данному штамму, и обладать стандартной устойчивостью к эталонным ДС и температуре.
6.2 Методика приготовления суспензии тест-микроорганизмов. Определение биологической концентрации тест-микроорганизмов в суспензии
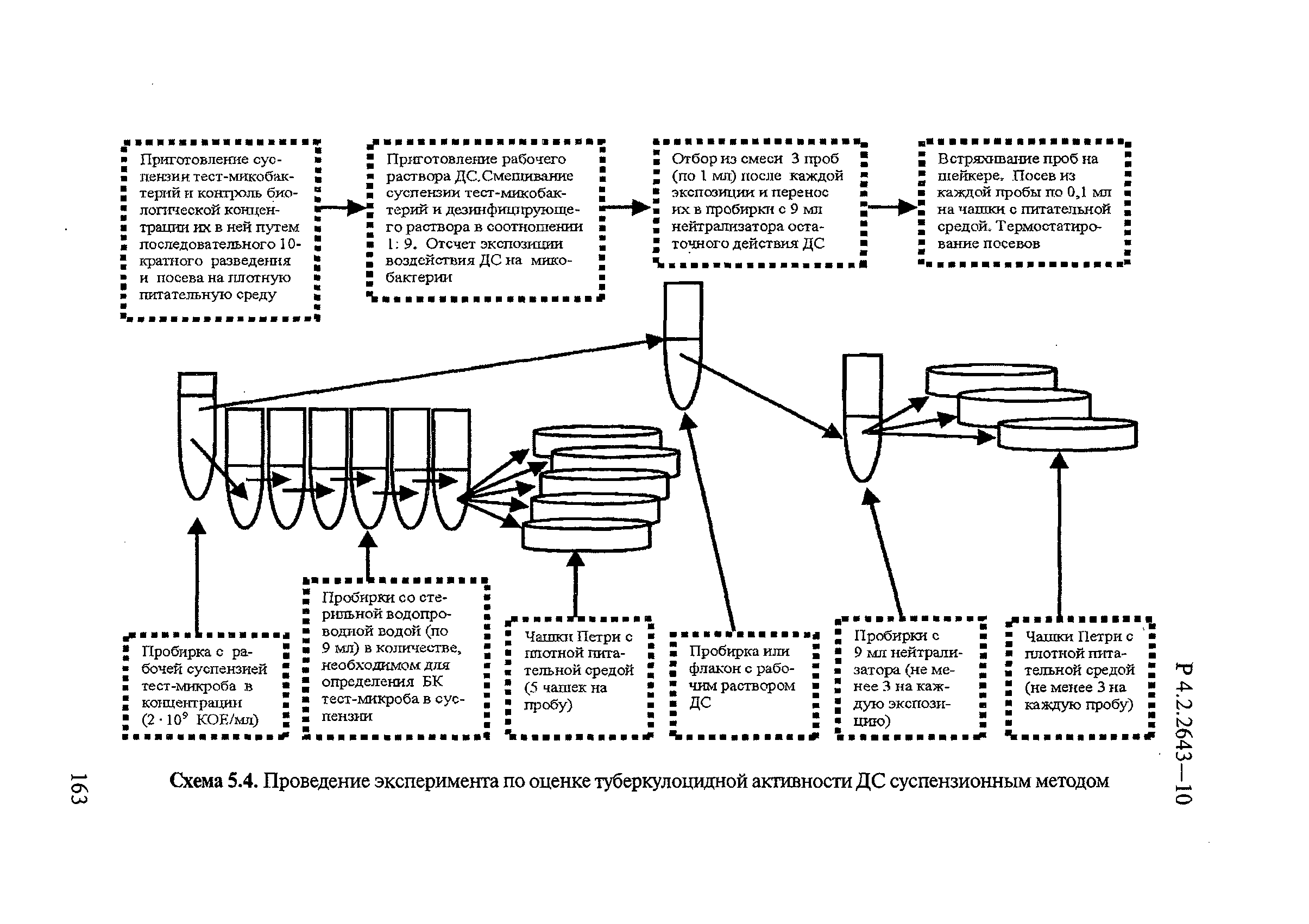
Для получения первого пассажа культуры тест-штамма микобактерий, используемой при оценке эффективности ДС, необходимое для исследования количество хранящихся при температуре минус 70°С или минус 20°С микропробирок (2 штуки на 1 исследование) с данным штаммом микобактерий размораживают при комнатной температуре, переносят по 0,1 мл содержимого в пробирки со скошенной питательной средой Левенштейна-Йенсена или «Новая» или аналогичной питательной средой, предназначенной для культивирования микобактерий, и инкубируют в термостате при плюс (37±1)°С в течение 10-21 суток. Выросшую на плотной питательной среде в пробирках культуру используют для приготовления рабочей суспензии тест-микобактерий данного штамма.
Одну или несколько пробирок используют для получения второго пассажа культуры тест-микобактерий этого штамма. Для этого культуру первого пассажа в пробирке снимают платиновой лопаточкой или стеклянной палочкой с плотной питательной среды, помещают в толстостенную стеклянную пробирку и тщательно растирают, постепенно добавляя по каплям стерильную дистиллированную воду. Полученную суспензию рассевают на плотную питательную среду тем же способом, который используют для получения первого пассажа.
Культуры тест-микобактерий подвергают контролю их качества. Непосредственно перед использованием культур для исследовательских целей проверяют, что тест-микобактерии, выросшие на питательной среде, не загрязнены посторонней микрофлорой. Для оценки роста тест-микобактерий визуально просматривают каждую пробирку и учитывают характер и массивность роста, изменение цвета питательной среды. Проводят микроскопию мазка выросших культур методом окраски по Циль-Нильсену
Пример — М.terrae представляют собой короткие прямые палочки малиново-красного цвета, располагающиеся в мазке параллельно друг другу наподобие частокола. Размер клеток микобактерий 0,2-0,6х1-10 мкм.
Рабочую суспензию тест-микобактерий готовят из тест-штамма первого и/или второго пассажей, выросших на плотной питательной среде. Дальнейшее субкультивирование недопустимо.
Для приготовления рабочей суспензии культуру микобактерий снимают платиновой лопаточкой или стеклянной палочкой с плотной питательной среды и помещают в толстостенную стеклянную пробирку. Микробную биомассу тщательно гомогенизируют, постепенно добавляя по каплям стерильную дистиллированную воду. Густую исходную бактериальную суспензию оставляют на 15 минут для осаждения негомогенизированных конгломератов и частиц. Полученную надосадочную жидкость отбирают пастеровской пипеткой, переносят в стерильную пробирку и, добавляя стерильную дистиллированную воду, доводят до концентрации 1×109 клеток в 1 мл, соответствующей по мутности 10 единицам мутности отраслевого стандартного образца ОСО 42-28-84-11 (10 ME) или 3 единицам Мак-Фарланда, определяемых с помощью денситометра.
Контроль над содержанием живых микроорганизмов осуществляют посредством бактериологического контроля фактического их количества в приготовленной суспензии.
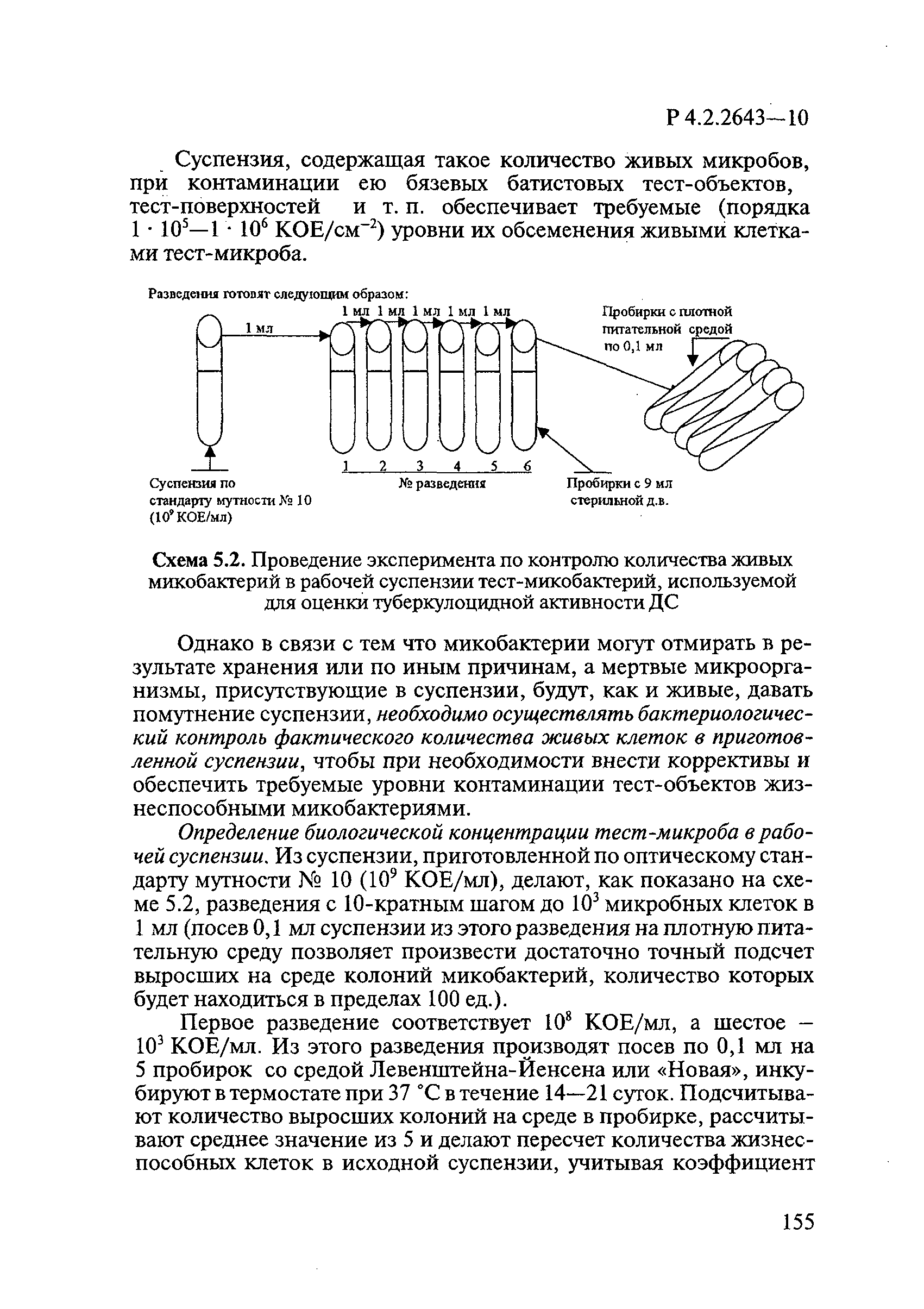
Из приготовленной суспензии делают, как показано на рисунке 1, разведения с 10-кратным шагом до 10 микробных клеток в 1 мл (посев 0,1 мл суспензии из этого разведения на плотную питательную среду позволяет произвести достаточно точный подсчет выросших на среде колоний микобактерий, количество которых будет находиться в пределах 100 единиц).
|
|
Рисунок 1 — Процесс разведения
Посевы инкубируют в термостате при плюс (37±1)°С в течение 10-21 суток. Подсчитывают количество выросших колоний на среде в пробирке, рассчитывают среднее значение из 5 и делают пересчет количества жизнеспособных клеток в исходной суспензии, учитывая коэффициент разведения. Количество жизнеспособных клеток в рабочей суспензии должно быть КОЕ/мл.
6.3 Исследование туберкулоцидной эффективности ДС, предназначенных для обеззараживания поверхностей в помещениях, мебели, аппаратов, приборов, санитарно-технического оборудования, транспортных средств и других объектов
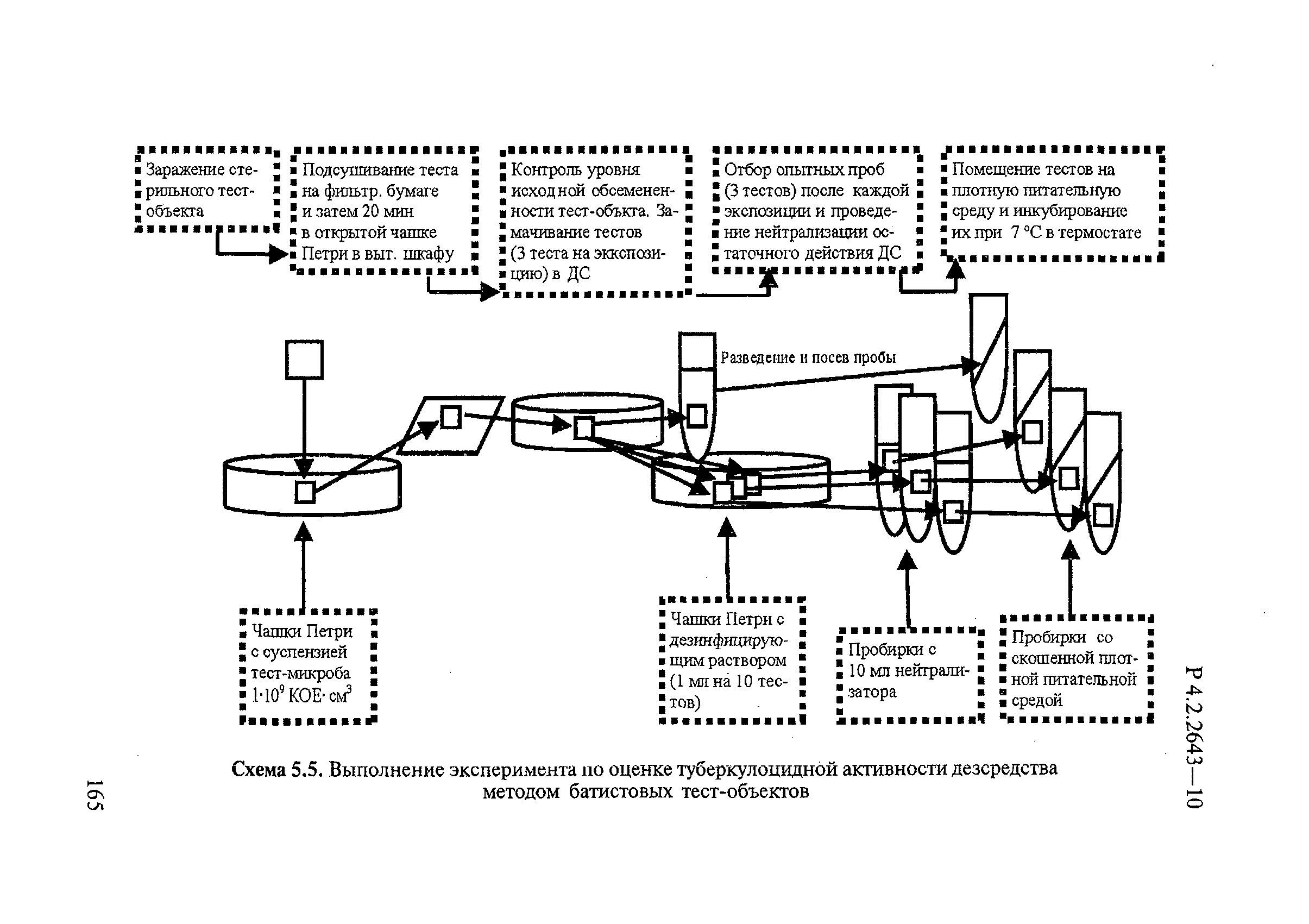
Подготовка тест-поверхностей и технология проведения эксперимента изложены в п.5.3.
Для контроля эффективности обеззараживания через определенные промежутки времени (15-30-60 и т.д. до 120 мин) с обработанных раствором ДС тест-поверхностей делают смывы путем тщательного протирания поверхности стерильной марлевой салфеткой (5×5 см), увлажненной нейтрализатором. После протирания на тест-поверхности не должно оставаться излишней влаги. Салфетки погружают на 5 минут в пробирки (емкости) с соответствующим нейтрализатором (10 мл), а затем в стерильную питьевую воду с бусами и встряхивают на шейкере в течение 10 мин. Полученную смывную жидкость вносят по 0,1 мл в 3-5 пробирок со скошенной плотной питательной средой Левенштейна-Йенсена или «Новая» или аналогичную питательную среду, предназначенную для культивирования микобактерий, тщательно распределяя ее по всей поверхности. Посевы инкубируют в термостате при температуре 37±1°С в течение 10-21 суток.
В контрольных опытах для обработки аналогично контаминированных тест-поверхностей вместо раствора ДС используют стерильную питьевую воду из того же расчета, что и опытные. Жидкость, в которую помещают стерильную марлевую салфетку после взятия смыва с контрольных поверхностей, перед посевом разводят в 100 раз и вносят по 0,1 мл на скошенную поверхность плотной питательной среды Левенштейна-Йенсена или «Новая» или аналогичной питательной средой, предназначенной для культивирования микобактерий 3-5 пробирок. Посевы инкубируют в термостате при температуре плюс (37±1)°С. Результаты учитывают через 10-21 суток.
Оценку результатов проводят по посеву того разведения, в котором число колоний на чашке Петри или в пробирке составляет от 30 до 300.
Допускается проводить исследования с использованием тест-поверхностей размером 5х5 см (5.3). После выдерживания посевов в термостате подсчитывают число колоний на чашках или пробирках с плотной питательной средой, рассчитывают остаточную плотность контаминации на 100 см тест-поверхности и высчитывают эффективность обеззараживания, принимая количество тест-микроорганизмов, снятых с контрольных тест-объектов (тест-поверхностей), за 100%.
Критерий эффективности ДС при обеззараживании тест-поверхностей из различных материалов, контаминированных тест-микроорганизмом, должен составлять не менее 99,99%.
6.4 Исследование туберкулоцидной эффективности ДС, предназначенных для обеззараживания белья
Исследования с ДС проводят в целях оценки эффективности его для обеззараживания белья и других объектов из ткани, чистых и загрязненных кровью или выделениями (фекалии, моча, мокрота).
Оценку эффективности ДС для обеззараживания белья, одежды, спецодежды и других объектов из ткани осуществляют в соответствии с п.5.4 После обработки раствором ДС тест-объекты вынимают из мешочка стерильным пинцетом, помещают на 5 мин в емкость с раствором соответствующего нейтрализатора, затем переносят в стерильную питьевую воду и высевают на питательный агар. Посевы инкубируют при (37±1)°С. Предварительный учет результатов проводят через 10-14 суток, а окончательный — через 21 сутки. В контрольных опытах белье погружают в стерильную питьевую воду. Мешочки с тестами закладывают так же, как и в опыте. При получении 100%-ной гибели тест-микроорганизма в опытах по обеззараживанию белья без белковых загрязнений переходят к опытам по обеззараживанию белья, загрязненного выделениями.
Для определения эффективности ДС при обеззараживании белья, одежды, спецодежды и других объектов из ткани, загрязненных кровью, выделениями (фекалии, мокрота, моча и др.), в лабораторных условиях используют бязевые тест-объекты, которые контаминируют суспензией тест-микобактерий с добавлением 40% инактивированной сыворотки (6 мл суспензии, содержащей 2х109 КОЕ/мл тест-микроорганизма, смешивают с 4 мл инактивированной сыворотки) или 40% фекальной эмульсии (6 мл суспензии тест-микроорганизма смешивают с 4 мл 40% фекальной эмульсии) исходя из расчета 30 мл суспензии на 10 тест-объектов. Для приготовления фекальной эмульсии 8 г фекалий растирают в ступке с 20 мл воды. Количество суспензии тест-микроорганизма, содержащей сыворотку или фекалии, готовят из расчета 30 мл на 10 тест-объектов. При изучении эффективности обеззараживания изделий из синтетических тканей (капрон, ацетат, лавсан и др.) используют тест-объекты из этих тканей размером 5×5 см. Контаминированные тест-объекты подсушивают в термостате при (37±1)°С в течение 20-25 мин или 1,5-2 ч при комнатной температуре до полного высыхания.
Критерием эффективности ДС при обеззараживании белья, одежды, спецодежды и других объектов из тканей является 100%-ная гибель тест-микроорганизмов на тест-объектах.
6.5 Исследование туберкулоцидной эффективности ДС, предназначенных для обеззараживания посуды
Для определения туберкулоцидной активности ДС, предназначенных для обеззараживания посуды (столовой, лабораторной и из-под выделений), используют в качестве тест-объектов, указанные в 5.5.
Обработку контаминированной столовой, чайной, лабораторной посуды, столовых приборов проводят способом погружения в дезинфицирующий раствор, аналогично изложенным в 5.5.
Время обеззараживания посуды — от 15 до 240 мин, в зависимости от вида ДС и наличия загрязнения.
Через определенные интервалы времени (15, 30, 60 минут и т.д.) извлекают по одному предмету разных наименований (тарелка, стакан, предметное стекло, нож и т.д.) из дезинфицирующего раствора стерильной марлевой салфеткой (5 см), смоченной в растворе нейтрализатора, соответствующего данному ДС, тщательно протирают зараженную часть каждого предмета и погружают в 10 мл этого же нейтрализатора на 5 мин, затем салфетку переносят в пробирку со стерильной питьевой водой и бусами. Время отмыва марлевой салфетки — 10 мин при постоянном встряхивании на шейкере. После отмыва смывную жидкость по 0,1 мл высевают в 3-5 пробирки со скошенной поверхностью плотной питательной среды Левенштейна-Йенсена или «Новая» или аналогичной питательной средой, предназначенной для культивирования микобактерий (по 0,1 мл в каждую). Посевы помещают в термостат при температуре 37°С. Предварительный учет результатов проводят через 10-14 суток, окончательный — через 21 сутки.
Контролем служит аналогично контаминированная посуда, которая погружается не в дезинфицирующий раствор, а в такой же объем стерильной питьевой воды.
Критерий эффективности обеззараживания посуды: гибель тест-микроорганизма не менее 100%.
7 Методы изучения и оценки фунгицидной активности дезинфицирующих средств
7.1 Требования к тест-микроорганизмам
При изучении фунгицидной активности ДС и их субстанций в качестве тест-микроорганизмов используют:
— Candida albicans (штамм 15 или шт. ВКПМ Y 3108 (АТСС 10231) — для оценки фунгицидной активности в отношении возбудителей кандидозов;
— Trichophyton gypseum (муз.штамм НИИД) — для оценки фунгицидной активности в отношении возбудителей дерматофитий;
— Aspergillus niger (муз.штамм НИИД) или Aspergillus brasiliensis (штамм NCPF2275/ATCC 16404) для оценки фунгицидной активности в отношении плесневых грибов.
При сертификационных испытаниях и экспертной оценке ранее зарегистрированных ДС набор тест-микроорганизмов ограничивают наиболее устойчивыми представителями каждой группы.
Тест-микроорганизмы культивируют на следующих питательных средах:
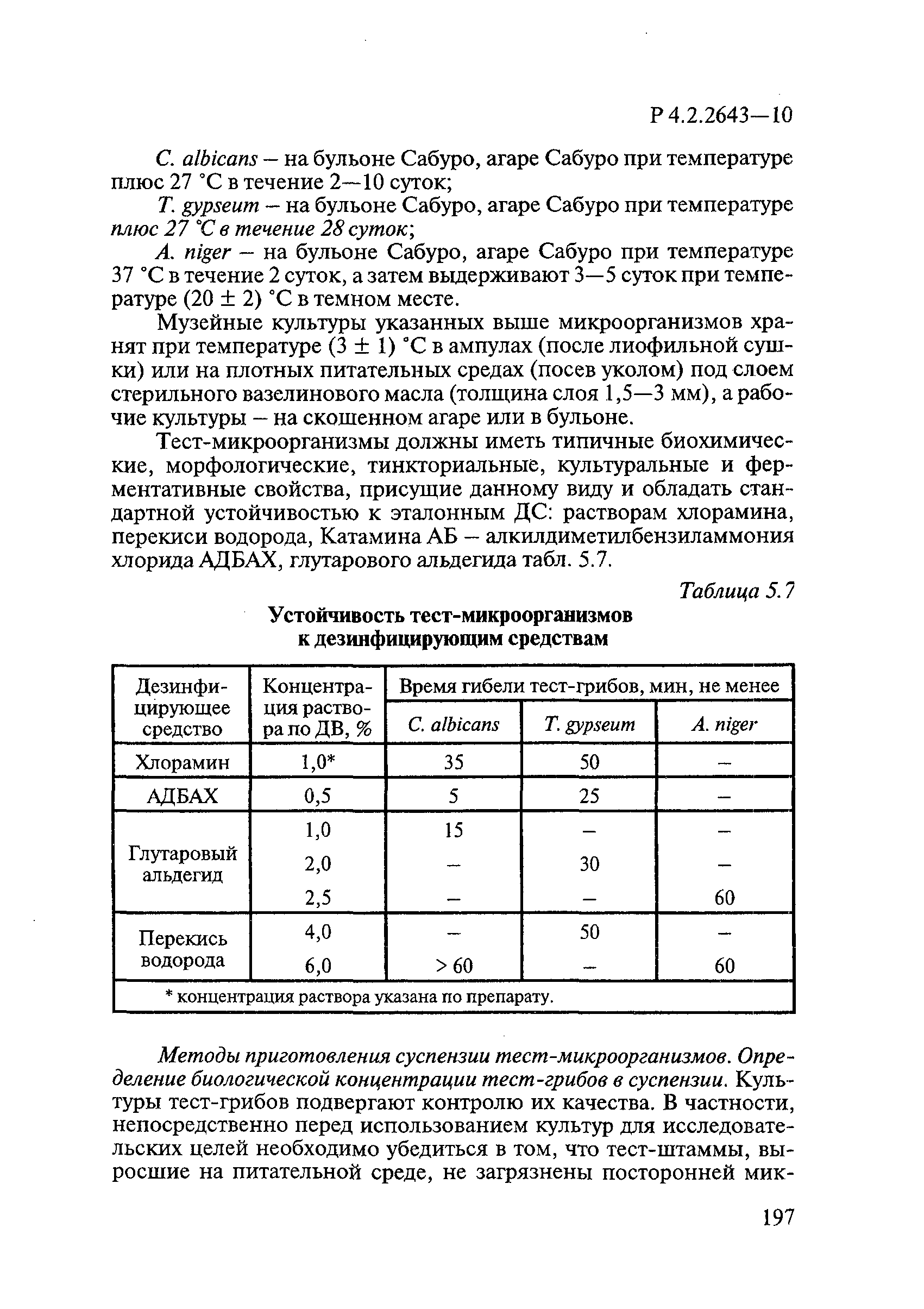
— С.albicans — на бульоне Сабуро, агаре Сабуро при температуре (27±1)°С в течение 2-10 суток;
— Т.gypseum — на бульоне Сабуро, агаре Сабуро при температуре (27±1)°С в течение 28 суток;
— A.niger и A.brasiliensis — на бульоне Сабуро, агаре Сабуро при температуре (37±1)°С в течение 2 суток, затем выдерживают 3-5 суток при температуре (20±2)°С в темном месте.
Музейные культуры микроорганизмов хранят при температуре (3±1)°С в ампулах (после лиофильной сушки) или на плотных питательных средах (посев уколом) под слоем стерильного вазелинового масла (толщина слоя 1,5-3 мм), а рабочие культуры — на скошенном агаре или в бульоне.
Тест-микроорганизмы должны иметь типичные биохимические, морфологические, тинкториальные, культуральные и ферментативные свойства, присущие данному виду, и обладать стандартной устойчивостью к эталонным ДС.
7.2 Методы приготовления суспензии тест-микроорганизмов
Непосредственно перед использованием культур для исследовательских целей получают подтверждение, что тест-микроорганизмы, выросшие на питательной среде, не загрязнены посторонней микрофлорой. Для оценки роста культур тест-грибов визуально просматривают каждую пробирку и учитывают характер и массивность роста, изменение цвета питательной среды.
Рабочие суспензии тест-микроорганизмов готовят из культуры тест-грибов, выращенных на питательной среде.
Культуру Т.gypseum, выращенную на бульоне Сабуро при температуре (27±1)°С в течение 28 суток, извлекают петлей из пробирки, помещают в фарфоровую ступку и растирают с небольшим количеством стерильного физиологического раствора до гомогенной взвеси с минимальным размером частиц. Полученную суспензию фильтруют через стерильный ватно-марлевый фильтр и доводят с помощью физиологического раствора до концентрации 2х клеток в 1 мл, соответствующей по мутности 20 единицам мутности отраслевого стандартного образца ОСО 42-28-84-11 (20 ME) или 6 единицам Мак-Фарланда, определяемых с помощью денситометра.
Культуру С.albicans выращивают на агаре Сабуро в течение 2 суток при температуре (27±1)°С в течение 48 часов. Затем смывают с питательной среды небольшим количеством стерильного физиологического раствора и тщательно перемешивают. Полученную суспензию фильтруют и разводят так же, как и культуру Т.gypseum.
Культуру A.niger, выращенную на бульоне Сабуро в течение 2 суток и выдержанную в течение 3-5 суток в темном месте, извлекают петлей из пробирки, помещают в фарфоровую ступку и растирают с небольшим количеством стерильного физиологического раствора до гомогенной суспензии с минимальным размером частиц. Полученную взвесь фильтруют и разводят также, как и культуру Т.gypseum.
В связи с тем, что суспензия содержит наряду с живыми мертвые микроорганизмы, определяют биологическую концентрацию тест-грибов. Для этого проводят десятикратные разведения суспензии тест-микроорганизама в стерильной дистиллированной воде с последующим высевом суспензии в чашки Петри с плотной питательной средой (агар Сабуро). После определенного времени инкубации при соответствующей температуре подсчитывают количество выросших колониеобразующих единиц (КОЕ) и определяют количество жизнеспособных клеток в одном мл суспензии, которое должно быть не менее .
Проверку устойчивости проводят не реже 1 раза в 6 месяцев. При снижении устойчивости культур делают их пересевы на обогащенные питательные среды до восстановления устойчивости.
7.3 Исследование фунгицидной эффективности ДС, предназначенных для обеззараживания поверхностей в помещениях, мебели, аппаратов, приборов, санитарно-технического оборудования, транспортных средств и других объектов
Исследования проводят в зависимости от вида поверхностей, их положения (горизонтальное, вертикальное), способа и кратности обработки.
При разработке режимов обеззараживания поверхностей используют поверхности размером 10х10 см из различных материалов:
— гладкие;
— шероховатые;
— впитывающие;
— не впитывающие.
Пример — Деревянные, оштукатуренные, окрашенные масляной, силикатной, водоэмульсионной или клеевой краской; оклеенные обоями, поверхности из линолеумных покрытий, окрашенного или неокрашенного металла — нержавеющая хром — никелевая кислотостойкая сталь, из пластика, стекла, искусственной или натуральной кожи, облицовочной плитки — кафельной и метлахской, фаянса.
Для исследования используют не менее 5 видов поверхностей.
В качестве тест-культур С.albicans, Т.gypseum; A.niger или A.brasiliensis используют для разработки режимов обеззараживания поверхностей с целью профилактики и борьбы с плесенью.
Для имитации загрязнения поверхностей санитарно-технического оборудования при контаминации С.albicans, Т.gypseum используют белковое загрязнение в виде 40% инактивированной лошадиной сыворотки.
Для имитации загрязнения поверхностей унитазов при контаминации С.albicans используют загрязнение в виде 40% фекальной эмульсии. Для этого перед контаминацией объектов к суспензии грибов С.albicans, Т.gypseum добавляют необходимое количество сыворотки и к суспензии С.albicans — необходимое количество фекальной эмульсии.
Перед контаминацией тест-микрорганизамами поверхности подвергают механической очистке — моют водой с мылом и щеткой (за исключением поверхностей, оклеенных обоями и окрашенных клеевой краской), затем протирают несколько раз стерильной салфеткой, увлажненной стерильной водопроводной водой.
Высушенные поверхности располагают горизонтально и на них пипеткой наносят взвесь тест-грибов из расчета 0,5 мл 2-миллиардной микробной взвеси на площадь в 100 см. Культуру равномерно распределяют по поверхности стеклянным шпателем. Поверхности подсушивают (до полного высыхания) при комнатной температуре 18-20°С и относительной влажности воздуха 50-60%, затем обрабатывают дезинфицирующим раствором.
При изучении эффективности обеззараживания горизонтально располагают:
— линолеум;
— плитку метлахскую;
— искусственную кожу; натуральную кожу;
— стекло.
Вертикально располагают:
— дерево, окрашенное масляной краской;
— дерево, окрашенное силикатной краской;
— дерево, окрашенное водоэмульсионной краской;
— дерево, окрашенное клеевой краской;
— поверхности, оклеенные обоями;
— пластик;
— кафельную плитку; фаянсовую плитку.
Обработку поверхностей проводят способами протирания или орошения (крупнокапельное и аэрозольное).
Для определения нормы расхода при однократной обработке дезинфицирующий раствор наносят с помощью пипетки на поверхность размером 10×10 см при применении способа протирания в количестве 1,0, 1,5 или 2,0 мл, а при крупнокапельном орошении наносят с помощью дозатора 1,5-3,0 мл. При аэрозольном методе обработки изучают эффективность обеззараживания при норме расхода 30-50-100 мл/м (в зависимости от вида аэрозольного генератора и применяемой аэрозольной насадки). Многократное протирание или орошение проводят с интервалом между обработками 5-15-30 мин.
Время обеззараживания поверхностей определяют в интервале от 5 до 120 мин. Выбор экспозиции зависит от назначения и рекомендуемых условий применения средства.
Контрольные поверхности обрабатывают стерильной питьевой водой также и из того же расчета, что и опытные.
Исследования проводят при комнатной температуре. При необходимости оценивают эффективность обеззараживания поверхностей при повышенной до 50°С или пониженной до минус 30°С температуре (исследования проводят в термо- или холодильной камере).
Для контроля эффективности обеззараживания тест-поверхностей марлевой салфеткой (размером 5×5 см), смоченной в растворе соответствующего для данного дезинфицирующего средства нейтрализатора, тщательно протирают тест-поверхность, затем ее погружают в 10 мл этого же нейтрализатора, находящегося в пробирках с бусами. Время отмыва марлевой салфетки — 10 мин при постоянном встряхивании. Отмывную жидкость сеют (на 2-3 чашки по 0,1-0,2 мл в каждую) на твердые дифференциально-диагностические питательные среды.
Допускается проводить исследования с использованием тест-поверхностей размером 5х5 см из тех же материалов, что и тест-поверхности 10х10 см. Метод можно применяют для оценки чувствительности к ДС микроорганизмов, выделенных с объектов окружающей среды. Тест-поверхности помещают на дно стерильной чашки Петри и располагают на лабораторном столе в микробиологическом боксе или боксах биологической безопасности II класса на поддонах с салфетками, смоченными дезинфицирующим раствором.
Пипеткой наносят на них 0,1 мл 2-миллиардной микробной взвеси (площадь поверхности 25 см), равномерно распределяют ее по поверхности стерильным шпателем, не допуская отекания суспензии за пределы тест-объекта, затем подсушивают, приоткрыв чашку Петри (до полного высыхания) при температуре 18-22°С и относительной влажности 40-60%, после чего обрабатывают раствором ДС так же, как указано выше.
После окончания экспозиции чашки с тест-объектами заливают 10 мл раствора нейтрализатора, соответствующего данному ДС, и делают несколько круговых движений чашкой для лучшего смачивания тест-объекта. Через несколько минут стерильным пинцетом переворачивают тест-объект и повторяют круговые движения. После контакта нейтрализатора с тест-объектом в течение 10 мин снова делают несколько круговых движений чашкой, затем стерильным пинцетом удаляют тест-объект из чашки и сбрасывают его в емкость с дезинфицирующим раствором с целью дальнейшего обеззараживания. Нейтрализатор из чашки Петри сеют (на 2-3 чашки по 0,1-0,2 мл в каждую) на твердые дифференциально-диагностические питательные среды либо заливают чашку с нейтрализатором растопленным и остуженным до 45°С агаром.
Посевы выращивают в термостате при температуре плюс (28±1)°С. Учет результатов проводят в течение 2-7 суток (С.albicans, A.niger) и 21-28 суток (Т.gypseum) путем подсчета количества выросших колоний, затем рассчитывают плотность контаминации 100 см поверхности и процент обеззараживания, принимая количество колоний, снятых с контрольных поверхностей, за 100%.
Критерий эффективности обеззараживания поверхностей — не менее 99,99% гибели тест-микроорганизмов
Таблица 4 — Показатели эффективности обеззараживания поверхностей
|
Микроорганизм |
Эффективность (%) |
Время обеззараживания (мин) |
|
С.albicans, Т.gypseum |
99,99 |
Не более 240 |
|
A.niger, A.brasiliensis |
99,99 |
Не более 360 |
7.4 Исследование фунгицидной эффективности ДС, предназначенных для обеззараживания белья
Эффективность обеззараживания белья ДС определяют в соответствии с изложенным в 5.4. Мешочки с контаминированными тест-объектами распределяют между слоями белья (сверху, в середине, внизу). Через заданное время воздействия дезинфектанта (например, 15, 30, 60 мин) извлекают по 1 мешочку с каждого уровня, стерильным пинцетом вынимают тест-объекты, переносят их в раствор нейтрализатора на 5 мин, затем промывают 5 мин в стерильной питьевой воде, затем помещают в жидкие питательные среды. В контрольных опытах вместо дезинфицирующего раствора используют стерильную питьевую воду.
Критерий эффективности — 100% гибель тест-микроорганизмов.
Таблица 5 — Показатели эффективности обеззараживания белья
|
Микроорганизм |
Объект обеззараживания |
Эффективность (%) |
Время обеззараживания (мин) |
|
С.albicans, Т.gypseum |
Белье без видимых загрязнений |
100 |
Не более 240 |
|
С.albicans, Т.gypseum |
Белье, загрязненное выделениями |
100 |
Не более 240 |
7.5 Исследование фунгицидной эффективности ДС, предназначенных для обеззараживания посуды
В зависимости от назначения ДС исследования проводят при обеззараживании посуды столовой и кухонной, лабораторной и из-под выделений.
В качестве тест-объектов при разработке режимов обеззараживания столовой и кухонной посуды используют:
— тарелки из различных материалов (фарфор, фаянс, алюминий, стекло, пластик, посуда, покрытая эмалью);
— стаканы из различных материалов (фарфор, фаянс, алюминий, стекло, пластик, посуда, покрытая эмалью);
— кружки из различных материалов (фарфор, фаянс, алюминий, стекло, пластик, посуда, покрытая эмалью);
— столовые приборы — ножи, вилки, ложки из различных материалов (нержавеющая сталь, алюминий, пластик);
— лабораторную посуду — предметные и покровные стекла, пипетки, чашки Петри, планшеты для иммунологического анализа и др.;
— посуду из-под выделений — подкладные судна, мочеприемники, горшки, плевательницы и др. или тест-объекты их имитирующие.
В качестве тест-микроорганизмов при контаминации столовой посуды используют С.albicans, лабораторной — С.albicans, Т.gypseum.
При разработке режимов обеззараживания посуды с остатками пищи суспензию С.albicans смешивают с овсяной, манной или другой кашей, сваренной на молоке со сливочным маслом (к 10 г каши добавляют 1 мл 2-миллиардной микробной взвеси).
Для имитации загрязнения чайной посуды используют кисель (к 10 г киселя добавляют 1 мл 2-миллиардной суспензии С.albicans), лабораторной посуды — 40% инактивированной сыворотки (6 мл 2-миллиардной суспензии С.albicans или Т.gypseum смешивают с 4 мл инактивированной сыворотки), а посуды из-под выделений — 40% фекальную эмульсию, контаминированную С.albicans (на 10 мл — 1 мл 2х109 суспензии).
Перед контаминацией тест-грибами посуду (столовую и лабораторную) и столовые приборы подвергают механической очистке — моют водой с мылом и щеткой. Посуду располагают горизонтально и на нее пипеткой наносят взвесь тест-грибов из расчета 0,5 мл 2-миллиардной суспензии на площадь в 100 см. Культуру равномерно распределяют по поверхности посуды стеклянным шпателем. Столовые приборы для контаминации погружают в бактериальную суспензию на 1-2 мин, оставляя незараженными их ручки.
Посуду подсушивают (до полного высыхания) при комнатной температуре 18-20°С и относительной влажности воздуха 50-60%, затем обрабатывают дезинфицирующим раствором.
Обработку столовой, чайной, лабораторной посуды и столовых приборов проводят способом погружения в дезинфицирующий раствор. Растворы готовят на питьевой воде. Температура испытуемого раствора 18-20°С. При необходимости изучают эффективность растворов, имеющих температуру 50°С.
Контролем служит аналогично контаминированная посуда, которую погружают в такой же объем стерильной питьевой воды.
Дезинфицирующий раствор должен полностью и с избытком покрыть всю посуду (столовую и лабораторную) и столовые приборы (из расчета не менее 2 л на 1 комплект).
Через определенные интервалы времени извлекают из дезинфицирующего раствора по одному предмету и стерильной марлевой салфеткой (размер 5×5 см), смоченной в растворе нейтрализатора, соответствующего данному ДС; тщательно протирают контаминированную часть каждого предмета, погружают салфетку в 10 мл этого же нейтрализатора, находящегося в пробирках с бусами. Время отмыва марлевой салфетки 10 мин при постоянном встряхивании. После отмыва марлевую салфетку погружают в соответствующую жидкую питательную среду. Отмывную жидкость сеют на 2-3 чашки по 0,2-0,5 мл в каждую на твердые питательные среды.
Посевы помещают в термостат при температуре 28°С и учитывают результат через 2-7 суток (С.albicans) и 21-28 суток (Т.gypseum).
Время обеззараживания посуды определяют в интервале от 15 до 240 мин в зависимости от вида тест-микроорганизма и наличия загрязнения.
Критерий эффективности обеззараживания — не менее 100%-ной гибели тест-микроорганизмы.
Таблица 6 — Показатели эффективности обеззараживания посуды
|
Микроорганизм |
Объект обеззараживания |
Эффективность (%) |
Время обеззараживания (мин) |
|
С.albicans |
Столовая посуда без остатков пищи |
100 |
Не более 60 |
|
Столовая посуда с остатками пищи |
100 |
Не более 120 |
|
|
С.albicans, Т.gypseum |
Лабораторная посуда |
100 |
Не более 120 |
|
С.albicans |
Посуда из-под выделений |
100 |
Не более 240 |
8 Методы изучения и оценки вирулицидной активности дезинфицирующих средств
8.1 Требования к тест-вирусам
Тест-вирусы получают из национальных или из международных коллекций вирусов. При исследованиях вирулицидной активности ДС необходимо использовать как РНК-, так и ДНК-содержащие тест-вирусы, поэтому обязательным для испытания вирулицидного действия всех ДС используют как минимум два тест-вируса:
— вирус полиомиелита 1 типа — вакцинный штамм Sabin (LSc-2ab), далее «полиовирус», РНК-содержащий вирус, не имеющий оболочки, из семейства пикорнавирусов;
— аденовирус тип 5, штамм Аденоид 75 (АТСС VR-5), далее «аденовирус» ДНК-содержащий вирус, не имеющий оболочки, из семейства аденовирусов.
Перечень вирусов может быть расширен при необходимости более детального изучения вирулицидного действия ДС или его эффективности в отношении вируса определенной инфекции за счет следующих вирусов:
— бычий парвовирус, штамм Хаден (АТСС VR-767);
— вирус гепатита А, штамм HAS-15, РНК-содержащий вирус, не имеющий оболочки, из семейства пикорнавирусов;
— вирус гепатита В уток (ВГВУ), штамм УФА-04, ДНК-содержащий, из семейства гепаднавирусов;
— вирус гепатита С человека, штамм Д1;
— вирус бычьей диареи (ВД-БС), РНК — содержащий вирус диареи — болезни слизистых оболочек крупного рогатого скота, из семейства пестивирусов, штамм ВК-1В1-N 28.
Средство, показавшее способность инактивировать полиовирус и аденовирус, включают в группу ДС с вирулицидной активностью. ДС с вирулицидной активностью используют для дезинфекции при любой вирусной (включая особо опасные) инфекции, имеющей значение в инфекционной патологии человека.
Для ДС, применяемых при повышенной (до 60°С) температуре растворов, кроме указанных двух основных вирусов в качестве тест-вируса используют бычий парвовирус (штамм Хаден).
Для изучения и оценки активности ДС в отношении вируса гепатита А используют вирус гепатита А человека (штамм HAS-15). ДС, инактивирующие вирус гепатита А, входит в группу средств с вирулицидной активностью.
Для изучения вирулицидной активности ДС в отношении вируса гепатита В применяют суррогатный вирус — вирус гепатита В уток (ВГВУ), в отношении вируса гепатита С — суррогатный вирус — вирус диарреи — болезни слизистых оболочек крупного рогатого скота ВД-БС (штамм ВК-1В1-N 28) или вирус гепатита С человека (штамм Д1).
Исходный вирус, полученный из референс центров (из национальных или международных коллекций вирусов), размноженный в объемах, достаточных для длительной работы сданным пассажем, хранят в малых объемах при минус 20°-минус 70°С или в жидком азоте.
Исходный вирус размножают в чувствительных клетках (лабораторных животных, утках и др.), продуцирующих вирус в высоких титрах. Клеточный детрит удаляют цетрифугированием* при низких оборотах (1000 об/5 мин), получая вирусную суспензию (ВС).
________________
* Текст соответствует оригиналу. — .
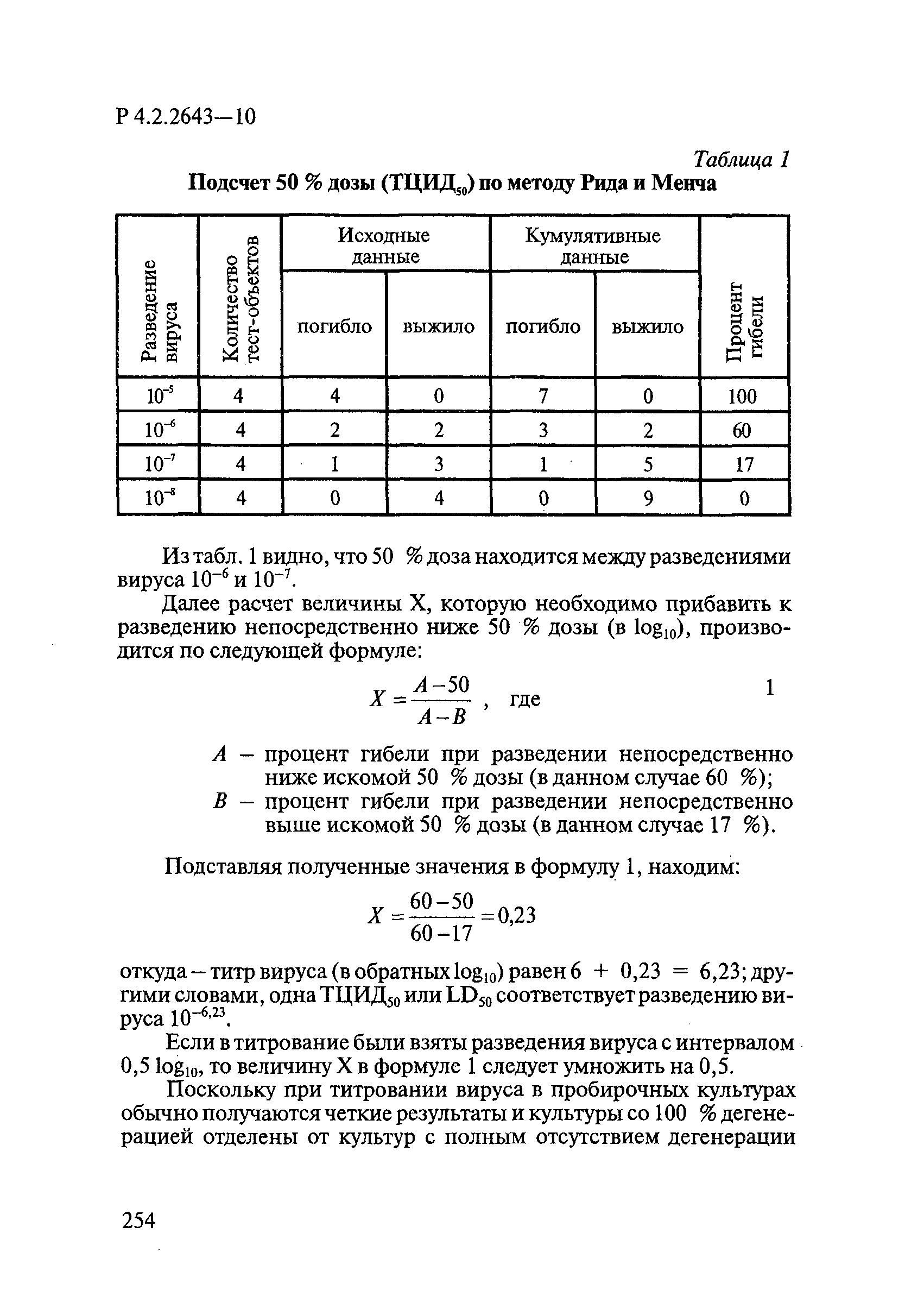
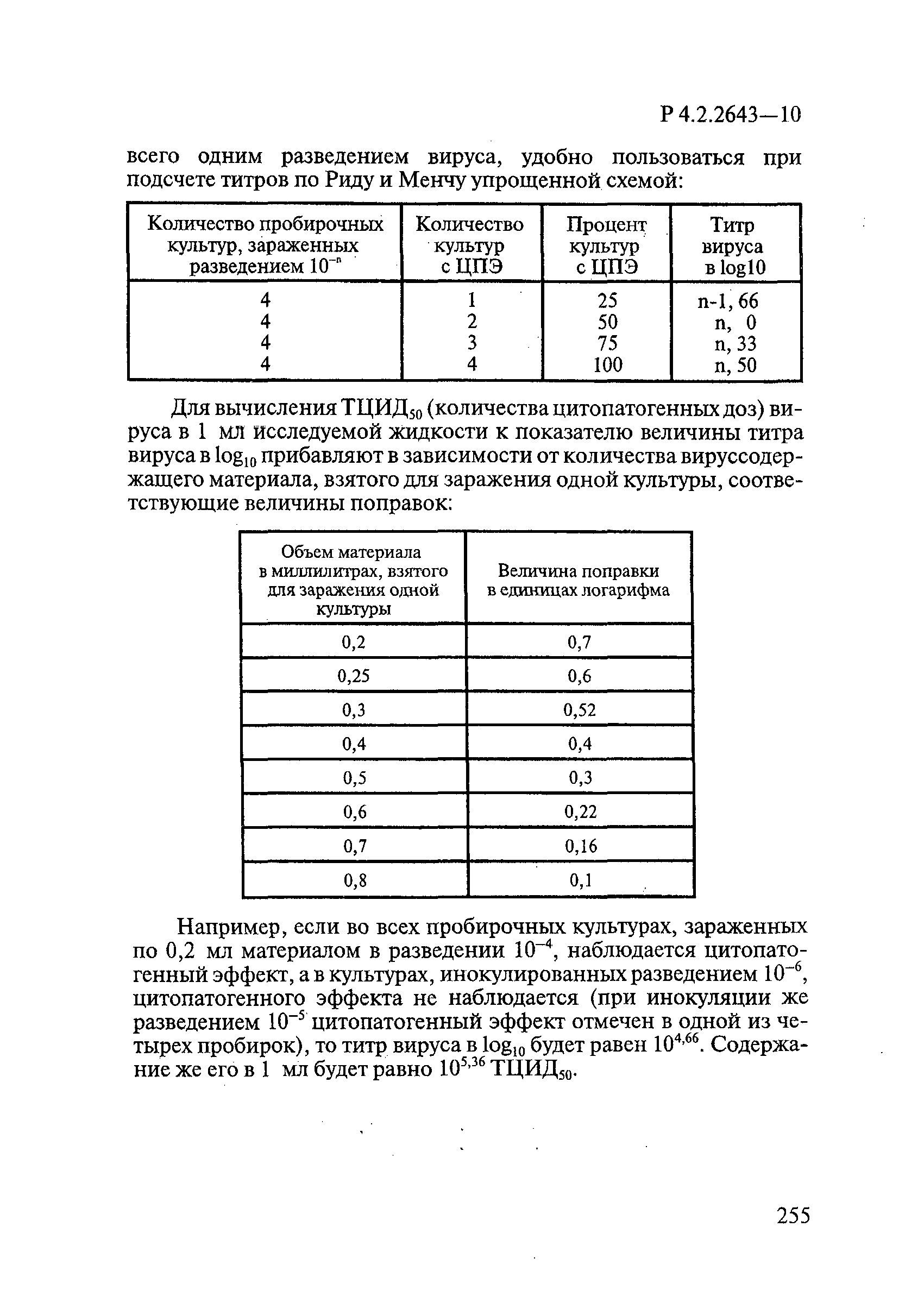
Титр ВС должен быть достаточно высоким, чтобы можно было получить снижение титра на 4,0 log10. Минимальный титр ВС должен составлять 106,5 ТЦИД/мл. Для подсчета ТЦИД или LD применяют метод полных кумулятивов Рида и Менча и метод определения «центральной величины» Кербера по [2].
Полиовирус размножают в перевиваемой культуре клеток RD и НЕр-2 или в других чувствительных клеточных культурах (4647, Vero и т.д.). Для получения ВС культуру клеток, инфицированную вирусом полиомиелита на стадии 100% поражения монослоя, вызванного цитопатическим действием вируса, трехкратно замораживают и оттаивают. После удаления разрушенных клеток центрифугированием полученную ВС используют в экспериментах.
Аденовирус размножают в перевиваемой клеточной культуре НЕр-2, 4647 и в других чувствительных клеточных культурах. Методика получения ВС аналогична методике получения вирусной суспензии для полиовируса, за исключением того, что перед процедурой разрушения клеток методом замораживания-оттаивания проводят замену культуральной среды на не содержащую сыворотки и добавляют ее в меньшем объеме.
Вирулицидное ДС (субстанция) должно подавлять инфекционность обязательных для испытаний тест-вирусов — полиовируса и аденовируса на исследуемых объектах не менее, чем на 4log10 ТЦИД (то есть степень инактивации должна быть не менее 99,99%).
Критерием вирулицидной активности ДС (субстанций) для других тест-вирусов (включая вирусы — возбудители особо опасных инфекций) является отсутствие инфекционности, определяемое современными методами индикации.
Степень инактивации тест-вируса определяют в чувствительных модельных системах по подавлению инфекционной, цитопатической или бляшкообразующей активности вируса в культуре клеток, или по отсутствию маркеров инфицирования, или по специфической гибели лабораторных животных. Для получения более точных результатов тест-вирус следует использовать с максимальным титром.
Показателем вирулицидной активности ДС (субстанций) является скорость инактивации, которая представляет собой соотношение концентрации тест-вируса, выраженное в десятичных логарифмах, до и после воздействия ДС за определенный промежуток времени (экспозиция). Степень снижения вирусной инфекционности вычисляется в десятичных логарифмах по разнице титров вируса до и после обработки ДС.
При отсутствии цитопатического эффекта пробы подвергают необходимой обработке с целью проведения второго, а при необходимости и третьего слепого пассажа для определения полноты ингибирования тест-вируса. Эксперименты сопровождают всеми необходимыми контролями, в том числе контролем полноты нейтрализации дезинфектанта, жизнеспособности тест-вируса, контаминации тест-объекта тест-вирусом, культуры клеток или лабораторных животных (мыши), утки и др.
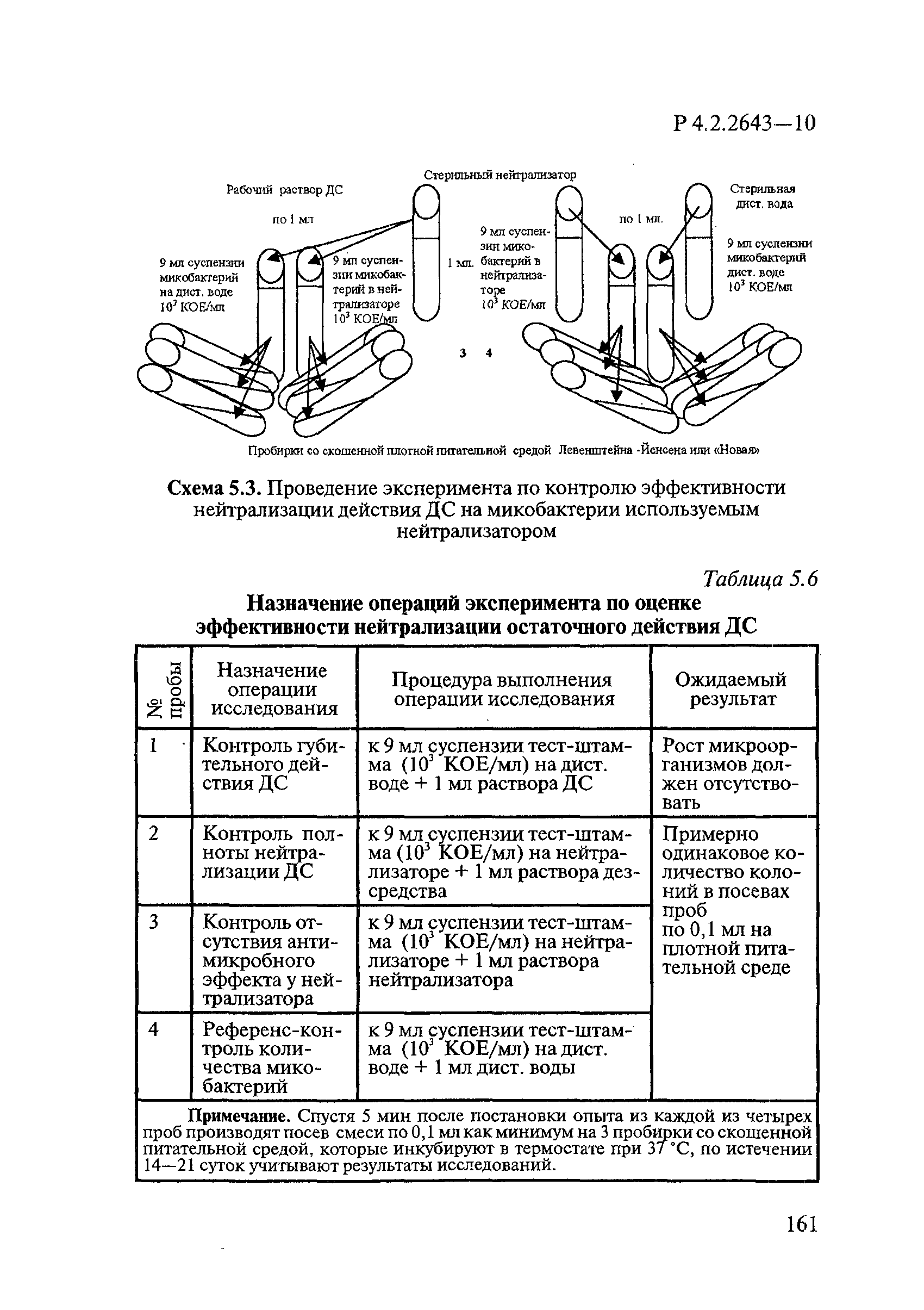
Для нейтрализации ДС используют нейтрализатор, подобранный к конкретному ДС (или дезинфицирующей субстанции), останавливающий действие ДС (характеристика нейтрализаторов указана в 4.3).
Комплексный нейтрализатор обладает выраженным цитотоксическим действием на клеточные культуры. Если не удается подобрать какой-либо химический нейтрализатор, так как его действие проявляется в неспецифической дегенерации культуры клеток (или гибели мышей, уток), то используют 60%-80% сыворотки (без консерванта) крупного рогатого скота (СКРС), инактивированной при 56°С. В течение 30 мин СКРС нейтрализует большой перечень ДВ и по своему действию наиболее близка к комплексному нейтрализатору.
При невозможности нейтрализовать токсическое действие ДС следует применять дополнительные методы удаления ДС — диализ смеси вирус-дезинфектант, например, с использованием сефадекса LH-20, G-75; осаждения вируса методом высокоскоростного центрифугирования или фильтрацией через мембранные фильтры.
8.2 Определение вирулицидной активности ДС, предназначенных для обеззараживания поверхностей в помещениях, мебели, аппаратов, приборов, санитарно-технического оборудования, транспортных средств и других объектов
Определение вирулицидной активности ДС при обеззараживании тест-поверхностей проводят двумя способами: способом протирания (одно- или двукратного) или способом орошения.
На поверхности, подготовленные и расположенные, как указано в 5.3, наносят ВС из расчета — 0,5 мл с добавлением 5% инактивированной СКРС на площадь в 100 см, равномерно распределяют по поверхности стеклянным шпателем. Контаминированные вирусом поверхности подсушивают до полного высыхания при температуре 20°С±2°С и относительной влажности воздуха 50-60%, затем обрабатывают раствором ДС.
Для имитации органического загрязнения используют 40% инактивированной сыворотки при разработке режимов обеззараживания раковин, ванн, унитазов — 80%. Возможно использование вируссодержащей фекальной эмульсии, которую наносят на поверхности из кафеля или фаянса в экспериментах с вирусами, выделяющимися из организма с фекалиями.
Контроль эффективности обеззараживания осуществляют через 15-30-60 минут. Пробы отбирают путем тщательного протирания обработанных раствором ДС поверхностей слегка увлажненной нейтрализатором в физиологическом растворе или растворе Хенкса с антибиотиками стерильной марлевой салфеткой (5×5 см), а затем сухой. Салфетки помещают в широкогорлые пробирки с бусами с 5 мл нейтрализатора.
Оптимальное время обеззараживания поверхностей — не более 60 мин.
В контроле вируса контаминированные ВС поверхности протирают или орошают стерильной водопроводной водой при той же норме расхода воды, что и ДС в опыте. Забор проб и их обработку проводят аналогично опытным. Для определения плотности контаминации проводят титрование смывов с поверхностей.
8.3 Определение вирулицидной активности ДС, предназначенных для обеззараживания белья
Изучение вирулицидной активности ДС проводят при обеззараживании белья без видимых загрязнений и белья, загрязненного выделениями. Для этого в емкость с раствором ДС помещают бязевое белье (1 кг на 4 л раствора). Контаминированные ВС бязевые тест-объекты подсушивают, закладывают в бязевые стерильные мешочки, которые размещают между слоями белья (верх, середина, низ).
Через определенные промежутки времени (15 и более мин) мешочки с тестами извлекают одновременно из трех слоев.
Тесты вынимают из мешочка стерильным пинцетом, погружают в широкогорлые пробирки с нейтрализатором и бусами, отмывают в шуттель-аппарате в течение 10 мин. Смывной жидкостью заражают культуру клеток (или другой биологический объект). Культуру клеток, отмытую от ростовой среды, оставляют на контакт на 30-60 мин для адсорбции вируса. Затем клетки промывают раствором Хенкса и заливают поддерживающей средой с сывороткой. Клетки инкубируют в термостате при оптимальной для конкретного вируса температуре.
Для изучения эффективности ДС при обеззараживании белья, загрязненного кровью (имитация в виде 40% сыворотки), медицинских отходов из тканей, марли, ваты (одноразовое хирургическое белье и акушерские комплекты, перевязочный материал, марлевые салфетки, ватные тампоны и др.) к 6 мл вируссодержащей жидкости добавляют 4 мл инактивированной СКРС, смешивают и заливают тесты, подсушивают их и используют в опыте.
Оптимальное время обеззараживания белья — не более 120 мин, медицинских отходов — не более 240 мин.
Для имитации загрязнения белья и медицинских отходов из тканей и др. фекалиями в экспериментах с тест-вирусом используют фекальную эмульсию. Фекальную эмульсию готовят следующим образом: к 6 мл 10% ВС добавляют 4 мл 40%-ной эмульсии фекалий. Для этого 8 г простерилизованных фекалий (1,5 атм в течение 30 мин) растирают в ступке с 20 мл стерильной воды. В качестве органической нагрузки также используют 80% инактивированной СКРС из расчета: 8 мл сыворотки и 2 мл ВС тщательно перемешивают и этой смесью заливают тесты. Избыток жидкости через 15 мин удаляют с помощью пипетки, тесты подсушивают при комнатной температуре. Далее эксперимент проводят по схеме — как с бельем, незагрязненным выделениями.
Время обеззараживания белья и медицинских отходов, загрязненных фекалиями — не более 240 мин.
8.4 Определение вирулицидной активности ДС, предназначенных для обеззараживания посуды
Исследования ДС проводят с использованием посуды без остатков пищи, а также без других видимых загрязнений и посуды с остатками пищи или другими загрязнениями.
При обеззараживании посуды без остатков пищи в качестве тест-объектов используют:
— тарелки;
— стаканы;
— эмалированные кружки;
— столовые приборы — ножи, вилки, ложки;
— лабораторную посуду — пипетки, в т.ч. микропипетки, наконечники к ним, предметные стекла, пробирки.
Чистую посуду контаминируют вирусной суспензией (ВС), которую наносят пипеткой из расчета 0,5 мл на 100 см и равномерно распределяют по поверхности стерильным стеклянным шпателем. Вилки, ложки и ножи погружают в ВС на 10-15 мин (за исключением ручек), каналы пипеток контаминируют вирусом.
Посуду, столовые приборы подсушивают при комнатной температуре. После полного высыхания погружают в раствор ДС, полностью их покрывая раствором (расход раствора составляет примерно 2 л на комплект посуды: чашка, блюдце, 2 тарелки, ложка, вилка, нож).
Через определенные интервалы времени (15, 30, 60, 90, 120 минут) посуду извлекают из раствора ДС. Для оценки эффективности обеззараживания стерильными марлевыми салфетками размером 5х5 см (вначале увлажненной нейтрализатором, затем сухой) тщательно протирают контаминированные вирусом части каждого предмета. Салфетки помещают в стерильную широкую пробирку с бусами и с 5 мл стерильного нейтрализатора.
Оптимальное время обеззараживания — не более 60 мин.
В качестве контроля используют аналогичным способом контаминированную вирусом посуду, погруженную на максимальную экспозицию в стерильную или прокипяченную водопроводную воду.
Для изучения эффективности ДС при обеззараживании посуды с остатками пищи, загрязненной лабораторной посуды многократного использования и однократного применения (перед утилизацией) к ВС добавляют 80% инактивированной СКРС из расчета: 20% ВС и 80% сыворотки, смесь наносят равномерно на посуду, подсушивают.
Оптимальное время обеззараживания — не более 120 мин для посуды многократного использования и не более 240 мин — для посуды однократного применения (перед утилизацией).
Библиография
|
[1] |
Технические условия ТУ 2481-135-07510508-07 |
Сульфонол порошок |
|
[2] |
Руководство Р 4.2.2643-10 |
Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности |
|
УДК 615.478.74:006.354 |
ОКС 11.080.20 |
Т58 |
||
|
Ключевые слова: средства дезинфицирующие, методы определения, показатели эффективности, бактерии, вирусы, грибы, нейтрализатор |
(Поправка. ИУС N 8-2018).
Редакция документа с учетом
изменений и дополнений подготовлена
Утверждаю
Руководитель Федеральной службы
по надзору в сфере защиты прав
потребителей и благополучия человека,
Главный государственный санитарный врач
Российской Федерации
А.Ю.ПОПОВА
18 декабря 2020 года
4.2. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
МЕТОДЫ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ И ИСПЫТАНИЙ ДЕЗИНФЕКЦИОННЫХ
СРЕДСТВ ДЛЯ ОЦЕНКИ ИХ ЭФФЕКТИВНОСТИ И БЕЗОПАСНОСТИ
РУКОВОДСТВО
Р 4.2.3676-20
1. Разработано ФБУН «Научно-исследовательский институт дезинфектологии» Роспотребнадзора (Т.В. Гололобова, Л.Г. Пантелеева, Л.С. Федорова, С.А. Рославцева, А.Ю. Скопин, М.В. Бидевкина, О.Ю. Еремина, Н.И. Шашина, Е.И. Баканова, Т.Б. Захарова, А.Л. Караев, Н.Н. Левчук, А.В. Лиманцев, Ю.В. Лопатина, В.В. Олифер, Г.П. Панкратова, С.В. Рябов, Т.Н. Шестопалова, А.С. Белова, Т.В. Воронцова, О.М. Германт, Т.Н. Потапова, А.А. Серов, А.И. Виноградова, А.В. Ильякова, К.С. Кривонос, Е.А. Матвеева, Д.Ю. Мохирев, Н.К. Ахмед); ФБУН «Федеральный научный центр гигиены им. Ф.Ф. Эрисмана» Роспотребнадзора (Г.М. Трухина); ФГБУ «Центр стратегического планирования и управления медико-биологическими рисками здоровью» ФМБА (Ю.А. Рахманин, З.И. Жолдакова, Р.А. Мамонов); ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России (Н.В. Шестопалов).
2. Утверждено Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации А.Ю. Поповой «18» декабря 2020 г.
3. Р 4.2.3676-20 введено взамен глав 1 — 3, 5 — 9, приложения 1 руководства Р 4.2.2643-10 «Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности», утвержденного Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации 01.06.2010.
- I. ОБЛАСТЬ ПРИМЕНЕНИЯ
- II. Общие положения
- III. Микробиологические методы исследований и критерии оценки эффективности дезинфицирующих и стерилизующих средств
- 3.1. Общие сведения о микробиологических испытаниях дезинфицирующих средств
- 3.2. Методы исследования и оценки бактерицидной активности дезинфицирующих средств и субстанций
- 3.3. Методы исследования и оценки туберкулоцидной активности дезинфицирующих средств
- 3.4. Методы изучения и оценки фунгицидной активности дезинфицирующих средств
- 3.5. Методы изучения и оценки вирулицидной активности дезинфицирующих средств
- 3.6. Методы исследования и оценки спороцидной активности дезинфицирующих средств и стерилизующих средств
- 3.7. Исследование эффективности дезинфицирующих средств, предназначенных для обеззараживания питьевой воды, воды плавательных бассейнов и сточных вод
- 3.8. Методы исследования активности антимикробных материалов (тканей, лакокрасочных покрытий)
- 3.9. Исследование эффективности дезинфицирующих средств, предназначенных для обеззараживания технологического оборудования, производственного инвентаря и тары в пищевой промышленности
- 3.10. Исследование бактерицидной эффективности дезинфицирующих средств, предназначенных для обеззараживания скорлупы яиц, фруктов и овощей
- 3.11. Исследование бактерицидной эффективности дезинфицирующих средств, предназначенных для обеззараживания тушек птиц
- 3.12. Методы исследования эффективности кожных антисептиков
- 3.13. Исследование эффективности дезинфицирующих средств, предназначенных для обеззараживания медицинских изделий
- 3.14. Определение микробопроницаемости стерилизационных упаковочных материалов, предназначенных для упаковки медицинских изделий перед стерилизацией. Исследование эффективности стерилизации медицинских изделий в упаковочных материалах
- 3.15. Методы исследований и критерии оценки эффективности средств для предстерилизационной очистки медицинских изделий
- 3.16. Методы исследования эффективности дезинфицирующих средств и кожных антисептиков в практических условиях
- IV. Энтомологические и акарологические методы исследований и критерии оценки эффективности дезинсекционных средств
- 4.1. Организация экспериментов
- 4.2. Методы изучения инсектицидной, акарицидной и репеллентной активности ДВ (субстанций)
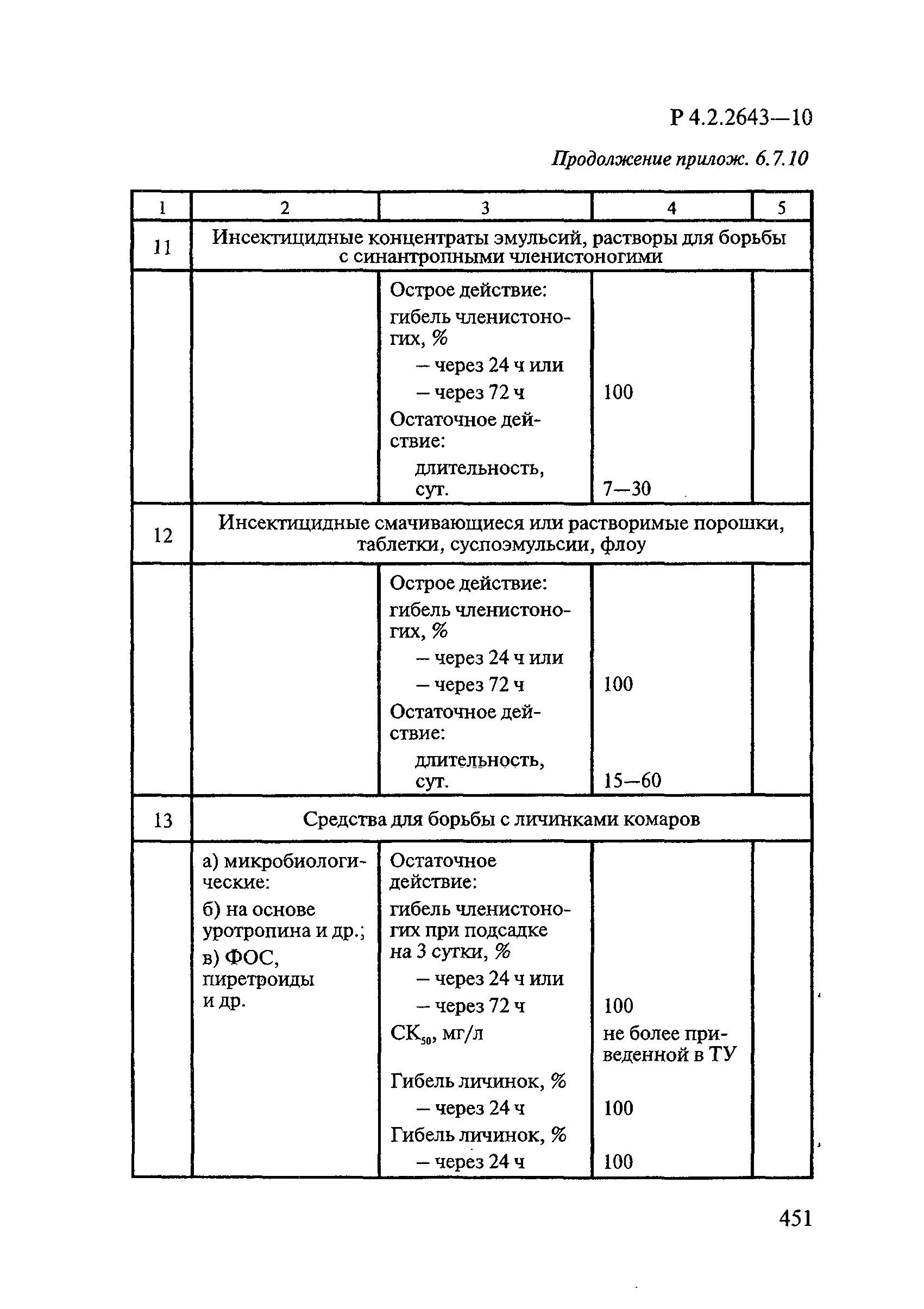
- 4.3. Методы оценки эффективности инсектицидных средств для борьбы с синантропными членистоногими
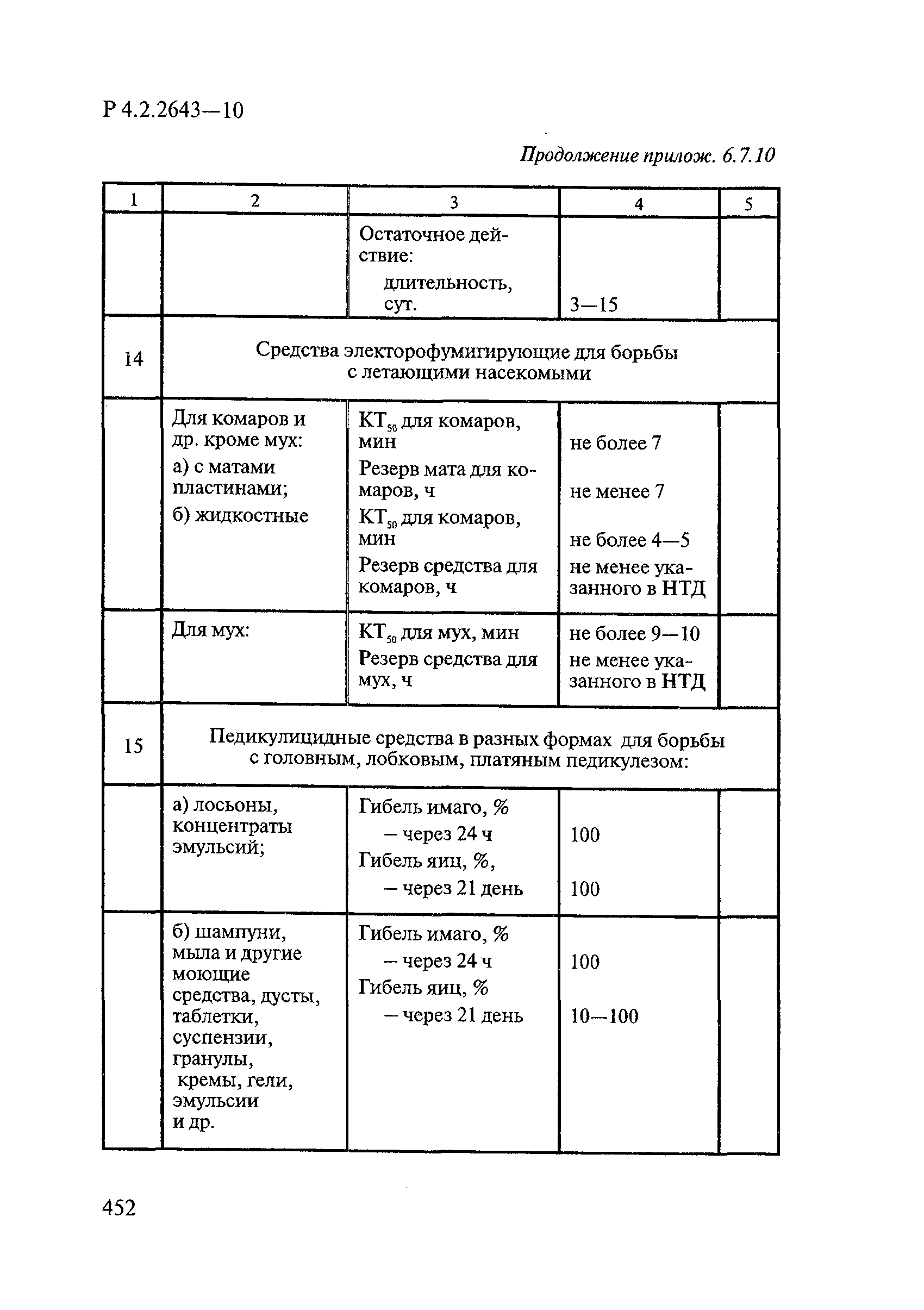
- 4.4. Методы оценки эффективности целевых инсектицидных средств
- 4.5. Методы оценки эффективности педикулицидных средств
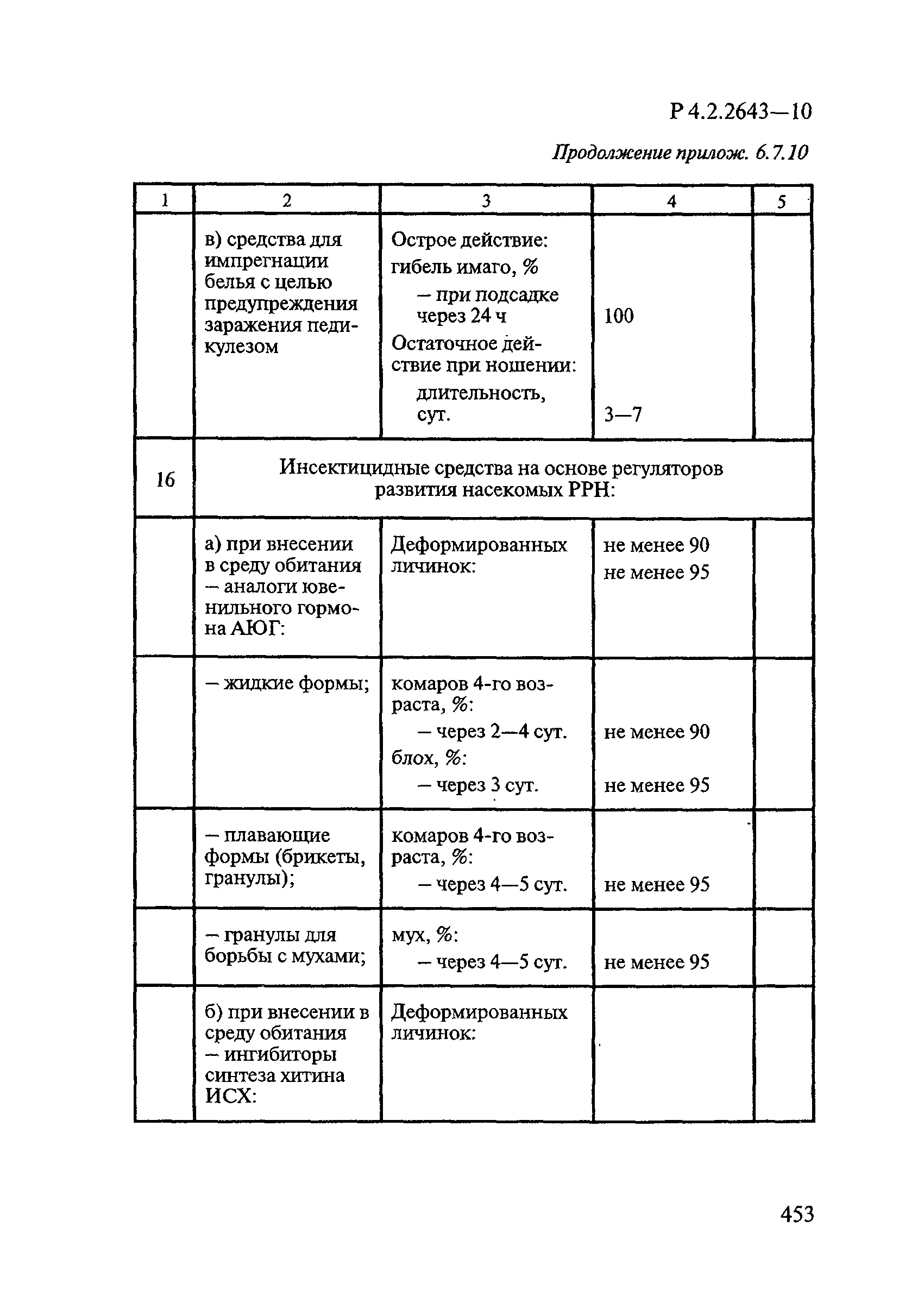
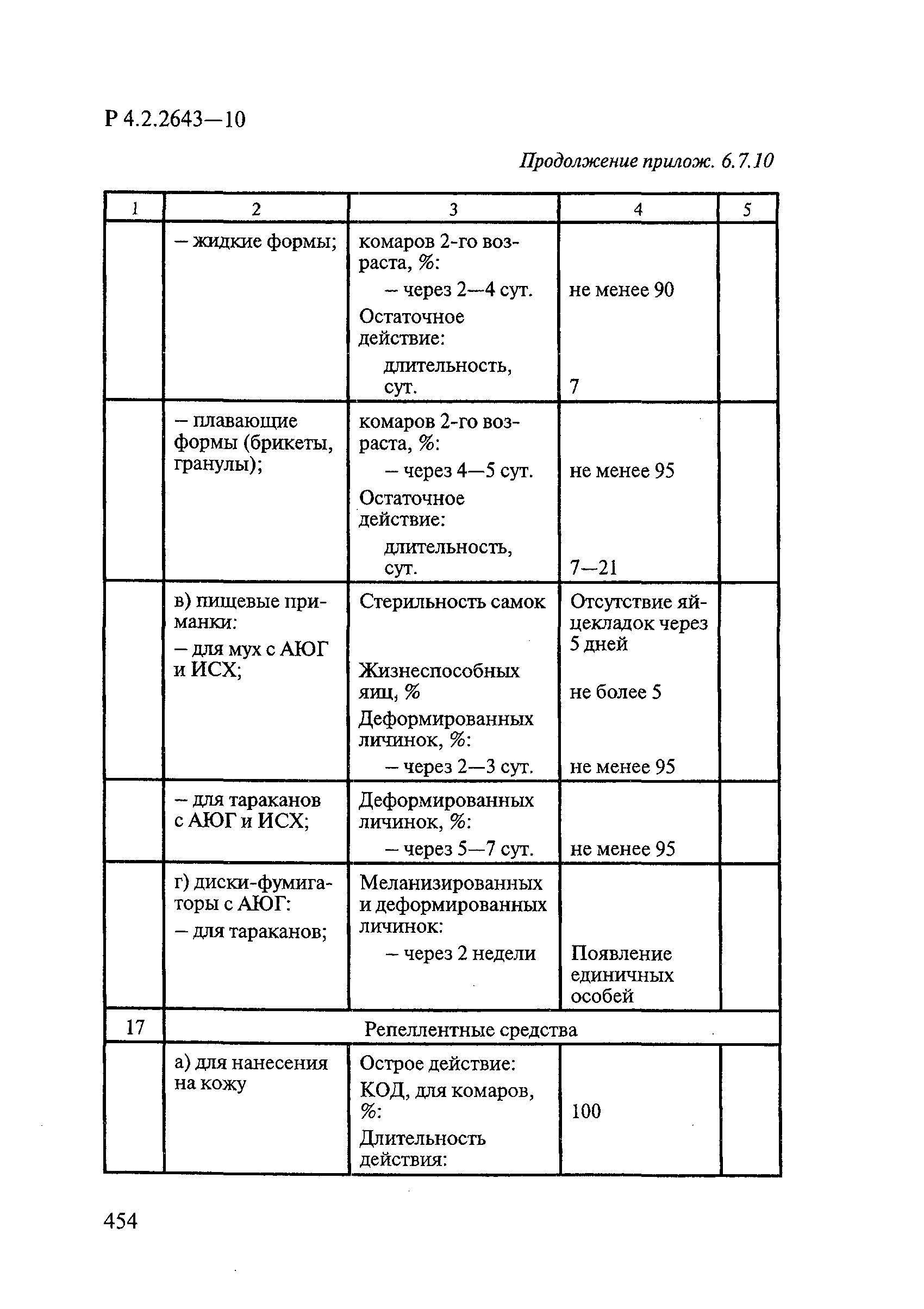
- 4.6. Методы оценки эффективности средств на основе регуляторов развития насекомых (РРН)
- 4.7. Методы оценки эффективности репеллентных средств и изделий для защиты от кровососущих членистоногих
- 4.8. Методы оценки эффективности инсектоакарицидных средств индивидуальной защиты людей от нападения иксодовых клещей, блох и других членистоногих, защитных свойств тканей, содержащих инсектоакарициды
- 4.9. Метод оценки эффективности инсектоакарицидных средств для обработки природных биотопов с целью уничтожения иксодовых клещей
- 4.10. Методы оценки защитных свойств специальной одежды для защиты от кровососущих насекомых и клещей
- 4.11. Методы оценки прокусываемости (устойчивости к прокусыванию) тканей кровососущими комарами
- 4.12. Методы оценки биологической повреждаемости материалов и изделий насекомыми
- 4.13. Метод оценки потенциального воздействия на членистоногих различными установками/приборами
- 4.14. Метод оценки изделий/приборов/установок для механического отлова летающих насекомых
- 4.15. Оценка эффективности инсектицидных, акарицидных и репеллентных средств при проведении испытаний в практических условиях
- 4.16. Методы определения резистентности членистоногих к инсектоакарицидам
- V. Методы исследований и критерии оценки эффективности дератизационных средств
- 5.1. Условия, предъявляемые к дератизационным средствам
- 5.2. Условия оценки целевой эффективности и биологической активности дератизационных средств
- 5.3. Условия, предъявляемые к экспериментам по оценке целевой эффективности и биологической активности дератизационных средств
- 5.4. Метод определения эффективности и биологической активности субстанций и концентратов ДВ
- 5.5. Методика постановки экспериментов и оформление полученных результатов
- 5.6. Методы исследований эффективности липких родентицидных покрытий
- 5.7. Метод исследования эффективности клейких масс и готовых клеевых ловушек
- 5.8. Метод исследования эффективности механических устройств летального действия типа давилок и капканов
- 5.9. Метод исследования эффективности живоловок
- 5.10. Метод оценки целевой эффективности и биологической активности дератизационных средств при групповом содержании грызунов
- 5.11. Методы оценки целевой эффективности и биологической активности отпугивающих химических веществ (роденторепеллентов)
- 5.12. Метод оценки эффективности и активности отпугивающих химических веществ в кассетно-мембранном ольфактометре
- 5.13. Метод оценки воздействия ультразвуковых дератизационных устройств на крыс с помощью графической регистрации их внешнего дыхания по Лиманцеву
- 5.14. Методы оценки действия УДУ с помощью пластиковой двухкамерной установки РМ-01
- 5.15. Метод прямого отпугивания грызунов ультразвуком
- 5.16. Метод оценки эффективности отпугивающего действия УДУ по реакции грызуна на корм
- 5.17. Условия проведения испытаний дератизационных средств в естественной среде обитания грызунов
- 5.18. Методика контрольно-пылевых (следовых) площадок
- 5.19. Исследование биологической активности и целевой эффективности дератизационных средств в естественных местах обитания грызунов
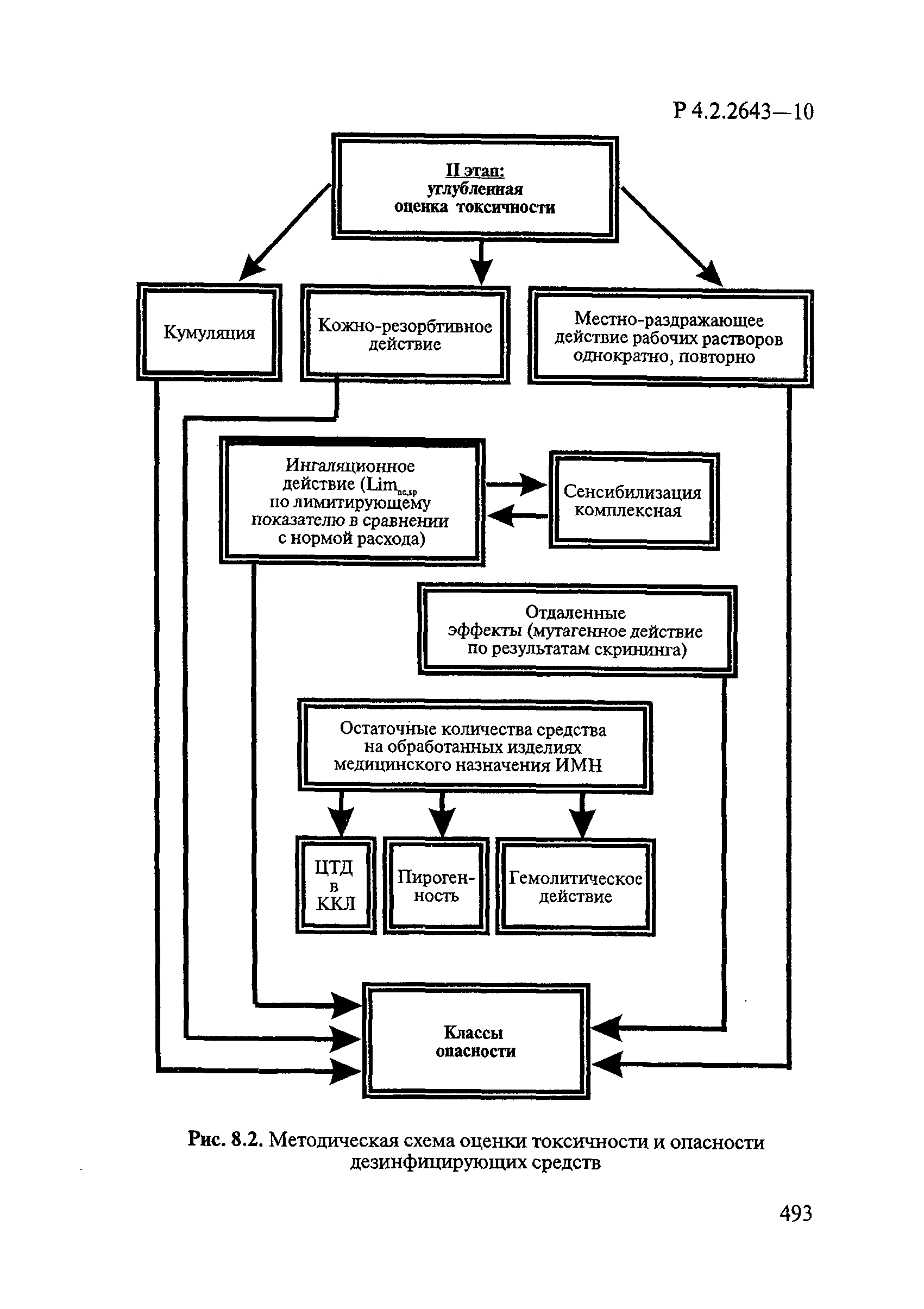
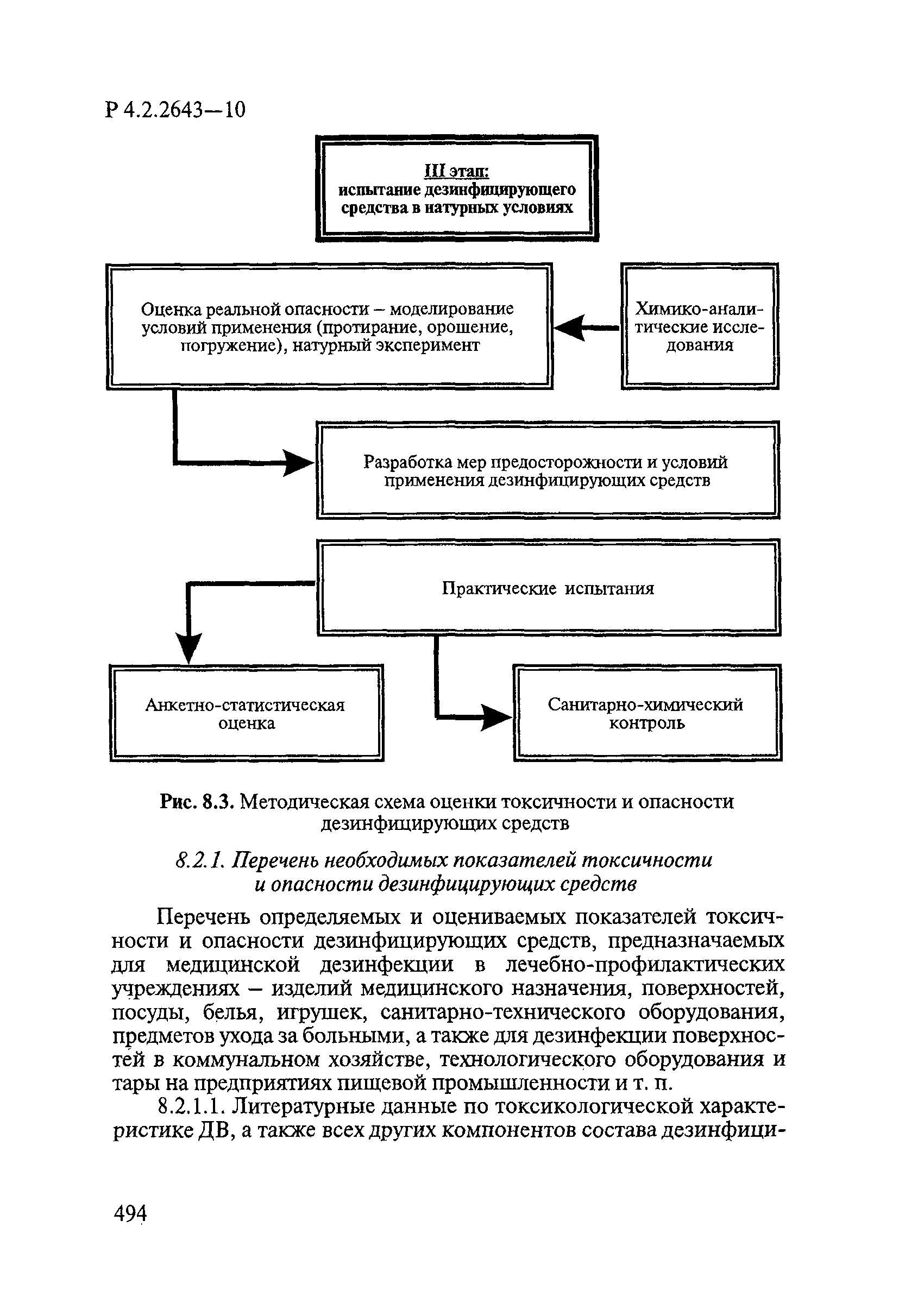
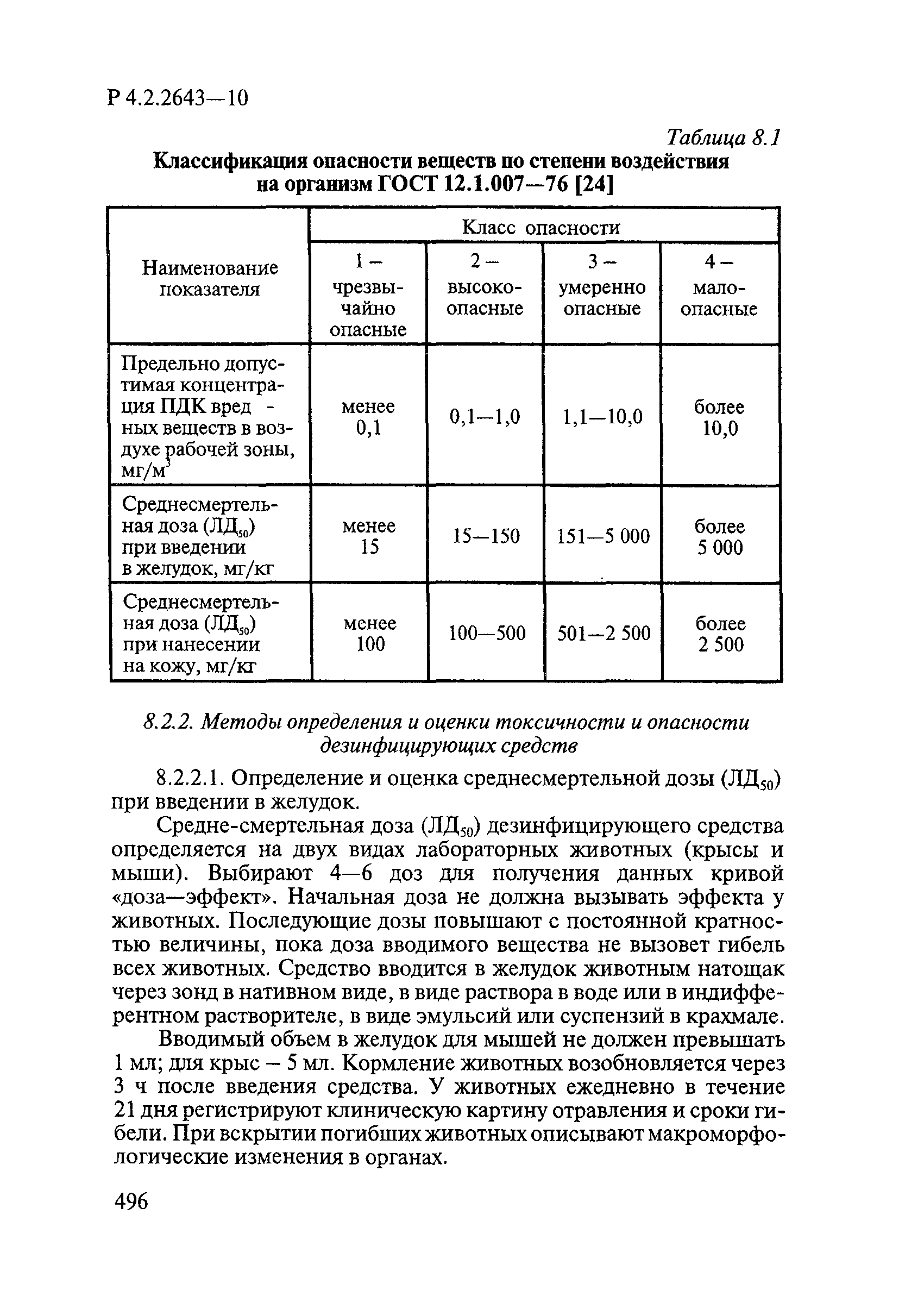
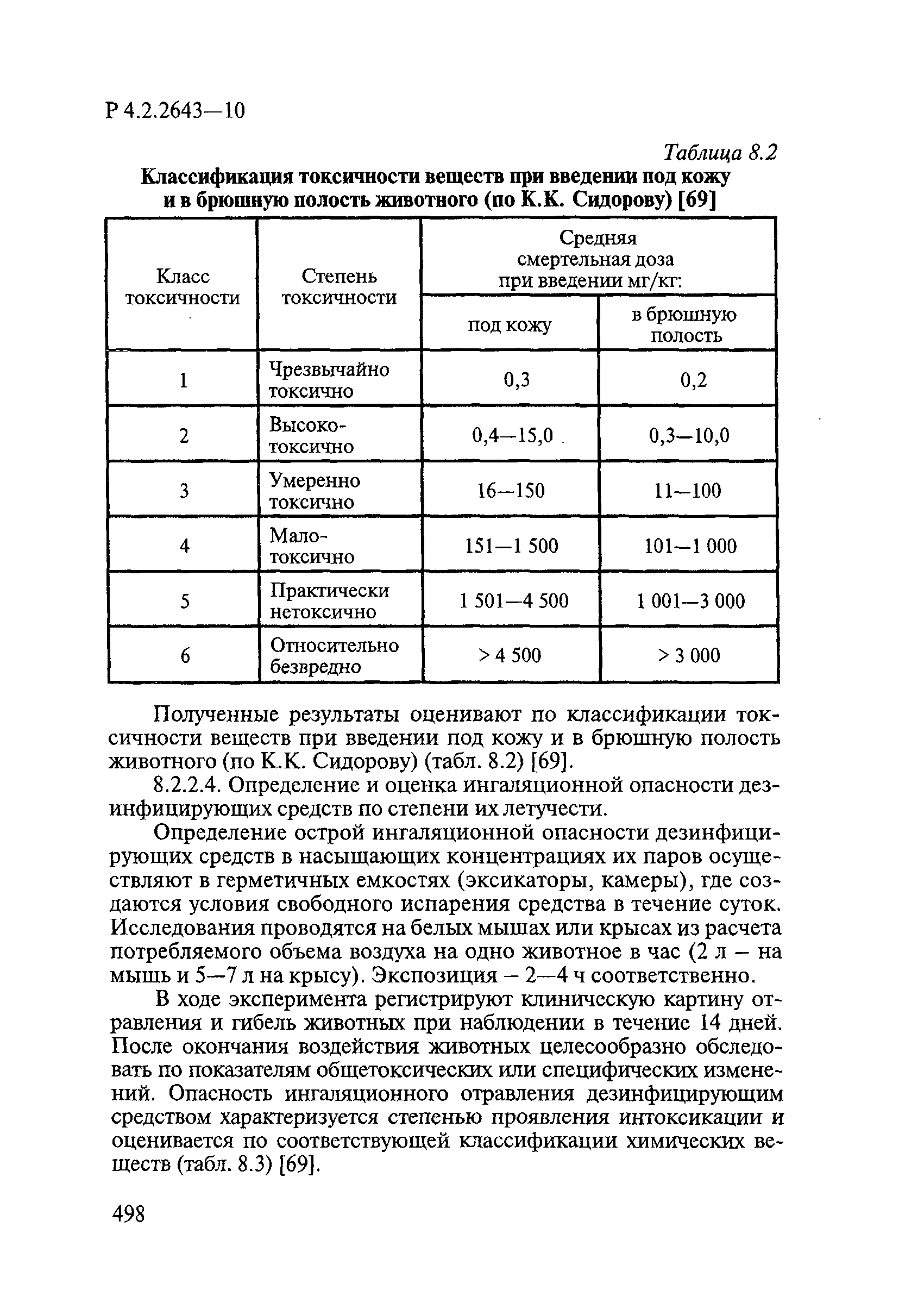
- VI. Методы исследования и критерии оценки токсичности и опасности дезинфекционных средств
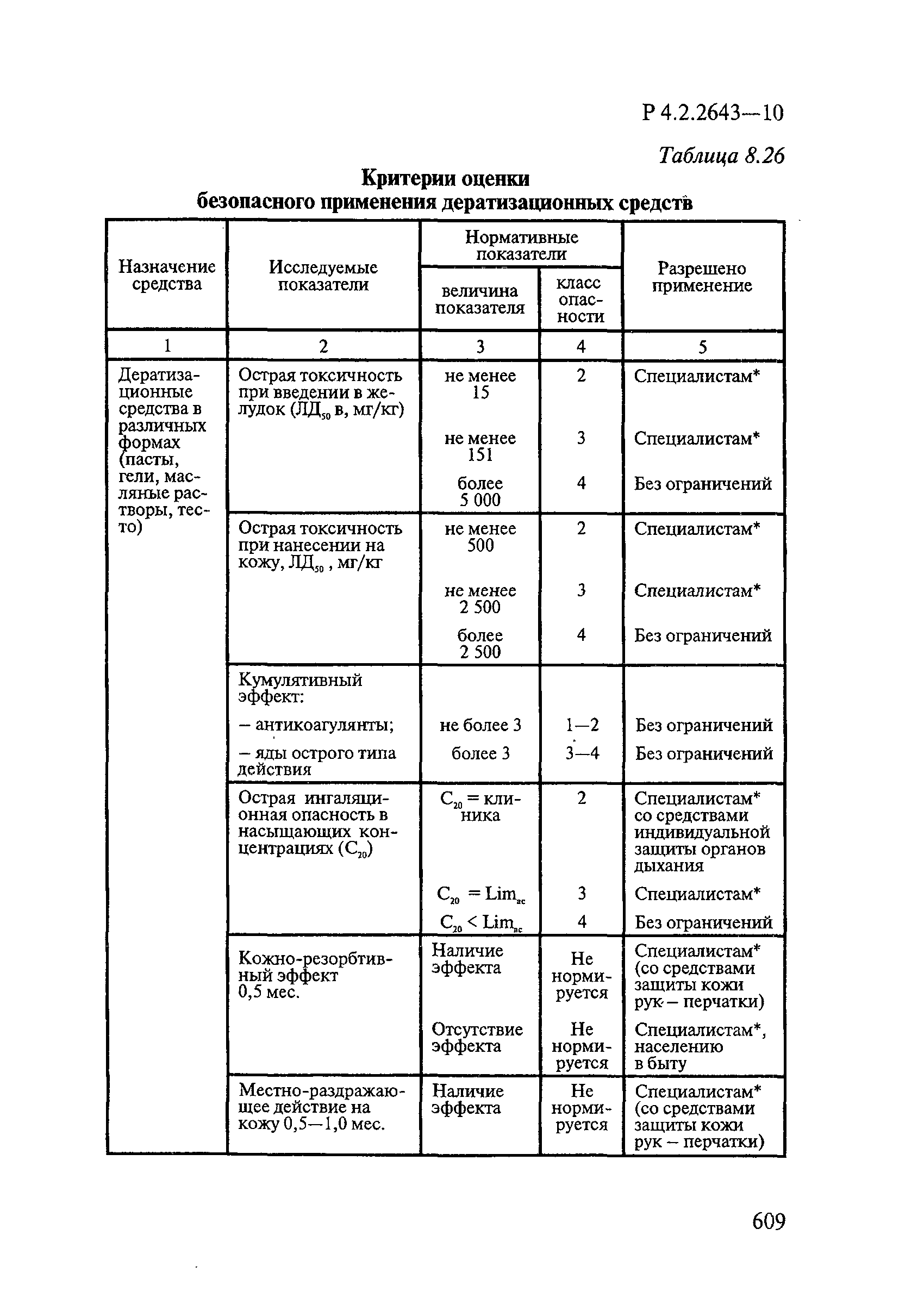
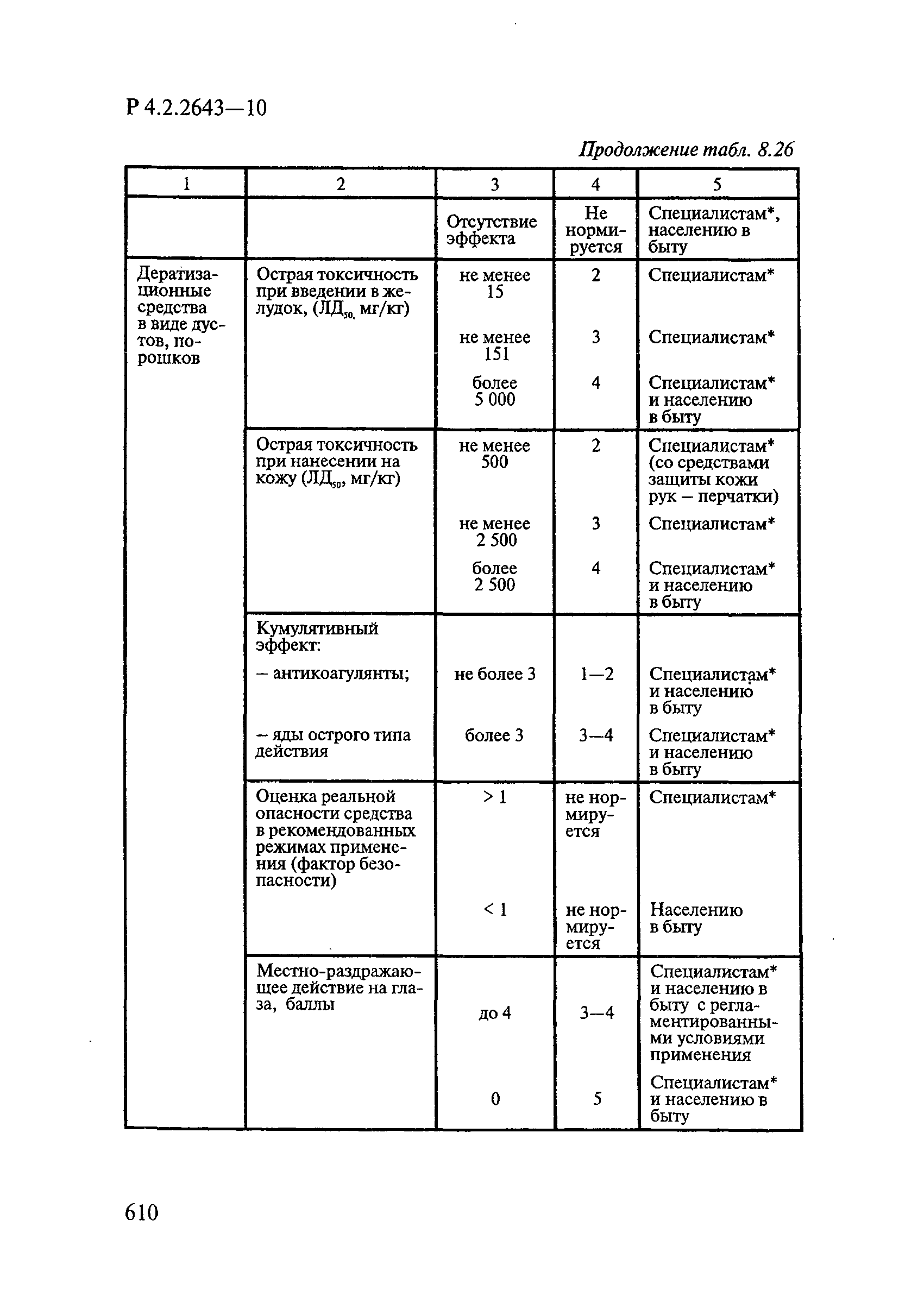
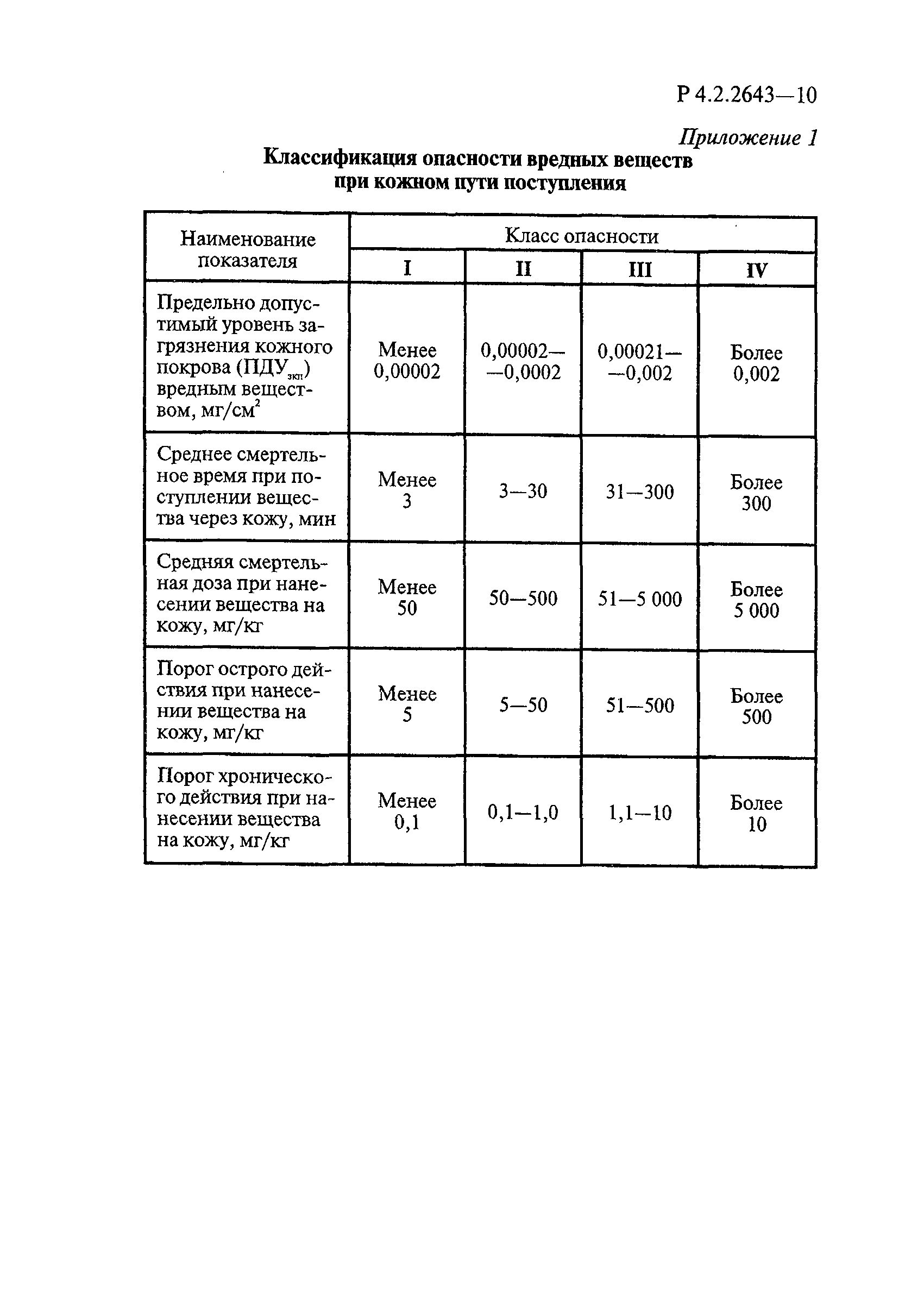
- 6.1. Условия проведения токсикологических исследований дезинфекционных средств
- 6.2. Методы изучения токсичности и опасности дезинфицирующих средств
- 6.3. Оценка токсичности и опасности дезинфицирующих средств, предназначенных для использования на предприятиях пищевой и перерабатывающей промышленности
- 6.4. Оценка токсичности и опасности средств для предстерилизационной очистки и стерилизации медицинских изделий (включая эндоскопы)
- 6.5. Методы изучения токсичности и опасности кожных антисептиков
- 6.6. Методы изучения токсичности и опасности средств для обеззараживания групповых и индивидуальных запасов питьевой воды
- 6.7. Методы изучения токсичности и опасности средств для обеззараживания воды плавательных бассейнов
- 6.8. Методы изучения токсичности и опасности средств для обеззараживания воды централизованных и нецентрализованных систем хозяйственно-питьевого водоснабжения, в т.ч. в системах горячего водоснабжения, а также сточных вод
- 6.9. Средства для обеззараживания воды в системах технического водоснабжения предприятий
- 6.10. Методы изучения токсичности и опасности дезинсекционных средств
- 6.11. Методы изучения токсичности и опасности педикулицидных средств
- 6.12. Методы изучения токсичности и опасности инсектоакарицидных средств
- 6.13. Методы изучения токсичности и опасности репеллентных средств
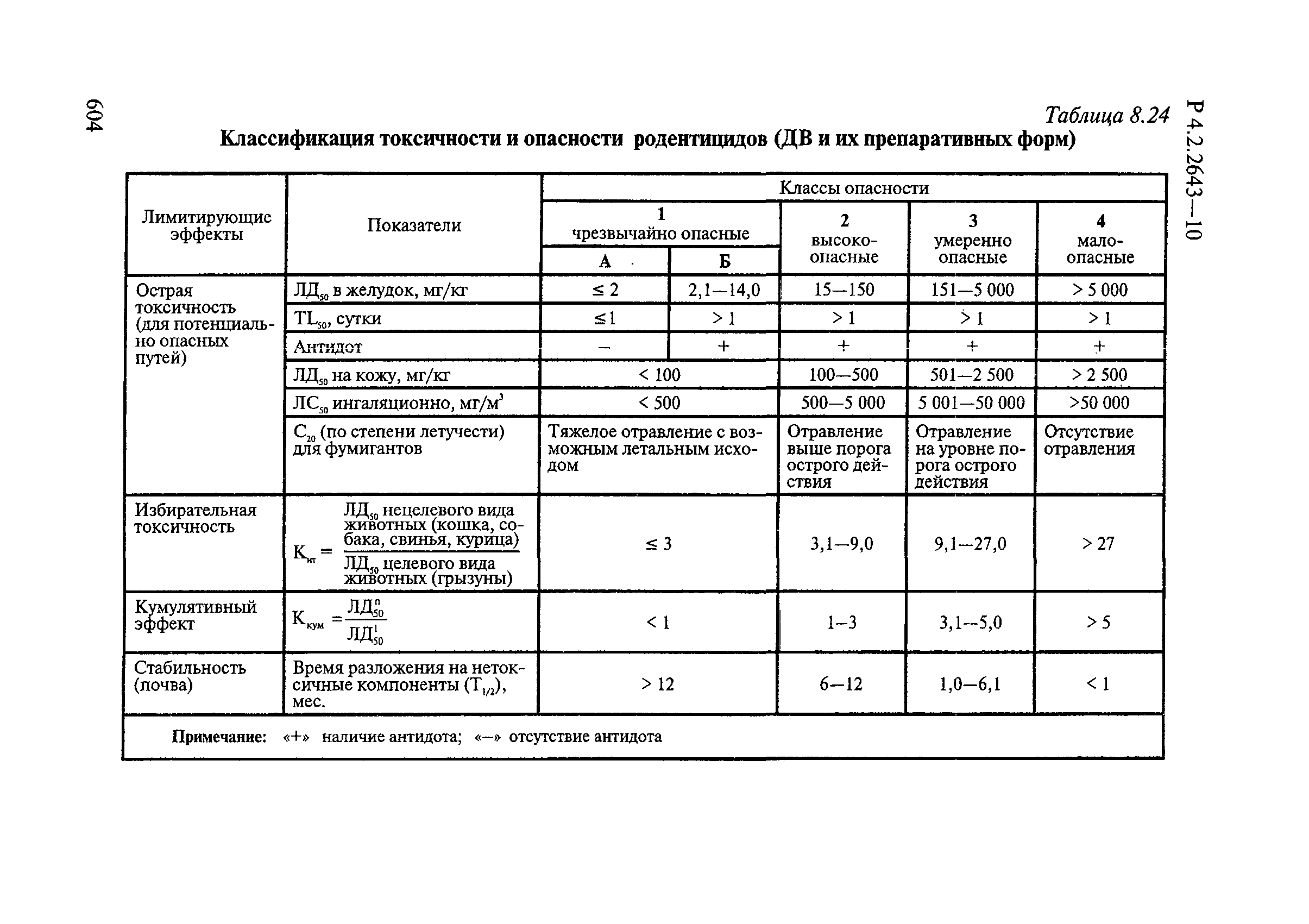
- 6.14. Методы изучения токсичности и опасности дератизационных средств
- ТЕСТ-ВИРУСЫ И МЕТОДЫ ИХ КУЛЬТИВИРОВАНИЯ
- СТАТИСТИЧЕСКАЯ ОБРАБОТКА РЕЗУЛЬТАТОВ ПО ОЦЕНКЕ ВИРУЛИЦИДНОЙ АКТИВНОСТИ
- ПЕРЕЧЕНЬ СТАНДАРТОВ ДЛЯ ТЕСТ-ИЗДЕЛИЙ
- ВЫБОР МОДЕЛЬНЫХ ОБЪЕКТОВ ПРИ ОЦЕНКЕ ЭФФЕКТИВНОСТИ СРЕДСТВ ДЕЗИНСЕКЦИИ ДЛЯ ЗАЩИТЫ ЛЮДЕЙ ОТ НАПАДЕНИЯ ЧЛЕНИСТОНОГИХ, ОБИТАЮЩИХ В ПРИРОДНЫХ БИОТОПАХ
- МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕТОДЫ ВЫЯВЛЕНИЯ РЕЗИСТЕНТНЫХ К ПИРЕТРОИДАМ НАСЕКОМЫХ
- ПОКАЗАТЕЛИ ЭФФЕКТИВНОСТИ ДЕРАТИЗАЦИОННЫХ СРЕДСТВ
- Библиографические ссылки
Государственное санитарно-эпидемиологическое нормирование Российской Федерации
3.5. ДЕЗИНФЕКТОЛОГИЯ
МЕТОДЫ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ И ИСПЫТАНИЙ ДЕЗИНФЕКЦИОННЫХ СРЕДСТВ ДЛЯ ОЦЕНКИ ИХ ЭФФЕКТИВНОСТИ И БЕЗОПАСНОСТИ
РУКОВОДСТВО
Р 4.2.2643-10
Издание
официальное
МОСКВА
2011
Государственная система санитарно-эпидемиологического нормирования Российской Федерации
3.5. ДЕЗИНФЕКТОЛОГИЯ
Методы
лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности
Руководство Р 4.2.2643-10
P 4.2.2643-10
5.8.3.3. Методы изучения факторов, влияющих
на спороцидную активность ДС, СС и их субстанций……285
5.8.4. Методы исследований спороцидной эффективности ДС, предназначенных для обеззараживания объектов внешней среды, контаминированных тест-микроорганизмами
в споровой форме…………………………287
5.8.4Л. Исследование спороцидной эффективности ДС, предназначенных для обеззараживания поверхностей помещений, мебели, аппаратов, приборов, санитарнотехнического оборудования, транспортных средств и других объектов………………………287
5.8.4.2. Исследование спороцидной эффективности ДС, предназначенных для обеззараживания предметов ухода за больными и игрушек из различных материалов
кроме мягких………………………..290
5.8.4.3. Исследование спороцидной эффективности ДС,
предназначенных для обеззараживания посуды столовой, лабораторной и из-под выделений……………..291
5.8.4.4. Исследование спороцидной эффективности ДС,
предназначенных для обеззараживания изделий медицинского назначения ИМН, включая эндоскопы………….293
5.8.4.5. Исследование спороцидной эффективности ДС,
предназначенных для обеззараживания белья, одежды, спецодежды и других объектов из ткани…………..295
5.8.4.6. Исследование спороцидной эффективности ДС
при обеззараживании рук в резиновых перчатках……..297
5.8.4.7. Исследование спороцидной эффективности ДС,
предназначенных для обеззараживания воды………..298
5.8.4.8. Исследование спороцидной эффективности ДС, предназначенных для обеззараживания выделений
моча, фекалии, мокрота, крови………………303
5.8.4.9. Исследование спороцидной эффективности ДС, предназначенных д ля обеззараживания медицинских
отходов…………………………….305
5.8.5. Методы исследования и оценки спороцидной активности
ДС при использовании в качестве тест-микроорганизмов вирулентных штаммов В. anthracis……………….306
5.8.6. Методы исследования и оценки спороцидной эффективности СС, предназначенных
для стерилизации ИМН, включая эндоскопы…………308
5.8.6.1. Исследование спороцидной эффективности
водяного насыщенного пара под избыточным давлением, предназначенного для стерилизации ИМН…………308
5.8.6.2. Исследование спороцидной эффективности сухого горячего воздуха, предназначенного для стерилизации ИМН . 310
10
P 4.2.2643-10
5.8.6.3. Исследования спороцидной эффективности
растворов химических СС, предназначенных
для стерилизации ИМН……………………312
5.8.7. Исследование и оценка спороцидной эффективности СС, предназначенных для исследования эффективности
ДВУ эндоскопов………………….. 313
5.8.8. Библиографические данные……………….314
5.8.9. Приложения……………………….318
5.9. Методы исследований и критерии оценки эффективности средств для предстерилизационной очистки ИМИ……….326
5.9.1. Общие положения…………………….326
5.9.2. Исследование эффективности действующих веществ
субстанций, предназначенных для производства средств предстерилизационной очистки ИМИ…………….327
5.9.3. Исследование эффективности
средств для предстерилизационной очистки ИМИ………331
5.9.3.1. Определение эффективности средств
в лабораторных условиях…………………..331
5.9.3.2. Определение эффективности средств
в практических условиях…………………..337
6. Энтомологические методы исследований и критерии
оценки эффективности дезинсекционных средств…………340
6.1. Общие положения. Организация экспериментов………340
6.1.1. Общие положения…………………….340
6.1.2. Организация экспериментов……………….341
6.1.2.1. Тест-членистоногие, используемые в экспериментах. . 341
6.1.2.2. Принципы приготовления рабочих растворов
для проведения экспериментов и расчеты активности субстанций и препаративных форм……………..344
6.2. Методы определения активности действующих веществ
субстанций дезинсекционных средств……………..349
6.2.1. Общие методы определения инсектоакарицидных свойств действующих веществ субстанций………….349
6.2.1.1. Метод топикального нанесения инсекгоакарицидов
на членистоногих………………… 349
6.2.1.2. Методы опрыскивания насекомых и тест-
поверхностей …………………………351
6.2.1.3. Методы принудительного контакта членистоногих
с поверхностями, обработанными инсектоакарицидами …. 352
6.2.1.4. Метод свободного контакта членистоногих
с поверхностями, обработанными инсектоакарицидами …. 354
И
P 4.2.2643-10
6.2.1.5. Методы изучения овицидного действия
инсектицидов…………………………355
6.2.1.6. Методы изучения активности инсектицидов
для преимагинальных стадий мух………………357
6.2.1.7. Метод изучения фумигационного действия
инсектицидов…………………………358
6.2.1.8. Методы изучения кишечного действия
инсектицидов…………………………358
6.2.1.9. Метод изучения раздражимости комаров
под действием инсектицидов…………………362
6.2.1.10. Метод изучения проявления нокдаун-эффекта
у насекомых под действием инсектицидов…… 363
6.2.2. Метод изучения двигательной активности и расселения популяционных группировок
синантропных тараканов……………………364
6.2.3. Методы изучения акарицидной активности
действующих веществ……………………..367
6.2.4. Методы изучения репеллентной активности веществ
по отношению к кровососущим насекомым и клещам…….370
6.3. Методы определения активности инсектицидных средств . . . 375
6.3.1. Методы оценки эффективности инсектицидных средств,
предназначенных для борьбы с нелетающими синантропными насекомыми………………….375
6.3.2. Методы оценки активности средств, применяемых
для борьбы с муравьялш…………………….383
6.3.3. Методы определения активности инсектицидных
средств, предназначенных для борьбы с летающими синантропными насекомыми………………….386
6.3.4. Метод оценки активности средств борьбы
с личинками комаров ……………………..391
6.3.5. Методы оценки активности педикулицидных средств. . . . 392
6.3.6. Методы оценки активности средств борьбы
с насекомыми-кератофагами………….. 394
6.3.7. Методы оценки инсектицидной активности средств
для уничтожения ос………………………397
6.4. Методы изучения активности акарицидных
и инсекго-акарицидных средств…………………400
6.4.1. Методы изучения активности средств, предназначенных для борьбы с иксодовыми клещами
и защиты людей от их нападения……………….400
6.4.2. Методы оценки активности акарицидных средств,
предназначенных для уничтожения кровососущих гамазовых клещей в помещениях обработка поверхностей……….401
12
P 4.2.2643-10
6.4.3. Методы оценки активности средств, предназначенных для борьбы с акариформными клещами чесоточные клещи и клещи домашней пыли…………403
6.4.3.1. Методы оценки активности средств скабицидов, предназначенных для обработки поверхностей в помещениях, одежды, белья и т. д. с целью уничтожения чесоточных
клещей…………………………….403
6.4.3.2. Методы оценки активности средств акарицидов, предназначенных для уничтожения клещей домашней пыли. . 405
6.5. Методы определения активности инсекто-
и акарорепеллентных средств…………………..406
6.5.1. Методы оценки эффективности репеллентных средств
в отношении насекомых…………………….406
6.5.2. Методы оценки активности репеллентных средств
для защиты от иксодовых клещей……………….409
6.5.3. Метод оценки активности акарорепеллентных средств
6.6. Методы определения активности средств на основе регуляторов развития насекомых и аттрактантов феромонов … 411
6.6.1. Методы оценки активности средств
в отношении гамазовых клещей………………..410
на основе регуляторов развития насекомых………….411
6.6.1.1. Методы оценки активности аналогов ювенильного
гормона АЮГ………………………..415
6.6.1.2. Методы оценки активности средств на основе
ингибиторов синтеза хитина ИСХ……….. 417
6.6.2. Методы оценки активности аттрактантов феромонов. . . 420
6.7. Методы определения эффективности инсектицидных, акарицидных и репеллентных средств в натурных условиях…..421
6.7.1. Общие требования к проведению испытаний
в натурных условиях………………………421
6.7.2. Испытания инсектицидных средств…………..422
6.7.2.1. Изучение эффективности инсектицидных средств
по отношению к тараканам, постельным клопам и блохам . . . 422
6.7.2.2. Изучение эффективности инсектицидных средств
по отношению к мухам ……………………423
6.7.2.3. Изучение эффективности средств в аэрозольных
и беспропеллентных упаковках……………….425
6.7.2.4. Изучение эффективности инсектицидных средств
по отношению к муравьям………………….427
6.7.2.5. Изучение эффективности инсектицидных средств
по отношению к имаго комаров……………….428
13
P 4.2.2643-10
6.7.2.6. Изучение эффективности
специальных средств для уничтожения ос………….429
6.7.3. Изучение эффективности инсектицидов и регуляторов
развития по отношению к личинкам комаров…………431
6.7.3.1. Изучение эффективности инсектицидных средств … 431
6.7.3.2. Изучение эффективности регуляторов
развития насекомых……………………. . 431
6.7.4. Изучение эффективности акарицидных
инсектоакарицидных средств для обработки природных биотопов с целью уничтожения иксодовых клещей………432
6.7.5. Изучение защитного действия репеллентных средств. . . . 435
6.7.6. Изучение защитного действия в отношении иксодовых клещей акарицидных инсектоакарицидных средств в виде брусков, концентратов эмульсий, аэрозольных
и беспропеллентных упаковок…………………436
6.7.7. Методы изучения эффективности репеллентных средств,
предназначенных для защиты от муравьев…………..437
6.7.8. Практические испытания инсектицидных, акарицидных
и репеллентных средств…………………….438
6.7.9- Библиографические данные……………….440
6.7.10. Приложение……………………….446
7. Родентологические методы исследований и критерии оценки эффективности дератизационных средств……………..459
7.1. Общие положения. Требования к экспериментальным
животным и условиям их содержания………………459
7.2. Методы исследований эффективности химических
родентицидных средств……………………..461
7.2.1. Требования к условиям эксперимента по оценке
эффективности родентицидных средств. Контролируемые показатели и обработка результатов………………461
7.2.2. Методы исследований эффективности различных
форм родентицидов………………………466
7.3. Методы исследования эффективности репеллентов…….469
7.4. Методы исследований эффективности механических
дератизационных средств…………………….471
7.5. Методы исследований эффективности химических родентицидных средств в условиях группового
содержания грызунов………………………474
7.6. Методы оценки эффективности дератизационных средств в естественных местообитаниях грызунов
в натурных условиях………………………475
14
P 4.2.2643-10
7.6.1. Требования к проведению испытаний дератизационных
средств в натурных условиях………………….475
7.6.2. Методы исследований эффективности
дератизационных средств……………………477
7.6.3. Критерии оценки биологической активности и целевой эффективности дератизационных средств
в естественных местах обитания [23]……………..479
7.7. Библиографические данные…………………481
8. Методы исследования и критерии оценки токсичности и опасности дезинфекционных средств………………483
8.1. Общие требования к организации и проведению токсикологических исследований дезинфекционных средств . . . 483
8.2. Методы изучения токсичности и опасности
микробоцидных дезинфицирующих средств………….491
8.2.1. Перечень необходимых показателей токсичности
и опасности дезинфицирующих средств……………494
8.2.2. Методы определения и оценки токсичности и опасности
дезинфицирующих средств…………………..496
8.2.3. Критерии оценки токсичности и опасности
дезинфицирующих средств на первом этапе………….510
8.2.4. Критерии оценки токсичности и опасности
дезинфицирующих средств на втором этапе………….510
8.2.5. Критерии оценки токсичности и опасности
8.2.6. Перечень необходимых токсикологических показателей при оценке токсичности и опасности дезинфицирующих средств, предназначенных для дезинфекции на предприятиях
дезинфицирующих средств на третьем этапе………….513
пищевой промышленности (пивобезалкогольная и винодельческая, мясо-молочная, хлебопекарная, кондитерская, сыроварения, рыбоперерабатывающая промышленность)……………………….514
8.3. Методы изучения токсичности и опасности средств
для стерилизации и предстерилизационной очистки изделий медицинского назначения ИМН………………..515
8.3.1. Оценка токсичности и опасности средств, предназначенных для предстерилизационной очистки ИМН. . . 515
8.3.2. Изучение оценки токсичности и опасности стерилизующих средств СС, предназначенных
для стерилизации ИМН, включая эндоскопы…………516
8.4. Методы изучения токсичности и опасности
кожных антисептиков………………………520
8.4.1. Перечень необходимых показателей токсичности и опасности кожных антисептиков………………521
15
P 4.2.2643-10
8.4.2. Методы определения и оценка токсичности и опасности
кожных антисептиков……………………..523
8.4.3. Испытания кожных антисептиков
в практических условиях……………………525
8.4.4. Критерии оценки токсичности, опасности
и отбор кожных антисептиков…………………527
8.5. Методы изучения токсичности и опасности средств для обеззараживания питьевой воды
при нецентрализованном водоснабжении…………..528
8.5.1. Перечень определяемых показателей для оценки токсичности и опасности дезинфицирующих средств
на первом этапе их доклинических исследований……….530
8.5.2. Критерии отбора дезинфицирующих средств
8.5.3. Изучение токсичности обеззараженной средствами питьевой воды на втором этапе доклинических исследований . . 531
8.5.4. Клинические испытания обеззараженной питьевой воды
для обеззараживания воды на первом этапе………….530
в режиме применения……………………..533
8.5.5. Методы определения других показателей качества
обеззараженной воды……………………..534
8.5.6. Оценка реальной опасности риска
обеззараженной воды……………………..535
8.6. Методы изучения токсичности и опасности средств
для обеззараживания воды плавательных бассейнов………536
8.6.1. Методическая схема изучения и критерии оценки
дезинфицирующих средств для обеззараживания воды плавательных бассейнов…………………….536
8.6.2. Токсикологическое изучение и оценка качества
обеззараженной дезинфектантами воды плавательных бассейнов 2-й этап………………………540
8.6.3. Практические испытания обеззараженной воды
плавательных бассейнов в рекомендуемом режиме применения дезинфицирующих средств 3-й этап……………..542
8.7. Методы изучения токсичности и опасности
дезинсекционных средств…………………….542
8.7.1. Перечень необходимых токсикологических показателей
токсичности и опасности дезинсекционных средств……..549
8.7.2. Методы определения и оценки
токсичности и опасности дезинсекционных средств……..552
в рекомендуемом режиме применения в натурных условиях . . . 555
8.7.4. Критерии оценки токсичности и опасности
средств дезинсекции………………………560
8.7.3. Определение реальной опасности средства
16
P 4.2.2643-10
8.8. Методы изучения токсичности и опасности
репеллентных средств………………………573
8.8.1. Методическая схема, критерии оценки
и методы изучения токсичности и опасности репеллентов …. 573
8.8.1.1. Общие положения………………….573
8.8.1.2. Оценка токсичности и опасности репеллентных
средств…………………………….574
8.8.1.3. Клинические испытания репеллентных средств
в практических условиях…………………..578
8.8.2. Методическая схема, критерии оценки
и методы определения репеллентных средств для детей……579
8.8.2.1. Общие требования………………….579
8.8.2.2. Критерии отбора животных по возрастным труппам,
соответствующим возрасту ребенка……………..579
8.8.2.3. Основные требования по безопасности
для репеллентных средств для детей…………….581
8.9. Методы изучения токсичности и опасности
педикулицидных средств……………………..582
8.9.1. Перечень определяемых показателей для оценки токсичности и опасности педикулицидных средств
против головного и лобкового педикулеза…………..586
8.9.2. Методы определения и оценки токсичности
и опасности педикулицидных средств против головного и лобкового педикулеза…………………….586
8.9.2.1. Показатели острой токсичности…………..586
8.9.2.2. Ингаляционная опасность в режимах применения . . . 586
8.9.2.3. Определение и оценка местного раздражающего
действия на кожу……………………….587
8.9.2.4. Определение и оценка местнораздражающего
действия на глаза……………………….588
8.9.2.5. Определение и оценка кожно-резорбтивного
действия……………………………588
8.9.2.6. Определение коэффициента возрастной
чувствительности КВЧ…………………..588
8.9.2.7. Определение и оценка сенсибилизирующих свойств . . 589
8.9.3. Перечень показателей и методы определения
токсичности и опасности педикулицидных средств против платяного педикулеза……………………..589
8.9.3 Л. Определение и оценка кожно-резорбтивного
действия средства………………………590
8.9.3.2. Санитарно-гигиеническая оценка материалов, обработанных или импрегнированных педикулицидами …. 590
17
P 4.2.2643-10
8.9.4. Испытания средства в практических условиях……..591
8.9.5. Критерии оценки токсичности, опасности и отбор
педикулицидных средств……………………593
8.10. Методы изучения токсичности и опасности
дератизационных средств…………………….595
8.10.1. Этапы изучения токсичности и опасности
дератизационных средств……………………595
8.10.2. Перечень определяемых показателей для оценки
токсичности и опасности дератизационных средств……..600
8.10.2.1. Дератизационные средства в различных формах
пасты, гели, масляные растворы, тесто…………..600
8.10.2.2. Дератизационные средства в виде дустов и порошков. 600
8.10.2.3. Дератизационные приманки (зерновые, гранулированные, блоки восковые, парафинированные). … 601
8.10.3. Методы изучения токсичности и опасности
дератизационных средств………………….. . 601
8.10.3.1. Определение средне-смертельной дозы
при однократном введении в желудок (ЛД50)……….. 601
8.10.3.2. Определение средне-смертельной дозы при однократном нанесении на неповрежденные
кожные покровы (ЛД50)…………………… 601
8.10.3.3. Определение кумулятивных свойств………..601
8.10.3.4. Определение ингаляционной опасности
в насыщающих концентрациях по степени летучести (С20) . . . 602
8.10.3.5. Определение местно-раздражающего
действия на кожу……………………….602
8.10.3.6. Определение кожно-резорбтивного действия
средства на кожные покровы…………………602
8.10.3.7. Определение местно-раздражающего действия
на слизистые оболочки глаз…………………603
8.10.3.8. Определение сенсибилизирующего действия
дератизационных средств…………………..603
8.10.3.9. Определение фактора безопасности (SF)………603
8.10.4. Критерии оценки токсичности и опасности
дератизационных средств……………………603
8.10.4.1. Критерии отбора…………………..603
8.10.4.2. Критерии оценки………………….607
8.11. Библиографические данные…………………611
18
P 4.2.2643-10
УТВЕРЖДАЮ Руководитель Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главный государственный санитарный врач Российской Федерации
Г. Г. Онищенко
1 июня 2010 г.
Дата введения: 2 июня 2010 г.
3.5. ДЕЗИНФЕКТОЛОГИЯ
Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности
Руководство Р 4.2.2643-10
1. Область применения
1.1. Настоящее руководство (далее — руководство) устанавливает единые методы лабораторных исследований и испытаний дезинфекционных средств для оценки их антимикробной, инсектицидной, акарицидной, репеллентной и родентицидной активности, эффективности и безопасности при применении в быту, в лечебно-профилактических организациях и на других объектах для обеспечения безопасности жизни и здоровья людей, животных и неловреждения объектов внешней среды.
1.2. Настоящее руководство предназначено для организаций, учреждений, предприятий, аккредитованных испытательных центров лабораторий, органов по сертификации дезинфекционных средств, аккредитованных в системе аккредитации ГОСТ Р, специалистов, осуществляющих исследования дезинфицирующих, стерилизующих, дезинсекционных, дератизационных средств, а также их субстанций (действующих веществ) в процессе их разработки, производства, применения, регистрационных и сертификационных испытаний, производственного контроля и надзора [4, 5].
1.3. Руководство разработано на основе Федерального закона от 31.03.1999 № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения» [1], Федерального закона от 10.01.2002 № 23001 «Об охране окружающей среды» [2], Федерального закона «Основы законодательства Российской Федерации об охране здоровья граждан» от 22.06.1993 № 5487-1 [3], Постановления Правительства от
19
ББК 51.9 Р85
Р85 Методы лабораторных исследований и испытаний медикопрофилактических дезинфекционных средств для оценки их эффективности и безопасности: Руководство. —М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2010.-615 с.
ISBN 978-5-7508—1002—4
1. Разработаны Федеральным государственным учреждением науки «НИИ дезинфектолоши» Роспотребнадзора и кафедрой дезинфектологии ММА им. И. М. Сеченова (М. Г. Шандала, Н. Ф. Соколова, Л. Г. Пантелеева,
И. М. Абрамова, С. А. Рославцева, М. И. Шутова, Е. Н. Богданова,
А. И. Фролова, А. Н. Сукиасян, В. М. Лубошнюсова, Э. А Новикова,
Л. С. Федорова, И. М. Цвирова, Н. Н. Левчук, А С Белова, Л. И. Анисимова,
Л. И. Колычева, Г. Н. Мельникова, В. В. Дьяков, М. Н. Костина, Н. И. Шаши-на, О. Ю. Еремина, Е. И. Баканова, Л. С. Путинцева, Н. А Хрусталева,
Ю. В. Лопатина, В. В. Олифер, М. А Алексеев, О. М. Германт, И. В. Ибрагим-халилова, С. В. Рябов, М. М. Мальцева, Г. Н. Заева, Г. П. Панкратова, Т. 3. Ры-сина, Р П Родионова, А П. Степнов, О. И. Березовский); Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Л. С. Бойко, О. В. Романченко); ФГУН 48 НИИМ МО РФ — Центром военно-технических проблем биологической защиты (В. В. Каншцев); Научно-исследовательским центром бытовой химии (Т. А Перегуда), ООО «Супер-сан-МК» (М. В. Кунашев); Институтом медицинской паразитологии тропической медицины им. Е. И. Мархщновского ММА им. И. М. Сеченова (В. П. Сергиев, Л. А Ганнушкина); кафедрой тропической медицины и паразитарных болзней МПФ ППО ММА им. И. М. Сеченова (Е. А. Черникова);
ГУ НИИ вирусологии им. Д. И. Ивановского РАМН (Д. К. Львов, Н. Н. Носик,
П. Г. Дерябин); ГУ институтом полиомиелита и вирусных энцефалитов им. М. П. Чумакова РАМН (М. И. Михайлов, Н. А Замятина, К. К. Кюрегян,
Р. М. Элбакян).
2. Рекомендованы к утверждению Комиссией по санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 24 декабря 2009 г. №4).
3. Утверждены Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации, Г. Г. Онищенко I июня 2010 г.
4. Введены в действие со 2 июня 2010 г.
5. Введены взамен «Методических рекомендаций по определению виру-лицидной активности препаратов» (от 6.09Л 973 № 1119—73), «Инструкции по определению бактерицидах свойств новых дезинфицирующих средств (от 6 мая 1968 г. N° 739—68), Методических указаний «Методы испытаний дезинфекционных средств для оценки их безопасности и эффективности», 1998 г.
ББК 51.9
© Роспотребнадзор, 2011 © Федеральный центр гигиены
и эпидемиологии Роспотребнадзора, 2011
P 4.2.2643-10
04.04.2001 № 262 «О государственной регистрации отдельных видов продукции, представляющих потенциальную опасность для человека, а также отдельных видов продукции, впервые ввозимых на территорию Российской Федерации» [7], а также «Положения о государственного санитарно-эпидемиологическом нормировании», утвержденного постановлением Правительства Российской Федерации от 24 июля 2000 г. № 554 [6], и других нормативных и методических показателей, приведенных в разделе 2 «Нормативные ссылки».
2. Нормативные ссылки
1. Федеральный закон от 31.03.1999 г. № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения» (Собрание законодательства Российской Федерации, 1999, 314, ст.1650; 2002, № 1 ч.1, ст. 2; 2003, № 2, ст.167; № 27 (ч. 1), ст. 2007; 2004, № 35, ст. 3607; 2005, № 19, ст. 1752; 2006, № 1, ст. 10; 2007, № 1, Ст. 29; № 27, ст. 3213; № 46, ст. 5554; М> 49, ст. 6070).
2. Федеральный закон от 10.01.2002 № 23001 «Об охране окружающей среды».
3. «Основы законодательства Российской Федерации об охране здоровья граждан» от 22 июня 1993 г. № 5487-1 (с изменениями от 2 марта 19998 г., 20 декабря 1999 г., 2 декабря 2000 г., 10 января, 27 февраля, 30 июня 2003 г., 29 июня, 22 августа, 1,29 декабря 2004 г., 7 марта, 21, 31 декабря 2005 г., 2 февраля 2006 г.).
4. Федеральный закон от 16.09.1998 № 158-ФЗ «О лицензировании отдельных видов деятельности».
5. Федеральный закон от 10.06.1993 № 5151-1 «О сертификации продукции и услуг».
6. «Положение о государственном санитарно-эпидемиологическом нормировании», утвержденное постановлением Правительства Российской Федерации от 24 июля 2000 г. № 554 (Собрание законодательства Российской Федерации, 2000, № 31, ст. 3295).
7. Постановление Правительства от 04.04.2001 № 262 «О государственной регистрации отдельных видов продукции, представляющих потенциальную опасность для человека, а также отдельных видов продукции, впервые ввозимых на территорию РоссОий-ской Федерации».
8. Приказ Минздрава СССР от 30.12.1983 № 1509 «О дальнейших мерах по совершенствованию порядка оформления разрешения к медицинскому применению и передачи для промышленного производства новых лекарственных средств».
9. Приказ Минздрава России от 20.07.1998 № 217 «О гигиенической оценке производства, поставки и реализации продукции и товаров».
20
Р 4.2.2643-10
Содержание
1. Область применения………………………..19
2. Нормативные ссылки……………………….20
3. Общие положения…………………………25
4. Химико-аналитические методы исследований
дезинфекционных средств……………………..27
4.1. Общие положения……………………….27
4.1.1. Методы определения физико-химических показателей
дезинфекционных средств……………………28
4.1.2. Методы количественного определения действующих
веществ в дезинфекционных средствах……………..30
4.2. Методы количественного определения действующих веществ в дезинфицирующих, стерилизующих средствах
и средствах для предстерилизационной очистки…………31
4.2.1. Методы определения галоидактивных соединений
хлорактивных, бромактивных и йодактивных………..32
4.2.2. Методы определения перекисных соединений (перекиси водорода, ее комплексов с солями,
надуксусной кислоты и озона)………………….34
4.2.4. Методы определения четвертичных аммониевых солей … 38
4.2.5. Методы определения производных гуанидина (солей полигексаметиленгуанидина гидрохлорида
и хлоргексидина биглюконата)…………………40
4.2.6. Методы определения третичного алкиламина —
^К-бисЗ-аминопрохшлдодециламина…………….42
4.2.7. Методы определения низших жирных спиртов
этилового, изопропилового и н-пропилового…………43
4.2.8. Метод определения соединений фенольного
ряда [2-бифенилола, 2-бензил-4-хлорфенола, 5-хлор-2-гидроксидифенил-метана, 5-хлор-2-2,4-дихлорфенокси фенола] и др……………………………44
4.2.9. Метод определения кислот и щелочей…………..50
4.2.10. Методы анализа анионных и неионогенных ПАВ……52
4.2.11. Методы анализа метасиликата натрия………….52
4.3. Методы исследования дезинсекционных средств………52
4.3.1. Метод газо-жидкостной хроматографии ГЖХ
для идентификации и количественного определения действующих веществ в дезинсекционных средствах……..53
4.3.2. Метод ГЖХ для определения пиретроидов………..56
4.3.3. Методы определения фосфорорганических соединений, . . 71
3
P 4.2.2643-10
4.3.4. Метод ГЖХ для определения карбаматов…………78
4.3.5. Метод ГЖХ для определения регулятора размножения
тараканов — S-гидропрена…………………..80
4.3.6. Методы идентификации и количественного определения действующих веществ в репеллентных средствах. . . 81
4.4. Методы исследований дератизационных средств………87
4.4.1. Методы определения фосфида цинка в дератизационных
субстанциях и средствах…………………….88
4.4.2. Методы определения 1-1 -нафшл-2-тиомочевины
в дератизационных субстанциях и средствах………….91
4.4.2Л. Спектрофотометрические методы определения М-нафтил-2-тиомочевины…………………91
4.4.2.2. Хроматографический метод определения
1-1-нафтил-2-тиомочевины…………………93
4.4.3. Методы определения индандионов в дератизационных
субстанциях и средствах…………………….94
4.4.3Л. Титриметрический метод определения дифенацина, этилфенацина и изопропилфенацина…………….94
4.4.3.2. Спектрофотометрические методы определения
дифенацина, этилфенацина и изопропилфенацина……..95
4.4.3.3. Хроматографические методы определения
антикоагулянтов индандионового ряда……………98
4.4.4. Методы определения антикоагулянтов
кумаринового ряда……………………….102
4.4.4Л. Спектрофотометрические методы определения зоокумарина и бромадиолона……………. 102
4.4.4.2. Хроматографические методы определения антикоагулянтов оксикумаринового ряда………….104
4.5. Библиографические данные…………………111
5. Микробиологические методы исследований и критерии оценки эффективности дезинфицирующих и стерилизующих средств…..112
5.1. Методы изучения и оценки бактерицидной активности дезинфицирующих средств и их субстанций…………..114
5.1.1. Тест-микроорганизмы для изучения бактерицидной активности ДС и их субстанций. Требования к тест-микроорганизмам ……………………….114
5 Л .1Л. Методы приготовления суспензии тест-микроорганизмов. Определение биологической концентрации тест-микроорганизмов в бактериальной суспензии…..115
5 Л .1.2. Приготовление рабочих растворов ДС и их субстанций……………………….116
P 4.2.2643-10
5.1.2. Методы исследований и оценки результатов
бактерицидной активности ДС и их субстанций in vitro……117
5 Л. 2.1. Суспензионный метод………………..118
5.1.2.2. Метод батистовых тест-объекгов…………..118
5Л.2.3. Методы исключения бактериостатического действия действующих веществ…………………….120
5.1.2.4. Методы изучения факторов, влияющих на бактерицидную активность ДС и их субстанций…….122
5.1.3. Методы исследования бактерицидной эффективности
ДС, предназначенных для обеззараживания объектов внешней среды, контаминированныхтест-микроорганизмами…….124
5.1.3.1. Исследование бактерицидной эффективности
ДС, предназначенных для обеззараживания ИМН……..124
5.1.3.2. Исследование бактерицидной эффективности ДС,
предназначенных для обеззараживания стоматологических оттисков……………………………126
5.1.3.3. Исследование бактерицидной эффективности ДС, предназначенных для обеззараживания предметов ухода
за больными, игрушек…………………….127
5.1.3.4. Исследование бактерицидной эффективности
ДС, предназначенных для обеззараживания белья……..128
5.1.3.5. Исследование бактерицидной эффективности ДС,
предназначенных для обеззараживания поверхностей……129
5.1.3.6. Исследование бактерицидной эффективности ДС,
предназначенных для обеззараживания посуды……….131
5.1.3.7. Исследование бактерицидной эффективности ДС,
предназначенных для обеззараживания выделений…….133
5.1.3.8. Исследование бактерицидной эффективности ДС,
предназначенных для обеззараживания воздуха………135
5.1.3.9. Исследование эффективности ДС, предназначенных
для обеззараживания питьевой воды и воды плавательных бассейнов…………………………..137
5.2. Методы изучения и оценки туберкулоцвдной активности дезинфицирующих средств……………………148
5.2.1. Общие положения…………………….149
5.2.1.1. Тест-микроорганизмы для изучения туберкулоцидной активности дезинфицирующих средств и их субстанций.
Требования к тест-микроорганизмам…………….151
5.2.1.2. Методика приготовления суспензии тест-
микроорганизмов ………………………153
5.2.1.3. Определение устойчивости тест-микроорганизмов
к эталонным Д С……………………….156
5
P 4.2.2643-10
5.2.1.4. Обеспечение стандартности условий проведения исследований активности ДС и их субстанций……….159
5.2.2. Методы исследований и оценки
результатов активности ДС и их субстанций in vitro………162
5.2.2.1. Суспензионный метод………………..162
5.2.2.2. Метод батистовых тест-объектов…………..166
5.2.2.3. Методы изучения факторов, влияющих
на туберкулоцидную активность ДС и их субстанций……169
5.2.3. Методы исследований туберкулоцидной эффективности
5.2.3.1. Исследование туберкулоцидной эффективности ДС, предназначенных для обеззараживания поверхностей помещений, мебели, аппаратов, приборов, санитарнотехнического оборудования, транспортных средств
ДС, предназначенных для обеззараживания объектов внешней среды, контаминированных тест-микроорганизмами…….171
и других объектов………………………171
5.2.3.2. Исследование туберкулоцидной эффективности ДС, предназначенных для обеззараживания предметов ухода за больными и игрушек из различных материалов кроме мягких. . . 173
5.2.3.3. Исследование туберкулоцидной эффективности ДС,
предназначенных для обеззараживания посуды столовой, лабораторной и из-под выделений……………..175
5.2.3.4. Исследование туберкулоцидной эффективности ДС, предназначенных для обеззараживания изделий медицинского назначения ИМИ, включая эндоскопы …. 176
5.2.3.5. Исследование туберкулоцидной эффективности
ДС, предназначенных для обеззараживания белья, одежды, спецодежды и других объектов из ткани…………..179
5.2.3.6. Исследование туберкулоцидной эффективности
камерного метода обеззараживания……………..181
5.2.3.7. Исследование туберкулоцидной эффективности ДС
при обеззараживании рук в резиновых перчатках……..181
5.2.3.8. Исследование туберкулоцидной эффективности ДС, предназначенных для обеззараживания выделений
моча, кал, мокрота и крови…………………182
5.2.3.9. Исследование туберкулоцидной эффективности
ДС, предназначенных для обеззараживания медицинских отходов…………………………….184
5.2.3.10. Методы определения туберкулоцидной активности
ДС при обеззараживании воздуха………………185
5.2.4. Методы исследования и оценки туберкулоцидной
активности ДС в практических условиях……………186
5.2.5. Приложения……………………….187
6
P 4.2.2643-10
5.3. Методы изучения и оценки фунгицидной активности
дезинфицирующих средств……………………196
5.3.1. Общие положения…………………….196
5.3.1.1. Тест-микроорганизмы для изучения фунгицидной активности ДС и их субстанций. Требования к тест-грибам . . 196
5.3.2. Методы исследований и оценки результатов
фунгицидной активности ДС и их субстанций in vitro…….199
5.3.2.1. Суспензионный метод………………..199
5.3.2.2. Метод батистовых тест-объекгов…………..200
5.3.2.3. Методы исключения фуншстатического действия
действующих веществ…………………….200
5.3.2.4. Методы изучения факторов, влияющих
на фунгицидную активность ДС и их субстанций……..200
5.3.3. Методы исследования фунгицидной эффективности ДС,
предназначенных для обеззараживания различных объектов внешней среды, контаминированных тест-грибами……..201
5.3.3Л. Исследование фунгицидной эффективности ДС, предназначенных для обеззараживания ИМИ……….201
5.3.3.2. Исследование фунгицидной эффективности ДС, предназначенных для обеззараживания эндоскопов,
включая дезинфекцию высокого уровня ДВУ………203
5.3.3.3. Исследование фунгицидной эффективности ДС,
предназначенных для обеззараживания стоматологических оттисков……………………………205
5.3.3.4. Исследование фунгицидной эффективности ДС, предназначенных для обеззараживания предметов ухода
за больными, игрушек…………………….205
5.3.3.5. Исследование фунгицидной эффективности ДС,
предназначенных для обеззараживания белья………..207
5.3.3.6. Исследование фунгицидной эффективности ДС,
предназначенных для обеззараживания поверхностей……208
5.3.3.7. Исследование фунгицидной эффективности ДС,
предназначенных для обеззараживания посуды………210
5.3.3.8. Исследование фунгицидной эффективности ДС,
предназначенных для обеззараживания выделений…….211
5.4. Методы определения активности антимикробных
материалов тканей, лакокрасочных покрытий…………213
5.5. Методы определения эффективности
кожных антисептиков………………………215
5.5Л. Общие положения. ……………………215
5,5.2. Определение эффективности кожных антисептиков, предназначенных для гигиенической обработки рук……..216
7
P 4.2.2643—10
5.5.3. Определение эффективности кожных антисептиков,
предназначенных для обработки рук хирургов………..217
5.5.4. Определение эффективности кожных антисептиков, предназначенных для обработки кожи операционного
и инъекционного полей и локтевых сгибов доноров…….. 219
5.5.5. Определение эффективности кожных антисептиков, предназначенных для санитарной обработки кожных
покровов…………………………….220
5.5.6. Определение эффективности «кожных антисептиков —
моющих средств», предназначенных для гигиенической обработки рук, санитарной обработки кожных покровов…..220
5.6. Методы определения эффективности ДС
и кожных антисептиков в практических условиях………..221
5.6.1. Общие положения…………………….221
5.6.2. Определение эффективности ДС при обеззараживании
различных объектов поверхностей, белья, посуды и др……222
5.6.3. Определение эффективности ДС
при обеззараживании ИМН………………….223
5.6.4. Определение активности изделий
из антимикробных тканей……………………225
5.6.5. Определение антимикробной активности
лакокрасочных покрытий……………………226
5.6.6. Определение эффективности кожных антисептиков …. 226
5.7. Методы изучения и оценки вирулицидной активности
дезинфицирующих средств……………………228
5.7.1. Общие положения…………………….228
5.7.2. Тест-вирусы, модельные системы, критерии оценки и основные условия, которые необходимо соблюдать при исследованиях вирулицидной активности ДС
и их субстанций. Применение нейтрализатора………..229
5.7.3. Основные этапы и методы изучения
вирулицидной активности ДС и субстанций………….233
5.7.3.1. Суспензионный метод………………..233
5.7.3.2. Метод батистовых тест-объектов…………..234
5.7.4. Методы изучения и оценки вирулицидной
эффективности ДС, предназначенных для обеззараживания различных объектов, контаминированных тест-вирусами…..236
5.7.4.1. Определение вирулицидной активности ДС,
предназначенных для обеззараживания ИМН……….236
5.7.4.2. Определение вирулицидной активности ДС, предназначенных для обеззараживания предметов ухода
за больными и игрушек……………………239
8
P 4.2.2643-10
57.4.3. Определение вирулицидной активности ДС, предназначенных д ля обеззараживания белья, спецодежды
и других изделий из тканей………………….241
57.4.4. Определение вирулицидной активности ДС, предназначенных для обеззараживания посуды,
в том числе лабораторной…………………..242
57.4.5. Определение вирулицидной активности ДС,
предназначенных для обеззараживания поверхностей……243
57.4.6. Определение вирулицидной активности ДС, предназначенных для обеззараживания выделений
моча, фекалии, мокрота и крови………………244
57.47. Определение вирулицидной активности аэрозолей ДС, предназначенных для обеззараживания воздуха в помещениях…………………………246
57.4.8. Определение вирулицидной активности ДС,
предназначенных для обеззараживания медицинских
отходов……………………………247
57.5. Определение вирулицидной активности
кожных антисептиков……………………..247
57.6. Определение вирулицидной активности антимикробных
тканей, лакокрасочных материалов………………247
577. Библиографические данные……………….248
57.8. Приложения……………………….249
5.8. Методы изучения и оценки спороцидной активности дезинфицирующих и стерилизующих средств………….257
5.8.1. Общие положения…………………….257
5.8.1.1. Тест-микроорганизмы для изучения и оценки спороцидной активности ДС, СС и их субстанций.
Требования к тест-микроорганизмам…………….259
5.8.1.2. Методика приготовления суспензии спор
тест-микроорганизмов……………………261
5.8.1.3. Определение биологической концентрации тест-
микроорганизма в споровой суспензии …………..264
5.8.1.4. Методики определения устойчивости спор
тест-микроорганизмов к эталонным ДС…………..267
5.8.2. Обеспечение стандартности условий
проведения исследований спороцидной активности ДС, СС и их субстанций…………………………274
5.8.3. Методы исследований и оценки результатов спороцидной
активности ДС, СС и их субстанций in vitro………….278
5.8.3.1. Суспензионный метод…………….. 278
5.8.3.2. Метод батистовых тест-объектов…………..281
9
Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности
| Обозначение: |  Р 4.2.2643-10 Р 4.2.2643-10 |
| Обозначение англ: |  R 4.2.2643-10 R 4.2.2643-10 |
| Статус: | действует |
| Название рус.: | Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности |
| Дата добавления в базу: | 01.09.2013 |
| Дата актуализации: | 01.01.2021 |
| Дата введения: | 02.06.2010 |
| Область применения: | Руководство устанавливает единые методы лабораторных исследований и испытаний дезинфекционных средств для оценки их антимикробной, инсектицидной, акарицидной, репеллентной и родентицидной активности, эффективности и безопасности при применении в быту, в лечебно-профилактических организациях и на других объектах для обеспечения безопасности жизни и здоровья людей, животных и неповреждения объектов внешней среды. Руководство предназначено для организаций, учреждений, предприятий, аккредитованных испытательных центров лабораторий, органов по сертификации дезинфекционных средств, аккредитованных в системе аккредитации ГОСТ Р, специалистов, осуществляющих исследования дезинфицирующих, стерилизующих, дезинсекционных, дератизационных средств, а также их субстанций (действующих веществ) в процессе их разработки, производства, применения, регистрационных и сертификационных испытаний, производственного контроля и надзора. |
| Оглавление: | 1. Область применения 2. Нормативные ссылки 3. Общие положения 4. Химико-аналитические методы исследований дезинфекционных средств 4.1. Общие положения 4.2. Методы количественного определения действующих веществ в дезинфицирующих, стерилизующих средствах и средствах для предстерилизационной очистки 4.3. Методы исследования дезинсекционных средств 4.4. Методы исследований дератизационных средств 4.5. Библиографические данные 5. Микробиологические методы исследований и критерии оценки эффективности дезинфицирующих и стерилизующих средств 5.1. Методы изучения и оценки бактерицидной активности дезинфицирующих средств и их субстанций 5.2. Методы изучения и оценки туберкулоцидной активности дезинфицирующих средств 5.3. Методы изучения и оценки фунгицидной активности дезинфицирующих средств 5.4. Методы определения активности антимикробных материалов тканей, лакокрасочных покрытий 5.5. Методы определения эффективности кожных антисептиков 5.6. Методы определения эффективности ДС и кожных антисептиков в практических условиях 5.7. Методы изучения и оценки вирулицидной активности дезинфицирующих средств 5.8. Методы изучения и оценки спороцидной активности дезинфицирующих и стерилизующих средств 5.9. Методы исследований и критерии оценки эффективности средств для предстерилизационной очистки ИМН 6. Энтомологические методы исследований и критерии оценки эффективности дезинсекционных средств 6.1. Общие положения. Организация экспериментов 6.2. Методы определения активности действующих веществ субстанций дезинсекционных средств 6.3. Методы определения активности инсектицидных средств 6.4. Методы изучения активности акарицидных и инсекто-акарицидных средств 6.5. Методы определения активности инсекто- и акарорепеллентных средств 6.6. Методы определения активности средств на основе регуляторов развития насекомых и аттрактантов феромонов 6.7. Методы определения эффективности инсектицидных, акарицидных и репеллентных средств в натурных условиях 7. Родентологические методы исследований и критерии оценки эффективности дератизационных средств 7.1. Общие положения. Требования к экспериментальным животным и условиям их содержания 7.2. Методы исследований эффективности химических родентицидных средств 7.3. Методы исследования эффективности репеллентов 7.4. Методы исследований эффективности механических дератизационных средств 7.5. Методы исследований эффективности химических родентицидных средств в условиях группового содержания грызунов 7.6. Методы оценки эффективности дератизационных средств в естественных местообитаниях грызунов в натурных условиях 7.7. Библиографические данные 8. Методы исследования и критерии оценки токсичности и опасности дезинфекционных средств 8.1. Общие требования к организации и проведению токсикологических исследований дезинфекционных средств 8.2. Методы изучения токсичности и опасности микробоцидных дезинфицирующих средств 8.3. Методы изучения токсичности и опасности средств для стерилизации и предстерилизационной очистки изделий медицинского назначения ИМН 8.4. Методы изучения токсичности и опасности кожных антисептиков 8.5. Методы изучения токсичности и опасности средств для обеззараживания питьевой воды при нецентрализованном водоснабжении 8.6. Методы изучения токсичности и опасности средств для обеззараживания воды плавательных бассейнов 8.7. Методы изучения токсичности и опасности дезинсекционных средств 8.8. Методы изучения токсичности и опасности репеллентных средств 8.9. Методы изучения токсичности и опасности педикулицидных средств 8.10. Методы изучения токсичности и опасности дератизационных средств 8.11. Библиографические данные |
| Разработан: | НИИ дезинфектологии Институт медицинской паразитологии и тропической медицины им. Е.И. Марциновского МЗ РФ ГУ Институт полиомиелита и вирусных энцефалитов им. М.П. Чумакова ФГУН 48 НИИМ МО РФ |
| Утверждён: | 01.06.2010 Главный государственный санитарный врач Российской Федерации |
| Издан: | Федеральный центр гигиены и эпидемиологии Роспотребнадзора (2011 г. ) |
| Расположен в: | Техническая документация Экология ЗДРАВООХРАНЕНИЕ Стерилизация и дезинфекция Стерилизация и дезинфекция, прочие аспекты |
| Заменяет собой: |
|
| Нормативные ссылки: |
|
-
Главная -
Новости -
Всё о НОД
-
Структура НОД
-
Президиум НОД -
Исполнительная дирекция -
Члены НОД
-
-
Членство в НОД
-
Как вступить в НОД -
Преимущества членства в НОД -
Положение о членстве в НОД -
Членские взносы
-
-
Система СДСД
-
Что такое СДСД -
Положение о СДСД -
О структурных органах -
Порядок проведения -
Документы для прохождения СДСД -
Положение о Знаке соответствия -
Организации, прошедшие СДСД
-
-
Деятельность НОД
-
Издания НОД -
Сотрудничество -
Решения коллегиальных органов
-
-
Номинации и поощрения
-
О поощрении членов НОД -
Почётный член НОД -
Грант им. Г.И. Останина -
Премия им. В.И. Вашкова -
Номинации членов НОД
-
-
Совет производителей
-
Положение о Совете -
Состав -
Этический кодекс
-
-
Информация для населения
-
-
Журнал «ДезДело» -
Документы
-
Общие вопросы -
Дезинфекция -
Дезинсекция -
Дератизация -
Стерилизация -
Эпидемиология -
Медицинские отходы
-
-
Контакты -
Реклама
-
Главная -
Новости -
Всё о НОД
-
Структура НОД
-
Президиум НОД -
Исполнительная дирекция -
Члены НОД
-
-
Членство в НОД
-
Как вступить в НОД -
Преимущества членства в НОД -
Положение о членстве в НОД -
Членские взносы
-
-
Система СДСД
-
Что такое СДСД -
Положение о СДСД -
О структурных органах -
Порядок проведения -
Документы для прохождения СДСД -
Положение о Знаке соответствия -
Организации, прошедшие СДСД
-
-
Деятельность НОД
-
Издания НОД -
Сотрудничество -
Решения коллегиальных органов
-
-
Номинации и поощрения
-
О поощрении членов НОД -
Почётный член НОД -
Грант им. Г.И. Останина -
Премия им. В.И. Вашкова -
Номинации членов НОД
-
-
Совет производителей
-
Положение о Совете -
Состав -
Этический кодекс
-
-
Информация для населения
-
-
Журнал «ДезДело» -
Документы
-
Общие вопросы -
Дезинфекция -
Дезинсекция -
Дератизация -
Стерилизация -
Эпидемиология -
Медицинские отходы
-
-
Контакты -
Реклама
РУКОВОДСТВО Р 4.2.2643-10
- Разработаны Федеральным государственным учреждением науки «НИИ дезинфектологии» Роспотребнадзора и кафедрой дезинфектологии ММА им. И. М. Сеченова; Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека; ФГУН 48 НИИМ МО РФ — Центром военно-технических проблем биологической защиты; Научно-исследовательским центром бытовой химии; ООО «Суперсан-МК»;
Институтом медицинской паразитологии тропической медицины им. Е.И. Марциновского ММА им. И.М. Сеченова; кафедрой тропической медицины и паразитарных болезней МПФ ППО ММА им. И. М. Сеченова; ГУ НИИ вирусологии имени Д. И. Ивановского РАМН; ГУ институтом полиомиелита и вирусных энцефалитов им. М. П. Чумакова РАМН. - Рекомендованы к утверждению Комиссией по санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 24 декабря 2009 г. N 4).
- Утверждены Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г. Г. Онищенко 1 июня 2010 г.
- Введены в действие со 2 июня 2010 г.
- Введены взамен «Методических рекомендаций по определению вирулицидной активности препаратов» (от 06.09.1973 N 1119-73), «Инструкции по определению бактерицидных свойств новых дезинфицирующих средств» (от 6 мая 1968 г. N 739-68), Методических указаний «Методы испытаний дезинфекционных средств для оценки их безопасности и эффективности», 1998 г.
Область применения:
- Настоящее руководство (далее — руководство) устанавливает единые методы лабораторных исследований и испытаний дезинфекционных средств для оценки их антимикробной, инсектицидной, акарицидной, репеллентной и родентицидной активности, эффективности и безопасности при применении в быту, в лечебно-профилактических организациях и на других объектах для обеспечения безопасности жизни и здоровья людей, животных и неповреждения объектов внешней среды.
- Настоящее руководство предназначено для организаций, учреждений, предприятий, аккредитованных испытательных центров лабораторий, органов по сертификации дезинфекционных средств, аккредитованных в системе аккредитации ГОСТ Р, специалистов, осуществляющих исследования дезинфицирующих, стерилизующих, дезинсекционных, дератизационных средств, а также их субстанций (действующих веществ) в процессе их разработки, производства, применения, регистрационных и сертификационных испытаний, производственного контроля и надзора [4, 5].
- Руководство разработано на основе Федерального закона от 31.03.1999 N 52-ФЗ «О санитарно-эпидемиологическом благополучии населения» [1], Федерального закона от 10.01.2002 N 23001 «Об охране окружающей среды» [2], Федерального закона «Основы законодательства Российской Федерации об охране здоровья граждан» от 22.06.1993 N 5487-1 [3], Постановления Правительства от 04.04.2001 N 262 «О государственной регистрации отдельных видов продукции, представляющих потенциальную опасность для человека, а также отдельных видов продукции, впервые ввозимых на территорию Российской Федерации» [7], а также «Положения о государственном санитарно-эпидемиологическом нормировании», утвержденного Постановлением Правительства Российской Федерации от 24 июля 2000 г. N 554 [6], и других нормативных и методических показателей, приведенных в разделе 2 «Нормативные ссылки».
Нормативные ссылки:
- Федеральный закон от 31.03.1999 N 52-ФЗ «О санитарно-эпидемиологическом благополучии населения» (собрание законодательства Российской Федерации, 1999, N 14, ст. 1650; 2002, N 1 (ч. 1), ст. 2; 2003, N 2, ст. 167; N 27 (ч. 1), ст. 2007; 2004, N 35, ст. 3607; 2005, N 19, ст. 1752; 2006, N 1, ст. 10; 2007, N 1, ст. 29; N 27, ст. 3213; N 46, ст. 5554; N 49, ст. 6070).
- Федеральный закон от 10.01.2002 N 23001 «Об охране окружающей среды».
- «Основы законодательства Российской Федерации об охране здоровья граждан» от 22 июня 1993 г. N 5487-1 (с изменениями от 2 марта 1998 г., 20 декабря 1999 г., 2 декабря 2000 г., 10 января, 27 февраля, 30 июня 2003 г., 29 июня, 22 августа, 1, 29 декабря 2004 г., 7 марта, 21, 31 декабря 2005 г., 2 февраля 2006 г.).
- Федеральный закон от 16.09.1998 N 158-ФЗ «О лицензировании отдельных видов деятельности».
- Федеральный закон от 10.06.1993 N 5151-1 «О сертификации продукции и услуг».
- «Положение о государственном санитарно-эпидемиологическом нормировании», утвержденное Постановлением Правительства Российской Федерации от 24 июля 2000 г. №554 (Собрание законодательства Российской Федерации, 2000, №31, ст. 3295).
- Постановление Правительства от 04.04.2001 N 262 «О государственной регистрации отдельных видов продукции, представляющих потенциальную опасность для человека, а также отдельных видов продукции, впервые ввозимых на территорию Российской Федерации».
- Приказ Минздрава СССР от 30.12.1983 N 1509 «О дальнейших мерах по совершенствованию порядка оформления разрешения к медицинскому применению и передачи для промышленного производства новых лекарственных средств».
- Приказ Минздрава России от 20.07.1998 N 217 «О гигиенической оценке производства, поставки и реализации продукции и товаров».
- Приказ Минздрава России от 10.11.2002 N 344 «О государственной регистрации дезинфицирующих, дезинсекционных и дератизационных средств для применения в быту, в лечебно-профилактических учреждениях и на других объектах для обеспечения безопасности и здоровья людей».
- Постановление Госстандарта России от 30.07.2002 N 64 «Номенклатура продукции, в отношении которой законодательными актами Российской Федерации предусмотрена обязательная сертификация». 12. СП 3.1/3.2.558-96 «Общие требования по профилактике инфекционных и паразитарных заболеваний».
- СП 3.5.3.1129-02 «Санитарно-эпидемиологические требования к проведению дератизации».
- СП 3.5.1378-03 «Санитарно-эпидемиологические требования к организации и осуществлению дезинфекционной деятельности».
- СП 1.3.1285-03 «Безопасность работы с микроорганизмами I — II групп патогенности (опасности)».
- СП 3.1.1275-03 «Профилактика инфекционных заболеваний при эндоскопических манипуляциях».
- СП 1.3.2322-08 «Безопасность работы с микроорганизмами III — IV групп патогенности (опасности) и возбудителями паразитарных болезней» с дополнениями и изменениями (СП 1.3.2518-09).
- СанПиН 1.2.681-97 «Гигиенические требования к производству и безопасности парфюмерно-косметической продукции».
- СанПиН 2.1.7.728-99 «Правила сбора, хранения и удаления отходов лечебно-профилактических учреждений».
- СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников».
- Нормативные показатели безопасности и эффективности дезинфекционных средств, подлежащих контролю при проведении обязательной сертификации. 1998 г., N 01-12/75-97.
- СанПиН 2.1.2.1188-03 «Плавательные бассейны. Гигиенические требования к устройству, эксплуатации и качеству воды. Контроль качества».
- Нормативные показатели эффективности и безопасности дезинфекционных средств, утвержденные 08.03.2004.
- ГОСТ 12.1.007-76 «ССБТ. Вредные вещества. Классификация и общие требования безопасности».
- ГОСТ 22567.8-77 «Средства моющие синтетические. Методы определения силиката натрия».
- ГОСТ 8728-77 «Диметилфталат. Технические условия».
- ГОСТ 13081-77 «Фосфид цинка. Технические условия».
- ГОСТ 27283-87 «Средства индивидуальные химические для обеззараживания воды от бактериологических средств».
- ГОСТ 177-88 «Водорода перекись. Технические условия».
- ГОСТ 29188.0-91 «Изделия парфюмерно-косметические. Правила приемки, отбор проб, методы органолептических исследований».
- ГОСТ 29188.6-91 «Изделия парфюмерно-косметические. Газохроматографический метод определения этилового спирта».
- ГОСТ Р 50550-93 «Товары бытовой химии. Метод определения показателя активности водородных ионов pH».
- ГОСТ 22567.5-93 «Средства моющие синтетические и вещества поверхностно-активные. Методы определения концентрации водородных ионов pH».
- ГОСТ Р 50551-93 «Товары бытовой химии. Метод определения активного хлора».
- ГОСТ 18995.1-73 «Продукты химические жидкие. Методы определения плотности».
- ГОСТ 18995.2-73 «Продукты химические жидкие. Методы определения показателя преломления».
- ГОСТ 18995.4-73 «Продукты химические органические. Методы определения интервала температуры плавления».
- ГОСТ Р 51022-97 «Методы определения анионного поверхностно-активного вещества».
- ГОСТ Р 51018-97 «Методы определения неионогенного поверхностно-активного вещества».
- Ратиндан. Фармакопейная статья ФС 42-330-79.
- Определение температуры плавления. Государственная фармакопея СССР. XI изд., вып. 1. С. 16.
- Определение плотности. Государственная фармакопея СССР. XI изд., вып. 1. С. 24.
- Определение показателя преломления (рефрактометрия). Государственная фармакопея СССР. XI изд., вып. 1. С. 29.
- Определение вязкости жидкостей. Государственная фармакопея СССР. XI изд., вып. 1. С. 87.
- Определение pH. Государственная фармакопея СССР. XI изд., вып. 1. С. 113.
- ОСТ 42-21-2-85 «Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства, режимы». М., 1985 г.
- Стандарт Европейского Комитета по стандартизации NEN-EN 14476.
- Государственная фармакопея СССР. XI изд., вып. 1. С. 183 — 186.
- ГОСТ Р 51021-97 «Методы определения смываемости с посуды».
- Инструкция по определению бактерицидных свойств новых дезинфицирующих средств. Утв. МЗ СССР 6 мая 1968 г. N 739-68.
- Методические указания по оценке дезинфицирующих средств, предназначенных для обеззараживания различных объектов и санитарной обработки людей. Утв. МЗ СССР 20 августа 1970 г. N 859-70.
- Методические указания по определению эффективности препаратов для борьбы с молью. Утв. МЗ СССР 12.06.1977.
- Методические указания по гигиенической оценке одежды и обуви из полимерных материалов. М., 1977, 47 с.
- Методические указания по изучению токсичности препаратов санитарно-гигиенического и бытового назначения в аэрозольных баллонах. М., 1980 г.
- МУ 2163-80 «Методические указания к постановке исследований для обоснования санитарных стандартов вредных веществ в воздухе рабочей зоны». М., 1980.
- Методические указания по первичному отбору новых акарицидов и сравнительному изучению их активности против саркоподобных клещей от 23.07.1982. Утв. ВАСХНИЛ.
- Методические указания по определению устойчивости культур микроорганизмов, контаминирующих изделий медицинского назначения в условиях производства и эксплуатации, к стерилизующим агентам. Утв. МЗ СССР 29 марта 1985 г. N 28-6/7.
- Методические указания «Токсикологическая оценка педикулицидов» от 20.06.1985 N 26-6/6.
- Временные методические указания по обоснованию предельно допустимых концентраций ПДК загрязняющих веществ в атмосферном воздухе населенных мест от 15.06.1988 N 4681-88.
- Методические указания по использованию культуры диплоидных клеток человека, рекомендуемых для токсиколого-гигиенических исследований. Утв. МЗ СССР 18.09.1991. 20 с.
- Методические указания по оценке активности хемостерилянтов и регуляторов развития насекомых. МУ 01-19/06-11 от 03.02.1995.
- Гигиеническая оценка условий труда при применении пестицидов. Методические указания от 20.11.1995 N 01-19/140-17.
- Методические указания по лабораторной оценке воздействия соединений на синантропных тараканов. Утв. ГКСЭН РФ от 09.02.1995 N 01-19/17-11.
- МУ 1.1.578-96 «Требования к постановке экспериментальных исследований по обоснованию предельно допустимых концентраций промышленных химических аллергенов в воздухе рабочей зоны и атмосферы». М., 1997.
- Методы испытаний дезинфекционных средств для оценки их безопасности и эффективности. Утв. МЗ РФ, 1998.
- МУ 3.1.1027-01 «Сбор, учет и подготовка к лабораторному исследованию кровососущих членистоногих — переносчиков возбудителей природно-очаговых инфекций».
- Методические указания по дезинфекции, предстерилизационной очистке и стерилизации изделий медицинского назначения. МУ 287-113 от 30.12.1998.
- МУ 1.2.1105-02 «Оценка токсичности и опасности дезинфицирующих средств». Утв. МЗ России, 10.02.2002.
- Методические указания по лабораторной оценке антимикробной активности текстильных материалов, содержащих антимикробные препараты. МУ от 18.11.1983 N 28-6/32.
- МУ 3.1.1029-01 «Отлов, учет и прогноз численности мелких млекопитающих и птиц в природных очагах инфекций». М., 2002.
- МУ 3.5.2.1759-03 «Методы определения эффективности инсектицидов, акарицидов, регуляторов развития и репеллентов, используемых в медицинской дезинсекции».
- МУ 3.5.1937-04 «Очистка, дезинфекция и стерилизация эндоскопов и инструментов к ним».
- МУ 3.5.2435-09 «Методы изучения и оценки спороцидной активности дезинфицирующих и стерилизующих средств».
- МУ 3.5.2431-08 «Методические указания по изучению и оценке вирулицидной активности дезинфицирующих средств».
- Сборник руководящих методических материалов по токсиколого-гигиеническим исследованиям полимерных материалов и изделий на их основе медицинского назначения. Утв. МЗ СССР, 1987 г. С. 85.
- Методические указания «Оценка воздействия вредных химических соединений на кожные покровы и обоснование предельно допустимых уровней загрязнения кожи» от 01.11.1979 N 2102-79.
- ГОСТ 9.055-75 «Ткани шерстяные. Методы лабораторных испытаний на устойчивость к повреждению молью». М., 1975.
- Приказ Минздрава СССР от 06.04.1973 «Санитарные правила по устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)».
- Приказ Минздрава СССР от 10.10.1983 «Об утверждении нормативов затрат кормов для лабораторных животных в учреждениях здравоохранения СССР».
- МУК 4.2.1018-01 «Санитарно-микробиологический анализ питьевой воды». М.: Минздрав России, 2001.
- СП 3.1.3.2.52-08 «Профилактика клещевого вирусного энцефалита».
- Методические рекомендации по отбору и изучению биологической активности и токсичности репеллентов. М., 1987.
- Р 1.1.003-96 «Общие требования к построению, изложению и оформлению нормативных и методических документов системы государственного санитарно-эпидемиологического нормирования».
- Методические указания по определению зоокумарина в тканях и крови животных, в приманках и препарате пенокумарин хроматографическими и спектрофотометрическими методами №1550-76.
Дезинфектология.
Обоснования выбора химических дезинфицирующих и стерилизующих средств для применения в организациях, осуществляющих медицинскую деятельность.
- Область применения.
- Настоящие рекомендации устанавливают общие требования к выбору химических дезинфицирующих и стерилизующих средств для применения в организациях, осуществляющих медицинскую деятельность.
- Методические рекомендации предназначены для медицинских работников организаций, осуществляющих медицинскую деятельность, госпитальных эпидемиологов, должностных лиц органов, уполномоченных осуществлять государственный санитарно-эпидемиологический надзор.
- Общие положения.
- Подавляющее большинство зарегистрированных в России отечественных и зарубежных средств предназначено для применения в организациях, осуществляющих медицинскую деятельность (далее – «медицинские организации»). Они рекомендованы для обеззараживания различных объектов при проведении текущих и генеральных уборок, профилактической, текущей, заключительной дезинфекции, очистки и стерилизации изделий медицинского назначения, обработки рук медицинских работников, обеззараживания воздуха в помещениях, дезинфекции медицинских отходов и др.
- Эпидемиологическую опасность для пациентов и медицинских работников в медицинских организациях представляют патогенные и условно патогенные микроорганизмы, в том числе возбудители внутрибольничных инфекций: бактерии (включая возбудителей туберкулеза), вирусы, грибы (возбудители кандидозов и дерматофитий), плесневые грибы, споры бактерий (например, возбудители газовой анаэробной инфекции, псевдомембранозного колита, вызываемого Clostridiumdifficile. Они существенно различаются между собой по устойчивости к химическим дезинфицирующим средствам.
Текст ГОСТ Р 58151.4-2018 Средства дезинфицирующие. Методы определения показателей эффективности
ГОСТ Р 58151.4-2018
Группа Т58
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
СРЕДСТВА ДЕЗИНФИЦИРУЮЩИЕ
Методы определения показателей эффективности
Disinfectants. Methods for determining efficiency factor
ОКС 11.080.20*
________________
* Поправка (ИУС N 8-2018)
Дата введения 2019-01-01
Предисловие
1 РАЗРАБОТАН Федеральным бюджетным учреждением науки «Научно-исследовательский институт дезинфектологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 339 «Безопасность сырья, материалов и веществ»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 5 июня 2018 г. N 317-ст
4 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
ВНЕСЕНА поправка, опубликованная в ИУС N 8, 2018 год
Поправка внесена изготовителем базы данных
1 Область применения
Настоящий стандарт распространяется на химические дезинфицирующие средства (далее ДС) и устанавливает методы исследования дезинфицирующих средств для разработки эффективных режимов дезинфекции, обеспечивающих эпидемиологическую безопасность жизни и здоровья населения, охрану окружающей среды и предупреждение действий, вводящих в заблуждение потребителей путем предоставления недостоверной информации о средствах.
Настоящий стандарт распространяется на методы исследований эффективности дезинфицирующих средств, предназначенных для обеззараживания поверхностей в помещениях, мебели, аппаратов, приборов, санитарно-технического оборудования, транспортных средств; белья и других изделий из текстильных материалов; посуды столовой, лабораторной и др., контаминированных бактериями (включая микобактерии), грибами и вирусами, с целью разработки режимов их дезинфекции.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ 6709 Вода дистиллированная. Технические условия
ГОСТ 11683 Пиросульфит натрия технический. Технические условия
ГОСТ 27068 Реактивы. Натрий серноватистокислый (натрия тиосульфат) 5-водный. Технические условия
ГОСТ 32770 Добавки пищевые. Эмульгаторы пищевых продуктов. Термины и определения
ГОСТ Р 56990 Химические дезинфицирующие средства и антисептики. Дезинфицирующие средства. Критерии и показатели эффективности
ГОСТ Р 56994 Дезинфектология и дезинфекционная деятельность. Термины и определения
Примечание — При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов и классификаторов в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячно издаваемого информационного указателя «Национальные стандарты» за текущий год. Если заменен ссылочный стандарт, на который дана недатированная ссылка, то рекомендуется использовать действующую версию этого стандарта с учетом всех внесенных в данную версию изменений. Если заменен ссылочный стандарт, на который дана датированная ссылка, то рекомендуется использовать версию этого стандарта с указанным выше годом утверждения (принятия). Если после утверждения настоящего стандарта в ссылочный стандарт, на который дана датированная ссылка, внесено изменение, затрагивающее положение, на которое дана ссылка, то это положение рекомендуется применять без учета данного изменения. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, рекомендуется применять в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены термины по ГОСТ Р 56994.
4 Микробиологические методы исследований и критерии оценки эффективности дезинфицирующих средств
4.1 Общие положения
Объем микробиологических исследований определяют в соответствии с предполагаемой сферой применения дезинфицирующих средств (ДС).
Микробиологические исследования начинают только после получения результатов химико-аналитических исследований, подтверждающих соответствие средства требованиям нормативно-технической документации (НТД): технических условий — на отечественные средства, спецификации — на зарубежные.
Критерии эффективности ДС установлены в ГОСТ Р 56990.
4.2 Приготовление рабочих растворов ДС и их субстанций
Рабочие растворы ДС и их субстанций готовят непосредственно перед проведением исследований, за исключением изучения стабильности рабочих растворов в процессе хранения.
При изучении ДС, производимых в форме гранул, порошков, таблеток и др., рабочие растворы используют только после полного растворения действующих веществ (ДВ) ДС, если не указано на возможность выпадения осадка.
Для оценки антимикробного действия субстанций и ДС в лабораторных условиях и исследования эффективности ДС, предназначенных для обеззараживания различных объектов, растворы готовят на стерильной питьевой воде.
Для приготовления раствора определенной концентрации и нужного объема необходимое количество сухого ДС или жидкого концентрата вносят в пробирку (колбу) соответствующего или превосходящего объема и добавляют расчетное количество воды, тщательно размешивают и закрывают пробкой.
Пример — Для приготовления 1% раствора 1 г средства растворяют в 100 мл воды.
Отмечают время полного растворения и внешний вид приготовленного рабочего раствора.
Температура растворов ДС должна быть в пределах 20±2°С (если по условиям эксперимента не рекомендована другая температура) независимо от температуры окружающей среды. Для поддержания требуемой температуры используют водяную баню.
При испытании ДС в практических условиях рабочие растворы готовят на нестерильной питьевой воде комнатной температуры (20±2°С) или умеренно повышенной температуры (45-50°С).
Для приготовления раствора необходимой концентрации навеску средства или отмеренное количество жидкого концентрата вносят в соответствующую емкость, добавляют воду, размешивают и закрывают крышкой. Работу с раствором начинают после полного растворения ДВ. Рабочие растворы из ДС в форме таблеток готовят путем добавления в отмеренный объем воды определенного числа таблеток
Пример — 1 таблетка на 10 л воды.
Рабочие растворы субстанций и ДС готовят с соблюдением мер предосторожности. Если ДВ относится к летучим веществам и представляет опасность при ингаляционном воздействии, растворы готовят в вытяжном шкафу или в отдельном помещении, оборудованном приточно-вытяжной вентиляцией, в респираторе РУ 60М или РПГ-67, кожу рук защищают резиновыми перчатками, глаза — защитными очками.
Исследуемые ДС (перед, во время и после исследований) хранят в соответствии с требованиями технических условий или спецификации; при отсутствии таковых — в соответствии с нормативными документами.
4.3 Применение нейтрализаторов действующих веществ
Для разграничения биоцидного и биостатического действий ДС при определении антимикробной активности и эффективности применяют нейтрализаторы, исключающие остаточное атимикробное действие.
Для нейтрализации антимикробного действия ДС из различных химических групп применяют следующие нейтрализаторы:
— для галоидактивных (хлор-, бром- и йодактивные) и кислородактивных (перекись водорода, ее комплексы с солями, надуксусная кислота, озон) — 0,1-1,0% растворы тиосульфата натрия по ГОСТ 27068;
— для четвертичных аммониевых солей (алкилдиметилбензиламмоний хлорид, дидецилдиметиламмоний хлорид и др.), производных гуанидина (полигексаметиленгуанидин гидрохлорид, хлоргексидин биглюконат и др.) — 0,1-1,0% растворы лаурилсульфата натрия (сульфонол) [1]), растворы лаурилсульфата натрия с 10% обезжиренного молока или универсальный нейтрализатор;
— для альдегидов (глутаровый альдегид, глиоксаль, формальдегид, ортофталевый альдегид) — 1,0% раствор пиросульфита (метабисульфита) натрия по ГОСТ 11683 или универсальный нейтрализатор;
— для кислот — щелочи в эквивалентном количестве;
— для щелочей — кислоты в эквивалентном количестве;
— для спиртов — разведение в воде до недействующей концентрации;
— для композиционных средств — универсальный нейтрализатор, содержащий Твин 80 по ГОСТ 32770 3%, сапонин 0,3-3%, гистидин — 0,1%, цистеин — 0,1%.
Если в состав композиции входят окислители, в нейтрализатор дополнительно вводят тиосульфат натрия по ГОСТ 27068.
В качестве универсального нейтрализатора при изучении туберкулоцидного действия используют нейтрализующий бульон по Ди-Ингли.
Растворы нейтрализаторов готовят в асептических условиях, применяя для этого стерильную дистиллированную воду по ГОСТ 6709.
При невозможности соблюдения асептических условий приготовления нейтрализаторов допускают стерилизацию готовых растворов автоклавированием при 1,1 атм. (121°С) в течение 15 мин.
Температура растворов нейтрализаторов должна быть 20°С, независимо от температуры окружающей среды.
Готовые растворы должны использоваться в день приготовления. Допускается хранение готовых растворов при температуре 4°С в течение 48 ч.
Исследование эффективности ДС проводят в зависимости от концентрации ДВ, времени воздействия, нормы расхода, характера объекта, вида его загрязнения, температуры, способа и кратности обработки по [2].
5 Методы изучения и оценки бактерицидной активности дезинфицирующих средств
5.1 Требования к тест-микроорганизмам
При изучении бактерицидной активности дезинфицирующих субстанций и ДС в качестве тест-микроорганизмов используют:
— Escherichia coli (штамм 1257);
— Pseudomonas aeruginosa (штамм АТСС 27853);
— Salmonella typhimurium (штамм 00074 NCTC=13311 АТСС) — для оценки бактерицидной активности в отношении грамотрицательных бактерий;
— Staphylococcus aureus (штамм 906) — для оценки бактерицидной активности в отношении грамположительных бактерий.
Или другие микроорганизмы, обладающие аналогичной устойчивостью к ДС.
Тест-микроорганизмы должны иметь типичные биохимические, морфологические, тинкториальные, культуральные и ферментативные свойства, присущие данному виду, и обладать стандартной устойчивостью к эталонным ДС.
Музейные культуры микроорганизмов хранят при температуре 3-10°С в ампулах (после лиофильной сушки) или на плотных питательных средах (посев уколом) под слоем стерильного вазелинового масла с толщиной слоя 1,5-3 мм, рабочие культуры — на скошенном агаре или в бульоне.
Проверку устойчивости тест-микроорганизмов проводят не реже 1 раза в месяц по [2]. При снижении резистентности культур делают их пересевы на обогащенные питательные среды до восстановления устойчивости.
Тест-микроорганизмы культивируют при температуре 37°С в течение 18-24 ч на следующих питательных средах:
— казеиновом бульоне;
— мясо-пептонном бульоне;
— агаре Эндо;
— казеиновом агаре;
— мясо-пептонном агаре.
5.2 Методы приготовления суспензии тест-микроорганизмов. Определение биологической концентрации тест-микроорганизмов в бактериальной суспензии
Перед изучением бактерицидной активности ДС культуры тест-микроорганизмов подвергают контролю их качества. Перед использованием тест-культур для исследовательских целей проверяют отсутствие среди тест-микроорганизмов, выросших на питательной среде, посторонней микрофлоры. Для оценки роста тест-микроорганизмов визуально просматривают каждую пробирку и учитывают характер и массивность роста, изменение цвета питательной среды. Проводят микроскопию мазка выросших тест-микроорганизмов, окрашенных по Граму.
Рабочую суспензию тест-микроорганизмов готовят из культуры данного тест-штамма, выращенного на плотной питательной среде (МПА или казеиновый агар) при температуре (37±1)°С в течение 18-24 ч. Для приготовления бактериальной взвеси культуру смывают с агара стерильной питьевой водой. Полученную взвесь тест-микроорганизмов фильтруют через ватно-марлевый фильтр и разводят стерильной питьевой водой до концентрации 2×109 клеток в 1 мл, соответствующей по мутности 20 единицам мутности отраслевого стандартного образца ОСО 42-28-84-11 (20 ME) или 6 единицам Мак-Фарланда, определяемых с помощью денситометра.
В связи с тем, что суспензия может содержать наряду с живыми мертвые микроорганизмы, необходимо определять биологическую концентрацию фактического количества живых клеток в приготовленной суспензии для корректировки и обеспечения требуемых уровней контаминации тест-объектов жизнеспособными микроорганизмами.
Определение биологической концентрации тест-микроорганизмов выполняют методом последовательных десятикратных разведений суспензии тест-микроорганизма в стерильной питьевой воде с последующим высевом суспензии в чашки Петри с плотной питательной средой (казеиновый агар, агар Эндо, МПА). После определенного времени инкубации при соответствующей температуре проводят подсчет выросших колониеобразующих единиц (КОЕ) и определяют количество жизнеспособных бактерий в 1 мл суспензии.
5.3 Исследование бактерицидной эффективности ДС, предназначенных для обеззараживания поверхностей в помещениях, мебели, аппаратов, приборов, санитарно-технического оборудования, транспортных средств и других объектов
Исследования проводят в зависимости от вида поверхностей, их положения (горизонтальное, вертикальное), способа и кратности обработки.
В качестве тест-поверхностей используют поверхности размером 10×10 см из различных материалов:
— гладкие;
— шероховатые;
— впитывающие;
— не впитывающие.
Пример — Деревянные, оштукатуренные, окрашенные масляной, силикатной, водоэмульсионной или клеевой краской; оклеенные обоями, поверхности из линолеумных покрытий, окрашенного или неокрашенного металла — нержавеющая хром-никелевая кислотостойкая сталь, из пластика, стекла, искусственной или натуральной кожи, облицовочной плитки — кафельной и метлахской, фаянса.
Для исследования используют не менее 5 видов поверхностей. Набор тест-поверхностей для исследований определяют по назначению средства.
В качестве тест-микроорганизмов используют S.aureus и E.coli, при необходимости дополнительно используют S.typhimurium, P.aeruginosa или другие виды бактерий.
Перед контаминацией тест-микроорганизмами поверхности подвергают механической очистке — моют водой с мылом и щеткой (за исключением поверхностей, оклеенных обоями и окрашенных клеевой краской). Последние протирают несколько раз стерильной салфеткой, увлажненной стерильной питьевой водой.
Высушенные поверхности располагают горизонтально и на них пипеткой наносят взвесь тест-микроорганизмов из расчета 0,5 мл 2-миллиардной микробной взвеси на площадь в 100 см и равномерно распределяют ее по поверхности стеклянным шпателем. Поверхности подсушивают (до полного высыхания) при температуре 18-20°С и относительной влажности воздуха 50-60%, затем обрабатывают дезинфицирующим раствором.
При изучении эффективности обеззараживания горизонтально располагают:
— линолеум;
— плитку метлахскую;
— искусственную кожу;
— натуральную кожу.
Вертикально располагают:
— дерево, окрашенное масляной или другими видами красок;
— поверхности, оклеенные обоями;
— пластик;
— кафельную плитку;
— фаянсовую плитку;
— стекло.
Для имитации загрязнения поверхностей используют белковое или фекальное загрязнение: 40% инактивированной сыворотки, 40% фекальной эмульсии (при разработке режимов обеззараживания санитарно-технического оборудования).
Обработку поверхностей проводят способами протирания или орошения (крупнокапельное и аэрозольное).
Для определения нормы расхода при однократной обработке дезинфицирующий раствор наносят с помощью пипетки на поверхность размером 10х10 см при применении способа протирания в количестве 1,0, 1,5 или 2,0 мл, а при крупнокапельном орошении наносят с помощью дозатора 1,5-3,0 мл. При аэрозольном методе обработки изучают эффективность обеззараживания при норме расхода 1-100 мл/м (в зависимости от вида аэрозольного генератора и применяемой аэрозольной насадки). Многократное протирание или орошение проводят с интервалом между обработками 5-15-30 мин.
Время обеззараживания поверхностей определяют в интервале от 5 до 120 мин. Выбор экспозиции зависит от назначения и рекомендуемых условий применения ДС.
Контрольные поверхности обрабатывают стерильной водопроводной водой так же и из того же расчета, что и опытные.
Исследования проводят при температуре 18-20°С. При необходимости оценивают эффективность обеззараживания поверхностей при повышенной до 50°С или пониженной до минус 30°С температуре (исследования проводят в термо- или холодильной камере).
Контроль эффективности обеззараживания тест-поверхностей проводят следующим образом: марлевой салфеткой (размером 5×5 см), смоченной в растворе соответствующего для данного дезинфицирующего средства нейтрализатора, тщательно протирают тест-поверхность, затем ее погружают в 10 мл этого же нейтрализатора, находящегося в пробирках с бусами. Время отмыва марлевой салфетки 10 мин при постоянном встряхивании. Отмывную жидкость сеют (на 2-3 чашки по 0,1-0,2 мл в каждую) на твердые дифференциально-диагностические питательные среды.
Допустимо проводить исследования с использованием тест-поверхностей размером 5х5 см из тех же материалов, что и тест-поверхности 10х10 см. Этот метод можно использовать при оценке чувствительности к ДС микроорганизмов, выделенных с объектов окружающей среды.
Тест-поверхности помещают на дно стерильной чашки Петри и пипеткой наносят на них 0,1 мл 2-миллиардной микробной взвеси (площадь поверхности 25 см), равномерно распределяют ее по поверхности стерильным шпателем, не допуская отекания суспензии за пределы тест-объекта, затем подсушивают, приоткрыв чашку Петри (до полного высыхания) при температуре плюс 18-22°С и относительной влажности 40-60%, после чего обрабатывают раствором ДС так же, как указано выше. После окончания экспозиции чашки с тест-объектами заливают 10 мл раствора нейтрализатора, соответствующего данному ДС, и делают несколько круговых движений чашкой для лучшего смачивания тест-объекта. Через несколько минут стерильным пинцетом переворачивают тест-объект и повторяют круговые движения. После контакта нейтрализатора с тест-объектом в течение 10 мин снова делают несколько круговых движений чашкой, затем стерильным пинцетом удаляют тест-объект из чашки и сбрасывают его в емкость с дезинфицирующим раствором с целью дальнейшего обеззараживания. Если тест-объект обработан способом погружения в дезинфицирующий раствор, то по завершении экспозиции его переносят в чашку Петри с 10 мл раствора нейтрализатора на 10 мин, после чего извлекают и сбрасывают в емкость с дезинфицирующим раствором для обеззараживания.
Нейтрализатор из чашки Петри сеют (на 2-3 чашки по 0,1-0,2 мл в каждую) на твердые дифференциально-диагностические питательные среды либо заливают чашку с нейтрализатором растопленным и остуженным до 45°С агаром.
Посевы помещают для выращивания в термостате при температуре (37±1)°С. Учет результатов проводят в течение 1-2 суток путем подсчета количества выросших колоний, затем рассчитывают плотность контаминации 100 см поверхности и процент обеззараживания, принимая количество колоний, снятых с контрольных поверхностей, за 100%.
Критерий эффективности обеззараживания поверхностей — не менее 99,99% гибели тест-микроорганизмов.
Таблица 1 — Показатели эффективности ДС при обработке поверхностей
|
Показатель |
Значение показателя |
|
Критерий эффективности |
99,99% гибель тест-культуры |
|
Время гибели S.aureus, E.coli, S.typhimurium, Paeruginosa |
Не более 120 мин |
5.4 Исследование бактерицидной эффективности ДС, предназначенных для обеззараживания белья
Эффективность обеззараживания белья ДС определяют с помощью тест-объектов, представляющих собой кусочки ткани из бязи размером 2х2 см. В качестве тест-культур используют S.aureus и E.coli.
При разработке режима обеззараживания загрязненного белья к суспензии микроорганизмов перед контаминацией тест-объектов добавляют 40% инактивированной сыворотки (6 мл 2-миллиардной взвеси тест-культуры смешивают с 4 мл инактивированной сыворотки) или 40% фекальной эмульсии (6 мл 2-миллиардной взвеси тест-культуры смешивают с 4 мл фекальной эмульсии). Для приготовления фекальной эмульсии 8 г фекалий растирают в ступке с 20 мл воды. Контаминированные тест-объекты подсушивают в термостате при 37°С в течение 20-25 мин или 1,5-2 ч при комнатной температуре до полного высыхания.
Стерильные тест-объекты пропитывают 2-миллиардной взвесью тест-микроорганизмов из расчета 20 мл на 10 тест-объектов и подсушивают в термостате. Далее контаминированные тест-объекты помещают в стерильные бязевые мешочки размером 5х8 см по 2 штуки в каждый.
При разработке режимов обеззараживания белья, не загрязненного выделениями, белье погружают в емкость с дезинфицирующим раствором из расчета 4 л раствора на 1 кг сухого белья.
При разработке режимов обеззараживания белья, загрязненного выделениями, белье погружают в емкость с дезинфицирующим раствором из расчета 5 л раствора на 1 кг сухого белья.
Белье погружают в раствор последовательно, без воздушных полостей между вещами, препятствующих процессу дезинфекции. Мешочки с контаминированными тест-объектами распределяют между слоями белья (сверху, в середине, внизу). Через заданное время воздействия ДС извлекают по 1 мешочку с каждого уровня, стерильным пинцетом вынимают тест-объекты, переносят их в раствор нейтрализатора на 5 мин, промывают 5 мин в стерильной питьевой воде и помещают в жидкие питательные среды. В контрольных опытах вместо дезинфицирующего раствора используют стерильную питьевую воду.
Показатели эффективности обеззараживания белья приведены в таблице 2.
Таблица 2 — Критерии эффективности обеззараживания белья
|
Показатель |
Значение показателя |
|
Критерий эффективности |
100% гибель тест-культуры |
|
Время обеззараживания белья без видимых загрязнений, контаминированного S.aureus, E.coli |
Не более 120 мин |
|
Время обеззараживания белья, загрязненного выделениями и контаминированного S.aureus, E.coli |
Не более 240 мин |
5.5 Исследование бактерицидной эффективности ДС, предназначенных для обеззараживания посуды
В зависимости от назначения ДС исследования проводят при обеззараживании посуды столовой и кухонной, лабораторной и из-под выделений.
В качестве тест-объектов при разработке режимов обеззараживания столовой и кухонной посуды используют:
— тарелки из различных материалов (фарфор, фаянс, алюминий, стекло, пластик, посуда, покрытая эмалью);
— стаканы из различных материалов (фарфор, фаянс, алюминий, стекло, пластик, посуда, покрытая эмалью);
— кружки из различных материалов (фарфор, фаянс, алюминий, стекло, пластик, посуда, покрытая эмалью);
— столовые приборы — ножи, вилки, ложки из различных материалов (нержавеющая сталь, алюминий, пластик);
— лабораторную посуду — предметные и покровные стекла, пипетки, пробирки, чашки Петри, планшеты для иммунологического анализа и др.;
— посуду из-под выделений — подкладные судна, мочеприемники, горшки, плевательницы и др. или тест-объекты их имитирующие.
В качестве тест-микроорганизмов при контаминации столовой посуды используют S.aureus, E.coli.
Для имитации загрязнения чайной посуды используют кисель (к 10 г киселя добавляют 1 мл 2-миллиардной микробной взвеси), лабораторной посуды — 40% инактивированной сыворотки, посуды из-под выделений — 40% фекальную эмульсию или мокроту, контаминированные тест-микроорганизмами (на 10 мл — 1 мл 2х млрд. взвеси).
Перед контаминацией микроорганизмами посуду и столовые приборы подвергают механической очистке — моют водой с мылом и щеткой. Посуду располагают горизонтально, наносят пипеткой взвесь тест-микроорганизмов из расчета 0,5 мл 2 млрд. взвеси на площадь в 100 см и равномерно распределяют ее по поверхности посуды стеклянным шпателем. Столовые приборы для контаминации погружают в бактериальную суспензию на 1-2 мин, оставляя незараженными их ручки.
Посуду подсушивают (до полного высыхания) при комнатной температуре 18-20°С и относительной влажности воздуха 50-60%, затем обрабатывают дезинфицирующим раствором.
Для разработки режимов обеззараживания посуды с остатками пищи до ее контаминации микробную взвесь смешивают с овсяной, манной или другой кашей, сваренной на молоке со сливочным маслом (к 10 г каши добавляют 1 мл 2-миллиардной микробной взвеси).
Обработку столовой, чайной, лабораторной посуды и столовых приборов проводят способом погружения в дезинфицирующий раствор. Растворы готовят на питьевой воде. Температура испытуемого раствора 18-20°С. При необходимости изучают эффективность растворов, имеющих температуру 50°С.
Контролем служит аналогично контаминированная посуда, которую погружают в такой же объем стерильной питьевой воды.
Дезинфицирующий раствор должен полностью и с избытком покрыть всю посуду и приборы (из расчета не менее 2 л на 1 комплект).
Через определенные интервалы времени извлекают из дезинфицирующего раствора по одному предмету и стерильной марлевой салфеткой (размер 5×5 см), смоченной в растворе нейтрализатора, соответствующего данному ДС; тщательно протирают зараженную часть каждого предмета, погружают салфетку в 10 мл этого же нейтрализатора, находящегося в пробирках с бусами. Время отмыва марлевой салфетки 10 мин при постоянном встряхивании. После отмыва марлевую салфетку погружают в соответствующую жидкую питательную среду. Отмывную жидкость сеют на 2-3 чашки по 0,2-0,5 мл в каждую на твердые питательные среды.
Посевы помещают в термостат при температуре 37°С и учитывают через 2 суток.
Время обеззараживания посуды определяют в интервале от 15 до 240 мин в зависимости от вида тест-микроорганизма и наличия загрязнения.
Критерий эффективности обеззараживания — не менее 100%.
Таблица 3 — Показатели эффективности обеззараживания посуды
|
Микроорганизм |
Объекты обеззараживания |
Эффективность (%) — время обеззараживания (мин) |
|
S.aureus, E.coli |
Столовая посуда без остатков пищи |
100% — не более 60 мин |
|
S.aureus, E.coli, S.typhimurium |
Столовая посуда с остатками пищи |
100% — не более 120 мин |
|
S.aureus, E.coli |
Лабораторная посуда |
100% — не более 120 мин |
|
E.coli, S.typhimurium |
Посуда из-под выделений |
100% — не более 240 мин |
6 Методы изучения и оценки туберкулоцидной активности дезинфицирующих средств
6.1 Требования к тест-микроорганизмам
Исследование и оценку туберкулоцидной и микобактерицидной (в отношении непатогенных микобактерий) активности ДС проводят, используя в качестве тест-микроорганизмов следующие:
— агаровую культуру Mycobacterium terrae для оценки активности ДС и разработки режимов их применения при обеззараживании объектов в отношении возбудителя туберкулеза и микобактериозов;
— агаровую культуру Mycobacterium tuberculosis для подтверждения эффективности разработанных режимов применения ДС в отношении возбудителей туберкулеза и микобактериозов в практических условиях.
Тест-микобактерии должны иметь типичные морфологические, культуральные, биохимические, тинкториальные и ферментативные свойства, присущие данному штамму, и обладать стандартной устойчивостью к эталонным ДС и температуре.
6.2 Методика приготовления суспензии тест-микроорганизмов. Определение биологической концентрации тест-микроорганизмов в суспензии
Для получения первого пассажа культуры тест-штамма микобактерий, используемой при оценке эффективности ДС, необходимое для исследования количество хранящихся при температуре минус 70°С или минус 20°С микропробирок (2 штуки на 1 исследование) с данным штаммом микобактерий размораживают при комнатной температуре, переносят по 0,1 мл содержимого в пробирки со скошенной питательной средой Левенштейна-Йенсена или «Новая» или аналогичной питательной средой, предназначенной для культивирования микобактерий, и инкубируют в термостате при плюс (37±1)°С в течение 10-21 суток. Выросшую на плотной питательной среде в пробирках культуру используют для приготовления рабочей суспензии тест-микобактерий данного штамма.
Одну или несколько пробирок используют для получения второго пассажа культуры тест-микобактерий этого штамма. Для этого культуру первого пассажа в пробирке снимают платиновой лопаточкой или стеклянной палочкой с плотной питательной среды, помещают в толстостенную стеклянную пробирку и тщательно растирают, постепенно добавляя по каплям стерильную дистиллированную воду. Полученную суспензию рассевают на плотную питательную среду тем же способом, который используют для получения первого пассажа.
Культуры тест-микобактерий подвергают контролю их качества. Непосредственно перед использованием культур для исследовательских целей проверяют, что тест-микобактерии, выросшие на питательной среде, не загрязнены посторонней микрофлорой. Для оценки роста тест-микобактерий визуально просматривают каждую пробирку и учитывают характер и массивность роста, изменение цвета питательной среды. Проводят микроскопию мазка выросших культур методом окраски по Циль-Нильсену
Пример — М.terrae представляют собой короткие прямые палочки малиново-красного цвета, располагающиеся в мазке параллельно друг другу наподобие частокола. Размер клеток микобактерий 0,2-0,6х1-10 мкм.
Рабочую суспензию тест-микобактерий готовят из тест-штамма первого и/или второго пассажей, выросших на плотной питательной среде. Дальнейшее субкультивирование недопустимо.
Для приготовления рабочей суспензии культуру микобактерий снимают платиновой лопаточкой или стеклянной палочкой с плотной питательной среды и помещают в толстостенную стеклянную пробирку. Микробную биомассу тщательно гомогенизируют, постепенно добавляя по каплям стерильную дистиллированную воду. Густую исходную бактериальную суспензию оставляют на 15 минут для осаждения негомогенизированных конгломератов и частиц. Полученную надосадочную жидкость отбирают пастеровской пипеткой, переносят в стерильную пробирку и, добавляя стерильную дистиллированную воду, доводят до концентрации 1×109 клеток в 1 мл, соответствующей по мутности 10 единицам мутности отраслевого стандартного образца ОСО 42-28-84-11 (10 ME) или 3 единицам Мак-Фарланда, определяемых с помощью денситометра.
Контроль над содержанием живых микроорганизмов осуществляют посредством бактериологического контроля фактического их количества в приготовленной суспензии.
Из приготовленной суспензии делают, как показано на рисунке 1, разведения с 10-кратным шагом до 10 микробных клеток в 1 мл (посев 0,1 мл суспензии из этого разведения на плотную питательную среду позволяет произвести достаточно точный подсчет выросших на среде колоний микобактерий, количество которых будет находиться в пределах 100 единиц).
|
|
Рисунок 1 — Процесс разведения
Посевы инкубируют в термостате при плюс (37±1)°С в течение 10-21 суток. Подсчитывают количество выросших колоний на среде в пробирке, рассчитывают среднее значение из 5 и делают пересчет количества жизнеспособных клеток в исходной суспензии, учитывая коэффициент разведения. Количество жизнеспособных клеток в рабочей суспензии должно быть КОЕ/мл.
6.3 Исследование туберкулоцидной эффективности ДС, предназначенных для обеззараживания поверхностей в помещениях, мебели, аппаратов, приборов, санитарно-технического оборудования, транспортных средств и других объектов
Подготовка тест-поверхностей и технология проведения эксперимента изложены в п.5.3.
Для контроля эффективности обеззараживания через определенные промежутки времени (15-30-60 и т.д. до 120 мин) с обработанных раствором ДС тест-поверхностей делают смывы путем тщательного протирания поверхности стерильной марлевой салфеткой (5×5 см), увлажненной нейтрализатором. После протирания на тест-поверхности не должно оставаться излишней влаги. Салфетки погружают на 5 минут в пробирки (емкости) с соответствующим нейтрализатором (10 мл), а затем в стерильную питьевую воду с бусами и встряхивают на шейкере в течение 10 мин. Полученную смывную жидкость вносят по 0,1 мл в 3-5 пробирок со скошенной плотной питательной средой Левенштейна-Йенсена или «Новая» или аналогичную питательную среду, предназначенную для культивирования микобактерий, тщательно распределяя ее по всей поверхности. Посевы инкубируют в термостате при температуре 37±1°С в течение 10-21 суток.
В контрольных опытах для обработки аналогично контаминированных тест-поверхностей вместо раствора ДС используют стерильную питьевую воду из того же расчета, что и опытные. Жидкость, в которую помещают стерильную марлевую салфетку после взятия смыва с контрольных поверхностей, перед посевом разводят в 100 раз и вносят по 0,1 мл на скошенную поверхность плотной питательной среды Левенштейна-Йенсена или «Новая» или аналогичной питательной средой, предназначенной для культивирования микобактерий 3-5 пробирок. Посевы инкубируют в термостате при температуре плюс (37±1)°С. Результаты учитывают через 10-21 суток.
Оценку результатов проводят по посеву того разведения, в котором число колоний на чашке Петри или в пробирке составляет от 30 до 300.
Допускается проводить исследования с использованием тест-поверхностей размером 5х5 см (5.3). После выдерживания посевов в термостате подсчитывают число колоний на чашках или пробирках с плотной питательной средой, рассчитывают остаточную плотность контаминации на 100 см тест-поверхности и высчитывают эффективность обеззараживания, принимая количество тест-микроорганизмов, снятых с контрольных тест-объектов (тест-поверхностей), за 100%.
Критерий эффективности ДС при обеззараживании тест-поверхностей из различных материалов, контаминированных тест-микроорганизмом, должен составлять не менее 99,99%.
6.4 Исследование туберкулоцидной эффективности ДС, предназначенных для обеззараживания белья
Исследования с ДС проводят в целях оценки эффективности его для обеззараживания белья и других объектов из ткани, чистых и загрязненных кровью или выделениями (фекалии, моча, мокрота).
Оценку эффективности ДС для обеззараживания белья, одежды, спецодежды и других объектов из ткани осуществляют в соответствии с п.5.4 После обработки раствором ДС тест-объекты вынимают из мешочка стерильным пинцетом, помещают на 5 мин в емкость с раствором соответствующего нейтрализатора, затем переносят в стерильную питьевую воду и высевают на питательный агар. Посевы инкубируют при (37±1)°С. Предварительный учет результатов проводят через 10-14 суток, а окончательный — через 21 сутки. В контрольных опытах белье погружают в стерильную питьевую воду. Мешочки с тестами закладывают так же, как и в опыте. При получении 100%-ной гибели тест-микроорганизма в опытах по обеззараживанию белья без белковых загрязнений переходят к опытам по обеззараживанию белья, загрязненного выделениями.
Для определения эффективности ДС при обеззараживании белья, одежды, спецодежды и других объектов из ткани, загрязненных кровью, выделениями (фекалии, мокрота, моча и др.), в лабораторных условиях используют бязевые тест-объекты, которые контаминируют суспензией тест-микобактерий с добавлением 40% инактивированной сыворотки (6 мл суспензии, содержащей 2х109 КОЕ/мл тест-микроорганизма, смешивают с 4 мл инактивированной сыворотки) или 40% фекальной эмульсии (6 мл суспензии тест-микроорганизма смешивают с 4 мл 40% фекальной эмульсии) исходя из расчета 30 мл суспензии на 10 тест-объектов. Для приготовления фекальной эмульсии 8 г фекалий растирают в ступке с 20 мл воды. Количество суспензии тест-микроорганизма, содержащей сыворотку или фекалии, готовят из расчета 30 мл на 10 тест-объектов. При изучении эффективности обеззараживания изделий из синтетических тканей (капрон, ацетат, лавсан и др.) используют тест-объекты из этих тканей размером 5×5 см. Контаминированные тест-объекты подсушивают в термостате при (37±1)°С в течение 20-25 мин или 1,5-2 ч при комнатной температуре до полного высыхания.
Критерием эффективности ДС при обеззараживании белья, одежды, спецодежды и других объектов из тканей является 100%-ная гибель тест-микроорганизмов на тест-объектах.
6.5 Исследование туберкулоцидной эффективности ДС, предназначенных для обеззараживания посуды
Для определения туберкулоцидной активности ДС, предназначенных для обеззараживания посуды (столовой, лабораторной и из-под выделений), используют в качестве тест-объектов, указанные в 5.5.
Обработку контаминированной столовой, чайной, лабораторной посуды, столовых приборов проводят способом погружения в дезинфицирующий раствор, аналогично изложенным в 5.5.
Время обеззараживания посуды — от 15 до 240 мин, в зависимости от вида ДС и наличия загрязнения.
Через определенные интервалы времени (15, 30, 60 минут и т.д.) извлекают по одному предмету разных наименований (тарелка, стакан, предметное стекло, нож и т.д.) из дезинфицирующего раствора стерильной марлевой салфеткой (5 см), смоченной в растворе нейтрализатора, соответствующего данному ДС, тщательно протирают зараженную часть каждого предмета и погружают в 10 мл этого же нейтрализатора на 5 мин, затем салфетку переносят в пробирку со стерильной питьевой водой и бусами. Время отмыва марлевой салфетки — 10 мин при постоянном встряхивании на шейкере. После отмыва смывную жидкость по 0,1 мл высевают в 3-5 пробирки со скошенной поверхностью плотной питательной среды Левенштейна-Йенсена или «Новая» или аналогичной питательной средой, предназначенной для культивирования микобактерий (по 0,1 мл в каждую). Посевы помещают в термостат при температуре 37°С. Предварительный учет результатов проводят через 10-14 суток, окончательный — через 21 сутки.
Контролем служит аналогично контаминированная посуда, которая погружается не в дезинфицирующий раствор, а в такой же объем стерильной питьевой воды.
Критерий эффективности обеззараживания посуды: гибель тест-микроорганизма не менее 100%.
7 Методы изучения и оценки фунгицидной активности дезинфицирующих средств
7.1 Требования к тест-микроорганизмам
При изучении фунгицидной активности ДС и их субстанций в качестве тест-микроорганизмов используют:
— Candida albicans (штамм 15 или шт. ВКПМ Y 3108 (АТСС 10231) — для оценки фунгицидной активности в отношении возбудителей кандидозов;
— Trichophyton gypseum (муз.штамм НИИД) — для оценки фунгицидной активности в отношении возбудителей дерматофитий;
— Aspergillus niger (муз.штамм НИИД) или Aspergillus brasiliensis (штамм NCPF2275/ATCC 16404) для оценки фунгицидной активности в отношении плесневых грибов.
При сертификационных испытаниях и экспертной оценке ранее зарегистрированных ДС набор тест-микроорганизмов ограничивают наиболее устойчивыми представителями каждой группы.
Тест-микроорганизмы культивируют на следующих питательных средах:
— С.albicans — на бульоне Сабуро, агаре Сабуро при температуре (27±1)°С в течение 2-10 суток;
— Т.gypseum — на бульоне Сабуро, агаре Сабуро при температуре (27±1)°С в течение 28 суток;
— A.niger и A.brasiliensis — на бульоне Сабуро, агаре Сабуро при температуре (37±1)°С в течение 2 суток, затем выдерживают 3-5 суток при температуре (20±2)°С в темном месте.
Музейные культуры микроорганизмов хранят при температуре (3±1)°С в ампулах (после лиофильной сушки) или на плотных питательных средах (посев уколом) под слоем стерильного вазелинового масла (толщина слоя 1,5-3 мм), а рабочие культуры — на скошенном агаре или в бульоне.
Тест-микроорганизмы должны иметь типичные биохимические, морфологические, тинкториальные, культуральные и ферментативные свойства, присущие данному виду, и обладать стандартной устойчивостью к эталонным ДС.
7.2 Методы приготовления суспензии тест-микроорганизмов
Непосредственно перед использованием культур для исследовательских целей получают подтверждение, что тест-микроорганизмы, выросшие на питательной среде, не загрязнены посторонней микрофлорой. Для оценки роста культур тест-грибов визуально просматривают каждую пробирку и учитывают характер и массивность роста, изменение цвета питательной среды.
Рабочие суспензии тест-микроорганизмов готовят из культуры тест-грибов, выращенных на питательной среде.
Культуру Т.gypseum, выращенную на бульоне Сабуро при температуре (27±1)°С в течение 28 суток, извлекают петлей из пробирки, помещают в фарфоровую ступку и растирают с небольшим количеством стерильного физиологического раствора до гомогенной взвеси с минимальным размером частиц. Полученную суспензию фильтруют через стерильный ватно-марлевый фильтр и доводят с помощью физиологического раствора до концентрации 2х клеток в 1 мл, соответствующей по мутности 20 единицам мутности отраслевого стандартного образца ОСО 42-28-84-11 (20 ME) или 6 единицам Мак-Фарланда, определяемых с помощью денситометра.
Культуру С.albicans выращивают на агаре Сабуро в течение 2 суток при температуре (27±1)°С в течение 48 часов. Затем смывают с питательной среды небольшим количеством стерильного физиологического раствора и тщательно перемешивают. Полученную суспензию фильтруют и разводят так же, как и культуру Т.gypseum.
Культуру A.niger, выращенную на бульоне Сабуро в течение 2 суток и выдержанную в течение 3-5 суток в темном месте, извлекают петлей из пробирки, помещают в фарфоровую ступку и растирают с небольшим количеством стерильного физиологического раствора до гомогенной суспензии с минимальным размером частиц. Полученную взвесь фильтруют и разводят также, как и культуру Т.gypseum.
В связи с тем, что суспензия содержит наряду с живыми мертвые микроорганизмы, определяют биологическую концентрацию тест-грибов. Для этого проводят десятикратные разведения суспензии тест-микроорганизама в стерильной дистиллированной воде с последующим высевом суспензии в чашки Петри с плотной питательной средой (агар Сабуро). После определенного времени инкубации при соответствующей температуре подсчитывают количество выросших колониеобразующих единиц (КОЕ) и определяют количество жизнеспособных клеток в одном мл суспензии, которое должно быть не менее .
Проверку устойчивости проводят не реже 1 раза в 6 месяцев. При снижении устойчивости культур делают их пересевы на обогащенные питательные среды до восстановления устойчивости.
7.3 Исследование фунгицидной эффективности ДС, предназначенных для обеззараживания поверхностей в помещениях, мебели, аппаратов, приборов, санитарно-технического оборудования, транспортных средств и других объектов
Исследования проводят в зависимости от вида поверхностей, их положения (горизонтальное, вертикальное), способа и кратности обработки.
При разработке режимов обеззараживания поверхностей используют поверхности размером 10х10 см из различных материалов:
— гладкие;
— шероховатые;
— впитывающие;
— не впитывающие.
Пример — Деревянные, оштукатуренные, окрашенные масляной, силикатной, водоэмульсионной или клеевой краской; оклеенные обоями, поверхности из линолеумных покрытий, окрашенного или неокрашенного металла — нержавеющая хром — никелевая кислотостойкая сталь, из пластика, стекла, искусственной или натуральной кожи, облицовочной плитки — кафельной и метлахской, фаянса.
Для исследования используют не менее 5 видов поверхностей.
В качестве тест-культур С.albicans, Т.gypseum; A.niger или A.brasiliensis используют для разработки режимов обеззараживания поверхностей с целью профилактики и борьбы с плесенью.
Для имитации загрязнения поверхностей санитарно-технического оборудования при контаминации С.albicans, Т.gypseum используют белковое загрязнение в виде 40% инактивированной лошадиной сыворотки.
Для имитации загрязнения поверхностей унитазов при контаминации С.albicans используют загрязнение в виде 40% фекальной эмульсии. Для этого перед контаминацией объектов к суспензии грибов С.albicans, Т.gypseum добавляют необходимое количество сыворотки и к суспензии С.albicans — необходимое количество фекальной эмульсии.
Перед контаминацией тест-микрорганизамами поверхности подвергают механической очистке — моют водой с мылом и щеткой (за исключением поверхностей, оклеенных обоями и окрашенных клеевой краской), затем протирают несколько раз стерильной салфеткой, увлажненной стерильной водопроводной водой.
Высушенные поверхности располагают горизонтально и на них пипеткой наносят взвесь тест-грибов из расчета 0,5 мл 2-миллиардной микробной взвеси на площадь в 100 см. Культуру равномерно распределяют по поверхности стеклянным шпателем. Поверхности подсушивают (до полного высыхания) при комнатной температуре 18-20°С и относительной влажности воздуха 50-60%, затем обрабатывают дезинфицирующим раствором.
При изучении эффективности обеззараживания горизонтально располагают:
— линолеум;
— плитку метлахскую;
— искусственную кожу; натуральную кожу;
— стекло.
Вертикально располагают:
— дерево, окрашенное масляной краской;
— дерево, окрашенное силикатной краской;
— дерево, окрашенное водоэмульсионной краской;
— дерево, окрашенное клеевой краской;
— поверхности, оклеенные обоями;
— пластик;
— кафельную плитку; фаянсовую плитку.
Обработку поверхностей проводят способами протирания или орошения (крупнокапельное и аэрозольное).
Для определения нормы расхода при однократной обработке дезинфицирующий раствор наносят с помощью пипетки на поверхность размером 10×10 см при применении способа протирания в количестве 1,0, 1,5 или 2,0 мл, а при крупнокапельном орошении наносят с помощью дозатора 1,5-3,0 мл. При аэрозольном методе обработки изучают эффективность обеззараживания при норме расхода 30-50-100 мл/м
(в зависимости от вида аэрозольного генератора и применяемой аэрозольной насадки). Многократное протирание или орошение проводят с интервалом между обработками 5-15-30 мин.
Время обеззараживания поверхностей определяют в интервале от 5 до 120 мин. Выбор экспозиции зависит от назначения и рекомендуемых условий применения средства.
Контрольные поверхности обрабатывают стерильной питьевой водой также и из того же расчета, что и опытные.
Исследования проводят при комнатной температуре. При необходимости оценивают эффективность обеззараживания поверхностей при повышенной до 50°С или пониженной до минус 30°С температуре (исследования проводят в термо- или холодильной камере).
Для контроля эффективности обеззараживания тест-поверхностей марлевой салфеткой (размером 5×5 см), смоченной в растворе соответствующего для данного дезинфицирующего средства нейтрализатора, тщательно протирают тест-поверхность, затем ее погружают в 10 мл этого же нейтрализатора, находящегося в пробирках с бусами. Время отмыва марлевой салфетки — 10 мин при постоянном встряхивании. Отмывную жидкость сеют (на 2-3 чашки по 0,1-0,2 мл в каждую) на твердые дифференциально-диагностические питательные среды.
Допускается проводить исследования с использованием тест-поверхностей размером 5х5 см из тех же материалов, что и тест-поверхности 10х10 см. Метод можно применяют для оценки чувствительности к ДС микроорганизмов, выделенных с объектов окружающей среды. Тест-поверхности помещают на дно стерильной чашки Петри и располагают на лабораторном столе в микробиологическом боксе или боксах биологической безопасности II класса на поддонах с салфетками, смоченными дезинфицирующим раствором.
Пипеткой наносят на них 0,1 мл 2-миллиардной микробной взвеси (площадь поверхности 25 см), равномерно распределяют ее по поверхности стерильным шпателем, не допуская отекания суспензии за пределы тест-объекта, затем подсушивают, приоткрыв чашку Петри (до полного высыхания) при температуре 18-22°С и относительной влажности 40-60%, после чего обрабатывают раствором ДС так же, как указано выше.
После окончания экспозиции чашки с тест-объектами заливают 10 мл раствора нейтрализатора, соответствующего данному ДС, и делают несколько круговых движений чашкой для лучшего смачивания тест-объекта. Через несколько минут стерильным пинцетом переворачивают тест-объект и повторяют круговые движения. После контакта нейтрализатора с тест-объектом в течение 10 мин снова делают несколько круговых движений чашкой, затем стерильным пинцетом удаляют тест-объект из чашки и сбрасывают его в емкость с дезинфицирующим раствором с целью дальнейшего обеззараживания. Нейтрализатор из чашки Петри сеют (на 2-3 чашки по 0,1-0,2 мл в каждую) на твердые дифференциально-диагностические питательные среды либо заливают чашку с нейтрализатором растопленным и остуженным до 45°С агаром.
Посевы выращивают в термостате при температуре плюс (28±1)°С. Учет результатов проводят в течение 2-7 суток (С.albicans, A.niger) и 21-28 суток (Т.gypseum) путем подсчета количества выросших колоний, затем рассчитывают плотность контаминации 100 см поверхности и процент обеззараживания, принимая количество колоний, снятых с контрольных поверхностей, за 100%.
Критерий эффективности обеззараживания поверхностей — не менее 99,99% гибели тест-микроорганизмов
Таблица 4 — Показатели эффективности обеззараживания поверхностей
|
Микроорганизм |
Эффективность (%) |
Время обеззараживания (мин) |
|
С.albicans, Т.gypseum |
99,99 |
Не более 240 |
|
A.niger, A.brasiliensis |
99,99 |
Не более 360 |
7.4 Исследование фунгицидной эффективности ДС, предназначенных для обеззараживания белья
Эффективность обеззараживания белья ДС определяют в соответствии с изложенным в 5.4. Мешочки с контаминированными тест-объектами распределяют между слоями белья (сверху, в середине, внизу). Через заданное время воздействия дезинфектанта (например, 15, 30, 60 мин) извлекают по 1 мешочку с каждого уровня, стерильным пинцетом вынимают тест-объекты, переносят их в раствор нейтрализатора на 5 мин, затем промывают 5 мин в стерильной питьевой воде, затем помещают в жидкие питательные среды. В контрольных опытах вместо дезинфицирующего раствора используют стерильную питьевую воду.
Критерий эффективности — 100% гибель тест-микроорганизмов.
Таблица 5 — Показатели эффективности обеззараживания белья
|
Микроорганизм |
Объект обеззараживания |
Эффективность (%) |
Время обеззараживания (мин) |
|
С.albicans, Т.gypseum |
Белье без видимых загрязнений |
100 |
Не более 240 |
|
С.albicans, Т.gypseum |
Белье, загрязненное выделениями |
100 |
Не более 240 |
7.5 Исследование фунгицидной эффективности ДС, предназначенных для обеззараживания посуды
В зависимости от назначения ДС исследования проводят при обеззараживании посуды столовой и кухонной, лабораторной и из-под выделений.
В качестве тест-объектов при разработке режимов обеззараживания столовой и кухонной посуды используют:
— тарелки из различных материалов (фарфор, фаянс, алюминий, стекло, пластик, посуда, покрытая эмалью);
— стаканы из различных материалов (фарфор, фаянс, алюминий, стекло, пластик, посуда, покрытая эмалью);
— кружки из различных материалов (фарфор, фаянс, алюминий, стекло, пластик, посуда, покрытая эмалью);
— столовые приборы — ножи, вилки, ложки из различных материалов (нержавеющая сталь, алюминий, пластик);
— лабораторную посуду — предметные и покровные стекла, пипетки, чашки Петри, планшеты для иммунологического анализа и др.;
— посуду из-под выделений — подкладные судна, мочеприемники, горшки, плевательницы и др. или тест-объекты их имитирующие.
В качестве тест-микроорганизмов при контаминации столовой посуды используют С.albicans, лабораторной — С.albicans, Т.gypseum.
При разработке режимов обеззараживания посуды с остатками пищи суспензию С.albicans смешивают с овсяной, манной или другой кашей, сваренной на молоке со сливочным маслом (к 10 г каши добавляют 1 мл 2-миллиардной микробной взвеси).
Для имитации загрязнения чайной посуды используют кисель (к 10 г киселя добавляют 1 мл 2-миллиардной суспензии С.albicans), лабораторной посуды — 40% инактивированной сыворотки (6 мл 2-миллиардной суспензии С.albicans или Т.gypseum смешивают с 4 мл инактивированной сыворотки), а посуды из-под выделений — 40% фекальную эмульсию, контаминированную С.albicans (на 10 мл — 1 мл 2х109 суспензии).
Перед контаминацией тест-грибами посуду (столовую и лабораторную) и столовые приборы подвергают механической очистке — моют водой с мылом и щеткой. Посуду располагают горизонтально и на нее пипеткой наносят взвесь тест-грибов из расчета 0,5 мл 2-миллиардной суспензии на площадь в 100 см. Культуру равномерно распределяют по поверхности посуды стеклянным шпателем. Столовые приборы для контаминации погружают в бактериальную суспензию на 1-2 мин, оставляя незараженными их ручки.
Посуду подсушивают (до полного высыхания) при комнатной температуре 18-20°С и относительной влажности воздуха 50-60%, затем обрабатывают дезинфицирующим раствором.
Обработку столовой, чайной, лабораторной посуды и столовых приборов проводят способом погружения в дезинфицирующий раствор. Растворы готовят на питьевой воде. Температура испытуемого раствора 18-20°С. При необходимости изучают эффективность растворов, имеющих температуру 50°С.
Контролем служит аналогично контаминированная посуда, которую погружают в такой же объем стерильной питьевой воды.
Дезинфицирующий раствор должен полностью и с избытком покрыть всю посуду (столовую и лабораторную) и столовые приборы (из расчета не менее 2 л на 1 комплект).
Через определенные интервалы времени извлекают из дезинфицирующего раствора по одному предмету и стерильной марлевой салфеткой (размер 5×5 см), смоченной в растворе нейтрализатора, соответствующего данному ДС; тщательно протирают контаминированную часть каждого предмета, погружают салфетку в 10 мл этого же нейтрализатора, находящегося в пробирках с бусами. Время отмыва марлевой салфетки 10 мин при постоянном встряхивании. После отмыва марлевую салфетку погружают в соответствующую жидкую питательную среду. Отмывную жидкость сеют на 2-3 чашки по 0,2-0,5 мл в каждую на твердые питательные среды.
Посевы помещают в термостат при температуре 28°С и учитывают результат через 2-7 суток (С.albicans) и 21-28 суток (Т.gypseum).
Время обеззараживания посуды определяют в интервале от 15 до 240 мин в зависимости от вида тест-микроорганизма и наличия загрязнения.
Критерий эффективности обеззараживания — не менее 100%-ной гибели тест-микроорганизмы.
Таблица 6 — Показатели эффективности обеззараживания посуды
|
Микроорганизм |
Объект обеззараживания |
Эффективность (%) |
Время обеззараживания (мин) |
|
С.albicans |
Столовая посуда без остатков пищи |
100 |
Не более 60 |
|
Столовая посуда с остатками пищи |
100 |
Не более 120 |
|
|
С.albicans, Т.gypseum |
Лабораторная посуда |
100 |
Не более 120 |
|
С.albicans |
Посуда из-под выделений |
100 |
Не более 240 |
8 Методы изучения и оценки вирулицидной активности дезинфицирующих средств
8.1 Требования к тест-вирусам
Тест-вирусы получают из национальных или из международных коллекций вирусов. При исследованиях вирулицидной активности ДС необходимо использовать как РНК-, так и ДНК-содержащие тест-вирусы, поэтому обязательным для испытания вирулицидного действия всех ДС используют как минимум два тест-вируса:
— вирус полиомиелита 1 типа — вакцинный штамм Sabin (LSc-2ab), далее «полиовирус», РНК-содержащий вирус, не имеющий оболочки, из семейства пикорнавирусов;
— аденовирус тип 5, штамм Аденоид 75 (АТСС VR-5), далее «аденовирус» ДНК-содержащий вирус, не имеющий оболочки, из семейства аденовирусов.
Перечень вирусов может быть расширен при необходимости более детального изучения вирулицидного действия ДС или его эффективности в отношении вируса определенной инфекции за счет следующих вирусов:
— бычий парвовирус, штамм Хаден (АТСС VR-767);
— вирус гепатита А, штамм HAS-15, РНК-содержащий вирус, не имеющий оболочки, из семейства пикорнавирусов;
— вирус гепатита В уток (ВГВУ), штамм УФА-04, ДНК-содержащий, из семейства гепаднавирусов;
— вирус гепатита С человека, штамм Д1;
— вирус бычьей диареи (ВД-БС), РНК — содержащий вирус диареи — болезни слизистых оболочек крупного рогатого скота, из семейства пестивирусов, штамм ВК-1В1-N 28.
Средство, показавшее способность инактивировать полиовирус и аденовирус, включают в группу ДС с вирулицидной активностью. ДС с вирулицидной активностью используют для дезинфекции при любой вирусной (включая особо опасные) инфекции, имеющей значение в инфекционной патологии человека.
Для ДС, применяемых при повышенной (до 60°С) температуре растворов, кроме указанных двух основных вирусов в качестве тест-вируса используют бычий парвовирус (штамм Хаден).
Для изучения и оценки активности ДС в отношении вируса гепатита А используют вирус гепатита А человека (штамм HAS-15). ДС, инактивирующие вирус гепатита А, входит в группу средств с вирулицидной активностью.
Для изучения вирулицидной активности ДС в отношении вируса гепатита В применяют суррогатный вирус — вирус гепатита В уток (ВГВУ), в отношении вируса гепатита С — суррогатный вирус — вирус диарреи — болезни слизистых оболочек крупного рогатого скота ВД-БС (штамм ВК-1В1-N 28) или вирус гепатита С человека (штамм Д1).
Исходный вирус, полученный из референс центров (из национальных или международных коллекций вирусов), размноженный в объемах, достаточных для длительной работы сданным пассажем, хранят в малых объемах при минус 20°-минус 70°С или в жидком азоте.
Исходный вирус размножают в чувствительных клетках (лабораторных животных, утках и др.), продуцирующих вирус в высоких титрах. Клеточный детрит удаляют цетрифугированием* при низких оборотах (1000 об/5 мин), получая вирусную суспензию (ВС).
________________
* Текст соответствует оригиналу. — .
Титр ВС должен быть достаточно высоким, чтобы можно было получить снижение титра на 4,0 log10. Минимальный титр ВС должен составлять 106,5 ТЦИД/мл. Для подсчета ТЦИД
или LD
применяют метод полных кумулятивов Рида и Менча и метод определения «центральной величины» Кербера по [2].
Полиовирус размножают в перевиваемой культуре клеток RD и НЕр-2 или в других чувствительных клеточных культурах (4647, Vero и т.д.). Для получения ВС культуру клеток, инфицированную вирусом полиомиелита на стадии 100% поражения монослоя, вызванного цитопатическим действием вируса, трехкратно замораживают и оттаивают. После удаления разрушенных клеток центрифугированием полученную ВС используют в экспериментах.
Аденовирус размножают в перевиваемой клеточной культуре НЕр-2, 4647 и в других чувствительных клеточных культурах. Методика получения ВС аналогична методике получения вирусной суспензии для полиовируса, за исключением того, что перед процедурой разрушения клеток методом замораживания-оттаивания проводят замену культуральной среды на не содержащую сыворотки и добавляют ее в меньшем объеме.
Вирулицидное ДС (субстанция) должно подавлять инфекционность обязательных для испытаний тест-вирусов — полиовируса и аденовируса на исследуемых объектах не менее, чем на 4log10 ТЦИД (то есть степень инактивации должна быть не менее 99,99%).
Критерием вирулицидной активности ДС (субстанций) для других тест-вирусов (включая вирусы — возбудители особо опасных инфекций) является отсутствие инфекционности, определяемое современными методами индикации.
Степень инактивации тест-вируса определяют в чувствительных модельных системах по подавлению инфекционной, цитопатической или бляшкообразующей активности вируса в культуре клеток, или по отсутствию маркеров инфицирования, или по специфической гибели лабораторных животных. Для получения более точных результатов тест-вирус следует использовать с максимальным титром.
Показателем вирулицидной активности ДС (субстанций) является скорость инактивации, которая представляет собой соотношение концентрации тест-вируса, выраженное в десятичных логарифмах, до и после воздействия ДС за определенный промежуток времени (экспозиция). Степень снижения вирусной инфекционности вычисляется в десятичных логарифмах по разнице титров вируса до и после обработки ДС.
При отсутствии цитопатического эффекта пробы подвергают необходимой обработке с целью проведения второго, а при необходимости и третьего слепого пассажа для определения полноты ингибирования тест-вируса. Эксперименты сопровождают всеми необходимыми контролями, в том числе контролем полноты нейтрализации дезинфектанта, жизнеспособности тест-вируса, контаминации тест-объекта тест-вирусом, культуры клеток или лабораторных животных (мыши), утки и др.
Для нейтрализации ДС используют нейтрализатор, подобранный к конкретному ДС (или дезинфицирующей субстанции), останавливающий действие ДС (характеристика нейтрализаторов указана в 4.3).
Комплексный нейтрализатор обладает выраженным цитотоксическим действием на клеточные культуры. Если не удается подобрать какой-либо химический нейтрализатор, так как его действие проявляется в неспецифической дегенерации культуры клеток (или гибели мышей, уток), то используют 60%-80% сыворотки (без консерванта) крупного рогатого скота (СКРС), инактивированной при 56°С. В течение 30 мин СКРС нейтрализует большой перечень ДВ и по своему действию наиболее близка к комплексному нейтрализатору.
При невозможности нейтрализовать токсическое действие ДС следует применять дополнительные методы удаления ДС — диализ смеси вирус-дезинфектант, например, с использованием сефадекса LH-20, G-75; осаждения вируса методом высокоскоростного центрифугирования или фильтрацией через мембранные фильтры.
8.2 Определение вирулицидной активности ДС, предназначенных для обеззараживания поверхностей в помещениях, мебели, аппаратов, приборов, санитарно-технического оборудования, транспортных средств и других объектов
Определение вирулицидной активности ДС при обеззараживании тест-поверхностей проводят двумя способами: способом протирания (одно- или двукратного) или способом орошения.
На поверхности, подготовленные и расположенные, как указано в 5.3, наносят ВС из расчета — 0,5 мл с добавлением 5% инактивированной СКРС на площадь в 100 см, равномерно распределяют по поверхности стеклянным шпателем. Контаминированные вирусом поверхности подсушивают до полного высыхания при температуре 20°С±2°С и относительной влажности воздуха 50-60%, затем обрабатывают раствором ДС.
Для имитации органического загрязнения используют 40% инактивированной сыворотки при разработке режимов обеззараживания раковин, ванн, унитазов — 80%. Возможно использование вируссодержащей фекальной эмульсии, которую наносят на поверхности из кафеля или фаянса в экспериментах с вирусами, выделяющимися из организма с фекалиями.
Контроль эффективности обеззараживания осуществляют через 15-30-60 минут. Пробы отбирают путем тщательного протирания обработанных раствором ДС поверхностей слегка увлажненной нейтрализатором в физиологическом растворе или растворе Хенкса с антибиотиками стерильной марлевой салфеткой (5×5 см), а затем сухой. Салфетки помещают в широкогорлые пробирки с бусами с 5 мл нейтрализатора.
Оптимальное время обеззараживания поверхностей — не более 60 мин.
В контроле вируса контаминированные ВС поверхности протирают или орошают стерильной водопроводной водой при той же норме расхода воды, что и ДС в опыте. Забор проб и их обработку проводят аналогично опытным. Для определения плотности контаминации проводят титрование смывов с поверхностей.
8.3 Определение вирулицидной активности ДС, предназначенных для обеззараживания белья
Изучение вирулицидной активности ДС проводят при обеззараживании белья без видимых загрязнений и белья, загрязненного выделениями. Для этого в емкость с раствором ДС помещают бязевое белье (1 кг на 4 л раствора). Контаминированные ВС бязевые тест-объекты подсушивают, закладывают в бязевые стерильные мешочки, которые размещают между слоями белья (верх, середина, низ).
Через определенные промежутки времени (15 и более мин) мешочки с тестами извлекают одновременно из трех слоев.
Тесты вынимают из мешочка стерильным пинцетом, погружают в широкогорлые пробирки с нейтрализатором и бусами, отмывают в шуттель-аппарате в течение 10 мин. Смывной жидкостью заражают культуру клеток (или другой биологический объект). Культуру клеток, отмытую от ростовой среды, оставляют на контакт на 30-60 мин для адсорбции вируса. Затем клетки промывают раствором Хенкса и заливают поддерживающей средой с сывороткой. Клетки инкубируют в термостате при оптимальной для конкретного вируса температуре.
Для изучения эффективности ДС при обеззараживании белья, загрязненного кровью (имитация в виде 40% сыворотки), медицинских отходов из тканей, марли, ваты (одноразовое хирургическое белье и акушерские комплекты, перевязочный материал, марлевые салфетки, ватные тампоны и др.) к 6 мл вируссодержащей жидкости добавляют 4 мл инактивированной СКРС, смешивают и заливают тесты, подсушивают их и используют в опыте.
Оптимальное время обеззараживания белья — не более 120 мин, медицинских отходов — не более 240 мин.
Для имитации загрязнения белья и медицинских отходов из тканей и др. фекалиями в экспериментах с тест-вирусом используют фекальную эмульсию. Фекальную эмульсию готовят следующим образом: к 6 мл 10% ВС добавляют 4 мл 40%-ной эмульсии фекалий. Для этого 8 г простерилизованных фекалий (1,5 атм в течение 30 мин) растирают в ступке с 20 мл стерильной воды. В качестве органической нагрузки также используют 80% инактивированной СКРС из расчета: 8 мл сыворотки и 2 мл ВС тщательно перемешивают и этой смесью заливают тесты. Избыток жидкости через 15 мин удаляют с помощью пипетки, тесты подсушивают при комнатной температуре. Далее эксперимент проводят по схеме — как с бельем, незагрязненным выделениями.
Время обеззараживания белья и медицинских отходов, загрязненных фекалиями — не более 240 мин.
8.4 Определение вирулицидной активности ДС, предназначенных для обеззараживания посуды
Исследования ДС проводят с использованием посуды без остатков пищи, а также без других видимых загрязнений и посуды с остатками пищи или другими загрязнениями.
При обеззараживании посуды без остатков пищи в качестве тест-объектов используют:
— тарелки;
— стаканы;
— эмалированные кружки;
— столовые приборы — ножи, вилки, ложки;
— лабораторную посуду — пипетки, в т.ч. микропипетки, наконечники к ним, предметные стекла, пробирки.
Чистую посуду контаминируют вирусной суспензией (ВС), которую наносят пипеткой из расчета 0,5 мл на 100 см и равномерно распределяют по поверхности стерильным стеклянным шпателем. Вилки, ложки и ножи погружают в ВС на 10-15 мин (за исключением ручек), каналы пипеток контаминируют вирусом.
Посуду, столовые приборы подсушивают при комнатной температуре. После полного высыхания погружают в раствор ДС, полностью их покрывая раствором (расход раствора составляет примерно 2 л на комплект посуды: чашка, блюдце, 2 тарелки, ложка, вилка, нож).
Через определенные интервалы времени (15, 30, 60, 90, 120 минут) посуду извлекают из раствора ДС. Для оценки эффективности обеззараживания стерильными марлевыми салфетками размером 5х5 см (вначале увлажненной нейтрализатором, затем сухой) тщательно протирают контаминированные вирусом части каждого предмета. Салфетки помещают в стерильную широкую пробирку с бусами и с 5 мл стерильного нейтрализатора.
Оптимальное время обеззараживания — не более 60 мин.
В качестве контроля используют аналогичным способом контаминированную вирусом посуду, погруженную на максимальную экспозицию в стерильную или прокипяченную водопроводную воду.
Для изучения эффективности ДС при обеззараживании посуды с остатками пищи, загрязненной лабораторной посуды многократного использования и однократного применения (перед утилизацией) к ВС добавляют 80% инактивированной СКРС из расчета: 20% ВС и 80% сыворотки, смесь наносят равномерно на посуду, подсушивают.
Оптимальное время обеззараживания — не более 120 мин для посуды многократного использования и не более 240 мин — для посуды однократного применения (перед утилизацией).
Библиография
|
[1] |
Технические условия ТУ 2481-135-07510508-07 |
Сульфонол порошок |
|
[2] |
Руководство Р 4.2.2643-10 |
Методы лабораторных исследований и испытаний дезинфекционных средств для оценки их эффективности и безопасности |
|
УДК 615.478.74:006.354 |
ОКС 11.080.20 |
Т58 |
||
|
Ключевые слова: средства дезинфицирующие, методы определения, показатели эффективности, бактерии, вирусы, грибы, нейтрализатор |
(Поправка. ИУС N 8-2018).
Редакция документа с учетом
изменений и дополнений подготовлена

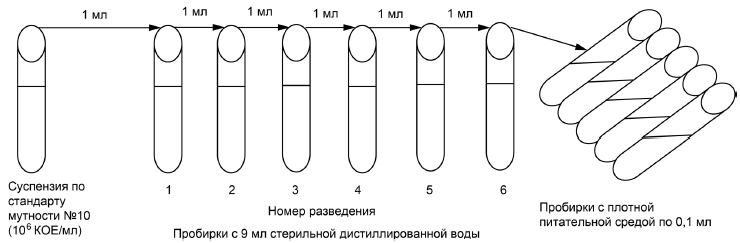
 МР 1119-73 «Методические рекомендации по определению вирулицидной активности препаратов»
МР 1119-73 «Методические рекомендации по определению вирулицидной активности препаратов»