В книге даны обобщающие сведения о результатах иммуногистохимических исследований большинства опухолей человека. В ней описаны основные принципы и алгоритмы иммуногистохимической гистогенетической диагностики новообразований человека, а также описаны их основные предсказательные и прогностические маркеры. Приводится подробная иммуногистохимическая характеристика опухолей системы лимфо- и гемопоэза, мягких тканей, молочной железы, кожи, легкого, желудка, толстой кишки, печени, поджелудочной и щитовидной желез, надпочечников, гипофиза, почек, мочевого пузыря, простаты, яичек, матки, яичников, периферической и центральной нервной системы и др.
Представлены современные сведения о нейроэндокринной системе, механизмах апоптоза, скорости клеточного цикла, молекулярно-генетических особенностях ряда злокачественных опухолей. На примере гибридизации и ПЦР in situ даются базовые сведения о молекулярно-биологических методах морфологической диагностики предопухолевых состояний и злокачественных новообразований. Значительное внимание уделено контролю качества, трудностям иммуногистохимического выявления клеточного источника новообразования при метастатических поражениях, а также особенностям метода.
Монография предназначается для патологоанатомов, цитологов, онкологов, студентов старших курсов медицинских вузов, а также для медиков и биологов, занимающихся изучением опухолей человека
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Стяжкина С.Н.
1
Порываева Е.Л.
1
Климентов М.Н.
1
Леднева А.В.
1
1 ФГБОУ ВО «Ижевская государственная медицинская академия»
Иммуногистохимическое исследование используется для выявления локализации антигена в клетках и тканях. Albert Coons в 1941 г. впервые получил меченные флюоресцеином антитела и применил их в диагностических целях. В 1970 г. Ludwig Sternberger изобрёл пероксидаза-антипероксидазный метод [25], а в 1975 г. Georges Kцhler и Cйsar Milstein впервые добились слияния короткоживущих лимфоцитов, продуцирующих антитела, и постоянно растущих клеток плазмоцитомы, и полученные, теоретически «бессмертные», культивируемые клоны гибридных клеток позволили получать разнообразные моноклональные антитела в больших количествах. В 1990-х было обнаружено, что возможен поиск нереактивных антигенов в тканях, фиксированных формалином и заключённых в парафин, путём их нагрева в буферных растворах. Это расширило возможности метода и повысило его чувствительность. Целью данного исследования являлась оценка пролиферативной активности ткани щитовидной железы с помощью иммуногистохимических исследований. Определение степени пролиферации позволяет выбирать наиболее оптимальный объем оперативного лечения.
оперативное лечение
иммуногистохимия
щитовидная железа
1. Павлова Т.В. Ультраструктурные и иммуногистохимические особенности рака щитовидной железы / Т.В. Павлова, Е.А. Смирнова // Архив патологии. — 2008. — № 3. – С. 49-52.
2. Петров С.В. Руководство по иммуногистохимической диагностике опухолей человека / Петров С.В., Райхлин Н.Т. – Казань, 2000. – С. 456.
3. Петров С.В. Иммуногистохимическая диагностика опухолей щитовидной и паращитовидных желез, вилочковой железы // Руководство по иммуногистохимической диагностике опухолей человека / под ред. С.В. Петрова, Н.Т. Райхлина. – Казань : Татул, 2004. – С. 150–159.
4. Стяжкина С.Н., Грачева В.А., Ситников В.А. Клинико-морфологические параллели при узловых образованиях щитовидной железы // Морфологические ведомости : международный морфологический журнал. – М. – Берлин, 2009. — С. 217–217.
5. Стяжкина С.Н., Елгашина Л.Н., Габибова С.Ф., Максимова Т.А. Выявление рака щитовидной железы у больной с узловым зобом // Сборник трудных ситуаций в хирургии. – Ижевск, 2015. – С. 10.
Иммуногистохимия (ИГХ) — это метод выявления точной локализации того или иного клеточного или тканевого компонента (антигена) благодаря связыванию его с мечеными антителами. Albert Coons в 1941 г. впервые получил меченные флюоресцеином антитела и применил их в диагностических целях. В 1970 г. Ludwig Sternberger изобрёл пероксидаза-антипероксидазный метод, а в 1975 г. Georges Kцhler и Cйsar Milstein впервые добились слияния короткоживущих лимфоцитов, продуцирующих антитела, и постоянно растущих клеток плазмоцитомы, и полученные, теоретически «бессмертные», культивируемые клоны гибридных клеток позволили получать разнообразные моноклональные антитела в больших количествах. В 1990-х было обнаружено, что возможен поиск нереактивных антигенов в тканях, фиксированных формалином и заключённых в парафин, путём их нагрева в буферных растворах. Это расширило возможности метода и повысило его чувствительность [1].
В последнее десятилетие ИГХ-анализ обрёл широкое применение в каждодневной диагностической практике, перестал быть методом сугубо научных исследований.
На сегодняшний день существуют различные иммуногистохимические методы, однако в практической деятельности наиболее широко распространено непрямое иммуноокрашивание с использованием биотинавидинового комплекса. Непрямой метод предполагает использование двух различных антител.
Первичные антитела реагируют с антигенами ткани. Связанные с меткой вторичные антитела специфически взаимодействуют с первичными, которые для вторичных антител являются антигеном. Метод значительно чувствительнее прямого, т.к. с каждой молекулой первичных антител связывается несколько молекул вторичных антител, содержащих метку. Биотин (витамин H) — соединение, стойкое к действию высоких температур, к кислой и щелочной среде, хорошо растворяется в воде и спирте. Он является коферментом во многих реакциях присоединения (карбоксилирования). Биотин легко может вступать в стойкое соединение с различными белками, в том числе с ферментами и иммуноглобулинами. Авидин образует с биотином чрезвычайно стойкий комплекс. Разрушить такой комплекс можно только при температурной обработке, т.к. авидин разрушается при нагревании. Авидин имеет 4 места связывания, к которым можно присоединить биотин или белки. Таким образом, комплекс биотинавидин используется связующим мостиком между антителами и ферментами. Для этого готовится комплекс, состоящий из фермента, связанного с биотином, и авидина [2].
В настоящее время все большее распространение иммуногистохимическое исследование приобретает в исследовании щитовидной железы. Данное исследование позволяет оценить степень пролиферативной активности клеток щитовидной железы.
Цель исследования
Целью работы явилось исследование пролиферативной активности ткани щитовидной железы на основе экспрессии белков Ki67 (клон MIB-1), p53 (клон DO-7), Тиреоидного фактора транскрипции TTF-1 (клон 8G7G3/1), тиреоглобулина (клон DAK-Tg6) и их взаимосвязи с возможностью рецидива зоба после оперативного лечения. Это позволяет прогнозировать возможность либо отсутствие рецидива, помогает в выборе более щадящей операции.
Материалы и методы исследования
Иммуногистохимические реакции проводились на фиксированных 10%-ным фосфатным забуференным формалином, залитых в парафин срезах. Использовались моноклональные антитела к белкам Ki67 (клон MIB-1), p53 (клон DO-7), Тиреоидному фактору транскрипции TTF-1 (клон 8G7G3/1), тиреоглобулину (клон DAK-Tg6). Для восстановления антигенных детерминант применялся метод нагревания в цитратном буфере при 95 градусах Цельсия в течение 20 минут на водяной бане. Использовалась высокочувствительная полимерная система детекции, меченная пероксидазой хрена. В качестве хромогена использовался диаминобензидин (продукт реакции имеет различные оттенки коричневого цвета, от желтоватого до почти чёрного, в зависимости от концентрации антигена в исследуемой ткани). В целях визуализации морфологии ткани срезы докрашивались гематоксилином Майера в течение 30 секунд до слабой сине-фиолетовой окраски ядер клеток. В дальнейшем готовые препараты изучались при помощи микроскопа в проходящем свете. Диапазон увеличений от 50 до 1000.
В исследовании было проведено 30 иммуногистохимических исследований препаратов щитовидной железы, удаленных у пациентов хирургического отделения БУЗ МЗ «Первая республиканская клиническая больница МЗ УР» г. Ижевска с диффузными токсическими и диффузно-узловыми формами зоба в период с 01.02. 2015 г. по 01.02.2016 г.
Результаты исследования
При исследовании операционного материала производили его распределение по морфологическим признакам: диффузный зоб, узловой зоб, смешанный зоб (включая кистозный и кистозно-узловой).
Таблица 1
Распределение зоба по морфологическому строению
|
Диффузный зоб |
Узловой зоб |
Смешанный зоб |
Всего |
|
|
количество |
6 |
21 |
3 |
40 |
|
20% |
70% |
10% |
100% |
Таблица 2
Распределение факторов пролиферативной активности у пациентов при иммуногистохимическом исследовании
|
До 20% |
20-55% |
Более 55% |
|
|
Ki67 |
18 |
10 |
2 |
|
60% |
33% |
7% |
|
|
До 30% |
30-50% |
Более 50% |
|
|
p53 |
23 |
6 |
1 |
|
77% |
20% |
3% |
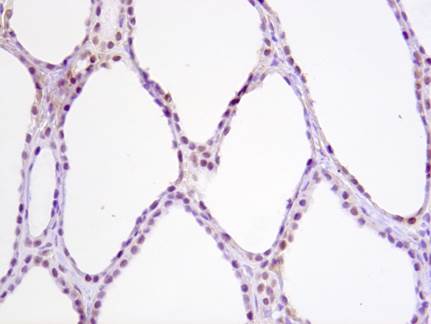
У пациентов с макрофолликулярными формами зоба отмечается низкий индекс пролиферации фолликулярного эпителия (до 1% позитивных клеток) — экспрессия Ki67. При микрофолликулярных формах зоба отмечается более высокий индекс пролиферации фолликулярного эпителия (до 5% позитивных клеток). Белок p53 является проапоптотическим белком, участвует в одном из основных сигнальных путей, регулирующих запрограммированную гибель клетки (апоптоз) – ядерный путь апоптоза. Он экспрессируется в ядрах большинства нормальных клеток, при этом определяемая степень экспрессии слабая (желтоватое или бледно-коричневое окрашивание ядер) – так называемый дикий тип гена. При мутации гена, кодирующего белок р53, функция белка нарушается, ядерный путь апоптоза блокируется, клетки становятся «бессмертными», что может впоследствии служить основой для развития опухоли. Мутантный ген также обладает свойством гиперэкспрессии – производится большое количество белка р53, не обладающего функциональной активностью. Продукт мутантного гена накапливается в ядрах клеток, что иммуногистохимически выявляется в виде тёмно-коричневого окрашивания ядер, более яркого, чем окраска ядер соседних клеток, несущих ген «дикого» типа (рисунок).
Экспрессия белка р53 в нормальной ткани щитовидной железы. Слабое желтовато-коричневое окрашивание ядер на сине-фиолетовом фоне. «Дикий тип» экспрессии гена р53
У пациентов с пролиферативными формами зоба наблюдалось более интенсивное коричневое окрашивание ядер, что указывает на гиперэкспрессию гена р53 в участках микрофолликулярной пролиферации и косвенно свидетельствует о возможной мутации гена р53. У 2 пациентов наблюдалась гиперэкспрессия мутантного гена р53 в участке микрофолликулярной пролиферации эпителия с морфологическими (ядерными) признаками тяжёлой дисплазии, что говорит о высоком потенциале опухолевой трансформации этой клеточной популяции [3].
Тиреоглобулин – белковый продукт фолликулярного эпителия щитовидной железы, выявляемый в цитоплазме фолликулярных клеток, в коллоиде фолликулов щитовидной железы. Позитивная реакция определяется по различным оттенкам коричневого окрашивания вышеназванных структур. У пациентов с макрофолликуляным зобом наблюдается умеренная интенсивность реакции в коллоиде фолликулов. У пациентов с тиреотоксическими формами зоба наблюдалась интенсивная реакция в коллоиде фолликулов и в цитоплазме фолликулярного эпителия, что свидетельствует о высокой функциональной активности ткани железы. У пациентов с микрофолликулярными формами зоба структуры в цитоплазме практически не содержат коллоида, что говорит о функциональной незрелости данного участка железистой ткани. Тиреоидный фактор транскрипции TTF-1 – белковый продукт, локализующийся в ядрах клеток фолликулярного эпителия щитовидной железы, С-клеток щитовидной железы, альвеолярного эпителия и нейроэндокринных клеток лёгкого. Этот белок является индуктором транскрипции (экспрессии) групп генов, ответственных за дифференцировку вышеназванных клеточных типов, имеющих общее происхождение в эмбриогенезе. Позитивная реакция определяется по коричневому окрашиванию ядер клеток.
При всех вариантах зоба наблюдалась интенсивная экспрессия TTF-1 в фолликулярном эпителии.
После проведенных иммуногистохимических исследований все случаи были распределены в 3 группы в соответствии со степенью выявленной пролиферации ткани щитовидной железы [4].
I степень пролиферации:
- индекс пролиферации Ki-67 составляет 15-20%;
- экспрессия протеина Р53 составляет 25-30%;
- пролиферация фолликулярного и парафолликулярного эпителия, занимающих 30-35% фолликулов.
II степень пролиферации:
- индекс пролиферации Ki-67 составил 50-55%;
- экспрессия протеина Р53 составляет 55-60%;
- пролиферация фолликулярного и парафолликулярного эпителия, занимающих 50% фолликулов.
III степень пролиферации:
- пролиферация фолликулярного и парафолликулярного эпителия, занимающих 70-75% фолликулов;
- индекс пролиферации Ki-67 составил 70%;
- экспрессия протеина Р53 75-80%.
Результаты исследования
После проведенных иммуногистохимических исследований все случаи были распределены в 3 группы в соответствии со степенью выявленной пролиферации ткани щитовидной железы. В 60% случаев была выявлена I степень пролиферации, что позволяет в данных случаях выполнять органосохраняющие операции. В 33% случаях была выявлена II степень пролиферации ткани щитовидной железы, что может говорить о высоком риске рецидивирования, в данном случае будут оправданы радикальные операции. В 7% случаев была выявлена III степень пролиферации, что подразумевает риск малигнизации, данные пациенты должны быть оперированы в условиях онкологического диспансера [5].
Выводы
Первая степень зобной пролиферации не является фактором риска рецидива зоба после оперативного удаления одной доли (гемиструмэктомии) или резекции щитовидной железы. Вторая степень зобной пролиферации служит фактором риска рецидива зоба. Третья степень пролиферации служит достоверным признаком рецидива зоба и возможной малигнизации узлов-регенератов. Эта стадия должна рассматриваться как предраковая и оцениваться как дисплазия III степени.
Заключение
При выявлении первой степени пролиферации зоба оправданными были органосохраняющие операции, гемитиреоидэктомия или резекция щитовидной железы, поскольку риск рецидивирования отсутствует. При выявлении второй степени пролиферации целесообразнее выполнять субтотальную тиреоидэктомию, так как существует риск рецидивирования. При выявлении третьей степени пролиферации должно проводиться радикальное оперативное лечение в условиях онкологического диспансера.
Библиографическая ссылка
Стяжкина С.Н., Порываева Е.Л., Климентов М.Н., Леднева А.В. ВОЗМОЖНОСТИ ИММУНОГИСТОХИМИЧЕСКОГО ИССЛЕДОВАНИЯ ДЛЯ ОЦЕНКИ ПРОЛИФЕРАТИВНОЙ АКТИВНОСТИ ТКАНИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ // Современные проблемы науки и образования. – 2017. – № 2.
;
URL: https://science-education.ru/ru/article/view?id=26185 (дата обращения: 24.04.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Туффаха С..А. Муин, Гичка Сергей, Гуски Ганс, Кристиансен Глен. Иммуногистохимия в диагностике опухолей. — Киев.: Книга-плюс, 2018. — 336 с.
Медицинская наука постоянно развивается, появляется новая информация и совершенствуются методы и подходы в диагностике и лечении заболеваний. Авторы и издатель гарантируют, что информация, представленная в этой книге, является точной и актуальной. Однако, авторы и издатель не несут ответственности за возможные ошибки или любые последствия, возникшие в результате применения информации, содержащейся в книге. Ни издатель, ни авторы не несут никакой ответственности за любые неблагоприятные последствия и/или убытки, причиненные людям или имуществу, вытекающие из данной публикации. Все протоколы и методы, изложенные в книге, предназначены только для исследовательских целей. Каждая лаборатория должна получить официальное разрешение на использование этих методов и протоколов с целью диагностики в соответствии с национальным законодательством и регионарными правилами.
Руководство по иммуногистохимической диагностике опухолей человека [Текст] = Manual on immunohistochemical diagnostics of human tumors : [монография]
Карточка
Руководство по иммуногистохимической диагностике опухолей человека [Текст] = Manual on immunohistochemical diagnostics of human tumors : [монография] / [Петров С. В. и др.] ; под ред. С. В. Петрова, Н. Т. Райхлина ; Республиканский клинический онкологический диспансер М-ва здравоохранения Республики Татарстан [и др.]. — 4-е изд., доп. и перераб. — Казань : Татмедиа, 2012. — 623 с. : ил., цв. ил.; 27 см.; ISBN 978-5-85247-559-6 (в пер.)
Авт. указаны на 6-9-й с. текста
На обл. авт.: С. В. Петров, Н. Т. Райхлин
Указ.
Здравоохранение. Медицинские науки — Онкология — Иммунодиагностика — Руководство для специалистов
Иммуногистохимическая диагностика — Практические пособия — Методика и техника
Опухоли — Практические пособия — Иммуноцитохимическая диагностика
иммуногистохимическая диагностика опухолей
Шифр хранения:
FB 2 12-64/98
FB 2 12-64/99
Описание
| Заглавие | Руководство по иммуногистохимической диагностике опухолей человека [Текст] = Manual on immunohistochemical diagnostics of human tumors : [монография] |
|---|---|
| Дата поступления в ЭК | 10.09.2012 |
| Каталоги | Книги (изданные с 1831 г. по настоящее время) |
| Сведения об ответственности | [Петров С. В. и др.] ; под ред. С. В. Петрова, Н. Т. Райхлина ; Республиканский клинический онкологический диспансер М-ва здравоохранения Республики Татарстан [и др.] |
| Издание | 4-е изд., доп. и перераб. |
| Выходные данные | Казань : Татмедиа, 2012 |
| Физическое описание | 623 с. : ил., цв. ил.; 27 см |
| ISBN | ISBN 978-5-85247-559-6 (в пер.) |
| Примечание | Авт. указаны на 6-9-й с. текста |
| На обл. авт.: С. В. Петров, Н. Т. Райхлин | |
| Указ. | |
| Тема | Здравоохранение. Медицинские науки — Онкология — Иммунодиагностика — Руководство для специалистов |
| Иммуногистохимическая диагностика — Практические пособия — Методика и техника | |
| Опухоли — Практические пособия — Иммуноцитохимическая диагностика | |
| иммуногистохимическая диагностика опухолей | |
| BBK-код | Р56-47,07 |
| Язык | Английский |
| Русский | |
| Места хранения | FB 2 12-64/98 |
| FB 2 12-64/99 |
Введение. В последние годы в России и в мире появилась тенденция к увеличению частоты возникновения злокачественных новообразований, в том числе — почек, что привлекает внимание специалистов разных направлений (урологов, онкологов, патоморфологов). Злокачественные опухоли почек занимают 10-е место в раковом реестре среди всех новообразований, а наиболее распространенный в этой группе почечно-клеточный рак стоит на 3-м месте среди урологических опухолей [1,12]. Самой часто встречающейся опухолью почки считают злокачественную опухоль эпителиального происхождения — почечно-клеточный рак (ПКР) — 80-90% всех опухолей почек. ПКР имеет большое количество гистологических вариантов строения: наиболее часто встречается светлоклеточный вариант, реже встречаются папиллярный, хромофобный и другие варианты [1,12]. Иммуногистохимическое исследование в настоящее время считается одним из наиболее информативных, так как позволяет максимально точно определить как гистогенез опухоли, так и установить степень ее дифференцировки [5].
Целью нашего исследования явилось определение наиболее стабильных иммуногистохимических характеристик различных вариантов опухолей почек для своевременной и более точной диагностики новообразований этой локализации, что в перспективе позволяет прогнозировать течение опухоли.
Материалы и методы. Для достижения цели нашего исследования мы использовали следующие материалы и методы: данные историй болезни, морфологическое и иммуногистохимическое исследования операционного материала (опухолей почки), взятого от 487 больных, находящихся на лечении в урологических отделениях 3 ГКБ им. Р.В. Миротворцева г. Саратова за 5 лет с 2006 г. по 2010 г. Так как из 487 в 459 случаев у пациентов обнаруживалась злокачественная опухоль почки, что составляет 94,3% всех ренальных опухолевых процессов, то при дальнейшем описании опухолей почек мы будем упоминать злокачественное эпителиальное образование — почечно-клеточный рак.
Результаты. Согласно литературным данным, средний возраст, при котором выявляются злокачественные опухоли в почках, составляет 62 года [6,7,9], однако, при анализе историй болезни в нашем исследовании мы отмечали возникновение рака почек в более раннем возрасте – 57 лет. Некоторые случаи ПКР регистрировались в 30-35 лет и даже в более молодом возрасте. При этом нами было отмечено, что у лиц молодого возраста чаще выявляются редкие варианты ПКР (хромофобный, папиллярный, веретеноклеточный, мультилокулярный поликистозный).
Анализ литературных данных показал, что мужчины поражаются ПКР практически в 2 раза чаще женщин [9,10,12], однако в нашем исследовании опухоли почек одинаково часто диагностировались как у мужчин (52%), так и женщин (48%). Возможно, это связано с тем, что в литературе анализируется в основном наиболее распространенный почечно-клеточный рак, который действительно чаще встречается у мужчин. Если учитывать всю совокупность опухолей, то у женщин чаще развиваются редкие формы ПКР, а также доброкачественные мезенхимальные новообразования в почках.
В последние годы все чаще опухоли почек (особенно злокачественные) диагностируются поздно, когда патологический процесс уже имеет признаки агрессивного роста: прорастание опухоли в сосуды, что в дальнейшем приводит к образованию метастазов и сокращает сроки выживаемости больных [6,7,11]. В нашем исследовании было выявлено, что из 459 злокачественных новообразований почек, признаки инвазии имели 320, что составляет 69,7% всех злокачественных опухолей.
Прогноз злокачественных опухолей в почке, как и при опухолях других локализаций, зависит от наличия или отсутствия регионарных и отдаленных метастазов, от стадии и гистологического варианта заболевания, которые невозможно дифференцировать без морфологического исследования [2,3,4,8,13,14]. Часто на основании обычного гистологического исследования с использованием окраски гематоксилином и эозином возможно поставить патогистологический диагноз, на основании которого врачи-урологи назначают или корректируют дальнейшее лечение и составляют прогноз опухолевого процесса. Однако в последние годы все чаще встречаются сложные случаи, когда опухоль имеет настолько низкую дифференцировку, что становится трудно или даже невозможно поставить гистологический диагноз на основании обычного морфологического исследования, иногда тяжело высказаться даже о происхождении опухоли эпителиальный или мезенхимальный она имеет характер. В таких случаях на помощь приходит иммуногистохимическое исследование [5]. Чтобы выявить эпителиальное происхождение опухоли (почечно-клеточный рак), мы использовали группу цитокератинов (СК). Нами установлено, что СК 17, СК 18, СК 19, СК 20 дают более интенсивную реакцию на рак почки, чем СК 56, СК 7, СК 1013. Кроме того, было отмечено, что при различной дифференцировке (G) светлоклеточного ПКР интенсивность реагирования цитокератинов была различной (табл.1).
Каждый гистологический вариант ПКР дает своеобразную комбинацию и интенсивность окрашивания как СК, так и другими антителами (табл.2). Эпителиальный характер опухоли почек позволяют подтвердить такие антитела как рецептор эпидермального фактора роста (EGFR) и AMACR. Известно, что AMACR — это специфический маркер для выявления рака предстательной железы, однако он дает реакцию и на злокачественные эпителиальные опухоли других локализаций [5].
Дифференцировку опухоли помогают установить антитела пролиферации и апоптоза: Р53, Р63, Ki-67, PCNA: чем интенсивнее экспрессия маркеров пролиферации, тем более агрессивно ведет себя опухоль и соответственно имеет более низкую дифференцировку. Соответственно для каждой опухоли почки, так же как и для каждого варианта ПКР имеется своя собственная оригинальная комбинация и интенсивность окраски антителами.
После проведения иммуногистохимических реакций в нашем исследовании были скорректированы диагнозы для некоторых опухолей и даже несколько опухолей были перенесены из одной группы в другую. Так, изначально после проведения гистологического исследования с помощью красителя гематоксилина и эозина в группе мультилокулярного поликистозного варианта ПКР находилось 13 случаев. Известно, что этот вариант почечно-клеточного рака наиболее благоприятен в плане прогноза – чаще имеет высокую дифференцировку и никогда не дает метастазов [13]. Но в одном из 13 случаев после проведения иммуногистохимического исследования было отмечено, что дифференцировка опухоли более низкая и после тщательного обследования у больного были обнаружены метастазы рака почки в регионарные лимфатические узлы. После проведения иммуногистохимического исследования в этом случае вместо первоначально поставленного диагноза мультилокулярного поликистозного варианта ПКР был выставлен диагноз светлоклеточного ПКР с кистозной трансформацией, больному назначена дополнительная иммунотерапия.
Заключение. Таким образом, иммуногистохимический метод исследования в диагностике опухолей почек играет важное диагностическое и прогностическое значение. Оно может оказать помощь врачам патогистологам в сложных и неоднозначных случаях правильно диагностировать ренальные новообразования. Это даст возможность назначить правильное лечение и прогнозировать течение злокачественного роста опухоли у больных.