Руководство по нейроиммуноэндокринологии 2-е издание.
Руководство состоит из двух частей. Первая часть посвящена молекулярным основам нейроиммуноэндокринной регуляции. Особое внимание уделяется молекулярно-клеточным взаимодействиям трех регуляторных систем организма — нервной, эндокринной и иммунной, которые в традиционных руководствах описываются отдельно. Поэтому «внутренняя» организация каждой отдельной системы рассматривается кратко и лишь постольку, поскольку это необходимо для анализа взаимосвязей между ними.
1-я глава посвящена общим принципам клеточной сигнализации и обоснованию представлений о гормональной регуляции как общебиологическом феномене, присущем любой клетке, независимо от ее происхождения и основной биологической роли в организме. Во 2-й главе описывается структурно-функциональная организация клеток, осуществляющих нейроиммуноэндокринные взаимодействия.
В последующих двух главах анализируются молекулярные механизмы нейроиммуноэндокринных взаимодействий. При этом авторы сочли целесообразным отказаться от традиционного порядка изложения материала и сначала охарактеризовать не разнообразные сигнальные молекулы (гормоны), а способы их действия на клетки и механизмы рецепции (3-я глава), что позволяет классифицировать огромное множество сигнальных молекул (4-я глава) в соответствии с гораздо менее многочисленными механизмами их действия.
Особенностью изложения материала в данном издании является приоритет внимания к тем аспектам функционирования сигнальных молекул, обеспечивающих нейроиммуноэндокринные взаимодействия, которые по-новому и иногда даже неожиданно трактуют традиционные взгляды. По этой причине, например, катехоламины (при их бесспорной важности) охарактеризованы менее подробно, чем пурины, хотя сведений о катехолами-нах накоплено гораздо больше. Такой подход, как нам кажется, оправдан тем, что многие сведения о катехоламинах широко известны, их можно легко найти в доступной литературе.
5-я глава посвящена молекулярной физиологии нейроиммуноэндокринных взаимодействий. Подробно освещаются факты, демонстрирующие существование и важное биологическое значение взаимодействий между иммунной, эндокринной, центральной и периферической нервной системами. При этом сначала рассмотрены взаимодействия между ними как целостными функциональными системами организма, а затем анализируется роль сигнальных молекул в обеспечении локальных коммуникационных взаимоотношений между клетками этих систем.
В 6-й главе анализируются нейроиммуноэндокринные механизмы общепатологических процессов и старения. Такой аспект был выбран в силу того, что инволютивные изменения органов и тканей при старении, и прежде всего основных регуляторных («управляющих») систем — нервной, эндокринной и иммунной, приводят к ослаблению их функций, обусловленных нарушением синтеза и секреции сигнальных молекул, прежде всего пептидов, при этом развиваются многие общепатологические процессы, приводящие к возникновению заболеваний, ассоциированных с возрастом. Вторая часть руководства посвящена частной нейроиммуноэндокрино-логии органов и тканей в норме и при патологии.
В отдельных главах детально рассмотрены топография, физиология, регуляторное значение и патология клеток и молекул, осуществляющих локальную нейроиммуноэн-докринную регуляцию в головном мозге, сердечно-сосудистой системе, органах дыхания, желудочно-кишечном тракте, печени, тимусе, молочной железе, плаценте, предстательной железе, яичках, коже и жировой ткани, почках и других органах.
Комментарии, рецензии и мнения о издании: «Руководство по нейроиммуноэндокринологии», автор Пальцев М. А.:
Закрепленные
Понравившиеся
- Главная
- Книги
- Руководство по нейроиммуноэндокринологии
Описание книги
Настоящее руководство представляет собой первое издание, в котором предпринята попытка детально представить роль и значение сигнальных молекул (гормонов) в формировании единых механизмов нейроиммуноэндокринных взаимодействий, обеспечивающих течение жизненных процессов на уровне, соответствующем эволюционному и генетическому статусу живой системы. Книга «Руководство по нейроиммуноэндокринологии» авторов М. А. Пальцев, Кветной Игорь оценена посетителями КнигоГид, и её читательский рейтинг составил…
Настоящее руководство представляет собой первое издание, в котором предпринята попытка детально представить роль и значение сигнальных молекул (гормонов) в формировании единых механизмов нейроиммуноэндокринных взаимодействий, обеспечивающих течение жизненных процессов на уровне, соответствующем эволюционному и генетическому статусу живой системы. Книга «Руководство по нейроиммуноэндокринологии» авторов М. А. Пальцев, Кветной Игорь оценена посетителями КнигоГид, и её читательский рейтинг составил 0.00 из 10.
Для бесплатного просмотра предоставляются: аннотация, публикация, отзывы, а также файлы для скачивания.
- Просмотров: 372
- Рецензий: 0
Информация об издании
- Переводчики: не указаны
- Серия:
не указана - ISBN (EAN): 978-5-900758-64-0
- Языки: Русский
- Возрастное ограничение: не указано
- Год написания: 2014
Эта книга еще не добавлена в подборки
К ЭТОЙ КНИГЕ НЕ ДОБАВЛЕНЫ персонажи
КНИГА НЕ УПОМИНАЛАСЬ В БЛОГАХ
Посмотрите еще
Пищеводитель
Вы хотели бы узнать о факторе, который может на 70 % снизить риск ожирения и диабета, предотвратить более 20 % онкологических и 40 % заболеваний сердца и сосудов, А если дополнительно узнаете, что этот фактор дейстует на нас каждый день от 3 до 5 и более раз? Среди океана информации о питании и диетах есть правильные и полезные советы. А есть тонны неправильных постулатов, обрывки знаний и просто …
Все на своем месте
Оливер Сакс – известный британский невролог, автор ряда популярных книг, переведенных на двадцать языков, две из которых – «Человек, который принял жену за шляпу» и «Антрополог на Марсе» – стали международными бестселлерами.
Оливер Сакс написал много книг, и все они очень разные, но в каждой из них красной нитью проходит гуманистическое отношение к пациенту. К сожалению, далеко не все свои мысли …
Здоровье по Дарвину. Почему мы болеем и как это связано с эволюцией
Почему люди не живут вечно? Почему мы не можем раз и навсегда избавиться от рака и других болезней? И почему сегодня, несмотря на все достижения медицины, заболеваемость не снижается, а растет? Коротко говоря, потому что человек — это результат эволюции, которая озабочена бессмертием генов, но не бессмертием тел. Эволюцию не интересует наше здоровье, счастье или долголетие. Джереми Тейлор предлага…
Доказательная гинекология и немного волшебства на пути к двум полоскам
«Слишком увлекаться здоровым образом жизни — зло!» — убежден один из самых известных отечественных гинекологов-практиков Камиль Бахтияров. Что нужно, чтобы зачать, выносить и родить здорового малыша? Когда уже стоит волноваться? Правда ли, что «дети из пробирки» могут быть генетическими мутантами? На эти и другие вопросы вы найдете ответы в данной книге.
И еще более 30 весьма интересных тем о рабо…
Тюремный доктор. Истории о любви, вере и сострадании
Жестокость. Наркотики. Суицид. Добро пожаловать в мир тюремного доктора!
Леденящие кровь, душераздирающие и поучительные — так можно охарактеризовать случаи из жизни и истории лечения пациентов, описанные врачом, считавшим своим профессиональным долгом помощь тем, кто находится под арестом. Все ее пациенты — преступники. Но, несмотря ни на что, для них она по-прежнему остается лечащим врачом.
Док…
Вынос мозга. Чудеса восприятия и другие особенности работы нервной системы
Что происходит с нашей нервной системой в течение дня? Как реагирует наш мозг на кофеин, алкоголь, влюбленность, сон? Можно ли силой мысли замедлить биение сердца или умереть от счастья? На все эти вопросы ответит книга врача-невролога и популярного блогера Ирины Галеевой.
Вымышленный герой, в котором каждый может узнать себя, пройдет по лабиринту нервной системы и откроет все загадки самой слож…
Мозг, ты спишь? 14 историй, которые приоткроют дверь в ночную жизнь нашего самого загадочного органа
Задумывались ли вы когда-нибудь, сколько тайн скрыто за таким простым действием, как засыпание в уютной постели после рабочего или учебного дня? Стремясь разгадать загадку сна, доктор Гай Лешцинер отправляется в 14 удивительных путешествий вместе со своими пациентами.
Все они – обычные люди, но с необычными способностями: у одного из них 25 часов в сутках, другой, засыпая, чувствует жужжащих у нег…
Генный апгрейд. Почему мы пользуемся устаревшей моделью тела в новой модели мира и как это исправить
Вы тоже заметили, что мир в последнее время меняется безумно быстро — в отличие от организма человека? Все острее ощущается, что наша эволюция отстает. Если в древности любовь к жирной и высокоуглеводной пище была залогом выживания, сейчас из-за нее мы набираем лишний вес. Если раньше всплеск кортизола с адреналином во время стресса был необходим для выживания при встрече с врагом, сейчас из-за эт…
Стареть не обязательно! Будь вечно молодым
Тема продления жизни очень интересовала людей во все времена. И в наши дни она находится в фокусе ведущих ученых мира. Как суметь прожить максимально долго и даже в глубокой старости сохранять энергию, подвижность, жизнелюбие и здравый ум? Какие изменения с возрастом происходят с нашим организмом? Что за недуги коварно подкарауливают пожилых людей и что с этим можно сделать? Ка…
Статья на конкурс «био/мол/текст»: Иммунная и нервная системы в клинических и фундаментальных исследованиях долгое время рассматривались по-отдельности, и как следствие появилось множество методов коррекции нарушений либо одной, либо другой системы, но никогда их обеих. На самом деле, можно ли вылечить депрессию, применяя иммуномодуляторы? Можно ли скорректировать нарушения иммунитета, принимая антидепрессанты? А что будет, если их применять вместе — не является ли это ключом к решению проблемы хронических и устойчивых заболеваний? Факты, накопленные к настоящему моменту, отчасти позволяют дать утвердительные ответы на эти вопросы, но многое пока остаётся неясным.
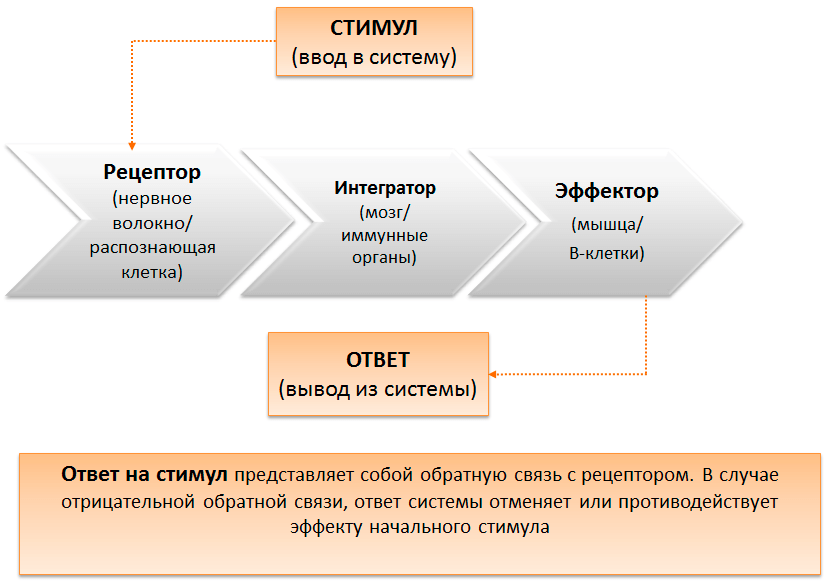
Дао гомеостаза
В последнее время накопилось немало исследований, показывающих, что нервная, иммунная и эндокринная системы работают не полностью автономно, а в тесной кооперации, формируя единую систему реагирования на изменения окружающей среды. Пониманию важной роли взаимодействия между этими системами организма поспособствовало переосмысление идеи гомеостатического равновесия (рис. 1), которая была предложена в 1932-м году Уолтером Кенноном в книге «Мудрость тела». Согласно ей все физиологические процессы в теле работают скоординированно. И таким образом, если происходят изменения в одной из составляющих данного равновесия, то это неизбежно должно отразиться и на другой. Как оказалось, нервная и иммунная системы, взаимодействуя друг с другом, являются механизмом, поддерживающим гомеостаз в организме человека, нарушение которого приводит к заболеванию [1], [2]. В связи с этим перед клиницистами и исследователями встали новые вопросы, касающиеся поиска механизмов неврологических заболеваний и методов их лечения. В последние годы этот поиск был связан с клиническими исследованиями иммунологических препаратов. Успехи не заставили себя ждать. Ведь, как оказалось, именно нервная и иммунная системы, взаимодействуя между собой, формируют функциональный «буфер», приспосабливающий организм к изменениям окружающей среды.
Рисунок 1. Гомеостáз (др.-греч. ομοιος — подобный, одинаковый + στασις — стояние, неподвижность) — это способность организма поддерживать функционально значимые переменные в пределах, обеспечивающих его оптимальную жизнедеятельность. Регуляторные механизмы, поддерживающие физиологическое состояние или свойства клеток, органов и систем целостного организма на уровне, соответствующем его текущим потребностям, называются гомеостатическими. Малая медицинская энциклопедия. — М.: Медицинская энциклопедия. 1991–1996 гг.
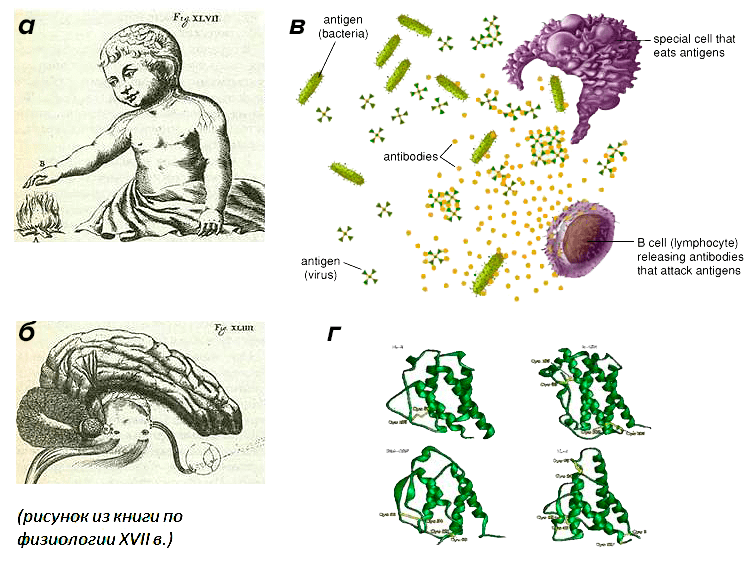
Сходства больше, чем различия?
Давно было отмечено, что нервная и иммунная системы имеют некоторые общие черты в принципах функционирования (рис. 2), а именно:
- только эти системы обладают способностью к «узнаванию объектов» (в случае иммунной системы это распознавание «своего и чужого» посредством специальных рецепторов, в случае нервной — распознавание внешних и внутренних стимулов, преобразующихся в нервный сигнал также благодаря специальным рецепторам);
- обе эти системы обладают памятью (иммунологическая память , которая позволяет В-клеткам памяти запоминать антигены, с которыми встретился организм, и нейрональная память, которая также способна хранить следы воздействия внешних стимулов, благодаря свойству пластичности нервных клеток);
- эти системы способны выделять химические сигналы, которые регулируют поведение отдельных клеток (цитокины и медиаторы соответственно), а также взаимодействуют на уровне непосредственных контактов (взаимодействие рецептор–лиганд в случае иммунных клеток и щелевые контакты в случае нервных клеток).
Подробнее о концепции иммунологической памяти мы рассказывали в статье «Иммунологическая Нобелевская премия (2011)» [3].
О паттерн-распознающих рецепторах и их роли в иммунитете рассказывается в статье «Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года» [4].
Рисунок 2. Параллели в работе нервной и иммунной систем. а — осязание; б — зрение; в — распознавание антигена; г — цитокины. Нервная система воспринимает сенсорные сигналы (физические, химические, эмоциональные), а иммунная — чужеродные субстанции (антигены, опухолевые клетки), которые не могут распознать нервная и эндокринная системы. При этом иммунная система использует эндокрин-подобные механизмы взаимодействия с нервной системой, а именно химические сигналы, где медиаторами служат цитокины.
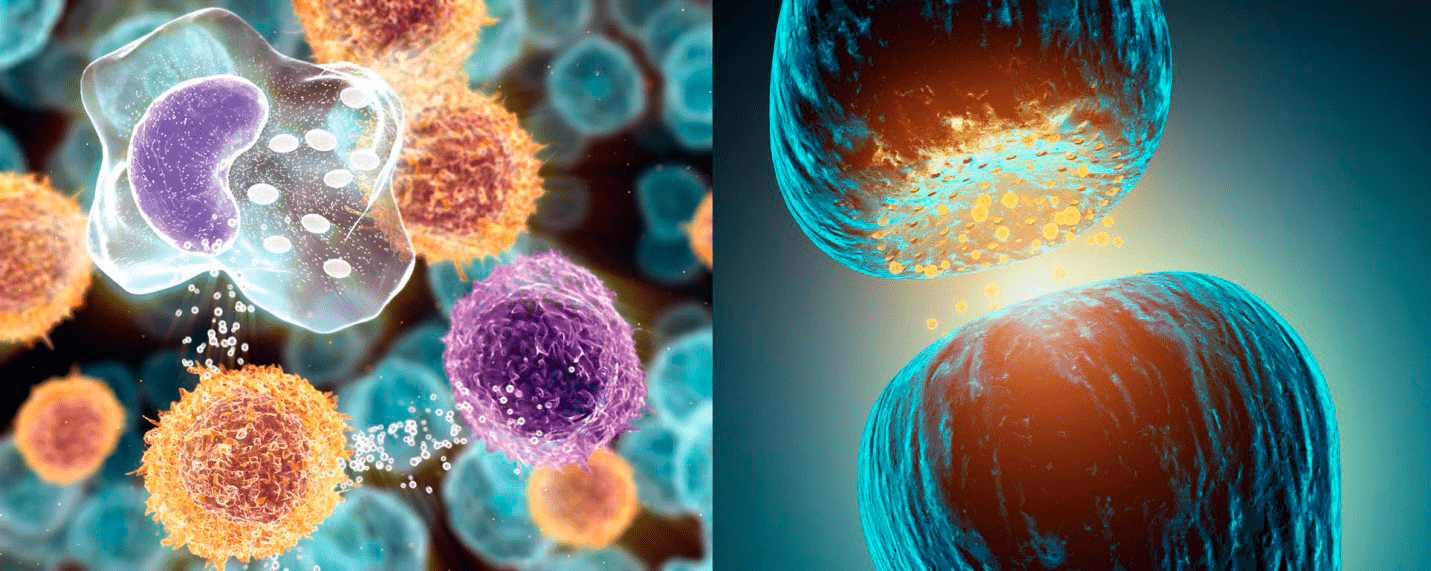
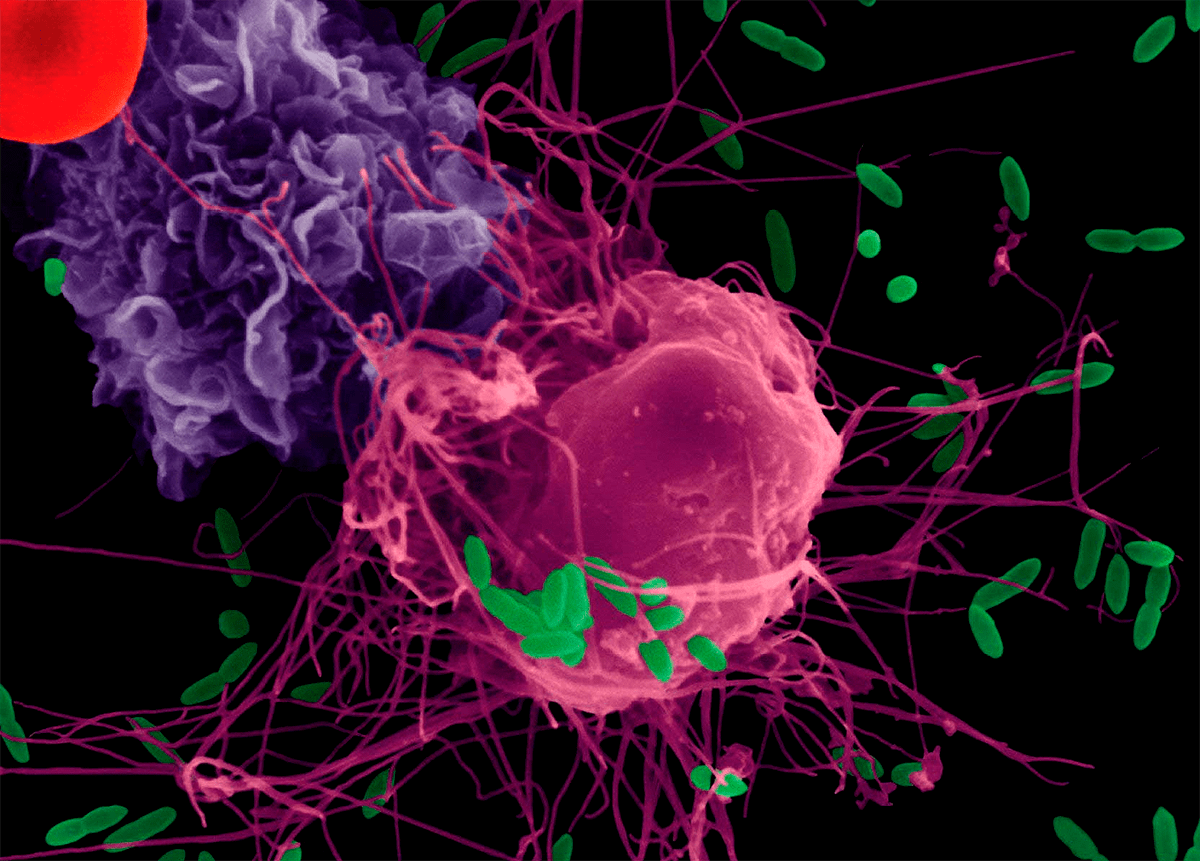
Позднее было обнаружено, что существует прямой «диалог» между нервной и иммунной системами, и осуществляется он при помощи химических сигналов (рис. 3). Клетки иммунной системы — лимфоциты — имеют рецепторы для ряда нейромедиаторов, таких как ацетилхолин, дофамин, энкефалины и эндорфины [2]. В центральной нервной системе (ЦНС) нет иммунных клеток, характерных для периферии, но есть своя внутренняя «служба иммунной безопасности», представленная глиальными клетками, которые способны производить различные цитокины. Впрочем, активированные Т-лимфоциты все же могут преодолевать гематоэнцефалический барьер. Таким образом в ЦНС обеспечивается иммунологический надзор.
Рисунок 3. Цитокины и нейромедиаторы. Слева: Цитокины — группа гормоноподобных белков и пептидов — синтезируются и секретируются клетками иммунной системы и другими типами клеток. Цитокины принимают участие в регуляции роста, дифференцировки и продолжительности жизни клеток, а также в управлении апоптозом. Справа: Нейромедиаторы — физиологически активные вещества, вырабатываемые нервными клетками. С помощью нейромедиаторов нервные импульсы передаются от одного нервного волокна другому волокну или другим клеткам через пространство, разделяющее мембраны контактирующих клеток; это пространство, называемое синаптической щелью, является составной частью синапса.
Список медиаторов, участвующих в диалоге нервной и иммунной систем (назовем его «лексикон»), продолжает расширяться. Так, первоначально в этот «лексикон» вошли некоторые классические медиаторы [5], а позднее была открыта иммуномодулирующая функция гормонов и опиоидных пептидов [6]. В итоге «лексикон» стал выглядеть следующим образом:
| Гормональные пептиды | Классические медиаторы | Эндогенные опиоиды |
|---|---|---|
|
|
|
Лавина научных открытий
После прохождения первого рубежа исследований данные о тесной взаимосвязи нервной и иммунной систем стали появляться регулярно. Было установлено, что иммунная система способна отвечать на активность клеток в ряде мозговых структур (рис. 4), таких как гипоталамус, гипофиз, гиппокамп, миндалина, вентральное поле покрышки и др., а также чувствительна к изменениям в нейрохимических системах мозга — дофаминергической, серотонинергической и др. [7].
Рисунок 4. Ключевым звеном центрального аппарата нервной регуляции функций иммунной системы является гипоталамус. Он связан со всеми звеньями центрального аппарата нервной регуляции и дает начало сложному эфферентному пути передачи центральных нейрорегуляторных влияний на иммунокомпетентные клетки, которые обладают соответствующими рецепторами к нейротрансмиттерам, нейропептидам, а также к гормонам эндокринных желёз.
Были открыты иммуномодулирующие свойства нейропептидов, что позволило существенно дополнить представления о механизмах передачи сигналов от нервной системы к иммунной. На иммунокомпетентных клетках обнаружены рецепторы ко многим известным нейропептидам, что доказывает их участие в реализации эфферентного звена нейроиммунного взаимодействия (рис. 1). Выявлены конкретные медиаторы, с помощью которых реализуется взаимосвязь между иммунокомпетентными и нервными клетками. Так, была открыта продукция опиоидных пептидов иммунокомпетентными клетками и доказана возможность действия медиаторов иммунитета на нервные клетки.
В то же время долго оставался неясным вопрос о механизмах обратной связи от иммунной системы к нервной.
Недостающее звено коммуникации
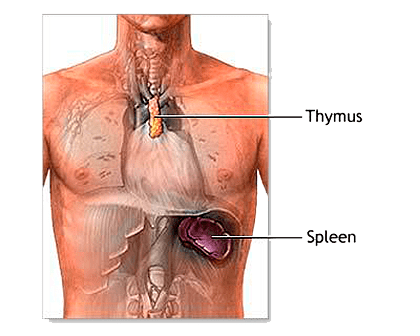
Рисунок 5. Тимус (вилочковая, или зобная, железа) — эндокринная железа, играющая важнейшую роль в формировании иммунитета. Она стимулирует развитие Т-клеток («тимусных») как в собственной ткани, так и в лимфоидной ткани других частей тела. Т-клетки атакуют попавшие в организм чужеродные вещества, осуществляют контроль над выработкой антител против болезнетворных агентов, влияют на другие защитные реакции организма. Тимус имеется у всех позвоночных животных, но его форма и местоположение могут различаться. У человека тимус состоит из двух долей, расположенных в верхней части грудной клетки сразу за грудиной.
Наконец, в 80-е годы была обнаружена продукция ряда гормонов и опиоидных пептидов иммунокомпетентными клетками и доказана возможность действия медиаторов иммунитета на нервные клетки [2]. Группа опиоидных пептидов была впервые обнаружена среди миелопептидов; в костном мозге выявлен предшественник эндорфинов — проопиомеланокортин.
Опиоидные пептиды и их предшественник были затем найдены и в вилочковой железе (тимусе) — рисунок 5. Принципиально важными стали также работы по изучению нейротропной активности цитокинов, которые, как оказалось, обладают способностью регулировать функции структур ЦНС, включая гипоталамус (центр гормональной регуляции!) и гиппокамп (ключевая структура процессов памяти), и влиять на состояние основных нейромедиаторных систем (норадреналина, серотонина и дофамина). Оказалось, что стресс и эмоциональное напряжение приводят к гомеостатическим сдвигам в иммунной и нейроэндокринной системах [8].
В преддверии новых открытий
Пептиды, составляющие «лексикон» нейроиммунного взаимодействия, имеют общие для обеих систем рецепторы. Так, иммунокомпетентные клетки могут синтезировать нейропептиды и отвечать на большинство, если не на все, соединения этой группы. Клетки нервной системы производят некоторые лимфокины и монокины и отвечают на них. Это позволяет считать, что указанные системы имеют и используют, по сути, одинаковый набор сигнальных молекул для внутрисистемной и межсистемной связи. Также за последние двадцать лет значительно увеличивается объем данных, говорящих о взаимосвязи между психическим состоянием и состоянием иммунной системы [2].
Все это в свою очередь привело исследователей к предположению о том, что ряд иммунных расстройств может быть обусловлен нарушением работы в структурах нервной системы и наоборот. Все эти предположения еще предстояло проверить на практике. И одной из наиболее строгих проверок должны были стать испытания, полученные в клиниках. Особый интерес представлял анализ психотропного эффекта препаратов, обладающих способностью модулировать иммунный ответ (рис. 6).
Рисунок 6. Цитокины влияют на выделение и обмен норадреналина и серотонина в головном мозге, в особенности в гипоталамусе и гиппокампе, оказывая как стимулирующее, так и тормозящее воздействия на основные медиаторные системы, приводя, в конечном итоге, к модуляции эмоционального состояния и процессов памяти, влияя на мотивацию поведения.
От теории к практике: новые подходы к эффективной терапии и диагностике
Интерес к проблеме повторно возник в связи с клиническими исследованиями. Первоначально в экспериментальных работах было замечено, что изменение поведения у лабораторных животных приводит к изменению параметров иммунной системы [2]. После чего, в последние десятилетия, тема нервно-иммунных взаимодействий перестала быть исключительно теоретической и нашла свое клиническое применение, вначале в соматической и неврологической практике, а затем и в психиатрии. Появились новые возможности диагностики психических расстройств на основе объективных данных и кардинально новые методы оценки эффективности терапии, в том числе и психофармакотерапии. При этом особое внимание уделяется изучению взаимодействий иммунной, нервной и эндокринной систем при стрессовых воздействиях, при тревожных расстройствах и депрессии [2].
Доклинические оценки монотерапии иммуномодуляторами (а именно, деринатом и тактивином) были проведены автором данной статьи и коллективом лаборатории эволюции механизмов обучения и памяти на кафедре физиологии высшей нервной деятельности в МГУ им. М.В. Ломоносова. В нашей работе оценивалось влияние иммуномодуляторов на коррекцию нарушений, вызванных хронической алкоголизацией [9], [10], острым и хроническим стрессом [11–13], а также на восстановление нормальных когнитивных функций (а именно, обучения и памяти), сниженных после воздействия повреждающих факторов [14]. По результатам работы были сделаны выводы о том, что данные иммуномодуляторы сами по себе способны оказывать корректирующее и протекторное действие на когнитивные функции. В нашей работе оценивалось изменение уровня обучения и памяти в разных условиях — как в норме, так и при искусственно созданной патологии, вызванной действием таких факторов как стресс и хроническая алкоголизация. Нами показано, что препарат пептидов тимуса проявляет ноотропный эффект (его сравнивали с классическим ноотропом — пирацетамом), что сказывается на темпах обучения. Также ему свойственен анксиолитический и общий протекторный эффект, что позволило животным эффективно обучаться и быстро адаптироваться в условиях давления стресса и токсичного действия алкоголя. Отдельно оценивалась способность иммуномодуляторов повышать устойчивость организма к стрессу как таковому — физическому (удары током), эмоциональному (резкое изменение условий опыта), острому (кратковременная иммобилизация), хроническому (долговременная иммобилизация). Нами получены данные о том, что иммуномодулятор тактивин оказывает эффективное стресс-протекторное действие, которое снижает пагубные последствия жесткого стресса. (У людей, как известно, стресс может явиться причиной большого ряда заболеваний, в числе которых инсульты, инфаркты, снижение иммунитета, депрессия и прочие.) При этом заметно улучшались показатели физического состояния животных, подвергшихся стрессу [13].
Данные, полученные в клинических и доклинических исследованиях, обосновывают возможность разрабатывать новые терапевтические подходы при диагностике и лечении психических заболеваний. Для психофармакологии поиск новых безопасных средств или способов снизить побочный эффект терапии особенно важен, т.к. на сегодняшний день большинство психотропных препаратов обладают выраженными побочными эффектами (например, метадоновая терапия героиновых наркоманов), либо недостаточно эффективны (хронические формы депрессии и шизофрения).
О депрессии и разновидностях антидепрессантов мы уже рассказывали в статье «Краткая история антидепрессантов» [15].
Расширенная диагностика
К настоящему времени исследованию иммунологических нарушений при тревожных и тревожно-депрессивных расстройствах посвящено достаточно большое число работ [16–18]. Для тревожных расстройств в настоящее время установлено, что при их развитии происходит активация Т-лимфоцитов, которые являются одними из основных источников и регуляторов секреции и продукции цитокинов [17].
Для ряда психических расстройств отмечалась связь между наличием и характером психопатологической симптоматики и уровнями интерферонов α и γ (то есть в патологический процесс также вовлекается иммунная система). Эти данные получены для таких заболеваний, как шизофрения, аутизм, синдром нарушенного внимания, депрессивные расстройства, навязчивые расстройства, рассеянный склероз, системная красная волчанка, ревматоидный артрит, что в свою очередь оправдывает применение иммуномодуляторов в клинике психических расстройств (рис. 7).
Рисунок 7. Иммуномодуляторы — это лекарственные препараты, восстанавливающие при применении в терапевтических дозах функции иммунной системы (эффективную иммунную защиту). В группу иммуномодуляторов выделяют препараты животного, микробного, дрожжевого и синтетического происхождения, обладающие специфической способностью стимулировать иммунные процессы и активировать иммунокомпетентные клетки (Т- и В-лимфоциты) и дополнительные факторы иммунитета (макрофаги).
Особенно интересными эти данные выглядят в свете того, что разные классы нейролептиков и антидепрессантов [15], применяющихся в клинике, обладают иммуномодулирующей активностью и способностью влиять на цитокиновую систему [18].
Новые методы лечения
С середины 1970-х годов в терапии психических расстройств применяются иммуномодуляторы и другие иммунотропные препараты. Одной из причин применения иммунотропных препаратов при психических расстройствах считается терапевтическая резистентность больных, в развитии которой важную роль играют иммунные нарушения.
Иммуннотропные препараты нормализуют иммунологические показатели в случае их отклонения от нормы в ту или иную сторону, не вызывая критических нарушений. В настоящее время существует успешная история применения иммунотропных препаратов и интерферонов в комплексной терапии. Примеры приведены в приложении в конце статьи.
Единичные исследования эффективности иммуномодуляторов в составе монотерапии (т.е. без использования традиционных для данных случаев психотропных средств) проводились при лечении шизофрении, терапии навязчивых состояний, нервной анорексии и других заболеваний ЦНС, однако в настоящее время данных для оценки эффективности такой терапии недостаточно. Таким образом, перспективы применения иммуномодулирующих пептидов в качестве монотерапии на новом поле, а именно в клинике психических расстройств и состояний зависимости (наркоманий), а также появление новых терапевтических комбинаций и диагностических методов — это перспективная задача будущих исследований. Ее успешное решение должно привести к появлению нового типа лекарств и новых методов терапии, воздействующих не на одно (в отдельности), а сразу на несколько ключевых звеньев гомеостаза. Предположительно, это позволит найти новые и более безопасные методы лечения ряда заболеваний, которые на настоящий день не имеют эффективного лечения, например, шизофрении, героиновой наркомании и алкоголизма.
- Адо А.Д. Патологическая физиология. М.: Триада-Х, 2000. — 607 с.;
- Александровский Ю.А. и Чехонин В. П. Клиническая иммунология пограничных психических расстройств. М.: ГЭОТАР-МЕДИА, 2005. — 256 с.;
- Иммунологическая Нобелевская премия (2011);
- Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года;
- Нормальная физиология человека: учебник для высших учебных заведений (2-е изд., испр. и доп.) / Под ред. академика РАМН Ткаченко Б.И. М.: Медицина, 2005. — 928 с.;
- Магаева С.В. и Морозов С.Г. Нейроиммунофизиология. М.: Изд-во ГУ НИИ биомедицинской химии им. В.Н. Ореховича РАМН, 2005. — 160 с.;
- Девойно Л.В. и Ильюченок Р.Ю. Нейромедиаторные системы в психонейроиммуномодуляции: допамин, серотонин, ГАМК, нейропептиды. Новосибирск: Изд-во ЦЭРИС, 1993. — 240 с.;
- Меерсон Ф.З. и Пшенникова М.Г. Адаптация к стрессовым ситуациям и физическим нагрузкам. М.: Медицина, 1988. — 256 с.;
- Матвеева О.Д., Новоселецкая А.В., Зимина И.В., Калинина А.Г., Бесчастная Н.В., Белова О.В. и др. (2013). Влияние препарата тимуса тактивина на двигательную активность крыс, подвергшихся алкоголизации. Нейронаука для медицины и психологии: 9-й Международный междисциплинарный конгресс. 392 с.;
- Матвеева О.Д. и Новоселецкая А.В. (2013). Влияние препарата тимуса тактивина на обучение животных в модифицированном тесте «условная реакция пассивного избегания». Фундаментальная наука и клиническая медицина — Человек и его здоровье: Тезисы XVI Всероссийской медико-биологической конференции молодых исследователей (с международным участием). 512 с.;
- Новоселецкая А.В., Матвеева О.Д., Киселева Н.М., Иноземцев А.Н. (2012). Влияние препарата пептидов тимуса Тактивина на развитие стресс-вызванной анальгезии, вызванной иммобилизацией. Здоровье и медицина в XXI веке. Серия медицина. 1, 227–228;
- Матвеева О.Д. и Новоселецкая А.В. (2012). Влияние иммунотропного препарата «тактивина» на болевую чувствительность животных. XV Всероссийская медико-биологическая конференция молодых исследователей «Фундаментальная наука и клиническая медицина». С. 188;
- Иноземцев А.Н., Новоселецкая А.В., Матвеева О.Д., Аристова В.В., Калюжный А. Л., Шульговский В.В. и др. (2013). Опиоидная система участвует в реализации анальгетических эффектов тактивина. Доклады академии наук. 450, 613–616;
- Киселева Н.М., Новоселецкая А.В., Зимина И.В., Иноземцев А.Н., Арион В.Я. (2008). Значение иммунокорригирующего препарата тактивина при функциональном нарушении реакции избегания у крыс. Аллергология и иммунология. 9, 269;
- Краткая история антидепрессантов;
- Крыжановский Г.Н., Магаева С.В., Макаров С.В., Сепиашвили Р.И. Нейроиммунные процессы при патологии ЦНС. // Нейроиммунопатология. Руководство. М: Изд-во НИИ общей патологии и па-тофизиологии, 2003. С. 67–132;
- Пальцев М.А. и Кветной И.М. Руководство по нейроиммуноэндокринологии. М.: Медицина, 2008. — 512 с;
- Казанцева К.В. (2008). Цитокиновые нарушения при шизофрении и аффективных расстройствах (аналитический обзор). Фарматека. Спецвыпуск: Психиатрия. 3, 8–14;
- Энциклопедия лекарственных средств, «РЛС-2007». М., 2006. — 1488 с.;
- Александровский Ю.А., Ахапкин Р.В., Гурина О.И., Куликова Т.Ю. (2008). Перспективы применения иммуномодуляторов при лечении пограничных психических расстройств. Фарматека. Спецвыпуск: Психиатрия. 0, 22–25;
- Гамалея Н.Б., Наумова Т.А., Хотовицкий А.В., Кузьмина Т.И., Гамалея А.А. (2002). Исследование влияния тактивина на процессы внутриклеточной передачи сигнала в ответ на стимуляцию опиоидных, дофаминовых и серотониновых рецепторов на лимфоцитах периферической крови у здоровых и больных героиновой наркоманией. Вопросы наркологии. 3, 66–75;
- Палько О.Л. Комплексная терапия больных с невротическими расстройствами с использованием иммунокорректоров миелопептидной природы: дис…. канд. мед. наук. — М., 2004. — 127 с.;
- Куликова Т.Ю. Применение иммуномодуляторов и нейрометаботропных стимуляторов (ноотропов) при лечении больных с астеническими расстройствами: дис…. канд. мед. наук. — М., 2006. — 162 с.;
- Новиков Д.Д. Применение иммуномодуляторов в комплексной терапии больных с тревожными расстройствами: дис…. канд. мед. наук. — М., 2005. — 174 с.;
- Штарк М.Б., Береговой Н.А., Старостина М.В. и др. Материалы XIII съезда психиатров России. М., 2000. С. 374;
- Шмидт Т.Е. и Жученко Т.Д. (2003). Механизмы действия иммуномодулирующих препаратов при рассеянном склерозе. Нейроимунология. 1, 161–162;
- Невидимова Т.И. и Суслов Н.И. (1995). Психотропный эффект тимогена. Бюлл. эксп. биол. и мед. 2, 199–201.
Пальцев, Михаил Александрович — Руководство по нейроиммуноэндокринологии [Текст] : учебник для студентов медицинских вузов
Карточка
Пальцев, Михаил Александрович (1949-).
Руководство по нейроиммуноэндокринологии [Текст] : учебник для студентов медицинских вузов / М. А. Пальцев, И. М. Кветной. — Изд. 3-е, доп. и расш. — Москва : Шико, 2014. — 748 с. : ил., цв. ил., портр., табл.; 25 см.; ISBN 978-5-900758-64-0
Фактическая дата выхода в свет — 2013
Здравоохранение. Медицинские науки — Патологическая физиология — Реактивность организма — Аллергология и иммунология — Иммунология — Пособие для специалистов
Здравоохранение. Медицинские науки — Патологическая физиология — Нарушения функций эндокринной системы — Пособие для специалистов
Биологические науки — Физиология, биофизика и биохимия животных и человека — Эндокринология — Нервная регуляция и взаимосвязь желез внутренней секреции с нервной и иммунной системами — Пособие для специалистов
нейроиммуноэндокринология
Шифр хранения:
FB 2 13-94/131
FB 2 13-94/132
Описание
| Автор | |
|---|---|
| Заглавие | Руководство по нейроиммуноэндокринологии [Текст] : учебник для студентов медицинских вузов |
| Дата поступления в ЭК | 23.10.2008 |
| Каталоги | Книги (изданные с 1831 г. по настоящее время) |
| Сведения об ответственности | М. А. Пальцев, И. М. Кветной |
| Издание | Изд. 3-е, доп. и расш. |
| Выходные данные | Москва : Шико, 2014 |
| Физическое описание | 748 с. : ил., цв. ил., портр., табл.; 25 см |
| ISBN | ISBN 978-5-900758-64-0 |
| Примечание | Фактическая дата выхода в свет — 2013 |
| Тема | Здравоохранение. Медицинские науки — Патологическая физиология — Реактивность организма — Аллергология и иммунология — Иммунология — Пособие для специалистов |
| Здравоохранение. Медицинские науки — Патологическая физиология — Нарушения функций эндокринной системы — Пособие для специалистов | |
| Биологические науки — Физиология, биофизика и биохимия животных и человека — Эндокринология — Нервная регуляция и взаимосвязь желез внутренней секреции с нервной и иммунной системами — Пособие для специалистов | |
| нейроиммуноэндокринология | |
| BBK-код | Р252.325,07 |
| Р252.77,07 | |
| Е978,07 | |
| Язык | Русский |
| Места хранения | FB 2 13-94/131 |
| FB 2 13-94/132 |
На рубеже 2 столетий сформировалась новая область знаний — нейроиммуноэндокринология. Чтобы получить о ней представление, полезно вспомнить, как она формировалась, в частности как развивались представления о взаимодействиях основных регулирующих систем — нервной, эндокринной и иммунной. История развития этих представлений примечательна и в известной мере драматична. Ее отсчет начинается с того времени, когда появились факты, свидетельствовавшие о способности отдельных нейронов мозга секретировать гормоны, что сближало их с клетками эндокринных желез. Эти факты не укладывались в традиционные представления и поначалу сильно озадачивали.
Сложившаяся в нейробиологии логика исследовательского мышления не могла мириться с тем, что нервные клетки, характерным свойством которых является способность их электрогенных мембран генерировать и распространять нервные импульсы, могут одновременно вести себя как эндокринные железистые клетки, т. е. синтезировать нейрогормоны и транспортировать их по нервным отросткам. Такое двуединство нейрона, его способность функционировать одновременно как нервная и эндокринная клетка, были впервые описаны в гипоталамических нейронах у рыб [78], которые соответствовали крупным нейронам супраоптического и паравентрикулярного ядер млекопитающих, синтезирующим вазопрессин и окситоцин [14]. Этот факт был подтвержден в широком эволюционном ряду, включающем моллюсков и насекомых [9, 79, 80].
Более поздние наблюдения показали способность к нейросекреции также в тех нейронах гипоталамуса, аксоны которых оканчиваются на капиллярных корнях портальных сосудов гипофиза, приносящих кровь в его переднюю долю [1]. Предполагалось, что гипоталамические нейроны, контролирующие секрецию тропных гормонов гипофиза, выделяют в его портальное русло некие нейрогуморы, которые опосредуют их регулирующие влияния [42]. Нейрогуморами оказались пептидные гормоны, выделенные из этих гипоталамических нейронов, которые в зависимости от* их способности стимулировать или тормозить продукцию гормонов гипофиза получили название рилизинг-факторов, или ингибирующий факторов [67, 77]. В дальнейшем было показано, что нейросекреторные клетки гипоталамуса вовлечены в механизмы обратных связей с циркулирующими гормонами эндокринных желез и одновременно способны отвечать на нервные сигналы, опосредуемые через их синоптические связи [88]. Таким образом, двуединство гипоталамических нейронов перестало быть загадочным явлением. Более того, оно стало краеугольным камнем, который лег в основу рождения новой области знаний — нейроэндокринологии, получившей статус самостоятельной дисциплины, имеющей свой международный журнал и свое международное научное общество [2].
Между тем удивительные факты продолжали накапливаться. Было показано, что способность нейронов секретировать пептидные гормоны присуща не только гипоталамической области мозга, но практически всей центральной и периферической нервной системе [48, 87]. Оказалось, что контуры обратных связей с циркулирующими гормонами могут замыкаться не только на гипоталамических нейронах, но и на нейронах периферических вегетативных ганглиев, в связи с чем понятие нейроэндокринного центра стало распространяться также и на них [8].
В недавнее время фокус удивительных открытий сместился в область иммунологии. Иммунную систему в свете накопленных фактов стали рассматривать как некий сенсорный орган [19], способный экспрессировать рецепторы ко всем сигнальным молекулам, опосредующим воздействия нейроэндокринной системы: нейротрансмиттерам, пептидным гормонам, стероидным гормонам, факторам роста, цитокинам [44, 45, 59, 69, 94].
Существенная роль среди сигнальных молекул иммунной системы (на этом подробнее мы остановимся ниже) принадлежит семейству эволюционно консервативных пептидов. В их ряду заслуживают упоминания такие пептиды, как гормон роста (ГР) и пролактин (ПРЛ), рецепторы которых относятся к большому семейству гемопоэтиновых: рецепторов к интерлейкинам, эритропоэтину, к гранулоцитарно-макрофагальному колониеобразуещему фактору [53]. Активность ГР снижается с возрастом параллельно со снижением реакций иммунной защиты. Сходным образом при физиологических состояниях, сопровождающихся угнетением иммунной системы, например при беременности, снижается секреция ПРЛ. При этом имеет место повышенная секреция половых стероидов эстрогенов, прогестерона. После родов, когда снижается секреция стероидных гормонов и вновь активируется иммунная система, повышается секреция ПРЛ и окситоцина, который, как уже упоминалось, тоже принадлежит к эволюционно древним пептидам [36, 43]. Связь иммун-
Хромосома 6
Главный комплекс
тканесовместимости
КлассИ к______
О )У) >) >) )<)
Серологически иоенгисрици- I рованные Г молекулы HLA
Z2/77 DRw52
| T)Rw53
DR1Q
Гены главного комплекса гистосовместимости человека, локализованные на коротком плече хромосомы 6.
Экспрессируемые нами HLA-антигены подразделяются на класс I (А, В, С) и класс II (D). Гены, экспрессирующие HLA-антигены класса II, распределяются в 3 локусах: DP, DQ, DR. Кодируемые ими молекулы HLA-антигенов состоят из 2 поли- пептидных цепей А и В | I0J.
ной активности с гормональными производными других представителей эволюционно консервативных пептидов прослеживается также на примере опиоидных гормонов и адренокортикотропного гормона (АКТГ), которые являются фрагментами единого предшественника — проопиомеланокор- тина. В сущности тесные взаимодействия АКТГ с иммунной системой впервые дали начало исследованиям взаимодействий между основными регулирующими системами — нейроэндокринной и иммунной. Приоритет в этом принадлежит Гансу Селье. Итогом редких по прозорливости наблюдений этого ученого явилась концепция об общем адаптационном синдроме, в основе которой лежит идея о нейроэндокринном пути реализации защитной биологической реакции, названной им реакцией-стресс, развивающейся в ответ на действие широкого спектра агрессивных агентов внешней среды, нарушающих гомеостаз, таких как микробные, холодовые, болевые агенты, факторы неподвижности, эмоциональные воздействия и многие другие [83]. При всех этих воздействиях повышается секреция АКТГ и глюкокортикоидных гормонов и угнетается активность иммунной системы, что при сильном стрессе сопровождается инволюцией тимуса. Селье не мог ответить на вопрос, почему угнетается иммунная система. Механизмы последнего стали проясняться лишь в последнее время [3, 4, 6, 30, 55]. Прежде чем перейти к ним, уместно дать общее представление о принципах, лежащих в основе организации иммунной системы и иммунных ответов.
При их рассмотрении обращает на себя внимание сходство в организации нервной и иммунной систем. Последнее проявляется в том, что обе системы состоят из большого числа фенотипически различающихся клеток, организованных в сложные сети [26, 49, 50, 70]. В пределах такой сети отдельные клетки взаимосвязаны и функционируют по принципу обратной связи, когда пусковым сигналом служит адекватный раздражитель, а конечный ответ направлен на обеспечение полезного результата. Различие же заключается в том, что в нервной системе клетки жестко фиксированы в пространстве, тогда как в иммунной они непрерывно перемещаются и лишь кратковременно взаимодействуют друг с другом. Чтобы лучше понять сказанное, напомним, как осуществляется иммунный ответ, в процессе которого представляется возможность проследить тесные взаимодействия регулирующих систем.
Клетки иммунной системы, представленные лимфоцитами и макрофагами, происходят из общего источника — стволовых клеток костного мозга. По мере развития они дифференцируются на 2 группы клеток: предшественники В- и Т-лимфоцитов и клетки (предшественники моноцитов), из которых развиваются макрофаги. Название В-лимфоцитов происходит от английского слова bone marrow (костный мозг), а учитывается также и то, что у птиц они развиваются из кишечного кармана, или бурсы Фабрициуса. Функция В-лимфоцитов заключается в выработке антител, что определяет их участие в гуморальном иммунитете. Что касается Т-лимфоцитов, то их название и функции, в основе которых лежит организация клеточного иммунитета, тесно связаны с тимусом [31]. На ранней стадии развития часть незрелых лимфоцитов попадает в тимус, где пре- Т-лимфоциты проходят, образно выражаясь, курс обучения, в результате чего они дифференцируются на целый ряд функционально различающихся типов клеток: клетки, помогающие В-лимфо- цитам в реализации гуморального иммунитета, а Т-лимфоцитам — в реализации клеточного иммунитета (так называемые Т-хелперы); клетки-тор- мозящие по механизму обратной связи избыточную активность Т-хелперов (так называемые Т- супрессоры); наконец, клетки, способные уничтожать зараженные (вирусом, бактерией) или трансформированные в опухолевые собственные клеточные элементы — цитотоксические Т-лимфоциты и естественные клетки-киллеры [54, 95].
Тимус до недавнего времени был довольно загадочным органом, и лишь последние десятилетия приподняли завесу над его тайнами. Были выявлены 2 его важные функции: способность обучать пре-Т-лимфоциты не узнавать антигены собственного организма и тем самым предотвращать аутоиммунную агрессию (приобретенная толерантность) и способность развивающихся лимфоцитов узнавать особые антигены, строго специфические для каждого индивидуума, которые маркируют его наподобие номерных знаков автомашины (естественная толерантность). Эти антигены (гликопротеиновой природы) экспрессируются генами главного комплекса гистосовместимости и локализуются на поверхности клеток (см. рисунок). Их называют трансплантационными, так как впервые они были обнаружены у человека после переливания крови и выделены в виде антигенных детерминант, связанных с лейкоцитами. Они известны как антигены HLA (human leucocyte-associated) [16, 22, 25, 32, 47, 82].
Хотя существование обоих типов иммунитета (приобретенного и естественного) общепризнано, опосредующие их механизмы не до конца ясны. Предполагается, что в их основе лежат различные способы отбора, или селекции, развивающихся в тимусе лимфоцитов. В случае приобретенного иммунитета, формирующегося в раннем периоде индивидуального развития, имеет место негативная селекция, под которой подразумевают отбраковку (ее механизмы могут быть разными: апоптоз, или запрограммированная смерть клетки, либо формирование функциональной ареактивности) тех клонов пре-Т-лимфоцитов, у которых в результате случайной рекомбинации генов экспрессируются рецепторы к антигенам собственного организма, т. е. создаются предпосылки к развитию аутоиммунной агрессии. Позитивная селекция, лежащая в основе естественного иммунитета, допускает экспрессию Т-клеточных рецепторов к собственным антигенам, но не ко всем, а лишь к маркерным HLA-антигенам. Тем самым создаются предпосылки для иммунного ответа, однако иммунный ответ, рестриктированный этими антигенами, носит не агрессивный, а скорее сигнальный характер, информирующий иммунную систему о присутствии в организме чужеродного антигена. Последнее происходит в результате того, что чужеродный антиген способен связываться с HLA-антигенами, которые располагаются либо на поверхности каждой клетки (HLA-антигены I класса), либо на поверхности только клеток иммунной системы (HLA-антигены II класса): макрофагов, В-лимфоцитов, эпителиальных клеток тимуса и др. Таким образом, развивающиеся Т-лимфоциты обучаются узнавать ’’чужое” через узнавание «своего”, т. е. через узнавание маркерных HLA-антигенов I или II класса. Взаимодействуя с HLA-антигенами I класса, они индуцируют цитолитический эффект (активируются цитотоксические Т-лимфоциты), тогда как их взаимодействие с HLA-антигенами II класса индуцирует стимуляцию макрофагов и выделение ими интерлейкинов.
Процесс обучения пре-Т-лимфоцитов, происходящий в тимусе и лежащий в основе механизмов обоих типов иммунитета, начинается с того, что в раннем периоде индивидуального развития антигены собственного организма представляются находящимся в тимусе пре-Т-лимфоцитам. Наиболее важную роль в процессе презентации этих антигенов выполняют эпителиальные клетки тимуса [23, 62, 73, 92], о значении чего будет сказано ниже.
Итак, рассмотрев кратко основные принципы формирования иммунных ответов, вернемся к механизмам, которые лежат в основе взаимодействия нейроэндокринной и иммунной систем, что, как уже упоминалось, удобно сделать на модели реакции-стресс.
Показано, что важную роль посредников во взаимодействиях нейроэндокринной и иммунной систем выполняют клетки иммунной системы макрофаги, способные при их стимуляции секретировать ключевые иммунорегуляторные факторы, такие как интерлейкины (ИЛ-1, ИЛ-6), фактор некроза опухолей, тромбоцитактивирующий фактор и другие [4, 18, 30]. Стимуляцию макрофагов могут вызывать все упомянутые выше агенты, которые провоцируют реакцию-стресс, сопровождающуюся выделением АКТГ и глюкокортикоидов. В физиологических дозах последние способны стимулировать секрецию макрофагами ИЛ-1, который легко преодолевает гематоэнцефалический барьер в тех его участках, где существуют «окна” для такого рода соединений. Пониженная барьерная активность этих участков обусловлена особенностями организации и функционирования своеобразной эпендимной глии, выстилающей желудочки мозга [58]. Попав в мозг, ИЛ-1 стимулирует секрецию кортикотропин-рилизинг-фактора (КРФ), синтезируемого нейронами паравентрикулярного ядра гипоталамуса, причем этот эффект является простагландин-Е2-зави- симым [17, 65]. КРФ стимулирует повышенную секрецию АКТГ в гипофизе и соответственно глюкокортикоидов в коре надпочечников. Повышенная секреция этих гормонов тормозит секрецию ИЛ-1 в макрофагах и тем самым угнетает иммунный ответ при его избыточности [51, 56, 68]. Таким образом, здесь в чистом виде работают механизмы отрицательной обратной связи, замыкающиеся между иммунными пептидами (ИЛ-1), нейропептидами (КРФ) и гормонами: АКТГ и глюкокортикоиды [15, 18].
Нередко у лиц среднего и пожилого возраста после перенесенного эмоционального стресса (смерть близкого человека, конфликтные ситуации в быту или на службе и т. д.) наблюдаются нарушения углеводного гомеостаза. Одно из ранних проявлений таких нарушений — повышение уровня сахара в крови, что настораживает как тревожный сигнал возможного заболевания сахарным диабетом. Последнее действительно имеет место, что подтверждается дальнейшими обследованиями и проявляется в виде стойкого или преходящего заболевания. В этом случае легко допустить возможность того, что в механизме развития диабета, т. е. в его патогенезе, важная роль принадлежит описанному выше механизму обратной связи, в котором роль триггера выполняет эмоциональный стресс. Эмоциональный стресс приводит к повышенному выделению КРФ, который, по образному выражению Г. Селье, является «рилизинг-фактором стресса» [84]. Известно, что стрессовые реакции сопровождаются появлением бактериальных белков теплового шока, которые воспринимаются макрофагами как чужеродные антигены и вызывают в них повышенную секрецию иммунопептида ИЛ-1 [10]. Последний в свою очередь усиливает секрецию гипоталамического нейропептида КРФ, что приводит к повышению секреции ключевых гормонов реакции- стресс (АКТГ и глюкокортикоидов) и длительно поддерживает эту реакцию как некую патогенную доминанту, функционирующую в качестве генератора патологически усиленного возбуждения [7]. Образовавшийся замкнутый, или порочный, круг становится причиной нарушений со стороны иммунной системы, в частности нарушения такой важной ее функции, как дифференцирование своего и чужого антигенов. В результате развиваются агрессивные атаки, направленные против собственных клеток. Одной из наиболее частых мишеней таких аутоиммунных реакций являются В-клетки поджелудочной железы, секретирующие инсулин [10]. Таким образом, ломаются физиологические взаимодействия всех 3 регулирующих систем — нервной, иммунной и эндокринной.
Может быть и так, что первичные нарушения функции иммунной системы, приводящие к аутоиммунным ответам, вовлекают нервную систему в качестве мишени. Последнее демонстративно проявляется в форме тяжелого заболевания, известного как рассеянный склероз. В этом случае чужеродным антигеном становится основной белок миелина, покрывающего в виде пограничной оболочки нервные волокна [29, 71]. Миелин выполняет функцию изолятора, предотвращающего утечку ионных токов. При повреждении этого изолятора нервные импульсы затухают и не могут достичь своих мишеней. В результате нарушается иннервация мышц, и больные погибают от паралича дыхательной мускулатуры. Такой же печальный исход наблюдается при другом аутоиммунном заболевании, известном как тяжелая миастения (myastenia gravis). В данном случае чужеродным антигеном становятся белковые рецепторы к нейромедиатору ацетилхолину, выделяемому в области нервно-мышечных синапсов [60].
При обсуждении общности организации и функционирования 2 регулирующих систем (нервной и эндокринной) упоминалось о том, что нейроны, сохраняя специфические особенности регуляции, т. е. способность генерировать и распространять нервные импульсы, могут одновременно функционировать как эндокринные клетки, секретирующие пептидные нейрогормоны. Аналогичное можно сказать и о клеточных элементах иммунной системы, особенно о макрофагах. Участвуя в регуляции гомеостаза с помощью специфических иммунных механизмов, они одновременно проявляют способность секретировать пептиды, например ИЛ, которые можно рассматривать как пептидные иммуногормоны или иммуномедиаторы. Более того, они могут синтезировать пептиды, близкие по иммунореактивности и аминокислотному составу к нейроэндокринным пептидам, в частности к p-эндорфину и АКТГ [5, 61]. Их клеточные мембраны, подобно таковым в нейроэндокринных клетках, содержат рецепторы к гормонам, нейромедиаторам и нейропептидам [15, 19—21, 44, 45, 93], что обеспечивает тесные взаимодействия иммунной и нейроэндокринной систем.
Сходство в организации регулирующих систем усугубляется тем, что в нервных и глиальных клетках мозга в свою очередь обнаруживаются рецепторы к медиаторам иммунной системы, в частности к ИЛ-1 [11, 13, 35]. В них определяется иммунореактивность, свойственная ИЛ-1 [24, 57], последняя возрастает после воздействия эндотоксинов [90]. Показана также способность гипоталамических нейронов, в частности нейронов паравентрикулярного ядра, синтезировать иммуномедиаторы и даже выделен ген, ответственный за продукцию ИЛ-1, причем его экспрессия стимулируется липополисахаридами, т. е. бактериальными антигенами [12]. Подобно тому как гормоны, нейромедиаторы и нейропептиды влияют на секрецию ИЛ-1 в макрофагах, этот иммуномедиатор в свою очередь влияет на обмен и выделение гипоталамических нейромедиаторов и рилизинг-гормонов, в частности КРФ [66, 74, 85, 91]. Более того, показано влияние ИЛ-1 на экспрессию гена, ответственного за продукцию КРФ [52, 86]. С другой стороны, повышенная секреция КРФ под влиянием иммобилизационного стресса индуцирует экспрессию гена, ответственного за продукцию ИЛ-1 в гипоталамусе [64]. Наконец, в астроцитах мозга синтезируется интерферон, выделение которого повышает экспрессию ИЛ-2 в нервных структурах мозга [89]. Все это заставляет думать, что для формирования оптимальной величины иммунного ответа необходим баланс гормонов, нейропептидов, нейротрансмиттеров и иммуномедиаторов, и позволяет предполагать возможность осуществления иммунных ответов не только системного характера, но и местных, включая головной мозг [4].
Исследования последнего времени показали, что в механизмах взаимодействий нейроэндокринной и иммунной систем важным звеном является тимус, рассматриваемый в качестве некоего полигона, на котором разворачиваются критически важные события при формировании приобретенного и естественного иммунитета. Примечательно, что при развитии представлений о взаимодействиях нервной и эндокринной систем роль такого полигона отводилась гипоталамической области мозга, где впервые были обнаружены в нервных клетках признаки секреции гормонов. Аналогичным образом в эпителиальных клетках тимуса были недавно выявлены почти все известные пептидные гормоны [72, 76]. Это примечательно и потому, что в свете современных концепций важная роль в функциях тимуса отводится тем эволюционно древним пептидам, которые были первоначально выявлены в нейросекреторных клетках гипоталамуса, в частности окситоцину, вазопрессину и их белковым носителям нейрофизинам [41]. В связи с этим полезно напомнить об особенностях гистофизиологии клеток тимуса.
Клеточный состав тимуса, или, как принято говорить, его клеточное микроокружение, представлено тесно перемешанными собственными клетками тимуса эпителиального типа, локализованными субкапсулярно и медуллярно, и пришлыми клетками иммунной системы — развивающимися лимфоцитами и макрофагами. В свою очередь среди собственных клеток тимуса выделяют популяцию, клетки которой называют клетками-кормилицами. Оба типа клеток в равной мере метятся моноклональными антителами, распознающими сложные ганглиозиды тканей мозга и элементов диффузной эндокринной системы [46]. В них в свое время была выявлена секреция иммуномодуляторных пептидов тимозина и тимулина [46, 75], а позднее продемонстрирована способность к секреции эволюционно консервативных пептидов, относящихся к семействам гипоталамо-нейрогипофизарных [38, 39], инсулиновых пептидов [40] и тахикининов [33].
Особая роль во взаимодействиях между синтезируемыми в тимусе пептидами и развивающимися лимфоцитами принадлежит клеткам-кормилицам. Аналогичными по функции являются клетки Сертоли в семенниках. И в том, и в другом органе эти клетки обволакивают незрелые клеточные элементы (в тимусе — пре-Т-лимфоциты, в семенниках — сперматиды), которые, достигнув своей зрелости, мигрируют из этих органов. Недавно была высказана весьма привлекательная и ставшая достаточно признанной гипотеза [37], согласно которой, между клетками-кормилицами и их «воспитанниками» устанавливается межклеточный диалог, заключающийся в передаче созревающим клеткам сигнальных молекул. Функцию последних выполняют пептиды, секретируемые клетками-кормилицами. Такая секреция была названа кринотропной. Предполагается, что выделяемые путем кринотропной секреции пептидные гормоны индуцируют экспрессию соответствующих рецепторов в развивающихся клетках.
Идея кринотропной секреции эпителиальных клеток тимуса оказала существенное влияние на развитие современных представлений о механизмах, с помощью которых нейрогормоны могут участвовать в обучении пре-Т-лимфоцитов и соответственно быть причастными к формированию приобретенного и естественного иммунитета. Весьма интригующей в этом смысле представляется гипотеза Гинена [41], развиваемая применительно к взаимодействиям между преобладающим в тимусе эволюционно древним семейством гипоталамических нейропептидов (окситоцином, вазопрессином, их белковыми носителями нейро- физинами) и рецепторами пре-Т-лимфоцитов. Роль этих пептидов и механизмы их секреции в гипоталамо-нейрогипофизарной системе отличаются от таковых в тимусе. В первом случае нейропептиды секретируются нейронами супраоптического и паравентрикулярного ядер и с помощью нейрофизинов транспортируются по аксонам в заднюю долю гипофиза, где они депонируются и по мере надобности выделяются в кровь. Иная ситуация имеет место в тимусе, где совсем другая роль отводится нейропептидам и их белкам-носителям.
Показано, что между нейрофизинами, секретируемыми эпителиальными клетками тимуса, и HLA-антигенали существует сходство, определяемое по целому ряду показателей: сродству к моноклональным антителам и близким значениям молекулярной массы [41], сходству механизмов бе- лок-белкового узнавания в процессе презентации пре-Т-лимфоцитам [34, 63], признакам сходства в молекулярной организации нейрофизинов и протеинов суперсемейства HLA-антигены—иммуноглобулины [27, 28]. Наконец, показана экспрессия в тимусе предшественника нейропептидных гормонов, содержащего короткую аминокислотную цепь, способного воспроизводить все семейство нейропептидов и антигены HLA I класса, родственные нейрофизину [41].
Эти данные позволяли предполагать, что ней- рофизины, синтезируемые в эпителиальных клетках тимуса, близкородственны HLA-антигенам и способны выполнять функцию последних, т. е. презентировать пре-Т-лимфоцитам связываемые ими нейропептиды окситоцин и вазопрессин. Принимая во внимание, что развивающиеся Т- лимфоциты обучаются узнавать HLA-антигены, экспрессируя к ним рецепторы, логично было ожидать узнавание Т-лимфоцитами нейрофизинов и экспрессию рецепторов к презентируемым ими нейропептидам. Эти предположения подтвердились. Показано, что в тимусе рецепторы к окситоцину экспрессируются в пре-Т-лимфоцитах в той же временной последовательности, что и в гипоталамо-нейрогипофизарной системе, т. е. первоначально появляются провизорные рецепторы типа VI, а позднее — дефинитивные рецепторы [41]. Как упоминалось выше, пре-Т-лимфоци- ты обучаются узнавать HLA-антигены и не давать иммунного ответа в случае, когда они презентируют антигены собственного организма. В полной мере это относится к окситоцину, презентируемому нейрофизином. Что касается вазопрессина, здесь могут происходить срывы в механизме обучения пре-Т-лимфоцитов: этот нейропептид у отдельных индивидуумов воспринимается как чужеродный антиген. В этих случаях развивается ау- тоимунное заболевание, поражающее нейроны гипоталамуса, которые секретируют вазопрессин, т. е. развивается несахарный диабет [81].
Резюмируя вышесказанное, можно сформулировать некоторые заключения, которые носят характер перспективных гипотез. Прежде всего представленные факты позволяют думать, что нейроэндокринная и иммунная системы происходят от общих предков в процессе их эволюционного развития. Далее становится все более очевидным, что эволюционно консервативные пептиды, обнаруживаемые в тимусе, способны вовлекаться в механизмы, опосредующие обучение пре-Т-лимфоцитов в процессе формирования приобретенной и естественной толерантности. На сегодня такая возможность хорошо аргументирована для окситоцина, который, как выяснилось, наделен способностью оказывать митогенное действие на пре-Т-лимфоциты, что немаловажно в процессе положительной селекции, когда необходимо увеличивать популяцию развивающихся Т-лимфоцитов, не дающих аутоиммунной агрессии к собственному антигену [41].
Гипотеза о том, что нейропептиды принимают участие в механизмах селекции, представляется перспективной и с той точки зрения, что она может оказаться полезной в решении некоторых дискуссионных проблем современной иммунологии. До сих пор остается без каких-либо удовлетворительных объяснений некий парадокс в современных иммунологических концепциях, когда в рамках одной и той же тримолекулярной структуры (рецептор Т-лимфоцита—антиген— HLA- молекула) допускается реализация 2 диаметрально противоположных процессов: негативной селекции развивающихся лимфоцитов, когда уничтожаются целые клоны (клональная делеция) клеток, реагирующих на собственные антигены, и позитивной селекции, создающей условия для сохранения клеточных клонов и их размножения. Напрашивается предположение, что одних только HLA-молекул недостаточно для рестрикции этих процессов, что аналогичную функцию могут выполнять синтезируемые в клетках тимуса пептидные молекулы. Последнее может также объяснить столь широкий репертуар пептидов тимуса.
1. Акмаев И. Г. Структурные основы механизмов гипоталамической регуляции эндокринных функций. — М., 1979.
2. Акмаев И. Г. // Вести. Рос. АМН. — 1993. — № 7. — С. 55-59.
3. Акмаев И. Г. // Успехи физиол. наук. — 1996. — № 1. — С. 3-20.
4. Громыхина Н. Ю., Крымская Л. Г., Козлов В. А. // Там же. 1993.- № 1 — С. 59-79.
5. Завьялов В. П., Денесюк А. И. // Докл. АН СССР. — 1987. № 3. — С. 727-730.
6. Корнева Е. А., Шхинек Э. К. // Вести. АМН СССР. — 1985 — № 8. — С. 44-50.
7. Крыжановский Г. Н. Детерминантные структуры в патологии нервной системы: генераторные механизмы нейропатологических синдромов.— М., 1980.
8. Ноздрачев А. Д, Вуколова Р. П. // Успехи физиол. наук. — 1993- № 1. — С. 80-98.
9. Acher R. // Regul. Pept. — 1993. — Vol. 45. — P. 1-13.
10. Atkinson M. A., Maclaren N. K. // Sci. Am. — 1980. — Vol. 263. — P. 42-49.
11. Ban E., Milon G., Prudhomme N. et al. // Neuroscience. — 1991- Vol. 43. — P. 21-30.
12. Ban E., Haour F, Lenstra R. // Cytokine. — 1992. — Vol. 4.P. 48-54.
13. Ban E., Sarlieve L. L., Haour F. // Neuroscience. — 1993. — Vol. 52. — P. 725-733.
14. Bargmann W., Scharrer E. // Sci. Am. — 1951. — Vol. 39. — P. 255-259.
15. Bateman A., Singh A., Kral T. et al. // Endocrine Rev. — 1989.Vol. 10. — P. 98-112.
16. Benacerraf B. // J. Immunol. — 1978. — Vol. 120. — P. 1809-1812.
17. Bernardini R., Calogero A. E., Mauceri G. et al. // Life Sci. — 1990. — Vol. 47. — P. 1601-1607.
18. Besedovsky H., Del Rey., Sorkin E. et al. // Science. — 1986.Vol. 233. — P. 652-654.
19. Blalock J. E. // J. Immunol. — 1984. — Vol. 132. — P. 1067— 1070.
20. Blalock J. E., Bost K. L. // Prog. Allergy. — 1988. — Vol. 43.P. 1-165.
21. Blalock J. E. // Immunol. Today. — 1994. — Vol. 15. — P. 504-511.
22. Boehmer H. von, Haas W., Jerne N. E. // Proc. natl. Acad. Sci. USA. — 1978. — Vol. 75. — P. 2439-2442.
23. Bonomo A., Matzinger P. // J. exp. Med. — 1993. — Vol. 177.P. 1153-1164.
24. Breder C. D., Dinarello C. A., Saper С. B. // Science. — 1988. -Vol. 240. — P. 321-324.
25. Burnet F. M. The Clonal Selection Theory of Acquired Immunity. — Cambridge, 1959.
26. Cantor H. , Gershon R. K. // Fed. Proc. — 1979. — Vol. 38. — P. 205-2064.
27. Carpa J. D., Cheng K. W., Friesen H. G. et al. // FEBS Lett.1974. — Vol. 46. — P. 71-74.
28. Carpa J. D., Walter R. // Ann. N. Y. Acad. Sci. — 1975. — Vol. 248. — P. 397-407.
29. Cohen I. R. // Sci. Am. — 1988. — Vol. 258. — P. 34-42.
30. Dantzer R., Kelly K. W. // Life Sci. — 1989. — Vol. 44. — P. 1995-2008.
31. Davies A. J. S. // Transplant. Rev. — 1969. — Vol. 1. — P. 43-91
32. Dorf M. E. (Ed.) The Role of the Major histocompatibility Complex in Immunology. — New York, 1981.
33. Ericson A., Geenen V., Robert F. et al. // Mol. Endocrinol. — 1990. — Vol. 4. — P. 1211-1218.
34. Falk K., Rotzschke O., Stevanovic S. et al. // Nature. — 1991.Vol 351. — P. 290-296.
35. Farrar W. L., Killian P. L., Ruff M. R. et al. // J. Immunol. — 1987. — Vol. 139. — P. 459-463.
36. Friesen H. G., Di Mattia G. E., Too С. K. L. // Prog. NeuroEndocrinol. Immunol. — 1991. — Vol. 4. — P. 1—9.
37. Funder J. W. // Mol. Cell Endocrinol. — 1990. — Vol. 70. — P. C21-C24.
38. Geenen V., Legros J. J., Franchimont P. et al. // Science. — 1985- Vol. 232. — P. 508-51 1.
39. Geenen V, Legros J. J., Franchimont P. et al. // Ann. N. Y. Acad. Sci. — 1987. — Vol. 497. — P. 56-66.
40. Geenen V., Achour I., Robert F. et al. // Thymus. — 1993. — Vol. 21. — P. 115-127.
41. Geenen V., Cormann-Gojfin N., Vandersmissen E. et al. // Ann. N. Y. Acad. Sci. — 1994. — Vol. 741. — P. 85-99.
42. Green J. D., Harris G. W. // J. Endocrinol. — 1947. — Vol. 5.P. 136-146.
43. Grossman C. J. // Science. — 1985. — Vol. 227. — P. 257- 261.
44. Hall N. R. Psychoneuroimmunology. — New York, 1981.
45. Harting H. P., Walters K, Toyka K. // J. Immunol. — 1986. — Vol. 136. — P. 3856-3863.
46. Haynes B. E, Shimizu K, Eisenbarth G. S. // J. clin. Invest. — 1983- Vol. 71. — P. 9-14.
47. Howard J. G., Mitchison N. A. // Prog. Allergy. — 1975. — Vol. 18. — P. 43-96.
48. Inagaki S., Kito S. // Prog. Brain Res. — 1986. — Vol. 66. — P. 269-316.
49. Jerne I. // Sci. Am. — 1973. — Vol. 229. — P. 52-69.
50. Jerne N. K. // Ann. Immunol. — 1974. — Vol. 125C. — P. 378-389.
51. Johnson H. M., Tozres B. A. // Prog. Allergy. — 1988. — Vol. 43. — P. 37-67.
52. Kakucska I., Qi Y., Clark B. D. et al. // Endocrinology. — 1993. — Vol. 133. — P. 815-821.
53. Kelly P. A., Ali S., Rozakis M. et al. // Rec. Prog. Horm. Res. 1993. — Vol. 48. — P. 123-164.
54. Kiessling R., Wigzell H. // Immunol. Rev. — 1979. — Vol. 44. P. 165-208.
55. Korneva E. A., Khai L. M. // Foundations of Psychoneuroimmunology / Ed. S. Locke et al. — New York, 1986. — P. 11 — 20.
56. Knudsen P. J., Dinarello C. A., Strom T. B. // J. Immunol. — 1985- Vol. 139. — P. 4129-4134.
57. Lechan R. M., Toni R., Clark B. D. et al. // Brain Res. — 1990. — Vol. 514. — P. 135-140.
58. Leonhardt H. // Handbuch der mikroskopischen Anatomie des Menschen. / Hrsg A. Oksche. — Berlin, 1980. — Bd. 4, T. — S. 177-666.
59. Levi-Montalcini R. // Science. — 1987. — Vol. 237. — P. 1154-1162.
60. Lindstrom J. // Adv. Immunol. — 1979. — Vol. 27. — P. 1 — 50.
61. Lobait S. J., Lim A. T. W., Toh B. et al. // J. clin. Invest. — 1983- Vol. 73. — P. 277-280.
62. Marrack P., Mccormack J., Kappler J. // Nature. — 1989. — Vol. 338. — P. 503-505.
63. Maryanski J. L., Romero P., Van Pel A. et al. / Int. Immunol. 1991. — Vol. 3. — P. 1035-1042.
64. Minami M., Kuraishi Y., Yamaguchi T. et al. // Neurosci. Lett. 1991. — Vol. 123. — P. 254-256.
65. Navarra P., Tsagarakis S., Faria M. S. et al. // Endocrinology. 1991. — Vol. 128. — P. 37-44.
66. Palazzolo D. L., Quardi S. K. // Life Sci. — 1990. — Vol. 47. P. 2105-2109.
67. Pelletier G. // Hypothalamus and Endocrine Function / Ed. F. Labrie et al. — New York, 1976. — P. 433—450.
68. Peretti M., Becherucci C., Scapigliati G. et al. // Brit. J. Pharmacol. — 1989. — Vol. 98. — T. 1137—1142.
69. Plaut M. II Ann. Rev. Immunol. — 1987. — Vol. 5. — P. 621-629.
70. Raff M. I/ Nature. — 1977. — Vol. 265. — P. 205-207.
71. Rennie J. // Sci. Am. — 1990. — Vol. 263. — P. 76—85.
72. Robert F. R., Martens H., Cormann N. // Dev. Immunol.— 1991- Vol. 2. — P. 131-140.
73. Salaun J. C., Bandereira A., Khazaai I. et al. // Science. — 1990. — Vol. 247. — P. 1471-1473.
74. Sapolsky R., Rivier C., Yamamoto G. et al. // Ibid. — 1987. — Vol. 238. — P 522-524.
75. Savino W., Dardenne M., Papiernik M. et al. // J. exp. Med. — 1982. — Vol. 156. — P. 628-632.
76. Savino W., Dardenne M. // Immunol. Today. — 1995. — Vol. 16. — P. 318-322.
77. Schally A. V., Arimura A., Bowers C. Y. et al. // Rec. Prog. Horm. Res. — 1968. — Vol. 24. — P. 497-581.
78. Scharrer E. // Z. vergleich. Physiol. — 1928. — Bd 7. — S. 1 — 38.
79. Scharrer E., Scharrer B. // Biol. Rev.Camb. Phil. Soc. — 1937. Vol. 12. — P. 185-216.
80. Scharrer E., Scharrer B. Neuroendocrinology. — New York, 1963.
81. Scherbaum W. A., Botazzo G. E, Czernichow P. et al. // Front. Horm. Res. — 1985. — Vol. 13. — P. 232—238.
82. Schwartz R. H. // Scand. J. Immunol. — 1978. — Vol. 7. — P. 3-10.
83. Selye H. // J. clin. Erdocrinol. Metab. — 1946. — Vol. 6. — P. 117-129.
84. Selye H. The Stress of Life. — New York, 1976.
85. Shintani E, Kanba S., Nakai T. et al. // J. Neurosci. — 1993. Vol. 13. — P. 3574-3581.
86. Suda T, Tozawa F, Ushiyama T. et al. // Endocrinology. — 1990. — Vol. 126. — P. 1223-1228.
87. Swaab D. F. // Prog. Brain Res. — 1982. — Vol. 55. — P. 97-122
88. Szentagothai J., Flerko B., Mess B., Halasz B. Hypothalamic Control of the Anterior Pituitary. — Budapest, 1962.
89. Tedeshi B., Berrett J. N., Keane R. W. // J. Cell Biol. — 1986. Vol. 102. — P. 2244-2253.
90. van Dam A. M., Brouns M., Lousee S. et al. // Brain Res. — 1992. — Vol. 588. — P. 291-296.
91. Watanobe H., Sasaki S., Takebe K. // Neurosci. Lett. — 1991. Vol.133. — P. 7-10.
92. Webb S., Sprent J. // Eur. J. Immunol. — 1990. — Vol. 20. — P. 2525-2530.
93. Werb Z., Foley R., Munch A. // J. exp. Med. — 1978. — Vol. 147. — P. 1684-1694.
94. Wybran J., Appelboom T., Famaey J. P. et al. // J. Immunol. 1979. — Vol. 123. — P. 1068-1071.
95. Zinkemagel R. M., Doherty P. C. // Adv. Immunol. — 1979. — Vol. 27. — P. 51-177.