-
Contents
-
Table of Contents
-
Troubleshooting
-
Bookmarks
Quick Links
®
Cell Saver
5+
Autologous Blood Recovery System
— Operator’s Manual —
Haemonetics Corporation
400 Wood Road
Braintree, Massachusetts 02184, USA
P/N 53063-50, Manual revision: B
©1993, 2000, 2004, Haemonetics Corporation. All rights reserved.
November 2004
Related Manuals for Haemonetics Cell Saver 5+
Summary of Contents for Haemonetics Cell Saver 5+
-
Page 1
® Cell Saver Autologous Blood Recovery System — Operator’s Manual — Haemonetics Corporation 400 Wood Road Braintree, Massachusetts 02184, USA P/N 53063-50, Manual revision: B ©1993, 2000, 2004, Haemonetics Corporation. All rights reserved. November 2004… -
Page 2
Preface P/N 53063-50, Manual Revision: B… -
Page 3
Bentley, Cell–3000/3000F, BCR–3000, and BCR–3500 are trademarks of Baxter Healthcare Corporation. Scope This manual is intended for users of the Haemonetics® Cell Saver® 5+ Autologous Blood Recovery System. The contents of this Operator’s Manual explain the operation and basic maintenance for the Cell Saver 5+ System. Diagnostics and subsequent repairs to this system should only be attempted by a qualified technician. -
Page 4
Information with respect to the availability of such training can be obtained by writing Haemonetics Corporation, Attention: Patient Division. The uses to which the Haemonetics products may be applied, and the results obtained therefrom, shall be the sole responsibility of the Buyer. Haemonetics… -
Page 5
Chiyoda-ku 102, Tokyo, Japan In the United States, telephone inquiries may be made by using the toll-free number: 1 (800) 225-5242, or by calling (781) 848-7100. All Haemonetics products are manufactured in accordance with ISO 9000 standards. Authorized European Representative HAEMONETICS U.K. -
Page 6
Preface P/N 53063-50, Manual Revision: B ONTACTING AEMONETICS WORLDWIDE Use the following list when contacting the appropriate Haemonetics representative for each region. Haemonetics Asia Inc. Haemonetics France S.A.R.L. Taiwan Branch 46 bis, rue Pierre Curie 26F-1, No. 102 Roosevelt Road Sec. 2 Z.I. -
Page 7: Table Of Contents
Historical Overview ……..1-6 Haemonetics Cell Saver Systems ……1-7 Special features of the CS5+ .
-
Page 8
Table of Contents P/N 53063-50, Manual Revision: B Chapter 2: Equipment and Disposable Description General ……….. . 2-3 Controls and indicators . -
Page 9
P/N 53063-50, Manual Revision: B Table of Contents Chapter 4: Setup Procedures for Cell Salvage General operation ……….4-2 Setup . -
Page 10
Table of Contents P/N 53063-50, Manual Revision: B Chapter 8: Maintenance General ……….. . 8-2 Maintenance and cleaning . -
Page 11
Historical Overview ……..1-6 Haemonetics Cell Saver Systems ……1-7 SPECIAL FEATURES OF THE CS5+ . -
Page 12: Introducing The Cell Saver 5+ System
5+ S NTRODUCING THE AVER YSTEM The Haemonetics Cell Saver 5+ Autologous Blood Recovery System, shown in Figure 1-1, represents the fifth generation of autologous blood recovery systems. Using the latest microprocessor technology, the Cell Saver 5+ System (CS5+) Haemonetics introduced the first delivers a new level of automation in the processing of autologous blood.
-
Page 13
P/N 53063-50, Manual Revision: B Introduction Figure 1-1: The Haemonetics Cell Saver 5+ Autologous Blood Recovery System… -
Page 14: Indications For Use
P/N 53063-50, Manual Revision: B Indications for The Haemonetics Cell Saver 5+ System and its related accessory components are intended to be used for the recovery and processing of blood shed during or subsequent to an operation or as a result of trauma. The recovered blood is…
-
Page 15: Autologous Blood Transfusion
P/N 53063-50, Manual Revision: B Introduction UTOLOGOUS BLOOD TRANSFUSION Autologous blood is The term, autologous blood, refers to blood derived from the same individual. An now widely accepted autologous blood transfusion therefore, is one in which a patient receives his or as the first choice for her own blood.
-
Page 16: Historical Overview
Introduction P/N 53063-50, Manual Revision: B Historical The following paragraphs are a brief summary of the history of transfusion methods. Overview Early Experiments with Transfusion Some of the earliest recorded attempts at transfusion were undertaken by a French physician, Jean Denys, who in the 1660’s performed transfusions between animals and humans with predictably disastrous results.
-
Page 17: Haemonetics Cell Saver Systems
Haemonetics Cell Haemonetics Cell Saver Systems are aptly named. Their primary purpose is the recovery of red blood cells (RBCs). The RBCs are recovered from the shed blood Saver Systems that has, in the past, simply been discarded after an operation.
-
Page 18: Special Features Of The Cs5
The CS5+ improves upon the design and performance of its predecessors. The CS5+ processes shed blood faster without compromising the quality of the end product (concentrated RBCs). Haemonetics has improved and streamlined the features and functions of earlier units and introduced the latest microprocessor…
-
Page 19: Computer Guided Setup
Caution: The instructions provided by the display panel are not intended to replace formal training by Haemonetics in the operation of the Cell Saver 5+ System, nor do they relieve the operator of the obligation to read this manual.
-
Page 20: Specifications
Introduction P/N 53063-50, Manual Revision: B PECIFICATIONS Dimensions and Weight Table 1-1: Dimensions and weight* Depth/in. (cm) Height/in. (cm) Width/in. (cm) Machine alone IV Pole extended 14.5 (37) 74.5 (189) 16 (41) IV Pole down 14.5 (37) 37 (94) 16 (41) Machine with Cart IV Pole extended 23 (58)
-
Page 21: Fluid Management Systems
P/N 53063-50, Manual Revision: B Introduction Fluid The CS5+ is equipped with a pole for hanging saline solution, the anticoagulant solution, the reservoir, reinfusion bag, and transfer packs. The IV pole has a Management handgrip at the base of the IV pole and contains pigtails for hanging bags. The Systems lower half of the IV pole may be raised and lowered by turning the handgrip at the base of the IV pole counterclockwise, adjusting the IV pole to the proper…
-
Page 22: Construction
Cabinet and Cart Materials: Fabricated sheet metal and cast aluminum. b. Control Panel: Membrane switch technology, environmentally sealed with backlit option keys. Note: Only Haemonetics disposable sets may be used with the Cell Saver 5+ System; the system will not function properly with other sets. 1-12…
-
Page 23: Machine Symbol Chart
P/N 53063-50, Manual Revision: B Introduction Machine Symbol (as per IEC 601–1:88) Chart Type BF Class 1 equipment with isolated (floating) applied part providing adequate protection against electrical shock, particularly regarding allowable leakage currents and reliability of the protective earth connection. Alternating Current IPX1 Protection against Dripping Water…
-
Page 24: Disposable Packaging Symbol Chart
Introduction P/N 53063-50, Manual Revision: B Disposable Packaging Symbol Chart Catalog number Expiration date Lot number Contents sterile by exposure to ethylene oxide Fluid path sterile by exposure to ethylene oxide Do not reuse Caution: consult operator manual for instructions Storage conditions, humidity level Storage conditions, temperature level Fragile, handle with care…
-
Page 25: Bowl Symbol Chart
P/N 53063-50, Manual Revision: B Introduction Bowl symbol During a procedure, the bowl icon on screen reflects the bowl size currently in use. See below for bowl sizes and corresponding icons. chart 70 mL bowl 125 mL bowl 225 mL bowl Primary Power a.
-
Page 26: Ordering Information
RDERING INFORMATION The following is a summary of the List Numbers associated with the Cell Saver 5+ System. Note: There is no latex present in the fluid pathways of the Haemonetics disposable components in the following list. List No. Description Collection Reservoir, 3L, 150 micron filter.
-
Page 27
Basic Mini Volume (70 ml) Cell Saver 5+ Bowl Set, Includes tubing harness, reinfusion bag, waste bag, and 70 ml centrifuge bowl. Sterile fluid path, disposable, for single patient use. 2005 110 EP Haemonetics Cell Saver 5+ System for 110 Vac English Language. 1-17… -
Page 28: References
Introduction P/N 53063-50, Manual Revision: B EFERENCES “Guidelines for Blood Salvage and Reinfusion in Surgery and Trauma,” Ameri- can Association of Blood Banks, 1993. Geoffrey Keynes, ed., Blood Transfusion. Bristol: John Wright & Sons Ltd., 1949, pp. 15-16. Keynes., p. 22. Blundell, James, “Experiments on the Transfusion of Blood by the Syringe,”…
-
Page 29
Chapter 2 Equipment and Disposable Description GENERAL ……….2-3 CONTROLS AND INDICATORS . -
Page 30
Equipment and Disposable Description P/N 53063-50, Manual Revision: B Pigtails for Saline, Anticoagulant and Reinfusion Bags Reservoir Bracket Pump Display Centrifuge Control Panel Tubing Manifold Waste Hangers Figure 2-1: Cell Saver 5+ components… -
Page 31: Chapter 2: Equipment And Disposable Description
P/N 53063-50, Manual Revision: B Equipment and Disposable Description ENERAL This chapter identifies the major components of the Cell Saver 5+ System (CS5+), and explains their intended uses. A general description of the operation of the system is also provided. For detailed setup and operating instructions for the various protocols performed by the CS5+, please refer to Chapters 3 through 6.
-
Page 32: Controls And Indicators
Equipment and Disposable Description P/N 53063-50, Manual Revision: B ONTROLS AND INDICATORS Figure 2-1 shows the CS5+. The control panel consists of a plastic covered key pad section, a backlit key pad section, and the display screen. Only the necessary readouts are illuminated, thus helping the operator to focus on information needed.
-
Page 33: Control Panel
P/N 53063-50, Manual Revision: B Equipment and Disposable Description State Mode WASH CELLS AUTOMATIC Processed Vol: 800 ml Wash Vol: 50 ml NaCl Reinfusion Vol: 0 ml Bowls Processed: Pump Rate: 500 ml/min Wash Volume: 150/1000 ml Press MODE twice to enter EMERGENCY option Press MODIFY to change volume of wash Prompt Information Procedure Data…
-
Page 34
Equipment and Disposable Description P/N 53063-50, Manual Revision: B The other control keys are backlit when moving into Manual operation or when modifying the preset parameters as shown in Figure 2-5. Following is a summary of the functions of the controls on this panel. Auto Mode Start… -
Page 35
P/N 53063-50, Manual Revision: B Equipment and Disposable Description WASH Cell Saver: Pumps saline into spinning bowl from saline bag. Sequester: Not used. EMPTY Cell Saver: Pumps fluid from stationary bowl into product bag or reser- voir. Sequester: Pumps fluid from stationary bowl into product bag or reser- voir. -
Page 36
Equipment and Disposable Description P/N 53063-50, Manual Revision: B Automatic Controls (See Figure 2-4.) Located directly below the display, the Automatic controls regulate the automatic functioning of the CS5+. The Automatic Controls are as follows: a. START, as its name suggests, is used to initiate the first cycle of a set of cycles. Also, if the system is in STANDBY, pressing START resumes the process where it was stopped. -
Page 37: Major Components
P/N 53063-50, Manual Revision: B Equipment and Disposable Description AJOR COMPONENTS The CS5+ consists of two groups of components: the machine and the disposable. The machine controls the fluid pathway provided by the disposable. The machine includes a centrifuge, peristaltic fluid pump, pinch valves, and various sensors. A cart is provided with the system for added maneuverability and for setting the system at the proper working height.
-
Page 38
Warning: Do not grease any part of the mechanical centrifuge. If grease has been applied to the mechanical chuck, contact Haemonetics hotline immediately. Bowl Optics Sensors… -
Page 39
P/N 53063-50, Manual Revision: B Equipment and Disposable Description Note: The Bowl Optics sensors ARE disabled in the manual mode and when using the 70 mL bowl. Fluid Sensors (See Figure 2-6) The fluid leak sensors are mounted in the centrifuge well. These sensors stop the pump and the centrifuge if fluid comes in contact with the fluid sensor surface in the unlikely event of a bowl leak. -
Page 40
Equipment and Disposable Description P/N 53063-50, Manual Revision: B CLAMPED LINE DETECTED Check for kinks or occlusions in tubing. Ensure clamp on reinfusion bag and reservoir are open. Effluent Line Sensor The effluent line sensor monitors the quality of the bowl effluent. During FILL and WASH it adjusts pump speed to reduce red cell spillage. -
Page 41: Disposables
A variety of disposables are available for use with the CS5+. Chapter 4 explains the available disposables in detail. The purpose of this section is to give a general understanding of the uses and operating characteristics of the disposables rather than to provide specifications: HAEMONETICS IOOO Reinfusion Bag MILLILITERS…
-
Page 42
Equipment and Disposable Description P/N 53063-50, Manual Revision: B Receptacles Every CS5+ disposable setup must be equipped with a waste bag and a reinfusion bag. There must also be a source of unprocessed blood which may be either a collection reservoir or an extracorporeal circuit. Figure 2-8 identifies the receptacles used in a typical set up. -
Page 43
P/N 53063-50, Manual Revision: B Equipment and Disposable Description The two subassemblies are joined with a rotary seal which forms a barrier between the inside and outside of the bowl. The seal’s effectiveness may be lost if the bowl is incorrectly mounted in the chuck. Fully seating the bowl in the chuck will assure proper alignment. -
Page 44
Equipment and Disposable Description P/N 53063-50, Manual Revision: B supernatant is forced through the outlet port. The hematocrit of blood in the bowl increases as more blood solution is pumped in and the supernatant is forced out. Supernatant From From Air To Collection Waste to… -
Page 45
P/N 53063-50, Manual Revision: B Equipment and Disposable Description Warning: Prior to pumping blood through the CS5+ harness and bowl, the blood must be anticoagulated, either systemically or regionally. Non-anticoagulated blood or blood components introduced into the bowl/ harness assembly will clot. -
Page 46: General Operation
Equipment and Disposable Description P/N 53063-50, Manual Revision: B ENERAL OPERATION This section provides a general overview of how the CS5+ works. For detailed instructions for each protocol performed by the CS5+, consult Chapters 5 – 7. Note: Note that the Cell Saver 5+ System is programmed to produce consistently good results in most procedures.
-
Page 47: Filling The Centrifuge Bowl
Warning: Normal saline is the recommended wash solution for use with the Haemonetics Cell Saver 5+. At the start and finish of the WASH mode there is a brief “switching” of the valves that the operator may notice. At the start of the WASH mode, the blue line valve…
-
Page 48: Washing Partial Bowls
Equipment and Disposable Description P/N 53063-50, Manual Revision: B In the Automatic mode the wash volume is programmable from 750 — 3000 ml (500 — 3000 ml for a 125 ml bowl, 300 — 3000 ml for a 70 ml bowl). The recommended wash volume for a 225 ml bowl is 1000 ml(750ml for a 125 ml bowl and 300ml for a 70 ml bowl).
-
Page 49
Chapter 3 Safety and Patient Care Precautions GENERAL ……….3-2 SAFETY AND PATIENT CARE PRECAUTIONS. -
Page 50: Chapter 3: Safety And Patient Care Precautions
Safety and Patient Care Precautions P/N 53063-50, Manual Revision: B ENERAL Chapter 3 provides general information on Safety and Patient Care Precautions for the Cell Saver 5+ System (CS5+), and discusses parameters that affect processing times.
-
Page 51: Safety And Patient Care Precautions
P/N 53063-50, Manual Revision: B Safety and Patient Care Precautions AFETY AND PATIENT CARE PRECAUTIONS The following paragraphs outline precautions that must be taken to ensure safe operation of the CS5+. Storage and Many plastics are sensitive to chemicals such as solvents, refrigerants, and detergents.
-
Page 52: Rotating Machinery
OSHA Blood Borne Pathogen Standard. When any Haemonetics product (equipment or disposables) which has been used during a procedure is returned to Haemonetics for any reason, the customer must decontaminate and repackage the product in compliance with the medical facility’s Infection Control Plan and U.S.
-
Page 53: Twists And Kinks In Tubing
P/N 53063-50, Manual Revision: B Safety and Patient Care Precautions Twists and Kinks A careful recheck of the mounted harness should be carried out to make certain that each section is in the correct position on the machine, and that all tubes are in Tubing free of twists or kinks that would prohibit fluid flow.
-
Page 54: Red Cell Spillage
Safety and Patient Care Precautions P/N 53063-50, Manual Revision: B Red Cell Spillage Under normal conditions there should be little or no red cell spillage. The effluent line sensor should mitigate any spillage. During the WASH mode, two conditions may especially result in red cells spilling over into the waste bag: 1.
-
Page 55: Depletion Of Clotting Factors
P/N 53063-50, Manual Revision: B Safety and Patient Care Precautions Depletion Warning: Washed, concentrated cells are depleted of clotting factors. The physician must monitor the quantity of washed cells returned to the patient, and of Clotting supplement the washed, concentrated cells with fresh frozen plasma and Factors platelets if required for hemostasis.
-
Page 56: Factors Affecting Processing Time
Safety and Patient Care Precautions P/N 53063-50, Manual Revision: B ACTORS AFFECTING PROCESSING TIME Cell Salvage The time required to process a centrifuge bowl of salvaged blood is dependent upon the following factors: Salvaged blood hematocrit Bowl volume Bowl filling rate Wash volume Wash flow rate Empty flow rate…
-
Page 57
Chapter 4 Setup Procedures for Cell Salvage GENERAL OPERATION ……..4-2 SETUP . -
Page 58: Chapter 4: Setup Procedures For Cell Salvage
Setup Procedures for Cell Salvage P/N 53063-50, Manual Revision: B ENERAL OPERATION Chapter 4 provides detailed setup procedures for the Cell Saver 5+ System (CS5+) and required disposable components. The following sections describe the basic setup regardless of how the system will be operated for a Cell Saver procedure. Note: Machine should be powered on and given an opportunity to complete the self-test prior to loading disposable.
-
Page 59: Setup
The unit then goes into self-test to insure that all the functions are operating before the unit is allowed to be used in a procedure. A SELF-TEST screen will be displayed indicating the stage of self-test completion: HAEMONETICS CORPORATION CELL SAVER CS5+-X.X…
-
Page 60
Setup Procedures for Cell Salvage P/N 53063-50, Manual Revision: B If a fault is found an appropriate message with actions will be displayed: SELF TEST NOTICE UNEXPECTED SENSOR READING Waste bag weigher To retry the test, press YES To proceed in MANUAL mode, press MODE Figure 4-3: Self-Test Failure Screen Note: Do not load disposables until the self-test is complete. -
Page 61: Installing The Cell Saver Disposables
Cell Saver Disposables Note: The setup instructions provided by the HELP key are merely reminders and are not intended to serve as a substitute for formal Haemonetics training on the use of the CS5+. 1. Prepare the Collection — “Standby”…
-
Page 62
Setup Procedures for Cell Salvage P/N 53063-50, Manual Revision: B Figure 4-7: Hang the anticoagulant solution from the IV pole Connect the Aspiration and Anticoagulation set to the reservoir. Attach suction source to reservoir and set suction at a minimal acceptable flow rate (under 200 mmHg). -
Page 63
P/N 53063-50, Manual Revision: B Setup Procedures for Cell Salvage 2. Ready the Machine and Bowl Disposable. Open the fluid deck cover, pump lever, and manifold door. Open the centrifuge cover by pulling the grey/blue knob on the right side of the cover and opening the header arm. -
Page 64
Setup Procedures for Cell Salvage P/N 53063-50, Manual Revision: B Thread the effluent tubing through the effluent line sensor. Be sure that the tubing is threaded deep into the effluent line sensor notch. Figure 4-10: Thread Tubing through Line Sensor 4. -
Page 65
P/N 53063-50, Manual Revision: B Setup Procedures for Cell Salvage Hang the waste bag on the pins on the front of the machine. Ensure that the waste bag is securely connected to the effluent line and the drain port is completely closed. Figure 4-12: Hang Waste Bag and Check Connection to Effluent Line 5. -
Page 66
Setup Procedures for Cell Salvage P/N 53063-50, Manual Revision: B 6. Set up the saline. (Each cycle requires approximately 750 to 1000 ml.) Hang the saline wash containers on the IV pole. Close the clamps on both of the yellow wash lines before spiking the saline bags. -
Page 67
P/N 53063-50, Manual Revision: B Setup Procedures for Cell Salvage Warning: The bowl base (or adapter) must be firmly installed and evenly seated in the centrifuge chuck. If the centrifuge chuck spins with the bowl base (or adapter) not evenly seated, as indicated by bowl wobbling or noise, bowl damage will occur and the bowl and harness set must be replaced. -
Page 68
Setup Procedures for Cell Salvage P/N 53063-50, Manual Revision: B Note: Changes made at this point will become permanent until changed by the user. The no wash option, pump regulation off option, and min wash volumes below 1000 ml for a 225 ml bowl, 750 ml for a 125 ml bowl are retained on a per procedure basis only. -
Page 69
Chapter 5 Automatic Operation: Cell Salvage GENERAL ……….5-2 PROCESSING IN THE AUTOMATIC MODE . -
Page 70: General
Automatic Operation: Cell Salvage P/N 53063-50, Manual Revision: B ENERAL This section explains how to operate the Cell Saver 5+ (CS5+) Autologous Blood Recovery System in the AUTOMATIC mode.
-
Page 71: Processing In The Automatic Mode
P/N 53063-50, Manual Revision: B Automatic Operation: Cell Salvage ROCESSING IN THE AUTOMATIC MODE Before any blood can be processed, the disposables must be loaded correctly. Follow the directions in the previous chapter. Note: Anticoagulant, as prepared in Chapter 4, is not controlled by the CS5+. This should be done manually in a 1:7 ratio (for heparin solution) of anticoagulant rate to the rate of blood entering the reservoir.
-
Page 72
Automatic Operation: Cell Salvage P/N 53063-50, Manual Revision: B The following screen will be displayed: FILL BOWL AUTOMATIC Processed Vol: xx ml Wash Vol: 0 ml Reinfusion Vol: 0 ml Bowls Processed: Pump Rate: 600 ml/min Press MODE twice to enter EMERGENCY option 3. -
Page 73
P/N 53063-50, Manual Revision: B Automatic Operation: Cell Salvage The operator can begin a FILL mode at anytime during Standby by pressing the START key. But at this point, the operator has other options, depending upon which keys are lit. The operator can: a. -
Page 74
Automatic Operation: Cell Salvage P/N 53063-50, Manual Revision: B In this AUTOMATIC WASH mode, the CS5+ will optimize the processing by operating at the optimum pump speed between 250 ml/min and 500 ml/min (or 200–300 ml/min if the 125 ml bowl is being used or 100-300 ml/min for the 70 ml bowl). -
Page 75
P/N 53063-50, Manual Revision: B Automatic Operation: Cell Salvage When the appropriate volume of saline has entered the bowl, the system will automatically stop the pump, the centrifuge will stop spinning, and the red blood cells suspended in saline will be pumped out of the centrifuge bowl and into the reinfusion bag. -
Page 76
Automatic Operation: Cell Salvage P/N 53063-50, Manual Revision: B Warning: Close the clamp between the reinfusion bag and the patient between reinfusions. Do not close the white clamp on the blue line between the reinfusion bag and the CS5+. Warning: Washed, concentrated cells are depleted of clotting factors. The physician must monitor the quantity of washed cells returned to the patient, and supplement the washed, concentrated cells with fresh frozen plasma and platelets if required for hemostasis. -
Page 77
P/N 53063-50, Manual Revision: B Automatic Operation: Cell Salvage When air is sensed in the WASH mode and less than 90% of the wash volume has been processed, the pump stops, an audible chime is sounded and the display reads: Saline bag empty Replace saline bag The operator should replace the saline bags and then press START to resume… -
Page 78: Modifying The Preset Parameters
Automatic Operation: Cell Salvage P/N 53063-50, Manual Revision: B ODIFYING THE PRESET PARAMETERS The CS5+ is programmed with preset processing parameters that can be modified by the operator while in AUTOMATIC operation. These parameters can all be modified from the STANDBY state or some parameters can be changed at various points in the processing cycle.
-
Page 79: Additional Functions In Automatic
P/N 53063-50, Manual Revision: B Automatic Operation: Cell Salvage DDITIONAL FUNCTIONS IN AUTOMATIC CONC The concentrate option is used when the volume of red cells in the bowl is low, and it is necessary to wash and return whatever cells there are. (This is sometimes (Concentrate) at the end of a procedure when the bowl is less than full, and no more blood loss Option…
-
Page 80: Pump Regulation Option
Automatic Operation: Cell Salvage P/N 53063-50, Manual Revision: B When the RBCs reach the trip point, the WASH mode is initiated. To prevent overfilling of the bowl with red cells before the WASH mode begins, the blue line valve closes, the red line valve opens, and the pump reverses to withdraw blood from the tubing to the bowl header into the red line.
-
Page 81: Empty Rbcs To Blue/Red Line (Return Option)
P/N 53063-50, Manual Revision: B Automatic Operation: Cell Salvage EMPTY RBCs TO “Empty RBCs to Blue Line” directs the CS5+ to send a bowl of washed RBCs to the blue line and the reinfusion bag after a wash cycle has been completed. This BLUE/RED LINE is the default value.
-
Page 82
Automatic Operation: Cell Salvage P/N 53063-50, Manual Revision: B Once the MODIFY key is pressed a screen similar to the following is displayed: CELL SAVER SETUP AUTOMATIC Min Wash Vol. — 225: 1000 ml NO WASH Option: -125: 750 ml 800 ml Reservoir Level: 400 ml… -
Page 83: Wash Option
P/N 53063-50, Manual Revision: B Automatic Operation: Cell Salvage An example of the display that will appear when the system trips into RETURN is: RETURN AUTOMATIC Processed Vol: 2525 ml Wash Vol: 2000 ml Reinfusion Vol: 400 ml Bowls Processed: Pump Rate: 250 ml/min Press MODE twice to enter EMERGENCY option…
-
Page 84
Automatic Operation: Cell Salvage P/N 53063-50, Manual Revision: B STANDBY AUTOMATIC Processed Vol: 0 ml Wash Vol: 0 ml Reinfusion Vol: 0 ml Bowls Processed: Need 800 ml in reservoir to FILL automatically Press START to FILL bowl or CONC to concentrate Press MODIFY to change parameters Once the MODIFY key is pressed a screen similar to the following is displayed: CELL SAVER SETUP… -
Page 85: Emergency Option
P/N 53063-50, Manual Revision: B Automatic Operation: Cell Salvage EMERGENCY The emergency option is available for those situations in which the speed at which blood is available for return to the patient is the most important factor. The Option emergency option is accessible from the AUTOMATIC mode when the machine is in the FILL,WASH, EMPTY, CONC, and RETURN functions.
-
Page 86: Empty Blue Line Option
Automatic Operation: Cell Salvage P/N 53063-50, Manual Revision: B EMPTY BLUE At the completion of the procedure, approximately 40 mL (13 mL for the 70 mL bowl) of RBCs remain in the blue line that should be emptied to the reinfusion LINE Option bag.
-
Page 87: System Status
P/N 53063-50, Manual Revision: B Automatic Operation: Cell Salvage YSTEM STATUS The next section briefly discusses some information regarding the display and how current procedure statistics are displayed. The current system status is displayed as shown in the following example: FILL BOWL AUTOMATIC Processed Vol:…
-
Page 88: Wash Volume Monitor
Automatic Operation: Cell Salvage P/N 53063-50, Manual Revision: B To return to full automatic operation (enabling the effluent line sensor): 1. Press the UP (▲) or DOWN (▼) key until the “Pump Regulation Off” message disappears from the screen. This will occur when the pump is returned to its original speed.
-
Page 89: Volume Accounting Function
P/N 53063-50, Manual Revision: B Automatic Operation: Cell Salvage Volume The Volume Accounting Function of the CS5+ allows the operator to monitor the approximate fluid volume processed and the approximate fluid volume returned Accounting to the patient by the CS5+. This information is constantly displayed during each Function mode, and is being constantly updated.
-
Page 90: Troubleshooting
If you are not comfortable troubleshooting problems with your equipment or disposables, Haemonetics has a 24 hour Hotline (800) 433-3431 that you may call for assistance. 5-22…
-
Page 91
Chapter 6 Manual Operation GENERAL ……….6-2 CONTROLS AND INDICATORS . -
Page 92: General
Manual Operation P/N 53063-50, Manual Revision: B ENERAL This chapter explains how to operate the Cell Saver (CS5+) System in the MANUAL mode. Though not recommended, it is possible to process blood manually in the CS5+. Given the processing capabilities of the CS5+, manual processing is unnecessary. The steps involved in manual processing during autotransfusion are outlined below.
-
Page 93: Controls And Indicators
P/N 53063-50, Manual Revision: B Manual Operation ONTROLS AND INDICATORS By pressing the MODE key once the machine switches from Automatic operation to Manual operation. Once MANUAL operation is selected the backlit control panel lights up and additional control keys become functional as shown in Figure 6-1.
-
Page 94: Manual Operation
Manual Operation P/N 53063-50, Manual Revision: B ANUAL OPERATION 1. Set up the system and disposables as described in Chapter 4. Choose the Cell Saver Protocol as described in the section, Processing In Automatic Mode in Chapter 5+, at which time the following display will be shown: STANDBY AUTOMATIC Processed Vol:…
-
Page 95
P/N 53063-50, Manual Revision: B Manual Operation 3. Initiation of the FILL mode is largely dependent upon the rate of fluid collection in the reservoir. If the patient’s rate of blood loss is steady and rapid, processing may begin as soon as 100 ml of fluid enter the reservoir. Typically, however, the processing mode (FILL) can be initiated after the reservoir has accumulated 600–900 ml of volume or 200-600 ml when using the 70 ml bowl… -
Page 96
Manual Operation P/N 53063-50, Manual Revision: B During the WASH mode the following display will be shown: WASH CELLS MANUAL Processed Vol: 800 ml Wash Vol: 150 ml NaCl Reinfusion Vol: 0 ml Bowls Processed: Pump Rate: 500 ml/min Wash Volume: 150 ml Press MODE key for AUTOMATIC Press ARROW keys to change values Note: If during the WASH mode the red cell/supernatant interface disappears and… -
Page 97
Warning: DO NOT PRESSURE REINFUSE. Pressure reinfusion can lead to the fatal infusion of air into the patient. The Haemonetics Cell Saver 5+ System’s disposables are not intended to be used with a pressure reinfusion cuff. For information on removing air from the reinfusion bag see the section, Pressure Reinfusion in Chapter 3. -
Page 98: Emergency Option
Manual Operation P/N 53063-50, Manual Revision: B EMERGENCY An emergency option is available from the MANUAL mode. This option is described in detail in Chapter 5. The EMERGENCY option is not available for use Option with the 70 ml bowl. To enter the EMERGENCY option from the MANUAL mode, press the MODE key twice.
-
Page 99
Chapter 7 Sequestering on the Cell Saver 5+ System GENERAL ……….7-2 OVERVIEW OF THE SEQUESTERING PROTOCOL . -
Page 100: General
Sequestering on the Cell Saver 5+ System P/N 53063-50, Manual Revision: B ENERAL This section explains how to perform sequestering on the Cell Saver 5+ (CS5+) Autologous Blood Recovery System. This protocol allows for the separation of platelet-rich plasma (PRP) and platelet-poor plasma (PPP) from RBCs.
-
Page 101: Overview Of The Sequestering Protocol
P/N 53063-50, Manual Revision: B Sequestering on the Cell Saver 5+ System VERVIEW OF THE SEQUESTERING PROTOCOL The Sequestering Protocol is usually performed before the Cell Saver Protocol. After the power on and self-tests complete, the system is set up with the standard bowl processing set.
-
Page 102: Setting The Parameters
Sequestering on the Cell Saver 5+ System P/N 53063-50, Manual Revision: B Step 7: Install the large bore tubing on the sequestering harness into the effluent line sensor by grasping the distal (towards the bags) con- nection tubing stop and using a “flossing” motion, pull the tuning down through the sensor until the bowl end connection tubing stop reaches the upper end of the effluent line.
-
Page 103
P/N 53063-50, Manual Revision: B Sequestering on the Cell Saver 5+ System 2. Press MODIFY to see the SETUP screen. CELL SAVER SETUP AUTOMATIC NO WASH Min Wash Vol. — 225: 1000 ml NO WASH Option: Protocol: Cell Saver -125: 750 ml Reservoir Level: 800 ml… -
Page 104
Sequestering on the Cell Saver 5+ System P/N 53063-50, Manual Revision: B 4. Press MODIFY to save changes and return to the current settings screen. 5. Press START to enter the STANDBY screen. STANDBY SEQUESTER Processed Vol: 0 ml Reinfusion Vol: 0 ml Bowls Processed: Press START to FILL bowl or CONC to concentrate… -
Page 105: Method 1 — Manual Sequestration
P/N 53063-50, Manual Revision: B Sequestering on the Cell Saver 5+ System 1 — M ETHOD ANUAL SEQUESTRATION 1. Collect whole blood from the patient via short intravenous or arterial cannula into anticoagulated blood bag(s). Warning: Only one unit of blood should be collected and processed at a time. Unless directed by a physician, do not begin withdrawal of the second unit of blood from the patient until the first unit of concentrated red autologous blood cells has been returned.
-
Page 106
Sequestering on the Cell Saver 5+ System P/N 53063-50, Manual Revision: B Caution: Never close the yellow (PPP), Blue (PRP), and white (air) bag clamps at the same time. 5. Continue to observe the centrifuge bowl. Allow plasma to run into the PPP bag at the same flow rate. -
Page 107
P/N 53063-50, Manual Revision: B Sequestering on the Cell Saver 5+ System If the “Return Plasma?” parameter in the Sequester Setup is set to “YES” the following screen is displayed: EMPTY BOWL SEQUESTER Processed Vol: 910 ml 236 ml Reinfusion Vol: Bowls Processed: OPEN PPP bag clamp CLOSE PRP bag clamp… -
Page 108
Sequestering on the Cell Saver 5+ System P/N 53063-50, Manual Revision: B 8. When the bowl completely empties, the pump will stop and the following display will be shown: STANDBY SEQUESTER Processed Vol: 510 ml 125 ml Reinfusion Vol: Bowls Processed: Press START to fill bowl or CONC to concentrate Press MODIFY to change parameters Press YES to select Cell Saver protocol… -
Page 109: System Breakdown
P/N 53063-50, Manual Revision: B Sequestering on the Cell Saver 5+ System System 1. After the final pass, remove the collection bag(s) from the pin(s) and invert it (them). Tap the sides of the tubing going from the bowl to the collection bag Breakdown to dislodge any plasma/platelets that might have adhered to the tubing wall.
-
Page 110
Sequestering on the Cell Saver 5+ System P/N 53063-50, Manual Revision: B 6. To perform a cell salvage procedure once the sequestering procedure is complete, press the YES key while the system is in STANDBY to return the CS5+ to the Cell Saver Protocol. LOAD DISPOSABLE NaCl When disposable is loaded, press START… -
Page 111
P/N 53063-50, Manual Revision: B Sequestering on the Cell Saver 5+ System 2 — A ETHOD SSISTED SEQUESTER MODE 1. Collect whole blood from the patient via short intravenous or arterial cannula into anticoagulated blood bag(s). Note: Only one unit of blood should be collected and processed at a time. Unless directed by a physician, do not begin withdrawal of the second unit of blood from the patient until the first unit of concentrated red autologous blood cells has been returned. -
Page 112: Sequester Setup Terminology
Sequestering on the Cell Saver 5+ System P/N 53063-50, Manual Revision: B SEQUESTER SETUP — ASSISTED SEQUESTER ↑↓ PARAMETER Default Assisted Sequester Mode: Toggle Fill Bowl DRAW Rate: Fill Bowl Centrifuge Speed: 4750 5650 2050 PRP Collection DRAW Rate: PRP Collect Centrifuge Speed: 4750 5650 2050…
-
Page 113
P/N 53063-50, Manual Revision: B Sequestering on the Cell Saver 5+ System Milk Delay: The time in seconds the pump will be stopped during the PRP collection phase before starting to pump the programmed Milk Vol parameter. 2. Once the Assisted Sequester Setup parameters have been set and the START key is pressed to begin a new procedure, the screen display changes to the STANDBY screen and further information is requested before processing can begin. -
Page 114
Sequestering on the Cell Saver 5+ System P/N 53063-50, Manual Revision: B If the AIR bag was selected to manage the system air: STANDBY SEQUESTER Processed Vol: Reinfusion Vol: Bowls Processed: CLOSE RED bag clamps PPP Volume: OPEN AIR bag clamp PRP Volume: CLOSE YELLOW bag clamp CLOSE BLUE bag clamp… -
Page 115
P/N 53063-50, Manual Revision: B Sequestering on the Cell Saver 5+ System 6a. Observe the centrifuge bowl filling and allow air from the circuit and the bowl to flow to the air bag or PPP collection bag. b. When plasma reaches the effluent line, the machine will decide if the process should pause as determined by the selection that was made for air management. -
Page 116
Sequestering on the Cell Saver 5+ System P/N 53063-50, Manual Revision: B On the first cycle the bowl size is determined by the machine. The high volume bowl (225 ml) and low volume bowl (125 ml) can both be used for sequestering. By default the machine expects to detect a low volume bowl (125 ml). -
Page 117
P/N 53063-50, Manual Revision: B Sequestering on the Cell Saver 5+ System 8. The white buffy coat band (made up of platelets and white cells), which is immediately adjacent to the top of the red cell level, will be seen coming up over the shoulder of the bowl. -
Page 118
Sequestering on the Cell Saver 5+ System P/N 53063-50, Manual Revision: B 9. Once the START key is pressed the machine first looks at the centrifuge speed for PRP collection that was programmed in Sequester Setup. If the programmed PRP collection centrifuge speed is equal to or greater than the programmed Fill Bowl centrifuge speed, the pump is started and PRP collection is resumed. -
Page 119
P/N 53063-50, Manual Revision: B Sequestering on the Cell Saver 5+ System has been reached the pump restarts and the process repeats. This process of stopping and starting will continue until the PRP collection is completed. 11. After 10 ml of PRP have been collected the effluent line sensor starts looking for RBCs spilling into the PRP collection bag. -
Page 120
Sequestering on the Cell Saver 5+ System P/N 53063-50, Manual Revision: B 12. Once the pump has pumped the programmed PRP Extended Collection Volume, the pump is stopped and the PRP collection is complete and the display adds COMPLETE to the screen as follows: COLLECTION SEQUESTER COMPLETE… -
Page 121
P/N 53063-50, Manual Revision: B Sequestering on the Cell Saver 5+ System If the “Return Plasma?” parameter in the Sequester Setup is set to “YES” the following screen is displayed: EMPTY BOWL SEQUESTER Processed Vol: 299 ml 0 ml Reinfusion Vol: Bowls Processed: PPP Volume: 100/… -
Page 122
Sequestering on the Cell Saver 5+ System P/N 53063-50, Manual Revision: B 15. When the bowl completely empties, the pump stops and the following display is shown: STANDBY SEQUESTER Processed Vol: 299 ml Reinfusion Vol: 199 ml Bowls Processed: PPP Volume: 40 ml PRP Volume: 60 ml… -
Page 123: System Breakdown
P/N 53063-50, Manual Revision: B Sequestering on the Cell Saver 5+ System System 1. After the final pass, remove the collection bag(s) from the pin(s) and invert it (them). Tap the sides of the tubing going from the bowl to the collection bag Breakdown to dislodge any plasma/platelets that might have adhered to the tubing wall.
-
Page 124
6. To perform a cell salvage procedure once the sequestering procedure is complete, press the YES key while the system is in STANDBY to return the CS5+ to the Cell Saver Protocol. LOAD DISPOSABLE NaCl When disposable is loaded, press START 7. -
Page 125
Chapter 8 Maintenance GENERAL ……….8-2 MAINTENANCE AND CLEANING . -
Page 126: General
The date and type of maintenance performed should be recorded regularly. Warning: Do not grease any part of the mechanical centrifuge. If grease has been applied to the mechanical centrifuge, contact Haemonetics hotline immediately.
-
Page 127: Maintenance And Cleaning
OSHA Blood Borne Pathogen Standard. When any Haemonetics product (equipment or disposables) which has been used during a procedure is returned to Haemonetics for any reason, the customer must decontaminate and repackage the product in compliance with the medical facility’s Infection Control Plan and U.S.
-
Page 128: Cleaning The Effluent Line Sensor
Note: If the mechanical chuck becomes contaminated with blood, call Haemonetics hotline at (800) 433-3431 for further assistance. If blood has entered the finger-locking mechanism, the mechanical chuck must be cleaned by a trained biomed or a haemonetics field service engineer.
-
Page 129
P/N 53063-50, Manual Revision: B Maintenance Filter Cleaning Procedure Cleaning the air filter is simple and easy. The following steps outline the correct procedure. 1. Unplug the CS5+. 2. If there is a louvered panel covering the filter, remove the four screws which hold it in place, and set the panel and screws aside. -
Page 130: Field Service
P/N 53063-50, Manual Revision: B IELD SERVICE Throughout the United States and in many locations worldwide, Haemonetics maintains a network of factory-trained field service engineers. If a problem should arise, one of these equipment specialists can usually be on-site within twenty-four hours to diagnose and correct any malfunction.
-
Page 131: Technical Services
Maintenance ECHNICAL SERVICES Installation and Haemonetics has a large network of clinical specialists proficient in both the medical and technical aspects of all Haemonetics equipment. They are Training experienced trainers who can listen and respond to your questions and concerns.
-
Page 132: Returned Goods Authorization (Rga) System
RGA Procedure The steps that should be followed in returning any equipment are outlined below. All devices to be returned to Haemonetics for product performance or quality problems should be handled according to the Product Complaint Coordinator’s instructions ([800] 433-3431). Merchandise received by a customer which was shipped in error by Haemonetics will be handled by the Customer Services Department (800) 225-5297.
-
Page 133
P/N 53063-50, Manual Revision: B Maintenance 5. Should Haemonetics request the return of contaminated disposables, or equipment, the disposables or equipment must be decontaminated prior to shipment pursuant to those policies and procedures dictated by the medical facility’s Infection Control Plan, as required by OSHA Blood Borne Pathogen Standard. -
Page 135
Appendices APPENDIX A: COMPLICATIONS AND CONTRAINDICATIONS..APP-2 References ……….APP-6 APPENDIX B: CLEANING PROCEDURES . -
Page 136: Appendix A: Complications And Contraindications
Appendices P/N 53063-50, Manual Revision: B A: C PPENDIX OMPLICATIONS AND CONTRAINDICATIONS Complications of and contraindications to perioperative blood recovery (Per 1997 AABB Guidelines for blood recovery and reinfusion in surgery and trauma pg 19-22) Substance Effects Recommended Action Pharmacologic Agents A.
-
Page 137
P/N 53063-50, Manual Revision: B Appendices Complications of and contraindications to perioperative blood recovery (Per 1997 AABB Guidelines for blood recovery and reinfusion in surgery and trauma pg 19-22) Substance Effects Recommended Action 4. Chloropactin (Bleach) Causes red cell lysis. Avoid aspiration in area where product is being used. -
Page 138
Appendices P/N 53063-50, Manual Revision: B Complications of and contraindications to perioperative blood recovery (Per 1997 AABB Guidelines for blood recovery and reinfusion in surgery and trauma pg 19-22) Substance Effects Recommended Action Contaminants A. Amniotic Fluid Contains proteolytic Cell salvage is an option after enzymes which may delivery of the fetus, removal of the activate clotting. -
Page 139
P/N 53063-50, Manual Revision: B Appendices Complications of and contraindications to perioperative blood recovery (Per 1997 AABB Guidelines for blood recovery and reinfusion in surgery and trauma pg 19-22) Substance Effects Recommended Action Malignancy A. Primary at Operative Site Cell salvage is widely used Avoid cell salvaging at tumor site. -
Page 140: References
Appendices P/N 53063-50, Manual Revision: B Complications of and contraindications to perioperative blood recovery (Per 1997 AABB Guidelines for blood recovery and reinfusion in surgery and trauma pg 19-22) Substance Effects Recommended Action C. Cold Agglutinin Antibody Agglutination of red cells If cold agglutinins show significant may occur at temperatures activity at room temperature…
-
Page 141: Appendix B: Cleaning Procedures
P/N 53063-50, Manual Revision: B Appendices B: C PPENDIX LEANING PROCEDURES Cleaning Procedures for Cell Saver 5+ Parts (detailed instructions in chapter
Part Procedure Air Detector 1. Floss with lint-free cloth dampened with clear water. 2. Floss again using a dry lint-free cloth. Air Filter 1.
-
Page 142: Appendix C: Machine Messages/Troubleshooting
Appendices P/N 53063-50, Manual Revision: B C: M PPENDIX ACHINE MESSAGES TROUBLESHOOTING Machine Messages/Troubleshooting Condition/Reason Mode Action “AIR DETECTED EARLY” EMPTY/RETURN 1. Check tubing placement. Air detected before bowl has been 2. Check for occlusions in effluent tubing. emptied. 3. Check for bowl displacement air in waste bag.
-
Page 143: Appendix C: Machine Messages/Troubleshooting
1. Check for occlusions or kinks in tubing. Pressure sensed in fluid lines. 2. Ensure clamps on reinfusion bag and res- ervoir are open. DISPLAY INOPERATIVE Contact Haemonetics Hotline. “LONG EMPTY (or RETURN) EMPTY/RETURN 1. Check tubing placement. CYCLE“ 2. Check for occlusions in effluent, blue and Air should be detected by 300ml.
-
Page 144
Empty or change waste bag. Greater than 9 L in waste bag. Ensure bowl is empty. If you are not comfortable troubleshooting problems with your equipment or disposables, Haemonetics has a 24 hour Hotline (800) 433-3431 that you may call for assistance. APP-10… -
Page 145: Operation Precautions
Cell Saver device precautions using a power cord not supplied by Haemonetics, a multiple portable socket outlet or an extension cord. Mobile RF communication equipment not approved by Haemonetics and portable communication equipment can affect the system.
-
Page 146
Appendices P/N 53063-50, Manual Revision: B IEC 60601-1-2: 2001, Table 202: Guidance and manufacturer’s declaration — electromagnetic immunity The Cell Saver system is intended for use in the electromagnetic environment specified below. The customer or the user of the Cell Saver system should assure that it is used in such an environment. Immunity test IEC 60601 Compliance level… -
Page 147
P/N 53063-50, Manual Revision: B Appendices IEC 60601-1-2: 2001, Table 204: Guidance and manufacturer’s declaration — electromagnetic immunity The Cell Saver system is intended for use in the electromagnetic environment specified below. The customer or the user of the Cell Saver system should assure that it is used in such an environment. Immunity test IEC 60601 Compliance level… -
Page 148
Appendices P/N 53063-50, Manual Revision: B IEC 60601-1-2: 2001, Table 206: Recommended separation distance between portable RF communications equipment and the Cell Saver device The Cell Saver system is intended for use in an electromagnetic environment in which radiated RF disturbances are controlled. -
Page 149
Index AABB standards 5-8, 7-10, 7-11, 7-24, 7-25, APP-2 Air Detector 1-8, 2-9, 2-13, 4-9, 5-17, 6-2, 8-4, APP-7, APP-8, APP-9 Anticoagulant 2-14, 2-16, 2-17, 2-18, 2-19, 3-8, 4-6, 5-3, 5-16, 6-5, 7-3, 7-11, 7-25, APP-3, APP-4 Aspiration and Anticoagulation Assembly 1-16, 1-17, 2-14, 4-5 Automatic 1-11, 1-12, 2-5, 2-6, 2-7, 2-9, 2-11, 2-12, 2-20, 4-11, 4-12, 5-1, 6-2, 6-8, 7-12, 7-26 Automatic Controls 2-5, 2-8, 2-17… -
Page 150
Index P/N 53063-50, Manual Revision: B Depletion of Clotting Factors 3-7 Dimensions 1-10 Display Panel 2-4 Drip Chamber 2-14, 4-6 Effluent Line 1-8, 2-13 Effluent Line Sensor 1-12, 2-12, 2-19, 2-20, 3-6, 4-8, 5-4, 5-6, 5-12, 5-19, 5-20, 8-4, APP-7 Electrical Shock Hazard 1-13, 3-3 EMERGENCY Option 2-6, 2-12, 5-17, 6-8 Emergency Option 2-8… -
Page 151
P/N 53063-50, Manual Revision: B Index Indications 1-4 Installing the Disposables 4-5 IV Pole 1-10, 1-11, 4-6, 4-8 Kinks 3-5 Leakage Current 1-13, 3-3 Line Sensor 8-4 Machine Symbol Chart 1-13 Maintenance 8-3 Malignancy 1-4, APP-5 Managing the Inventory of Air 3-6 Manifold 4-7, 4-9 Manual 2-5, 2-6, 2-8, 6-1 Manual Controls 2-8… -
Page 152
Index P/N 53063-50, Manual Revision: B Partial Bowls 2-20 PAUSE 2-7, 6-2 Plasma Hemoglobin 3-5 Plasma Sequestration 7-3 Platelet Poor Plasma (PPP) 7-2, 7-3, 7-8, 7-14, 7-15 Platelet Rich Plasma (PRP) 7-2, 7-3, 7-8, 7-14, 7-15 Power Cord 1-15 Power Switch 2-4 Preset Parameters 5-3, 5-10, 5-17, 6-4, 6-5, 6-8, 7-5 Pressure Cuff 3-6, 5-8 Pressure Reinfusion 3-6, 5-8, 6-7… -
Page 153
P/N 53063-50, Manual Revision: B Index Warning iii Warranty iv Wash Rate 1-12, 5-5, 5-17, 6-5 Wash Solution 2-19, 2-20 Washing Partial Bowls 2-20 Waste Bag 1-16, 2-11, 2-12, 2-13, 4-9, 5-5 Waste Bag Weigher 2-11, 6-2 Yellow Line 2-9, 2-13 IX-5…
Последние обновления каталогов
20.04.2023
Ультразвуковая диагностика, Эндоскопия, Хирургия и Наркозно-дыхательные аппараты
Уважаемый покупатель,
Предлагаем вашему вниманию актуальный список оборудования доступный для заказа уже сегодня:
Эндоскопия:
- Sonocape HD-500
- Видеогастроскоп EG-500
- Видеоколоноскоп EC-500T
- Pentax EPK-i5000 (со встроенным источником света)
- Видеогастроскоп EG-2990i
- Видеоколоноскоп EC-3890Li
- Тестер герметичности
- Pentax VERSA EPK-V1500c(K)
- Видеогастроскоп EG27-V10c
- Видеоколоноскоп EC38-V10cL
|
Узи аппараты:
|
Стойки эндоскопические:
|
|
Видео-мониторы:
|
Наркозно-дыхательные аппараты:
|
|
Хирургические столы:
|
Операционный свет:
|
24.03.2023
Распродажа расходных материалов и оборудования от 20.02.2023 г
Уважаемый посетитель,
Наша компания спешит предложить самые выгодные условия на поставку расходных материалов и оборудования:
- Фетальный монитор Bionet FC 700, Южная Корея — 84 000 руб/ шт;
- Фетальный монитор Bionet FC 1400, Южная Корея — 133 000 руб/шт;
- Фетальный допплер Bionet Baby Care, Южная Корея — 18 000 руб/шт;
- Фетальный допплер Bistos BT-200, Южная Корея — 18 200 руб/шт:
- US-датчик для фетальных мониторов FC 700, FC 1400 — 24 000 руб/шт;
- TOCO-датчик для фетальных мониторов FC 700,FC 1400 — 22 000 руб/шт;
- Тележка для фетальных мониторов серии FC — 64 000 руб/шт;
- УЗИ аппарат Alpinion E-CUBE i7, Южная Корея — от 17 000 USD;
- Электрокардиограф Bionet CardioCare 2000 с принадлежностями, Республика Корея — 65 000 руб/шт;
- Система пневматической компрессии терапевтическая SCD 700 серии, с принадлежностями — 164 000 руб/шт;
- Манжеты Comfort для системы пневматической компрессии терапевтической SCD 700 в ассортименте — 5400 руб/пара;
- Комплекс анестезиологический универсальный Primus c принадлежностями (бу, восстановленный) — 1 750 000 руб.;
- Контур пациента «51 (К.Н.773997) (4шт/упак) — 195 000 руб/упак;
- Наркозно-дыхательный аппарат MJ- 560В — от 500 000 руб/шт;
- Монитор пациента серии BM с принадлежностями, модель BM1, Южная Корея — 35 000 руб;
- Помпа инфузионная IP-7700 с принадлежностями, Южная Корея — 35 000 руб.
Перчатки Benovy в ассортименте, Малайзия — ЛУЧШАЯ ЦЕНА!
Электроды Surgitron, биопсийные щипцы Pentax Medical, биопсийные щипцы Medi-Globe, фильтры для инкубаторов ATOM Medical, расходные материалы для мониторов пациента Armed — в наличии на складе!
Оборудование и расходные материалы в наличии на складе! Подробности уточняйте у менеджеров по телефону +7 (499) 391-32-38.
Дополнительная информация доступна на странице Акций

- Описание
- Технические характеристики
- Видео-презентация
- Комплектация
- Документация
Cell Saver 5+ представляет собой пятое поколение систем для получения аутологичной крови, продукт тридцатилетних испытаний, совмещающий в себе ранее достигнутые преимущества с последними разработками микропроцессорной и сенсорной технологии.
Информация о системе:
Cell Saver 5+ предназначен для восстановления крови, обычно теряемой во время хирургической операции. Основные преимущества процедуры — нет риска передачи болезней, нет реакций при переливании, нет необходимости проводить анализы. Дополнительные преимущества — удаление свободного гемоглобина, антикоагулянта, внеклеточного калия, продуктов распада, липидов. Возможно использование в палате реанимации при дренаже. Позволяет исключить необходимость применения гемоконцентраторов. Имеется сет для предоперационного получения тромбоконцентрата с целью дальнейшего переливания и/или получения фибринового геля для обеспечения гемостаза.
Кровь собирается, смешивается с антикоагулянтом, фильтруется и поступает в стерильный резервуар. При достижении достаточного объема автоматически запускается цикл обработки, включающий процессы гемоконцентрации и отмывания клеток крови стерильным физиологическим раствором. По окончании циклов отмытые эритроциты перекачиваются в пластиковый мешок для реинфузии.
Показания к применению: операции на открытом сердце и сосудах, аневризмах, операции на суставах и позвоночнике, операции на печени и селезёнке, разрывная эктопическая беременность и некоторые нейрохирургические процедуры.
Особенности:
Автоматическая работа
- автоматический запуск процесса при достижении достаточного количества жидкости в резервуаре;
- автоматический выбор оптимальных параметров для обработки;
- встроенный микропроцессор управляет работой аппарата, используя данные, полученные от множества сенсоров.
Простота и удобство использования
- установка системы по подсказкам микропроцессора;
- панель управления проста и удобна, имеется хорошо информативный дисплей;
- конструкция системы трубок не допускает возможности ошибочной установки;
Маневренность и портативность
- Гематокрит конечного продукта — 55% в автоматическом режиме (не менее 50% в смешанном режиме)
- Типовое время обработки — 3-5 мин.
- Объем центрифужного колокола: 70,125 и 225 мл.
- Скорость центрифуги: от 2050 до 5650 об./мин со ступенью 100 об./мин.
- Скорость насоса крови 500мл/мин
- Вес аппарата — 34 кг.
- Вес тележки — 20,4 кг.
- Размеры аппарата (см) — 37х86х41 с учётом сложенной стойки.
- Размеры аппарата без стойки(ГхВхШ) 37х55х41 см
- Размеры аппарата с тележкой (см) — 48,3х122х53,5
- Источник питания: 220 В, 50 Гц.
По запросу
По запросу
Данный интернет-портал и материалы, размещенные на нем, носят исключительно информационный характер и ни при каких условиях не являются публичной офертой, определяемой положениями статьи 437 Гражданского кодекса РФ.
Мегагрупп.ру
Cell Saver 5+ представляет собой пятое поколение систем для получения аутологичной крови, продукт тридцатилетних испытаний, совмещающий в себе ранее достигнутые преимущества с последними разработками микропроцессорной и сенсорной технологии.
Информация о системе:
Cell Saver 5+ предназначен для восстановления крови, обычно теряемой во время хирургической операции. Основные преимущества процедуры — нет риска передачи болезней, нет реакций при переливании, нет необходимости проводить анализы. Дополнительные преимущества — удаление свободного гемоглобина, антикоагулянта, внеклеточного калия, продуктов распада, липидов. Возможно использование в палате реанимации при дренаже. Позволяет исключить необходимость применения гемоконцентраторов. Имеется сет для предоперационного получения тромбоконцентрата с целью дальнейшего переливания и/или получения фибринового геля для обеспечения гемостаза.
Кровь собирается, смешивается с антикоагулянтом, фильтруется и поступает в стерильный резервуар. При достижении достаточного объема автоматически запускается цикл обработки, включающий процессы гемоконцентрации и отмывания клеток крови стерильным физиологическим раствором. По окончании циклов отмытые эритроциты перекачиваются в пластиковый мешок для реинфузии.
Показания к применению: операции на открытом сердце и сосудах, аневризмах, операции на суставах и позвоночнике, операции на печени и селезёнке, разрывная эктопическая беременность и некоторые нейрохирургические процедуры.
Особенности:
Автоматическая работа
- автоматический запуск процесса при достижении достаточного количества жидкости в резервуаре;
- автоматический выбор оптимальных параметров для обработки;
- встроенный микропроцессор управляет работой аппарата, используя данные, полученные от множества сенсоров.
Простота и удобство использования
- установка системы по подсказкам микропроцессора;
- панель управления проста и удобна, имеется хорошо информативный дисплей;
- конструкция системы трубок не допускает возможности ошибочной установки;
Маневренность и портативность
Основные технические характеристики Cell Saver 5+:
- Гематокрит конечного продукта — 55% в автоматическом режиме (не менее 50% в смешанном режиме)
- Типовое время обработки — 3-5 мин.
- Объем центрифужного колокола: 70,125 и 225 мл.
- Скорость центрифуги: от 2050 до 5650 об./мин со ступенью 100 об./мин.
- Скорость насоса крови 500мл/мин
- Вес аппарата — 34 кг.
- Вес тележки — 20,4 кг.
- Размеры аппарата (см) — 37х86х41 с учётом сложенной стойки.
- Размеры аппарата без стойки(ГхВхШ) 37х55х41 см
- Размеры аппарата с тележкой (см) — 48,3х122х53,5
- Источник питания: 220 В, 50 Гц.
Сельтавир — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер
ЛП-005234
Торговое наименование препарата
Сельтавир®
Международное непатентованное наименование
Осельтамивир
Лекарственная форма
капсулы
Состав
Состав на 1 капсулу 30 мг:
Действующее вещество: осельтамивира фосфат — 39,41 мг, в пересчете на осельтамивир — 30,0 мг.
Вспомогательные вещества: крахмал кукурузный — 54,35 мг; крахмал прежелатинизированный — 40,00 мг; повидон-К25 — 5,76 мг; кроскармеллоза натрия — 3,04 мг; натрия стеарилфумарат — 1,44 мг.
Состав корпуса капсулы: краситель хинолиновый желтый — 0,7500%; краситель солнечный закат желтый — 0,0059%; титана диоксид — 2,0000%; желатин — до 100%.
Состав крышечки капсулы: краситель хинолиновый желтый — 0,7500%; краситель солнечный закат желтый — 0,0059%; титана диоксид — 2,0000%; желатин — до 100%.
Состав на 1 капсулу 45 мг:
Действующее вещество: осельтамивира фосфат — 59,12 мг, в пересчете на осельтамивир — 45,0 мг.
Вспомогательные вещества: крахмал кукурузный — 81,52 мг; крахмал прежелатинизированный — 60,00 мг; повидон-К25 — 8,64 мг; кроскармеллоза натрия — 4,56 мг; натрия стеарилфумарат -2,16 мг.
Состав корпуса капсулы: краситель железа оксид черный — 0,5400%; титана диоксид — 2,0000 %; желатин — до 100%.
Состав крышечки капсулы:краситель железа оксид черный — 0,5400%; титана диоксид — 2,0000 %; желатин — до 100%.
Состав на 1 капсулу 75 мг:
Действующее вещество: осельтамивира фосфат — 98,53 мг, в пересчёте на осельтамивир 75,0 мг.
Вспомогательные вещества: крахмал кукурузный — 135,87 мг; крахмал прежелатинизированный — 100,00 мг; повидон-К25 — 14,40 мг; кроскармеллоза натрия — 7,60 мг; натрия стеарилфумарат — 3,60 мг.
Состав корпуса капсулы: краситель железа оксид черный — 0,0500%; титана диоксид — 2,0%; желатин — до 100%.
Состав крышечки капсулы: краситель хинолиновый желтый — 0,7500%; краситель солнечный закат желтый — 0,0059%; титана диоксид — 2,0000%; желатин — до 100%.
Описание
Дозировка 30 мг: Твердые желатиновые капсулы № 2. Корпус и крышка капсулы — желтого цвета, непрозрачные.
Дозировка 45 мг: Твердые желатиновые капсулы № 2. Корпус и крышка капсулы — темно-серого цвета, непрозрачные.
Дозировка 75 мг: Твердые желатиновые капсулы № 0. Корпус капсулы светло-серого цвета, крышка капсулы желтого цвета, непрозрачные.
Содержимое капсул — смесь порошка и гранул белого или белого с желтоватым оттенком цвета. Допускается уплотнение содержимого капсул в комки по форме капсулы, разрушаемые при надавливании стеклянной палочкой.
Фармакотерапевтическая группа
Противовирусное средство
Код АТХ
J05AH02
Фармакодинамика:
Противовирусный препарат, осельтамивира фосфат является пролекарством, его активный метаболит (осельтамивира карбоксилат, ОК) — эффективный и селективный ингибитор нейраминидазы вирусов гриппа типа А и В — фермента, катализирующего процесс высвобождения вновь образованных вирусных частиц из инфицированных клеток, их проникновения в неинфицированные клетки эпителия дыхательных путей и дальнейшего распространения вируса в организме.
Тормозит рост вируса гриппа in vitro и подавляет репликацию вируса и его патогенность in vivo, уменьшает выделение вирусов гриппа А и В из организма. Исследования клинических изолятов вируса гриппа показали, что концентрация OK, необходимая для ингибирования нейраминидазы на 50% (IC50), составляет 0,1-1,3 нМ для вируса гриппа А и 2,6 нМ для вируса гриппа В. Согласно данным опубликованных исследований медиана значений IC50 для вируса гриппа В несколько выше и составляет 8,5 нМ.
Клиническая эффективность
В проведенных исследованиях осельтамивир не оказывал влияния на образование противогриппозных антител, в том числе на выработку антител в ответ на введение инактивированной вакцины против гриппа.
Исследования естественной гриппозной инфекции
В клинических исследованиях, проведенных во время сезонной инфекции гриппа, пациенты начинали получать осельтамивир не позднее 40 ч после появления первых симптомов гриппозной инфекции. 97% пациентов были инфицированы вирусом гриппа А и 3% пациентов — вирусом гриппа В. Осельтамивир значительно сокращал период клинических проявлений гриппозной инфекции (на 32 ч.). У пациентов с подтвержденным диагнозом гриппа, принимавших осельтамивир, тяжесть заболевания, выраженная как площадь под кривой для суммарного индекса симптомов, была на 38% меньше по сравнению с пациентами, получавшими плацебо. Более того, у молодых пациентов без сопутствующих заболеваний осельтамивир снижал примерно на 50% частоту развития осложнений гриппа, требующих применения антибиотиков (бронхита, пневмонии, синусита, среднего отита). Были получены четкие доказательства эффективности препарата в отношении вторичных критериев эффективности, относящихся к антивирусной активности: осельтамивир вызывал как укорочение времени выделения вируса из организма, так и уменьшение площади по кривой «вирусные титры-время».
Данные, полученные в исследовании по терапии осельтамивира у пациентов пожилого и старческого возраста, показывают, что прием осельтамивира в дозе 75 мг 2 раза в сутки в течение 5 дней сопровождался клинически значимым уменьшением медианы периода клинических проявлений гриппозной инфекции, аналогичным таковому у взрослых пациентов более молодого возраста, однако различия не достигли статистической значимости. В другом исследовании больные гриппом старше 13 лет, имевшие сопутствующие хронические заболевания сердечно-сосудистой и/или дыхательной систем, получали осельтамивир в том же режиме дозирования или плацебо. Отличий в медиане периода до уменьшения клинических проявлений гриппозной инфекции в группах осельтамивира и плацебо не было, однако период повышения температуры при приеме осельтамивира сокращался примерно на 1 день. Доля пациентов, выделяющих вирус на 2-ой и 4-ый день, становилась значительно меньше.
Профиль безопасности осельтамивира у пациентов группы риска не отличался от такового в общей популяции взрослых пациентов.
Лечение гриппа у детей
У детей в возрасте 1-12 лет (средний возраст 5,3 года), имевших лихорадку (≥37,8°С) и один из симптомов со стороны дыхательной системы (кашель или ринит) в период циркуляции вируса гриппа среди населения, было проведено двойное слепое плацебо-контролируемое исследование. 67% пациентов были инфицированы вирусом гриппа А и 33% пациентов — вирусом гриппа В.
Осельтамивир (при приеме не позднее 48 ч после появления первых симптомов гриппозной инфекции) значительно снижал продолжительность заболевания (на 35,8 ч) по сравнению с плацебо. Продолжительность заболевания определялась как время до купирования кашля, заложенности носа, исчезновения лихорадки, возвращения к обычной активности.
В группе детей, получавших осельтамивир, частота острого среднего отита снижалась на 40% по сравнению с группой плацебо. Выздоровление и возвращение к обычной активности наступало почти на 2 дня раньше у детей, получавших осельтамивир, по сравнению с группой плацебо.
В другом исследовании участвовали дети в возрасте 6-12 лет, страдающие бронхиальной астмой; 53,6% пациентов имели гриппозную инфекцию, подтвержденную серологически и/или в культуре. Медиана продолжительности заболевания в группе пациентов, получавших осельтамивир, значительно не снижалась. Но к последнему 6-му дню терапии осельтамивиром объем форсированного выдоха за 1 сек (ОФВ1) повышался на 10,8% по сравнению с 4,7% у пациентов, получавших плацебо.
Профилактика гриппа у взрослых и подростков
Профилактическая эффективность осельтамивира при естественной гриппозной инфекции А и В была доказана в клинических исследованиях. На фоне приема осельтамивира гриппом заболели около 1% пациентов. Осельтамивир также значительно уменьшал частоту выделения вируса и предотвращал передачу вируса от одного члена семьи к другому.
Взрослые и подростки, которые были в контакте с больным членом семьи, начинали прием осельтамивира в течение двух дней после возникновения симптомов гриппа у членов семьи и продолжали его в течение 7 дней, что достоверно уменьшало частоту случаев гриппа у контактировавших лиц на 92%.
У непривитых и в целом здоровых взрослых в возрасте 18-65 лет прием осельтамивира во время эпидемии гриппа существенно снижал заболеваемость гриппом (на 76%). Пациенты принимали препарат в течение 42 дней.
У лиц пожилого и старческого возраста, находившихся в домах для престарелых, 80% из которых были привиты перед сезоном, когда проводилось исследование, осельтамивир снижал заболеваемость гриппом на 92%. В том же исследовании осельтамивир (на 86%) уменьшал частоту осложнений гриппа: бронхита, пневмонии, синусита. Пациенты принимали препарат в течение 42 дней.
Профилактика гриппа у детей
Профилактическая эффективность осельтамивира при естественной гриппозной инфекции была продемонстрирована у детей от 1 года до 12 лет после контакта с заболевшим членом семьи или с кем-то из постоянного окружения. Основным параметром эффективности была частота лабораторно подтвержденной гриппозной инфекции. У детей, получавших осельтамивир в дозе от 30 до 75 мг 1 раз в день в течение 10 дней и не выделявших вирус исходно, частота лабораторно подтвержденного гриппа уменьшилась до 4% по сравнению с 21% в группе плацебо.
Профилактика гриппа у лиц с ослабленным иммунитетом
У лиц с ослабленным иммунитетом при сезонной гриппозной инфекции и при отсутствии вирусовыделения исходно, профилактическое применение осельтамивира приводило к снижению частоты лабораторно подтвержденной гриппозной инфекции, сопровождающейся клинической симптоматикой, до 0,4% по сравнению с 3% в группе плацебо.
Лабораторно подтвержденная гриппозная инфекция, сопровождающаяся клинической симптоматикой, диагностировалась при наличии температуры в полости рта выше 37,2°С, кашля и/или острого ринита (все зарегистрированные в один и тот же день во время приема препарата/плацебо), а также положительного результата обратно-транскриптазной полимеразной цепной реакции на РНК вируса гриппа.
Резистентность
Клинические исследования
Риск появления вирусов гриппа со сниженной чувствительностью или резистентностью к препарату изучался в клинических исследованиях. У всех пациентов-носителей ОК- резистентного вируса носительство имело временный характер, не влияло на элиминацию вируса и не вызывало ухудшения клинического состояния.
|
Популяция пациентов |
Пациенты с мутациями, приводящими к резистентности |
|
|
Фенотипирование* |
Гено-и фенотипирование* |
|
|
Взрослые и подростки |
4/1245 (0,32%) |
5/1245 (0,4%) |
|
Дети (1-12 лет) |
19/464 (4,1 %) |
25/464 (5,4%) |
* Полное генотипирование не было проведено ни в одном из исследований.
При приеме осельтамивира с целью постконтактной профилактики (7 дней), профилактики контактировавших в семье (10 дней) и сезонной профилактики (42 дня) у лиц с нормальной функцией иммунной системы случаев резистентности к препарату не отмечено. В 12- недельном исследовании по сезонной профилактике у лиц с ослабленным иммунитетом случаев возникновения резистентности также не наблюдалось.
Данные отдельных клинических случаев и наблюдательных исследований
У пациентов, не получавших осельтамивир, обнаружены возникающие в природных условиях мутации вирусов гриппа А и В, которые обладали сниженной чувствительностью к осельтамивиру. В 2008 году мутация по типу замены H275Y, приводящая к резистентности, была обнаружена более чем у 99 % штаммов вируса 2008 H1N1, циркулирующих в Европе. Вирус гриппа 2009 H1N1 («свиной грипп») в большинстве случаев был чувствителен к осельтамивиру.
Устойчивые к осельтамивиру штаммы обнаружены у лиц с нормальной функцией иммунной системы и лиц с ослабленным иммунитетом, принимавших осельтамивир. Степень снижения чувствительности к осельтамивиру и частота встречаемости подобных вирусов может отличаться в зависимости от сезона и региона. Устойчивость к осельтамивиру обнаружена у пациентов с пандемическим гриппом H1N1, получавших препарат как для лечения, так и для профилактики.
Частота встречаемости резистентности может быть выше у более молодых пациентов и пациентов с ослабленным иммунитетом. Устойчивые к осельтамивиру лабораторные штаммы вирусов гриппа и вирусы гриппа от пациентов, получавших терапию осельтамивиром, несут мутации нейраминидазы N1 и N2. Мутации, приводящие к устойчивости, часто являются специфическими для подтипа нейраминидазы.
При принятии решения о применении осельтамивира следует учитывать сезонную чувствительность вируса гриппа к препарату (последнюю информацию можно найти на сайте ВОЗ).
Доклинические данные
Доклинические данные, полученные на основании стандартных исследований по изучению фармакологической безопасности, генотоксичности и хронической токсичности, не выявили особой опасности для человека.
Канцерогенность
Результаты 3 исследований по выявлению канцерогенного потенциала (2-летних исследований на крысах и мышах для осельтамивира и одного 6 месячного исследования на трансгенных мышах Tg: АС для активного метаболита) были отрицательными.
Мутагенность: стандартные генотоксические тесты для осельтамивира и активного метаболита были отрицательными.
Влияние на фертильность: осельтамивир в дозе 1500 мг/кг/сут не влиял на репродуктивную функцию самцов и самок крыс.
Тератогенность
В исследованиях по изучению тератогенности осельтамивира в дозе до 1500 мг/кг/сут (на крысах) и до 500 мг/кг/сут (на кроликах) влияния на эмбриональное развитие не обнаружено. В исследованиях по изучению антенатального и постнатального периодов развития у крыс при введении осельтамивира в дозе 1500 мг/кг/сут наблюдалось увеличение периода родов: предел безопасности между экспозицией для человека и максимальной не оказывающей эффекта дозой у крыс (500 мг/кг/сут) для осельтамивира выше в 480 раз, а для его активного метаболита — в 44 раза. Экспозиция у плода составляла 15-20% от таковой у матери.
Прочее
Осельтамивир и активный метаболит проникают в молоко лактирующих крыс. Согласно ограниченным данным осельтамивир и его активный метаболит проникают в грудное молоко человека. По результатам экстраполяции данных, полученных в исследованиях у животных, их количество в грудном молоке может составлять 0,01 мг/сут и 0,3 мг/сут, соответственно. Примерно у 50% протестированных морских свинок при введении максимальных доз активной субстанции осельтамивира наблюдалась сенсибилизация кожи в виде эритемы. Также выявлено обратимое раздражение глаз у кроликов.
В то время как очень высокие пероральные однократные дозы (657 мг/кг и выше) осельтамивира фосфата не оказывали влияния на взрослых крыс, данные дозы оказывали токсическое действие на незрелых 7-дневных детенышей крыс, в т.ч. приводили к гибели животных. Нежелательных эффектов не наблюдалось при хроническом введении в дозе 500 мг/кг/сут с 7 по 21 день постнатального периода.
Фармакокинетика:
Абсорбция
Осельтамивира фосфат легко всасывается в желудочно-кишечном тракте и в высокой степени превращается в активный метаболит под действием печеночных и кишечных эстераз. Концентрация активного метаболита в плазме определяется в пределах 30 мин, время достижения максимальной концентрации 2-3 ч, и более чем в 20 раз превышают концентрацию пролекарства. Не менее 75% принятой внутрь дозы попадает в системный кровоток в виде активного метаболита, менее 5% — в виде исходного препарата. Плазменные концентрации как пролекарства, так и активного метаболита пропорциональны дозе и не зависят от приема пищи.
Распределение
Объем распределения (Vss) активного метаболита — 23 л.
По данным исследований, проведенных на животных, после приема внутрь осельтамивира фосфата его активный метаболит обнаруживался во всех основных очагах инфекции (легких, промывных водах бронхов, слизистой оболочки полости носа, среднем ухе и трахее) в концентрациях, обеспечивающих противовирусный эффект.
Связь активного метаболита с белками плазмы — 3%. Связь пролекарства с белками плазмы 42%, что недостаточно, чтобы служить причиной существенных лекарственных взаимодействий.
Метаболизм
Осельтамивира фосфат в высокой степени превращается в активный метаболит под действием эстераз, находящихся преимущественно в печени. Ни осельтамивира фосфат, ни активный метаболит не являются субстратами или ингибиторами изоферментов системы цитохрома Р450.
Выведение
Выводится (>90%) в виде активного метаболита преимущественно почками. Активный метаболит не подвергается дальнейшей трансформации и выводится почками (>99%) путем клубочковой фильтрации и канальцевой секреции. Почечный клиренс (18,8 л/ч) превышает скорость клубочковой фильтрации (7,5 л/ч), что указывает на то, что препарат выводится еще и путем канальцевой секреции. Через кишечник выводится менее 20% приятного препарата. Период полувыведения активного метаболита 6-10 ч.
Фармакокинетика в особых группах пациентов
Пациенты с поражением почек
При применении осельтамивира (100 мг два раза в сутки в течение 5 дней) у пациентов с различной степенью поражения почек площадь под кривой «концентрация активного метаболита в плазме — время» (AUC осельтамивира карбоксилата) обратно пропорциональна снижению функции почек.
Фармакокинетика осельтамивира у пациентов с терминальной стадией почечной недостаточности (с клиренсом креатинина <10 мл/мин), не находящихся на диализе, не изучалась. В связи с этим рекомендации по дозированию у данной группы пациентов отсутствуют.
Пациенты с поражением печени
Полученные in vitro и в исследованиях на животных данные об отсутствии значительного повышения AUC осельтамивира фосфата при нарушении функции печени легкой и средней степени тяжести были подтверждены и в клинических исследованиях.
Безопасность и фармакокинетика осельтамивира фосфата у пациентов с тяжелым нарушением функции печени не изучалась.
Пациенты пожилого и старческого возраста
У пациентов пожилого и старческого возраста (65-78 лет) экспозиция метаболита в равновесном состоянии на 25-35% выше, чем у более молодых пациентов при назначении аналогичных доз осельтамивира. Период полувыведения препарата у пациентов пожилого и старческого возраста существенно не отличался от такового у более молодых пациентов. С учетом данных по экспозиции препарата и его переносимости пациентам пожилого и старческого возраста коррекции дозы при лечении и профилактике гриппа не требуется.
Дети в возрасте от 1 года до 8 лет и подростки
Фармакокинетику осельтамивира изучали у детей от 1 года до 16 лет в фармакокинетическом исследовании с однократным приемом осельтамивира и в клиническом исследовании по изучению многократного приема осельтамивира у небольшого числа детей в возрасте 3-12 лет.
Скорость выведения активного метаболита с поправкой на массу тела у детей младшего возраста выше, чем у взрослых, что приводит к более низким AUC по отношению к конкретной дозе.
Прием препарата в дозе 2 мг/кг и однократных доз в 30 мг и 45 мг, обеспечивает такую же AUC осельтамивира карбоксилата, какая достигается у взрослых после однократного приема капсулы с 75 мг препарата (что эквивалентно примерно 1 мг/кг).
Фармакокинетика осельтамивира у детей старше 12 лет такая же, как у взрослых.
Показания:
Лечение гриппа у взрослых и детей в возрасте старше 1 года.
Профилактика гриппа у взрослых и подростков в возрасте старше 12 лет, находящихся в группах повышенного риска инфицирования вирусом (в воинских частях и больших коллективах, у ослабленных пациентов).
Профилактика гриппа у детей старше 1 года.
Противопоказания:
Повышенная чувствительность к осельтамивира фосфату или любому компоненту препарата, терминальная стадия почечной недостаточности (клиренс креатинина ≤ 10 мл/мин), тяжелая печеночная недостаточность, детский возраст до 1 года.
С осторожностью:
Беременность, период грудного вскармливания.
Беременность и лактация:
Контролируемых исследований у беременных женщин не проводилось. Однако результаты постмаркетинговых и наблюдательных исследований продемонстрировали пользу предлагаемого стандартного режима дозирования для данной популяции пациентов. Результаты фармакокинетического анализа показали более низкую экспозицию активного метаболита (приблизительно на 30% в течение всех триместров беременности) у беременных женщин по сравнению с не беременными. Тем не менее, значение расчетной экспозиции остается выше ингибирующих концентраций (значение IC95) и терапевтических значений для многих штаммов вируса гриппа. Изменение режима дозирования у беременных женщин при проведении терапии или профилактики не рекомендуется.
Не обнаружено прямого или опосредованного неблагоприятного влияния препарата на беременность, эмбрио-фетальное или постнатальное развитие (см. «Доклинические данные»). При назначении осельтамивира беременным женщинам следует учитывать, как данные по безопасности, так и течение беременности, и патогенность циркулирующего штамма вируса гриппа.
Во время доклинических исследований осельтамивир и активный метаболит проникали в молоко лактирующих крыс. Данные по экскреции осельтамивира с грудным молоком у человека и применению осельтамивира кормящими женщинами ограничены. Осельтамивир и его активный метаболит в небольших количествах проникают в грудное молоко (см. «Доклинические данные»), создавая субтерапевтические концентрации в крови грудного ребенка. При назначении осельтамивира кормящим женщинам следует также учитывать сопутствующее заболевание и патогенность циркулирующего штамма вируса гриппа.
При беременности и в период грудного вскармливания осельтамивир применяют только в случае, если предполагаемая польза для матери превышает потенциальный риск для плода и ребенка.
Способ применения и дозы:
Внутрь, независимо от приема пищи или во время еды. Переносимость препарата можно улучшить, если принимать его во время еды.
В случаях, когда у взрослых, подростков и детей существует проблема с проглатыванием капсул или при наличии признаков «старения» капсул (например, повышенная хрупкость или другие нарушения физиологического состояния), необходимо открыть капсулу и высыпать ее содержимое в небольшое количество (максимально 1 чайная ложка) подходящего подслащенного продукта питания (шоколадный сироп с нормальным содержанием сахара или без содержания сахара, мед, светло-коричневый сахар или столовый сахар, растворенный в воде, сладкий десерт, сгущенное молоко с сахаром, яблочное пюре или йогурт) для того, чтобы скрыть горький вкус. Смесь необходимо тщательно перемешать и дать пациенту целиком. Следует проглотить смесь сразу же после приготовления.
Стандартный режим дозирования
Лечение
Прием препарата необходимо начинать не позднее 2 суток с момента развития симптомов заболевания.
Взрослые и подростки в возрасте ≥ 12 лет
Рекомендуемая суточная доза составляет 150 мг. Препарат назначают в дозе 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 2 раза в сутки внутрь в течение 5 дней.
Дети с массой тела более 40 кг или в возрасте от 8 лет до 12 лет
Дети, которые умеют проглатывать капсулы, также могут получать лечение, принимая по 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 2 раза в сутки в течение 5 дней.
Дети в возрасте от 1 года до 8 лет
Рекомендованный режим дозирования осельтамивира капсулы 30 и 45 мг или экстемпорально приготовленной суспензии
|
Масса тела |
Рекомендованная доза в течение 5 дней |
|
≤15 кг |
30 мг два раза в сутки |
|
>15-23 кг |
45 мг два раза в сутки |
|
>23-40 кг |
60 мг два раза в сутки |
|
> 40 кг |
75 мг два раза в сутки |
Профилактика
Прием препарата необходимо начинать не позднее 2 суток после контакта с больными.
Взрослые и подростки в возрасте ≥12 лет
По 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 1 раз в сутки внутрь в течение не менее 10 дней после контакта с больным. Во время сезонной эпидемии гриппа — по 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 1 раз в сутки в течение 6 недель. Профилактическое действие продолжается столько, сколько длится прием препарата.
Дети с массой тела более 40 кг или в возрасте от 8 лет до 12 лет
Дети, которые могут проглатывать капсулы, также могут получать профилактическую терапию, принимая по 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 1 раз в сутки в течение 10 дней.
Дети в возрасте от 1 года до 8 лет
Рекомендованный режим дозирования осельтамивира капсулы 30 и 45 мг или экстемпорально приготовленной суспензии:
|
Масса тела |
Рекомендованная доза в течение 10 дней |
|
≤15 кг |
30 мг 1 раза в сутки |
|
>15-23 кг |
45 мг 1 раза в сутки |
|
>23-40 кг |
60 мг 1 раза в сутки |
|
>40 кг |
75 мг 1 раз в сутки |
Дозирование в особых случаях
Пациенты с нарушением функции почек
Лечение
Пациентам с клиренсом креатинина более 60 мл/мин коррекции дозы не требуется. У пациентов с клиренсом креатинина от 30 до 60 мл/мин дозу осельтамивира следует уменьшить до 30 мг два раза в сутки в течение 5 дней.
У пациентов с клиренсом креатинина от 10 до 30 мл/мин дозу осельтамивира следует уменьшить до 30 мг один раз в сутки в течение 5 дней.
Пациентам, находящимся на постоянном гемодиализе, осельтамивир в первоначальной дозе 30 мг можно принять до начала диализа, если симптомы гриппа появились в течение 48 ч между сеансами диализа. Для поддержания плазменной концентрации на терапевтическом уровне осельтамивир следует принимать по 30 мг после каждого сеанса диализа.
Пациентам, находящимся на перитонеальном диализе, осельтамивир следует принимать в первоначальной дозе 30 мг до начала проведения диализа, затем по 30 мг каждые 5 дней.
Фармакокинетика осельтамивира у пациентов с терминальной стадией хронической почечной недостаточности (с клиренсом креатинина ≥ 10 мл/мин), не находящихся на диализе, не изучалась. В связи с этим рекомендации по дозированию у данной группы пациентов отсутствуют.
Профилактика
Пациентам с клиренсом креатинина более 60 мл/мин коррекции дозы не требуется. У пациентов с клиренсом креатинина от 30 до 60 мл/мин дозу осельтамивира следует уменьшить до 30 мг один раз в сутки.
У пациентов с клиренсом креатинина от 10 до 30 мл/мин рекомендуется уменьшить дозу осельтамивира до 30 мг через день.
Пациентам, находящимся на постоянном гемодиализе, осельтамивир в первоначальной дозе 30 мг можно принять до начала диализа. Для поддержания плазменной концентрации на терапевтическом уровне осельтамивир следует принимать по 30 мг после каждого последующего нечетного сеанса диализа.
Пациентам, находящимся на перитонеальном диализе, осельтамивир следует принимать в первоначальной дозе 30 мг до начала проведения диализа, затем по 30 мг каждые 7 дней.
Фармакокинетика осельтамивира у пациентов с терминальной стадией хронической почечной недостаточности (с клиренсом креатинина < 10 мл/мин), не находящихся на диализе, не изучалась. В связи с этим рекомендации по дозированию у данной группы пациентов отсутствуют.
Пациенты с нарушением функции печени
Коррекции дозы при лечении и профилактике гриппа у пациентов с нарушением функции печени легкой и средней степени тяжести не требуется. Безопасность и фармакокинетика осельтамивира у пациентов с тяжелыми нарушениями функции печени не изучалась.
Пациенты пожилого и старческого возраста
Коррекции дозы для профилактики или лечения гриппа не требуется.
Пациенты с ослабленным иммунитетом (после трансплантации)
Для сезонной профилактики гриппа у пациентов с ослабленным иммунитетом в возрасте ≥ 1 лет — в течение 12 недель, коррекции дозы не требуется.
Дети
Сельтавир® в данной лекарственной форме не следует назначать детям до 1 года.
Экстемпоральное приготовление суспензии
В случаях, когда у взрослых, подростков и детей существует проблема с проглатыванием капсул или при наличии признаков «старения» капсул, необходимо открыть капсулу и высыпать ее содержимое в небольшое количество (максимально 1 чайная ложка) подходящего подслащенного продукта питания (см. выше) для того, чтобы скрыть горький вкус. Смесь необходимо тщательно перемешать и дать пациенту целиком. Следует проглотить смесь сразу же после приготовления.
Капсулы 75 мг
Если пациентам требуется доза 75 мг, то необходимо следовать следующим инструкциям:
1. Держа одну капсулу 75 мг препарата Сельтавир® над маленькой емкостью, аккуратно раскрыть капсулу и высыпать порошок в емкость.
2. Добавить небольшое количество (не более 1 чайной ложки) подходящего подслащенного продукта питания (чтобы скрыть горький вкус) и хорошо перемешать.
3. Тщательно перемешать смесь и выпить ее сразу же после приготовления. Если в емкости осталось небольшое количество смеси, то следует ополоснуть емкость небольшим количеством воды и выпить оставшуюся смесь.
Если пациентам требуется доза 30-60 мг, то необходимо следовать следующим инструкциям:
1. Держа одну капсулу 75 мг препарата Сельтавир® над маленькой емкостью, аккуратно раскрыть капсулу и высыпать порошок в емкость.
2. Добавить в порошок 5 мл воды с помощью шприца с метками, показывающими количество набранной жидкости. Тщательно перемешать в течение 2 минут.
3. Набрать в шприц необходимое количество смести из емкости согласно нижеприведенной таблице:
|
Масса тела |
Рекомендованная доза |
Количество смеси Сельтавир® на один прием |
|
≤ 15 кг |
30 мг |
2 мл |
|
> 15-23 кг |
45 мг |
3 мл |
|
> 23-40 кг |
60 мг |
4 мл |
Нет необходимости в заборе нерастворенного белого порошка, поскольку он является неактивным наполнителем. Нажав на поршень шприца, ввести все его содержимое во вторую емкость. Оставшуюся неиспользованную смесь необходимо выбросить.
4. Во вторую емкость добавить небольшое количество (не более 1 чайной ложки) подходящего подслащенного продукта питания, чтобы скрыть горький вкус, и хорошо перемешать.
5. Тщательно перемешать смесь и выпить ее сразу же после приготовления. Если в емкости осталось небольшое количество смеси, то следует ополоснуть емкость небольшим количеством воды и выпить оставшуюся смесь.
Повторяйте данную процедуру перед каждым приемом препарата.
Капсулы 30 мг и 45 мг
Для правильного дозирования необходимо следовать следующим инструкциям:
1. Определить необходимое количество капсул Сельтавир®, требующееся для приготовления смеси:
|
Масса тела* |
Количество капсул Сельтавир® для обеспечения рекомендованной дозы с целью лечения в течение 5 дней |
Количество капсул Сельтавир® для обеспечения рекомендованной дозы с целью профилактики |
|
≤ 15 кг |
1 капсула 30 мг 2 раза в сутки |
1 капсула 30 мг 1 раз в сутки |
|
> 15-23 кг |
1 капсула 45 мг 2 раза в сутки |
1 капсула 45 мг 1 раз в сутки |
|
> 23-40 кг |
2 капсулы 30 мг 2 раза в сутки |
2 капсулы 30 мг 1 раз в сутки |
*Дети с массой тела > 40 кг и взрослые могут получать препарат Сельтавир®, используя для приготовления смеси одну капсулу 45 мг + одну капсулу 30 мг 2 раза в сутки для лечения или 1 раз в сутки для профилактики.
2. Убедитесь, что используется правильная доза препарата (в соответствии с вышеприведенной таблицей). Держа одну/или несколько капсул препарата Сельтавир® над маленькой емкостью, аккуратно раскрыть одну/или несколько капсул и высыпать порошок в емкость.
3. Добавить небольшое количество (не более 1 чайной ложки) подходящего подслащенного продукта питания, чтобы скрыть горький вкус, и хорошо перемешать.
4. Тщательно перемешать смесь и выпить ее сразу же после приготовления. Если в емкости осталось небольшое количество смеси, то следует ополоснуть емкость небольшим количеством воды и выпить оставшуюся смесь.
Повторяйте данную процедуру перед каждым приемом препарата.
Побочные эффекты:
В исследованиях по лечению гриппа у взрослых/пациентов подросткового возраста самыми частыми нежелательными реакциями (HP) были тошнота рвота и головная боль. Большинство HP возникали в первый или второй день лечения и проходили самостоятельно в течение 1-2 дней. В исследованиях по профилактике гриппа у взрослых и подростков самыми частыми HP были тошнота, рвота, головная боль и боль. У детей наиболее часто встречалась рвота. Описанные HP в большинстве случаев не требовали отмены препарата.
Лечение и профилактика гриппа у взрослых и подростков
В таблице 1 представлены HP, возникавшие наиболее часто (≥1%) при приеме рекомендованной дозы осельтамивира в исследованиях по профилактике и лечению гриппа у взрослых и подростков (75 мг 2 раза в сутки в течение 5 дней для лечения и 75 мг 1 раз в сутки до 6 недель для профилактики), и частота которых как минимум на 1% выше по сравнению с плацебо. В исследования по лечению гриппа вошли взрослые/подростки без сопутствующей патологии и больные группы риска, т.е. пациенты с высоким риском развития осложнений гриппа (пациенты пожилого и старческого возраста, пациенты с хроническими заболеваниями сердца или органов дыхания). В целом профиль безопасности у пациентов группы риска соответствовал таковому у взрослых/пациентов подросткового возраста без сопутствующей патологии.
В исследованиях по профилактике гриппа профиль безопасности у пациентов, получавших рекомендованную дозу осельтамивира (75 мг 1 раз в сутки до 6 недель), не отличался от такового в исследованиях по лечению гриппа, несмотря на более длительный прием препарата.
Таблица 1. Процент взрослых/подростков с HP, возникавшими с частотой ≥1% в группе осельтамивира в исследованиях по лечению и профилактике гриппозной инфекции (различие с плацебо ≥1%).
|
Системно-органный класс Нежелательная реакция |
Лечение |
Профилактика |
Категория частотыа |
||
|
Осельтамивир (75 мг 2 раза/сут) N=2647 |
Плацебо N=1977 |
Осельтамивир (75 мг 1 раз/сут) N=1945 |
Плацебо N=1588 |
||
|
Нарушения со стороны желудочно-кишечного тракта |
|||||
|
Тошнота |
10% |
6% |
8% |
4% |
очень часто |
|
Рвота |
8% |
3% |
2% |
1 % |
часто |
|
Нарушения со стороны нервной системы |
|||||
|
Головная боль |
2% |
1 % |
17% |
16% |
очень часто |
|
Общие расстройства |
|||||
|
Боль |
<1 % |
<1 % |
4% |
3% |
часто |
а Категория частоты представлена только для группы осельтамивира. Для оценки частоты HP использованы следующие категории частоты: очень часто (≥1/10); часто (≥1/100, <1/10).
Далее представлены нежелательные явления, которые возникали с частотой >1% у взрослых и подростков, получавших осельтамивир в качестве терапии и профилактики гриппозной инфекции. Данные нежелательные явления либо более часто наблюдались у пациентов, получавших плацебо, либо различия в частоте между группами осельтамивира и плацебо составили менее 1%.
Нарушения со стороны желудочно-кишечного тракта (осельтамивир против плацебо): лечение — диарея (6% против 7%), боль в животе (включая боль в верхней части живота, 2% против 3%); профилактика — диарея (3% против 4%), боль в верхней части живота (2% против 2%), диспепсия (1% против 1%).
Инфекции и инвазии (осельтамивир против плацебо): лечение — бронхит (3% против 4%), синусит (1% против 1%), простой герпес (1% против 1%); профилактика — назофарингит (4% против 4%), инфекции верхних дыхательных путей (3% против 3%), гриппозная инфекция (2% против 3%).
Общие расстройства (осельтамивир против плацебо): лечение — головокружение (включая вертиго, 2% против 3%); профилактика — усталость (7% против 7%), пирексия (2% против 2%), гриппоподобное заболевание (1% против 2%), головокружение (1% против 1%), боль в конечности (1% против 1%).
Нарушения со стороны нервной системы (осельтамивир против плацебо): лечение — бессонница (1% против 1%); профилактика — бессонница (1% против 1%).
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения (осельтамивир против плацебо): лечение — кашель (2% против 2%), заложенность носа (1% против 1%); профилактика — заложенность носа (7% против 7%), ангина (5% против 5%), кашель (5% против 6%), ринорея (1% против 1%).
Нарушения со стороны скелетно-мышечной и соединительной ткани (осельтамивир против плацебо): профилактика — боль в спине (2% против 3%), артралгия (1% против 2%), миалгия (1% против 1%).
Нарушения со стороны половых органов и молочной железы (осельтамивир против плацебо): профилактика — дисменорея (3% против 3%).
Лечение и профилактика гриппозной инфекции лиц пожилого и старческого возраста
Профиль безопасности у 942 пациентов пожилого и старческого возраста, получавших осельтамивир или плацебо, клинически не отличался от такового у лиц более молодого возраста (до 65 лет).
Профилактика гриппозной инфекции у пациентов с ослабленным иммунитетом
В 12-недельном исследовании по профилактике гриппа с участием 475 пациентов с ослабленным иммунитетом (включая 18 детей в возрасте от 1 до 12 лет), у пациентов, принимавших осельтамивир (n = 238), профиль безопасности соответствовал описанному ранее в исследованиях по профилактике гриппа.
Лечение и профилактика гриппозной инфекции у детей без сопутствующих заболеваний в возрасте 1-12 лет и пациентов с бронхиальной астмой
В исследованиях по лечению естественной гриппозной инфекции у детей в возрасте от 1 года до 12 лет HP при применении осельтамивира (n = 858), отмеченной с частотой ≥1% и как минимум на 1% чаще по сравнению с плацебо (n = 622), была рвота. У детей, получавших рекомендованную дозу препарата 1 раз в сутки в качестве постконтактной профилактики в домашних условиях, наиболее часто встречалась рвота (8% в группе осельтамивира против 2% в группе, не получавшей профилактическое лечение).
Осельтамивир хорошо переносился, зарегистрированные нежелательные явления соответствовали описанным ранее при проведении лечения гриппа у детей. Далее представлены нежелательные явления, отмеченные у детей с частотой ≥1% в исследованиях по лечению гриппа (n = 858) или с частотой ≥5% в исследованиях по профилактике гриппа (n = 148).
Данные нежелательные явления более часто наблюдались в группе плацебо/отсутствие профилактики, различия между группами осельтамивира и плацебо/отсутствие профилактики составили менее 1%.
Нарушения со стороны желудочно-кишечного тракта (осельтамивир против плацебо): лечение — диарея (9% против 9%), тошнота (4% против 4%), боль в животе (включая боль в верхней части живота, 3% против 3%).
Инфекции и инвазии (осельтамивир против плацебо): лечение — средний отит (5 % против 8 %), бронхит (2% против 3%), пневмония (1% против 3%), синусит (1% против 2%).
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения (осельтамивир против плацебо): лечение — астма (включая обострение, 3% против 4%), носовое кровотечение (2% против 2%); профилактика — кашель (12% против 26%), заложенность носа (11% против 20%).
Нарушения со стороны кожи и подкожных тканей (осельтамивир против плацебо): лечение — дерматит (включая аллергический и атопический дерматит 1% против 2%).
Нарушения со стороны органа слуха и лабиринтные нарушения (осельтамивир против плацебо): лечение — боль в ухе (1% против 1%).
Нарушения со стороны органа зрения (оселътамивир против плацебо): лечение — конъюнктивит (включая покраснение глаз, выделения из глаза и боль в глазах, 1% против <1%).
Дополнительные нежелательные явления, отмеченные при проведении лечения гриппа у детей, не соответствовавшие описанным выше критериям.
Нарушения со стороны крови и лимфатической системы (осельтамивир против плацебо): лечение — лимфоаденопатия (<1% против 1%).
Нарушения со стороны органа слуха и лабиринтные нарушения (осельтамивир против плацебо): лечение — повреждение барабанной перепонки (<1% против 1%).
Постмаркетинговое наблюдение
Далее представлены нежелательные явления при применении осельтамивира, которые наблюдались в период постмаркетингового наблюдения. Частота данных нежелательных явлений и/или причинно-следственная связь с применением препарата не может быть установлена, так как не известен истинный размер популяции в виду добровольного характера сообщений.
Нарушения со стороны кожи и подкожных тканей: реакции гиперчувствительности — дерматит, кожная сыпь, экзема, крапивница, мультиформная экссудативная эритема, синдром Стивенса-Джонсона и токсический эпидермальный некролиз, аллергия, анафилактические и анафилактоидные реакции, отек Квинке.
Нарушения со стороны печени и желчевыводящих путей: гепатит, увеличение активности «печеночных» ферментов у пациентов с гриппоподобными симптомами, получавших осельтамивир; фульминантный гепатит (в том числе с фатальным исходом), печеночная недостаточность, желтуха.
Нарушения со стороны нервно-психической сферы:гриппозная инфекция может ассоциироваться с различными неврологическими симптомами и изменениями поведения, включая такие симптомы, как галлюцинации, бред и анормальное поведение. В некоторых случаях они могут привести к смертельному исходу. Такие явления могут возникать как на фоне развития энцефалопатии или энцефалита, так и без проявления данных заболеваний.
У пациентов (в основном у детей и подростков), принимавших осельтамивир с целью лечения гриппа, были зарегистрированы судороги и делирий (включая такие симптомы, как нарушение сознания, дезориентация во времени и пространстве, анормальное поведение, бред, галлюцинации, возбуждение, тревога, ночные; кошмары). Эти случаи редко сопровождались опасными для жизни действиями. Роль осельтамивира в развитии этих явлений неизвестна. Подобные психоневрологические нарушения так же отмечены у пациентов с гриппом, не получавших осельтамивир.
Нарушения со стороны желудочно-кишечного тракта: желудочно-кишечные кровотечения после приема осельтамивира (в частности, нельзя исключить связь между явлениями геморрагического колита и приемом осельтамивира, поскольку указанные явления исчезали как после выздоровления пациента от гриппа, так и после отмены препарата).
Нарушения со стороны органа зрения: нарушение зрения.
Нарушения со стороны сердца: аритмия.
Передозировка:
В большинстве случаев передозировка в ходе клинических исследований и при постмаркетинговом применении осельтамивира не сопровождалась какими-либо нежелательными явлениями. В остальных случаях симптомы передозировки соответствовали нежелательным явлениям, представленным в разделе «Побочное действие».
Взаимодействие:
Клинически значимые лекарственные взаимодействия маловероятны по данным фармакологических и фармакокинетических исследований.
Осельтамивира фосфат в высокой степени превращается в активный метаболит под действием эстераз, в основном расположенных в печени. Лекарственные взаимодействия, обусловленные конкуренцией за связывание с активными центрами эстераз, в литературных источниках широко не представлены.
Низкая степень связывания осельтамивира и активного метаболита с белками плазмы не дают оснований предполагать наличие взаимодействий, связанных с вытеснением лекарственных средств из связи с белками.
Исследованияin vitro показывают, что ни осельтамивира фосфат, ни его активный метаболит не являются предпочтительным субстратом для полифункциональных оксидаз системы цитохрома Р450 или для глюкуронилтрансфераз. Оснований для взаимодействия с пероральными контрацептивами нет.
Циметидин, неспецифический ингибитор изофермента системы цитохрома Р450 и конкурирующий в процессе канальцевой секреции с препаратами щелочного типа и катионами, не влияет на плазменные концентрации осельтамивира и его активного метаболита.
Маловероятны клинически значимые межлекарственные взаимодействия, связанные с конкуренцией за канальцевую секрецию, принимая во внимание резерв безопасности для большинства подобных препаратов, пути выведения активного метаболита осельтамивира (клубочковая фильтрация и анионная канальцевая секреция), а также выводящую способность каждого из путей.
Пробенецидприводит к увеличению AUC активного метаболита осельтамивира примерно в 2 раза (за счет снижения активной канальцевой секреции в почках). Однако коррекции дозы при одновременном применении с пробенецидом не требуется, учитывая резерв безопасности активного метаболита.
Одновременный прием с амоксициллиномне влияет на плазменные концентрации осельтамивира и его компонентов, демонстрируя слабую конкуренцию за выведение путем анионной канальцевой секреции.
Одновременный прием с парацетамоломне влияет на плазменные концентрации осельтамивира и его активного метаболита или парацетамола.
Фармакокинетических взаимодействий между осельтамивиром, его основным метаболитом не обнаружено при одновременном приеме с парацетамолом, ацетилсалициловой кислотой, циметидином или антацидными средствами (магния и алюминия гидроксид, кальция карбонат), варфарином, римантадином или амантадином.
При использовании осельтемивира с часто применяемыми препаратами, такими как ингибиторы ангиотензинпревращающего фермента (эналаприл, каптоприл), тиазидные диуретики (бендрофлуметиазид), антибиотики (пенициллин, цефалоспорины, азитромицин, эритромицин и доксициклин), блокаторы Н2— гистаминовых рецепторов (ранитидин, циметидин), бета-адреноблокаторы (пропранолол), ксантины (теофиллин), симпатомиметики (псевдоэфедрин), опиаты (кодеин), глюкокортикостероиды, ингаляционные бронхолитики и ненаркотические анальгетики (ацетилсалициловая кислота, ибупрофен и парацетамол), изменений характера или частоты нежелательных явлений не наблюдалось.
Применять осельтамивир в комбинации с препаратами, имеющими узкую широту терапевтического действия (например, хлорпропамид, метотрексат, бутадион), необходимо с осторожностью.
Особые указания:
Нарушения психики
У пациентов (в основном у детей и подростков), принимавших осельтамивир с целью лечения гриппа, были зарегистрированы нарушения со стороны психики, судороги и делирий-подобные психоневрологические нарушения. Эти случаи редко сопровождались опасными для жизни действиями. Роль осельтамивира в развитии этих явлений неизвестна. Подобные психоневрологические нарушения так же отмечены у пациентов с гриппом, не получавших осельтамивир.
Риск развития психоневрологических нарушений у пациентов, получающих осельтамивир, не превышает таковой у пациентов с гриппом, не получающих противовирусные препараты.
Рекомендуется тщательное наблюдение за состоянием и поведением пациентов, особенно детей и подростков, с целью выявления признаков анормального поведения и оценки риска продолжения приема препарата при развитии данных явлений.
Данных по эффективности осельтамивира при любых заболеваниях, вызванных другими возбудителями, кроме вирусов гриппа А и В, нет.
Осельтамивир не является заменой вакцинации.
Профилактический прием препарата возможен по эпидемиологическим показаниям. Рекомендации по коррекции дозы у пациентов с поражением почек представлены в подразделе «Дозирование в особых случаях» (также см. «Фармакокинетика в особых группах пациентов»).
Влияние на способность управлять транспортными средствами и механизмами:
Исследования по изучению влияния препарата на способность управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций, не проводились. Исходя из профиля безопасности, влияние осельтамивира на данные виды деятельности маловероятно.
Форма выпуска/дозировка:
Капсулы, 30 мг, 45 мг и 75 мг.
Упаковка:
По 5, 7, 10, 14 капсул в контурную ячейковую упаковку из пленки поливинилхлоридной и фольги алюминиевой печатной лакированной.
По 10, 20, 30, 40, 50 или 100 капсул в банки из полиэтилентерефталата для лекарственных средств или полипропиленовые для лекарственных средств, укупоренные крышками из полиэтилена высокого давления с контролем первого вскрытия или крышками полипропиленовыми с системой «нажать-повернуть» или крышками из полиэтилена низкого давления с контролем первого вскрытия.
Одну банку или 1, 2, 3, 4, 5 или 10 контурных ячейковых упаковок вместе с инструкцией по применению помещают в картонную упаковку (пачку).
Допускается комплектация по 2 или 3 картонные упаковки (пачки) в групповую упаковку (транспортную тару) из картона для потребительской тары.
Условия хранения:
Хранить при температуре не выше 25 °С.
Хранить в недоступном для детей месте.
Срок годности:
3 года.
Не использовать после истечения срока годности.
Условия отпуска
По рецепту
Производитель
Общество с ограниченной ответственностью «Озон» (ООО «Озон»), 445351, Самарская обл., г. Жигулёвск, ул. Гидростроителей, д. 6, Россия
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
ООО «Атолл»
Купить Сельтавир в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Cell Saver 5+ от Haemonetics – это система для аутотрансфузии (восстановления) потерянной крови после хирургических операциях. Также применяется при дренаже в отделениях реанимации. Устройство исключает риск передачи инфекций и устраняет необходимость применения гемоконцентраторов. Предусмотрен набор для получения тромбоконцентрата перед операцией для дальнейшего переливания и/или получения фибринового геля для обеспечения гемостаза.
Cell Saver 5+ удаляет из крови свободный гемоглабин, липиды, антикоагулянт, внеклеточный калий и продукты распада. Кровь собирается и смешивается антикоагулянтом. Затем производится фильтрация и поступление крови в резервуар, который полностью стерилен. Как только достигнут достаточный объем в автоматическом режиме запускается цикл обработки. Он включает в себя процесс гемоконцентрации и отмывания клеток крови при помощи стерильного физиологического раствора. После завершения циклов эритроциты переливаются в пластиковый мешок для реинфузии.
Система для аутотрансфузии Cell Saver 5+ автоматизирована и запускает циклы обработки при достижении необходимого объема жидкости в резервуаре самостоятельно, что значительно ускоряет и упрощает процесс работы. Работой системы управляет микропроцессор, который анализирует информацию со множества сенсоров. Оптимальные параметры обработки также выбираются автоматически.
Удобная и интуитивно понятная командная панель облегчает управление прибором. Предусмотрен информативный встроенный экран. Система трубок сконструирована таким образом, что исключает риск некорректной установки.
Cell Saver 5+ применяется при хирургических операциях на суставах и позвоночнике, открытом сердце и сосудах, аневризмах, на печени и селезенке. Также применение системы эффективно при разрывной эктопической беременности и ряде нейрохирургических процедур.
Система Cell Saver 5+ успешно совмещает в себе самые передовые сенсорные и микропроцессорные технологии для наилучшего качества и точности работы. Установка оборудована тележкой на маневренных колесиках, поэтому проста в перемещении по отделению.
Характеристики
|
Вес |
Вес аппарата: 34 кг; Вес тележки: 20,4 кг |
|
Насос по крови |
500 мл/мин |
|
Скорость вращения центрифуги |
от 2050 до 5650 об/мин со ступенью 100 об/мин |
|
Гематокрит конечного продукта |
55% в автоматическом режиме (не менее 50% в смешанном режиме) |
|
Типовое время обработки |
3-5 мин |
|
Объем центрифужного колокола |
70,125 и 225 мл. |
|
Страна производства |
США |
|
Размер (ШxВxГ), см |
Размеры аппарата:37х86х41 см с учетом сложенной стойки.; Размеры аппарата без стойки: 37 х 55 х 41 см; Размеры аппарата с тележкой: 48,3 х 122 х 53,5 см |
Для приобретения необходимого Вам устройства, сформируйте заказ. Вы можете сделать это несколькими способами:
- Выбрать понравившийся товар, нажать кнопку «Заказать» и заполнить специальную форму. Затем Вам перезвонит менеджер, чтобы уточнить детали.
- Связаться с нашими сотрудниками по номеру телефона 8 800 500 13 42 или электронной почте info@west-medical.ru.
- Заказать обратный звонок. Для этого необходимо нажать кнопку «Заказать звонок» в шапке сайта. Наши сотрудники оперативно свяжутся с Вами для оформления заказа и консультации.
Мы работаем с физическими и юридическими лицами. Для Вас доступно несколько методов оплаты:
- Наличный расчет при самовывозе товара из нашего офиса или доставке курьером.
- Безналичный расчет банковской картой.
- Безналичный расчет банковским переводом.
Вы можете получить Ваш заказ несколькими способами:
- Курьерская доставка по Москве и Московской области.
- Доставка удобной для Вас транспортной компанией в любой регион России и в страны СНГ.
- Самовывоз из нашего офиса после согласования с менеджером.
10.04.2023
Описание препарата Сельтавир® (капсулы, 30 мг) основано на официальной инструкции, утверждено компанией-производителем в 2023 году
Дата согласования: 10.04.2023
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Отзывы
Действующее вещество
ATX
Фармакологическая группа
Состав
| Капсулы | 1 капс. |
| действующее вещество: | |
| осельтамивира фосфат | 39,41 мг |
| в пересчете на осельтамивир — 30,00 мг | |
| вспомогательные вещества: крахмал кукурузный — 54,35 мг; крахмал прежелатинизированный — 40,00 мг; повидон-К25 — 5,76 мг; кроскармеллоза натрия — 3,04 мг; натрия стеарилфумарат — 1,44 мг | |
| состав корпуса капсулы: краситель хинолиновый желтый — 0,7500%; краситель солнечный закат желтый — 0,0059%; титана диоксид — 2,0000%; желатин — до 100% | |
| состав крышки капсулы: краситель хинолиновый желтый — 0,7500%; краситель солнечный закат желтый — 0,0059%; титана диоксид — 2,0000%; желатин — до 100% |
| Капсулы | 1 капс. |
| действующее вещество: | |
| осельтамивира фосфат | 59,12 мг |
| в пересчете на осельтамивир — 45,00 мг | |
| вспомогательные вещества: крахмал кукурузный — 81,52 мг; крахмал — – 4,56 мг; натрия стеарилфумарат — 2,16 мг | |
| состав корпуса капсулы: краситель железа оксид черный — 0,5400%; титана диоксид — 2,0000%; желатин — до 100%. | |
| состав крышки капсулы: краситель железа оксид черный — 0,5400%; титана диоксид — 2,0000%; желатин — до 100% |
| Капсулы | 1 капс. |
| действующее вещество: | |
| осельтамивира фосфат | 98,53 мг |
| в пересчете на осельтамивир — 75,00 мг | |
| вспомогательные вещества: крахмал кукурузный — 135,87 мг; крахмал прежелатинизированный — 100,00 мг; повидон-К25 — 14,40 мг; кроскармеллоза натрия — 7,60 мг; натрия стеарилфумарат — 3,60 мг | |
| состав корпуса капсулы: краситель железа оксид черный — 0,0500%; титана диоксид — 2,0000%; желатин — до 100% | |
| состав крышки капсулы: краситель хинолиновый желтый — 0,7500%; краситель солнечный закат желтый — 0,0059%; титана диоксид — 2,0000%; желатин — до 100% |
Фармакологическое действие
Фармакологическое действие
—
противовирусное, ингибирующее нейраминидазу.
Фармакодинамика
Противовирусный препарат осельтамивира фосфат является пролекарством, его активный метаболит (осельтамивира карбоксилат, ОК) — эффективный и селективный ингибитор нейраминидазы вирусов гриппа типа А и В — фермента, катализирующего процесс высвобождения вновь образованных вирусных частиц из инфицированных клеток, их проникновения в неинфицированные клетки эпителия дыхательных путей и дальнейшего распространения вируса в организме. Тормозит рост вируса гриппа in vitro и подавляет репликацию вируса и его патогенность in vivo, уменьшает выделение вирусов гриппа А и В из организма. Исследования клинических изолятов вируса гриппа показали, что концентрация ОК, необходимая для ингибирования нейраминидазы на 50% (IC50), составляет 0,1–1,3 нМ для вируса гриппа А и 2,6 нМ для вируса гриппа В. Согласно данным опубликованных исследований, медиана значений IC50 для вируса гриппа В несколько выше и составляет 8,5 нМ.
Клиническая эффективность
В проведенных исследованиях осельтамивир не оказывал влияния на образование противогриппозных антител, в том числе на выработку антител в ответ на введение инактивированной вакцины против гриппа.
Исследования естественной гриппозной инфекции
В клинических исследованиях, проведенных во время сезонной инфекции гриппа, пациенты начинали получать осельтамивир не позднее 40 ч после появления первых симптомов гриппозной инфекции. 97% пациентов были инфицированы вирусом гриппа А и 3% пациентов — вирусом гриппа В. Осельтамивир значительно сокращал период клинических проявлений гриппозной инфекции (на 32 ч.). У пациентов с подтвержденным диагнозом гриппа, принимавших осельтамивир, тяжесть заболевания, выраженная как площадь под кривой для суммарного индекса симптомов, была на 38% меньше по сравнению с пациентами, получавшими плацебо. Более того, у молодых пациентов без сопутствующих заболеваний осельтамивир снижал примерно на 50% частоту развития осложнений гриппа, требующих применения антибиотиков (бронхита, пневмонии, синусита, среднего отита). Были получены четкие доказательства эффективности препарата в отношении вторичных критериев эффективности, относящихся к антивирусной активности: осельтамивир вызывал как укорочение времени выделения вируса из организма, так и уменьшение площади под кривой «вирусные титры-время».
Данные, полученные в исследовании по терапии осельтамивиром у пациентов пожилого и старческого возраста, показывают, что прием осельтамивира в дозе 75 мг 2 раза в сутки в течение 5 дней сопровождался клинически значимым уменьшением медианы периода клинических проявлений гриппозной инфекции, аналогичным таковому у взрослых пациентов более молодого возраста, однако различия не достигли статистической значимости. В другом исследовании больные гриппом старше 13 лет, имевшие сопутствующие хронические заболевания сердечно-сосудистой и/или дыхательной систем, получали осельтамивир в том же режиме дозирования или плацебо. Отличий в медиане периода до уменьшения клинических проявлений гриппозной инфекции в группах осельтамивира и плацебо не было, однако период повышения температуры при приеме осельтамивира сокращался примерно на 1 день. Доля пациентов, выделяющих вирус на 2-й и 4-й день, становилась значительно меньше. Профиль безопасности осельтамивира у пациентов группы риска не отличался от такового в общей популяции взрослых пациентов.
Лечение гриппа у детей
У детей в возрасте 1–12 лет (средний возраст 5,3 года), имевших лихорадку (≥37,8 °C) и один из симптомов со стороны дыхательной системы (кашель или ринит) в период циркуляции вируса гриппа среди населения, было проведено двойное слепое плацебо-контролируемое исследование. 67% пациентов были инфицированы вирусом гриппа А и 33% пациентов — вирусом гриппа В. Осельтамивир (при приеме не позднее 48 ч после появления первых симптомов гриппозной инфекции) значительно снижал продолжительность заболевания (на 35,8 ч) по сравнению с плацебо. Продолжительность заболевания определялась как время до купирования кашля, заложенности носа, исчезновения лихорадки, возвращения к обычной активности. В группе детей, получавших осельтамивир, частота острого среднего отита снижалась на 40% по сравнению с группой плацебо. Выздоровление и возвращение к обычной активности наступало почти на 2 дня раньше у детей, получавших осельтамивир, по сравнению с группой плацебо.
В другом исследовании участвовали дети в возрасте 6–12 лет, страдающие бронхиальной астмой; 53,6% пациентов имели гриппозную инфекцию, подтвержденную серологически и/или в культуре. Медиана продолжительности заболевания в группе пациентов, получавших осельтамивир, значительно не снижалась. Но к последнему 6-му дню терапии осельтамивиром объем форсированного выдоха за 1 сек (ОФВ1) повышался на 10,8% по сравнению с 4,7% у пациентов, получавших плацебо.
Профилактика гриппа у взрослых и подростков
Профилактическая эффективность осельтамивира при естественной гриппозной инфекции А и В была доказана в клинических исследованиях. На фоне приема осельтамивира гриппом заболели около 1% пациентов. Осельтамивир также значительно уменьшал частоту выделения вируса и предотвращал передачу вируса от одного члена семьи к другому.
Взрослые и подростки, которые были в контакте с больным членом семьи, начинали прием осельтамивира в течение двух дней после возникновения симптомов гриппа у члена семьи и продолжали его в течение 7 дней, что достоверно уменьшало частоту случаев гриппа у контактировавших лиц на 92%.
У непривитых и в целом здоровых взрослых в возрасте 18–65 лет прием осельтамивира во время эпидемии гриппа существенно снижал заболеваемость гриппом (на 76%). Пациенты принимали препарат в течение 42 дней.
У лиц пожилого и старческого возраста, находившихся в домах для престарелых, 80% из которых были привиты перед сезоном, когда проводилось исследование, осельтамивир снижал заболеваемость гриппом на 92%. В том же исследовании осельтамивир (на 86%) уменьшал частоту осложнений гриппа: бронхита, пневмонии, синусита. Пациенты принимали препарат в течение 42 дней.
Профилактика гриппа у детей
Профилактическая эффективность осельтамивира при естественной гриппозной инфекции была продемонстрирована у детей от 1 года до 12 лет после контакта с заболевшим членом семьи или с кем-то из постоянного окружения. Основным параметром эффективности была частота лабораторно подтвержденной гриппозной инфекции. У детей, получавших осельтамивир в дозе от 30 до 75 мг 1 раз в день в течение 10 дней и не выделявших вирус исходно, частота лабораторно подтвержденного гриппа уменьшилась до 4% по сравнению с 21% в группе плацебо.
Профилактика гриппа у лиц с ослабленным иммунитетом
У лиц с ослабленным иммунитетом при сезонной гриппозной инфекции и при отсутствии вирусовыделения исходно профилактическое применение осельтамивира приводило к снижению частоты лабораторно подтвержденной гриппозной инфекции, сопровождающейся клинической симптоматикой, до 0,4% по сравнению с 3% в группе плацебо. Лабораторно подтвержденная гриппозная инфекция, сопровождающаяся клинической симптоматикой, диагностировалась при наличии температуры в полости рта выше 37,2 °C, кашля и/или острого ринита (все зарегистрированные в один и тот же день во время приема препарата/плацебо), а также положительного результата обратно-транскриптазной полимеразной цепной реакции на РНК вируса гриппа.
Резистентность
Клинические исследования
Риск появления вирусов гриппа со сниженной чувствительностью или резистентностью к препарату изучался в клинических исследованиях. У всех пациентов — носителей ОК-резистентного вируса носительство имело временный характер, не влияло на элиминацию вируса и не вызывало ухудшения клинического состояния.
| Популяция пациентов | Пациенты с мутациями, приводящими к резистентности | |
| Фенотипирование* | Гено- и фенотипирование* | |
| Взрослые и подростки | 4/1245 (0,32%) | 5/1245 (0,4%) |
| Дети (1–12 лет) | 19/464 (4,1 %) | 25/464 (5,4 %) |
* Полное генотипирование не было проведено ни в одном из исследований.
При приеме осельтамивира с целью постконтактной профилактики (7 дней), профилактики контактировавших в семье (10 дней) и сезонной профилактики (42 дня) у лиц с нормальной функцией иммунной системы случаев резистентности к препарату не отмечено. В 12-недельном исследовании по сезонной профилактике у лиц с ослабленным иммунитетом случаев возникновения резистентности также не наблюдалось.
Данные отдельных клинических случаев и наблюдательных исследований
У пациентов, не получавших осельтамивир, обнаружены возникающие в природных условиях мутации вирусов гриппа А и В, которые обладали сниженной чувствительностью к осельтамивиру. В 2008 году мутация по типу замены H275Y, приводящая к резистентности, была обнаружена более чем у 99 % штаммов вируса 2008 H1N1, циркулирующих в Европе. Вирус гриппа 2009 H1N1 (свиной грипп) в большинстве случаев был чувствителен к осельтамивиру. Устойчивые к осельтамивиру штаммы обнаружены у лиц с нормальной функцией иммунной системы и лиц с ослабленным иммунитетом, принимавших осельтамивир. Степень снижения чувствительности к осельтамивиру и частота встречаемости подобных вирусов может отличаться в зависимости от сезона и региона. Устойчивость к осельтамивиру обнаружена у пациентов с пандемическим гриппом H1N1, получавших препарат как для лечения, так и для профилактики.
Частота встречаемости резистентности может быть выше у более молодых пациентов и пациентов с ослабленным иммунитетом. Устойчивые к осельтамивиру лабораторные штаммы вирусов гриппа и вирусы гриппа от пациентов, получавших терапию осельтамивиром, несут мутации нейраминидазы N1 и N2. Мутации, приводящие к устойчивости, часто являются специфическими для подтипа нейраминидазы.
При принятии решения о применении осельтамивира следует учитывать сезонную чувствительность вируса гриппа к препарату (последнюю информацию можно найти на сайте ВОЗ).
Доклинические данные
Доклинические данные, полученные на основании стандартных исследований по изучению фармакологической безопасности, генотоксичности и хронической токсичности, не выявили особой опасности для человека.
Канцерогенность
Результаты 3 исследований по выявлению канцерогенного потенциала (2-летних исследований на крысах и мышах для осельтамивира и одного 6-месячного исследования на трансгенных мышах (Tg: AC для активного метаболита) были отрицательными.
Мутагенность: стандартные генотоксические тесты для осельтамивира и активного метаболита были отрицательными.
Влияние на фертильность: осельтамивир в дозе 1500 мг/кг/сут не влиял на репродуктивную функцию самцов и самок крыс.
Тератогенность
В исследованиях по изучению тератогенности осельтамивира в дозе до 1500 мг/кг/сут (на крысах) и до 500 мг/кг/сут (на кроликах) влияния на эмбриональное развитие не обнаружено. В исследованиях по изучению антенатального и постнатального периодов развития у крыс при введении осельтамивира в дозе 1500 мг/кг/сут наблюдалось увеличение периода родов: предел безопасности между экспозицией для человека и максимальной не оказывающей эффекта дозой у крыс (500 мг/кг/сут) для осельтамивира выше в 480 раз, а для его активного метаболита — в 44 раза. Экспозиция у плода составляла 15–20% от таковой у матери.
Прочее
Осельтамивир и активный метаболит проникают в молоко лактирующих крыс. Согласно ограниченным данным, осельтамивир и его активный метаболит проникают в грудное молоко женщины. По результатам экстраполяции данных, полученных в исследованиях у животных, их количество в грудном молоке может составлять 0,01 мг/сут и 0,3 мг/сут соответственно.
Примерно у 50% протестированных морских свинок при введении максимальных доз активной субстанции осельтамивира наблюдалась сенсибилизация кожи в виде эритемы. Также выявлено обратимое раздражение глаз у кроликов.
В то время как очень высокие пероральные однократные дозы (657 мг/кг и выше) осельтамивира фосфата не оказывали влияния на взрослых крыс, данные дозы оказывали токсическое действие на незрелых 7-дневных детенышей крыс, в т.ч. приводили к гибели животных. Нежелательных эффектов не наблюдалось при хроническом введении в дозе 500 мг/кг/сут с 7-го по 21-й день постнатального периода.
Фармакокинетика
Абсорбция
Осельтамивира фосфат легко всасывается в желудочно-кишечном тракте и в высокой степени превращается в активный метаболит под действием печеночных и кишечных эстераз. Концентрация активного метаболита в плазме определяется в пределах 30 мин, время достижения максимальной концентрации 2-3 ч, и более чем в 20 раз превышает концентрацию пролекарства. Не менее 75% принятой внутрь дозы попадает в системный кровоток в виде активного метаболита, менее 5% — в виде исходного препарата. Плазменные концентрации как пролекарства, так и активного метаболита пропорциональны дозе и не зависят от приема пищи.
Распределение
Объем распределения активного метаболита — 23 л.
По данным исследований, проведенных на животных, после приема внутрь осельтамивира фосфата его активный метаболит обнаруживался во всех основных очагах инфекции (легких, промывных водах бронхов, слизистой оболочке полости носа, среднем ухе и трахее) в концентрациях, обеспечивающих противовирусный эффект.
Связь активного метаболита с белками плазмы — 3%. Связь пролекарства с белками плазмы 42%, что недостаточно, чтобы служить причиной существенных лекарственных взаимодействий.
Метаболизм
Осельтамивира фосфат в высокой степени превращается в активный метаболит под действием эстераз, находящихся преимущественно в печени. Ни осельтамивира фосфат, ни активный метаболит не являются субстратами или ингибиторами изоферментов системы цитохрома Р450.
Выведение
Выводится (>90%) в виде активного метаболита преимущественно почками. Активный метаболит не подвергается дальнейшей трансформации и выводится почками (>99%) путем клубочковой фильтрации и канальцевой секреции. Почечный клиренс (18,8 л/ч) превышает скорость клубочковой фильтрации (7,5 л/ч), что указывает на то, что препарат выводится еще и путем канальцевой секреции. Через кишечник выводится менее 20% принятого препарата. Период полувыведения активного метаболита 6–10 ч.
Фармакокинетика в особых группах пациентов
Пациенты с поражением почек. При применении осельтамивира (100 мг два раза в сутки в течение 5 дней) у пациентов с различной степенью поражения почек площадь под кривой «концентрация активного метаболита в плазме — время» (AUC осельтамивира карбоксилата) обратно пропорциональна снижению функции почек.
Фармакокинетика осельтамивира у пациентов с терминальной стадией почечной недостаточности (с клиренсом креатинина <10 мл/мин), не находящихся на диализе, не изучалась. В связи с этим рекомендации по дозированию у данной группы пациентов отсутствуют.
Пациенты с поражением печени. Полученные in vitro и в исследованиях на животных данные об отсутствии значительного повышения AUC осельтамивира фосфата при нарушении функции печени легкой и средней степени тяжести были подтверждены и в клинических исследованиях. Безопасность и фармакокинетика осельтамивира фосфата у пациентов с тяжелым нарушением функции печени не изучалась.
Пациенты пожилого и старческого возраста. У пациентов пожилого и старческого возраста (65–78 лет) экспозиция метаболита в равновесном состоянии на 25–35% выше, чем у более молодых пациентов при назначении аналогичных доз осельтамивира. Период полувыведения препарата у пациентов пожилого и старческого возраста существенно не отличался от такового у более молодых пациентов. С учетом данных по экспозиции препарата и его переносимости пациентам пожилого и старческого возраста коррекции дозы при лечении и профилактике гриппа не требуется.
Дети в возрасте от 1 года до 8 лет и подростки. Фармакокинетику осельтамивира изучали у детей от 1 года до 16 лет в фармакокинетическом исследовании с однократным приемом осельтамивира и в клиническом исследовании по изучению многократного приема осельтамивира у небольшого числа детей в возрасте 3–12 лет.
Скорость выведения активного метаболита с поправкой на массу тела у детей младшего возраста выше, чем у взрослых, что приводит к более низким AUC по отношению к конкретной дозе. Прием препарата в дозе 2 мг/кг и однократных доз в 30 мг и 45 мг, обеспечивает такую же AUC осельтамивира карбоксилата, какая достигается у взрослых после однократного приема капсулы с 75 мг препарата (что эквивалентно примерно 1 мг/кг).
Фармакокинетика осельтамивира у детей старше 12 лет такая же, как у взрослых.
Показания
лечение гриппа у взрослых и детей в возрасте старше 1 года;
профилактика гриппа у взрослых и подростков старше 12 лет, находящихся в группах повышенного риска инфицирования вирусом (в воинских частях и больших коллективах, у ослабленных пациентов);
профилактика гриппа у детей старше 1 года.
Противопоказания
повышенная чувствительность к осельтамивира фосфату или любому компоненту препарата, терминальная стадия почечной недостаточности (клиренс креатинина ≤10 мл/мин);
тяжелая печеночная недостаточность;
детский возраст до 1 года.
С осторожностью: беременность; период грудного вскармливания.
Применение при беременности и кормлении грудью
Контролируемых исследований у беременных женщин не проводилось. Однако результаты постмаркетинговых и наблюдательных исследований продемонстрировали пользу предлагаемого стандартного режима дозирования для данной популяции пациентов. Результаты фармакокинетического анализа показали более низкую экспозицию активного метаболита (приблизительно на 30% в течение всех триместров беременности) у беременных женщин по сравнению с небеременными. Тем не менее значение расчетной экспозиции остается выше ингибирующих концентраций (значение IC95) и терапевтических значений для многих штаммов вируса гриппа. Изменение режима дозирования у беременных женщин при проведении терапии или профилактики не рекомендуется. Не обнаружено прямого или опосредованного неблагоприятного влияния препарата на беременность, эмбриофетальное или постнатальное развитие (см. Доклинические данные). При назначении осельтамивира беременным женщинам следует учитывать, как данные по безопасности, так и течение беременности, и патогенность циркулирующего штамма вируса гриппа.
Во время доклинических исследований осельтамивир и активный метаболит проникали в молоко лактирующих крыс. Данные по экскреции осельтамивира с грудным молоком у женщины и применению осельтамивира кормящими женщинами ограничены. Осельтамивир и его активный метаболит в небольших количествах проникают в грудное молоко (см. Доклинические данные), создавая субтерапевтические концентрации в крови грудного ребенка. При назначении осельтамивира кормящим женщинам следует также учитывать сопутствующее заболевание и патогенность циркулирующего штамма вируса гриппа.
При беременности и в период грудного вскармливания осельтамивир применяют только в случае, если предполагаемая польза для матери превышает потенциальный риск для плода и ребенка.
Способ применения и дозы
Внутрь, независимо от приема пищи или во время еды. Переносимость препарата можно улучшить, если принимать его во время еды.
В случаях, когда у взрослых, подростков и детей существует проблема с проглатыванием капсул или при наличии признаков «старения» капсул (например, повышенная хрупкость или другие нарушения физиологического состояния), необходимо открыть капсулу и высыпать ее содержимое в небольшое количество (максимально 1 чайная ложка) подходящего подслащенного продукта питания (шоколадный сироп с нормальным содержанием сахара или без содержания сахара, мед, светло-коричневый сахар или столовый сахар, растворенный в воде, сладкий десерт, сгущенное молоко с сахаром, яблочное пюре или йогурт) для того, чтобы скрыть горький вкус. Смесь необходимо тщательно перемешать и дать пациенту целиком. Следует проглотить смесь сразу же после приготовления.
Стандартный режим дозирования
Лечение
Прием препарата необходимо начинать не позднее 2 суток с момента развития симптомов заболевания.
Взрослые и подростки в возрасте ≥12 лет
Рекомендуемая суточная доза составляет 150 мг. Препарат назначают в дозе 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 2 раза в сутки внутрь в течение 5 дней.
Дети с массой тела более 40 кг или в возрасте от 8 лет до 12 лет
Дети, которые умеют проглатывать капсулы, также могут получать лечение, принимая по 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 2 раза в сутки в течение 5 дней.
Дети в возрасте от 1 года до 8 лет
Рекомендованный режим дозирования осельтамивира капсулы 30 и 45 мг или экстемпорально приготовленная суспензия.
| Масса тела, кг | Рекомендованная доза в течение 5 дней |
| ≤15 | 30 мг два раза в сутки |
| >15–23 | 45 мг два раза в сутки |
| >23–40г > 40 |
60 мг два раза в сутки 75 мг два раза в сутки |
Профилактика
Прием препарата необходимо начинать не позднее 2 суток после контакта с больными.
Взрослые и подростки в возрасте ≥12 лет
По 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 1 раз в сутки внутрь в течение не менее 10 дней после контакта с больным. Во время сезонной эпидемии гриппа — по 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 1 раз в сутки в течение 6 недель. Профилактическое действие продолжается столько, сколько длится прием препарата.
Дети с массой тела более 40 кг или в возрасте от 8 лет до 12 лет
Дети, которые могут проглатывать капсулы, также могут получать профилактическую терапию, принимая по 75 мг (одна капсула 75 мг или одна капсула 30 мг + одна капсула 45 мг) 1 раз в сутки в течение 10 дней.
Дети в возрасте от 1 года до 8 лет
Рекомендованный режим дозирования осельтамивира капсулы 30 и 45 мг или экстемпорально приготовленная суспензия.
| Масса тела, кг | Рекомендованная доза в течение 10 дней |
| <15 | 30 мг 1 раз в сутки |
| >15–23 | 45 мг 1 раз в сутки |
| >23–40 >40 |
60 мг 1 раз в сутки 75 мг 1 раз в сутки |
Дозирование в особых случаях
Пациенты с нарушением функции почек
Лечение
Пациентам с клиренсом креатинина более 60 мл/мин коррекции дозы не требуется. У пациентов с клиренсом креатинина от 30 до 60 мл/мин дозу осельтамивира следует уменьшить до 30 мг два раза в сутки в течение 5 дней.
У пациентов с клиренсом креатинина от 10 до 30 мл/мин дозу осельтамивира следует уменьшить до 30 мг один раз в сутки в течение 5 дней. Пациентам, находящимся на постоянном гемодиализе, осельтамивир в первоначальной дозе 30 мг можно принять до начала диализа, если симптомы гриппа появились в течение 48 ч между сеансами диализа. Для поддержания плазменной концентрации на терапевтическом уровне осельтамивир следует принимать по 30 мг после каждого сеанса диализа. Пациентам, находящимся на перитонеальном диализе, осельтамивир следует принимать в первоначальной дозе 30 мг до начала проведения диализа, затем по 30 мг каждые 5 дней.
Фармакокинетика осельтамивира у пациентов с терминальной стадией хронической почечной недостаточности (с клиренсом креатинина ≤10 мл/мин), не находящихся на диализе, не изучалась. В связи с этим рекомендации по дозированию у данной группы пациентов отсутствуют.
Профилактика
Пациентам с клиренсом креатинина более 60 мл/мин коррекции дозы не требуется. У пациентов с клиренсом креатинина от 30 до 60 мл/мин дозу осельтамивира следует уменьшить до 30 мг один раз в сутки. У пациентов с клиренсом креатинина от 10 до 30 мл/мин рекомендуется уменьшить дозу осельтамивира до 30 мг через день. Пациентам, находящимся на постоянном гемодиализе, осельтамивир в первоначальной дозе 30 мг можно принять до начала диализа. Для поддержания плазменной концентрации на терапевтическом уровне осельтамивир следует принимать по 30 мг после каждого последующего нечетного сеанса диализа. Пациентам, находящимся на перитонеальном диализе, осельтамивир следует принимать в первоначальной дозе 30 мг до начала проведения диализа, затем по 30 мг каждые 7 дней. Фармакокинетика осельтамивира у пациентов с терминальной стадией хронической почечной недостаточности (с клиренсом креатинина ≤10 мл/мин), не находящихся на диализе, не изучалась. В связи с этим рекомендации по дозированию у данной группы пациентов отсутствуют.
Пациенты с нарушением функции печени
Коррекции дозы при лечении и профилактике гриппа у пациентов с нарушением функции печени легкой и средней степени тяжести не требуется. Безопасность и фармакокинетика осельтамивира у пациентов с тяжелыми нарушениями функции печени не изучалась.
Пациенты пожилого и старческого возраста
Коррекции дозы для профилактики или лечения гриппа не требуется.
Пациенты с ослабленным иммунитетом (после трансплантации)
Для сезонной профилактики гриппа у пациентов с ослабленным иммунитетом в возрасте ≥1 года — в течение 12 недель, коррекции дозы не требуется.
Дети
Сельтавир в данной лекарственной форме не следует назначать детям до 1 года.
Экстемпоральное приготовление суспензии
В случаях, когда у взрослых, подростков и детей существует проблема с проглатыванием капсул или при наличии признаков «старения» капсул, необходимо открыть капсулу и высыпать ее содержимое в небольшое количество (максимально 1 чайная ложка) подходящего подслащенного продукта питания (см. выше) для того, чтобы скрыть горький вкус. Смесь необходимо тщательно перемешать и дать пациенту целиком. Следует проглотить смесь сразу же после приготовления.
Капсулы 75 мг
Если пациентам требуется доза 75 мг, то необходимо следовать следующим инструкциям.
1. Держа одну капсулу 75 мг препарата Сельтавир® над маленькой емкостью, аккуратно раскрыть капсулу и высыпать порошок в емкость.
2. Добавить небольшое количество (не более 1 чайной ложки) подходящего подслащенного продукта питания (чтобы скрыть горький вкус) и хорошо перемешать.
3. Тщательно перемешать смесь и принять ее сразу же после приготовления. Если в емкости осталось небольшое количество смеси, то следует ополоснуть емкость небольшим количеством воды и выпить оставшуюся смесь.
Если пациентам требуется доза 30–60 мг, то необходимо следовать следующим инструкциям.
1. Держа одну капсулу 75 мг препарата Сельтавир® над маленькой емкостью, аккуратно раскрыть капсулу и высыпать порошок в емкость.
2. Добавить в порошок 5 мл воды с помощью шприца с метками, показывающими количество набранной жидкости. Тщательно перемешать в течение 2 минут.
3. Набрать в шприц необходимое количество смеси из емкости согласно нижеприведенной таблице.
| Масса тела, кг | Рекомендованная доза, мг | Количество смеси Сельтавир® на один прием, мл |
| ≤15 | 30 | 2 |
| >15–23 | 45 | 3 |
| >23–40 | 60 | 4 |
Нет необходимости в заборе нерастворенного белого порошка, поскольку он является неактивным наполнителем. Нажав на поршень шприца, ввести все его содержимое во вторую емкость. Оставшуюся неиспользованную смесь необходимо выбросить.
4. Во вторую емкость добавить небольшое количество (не более 1 чайной ложки) подходящего подслащенного продукта питания, чтобы скрыть горький вкус, и хорошо перемешать.
5. Тщательно перемешать смесь и принять ее сразу же после приготовления. Если в емкости осталось небольшое количество смеси, то следует ополоснуть емкость небольшим количеством воды и выпить оставшуюся смесь.
Повторять данную процедуру перед каждым приемом препарата.
Капсулы 30 и 45 мг
Для правильного дозирования необходимо следовать следующим инструкциям.
1. Определить необходимое количество капсул Сельтавир®, требующееся для приготовления смеси.
| Масса тела*, кг | Количество капсул Сельтавир® для обеспечения рекомендованной дозы с целью лечения в течение 5 дней | Количество капсул Сельтавир® для обеспечения рекомендованной дозы с целью профилактики |
| ≤15 | 1 капсула 30 мг 2 раза в сутки | 1 капсула 30 мг 1 раз в сутки |
| >15–23 | 1 капсула 45 мг 2 раза в сутки | 1 капсула 45 мг 1 раз в сутки |
| >23–40 | 2 капсулы 30 мг 2 раза в сутки | 2 капсулы 30 мг 1 раз в сутки |
*Дети с массой тела >40 кг и взрослые могут получать препарат Сельтавир®, используя для приготовления смеси одну капсулу 45 мг + одну капсулу 30 мг 2 раза в сутки для лечения или 1 раз в сутки для профилактики.
2. Убедиться, что используется правильная доза препарата (в соответствии с вышеприведенной таблицей). Держа одну/или две капсулы препарата Сельтавир® над маленькой емкостью, аккуратно раскрыть одну/или несколько капсул и высыпать порошок в емкость.
3. Добавить небольшое количество (не более 1 чайной ложки) подходящего подслащенного продукта питания, чтобы скрыть горький вкус, и хорошо перемешать.
4. Тщательно перемешать смесь и принять ее сразу же после приготовления. Если в емкости осталось небольшое количество смеси, то следует ополоснуть емкость небольшим количеством воды и выпить оставшуюся смесь.
Повторять данную процедуру перед каждым приемом препарата.
Побочные действия
В исследованиях по лечению гриппа у взрослых/пациентов подросткового возраста самыми частыми нежелательными реакциями (HP) были тошнота, рвота и головная боль. Большинство HP возникали в первый или второй день лечения и проходили самостоятельно в течение 1–2 дней. В исследованиях по профилактике гриппа у взрослых и подростков самыми частыми HP были тошнота, рвота, головная боль и боль. У детей наиболее часто встречалась рвота. Описанные HP в большинстве случаев не требовали отмены препарата.
Лечение и профилактика гриппа у взрослых и подростков
В таблице представлены HP, возникавшие наиболее часто (≥1%) при приеме рекомендованной дозы осельтамивира в исследованиях по профилактике и лечению гриппа у взрослых и подростков (75 мг 2 раза в сутки в течение 5 дней для лечения и 75 мг 1 раз в сутки до 6 недель для профилактики), и частота которых как минимум на 1% выше по сравнению с плацебо. В исследования по лечению гриппа вошли взрослые/подростки без сопутствующей патологии и больные группы риска, т.е. пациенты с высоким риском развития осложнений гриппа (пациенты пожилого и старческого возраста, пациенты с хроническими заболеваниями сердца или органов дыхания). В целом профиль безопасности у пациентов группы риска соответствовал таковому у взрослых/пациентов подросткового возраста без сопутствующей патологии.
В исследованиях по профилактике гриппа профиль безопасности у пациентов, получавших рекомендованную дозу осельтамивира (75 мг 1 раз в сутки до 6 недель), не отличался от такового в исследованиях по лечению гриппа, несмотря на более длительный прием препарата.
Таблица 1
Процент взрослых/подростков с HP, возникавшими с частотой ≥1% в группе осельтамивира в исследованиях по лечению и профилактике гриппозной инфекции (различие с плацебо ≥1%)
| Системноорганный класс Нежелательная реакция |
Лечение | Профилактика | Категория *частоты | ||
| Осельтамивир (75 мг 2 раза/сут) n=2647 |
Плацебо n=1977 |
Осельтамивир (75 мг 1 раз/сут) n=1945 |
Плацебо n=1588 |
||
| Нарушения со стороны желудочно-кишечного тракта | |||||
| Тошнота | 10% | 6% | 8% | 4% | очень часто |
| Рвота | 8% | 3 % | 2% | 1 % | часто |
| Нарушения со стороны нервной системы | |||||
| Головная боль | 2% | 1% | 17% | 16% | очень часто |
| Общие расстройства | |||||
| Боль | <1 % | <1% | 4% | 3% | часто |
*Категория частоты представлена только для группы осельтамивира. Для оценки частоты HP использованы следующие категории частоты: очень часто (≥1/10); часто (≥1/100, <1/10).
Далее представлены нежелательные явления, которые возникали с частотой >1% у взрослых и подростков, получавших осельтамивир в качестве терапии и профилактики гриппозной инфекции. Данные нежелательные явления либо более часто наблюдались у пациентов, получавших плацебо, либо различия в частоте между группами осельтамивира и плацебо составили менее 1%.
Нарушения со стороны желудочно-кишечного тракта (осельтамивир против плацебо): лечение — диарея (6% против 7%), боль в животе (включая боль в верхней части живота, 2% против 3%); профилактика — диарея (3% против 4%), боль в верхней части живота (2% против 2%), диспепсия (1% против 1%).
Инфекции и инвазии (осельтамивир против плацебо): лечение — бронхит (3% против 4%), синусит (1% против 1%), простой герпес (1% против 1%); профилактика — назофарингит (4% против 4%), инфекции верхних дыхательных путей (3% против 3%), гриппозная инфекция (2% против 3%).
Общие расстройства (осельтамивир против плацебо): лечение — головокружение (включая вертиго, 2% против 3%); профилактика — усталость (7% против 7%), пирексия (2% против 2%), гриппоподобное заболевание (1% против 2%), головокружение (1% против 1%), боль в конечности (1% против 1%).
Нарушения со стороны нервной системы (осельтамивир против плацебо): лечение — бессонница (1% против 1%); профилактика — бессонница (1% против 1%).
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения (осельтамивир против плацебо): лечение — кашель (2% против 2%), заложенность носа (1% против 1%); профилактика — заложенность носа (7% против 7%), ангина (5% против 5%), кашель (5% против 6%), ринорея (1% против 1%).
Нарушения со стороны скелетно-мышечной системы и соединительной ткани (осельтамивир против плацебо): профилактика — боль в спине (2% против 3%), артралгия (1% против 2%), миалгия (1% против 1%).
Нарушения со стороны половых органов и молочной железы (осельтамивир против плацебо): профилактика — дисменорея (3% против 3%).
Лечение и профилактика гриппозной инфекции лиц пожилого и старческого возраста
Профиль безопасности у 942 пациентов пожилого и старческого возраста, получавших осельтамивир или плацебо, клинически не отличался от такового у лиц более молодого возраста (до 65 лет).
Профилактика гриппозной инфекции у пациентов с ослабленным иммунитетом
В 12-недельном исследовании по профилактике гриппа с участием 475 пациентов с ослабленным иммунитетом (включая 18 детей в возрасте от 1 до 12 лет), у пациентов, принимавших осельтамивир (n=238), профиль безопасности соответствовал описанному ранее в исследованиях по профилактике гриппа.
Лечение и профилактика гриппозной инфекции у детей без сопутствующих заболеваний в возрасте 1–12 лет и пациентов с бронхиальной астмой
В исследованиях по лечению естественной гриппозной инфекции у детей в возрасте от 1 года до 12 лет HP при применении осельтамивира (n= 858), отмеченной с частотой ≥1% и как минимум на 1% чаще по сравнению с плацебо (n=622), была рвота. У детей, получавших рекомендованную дозу препарата 1 раз в сутки в качестве постконтактной профилактики в домашних условиях, наиболее часто встречалась рвота (8% в группе осельтамивира против 2% в группе, не получавшей профилактическое лечение).
Осельтамивир хорошо переносился, зарегистрированные нежелательные явления соответствовали описанным ранее при проведении лечения гриппа у детей. Далее представлены нежелательные явления, отмеченные у детей с частотой ≥1% в исследованиях по лечению гриппа (n=858) или с частотой ≥5% в исследованиях по профилактике гриппа (n=148). Данные нежелательные явления более часто наблюдались в группе плацебо/отсутствие профилактики, различия между группами осельтамивира и плацебо/отсутствие профилактики составили менее 1%.
Нарушения со стороны желудочно-кишечного тракта (осельтамивир против плацебо): лечение — диарея (9% против 9%), тошнота (4% против 4%), боль в животе (включая боль в верхней части живота, 3% против 3%).
Инфекции и инвазии (осельтамивир против плацебо): лечение — средний отит (5% против 8%), бронхит (2% против 3%), пневмония (1% против 3%), синусит (1% против 2%).
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения (осельтамивир против плацебо): лечение — астма (включая обострение, 3% против 4%), носовое кровотечение (2% против 2%); профилактика — кашель (12% против 26%), заложенность носа (11% против 20%).
Нарушения со стороны кожи и подкожных тканей (осельтамивир против плацебо): лечение — дерматит (включая аллергический и атопический дерматит, 1% против 2%).
Нарушения со стороны органа слуха и лабиринтные нарушения (осельтамивир против плацебо): лечение — боль в ухе (1% против 1%).
Нарушения со стороны органа зрения (осельтамивир против плацебо): лечение — конъюнктивит (включая покраснение глаз, выделения из глаза и боль в глазах, 1% против <1%).
Дополнительные нежелательные явления, отмеченные при проведении лечения гриппа у детей, не соответствовавшие описанным выше критериям.
Нарушения со стороны крови и лимфатической системы (осельтамивир против плацебо): лечение — лимфоаденопатия (<1% против 1%).
Нарушения со стороны органа слуха и лабиринтные нарушения (осельтамивир против плацебо): лечение — повреждение барабанной перепонки (<1% против 1%).
Постмаркетинговое наблюдение
Далее представлены нежелательные явления при применении осельтамивира, которые наблюдались в период постмаркетингового наблюдения. Частота данных нежелательных явлений и/или причинно-следственная связь с применением препарата не может быть установлена, так как неизвестен истинный размер популяции в виду добровольного характера сообщений.
Нарушения со стороны кожи и подкожных тканей: реакции гиперчувствительности — дерматит, кожная сыпь, экзема, крапивница, мультиформная экссудативная эритема, синдром Стивенса-Джонсона и токсический эпидермальный некролиз, аллергия, анафилактические и анафилактоидные реакции, отек Квинке.
Нарушения со стороны печени и желчевыводящих путей: гепатит, увеличение активности печеночных ферментов у пациентов с гриппоподобными симптомами, получавших осельтамивир; фульминантный гепатит (в том числе с фатальным исходом), печеночная недостаточность, желтуха.
Нарушения со стороны нервно-психической сферы: гриппозная инфекция может ассоциироваться с различными неврологическими симптомами и изменениями поведения, включая такие симптомы, как галлюцинации, бред и анормальное поведение. В некоторых случаях они могут привести к смертельному исходу. Такие явления могут возникать как на фоне развития энцефалопатии или энцефалита, так и без проявления данных заболеваний.
У пациентов (в основном у детей и подростков), принимавших осельтамивир с целью лечения гриппа, были зарегистрированы судороги и делирий (включая такие симптомы, как нарушение сознания, дезориентация во времени и пространстве, анормальное поведение, бред, галлюцинации, возбуждение, тревога, ночные кошмары). Эти случаи редко сопровождались опасными для жизни действиями. Роль осельтамивира в развитии этих явлений неизвестна. Подобные психоневрологические нарушения также отмечены у пациентов с гриппом, не получавших осельтамивир.
Нарушения со стороны желудочно-кишечного тракта: желудочно-кишечные кровотечения после приема осельтамивира (в частности, нельзя исключить связь между явлениями геморрагического колита и приемом осельтамивира, поскольку указанные явления исчезали как после выздоровления пациента от гриппа, так и после отмены препарата).
Нарушения со стороны органа зрения: нарушение зрения.
Нарушения со стороны сердца: аритмия.
Взаимодействие
Клинически значимые лекарственные взаимодействия маловероятны, по данным фармакологических и фармакокинетических исследований. Осельтамивира фосфат в высокой степени превращается в активный метаболит под действием эстераз, в основном расположенных в печени.
Лекарственные взаимодействия, обусловленные конкуренцией за связывание с активными центрами эстераз, в литературных источниках широко не представлены. Низкая степень связывания осельтамивира и активного метаболита с белками плазмы не дает оснований предполагать наличие взаимодействий, связанных с вытеснением лекарственных средств из связи с белками.
Исследования in vitro показывают, что ни осельтамивира фосфат, ни его активный метаболит не являются предпочтительным субстратом для полифункциональных оксидаз системы цитохрома Р450 или для глюкуронилтрансфераз. Оснований для взаимодействия с пероральными контрацептивами нет.
Циметидин, неспецифический ингибитор изофермента системы цитохрома Р450, конкурирующий в процессе канальцевой секреции с препаратами щелочного типа и катионами, не влияет на плазменные концентрации осельтамивира и его активного метаболита.
Маловероятны клинически значимые межлекарственные взаимодействия, связанные с конкуренцией за канальцевую секрецию, принимая во внимание, резерв безопасности для большинства подобных препаратов, пути выведения активного метаболита осельтамивира (клубочковая фильтрация и анионная канальцевая секреция), а также выводящую способность каждого из путей.
Пробенецид приводит к увеличению AUC активного метаболита осельтамивира примерно в 2 раза (за счет снижения активной канальцевой секреции в почках). Однако коррекции дозы при одновременном применении с пробенецидом не требуется, учитывая резерв безопасности активного метаболита.
Одновременный прием с амоксициллином не влияет на плазменные концентрации осельтамивира и его компонентов, демонстрируя слабую конкуренцию за выведение путем анионной канальцевой секреции.
Одновременный прием с парацетамолом не влияет на плазменные концентрации осельтамивира и его активного метаболита или парацетамола.
Фармакокинетических взаимодействий осельтамивира, его основного метаболита не обнаружено при одновременном приеме с парацетамолом, ацетилсалициловой кислотой, циметидином или антацидными средствами (магния и алюминия гидроксид, кальция карбонат), варфарином, римантадином или амантадином. При использовании осельтамивира с часто применяемыми препаратами, такими как ингибиторы ангиотензинпревращающего фермента (эналаприл, каптоприл), тиазидные диуретики (бендрофлуметиазид), антибиотики (пенициллин, цефалоспорины, азитромицин, эритромицин и доксициклин), блокаторы Н2-гистаминовых рецепторов (ранитидин, циметидин), бета-адреноблокаторы (пропранолол), ксантины (теофиллин), симпатомиметики (псевдоэфедрин), опиаты (кодеин), глюкокортикостероиды, ингаляционные бронхолитики и ненаркотические анальгетики (ацетилсалициловая кислота, ибупрофен и парацетамол), изменений характера или частоты нежелательных явлений не наблюдалось.
Применять осельтамивир в комбинации с препаратами, имеющими узкую широту терапевтического действия (например, хлорпропамид, метотрексат, бутадион), необходимо с осторожностью.
Передозировка
В большинстве случаев передозировка в ходе клинических исследований и при постмаркетинговом применении осельтамивира не сопровождалась какими-либо нежелательными явлениями. В остальных случаях симптомы передозировки соответствовали нежелательным явлениям, представленным в разделе «Побочные действия».
Особые указания
Нарушения психики
У пациентов (в основном у детей и подростков), принимавших осельтамивир с целью лечения гриппа, были зарегистрированы нарушения со стороны психики, судороги и делирийподобные психоневрологические нарушения. Эти случаи редко сопровождались опасными для жизни действиями. Роль осельтамивира в развитии этих явлений неизвестна. Подобные психоневрологические нарушения также отмечены у пациентов с гриппом, не получавших осельтамивир. Риск развития психоневрологических нарушений у пациентов, получающих осельтамивир, не превышает таковой у пациентов с гриппом, не получающих противовирусные препараты.
Рекомендуется тщательное наблюдение за состоянием и поведением пациентов, особенно детей и подростков, с целью выявления признаков анормального поведения и оценки риска продолжения приема препарата при развитии данных явлений.
Данных по эффективности осельтамивира при любых заболеваниях, вызванных другими возбудителями, кроме вирусов гриппа А и В, нет.
Осельтамивир не является заменой вакцинации.
Профилактический прием препарата возможен по эпидемиологическим показаниям. Рекомендации по коррекции дозы у пациентов с поражением почек представлены в подразделе Дозирование в особых случаях (также см. Фармакокинетика в особых группах пациентов).
Влияние на способность управлять транспортными средствами, механизмами. Исследования по изучению влияния препарата на способность управлять транспортными средствами и заниматься другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций, не проводились. Исходя из профиля безопасности, влияние осельтамивира на данные виды деятельности маловероятно.
Форма выпуска
Капсулы, 30 мг, 45 мг, 75 мг.
По 5, 7, 10, 14 капсул в контурную ячейковую упаковку из пленки поливинилхлоридной либо пленки поливинилхлоридной/поливинилиденхлоридной и фольги алюминиевой печатной лакированной.
Или по 5, 7, 10, 14 капсул в контурную ячейковую упаковку из материала комбинированного на основе фольги (трехслойный материал, включающий алюминиевую фольгу, пленку из ориентированного полиамида, поливинилхлоридную пленку) и фольги алюминиевой печатной лакированной.
1, 2, 3, 4, 5 или 10 контурных ячейковых упаковок вместе с инструкцией по медицинскому применению (листок-вкладыш) помещают в картонную упаковку (пачку).
Производитель
ООО «Озон». Россия, Самарская обл., г.о. Жигулевск, г. Жигулевск, ул. Гидростроителей, д. 6.
Держатель регистрационного удостоверения. ООО «Атолл». Россия, 445351, Самарская обл., г. Жигулевск, ул. Гидростроителей, д. 6.
Организация, принимающая претензии от потребителей. ООО «Озон». Россия, 445351, Самарская обл., г.о. Жигулевск, г. Жигулевск, ул. Гидростроителей, д. 6.
Тел.: (987) 459-99-91, (987) 459-99-92.
e-mail: ozon@ozon-pharm.ru
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.

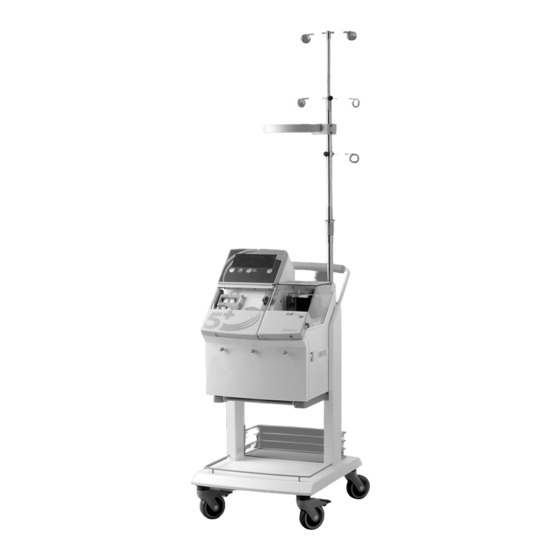
 Part Procedure Air Detector 1. Floss with lint-free cloth dampened with clear water. 2. Floss again using a dry lint-free cloth. Air Filter 1.
Part Procedure Air Detector 1. Floss with lint-free cloth dampened with clear water. 2. Floss again using a dry lint-free cloth. Air Filter 1. 