Болезнь Шегрена
Также:
болезнь шёгрена
Версия: Клинические рекомендации РФ 2013-2017 (Россия)
Категории МКБ:
Другие перекрестные синдромы (M35.1), Прогрессирующий системный склероз (M34.0), Системный склероз (M34), Сухой синдром [Шегрена] (M35.0)
Разделы медицины:
Ревматология
Общая информация
Краткое описание
Общероссийская общественная организация Ассоциация ревматологов России
Федеральные клинические рекомендации по диагностике и лечению болезни Шегрена
Клинические рекомендации «Синдром Шегрена» прошли общественную экспертизу, согласованны и утверждены 17 декабря 2013 г., на заседании Пленума правления АРР, проведенного совместно с профильной комиссией МЗ РФ по специальности «ревматология». (Президент АРР, академик РАН — Е.Л.Насонов)
Болезнь Шёгрена (БШ) — системное заболевание неизвестной этиологии, характерной чертой которого является хронический аутоиммунный и лимфопролиферативный процесс в секретирующих эпителиальных железах с развитием паренхиматозного сиаладенита с ксеростомией и сухого кератоконъюнктивита с гиполакримией.
Синдром Шёгрена (СШ) — аналогичное болезни Шёгрена поражение слюнных и слёзных желёз, развивающееся у 5-25% больных с системными заболеваниями соединительной ткани, чаще ревматоидным артритом, у 50-75% больных с хроническими аутоиммунными поражениями печени (хронический аутоиммунный гепатит, первичный билиарный цирроз печени) и реже при других аутоиммунных заболеваниях.
Код по МКБ-10
М.35.0 Системная красная волчанка
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 500 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Классификационные критерии синдрома Шёгрена (Sjogren’s International Collaborative Clinical Alliance = SICCA, 2012г)
1. Наличие анти-SSA/Ro и (или) анти-SSB/La антиядерных антител или позитивный РФ и АНФ
2. В биоптате малых слюнных желез – очаговая лимфоцитарная инфильтрация ( ≥ 1 фокус в 4 мм²)
3. Сухой кератоконъюнктивит — ≥ 3 балла по шкале окраски глазного эпителия флюоресцеином и лиссаминовым зелёным* (исключить антиглаукомные глазные капли, угнетающие продукцию внутриглазной жидкости, операции на роговице и блефаропластику ).
Заболевание может быть классифицировано как синдром Шёгрена при соответствии двум из трёх пунктов критериев при исключении: облучения головы и шеи, HCV-инфекции, ВИЧ-инфекции, саркоидоза, амилоидоза, IgG4-связанного заболевания, РА, СКВ, ССД и других аутоиммунных заболеваний.
* Оценочная шкала окраски глазного эпителия
Эпидемиология
Заболеваемость БШ колеблется от 4 до 250 случаев на 100000 населения. Пик заболеваемости приходится на 135-50 лет. Женщины страдают в 8-10 раз чаще мужчин. Смертность при БШ в 3 раза выше, чем в популяции.
Диагностика
Диагноз БШ устанавливается на основании жалоб, анамнестических данных, клинико-лабораторного и инструментального обследования пациента, при исключении других заболеваний.
Клинические признаки, повышающие вероятность диагноза БШ
Поражение секретирующих эпителиальных желёз (аутоиммунный эпителиит).
· Слюнные железы поражаются у всех больных по типу рецидивирующего паренхиматозного сиаладенита (чаще паротита), реже субмаксиллита в сочетании с сиалодохитом у четверти больных, или наблюдается постепенное увеличение околоушных/поднижнечелюстных слюнных желёз, крайне редко малых слюнных желёз слизистой полости рта.
· Различной степени тяжести сухой коньюнктивит/кератоконъюнктивит (снижение слёзовыделения по стимулированному тесту Ширмера < 10мм/ за 5 минут, дистрофия эпителия конъюнктивы и роговицы I-III cтепени, нитчатый кератит, ксероз роговицы) присутствует у всех больных в зависимости от длительности течения и определяемой стадии развития заболевания. Язва с возможной перфорацией роговицы является серьезным осложнением текущего сухого кератоконъюнктивита.
· Хейлит, рецидивирующий афтозный/грибковый стоматит, сухой субатрофический/атрофический ринофаринголарингит являются основными проявлениями поражений слизистой оболочки полости рта.
· Поражение эпителия желчевыводящих путей и канальцевого аппарата почек с формированием билиарных поражений печени и канальцевого ацидоза.
Внежелезистые системные проявления
· Артралгии наблюдаются у 70% больных. У трети больных встречается рецидивирующий неэрозивный артрит, преимущественно мелких суставов кистей.
· Гипергаммаглобулинемическая пурпура, являющаяся клиническим признаком лимфоцитарного васкулита, и криоглобулинемическая пурпура, как проявление лейкоцитокластического (нейтрофильного, деструктивного) васкулита, наблюдаются у трети больных. При втором типе васкулита нередко образуются язвы, преимущественно на голенях, реже на верхних конечностях и слизистой оболочке полости рта.
· Интерстициальный нефрит, значительно реже наблюдается гломерулонефрит мезангиопролиферативного, мембранопролиферативного типа с развитием в некоторых случаях нефротического синдрома.
· Поражение периферической нервной системы (сенсорная, сенсорно-моторная полинейропатия, множественная мононевропатия, мононеврит, радикулоневропатия, туннельная невропатия (редко)) наблюдается у трети больных с длительным течением заболевания и генерализованным васкулитом.
Методы диагностики
Для диагностики паренхиматозного сиаладенита используют
· сиалографию околоушной слюнной железы с омнипаком (обнаружение полостей >1 мм в диаметре характерно для паренхиматозного паротита)
· биопсию малых слюнных желёз нижней губы (обнаружение 100 и более клеток в поле зрения в среднем при просмотре не менее 4-х малых слюнных желёз является диагностичным).
· биопсию увеличенных околоушных/поднижнечелюстных слюнных желез (с целью диагностики MALT-лимфомы)
· сиалометрию (снижение стимулированной секреции слюны <2,5 мл/5 мин используют для обьективизации степени ксеростомии)
· УЗИ и МРТ слюнных желез (для оценки структуры, размеров и локализации внутрижелезистых лимфоузлов и паренхимы желез)
Для диагностики сухого кератоконъюнктивита используют
· тест Ширмера (снижение слёзовыделения после стимуляции нашатырным спиртом менее 10 мм за 5 мин свидетельствует о гипофункции слезных желез)
· окрашивание эпителия конъюнктивы и роговицы флюоресцеином и лиссаминовым зеленым (позволяет диагностировать повреждение эпителия коньюнктивы и роговицы)
· определение стабильности слезной пленки по времени образования «сухих пятен» на роговице (в норме составляет более 10 сек). Время разрыва слезной пленки – это временной интервал между последним морганием и появлением первого «сухого пятна» разрыва в слёзной плёнке, окрашенной 0,1% раствором флюоресцеина
Лабораторные исследования
· Лейкопения является характерным признаком заболевания, часто ассоциирована с высокой иммунологической активностью и наличием антилейкоцитарных антител в крови.
· Высокие цифры СОЭ выявляются у половины больных и, как правило, связаны с диспротеинемическими нарушениями (высокими цифрами общего белка и гипергаммаглобулинемией). Воспалительный характер СОЭ может быть следствием генерализованного васкулита, серозита, развития лимфом или присоединения вторичной инфекции.
· Увеличение СРБ не характерно для БШ. Высокие цифры наблюдаются только при выпотном серозите, гломерулонефрите, деструктивном васкулите с развитием язвенно-некротических поражений, демиелинизирующей невропатии и агрессивных лимфом.
· Ревматоидный и антинуклеарный фактор определяются у 95-100% больных БШ. Высокие цифры РФ характерны для больных, имеющих криоглобулинемический васкулит и морфологические признаки формирования MALT-ткани в слюнных/слёзных железах и легких. Наиболее характерным типом свечения АНФ является крапчатый, реже выявляется гомогенный и периферический тип, антицентромерный и крайне редко встречается NUMA тип свечения.
· Антитела к Ro/SS-A и La/SS-B ядерным антигенам при использовании иммуноферментного метода выявляются у 85-100% больных. Одновременное обнаружение Ro и La антител наиболее специфично для БШ, но наблюдается у 40-50% больных, в остальных случаях обнаруживаются только Ro и крайне редко только La антитела. Ro антитела часто выявляются у больных с различными вариантами СШ (РА, СКВ, ССД, ПБЦ, ХАГ), что затрудняет дифференциальную диагностику и требует дополнительных методов исследования. La антитела более специфичны для заболевания.
· Криоглобулины выявляются у трети больных БШ, и у 40% из них определяется II тип криоглобулинемии (смешанная моноклональная криоглобулинемия). В отличие от больных с криоглобулинемическим васкулитом, ассоциированным с HCV инфекцией, у больных БШ отсутствует связь с вирусами гепатита В и С.
· Снижение С4 компонента комплемента является прогностически неблагоприятным признаком, влияющим на выживаемость больных при этом заболевании, и отражает активное течение криоглобулинемического васкулита, также как и является предиктором возможного развития лимфопролиферативного заболевания.
· Поликлональная гипергаммаглобулинемия, преимущественно за счёт увеличения IgG и IgA, реже IgM, встречается у 50-60% больных. Моноклональные иммуноглобулины, чаще М класса, в сыворотке крови и их легкие цепи в моче (белок Бенс-Джонса) выявляются у 20% больных БШ. У 50-60% больных при обнаружении моноклональной секреции иммуноглобулинов удаётся диагностировать НХЛ.
Диагностика БШ основана на выявлении у больных одновременного поражения глаз и слюнных желёз, а также лабораторных признаков аутоиммунного заболевания (ревматоидный/антинуклеарный фактор, антитела к Ro/La ядерным антигенам).
Отечественные критерии диагноза БШ (ФГБУ НИИР РАМН, 2001г)
I. Сухой кератоконъюнктивит
1) снижение слезовыделения по тесту Ширмера < 10мм за 5 минут
2) окрашивание эпителия роговицы/конъюнктивы флюоресцеином (I-IIIст.)
3) снижение времени разрыва прекорнеальной слёзной плёнки < 10 секунд
II. Паренхимотозный сиаладенит
1) Сиалометрия стимулированная < 2,5 мл за 5 мин
2) Сиалография — обнаружение полостей > 1 мм
3) Очагово-диффузная лимфогистиоцитарная инфильтрация в биоптатах
малых слюнных желез ( ≥ 2 фокусов* в 4 мм²)
III. Лабораторные признаки аутоиммунного заболевания
1) Положительный РФ или
2) Положительный АНФ или
3) Наличие анти-SSA/Ro и (или) анти-SSB/La антиядерных антител
*Фокус — скопление не менее 50 лимфоидных клеток в 4мм2 поверхности слюнной железы. Средний фокус оценивается по 4 малым слюнным железам.
Диагноз определенной БШ может быть поставлен при наличии первых двух критериев (I, II) и не менее одного признака из III критерия, при исключении СКВ, ССД, РА и аутоиммунных гепатобилиарных заболеваний. СШ может быть поставлен при наличии чётко верифицированного аутоиммунного заболевания и одного из первых двух критериев.
Дифференциальный диагноз
Дифференциальная диагностика
· Наиболее часто в ревматологической практике необходимо проводить дифференциальную диагностику между БШ и СШ в сочетании с РА, ССД, СКВ, аутоиммунным гепатитом, первичным билиарным циррозом печени.
· Помимо БШ сухость глаз и полости рта может быть следствием многих причин.
Сухость глаз
1) структурные нарушения слёзной плёнки
— дефицит водного слоя (сухой кератоконъюнктивит)
— дефицит муцина (гиповитаминоз А, пемфигус, химические ожоги, синдром Стивена-Джонса)
— дефицит жирового слоя (блефарит)
2) роговичная эпителиопатия (поражение V черепного нерва, ношение контактных линз)
3) дисфункция век
Дефицит слёз
1) Заболевания слёзных желёз
Первичные
— врождённая алакримия
— приобретенная алакримия
— первичное заболевание слёзных желёз
Вторичные
— саркоидоз
— ВИЧ
— реакция трансплантат против хозяина
— ксерофтальмия
2) Слёзная обструкция
— трахома
— офтальмологическая рубцовая пузырчатка
— синдром Стивена-Джонса
— ожоги
3) Рефлекторные нарушения
— нейропатический кератит
— контактные линзы
— паралич лицевого нерва
Сухость рта
— Лекарственные препараты (диуретики, антидепрессанты, нейролептики, транквилизаторы, седативные, антихолинергические, антигистаминные)
— Психогенные факторы (тревожное состояние, депрессия)
— Системные заболевания (саркоидоз, туберкулёз, амилоидоз, сахарный диабет, панкреатит, IgG4 склерозирующий сиалоаденит, лимфомы)
— Дегидратация
— Вирусные инфекции
— Аплазия или недоразвитие слюнных желёз (редко)
— Облучение
— Постменопауза
— Белковое голодание
Увеличение слюнных и/или слёзных желез, характерное для многих заболеваний, входящих в круг дифференциальной диагностики БШ, может быть одно- или двухсторонним.
Увеличение слёзных желез
Двухстороннее:
Бактериальный/вирусный дакриоаденит
Гранулематозные поражения (туберкулез, саркоидоз )
Лимфопролиферативные заболевания
Идиопатическое воспалительное заболевание орбиты
Доброкачественная лимфоидная гиперплазия (MALT-дакриоаденит)
IgG4-связанные заболевания (IgG4-связанный псевдотумор орбит и склерозирую-
щий дакриоаденит)
Гистиоцитозы (ювенильная ксантогранулёма, ретикулогистиоцитоз )
Одностороннее
Бактериальный/вирусный дакриоаденит
Лимфопролиферативные заболевания с поражением слёзных желёз
Первичные опухоли:
Эпителиальные (аденома, аденокарцинома)
Смешанные (ангиома, меланома)
Увеличение слюнных желез
Одностороннее
Бактериальные инфекции
Хронический сиаладенит
Сиалолитиаз
Первичные неоплазии (аденома, аденокарцинома, лимфома, смешанная опухоль слюнных желёз)
Двухстороннее
Бактериальные/вирусные инфекции (Эпштейн Барр, цитомегаловирус, коксаки, паромиксовирус, герпес, ВИЧ, вирус эпидемического паротита)
Гранулёматозные заболевания (туберкулез, саркоидоз)
AL-амилоидоз, мастоцитоз
Метаболические нарушения (гиперлипидемия, сахарный диабет, подагра, алкогольный цирроз печени)
Акромегалия
Анорексия, гипоменструальный синдром
IgG4-связанные склерозирующие сиалоадениты
Лимфоэпителиальный сиаладенит
Онкоцитарная гиперплазия слюнных желёз
Лимфомы
Лечение
Лечение проводится в зависимости от наличия железистых и внежелезистых проявлений, и иммуновоспалительной активности заболевания.
Цели лечения
· Достижение клинико-лабораторной ремиссии заболевания.
· Улучшение качества жизни больных.
· Предотвращение развития опасных для жизни проявлений заболевания (генерализованный язвенно-некротический васкулит, тяжёлые поражения центральной и периферической нервной системы, аутоиммунные цитопении, лимфопролиферативные заболевания).
Нефармакологические подходы к сухому синдрому (D)
1. Избегать ситуаций, усиливающих сухость слизистых оболочек: сухой или кондиционированный воздух, сигаретный дым, сильный ветер, длительная зрительная (особенно компьютерная), речевая или психоэмоциональная нагрузка.
2. Ограничить применение препаратов, усугубляющих сухость (диуретики, трициклические антидепрессанты, бета-блокаторы, антигистаминные), и определенных раздражающих веществ (кофе, алкоголь, никотин).
3. Частое употребление небольших количеств воды или не содержащей сахара жидкости облегчает симптомы сухости рта. Полезна вкусовая и механическая стимуляция саливации с использованием жевательной резинки и леденцов без сахара.
4. Скрупулезная гигиена полости рта, использование зубной пасты и ополаскивателей с фторидами, тщательный уход за зубными протезами, регулярное посещение стоматолога обязательно с профилактической целью относительно прогрессирующего кариеса и периодонтита.
5. Терапевтические контактные линзы могут служить дополнительной протекцией эпителия роговицы, однако, их ношение должно сопровождаться адекватным увлажнением и профилактической инстилляцией антибиотиков.
Применение точечной окклюзии входных отверстий носослезного канала: временной (силиконовые или коллагеновые пробки) или чаще перманентной (прижигание или хирургическое вмешательство).
Лечение железистых проявлений БШ.
1. Для лечения железистых проявлений используют локальную терапию сухого синдрома (увлажняющие заместители, иммуномодулирующие препараты), стимуляторы эндогенной секреции слюнных и слезных желез.
Для улучшения саливации и терапии сухого кератоконъюнктивита возможно применение препаратов системного действия (малые дозы ГК и лейкерана (C), ритуксимаб (РТМ) (А).
2. Для замещения объема слезы пациентам следует 3-4 и > раз в день использовать искусственные слезы, содержащие 0,1-0,4% гиалуронат натрия, 0,5-1% гидроксипропилметилцеллюлозу, 0,5-1% карбоксиметилцеллюлозу, 0,1-3% декстран 70. При необходимости интервал между закапыванием слез может быть сокращен до 1 часа. Препараты без консервантов позволяют избежать раздражения глаз. Для пролонгирования эффекта возможно использование препаратов искусственной слезы большей вязкости. Такие препараты лучше применять на ночь из-за возникновения эффекта помутнения зрения (В).
3. Глазные капли на основе сыворотки крови применимы для пациентов с непереносимостью искусственных слез или тяжелым, резистентным к лечению сухим кератоконъюнктивитом. Обязательно чередование с антибактериальными каплями (В).
4. Использование препаратов-заменителей слюны на основе муцина и карбоксиметилцеллюлозы восполняет её смазывающие и увлажняющие функции, особенно во время ночного сна (Oral balance гель, Biotene ополаскиватель, Salivart, Xialine). (В).
5. Учитывая высокую частоту развития кандидозной инфекции при наличии сухого синдрома, показано локальное и системное противогрибковое лечение (нистатин, клотримазол, флуконазол) (D) [21-22].
6. У пациентов со значительным увеличением околоушных, поднижнечелюстных слюнных и слёзных желёз, рецидивирующим характером паренхиматозного сиалоаденита противопоказана их рентгенотерапия ввиду значительного нарастания сухости и увеличения риска развития лимфом (С).
7. Офтальмологическая эмульсия Циклоспорина А (Restasis) рекомендуется для лечения сухого кератоконъюнктивита. Считается оптимальным назначение 0,05% глазных капель два раза в день в течение 6-12 мес. (В).
8. Локальное применение НПВП (0,1% индометацин, 0,1% диклофенак) уменьшает дискомфортные ощущения в глазах, однако, может провоцировать повреждения роговицы (С).
9. Приемлемым считается локальное применение ГК короткими курсами (до двух недель) при обострении сухого кератоконъюнктивита. (С). Потенциальные побочные эффекты, повышение внутриглазного давления, развитие катаракты, ограничивают длительность применения ГК. Для локального применения лучше подходят Лотепреднол (Lotemax) и Римексолон (Vexol), не обладающие типичными побочными эффектами.
10. Для стимуляции остаточной секреции слюнных и слезных желез системно применяются агонисты М1 и М3 мускариновых рецепторов: пилокарпин (Salagen) 5 мг 4 раза в день или цевимелин (Evoxac) 30 мг 3 раза в день. (А).
11. Диквафозол, агонист пуриновых P2Y2 рецепторов, стимулирует нежелезистую секрецию водного, муцинового и липидного компонента слезной пленки. Используется локально 2% раствор (В).
12. 2% офтальмологическая эмульсия ребамипида, повышающего количество муциноподобных веществ и слезной жидкости, улучшает повреждения роговицы и конъюнктивы (В). Пероральный прием ребамипида (Мукоген) по 100 мг 3 раза в день улучшает симптомы сухости рта (A).
13. Облегчение сухости верхних дыхательных путей (ринит, синусит, ларингит, бронхит) достигается при приеме бромгексина или ацетилцистеина в терапевтических дозах. (С).
14. При диспареунии, обусловленной недостаточной лубрикацией, помимо местного использование лубрикантов, в постменопаузальном периоде показано локальное и системное применение эстрогенов (D).
Лечение внежелезистых системных проявлений БШ.
Для лечения системных внежелезистых проявления БШ используются ГК, алкилирующие цитостатические (лейкеран, циклофосфан), биологические (ритуксимаб) препараты.
1. Больным с рецидивирующими сиаладенитами и минимальными системными проявлениями, такими как суставной синдром, назначают ГК в малых дозах (преднизолон 5 мг в день или через день) либо НПВП (С).
2. При значительном увеличении больших слюнных желёз (после исключения лимфомы), диффузной инфильтрации малых слюнных желёз, отсутствии признаков тяжёлых системных проявлений, умеренных и значительных сдвигах показателей лабораторной активности необходимо назначение малых доз ГК в сочетании с лейкераном 2-4 мг/сут в течение года, затем 6-14 мг/неделю в течение нескольких лет (С).
3. При лечении васкулита (криоглобулинемический гломерулонефрит, поражение периферической и центральной нервной системы, рецидивирующая пурпура и язвенно-некротическое поражение кожи) назначается циклофосфан. В комбинации с малыми дозами ГК циклофосфан в дозе 200 мг/неделю в течение 3 месяцев с последующим переходом на 400 мг/месяц применяется при не угрожающих жизни системных проявлениях заболевания (рецидивирующая криоглобулинемическая пурпура, смешанная моноклональная криоглобулинемия, сенсорно-моторная полинейропатия) (С).
4. Тяжелые системные проявления БШ, такие как криоглобулинемический и интерстициальный нефрит, язвенно-некротический васкулит, сенсорно-моторная нейропатия аксонально-демиелинизирующего и демиелинизирующего типа, мононеврит, полиневрит, энцефаломиелополирадикулоневрит, миозит, интерстициальный пневмонит, генерализованная лимфаденопатия, аутоиммунная гемолитическая анемия и тромбоцитопения, а также MALT-лимфома слюнных желез, требуют более высоких доз преднизолона (20-60 мг/сут) и цитостатических средств (лейкеран 6-10 мг/сут, циклофосфан 0,8-3,0 г/месяц) в сочетании с интенсивными методами терапии (С).
5. Длительный приём малых доз ГК в комбинации с лейкераном или циклофосфаном не только снижает частоту рецидивов паротита, приводит к нормализации размеров слюнных желёз, уменьшает показатели лабораторной активности, улучшает клиническую симптоматику и замедляет прогрессирование многих системных проявлений заболевания, но и достоверно повышает саливацию, уменьшает частоту развития лимфом и увеличивает выживаемость больных БШ (С).
6. Внутривенный иммуноглобулин применяется в лечении агранулоцитоза, аутоиммунной тромбоцитопении, гемолитической анемии при БШ, а также у отдельных больных с выраженной сенсорной нейропатией при резистентности к терапии (D).
Интенсивная терапия (пульс-терапия ГК, комбинированная пульс-терапия ГК и циклофосфаном, эфферентные методы терапии — криоаферез, плазмаферез, двойная фильтрация плазмы в сочетании с комбинированной пульс-терапией) должна использоваться при тяжелых и угрожающих жизни проявлениях БШ с целью купирования высокой иммуновоспалительной активности, изменения характера течения и улучшения прогноза заболевания (D).
Показания к проведению пульс-терапии (D)
:
· выпотной серозит
· тяжёлые лекарственные аллергические реакции
· аутоиммунная гемолитическая анемия и тромбоцитопения
· при наличии противопоказаний для проведения комбинированной пульс-терапии.
Пульс-терапия позволяет снизить дозу пероральных ГК и уменьшить частоту их побочных проявлений (D).
Показания к комбинированной пульс-терапии (D)
:
· острый криоглобулинемический гломерулонефрит, гломерулонефрит с быстро прогрессирующей почечной недостаточностью
· язвенно-некротический васкулит
· аутоиммунная панцитопения
· интерстициальный пневмонит
· мононеврит, полиневрит, энцефаломиелополирадикулоневрит, поперечный и восходящий миелит, цереброваскулит
После достижения клинического эффекта и нормализации иммуновоспалительной активности заболевания больные переводятся на поддерживающие дозы ГК и алкилирующих цитостатических препаратов (С).
Показания к проведению экстракорпоральной терапии (D)
:
Абсолютные
· язвенно-некротический васкулит
· криоглобулинемический гломерулонефрит
· энцефаломиелополирадикулоневрит, демиелинизирующая миелопатия, полиневрит
· ишемия верхних и нижних конечностей вследствие криоглобулинемического васкулита.
· синдром гипервязкости крови
Относительные
· гипергаммаглобулинемическая пурпура
· мононеврит
· лекарственный дерматит, отек Квинке, феномен Артюса
· интерстициальный пневмонит
· гемолитическая анемия, тромботическая тромбоцитопеническая пурпура
В случаях аллергических реакций, интерстициального нефрита с признаками хронической почечной недостаточности, при низких цифрах общего белка в сыворотке крови, тяжёлых офтальмологических проявлениях (буллёзно-нитчатый кератит, язвы роговицы) предпочтительно использование гемосорбции, криоафереза. При остальных системных проявлениях более эффективным является плазмаферез, криоаферез и двойная фильтрация плазмы. Последние два метода наиболее эффективны при смешанной моноклональной криоглобулинемии. Обычно процедуры проводятся с 2-5-дневным интервалом с введением после каждой процедуры 250-1000 мг метилпреднизолона и 200-1000 мг циклофосфана в зависимости от тяжести системных проявлений и иммуновоспалительной активности заболевания. Для больных с нормальным или низким общим белком сыворотки крови предпочтительно применять двойную фильтрацию плазмы, криоаферез с гепаринокриофракционированием плазменных белков. Всего проводится 3-5 процедур при наличии гипергаммаглобулинемической пурпуры и 5-8 процедур при криоглобулинемической пурпуре. При васкулите, обусловленном смешанной моноклональной криоглобулинемией, целесообразно использовать программный плазмаферез в течение года до достижения стойкой клинико-лабораторной ремиссии (D).
Применение генно-инженерных биологических препаратов
Применение анти-В клеточной терапии ритуксимабом (РТМ) позволяет контролировать системные внежелезистые проявления БШ и уменьшать функциональную железистую недостаточность. РТМ улучшает клиническое течение БШ без увеличения частоты побочных эффектов.
· РТМ назначается больным БШ с тяжелыми системными проявлениями (криоглобулинемический васкулит, гломерулонефрит, энцефаломиелополирадикулоневрит, интерстициальный пневмонит, аутоиммунная панцитопения), а также в случаях резистентности или недостаточной эффективности традиционного лечения ГК и цитостатическими препаратами. С целью усиления эффективности РТМ показана комбинированная терапия с циклофосфаном (D).
· У больных с небольшой длительностью БШ и сохраненной остаточной секрецией слюнных и слезных желез монотерапия РТМ приводит к увеличению саливации и улучшению офтальмологических проявлений (А).
· РТМ назначается при БШ, осложненной лимфомой низкой степени злокачественности MALT-типа: локализованной экстранодальной лимфомой слюнных, слезных желез или легких, без поражения костного мозга. Проводится как монотерапия РТМ, так и комбинированная терапия РТМ и циклофосфаном (D).
На протяжении всего периода терапии должен осуществляться клинико-лабораторный мониторинг основных параметров БШ. При использовании цитостатических препаратов общий анализ крови делается не реже 1 раза в месяц, а при применении комбинированной пульс-терапии — через 12 дней после каждого введения циклофосфана (для исключения развития тяжёлой супрессии костного мозга) (D).
Профилактика
Первичная профилактика невозможна ввиду неясной этиологии заболевания. Вторичная профилактика направлена на предупреждение обострения, прогрессирования заболевания и своевременное выявление развивающихся лимфом. Она предусматривает раннюю диагностику и своевременно начатую адекватную терапию. Некоторые больные нуждаются в ограничении нагрузки на органы зрения, голосовые связки и исключении аллергизирующих факторов. Больным противопоказана вакцинация, лучевая терапия и нервные перегрузки. С большой осторожностью должны применяться электропроцедуры.
Обучение пациентов
Так как больные БШ имеют хроническое заболевание с неуклонной прогрессией на протяжении всей жизни, необходимо наладить тесный контакт с больными. Только при полном доверии пациента к врачу, он будет соблюдать рекомендуемую терапию. Необходимо научить пациента как можно раньше улавливать возможные побочные проявления назначаемых препаратов и знать основные признаки обострения заболевания.
Информация
Источники и литература
-
Федеральные клинические рекомендации по ревматологии 2013 г. с дополнениями от 2016 г.
Информация
Методология
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных.
Описание методов, использованных для сбора/селекции доказательств:
доказательной базой для рекомендаций является глубина публикаций вошедших в Кохрановскую библиотеку, базы данных EMBASE и MEDLINE. Глубина поиска составляла 10 лет.
Методы, использованные для оценки качества и глубины доказательств:
· Консенсус экспертов
· Оценка значимости в соответствии с рейтиноговой схемой
Рейтиноговая схема для оценки силы рекомендаций
| сила | описание |
| А | По меньшей мере, один метаанализ, систематический обзор, или РКИ напрямую примененные к целевой популяции и демонстрирующий устойчивость результатов |
| В | Группа доказательств, включающих результаты исследований, напрямую применимые к целевой популяции и демонстрирующих общую устойчивость результатов |
| С | Хорошо проведенные исследования случай-контроль или когортные исследования со средней вероятностью причинной взаимосвязи |
| D | Небольшие пилотные исследования, описание случаев, мнение экспертов |
Описание метода валидизации рекомендаций
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами по доступности для понимания врачей ревматологов, врачей первичного звена и участковых терапевтов, оценки их важности для повседневной практики.
Комментарии, полученные от экспертов систематизировались и обсуждались председателем и членами рабочей группы, регистрировались изменения каждого пункта рекомендаций. Предварительные рекомендации были представлены для дискуссии на Конференции ФГБУ НИИР РАМН, на совещании Экспертного Совета Ассоциации ревматологов России и выставлены для широкого обсуждения на сайте ФГБУ НИИР РАМН и АРР.
Рабочая группа
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключении, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок сведен к минимуму.
Основные рекомендации
Сила рекомендаций (А-D) приводятся при изложении текста рекомендаций.
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Дата публикации 28 октября 2021Обновлено 28 октября 2021
Определение болезни. Причины заболевания
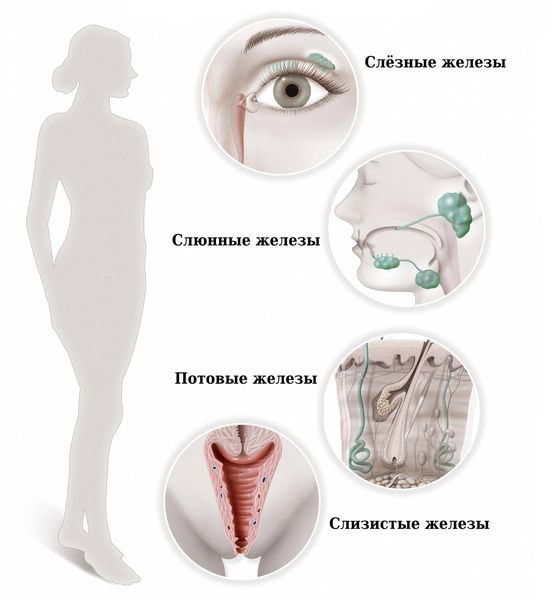
Синдром Шёгрена (Sjogren’s syndrome) — это аутоиммунное системное заболевание соединительной ткани, при котором поражаются железы внешней секреции: преимущественно слёзные и слюнные, а также потовые, сальные, слизистые и др. Характерными признаками болезни являются сухость глаз, полости рта и кожи.
Синонимы: болезнь Шёгрена, синдром Съегрена, «сухой» синдром, ксеродерматоз, синдром Предтеченского — Гужеро — Шёгрена.
Синдром Шёгрена бывает первичным и вторичным:
- Первичный (болезнь Шёгрена) — это поражение желёз без сопутствующих заболеваний.
- Вторичный — поражение желёз внешней секреции в сочетании с другими системными болезнями соединительной ткани (до 47 % случаев) или аутоиммунными заболеваниями. Чаще всего сочетается с аутоиммунными поражениями печени (50–70 % случаев) [1][2][3].
Распространённость
Синдромом Шёгрена страдают от 4 до 250 человек на 100 000 населения. Женщины болеют чаще мужчин примерно в 8–25 раз. Возраст большинства заболевших от 35 до 50 лет. Дети этим заболеванием болеют крайне редко. У пациентов с ревматоидным артритом и системными заболеваниями соединительной ткани, такими как системная красная волчанка, системная склеродермия и др., синдром Шёгрена встречается в 5–25 % случаев, а при аутоиммунном поражении печени (например, аутоиммунном гепатите) — в 50–75 % случаев [4][6].
По некоторым данным, синдромом Шёгрена страдает 2 % взрослого населения, при этом болезнь остаётся не диагностированной примерно у половины пациентов с симптомами [7].
Причины развития синдрома Шёгрена
Причина синдрома Шёгрена неизвестна. Большинство исследователей рассматривают её как патологическую реакцию иммунитета на вирусную инфекцию, предположительно ретровирусную. В пользу этой теории говорит то, что из поражённой ткани слюнных желёз выделяются вирусные частицы, а в крови находят антитела к вирусам. Предполагают участие вирусов Эпштейна — Барр, герпеса 6-го типа, цитомегаловируса, лимфотропного герпес-вируса и Т-лимфотропного вируса человека. Однако прямых и достоверных доказательств вирусной теории пока нет [1][5][6][7][8].
Наличие похожей патологии слюнных желёз у родственников (братьев и сестёр, родителей или детей) указывает на генетическую предрасположенность к развитию болезни Шёгрена.
Факторы риска развития синдрома Шёгрена
В 90 % случаев синдром Шёгрена развивается после перенесённого стресса: кратковременного или длительного. Также к предрасполагающим факторам относят нарушения работы эндокринных органов, при которых меняется соотношение эстрогенов и андрогенов. Это объясняет высокую частоту развития заболевания у женщин в период пери- и постменопаузы. Также к таким нарушениям относят гиперфункцию яичников, дефицит тестостерона у мужчин, первичную или вторичную недостаточность надпочечников [4].
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы синдрома Шёгрена
Проявления синдрома Шёгрена разнообразны. Среди них можно выделить две группы симптомов:
- связанные с поражением желёз;
- внежелезистые системные проявления.
Симптомы, связанные с поражением желёз
Поражение слёзных желёз сопровождается сухим кератоконъюнктивитом (воспалением роговицы и конъюнктивы). Это постоянный признак болезни Шёгрена. Вначале появляется сухость, резь в глазах и светобоязнь после длительной зрительной нагрузки, такой как работа за компьютером. Затем эти симптомы становятся практически постоянными. Также пациента может беспокоить ощущение песка и постоянного инородного тела в глазах, жжение, царапание и нитевидные выделения из глаз.
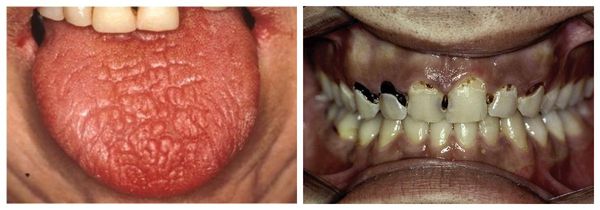
Нарушение работы слюнных желёз проявляется сухостью во рту (ксеростомией). Это второй постоянный симптомом «сухого» синдрома. Ещё до начала клинически выраженной картины болезни Шёгрена можно заметить сухость губ, «заеды» в уголках рта и стоматит. Со временем уменьшается количество слюны и появляется сухость во рту. Сначала она беспокоит только при волнении и физической нагрузке, затем постоянно. Больному приходится запивать сухую пищу и увлажнять рот во время разговора.
Губы могут трескаться, во рту образуются язвочки, из-за прогрессирующего пришеечного кариеса портятся зубы [6][7]. Из-за сухости носоглотки, глотки и голосовых связок больному труднее глотать, голос становится сиплым. Если в процесс вовлекается евстахиевая труба, развиваются отиты, человек может периодически терять слух.
Поражение подслизистых желёз трахеи и бронхов вызывает у пациентов сухой лающий кашель.
Поражение потовых и сальных желёз — причина сухости кожи при болезни Шёгрена. Нарушение работы потовых желёз наружных половых органов вызывает жжение, зуд, иногда интенсивные жгучие боли.
Поражение желудочно-кишечного тракта часто становится причиной боли в животе различной локализации, тошноты, отрыжки воздухом с тухлым запахом и др. [1][2]
Внежелезистые системные проявления
Могут включать:
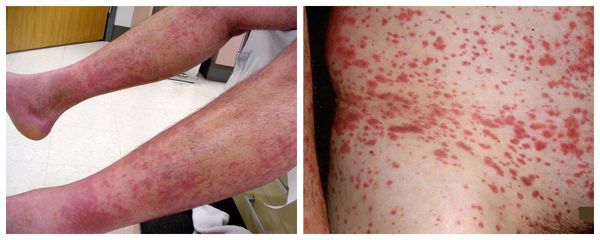
- Васкулит (воспаление сосудов). Из-за повреждения мелких сосудов у трети больных на коже появляются различные высыпания, например множественные кровоизлияния или участки стойкого интенсивного покраснения кольцевидной, круглой или неправильной формы, иногда с плотным основанием
- Нарушение чувствительности периферических нервов или болевую нейропатию.
- Гломерулонефрит (воспаление почечных клубочков) с повышением артериального давления.
- Синдром Рейно — временное нарушение работы мелких сосудов кожи, в основном в виде спазма. при этом пальцы рук холодеют, белеют, затем краснеют. Синдром Рейно — частое поражение сосудов при синдрома Шёгрена. Наблюдается у трети пациентов [1].
Патогенез синдрома Шёгрена
Механизм развития синдрома Шегрена неясен. Считается, что под воздействием стресса или каких-либо факторов окружающей среды у генетически предрасположенных людей нарушается работа иммунной системы, что и приводит к развитию болезни.
Например, в слюнных железах под воздействием провоцирующих факторов повышается проницаемость клеточных мембран. Из-за этого секрет, который образуется в клетках желёз, не поступает в проток, он переполняет клетку и проникает через её оболочку в интерстициальную (соединительную) ткань. Белок, содержащийся в секрете, попадая в интерстициальную ткань, воспринимается организмом как чужеродный и вызывает образование антител против ткани железы.
Возникший аутоиммунный процесс вызывает реакцию лимфоидной ткани. В-лимфоциты становятся гиперреактивными, лимфоидные клетки накапливаются в железах внешней секреции и органах-мишенях, образуя лимфоидные инфильтраты. Эти инфильтраты вырабатывают большое количество аутоантител, которые повреждают собственные ткани: эпителий протоков желёз и другие органы (сосуды, лёгкие, почки и др.) [1][4][6].
Классификация и стадии развития синдрома Шёгрена
Классификация болезни Шёгрена по течению:
1. Подострый вариант. Он начинается с повышения температуры до 38–40 ˚C и симптомов одностороннего или двустороннего паротита (воспаления околоушных слюнных желёз). Пациент при этом чувствует дискомфорт, распирание или боль в проекции околоушных слюнных желёз. Эта область припухает, а при выраженном воспалительном отёке железы значительно увеличиваются в размерах.
Форма лица становится грушевидной. Кожа над поражённой слюнной железой туго натянута, лоснится, кожные складки не образуются или образуются с трудом. Также характерно выраженное поражение суставов: чаще воспаляются мелкие суставы кистей, но иногда процесс затрагивает и крупные суставы (коленные, плечевые, локтевые). Воспаление сопровождается сильной болью в суставах.
В анализах крови наблюдается увеличенная скорость оседания эритроцитов (СОЭ), повышенный уровень определённых иммуноглобулинов (антител), снижение количества лейкоцитов и высокие титры ревматоидного фактора. Подострый вариант болезни чаще развивается у молодых пациентов.
2. Хронический вариант. Отмечается примерно у половины пациентов. Болезнь начинается без ярких клинических проявлений. У пациента постепенно появляется сухость во рту, развивается прогрессирующий пришеечный кариес, медленно увеличиваются околоушные слюнные железы, появляются симптомы конъюнктивита или кератоконъюнктивита [1][2][6][7].
Нарушения параметров крови выражены умеренно, системные проявления, такие как регионарная лимфоаденопатия (увеличение лимфатических узлов), поражение почек и другие, отмечаются крайне редко. Этот вариант течения синдрома Шёгрена чаще встречается у пациентов старше 50 лет.
По стадиям развития:
- Начальная стадия. На этой стадии болезнь выявляют редко. Пациент может заметить дискомфорт в области слюнных желёз, например распирание во время приёма пищи. Иногда температура тела повышается до 37,1–38,0 °C, беспокоит сухость во рту, из слюнных протоков выделяется гной. Симптомы обычно проходят за 7–10 дней самостоятельно или после симптоматической терапии [4][5].
- Выраженная стадия. Характеризуется активным течением паротита с частыми рецидивами. Сопровождается высокими лабораторными показателями (СОЭ, уровня лейкоцитов и ревматоидного фактора). У большинства больных увеличиваются лимфатические узлы, причём как во время обострения, так и после него. В 38 % случаев в этой стадии заболевание протекает без выраженных обострений с постепенным увеличением околоушных слюнных желёз [5].
- Поздняя стадия. Проявляется глубоким поражением и изменением слюнных желёз, потерей зубов из-за пришеечного кариеса, грибковыми стоматитами, изъязвлением и помутнением роговицы, слизисто-гнойными выделениями из глаз в результате недостатка слёзной жидкости, а также внежелезистыми поражениями.
По степени активности:
- 1 степень (минимальная) — преобладают процессы поствоспалительного склероза слюнных и слёзных желёз. Лабораторные показатели невысокие. Нарушается работа желёз, при этом уменьшается выделение секрета (слёз, слюны, влагалищной жидкости и др.).
- 2 степень (умеренная) — проявляется обострениями паротита, увеличением лабораторных признаков воспалительной и иммунологической активности, снижением функции слюнных, слёзных и других эпителиальных желёз.
- 3 степень (высокая) — характеризуется рецидивирующим паротитом, высокой температурой тела пациента, слабостью, головными болями, грибковым или вирусным стоматитом, острым множественным кариесом, рецидивирующей пурпурой, увеличением лимфатических узлов. Лабораторные показатели активности высокие [5].
Осложнения синдрома Шёгрена
Инфекционные осложнения. Из-за сухости полости рта, носоглотки, слизистых оболочек глаз и изменения состава слюны и слёзной жидкости присоединяются бактериальные, герпесные или грибковые кератоконъюнктивиты, синуситы, трахеобронхиты и пневмонии.
Из-за сухости влагалища могут развиваться рецидивирующие герпетические высыпания в области половых губ и воспаление бартолиновых желёз. Кроме этого, из-за выраженных дистрофических процессов даже у молодых женщин сужается влагалище. Половой акт при этом становится крайне болезненным или вовсе невозможен [1][4].
Злокачественные проявления:
- Аденокарцинома и перстневидно-клеточный рак желудка могут быть следствием сухости во рту, нарушения моторики пищевода и атрофического гастрита.
- Онкологические заболевания и поражения билиарной системы печени могут развиваться из-за поражения эпителия желчевыводящих путей.
- Лимфома (злокачественная опухоль клеток иммунитета). При ней лимфоциты увеличиваются до гигантских размеров, бесконтрольно делятся и поражают лимфатическую систему: лимфоузлы, костный мозг, вилочковую железу. Лимфомы выявляются у пациентов с синдромом Шёгрена в 5–15 % случаев. Это в 44 раза чаще, чем в общей популяции. Чаще всего они образуются в околоушных, реже в слёзных железах, иногда встречаются в лёгочной ткани. Чаще это В-клеточные лимфомы слюнных желёз с низкой степенью злокачественности. Однако если они существуют более 5 лет, то могут трансформироваться в высокоагрессивные. Лимфомы являются причиной смерти у 20–50 % пациентов с болезнью Шёгрена [1][2][5][11].
Внежелезистые системные проявления. Выявляются у трети больных. К таким проявлениям относят: васкулит, нейропатию, поражение почек, лимфаденопатию [2][7].
Поражение центральной и периферической нервной системы часто бывает опасно жизнеугрожающими осложнениями. Они возникают у 2–4 % больных. К таким осложнениям относятся острое нарушение мозгового кровообращения (инсульт), поражение ЦНС по типу рассеянного склероза, поперечный миелит, тяжёлый цереброваскулит и др. [10]
При вовлечении в патологический процесс почек часто развивается мочекаменная болезнь, нефрокальциноз (отложение солей кальция в почках), рецидивирующий гипокалиемический паралич. Может возникать хроническая почечная недостаточность на фоне медленно прогрессирующего гломерулонефрита. На последних стадиях почечная недостаточность требует гемодиализа. Относительно редко встречается острая почечная недостаточность на фоне тромбоза почечных артерий или быстро прогрессирующего гломерулонефрита в сочетании с повышенным уровнем криоглобулина в крови.
Диагностика синдрома Шёгрена
Пациент с начальными признаками болезни Шёгрена может оказаться на приёме у стоматолога, офтальмолога, оториноларинголога, терапевта и ревматолога. Диагностика основана на выявлении у больных одновременного поражения глаз и слюнных желёз, а также лабораторных признаков аутоиммунного заболевания.
Сбор жалоб и осмотр
К типичным офтальмологическим симптомам болезни относят постоянную сухость глаз на протяжении трёх месяцев и более, ощущение песка в глазах, необходимость использовать искусственные слёзы три раза в день и чаще.
При осмотре врач отмечает сухость склеры и конъюнктивы, расширение сосудов конъюнктивы, белые или желтоватые выделения крошковатого вида или густой вязкой консистенции. Из-за уменьшения слёз развивается сухой конъюнктивит или блефароконъюнктивит с дистрофией и изъязвлением слизистой оболочки глаз.
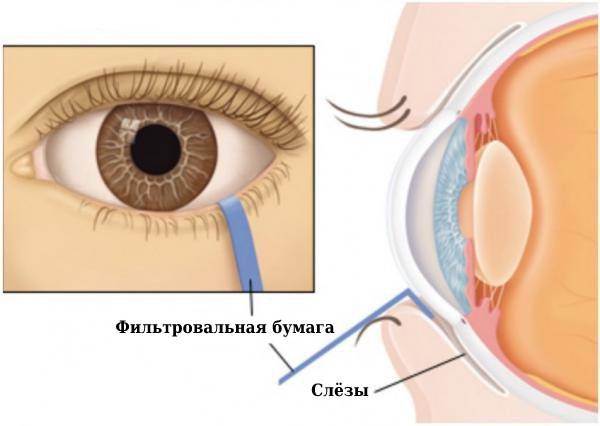
Чтобы определить, насколько уменьшилось выделение слёзной жидкости, используют тест Шиммера: в конъюнктивальные мешки закладывают специальные полоски фильтровальной бумаги и определяют скорость её намокания. Этот тест можно проводить также со стимуляцией, когда пациент вдыхает пары раствора нашатырного спирта, который стимулирует выработку слезы [1][2][7].
Сухость в полости рта тоже определяется при осмотре. Язык у пациента сухой, складчатый, десны кровоточат, слизистая полости рта легко травмируется, у 40 % больных образуются околозубные карманы, однако зубные камни отсутствуют. Зубы поражены множественным пришеечным и циркулярным кариесом, из-за которого на поздних стадиях пациент может частично или полностью потерять зубы (у 32 % пациентов). Из-за постоянного травмирования слизистой, снижения количества и изменения состава слюны в патологический процесс вовлекается инфекция, чаще грибковая или герпетическая [5].
Состояние слюнных желёз сначала определяют с помощью сиалометрии, когда врач собирает слюну пациента в пробирку, затем оценивает её количество. Также слюнные железы исследуют с помощью инструментальных методов диагностики.
Инструментальная диагностика
Сиалография. Это рентгенконтрастное исследование слюнных желёз. При синдроме Шёгрена сиалография показывает характерные признаки: изменение строения долек и повреждение протоков железы. Также определяется выход контрастного вещества в ткань желёз за пределы протоков. Поэтому контуры протоков нечёткие, вокруг них определяется «облачко» контрастной массы, проникшей в окружающие ткани.
УЗИ и МРТ. Эти методы позволяют оценить структуру желёз и внутрижелезистых лимфоузлов, контролировать динамику лечения и отличить болезнь от опухоли слюнных желёз.
Лабораторная диагностика
В ходе лабораторной диагностики выполняют:
- Общий анализ крови: выявляется снижение количества лейкоцитов в периферической крови (лейкопения); умеренная анемия со снижением гемоглобина до 70–90 г/л; характерные признаки воспаления — повышение СОЭ (не менее 20 мм/час).
- Иммунологическое исследование крови: обнаруживаются специфические антитела, например, ревматоидный фактор выявляется практически у 100 % больных; повышается уровень циркулирующих иммунных комплексов (комплексов «антиген-антитело»); могут выявляться моноклональные иммуноглобулины (иммуноглобулины одинакового класса), что указывает на вероятность лимфомы.
- Анализ мочи: у 15–20 % больных в моче выявляется белок Бенс-Джонса (онкомаркер, который может быть предвестником лимфомы) [1][2][6][7][13].
Дифференциальная диагностика
Слюнные и слёзные железы могут поражаться не только при синдроме Шёгрена. Похожие симптомы могут наблюдаться при саркоидозе, мультифокальном фиброзе. При выявлении моноклональных иммуноглобулинов проводят дифференциальную диагностику болезни Шёгрена с разными формами лимфопролиферативных заболеваний (например, с неходжкинскими лимфомами), макроглобулинемией Вальденстрёма, первичным амилоидозом, миеломной болезнью и плазмоцитомой.
Лечение синдрома Шёгрена
Лечение проводится в зависимости от наличия железистых и внежелезистых проявлений и иммуновоспалительной активности заболевания.
Цели лечения:
- достичь ремиссии болезни по клиническим и лабораторным показателям;
- улучшить качество жизни пациента;
- предотвратить развитие опасных для жизни проявлений заболевания (генерализованного язвенно-некротического васкулита, тяжёлых поражений центральной и периферической нервной системы, лимфомы).
В первую очередь всем пациентам с синдромом Шёгрена рекомендуется немедикаментозное лечение:
- не следует долго находиться в районах с сухим и жарким климатом;
- в помещениях использовать увлажнители воздуха;
- лечить очаги инфекции;
- постоянно применять фторсодержащие и противовоспалительные зубные пасты.
Лечение железистых проявлений
Симптоматическое лечение улучшает качество жизни больного. Чтобы уменьшить сухость глаз, можно использовать искусственные слёзы на основе гиалуроната натрия и др. Их можно применять до 16–18 раз в сутки. Для лечения сухого кератоконъюнктивита применяются глазные капли Циклоспорина А. При тяжёлых сухих кератоконънктивитах, которые не поддаются лечению, или при непереносимости других заменителей слёз могут использоваться препараты на основе сыворотки крови [1][2][6][7].
При поражении слюнных желёз используют заменители слюны. Их изготавливают на основе муцина и метилцеллюлозы, они смазывают и увлажняют полость рта, облегчая состояние пациента.
Часто удаётся стимулировать остаточную функцию слюнных и слёзных желёз, для этого используются агонисты М1 и М3 мускариновых рецепторов: Пилокарпин или Цевимелин.
Приём Ребамипида (Мукогена) уменьшает сухость во рту, а офтальмологическая эмульсия с этим препаратом помогает при сухости глаз [7].
Лечение внежелезистых проявлений
Основой лекарственной терапии болезни Шегрена являются две группы препаратов:
- Глюкокортикоиды — противовоспалительные препараты (Преднизолон).
- Цитостатики — противоопухолевые препараты, которые нарушают процессы роста, развития и деления клеток. К ним относятся Хлорбутин, Лейкеран, Циклофосфамид (Циклофосфан).
Они назначаются при системных проявлениях заболевания и высокой активности процесса, подтверждённой лабораторными показателями.
Если пациента беспокоит рецидивирующий сиалоаденит (воспаление слюнных желёз), но нет признаков системных поражений или выявляются незначительные внежелезистые патологии (суставной синдром, боли в мышцах, увеличение лимфоузлов и т. д.), назначается Преднизолон в небольших дозировках.
Если у пациента нет системных проявления, но отмечается большой объём слюнных желёз (если исключена лимфома), диффузная инфильтрация малых слюнных желёз и умеренная выраженность лабораторных сдвигов, применяется Преднизолон в небольших дозах в комбинации с Лейкераном в течение года. После этого пациента переводят на поддерживающую дозу [1][3][6][7].
Пациентам с васкулитом назначается Циклофосфан в комбинации с Преднизолоном. Дозы подбираются в зависимости от тяжести внежелезистых симптомов. Доза Преднизолона при тяжёлых угрожающих жизни системных проявлениях увеличивается.
У пациентов с такими симптомами может использоваться также пульс-терапия Преднизолоном или комбинированная пульс-терапия Преднизолоном и Циклофосфаном. При этом в начале лечения применяются значительные дозы препаратов, затем они снижаются и пациент длительно получает умеренные или низкие дозы. Пульс-терапия позволяет уменьшить ежедневную дозу пероральных глюкокортикоидов и цитостатиков и избежать осложнений, возникающих из-за их длительного применения. Длительный приём глюкокортикоидов может привести к стероидному диабету, язве желудка или двенадцатиперстной кишки, повышению артериального давления и др. Цитостатики уменьшают количество нейтрофилов и тромбоцитов, токсично влияют на сердце, печень и почки. Кроме того, применение препаратов обеих этих групп снижает иммунитет и повышает риск присоединения инфекции.
Экстракорпоральная терапия — это метод интенсивной терапии болезни Шёгрена. К ней относится гемосорбция, криоаферез, плазмоферез, двойная фильтрация плазмы, которая проводится одновременно с пульс-терапией. Эти методы основаны на очистке крови и плазмы от циркулирующих иммунных комплексов и агрессивных аутоантилел вне тела пациента на специальном оборудовании.
Абсолютные показания для экстракорпоральной терапии:
- некротически-язвенный тип васкулита;
- гломерулонефрит в сочетании с повышенным уровнем криоглобулина в крови;
- многоочаговое поражение головного и спинного мозга;
- ишемия рук и ног как осложнение васкулита;
- синдром гипервязкости крови.
При васкулите, обусловленном смешанной моноклональной криоглобулинемией, целесообразно проводить экстракорпоральную терапию в течение года до достижения стойкой клинико-лабораторной ремиссии [1][3].
Прогноз. Профилактика
Прогноз при болезни Шёгрена будет благоприятным, если вовремя начать лечение. При длительном течении заболевания (более 5–8 лет) у 13,8 % больных развиваются лимфомы слюнных желёз, неходжкинские лимфомы становятся причиной смерти при болезни Шёгрена в 34,5 % случаев [1].
Кроме нарастающего поражения слюнных и слёзных желёз со временем прогрессируют и внежелезистые проявления. Причиной летального исхода может быть генерализованный васкулит, опухоли (чаще всего желудочно-кишечного тракта) и аутоиммунные пацитопении (одновременное снижение лейкоцитов, эритроцитов и тромбоцитов), реже интерстициальный нефрит с почечной недостаточностью, острый инфаркт миокарда и острое нарушение мозгового кровообращения.
Прогноз может быть неблагоприятным при смешанной моноклональной криоглобулинемии. Только 41,9 % пациентов при этом состоянии проживают 20 лет и более. При этом общая 20-летняя выживаемость при болезни Шегрена — 81,3 % [1][2][6].
Факторы риска неблагоприятного исхода при болезни Шёгрена: анемия, лейкопения или тромбоцитопения, генерализованная лимфаденопатия, спленомегалия (увеличение селезёнки), значительное увеличение околоушных слюнных желёз, полиневропатия, криоглобулинемическая пурпура. Эти факторы могут возникать одновременно, или один фактор может предшествовать другому.
Профилактика синдрома Шёгрена
Первичная профилактика направлена на предотвращение болезни. Так как этиология болезни Шёгрена неизвестна, методов первичной профилактики не существует.
Вторичная профилактика проводится, чтобы предотвратить прогрессирование болезни и развитие осложнений. Для этого необходимо своевременное и адекватное лечение. Чтобы начать лечение как можно раньше, пациенту нужно обратиться к врачу при первых признаках болезни: сухости глаз и полости рта, рецидивирующей или постоянной припухлости в области слюнных желёз. Насторожить должен также прогрессирующий множественный пришеечный кариес.
Одним из методов вторичной профилактики является обучение пациентов. Нужно рассказать больным о побочных действиях препаратов, о симптомах обострения заболевания и признаках его осложнения, а также о некоторых ограничениях в быту и на работе. Пациентам с болезнью Шёгрена следует ограничить нагрузку на глаза и голосовые связки, им нельзя долго находиться на солнце, вакцинироваться, длительно контактировать с аллергенами и подвергаться лучевой нагрузке [3].
Синдром Шегрена: Руководство для врачей
Год издания: 2013
Кол-во страниц: 600
- Аннотация
- Коллекции
- Классификаторы
- Аффилиация
- Бибзапись
- Фрагменты
Многие заболевания выходят за рамки одной медицинской дисциплины, и это становится серьезной преградой на пути к их изучению. Создание мультидисциплинарной группы с участием всех заинтересованных специалистов — путь к решению проблемы. Именно такое решение было принято в далекие 1980-е годы Российской Академией наук в отношении синдрома Шегрена. Объединение совместных усилий нескольких академических институтов привело к серьезным прорывам при изучении фундаментальных основ этой сложной патологии. Благодаря этому сегодня Российская Федерация вошла в десятку стран — лидеров в решении этой проблемы. В настоящем руководстве на основании многолетнего собственного опыта авторов и анализа данных мировой литературы освещены особенности клиники, диагностики и современных методов лечения больных с синдромом Шегрена.
- Московский государственный университет им. М.В. Ломоносова
Сафонова, Т. Н. Синдром Шегрена: Руководство для врачей / Т.Н. Сафонова, В.И. Васильев, В.Г. Лихванцева ; под ред. В.Г. Лихванцевой. — Москва : Издательство Московского университета, 2013. — 600 с. — ISBN 978-5-19-010836-1.1022580. — Текст : электронный. — URL: https://znanium.com/catalog/product/1027632 (дата обращения: 25.04.2023). – Режим доступа: по подписке.
Скопировать запись
Фрагмент текстового слоя документа размещен для индексирующих роботов.
Для полноценной работы с документом, пожалуйста, перейдите в
ридер.
М- - - - М. В. Л- ФГБУ НИИ - - РАМН ФГБУ НИИ - РАМН
Lomonosov Moscow State University State Research Institute of Eye Diseases of the Russian Academy of Medical Sciences Institute of Rheumatology of the Russian Academy of Medical Sciences T. N. Safonova, V. I. Vasiliev, V. G. Likhvantseva SJÖGREN’S SYNDROME TUTORIAL FOR DOCTORS Edited by V. G. Likhvantseva Moscow University Press 2013
М- - - - М. В. Л- ФГБУ НИИ - - РАМН ФГБУ НИИ - РАМН Т. Н. С, В. И. В, В. Г. Л- СИНДРОМ ШЕГРЕНА РУКОВОДСТВО ДЛЯ ВРАЧЕЙ Под редакцией В. Г. Лихванцевой Издательство Московского университета 2013
УДК 617.7 ББК 56.7 С21 Рекомендовано к изданию Ученым советом факультета фундаментальной медицины Московского государственного университета имени М.В. Ломоносова в качестве руководства для врачей, послевузовского и дополнительного профессионального образования врачей по направлению «Офтальмология», «Ревматология», студентов медицинских вузов, аспирантов и клинических ординаторов (Протокол №10 от 26 декабря 2012 года) Сафонова Т.Н., Васильев В.И., Лихванцева В.Г. Синдром Шегрена: Руководство для врачей / Т.Н. Сафонова, В.И. Ва сильев, В.Г. Лихванцева; под ред. В.Г. Лихванцевой. – М.: Издательство Московского университета, 2013. – 600 с. ISBN 978-5-19-010836-1 Многие заболевания выходят за рамки одной медицинской дисциплины, и это становится серьезной преградой на пути к их изучению. Создание мультидисциплинарной группы с участием всех заинтересованных специалистов – путь к решению проблемы. Именно такое решение было принято в далекие 1980-е годы Российской Академией наук в отношении синдрома Шегрена. Объединение совместных усилий нескольких академических институтов привело к серьезным прорывам при изучении фундаментальных основ этой сложной патологии. Благодаря этому сегодня Российская Федерация вошла в десятку стран – лидеров в решении этой проблемы. В настоящем руководстве на основании многолетнего собственного опыта авторов и анали- за данных мировой литературы освещены особенности клиники, диагностики и современных методов лечения больных с синдромом Шегрена. Ключевые слова: аутоиммунное заболевание, ксеростомия, сухой кератоконъюнктивит, слезная железа, слюнные железы. Safonova T.N., Vasiliev V.I., Likhvantseva V.G. Sjögren’s Syndrome: Tutorial for doctors / T.N. Safonova, V.I. Vasiliev, V.G. Likhvantseva; ed. by V.G. Likhvantseva. – Moscow: Moscow University Press, 2013. – 600 p. ISBN 978-5-19-010836-1 Many diseases are beyond one medical discipline, and it turns out to be a serious obstacle for their research. Creation of multidisciplinary group involving all the specialists interested – is a key to solving this problem. Such a decision was made long ago, in 1980’s, by the Russian Academy of Sciences concerning Sjögren’s syndrome. Uniting together efforts of several academic institutions has led to a serious breakthrough in the research of fundamental basis of this complicated pathology. Due to this, nowadays the Russian Federation is one of the ten leaders in this problem solution. The book reflects a long-term experience of the authors as well as analysis of the world literature data to present the peculiarities of clinical picture, diagnostics and contemporary methods of curing patients with Sjögren’s syndrome. Key words: autoimmune disease, xerostomia, dry eye syndrome, lacrimal gland, salivary gland. С21 УДК 617.7 ББК 56.7 ISBN 978-5-19-010836-1 © Сафонова Т.Н., Васильев В.И., Лихванцева В.Г., 2013 © Издательство Московского университета, 2013
ОГЛАВЛЕНИЕ 6 8 16 29 37 64 72 125 213 225 258 265 343 348 491 519 541 598 Введение ............................................................................................................................... Глава первая. Историческая справка .......................................................................... Глава вторая. Эпидемиологические аспекты синдрома Шегрена . ................. Глава третья. Современная классификация .......................................................... Глава четвертая. Слезная железа как орган иммунного надзора, интегри- рованный в единую иммунную систему слизистых оболочек. ................... Глава пятая. Сравнительная характеристика слезной и слюнной желез......... Глава шестая. Патогенетические аспекты синдрома Шегрена ......................... Глава седьмая. Клинические проявления синдрома Шегрена .......................... Глава восьмая. Лабораторные нарушения при синдроме Шегрена ................. Глава девятая. Исследование кожной микроциркуляции при синдроме Шегрена .......................................................................................................................... Глава десятая. Морфологические исследования при синдроме Шегрена. ...... Глава одиннадцатая. Диагностика синдрома Шегрена. ...................................... Глава двенадцатая. Дифференциальная диагностика синдрома Шегрена...... Глава тринадцатая. Лечение синдрома Шегрена ................................................. Глава четырнадцатая. Лимфопролиферативные заболевания при ПСШ ..... Глава пятнадцатая. Стандартизированные показатели смертности и ее структура в популяции ПСШ. Прогнозирование летальных исходов при первичном синдроме Шегрена ............................................................................... Список литературы .......................................................................................................... Список сокращений .........................................................................................................
ВВЕДЕНИЕ Острый дефицит информации в определенных областях медицины порой порождает неверное представление о «безобидности» той или иной патоло- гии, а также уверенность врачей-специалистов узкого профиля в том, что они могут с ней справиться самостоятельно. Это в полной мере касается синдрома Шегрена. Более того, в отечественной литературе бытует представление о том, что это заболевание не нуждается в системной терапии, ибо оно «почти не прогрессирует». Настоящее руководство является результатом коллективного творчества специалистов различного профиля: ревматологов, стоматологов, офтальмо- логов, морфологов ведущих учреждений Российской Академии медицинских наук, более 30 лет сотрудничавших в исследовании специфических закономер- ностей одного заболевания и разработке эффективных методов его лечения. В основу легли несколько кандидатских и докторских диссертаций, посвя- щенных изучению различных аспектов синдрома Шегрена, а также анализ накопленных мировых данных о расшифровке иммунных, молекулярных и генетических механизмов этой сложной аутоиммунной патологии. Немалая заслуга в этом принадлежит российским исследователям. Целью настоящей работы является изложение врачебному сообществу современных представлений о синдроме Шегрена, принятой международной классификации, принципах диагностики и базисной терапии. Детальный анализ 30-летнего наблюдения за пациентами в корне меняет бытующее представление о «безобидности» этой патологии. Авторы устано- вили, что системные проявления заболевания только за 10-летний период на- блюдения прогрессируют у 67,4% больных ПСШ, а риск развития летальных исходов возрастает многократно. Кроме этого, популяция больных с синдро- мом Шегрена является группой высокого риска развития лимфопролифера- тивных заболеваний. Экспертам удалось выявить и обосновать экспертные маркеры неблагоприятного витального прогноза.
В В Е Д Е Н И Е Выявление таких маркеров на этапе первичной или повторной диагностики представляется очень важной и полезной информацией – в равной степени и для пациента, и для лечащего врача. Эта информация позволяет отнести боль- ного к группе высокого риска летальных исходов, обосновывает необходимость его частых визитов к врачу, тщательного лабораторно-инструментального мониторинга и, возможно, более агрессивного лечения, предлагающего новые иммунные механизмы терапевтического эффекта уже на ранней стадии за- болевания, которые при таком прогнозе вполне оправданны. В ряде случаев такая информация избавляет пациента от мыслей о преждевременной смерти, а усилия врача сводит к проведению менее жесткой базисной и/или замести- тельной терапии и обучению стратегии выживания и борьбе с усталостью, чтобы улучшить качество жизни пациента. Авторы выражают искреннюю признательность директору ФГБУ НИИ глазных болезней РАМН академику С.Э. Аветисову за предоставленную воз- можность работать над проектом, моральную и финансовую поддержку при создании книги. Мы глубоко признательны директору ФГБУ НИИ ревматологии РАМН академику Е.Л. Насонову, обеспечившему клиническую базу, содействие и помощь в организации работы мультидисциплинарной команды. Слова глубокой благодарности заведующему кафедрой офтальмологии ФФМ МГУ имени М.В. Ломоносова профессору В.С. Акопяну, создавшему условия для работы над проектом и оказавшему организационную поддержку издания книги. Выражаем сердечную благодарность за предоставление данных своим коллегам, принимавшим активное участие в разработке этой патологии, – С.И. Харлапу, А.Г. Маркосян, М.В. Симоновой. Выражаем глубокую признательность заведующему патолого-анато- мическим отделением ЦКБ РАН профессору М.В. Самойлову и его сотруднику К.А. Кузьмину, а также сотруднику ФГБУ НИИ ГБ РАМН канд. мед. наук А.А. Федорову, сотрудникам отдела морфологии опухолей РОНЦ профессору Н.А. Пробатовой и Н.В. Кокосадзе за помощь в проведении гистологических и цитологических исследований. Отдельные слова благодарности нашей коллеге зав. лабораторией гемато- логии ФГБУ НИИ гематологии канд. мед. наук Е.Ю. Варламовой. Авторы выражают искреннюю признательность академику В.А. Насоновой, профессору И.Ф. Ромачевой и канд. мед. наук Ю.В. Юдиной, инициирующим изучение проблемы в ревматологии, стоматологии и офтальмологии.
Несмотря на то что синдром назван именем Шегрена, не Шегрен был перво- открывателем проблемы. Задолго до него, в 1882 г., некто доктор Leber описал клинические проявления синдрома сухого глаза и ввел в офтальмологию термин «нитчатый кератит» (синоним сухого кератоконъюнктивита), кото- рый в дальнейшем стал «золотым» маркером синдрома Шегрена (СШ) [615]. Заметим, симптомы нитчатого кератита были описаны и другими авторами: E. Fischer (1889), C. Hess (1892) [477]; J.P. NuöI (1892–1893) [771; 772]; T.H. Saemisch (1904) [152; 353; 891]. Семью годами позже (1889) E. Fischer укажет на связь нитчатого кератита с артритом [353]. Имя другого исследователя (W.B. Hadden; 1856–1893) также не упомина- ется, между тем именно W.B. Hadden [448] стал первым автором, описавшим клинические особенности синдрома Шегрена. 8 марта 1888 г. он представил Лондонскому врачебному сообществу в качестве клинического наблюдения (case report) 65-летнюю пациентку с тяжелой ксеростомией. Перечисляя ее жалобы, доктор указал, что пациентка испытывает постоянную сухость носоглотки и трудности при глотании пищи, что вынуждает ее непрерывно «потягивать» жидкость. Он отметил, что ее язык был красным, исчерченным по всем направлениям, подобно «крокодиловой коже», и абсолютно сухим. Тестируя сохранность вкусовых качеств языка с помощью сахара и/или соли, Hadden [448] продемонстрировал снижение вкусовой чувствительности. Для описания гипофункции слюнных желез автор впервые ввел термин «ксеро- стомия». После курсового лечения пилокарпином, который использовался per os х трижды в день, рот несколько увлажнялся. Несмотря на то что внешне конъюнктива выглядела нормальной, раздражение слизистых носа и глаз концентрированным раствором аммиака не сопровождалось стимуляцией слезопродукции. Автор прокомментировал ксеростомию как «арест» секреции слюнных и щечных желез – сухость во рту. Глава первая ИСТОРИЧЕСКАЯ СПРАВКА
И С Т О Р И Ч Е С К А Я С П РА В К А В своем знаменитом учебнике «Принципы и практика медицины», впервые опубликованном в 1892 г., W. Osler (1849–1919) [785] удивитель- ным образом забыл упомянуть Hadden в качестве первого клинициста, давшего мировому сообще- ству клиническое описание симптомокомплекса синдрома Шегрена. Вероятно, ошибочно Osler утверждал, что ксеростомия впервые была опи- сана сэром J. Hutchison (1828–1913) из Лондона, который также дал характеристику зубчатых резцов («зубы Hutchison») и «триады Hutchison» (паренхиматозный кератит, верхние центральные резцы в виде бочкообразных зубов, шире у шейки с полулунной выемкой по свободному краю, глухота вследствие поражения слухового лабиринта) при врожденном сифилисе. Практически полностью цитируя Hadden в своем учебнике, Osler писал, что при ксеростомии «язык является красным и сухим, иногда в нем имеются трещины; слизистая оболочка щек и неба гладкая, блестящая и сухая, при этом затруднены акты жевания, глотания и артикуля- ции. Анализируя отдельные эпидемиологические аспекты, Osler указывал, что это состояние встре- чается крайне редко, развивается главным образом у женщин с неослабленным здоровьем. Объясняя причины возникновения патологии, Osler бук- вально цитирует Hadden, предположившего, что развитие заболевания обусловлено «вовлечением в процесс некоторых центров контроля и управления секрецией слюнных и щечных желез». Одновременно с выходом в свет учебника Osler (1892) J. von Mikulicz- Radecki (рис. 1) опубликовал статью с описанием сорокадвухлетнего внешне «здорового» фермера с двусторонним симметричным увеличением слезных и всех групп слюнных (околоушных, подчелюстных, небных) желез [701]. Гисто- логические исследования биоптатов слезной и подчелюстной желез выявили обширные участки ацинарной атрофии, вокруг которых имела место очаговая инфильтрация. Пациент умер шесть месяцев спустя от разрыва аппендикса. Патолого-анатомическое исследование выполнено не было. Справедливости ради следует отметить, что в этой публикации нет сведений, о том, что клинико- морфологические изменения в слезных и слюнных железах сопровождались функциональными нарушениями секреции слезы и/или слюны [701]. Свое сообщение Mikulicz-Radecki опубликовал на немецком языке, но вскоре оно было переведено на английский язык и напечатано в «Medical Рис. 2. H. Gougerot (1881–1955) Рис. 1. J. von Mikulicz-Radecki (1850–1905)
И С Т О Р И Ч Е С К А Я С П РА В К А Classics» [701]. После этой публикации всякий пациент с увеличением слезной и слюнных желез был диагностирован как «имеющий болезнь Микулича». Несмотря на то что в своей статье Mikulicz-Radecki подробно остановил- ся на клинических и патологических аспектах этого наблюдения, показав доброкачественность лимфоидной инфильтрации желез и четкие отличия от специфического воспаления слюнных и слезных желез, вызванных туберку- лезом, лейкемией или злокачественными лимфомами, более половины сто- летия термин «синдром Микулича» ошибочно использовали при постановке диагноза и описании патологических состояний, вызванных туберкулезом, саркоидозом и лимфомами. Постепенно становилось очевидным, что опи- санный Mikulicz-Radecki симптомокомплекс может развиваться при многих заболеваниях различного генеза. Поэтому в 1927 г. Schäffer [917] и Jacobsen [918] предложили охарактеризовать болезнь Микулича как хроническое воспаление слезной и слюнных желез для дифференцирования болезни от синдрома Микулича. (Синдром – устойчивая совокупность ряда клинических симптомов с единым патогенезом.) Несмотря на интенсивные пионерские разработки Schirmer [926] в области дакриологии, начатые им в 1903 г. и направленные на изучение механизмов секреции слезы и разработку способов оценки секреторной функции слезной железы, до 1919 г. связь между снижением слезопродукции и нитчатым ке- ратитом отмечал только A. Fuchs [388]. В 1919 г. он представил сообщение, в котором описал 54-летнюю женщину с сухостью рта и глаз, сопровождав- шейся двусторонним увеличением околоушных слюнных желез). В 1924 г. связь нитчатого кератита с гипофункцией слезных желез была подтверждена работами другого исследователя – L. Schöninger [934]. В 1926 г. H. Gougerot (рис. 2), практикуя в госпитале Saint Louis в Париже, описал трех пациентов с прогрессирующей атрофией слюнных желез, а также сухостью конъюнктивы, рта, носа, гортани и влагалища, которые в совокуп- ности, по его мнению, представляли собой единый синдром [424]. В 1927 г. A.W.M. Houwer [489] вновь обращает внимание мирового со- общества на тесную связь нитчатого кератита с хроническим артритом: 6 пациентов в наблюдаемой им популяции (n = 10) с нитчатым кератитом имели хронический артрит. Следом за ним J. Isakowitz [500] указывает на ассоциативную связь нит- чатого кератита не только с артритом, но и снижением потовой секреции (генерализованная сухость). Затем A. Betsch [196] описывает точечный кератит, а K. Albrich [117] представляет гистологические изменения в слезной железе при этом виде кератита. Несколькими месяцами позднее Albrich [117] предлагает доказательства взаимосвязи нитчатого кератита с массивной лимфоидной инфильтрацией слезных желез и двусторонним увеличением околоушных и подъязычных слюнных желез.
И С Т О Р И Ч Е С К А Я С П РА В К А Всего за 1926–1933 гг. (в это время появилась и монография H. Sjögren) было опубликовано шесть статей с описанием сочетания признаков ксеросто- мии, сухого кератоконъюнктивита и артрита. Таким образом, в период с 1880-х по 1933 г. по крайней мере три офтальмолога настойчиво ука- зывали на связь функциональных и морфологи- ческих изменений в слезных и слюнных железах с артритом [616; 489], с гипофункцией щитовидной железы и яичников [424]. Шегрен, по сути, замыкал плеяду ученых прошлого века, внесших свою лепту в изучение синдрома «сухого глаза». (Для справки: шведский офтальмолог H. Sjög- ren родился в 1899 г. в г. Jonköping. В 1927 стал дипломированным врачом. В 1933 г. защитил дис- сертацию, написанную на немецком языке. С 1936 до 1967 г. работал в Сток- гольме, затем переехал в Лунд, где и умер 17 июля 1986 г. Sjögren был избран почетным профессором университета Гетеборга. В мае 1986 он стал почетным председателем Первого международного офтальмологического семинара в Копенгагене.). В 1933 г. Sjögren [968] (рис. 3) опубликовал сообщение «Zur Kenntnis der Keratoconjunctivitis Sicca Keratitits filiformis bei hypofunction der Tranendriisen», в котором подробно и детально описал клинические и патоморфологические признаки заболевания у 19 женщин в виде отсутствия секреции слезы (вы- ражаясь современным языком, алакримия). Подавляющее большинство этих женщин пребывало в постменопаузе; 13 из них страдали артритом. Для того чтобы дифференцировать кератит, сопровождающийся гиполакримией, от ксерофтальмии, вызванной недостаточностью витамина А, Sjögren ввел тер- мин «сухой кератоконъюнктивит». Автор пришел к выводу, что описанные им признаки являются симптомами генерализованного заболевания, имеющего широко распространенный характер патологических изменений, которое по своей сути представляет самостоятельную нозологическую единицу. Он подчеркнул, что описанный им сухой кератоконъюнктивит (СКК) не свя- зан с ксерофтальмией, обусловленной дефицитом витамина А. Заболевание развивается, главным образом, из-за «дефицита» воды, а гиповитаминоз А – результат дефицита муцина. Sjögren [967–970] положил начало основам алгоритма диагностики СКК. В частности, он обнаружил, что окрашивание поверхности глаза 1% раствором бенгальского розового является отличным диагностическим методом выявления патологических изменений эпителия на поверхности конъюнктивы и роговицы. Этот краситель и поныне широко используется в рутинной практике, хотя все чаще его заменяют лиссаминовым зеленым, для того чтобы уйти от болевых ощущений, вызванных окрашива- нием дефектов конъюнктивы и роговицы бенгальским розовым. Рис. 3. H. Sjögren (1899–1986)
- document_id: 340496
- product_id: 1027632
- ins_time: 2019-04-09 18:49:38
- upd_time: 2019-04-09 18:49:38
- upp_upd_date: 2019-08-15
- Full PDF:
WARN Путь не доступен (не определен) /mnt/znanium_fullpdf/booksfull/done/1027/1027632.pdf - PDF pages:
OK /mnt/resources/resources/1027/1027632/pdf Страниц(600), Путь /mnt/resources/resources/1027/1027632/pdf - XML pages:
OK /mnt/resources/resources/1027/1027632/xml Страниц(600) - text *.idx:
OK - Full text:
OK /mnt/resources/resources/1027/1027632/txt/1027632.txt - Оглавления:
OK Путь /mnt/resources/resources/1027/1027632/txt/1027632.toc.txt
Подробно рассмотрены вопросы этиологии и патогенеза, патоморфологии и диагностики, в том числе дифференциальной, болезни Шегрена. Даны рекомендации по лечению заболевания и симптоматической терапии его офтальмологических, стоматологических, гастроэнтерологических и других проявлений.
The paper fully considers the etiology and pathogenesis, pathomorphology and diagnosis, including differential diagnosis, of Sjogren’s syndrome, gives recommendations on the treatment of the syndrome and symptomatic therapy of its ophthalmological, dental, gastroenterological, and other manifestations.
В.И. Васильев — Институт ревматологии РАМН, Москва
V.I. Vasilyev — Institute of Rheumatology Academician of the Russian Academy of Medical Sciences, Moscow
Болезнь Шегрена (Н. Sjogren, шведский офтальмолог, 1899–1986) – БШ – системное аутоиммунное заболевание, относящееся к диффузным болезням соединительной ткани; характеризуется поражением многих секретирующих эпителиальных (экзокринных) желез, главным образом слюнных и слезных. Выделяют также синдром Шегрена (поражение слезных желез с развитием сухого кератоконъюнктивита и слюнных желез по типу паренхиматозного паротита), сопутствующий ревматоидному артриту, диффузным болезням соединительной ткани, гепатобилиарным заболеваниям и другим аутоиммунным болезням.
БШ является наиболее частой патологией среди диффузных болезней соединительной ткани и встречается у женщин в 10–25 раз чаще, чем у мужчин, обычно в возрасте 20–60 лет, значительно реже наблюдается у детей. Проведенные в последние годы эпидемиологические исследования позволили установить наличие БШ у 0,59 – 0,77% населения в целом и у 2,7% людей старше 50 лет.
Этиология неизвестна. Большинство исследователей рассматривают БШ как следствие иммунопатологических реакций на вирусную инфекцию, предположительно ретровирусную. В пользу возможного участия ретровирусов в развитии БШ свидетельствуют следующие факты:
• инфекция и персистенция клеток иммунной системы, таких как лимфоциты CD 4+ и макрофаги, в потенциальных органах-мишенях, например, слюнных железах;
• сходство между известными ретровирусными инфекциями (например, ВИЧ) и БШ;
• развитие заболевания, напоминающего БШ у трансгенных мышей, имеющих HTLV – 1 + tax ген;
• повышение содержания перекрестно реагирующих антител к антигенам ретровирусов;
• изоляция ретровирусных элементов из культуры клеток, полученных из биоптатов слюнных желез больных БШ;
• обнаружение антигенов, реагирующих с моноклональными антителами к некоторым антигенам ретровирусов, в лимфоидных инфильтратах при БШ.
Косвенным доказательством вирусной этиологии БШ является сходство иммунологических нарушений (поликлональная b-клеточная активация, большое количество иммунных комплексов, снижение содержания сывороточного b2-микроглобулина, наличие кислотонеустойчивого интерферона, снижение количества интерлейкина-2 (ИЛ–2) и естественных киллерных клеток в крови при БШ и СПИДе, вызываемом известными ретровирусами, однако прямых доказательств вирусной этиологии заболевания пока не получено.
Патогенез
Наиболее признанной является гипотеза аутоиммунного генеза БШ, в пользу которой свидетельствует частое обнаружение у больных как органоспецифических (к эпителию протоков слюнных желез и поджелудочной железы, париетальных клеток желудка, тиреоглобулину и др.), так и органонеспецифических аутоантител (например, ревматоидных и антинуклеарных факторов, антител к некоторым ядерным антигенам – SS-A/Ro и SS-B/La). Предполагается, что аутоиммунные нарушения при БШ имеют многофакторную природу и состоят из комбинации следующих элементов:
• генетический контроль, связанный с активностью генов специфического иммунного ответа;
• иммунный контроль, находящийся под влиянием Т-зависимых лимфоцитов;
• возможная вирусная инфекция;
• влияние половых гормонов на иммунную регуляцию;
• влияние стресса на иммунный ответ.
Случаи БШ у однояйцовых близнецов, значительная распространенность в семьях больных БШ других аутоиммунных нарушений, а также повышенная частота антигенов гистосовместимости DR 3 и В 8 у больных БШ указывают на генетическую детерминированность заболевания. Показано, что первоначально снижается активность Т-супрессоров, что приводит к повышению активности Т-хелперов и хронической стимуляции b-лимфоцитов.
Патоморфология
Основным и патогномоничным морфологическим признаком БШ является лимфоплазматическая инфильтрация паренхимы секретирующих желез. Большинство клеток, инфильтрирующих железы, составляют Т-лимфоциты, в то время как на долю b-лимфоцитов приходится 20%, моноцитов, макрофагов и NK-клеток — не более 5%, 60–70% Т-лимфоцитов составляют клетки CD 4+. Лимфоидные инфильтраты синтезируют большое количество IgG, IgM, ревматоидных факторов, продуцируют большое количество ИЛ (ИЛ-2, ИЛ-6, ИЛ-10), причем количество их прямо зависит от степени лимфоидной инфильтрации. У трети больных лимфоплазмоклеточная инфильтрация не ограничивается тканью секретирующих эпителиальных желез и принимает генерализованный характер с вовлечением в процесс мышц (миозит), легких (лимфоцитарные инфильтраты с развитием интерстициальной пневмонии или фокусов инфильтрации по типу псевдолимфомы), почек (интерстициальный нефрит), сосудов (продуктивный, продуктивно-деструктивный васкулит), вызывая функциональные изменения в пораженных органах с развитием разнообразных клинических проявлений. Вовлечение в процесс системы фагоцитирующих макрофагов у 5–10% БШ приводит к развитию злокачественных лимфопролиферативных заболеваний, преимущественно b-клеточных лимфом и макроглобулинемии Вальденстрема.
Клиническая картина
Клинические проявления БШ можно разделить на железистые и внежелезистые. Железистые симптомы обусловлены поражением секретирующих эпителиальных желез, характеризующимся главным образом их гипофункцией. Постоянным клиническим признаком поражения слезных желез при БШ является сухой кератоконъюнктивит, связанный со снижением секреции слезной жидкости. Больные жалуются на ощущения жжения, “царапины” и “песка” в глазах. Нередко отмечаются зуд век, покраснение, скопление в углах вязкого белого отделяемого.
Позднее появляются светобоязнь, сужение глазных щелей, снижается острота зрения. Резкое снижение или полное отсутствие слезовыделения ведет к развитию точечных инфильтратов, а также к формированию глубокого ксероза роговицы и ее помутнению. Нередко присоединяется вторичный бактериальный конъюнктивит. Увеличение слезных желез при БШ наблюдается редко. Грозным осложнением сухого кератоконъюнктивита является изъявление инфильтратов, которое может привести к образованию гнойных язв и перфорации роговицы.
Вторым обязательным и постоянным признаком БШ является поражение слюнных желез с развитием хронического паренхиматозного паротита.
Для него характерны ксеростомия и увеличение слюнных желез. Нередко еще до появления этих признаков отмечаются сухость красной каймы губ, заеды, стоматит, увеличение регионарных лимфатических узлов, множественный (чаще пришеечный) кариес зубов. Примерно у половины больных отмечается рецидивирующее течение паротита, у некоторых больных после очередного обострения околоушные железы остаются постоянно увеличенными. У трети больных наблюдается постепенное увеличение околоушных желез, приводящее к характерному изменению овала лица, описываемому в литературе как “мордочка хомяка” или “мордочка бурундука”.
Околоушные железы при пальпации безболезненны или малоболезненны. Увеличение подчелюстных, подъязычных и небных слюнных желез встречается редко.
В начальной стадии болезни сухость во рту появляется только при физической нагрузке и волнении. В выраженной стадии сухость во рту становится постоянной, сопровождается потребностью запивать сухую пищу, желанием увлажнить рот во время разговора. Слизистая оболочка полости рта становится ярко-розовой, легко травмируется. Свободной слюны мало, она пенистая или вязкая. Язык сухой. Губы покрыты корочками, отмечаются явления ангулярного стоматита, глоссита, может присоединяться вторичная инфекция, в том числе грибковая и вирусная. Характерен множественный пришеечный кариес зубов. Поздняя стадия проявляется резкой сухостью полости рта, невозможностью говорить, проглатывать пищу, не запивая ее жидкостью. Губы у таких больных сухие, в трещинах, слизистая оболочка полости рта с явлениями ороговения, язык складчатый, сосочки его атрофичны, свободная слюна в полости рта не определяется. Наблюдается частичная или полная адентия вследствие прогрессирования кариеса зубов.
Сухость носоглотки с образованием сухих корок в носу, в просвете слуховых труб может приводить к временной глухоте и развитию отита. Сухость глотки, а также голосовых связок обусловливает осиплость голоса.
Развивается субатрофический (или атрофический) ринофаринголарингит.
Частыми осложнениями являются вторичные инфекции: синуситы, рецидивирующие трахеобронхиты и пневмонии.
Поражение апокринных желез наружных половых органов наблюдается примерно у 1/3 больных БШ. Слизистая оболочка влагалища гиперемирована, сухая, атрофичная, нередко больных беспокоят жгучие боли и зуд.
Частым признаком БШ является сухость кожи. Потоотделение может быть снижено.
Изменения системы пищеварения при БШ наблюдаются часто и многообразны по своему характеру.
Дисфагия обусловлена наличием ксеростомии, а также, в ряде случаев, гипокинезией пищевода. У многих больных развивается хронический атрофический гастрит с выраженной секреторной недостаточностью, клинически проявляющийся синдромом желудочной диспепсии (тяжесть и дискомфорт в эпигастрии после еды, отрыжка воздухом, тошнота, снижение аппетита). Реже наблюдаются боли в эпигастральной области. Прослеживается прямая зависимость между степенью ксеростомии и угнетением секреторной функции желудка. Патология желчных путей (хронический холецистит) и печени (персистирующий гепатит) наблюдается у большинства больных. Имеются жалобы на тяжесть и боли в правом подреберье, горечь во рту, тошноту, плохую переносимость жирной пищи.
Вовлечение в процесс поджелудочной железы (панкреатит) проявляется болевым и диспепсическим синдромами. Клинические признаки поражения кишечника (колит) выражены обычно неярко, но у большинства больных БШ присутствуют.
Внежелезистые проявления БШ очень разнообразны, носят системный характер. Артралгии, небольшая скованность по утрам, рецидивирующий неэрозивный (т.е. без костной деструкции на рентгенограммах) артрит мелких, реже крупных суставов и болевые сгибательные контрактуры встречаются примерно у 2/3 больных. Признаки молимиозита (миалгии, умеренная мышечная слабость, незначительное повышение уровня креатинфосфокиназы в крови) наблюдаются у 5–10% больных. Исключительно редко может развиться тяжелый миозит.
У большинства больных БШ отмечается регионарная лимфаденопатия (увеличение подчелюстных, шейных, затылочных, надключичных лимфатических узлов), а у 1/3 больных лимфаденопатия носит генерализованный характер. В последнем случае нередко выявляется гепато- и спленомегалия.
Частота появления этих симптомов возрастает при наличии васкулита и развитии злокачественной лимфопролиферации (псевдолимфом, b-клеточных лимфом и макроглобулинемии Вальденстрема).
Различные поражения дыхательных путей наблюдаются у 50% больных.
При целенаправленном рентгенологическом и функциональном обследовании у 2/3 больных выявляются признаки поражения легких. Сухость в горле, першение и царапание, сухой кашель и одышка являются наиболее частыми жалобами. Одышка чаще свидетельствует о поражении легочной паренхимы (интерстициальная пневмония и интерстициальный фиброз). Сравнительно редко при БШ наблюдаются рецидивирующие сухие и выпотные плевриты.
У 20–30% больных отмечаются различные поражения почек, чаще – канальцевого аппарата: канальцевый ацидоз, генерализованная аминоацидурия и фосфатурия с развитием в некоторых случаях нефрогенного диабета.
Следствием канальцевого ацидоза могут быть остеомаляция, нефрокальциноз и гипокалиемия, приводящая к мышечной слабости. Развитие хронической почечной недостаточности является результатом длительного течения канальцевого ацидоза. Значительно реже наблюдается диффузный гломерулонефрит мембранозно-пролиферативного или мембранозного типа иммунокомплексного характера. Тяжелые формы гломерулонефрита с нефротическим синдромом и развитием почечной недостаточности наблюдаются у больных БШ с криоглобулинемией. Острая почечная недостаточность вследствие тромбоза почечных артерий может быть причиной летального исхода у больных БШ с продуктивно-деструктивным васкулитом.
У 1/3 больных БШ наблюдается синдром Рейно, чаще – стертые его формы. При БШ встречаются два типа васкулита: продуктивный и продуктивно-деструктивный. Также наблюдаются изменения по типу облитерирующего эндартериита, которые не носят самостоятельного характера и сопутствуют чаще продуктивно-деструктивному (70%), реже продуктивному (30%) васкулиту. Кожный васкулит при БШ обусловлен поражением сосудов мелкого и среднего калибра. При БШ наблюдаются капилляриты, сетчатое ливедо, различные виды пурпуры. Рецидивирующая гипергаммаглобулинемическая и криоглобулинемическая пурпуры наблюдаются примерно у 1/4 больных. Мелкоточечные геморрагические высыпания чаще появляются на коже голеней, однако со временем распространяются выше и могут обнаруживаться на коже бедер, ягодиц и живота. Высыпания сопровождаются зудом, болезненным жжением и повышением температуры кожи в пораженной области. У больных с длительно рецидивирующей гипергаммаглобулинемической пурпурой обычно развивается гиперпигментация кожи вследствие отложения гемосидерина. В биоптатах кожи таких больных выявляется картина продуктивного васкулита. Тяжелые формы васкулита с развитием множественных язвенно-некротических изменений кожи конечностей, туловища и лица, образованием длительно незаживающих язв и возникновением гангрены отмечаются у больных с рецидивирующей криоглобулинемической пурпурой. Для нее характерно появление высыпаний по типу пузырьков и пустул с геморрагическим содержимым. В биоптатах кожи обнаруживаются признаки продуктивно-деструктивного васкулита, нередко его некротизирующая форма. Для больных БШ с продуктивным васкулитом характерно наличие в крови высокого уровня g–глобулина, циркулирующих иммунных комплексов, ревматоидного фактора, тогда как иммунологическим маркером продуктивно-деструктивного васкулита является криоглобулинемия, обнаруживаемая у 95% больных с этой формой васкулита.
Клинические признаки периферической полинейропатии с нарушением чувствительности по типу “носков” и “перчаток”, парестезии, реже – полиневриты и мононевриты, невриты лицевого и тройничного нервов наблюдаются у трети больных. Значительно реже могут развиваться миелополирадикулоневриты и цереброваскулиты у больных с продуктивно-деструктивным васкулитом.
Клинически очевидные признаки гипотиреоидизма обнаруживаются у 10–15% больных (исключительно редко – тиреотоксикоз). Антитела к тиреоглобулину, микросомальной фракции щитовидной железы и тиреоидстимулирующему гормону выявляются у половины больных БШ; предполагается, что субклинические повреждения щитовидной железы встречаются чаще.
Таким образом, эндокринные железы, так же как и экзокринные, могут быть мишенями для иммунных атак при БШ. Известное сходство в генетической предрасположенности HLA-DR 3 и гистологическое сходство между тиреоидитом Хашимото и БШ подтверждают предположения о том, что при этих заболеваниях могут быть задействованы сходные механизмы. Инсулинзависимый диабет и пернициозная анемия у больных БШ встречаются редко.
У трети больных наблюдаются аллергические реакции, чаще – на антибиотики, сульфаниламиды, новокаин, препараты группы В, а также на химические средства (стиральные порошки и др.) и пищевые продукты.
Лабораторные исследования
Наиболее информативными лабораторными показателями при БШ являются высокая СОЭ, лейкопения, гипергаммаглобулинемия (80–70%), наличие антинуклеарных и ревматоидных факторов (90–100%), а также антител к растворимым ядерным антигенам SS-A/Ro и SS-B/La (60–100%). У трети больных обнаруживаются криоглобулины, которые могут быть поликлональными или моноклональными в зависимости от иммуноглобулинов, входящих в их состав. Моноклональные иммуноглобулины (IgM и IgA) с легкими цепями обнаруживаются в криопреципитатах и биоптатах слюнных желез в ранних стадиях заболевания, что затрудняет проведение дифференциальной диагностики между БШ с трансформацией в злокачественную лимфому и доброкачественной лимфопролиферацией при этом заболевании.
Диагноз
В поликлинических условиях целесообразно учитывать различные сочетания следующих симптомов:
• артралгии или (реже) неэрозивный артрит мелких суставов кистей;
• рецидивирующий паротит и постепенное увеличение околоушных желез;
• сухость слизистой оболочки полости рта (носоглотки) и быстрое развитие множественного, преимущественно пришеечного, кариеса зубов;
• рецидивирующий хронический конъюнктивит;
• синдром Рейно;
• стойкое повышение СОЭ (свыше 30 мм/ч);
• гипергаммаглобулинемия (свыше 20%);
• наличие ревматоидного фактора в крови (титр более 1: 80).
Хотя ни один из этих признаков, взятый в отдельности, не является специфичным для БШ, наличие четырех признаков и более позволяет в 80–70% случаев заподозрить и в дальнейшем с помощью специальных методов исследования подтвердить диагноз БШ.
Критерии диагноза БШ
• Сухой кератоконъюнктивит:
а) снижение слезовыделения после стимуляции нашатырным спиртом, тест Ширмера (менее 10 мм/5 мин);
б) окрашивание эпителия конъюнктивы и роговицы бенгальским розовым или флюоресцеином с последующей биомикроскопией.
• Паренхиматозный паротит:
а) обнаружение полостей более 1 мм при сиалографии;
б) уровень стимулированной секреции слюны менее 2,5 мл/5 мин;
в) очагово-диффузная, диффузная лимфоплазмоклеточная инфильтрация в биоптатах слюнных желез нижней губы.
• Лабораторные признаки системного аутоиммунного заболевания:
а) положительный ревматоидный (антинуклеарный) фактор;
б) обнаружение Ro/La антиядерных антител.
Диагноз определенной БШ может быть поставлен при наличии трех критериев и исключении других диффузных болезней соединительной ткани, ревматоидного артрита и аутоиммунных гепатобилиарных заболеваний.
Дифференциальный диагноз при БШ проводят с ревматоидным артритом, системной красной волчанкой, аутоиммунными заболеваниями печени и желчных путей в сочетании с синдромом Шегрена. Несмотря на длительное существование артралгии для БШ в отличие от ревматоидного артрита, нехарактерно наличие стойкого артрита и деформаций суставов; на рентгенограммах не обнаруживаются признаки эрозивного поражения суставов; артрит при БШ обычно полностью исчезает на 2-3-й день после назначения небольших доз кортикостероидов. Для системной красной волчанки характерны эритематозные высыпания на лице в виде “бабочки”, эндокардит, экссудативный серозит, нефротический синдром, наличие в крови ЛЕ-клеток и др. При хроническом активном гепатите, билиарном циррозе печени в отличие от БШ нарушения функциональных проб печени являются постоянным признаком, в крови обнаруживаются маркеры вируса гепатита В; в материале, полученном при биопсии печени, выявляются присущие этим заболеваниям морфологические изменения.
Отдельные симптомы, имеющие место при БШ, могут наблюдаться при различных других заболеваниях. Так, увеличение слюнных желез отмечается при опухолях желез, болезни Микулича, злокачественных лимфомах, саркоидозе, туберкулезе, актиномикозе, остром бактериальном и вирусном сиалоадените, хроническом паренхиматозном паротите, сиалодохите, гиперлипидемии и сахарном диабете, а также при нейроэндокринных заболеваниях (дисфункции половых и щитовидных желез). Использование критериев для диагностики БШ, отсутствие при этих состояниях признаков аутоиммунного заболевания, а также проведение биопсии малых слюнных желез нижней губы позволяют исключить БШ у большинства больных с названными состояниями.
Лечение
Основное место в лечении БШ принадлежит кортикостероидам и цитостатическим иммунодепрессантам (хлорбутин, циклофосфамид).
В начальной стадии заболевания при отсутствии признаков системных проявлений и умеренных нарушениях лабораторных показателей целесообразно длительное лечение преднизолоном в малых дозах (5–10 мг/день). В выраженной и поздней стадиях заболевания при отсутствии признаков системных проявлений необходимо назначение преднизолона (5–10 мг/день) и хлорбутина (2–4 мг/день) с последующим длительным, в течение нескольких лет, приемом поддерживающих доз преднизолона (5 мг/день) и хлорбутина (6–14 мг/нед). Такая схема может быть использована для лечения больных в начальных стадиях заболевания при наличии выраженных нарушений лабораторных показателей активности процесса, а также криоглобулинемии без четких признаков системных проявлений.
При наличии системных проявлений, независимо от стадии заболевания, гормональные и цитотоксические препараты используются в значительно более высоких дозах с учетом тяжести системных проявлений.
Пульс-терапия высокими дозами преднизолона и циклофосфана (1000 мг 6-метилпреднизолона внутривенно ежедневно в течение трех дней подряд и однократное внутривенное введение 1000 мг циклофосфана) с последующим переводом на умеренные дозы преднизолона (30–40 мг/день) и цитостатиков (хлорбутин 4-6 мг/день или циклофосфамид 200 мг внутримышечно 1–2 раза в неделю) при отсутствии гепатотоксического воздействия является наиболее эффективным методом лечения больных с тяжелыми системными проявлениями БШ, как правило, хорошо переносится больными и позволяет избежать многих осложнений, связанных с длительным приемом высоких доз преднизолона и цитостатиков. Экстракорпоральные методы лечения (гемосорбция, криоадсорбция, плазмаферез, двойная фильтрация плазмы) в комбинации с пульс-терапией наиболее эффективны при лечении больных БШ с язвенно-некротическим васкулитом, гломерулонефритом, полиневритом, миелополирадикулоневритом, цереброваскулитом, обусловленными криоглобулинемией.
Опыт предыдущих исследований свидетельствует о необходимости использования программных, т.е. проводящихся на протяжении длительного периода времени, методик экстракорпоральной терапии, особенно у больных БШ с моноклональной криоглобулинемией. По достижении выраженного клинического эффекта (улучшение общего состояния, регресс полисерозита, нефрита, полиневрита, васкулита и т.д.) и снижения лабораторных показателей активности процесса больных постепенно переводят на поддерживающие дозы глюкокортикостероидов и цитостатиков.
Параллельно проводят симптоматическую терапию офтальмологических, стоматологических, гастроэнтерологических и других проявлений заболевания.
Местная терапия при сухом кератоконъюнктивите направлена на преодоление гиполакримии, предотвращение вторичной инфекции, ускорение процессов регенерации эпителия конъюнктивы и роговицы. Гиполакримия является показанием к назначению искусственных слез. Они восполняют дефицит водного слоя прекорнеальной слезной пленки и удерживают ее в стабильном положении. Частота применения препаратов зависит от тяжести поражения органа зрения и колеблется от 3 до 10 раз в сутки. Во многих составах искусственных слез в качестве полимерного ингредиента используются эфиры целлюлозы: гидроксилпропилцеллюлоза – lacrisert, lacril, tiarisol, гидроксилцеллюлоза – clerz, lyteers, гидроксиметилцеллюлоза – лакрисин, лакрисифи. Широко используются другие гидрофильные полимеры: поливиниловый спирт – ligufilm, поливинилпирролидон. С целью сохранения остаточной слезной секреции применяются различные способы блокирования слезных путей: прижигание, введение желатина или клейких тканей (N-бутилцианокрил) непосредственно в слезные канальцы, а также силиконовые пробки (punctum plug) для перманентной тампонады слезной точки и создания физиологического блока.
С целью защиты роговицы применяются лечебные мягкие контактные линзы. Для профилактики вторичной инфекции используют растворы фурацилина (в разведении 1:5000), 0,25% раствор левомицетина, ципрофлоксацина и др. Уменьшению вязкости прекорнеального слоя способствует применение трипсина, хемотрипсина (2 мг на 10 мл изотонического раствора натрия хлорида), фибринолизина и лекозима. С целью воздействия на регенерацию эпителия роговицы и конъюнктивы инстиллируют цитраль с рибофлавином, закладывают на ночь 0,5% тиаминовую, 10% метилурациловую, солкосериловую мази.
Терапия хронического сиалоаденита направлена на преодоление гипосаливации, укрепление стенок протоков слюнных желез, профилактику обострений сиалоаденита, улучшение регенерации эпителия слизистой оболочки полости рта и борьбу со вторичной инфекцией. С целью нормализации трофики и секреции слюнных желез используют новокаиновые блокады. В случаях обострения хронического паротита (и для профилактики его рецидивов) применяют аппликации 10–30% раствора димексида. В случаях развития гнойного паротита в протоки слюнных желез вводят антибиотики и местно назначают противогрибковые препараты (нистатин, леворин, нистатиновую мазь). Для уменьшения проницаемости протоков внутривенно или внутримышечно вводят препараты кальция.
Ускорить эпителизацию слизистой оболочки полости рта и красной каймы губ при возникновении эрозий и трещин удается с помощью масел шиповника и облепихи, солкосериловой и метилурациловой мазей, а также путем обработки слизистой оболочки рта препаратом ЭНКАД (активные дериваты нуклеиновых кислот). Антибактериальными свойствами обладает также декаминовая карамель. При сухости слизистой оболочки носа применяют частые аппликации изотонического раствора натрия хлорида (с помощью турунд). Сухость влагалища уменьшается при использовании калиево-йодистого желе. При сухости трахеи и бронхов рекомендуется длительный прием бромгексина (8–16 мг 3 раза в сутки в течение 2–3 мес). При наличии симптомов хронического гастрита с секреторной недостаточностью в течение длительного времени проводят заместительную терапию (соляная кислота, натуральный желудочный сок, пепсидил). Недостаточность панкреатической секреции требует приема ферментов: панзинорма, креона, фестала курсами по 2–3 мес или постоянно, проводится также лечение солкосерилом (по 2 мл внутримышечно 2 раза в день в течение 15–30 дней).
Прогноз для жизни благоприятный. При своевременно начатом лечении удается замедлить прогрессирование заболевания, восстановить трудоспособность больных. При позднем начале лечения обычно быстро развиваются тяжелые офтальмологические, стоматологические, а также системные проявления заболевания, происходит инвалидизация больного. У больного БШ с моноклональной криоглобулинемией и в случаях развития злокачественных лимфопролиферативных заболеваний прогноз менее благоприятный.
Профилактика направлена на предупреждение обострений и прогрессирования заболевания. Она предусматривает раннюю диагностику и своевременное начало адекватной терапии. Некоторые больные нуждаются в ограничении физических нагрузок и нагрузок на органы зрения, в исключении аллергизирующих воздействий. Больным противопоказана вакцинация, с большой осторожностью должны применяться тепловые процедуры. Необходимы санация рта и своевременное протезирование зубов.
Литература:
1. В.И. Васильев, М.В. Симонова, Т.Н. Сафонова. Болезнь Шегрена // Руководство по внутренним болезням “Ревматические болезни”, под рук. В.А. Насоновой, Н.В. Бунчука. М., “Медицина”, 1997;196–210.
2. International Seminar on SjЪurgren’s Syndrome. Editors R.Manthorpe, J.U. Prause. Scand Jorn of Rheum 1986;61:1–291.
3. Sjogren’s Syndrome. Clinical and Immunologicai Aspects. Editors N. Talal, Moutsopoulos HM, Kassan SS. Springer-Verlag, Berlin-Heidelberg, 1987;1–299.
4. Siogren’s Syndrome. State of the art. Kugler Publications. Amsterdam/New York. Editors Homma M., Sugaj S., Tojo T., Miysaka N., Akizuki M. 1994;1–615.
5. Fifth International Symposium on SjЪgren’s Syndrome. Fox RI. Arthritis Rheum 1996;39 (2):195–6.
В статье рассматриваются особенности патогенеза болезни Шегрена и современные терапевтические подходы. Подробно обсуждается доказательная база как синтетических иммуносупрессоров, так и современных генно-инженерных биологических препаратов. Проанализированы возможные причины недостаточной доказательной базы, а также сложности при организации рандомизированных контролируемых исследований при болезни Шегрена.
Ключевые слова: болезнь Шегрена, аутоиммунный эпителиит, MALT-лимфома, ритуксимаб
Введение
Болезнь Шегрена (БШ) – медленно прогрессирующее аутоиммунное заболевание, характеризующееся лимфоцитарной инфильтрацией эпителия протоков экзокринных желез (в первую очередь слюнных и слезных), ведущей к формированию их необратимой деструкции и развитию сухого синдрома. Заболевание имеет широкий клинический спектр от доброкачественно протекающей экзокринопатии до тяжелых и опасных для жизни состояний, таких как васкулит и лимфома, приводящих к конечной стадии органной недостаточности и иногда к смерти [1].
Пациенты с БШ встречаются не только в практике ревматолога, они обращаются к стоматологу с множественным пришеечным кариесом, рецидивирующими инфекционными процессами, кандидозом ротовой полости, ангулитом на фоне синдрома сухого рта [2]. Такие пациенты могут много лет наблюдаться у офтальмолога с сухим кератоконьюнктивитом и его осложнениями, и им даже может проводиться трансплантация роговицы, нередко безуспешно из-за развития реакции отторжения трансплантата и прогрессирования кератита [3]. Крайне важно повышать информированность врачей-стоматологов и офтальмологов о клинических проявлениях и методах диагностики БШ. Заместительная терапия увлажняющими препаратами на основании гиалуроновой кислоты, локальная стимуляция секреции и прочие методы, имеющиеся в арсенале офтальмолога и стоматолога, приводят к временному облегчению, но не останавливают прогрессирования процесса. В связи с этим наблюдение и лечение пациентов с БШ должно проводиться всегда врачом-ревматологом совместно с офтальмологом и стоматологом.
Считается, что клинические проявления БШ являются результатом двух основных иммунопатологических явлений: типичной периэпителиальной лимфоцитарной инфильтрации пораженных тканей и гиперактивности В-клеток. Было обнаружено, что эпителий слюнных и слезных желез играет важную роль в патогенезе заболевания. Клетки эпителия экспрессируют MHC (major histocompatibility complex) классов I и II, костимулирующие молекулы и молекулы адгезии, которые способны активировать наивные Т-клетки, а также продуцируют хемокины и цитокины, опосредующие рекрутирование и дифференцировку Т- и В-лимфоцитов в месте поражения. Эпителиальные клетки атакуются лимфоцитами и погибают в результате апоптоза, высвобождая некоторые аутоантигены, способствующие сохранению локального аутоиммунного ответа [4]. Центральная роль эпителия в патогенезе БШ привела к появлению в литературе термина «аутоиммунный эпителиит» [5].
В результате разрушения эпителия и замещения его клеток фиброзными структурами формируются деструкция и дисфункция тканей, вызывающие сухость слизистых оболочек. Подобная периэпителиальная лимфоцитарная инфильтрация может также наблюдаться в других органах, таких как бронхи, почки и печень, опосредуя внежелезистые проявления болезни [6]. Гиперактивность В-клеток – еще одно ключевое звено патогенеза БШ, подтверждается наличием гипергаммаглобулинемии и выработкой аутоантител, таких как антинуклеарные антитела, анти-Ro/SSA, анти-La/SSB и криоглобулины типа II. Кроме того, в малых слюнных железах происходит формирование структур, подобных эктопическому зародышевому центру, представляющих собой активный центр выработки криоглобулинов и лимфомагенеза при БШ [7]. Криоглобулины типа II, связанные с иммунными комплексами, вызывают повреждение тканей и развитие внеэпителиальных проявлений, таких как пальпируемая пурпура, периферическая невропатия и гломерулонефрит [8].
БШ, как правило, протекает доброкачественно. Большинство пациентов к моменту постановки диагноза имеют сложившуюся клиническую картину, которая может меняться на протяжении заболевания. У пациентов с железистыми проявлениями постепенно развивается тяжелый сухой синдром, существенно ухудшающий качество жизни, а развитие поздней стадии паренхиматозного паротита со временем является фактором риска формирования лимфомы слюнных желез [9].
Аналогичным образом внежелезистые системные проявления развиваются медленно и протекают относительно доброкачественно, у части больных имеют тенденцию возникать в период до появления признаков сухого синдрома или при постановке диагноза. В некоторых случаях хронический воспалительный процесс может приводить к медленно прогрессирующему поражению органа и конечной стадии органной недостаточности. С другой стороны, проявления БШ, опосредованные экстраэпителиальными иммунными комплексами, могут развиваться на любом этапе заболевания, существенно утяжеляют прогноз заболевания и обусловливают высокий риск смертности. Повышенная смертность среди пациентов с первичным синдромом Шегрена также связана с развитием лимфопролиферативных заболеваний, которые возникают в основном при длительном течении заболеваний, но далеко не всегда сопровождаются тяжелыми системными проявлениями в виде криоглобулинемии [10].
Возможности терапии
За долгие годы изучения заболевания общепринятые терапевтические подходы не продвинулись дальше облегчения симптомов железистой дисфункция и контроля различных системных проявлений с помощью иммуномодулирующих средств, заимствованных из терапевтического арсенала других аутоиммунных заболеваний, таких как ревматоидный артрит (РА) и СКВ. На сегодняшний день не существует общепринятой надежной болезнь-модифицирующей терапии БШ, которая могла бы использоваться в контрольных группах рандомизированных клинических исследований – РКИ [11].
Основными методами терапии, влияющими на течение заболевания и прогноз, являются иммуносупрессия глюкокортикостероидами (ГКС) и цитостатическими препаратами. Для замедления разрушения желез и сохранения их функции применяется базисная патогенетическая терапия [12]. По имеющимся данным, длительный прием малых доз хлорамбуцила или циклофосфамида в сочетании с малыми дозами ГКС или многолетняя поддерживающая терапия ритуксимабом (РТМ) позволяет сдерживать клинико-лабораторную активность заболевания, замедляет прогрессирование железистых проявлений [13].
Есть несколько причин, по которым современные фармацевтические разработки обошли своим вниманием БШ. Во-первых, медленно проводились исследования новых целевых методов лечения БШ по сравнению с обширной работой, посвященной поиску новых методов лечения РА и других типов воспалительного артрита. До недавнего времени среди многих фармацевтических и биотехнологических компаний преобладало ошибочное представление о том, что БШ является относительно благоприятным состоянием и не представляет собой привлекательную область инвестиций. Перспективы разработки новых лекарств для лечения БШ изменились за последние несколько лет с признанием того, что дисфункция желез представляет собой нечто большее, чем просто сухой синдром, и что внежелезистые проявления заболевание могут протекать с серьезными осложнениями. Кроме того, поиск модифицирующих болезнь подходов терапии БШ оказался более сложной задачей, чем ожидалось, по сравнению с разработкой новых методов лечения РА и других системных воспалительных заболеваний [13].
Ниже представлена доказательная база основных иммуносупрессивных препаратов, которые по-прежнему используют за рубежом.
Гидроксихлорохин (ГХ)
ГХ назначается больным БШ с целью купирования суставного синдрома и уменьшения слабости.
В нескольких открытых ретроспективных исследованиях ГХ снижал выраженность слабости, артралгий, миалгий и сухого синдрома при БШ [14, 15]. Эффективности ГХ при БШ посвящено несколько РКИ [16, 17].
Первое РКИ, проведенное в 1993 г., было крайне малочисленным, в нем приняли участие всего 19 пациентов с высокой активностью БШ. Пациенты были разделены на 2 группы, одна получала в течение года ГХ 400 мг/сут, затем еще год – плацебо. Вторая группа получала такую же терапию только в обратном порядке. Не отмечено влияния ГХ на слезопродукцию, данные сцинтиграфии слезных желез или другие параметры активности заболевания [16]. Второе РКИ JOKER включило уже 120 пациентов с низкой степенью активности БШ (медиана ESSDAI составила 2,5). Пациенты получали ГХ или плацебо в течение 24 недель, а затем еще 24 недели ГХ получали обе группы. ГХ никак не влиял на проявления сухого синдрома, суставной синдром и слабость. Отмечалось некоторое снижение СОЭ, уровня иммуноглобулина G (IgG) и IgM, которое было недостоверным [17]. Несмотря на эти данные, в большинстве руководств по терапии БШ ГХ по-прежнему рекомендован при поражении кожи, суставов, общей слабости [18, 19].
Метотрексат (МТС)
МТС фигурирует во всех зарубежных клинических рекомендациях, но его эффективность при БШ изучена крайне мало: было проведено одно открытое клиническое исследование и описан ряд наблюдений единичных случаев его успешного применения. МТС применялся при ассоциированной с БШ миелопатии и часто в комбинации с ГКС с недостаточным эффектом [20, 21]. Открытое клиническое исследование включило 17 пациентов, которые получали МТС в дозе 0,2 мг/кг/нед в течение года [22]. Некоторое субъективное уменьшение сухости не нашло своего подтверждения при оценке объективных параметров: саливация, и значения теста Ширмера не изменились. Уровень IgG и СОЭ были повышены исходно у 82 и 65% пациентов и остались неизменными в ходе лечения.
Азатиоприн (АЗА)
В литературе есть множество сообщений о случаях использования АЗА в сочетании с ГКС при различных внежелезистых проявлениях БШ: легочной гипертензии [23], интерстициальном цистите [24], интерстициальном поражении легких [25], интерстициальном нефрите [26], миелопатии [27].
C. Yeoman et al. обнаружили уменьшение числа фокусов лимфоидной инфильтрации в больших слюнных железах у мышей линии NZB/NZW после приема АЗА [28]. Единственное РКИ включbло 25 человек, которые были разделены на 2 группы, экспериментальная группа получала АЗА 1 мг/кг в течение 6 месяцев. В результате на фоне терапии не было обнаружено улучшения клинических (сухость, слабость, миалгии, артралгии), серологических и гистологических параметров. Шесть из 13 пациентов экспериментальной группы были исключены из исследования досрочно в связи с развитием побочных эффектов [29]. Вместе с тем препарат продолжает использоваться при внежелезистых проявлениях со стероидо-сберегающей целью.
Циклоспорин А (ЦсА)
Эффективность и безопасность ЦсА lkz пациентов с БШ оценивалась в двойном слепом РКИ с участием 20 пациентов [30]. Десять пациентов 6 месяцев получали препарат в дозировке 5 мг/кг, контрольная группа получала плацебо. В экспериментальной группе улучшение наблюдалось только в отношении ксеростомии. Все остальные субъективные и объективные параметры существенно не изменились после лечения в обеих группах. Гистологические параметры после 6 месяцев приема ЦсА также не изменились, в то время как в группе плацебо наблюдалась отрицательная динамика. К сожалению, уровень сывороточного IgG не оценивался.
Достаточно широко изучено местное использование ЦсА. Однако в большинство исследований включали как больных БШ, так и пациентов с синдромом сухого глаза неуточненного генеза.
Сообщалось о двух идентичных РКИ, изучавших эффективность и безопасность офтальмологической эмульсии ЦсА 0,05 и 0,1% по сравнению с плацебо [31]. Всего были включены 877 пациентов и лишь 30% – с БШ. Значительное улучшение наблюдалось как в группе 0,05%, так и в группе 0,1% ЦсA по сравнению с группой плацебо по таким объективным параметрам, как окрашивание роговицы и значения теста Ширмера, но время слезной пленки существенно не изменилось. Субъективные параметры – нечеткость зрения, частота использование препаратов искусственной слезы и оценка врачом общего ответа на лечение, существенно улучшились в группе, получавшей ЦсА 0,05%, по сравнению с группой плацебо. Местное применение ЦсА, как правило, безопасно, закапывание может сопровождаться чувством жжения, инфекционные осложнения развиваются крайне редко.
Лефлуномид (ЛФ)
Открытое пилотное исследование эффективности ЛФ при БШ включало 15 больных на ранней стадии заболевания, получавших 20 мг/сут ЛФ в течение 24 недель [32]. К концу исследования отмечалось снижение слабости, уровней иммуноглобулинов, ревматоидного фактора. Значения теста Ширмера существенно не изменились. Повторные биопсии малых слюнных желез были выполнены 5 из 15 больных, у 4 из них была обнаружена положительная динамика. Анализ цитокинового профиля был проведен 13 больным [33]. Через 24 недели было обнаружено снижение продукции фактора некроза опухоли α (ФНО-α), интерлейкина-1 (ИЛ-1), интерферона γ (ИФН-γ), ИЛ-2, ИЛ-6, ИЛ-10. Экспрессия CD40L CD4 Т лимфоцитами также снижалась на фоне приема ЛЕФ. Развитие этих эффектов возможно как в результате влияния препарата на В-лимфоциты, так и в связи со снижением Т-клеточной активации. Из 13 пациентов, принявших участие в исследовании, у 7 наблюдалось минимум 50% улучшения 2 из 3 параметров (сухость в глазах, сухость во рту, лабораторная динамика). Именно у этих пациентов обнаружено снижение уровней Т-клеточных цитокинов: ФНО-α и ИФН-γ. Авторы делают вывод, согласно которому эффект ЛФ обусловлен в основном подавлением активации Т-лимфоцитов.
Глюкокортикостероиды (ГКС)
Активное использование ГКС в клинической практике при БШ не подтверждается достоверными научными данными. Проспективное исследование в течение 4 лет показало, что прием ГКС не влияет на прогрессирование снижения саливации. РКИ эффективности преднизолона в дозе 30 мг/сут и пироксикама 20 мг/сут через 6 месяцев терапии продемонстрировало улучшение субъективных симптомов, при отсутствии достоверных изменений результатов саливации или уровня инфильтрации малых слюнных желез [34].
Следует отметить, что применение средних и высоких доз ГКС больными БШ, которые, как правило, пожилого возраста, сопровождается плохой переносимостью и ведет к быстрому развитию сахарного диабета 2 типа, остеопороза и других побочных эффектов. Данные небольших РКИ показывают, что системное применение ГКС может улучшить субъективные проявления сухого синдрома, однако данное улучшение не нашло своего отражения при оценке сиалометрии и слезовыделительной функции в динамике [35]. Таким образом, ГКС назначаются в низких дозах при системных проявлениях в сочетании с иммуносупрессоврными препаратами.
ГИБП-терапия БШ
Ингибиторы ФНО-α не рекомендовано использовать для лечения БШ. Эта рекомендация основана на небольшом контролируемом исследовании и единственном РКИ, где блокаторы ФНО-α используются для терапии РА или других нозологий в сочетании с вторичным синдромом Шегрена. Несмотря на теоретические предпосылки, доказательств повышения риска развития лимфомы у больных БШ на фоне терапии ингибиторами ФНО-α не было получено [36].
Известно, что при БШ в сыворотке и ткани желез повышена экспрессия цитокина, активирующего В-лимфоциты (BAFF – B-cell activating factor), который также называется В-клеточный стимулятор (BlyS), по сравнению с контрольной группой. Этот фактор стимулирует рост В-клеток и их гиперактивность и потому играет важную роль в патогенезе БШ. Концентрация BAFF в сыворотке больных коррелирует с активностью заболевания и развитием лимфопролиферативных осложнений. Белимумаб (БЛМ) – человеческое моноклональное антитело, ингибирующее BAFF. Препарат доказал свою эффективность и активно используется при СКВ, при БШ перспективы использования БЛМ по-прежнему неясны. Доступны результаты единственного открытого исследования с участием 30 человек, изложенные в нескольких статьях. На фоне терапии БЛМ обнаружено умеренное субъективное улучшение течения сухого синдрома. Более впечатляющие данные были получены при анализе объективных параметров: существенное и персистирующее снижение системной активности, нормализация биологических маркеров. Наблюдалось исчезновение криоглобулинемии, а также нормализация размеров слюнных желез у 10 из 13 больных с обострением после отмены терапии. Принимая во внимание что В-клеточная гиперреактивность лежит в основе лимфопролиферации при БШ, а персистирующая сиаломегалия и криоглобулинемия являются предикторами развития лимфом, БЛМ имеет перспективы в отношении предупреждения развития лимфопролиферативных осложнений. К сожалению, полученные данные имеют низкий уровень доказательности: единственное исследование не было рандомизированным и не имело контрольной группы. Ожидаются результаты многоцентрового двойного слепого плацебо-контролируемого исследования, посвященного эффективности монотерапии БЛМ и комбинированного использования РТМ и БЛМ при БШ [37].
Несколько новых препаратов, проходящих в настоящее время испытания, также в основе имеют воздействие на ось BAFF/BAF-R. Тибулизумаб – гуманизированное моноклональное антитело к BAFF и ИЛ-17а и яналумаб – человеческое IgG1 моноклональное антитело к BAFF-рецептору, вызывающее деплецию, вероятно, через механизм антитело-зависимой цитотоксичности и блокады сигнала BAFF/BAFF-R. Эффективность и безопасность яналумаба исследована в РКИ с параллельными группами в течение 24 недель с участием 27 пациентов. У всех пациентов на фоне терапии отмечалось снижение сывороточного уровня BAFF и степени поражения околоушных слюнных желез по данным ультразвукового исследования. Определялось улучшение по данным ESSDAI, ESSPRI и SF-36, общей оценки эффективности врачом и пациентом, которое не было достоверным. Была получена В-клеточная деплеция. Интересно, что выраженное улучшение физической активности и снижение общей слабости были получены после однократного введения 10 мг/кг и сохранялось до конца исследования. Эти результаты предварительные, исследование продолжается [38].
Анти В-клеточная терапия РТМ показана как пациентам с железистыми формами БШ, так и при развитии системных осложнений заболевания. Использование препаратов искусственной слезы, стимуляторов секреции, противовоспалительных капель с ГКС и нестероидных противовоспалительных средств и использования обтураторов носослезных канальцев имеет лишь симптоматическое действие. Прогрессирование сухого кератоконъюнктивита ведет к дальнейшему повреждению роговицы, развитию нитчатого кератита и дистрофии роговицы, а в ряде случаев – к формированию язв роговицы с необходимостью хирургического лечения. На фоне терапии РТМ улучшается течение кератоконъюнктивита, а при тяжелом повреждении роговицы применение системной иммуносупрессии РТМ в сочетании с ЦФ улучшает приживаемость трансплантата после неоднократных реакций отторжения. Стимуляторы секреции и заменители слюны не сдерживают прогрессирования деструкции желез. Ксеростомия с наличием остаточной секреции также хорошо отвечает на анти-В-клеточную терапию. И хотя проведенные РКИ не достигли своих конечных точек, эти данные получены при анализе вторичных точек РКИ и результатов неконтролируемых исследований [19].
РТМ показан при системных проявлениях БШ, таких как васкулит, поражение легких, полиневропатия и множественный мононеврит. Прицельно эффективность РТМ при тех или иных системных проявлениях не исследовалась в РКИ. Эта рекомендация основана на нерандомизированных контролируемых испытаниях и описаниях серий случаев, в т.ч. результатов французского регистра, включающего 78 пациентов с различными внежелезистыми проявлениями [39]. Кроме того, результаты клинических исследований при других ревматических патологиях, например РА или васкулит, как правило, экстраполируются на пациентов с БШ. Сила данной рекомендации невысока и основана на экспертном мнении. В систематическом обзоре была проанализирована эффективность и безопасность РТМ суммарно у 298 пациентов с БШ, принявших участие в 4 РКИ и одном субисследовании [40–43]. Авторы сделали вывод, что 2 из 5 исследований достигли конечных точек: было обнаружено увеличение стимулированной саливации у пациентов с сохранной остаточной продукцией слюны, а также достигнута положительная динамика ультразвукового индекса оценки слюнных желез. Кроме того, на фоне терапии РТМ отмечалось уменьшение слабости по шкале MFI. РТМ рекомендован при системных проявлениях БШ, рефрактерных к традиционной иммуносупрессивной терапии, для усиления эффективности может сочетаться с цитостатическими препаратами.
У пациентов с небольшой длительностью заболевания и сохраненной остаточной секрецией желез монотерапия РТМ приводит к увеличению саливации и улучшению офтальмологических проявлений. РТМ назначают при БШ, осложненной лимфомой низкой степени злокачественности MALT-типа (локализованной экстранодальной лимфомой слюнных и слезных желез без поражения костного мозга). Проводится как монотерапия РТМ, так и комбинированная терапия РТМ и ЦФ. По нашему мнению, лечение железистых и внежелезистых проявлений БШ надо начинать сразу после диагностики заболевания и оптимальным методом лечения является РТМ, который заменил эффективные, но более токсичные хлорбутин и циклофосфан.
Исходы клинических исследований при БШ зависят от многих факторов, например от характеристик популяции больных, продолжительности РКИ, оцениваемых конечных точек.
У многих пациентов первые симптомы появляются за 5 лет до постановки диагноза, таким образом, к моменту начала терапии фиброзные изменения экзокринных желез сильно выражены и, соответственно, не полностью обратимы. Это может определять недостаточную эффективность исследуемых препаратов в отношении улучшения функции желез. Кроме того, доказано, что между субъективными и объективными параметрами плохая корреляция, что делает сложной задачу выбора конечных точек [44]. Недостаточная продолжительность исследований также снижает возможность зафиксировать различия между экспериментальной и контрольной группами. Улучшение секреторной функции желез происходит только при существенном уменьшении лимфоцитарной инфильтрации экзокринных желез и ремоделировании железистой ткани, что также требует длительного периода исследования. Предыдущие эксперименты с повреждением слюнной железы показали, что регенерация в некоторой степени возможна благодаря самообновлению ацинарных клеток [45]. Сроки регенерации неясны, но предположительно колеблются от нескольких месяцев до нескольких лет.
Стоит отметить, что синтетические иммуносупрессоры, фигурирующие во всех международных рекомендациях, согласно имеющейся доказательной базе, не оказывают влияния ни на одно из звеньев патогенеза БШ. Они не снижают В-клеточную гиперактивность и не уменьшают инфильтрацию желез, а следовательно, практически не влияют на клинические проявления заболевания и не предотвращают развития системных проявлений и лимфопролиферативных осложнений. При этом РТМ при БШ эффективно снижает В-клеточную активность, улучшает морфологическую картину слюнных желез и позволяет контролировать внежелезистые проявления заболевания, уменьшает проявления сухого синдрома и слабости.
Заключение
Есть надежда, что последующие исследования, проведенные с учетом уже признанных недочетов, достаточной продолжительности, с хорошо подобранными конечными точками и стратификацией пациентов на клинико-лабораторные группы, позволят получить более достоверные результаты и предложат ревматологам новые эффективные терапевтические подходы к лечению БШ.
1. Goules A.V., Tziofas A.G: Primary Sjögren’s syndrome: Clinical phenotypes, outcome and the development of biomarkers. Autoimmun Rev. 2016;15:695–703. Doi: 10.1007/s12026-016-8844-4.
2. Barbosa E.C., Jéssica Bruna Corrêa Lindoso, de Oliveira Conde N.C., et al. Oral manifestations and histopathology of minor salivary gland from patients with Sjögren’s Syndrome and its diagnosis in a public health system. Rev Bras Odontol. 201673(4):297–304. Doi: 10.18363/rbo.v73n4.p.297.
3. Bordal O., Norheim K.B., Rødahl E., et al. Primary Sjögren’s syndrome and the eye. Surv Ophthalmol. 2020;65(2):119–32. Doi: 10.1016/j.survophthal.2019.10.004.
4. Goules A.V., Kapsogeorgou E.K., Tziofas A.G. Insight into pathogenesis of Sjögren’s syndrome: Dissection on autoim¬mune infiltrates and epithelial cells. Clin Immunol. 2017;182:30–40. Doi: 10.1016/j.clim.2017.03.007.
5. Katsiougiannis S., Tenta R., Skopouli F.N. Autoimmune epithelitis (Sjögren’s syndrome); the impact of metabolic status of glandular epithelial cells on auto-immunogenicity. J Autoimmun. 2019;104:102335. Doi:10.1016/j.jaut.2019.102335.
6. Skopouli F.N., Dafni U., Ioannidis J.P., Moutsopoulos H.M. Clinical evolution, and morbidity and mortality of primary Sjögren’s syndrome. Semin Arthr Rheum. 2000;29:296–304. doi: 10.1016/s0049-0172(00)80016-5.
7. Błochowiak K., Sokalski J. Labial salivary gland biopsy in the diagnosis of Sjögren’s syndrome. Eur J Clin Exp Med. 2019;17(2):162–68. Doi:10.15584/ejcem.2019.2.10.
8. Argyropoulou O.D., Pezoulas V., Chatzis L., et al. Cryoglobulinemic vasculitis in primary Sjögren’s Syndrome: Clinical presentation, association with lymphoma and comparison with Hepatitis C-related disease. Semin Arthr Rheum. 2020;50(5):846–53. Doi: 10.1016/j.semarthrit.2020.07.013.
9. Sun R., Medeiros L.J., Young K.H. Diagnostic and predictive biomarkers for lymphoma diagnosis and treatment in the era of precision medicine. Mod Pathol. 2016;29(10):1118–42. Doi: 10.1038/modpathol.2016.92.
10. Ioannidis J.P., Vassiliou V.A., Moutsopoulos H.M.Long-term risk of mortality and lymphoproliferative disease and predictive classification of primary Sjögren’s syndrome. Arthr Rheum. 2002;46:741–47. Doi: 10.1002/art.10221.
11. Leverenz D.L., St. Clair E.W. Recent advances in the search for a targeted immunomodulatory therapy for primary Sjögren’s syndrome
12. Сафонова Т.Н., Васильев В.И., Лихванцева В.Г. Синдром Шегрена: Руководство для врачей. Под ред. В.Г. Лихванцевой. М., 2013. 600 с.
13. Torgashina A., Rodionova E., Safonova T., et al. Efficacy of prolonged maintenance monotherapy with rituximab in patients with primary Sjogren’s syndrome: three-year follow-up. Ann Rheum Dis. 2018;77(Suppl. 2). Doi: 10.1136/annrheumdis-2018-eular.5718.
14. Çankaya H., Alpöz E., Karabulut G., et al. Effects of hydroxychloroquine on salivary flow rates and oral complaints of Sjögren patients: a prospective sample study. Oral Surg Oral Med Oral Pathol. Oral Radiol. Endod. 2010;110:62–7. Doi: 10.1016/j.tripleo.2010.02.032.
15. Tishler M., Yaron I., Shirazi I., Yaron M. Hydroxychloroquine treatment for primary Sjögren’s syndrome: its effect on salivary and serum inflammatory markers. Ann Rheum Dis. 1999;58:253–56. Doi: 10.1136/ard.58.4.253.
16. Kruize A., Hene R., Kallenberg C., et al. Hydroxychloroquine treatment for primary Sjögren’s syndrome: a two year double blind cross over trial. Ann Rheum Dis. 1993;52:360–4. doi: 10.1136/ard.52.5.360.
17. Gottenberg J.-E., Ravaud P., Puéchal X., et al. Effects of hydroxychloroquine on symptomatic improvement in primary Sjögren syndrome the JOQUER randomized clinical trial. JAMA. 2014;312:249–58. Doi: 10.1001/jama.2014.7682.
18. Romгo V.C., Talarico R., Scir C.A., et al. Sjögren’s syndrome: state of the art on clinical practice guidelines. RMD. Open. 2018;0:e000789. Doi: 10.1136/rmdopen-2018-000789.
19. Price E.J., Rauz S., Tappuni A.R., et al. The British Society for Rheumatology guideline for the management of adults with primary Sjogren’s Syndrome. Rheumatol. (Oxford). 2017;56(10):e24–48. Doi: 10.1093/rheumatology/kex166.
20. Rogers S., Williams C., Roman G. Myelopathy in Sjögren’s syndrome: role of non-steroidal immunosuppressants. Drugs. 2004;64:123–32. Doi: 10.2165/00003495-200464020-00001.
21. Misterska-Skóra M., Sebastian A., Dziefiel P., Sebastian M., Wiland P. Inclusion body myositis associated with Sjögren’s syndrome. Rheumatol Int. 2013;33:3083–86. Doi: 10.1007/s00296-012-2556-4.
22. Skopouli F., Jagiello P., Moutsopoulos H. Methotrexate in primary Sjögren’s syndrome. Clin Exp Rheumatol. 1996;14:555–58.
23. Hwang J., Yang T., Lee J., et al. Severe pulmonary hypertension in primary Sjögren’s syndrome. Korean Circ J. 2013;43(7):504. Doi:10.4070/kcj.2013.43.7.504.
24. Darrieutort-Laffite C., André V., Hayem G., et al. Sjögren’s syndrome complicated by interstitial cystitis: a case series and literature review. J Bone Spine. 2015;82:245–50. Doi:10.1016/j.jbspin. 2014.12.007.
25. Deheinzelin D., Capelozzi V.L., Kairalla R.A., et al. Interstitial lung disease in primary Sjogren’s syndrome. Clinical-pathological evaluation and response to treatment. Am J Respir Crit Care Med. 1996;154:794–99. Doi: 10.1164/ajrccm.154.3.8810621.
26. Kaufman I., Schwartz D., Caspi D., Paran D.Sjögren’s syndrome – not just Sicca: renal involvement in Sjögren’s syndrome. Scand J Rheumatol. 2008;37:213–18. Doi: 10.1080/03009740701867323.
27. Hermisson M., Klein R., Schmidt F., Weller M.,Kuker W. Myelopathy in primary Sjogren’s syndrome: diagnostic and therapeutic aspects. Acta Neurol Scand. 2002. Doi: 10.1034/j.1600-0404.2002.01167.x.
28. Yeoman C., Franklin C. The treatment of Sjögren’s disease in NZB/NZW F1 hybrid mice with azathioprine: a two-stage study. Clin Exp Rheumatol. 1994;12:49–53.
29. Price E., Rigby S., Clancy U., Venables P.A. Double blind placebo controlled trial of azathioprine in the treatment of primary Sjögren’s syndrome. J Rheumatol. 1998;25:896–99.
30. Drosos A., Skopouli F., Galanopoulo V., et al. Cyclosporin A. Therapy in patients with primary Sjögren’s syndrome: results at one year. Scan J Rheumatol. 1986;61(Suppl.):246–49.
31. Sall K., Stevenson O., Mundorf T., Reis B. Two multicenter, randomized studies of the efficacy and safety of cyclosporine ophtalmic emulsion in moderate to severe dry eye disease. Ophtalmol. 2005;112:1790–94. Doi: 10.1016/s0161-6420(99)00176-1.
32. Van Woerkom J.M.Kruize A.A., Geenen R., et al. Safety and efficacy of leflunomide in primary Sjögren’s syndrome: a phase II pilot study. Ann Rheum Dis. 2007;66:1026–32. Doi: 10.1136/ard.2006.060905.
33. Bikker A., van Woerkom J.-M., Kruize A.A., et al. Clinical efficacy of leflunomide in primary Sjogren’s syndrome is associated with regulation of T-cell activity and upregulation of IL-7 receptor α expression. Ann Rheum Dis. 2012;71:1934–41. Doi: 10.1136/annrheumdis-2011-201026.
34. Fox P.C., Datiles M., Atkinson J.C., et al. Prednisone and piroxicam for treatment of primary Sjögren’s syndrome. Clin Exp Rheumatol. 1993;11:149–56.
35. Miyawaki S., Nishiyama S., Matoba K. Efficacy of low-dose prednisolone maintenance for saliva production and serological abnormalities in patients with primary Sjögren’s syndrome. Intern Med. 1999;38:938–43. doi: 10.2169/internalmedicine.38.938.
36. Carsons S.E., Vivino F.B., Parke A., et al. Treatment Guidelines for Rheumatologic Manifestations of Sjogren’s Syndrome: Use of Biologic Agents, Management of Fatigue, and Inflammatory Musculoskeletal Pain. Arthr Care Res. (Hoboken). 2017;69(4):517–27. Doi:10.1002/acr.22968.
37. Blvarez-Rivasa N., Sang-Parkb H., del Campoc P.D., et al. Efficacy of Belimumab in Primary Sjogren’s Syndrome: A Systematic Review. Reumatol Clin. 2020;22;S1699-258X(20)30076-0. doi: 10.1016/j.reuma.2020.03.003.
38. Mavragani C.P., Moutsopoulos H.M. Sjögren’s syndrome: Old and new therapeutic targets. J Autoimmun. 2020;110:102364. Doi:10.1016/j.jaut.2019.102364.
39. Gottenberg J.E., Cinquetti G., Larroche C., et al. Efficacy of rituximab in systemic manifestations of primary Sjogren’s syndrome: results in 78 patients of the AutoImmune and Rituximab registry. Ann Rheum Dis. 2013;72(6):1026–31. Doi: 10.1136/annrheumdis-2012-202293.
40. Dass S., Bowman S.J., Vital E.M., et al. Reduction of fatigue in Sjo¨gren syndrome with rituximab: results of a randomised, double-blind, placebo-controlled pilot study. Ann Rheum Dis. 2008;67:1541–44. Doi:10.1136/ard.2007.083865.
41. Meijer J.M., Meiners P.M., Vissink A., et al. Effectiveness of Rituximab Treatment in Primary Sjogren’s Syndrome. A Randomized, Double-Blind, Placebo-Controlled Trial. Arthr Rheum. 2010;62(4):960–68. Doi: 10.1002/art.27314.
42. Devauchelle-Pensec V., Mariette X., Jousse-Joulin S., et al. Treatment of Primary Sjo¨gren Syndrome With Rituximab. A Randomized Trial. Ann Intern Med. 2014;160:233–42. Doi: 10.7326/M13-1085.
43. Bowman S.J., Everett C.C., O’Dwyer J.L., et al. Randomized controlled trial of rituximab and cost-effectiveness analysis in treating fatigue and oral dryness in primary Sjogren’s syndrome. Arthr Rheum. 2017;69(7):1440–50. Doi: 10.1002/art.40093.
44. Adatia F.A., Michaeli-Cohen A., Naor J., et al. Correlation between corneal sensitivity, subjective dry eye symptoms and corneal staining in Sjogren’s syndrome. Canadian journal of ophthalmology. J Canad d’ophtalmol. 2004;39(7):767–71. Doi: 10.1016/s0008-4182(04)80071-1.
45. Aure M.H., Arany S., Ovitt C.E. Salivary Glands: Stem Cells, Self-duplication, or Both? J Dent Res. 2015;94(11):1502–507. Doi: 10.1177/0022034515599770.
Автор для связи: А.В. Торгашина, к.м.н., лаборатория интенсивных методов терапии, Научно-исследовательский институт ревматологии
им. В.А. Насоновой, Москва, Россия; anna.torgashina@gmail.com; ORCID: https://orcid.org/0000-0001-8099-2107
Адрес: 115522, Россия, Москва, Каширское ш., 34А