Дата публикации 28 января 2021Обновлено 26 апреля 2021
Определение болезни. Причины заболевания
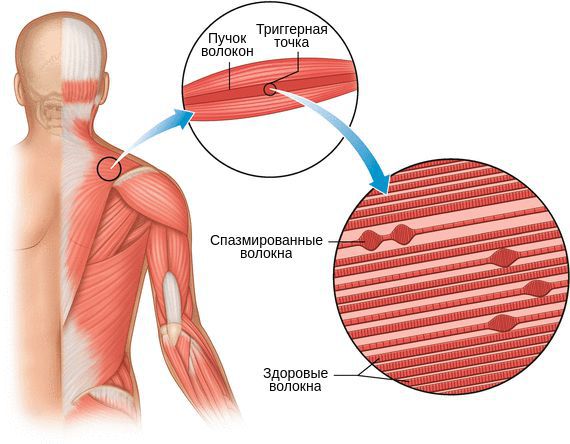
Миофасциальный синдром — это болезненное состояние, для которого характерна боль в любой части тела и болезненные мышечные напряжения с локальными уплотнениями — триггерными точками. Источником такой боли становятся мышцы и фасции — соединительная ткань, покрывающая мышцы.
Миофасциальный синдром — распространённая патология. Она встречается у 3-13 % населения США, т. е. у 21-93 % американцев с хронической скелетно-мышечной болью [27].
Миофасциальная боль — одно из проявлений миофасциального синдрома. Она развивается при хронической скелетно-мышечной боли и может возникать в любых скелетных мышцах.
Такая боль является причиной частых обращений к ревматологам, неврологам, ортопедам, гнатологам и другим врачам, специализирующихся на лечении боли. Однако диагноз часто пропускают, так как миофасциальная боль — малоизученный феномен [1].
Триггерные точки, как и миофасциальная боль, могут располагаться в любой мышце. Их появление не зависит от расы и пола, однако с возрастом риск образования увеличивается.
Вероятность возникновения триггерных точек также зависит от уровня физической активности. Люди, которые ведут малоподвижный образ жизни, более склонны к появлению триггерных точек чем те, кто ежедневно энергично тренируются. Это связано с состоянием мышечной ткани: у активных людей мышцы лучше кровоснабжаются, в них быстрее протекают все биохимические реакции.
Развитию миофасциальной боли способствуют многие факторы:
- перегрузка нетренированных мышц — часто такое происходит во время работы на даче;
- резкие движения;
- чрезмерные физические нагрузки;
- болезни внутренних органов, например гепатит и пиелонефрит;
- эмоциональный стресс.
Боль в поражённых внутренних органах и суставах приводит к защитному напряжению мышц. Это позволяет разгрузить сустав и создать мышечный корсет вокруг внутреннего органа. Например, при некоторых болезнях желудка тонус сгибателей шеи снижается, а тонус разгибателей повышается. Это приводит к боли в области затылка.
Эмоциональный стресс также сопровождается мышечным напряжением, чем может активировать триггерные точки. При этом мышцы могут оставаться в спазмированном состоянии даже после прекращения стресса.
Другими причинами миофасциального синдрома могут стать длительное статическое напряжение мышц и стереотипные движения, особенно в условиях низкой температуры. К таким факторам относят частые повороты и наклоны туловища, однообразный тяжёлый физический труд, длительную сидячую работу в офисе или долгие поездки за рулём.
Спровоцировать появление триггерных точек может сдавление мышц ремнями, лямками рюкзака, узкими бретельками, тугими джинсами или тяжёлой шубой.
Ещё одна причина — длительная неподвижность мышцы, например сон в одной и той же позе или ношение гипса после перелома.
Свой вклад в формирование миофасциального синдрома также вносят:
- разная длина ног;
- асимметрия скелета;
- нарушения осанки;
- плоскостопие;
- аномалия строения грудной клетки и таза;
- анемия;
- низкий уровень кальция, калия, железа и витаминов С, В1, В6 и В12;
- дефицит витамина D;
- хронические инфекции, например цистит;
- недосыпание;
- радикулопатия;
- депрессия;
- гипотиреоз;
- гипогликемия;
- гиперурикемия — повышенный уровень мочевой кислоты в крови [1][4].
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы миофасциального синдрома
Классическими признаками миофасциальной боли являются:
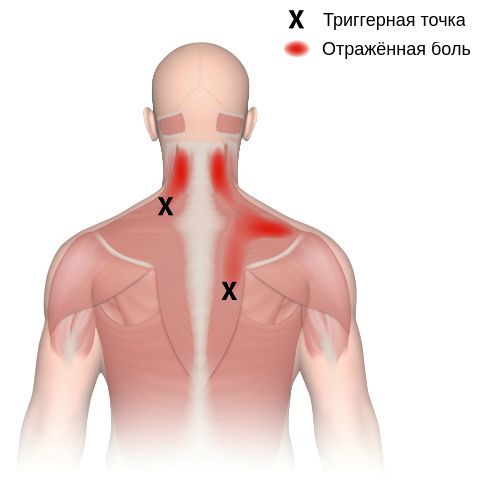
- появление триггерных точек, которые вызывают отражённую (иррадиирующую) боль в конкретных зонах, характерных для каждой мышцы;
- скованность и ограниченность движений в той части тела, где возникла миофасциальная боль;
- видимые на глаз или ощутимые при пальпации ответные подёргивания мышц.
Пациенты с миофасциальной болью обычно жалуются на местные ноющие и плохо локализуемые боли в мышцах и суставах, которые часто не дают им уснуть. Боль может быть очень сильной и отдавать в конечность. Такое состояние пациенты часто трактуют, как ущемление нерва.
Миофасциальная боль может вызывать напряжение, мышечную слабость, треск и щелчки в суставах, а также вегетативные явления, например потливость, ощущение «ползания мурашек» и изменения температуры кожи.
Спазмированная мышца, сдавившая проходящий рядом кровеносный/лимфатический сосуд или нерв, может вызвать дополнительные симптомы, такие как онемение и отёк части тела. При спазмировании мышц шеи может возникнуть головокружение, заложенность и шум в ухе.
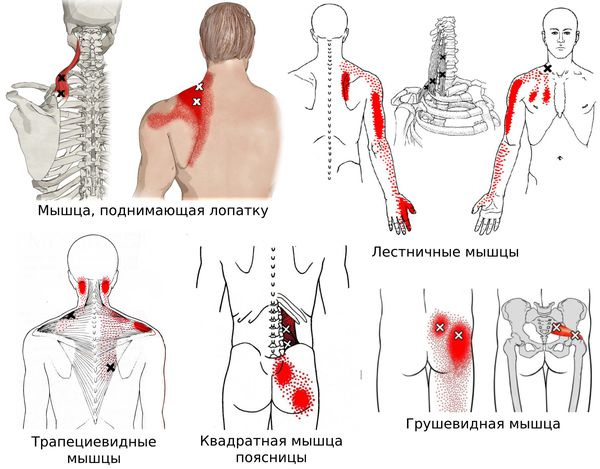
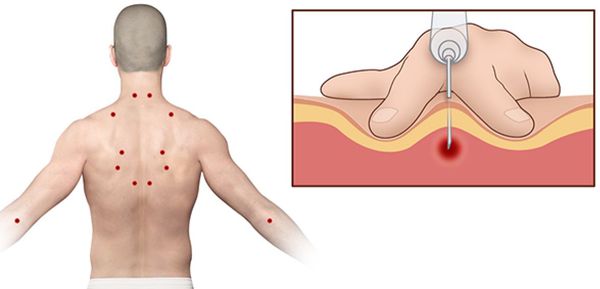
Согласно наблюдениям, чаще спазм возникает в мышце, поднимающей лопатку, грушевидной, трапециевидной, лестничной мышцах и квадратной мышце поясницы.
Свыше 70 % триггерных точек соответствуют акупунктурным точкам, которые используются для лечения боли [2]. При этом в каждой мышце может быть минимум одна триггерная точка.
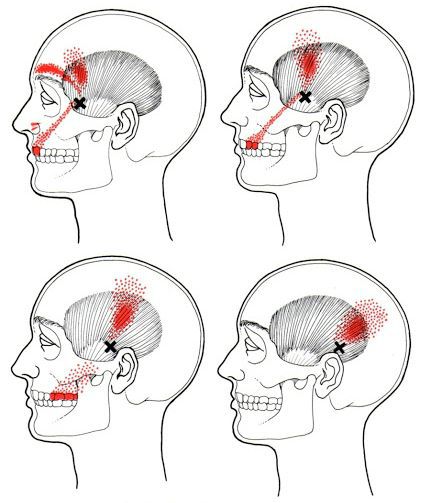
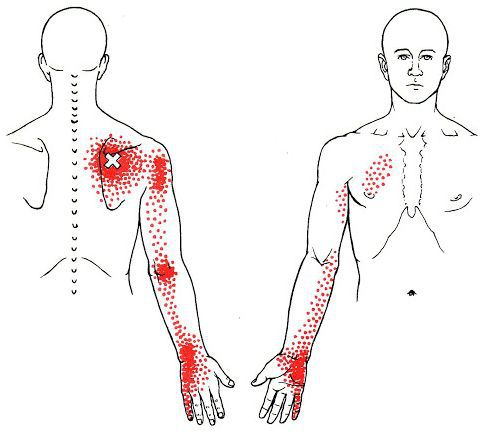
Каждой точке характерны свои зоны иррадиации. Например:
- при появлении триггерной точки в височной мышце боль распространяется в различные части головы и даже зубы;
- при триггерной точке в верхней части спины — в область шеи, виска, нижнюю челюсть и руку;
- при точке в нижней части спины — в поясницу, ягодицы, бёдра и копчик;
- при точке в области шеи — в лопатку, затылок, лоб, темя и уши;
- при точке в области живота — в бок, поясницу и бёдра [10].
Активные триггерные точки являются непосредственным источником боли. После их стимуляции боль распространяется в отдалённые, но строго определённые зоны, как на картинках выше.
Латентные триггерные точки вызывают скованность и ограничение движений в мышце, но не являются источником боли [3]. Они болят только при пальпации. Их активация чаще происходит из-за стресса, постоянного мышечного напряжения и нарушения осанки. Появляются такие точки в ответ на первично-активные триггерные точки и обычно исчезают после того, как активная точка была инактивирована.
Уплотнение участка мышцы может предшествовать формированию триггерной точки, поэтому его появление не всегда сопровождается болью.
Патогенез миофасциального синдрома
Патофизиология миофасциальной боли не совсем понятна. Считается, что в основе этой патологии лежит нарушение сократимости мышц и уменьшение их способности к расслаблению.
Согласно теории ишемического спазма мышцы, развитие миофасциального синдрома начинается с острой или хронической перегрузки мышцы [38]. Эта перегрузка запускает каскад патологических изменений:
- нарушается кровоток;
- повреждаются ткани;
- накапливаются воспалительные вещества;
- раздражаются болевые рецепторы;
- возникает боль;
- усиливается спазм мышцы.
Длительный спазм приводит к рубцеванию мышцы и формированию триггерных точек. Мышца становиться менее растяжимой, что ведёт к ограничению движений.
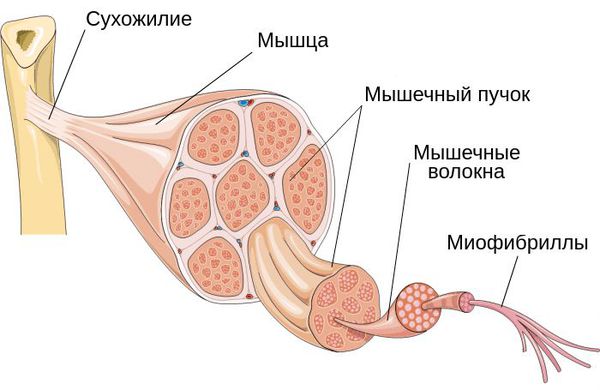
Поражение может локализоваться как в пределах нескольких миофибрилл — микроструктурной части мышцы, так и в мышечных группах.
Один из показателей изменения тонуса мышц — наличие локальных уплотнений. Они могут образоваться в вялой (гипотоничной) мышце в виде малоактивных образований или как триггерный феномен в виде уплотнённого участка мышцы с выраженной местной и отражённой болью и локальным судорожным ответом.
Как показало исследование 2008 года, в мышечной ткани вокруг активных триггерных точек повышена концентрации веществ, связанных с болью: медиаторов воспаления, нейропептидов, цитокинов и катехоламинов. Вокруг неактивных триггерных точек концентрация этих соединений была меньше по сравнению с активной точкой, но больше, чем у обследуемых без миофасциального синдрома [6].
Согласно другому исследованию, несколько лоскутов в области триггерных точек тесно связаны с нервными волокнами и моторными концевыми пластинами позвонков. Вероятно, напряжение мышц при миофасциальном синдроме может быть связано с дисфункцией этих моторных концевых пластин и повышенной чувствительностью восходящих нервных волокон и нейронов задних рогов спинного мозга [7].
Благодаря ещё одному исследованию, проведённому в Испании в 2011 году, у женщин была обнаружена связь между количеством активных триггерных точек и интенсивностью спонтанной боли [8]. Взаимосвязь была прямо пропорциональной: чем больше было точек, тем сильнее выражалась боль.
Классификация и стадии развития миофасциального синдрома
В Международной классификации болезней (МКБ-10) нет отдельного кода для миофасциального синдрома. Он относится сразу к нескольким рубрикам:
- М79.9 — «Другие болезни мягких тканей, не классифицированные в других рубриках»;
- М79.1 — «Миалгия», т. е. боль в мышцах;
- М72.5 — «Фасциит, не классифицированный в других рубриках», т. е. воспаление ткани, покрывающей мышцы;
- М62.9 — «Неуточнённые нарушения мышц» [39].
Сам синдром подразделяют на первичный и вторичный [9].
Первичный синдром связан с первоначальной дисфункцией мышцы, например перерастяжением, повторной микротравмой, переохлаждением мышцы и работой за компьютером в неправильной позе.
Вторичный синдром развивается на фоне патологий позвоночника и других соматических заболеваний. К таким причинам относят остеоартроз, сколиоз, разную длину ног, ревматоидный артрит, гипотиреоз, хронические инфекции, например кандидоз, и др. [3].
Течение миофасциальной боли разделяют на три фазы:
- I фаза — острая боль: постоянные мучительные боли, есть активные триггерные точки;
- II фаза — подострая боль: болезненные ощущения возникают только при движении;
- III фаза — хроническая боль: чувство дискомфорта и умеренные мышечные нарушения, есть латентные триггерные точки, которые активируются под воздействием негативных факторов [5].
Острая миофасциальная боль развивается в ответ на определённое событие или травму, например после быстрого неловкого движения. Хроническая боль может возникать в результате плохой осанки или чрезмерной мышечной нагрузки [4].
Осложнения миофасциального синдрома
Триггерные точки могут возникать в результате соматических заболеваний [3]. Боль в поражённом органе приводит к защитному напряжению рядом расположенных мышц:
- при язве желудка или заболевании почек триггерные точки формируются в мышцах позвоночного столба;
- гинекологическая патология может привести к появлению триггерных точек в мышцах тазового дна и хронических болей внизу живота и спины;
- при ишемической болезни сердца триггерные точки обычно формируются слева в лестничных, большой грудной, подключичной и трапециевидной мышцах.
Появление таких триггерных точек затрудняет диагностику изначальной патологии, так как они изменяют «классическую» клиническую картину болезни. Миофасциальная боль может замаскировать течение таких серьёзных состояний, как аппендицит или инфаркт миокарда.
Лечение триггерных точек временно облегчает боль, иррадиирующую из внутренних органов. Без лечения миофасциальный синдром может усугубить симптомы остеохондроза, сколиоза или другого основного заболевания, тем самым формируя порочный круг.
В качестве осложнений также можно отметить сдавление сосудов и нервов спазмированной мышцей. Это состояние приводит к радикулиту и вазомоторным нарушениям: приливам, повышенной потливости и побледнению кожи.
Диагностика миофасциального синдрома
Диагностировать миофасциальный синдром сложно из-за малоизученности патогенеза, обилия симптомов и возможного сочетания с другими болезнями. У этой патологии нет стандартизированных методов диагностики [9]. Поэтому поставить точный диагноз может только опытный специалист.
Эталонным источником по диагностике и лечению миофасциального синдрома считается книга Дж. Г. Тревелла и Д. Г. Симонса «Руководство по триггерным точкам» [10]. Авторы выделили две группы диагностических критериев миофасциального синдрома.
«Большие» критерии:
- жалобы на локальную или отражённую боль;
- уплотнение в мышце, обнаруженное при пальпации;
- повышенная чувствительность в пределах уплотнения;
- характерные зоны отражённой боли или нарушения чувствительности;
- скованность и ограниченность движений в области мышцы с триггерными точками.
«Малые» критерии:
- возобновление боли или нарушений чувствительности при стимуляции триггерных точек;
- локальные судорожные подёргивания в ответ на пальпацию или пункцию (прокол) триггерных точек;
- уменьшение боли после растяжения мышцы, поверхностного охлаждения или введения анестетика в триггерные точки [10][11].
Чтобы поставить диагноз «миофасциальный синдром», необходимо выявить у пациента пять больших критериев и один из трёх малых.
Физикальное обследование
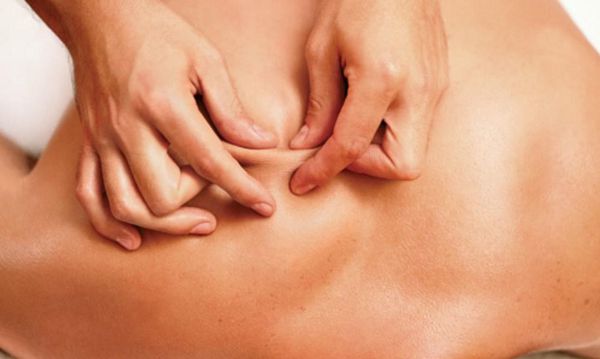
Поиск триггерных точек — наиболее важная часть осмотра при подозрении на миофасциальный синдром. Как правило, они находятся в определённых участках мышц. При давлении на такие точки пациент подпрыгивает или вздрагивает от боли и дискомфорта. Причём боль возникает в характерной для каждой мышцы области.
Пальпируя мышцу перпендикулярно мышечным волокнам, можно обнаружить узел или тугой тяж — веревкообразное утолщение. Это и есть триггерная точка. Пальпация данной зоны очень болезненна.
В области активных и латентных триггерных точек пальпируемой мышцы могут отмечаться подёргивания, местные вегетативные реакции и сенсорные нарушения, такие как парестезии и дизестезии.
Парестезии — это ощущения, которые возникают без каких-либо раздражителей, например ползание мурашек.
Дизестезии — это ощущения, которые не соответствуют силе раздражителя. В таких случаях лёгкое прикосновение к коже может вызывать неприятные ощущения или даже сильную боль.
Часто сенсорные нарушения соответствуют зоне распространения боли.
Лабораторные исследования
Лабораторных тестов, выявляющих миофасциальный синдром, не существует. Однако они полезны в поиске предрасполагающих факторов, таких как гипотиреоз, гипогликемия и дефицит витаминов.
Перечень анализов включает общий анализ крови, скорость оседания эритроцитов (СОЭ), биохимический профиль и определение уровня витаминов C, B1, B6, B12 и фолиевой кислоты. На причину миофасциальной боли могут указать любые отклонения в результатах данных тестов.
Анализ на тиреотропин, или тиреотропный гормон (ТТГ), может быть полезным при наличии клинических признаков заболевания щитовидной железы. Допустимые значения тиреотропина для взрослых составляют 0,3-4,2 мкме/мл.
Дополнительные методы исследования
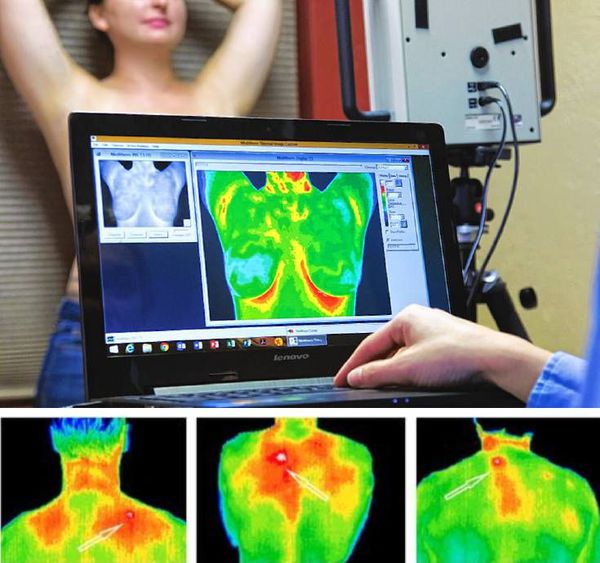
Инфракрасная или жидкокристаллическая термография позволяют визуализировать усиление кровотока, которое иногда отмечается в триггерных точках. Но данные методики применяются редко, так как они не являются стандартизированными.
МРТ, КТ и УЗИ назначают для исключения органической патологии, которая может быть источником боли. Однако исследование, проведённое канадскими учёными, показало, что ультразвуковой анализ текстуры мышц можно использовать при диагностике миофасциальной боли. Этот метод позволяет отличить здоровые ткани трапециевидных мышц от поражённых [12].
Дифференциальная диагностика
В ходе обследования важно исключить другие причины боли: фибромиалгию, радикулопатию, дискогенную боль, спондилогенную боль, заболевания суставов (артрозы, артриты) и болезни внутренних органов.
Лечение миофасциального синдрома
В лечении миофасциальной боли применяют комплексный подход. Он предполагает устранение патологического мышечного напряжения и триггерных точек.
При первичном синдроме проводится местное воздействие на поражённые структуры:
- покой и влажное горячее обёртывание поражённой мышцы;
- аппликация противовоспалительных гелей и мазей на область триггерных точек;
- ишемическая компрессия (сдавливание) триггерных точек;
- постизометрическая релаксация — расслабление мышц после их волевого напряжения;
- растяжение мышц при помощи упражнений, мягких миорелаксических техник и расслабляющего массажа;
- использование пластырей с лидокаином (местной анестезией);
- инъекции в триггерные точки.
При вторичном синдроме на первый план выходит лечение основного заболевания.
К медикаментозным методам лечения миофасциальной боли относят:
- НПВП — нестероидные противовоспалительные препараты;
- мышечные релаксанты;
- трициклические антидепрессанты.
НПВП снимают боль, воспаление и понижают температуру тела. Механизм их действия основан на подавлении активности веществ, которые участвуют в каскаде воспалительных реакций.
При выраженном болевом синдроме назначают низкие дозы трициклических антидепрессантов. Они уменьшают мышечную боль и обладают седативным эффектом.
Ишемическая компрессия триггерных точек направлена на прекращение или значительное снижение мышечного напряжения и уменьшение боли. Триггерная точка сдавливается кончиками пальцев и удерживается 60-90 секунд с постепенным увеличением силы давления.
Одновременно со сдавливанием триггерной точки производится растяжение поражённой мышцы. Это позволяет сократить время процедуры: чем больше мышца растягивается, тем сильнее она расслабляется, снимается гипертонус, быстрее происходит обезболивание.
Инъекции в триггерные точки иногда выполняются с бупивакаином, этидокаином, лидокаином, физиологическим раствором или водой для инъекций в сочетании с пассивным растяжением мышцы и/или распылением хладагента над триггерной точкой и зоной отражённой боли [13][14][15][16][17]. Всё это делается для местного обезболивания. В некоторых случаях проводится «сухая» пункция — укол в триггерною точку без введения какого-либо вещества [16][17].
Ботулотоксин типа А, вводимый в триггерные точки, уменьшает мышечный спазм на 3-6 месяцев [18][19][20][21][22][23]. Он подавляет высвобождение нейромедиатора ацетилхолина, который осуществляет нервно-мышечную передачу.
Эффективность инъекционной терапии ботулотоксином типа A в сочетании с физиотерапией была подтверждена ретроспективным исследованием испанских учёных. В ходе эксперимента были изучены медицинские карты 301 пациента с синдромом постоянной миофасциальной боли. Учёные установили, что через 6 месяцев в результате такого комбинированного лечения болевой синдром снизился у 58,1 % пациентов, в том числе у 82,9 % пациентов с синдромом первичной миофасциальной боли и у 54,9 % пациентов с вторичным синдром [23].
Осложнения, связанные с инъекциями в триггерные точки, встречаются редко и зависят от области инъекции. Они включают боль в месте инъекции, кровотечение, кровоподтёки, образование внутримышечной гематомы, присоединение инфекции, повреждение нервных или сосудистых стволов.
Местная терапия в виде пластыря с анестетиком облегчает миофасциальную боль и не вызывает дискомфорт, в отличие от инъекционных методик. Такой вывод сделали учёные из Италии в ходе рандомизированного контролируемого исследования [24].
Пациенты, принимавшие участие в эксперименте, были разделены на три группы по 20 человек: первую группу лечили в течение 4-х дней с помощью лидокаинового пластыря, приклеенного на триггерную точку; второй группе назначался пластырь с плацебо; а третья группа получала инъекции 0,5 % гидрохлорида бупивакаина.
Исследователи обнаружили, что в первой и третьей группах значительно уменьшились субъективные симптомы и увеличился порог болевой чувствительности. Причём эффективность терапии оказалась выше у пациентов третьей группы, которая получала инъекции анестетика, но они испытывали больший дискомфорт от проводимого лечения, чем пациенты из первой группы.
Пластырь используют только один раз в сутки. Его приклеивают на сухую неповреждённую кожу в области боли не больше чем на полдня, после чего делают перерыв не менее 12 часов. Перед приклеиванием пластыря волосы на коже нужно состричь ножницами, не сбривать.
Одновременно можно использовать не больше трёх пластырей. Если потребуется, пластырь можно разрезать на части, но только перед удалением защитной плёнки. Повторно использовать снятый пластырь не следует.
Важно регулярно оценивать эффективность такой местной терапии. Это позволит определить оптимальное количество пластырей, которые можно использовать одновременно, чтобы покрыть область боли или увеличить время между аппликациями.
Через 2-4 недели от начала лечения эффективность аппликаций нужно оценить повторно. Если за это время ответ на терапию был недостаточным или терапевтический эффект определяется только защитными свойствами пластыря, лечение следует прекратить.
Другими эффективными процедурами, уменьшающими боль, согласно исследованиям, можно считать фонофорез [25][26], массаж и физические упражнения [34], растяжки (работа с инструктором), ультразвук [30], электроакупунктуру, электрическую стимуляцию нерва [28][29], сочетание вышеперечисленных методик [25] и ЭМГ-БОС — биологическую обратную связь по электромиограмме [32].
В систематическом обзоре канадских учёных высказано предположение, что электроакупунктура более эффективна, чем чрескожная электрическая стимуляция нервов [33]. При электроакупунктуре в триггерную точку вводится игла, на которую подаётся электрический ток. При чрескожной электростимуляции электроды, через которые подаётся ток, накладываются на кожу, не повреждая её.
Иглоукалывание и мануальная терапия также могут быть эффективны [31][35][36]. Но, как и любой другой немедикаментозный метод лечения, они воздействуют на каждого пациента с разной эффективностью.
Исследование, проведённое учёными из Тайвани, показало, что программа самомассажа и регулярное выполнение лечебной физкультуры в домашних условиях улучшает результаты лечения миофасциальной боли и значительно повышает порог болевой чувствительности при давлении на триггерные точки [34].
В лечебный комплекс должны быть включены упражнения по перестройке неоптимального двигательного стереотипа. Они корректируют позы и движения, выполняемые в быту и во время работы.
В университете штата Мичиган проводилось изучение различных методик массажа и мануальной терапии, в результате которого был разработан специальный метод воздействия на миофасциальные структуры — «миофасциальный релиз«. Данная техника предполагает самостоятельное выполнение упражнений, без помощи врача или массажиста, что даёт возможность регулировать степень нажатия на мышцы и их растяжение, руководствуясь своими ощущениями.
Миофасциальный релиз можно выполнять с помощью различных инструментов: пенопластовых и ручных роликов, латексных шариков или других вспомогательных устройств. Они позволяют снять излишнее напряжение в триггерных точках, расслабить мышцы и связочный аппарат путём воздействия на фасцию. В результате наступает полное расслабление одной или группы мышц.
Механизмы, лежащие в основе миофасциального релиза, изучены недостаточно. Исследования, пытающиеся проиллюстрировать эффективность данной техники, часто плохо спланированы и не дают ответа на вопросы о том, как долго должна проводиться эта процедура, какой должна быть сила давления на поражённую мышцу и какое приспособление лучше подходит для упражнений.
Программа реабилитации предполагает использование ортезов: корсетов, бандажей, специальной обуви, стелек и пр. Ортопедические стельки, специальная ортопедическая обувь и подпяточники, к примеру, могут быть полезны для коррекции длины ног.
Прогноз. Профилактика
Миофасциальный синдром — не опасное для жизни состояние, но оно может значительно снизить качество жизни и стать основной причиной временной нетрудоспособности.
Вероятность развития синдрома увеличивается с возрастом и зависит от уровня физической активности [9]. Поэтому основной профилактикой является регулярная, умеренная физическая нагрузка. Она позволяет избежать развития миофасциального синдрома, остеохондроза, сколиоза и других заболеваний.
Всем людям, старше 18 лет, Всемирная организация здравоохранения рекомендует:
- 2,5-5 часов в неделю заниматься умеренной аэробной активностью — скандинавской ходьбой, пешими прогулками, утренней зарядкой;
- 1,5-2,5 часа в неделю заниматься интенсивной аэробной активностью — бегать, заниматься спортом;
- не меньше двух раз в неделю делать упражнения на развитие мышечной силы;
- как можно меньше времени проводить сидя или лёжа [37].
Если мышцы будут крепкими, упругими, эластичными, с хорошим кровоснабжением, то в условиях перегрузок они либо не пострадают, либо пострадают минимально и быстро восстановятся.
Помимо ведения активного образа жизни важно избегать провоцирующих факторов и не заниматься самолечением при появлении боли, независимо от её локализации.
Казанская государственная медицинская академия — филиал ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
Хабиров Ф.А.
ГАУЗ «Республиканский клинический неврологический центр»
- ORCID:
0000-0002-2572-6970
Миофасциальный болевой синдром: практическое развитие теоретических оснований
Авторы:
Девликамова Ф.И., Хабиров Ф.А.
Как цитировать:
Девликамова Ф.И., Хабиров Ф.А. Миофасциальный болевой синдром: практическое развитие теоретических оснований. Российский журнал боли.
2020;18(3):39‑47.
Devlikamova FI, Khabirov FA. Myofascial pain syndrome: practical development of theoretical foundations. Russian Journal of Pain. 2020;18(3):39‑47. (In Russ.)
https://doi.org/10.17116/pain20201803139

Миофасциальный болевой синдром (МБС) — хроническая мышечно-скелетная боль с локализованными высокочувствительными зонами изменения болевой чувствительности. Патогномоничным признаком миофасциальной боли являются локальные миофасциальные триггерные зоны (МТЗ), которые обнаруживаются практически во всех мышцах, преобладая в скелетных мышцах, выполняющих статические функции. Основными признаками МТЗ являются моторная дисфункция мышцы с наличием пальпируемого постоянного или дискретного уплотнения в пределах мышцы в сочетании с сенсорным расстройством, которое характеризуется прежде всего локальной болью в зоне пальпируемого уплотнения и отраженной болью на отдалении.
Такая проблема носит междисциплинарный характер, так как МБС является ведущим синдромом в клинической картине целого ряда заболеваний, тем самым привлекая внимание неврологов, ревматологов, травматологов-ортопедов, мануальных терапевтов и врачей других специальностей.
Научный интерес к проблеме миофасциальной боли не ослабевает в течение без малого двух веков. Немецкий хирург R. Frorier одним из первых в опубликованной им книге (1843) обратил внимание на болезненные тяжи в мышцах, называя их «мышечной мозолью», а припухлость над этой областью — «мышечным отеком» [1]. Многообразная терминология самого локального миофасциального уплотнения исторически отражает попытки изучения морфологического субстрата мышечного уплотнения: миалгические точки Гатштейна, отраженные мышечные боли Келлгрена, узелки Мюллера и Корнелиуса, миогелозы Шаде—Ланге, а также периостит, фиброзит, нейродистрофия, миалгия, ревматическая миалгия, внесуставной ревматизм [2]. В отечественной литературе мы встречаем такие термины, как нейроостеофиброз, алгическая и триггерная стадии нейромиофиброза, болезненное мышечное уплотнение. В течение многих лет в мировой литературе господствующим термином является «миофасциальная триггерная точка», первое упоминание о котором появилось в работе J. Travell в 1942 г. при описании идиопатической миалгии в виде «точечного уплотнения и отраженной боли, уменьшающейся после лечения». В книге «Мио-фасциальный генез боли» (1952) J. Travell совместно с S. Rinzler, предложив термин, дала характеристику миофасциальных триггерных точек, расположенных в 32 скелетных мышцах [3]. Современная модель мультифокального локуса миофасциального триггера предопределяет термин «миофасциальная триггерная зона», в основе которой лежат структурные изменения в зоне локального уплотнения мышцы: множественные истонченные отдельные мышечные волокна (МВ) с локальным укорочением саркомеров в виде узелков сокращений, которые располагаются между нормальными МВ в МТЗ.
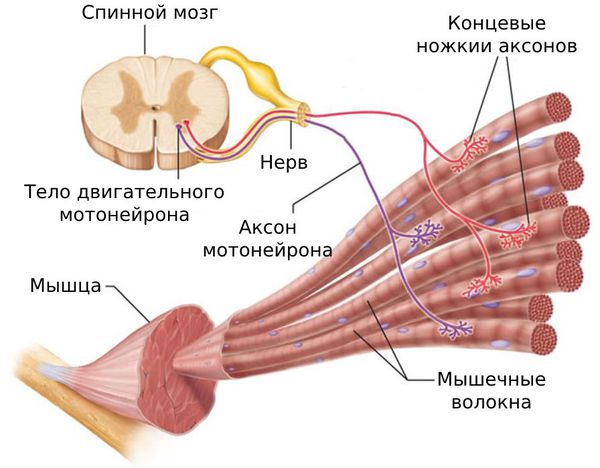
МТЗ — это такой участок локального мышечного спазма, который может быть инициирован продолжительным напряжением и сокращением мышцы или непосредственной травмой. Как правило, это приводит к стойкому высвобождению внутриклеточного кальция и патологическому сокращению мышцы в отдельной ее части. Хорошо известно, что сокращение и расслабление мышцы происходит благодаря скольжению нитей актина и миозина относительно друг друга: при сокращении нити актина входят между нитями миозина, при расслаблении — возвращаются в исходное положение. Если этого не происходит, в МВ формируется напряженный участок. Чрезмерно сокращенные саркомеры способствуют формированию уплотнения в зоне сокращения [4, 5].
В формировании мышечного спазма могут участвовать непосредственно расположенные и вовлеченные в патологический процесс двигательные окончания [6]. Высвобождение серотонина, простагландинов и других медиаторов воспаления может способствовать формированию боли. В результате этого возникает рефлекторный спазм всей мышцы. Длительное сокращение мышцы приводит к ишемии на клеточном уровне за счет анаэробного разложения аденозинтрифосфата и образования лактата. Кроме того, за счет уменьшения локального кровоснабжения снижается перфузия кислорода в мышце. Такая модель энергетического кризиса является базисом теории ишемического мышечного спазма [7].
Приводящий к локальному спазму болевой синдром может быть обусловлен патологической гиперактивностью мышечных веретен. Так, патологическая активность мышечных веретен, которая не снижалась под действием кураре, блокирующего холинергическую электромиографическую активность (ЭМГ-активность), но устранялась фентоламином, селективно блокирующим симпатическое проведение (проведение по афферентным волокнам из мышечных веретен), зарегистрирована в области триггерной зоны в виде низкоуровневой ЭМГ-активности. Таким образом, предполагается определенная роль интрафузальных мышечных волокон в генезе мышечного уплотнения. И это позволило говорить, что повреждение мышечных веретен способствует появлению боли, реализуемой симпатическими волокнами [8]. На удалении от МТЗ (отраженная боль) боль вызывается или давлением на чувствительные волокна локально спазмированной мышцей, или сенситизацией молчащих афферентных волокон медиаторами воспаления.
Отдельного интереса заслуживает концепция дисфункции нервно-мышечного аппарата в непосредственной близости от двигательной концевой пластинки (КП) зоны миофасциального триггера [4]. В МТЗ зарегистрирована фоновая непрерывная низкоамплитудная активность потенциалов (от 10—50 до 80 мкВ), которая отчасти напоминала описанную ранее активность интрафузальных мышечных волокон [8].
Миниатюрный локус, в котором зарегистрирована спонтанная электрическая активность, определен как активный локус миофасциального триггера. В ходе дальнейших исследований выяснилось, что «спонтанная электрическая активность» — не что иное, как шум КП [9].
Оценка состояния отдельных мышечных волокон в МТЗ показывает увеличение плотности мышечных волокон и межимпульсного интервала, что свидетельствует о ранних признаках реорганизации двигательной единицы [8]. Динамика времени нарастания потенциала КП и колебания порога мышечной мембраны, необходимого для генерации потенциала действия, приводят к вариабельности времени передачи через нервно-мышечный синапс. Как следует из большого количества экспериментов, ведущая роль в формировании МТЗ принадлежит нервно-мышечной дисфункции с патологической активностью аномально функционирующих концевых пластинок экстрафузальных мышечных волокон, что лежит в основе их локального чрезмерного сокращения. Причиной этого являются повторяющиеся микротравмы или биомеханические перегрузки, такие как длительная неправильная поза, дискоординированные динамические нагрузки, метаболические и алиментарные нарушения, психологические факторы или сопутствующие заболевания.
В настоящее время обсуждаются несколько теорий патогенеза мышечно-скелетной боли с формированием МТЗ. Согласно первой теории ишемического спазма мышцы, непосредственная или опосредованная травма, избыточное напряжение и иные причины приводят к высвобождению внутриклеточного кальция, изменению времени сокращения мышцы, что вызывает боль за счет высвобождения серотонина, простагландинов и других медиаторов воспаления, вновь приводит к спазму и усугубляет гипоксию. Посредством техники микродиализа выявлено статистически значимое увеличение субстанции Р, брадикинина, норепинефрина, фактора некроза опухоли альфа и интерлейкина 1-го типа, а также повышение кислотности, преобладающее в активном МТЗ [10]. Вторая теория — гиперактивность мышечных веретен, предложена после регистрации в МТЗ низкоуровневой ЭМГ-активности, которая снижалась фентоламином, селективно блокирующим симпатическое проведение (проведение по афферентным волокнам из мышечных веретен). Третья теория, связанная с гипер-активностью концевых двигательных пластинок, объясняет наблюдавшуюся локальную ЭМГ-активность как патологическую активность небольшого числа концевых пластинок. Интерес представляет теория периферической сенситизации, согласно которой под влиянием медиаторов воспаления, источником которого служат поврежденные мышцы, происходит сенситизация скрытых периферических афферентов, локализованных в коже и суставах. Теория центральной сенситизации и вторичной гипералгезии, объясняющая отраженную боль, связывает развитие гипералгезии с сенситизацией NMDA-нейронов задних рогов спинного мозга под влиянием уменьшения центральных ингибирующих влияний. Хронический спазм может приводить к центральной сенситизации, заключающейся в нейропластических изменениях клеток задних рогов, с последующим локальным и дистантным распространением боли [11]. Все эти теории являются взаимодополняющими и всесторонне отражают интегративную гипотезу взаимосвязи повышенной синаптической активности локально сокращенных саркомеров и высвобождения гистохимических субстанций [12], что лежит в основе замкнутого круга спазм—ишемия—боль—спазм [13].
Практическая ценность изучения механизмов миофасциальной боли велика из-за неразрывной связи поиска путей лечения и взглядов на патогенез. Остаются вопросы, которые продолжают интересовать исследователей: какое влияние на процессы формирования симптомов миофасциальной боли оказывают изменения архитектоники мышечных волокон и как эти изменения связаны с характером ультраструктурных нарушений?
Цель исследования — раскрыть значение изучения механизмов миофасциальной боли в практическом аспекте и оценить влияние изменений архитектоники мышечных волокон на процессы формирования клинического симптомокомплекса.
Материал и методы
В основу клинического материала легли 25-летние исследования больных с миофасциальной болью. Диагноз «миофасциальный болевой синдром» (по МКБ-10 классифицируется как миалгия — М79.1) основывается на клинических данных и требует исключения других возможных причин боли, в том числе проводится дифференциальный диагноз с рефлекторными мышечно-тоническими синдромами.
Все пациенты проходили клиническое исследование для установления диагноза МБС с оценкой миофасциальной триггерной зоны в соответствии с большими и малыми критериями. Клинически МБС проявляется в жалобах на локальную боль; пальпируемом «тугом тяже» в мышце; наличии участка повышенной чувствительности в пределах этого тяжа; характерном паттерне отраженной боли; признаках вазоконстрикции и иных вегетативных отклонений; ограничении объема движения; воспроизводимости боли или нарушений чувствительности при стимуляции МТЗ; локальном судорожном ответе на интенсивную пальпацию; уменьшении боли при растяжении мышцы или инъекции. Помимо боли нередко развиваются мышечная утомляемость и незначительная слабость мышцы без атрофий. Активные МТЗ с типичной спонтанной воспроизводимой болью являются основной причиной обращения пациента за помощью к врачу. Однако выявление латентных, «дремлющих» МТЗ доходит до 90% при исследовании здоровых лиц, а неблагоприятные воздействия (переохлаждение, позотоническое перенапряжение, эмоциональный стресс, чрезмерная физическая нагрузка, длительное пребывание мышцы в укороченном состоянии и прочее) нередко способствуют их переходу в активное состояние с соответствующим симптомокомплексом.
Состояние МТЗ оценивали посредством визуального теститрования и кинестезического исследования с подсчетом индекса мышечного синдрома. Для выявления степени выраженности болевого синдрома по интерпретации утверждений самих пациентов использовали аналоговые шкалы боли, болевой опросник МакГилла; оценку общего клинического впечатления проводили по опроснику общей оценки эффективности лечения.
При МБС основным методом диагностики является осмотр пациента. Для подтверждения или уточнения предварительного диагноза могут использоваться дополнительные инструментальные методы обследования.
Клиническая электромиография, позволяющая изучать состояние двигательных единиц скелетных мышц, мышечных волокон и нервно-мышечной передачи, в сочетании с ультраструктурным изучением мышечных волокон и ультразвуковым исследованием мышцы выбраны в качестве методического приема для проведения представленного исследования.
Результаты и обсуждение
МБС не является локальным феноменом, что следует из проведенных исследований состояния нервно-мышечного соединения, отдельных мышечных волокон скелетных мышц человека и морфофункциональной организации двигательных единиц в зоне миофасциального триггера. Он имеет генерализованный характер с последовательным вовлечением триггерных зон, обусловленный нервно-мышечной дисфункцией КП экстрафузальных мышечных волокон.
По сути, мышца страдает первично, а не из-за морфологических или функциональных нарушений иных структур периферического нейромоторного аппарата. Заключение сформировано с учетом следующих теоретических оснований.
Поскольку в норме электрическая активность мышцы в состоянии покоя не регистрируется, за исключением фоновой активности зоны КП при раздражении верхушкой электрода маленьких внутримышечных нервных терминалей, тщательный анализ ЭМГ-активности зоны КП проводился с целью дифференциации с патологической спонтанной активностью мышечных волокон [14]. Отсутствие спонтанной патологической активности как в зоне активного, так и в зоне латентного МТЗ является указанием того, что иннервация мышечных волокон в исследуемой мышце не нарушена. Введение игольчатого электрода в МТЗ сопровождалось фоновой активностью зоны КП, при этом в зоне активного триггера преобладал низкоамплитудный волнообразный шум КП с единичными высокоамплитудными прерывистыми спайками. Шум КП может объективизировать МТЗ, но не является абсолютным диагностическим критерием МБС. Высокая частота регистрации шума КП в МТЗ позволила ряду авторов [9, 15] высказать предположение о генерации фоновой активности измененными двигательными КП. Экспериментальные исследования указывают на то, что потенциалы, похожие на шум КП, представляют собой бурную патологическую активность КП. Шум и спайки КП являются результатом чрезмерного увеличения скорости спонтанного высвобождения ацетилхолина из нервной терминали двигательной КП [16], которая разрушена механически или биохимически [17].
Если интерпретировать наблюдающиеся фоновые локальные изменения ЭМГ как патологическую активность двигательных КП, то патогенный очаг, приводящий к формированию МТЗ, можно локализовать в зоне небольшого числа аномально функционирующих двигательных КП. В соответствии с этим можно ожидать положительный эффект от введения ботулинического токсина типа А (БТА), блокирующего аномальные двигательные КП, с последующим разветвлением, ростом новых двигательных терминалей и развитием новых нормальных КП, что подтверждено серией исследований, речь о которых пойдет ниже.
Изучение двигательных единиц (ДЕ) скелетных мышц посредством анализа их потенциалов (ПДЕ) выявило в зоне активного миофасциального триггера наличие ПДЕ, длительность которых выходила за границы допустимых для здоровой мышцы ±30%, при этом большая часть ПДЕ несколько укорочена. Это привело к уменьшению средней нормализованной длительности по сравнению со средним значением контрольной группы. Изменение параметров ПДЕ в МТЗ у пациентов с МБС характеризуется незначительным снижением амплитуды, увеличением количества фаз и турнов в потенциалах и их спайковой части.
В исследовании больных с МБС выявлено увеличение средней длительности спайкового компонента ПДЕ. Известно, что перестройка ДЕ, повышающая концентрацию МВ в зоне отведения электрода (расположенного в центре ДЕ) с элиминацией к периферии, приводит к увеличению длительности спайкового компонента в потенциалах нормальных параметров. Даже незначительная «рассинхронизация» потенциалов отдельных МВ ДЕ ведет к росту числа турнов, отражающих количество отдельных МВ, участвующих в формировании спайкового компонента ПДЕ [18]. Уже на самых ранних стадиях развития патологического процесса в отдельных зонах мышцы увеличивается концентрация МВ в одной ДЕ, что подтверждается количеством турнов спайковой части потенциала в активном МТЗ. Среднее значение обсуждаемого параметра в зоне активного миофасциального триггера увеличено в 2 раза по сравнению с нормой (рис. 1).

Рис. 1. Гистограмма распределения плотности мышечных волокон в миофасциальной триггерной зоне до и в различные периоды после введения ботулинического токсина типа А.
Пунктирной линией обозначены показатели нормы (1,48, SD 0,3).
Fig. 1. Histogram of muscular fiber distribution density in myofascial trigger zone before and within different periods after type A botulinum toxin injection.
The dashed line indicates reference values (1.48, SD 0.3).
Серия проведенных работ выявила увеличение плотности МВ активного и латентного МТЗ. Множественные истонченные отдельные МВ с локальным укорочением саркомеров в виде «узелков сокращения» располагаются между нормальными МВ в зоне мышечного уплотнения. В уплотненном участке мышцы зоны миофасциального триггера наблюдается рост количества МВ с «узелками сокращения», что ведет к укорочению расстояния между отдельными МВ. Таким образом, чрезмерно сокращенные саркомеры способствуют формированию уплотнения в зоне сокращения [5, 12].
Интерес представляет выявленная корреляция между изменением плотности МВ в ДЕ и числом турнов спайковой части ПДЕ на различных стадиях денервационно-реиннервационного процесса в серии исследований после введения БТА в МТЗ горизонтальной порции верхней части трапециевидной мышцы (рис. 2). Исходное среднее значение плотности МВ в МТЗ, измеряемое в условных величинах, составило 2,05, SD 0,26. При этом среднее число турнов спайковой части ПДЕ имело очень близкую величину и составило 2,05, SD 0,69. Эти показатели статистически значимо превосходили исходные показатели у здоровых испытуемых (1,48±0,3 и 1,30±0,4 соответственно; p<0,01).

Рис 2. Изменение плотности мышечных волокон двигательной единицы и числа турнов спайковой части потенциала, регистрируемых в миофасциальной триггерной зоне до и в различные периоды после введения ботулинического токсина типа А.
МВ — мышечные волокна; ПДЕ — потенциалы двигательных единиц.
Fig. 2. Changes of muscle fiber density and the number of turns of the main spike in myofascial trigger zone before and within different periods after type A botulinum toxin injection.
Через неделю после введения БТА изменения плотности МВ не наблюдалось. К концу первого месяца после введения препарата регистрировалось снижение как числа турнов, так и уменьшение плотности МВ в МТЗ; через 4 мес наблюдалось нарастание анализируемых параметров с последующей их стабилизацией и возвращением к исходной величине. Выявлена жесткая корреляция между величиной плотности МВ и числом турнов спайковой части ПДЕ. Это еще раз подтверждает возможность косвенно судить о плотности МВ в ДЕ, лишь анализируя число турнов спайкового компонента при стандартном ЭМГ-обследовании. Через год после введения препарата наблюдалась тенденция к восстановлению плотности МВ (1,6, SD 0,27), но показатель был статистически значимо ниже исходной величины и сопоставим с показателями, зарегистрированными в мышце здоровых испытуемых.
Как показал анализ клинических данных, положительная динамика состояния больных проявлялась к концу первой недели после введения препарата БТА, а к концу первого месяца регистрировалось восстановление плотности мышечной ткани и почти нивелировался триггерный феномен. В течение 6 мес не было рецидива со стороны исследуемых мышц. Лишь у ряда пациентов при воздействии неблагоприятных факторов, в первую очередь познотонических перегрузок и эмоционального стресса, наблюдалось формирование латентных МТЗ в этой области. При дополнительном воздействии методов коррекции двигательного стереотипа можно увеличить интервал действия препарата до года и вполне допустимо отказаться от повторного применения.
Выявленные фоновые локальные изменения ЭМГ, отражающие патологическую активность двигательных КП, позволяют локализовать очаг в зону небольшого числа аномально функционирующих двигательных КП. В соответствии с этим вполне объясним продолжительный эффект БТА при использовании малых доз. Причем локальное введение небольших доз препарата БТА непосредственно в МТЗ позволило избежать быстрой диффузии, клинически проявляющейся генерализованной мышечной слабостью и нейрофизиологически — активной денервацией, что обычно наблюдается при введении БТА в относительно большом объеме в двигательную точку мышцы [19].
Известно, что связанное с блокадой холинергической иннервации действие БТА влечет за собой обратимое снижение мышечной гиперактивности, декомпрессию чувствительных окончаний и сосудов с прекращением ноцицептивной афферентации и восстановлением кровообращения в МТЗ.
Состояние кровотока в МТЗ оценивали при проведении ультразвукового исследования (УЗИ) 50 пациентов (средний возраст 41,67±11,86 года, средняя длительность заболевания 3,32±2,56 года) с болезненным мышечным спазмом в области шейного и поясничного отдела позвоночника вследствие миофасциального болевого синдрома [20]. О перспективности ультразвуковой диагностики МТЗ для клиники с целью выявления зоны уплотнения и возможности точного введения иглы в мышечную ткань при локальной инъекционной терапии упоминается в работах S. Sikdar и соавт. [21]. Для локального мышечного уплотнения характерны точечные и линейные гиперэхогенные включения в соединительнотканные структуры мышцы, нарушающие непрерывность фасцикулярных линий; эхогенность нарастает по мере увеличения степени фиброзирования [6]. Проведенное УЗИ зоны миофасциального триггера позволило не только лоцировать МТЗ, но и оценить состояние кровотока в зоне миофасциального триггера. У обследованных пациентов визуализировалась формирующаяся или сформированная гиперэхогенная, реже — изоэхогенная триггер-зона (от 4×5×3 до 15×4×3 мм и более) с единичными включениями кальция. При цветном допплеровском картировании у всех пациентов регистрировалась пониженная васкуляризация по сравнению с близлежащими участками мышцы. Лоцировался периферический кровоток у основания зоны с линейной скоростью кровотока не более 10—15 см/с. В отдельных случаях при энергетической допплерографии не выявлялись признаки кровотока (аваскуляризация). Таким образом, у пациентов с МБС отмечается внутримышечная гипоперфузия, а ее результатом служит гипоксия в зоне миофасциального триггера.
Известно, что у пациентов с профессионально обусловленной трапециевидной миалгией имелся дефицит цитохром С-оксидазы, что наводит на размышления об энергетическом кризисе в пределах мышцы. Этот факт коррелирует с сообщениями о низких уровнях АТФ и АДФ у лиц с трапециевидной миалгией. В мышцах также отмечались высокая степень митохондриальной дисфункции и уменьшение числа кровеносных капилляров [11]. Данные подтверждают концепцию ишемически индуцированного энергетического кризиса в развитии мышечной боли.
Повторное УЗИ проводили через 10 дней после локальной инъекционной терапии, которую осуществляли с целью миорелаксации триггерной зоны, устранения ишемии и, как результат, купирования боли. Применяли препарат толперизона гидрохлорид, назначаемый для лечения болезненных мышечных спазмов или спастичности.
Миорелаксирующее действие препарата толперизона гидрохлорид реализуется путем ингибирования пресинаптического высвобождения нейромедиаторов из центральных терминалей афферентных волокон за счет комбинированного влияния на потенциалзависимые натриевые и кальциевые каналы. Помимо действия на мышечный тонус препарат толперизона гидрохлорид способен улучшать периферическое кровообращение, что объясняют блокадой адренорецепторов, располагающихся в сосудистой стенке [22, 23]. Через 10 дней после введения терапевтической дозы препарата толперизона гидрохлорид в МТЗ лоцировалась нормализация структуры мышцы, участок уплотнения становился более расплывчатым. При цветном допплеровском картировании регистрировалась умеренная гиперваскуляризация по сравнению с предыдущим исследованием. Лоцировался периферический артериальный кровоток с линейной скоростью кровотока более 30 см/с, центральный кровоток — 5—7 см/с; в отдельных случаях фиксировались признаки выраженной «неоваскуляризации» мышцы. Данные ультразвукового исследования с восстановлением, а порой и возобновлением кровотока позволили обосновать патогенетическую направленность применения препарата толперизона гидрохлорид в МТЗ (рис. 3).

Рис. 3. Ультразвуковое исследование верхней порции трапециевидной мышцы.
а — до локального введения препарата толперизона гидрохлорид; лоцируется сформированная гиперэхогенная триггерная зона с единичными включениями кальция размером 15×4×3 мм, при цветном допплеровском картировании лоцируется периферический кровоток у основания зоны с линейной скоростью кровотока 11 см/с; б — через 10 дней после локального введения препарата толперизона гидрохлорид; лоцируется нормализация структуры мышцы, триггерная зона стала более расплывчатой, при цветном допплеровском картировании лоцируется периферический кровоток с линейной скоростью кровотока 30—40 см/с, регистрируется центральный кровоток до 5 см/с.
Fig. 3. Ultrasound examination of the upper trapezius muscle.
a — prior to local injection of Tolperisone hydrochloride; hyperechoic trigger zone with single calcium inclusions 15×4×3 mm is visualized; peripheral blood flow is observed at the base of this zone with a linear blood flow velocity of 11 cm/s during Doppler mapping; b — 10 days after local injection of Tolperisone hydrochloride; muscle structure normalization, trigger zone has become vaguer, peripheral blood flow with a linear blood flow velocity of 30—40 cm/s is visualized during Doppler mapping, central blood flow up to 5 cm/s is observed.
Изучение потенциалов ДЕ, их спайкового компонента и анализ плотности МВ при исследовании латентной МТЗ выявили подобные по характеру, но меньшие по степени проявления изменения, чем регистрируемые в активной МТЗ. Это подтверждает структурную перестройку ДЕ в зоне как активного, так и латентного триггера. Нередко латентные МТЗ регистрируются в соответствующей мышце контралатеральной стороны. Возможно, их формированию способствуют центральные механизмы сигнального запуска спраутинга. Латентная МТЗ существует на стадии той эволюции, которая в дальнейшем при негативных воздействиях преобразуется в активное состояние с соответствующим комплексом симптомов.
С точки зрения клинической практики дифференциация активных и латентных МТЗ довольно условна, поскольку они являются последовательными стадиями единого патологического процесса и требуют своевременной патогенетической терапии. Следует отметить, что уплотнения в пределах мышцы или плотные тяжи являются первичным ответом мышцы на метаболическое или физическое напряжение, а доминантным фактором развития участков мышечного уплотнения служит ишемия. Участки локального мышечного уплотнения имеют свои особенности, отличающиеся от интактной мышечной ткани. МТЗ перманентно напряжены, их ткань может резко сократиться дополнительно вследствие механического раздражения, например, при щипке или уколе иглой.
Экспериментально показано, что нервно-мышечная дисфункция зоны МТП связана с изменением состояния моторных КП [9]. Отсутствие спонтанной активности мышечных волокон, регистрация спонтанной активности КП и ее инактивация введением БТА, анализ параметров ПДЕ (снижение амплитуды, смещение гистограммы распределения ПДЕ по длительности в сторону меньших величин и большая доля полифазии за счет нарастания числа турнов), а также увеличение плотности мышечных волокон в МТЗ скелетной мышцы человека характеризуют структурно-функциональные изменения состояния мышцы, которые доказывают реорганизацию ДЕ с преимущественным повреждением мышечного субстрата в зоне двигательной КП с избыточной активностью ацетилхолина.
Проведенное электронно-микроскопическое исследование в МТЗ трапециевидной мышцы показало атрофические изменения в виде разрушения миофибрилл, приводящие к их истончению и увеличению межфибриллярных пространств (рис. 4). Подобные изменения описаны, в частности, при экспериментах с истощающей физической нагрузкой [24, 25]. Отдельные миофибриллы теряли свою целостность вследствие расщепления саркомеров, а также утраты части сократительных белков саркомеров. Выявленное расхождение миофиламентов и Z-линий (рис. 5) может быть связано с разрушением белков цитоскелета миофибрилл, в том числе не исключается возможность механического отрыва актиновых нитей от Z-линии в результате разрывного усилия на мышцу, изначально находящуюся в спазмированном состоянии. Структурные нарушения в трапециевидной мышце при хронической миалгии в виде измененных миофибрилл, а также неравномерного распределения митохондрий в пределах волокна с частой аккумуляцией под сарколеммой и отсутствием в зоне Z-диска в совокупности с наличием «изъеденных молью» и рваных красных волокон (выявленных при световой микроскопии) могут быть следствием нарушенной микроциркуляции с локальной гипоксией или ишемией и локальных мышечных перегрузок [26, 27]. Появление аутофагосом в зоне мышечного уплотнения (рис. 6), возможно, связано с атрофией мышцы в результате неадекватной нагрузки либо с нарушением нейротрофического контроля, что находит свое отражение в работах Ф.А. Хабирова [28].

Рис. 4. Электронная микрофотография миофасциальной триггерной зоны трапециевидной мышцы.
Истончение миофибрилл, расширение межфибриллярных пространств; разрушение миофибрилл; в межфибриллярных пространствах и на месте разрушенных миофибрилл находятся митохондрии округлой или овальной формы с нечеткими кристами со слегка просветленным матриксом (ув. 13 000).
Fig. 4. Electron microscopic image of myofascial trigger zone of trapezius muscle.
Thinning of myofibrils, enlargement of interfibrillary spaces; destruction of myofibrils; rounded or oval mitochondria with uneven crista and light matrix are visualized within interfibrillary space and destructed myofibrils (13 000-fold magnification).

Рис. 5. Электронная микрофотография миофасциальной триггерной зоны трапециевидной мышцы.
Разрушены отдельные саркомеры в центре, не прослеживается контакт актиновых филаментов с Z-линией. Миофибриллы на концах саркомеров расходятся, образуя «веерообразные» структуры. Расширены межфибриллярные пространства (ув. 16 650).
Fig. 5. Electron microscopic image of myofascial trigger zone of trapezius muscle.
Destruction of several sarcomeres, no attachment of myofilaments to Z-line. Myofibrils diverge at the ends of sarcomeres («fan-shaped» structures). Enlarged interfibrillary spaces (16 650-fold magnification).

Рис. 6. Электронная микрофотография миофасциальной триггерной зоны трапециевидной мышцы.
Аутофагосома в области клеточного ядра (ув. 14 000).
Fig. 6. Electron microscopic image of myofascial trigger zone of trapezius muscle.
Autophagosome near cellular nucleus (14 000-fold magnification)
Таким образом, кратковременная чрезмерная нагрузка на фоне длительного статического напряжения, особенно в нефизиологическом положении, может служить причиной развития острой или обострения хронической мио-фасциальной боли. Следует отметить, что и сама по себе продолжительная статическая нагрузка способствует перегрузке и перерастяжению мышц. В этом случае можно говорить об активации болевых рецепторов, то есть о ноцицептивной боли. Средние сроки восстановления и купирования ноцицептивной боли при этом не превышают 2—3 нед, что, несомненно, следует учитывать при формировании комплекса лечебных мероприятий больным с МБС.
Комплексный подход в лечении МБС включает воздействие на все уровни формирования «порочного круга»: назначение анальгетиков, миорелаксантов, анксиолитиков с вегетостабилизирующим действием, антидепрессантов, воздействие на вовлеченную мышцу с МТЗ (растяжение, массаж, тепло, рефлексотерапия, компрессы с димексидом и анестетиками) и локальную инъекционную терапию. Наиболее важным аспектом лечения миофасциальной боли является восстановление длины и эластичности пораженных мышц, что лучше всего достигается упражнениями на растяжение мышц (постизометрическая релаксация).
Лечение миофасциальной боли с помощью инъекции в МТЗ (миорелаксант, анестетик или «сухая игла») приводит к очевидному размягчению плотного тяжа. В комплексной терапии МБС локальные инъекции именно в МТЗ являются более эффективными, чем обычное внутримышечное введение препаратов.
Проведенное нами исследование по применению периферического миорелаксанта — препарата ботулинического токсина типа А — у больных с МБС продемонстрировало положительное действие на электрофизиологические параметры, отражающие функциональное состояние периферического нейромоторного аппарата. Положительный клинический эффект значительно облегчил состояние пациентов и позволил не применять в течение длительного периода каких-либо препаратов из огромного числа фармакологических средств и мануальных пособий [19].
Поскольку молекула толперизона имеет сходство с молекулой лидокаина, препарат оказывает наряду с миорелаксирующим местноанестезирующее действие, а вследствие блокирующего воздействия на α-адренорецепторы вызывает вазодилатирующий эффект. Это стало основанием к использованию препарата в качестве локальной инъекционной терапии при МБС [29]. Эффективность и безопасность локального применения препарата толперизона гидрохлорид у больных с МБС подтверждены положительным миорелаксирующим и обезболивающим действием. Это способствовало также восстановлению периферического кровообращения в МТЗ, что подтверждается результатами ультразвукового исследования. Значительный анальгезирующий эффект препарата при введении в МТЗ проявился к 3-му дню, максимальный релаксирующий эффект терапии отмечен на 10-й день [20].
Наиболее важной частью лечебного процесса миофасциальной боли является реабилитация с формированием новой «памяти» ранее поврежденных мышц посредством нервно-мышечного обучения. Благодаря этому разрывается порочный круг спазм—ишемия—боль—спазм и формируется нормальный двигательный стереотип. Тщательно подобранная программа комплекса физической нагрузки становится основой для последующего функционального восстановления мышц при МБС.
Заключение
Значение изучения механизмов миофасциальной боли велико из-за неразрывной связи поиска путей лечения и взглядов на патогенез. Длительная статическая нагрузка способствует перегрузке и перерастяжению мышц, что позволяет говорить об активации болевых рецепторов и формировать комплекс лечебных мероприятий для восстановления функции мышцы и купирования ноцицептивной боли с воздействием на все уровни порочного круга спазм—ишемия—боль—спазм.
Авторы заявляют об отсутствии конфликта интересов.
Статья посвящена вопросам диагностики и лечения миофасциального болевого синдрома

Для цитирования. Курушина О.В., Барулин А.Е., Данилов А.Б. Миофасциальный болевой синдром // РМЖ. Болевой синдром. 2015. С. 22–26.
Боли в спине – наверное, одна из самых обсуждаемых проблем в современной неврологии. Множество публикаций, научных дискуссий, практических рекомендаций и теоретических разборов посвящены этой теме. Но по-прежнему боль в спине продолжает оставаться сложной терапевтической задачей. Одной из причин неоднозначности данного болевого синдрома является его неспецифический характер. Данное алгическое расстройство может быть обусловлено множеством причин, и в большинстве случаев точно установить источник болевой импульсации пока не представляется возможным. Однако преимущественно боль в спине связана с функциональными и дистрофическими изменениями в тканях опорно-двигательного аппарата (фасции, мышцы, сухожилия, связки, суставы, диски), с вовлечением структур периферической и центральной нервной системы (корешки, нервы, чувствительные и вегетативные ганглии, мозговые оболочки, а также другие структуры спинного мозга). Каждая из этих структур может давать ответ на свое повреждение выбросом биохимически и иммунологически активных медиаторов, стимулирующих чувствительные рецепторы. Это в свою очередь запускает очень сложные и еще не до конца изученные нейрофизиологические механизмы формирования ощущения боли [2]. Появление болевой импульсации сопровождается, как правило, рефлекторной мышечно-тонической реакцией, приводящей к иммобилизации пораженного участка тела. Однако физиологическая функция спазмированной мышцы впоследствии трансформируется в дополнительный источник боли, при этом поражение мышцы может быть первичным по отношению к возникающим впоследствии морфофункциональным изменениям позвоночника.
Распространенность боли в спине всегда была достаточно велика. Но в последнее время она приобретает характер пандемии. Это в первую очередь связано с урбанизацией населения, малоподвижным образом жизни, изменением двигательных стереотипов, характера питания и прочими факторами риска [3, 7], и большинство из них поддается изменению. Предложено все факторы риска развития вертеброневрологической патологии разделять на корректируемые, которые можно устранить (основа преждевременного развития хронического течения боли в спине), и некорректируемые: наследственность, возраст, пол.
Корректируемые факторы риска:
– профессиональные (тяжелые физические работы, статические нагрузки на позвоночник, монотонный физический труд, включающий в себя частые наклоны вперед и повороты тела; работа, сопровождающаяся вибрационными процессами);
– психосоциальные факторы (мышечный дистресс, вызванный нахождением в условиях острого и(или) хронического стресса; у подростков имеют даже большее значение, чем механические, особенно при затяжном течении);
– индивидуальные соматические особенности (сколиоз, кифосколиоз, сутулость ввиду слабости мышечного корсета и отсутствия регулярных занятий физкультурой);
– индивидуальные физические факторы (противоестественное положение тела, монотонные стереотипные движения, статичность позы и др.);
– влияние метеофакторов (локальное и общее переохлаждение);
– нерациональное питание и заболевания ЖКТ (нарушения всасывания витаминов группы В, употребление пищи с большим количеством пуриновых оснований, избыточная масса тела);
– курение, злоупотребление алкоголем.
Устранив или скорректировав эти факторы, можно в значительной степени этиологически изменить течение патологического процесса.
Учитывая наличие этих факторов, можно представить себе многообразие клинических ситуаций, при которых может возникнуть миофасциальный болевой синдром (МФБС). Кроме этого, нельзя забывать, что МФБС можно рассматривать как первичный процесс, в основе которого лежат биомеханические нарушения, приведшие к изменению двигательного стереотипа, так и вторичный, сформировавшийся на фоне каких-либо системных заболеваний (ревматоидного артрита, спондилита, остеоартроза и т. д.). Во втором случае диагностика и тактика лечения обязательно будут учитывать особенности первичной, системной патологии [5].
Общая характеристика миогенной боли:
– уплотнение мышцы;
– болезненность;
– повышение сократительной активности;
– нарушение нормальных координационных отношений между различными мышечными группами.
При длительном нахождении мышцы в состоянии спазма формируются сначала латентные, а затем и активные триггерные пункты (точки). По данным Г.А. Иваничева, триггерная точка (ТТ) – это объект раздражения ноцицепторов, который иннервирует связки, капсулы суставов, жировую ткань, периост, скелетные мышцы и наружные оболочки кровеносных сосудов. Латентные ТТ служат нейрофизиологической основой формирования активного триггерного пункта, что впоследствии может приводить к формированию регионарной и генерализованной мышечной боли. Активные ТТ характеризуются повышенной сократительной активностью мышц-агонистов, а регионарные мышечно-тонические реакции уже начинают носить не защитный, а патологический характер, теряя свое приспособительное значение.
Факторы формирования ТТ:
• определяющие (вертеброгенный, висцерогенный, травматический);
• предрасполагающие (генетический, нейровегетативный, психогенный);
• провоцирующие (неблагоприятные статико-кинетические и психоэмоциональные воздействия).
С целью систематизировать различные виды миофасциальной боли было предложено достаточно большое количество классификаций. На наш взгляд, предложенная классификация является наиболее удачной.
Миофасциальная боль подразделяется на (Иваничев Г.А., 2010):
– локальную;
– регионарную;
– генерализованную.
Локальная боль:
– в покое не испытывается;
– провоцируется давлением или растяжением мышцы;
– определяется тугой тяж вдоль мышцы;
– отраженная боль отсутствует;
– мышца при пальпации обычной консистенции и не укорочена;
– местные вегетативные реакции (пиломоторный эффект, гипергидроз, вазодистонические реакции) в покое не выражены, воспроизводятся только при энергичной пальпации.
Регионарная боль:
– тянущего характера, ощущается по всей длине мышцы, при наличии локального мышечного гипертонуса;
– может быть спонтанной и вызванной;
– характерны болезненные переживания ночью, уменьшающиеся при активности. Негрубое снижение мышечной силы;
– при пальпации воспроизводится типичная отраженная боль в соседние участки;
– определяется повышение тонуса всей мышцы или группы мышц-агонистов.
Генерализованная боль:
– диффузная выраженная боль как в покое в группе мышц, так и усиливающаяся при любом движении;
– пальпация мышцы сопровождается генерализацией болезненности и резким повышением тонуса не только мышц-агонистов, но и антагонистов;
– значительное снижение мышечной силы;
– определение локального мышечного гипертонуса затруднено из-за повышенного тонуса исследуемой мышцы;
– формируется патологический двигательный стереотип;
– формируются надсегментарные вегетативные расстройства;
– астено-депрессивный синдром;
– дизсомнические нарушения.
Как диагностировать миофасциальную боль?
Прежде чем говорить о диагностике МФБС, нужно отметить, что локально возникший МФБС может быть только частью какого-то единого биомеханического процесса. И зачастую боль, сформированная в одном месте, обусловленная перегрузкой в этом регионе (саногенетически значимый регион), является следствием нарушений и «слабости» мышц в другом отделе опорно-двигательного аппарата (патогенетически значимый регион). Поэтому очень важным моментом является изучение структуры биомеханических нарушений всей двигательной системы [1].
Проводя клиническую диагностику миофасциальной боли, необходимо определить локализацию боли, установить тип, интенсивность, длительность, а также факторы, влияющие на ее интенсивность. Наряду с признанием интенсивности боли как субъективно значимого критерия проводится оценка площади болевых ощущений. Этот критерий приобретает особое значение при психогенной генерализованной боли, когда площадь болевых ощущений не всегда соответствует интенсивности.
Важным моментом является также правильность проведения процедуры пальпации мышечной ткани, и на этом мы хотели бы заострить особое внимание. При проведении пальпации необходимо соблюдать следующие правила:
– деликатность;
– погружение в мышцу должно быть постепенным, медленным и осторожным;
– исследование должно проводиться теплыми руками и в теплом помещении;
– положение как врача, так и пациента должно быть удобным, не вызывающим напряжения и утомления.
Основные ошибки при проведении пальпации:
– эмоциональная реакция пациента на пальпацию не является показателем точности диагноза;
– при большом давлении пальцем точность исследования снижается;
– проведение интенсивной пальпации кончиками пальцев является менее чувствительным;
– нельзя проводить оценку степени выраженности боли по размерам ТТ;
– недопустимо исследование пациента проводить через белье, даже самое тонкое.
Как лечить миофасциальную боль?
Лечение МФБС требует мультидисциплинарного подхода. Первостепенными задачами являются коррекция факторов риска и изменение неоптимального двигательного стереотипа, который привел к формированию боли. Это позволит предупредить рецидивы боли и хронизацию болевого синдрома. Но проведение этой терапевтической стратегии требует адекватного обезболивания и устранения активных и латентных ТТ, что в свою очередь приведет к редукции боли. В неврологической практике для этой цели используют как воздействие непосредственно на ТТ – их прокалывание сухой иглой или растяжение мышц после охлаждения кожи, так и медикаментозные блокады (инъекции анестетиков прокаина, лидокаина), в т. ч. и с применением гормональных средств (дексаметазон, гидрокортизон) в ТТ [13].
Систематический обзор Медлайна и базы данных Кокрейна показал, что при острой боли в спине наиболее эффективным лечением является применение нестероидных противовоспалительных средств (НПВС) и миорелаксантов, а при хронической боли в спине наиболее убедительные доказательства эффективности найдены для трициклических антидепрессантов [8, 11]. Терапевтическая эффективность НПВС связывается с угнетением активности ЦОГ, что приводит к торможению синтеза простагландина Е2, тромбоксана А2, а также к снижению уровня лейкотриенов, кининов, гистамина, серотонина и других медиаторов воспаления. НПВС оказывают действие и на супраспинальном уровне. Они влияют на таламические центры болевой чувствительности, блокируя синтез простагландинов в таламусе. Реализация всех этих механизмов приводит к достаточно высокой эффективности НПВС при ноцицептивной и смешанной боли, но к незначительному уменьшению интенсивности нейропатической боли. По анальгетической активности НПВС разделяют на 4 группы: 1) с относительно низкой анальгетической активностью и коротким периодом полувыведения; 2) с высокой анальгетической активностью и коротким периодом полувыведения; 3) с умеренной анальгетической активностью и средним периодом полувыведения и 4) с высокой анальгетической активностью и длительным периодом полувыведения. Для лечения МФБС предпочтительней использовать препараты, отличающиеся высокой анальгетической активностью и коротким периодом полувыведения. Одним из таких препаратов является лорноксикам (Ксефокам) из класса оксикамов. Он мощно и сбалансированно ингибирует ЦОГ-1/ЦОГ-2, тормозит образование интерлейкина-6, ИЛ-8 и синтез индуцибельного оксида азота, подавляет активность NF-κB и угнетает выработку ФНО-a. Кроме того, препарат стимулирует опиоидэргические системы, усиливая выработку эндогенного динорфина и эндорфина. Это способствует физиологической активации антиноцицептивной системы организма. Ксефокам является одним из наиболее мощных анальгетиков в группе НПВС. По данным клинических исследований, по силе воспалительного и обезболивающего действия он превосходит кеторолак, кетопрофен, трамадол [9, 10]. При сравнительной оценке трамадола (100 мг 3 р./сут) и лорноксикама (8 мг 2 р./сут) при терапии радикулярных и постоперационных болевых синдромов эффективность трамадола была оценена как «средняя» у 27% пациентов, лорноксикама – у 15%. В то же время «очень хорошее обезболивание» достигнуто у 31% пациентов, получавших трамадол, и у 52% – лорноксикам. Все пациенты отмечали хорошую переносимость без развития сонливости и других побочных явлений [8].
Абсолютная биодоступность препарата составляет 97%, максимальная концентрация его в плазме достигается уже через 15 мин после в/м введения, а степень связывания с белками плазмы составляет 99%. Ксефокам полностью метаболизируется в печени под действием цитохрома Р450, примерно 1/3 выводится почками с мочой, а 2/3 – печенью и кишечником, при этом энтеропеченочная циркуляция отсутствует. Хорошая переносимость препарата обеспечивается двойным путем экскреции, тем самым снижается нагрузка на данные органы и не требуется коррекции его дозы. Фармакокинетика Ксефокама достоверно не отличается у лиц пожилого, зрелого и молодого возраста, что позволяет использовать препарат в геронтологической практике без корректировки дозы с учетом возраста.
Эффективность лорноксикама (Ксефокама) при острой миофасциальной боли потенцируется лекарственными формами препарата. При острой боли для парентерального введения препарат применяется в форме лиофилизата, из которого приготавливается раствор для в/в и в/м введения. Эффективной для лечения миофасциальной боли является и энтеральная форма с быстрым всасыванием из ЖКТ – Ксефокам рапид. В быстровысвобождаемой форме Ксефокам рапид действующее вещество заключено в гранулы, содержащие бикарбонат натрия, которые создают слабощелочное микроокружение в желудке. Это способствуют скорейшему растворению гранул и быстрому всасыванию препарата из желудка и начальных отделов тонкой кишки. После распада гранул быстрота всасывания препарата из ЖКТ такова, что фармакокинетические параметры таблеток Ксефокам рапид аналогичны таковым парентеральной формы препарата.
Длительность применения и способ введения Ксефокама зависят от интенсивности болевого синдрома. При интенсивной боли, существенно ограничивающей передвижение пациента, применяются инъекционные пути введения НПВП в течение 3–7 сут, с переходом в дальнейшем на энтеральные формы. По этой схеме лорноксикам (Ксефокам) применяется в суточной дозе 8–16 мг в 2–3 приема (парентерально – лиофилизат; энтерально – таблетки). Максимальная суточная доза составляет 16 мг, для Ксефокама рапид – 24 мг в 1-е сут.
Для уменьшения выраженности болевого синдрома и снижения мышечного спазма НПВС следует комбинировать с миорелаксантами. Эта комбинация позволяет сократить сроки лечения и уменьшить риск развития побочных эффектов НПВС за счет снижения дозировок последних при комбинированной терапии. Их применение способствует не только существенному снижению мышечного дефанса, но и уменьшению выраженности болевого синдрома, предотвращению формирования контрактур, улучшению функциональной способности опорно-двигательного аппарата, облегчению возможности проведения широких реабилитационных мероприятий, сохранению трудоспособности пациента и его активности в повседневной жизни.
Чем выше риск генерализации боли, тем большее место в лечении занимают препараты адъювантного ряда: антидепрессанты, антаконвульсанты, витамины группы В [12].
Трансдермальные аппликации с диметилсульфоксидом обладают способностью проходить через биологические мембраны, в т. ч. через кожные барьеры. Оказывают обезболивающее и противовоспалительное действие, усиливают проникновение через кожу многих лекарственных средств. Применяют аппликации в чистом виде (обычно 50% раствор), в смеси с анальгетиками или прокаином (1:1).
Физиотерапевтическое лечение (ФТЛ) является неотъемлемой частью терапевтической стратегии при МФБС, т. к. оно способствует нормализации гомеостаза, стимулирует защитные рефлексы, иммунную систему, процессы репарации. Однако надо учитывать, что сформированная местно-воспалительная реакция протекает с явлениями отека, и назначение в этот период тепловых процедур будет усиливать локальный застой и приводить к усилению боли. При стихании воспалительного процесса наиболее адекватными из методов ФТЛ будут лазеротерапия, диадинамические и синусоидально модулированные токи, чрескожная электронейростимуляция ЧЭНС, электрофорез с анестетиками и фонофорез с глюкокортикостероидами.
Включение в алгоритм лечения методов немедикаментозной коррекции не только двигательного, но и дыхательного стереотипов является обоснованным и необходимым. Наиболее эффективными являются методы, основанные на принципе биологической обратной связи, и мануальная терапия. В европейских рекомендациях короткий курс лечения с помощью мануальной терапии и рефлексотерапии рекомендован к рассмотрению как один из методов выбора в лечении хронической неспецифической боли в нижней части спины
Задачи мануальной терапии:
1. Восстановление подвижности.
2. Коррекция мышечно-силового дисбаланса.
3. Формирование правильного двигательного стереотипа.
4. Сохранение сформированного стереотипа движения.
5. АутоПИРМ-гимнастика.
Доказанной эффективностью для лечения хронической боли в спине и предупреждения хронизации острой обладает методика обучения пациентов «безболевому» поведению. Создание так называемых «Школ боли в спине» приносит значительный эффект в снижении длительности периодов нетрудоспособности, уменьшает количество обострений и улучшает качество жизни больных [4].
В лечении МФБС важную роль играет восстановление оптимального двигательного стереотипа. Для этого предлагается много лечебных комплексов физических упражнений, что направлено на уменьшение отека, нормализацию кровоснабжения, укрепление мышечного корсета. Упражнения могут назначаться уже в подострый период, но они должны быть щадящими.
Заключение
Справедливо заметить, что лечение МФБС – это мультидисциплинарная проблема, решение которой требует участия нейрофизиологов, неврологов, альгологов, кинезиологов, мануальных терапевтов, травматологов-ортопедов. В первую очередь терапия призвана повысить качество жизни пациентов, т. к. созданное мнение о неизбежности прогрессирования боли в спине, со слов C.R. Chapman (1988), «ничегонеделание и поглощение лекарств становятся для больных привычкой», ведут к выработке у пациентов стратегии на катастрофизацию, в последующем сменяющуюся бездеятельностью. Лечение этой категории пациентов требует комплексного подхода, в первую очередь направленного на немедикаментозную коррекцию и формирование оптимального двигательного стереотипа на фоне адекватной обезболивающей терапии. Такой подход способствует активному вовлечению пациентов в процесс лечения и повышению мотивационных установок на выздоровление.
Миофасциальный болевой синдром (МБС) — вариант соматогенной боли, источником которой являются скелетные мышцы и прилегающие фасции. По локализации повреждения данный вид боли является глубокой соматической болью [1]. В соответствии с Международной классификацией болезней (МКБ-10) МБС относится к болезням околосуставных мягких тканей.
Формирование болевого ощущения в мышцах обусловлено раздражением болевых рецепторов — ноцицепторов неинкапсулированных нервных окончаний А-дельта и С-афферентных волокон, богато представленных в мышечных волокнах, фасциях и сухожилиях. Эти сенсорные единицы активируются механическими воздействиями, температурой или химическими раздражителями, что сопровождается появлением диффузной, слабо локализованной боли.
Факторы, способствующие активации мышечных ноцицепторов и развитию МБС, многообразны. Неслучайно МБС является одной из наиболее частых причин боли в спине, шее и конечностях.
Основные причины развития миофасциального болевого синдрома [2]:
- перегрузка отдельных скелетных мышц, обусловленная позным перенапряжением в нефизиологических условиях вследствие структурной аномалии скелета (разная длина ног, плоскостопие, деформации таза и т. д.);
- особенности трудовой деятельности — длительная нефизиологическая поза при работе за компьютером, вождении автомобиля; часто повторяющиеся стереотипные движения, приводящие к переутомлению отдельных мышц;
- длительная иммобилизация мышц (во время крепкого сна или после долгого ношения лонгет при переломах и вывихах);
- длительное непосредственное сдавление разных групп мышц;
- переохлаждение.
Большое значение в развитии МБС имеют психические факторы. Психоэмоциональный стресс всегда сопровождается тревогой и мышечным напряжением. Мышцы после прекращения воздействия эмоциональных стрессоров часто остаются в спазмированном состоянии. Особенно важную роль играют хронические стрессовые ситуации с высоким уровнем тревожных расстройств, сопровождающихся мышечным напряжением, а также депрессивные состояния, при которых меняется стереотип движений, осанка, поза, что может приводить к формированию мышечных спазмов. Формируется порочный круг: стресс — эмоционально-аффективные расстройства — изменение двигательного стереотипа с избыточным напряжением ряда мышечных групп — боли от напряженных мышц — усиление стресса — усиление эмоционально-аффективных расстройств — усугубление нарушений двигательного стереотипа.
Заболевания суставов и внутренних органов — одна из наиболее частых причин формирования миофасциального болевого синдрома. Практически любая соматическая патология может сопровождаться миофасциальными болевыми синдромами. Болевая импульсация с пораженного висцерального органа или сустава приводит к защитному напряжению соответствующих мышц для иммобилизации сустава или создания мышечного защитного напряжения вокруг больного органа. Так, например, стенокардия или инфаркт миокарда нередко сопровождаются появлением миофасциальных болей в лестничных, малой и большой грудных, подключичной и трапециевидной мышцах, в над-, под- и межлопаточных областях. При заболеваниях желудочно-кишечного тракта (например, язвенной болезни желудка) развивается миофасциальный болевой синдром с вовлечением паравертебральных мышц. Это же касается и патологии почек. Нередкой причиной миофасциальных болевых синдромов, затрагивающих мышцы тазового дна, является гинекологическая патология. При последнем варианте хронические боли локализуются внизу живота, пояснице, области крестца.
Миофасциальные болевые синдромы, сопровождающие висцеральную патологию, меняют картину соответствующей соматической болезни, что может значительно затруднять диагностику. После купирования обострения соматического заболевания вызванные им миофасциальные боли обычно сохраняются в течение длительного времени. Миофасциальный болевой синдром может формироваться на фоне остеохондроза позвоночника, осложняя его течение. В этом случае основную роль в развитии МБС играет измененная поза и неправильный двигательный стереотип, свойственные больным остеохондрозом, а также рефлекторный мышечный спазм. Однако во многих случаях МБС не связан с остеохондрозом позвоночника, а болевой импульс первично исходит из пораженной мышцы.
Факторами, предрасполагающими к развитию МБС, являются нетренированность мышц, гипотиреоз, дефицит ряда микроэлементов и витаминов. Мышечная боль нередко возникает в результате непривычной длительной работы слабых и нетренированных мышц, например, после интенсивных сезонных дачных работ, несистематических занятий спортом.
Миофасциальная боль бывает различной интенсивности, она усиливается при физической нагрузке и охлаждении и уменьшается в тепле. Она может быть локализована в пораженном участке мыщцы или иррадиировать в прилегающую анатомическую область. Боль может сопровождаться ощущением скованности после длительной иммобилизации мышцы. В отличие от неврогенных болевых синдромов, при МБС не выявляют неврологической симптоматики, изменений при электромиографии, а распространение боли не является сегментарным. Иногда при МБС одновременно страдают несколько мышц, а зоны отраженных болей перекрывают друг друга. В результате наблюдается комбинация различных болевых зон, вызванных триггерными точками, расположенными в нескольких мышцах.
Диагноз «миофасциальный болевой синдром» ставится на основании клинического обследования и требует систематизированного подхода, включающего тщательное изучение анамнеза заболевания, целенаправленное выявление триггерных точек и обнаружение сопутствующих соматических, психологических и поведенческих нарушений. При обследовании пациента с мышечной болью необходимо учитывать анамнестические и физикальные данные [7]:
- связь боли с физической перегрузкой, возникновение ее после длительного пребывания в фиксированном неудобном положении, после прямого переохлаждения мышцы;
- выявление при осмотре спазмированной, болезненной при пальпации мышцы (мышц), что является существенным фактором. В пределах напряженных мышц определяются участки еще большего болезненного мышечного уплотнения — пальпируемые тяжи. Феномен пальпируемых уплотнений в спазмированных мышцах неоднократно пытались объяснить разными причинами: наличием серозного экссудата, мукополисахаридных отложений; образованием соединительной ткани. Одной из последних гипотез является существование стойкой длительной мышечной контрактуры. Неконтролируемая сократительная активность пораженной группы мышечных волокон сопровождается повышенным локальным метаболизмом. Устойчивое сокращение прилежащих друг к другу мышечных волокон приводит, таким образом, к формированию уплотненного и напряженного тяжа [7];
- распространение боли в области, достаточно отдаленные от напряженной, спазмированной мышцы (зоны отраженных болей);
- патогномоничным признаком миофасциального болевого синдрома является наличие триггерных точек. Триггерная точка представляет собой локальную зону исключительно высокой чувствительности, расположенной обычно в пределах «тугого» тяжа заинтересованной мышцы. Стимуляция триггерных точек вызывает боль в удаленном от давления, но строго определенном месте. Триггерные точки могут находиться как в активном, так и в латентном состоянии. Активная триггерная точка — это фокус гиперраздражимости в мышце или ее фасции, проявляющейся в виде боли. Диаметр триггерной точки обычно 1–3 мм, однако группа из нескольких триггерных точек достигает диаметра 1 см. Считается, что триггерные точки формируются вследствие микротравматизации заинтересованных мышц. Гистологические изменения в этой области неспецифичны, обычно выявляются признаки локальной гипоксии.
Характерна четкая воспроизводимость боли в зоне отраженных болей при сдавливании или проколе активных триггерных точек. При этом боль ощущается не столько в области триггерной точки, сколько в отдаленных от нее участках, то есть отражается в характерные для данной точки области. Отраженная боль может наблюдаться в покое и при движении. Активный триггер очень чувствителен, препятствует полному растяжению мышцы и несколько ослабляет ее силу. При попытке активного растяжения мышцы боль и в самой мышце, и в зоне отраженных болей резко усиливается. При надавливании на активную триггерную точку пациент нередко бурно реагирует на боль, непроизвольно пытаясь устранить вызвавший боль раздражитель, подпрыгивая на кушетке, что известно под названием «симптом прыжка».
- В мышцах никогда не наблюдаются гипо- или атрофии.
- Характерно исчезновение болей и мышечного спазма при специфическом местном воздействии на напряженную мышцу.
- Изменениям функционального состояния мышц, связанным с миофасциальным болевым синдромом, часто сопутствуют психологические и поведенческие нарушения (например, депрессия).
Дифференциальный диагноз миофасциального болевого синдрома проводится с основными патологическими состояниями, сопровождающимися мышечными болями, в первую очередь с ревматической полимиалгией и фибромиалгией.
Ревматическая полимиалгия (РП) — системное воспалительное заболевание, свойственное людям пожилого возраста, при котором поражаются преимущественно околосуставные мягкие ткани — сухожилия, связки, энтезисы. РП сопровождается конституциональными симптомами (лихорадка, слабость, похудание, снижение аппетита), лабораторными признаками системного воспаления — одним из диагностических критериев является ускорение СОЭ.
Фибромиалгия (ФМ) в отличие от МБС характеризуется хроническим течением с вовлечением множественных мышечных групп, распространением на большую часть тела и наличием болезненных при пальпаторном воздействии точек, вызывающих только локальную боль. При миофасциальном болевом синдроме имеется тенденция к большей остроте и специфичности процесса и к вовлечению меньшего количества мышц, а воздействие на триггерные точки вызывает отраженную боль.
Лечение миофасциального болевого синдрома следует начинать с немедикаментозных методов, включающих работу по обучению пациента различным методам мышечной релаксации, коррекции массы тела, правильной организации рабочего места, периодической разгрузке мышц в течение рабочего дня. При имеющихся аномалиях развития желательно начинать их коррекцию с самого раннего детского возраста под наблюдением ортопеда с целью сохранения правильной осанки. Большое значение имеют своевременное лечение заболеваний внутренних органов, позвоночника и суставов.
Широко используются нефармакологические методы воздействия, направленные непосредственно на спазмированную мышцу: разминание и точечный массаж болезненных мышечных уплотнений, ишемическая компрессия триггерных точек, тепловые физиопроцедуры, иглорефлексотерапия.
Одним из важнейших методов терапии является лечебная физкультура. Ее желательно начинать как можно раньше, как только исчезнут боли в покое. Комплекс упражнений должен быть подобран индивидуально, нагрузки наращиваются постепенно. Обязательно следует вводить в комплекс упражнений приемы на растяжение мышц. Лечебную физкультуру следует проводить в течение длительного времени без перерывов.
Для купирования острого болевого синдрома применяются как нестероидные противовоспалительные препараты (НПВП) — диклофенак, кетопрофен, напроксен, так и другие анальгетические средства, в том числе простые анальгетики (парацетамол) и синтетические опиоиды (трамадол). Препараты можно назначать как перорально, так и внутримышечно. Длительность курса лечения НПВП при миофасциальных болевых синдромах зависит от тяжести болевого синдрома.
Для более эффективной борьбы с болевым синдромом используются психотропные средства, особенно если имеется стойкий рецидивирующий болевой синдром, сопровождающийся депрессивным состоянием. В этом случае хороший эффект дают антидепрессанты: амитриптилин, флуоксетин. Анальгетический эффект этих препаратов развивается через неделю после начала терапии, для его поддержания необходим достаточно длительный прием этих препаратов — не менее 1,5 месяцев [8, 9].
Прием миорелаксантов помогает разорвать порочный круг боль — мышечный спазм — боль, поэтому назначение этой группы препаратов также показано в комплексной терапии мышечных болевых синдромов. Назначаются Сирдалуд, Мидокалм, Баклофен.
К сожалению, длительное применение НПВП в полных дозах ограничивается большим числом нежелательных явлений: поражение желудочно-кишечного тракта, почек, задержка жидкости, токсические явления со стороны центральной нервной системы, гепатопатия и апластическая анемия [5]. Возможно применение при мышечных болях селективных ингибиторов циклооксигеназы-2: нимесулида, мелоксикама. Однако большинство авторов отмечает, что новые НПВП менее эффективны, чем традиционные.
Одним из методов снижения вероятности развития нежелательных реакций является широкое применение локальных методов терапии болевых синдромов, к которым относится местное применение НПВП-содержащих препаратов [4]. Местные формы НПВП более безопасны по сравнению с таблетированными. Кроме того, использование кремов и гелей позволяет снизить дозу принимаемых перорально и парентерально НПВП [6]. При этом значительно уменьшается поступление препарата в общий кровоток и, следовательно, уменьшается его накопление в органах, чувствительных к отрицательному воздействию НПВП [3]. Местное применение современных мазей, гелей и кремов, содержащих НПВП, обеспечивает достаточно выраженный обезболивающий и противовоспалительный эффект.
Одним из наиболее эффективных местных НПВП является Вольтарен® Эмульгель. Он содержит 1,16% диклофенака диэтиламина в уникальной форме Эмульгель, который состоит из жировых мицелл и водно-спиртового геля. Благодаря водно-спиртовой основе при нанесении на кожу Вольтарен® Эмульгель оказывает охлаждающее действие, а после испарения спирта с поверхности кожи диклофенак концентрируется в жировых мицеллах, что облегчает его трансдермальное проникновение к очагу боли и воспаления. Обеспечивая быструю пенетрацию на глубину до 14 мм (что почти в 2 раза выше, чем при применении мазевых форм, и в 3 раза выше, чем при применении стандартных гелей). При нанесении на область поражения количество адсорбирующегося через кожу диклофенака пропорционально времени контакта и площади, на которую нанесен препарат, что немаловажно при терапии МФС. За счет высокой пенетрации и активности кислой молекулы вещества в очагах воспаления, сопровождающегося ацидозом, диклофенак в форме Эмульгель начинает действовать уже через 10–14 минут после однократного нанесения, обеспечивая не только избавление от болевого синдрома, но и положительные функциональные изменения в воспаленных тканях [6]. После аппликации на поверхность кожи площадью 500 см2 2,5 г Вольтарен® Эмульгеля абсорбция диклофенака в системный кровоток составляет менее 6%, что говорит о его безопасности: максимальная концентрация препарата в крови в 100 раз ниже, чем при пероральном приеме диклофенака.
Количество препарата зависит от размера болезненной зоны и интенсивности боли. Для нанесения на область площадью 400–800 см2 достаточно 2–4 г Вольтарен® Эмульгеля. Оптимальная кратность нанесения Вольтарен® Эмульгеля при миофасциальных болевых синдромах 3–4 раза в сутки.
Нежелательные явления при лечении Вольтарен® Эмульгелем развиваются крайне редко. Изредка возникают местные кожные реакции: кожный зуд, эритема. Все вышеизложенное позволяет широко применять Вольтарен® Эмульгель в комплексном лечении боли при воспалительных и дегенеративных заболеваниях опорно-двигательного аппарата, в том числе миофасциального болевого синдрома. При этом значительно повышается эффективность и безопасность терапии.
Литература
- Кукушкин М. Л., Хитров Н. К. Общая патология боли. М.: Медицина, 2004.
- Вознесенская Т. В. Миофасциальный болевой синдром // Consilium medicum.
- Нитхарт Ф. У., Голд М. С., Соломон Дж. С. Эффективность диклофенака диэтиламина для местного применения в лечении остеоартрита коленного сустава // РМЖ. 2007, т. 15, № 8, с. 677–684.
- Чичасова Н. В. Место локальной терапии суставов, периартикулярных тканей и позвоночника в клинической практике // Consilium medicum. 2001, т. 3, № 9, 426–427.
- Насонова В. А., Насонов Е. Л. Рациональная фармакотерапия ревматических заболеваний. М.: Литтерра, 2003.
- Topical NSAID for OA: update // Bandolier Journal. № 110.
- Тревелл Д. Г., Симоне Д. Г. Миофасциальные боли. М.: Медицина, 1989.
- Черненко О. А. Лечение болевых скелетно-мышечных поясничных синдромов // Русский медицинский журнал. 2 (ХХ), т. 8, № 10, с. 408–410.
- Яхно Н. Н., Штульман Д. Р. Болезни нервной системы. Руководство для врачей. М.: Медицина, 2001.
А. А. Годзенко, кандидат медицинских наук, доцент
ГБОУ ДПО РМАПО Минздравсоцразвития России, Москва
Контактная информация об авторе для переписки: alla1106@mail.ru