Основная информация:
- натуральный продукт
- является аюрведическим пребиотиком и иммуномодулятором
- помогает в качестве вспомогательной терапии при различных недугах
- может приниматься в течение курса химиотерапии
- БАД, не является лекарственным средством
- пищевая аюрведическая добавка
Показания к применению:
- слабый иммунитет
- сахарный диабет 2 типа
- туберкулёз
- ВИЧ-инфекция
- болезнь Крона
- рак
- астма
Противопоказания:
- индивидуальная непереносимость отдельных компонентов
- при беременности и в период лактации необходимо проконсультироваться с врачом
Активнодействующие компоненты:
Гудучи (Tinospora cordifolia) – натуральный пребиотик и иммуномодулятор, питает полезные бифидобактерии и лактобациллы.
Ашвагандха (Withania somnifera) – устраняет усталость, восполняет энергию и силы организма.
Амла (Emblica officinalis) – эффективно повышает защитные функции организма.
Гокшура (Tribulus terrestris) – обладает антистрессовыми и адаптогенными свойствами.
Инструкция по применению:
Принимать по 1 капсуле 2 раза в день в течение 12-16 недель. Рекомендуется предварительная консультация с врачом.
Состав:
Каждая капсула содержит:
Бала (Sida cordifolia), Ашвагандха (Withania somnifera), Виданга (Embelia ribes), Гудучи (Tinospora cordifolia), Виноград (Vitis vinifera), Амла (Emblica officinalis), Гокшура (Tribulus terrestris), Шатавари (Asparagus racemosus).
Условия хранения:
Хранить в сухом недоступном для света месте.
Отказ от ответственности:
MYINDIA.RU старается предоставлять только актуальную информацию о продукции, но дизайн упаковки может отличаться от представленного на сайте. Перед использованием средства ознакомьтесь с приложенной к нему инструкцией по применению или проконсультируйтесь со специалистом.
Вес: 50 г.
Сомаверт — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-005117
Торговое наименование препарата:
Сомаверт®
Международное непатентованное наименование:
пэгвисомант
Лекарственная форма:
лиофилизат для приготовления раствора для подкожного введения
Состав
Действующее вещество: пэгвисомант 10 мг, 15 мг или 20 мг.
Вспомогательные вещества: глицин 1,36/1,36/1,36 мг, маннитол 36,00/36,00/36,00 мг, натрия гидрофосфат 1,04/1,04/1,04 мг, натрия дигидрофосфата моногидрат 0.36/0,36/0,36 мг.
Растворитель: вода для инъекций 7,8 мл (флаконы) или 1,0 мл (одноразовые шприцы).
Описание
Белый или практически белый лиофилизированный порошок. Растворитель – прозрачная бесцветная жидкость (вода для инъекций).
Фармакотерапевтическая группа:
антагонист рецепторов гормона роста
Код ATX:
Н01АХ01
Фармакологические свойства
Фармакодинамика
Пэгвисомант – это генетически модифицированный аналог человеческого гормона роста, являющийся антагонистом его рецепторов.
Пэгвисомант связывается с рецепторами гормона роста на поверхности клетки и блокирует их взаимодействие с эндогенным соматотропным гормоном, нарушая передачу сигнала внутрь клетки. Пэгвисомант обладает высокой селективностью в отношении рецепторов гормона роста и не взаимодействует с рецепторами других цитокинов, включая пролактин. Подавление действия гормона роста под влиянием пэгвисоманта приводит к снижению концентраций инсулиноподобного фактора роста (ИФР-1) в сыворотке крови, а также сывороточных белков, чувствительных к гормону роста, включая свободный ИФР-1, кислотно-лабильную субъединицу ИФР-1 и белок-3 связывающий инсулиноподобный фактор роста (БСИФР-3).
При применении препарата Сомаверт® во всех дозах было отмечено статистически значимое уменьшение суммарного индекса симптомов по сравнению с плацебо (р<0,05).
При наблюдении пациентов, получавших пэгвисомант ежедневно в течение в среднем 55 недель, было отмечено, что средняя концентрация ИФР-1 снижается с 917 до 299 нг/мл и у 92% пациентов достигает возрастной нормы.
Фармакокинетика
Абсорбция.
Пэгвисомант медленно и длительно всасывается после подкожного введения. Его максимальная концентрация в сыворотке крови достигается обычно через 33-77 ч после введения. Степень всасывания составляет в среднем 57% (при подкожном введении 20 мг) по сравнению с внутривенным введением 10 мг.
Распределение
Средний объем распределения пэгвисоманта сравнительно небольшой (7-12 л).
Метаболизм
Метаболизм пэгвисоманта не изучался.
Выведение
Общий клиренс пэгвисоманта из организма при многократном подкожном введении в дозе 10-20 мг/сут составляет в среднем 36-28 мл/ч соответственно. Почечный клиренс пэгвисоманта незначительный и составляет менее 1% (в течение более 96 часов) от общего клиренса. Пэгвисомант медленно выводится из сыворотки крови. Период полувыведения варьирует от 74 до 172 ч при однократном или повторном применении.
После однократного подкожного введения пэгвисоманта в дозах 10, 15 и 20 мг линейного роста концентрации не выявили. В популяционных фармакокинетических исследованиях фармакокинетика пэгвисоманта в равновесном состоянии была практически линейной. У 145 пациентов, которые получали пэгвисомант в дозах 10, 15 и 20 мг в двух длительных исследованиях, средние концентрации пэгвисоманта в сыворотке крови (±стандартное отклонение) составили примерно 8800±6300, 13200±8000 и 15600±10300 нг/мл, соответственно.
Фармакокинетика пэгвисоманта была сопоставимой у здоровых добровольцев и пациентов с акромегалией, хотя у пациентов с более высокой массой тела общий клиренс пэгвисоманта был выше, чем у пациентов с меньшей массой тела (соответственно, первым могут потребоваться более высокие дозы препарата). Клиренс пэгвисоманта ниже при многократном применении, чем при однократном применении.
Сведений о фармакокинетике пэгвисоманта в особых группах (дети, пациенты с нарушением функции почек и печени) нет.
Показания к применению
Препарат Сомаверт® применяют для лечения пациентов с акромегалией, у которых отсутствует адекватный ответ на хирургическое лечение и/или лучевую терапию и у которых терапия аналогами соматостатина не нормализовала концентрацию ИРФ-1, или при непереносимости данной группы препаратов.
Противопоказания
- гиперчувствительность к пэгвисоманту или другим компонентам препарата;
- детский возраст до 18 лет (безопасность и эффективность препарата Сомаверт® у детей не установлены);
- почечная или печеночная недостаточность (безопасность и эффективность препарата Сомаверт® у пациентов с почечной или печеночной недостаточностью не установлены).
Применение при беременности и в период грудного вскармливания
Исследования у беременных женщин не проводились. Препарат Сомаверт® не рекомендуется применять при беременности. Применение препарата во время беременности возможно только в случаях крайней необходимости, если ожидаемая польза для матери превышает возможный риск для плода.
Сведений о проникновении пэгвисоманта в грудное молоко нет. Препарат Сомаверт® не рекомендуется к применению в период грудного вскармливания или грудное вскармливание должно быть прекращено.
Способ применения и дозы
Перед началом терапии необходимо проверить концентрацию ИФР-1 в сыворотке крови.
Под контролем врача подкожно вводят начальную дозу 40 мг или 80 мг препарата Препарат Сомаверт®. После чего пациент должен начать ежедневные подкожные инъекции по 10 мг препарата Препарат Сомаверт®.
Каждые 4-6 недель проверяют концентрацию ИФР-1 в сыворотке крови и проводят необходимую коррекцию дозы, увеличивая или уменьшая на 5 мг/день с тем, чтобы поддерживать концентрацию ИФР-1 в сыворотке крови в соответствии с возрастной нормой и нивелировать признаки и симптомы акромегалии.
Максимальная поддерживающая доза не должна превышать 30 мг/сут.
Необходимо чередовать места инъекций каждый день, чтобы предотвратить развитие липодистрофии.
Применение препарата противопоказано у детей и пациентов с почечной и печеночной недостаточностью.
Применение у пожилых пациентов
Коррекция дозы не требуется.
Инструкция по приготовлению раствора для инъекции
Для растворения пэгвисоманта во флакон с лиофилизатом вводят 1 мл прилагаемого растворителя (стерильная вода для инъекций), направляя струю жидкости на стенку флакона. Флакон держат в ладонях и аккуратно прокатывают его, чтобы растворить лиофилизат. НЕ ВСТРЯХИВАЙТЕ ФЛАКОН, поскольку это может вызвать денатурацию пэгвисоманта. После растворения каждый флакон содержит 10, 15 или 20 мг пэгвисоманта в 1 мл раствора. Полученный раствор должен быть прозрачным. Если раствор мутный, или содержит видимые включения, не используйте его. Из флакона должна вводиться только одна доза. После приготовления раствор следует использовать как можно быстрее (не позднее 6 часов).
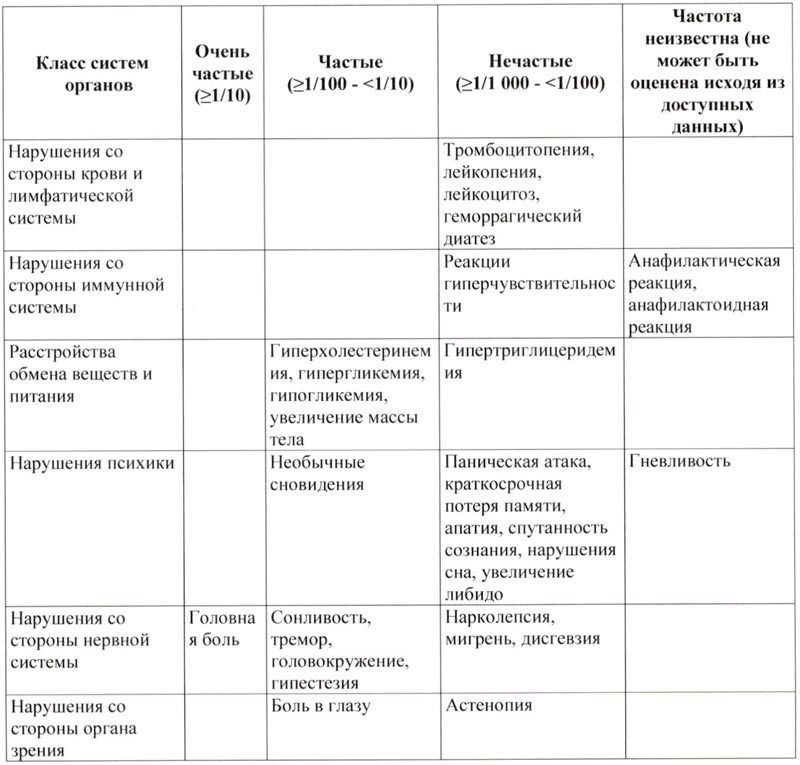
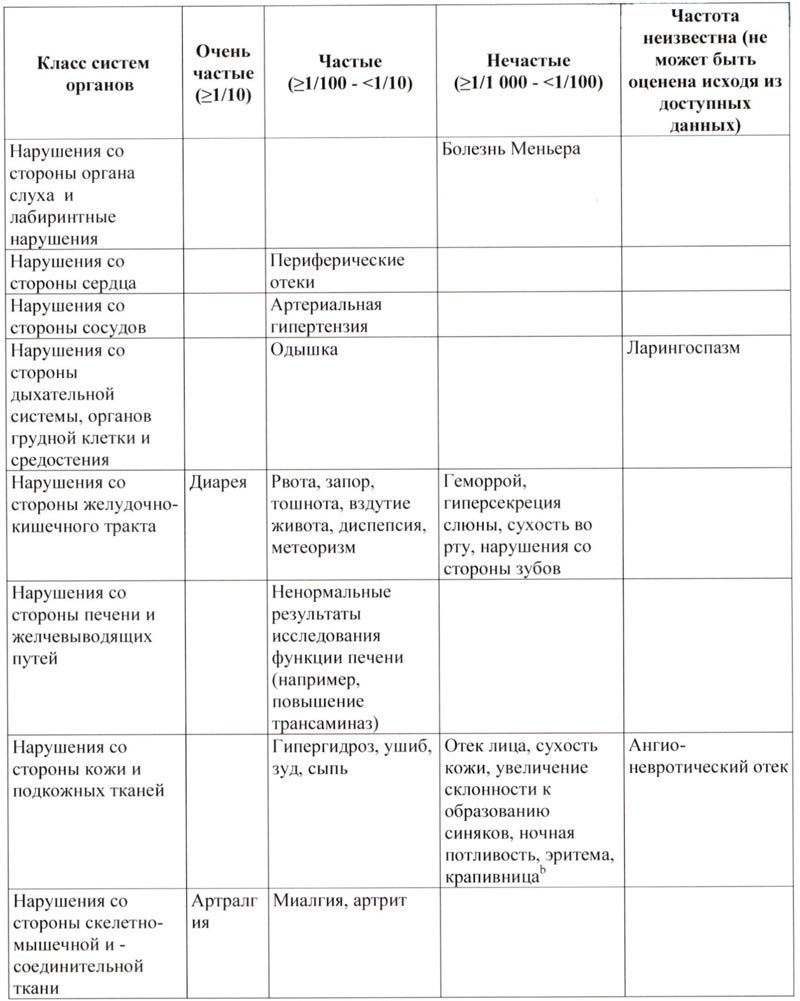
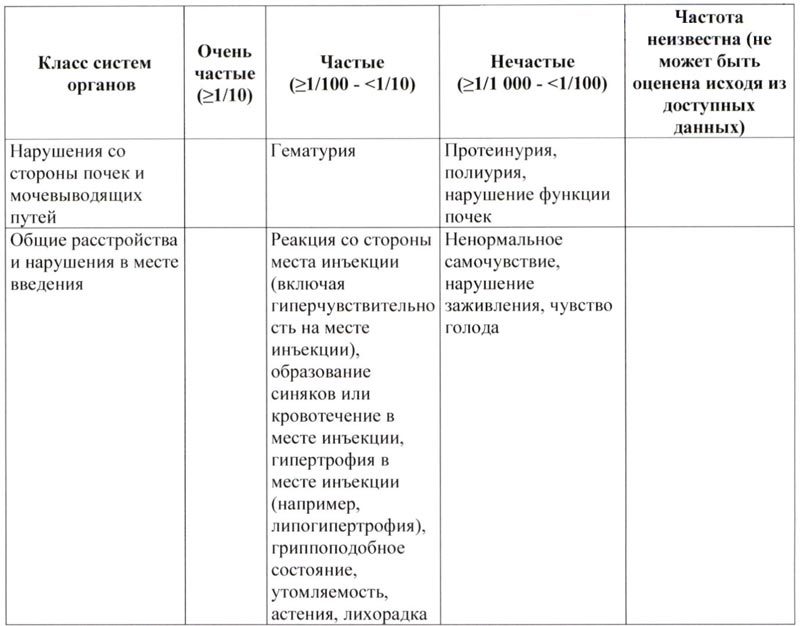
Побочное действие
Выявленные побочные явления у пациентов, получавших лечение пэгвисомантом, были легкой или умеренной степени тяжести, небольшой продолжительности и не требовали отмены терапии.
Наиболее часто описываемые неблагоприятные реакции, которые возникали у ≥10% пациентов с акромегалией, которые получали лечение пэгвисомантом во время клинических исследований, представляли собой головную боль у 25%, артралгии у 16% и диарею у 13%.
Приведенный ниже список включает в себя побочные действия, которые наблюдались в клинических исследованиях или которые фигурировали в спонтанных сообщениях, с распределением по классам систем органов и частоте.
Неблагоприятные реакции включены в список исходя из следующих категорий:
Очень частые: ≥1/10
Частые: ≥1/100 — <1/10
Нечастые: ≥1/1 000 — <1/100
Неизвестно (невозможно оценить на основании доступных данных)
Передозировка
У пациента, самостоятельно вводившего себе препарат Сомаверт® в дозе 80 мг/сут в течение 7 дней, не выявлено клинически значимых нежелательных явлений, которые можно было бы связать с передозировкой.
В случае передозировки введение препарата Сомаверт® следует прекратить. Терапию возобновляют, когда концентрации ИФР-1 вернутся к норме или превысят ее.
Взаимодействие с другими лекарственными средствами
Взаимодействие пэгвисоманта с другими лекарственными препаратами специально не изучалось. При одновременном применении аналогов соматостатина следует оценить необходимость дальнейшего применения этих препаратов.
Одновременное применение пэгвисоманта с другими препаратами для лечения акромегалии не исследовалось.
У пациентов, получающих инсулин или пероральные гипогликемические средства, может потребоваться снижение доз этих препаратов, так как пэгвисомант повышает чувствительность к инсулину.
Особые указания
При применении пэгвисоманта доброкачественные опухоли гипофиза, секретирующие гормон роста иногда могут расти, вызывая серьезные осложнения (например дефекты поля зрения).
Лечение пэгвисомантом не вызывает уменьшения размеров опухолей гипофиза, секретирующих гормон роста. Всех пациентов с подобными опухолями необходимо периодически обследовать с целью выявления возможного роста опухоли.
Перед началом лечения препаратом Сомаверт® следует определить сывороточную активность АЛТ (аланинаминотрансферазы) и ACT (аспартатаминотрансферазы); их концентрацию необходимо контролировать каждые 4-6 недель в течение первых 6 мес. после начала лечения, а затем периодически, а также мри появлении симптомов гепатита. У пациентов с повышенной активностью АЛТ и ACT, а также пациентов, получавших ранее аналоги соматостатина, необходимо исключить наличие обструкции желчевыводящих путей. При наличии признаков поражения печени не следует назначать пэгвисомант или продолжать начатую терапию, пока не будет проведено полное обследование функции печени.
Пэгвисомант по структуре сходен с гормоном роста и может определяться в сыворотке крови при проведении тестов с помощью коммерческих наборов, предназначенных для количественного анализа соматотропного гормона в сыворотке крови. Концентрации пэгвисоманта в сыворотке крови в терапевтически эффективных дозах обычно в 100-1000 раз превышают концентрацию эндогенного гормона роста в сыворотке пациентов с акромегалией, поэтому результаты подобных тестов будут ложными (завышенными). В связи с этим лечение препаратом Сомаверт® и подбор его дозы не следует проводить под контролем концентраций гормона роста в сыворотке крови, измеренных с помощью коммерческих наборов.
Дозу препарата следует подбирать под контролем концентрации ИФР-1 и поддерживать в пределах возрастной нормы. Пэгвисомант – это мощный антагонист гормона роста. Во время лечения этим препаратом необходимо контролировать клинические симптомы недостаточности гормона роста, даже при повышении его концентрации в сыворотке крови.
При лечении препаратом Сомаверт® пациентам, получающим гипогликемическую терапию, может потребоваться снижение дозы инсулина или пероральных гипогликемических средств, так как пэгвисомант повышает чувствительность к инсулину и толерантность к глюкозе. В результате исследования применения пэгвисоманта у этой группы пациентов был выявлен риск возникновения гипогликемии.
Терапевтическая польза в виде снижения концентрации ИФР-1, которое приводит к улучшению клинического состояния пациента, потенциально может повышать фертильность у пациенток. Пациентам следует использовать соответствующие средства контрацепции.
Влияние на способность управлять транспортными средствами и механизмами.
Влияние препарата на способность управлять транспортными средствами и механизмами не изучалось. Однако, учитывая, что препарат Сомаверт® может вызывать головокружение, следует соблюдать осторожность при выполнении перечисленных действий в период применения препарата.
Форма выпуска
Лиофилизат для приготовления раствора для подкожного введения, 10 мг, 15 мг или 20 мг.
Лиофилизат: по 10, 15, 20 мг пэгвисоманта в стеклянном флаконе типа I, укупоренном резиновой пробкой и запечатанном алюминиевым колпачком, снабжённым пластиковым колпачком «flip-off».
Растворитель (вода для инъекций): 7,8 мл в стеклянный флакон типа I, укупоренный резиновой пробкой и пластиковым колпачком или 1,0 мл в шприц одноразовый из бесцветного стекла типа I.
1 шприц, 1 инъекционную иглу, снабженную защитным колпачком, помещают в пластиковую упаковку.
30 флаконов лиофилизата, 30 флаконов растворителя и инструкцию по применению помещают в картонную пачку. Или по 10 флаконов с лиофилизатом помещают в картонную пачку, по 3 картонных пачки с лиофилизатом и по 30 пластиковых упаковок с растворителем и иглой помещают в пачку из картона.
Условия хранения
Хранить при температуре от 2 до 8 °С. Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
3 года (лиофилизат), 5 лет (растворитель).
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска
Отпускают по рецепту.
Производитель
Пфайзер МФГ. Бельгия Н.В.
Рийксвег 12, 2870 Пюре, Бельгия
Претензии потребителей направлять по адресу:
ООО «Пфайзер Инновации»
123112, Москва, Пресненская наб., д. 10
БЦ «Башня на набережной» (Блок С)
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Витамин В комплекс – комбинированное лекарственное средство, содержащее витамины группы В (Витамин В1, В2, B6) и никотинамид. Данные вещества необходимы для нормального функционирования организма, они участвуют в обмене белков, углеводов и жиров и используются для лечения состояний и заболеваний, связанных с недостатком витаминов группы В и никотинамида.
Витамин В комплекс применяют при доказанном дефиците витаминов группы В (В1, В2, B6) и никотинамида в случаях, когда не могут быть использованы лекарственные формы для перорального применения.
• если у Вас повышенная чувствительность (аллергия) к активным веществам или любому другому компоненту препарата.
В случае развития реакций гиперчувствительности следует прекратить применение препарата и обратиться к врачу.
• при повышенном давлении крови (артериальная гипертония II-III степени).
• Уведомите вашего врача, если у Вас имеются следующие заболевания:
— злокачественные опухоли;
— заболевания печени, заболевания желчного пузыря и желчных путей, язвенная болезнь желудка или двенадцатиперстной кишки, гастрит, геморрагии, подагра.
• При приеме лекарственного средства в высоких дозах в течение длительного времени возможно развитие периферической невропатии, проявляющейся нарушениями координации и жгучими болями в стопах. Развитие данных симптомов может наступить через 1 месяц — 3 года после начала лечения.
• Лекарственное средство может вызвать ложноположительные результаты при определении уробилиногена в моче с использованием реактива Эрлиха.
• Лекарственное средство может окрасить мочу в желто-оранжевый цвет.
Важная информация о вспомогательных веществах лекарственного средства
• В качестве вспомогательного вещества лекарственное средство содержит метилпарагидроксибензоат, который может вызвать аллергические реакции (возможно замедленного типа), а в исключительных случаях – бронхоспазм.
• Лекарственное средство содержит менее 1 ммоля натрия (23 мг) в одной дозе, т.е. практически не содержит натрия.
Пожалуйста, сообщите Вашему врачу или фармацевту, если Вы недавно принимали или принимаете другие лекарственные средства, в том числе отпускаемые без рецепта врача.
• Содержание витамина В1 может привести к уменьшению эффекта некоторых лекарственных средств, применяемых для лечения повышенного кровянного давления (антигипертензивных средств), а также к снижению снотворного эффекта барбитуратов и глутетимида.
• Витамин В1 может усилить действие лекарственных средств, применяемых для лечения депрессивных состояний (имипрамин, дезипрамин), особенно у пациентов пожилого возраста.
• Витамин В1 утрачивает свое действие при применении с цитостатиком 5-фторурацилом.
• Витамин B6 уменьшает антипаркинсонический эффект леводопы.
• Одновременный прием никотинамида и противоэпилептических средств (карбамазепин, диазепам и натрия вальпроат) может усилить их противосудорожный эффект.
• Хлорпромазин увеличивает выведение витамина В2 с мочой.
• Пробенецид подавляет тубулярную секрецию витамина В2, в результате чего замедляется его экскреция с мочой и могут усилиться терапевтические и побочные действия.
• Из-за различных несовместимостей не допускается одновременное применение (в одном и том же шприце) вместе с бензилпенициллином и оксациллином, макролидами, хлорамфениколом (антибиотики), витамином В12, витамином С.
Необходимо проинформировать вашего лечащего врача о любом сопутствующем лечении другими лекарственными средствами, чтобы избежать возможных взаимодействий между ними.
Обратитесь за советом к вашему врачу или фармацевту перед применением любого лекарственного средства.
Лекарственное средство можно применять в терапевтических дозах во время беременности.
Не рекомендуется прием Витамин В комплекс во время грудного вскармливания. Если его прием является необходимым, грудное вскармливание следует прекратить.
Из-за отсутствия контролируемых клинических исследований, подтверждающих безопасность, использование лекарственного средства во время беременности возможно только по назначению врача, после оценки соотношения польза/риск.
Лекарственное средство не оказывает влияния на способность управлять транспортными средствами и работать со сложными механизмами.
Витамин В комплекс раствор для инъекций применяют по назначению врача. Если у Вас есть какие-либо сомнения, проконсультируйтесь с лечащим врачом или фармацевтом.
Лекарственное средство вводится обычно внутримышечно или реже внутривенно медленно в дозе 1-2 мл в день или через день в течение 5-10 дней.
Дозировку и продолжительность лечения определяет лечащий врач в зависимости от тяжести заболевания и переносимости лекарственного средства.
При первой возможности, рекомендуется переход на лекарственные формы для перорального применения.
Дети: Безопасность и эффективность использования лекарственного средства у детей не доказаны, не рекомендуется применять его в педиатрии.
Если Вы приняли лекарственное средство в большем количестве, чем было назначено вашим лечащим врачом
Случаи передозировки маловероятны, так как лекарственное средство вводится квалифицированными специалистами. Но, если Вы считаете, что доза была высокой, проконсультируйтесь с вашим врачом.
При применении лекарственного средства в очень высоких дозах могут наблюдаться симптомы передозировки: возбуждение, страх, тремор, бессонница, головная боль, судороги.
Если Вы пропустили применение лекарственного средства
Не употребляйте двойную дозу для компенсации пропущенной.
Продолжайте применение в соответствии с назначением врача.
Если у Вас есть какие-либо дополнительные вопросы, связанные с применением этого лекарственного средства, пожалуйста, обратитесь к вашему врачу или фармацевту.
Как и все другие лекарственные средства, Витамин В комплекс может вызвать побочные действия, хотя они не наблюдаются у всех пациентов.
Нарушения со стороны иммунной системы: реакции гиперчувствительности (крапивница, отек Квинке).
Нарушения со стороны почек и мочевыводящих путей: окрашивание мочи в желтый цвет, обусловленное наличием в препарате рибофлавина.
Со стороны кожи и подкожной клетчатки: покраснение кожи лица, приливы жара, сыпь, зуд.
Общие расстройства и состояния в месте введения: боль в месте инъекции.
При применении действующих веществ лекарственного средства также регистрировались следующие побочные реакции:
Нарушения со стороны иммунной системы: реакции гиперчувствительности (повышенное потоотделение, тахикардия, крапивница, зуд кожи, затрудненное дыхание, одышка, бронхоспазм), анафилактический шок.
Нарушения со стороны нервной системы: головная боль, головокружение, периферическая полинейропатия (при длительном применении высоких доз).
Со стороны желудочно-кишечного тракта: тошнота, рвота, диарея, боль в животе.
Со стороны печени и желчевыводящих путей: повышение уровня трансаминаз, гепатит.
Побочные реакции исчезают при прекращении лечения.
Если у Вас появятся какие-либо побочные действия, не указанные в данном листке-вкладыше, пожалуйста, сообщите об этом лечащему врачу или фармацевту.
В оригинальной упаковке для защиты от света, при температуре не выше 25°С.
Не замораживать!
Хранить в недоступном для детей месте.
Не используйте Витамин В комплекс после истечения срока годности, указанного на упаковке.
Срок годности соответствует последнему дню указанного месяца.
Лекарственные средства не следует выбрасывать в канализацию или в контейнер для бытовых отходов. Поинтересуйтесь у вашего врача, как утилизировать неиспользованные Вами лекарственные средства. Эти меры будут способствовать охране окружающей среды.
2 мл раствора для инъекций в ампуле содержат:
Активные вещества: тиамина гидрохлорид (витамин B1) 10 мг, рибофлавина натрия фосфат, эквивалентный рибофлавину, (витамин В2) 2 мг, пиридоксина гидрохлорид (витамин В6) 10 мг, никотинамид (витамин РР) 100 мг.
Вспомогательные вещества: динатрия эдетат, метилпарагидроксибензоат (Е218), глицерол, хлористоводородная кислота (1 моль/л), вода для инъекций.
Описание: Прозрачная жидкость, практически свободная от частиц, желто-зеленого цвета со специфическим запахом тиамина гидрохлорида.
Первичная упаковка: По 2 мл в ампулы из коричневого стекла 1-го гидролитического класса с маркировкой для вскрытия ампул (цветная точка/кольцо).
Вторичная упаковка: 10 ампул в блистере из ПВХ пленки. По 1 блистеру в картонной пачке вместе с листком-вкладышем с указаниями по применению.
Владелец регистрационного удостоверения и производитель
АО СОФАРМА
1220 София, ул. Илиенское шоссе 16, Болгария
МНН: Пегвисомант
Производитель: Пфайзер Мануфактуринг Бельгия Н.В.
Анатомо-терапевтическо-химическая классификация: Пегвисомант
Номер регистрации в РК:
РК-ЛС-5№024940
Информация о регистрации в РК:
01.03.2021 — 01.03.2026
- Скачать инструкцию медикамента
Торговое наименование
Сомаверт®
Международное непатентованное название
Пегвисомант
Лекарственная форма, дозировка
Лиофилизат для приготовления раствора для подкожного введения, 10 мг, 15 мг, 20 мг, в комплекте с растворителем, 1 мл.
Фармакотерапевтическая группа
Гормональные препараты системного действия, исключая половые гормоны и инсулины. Гипоталамо-гипофизарные гормоны и их аналоги. Гормоны передней доли гипофиза и их аналоги. Прочие гормоны передней доли гипофиза и их аналоги. Пегвисомант.
Код АТХ: H01AX01
Показания к применению
Лечение взрослых пациентов с акромегалией, демонстрирующих недостаточный ответ на хирургическое вмешательство и/или лучевую терапию, а также пациентов, у которых соответствующее лечение аналогами соматостатина не привело к нормализации концентрации ИФР‑1 или плохо переносилось.
Перечень сведений, необходимых до начала применения
Противопоказания
— гиперчувствительность к действующему веществу или к любому из вспомогательных веществ, перечисленных в разделе «Дополнительные сведения».
Необходимые меры предосторожности при применении
Опухоли, секретирующие гормон роста
Доброкачественные опухоли, секретирующие гормон роста, иногда могут расти, вызывая серьезные осложнения (например, дефекты полей зрения). Лечение пегвисомантом не приводит к уменьшению размера опухоли. Следует тщательно отслеживать состояние всех пациентов с такими опухолями для того, чтобы избежать любого возможного увеличения размера опухоли в ходе лечения.
Мониторинг уровня ИФР‑1 в сыворотке крови
Пегвисомант является мощным антагонистом действия гормона роста. В результате применения этого лекарственного препарата может возникнуть дефицит гормона роста, несмотря на наличие повышенного уровня гормона роста в сыворотке крови. Следует контролировать и поддерживать концентрации ИФР‑1 в сыворотке крови в пределах стандартизованного по возрасту нормального диапазона путем коррекции дозы пегвисоманта.
Повышение уровней АЛТ или АСТ
До начала лечения препаратом Сомаверт® у пациентов следует определить исходные уровни биохимических показателей функции печени [аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), общий билирубин (ОБ) и щелочная фосфатаза (ЩФ) в сыворотке крови].
У пациентов с повышенной активностью АЛТ и АСТ или у пациентов с наличием в анамнезе лечения аналогами соматостатина необходимо исключить признаки обструктивного заболевания желчевыводящих путей. Применение пегвисоманта следует прекратить, если признаки заболевания печени сохраняются.
Рекомендации, касающиеся начала лечения препаратом Сомаверт®, исходя из исходных уровней биохимических показателей функции печени (БПФП), и рекомендации по мониторингу уровня биохимических показателей функции печени во время лечения препаратом Сомаверт® представлены в таблице А.
Таблица А. Рекомендации, касающиеся начала лечения препаратом Сомаверт®, исходя из исходных уровней БПФП, и рекомендации по периодическому мониторингу уровня БПФП во время лечения препаратом Сомаверт®
|
Исходный уровень БПФП |
Рекомендации |
|
Нормальный |
|
|
Превышение, но менее трехкратной ВГН |
|
|
Превышение трёхкратной ВГН |
|
Сокращения: АЛТ — аланинаминотрансфераза; АСТ — аспартатаминотрансфераза; БПФП — биохимический показатель функции печени; ВГН — верхняя граница нормы.
Если у пациента во время лечения препаратом Сомаверт® повысились уровни БПФП или возникли другие признаки или симптомы нарушения функции печени, рекомендуются следующие варианты лечения (таблица Б).
Таблица Б. Клинические рекомендации, основанные на отклоняющихся от нормы результатах оценки биохимических показателей функции печени во время лечения препаратом Сомаверт®
|
Уровень БПФП и клинические признаки/симптомы |
Рекомендации |
|
Превышение, но менее трехкратной ВГН |
|
|
Превышение трёхкратного ВГН, но меньше пятикратного ВГН (без признаков/симптомов гепатита или другого поражения печени, или повышения уровня ОБ в сыворотке крови) |
|
|
По крайней мере, пятикратное превышение ВГН или повышение уровня трансаминаз, по крайней мере, трехкратной ВГН, связанное с каким-либо увеличением сывороточного ОБ (при наличии или отсутствии признаков/симптомов гепатита или других поражений печени) |
|
|
Признаки или симптомы, указывающие на гепатит или другое поражение печени (например, желтуха, билирубинурия, повышенная утомляемость, тошнота, рвота, боль в правом верхнем квадранте живота, асцит, необъяснимый отек, склонность к легкому образованию гематом) |
|
Гипогликемия
В результате исследования применения пегвисоманта у пациентов с сахарным диабетом, получавших лечение инсулином или пероральными гипогликемическими лекарственными препаратами, был выявлен риск возникновения гипогликемии в этой популяции. В связи с этим у пациентов с акромегалией и сахарным диабетом может потребоваться снижение дозы инсулина или гипогликемических лекарственных препаратов.
Повышенная фертильность
Терапевтическая польза в виде снижения концентрации ИФР‑1, которое приводит к улучшению клинического состояния пациента, потенциально может повышать фертильность у пациенток. Пациентам следует порекомендовать при необходимости использовать соответствующие средства контрацепции. Сомаверт® не рекомендуется применять во время беременности.
Взаимодействия с другими лекарственными препаратами
Исследования взаимодействия не проводились. Следует рассмотреть вопрос о продолжении лечения аналогами соматостатина. Использование этого лекарственного препарата в комбинации с другими лекарственными препаратами для лечения акромегалии всесторонне не изучалось.
Пациентам, получающим инсулин или пероральные гипогликемические лекарственные препараты, может потребоваться снижение дозы этих действующих веществ в связи с влиянием пегвисоманта на чувствительность к инсулину.
Пегвисомант обладает значительной структурной схожестью с гормоном роста, что приводит к перекрестной реактивности при использовании стандартных коммерчески доступных тест-систем для количественного определения гормона роста. Поскольку концентрации в сыворотке крови терапевтически эффективных доз этого препарата, как правило, в 100–1000 раз выше, чем фактические концентрации гормона роста в сыворотке крови, наблюдаемые у пациентов с акромегалией, результаты измерений концентраций гормона роста в сыворотке крови, получаемые с помощью коммерчески доступных тест-систем для количественного определения гормона роста, будут сомнительными. Поэтому лечение пегвисомантом не следует контролировать или корректировать на основании концентраций гормона роста в сыворотке крови, определяемых с помощью этих тест-систем для количественного анализа.
Специальные предупреждения
Женщины, способные к деторождению
Терапевтическая польза в виде снижения концентрации ИФР‑1, которое приводит к улучшению клинического состояния пациента, потенциально может повышать фертильность у пациенток. Пациентам следует порекомендовать при необходимости использовать соответствующие средства контрацепции.
Во время беременности или лактации
Сомаверт® не следует применять во время беременности в отсутствие очевидной необходимости.
Грудное вскармливание
Сомаверт® не следует применять у кормящих грудью женщин. Тем не менее, грудное вскармливания может продолжаться при условии отмены лечения препаратом: при принятии этого решения следует учитывать пользу от терапии пегвисомантом для матери и пользу от грудного вскармливания для ребенка.
Фертильность
Данные по влиянию пегвисоманта на фертильность отсутствуют.
Особенности влияния препарата на способность управлять транспортным средством или потенциально опасными механизмами
Исследований по влиянию препарата на способность управлять автотранспортными средствами и работать с механизмами не проводилось.
Сомаверт® содержит натрий
Этот лекарственный препарат содержит менее 1 ммоль натрия (23 мг) на дозу, т. е. практически не содержит натрия.
Рекомендации по применению
Всегда вводите препарат именно так, как порекомендовал врач. Если у Вас есть сомнения по поводу применения препарата, проконсультируйтесь с врачом.
Режим дозирования
Нагрузочную дозу пегвисоманта (80 мг) следует вводить подкожно под наблюдением врача. После этого Сомаверт®, 10 мг, восстановленный в 1 мл растворителя, следует вводить один раз в сутки путем подкожной инъекции.
Коррекцию дозы следует проводить на основании уровней ИФР‑1 в сыворотке крови. Концентрации ИФР‑1 в сыворотке крови следует измерять каждые 4–6 недель и осуществлять соответствующую коррекцию дозы с шагом повышения 5 мг/сутки для поддержания концентрации ИФР‑1 в сыворотке крови в пределах стандартизованного по возрасту нормального диапазона для поддержания оптимального терапевтического ответа.
Определение исходных уровней печеночных ферментов до начала лечения препаратом Сомаверт®
До начала лечения препаратом Сомаверт® у пациентов следует определить исходные уровни биохимических показателей функции печени (БПФП) [аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), общий билирубин (ОБ) и щелочная фосфатаза (ЩФ) в сыворотке крови]. Для ознакомления с рекомендациями, касающимися начала лечения препаратом Сомаверт®, исходя из исходных уровней БПФП, и рекомендациями по мониторингу уровня БПФП во время лечения препаратом Сомаверт® см. таблицу А.
Максимальная доза не должна превышать 30 мг/сутки.
Для различных режимов дозирования препарат выпускается в следующих дозировках: Сомаверт®, 10 мг; Сомаверт®, 15 мг; Сомаверт®, 20 мг.
Особые группы пациентов
Дети
Безопасность и эффективность препарата Сомаверт® у детей в возрасте от 0 до 17 лет не установлены. Данные отсутствуют.
Пациенты пожилого возраста
Коррекция дозы препарата не требуется.
Пациенты с печеночной недостаточностью
Безопасность и эффективность применения Сомаверта® у пациентов с печеночной недостаточностью не установлены.
Пациенты с почечной недостаточностью
Безопасность и эффективность применения Сомаверта® у пациентов с почечной недостаточностью не установлены.
Метод и путь введения
Сомаверт® следует вводить путем подкожной инъекции. Место инъекции следует ежедневно менять для предотвращения липогипертрофии.
Длительность лечения
Длительность применения определяет врач.
Меры, которые необходимо принять в случае передозировки
Если Вы случайно ввели большую дозу препарата Сомаверт®, следует немедленно связаться со своим врачом.
Меры, необходимые при пропуске одной или нескольких доз лекарственного препарата
Если Вы забыли выполнить инъекцию, следует ввести следующую дозу, как только Вы об этом вспомните, а затем продолжить вводить Сомаверт® согласно предписанию врача. Не вводите двойную дозу, чтобы восполнить пропущенную дозу.
Рекомендации по обращению за консультацией к медицинскому работнику для разъяснения способа применения лекарственного препарата
При наличии дополнительных вопросов о применении этого лекарственного препарата проконсультируйтесь с врачом.
Описание нежелательных реакций, которые проявляются при стандартном применении ЛП и меры, которые следует принять в этом случае
Данный препарат, как и все другие лекарственные средства, может вызывать побочные эффекты, хотя и не у всех пациентов.
У некоторых пациентов, принимавших препарат Сомаверт®, были зарегистрированы аллергические реакции как легкой степени тяжести, так и тяжелой (анафилактические реакции). Серьезная аллергическая реакция может проявляться одним или несколькими перечисленными ниже симптомами: отек лица, языка, губ или горла; свистящее дыхание или затруднение дыхания (спазм гортани); генерализованная кожная сыпь, крапивница или зуд; головокружение. Немедленно обратитесь к врачу, если у Вас возник какой-либо из этих симптомов.
Очень часто
- головная боль
- диарея
- боль в суставах
Часто
- затрудненное дыхание
- повышенные уровни веществ, которые отображают состояние функции печени (это можно наблюдать по результатам анализов крови)
- кровь в моче
- повышенное артериальное давление
- запор, тошнота, рвота, вздутие живота, нарушение пищеварения, образование газов снижение тактильного чувства (осязания)
- образование синяка или кровотечение в месте инъекции, чувствительность или отек кожи в месте инъекции, скопление жировой ткани под поверхностью кожи в месте инъекции, отек конечностей, слабость, повышение температуры
- потливость, зуд, сыпь, повышенная склонность к образованию синяков
- боль в мышцах, артрит
- повышение уровня холестерина в крови, увеличение массы тела, повышение уровня глюкозы в крови, снижение уровня глюкозы в крови
- гриппоподобное заболевание, повышенная утомляемость
- необычные сновидения
- боль в глазу
Нечасто
- аллергическая реакция после введения (повышение температуры, сыпь, зуд и, в тяжелых случаях, затрудненность дыхания, быстрый отек кожи, требующий оказания срочной медицинской помощи), которые могут возникать немедленно или через несколько дней после введения
- белок в моче, увеличение объема мочеиспускания, нарушение функции почек
- потеря интереса, спутанность сознания, увеличение полового влечения, паническая атака, потеря памяти, нарушение сна
- снижение количества тромбоцитов в крови, повышение или снижение количества лейкоцитов в крови, склонность к кровотечениям
- плохое самочувствие, нарушение заживления ран
- астенопия, нарушения со стороны внутреннего уха
- отек лица, сухость кожи, ночная потливость, покраснение кожи (эритема), выступающие зудящие пузырьки на коже (крапивница)
- повышенный уровень жировых веществ в крови, повышенный аппетит
- сухость во рту, усиление слюноотделения, проблемы с зубами, геморрой
- нарушение вкусовых ощущений, мигрень.
Неизвестно (невозможно оценить на основании имеющихся данных)
- гнев
- тяжелая одышка (ларингоспазм)
- быстрый отек кожи и подкожной ткани, а также внутренней (слизистой) оболочки органов (ангионевротический отек).
Приблизительно у 17% пациентов в ходе лечения образуются антитела к соматотропному гормону. Антитела, по-видимому, не препятствуют действию этого лекарственного препарата.
При возникновении нежелательных лекарственных реакций обращаться к медицинскому работнику, фармацевтическому работнику или напрямую в информационную базу данных по нежелательным реакциям (действиям) на лекарственные препараты, включая сообщения о неэффективности лекарственных препаратов
РГП на ПХВ «Национальный Центр экспертизы лекарственных средств и медицинских изделий» Комитета медицинского и фармацевтического контроля Министерства здравоохранения Республики Казахстан
http://www.ndda.kz
Дополнительные сведения
Состав лекарственного препарата
Один флакон содержит
активное вещество — пегвисомант 10 мг, 15 мг, 20 мг,
вспомогательные вещества – глицин, маннитол, динатрия гидрофосфат (безводный), натрия дигидрофосфата моногидрат,
растворитель: вода для инъекций
Описание внешнего вида, запаха, вкуса
Масса белого или почти белого цвета.
Растворитель — прозрачная бесцветная жидкость, практически без видимых частиц.
Восстановленный препарат – прозрачный или слегка опалесцирующий, от бесцветного до зеленовато-желтого цвета раствор, без видимых частиц.
Форма выпуска и упаковка
Препарат помещают в стеклянный флакон (тип I), укупоренный хлорбутиловой резиновой пробкой, обжатый алюминиевой обкаткой, снабженной пластиковым колпачком типа «flip-off».
10 флаконов с препаратом помещают в картонную пачку.
Растворитель (1.0 мл) помещают в одноразовый шприц из бесцветного стекла (тип I) с бромбутиловым резиновым плунжером и бромбутиловым запорным устройством.
1 шприц и 1 иглу, снабженную защитным колпачком, помещают в пластиковую упаковку.
По 3 картонных пачки с препаратом и 30 пластиковых упаковок с растворителем вместе с инструкцией по медицинскому применению на казахском и русском языках помещают в пачку из картона.
Срок хранения
Лекарственный препарат 3 года.
Растворитель 5 лет.
Не применять по истечении срока годности!
Условия хранения
Хранить при температуре от 2 оС до 8 ºС. Не замораживать.
Восстановленный препарат использовать немедленно.
Хранить в недоступном для детей месте!
Условия отпуска из аптек
По рецепту
Сведения о производителе
Производитель/Упаковщик:
Пфайзер Мануфактуринг Бельгия Н.В.,
Рийксвег 12,
2870 Пюрс, Бельгия
Тел: + 323 890 92 11
Держатель регистрационного удостоверения
Пфайзер Эйч Си Пи Корпорэйшн,
235 Ист 42 Стрит, Нью-Йорк, штат Нью-Йорк 10017-5755 США
Tел: 212-573-2323
Факс: 212-573-1895
Наименование, адрес и контактные данные (телефон, факс, электронная почта) организации на территории Республики Казахстан, принимающей претензии (предложения) по качеству лекарственных средств от потребителей и ответственной за пострегистрационное наблюдение за безопасностью лекарственного средства
Филиал компании Pfizer Export B.V. (Пфайзер Экспорт Би.Ви.) в Республике Казахстан
Республика Казахстан, г. Алматы, 050000, Медеуский район, пр. Н.Назарбаева, д. 100/4
тел.: +7 (727) 250 09 16
факс: +7 (727) 250 42 09
электронная почта: PfizerKazakhstan@pfizer.com
Инструкция по приготовлению и выполнению инъекции препарата Сомаверт®
Сомаверт® выпускается во флаконе в виде массы белого или почти белого цвета. Перед применением необходимо смешать препарат Сомаверт® с растворителем. Растворитель в предварительно заполненном шприце с маркировкой «Растворитель для приготовления раствора препарата Сомаверта®».
Не смешивайте с Сомавертом® какую-либо другую жидкость.
Не следует делать инъекцию себе или кому-либо другому, не пройдя обучение у медицинского работника
- Что Вам потребуется
Одна упаковка Сомаверта®, содержащая следующее:
- флакон с препаратом Сомаверт®;
- предварительно заполненный шприц с растворителем;
- безопасная игла.
Также понадобится следующее:
- ватный шарик;
- спиртовая салфетка;
- подходящий контейнер для утилизации острых предметов.
Пробка флакона
(колпачок флакона снят)
Дата окончания срока годности
- Подготовка
Перед началом процедуры
- Смешивайте препарат Сомаверт® с растворителем, только когда будете готовы к введению дозы.
- Извлеките одну упаковку Сомаверта® из холодильника и дайте ей нагреться до комнатной температуры естественным образом в безопасном месте.
- Вымойте руки водой с мылом и тщательно высушите их.
- Снимите защитную пленку с упаковки шприца и безопасной иглы, чтобы было проще извлечь компоненты, когда они потребуются при подготовке к инъекции.
- Не используйте шприц или флакон, если:
- они повреждены или неисправны;
- истек срок годности;
- он был заморожен, даже если потом его разморозили (только для шприца).
- Выберите область инъекции
Выберите область инъекции
по меньшей мере 5 см от пупка
Руки или нижняя часть спины:
задняя поверхность верхней части руки (только медицинский работник или лицо, осуществляющее уход за пациентом)
- Для каждой инъекции используйте новое место в выбранной области.
- Не вводите препарат в участки с поверхностно расположенными костями, синяками, покраснением, болезненными повреждениями или уплотнениями, а также в участки с рубцами или участки, пораженные кожным заболеванием.
- Обработайте место инъекции спиртовым тампоном согласно указаниям медицинского работника.
- Дайте месту инъекции высохнуть.
- Снимите колпачок флакона
- Снимите колпачок с флакона.
- Выбросьте колпачок; он больше не понадобится.
Осторожно! Не касайтесь ничего пробкой флакона.
- Удалите колпачок шприца
- Отломите колпачок шприца. Для отламывания может потребоваться достаточно большое усилие.
- Выбросьте колпачок шприца; он больше не понадобится.
- Держите шприц вертикально, чтобы не допустить утечки.
Осторожно! Когда колпачок шприца снят, конец шприца не должен ничего касаться.
- Присоедините безопасную иглу
Присоедините безопасную иглу
- С усилием заверните безопасную иглу на шприце до упора.
- Снимите колпачок иглы
- Отогните защитный колпачок иглы в сторону от колпачка иглы.
- Снимите колпачок иглы, осторожно потянув его по прямой.
- Выбросьте колпачок иглы; он больше не понадобится.
Осторожно! Не касайтесь ничего иглой.
- Введите иглу
- Введите иглу через центр пробки флакона, как показано на рисунке.
- Когда игла введена в пробку флакона, поддерживайте шприц, чтобы не погнуть иглу.
- Добавьте жидкость
- Наклоните флакон со шприцем, как показано на рисунке.
- Медленно нажимайте на шток поршня до тех пор, пока вся жидкость не окажется во флаконе.
- Осторожно! Не направляйте струю жидкости непосредственно на порошок, так как это может вызвать образование пены. Пена делает препарат непригодным к использованию.
- Пока не извлекайте иглу.
- Смешайте содержимое флакона
Смешайте содержимое флакона
- Удерживайте шприц и флакон одной рукой, как показано на рисунке.
- Осторожно перемешивайте жидкость, перемещая флакон по кругу на плоской поверхности.
- Продолжайте перемешивать жидкость, вращая флакон, пока порошок не растворится полностью.
Примечание: это может занять до 5 минут.
- Проверьте препарат
- Оставьте иглу во флаконе и внимательно осмотрите препарат. Он должен быть прозрачным или слегка опалесцирующим, от бесцветного до зеленовато-желтого цвета раствором, без видимых частиц.
- Не используйте препарат, если:
- он мутный или белесоватый;
- во флаконе заметны частицы или слой пены.
- Переставьте иглу
- Поверните флакон, чтобы видеть зазор в пробке, как показано на рисунке.
- Вытяните иглу вниз таким образом, чтобы ее кончик находился в самой нижней точке жидкости. Это позволит забрать максимальный объем жидкости.
- Убедитесь в том, что шток поршня не сдвинулся — если это произошло, вставьте его обратно полностью в шприц. Это гарантирует удаление всего воздуха из шприца перед забором дозы.
- Заберите дозу
- Медленное потяните за шток поршня, чтобы извлечь как можно больше препарата из флакона.
Примечание: если в шприце есть воздух, постучите по цилиндру, чтобы пузырьки всплыли, а затем осторожно выдавите их во флакон.
- Извлеките иглу из флакона.
- Введите иглу
- Осторожно зажмите складку кожи в месте инъекции.
- Введите иглу на ее полную длину в складку кожи.
- Введите препарат
- Медленно нажимайте на шток поршня до тех пор, пока цилиндр шприца не окажется пустым.
Примечание: обязательно вводите иглу на полную длину.
- Отпустите кожу и вертикально вверх извлеките иглу.
- Обеспечьте безопасность иглы
Обеспечьте безопасность иглы
- Согните защитный колпачок иглы в сторону иглы.
- Осторожно прижмите защитный колпачок иглы к твердой поверхности для его защелкивания.
Примечание: после защелкивания защитного колпачка иглы раздастся щелчок.
- Утилизация
- Шприц или иглу ни в коем случае НЕЛЬЗЯ использовать повторно. Утилизируйте иглу и шприц в соответствии с указаниями лечащего врача, медсестры или фармацевта, а также соблюдая местное законодательство в сфере охраны здоровья и безопасности.
- После инъекции
- При необходимости слегка прижмите место инъекции чистым ватным тампоном.
- Не растирайте это место.
ВОПРОСЫ И ОТВЕТЫ
Что делать, если пробка флакона коснулась чего-либо?
- Очистите пробку флакона свежей спиртовой салфеткой, и дождитесь, когда пробка полностью высохнет. Если очистить пробку невозможно, не используйте флакон.
Что делать со шприцем, если он упал?
- Не используйте его, даже если он выглядит неповрежденным. Утилизируйте шприц таким же образом, как использованный. Необходимо использовать запасной шприц.
Сколько раз можно безопасно вводить иглу в пробку флакона?
- Только один раз. Извлечение и повторное введение существенно повышают риск повреждения иглы и приводят к ее затуплению. Это может создать дискомфорт и повышает риск повреждения кожи и инфицирования. Также существует риск потерять какую-то часть лекарственного препарата.
Можно ли встряхивать флакон, если порошок не растворяется?
- Нет, ни в коем случае не встряхивайте флакон. Встряхивание может привести к разрушению лекарственного препарата и появлению пены. Полное растворение порошка может занять несколько минут, поэтому продолжайте совершать осторожные круговые движения флаконом, пока жидкость не станет полностью прозрачной.
Как можно понять, что во флаконе образовалась пена?
• Пена выглядит как слой небольших пузырьков на поверхности жидкости. Запрещается вводить вспененный Сомаверт®.
Наличие небольших пузырьков воздуха допустимо
Наличие слоя пены недопустимо
Как можно предотвратить вспенивание лекарственного препарата?
- Нажимайте на шток поршня очень медленно, для того чтобы жидкость аккуратно стекала по стенкам флакона. Не направляйте струю жидкости непосредственно на порошок, так как это может вызвать образование пены. Этот метод также сокращает время взбалтывания и позволяет забрать большее количество лекарственного препарата.
В шприце заметно некоторое количество воздуха. Это нормально?
- Мельчайшие пузырьки воздуха в жидкости представляют собой нормальное явление и не создают опасности при инъекции. Однако можно случайно забрать в шприц воздух, который следует удалить перед инъекцией. Пузырьки или воздушные прослойки на поверхности жидкости следует выдавить во флакон.
Почему не получается забрать весь лекарственный препарат из флакона?
- Форма флакона такова, что в нем остается незначительное количество лекарственного препарата. Это нормально. Чтобы забрать максимальное количество препарата, кончик иглы следует погрузить во флакон как можно ниже.
Что делать в случае каких-либо сомнений относительно лекарственного препарата?
- Со всеми вопросами следует обращаться к врачу, хорошо знакомому с применением препарата Сомаверт®.
| Инструкция_рус.docx | 1.14 кб |
| Сомаверт_каз.docx | 1.14 кб |
Отправить прикрепленные файлы на почту
Вимово™ (Vimovo) инструкция по применению
📜 Инструкция по применению Вимово™
💊 Состав препарата Вимово™
✅ Применение препарата Вимово™
📅 Условия хранения Вимово™
⏳ Срок годности Вимово™
⚠️ Государственная регистрация данного препарата отменена
Описание лекарственного препарата
Вимово™
(Vimovo)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2013 года.
Дата обновления: 2020.10.29
Владелец регистрационного удостоверения:
Код ATX:
M01AE52
(Напроксен и эзомепразол)
Лекарственная форма
| Вимово™ |
Таб., покр. кишечнорастворимой оболочкой, 500 мг+20 мг: 6 или 60 шт. рег. №: ЛП-001426 |
Форма выпуска, упаковка и состав
препарата Вимово™
Таблетки, покрытые кишечнорастворимой оболочкой (пленочной) желтого цвета, овальные, с надписью «500/20» на одной стороне, выполненной черным красителем.
Вспомогательные вещества: кроскармеллоза натрия — 22 мг, повидон К90 — 11 мг, кремния диоксид коллоидный — 2.62 мг, магния стеарат — 1.38 мг, гипромеллоза 3 мПас — 77.35 мг, макрогол 8000 — 5.85 мг, триэтилцитрат — 8.18 мг, полисорбат 80 — 4.55 мг, глицерил моностеарат 40-55 — 2.69 мг, метилпарагидроксибензоат (Е218) — около 20 мкг, пропилпарагидроксибензоат (Е216) — около 10 мкг, сополимер метакриловой кислоты и этилакрилата (1:1), суспензия 30% — 54.6 мг, титана диоксид — 13.26 мг, полидекстроза (E1200) — 6.3 мг, гипромеллоза 6 мПас — 10.85 мг, гипромеллоза 50 мПас — 680 мкг, железа оксид желтый (E172) — 580 мкг, воск карнаубский — 50 мкг, чернила черные (опакод черный) — q.s.
Состав черных чернил (опакод черный): железа оксид черный — 22%, гипромеллоза 6 мПас — 7%, пропиленгликоль — 10%, изопропанол (удаляется в процессе производства) — 12%, вода очищенная (удаляется в процессе производства) — 49%.
6 шт. — флаконы пластиковые (1) — пачки картонные.
60 шт. — флаконы пластиковые (1) — пачки картонные.
Фармакологическое действие
Комбинированный препарат, содержащий НПВП и ингибитор протонового насоса. Препарат Вимово™ разработан в виде таблеток с последовательной доставкой веществ: в оболочке содержится эзомепразол магния немедленного высвобождения, а в ядре — напроксен замедленного высвобождения, покрытый кишечнорастворимой оболочкой. В результате эзомепразол высвобождается в желудке до растворения напроксена в тонкой кишке. Кишечнорастворимая оболочка предотвращает высвобождение напроксена при рН ниже 5.5, обеспечивая защиту от возможного негативного воздействия напроксена на слизистую оболочку желудка.
Напроксен — НПВП, обладает анальгезирующим и жаропонижающим действием. Механизм действия аниона напроксена, как и других НПВП, до конца не выяснен, но может быть связан с подавлением простагландинсинтетазы.
Эзомепразол — ингибитор протонового насоса, является S-изомером омепразола и снижает секрецию соляной кислоты в желудке путем специфического ингибирования протонной помпы в париетальных клетках желудка. S- и R-изомеры омепразола обладают сходной фармакодинамической активностью.
Эзомепразол является слабым основанием, которое переходит в активную форму в сильно кислой среде секреторных канальцев париетальных клеток слизистой оболочки желудка и ингибирует протоновый насос — фермент Н+/К+-АТФазу, при этом происходит ингибирование как базальной, так и стимулированной секреции соляной кислоты.
Влияние на секрецию соляной кислоты в желудке
После 9 дней двукратного приема трех комбинаций Вимово™: напроксен по 500 мг в сочетании с эзомепразолом в дозах 10 мг, 20 мг или 30 мг, рН желудка выше 4 поддерживался в среднем 9.8 ч, 17.1 ч и 18.4 ч соответственно, в течение суток у здоровых добровольцев. Изменчивость индивидуальных значений времени поддержания рН желудка выше 4, в виде коэффициента вариабельности (CV), составила 55%, 18% и 16% соответственно.
Другие эффекты, связанные с ингибированием секреции соляной кислоты. Во время лечения препаратами, понижающими секрецию желез желудка, концентрация гастрина в плазме повышается в результате снижения секреции кислоты.
Вследствие снижения секреции соляной кислоты повышается концентрация хромогранина A (CgA). Повышение концентрации CgA может оказывать влияние на результаты обследований для выявления нейроэндокринных опухолей. Для предотвращения данного влияния необходимо временно прекратить прием эзомепразола за 5 дней до проведения исследования концентрации CgA.
У пациентов, длительное время получавших эзомепразол, отмечается увеличение количества энтерохромаффиноподобных клеток, вероятно, связанное с повышением концентрации гастрина в плазме.
У пациентов, принимающих препараты, понижающие секрецию желез желудка, в течение длительного времени, чаще отмечается образование железистых кист в желудке. Эти явления обусловлены физиологическими изменениями в результате выраженного ингибирования секреции соляной кислоты. Кисты доброкачественные и подвергаются обратному развитию.
Применение лекарственных препаратов, подавляющих секрецию соляной кислоты в желудке, в т.ч. ингибиторов протоновой помпы, сопровождается увеличением содержания в желудке микробной флоры, в норме присутствующей в ЖКТ. Применение ингибиторов протонной помпы может приводить к незначительному увеличению риска инфекционных заболеваний ЖКТ, вызванного бактериями рода Salmonella spp. и Campylobacter spp., а также, возможно, бактериями Clostridium difficile у госпитализированных пациентов.
Клиническая эффективность и безопасность
Вимово™ в дозе 500 мг/20 мг 2 раза/сут существенно уменьшал частоту язв, ассоциированных с приемом НПВП у пациентов, не инфицированных Helicobacter pylori, относящихся к группе риска (пожилой возраст, язвенная болезнь желудка или двенадцатиперстной кишки в анамнезе), по сравнению с напроксеном в таблетках, покрытых кишечнорастворимой оболочкой, по 500 мг 2 раза/сут в ходе 6-месячной терапии в комбинации с другими ингибиторами протоновой помпы или в режиме монотерапии. Частота развития язвы желудка при применении Вимово™ составила 5.6, а при приеме напроксена — 23.7. Прием Вимово™ также уменьшал частоту развития язв двенадцатиперстной кишки по сравнению с терапией напроксеном (0.7% и 5.4% соответственно).
У пациентов, получавших Вимово™, отмечена более низкая частота побочных эффектов НПВП со стороны верхних отделов ЖКТ по сравнению с пациентами, принимавшими напроксен в таблетках, покрытых кишечнорастворимой оболочкой (53.3% и 70.4% соответственно).
У пациентов, получавших Вимово™ и ацетилсалициловую кислоту в низкой дозе, отмечалась более низкая частота язв желудка и двенадцатиперстной кишки по сравнению с пациентами, которые принимали ацетилсалициловую кислоту вместе с напроксеном в таблетках, покрытых кишечнорастворимой оболочкой (4% и 32.4% соответственно).
Вимово™ был эффективен и у пациентов в возрасте 60 лет и старше — частота язв желудка и двенадцатиперстной кишки составила 3.3%, а у пациентов, получавших напроксен в таблетках, покрытых кишечнорастворимой оболочкой — 30.1%.
У пациентов, получавших Вимово™ в течение 6 месяцев, была отмечена более низкая частота симптомов диспепсии по сравнению с приемом напроксена в таблетках, покрытых кишечнорастворимой оболочкой.
Пациенты, получавшие Вимово™, реже прекращали терапию из-за развития побочных эффектов (7.9%) по сравнению с пациентами, получавшими напроксен в таблетках, покрытых кишечнорастворимой оболочкой (12.5%). Частота прекращения терапии из-за побочных эффектов со стороны верхних отделов ЖКТ также была ниже при терапии Вимово™ (4% и 12% соответственно). Средняя продолжительность терапии Вимово™ составила 152 дня по сравнению с 124 днями монотерапии напроксеном.
При остеоартрите коленного сустава отмечена сходная эффективность Вимово™ в дозе по 500 мг/20 мг 2 раза/сут и целекоксиба в дозе 200 мг/сут при приеме в течение 12 недель терапии. Частота отмены терапии из-за развития побочных эффектов также была сходной.
Фармакокинетика
Всасывание
Напроксен. В равновесном состоянии после двукратного приема Вимово™ Cmax напроксена в плазме крови достигается в среднем в течение 3 ч после приема препарата утром и вечером. Tmax напроксена в плазме немного больше в первый день терапии, при этом медианы времени после утреннего и вечернего приема составляют 4 ч и 5 ч соответственно.
По значениям AUC и Cmax напроксена в плазме крови была доказана биоэквивалентность Вимово™ и напроксена, покрытого кишечнорастворимой оболочкой.
Напроксен быстро и полностью абсорбируется из ЖКТ, биодоступность составляет 95% Css напроксена достигается через 4-5 дней приема.
Прием Вимово™ с пищей не влияет на степень абсорбции напроксена, но существенно тормозит (на 8 ч) абсорбцию и снижает на 12% Cmax в плазме. Прием Вимово™ за 30 минут до еды не влиял (или только в минимальной степени) на величину и время абсорбции напроксена, по сравнению с приемом Вимово™ во время еды.
Эзомепразол. После двукратного приема Вимово™ эзомепразол быстро абсорбируется, достигая Cmax в плазме крови, в среднем, через 0.5-0.75 ч после приема утром и вечером в первый день и после достижения равновесного состояния.
Cmax в плазме выше при равновесном состоянии по сравнению с концентрацией в первый день приема Вимово™. Это частично объясняется усилением абсорбции за счет фармакодинамического эффекта эзомепразола, повышающего рН желудка, что приводит к уменьшению кислотного распада эзомепразола в желудке. Снижение пресистемного метаболизма и системного клиренса эзомепразола на фоне повторного приема препарата также способствует увеличению плазменных концентраций эзомепразола в равновесном состоянии.
Прием Вимово™ с пищей не замедляет всасывание эзомепразола, но существенно уменьшает степень абсорбции, что приводит к снижению на 52% и 75% AUC и Cmax в плазме соответственно. Прием Вимово™ за 30 минут до еды существенно не влиял на скорость и степень абсорбции эзомепразола по сравнению с приемом Вимово™ во время еды.
Распределение
Напроксен. Связывание напроксена в терапевтических концентрациях с альбуминами плазмы составляет более 99%. Vd напроксена составляет 0.16 л/кг. При приеме напроксена в дозах более 500 мг/сут плазменные концентрации увеличиваются менее чем пропорционально дозе из-за повышения клиренса в результате насыщаемости связи с белками плазмы при более высоких дозах (средняя минимальная Css 36.5, 49.2 и 56.4 мг/л после приема напроксена в суточных дозах 500, 1000 и 1500 мг соответственно). Анион напроксена обнаруживался в грудном молоке у женщин в концентрации, составлявшей примерно 1% от Cmax напроксена в плазме.
Эзомепразол. Связывание эзомепразола с белками плазмы составляет 97%. Кажущийся Vd эзомепразола в равновесном состоянии у здоровых добровольцев составляет примерно 0.22 л/кг массы тела.
Метаболизм
Напроксен. Напроксен интенсивно метаболизируется в печени под действием изоферментов системы цитохрома Р450, в основном, изофермента CYP2C9, с образованием 6-О-десметилнапроксена. Неизмененный препарат или его метаболиты не вызывают индукцию данных изоферментов. Напроксен и 6-О-десметилнапроксен дополнительно метаболизируются до соответствующих ацилглюкуронид конъюгированных метаболитов. В соответствии с T1/2 напроксена AUC увеличивается при повторном приеме Вимово™ 2 раза/сут.
Эзомепразол. Эзомепразол полностью метаболизируется под действием изоферментов системы цитохрома Р450. Значительная часть метаболизма эзомепразола зависит от полиморфного фермента СYP2C19, который отвечает за формирование гидрокси- и десметил- метаболитов эзомепразола. Остальная часть зависит от другой специфической изоформы, CYP3A4, которая отвечает за формирование эзомепразола сульфона, основного метаболита в плазме крови. Основные метаболиты эзомепразола не влияют на секрецию соляной кислоты желудка.
AUC эзомепразола увеличивается при повторном приеме Вимово™ 2 раза/сут. Это увеличение зависит от дозы и объясняет нелинейную связь дозы с AUC после повторного приема препарата. Эта зависимость от времени и от дозы частично обусловлена снижением пресистемного метаболизма и системного клиренса, вероятно, вызванным ингибированием изофермента CYP2C19 эзомепразолом и/или его сульфоновым метаболитом. Повышенная абсорбция эзомепразола при повторном приеме Вимово™, вероятно, также способствует зависимости от времени и дозы.
Выведение
Напроксен. После двукратного приема Вимово™ средний T1/2 напроксена составляет примерно 9 ч и 15 ч после приема утром и вечером соответственно, и не меняется при повторном приеме препарата.
Клиренс напроксена составляет 0.13 мл/мин/кг. Примерно 95% напроксена из любой дозы выводится с мочой, в основном, в виде напроксена (<1%), 6-О-десметилнапроксена (<1%) или их конъюгатов (от 66% до 92%). Небольшие количества, 3% или менее от принятой дозы, выводятся с калом. У пациентов с почечной недостаточностью могут накапливаться метаболиты.
Эзомепразол. После двукратного приема Вимово™ средний T1/2 эзомепразола составляет примерно 1 ч после приема утром и вечером в первый день и немного удлиняется после достижения равновесного состояния (1.2-1.5 ч).
Общий плазменный клиренс эзомепразола составляет 17 л/ч после однократного приема и 9 л/ч после повторного приема.
Почти 80% дозы эзомепразола после приема внутрь выводится в виде метаболитов с мочой, остальная часть — с калом. Менее 1% неизмененного препарата выводится с мочой.
Фармакокинетика в особых клинических случаях
Пациенты с почечной недостаточностью. У пациентов с почечной недостаточностью исследования фармакокинетики Вимово™ не проводились.
Напроксен: не определялись параметры фармакокинетики напроксена у пациентов с почечной недостаточностью. Т.к. напроксен, его метаболиты и конъюгаты, главным образом, выводятся с мочой, в случае почечной недостаточности возможна кумуляция метаболитов напроксена. У пациентов с почечной недостаточностью тяжелой степени снижается элиминация напроксена. Не рекомендуется применять Вимово™ у пациентов с почечной недостаточностью тяжелой степени (КК < 30 мл/мин).
Эомепразол: не проводились исследования эзомепразола у пациентов с нарушением функции почек. Т.к. экскреция метаболитов эзомепразола, а не исходного препарата, осуществляется почками, то не ожидается, что у пациентов с нарушением функции почек изменится метаболизм эзомепразола.
Пациенты с печеночной недостаточностью. Не проводились исследования фармакокинетики Вимово™ у пациентов с печеночной недостаточностью.
Напроксен: не определялись параметры фармакокинетики напроксена у пациентов с печеночной недостаточностью. Алкогольный цирроз и, вероятно, другие формы цирроза уменьшают общую концентрацию напроксена в плазме крови, но увеличивают концентрацию несвязанного напроксена в плазме. Применимость этих данных для напроксена в препарате Вимово™ неизвестна, но в таких ситуациях целесообразно назначение препарата в минимальной эффективной дозе.
Эзомепразол: слабая или умеренная печеночная недостаточность может повлиять на метаболизм эзомепразола. Уровень метаболизма снижен у пациентов с тяжелой печеночной недостаточностью, что приводит к удвоению AUC эзомепразола. Поэтому не следует превышать максимальную суточную дозу эзомепразола 20 мг у пациентов с тяжелой печеночной недостаточностью.
Не следует назначать Вимово™ пациентам с тяжелой печеночной недостаточностью.
Пациенты пожилого возраста. Отсутствуют данные по фармакокинетике Вимово™ у пациентов в возрасте старше 65 лет.
Напроксен: исследования показывают, что хотя общая концентрация напроксена в плазме крови не изменяется, несвязанная доля напроксена в плазме крови увеличивается у пациентов пожилого возраста, однако несвязанная фракция составляет менее 1% от общей концентрации напроксена. Cmin несвязанного напроксена у пациентов пожилого возраста варьировали от 0.12% до 0.19% от общей концентрации напроксена по сравнению с 0.05%-0.075% у молодых пациентов. Клиническая значимость этих данных неизвестна, хотя возможно, что увеличение концентрации свободного напроксена может сопровождаться повышением частоты развития нежелательных явлений при приеме конкретной дозы у некоторых пациентов пожилого возраста.
Эзомепразол: метаболизм эзомепразола существенно не меняется у пациентов пожилого возраста в возрасте от 71 до 80 лет.
Особенности фармакокинетики в некоторых группах пациентов. Приблизительно у 2.9±1.5% населения снижена активность изофермента CYP2C19. У таких пациентов метаболизм эзомепразола, в основном, происходит в результате действия CYP3A4. При систематическом приеме эзомепразола в дозе 40 мг 1 раз/сут среднее значение AUC на 100% превышает значение этого параметра у пациентов с повышенной активностью изофермента CYP2C19. Средние значения Cmax в плазме у пациентов со сниженной активностью изофермента повышены приблизительно на 60%. Указанные особенности не влияют на дозу и способ применения Вимово™.
Пол. После однократного приема эзомепразола в дозе 40 мг среднее значение AUC на 30% выше у женщин, чем у мужчин. После повторного приема эзомепразола 1 раз/сут не выявлено различий в зависимости от пола больных. Эти данные не имеют значения для режима дозирования препарата Вимово™.
Показания препарата
Вимово™
- с целью облегчения симптомов при лечении остеоартрита, ревматоидного артрита и анкилозирующего спондилита у пациентов с риском развития язв желудка и/или двенадцатиперстной кишки, ассоциированных с приемом НПВП.
Режим дозирования
Препарат назначают внутрь, по 1 таб. (500 мг/20 мг) 2 раза/сут. Рекомендуется принимать Вимово™, как минимум, за 30 мин до еды.
Таблетку следует проглатывать целиком, запивая водой, не разжевывая, не ломая пополам и не измельчая.
Пациентам с почечной недостаточностью легкой и умеренно степени тяжести Вимово™ следует назначать с осторожностью и под тщательным контролем функции почек. Может потребоваться снижение суточной дозы напроксена. Если не приемлема суточная доза напроксена 1000 мг, то следует использовать альтернативные режимы терапии. Противопоказано применение препарата у пациентов с почечной недостаточностью тяжелой степени (КК < 30 мл/мин) в связи с наблюдавшейся кумуляцией метаболитов напроксена у данной категории пациентов и у больных, находящихся на гемодиализе.
Пациентам со слабой или умеренной печеночной недостаточностью Вимово™ следует назначать с осторожностью и под тщательным контролем функции печени. Может потребоваться снижение суточной дозы напроксена. Если не приемлема суточная доза напроксена 1000 мг, то следует использовать альтернативные режимы терапии. Вимово™ противопоказан пациентам с тяжелой печеночной недостаточностью, т.к. этим пациентам не рекомендуется принимать более 20 мг эзомепразола в сут.
У пациентов пожилого возраста повышен риск развития серьезных осложнений от нежелательных реакций.
Побочное действие
В состав препарата Вимово™ входят напроксен и эзомепразол, поэтому возможно развитие тех же нежелательных эффектов, которые наблюдались при применении этих активных веществ в отдельности. Нежелательные эффекты со стороны ЖКТ, такие как диспепсия, боль в желудке, тошнота и рвота, наиболее часто развиваются при применении напроксена. При разработке Вимово™ в его состав включен эзомепразол для снижения частоты развития желудочно-кишечных побочных эффектов напроксена. Показано, что при приеме Вимово™ значительно понизилась частота развития язвенных поражений желудка и нежелательных явлений в верхнем отделе ЖКТ, ассоциированных с НПВП, по сравнению с монотерапией напроксеном.
В ходе плацебо-контролируемых исследований наиболее частые нежелательные явления при приеме Вимово™ (n=490) по сравнению с плацебо (n=246) включали диарею, боль в верхней части живота, запор, головокружение и периферический отек, которые являются нежелательными лекарственными реакциями при применении активных веществ в отдельности. Не получено новых данных по безопасности при применении Вимово™ у общей популяции больных (n=1157) по сравнению с хорошо известными профилями безопасности активных веществ напроксена и эзомепразола.
Не установлено различий в типах нежелательных реакций при применении препарата в течение 12 месяцев по сравнению с краткосрочной терапией. Пациенты, принимавшие Вимово™, значительно реже досрочно прекращали терапию из-за развития нежелательных реакций по сравнению с больными, принимавшими один напроксен, покрытый кишечнорастворимой оболочкой (7.9% по сравнению с 12.5% соответственно). Доля пациентов, прекративших лечение из-за развития любого нежелательного явления в верхнем отделе ЖКТ (включая язвы двенадцатиперстной кишки) при применении Вимово™ составила 4% по сравнению с 12% больных, получавших один напроксен, покрытый кишечнорастворимой оболочкой. Нежелательные реакции классифицированы по частоте развития и органам, и системам. Определение частоты нежелательных реакций: очень часто (>1/10), часто (>1/100 до <1/10), нечасто (>1/1000 до <1/100), редко (>1/10 000 до <1/1000), очень редко (<1/10 000); неизвестно (невозможно оценить по полученным данным).
Напроксен
В таблице 1 приведены нежелательные реакции отмечены у пациентов, получавших напроксен во время клинических исследований и постмаркетингового периода.
Таблица 1.
Эзомепразол
В таблице 2 представлены нежелательные реакции, которые выявлены или предполагались у пациентов, получавших эзомепразол, покрытый кишечнорастворимой оболочкой, во время клинических исследований и/или постмаркетингового периода. Ни одна из этих нежелательных реакций не зависела от дозы препарата.
Таблица 2.
В составе Вимово™ содержатся метил- и пропилпарагидроксибензоат, которые могут вызвать развитие аллергических реакций (возможно замедленного типа).
Противопоказания к применению
- указания в анамнезе на бронхиальную астму, крапивницу и аллергических реакций при приеме ацетилсалициловой кислоты и других НПВП (полное или неполное сочетание непереносимости ацетилсалициловой кислоты, риносинусита, крапивницы/ангионевротического отека, полипоза слизистой оболочки полости носа и бронхиальной астмы);
- тяжелая печеночная недостаточность (класс С по Чайлд-Пью) или активные заболевания печени;
- почечная недостаточность тяжелой степени (КК менее 30 мл/мин);
- тяжелая неконтролируемая сердечная недостаточность;
- подтвержденная гиперкалиемия;
- язвенная болезнь желудка или двенадцатиперстной кишки в фазе обострения;
- желудочно-кишечное кровотечение, кровоизлияние в мозг или другие кровотечения;
- воспалительные заболевания кишечника в фазе обострения (язвенный колит, болезнь Крона);
- состояния после аортокоронарного шунтирования;
- одновременный прием с атазанавиром и нелфинавиром;
- III триместр беременности;
- период грудного вскармливания;
- детский и подростковый возраст до 18 лет (эффективность и безопасность применения не изучены);
- повышенная чувствительность к компонентам препарата;
- повышенная чувствительность к другим замещенным бензимидазолам.
С осторожностью: хроническая сердечная недостаточность (II-IV функциональный класс по классификации NYHA); побочные эффекты со стороны ЖКТ при приеме ацетилсалициловой кислоты или НПВП в анамнезе; артериальная гипертензия; ИБС; заболевания периферических артерий; нарушение мозгового кровообращения; одновременный прием пероральных кортикостероидов, антикоагулянтов, селективных ингибиторов обратного захвата серотонина или антитромботических препаратов (например, ацетилсалициловой кислоты), ингибиторов АПФ, диуретиков; пациенты с факторами риска развития сердечно-сосудистых заболеваний (например, артериальная гипертензия, гиперлипидемия, сахарный диабет, курение); заболевания ЖКТ в анамнезе (болезнь Крона, язвенный колит); гиповолемия; почечная недостаточность средней и тяжелой степени; легкая и умеренная печеночная недостаточность; пациенты пожилого возраста.
Применение при беременности и кормлении грудью
Беременность
Напроксен. Исследования напроксена, проведенные на животных, не выявили прямого или косвенного неблагоприятного воздействия на развитие эмбриона/плода. Врожденные аномалии отмечены при применении НПВП у человека; однако они развивались редко и не были специфичными. Как и при применении других препаратов этого типа, напроксен тормозит роды у животных и влияет на сердечно-сосудистую систему плода человека (преждевременное закрытие артериального протока). Противопоказано применение напроксена в III триместре беременности. НПВП не следует назначать в течение I и II триместров беременности, за исключением случаев, когда ожидаемая польза для матери перевешивает потенциальный риск для плода.
Препараты, содержащие в своем составе напроксен, не рекомендуется применять при родовых схватках и родах в связи с подавлением напроксеном синтеза простагландинов; напроксен может неблагоприятно влиять на кровообращение плода и угнетать схватки, увеличивая кровотечение у матери и ребенка.
Эзомепразол. Клинических данных о влиянии эзомепразола на беременность недостаточно. В исследованиях на животных эзомепразол не оказывал прямого или косвенного неблагоприятного воздействия на развитие эмбриона/плода. В исследованиях на животных рацемическая смесь не оказывала прямого или косвенного неблагоприятного воздействия на беременность, роды или постнатальное развитие. Следует с осторожностью назначать эзомепразол беременным женщинам.
Грудное вскармливание
Напроксен выделяется с грудным молоком у человека. Неизвестно, выделяется ли эзомепразол с грудным молоком, т. к. исследования у женщин в период лактации не проводились. Противопоказано применение препарата Вимово™ в период грудного вскармливания.
Применение при нарушениях функции печени
Пациентам со слабой или умеренной печеночной недостаточностью Вимово™ следует назначать с осторожностью и под тщательным контролем функции печени. Может потребоваться снижение суточной дозы напроксена. Если не приемлема суточная доза напроксена 1000 мг, то следует использовать альтернативные режимы терапии. Вимово™ противопоказан пациентам с тяжелой печеночной недостаточностью, т.к. этим пациентам не рекомендуется принимать более 20 мг эзомепразола в сут.
Применение при нарушениях функции почек
Пациентам с почечной недостаточностью легкой и умеренно степени тяжести Вимово™ следует назначать с осторожностью и под тщательным контролем функции почек. Может потребоваться снижение суточной дозы напроксена. Если не приемлема суточная доза напроксена 1000 мг, то следует использовать альтернативные режимы терапии. Противопоказано применение препарата у пациентов с почечной недостаточностью тяжелой степени (КК < 30 мл/мин) в связи с наблюдавшейся кумуляцией метаболитов напроксена у данной категории пациентов и у больных, находящихся на гемодиализе.
Применение у детей
Противопоказан в детском и подростковом возрасте до 18 лет.
Применение у пожилых пациентов
У пациентов пожилого возраста повышен риск развития серьезных осложнений от нежелательных реакций.
Особые указания
Пациенты пожилого возраста
Напроксен. У пациентов пожилого возраста наблюдалась повышенная частота развития нежелательных реакций при применении НПВП, в частности, желудочно-кишечные кровотечения, язвенные поражения и перфорация ЖКТ, которые могут привести к смерти больного. В ходе клинических исследований препарата Вимово™ у пациентов пожилого возраста не отмечено повышения частоты развития язвы желудка и двенадцатиперстной кишки по сравнению с пациентами моложе 60 лет; снижение риска развития язвы сохранялось в этой популяции пожилых больных. Однако осложнения язвы, такие как кровотечение, перфорация и обструкция ЖКТ, не изучались в этих исследованиях Вимово™.
Влияние на ЖКТ
Напроксен. Желудочно-кишечное кровотечение, изъязвление или перфорация ЖКТ, которые могут привести к смерти пациента, наблюдались при применении всех НПВП в любое время в ходе лечения, с развитием симптомов поражения или без, при наличии серьезных желудочно-кишечных заболеваний в анамнезе или без. В состав препарата Вимово™ входит эзомепразол для уменьшения частоты развития желудочно-кишечных побочных эффектов напроксена, включая изъязвление. Несмотря на то, что Вимово™ существенно уменьшает частоту развития язв желудка по сравнению с одним напроксеном, по-прежнему возможно развитие язв и сопровождающих их осложнений.
Риск развития желудочно-кишечного кровотечения, изъязвления и перфорации ЖКТ при применении НПВП увеличивается при повышении дозы напроксена у пациентов с язвенной болезнью в анамнезе, особенно, если язва осложнена кровотечением или перфорацией, и у пациентов пожилого возраста. Таким пациентам следует назначать терапию, начиная с наименьшей дозы. Пациенты с желудочно-кишечными нежелательными реакциями в анамнезе; особенно пациенты пожилого возраста, должны сообщать о любых необычных симптомах в брюшной полости (особенно, о желудочно-кишечном кровотечении) и, особенно, в начале лечения. Следует с осторожностью назначать НПВП пациентам, уже принимающим препараты, которые могут повысить риск развития язвы или кровотечения, такие как пероральные кортикостероиды, антикоагулянты, например, варфарин, селективные ингибиторы обратного захвата серотонина или антитромботические препараты, такие как ацетилсалициловая кислота.
При развитии желудочно-кишечного кровотечения или язвы применение препарата Вимово™ необходимо прекратить.
Следует с осторожностью назначать НПВП пациентам с заболеванием ЖКТ в анамнезе (язвенный колит, болезнь Крона) в связи с возможным обострением этого заболевания.
Эзомепразол. При развитии любого настораживающего симптома (например, значительная, непреднамеренная потеря веса, рецидивирующая рвота, дисфагия, кровавая рвота или мелена) и наличии предположения или уверенности в развитии язвы желудка, необходимо исключить злокачественное новообразование, т.к. эзомепразол магния может облегчать симптомы и отсрочивать постановку диагноза. Терапия ингибиторами протонного насоса может незначительно повышать риск инфицирования ЖКТ такими микроорганизмами как Salmonella и Campylobacter.
Влияние на сердечно-сосудистую систему и мозговое кровообращение
Напроксен. Как и при применении любого НПВП необходимо вести наблюдение за пациентами с артериальной гипертензией и/или хронической сердечной недостаточностью в анамнезе, т.к. терапия НПВП сопровождается задержкой жидкости и развитием отеков.
Пациентам с неконтролируемой артериальной гипертензией, хронической сердечной недостаточностью, ИБС, заболеванием периферических артерий и/или нарушением мозгового кровообращения следует назначать напроксен только после тщательного обследования. Такое же обследование следует выполнить перед началом длительной терапии пациентов с факторами риска развития сердечно-сосудистых заболеваний (например, артериальная гипертензия, гиперлипидемия, сахарный диабет, курение).
По результатам клинических и эпидемиологических исследований терапия напроксеном (1000 мг/сут) может сопровождаться более низким риском развития тромбоза артерий, чем селективные ингибиторы ЦОГ-2, но невозможно исключить этот небольшой риск. В целом, данные не подтверждают кардиопротективного эффекта.
Влияние на почки
Напроксен. Длительное применение НПВП приводило к развитию медуллярного некроза почки и другим поражениям почек. Токсичность на почки также наблюдалась у пациентов, у которых почечные простагландины играли компенсаторную роль в поддержании почечной перфузии. У этих пациентов применение НПВП может привести к дозозависимому уменьшению синтеза простагландинов, и во вторую очередь — к снижению почечного кровотока, что может ускорить развитие почечной недостаточности с клиническими проявлениями. Наибольший риск развития такой реакции присутствует у пациентов с нарушенной функцией почек, гиповолемией, сердечной недостаточностью, печеночной недостаточностью, с избыточным выведением натрия хлорида из организма, у пациентов, получающих диуретики и ингибиторы АПФ, и у пациентов пожилого возраста. После отмены терапии НПВП состояние пациентов обычно восстанавливается до уровня до начала лечения.
Применение у пациентов с почечной недостаточностью
Т.к. напроксен в большей степени (95%) выводится почечной экскрецией путем клубочковой фильтрации, с большой осторожностью следует назначать его пациентам с почечной недостаточностью, и рекомендуется контролировать сывороточный уровень креатинина и/или КК у этих пациентов. Не рекомендуется назначать Вимово™ пациентам с исходным КК менее 30 мл/мин. Гемодиализ не снижает плазменную концентрацию напроксена из-за высокого связывания с белками плазмы. Определенным пациентам, особенно с нарушенным почечным кровотоком в результате уменьшения объема межклеточной жидкости, цирроза печени, ограниченного потребления соли, хронической сердечной недостаточности и ранее существовавшего заболевания почек, необходимо оценивать функцию почек до и во время приема Вимово™. Некоторые пациенты пожилого возраста с предполагаемым нарушением функции почек, а также пациенты, получающие диуретики, могут также попасть в эту категорию. Чтобы предотвратить возможную чрезмерную кумуляцию метаболитов напроксена у этих пациентов, следует уменьшить суточную дозу препарата.
Влияние на систему кроветворения
Напроксен. Необходимо с осторожностью назначать препараты, содержащие в своем составе напроксен, пациентам с нарушениями коагуляции или получающим терапию, влияющую на гемостаз. Риск развития кровотечения у таких пациентов с высоким риском кровотечения или получающих полную антикоагулянтную терапию (например, производные дикумарола), возрастает при сопутствующем применении препаратов, содержащих в своем составе напроксен. Напроксен уменьшает агрегацию тромбоцитов и удлиняет время кровотечения. Это следует учитывать при определении времени кровотечения.
При развитии активного или клинически значимого кровотечения в любой области у пациентов, принимающих Вимово™, терапию необходимо прекратить.
Дерматологические эффекты
Напроксен. Очень редко при применении НПВП развивались серьезные кожные реакции, некоторые из которых привели к смерти больных, в т.ч. эксфолиативный дерматит, синдром Стивенса-Джонсона и токсический эпидермальный некролиз. Наибольший риск развития таких реакций существует в начале терапии, и в большинстве случаев начало развития таких реакций происходит в первый месяц лечения. При первых признаках кожной сыпи, поражений слизистых оболочек или других симптомах гиперчувствительности необходимо прекратить прием Вимово™.
Влияние на зрительную функцию
При появлении зрительных нарушений при приеме препарата Вимово™ рекомендуется консультация офтальмолога.
Анафилактические (анафилактоидные) реакции
Напроксен. Реакции гиперчувствительности могут развиться у предрасположенных к ним пациентам. Анафилактические (анафилактоидные) реакции могут развиться у пациентов с гиперчувствительностью в анамнезе или без нее, или при наличии или без гиперчувствительности к ацетилсалициловой кислоте, другим НПВП или препаратам, содержащим напроксен. Эти реакции могут развиться у пациентов с ангионевротическим отеком, бронхоспазмом (например, бронхиальная астма), ринитом и полипозной риносинусопатией в анамнезе.
Пациенты с бронхиальной астмой
Напроксен. Применение ацетилсалициловой кислоты у пациентов с аспириновой астмой сопровождалось развитием тяжелого бронхоспазма, который может привести к смерти больного. Т.к. у пациентов с гиперчувствительностью к ацетилсалициловой кислоте отмечена перекрестная реактивность, включая бронхоспазм, между ацетилсалициловой кислотой и другими НПВП, не рекомендуется назначать Вимово™ пациентам с такой гиперчувствительностью к ацетилсалициловой кислоте и с осторожностью назначать пациентам с бронхиальной астмой.
Воспаление
Напроксен. Жаропонижающие и противовоспалительные свойства напроксена могут уменьшать лихорадку и другие признаки воспаления, тем самым снижая их значимость в качестве диагностических симптомов.
Комбинации с другими лекарственными препаратами
Напроксен. Не рекомендуется применять напроксен одновременно с НПВП (кроме ацетилсалициловой кислоты), включая селективные ингибиторы ЦОГ-2, в связи с кумулятивным риском развития серьезных нежелательных явлений, связанных с НПВП.
Общие указания
Если не приемлема суточная доза напроксена 1000 мг, то следует использовать альтернативные режимы терапии.
За больными, получающими длительную терапию (особенно более 1 года), необходимо вести постоянное наблюдение.
Влияние на способность к управлению транспортными средствами и механизмами
В связи с тем, что во время терапии препаратом Вимово™ могут наблюдаться головокружение, нарушение зрения и сонливость, следует соблюдать осторожность при управлении автотранспортом и другими механизмами.
Передозировка
Данные о передозировке Вимово™ отсутствуют. Любые эффекты передозировки Вимово™ будут, в основном, отражать эффекты передозировки напроксеном.
Симптомы
Напроксен. При клинически значимой передозировке напроксена возможны летаргия, головокружение, сонливость, боли в эпигастрии, дискомфорт в животе, изжога, нарушение пищеварения, тошнота, транзиторные изменения функции печени, гипопротромбинемия, нарушения функции почек, метаболический ацидоз, апноэ, дезориентация или рвота, желудочно-кишечное кровотечение. В более редких случаях — повышение АД, острая почечная недостаточность, дыхательная недостаточность и кома. У некоторых больных наблюдались судороги, но связь с приемом препарата достоверно не установлена. Также неизвестно, какая доза препарата будет угрожать жизни больного.
Эзомепразол. Симптомы преднамеренной передозировки эзомепразолом (ограниченный опыт применения доз выше 240 мг/сут) временные. Пероральный прием эзомепразола в дозе 280 мг сопровождался общей слабостью и симптомами со стороны ЖКТ. При однократном приеме эзомепразола в дозе 80 мг не наблюдалось развития передозировки.
Лечение
Напроксен. После передозировки НПВП следует проводить симптоматическую и поддерживающую терапию, особенно при развитии желудочно-кишечных эффектов и поражения почек. Специфические антидоты отсутствуют. Гемодиализ не снижает концентрацию напроксена в плазме из-за высокой степени его связывания с белками плазмы. Стимулирование рвоты и/или прием активированного угля (60-100 г взрослым пациентам, 1-2 г/кг детям) и/или применение осмотического слабительного средства можно назначить пациентам через 4 ч после приема препарата при наличии симптомов или после значительной передозировки. Форсированный диурез, подщелачивание мочи или гемоперфузия не эффективны из-за высокого связывания препарата с белками плазмы.
Эзомепразол. Специфический антидот неизвестен. Эзомепразол в высокой степени связывается с белками плазмы, поэтому он не выводится при гемодиализе. При передозировке эзомепразолом следует проводить симптоматическую и поддерживающую терапию.
Лекарственное взаимодействие
Нерекомендуемые комбинации
Антиретровирусные препараты. Показано, что омепразол, и его рацемат — эзомепразол, взаимодействуют с некоторыми антиретровирусными препаратами. Клиническая значимость и механизмы этого взаимодействия до конца не ясны. Повышение рН желудка во время приема омепразола может изменить абсорбцию антиретровирусного препарата. Другие возможные механизмы взаимодействия опосредованы изоферментом CYP2C19. При применении некоторых антиретровирусных препаратов, таких как атазанавир и нелфинавир, одновременно с омепразолом понижались концентрации этих препаратов в сыворотке крови. В связи с этим не рекомендуется принимать омепразол одновременно с такими препаратами, как атазанавир и нелфинавир. При применении омепразола одновременно с другими антиретровирусными препаратами, такими как саквинавир, отмечено повышение концентрации последнего в сыворотке крови. Концентрации некоторых других антиретровирусных препаратов в сыворотке не изменялись при сопутствующем применении с омепразолом. В связи со сходством фармакодинамических и фармакокинетических свойств омепразола и эзомепразола, противопоказано назначение эзомепразола одновременно с антиретровирусными препаратами, такими как атазанавир и нелфинавир.
Применять с осторожностью
Ацетилсалициловая кислота. Вимово™ можно принимать одновременно с ацетилсалициловой кислотой в низкой дозе (≤325 мг/сут). В ходе клинических исследований у пациентов, принимавших Вимово™ в комбинации с ацетилсалициловой кислотой в низкой дозе, не повышалась частота развития язв желудка по сравнению с пациентами, получавшими только Вимово™. Однако сопутствующее применение ацетилсалициловой кислоты и Вимово™ может повышать риск развития серьезных побочных эффектов.
При одновременном применении напроксена с ацетилсалициловой кислотой в высоких дозах понижается его связывание с белками плазмы, но без влияния на клиренс свободного напроксена. Клиническая значимость этого взаимодействия неизвестна.
Диуретики. Клинические исследования, а также постмаркетинговое наблюдение показали, что у некоторых пациентов НПВП способны уменьшать натрийуретический эффект фуросемида и тиазидных диуретиков. Это связано с подавлением синтеза простагландинов в почках. При применении диуретиков с НПВП следует тщательно наблюдать за признаками почечной недостаточности, а также контролировать эффективность терапии диуретиками.
Селективные ингибиторы обратного захвата серотонина. По данным эпидемиологических исследований существует связь между применением психотропных препаратов, влияющих на обратный захват серотонина, и развитием кровотечения из верхних отделов ЖКТ. Поэтому следует с осторожностью назначать НПВП, включая селективные ингибиторы ЦОГ-2, одновременно с селективными ингибиторами обратного захвата серотонина.
Кортикостероиды. При одновременном применении кортикостероидов с НПВП, включая селективные ингибиторы ЦОГ-2, повышается риск развития желудочно-кишечного кровотечения. Следует с осторожностью назначать НПВП одновременно с кортикостероидами.
Ингибиторы АПФ. НПВП способны уменьшать антигипертензивный эффект ингибиторов АПФ. Это взаимодействие следует учитывать при назначении НПВП одновременно с ингибиторами АПФ.
Препараты лития. НПВП повышают концентрацию лития в плазме крови и снижают почечный клиренс лития. Средняя Cmin лития повышается на 15%, а почечный клиренс понижается на 20%. Эти эффекты были обусловлены ингибированием синтеза простагландинов в почках под влиянием НПВП. Поэтому при одновременном применении НПВП и препаратов лития следует внимательно следить за признаками токсичности лития.
Метотрексат. НПВП конкурентно ингибируют кумуляцию метотрексата и понижают секрецию метотрексата в почечных канальцах на модели животных. Это может указывать на возможное усиление токсичности метотрексата при одновременном применении с НПВП. В связи с этим следует соблюдать осторожность при совместном применении НПВП и метотрексата.
Производные сульфонилмочевины, гидантоина. Напроксен в высокой степени связывается с альбумином плазмы крови, поэтому теоретически возможно взаимодействие с другими препаратами, связывающими альбумин, такими как производные сульфонилмочевины и гидантоина. Пациентам, получающим одновременно напроксен и производные гидантоина, сульфонамид или производные сульфонилмочевины, при необходимости следует корректировать дозу препарата.
Варфарин. НПВП могут усиливать эффект пероральных антикоагулянтов (например, варфарина и аценокумарола) и гепарина. При одновременном применении эзомепразола в дозе 40 мг с варфарином, несмотря на незначительное увеличение Cmin в плазме менее сильного R-изомера варфарина, время коагуляции оставалось в пределах допустимой нормы. Однако в ходе постмаркетингового наблюдения выявлены случаи клинически значимого повышения MHO при сопутствующем применении с варфарином. Поэтому рекомендуется вести тщательное наблюдение во время начала и завершения терапии варфарином или другими кумариновыми производными.
Бета-адреноблокаторы. Напроксен и другие НПВП способны уменьшать антигипертензивный эффект пропранолола и других бета-адреноблокаторов.
Циклоспорин/такролимус. Из-за повышенного риска нефротоксичности следует соблюдать осторожность при одновременном приеме циклоспорина или такролимуса с любыми НПВП.
Пробенецид. Сопутствующая терапия пробенецидом повышает плазменную концентрацию аниона напроксена и существенно удлиняет T1/2 из плазмы.
Препараты, абсорбция которых зависит от pH желудка. Уменьшение кислотности желудочного сока при применении эзомепразола может повышать или понижать абсорбцию препаратов, если механизм всасывания этих препаратов зависит от кислотности желудочного сока. Также как и при применении других препаратов, подавляющих секрецию соляной кислоты, или антацидных средств, лечение эзомепразолом может привести к снижению всасывания кетоконазола или итраконазола, а также к повышению всасывания дигоксина. Совместный прием омепразола в дозе 20 мг 1 раз/сут и дигоксина повышает биодоступность дигоксина на 10% (биодоступность дигоксина повышалась на величину до 30% у 20% пациентов).
Лекарственное взаимодействие с другими препаратами
Исследования совместного применения эзомепразола и напроксена (неселективный НПВП) или рофекоксиба (селективный ингибитор ЦОГ-2) не выявили клинически значимого взаимодействия.
Как и при приеме других НПВП, сопутствующее применение колестирамина может тормозить абсорбцию напроксена.
Эзомепразол подавляет CYP2C19, основной изофермент, участвующий в метаболизме эзомепразола. Эзомепразол также метаболизируется под действием фермента CYP3A4. Имеются следующие данные, касающиеся CYP2C19-, CYP3A4-опосредованного взаимодействия:
- совместное применение эзомепразола в дозе 30 мг понижает на 45% клиренс диазепама, субстрата CYP2C19 (маловероятно, что это взаимодействие имеет клиническую значимость).
- совместное применение эзомепразола в дозе 40 мг на 13% повышает Cmin фенитоина в плазме крови у пациентов с эпилепсией.
- cовместное применение эзомепразола и комбинированного ингибитора CYP2C19 и CYP3A4, такого как вориконазол, может почти в 2 раза увеличить концентрацию эзомепразола;
- совместное применение эзомепразол и ингибитора CYP3A4, кларитромицина (500 мг 2 раза/сут), в 2 раза увеличивает AUC эзомепразола.
Не требуется изменять дозу эзомепразола в этих случаях.
Лекарственные препараты, индуцирующие изоферменты CYP2C19 и CYP3A4, такие как рифампицин и препараты зверобоя продырявленного, при совместном применении с эзомепразолом могут приводить к снижению концентрации эзомепразола в плазме крови за счет ускорения метаболизма эзомепразола.
Влияние на лабораторные показатели
Напроксен может уменьшать агрегацию тромбоцитов и удлинять время кровотечения. Об этом следует помнить при определении времени кровотечения.
Напроксен может повышать уровни 17-кетостероидов в моче при их определении в результате взаимодействия препарата и/или его метаболитов с м-динитробензолом, используемом в этом анализе. Хотя измерения 17-гидроксикортикостероидов (тест Porter-Silber) не были изменены, терапию напроксеном временно на 72 ч приостановили до выполнения анализов по оценке функции надпочечников, если использовался тест Porter-Silber.
Напроксен может вступать во взаимодействия с некоторыми веществами, используемыми при анализе мочи на 5-гидроксииндолуксусную кислоту.
Условия хранения препарата Вимово™
Препарат следует хранить в недоступном для детей месте, в оригинальной упаковке, в плотно закрытом флаконе для защиты от влаги, при температуре не выше 30°С.
Срок годности препарата Вимово™
Условия реализации
Препарат отпускается по рецепту.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код