Описание препарата Янувия® (таблетки, покрытые пленочной оболочкой, 100 мг) основано на официальной инструкции, утверждено компанией-производителем в 2019 году
Дата согласования: 30.12.2019
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
- Отзывы
Фотографии упаковок

30.12.2019
Действующее вещество
ATX
Фармакологическая группа
Состав
| Таблетки, покрытые пленочной оболочкой | 1 табл. |
| активное вещество: | |
| ситаглиптина фосфата моногидрат | 32,13 мг |
| (эквивалентно 25 мг ситаглиптина) | |
| вспомогательные вещества: МКЦ — 30,94 мг; кальция гидрофосфат неизмельченный — 30,94 мг; кроскармеллоза натрия — 2 мг; магния стеарат — 1 мг; натрия стеарилфумарат — 3 мг | |
| оболочка таблетки: Опадрай® II розовый 85F97191 (поливиниловый спирт — 40%, титана диоксид (Е171) — 24,142%, макрогол 3350 (ПЭГ) — 20,2%, тальк — 14,87%, краситель железа оксид желтый (Е172) — 0,579%, краситель железа оксид красный (Е172) — 0,209%) — 4 мг |
| Таблетки, покрытые пленочной оболочкой | 1 табл. |
| активное вещество: | |
| ситаглиптина фосфата моногидрат | 64,25 мг |
| (эквивалентно 50 мг ситаглиптина) | |
| вспомогательные вещества: МКЦ — 61,88 мг; кальция гидрофосфат неизмельченный — 61,88 мг; кроскармеллоза натрия — 4 мг; магния стеарат — 2 мг; натрия стеарилфумарат — 6 мг | |
| оболочка таблетки: Oпадрай® II светло-бежевый 85F17498 (поливиниловый спирт — 40%, титана диоксид (Е171) — 24,142%, макрогол 3350 (ПЭГ) — 20,2%, тальк — 14,8%, краситель железа оксид желтый (Е172) — 0,765%, краситель железа оксид красный (Е172) — 0,093%) — 8 мг |
| Таблетки, покрытые пленочной оболочкой | 1 табл. |
| активное вещество: | |
| ситаглиптина фосфата моногидрат | 128,5 мг |
| (эквивалентно 100 мг ситаглиптина) | |
| вспомогательные вещества: МКЦ — 123,8 мг; кальция гидрофосфат неизмельченный — 123,8 мг; кроскармеллоза натрия — 8 мг; магния стеарат — 4 мг; натрия стеарилфумарат — 12 мг | |
| оболочка таблетки: Опадрай® II бежевый 85F17438 (поливиниловый спирт — 40%, титана диоксид (Е171) — 21,56%, макрогол 3350 (ПЭГ) — 20,2%, тальк — 14,8%, краситель железа оксид желтый (Е172) — 3,07%, краситель железа оксид красный (Е172) — 0,37%) — 16 мг |
Описание лекарственной формы
Таблетки, 25 мг: круглые, двояковыпуклые, светло-розового цвета со слабым бежеватым оттенком, покрытые пленочной оболочкой, с гравировкой «221» на одной стороне и гладкие на другой.
Таблетки, 50 мг: круглые, двояковыпуклые, светло-бежевого цвета, покрытые пленочной оболочкой, с гравировкой «112» на одной стороне и гладкие на другой.
Таблетки, 100 мг: круглые, двояковыпуклые, бежевого цвета, покрытые пленочной оболочкой, с гравировкой «277» на одной стороне и гладкие на другой.
Фармакологическое действие
Фармакологическое действие
—
гипогликемическое.
Фармакодинамика
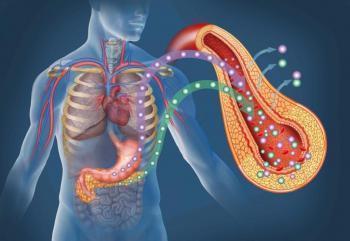
Препарат Янувия® (ситаглиптин) является активным при пероральном приеме, высокоселективным ингибитором фермента ДПП-4, предназначенным для лечения сахарного диабета типа 2. Ситаглиптин отличается по химической структуре и фармакологическому действию от аналогов ГПП-1, инсулина, производных сульфонилмочевины, бигуанидов, агонистов гамма-рецепторов, активируемых пролифератором пероксисом (PPAR-γ), ингибиторов альфа-глюкозидазы, аналогов амилина. Ингибируя ДПП-4, ситаглиптин повышает концентрацию двух гормонов семейства инкретинов: ГПП-1 и ГИП. Гормоны семейства инкретинов секретируются в кишечнике в течение суток, их концентрация повышается в ответ на прием пищи. Инкретины являются частью внутренней физиологической системы регуляции гомеостаза глюкозы. При нормальной или повышенной концентрации глюкозы в крови гормоны семейства инкретинов способствуют увеличению синтеза инсулина, а также его секреции бета-клетками поджелудочной железы за счет сигнальных внутриклеточных механизмов, ассоциированных с цАМФ.
ГПП-1 также способствует подавлению повышенной секреции глюкагона альфа-клетками поджелудочной железы. Снижение концентрации глюкагона на фоне повышения концентрации инсулина способствует уменьшению продукции глюкозы печенью, что в итоге приводит к уменьшению гликемии. Этот механизм действия отличается от механизма действия производных сульфонилмочевины, которые стимулируют высвобождение инсулина и при низкой концентрации глюкозы в крови, что чревато развитием сульфониндуцированной гипогликемии не только у больных сахарным диабетом типа 2, но и у здоровых лиц.
При низкой концентрации глюкозы в крови перечисленные эффекты инкретинов на выброс инсулина и уменьшение секреции глюкагона не наблюдаются. ГПП-1 и ГИП не влияют на выброс глюкагона в ответ на гипогликемию. В физиологических условиях активность инкретинов ограничивается ферментом ДПП-4, который быстро гидролизует инкретины с образованием неактивных продуктов.
Ситаглиптин предотвращает гидролиз инкретинов ферментом ДПП-4, тем самым увеличивая плазменные концентрации активных форм ГПП-1 и ГИП. Повышая концентрацию инкретинов, ситаглиптин увеличивает глюкозозависимый выброс инсулина и способствует уменьшению секреции глюкагона. У пациентов с сахарным диабетом типа 2 с гипергликемией эти изменения секреции инсулина и глюкагона приводят к снижению концентрации HbA1c и уменьшению плазменной концентрации глюкозы, определяемой натощак и после нагрузочной пробы.
У пациентов с сахарным диабетом типа 2 прием одной дозы препарата Янувия® приводит к ингибированию активности фермента ДПП-4 в течение 24 ч, что приводит к увеличению концентрации циркулирующих инкретинов ГПП-1 и ГИП в 2–3 раза, нарастанию плазменной концентрации инсулина и С-пептида, снижению концентрации глюкагона в плазме крови, уменьшению гликемии натощак, а также после нагрузки глюкозой или пищевой нагрузки.
Влияние на АД. В рандомизированном плацебо-контролируемом перекрестном исследовании с участием пациентов с артериальной гипертензией сочетанный прием гипотензивных препаратов (одного или более из списка: ингибиторы АПФ, АРА II, БКК, бета-адреноблокаторы, диуретики) с препаратом Янувия® в целом хорошо переносился пациентами. У этой категории пациентов препарат Янувия® продемонстрировал незначительное гипотензивное действие: в суточной дозе 100 мг ситаглиптин снижал среднесуточное амбулаторное значение сАД на 2 мм рт.ст. по сравнению с группой плацебо. У пациентов с нормальным АД не наблюдали гипотензивного эффекта.
Влияние на электрофизиологию сердца. В рандомизированном плацебо-контролируемом перекрестном исследовании у здоровых добровольцев препарат Янувия® принимался однократно в дозе 100 или 800 мг (8-кратное превышение рекомендуемой дозы), либо плацебо. После приема рекомендуемой терапевтической дозы 100 мг какого-либо влияния препарата на продолжительность интервала QT как в момент его плазменной Cmax, так и в других точках проверки на протяжении всего исследования не наблюдали. После приема 800 мг максимальное увеличение скорректированного по плацебо среднего изменения длительности интервала QT по сравнению с исходным значением через 3 ч после приема препарата составило 8 мс. Подобное незначительное увеличение было оценено как клинически незначимое. После приема дозы 800 мг значение плазменной Cmax ситаглиптина примерно в 11 раз превышало соответствующее значение после приема терапевтической дозы 100 мг.
Исследование по оценке сердечно-сосудистой безопасности ситаглиптина (TECOS). В исследовании TECOS пациенты принимали препарат Янувия® 100 мг в день (или 50 мг в день, если исходный показатель расчетной СКФ (рСКФ) был ≥30 и <50 мл/мин/1,73 м2) или плацебо, которые добавлялись к стандартной терапии согласно существующим национальным стандартам по определению целевых уровней HbA1c и контролю сердечно-сосудистых факторов риска. По завершении среднего периода наблюдения, составившего 3 года, у пациентов с сахарным диабетом типа 2 прием препарата Янувия® в дополнение к стандартному лечению не увеличил риск серьезных нежелательных явлений со стороны ССС (соотношение рисков — 0,98; 95% ДИ: 0,89–1,08; р<0,001 для доказательства отсутствия превосходства) или риск госпитализации по причине сердечной недостаточности (соотношение рисков — 1; 95% ДИ: 0,83–1,2; р=0,98 для различия частоты рисков), по сравнению со стандартным лечением без дополнительного приема препарата Янувия®.
Фармакокинетика
Фармакокинетика ситаглиптина всесторонне описана у здоровых лиц и пациентов с сахарным диабетом типа 2. У здоровых лиц после перорального приема 100 мг ситаглиптина отмечается быстрая абсорбция препарата с достижением Cmax в интервале от 1 до 4 ч с момента приема. AUC увеличивается пропорционально дозе и составляет у здоровых субъектов 8,52 мкмоль/л·ч при приеме 100 мг внутрь, Cmax составляла 950 нмоль/л. Плазменная AUC ситаглиптина увеличивалась приблизительно на 14% после следующего приема дозы 100 мг препарата по достижению равновесного состояния после приема первой дозы. Внутри- и межсубъектные коэффициенты вариации AUC ситаглиптина были незначительными.
Абсорбция. Абсолютная биодоступность ситаглиптина составляет приблизительно 87%. Поскольку совместный прием препарата Янувия® и жирной пищи не оказывает эффекта на фармакокинетику, то препарат Янувия® может назначаться вне зависимости от приема пищи.
Распределение. Средний Vss после однократной дозы 100 мг ситаглиптина у здоровых добровольцев составляет приблизительно 198 л. Фракция ситаглиптина, связывающаяся с плазменными белками, относительно низка и составляет 38%.
Метаболизм. Приблизительно 79% ситаглиптина выводится в неизмененном виде почками. Метаболизируется лишь незначительная часть поступившего в организм препарата. После введения 14С-меченного ситаглиптина внутрь приблизительно 16% радиоактивного ситаглиптина выводилось в виде его метаболитов. Были обнаружены следы 6 метаболитов ситаглиптина, вероятно, не обладающие ДПП-4-ингибирующей активностью. В исследованиях in vitro было выявлено, что первичными изоферментами, участвующими в ограниченном метаболизме ситаглиптина, являются CYP3A4 и CYP2C8.
Выведение. После введения 14С-меченного ситаглиптина внутрь здоровым добровольцам приблизительно 100% введенного ситаглиптина выводилось следующим образом: 13% через кишечник, 87% почками — в течение одной недели после приема препарата. Средний T1/2 ситаглиптина при пероральном приеме 100 мг составляет приблизительно 12,4 ч; почечный клиренс — приблизительно 350 мл/мин.
Выведение ситаглиптина осуществляется первично путем экскреции почками по механизму активной канальцевой секреции. Ситаглиптин является субстратом для транспортера органических анионов человека третьего типа (hOAT-3), который и может быть вовлечен в процесс выведения ситаглиптина почками. Клинически вовлеченность hOAT-3 в транспорт ситаглиптина не изучалась. Ситаглиптин также является субстратом P-gp, который может участвовать в процессе выведения ситаглиптина почками. Однако циклоспорин, являющийся ингибитором P-gp, не уменьшал почечный клиренс ситаглиптина.
Отдельные группы пациентов
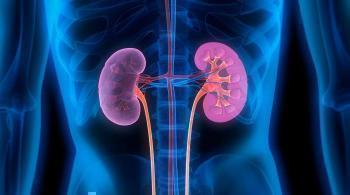
Нарушение функции почек. Открытое исследование препарата Янувия® в дозе 50 мг/сут было проведено с целью изучения его фармакокинетики у пациентов с различной степенью тяжести хронического нарушения функции почек в сравнении с контрольной группой здоровых добровольцев. В исследование были включены пациенты с нарушениями функции почек легкой, средней и тяжелой степени, а также пациенты с терминальной стадией ХБП, нуждающиеся в диализе. Кроме того, влияние нарушения функции почек на фармакокинетику ситаглиптина у пациентов с сахарным диабетом типа 2 и нарушением функции почек легкой, средней или тяжелой степени (включая пациентов с терминальной стадией ХБП) оценивали с использованием популяционных фармакокинетических анализов.
Увеличение плазменной AUC ситаглиптина приблизительно в 1,2 и 1,6 раза по сравнению с контрольной группой отмечалось у пациентов с нарушением функции почек легкой (рСКФ от ≥60 до <90 мл/мин/1,73 м2) и средней (рСКФ от ≥45 до <60 мл/мин/1,73 м2) степени тяжести соответственно. Поскольку увеличение этой величины не является клинически значимым, корректировка дозы у этих пациентов не требуется. Приблизительно двукратное увеличение плазменной AUC ситаглиптина отмечалось у пациентов с нарушением функции почек средней степени тяжести (рСКФ от ≥30 до <60 мл/мин/1,73 м2) и приблизительно четырехкратное — у пациентов с нарушением функции почек тяжелой степени (рСКФ <30 мл/мин/1,73 м2), включая пациентов с терминальной стадией ХБП, нуждающихся в диализе. Ситаглиптин в незначительном количестве удалялся во время процедуры гемодиализа: только 13,5% от введенной дозы было выведено из организма в течение 3–4-часового сеанса диализа, начатого через 4 ч после введения препарата. Таким образом, для достижения терапевтической концентрации ситаглиптина в плазме крови (сходной с таковой у пациентов с нормальной функцией почек) у пациентов с рСКФ <45 мл/мин/1,73 м2 рекомендованы более низкие дозы (см. «Способ применения и дозы»).
Нарушение функции печени. У пациентов с нарушением функции печени средней степени тяжести (7–9 баллов по шкале Чайлд-Пью) средняя AUC и Cmax ситаглиптина при однократном приеме 100 мг увеличиваются приблизительно на 21 и 13% соответственно, в сравнении с контрольной группой здоровых добровольцев. Таким образом, коррекции дозы препарата при нарушениях функции печени легкой и средней степени тяжести не требуется.
Нет клинических данных о применении ситаглиптина у пациентов с нарушением функции печени тяжелой степени (>9 баллов по шкале Чайлд-Пью). Однако вследствие того, что ситаглиптин первично выводится почками, не следует ожидать значимого изменения фармакокинетики ситаглиптина у пациентов с нарушением функции печени тяжелой степени.
Пожилые пациенты. Возраст пациентов не оказывал клинически значимого воздействия на фармакокинетические параметры ситаглиптина. По сравнению с молодыми пациентами, у пожилых пациентов (65–80 лет) концентрация ситаглиптина приблизительно на 19% выше. Коррекции дозы препарата в зависимости от возраста не требуется.
Показания
Монотерапия
Препарат Янувия® показан как дополнение к диете и физическим нагрузкам для улучшения гликемического контроля у пациентов с сахарным диабетом типа 2.
Комбинированная терапия
Комбирирование с метформином. Препарат Янувия® в комбинации с метформином у пациентов с сахарным диабетом типа 2 для улучшения гликемического контроля в качестве стартовой терапии или когда диета и физическая нагрузка в сочетании с монотерапией одним из перечисленных препаратов не приводят к адекватному гликемическому контролю.
Комбинирование с производными сульфонилмочевины. Препарат Янувия® в комбинации с производными сульфонилмочевины у пациентов с сахарным диабетом типа 2 для улучшения гликемического контроля, когда диета и физическая нагрузка в сочетании с монотерапией одним из перечисленных препаратов не приводят к адекватному гликемическому контролю.
Комбинирование с агонистами PPAR-γ. Препарат Янувия® в комбинации с агонистами PPAR-γ (тиазолидиндионы) у пациентов с сахарным диабетом типа 2 для улучшения гликемического контроля, когда диета и физическая нагрузка в сочетании с монотерапией одним из перечисленных препаратов не приводят к адекватному гликемическому контролю;
Комбинирование с метформином и производными сульфонилмочевины. Препарат Янувия® в комбинации с метформином и производными сульфонилмочевины у пациентов с сахарным диабетом типа 2 для улучшения гликемического контроля, когда диета и физическая нагрузка в сочетании с терапией двумя из перечисленных препаратов не приводят к адекватному гликемическому контролю;
Комбинирование с метформином и агонистами PPAR-γ. Препарат Янувия® в комбинации с метформином и агонистами PPAR-γ (тиазолидиндионы) у пациентов с сахарным диабетом типа 2 для улучшения гликемического контроля, когда диета и физическая нагрузка в сочетании с терапией двумя из перечисленных препаратов не приводят к адекватному гликемическому контролю;
Комбинирование с инсулином. Препарат Янувия® в качестве дополнения к инсулину (с или без метформина) у пациентов с сахарным диабетом типа 2 в тех случаях, когда диета, физические нагрузки и стабильная доза инсулина не приводят к адекватному гликемическому контролю.
Противопоказания
повышенная чувствительность к какому-либо из компонентов препарата;
сахарный диабет типа 1;
диабетический кетоацидоз;
беременность;
период грудного вскармливания;
детский возраст до 18 лет.
С осторожностью: нарушение функции почек (основной путь выведения ситаглиптина из организма — почечная экскреция. Для достижения таких же плазменных концентраций, что и у пациентов с нормальной функцией почек, пациентам с рСКФ <45 мл/мин/1,73 м2, а также пациентам с терминальной стадией хронической болезни почек, требующей гемодиализа или перитонеального диализа, следует проводить коррекцию (снижение) дозы препарата Янувия® (см. «Способ применения и дозы», Нарушение функции почек); панкреатит (см. «Особые указания», Панкреатит).
Применение при беременности и кормлении грудью
Не проводилось контролируемых исследований препарата Янувия® у беременных женщин, следовательно, нет данных о безопасности его применения у беременных. Препарат Янувия®, как и другие пероральные гипогликемические препараты, не рекомендован к применению во время беременности.
Отсутствуют данные о проникновении ситаглиптина в грудное молоко. Следовательно, препарат Янувия® не должен назначаться в период грудного вскармливания.
Способ применения и дозы
Принимают внутрь. Рекомендуемая доза препарата Янувия® составляет 100 мг 1 раз в сутки в качестве монотерапии или в комбинации с метформином, или производными сульфонилмочевины, или агонистами PPAR-γ (тиазолидиндионы), или инсулином (с или без метформина), или в комбинации с метформином и производным сульфонилмочевины, или метформином и агонистами PPAR-γ.
Препарат Янувия® может приниматься независимо от приема пищи. Режим дозирования метформина, производных сульфонилмочевины и агонистов PPAR-γ должен подбираться исходя из рекомендованных доз для этих ЛС.
При комбинировании препарата Янувия® с производными сульфонилмочевины или инсулином традиционно рекомендуемую дозу производного сульфонилмочевины или инсулина целесообразно уменьшить для снижения риска развития сульфон-индуцированной или инсулин-индуцированной гипогликемии (см. «Особые указания», Гипогликемия).
В случае если пациент пропустил прием препарата Янувия®, препарат должен быть принят как можно быстрее после того, как пациент вспомнит о пропущенном приеме препарата.
Недопустим прием двойной дозы препарата Янувия® в один и тот же день.
Особые группы пациентов
Нарушение функции почек. Ввиду необходимости коррекции дозы пациентам с нарушением функции почек рекомендуется проводить оценку функции почек до начала лечения препаратом Янувия® и периодически в процессе лечения.
Пациентам с нарушением функции почек легкой степени тяжести (рСКФ от ≥60 до <90 мл/мин/1,73 м2) коррекции дозы препарата Янувия® не требуется.
Пациентам с нарушением функции почек средней степени тяжести (рСКФ от ≥45 до <60 мл/мин/1,73 м2) коррекции дозы препарата Янувия® не требуется.
У пациентов с нарушением функции почек средней степени тяжести (рСКФ от ≥30 до <45 мл/мин/1,73 м2) доза препарата Янувия® составляет 50 мг 1 раз в сутки.
У пациентов с нарушением функции почек тяжелой степени (рСКФ от ≥15 до <30 мл/мин/1,73 м2) или терминальной стадией ХБП (рСКФ <15 мл/мин/1,73 м2), нуждающихся в гемодиализе или перитонеальном диализе, доза препарата Янувия® составляет 25 мг 1 раз в сутки. Препарат Янувия® может применяться вне зависимости от расписания процедуры диализа.
Нарушение функции печени. Не требуется коррекции дозы препарата Янувия® у пациентов с нарушением функции печени легкой и средней степени тяжести. Препарат не исследовался у пациентов с нарушением функции печени тяжелой степени тяжести.
Пожилые пациенты. Не требуется коррекции дозы препарата Янувия® у пожилых пациентов.
Побочные действия
Обзор профиля безопасности
Сообщалось о серьезных нежелательных явлениях, включавших панкреатит и реакции гиперчувствительности. Гипогликемию регистрировали при приеме препарата в сочетании с сульфонилмочевиной (4,7–13,8%) и инсулином (9,6%) (см. «Особые указания»).
Частота нежелательных явлений, выявленных в плацебо-контролируемых клинических исследованиях ситаглиптина в монотерапии и при пострегистрационном наблюдении.
Нежелательные явления перечислены ниже по системно-органным классам и частоте. Частоты определены как: очень часто (≥1/10); часто (≥1/100 — <1/10); нечасто (≥1/1000 — <1/100); редко (≥1/10000 — <1/1000); очень редко (<1/10000); частота не установлена (нельзя установить на основании доступных данных).
Со стороны крови и лимфатической системы: редко — тромбоцитопения.
Со стороны иммунной системы: частота не установлена — реакции гиперчувствительности, в т.ч. анафилаксия*, **.
Со стороны обмена веществ и питания: часто — гипогликемия**.
Со стороны нервной системы: часто — головная боль; нечасто — головокружение.
Со стороны дыхательной системы, органов грудной клетки и средостения: частота не установлена — интерстициальное заболевание легких*.
Со стороны ЖКТ: нечасто — запор; частота не установлена — рвота*, острый панкреатит*, **, ***, фатальный и нефатальный геморрагический и некротический панкреатит*, **.
Со стороны кожи и подкожных тканей: нечасто — зуд*; частота не установлена — ангионевротический отек*, **, сыпь*, **, крапивница*, **, кожный васкулит*, **, эксфолиативные заболевания кожи, включая синдром Стивенса-Джонсона*, **, буллезный пемфигоид*.
Со стороны скелетно-мышечной системы и соединительной ткани: частота не установлена — артралгия*, миалгия*, боль в спине*, артропатия*.
Со стороны почек и мочевыводящих путей: частота не установлена — нарушение функции почек*, острая почечная недостаточность*.
*Нежелательные явления были выявлены в ходе пострегистрационного наблюдения.
**См. раздел «Особые указания».
***См. Исследование TECOS.
Описание отдельных нежелательных явлений
Помимо связанных с препаратом нежелательных явлений, описанных выше, нежелательные явления регистрировали независимо от наличия связи с препаратом, если они развивались как минимум у 5% и более пациентов, получавших ситаглиптин, в т.ч. инфекции верхних дыхательных путей и назофарингит. Нежелательными явлениями, подлежавшими регистрации дополнительно, вне зависимости от наличия связи с препаратом, были реакции, которые чаще развивались у пациентов, получавших ситаглиптин (частота не достигала уровня 5%, но была более чем на 0,5% выше в группах ситаглиптина по сравнению с контрольной группой); они включали остеоартроз и боль в конечностях.
Некоторые нежелательные явления регистрировались чаще в исследованиях с комбинированным применением ситаглиптина и других сахароснижающих препаратов, нежели в исследованиях монотерапии ситаглиптином. Они включали гипогликемию (частота: очень часто в комбинации с производными сульфонилмочевины и метформином), грипп (часто на фоне приема инсулина (с метформином и без него), тошноту и рвоту (часто в комбинации с метформином), вздутие живота (часто при применении вместе с метформином или пиоглитазоном), запор (часто при применении в сочетании с производными сульфонилмочевины и метформином), периферические отеки (часто при применении в сочетании с пиоглитазоном или комбинацией пиоглитазона и метформина), сонливость и диарею (нечасто в комбинации с метформином) и сухость во рту (нечасто в комбинации с инсулином (с метформином и без него).
Исследование по оценке сердечно-сосудистой безопасности ситаглиптина TECOS
В исследование TECOS было включено 7332 пациента, которые принимали ситаглиптин 100 мг в день (или 50 мг в день, если исходный показатель рСКФ был ≥30 и <50 мл/мин/1,73 м2), и 7339 пациентов, принимавших плацебо, в общей популяции пациентов, которым было назначено лечение (intention-to-treat). Исследуемый препарат (ситаглиптин или плацебо) добавлялся к стандартной терапии согласно существующим национальным стандартам по выбору целевого уровня HbA1c и контролю сердечно-сосудистых факторов риска. Общая частота возникновения серьезных нежелательных явлений у пациентов, принимавших ситаглиптин, была такой же, как у пациентов, принимавших плацебо.
В популяции пациентов, которым было назначено лечение (intention-to-treat), среди тех, кто исходно получал инсулинотерапию и/или препараты сульфонилмочевины, частота возникновения эпизодов тяжелой гипогликемии составила 2,7% у пациентов, принимавших ситаглиптин, и 2,5% у пациентов, принимавших плацебо. Среди пациентов, исходно не получавших инсулин и/или препараты сульфонилмочевины, частота возникновения эпизодов тяжелой гипогликемии составила 1% у пациентов, принимавших ситаглиптин, и 0,7% у пациентов, принимавших плацебо. Частота возникновения подтвержденных экспертизой случаев панкреатита составила 0,3% у пациентов, принимавших ситаглиптин, и 0,2% у пациентов, принимавших плацебо.
Взаимодействие
В исследованиях по взаимодействию с другими ЛС ситаглиптин не оказывал клинически значимого эффекта на фармакокинетику следующих препаратов: метформина, росиглитазона, глибенкламида, симвастатина, варфарина, пероральных контрацептивов. Основываясь на этих данных, ситаглиптин не ингибирует изоферменты CYP3А4, CYP2С8 или CYP2С9. Основываясь на данных in vitro, ситаглиптин также не ингибирует изоферменты CYP2D6, CYP1А2, CYP2С19 и CYP2В6 и не индуцирует изофермент СYP3А4.
Многократный прием метформина в комбинации с ситаглиптином не оказывал существенного влияния на фармакокинетические параметры ситаглиптина у больных сахарным диабетом типа 2.
По данным популяционного фармакокинетического анализа больных сахарным диабетом типа 2, сопутствующая терапия не оказывала клинически значимого влияния на фармакокинетику ситаглиптина. В исследовании оценивали ряд препаратов, наиболее часто используемых больными сахарным диабетом типа 2, в т.ч. гиполипидемические препараты (статины, фибраты, эзетимиб), антиагреганты (клопидогрел), антигипертензивные препараты (ингибиторы АПФ, АРА II, бета-адреноблокаторы, БКК, гидрохлоротиазид), НПВП (напроксен, диклофенак, целекоксиб), антидепрессанты (бупропион, флуоксетин, сертралин), антигистаминные препараты (цетиризин), ингибиторы протонной помпы (омепразол, лансопразол) и препараты для лечения эректильной дисфункции (силденафил).
Было отмечено небольшое увеличение AUC (11%), а также средней Cmax (18%) дигоксина при совместном применении с ситаглиптином. Это увеличение не считается клинически значимым. Не рекомендуется изменение дозы ни дигоксина, ни препарата Янувия® при их совместном применении.
Было отмечено увеличение AUC и Cmax препарата Янувия® на 29 и 68% соответственно у пациентов при совместном применении разовой пероральной дозы 100 мг препарата Янувия® и разовой пероральной дозы 600 мг циклоспорина, мощного ингибитора P-gp. Наблюдаемые изменения фармакокинетических характеристик ситаглиптина не считаются клинически значимыми. Не рекомендуется изменение дозы препарата Янувия® при совместном применении с циклоспорином и другими ингибиторами P-gp (например, кетоконазолом).
Популяционный фармакокинетический анализ пациентов и здоровых добровольцев (n=858) на широкий спектр сопутствующих препаратов (n=83, приблизительно половина из которых выводится почками) не выявил каких-либо клинически значимых эффектов этих веществ на фармакокинетику ситаглиптина.
Передозировка
Во время клинических исследований у здоровых добровольцев разовая доза 800 мг препарата Янувия® в целом хорошо переносилась. Минимальные изменения интервала QTc, не считающиеся клинически значимыми, отмечались в одном из исследований препарата Янувия® в дозе 800 мг/сут. Доза свыше 800 мг/сут у людей не изучалась.
В I фазе клинических исследований многократного приема каких-либо связанных с лечением препаратом Янувия® нежелательных реакций при приеме препарата в суточной дозе до 400 мг на протяжении 28 дней не отмечали.
Лечение: в случае передозировки необходимо начать стандартные поддерживающие мероприятия — удаление неабсорбированного препарата из ЖКТ, осуществление мониторирования показателей жизнедеятельности, включая ЭКГ, а также назначение поддерживающей терапии, если требуется.
Ситаглиптин слабо диализируется. В клинических исследованиях только 13,5% дозы удалялось из организма в течение 3–4-часового сеанса диализа. Пролонгированный диализ может назначаться в случае клинической необходимости. Данных об эффективности перитонеального диализа ситаглиптина нет.
Особые указания
Панкреатит. Были получены сообщения о развитии острого панкреатита, включая геморрагический или некротический с летальным и без летального исхода, у пациентов, принимающих ситаглиптин (см. «Побочные действия»). Пациенты должны быть проинформированы о характерных симптомах острого панкреатита — стойкие, сильные боли в животе. Клинические проявления панкреатита исчезали после прекращения приема ситаглиптина. В случае подозрения на панкреатит необходимо прекратить прием препарата Янувия® и других потенциально опасных лекарственных препаратов.
Гипогликемия. По данным клинических исследований препарата Янувия®, частота возникновения гипогликемии при монотерапии и комбинированной терапии с препаратами, не вызывающими гипогликемию (метформин, пиоглитазон), была сопоставима с частотой развития гипогликемии в группе плацебо. Как и в случае приема других гипогликемических препаратов совместно с сульфонилмочевиной или инсулином, частота возникновения гипогликемии при применении ситаглиптина в комбинации с инсулином или производными сульфонилмочевины была выше, чем при приеме плацебо (см. «Побочные действия»). С целью снижения риска развития инсулин- или сульфон-индуцированной гипогликемии дозу инсулина или производного сульфонилмочевины следует уменьшить (см. «Способ применения и дозы»).
Реакции гиперчувствительности. В ходе пострегистрационного мониторинга применения препарата Янувия® были выявлены серьезные реакции гиперчувствительности. Данные реакции включали анафилаксию, ангионевротический отек, эксфолиативные кожные заболевания, включая синдром Стивенса-Джонсона. Поскольку эти данные были получены добровольно от популяции неопределенного размера, частоту и причинно-следственную связь данных реакций с терапией определить невозможно. Данные реакции возникали в течение первых 3 мес после начала лечения препаратом Янувия®, некоторые наблюдались после приема первой дозы препарата. Если подозревается развитие реакции гиперчувствительности, необходимо прекратить прием препарата Янувия®, оценить другие возможные причины развития нежелательного явления и назначить другую медикаментозную терапию для лечения сахарного диабета (см. «Противопоказания», «Побочные действия»).
Применение у лиц пожилого возраста. В клинических исследованиях эффективность и безопасность препарата Янувия® у пожилых пациентов (≥65 лет, 409 пациентов) были сравнимы с этими показателями у пациентов моложе 65 лет. Коррекции дозы в зависимости от возраста не требуется. Пожилые пациенты чаще склонны к развитию нарушения функции почек. Соответственно, как и в других возрастных группах, необходима коррекция дозы у пациентов с выраженным нарушением функции почек (см. «Способ применения и дозы»).
Буллезный пемфигоид. Сообщалось о пострегистрационных случаях возникновения буллезного пемфигоида, требующего госпитализации, у пациентов, принимавших ингибиторы ДПП-4. В сообщенных случаях пациенты выздоравливали либо от местной, либо от системной иммуносупрессивной терапии и отмены ингибитора ДПП-4. Пациенты должны быть проинформированы о необходимости сообщать о развитии волдырей или изъязвлений в ходе лечения препаратом Янувия®. В случае подозрения на буллезный пемфигоид необходимо прекратить прием препарата Янувия® и обратиться к дерматологу для диагностики и назначения соответствующего лечения.
Влияние на способность управлять транспортными средствами и работать с механизмами. Не проводилось исследований по изучению влияния препарата Янувия® на способность управлять транспортными средствами и работать с механизмами. Тем не менее не ожидается отрицательного влияния препарата Янувия® на способность управлять транспортными средствами и работать с механизмами.
Форма выпуска
Таблетки, покрытые пленочной оболочкой, 25 мг, 50 мг, 100 мг. По 14 табл. в блистере из пленки ПВДХ/полиэтилен/ПВХ и алюминиевой фольги. По 1, 2, 4, 6 или 7 бл. помещают в картонную пачку.
При производстве на АО «АКРИХИН»
Таблетки, покрытые пленочной оболочкой, 100 мг. По 14 табл. в блистере из пленки ПВДХ/полиэтилен/ПВХ и алюминиевой фольги. По 2 бл. помещают в картонную пачку.
Производитель
Мерк Шарп и Доум Лтд., Великобритания/Merck Sharp & Dohme Ltd., United Kingdom. Shotton Lane, Cramlington, Northumberland NE23 3JU, United Kingdom.
Или (для дозировки 100 мг) АО «Химико-фармацевтический комбинат «АКРИХИН»» (АО «АКРИХИН»). 142450, Московская обл., Ногинский р-н, г. Старая Купавна, ул. Кирова, 29.
Упаковано/выпускающий контроль качества: Мерк Шарп и Доум Лтд., Великобритания.
Или Мерк Шарп и Доум Б.В., Нидерланды/Merck Sharp & Dohme B.V., the Netherlands. Waarderweg, 39, 2031 BN Haarlem, the Netherlands.
Или АО «АКРИХИН».142450, Московская обл., Ногинский р-н, г. Старая Купавна, ул. Кирова, 29.
Юридическое лицо, на имя которого выдано регистрационное удостоверение: Мерк Шарп и Доум Б.В., Нидерланды.
Претензии потребителей направлять по адресу: ООО «МСД Фармасьютикалс». 119021, Россия, Москва, ул. Тимура Фрунзе, 11, стр. 1.
Тел.: (495) 916-71-00; факс: (495) 916-70-94.
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Препарат Янувия® в целом хорошо переносится как в режиме монотерапии, так и в комбинации с другими гипогликемическими препаратами. В клинических исследованиях общая частота нежелательных явлений, а также частота отмены препарата из-за нежелательных явлений были схожи с таковыми при приеме плацебо.
По данным 4 плацебо-контролируемых исследований (длительность — 18–24 нед) препарата Янувия® в суточной дозе 100–200 мг в качестве моно- или комбинированной терапии с метформином или пиоглитазоном, не наблюдалось связанных с исследуемым препаратом нежелательных реакций, частота которых превысила 1% в группе пациентов, принимавших препарат Янувия®. Профиль безопасности суточной дозы 200 мг был сравним с профилем безопасности суточной дозы 100 мг.
Анализ данных, полученных в ходе указанных выше клинических исследований, показал, что общая частота развития гипогликемии у пациентов, принимавших препарат Янувия®, была сходна с таковой при приеме плацебо (Янувия® 100 мг — 1,2%, Янувия® 200 мг — 0,9%, плацебо — 0,9%). Частота отслеживаемых нежелательных явлений со стороны ЖКТ при приеме препарата Янувия® в обеих дозах была схожа с таковой при приеме плацебо (за исключением более частого возникновения тошноты при приеме препарата Янувия® в дозе 200 мг/сут): боль в животе (Янувия® 100 мг — 2,3%, Янувия® 200 мг — 1,3%, плацебо — 2,1%), тошнота (1,4; 2,9; 0,6%), рвота (0,8; 0,7; 0,9%), диарея (3; 2,6; 2,3%).
Во всех исследованиях нежелательные реакции в виде гипогликемии регистрировались на основании всех сообщений о клинически выраженных симптомах гипогликемии; параллельное измерение концентрации глюкозы в крови не требовалось.
Стартовая комбинированная терапия с метформином
В 24-недельном плацебо-контролируемом факториальном исследовании стартовой комбинированной терапии препаратом Янувия® в суточной дозе 100 мг и метформином в суточной дозе 1000 мг или 2000 мг (ситаглиптин 50 мг + метформин 500 мг или 1000 мг × 2 раза в сутки) в группе комбинированного лечения по сравнению с группой монотерапии метформином наблюдались следующие нежелательные явления, связанные с приемом препарата, с частотой ≥1% в группе лечения препаратом Янувия® и чаще, чем в группе лечения метформином в монотерапии: диарея (Янувия® + метформин — 3,5%, метформин — 3,3%), диспепсия (1,3; 1,1%), головная боль (1,3; 1,1%), метеоризм (1,3; 0,5%), гипогликемия (1,1; 0,5%), рвота (1,1; 0,3%).
Комбинирование с производными сульфонилмочевины или производными сульфонилмочевины и метформином
В 24-недельном плацебо-контролируемом исследовании комбинированной терапии препаратом Янувия® (суточная доза 100 мг) и глимепиридом или глимепиридом и метформином в группе исследуемого препарата по сравнению с группой пациентов, принимавших плацебо и глимепирид или глимепирид и метформин, наблюдались следующие нежелательные явления, связанные с приемом препарата, с частотой ≥1% в группе лечения препаратом Янувия® и чаще, чем в группе комбинированной терапии с плацебо: гипогликемия (Янувия® — 9,5%, плацебо — 0,9%).
Стартовая комбинированная терапия с агонистами PPAR-γ
В 24-недельном исследовании стартовой комбинированной терапии препаратом Янувия® в суточной дозе 100 мг и пиоглитазоном в суточной дозе 30 мг в группе комбинированного лечения по сравнению с монотерапией пиоглитазоном наблюдались следующие нежелательные явления, связанные с приемом препарата, наблюдавшиеся с частотой ≥1% в группе лечения препаратом Янувия® и чаще, чем в группе лечения пиоглитазоном в монотерапии: бессимптомное снижение концентрации глюкозы в крови (Янувия® + пиоглитазон — 1,1%, пиоглитазон — 0%), симптоматическая гипогликемия (0,4; 0,8%).
Комбинирование с агонистами PPAR-γ и метформином
По данным плацебо-контролируемого исследования при лечении препаратом Янувия® (суточная доза 100 мг) в комбинации с росиглитазоном и метформином в группе исследуемого препарата по сравнению с группой пациентов, принимавших плацебо с росиглитазоном и метформином, наблюдались следующие нежелательные явления, связанные с приемом препарата, с частотой ≥1% в группе лечения препаратом Янувия® и чаще, чем в группе комбинированной терапии с плацебо: на 18 нед наблюдения — головная боль (Янувия® — 2,4%, плацебо — 0%), диарея (1,8; 1,1%), тошнота (1,2; 1,1%), гипогликемия (1,2; 0%), рвота (1,2; 0%); на 54 нед наблюдения — головная боль (Янувия® — 2,4%, плацебо — 0%), гипогликемия (2,4; 0%), инфекции верхних дыхательных путей (1,8; 0%), тошнота (1,2; 1,1%), кашель (1,2; 0%), грибковая инфекция кожи (1,2; 0%), периферические отеки (1,2; 0%), рвота (1,2; 0%).
Комбинирование с инсулином
В 24-недельном плацебо-контролируемом исследовании комбинированной терапии препаратом Янувия® (в суточной дозе 100 мг) и постоянной дозой инсулина (с или без метформина) в группе исследуемого препарата по сравнению с группой пациентов, принимавших плацебо и инсулин (с или без метформина), наблюдались следующие нежелательные явления, связанные с приемом препарата, с частотой ≥1% в группе лечения препаратом Янувия® и чаще, чем в группе лечения инсулином (с или без метформина): гипогликемия (Янувия® + инсулин (с или без метформина) — 9,6%, плацебо + инсулин (с или без метформина) — 5,3%), грипп (1,2; 0,3%), головная боль (1,2; 0%).
В другом 24-недельном исследовании, в котором пациенты получали препарат Янувия® в качестве дополнительной терапии к терапии инсулином (с или без метформина), не было выявлено нежелательных реакций, связанных с приемом препарата, с частотой ≥1% в группе лечения препаратом Янувия® (в дозе 100 мг) и чаще, чем в группе плацебо.
Панкреатит
В обобщенном анализе 19 двойных слепых рандомизированных клинических исследований применения ситаглиптина в суточной дозе 100 мг или соответствующего препарата контроля (активного или плацебо) частота развития неподтвержденного острого панкреатита составила 0,1 случая на 100 пациенто-лет лечения в каждой группе (см. «Особые указания», Панкреатит, а также исследование по оценке сердечно-сосудистой безопасности ситаглиптина (TECOS) ниже).
Клинически значимых отклонений показателей жизненно важных функций или ЭКГ (включая продолжительность интервала QTс) на фоне лечения препаратом Янувия® не наблюдали.
Исследование по оценке сердечно-сосудистой безопасности ситаглиптина (TECOS)
В исследование по оценке сердечно-сосудистой безопасности ситаглиптина (TECOS) было включено 7332 пациента с сахарным диабетом типа 2, которые принимали препарат Янувия® 100 мг в день (или 50 мг в день, если исходный показатель рСКФ был ≥30 и <50 мл/мин/1,73 м2), и 7339 пациентов, принимавших плацебо, в общей популяции пациентов, которым было назначено лечение. Исследуемый препарат (Янувия® или плацебо) добавлялся к стандартной терапии согласно существующим национальным стандартам по выбору целевого уровня HbA1C и контролю сердечно-сосудистых факторов риска. В исследование в общей сложности было включено 2004 пациента 75 лет и старше (970 принимали препарат Янувия® и 1034 — плацебо). Общая частота возникновения серьезных нежелательных явлений у пациентов, принимавших препарат Янувия®, была такой же, как у пациентов, принимавших плацебо. Оценка ранее обозначенных для отслеживания осложнений, связанных с сахарным диабетом, выявила сопоставимую частоту возникновения нежелательных явлений между группами, включая инфекции (18,4% у пациентов, принимавших препарат Янувия®, и 17,7% у пациентов, принимавших плацебо) и нарушение функции почек (1,4% у пациентов, принимавших препарат Янувия®, и 1,5% у пациентов, принимавших плацебо). Профиль нежелательных явлений у пациентов 75 лет и старше в целом был схож с таковым для общей популяции.
В популяции пациентов intention-to-treat (пациенты, которые приняли хотя бы одну дозу исследуемого препарата), среди тех, кто исходно получал инсулинотерапию и/или препараты сульфонилмочевины, частота возникновения эпизодов тяжелой гипогликемии составила 2,7% у пациентов, принимавших препарат Янувия®, и 2,5% у пациентов, принимавших плацебо. Среди пациентов, исходно не получавших инсулин и/или препараты сульфонилмочевины, частота возникновения эпизодов тяжелой гипогликемии составила 1% у пациентов, принимавших препарат Янувия®, и 0,7% у пациентов, принимавших плацебо. Частота возникновения подтвержденных экспертизой случаев панкреатита составила 0,3% у пациентов, принимавших препарат Янувия®, и 0,2% у пациентов, принимавших плацебо. Частота возникновения подтвержденных экспертизой случаев злокачественных новообразований составила 3,7% у пациентов, принимавших препарат Янувия®, и 4% у пациентов, принимавших плацебо.
Пострегистрационные наблюдения
В ходе пострегистрационного мониторинга применения препарата Янувия® в монотерапии и/или в комбинированной терапии с другими гипогликемическими средствами были выявлены дополнительные нежелательные явления. Поскольку эти данные были получены добровольно от популяции неопределенного размера, частоту и причинно-следственную связь с терапией данных нежелательных явлений определить невозможно. К ним относятся реакции гиперчувствительности, в т.ч. анафилаксия, ангионевротический отек, сыпь, крапивница, кожный васкулит, эксфолиативные кожные заболевания, включая синдром Стивенса-Джонсона; острый панкреатит, включая геморрагическую и некротическую формы с летальным и без летального исхода; ухудшение функции почек, включая острую почечную недостаточность (иногда требуется диализ); инфекции верхних дыхательных путей; назофарингит; запор; рвота; головная боль; артралгия; миалгия; боль в конечности; боль в спине; зуд; пемфигоид.
Изменения лабораторных показателей
Частота отклонений лабораторных показателей в группах лечения препаратом Янувия® (в суточной дозе 100 мг) была сравнимой с частотой в группах плацебо. В большинстве, но не во всех клинических исследованиях наблюдалось небольшое увеличение содержания лейкоцитов (приблизительно на 200/мкл по сравнению с плацебо, среднее содержание в начале лечения — 6600/мкл), обусловленное увеличением количества нейтрофилов.
Анализ данных клинических исследований препарата показал небольшое увеличение концентрации мочевой кислоты (приблизительно на 0,2 мг/дл по сравнению с плацебо, средняя концентрация до лечения 5–5,5 мг/дл) у пациентов, получавших препарат Янувия® в дозе 100 и 200 мг/сут. Случаев развития подагры зарегистрировано не было.
Наблюдалось небольшое уменьшение концентрации общей ЩФ (приблизительно на 5 МЕ/л по сравнению с плацебо, средняя концентрация до лечения — 56–62 МЕ/л), частично связанное с небольшим уменьшением костной фракции ЩФ.
Перечисленные изменения лабораторных показателей не считаются клинически значимыми.
Состав
Одна таблетка средства Янувия может включать 100 мг, 50 мг или 25 мг ситаглиптина.
Дополнительные вещества: гидрофосфат кальция, микрокристаллическая целлюлоза, стеарат магния, кроскармеллоза натрия, стеарилфумарат натрия.
Состав оболочки: поливиниловый спирт, Opadry 2 бежевый, диоксид титана, желтый оксид железа, тальк, макрогол 3350, красный оксид железа.
Форма выпуска
Бежевые двояковыпуклые таблетки круглой формы, с гравировкой «277». 14 таблеток в контурной упаковке, две упаковки в картонной пачке.
Фармакологическое действие
Гипогликемическое действие.
Фармакодинамика и фармакокинетика
Фармакодинамика
Гипогликемический препарат для перорального приема, высокоизбирательный блокатор дипептидилпептидазы-4. Отличается по структуре и действию от инсулина, бигуанидов, производных сульфонилмочевины, агонистов γ-рецепторов, блокаторов альфа-гликозидазы, аналогов глюкагоноподобного пептида 1 и амилина. Блокируя дипептидилпептидазу-4, ситаглиптин увеличивает уровень двух известных гормонов-инкретинов: инсулинотропного глюкозозависимого пептида и глюкагоноподобного пептида 1.
Указанные гормоны секретируются в кишечнике, а их уровень увеличивается в ответ на прием еды. Инкретины – это часть внутренней системы регуляции метаболизма глюкозы. При нормальном или увеличенном содержании плазменной глюкозы гормоны-инкретины способствуют стимуляции синтеза инсулина и его выделению поджелудочной железой.
Глюкагоноподобный пептид 1 также способствует торможению увеличенной секреции глюкагона поджелудочной железой. Уменьшение содержания глюкагона на фоне увеличения уровня инсулина вызывает снижение синтеза глюкозы печенью, что в конце концов приводит к ослаблению гликемии.
При малой концентрации глюкозы в плазме вышеперечисленные эффекты указанных гормонов-инкретинов на выделение инсулина и подавление секреции глюкагона не регистрируются. Глюкагоноподобный пептид 1 и инсулинотропный глюкозозависимый пептид не влияют на выделение глюкагона в ответ на развитие гипогликемии.
Ситаглиптин тормозит гидролиз инкретинов энзимом дипептидилпептидазой-4, тем самым повышая плазменные уровни активных форм глюкагоноподобного пептида 1 и инсулинотропного глюкозозависимого пептида. Увеличивая содержание инкретинов, ситаглиптин повышает глюкозозависимое выделение инсулина и способствует торможению секреции глюкагона. У лиц с сахарным диабетом 2 типа на фоне гипергликемии эти изменения продукции инсулина и глюкагона вызывают снижение концентрации гликированного гемоглобина и уменьшению уровня глюкозы в крови.
У лиц с сахарным диабетом 2 типа прием стандартной дозы средства Янувия приводит к подавлению активности фермента дипептидилпептидазы-4 в течение суток, что вызывает увеличение содержания циркулирующих инкретинов (глюкагоноподобного пептида 1 и инсулинотропного глюкозозависимого пептида) в 2-3 раза, повышение концентрации инсулина и С-пептида в плазме, понижение уровня глюкагона в крови, ослаблении гликемии натощак.
Фармакокинетика
После употребления 100 мг препарата отмечается быстрое всасывание ситаглиптина с достижением наибольшего содержания в крови спустя 1-4 часа. Абсолютная биодоступность составляет около 87%. Одновременное употребление жирной пищи не изменяет фармакокинетику ситаглиптина.
Связывание активного вещества с белками плазмы достигает 38%.
Трансформируется только малая часть принятого препарата. 16% дозы выделяется в виде метаболитов. Известно 6 метаболитов ситаглиптина, которые вероятно не обладают его активностью. Первичными ферментами, ответственными за метаболизм ситаглиптина, являются CYP2C8 и CYP3A4. До 79% препарата выводится в первоначальном виде с мочой. Время полувыведения ситаглиптина составляет примерно 12,5 часа.
Показания к применению
- В составе комбинированного лечения сахарного диабета второго типа для усиления контроля над гликемией в сочетании с агонистами PPAR-γ или Метформином, когда физическая нагрузка и диета в сочетании с монотерапией вышеперечисленными средствами не позволяют контролировать гликемию.
- Монотерапия препаратом в качестве дополнения к физическим нагрузкам и диете для усиления контроля над гликемией у страдающих сахарным диабетом второго типа.
Противопоказания
- сахарный диабет 1 типа;
- беременность и лактация;
- диабетический кетоацидоз;
- гиперчувствительность к компонентам препарата;
- не советуется назначать препарат лицам младше 18 лет.
Рекомендуется с осторожностью назначать средство пациентам, страдающим почечной недостаточностью. При недостаточности работы почек умеренной и тяжелой степени, больным с терминальной стадией данного завоевания, нуждающимся в гемодиализе необходима коррекция режима приема.
Побочные действия
- Расстройства со стороны дыхания: инфекции дыхательных путей, назофарингит.
- Расстройства со стороны нервной деятельности: головная боль.
- Расстройства со стороны пищеварения: боли в животе, диарея, рвота, тошнота.
- Расстройства со стороны костно-мышечного аппарата: артралгия.
- Расстройства со стороны иммунитета: гипогликемия.
- Расстройства со стороны лабораторных данных: увеличение содержания мочевой кислоты, незначительное снижение концентрации щелочной фосфатазы, увеличение количества нейтрофилов.
Янувия, инструкция по применению (Способ и дозировка)
Инструкция на Янувию устанавливает рекомендуемую дозу средства при применении в виде монотерапии или в комбинации с иными лекарствами в 100 мг ежедневно.
Препарат разрешено принимать независимо от еды. Если пациент забыл принять лекарство, то необходимо принять эту дозу как можно быстрее. Запрещен прием удвоенной дозы препарата.
При легкой степени почечной недостаточности коррекции дозировки не требуется.
При умеренной степени почечной недостаточности доза препарата должна составлять 50 мг ежедневно.
При тяжелой почечной недостаточности и у пациентов с завершающей стадией недостаточности работы почек, а также при необходимости гемодиализа дозировка препарата составляет 25 мг ежедневно.
Передозировка
Признаки передозировки: при приеме единовременно 800 мг препарата были выявлены минимальные изменения отрезка QTc. Клинических исследований приема препарата в дозе свыше 800 мг в день не проводилось.
Лечение передозировки: промывание желудка, прием энтеросорбентов, мониторирование жизненно важных показателей, проведение поддерживающей и симптоматической терапии.
Активное вещество плохо диализируется.
Взаимодействие
Было отмечено слабое повышение значений максимальной концентрации Дигоксина при совместном использовании с ситаглиптином.
Также было зафиксировано увеличение повышения значений максимальной концентрации ситаглиптина у пациентов при совместном использовании с Циклоспорином.
Условия продажи
По рецепту.
Условия хранения
Хранить при температуре до 30°С. Беречь от детей.
Срок годности
2 года.
Особые указания
Во время клинических исследований препарата частота появления гипогликемии при его применении была сходной с таковой частотой при использовании плацебо.
Пациентам с компенсированной печеночной недостаточностью изменения дозировки препарата не требуется.
Аналоги
Совпадения по коду АТХ 4-го уровня:
Аналоги Янувии: Гальвус, Комбоглиза XR, Несина, Онглиза, Тражента.
Детям
Не следует назначать препарат лицам, не достигшим 18 лет.
При беременности и лактации
Указанные периоды являются противопоказанием для применения препарата.
Отзывы о Янувии
Почти все отзывы о Янувии высоко оценивают результаты лечения препаратом при вышеописанных показаниях. Широкое применение лекарства ограничивает его дороговизна.
Цена Янувии, где купить
Цена Янувия 100 мг №28 составляет в России 2180-2700 рублей, а на Украине цена такой формы выпуска приближается к 1200 гривнам.
- Интернет-аптеки РоссииРоссия
ЗдравСити
-
Янувия таблетки п/о плен. 100мг 28штAO «АКРИХИН»
показать еще
Янувия® (Januvia)
💊 Состав препарата Янувия®
✅ Применение препарата Янувия®
Описание активных компонентов препарата
Янувия®
(Januvia)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2020.08.07
Владелец регистрационного удостоверения:
Код ATX:
A10BH01
(Ситаглиптин)
Лекарственные формы
| Янувия® |
Таб., покр. пленочной оболочкой, 25 мг: 14, 28, 56, 84 или 98 шт. рег. №: ЛСР-003200/07 |
|
|
Таб., покр. пленочной оболочкой, 50 мг: 14, 28, 56, 84 или 98 шт. рег. №: ЛСР-003200/07 |
||
|
Таб., покр. пленочной оболочкой, 100 мг: 14, 28, 56, 84 или 98 шт. рег. №: ЛСР-003200/07 |
Форма выпуска, упаковка и состав
препарата Янувия®
Таблетки, покрытые пленочной оболочкой светло-розового цвета со слабым бежеватым оттенком, круглые, двояковыпуклые, с гравировкой «221» на одной стороне и гладкие на другой.
Вспомогательные вещества: целлюлоза микрокристаллическая — 30.94 мг, кальция гидрофосфат неизмельченный — 30.94 мг, кроскармеллоза натрия — 2 мг, магния стеарат — 1 мг, натрия стеарилфумарат — 3 мг.
Состав оболочки: Opadry II розовый 85F97191 — 4 мг (поливиниловый спирт 40%, титана диоксид (E171) 24.142%, макрогол 3350 (полиэтиленгликоль) 20.2%, тальк 14.87%, краситель железа оксид желтый (E172) 0.579%, краситель железа оксид красный (E172) 0.209%).
14 шт. — упаковки ячейковые контурные (1) — пачки картонные.
14 шт. — упаковки ячейковые контурные (2) — пачки картонные.
14 шт. — упаковки ячейковые контурные (4) — пачки картонные.
14 шт. — упаковки ячейковые контурные (6) — пачки картонные.
14 шт. — упаковки ячейковые контурные (7) — пачки картонные.
Таблетки, покрытые пленочной оболочкой светло-бежевого цвета, круглые, двояковыпуклые, с гравировкой «112» на одной стороне и гладкие на другой.
Вспомогательные вещества: целлюлоза микрокристаллическая — 61.88 мг, кальция гидрофосфат неизмельченный — 61.88 мг, кроскармеллоза натрия — 4 мг, магния стеарат — 2 мг, натрия стеарилфумарат — 6 мг.
Состав оболочки: Opadry II светло-бежевый 85F17498 — 8 мг (поливиниловый спирт 40%, титана диоксид (E171) 24.142%, макрогол 3350 (полиэтиленгликоль) 20.2%, тальк 14.8%, краситель железа оксид желтый (E172) 0.765%, краситель железа оксид красный (E172) 0.093%).
14 шт. — упаковки ячейковые контурные (1) — пачки картонные.
14 шт. — упаковки ячейковые контурные (2) — пачки картонные.
14 шт. — упаковки ячейковые контурные (4) — пачки картонные.
14 шт. — упаковки ячейковые контурные (6) — пачки картонные.
14 шт. — упаковки ячейковые контурные (7) — пачки картонные.
Таблетки, покрытые пленочной оболочкой бежевого цвета, круглые, двояковыпуклые, с гравировкой «277» на одной стороне и гладкие на другой.
Вспомогательные вещества: целлюлоза микрокристаллическая — 123.8 мг, кальция гидрофосфат неизмельченный — 123.8 мг, кроскармеллоза натрия — 8 мг, магния стеарат — 4 мг, натрия стеарилфумарат — 12 мг.
Состав оболочки: Opadry II бежевый 85F17438 — 16 мг (поливиниловый спирт 40%, титана диоксид (E171) 24.56%, макрогол 3350 (полиэтиленгликоль) 20.2%, тальк 14.8%, краситель железа оксид желтый (E172) 3.07%, краситель железа оксид красный (E172) 0.37%).
14 шт. — упаковки ячейковые контурные (1) — пачки картонные.
14 шт. — упаковки ячейковые контурные (2) — пачки картонные.
14 шт. — упаковки ячейковые контурные (4) — пачки картонные.
14 шт. — упаковки ячейковые контурные (6) — пачки картонные.
14 шт. — упаковки ячейковые контурные (7) — пачки картонные.
Фармакологическое действие
Пероральное гипогликемическое средство, высоко селективный ингибитор дипептидилпептидазы 4 (ДПП-4).
Ситаглиптин отличается по химической структуре и фармакологическому действию от аналогов глюкагоноподобного пептида-1 (ГПП-1), инсулина, производных сульфонилмочевины, бигуанидов, агонистов γ-рецепторов, активируемых пролифератором пероксисом (PPAR-γ), ингибиторов альфа-гликозидазы, аналогов амилина. Ингибируя ДПП-4, ситаглиптин повышает концентрацию 2 известных гормонов семейства инкретинов: ГПП-1 и глюкозо-зависимого инсулинотропного пептида (ГИП). Гормоны семейства инкретинов секретируются в кишечнике в течение суток, их уровень повышается в ответ на прием пищи. Инкретины являются частью внутренней физиологической системы регуляции гомеостаза глюкозы. При нормальном или повышенном уровне глюкозы крови гормоны семейства инкретинов способствуют увеличению синтеза инсулина, а также его секреции β-клетками поджелудочной железы за счет сигнальных внутриклеточных механизмов, ассоциированных с циклическим АМФ.
ГПП-1 также способствует подавлению повышенной секреции глюкагона α-клетками поджелудочной железы. Снижение концентрации глюкагона на фоне повышения уровня инсулина способствует уменьшению продукции глюкозы печенью, что в итоге приводит к уменьшению гликемии.
При низкой концентрации глюкозы крови перечисленные эффекты инкретинов на выброс инсулина и уменьшение секреции глюкагона не наблюдаются. ГПП-1 и ГИП не влияют на выброс глюкагона в ответ на гипогликемию. В физиологических условиях активность инкретинов ограничивается ферментом ДПП-4, который быстро гидролизует инкретины с образованием неактивных продуктов.
Ситаглиптин предотвращает гидролиз инкретинов ферментом ДПП-4, тем самым увеличивая плазменные концентрации активных форм ГПП-1 и ГИП. Повышая уровень инкретинов, ситаглиптин увеличивает глюкозозависимый выброс инсулина и способствует уменьшению секреции глюкагона. У пациентов с сахарным диабетом типа 2 с гипергликемией эти изменения секреции инсулина и глюкагона приводят к снижению уровня гликированного гемоглобина HbA1С и уменьшению плазменной концентрации глюкозы, определяемой натощак и после нагрузочной пробы.
У пациентов с сахарным диабетом 2 типа прием одной дозы ситаглиптина приводит к ингибированию активности фермента ДПП-4 в течение 24 ч, что приводит к увеличению уровня циркулирующих инкретинов ГПП-1 и ГИП в 2-3 раза, нарастанию плазменной концентрации инсулина и С-пептида, снижению концентрации глюкагона в плазме крови, уменьшению гликемии натощак, а также уменьшению гликемии после нагрузки глюкозой или пищевой нагрузки.
Фармакокинетика
Фармакокинетика ситаглиптина изучена у здоровых лиц и пациентов с сахарным диабетом 2 типа.
После приема внутрь препарата в дозе 100 мг у здоровых лиц отмечается быстрая абсорбция ситаглиптина с достижением Cmax через 1-4 ч. AUC увеличивается пропорционально дозе и составляет у здоровых субъектов 8.52 мкмоль × ч при приеме внутрь в дозе 100 мг, Cmax составляла 950 нмоль. Абсолютная биодоступность ситаглиптина составляет приблизительно 87%. Внутри- и межиндивидуальные коэффициенты вариабельности AUC ситаглиптина незначительны. Одновременный прием жирной пищи не влияет на фармакокинетику ситаглиптина.
Плазменная AUC ситаглиптина увеличивалась приблизительно на 14% после следующего приема препарата в дозе 100 мг по достижению равновесного состояния после приема первой дозы. После однократного приема препарата в дозе 100 мг средний Vd ситаглиптина у здоровых добровольцев составлял приблизительно 198 л. Связывание ситаглиптина с белками плазмы составляет 38%.
Метаболизируется лишь незначительная часть поступившего в организм препарата. После введения 14C-меченного ситаглиптина внутрь приблизительно 16% радиоактивного препарата экскретировалось в виде его метаболитов. Были обнаружены следы 6 метаболитов ситаглиптина, вероятно не обладающие ДПП-4-ингибирующей активностью. В исследованиях in vitro было выявлено, что первичным ферментом, участвующем в ограниченном метаболизме ситаглиптина, является CYP3A4 с участием CYP2C8.
Приблизительно 79% ситаглиптина выводится в неизмененном виде с мочой. В течение 1 недели после приема препарата здоровыми добровольцами 14C-меченный ситаглиптин выводился: с мочой — 87% и калом -13%. T1/2 ситаглиптина при приеме внутрь в дозе 100 мг составляет приблизительно 12.4 ч. Почечный клиренс составляет приблизительно 350 мл/мин.
Выведение ситаглиптина осуществляется первично путем экскреции почками по механизму активной канальцевой секреции. Ситаглиптин является субстратом для транспортера органических анионов человека третьего типа (hOAT-3), который и может быть вовлечен в процесс выведения ситаглиптина почками. Ситаглиптин также является субстратом р-гликопротеина, который также может участвовать в процессе почечной элиминации ситаглиптина.
Показания активных веществ препарата
Янувия®
Монотерапия: в качестве дополнения к диете и физическим нагрузкам для улучшения контроля над гликемией при сахарном диабете 2 типа;
Комбинированная терапия: сахарный диабет 2 типа для улучшения контроля над гликемией в комбинации с метформином или агонистами PPAR-γ (например, тиазолидиндионом), когда диета и физическая нагрузка в сочетании с монотерапией перечисленными средствами не приводят к адекватному контролю над гликемией.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Внутрь. Разовая доза — 100 мг 1 раз/сут.
При почечной недостаточности требуется коррекция режима дозирования.
Побочное действие
Со стороны дыхательной системы: инфекции верхних дыхательных путей (100 мг – 6.8%, 200 мг – 6.1%, плацебо – 6.7%), назофарингит (100 мг – 4.5%, 200 мг – 4.4%, плацебо – 3.3%).
Со стороны ЦНС: головная боль (100 мг – 3.6%, 200 мг – 3.9%, плацебо – 3.6%).
Со стороны пищеварительной системы: диарея (100 мг – 3%, 200 мг – 2.6%, плацебо – 2.3%), боли в животе (100 мг – 2.3%, 200 мг – 1.3%, плацебо – 2.1%), тошнота (100 мг – 1.4%, 200 мг – 2.9%, плацебо – 0.6%), рвота (100 мг – 0.8%, 200 мг – 0.7%, плацебо – 0.9%), диарея (100 мг – 3%, 200 мг – 2.6%, плацебо – 2.3%).
Со стороны костно-мышечной системы: артралгия (100 мг – 2.1%, 200 мг – 3.3%, плацебо – 1.8%).
Со стороны эндокринной системы: гипогликемия (100 мг – 1.2%, 200 мг – 0.9%, плацебо – 0.9%).
Со стороны лабораторных показателей: при дозах 100 мг/сут и 200 мг/сут — увеличение мочевой кислоты приблизительно на 0.2 мг/дл по сравнению с плацебо (средний уровень 5-5.5 мг/дл) у пациентов, получавших препарат в дозе 100 мг/сут и 200 мг/сут. Случаев развития подагры не зарегистрировано.
Противопоказания к применению
Сахарный диабет 1 типа; диабетический кетоацидоз; беременность; период лактации (грудного вскармливания); дети и подростки в возрасте до 18 лет; повышенная чувствительность к ситаглиптину.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период лактации (грудного вскармливания).
Применение у детей
Препарат противопоказан для применения у детей и подростков в возрасте до 18 лет
Применение у пожилых пациентов
Пациенты пожилого возраста чаще склонны к развитию почечной недостаточности. Соответственно, как и в других возрастных группах необходима коррекция дозы у пациентов с выраженной почечной недостаточностью.
Особые указания
С осторожностью применять у пациентов с почечной недостаточностью. При почечной недостаточности средней и тяжелой степени, а также пациентам с терминальной стадией почечной недостаточности, нуждающимся в гемодиализе, требуется коррекция режима дозирования.
Пациенты пожилого возраста чаще склонны к развитию почечной недостаточности. Соответственно, как и в других возрастных группах необходима коррекция дозы у пациентов с выраженной почечной недостаточностью.
Лекарственное взаимодействие
Было отмечено небольшое увеличение AUC (11%), а также средней Сmax (18%) дигоксина при совместном применении с ситаглиптином. Это увеличение не считается клинически значимым.
Было отмечено увеличение AUC и Сmax ситаглиптина на 29% и 68% соответственно у пациентов при совместном применении ситаглиптина в разовой дозе 100 мг и циклоспорина (мощного ингибитора P-гликопротеина) в разовой дозе 600 мг. Данные изменения фармакокинетических параметров ситаглиптина не считаются клинически значимыми.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
1 таблетка, покрытая пленочной оболочкой, содержит ситаглиптина фосфата гидрат эквивалентно 25 мг, 50 мг, 100 мг ситаглиптина.
Вспомогательные вещества: целлюлоза микрокристаллическая; кальция гидрофосфат неизмельченный; кроскармеллоза натрия; магния стеарат; натрия стеарилфумарат.
Оболочка таблетки (Опадрай® II: Розовый 85 F97191 для дозировки 25 мг; Светло-бежевый 85 F 17498 для дозировки 50 мг; Бежевый 85 F 17438 для дозировки 100 мг) содержит поливиниловый спирт, титана диоксид, макрогол (полиэтиленгликоль) 3350, тальк, железа оксид желтый, железа оксид красный.
Круглые двояковыпуклые таблетки светло-розового цвета со слабым бежеватым оттенком, покрытые пленочной оболочкой с гравировкой «221» на одной стороне и гладкие на другой.
Таблетки 50 мг:
Круглые двояковыпуклые таблетки светло-бежевого цвета, покрытые пленочной оболочкой с гравировкой «112» на одной стороне и гладкие на другой.
Таблетки 100 мг:
Круглые двояковыпуклые таблетки бежевого цвета, покрытые пленочной оболочкой с гравировкой «277» на одной стороне и гладкие на другой.
Ингибитор Дипептидилпептидазы 4.
Код АТХ
А10ВН01
Фармакодинамика
ЯНУВИЯ (ситаглиптин) является активным при пероральном приеме, высоко селективным ингибитором фермента дипептидилпептидазы 4 (ДПП-4), предназначенным для лечения сахарного диабета 2 типа. Ситаглиптин отличается по химической структуре и фармакологическому действию от аналогов глюкагоноподобного пептида-1 (ГПП-1), инсулина, производных сульфонилмочевины, бигуанидов, агонистов гамма-рецепторов, активируемых пролифератором пероксисом (PPAR-?), ингибиторов альфа-гликозидазы, аналогов амилина. Ингибируя ДПП-4, ситаглиптин повышает концентрацию двух известных гормонов семейства инкретинов: ГПП-1 и глюкозо-зависимого инсулинотропного пептида (ГИП). Гормоны семейства инкретинов секретируются в кишечнике в течение суток, их уровень повышается в ответ на прием пищи. Инкретины являются частью внутренней физиологической системы регуляции гомеостаза глюкозы. При нормальном или повышенном уровне глюкозы крови гормоны семейства инкретинов способствуют увеличению синтеза инсулина, а также его секреции бета-клетками поджелудочной железы за счет сигнальных внутриклеточных механизмов, ассоциированных с циклическим АМФ.
ГПП-1 также способствует подавлению повышенной секреции глюкагона альфа-клетками поджелудочной железы. Снижение концентрации глюкагона на фоне повышения уровня инсулина способствует уменьшению продукции глюкозы печенью, что в итоге приводит к уменьшению гликемии.
При низкой концентрации глюкозы крови перечисленные эффекты инкретинов на выброс инсулина и уменьшение секреции глюкагона не наблюдаются. ГПП-1 и ГИП не влияют на выброс глюкагона в ответ на гипогликемию. В физиологических условиях активность инкретинов ограничивается ферментом ДПП-4, который быстро гидролизует инкретины с образованием неактивных продуктов.
Ситаглиптин предотвращает гидролиз инкретинов ферментом ДПП-4, тем самым увеличивая плазменные концентрации активных форм ГПП-1 и ГИП. Повышая уровень инкретинов, ситаглиптин увеличивает глюкозо-зависимый выброс инсулина и способствует уменьшению секреции глюкагона. У пациентов с сахарным диабетом 2 типа с гипергликемией эти изменения секреции инсулина и глюкагона приводят к снижению уровня гликозилированного гемоглобина НbА1С и уменьшению плазменной концентрации глюкозы, определяемой натощак и после нагрузочной пробы.
У пациентов с сахарным диабетом 2 типа прием одной дозы препарата ЯНУВИЯ приводит к ингибированию активности фермента ДПП-4 в течение 24 часов, что приводит к увеличению уровня циркулирующих инкретинов ГПП-1 и ГИП в 2-3 раза, нарастанию плазменной концентрации инсулина и С-пептида, снижению концентрации глюкагона в плазме крови, уменьшению гликемии натощак, а также уменьшению гликемии после нагрузки глюкозой или пищевой нагрузки.
Фармакокинетика
Фармакокинетика ситаглиптина всесторонне охарактеризована у здоровых лиц и пациентов с сахарным диабетом 2 типа. У здоровых лиц после перорального приема 100 мг ситаглиптина отмечается быстрая абсорбция препарата с достижением максимальной концентрации (Cmax) в интервале от 1 до 4 часов с момента приема. Площадь под кривой «концентрация – время» (AUC) увеличивается пропорционально дозе, и составляет у здоровых субъектов 8,52 ?Мхчас при приеме 100 мг внутрь, Cmax составляла 950 nM, средний период полувыведения составил 12,4 часа. Плазменная AUC ситаглиптина увеличивалась приблизительно на 14% после следующего приема дозы 100 мг препарата по достижению равновесного состояния после приема первой дозы. Внутри- и меж-субъектные коэффициенты вариации AUC ситаглиптина были незначительными.
Абсорбция
Абсолютная биодоступность ситаглиптина составляет приблизительно 87%. Поскольку совместный прием препарата ЯНУВИЯ и жирной пищи не оказывает эффекта на фармакокинетику, то препарат ЯНУВИЯ может назначаться вне зависимости от приема пищи.
Распределение
Средний объем распределения в равновесном состоянии после однократной дозы 100 мг ситаглиптина у здоровых добровольцев составляет приблизительно 198 л. Фракция ситаглиптина, связывающаяся с плазменными белками, относительно низка и составляет 38%.
Метаболизм
Приблизительно 79% ситаглиптина экскретируется в неизмененном виде с мочой.
Метаболизируется лишь незначительная часть поступившего в организм препарата.
После введения 14С-меченного ситаглиптина внутрь приблизительно 16% радиоактивного препарата экскретировалось в виде его метаболитов. Были обнаружены следы 6 метаболитов ситаглиптина, вероятно не обладающие ДПП-4-ингибирующей активностью. В исследованиях in vitro было выявлено, что первичным ферментом, участвующем в ограниченном метаболизме ситаглиптина, является CYP3A4 с участием CYP2C8.
Выведение
После введения 14С-меченного ситаглиптина внутрь здоровым добровольцам приблизительно 100% введенного препарата выводилось: 13% через кишечник, 87% почками – в течение одной недели после приема препарата. Средний период полувыведения ситаглиптина при пероральном приеме 100 мг составляет приблизительно 12,4 часа; почечный клиренс составляет приблизительно 350 мл/мин.
Выведение ситаглиптина осуществляется первично путем экскреции почками по механизму активной канальцевой секреции. Ситаглиптин является субстратом для транспортера органических анионов человека третьего типа (hOAT-3), который и может быть вовлечен в процесс выведения ситаглиптина почками. Клинически вовлеченность hOAT-3 в транспорт ситаглиптина не изучалась. Ситаглиптин также является субстратом р-гликопротеина, который также может участвовать в процессе почечной элиминации ситаглиптина. Однако, циклоспорин, являющийся ингибитором р-гликопротеина, не уменьшал почечный клиренс ситаглиптина.
Фармакокинетика у отдельных групп пациентов
Пациенты с почечной недостаточностью
Открытое исследование препарата ЯНУВИЯ в дозировке 50 мг в сутки было проведено с целью изучения его фармакокинетики у пациентов с различной степенью тяжести хронической почечной недостаточности. Включенные в исследование пациенты были разделены на группы мягкой почечной недостаточности (клиренс креатинина от 50 до 80 мл/мин), умеренной (клиренс креатинина от 30 до 50 мл/мин) и тяжелой почечной недостаточности (клиренс креатинина менее 30 мл/мин), а также пациенты с терминальной стадией патологии почек, нуждающиеся в диализе.
У пациентов с мягкой почечной недостаточностью не отмечалось клинически значимого изменения концентрации ситаглиптина в плазме по сравнению с контрольной группой здоровых добровольцев.
Увеличение AUC ситаглиптина приблизительно в два раза по сравнению с контрольной группой отмечалось у пациентов с умеренной почечной недостаточностью, приблизительно четырехкратное увеличение AUC отмечалось у пациентов с тяжелой почечной недостаточностью, а также у пациентов с терминальной стадией патологии почек по сравнению с контрольной группой. Ситаглиптин в слабой степени удалялся из циркуляции с помощью гемодиализа: только 13,5% дозы удалялось из организма в течение 3-4 часового сеанса диализа.
Таким образом, для достижения терапевтической концентрации препарата в плазме крови (сходной с таковой у пациентов с нормальной функцией почек) у пациентов с умеренной и тяжелой почечной недостаточностью требуется коррекция дозировки (см. Способ применения и дозировка).
Пациенты с печеночной недостаточностью
У пациентов с умеренной печеночной недостаточностью (7-9 баллов по шкале Чайлд-Пью) средняя AUC и Cmax ситаглиптина при однократном приеме 100 мг увеличиваются приблизительно на 21% и 13% соответственно. Таким образом, коррекции дозировки препарата при мягкой и умеренной печеночной недостаточности не требуется.
Нет клинических данных о применении ситаглиптина у пациентов с тяжелой печеночной недостаточностью (более 9 баллов по шкале Чайлд-Пью). Однако в следствие того, что препарат первично выводится почками, не следует ожидать значимого изменения фармакокинетики ситаглиптина у пациентов с тяжелой печеночной недостаточностью.
Пожилые пациенты
Возраст пациентов не оказывал клинически значимого воздействия на фармакокинетические параметры ситаглиптина. По сравнению с молодыми пациентами у пожилых пациентов (65-80 лет) концентрация ситаглиптина приблизительно на 19% выше. Коррекции дозы препарата в зависимости от возраста не требуется
Монотерапия
Препарат ЯНУВИЯ показан как дополнение к диете и физическим нагрузкам для улучшения контроля над гликемией у пациентов с сахарным диабетом 2 типа Комбинированная терапия
Препарат ЯНУВИЯ также показан пациентам с сахарным диабетом 2 типа для улучшения контроля над гликемией в комбинацией с метформином или агонистами PPAR? (например, тиазолидиндионом), когда диета и физическая нагрузка в сочетании с монотерапией перечисленными средствами не приводят к адекватному контролю над гликемией.
- повышенная чувствительность к какому-либо из компонентов препарата;
- беременность, период грудного вскармливания;
- сахарный диабет 1 типа;
- диабетический кетоацидоз.
Данных об использовании препарата ЯНУВИЯ в педиатрической практике у пациентов моложе 18 лет нет. Таким образом, использование препарата ЯНУВИЯ у данной категории пациентов не рекомендуется.
С осторожностью
Почечная недостаточность
Коррекция дозировки препарата ЯНУВИЯ требуется у пациентов с умеренной и тяжелой почечной недостаточностью, а также у пациентов с терминальной стадией почечной патологии, нуждающихся в гемодиализе (см. Способ применения и дозировка).
Применение при беременности и в период лактации
Не проводилось контролируемых исследований препарата ЯНУВИЯ у беременных, следовательно нет данных о безопасности его применения у беременных женщин. Препарат ЯНУВИЯ, как и другие пероральные гипогликемические препараты, не рекомендован к применению во время беременности. Отсутствуют данные об экскреции ситаглиптина с молоком. Следовательно, препарат ЯНУВИЯ не должен назначаться в период лактации.
Способ применения и дозировка
Рекомендуемая дозировка препарата ЯНУВИЯ составляет 100 мг один раз в сутки в качестве монотерапии или в комбинации с метформином или агонистом PPAR? (например, тиазолидиндионом).
ЯНУВИЯ может приниматься не зависимо от приема пищи.
В случае, если пациент пропустил прием препарата ЯНУВИЯ, он должен быть принят как можно быстрее после того, как пациент вспомнит о пропущенном приеме препарата. Не допустим прием двойной дозы препарата ЯНУВИЯ.
Пациенты с почечной недостаточностью
Пациентам с легкой почечной недостаточностью (клиренс креатинина ?50 мл/мин, приблизительно соответствующий уровню креатинина плазмы ?1,7 мг/дл у мужчин, ?1,5 мг/дл у женщин) коррекции дозировки препарата ЯНУВИЯ не требуется.
Для пациентов с умеренной почечной недостаточностью (клиренс креатинина ?30 мл/мин, но <50 мл/мин, приблизительно соответствующий уровню креатинина плазмы >1,7 мг/дл, но ?3 мг/дл у мужчин, >1,5 мг/дл, но ?2,5 мг/дл у женщин) доза препарата ЯНУВИЯ составляет 50 мг один раз в сутки.
Для пациентов с тяжелой почечной недостаточностью (клиренс креатинина <30 мл/мин, приблизительно соответствующий уровню креатинина плазмы >3 мг/дл у мужчин, >2,5 мг/дл у женщин), а также с терминальной стадией патологии почек, нуждающихся в гемодиализе, доза препарата ЯНУВИЯ составляет 25 мг один раз в сутки. Препарат ЯНУВИЯ может применяться вне зависимости от расписания процедуры гемодиализа.
Пациенты с печеночной недостаточностью
Не требуется коррекции дозировки препарата ЯНУВИЯ у пациентов с легкой и умеренной печеночной недостаточностью. Препарат не исследовался у пациентов с тяжелой печеночной недостаточностью.
Пожилые пациенты
Не требуется коррекции дозировки препарата ЯНУВИЯ у пожилых пациентов.
Препарат ЯНУВИЯ в целом хорошо переносится как в качестве монотерапии, так и в комбинации с другими гипогликемическими препаратами. В клинических исследованиях общая частота встречаемости побочных эффектов, а также частота отмены препарата из-за побочных нежелательных явлений, были схожи с таковыми при приеме плацебо.
Побочные явления, встречавшиеся без причинной связи с приемом препарата ЯНУВИЯ в дозе 100 мг и 200 мг в сутки, но чаще чем при приеме плацебо, с частотой ?3%: инфекция верхних дыхательных путей (ЯНУВИЯ 100 мг – 6,8%, ЯНУВИЯ 200 мг – 6,1%, плацебо – 6,7%), назофарингит (ЯНУВИЯ 100 мг – 4,5%, ЯНУВИЯ 200 мг – 4,4%, плацебо – 3,3%), головная боль (ЯНУВИЯ 100 мг – 3,6%, ЯНУВИЯ 200 мг – 3,9%, плацебо – 3,6%), диарея (ЯНУВИЯ 100 мг – 3,0%, ЯНУВИЯ 200 мг – 2,6%, плацебо – 2,3%), артралгия (ЯНУВИЯ 100 мг – 2,1%, ЯНУВИЯ 200 мг – 3,3%, плацебо – 1,8%)
Общая частота развития гипогликемии у пациентов, получавших препарат ЯНУВИЯ, была сходна с таковой при приеме плацебо (ЯНУВИЯ 100 мг – 1,2%, ЯНУВИЯ 200 мг – 0,9%, плацебо – 0,9%).
Частота встречаемости некоторых побочных эффектов со стороны желудочно-кишечного тракта при приеме препарата ЯНУВИЯ в обеих дозировках была схожа с таковой при приеме плацебо, за исключением более частой тошноты при приеме препарата ЯНУВИЯ в дозе 200 мг в сутки: боль в животе (ЯНУВИЯ 100 мг – 2,3%, ЯНУВИЯ 200 мг – 1,3%, плацебо – 2,1%), тошнота (ЯНУВИЯ 100 мг – 1,4%, ЯНУВИЯ 200 мг – 2,9%, плацебо – 0,6%), рвота (ЯНУВИЯ 100 мг – 0,8%, ЯНУВИЯ 200 мг – 0,7%, плацебо – 0,9%), диарея (ЯНУВИЯ 100 мг – 3,0%, ЯНУВИЯ 200 мг – 2,6%, плацебо – 2,3%).
Изменения лабораторных показателей
Анализ клинических исследований препарата показал небольшое увеличение мочевой кислоты (приблизительно на 0,2 мг/дл по сравнению с плацебо, средний уровень 5-5,5 мг/дл) у пациентов, получавших препарат ЯНУВИЯ в дозе 100 и 200 мг в сутки. Случаев развития подагры зарегистрировано не было.
Наблюдалось небольшое уменьшение концентрации общей щелочной фосфатазы (приблизительно на 5 МЕ/л по сравнению с плацебо, средний уровень 56-62 МЕ/л), частично связанное с небольшим уменьшением костной фракции щелочной фосфатазы.
Отмечалось небольшое увеличение содержания лейкоцитов (приблизительно на 200/мкл по сравнению с плацебо, средний уровень 6600/мкл), обусловленное увеличением количества нейтрофилов. Это наблюдение отмечалось в большинстве, но не во всех исследованиях.
Перечисленные изменения лабораторных показателей не считаются клинически значимыми.
За время лечения препаратом ЯНУВИЯ не отмечалось клинически значимых изменений жизненных показателей и ЭКГ (включая интервал QTc).
Во время клинических исследований на здоровых добровольцах, разовая доза 800 мг препарата ЯНУВИЯ в целом хорошо переносилась. Минимальные изменения интервала QTc, не считающиеся клинически значимыми, отмечались в одном из исследований препарата ЯНУВИЯ в дозе 800 мг в сутки. Доза свыше 800 мг в сутки у людей не изучалась.
В случае передозировки необходимо начать стандартные поддерживающие мероприятия: удаление неабсорбированного препарата из желудочно-кишечного тракта, осуществление мониторирования показателей жизнедеятельности, включая ЭКГ, а также назначение поддерживающей терапии, если требуется.
Ситаглиптин слабо диализируется. В клинических исследованиях только 13,5% дозы удалялось из организма в течение 3-4 часового сеанса диализа. Пролонгированный диализ может назначаться в случае клинической необходимости. Данных об эффективности перитонеального диализа ситаглиптина нет.
Взаимодействие с другими лекарственными средствами
В исследованиях по взаимодействию с другими лекарственными средствами, ситаглиптин не оказывал клинически значимого эффекта на фармакокинетику следующих препаратов: метформина, розиглитазона, глибенкламида, симвастатина, варфарина, пероральных контрацептивов. Основываясь на этих данных, ситаглиптин не ингибирует CYP изоэнзимы CYP3А4, 2С8 или 2С9. Основываясь на данные, полученные in vitro, ситаглиптин также вероятно не ингибирует CYP2D6, 1А2, 2С19 или 2В6, а также не индуцирует СYP3А4.
Было отмечено легкое увеличение AUC (11%), а также средней Сmax (18%) дигоксина при совместном применении с ситаглиптином. Это увеличение не считается клинически значимым. Не рекомендуется изменение дозы ни дигоксина, ни препарата ЯНУВИЯ при совместном их применении.
Было отмечено увеличение AUC и Сmax препарата ЯНУВИЯ на 29% и 68% соответственно у пациентов при совместном применении разовой пероральной дозы 100 мг препарата ЯНУВИЯ и разовой пероральной дозы 600 мг циклоспорина, мощного ингибитора р-гликопротеина.
Наблюдаемые изменения фармакокинетических характеристик ситаглиптина не считаются клинически значимыми. Не рекомендуется изменение дозы препарата ЯНУВИЯ при совместном применении с циклоспорином и другими ингибиторами р-гликопротеина (например, кетоконазолом).
Популяционный фармакокинетический анализ пациентов и здоровых добровольцев (N=858) на широкий спектр сопутствующих препаратов (N=83, приблизительно половина из которых выводится почками) не выявил каких-либо клинически значимых эффектов этих веществ на фармакокинетику ситаглиптина.
Гипогликемия
В клинических исследованиях препарата ЯНУВИЯ в качестве монотерапии или как части комбинированной терапии с метформином или пиоглитазоном, частота развития гипогликемии при использовании препарата ЯНУВИЯ была сходной с частотой развития гипогликемии при использовании плацебо. Совместное применение препарата ЯНУВИЯ в комбинации с препаратами, способными вызывать гипогликемию, такими как инсулин, производные сульфонилмочевины, не исследовалось.
Применение у лиц пожилого возраста.
В клинических исследованиях эффективность и безопасность препарата ЯНУВИЯ у пожилых (?65 лет, 409 пациентов) были сравнимы с этими показателями у пациентов моложе 65 лет.
Коррекции дозировки по возрасту не требуется. Пожилые пациенты чаще склонны к развитию почечной недостаточности. Соответственно, как и в других возрастных группах необходима коррекция дозировки у пациентов с выраженной почечной недостаточностью (см. Способ применения и дозировка).
Влияние на способность управления автотранспортом и работы с механизмами
.
Не проводилось исследований по изучению влияния препарата ЯНУВИЯ на способность управлять автотранспортом. Тем не менее, не ожидается отрицательного влияния препарата ЯНУВИЯ на способность управления автомобилем или сложными механизмами.
По 14 таблеток в ПВХ/Ал блистер. 1, 2, 4, 6 или 7 блистеров помещают в картонную пачку вместе с инструкцией по применению.
Хранить при температуре не выше 30°С.
Хранить в недоступном для детей месте.
2 года.
Не использовать по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
По рецепту.
Фирма-производитель
«Мерк Шарп и Доум Б.В.», Нидерланды.
(адрес: Ваардервег 39, 2031 БН Хаарлем, Нидерланды / Waarderweg 39, 2031 BN Haarlem, The Netherlands)
Представительство компании в России
«Мерк Шарп и Доум ИДЕА, Инк.».
121059 Россия, Москва, Площадь Европы 2,
1 таблетка, покрытая пленочной оболочкой, содержит 100 мг ситаглиптина в форме ситаглиптина фосфата моногидрата.
Вспомогательные вещества: целлюлоза микрокристаллическая; кальция фосфат
двухосновный безводный, неизмельченный; натрия кроскармеллоза; магния стеарат; натрия стеарилфумарат.
Оболочка таблетки (Опадрай® II: Бежевый 85 F17438) содержит поливиниловый спирт, титана диоксид (Е171), макрогол (полиэтиленгликоль) 3350, тальк, железа оксид желтый (Е172), железа оксид красный (Е172).
Круглые,двояковыпуклые таблетки, покрытые пленочной оболочкой светло-розового со слабымбежеватым оттенком цвета, с гравировкой «221» на одной стороне и гладкие надругой (для дозировки 25 мг).
Круглые, двояковыпуклые таблетки, покрытые пленочнойоболочкой светло-бежевого цвета, с гравировкой «112» на одной стороне и гладкиена другой (для дозировки 50 мг).
Круглые, двояковыпуклые таблетки, покрытые пленочной оболочкойбежевого цвета, с гравировкой «277» на одной стороне и гладкие на другой (длядозировки 100 мг).
Янувия® является активным при пероральном приеме, высокоселективным ингибитором фермента дипептидилпептидазы 4 (ДПП-4), предназначеннымдля лечения сахарного диабета 2 типа. Ингибируя ДПП-4, ситаглиптин повышаетконцентрацию двух известных гормонов семейства инкретинов: ГПП-1(глюкагонподобный пептид) и глюкозозависимого инсулинотропного пептида (ГИП).Гормоны семейства инкретинов секретируются в кишечнике в течение суток, ихуровень повышается в ответ на прием пищи. Инкретины являются частью внутреннейфизиологической системы регуляции гомеостаза глюкозы. При нормальном илиповышенном уровне глюкозы крови гормоны семейства инкретинов способствуютувеличению синтеза инсулина, а также его секреции бета-клетками поджелудочнойжелезы за счет сигнальных внутриклеточных механизмов, ассоциированных сциклическим АМФ (аденозинмонофосфат).
ГПП-1 также способствует подавлению повышенной секрецииглюкагона альфа-клетками поджелудочной железы. Снижение концентрации глюкагонана фоне повышения уровня инсулина способствует уменьшению продукции глюкозыпеченью, что в итоге приводит к уменьшению гликемии.
При низкой концентрации глюкозы крови перечисленные эффектыинкретинов на выброс инсулина и уменьшение секреции глюкагона не наблюдаются.ГПП-1 и ГИП не влияют на выброс глюкагона в ответ на гипогликемию. Вфизиологических условиях активность инкретинов ограничивается ферментом ДПП-4,который быстро гидролизует инкретины с образованием неактивных продуктов.
Янувия® предотвращаетгидролиз инкретинов ферментом ДПП-4, тем самым увеличивая плазменныеконцентрации активных форм ГПП-1 и ГИП. Повышая уровень инкретинов, Янувия® увеличивает глюкозо-зависимый выброс инсулинаи способствует уменьшению секреции глюкагона. У пациентов с сахарным диабетом 2типа с гипергликемией эти изменения секреции инсулина и глюкагона приводят кснижению уровня гликозилированного гемоглобина НbА1С и уменьшению плазменнойконцентрации глюкозы, определяемой натощак и после нагрузочной пробы.
У пациентов с сахарным диабетом 2 типа прием одной дозыпрепарата Янувия® приводит кингибированию активности фермента ДПП-4 в течение 24 часов, что приводит кувеличению уровня циркулирующих инкретинов ГПП-1 и ГИП в 2-3 раза, нарастаниюплазменной концентрации инсулина и С-пептида, снижению концентрации глюкагона вплазме крови, уменьшению гликемии натощак, а также уменьшению гликемии посленагрузки глюкозой или пищевой нагрузки.
После перорального приема 100 мг ситаглиптина отмечаетсябыстрая абсорбция препарата с достижением максимальной концентрации (Cmax) винтервале от 1 до 4 часов с момента приема. Площадь под кривой»концентрация – время» (AUC) увеличивается пропорционально дозе, исоставляет 8,52 мкмоль·час при приеме 100 мг внутрь, Cmax составляла 950 нмоль.Плазменная AUC ситаглиптина увеличивалась приблизительно на 14% послеследующего приема дозы 100 мг препарата по достижению равновесного состоянияпосле приема первой дозы.
Абсолютная биодоступность ситаглиптина составляетприблизительно 87%. Поскольку совместный прием препарата Янувия® и жирной пищи не оказывает эффекта нафармакокинетику, то препарат Янувия® можетназначаться вне зависимости от приема пищи.
Средний объем распределения в равновесном состоянии послеоднократной дозы 100 мг ситаглиптина составляет приблизительно 198 л. Фракция ситаглиптина,связывающаяся с плазменными белками, относительно низка и составляет 38%.
После введения ситаглиптина внутрь приблизительно 16%препарата экскретировалось в виде его метаболитов. Были обнаружены следы 6метаболитов ситаглиптина, вероятно не обладающие ДПП-4-ингибирующейактивностью. Было выявлено, что первичным ферментом, участвующем в ограниченномметаболизме ситаглиптина, является CYP3A4 с участием CYP2C8.
Приблизительно 79% ситаглиптина экскретируется внеизмененном виде с мочой. Метаболизируется лишь незначительная частьпоступившего в организм препарата.
После приема ситаглиптина внутрь приблизительно 13%выводилось через кишечник, 87% почками – в течение одной недели после приемапрепарата. Средний период полувыведения ситаглиптина при пероральном приеме 100мг составляет приблизительно 12,4 часа; почечный клиренс составляетприблизительно 350 мл/мин.
Выведение ситаглиптина осуществляется первично путемэкскреции почками по механизму активной канальцевой секреции. Ситаглиптинявляется субстратом для транспорта органических анионов человека третьего типа(hOAT-3), в качестве которого ситаглиптинвыводится почками. Ситаглиптин также является субстратом р-гликопротеина,который также может участвовать в процессе почечной элиминации ситаглиптина.Однако циклоспорин, являющийся ингибитором р-гликопротеина, не уменьшалпочечный клиренс ситаглиптина.
Пациенты с почечной недостаточностью
У пациентов с легкой почечной недостаточностью (клиренскреатинина 50-80 мл/мин.) не отмечалось клинически значимого измененияконцентрации ситаглиптина в плазме по сравнению с контрольной группой здоровыхдобровольцев.
Увеличение AUC ситаглиптина приблизительно в 2 раза посравнению с контрольной группой отмечалось у пациентов с почечнойнедостаточностью средней степени (клиренс креатинина 30-50 мл/мин.).Приблизительнов 4 раза увеличение AUC отмечалось у пациентов с почечной недостаточностьютяжелой степени (клиренс креатинина менее 30 мл/мин.), а также у пациентов с терминальной стадией почечнойнедостаточности по сравнению сконтрольной группой. Поэтому длядостижения терапевтической концентрации препарата в плазме крови (сходной стаковой у пациентов с нормальной функцией почек) у пациентов с почечнойнедостаточностью средней и тяжелой степени требуется коррекция дозы.
Ситаглиптин в слабойстепени удалялся из системного кровотока с помощью гемодиализа: только 13.5%дозы удалялось из организма в течение 3-4 часового сеанса диализа.
Пациенты с печеночной недостаточностью
У пациентов с умеренной печеночной недостаточностью (7-9баллов по шкале Чайлд-Пью) средняя AUC и Cmax ситаглиптина при однократномприеме 100 мг увеличиваются приблизительно на 21% и 13% соответственно.Поэтому коррекции дозы препарата прилегкой и умеренной печеночной недостаточности не требуется.
Нет клинических данных о применении ситаглиптина у пациентовс тяжелой печеночной недостаточностью (более 9 баллов по шкале Чайлд-Пью).Однако вследствие того, что Янувия® первично выводится почками, не следуетожидать значимого изменения фармакокинетики ситаглиптина у пациентов с тяжелойпеченочной недостаточностью.
— сахарный диабет 2типа (инсулиннезависимый) в качестве монотерапии как дополнение к физическим нагрузкам и при неэффективности диетотерапии
— сахарный диабет 2 типа(инсулиннезависимый) в составе комплексной терапии
— повышенная чувствительность к какому-либо из компонентовпрепарата
— беременность и период лактации
— сахарный диабет 1 типа (инсулинзависимый)
— диабетический кетоацидоз
— детский и подростковый возраст до 18 лет (ввиду отсутствияклинических
данных)
Начальная рекомендуемая доза – 25 мг под контролем лечащеговрача. Поддерживающая доза препарата Янувия® составляет 100 мг один раз в суткив качестве монотерапии или в комбинации с метформином или агонистом PPARγ(например, тиазолидиндионом).
Длительность терапии препаратом Янувия® и коррекция дозыопределяется лечащим врачом под контролем гликемического профиля.
Янувия® может приниматься независимо от приема пищи.
В случае, если пациент пропустил прием препарата Янувия®, ондолжен быть принят как можно быстрее после того, как пациент вспомнит опропущенном приеме препарата. Не допустим прием двойной дозы препарата Янувия®
Пациенты с почечной недостаточностью
Пациентам с легкой почечной недостаточностью (клиренскреатинина ≥50 мл/мин, приблизительно соответствующий уровню креатинина плазмы≤1,7 мг/дл у мужчин, ≤1,5 мг/дл у женщин) коррекции дозировки препарата Янувия®не требуется.
Для пациентов с умеренной почечной недостаточностью (клиренскреатинина ≥30 мл/мин, но <50 мл/мин, приблизительно соответствующий уровнюкреатинина плазмы >1,7 мг/дл, но ≤3 мг/дл у мужчин, >1,5 мг/дл, но ≤2,5мг/дл у женщин) доза препарата Янувия®составляет 50 мг один раз в сутки.
Для пациентов с тяжелой почечной недостаточностью (клиренскреатинина <30 мл/мин, приблизительно соответствующий уровню креатининаплазмы >3 мг/дл у мужчин, >2,5 мг/дл у женщин), а также с терминальнойстадией патологии почек, нуждающихся в гемодиализе, доза препарата Янувия® составляет25 мг один раз в сутки. Препарат Янувия ® может применяться вне зависимости отрасписания процедуры гемодиализа.
Пациенты с печеночной недостаточностью
Не требуется коррекции дозировки препарата Янувия® упациентов с легкой и умеренной печеночной недостаточностью. Препарат неисследовался у пациентов с тяжелой печеночной недостаточностью.
— инфекции верхних дыхательных путей, назофарингит
— головная боль
— артралгии
— тошнота, рвота,боль в животе, диарея
Редко
— острый панкреатит, в том числе геморрагический и некротический
— увеличение мочевой кислоты в крови, снижение активностиобщей щелочной фосфатазы исоответственно костной фракции щелочной фосфатазы
— лейкоцитоз, обусловленный увеличением количестванейтрофилов
Симптомы: усиление побочных эффектов препарата, удлинениеQ-T
Лечение: удаление неабсорбированного препарата изжелудочно-кишечного тракта, осуществление мониторирования показателейжизнедеятельности, включая ЭКГ, симптоматическая терапия.
Ситаглиптин слабо диализируется, но пролонгированный диализможет назначаться в случае клинической необходимости (в течение 3-4 часовудаляется 13,5%).
В исследованиях по взаимодействию с другими лекарственнымисредствами, ситаглиптин не оказывал клинически значимого эффекта нафармакокинетику следующих препаратов: метформина, розиглитазона, глибенкламида,симвастатина, варфарина, пероральных контрацептивов.
Было отмечено легкое увеличение AUC на 11%, а также среднейСmax на 18% дигоксина при совместномприменении с ситаглиптином. Это увеличение не считается клинически значимым, ипоэтому не требует коррекции дигоксинаи Янувии® при совместном их применении.
Было отмечено увеличение AUC и Сmax ситаглиптина на 29% и 68% соответственно упациентов при совместном применении разовой пероральной дозы 100 мг препарата Янувия®и разовой пероральной дозы 600 мг циклоспорина, мощного ингибиторар-гликопротеина. Наблюдаемые изменения фармакокинетических характеристикситаглиптина не считаются клинически значимыми и не требуют коррекции дозы Янувии® присовместном применении с циклоспорином и другими ингибиторами р-гликопротеина(например, кетоконазолом).
Янувия® используется в составе комплексной терапииинсулиннезависимого сахарного диабета 2 типа со следующими препаратами:инсулин, метформин, сульфонилмочевина, тиазолидиндионы.
Постмаркетинговое использование у пациентов, принимающих ситаглиптин.
При постмаркетинговом использовании были сообщения об остромпанкреатите, включая геморрагический или некротический панкреатит с или безлетального исхода (см. Побочные действия),
Поскольку эти отчеты были проведены на добровольцахразличного телосложения, не возможно было достоверно оценить их частоту илиустановить причинно-следственную связь с воздействием препарата. Пациентыдолжны быть информированы о характерных симптомах острого панкреатита:постоянные, тяжелые боли в брюшной полости. Панкреатит проходил послепрекращения приема ситаглиптина. При подозрении на панкреатит прием Янувия® идругих потенциальных препаратов, провоцирующих развитие паркреатита должен бытьпрекращен.
Особенности влияния лекарственного препарата на способностьуправлять
автотранспортом или движущимися механизмами
Учитывая возможность развития побочных эффектов на фонелечения препаратом Янувия®, нужно проявлять особую осторожность при управленииавтомобилем и работе с механизмами.
По 14 таблеток в контурную ячейковую упаковку из пленкиполивинилхлоридной и фольги алюминиевой. По 2 контурные упаковки вместе с инструкцией по медицинскому применению нагосударственном и русском языках помещают в картонную пачку.
Хранить при температуре не выше 30 °С.
Хранить в недоступном для детей месте!
3 года
Не применять по истечении срока годности, указанного на упаковке.

Товары из категории — Эндокринология
Инструкция по применению
Цена в интернет-аптеке WER.RU: от 1 590
Фармакологические свойства
Медикаментозное средство Янувия является противодиабетическим средством, которое предназначено для лечения инсулиннезависимого диабета. В состав медикамента входит активное вещество ситаглиптин, которое оказывает направленное воздействие на содержание глюкозы и инсулина в организме.
Ситаглиптин существенно отличается по составу и воздействию от веществ, которые считаются аналогами медикамента, таких как энтероглюкагон, белковый гормон поджелудочной железы инсулин, синтетические противодиабетические средства, гипогликемические лекарственные средства, тиазолидиндионы, ингибиторы альфа-глюкозидазы, островковый амилоидный полипептид поджелудочной железы.
Медикамент является ингибитором дипептидил пептидазы, увеличивает уровень содержания жизненно важных гормонов энтероглюкагона и гастроингибиторного полипептида. Уровень гормонов поднимается после приема пищи, они способствуют нормальному усвоению и регулированию уровня декстрозы.
Медикамент хорошо воспринимается большинством пациентов. Средство назначается пациентам при инсулиннезависимом диабете. Уже после первого приема видны хорошие результаты. Медикамент быстро всасывается и начинает действовать уже спустя час после приема, максимально время абсорбции составляет четыре часа. Принимать медикамент можно в любое время дня, вне зависимости от приема пищи.
Медикаментозное средство хорошо усваивается в организме. Около 80 % компонентов лекарства выводятся из организма вместе с мочой. Уже спустя неделю после приема медикамента отмечаются значительные улучшения в ходе течения болезни.
Терапия больных с заболеваниями почек. Медикаментозное средство тестировалось на пациентах с разной формой заболевания почек: от самой начальной до тяжелой степени. Исследования показали, что медикамент оказывает разное воздействие на пациентов в зависимости от формы заболевания почек.
Медикаментозное средство не оказало никакого воздействия на пациентов, которые страдают легкой формой заболевания почек, поэтому таким пациентам не требуется коррекция рекомендуемой дозировки и им можно назначать по 100 мг средства.
При средней степени почечной недостаточности у пациентов наблюдалось повышение уровня содержания компонентов средства, так как средство не выводится в достаточном количестве из организма. Таким пациентам необходимо понижать дозировку до 50 мг в день.
При выраженном синдроме нарушения всех функций почек, пациенты нуждаются в уменьшении дозировки до 25 мг в день, так как почки не справляются уже со своей функцией и не способны выводить вещества из организма, что может привести к развитию гипогликемии и интоксикации организма.
Терапия пациентов с заболеваниями печени. При терапии медикаментом Янувия пациентов, у которых обнаружено нарушение одной или нескольких функций печени, уменьшать дозировку не требуется. Медикамент можно принимать в дозе, составляющей 100 мг в день.
Сведений и показаний о воздействии компонентов медикамента на пациентов, которые страдают тяжелой формой печеночной недостаточности, нет. Учитывая тот факт, что медикаментозное средство и его компоненты выводятся из организма через почки, можно предположить, что негативного воздействия на пациента рекомендуемая дозировка не окажет.
Терапия пациентов пожилого возраста. Медикаментозное средство не оказывает негативного воздействия на здоровье пациентов пожилого возраста. Пациенты, возраст которых превышает 65 лет, не нуждаются в корректировке дозировки медикамента.
Терапия детей. Медикаментозное средство не следует назначать детям, возраст которых не достигает 18-ти лет, так как исследований о воздействии медикамента на детский организм не проводилось.
Состав и форма выпуска
Медикаментозное средство выпускается в виде капсуловидных таблеток, покрытых тонкой пленочной оболочкой, которые могут иметь молекулярную массу в 25, 50 или 100 мг для удобства использования. В одной пачке содержится два блистера по 14 таблеток в каждом.
В состав препарата Янувия входят следующие компоненты:
Оболочка состоит из:
Показания к применению
Медикаментозное средство используется в качестве монотерапии или комплексного лечения. Препарат назначают при инсулиннезависимом диабете, когда соблюдение рекомендуемой диеты и ограничений физических нагрузок не приводят к нужному результату. Прием медикамента снижает риск значительного снижения концентрации глюкозы в сыворотке крови.
Международная классификация болезней (МКБ-10)
Е.11. Инсулиннезависимый сахарный диабет.
Побочные эффекты
Прием медикамента может стать причиной проявления ряда побочных признаков:
Противопоказания
Препарат Янувия не рекомендуется принимать пациентам при:
Применение при беременности
Нет сведений и исследований о воздействии медикамента на плод, находящийся в утробе женщины, поэтому следует отказаться от приема медикамента во время вынашивания ребенка.
Во время терапии при помощи медикамента Янувия следует отказаться от грудного вскармливания, та как сведений о проникновении компонентов средства с грудным молоком в организм младенца нет.
Способ и особенности использования
Медикаментозное средство предназначено для внутреннего приема. Используется медикамент для монотерапии, а также в качестве комплексного воздействия на болезнь в сочетании с другими препаратами.
Рекомендуемая суточная дозировка составляет 100 мг лекарства. Принимать дозу необходимо дин раз в день. Использовать медикамент можно в любое время дня вне зависимости от употребления пищи. При пропуске таблетки необходимо как можно быстрее восполнить пробел. Нельзя принимать в день больше, чем одну таблетку.
При лёгкой степени заболеваний почек пациенты не нуждаются в корректировке дозы, при средней степени тяжести заболевания, пациентам необходимо уменьшить дозировку до 50 мг в день, при почечной недостаточности в тяжелой форме пациентам нужно назначать не более 25 мг в сутки.
Пациентам, страдающим заболеваниями печени, корректировка дозировки не требуется.
Пожилые пациенты, возраст которых выше 65 лет, могут принимать медикамент в рекомендуемой дозировке без корректировки.
Назначать медикамент детям, возраст которых не достигает 18-ти лет, нельзя, так как нет данных о воздействии компонентов средства на развивающийся организм.
В инструкции по применению содержится подробная информация о рекомендуемых дозировках и продолжительности терапии, однако окончательное решение принимает лечащий врач после проведения обследования, сбора анализов и определения анамнеза.
Совместимость с алкоголем
Медикаментозное средство нельзя принимать вместе со спиртосодержащими напитками, так как это может привести к проявлению побочных эффектов и других симптоматических признаков.
Взаимодействие с другими лекарствами
Медикаментозное средство не рекомендуется принимать с сердечным гликозидом Digoxin, так как это может стать причиной увеличения концентрации компонентов Янувии в организме.
При одновременном приеме препарата Янувии с мощным иммунодепрессантом Cyclosporinum отмечалось повышение уровня ситаглиптина в организме.
Передозировка
При передозировке медикаментом у пациента может измениться показатель частоты сердечного ритма.
Если проявились побочные эффекты или обнаружились другие симптоматические признаки, пациенту необходимо обратиться к лечащему врачу для получения своевременной терапевтической помощи.
Помощь при передозировке:
Аналоги
Аналогами медикамента Янувия по составу и фармакологическому воздействию являются следующие препараты:
Условия продажи
Медикаментозное средство Янувия продается в аптечных пунктах по назначению лечащего врача и при наличии рецептурного листа.
Условия хранения
Медикаментозное средство Янувия рекомендуется хранить в недоступном для детей месте при температуре, не превышающей 30 °С. Срок хранения медикамента составляет два года с даты изготовления. По истечении срока годности использовать медикамент нельзя и его необходимо утилизировать в соответствии с санитарными нормами. Инструкция по применению содержит более подробную информацию о нормах хранения и сроках годности медикамента в открытом и запечатанном виде.
Цены на Янувия в Москве
Заберите заказ в в аптеке
WER (г. Москва)
Цена: от 1 590 руб.