Загрузить PDF
Загрузить PDF
Если таблица Менделеева кажется вам сложной для понимания, вы не одиноки! Хотя бывает непросто понять ее принципы, умение работать с ней поможет при изучении естественных наук. Для начала изучите структуру таблицы и то, какую информацию можно узнать из нее о каждом химическом элементе. Затем можно приступить к изучению свойств каждого элемента. Наконец, с помощью таблицы Менделеева можно определить число нейтронов в атоме того или иного химического элемента.
-
1
Таблица Менделеева, или периодическая система химических элементов, начинается в левом верхнем углу и заканчивается в конце последней строки таблицы (в нижнем правом углу). Элементы в таблице расположены слева направо в порядке возрастания их атомного номера. Атомный номер показывает, сколько протонов содержится в одном атоме. Кроме того, с увеличением атомного номера возрастает и атомная масса. Таким образом, по расположению того или иного элемента в таблице Менделеева можно определить его атомную массу.
- Атомная масса увеличивается слева направо и сверху вниз, поскольку в атомах элементов с бо́льшим номером содержится больше протонов и нейтронов. Каждый последующий элемент содержит больше протонов, чем предыдущий, поэтому возрастает и его атомная масса.
- В атомной массе не учитываются электроны, поскольку они весят намного меньше, чем протоны и нейтроны.[1]
-
2
Как видно, каждый следующий элемент содержит на один протон больше, чем предшествующий ему элемент. Это очевидно, если посмотреть на атомные номера. Атомные номера возрастают на один при движении слева направо. Поскольку элементы расположены по группам, некоторые ячейки таблицы остаются пустыми.[2]
- Например, первая строка таблицы содержит водород, который имеет атомный номер 1, и гелий с атомным номером 2. Однако они расположены на противоположных краях, так как принадлежат к разным группам.
-
3
Узнайте о группах, которые включают в себя элементы со схожими физическими и химическими свойствами. Элементы каждой группы располагаются в соответствующей вертикальной колонке. Как правило, они обозначаются одним цветом, что помогает определить элементы со схожими физическими и химическими свойствами и предсказать их поведение.[3]
Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке.[4]
- Водород можно отнести как к группе щелочных металлов, так и к группе галогенов. В некоторых таблицах его указывают в обеих группах.
- В большинстве случаев группы пронумерованы от 1 до 18, и номера ставятся вверху или внизу таблицы. Номера могут быть указаны римскими (например, IA) или арабскими (например,1A или 1) цифрами.
- При движении вдоль колонки сверху вниз говорят, что вы «просматриваете группу».
-
4
Узнайте, почему в таблице присутствуют пустые ячейки. Элементы упорядочены не только в соответствии с их атомным номером, но и по группам (элементы одной группы обладают схожими физическими и химическими свойствами). Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.[5]
- Например, первые 3 строки имеют пустые ячейки, поскольку переходные металлы встречаются лишь с атомного номера 21.
- Элементы с атомными номерами с 57 по 71 относятся к редкоземельным элементам, и обычно их выносят в отдельную подгруппу в нижнем правом углу таблицы.
-
5
Каждая строка таблицы представляет собой период. Все элементы одного периода имеют одинаковое число атомных орбиталей, на которых расположены электроны в атомах. Количество орбиталей соответствует номеру периода. Таблица содержит 7 строк, то есть 7 периодов.[6]
- Например, атомы элементов первого периода имеют одну орбиталь, а атомы элементов седьмого периода — 7 орбиталей.
- Как правило, периоды обозначаются цифрами от 1 до 7 слева таблицы.
- При движении вдоль строки слева направо говорят, что вы «просматриваете период».
-
6
Научитесь различать металлы, металлоиды и неметаллы. Вы лучше будете понимать свойства того или иного элемента, если сможете определить, к какому типу он относится. Для удобства в большинстве таблиц металлы, металлоиды и неметаллы обозначаются разными цветами. Металлы находятся в левой, а неметаллы — в правой части таблицы. Металлоиды расположены между ними.[7]
- Помните, что по свойствам водород можно отнести как к щелочным металлам, так и к галогенам, поэтому он может иметь разный цвет и располагаться в двух ячейках.
- Металлические элементы блестят, являются твердыми при комнатной температуре (за исключением ртути), хорошо проводят тепло и электрический заряд и достаточно пластичны.
- Неметаллы не имеют выраженного блеска, плохо проводят тепло и электрический заряд, обладают низкой пластичностью. Как правило, при комнатной температуре неметаллические элементы представляют собой газ, но при определенных температурах и давлениях они могут принимать жидкое или твердое состояние.
- Металлоиды совмещают в себе свойства металлов и неметаллов.[8]
Реклама
-
1
Каждый элемент обозначается одной или двумя латинскими буквами. Как правило, символ элемента приведен крупными буквами в центре соответствующей ячейки. Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.[9]
- Обычно символы элементов являются сокращением их латинского названия, хотя для некоторых, особенно недавно открытых элементов, они получены из общепринятого названия. К примеру, гелий обозначается символом He, что близко к общепринятому названию в большинстве языков. В то же время железо обозначается как Fe, что является сокращением его латинского названия.
-
2
Обратите внимание на полное название элемента, если оно приведено в таблице. Это «имя» элемента используется в обычных текстах. Например, «гелий» и «углерод» являются названиями элементов. Обычно, хотя и не всегда, полные названия элементов указываются под их химическим символом.[10]
- Иногда в таблице не указываются названия элементов и приводятся лишь их химические символы.
-
3
Найдите атомный номер. Обычно атомный номер элемента расположен вверху соответствующей ячейки, посередине или в углу. Он может также находиться под символом или названием элемента. Элементы имеют атомные номера от 1 до 118.[11]
- Атомный номер всегда является целым числом.
-
4
Помните о том, что атомный номер соответствует числу протонов в атоме. Все атомы того или иного элемента содержат одинаковое количество протонов. В отличие от электронов, количество протонов в атомах элемента остается постоянным. В противном случае получился бы другой химический элемент![12]
- По атомному номеру элемента можно также определить количество электронов и нейтронов в атоме.
-
5
Обычно количество электронов равно числу протонов. Исключением является тот случай, когда атом ионизирован. Протоны имеют положительный, а электроны — отрицательный заряд. Поскольку атомы обычно нейтральны, они содержат одинаковое количество электронов и протонов. Тем не менее, атом может захватывать электроны или терять их, и в этом случае он ионизируется.[13]
- Ионы имеют электрический заряд. Если в ионе больше протонов, то он обладает положительным зарядом, и в этом случае после символа элемента ставится знак «плюс». Если ион содержит больше электронов, он имеет отрицательный заряд, что обозначается знаком «минус».
- Знаки «плюс» и «минус» не ставятся, если атом не является ионом.
Реклама
-
1
Найдите атомную массу. Обычно атомную массу указывают внизу ячейки, под символом элемента. Атомная масса представляет собой сумму масс частиц, составляющих ядро атома, то есть протонов и нейтронов. Однако элементы имеют изотопы, поэтому атомная масса является средней величиной с учетом их распространенности в природе.[14]
- Поскольку атомная масса представляет собой среднюю величину, для большинства элементов она записывается в виде десятичной дроби.
- Хотя может показаться, что атомная масса всегда возрастает при движении слева направо и сверху вниз, это справедливо не во всех случаях.
-
2
Найдите массовое число конкретного элемента. Поскольку в атомной массе учитываются все изотопы элемента, для определения массового числа достаточно округлить приведенную в таблице атомную массу до ближайшего целого числа.[15]
- Например, атомная масса углерода составляет 12,011, после округления получаем 12. Для железа, атомная масса которого равна 55,847, получаем 56.
-
3
Вычтите из массового числа атома его атомный номер, чтобы найти количество нейтронов. Масса атома представляет сумму масс протонов и нейтронов. Ввиду этого можно легко определить число нейтронов — достаточно вычесть из массового числа атомный номер, то есть количество протонов![16]
- Используйте следующую формулу: Число нейтронов = Массовое число – Число протонов.
- Например, массовое число углерода равно 12, и атом углерода имеет 6 протонов. Поскольку 12 – 6 = 6, атом углерода содержит 6 нейтронов.
- Массовое число железа составляет 56, и его атом содержит 26 протонов. Так как 56 – 26 = 30, в атоме железа содержится 30 нейтронов.
- Изотопы элементов имеют разное количество нейтронов, благодаря чему меняется их атомная масса.
Реклама
Советы
- Многим сложно освоить таблицу Менделеева. Не расстраивайтесь, если столкнетесь с определенными трудностями!
- Хотя цвета могут меняться, они передают одну и ту же информацию.
- Встречаются упрощенные таблицы. Например, в таблице могут содержаться лишь символы элементов и их атомные номера. Выберите такую таблицу, которая подходит для ваших целей.
Реклама
Об этой статье
Эту страницу просматривали 248 463 раза.
Была ли эта статья полезной?

- Периодическая система Менделеева систематизирует элементы и их свойства. В ней все элементы упорядочены с учетом их атомного числа и повторяющихся химических свойств.
- Периодический закон: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Расшифровка обозначений элементов
Каждому химическому элементу в таблице отведена одна клеточка, в которой указаны символ и название элемента, порядковый номер и относительная атомная масса.
Расшифровка обозначений элементов таблицы Менделеева:
- Обозначение: одной или двумя латинскими буквами.
- Порядковый номер элемента или атомный номер равен числу протонов в его ядре. Обычно пишется в левом верхнем углу.
- Относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учетом их содержания в природе. Поэтому обычно она является дробным числом.
- Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число.
- Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
- Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
- Электронная конфигурация — формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы.
-
Чтобы узнать количество нейтронов в ядре элемента, необходимо из относительной атомной массы (массового числа) вычесть порядковый номер.
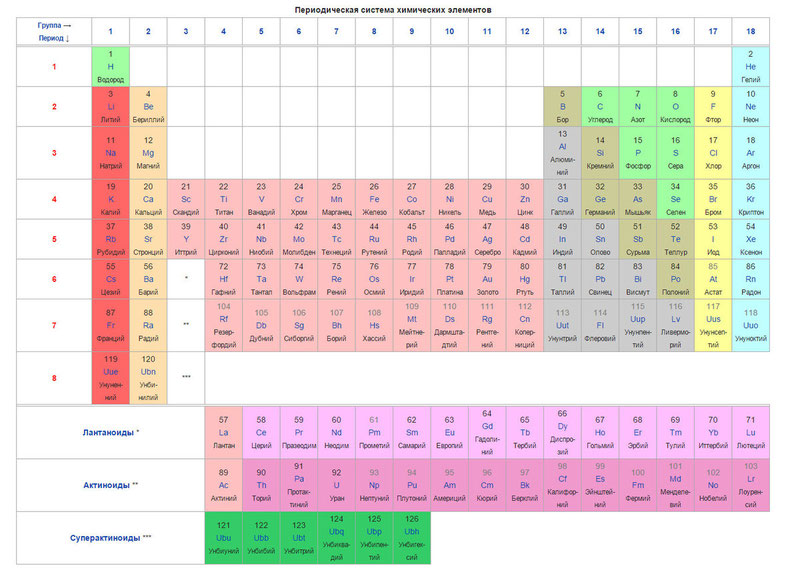
Элементы периодической таблицы Менделеева
Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
- Металлы обладают хорошей электро- и теплопроводностью, способны отражать яркий свет, имеют высокую температуру плавления (остаются твердыми при нормальных значениях окружающей среды, исключение — ртуть).
- Неметаллы встречаются в природе в трех состояниях: газ (например, водород), жидкость (например, бром) и твердые вещества (например, фосфор). Он не способны проводить тепло и электричество. Имеют более низкую температуру плавления в сравнении с металлами, более хрупкие и ломкие. Могут иметь разнообразный внешний вид (элементы с низкой плотностью и яркостью).
- Металлоиды имеют смешанные свойства металлов и неметаллов (например, кремний). Они имеют среднюю тепло- и электропроводность. Различаются между собой по температуре плавления, плотности, цвету и форме. Внешний вид может быть схож с металлами или неметаллами.
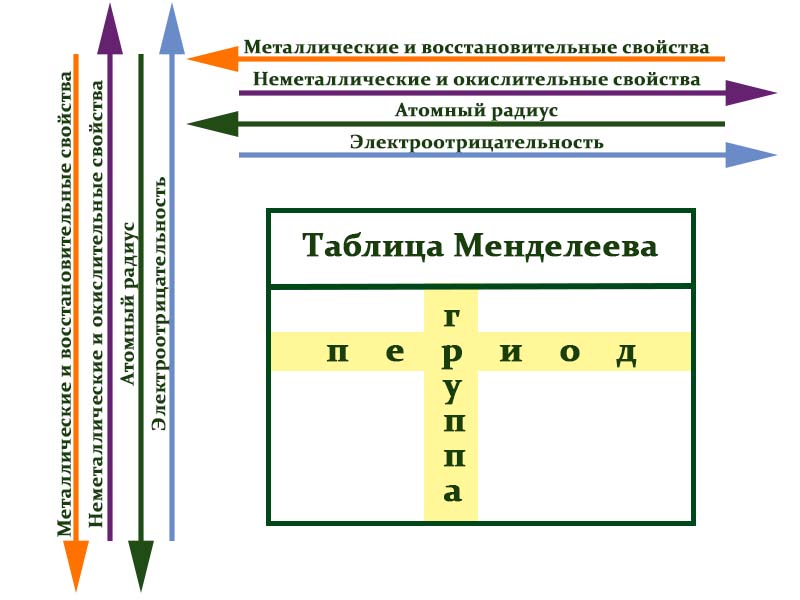
Расшифровка групп и периодов таблицы Менделеева
В таблице химические вещества расположены в специальном порядке: слева направо по мере роста их атомных масс. Все они в периодической системе объединены в периоды и группы.
Периоды — это горизонтальные ряды в таблице. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Номер периода, в котором находится элемент, совпадает с номером его валентной оболочки. Эта валентная оболочка постепенно заполняется от начала к концу периода.
Закономерности периодов:
- Металлические свойства убывают, неметаллические и окислительные -возрастают. Каждый период начинается активным металлом и заканчивается инертным газом.
- Уменьшается атомный радиус.
- Увеличивается электроотрицательность.
Группы — это столбцы. Элементы во всех группах имеют одинаковое электронное строение внешних электронных оболочек. В каждой группе на внешнем энергетическом атома одинаковое число электронов, то есть номер группы совпадает с числом валентных электронов, которые могут участвовать в образовании химических связей. Поэтому номер группы часто совпадает с валентностью элементов. Например, номер группы совпадает с валентностью s-элементов и с наибольшей возможной валентностью p-элементов.
Закономерности групп:
- Металлические свойства увеличиваются, неметаллические и окислительные- убывают.
- Увеличивается радиус атома элементов в рамках одной группы.
- Уменьшается электроотрицательность.
Атомное число показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Валетность — это свойство элементов образовывать химические связи. То есть это количество химических связей, которые образует атом или число атомов, которое может присоединить или заместить атом данного элемента. Валентность бывает: постоянная и переменная (зависит от состава вещества, в которое входит элемент).
Определить валентность:
— Постоянная валентность идентична номеру группы главной подгруппы. Номера групп в таблице изображаются римскими цифрами.
— Переменная валентность (часто бывает у неметаллов) определяется по формуле: 8 вычесть № группы, в которой находится вещество.
Расшифровка периодов и групп периодической таблицы Менделеева
Каждый элемент имеет свой порядковый (атомный) номер, располагается в определённом периоде и определённой группе.
Периоды
- Малые периоды: первый, второй и третий периоды. В них содержится соответственно 2, 8 и 8 элементов;
- Большие периоды: остальные элементы. В четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент.
В таблице 7 периодов. В каждом содержится определённое число элементов:
1-й период — 2 элемента (малый период),
2-й период — 8 элементов (малый период),
3-й период — 8 элементов (малый период),
4-й период — 18 элементов (большой период),
5-й период — 18 элементов (большой период),
6-й период — 32 элемента (18+14) (большой период),
7-й период — 32 элемента (18+14) (большой период).
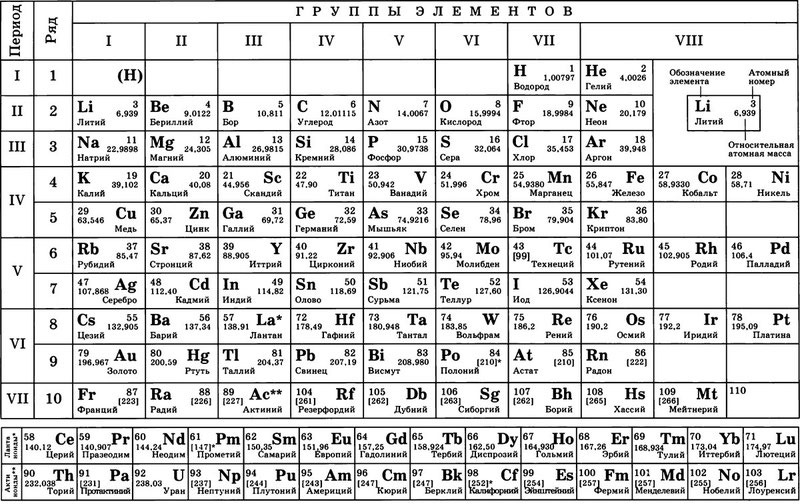
Группы и подгруппы
- Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов.
- Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
В Периодической таблице может использоваться разное обозначение групп. Поэтому согласно такому обозначению бывает разная расшифровка групп таблицы менделеева:
- 18 групп, пронумерованных арабскими цифрами.
- 8 групп, пронумерованных цифрами с добавлением букв A или B.
Группы A — это главные подгруппы.
Группы B — это побочные подгруппы в больших периодов. Это только металлы.
IA, VIIIA — по 7 элементов;
IIA — VIIA — по 6 элементов;
IIIB — 32 элемента (4+14 лантаноидов +14 актиноидов);
VIIIB — 12 элементов;
IB, IIB, IVB — VIIB — по 4 элемента.
Римский номер группы, как правило, показывает высшую валентность в оксидах (но для некоторых элементов не выполняется).
Элементы с порядковыми номерами 58–71 (лантаноиды) и 90–103 (актиноиды) вынесены из таблицы и располагаются под ней. Это элементы IIIB группы. Лантаноиды относятся к шестому периоду, а актиноиды — к седьмому.
Элементы главной подгруппы
1 группа главная подгруппа элементов (IA) — щелочные металлы.
Это мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним электроном на внешней оболочке и прекрасно вступают в реакцию.
Литий Li (3), Натрий Na (11), Калий K (19), Рубидий Rb (37), Цезий Cs (55), Франций Fr (87).
2 группа главная подгруппа (IIА) -щелочноземельными металлами.
Имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Кальций Ca (20), Стронций Sr (38), Барий Ba (56), Радий Ra (88).
3 группа главная подгруппа (IIIА).
Все элементы данной подгруппы, за исключением бора, металлы. Главную подгруппу составляют составляют бор, алюминий, галлий, индий и таллий. На внешнем электронном уровне элементов по три электрона. Они легко отдают эти электроны или образуют три неспаренных электрона.
4 группа главная подгруппа (IVА) .
Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы).
5 группа главная подгруппа (VA).
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
6 группа главной подгруппы (VIA) .
Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства.
7 группа главная подгруппа (VIIA) — галогены .
(F, Cl, Br, I, At). Имеют семь электронов на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
8 группа главная подгруппа (VIIIA) — инертные (благородные) газы.
(He, Ne, Ar, Kr, Xe, Rn, Og). У них полностью заполнен внешний электронный уровень. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными». У инертных газов есть способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Элементы побочной подгруппы
Элементы побочных подгрупп кроме лантаноидов и актиноидов — переходные металлы.
Твёрдые (исключение жидкая ртуть), плотные, обладают характерным блеском, хорошо проводят тепло и электричество.
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
3 группа побочная подгруппа (IIIB) шестого и седьмого периодов — лантаноиды и актиноиды.
Для удобства их помещают под основной таблицей.
- Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
- Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Неметаллы
Правый верхний угол таблицы до инертных газов -неметаллы.
Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе.
Кислородные и водородные соединения
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения.
Существует 8 форм кислородных соединений: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4,
где R — элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют 4 формы водородных соединений: RH4, RH3, RH2, RH.
Характер соединений: RH — сильнокислый; RH2 — слабокислый; RH3 — слабоосновный; RH4 — нейтральный.
Из таблицы Менделеева можно почерпнуть огромное количество информации о каждом химическом элементе, что значительно облегчит решение задач. Более того, периодическую систему можно использовать на ЕГЭ, и это может стать серьезным подспорьем. Главное — уметь грамотно ей пользоваться. Как это делать — читайте в нашей статье.
Таблица Менделеева — краткое описание
Таблица Менделеева — это графическое выражение периодического закона, который открыл русский ученый Д.И. Менделеев в 1869 году. Периодическая система представляет собой классификацию химических элементов, которая основана на зависимости свойств химических элементов от заряда их атомного числа. Первоначальный вариант предполагал зависимость свойств веществ от их атомной массы.
Существуют три формата таблицы Менделеева:
- короткий (короткопериодный);
- длинный (длиннопериодный);
- сверхдлинный.
Международным союзом теоретической и прикладной химии (ИЮПАК) в качестве основного утвержден длинный вариант таблицы Менделеева, а короткий вариант официально отменен в 1989 году.
Пустые ячейки в таблице
Создав периодическую таблицу в 1869 году на базе уже известных миру 63-х химических элементов, Менделеев предсказал открытие новых и оставил для них пустые ячейки в таблице. Русский ученый оказался прав. Гипотеза Менделеева в скором времени была подтверждена открытиями других ученых: в 1875 году был открыт галлий, в 1879 — скандий, в 1886 — германий. На 2023 год в таблицу собраны 118 известных элементов. Последние из них открыты в 2016 году: ученые обнаружили нихоний, московий, теннессин и оганесон.
Структура таблицы
В таблице Менделеева химические вещества расположены в специальном порядке: слева направо по мере роста их атомных масс. Все они в периодической системе объединены в периоды и группы. Таблица состоит из семи периодов и восьми групп.
Периоды — это горизонтальные ряды в таблице.
Элементы, которые относятся к одному периоду, показывают следующие закономерности с увеличением их порядкового номера:
- Возрастает электроотрицательность.
- Металлические свойства убывают, неметаллические возрастают.
- Атомный радиус падает.
Периоды в таблице делятся на:
- малые;
- большие.
Малыми называются периоды, которые содержат небольшое количество элементов. Это первый, второй и третий периоды, первый состоит из 2-х, второй и третий из 8 элементов.
Все остальные периоды — это большие периоды. Четвертый и пятый состоят из 18 элементов, шестой — из 32-х, седьмой — из 24-х.
В нижней части таблицы Менделеева расположены химические вещества, которые называются лантаноидами и актиноидами.
Таблица периодической системы содержит десять рядов. Малые периоды состоят из одного ряда, большие периоды содержат по два ряда. В седьмом периоде находится один ряд.
Каждый большой период состоит из четного и нечетного рядов. В четных рядах содержатся металлы, в нечетных рядах — неметаллы.
Периодическая система начинается водородом — первым химическим элементом, а заканчивается на сегодняшний день 118-м — оганесоном. Ученые утверждают, что таблица не закончена, идет активный поиск 119-го элемента.
Группы элементов с похожими свойствами
Группа — это вертикальная колонка в периодической таблице, определяющая основные физико-химические свойства элементов. Вещества, принадлежащие к одной и той же группе, обладают похожими химическими особенностями и демонстрируют одинаковую закономерность в изменении своих свойств по мере увеличения атомного числа.
Всем группам (колонкам таблицы) присваиваются номера от 1 до 18 — слева направо (от щелочных металлов к благородным газам). Такая система вступила в силу в 1988 году по инициативе ИЮПАК. Все прежние названия групп, которые использовали в разных странах, больше не употребляются.
Элементы, которые относятся к одной группе, показывают следующие закономерности по направлению сверху вниз:
- Возрастает радиус атома элементов в рамках одной группы.
- Усиливаются металлические свойства элементов и ослабевают неметаллические.
- Падает электроотрицательность.
Цветовое определение групп
Вещества в каждой группе делятся на те, которые находятся в главной подгруппе и те, которые входят в побочную подгруппу. В таблице составляющие побочной группы выделяются синим цветом, к ней относятся элементы только больших периодов (начинаются с четвертого периода). В главную подгруппу могут входить элементы и малых, и больших периодов (начинаются с первого или второго периодов).
Различение металлов, металлоидов и неметаллов
Все химические элементы в зависимости от их химических и физических свойств можно разделить на 3 типа:
- металлы;
- металлоиды;
- неметаллы.
Характеристика металлов (например, медь, алюминий, золото):
- Хорошая электро- и теплопроводность.
- Способность отражать свет (яркий внешний вид).
- Высокая температура плавления (остаются твердыми при нормальных значениях окружающей среды, исключение — ртуть).
- Пластичность и податливость.
Неметаллы встречаются в природе в трех состояниях: газ (например, водород), жидкость (например, бром) и твердые вещества (например, фосфор). Их характеризуют:
- Неспособность проводить тепло и электричество.
- Разнообразный внешний вид (элементы с низкой плотностью и яркостью).
- Значительно более низкая температура плавления в сравнении с металлами.
- Хрупкость и ломкость.
Металлоиды имеют смешанные свойства металлов и неметаллов (например, кремний). Их основные черты:
- Средняя тепло- и электропроводность.
- Внешний вид может быть схож с металлами или неметаллами.
- Различаются между собой по температуре плавления, плотности, цвету и форме.
Обозначение элементов
Каждый элемент в периодической системе Менделеева имеет несколько обозначений:
- название;
- буквенное выражение;
- атомный номер;
- массовое число.
Буквенное, название
В таблице может быть указано полное название вещества (например, Carbon), в таких случаях его располагают под химическим символом.
Символ — это сокращенное название элемента (например, гелий — He).
Иногда в таблице не указываются названия вещества и приводится лишь его химический символ. Обозначения, как правило, состоят из одной или двух латинских букв. Символ элемента расположен в центре соответствующей ячейки в таблице.
Атомный номер
Атомный номер элемента обычно располагается вверху соответствующей ячейки, посередине или в углу. Все элементы имеют атомные номера от 1 до 118. Атомный номер — это всегда целое число.
Массовое число
Массовое число — это общее количество протонов и нейтронов в ядре. Его легко определить по атомной массе элемента, округляя ее до ближайшего целого числа.
Атомная масса указывается внизу ячейки, под символом элемента. Атомная масса — это сумма масс частиц, которые составляют ядро атома (протоны и нейтроны), представляет собой среднюю величину, для большинства элементов записывается в виде десятичной дроби.
Например, фосфор (P) имеет атомную массу равную 30,97376, следовательно, массовое число (количество протонов и нейтронов в ядре) составит 31.
Валентность
Валентность — это свойство элементов образовывать химические связи.
Валентность бывает:
- постоянная;
- переменная (зависит от состава вещества, в которое входит элемент).
Определить валентность по таблице Менделеева несложно:
- Постоянная валентность идентична номеру группы главной подгруппы. Номера групп в таблице изображаются римскими цифрами.
- Переменная валентность (часто бывает у неметаллов) определяется по формуле: 8 (всего 8 групп в таблице) вычесть № группы, в которой находится вещество.
Например, вещества, находящиеся в первой группе главной подгруппы (Li, К) имеют валентность, равную I; элементы, которые располагаются во второй группе главной подгруппы (Mg, Ca) обладают II валентностью. Мышьяк (As) находится в V группе главной подгруппы, следовательно, значение его валентности также будет равняться V. Помимо этого, у вещества есть еще одно значение валентности. Определяется оно по приведенной выше формуле и равняется III.
Если у вас возникнут сложности в усвоении знаний не только по химии, но и по любому другому предмету, обращайтесь за помощью к образовательному ресурсу Феникс.Хелп. Для нас не существует нелюбимых дисциплин и сложных тем!
Download Article
Download Article
If you find the periodic table confusing and difficult to understand, you aren’t alone! Understanding how it works can be hard, but learning how to read it will help you be successful in the sciences. Start by recognizing the structure of the periodic table and what this tells you about each element. Next, you can study each element. Finally, use the information provided on the periodic table to find the number of neutrons in an atom.
Sample Periodic Table
-
1
Read the periodic table from top left to bottom right. The elements are ordered by their atomic numbers, which increase as you move across and down the periodic table. The atomic number is how many protons the element’s atom possesses. You’ll also notice that each element’s atomic mass increases as you move across the table. This means you can recognize a lot about an element’s weight by just looking at its place on the table.[1]
- The atomic mass increases as you move across or down the table because the mass is calculated by adding up the protons and neutrons in each element’s atom. The number of protons increases with each element, which means the weight goes up, as well.
- Electrons are not included in the atomic mass, as they contribute much less to the atom’s weight than protons and neutrons.
-
2
Observe that each element contains 1 more proton than its predecessor. You can tell this by looking at the atomic number. Atomic numbers are ordered from left to right. Since the elements are also arranged by group, you will see gaps on the table.[2]
- For example, the first row contains Hydrogen, which has an atomic number of 1, and Helium, which has an atomic number of 2. However, they are at opposite ends of the table, as they are in different groups.
Advertisement
-
3
Recognize groups, which share physical and chemical properties. Groups, also known as families, fall in a vertical column. In most cases, groups will share the same color, as well. This helps you identify which elements have similar physical and chemical properties to each other, which allows you to predict how they’ll behave.[3]
Each element in a particular group has the same number of electrons in its outer orbital.[4]
- Most elements fall into 1 group, but Hydrogen can be placed with the Halogen family or the Alkali Metals. On some charts, it will appear with both.
- In most cases, the columns will be numbered 1-18, either above or below the table. The numbers may be shown in Roman numerals (IA), Arabic numerals (1A), or numerals (1).
- When you go down a group from top to bottom, it’s called “reading down a group.”
-
4
Notice why gaps exist in the table. Although elements are ordered based on their atomic number, they’re also arranged into groups and families that share the same physical and chemical properties. This helps you better understand how each element behaves. Since elements don’t always fall neatly into groupings as they increase in number, the periodic table contains gaps.
- For example, the first 3 rows have gaps, as the Transition Metals don’t appear on the table until atomic number 21.
- Similarly, elements 57 through 71, which are the Rare Earth Elements, are usually pictured as a subset at the bottom right of the table.
-
5
Notice that each row is called a period. All of the elements in a period have the same number of atomic orbitals, which is where their electrons go. The number of orbitals will match the number of the period. There are 7 rows, meaning that there are 7 periods.[5]
- For example, the elements in the period 1 have 1 orbital, while the elements in period 7 have 7 orbitals.
- In most cases, they’re numbered 1-7 down the left hand side of the table.
- When you move across a row from left to right, it’s called “reading across a period.”
-
6
Distinguish between metals, semi-metals, and non-metals. You can better understand the properties of an element by recognizing what type of element it is. Fortunately, most periodic tables use color to indicate whether the element is a metal, semi-metal, or non-metal. You’ll notice that metals occur to the left of the table, while non-metals fall on the right. Semi-metals are sandwiched between them.[6]
- Keep in mind that hydrogen can be grouped with either the Halogens or the Alkali Metals because of its properties, so it may appear on either side of the table or may be colored differently.
- Elements are labeled as a metal if they have luster, are solid at room temperature, conduct heat and electricity, and are malleable and ductile.
- Elements are considered a non-metal if they lack luster, don’t conduct heat or electricity, and are non-malleable. These elements are usually gases at room temperature but may also become a solid or liquid at certain temperatures.
- Elements are labeled as semi-metals if they have a mixture of properties of both metals and non-metals.[7]
Advertisement
-
1
Recognize the element’s 1 to 2-letter symbol. It most often appears in the center of the box in a large font. The symbol abbreviates the element’s name, which is standardized across different languages. When you’re doing experiments or working with elemental equations, you’ll likely use the elements’ symbols, so it’s important to familiarize yourself with them.[8]
- This symbol is usually derived from the Latin form of the element’s name, but it may be derived from the widely accepted common name, especially for newer elements. For example, the symbol for Helium is He, which closely resembles the common name. However, the symbol for Iron is Fe, which is harder to recognize at first.
-
2
Look for the full name of the element, if it’s present. This is the name of the element that you will use when writing it out. For example, “Helium” and “Carbon” are the names of elements. In most cases, this will appear just below the symbol, but its placement can vary.[9]
- Some periodic tables may omit the full name, using just the symbol.
-
3
Find the atomic number. The atomic number is often located at the top of the box, either in the center or the corner. However, it could be located under the element symbol or name. Atomic numbers run sequentially from 1-118.[10]
- The atomic number will be a whole number, not a decimal.
-
4
Recognize the atomic number is the number of protons in an atom. All of an element’s atoms contain the same number of protons. Unlike with electrons, an atom cannot gain or lose protons. Otherwise, the element would change![11]
- You’ll use the atomic number to find the number of electrons and neutrons as well!
-
5
Know elements contain the same number of electrons as protons. There is an exception if they’re ionized. Protons have a positive charge, and electrons have a negative charge. Since regular atoms don’t have an electrical charge, that means electrons and protons are equal. However, an atom can lose or gain electrons, which makes it ionized.[12]
- Ions are electrically charged. If an ion has more protons, it is positive, which is indicated with a positive sign next to the ion’s symbol. If it has more electrons, the ion is negative, which is indicated with a negative symbol.
- You will not see a plus or minus symbol if the element is not an ion.
Advertisement
-
1
Find the atomic weight. The atomic weight usually appears at the bottom of the box, below the element symbol. The atomic weight represents the combined weight of the particles in the nucleus, which includes protons and neutrons. However, isotopes complicate the calculation, so the atomic weight represents an average of the atomic mass of the element and the atomic mass of its isotopes.[13]
- Because the weights are averaged, most elements will have atomic weights that include decimals.
- Although it may appear as though the atomic weight increases in number from top left to bottom right, this is not true in all cases.
-
2
Determine the mass number of the element you’re studying. You can find the mass number by rounding the atomic mass to the nearest whole number. This accounts for the fact that the atomic weight is an average of all possible atomic masses for that element, including isotopes.[14]
- For example, the atomic weight of Carbon is 12.011, which rounds to 12. Similarly, the weight of Iron is 55.847, which rounds to 56.
-
3
Subtract the atomic number from the mass number to find the neutrons. The mass number is calculated by adding together the number of protons and neutrons. This allows you to easily find the number of neutrons in an atom by subtracting the number or protons from the mass number![15]
- Use this formula: Neutrons = Mass Number — Protons
- For example, Carbon’s mass number is 12, and it has 6 protons. Since 12 — 6 = 6, you know Carbon has 6 neutrons.
- For another example, Iron’s mass number is 56, and it has 26 protons. Since 56 — 26 = 30, you know Iron has 30 neutrons.
- An atom’s isotopes will contain a different number of neutrons, which changes the atom’s weight.
Advertisement
Add New Question
-
Question
How do I find the number of protons?
Bess Ruff is a Geography PhD student at Florida State University. She received her MA in Environmental Science and Management from the University of California, Santa Barbara in 2016. She has conducted survey work for marine spatial planning projects in the Caribbean and provided research support as a graduate fellow for the Sustainable Fisheries Group.
Environmental Scientist
Expert Answer
-
Question
Where do I find the lighter atomic mass on a periodic table?
Bess Ruff is a Geography PhD student at Florida State University. She received her MA in Environmental Science and Management from the University of California, Santa Barbara in 2016. She has conducted survey work for marine spatial planning projects in the Caribbean and provided research support as a graduate fellow for the Sustainable Fisheries Group.
Environmental Scientist
Expert Answer
Support wikiHow by
unlocking this expert answer.Since atomic mass is the combined weight of the particles in the nucleus, it increases along with atomic number, which is the number of protons in an atom of that element. As such, lighter atomic mass is found in the upper left corner of the table and increases with atomic number moving to the right and down the table.
-
Question
What happens when you take away electrons?
The atom becomes a positively charged ion. It will be positively charged because the number of protons is now greater than the number of electrons. Protons are positively charged, while electrons are negatively charged. Usually an atom has the same number of electrons as protons, but when there are more protons, the atom has an overall positive charge.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
Reading the periodic table is hard for many people! Don’t feel bad if you’re struggling to learn how to use it.
-
Colors may vary, but the information is the same.
-
Some periodic tables may simplify the information. For example, they may provide just the symbol and atomic number. Look for a table that meets your needs.
Advertisement
References
About This Article
Article SummaryX
The periodic table can seem a little daunting at first. But it’s not too difficult to understand once you learn the basics of how it works. When you’re reading the periodic table, move across the table from top left to bottom right. As you move across the table, the number of protons and the atomic mass of each element increases. Each element has its own atomic number, which represents the number of protons in one atom of the element. For instance, the first element in the periodic table, hydrogen, has an atomic number of 1, because a hydrogen atom has only 1 proton. At the other extreme, an atom of the synthetic element oganesson has 118 protons and an atomic number of 118. The elements are also organized into groups, or families, that share similar physical and chemical properties. Each column in the periodic table, going from top to bottom, represents one of these groups. Additionally, related elements are usually color-coded to indicate whether they are metals, semi-metals, or non-metals. When you read the period table in rows going across from left to right, you will find that the elements in each row share the same number of atomic orbitals. The orbitals are the regions around the atom’s nucleus where electrons are most likely to appear. Each of these 7 rows is called a “period.” Finally, you might notice that there are gaps in the periodic table, particularly in the top 3 rows. This is because the elements don’t always fit neatly into groups that share the same physical and chemical characteristics. One group of elements that have nearly indistinguishable chemical properties, called the rare earth elements, is separated out into its own separate space at the bottom of the periodic table. When you look at individual elements on the periodic table, there are several pieces of information that you can find on each square. For example, every element has a 1 to 3-letter symbol that represents the name of the element. While some of these are pretty obvious, like O for oxygen and C for carbon, others don’t necessarily match the common name of the element. For instance, the symbol for lead is Pb, from the Latin word for lead, plumbum. In addition to the element symbol, you’ll also see the atomic number at the top of the square, which represents the number of protons in an atom of the element. Unless the element is ionized, the number of protons will be equal to the number of electrons. Another number that appears in each square is the atomic weight, which is usually written as a whole number with a decimal after it. This number represents the combined weight of all the particles in the atom’s nucleus, including protons and neutrons. You can use this number to figure out things like the number of neutrons in an atom of the element. To do this, round up the atomic weight to the nearest whole number to find the mass number, then subtract the number of protons. The resulting number is the number of neutrons in the atom. For tips on how to remember the elements by their letter symbols, read on!
Did this summary help you?
Thanks to all authors for creating a page that has been read 544,305 times.
Reader Success Stories
-
«As a teacher I wanted to do an excellent job as I know this is their first encounter with this. I needed to know…» more
Did this article help you?
Как пользоваться таблицей Менделеева? Для непосвященного человека читать таблицу Менделеева – всё равно, что для гнома смотреть на древние руны эльфов. А таблица Менделеева может рассказать о мире очень многое.
Помимо того, что сослужит вам службу на экзамене, она еще и просто незаменима при решении огромного количества химических и физических задач. Но как ее читать? К счастью, сегодня этому искусству может научиться каждый. В этой статье расскажем, как понять таблицу Менделеева.
Периодическая система химических элементов (таблица Менделеева) – это классификация химических элементов, которая устанавливает зависимость различных свойств элементов от заряда атомного ядра.
История создания Таблицы
Дмитрий Иванович Менделеев был не простым химиком, если кто-то так думает. Это был химик, физик, геолог, метролог, эколог, экономист, нефтяник, воздухоплаватель, приборостроитель и педагог. За свою жизнь ученый успел провести фундаментально много исследований в самых разных областях знаний. Например, широко распространено мнение, что именно Менделеев вычислил идеальную крепость водки – 40 градусов.
Не знаем, как Менделеев относился к водке, но точно известно, что его диссертация на тему «Рассуждение о соединении спирта с водой» не имела к водке никакого отношения и рассматривала концентрации спирта от 70 градусов. При всех заслугах ученого, открытие периодического закона химических элементов – одного их фундаментальных законов природы, принесло ему самую широкую известность.
Существует легенда, согласно которой периодическая система приснилась ученому, после чего ему осталось лишь доработать явившуюся идею. Но, если бы все было так просто.. Данная версия о создании таблицы Менделеева, по-видимому, не более чем легенда. На вопрос о том, как была открыта таблица, сам Дмитрий Иванович отвечал: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово»
В середине девятнадцатого века попытки упорядочить известные химические элементы (известно было 63 элемента) параллельно предпринимались несколькими учеными. Например, в 1862 году Александр Эмиль Шанкуртуа разместил элементы вдоль винтовой линии и отметил циклическое повторение химических свойств.
Химик и музыкант Джон Александр Ньюлендс предложил свой вариант периодической таблицы в 1866 году. Интересен тот факт, что в расположении элементов ученый пытался обнаружить некую мистическую музыкальную гармонию. В числе прочих попыток была и попытка Менделеева, которая увенчалась успехом.
В 1869 году была опубликована первая схема таблицы, а день 1 марта 1869 года считается днем открытия периодического закона. Суть открытия Менделеева состояла в том, что свойства элементов с ростом атомной массы изменяются не монотонно, а периодически.
Первый вариант таблицы содержал всего 63 элемента, но Менделеев предпринял ряд очень нестандартных решений. Так, он догадался оставлять в таблице место для еще неоткрытых элементов, а также изменил атомные массы некоторых элементов. Принципиальная правильность закона, выведенного Менделеевым, подтвердилась очень скоро, после открытия галлия, скандия и германия, существование которых было предсказано ученым.
Современный вид таблицы Менделеева
Ниже приведем саму таблицу
Сегодня для упорядочения элементов вместо атомного веса (атомной массы) используется понятие атомного числа (числа протонов в ядре). В таблице содержится 120 элементов, которые расположены слева направо в порядке возрастания атомного числа (числа протонов)
Столбцы таблицы представляют собой так называемые группы, а строки – периоды. В таблице 18 групп и 8 периодов.
- Металлические свойства элементов при движении вдоль периода слева направо уменьшаются, а в обратном направлении – увеличиваются.
- Размеры атомов при перемещении слева направо вдоль периодов уменьшаются.
- При движении сверху вниз по группе увеличиваются восстановительные металлические свойства.
- Окислительные и неметаллические свойства при движении вдоль периода слева направо увеличиваются.
Что мы узнаем об элементе по таблице? Для примера, возьмем третий элемент в таблице – литий, и рассмотрим его подробно.
Первым делом мы видим сам символ элемента и его название под ним. В верхнем левом углу находится атомный номер элемента, в порядке которого элемент расположен в таблице. Атомный номер, как уже было сказано, равен числу протонов в ядре. Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
Атомная масса указана под атомным числом (в данном варианте таблицы). Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число. Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
Вот и закончился наш курс «Таблица Менделеева для чайников». В завершение, предлагаем вам посмотреть тематическое видео, и надеемся, что вопрос о том, как пользоваться периодической таблицей Менделеева, стал вам более понятен. Напоминаем, что изучать новый предмет всегда эффективнее не одному, а при помощи опытного наставника. Именно поэтому, никогда не стоит забывать о студенческом сервисе, который с радостью поделится с вами своими знаниями и опытом.